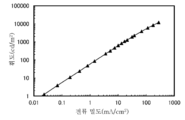
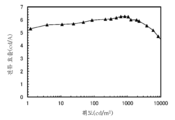
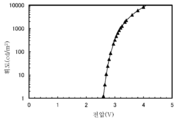
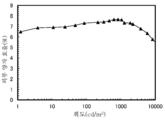
KR20190129946A - 유기 화합물, 발광 소자, 발광 장치, 전자 기기, 표시 장치, 및 조명 장치 - Google Patents
유기 화합물, 발광 소자, 발광 장치, 전자 기기, 표시 장치, 및 조명 장치 Download PDFInfo
- Publication number
- KR20190129946A KR20190129946A KR1020197030464A KR20197030464A KR20190129946A KR 20190129946 A KR20190129946 A KR 20190129946A KR 1020197030464 A KR1020197030464 A KR 1020197030464A KR 20197030464 A KR20197030464 A KR 20197030464A KR 20190129946 A KR20190129946 A KR 20190129946A
- Authority
- KR
- South Korea
- Prior art keywords
- carbon atoms
- light emitting
- group
- organic compound
- hydrocarbon group
- Prior art date
Links
- 150000002894 organic compounds Chemical class 0.000 title claims abstract description 152
- 125000004432 carbon atom Chemical group C* 0.000 claims description 137
- 125000001424 substituent group Chemical group 0.000 claims description 137
- 238000000034 method Methods 0.000 claims description 75
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 claims description 52
- 239000001257 hydrogen Substances 0.000 claims description 39
- 229910052739 hydrogen Inorganic materials 0.000 claims description 39
- 125000004430 oxygen atom Chemical group O* 0.000 claims description 34
- 229910052717 sulfur Inorganic materials 0.000 claims description 33
- 125000001931 aliphatic group Chemical group 0.000 claims description 32
- 125000002723 alicyclic group Chemical group 0.000 claims description 31
- 125000004986 diarylamino group Chemical group 0.000 claims description 30
- 125000004434 sulfur atom Chemical group 0.000 claims description 30
- 125000002029 aromatic hydrocarbon group Chemical group 0.000 claims description 25
- 125000000623 heterocyclic group Chemical group 0.000 claims description 23
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 21
- 150000002431 hydrogen Chemical class 0.000 claims description 17
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 claims description 12
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 claims description 12
- 229910052736 halogen Inorganic materials 0.000 claims description 11
- 150000002367 halogens Chemical class 0.000 claims description 9
- 125000004429 atom Chemical group 0.000 claims description 5
- 125000001183 hydrocarbyl group Chemical group 0.000 claims 1
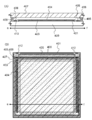
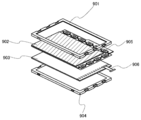
- 239000010410 layer Substances 0.000 description 263
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 234
- 239000000463 material Substances 0.000 description 175
- 239000000758 substrate Substances 0.000 description 142
- -1 diphenylamino Chemical group 0.000 description 118
- 239000000203 mixture Substances 0.000 description 96
- 239000007787 solid Substances 0.000 description 95
- 230000015572 biosynthetic process Effects 0.000 description 91
- 238000003786 synthesis reaction Methods 0.000 description 90
- 150000001875 compounds Chemical class 0.000 description 75
- 239000000243 solution Substances 0.000 description 57
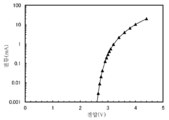
- 238000002347 injection Methods 0.000 description 53
- 239000007924 injection Substances 0.000 description 53
- 239000010408 film Substances 0.000 description 49
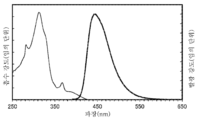
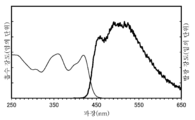
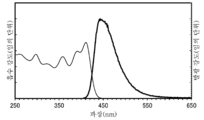
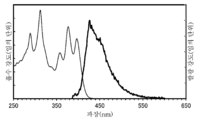
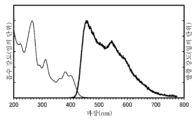
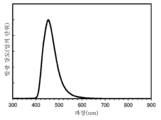
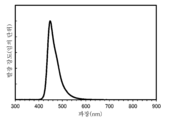
- 238000000295 emission spectrum Methods 0.000 description 43
- 229910052757 nitrogen Inorganic materials 0.000 description 43
- 238000003756 stirring Methods 0.000 description 43
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 42
- 150000002500 ions Chemical class 0.000 description 41
- 238000000862 absorption spectrum Methods 0.000 description 36
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 36
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 36
- 238000005481 NMR spectroscopy Methods 0.000 description 32
- 238000001228 spectrum Methods 0.000 description 31
- 239000010409 thin film Substances 0.000 description 31
- 230000005525 hole transport Effects 0.000 description 27
- 239000002904 solvent Substances 0.000 description 27
- 238000004458 analytical method Methods 0.000 description 26
- 238000007740 vapor deposition Methods 0.000 description 26
- 239000000126 substance Substances 0.000 description 25
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 24
- 238000000151 deposition Methods 0.000 description 24
- 238000010438 heat treatment Methods 0.000 description 24
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 24
- 239000000047 product Substances 0.000 description 23
- 238000007789 sealing Methods 0.000 description 23
- 238000001771 vacuum deposition Methods 0.000 description 23
- MILUBEOXRNEUHS-UHFFFAOYSA-N iridium(3+) Chemical compound [Ir+3] MILUBEOXRNEUHS-UHFFFAOYSA-N 0.000 description 22
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 21
- 239000000706 filtrate Substances 0.000 description 21
- 230000006870 function Effects 0.000 description 21
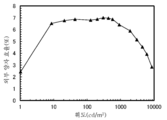
- 238000006862 quantum yield reaction Methods 0.000 description 20
- 239000004065 semiconductor Substances 0.000 description 20
- 230000005284 excitation Effects 0.000 description 18
- 238000004811 liquid chromatography Methods 0.000 description 18
- 239000003566 sealing material Substances 0.000 description 18
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 18
- 238000000926 separation method Methods 0.000 description 17
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 16
- 239000011521 glass Substances 0.000 description 15
- 238000004519 manufacturing process Methods 0.000 description 15
- 238000005259 measurement Methods 0.000 description 15
- 239000007983 Tris buffer Substances 0.000 description 14
- 238000010521 absorption reaction Methods 0.000 description 14
- CUJRVFIICFDLGR-UHFFFAOYSA-N acetylacetonate Chemical compound CC(=O)[CH-]C(C)=O CUJRVFIICFDLGR-UHFFFAOYSA-N 0.000 description 14
- 150000001768 cations Chemical class 0.000 description 14
- 229910052751 metal Inorganic materials 0.000 description 14
- 239000002184 metal Substances 0.000 description 14
- 230000008569 process Effects 0.000 description 14
- 239000002096 quantum dot Substances 0.000 description 14
- 239000011669 selenium Substances 0.000 description 14
- ODHXBMXNKOYIBV-UHFFFAOYSA-N triphenylamine Chemical compound C1=CC=CC=C1N(C=1C=CC=CC=1)C1=CC=CC=C1 ODHXBMXNKOYIBV-UHFFFAOYSA-N 0.000 description 14
- 229910000027 potassium carbonate Inorganic materials 0.000 description 13
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 12
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 12
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 12
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 12
- 125000005843 halogen group Chemical group 0.000 description 12
- 125000001072 heteroaryl group Chemical group 0.000 description 12
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 12
- 239000011159 matrix material Substances 0.000 description 12
- 238000010898 silica gel chromatography Methods 0.000 description 11
- 0 *c1c(*)c(*)c(*)c(-c2c3*)c1*c2c(*)c1c3c(*)c2-c3c(*)c(*)c(*)c(*)c3*c2c1* Chemical compound *c1c(*)c(*)c(*)c(-c2c3*)c1*c2c(*)c1c3c(*)c2-c3c(*)c(*)c(*)c(*)c3*c2c1* 0.000 description 10
- UKVXRNOJXLSJJB-UHFFFAOYSA-N 2,7-bis(4-chloro-2-fluorophenyl)-3,6-dimethoxynaphthalene Chemical compound ClC1=CC(=C(C=C1)C=1C(=CC2=CC(=C(C=C2C=1)C1=C(C=C(C=C1)Cl)F)OC)OC)F UKVXRNOJXLSJJB-UHFFFAOYSA-N 0.000 description 10
- CJDIUCQBWXQDFL-UHFFFAOYSA-N 3,6-bis(4-chloro-2-fluorophenyl)naphthalene-2,7-diol Chemical compound ClC1=CC(=C(C=C1)C=1C(=CC2=CC(=C(C=C2C=1)C1=C(C=C(C=C1)Cl)F)O)O)F CJDIUCQBWXQDFL-UHFFFAOYSA-N 0.000 description 10
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 10
- XLOMVQKBTHCTTD-UHFFFAOYSA-N Zinc monoxide Chemical compound [Zn]=O XLOMVQKBTHCTTD-UHFFFAOYSA-N 0.000 description 10
- 239000003960 organic solvent Substances 0.000 description 10
- 239000008096 xylene Substances 0.000 description 10
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 9
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 9
- 125000005595 acetylacetonate group Chemical group 0.000 description 9
- 229910052782 aluminium Inorganic materials 0.000 description 9
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 9
- 125000003118 aryl group Chemical group 0.000 description 9
- 239000002585 base Substances 0.000 description 9
- 238000006243 chemical reaction Methods 0.000 description 9
- 239000011229 interlayer Substances 0.000 description 9
- 238000004544 sputter deposition Methods 0.000 description 9
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 9
- FKHIFSZMMVMEQY-UHFFFAOYSA-N talc Chemical compound [Mg+2].[O-][Si]([O-])=O FKHIFSZMMVMEQY-UHFFFAOYSA-N 0.000 description 9
- ILAHWRKJUDSMFH-UHFFFAOYSA-N boron tribromide Chemical compound BrB(Br)Br ILAHWRKJUDSMFH-UHFFFAOYSA-N 0.000 description 8
- 239000002131 composite material Substances 0.000 description 8
- 238000001514 detection method Methods 0.000 description 8
- 238000001035 drying Methods 0.000 description 8
- 150000002391 heterocyclic compounds Chemical class 0.000 description 8
- 229910052741 iridium Inorganic materials 0.000 description 8
- GKOZUEZYRPOHIO-UHFFFAOYSA-N iridium atom Chemical compound [Ir] GKOZUEZYRPOHIO-UHFFFAOYSA-N 0.000 description 8
- 239000004973 liquid crystal related substance Substances 0.000 description 8
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 8
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 8
- 239000010453 quartz Substances 0.000 description 8
- 229910052814 silicon oxide Inorganic materials 0.000 description 8
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 8
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 7
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical compound [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 description 7
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 7
- 150000001412 amines Chemical class 0.000 description 7
- 239000000872 buffer Substances 0.000 description 7
- 229910052799 carbon Inorganic materials 0.000 description 7
- AMGQUBHHOARCQH-UHFFFAOYSA-N indium;oxotin Chemical compound [In].[Sn]=O AMGQUBHHOARCQH-UHFFFAOYSA-N 0.000 description 7
- 239000012212 insulator Substances 0.000 description 7
- 238000002955 isolation Methods 0.000 description 7
- 229910000476 molybdenum oxide Inorganic materials 0.000 description 7
- 239000012044 organic layer Substances 0.000 description 7
- PQQKPALAQIIWST-UHFFFAOYSA-N oxomolybdenum Chemical compound [Mo]=O PQQKPALAQIIWST-UHFFFAOYSA-N 0.000 description 7
- 238000005192 partition Methods 0.000 description 7
- 150000003379 silver compounds Chemical class 0.000 description 7
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 7
- HEZMWWAKWCSUCB-PHDIDXHHSA-N (3R,4R)-3,4-dihydroxycyclohexa-1,5-diene-1-carboxylic acid Chemical compound O[C@@H]1C=CC(C(O)=O)=C[C@H]1O HEZMWWAKWCSUCB-PHDIDXHHSA-N 0.000 description 6
- DHDHJYNTEFLIHY-UHFFFAOYSA-N 4,7-diphenyl-1,10-phenanthroline Chemical compound C1=CC=CC=C1C1=CC=NC2=C1C=CC1=C(C=3C=CC=CC=3)C=CN=C21 DHDHJYNTEFLIHY-UHFFFAOYSA-N 0.000 description 6
- VFUDMQLBKNMONU-UHFFFAOYSA-N 9-[4-(4-carbazol-9-ylphenyl)phenyl]carbazole Chemical group C12=CC=CC=C2C2=CC=CC=C2N1C1=CC=C(C=2C=CC(=CC=2)N2C3=CC=CC=C3C3=CC=CC=C32)C=C1 VFUDMQLBKNMONU-UHFFFAOYSA-N 0.000 description 6
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 6
- ZOKXTWBITQBERF-UHFFFAOYSA-N Molybdenum Chemical compound [Mo] ZOKXTWBITQBERF-UHFFFAOYSA-N 0.000 description 6
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 6
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 6
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical group C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 6
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 description 6
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 6
- 229910008449 SnF 2 Inorganic materials 0.000 description 6
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 6
- 229910052783 alkali metal Inorganic materials 0.000 description 6
- 150000001340 alkali metals Chemical class 0.000 description 6
- 229910052786 argon Inorganic materials 0.000 description 6
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 6
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 6
- 230000002950 deficient Effects 0.000 description 6
- TXCDCPKCNAJMEE-UHFFFAOYSA-N dibenzofuran Chemical compound C1=CC=C2C3=CC=CC=C3OC2=C1 TXCDCPKCNAJMEE-UHFFFAOYSA-N 0.000 description 6
- 230000000694 effects Effects 0.000 description 6
- 238000005516 engineering process Methods 0.000 description 6
- 150000004820 halides Chemical class 0.000 description 6
- 238000003384 imaging method Methods 0.000 description 6
- 229910052738 indium Inorganic materials 0.000 description 6
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 description 6
- PQXKHYXIUOZZFA-UHFFFAOYSA-M lithium fluoride Chemical compound [Li+].[F-] PQXKHYXIUOZZFA-UHFFFAOYSA-M 0.000 description 6
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 6
- 229910052761 rare earth metal Inorganic materials 0.000 description 6
- 150000002910 rare earth metals Chemical class 0.000 description 6
- 229910052711 selenium Inorganic materials 0.000 description 6
- 229910052710 silicon Inorganic materials 0.000 description 6
- 239000010703 silicon Substances 0.000 description 6
- 238000000859 sublimation Methods 0.000 description 6
- 230000008022 sublimation Effects 0.000 description 6
- 238000011282 treatment Methods 0.000 description 6
- QPFMBZIOSGYJDE-QDNHWIQGSA-N 1,1,2,2-tetrachlorethane-d2 Chemical compound [2H]C(Cl)(Cl)C([2H])(Cl)Cl QPFMBZIOSGYJDE-QDNHWIQGSA-N 0.000 description 5
- 125000001637 1-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C(*)=C([H])C([H])=C([H])C2=C1[H] 0.000 description 5
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 5
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 5
- CBENFWSGALASAD-UHFFFAOYSA-N Ozone Chemical compound [O-][O+]=O CBENFWSGALASAD-UHFFFAOYSA-N 0.000 description 5
- 239000002253 acid Substances 0.000 description 5
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 5
- 150000001342 alkaline earth metals Chemical class 0.000 description 5
- 229910045601 alloy Inorganic materials 0.000 description 5
- 239000000956 alloy Substances 0.000 description 5
- 125000003277 amino group Chemical group 0.000 description 5
- 125000005577 anthracene group Chemical group 0.000 description 5
- 150000004982 aromatic amines Chemical class 0.000 description 5
- 239000012298 atmosphere Substances 0.000 description 5
- 125000000319 biphenyl-4-yl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1C1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 5
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 5
- 229910052794 bromium Inorganic materials 0.000 description 5
- 239000003086 colorant Substances 0.000 description 5
- 239000010949 copper Substances 0.000 description 5
- DMBHHRLKUKUOEG-UHFFFAOYSA-N diphenylamine Chemical compound C=1C=CC=CC=1NC1=CC=CC=C1 DMBHHRLKUKUOEG-UHFFFAOYSA-N 0.000 description 5
- 238000007599 discharging Methods 0.000 description 5
- 125000006575 electron-withdrawing group Chemical group 0.000 description 5
- 238000001704 evaporation Methods 0.000 description 5
- 230000008020 evaporation Effects 0.000 description 5
- 238000001914 filtration Methods 0.000 description 5
- 238000010304 firing Methods 0.000 description 5
- 238000004768 lowest unoccupied molecular orbital Methods 0.000 description 5
- 239000012046 mixed solvent Substances 0.000 description 5
- 229910052750 molybdenum Inorganic materials 0.000 description 5
- 239000011733 molybdenum Substances 0.000 description 5
- CWQXQMHSOZUFJS-UHFFFAOYSA-N molybdenum disulfide Chemical compound S=[Mo]=S CWQXQMHSOZUFJS-UHFFFAOYSA-N 0.000 description 5
- UFWIBTONFRDIAS-UHFFFAOYSA-N naphthalene-acid Natural products C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 5
- 239000012299 nitrogen atmosphere Substances 0.000 description 5
- QGLKJKCYBOYXKC-UHFFFAOYSA-N nonaoxidotritungsten Chemical compound O=[W]1(=O)O[W](=O)(=O)O[W](=O)(=O)O1 QGLKJKCYBOYXKC-UHFFFAOYSA-N 0.000 description 5
- 125000002524 organometallic group Chemical group 0.000 description 5
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 5
- 229920000728 polyester Polymers 0.000 description 5
- 238000000746 purification Methods 0.000 description 5
- 125000000714 pyrimidinyl group Chemical group 0.000 description 5
- 230000009467 reduction Effects 0.000 description 5
- 229910001930 tungsten oxide Inorganic materials 0.000 description 5
- UKSZBOKPHAQOMP-SVLSSHOZSA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 UKSZBOKPHAQOMP-SVLSSHOZSA-N 0.000 description 4
- JHAAGSWHIJTNOT-UHFFFAOYSA-N 3,6-bis(5-chloro-2-fluorophenyl)naphthalene-2,7-diol Chemical compound ClC=1C=CC(=C(C=1)C=1C(=CC2=CC(=C(C=C2C=1)C1=C(C=CC(=C1)Cl)F)O)O)F JHAAGSWHIJTNOT-UHFFFAOYSA-N 0.000 description 4
- WQRYZOAFWABMBD-UHFFFAOYSA-N 3-(4-phenanthren-9-ylphenyl)-9-phenylcarbazole Chemical compound C1=CC=CC=C1N1C2=CC=C(C=3C=CC(=CC=3)C=3C4=CC=CC=C4C4=CC=CC=C4C=3)C=C2C2=CC=CC=C21 WQRYZOAFWABMBD-UHFFFAOYSA-N 0.000 description 4
- AZFHXIBNMPIGOD-UHFFFAOYSA-N 4-hydroxypent-3-en-2-one iridium Chemical compound [Ir].CC(O)=CC(C)=O.CC(O)=CC(C)=O.CC(O)=CC(C)=O AZFHXIBNMPIGOD-UHFFFAOYSA-N 0.000 description 4
- OSEYRMLILPOFGJ-UHFFFAOYSA-N BrC=1C(=CC2=CC(=C(C=C2C=1)C1=C(C=CC=C1)F)OC)OC Chemical compound BrC=1C(=CC2=CC(=C(C=C2C=1)C1=C(C=CC=C1)F)OC)OC OSEYRMLILPOFGJ-UHFFFAOYSA-N 0.000 description 4
- JEUYUOHNNTYECN-UHFFFAOYSA-N ClC=1C=CC(=C(C=1)C=1C(=CC2=CC(=C(C=C2C=1)C1=C(C=CC(=C1)Cl)F)OC)OC)F Chemical compound ClC=1C=CC(=C(C=1)C=1C(=CC2=CC(=C(C=C2C=1)C1=C(C=CC(=C1)Cl)F)OC)OC)F JEUYUOHNNTYECN-UHFFFAOYSA-N 0.000 description 4
- PDGZOVJRGHBAGK-UHFFFAOYSA-N FC1=C(C=CC=C1)C=1C(=CC2=CC(=C(C=C2C=1)C1=C(C=C(C=C1)Cl)F)O)O Chemical compound FC1=C(C=CC=C1)C=1C(=CC2=CC(=C(C=C2C=1)C1=C(C=C(C=C1)Cl)F)O)O PDGZOVJRGHBAGK-UHFFFAOYSA-N 0.000 description 4
- CIKHLZFHXWHEJZ-UHFFFAOYSA-N FC1=C(C=CC=C1)C=1C(=CC2=CC(=C(C=C2C=1)C1=C(C=C(C=C1)Cl)F)OC)OC Chemical compound FC1=C(C=CC=C1)C=1C(=CC2=CC(=C(C=C2C=1)C1=C(C=C(C=C1)Cl)F)OC)OC CIKHLZFHXWHEJZ-UHFFFAOYSA-N 0.000 description 4
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 4
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical group C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 4
- 239000005083 Zinc sulfide Substances 0.000 description 4
- 125000000217 alkyl group Chemical group 0.000 description 4
- 125000005428 anthryl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C3C(*)=C([H])C([H])=C([H])C3=C([H])C2=C1[H] 0.000 description 4
- 229910052785 arsenic Inorganic materials 0.000 description 4
- 125000001769 aryl amino group Chemical group 0.000 description 4
- HTJWUNNIRKDDIV-UHFFFAOYSA-N bis(1-adamantyl)-butylphosphane Chemical compound C1C(C2)CC(C3)CC2CC13P(CCCC)C1(C2)CC(C3)CC2CC3C1 HTJWUNNIRKDDIV-UHFFFAOYSA-N 0.000 description 4
- 229910052793 cadmium Inorganic materials 0.000 description 4
- BDOSMKKIYDKNTQ-UHFFFAOYSA-N cadmium atom Chemical compound [Cd] BDOSMKKIYDKNTQ-UHFFFAOYSA-N 0.000 description 4
- XJHCXCQVJFPJIK-UHFFFAOYSA-M caesium fluoride Chemical compound [F-].[Cs+] XJHCXCQVJFPJIK-UHFFFAOYSA-M 0.000 description 4
- 230000008859 change Effects 0.000 description 4
- 239000000460 chlorine Substances 0.000 description 4
- 229910052801 chlorine Inorganic materials 0.000 description 4
- 238000000576 coating method Methods 0.000 description 4
- 230000021615 conjugation Effects 0.000 description 4
- 125000004093 cyano group Chemical group *C#N 0.000 description 4
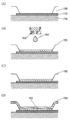
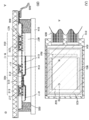
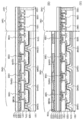
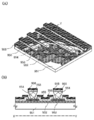
- 238000010586 diagram Methods 0.000 description 4
- IYYZUPMFVPLQIF-UHFFFAOYSA-N dibenzothiophene Chemical compound C1=CC=C2C3=CC=CC=C3SC2=C1 IYYZUPMFVPLQIF-UHFFFAOYSA-N 0.000 description 4
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 4
- 125000005842 heteroatom Chemical group 0.000 description 4
- AMWRITDGCCNYAT-UHFFFAOYSA-L hydroxy(oxo)manganese;manganese Chemical compound [Mn].O[Mn]=O.O[Mn]=O AMWRITDGCCNYAT-UHFFFAOYSA-L 0.000 description 4
- 229910003437 indium oxide Inorganic materials 0.000 description 4
- PJXISJQVUVHSOJ-UHFFFAOYSA-N indium(iii) oxide Chemical compound [O-2].[O-2].[O-2].[In+3].[In+3] PJXISJQVUVHSOJ-UHFFFAOYSA-N 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- 239000011777 magnesium Substances 0.000 description 4
- AUHZEENZYGFFBQ-UHFFFAOYSA-N mesitylene Substances CC1=CC(C)=CC(C)=C1 AUHZEENZYGFFBQ-UHFFFAOYSA-N 0.000 description 4
- 125000001827 mesitylenyl group Chemical group [H]C1=C(C(*)=C(C([H])=C1C([H])([H])[H])C([H])([H])[H])C([H])([H])[H] 0.000 description 4
- 150000002825 nitriles Chemical class 0.000 description 4
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 4
- 125000005561 phenanthryl group Chemical group 0.000 description 4
- 125000000843 phenylene group Chemical group C1(=C(C=CC=C1)*)* 0.000 description 4
- 229920003023 plastic Polymers 0.000 description 4
- 239000004033 plastic Substances 0.000 description 4
- 229920000767 polyaniline Polymers 0.000 description 4
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 4
- 125000003373 pyrazinyl group Chemical group 0.000 description 4
- 239000002994 raw material Substances 0.000 description 4
- 238000004528 spin coating Methods 0.000 description 4
- 239000011593 sulfur Substances 0.000 description 4
- 239000013076 target substance Substances 0.000 description 4
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 4
- COIOYMYWGDAQPM-UHFFFAOYSA-N tris(2-methylphenyl)phosphane Chemical compound CC1=CC=CC=C1P(C=1C(=CC=CC=1)C)C1=CC=CC=C1C COIOYMYWGDAQPM-UHFFFAOYSA-N 0.000 description 4
- WFKWXMTUELFFGS-UHFFFAOYSA-N tungsten Chemical compound [W] WFKWXMTUELFFGS-UHFFFAOYSA-N 0.000 description 4
- 229910052721 tungsten Inorganic materials 0.000 description 4
- 239000010937 tungsten Substances 0.000 description 4
- 239000011701 zinc Substances 0.000 description 4
- 239000011787 zinc oxide Substances 0.000 description 4
- 229910052984 zinc sulfide Inorganic materials 0.000 description 4
- IXKYNFRCDWZQOX-UHFFFAOYSA-N 2,7-dibromo-3,6-dimethoxynaphthalene Chemical compound COC1=C(Br)C=C2C=C(Br)C(OC)=CC2=C1 IXKYNFRCDWZQOX-UHFFFAOYSA-N 0.000 description 3
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 3
- WUPHOULIZUERAE-UHFFFAOYSA-N 3-(oxolan-2-yl)propanoic acid Chemical compound OC(=O)CCC1CCCO1 WUPHOULIZUERAE-UHFFFAOYSA-N 0.000 description 3
- JFHIIYSJKXQYIJ-UHFFFAOYSA-N 7-[4-(10-phenyl-9-anthryl)phenyl]-7h-dibenzo[c,g]carbazole Chemical compound C1=CC=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=C(N2C3=C(C4=CC=CC=C4C=C3)C3=C4C=CC=CC4=CC=C32)C=C1 JFHIIYSJKXQYIJ-UHFFFAOYSA-N 0.000 description 3
- UQVFZEYHQJJGPD-UHFFFAOYSA-N 9-[4-(10-phenylanthracen-9-yl)phenyl]carbazole Chemical compound C1=CC=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=C(N2C3=CC=CC=C3C3=CC=CC=C32)C=C1 UQVFZEYHQJJGPD-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical group C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 3
- YNPNZTXNASCQKK-UHFFFAOYSA-N Phenanthrene Natural products C1=CC=C2C3=CC=CC=C3C=CC2=C1 YNPNZTXNASCQKK-UHFFFAOYSA-N 0.000 description 3
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 3
- 239000002202 Polyethylene glycol Substances 0.000 description 3
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 3
- DGEZNRSVGBDHLK-UHFFFAOYSA-N [1,10]phenanthroline Chemical compound C1=CN=C2C3=NC=CC=C3C=CC2=C1 DGEZNRSVGBDHLK-UHFFFAOYSA-N 0.000 description 3
- XHCLAFWTIXFWPH-UHFFFAOYSA-N [O-2].[O-2].[O-2].[O-2].[O-2].[V+5].[V+5] Chemical compound [O-2].[O-2].[O-2].[O-2].[O-2].[V+5].[V+5] XHCLAFWTIXFWPH-UHFFFAOYSA-N 0.000 description 3
- NIXOWILDQLNWCW-UHFFFAOYSA-N acrylic acid group Chemical group C(C=C)(=O)O NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 3
- 125000005103 alkyl silyl group Chemical group 0.000 description 3
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 3
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 3
- RQNWIZPPADIBDY-UHFFFAOYSA-N arsenic atom Chemical compound [As] RQNWIZPPADIBDY-UHFFFAOYSA-N 0.000 description 3
- 125000006267 biphenyl group Chemical group 0.000 description 3
- 229910052980 cadmium sulfide Inorganic materials 0.000 description 3
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 3
- 229910000024 caesium carbonate Inorganic materials 0.000 description 3
- 229910052800 carbon group element Inorganic materials 0.000 description 3
- 229910052798 chalcogen Inorganic materials 0.000 description 3
- 238000001816 cooling Methods 0.000 description 3
- 230000008021 deposition Effects 0.000 description 3
- 230000006866 deterioration Effects 0.000 description 3
- 235000014113 dietary fatty acids Nutrition 0.000 description 3
- ATUOYWHBWRKTHZ-UHFFFAOYSA-N dimethylmethane Natural products CCC ATUOYWHBWRKTHZ-UHFFFAOYSA-N 0.000 description 3
- DKHNGUNXLDCATP-UHFFFAOYSA-N dipyrazino[2,3-f:2',3'-h]quinoxaline-2,3,6,7,10,11-hexacarbonitrile Chemical group C12=NC(C#N)=C(C#N)N=C2C2=NC(C#N)=C(C#N)N=C2C2=C1N=C(C#N)C(C#N)=N2 DKHNGUNXLDCATP-UHFFFAOYSA-N 0.000 description 3
- 239000000194 fatty acid Substances 0.000 description 3
- 229930195729 fatty acid Natural products 0.000 description 3
- 230000002349 favourable effect Effects 0.000 description 3
- 229910052733 gallium Inorganic materials 0.000 description 3
- 230000005484 gravity Effects 0.000 description 3
- 238000004770 highest occupied molecular orbital Methods 0.000 description 3
- SMWDFEZZVXVKRB-UHFFFAOYSA-O hydron;quinoline Chemical compound [NH+]1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-O 0.000 description 3
- 238000004020 luminiscence type Methods 0.000 description 3
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 3
- 235000019341 magnesium sulphate Nutrition 0.000 description 3
- 239000003550 marker Substances 0.000 description 3
- 229910044991 metal oxide Inorganic materials 0.000 description 3
- 150000004706 metal oxides Chemical class 0.000 description 3
- 125000001624 naphthyl group Chemical group 0.000 description 3
- 230000003287 optical effect Effects 0.000 description 3
- LXNAVEXFUKBNMK-UHFFFAOYSA-N palladium(II) acetate Substances [Pd].CC(O)=O.CC(O)=O LXNAVEXFUKBNMK-UHFFFAOYSA-N 0.000 description 3
- 230000000737 periodic effect Effects 0.000 description 3
- 125000002080 perylenyl group Chemical group C1(=CC=C2C=CC=C3C4=CC=CC5=CC=CC(C1=C23)=C45)* 0.000 description 3
- CSHWQDPOILHKBI-UHFFFAOYSA-N peryrene Natural products C1=CC(C2=CC=CC=3C2=C2C=CC=3)=C3C2=CC=CC3=C1 CSHWQDPOILHKBI-UHFFFAOYSA-N 0.000 description 3
- 229910052697 platinum Inorganic materials 0.000 description 3
- 229910052696 pnictogen Inorganic materials 0.000 description 3
- 229920001223 polyethylene glycol Polymers 0.000 description 3
- 229920001721 polyimide Polymers 0.000 description 3
- 238000012545 processing Methods 0.000 description 3
- 239000001294 propane Substances 0.000 description 3
- 125000006239 protecting group Chemical group 0.000 description 3
- 239000003223 protective agent Substances 0.000 description 3
- 239000011347 resin Substances 0.000 description 3
- 229920005989 resin Polymers 0.000 description 3
- 229920006395 saturated elastomer Polymers 0.000 description 3
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 3
- 235000017557 sodium bicarbonate Nutrition 0.000 description 3
- 238000003860 storage Methods 0.000 description 3
- 238000006467 substitution reaction Methods 0.000 description 3
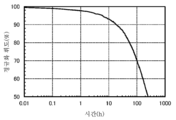
- 230000036962 time dependent Effects 0.000 description 3
- 229910052718 tin Inorganic materials 0.000 description 3
- 239000010936 titanium Substances 0.000 description 3
- OGIDPMRJRNCKJF-UHFFFAOYSA-N titanium oxide Inorganic materials [Ti]=O OGIDPMRJRNCKJF-UHFFFAOYSA-N 0.000 description 3
- 125000003960 triphenylenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C3=CC=CC=C3C12)* 0.000 description 3
- 229910001935 vanadium oxide Inorganic materials 0.000 description 3
- 229910052725 zinc Inorganic materials 0.000 description 3
- RVPCPPWNSMAZKR-UHFFFAOYSA-N (10-phenylanthracen-9-yl)boronic acid Chemical compound C12=CC=CC=C2C(B(O)O)=C2C=CC=CC2=C1C1=CC=CC=C1 RVPCPPWNSMAZKR-UHFFFAOYSA-N 0.000 description 2
- YBNDRTRLXPEWKQ-UHFFFAOYSA-N (4-chloro-2-fluorophenyl)boronic acid Chemical compound OB(O)C1=CC=C(Cl)C=C1F YBNDRTRLXPEWKQ-UHFFFAOYSA-N 0.000 description 2
- SKJCKYVIQGBWTN-UHFFFAOYSA-N (4-hydroxyphenyl) methanesulfonate Chemical compound CS(=O)(=O)OC1=CC=C(O)C=C1 SKJCKYVIQGBWTN-UHFFFAOYSA-N 0.000 description 2
- PFNQVRZLDWYSCW-UHFFFAOYSA-N (fluoren-9-ylideneamino) n-naphthalen-1-ylcarbamate Chemical compound C12=CC=CC=C2C2=CC=CC=C2C1=NOC(=O)NC1=CC=CC2=CC=CC=C12 PFNQVRZLDWYSCW-UHFFFAOYSA-N 0.000 description 2
- YJTKZCDBKVTVBY-UHFFFAOYSA-N 1,3-Diphenylbenzene Chemical group C1=CC=CC=C1C1=CC=CC(C=2C=CC=CC=2)=C1 YJTKZCDBKVTVBY-UHFFFAOYSA-N 0.000 description 2
- 125000001989 1,3-phenylene group Chemical group [H]C1=C([H])C([*:1])=C([H])C([*:2])=C1[H] 0.000 description 2
- UHXOHPVVEHBKKT-UHFFFAOYSA-N 1-(2,2-diphenylethenyl)-4-[4-(2,2-diphenylethenyl)phenyl]benzene Chemical group C=1C=C(C=2C=CC(C=C(C=3C=CC=CC=3)C=3C=CC=CC=3)=CC=2)C=CC=1C=C(C=1C=CC=CC=1)C1=CC=CC=C1 UHXOHPVVEHBKKT-UHFFFAOYSA-N 0.000 description 2
- IHGSAQHSAGRWNI-UHFFFAOYSA-N 1-(4-bromophenyl)-2,2,2-trifluoroethanone Chemical compound FC(F)(F)C(=O)C1=CC=C(Br)C=C1 IHGSAQHSAGRWNI-UHFFFAOYSA-N 0.000 description 2
- SPDPTFAJSFKAMT-UHFFFAOYSA-N 1-n-[4-[4-(n-[4-(3-methyl-n-(3-methylphenyl)anilino)phenyl]anilino)phenyl]phenyl]-4-n,4-n-bis(3-methylphenyl)-1-n-phenylbenzene-1,4-diamine Chemical compound CC1=CC=CC(N(C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C=CC(=CC=2)C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C=CC(=CC=2)N(C=2C=C(C)C=CC=2)C=2C=C(C)C=CC=2)C=2C=C(C)C=CC=2)=C1 SPDPTFAJSFKAMT-UHFFFAOYSA-N 0.000 description 2
- ZABORCXHTNWZRV-UHFFFAOYSA-N 10-[4-(4,6-diphenyl-1,3,5-triazin-2-yl)phenyl]phenoxazine Chemical compound O1C2=CC=CC=C2N(C2=CC=C(C=C2)C2=NC(=NC(=N2)C2=CC=CC=C2)C2=CC=CC=C2)C2=C1C=CC=C2 ZABORCXHTNWZRV-UHFFFAOYSA-N 0.000 description 2
- CYPVTICNYNXTQP-UHFFFAOYSA-N 10-[4-[4-(9,9-dimethylacridin-10-yl)phenyl]sulfonylphenyl]-9,9-dimethylacridine Chemical compound C12=CC=CC=C2C(C)(C)C2=CC=CC=C2N1C1=CC=C(S(=O)(=O)C=2C=CC(=CC=2)N2C3=CC=CC=C3C(C)(C)C3=CC=CC=C32)C=C1 CYPVTICNYNXTQP-UHFFFAOYSA-N 0.000 description 2
- ASXSTQHYXCIZRV-UHFFFAOYSA-N 10-phenylspiro[acridine-9,10'-anthracene]-9'-one Chemical compound C12=CC=CC=C2C(=O)C2=CC=CC=C2C1(C1=CC=CC=C11)C2=CC=CC=C2N1C1=CC=CC=C1 ASXSTQHYXCIZRV-UHFFFAOYSA-N 0.000 description 2
- CNSRBJWFPJMRFB-UHFFFAOYSA-N 2,8-diphenyl-4-[4-(9-phenylfluoren-9-yl)phenyl]dibenzothiophene Chemical compound C1=CC=CC=C1C1=CC=C(SC=2C3=CC(=CC=2C=2C=CC(=CC=2)C2(C4=CC=CC=C4C4=CC=CC=C42)C=2C=CC=CC=2)C=2C=CC=CC=2)C3=C1 CNSRBJWFPJMRFB-UHFFFAOYSA-N 0.000 description 2
- GEQBRULPNIVQPP-UHFFFAOYSA-N 2-[3,5-bis(1-phenylbenzimidazol-2-yl)phenyl]-1-phenylbenzimidazole Chemical compound C1=CC=CC=C1N1C2=CC=CC=C2N=C1C1=CC(C=2N(C3=CC=CC=C3N=2)C=2C=CC=CC=2)=CC(C=2N(C3=CC=CC=C3N=2)C=2C=CC=CC=2)=C1 GEQBRULPNIVQPP-UHFFFAOYSA-N 0.000 description 2
- WBPXZSIKOVBSAS-UHFFFAOYSA-N 2-tert-butylanthracene Chemical compound C1=CC=CC2=CC3=CC(C(C)(C)C)=CC=C3C=C21 WBPXZSIKOVBSAS-UHFFFAOYSA-N 0.000 description 2
- WAJDLGKOJABKAN-UHFFFAOYSA-N 3-(4-naphthalen-1-ylphenyl)-9-phenylcarbazole Chemical compound C1=CC=CC=C1N1C2=CC=C(C=3C=CC(=CC=3)C=3C4=CC=CC=C4C=CC=3)C=C2C2=CC=CC=C21 WAJDLGKOJABKAN-UHFFFAOYSA-N 0.000 description 2
- ZVFQEOPUXVPSLB-UHFFFAOYSA-N 3-(4-tert-butylphenyl)-4-phenyl-5-(4-phenylphenyl)-1,2,4-triazole Chemical compound C1=CC(C(C)(C)C)=CC=C1C(N1C=2C=CC=CC=2)=NN=C1C1=CC=C(C=2C=CC=CC=2)C=C1 ZVFQEOPUXVPSLB-UHFFFAOYSA-N 0.000 description 2
- FTZXDZQJFKXEGW-UHFFFAOYSA-N 3-(9,9-dimethylacridin-10-yl)xanthen-9-one Chemical compound C12=CC=CC=C2C(C)(C)C2=CC=CC=C2N1C1=CC=C2C(=O)C3=CC=CC=C3OC2=C1 FTZXDZQJFKXEGW-UHFFFAOYSA-N 0.000 description 2
- CINYXYWQPZSTOT-UHFFFAOYSA-N 3-[3-[3,5-bis(3-pyridin-3-ylphenyl)phenyl]phenyl]pyridine Chemical compound C1=CN=CC(C=2C=C(C=CC=2)C=2C=C(C=C(C=2)C=2C=C(C=CC=2)C=2C=NC=CC=2)C=2C=C(C=CC=2)C=2C=NC=CC=2)=C1 CINYXYWQPZSTOT-UHFFFAOYSA-N 0.000 description 2
- OGGKVJMNFFSDEV-UHFFFAOYSA-N 3-methyl-n-[4-[4-(n-(3-methylphenyl)anilino)phenyl]phenyl]-n-phenylaniline Chemical compound CC1=CC=CC(N(C=2C=CC=CC=2)C=2C=CC(=CC=2)C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C=C(C)C=CC=2)=C1 OGGKVJMNFFSDEV-UHFFFAOYSA-N 0.000 description 2
- QIHHYQWNYKOHEV-UHFFFAOYSA-N 4-tert-butyl-3-nitrobenzoic acid Chemical compound CC(C)(C)C1=CC=C(C(O)=O)C=C1[N+]([O-])=O QIHHYQWNYKOHEV-UHFFFAOYSA-N 0.000 description 2
- MARUHZGHZWCEQU-UHFFFAOYSA-N 5-phenyl-2h-tetrazole Chemical compound C1=CC=CC=C1C1=NNN=N1 MARUHZGHZWCEQU-UHFFFAOYSA-N 0.000 description 2
- WTHBTUVMXUWUNO-UHFFFAOYSA-N 6-[3-(9,10-diphenylanthracen-2-yl)phenyl]naphtho[2,1-b][1]benzofuran Chemical compound C1=CC=CC=C1C(C1=CC=C(C=C11)C=2C=C(C=CC=2)C=2C=3OC4=CC=CC=C4C=3C3=CC=CC=C3C=2)=C(C=CC=C2)C2=C1C1=CC=CC=C1 WTHBTUVMXUWUNO-UHFFFAOYSA-N 0.000 description 2
- QUSBGJQBCNEPES-UHFFFAOYSA-N 9,9-dimethyl-n-phenyl-n-[4-(9-phenylcarbazol-3-yl)phenyl]fluoren-2-amine Chemical compound C1=C2C(C)(C)C3=CC=CC=C3C2=CC=C1N(C=1C=CC(=CC=1)C=1C=C2C3=CC=CC=C3N(C=3C=CC=CC=3)C2=CC=1)C1=CC=CC=C1 QUSBGJQBCNEPES-UHFFFAOYSA-N 0.000 description 2
- MZYDBGLUVPLRKR-UHFFFAOYSA-N 9-(3-carbazol-9-ylphenyl)carbazole Chemical compound C12=CC=CC=C2C2=CC=CC=C2N1C1=CC(N2C3=CC=CC=C3C3=CC=CC=C32)=CC=C1 MZYDBGLUVPLRKR-UHFFFAOYSA-N 0.000 description 2
- VIJYEGDOKCKUOL-UHFFFAOYSA-N 9-phenylcarbazole Chemical compound C1=CC=CC=C1N1C2=CC=CC=C2C2=CC=CC=C21 VIJYEGDOKCKUOL-UHFFFAOYSA-N 0.000 description 2
- ZYNFGMXIAPFYDQ-UHFFFAOYSA-N C1=CC=C(C=C1)N1C(=NN=C1C1=CC=C(C=C1)N1C2=CC=CC=C2N(C2=CC=CC=C2)C2=CC=CC=C12)C1=CC=CC=C1 Chemical compound C1=CC=C(C=C1)N1C(=NN=C1C1=CC=C(C=C1)N1C2=CC=CC=C2N(C2=CC=CC=C2)C2=CC=CC=C12)C1=CC=CC=C1 ZYNFGMXIAPFYDQ-UHFFFAOYSA-N 0.000 description 2
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 2
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 2
- 108091006149 Electron carriers Proteins 0.000 description 2
- 229920002430 Fibre-reinforced plastic Polymers 0.000 description 2
- GYHNNYVSQQEPJS-UHFFFAOYSA-N Gallium Chemical compound [Ga] GYHNNYVSQQEPJS-UHFFFAOYSA-N 0.000 description 2
- JMASRVWKEDWRBT-UHFFFAOYSA-N Gallium nitride Chemical compound [Ga]#N JMASRVWKEDWRBT-UHFFFAOYSA-N 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 2
- VUMVABVDHWICAZ-UHFFFAOYSA-N N-phenyl-N-[4-[4-[N-(9,9'-spirobi[fluorene]-2-yl)anilino]phenyl]phenyl]-9,9'-spirobi[fluorene]-2-amine Chemical group C1=CC=CC=C1N(C=1C=C2C3(C4=CC=CC=C4C4=CC=CC=C43)C3=CC=CC=C3C2=CC=1)C1=CC=C(C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C=C3C4(C5=CC=CC=C5C5=CC=CC=C54)C4=CC=CC=C4C3=CC=2)C=C1 VUMVABVDHWICAZ-UHFFFAOYSA-N 0.000 description 2
- 229920001609 Poly(3,4-ethylenedioxythiophene) Polymers 0.000 description 2
- 239000004642 Polyimide Substances 0.000 description 2
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 2
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 2
- UCKMPCXJQFINFW-UHFFFAOYSA-N Sulphide Chemical compound [S-2] UCKMPCXJQFINFW-UHFFFAOYSA-N 0.000 description 2
- 238000006161 Suzuki-Miyaura coupling reaction Methods 0.000 description 2
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 2
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 2
- TXTQARDVRPFFHL-UHFFFAOYSA-N [Sb].[H][H] Chemical compound [Sb].[H][H] TXTQARDVRPFFHL-UHFFFAOYSA-N 0.000 description 2
- 230000001133 acceleration Effects 0.000 description 2
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical compound C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 2
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 2
- 230000002776 aggregation Effects 0.000 description 2
- 238000004220 aggregation Methods 0.000 description 2
- 150000001339 alkali metal compounds Chemical class 0.000 description 2
- 150000001341 alkaline earth metal compounds Chemical class 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 239000004760 aramid Substances 0.000 description 2
- 229920003235 aromatic polyamide Polymers 0.000 description 2
- CJDPJFRMHVXWPT-UHFFFAOYSA-N barium sulfide Chemical compound [S-2].[Ba+2] CJDPJFRMHVXWPT-UHFFFAOYSA-N 0.000 description 2
- JDIBGQFKXXXXPN-UHFFFAOYSA-N bismuth(3+) Chemical compound [Bi+3] JDIBGQFKXXXXPN-UHFFFAOYSA-N 0.000 description 2
- 229910052795 boron group element Inorganic materials 0.000 description 2
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 2
- FIIBTVXVWDIJAX-UHFFFAOYSA-N c(cc1)ccc1N(c1ccccc1)c1ccc(c(c([o]2)cc3c4)cc3cc3c4[o]c4cc(N(c5ccccc5)c5ccccc5)ccc34)c2c1 Chemical compound c(cc1)ccc1N(c1ccccc1)c1ccc(c(c([o]2)cc3c4)cc3cc3c4[o]c4cc(N(c5ccccc5)c5ccccc5)ccc34)c2c1 FIIBTVXVWDIJAX-UHFFFAOYSA-N 0.000 description 2
- 239000011575 calcium Substances 0.000 description 2
- JGIATAMCQXIDNZ-UHFFFAOYSA-N calcium sulfide Chemical compound [Ca]=S JGIATAMCQXIDNZ-UHFFFAOYSA-N 0.000 description 2
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical compound OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 2
- 239000003054 catalyst Substances 0.000 description 2
- 239000011651 chromium Substances 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 238000004440 column chromatography Methods 0.000 description 2
- 238000004891 communication Methods 0.000 description 2
- 239000004020 conductor Substances 0.000 description 2
- 229910052802 copper Inorganic materials 0.000 description 2
- 239000011258 core-shell material Substances 0.000 description 2
- VPUGDVKSAQVFFS-UHFFFAOYSA-N coronene Chemical compound C1=C(C2=C34)C=CC3=CC=C(C=C3)C4=C4C3=CC=C(C=C3)C4=C2C3=C1 VPUGDVKSAQVFFS-UHFFFAOYSA-N 0.000 description 2
- 238000006880 cross-coupling reaction Methods 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 238000007766 curtain coating Methods 0.000 description 2
- 125000004122 cyclic group Chemical group 0.000 description 2
- JHIVVAPYMSGYDF-UHFFFAOYSA-N cyclohexanone Chemical compound O=C1CCCCC1 JHIVVAPYMSGYDF-UHFFFAOYSA-N 0.000 description 2
- NNBZCPXTIHJBJL-UHFFFAOYSA-N decalin Chemical compound C1CCCC2CCCCC21 NNBZCPXTIHJBJL-UHFFFAOYSA-N 0.000 description 2
- 230000007547 defect Effects 0.000 description 2
- 230000003111 delayed effect Effects 0.000 description 2
- 239000002274 desiccant Substances 0.000 description 2
- 125000005266 diarylamine group Chemical group 0.000 description 2
- 238000007607 die coating method Methods 0.000 description 2
- SBZXBUIDTXKZTM-UHFFFAOYSA-N diglyme Chemical compound COCCOCCOC SBZXBUIDTXKZTM-UHFFFAOYSA-N 0.000 description 2
- SNRUBQQJIBEYMU-UHFFFAOYSA-N dodecane Chemical compound CCCCCCCCCCCC SNRUBQQJIBEYMU-UHFFFAOYSA-N 0.000 description 2
- ADHNFLCTOCFIFV-UHFFFAOYSA-N europium(3+) 1,10-phenanthroline Chemical compound [Eu+3].c1cnc2c(c1)ccc1cccnc21 ADHNFLCTOCFIFV-UHFFFAOYSA-N 0.000 description 2
- 230000001747 exhibiting effect Effects 0.000 description 2
- 239000000835 fiber Substances 0.000 description 2
- 239000011151 fibre-reinforced plastic Substances 0.000 description 2
- 239000000945 filler Substances 0.000 description 2
- 239000011888 foil Substances 0.000 description 2
- 239000010931 gold Substances 0.000 description 2
- 238000007646 gravure printing Methods 0.000 description 2
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 2
- WPYVAWXEWQSOGY-UHFFFAOYSA-N indium antimonide Chemical compound [Sb]#[In] WPYVAWXEWQSOGY-UHFFFAOYSA-N 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 150000002503 iridium Chemical class 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- XGZVUEUWXADBQD-UHFFFAOYSA-L lithium carbonate Chemical compound [Li+].[Li+].[O-]C([O-])=O XGZVUEUWXADBQD-UHFFFAOYSA-L 0.000 description 2
- 229910052808 lithium carbonate Inorganic materials 0.000 description 2
- FUJCRWPEOMXPAD-UHFFFAOYSA-N lithium oxide Chemical compound [Li+].[Li+].[O-2] FUJCRWPEOMXPAD-UHFFFAOYSA-N 0.000 description 2
- 229910001947 lithium oxide Inorganic materials 0.000 description 2
- 125000000040 m-tolyl group Chemical group [H]C1=C([H])C(*)=C([H])C(=C1[H])C([H])([H])[H] 0.000 description 2
- 229910052749 magnesium Inorganic materials 0.000 description 2
- 239000007769 metal material Substances 0.000 description 2
- MGIYCRUAYQQSNL-UHFFFAOYSA-N methyl 2-bromo-4-methoxybenzoate Chemical compound COC(=O)C1=CC=C(OC)C=C1Br MGIYCRUAYQQSNL-UHFFFAOYSA-N 0.000 description 2
- IBHBKWKFFTZAHE-UHFFFAOYSA-N n-[4-[4-(n-naphthalen-1-ylanilino)phenyl]phenyl]-n-phenylnaphthalen-1-amine Chemical group C1=CC=CC=C1N(C=1C2=CC=CC=C2C=CC=1)C1=CC=C(C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C3=CC=CC=C3C=CC=2)C=C1 IBHBKWKFFTZAHE-UHFFFAOYSA-N 0.000 description 2
- 125000003261 o-tolyl group Chemical group [H]C1=C([H])C(*)=C(C([H])=C1[H])C([H])([H])[H] 0.000 description 2
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 2
- 238000007645 offset printing Methods 0.000 description 2
- 230000001151 other effect Effects 0.000 description 2
- 230000003647 oxidation Effects 0.000 description 2
- 238000007254 oxidation reaction Methods 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- BPUBBGLMJRNUCC-UHFFFAOYSA-N oxygen(2-);tantalum(5+) Chemical compound [O-2].[O-2].[O-2].[O-2].[O-2].[Ta+5].[Ta+5] BPUBBGLMJRNUCC-UHFFFAOYSA-N 0.000 description 2
- RVTZCBVAJQQJTK-UHFFFAOYSA-N oxygen(2-);zirconium(4+) Chemical compound [O-2].[O-2].[Zr+4] RVTZCBVAJQQJTK-UHFFFAOYSA-N 0.000 description 2
- 229910052763 palladium Inorganic materials 0.000 description 2
- 230000002093 peripheral effect Effects 0.000 description 2
- 229910052698 phosphorus Inorganic materials 0.000 description 2
- 239000011574 phosphorus Substances 0.000 description 2
- 229920003227 poly(N-vinyl carbazole) Polymers 0.000 description 2
- 229920000172 poly(styrenesulfonic acid) Polymers 0.000 description 2
- 229920000139 polyethylene terephthalate Polymers 0.000 description 2
- 239000005020 polyethylene terephthalate Substances 0.000 description 2
- 229920001343 polytetrafluoroethylene Polymers 0.000 description 2
- 239000004810 polytetrafluoroethylene Substances 0.000 description 2
- 229920002635 polyurethane Polymers 0.000 description 2
- 239000004814 polyurethane Substances 0.000 description 2
- 229920002620 polyvinyl fluoride Polymers 0.000 description 2
- 150000004032 porphyrins Chemical class 0.000 description 2
- 239000011591 potassium Substances 0.000 description 2
- 238000010248 power generation Methods 0.000 description 2
- 238000007639 printing Methods 0.000 description 2
- 125000001725 pyrenyl group Chemical group 0.000 description 2
- 150000002909 rare earth metal compounds Chemical class 0.000 description 2
- 230000009257 reactivity Effects 0.000 description 2
- 238000011084 recovery Methods 0.000 description 2
- YYMBJDOZVAITBP-UHFFFAOYSA-N rubrene Chemical compound C1=CC=CC=C1C(C1=C(C=2C=CC=CC=2)C2=CC=CC=C2C(C=2C=CC=CC=2)=C11)=C(C=CC=C2)C2=C1C1=CC=CC=C1 YYMBJDOZVAITBP-UHFFFAOYSA-N 0.000 description 2
- 150000003335 secondary amines Chemical class 0.000 description 2
- NDVLTYZPCACLMA-UHFFFAOYSA-N silver oxide Chemical compound [O-2].[Ag+].[Ag+] NDVLTYZPCACLMA-UHFFFAOYSA-N 0.000 description 2
- 239000002356 single layer Substances 0.000 description 2
- 238000003980 solgel method Methods 0.000 description 2
- 238000005507 spraying Methods 0.000 description 2
- 239000010935 stainless steel Substances 0.000 description 2
- 229910001220 stainless steel Inorganic materials 0.000 description 2
- 238000001308 synthesis method Methods 0.000 description 2
- 229910001936 tantalum oxide Inorganic materials 0.000 description 2
- JBQYATWDVHIOAR-UHFFFAOYSA-N tellanylidenegermanium Chemical compound [Te]=[Ge] JBQYATWDVHIOAR-UHFFFAOYSA-N 0.000 description 2
- OCGWQDWYSQAFTO-UHFFFAOYSA-N tellanylidenelead Chemical compound [Pb]=[Te] OCGWQDWYSQAFTO-UHFFFAOYSA-N 0.000 description 2
- 229910052714 tellurium Inorganic materials 0.000 description 2
- PORWMNRCUJJQNO-UHFFFAOYSA-N tellurium atom Chemical compound [Te] PORWMNRCUJJQNO-UHFFFAOYSA-N 0.000 description 2
- VZGDMQKNWNREIO-UHFFFAOYSA-N tetrachloromethane Chemical compound ClC(Cl)(Cl)Cl VZGDMQKNWNREIO-UHFFFAOYSA-N 0.000 description 2
- FCEHBMOGCRZNNI-UHFFFAOYSA-N thianaphthalene Natural products C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 description 2
- AFNRRBXCCXDRPS-UHFFFAOYSA-N tin(ii) sulfide Chemical compound [Sn]=S AFNRRBXCCXDRPS-UHFFFAOYSA-N 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 229910000314 transition metal oxide Inorganic materials 0.000 description 2
- 210000003462 vein Anatomy 0.000 description 2
- OYQCBJZGELKKPM-UHFFFAOYSA-N zinc indium(3+) oxygen(2-) Chemical compound [O-2].[Zn+2].[O-2].[In+3] OYQCBJZGELKKPM-UHFFFAOYSA-N 0.000 description 2
- DRDVZXDWVBGGMH-UHFFFAOYSA-N zinc;sulfide Chemical compound [S-2].[Zn+2] DRDVZXDWVBGGMH-UHFFFAOYSA-N 0.000 description 2
- 229910052726 zirconium Inorganic materials 0.000 description 2
- 229910001928 zirconium oxide Inorganic materials 0.000 description 2
- YBNMDCCMCLUHBL-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 4-pyren-1-ylbutanoate Chemical compound C=1C=C(C2=C34)C=CC3=CC=CC4=CC=C2C=1CCCC(=O)ON1C(=O)CCC1=O YBNMDCCMCLUHBL-UHFFFAOYSA-N 0.000 description 1
- QCSLIRFWJPOENV-UHFFFAOYSA-N (2-fluorophenyl)boronic acid Chemical compound OB(O)C1=CC=CC=C1F QCSLIRFWJPOENV-UHFFFAOYSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- MIOPJNTWMNEORI-GMSGAONNSA-N (S)-camphorsulfonic acid Chemical compound C1C[C@@]2(CS(O)(=O)=O)C(=O)C[C@@H]1C2(C)C MIOPJNTWMNEORI-GMSGAONNSA-N 0.000 description 1
- FFJCNSLCJOQHKM-CLFAGFIQSA-N (z)-1-[(z)-octadec-9-enoxy]octadec-9-ene Chemical compound CCCCCCCC\C=C/CCCCCCCCOCCCCCCCC\C=C/CCCCCCCC FFJCNSLCJOQHKM-CLFAGFIQSA-N 0.000 description 1
- IWZZBBJTIUYDPZ-DVACKJPTSA-N (z)-4-hydroxypent-3-en-2-one;iridium;2-phenylpyridine Chemical compound [Ir].C\C(O)=C\C(C)=O.[C-]1=CC=CC=C1C1=CC=CC=N1.[C-]1=CC=CC=C1C1=CC=CC=N1 IWZZBBJTIUYDPZ-DVACKJPTSA-N 0.000 description 1
- XGCDBGRZEKYHNV-UHFFFAOYSA-N 1,1-bis(diphenylphosphino)methane Chemical compound C=1C=CC=CC=1P(C=1C=CC=CC=1)CP(C=1C=CC=CC=1)C1=CC=CC=C1 XGCDBGRZEKYHNV-UHFFFAOYSA-N 0.000 description 1
- RTSZQXSYCGBHMO-UHFFFAOYSA-N 1,2,4-trichloro-3-prop-1-ynoxybenzene Chemical compound CC#COC1=C(Cl)C=CC(Cl)=C1Cl RTSZQXSYCGBHMO-UHFFFAOYSA-N 0.000 description 1
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- OCJBOOLMMGQPQU-UHFFFAOYSA-N 1,4-dichlorobenzene Chemical compound ClC1=CC=C(Cl)C=C1 OCJBOOLMMGQPQU-UHFFFAOYSA-N 0.000 description 1
- 125000001140 1,4-phenylene group Chemical group [H]C1=C([H])C([*:2])=C([H])C([H])=C1[*:1] 0.000 description 1
- FJLUATLTXUNBOT-UHFFFAOYSA-N 1-Hexadecylamine Chemical compound CCCCCCCCCCCCCCCCN FJLUATLTXUNBOT-UHFFFAOYSA-N 0.000 description 1
- XFDYBCQHRPMIGD-UHFFFAOYSA-N 1-N,6-N-bis(3-methylphenyl)-1-N,6-N-bis[3-(9-phenylfluoren-9-yl)phenyl]pyrene-1,6-diamine Chemical compound CC1=CC=CC(N(C=2C=C(C=CC=2)C2(C3=CC=CC=C3C3=CC=CC=C32)C=2C=CC=CC=2)C=2C3=CC=C4C=CC(=C5C=CC(C3=C54)=CC=2)N(C=2C=C(C)C=CC=2)C=2C=C(C=CC=2)C2(C3=CC=CC=C3C3=CC=CC=C32)C=2C=CC=CC=2)=C1 XFDYBCQHRPMIGD-UHFFFAOYSA-N 0.000 description 1
- IPNLBJDLLBQZDZ-UHFFFAOYSA-N 1-N,6-N-diphenyl-1-N,6-N-bis[4-(9-phenylfluoren-9-yl)phenyl]pyrene-1,6-diamine Chemical compound C1=CC=CC=C1N(C=1C2=CC=C3C=CC(=C4C=CC(C2=C43)=CC=1)N(C=1C=CC=CC=1)C=1C=CC(=CC=1)C1(C2=CC=CC=C2C2=CC=CC=C21)C=1C=CC=CC=1)C1=CC=C(C2(C3=CC=CC=C3C3=CC=CC=C32)C=2C=CC=CC=2)C=C1 IPNLBJDLLBQZDZ-UHFFFAOYSA-N 0.000 description 1
- IANQTJSKSUMEQM-UHFFFAOYSA-N 1-benzofuran Chemical group C1=CC=C2OC=CC2=C1 IANQTJSKSUMEQM-UHFFFAOYSA-N 0.000 description 1
- LOWMYOWHQMKBTM-UHFFFAOYSA-N 1-butylsulfinylbutane Chemical compound CCCCS(=O)CCCC LOWMYOWHQMKBTM-UHFFFAOYSA-N 0.000 description 1
- MNZAKDODWSQONA-UHFFFAOYSA-N 1-dibutylphosphorylbutane Chemical compound CCCCP(=O)(CCCC)CCCC MNZAKDODWSQONA-UHFFFAOYSA-N 0.000 description 1
- PPDZLUVUQQGIOJ-UHFFFAOYSA-N 1-dihexylphosphorylhexane Chemical compound CCCCCCP(=O)(CCCCCC)CCCCCC PPDZLUVUQQGIOJ-UHFFFAOYSA-N 0.000 description 1
- SNZSAFILJOCMFM-UHFFFAOYSA-N 1-dipropylphosphorylpropane Chemical compound CCCP(=O)(CCC)CCC SNZSAFILJOCMFM-UHFFFAOYSA-N 0.000 description 1
- BMVXCPBXGZKUPN-UHFFFAOYSA-N 1-hexanamine Chemical compound CCCCCCN BMVXCPBXGZKUPN-UHFFFAOYSA-N 0.000 description 1
- LWGTWWGANHDJRJ-UHFFFAOYSA-N 1-methyl-5-phenyl-3-propyl-1,2,4-triazole Chemical compound CN1N=C(CCC)N=C1C1=CC=CC=C1 LWGTWWGANHDJRJ-UHFFFAOYSA-N 0.000 description 1
- XOYZGLGJSAZOAG-UHFFFAOYSA-N 1-n,1-n,4-n-triphenyl-4-n-[4-[4-(n-[4-(n-phenylanilino)phenyl]anilino)phenyl]phenyl]benzene-1,4-diamine Chemical group C1=CC=CC=C1N(C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC(=CC=1)C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 XOYZGLGJSAZOAG-UHFFFAOYSA-N 0.000 description 1
- FQNVFRPAQRVHKO-UHFFFAOYSA-N 1-n,4-n-bis(4-methylphenyl)-1-n,4-n-diphenylbenzene-1,4-diamine Chemical compound C1=CC(C)=CC=C1N(C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC(C)=CC=1)C1=CC=CC=C1 FQNVFRPAQRVHKO-UHFFFAOYSA-N 0.000 description 1
- OOWLPGTVRWFLCX-UHFFFAOYSA-N 2,3,6,7-tetramethyl-9,10-dinaphthalen-1-ylanthracene Chemical compound C1=CC=C2C(C=3C4=CC(C)=C(C)C=C4C(C=4C5=CC=CC=C5C=CC=4)=C4C=C(C(=CC4=3)C)C)=CC=CC2=C1 OOWLPGTVRWFLCX-UHFFFAOYSA-N 0.000 description 1
- JEBPFDQAOYARIB-UHFFFAOYSA-N 2,3,6,7-tetramethyl-9,10-dinaphthalen-2-ylanthracene Chemical compound C1=CC=CC2=CC(C=3C4=CC(C)=C(C)C=C4C(C=4C=C5C=CC=CC5=CC=4)=C4C=C(C(=CC4=3)C)C)=CC=C21 JEBPFDQAOYARIB-UHFFFAOYSA-N 0.000 description 1
- VFMUXPQZKOKPOF-UHFFFAOYSA-N 2,3,7,8,12,13,17,18-octaethyl-21,23-dihydroporphyrin platinum Chemical compound [Pt].CCc1c(CC)c2cc3[nH]c(cc4nc(cc5[nH]c(cc1n2)c(CC)c5CC)c(CC)c4CC)c(CC)c3CC VFMUXPQZKOKPOF-UHFFFAOYSA-N 0.000 description 1
- HQYLCTWBSBBHPN-UHFFFAOYSA-N 2,3-bis[4-(10-phenylanthracen-9-yl)phenyl]-6-pyridin-2-ylpyridine Chemical compound C1=CC=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=C(C=2C(=NC(=CC=2)C=2N=CC=CC=2)C=2C=CC(=CC=2)C=2C3=CC=CC=C3C(C=3C=CC=CC=3)=C3C=CC=CC3=2)C=C1 HQYLCTWBSBBHPN-UHFFFAOYSA-N 0.000 description 1
- OVSKIKFHRZPJSS-UHFFFAOYSA-N 2,4-D Chemical compound OC(=O)COC1=CC=C(Cl)C=C1Cl OVSKIKFHRZPJSS-UHFFFAOYSA-N 0.000 description 1
- BFTIPCRZWILUIY-UHFFFAOYSA-N 2,5,8,11-tetratert-butylperylene Chemical group CC(C)(C)C1=CC(C2=CC(C(C)(C)C)=CC=3C2=C2C=C(C=3)C(C)(C)C)=C3C2=CC(C(C)(C)C)=CC3=C1 BFTIPCRZWILUIY-UHFFFAOYSA-N 0.000 description 1
- OISVCGZHLKNMSJ-UHFFFAOYSA-N 2,6-dimethylpyridine Chemical class CC1=CC=CC(C)=N1 OISVCGZHLKNMSJ-UHFFFAOYSA-N 0.000 description 1
- IZJOTDOLRQTPHC-UHFFFAOYSA-N 2-(4-carbazol-9-ylphenyl)-5-phenyl-1,3,4-oxadiazole Chemical compound C1=CC=CC=C1C1=NN=C(C=2C=CC(=CC=2)N2C3=CC=CC=C3C3=CC=CC=C32)O1 IZJOTDOLRQTPHC-UHFFFAOYSA-N 0.000 description 1
- FQJQNLKWTRGIEB-UHFFFAOYSA-N 2-(4-tert-butylphenyl)-5-[3-[5-(4-tert-butylphenyl)-1,3,4-oxadiazol-2-yl]phenyl]-1,3,4-oxadiazole Chemical compound C1=CC(C(C)(C)C)=CC=C1C1=NN=C(C=2C=C(C=CC=2)C=2OC(=NN=2)C=2C=CC(=CC=2)C(C)(C)C)O1 FQJQNLKWTRGIEB-UHFFFAOYSA-N 0.000 description 1
- YLYPIBBGWLKELC-RMKNXTFCSA-N 2-[2-[(e)-2-[4-(dimethylamino)phenyl]ethenyl]-6-methylpyran-4-ylidene]propanedinitrile Chemical compound C1=CC(N(C)C)=CC=C1\C=C\C1=CC(=C(C#N)C#N)C=C(C)O1 YLYPIBBGWLKELC-RMKNXTFCSA-N 0.000 description 1
- BSXFTEYFRAXUFI-UHFFFAOYSA-N 2-[2-[2-[4-(dimethylamino)phenyl]ethenyl]-6-methylpyran-4-ylidene]propanenitrile Chemical compound CN(C1=CC=C(C=C1)C=CC=1OC(=CC(C=1)=C(C#N)C)C)C BSXFTEYFRAXUFI-UHFFFAOYSA-N 0.000 description 1
- ZVUNTIMPQCQCAQ-UHFFFAOYSA-N 2-dodecanoyloxyethyl dodecanoate Chemical compound CCCCCCCCCCCC(=O)OCCOC(=O)CCCCCCCCCCC ZVUNTIMPQCQCAQ-UHFFFAOYSA-N 0.000 description 1
- 125000004135 2-norbornyl group Chemical group [H]C1([H])C([H])([H])C2([H])C([H])([H])C1([H])C([H])([H])C2([H])* 0.000 description 1
- VQGHOUODWALEFC-UHFFFAOYSA-N 2-phenylpyridine Chemical compound C1=CC=CC=C1C1=CC=CC=N1 VQGHOUODWALEFC-UHFFFAOYSA-N 0.000 description 1
- IBHNCJLKIQIKFU-UHFFFAOYSA-N 2-tert-butyl-9,10-bis(2-naphthalen-1-ylphenyl)anthracene Chemical compound C1=CC=C2C(C3=CC=CC=C3C3=C4C=CC=CC4=C(C=4C(=CC=CC=4)C=4C5=CC=CC=C5C=CC=4)C4=CC=C(C=C43)C(C)(C)C)=CC=CC2=C1 IBHNCJLKIQIKFU-UHFFFAOYSA-N 0.000 description 1
- MNHPNCZSKTUPMB-UHFFFAOYSA-N 2-tert-butyl-9,10-bis(4-phenylphenyl)anthracene Chemical compound C=12C=CC=CC2=C(C=2C=CC(=CC=2)C=2C=CC=CC=2)C2=CC(C(C)(C)C)=CC=C2C=1C(C=C1)=CC=C1C1=CC=CC=C1 MNHPNCZSKTUPMB-UHFFFAOYSA-N 0.000 description 1
- ONMVVYFKZFORGI-UHFFFAOYSA-N 2-tert-butyl-9,10-dinaphthalen-1-ylanthracene Chemical compound C1=CC=C2C(C3=C4C=CC=CC4=C(C=4C5=CC=CC=C5C=CC=4)C4=CC=C(C=C43)C(C)(C)C)=CC=CC2=C1 ONMVVYFKZFORGI-UHFFFAOYSA-N 0.000 description 1
- OBAJPWYDYFEBTF-UHFFFAOYSA-N 2-tert-butyl-9,10-dinaphthalen-2-ylanthracene Chemical compound C1=CC=CC2=CC(C3=C4C=CC=CC4=C(C=4C=C5C=CC=CC5=CC=4)C4=CC=C(C=C43)C(C)(C)C)=CC=C21 OBAJPWYDYFEBTF-UHFFFAOYSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- MKAQNAJLIITRHR-UHFFFAOYSA-N 3-(3-dibenzothiophen-4-ylphenyl)phenanthro[9,10-b]pyrazine Chemical compound C1=CC=C2C3=NC(C=4C=CC=C(C=4)C4=C5SC=6C(C5=CC=C4)=CC=CC=6)=CN=C3C3=CC=CC=C3C2=C1 MKAQNAJLIITRHR-UHFFFAOYSA-N 0.000 description 1
- TVMBOHMLKCZFFW-UHFFFAOYSA-N 3-N,6-N,9-triphenyl-3-N,6-N-bis(9-phenylcarbazol-3-yl)carbazole-3,6-diamine Chemical compound C1=CC=CC=C1N(C=1C=C2C3=CC(=CC=C3N(C=3C=CC=CC=3)C2=CC=1)N(C=1C=CC=CC=1)C=1C=C2C3=CC=CC=C3N(C=3C=CC=CC=3)C2=CC=1)C1=CC=C(N(C=2C=CC=CC=2)C=2C3=CC=CC=2)C3=C1 TVMBOHMLKCZFFW-UHFFFAOYSA-N 0.000 description 1
- PCUTZMWETFJZDZ-UHFFFAOYSA-N 3-[3-(3-carbazol-9-ylphenyl)phenyl]phenanthro[9,10-b]pyrazine Chemical compound C12=CC=CC=C2C2=CC=CC=C2N1C1=CC(C=2C=CC=C(C=2)C=2N=C3C4=CC=CC=C4C4=CC=CC=C4C3=NC=2)=CC=C1 PCUTZMWETFJZDZ-UHFFFAOYSA-N 0.000 description 1
- MFWOWURWNZHYLA-UHFFFAOYSA-N 3-[3-(3-dibenzothiophen-4-ylphenyl)phenyl]phenanthro[9,10-b]pyrazine Chemical compound C1=CC=C2C3=NC(C=4C=CC=C(C=4)C=4C=CC=C(C=4)C4=C5SC=6C(C5=CC=C4)=CC=CC=6)=CN=C3C3=CC=CC=C3C2=C1 MFWOWURWNZHYLA-UHFFFAOYSA-N 0.000 description 1
- QVSJCRDHNCCXFC-UHFFFAOYSA-N 3-[9-[4-(4,6-diphenyl-1,3,5-triazin-2-yl)phenyl]carbazol-3-yl]-9-phenylcarbazole Chemical compound C1=CC=CC=C1C1=NC(C=2C=CC=CC=2)=NC(C=2C=CC(=CC=2)N2C3=CC=C(C=C3C3=CC=CC=C32)C=2C=C3C4=CC=CC=C4N(C=4C=CC=CC=4)C3=CC=2)=N1 QVSJCRDHNCCXFC-UHFFFAOYSA-N 0.000 description 1
- CWVPIIWMONJVGG-UHFFFAOYSA-N 3-methyl-n-(3-methylphenyl)aniline Chemical compound CC1=CC=CC(NC=2C=C(C)C=CC=2)=C1 CWVPIIWMONJVGG-UHFFFAOYSA-N 0.000 description 1
- DGVHCUNJUVMAKG-UHFFFAOYSA-N 4,6-bis(3-phenanthren-9-ylphenyl)pyrimidine Chemical compound C1=CC=C2C(C=3C=CC=C(C=3)C=3C=C(N=CN=3)C=3C=CC=C(C=3)C=3C4=CC=CC=C4C4=CC=CC=C4C=3)=CC3=CC=CC=C3C2=C1 DGVHCUNJUVMAKG-UHFFFAOYSA-N 0.000 description 1
- HXWWMGJBPGRWRS-CMDGGOBGSA-N 4- -2-tert-butyl-6- -4h-pyran Chemical compound O1C(C(C)(C)C)=CC(=C(C#N)C#N)C=C1\C=C\C1=CC(C(CCN2CCC3(C)C)(C)C)=C2C3=C1 HXWWMGJBPGRWRS-CMDGGOBGSA-N 0.000 description 1
- ZNJRONVKWRHYBF-VOTSOKGWSA-N 4-(dicyanomethylene)-2-methyl-6-julolidyl-9-enyl-4h-pyran Chemical compound O1C(C)=CC(=C(C#N)C#N)C=C1\C=C\C1=CC(CCCN2CCC3)=C2C3=C1 ZNJRONVKWRHYBF-VOTSOKGWSA-N 0.000 description 1
- YKWORNGFRSSYRV-UHFFFAOYSA-N 4-[2-[6-[2-[4-(dimethylamino)phenyl]ethenyl]-4-propan-2-ylidenepyran-2-yl]ethenyl]-N,N-dimethylaniline Chemical compound CN(C1=CC=C(C=C1)C=CC=1OC(=CC(C=1)=C(C)C)C=CC1=CC=C(C=C1)N(C)C)C YKWORNGFRSSYRV-UHFFFAOYSA-N 0.000 description 1
- HGHBHXZNXIDZIZ-UHFFFAOYSA-N 4-n-(9,10-diphenylanthracen-2-yl)-1-n,1-n,4-n-triphenylbenzene-1,4-diamine Chemical compound C1=CC=CC=C1N(C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=C2C(C=3C=CC=CC=3)=C3C=CC=CC3=C(C=3C=CC=CC=3)C2=CC=1)C1=CC=CC=C1 HGHBHXZNXIDZIZ-UHFFFAOYSA-N 0.000 description 1
- IJVFZXJHZBXCJC-UHFFFAOYSA-N 4-n-[4-(9,10-diphenylanthracen-2-yl)phenyl]-1-n,1-n,4-n-triphenylbenzene-1,4-diamine Chemical compound C1=CC=CC=C1N(C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC(=CC=1)C=1C=C2C(C=3C=CC=CC=3)=C3C=CC=CC3=C(C=3C=CC=CC=3)C2=CC=1)C1=CC=CC=C1 IJVFZXJHZBXCJC-UHFFFAOYSA-N 0.000 description 1
- KLNDKWAYVMOOFU-UHFFFAOYSA-N 4-n-[9,10-bis(2-phenylphenyl)anthracen-2-yl]-1-n,1-n,4-n-triphenylbenzene-1,4-diamine Chemical compound C1=CC=CC=C1N(C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=C2C(C=3C(=CC=CC=3)C=3C=CC=CC=3)=C3C=CC=CC3=C(C=3C(=CC=CC=3)C=3C=CC=CC=3)C2=CC=1)C1=CC=CC=C1 KLNDKWAYVMOOFU-UHFFFAOYSA-N 0.000 description 1
- AEJARLYXNFRVLK-UHFFFAOYSA-N 4H-1,2,3-triazole Chemical group C1C=NN=N1 AEJARLYXNFRVLK-UHFFFAOYSA-N 0.000 description 1
- KIYZNTXHGDXHQH-UHFFFAOYSA-N 5,12-diphenyl-6,11-bis(4-phenylphenyl)tetracene Chemical compound C1=CC=CC=C1C1=CC=C(C=2C3=C(C=4C=CC=CC=4)C4=CC=CC=C4C(C=4C=CC=CC=4)=C3C(C=3C=CC(=CC=3)C=3C=CC=CC=3)=C3C=CC=CC3=2)C=C1 KIYZNTXHGDXHQH-UHFFFAOYSA-N 0.000 description 1
- TYGSHIPXFUQBJO-UHFFFAOYSA-N 5-n,5-n,11-n,11-n-tetrakis(4-methylphenyl)tetracene-5,11-diamine Chemical compound C1=CC(C)=CC=C1N(C=1C2=CC3=CC=CC=C3C(N(C=3C=CC(C)=CC=3)C=3C=CC(C)=CC=3)=C2C=C2C=CC=CC2=1)C1=CC=C(C)C=C1 TYGSHIPXFUQBJO-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- UOOBIWAELCOCHK-BQYQJAHWSA-N 870075-87-9 Chemical compound O1C(C(C)C)=CC(=C(C#N)C#N)C=C1\C=C\C1=CC(C(CCN2CCC3(C)C)(C)C)=C2C3=C1 UOOBIWAELCOCHK-BQYQJAHWSA-N 0.000 description 1
- NKEZXXDRXPPROK-UHFFFAOYSA-N 9,10-bis(2-naphthalen-1-ylphenyl)anthracene Chemical compound C12=CC=CC=C2C(C2=CC=CC=C2C=2C3=CC=CC=C3C=CC=2)=C(C=CC=C2)C2=C1C1=CC=CC=C1C1=CC=CC2=CC=CC=C12 NKEZXXDRXPPROK-UHFFFAOYSA-N 0.000 description 1
- USIXUMGAHVBSHQ-UHFFFAOYSA-N 9,10-bis(3,5-diphenylphenyl)anthracene Chemical compound C1=CC=CC=C1C1=CC(C=2C=CC=CC=2)=CC(C=2C3=CC=CC=C3C(C=3C=C(C=C(C=3)C=3C=CC=CC=3)C=3C=CC=CC=3)=C3C=CC=CC3=2)=C1 USIXUMGAHVBSHQ-UHFFFAOYSA-N 0.000 description 1
- YTSGZCWSEMDTBC-UHFFFAOYSA-N 9,10-bis(4-methylnaphthalen-1-yl)anthracene Chemical compound C12=CC=CC=C2C(C)=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=C(C)C2=CC=CC=C12 YTSGZCWSEMDTBC-UHFFFAOYSA-N 0.000 description 1
- BITWULPDIGXQDL-UHFFFAOYSA-N 9,10-bis[4-(2,2-diphenylethenyl)phenyl]anthracene Chemical compound C=1C=C(C=2C3=CC=CC=C3C(C=3C=CC(C=C(C=4C=CC=CC=4)C=4C=CC=CC=4)=CC=3)=C3C=CC=CC3=2)C=CC=1C=C(C=1C=CC=CC=1)C1=CC=CC=C1 BITWULPDIGXQDL-UHFFFAOYSA-N 0.000 description 1
- VIZUPBYFLORCRA-UHFFFAOYSA-N 9,10-dinaphthalen-2-ylanthracene Chemical compound C12=CC=CC=C2C(C2=CC3=CC=CC=C3C=C2)=C(C=CC=C2)C2=C1C1=CC=C(C=CC=C2)C2=C1 VIZUPBYFLORCRA-UHFFFAOYSA-N 0.000 description 1
- FCNCGHJSNVOIKE-UHFFFAOYSA-N 9,10-diphenylanthracene Chemical compound C1=CC=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=CC=C1 FCNCGHJSNVOIKE-UHFFFAOYSA-N 0.000 description 1
- JSEQNGYLWKBMJI-UHFFFAOYSA-N 9,9-dimethyl-10h-acridine Chemical compound C1=CC=C2C(C)(C)C3=CC=CC=C3NC2=C1 JSEQNGYLWKBMJI-UHFFFAOYSA-N 0.000 description 1
- QRMLAMCEPKEKHS-UHFFFAOYSA-N 9,9-dimethyl-n-(4-phenylphenyl)fluoren-2-amine Chemical compound C1=C2C(C)(C)C3=CC=CC=C3C2=CC=C1NC(C=C1)=CC=C1C1=CC=CC=C1 QRMLAMCEPKEKHS-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- SMFWPCTUTSVMLQ-UHFFFAOYSA-N 9-N,9-N,21-N,21-N-tetrakis(4-methylphenyl)-4,15-diphenylheptacyclo[12.10.1.13,7.02,12.018,25.019,24.011,26]hexacosa-1,3,5,7,9,11(26),12,14,16,18(25),19(24),20,22-tridecaene-9,21-diamine Chemical compound C1=CC(C)=CC=C1N(C=1C=C2C(C=3[C]4C5=C(C=6C=CC=CC=6)C=CC6=CC(=CC([C]56)=C4C=C4C(C=5C=CC=CC=5)=CC=C2C=34)N(C=2C=CC(C)=CC=2)C=2C=CC(C)=CC=2)=CC=1)C1=CC=C(C)C=C1 SMFWPCTUTSVMLQ-UHFFFAOYSA-N 0.000 description 1
- VDHOGVHFPFGPIP-UHFFFAOYSA-N 9-[3-[5-(3-carbazol-9-ylphenyl)pyridin-3-yl]phenyl]carbazole Chemical compound C12=CC=CC=C2C2=CC=CC=C2N1C1=CC(C=2C=NC=C(C=2)C=2C=CC=C(C=2)N2C3=CC=CC=C3C3=CC=CC=C32)=CC=C1 VDHOGVHFPFGPIP-UHFFFAOYSA-N 0.000 description 1
- XCICDYGIJBPNPC-UHFFFAOYSA-N 9-[4-[3,5-bis(4-carbazol-9-ylphenyl)phenyl]phenyl]carbazole Chemical compound C12=CC=CC=C2C2=CC=CC=C2N1C1=CC=C(C=2C=C(C=C(C=2)C=2C=CC(=CC=2)N2C3=CC=CC=C3C3=CC=CC=C32)C=2C=CC(=CC=2)N2C3=CC=CC=C3C3=CC=CC=C32)C=C1 XCICDYGIJBPNPC-UHFFFAOYSA-N 0.000 description 1
- LZZALARSKCRKLE-UHFFFAOYSA-N 9-[4-[5-(4-carbazol-9-ylphenyl)pyridin-3-yl]phenyl]carbazole Chemical compound C12=CC=CC=C2C2=CC=CC=C2N1C1=CC=C(C=2C=C(C=NC=2)C=2C=CC(=CC=2)N2C3=CC=CC=C3C3=CC=CC=C32)C=C1 LZZALARSKCRKLE-UHFFFAOYSA-N 0.000 description 1
- FNUFTJBAGDCPLO-UHFFFAOYSA-N 9-fluoren-9-ylidene-N-phenyl-N-[4-(9-phenylcarbazol-3-yl)phenyl]fluoren-2-amine Chemical compound C1=CC=CC=C1N(C=1C=C2C(=C3C4=CC=CC=C4C4=CC=CC=C43)C3=CC=CC=C3C2=CC=1)C1=CC=C(C=2C=C3C4=CC=CC=C4N(C=4C=CC=CC=4)C3=CC=2)C=C1 FNUFTJBAGDCPLO-UHFFFAOYSA-N 0.000 description 1
- DDCOSPFEMPUOFY-UHFFFAOYSA-N 9-phenyl-3-[4-(10-phenylanthracen-9-yl)phenyl]carbazole Chemical compound C1=CC=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=C(C=2C=C3C4=CC=CC=C4N(C=4C=CC=CC=4)C3=CC=2)C=C1 DDCOSPFEMPUOFY-UHFFFAOYSA-N 0.000 description 1
- UJOBWOGCFQCDNV-UHFFFAOYSA-N 9H-carbazole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 239000004925 Acrylic resin Substances 0.000 description 1
- 229920000178 Acrylic resin Polymers 0.000 description 1
- 229910018072 Al 2 O 3 Inorganic materials 0.000 description 1
- 229910017073 AlLi Inorganic materials 0.000 description 1
- 229910017115 AlSb Inorganic materials 0.000 description 1
- PIGFYZPCRLYGLF-UHFFFAOYSA-N Aluminum nitride Chemical compound [Al]#N PIGFYZPCRLYGLF-UHFFFAOYSA-N 0.000 description 1
- JBRZTFJDHDCESZ-UHFFFAOYSA-N AsGa Chemical compound [As]#[Ga] JBRZTFJDHDCESZ-UHFFFAOYSA-N 0.000 description 1
- 102100025982 BMP/retinoic acid-inducible neural-specific protein 1 Human genes 0.000 description 1
- ROFVEXUMMXZLPA-UHFFFAOYSA-N Bipyridyl Chemical group N1=CC=CC=C1C1=CC=CC=N1 ROFVEXUMMXZLPA-UHFFFAOYSA-N 0.000 description 1
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical compound [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 description 1
- PZNSFCLAULLKQX-UHFFFAOYSA-N Boron nitride Chemical compound N#B PZNSFCLAULLKQX-UHFFFAOYSA-N 0.000 description 1
- 238000006443 Buchwald-Hartwig cross coupling reaction Methods 0.000 description 1
- SZLZVPNMBKWFIT-UHFFFAOYSA-N C1=CC=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=C(C=2C=CC(=CC=2)C=2C(=NC(=CC=2)C=2N=CC=CC=2)C=2C=CC(=CC=2)C=2C=CC(=CC=2)C=2C3=CC=CC=C3C(C=3C=CC=CC=3)=C3C=CC=CC3=2)C=C1 Chemical compound C1=CC=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=C(C=2C=CC(=CC=2)C=2C(=NC(=CC=2)C=2N=CC=CC=2)C=2C=CC(=CC=2)C=2C=CC(=CC=2)C=2C3=CC=CC=C3C(C=3C=CC=CC=3)=C3C=CC=CC3=2)C=C1 SZLZVPNMBKWFIT-UHFFFAOYSA-N 0.000 description 1
- MSDMPJCOOXURQD-UHFFFAOYSA-N C545T Chemical compound C1=CC=C2SC(C3=CC=4C=C5C6=C(C=4OC3=O)C(C)(C)CCN6CCC5(C)C)=NC2=C1 MSDMPJCOOXURQD-UHFFFAOYSA-N 0.000 description 1
- XMWRBQBLMFGWIX-UHFFFAOYSA-N C60 fullerene Chemical class C12=C3C(C4=C56)=C7C8=C5C5=C9C%10=C6C6=C4C1=C1C4=C6C6=C%10C%10=C9C9=C%11C5=C8C5=C8C7=C3C3=C7C2=C1C1=C2C4=C6C4=C%10C6=C9C9=C%11C5=C5C8=C3C3=C7C1=C1C2=C4C6=C2C9=C5C3=C12 XMWRBQBLMFGWIX-UHFFFAOYSA-N 0.000 description 1
- QCWXDVFBZVHKLV-UHFFFAOYSA-N CC(C)(C)c1ccc(C)cc1 Chemical compound CC(C)(C)c1ccc(C)cc1 QCWXDVFBZVHKLV-UHFFFAOYSA-N 0.000 description 1
- RYCLVGOFIVQDOV-UHFFFAOYSA-N CC1(C)c(ccc(C)c2)c2-c2ccccc12 Chemical compound CC1(C)c(ccc(C)c2)c2-c2ccccc12 RYCLVGOFIVQDOV-UHFFFAOYSA-N 0.000 description 1
- DXSIFZLOUITCRR-UHFFFAOYSA-N CC1(C)c2cc(C)ccc2-c2ccccc12 Chemical compound CC1(C)c2cc(C)ccc2-c2ccccc12 DXSIFZLOUITCRR-UHFFFAOYSA-N 0.000 description 1
- YEESDELPRBFUPK-UHFFFAOYSA-N CC1(C)c2ccccc2N(c2cc(Oc3ccccc3C3O)c3cc2)c2c1cccc2 Chemical compound CC1(C)c2ccccc2N(c2cc(Oc3ccccc3C3O)c3cc2)c2c1cccc2 YEESDELPRBFUPK-UHFFFAOYSA-N 0.000 description 1
- VFFVVJXIMCBKQQ-UHFFFAOYSA-N CN(c(cc1)ccc1-c1ccccc1)c1c(cccc2)c2ccc1 Chemical compound CN(c(cc1)ccc1-c1ccccc1)c1c(cccc2)c2ccc1 VFFVVJXIMCBKQQ-UHFFFAOYSA-N 0.000 description 1
- GPPLCUGJDURTHA-UHFFFAOYSA-N CN(c(cc1)ccc1-c1ccccc1)c1cc(cccc2)c2cc1 Chemical compound CN(c(cc1)ccc1-c1ccccc1)c1cc(cccc2)c2cc1 GPPLCUGJDURTHA-UHFFFAOYSA-N 0.000 description 1
- MGWJPPSCLDTKIV-UHFFFAOYSA-N CN(c1ccccc1)c(cc1)cc2c1c1ccccc1c1ccccc21 Chemical compound CN(c1ccccc1)c(cc1)cc2c1c1ccccc1c1ccccc21 MGWJPPSCLDTKIV-UHFFFAOYSA-N 0.000 description 1
- VCAIXZJFZMWFAX-UHFFFAOYSA-N CN(c1ccccc1)c(cc1)cc2c1cc(cccc1)c1c2 Chemical compound CN(c1ccccc1)c(cc1)cc2c1cc(cccc1)c1c2 VCAIXZJFZMWFAX-UHFFFAOYSA-N 0.000 description 1
- LCDJVKDVHVCYQJ-UHFFFAOYSA-N CN(c1ccccc1)c1c(ccc2cccc(cc3)c22)c2c3cc1 Chemical compound CN(c1ccccc1)c1c(ccc2cccc(cc3)c22)c2c3cc1 LCDJVKDVHVCYQJ-UHFFFAOYSA-N 0.000 description 1
- XDJCIFRIAOBGTE-UHFFFAOYSA-N CN(c1ccccc1)c1c(cccc2)c2cc2c1cccc2 Chemical compound CN(c1ccccc1)c1c(cccc2)c2cc2c1cccc2 XDJCIFRIAOBGTE-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 244000025254 Cannabis sativa Species 0.000 description 1
- 235000012766 Cannabis sativa ssp. sativa var. sativa Nutrition 0.000 description 1
- 235000012765 Cannabis sativa ssp. sativa var. spontanea Nutrition 0.000 description 1
- HQLHAPRTMMIZSV-UHFFFAOYSA-N Cc(cc1)cc(cc2)c1cc2-c1ccccc1 Chemical compound Cc(cc1)cc(cc2)c1cc2-c1ccccc1 HQLHAPRTMMIZSV-UHFFFAOYSA-N 0.000 description 1
- BEZDDPMMPIDMGJ-UHFFFAOYSA-N Cc1c(C)c(C)c(C)c(C)c1 Chemical compound Cc1c(C)c(C)c(C)c(C)c1 BEZDDPMMPIDMGJ-UHFFFAOYSA-N 0.000 description 1
- BFIMMTCNYPIMRN-UHFFFAOYSA-N Cc1cc(C)c(C)c(C)c1 Chemical compound Cc1cc(C)c(C)c(C)c1 BFIMMTCNYPIMRN-UHFFFAOYSA-N 0.000 description 1
- GWHJZXXIDMPWGX-UHFFFAOYSA-N Cc1ccc(C)c(C)c1 Chemical compound Cc1ccc(C)c(C)c1 GWHJZXXIDMPWGX-UHFFFAOYSA-N 0.000 description 1
- JSJIOERAEHZSPG-UHFFFAOYSA-N Cc1cccc(-c(cc2)ccc2N(C)c2cc(C)cc(C)c2)c1 Chemical compound Cc1cccc(-c(cc2)ccc2N(C)c2cc(C)cc(C)c2)c1 JSJIOERAEHZSPG-UHFFFAOYSA-N 0.000 description 1
- 229920000298 Cellophane Polymers 0.000 description 1
- 229910052684 Cerium Inorganic materials 0.000 description 1
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 1
- HCJCDNBVAQWOCZ-UHFFFAOYSA-N Clc(cc1)cc(c2cc3c4)c1[o]c2cc3cc1c4c(cc(cc2)Cl)c2[o]1 Chemical compound Clc(cc1)cc(c2cc3c4)c1[o]c2cc3cc1c4c(cc(cc2)Cl)c2[o]1 HCJCDNBVAQWOCZ-UHFFFAOYSA-N 0.000 description 1
- QPLDLSVMHZLSFG-UHFFFAOYSA-N Copper oxide Chemical compound [Cu]=O QPLDLSVMHZLSFG-UHFFFAOYSA-N 0.000 description 1
- 239000005751 Copper oxide Substances 0.000 description 1
- 229910021591 Copper(I) chloride Inorganic materials 0.000 description 1
- 229910021594 Copper(II) fluoride Inorganic materials 0.000 description 1
- 229920000742 Cotton Polymers 0.000 description 1
- MHZGKXUYDGKKIU-UHFFFAOYSA-N Decylamine Chemical compound CCCCCCCCCCN MHZGKXUYDGKKIU-UHFFFAOYSA-N 0.000 description 1
- HTIRHQRTDBPHNZ-UHFFFAOYSA-N Dibutyl sulfide Chemical compound CCCCSCCCC HTIRHQRTDBPHNZ-UHFFFAOYSA-N 0.000 description 1
- 239000004593 Epoxy Substances 0.000 description 1
- FPVVYTCTZKCSOJ-UHFFFAOYSA-N Ethylene glycol distearate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCCOC(=O)CCCCCCCCCCCCCCCCC FPVVYTCTZKCSOJ-UHFFFAOYSA-N 0.000 description 1
- 229910052693 Europium Inorganic materials 0.000 description 1
- MBMLMWLHJBBADN-UHFFFAOYSA-N Ferrous sulfide Chemical compound [Fe]=S MBMLMWLHJBBADN-UHFFFAOYSA-N 0.000 description 1
- 229910002601 GaN Inorganic materials 0.000 description 1
- 229910005542 GaSb Inorganic materials 0.000 description 1
- 101000933342 Homo sapiens BMP/retinoic acid-inducible neural-specific protein 1 Proteins 0.000 description 1
- 101000715194 Homo sapiens Cell cycle and apoptosis regulator protein 2 Proteins 0.000 description 1
- GPXJNWSHGFTCBW-UHFFFAOYSA-N Indium phosphide Chemical compound [In]#P GPXJNWSHGFTCBW-UHFFFAOYSA-N 0.000 description 1
- 239000002841 Lewis acid Substances 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 1
- 229930192627 Naphthoquinone Natural products 0.000 description 1
- 239000004677 Nylon Substances 0.000 description 1
- GOZPTOHMTKTIQP-UHFFFAOYSA-N OC1=CC=CC2=CC=C3C=CC(=NC3=C21)C(=O)O Chemical compound OC1=CC=CC2=CC=C3C=CC(=NC3=C21)C(=O)O GOZPTOHMTKTIQP-UHFFFAOYSA-N 0.000 description 1
- REYJJPSVUYRZGE-UHFFFAOYSA-N Octadecylamine Chemical compound CCCCCCCCCCCCCCCCCCN REYJJPSVUYRZGE-UHFFFAOYSA-N 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- 235000021314 Palmitic acid Nutrition 0.000 description 1
- 229910002665 PbTe Inorganic materials 0.000 description 1
- 229920012266 Poly(ether sulfone) PES Polymers 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 229920002873 Polyethylenimine Polymers 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- 229920000297 Rayon Polymers 0.000 description 1
- 229910052581 Si3N4 Inorganic materials 0.000 description 1
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical group [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 1
- 229910005642 SnTe Inorganic materials 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 1
- PLZVEHJLHYMBBY-UHFFFAOYSA-N Tetradecylamine Chemical compound CCCCCCCCCCCCCCN PLZVEHJLHYMBBY-UHFFFAOYSA-N 0.000 description 1
- XBDYBAVJXHJMNQ-UHFFFAOYSA-N Tetrahydroanthracene Natural products C1=CC=C2C=C(CCCC3)C3=CC2=C1 XBDYBAVJXHJMNQ-UHFFFAOYSA-N 0.000 description 1
- 229910010413 TiO 2 Inorganic materials 0.000 description 1
- NRTOMJZYCJJWKI-UHFFFAOYSA-N Titanium nitride Chemical compound [Ti]#N NRTOMJZYCJJWKI-UHFFFAOYSA-N 0.000 description 1
- WGLPBDUCMAPZCE-UHFFFAOYSA-N Trioxochromium Chemical compound O=[Cr](=O)=O WGLPBDUCMAPZCE-UHFFFAOYSA-N 0.000 description 1
- 238000006887 Ullmann reaction Methods 0.000 description 1
- 229910052769 Ytterbium Inorganic materials 0.000 description 1
- PTFCDOFLOPIGGS-UHFFFAOYSA-N Zinc dication Chemical compound [Zn+2] PTFCDOFLOPIGGS-UHFFFAOYSA-N 0.000 description 1
- QCWXUUIWCKQGHC-UHFFFAOYSA-N Zirconium Chemical compound [Zr] QCWXUUIWCKQGHC-UHFFFAOYSA-N 0.000 description 1
- PQMLGKMSUIYHPT-UHFFFAOYSA-N [Ir+3].C(C)(C)(C)C1=NC=NC(=C1)C1=CC=CC=C1.C(C)(C)(C)C1=NC=NC(=C1)C1=CC=CC=C1.C(C)(C)(C)C1=NC=NC(=C1)C1=CC=CC=C1 Chemical compound [Ir+3].C(C)(C)(C)C1=NC=NC(=C1)C1=CC=CC=C1.C(C)(C)(C)C1=NC=NC(=C1)C1=CC=CC=C1.C(C)(C)(C)C1=NC=NC(=C1)C1=CC=CC=C1 PQMLGKMSUIYHPT-UHFFFAOYSA-N 0.000 description 1
- WRNUGYVROIIUTC-UHFFFAOYSA-L [Ir+3].N1=C(C=CC2=CC=C3C(=C12)C=CC=C3)C(=O)[O-].N3=C(C=CC1=CC=C2C(=C31)C=CC=C2)C(=O)[O-] Chemical compound [Ir+3].N1=C(C=CC2=CC=C3C(=C12)C=CC=C3)C(=O)[O-].N3=C(C=CC1=CC=C2C(=C31)C=CC=C2)C(=O)[O-] WRNUGYVROIIUTC-UHFFFAOYSA-L 0.000 description 1
- PVVYUQFWZMHXNL-UHFFFAOYSA-K [Ir+3].N1=C(C=CC2=CC=C3C(=C12)C=CC=C3)C(=O)[O-].N3=C(C=CC1=CC=C2C(=C31)C=CC=C2)C(=O)[O-].N2=C(C=CC3=CC=C1C(=C23)C=CC=C1)C(=O)[O-] Chemical compound [Ir+3].N1=C(C=CC2=CC=C3C(=C12)C=CC=C3)C(=O)[O-].N3=C(C=CC1=CC=C2C(=C31)C=CC=C2)C(=O)[O-].N2=C(C=CC3=CC=C1C(=C23)C=CC=C1)C(=O)[O-] PVVYUQFWZMHXNL-UHFFFAOYSA-K 0.000 description 1
- RQNIVQXCEWRMFU-UHFFFAOYSA-N [O-2].[Ca+2].[O-2].[Al+3] Chemical compound [O-2].[Ca+2].[O-2].[Al+3] RQNIVQXCEWRMFU-UHFFFAOYSA-N 0.000 description 1
- OEEBMHFZRDUQFW-UHFFFAOYSA-L [Pt](Cl)Cl.C(C)C1=C(C=2C=C3C(=C(C(=CC=4C(=C(C(=CC5=C(C(=C(N5)C=C1N2)CC)CC)N4)CC)CC)N3)CC)CC)CC Chemical compound [Pt](Cl)Cl.C(C)C1=C(C=2C=C3C(=C(C(=CC=4C(=C(C(=CC5=C(C(=C(N5)C=C1N2)CC)CC)N4)CC)CC)N3)CC)CC)CC OEEBMHFZRDUQFW-UHFFFAOYSA-L 0.000 description 1
- AZWHFTKIBIQKCA-UHFFFAOYSA-N [Sn+2]=O.[O-2].[In+3] Chemical compound [Sn+2]=O.[O-2].[In+3] AZWHFTKIBIQKCA-UHFFFAOYSA-N 0.000 description 1
- SUFKFXIFMLKZTD-UHFFFAOYSA-N [Tb+3].N1=CC=CC2=CC=C3C=CC=NC3=C12 Chemical compound [Tb+3].N1=CC=CC2=CC=C3C=CC=NC3=C12 SUFKFXIFMLKZTD-UHFFFAOYSA-N 0.000 description 1
- SORGEQQSQGNZFI-UHFFFAOYSA-N [azido(phenoxy)phosphoryl]oxybenzene Chemical compound C=1C=CC=CC=1OP(=O)(N=[N+]=[N-])OC1=CC=CC=C1 SORGEQQSQGNZFI-UHFFFAOYSA-N 0.000 description 1
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 1
- 238000004378 air conditioning Methods 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 description 1
- 150000005215 alkyl ethers Chemical class 0.000 description 1
- 125000005037 alkyl phenyl group Chemical group 0.000 description 1
- MDPILPRLPQYEEN-UHFFFAOYSA-N aluminium arsenide Chemical compound [As]#[Al] MDPILPRLPQYEEN-UHFFFAOYSA-N 0.000 description 1
- COOGPNLGKIHLSK-UHFFFAOYSA-N aluminium sulfide Chemical compound [Al+3].[Al+3].[S-2].[S-2].[S-2] COOGPNLGKIHLSK-UHFFFAOYSA-N 0.000 description 1
- REDXJYDRNCIFBQ-UHFFFAOYSA-N aluminium(3+) Chemical compound [Al+3] REDXJYDRNCIFBQ-UHFFFAOYSA-N 0.000 description 1
- 239000005407 aluminoborosilicate glass Substances 0.000 description 1
- 238000000137 annealing Methods 0.000 description 1
- DYBXVITUBPGBBW-UHFFFAOYSA-N anthracen-1-ylboronic acid Chemical compound C1=CC=C2C=C3C(B(O)O)=CC=CC3=CC2=C1 DYBXVITUBPGBBW-UHFFFAOYSA-N 0.000 description 1
- 229940111121 antirheumatic drug quinolines Drugs 0.000 description 1
- 125000001204 arachidyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 150000001491 aromatic compounds Chemical class 0.000 description 1
- ROTPTZPNGBUOLZ-UHFFFAOYSA-N arsenic boron Chemical compound [B].[As] ROTPTZPNGBUOLZ-UHFFFAOYSA-N 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- NWAIGJYBQQYSPW-UHFFFAOYSA-N azanylidyneindigane Chemical compound [In]#N NWAIGJYBQQYSPW-UHFFFAOYSA-N 0.000 description 1
- 229910052788 barium Inorganic materials 0.000 description 1
- DSAJWYNOEDNPEQ-UHFFFAOYSA-N barium atom Chemical compound [Ba] DSAJWYNOEDNPEQ-UHFFFAOYSA-N 0.000 description 1
- JRPBQTZRNDNNOP-UHFFFAOYSA-N barium titanate Chemical compound [Ba+2].[Ba+2].[O-][Ti]([O-])([O-])[O-] JRPBQTZRNDNNOP-UHFFFAOYSA-N 0.000 description 1
- 229910002113 barium titanate Inorganic materials 0.000 description 1
- HFACYLZERDEVSX-UHFFFAOYSA-N benzidine Chemical compound C1=CC(N)=CC=C1C1=CC=C(N)C=C1 HFACYLZERDEVSX-UHFFFAOYSA-N 0.000 description 1
- 125000005878 benzonaphthofuranyl group Chemical group 0.000 description 1
- 229910052790 beryllium Inorganic materials 0.000 description 1
- ATBAMAFKBVZNFJ-UHFFFAOYSA-N beryllium atom Chemical compound [Be] ATBAMAFKBVZNFJ-UHFFFAOYSA-N 0.000 description 1
- FQDSYGKTHDFFCM-UHFFFAOYSA-N beryllium sulfide Chemical compound S=[Be] FQDSYGKTHDFFCM-UHFFFAOYSA-N 0.000 description 1
- 125000006268 biphenyl-3-yl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C1=C([H])C(*)=C([H])C([H])=C1[H] 0.000 description 1
- 125000006616 biphenylamine group Chemical group 0.000 description 1
- UFVXQDWNSAGPHN-UHFFFAOYSA-K bis[(2-methylquinolin-8-yl)oxy]-(4-phenylphenoxy)alumane Chemical compound [Al+3].C1=CC=C([O-])C2=NC(C)=CC=C21.C1=CC=C([O-])C2=NC(C)=CC=C21.C1=CC([O-])=CC=C1C1=CC=CC=C1 UFVXQDWNSAGPHN-UHFFFAOYSA-K 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- FFBGYFUYJVKRNV-UHFFFAOYSA-N boranylidynephosphane Chemical compound P#B FFBGYFUYJVKRNV-UHFFFAOYSA-N 0.000 description 1
- 229910052796 boron Inorganic materials 0.000 description 1
- 239000005388 borosilicate glass Substances 0.000 description 1
- ODWXUNBKCRECNW-UHFFFAOYSA-M bromocopper(1+) Chemical compound Br[Cu+] ODWXUNBKCRECNW-UHFFFAOYSA-M 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- XZCJVWCMJYNSQO-UHFFFAOYSA-N butyl pbd Chemical compound C1=CC(C(C)(C)C)=CC=C1C1=NN=C(C=2C=CC(=CC=2)C=2C=CC=CC=2)O1 XZCJVWCMJYNSQO-UHFFFAOYSA-N 0.000 description 1
- IOTQNFLFULVAMU-UHFFFAOYSA-N c(cc1)ccc1-c1c(cccc2)c2c(-c(cc2c3c4)ccc2[o]c3cc2c4cc(c3cc(-c4c(cccc5)c5c(-c5ccccc5)c5ccccc45)ccc3[o]3)c3c2)c2c1cccc2 Chemical compound c(cc1)ccc1-c1c(cccc2)c2c(-c(cc2c3c4)ccc2[o]c3cc2c4cc(c3cc(-c4c(cccc5)c5c(-c5ccccc5)c5ccccc45)ccc3[o]3)c3c2)c2c1cccc2 IOTQNFLFULVAMU-UHFFFAOYSA-N 0.000 description 1
- AOXSBVQAPGZWOV-UHFFFAOYSA-N c(cc1)ccc1N(c1ccccc1)c(cc1)cc(c2cc3c4)c1[o]c2cc3cc1c4c2cc(N(c3ccccc3)c3ccccc3)ccc2[o]1 Chemical compound c(cc1)ccc1N(c1ccccc1)c(cc1)cc(c2cc3c4)c1[o]c2cc3cc1c4c2cc(N(c3ccccc3)c3ccccc3)ccc2[o]1 AOXSBVQAPGZWOV-UHFFFAOYSA-N 0.000 description 1
- AQCDIIAORKRFCD-UHFFFAOYSA-N cadmium selenide Chemical compound [Cd]=[Se] AQCDIIAORKRFCD-UHFFFAOYSA-N 0.000 description 1
- 229910052792 caesium Inorganic materials 0.000 description 1
- TVFDJXOCXUVLDH-UHFFFAOYSA-N caesium atom Chemical compound [Cs] TVFDJXOCXUVLDH-UHFFFAOYSA-N 0.000 description 1
- 238000001354 calcination Methods 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- WUKWITHWXAAZEY-UHFFFAOYSA-L calcium difluoride Chemical compound [F-].[F-].[Ca+2] WUKWITHWXAAZEY-UHFFFAOYSA-L 0.000 description 1
- 235000009120 camo Nutrition 0.000 description 1
- 239000003990 capacitor Substances 0.000 description 1
- 150000001721 carbon Chemical group 0.000 description 1
- 238000005266 casting Methods 0.000 description 1
- 235000005607 chanvre indien Nutrition 0.000 description 1
- 229910052804 chromium Inorganic materials 0.000 description 1
- 229910000423 chromium oxide Inorganic materials 0.000 description 1
- 239000008199 coating composition Substances 0.000 description 1
- 229910017052 cobalt Inorganic materials 0.000 description 1
- 239000010941 cobalt Substances 0.000 description 1
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 1
- 229910000428 cobalt oxide Inorganic materials 0.000 description 1
- INPLXZPZQSLHBR-UHFFFAOYSA-N cobalt(2+);sulfide Chemical compound [S-2].[Co+2] INPLXZPZQSLHBR-UHFFFAOYSA-N 0.000 description 1
- IVMYJDGYRUAWML-UHFFFAOYSA-N cobalt(ii) oxide Chemical compound [Co]=O IVMYJDGYRUAWML-UHFFFAOYSA-N 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 150000004696 coordination complex Chemical class 0.000 description 1
- 229910000431 copper oxide Inorganic materials 0.000 description 1
- OXBLHERUFWYNTN-UHFFFAOYSA-M copper(I) chloride Chemical compound [Cu]Cl OXBLHERUFWYNTN-UHFFFAOYSA-M 0.000 description 1
- ORTQZVOHEJQUHG-UHFFFAOYSA-L copper(II) chloride Chemical compound Cl[Cu]Cl ORTQZVOHEJQUHG-UHFFFAOYSA-L 0.000 description 1
- GWFAVIIMQDUCRA-UHFFFAOYSA-L copper(ii) fluoride Chemical compound [F-].[F-].[Cu+2] GWFAVIIMQDUCRA-UHFFFAOYSA-L 0.000 description 1
- GBRBMTNGQBKBQE-UHFFFAOYSA-L copper;diiodide Chemical compound I[Cu]I GBRBMTNGQBKBQE-UHFFFAOYSA-L 0.000 description 1
- JRUYYVYCSJCVMP-UHFFFAOYSA-N coumarin 30 Chemical compound C1=CC=C2N(C)C(C=3C4=CC=C(C=C4OC(=O)C=3)N(CC)CC)=NC2=C1 JRUYYVYCSJCVMP-UHFFFAOYSA-N 0.000 description 1
- BHQBDOOJEZXHPS-UHFFFAOYSA-N ctk3i0272 Chemical group C1=CC=CC=C1C(C(=C(C=1C=CC=CC=1)C(=C1C=2C=CC=CC=2)C=2C3=CC=CC=C3C(C=3C4=CC=CC=C4C(C=4C(=C(C=5C=CC=CC=5)C(C=5C=CC=CC=5)=C(C=5C=CC=CC=5)C=4C=4C=CC=CC=4)C=4C=CC=CC=4)=C4C=CC=CC4=3)=C3C=CC=CC3=2)C=2C=CC=CC=2)=C1C1=CC=CC=C1 BHQBDOOJEZXHPS-UHFFFAOYSA-N 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- HHNHBFLGXIUXCM-GFCCVEGCSA-N cyclohexylbenzene Chemical compound [CH]1CCCC[C@@H]1C1=CC=CC=C1 HHNHBFLGXIUXCM-GFCCVEGCSA-N 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 238000006900 dealkylation reaction Methods 0.000 description 1
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 125000005509 dibenzothiophenyl group Chemical group 0.000 description 1
- 229940117389 dichlorobenzene Drugs 0.000 description 1
- 150000005690 diesters Chemical class 0.000 description 1
- ZZEMEJKDTZOXOI-UHFFFAOYSA-N digallium;selenium(2-) Chemical compound [Ga+3].[Ga+3].[Se-2].[Se-2].[Se-2] ZZEMEJKDTZOXOI-UHFFFAOYSA-N 0.000 description 1
- 238000003618 dip coating Methods 0.000 description 1
- JRBPAEWTRLWTQC-UHFFFAOYSA-N dodecylamine Chemical compound CCCCCCCCCCCCN JRBPAEWTRLWTQC-UHFFFAOYSA-N 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- 230000005684 electric field Effects 0.000 description 1
- 230000005611 electricity Effects 0.000 description 1
- 239000007772 electrode material Substances 0.000 description 1
- 238000010893 electron trap Methods 0.000 description 1
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical class [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 1
- 239000003822 epoxy resin Substances 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- OGPBJKLSAFTDLK-UHFFFAOYSA-N europium atom Chemical compound [Eu] OGPBJKLSAFTDLK-UHFFFAOYSA-N 0.000 description 1
- 239000004744 fabric Substances 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 239000002657 fibrous material Substances 0.000 description 1
- 238000011049 filling Methods 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 239000000446 fuel Substances 0.000 description 1
- 229910003472 fullerene Inorganic materials 0.000 description 1
- HZXMRANICFIONG-UHFFFAOYSA-N gallium phosphide Chemical compound [Ga]#P HZXMRANICFIONG-UHFFFAOYSA-N 0.000 description 1
- 229910052732 germanium Inorganic materials 0.000 description 1
- GNPVGFCGXDBREM-UHFFFAOYSA-N germanium atom Chemical compound [Ge] GNPVGFCGXDBREM-UHFFFAOYSA-N 0.000 description 1
- BIXHRBFZLLFBFL-UHFFFAOYSA-N germanium nitride Chemical compound N#[Ge]N([Ge]#N)[Ge]#N BIXHRBFZLLFBFL-UHFFFAOYSA-N 0.000 description 1
- 229940100608 glycol distearate Drugs 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 229910021389 graphene Inorganic materials 0.000 description 1
- 229910000449 hafnium oxide Inorganic materials 0.000 description 1
- WIHZLLGSGQNAGK-UHFFFAOYSA-N hafnium(4+);oxygen(2-) Chemical compound [O-2].[O-2].[Hf+4] WIHZLLGSGQNAGK-UHFFFAOYSA-N 0.000 description 1
- 150000008282 halocarbons Chemical class 0.000 description 1
- 239000011487 hemp Substances 0.000 description 1
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- BHEPBYXIRTUNPN-UHFFFAOYSA-N hydridophosphorus(.) (triplet) Chemical compound [PH] BHEPBYXIRTUNPN-UHFFFAOYSA-N 0.000 description 1
- 150000002430 hydrocarbons Chemical group 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- RPQDHPTXJYYUPQ-UHFFFAOYSA-N indium arsenide Chemical compound [In]#[As] RPQDHPTXJYYUPQ-UHFFFAOYSA-N 0.000 description 1
- AKUCEXGLFUSJCD-UHFFFAOYSA-N indium(3+);selenium(2-) Chemical compound [Se-2].[Se-2].[Se-2].[In+3].[In+3] AKUCEXGLFUSJCD-UHFFFAOYSA-N 0.000 description 1
- SIXIBASSFIFHDK-UHFFFAOYSA-N indium(3+);trisulfide Chemical compound [S-2].[S-2].[S-2].[In+3].[In+3] SIXIBASSFIFHDK-UHFFFAOYSA-N 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 229910010272 inorganic material Inorganic materials 0.000 description 1
- 239000011147 inorganic material Substances 0.000 description 1
- 238000012905 input function Methods 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- CECAIMUJVYQLKA-UHFFFAOYSA-N iridium 1-phenylisoquinoline Chemical compound [Ir].C1=CC=CC=C1C1=NC=CC2=CC=CC=C12.C1=CC=CC=C1C1=NC=CC2=CC=CC=C12.C1=CC=CC=C1C1=NC=CC2=CC=CC=C12 CECAIMUJVYQLKA-UHFFFAOYSA-N 0.000 description 1
- AOZVYCYMTUWJHJ-UHFFFAOYSA-K iridium(3+) pyridine-2-carboxylate Chemical compound [Ir+3].[O-]C(=O)C1=CC=CC=N1.[O-]C(=O)C1=CC=CC=N1.[O-]C(=O)C1=CC=CC=N1 AOZVYCYMTUWJHJ-UHFFFAOYSA-K 0.000 description 1
- UQSXHKLRYXJYBZ-UHFFFAOYSA-N iron oxide Inorganic materials [Fe]=O UQSXHKLRYXJYBZ-UHFFFAOYSA-N 0.000 description 1
- 235000013980 iron oxide Nutrition 0.000 description 1
- VBMVTYDPPZVILR-UHFFFAOYSA-N iron(2+);oxygen(2-) Chemical class [O-2].[Fe+2] VBMVTYDPPZVILR-UHFFFAOYSA-N 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- 125000005956 isoquinolyl group Chemical group 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 238000010030 laminating Methods 0.000 description 1
- 229910052746 lanthanum Inorganic materials 0.000 description 1
- 229910052981 lead sulfide Inorganic materials 0.000 description 1
- 229940056932 lead sulfide Drugs 0.000 description 1
- 239000010985 leather Substances 0.000 description 1
- 150000007517 lewis acids Chemical class 0.000 description 1
- 239000011344 liquid material Substances 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 238000001459 lithography Methods 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- AZUPEYZKABXNLR-UHFFFAOYSA-N magnesium;selenium(2-) Chemical compound [Mg+2].[Se-2] AZUPEYZKABXNLR-UHFFFAOYSA-N 0.000 description 1
- VCEXCCILEWFFBG-UHFFFAOYSA-N mercury telluride Chemical compound [Hg]=[Te] VCEXCCILEWFFBG-UHFFFAOYSA-N 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- FQPSGWSUVKBHSU-UHFFFAOYSA-N methacrylamide Chemical compound CC(=C)C(N)=O FQPSGWSUVKBHSU-UHFFFAOYSA-N 0.000 description 1
- 229940073584 methylene chloride Drugs 0.000 description 1
- 239000011259 mixed solution Substances 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000000465 moulding Methods 0.000 description 1
- WOYDRSOIBHFMGB-UHFFFAOYSA-N n,9-diphenyl-n-(9-phenylcarbazol-3-yl)carbazol-3-amine Chemical compound C1=CC=CC=C1N(C=1C=C2C3=CC=CC=C3N(C=3C=CC=CC=3)C2=CC=1)C1=CC=C(N(C=2C=CC=CC=2)C=2C3=CC=CC=2)C3=C1 WOYDRSOIBHFMGB-UHFFFAOYSA-N 0.000 description 1
- BBNZOXKLBAWRSH-UHFFFAOYSA-N n,9-diphenyl-n-[4-(10-phenylanthracen-9-yl)phenyl]carbazol-3-amine Chemical compound C1=CC=CC=C1N(C=1C=C2C3=CC=CC=C3N(C=3C=CC=CC=3)C2=CC=1)C1=CC=C(C=2C3=CC=CC=C3C(C=3C=CC=CC=3)=C3C=CC=CC3=2)C=C1 BBNZOXKLBAWRSH-UHFFFAOYSA-N 0.000 description 1
- NCCYEOZLSGJEDF-UHFFFAOYSA-N n,n,9-triphenyl-10h-anthracen-9-amine Chemical compound C12=CC=CC=C2CC2=CC=CC=C2C1(C=1C=CC=CC=1)N(C=1C=CC=CC=1)C1=CC=CC=C1 NCCYEOZLSGJEDF-UHFFFAOYSA-N 0.000 description 1
- CRWAGLGPZJUQQK-UHFFFAOYSA-N n-(4-carbazol-9-ylphenyl)-4-[2-[4-(n-(4-carbazol-9-ylphenyl)anilino)phenyl]ethenyl]-n-phenylaniline Chemical compound C=1C=C(N(C=2C=CC=CC=2)C=2C=CC(=CC=2)N2C3=CC=CC=C3C3=CC=CC=C32)C=CC=1C=CC(C=C1)=CC=C1N(C=1C=CC(=CC=1)N1C2=CC=CC=C2C2=CC=CC=C21)C1=CC=CC=C1 CRWAGLGPZJUQQK-UHFFFAOYSA-N 0.000 description 1
- DKQKUOFOSZLDGL-UHFFFAOYSA-N n-(4-carbazol-9-ylphenyl)-n-phenyl-9,10-bis(2-phenylphenyl)anthracen-2-amine Chemical compound C1=CC=CC=C1N(C=1C=C2C(C=3C(=CC=CC=3)C=3C=CC=CC=3)=C3C=CC=CC3=C(C=3C(=CC=CC=3)C=3C=CC=CC=3)C2=CC=1)C1=CC=C(N2C3=CC=CC=C3C3=CC=CC=C32)C=C1 DKQKUOFOSZLDGL-UHFFFAOYSA-N 0.000 description 1
- AJNJGJDDJIBTBP-UHFFFAOYSA-N n-(9,10-diphenylanthracen-2-yl)-n,9-diphenylcarbazol-3-amine Chemical compound C1=CC=CC=C1N(C=1C=C2C(C=3C=CC=CC=3)=C3C=CC=CC3=C(C=3C=CC=CC=3)C2=CC=1)C1=CC=C(N(C=2C=CC=CC=2)C=2C3=CC=CC=2)C3=C1 AJNJGJDDJIBTBP-UHFFFAOYSA-N 0.000 description 1
- HWJHZLJIIWOTGZ-UHFFFAOYSA-N n-(hydroxymethyl)acetamide Chemical compound CC(=O)NCO HWJHZLJIIWOTGZ-UHFFFAOYSA-N 0.000 description 1
- UMFJAHHVKNCGLG-UHFFFAOYSA-N n-Nitrosodimethylamine Chemical compound CN(C)N=O UMFJAHHVKNCGLG-UHFFFAOYSA-N 0.000 description 1
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 1
- RVHDEFQSXAYURV-UHFFFAOYSA-N n-[4-(9,10-diphenylanthracen-2-yl)phenyl]-n,9-diphenylcarbazol-3-amine Chemical compound C1=CC=CC=C1N(C=1C=C2C3=CC=CC=C3N(C=3C=CC=CC=3)C2=CC=1)C1=CC=C(C=2C=C3C(C=4C=CC=CC=4)=C4C=CC=CC4=C(C=4C=CC=CC=4)C3=CC=2)C=C1 RVHDEFQSXAYURV-UHFFFAOYSA-N 0.000 description 1
- KUGSVDXBPQUXKX-UHFFFAOYSA-N n-[9,10-bis(2-phenylphenyl)anthracen-2-yl]-n,9-diphenylcarbazol-3-amine Chemical compound C1=CC=CC=C1N(C=1C=C2C(C=3C(=CC=CC=3)C=3C=CC=CC=3)=C3C=CC=CC3=C(C=3C(=CC=CC=3)C=3C=CC=CC=3)C2=CC=1)C1=CC=C(N(C=2C=CC=CC=2)C=2C3=CC=CC=2)C3=C1 KUGSVDXBPQUXKX-UHFFFAOYSA-N 0.000 description 1
- COVCYOMDZRYBNM-UHFFFAOYSA-N n-naphthalen-1-yl-9-phenyl-n-(9-phenylcarbazol-3-yl)carbazol-3-amine Chemical compound C1=CC=CC=C1N1C2=CC=C(N(C=3C=C4C5=CC=CC=C5N(C=5C=CC=CC=5)C4=CC=3)C=3C4=CC=CC=C4C=CC=3)C=C2C2=CC=CC=C21 COVCYOMDZRYBNM-UHFFFAOYSA-N 0.000 description 1
- 239000002159 nanocrystal Substances 0.000 description 1
- 150000002791 naphthoquinones Chemical class 0.000 description 1
- 239000007773 negative electrode material Substances 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 229910000480 nickel oxide Inorganic materials 0.000 description 1
- FPOBXNYAWLLCGZ-UHFFFAOYSA-N nickel(2+);1,2,3,4,5-pentamethylcyclopenta-1,3-diene Chemical compound [Ni+2].CC=1C(C)=C(C)[C-](C)C=1C.CC=1C(C)=C(C)[C-](C)C=1C FPOBXNYAWLLCGZ-UHFFFAOYSA-N 0.000 description 1
- YCWSUKQGVSGXJO-NTUHNPAUSA-N nifuroxazide Chemical group C1=CC(O)=CC=C1C(=O)N\N=C\C1=CC=C([N+]([O-])=O)O1 YCWSUKQGVSGXJO-NTUHNPAUSA-N 0.000 description 1
- 229910000484 niobium oxide Inorganic materials 0.000 description 1
- URLJKFSTXLNXLG-UHFFFAOYSA-N niobium(5+);oxygen(2-) Chemical compound [O-2].[O-2].[O-2].[O-2].[O-2].[Nb+5].[Nb+5] URLJKFSTXLNXLG-UHFFFAOYSA-N 0.000 description 1
- 150000004767 nitrides Chemical class 0.000 description 1
- 125000001400 nonyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000002868 norbornyl group Chemical group C12(CCC(CC1)C2)* 0.000 description 1
- 229920001778 nylon Polymers 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- IOQPZZOEVPZRBK-UHFFFAOYSA-N octan-1-amine Chemical compound CCCCCCCCN IOQPZZOEVPZRBK-UHFFFAOYSA-N 0.000 description 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 235000021313 oleic acid Nutrition 0.000 description 1
- 239000011368 organic material Substances 0.000 description 1
- 150000002897 organic nitrogen compounds Chemical class 0.000 description 1
- 150000002898 organic sulfur compounds Chemical class 0.000 description 1
- 150000002903 organophosphorus compounds Chemical class 0.000 description 1
- AHLBNYSZXLDEJQ-FWEHEUNISA-N orlistat Chemical compound CCCCCCCCCCC[C@H](OC(=O)[C@H](CC(C)C)NC=O)C[C@@H]1OC(=O)[C@H]1CCCCCC AHLBNYSZXLDEJQ-FWEHEUNISA-N 0.000 description 1
- BASAKOUVGYHNRZ-UHFFFAOYSA-N oxido(tridecyl)phosphanium Chemical compound C(CCCCCCCCCCCC)[PH2]=O BASAKOUVGYHNRZ-UHFFFAOYSA-N 0.000 description 1
- TWNQGVIAIRXVLR-UHFFFAOYSA-N oxo(oxoalumanyloxy)alumane Chemical compound O=[Al]O[Al]=O TWNQGVIAIRXVLR-UHFFFAOYSA-N 0.000 description 1
- GNRSAWUEBMWBQH-UHFFFAOYSA-N oxonickel Chemical compound [Ni]=O GNRSAWUEBMWBQH-UHFFFAOYSA-N 0.000 description 1
- DYIZHKNUQPHNJY-UHFFFAOYSA-N oxorhenium Chemical compound [Re]=O DYIZHKNUQPHNJY-UHFFFAOYSA-N 0.000 description 1
- SOQBVABWOPYFQZ-UHFFFAOYSA-N oxygen(2-);titanium(4+) Chemical class [O-2].[O-2].[Ti+4] SOQBVABWOPYFQZ-UHFFFAOYSA-N 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- SLIUAWYAILUBJU-UHFFFAOYSA-N pentacene Chemical compound C1=CC=CC2=CC3=CC4=CC5=CC=CC=C5C=C4C=C3C=C21 SLIUAWYAILUBJU-UHFFFAOYSA-N 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 239000012466 permeate Substances 0.000 description 1
- 150000005359 phenylpyridines Chemical class 0.000 description 1
- 150000003003 phosphines Chemical class 0.000 description 1
- IEQIEDJGQAUEQZ-UHFFFAOYSA-N phthalocyanine Chemical compound N1C(N=C2C3=CC=CC=C3C(N=C3C4=CC=CC=C4C(=N4)N3)=N2)=C(C=CC=C2)C2=C1N=C1C2=CC=CC=C2C4=N1 IEQIEDJGQAUEQZ-UHFFFAOYSA-N 0.000 description 1
- 229920003190 poly( p-benzamide) Polymers 0.000 description 1
- 229920000078 poly(4-vinyltriphenylamine) Polymers 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 229920000647 polyepoxide Polymers 0.000 description 1
- 239000011112 polyethylene naphthalate Substances 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 229920000259 polyoxyethylene lauryl ether Polymers 0.000 description 1
- 229920001155 polypropylene Polymers 0.000 description 1
- 229920000915 polyvinyl chloride Polymers 0.000 description 1
- 239000004800 polyvinyl chloride Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 1
- FVSKHRXBFJPNKK-UHFFFAOYSA-N propionitrile Chemical compound CCC#N FVSKHRXBFJPNKK-UHFFFAOYSA-N 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- VLRICFVOGGIMKK-UHFFFAOYSA-N pyrazol-1-yloxyboronic acid Chemical compound OB(O)ON1C=CC=N1 VLRICFVOGGIMKK-UHFFFAOYSA-N 0.000 description 1
- 125000005412 pyrazyl group Chemical group 0.000 description 1
- BUAWIRPPAOOHKD-UHFFFAOYSA-N pyrene-1,2-diamine Chemical class C1=CC=C2C=CC3=C(N)C(N)=CC4=CC=C1C2=C43 BUAWIRPPAOOHKD-UHFFFAOYSA-N 0.000 description 1
- 150000003222 pyridines Chemical class 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 150000003248 quinolines Chemical class 0.000 description 1
- 125000005493 quinolyl group Chemical group 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- 239000002964 rayon Substances 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 238000002310 reflectometry Methods 0.000 description 1
- 229910003449 rhenium oxide Inorganic materials 0.000 description 1
- 239000005060 rubber Substances 0.000 description 1
- 229910001925 ruthenium oxide Inorganic materials 0.000 description 1
- WOCIAKWEIIZHES-UHFFFAOYSA-N ruthenium(iv) oxide Chemical compound O=[Ru]=O WOCIAKWEIIZHES-UHFFFAOYSA-N 0.000 description 1
- 238000006748 scratching Methods 0.000 description 1
- 230000002393 scratching effect Effects 0.000 description 1
- 238000007650 screen-printing Methods 0.000 description 1
- OQRNKLRIQBVZHK-UHFFFAOYSA-N selanylideneantimony Chemical compound [Sb]=[Se] OQRNKLRIQBVZHK-UHFFFAOYSA-N 0.000 description 1
- YWDGEUIDOIIHTK-UHFFFAOYSA-N selanylidenebarium Chemical compound [Ba]=[Se] YWDGEUIDOIIHTK-UHFFFAOYSA-N 0.000 description 1
- UKGBSHWRVFPDKV-UHFFFAOYSA-N selanylideneberyllium Chemical compound [Se]=[Be] UKGBSHWRVFPDKV-UHFFFAOYSA-N 0.000 description 1
- AHMCFSORHHSTSB-UHFFFAOYSA-N selanylidenecalcium Chemical compound [Se]=[Ca] AHMCFSORHHSTSB-UHFFFAOYSA-N 0.000 description 1
- IRPLSAGFWHCJIQ-UHFFFAOYSA-N selanylidenecopper Chemical compound [Se]=[Cu] IRPLSAGFWHCJIQ-UHFFFAOYSA-N 0.000 description 1
- GGYFMLJDMAMTAB-UHFFFAOYSA-N selanylidenelead Chemical compound [Pb]=[Se] GGYFMLJDMAMTAB-UHFFFAOYSA-N 0.000 description 1
- YQMLDSWXEQOSPP-UHFFFAOYSA-N selanylidenemercury Chemical compound [Hg]=[Se] YQMLDSWXEQOSPP-UHFFFAOYSA-N 0.000 description 1
- MFIWAIVSOUGHLI-UHFFFAOYSA-N selenium;tin Chemical compound [Sn]=[Se] MFIWAIVSOUGHLI-UHFFFAOYSA-N 0.000 description 1
- 150000003346 selenoethers Chemical class 0.000 description 1
- HQVNEWCFYHHQES-UHFFFAOYSA-N silicon nitride Chemical compound N12[Si]34N5[Si]62N3[Si]51N64 HQVNEWCFYHHQES-UHFFFAOYSA-N 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 229940100890 silver compound Drugs 0.000 description 1
- 229910001923 silver oxide Inorganic materials 0.000 description 1
- 239000005361 soda-lime glass Substances 0.000 description 1
- 229910052566 spinel group Inorganic materials 0.000 description 1
- 230000003068 static effect Effects 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 239000004575 stone Substances 0.000 description 1
- 229910052712 strontium Inorganic materials 0.000 description 1
- CIOAGBVUUVVLOB-UHFFFAOYSA-N strontium atom Chemical compound [Sr] CIOAGBVUUVVLOB-UHFFFAOYSA-N 0.000 description 1
- 238000000967 suction filtration Methods 0.000 description 1
- SEEPANYCNGTZFQ-UHFFFAOYSA-N sulfadiazine Chemical compound C1=CC(N)=CC=C1S(=O)(=O)NC1=NC=CC=N1 SEEPANYCNGTZFQ-UHFFFAOYSA-N 0.000 description 1
- UQMCSSLUTFUDSN-UHFFFAOYSA-N sulfanylidenegermane Chemical compound [GeH2]=S UQMCSSLUTFUDSN-UHFFFAOYSA-N 0.000 description 1
- SMDQFHZIWNYSMR-UHFFFAOYSA-N sulfanylidenemagnesium Chemical compound S=[Mg] SMDQFHZIWNYSMR-UHFFFAOYSA-N 0.000 description 1
- QXKXDIKCIPXUPL-UHFFFAOYSA-N sulfanylidenemercury Chemical compound [Hg]=S QXKXDIKCIPXUPL-UHFFFAOYSA-N 0.000 description 1
- 150000003457 sulfones Chemical class 0.000 description 1
- 150000003462 sulfoxides Chemical class 0.000 description 1
- 230000001502 supplementing effect Effects 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 229920002994 synthetic fiber Polymers 0.000 description 1
- 239000012209 synthetic fiber Substances 0.000 description 1
- 229920003002 synthetic resin Polymers 0.000 description 1
- 239000000057 synthetic resin Substances 0.000 description 1
- 239000013077 target material Substances 0.000 description 1
- UCMJLSDIXYLIDJ-UHFFFAOYSA-N tellanylidenebarium Chemical compound [Ba]=[Te] UCMJLSDIXYLIDJ-UHFFFAOYSA-N 0.000 description 1
- PUZSUGPVBHGJRE-UHFFFAOYSA-N tellanylideneberyllium Chemical compound [Te]=[Be] PUZSUGPVBHGJRE-UHFFFAOYSA-N 0.000 description 1
- UFTQLBVSSQWOKD-UHFFFAOYSA-N tellanylidenecalcium Chemical compound [Te]=[Ca] UFTQLBVSSQWOKD-UHFFFAOYSA-N 0.000 description 1
- XSOKHXFFCGXDJZ-UHFFFAOYSA-N telluride(2-) Chemical compound [Te-2] XSOKHXFFCGXDJZ-UHFFFAOYSA-N 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 150000003512 tertiary amines Chemical class 0.000 description 1
- XPDICGYEJXYUDW-UHFFFAOYSA-N tetraarsenic tetrasulfide Chemical compound S1[As]2S[As]3[As]1S[As]2S3 XPDICGYEJXYUDW-UHFFFAOYSA-N 0.000 description 1
- IFLREYGFSNHWGE-UHFFFAOYSA-N tetracene Chemical compound C1=CC=CC2=CC3=CC4=CC=CC=C4C=C3C=C21 IFLREYGFSNHWGE-UHFFFAOYSA-N 0.000 description 1
- 238000007725 thermal activation Methods 0.000 description 1
- 150000003568 thioethers Chemical class 0.000 description 1
- 229930192474 thiophene Natural products 0.000 description 1
- WYUZTTNXJUJWQQ-UHFFFAOYSA-N tin telluride Chemical compound [Te]=[Sn] WYUZTTNXJUJWQQ-UHFFFAOYSA-N 0.000 description 1
- TUQOTMZNTHZOKS-UHFFFAOYSA-N tributylphosphine Chemical compound CCCCP(CCCC)CCCC TUQOTMZNTHZOKS-UHFFFAOYSA-N 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- FPZZZGJWXOHLDJ-UHFFFAOYSA-N trihexylphosphane Chemical compound CCCCCCP(CCCCCC)CCCCCC FPZZZGJWXOHLDJ-UHFFFAOYSA-N 0.000 description 1
- RMZAYIKUYWXQPB-UHFFFAOYSA-N trioctylphosphane Chemical compound CCCCCCCCP(CCCCCCCC)CCCCCCCC RMZAYIKUYWXQPB-UHFFFAOYSA-N 0.000 description 1
- ZMBHCYHQLYEYDV-UHFFFAOYSA-N trioctylphosphine oxide Chemical compound CCCCCCCCP(=O)(CCCCCCCC)CCCCCCCC ZMBHCYHQLYEYDV-UHFFFAOYSA-N 0.000 description 1
- KCTAHLRCZMOTKM-UHFFFAOYSA-N tripropylphosphane Chemical compound CCCP(CCC)CCC KCTAHLRCZMOTKM-UHFFFAOYSA-N 0.000 description 1
- 238000000870 ultraviolet spectroscopy Methods 0.000 description 1
- 238000007738 vacuum evaporation Methods 0.000 description 1
- PXXNTAGJWPJAGM-UHFFFAOYSA-N vertaline Natural products C1C2C=3C=C(OC)C(OC)=CC=3OC(C=C3)=CC=C3CCC(=O)OC1CC1N2CCCC1 PXXNTAGJWPJAGM-UHFFFAOYSA-N 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
- 239000002023 wood Substances 0.000 description 1
- 125000001834 xanthenyl group Chemical group C1=CC=CC=2OC3=CC=CC=C3C(C12)* 0.000 description 1
- NAWDYIZEMPQZHO-UHFFFAOYSA-N ytterbium Chemical compound [Yb] NAWDYIZEMPQZHO-UHFFFAOYSA-N 0.000 description 1
- 229910052727 yttrium Inorganic materials 0.000 description 1
- HTPBWAPZAJWXKY-UHFFFAOYSA-L zinc;quinolin-8-olate Chemical compound [Zn+2].C1=CN=C2C([O-])=CC=CC2=C1.C1=CN=C2C([O-])=CC=CC2=C1 HTPBWAPZAJWXKY-UHFFFAOYSA-L 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D493/00—Heterocyclic compounds containing oxygen atoms as the only ring hetero atoms in the condensed system
- C07D493/02—Heterocyclic compounds containing oxygen atoms as the only ring hetero atoms in the condensed system in which the condensed system contains two hetero rings
- C07D493/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D495/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms
- C07D495/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D495/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic Table
- C07F7/02—Silicon compounds
- C07F7/08—Compounds having one or more C—Si linkages
- C07F7/0803—Compounds with Si-C or Si-Si linkages
- C07F7/081—Compounds with Si-C or Si-Si linkages comprising at least one atom selected from the elements N, O, halogen, S, Se or Te
- C07F7/0812—Compounds with Si-C or Si-Si linkages comprising at least one atom selected from the elements N, O, halogen, S, Se or Te comprising a heterocyclic ring
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H01L51/0052—
-
- H01L51/006—
-
- H01L51/0061—
-
- H01L51/0073—
-
- H01L51/5012—
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/14—Carrier transporting layers
- H10K50/15—Hole transporting layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/626—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene containing more than one polycyclic condensed aromatic rings, e.g. bis-anthracene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
- H10K85/633—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine comprising polycyclic condensed aromatic hydrocarbons as substituents on the nitrogen atom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
- H10K85/636—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine comprising heteroaromatic hydrocarbons as substituents on the nitrogen atom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6574—Polycyclic condensed heteroaromatic hydrocarbons comprising only oxygen in the heteroaromatic polycondensed ring system, e.g. cumarine dyes
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6576—Polycyclic condensed heteroaromatic hydrocarbons comprising only sulfur in the heteroaromatic polycondensed ring system, e.g. benzothiophene
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/10—Triplet emission
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Physics & Mathematics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Optics & Photonics (AREA)
- Electroluminescent Light Sources (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
- Devices For Indicating Variable Information By Combining Individual Elements (AREA)
- Illuminated Signs And Luminous Advertising (AREA)
Abstract
신규 유기 화합물을 제공한다. 색도가 높은 광을 방출하는 유기 화합물을 제공한다. 색도가 높은 청색 광을 방출하는 유기 화합물을 제공한다. 발광 효율이 높은 유기 화합물을 제공한다. 정공 수송성이 우수한 유기 화합물을 제공한다. 신뢰성이 높은 유기 화합물을 제공한다. 나프토[2,3-b;7,6-b']비스벤조퓨란 골격 또는 나프토[2,3-b;7,6-b']비스벤조싸이오펜 골격을 가지며 분자량이 5000 이하인 유기 화합물을 제공한다. 본 발명자들은 상기 유기 화합물이 발광 소자의 발광단(luminophor)으로서 매우 효과적인 골격인 것을 발견하였다. 상기 유기 화합물은 발광 효율이 높으며 양호한 청색 발광을 나타내므로, 상기 유기 화합물을 사용한 발광 소자는 발광 효율이 높은 청색 발광 소자로 할 수 있다
Description
본 발명의 실시형태는 발광 소자, 디스플레이 모듈, 조명 모듈, 표시 장치, 발광 장치, 전자 기기, 및 조명 장치에 관한 것이다. 또한 본 발명의 일 형태는 상술한 기술분야에 한정되지 않는다. 본 명세서 등에 개시(開示)된 발명의 일 형태의 기술분야는 물건, 방법, 또는 제작 방법에 관한 것이다. 본 발명의 일 형태는 공정(process), 기계(machine), 제품(manufacture), 또는 조성물(composition of matter)에 관한 것이다. 구체적으로, 본 명세서에 개시된 본 발명의 일 형태의 기술분야의 예에는 반도체 장치, 표시 장치, 액정 표시 장치, 발광 장치, 조명 장치, 축전 장치, 기억 장치, 촬상 장치, 이들 중 어느 것의 구동 방법, 및 이들 중 어느 것의 제작 방법이 포함된다.
유기 EL 소자를 포함하는 표시 장치 및 발광 장치는 일부 실용화되고 점점 다양하게 응용되고 있다. 근년에 들어 액정 디스플레이가 큰 진보를 보이고 있으므로, 차세대 디스플레이인 유기 EL 디스플레이는 당연히 품질이 높은 것을 필요로 한다.
유기 EL 디스플레이의 재료로서는 다양한 물질이 개발되고 있지만, 실용화에 충분한 높은 내성을 가지는 것은 많지 않다. 조합의 다양성 및 상응성 등을 고려하면, 선택지가 많을수록 바람직한 것은 말할 나위 없다.
유기 EL 소자는 복수의 물질이 상이한 기능을 가지는 기능 분리형 구조를 가진다. 이 물질들 중에서 발광 재료, 특히 소비전력에 영향을 미치는 발광 효율 및 표시 품질을 향상시킬 수 있는 발광색에 대한 요구가 크다.
특허문헌 1에는 나프토비스벤조퓨란 골격을 가지는 유기 화합물이 개시되어 있다.
본 발명의 일 형태의 과제는 신규 유기 화합물을 제공하는 것이다. 본 발명의 일 형태의 다른 과제는 색도가 높은 광을 방출하는 유기 화합물을 제공하는 것이다. 본 발명의 일 형태의 다른 과제는 색도가 높은 청색 광을 방출하는 유기 화합물을 제공하는 것이다. 본 발명의 일 형태의 다른 과제는 발광 효율이 높은 유기 화합물을 제공하는 것이다. 본 발명의 일 형태의 다른 과제는 캐리어 수송성이 우수한 유기 화합물을 제공하는 것이다. 본 발명의 일 형태의 다른 과제는 신뢰성이 높은 유기 화합물을 제공하는 것이다.
본 발명의 일 형태의 다른 과제는 신규 발광 소자를 제공하는 것이다. 본 발명의 일 형태의 다른 과제는 발광 효율이 높은 발광 소자를 제공하는 것이다. 본 발명의 일 형태의 다른 과제는 색도가 높은 발광 소자를 제공하는 것이다. 본 발명의 일 형태의 다른 과제는 색도가 높은 청색 광을 방출하는 발광 소자를 제공하는 것이다. 본 발명의 일 형태의 다른 과제는 수명이 긴 발광 소자를 제공하는 것이다. 본 발명의 일 형태의 다른 과제는 구동 전압이 낮은 발광 소자를 제공하는 것이다.
본 발명의 일 형태의 다른 과제는 소비전력이 낮은 발광 장치, 전자 기기, 및 표시 장치 각각을 제공하는 것이다. 본 발명의 일 형태의 다른 과제는 신뢰성이 높은 발광 장치, 전자 기기, 및 표시 장치 각각을 제공하는 것이다. 본 발명의 일 형태의 다른 과제는 표시 품질이 높은 발광 장치, 전자 기기, 및 표시 장치 각각을 제공하는 것이다.
본 발명에서는 상술한 과제들 중 적어도 하나를 달성하면 된다.
본 발명의 일 형태는 하기 일반식(G1)으로 나타내어지며, 분자량이 5000 이하인 유기 화합물을 포함하는 발광 소자이다.
[화학식 1]
일반식(G1)에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타내고, R1 내지 R12는 독립적으로 수소 또는 치환기를 나타낸다.
본 발명의 다른 일 형태는 상기 치환기가, 치환 또는 비치환된 탄소수 1 내지 100의 지방족 탄화수소기, 치환 또는 비치환된 탄소수 3 내지 100의 지환식 탄화수소기, 치환 또는 비치환된 탄소수 6 내지 100의 방향족 탄화수소기, 치환 또는 비치환된 탄소수 1 내지 100의 헤테로 고리기, 혹은 치환 또는 비치환된 탄소수 12 내지 100의 다이아릴아미노기인 상술한 구조를 가지는 발광 소자이다.
본 발명의 다른 일 형태는 하기 일반식(G1)으로 나타내어지며, 분자량이 5000 이하인 유기 화합물을 포함하는 발광 소자이다.
[화학식 2]
일반식(G1)에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타낸다. 상기 식에 있어서, R1 내지 R12 중 적어도 하나는 탄소수 6 내지 100의 치환기를 나타내고, 나머지는 독립적으로 수소 또는 탄소수 1 내지 25의 치환기를 나타낸다.
본 발명의 다른 일 형태는 하기 일반식(G1)으로 나타내어지며, 분자량이 5000 이하인 유기 화합물을 포함하는 발광 소자이다.
[화학식 3]
일반식(G1)에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타낸다. 상기 식에 있어서, R1 내지 R12 중 하나 또는 2개는 독립적으로 탄소수 6 내지 100의 치환기를 나타내고, 나머지는 독립적으로 수소 또는 탄소수 1 내지 25의 치환기를 나타낸다.
본 발명의 다른 일 형태는 하기 일반식(G1)으로 나타내어지며, 분자량이 5000 이하인 유기 화합물을 포함하는 발광 소자이다.
[화학식 4]
일반식(G1)에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타낸다. 상기 식에 있어서, R1 내지 R12 중에서 R2 및 R9 중 한쪽 또는 양쪽은 독립적으로 탄소수 6 내지 100의 치환기를 나타내고, 나머지는 독립적으로 수소 또는 탄소수 1 내지 25의 치환기를 나타낸다.
본 발명의 다른 일 형태는 하기 일반식(G1)으로 나타내어지며, 분자량이 5000 이하인 유기 화합물을 포함하는 발광 소자이다.
[화학식 5]
일반식(G1)에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타낸다. 상기 식에 있어서, R1 내지 R12 중에서 R3 및 R8 중 한쪽 또는 양쪽은 독립적으로 탄소수 6 내지 100의 치환기를 나타내고, 나머지는 독립적으로 수소 또는 탄소수 1 내지 25의 치환기를 나타낸다.
본 발명의 다른 일 형태는 상기 탄소수 6 내지 100의 치환기가, 치환 또는 비치환된 지방족 탄화수소기, 치환 또는 비치환된 지환식 탄화수소기, 치환 또는 비치환된 방향족 탄화수소기, 치환 또는 비치환된 헤테로 고리기, 혹은 치환 또는 비치환된 다이아릴아미노기인 상술한 구조를 가지는 발광 소자이다. 또한 상기 다이아릴아미노기에 포함되는 아릴기의 예에는 헤테로아릴기가 포함된다.
본 발명의 다른 일 형태는 상기 탄소수 6 내지 100의 치환기가 탄소수 12 내지 100의 치환기인 상술한 구조를 가지는 발광 소자이다.
본 발명의 다른 일 형태는 상기 탄소수 6 내지 100의 치환기가 하기 일반식(g1) 또는 일반식(g2)으로 나타내어지는 치환기인 상술한 구조를 가지는 발광 소자이다.
[화학식 6]
본 발명의 다른 일 형태는 상기 탄소수 6 내지 100의 치환기가 하기 구조식(Ar-100) 내지 구조식(Ar-109) 및 구조식(Ar-29)으로 나타내어지는 치환기로부터 선택되는 치환기인 상술한 구조를 가지는 발광 소자이다.
[화학식 7]
본 발명의 다른 일 형태는 상기 탄소수 1 내지 25의 치환기가, 치환 또는 비치환된 지방족 탄화수소기, 치환 또는 비치환된 지환식 탄화수소기, 치환 또는 비치환된 방향족 탄화수소기, 혹은 치환 또는 비치환된 헤테로 고리기인 상술한 구조를 가지는 발광 소자이다.
본 발명의 다른 일 형태는 하기 일반식(G2)으로 나타내어지는 유기 화합물을 포함하는 발광 소자이다.
[화학식 8]
일반식(G2)에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타낸다. 상기 식에 있어서, R1, R3 내지 R8, R10 내지 R12, R20 내지 R29, 및 R30 내지 R39는 독립적으로 수소, 탄소수 1 내지 10의 지방족 탄화수소기, 탄소수 3 내지 20의 지환식 탄화수소기, 탄소수 6 내지 25의 방향족 탄화수소기, 또는 탄소수 1 내지 25의 헤테로 고리기를 나타낸다.
본 발명의 다른 일 형태는 하기 일반식(G3)으로 나타내어지는 유기 화합물을 포함하는 발광 소자이다.
[화학식 9]
일반식(G3)에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타낸다. 상기 식에 있어서, R1, R2, R4 내지 R7, R9 내지 R12, R20 내지 R29, 및 R30 내지 R39는 독립적으로 수소, 탄소수 1 내지 10의 지방족 탄화수소기, 탄소수 3 내지 20의 지환식 탄화수소기, 탄소수 6 내지 25의 방향족 탄화수소기, 또는 탄소수 1 내지 25의 헤테로 고리기를 나타낸다.
본 발명의 다른 일 형태는 하기 일반식(G4)으로 나타내어지는 유기 화합물을 포함하는 발광 소자이다.
[화학식 10]
일반식(G4)에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타낸다. 상기 식에 있어서, R1, R3 내지 R8, R10 내지 R12, R40 내지 R49, 및 R50 내지 R59는 독립적으로 수소, 탄소수 1 내지 10의 지방족 탄화수소기, 탄소수 3 내지 20의 지환식 탄화수소기, 탄소수 6 내지 25의 방향족 탄화수소기, 또는 탄소수 1 내지 25의 헤테로 고리기를 나타낸다.
본 발명의 다른 일 형태는 X1과 X2가 동일한 원자인 상술한 구조를 가지는 발광 소자이다.
본 발명의 다른 일 형태는 X1 및 X2가 산소 원자인 상술한 구조를 가지는 발광 소자이다.
본 발명의 다른 일 형태는 상기 유기 화합물의 분자량이 3000 이하인 발광 소자이다.
본 발명의 다른 일 형태는 상기 유기 화합물의 분자량이 1500 이하인 발광 소자이다.
본 발명의 다른 일 형태는 하기 일반식(G1)으로 나타내어지며, 분자량이 5000 이하인 유기 화합물이다.
[화학식 11]
일반식(G1)에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타낸다. 상기 식에 있어서, R1 내지 R12 중 적어도 하나는 탄소수 6 내지 100의 치환기를 나타내고, 나머지는 독립적으로 수소 또는 탄소수 1 내지 25의 치환기를 나타낸다.
본 발명의 다른 일 형태는 하기 일반식(G1)으로 나타내어지며, 분자량이 5000 이하인 유기 화합물이다.
[화학식 12]
일반식(G1)에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타낸다. 상기 식에 있어서, R1 내지 R12 중 하나 또는 2개는 독립적으로 탄소수 6 내지 100의 치환기를 나타내고, 나머지는 독립적으로 수소 또는 탄소수 1 내지 25의 치환기를 나타낸다.
본 발명의 다른 일 형태는 하기 일반식(G1)으로 나타내어지며, 분자량이 5000 이하인 유기 화합물이다.
[화학식 13]
일반식(G1)에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타낸다. 상기 식에 있어서, R1 내지 R12 중에서 R2 및 R9 중 한쪽 또는 양쪽은 독립적으로 탄소수 6 내지 100의 치환기를 나타내고, 나머지는 독립적으로 수소 또는 탄소수 1 내지 25의 치환기를 나타낸다.
본 발명의 다른 일 형태는 하기 일반식(G1)으로 나타내어지며, 분자량이 5000 이하인 유기 화합물이다.
[화학식 14]
일반식(G1)에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타낸다. 상기 식에 있어서, R1 내지 R12 중에서 R3 및 R8 중 한쪽 또는 양쪽은 독립적으로 탄소수 6 내지 100의 치환기를 나타내고, 나머지는 독립적으로 수소 또는 탄소수 1 내지 25의 치환기를 나타낸다.
본 발명의 다른 일 형태는 상기 탄소수 6 내지 100의 치환기가, 치환 또는 비치환된 지방족 탄화수소기, 치환 또는 비치환된 지환식 탄화수소기, 치환 또는 비치환된 방향족 탄화수소기, 치환 또는 비치환된 헤테로 고리기, 혹은 치환 또는 비치환된 다이아릴아미노기인 상술한 구조를 가지는 유기 화합물이다. 또한 상기 다이아릴아미노기에 포함되는 아릴기의 예에는 헤테로아릴기가 포함된다.
본 발명의 다른 일 형태는 상기 탄소수 6 내지 100의 치환기가 탄소수 12 내지 100의 치환기인 상술한 구조를 가지는 유기 화합물이다.
본 발명의 다른 일 형태는 상기 탄소수 6 내지 100의 치환기가 하기 일반식(g1) 또는 일반식(g2)으로 나타내어지는 치환기인 상술한 구조를 가지는 유기 화합물이다.
[화학식 15]
본 발명의 다른 일 형태는 상기 탄소수 6 내지 100의 치환기가 하기 구조식(Ar-100) 내지 구조식(Ar-109) 및 구조식(Ar-29)으로 나타내어지는 치환기로부터 선택되는 치환기인 상술한 구조를 가지는 유기 화합물이다.
[화학식 16]
본 발명의 다른 일 형태는 상기 탄소수 1 내지 25의 치환기가, 치환 또는 비치환된 지방족 탄화수소기, 치환 또는 비치환된 지환식 탄화수소기, 치환 또는 비치환된 방향족 탄화수소기, 혹은 치환 또는 비치환된 헤테로 고리기인 상술한 구조를 가지는 유기 화합물이다.
본 발명의 다른 일 형태는 하기 일반식(G2)으로 나타내어지는 유기 화합물이다.
[화학식 17]
일반식(G2)에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타낸다. 상기 식에 있어서, R1, R3 내지 R8, R10 내지 R12, R20 내지 R29, 및 R30 내지 R39는 독립적으로 수소, 탄소수 1 내지 10의 지방족 탄화수소기, 탄소수 3 내지 20의 지환식 탄화수소기, 탄소수 6 내지 25의 방향족 탄화수소기, 또는 탄소수 1 내지 25의 헤테로 고리기를 나타낸다.
본 발명의 다른 일 형태는 하기 일반식(G3)으로 나타내어지는 유기 화합물이다.
[화학식 18]
일반식(G3)에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타낸다. 상기 식에 있어서, R1, R2, R4 내지 R7, R9 내지 R12, R20 내지 R29, 및 R30 내지 R39는 독립적으로 수소, 탄소수 1 내지 10의 지방족 탄화수소기, 탄소수 3 내지 20의 지환식 탄화수소기, 탄소수 6 내지 25의 방향족 탄화수소기, 또는 탄소수 1 내지 25의 헤테로 고리기를 나타낸다.
본 발명의 다른 일 형태는 하기 일반식(G4)으로 나타내어지는 유기 화합물이다.
[화학식 19]
일반식(G4)에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타낸다. 상기 식에 있어서, R1, R3 내지 R8, R10 내지 R12, R40 내지 R49, 및 R50 내지 R59는 독립적으로 수소, 탄소수 1 내지 10의 지방족 탄화수소기, 탄소수 3 내지 20의 지환식 탄화수소기, 탄소수 6 내지 25의 방향족 탄화수소기, 또는 탄소수 1 내지 25의 헤테로 고리기를 나타낸다.
본 발명의 다른 일 형태는 X1과 X2가 동일한 원자인 상술한 구조를 가지는 유기 화합물이다.
본 발명의 다른 일 형태는 X1 및 X2가 산소 원자인 상술한 구조를 가지는 유기 화합물이다.
본 발명의 다른 일 형태는 분자량이 3000 이하인 상술한 구조를 가지는 유기 화합물이다.
본 발명의 다른 일 형태는 분자량이 1500 이하인 상술한 구조를 가지는 유기 화합물이다.
본 발명의 다른 일 형태는 하기 구조식(100)으로 나타내어지는 유기 화합물이다.
[화학식 20]
본 발명의 다른 일 형태는 하기 구조식(300)으로 나타내어지는 유기 화합물이다.
[화학식 21]
본 발명의 다른 일 형태는 하기 구조식(118)으로 나타내어지는 유기 화합물이다.
[화학식 22]
본 발명의 다른 일 형태는 상술한 구조를 가지는 유기 화합물을 포함하는 발광 소자이다.
본 발명의 다른 일 형태는 상술한 구조를 가지는 발광 소자와, 트랜지스터 또는 기판을 포함하는 발광 장치이다.
본 발명의 다른 일 형태는 상술한 구조를 가지는 발광 소자와, 트랜지스터 또는 기판을 포함하는 표시 장치이다.
본 발명의 다른 일 형태는 상술한 구조를 가지는 발광 장치와, 센서, 조작 버튼, 스피커, 또는 마이크로폰을 포함하는 전자 기기이다.
본 발명의 다른 일 형태는 상술한 구조를 가지는 발광 장치와 하우징을 포함하는 조명 장치이다.
본 발명의 다른 일 형태는 하기 일반식(G01)으로 나타내어지는 유기 화합물이다.
[화학식 23]
일반식(G01)에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타낸다. 상기 식에 있어서, R21 내지 R32 중 하나 또는 2개는 할로젠을 나타내고, 나머지는 독립적으로 수소, 탄소수 1 내지 10의 지방족 탄화수소기, 탄소수 3 내지 20의 지환식 탄화수소기, 탄소수 6 내지 25의 방향족 탄화수소기, 또는 탄소수 1 내지 25의 헤테로 고리기를 나타낸다.
본 발명의 다른 일 형태는 하기 일반식(G02)으로 나타내어지는 유기 화합물이다.
[화학식 24]
일반식(G02)에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타낸다. 상기 식에 있어서, Y3 및 Y4는 독립적으로 할로젠을 나타내고, R21, R23 내지 R28, 및 R30 내지 R32는 독립적으로 수소, 탄소수 1 내지 10의 지방족 탄화수소기, 탄소수 3 내지 20의 지환식 탄화수소기, 탄소수 6 내지 25의 방향족 탄화수소기, 또는 탄소수 1 내지 25의 헤테로 고리기를 나타낸다.
본 발명의 다른 일 형태는 하기 일반식(G03)으로 나타내어지는 유기 화합물이다.
[화학식 25]
일반식(G03)에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타낸다. 상기 식에 있어서, Y5 및 Y6은 독립적으로 할로젠을 나타내고, R21, R22, R24 내지 R27, 및 R29 내지 R32는 독립적으로 수소, 탄소수 1 내지 10의 지방족 탄화수소기, 탄소수 3 내지 20의 지환식 탄화수소기, 탄소수 6 내지 25의 방향족 탄화수소기, 또는 탄소수 1 내지 25의 헤테로 고리기를 나타낸다.
또한 본 명세서에서의 발광 장치는 발광 소자를 사용한 화상 표시 장치를 그 범주에 포함한다. 발광 장치는 발광 소자에 이방성 도전막 또는 TCP(tape carrier package) 등의 커넥터가 제공된 모듈, TCP 끝에 인쇄 배선판이 제공된 모듈, 및 발광 소자에 COG(chip on glass)법에 의하여 IC(integrated circuit)가 직접 실장된 모듈을 포함하여도 좋다. 발광 장치는 조명 장치 등에 포함되어도 좋다.
본 발명의 일 형태에 따르면, 신규 유기 화합물을 제공할 수 있다. 색도가 높은 광을 방출하는 유기 화합물을 제공할 수 있다. 색도가 높은 청색 광을 방출하는 유기 화합물을 제공할 수 있다. 발광 효율이 높은 유기 화합물을 제공할 수 있다. 정공 수송성이 우수한 유기 화합물을 제공할 수 있다. 신뢰성이 높은 유기 화합물을 제공할 수 있다.
본 발명의 다른 일 형태에 따르면, 신규 발광 소자를 제공할 수 있다. 발광 효율이 높은 발광 소자를 제공할 수 있다. 색도가 높은 발광 소자를 제공할 수 있다. 색도가 높은 청색 광을 방출하는 발광 소자를 제공할 수 있다. 수명이 긴 발광 소자를 제공할 수 있다. 구동 전압이 낮은 발광 소자를 제공할 수 있다.
본 발명의 다른 일 형태에 따르면, 소비전력이 낮은 발광 장치, 전자 기기, 및 표시 장치 각각을 제공할 수 있다. 신뢰성이 높은 발광 장치, 전자 기기, 및 표시 장치 각각을 제공할 수 있다. 표시 품질이 높은 발광 장치, 전자 기기, 및 표시 장치 각각을 제공할 수 있다.
또한 이들 효과의 기재는 다른 효과의 존재를 방해하지 않는다. 본 발명의 일 형태는 상술한 모든 효과를 반드시 가질 필요는 없다. 다른 효과는 명세서, 도면, 및 청구항 등의 기재로부터 명백해질 것이고 추출될 수 있다.
도 1의 (A) 내지 (C)는 발광 소자의 개략도이다.
도 2의 (A) 내지 (D)는 발광 소자의 제작 방법의 일례를 도시한 것이다.
도 3은 발광 소자의 제작 방법의 일례를 도시한 것이다.
도 4의 (A) 및 (B)는 액티브 매트릭스 발광 장치의 개념도이다.
도 5의 (A) 및 (B)는 액티브 매트릭스 발광 장치의 개념도이다.
도 6은 액티브 매트릭스 발광 장치의 개념도이다.
도 7의 (A) 및 (B)는 패시브 매트릭스 발광 장치의 개념도이다.
도 8의 (A) 및 (B)는 조명 장치를 도시한 것이다.
도 9의 (A), (B1), (B2), (C), 및 (D)는 전자 기기를 도시한 것이다.
도 10은 광원 장치를 도시한 것이다.
도 11은 조명 장치를 도시한 것이다.
도 12는 조명 장치를 도시한 것이다.
도 13은 차량용 표시 장치 및 조명 장치를 도시한 것이다.
도 14의 (A) 내지 (C)는 전자 기기를 도시한 것이다.
도 15의 (A) 내지 (C)는 전자 기기를 도시한 것이다.
도 16의 (A) 및 (B)는 3,6-비스(5-클로로-2-플루오로페닐)-2,7-다이메톡시나프탈렌의 1H NMR 스펙트럼을 나타낸 것이다.
도 17의 (A) 및 (B)는 3,6-비스(5-클로로-2-플루오로페닐)-2,7-다이하이드록시나프탈렌의 1H NMR 스펙트럼을 나타낸 것이다.
도 18의 (A) 및 (B)는 2,11-다이클로로나프토[2,3-b;7,6-b']비스벤조퓨란의 1H NMR 스펙트럼을 나타낸 것이다.
도 19의 (A) 및 (B)는 2,11-비스(다이페닐아미노)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 2,11DPhA2Nbf(II))의 1H NMR 스펙트럼을 나타낸 것이다.
도 20은 톨루엔 용액에서의 2,11DPhA2Nbf(II)의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 21은 2,11DPhA2Nbf(II)의 박막의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 22는 2,11DPhA2Nbf(II)의 MS 스펙트럼을 나타낸 것이다.
도 23의 (A) 및 (B)는 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이메톡시나프탈렌의 1H NMR 스펙트럼을 나타낸 것이다.
도 24의 (A) 및 (B)는 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이하이드록시나프탈렌의 1H NMR 스펙트럼을 나타낸 것이다.
도 25의 (A) 및 (B)는 3,10-다이클로로나프토[2,3-b;7,6-b']비스벤조퓨란의 1H NMR 스펙트럼을 나타낸 것이다.
도 26의 (A) 및 (B)는 3,10-비스(다이페닐아미노)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 3,10DPhA2Nbf(II))의 1H NMR 스펙트럼을 나타낸 것이다.
도 27은 톨루엔 용액에서의 3,10DPhA2Nbf(II)의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 28은 3,10DPhA2Nbf(II)의 박막의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 29는 3,10DPhA2Nbf(II)의 MS 스펙트럼을 나타낸 것이다.
도 30의 (A) 및 (B)는 3,10-비스[N-(4-바이페닐)-N-(9,9-다이메틸-9H-플루오렌-2-일)아미노]나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 3,10FBi2Nbf(II))의 1H NMR 스펙트럼을 나타낸 것이다.
도 31은 톨루엔 용액에서의 3,10FBi2Nbf(II)의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 32는 3,10FBi2Nbf(II)의 박막의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 33은 3,10FBi2Nbf(II)의 MS 스펙트럼을 나타낸 것이다.
도 34의 (A) 및 (B)는 3,10-비스(3,3'-다이메틸다이페닐아미노)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 3,10mMeDPhA2Nbf(II))의 1H NMR 스펙트럼을 나타낸 것이다.
도 35는 톨루엔 용액에서의 3,10mMeDPhA2Nbf(II)의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 36은 3,10mMeDPhA2Nbf(II)의 박막의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 37은 3,10mMeDPhA2Nbf(II)의 MS 스펙트럼을 나타낸 것이다.
도 38의 (A) 및 (B)는 3,10-비스(10-페닐-9-안트릴)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 3,10PhA2Nbf(II))의 1H NMR 스펙트럼을 나타낸 것이다.
도 39는 톨루엔 용액에서의 3,10PhA2Nbf(II)의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 40은 3,10PhA2Nbf(II)의 박막의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 41은 3,10PhA2Nbf(II)의 MS 스펙트럼을 나타낸 것이다.
도 42는 3,10PhA2Nbf(II)의 MS 스펙트럼을 나타낸 것이다.
도 43의 (A) 및 (B)는 3-브로모-6-(2-플루오로페닐)-2,7-다이메톡시나프탈렌의 1H NMR 스펙트럼을 나타낸 것이다.
도 44의 (A) 및 (B)는 3-(2-플루오로페닐)-6-(2-플루오로-4-클로로페닐)-2,7-다이메톡시나프탈렌의 1H NMR 스펙트럼을 나타낸 것이다.
도 45의 (A) 및 (B)는 3-(2-플루오로페닐)-6-(2-플루오로-4-클로로페닐)-2,7-다이하이드록시나프탈렌의 1H NMR 스펙트럼을 나타낸 것이다.
도 46의 (A) 및 (B)는 2-클로로나프토[2,3-b;7,6-b']비스벤조퓨란의 1H NMR 스펙트럼을 나타낸 것이다.
도 47의 (A) 및 (B)는 3-(10-페닐-9-안트릴)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: Nbf(II)PhA)의 1H NMR 스펙트럼을 나타낸 것이다.
도 48은 톨루엔 용액에서의 Nbf(II)PhA의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 49는 Nbf(II)PhA의 박막의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 50은 Nbf(II)PhA의 MS 스펙트럼을 나타낸 것이다.
도 51은 발광 소자 1의 휘도-전류 밀도 특성을 나타낸 것이다.
도 52는 발광 소자 1의 전류 효율-휘도 특성을 나타낸 것이다.
도 53은 발광 소자 1의 휘도-전압 특성을 나타낸 것이다.
도 54는 발광 소자 1의 전류-전압 특성을 나타낸 것이다.
도 55는 발광 소자 1의 외부 양자 효율-휘도 특성을 나타낸 것이다.
도 56은 발광 소자 1의 발광 스펙트럼을 나타낸 것이다.
도 57은 발광 소자 1의 정규화 휘도의 시간 의존성을 나타낸 것이다.
도 58은 발광 소자 2의 휘도-전류 밀도 특성을 나타낸 것이다.
도 59는 발광 소자 2의 전류 효율-휘도 특성을 나타낸 것이다.
도 60은 발광 소자 2의 휘도-전압 특성을 나타낸 것이다.
도 61은 발광 소자 2의 전류-전압 특성을 나타낸 것이다.
도 62는 발광 소자 2의 외부 양자 효율-휘도 특성을 나타낸 것이다.
도 63은 발광 소자 2의 발광 스펙트럼을 나타낸 것이다.
도 64는 발광 소자 2의 정규화 휘도의 시간 의존성을 나타낸 것이다.
도 65는 발광 소자 3의 휘도-전류 밀도 특성을 나타낸 것이다.
도 66은 발광 소자 3의 전류 효율-휘도 특성을 나타낸 것이다.
도 67은 발광 소자 3의 휘도-전압 특성을 나타낸 것이다.
도 68은 발광 소자 3의 전류-전압 특성을 나타낸 것이다.
도 69는 발광 소자 3의 외부 양자 효율-휘도 특성을 나타낸 것이다.
도 70은 발광 소자 3의 발광 스펙트럼을 나타낸 것이다.
도 71은 발광 소자 4의 휘도-전류 밀도 특성을 나타낸 것이다.
도 72는 발광 소자 4의 전류 효율-휘도 특성을 나타낸 것이다.
도 73은 발광 소자 4의 휘도-전압 특성을 나타낸 것이다.
도 74는 발광 소자 4의 전류-전압 특성을 나타낸 것이다.
도 75는 발광 소자 4의 외부 양자 효율-휘도 특성을 나타낸 것이다.
도 76은 발광 소자 4의 발광 스펙트럼을 나타낸 것이다.
도 77은 발광 소자 4의 정규화 휘도의 시간 의존성을 나타낸 것이다.
도 78은 발광 소자 5의 휘도-전류 밀도 특성을 나타낸 것이다.
도 79는 발광 소자 5의 전류 효율-휘도 특성을 나타낸 것이다.
도 80은 발광 소자 5의 휘도-전압 특성을 나타낸 것이다.
도 81은 발광 소자 5의 전류-전압 특성을 나타낸 것이다.
도 82는 발광 소자 5의 외부 양자 효율-휘도 특성을 나타낸 것이다.
도 83은 발광 소자 5의 발광 스펙트럼을 나타낸 것이다.
도 2의 (A) 내지 (D)는 발광 소자의 제작 방법의 일례를 도시한 것이다.
도 3은 발광 소자의 제작 방법의 일례를 도시한 것이다.
도 4의 (A) 및 (B)는 액티브 매트릭스 발광 장치의 개념도이다.
도 5의 (A) 및 (B)는 액티브 매트릭스 발광 장치의 개념도이다.
도 6은 액티브 매트릭스 발광 장치의 개념도이다.
도 7의 (A) 및 (B)는 패시브 매트릭스 발광 장치의 개념도이다.
도 8의 (A) 및 (B)는 조명 장치를 도시한 것이다.
도 9의 (A), (B1), (B2), (C), 및 (D)는 전자 기기를 도시한 것이다.
도 10은 광원 장치를 도시한 것이다.
도 11은 조명 장치를 도시한 것이다.
도 12는 조명 장치를 도시한 것이다.
도 13은 차량용 표시 장치 및 조명 장치를 도시한 것이다.
도 14의 (A) 내지 (C)는 전자 기기를 도시한 것이다.
도 15의 (A) 내지 (C)는 전자 기기를 도시한 것이다.
도 16의 (A) 및 (B)는 3,6-비스(5-클로로-2-플루오로페닐)-2,7-다이메톡시나프탈렌의 1H NMR 스펙트럼을 나타낸 것이다.
도 17의 (A) 및 (B)는 3,6-비스(5-클로로-2-플루오로페닐)-2,7-다이하이드록시나프탈렌의 1H NMR 스펙트럼을 나타낸 것이다.
도 18의 (A) 및 (B)는 2,11-다이클로로나프토[2,3-b;7,6-b']비스벤조퓨란의 1H NMR 스펙트럼을 나타낸 것이다.
도 19의 (A) 및 (B)는 2,11-비스(다이페닐아미노)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 2,11DPhA2Nbf(II))의 1H NMR 스펙트럼을 나타낸 것이다.
도 20은 톨루엔 용액에서의 2,11DPhA2Nbf(II)의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 21은 2,11DPhA2Nbf(II)의 박막의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 22는 2,11DPhA2Nbf(II)의 MS 스펙트럼을 나타낸 것이다.
도 23의 (A) 및 (B)는 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이메톡시나프탈렌의 1H NMR 스펙트럼을 나타낸 것이다.
도 24의 (A) 및 (B)는 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이하이드록시나프탈렌의 1H NMR 스펙트럼을 나타낸 것이다.
도 25의 (A) 및 (B)는 3,10-다이클로로나프토[2,3-b;7,6-b']비스벤조퓨란의 1H NMR 스펙트럼을 나타낸 것이다.
도 26의 (A) 및 (B)는 3,10-비스(다이페닐아미노)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 3,10DPhA2Nbf(II))의 1H NMR 스펙트럼을 나타낸 것이다.
도 27은 톨루엔 용액에서의 3,10DPhA2Nbf(II)의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 28은 3,10DPhA2Nbf(II)의 박막의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 29는 3,10DPhA2Nbf(II)의 MS 스펙트럼을 나타낸 것이다.
도 30의 (A) 및 (B)는 3,10-비스[N-(4-바이페닐)-N-(9,9-다이메틸-9H-플루오렌-2-일)아미노]나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 3,10FBi2Nbf(II))의 1H NMR 스펙트럼을 나타낸 것이다.
도 31은 톨루엔 용액에서의 3,10FBi2Nbf(II)의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 32는 3,10FBi2Nbf(II)의 박막의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 33은 3,10FBi2Nbf(II)의 MS 스펙트럼을 나타낸 것이다.
도 34의 (A) 및 (B)는 3,10-비스(3,3'-다이메틸다이페닐아미노)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 3,10mMeDPhA2Nbf(II))의 1H NMR 스펙트럼을 나타낸 것이다.
도 35는 톨루엔 용액에서의 3,10mMeDPhA2Nbf(II)의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 36은 3,10mMeDPhA2Nbf(II)의 박막의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 37은 3,10mMeDPhA2Nbf(II)의 MS 스펙트럼을 나타낸 것이다.
도 38의 (A) 및 (B)는 3,10-비스(10-페닐-9-안트릴)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 3,10PhA2Nbf(II))의 1H NMR 스펙트럼을 나타낸 것이다.
도 39는 톨루엔 용액에서의 3,10PhA2Nbf(II)의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 40은 3,10PhA2Nbf(II)의 박막의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 41은 3,10PhA2Nbf(II)의 MS 스펙트럼을 나타낸 것이다.
도 42는 3,10PhA2Nbf(II)의 MS 스펙트럼을 나타낸 것이다.
도 43의 (A) 및 (B)는 3-브로모-6-(2-플루오로페닐)-2,7-다이메톡시나프탈렌의 1H NMR 스펙트럼을 나타낸 것이다.
도 44의 (A) 및 (B)는 3-(2-플루오로페닐)-6-(2-플루오로-4-클로로페닐)-2,7-다이메톡시나프탈렌의 1H NMR 스펙트럼을 나타낸 것이다.
도 45의 (A) 및 (B)는 3-(2-플루오로페닐)-6-(2-플루오로-4-클로로페닐)-2,7-다이하이드록시나프탈렌의 1H NMR 스펙트럼을 나타낸 것이다.
도 46의 (A) 및 (B)는 2-클로로나프토[2,3-b;7,6-b']비스벤조퓨란의 1H NMR 스펙트럼을 나타낸 것이다.
도 47의 (A) 및 (B)는 3-(10-페닐-9-안트릴)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: Nbf(II)PhA)의 1H NMR 스펙트럼을 나타낸 것이다.
도 48은 톨루엔 용액에서의 Nbf(II)PhA의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 49는 Nbf(II)PhA의 박막의 흡수 스펙트럼 및 발광 스펙트럼을 나타낸 것이다.
도 50은 Nbf(II)PhA의 MS 스펙트럼을 나타낸 것이다.
도 51은 발광 소자 1의 휘도-전류 밀도 특성을 나타낸 것이다.
도 52는 발광 소자 1의 전류 효율-휘도 특성을 나타낸 것이다.
도 53은 발광 소자 1의 휘도-전압 특성을 나타낸 것이다.
도 54는 발광 소자 1의 전류-전압 특성을 나타낸 것이다.
도 55는 발광 소자 1의 외부 양자 효율-휘도 특성을 나타낸 것이다.
도 56은 발광 소자 1의 발광 스펙트럼을 나타낸 것이다.
도 57은 발광 소자 1의 정규화 휘도의 시간 의존성을 나타낸 것이다.
도 58은 발광 소자 2의 휘도-전류 밀도 특성을 나타낸 것이다.
도 59는 발광 소자 2의 전류 효율-휘도 특성을 나타낸 것이다.
도 60은 발광 소자 2의 휘도-전압 특성을 나타낸 것이다.
도 61은 발광 소자 2의 전류-전압 특성을 나타낸 것이다.
도 62는 발광 소자 2의 외부 양자 효율-휘도 특성을 나타낸 것이다.
도 63은 발광 소자 2의 발광 스펙트럼을 나타낸 것이다.
도 64는 발광 소자 2의 정규화 휘도의 시간 의존성을 나타낸 것이다.
도 65는 발광 소자 3의 휘도-전류 밀도 특성을 나타낸 것이다.
도 66은 발광 소자 3의 전류 효율-휘도 특성을 나타낸 것이다.
도 67은 발광 소자 3의 휘도-전압 특성을 나타낸 것이다.
도 68은 발광 소자 3의 전류-전압 특성을 나타낸 것이다.
도 69는 발광 소자 3의 외부 양자 효율-휘도 특성을 나타낸 것이다.
도 70은 발광 소자 3의 발광 스펙트럼을 나타낸 것이다.
도 71은 발광 소자 4의 휘도-전류 밀도 특성을 나타낸 것이다.
도 72는 발광 소자 4의 전류 효율-휘도 특성을 나타낸 것이다.
도 73은 발광 소자 4의 휘도-전압 특성을 나타낸 것이다.
도 74는 발광 소자 4의 전류-전압 특성을 나타낸 것이다.
도 75는 발광 소자 4의 외부 양자 효율-휘도 특성을 나타낸 것이다.
도 76은 발광 소자 4의 발광 스펙트럼을 나타낸 것이다.
도 77은 발광 소자 4의 정규화 휘도의 시간 의존성을 나타낸 것이다.
도 78은 발광 소자 5의 휘도-전류 밀도 특성을 나타낸 것이다.
도 79는 발광 소자 5의 전류 효율-휘도 특성을 나타낸 것이다.
도 80은 발광 소자 5의 휘도-전압 특성을 나타낸 것이다.
도 81은 발광 소자 5의 전류-전압 특성을 나타낸 것이다.
도 82는 발광 소자 5의 외부 양자 효율-휘도 특성을 나타낸 것이다.
도 83은 발광 소자 5의 발광 스펙트럼을 나타낸 것이다.
본 발명의 실시형태 및 실시예에 대하여 도면을 참조하여 이하에서 설명한다. 본 발명의 취지 및 범위에서 벗어나지 않고 본 발명의 형태 및 자세한 사항을 다양하게 변경할 수 있다는 것은 통상의 기술자에 의하여 쉽게 이해될 것이다. 따라서, 본 발명은 이하의 실시형태 및 실시예의 기재에 한정하여 해석되는 것은 아니다.
(실시형태 1)
본 발명의 일 형태는 나프토[2,3-b;7,6-b']비스벤조퓨란 골격 또는 나프토[2,3-b;7,6-b']비스벤조싸이오펜 골격을 가지며 분자량이 5000 이하인 유기 화합물 및 상기 유기 화합물을 포함하는 발광 소자이다. 본 발명자들은 상기 유기 화합물이 발광 소자의 발광단(luminophor)으로서 매우 효과적인 골격인 것을 발견하였다. 상기 유기 화합물은 발광 효율이 높으며 양호한 청색 발광을 나타내므로, 상기 유기 화합물을 사용한 발광 소자는 발광 효율이 높은 청색 발광 소자로 할 수 있다. 청색 형광 재료로서 다양한 물질이 개발되고 있고, 그 중에서 본 유기 화합물은, 청색 발광의 색도가 매우 높기 때문에, BT2020 색 영역을 지원하는 색 영역을 나타내는 청색 발광 재료로서 매우 유망한 재료이다.
나프토[2,3-b;7,6-b']비스벤조퓨란 골격 또는 나프토[2,3-b;7,6-b']비스벤조싸이오펜 골격을 가지며 분자량이 5000 이하인 유기 화합물은 치환기를 가지는 것이 바람직하다. 상기 치환기는 탄소수 1 내지 100의 치환기인 것이 바람직하다. 탄소수 1 내지 100의 치환기의 구체적인 예에는 탄소수 1 내지 100의 치환 또는 비치환된 지방족 탄화수소기, 탄소수 3 내지 100의 치환 또는 비치환된 지환식 탄화수소기, 탄소수 6 내지 100의 치환 또는 비치환된 방향족 탄화수소기, 탄소수 1 내지 100의 치환 또는 비치환된 헤테로 고리기, 및 탄소수 12 내지 100의 치환 또는 비치환된 다이아릴아미노기가 포함된다.
또한 상기 유기 화합물은, 바람직하게는 탄소수 6 내지 100의 치환기를 하나 또는 2개, 더 바람직하게는 탄소수 12 내지 100의 비교적 큰 제 1 치환기를 하나 또는 2개 가진다. 또한 상기 유기 화합물은 비교적 작은 제 2 치환기를 가져도 좋고, 제 2 치환기는 탄소수 1 내지 25의 치환기인 것이 바람직하고, 탄소수 1 내지 6의 치환기인 것이 더 바람직하다. 제 1 치환기를 가지고 제 2 치환기를 가지지 않는 본 발명의 일 형태의 유기 화합물은, 합성이 용이하며 원료 조달도 용이하므로 저렴하게 제조할 수 있다. 그래서 본 유기 화합물은 바람직하다.
또한 상기 유기 화합물은, 합성이 용이하다는 면에서 분자량이 3000 이하인 것이 바람직하고, 증착이 용이하다는 면에서 분자량이 1500 이하인 것이 더 바람직하다.
분자량이 5000 이하인 본 발명의 일 형태의 유기 화합물은 하기 일반식(G1)으로 나타낼 수 있다.
[화학식 26]
일반식(G1)에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타낸다. 또한 X1과 X2는 합성이 단순하다는 면에서 동일한 원자인 것이 바람직하다. X1 및 X2가 둘 다 산소 원자이면, 예를 들어 합성이 용이하고, 단일항 여기 준위가 높기 때문에 보다 단파장의 광이 방출되고, 높은 발광 양자 수율이 달성될 수 있다는 효과가 얻어지므로 더 바람직하다. 또한 X1 및 X2의 산소 원자의 수가 많아질수록 보다 단파장의 광이 방출되고, X1 및 X2의 황 원자의 수가 많아질수록 보다 장파장의 광이 방출된다. 그러므로 X1 및 X2는 목적의 단일항 여기 준위 및 발광 파장에 따라 적당하게 결정될 수 있다. 상기 식에 있어서, R1 내지 R12는 독립적으로 수소 또는 치환기를 나타낸다.
상기 치환기는 독립적으로 탄소수가 1 내지 100인 것이 바람직하다. 상기 치환기의 예에는, 치환 또는 비치환된 탄소수 1 내지 100의 지방족 탄화수소기, 치환 또는 비치환된 탄소수 3 내지 100의 지환식 탄화수소기, 치환 또는 비치환된 탄소수 6 내지 100의 방향족 탄화수소기, 치환 또는 비치환된 탄소수 1 내지 100의 헤테로 고리기, 및 치환 또는 비치환된 탄소수 12 내지 100의 다이아릴아미노기가 포함된다.
R1 내지 R12 중 적어도 하나는 탄소수 6 내지 100의 치환기를 나타내고, 이 경우 나머지는 독립적으로 수소 또는 탄소수 1 내지 25의 치환기를 나타낸다. R1 내지 R12에서의 탄소수 6 내지 100의 치환기의 수는 합성이 단순하고 증착이 용이하다는 면에서 1 또는 2인 것이 바람직하고, 증착을 용이하게 하기 위해서는 1이면 분자량이 적어 바람직하다. 한편 내열성을 높게 하기 위해서는 분자량이 많은 것이 바람직하고, 이 경우 치환기의 수가 많으면 콘쥬게이션(conjugation)을 그다지 넓히지 않고 쉽게 분자량을 증가시킬 수 있기 때문에 바람직하다.
일반식(G1)으로 나타내어지는 상기 유기 화합물이 탄소수 6 내지 100의 치환기를 가지는 경우, R2 및 R9 중 한쪽 또는 양쪽 혹은 R3 및 R8 중 한쪽 또는 양쪽이 치환기인 것이 합성이 단순하다는 면에서 바람직하다. R2 및 R9 중 한쪽 또는 양쪽이 탄소수 6 내지 100의 치환기이면, 발광 양자 수율이 높아지기 때문에 특히 바람직하다.
일반식(G1)으로 나타내어지는 상기 유기 화합물이 탄소수 6 내지 100의 치환기를 가지는 경우, 메타 위치의 치환기(예를 들어 R1 또는 R2 및 R5 또는 R6) 중 하나가 수소이면, 치환기들의 입체 장애가 작아지기 때문에 합성이 단순하다는 면에서 바람직하다. 즉 수소가, 상기 탄소수 6 내지 100의 치환기가 결합되는 탄소에 인접한 탄소에 결합되는 것이 바람직하다.
일반식(G1)으로 나타내어지는 상기 유기 화합물이 탄소수 6 내지 100의 치환기를 가지는 경우, R1 내지 R3 및 R8 내지 R12 중 하나 또는 복수가 치환기이면, 치환기들의 입체 장애가 작아지기 때문에 합성이 단순하다는 면에서 바람직하다.
또한 상기 탄소수 6 내지 100의 치환기의 예에는 치환 또는 비치환된 지방족 탄화수소기, 치환 또는 비치환된 지환식 탄화수소기, 치환 또는 비치환된 방향족 탄화수소기, 치환 또는 비치환된 헤테로 고리기, 및 치환 또는 비치환된 다이아릴아미노기가 포함된다. 또한 상기 다이아릴아미노기에 포함되는 아릴기의 예에는 헤테로아릴기가 포함된다. 발광 양자 수율을 향상시키기 위하여 상기 다이아릴아미노기가 선택되는 것이 바람직하다.
일반식(G1)으로 나타내어지는 상기 유기 화합물이 상기 탄소수 6 내지 100의 치환기로서 탄소수 12 내지 100의 치환 또는 비치환된 다이아릴아미노기를 가지는 경우, R2 및 R9 중 하나 또는 양쪽이 상기 다이아릴아미노기이면, 발광 재료로서의 상기 유기 화합물의 신뢰성이 높아지기 때문에 바람직하다. R2 및 R9가 둘 다 탄소수 12 내지 100의 치환 또는 비치환된 다이아릴아미노기인 유기 화합물은 양자 수율이 높기 때문에 더 바람직하다. 또한 R2 및 R9가 둘 다 탄소수 12 내지 100의 치환 또는 비치환된 다이아릴아미노기인 유기 화합물은 발광 파장이 짧고 예리한 스펙트럼을 가지므로, 디스플레이 용도 등, 단색광을 얻을 필요가 있는 경우에 상기 유기 화합물을 사용하는 것이 바람직하다.
상기 탄소수 6 내지 100의 치환기가 탄소수 12 내지 100의 치환 또는 비치환된 다이아릴아미노기인 경우, R3 및 R8 중 한쪽 또는 양쪽이 상기 다이아릴아미노기이면 정공 수송성이 양호하기 때문에 바람직하고, R3 및 R8이 둘 다 상기 다이아릴아미노기이면 정공 수송성이 더 양호하기 때문에 더 바람직하다. R3 및 R8 중 한쪽 또는 양쪽이 상기 다이아릴아미노기인 유기 화합물은, R2 및 R9 중 한쪽 또는 양쪽이 치환기인 유기 화합물보다 발광 파장이 길고 약간 넓은 스펙트럼을 가진다.
상기 탄소수 6 내지 100의 치환기의 구체적인 예에는 페닐기, 바이페닐기, 터페닐기, 나프틸기, 플루오렌일기, 스파이로플루오렌일기, 페난트릴기, 안트릴기, 다이하이드로안트릴기, 트라이페닐렌일기, 및 피렌일기 등의 방향족 탄화수소기, 그리고 피리딜기, 바이피리딜기, 피리미딜기, 바이피리미딜기, 피라질기, 바이피라질기, 트라이아질기, 퀴놀릴기, 아이소퀴놀릴기, 페난트릴기, 퀴녹살린일기, 아조플루오렌일기, 다이아조플루오렌일기, 카바졸릴기, 벤조카바졸릴기, 다이벤조카바졸릴기, 다이벤조퓨란일기, 벤조나프토퓨란일기, 다이나프토퓨란일기, 다이벤조싸이오페닐기, 벤조나프토싸이오페닐기, 다이나프토싸이오페닐기, 벤조퓨로피리딜기, 벤조퓨로피리미딜기, 벤조싸이오피리딜기, 벤조싸이오피리미딜기, 나프토퓨로피리딜기, 나프토퓨로피리미딜기, 나프토싸이오피리딜기, 나프토싸이오피리미딜기, 다이벤조퀴녹살린일기, 아크리딘일기, 크산텐일기, 페노싸이아진일기, 페녹사진일기, 및 페나질기 등의 헤테로 고리기가 포함된다. 다른 예에는 다이아릴아미노기가 있다. 상기 다이아릴아미노기는 아릴기로서, 페닐기, 바이페닐기, 터페닐기, 나프틸기, 플루오렌일기, 스파이로플루오렌일기, 페난트릴기, 안트릴기, 트라이페닐렌일기, 또는 피렌일기가 아민의 질소에 결합된 구조를 가진다. 상기 탄소수 6 내지 100의 치환기는 상기 다이아릴아미노기인 것이 바람직하다.
또한 이들 치환기의 각각은 탄소수 1 내지 6의 지방족 탄화수소기 또는 탄소수 3 내지 6의 지환식 탄화수소기 등을 치환기로서 더 가져도 좋다. 이 구조는 유기 용매에 대한 용해성이 높아지기 때문에 바람직하다.
상기 탄소수 6 내지 100의 치환기의 예의 구조식을 이하에 나타낸다. 상술한 바와 같이 이 치환기들의 각각은 예를 들어 탄소수 1 내지 6의 지방족 탄화수소기 또는 탄소수 3 내지 6의 지환식 탄화수소기를 치환기로서 더 가져도 좋다.
[화학식 27]
[화학식 28]
[화학식 29]
[화학식 30]
[화학식 31]
[화학식 32]
[화학식 33]
또한 (Ar-2) 내지 (Ar-9), (Ar-12) 내지 (Ar-15), (Ar-17) 내지 (Ar-23), (Ar-28), (Ar-29), (Ar-33) 내지 (Ar-38), (Ar-42) 내지 (Ar-46), (Ar-48), (Ar-49), (Ar-57) 내지 (Ar-61), (Ar-63) 내지 (Ar-65), (Ar-79), (Ar-92), 및 (Ar-93)과 같은, 치환기가 2개 이상 서로 연결되어 있는 치환기의 구조는 입체적이기 때문에, 이러한 치환기를 가지는 유기 화합물을 포함하는 막은 쉽게 결정화되지 않아 안정적인 막질이 얻어진다.
(Ar-13), (Ar-14), (Ar-22), 및 (Ar-23)의 구조와 같이, 치환기가 페닐렌기를 통하여 다른 치환기에 연결되면, 그 치환기까지 콘쥬게이션이 쉽게 넓어지지 않기 때문에, 단일항 여기 준위를 높게 유지할 수 있다. 특히 치환기가 메타페닐렌기를 통하여 다른 치환기에 연결되는 구조는 효과가 현저하기 때문에 바람직하다. 치환기가 파라페닐렌기를 통하여 다른 치환기에 연결되는 구조는 신뢰성이 높기 때문에 바람직하다.
또한 (Ar-10) 내지 (Ar-96)과 같은, 2개 이상의 축합 고리를 가지는 치환기, 및 헤테로 고리 화합물은 캐리어 수송성이 우수하기 때문에 바람직하다. (Ar-26) 내지 (Ar-29)의 안트릴기는 정공 및 전자 수송성이 우수하기 때문에 바람직하다.
(Ar-100) 내지 (Ar-140)의 치환기는 아릴아미노기의 예이다. 아릴아미노기가, (Ar-101), (Ar-102), (Ar-104), (Ar-107) 내지 (Ar-120), (Ar-123), 및 (Ar-129) 내지 (Ar-132)와 같이, 서로 연결된 2개 이상의 치환기가 질소에 결합되어 있는 구조를 가지는 경우, 이 구조는 입체적이기 때문에, 이러한 아릴아미노기를 가지는 유기 화합물을 포함하는 막은 쉽게 결정화되지 않아 안정적인 막질이 얻어진다. 또한 상기 탄소수 6 내지 100의 치환기로서 이러한 아릴아미노기가 선택되면 유기 화합물의 발광 양자 수율이 높아지기 때문에 바람직하다.
아릴기가 페닐렌기를 통하여 아민의 질소에 연결된 (Ar-108), (Ar-109), (Ar-129), 및 (Ar-132)의 구조는 아릴기까지 콘쥬게이션이 쉽게 넓어지지 않기 때문에, 단일항 여기 준위를 높게 유지할 수 있어 바람직하다. 페닐렌기를 통하여 다른 치환기가 아민에 연결된 구조는 콘쥬게이션이 쉽게 넓어지지 않기 때문에, 단일항 여기 준위를 높게 유지할 수 있어 바람직하다. 특히 상기 페닐렌기가 메타페닐렌기이면 커다란 효과를 얻을 수 있기 때문에 바람직하다.
(Ar-101) 내지 (Ar-120), (Ar-123), (Ar-129) 내지 (Ar-132), (Ar-137), 및 (Ar-138)과 같은, 파라바이페닐 구조가 아민에 결합되어 있는 치환기는 발광 재료의 신뢰성이 향상되기 때문에 바람직하다.
알킬기 또는 알킬실릴기를 포함하는 (Ar-103) 내지 (Ar-107), (Ar-121) 내지 (Ar-123), 및 (Ar-139)의 구조는 유기 용매에 대한 용해성이 높기 때문에 바람직하다. 또한 분자들 간의 상호 작용을 억제함으로써 승화 온도의 저하를 촉진할 수 있기 때문에, 알킬기 또는 알킬실릴기는 (Ar-103) 및 (Ar-123)의 구조와 같이 복수의 치환기에 결합되어 있는 것이 바람직하다.
또한 상기 유기 화합물이 치환기로서 2개 이상의 다이아릴아미노기를 가지는 경우, 유기 화합물의 발광 중심 골격을 나프토[2,3-b;7,6-b']비스벤조퓨란 골격 또는 나프토[2,3-b;7,6-b']비스벤조싸이오펜 골격으로 할 수 있으므로 양자 수율이 높아진다.
치환기가, 예를 들어 플루오린의 9위치에서 시그마 결합을 가지는 탄소를 통하여 연결되는 (Ar-19) 내지 (Ar-23), (Ar-92), (Ar-93), 및 (Ar-137) 내지 (Ar-140)의 구조는 콘쥬게이션이 쉽게 넓어지지 않고, S1 준위가 높고, 발광 파장이 더 짧기 때문에 바람직하다.
또한 상기에 나타낸 기 중에서도 하기 구조식으로 나타내어지는 기가 특히 바람직하다.
[화학식 34]
또한 상기 탄소수 6 내지 100의 치환기로서 하기 일반식(g1) 및 일반식(g2)으로 나타내어지는 기가 바람직하다.
[화학식 35]
상술한 치환기 중에서도 일반식(g1)으로 나타내어지는 기를 가지는 일반식(G1)으로 나타내어지는 유기 화합물은 발광 효율이 높기 때문에 바람직하다. 상술한 치환기 중에서도 일반식(g2)으로 나타내어지는 기를 가지는 일반식(G1)으로 나타내어지는 유기 화합물은 캐리어 수송성이 우수하기 때문에 바람직하다. 즉 하기 일반식(G2) 내지 일반식(G4)으로 나타내어지는 유기 화합물이 바람직하다.
[화학식 36]
[화학식 37]
[화학식 38]
일반식(G2) 내지 일반식(G4)에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타낸다. 또한 일반식(G2) 중의 R1, R3 내지 R8, R10 내지 R12, R20 내지 R29, 및 R30 내지 R39, 일반식(G3) 중의 R1, R2, R4 내지 R7, R9 내지 R12, R20 내지 R29, 및 R30 내지 R39, 그리고 일반식(G4) 중의 R1, R3 내지 R8, R10 내지 R12, R40 내지 R49, 및 R50 내지 R59는 독립적으로 수소 또는 탄소수 1 내지 25의 치환기를 나타낸다.
탄소수 1 내지 25의 치환기의 예에는 탄소수 1 내지 10의 지방족 탄화수소기, 탄소수 3 내지 20의 지환식 탄화수소기, 탄소수 6 내지 25의 방향족 탄화수소기, 탄소수 1 내지 25의 헤테로 고리기, 및 알킬실릴기가 포함된다.
상기 탄소수 1 내지 10의 지방족 탄화수소기의 예에는 메틸기, 에틸기, 프로필기, 아이소프로필기, 뷰틸기, tert-뷰틸기, 펜틸기, 헥실기, 헵틸기, 옥틸기, 노닐기, 데실기, 및 아이코실기가 포함된다. 탄소수 3 내지 20의 지환식 탄화수소기의 예에는 사이클로프로필기, 사이클로헥실기, 아다만틸기, 및 노보닐기가 포함된다. 탄소수 6 내지 25의 방향족 탄화수소기의 예에는 페닐기, 바이페닐기, 나프틸기, 페난트릴기, 안트릴기, 플루오렌일기, 9위치가 2개의 알킬기로 치환된 플루오렌일기, 스파이로플루오렌일기, 피렌일기, 및 트라이페닐렌일기가 포함된다. 탄소수 1 내지 25의 헤테로 고리기의 예에는 카바졸릴기, 다이벤조퓨란일기, 및 다이벤조싸이오페닐기가 포함된다.
이들 치환기의 각각은 탄소수 1 내지 6의 지방족 탄화수소기 또는 탄소수 3 내지 6의 지환식 탄화수소기 등을 치환기로서 더 가져도 좋다.
상술한 구조를 가지는 본 발명의 실시형태의 유기 화합물의 예를 이하에 나타낸다.
[화학식 39]
[화학식 40]
[화학식 41]
[화학식 42]
[화학식 43]
[화학식 44]
[화학식 45]
[화학식 46]
[화학식 47]
[화학식 48]
[화학식 49]
[화학식 50]
[화학식 51]
[화학식 52]
[화학식 53]
[화학식 54]
[화학식 55]
[화학식 56]
[화학식 57]
[화학식 58]
[화학식 59]
[화학식 60]
[화학식 61]
[화학식 62]
[화학식 63]
[화학식 64]
[화학식 65]
[화학식 66]
[화학식 67]
[화학식 68]
[화학식 69]
다음으로 상술한 본 발명의 일 형태의 유기 화합물의 합성 방법의 예로서, 일반식(G1)으로 나타내어지는 유기 화합물의 합성 방법에 대하여 설명한다. 일반식(G1)으로 나타내어지는 유기 화합물을 이하에 나타낸다.
[화학식 70]
또한 일반식(G1)으로 나타내어지는 상기 유기 화합물은 분자량이 5000 이하이다. 상기 식에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타내고, R1 내지 R12는 독립적으로 수소 또는 치환기를 나타낸다. 또한 R1 내지 R12 중 적어도 하나는 치환기인 것이 바람직하므로, 치환기를 가지는 유기 화합물의 합성 방법에 대하여 이하에서 설명한다.
먼저 나프토비스벤조퓨란 골격 또는 나프토비스벤조싸이오펜 골격의 합성 방법에 대하여 설명한다. 하기 스킴에 나타내어진 바와 같이, 나프탈렌 화합물(a1)과, 아릴 화합물(a2)과, 아릴 화합물(a3)의 크로스 커플링 반응을 일으킴으로써 (a4)로 나타내어지는 나프탈렌 화합물을 얻을 수 있다. 이 스킴에 있어서 예를 들어, R100 및 R101 각각은 메틸기 등의 알킬기를 나타내고, B1 및 B2 각각은 보론산 또는 다이알콕시보론산을 나타낸다. Y3 및 Y4 중 적어도 하나가 예를 들어 염소 또는 브로민 등의 할로젠기 혹은 설폰일기를 나타내고, 나중에 이 Y3 및/또는 Y4의 자리에 치환기를 도입할 수 있다. 또한 Y3 및 Y4의 자리는 예일 뿐이고, 이 자리는 변경되어도 좋기 때문에, 치환기를 다양한 자리에 도입할 수 있다. Y3 및 Y4 중 하나가 염소 또는 브로민 등의 할로젠기 혹은 설폰일기를 나타내는 경우, 다른 하나는 수소 또는 기타 치환기를 나타내어도 좋다. 이 스킴에 있어서 Y1 및 Y2 각각은 브로민 또는 아이오딘 등의 할로젠기 혹은 설폰일기를 나타낸다. 또한 Y1 및 Y2 각각은 Y3 및 Y4에 비하여 반응성이 높은 이탈기를 나타내는 것이 바람직하다.
[화학식 71]
상기 스킴에 나타낸 반응을 일으키는 데 다양한 조건을 적용할 수 있다. 일례로서 스즈키-미야우라 반응(Suzuki-Miyaura reaction) 등, 염기의 존재하에 금속 촉매를 사용한 합성 방법을 적용할 수 있다.
여기서는 화합물(a2) 및 화합물(a3)을 동시에 화합물(a1)과 반응시켰지만, 화합물(a2)과 화합물(a3)이 상이한 치환기를 가지는 경우, 이 반응은 화합물(a2)과 화합물(a1)을 서로 반응시킨 다음에, 그 생성물과 화합물(a3)을 반응시키는 식으로 수행하는 것이 바람직하다. 이 경우 목적 물질의 높은 수율 및 높은 순도가 달성될 수 있다.
다음으로 하기 스킴과 같이 나프탈렌 화합물(a4)의 탈알킬 반응을 일으킴으로써 (a5)로 나타내어지는 나프탈렌 화합물을 얻을 수 있다.
[화학식 72]
이 반응을 일으키는 데 다양한 조건을 적용할 수 있고, 예를 들어 다이클로로메테인 등의 용매 중에서 3브로민화 붕소 등의 루이스산이 사용된다.
다음으로 하기 스킴에 나타내어진 바와 같이, 나프탈렌 화합물(a5)로부터 (a6)으로 나타내어지는 할로젠화 나프토[2,3-b;7,6-b']비스벤조퓨란 화합물 또는 할로젠화 나프토[2,3-b;7,6-b']비스벤조싸이오펜 화합물을 얻을 수 있다.
[화학식 73]
이 반응을 일으키는 데 다양한 조건을 적용할 수 있고, 예를 들어 화합물(a5)을 N-메틸피롤리돈(약칭: NMP) 또는 다이메틸설폭사이드(약칭: DMSO) 등에 용해시키고, 그 용액에 탄산 포타슘 또는 탄산 세슘을 첨가하고 가열을 수행한다.
이어서, 하기 스킴에 나타내어진 바와 같이, 할로젠화 나프토[2,3-b;7,6-b']비스벤조퓨란 화합물 또는 할로젠화 나프토[2,3-b;7,6-b']비스벤조싸이오펜 화합물(a6)과, 아릴 화합물(a7)과, 아릴 화합물(a8)의 크로스 커플링 반응을 일으킴으로써, 일반식(G1)으로 나타내어지는 나프토[2,3-b;7,6-b']비스벤조퓨란 화합물 또는 나프토[2,3-b;7,6-b']비스벤조싸이오펜 화합물을 얻을 수 있다. 또한 B3 및 B4는 독립적으로 보론산, 다이알콕시보론산, 알루미늄, 지르코늄, 아연, 또는 주석 등으로 할 수 있다. 아릴 화합물(a7) 및 아릴 화합물(a8)이 2급 아민인 경우, B3 및 B4은 수소를 나타낸다.
[화학식 74]
이 반응을 일으키는 데 다양한 조건을 적용할 수 있다. 일례로서 스즈키-미야우라 반응 등, 염기의 존재하에 금속 촉매를 사용한 합성 방법을 적용할 수 있다. 아릴 화합물(a7) 및 아릴 화합물(a8)이 2급 아민인 경우, 울만 커플링(Ullmann coupling) 또는 Buchwald-Hartwig 반응을 적용할 수 있다.
여기서는 화합물(a7) 및 화합물(a8)을 동시에 화합물(a6)과 반응시켰지만, 화합물(a7)과 화합물(a8)이 상이한 치환기를 가지는 경우, 즉 R2 및 R9가 상이한 치환기인 경우, 이 반응은 화합물(a7)과 화합물(a6)을 서로 반응시킨 다음에, 그 생성물과 화합물(a8)을 반응시키는 식으로 2단계로 수행하는 것이 바람직하다. 그래서 목적 물질의 높은 수율 및 높은 순도가 달성될 수 있다.
여기서는 화합물(a6)의 Y3 및 Y4가 각각 화합물(a7)의 R2 및 화합물(a8)의 R9로 치환되는 반응을 나타내었다. 도입되는 치환기의 자리 또는 수를 바꾸기 위해서는 화합물(a2) 및/또는 화합물(a3)의 치환자리에 할로젠기 또는 설폰일기가 도입된 원료를 사용한다.
그러므로 화합물(a6)은 일반식(G1)으로 나타내어지는 상기 유기 화합물을 합성하기 위하여 유용한 원료이다. 마찬가지로 화합물(a5) 및 화합물(a4)도 유용한 원료이다.
화합물(a6)의 Y3 및 Y4 중 적어도 하나가 염소 또는 브로민 등의 할로젠기 혹은 설폰일기를 나타내고, 나중에 이 Y3 및/또는 Y4의 자리에 치환기를 도입할 수 있다. 또한 Y3 및 Y4의 자리는 예일 뿐이고, 이 자리는 R1, R3 내지 R8, 및 R10내지 R12 중 어느 것으로 변경되어도 좋기 때문에, 치환기를 다양한 자리에 도입할 수 있다. Y3 및 Y4 중 하나가 염소 또는 브로민 등의 할로젠기 혹은 설폰일기를 나타내는 경우, 다른 하나는 수소 또는 기타 치환기를 나타내어도 좋다.
즉 화합물(a6)은 일반식(G01)으로 나타낼 수 있다.
[화학식 75]
일반식(G01)에 있어서, X1 및 X2는 독립적으로 산소 원자 또는 황 원자를 나타낸다. 상기 식에 있어서, R21 내지 R32 중 하나 또는 2개는 할로젠기 또는 설폰일기를 나타내고, 나머지는 독립적으로 수소, 탄소수 1 내지 10의 지방족 탄화수소기, 탄소수 3 내지 20의 지환식 탄화수소기, 탄소수 6 내지 25의 방향족 탄화수소기, 또는 탄소수 1 내지 25의 헤테로 고리기를 나타낸다.
일반식(G1)으로 나타내어지는 상기 유기 화합물은 R2 및 R9에 치환기를 가지는 것이 바람직하다. 즉 일반식(G01)으로 나타내어지는 상기 유기 화합물은 R22 및 R29에 할로젠기 및 설폰일기를 가지는 것이 바람직하고, 하기 일반식(G02)으로 나타내어지는 유기 화합물이 더 유용하다.
[화학식 76]
일반식(G1)으로 나타내어지는 상기 유기 화합물은 R3 및 R8에 치환기를 가지는 것이 바람직하다. 즉 일반식(G01)으로 나타내어지는 상기 유기 화합물은 R23 및 R28에 할로젠기 및 설폰일기를 가지는 것이 바람직하고, 하기 일반식(G03)으로 나타내어지는 유기 화합물이 더 유용하다.
[화학식 77]
(실시형태 2)
본 발명의 일 형태인 발광 소자의 일례에 대하여 도 1의 (A)를 참조하여 이하에서 자세히 설명한다.
본 실시형태에서 발광 소자는 한 쌍의 전극(양극(101) 및 음극(102)) 및 양극(101)과 음극(102) 사이에 제공된 EL층(103)을 포함한다.
양극(101)은 각각 일함수가 높은(구체적으로는, 일함수가 4.0eV 이상) 금속, 합금, 도전성 화합물, 또는 이들의 혼합물의 어느 것 등 중 임의의 것을 사용하여 형성되는 것이 바람직하다. 구체적인 예로서는, 산화 인듐-산화 주석(ITO: indium tin oxide), 실리콘 또는 산화 실리콘을 포함하는 산화 인듐-산화 주석, 산화 인듐-산화 아연, 및 산화 텅스텐 및 산화 아연을 포함하는 산화 인듐(IWZO) 등이 있다. 이들 도전성 금속 산화물의 막은 보통 스퍼터링법에 의하여 형성되지만, 졸-겔법 등을 응용하여 형성하여도 좋다. 형성 방법의 예에서, 산화 인듐-산화 아연은, 산화 인듐에 대하여 1wt% 이상 20wt% 이하의 산화 아연을 첨가한 타깃을 사용하여 스퍼터링법으로 퇴적될 수 있다. 또한 산화 텅스텐 및 산화 아연을 포함하는 산화 인듐(IWZO)은 산화 인듐에 대하여 0.5wt% 이상 5wt% 이하의 산화 텅스텐을 첨가하고, 0.1wt% 이상 1wt% 이하의 산화 아연을 첨가한 타깃을 사용하여 스퍼터링법으로 퇴적할 수 있다. 다른 예에는 금(Au), 백금(Pt), 니켈(Ni), 텅스텐(W), 크로뮴(Cr), 몰리브데넘(Mo), 철(Fe), 코발트(Co), 구리(Cu), 팔라듐(Pd), 알루미늄(Al), 또는 금속 재료의 질화물(예를 들어 질화 타이타늄)이 있다. 그래핀을 사용할 수도 있다. 정공 주입층(111)이 제 1 물질 및 제 2 물질을 포함하는 복합 재료를 포함하는 경우, 일함수에 상관없이 상술한 것 이외의 전극 재료를 선택할 수 있다.
정공 주입층(111)은 억셉터성이 비교적 우수한 제 1 물질을 사용하여 형성된다. 정공 주입층(111)은 억셉터성을 가지는 제 1 물질과 정공 수송성을 가지는 제 2 물질의 복합 재료를 사용하여 형성되는 것이 바람직하다. 복합 재료를 정공 주입층(111)의 재료로서 사용하는 경우, 제 1 물질로서 제 2 물질에 대한 억셉터성을 가지는 물질을 사용한다. 제 1 물질이 제 2 물질로부터 전자를 추출함으로써 제 1 물질에 전자가 발생된다. 전자가 추출된 제 2 물질에는 정공이 발생된다. 전계에 의하여 추출된 전자는 양극(101)에 흐르고, 발생된 정공은 정공 수송층(112)을 통하여 발광층(113)에 주입된다. 그러므로 구동 전압이 낮은 발광 소자를 제공할 수 있다.
제 1 물질은 전이 금속 산화물, 주기율표의 4족 내지 8족 중 어느 것에 속하는 금속의 산화물, 또는 전자 흡인기(할로젠기 또는 사이아노기)를 가지는 유기 화합물 등이 바람직하다.
상기 전이 금속 산화물 또는 주기율표의 4족 내지 8족 중 어느 것에 속하는 금속의 산화물로서는, 바나듐 산화물, 나이오븀 산화물, 탄탈럼 산화물, 크로뮴 산화물, 몰리브데넘 산화물, 텅스텐 산화물, 망가니즈 산화물, 레늄 산화물, 타이타늄 산화물, 루테늄 산화물, 지르코늄 산화물, 하프늄 산화물, 또는 은 산화물이 억셉터성이 우수하기 때문에 바람직하다. 특히 몰리브데넘 산화물은 대기 중에서 안정성이 높고, 흡습성이 낮고, 취급하기 쉽기 때문에 바람직하다.
상기 전자 흡인기(할로젠기 또는 사이아노기)를 가지는 유기 화합물의 예에는 7,7,8,8-테트라사이아노-2,3,5,6-테트라플루오로퀴노다이메테인(약칭: F4-TCNQ), 클로라닐, 2,3,6,7,10,11-헥사사이아노-1,4,5,8,9,12-헥사아자트라이페닐렌(약칭: HAT-CN), 및 1,3,4,5,7,8-헥사플루오로테트라사이아노-나프토퀴노다이메테인(약칭: F6-TCNNQ)이 포함된다. 특히 HAT-CN과 같은, 전자 흡인기가 복수의 헤테로 원자를 가지는 축합 방향족 고리에 결합되어 있는 화합물은 열적으로 안정적이기 때문에 바람직하다.
제 2 물질은 정공 수송성을 가지고, 10-6 cm2/Vs 이상의 정공 이동도를 가지는 것이 바람직하다. 제 2 물질로서 사용할 수 있는 재료의 예에는 N,N'-다이(p-톨릴)-N,N'-다이페닐-p-페닐렌다이아민(약칭: DTDPPA), 4,4'-비스[N-(4-다이페닐아미노페닐)-N-페닐아미노]바이페닐(약칭: DPAB), N,N'-비스{4-[비스(3-메틸페닐)아미노]페닐}-N,N'-다이페닐-(1,1'-바이페닐)-4,4'-다이아민(약칭: DNTPD), 및 1,3,5-트리스[N-(4-다이페닐아미노페닐)-N-페닐아미노]벤젠(약칭: DPA3B) 등의 방향족 아민; 3-[N-(9-페닐카바졸-3-일)-N-페닐아미노]-9-페닐카바졸(약칭: PCzPCA1), 3,6-비스[N-(9-페닐카바졸-3-일)-N-페닐아미노]-9-페닐카바졸(약칭: PCzPCA2), 3-[N-(1-나프틸)-N-(9-페닐카바졸-3-일)아미노]-9-페닐카바졸(약칭: PCzPCN1), 4,4'-다이(N-카바졸릴)바이페닐(약칭: CBP), 1,3,5-트리스[4-(N-카바졸릴)페닐]벤젠(약칭: TCPB), 9-[4-(10-페닐-9-안트릴)페닐]-9H-카바졸(약칭: CzPA), 및 1,4-비스[4-(N-카바졸릴)페닐]-2,3,5,6-테트라페닐벤젠 등의 카바졸 유도체; 및 2-tert-뷰틸-9,10-다이(2-나프틸)안트라센(약칭: t-BuDNA), 2-tert-뷰틸-9,10-다이(1-나프틸)안트라센, 9,10-비스(3,5-다이페닐페닐)안트라센(약칭: DPPA), 2-tert-뷰틸-9,10-비스(4-페닐페닐)안트라센(약칭: t-BuDBA), 9,10-다이(2-나프틸)안트라센(약칭: DNA), 9,10-다이페닐안트라센(약칭: DPAnth), 2-tert-뷰틸안트라센(약칭: t-BuAnth), 9,10-비스(4-메틸-1-나프틸)안트라센(약칭: DMNA), 2-tert-뷰틸-9,10-비스[2-(1-나프틸)페닐]안트라센, 9,10-비스[2-(1-나프틸)페닐]안트라센, 2,3,6,7-테트라메틸-9,10-다이(1-나프틸)안트라센, 2,3,6,7-테트라메틸-9,10-다이(2-나프틸)안트라센, 9,9'-바이안트릴, 10,10'-다이페닐-9,9'-바이안트릴, 10,10'-비스(2-페닐페닐)-9,9'-바이안트릴, 10,10'-비스[(2,3,4,5,6-펜타페닐)페닐]-9,9'-바이안트릴, 안트라센, 테트라센, 펜타센, 코로넨, 루브렌, 페릴렌, 및 2,5,8,11-테트라(tert-뷰틸)페릴렌 등의 방향족 탄화수소가 포함된다. 방향족 탄화수소는 바이닐 골격을 가져도 좋다. 바이닐기를 가지는 방향족 탄화수소의 예에는 4,4'-비스(2,2-다이페닐바이닐)바이페닐(약칭: DPVBi) 및 9,10-비스[4-(2,2-다이페닐바이닐)페닐]안트라센(약칭: DPVPA)이 있다. 또는, 4,4'-비스[N-(1-나프틸)-N-페닐아미노]바이페닐(약칭: NPB), N,N'-비스(3-메틸페닐)-N,N'-다이페닐-[1,1'-바이페닐]-4,4'-다이아민(약칭: TPD), 4,4'-비스[N-(스파이로-9,9'-바이플루오렌-2-일)-N-페닐아미노]바이페닐(약칭: BSPB), 4-페닐-4'-(9-페닐플루오렌-9-일)트라이페닐아민(약칭: BPAFLP), 4-페닐-3'-(9-페닐플루오렌-9-일)트라이페닐아민(약칭: mBPAFLP), 4-페닐-4'-(9-페닐-9H-카바졸-3-일)트라이페닐아민(약칭: PCBA1BP), 4,4'-다이페닐-4''-(9-페닐-9H-카바졸-3-일)트라이페닐아민(약칭: PCBBi1BP), 4-(1-나프틸)-4'-(9-페닐-9H-카바졸-3-일)트라이페닐아민(약칭: PCBANB), 4,4'-다이(1-나프틸)-4''-(9-페닐-9H-카바졸-3-일)트라이페닐아민(약칭: PCBNBB), 9,9-다이메틸-N-페닐-N-[4-(9-페닐-9H-카바졸-3-일)페닐]-플루오렌-2-아민(약칭: PCBAF), 또는 N-페닐-N-[4-(9-페닐-9H-카바졸-3-일)페닐]-스파이로-9,9'-바이플루오렌-2-아민(약칭: PCBASF) 등의 방향족 아민 골격을 가지는 화합물; 1,3-비스(N-카바졸릴)벤젠(약칭: mCP), 4,4'-다이(N-카바졸릴)바이페닐(약칭: CBP), 3,6-비스(3,5-다이페닐페닐)-9-페닐카바졸(약칭: CzTP), 또는 3,3'-비스(9-페닐-9H-카바졸)(약칭: PCCP) 등의 카바졸 골격을 가지는 화합물; 4,4',4''-(벤젠-1,3,5-트라이일)트라이(다이벤조싸이오펜)(약칭: DBT3P-II), 2,8-다이페닐-4-[4-(9-페닐-9H-플루오렌-9-일)페닐]다이벤조싸이오펜(약칭: DBTFLP-III), 또는 4-[4-(9-페닐-9H-플루오렌-9-일)페닐]-6-페닐다이벤조싸이오펜(약칭: DBTFLP-IV) 등의 싸이오펜 골격을 가지는 화합물; 혹은 4,4',4''-(벤젠-1,3,5-트라이일)트라이(다이벤조퓨란)(약칭: DBF3P-II) 또는 4-{3-[3-(9-페닐-9H-플루오렌-9-일)페닐]페닐}다이벤조퓨란(약칭: mmDBFFLBi-II) 등의 퓨란 골격을 가지는 화합물을 사용할 수 있다. 상술한 재료 중에서, 방향족 아민 골격을 가지는 화합물 및 카바졸 골격을 가지는 화합물은 신뢰성이 높고 정공 수송성이 높아 구동 전압의 감소에 기여하기 때문에 바람직하다.
본 발명의 일 형태의 유기 화합물도 정공 수송성을 가지는 물질이므로 제 2 물질로서 사용할 수 있다. 다이아릴아미노기, 전자 과잉형 헤테로 고리기, 또는 방향족 탄화수소기를 치환기로서 가지는 유기 화합물은 특히 바람직하다.
정공 주입층(111)의 형성에 웨트 프로세스를 사용할 수 있다. 이 경우 예를 들어, 폴리(에틸렌다이옥시싸이오펜)/폴리(스타이렌설폰산) 수용액 (PEDOT/PSS), 폴리아닐린/장뇌 설폰산 수용액(PANI/CSA), PTPDES, Et-PTPDEK, PPBA, 또는 폴리아닐린/폴리(스타이렌설폰산)(PANI/PSS) 등의 산을 첨가한 도전성 고분자 화합물을 사용할 수 있다.
정공 수송층(112)은 정공 수송성을 가지는 재료를 포함하는 층이다. 이 정공 수송성을 가지는 재료로서, 정공 주입층(111)에 포함되는 물질인 제 2 물질의 재료 중 어느 것을 사용할 수 있다. 정공 수송층(112)은 단층 또는 복수의 층으로 형성될 수 있다. 정공 수송층(112)이 복수의 층으로 형성되는 경우, 정공 주입을 용이하게 하기 위하여 정공 수송층(112)의 HOMO 준위는 정공 주입층(111) 측의 층으로부터 발광층(113) 측의 층으로 계단식으로 깊어져 있는 것이 바람직하다. 이러한 구조는 발광층(113)에서의 호스트 재료의 HOMO 준위가 깊은 청색 형광 발광 소자에 매우 적합하다.
발광층(113)으로 향해 계단식으로 깊어져 있는 HOMO 준위를 가지는 복수의 층을 포함하는 정공 수송층(112)의 구조는, 정공 주입층(111)을 유기 억셉터(상술한 전자 흡인기(할로젠기 또는 사이아노기)를 가지는 유기 화합물)를 사용하여 형성한 소자에 특히 적합하다. 이러한 구조를 사용함으로써 캐리어-주입성이 우수하고 구동 전압이 낮은 매우 바람직한 소자를 형성하는 것이 가능하다.
본 발명의 일 형태의 유기 화합물도 정공 수송성을 가지는 물질이므로 정공 수송성을 가지는 재료로서 사용할 수 있다. 다이아릴아미노기, 전자 과잉형 헤테로 고리기, 또는 방향족 탄화수소기를 치환기로서 가지는 유기 화합물은 특히 바람직하다.
또한 정공 수송층(112)은 웨트 프로세스를 사용하여 형성할 수 있다. 웨트 프로세스로 정공 수송층(112)을 형성하는 경우, 폴리(N-바이닐카바졸)(약칭: PVK), 폴리(4-바이닐트라이페닐아민)(약칭: PVTPA), 폴리[N-(4-{N'-[4-(4-다이페닐아미노)페닐]페닐-N'-페닐아미노}페닐)메타크릴아마이드](약칭: PTPDMA), 또는 폴리[N,N'-비스(4-뷰틸페닐)-N,N'-비스(페닐)벤지딘](약칭: poly-TPD) 등의 고분자 화합물을 사용할 수 있다.
발광층(113)은 형광 물질, 인광 물질, 열활성화 지연 형광(TADF)을 방출하는 물질, 퀀텀닷(quantum dot), 또는 금속 할로젠 페로브스카이트 등, 어느 발광 물질을 포함하여도 좋지만, 발광층(113)은 실시형태 1에서 설명한 본 발명의 일 형태의 유기 화합물을 발광 물질로서 포함하는 것이 바람직하다. 본 발명의 일 형태의 유기 화합물을 발광 물질로서 사용함으로써 효율이 높고 색도가 매우 높은 발광 소자의 형성을 용이하게 한다.
또한 발광층(113)은 단층이어도 좋고, 또는 복수의 층을 포함하여도 좋다. 복수의 층을 포함하는 발광층을 형성하는 경우, 인광 물질을 포함하는 층과 형광 물질을 포함하는 층을 적층하여도 좋다. 이 경우, 인광 물질을 포함하는 층에, 후술하는 들뜬 복합체를 이용하는 것이 바람직하다.
본 발명의 일 형태의 유기 화합물은 양호한 양자 수율을 가지는 물질이므로 발광 물질로서 사용할 수 있다. 특히 나프토[2,3-b;7,6-b']비스벤조퓨란 골격 또는 나프토[2,3-b;7,6-b']비스벤조싸이오펜 골격을 가지는 물질은 청색 광 등 단파장의 광을 나타내는 재료로서 설계하기 쉽다. 또한 이 유기 화합물은 단일항 여기 준위가 높아 형광 호스트 재료로서도 적합하다.
사용할 수 있는 형광 물질의 예에는 5,6-비스[4-(10-페닐-9-안트릴)페닐]-2,2'-바이피리딘(약칭: PAP2BPy), 5,6-비스[4'-(10-페닐-9-안트릴)바이페닐-4-일]-2,2'-바이피리딘(약칭: PAPP2BPy), N,N'-다이페닐-N,N'-비스[4-(9-페닐-9H-플루오렌-9-일)페닐]피렌-1,6-다이아민, N,N'-비스(3-메틸페닐)-N,N'-비스[3-(9-페닐-9H-플루오렌-9-일)페닐]피렌-1,6-다이아민(약칭: 1,6mMemFLPAPrn), N,N'-비스[4-(9H-카바졸-9-일)페닐]-N,N'-다이페닐스틸벤-4,4'-다이아민(약칭: YGA2S), 4-(9H-카바졸-9-일)-4'-(10-페닐-9-안트릴)트라이페닐아민(약칭: YGAPA), 4-(9H-카바졸-9-일)-4'-(9,10-다이페닐-2-안트릴)트라이페닐아민(약칭: 2YGAPPA), N,9-다이페닐-N-[4-(10-페닐-9-안트릴)페닐]-9H-카바졸-3-아민(약칭: PCAPA), 페릴렌, 2,5,8,11-테트라(tert-뷰틸)페릴렌(약칭: TBP), 4-(10-페닐-9-안트릴)-4'-(9-페닐-9H-카바졸-3-일)트라이페닐아민(약칭: PCBAPA), N,N''-(2-tert-뷰틸안트라센-9,10-다이일다이-4,1-페닐렌)비스[N,N',N'-트라이페닐-1,4-페닐렌다이아민](약칭: DPABPA), N,9-다이페닐-N-[4-(9,10-다이페닐-2-안트릴)페닐]-9H-카바졸-3-아민(약칭: 2PCAPPA), N-[4-(9,10-다이페닐-2-안트릴)페닐]-N,N',N'-트라이페닐-1,4-페닐렌다이아민(약칭: 2DPAPPA), N,N,N',N',N'',N'',N''',N'''-옥타페닐다이벤조[g,p]크리센-2,7,10,15-테트라아민(약칭: DBC1), 쿠마린 30, N-(9,10-다이페닐-2-안트릴)-N,9-다이페닐-9H-카바졸-3-아민(약칭: 2PCAPA), N-[9,10-비스(1,1'-바이페닐-2-일)-2-안트릴]-N,9-다이페닐-9H-카바졸-3-아민(약칭: 2PCABPhA), N-(9,10-다이페닐-2-안트릴)-N,N',N'-트라이페닐-1,4-페닐렌다이아민(약칭: 2DPAPA), N-[9,10-비스(1,1'-바이페닐-2-일)-2-안트릴]-N,N',N'-트라이페닐-1,4-페닐렌다이아민(약칭: 2DPABPhA), 9,10-비스(1,1'-바이페닐-2-일)-N-[4-(9H-카바졸-9-일)페닐]-N-페닐안트라센-2-아민(약칭: 2YGABPhA), N,N,9-트라이페닐안트라센-9-아민(약칭: DPhAPhA), 쿠마린 545T, N,N'-다이페닐퀴나크리돈(약칭: DPQd), 루브렌, 5,12-비스(1,1'-바이페닐-4-일)-6,11-다이페닐테트라센(약칭: BPT), 2-(2-{2-[4-(다이메틸아미노)페닐]에텐일}-6-메틸-4H-피란-4-일리덴)프로페인다이나이트릴(약칭: DCM1), 2-{2-메틸-6-[2-(2,3,6,7-테트라하이드로-1H,5H-벤조[ij]퀴놀리진-9-일)에텐일]-4H-피란-4-일리덴}프로페인다이나이트릴(약칭: DCM2), N,N,N',N'-테트라키스(4-메틸페닐)테트라센-5,11-다이아민(약칭: p-mPhTD), 7,14-다이페닐-N,N,N',N'-테트라키스(4-메틸페닐)아세나프토[1,2-a]플루오란텐-3,10-다이아민(약칭: p-mPhAFD), 2-{2-아이소프로필-6-[2-(1,1,7,7-테트라메틸-2,3,6,7-테트라하이드로-1H,5H-벤조[ij]퀴놀리진-9-일)에텐일]-4H-피란-4-일리덴}프로페인다이나이트릴(약칭: DCJTI), 2-{2-tert-뷰틸-6-[2-(1,1,7,7-테트라메틸-2,3,6,7-테트라하이드로-1H,5H-벤조[ij]퀴놀리진-9-일)에텐일]-4H-피란-4-일리덴}프로페인다이나이트릴(약칭: DCJTB), 2-(2,6-비스{2-[4-(다이메틸아미노)페닐]에텐일}-4H-피란-4-일리덴)프로페인다이나이트릴(약칭: BisDCM), 및 2-{2,6-비스[2-(8-메톡시-1,1,7,7-테트라메틸-2,3,6,7-테트라하이드로-1H,5H-벤조[ij]퀴놀리진-9-일)에텐일]-4H-피란-4-일리덴}프로페인다이나이트릴(약칭: BisDCJTM)이 포함되지만, 이에 한정되지는 않는다. 특히 1,6FLPAPrn 및 1,6mMemFLPAPrn 등의 피렌다이아민 화합물로 대표되는 축합 방향족 다이아민 화합물은 정공 트랩성이 높고, 발광 효율이 높고, 신뢰성이 높기 때문에 바람직하다.
발광층(113)에 있어서 인광 물질로서 사용할 수 있는 재료의 예에는, 트리스{2-[5-(2-메틸페닐)-4-(2,6-다이메틸페닐)-4H-1,2,4-트라이아졸-3-일-*?*N2]페닐- C}이리듐(III)(약칭: [Ir(mpptz-dmp)3]), 트리스(5-메틸-3,4-다이페닐-4H-1,2,4-트라이아졸레이토)이리듐(III)(약칭: [Ir(Mptz)3]), 및 트리스[4-(3-바이페닐)-5-아이소프로필-3-페닐-4H-1,2,4-트라이아졸레이토]이리듐(III)(약칭: [Ir(iPrptz-3b)3]) 등의 4H-트라이아졸 골격을 가지는 유기 금속 이리듐 착체; 트리스[3-메틸-1-(2-메틸페닐)-5-페닐-1H-1,2,4-트라이아졸레이토]이리듐(III)(약칭: [Ir(Mptz1-mp)3]) 및 트리스(1-메틸-5-페닐-3-프로필-1H-1,2,4-트라이아졸레이토)이리듐(III)(약칭: [Ir(Prptz1-Me)3]) 등의 1H-트라이아졸 골격을 가지는 유기 금속 이리듐 착체; fac-트리스[1-(2,6-다이아이소프로필페닐)-2-페닐-1H-이미다졸]이리듐(III)(약칭: [Ir(iPrpmi)3]) 및 트리스[3-(2,6-다이메틸페닐)-7-메틸이미다조[1,2-f]페난트리디네이토]이리듐(III)(약칭: [Ir(dmpimpt-Me)3]) 등의 이미다졸 골격을 가지는 유기 금속 이리듐 착체; 및 비스[2-(4',6'-다이플루오로페닐)피리디네이토-N,C 2']이리듐(III) 테트라키스(1-피라졸릴)보레이트(약칭: FIr6), 비스[2-(4',6'-다이플루오로페닐)피리디네이토-N,C 2']이리듐(III)피콜리네이트(약칭: FIrpic), 비스{2-[3',5'-비스(트라이플루오로메틸)페닐]피리디네이토-N,C 2'}이리듐(III)피콜리네이트(약칭: [Ir(CF3ppy)2(pic)]), 및 비스[2-(4',6'-다이플루오로페닐)피리디네이토-N,C 2']이리듐(III)아세틸아세토네이트(약칭: FIr(acac)) 등의 전자 흡인기를 가지는 페닐피리딘 유도체가 리간드(ligand)인 유기 금속 이리듐 착체가 포함된다. 이들 화합물은 청색의 인광을 방출하며 440nm 내지 520nm에 발광 피크를 가진다.
다른 예에는, 트리스(4-메틸-6-페닐피리미디네이토)이리듐(III)(약칭: [Ir(mppm)3]), 트리스(4-t-뷰틸-6-페닐피리미디네이토)이리듐(III)(약칭: [Ir(tBuppm)3]), (아세틸아세토네이토)비스(6-메틸-4-페닐피리미디네이토)이리듐(III)(약칭: [Ir(mppm)2(acac)]), (아세틸아세토네이토)비스(6-tert-뷰틸-4-페닐피리미디네이토)이리듐(III)(약칭: [Ir(tBuppm)2(acac)]), (아세틸아세토네이토)비스[6-(2-노보닐)-4-페닐피리미디네이토]이리듐(III)(약칭: [Ir(nbppm)2(acac)]), (아세틸아세토네이토)비스[5-메틸-6-(2-메틸페닐)-4-페닐피리미디네이토]이리듐(III)(약칭: [Ir(mpmppm)2(acac)]), 및 (아세틸아세토네이토)비스(4,6-다이페닐피리미디네이토)이리듐(III)(약칭: [Ir(dppm)2(acac)]) 등의 피리미딘 골격을 가지는 유기 금속 이리듐 착체; (아세틸아세토네이토)비스(3,5-다이메틸-2-페닐피라지네이토)이리듐(III)(약칭: [Ir(mppr-Me)2(acac)]) 및 (아세틸아세토네이토)비스(5-아이소프로필-3-메틸-2-페닐피라지네이토)이리듐(III)(약칭: [Ir(mppr-iPr)2(acac)]) 등의 피라진 골격을 가지는 유기 금속 이리듐 착체; 트리스(2-페닐피리디네이토-N,C 2')이리듐(III)(약칭: [Ir(ppy)3]), 비스(2-페닐피리디네이토-N,C 2')이리듐(III)아세틸아세토네이트(약칭: [Ir(ppy)2(acac)]), 비스(벤조[h]퀴놀리네이토)이리듐(III)아세틸아세토네이트(약칭: [Ir(bzq)2(acac)]), 트리스(벤조[h]퀴놀리네이토)이리듐(III)(약칭: [Ir(bzq)3]), 트리스(2-페닐퀴놀리네이토-N,C 2')이리듐(III)(약칭: [Ir(pq)3]), 및 비스(2-페닐퀴놀리네이토-N,C 2')이리듐(III)아세틸아세토네이트(약칭: [Ir(pq)2(acac)]) 등의 피리딘 골격을 가지는 유기 금속 이리듐 착체; 및 트리스(아세틸아세토네이토)(모노페난트롤린)터븀(III)(약칭: [Tb(acac)3(Phen)]) 등의 희토류 금속 착체가 포함된다. 이들 화합물은 주로 녹색의 인광을 방출하며 500nm 내지 600nm에 발광 피크를 가진다. 또한 피리미딘 골격을 가지는 유기 금속 이리듐 착체는 신뢰성 및 발광 효율이 두드러지게 높기 때문에 특히 바람직하다.
다른 예에는, (다이아이소뷰타이릴메타네이토)비스[4,6-비스(3-메틸페닐)피리미디네이토]이리듐(III)(약칭: [Ir(5mdppm)2(dibm)]), 비스[4,6-비스(3-메틸페닐)피리미디네이토](다이피발로일메타네이토)이리듐(III)(약칭: [Ir(5mdppm)2(dpm)]), 및 비스[4,6-다이(나프탈렌-1-일)피리미디네이토](다이피발로일메타네이토)이리듐(III)(약칭: [Ir(d1npm)2(dpm)]) 등의 피리미딘 골격을 가지는 유기 금속 이리듐 착체; (아세틸아세토네이토)비스(2,3,5-트라이페닐피라지네이토)이리듐(III)(약칭: [Ir(tppr)2(acac)]), 비스(2,3,5-트라이페닐피라지네이토)(다이피발로일메타네이토)이리듐(III)(약칭: [Ir(tppr)2(dpm)]), 및 (아세틸아세토네이토)비스[2,3-비스(4-플루오로페닐)퀴녹살리네이토]이리듐(III)(약칭: [Ir(Fdpq)2(acac)]) 등의 피라진 골격을 가지는 유기 금속 이리듐 착체; 트리스(1-페닐아이소퀴놀리네이토-N,C 2')이리듐(III)(약칭: [Ir(piq)3]) 및 비스(1-페닐아이소퀴놀리네이토-N,C 2')이리듐(III)아세틸아세토네이트(약칭: [Ir(piq)2(acac)]) 등의 피리딘 골격을 가지는 유기 금속 이리듐 착체; 2,3,7,8,12,13,17,18-옥타에틸-21H,23H-포르피린 백금(II)(약칭: PtOEP) 등의 백금 착체; 및 트리스(1,3-다이페닐-1,3-프로페인다이오네이토)(모노페난트롤린)유로퓸(III)(약칭: [Eu(DBM)3(Phen)]) 및 트리스[1-(2-테노일)-3,3,3-트라이플루오로아세토네이토](모노페난트롤린)유로퓸(III)(약칭: [Eu(TTA)3(Phen)]) 등의 희토류 금속 착체가 포함된다. 이들 화합물은 적색의 인광을 방출하며 600nm 내지 700nm에 발광 피크를 가진다. 또한 피라진 골격을 가지는 유기 금속 이리듐 착체는 색도가 높은 적색 광을 방출할 수 있다.
상술한 인광성 화합물 외에, 다양한 인광 재료를 선택하여 사용하여도 좋다.
TADF 재료의 예에는, 풀러렌, 그 유도체, 아크리딘, 그 유도체, 및 에오신 유도체가 포함된다. 또한 마그네슘(Mg), 아연(Zn), 카드뮴(Cd), 주석(Sn), 백금(Pt), 인듐(In), 또는 팔라듐(Pd) 등의 금속을 포함하는 포르피린을 사용할 수 있다. 금속-함유 포르피린의 예에는, 이하의 구조식으로 나타낸, 프로토포르피린-플루오린화 주석 착체(SnF2(Proto IX)), 메소포르피린-플루오린화 주석 착체(SnF2(Meso IX)), 헤마토포르피린-플루오린화 주석 착체(SnF2(Hemato IX)), 코프로포르피린 테트라메틸 에스터-플루오린화 주석 착체(SnF2(Copro III-4Me)), 옥타에틸포르피린-플루오린화 주석 착체(SnF2(OEP)), 에티오포르피린-플루오린화 주석 착체(SnF2(Etio I)), 및 옥타에틸포르피린-염화 백금 착체(PtCl2(OEP))가 포함된다.
[화학식 78]
또는 이하의 구조식으로 나타내어지는, 2-(바이페닐-4-일)-4,6-비스(12-페닐인돌로[2,3-a]카바졸-11-일)-1,3,5-트라이아진(약칭: PIC-TRZ), 9-(4,6-다이페닐-1,3,5-트라이아진-2-일)-9'-페닐-9H,9'H-3,3'-바이카바졸(약칭: PCCzTzn), 2-{4-[3-(N-페닐-9H-카바졸-3-일)-9H-카바졸-9-일]페닐}-4,6-다이페닐-1,3,5-트라이아진(약칭: PCCzPTzn), 2-[4-(10H-페녹사진-10-일)페닐]-4,6-다이페닐-1,3,5-트라이아진(약칭: PXZ-TRZ), 3-[4-(5-페닐-5,10-다이하이드로페나진-10-일)페닐]-4,5-다이페닐-1,2,4-트라이아졸(약칭: PPZ-3TPT), 3-(9,9-다이메틸-9H-아크리딘-10-일)-9H-크산텐-9-온(약칭: ACRXTN), 비스[4-(9,9-다이메틸-9,10-다이하이드로아크리딘)페닐]설폰(약칭: DMAC-DPS), 또는 10-페닐-10H,10'H-스파이로[아크리딘-9,9'-안트라센]-10'-온(약칭: ACRSA) 등, π전자 과잉형 헤테로 방향족 고리 및 π전자 부족형 헤테로 방향족 고리의 양쪽 모두를 가지는 헤테로 고리 화합물을 사용할 수 있다. 이러한 헤테로 고리 화합물은 π전자 과잉형 헤테로 방향족 고리 및 π전자 부족형 헤테로 방향족 고리에 의하여, 우수한 전자 수송성 및 정공 수송성을 가져 바람직하다. 또한 π전자 과잉형 헤테로 방향족 고리가 π전자 부족형 헤테로 방향족 고리와 직접 결합된 물질은, π전자 과잉형 헤테로 방향족 고리의 도너성 및 π전자 부족형 헤테로 방향족 고리의 억셉터성 양쪽 모두가 향상되고, S1 준위와 T1 준위의 에너지 차이가 작아지므로 열활성화 지연 형광을 높은 효율로 얻을 수 있기 때문에 특히 바람직하다. 또한 π전자 부족형 헤테로 방향족 고리 대신에, 사이아노기 등 전자 흡인기가 결합된 방향족 고리를 사용하여도 좋다.
[화학식 79]
퀀텀닷의 예에는 14족 원소, 15족 원소, 16족 원소, 복수의 14족 원소의 화합물, 4족 내지 14족 중 어느 것에 속하는 원소와 16족 원소의 화합물, 2족 원소와 16족 원소의 화합물, 13족 원소와 15족 원소의 화합물, 13족 원소와 17족 원소의 화합물, 14족 원소와 15족 원소의 화합물, 11족 원소와 17족 원소의 화합물, 산화 철류, 산화 타이타늄류, 칼코게나이드스피넬류, 반도체 클러스터들, 및 금속 할로젠 페로브스카이트류 등의 나노 크기 입자가 포함된다.
구체적인 예에는, 셀레늄화 카드뮴(CdSe), 황화 카드뮴(CdS), 텔루륨화 카드뮴(CdTe), 셀레늄화 아연(ZnSe), 산화 아연(ZnO), 황화 아연(ZnS), 텔루륨화 아연(ZnTe), 황화 수은(HgS), 셀레늄화 수은(HgSe), 텔루륨화 수은(HgTe), 비소화 인듐(InAs), 인화 인듐(InP), 비소화 갈륨(GaAs), 인화 갈륨(GaP), 질화 인듐(InN), 질화 갈륨(GaN), 안티모니화 인듐(InSb), 안티모니화 갈륨(GaSb), 인화 알루미늄(AlP), 비소화 알루미늄(AlAs), 안티모니화 알루미늄(AlSb), 셀레늄화 납(II)(PbSe), 텔루륨화 납(II)(PbTe), 황화 납(II)(PbS), 셀레늄화 인듐(In2Se3), 텔루륨화 인듐(In2Te3), 황화 인듐(In2S3), 셀레늄화 갈륨(Ga2Se3), 황화 비소(III)(As2S3), 셀레늄화 비소(III)(As2Se3), 텔루륨화 비소(III)(As2Te3), 황화 안티모니(III)(Sb2S3), 셀레늄화 안티모니(III)(Sb2Se3), 텔루륨화 안티모니(III)(Sb2Te3), 황화 비스무트(III)(Bi2S3), 셀레늄화 비스무트(III)(Bi2Se3), 텔루륨화 비스무트(III)(Bi2Te3), 실리콘(Si), 탄소화 실리콘(SiC), 저마늄(Ge), 주석(Sn), 셀레늄(Se), 텔루륨(Te), 붕소(B), 탄소(C), 인(P), 질화 붕소(BN), 인화 붕소(BP), 비소화 붕소(BAs), 질화 알루미늄(AlN), 황화 알루미늄(Al2S3), 황화 바륨(BaS), 셀레늄화 바륨(BaSe), 텔루륨화 바륨(BaTe), 황화 칼슘(CaS), 셀레늄화 칼슘(CaSe), 텔루륨화 칼슘(CaTe), 황화 베릴륨(BeS), 셀레늄화 베릴륨(BeSe), 텔루륨화 베릴륨(BeTe), 황화 마그네슘(MgS), 셀레늄화 마그네슘(MgSe), 황화 저마늄(GeS), 셀레늄화 저마늄(GeSe), 텔루륨화 저마늄(GeTe), 황화 주석(IV)(SnS2), 황화 주석(II)(SnS), 셀레늄화 주석(II)(SnSe), 텔루륨화 주석(II)(SnTe), 산화 납(II)(PbO), 플루오린화 구리(I)(CuF), 염화 구리(I)(CuCl), 브로민화 구리(I)(CuBr), 아이오딘화 구리(I)(CuI), 산화 구리(I)(Cu2O), 셀레늄화 구리(I)(Cu2Se), 산화 니켈(II)(NiO), 산화 코발트(II)(CoO), 황화 코발트(II)(CoS), 사산화삼철(Fe3O4), 황화 철(II)(FeS), 산화 망가니즈(II)(MnO), 황화 몰리브데넘(IV)(MoS2), 산화 바나듐(II)(VO), 산화 바나듐(IV)(VO2), 산화 텅스텐(IV)(WO2), 산화 탄탈럼(V)(Ta2O5), 산화 타이타늄(예를 들어 TiO2, Ti2O5, Ti2O3, 및 Ti5O9), 산화 지르코늄(ZrO2), 질화 실리콘(Si3N4), 질화 저마늄(Ge3N4), 산화 알루미늄(Al2O3), 타이타늄산 바륨(BaTiO3), 셀레늄, 아연, 및 카드뮴의 화합물(CdZnSe), 인듐, 비소, 및 인의 화합물(InAsP), 카드뮴, 셀레늄, 및 황의 화합물(CdSeS), 카드뮴, 셀레늄, 및 텔루륨의 화합물(CdSeTe), 인듐, 갈륨, 및 비소의 화합물(InGaAs), 인듐, 갈륨, 및 셀레늄의 화합물(InGaSe), 인듐, 셀레늄, 및 황의 화합물(InSeS), 구리, 인듐, 및 황의 화합물(예를 들어, CuInS2), 및 이들의 조합이 포함되지만, 이에 한정되지는 않는다. 조성이 임의의 비율로 나타내어지는, 소위 합금형 퀀텀닷을 사용하여도 좋다. 예를 들어, CdS x Se1- x (x는 0 이상 1 이하의 임의의 수)로 나타내어지는 합금형 퀀텀닷은 x를 변화시킴으로써 발광 파장을 바꿀 수 있기 때문에, 청색 발광을 얻기에 유효한 수단이다.
퀀텀닷으로서는 코어형 퀀텀닷, 코어 셸 퀀텀닷, 또는 코어 멀티셸 퀀텀닷 등을 사용하여도 좋다. 더 넓은 밴드 갭을 가지는 다른 무기 재료로 형성되는 셸로 코어가 덮이면, 나노 결정의 표면에 존재하는 결함 또는 댕글링 본드의 영향을 저감시킬 수 있다. 이러한 구조는 발광의 양자 효율을 크게 향상시킬 수 있기 때문에 코어 셸 또는 코어 멀티셸 퀀텀닷을 사용하는 것이 바람직하다. 셸의 재료의 예에는, 황화 아연(ZnS) 및 산화 아연(ZnO)이 포함된다.
퀀텀닷은 표면 원자의 비율이 높기 때문에 반응성이 높고 응집되기 쉽다. 이러한 이유로 퀀텀닷의 표면에는 보호제가 부착되거나 또는 보호기가 제공되는 것이 바람직하다. 상기 보호제가 부착되거나 또는 상기 보호기가 제공됨으로써, 응집을 방지하고 용매에 대한 용해성을 높일 수 있다. 반응성을 저감시키고 전기적 안정성을 향상시킬 수도 있다. 보호제(또는 보호기)의 예에는 폴리옥시에틸렌라우릴에터, 폴리옥시에틸렌스테아릴에터, 및 폴리옥시에틸렌올레일에터 등의 폴리옥시에틸렌알킬에터류; 트라이프로필포스핀, 트라이뷰틸포스핀, 트라이헥실포스핀, 및 트라이옥틸포스핀 등의 트라이알킬포스핀류; 폴리옥시에틸렌 n-옥틸페닐에터 및 폴리옥시에틸렌 n-노닐페닐에터 등의 폴리옥시에틸렌알킬페닐에터류; 트라이(n-헥실)아민, 트라이(n-옥틸)아민, 및 트라이(n-데실)아민 등의 제 3급 아민류; 트라이프로필포스핀옥사이드, 트라이뷰틸포스핀옥사이드, 트라이헥실포스핀옥사이드, 트라이옥틸포스핀옥사이드, 및 트라이데실포스핀옥사이드 등의 유기 인 화합물; 폴리에틸렌글라이콜다이라우레이트 및 폴리에틸렌글라이콜다이스테아레이트 등의 폴리에틸렌글라이콜다이에스터류; 예를 들어 피리딘류, 루티딘류, 콜리딘류, 및 퀴놀린류 등의 질소 함유 방향족 화합물 등의 유기 질소 화합물; 헥실아민, 옥틸아민, 데실아민, 도데실아민, 테트라데실아민, 헥사데실아민, 및 옥타데실아민 등의 아미노알케인류; 다이뷰틸설파이드 등의 다이알킬설파이드류; 다이메틸설폭사이드 및 다이뷰틸설폭사이드 등의 다이알킬설폭사이드류; 예를 들어 싸이오펜 등의 황 함유 방향족 화합물 등의 유기 황 화합물; 팔미트산, 스테아르산, 및 올레산 등의 고급 지방산; 알코올류; 소르비탄 지방산 에스터류; 지방산 변성 폴리에스터류; 3급 아민변성 폴리우레탄류; 및 폴리에틸렌이민류가 포함된다.
퀀텀닷은 막대 형상의 퀀텀 로드이어도 좋다. 퀀텀 로드는 c축 방향으로 편광된 지향성의 광을 방출하기 때문에, 퀀텀 로드를 발광 재료로서 사용하여 외부 양자 효율이 더 높은 발광 소자를 얻을 수 있다.
발광 재료로서 퀀텀닷이 호스트 재료에 분산된 발광층은, 호스트 재료에 퀀텀닷을 분산시키거나, 혹은 호스트 재료 및 퀀텀닷을 적절한 액체 매체에 용해 또는 분산시키고, 웨트 프로세스(예를 들어 스핀 코팅법, 캐스트법, 다이 코팅법, 블레이드 코팅법, 롤 코팅법, 잉크젯법, 인쇄법, 스프레이 코팅법, 커튼 코팅법, 또는 랭뮤어-블라젯법(Langmuir-Blodgett method))를 수행하여 층을 형성한 후에, 용매를 제거하거나 또는 소성을 수행하여 형성되어도 좋다.
웨트 프로세스에 사용되는 액체 매체의 예에는, 메틸에틸케톤 및 사이클로헥사논 등의 케톤류; 아세트산 에틸 등의 지방산 에스터류; 다이클로로벤젠 등의 할로젠화 탄화수소류; 톨루엔, 자일렌, 메시틸렌, 및 사이클로헥실벤젠 등의 방향족 탄화수소류; 사이클로헥세인, 데칼린, 및 도데케인 등의 지방족 탄화수소류; 다이메틸폼아마이드(DMF); 및 다이메틸설폭사이드(DMSO) 등의 유기 용매가 포함된다.
형광 물질을 사용하는 경우, 발광층에 적합한 호스트 재료는, 9-페닐-3-[4-(10-페닐-9-안트릴)페닐]-9H-카바졸(약칭: PCzPA), 3-[4-(1-나프틸)-페닐]-9-페닐-9H-카바졸(약칭: PCPN), 9-[4-(10-페닐-9-안트릴)페닐]-9H-카바졸(약칭: CzPA), 7-[4-(10-페닐-9-안트릴)페닐]-7H-다이벤조[c,g]카바졸(약칭: cgDBCzPA), 6-[3-(9,10-다이페닐-2-안트릴)페닐]-벤조[b]나프토[1,2-d]퓨란(약칭: 2mBnfPPA), 및 9-페닐-10-{4-(9-페닐-9H-플루오렌-9-일)바이페닐-4'-일}안트라센(약칭: FLPPA) 등의 안트라센 골격을 가지는 재료이다. 안트라센 골격을 가지는 물질을 형광 물질의 호스트 재료로서 사용함으로써, 발광 효율이 높고 내구성이 높은 발광층을 얻을 수 있다. 또한 특히 CzPA, cgDBCzPA, 2mBnfPPA, 및 PCzPA는 특성이 우수하기 때문에 선택되는 것이 바람직하다.
상술한 재료 이외의 재료를 호스트 재료로서 사용하는 경우, 전자 수송성을 가지는 재료 및 정공 수송성을 가지는 재료 등 다양한 캐리어 수송 재료를 사용할 수 있다.
전자 수송성을 가지는 재료의 예에는, 비스(10-하이드록시벤조[h]퀴놀리네이토)베릴륨(II)(약칭: BeBq2), 비스(2-메틸-8-퀴놀리놀레이토)(4-페닐페놀레이토)알루미늄(III)(약칭: BAlq), 비스(8-퀴놀리놀레이토)아연(II)(약칭: Znq), 비스[2-(2-벤즈옥사졸릴)페놀레이토]아연(II)(약칭: ZnPBO), 및 비스[2-(2-벤조싸이아졸릴)페놀레이토]아연(II)(약칭: ZnBTZ) 등의 금속 착체; 2-(4-바이페닐릴)-5-(4-tert-뷰틸페닐)-1,3,4-옥사다이아졸(약칭: PBD), 3-(4-바이페닐릴)-4-페닐-5-(4-tert-뷰틸페닐)-1,2,4-트라이아졸(약칭: TAZ), 1,3-비스[5-(p-tert-뷰틸페닐)-1,3,4-옥사다이아졸-2-일]벤젠(약칭: OXD-7), 9-[4-(5-페닐-1,3,4-옥사다이아졸-2-일)페닐]-9H-카바졸(약칭: CO11), 2,2',2''-(1,3,5-벤젠트라이일)트리스(1-페닐-1H-벤즈이미다졸)(약칭: TPBI), 및 2-[3-(다이벤조싸이오펜-4-일)페닐]-1-페닐-1H-벤즈이미다졸(약칭: mDBTBIm-II) 등의 폴리아졸 골격을 가지는 헤테로 고리 화합물; 2-[3-(다이벤조싸이오펜-4-일)페닐]다이벤조[f,h]퀴녹살린(약칭: 2mDBTPDBq-II), 2-[3'-(다이벤조싸이오펜-4-일)바이페닐-3-일]다이벤조[f,h]퀴녹살린(약칭: 2mDBTBPDBq-II), 2-[3'-(9H-카바졸-9-일)바이페닐-3-일]다이벤조[f,h]퀴녹살린(약칭: 2mCzBPDBq), 4,6-비스[3-(페난트렌-9-일)페닐]피리미딘(약칭: 4,6mPnP2Pm), 및 4,6-비스[3-(4-다이벤조싸이엔일)페닐]피리미딘(약칭: 4,6mDBTP2Pm-II) 등의 다이아진 골격을 가지는 헤테로 고리 화합물; 및 3,5-비스[3-(9H-카바졸-9-일)페닐]피리딘(약칭: 35DCzPPy) 및 1,3,5-트라이[3-(3-피리딜)페닐]벤젠(약칭: TmPyPB) 등의 피리딘 골격을 가지는 헤테로 고리 화합물이 있다. 상술한 재료 중에서, 다이아진 골격을 가지는 헤테로 고리 화합물 및 피리딘 골격을 가지는 헤테로 고리 화합물은 신뢰성이 높기 때문에 바람직하다. 특히 다이아진(피리미딘 또는 피라진) 골격을 가지는 헤테로 고리 화합물은 전자 수송성이 우수하여 구동 전압의 감소에 기여한다.
정공 수송성을 가지는 재료의 예에는, 4,4'-비스[N-(1-나프틸)-N-페닐아미노]바이페닐(약칭: NPB), N,N'-비스(3-메틸페닐)-N,N'-다이페닐-[1,1'-바이페닐]-4,4'-다이아민(약칭: TPD), 4,4'-비스[N-(스파이로-9,9'-바이플루오렌-2-일)-N-페닐아미노]바이페닐(약칭: BSPB), 4-페닐-4'-(9-페닐플루오렌-9-일)트라이페닐아민(약칭: BPAFLP), 4-페닐-3'-(9-페닐플루오렌-9-일)트라이페닐아민(약칭: mBPAFLP), 4-페닐-4'-(9-페닐-9H-카바졸-3-일)트라이페닐아민(약칭: PCBA1BP), 4,4'-다이페닐-4''-(9-페닐-9H-카바졸-3-일)트라이페닐아민(약칭: PCBBi1BP), 4-(1-나프틸)-4'-(9-페닐-9H-카바졸-3-일)트라이페닐아민(약칭: PCBANB), 4,4'-다이(1-나프틸)-4''-(9-페닐-9H-카바졸-3-일)트라이페닐아민(약칭: PCBNBB), 9,9-다이메틸-N-페닐-N-[4-(9-페닐-9H-카바졸-3-일)페닐]플루오렌-2-아민(약칭: PCBAF), 및 N-페닐-N-[4-(9-페닐-9H-카바졸-3-일)페닐]스파이로-9,9'-바이플루오렌-2-아민(약칭: PCBASF) 등의 방향족 아민 골격을 가지는 화합물; 1,3-비스(N-카바졸릴)벤젠(약칭: mCP), 4,4'-다이(N-카바졸릴)바이페닐(약칭: CBP), 3,6-비스(3,5-다이페닐페닐)-9-페닐카바졸(약칭: CzTP), 및 3,3'-비스(9-페닐-9H-카바졸)(약칭: PCCP) 등의 카바졸 골격을 가지는 화합물; 4,4',4''-(벤젠-1,3,5-트라이일)트라이(다이벤조싸이오펜)(약칭: DBT3P-II), 2,8-다이페닐-4-[4-(9-페닐-9H-플루오렌-9-일)페닐]다이벤조싸이오펜(약칭: DBTFLP-III), 및 4-[4-(9-페닐-9H-플루오렌-9-일)페닐]-6-페닐다이벤조싸이오펜(약칭: DBTFLP-IV) 등의 싸이오펜 골격을 가지는 화합물; 및 4,4',4''-(벤젠-1,3,5-트라이일)트라이(다이벤조퓨란)(약칭: DBF3P-II) 및 4-{3-[3-(9-페닐-9H-플루오렌-9-일)페닐]페닐}다이벤조퓨란(약칭: mmDBFFLBi-II) 등의 퓨란 골격을 가지는 화합물이 포함된다. 상술한 재료 중에서, 방향족 아민 골격을 가지는 화합물 및 카바졸 골격을 가지는 화합물은 신뢰성이 높고 정공 수송성이 높아 구동 전압의 감소에 기여하기 때문에 바람직하다. 정공 수송 재료는 상술한 정공 수송 재료 외에도 다양한 물질로부터 선택하여도 좋다.
형광 물질을 발광 물질로서 사용하는 경우, 9-페닐-3-[4-(10-페닐-9-안트릴)페닐]-9H-카바졸(약칭: PCzPA), 3-[4-(1-나프틸)-페닐]-9-페닐-9H-카바졸(약칭: PCPN), 9-[4-(10-페닐-9-안트라센일)페닐]-9H-카바졸(약칭: CzPA), 7-[4-(10-페닐-9-안트릴)페닐]-7H-다이벤조[c,g]카바졸(약칭: cgDBCzPA), 6-[3-(9,10-다이페닐-2-안트릴)페닐]-벤조[b]나프토[1,2-d]퓨란(약칭: 2mBnfPPA), 및 9-페닐-10-{4-(9-페닐-9H-플루오렌-9-일)-바이페닐-4'-일}-안트라센(약칭: FLPPA) 등의 안트라센 골격을 가지는 재료를 사용하는 것이 바람직하다. 안트라센 골격을 가지는 물질을 형광 물질의 호스트 재료로서 사용함으로써, 발광 효율이 높고 내구성이 높은 발광층을 얻을 수 있다. 또한 특히 CzPA, cgDBCzPA, 2mBnfPPA, 및 PCzPA는 특성이 우수하기 때문에 선택되는 것이 바람직하다.
또한 호스트 재료는 복수 종류의 물질의 혼합물이어도 좋고, 혼합된 호스트 재료를 사용하는 경우에는, 전자 수송성을 가지는 재료를 정공 수송성을 가지는 재료와 혼합하는 것이 바람직하다. 전자 수송성을 가지는 재료를 정공 수송성을 가지는 재료와 혼합함으로써, 발광층(113)의 수송성을 쉽게 조절할 수 있고 재결합 영역을 쉽게 제어할 수 있다. 정공 수송성을 가지는 재료의 함유량과 전자 수송성을 가지는 재료의 함유량의 비율은 1:9 내지 9:1로 하여도 좋다.
이러한 혼합된 호스트 재료의 물질들이 들뜬 복합체를 형성하여도 좋다. 파장이 형광 물질, 인광 물질, 또는 TADF 재료의 가장 낮은 에너지 측의 흡수대의 파장과 중첩되는 발광을 나타내는 들뜬 복합체를 형성하도록 재료의 조합을 선택하면, 에너지가 원활하게 이동하고 발광을 효율적으로 얻을 수 있다. 이러한 구조는 구동 전압을 감소시키는 데에 바람직하다.
상술한 구조를 가지는 발광층(113)은 진공 증착법에 의한 공증착, 혼합 용액을 사용한 그라비어 인쇄법, 오프셋 인쇄법, 잉크젯법, 스핀 코팅법, 또는 딥 코팅법 등에 의하여 형성할 수 있다.
전자 수송층(114)은 전자 수송성을 가지는 물질을 포함한다. 전자 수송성을 가지는 물질로서는 호스트 재료로서 사용할 수 있는, 전자 수송성을 가지는 재료 및 안트라센 골격을 가지는 재료 중 어느 것을 사용할 수 있다.
본 발명의 일 형태의 유기 화합물도 정공 수송성을 가지는 물질이므로 정공 수송성을 가지는 재료로서 사용할 수 있다. 전자 부족형 헤테로 고리기 또는 방향족 탄화수소기를 치환기로서 가지는 유기 화합물은 특히 바람직하다.
전자 수송층과 발광층 사이에, 전자 캐리어의 이동을 제어하는 층을 제공하여도 좋다. 이 층은 상술한 전자 수송성이 우수한 재료에 전자 트랩성이 우수한 물질을 소량 첨가함으로써 형성하는 층이고, 전자 캐리어의 이동을 방해함으로써 캐리어 밸런스를 조절할 수 있다. 이러한 구조는, 전자가 발광층을 통과할 때 발생되는 문제(소자 수명의 저하 등)를 방지하는 데 매우 효과적이다.
전자 수송층(114)과 음극(102) 사이에 음극(102)과 접하여 전자 주입층(115)을 제공하여도 좋다. 전자 주입층(115)에는, 플루오린화 리튬(LiF), 플루오린화 세슘(CsF), 또는 플루오린화 칼슘(CaF2) 등의 알칼리 금속, 알칼리 토금속, 또는 그 화합물을 사용할 수 있다. 예를 들어, 전자 수송성을 가지는 물질을 사용하여 형성되며 알칼리 금속, 알칼리 토금속, 또는 그 화합물을 포함하는 층을 사용할 수 있다. 또한 전자 주입층(115)에 전자화물(electride)을 사용하여도 좋다. 전자화물의 예에는 칼슘과 알루미늄의 혼합 산화물(calcium oxide-aluminum oxide)에 높은 농도로 전자를 첨가한 물질이 포함된다. 또한 전자 수송성을 가지는 물질을 사용하여 형성되며 알칼리 금속 또는 알칼리 토금속을 포함하는 층을 전자 주입층(115)으로서 사용하면, 음극(102)으로부터의 전자 주입이 효율적으로 수행되므로 바람직하다.
전자 주입층(115) 대신에 전하 발생층(116)을 제공하여도 좋다(도 1의 (B)). 전하 발생층(116)이란, 전위가 인가될 때 전하 발생층(116)의 음극 측과 접하는 층에 정공을, 그 양극 측과 접하는 층에 전자를 주입할 수 있는 층을 말한다. 전하 발생층(116)은 적어도 p형층(117)을 포함한다. p형층(117)은, 정공 주입층(111)에 사용할 수 있는 재료의 예로서 상술한 복합 재료들 중 임의의 것을 사용하여 형성되는 것이 바람직하다. p형층(117)은, 복합 재료에 포함되는 재료로서 상술한 억셉터 재료를 포함하는 막과 상술한 정공 수송 재료를 포함하는 막을 적층시켜 형성되어도 좋다. p형층(117)에 전위를 인가하면, 전자 수송층(114)에 전자가 주입되고, 음극(102)에 정공이 주입되므로, 발광 소자가 동작된다. 전하 발생층(116)과 접하는 전자 수송층(114)에 본 발명의 일 형태의 유기 화합물을 포함하는 층이 존재하면, 발광 소자의 구동 시간에 따른 휘도 저하를 억제할 수 있으므로, 발광 소자는 긴 수명을 가질 수 있다.
또한 전하 발생층(116)은 p형층(117)에 더하여 전자 릴레이층(118) 및/또는 전자 주입 버퍼층(119)을 포함하는 것이 바람직하다.
전자 릴레이층(118)은 전자 수송성을 가지는 물질을 적어도 포함하고, 전자 주입 버퍼층(119)과 p형층(117)의 상호 작용을 방지하고 전자를 원활하게 수송하는 기능을 가진다. 전자 릴레이층(118)에 포함되는 전자 수송성을 가지는 물질의 LUMO 준위는, p형층(117)에서의 억셉터성 물질의 LUMO 준위와, 전자 수송층(114) 중 전하 발생층(116)과 접하는 층에 포함되는 물질의 LUMO 준위 사이에 있는 것이 바람직하다. 구체적으로 전자 릴레이층(118)에 사용되는 전자 수송성을 가지는 물질의 LUMO의 에너지 준위는 -5.0eV 이상인 것이 바람직하고, -5.0eV 이상 -3.0eV 이하인 것이 더 바람직하다. 전자 릴레이층(118)에 사용되는 전자 수송성을 가지는 물질로서는, 프탈로사이아닌계 재료 또는 금속-산소 결합과 방향족 리간드를 가지는 금속 착체를 사용하는 것이 바람직하다.
전자 주입 버퍼층(119)에는 전자 주입성이 우수한 물질을 사용할 수 있다. 예를 들어, 알칼리 금속, 알칼리 토금속, 희토류 금속, 또는 이들의 화합물(예를 들어, 알칼리 금속 화합물(산화 리튬 등의 산화물, 할로젠화물, 및 탄산 리튬 및 탄산 세슘 등의 탄산염을 포함함)), 알칼리 토금속 화합물(산화물, 할로젠화물, 및 탄산염을 포함함), 또는 희토류 금속 화합물(산화물, 할로젠화물, 및 탄산염을 포함함)을 사용할 수 있다.
전자 주입 버퍼층(119)이 전자 수송성을 가지는 물질 및 도너 물질을 포함하는 경우, 알칼리 금속, 알칼리 토금속, 희토류 금속, 이들의 화합물(예를 들어, 알칼리 금속 화합물(산화 리튬 등의 산화물, 할로젠화물, 및 탄산 리튬 및 탄산 세슘 등의 탄산염을 포함함), 알칼리 토금속 화합물(산화물, 할로젠화물, 및 탄산염을 포함함), 또는 희토류 금속 화합물(산화물, 할로젠화물, 및 탄산염을 포함함))에 더하여, 테트라싸이아나프타센(약칭: TTN), 니켈로센, 또는 데카메틸니켈로센 등의 유기 화합물을 도너 물질로서 사용할 수 있다. 전자 수송성을 가지는 물질로서는 상술한, 전자 수송층(114)의 재료와 비슷한 재료를 사용할 수 있다.
음극(102)에는, 각각 일함수가 낮은(구체적으로는 3.8eV 이하) 금속, 합금, 도전성 화합물, 또는 이들의 혼합물 등을 사용할 수 있다. 이러한 음극 재료의 구체적인 예에는, 알칼리 금속(예를 들어, 리튬(Li) 및 세슘(Cs)), 마그네슘(Mg), 칼슘(Ca), 및 스트론튬(Sr) 등의 주기율표의 1족 및 2족에 속하는 원소, 이들 원소를 포함하는 합금(예를 들어, MgAg 및 AlLi), 유로퓸(Eu) 및 이터븀(Yb) 등의 희토류 금속, 및 이들 희토류 금속을 포함하는 합금이 있다. 그러나, 음극(102)과 전자 수송층 사이에 전자 주입층을 제공하면, 일함수에 상관없이, Al, Ag, ITO, 혹은 실리콘 또는 산화 실리콘을 포함한 산화 인듐-산화 주석 등 다양한 도전 재료를 음극(102)에 사용할 수 있다. 이들 도전 재료의 막은, 진공 증착법 또는 스퍼터링법 등의 드라이 프로세스, 잉크젯법, 혹은 스핀 코팅법 등에 의하여 형성할 수 있다. 또는, 졸-겔법을 사용한 웨트 프로세스 또는 금속 재료의 페이스트를 사용한 웨트 프로세스를 적용하여도 좋다.
드라이 프로세스든 웨트 프로세스든, 다양한 방법을 사용하여 EL층(103)을 형성할 수 있다. 예를 들어 진공 증착법 또는 웨트 프로세스(스핀 코팅법, 캐스트법, 다이 코팅법, 블레이드 코팅법, 롤 코팅법, 잉크젯법, 인쇄법(예를 들어 그라비어 인쇄법, 오프셋 인쇄법, 및 스크린 인쇄법), 스프레이 코팅법, 커튼 코팅법, 및 랭뮤어-블라젯법 등)을 사용하여도 좋다.
다른 방법을 사용하여 상술한 전극들 또는 층들을 형성하여도 좋다.
여기서, 액적 토출법에 의하여 발광 물질을 포함하는 층(786)을 형성하는 방법에 대하여 도 2의 (A) 내지 (D)를 참조하여 설명한다. 도 2의 (A) 내지 (D)는 발광 물질을 포함하는 층(786)을 형성하는 방법을 도시한 단면도이다.
먼저, 도전막(772)을 평탄화 절연막(770) 위에 형성하고, 절연막(730)을 도전막(772)의 일부를 덮도록 형성한다(도 2의 (A) 참조).
다음으로, 액적 토출 장치(783)로부터 절연막(730)의 개구에서 노출된 도전막(772)에 액적(784)을 토출하여, 조성물을 포함하는 층(785)을 형성한다. 액적(784)은 용매를 포함하는 조성물이며, 도전막(772)에 부착된다(도 2의 (B) 참조).
또한 액적(784)을 토출하는 단계는 감압하에서 수행되어도 좋다.
다음으로, 조성물을 포함하는 층(785)에서 용매를 제거하고, 그 층을 고체화함으로써 발광 물질을 포함하는 층(786)을 형성한다(도 2의 (C) 참조).
용매는 건조 또는 가열에 의하여 제거하여도 좋다.
다음으로, 발광 물질을 포함하는 층(786) 위에 도전막(788)을 형성하여, 발광 소자(782)를 형성한다(도 2의 (D) 참조).
이러한 식으로 액적 토출법에 의하여 발광 물질을 포함하는 층(786)을 형성하면, 조성물을 선택적으로 토출할 수 있고, 이에 따라 재료의 낭비를 삭감할 수 있다. 또한 성형을 위한 리소그래피 공정 등이 불필요하기 때문에 공정이 간략화되고, 비용의 저감을 달성할 수 있다.
상술한 액적 토출법은, 조성물의 토출구를 가지는 노즐, 또는 하나 또는 복수의 노즐을 가지는 헤드 등의 액적 토출 수단을 사용한 방법의 총칭이다.
다음으로 액적 토출법에 사용하는 액적 토출 장치에 대하여 도 3을 참조하여 설명한다. 도 3은 액적 토출 장치(1400)를 도시한 개념도이다.
액적 토출 장치(1400)는 액적 토출 수단(1403)을 포함한다. 액적 토출 수단(1403)은 헤드(1405), 헤드(1412), 및 헤드(1416)를 포함한다.
헤드(1405 및 1412)는 컴퓨터(1410)로 제어되는 제어 수단(1407)에 접속되기 때문에, 미리 프로그램된 패턴을 묘화할 수 있다.
묘화는 예를 들어, 기판(1402) 위에 형성되는 마커(1411)에 기초한 타이밍에서 수행하여도 좋다. 또는, 기판(1402)의 외단부에 기초하여 기준점을 결정하여도 좋다. 여기서는, 촬상 수단(1404)에 의하여 마커(1411)를 검출하고, 화상 처리 수단(1409)에 의하여 디지털 신호로 변환한다. 컴퓨터(1410)가 이 디지털 신호를 인식한 다음, 제어 신호를 생성하여 제어 수단(1407)으로 전송한다.
촬상 수단(1404)으로서는 전하 결합 소자(CCD) 또는 상보형 금속 산화물 반도체(CMOS)를 포함하는 이미지 센서 등을 사용할 수 있다. 또한 기판(1402) 위에 형성될 패턴에 대한 정보는 기억 매체(1408)에 저장되어 있고, 이 정보에 기초하여 제어 신호가 제어 수단(1407)으로 전송됨으로써, 액적 토출 수단(1403)의 헤드(1405, 1412, 및 1416)가 독립적으로 제어될 수 있다. 토출하는 재료는, 재료 공급원(1413, 1414, 및 1415)으로부터 각각 배관을 통하여 헤드(1405, 1412, 및 1416)로 공급된다.
헤드(1405, 1412, 및 1416)의 각각의 내부에는, 점선(1406)으로 가리킨 액상의 재료를 충전하는 공간, 및 토출구로서 기능하는 노즐이 제공되어 있다. 도시하지 않았지만, 헤드(1412)의 내부 구조는 헤드(1405)의 내부 구조와 비슷하다. 헤드(1405)와 헤드(1412)의 노즐 크기가 서로 다르면, 상이한 재료를 상이한 폭으로 동시에 토출할 수 있다. 각 헤드는 복수의 발광 재료 등을 토출하고 패턴을 묘화할 수 있다. 넓은 영역에 패턴을 묘화하는 경우, 스루풋을 향상시키기 위하여 복수의 노즐로부터 같은 재료를 동시에 토출할 수 있다. 대형 기판을 사용하는 경우, 헤드(1405, 1412, 및 1416)는 도 3의 화살표 X, Y, 및 Z의 방향으로 기판을 자유로이 주사할 수 있고, 패턴을 묘화하는 영역을 자유로이 설정할 수 있다. 그러므로, 같은 패턴들을 하나의 기판에 묘화할 수 있다.
또한 조성물을 토출하는 단계는 감압하에서 수행되어도 좋다. 조성물을 토출할 때, 기판을 가열하여도 좋다. 조성물을 토출한 후, 건조 및/또는 베이킹을 수행한다. 건조와 베이킹은 양쪽 모두 가열 처리이지만, 목적, 온도, 및 시간이 상이하다. 건조 및 베이킹은 상압하 또는 감압하에서 레이저 조사, 순간 열 어닐, 또는 가열로에서의 가열 등에 의하여 수행된다. 또한 가열 처리의 타이밍 및 가열 처리의 횟수에 특별한 한정은 없다. 건조 및 베이킹을 적절하게 수행하기 위한 온도는 기판의 재료 및 조성물의 성질에 의존한다.
상술한 식으로, 발광 물질을 포함하는 층(786)을 액적 토출 장치를 사용하여 형성할 수 있다.
다양한 유기 재료 중 임의의 것 및 유기-무기 할로젠 페로브스카이트 재료들을 용매에 용해 또는 분산시킨 조성물을 사용하여, 발광 물질을 포함하는 층(786)을, 웨트 프로세스에 의하여 액적 토출 장치를 사용하여 형성할 수 있다. 이 경우, 하기 다양한 유기 용매: 벤젠, 톨루엔, 자일렌, 메시틸렌, 테트라하이드로퓨란, 다이옥세인, 에탄올, 메탄올, n-프로판올, 아이소프로판올, n-뷰탄올, t-뷰탄올, 아세토나이트릴, 다이메틸설폭사이드, 다이메틸폼아마이드, 클로로폼, 메틸렌클로라이드, 사염화 탄소, 아세트산 에틸, 헥세인, 및 사이클로헥세인을 사용하여 도포 조성물을 형성할 수 있다. 특히, 벤젠, 톨루엔, 자일렌, 또는 메시틸렌 등의 극성이 낮은 벤젠 유도체를 사용하면, 적합한 농도의 용액을 얻을 수 있고, 잉크에 포함되는 재료가 산화 등으로 인하여 열화되는 것을 방지할 수 있기 때문에 바람직하다. 또한 균일한 막 또는 균일한 두께를 가지는 막을 형성하기 위하여, 비점이 100℃ 이상의 용매를 사용하는 것이 바람직하고, 톨루엔, 자일렌, 또는 메시틸렌을 사용하는 것이 더 바람직하다.
또한 상술한 구조는 본 실시형태 및 다른 실시형태의 구조 중 어느 것과 조합될 수 있다.
다음으로, 복수의 발광 유닛이 적층된 발광 소자(적층 소자라고도 함)의 일 형태에 대하여 도 1의 (C)를 참조하여 설명한다. 이 발광 소자는 양극과 음극 사이에 복수의 발광 유닛을 포함한다. 각 발광 유닛은 도 1의 (A)에 도시된 EL층(103)과 비슷한 구조를 가진다. 바꿔 말하면, 도 1의 (A) 또는 (B)에 도시된 발광 소자는 하나의 발광 유닛을 포함하고, 도 1의 (C)에 도시된 발광 소자는 복수의 발광 유닛을 포함한다.
도 1의 (C)에서, 제 1 전극(501)과 제 2 전극(502) 사이에 제 1 발광 유닛(511)과 제 2 발광 유닛(512)이 적층되고, 제 1 발광 유닛(511)과 제 2 발광 유닛(512) 사이에 전하 발생층(513)이 제공된다. 제 1 전극(501) 및 제 2 전극(502)은 각각, 도 1의 (A)에 도시된 양극(101) 및 음극(102)에 상당하며, 도 1의 (A)의 설명을 적용할 수 있다. 또한 제 1 발광 유닛(511) 및 제 2 발광 유닛(512)은 같은 구조를 가져도 좋고 다른 구조를 가져도 좋다.
전하 발생층(513)은, 제 1 전극(501)과 제 2 전극(502) 사이에 전압이 인가될 때, 발광 유닛들 중 한쪽에 전자를 주입하고 발광 유닛들 중 다른 한쪽에 정공을 주입하는 기능을 가진다. 즉, 도 1의 (C)에서, 제 1 전극의 전위가 제 2 전극의 전위보다 높아지도록 전압이 인가되면, 전하 발생층(513)은 제 1 발광 유닛(511)에 전자를, 제 2 발광 유닛(512)에 정공을 주입한다.
전하 발생층(513)은 도 1의 (B)를 참조하여 설명한 전하 발생층(116)과 비슷한 구조를 가지는 것이 바람직하다. 유기 화합물과 금속 산화물의 복합 재료는 캐리어 주입성 및 캐리어 수송성이 우수하기 때문에, 저전압 구동 및 저전류 구동을 실현할 수 있다. 발광 유닛의 양극 측의 면이 전하 발생층(513)과 접하는 경우에는, 전하 발생층(513)이 발광 유닛의 정공 주입층으로서도 기능할 수 있으므로, 발광 유닛에 정공 주입층을 제공하지 않아도 된다.
전하 발생층(513)이 전자 주입 버퍼층(119)을 포함하는 경우, 전자 주입 버퍼층(119)은 양극 측의 발광 유닛에서의 전자 주입층으로서 기능하므로, 발광 유닛에 또 다른 전자 주입층을 제공하지 않아도 된다.
2개의 발광 유닛을 가지는 발광 소자에 대하여 도 1의 (C)를 참조하여 설명하였지만, 본 발명의 일 형태는 3개 이상의 발광 유닛이 적층되는 발광 소자에 대해서도 적용될 수 있다. 본 실시형태의 발광 소자와 같이, 한 쌍의 전극 사이에서 복수의 발광 유닛이 전하 발생층(513)에 의하여 분할됨으로써, 낮은 전류 밀도로 휘도가 높은 광을 방출할 수 있는, 수명이 긴 소자를 제공할 수 있다. 낮은 전압으로 구동되며 소비전력이 낮은 발광 장치를 제공할 수 있다.
또한 발광 유닛들의 발광색을 다르게 하면, 발광 소자 전체로서 원하는 색의 발광을 얻을 수 있다.
(실시형태 3)
본 실시형태에서는, 실시형태 1에서 설명한 발광 소자를 포함하는 발광 장치에 대하여 설명한다.
본 발명의 일 형태의 발광 장치에 대하여 도 4의 (A) 및 (B)를 참조하여 설명한다. 도 4의 (A)는 발광 장치의 상면도이고, 도 4의 (B)는 도 4의 (A)의 선 A-B 및 선 C-D를 따라 취한 단면도이다. 이 발광 장치는, 발광 소자의 발광을 제어하는, 점선으로 도시된 구동 회로부(소스선 구동 회로)(601), 화소부(602), 및 구동 회로부(게이트선 구동 회로)(603)를 포함한다. 부호 604는 밀봉 기판을, 605는 밀봉재를 나타내고, 607은 밀봉재(605)로 둘러싸인 공간이다.
또한 리드 배선(608)은, 소스선 구동 회로(601) 및 게이트선 구동 회로(603)에 입력되는 신호를 전송하며, 외부 입력 단자로서 기능하는 FPC(flexible printed circuit)(609)로부터 비디오 신호, 클록 신호, 스타트 신호, 및 리셋 신호 등을 받기 위한 배선이다. 여기서는 FPC만을 도시하였지만, FPC에 프린트 배선판(PWB)이 제공되어도 좋다. 본 명세서의 발광 장치는 발광 장치 자체뿐만 아니라, FPC 또는 PWB가 제공된 장치도 그 범주에 포함한다.
다음으로, 도 4의 (B)를 참조하여 단면 구조에 대하여 설명한다. 소자 기판(610) 위에는 구동 회로부 및 화소부가 형성되어 있다. 여기서는 구동 회로부인 소스선 구동 회로(601), 및 화소부(602)의 하나의 화소를 도시하였다.
소스선 구동 회로(601)로서, n채널 FET(623)와 p채널 FET(624)를 조합한 CMOS 회로를 형성한다. CMOS 회로, PMOS 회로, 및 NMOS 회로 등 다양한 회로를 사용하여 구동 회로를 형성하여도 좋다. 본 실시형태에서는 기판 위에 구동 회로가 형성되는 드라이버 일체형에 대하여 설명하지만, 구동 회로를 기판 위에 형성하지 않아도 되고, 기판 외부에 형성하여도 있다.
화소부(602)는 스위칭 FET(611), 전류 제어 FET(612), 및 전류 제어 FET(612)의 드레인에 전기적으로 접속된 제 1 전극(613)을 각각 포함하는 복수의 화소를 포함한다. 본 발명의 일 형태는 이 구조에 한정되지 않는다. 화소부의 각 화소는 3개 이상의 FET와 용량 소자를 조합하여 포함하여도 좋다.
FET에 사용하는 반도체의 종류 및 결정성에 특별한 한정은 없고, 비정질 반도체를 사용하여도 좋고, 또는 결정성 반도체를 사용하여도 좋다. FET에 사용하는 반도체의 예에는, 13족 반도체, 14족 반도체, 화합물 반도체, 산화물 반도체, 및 유기 반도체 재료가 포함된다. 산화물 반도체가 특히 바람직하다. 산화물 반도체의 예에는, In-Ga 산화물 및 In-M-Zn 산화물(M은 Al, Ga, Y, Zr, La, Ce, 또는 Nd)이 포함된다. 또한 에너지 갭이 2eV 이상, 바람직하게는 2.5eV 이상, 더 바람직하게는 3eV 이상인 산화물 반도체 재료를 사용하면, 트랜지스터의 오프 상태 전류를 감소시킬 수 있으므로 바람직하다.
또한 제 1 전극(613)의 단부를 덮도록 절연물(614)이 형성된다. 여기서 절연물(614)은 포지티브 감광성 아크릴 수지막을 사용하여 형성할 수 있다.
피복성을 향상시키기 위하여, 절연물(614)은 그 상단부 또는 하단부에 곡률을 가지는 곡면을 가지도록 형성된다. 예를 들어, 절연물(614)의 재료로서 포지티브 감광성 아크릴을 사용하는 경우, 절연물(614)의 상단부만이 곡률 반경(0.2μm 내지 3μm)을 가지는 곡면을 가지는 것이 바람직하다. 절연물(614)로서, 네거티브 감광성 수지 또는 포지티브 감광성 수지를 사용할 수 있다.
제 1 전극(613) 위에 EL층(616) 및 제 2 전극(617)이 형성된다. 제 1 전극(613), EL층(616), 및 제 2 전극(617)은 각각 도 1의 (A) 및 (B)의 양극(101), EL층(103), 및 음극(102), 또는 도 1의 (C)의 제 1 전극(501), EL층(503), 및 제 2 전극(502)에 상당한다.
EL층(616)은 유기 금속 착체를 포함하는 것이 바람직하다. 발광층의 발광 중심 물질로서 상기 유기 금속 착체를 사용하는 것이 바람직하다.
밀봉재(605)를 사용하여 밀봉 기판(604)이 소자 기판(610)에 접착되어, 소자 기판(610), 밀봉 기판(604), 및 밀봉재(605)에 의하여 둘러싸인 공간(607)에 발광 소자(618)가 제공된다. 공간(607)은 충전재로 충전되어 있고, 불활성 가스(예를 들어 질소 또는 아르곤) 또는 밀봉재(605)에 의하여 충전되어도 좋다. 밀봉 기판이 건조제가 제공된 오목부를 가지면, 수분으로 인한 열화를 억제할 수 있으므로 바람직하다.
밀봉재(605)로서 에폭시계 수지 또는 유리프릿을 사용하는 것이 바람직하다. 이 경우, 수분 또는 산소를 가능한 한 투과시키지 않는 재료를 사용하는 것이 바람직하다. 소자 기판(610) 및 밀봉 기판(604)으로서는 유리 기판, 석영 기판, 혹은 FRP(fiber reinforced plastic), PVF(polyvinyl fluoride), 폴리에스터, 또는 아크릴 등으로 형성된 플라스틱 기판을 사용할 수 있다.
본 명세서 등에서 예를 들어, 트랜지스터 또는 발광 소자는 다양한 기판을 사용하여 형성될 수 있다. 기판의 종류는 특정한 종류에 한정되지 않는다. 기판으로서는 반도체 기판(예를 들어, 단결정 기판 또는 실리콘 기판), SOI 기판, 유리 기판, 석영 기판, 플라스틱 기판, 금속 기판, 스테인리스강 기판, 스테인리스강 포일을 포함하는 기판, 텅스텐 기판, 텅스텐 포일을 포함하는 기판, 플렉시블 기판, 접합 필름, 섬유상 재료를 포함하는 종이, 또는 베이스(base) 재료 필름 등을 사용할 수 있다. 유리 기판에는 예를 들어, 바륨 붕규산염 유리, 알루미노 붕규산염 유리, 또는 소다 석회 유리를 사용할 수 있다. 플렉시블 기판, 접합 필름, 또는 베이스 재료 필름 등의 재료의 예는, 폴리에틸렌테레프탈레이트(PET), 폴리에틸렌나프탈레이트(PEN), 및 폴리에터설폰(PES)으로 대표되는 플라스틱이다. 다른 예는 아크릴 등의 합성 수지이다. 또는, 폴리테트라플루오로에틸렌(PTFE), 폴리프로필렌, 폴리에스터, 폴리플루오린화바이닐, 또는 폴리염화바이닐 등을 사용할 수 있다. 또는, 폴리아마이드, 폴리이미드, 아라미드, 에폭시, 증착에 의하여 형성된 무기 필름, 또는 종이 등을 사용할 수 있다. 특히, 반도체 기판, 단결정 기판, 또는 SOI 기판 등을 사용함으로써, 특성, 크기, 또는 형상 등의 편차가 적고 전류 능력이 높은 소형의 트랜지스터를 제작할 수 있다. 이러한 트랜지스터를 포함한 회로는, 회로의 저소비전력화 또는 고집적화를 실현한다.
또는, 기판으로서 플렉시블 기판을 사용하고, 플렉시블 기판 위에 트랜지스터 또는 발광 소자를 직접 형성하여도 좋다. 또는, 기판과 트랜지스터 사이 또는 기판과 발광 소자 사이에 분리층을 제공하여도 좋다. 분리층 위에 형성된 반도체 장치의 일부 또는 전체를 기판으로부터 분리하여 다른 기판으로 전치(轉置)할 때에 분리층을 사용할 수 있다. 이러한 경우, 트랜지스터는 내열성이 낮은 기판 또는 플렉시블 기판으로도 전치할 수 있다. 분리층으로서는 예를 들어, 무기막, 즉 텅스텐막과 산화 실리콘막의 적층, 또는 기판 위에 형성된 폴리이미드 등의 유기 수지막을 사용할 수 있다.
바꿔 말하면, 트랜지스터 또는 발광 소자를 하나의 기판을 사용하여 형성한 다음, 다른 기판으로 전치하여도 좋다. 트랜지스터 또는 발광 소자를 전치하는 기판의 예에는, 트랜지스터를 형성할 수 있는 상술한 기판에 더하여, 종이 기판, 셀로판 기판, 아라미드 필름 기판, 폴리이미드 필름 기판, 석재 기판, 목재 기판, 천 기판(천연 섬유(예를 들어, 견(silk), 면(cotton), 및 마(hemp)), 합성 섬유(예를 들어, 나일론, 폴리우레탄, 및 폴리에스터), 및 재생 섬유(예를 들어, 아세테이트, 큐프라, 레이온, 또는 재생 폴리에스터) 등을 포함함), 피혁 기판, 및 고무 기판이 포함된다. 이러한 기판을 사용하면, 특성이 우수한 트랜지스터 또는 소비전력이 낮은 트랜지스터를 형성할 수 있거나, 높은 내구성 및 높은 내열성을 가지는 장치를 제공할 수 있거나, 및/또는 무게 또는 두께의 감소를 실현할 수 있다.
도 5의 (A) 및 (B) 각각은 백색 발광을 나타내는 발광 소자 및 착색층(컬러 필터) 등을 포함하여 풀 컬러 화상을 표시하는 발광 장치의 예를 도시한 것이다. 도 5의 (A)에는 기판(1001), 베이스 절연막(1002), 게이트 절연막(1003), 게이트 전극(1006, 1007, 및 1008), 제 1 층간 절연막(1020), 제 2 층간 절연막(1021), 주변부(1042), 화소부(1040), 구동 회로부(1041), 발광 소자의 제 1 전극(1024W, 1024R, 1024G, 및 1024B), 격벽(1025), EL층(1028), 음극(1029), 밀봉 기판(1031), 및 밀봉재(1032) 등을 도시하였다.
도 5의 (A)에서, 투명 베이스 재료(1033) 상에 착색층(적색 착색층(1034R), 녹색 착색층(1034G), 및 청색 착색층(1034B))이 제공된다. 추가적으로 흑색층(블랙 매트릭스)(1035)이 제공되어도 좋다. 착색층 및 흑색층이 제공된 투명 베이스 재료(1033)는 기판(1001)에 배치 및 고정된다. 또한 착색층 및 흑색층은 오버코트층(1036)으로 덮인다. 도 5의 (A)에서, 일부 발광층으로부터 방출된 광은 착색층을 통과하지 않고, 나머지 발광층으로부터 방출된 광은 각색의 착색층을 통과한다. 착색층을 통과하지 않은 광은 백색이고 착색층들 중 어느 하나를 통과한 광은 적색, 청색, 또는 녹색이기 때문에, 그 4색의 화소를 사용하여 화상을 표시할 수 있다.
도 5의 (B)는 착색층(적색 착색층(1034R), 녹색 착색층(1034G), 및 청색 착색층(1034B))이 게이트 절연막(1003)과 제 1 층간 절연막(1020) 사이에 형성된 예를 도시한 것이다. 이 구조와 같이, 착색층은 기판(1001)과 밀봉 기판(1031) 사이에 제공되어도 좋다.
상술한 발광 장치는, FET가 형성되는 기판(1001) 측으로부터 광이 추출되는 구조(보텀 이미션 구조(bottom emission structure))를 가지지만, 밀봉 기판(1031) 측으로부터 광이 추출되는 구조(톱 이미션 구조(top emission structure))를 가져도 좋다. 도 6은 톱 이미션 발광 장치의 단면도이다. 이 경우, 기판(1001)으로서 광을 투과시키지 않는 기판을 사용할 수 있다. FET와 발광 소자의 양극을 접속시키는 접속 전극을 형성하는 단계까지의 공정은 보텀 이미션 발광 장치와 비슷한 식으로 수행된다. 그리고, 제 3 층간 절연막(1037)이 전극(1022)을 덮도록 형성된다. 이 절연막은 평탄화 기능을 가져도 좋다. 제 3 층간 절연막(1037)은 제 2 층간 절연막(1021)과 비슷한 재료 또는 다른 다양한 재료 중 어느 것을 사용하여 형성할 수 있다.
여기서 발광 소자의 제 1 전극(1024W, 1024R, 1024G, 및 1024B)은 각각 양극으로서 기능하지만, 각각 음극으로서 기능하여도 좋다. 또한 도 6에 도시된 톱 이미션 발광 장치의 경우, 제 1 전극은 반사 전극인 것이 바람직하다. EL층(1028)은 도 1의 (A) 또는 (B)의 EL층(103) 혹은 도 1의 (C)의 EL층(503)의 구조와 비슷한 구조를 가지며, 이에 의하여 백색 발광을 얻을 수 있다.
도 6과 같은 톱 이미션 구조의 경우, 착색층(적색 착색층(1034R), 녹색 착색층(1034G), 및 청색 착색층(1034B))이 제공되는 밀봉 기판(1031)으로 밀봉을 수행할 수 있다. 밀봉 기판(1031)에는 화소들 사이에 위치하는 흑색층(블랙 매트릭스)(1035)이 제공되어도 좋다. 착색층(적색 착색층(1034R), 녹색 착색층(1034G), 및 청색 착색층(1034B))과 흑색층은 오버코트층으로 덮여도 좋다. 또한 밀봉 기판(1031)으로서 투광성 기판이 사용된다.
본 발명의 일 형태는 여기서 나타낸, 적색, 녹색, 청색, 및 백색의 4색을 사용하여 풀 컬러 화상을 표시하는 예에 특별히 한정되지 않고, 적색, 녹색, 및 청색의 3색 또는 적색, 녹색, 청색, 및 황색의 4색을 사용하여 풀 컬러 화상을 표시하여도 좋다.
도 7의 (A) 및 (B)는 본 발명의 일 형태의 패시브 매트릭스 발광 장치를 도시한 것이다. 도 7의 (A)는 발광 장치의 사시도이고, 도 7의 (B)는 도 7의 (A)의 선 X-Y를 따라 취한 단면도이다. 도 7의 (A) 및 (B)에 있어서, 기판(951) 위에서 전극(952)과 전극(956) 사이에는 EL층(955)이 제공된다. 전극(952)의 단부는 절연층(953)으로 덮인다. 절연층(953) 위에는 격벽층(954)이 제공된다. 격벽층(954)의 측벽은, 측벽들 사이의 거리가 기판의 표면을 향하여 서서히 좁아지도록 경사져 있다. 즉, 격벽층(954)의 짧은 변 방향의 단면은 사다리꼴형이고, 아랫변(절연층(953)의 평면 방향에 대하여 실질적으로 평행하고 절연층(953)과 접하는 변)이 윗변(절연층(953)의 평면 방향에 대하여 실질적으로 평행하고 절연층(953)과 접하지 않는 변)보다 짧다. 이러한 식으로 제공된 격벽층(954)에 의하여 정전기 등으로 인한 발광 소자의 결함을 방지할 수 있다.
매트릭스상으로 배열된 많은 미세 발광 소자들은 화소부에 형성된 FET에 의하여 독립적으로 제어될 수 있기 때문에, 상술한 발광 장치는 화상 표시 장치로서 적합하게 사용될 수 있다.
<<조명 장치>>
본 발명의 일 형태의 조명 장치에 대하여 도 8의 (A) 및 (B)를 참조하여 설명한다. 도 8의 (B)는 조명 장치의 상면도이고, 도 8의 (A)는 도 8의 (B)의 선 e-f를 따라 취한 단면도이다.
조명 장치에서, 지지체이며 투광성을 가지는 기판(400) 위에 제 1 전극(401)이 형성된다. 제 1 전극(401)은 도 1의 (A) 및 (B)의 양극(101)에 상당한다. 제 1 전극(401) 측으로부터 광이 추출될 때, 제 1 전극(401)은 투광성을 가지는 재료를 사용하여 형성된다.
기판(400) 위에는, 제 2 전극(404)에 전압을 인가하기 위한 패드(412)가 형성된다.
제 1 전극(401) 위에 EL층(403)이 형성된다. EL층(403)은 예를 들어 도 1의 (A) 및 (B)의 EL층(103)에 상당한다. 이들 구조에 대해서는 상당하는 설명을 참조할 수 있다.
EL층(403)을 덮도록 제 2 전극(404)이 형성된다. 제 2 전극(404)은 도 1의 (A)의 음극(102)에 상당한다. 제 2 전극(404)은, 제 1 전극(401) 측으로부터 광이 추출될 때, 높은 반사성을 가지는 재료를 포함한다. 제 2 전극(404)은 패드(412)에 접속되어 전압이 인가된다.
제 1 전극(401), EL층(403), 및 제 2 전극(404)에 의하여 발광 소자가 형성된다. 발광 소자를 밀봉재(405 및 406)에 의하여 밀봉 기판(407)에 고정시켜 밀봉함으로써, 조명 장치가 완성된다. 밀봉재(405) 또는 밀봉재(406)는 생략 가능하다. 또한 내측의 밀봉재(406)에 수분의 흡수를 가능하게 하는 건조제를 혼합시킬 수 있어 신뢰성이 높아진다.
패드(412)의 일부 및 제 1 전극(401)의 일부가 밀봉재(405 및 406)의 외부로 연장되면, 그 연장된 부분은 외부 입력 단자로서 기능할 수 있다. 컨버터 등이 탑재된 IC칩(420)이 외부 입력 단자 위에 제공되어도 좋다.
<<전자 기기>>
본 발명의 일 형태의 전자 기기의 예에 대하여 설명한다. 전자 기기의 예는 텔레비전 장치(텔레비전 또는 텔레비전 수신기라고도 함), 컴퓨터 등의 모니터, 디지털 카메라, 디지털 비디오 카메라, 디지털 포토 프레임, 휴대 전화(이동 전화 또는 이동 전화기라고도 함), 휴대용 게임기, 휴대 정보 단말, 음향 재생 장치, 및 파친코 기기 등의 대형 게임기가 포함된다. 이들 전자 기기의 구체적인 예를 이하에서 나타낸다.
도 9의 (A)는 텔레비전 장치의 예를 도시한 것이다. 상기 텔레비전 장치에서, 하우징(7101)에 표시부(7103)가 포함된다. 여기서, 하우징(7101)은 스탠드(7105)에 의하여 지탱된다. 표시부(7103)에 영상이 표시될 수 있고, 발광 소자들이 매트릭스상으로 배열된다.
상기 텔레비전 장치는 하우징(7101)의 조작 스위치 또는 별도의 리모트 컨트롤러(7110)로 조작할 수 있다. 리모트 컨트롤러(7110)의 조작 키(7109)에 의하여, 채널과 음량을 제어할 수 있고, 표시부(7103)에 표시되는 화상을 제어할 수 있다. 또한 리모트 컨트롤러(7110)에는 리모트 컨트롤러(7110)로부터 출력되는 데이터를 표시하기 위한 표시부(7107)가 제공되어도 좋다.
또한 상기 텔레비전 장치에는 수신기 및 모뎀 등이 제공된다. 수신기를 사용함으로써, 일반 텔레비전 방송을 수신할 수 있다. 또한 텔레비전 장치를 모뎀을 통하여 유선 또는 무선의 통신 네트워크에 접속시키면, 일방향(송신자로부터 수신자) 또는 쌍방향(송신자와 수신자 간, 또는 수신자들끼리)의 데이터 통신을 수행할 수 있다.
도 9의 (B1)은, 본체(7201), 하우징(7202), 표시부(7203), 키보드(7204), 외부 접속 포트(7205), 및 포인팅 디바이스(7206) 등을 포함하는 컴퓨터를 도시한 것이다. 또한 이 컴퓨터는, 표시부(7203)에서 발광 소자를 매트릭스상으로 배열하여 제작된다. 도 9의 (B1)의 컴퓨터는 도 9의 (B2)의 구조를 가져도 좋다. 도 9의 (B2)의 컴퓨터에는 키보드(7204)와 포인팅 디바이스(7206) 대신에 제 2 표시부(7210)가 제공된다. 제 2 표시부(7210)는 터치 패널이며, 제 2 표시부(7210) 상의 입력용 표시를 손가락 또는 전용 펜으로 터치함으로써 입력 조작을 수행할 수 있다. 제 2 표시부(7210)는 입력용 표시 이외의 화상을 표시할 수도 있다. 표시부(7203)도 터치 패널이어도 좋다. 이 2개의 화면을 힌지로 접속시킴으로써, 예를 들어, 컴퓨터를 보관 또는 운반하는 동안에 화면이 긁히거나 파손되는 문제를 방지할 수 있다.
도 9의 (C) 및 (D) 각각은 휴대 정보 단말의 예를 도시한 것이다. 휴대 정보 단말에는, 하우징(7401)에 제공된 표시부(7402), 조작 버튼(7403), 외부 접속 포트(7404), 스피커(7405), 및 마이크로폰(7406) 등이 제공된다. 또한 휴대 정보 단말은 발광 소자가 매트릭스상으로 배열된 표시부(7402)를 포함한다.
표시부(7402)를 손가락 등으로 터치함으로써, 도 9의 (C) 및 (D)에 도시된 휴대 정보 단말의 각각에 정보를 입력할 수 있다. 이 경우, 전화를 걸거나 이메일을 작성하는 등의 조작은, 표시부(7402)를 손가락 등으로 터치함으로써 수행할 수 있다.
표시부(7402)는 주로 3가지 화면 모드를 가진다. 제 1 모드는 주로 화상을 표시하기 위한 표시 모드이다. 제 2 모드는 주로 문자 등의 정보를 입력하기 위한 입력 모드이다. 제 3 모드는 표시 모드와 입력 모드의 두 가지 모드가 조합된 표시 및 입력 모드이다.
예를 들어, 전화를 걸거나 또는 이메일을 작성하는 경우, 표시부(7402)에 주로 문자를 입력하기 위한 문자 입력 모드를 선택하여, 화면에 표시된 문자를 입력할 수 있다. 이 경우, 표시부(7402)의 화면의 거의 전체에 키보드 또는 번호 버튼을 표시하는 것이 바람직하다.
자이로스코프 센서 또는 가속도 센서 등 기울기를 검지하기 위한 센서를 포함하는 검지 장치가 휴대 정보 단말 내부에 제공되면, 휴대 정보 단말의 방향(휴대 정보 단말이 가로로 배치되는지 세로로 배치되는지)을 판정함으로써, 표시부(7402)의 화면 표시를 자동적으로 바꿀 수 있다.
화면 모드는 표시부(7402)를 터치하거나 또는 하우징(7401)의 조작 버튼(7403)으로 조작함으로써 전환된다. 또는, 표시부(7402)에 표시되는 화상의 종류에 따라 화면 모드를 전환할 수 있다. 예를 들어, 표시부에 표시되는 화상의 신호가 동영상 데이터의 신호이면 화면 모드가 표시 모드로 전환된다. 신호가 텍스트 데이터의 신호이면 화면 모드가 입력 모드로 전환된다.
또한 입력 모드에서 표시부(7402)의 광 센서로 검지되는 신호를 검지하면서, 표시부(7402)의 터치에 의한 입력이 일정 기간 행해지지 않는 경우에는, 화면 모드가 입력 모드에서 표시 모드로 전환되도록 제어하여도 좋다.
표시부(7402)는 이미지 센서로서 기능하여도 좋다. 예를 들어, 표시부(7402)를 손바닥 또는 손가락으로 터치하였을 때 장문 또는 지문 등의 화상을 찍음으로써, 개인 인증을 수행할 수 있다. 또한 근적외광을 방출하는 백라이트 또는 센싱용 광원을 표시부에 제공함으로써, 손가락 정맥 또는 손바닥 정맥 등의 화상을 찍을 수도 있다.
또한 상술한 전자 기기에서, 본 명세서에 기재된 구조 중 어느 것을 적절히 조합할 수 있다.
표시부는 본 발명의 일 형태의 발광 소자를 포함하는 것이 바람직하다. 이 발광 소자는 높은 발광 효율을 가질 수 있다. 또한 이 발광 소자는 낮은 전압으로 구동시킬 수 있다. 따라서, 본 발명의 일 형태의 발광 소자를 포함하는 전자 기기의 소비전력을 낮게 할 수 있다.
도 10은 발광 소자를 백라이트에 사용한 액정 표시 장치의 일례를 도시한 것이다. 도 10에 도시된 액정 표시 장치는 하우징(901), 액정층(902), 백라이트 유닛(903), 및 하우징(904)을 포함한다. 액정층(902)은 드라이버 IC(905)에 접속된다. 백라이트 유닛(903)에 발광 소자를 사용하고, 단자(906)를 통하여 전류가 공급된다.
발광 소자로서, 본 발명의 일 형태의 발광 소자를 사용하는 것이 바람직하다. 상기 발광 소자를 포함함으로써, 액정 표시 장치의 백라이트의 소비전력을 낮게 할 수 있다.
도 11은 본 발명의 일 형태의 탁상용 스탠드의 일례를 도시한 것이다. 도 11에 도시된 탁상용 스탠드는 하우징(2001) 및 광원(2002)을 포함하고, 광원(2002)으로서 발광 소자를 포함하는 조명 장치가 사용된다.
도 12는 실내 조명 장치(3001)의 일례를 도시한 것이다. 본 발명의 일 형태의 발광 소자를 조명 장치(3001)에 사용하는 것이 바람직하다.
본 발명의 일 형태의 자동차를 도 13에 도시하였다. 상기 자동차에서, 발광 소자가 앞유리 및 대시보드에 사용된다. 발광 소자, 바람직하게는 본 발명의 일 형태의 발광 소자를 사용하여 표시 영역(5000 내지 5005)이 형성된다. 이로써 표시 영역(5000 내지 5005)의 소비전력이 억제되므로, 자동차로의 사용에 적합한 것을 나타낸다.
표시 영역(5000 및 5001)은 자동차의 앞유리에 제공되며 상기 발광 소자를 포함하는 표시 장치이다. 이들 발광 소자의 제 1 전극 및 제 2 전극으로서 투광성을 가지는 전극이 사용되면, 반대쪽을 볼 수 있는 소위 시스루 표시 장치를 얻을 수 있다. 이러한 시스루 표시 장치는 자동차의 앞유리에도 시야를 저해하는 일 없이 제공될 수 있다. 구동 트랜지스터 등이 제공되는 경우, 유기 반도체 재료를 포함하는 유기 트랜지스터 또는 산화물 반도체를 포함하는 트랜지스터 등 투광성을 가지는 트랜지스터를 사용하는 것이 바람직하다.
표시 영역(5002)은 필러 부분에 제공되며 상기 발광 소자를 포함하는 표시 장치이다. 표시 영역(5002)은 차체에 제공된 촬상 유닛으로 얻은 화상을 표시함으로써, 필러로 저해된 시야를 보완할 수 있다. 마찬가지로, 대시보드 부분에 제공된 표시 영역(5003)은 자동차의 외부에 제공된 촬상 유닛으로 얻은 화상을 표시함으로써, 차체로 저해된 시야를 보완할 수 있다. 그러므로 안 보이는 영역을 없애 안전성을 높일 수 있다. 운전자가 볼 수 없는 영역을 보완함으로써, 운전자가 쉽고 편하게 안전을 확인할 수 있다.
표시 영역(5004 및 5005)은 내비게이션 정보, 속도계, 태코미터, 주행 거리, 연료 미터, 변속 기어 인디케이터, 및 에어컨디션의 설정 등 다양한 정보를 제공할 수 있다. 표시의 내용 또는 레이아웃은 사용자에 의하여 자유롭게 적절히 바꿀 수 있다. 또한 이런 정보는 표시 영역(5000 내지 5003)에도 표시할 수 있다. 표시 영역(5000 내지 5005)은 조명 장치로서 사용될 수도 있다.
도 14의 (A) 및 (B)는 폴더블 태블릿 단말의 일례를 도시한 것이다. 도 14의 (A)에 있어서 태블릿 단말은 펼친 상태이며, 하우징(9630), 표시부(9631a), 표시부(9631b), 표시 모드 전환 스위치(9034), 전원 스위치(9035), 전력 절약 모드 전환 스위치(9036), 및 클래스프(clasp)(9033)를 포함한다. 태블릿 단말에서는, 본 발명의 일 형태의 발광 소자를 포함하는 발광 장치가 표시부(9631a) 및/또는 표시부(9631b)에 사용된다.
표시부(9631a)의 일부를 터치 패널 영역(9632a)으로 할 수 있고, 표시된 조작 키(9637)를 터치하면 데이터를 입력할 수 있다. 표시부(9631a)의 구조는 도시된, 절반 영역이 표시 기능만을 가지고 나머지 절반 영역이 터치 패널 기능을 가지는 구조에 한정되지 않는다. 표시부(9631a)의 전체 영역이 터치 패널 기능을 가져도 좋다. 예를 들어, 표시부(9631a)의 전체 영역에 키보드 버튼을 표시시켜 터치 패널로서 기능시키고, 표시부(9631b)를 표시 화면으로서 사용할 수 있다.
표시부(9631a)와 같이, 표시부(9631b)의 일부를 터치 패널 영역(9632b)으로 할 수 있다. 터치 패널 상의 키보드를 보여 주거나 숨기기 위한 전환 버튼(9639)을 손가락 또는 스타일러스 등으로 터치하면, 표시부(9631b)에 키보드 버튼을 표시시킬 수 있다.
터치 패널 영역(9632a) 및 터치 패널 영역(9632b)에서 동시에 터치 입력을 수행할 수 있다.
표시 모드 전환 스위치(9034)는 예를 들어, 세로 모드와 가로 모드 등 사이, 및 흑백 표시와 컬러 표시 사이에서 표시를 전환할 수 있다. 전력 절약 모드 전환 스위치(9036)는, 태블릿 단말에 내장된 광학 센서에 의하여 검지되는, 사용 시의 외광의 양에 따라 표시의 휘도를 최적화할 수 있다. 광학 센서 외에, 예를 들어 자이로스코프 센서 또는 가속도 센서 등 기울기를 검지하기 위한 센서 등의 다른 검지 장치가 태블릿 단말에 내장되어도 좋다.
본 발명의 일 형태는 도 14의 (A)에 도시된, 표시부(9631a)와 표시부(9631b)의 표시 면적이 동일한 예에 한정되지 않는다. 표시부(9631a)와 표시부(9631b)는 면적 또는 표시 품질이 상이하여도 좋다. 예를 들어, 표시부(9631a 및 9631b) 중 한쪽에, 다른 한쪽보다 선명도가 높은 화상을 표시하여도 좋다.
도 14의 (B)에 있어서 태블릿 단말은 접힌 상태이다. 본 실시형태의 태블릿 단말은 하우징(9630), 태양 전지(9633), 충방전 제어 회로(9634), 배터리(9635), 및 DCDC 컨버터(9636)를 포함한다. 또한 도 14의 (B)에는, 충방전 제어 회로(9634)가 배터리(9635) 및 DCDC 컨버터(9636)를 포함하는 예를 도시하였다.
태블릿 단말은 접을 수 있기 때문에, 태블릿 단말이 사용되지 않을 때 하우징(9630)을 닫을 수 있다. 그러므로 표시부(9631a) 및 표시부(9631b)를 보호할 수 있으므로, 내구성이 높고 장기 사용에 대한 신뢰성이 높은 태블릿 단말을 제공할 수 있다.
또한 도 14의 (A) 및 (B)에 도시된 태블릿 단말은 다양한 정보(예를 들어 정지 화상, 동영상, 및 텍스트 화상)를 표시하는 기능, 달력, 날짜, 및/또는 시간 등을 표시부에 표시하는 기능, 표시부에 표시된 정보를 터치 입력에 의하여 조작하거나 또는 편집하는 터치 입력 기능, 및 다양한 소프트웨어(프로그램)에 의하여 처리를 제어하는 기능 등을 가질 수 있다.
태블릿 단말의 표면에 제공된 태양 전지(9633)는 전력을 터치 패널, 표시부, 또는 비디오 신호 처리부 등에 공급할 수 있다. 또한 태양 전지(9633)가 하우징(9630)의 하나 또는 2개의 표면에 제공되면, 배터리(9635)를 효율적으로 충전할 수 있기 때문에 바람직하다.
도 14의 (B)에 도시된 충방전 제어 회로(9634)의 구조 및 동작에 대하여 도 14의 (C)의 블록도를 참조하여 설명한다. 도 14의 (C)는 태양 전지(9633), 배터리(9635), DCDC 컨버터(9636), 컨버터(9638), 스위치(SW1 내지 SW3), 및 표시부(9631)를 도시한 것이다. 배터리(9635), DCDC 컨버터(9636), 컨버터(9638), 및 스위치(SW1 내지 SW3)는 도 14의 (B)에 도시된 충방전 제어 회로(9634)에 상당한다.
우선, 외광을 사용하여 태양 전지(9633)에 의하여 전력이 발생되는 경우의 동작의 예에 대하여 설명한다. 태양 전지에 의하여 발생된 전력의 전압은 배터리(9635)를 충전하기 위한 전압이 되도록 DCDC 컨버터(9636)에 의하여 상승 또는 강하된다. 그리고, 태양 전지(9633)에 의하여 저장된 전력이 표시부(9631)의 동작에 사용될 때는 스위치(SW1)를 온 상태로 하고, 전력의 전압을 표시부(9631)를 위하여 필요한 전압이 되도록 컨버터(9638)에 의하여 상승 또는 강하시킨다. 표시부(9631) 상의 표시가 수행되지 않을 때는, 스위치(SW1)를 오프 상태로 하고 스위치(SW2)를 온 상태로 하여 배터리(9635)를 충전한다.
태양 전지(9633)를 전력 발생 수단의 일례로서 설명하였지만, 전력 발생 수단에 특별한 한정은 없고, 압전 소자 또는 열전 변환 소자(펠티에 소자) 등의 다른 전력 발생 수단에 의하여 배터리(9635)를 충전하여도 좋다. 배터리(9635)는, 무선(비접촉)으로 전력을 송수신하여 충전할 수 있는 비접촉 전력 전송 모듈에 의하여 충전하여도 좋고, 또는 다른 충전 수단을 조합하여 사용하여도 좋고, 전력 발생 수단을 제공하지 않아도 된다.
표시부(9631)가 제공되기만 하면, 본 발명의 일 형태는 도 14의 (A) 내지 (C)에 도시된 형상을 가지는 태블릿 단말에 한정되지 않는다.
도 15의 (A) 내지 (C)는 폴더블 휴대 정보 단말(9310)을 도시한 것이다. 도 15의 (A)는 펼친 휴대 정보 단말(9310)을 도시한 것이다. 도 15의 (B)는 펼치거나 접히고 있는 휴대 정보 단말(9310)을 도시한 것이다. 도 15의 (C)는 접은 휴대 정보 단말(9310)을 도시한 것이다. 휴대 정보 단말(9310)은 접으면 가반성(可搬性)이 높다. 휴대 정보 단말(9310)을 펼쳤을 때는 이음매가 없고 큰 표시 영역에 의하여 일람성(一覽性)이 높다.
표시 패널(9311)은 힌지(9313)로 서로 연결된 3개의 하우징(9315)에 의하여 지지되어 있다. 또한 표시 패널(9311)은 터치 센서(입력 장치)를 포함하는 터치 패널(입출력 장치)이어도 좋다. 2개의 하우징(9315) 사이의 힌지(9313)에서 표시 패널(9311)을 접음으로써, 휴대 정보 단말(9310)을 펼친 상태로부터 접은 상태로 가역적으로 변형할 수 있다. 표시 패널(9311)에는 본 발명의 일 형태의 발광 장치를 사용할 수 있다. 표시 패널(9311)의 표시 영역(9312)은, 접은 휴대 정보 단말(9310)의 측면에 위치한다. 표시 영역(9312)에는 정보 아이콘 및 사용 빈도가 높은 애플리케이션 또는 프로그램의 바로가기 등을 표시할 수 있어, 정보를 쉽게 확인할 수 있고 애플리케이션을 원활하게 기동할 수 있다.
본 발명의 일 형태의 유기 화합물을 유기 박막 태양 전지 등의 전자 기기에 사용할 수 있다. 구체적으로는, 상기 유기 화합물은 캐리어 수송성을 가지므로, 캐리어 수송층 또는 캐리어 주입층에 사용할 수 있다. 또한 상기 유기 화합물과 억셉터성 물질의 혼합층을 전하 발생층으로서 사용할 수 있다. 상기 유기 화합물은 광 여기될 수 있어, 전력 발생층에 사용할 수 있다.
(실시예 1)
(합성예 1)
본 실시예에서는 실시형태 1에서 구조식(300)으로 나타내어진 2,11-비스(다이페닐아미노)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 2,11DPhA2Nbf(II))의 합성예에 대하여 자세히 설명한다. 2,11DPhA2Nbf(II)의 구조식을 이하에 나타낸다.
[화학식 80]
<단계 1: 3,6-비스(5-클로로-2-플루오로페닐)-2,7-다이메톡시나프탈렌의 합성>
200mL 3구 플라스크에 3.8g(11mmol)의 3,6-다이브로모-2,7-다이메톡시나프탈렌, 4.2g(24mmol)의 5-클로로-2-플루오로페닐보론산, 6.7g(48mmol)의 탄산 포타슘, 및 0.34g(1.1mmol)의 트리스(2-메틸페닐)포스핀을 넣었다. 이 혼합물에 60mL의 톨루엔을 첨가하였다. 얻어진 혼합물을 감압하면서 교반함으로써 탈기하였다. 이 혼합물에 49mg(0.22mmol)의 아세트산 팔라듐(II)을 첨가하고, 질소 기류하에 있어서 80℃에서 14시간 동안 교반을 수행하였다. 그 후, 얻어진 혼합물에 1.9g(11mmol)의 5-클로로-2-플루오로페닐보론산 및 3.0g(22mmol)의 탄산 포타슘을 첨가하고, 질소 기류하에 있어서 120℃에서 8시간 동안 교반을 수행하였다. 교반 후 이 혼합물에 톨루엔을 첨가하고, 얻어진 혼합물을, 플로리실(Wako Pure Chemical Industries, Ltd. 제조, 카탈로그 번호 540-00135), 셀라이트(Wako Pure Chemical Industries, Ltd. 제조, 카탈로그 번호 531-16855), 및 알루미나를 통하여 흡인 여과하여 여과액을 얻었다. 이 여과액을 농축하여 유상 물질을 얻었다.
얻어진 유상 물질을 실리카 겔 칼럼 크로마토그래피(전개 용매로서 톨루엔과 헥세인을 1:2의 비율로 사용함)에 의하여 정제하여, 목적 물질 3.9g을 수율 79%로 얻었다. 단계 1의 합성 스킴을 이하에 나타낸다.
[화학식 81]
얻어진 고체의 1H NMR 차트를 도 16의 (A) 및 (B)에 나타내었고, 수치 데이터를 이하에 나타낸다. 이들은 본 합성예에 있어서 3,6-비스(5-클로로-2-플루오로페닐)-2,7-다이메톡시나프탈렌이 얻어진 것을 나타낸다.
1H NMR(CDCl3, 300MHz): δ=3.93(s, 6H), 7.06(t, J1=9.0Hz, 2H), 7.19(s, 2H), 7.28-7.34(m, 2H), 7.40(dd, J1=2.4Hz, J2=5.7Hz, 2H), 7.65(s, 2H).
<단계 2: 3,6-비스(5-클로로-2-플루오로페닐)-2,7-다이하이드록시나프탈렌의 합성>
200mL 3구 플라스크에 5.0g(11mmol)의 3,6-비스(5-클로로-2-플루오로페닐)-2,7-다이메톡시나프탈렌을 넣었다. 질소 기류하, 이 플라스크에 30mL의 다이클로로메테인을 추가적으로 넣었다. 이 용액에 25mL의 3브로민화 붕소(약 1.0mol/L 다이클로로메테인 용액) 및 20mL의 다이클로로메테인을 적하하였다. 적하 후 얻어진 용액을 실온에서 교반하였다. 그 후, 얼음으로 냉각하면서 이 용액에 약 20mL의 물을 첨가하고, 이 용액을 교반하였다. 그리고 이 혼합물의 수성층에 대하여 다이클로로메테인으로 추출을 실시하고, 추출된 용액과 유기층을 합쳐 물 및 탄산수소소듐 포화수용액으로 세정하였다. 얻어진 유기층에 황산 마그네슘을 첨가하여 수분을 흡착시키고, 얻어진 혼합물에 대하여 중력 여과를 실시하였다. 얻어진 여과액을 농축하여 백색 고체 4.8g을 얻었다. 단계 2의 합성 스킴을 이하에 나타낸다.
[화학식 82]
얻어진 고체의 1H NMR 차트를 도 17의 (A) 및 (B)에 나타내었고, 수치 데이터를 이하에 나타낸다. 이들은 본 합성예에 있어서 3,6-비스(5-클로로-2-플루오로페닐)-2,7-다이하이드록시나프탈렌이 얻어진 것을 나타낸다.
1H NMR(CDCl3, 300MHz): δ=5.11(s, 2H), 7.16(t, J1=9.0Hz, 2H), 7.18(s, 2H), 7.35-7.40(m, 2H), 7.45(dd, J1=2.4Hz, J2=6.3Hz, 2H), 7.68(s, 2H).
<단계 3: 2,11-다이클로로나프토[2,3-b;7,6-b']비스벤조퓨란의 합성>
200mL 3구 플라스크에 4.8g(12mmol)의 3,6-비스(5-클로로-2-플루오로페닐)-2,7-다이하이드록시나프탈렌 및 6.3g(46mmol)의 탄산 포타슘을 넣었다. 이 혼합물에 115mL의 N-메틸-2-피롤리돈을 첨가하였다. 얻어진 혼합물을 감압하면서 교반함으로써 탈기하였다. 그리고 이 혼합물을 질소 기류하 120℃에서 6.5시간 동안 교반하였다. 그 후 이 혼합물에 물을 첨가하고, 석출한 고체를 여과에 의하여 회수하였다. 얻어진 고체를 물 및 에탄올로 세정하였다. 얻어진 고체에 에탄올을 첨가하고, 가열 교반을 수행한 후, 얻어진 혼합물을 여과하여 고체를 얻었다. 얻어진 고체에 톨루엔을 첨가하고, 가열 교반을 수행한 후, 얻어진 혼합물을 여과하여 백색 내지 밝은 갈색 고체 3.4g을 수율 79%로 얻었다. 단계 3의 합성 스킴을 이하에 나타낸다.
[화학식 83]
얻어진 고체의 1H NMR 차트를 도 18의 (A) 및 (B)에 나타내었고, 수치 데이터를 이하에 나타낸다. 이들은 본 합성예에 있어서 2,11-다이클로로나프토[2,3-b;7,6-b']비스벤조퓨란이 얻어진 것을 나타낸다.
1H NMR(1,1,2,2-Tetrachloroethane-D2, 300MHz): δ=7.53-7.54(m, 4H), 8.06(s, 2H), 8.10(dd, J1=0.9Hz, J1=2.1Hz, 2H), 8.58(s, 2H).
<단계 4: 2,11-비스(다이페닐아미노)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 2,11DPhA2Nbf(II))의 합성>
200mL 3구 플라스크에 1.5g(3.9mmol)의 2,11-다이클로로나프토[2,3-b;7,6-b']비스벤조퓨란, 2.0g(12mmol)의 다이페닐아민, 0.14g(0.39mmol)의 다이(1-아다만틸)-n-뷰틸포스핀, 및 2.2g(23mmol)의 소듐 tert-뷰톡사이드를 넣었다. 이 혼합물에 40mL의 자일렌을 첨가하였다. 얻어진 혼합물을 감압하면서 교반함으로써 탈기하였다. 이 혼합물에 45mg(77μmol)의 비스(다이벤질리덴아세톤)팔라듐(0)을 첨가하고, 질소 기류하에 있어서 150℃에서 14시간 동안 교반을 수행하였다. 교반 후 이 혼합물에 톨루엔을 첨가하고, 얻어진 혼합물을, 플로리실, 셀라이트, 및 알루미나를 통하여 흡인 여과하여 여과액을 얻었다. 얻어진 여과액을 농축하여 고체를 얻었다.
이 고체를 실리카 겔 칼럼 크로마토그래피(전개 용매로서 먼저 톨루엔과 헥세인을 1:3의 비율로 사용하고, 그 다음에 톨루엔과 헥세인을 1:2의 비율로 사용함)에 의하여 정제하여, 고체를 얻었다.
얻어진 고체를 톨루엔과 에탄올의 혼합 용매를 사용하여 재결정화하여 연한 황색 고체 1.7g을 수율 68%로 얻었다. 단계 4의 합성 스킴을 이하에 나타낸다.
[화학식 84]
얻어진 고체의 1H NMR 차트를 도 19의 (A) 및 (B)에 나타내었고, 수치 데이터를 이하에 나타낸다. 이들은 본 합성예에 있어서 본 발명의 일 형태의 유기 화합물인 2,11DPhA2Nbf(II)가 얻어진 것을 나타낸다.
1H NMR(DMSO-d6, 300MHz): δ=6.99-7.06(m, 12H), 7.27-7.33(m, 10H), 7.70(d, J1=8.4Hz, 2H), 8.05(d, J1=2.4Hz, 2H), 8.27(s, 2H), 8.77(s, 2H).
다음으로, 얻어진 고체 1.6g을 3.9Pa의 압력하, 아르곤 유량 15mL/min으로 295℃에서 트레인 서블리메이션법에 의하여 정제하였다. 승화 정제 후, 연한 황색 고체 1.3g을 회수율 78%로 얻었다.
다음으로, 도 20은 톨루엔 용액에서의 2,11DPhA2Nbf(II)의 흡수 및 발광 스펙트럼의 측정 결과를 나타낸 것이다. 도 21은 2,11DPhA2Nbf(II)의 박막의 흡수 및 발광 스펙트럼을 나타낸 것이다. 진공 증착법에 의하여 석영 기판 위에 고체 박막을 형성하였다. 톨루엔 용액의 흡수 스펙트럼은 자외 가시광 분광 광도계(V550, JASCO Corporation 제조)를 사용하여 측정하였고, 도 20은 톨루엔 용액에서의 2,11DPhA2Nbf(II)의 스펙트럼에서 톨루엔의 스펙트럼을 뺌으로써 얻어진 스펙트럼을 나타낸 것이다. 박막의 흡수 스펙트럼은 분광 광도계(U-4100 분광 광도계, Hitachi High-Technologies Corporation 제조)를 사용하여 측정하였다. 발광 스펙트럼은 형광 분광 광도계(FS920, Hamamatsu Photonics K.K. 제조)를 사용하여 측정하였다. 양자 수율은 절대 PL 양자 수율 측정 시스템(Quantaurus-QY, Hamamatsu Photonics K.K. 제조)을 사용하여 측정하였다.
도 20에 나타낸 바와 같이, 톨루엔 용액에서의 2,11DPhA2Nbf(II)는 389nm, 367nm, 326nm, 313nm, 및 282nm 부근에 흡수 피크를 가지고, 445nm(여기 파장: 368nm)에 발광 파장 피크를 가진다. 도 21에 나타낸 바와 같이, 2,11DPhA2Nbf(II)의 박막은 390nm, 373nm, 333nm, 313nm, 272nm, 및 237nm 부근에 흡수 피크를 가지고, 468nm 부근(여기 파장: 400nm)에 발광 파장 피크를 가진다. 이들 결과는, 2,11DPhA2Nbf(II)가 청색광을 방출하고, 발광 물질 또는 가시 영역에서 형광을 방출하는 물질의 호스트로서 사용될 수 있는 것을 나타낸다.
측정된 톨루엔 용액에서의 2,11DPhA2Nbf(II)의 양자 수율은 29%이었고, 이는 비교적 높다. 이는 2,11DPhA2Nbf(II)가 발광 재료에 적합한 것을 시사한다.
상술한 결과로부터 나프토[2,3-b;7,6-b']비스벤조퓨란 골격 또는 나프토[2,3-b;7,6-b']비스벤조싸이오펜 골격의 2위치 및 9위치에 다이아릴아민이 결합된 본 발명의 일 형태의 화합물의 발광 스펙트럼은 비교적 넓은 것을 알았다. 그러므로 이 화합물은 조명용 발광 재료에 적합하다.
다음으로 본 실시예에서 얻어진 2,11DPhA2Nbf(II)를 액체 크로마토그래피 질량 분석(LC-MS)에 의하여 분석하였다.
LC-MS에 의한 분석에서는, Thermo Fisher Scientific K.K. 제조의 UltiMate 3000으로 액체 크로마토그래피(LC) 분리를 실시하고, Thermo Fisher Scientific K.K. 제조의 Q Exactive로 MS 분석을 실시하였다.
LC 분리에서는, 40℃의 칼럼 온도에서 임의의 칼럼을 사용하고, 적절한 용매를 선택하고, 임의의 농도에서 유기 용매에 2,11DPhA2Nbf(II)를 용해시켜 시료를 준비하고, 주입량을 5.0μL로 하는 식으로 송액(solution sending)을 수행하였다.
Targeted-MS2법에 의하여 2,11DPhA2Nbf(II) 유래의 이온인 m/z=642.23의 성분에 대하여 MS2분석을 실시하였다. Targeted-MS2의 설정으로서 타깃 이온의 질량 범위를 m/z=642.23±2.0(isolation window=4)으로 하고, 검출은 포지티브 모드에서 수행하였다. 이 분석은 충돌 셀 내의 타깃 이온을 가속시키는 에너지(normalized collision energy: NCE)를 60으로 하여 수행하였다. 얻어진 MS 스펙트럼을 도 22에 나타내었다.
도 22는 2,11DPhA2Nbf(II)의 프로덕트 이온이 주로 m/z=566, 473, 및 397 부근에 검출되는 것을 나타낸다. 또한 도 22의 결과는 2,11DPhA2Nbf(II)에서 유래하는 특징을 나타낸 것이기 때문에, 혼합물 중에 포함되는 2,11DPhA2Nbf(II)를 동정하는 데 중요한 데이터인 것으로 간주할 수 있다.
m/z=566 부근의 프로덕트 이온은 2,11DPhA2Nbf(II)에서 페닐기가 제거된 상태의 양이온인 것으로 추정될 수 있다. 이는 2,11DPhA2Nbf(II)가 페닐기를 포함하는 것을 시사한다. 또한 m/z=473 부근의 프로덕트 이온은 2,11DPhA2Nbf(II)에서 다이페닐아미노기가 제거된 상태의 양이온인 것으로 추정될 수 있다. 이는 2,11DPhA2Nbf(II)가 다이페닐아미노기를 포함하는 것을 시사한다.
(실시예 2)
(합성예 2)
본 실시예에서는 실시형태 1에서 구조식(100)으로 나타내어진 3,10-비스(다이페닐아미노)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 3,10DPhA2Nbf(II))의 합성예에 대하여 자세히 설명한다. 3,10DPhA2Nbf(II)의 구조식을 이하에 나타낸다.
[화학식 85]
<단계 1: 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이메톡시나프탈렌의 합성>
200mL 3구 플라스크에 3.0g(8.7mmol)의 3,6-다이브로모-2,7-다이메톡시나프탈렌, 3.3g(19mmol)의 4-클로로-2-플루오로페닐보론산, 5.8g(42mmol)의 탄산 포타슘, 및 0.13g(0.43mmol)의 트리스(2-메틸페닐)포스핀을 넣었다. 이 혼합물에 85mL의 톨루엔을 첨가하였다. 얻어진 혼합물을 감압하면서 교반함으로써 탈기하였다. 이 혼합물에 19mg(87μmol)의 아세트산 팔라듐(II)을 첨가하고, 질소 기류하에 있어서 교반을 60℃에서 14시간 동안, 그 다음에 120℃에서 11.5시간 동안 수행하였다. 이 교반 도중에, 얻어진 혼합물에 3.0g(17mmol)의 4-클로로-2-플루오로페닐보론산 및 4.8g(35mmol)의 탄산 포타슘을 첨가하였다.
교반 후 이 혼합물에 톨루엔을 첨가하고, 얻어진 혼합물을, 플로리실(Wako Pure Chemical Industries, Ltd. 제조, 카탈로그 번호 540-00135), 셀라이트(Wako Pure Chemical Industries, Ltd. 제조, 카탈로그 번호 531-16855), 및 알루미나를 통하여 흡인 여과하여 여과액을 얻었다. 이 여과액을 농축하여 유상 물질을 얻었다. 얻어진 유상 물질을 실리카 겔 칼럼 크로마토그래피(전개 용매로서 톨루엔과 헥세인을 1:2의 비율로 사용함)에 의하여 정제하였다. 얻어진 고체를 고성능 액체 칼럼 크로마토그래피에 의하여 정제하였다. 고성능 액체 칼럼 크로마토그래피는 클로로폼을 전개 용매로서 사용하여 수행하였다. 얻어진 프랙션을 농축하여 목적 물질인 백색 고체 5.8g을 수율 76%로 얻었다. 단계 1의 합성 스킴을 이하에 나타낸다.
[화학식 86]
얻어진 고체의 1H NMR 차트를 도 23의 (A) 및 (B)에 나타내었고, 수치 데이터를 이하에 나타낸다. 이들은 본 합성예에 있어서 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이메톡시나프탈렌이 얻어진 것을 나타낸다.
1H NMR(CDCl3, 300MHz): δ=3.92(s, 6H), 7.16-7.22(m, 6H), 7.35(t, J1=7.8Hz, 2H), 7.63(s, 2H).
<단계 2: 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이하이드록시나프탈렌의 합성>
200mL 3구 플라스크에 5.8g(13mmol)의 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이메톡시나프탈렌을 넣었다. 플라스크 내의 공기를 질소로 치환하였다. 이 플라스크에 33mL의 다이클로로메테인을 추가적으로 넣었다. 이 용액에 29mL의 3브로민화 붕소(약 1.0mol/L 다이클로로메테인 용액) 및 40mL의 다이클로로메테인을 적하하였다. 적하 후 얻어진 용액을 실온에서 교반하였다. 그 후, 얼음으로 냉각하면서 이 용액에 약 20mL의 물을 첨가하고, 이 용액을 교반하였다. 그리고 이 혼합물의 수성층에 대하여 다이클로로메테인으로 추출을 실시하고, 추출된 용액과 유기층을 합쳐 물 및 탄산수소소듐 포화수용액으로 세정하였다. 그 후 얻어진 유기층에 황산 마그네슘을 첨가하여 수분을 흡착시키고, 얻어진 혼합물에 대하여 중력 여과를 실시하였다. 얻어진 여과액을 농축하여 백색 고체 5.7g을 얻었다. 단계 2의 합성 스킴을 이하에 나타낸다.
[화학식 87]
얻어진 고체의 1H NMR 차트를 도 24의 (A) 및 (B)에 나타내었고, 수치 데이터를 이하에 나타낸다. 이들은 본 합성예에 있어서 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이하이드록시나프탈렌이 얻어진 것을 나타낸다.
1H NMR(DMSO-d6, 300MHz): δ=7.04(s, 2H), 7.34(dd, J1=8.4Hz, J2=2.1Hz, 2H), 7.42-7.49(m, 4H), 7.65(s, 2H), 9.95(s, 2H).
<단계 3: 3,10-다이클로로나프토[2,3-b;7,6-b']비스벤조퓨란의 합성>
200mL 3구 플라스크에 2.5g(5.7mmol)의 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이하이드록시나프탈렌 및 7.6g(55mmol)의 탄산 포타슘을 넣었다. 이 혼합물에 137mL의 N-메틸-2-피롤리돈을 첨가하였다. 얻어진 혼합물을 감압하면서 교반함으로써 탈기하였다. 그 후, 이 혼합물을 질소 기류하 120℃에서 6시간 동안 교반하였다. 그 후 이 혼합물에 물을 첨가하고, 석출한 고체를 여과에 의하여 회수하였다. 얻어진 고체를 물 및 에탄올로 세정하였다. 얻어진 고체에 에탄올을 첨가하고, 가열 교반을 수행한 후, 얻어진 혼합물을 여과하여 고체를 얻었다. 얻어진 고체를 톨루엔을 사용하여 재결정화하여 백색 고체 4.4g을 수율 86%로 얻었다. 단계 3의 합성 스킴을 이하에 나타낸다.
[화학식 88]
얻어진 고체의 1H NMR 차트를 도 25의 (A) 및 (B)에 나타내었고, 수치 데이터를 이하에 나타낸다. 이들은 본 합성예에 있어서 3,10-다이클로로 나프토[2,3-b;7,6-b']비스벤조퓨란이 얻어진 것을 나타낸다.
1H NMR(1,1,2,2-Tetrachloroethane-D2, 300MHz): δ=7.44(d, J1=7.8Hz, 2H), 7.65(s, 2H), 8.04(d, J1=8.4Hz, 2H), 8.07(s, 2H), 8.59(s, 2H).
<단계 4: 3,10-비스(다이페닐아미노)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 3,10DPhA2Nbf(II))의 합성>
200mL 3구 플라스크에 1.5g(3.9mmol)의 3,10-다이클로로나프토[2,3-b;7,6-b']비스벤조퓨란, 2.0g(12mmol)의 다이페닐아민, 0.14g(0.39mmol)의 다이(1-아다만틸)-n-뷰틸포스핀, 및 2.2g(23mmol)의 소듐 tert-뷰톡사이드를 넣었다. 이 혼합물에 40mL의 자일렌을 첨가하였다. 얻어진 혼합물을 감압하면서 교반함으로써 탈기하였다. 이 혼합물에 45mg(78μmol)의 비스(다이벤질리덴아세톤)팔라듐(0)을 첨가하고, 질소 기류하에 있어서 150℃에서 14시간 동안 교반을 수행하였다. 교반 후 이 혼합물에 톨루엔을 첨가하고, 얻어진 혼합물을, 플로리실(Wako Pure Chemical Industries, Ltd. 제조, 카탈로그 번호 540-00135), 셀라이트(Wako Pure Chemical Industries, Ltd. 제조, 카탈로그 번호 531-16855), 및 알루미나를 통하여 흡인 여과하여 여과액을 얻었다. 얻어진 여과액을 농축하여 고체를 얻었다. 이 고체를 실리카 겔 칼럼 크로마토그래피(전개 용매로서 톨루엔:헥세인=1:3의 혼합 용매를 사용함)에 의하여 정제하여 고체를 얻었다. 얻어진 고체를 톨루엔과 에탄올의 혼합 용매를 사용하여 재결정화하여 연한 황색 고체 2.0g을 수율 81%로 얻었다. 단계 4의 합성 스킴을 이하에 나타낸다.
[화학식 89]
얻어진 고체의 1H NMR 차트를 도 26의 (A) 및 (B)에 나타내었고, 수치 데이터를 이하에 나타낸다. 이들은 본 합성예에 있어서 본 발명의 일 형태의 유기 화합물인 3,10DPhA2Nbf(II)가 얻어진 것을 나타낸다.
1H NMR(CDCl3, 300MHz): δ=7.05-7.11(m, 6H), 7.17-7.20(m, 8H), 7.22(d, J1=2.1Hz, 2H), 7.27-7.33(m, 8H), 7.87(d, J1=8.4Hz, 2H), 7.90(s, 2H), 8.40(s, 2H).
다음으로, 얻어진 고체 2.0g을 4.1Pa의 압력하, 아르곤 유량 15mL/min으로 300℃에서 트레인 서블리메이션법에 의하여 정제하였다. 승화 정제 후, 황색 고체 1.7g을 회수율 86%로 얻었다.
다음으로, 도 27은 톨루엔 용액에서의 3,10DPhA2Nbf(II)의 흡수 및 발광 스펙트럼의 측정 결과를 나타낸 것이다. 도 28은 3,10DPhA2Nbf(II)의 박막의 흡수 및 발광 스펙트럼을 나타낸 것이다. 진공 증착법에 의하여 석영 기판 위에 고체 박막을 형성하였다. 톨루엔 용액의 흡수 스펙트럼은 자외 가시광 분광 광도계(V550, JASCO Corporation 제조)를 사용하여 측정하였고, 도 27은 톨루엔 용액에서의 3,10DPhA2Nbf(II)의 스펙트럼에서 톨루엔의 스펙트럼을 뺌으로써 얻어진 스펙트럼을 나타낸 것이다. 박막의 흡수 스펙트럼은 분광 광도계(U-4100 분광 광도계, Hitachi High-Technologies Corporation 제조)를 사용하여 측정하였다. 발광 스펙트럼은 형광 분광 광도계(FS920, Hamamatsu Photonics K.K. 제조)를 사용하여 측정하였다. 양자 수율은 절대 PL 양자 수율 측정 시스템(Quantaurus-QY, Hamamatsu Photonics K.K. 제조)을 사용하여 측정하였다.
도 27에 나타낸 바와 같이, 톨루엔 용액에서의 3,10DPhA2Nbf(II)는 403nm, 383nm, 357nm, 322nm, 및 296nm 부근에 흡수 피크를 가지고, 419nm 및 442nm(여기 파장: 383nm)에 발광 파장 피크를 가진다. 도 28에 나타낸 바와 같이, 3,10DPhA2Nbf(II)의 박막은 411nm, 389nm, 359nm, 325nm, 298nm, 261nm, 및 225nm 부근에 흡수 피크를 가지고, 430nm 및 447nm 부근(여기 파장: 400nm)에 발광 파장 피크를 가진다. 이들 결과는, 3,10DPhA2Nbf(II)가 청색광을 방출하고, 발광 물질 또는 가시 영역에서 형광을 방출하는 물질의 호스트로서 사용될 수 있는 것을 나타낸다.
측정된 톨루엔 용액에서의 3,10DPhA2Nbf(II)의 양자 수율은 87%에 달하였고, 이는 3,10DPhA2Nbf(II)가 발광 재료에 적합한 것을 나타낸다.
상술한 결과로부터 나프토[2,3-b;7,6-b']비스벤조퓨란 골격의 3위치 및 10위치에 다이아릴아민이 결합된 본 발명의 일 형태의 화합물의 양자 수율은 매우 높은 것을 알았다. 또한 이 화합물은 예리한 발광 스펙트럼을 나타내고, 이는 색 순도가 높다는 것을 뜻한다. 그러므로 이 화합물은 디스플레이용 발광 재료에 적합하다.
다음으로 본 실시예에서 얻어진 3,10DPhA2Nbf(II)를 액체 크로마토그래피 질량 분석(LC-MS)에 의하여 분석하였다.
LC-MS에 의한 분석에서는, Thermo Fisher Scientific K.K. 제조의 UltiMate 3000으로 액체 크로마토그래피(LC) 분리를 실시하고, Thermo Fisher Scientific K.K. 제조의 Q Exactive로 MS 분석을 실시하였다.
LC 분리에서는, 40℃의 칼럼 온도에서 임의의 칼럼을 사용하고, 적절한 용매를 선택하고, 임의의 농도에서 유기 용매에 3,10DPhA2Nbf(II)를 용해시켜 시료를 준비하고, 주입량을 5.0μL로 하는 식으로 송액을 수행하였다.
Targeted-MS2법에 의하여 3,10DPhA2Nbf(II) 유래의 이온인 m/z=642.23의 성분에 대하여 MS2분석을 실시하였다. Targeted-MS2의 설정으로서 타깃 이온의 질량 범위를 m/z=642.23±2.0(isolation window=4)으로 하고, 검출은 포지티브 모드에서 수행하였다. 이 분석은 충돌 셀 내의 타깃 이온을 가속시키는 에너지(normalized collision energy: NCE)를 60으로 하여 수행하였다. 얻어진 MS 스펙트럼을 도 29에 나타내었다.
도 29는 3,10DPhA2Nbf(II)의 프로덕트 이온이 주로 m/z=566, 473, 및 397 부근에 검출되는 것을 나타낸다. 또한 도 29의 결과는 3,10DPhA2Nbf(II)에서 유래하는 특징을 나타낸 것이기 때문에, 혼합물 중에 포함되는 3,10DPhA2Nbf(II)를 동정하는 데 중요한 데이터인 것으로 간주할 수 있다.
m/z=566 부근의 프로덕트 이온은 3,10DPhA2Nbf(II)에서 페닐기가 제거된 상태의 양이온인 것으로 추정될 수 있다. 이는 3,10DPhA2Nbf(II)가 페닐기를 포함하는 것을 시사한다. 또한 m/z=473 부근의 프로덕트 이온은 3,10DPhA2Nbf(II)에서 다이페닐아미노기가 제거된 상태의 양이온인 것으로 추정될 수 있다. 이는 3,10DPhA2Nbf(II)가 다이페닐아미노기를 포함하는 것을 시사한다.
(실시예 3)
(합성예 3)
본 실시예에서는 실시형태 1에서 구조식(109)으로 나타내어진 본 발명의 일 형태의 유기 화합물인 3,10-비스[N-(4-바이페닐)-N-(9,9-다이메틸-9H-플루오렌-2-일)아미노]나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 3,10FBi2Nbf(II))의 합성예에 대하여 설명한다. 3,10FBi2Nbf(II)의 구조식을 이하에 나타낸다.
[화학식 90]
<단계 1: 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이메톡시나프탈렌의 합성>
합성예 2의 단계 1과 마찬가지로, 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이메톡시나프탈렌을 합성하였다.
<단계 2: 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이하이드록시나프탈렌의 합성>
합성예 2의 단계 2와 마찬가지로, 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이하이드록시나프탈렌을 합성하였다.
<단계 3: 3,10-다이클로로나프토[2,3-b;7,6-b']비스벤조퓨란의 합성>
합성예 2의 단계 3과 마찬가지로, 3,10-다이클로로나프토[2,3-b;7,6-b']비스벤조퓨란을 합성하였다.
<단계 4: 3,10-비스[N-(4-바이페닐)-N-(9,9-다이메틸-9H-플루오렌-2-일)아미노]나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 3,10FBi2Nbf(II))의 합성>
200mL 3구 플라스크에 0.73g(2.0mmol)의 3,10-다이클로로나프토[2,3-b;7,6-b']비스벤조퓨란, 2.1g(5.9mmol)의 N-(4-바이페닐)-(9,9-다이메틸플루오렌-2-일)아민, 70mg(0.20mmol)의 다이(1-아다만틸)-n-뷰틸포스핀, 및 1.1g(12mmol)의 소듐 tert-뷰톡사이드를 넣었다. 이 혼합물에 20mL의 자일렌을 첨가하였다. 얻어진 혼합물을 감압하면서 교반함으로써 탈기하였다. 이 혼합물에 22mg(39μmol)의 비스(다이벤질리덴아세톤)팔라듐(0)을 첨가하고, 질소 기류하에 있어서 150℃에서 15시간 동안 교반을 수행하였다. 교반 후 이 혼합물에 톨루엔을 첨가하고, 얻어진 혼합물을, 플로리실, 셀라이트, 및 알루미나를 통하여 흡인 여과하여 여과액을 얻었다. 얻어진 여과액을 농축하여 고체를 얻었다. 이 고체를 실리카 겔 칼럼 크로마토그래피(전개 용매로서 먼저 톨루엔과 헥세인을 1:3의 비율로 사용하고, 그 다음에 톨루엔과 헥세인을 1:1의 비율로 사용함)에 의하여 정제하여, 고체를 얻었다. 얻어진 고체를 톨루엔과 에탄올의 혼합 용매를 사용하여 재결정화하여 연한 황색 고체 1.7g을 수율 86%로 얻었다. 단계 4의 합성 스킴을 이하에 나타낸다.
[화학식 91]
얻어진 고체의 1H NMR 차트를 도 30의 (A) 및 (B)에 나타내었고, 수치 데이터를 이하에 나타낸다. 이들은 본 합성예에 있어서 본 발명의 일 형태의 유기 화합물인 3,10FBi2Nbf(II)가 얻어진 것을 나타낸다.
1H NMR(DMSO-d6, 300MHz): δ=1.41(s, 12H), 7.11-7.16(m, 4H), 7.23-7.37(m, 12H), 7.43-7.49(m, 6H), 7.54(d, J1=7.8Hz, 2H), 7.68-7.70(m, 8H), 7.79(d, J1=6.9Hz, 2H), 7.83(d, J1=7.8Hz, 2H), 8.16-8.19(m, 4H), 8.71(s, 2H).
다음으로, 도 31은 톨루엔 용액에서의 3,10FBi2Nbf(II)의 흡수 및 발광 스펙트럼의 측정 결과를 나타낸 것이다. 도 32는 3,10FBi2Nbf(II)의 박막의 흡수 및 발광 스펙트럼을 나타낸 것이다. 진공 증착법에 의하여 석영 기판 위에 고체 박막을 형성하였다. 톨루엔 용액의 흡수 스펙트럼은 자외 가시광 분광 광도계(V550, JASCO Corporation 제조)를 사용하여 측정하였고, 도 31은 톨루엔 용액에서의 3,10FBi2Nbf(II)의 스펙트럼에서 톨루엔의 스펙트럼을 뺌으로써 얻어진 스펙트럼을 나타낸 것이다. 박막의 흡수 스펙트럼은 분광 광도계(U-4100 분광 광도계, Hitachi High-Technologies Corporation 제조)를 사용하여 측정하였다. 발광 스펙트럼은 형광 분광 광도계(FS920, Hamamatsu Photonics K.K. 제조)를 사용하여 측정하였다. 양자 수율은 절대 PL 양자 수율 측정 시스템(Quantaurus-QY, Hamamatsu Photonics K.K. 제조)을 사용하여 측정하였다.
도 31에 나타낸 바와 같이, 톨루엔 용액에서의 3,10FBi2Nbf(II)는 417nm, 395nm, 360nm, 307nm, 및 282nm 부근에 흡수 피크를 가지고, 436nm(여기 파장: 400nm)에 발광 파장 피크를 가진다. 도 32에 나타낸 바와 같이, 3,10FBi2Nbf(II)의 박막은 420nm, 398nm, 358nm, 348nm, 308nm, 263nm, 248nm, 및 207nm 부근에 흡수 피크를 가지고, 458nm 및 505nm 부근(여기 파장: 390nm)에 발광 파장 피크를 가진다. 이들 결과는, 3,10FBi2Nbf(II)가 청색광을 방출하고, 발광 물질 또는 가시 영역에서 형광을 방출하는 물질의 호스트로서 사용될 수 있는 것을 나타낸다.
측정된 톨루엔 용액에서의 3,10FBi2Nbf(II)의 양자 수율은 76%에 달하였다. 이는 3,10FBi2Nbf(II)가 발광 재료에 적합한 것을 시사한다.
다음으로 본 실시예에서 얻어진 3,10FBi2Nbf(II)를 액체 크로마토그래피 질량 분석(LC-MS)에 의하여 분석하였다.
LC-MS에 의한 분석에서는, Thermo Fisher Scientific K.K. 제조의 UltiMate 3000으로 액체 크로마토그래피(LC) 분리를 실시하고, Thermo Fisher Scientific K.K. 제조의 Q Exactive로 MS 분석을 실시하였다.
LC 분리에서는, 40℃의 칼럼 온도에서 임의의 칼럼을 사용하고, 적절한 용매를 선택하고, 임의의 농도에서 유기 용매에 3,10FBi2Nbf(II)를 용해시켜 시료를 준비하고, 주입량을 5.0μL로 하는 식으로 송액을 수행하였다.
Targeted-MS2법에 의하여 3,10FBi2Nbf(II) 유래의 이온인 m/z=1026.42의 성분에 대하여 MS2분석을 실시하였다. Targeted-MS2의 설정으로서 타깃 이온의 질량 범위를 m/z=1026.42±2.0(isolation window=4)으로 하고, 검출은 포지티브 모드에서 수행하였다. 이 분석은 충돌 셀 내의 타깃 이온을 가속시키는 에너지(normalized collision energy: NCE)를 50으로 하여 수행하였다. 얻어진 MS 스펙트럼을 도 33에 나타내었다.
도 33은 3,10FBi2Nbf(II)의 프로덕트 이온이 주로 m/z=1011, 995, 817, 667, 652, 636, 360, 344, 및 330 부근에 검출되는 것을 나타낸다. 또한 도 33의 결과는 3,10FBi2Nbf(II)에서 유래하는 특징을 나타낸 것이기 때문에, 혼합물 중에 포함되는 3,10FBi2Nbf(II)를 동정하는 데 중요한 데이터인 것으로 간주할 수 있다.
m/z=1011 부근의 프로덕트 이온은 3,10FBi2Nbf(II)에서 메틸기가 제거된 상태의 양이온인 것으로 추정될 수 있다. 이는 3,10FBi2Nbf(II)가 메틸기를 포함하는 것을 시사한다. 또한 m/z=817 부근의 프로덕트 이온은 3,10FBi2Nbf(II)에서 메틸기 및 9,9-다이메틸플루오렌일기가 제거된 상태의 양이온인 것으로 추정될 수 있다. 이는 3,10FBi2Nbf(II)가 메틸기 및 9,9-다이메틸플루오렌일기를 포함하는 것을 시사한다. 또한 m/z=667 부근의 프로덕트 이온은 3,10FBi2Nbf(II)에서 N-(4-바이페닐)-(9,9-다이메틸플루오렌-2-일)아미노기가 제거된 상태의 양이온인 것으로 추정될 수 있다. 이는 3,10FBi2Nbf(II)가 N-(4-바이페닐)-(9,9-다이메틸플루오렌-2-일)아미노기를 포함하는 것을 시사한다.
(실시예 4)
(합성예 4)
본 실시예에서는 실시형태 1에서 구조식(102)으로 나타내어진 본 발명의 일 형태의 유기 화합물인 3,10-비스(3,3'-다이메틸다이페닐아미노)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 3,10mMeDPhA2Nbf(II))의 합성예에 대하여 설명한다. 3,10mMeDPhA2Nbf(II)의 구조식을 이하에 나타낸다.
[화학식 92]
<단계 1: 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이메톡시나프탈렌의 합성>
합성예 2의 단계 1과 마찬가지로, 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이메톡시나프탈렌을 합성하였다.
<단계 2: 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이하이드록시나프탈렌의 합성>
합성예 2의 단계 2와 마찬가지로, 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이하이드록시나프탈렌을 합성하였다.
<단계 3: 3,10-다이클로로나프토[2,3-b;7,6-b']비스벤조퓨란의 합성>
합성예 2의 단계 3과 마찬가지로, 3,10-다이클로로나프토[2,3-b;7,6-b']비스벤조퓨란을 합성하였다.
<단계 4: 3,10-비스(3,3'-다이메틸다이페닐아미노)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 3,10mMeDPhA2Nbf(II))의 합성>
200mL 3구 플라스크에 1.0g(2.7mmol)의 3,10-다이클로로나프토[2,3-b;7,6-b']비스벤조퓨란, 1.7g(8.6mmol)의 m,m'-다이톨릴아민, 0.10g(0.29mmol)의 다이(1-아다만틸)-n-뷰틸포스핀, 및 1.7g(17mmol)의 소듐 tert-뷰톡사이드를 넣었다. 이 혼합물에 30mL의 자일렌을 첨가하였다. 얻어진 혼합물을 감압하면서 교반함으로써 탈기하였다. 이 혼합물에 33mg(57μmol)의 비스(다이벤질리덴아세톤)팔라듐(0)을 첨가하고, 질소 기류하에 있어서 150℃에서 6.5시간 동안 교반을 수행하였다. 교반 후 이 혼합물에 톨루엔을 첨가하고, 얻어진 혼합물을, 플로리실, 셀라이트, 및 알루미나를 통하여 흡인 여과하여 여과액을 얻었다. 얻어진 여과액을 농축하여 고체를 얻었다. 이 고체를 실리카 겔 칼럼 크로마토그래피(전개 용매로서 톨루엔과 헥세인을 1:3의 비율로 사용함)에 의하여 정제하여 고체를 얻었다. 얻어진 고체를 톨루엔과 아세트산 에틸의 혼합 용매를 사용하여 재결정화하여 연한 황색 고체 1.3g을 수율 63%로 얻었다. 단계 4의 합성 스킴을 이하에 나타낸다.
[화학식 93]
다음으로, 얻어진 고체 1.3g을 7.0Х10-3Pa의 압력하, 아르곤 유량 0mL/min으로 300℃에서 트레인 서블리메이션법에 의하여 정제하였다. 승화 정제 후, 연한 황색 고체 1.0g을 회수율 82%로 얻었다.
얻어진 고체의 1H NMR 차트를 도 34의 (A) 및 (B)에 나타내었고, 수치 데이터를 이하에 나타낸다. 이들은 본 합성예에 있어서 본 발명의 일 형태의 유기 화합물인 3,10mMeDPhA2Nbf(II)가 얻어진 것을 나타낸다.
1H NMR(CDCl3, 300MHz): δ=2.23(s, 12H), 6.90(d, J1=7.5Hz, 4H), 6.96-6.99(m, 8H), 7.06(dd, J1=2.1Hz, J2=8.7Hz, 2H), 7.17-7.22(m, 6H), 7.85(d, J1=8.4Hz, 2H), 7.89(s, 2H), 8.39(s, 2H).
다음으로, 도 35는 톨루엔 용액에서의 3,10mMeDPhA2Nbf(II)의 흡수 및 발광 스펙트럼의 측정 결과를 나타낸 것이다. 도 36은 3,10mMeDPhA2Nbf(II)의 박막의 흡수 및 발광 스펙트럼을 나타낸 것이다. 진공 증착법에 의하여 석영 기판 위에 고체 박막을 형성하였다. 톨루엔 용액의 흡수 스펙트럼은 자외 가시광 분광 광도계(V550, JASCO Corporation 제조)를 사용하여 측정하였고, 도 35는 톨루엔 용액에서의 3,10mMeDPhA2Nbf(II)의 스펙트럼에서 톨루엔의 스펙트럼을 뺌으로써 얻어진 스펙트럼을 나타낸 것이다. 박막의 흡수 스펙트럼은 분광 광도계(U-4100 분광 광도계, Hitachi High-Technologies Corporation 제조)를 사용하여 측정하였다. 발광 스펙트럼은 형광 분광 광도계(FS920, Hamamatsu Photonics K.K. 제조)를 사용하여 측정하였다. 양자 수율은 절대 PL 양자 수율 측정 시스템(Quantaurus-QY, Hamamatsu Photonics K.K. 제조)을 사용하여 측정하였다.
도 35에 나타낸 바와 같이, 톨루엔 용액에서의 3,10mMeDPhA2Nbf(II)는 407nm, 386nm, 358nm, 319nm, 및 296nm 부근에 흡수 피크를 가지고, 420nm 및 445nm(여기 파장: 400nm)에 발광 파장 피크를 가진다. 도 36에 나타낸 바와 같이, 3,10mMeDPhA2Nbf(II)의 박막은 412nm, 392nm, 359nm, 323nm, 298nm, 262nm, 및 215nm 부근에 흡수 피크를 가지고, 445nm 부근(여기 파장: 400nm)에 발광 파장 피크를 가진다. 이들 결과는, 3,10mMeDPhA2Nbf(II)가 청색광을 방출하고, 발광 물질 또는 가시 영역에서 형광을 방출하는 물질의 호스트로서 사용될 수 있는 것을 나타낸다.
측정된 톨루엔 용액에서의 3,10mMeDPhA2Nbf(II)의 양자 수율은 87%에 달하였다. 이는 3,10mMeDPhA2Nbf(II)가 발광 재료에 적합한 것을 시사한다.
다음으로 본 실시예에서 얻어진 3,10mMeDPhA2Nbf(II)를 액체 크로마토그래피 질량 분석(LC-MS)에 의하여 분석하였다.
LC-MS에 의한 분석에서는, Thermo Fisher Scientific K.K. 제조의 UltiMate 3000으로 액체 크로마토그래피(LC) 분리를 실시하고, Thermo Fisher Scientific K.K. 제조의 Q Exactive로 MS 분석을 실시하였다.
LC 분리에서는, 40℃의 칼럼 온도에서 임의의 칼럼을 사용하고, 적절한 용매를 선택하고, 임의의 농도에서 유기 용매에 3,10mMeDPhA2Nbf(II)를 용해시켜 시료를 준비하고, 주입량을 5.0μL로 하는 식으로 송액을 수행하였다.
Targeted-MS2법에 의하여 3,10mMeDPhA2Nbf(II) 유래의 이온인 m/z=698.29의 성분에 대하여 MS2분석을 실시하였다. Targeted-MS2의 설정으로서 타깃 이온의 질량 범위를 m/z=698.29±2.0(isolation window=4)으로 하고, 검출은 포지티브 모드에서 수행하였다. 이 분석은 충돌 셀 내의 타깃 이온을 가속시키는 에너지(normalized collision energy: NCE)를 60으로 하여 수행하였다. 얻어진 MS 스펙트럼을 도 37에 나타내었다.
도 37은 3,10mMeDPhA2Nbf(II)의 프로덕트 이온이 주로 m/z=682, 501, 487, 411, 196, 및 181 부근에 검출되는 것을 나타낸다. 또한 도 37의 결과는 3,10mMeDPhA2Nbf(II)에서 유래하는 특징을 나타낸 것이기 때문에, 혼합물 중에 포함되는 3,10mMeDPhA2Nbf(II)를 동정하는 데 중요한 데이터인 것으로 간주할 수 있다.
m/z=682 부근의 프로덕트 이온은 3,10mMeDPhA2Nbf(II)에서 메틸기가 제거된 상태의 양이온인 것으로 추정될 수 있다. 이는 3,10mMeDPhA2Nbf(II)가 메틸기를 포함하는 것을 시사한다. 또한 m/z=501 부근의 프로덕트 이온은 3,10mMeDPhA2Nbf(II)에서 비스(3-다이메틸페닐)아미노기가 제거된 상태의 양이온인 것으로 추정될 수 있다. 이는 3,10mMeDPhA2Nbf(II)가 비스(3-다이메틸페닐)아미노기를 포함하는 것을 시사한다.
(실시예 5)
(합성예 5)
본 실시예에서는 실시형태 1에서 구조식(118)으로 나타내어진 본 발명의 일 형태의 유기 화합물인 3,10-비스(10-페닐-9-안트릴)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 3,10PhA2Nbf(II))의 합성예에 대하여 설명한다. 3,10PhA2Nbf(II)의 구조식을 이하에 나타낸다.
[화학식 94]
<단계 1: 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이메톡시나프탈렌의 합성>
합성예 2의 단계 1과 마찬가지로, 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이메톡시나프탈렌을 합성하였다.
<단계 2: 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이하이드록시나프탈렌의 합성>
합성예 2의 단계 2와 마찬가지로, 3,6-비스(4-클로로-2-플루오로페닐)-2,7-다이하이드록시나프탈렌을 합성하였다.
<단계 3: 3,10-다이클로로나프토[2,3-b;7,6-b']비스벤조퓨란의 합성>
합성예 2의 단계 3과 마찬가지로, 3,10-다이클로로나프토[2,3-b;7,6-b']비스벤조퓨란을 합성하였다.
<단계 4: 3,10-비스(10-페닐-9-안트릴)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 3,10PhA2Nbf(II))의 합성>
200mL 3구 플라스크에 1.2g(3.1mmol)의 3,10-다이클로로나프토[2,3-b;7,6-b']비스벤조퓨란, 2.4g(8.1mmol)의 10-페닐-9-안트라센보론산, 및 2.2g(16mmol)의 탄산 포타슘을 넣었다. 이 혼합물에 30mL의 자일렌을 첨가하였다. 얻어진 혼합물을 감압하면서 교반함으로써 탈기하였다. 이 혼합물에 71mg(61μmol)의 테트라키스(트라이페닐포스핀)팔라듐(0)을 첨가하고, 질소 기류하에 있어서 150℃에서 19시간 동안 교반을 수행하였다. 교반 후 얻어진 혼합물에 1.8g(6.2mmol)의 10-페닐-9-안트라센보론산, 1.7g(12mmol)의 탄산 포타슘, 64mg(0.18mmol)의 다이(1-아다만틸)-n-뷰틸포스핀, 8mg(36μmol)의 아세트산 팔라듐(II), 및 30mL의 다이에틸렌글라이콜다이메틸에터를 첨가하고, 질소 기류하에 있어서 150℃에서 28시간 동안 교반을 수행하였다. 교반 후 이 혼합물에 에탄올을 첨가하고, 얻어진 혼합물에 초음파를 조사한 다음, 흡인 여과하여 고체를 얻었다. 얻어진 고체를 물 및 에탄올로 세정하였다. 이 고체에 아세트산 에틸을 첨가하고, 얻어진 고체에 초음파를 조사한 다음, 흡인 여과하여 고체를 얻었다. 이 고체를 실리카 겔 칼럼 크로마토그래피(전개 용매로서 톨루엔을 사용함)에 의하여 정제하여 고체를 얻었다. 얻어진 고체에 톨루엔을 첨가하고 가열 교반을 수행한 다음, 얻어진 고체를 회수하였다. 이 처리를 2번 수행하여 연한 황색 고체 0.52g을 수율 21%로 얻었다. 단계 4의 합성 스킴을 이하에 나타낸다.
[화학식 95]
얻어진 고체의 1H NMR 차트를 도 38의 (A) 및 (B)에 나타내었고, 수치 데이터를 이하에 나타낸다. 이들은 본 합성예에 있어서 본 발명의 일 형태의 유기 화합물인 3,10PhA2Nbf(II)가 얻어진 것을 나타낸다.
1H NMR(1,1,2,2-Tetrachloroethane-D2, 300MHz): δ=7.39-7.43(m, 8H), 7.58-7.71(m, 12H), 7.79-7.87(m, 10H), 8.21(s, 2H), 8.40(d, J1=7.8Hz, 2H), 8.84(s, 2H).
다음으로, 얻어진 고체 0.52g을 1.2kХ10-2Pa의 압력하, 아르곤 유량 0mL/min으로 380℃에서 트레인 서블리메이션법에 의하여 정제하였다. 승화 정제 후, 황색 고체 0.42g을 회수율 80%로 얻었다.
다음으로, 도 39는 톨루엔 용액에서의 3,10PhA2Nbf(II)의 흡수 및 발광 스펙트럼의 측정 결과를 나타낸 것이다. 도 40은 3,10PhA2Nbf(II)의 박막의 흡수 및 발광 스펙트럼을 나타낸 것이다. 진공 증착법에 의하여 석영 기판 위에 고체 박막을 형성하였다. 톨루엔 용액의 흡수 스펙트럼은 자외 가시광 분광 광도계(V550, JASCO Corporation 제조)를 사용하여 측정하였고, 도 39는 톨루엔 용액에서의 3,10PhA2Nbf(II)의 스펙트럼에서 톨루엔의 스펙트럼을 뺌으로써 얻어진 스펙트럼을 나타낸 것이다. 박막의 흡수 스펙트럼은 분광 광도계(U-4100 분광 광도계, Hitachi High-Technologies Corporation 제조)를 사용하여 측정하였다. 발광 스펙트럼은 형광 분광 광도계(FS920, Hamamatsu Photonics K.K. 제조)를 사용하여 측정하였다.
도 39에 나타낸 바와 같이, 톨루엔 용액에서의 3,10PhA2Nbf(II)는 397nm, 377nm, 358nm, 338nm, 312nm, 및 289nm 부근에 흡수 피크를 가지고, 427nm 및 450nm(여기 파장: 397nm)에 발광 파장 피크를 가진다. 도 40에 나타낸 바와 같이, 3,10PhA2Nbf(II)의 박막은 401nm, 382nm, 363nm, 340nm, 314nm, 290nm, 266nm, 및 224nm 부근에 흡수 피크를 가지고, 455nm, 545nm, 및 590nm 부근(여기 파장: 390nm)에 발광 파장 피크를 가진다. 이들 결과는, 3,10PhA2Nbf(II)가 청색광을 방출하고, 발광 물질 또는 가시 영역에서 형광을 방출하는 물질의 호스트로서 사용될 수 있는 것을 나타낸다.
다음으로 본 실시예에서 얻어진 3,10PhA2Nbf(II)를 액체 크로마토그래피 질량 분석(LC-MS)에 의하여 분석하였다.
LC-MS에 의한 분석에서는, Thermo Fisher Scientific K.K. 제조의 UltiMate 3000으로 액체 크로마토그래피(LC) 분리를 실시하고, Thermo Fisher Scientific K.K. 제조의 Q Exactive로 MS 분석을 실시하였다.
LC 분리에서는, 40℃의 칼럼 온도에서 임의의 칼럼을 사용하고, 적절한 용매를 선택하고, 임의의 농도에서 유기 용매에 3,10PhA2Nbf(II)를 용해시켜 시료를 준비하고, 주입량을 5.0μL로 하는 식으로 송액을 수행하였다.
Targeted-MS2법에 의하여 3,10PhA2Nbf(II) 유래의 이온인 m/z=812.27의 성분에 대하여 MS2분석을 실시하였다. Targeted-MS2의 설정으로서 타깃 이온의 질량 범위를 m/z=812.27±2.0(isolation window=4)으로 하고, 검출은 포지티브 모드에서 수행하였다. 이 분석은 충돌 셀 내의 타깃 이온을 가속시키는 에너지(normalized collision energy: NCE)를 50으로 하여 수행하였다. 얻어진 MS 스펙트럼을 도 41에 나타내었다.
Targeted-MS2법에 의하여 3,10PhA2Nbf(II) 유래의 이온인 m/z=812.27의 성분에 대하여 MS2분석을 실시하였다. Targeted-MS2의 설정으로서 타깃 이온의 질량 범위를 m/z=812.27±2.0(isolation window=4)으로 하고, 검출은 포지티브 모드에서 수행하였다. 이 분석은 충돌 셀 내의 타깃 이온을 가속시키는 에너지(normalized collision energy: NCE)를 70으로 하여 수행하였다. 얻어진 MS 스펙트럼을 도 42에 나타내었다.
도 41 및 도 42는 3,10PhA2Nbf(II)의 프로덕트 이온이 주로 m/z=734, 656, 482, 및 252 부근에 검출되는 것을 나타낸다. 또한 도 41 및 도 42의 결과는 3,10PhA2Nbf(II)에서 유래하는 특징을 나타낸 것이기 때문에, 혼합물 중에 포함되는 3,10PhA2Nbf(II)를 동정하는 데 중요한 데이터인 것으로 간주할 수 있다.
m/z=734 부근의 프로덕트 이온은 3,10PhA2Nbf(II)에서 페닐기가 제거된 상태의 양이온인 것으로 추정될 수 있다. 이는 3,10PhA2Nbf(II)가 페닐기를 포함하는 것을 시사한다. 또한 m/z=482 부근의 프로덕트 이온은 3,10PhA2Nbf(II)에서 페닐기 및 9-페닐안트릴기가 제거된 상태의 양이온인 것으로 추정될 수 있다. 이는 3,10PhA2Nbf(II)가 페닐기 및 9-페닐안트릴기를 포함하는 것을 시사한다.
(실시예 6)
(합성예 6)
본 실시예에서는 실시형태 1에서 구조식(112)으로 나타내어진 본 발명의 일 형태의 유기 화합물인 3-(10-페닐-9-안트릴)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: Nbf(II)PhA)의 합성예에 대하여 설명한다. Nbf(II)PhA의 구조식을 이하에 나타낸다.
[화학식 96]
<단계 1: 3-브로모-6-(2-플루오로페닐)-2,7-다이메톡시나프탈렌의 합성>
200mL 3구 플라스크에 3.0g(8.7mmol)의 3,6-다이브로모-2,7-다이메톡시나프탈렌, 1.2g(8.7mmol)의 2-플루오로페닐보론산, 2.4g(17mmol)의 탄산 포타슘, 및 0.13g(0.43mmol)의 트리스(2-메틸페닐)포스핀을 넣었다. 이 혼합물에 90mL의 톨루엔을 첨가하였다. 얻어진 혼합물을 감압하면서 교반함으로써 탈기하였다. 이 혼합물에 19mg(87μmol)의 아세트산 팔라듐(II)을 첨가하고, 질소 기류하에 있어서 110℃에서 7시간 동안 교반을 수행하였다. 교반 후 이 혼합물에 톨루엔을 첨가하고, 얻어진 혼합물을, 플로리실(Wako Pure Chemical Industries, Ltd. 제조, 카탈로그 번호 540-00135), 셀라이트(Wako Pure Chemical Industries, Ltd. 제조, 카탈로그 번호 531-16855), 및 알루미나를 통하여 흡인 여과하여 여과액을 얻었다. 이 여과액을 농축하여 고체를 얻었다. 이 고체를 실리카 겔 칼럼 크로마토그래피(전개 용매로서 먼저 톨루엔과 헥세인을 1:2의 비율로 사용하고, 그 다음에 톨루엔과 헥세인을 1:1의 비율로 사용함)에 의하여 정제하여, 목적 물질인 백색 고체 1.1g을 수율 34%로 얻었다. 단계 1의 합성 스킴을 이하에 나타낸다.
[화학식 97]
얻어진 고체의 1H NMR 차트를 도 43의 (A) 및 (B)에 나타내었고, 수치 데이터를 이하에 나타낸다. 이들은 본 합성예에 있어서 3-브로모-6-(2-플루오로페닐)-2,7-다이메톡시나프탈렌이 얻어진 것을 나타낸다.
1H NMR(CDCl3, 300MHz): δ=3.90(s, 3H), 4.02(s, 3H), 7.12-7.18(m, 3H), 7.21(td, J1=7.8Hz, J2=0.9Hz, 1H), 7.33-7.42(m, 2H), 7.57(s, 1H), 7.97(s, 1H).
<단계 2: 3-(2-플루오로페닐)-6-(2-플루오로-4-클로로페닐)-2,7-다이메톡시나프탈렌의 합성>
200mL 3구 플라스크에 2.2g(6.0mmol)의 3-브로모-6-(2-플루오로페닐)-2,7-다이메톡시나프탈렌, 1.3g(7.2mmol)의 4-클로로-2-플루오로페닐보론산, 2.0g(14mmol)의 탄산 포타슘, 및 92mg(0.30mmol)의 트리스(2-메틸페닐)포스핀을 넣었다. 이 혼합물에 30mL의 톨루엔을 첨가하였다. 얻어진 혼합물을 감압하면서 교반함으로써 탈기하였다. 이 혼합물에 14mg(60μmol)의 아세트산 팔라듐(II)을 첨가하고, 질소 기류하에 있어서 110℃에서 7시간 동안 교반을 수행하였다. 교반 후 이 혼합물에 톨루엔을 첨가하고, 얻어진 혼합물을, 플로리실, 셀라이트, 및 알루미나를 통하여 흡인 여과하여 여과액을 얻었다. 이 여과액을 농축하여 고체를 얻었다. 이 고체를 실리카 겔 칼럼 크로마토그래피(전개 용매로서 톨루엔과 헥세인을 1:1의 비율로 사용함)에 의하여 정제하여, 목적 물질 2.4g을 수율 95%로 얻었다. 단계 2의 합성 스킴을 이하에 나타낸다.
[화학식 98]
얻어진 고체의 1H NMR 차트를 도 44의 (A) 및 (B)에 나타내었고, 수치 데이터를 이하에 나타낸다. 이들은 본 합성예에 있어서 3-(2-플루오로페닐)-6-(2-플루오로-4-클로로페닐)-2,7-다이메톡시나프탈렌이 얻어진 것을 나타낸다.
1H NMR(CDCl3, 300MHz): δ=3.92-3.93(m, 6H), 7.12-7.24(m, 6H), 7.33-7.44(m, 3H), 7.63(s, 1H), 7.66(s, 1H).
<단계 3: 3-(2-플루오로페닐)-6-(2-플루오로-4-클로로페닐)-2,7-다이하이드록시나프탈렌의 합성>
200mL 3구 플라스크에 2.3g(5.6mmol)의 3-(2-플루오로페닐)-6-(2-플루오로-4-클로로페닐)-2,7-다이메톡시나프탈렌을 넣었다. 플라스크 내의 공기를 질소로 치환하였다. 이 플라스크에 15mL의 다이클로로메테인을 추가적으로 넣었다. 이 용액에 12mL(12mmol)의 3브로민화 붕소(약 1.0mol/L 다이클로로메테인 용액) 및 15mL의 다이클로로메테인을 적하하였다. 적하 후 얻어진 용액을 실온에서 교반하였다. 그 후, 얼음으로 냉각하면서 이 용액에 약 20mL의 물을 첨가하고, 이 용액을 교반하였다. 그 후, 이 혼합물의 수성층과 유기층을 분리하고, 수성층에 대하여 다이클로로메테인으로 추출을 실시하였다. 추출된 용액과 유기층을 합쳐 물 및 탄산수소소듐 포화수용액으로 세정하였다. 유기층을 황산 마그네슘에 의하여 건조시킨 후, 이 혼합물을 중력 여과하였다. 얻어진 여과액을 농축하여 백색 고체 2.1g을 얻었다. 단계 3의 합성 스킴을 이하에 나타낸다.
[화학식 99]
얻어진 고체의 1H NMR 차트를 도 45의 (A) 및 (B)에 나타내었고, 수치 데이터를 이하에 나타낸다. 이들은 본 합성예에 있어서 3-(2-플루오로페닐)-6-(2-플루오로-4-클로로페닐)-2,7-다이하이드록시나프탈렌이 얻어진 것을 나타낸다.
1H NMR(CDCl3, 300MHz): δ=5.07(s, 1H), 5.11(s, 1H), 7.19-7.31(m, 6H), 7.38-7.48(m, 3H), 7.66(s, 1H), 7.69(s, 1H).
<단계 4: 2-클로로나프토[2,3-b;7,6-b']비스벤조퓨란의 합성>
200mL 3구 플라스크에 2.1g(5.6mmol)의 3-(2-플루오로페닐)-6-(2-플루오로-4-클로로페닐)-2,7-다이하이드록시나프탈렌 및 3.1g(22mmol)의 탄산 포타슘을 넣었다. 이 혼합물에 60mL의 N-메틸-2-피롤리돈을 첨가하였다. 얻어진 혼합물을 감압하면서 교반함으로써 탈기하였다. 그리고 이 혼합물을 질소 기류하 120℃에서 13.5시간 동안 교반하였다. 그 후 이 혼합물에 물을 첨가하고, 석출한 고체를 여과에 의하여 회수하였다. 얻어진 고체를 물 및 에탄올로 세정하였다. 얻어진 고체에 에탄올을 첨가하고, 가열 교반을 수행한 후, 얻어진 혼합물을 여과하여 고체를 얻었다. 이 고체를 실리카 겔 칼럼 크로마토그래피(전개 용매로서 톨루엔을 사용함)에 의하여 정제하였다. 얻어진 고체를 톨루엔을 사용하여 재결정화하여 백색 고체 1.6g을 수율 85%로 얻었다. 단계 4의 합성 스킴을 이하에 나타낸다.
[화학식 100]
얻어진 고체의 1H NMR 차트를 도 46의 (A) 및 (B)에 나타내었고, 수치 데이터를 이하에 나타낸다. 이들은 본 합성예에 있어서 3-클로로나프토[2,3-b;7,6-b']비스벤조퓨란이 얻어진 것을 나타낸다.
1H NMR(1,1,2,2-Tetrachloroethane-D2, 300MHz): δ=7.42-7.47(m, 2H), 7.57-7.65(m, 3H), 8.02-8.07(m, 3H), 8.14(d, J1=6.9Hz, 1H), 8.60(s, 1H), 8.62(s, 1H).
<단계 5: 3-(10-페닐-9-안트릴)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: Nbf(II)PhA)의 합성>
200mL 3구 플라스크에 1.2g(3.6mmol)의 3-클로로나프토[2,3-b;7,6-b']비스벤조퓨란, 1.3g(4.5mmol)의 10-페닐-9-안트라센보론산, 및 1.3g(9.0mmol)의 탄산 포타슘을 넣었다. 이 혼합물에 20mL의 다이에틸렌글라이콜다이메틸에터를 첨가하였다. 얻어진 혼합물을 감압하면서 교반함으로써 탈기하였다. 이 혼합물에 41mg(36μmol)의 테트라키스(트라이페닐포스핀)팔라듐(0)을 첨가하고, 질소 기류하에 있어서 150℃에서 18시간 동안 교반을 수행하였다. 교반 후 얻어진 혼합물에 20mL의 자일렌, 1.3g(4.5mmol)의 10-페닐-9-안트라센보론산, 1.3g(9.0mmol)의 탄산 포타슘, 64mg(0.18mmol)의 다이(1-아다만틸)-n-뷰틸포스핀, 및 8mg(36μmol)의 아세트산 팔라듐(II)을 첨가하고, 질소 기류하에 있어서 150℃에서 42시간 동안 교반을 수행하였다. 교반 후 이 혼합물에 톨루엔을 첨가하고, 얻어진 혼합물을, 플로리실, 셀라이트, 및 알루미나를 통하여 흡인 여과하여 여과액을 얻었다. 얻어진 여과액을 농축하여 고체를 얻었다. 이 고체를 실리카 겔 칼럼 크로마토그래피(전개 용매로서 톨루엔을 사용함)에 의하여 정제하였다. 얻어진 고체를 톨루엔을 사용하여 재결정화하여 연한 황색 고체 0.53g(crude)을 얻었다. 단계 5의 합성 스킴을 이하에 나타낸다.
[화학식 101]
얻어진 고체의 1H NMR 차트를 도 47의 (A) 및 (B)에 나타내었고, 수치 데이터를 이하에 나타낸다. 이들은 본 합성예에 있어서 본 발명의 일 형태의 유기 화합물인 Nbf(II)PhA가 얻어진 것을 나타낸다.
1H NMR(1,1,2,2-Tetrachloroethane-D2, 300MHz): δ=7.40(dd, J1=3.3Hz, J2=6.9Hz, 4H), 7.47(t, J1=7.8Hz, 1H), 7.57-7.68(m, 9H), 7.77-7.85(m, 5H), 8.13-8.20(m, 3H), 8.37(d, J1=7.2Hz, 1H), 8.71(s, 1H), 8.76(s, 1H).
다음으로, 얻어진 고체 0.52g을 1.6kХ10-2Pa의 압력하, 아르곤 유량 0mL/min으로 290℃에서 트레인 서블리메이션법에 의하여 정제하였다. 승화 정제 후, 연한 황색 고체 0.33g을 회수율 63%로 얻었다.
다음으로, 도 48은 톨루엔 용액에서의 Nbf(II)PhA의 흡수 및 발광 스펙트럼의 측정 결과를 나타낸 것이다. 도 49는 Nbf(II)PhA의 박막의 흡수 및 발광 스펙트럼을 나타낸 것이다. 진공 증착법에 의하여 석영 기판 위에 고체 박막을 형성하였다. 톨루엔 용액의 흡수 스펙트럼은 자외 가시광 분광 광도계(V550, JASCO Corporation 제조)를 사용하여 측정하였고, 도 48은 톨루엔 용액에서의 Nbf(II)PhA의 스펙트럼에서 톨루엔의 스펙트럼을 뺌으로써 얻어진 스펙트럼을 나타낸 것이다. 박막의 흡수 스펙트럼은 분광 광도계(U-4100 분광 광도계, Hitachi High-Technologies Corporation 제조)를 사용하여 측정하였다. 발광 스펙트럼은 형광 분광 광도계(FS920, Hamamatsu Photonics K.K. 제조)를 사용하여 측정하였다.
도 48에 나타낸 바와 같이, 톨루엔 용액에서의 Nbf(II)PhA는 397nm, 374nm, 356nm, 336nm, 311nm, 및 290nm 부근에 흡수 피크를 가지고, 424nm 및 430nm(여기 파장: 374nm)에 발광 파장 피크를 가진다. 도 49에 나타낸 바와 같이, Nbf(II)PhA의 박막은 401nm, 381nm, 358nm, 335nm, 311nm, 289nm, 264nm, 및 222nm 부근에 흡수 피크를 가지고, 451nm, 552nm, 및 585nm 부근(여기 파장: 390nm)에 발광 파장 피크를 가진다. 이들 결과는, Nbf(II)PhA가 청색광을 방출하고, 발광 물질 또는 가시 영역에서 형광을 방출하는 물질의 호스트로서 사용될 수 있는 것을 나타낸다.
다음으로 본 실시예에서 얻어진 Nbf(II)PhA를 액체 크로마토그래피 질량 분석(LC-MS)에 의하여 분석하였다.
LC-MS에 의한 분석에서는, Thermo Fisher Scientific K.K. 제조의 UltiMate 3000으로 액체 크로마토그래피(LC) 분리를 실시하고, Thermo Fisher Scientific K.K. 제조의 Q Exactive로 MS 분석을 실시하였다.
LC 분리에서는, 40℃의 칼럼 온도에서 임의의 칼럼을 사용하고, 적절한 용매를 선택하고, 임의의 농도에서 유기 용매에 Nbf(II)PhA를 용해시켜 시료를 준비하고, 주입량을 5.0μL로 하는 식으로 송액을 수행하였다.
Targeted-MS2법에 의하여 Nbf(II)PhA 유래의 이온인 m/z=560.18의 성분에 대하여 MS2분석을 실시하였다. Targeted-MS2의 설정으로서 타깃 이온의 질량 범위를 m/z=560.18±2.0(isolation window=4)으로 하고, 검출은 포지티브 모드에서 수행하였다. 이 분석은 충돌 셀 내의 타깃 이온을 가속시키는 에너지(normalized collision energy: NCE)를 50으로 하여 수행하였다. 얻어진 MS 스펙트럼을 도 50에 나타내었다.
도 50은 Nbf(II)PhA의 프로덕트 이온이 주로 m/z=482, 308, 및 252 부근에 검출되는 것을 나타낸다. 또한 도 50의 결과는 Nbf(II)PhA에서 유래하는 특징을 나타낸 것이기 때문에, 혼합물 중에 포함되는 Nbf(II)PhA를 동정하는 데 중요한 데이터인 것으로 간주할 수 있다.
m/z=482 부근의 프로덕트 이온은 Nbf(II)PhA에서 페닐기가 제거된 상태의 양이온인 것으로 추정될 수 있다. 이는 Nbf(II)PhA가 페닐기를 포함하는 것을 시사한다. 또한 m/z=308 부근의 프로덕트 이온은 Nbf(II)PhA에서 9-페닐안트릴기가 제거된 상태의 양이온인 것으로 추정될 수 있다. 이는 Nbf(II)PhA가 9-페닐안트릴기를 포함하는 것을 시사한다. 또한 m/z=252 부근의 프로덕트 이온은 Nbf(II)PhA에서 나프토[2,3-b;7,6-b']비스벤조퓨란이 제거된 상태의 양이온인 것으로 추정될 수 있다. 이는 Nbf(II)PhA가 나프토[2,3-b;7,6-b']비스벤조퓨란을 포함하는 것을 시사한다.
(실시예 7)
본 실시예에서는 상술한 실시형태에서 설명한 본 발명의 일 형태의 발광 소자인 발광 소자 1에 대하여 자세히 설명한다. 발광 소자 1에 사용한 유기 화합물의 구조식을 이하에 나타낸다.
[화학식 102]
(발광 소자 1의 제작 방법)
우선, 유리 기판 위에, 산화 실리콘을 포함하는 인듐 주석 산화물(ITSO)을 스퍼터링법에 의하여 퇴적하여 양극(101)을 형성하였다. 양극(101)의 두께는 70nm이고, 전극 면적은 4mm2(2mmХ2mm)이다.
다음으로, 기판 위에 발광 소자를 형성하기 위한 전처리에서, 기판의 표면을 물로 세정하고 200℃에서 1시간 동안 소성한 다음, UV 오존 처리를 370초 동안 수행하였다.
그 후, 10-4Pa 정도까지 압력이 저감된 진공 증착 장치에 기판을 이동하고, 진공 증착 장치의 가열 체임버에서 진공 소성을 170℃에서 30분 동안 수행한 다음, 기판을 약 45분 동안 냉각시켰다.
다음으로, 양극(101)이 형성된 면이 아래쪽을 향하도록, 진공 증착 장치 내에 제공된 기판 홀더에 양극(101)이 제공된 기판을 고정시켰다. 그리고, 양극(101) 위에, 구조식(i)으로 나타내어지는 9-페닐-3-[4-(10-페닐-9-안트릴)페닐]-9H-카바졸(약칭: PCzPA)과, 산화 몰리브데넘(VI)을 저항 가열을 사용한 증착법에 의하여, PCzPA 대 산화 몰리브데넘의 중량비가 4:2가 되도록 두께 10nm로 공증착함으로써 정공 주입층(111)을 형성하였다.
이어서 정공 주입층(111) 위에, PCzPA를 증착에 의하여 두께 30nm로 퇴적하여 정공 수송층(112)을 형성하였다.
다음으로, 구조식(ii)으로 나타내어지는 7-[4-(10-페닐-9-안트릴)페닐]-7H-다이벤조[c,g]카바졸(약칭: cgDBCzPA)과 구조식(iii)으로 나타내어지는 3,10-비스(다이페닐아미노)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 3,10DPhA2Nbf(II))을 중량비 1:0.03(=cgDBCzPA:3,10DPhA2Nbf(II))에서 두께 25nm로 공증착함으로써 발광층(113)을 형성하였다.
그리고, 발광층(113) 위에, cgDBCzPA를 증착에 의하여 두께 10nm로 퇴적한 다음, 구조식(iv)으로 나타내어지는 바소페난트롤린(약칭: BPhen)을 증착에 의하여 두께 15nm로 퇴적함으로써 전자 수송층(114)을 형성하였다.
전자 수송층(114)을 형성한 후, 플루오린화 리튬(LiF)을 증착에 의하여 두께 1nm로 퇴적함으로써 전자 주입층(115)을 형성하였다. 그리고, 알루미늄을 증착에 의하여 두께 200nm로 퇴적함으로써 음극(102)을 형성하였다. 이렇게 하여 본 실시예의 발광 소자 1이 제작되었다.
발광 소자 1의 소자 구조를 아래의 표에 나타내었다.
[표 1]
발광 소자 1은, 대기에 노출되지 않도록, 질소 분위기를 포함하는 글로브 박스에서 유리 기판을 사용하여 밀봉하였다(구체적으로는, 소자를 둘러싸도록 밀봉재를 도포하고, 밀봉 시에 UV 처리 및 80℃에서 1시간의 가열 처리를 수행하였음). 그리고, 이 발광 소자의 초기 특성을 측정하였다. 또한 이 측정은 실온에서 수행하였다.
도 51은 발광 소자 1의 휘도-전류 밀도 특성을 나타낸 것이다. 도 52는 발광 소자 1의 전류 효율-휘도 특성을 나타낸 것이다. 도 53은 발광 소자 1의 휘도-전압 특성을 나타낸 것이다. 도 54는 발광 소자 1의 전류-전압 특성을 나타낸 것이다. 도 55는 발광 소자 1의 외부 양자 효율-휘도 특성을 나타낸 것이다. 도 56은 발광 소자 1의 발광 스펙트럼을 나타낸 것이다.
[표 2]
도 51 내지 도 55 및 표 2에 따르면, 발광 소자 1은 1000cd/m2에서의 외부 양자 효율이 4.5%로 높았다.
도 57은, 전류 값을 2mA로 하고 전류 밀도가 일정한 조건하에서의 휘도의 구동 시간-의존 변화를 나타낸 그래프이다. 도 57에서 나타낸 바와 같이, 발광 소자 1은 100시간 구동 후에 초기 휘도의 75% 이상을 유지하여, 수명이 긴 발광 소자인 것을 알았다.
상술한 결과는, 나프토[2,3-b;7,6-b']비스벤조퓨란 골격 또는 나프토[2,3-b;7,6-b']비스벤조싸이오펜 골격이 치환기로서 다이아릴아미노기를 가지는 유기 화합물을 발광 소자의 발광 재료로서 사용하면, 발광 소자가 외부 양자 효율이 높다는 등 양호한 특성을 가지는 것을 시사한다. 특히 그 골격의 3위치 및 10위치에 다이아릴아미노기가 결합된 화합물은 신뢰성이 높다는 것을 알았다.
(실시예 8)
본 실시예에서는 상술한 실시형태에서 설명한 본 발명의 일 형태의 발광 소자인 발광 소자 2에 대하여 자세히 설명한다. 발광 소자 2에 사용한 유기 화합물의 구조식을 이하에 나타낸다.
[화학식 103]
(발광 소자 2의 제작 방법)
우선, 유리 기판 위에, 산화 실리콘을 포함하는 인듐 주석 산화물(ITSO)을 스퍼터링법에 의하여 퇴적하여 양극(101)을 형성하였다. 양극(101)의 두께는 70nm이고, 전극 면적은 4mm2(2mmХ2mm)이다.
다음으로, 기판 위에 발광 소자를 형성하기 위한 전처리에서, 기판의 표면을 물로 세정하고 200℃에서 1시간 동안 소성한 다음, UV 오존 처리를 370초 동안 수행하였다.
그 후, 10-4Pa 정도까지 압력이 저감된 진공 증착 장치에 기판을 이동하고, 진공 증착 장치의 가열 체임버에서 진공 소성을 170℃에서 30분 동안 수행한 다음, 기판을 약 30분 동안 냉각시켰다.
다음으로, 양극(101)이 형성된 면이 아래쪽을 향하도록, 진공 증착 장치 내에 제공된 기판 홀더에 양극(101)이 제공된 기판을 고정시켰다. 그리고, 양극(101) 위에, 구조식(v)으로 나타내어지는 3-[4-(9-페난트릴)-페닐]-9-페닐-9H-카바졸(약칭: PCPPn)과, 산화 몰리브데넘(VI)을 저항 가열을 사용한 증착법에 의하여, PCPPn 대 산화 몰리브데넘의 중량비가 4:2가 되도록 두께 10nm로 공증착함으로써 정공 주입층(111)을 형성하였다.
이어서 정공 주입층(111) 위에, PCPPn을 증착에 의하여 두께 30nm로 퇴적하여 정공 수송층(112)을 형성하였다.
다음으로, 구조식(ii)으로 나타내어지는 7-[4-(10-페닐-9-안트릴)페닐]-7H-다이벤조[c,g]카바졸(약칭: cgDBCzPA)과 구조식(iii)으로 나타내어지는 3,10-비스(다이페닐아미노)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 3,10DPhA2Nbf(II))을 중량비 1:0.03(=cgDBCzPA:3,10DPhA2Nbf(II))에서 두께 25nm로 공증착함으로써 발광층(113)을 형성하였다.
그리고, 발광층(113) 위에, cgDBCzPA를 증착에 의하여 두께 10nm로 퇴적하고, 구조식(iv)으로 나타내어지는 바소페난트롤린(약칭: BPhen)을 증착에 의하여 두께 15nm로 퇴적함으로써 전자 수송층(114)을 형성하였다.
전자 수송층(114)을 형성한 후, 플루오린화 리튬(LiF)을 증착에 의하여 두께 1nm로 퇴적함으로써 전자 주입층(115)을 형성하였다. 그리고, 알루미늄을 증착에 의하여 두께 200nm로 퇴적함으로써 음극(102)을 형성하였다. 이렇게 하여 본 실시예의 발광 소자 2가 제작되었다.
발광 소자 2의 소자 구조를 아래의 표에 나타내었다.
[표 3]
발광 소자 2는, 대기에 노출되지 않도록, 질소 분위기를 포함하는 글로브 박스에서 유리 기판을 사용하여 밀봉하였다(구체적으로는, 소자를 둘러싸도록 밀봉재를 도포하고, 밀봉 시에 UV 처리 및 80℃에서 1시간의 가열 처리를 수행하였음). 그리고, 이 발광 소자의 초기 특성을 측정하였다. 또한 이 측정은 실온에서 수행하였다.
도 58은 발광 소자 2의 휘도-전류 밀도 특성을 나타낸 것이다. 도 59는 발광 소자 2의 전류 효율-휘도 특성을 나타낸 것이다. 도 60은 발광 소자 2의 휘도-전압 특성을 나타낸 것이다. 도 61은 발광 소자 2의 전류-전압 특성을 나타낸 것이다. 도 62는 발광 소자 2의 외부 양자 효율-휘도 특성을 나타낸 것이다. 도 63은 발광 소자 2의 발광 스펙트럼을 나타낸 것이다.
[표 4]
도 58 내지 도 62 및 표 4에 따르면, 발광 소자 2는 1000cd/m2에서의 외부 양자 효율이 6.4%로 높았다.
도 64는, 전류 값을 2mA로 하고 전류 밀도가 일정한 조건하에서의 휘도의 구동 시간-의존 변화를 나타낸 그래프이다. 도 64에서 나타낸 바와 같이, 발광 소자 2는 100시간 구동 후에 초기 휘도의 65% 이상을 유지하여, 수명이 긴 발광 소자인 것을 알았다.
상술한 결과는, 나프토[2,3-b;7,6-b']비스벤조퓨란 골격 또는 나프토[2,3-b;7,6-b']비스벤조싸이오펜 골격이 치환기로서 다이아릴아미노기를 가지는 유기 화합물을 발광 소자의 발광 재료로서 사용하면, 발광 소자가 외부 양자 효율이 높다는 등 양호한 특성을 가지는 것을 시사한다. 특히 정공 수송층에 LUMO 준위가 높은 재료를 사용하면 효율이 높아지는 것처럼 보인다.
(실시예 9)
본 실시예에서는 상술한 실시형태에서 설명한 본 발명의 일 형태의 발광 소자인 발광 소자 3에 대하여 설명한다. 발광 소자 3에 사용한 유기 화합물의 구조식을 이하에 나타낸다.
[화학식 104]
(발광 소자 3의 제작 방법)
우선, 유리 기판 위에, 산화 실리콘을 포함하는 인듐 주석 산화물(ITSO)을 스퍼터링법에 의하여 퇴적하여 양극(101)을 형성하였다. 양극(101)의 두께는 70nm이고, 전극 면적은 4mm2(2mmХ2mm)이다.
다음으로, 기판 위에 발광 소자를 형성하기 위한 전처리에서, 기판의 표면을 물로 세정하고 200℃에서 1시간 동안 소성한 다음, UV 오존 처리를 370초 동안 수행하였다.
그 후, 10-4Pa 정도까지 압력이 저감된 진공 증착 장치에 기판을 이동하고, 진공 증착 장치의 가열 체임버에서 진공 소성을 170℃에서 30분 동안 수행한 다음, 기판을 약 45분 동안 냉각시켰다.
다음으로, 양극(101)이 형성된 면이 아래쪽을 향하도록, 진공 증착 장치 내에 제공된 기판 홀더에 양극(101)이 제공된 기판을 고정시켰다. 그리고, 양극(101) 위에, 구조식(v)으로 나타내어지는 3-[4-(9-페난트릴)-페닐]-9-페닐-9H-카바졸(약칭: PCPPn)과, 산화 몰리브데넘(VI)을 저항 가열을 사용한 증착법에 의하여, PCPPn 대 산화 몰리브데넘의 중량비가 4:2가 되도록 두께 10nm로 공증착함으로써 정공 주입층(111)을 형성하였다.
이어서 정공 주입층(111) 위에, PCPPn을 증착에 의하여 두께 30nm로 퇴적하여 정공 수송층(112)을 형성하였다.
다음으로, 구조식(ii)으로 나타내어지는 7-[4-(10-페닐-9-안트릴)페닐]-7H-다이벤조[c,g]카바졸(약칭: cgDBCzPA)과 구조식(vi)으로 나타내어지는 2,11-비스(다이페닐아미노)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 2,11DPhA2Nbf(II))을 중량비 1:0.03(=cgDBCzPA:2,11DPhA2Nbf(II))에서 두께 25nm로 공증착함으로써 발광층(113)을 형성하였다.
그리고, 발광층(113) 위에, cgDBCzPA를 증착에 의하여 두께 10nm로 퇴적한 다음, 구조식(iv)으로 나타내어지는 바소페난트롤린(약칭: BPhen)을 증착에 의하여 두께 15nm로 퇴적함으로써 전자 수송층(114)을 형성하였다.
전자 수송층(114)을 형성한 후, 플루오린화 리튬(LiF)을 증착에 의하여 두께 1nm로 퇴적함으로써 전자 주입층(115)을 형성하였다. 그리고, 알루미늄을 증착에 의하여 두께 200nm로 퇴적함으로써 음극(102)을 형성하였다. 이렇게 하여 본 실시예의 발광 소자 3이 제작되었다.
발광 소자 3의 소자 구조를 아래의 표에 나타내었다.
[표 5]
발광 소자 3은, 대기에 노출되지 않도록, 질소 분위기를 포함하는 글로브 박스에서 유리 기판을 사용하여 밀봉하였다(구체적으로는, 소자를 둘러싸도록 밀봉재를 도포하고, 밀봉 시에 UV 처리 및 80℃에서 1시간의 가열 처리를 수행하였음). 그리고, 이 발광 소자의 초기 특성을 측정하였다. 또한 이 측정은 실온에서 수행하였다.
도 65는 발광 소자 3의 휘도-전류 밀도 특성을 나타낸 것이다. 도 66은 발광 소자 3의 전류 효율-휘도 특성을 나타낸 것이다. 도 67은 발광 소자 3의 휘도-전압 특성을 나타낸 것이다. 도 68은 발광 소자 3의 전류-전압 특성을 나타낸 것이다. 도 69는 발광 소자 3의 외부 양자 효율-휘도 특성을 나타낸 것이다. 도 70은 발광 소자 3의 발광 스펙트럼을 나타낸 것이다.
[표 6]
도 65 내지 도 69 및 표 6에 따르면, 발광 소자 3은 1000cd/m2에서의 외부 양자 효율이 5.7%로 매우 높았다.
상술한 결과는, 나프토[2,3-b;7,6-b']비스벤조퓨란 골격 또는 나프토[2,3-b;7,6-b']비스벤조싸이오펜 골격이 치환기로서 다이아릴아미노기를 가지는 유기 화합물을 발광 소자의 발광 재료로서 사용하면, 발광 소자가 외부 양자 효율이 높다는 등 양호한 특성을 가지는 것을 시사한다. 특히 그 골격의 2위치 및 11위치에 다이아릴아미노기가 결합된 화합물을 사용하면 전류 효율이 높아지는 것처럼 보인다.
(실시예 10)
본 실시예에서는 상술한 실시형태에서 설명한 본 발명의 일 형태의 발광 소자인 발광 소자 4에 대하여 자세히 설명한다. 발광 소자 4에 사용한 유기 화합물의 구조식을 이하에 나타낸다.
[화학식 105]
(발광 소자 4의 제작 방법)
우선, 유리 기판 위에, 산화 실리콘을 포함하는 인듐 주석 산화물(ITSO)을 스퍼터링법에 의하여 퇴적하여 양극(101)을 형성하였다. 양극(101)의 두께는 70nm이고, 전극 면적은 4mm2(2mmХ2mm)이다.
다음으로, 기판 위에 발광 소자를 형성하기 위한 전처리에서, 기판의 표면을 물로 세정하고 200℃에서 1시간 동안 소성한 다음, UV 오존 처리를 370초 동안 수행하였다.
그 후, 10-4Pa 정도까지 압력이 저감된 진공 증착 장치에 기판을 이동하고, 진공 증착 장치의 가열 체임버에서 진공 소성을 170℃에서 30분 동안 수행한 다음, 기판을 약 45분 동안 냉각시켰다.
다음으로, 양극(101)이 형성된 면이 아래쪽을 향하도록, 진공 증착 장치 내에 제공된 기판 홀더에 양극(101)이 제공된 기판을 고정시켰다. 그리고, 양극(101) 위에, 구조식(v)으로 나타내어지는 3-[4-(9-페난트릴)-페닐]-9-페닐-9H-카바졸(약칭: PCPPn)과, 산화 몰리브데넘(VI)을 저항 가열을 사용한 증착법에 의하여, PCPPn 대 산화 몰리브데넘의 중량비가 4:2가 되도록 두께 10nm로 공증착함으로써 정공 주입층(111)을 형성하였다.
이어서 정공 주입층(111) 위에, PCPPn을 증착에 의하여 두께 30nm로 퇴적하여 정공 수송층(112)을 형성하였다.
다음으로, 구조식(ii)으로 나타내어지는 7-[4-(10-페닐-9-안트릴)페닐]-7H-다이벤조[c,g]카바졸(약칭: cgDBCzPA)과 구조식(vii)으로 나타내어지는 3,10-비스(3,3'-다이메틸다이페닐아미노)나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 3,10mMeDPhA2Nbf(II))을 중량비 1:0.03(=cgDBCzPA:3,10mMeDPhA2Nbf(II))에서 두께 25nm로 공증착함으로써 발광층(113)을 형성하였다.
그리고, 발광층(113) 위에, cgDBCzPA를 증착에 의하여 두께 10nm로 퇴적한 다음, 구조식(iv)으로 나타내어지는 바소페난트롤린(약칭: BPhen)을 증착에 의하여 두께 15nm로 퇴적함으로써 전자 수송층(114)을 형성하였다.
전자 수송층(114)을 형성한 후, 플루오린화 리튬(LiF)을 증착에 의하여 두께 1nm로 퇴적함으로써 전자 주입층(115)을 형성하였다. 그리고, 알루미늄을 증착에 의하여 두께 200nm로 퇴적함으로써 음극(102)을 형성하였다. 이렇게 하여 본 실시예의 발광 소자 4가 제작되었다.
발광 소자 4의 소자 구조를 아래의 표에 나타내었다.
[표 7]
발광 소자 4는, 대기에 노출되지 않도록, 질소 분위기를 포함하는 글로브 박스에서 유리 기판을 사용하여 밀봉하였다(구체적으로는, 소자를 둘러싸도록 밀봉재를 도포하고, 밀봉 시에 UV 처리 및 80℃에서 1시간의 가열 처리를 수행하였음). 그리고, 이 발광 소자의 초기 특성을 측정하였다. 또한 이 측정은 실온에서 수행하였다.
도 71은 발광 소자 4의 휘도-전류 밀도 특성을 나타낸 것이다. 도 72는 발광 소자 4의 전류 효율-휘도 특성을 나타낸 것이다. 도 73은 발광 소자 4의 휘도-전압 특성을 나타낸 것이다. 도 74는 발광 소자 4의 전류-전압 특성을 나타낸 것이다. 도 75는 발광 소자 4의 외부 양자 효율-휘도 특성을 나타낸 것이다. 도 76은 발광 소자 4의 발광 스펙트럼을 나타낸 것이다.
[표 8]
도 71 내지 도 75 및 표 8에 따르면, 발광 소자 4는 1000cd/m2에서의 외부 양자 효율이 6.4%로 매우 높았다.
도 77은, 전류 값을 2mA로 하고 전류 밀도가 일정한 조건하에서의 휘도의 구동 시간-의존 변화를 나타낸 그래프이다. 도 77에서 나타낸 바와 같이, 발광 소자 4는 100시간 구동 후에 초기 휘도의 70% 이상을 유지하여, 수명이 긴 발광 소자인 것을 알았다.
(실시예 11)
본 실시예에서는 상술한 실시형태에서 설명한 본 발명의 일 형태의 발광 소자인 발광 소자 5에 대하여 자세히 설명한다. 발광 소자 5에 사용한 유기 화합물의 구조식을 이하에 나타낸다.
[화학식 106]
(발광 소자 5의 제작 방법)
우선, 유리 기판 위에, 산화 실리콘을 포함하는 인듐 주석 산화물(ITSO)을 스퍼터링법에 의하여 퇴적하여 양극(101)을 형성하였다. 양극(101)의 두께는 70nm이고, 전극 면적은 4mm2(2mmХ2mm)이다.
다음으로, 기판 위에 발광 소자를 형성하기 위한 전처리에서, 기판의 표면을 물로 세정하고 200℃에서 1시간 동안 소성한 다음, UV 오존 처리를 370초 동안 수행하였다.
그 후, 10-4Pa 정도까지 압력이 저감된 진공 증착 장치에 기판을 이동하고, 진공 증착 장치의 가열 체임버에서 진공 소성을 170℃에서 30분 동안 수행한 다음, 기판을 약 45분 동안 냉각시켰다.
다음으로, 양극(101)이 형성된 면이 아래쪽을 향하도록, 진공 증착 장치 내에 제공된 기판 홀더에 양극(101)이 제공된 기판을 고정시켰다. 그리고, 양극(101) 위에, 구조식(v)으로 나타내어지는 3-[4-(9-페난트릴)-페닐]-9-페닐-9H-카바졸(약칭: PCPPn)과, 산화 몰리브데넘(VI)을 저항 가열을 사용한 증착법에 의하여, PCPPn 대 산화 몰리브데넘의 중량비가 4:2가 되도록 두께 10nm로 공증착함으로써 정공 주입층(111)을 형성하였다.
이어서 정공 주입층(111) 위에, PCPPn을 증착에 의하여 두께 30nm로 퇴적하여 정공 수송층(112)을 형성하였다.
다음으로, 구조식(ii)으로 나타내어지는 7-[4-(10-페닐-9-안트릴)페닐]-7H-다이벤조[c,g]카바졸(약칭: cgDBCzPA)과 구조식(viii)으로 나타내어지는 3,10-비스[N-(4-바이페닐)-N-(9,9-다이메틸-9H-플루오렌-2-일)아미노]나프토[2,3-b;7,6-b']비스벤조퓨란(약칭: 3,10FBi2Nbf(II))을 중량비 1:0.03(=cgDBCzPA:3,10FBi2Nbf(II))에서 두께 25nm로 공증착함으로써 발광층(113)을 형성하였다.
그리고, 발광층(113) 위에, cgDBCzPA를 증착에 의하여 두께 10nm로 퇴적한 다음, 구조식(iv)으로 나타내어지는 바소페난트롤린(약칭: BPhen)을 증착에 의하여 두께 15nm로 퇴적함으로써 전자 수송층(114)을 형성하였다.
전자 수송층(114)을 형성한 후, 플루오린화 리튬(LiF)을 증착에 의하여 두께 1nm로 퇴적함으로써 전자 주입층(115)을 형성하였다. 그리고, 알루미늄을 증착에 의하여 두께 200nm로 퇴적함으로써 음극(102)을 형성하였다. 이렇게 하여 본 실시예의 발광 소자 5가 제작되었다.
발광 소자 5의 소자 구조를 아래의 표에 나타내었다.
[표 9]
발광 소자 5는, 대기에 노출되지 않도록, 질소 분위기를 포함하는 글로브 박스에서 유리 기판을 사용하여 밀봉하였다(구체적으로는, 소자를 둘러싸도록 밀봉재를 도포하고, 밀봉 시에 UV 처리 및 80℃에서 1시간의 가열 처리를 수행하였음). 그리고, 이 발광 소자의 초기 특성을 측정하였다. 또한 이 측정은 실온에서 수행하였다.
도 78은 발광 소자 5의 휘도-전류 밀도 특성을 나타낸 것이다. 도 79는 발광 소자 5의 전류 효율-휘도 특성을 나타낸 것이다. 도 80은 발광 소자 5의 휘도-전압 특성을 나타낸 것이다. 도 81은 발광 소자 5의 전류-전압 특성을 나타낸 것이다. 도 82는 발광 소자 5의 외부 양자 효율-휘도 특성을 나타낸 것이다. 도 83은 발광 소자 5의 발광 스펙트럼을 나타낸 것이다.
[표 10]
도 78 내지 도 82 및 표 10에 따르면, 발광 소자 5는 1000cd/m2에서의 외부 양자 효율이 7.6%로 매우 높았다.
상술한 결과는, 치환기로서 플루오렌일아미노기 또는 바이페닐아미노기를 가지는 본 발명의 일 형태인 유기 화합물을 발광 소자의 발광 재료로서 사용하면, 발광 소자가 발광 스펙트럼이 예리하고 전류 효율이 높고 외부 양자 효율이 높다는 등, 특히 양호한 특성을 가진다는 것을 시사한다.
101: 양극, 102: 음극, 103: EL층, 111: 정공 주입층, 112: 정공 수송층, 113: 발광층, 114: 전자 수송층, 115: 전자 주입층, 116: 전하 발생층, 117: P형층, 118: 전자 릴레이층, 119: 전자 주입 버퍼층, 400: 기판, 401: 제 1 전극, 403: EL층, 404: 제 2 전극, 405: 밀봉재, 406: 밀봉재, 407: 밀봉 기판, 412: 패드, 420: IC칩, 501: 제 1 전극, 502: 제 2 전극, 503: EL층, 511: 제 1 발광 유닛, 512: 제 2 발광 유닛, 513: 전하 발생층, 601: 구동 회로부(소스선 구동 회로), 602: 화소부, 603: 구동 회로부(게이트선 구동 회로), 604: 밀봉 기판, 605: 밀봉재, 607: 공간, 608: 배선, 609: FPC(flexible printed circuit), 610: 소자 기판, 611: 스위칭 FET, 612: 전류 제어 FET, 613: 제 1 전극, 614: 절연물, 616: EL층, 617: 제 2 전극, 618: 발광 소자, 623: n채널 FET, 624: p채널 FET, 730: 절연막, 770: 평탄화 절연막, 772: 도전막, 782: 발광 소자, 783: 액적 토출 장치, 784: 액적, 785: 층, 786: 발광 물질을 포함하는 층, 788: 도전막, 901: 하우징, 902: 액정층, 903: 백라이트 유닛, 904: 하우징, 905: 드라이버 IC, 906: 단자, 951: 기판, 952: 전극, 953: 절연층, 954: 격벽층, 955: EL층, 956: 전극, 1001: 기판, 1002: 베이스 절연막, 1003: 게이트 절연막, 1006: 게이트 전극, 1007: 게이트 전극, 1008: 게이트 전극, 1020: 제 1 층간 절연막, 1021: 제 2 층간 절연막, 1022: 전극, 1024W: 발광 소자의 제 1 전극, 1024R: 발광 소자의 제 1 전극, 1024G: 발광 소자의 제 1 전극, 1024B: 발광 소자의 제 1 전극, 1025: 격벽, 1028: EL층, 1029: 음극, 1031: 밀봉 기판, 1032: 밀봉재, 1033: 투명 베이스 재료, 1034R: 적색 착색층, 1034G: 녹색 착색층, 1034B: 청색 착색층, 1035: 흑색 층(블랙 매트릭스), 1036: 오버코트층, 1037: 제 3 층간 절연막, 1040: 화소부, 1041: 구동 회로부, 1042: 주변부, 1400: 액적 토출 장치, 1402: 기판, 1403: 액적 토출 수단, 1404: 촬상 수단, 1405: 헤드, 1406: 점선, 1407: 제어 수단, 1408: 기억 매체, 1409: 화상 처리 수단, 1410: 컴퓨터, 1411: 마커, 1412: 헤드, 1413: 재료 공급원, 1414: 재료 공급원, 1415: 재료 공급원, 1416: 헤드, 2001: 하우징, 2002: 광원, 3001: 조명 장치, 5000: 표시 영역, 5001: 표시 영역, 5002: 표시 영역, 5003: 표시 영역, 5004: 표시 영역, 5005: 표시 영역, 7101: 하우징, 7103: 표시부, 7105: 스탠드, 7107: 표시부, 7109: 조작 키, 7110: 리모트 컨트롤러, 7201: 본체, 7202: 하우징, 7203: 표시부, 7204: 키보드, 7205: 외부 접속 포트, 7206: 포인팅 디바이스, 7210: 제 2 표시부, 7401: 하우징, 7402: 표시부, 7403: 조작 버튼, 7404: 외부 접속 포트, 7405: 스피커, 7406: 마이크로폰, 9033: 클래스프(clasp), 9034: 스위치, 9035: 전원 스위치, 9036: 스위치, 9038: 제어 스위치, 9310: 휴대 정보 단말, 9311: 표시 패널, 9312: 표시 영역, 9313: 힌지, 9315: 하우징, 9630: 하우징, 9631: 표시부, 9631a: 표시부, 9631b: 표시부, 9632a: 터치 패널 영역, 9632b: 터치 패널 영역, 9633: 태양 전지, 9634: 충방전 제어 회로, 9635: 배터리, 9636: DCDC 컨버터, 9637: 조작 키, 9638: 컨버터, 9639: 버튼
본 출원은 2017년 3월 17일에 일본 특허청에 출원된 일련 번호 2017-053054의 일본 특허 출원에 기초하고, 본 명세서에 그 전문이 참조로 통합된다.
본 출원은 2017년 3월 17일에 일본 특허청에 출원된 일련 번호 2017-053054의 일본 특허 출원에 기초하고, 본 명세서에 그 전문이 참조로 통합된다.
Claims (21)
- 제 1 항에 있어서,
상기 치환기는 치환 또는 비치환된 탄소수 1 내지 100의 지방족 탄화수소기, 치환 또는 비치환된 탄소수 3 내지 100의 지환식 탄화수소기, 치환 또는 비치환된 탄소수 6 내지 100의 방향족 탄화수소기, 치환 또는 비치환된 탄소수 1 내지 100의 헤테로 고리기, 혹은 치환 또는 비치환된 탄소수 12 내지 100의 다이아릴아미노기인, 유기 화합물. - 제 1 항에 있어서,
R1 내지 R12 중 적어도 하나는 탄소수 6 내지 100의 치환기를 나타내고,
나머지는 독립적으로 수소 또는 탄소수 1 내지 25의 치환기를 나타내는, 유기 화합물. - 제 1 항에 있어서,
R1 내지 R12 중 하나 또는 2개는 독립적으로 탄소수 6 내지 100의 치환기를 나타내고,
나머지는 독립적으로 수소 또는 탄소수 1 내지 25의 치환기를 나타내는, 유기 화합물. - 제 1 항에 있어서,
R2 및 R9 중 한쪽 또는 양쪽은 독립적으로 탄소수 6 내지 100의 치환기를 나타내고,
나머지는 독립적으로 수소 또는 탄소수 1 내지 25의 치환기를 나타내는, 유기 화합물. - 제 1 항에 있어서,
R3 및 R8 중 한쪽 또는 양쪽은 독립적으로 탄소수 6 내지 100의 치환기를 나타내고,
나머지는 독립적으로 수소 또는 탄소수 1 내지 25의 치환기를 나타내는, 유기 화합물. - 제 3 항 내지 제 6 항 중 어느 한 항에 있어서,
상기 탄소수 6 내지 100의 치환기는 치환 또는 비치환된 지방족 탄화수소기, 치환 또는 비치환된 지환식 탄화수소기, 치환 또는 비치환된 방향족 탄화수소기, 치환 또는 비치환된 헤테로 고리기, 혹은 치환 또는 비치환된 다이아릴아미노기인, 유기 화합물. - 제 3 항 내지 제 6 항 중 어느 한 항에 있어서,
상기 탄소수 1 내지 25의 치환기는 치환 또는 비치환된 지방족 탄화수소기, 치환 또는 비치환된 지환식 탄화수소기, 치환 또는 비치환된 방향족 탄화수소기, 혹은 치환 또는 비치환된 헤테로 고리기인, 유기 화합물. - 제 1 항에 있어서,
X1과 X2는 동일한 원자인, 유기 화합물. - 제 1 항에 있어서,
X1 및 X2는 산소 원자인, 유기 화합물. - 발광 소자로서,
제 1 항에 따른 유기 화합물을 포함하는, 발광 소자. - 전자 기기로서,
제 1 항에 따른 유기 화합물; 및
센서, 조작 버튼, 스피커, 및 마이크로폰 중 적어도 하나를 포함하는, 전자 기기.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020237044981A KR20240006089A (ko) | 2017-03-17 | 2018-03-08 | 유기 화합물, 발광 소자, 발광 장치, 전자 기기, 표시 장치, 및 조명 장치 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JPJP-P-2017-053054 | 2017-03-17 | ||
| JP2017053054 | 2017-03-17 | ||
| PCT/IB2018/051496 WO2018167612A1 (en) | 2017-03-17 | 2018-03-08 | Organic compound, light-emitting element, light-emitting device, electronic device, display device, and lighting device |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020237044981A Division KR20240006089A (ko) | 2017-03-17 | 2018-03-08 | 유기 화합물, 발광 소자, 발광 장치, 전자 기기, 표시 장치, 및 조명 장치 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20190129946A true KR20190129946A (ko) | 2019-11-20 |
Family
ID=63521929
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020237044981A KR20240006089A (ko) | 2017-03-17 | 2018-03-08 | 유기 화합물, 발광 소자, 발광 장치, 전자 기기, 표시 장치, 및 조명 장치 |
| KR1020197030464A KR20190129946A (ko) | 2017-03-17 | 2018-03-08 | 유기 화합물, 발광 소자, 발광 장치, 전자 기기, 표시 장치, 및 조명 장치 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020237044981A KR20240006089A (ko) | 2017-03-17 | 2018-03-08 | 유기 화합물, 발광 소자, 발광 장치, 전자 기기, 표시 장치, 및 조명 장치 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US11930703B2 (ko) |
| JP (2) | JP7050541B2 (ko) |
| KR (2) | KR20240006089A (ko) |
| CN (1) | CN110446715B (ko) |
| DE (1) | DE112018001414T5 (ko) |
| TW (2) | TWI829571B (ko) |
| WO (1) | WO2018167612A1 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20190044561A (ko) * | 2017-10-20 | 2019-04-30 | 주식회사 엘지화학 | 다환 화합물 및 이를 포함하는 유기 발광 소자 |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6798026B2 (ja) * | 2016-11-23 | 2020-12-09 | エルジー・ケム・リミテッド | 電気活性化合物 |
| US10777752B2 (en) | 2018-10-09 | 2020-09-15 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence device and electronic apparatus provided with the same |
| WO2020075783A1 (ja) * | 2018-10-09 | 2020-04-16 | 出光興産株式会社 | 新規な化合物、有機エレクトロルミネッセンス素子、電子機器 |
| US10763444B2 (en) | 2018-10-09 | 2020-09-01 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence device and electronic apparatus provided with the same |
| WO2020075769A1 (ja) * | 2018-10-09 | 2020-04-16 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子及びそれを用いた電子機器 |
| WO2020096021A1 (ja) * | 2018-11-07 | 2020-05-14 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子及びそれを用いた電子機器 |
| KR20210154262A (ko) * | 2019-05-10 | 2021-12-20 | 듀폰 일렉트로닉스, 인크. | 전기활성 화합물 |
| TW202130644A (zh) | 2019-12-12 | 2021-08-16 | 日商半導體能源研究所股份有限公司 | 有機化合物、發光器件、光學器件、發光裝置、電子裝置及照明設備 |
| CN114220922A (zh) * | 2021-11-18 | 2022-03-22 | 华中科技大学 | 一种原位钝化热蒸发钙钛矿材料的方法 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014237682A (ja) | 2008-07-14 | 2014-12-18 | グレイセル・ディスプレイ・インコーポレーテッドGracel Display Inc. | 新規の有機電界発光化合物およびこれを使用する有機電界発光素子 |
Family Cites Families (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102005023437A1 (de) * | 2005-05-20 | 2006-11-30 | Merck Patent Gmbh | Verbindungen für organische elektronische Vorrichtungen |
| US8049411B2 (en) * | 2008-06-05 | 2011-11-01 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescence device and organic electroluminescence device using the same |
| JP5498681B2 (ja) * | 2008-10-02 | 2014-05-21 | 山本化成株式会社 | 有機トランジスタ |
| US10570113B2 (en) | 2010-04-09 | 2020-02-25 | Semiconductor Energy Laboratory Co., Ltd. | Aromatic amine derivative, light-emitting element, light-emitting device, electronic device, and lighting device |
| JP2012169550A (ja) * | 2011-02-16 | 2012-09-06 | Tokai Rika Co Ltd | 有機半導体材料 |
| JP6012148B2 (ja) | 2011-08-22 | 2016-10-25 | ユー・ディー・シー アイルランド リミテッド | 有機電界発光素子、化合物、並びに該素子を用いた発光装置、表示装置及び照明装置 |
| JP6100476B2 (ja) * | 2012-04-27 | 2017-03-22 | ユー・ディー・シー アイルランド リミテッド | 有機電界発光素子、有機電界発光素子用材料並びに該有機電界発光素子を用いた発光装置、表示装置及び照明装置 |
| JP2013234151A (ja) | 2012-05-09 | 2013-11-21 | Idemitsu Kosan Co Ltd | 縮合多環芳香族化合物及びそれを用いた有機薄膜トランジスタ |
| WO2013173396A2 (en) | 2012-05-15 | 2013-11-21 | Plextronics, Inc. | Hole transport materials including oled applications |
| JP6312960B2 (ja) | 2012-08-03 | 2018-04-18 | 株式会社半導体エネルギー研究所 | 発光素子、発光装置、電子機器、照明装置及び複素環化合物 |
| JP5896863B2 (ja) | 2012-08-27 | 2016-03-30 | 富士フイルム株式会社 | 有機薄膜トランジスタ、有機半導体薄膜および有機半導体材料 |
| JP5975834B2 (ja) * | 2012-10-15 | 2016-08-23 | 富士フイルム株式会社 | 有機薄膜トランジスタ、有機半導体薄膜および有機半導体材料 |
| KR101900287B1 (ko) | 2012-12-11 | 2018-09-19 | 덕산네오룩스 주식회사 | 유기전기 소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| US9496503B2 (en) | 2013-03-25 | 2016-11-15 | Semiconductor Energy Laboratory Co., Ltd. | Organic compound, light-emitting element, light-emitting device, electronic device, and lighting device |
| KR102399864B1 (ko) | 2013-03-26 | 2022-05-20 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 유기 화합물, 발광 소자, 발광 장치, 표시 장치, 전자 기기 및 조명 장치 |
| KR102191995B1 (ko) | 2013-10-22 | 2020-12-17 | 삼성디스플레이 주식회사 | 축합환 화합물 및 이를 포함한 유기 발광 소자 |
| JP6363496B2 (ja) * | 2014-12-25 | 2018-07-25 | 富士フイルム株式会社 | 有機半導体インク、有機半導体膜、並びに、有機半導体素子及びその製造方法 |
| KR102312728B1 (ko) | 2015-03-26 | 2021-10-14 | 덕산네오룩스 주식회사 | 유기전기 소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| KR102417039B1 (ko) | 2015-08-20 | 2022-07-05 | 덕산네오룩스 주식회사 | 유기전기 소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| KR102420475B1 (ko) | 2015-09-18 | 2022-07-13 | 덕산네오룩스 주식회사 | 유기전기소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| KR20170077806A (ko) * | 2015-12-28 | 2017-07-06 | 에스에프씨 주식회사 | 신규한 헤테로고리 화합물 및 이를 포함하는 유기 발광 소자 |
| JP6798026B2 (ja) | 2016-11-23 | 2020-12-09 | エルジー・ケム・リミテッド | 電気活性化合物 |
| CN112961167A (zh) | 2017-04-07 | 2021-06-15 | 株式会社半导体能源研究所 | 有机化合物、发光元件、发光装置、电子设备、显示装置及照明装置 |
| WO2018194035A1 (ja) | 2017-04-17 | 2018-10-25 | 出光興産株式会社 | 新規化合物、それを用いた有機エレクトロルミネッセンス素子用材料、有機エレクトロルミネッセンス素子及び電子機器 |
| KR20190059448A (ko) | 2017-11-23 | 2019-05-31 | (재)한국건설생활환경시험연구원 | 용기의 시험 장치 및 방법 |
| KR102608414B1 (ko) * | 2018-06-22 | 2023-12-01 | 삼성디스플레이 주식회사 | 축합환 화합물 및 이를 포함한 유기 발광 소자 |
-
2018
- 2018-03-08 KR KR1020237044981A patent/KR20240006089A/ko active Search and Examination
- 2018-03-08 US US16/486,181 patent/US11930703B2/en active Active
- 2018-03-08 WO PCT/IB2018/051496 patent/WO2018167612A1/en active Application Filing
- 2018-03-08 CN CN201880018078.2A patent/CN110446715B/zh active Active
- 2018-03-08 KR KR1020197030464A patent/KR20190129946A/ko not_active Application Discontinuation
- 2018-03-08 DE DE112018001414.2T patent/DE112018001414T5/de active Pending
- 2018-03-15 TW TW112111485A patent/TWI829571B/zh active
- 2018-03-15 TW TW107108778A patent/TWI798205B/zh active
- 2018-03-16 JP JP2018049594A patent/JP7050541B2/ja active Active
-
2022
- 2022-03-29 JP JP2022053255A patent/JP7278449B2/ja active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014237682A (ja) | 2008-07-14 | 2014-12-18 | グレイセル・ディスプレイ・インコーポレーテッドGracel Display Inc. | 新規の有機電界発光化合物およびこれを使用する有機電界発光素子 |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20190044561A (ko) * | 2017-10-20 | 2019-04-30 | 주식회사 엘지화학 | 다환 화합물 및 이를 포함하는 유기 발광 소자 |
| US11618757B2 (en) | 2017-10-20 | 2023-04-04 | Lg Chem, Ltd. | Polycyclic compound and organic light emitting element comprising same |
Also Published As
| Publication number | Publication date |
|---|---|
| TWI798205B (zh) | 2023-04-11 |
| JP2022100324A (ja) | 2022-07-05 |
| JP2018157209A (ja) | 2018-10-04 |
| JP7278449B2 (ja) | 2023-05-19 |
| KR20240006089A (ko) | 2024-01-12 |
| US11930703B2 (en) | 2024-03-12 |
| TW202328143A (zh) | 2023-07-16 |
| TW201838999A (zh) | 2018-11-01 |
| CN110446715B (zh) | 2022-11-08 |
| DE112018001414T5 (de) | 2019-11-28 |
| JP7050541B2 (ja) | 2022-04-08 |
| TWI829571B (zh) | 2024-01-11 |
| CN110446715A (zh) | 2019-11-12 |
| US20190393420A1 (en) | 2019-12-26 |
| WO2018167612A1 (en) | 2018-09-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7278449B2 (ja) | 発光素子、発光装置、電子機器、表示装置及び照明装置 | |
| TWI813561B (zh) | 有機化合物、發光元件、發光裝置、電子裝置、顯示裝置及照明設備 | |
| TWI766926B (zh) | 有機化合物、發光元件、發光裝置、電子裝置、顯示裝置、及照明裝置 | |
| TW202035383A (zh) | 發光元件、發光裝置、電子裝置、及照明裝置 | |
| JP7296953B2 (ja) | 有機化合物、発光素子、発光装置、電子機器、照明装置、及び電子デバイス | |
| JP7086944B2 (ja) | 有機化合物、発光素子、発光装置、電子機器、照明装置および電子デバイス | |
| TW202415664A (zh) | 有機化合物、發光元件、發光裝置、電子裝置、顯示裝置及照明設備 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |