KR20190128626A - Nhe-매개 역수송의 저해제 - Google Patents
Nhe-매개 역수송의 저해제 Download PDFInfo
- Publication number
- KR20190128626A KR20190128626A KR1020197023351A KR20197023351A KR20190128626A KR 20190128626 A KR20190128626 A KR 20190128626A KR 1020197023351 A KR1020197023351 A KR 1020197023351A KR 20197023351 A KR20197023351 A KR 20197023351A KR 20190128626 A KR20190128626 A KR 20190128626A
- Authority
- KR
- South Korea
- Prior art keywords
- bis
- tetrahydroisoquinolin
- compound
- dioxo
- methyl
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/55—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound the modifying agent being also a pharmacologically or therapeutically active agent, i.e. the entire conjugate being a codrug, i.e. a dimer, oligomer or polymer of pharmacologically or therapeutically active compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/472—Non-condensed isoquinolines, e.g. papaverine
- A61K31/4725—Non-condensed isoquinolines, e.g. papaverine containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/10—Laxatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/12—Drugs for disorders of the metabolism for electrolyte homeostasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D217/00—Heterocyclic compounds containing isoquinoline or hydrogenated isoquinoline ring systems
- C07D217/02—Heterocyclic compounds containing isoquinoline or hydrogenated isoquinoline ring systems with only hydrogen atoms or radicals containing only carbon and hydrogen atoms, directly attached to carbon atoms of the nitrogen-containing ring; Alkylene-bis-isoquinolines
- C07D217/04—Heterocyclic compounds containing isoquinoline or hydrogenated isoquinoline ring systems with only hydrogen atoms or radicals containing only carbon and hydrogen atoms, directly attached to carbon atoms of the nitrogen-containing ring; Alkylene-bis-isoquinolines with hydrocarbon or substituted hydrocarbon radicals attached to the ring nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Epidemiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Other In-Based Heterocyclic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Medicinal Preparation (AREA)
Abstract
본 개시내용은, 하기 화합물 (I') 및 체액저류 또는 염 과부하, 예컨대 심부전(특히, 울혈성 심부전), 만성 신장병, 말기 신질환, 간질환, 및 페록시좀 증식체-활성화 수용체(PPAR) 감마 작용제-유발성 체액저류와 관련된 장애의 치료를 위한 방법에서의 이의 용도에 관한 것이다. 본 개시내용은 또한 화합물 (I') 및 고혈압의 치료를 위한 방법에서의 이의 용도에 관한 것이다. 본 개시내용은 또한 화합물 (I') 및 위장관 장애와 관련된 통증의 치료 또는 감소를 포함하는, 위장관 장애의 치료를 위한 방법에서의 이의 용도에 관한 것이다.
Description
본 출원은 2017년 1월 9일자로 출원된 미국 가출원 특허 제62/444,338호에 대한 우선권 및 유익을 주장하며, 이 기초출원은 본 명세서에 그의 전문이 참고로 편입된다.
기술분야
본 개시내용은 나트륨 이온 및 수소 이온의 NHE-매개 역수송을 저해하기 위한 위장관에서 실질적으로 활성인 테트라하이드로아이소퀴놀린 유도체, 및 위장관 장애와 관련된 통증의 치료 또는 통증의 감소를 비롯한, 체액저류 또는 염 과부하와 관련된 장애의 치료에서 그리고 위장관 장애의 치료에서 이러한 화합물의 용도에 관한 것이다.
체액저류
및 염 과부하와 관련된 장애
미국 심장 협회에 따르면, 5백만명 초과의 미국인이 심부전으로 고통받았고, 울혈성 심부전(heart failure: CHF)의 추정되는 550,000건의 사례가 매년 일어난다(Schocken, D. D. et al., Prevention of heart failure: a scientific statement from the American Heart Association Councils on Epidemiology and Prevention, Clinical Cardiology, Cardiovascular Nursing, and High Blood Pressure Research; Quality of Care and Outcomes Research Interdisciplinary Working Group; 및 Functional Genomics and Translational Biology Interdisciplinary Working Group: Circulation, v. 117, no. 19, p. 2544-2565 (2008)). 울혈성 심부전의 임상 증후군은 심장 기능장애가 말초 조직의 적절한 관류를 방지할 때 일어난다. CHF를 야기하는 심부전의 가장 통상적인 형태는 심근의 수축 부전에 의해 야기되는 심장수축성 심부전이다. CHF의 주요 원인은 경색이 있는 또는 없는 허혈성 관상동맥질환에 기인한다. 오래된 고혈압은 불량하게 제어될 때 CHF를 야기할 수 있다.
CHF를 갖는 환자에서, 신경호르몬 보상성 메커니즘(즉, 교감신경계 및 레닌-안지오텐신계)은 정상 순환을 유지하기 위한 노력에서 활성화된다. 레닌-안지오텐신계는 혈장 레닌, 안지오텐신 II, 및 알도스테론의 증가된 수준을 야기하는 감소된 심박출량에 반응하여 활성화된다. 심장에서 혈액 용적이 증가함에 따라, 심박출량은 심장이 추가로 팽창할 수 없는 지점에 대해 비례하여 증가한다. 심부전에서, 심수축능은 감소되며, 따라서 심장은 박출량을 유지하기 위해 더 높은 용적 및 더 높은 충만압에서 작용한다. 충만압은 종국적으로 폐 내로 유체의 누출 및 울혈성 증상(예를 들어, 부종, 숨가쁨)을 야기하는 수준으로 증가될 수 있다. 모든 이들 증상은 유체 용적 및 염 저류와 관련되며, 이런 만성 유체 및 염 과부하는 추가로 질환 진행에 기여한다.
의약 섭생에 의한 그리고 식이성 나트륨 제한에 의한 순응은 심부전이 있는 환자에 대한 자기-관리의 중요한 성분이며, 수명을 늘이거나, 입원 기간을 감소시키며, 삶의 질을 개선시킨다. 의사는 종종 심부전을 갖는 사람에 대해 1일당 2.3g 미만 및 1일당 2g 이하의 염 섭취를 유지하는 것으로 권장된다. 대부분의 사람들은 이보다 상당히 더 많이 먹으며, 따라서 울혈성 심부전이 있는 사람은 식이성 염을 감소시키는 방법을 발견할 필요가 있을 가능성이 있다.
다수의 약물 요법은 현재 CHF로 고통받는 환자에 대해 존재한다. 예를 들어, 이뇨제는 용적을 감소시킴으로써, 그리고 결과적으로, 폐부종을 야기하는 것 미만으로 압력을 채움으로써 울혈을 완화하기 위해 사용되거나 또는 투여될 수 있다. 용적 증가에 대응함으로써, 이뇨제는 심박출량을 감소시키지만; 그러나, 피로 및 현기증은 CHF 증상을 대체할 수 있다. 현재 사용 중인 이뇨제의 부류 또는 유형 중에 티아자이드가 있다. 티아자이드는 신장에서 NaCl 수송을 저해함으로써, 헨레 고리(loop of Henle)의 말단 부분 및 원위 곡뇨 세관의 근위 부분에서 피질 희석 분절(cortical diluting segment) 내 Na의 재흡수를 방지한다. 그러나, 사구체 여과율(glomerular filtration rate: GFR)이 30㎖/분 미만일 때 이들 약물은 효과적이지 않다. 추가적으로, 티아자이드뿐만 아니라 다른 이뇨제는 저칼륨혈증을 야기할 수 있다. 또한 현재 사용 중인 이뇨제의 부류 또는 유형 중에 루프 이뇨제(예를 들어, 푸로세마이드)가 있다. 이들은 가장 강한 이뇨제이며, 폐 부종을 치료하는 데 특히 효과적이다. 루프 이뇨제는 NaKCl 수송 시스템을 저해하며, 헨레 고리 내 Na의 재흡수를 방지한다.
고용량의 이뇨제를 받음에도 불구하고 지속적 부종을 갖는 환자는 이뇨제-내성이거나 또는 이뇨제 내성으로 될 수 있다. 이뇨제 내성은 약물의 불량한 이용 가능성에 의해 야기될 수 있다. CHF 집단에서 높은 발생을 갖는 신부전을 갖는 환자에서, 내인성 산은 네프론의 관 내강에서 유기산 분비 경로에 대해 루프 이뇨제, 예컨대 푸로세마이드와 경쟁한다. 따라서 적절한 양의 약물의 네프론 내로의 유입을 달성하기 위해 더 고용량 또는 지속적 주입이 필요하다. 그러나, 최근의 메타-분석은 CHF의 치료에서 이뇨제의 만성 사용의 장기간 위험에 관한 인식을 상승시켰다. 예를 들어, 최근의 연구에서(Ahmed et al., Int J Cardiol. 2008 April 10; 125(2): 246-253) 만성 이뇨제 용도는 안지오텐신 전환 저해제 및 이뇨제를 받는 심부전이 있는 이동하는 노인에서 상당히 증가된 사망률 및 입원기간과 관련되었다는 것이 나타났다.
앤지오텐신-전환 효소("Angiotensin-converting enzyme: ACE") 저해제는 울혈성 심부전을 치료하기 위해 사용될 수 있는 다른 약물 요법의 예이다. ACE 저해제는 레닌-안지오텐신-알도스테론 시스템을 차단함으로써 혈관 확장을 야기한다. 비정상적으로 낮은 심박출량은 레닌을 방출시킴으로써 신장계가 반응하도록 야기할 수 있으며, 이어서, 안지오텐시노겐을 안지오텐신 I로 전환시킨다. ACE는 안지오텐신 I을 안지오텐신 II로 전환시킨다. 앤지오텐신 II는 시상하부에서 음수중추를 자극하며, 혈관수축을 야기하고, 따라서 혈압 및 정맥환류를 증가시킨다. 앤지오텐신 II는 또한 알도스테론이 방출되도록 야기하며, Na의 재흡수 및 유체의 동시 수동적 재흡수를 야기하고, 이는 결국 혈액 용적의 증가를 야기한다. ACE 저해제는 이런 보상 시스템을 차단시키며, 전신 및 폐 혈관 저항을 감소시킴으로써 심장 성능을 개선시킨다. ACE 저해제는 생존 이점을 나타내었고, 관례적으로 CHF에 대한 선택 치료였다. 그러나, ACE 저해제는 K-분비 호르몬인 알도스테론을 낮추기 때문에, 그들의 사용의 부작용 중 하나는 고칼륨혈증이다. 추가로, ACE 저해제는 CHF 환자의 소정의 범주에서 급성 신부전을 야기하는 것으로 나타났다. (예를 들어, 문헌[C.S. Cruz et al., "Incidence and Predictors of Development of Acute Renal Failure Related to the Treatment of Congestive Heart Failure with ACE Inhibitors, Nephron Clin. Pract., v. 105, no. 2, pp c77-c83(2007)] 참조).
말기 신장 질환(end stage renal disease: "ESRD"), 즉, 5기 만성 신부전이 있는 환자는 1주마다 3회로 혈액투석을 받아야 한다. 신기능의 준-부재(quasi-absence) 및 염 및 유체를 제거하는 능력은 유체 및 염이 신체에서 축적(나트륨/용적 과부하)됨에 따라 체중의 큰 변동을 야기한다. 유체 과부하는 투석간 체중 증가를 특징으로 한다. 높은 유체 과부하는 또한 심장 기능장애, 구체적으로는 CHF에 의해 악화된다. 투석은 요독성 독소를 제거하기 위해 그리고 또한 염 및 유체 항상성을 조절하기 위해 사용된다. 그러나, 환자가 과투석될 때, 증후성 투석중 저하증(symptomatic intradialytic hypotension: SIH)이 일어날 수 있다. SIH는 ESRD 집단의 약 15% 내지 25%에서 나타난다(Davenport, A., C. Cox, 및 R. Thuraisingham, Blood pressure control and symptomatic intradialytic hypotension in diabetic haemodialysis patients: a cross-sectional survey; Nephron Clin. Pract., v. 109, no. 2, p. c65-c71(2008)). 고혈압 및 CHF 환자에서와 같이, 염 및 유체의 식이 제한은 고도로 권장되지만, 저염식의 불량한 식미때문에 불량하게 이어진다.
원발성 또는 "본태성" 고혈압의 원인은 찾기 힘들다. 그러나, 몇몇 관찰은 1차 요인으로서 신장을 지적한다. 과량의 염 흡수 및 상승된 혈압에 대한 가장 강한 데이터는 10,000명 초과의 참여자의 횡단적 연구(cross-sectional study)인 INTERSALT로부터 유래된다. 개체에 대해, 24시간 나트륨 배설과 심장 수축기 혈압 사이에 상당한, 양의 독립적 선형 관계가 발견되었다. 더 높은 개개 24시간 소변 나트륨 배설은 평균적으로, 6 내지 3/3 내지 0㎜Hg로 더 높은 심장수축기/심장 확장기 혈압과 관련된다는 것이 발견되었다. 원발성 고혈압은 복잡한, 다인성 및 다중 유전자 특질의 전형적인 예이다. 모든 이들 단일유전자 고혈압 증후군은 레닌-안지오텐신-알도스테론 시스템의 다양한 성분의 함수의 증가를 수반하는 돌연변이 유전자로 사실상 국한되어, 과량의 신장 나트륨 저류를 야기한다. 넓은 의미에서, 이들 증후군은 나트륨 수송 시스템에서의 1차적 결함 또는 무기질코르티코이드 수용체 활성의 자극 중 하나를 통해 생기는 증가된 신장 나트륨 재흡수를 특징으로 한다(Altun, B., and M. Arici, 2006, Salt and blood pressure: time to challenge; Cardiology, v. 105, no. 1, p. 9-16 (2006)). 나트륨 감소가 확립된 고혈압을 감소시키는지의 여부를 결정하기 위해 최근 30년동안 고혈압 대상체에 대해 훨씬 다수의 통제 연구가 수행되었다. 이들 연구의 메타-분석은 고혈압 환자에서 혈압의 큰 감소를 분명하게 나타내었다.
말기 간 질환(ESLD)에서, 간경변증에 기인하여 복수, 부종 또는 흉수로서 유체의 축적은 통상적이며, 세포외 유체 용적 조절 메커니즘에서의 교란으로부터 초래된다. 체액저류는 ESLD의 가장 빈번한 합병증이며, 간경변증 진단의 10년 내에 환자의 약 50%에서 일어난다. 이 합병증은 만성 환자의 삶의 질을 상당히 손상시키며, 또한 불량한 예후와 관련된다. 1년 및 5년 생존율은 각각 85% 및 56%이다(Kashani et al., Fluid retention in cirrhosis; QJM, v. 101, no. 2, p. 71-85 (2008)). 가장 허용 가능한 이론은 간경변 환자에서 복수 형성의 초기 사건이 굴혈관 고혈압이라는 것을 상정한다. 정현 압력의 증가에 기인하는 문맥압 항진은 혈관확장 메커니즘을 활성화시킨다. 간경변증의 진행된 병기에서, 소동맥 혈관확장은 전신 동맥 혈관 공간의 이차성 부종을 야기한다. 효과적인 혈액 용적 감소를 통한 이런 사건은 동맥압의 하강을 야기한다. 결과적으로, 정상 혈액 항상성을 회복시키기 위해 레닌-안지오텐신 알도스테론 시스템, 교감신경계의 압수용체-매개 활성화 및 항이뇨제 호르몬의 비삼투성 방출이 일어난다. 이들 사건은 신장 나트륨 및 유체의 추가적인 저류를 야기한다. 내장신경 혈관확장은 림프 수송계 능력을 초과하여 내장신경 림프 생산을 증가시키며, 복막강 내로의 림프 누출을 야기한다. 복막강 내로 림프 누출에 추가로 증가된 내장 혈관 침투성과 함께 지속적인 신장 나트륨 및 체액저류는 지속된 복수 형성에서 중요한 역할을 한다.
티아졸리딘다이온(TZD's), 예컨대 로시글리타존은 2형 당뇨병의 치료를 위해 사용되는 페록시좀 증식체-활성화 수용체(PPAR)이며, 널리 처방된다. 불행하게도, 체액저류는 TZD's의 가장 통상적이고 심각한 부작용으로서 나타나며, 요법 중단의 가장 빈번한 원인이 되었다. TZD-유도 체액저류의 발생률은 단일요법에서 7%로부터 인슐린과 병용될 때 15%까지만큼 높다(Yan, T., Soodvilai, S., PPAR Research volume 2008, article ID 943614). 이러한 부작용에 대한 메커니즘은 충분히 이해되지 않지만, 신장에서의 Na 및 유체 재흡수와 관련될 수 있다. 그러나 TZD-유도된 체액저류는 이러한 유체 과부하를 감소시키도록 제안된, 루프 이뇨제 또는 티아자이드 이뇨제, 및 페록시좀 증식체-활성화 수용체(PPAR) 알파의 PPAR 감마 작용제와의 조합물에 대해 내성이 있으며, 주요 유해 심혈관 사건과 관련된다.
앞서 언급한 것을 고려하여, 염 및 유체 축적은 심부전(특히, 울혈성 심부전), 만성 신장병, 말기 신질환, 간질환 등을 포함하는 다수 질환의 이환율 및 사망률에 기여한다는 것이 인식된다. 또한 염 및 유체 축적은 고혈압에 대한 위험인자인 것으로 받아들여진다. 따라서, 의약이 필요한 환자에게 투여될 때, 나트륨 저류, 체액저류, 또는 둘 다의 감소를 야기하는 의약에 대한 분명한 필요가 있다. 이러한 의약은 또한 유체/Na 항상성의 신장 메커니즘을 수반하지 않거나 또는 달라 손상시키지 않을 것이다.
과량의 유체 과부하를 치료하도록 고려되는 한 가지 선택사항은 설사이다. 설사는, 예를 들어, 완하제, 예컨대 솔비톨, 폴리에틸렌글리콜, 비사코딜 및 페놀프탈레인을 포함하는 몇몇 제제에 의해 촉발될 수 있다. 솔비톨 및 폴리에틸렌글리콜은 저수준의 분비된 전해질에 의해 삼투성 설사를 촉발하며; 따라서, GI관으로부터 나트륨염을 제거함에 있어서 그들의 효용은 제한된다. 페놀프탈레인의 작용 메커니즘은 분명하게 확립되지 않지만, Na/K ATPase 및 Cl/HCO3 음이온 교환체의 저해 및 생물발전 음이온 분비의 자극에 의해 야기되는 것으로 생각된다(예를 들어, 문헌[Eherer, A. J., C. A. Santa Ana, J. Porter, 및 J. S. Fordtran, 1993, Gastroenterology, v. 104, no. 4, p. 1007-1012] 참조). 그러나, 일부 완하제, 예컨대 페놀프탈레인은 인간에서의 발암성의 잠재적 위험에 기인하여, 유체 과부하의 만성 치료를 위한 실행 가능한 선택이 아니다. 더 나아가, 완하제는 만성적으로 사용되지 않을 수도 있는데, 그들이 자극물인 것으로 나타났고 점막 손상을 야기하였기 때문이다. 따라서, 또한 염 및 유체 과부하를 제어하기 위한 노력의 부분으로서 만성 설사의 유도는 대부분의 환자에 대한 원치않는 치료 양상인 것으로 인식되어야 한다. 따라서 이 목적을 위해 GI관을 이용하는 임의의 의약은 실행적 이점을 갖기 위해 설사를 제어할 필요가 있을 것이다.
경증의 설사의 치료에 대한 한 가지 접근은 유체-흡수 중합체, 예컨대 천연 식물 섬유 차전자의 투여이다. 중합체 물질, 및 더 구체적으로는 하이드로겔 중합체는 또한 위장(GI)관으로부터 유체의 제거를 위해 사용될 수 있다. 이러한 중합체의 사용은, 예를 들어, 미국 특허 제4,470,975호 및 제6,908,609호에 기재되어 있으며, 이들의 전문은 모든 적절하고 일관된 목적을 위해 본 명세서에 참고로 편입된다. 그러나, 이러한 중합체가 상당한 양의 유체를 효과적으로 제거하기 위해, 그들은 GI관에 존재하는 정압 및 삼투압 범위에 바람직하게 저항하여야 한다. 인간을 비롯한 다수의 포유류는 약 70%의 물 함량을 갖는 연변을 만들며, 배설물 덩어리에 의해 부과되는 높은 유압 저항성에 대해 유체를 수송함으로써 그렇게 된다. 몇몇 연구는 약 80% 내지 약 60%의 배설물을 탈수시키는데 필요한 압력이 약 500 kPa 내지 약 1000kPa(즉, 약 5 내지 약 10atm)이라는 것을 나타낸다. (예를 들어, 문헌[McKie, A. T., W. Powrie, 및 R. J. Naftalin, 1990, Am J Physiol, v. 258, no. 3 Pt 1, p. G391-G394; Bleakman, D., 및 R. J. Naftalin, 1990, Am J Physiol, v. 258, no. 3 Pt 1, p. G377-G390; Zammit, P. S., M. Mendizabal, 및 R. J. Naftalin, 1994, J Physiol, v. 477 (Pt 3), p. 539-548.] 참조) 그러나, 관광내로 측정된 정압은 보통 약 6kPa 내지 약 15kPa이다. 배설물을 탈수시키는데 필요한 다소 높은 압력은 본질적으로 삼투 과정에 기인하며, 근력에 의해 생산되는 기계적 과정에 기인하지 않는다. 삼투압은 궁극적으로 고장액 흡수를 생산하는 만성 점막에 걸쳐 염의 활성 수송으로부터 생긴다. 생산된 삼투 구배는 내강으로부터 점막의 장막측까지 유동한다. 유체-흡수성 중합체, 예컨대 미국 특허 제4,470,975호 및 제6,908,609호에 기재된 것은 이러한 압력을 지속시키지 못할 수도 있다. 이러한 중합체는 염 흡수 과정이 무손상인 정상 결장에서 붕괴될 수 있고, 따라서 적당한 양의 유체를 제거하고, 이에 의해 염을 제거한다.
나트륨에 결합하는 합성 중합체가 또한 기재되었다. 예를 들어, 이온-교환 중합체 수지, 예컨대 다우엑스형(Dowex-type) 양이온 교환 수지는 약 1950년대 이래로 공지되었다. 그러나, 고칼륨혈증의 치료용으로 승인된 폴리스타이렌 설포네이트 염인 케이엑살레이트(Kayexalate)(상표명)(또는 키오넥스(Kionex)(상표명))를 제외하고, 양이온 교환 수지는 그들의 제한된 능력 및 불량한 양이온 결합 선택성에 적어도 부분적으로 기인하여, 약물로서 용도가 매우 제한되었다. 추가적으로, 이온-교환 공정 동안, 수지는 화학량론적 양의 외인성 양이온(예를 들어, H, K, Ca)을 방출할 수 있는데, 이는 결국 산성혈증(H), 고칼륨혈증(K)을 잠재적으로 야기할 수 있거나 또는 혈관 석회화(Ca)에 기여할 수 있다. 이러한 수지는 또한 변비를 야기할 수 있다.
위장관 장애
변비는 드물고 어려운 대변의 통과를 특징으로 하며, 12개월의 기간 내에 12 비연속적 주동안 환자가 구체화된 증상으로 고통받을 때 만성으로 된다. 만성 변비는 그것이 다른 질환에 의해 야기되지 않는다면 또는 의약의 사용에 의해 야기되지 않는다면, 특발성이다. 북미에서 만성 변비의 관리에 대한 증거 기반 접근은(Brandt et al., 2005, Am. J. Gastroenterol. 100(Suppl.1):S5-S21) 유병률이 일반 집단의 대략 15%라는 것을 나타내었다. 변비는 여성, 노인, 비백인 및 더 낮은 사회경제적 그룹으로부터의 개체에서 더 통상적으로 보고된다.
과민성 대장 증후군(IBS)은 운동성, 분비 및 내장 감각의 변경과 관련된 통상적인 GI 장애이다. 다양한 임상 증상은 대변 빈도 및 형태, 복통 및 복부팽만을 포함하는 이러한 장애를 특징으로 한다. IBS의 임상 증상의 인식은 아직 정해지지 않았지만, 이는 현재 통상적으로 설사-우세형 IBS(D-IBS) 및 변비-우세형 IBS(C-IBS)를 지칭하되, D-IBS는 어렵거나, 드물거나 또는 겉보기에 불완전한 분변으로서 제시되는 기능성 장애의 그룹으로서 묽은 변 또는 물변 및 C-IBS의 지속적 통로로서 정의된다. IBS의 병리생리학은 완전히 이해되지 않으며, 다수의 메커니즘이 제안되었다. 내장 과민성은 종종 주된 병인학적 역할을 하는 것으로 고려되며, 복통의 다른 원인으로부터 IBS를 구별하는 데 매우 유용한 생리학적 마커가 되는 것으로 제안되었다. 최근의 임상 연구에서(Posserud, I. et al, Gastroenterology, 2007;133:1113-1123) IBS 환자는 내장 민감도 검사(풍선 확장)를 받았고, 건강한 대상체와 비교되었다. 61%의 IBS 환자는 통증 및 불편함 역치로 측정하여 내장 감각능 변화가 있다는 것을 나타내었다. 다른 검토는 다양한 위장관 장애의 복통 증상에서 내장 과민성의 역할을 보고하였다(Akbar, A, et al, Aliment. Pharmaco. Ther., 2009, 30, 423-435; Bueno et al., Neurogastroenterol Motility (2007) 19 (suppl.1), 89-119). 결장 및 직장 팽창은 동물 및 인간 연구에서의 내장 민감성을 평가하기 위한 도구로서 널리 사용하였다. 내장 민감성을 유도하기 위해 사용되는 스트레스 유형은 모델에 따라 다르지만(예를 들어, 문헌[Eutamen, H Neurogastroenterol Motil. 2009 Aug 25. [Epub ahead of print]), 그러나 스트레스, 예컨대 부분적 내성 스트레스(Partial restraint stress: PRS)는 IBS 상황을 더 나타내는 것으로 고려되는 상대적으로 경증의, 비-궤양유발성 모델이다.
변비는 칼슘 보충제를 취한 노인, 특히 골다공증이 있는 환자에서 통상적으로 발견된다. 칼슘 보충제는 골밀도를 회복하는데 골다공증 환자에서 유리한 것으로 나타났지만 칼슘-유발 변비 효과때문에 순응은 불량하다.
오피오이드-유발성 변비(OIC)(또한 오피오이드-유발성 장 기능장애 또는 오피오이드 장 기능장애(OBD)로서 지칭됨)는 오피오이드 요법과 관련된 통상적인 유해 효과이다. OIC는 통상적으로 변비로서 기재되지만; 그러나, 이는 또한 복부 경련, 복부팽만, 및 위식도역류증을 포함하는, 유해한 위장(GI) 효과의 무리이다. 암이 있는 환자는 오피오이드 요법에 의해 보통 악화되는 질환-관련 변비를 가질 수 있다. 그러나, OIC는 암 환자로 제한되지 않는다. 비-암 유래 통증에 대해 오피오이드 요법을 취한 환자의 최근의 조사는 대조군에서의 7.6%에 비해, 대략 40%의 환자가 오피오이드 요법과 관련된 변비를 경험하였다(주당 3회 미만의 완전한 분변)는 것을 발견하였다. 완하제 요법이 필요한 대상체 중에서, 46%의 오피오이드-치료 환자(대조군 대상체, 84%)만이 50% 초과의 시간에 목적으로 하는 치료 결과를 달성한다는 것을 보고하였다(Pappagallo, 2001, Am. J. Surg. 182(5A Suppl.):11S-18S).
만성 특발성 변비에 걸린 일부 환자는 생활습관 개선, 식이요법 변화 및 증가된 유체 및 섬유 흡수로 성공적으로 치료될 수 있으며, 이들 치료는 일반적으로 처음 시도된다. 이들 접근에 반응하지 않은 환자에 대해, 의사는 전형적으로 완화제를 권장하는데, 이들 대부분은 처방전 없이 이용 가능하다. 처방전 없이 제공되는 완하제의 사용은 환자의 약 절반에 의해 비효율적인 것으로 판단된다(Johanson and Kralstein, 2007, Aliment. Pharmacol. Ther. 25(5):599-608). OIC를 포함하는 IBS 및 만성 변비의 치료를 위해 현재 처방되고 있거나 또는 임상 개발 중인 다른 치료적 선택사항은, 예를 들어: 문헌[Chang et al., 2006, Curr. Teat. Options Gastroenterol. 9(4):314-323; Gershon and Tack, 2007, Gastroenterology 132(1):397-414; 및 Hammerle and Surawicz, 2008, World J. Gastroenterol. 14(17):2639-2649]에 기재되어 있다. 이러한 치료는 세로토닌 수용체 리간드, 염화물 통로 활성체, 오피오이드 수용체 길항제, 구아닐레이트-사이클라제 수용체 작용제 및 뉴클레오타이드 P2Y(2) 수용체 작용제를 포함하지만, 이들로 제한되지 않는다. 다수의 이들 치료 선택사항은 부적절한데, 그들이 일부 환자에서 습관성, 비효과적인 것일 수 있거나, 장기간 유해 효과를 야기할 수 있거나, 또 다르게는 최선이 아닐 수 있기 때문이다.
Na
+
/ H
+
교환체(NHE) 저해제
GI관의 다수의 기능은 GI관이 노출된 사실상 모든 물 및 Na를 흡수함으로써 물/Na 항상성을 유지하는 것이다. 포유류 결장의 정단부 표면을 뒤덮는 표층은 점막을 가로지르는 방향 둘 다에서 다량의 염과 물을 이동시킬 수 있는 전형적인 전해질-수송 상피이다. 예를 들어, 매일 GI관은 약 9 리터의 유체 및 약 800 meq의 Na를 처리한다. (예를 들어, 문헌[Zachos et al., Molecular physiology of intestinal Na+/H+ exchange; Annu. Rev. Physiol., v. 67, p. 411-443(2005).] 참조) 약 1.5 리터의 이런 유체 및 약 150 meq의 이런 나트륨만이 섭취로부터 유래되며; 오히려, 대다수의 유체(예를 들어, 약 7.5 리터) 및 나트륨(약 650 meq)은 소화의 부분으로서 GI 기관을 통해 분비된다. 따라서 GI관은 전신 나트륨 및 유체 수준을 조절하기 위한 실행 가능한 표적을 나타낸다.
다수의 검토는 GI관의 생리학 및 분비 및/또는 흡수 메커니즘에 대해 공개되었다(예를 들어, 문헌[Kunzelmann et al., Electrolyte transport in the mammalian colon: mechanisms and implications for disease; Physiol. Rev., v. 82, no. 1, p. 245-289 (2002); Geibel, J. P.; Secretion and absorption by colonic crypts; Annu. Rev. Physiol, v. 67, p. 471-490 (2005); Zachos et al., 상기 참조; Kiela, P. R. et al., Apical NA+/H+ exchangers in the mammalian gastrointestinal tract; J. Physiol. Pharmacol., v. 57 Suppl. 7, p. 51-79 (2006)] 참조). Na 흡수의 2가지 주요한 메커니즘은 전기중립 및 생물발전 수송이다. 전기중립 수송은 본질적으로 Na+/H+ 역수송 NHE(예를 들어, NHE-3)에 기인하며 대량의 Na 흡수 초래한다. 전기중립 수송은 상피 나트륨 통로("ENaC")에 의해 제공된다. 전기중립 수송은 주로 회장 분절 및 근위 결장에 위치되며, 생물발전 수송은 원위 결장에 위치된다.
혈장막 NHE는 세포내 pH 및 용적의 유지, NaCl 및 NaHCO3의 세포 가로방향 흡수 및 상피세포에 의해, 특히 신장, 장, 담낭 및 침샘에서 수행되는 유체 균형뿐만 아니라 전신 pH의 조절에 기여한다. 심장보호 또는 신장 보호를 위한 허열 및 재관류와 관련된 장애를 치료하기 위해 전신 NHE에 대한 역할 및 임상 개입에 이바지한 문헌이 있다. NHE의 9가지 동형이 동정되었고(Kiela, P. R., et al.; Apical NA+/H+ exchangers in the mammalian gastrointestinal tract; J. Physiol. Pharmacol., v. 57 Suppl 7, p. 51-79 (2006)), 이 중 NHE-2, NHE-3 및 NHE-8은 수송에 더 큰 기여를 제공하는 NHE-3과 함께 GI관의 정점측 상에서 발현된다. 다른, 이제 동정될, Cl-의존적 NHE는 래트 세포의 움(crypt)에서 동정되었다. 추가로, 많은 연구가 NHE의 저해제를 동정하는 데 이바지하였다. 이러한 연구의 1차 표적은 NHE-1 및 NHE-3이었다. 소분자 NHE 저해제는, 예를 들어, 미국 특허 5,866,610; 6,399,824; 6,911,453; 6,703,405; 6,005,010; 6,736,705; 6,887,870; 6,737,423; 7,326,705; 5,824,691(WO 94/026709); 6,399,824(WO 02/024637); 미국 특허 공개 2004/0039001(WO 02/020496); 2005/0020612(WO 03/055490); 2004/0113396(WO 03/051866); 2005/0020612; 2005/0054705; 2008/0194621; 2007/0225323; 2004/0039001; 2004/0224965; 2005/0113396; 2007/0135383; 2007/0135385; 2005/0244367; 2007/0270414; 국제 특허 출원 공개 WO 01/072742; WO 01/021582(CA2387529); WO 97/024113(CA02241531) 및 유럽 특허 EP0744397(CA2177007)에 기재되며; 이들 모두는 모든 적절하고 일관된 목적을 위해 그들의 전문이 본 명세서에 참고로 편입된다.
그러나, 이러한 연구는 최근에 WO 2010/078449에 개시된 바와 같이 흡수되지 않고(즉, 전신이 아님) 위장관을 표적화하지 않는 NHE 저해제의 값 또는 중요성을 개발하거나 인식하지 못하였다. 이러한 저해제는 체액저류 및 염 과부하와 관련된 장애의 치료에서 그리고 위장관 장애와 관련된 통증의 치료 또는 감소를 포함하는 GI관 장애의 치료에서 이용될 수 있다. 이러한 저해제는 그들은 전신의 표적 상 또는 비표적(off-target) 효과의 두려움이 감소된 채로(예를 들어, 신장 관여 또는 다른 전신 효과의 위험이 거의 없거나 또는 없음) 전달될 수 있기 때문에 특히 유리하다.
따라서, 앞서 언급한 분야에서 진전이 있었지만, 체액저류 및 염 과부하와 관련된 장애에서 그리고 위장관 장애와 관련된 통증의 치료 또는 감소를 포함하는 위장관 장애의 치료에서 사용하기 위한 신규한 화합물에 대한 당업계의 필요가 남아있다. 본 발명은 이런 필요를 충족시키며, 추가적인 관련된 이점을 제공한다.
간략하게, 본 발명은 나트륨 이온 및 수소 이온의 NHE-매개 역수송을 저해하기 위한 위장관에서 실질적으로 활성인 화합물, 및 위장관 장애와 관련된 통증의 치료 또는 통증의 감소를 비롯한, 체액저류 및 염 과부하와 관련된 장애의 치료에서 그리고 위장관 장애의 치료에서 이러한 화합물의 용도에 관한 것이다.
본 발명의 일 양상에서 하기 화학식 I'의 화합물 및 이의 약제학적으로 허용 가능한 염, 프로드러그, 용매화물, 수화물, 이성질체, 또는 호변이성질체가 제공된다,
식 중:
링커는 -R13-(CHR13)p-[Y-(CH2)r]s-Z-R13-(CH2)t-Z-이며;
Q는 결합 또는 -NHC(O)NH-이고;
Z는 독립적으로, 각각의 경우에, 결합, C(O) 또는 -C(O)NH-이며;
Y는 독립적으로, 각각의 경우에, O, S, NH, N(C1-C3알킬) 또는 -C(O)NH-이고;
X는 결합, NH, O, CR11R12, CR11, C 또는 -NHC(O)NH-이며;
n은 2 내지 4의 정수이며;
r 및 p는 독립적으로, 각각의 경우에, 0 내지 8의 정수이고;
s는 0 내지 4의 정수이며;
t는 0 내지 4의 정수이고;
u는 0 내지 2의 정수이며;
R1 및 R2는 독립적으로 할로겐, OH, CN, C1-C6알킬, C1-C6알콕시, C1-C6할로알킬, C1-C6할로알콕시 또는 -C(O)NR9R10이고;
R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴, N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴, -SR9, -OR9, -NHR9, -NR9R10, -S(O)2N(R9)2-, -S(O)2R9, -C(O)R9, -C(O)OR9, -NR9S(O)2R10, -S(O)R9, -S(O)NR9R10, -NR8S(O)R9이며;
R7은 독립적으로 각각의 경우에, H, C1-C6알킬, 또는 C1-C6할로알킬이고;
R8은 독립적으로 각각의 경우에, 결합, H, C1-C6알킬, C4-C8사이클로알켄일 , C3-C8사이클로알킬, 헤테로사이클릴, 아릴 또는 헤테로아릴이되, 각각의 사이클로알켄일, 사이클로알킬, 헤테로사이클릴, 아릴 또는 헤테로아릴은 하나 이상의 R17로 선택적으로 치환되거나; 또는
R7 및 R8은 그들이 부착된 원자와 함께 조합되어 독립적으로 각각의 경우에, 헤테로사이클릴 또는 N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴을 형성하되, 각각의 헤테로사이클릴 또는 헤테로아릴은 하나 이상의 R17로 선택적으로 치환되며;
R9 및 R10은 독립적으로 H, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴, 또는 N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴이고,
R11 및 R12는 독립적으로 H, C1-C6알킬, OH, NH2, CN 또는 NO2이며;
R13, R14, R15 및 R16은 독립적으로 각각의 경우에, H, OH, NH2 또는 C1-C3 알킬이되, 상기 알킬은 하나 이상의 R17로 선택적으로 치환되고; 그리고
R17은 독립적으로 각각의 경우에, H, OH, NH2, 옥소, C1-C6알킬, C1-C6할로알킬, 또는 C1-C6알콕시이며;
단:
(1) X가 결합, O 또는 CR11R12일 때, n은 2이고;
(2) n이 3일 때, X는 CR11 또는 NH이며;
(3) n이 4일 때, X는 C이고;
(4) Q 또는 X 중 하나만이 이 때에 -NHC(O)NH-이며;
본 발명의 다른 양상에서, 하기 화학식 (I)의 화합물 및 이의 약제학적으로 허용 가능한 염, 프로드러그, 용매화합물, 수화물, 이성질체 및 호변이성질체가 제공된다:
식 중:
링커는 -(CHR8)p-[Y-(CH2)r]s-Z-R8-(CH2)t-Z-이고;
Q는 결합 또는 -NHC(O)NH-이며;
Z는 독립적으로 각각의 경우에, 결합, C(O) 또는 -C(O)NH-이고;
Y 은 독립적으로 각각의 경우에, O, S, NH, N(C1-C3알킬) 또는 -C(O)NH-이며;
X는 결합, N, O, CR11R12, CR11, C 또는 -NHC(O)NH-이고;
n은 2 내지 4의 정수이며;
r 및 p는 독립적으로 각각의 경우에 0 내지 8의 정수이고;
s는 0 내지 4의 정수이며;
t는 0 내지 4의 정수이고;
u는 0 내지 2의 정수이며;
R1 및 R2는 독립적으로 할로겐, OH, CN, C1-C6알킬, C1-C6알콕시, C1-C6할로알킬, C1-C6할로알콕시 또는 -C(O)NR9R10이고;
R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴, N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴, -SR9, -OR9, -NHR9, -NR9R10, -S(O)2N(R9)2-, -S(O)2R9, -C(O)R9, -C(O)OR9, -NR9S(O)2R10, -S(O)R9, -S(O)NR9R10, -NR8S(O)R9이며;
R7은 독립적으로 각각의 경우에, H, C1-C6알킬, 또는 C1-C6할로알킬이고;
R8은 독립적으로 각각의 경우에, 결합, H, C1-C6알킬, C4-C8사이클로알켄일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴 또는 헤테로아릴이되, 각각의 사이클로알켄일, 사이클로알킬, 헤테로사이클릴, 아릴 또는 헤테로아릴은 하나 이상의 R17로 선택적으로 치환되거나; 또는
R7 및 R8은 그들이 부착된 원자와 함께 조합되어 독립적으로 각각의 경우에, 헤테로사이클릴 또는 N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴을 형성할 수 있되, 각각의 헤테로사이클릴 또는 헤테로아릴은 하나 이상의 R17로 선택적으로 치환되고;
R9 및 R10은 독립적으로 H, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴 또는 N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴이며;
R11 및 R12는 독립적으로 H, C1-C6알킬, OH, NH2, CN 또는 NO2이고;
R13, R14, R15 및 R16은 독립적으로 각각의 경우에, H, OH, NH2 또는 C1-C3 알킬이되, 상기 알킬은 하나 이상의 R17로 선택적으로 치환되며; 그리고
R17은 독립적으로 각각의 경우에, H, OH, NH2, 옥소, C1-C6알킬, C1-C6할로알킬, 또는 C1-C6알콕시이고;
단:
(1) X가 결합, O 또는 CR11R12일 때, n은 2이고;
(2) n이 3일 때, X는 CR11 또는 N이며;
(3) n이 4일 때, X는 C이고;
(4) Q 또는 X 중 하나만이 이 때에 -NHC(O)NH-이며;
다른 양상에서, 상기 제시한 바와 같은 화합물, 또는 이의 입체이성질체, 약제학적으로 허용 가능한 염 또는 프로드러그, 및 약제학적으로 허용 가능한 담체, 희석제 또는 부형제를 포함하는 약제학적 조성물이 제공된다. 약제학적 조성물은 체액저류 또는 염 과부하와 관련된 질환 또는 장애를 치료하는 데 효과적일 수 있다. 약제학적 조성물은 본 명세서에 기재된 질환을 치료하는 데 사용하기 위한 본 발명의 화합물을 포함할 수 있다. 조성물은 본 발명의 적어도 하나의 화합물 및 약제학적으로 허용 가능한 담체를 함유할 수 있다.
본 발명의 다른 양상은 나트륨 및 수소 이온의 NHE-매개 역수송을 저해하는 방법에 관한 것이다. 상기 방법은 치료가 필요한 포유류에게 약제학적 유효량의 본 명세서에 기재된 화합물 또는 약제학적 조성물을 투여하는 단계를 포함한다.
다른 양상에서, 체액저류 또는 염 과부하와 관련된 장애를 치료하기 위한 방법이 제공된다. 상기 방법은 치료가 필요한 포유류에게 약제학적 유효량의 상기 제시한 바와 같은 화합물 또는 약제학적 조성물을 투여하는 단계를 포함한다. 본 발명은 나트륨 및 수소 이온의 NHE-매개 역수송을 저해할 수 있는 화합물을 추가로 제공한다. 본 발명의 화합물의 효능-안전성 프로파일은 다른 공지된 NHE-3 저해제에 비해 개선될 수 있다. 추가적으로, 본 기술은 또한 심부전(예컨대 울혈성 심부전), 만성 신장병, 말기 신질환, 고혈압, 본태성 고혈압, 원발성 고혈압, 염-민감성 고혈압, 간질환, 및 페록시좀 증식체-활성화 수용체(PPAR) 감마 작용제-유발성 체액저류, 위장 운동 장애, 과민성 장 증후군, 만성 변비, 만성 특발성 변비, 낭성 섬유증 환자에서 생기는 만성 변비, 만성 신장병 환자에서 생기는 만성 변비, 골다공증성 환자에서의 칼슘-유도성 변비, 오피오이드-유발성 변비, 기능성 위장 장애, 파킨슨병, 다발성 경화증, 위식도역류질환, 기능성 가슴쓰림, 소화불량, 기능성 소화불량, 비궤양성 소화불량, 위마비, 만성 가성 장폐색증, 크론병, 염증성 장 증후군으로서 지칭되는 궤양성 대장염 및 관련된 질환, 결장 가성 폐색증, 위궤양, 감염성 설사, 암(결장직장), "장 누수 증후군", 낭성 섬유증 위장 질환, 다기관 부전, 미세장염, 괴사성 장염, 알레르기- 아토피, 식품 알레르기, 감염(호흡기), 급성 염증(예를 들어, 패혈증, 전신 염증 반응 증후군), 만성 염증(관절염), 비만-유발성 대사 질환(예를 들어, 비알코올성 지방간염, I형 당뇨병, II형 당뇨병, 심혈관 질환), 신장 질환, 당뇨성 신장 질환, 간경변증, 비알코올성 지방간염, 비알코올성 지방산 간질환, 지방증, 원발성 경화성 담관염, 원발성 담즙성 담관염, 문맥 고혈압, 자가면역 질환(예를 들어, 1형 당뇨병, 셀리악 이차성 PTH, 강직성 척추염, 루푸스, 원형 탈모증, 류마티스성 관절염, 류마티스성 다발근통, 섬유근육통, 만성 피로 증후군, 쇼그렌 증후군, 백반증, 갑상선염, 혈관염, 심마진(두드러기), 레이노 증후군), 조현병, 자폐 범주성 장애, 간성뇌증, 소장 박테리아 과성장, 및 만성 알코올 중독, 속발성 부갑상샘 항진증(PTH), 셀리악병, 고인산혈증 등.을 포함하지만, 이들로 제한되지 않는 다수의 상이한 유형의 질환에 대해 사용될 수 있는 이점을 가진다. 본 기술의 추가적인 특징 및 이점은 이하의 발명을 실시하기 위한 구체적인 내용을 읽을 때 당업자에게 명확할 것이다.
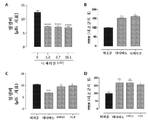
도 1A 내지 도 1D: 세포내 pH(pHi)에서 NHE3-독립적 변화는 회장 단일층 배양물에서 경상피 전기 저항을 조절한다는 것을 도시한 도면. 단일층 배양물에서의 공지된 NHE3 저해제인 테나파노 및 비히클(DMSO) 대조군과 비교되는 (A, B) 니제리신(nigericin) 및 (C, D) BAM15(3μM) 및 FCCP(3μM)에 의한 pHi 및 경상피 전기 저항(TEER)의 변화. *P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001 대 DMSO.
본 발명의 제1 양상은 하기 화학식의 화합물 및 이의 약제학적으로 허용 가능한 염, 프로드러그, 용매화물, 수화물, 이성질체, 또는 호변이성질체에 관한 것이다:
식 중: R1, R2, R3, R4, R5, R6, R7, R13, R14, R15, R16, n, u, X, Q 및 링커는 본 명세서에 기재된 바와 같다.
본 발명의 상세한 설명은 이하에 수반되는 설명에 제시된다. 본 명세서에 기재된 것과 유사하거나 또는 동일한 방법 및 물질은 본 발명의 실행 또는 시험에서 사용될 수 있지만, 예시적인 방법 및 물질을 이제 기재한다.
본 발명의 다른 특징, 대상 및 이점은 설명으로부터 그리고 청구범위로부터 분명하게 될 것이다. 본 명세서 및 첨부하는 청구범위에서, 단수 형태는 또한 달리 분명하게 나타내지 않는 한, 복수를 포함한다. 달리 정의되지 않는 한, 본 명세서에 사용되는 모든 기술적 및 과학적 용어는 본 발명이 속하는 기술분야의 당업자에 의해 통상적으로 이해되는 것과 동일한 의미를 가진다. 본 명세서에 인용되는 모든 환자 및 간행물은 그들의 전문이 본 명세서에 참고로 편입된다.
정의:
문맥에서 달리 요구되지 않는 한, 본 명세서 및 청구범위 전체적으로, 단어 "포함하다(comprise)" 및 이의 변형, 예컨대, "포함하다(comprises)" 및 "포함하는(comprising)"은 "포함하지만, 이들로 제한되지 않는" 개방, 포괄적 의미로 해석되어야 한다.
단수의 항목은 항목의 문법적 대상 중 하나 이상(즉, 적어도 하나)을 지칭하기 위해 본 명세서에서 사용된다. 예로서, "요소"는 하나의 요소 또는 하나 초과의 요소를 의미한다.
용어 "및/또는"은 달리 표시되지 않는 한, "및" 또는 "또는" 중 하나를 의미하기 위해 본 개시내용에서 사용된다.
본 명세서 전체적으로 "일 실시형태" 또는 "실시형태"에 대한 언급은 실시형태와 관련하여 기재된 특정 특성, 구조 또는 특징이 본 발명의 적어도 하나의 실시형태에 포함된다는 것을 의미한다. 따라서, 본 명세서 전체적으로 다양한 곳에서 어구 "일 실시형태에서" 또는 "실시형태에서"의 출현은 모두 동일한 실시형태에 관해 필수적이지는 않다. 더 나아가, 특정 특성, 구조 또는 특징은 하나 이상의 실시형태에서 임의의 적합한 방식으로 조합될 수 있다.
"아미노"는 -NH2 라디칼을 지칭한다.
"사이아노"는 -CN 라디칼을 지칭한다.
"하이드록시" 또는 "하이드록실"은 -OH 라디칼을 지칭한다.
"이미노"는 =NH 치환체를 지칭한다.
"나이트로"는 -NO2 라디칼을 지칭한다.
"옥소"는 =O 치환체를 지칭한다.
"티옥소"는 =S 치환체를 지칭한다.
본 명세서에 사용되는 용어 "치환된"은 임의의 상기 기(즉, 알킬, 알킬렌, 알콕시, 알킬아미노, 티오알킬, 아릴, 아르알킬, 사이클로알킬, 사이클로알킬알킬, 할로알킬, 헤테로사이클릴, N-헤테로사이클릴, 헤테로사이클릴알킬, 헤테로아릴, N-헤테로아릴 및/또는 헤테로아릴알킬)를 의미하되, 적어도 하나의 수소 원자는 비-수소 원자, 예컨대, 이하로 제한되는 것은 아니지만: 할로겐 원자, 예컨대 F, Cl, Br 및 I; 하이드록실기, 알콕시기 및 에스터기와 같은 기의 산소 원자; 티올기, 티오알킬기, 설폰기, 설폰일기, 및 설폭사이드기와 같은 기의 황 원자; 아민, 아마이-NR드, 알킬아민, 다이알킬아민, 아릴아민, 알킬아릴아민, 다이아릴아민, N-옥사이드, 이미드 및 엔아민과 같은 기의 질소 원자; 트라이알킬실릴기, 다이알킬아릴실릴기, 알킬다이아릴실릴기, 및 트라이아릴실릴기와 같은 기의 규소 원자; 및 다양한 다른 기의 다른 헤테로원자에 대한 결합에 의해 대체된다. "치환된"은 또한 하나 이상의 수소 원자가 헤테로원자, 예컨대 옥소, 카보닐, 카복실 및 에스터기의 산소; 및 이민, 옥심, 하이드라존 및 나이트릴과 같은 기의 질소에 대한 더 고차의 결합(예를 들어, 이중- 또는 삼중 결합)에 의해 대체되는 임의의 상기 기를 의미한다. 예를 들어, "치환된"은 하나 이상의 수소 원자가 -NRgRh, -NRgC(=O)Rh, -NRgC(=O)NRgRh, -NRgC(=O)ORh, -NRgSO2Rh, -OC(=O)NRgRh, -ORg, -SRg, -SORg, -SO2Rg, -OSO2Rg, -SO2ORg, =NSO2Rg 및 -SO2NRgRh로 대체되는 임의의 상기 기를 포함한다. "치환된"은 또한 하나 이상의 수소 원자가 -C(=O)Rg, -C(=O)ORg, -C(=O)NRgRh, -CH2SO2Rg, -CH2SO2NRgRh, -(CH2CH2O)2-10Rg로 대체되는 임의의 상기 기를 의미한다. 앞서 언급한 것에서, Rg 및 Rh는 동일 또는 상이하고, 독립적으로 수소, 알킬, 알콕시, 알킬아미노, 티오알킬, 아릴, 아르알킬, 사이클로알킬, 사이클로알킬알킬, 할로알킬, 헤테로사이클릴, N-헤테로사이클릴, 헤테로사이클릴알킬, 헤테로아릴, N-헤테로아릴 및/또는 헤테로아릴알킬이다. "치환된"은 추가로 하나 이상의 수소 원자가 아미노, 사이아노, 하이드록실, 이미노, 나이트로, 옥소, 티옥소, 할로, 알킬, 알콕시, 알킬아미노, 티오알킬, 아릴, 아르알킬, 사이클로알킬, 사이클로알킬알킬, 할로알킬, 헤테로사이클릴, N-헤테로사이클릴, 헤테로사이클릴알킬, 헤테로아릴, N-헤테로아릴 및/또는 헤테로아릴알킬기에 대한 결합에 의해 대체되는 임의의 상기 기를 의미한다. 추가로, 각각의 앞서 언급한 치환체는 또한 상기 치환체 중 하나 이상으로 선택적으로 치환될 수 있다.
용어 "선택적으로 치환된"은 주어진 화학적 모이어티(예를 들어, 알킬기)가 다른 치환체(예를 들어, 헤테로원자)에 결합될 수 있다(그러나 요구되는 것은 아님)는 것을 의미하는 것으로 이해된다. 예를 들어, 선택적으로 치환된 알킬기는 완전히 포화된 알킬쇄(즉, 순수한 탄화수소)일 수 있다. 대안적으로, 동일한 선택적으로 치환된 알킬기는 수소와 상이한 치환체를 가질 수 있다. 예를 들어, 이는 쇄를 따라서 임의의 지점에서 할로겐 원자, 하이드록실기, 또는 본 명세서에 기재된 임의의 다른 치환체에 결합될 수 있다. 따라서 용어 "선택적으로 치환된"은 주어진 화학적 모이어티가 다른 작용기를 함유할 가능성을 갖지만, 임의의 추가적인 작용기를 반드시 갖지 않는다는 것을 의미한다.
"알킬"은 1 내지 12개의 탄소 원자(C1-C12 알킬), 1 내지 8개의 탄소 원자(C1-C8 알킬) 또는 1 내지 6개의 탄소 원자(C1-C6 알킬)를 갖는 포화 또는 불포화인(즉, 하나 이상의 이중 및/또는 삼중 결합을 함유하는), 그리고 단일 결합, 예를 들어, 메틸, 에틸, n-프로필, 1-메틸에틸(아이소-프로필), n-뷰틸, n-펜틸, 1,1-다이메틸에틸(t-뷰틸), 3-메틸헥실, 2-메틸헥실, 에텐일, 프로프-1-엔일, 부트-1-엔일, 펜트-1-엔일, 펜타-1,4-다이엔일, 에틴일, 프로핀일, 뷰틴일, 펜틴일, 헥신일 등에 의해 분자의 나머지에 부착된 탄소 및 수소 원자만으로 이루어진 직선형 또는 분지형 탄화수소쇄 라디칼을 지칭한다. 본 명세서에서 달리 구체적으로 언급되지 않는 한, 알킬기는 선택적으로 치환될 수 있다.
"알콕시"는 식 -ORa의 라디칼을 지칭하며, 여기서 Ra는 1 내지 12개의 탄소 원자를 함유하는 상기 정의한 바와 같은 알킬 라디칼이다. 본 명세서에서 달리 구체적으로 언급되지 않는 한, 알콕시기는 선택적으로 치환될 수 있다.
"알켄일"은 2 내지 12개의 탄소 원자를 함유하는 직쇄 또는 분지쇄 포화 탄화수소를 지칭한다. "알켄일"기는 쇄 내에 적어도 하나의 이중 결합을 함유한다. 알켄일기의 이중 결합은 다른 불포화기에 비접합 또는 접합될 수 있다. 알켄일기의 예는 에텐일, 프로펜일, n-뷰텐일, 아이소-뷰텐일, 펜텐일 또는 헥센일을 포함한다. 알켄일기는 비치환 또는 치환될 수 있다. 본 명세서에 정의된 바와 같은 알켄일은 직선형 또는 분지형일 수 있다.
"알킨일"은 2 내지 12개의 탄소 원자를 함유하는 직쇄 또는 분지쇄 포화 탄화수소를 지칭한다. "알킨일"기는 쇄 내에 적어도 하나의 삼중 결합을 함유한다. 알켄일기의 예는 에틴일, 프로판일, n-뷰틴일, 아이소-뷰틴일, 펜틴일, 또는 헥신일을 포함한다. 알킨일기는 비치환 또는 치환될 수 있다.
용어 "사이클로알킬"은 3 내지 18개의 탄소 원자를 함유하는 단환식 또는 다환식 포화 탄소 고리를 의미한다. 사이클로알킬기의 예는 사이클로프로필, 사이클로뷰틸, 사이클로펜틸, 사이클로헥실, 사이클로헵탄일, 사이클로옥탄일, 노르보란일, 노르보렌일, 바이사이클로[2.2.2]옥탄일, 또는 바이사이클로[2.2.2]옥텐일을 포함하지만, 이들로 제한되지 않는다. C3-C8 사이클로알킬은 3 내지 8개의 탄소 원자를 함유하는 사이클로알킬기이다. 사이클로알킬기는 축합(예를 들어, 데칼린) 또는 브리지(예를 들어, 노르보난)될 수 있다.
용어 "사이클로알켄일"은 4 내지 18개의 탄소 원자를 함유하는 단환식, 비방향족 불포화 탄소 고리를 의미한다. 사이클로알켄일기의 예는 사이클로펜텐일, 사이클로헥센일, 사이클로헵텐일, 사이클로옥텐일 및 노르보렌일을 포함하지만, 이들로 제한되지 않는다. C4-C8 사이클로알켄일은 4 내지 8개의 탄소 원자를 함유하는 사이클로알켄일기이다.
용어 "헤테로사이클릴" 또는 "헤테로사이클로알킬" 또는 "헤테로사이클"은 탄소 및 산소, 인, 질소 또는 황으로부터 취해진 헤테로원자를 함유하는 단환식 또는 다환식의 3 내지 24-원 고리를 지칭하며, 고리 탄소 또는 헤테로원자 중에서 공유되는 비편재화 π 전자(방향족성)가 없다. 헤테로사이클릴 고리는 옥세탄일, 아제타딘일, 테트라하이드로퓨란일, 피롤리딘일, 옥사졸린일, 옥사졸리딘일, 티아졸린일, 티아졸리딘일, 피란일, 티오피란일, 테트라하이드로피란일, 다이옥살린일, 피페리딘일, 몰폴린일, 티오몰폴린일, 티오몰폴린일 S-옥사이드, 티오몰폴린일 S-다이옥사이드, 피페라진일, 아제핀일, 옥세핀일, 다이아제핀일, 트로판일 및 호모트로판일을 포함하지만, 이들로 제한되지 않는다. 헤테로사이클릴 또는 헤테로사이클로알킬 고리는 또한 축합되거나 또는 브리지될 수 있고, 예를 들어, 이환식 고리일 수 있다.
본 명세서에서 사용되는 용어 "할로" 또는 "할로겐"은 플루오로, 클로로, 브로모 또는 요오도기를 의미한다.
용어 "카보닐"은 산소 원자에 이중 결합된 탄소 원자로 구성된 작용기를 지칭한다. 본 명세서에서 "옥소"로서, C(O)로서, 또는 C=O로서 약칭될 수 있다.
용어 "아릴"은 단환식 또는 이환식기, 예컨대 페닐, 바이페닐 또는 나프틸을 포함하는, 1 내지 2개의 방향족 고리를 갖는 환식, 방향족 탄화수소기를 지칭한다. 2개의 방향족 고리(이환식 등)를 함유하는 경우, 아릴기의 방향족 고리는 단일 지점에 결합되거나(예를 들어, 바이페닐), 또는 축합(예를 들어, 나프틸)될 수 있다. 아릴기는 임의의 부착 지점에서 하나 이상의 치환체, 예를 들어, 1 내지 5개의 치환체에 의해 선택적으로 치환될 수 있다. 예시적인 치환체는 -H, -할로겐, -O-C1-C6알킬, -C1-C6알킬, -OC2-C6알켄일, -OC2-C6알킨일, -C2-C6알켄일, -C2-C6알킨일, -OH, -OP(O)(OH)2, -OC(O)C1-C6알킬, -C(O)C1-C6알킬, -OC(O)OC1-C6알킬, -NH2, -NH(C1-C6알킬), -N(C1-C6알킬)2, -S(O)2-C1-C6알킬, -S(O)NHC1-C6알킬, 및 -S(O)N(C1-C6알킬)2를 포함하지만, 이들로 제한되지 않는다. 치환체는 그 자체가 선택적으로 치환될 수 있다. 더 나아가 2개의 축합 고리를 함유할 때, 본 명세서에 정의된 아릴기는 완전히 포화된 고리와 축합된 불포화 또는 부분적으로 포화된 고리를 가질 수 있다. 이들 아릴기의 예시적인 고리계는 인단일, 인덴일, 테트라하이드로나프탈렌일 및 테트라하이드로벤조아눌렌일을 포함한다.
달리 구체적으로 정의되지 않는 한, "헤테로아릴"은 N, S, P 및 O로부터 선택된 하나 이상의 고리 헤테로원자를 함유하고, 남아있는 고리 원자는 C인, 5 내지 24개의 고리 원자의 1가 단환식 방향족 라디칼 또는 다환식 방향족 라디칼을 의미한다. 본 명세서에 정의되는 헤테로아릴은 또한 이환식 헤테로방향족기를 의미하되, 헤테로원자는 N, S, P 및 O로부터 선택된다. 방향족 라디칼은 선택적으로 본 명세서에 기재된 하나 이상의 치환체로 독립적으로 치환된다. 예는 퓨릴, 티엔일, 피롤릴, 피리딜, 피라졸릴, 피리미딘일, 이미다졸릴, 아이속사졸릴, 옥사졸릴, 옥사다이아졸릴, 피라진일, 인돌릴, 티오펜-2-일, 퀴놀릴, 벤조피란일, 아이소티아졸릴, 티아졸릴, 티아다이아졸, 인다졸, 벤즈이미다졸릴, 티에노[3,2-b]티오펜, 트라이아졸릴, 트라이아진일, 이미다조[1,2-b]피라졸릴, 퓨로[2,3-c]피리딘일, 이미다조[1,2-a]피리딘일, 인다졸릴, 피롤로[2,3-c]피리딘일, 피롤로[3,2-c]피리딘일, 피라졸로[3,4-c]피리딘일, 티에노[3,2-c]피리딘일, 티에노[2,3-c]피리딘일, 티에노[2,3-b]피리딘일, 벤조티아졸릴, 인돌릴, 인돌린일, 인돌리논일, 다이하이드로벤조티오페닐, 다이하이드로벤조퓨란일, 벤조퓨란, 크로만일, 티오크로만일, 테트라하이드로퀴놀린일, 다이하이드로벤조티아진, 다이하이드로벤족산일, 퀴놀린일, 아이소퀴놀린일, 1,6-나프티리딘일, 벤조[데]아이소퀴놀린일, 피리도[4,3-b][1,6]나프티리딘일, 티에노[2,3-b]피라진일, 퀴나졸린일, 테트라졸로[1,5-a]피리딘일, [1,2,4]트라이아졸로[4,3-a]피리딘일, 아이소인돌릴, 피롤로[2,3-b]피리딘일, 피롤로[3,4-b]피리딘일, 피롤로[3,2-b]피리딘일, 이미다조[5,4-b]피리딘일, 피롤로[1,2-a]피리미딘일, 테트라하이드로 피롤로[1,2-a]피리미딘일, 3,4-다이하이드로-2H-1□2-피롤로[2,1-b]피리미딘, 다이벤조[b,d] 티오펜, 피리딘-2-온, 퓨로[3,2-c]피리딘일, 퓨로[2,3-c]피리딘일, 1H-피리도[3,4-b][1,4] 티아진일, 벤조옥사졸릴, 벤조아이속사졸릴, 퓨로[2,3-b]피리딘일, 벤조티오페닐, 1,5-나프티리딘일, 퓨로[3,2-b]피리딘, [1,2,4]트라이아졸로[1,5-a]피리딘일, 벤조 [1,2,3]트라이아졸릴, 이미다조[1,2-a]피리미딘일, [1,2,4]트라이아졸로[4,3-b]피리다진일, 벤조[c][1,2,5]티아다이아졸릴, 벤조[c][1,2,5]옥사다이아졸, 1,3-다이하이드로-2H-벤조[d]이미다조l-2-온, 3,4-다이하이드로-2H-피라졸로 [1,5-b][1,2]옥사진일, 4,5,6,7-테트라하이드로피라졸로[1,5-a]피리딘일, 티아졸로[5,4-d]티아졸릴, 이미다조[2,1-b][1,3,4]티아다이아졸릴, 티에노[2,3-b]피롤릴, 3H-인돌릴 및 이들의 유도체를 포함하지만, 이들로 제한되지 않는다. 더 나아가 2개의 축합 고리를 함유할 때, 본 명세서에 정의된 헤테로아릴기는 완전히 포화된 고리와 축합된 불포화 또는 부분적으로 포화된 고리를 가질 수 있다. 이들 헤테로아릴기의 예시적인 고리계는 인돌린일, 인돌리논일, 다이하이드로벤조티오페닐, 다이하이드로벤조퓨란, 크로만일, 티오크로만일, 테트라하이드로퀴놀린일, 다이하이드로벤조티아진, 3,4-다이하이드로-1H-아이소퀴놀린일, 2,3-다이하이드로벤조퓨란, 인돌린일, 인돌릴 및 다이하이드로벤족산일을 포함한다.
"프로드러그"는 생리적 조건 하에 또는 본 발명의 생물학적으로 활성인 화합물에 대한 가용매분해에 의해 전환될 수 있는 화합물을 나타내는 것을 의미한다. 따라서, 용어 "프로드러그"는 약제학적으로 허용 가능한 본 발명의 화합물의 대사 전구체를 지칭한다. 프로드러그는 치료가 필요한 대상체에게 투여될 때 비활성일 수 있지만, 생체내에서 본 발명의 활성 화합물로 전환된다. 프로드러그는 전형적으로 본 발명의 모 화합물을 수득하기 위해, 예를 들어, 혈액 중의 가수분해에 의해, 빠르게 전환된다. 프로드러그 화합물은 종종 포유류 유기체에서 가용성, 조직 적합성 또는 지연된 방출의 이점을 제공한다(문헌[Bundgard, H., Design of Prodrugs (1985), pp. 7-9, 21-24(Elsevier, Amsterdam)] 참조). 프로드러그의 논의는 문헌[Higuchi, T., et al., A.C.S. Symposium Series, Vol. 14], 및 문헌[Bioreversible Carriers in Drug Design, Ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987]에서 제공된다.
용어 "프로드러그"는 또한 이러한 프로드러그가 포유류 대상체에게 투여될 때 생체내에서 본 발명의 활성 화합물을 방출하는 임의의 공유 결합된 담체를 포함하는 것을 의미한다. 본 발명의 화합물의 프로드러그는 일상적 조작에서 또는 생체내에서, 변형이 본 발명의 모 화합물로 절단되는 방식으로 본 발명의 화합물에 존재하는 작용기를 변형시킴으로써 제조될 수 있다. 프로드러그는 본 발명의 화합물을 포함하되, 하이드록시, 아미노 또는 머캅토기는, 본 발명의 프로드러그가 포유류 대상체에 투여될 때, 각각 유리 하이드록시, 유리 아미노 또는 유리 머캅토기를 형성하도록 절단되는 임의의 기에 결합된다. 프로드러그의 예는 본 발명의 화합물 등에서 알코올의 아세테이트, 포메이트 및 벤조에이트 유도체 또는 아민 작용기의 아마이드 유도체를 포함하지만, 이들로 제한되지 않는다.
본 명세서에 개시된 발명은 또하나 개시된 화합물의 생체내 대사 산물을 포함하는 것을 의미한다. 이러한 산물은 주로 효소 과정에 기인하여 투여되는 화합물의, 예를 들어, 산화, 환원, 가수분해, 아마이드화, 에스터화 등으로부터 초래될 수 있다. 따라서, 본 발명은 포유류에게 본 발명의 화합물을 이의 대사 산물을 수득하기에 충분한 기간 동안 투여하는 단계를 포함하는 방법에 의해 생산된 화합물을 포함한다. 이러한 산물은 전형적으로 동물, 예컨대 래트, 마우스, 기니픽, 원숭이에게 또는 인간에게 검출 가능한 용량으로 본 발명의 방사성표지된 화합물을 투여하고, 대사가 일어나기에 충분한 시간을 허용하고, 그리고 소변, 혈액 또는 다른 생물학적 샘플로부터 그의 전환 산물을 단리시키는 것에 의해 동정된다.
"안정한 화합물" 및 "안정한 구조"는 유용한 순도로 반응 혼합물로부터 단리, 및 효능있는 치료제로의 제형화를 견뎌내기에 충분히 강한 화합물을 나타내는 것을 의미한다.
"약제학적으로 허용 가능한 담체, 희석제 또는 부형제"는 인간 또는 가축 동물에서 사용하도록 허용되는 미국식품의약국에 의해 승인된 임의의 보조제, 담체, 부형제, 활택제, 감미제, 희석제, 보존제, 염료/색소, 향미 증강제, 계면활성제, 습윤제, 분산제, 현탁제, 안정제, 등장제, 용매 또는 유화제를 포함하지만, 이들로 제한되지 않는다.
"약제학적으로 허용 가능한 염"은 산 및 염기 부가염을 둘 다 포함한다.
"약제학적으로 허용 가능한 산 부가 염"은 생물학적으로 또는 달리 바람직하지 않은, 그리고 무기산, 예컨대 이하로 제한되지 않지만, 염산, 브로민화수소산, 황산, 질산, 인산 등, 및 유기산, 예컨대, 이하로 제한되는 것은 아니지만, 아세트산, 2,2-다이클로로아세트산, 아디프산, 알긴산, 아스코르브산, 아스파르트산, 벤젠설폰산, 벤조산, 4-아세트아미도벤조산, 캄퍼산, 캄퍼-10-설폰산, 카프르산, 카프로산, 카프릴산, 탄산, 신남산, 시트르산 사이클람산, 도데실황산, 에탄-1,2-다이설폰산, 에탄설폰산, 2-하이드록시에탄설폰산, 폼산, 퓨마르산, 갈락타르산, 겐티스산, 글루코헵톤산, 글루콘산, 글루쿠론산, 글루탐산, 글루타르산, 2-옥소-글루타르산, 글리세로포스폰산, 글리콜산, 히푸르산, 아이소뷰티르산, 락트산, 락토바이오산, 라우르산, 말레산, 말산, 말론산, 만델산, 메탄설폰산, 점액산, 나프탈렌-1,5-다이설폰산, 나프탈렌-2-설폰산, 1-하이드록시-2-나프토산, 니코틴산, 올레산, 오로트산, 옥살산, 팔미트산, 팜산, 프로피온산, 파이로글루탐산, 피루브산, 살리실산, 4-아미노살리실산, 세바스산, 스테아르산, 석신산, 타르타르산, 티오시안산, p-톨루엔설폰산, 트라이플루오로아세트산, 운데실렌산 등으로 형성되는 유리 염기의 생물학적 유효성 및 특성을 보유하는 해당 염을 지칭한다.
"약제학적으로 허용 가능한 염기 부가 염"은 생물학적이지 않은 또는 달리 바람직하지 않은 유리산의 생물학적 유효성 및 특성을 보유하는 해당 염을 지칭한다. 이들 염은 무기 염기 또는 유기 염기의 유리 산에 대한 부가로부터 제조된다. 무기 염기로부터 유래된 염은 나트륨, 칼륨, 리튬, 암모늄, 칼슘, 마그네슘, 철, 아연, 구리, 망간, 알루미늄 염을 포함하지만, 이들로 제한되지 않는다. 바람직한 무기염은 암모늄, 나트륨, 칼륨, 칼슘 및 마그네슘염이다. 유기 염기로부터 유래된 염은 1차, 2차 및 3차 아민, 천연 유래 치환된 아민, 환식 아민 및 염기성 이온 교환 수지, 예컨대 암모니아, 아이소프로필아민, 트라이메틸아민, 다이에틸아민, 트라이에틸아민, 트라이프로필아민, 다이에탄올아민, 에탄올아민, 데아놀, 2 다이메틸아미노에탄올, 2 다이에틸아미노에탄올, 다이사이클로헥실아민, 라이신, 알기닌, 히스티딘, 카페인, 프로카인, 하이드라바민, 콜린, 베타인, 베네타민, 벤자틴, 에틸렌다이아민, 글루코사민, 메틸글루카민, 테오브로민, 트라이에탄올아민, 트로메타민, 퓨린, 피페라진, 피페리딘, N 에틸피페리딘, 폴리아민 수지 등을 포함하는 치환된 아민의 염을 포함하지만, 이들로 제한되지 않는다. 특히 바람직한 유기 염기는 아이소프로필아민, 다이에틸아민, 에탄올아민, 트라이메틸아민, 다이사이클로헥실아민, 콜린 및 카페인이다.
종종 결정화는 본 발명의 화합물의 용매화물을 생산한다. 본 명세서에서 사용되는 용어 "용매화물"은 본 발명의 화합물의 하나 이상의 분자를 용매의 하나 이상의 분자와 함께 포함하는 응집물을 지칭한다. 용매는 물일 수 있으며, 이 경우에 용매화물은 수화물일 수 있다. 대안적으로, 용매는 유기 용매일 수 있다. 따라서, 본 발명의 화합물은 일수화물, 이수화물, 반수화물, 세스퀴수화물(sesquihydrate), 삼수화물, 사수화물 등뿐만 아니라 대응하는 용매화물화된 형태를 포함하는 수화물로서 존재할 수 있다. 본 발명의 화합물은 진정한 용매화물일 수 있는 반면, 다른 경우에, 본 발명의 화합물은 우연한 물을 거의 보유하지 않을 수도 있고 또는 물 + 일부 우연한 용매의 혼합물일 수 있다.
"약제학적 조성물"은 본 발명의 화합물과 포유류, 예를 들어, 인간에 생물학적으로 활성인 화합물의 전달을 위해 당업계에서 일반적으로 허용되는 배지의 제형을 지칭한다. 이러한 배지는 모든 약제학적으로 허용 가능한 담체, 희석제 또는 이에 대한 부형제를 포함한다.
본 발명의 화합물, 또는 이들의 약제학적으로 허용 가능한 염은 하나 이상의 비대칭 중심을 함유할 수 있고, 따라서 아미노산에 대해 (R) 또는 (S)로서 또는, (D) 또는 (L)로서 절대 입체화학에 관해 정해질 수 있는 거울상 이성질체, 부분입체이성질체 및 다른 입체이성질체 형태가 생기게 할 수 있다. 본 발명은 모든 이러한 가능한 이성질체뿐만 아니라 그들의 라세미체 및 광학적으로 순수한 형태를 포함하는 것을 의미한다. 광학적으로 활성인 (+) 및 (-), (R) 및 (S) 또는 (D) 및 (L) 이성질체는 카이랄 신톤 또는 카이랄 시약을 이용하여 제조되거나, 또는 통상적인 기법, 예를 들어, 크로마토그래피 및 분별결정을 이용하여 분해될 수 있다. 개개 거울상 이성질체의 제조/단리를 위한 통상적인 기법은, 예를 들어, 카이랄 고압 액체 크로마토그래피(HPLC)를 이용하는 라세미체(또는 염 또는 유도체의 라세미체)의 적합한 광학적으로 순수한 전구체 또는 분해능으로부터의 카이랄 합성을 포함한다. 본 명세서에 기재된 화합물이 기하학적 비대칭의 올레핀 이중 결합 또는 다른 중심을 함유하고, 달리 구체화되지 않을 때, 화합물이 E와 Z 기하학적 이성질체를 둘 다 포함하는 것으로 의도된다. 마찬가지로, 모든 호변이성질체 형태는 또한 포함되는 것으로 의도된다.
"입체이성질체"는 동일한 결합에 의해 결합된 동일한 원자로 구성되지만, 상호 호환 가능하지 않은 상이한 3차원 구조를 갖는 화합물을 지칭한다. 본 발명은 다양한 입체이성질체와 이의 혼합물을 상정하며, 분자가 서로 비대칭거울상인 2개의 입체이성질체를 지칭하는 "거울상 이성질체"를 포함한다.
"호변이성질체"는 분자의 하나의 원자로부터 동일한 분자의 다른 원자까지의 양성자 이동을 지칭한다. 본 발명은 임의의 상기 화합물의 호변이성질체를 포함한다.
본 개시내용에 따르면, 본 명세서에 기재된 화합물은 인간 또는 동물 대상체의 위장 내강에서 실질적으로 활성이거나 또는 국소화되도록 설계된다. 용어 "위장 내강"은 대상체의 GI 상피세포의 정단부 막에 의해 범위가 정해지는 위장관(GI관, 이는 또한 장으로서 지칭될 수 있음) 내의 공간 또는 공동을 지칭하기 위해 용어 "내강"과 함께 본 명세서에서 상호 호환적으로 사용된다. 일부 실시형태에서, 화합물은 GI관의 상피세포층(또한 GI 상피로서 알려짐)을 통해 흡수되지 않는다. "위장 점막"은 신체 나머지로부터 위장 내강을 분리하는 세포의 층(들)을 지칭하며, 위 및 장 점막, 예컨대 소장의 점막을 포함한다. 본 명세서에서 사용되는 "위장 상피세포" 또는 "장 상피세포"는, 예를 들어, 위의 상피세포, 장 상피세포, 결장 상피세포 등을 포함하는, 위장관 내강에 접하는 위장 점막면 상의 임의의 상피세포를 지칭한다.
"대상체"는 인간이지만, 또한 본 개시내용의 화합물에 의한 치료가 필요한 동물, 예를 들어, 반려 동물(예를 들어, 개, 고양이 등), 농장 동물(예를 들어, 소, 돼지, 말 등) 및 실험실 동물(예를 들어, 래트, 마우스, 기니픽 등)일 수 있다.
본 명세서에서 사용되는 "실질적으로 전신성으로 생체 이용 가능하지 않은" 및/또는 "실질적으로 비침투성인"(뿐만 아니라 이들의 변형)은 일반적으로 통계적으로 유의한 양, 및 일부 실시형태에서 본질적으로 모든 본 개시내용의 화합물(NHE-저해제 소분자를 포함)이 위장 내강에 남아있는 상황을 지칭한다. 예를 들어, 본 개시내용의 하나 이상의 실시형태에 따르면, 적어도 약 70%, 약 80%, 약 90%, 약 95%, 약 98%, 약 99%, 또는 심지어 약 99.5%의 화합물이 위장 내강에 남아있다. 이러한 경우에, 위장 내강에 대한 국소화는 상피세포, 예를 들어, 경세포와 세포사이 수송 둘 다에 의해서 뿐만 아니라 활성 및/또는 수동 수송에 의해 위장층을 가로지르는 순 움직임을 감소시키는 것을 지칭한다. 이러한 실시형태에서 화합물은, 예를 들어, 소장 상피세포의 정단부 막을 통해 경세포 수송에서 위장 상피세포층의 순 침투로부터 입체 방해된다. 이들 실시형태에서 화합물은 또한 "밀착연접" 특히 내강 내벽의 위장 상피세포 사이의 수송을 통해 순 침투로부터 입체방해된다.
이와 관련하여, 하나의 특정 실시형태에서, 화합물은 본질적으로 GI관 또는 위장 내강에 의해 전혀 흡수되지 않는다는 것이 주목되어야 한다. 본 명세서에서 사용되는 용어 "실질적으로 비침투성" 또는 "실질적으로 전신으로 생체 이용 가능하지 않은"은 일반적으로 당업계에 공지된 수단을 이용하여 검출 가능한 양의 화합물의 흡수 또는 침투 또는 전신 노출이 검출된 실시형태를 지칭한다.
이와 관련하여, 그러나, 대안의 실시형태에서 "실질적으로 비침투성" 또는 "실질적으로 전신으로 생체 이용 가능하지 않은"은 GI관에서, 더 구체적으로는 장 상피에서 일부 제한된 흡수가 일어나도록 제공하거나 또는 허용하며(예를 들어, 일부 검출 가능한 양의 흡수, 예를 들어 적어도 약 0.1%, 0.5%, 1% 이상 및 약 30%, 20%, 10%, 5% 등 미만, 흡수 범위는, 예를 들어, 약 1% 내지 30%, 또는 5% 및 20% 등임); 언급된 다른 방법에서, "실질적으로 비침투성" 또는 "실질적으로 전신으로 생체 이용 가능하지 않은"은 투여되는 화합물의 약 20% 미만(예를 들어, 약 15%, 약 10%, 또는 심지어 약 5% 미만, 및, 예를 들어 약 0.5%, 또는 1% 초과)의 GI관 내 세포의 상피 층에 대해 일부 검출 가능한 침투성을 나타내지만, 이어서, 간(즉, 간 추출) 및/또는 신장(즉, 신장 배출)에 의해 청소되는 화합물을 지칭한다는 것이 추가로 주목되어야 한다.
본 개시내용에 따르면, 그리고 본 명세서에서 이하에 추가로 상술하는 바와 같이, 위장관 및 더 구체적으로는 위장 상피에서 나트륨 이온(Na+) 및 수소 이온(H+)의 NHE-매개 역수송의 저해는 체액저류 및/또는 염 과부하와 관련되거나 또는 이에 의해 야기될 수 있는 다양한 장애, 및/또는 심부전(특히, 울혈성 심부전), 만성 신장병, 말기 신질환, 간질환, 및/또는 페록시좀 증식체-활성화 수용체(PPAR) 감마 작용제-유도된 체액저류와 같은 장애의 치료에 대한 강력한 접근이라는 것을 발견하였다. 더 구체적으로는, GI관에서 나트륨 이온 및 수소 이온의 NHE-매개 역수송의 저해는 나트륨의 분변 배설을 증가시켜, 나트륨 및 유체의 전신 수준을 효과적으로 감소시킨다는 것을 발견하였다. 이는 결국, 예를 들어, CHF, ESRD/CKD 및/또는 간질환으로 고통받는 환자의 임상 상태를 개선시킨다. 이러한 치료는 선택적으로 다른 유리한 화합물 또는 조성물, 예를 들어 유체-흡수성 중합체의 공동 투여에 의해 향상될 수 있다는 것이 추가로 발견되었다. 유체-흡수성 중합체는 공동 투약된 NHE-저해 화합물의 작용 메커니즘을 차단하거나 또는 달리 부정적으로 방해하지 않도록 최적으로 선택될 수 있다.
추가적으로, 그리고 또한 본 명세서에서 이하에 추가로 상술하는 바와 같이, 위장관 및 더 구체적으로는 위장 상피에서 나트륨 이온(Na+) 및 수소 이온(H+)의 NHE-매개 역수송의 저해는 체액저류 및/또는 염 과부하와 관련되거나 또는 이에 의해 야기될 수 있는 고혈압의 치료에 대한 강력한 접근이라는 것이 추가로 발견되었다. 더 구체적으로는, GI관에서 나트륨 이온 및 수소 이온의 NHE-매개 역수송의 저해는 나트륨의 분변 배설을 증가시켜, 나트륨 및 유체의 전신 수준을 효과적으로 감소시킨다는 것을 발견하였다. 이는 결국, 고혈압으로 고통받는 환자의 임상 상태를 개선시킨다. 이러한 치료는 선택적으로 다른 유리한 화합물 또는 조성물, 예를 들어 유체-흡수성 중합체의 공동 투여에 의해 향상될 수 있다. 유체-흡수성 중합체는 공동 투약된 NHE-저해 화합물의 작용 메커니즘을 차단하거나 또는 달리 부정적으로 방해하지 않도록 최적으로 선택될 수 있다.
추가적으로, 그리고 또한 본 명세서에서 이하에 추가로 상술하는 바와 같이, 위장관 및 더 구체적으로는 위장 상피에서 나트륨 이온(Na+) 및 수소 이온(H+)의 NHE-매개 역수송의 저해는 위장관 장애와 관련된 통증의 치료 또는 감소를 포함하는 다양한 위장관 장애의 치료 그리고 더 구체적으로는 장에서 적절한 유체 분비의 회복 및 변비 상태에서 접하는 병리학적 병태의 개선에 대한 강력한 접근이라는 것이 추가로 발견되었다. 출원인은 나트륨 이온 재흡수를 차단시킴으로써, GI관에서, 특히 높은 정도의 분변 탈수, 하부 장 운동성 및/또는 일반적으로 변비 상태 및 GI 불편함을 생성하는 느린 체류 시간을 야기하는 방법으로 유체 분비/흡수가 변경되는 상황에서 본 개시내용의 화합물이 유체 항상성을 회복한다는 것을 추가로 인식하였다. 이러한 치료는 선택적으로 다른 유리한 화합물 또는 조성물, 예를 들어 유체-흡수성 중합체의 공동 투여에 의해 향상될 수 있다는 것이 추가로 발견되었다. 유체-흡수성 중합체는 공동 투약된 NHE-저해 화합물의 작용 메커니즘을 차단하거나 또는 달리 부정적으로 방해하지 않도록 최적으로 선택될 수 있다. 신체 내 다른 기관 또는 조직에서 NHE의 존재에 기인하여, 본 개시내용의 방법은 바람직하게는 고도로 선택적이거나 또는 국소화된 화합물 및 조성물의 용도를 사용하며, 따라서 다른 조직 또는 기관에 대한 노출 없이 위장관에서 실질적으로 작용한다. 이 방법에서, 임의의 전신 효과는 최소화될 수 있다(그들이 표적 상이든 또는 비표적이든). 따라서, 본 명세서에서 사용되는 바와 같이, 그리고 본 명세서의 다른 곳에 추가로 상술되는 바와 같이, "위장관에서 실질적으로 활성"은 일반적으로 상피세포의 층, 더 구체적으로는 GI관의 상피에 대해 실질적으로 전신으로 생체 이용 가능하지 않고/않거나 실질적으로 비침투성인 화합물을 지칭한다는 것을 주목하여야 한다. 추가로 본 명세서에서 사용되는 바와 같이, 그리고 본 명세서의 다른 곳에 추가로 상술되는 바와 같이 "실질적으로 비침투성"은 더 구제적으로는 상피세포의 층, 및 더 구체적으로는 위장 상피(또는 상피층)에 대해 비침투성인 화합물을 포함한다는 것을 주목하여야 한다. "위장 상피"는 위장관의 내면을 뒤덮는 막성 조직을 지칭한다. 따라서, 실질적으로 비침투성인 것에 의해, 화합물은 위장 상피를 가로질러 전달되는 매우 제한된 능력을 가지며, 따라서 다른 내부 기관(예를 들어, 뇌, 심장, 간 등)과 접촉된다. 위장 상피를 가로질러 화합물이 전달되는 전형적 메커니즘은 경세포 수송에 의해(정단부 막과 기저측부막 둘 다를 통과하는 수동 또는 능동 수송에 의해 매개되는, 세포를 통한 물질 이동) 그리고/또는 세포사이 수송에 의하며, 여기서, 물질은 상피의 세포 사이를, 보통 "밀착연접"으로서 알려진 고도로 제한적인 구조를 통해 이동한다. 임의의 특정 이론으로 구속되는 일 없이, 본 개시내용의 NHE-저해 화합물(예를 들어, NHE-3, -2 및/또는 -8 저해제)은 장의 세포사이 침투성을 감소시키기 위해 별개의 그리고 독특한 메커니즘을 통해 작용하는 것으로 여겨진다. NHE3은 위장관의 정단부 표면 상에서 고수준으로 발현되고, 세포내 양성자의 분비에 내강 Na 흡수와 짝지어진다. 본 개시내용의 NHE-저해 화합물(예를 들어, NHE-3, -2 및/또는 -8 저해제)에 의한 NHE3의 저해는 세포내 양성자의 축적을 초래한다. NHE3 저해를 수반하는 세포내 양성자 체류는 경상피 전기 저항의 증가에 의해 측정될 수 있는 세포사이 침투성을 감소시키기 위해 세포 사이의 밀착연접을 조절한다. 장의 증가된 세포사이 및/또는 경세포 침투성이 위장 운동 장애, 과민성 장 증후군, 만성 변비, 만성 특발성 변비, 낭성 섬유증 환자에서 생기는 만성 변비, 만성 신장병 환자에서 생기는 만성 변비, 골다공증성 환자에서의 칼슘-유도성 변비, 오피오이드-유발성 변비, 다발성 경화증-유발성 변비, 파킨슨병-유발성 변비, 기능성 위장 장애, 위식도역류질환, 기능성 가슴쓰림, 소화불량, 기능성 소화불량, 비궤양성 소화불량, 위마비, 만성 가성 장폐색증, 크론병, 염증성 장 증후군으로서 지칭되는 궤양성 대장염 및 관련된 질환, 결장 가성 폐색증, 위궤양, 감염성 설사, 암(결장직장), "장 누수 증후군", 낭성 섬유증 위장 질환, 다기관 부전, 미세장염, 괴사성 장염, 알레르기 - 아토피, 식품 알레르기, 감염(호흡기), 급성 염증(예를 들어, 패혈증, 전신 염증 반응 증후군), 만성 염증(관절염), 비만-유발성 대사 질환(예를 들어, 비알코올성 지방간염, I형 당뇨병, II형 당뇨병, 심혈관 질환), 신장 질환, 당뇨성 신장 질환, 간경변증, 비알코올성 지방간염, 비알코올성 지방산 간질환, 지방증, 원발성 경화성 담관염, 원발성 담즙성 담관염, 문맥 고혈압, 자가면역 질환(예를 들어,1형 당뇨병, 강직성 척추염, 루푸스, 원형 탈모증, 류마티스성 관절염, 류마티스성 다발근통, 섬유근육통, 만성 피로 증후군, 쇼그렌 증후군, 백반증, 갑상선염, 혈관염, 심마진(두드러기), 레이노 증후군), 조현병, 자폐 범주성 장애, 간성뇌증, 소장 박테리아 과성장, 및 만성 알코올 중독 등을 포함하지만, 이들로 제한되지 않는 다수의 질환에서 관찰되었기 때문에, NHE 저해는 장에서 세포사이 및/또는 경세포 침투성을 감소시킴으로써 이들 질환에서 치료적 이점을 제공할 수 있는 것으로 예상된다.
따라서 일부 실시형태에서, 본 개시내용은 장의 세포사이 침투성을 감소시키는 방법을 제공한다. 일부 실시형태에서, 장의 세포사이 침투성을 감소시키는 방법은 NHE3 저해제의 투여를 포함한다. 일부 실시형태에서, NHE3의 저해는 세포내 양성자의 축적을 초래한다. 일부 실시형태에서, 세포사이 침투성의 감소는 NHE3 저해와 독립적으로 그리고 저해 없이 세포내 양성자의 증가에 기인한다. 다시 말해서, NHE3 저해 없이 세포내 양성자의 증가는 세포사이 침투성의 감소를 초래한다. 따라서 세포내 양성자를 증가시키는 단계를 포함하는 세포사이 침투성을 감소시키는 방법이 제공된다. 일부 실시형태에서, 밀착연접에서 세포내 양성자를 증가시킴으로써 세포사이 침투성을 감소시키는 제제를 투여하는 단계 및 이에 의해 질환을 치료하는 단계를 포함하는 세포사이 침투성과 관련된 질환을 치료하는 방법이 제공된다. 이러한 질환의 비제한적 예는 크론병, 염증성 장 증후군으로서 지칭되는 궤양성 대장염 및 관련된 질환, 결장 가성 폐색증, 위궤양, 감염성 설사, 암(결장직장), "장 누수 증후군", 낭성 섬유증 위장 질환, 다기관 부전, 미세장염, 괴사성 장염, 알레르기 - 아토피, 식품 알레르기, 감염(호흡기), 급성 염증(예를 들어, 패혈증, 전신 염증 반응 증후군), 만성 염증(관절염), 비만-유발성 대사 질환(예를 들어, 비알코올성 지방간염, I형 당뇨병, II형 당뇨병, 심혈관 질환), 신장 질환, 당뇨성 신장 질환, 간경변증, 비알코올성 지방간염, 비알코올성 지방산 간질환, 지방증, 원발성 경화성 담관염, 원발성 담즙성 담관염, 문맥 고혈압, 자가면역 질환(예를 들어, 1형 당뇨병, 강직성 척추염, 루푸스, 원형 탈모증, 류마티스성 관절염, 류마티스성 다발근통, 섬유근육통, 만성 피로 증후군, 쇼그렌 증후군, 백반증, 갑상선염, 혈관염, 심마진(두드러기), 레이노 증후군), 조현병, 자폐 범주성 장애, 간성뇌증, 소장 박테리아 과성장 및 만성 알코올 중독 등을 포함한다.
일부 실시형태에서, 본 개시내용은 장의 경세포 침투성을 조절하는 방법을 제공한다. 일부 실시형태에서, 장의 경세포 침투성을 조절하는 방법은 NHE3 저해제의 투여를 포함한다. 일부 실시형태에서, NHE3의 저해는 정단부 막과 기저측면막 둘 다를 통과하는 수동 또는 능동 수송 중 하나에 의해 매개되는, 세포를 통한 물질 이동을 초래한다. 따라서 정단부 막과 기저측면막 둘 다를 통과하는 물질의 수동 또는 능동 이동 중 하나를 매개하는 단계를 포함하는 경세포 침투성을 조절하는 방법이 제공된다. 일부 실시형태에서, 세포의 정단부 막과 기저측면막 둘 다를 통과하는 물질의 수동 또는 능동 수송을 매개하는 제제를 투여함으로써, 경세포 침투성을 조절하는 단계 및 이에 의해 질환을 치료하는 단계를 포함하는 경세포 침투성과 관련된 질환을 치료하는 방법이 제공된다. 이러한 질환의 비제한적 예는 위장 운동 장애, 과민성 장 증후군, 만성 변비, 만성 특발성 변비, 낭성 섬유증 환자에서 생기는 만성 변비, 만성 신장병 환자에서 생기는 만성 변비, 골다공증성 환자에서의 칼슘-유도성 변비, 오피오이드-유발성 변비, 다발성 경화증-유발성 변비, 파킨슨병-유발성 변비, 기능성 위장 장애, 위식도역류질환, 기능성 가슴쓰림, 소화불량, 기능성 소화불량, 비궤양성 소화불량, 위마비, 만성 가성 장폐색증을 포함한다.
따라서 본 개시내용의 화합물은 흡수되지 않을 수도 있고, 따라서 본질적으로 전신으로 전혀 생체 이용 가능하지 않거나(예를 들어, 위장 상피에 대해 전혀 비침투성), 또는 그들은 혈청 내 화합물의 검출 가능한 농도를 나타내지 않는다. 대안적으로, 화합물은: (i) 투여되는 화합물의 약 20% 미만의(예를 들어, 약 15%, 약 10%, 또는 심지어 약 5%, 및, 예를 들어 약 0.5%, 또는 1% 초과) 상피세포 층, 더 구체적으로는 GI관의 상피에 대해 일부 검출 가능한 침투성을 나타낼 수 있지만, 이어서, 초회 대사를 통해 간(즉, 간 추출)에서 빠르게 청소되고; 그리고/또는 (ii) 약 20% 미만의 투여되는 화합물(예를 들어, 약 15%, 약 10%, 또는 심지어 약 5% 미만, 그리고 예를 들어 약 0.5%, 또는 1% 초과) 상피세포의 층, 더 구체적으로는 GI관의 상피에 대해 일부 검출 가능한 침투성을 나타낼 수 있지만, 이어서, 신장(즉, 신장 배설)에서 빠르게 청소될 수 있다.
화합물은 또한 변하지 않은 순환으로부터 담즙 배출에 의해 담관 내로 청소될 수 있다. 따라서 본 개시내용의 화합물은 담관에서 검출 가능한 농도를 나타내지 않을 수도 있다. 대안적으로, 화합물은 담관에서 일부 검출 가능한 농도, 및 더 구체적으로는 담관 및 담낭 상피의 10μM 미만, 1μM 미만, 0.1μM 미만, 0.01μM 미만 또는 약 0.001μM 미만을 나타낼 수 있다.
이와 관련하여, 본 명세서에서 사용되는 바와 같은 "실질적으로 전신으로 생체 이용 가능하지 않은"은 일반적으로 화합물의 경구 투약 후 동물 또는 인간의 전신 순환에서 화합물을 검출하는 불능을 지칭한다는 것이 또한 추가로 주목되어야 한다. 생체 이용 가능하게 되는 화합물에 대해, 위장 상피를 가로질러 전달되어야 하며(즉, 상기 정의한 바와 같이 실질적으로 침투 가능), 문맥 순환을 통해 간까지 수송되고, 간에서의 실질적인 대사를 회피하며, 이어서, 전신 순환으로 전달된다.
임의의 특정 이론에 의해 구속되는 일 없이, 본 개시내용의 NHE-저해 화합물(예를 들어, NHE-3, -2 및/또는 -8 저해제)은 상기 유체 및 이온의 증가된 분비를 자극하기보다는 GI관에서 유체 및 이온의 체류를 야기하는(그리고 분변 배설을 자극하는) 별개의 그리고 독특한 메커니즘을 통해 작용하는 것으로 여겨진다. 예를 들어, 루비프로스톤(아미티자(Amitiza)(등록상표) 수캠포(Sucampo)/타케다(Takeda))는 2형 염화물 통로(ClC-2)를 활성화하고 장막으로부터 GI관의 점막측까지 염화물 풍부 유체 분비를 증가시키는 이환식 지방산 프로스타글란딘 E1 유사체이다(예를 들어, 문헌[Pharmacological Reviews for Amitiza®, NDA package] 참조). 리나클로타이드(MD-1100 아세테이트, 마이크로비아(Microbia)/포레스트 랩스(Forest Labs))는 내인성 호르몬, 구아닐린의 14가지 아미노산 펩타이드 유사체이며, 낭성 섬유증 막통과 전도도 조절자(Cystic Fibrosis Transmembrane Conductance Regulator: CFTR)를 간접적으로 활성화시킴으로써, GI관 내로 유체 및 전해질 분비를 유도한다(예를 들어, 문헌[Li et al., J. Exp. Med., vol. 202(2005), pp. 975-986] 참조). 본 개시내용의 실질적으로 비침투성 NHE-저해 화합물은 분비를 촉진시키기보다는 염 및 유체의 재흡수를 저해하는 작용을 한다. GI 간은 약 9리터의 유체 및 약 800meq의 Na을 매일 처리하기 때문에, NHE 저해는 부종을 재흡수하고 CHF 증상을 해결하기 위해 실질적인 양의 전신 유체 및 나트륨의 제거를 허용할 수 있었다는 것이 예상된다.
I.
NHE-저해 화합물
일 양상에서, 본 개시내용의 화합물은 일반적으로 하기 화학식 (I) 및 이의 약제학적으로 허용 가능한 염, 프로드러그, 용매화물, 수화물, 이성질체 및 호변이성질체로 나타낸다:
식 중: R1, R2, R3, R4, R5, R6, R7, R13, R14, R15, R16, n, u, X, Q 및 링커는 본 명세서에 기재되어 있다. 실시형태에서, 이들 NHE-저해 화합물(즉, 화학식 (I)의 화합물)은 그들이 실질적으로 불침투성의 또는 실질적으로 전신으로 생체 이용 가능하지 않은 전반적인 물리화학적 특성을 가진다.
본 명세서에 도시된 다수의 구조에서, 모든 다양한 연결 또는 결합은 모든 예에서 나타나지 않을 것임을 주목하여야 한다. 그러나, 이는 제한적 의미에서 검토되어서는 안 된다. 오히려, 얻어진 NHE-저해 화합물이 사용에 적합하도록(즉, GI관에서 실질적으로 비침투성 또는 실질적으로 전신으로 생체 이용 가능하지 않음) NHE-저해 분자는 일부 방법으로 (예를 들어, 결합 또는 링커에 의해) 결합되거나 또는 상호연결된다는 것이 이해되어야 한다.
또 다른 실시형태에서, 다가 NHE-저해 화합물은 올리고머 또는 중합체 형태일 수 있다. 각각의 화학식 (I)에서 반복 단위는 일반적으로 선택적으로 본 명세서에 언급된 방법에 의해 생성될 수 있는 선형, 분지형 및 수지상 구조를 포함하는 다양한 중합체 실시형태의 반복 단위를 포함한다는 것을 주목하여야 한다. 각각의 중합체 또는 더 일반적인 다가, 실시형태에서, 각각의 반복 단위는 동일 또는 상이할 수 있고, 그리고 존재한다면 결국 동일 또는 상이할 수 있는 링커에 의해 "X" 모이어티를 통해 연결될 수도 있고, 또는 연결되지 않을 수도 있다는 것을 주목하여야 한다. 이와 관련하여 본 명세서에서 사용되는 바와 같은 "다가"는 다중(예를 들어, 2, 4, 6, 8, 10개 이상의) NHE-저해 분자를 갖는 분자를 지칭한다는 것을 주목하여야 한다.
본 발명의 일 실시형태에서, 링커는
다른 실시형태에서, 링커는
본 발명의 일부 실시형태에서, R1 및 R2는 C1-C6알킬, CN 또는 할로겐이다. 일부 실시형태에서, R1 및 R2는 C1-C6알킬이다. 다른 실시형태에서, R1 및 R2는 메틸이다. 다른 실시형태에서, R1은 C1-C6알킬이고, R2는 할로겐이다. 다른 실시형태에서, R1은 메틸이고, R2는 할로겐이다. 다른 실시형태에서, R1은 CN이고, R2는 할로겐이다.
화학식 I의 화합물의 또 다른 실시형태에서, R3, R4, R5 및 R6은 H, 할로겐 또는 C1-C6알킬이다. 다른 실시형태에서, R3, R4, R5 및 R6은 H이다. 다른 실시형태에서, R3은 메틸 또는 플루오로이고, R4, R5 및 R6은 H이다. 실시형태에서, R5는 메틸이고, R3, R4 및 R6은 H이다.
화학식 I의 화합물의 일부 실시형태에서, Q는 -NHC(O)NH-이다. 화학식 I의 화합물의 다른 실시형태에서, Q는 -NHC(O)NH-이다. 특정 실시형태에서, Q는 -NHC(O)NH-이고, 링커는 -헤테로사이클릴-(CHR13)p-[Y-(CH2)r]s-이다. 특정 실시형태에서, Q는 -NHC(O)NH-이고, 링커는 -헤테로사이클릴-(CHR13)p-[Y-(CH2)r]s-이며, u는 0이다. 특정 실시형태에서, Q는 -NHC(O)NH-이고, 링커는 -헤테로사이클릴-(CHR13)p-[Y-(CH2)r]s-이며, u는 0이고, n은 2이다. 특정 실시형태에서, Q는 -NHC(O)NH-이고, 링커는 -헤테로사이클릴-(CHR13)p-[Y-(CH2)r]s-이며, u는 0이고, n은 2이며, X는 -(CHR13)p- 또는 C3-C6사이클로알킬이다. 다른 실시형태에서, Q는 결합이다. 일부 실시형태에서, Q는 결합이고, X는 -NHC(O)NH-이다.
화학식 I의 화합물의 일 실시형태에서, R13, R14, R15 및 R16은 모두 H이다. 화학식 I의 화합물의 일 실시형태에서, R13 및 R16은 H이다. 화학식 I의 화합물의 일 실시형태에서, R14 및 R16은 OH이다. 화학식 I의 화합물의 또 다른 실시형태에서, R13 및 R15은 H이고, R14 및 R16은 OH이다.
화학식 I의 화합물의 일 실시형태에서, Y는 O이고, r은 2이며, s는 1이다. 다른 실시형태에서, Y는 O이고, r은 2이며, s는 2이다. 일부 실시형태에서, s는 0이다. 일부 실시형태에서, Z는 C(O)이다.
화학식 I의 화합물의 일부 실시형태에서, R8은 H, C1-C6 알킬, 헤테로사이클릴 또는 헤테로아릴이다. 화학식 I의 화합물의 일부 실시형태에서, R8의 헤테로사이클릴 또는 헤테로아릴은 하나 이상의 R17로 선택적으로 치환된다. 일부 실시형태에서, R8은 하나 이상의 R17로 선택적으로 치환된 헤테로사이클릴이다. 일부 실시형태에서, R17는 옥소이다. 화학식 I의 화합물의 일부 실시형태에서, n은 2이다. 화학식 I의 화합물의 다른 실시형태에서, n은 3 또는 4이다.
본 발명의 일 실시형태에서, 화학식 I의 화합물은 하기 화학식 Ia를 가진다:
본 발명의 일 실시형태에서, 화학식 I의 화합물은 하기 화학식 Ib를 가진다:
본 발명의 일 실시형태에서, 화학식 I의 화합물은 하기 화학식 Ic를 가진다:
식 중, Het B는 헤테로사이클릴 또는 N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴을 나타내되, 각각의 헤테로사이클릴 또는 헤테로아릴은 하나 이상의 R17로 선택적으로 치환된다.
본 발명의 일 실시형태에서, 화학식 I의 화합물은 하기 화학식 Id를 가진다:
식 중, Het는 C4-C8사이클로알켄일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴 또는 헤테로아릴을 나타내는 R8이되, 각각의 사이클로알켄일, 사이클로알킬, 헤테로사이클릴, 아릴 또는 헤테로아릴은 하나 이상의 R17로 선택적으로 치환된다.
본 발명의 일 실시형태에서, 화학식 I의 화합물은 하기 화학식 Ie를 가진다:
본 발명의 일 실시형태에서, 화학식 I의 화합물은 하기 화학식 If를 가진다:
본 발명의 일 실시형태에서, 화학식 I의 화합물은 하기 화학식 Ig를 가진다:
다른 실시형태에서, 화학식 I의 화합물은 하기를 포함하지만, 이들로 제한되지 않는다,
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드];
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드];
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드];
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[5-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드];
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[5-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드];
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스(5-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드);
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드];
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드;
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[5-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[5-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[5-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[5-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[5-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[5-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드];
N,N'-[(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피페리딘-1,4-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-[(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피페리딘-1,4-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
1,1'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[N-([3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)페닐]설폰일)폼아마이드];
1,1'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[N-([3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)페닐]설폰일)폼아마이드];
1,1'-(5,12-다이옥소-4,6,11,13-테트라아자헥사데칸-1,16-다이일)비스[N-([3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)페닐]설폰일)피페리딘-4-카복사마이드];
1,1'-(5,12-다이옥소-4,6,11,13-테트라아자헥사데칸-1,16-다이일)비스[N-([3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)페닐]설폰일)피페리딘-3-카복사마이드];
N 1,N 18-비스([3-(6,8-다이클로로-2-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)페닐]설폰일)-6,13-다이옥소-5,7,12,14-테트라아자옥타데칸다이아마이드;
N,N'-[(3S,3'S)-(6,13-다이옥소-5,7,12,14-테트라아자옥타데칸다이오일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-[(3S,3'S)-(6,13-다이옥소-5,7,12,14-테트라아자옥타데칸다이오일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
1-[2-(2-[(1-[(3-[(S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐)설폰일]피페리딘-4-일)옥시]에톡시)에틸]-3-[4-(3-[2-(2-[(1-[(3-[(S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐)설폰일]피페리딘-4-일)옥시]에톡시)에틸]유레이도)뷰틸]유레아;
1-(2-(2-(((R)-1-((3-((S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)페닐)설폰일)피롤리딘-3-일)옥시)에톡시)에틸)-3-(4-(3-(2-(2-(((R)-1-((3-((S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)페닐)설폰일)피롤리딘-3-일)옥시)에톡시)에틸)유레이도)뷰틸)유레아;
1-(2-[2-([(S)-1-[(3-[(S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐)설폰일]피롤리딘-3-일]옥시)에톡시]에틸)-3-(4-[3-(2-[2-([(S)-1-[(3-[(S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐)설폰일]피롤리딘-3-일]옥시)에톡시]에틸)유레이도]뷰틸)유레아;
3-[(S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]-N-[(3R,28R)-28-[(3-[(S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐)설폰아미도]-2,29-다이메틸-12,19-다이옥소-5,8,23,26-테트라옥사-11,13,18,20-테트라아자트라이아콘탄-3-일]벤젠설폰아마이드;
N,N'-(10-옥소-3,6,14,17-테트라옥사-9,11-다이아자노나데칸-1,19-다이일)비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7-옥소-3,11-다이옥사-6,8-다이아자트라이데칸-1,13-다이일]비스[피롤리딘-1,3-다이일))비스(3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N 1,N 18-비스(1-[(3-[(S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐)설폰일]피페리딘-4-일)-6,13-다이옥소-5,7,12,14-테트라아자옥타데칸다이아미드;
N 1,N 18-비스(1-[(3-[(S)-6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐)설폰일]피페리딘-4-일)-6,13-다이옥소-5,7,12,14-테트라아자옥타데칸다이아마이드; 또는
N 1,N 18-비스(1-[(3-[(S)-6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐)설폰일]피페리딘-4-일)-6,13-다이옥소-5,7,12,14-테트라아자옥타데칸다이아마이드.
일부 실시형태에서, Y는 O, S, NH, N(C1-C3알킬), 또는 -C(O)NH-이다. 일부 실시형태에서, Y는 O이다. 일부 실시형태에서, Y는 S이다. 일부 실시형태에서, Y는 NH이다. 일부 실시형태에서, Y는 N(C1-C3알킬)이다. 일부 실시형태에서, Y는 -C(O)NH-이다. 일부 실시형태에서, Y는 O, S, NH, 또는 N(C1-C3알킬)이다. 일부 실시형태에서, Y는 O, S, 또는 NH이다. 일부 실시형태에서, Y는 O 또는 S이다.
일부 실시형태에서, Q는 결합 또는 -NHC(O)NH-이다. 일부 실시형태에서, Q는 결합, NH, -C(O)NH-, -NHC(O)NH- 또는 -NHC(O)N(CH3)-이다. 일부 실시형태에서, Q는 결합이다. 일부 실시형태에서, Q는 -NHC(O)NH-이다.
다른 실시형태에서, R1은 할로겐, OH, CN, C1-C6알킬, C1-C6알콕시, C1-C6할로알킬, C1-C6할로알콕시 또는 -C(O)NR9R10이다. 일 실시형태에서, R1은 할로겐, OH, CN, C1-C6알킬, C1-C6알콕시, C1-C6할로알킬 또는 C1-C6할로알콕시이다. 일 실시형태에서, R1은 할로겐, OH, CN, C1-C6알킬, C1-C6알콕시 또는 C1-C6할로알킬이다. 일 실시형태에서, R1은 할로겐, OH, CN, C1-C6알킬 또는 C1-C6알콕시이다. 일 실시형태에서, R1은 할로겐, OH, CN 또는 C1-C6알킬이다. R1은 할로겐, OH 또는 CN이다. 일 실시형태에서, R1은 할로겐 또는 OH이다. 일 실시형태에서, R1은 할로겐이다. R1은 OH이다. 일 실시형태에서, R1은 CN이다. 일 실시형태에서, R1은 C1-C6알킬이다. 일 실시형태에서, R1은 C1-C6알콕시이다. 일 실시형태에서, R1은 C1-C6할로알킬이다. 일 실시형태에서, R1은 C1-C6할로알콕시이다. 일 실시형태에서, R1은 -C(O)NR9R10이다.
다른 실시형태에서, R2는 할로겐, OH, CN, C1-C6알킬, C1-C6알콕시, C1-C6할로알킬, C1-C6할로알콕시 또는 -C(O)NR9R10이다. 일 실시형태에서, R2는 할로겐, OH, CN, C1-C6알킬, C1-C6알콕시, C1-C6할로알킬 또는 C1-C6할로알콕시이다. 일 실시형태에서, R2는 할로겐, OH, CN, C1-C6알킬, C1-C6알콕시 또는 C1-C6할로알킬이다. 일 실시형태에서, R2는 할로겐, OH, CN, C1-C6알킬 또는 C1-C6알콕시이다. 일 실시형태에서, R2 할로겐, OH, CN 또는 C1-C6알킬이다. R2은 할로겐, OH 또는 CN이다. 일 실시형태에서, R2는 할로겐 또는 OH이다. 일 실시형태에서, R2는 할로겐이다. R2은 OH이다. 일 실시형태에서, R2는 CN이다. 일 실시형태에서, R2는 C1-C6알킬이다. 일 실시형태에서, R2는 C1-C6알콕시이다. 일 실시형태에서, R2는 C1-C6할로알킬이다. 일 실시형태에서, R4는 C1-C6할로알콕시이다. 일 실시형태에서, R2는 -C(O)NR9R10이다.
일 실시형태에서, R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴, N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴, -SR9, -OR9, -NHR9, -NR9R10, -S(O)2N(R9)2-, -S(O)2R9, -C(O)R9, -C(O)OR9, -NR9S(O)2R10, -S(O)R9, -S(O)NR9R10, -NR8S(O)R9이다. 일 실시형태에서, R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴, N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴, -SR9, -OR9, -NHR9, -NR9R10, -S(O)2N(R9)2-, -S(O)2R9, -C(O)R9, -C(O)OR9, -NR9S(O)2R10, -S(O)R9, -S(O)NR9R10이다. 일 실시형태에서, R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴, N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴, -SR9, -OR9, -NHR9, -NR9R10, -S(O)2N(R9)2-, -S(O)2R9, -C(O)R9, -C(O)OR9, NR9S(O)2이다. 일 실시형태에서, R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴, N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴, -SR9, -OR9, -NHR9, -NR9R10, -S(O)2N(R9)2-, -S(O)2R9, -C(O)R9, -C(O)OR9이다. 일 실시형태에서, R3, R5, R6 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴, N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴, -SR9, -OR9, -NHR9, -NR9R10, -S(O)2N(R9)2-, -S(O)2R9, -C(O)R9이다. 일 실시형태에서, R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴, N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴, -SR9, -OR9, -NHR9, -NR9R10, -S(O)2N(R9)2-, -S(O)2R9이다. 일 실시형태에서, R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴, N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴, -SR9, -OR9, -NHR9, -NR9R10, -S(O)2N(R9)2-이다. 일 실시형태에서, R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴, N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴, -SR9, -OR9, -NHR9, -NR9R10이다. 일 실시형태에서, R5, R6, R7 및 R8은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴, N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴, -SR9, -OR9, -NHR9이다. 일 실시형태에서, R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴, N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴, -SR9, -OR9이다. 일 실시형태에서, R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴, N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴, -SR9이다. 일 실시형태에서, R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴, 또는 N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴이다. 일 실시형태에서, R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬, 헤테로사이클릴 또는 아릴이다. 일 실시형태에서, R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬 또는 헤테로사이클릴이다. 일 실시형태에서, R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일 또는 C3-C8사이클로알킬이다. 일 실시형태에서, R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일 또는 C2-C6알킨일이다. 일 실시형태에서, R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬, C2-C6알켄일 또는 C4-C8사이클로알켄일이다. 일 실시형태에서, R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬 또는 C2-C6알켄일이다. 일 실시형태에서, R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2 또는 C1-C6알킬이다. 일 실시형태에서, R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN 또는 -NO2이다. 일 실시형태에서, R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH 또는 CN이다. 일 실시형태에서, R3, R4, R5 및 R6은 독립적으로 H, 할로겐 또는 OH이다. 일 실시형태에서, R3, R4, R5 및 R6은 독립적으로 H 또는 할로겐이다.
일 실시형태에서, R13, R14, R15, 및 R16은 독립적으로, 각각의 경우에, H, OH, NH2 또는 C1-C3 알킬이다. 추가 실시형태에서, R13, R14, R15, 및 R16은 독립적으로, 각각의 경우에, H, OH 또는 NH2이다. 추가 실시형태에서, R13, R14, R15, 및 R16은 독립적으로, 각각의 경우에, H 또는 OH이다. 추가 실시형태에서, R13, R14, R15, 및 R16은 독립적으로, 각각의 경우에, H, OH, NH2 또는 C1-C3 알킬이되, 알킬은 하나 이상의 R17로 선택적으로 치환된다.
일 실시형태에서, X는 결합, H, N, O, CR11R12, CR11, C 또는 -NHC(O)NH-이다. 일 실시형태에서, X는 결합, H, N, O, CR11R12, CR11 또는 C이다. 일 실시형태에서, X는 결합, H, N, O, CR11R12 또는 CR11이다. 일 실시형태에서, X는 결합, H, N, O 또는 CR11R12이다. 일 실시형태에서, X는 결합, H, N 또는 O이다. 일 실시형태에서, X는 결합, H 또는 N이다. 일 실시형태에서, X는 결합 또는 H이다. 일 실시형태에서, X는 결합이다. 다른 실시형태에서 X는 H 및 n은 1이다. 다른 실시형태에서, n이 3일 때, X는 N이다. 다른 실시형태에서, X는 O이고, n은 2이다. 다른 실시형태에서, X는 CR11R12이고, n은 2이다. 다른 실시형태에서, X는 CR11이고, n은 3이다. 다른 실시형태에서, X는 C이고, n은 4이다. 다른 실시형태에서, X는 -NHC(O)NH-이다.
일부 실시형태에서, R7은 H, C1-C6알킬 또는 C1-C6할로알킬이다. 일부 실시형태에서, R7은 H 또는 C1-C6알킬이다. 일부 실시형태에서, R7은 H이다. 일부 실시형태에서, R7은 C1-C6알킬이다. 일부 실시형태에서, R7은 C1-C6할로알킬이다.
일부 실시형태에서, R8은 독립적으로 각각의 경우에, 결합, H, C1-C6알킬, C4-C8사이클로알켄일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴 또는 헤테로아릴이다. 일부 실시형태에서, R8은 독립적으로 각각의 경우에, 결합, H, C1-C6알킬, C4-C8사이클로알켄일, C3-C8사이클로알킬, 헤테로사이클릴 또는 아릴이다. 일부 실시형태에서, R8은 독립적으로 각각의 경우에, 결합, H, C1-C6알킬, C4-C8사이클로알켄일, C3-C8사이클로알킬, 또는 헤테로사이클릴이다. 일부 실시형태에서, R8은 독립적으로 각각의 경우에, 결합, H, C1-C6알킬, C4-C8사이클로알켄일 또는 C3-C8사이클로알킬이다. 일부 실시형태에서, R8은 독립적으로 각각의 경우에, 결합, H, C1-C6알킬, C4-또는 C8사이클로알켄일이다. 일부 실시형태에서, R8은 독립적으로 각각의 경우에, 결합, H 또는 C1-C6알킬이다. 일부 실시형태에서, R8은 독립적으로 각각의 경우에, 결합 또는 H이다.
일부 실시형태에서, R8은 독립적으로 각각의 경우에, 결합, H, C1-C6알킬, C4-C8사이클로알켄일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴 또는 헤테로아릴이되, 각각의 알킬, 사이클로알켄일, 사이클로알킬, 헤테로사이클릴, 아릴 또는 헤테로아릴은 하나 이상의 R17로 선택적으로 치환된다. 일부 실시형태에서, R8은 독립적으로 각각의 경우에, 결합, H, C1-C6알킬, C4-C8사이클로알켄일, C3-C8사이클로알킬, 헤테로사이클릴 또는 아릴이되, 각각의 알킬, 사이클로알켄일, 사이클로알킬, 헤테로사이클릴 또는 아릴은 하나 이상의 R17로 선택적으로 치환된다. 일부 실시형태에서, R8은 독립적으로 각각의 경우에, 결합, H, C1-C6알킬, C4-C8사이클로알켄일, C3-C8사이클로알킬, 또는 헤테로사이클릴이되, 각각의 알킬, 사이클로알켄일, 사이클로알킬, 또는 헤테로사이클릴은 하나 이상의 R17로 선택적으로 치환된다. 일부 실시형태에서, R8은 독립적으로 각각의 경우에, 결합, H, C1-C6알킬, C4-C8사이클로알켄일 또는 C3-C8사이클로알킬이되, 각각의 알킬, 사이클로알켄일 또는 사이클로알킬은 하나 이상의 R17로 선택적으로 치환된다. 일부 실시형태에서, R8은 독립적으로 각각의 경우에, 결합, H, C1-C6알킬, C4- 또는 C8사이클로알켄일이다. 일부 실시형태에서, R8은 독립적으로 각각의 경우에, 결합, H 또는 C1-C6알킬이되, 각각의 알킬은 하나 이상의 R17로 선택적으로 치환된다.
다른 실시형태에서, R7 및 R8은 그들이 부착된 원자와 함께 조합되어 독립적으로 각각의 경우에, 헤테로사이클릴 또는 헤테로아릴을 형성할 수 있다. 다른 실시형태에서, R7 및 R8은 그들이 부착된 원자와 함께 조합되어 독립적으로 각각의 경우에, 헤테로사이클릴을 형성할 수 있다. 일부 실시형태에서, R7 및 R8은 그들이 부착된 원자와 함께 조합되어 독립적으로 각각의 경우에, 헤테로아릴을 형성할 수 있다.
다른 실시형태에서, R7 및 R8은 그들이 부착된 원자와 함께 조합되어 독립적으로, 각각의 경우에, 헤테로사이클릴 또는 헤테로아릴을 형성할 수 있되, 각각의 헤테로사이클릴 또는 헤테로아릴은 하나 이상의 R17로 선택적으로 치환된다. 다른 실시형태에서, R7 및 R8은 그들이 부착된 원자와 함께 조합되어 독립적으로, 각각의 경우에, 헤테로사이클릴을 형성할 수 있되, 각각의 헤테로사이클릴은 하나 이상의 R17로 선택적으로 치환된다. 일부 실시형태에서, R13 및 R14는 그들이 부착된 원자와 함께 조합되어 독립적으로, 각각의 경우에, 헤테로아릴을 형성할 수 있되, 각각의 헤테로아릴은 하나 이상의 R17로 선택적으로 치환된다.
일부 실시형태에서, u는 0, 1 또는 2이다. 일부 실시형태에서, u는 0 또는 1이다. 일부 실시형태에서, u는 0이다. 일부 실시형태에서, u는 1이다. 일부 실시형태에서, u는 2이다.
일부 실시형태에서, n는 1, 2, 3 또는 4이다. 일부 실시형태에서, n는 1, 2 또는 3이다. 일부 실시형태에서, n은 1 또는 2이다. 일부 실시형태에서, n는 1이다. 일부 실시형태에서, n은 2이다. 일부 실시형태에서, n은 3이다. 일부 실시형태에서, n은 4이다.
일부 실시형태에서, s는 0, 1, 2, 3 또는 4이다. 일부 실시형태에서, s는 0, 1, 2 또는 3이다. 일부 실시형태에서, s는 0, 1 또는 2이다. 일부 실시형태에서, s는 0 또는 1이다. 일부 실시형태에서, s는 0이다. 일부 실시형태에서, s는 1이다. 일부 실시형태에서, s는 2이다. 일부 실시형태에서, s는 3이다. 일부 실시형태에서, s는 4이다.
일부 실시형태에서, r은 0, 1, 2, 3, 4, 5, 6, 7 또는 8이다. 일부 실시형태에서, r은 0, 1, 2, 3, 4, 5, 6 또는 7이다. 일부 실시형태에서, r은 0, 1, 2, 3, 4, 5 또는 6이다. 일부 실시형태에서, r은 0, 1, 2, 3, 4 또는 5이다. 일부 실시형태에서, r은 0, 1, 2, 3 또는 4이다. 일부 실시형태에서, r은 0, 1, 2 또는 3이다. 일부 실시형태에서, r은 0, 1 또는 2이다. 일부 실시형태에서, r은 0 또는 1이다. 일부 실시형태에서, r은 0이다. 일부 실시형태에서, r은 1이다. 일부 실시형태에서, r은 2이다. 일부 실시형태에서, r은 3이다. 일부 실시형태에서, r은 4이다. 일부 실시형태에서, r은 5이다. 일부 실시형태에서, r은 6이다. 일부 실시형태에서, r은 7이다. 일부 실시형태에서, r은 8이다.
일부 실시형태에서, p는 0, 1, 2, 3, 4, 5, 6, 7 또는 8이다. 일부 실시형태에서, p는 0, 1, 2, 3, 4, 5, 6 또는 7이다. 일부 실시형태에서, p는 0, 1, 2, 3, 4, 5 또는 6이다. 일부 실시형태에서, p는 0, 1, 2, 3, 4 또는 5이다. 일부 실시형태에서, p는 0, 1, 2, 3 또는 4이다. 일부 실시형태에서, p는 0, 1, 2 또는 3이다. 일부 실시형태에서, p는 0, 1 또는 2이다. 일부 실시형태에서, p는 0 또는 1이다. 일부 실시형태에서, p는 0이다. 일부 실시형태에서, p는 1이다. 일부 실시형태에서, p는 2이다. 일부 실시형태에서, p는 3이다. 일부 실시형태에서, p는 4이다. 일부 실시형태에서, p는 5이다. 일부 실시형태에서, p는 6이다. 일부 실시형태에서, p는 7이다. 일부 실시형태에서, p는 8이다.
설계 및 제조함에 있어서, 치료를 위해 이용될 수 있는 본 발명의 실질적으로 비침투성 또는 실질적으로 전신으로 생체 이용 가능하지 않은 NHE-저해 화합물은 본 개시내용에서 상술된다.
다른 양상에서, 연장된 탄화수소 작용기를 갖는 본 발명의 화합물은 그 자체가 분자내 방식으로 붕괴되어, 목적으로 하는 생물학적 표적과의 상호작용을 위해 증가된 엔탈피 장벽을 야기할 수 있다. 따라서, "X" 및 링커 모이어티를 설계할 때, 이들은 소수성 붕괴에 저항성인 것으로 설계된다. 예를 들어, 입체배좌적 제한, 예컨대 강성의 단환식, 이환식 또는 다환식 고리는 "X" 및 링커 모이어티에 놓여서 구조의 강성도를 증가시킬 수 있다. 불포화 결합, 예컨대 알켄 및 알킨은 또한 또는 대안적으로 놓일 수 있다. 이러한 변형은 NHE-저해 화합물이 그의 표적에 대한 생산적 결합에 대해 접근 가능하다는 것을 보장할 수 있다. 더 나아가, 링커의 친수성은 수소 결합 공여자 또는 수용자 모티프, 또는 이온성 모티프, 예컨대 GI에서 양성자화된 아민, 또는 탈양성자화된 산을 첨가함으로써 개선될 수 있다. 이러한 변형은 "X" 및 링커 모이어티의 친수성을 증가시키고, 소수성 붕괴를 방지할 것이다. 더 나아가, 이러한 변형은 또한 tPSA를 증가시킴으로써 얻어진 화합물의 비침투성에 기여할 것이다.
당업자는 또한 "X" 모이어티 및/또는 링커에 화학식 I의 화합물 분자의 나머지의 손쉬운 그리고 특이적인 부착을 허용하는 다양한 작용기를 고려할 수 있다. 이들 작용기는 친전자성 "X" 및 링커 모이어티와 반응할 수 있는 친핵성기 및/또는 친핵체와 반응할 수 있는 친전자체를 포함할 수 있다. 화학식 I의 NHE-저해 화합물은 또한, 예를 들어, 보론산으로 유사하게 유도체화될 수 있다. 화학식 I의 NHE-저해 화합물은 또한 올레핀 복분해 화학을 통해 올레핀, 또는 [2 + 3] 첨가 환화를 통해 그 다음에 적절한 다른 "X" 및 링커와 반응할 수 있는 알킨 또는 아자이드를 함유할 수 있다.
당업자는 적절한 친전자체 또는 친핵체로 작용기화될 수 있는 다수의 "X" 및 링커 모이어티를 생각할 수 있다는 것을 주목하여야 한다. 용해도, 입체 효과, 및 바람직한 구조-활성 관계를 부여하거나 또는 이와 일치되는 그들의 능력을 비롯한 몇몇 설계 고려사항에 기반하여 선택된 일련의 이러한 화합물을 이하에 나타낸다. 이와 관련하여, 그러나 이하 및 상기 제공되는 구조는 단지 예시적 목적을 위한 것이며, 따라서 제한적 의미로 고려되어서는 안 된다는 것을 추가로 주목하여야 한다.
예시적인 친전자성 및 친핵성 링커 모이어티는 실시예 및 하기에 도시되는 링커 모이어티를 포함하지만, 이들로 제한되지 않는다:
각각의 기재된 실시형태에서 연결 모이어티, 링커는 또한, 예를 들어 친수성 및/또는 소수성일 수 있는 화학적 결합 또는 다른 모이어티일 수 있다. 일 실시형태에서, 연결 모이어티는, 예를 들어, 당업계에 공지된 생 유리 라디칼 중합 접근을 이용하여, 중합체 골격에 접합된 중합체 모이어티일 수 있다.
다른 실시형태에서, 화학식 I의 화합물에 도시된 "X" 모이어티는 또한, 에터 모이어티, 에스터 모이어티, 설파이드 모이어티, 다이설파이드 모이어티, 아민 모이어티, 아릴 모이어티, 알콕실 모이어티 등, 예를 들어, 하기를 포함할 수 있지만, 이들로 제한되지 않는다:
식 중, 파선 결합(즉, 그들을 통해 물결 결합을 갖는 것, )은 n > 1일 때 화학식 I의 분자의 나머지에 대한 결합 지점이며, 상기 결합 지점은 화학결합 및 의학 화학 분야에 공지된 작용기를 이용하여 생성될 수 있으며; 그리고 추가로 각각의 p', q', r' 및 s'는 약 0 내지 약 48, 약 0 내지 약 36 또는 약 0 내지 약 24 또는 약 0 내지 약 16 범위의 정수로부터 독립적으로 선택된다. 일부 예에서, 각각의 p, q, r 및 s는 약 0 내지 12 범위의 정수로부터 독립적으로 선택될 수 있다. 추가적으로, R'은 할로겐화물, 하이드록실, 아민, 티올, 에터, 카보닐, 카복실, 에스터, 아마이드, 탄소환식, 복소환식 및 이들의 조합을 포함하는 모이어티로부터 일반적으로 선택되는 치환체 모이어티일 수 있다.
다른 접근에서, 화학식 I의 "X" 모이어티는 반복적으로 분지된 분자로서 정의되고(예를 들어, 문헌[J. M. J. , D. A. Tomalia, Dendrimers and Other Dendritic Polymers, John Wiley & Sons, Ltd. NY, NY, 2001] 참조) 그리고 이하에 개략적으로 나타내는 덴드리머일 수 있다:
이 접근에서, NHE-저해 분자의 나머지는 덴드리머 주변에 위치된 하나, 몇몇 또는 선택적으로 모든 말단에 대해 링커를 통해 부착된다. 다른 접근에서, 덴드론으로 명명되고 상기 도시한 덴드리머 빌딩 블록은 "X" 모이어티로서 사용되되, NHE-저해 분자의 나머지는 덴드론 주변에 위치된 하나, 몇몇 또는 선택적으로 모든 말단에 부착된다. 본 명세서에서의 생성 수는 전형적으로 약 0 내지 약 6, 및 약 0 내지 약 3이다. (생성은, 예를 들어, 문헌[J. M. J. , D. A. Tomalia, Dendrimers and Other Dendritic Polymers, John Wiley & Sons, Ltd. NY, NY.]에 정의된다) 덴드리머 및/또는 덴드론 구조는 당업계에 잘 공지되어 있고, 예를 들어: (i) 문헌[J. M. J. , D. A. Tomalia, Dendrimers and Other Dendritic Polymers, John Wiley & Sons, Ltd. NY, NY]; (ii) 문헌[George R Newkome, Charles N. Moorefield and Fritz Vogtle, Dendrimers and Dendrons: Concepts, Syntheses, Applications, VCH Verlagsgesellschaft Mbh]; 및, (iii) 문헌[Boas, U., Christensen, J.B., Heegaard, P.M.H., Dendrimers in Medicine and Biotechnology: New Molecular Tools, Springer, 2006]에 나타내거나 또는 도시된 것을 포함한다.
또 다른 접근에서, "X" 모이어티는 중합체 모이어티 또는 올리고머 모이어티일 수 있다. 중합체 또는 올리고머는, 각각의 경우에, 독립적으로 고려되며, 알킬(예를 들어, -CH2-), 치환된 알킬(예를 들어, -CHR-, 여기서, 예를 들어, R은 하이드록시임), 알켄일, 치환된 알켄일, 알킨일, 치환된 알킨일, 페닐, 아릴, 복소환식, 아민, 에터, 설파이드, 다이설파이드, 하이드라진, 및 산소, 황, 설폰일, 포스폰일, 하이드록실, 알콕실, 아민, 티올, 에터, 카보닐, 카복실, 에스터, 아마이드, 알킬, 알켄일, 알킨일, 아릴, 복소환식뿐만 아니라 이들의 조합을 포함하는 모이어티로 치환된 임의의 앞서 언급한 것으로부터 선택된 반복 모이어티로 이루어진 반복 모이어티를 포함할 수 있다. 또 다른 접근에서, "X" 모이어티는 에틸렌 단량체(예를 들어, 본 명세서의 이하의 다른 곳에 열거되는 해당 에틸렌 단량체)의 중합으로부터 초래된 반복 단위를 포함한다.
본 명세서에 개시된 다양한 치료 방법에서 사용하기 위한 다가인 실질적으로 비침투성 또는 실질적으로 전신으로 생체 이용 가능하지 않은 NHE-저해 화합물을 구성하는 데 유용한 중합체 모이어티에 대한 바람직한 중합체는 임의의 적합한 기법에 의해, 예컨대 유리 라디칼 중합, 축합 중합, 첨가 중합, 고리 열림 중합에 의해 제조될 수 있고, 그리고/또는 천연 유래 중합체, 예컨대 당류 중합체로부터 유도될 수 있다. 추가로, 일부 실시형태에서, 임의의 이들 중합체 모이어티는 작용기화될 수 있다.
이러한 화합물의 제조에서 유용한 다당류의 예는 셀룰로스 물질, 헤미셀룰로스, 알킬 셀룰로스, 하이드록시알킬 셀룰로스, 카복시메틸셀룰로스, 설포에틸셀룰로스, 전분, 자일란, 아밀로펙틴, 콘드로이틴, 하이아루로네이트, 헤파린, 구아, 잔탄, 만난, 갈락토만난, 키틴 및/또는 키토산을 포함하는 식물성 또는 동물성 유래의 물질을 포함하지만, 이들로 제한되지 않는다. 적어도 일부 예에서, GI관의 생리적 조건 하에서 분해되지 않는, 또는 상당하게 분해되지 않는 중합체 모이어티(예를 들어, 카복시메틸셀룰로스, 키토산 및 설포에틸셀룰로스)가 가장 바람직하다.
유리 라디칼 중합이 사용될 때, 중합체 모이어티는, 예를 들어, 아크릴, 메타크릴, 스타이렌, 비닐 및 다이엔을 포함하는 다양한 부류의 단량체로부터 제조될 수 있으며, 이의 전형적인 예는 이후에 제공한다: 스타이렌, 치환된 스타이렌, 알킬 아크릴레이트, 치환된 알킬 아크릴레이트, 알킬 메타크릴레이트, 치환된 알킬 메타크릴레이트, 아크릴로나이트릴, 메타크릴로나이트릴, 아크릴아마이드, 메타크릴아마이드, N-알킬아크릴아마이드, N-알킬메타크릴아마이드, N,N-다이알킬아크릴아마이드, N,N-다이알킬메타크릴아마이드, 아이소프렌, 부타다이엔, 에틸렌, 비닐 아세테이트, 및 이들의 조합. 이들 단량체의 작용기화된 형태가 또한 사용될 수 있고, 임의의 이들 단량체는 공단량체로서 다른 단량체와 함께 사용될 수 있다. 예를 들어, 본 개시내용에서 사용될 수 있는 구체적 단량체 또는 공단량체는 메틸 메타크릴레이트, 에틸 메타크릴레이트, 프로필 메타크릴레이트(모든 이성질체), 뷰틸 메타크릴레이트(모든 이성질체), 2-에틸헥실 메타크릴레이트, 아이소봄일 메타크릴레이트, 메타크릴산, 벤질 메타크릴레이트, 페닐 메타크릴레이트, 메타크릴로나이트릴, α-메틸스타이렌, 메틸 아크릴레이트, 에틸 아크릴레이트, 프로필 아크릴레이트(모든 이성질체), 뷰틸 아크릴레이트(모든 이성질체), 2-에틸헥실 아크릴레이트, 아이소봄일 아크릴레이트, 아크릴산, 벤질 아크릴레이트, 페닐 아크릴레이트, 아크릴로나이트릴, 스타이렌, 글리시딜 메타크릴레이트, 2-하이드록시에틸 메타크릴레이트, 하이드록시프로필 메타크릴레이트(모든 이성질체), 하이드록시뷰틸 메타크릴레이트(모든 이성질체), N,N-다이메틸아미노에틸 메타크릴레이트, N,N-다이에틸아미노에틸 메타크릴레이트, 트라이에틸렌글리콜 메타크릴레이트, 이타콘산 무수물, 이타콘산, 글리시딜 아크릴레이트, 2-하이드록시에틸 아크릴레이트, 하이드록시프로필 아크릴레이트(모든 이성질체), 하이드록시뷰틸 아크릴레이트(모든 이성질체), N,N-다이메틸아미노에틸 아크릴레이트, N,N-다이에틸아미노에틸 아크릴레이트, 트라이에틸렌글리콜 아크릴레이트, 메타크릴아마이드, N-메틸아크릴아마이드, N,N-다이메틸아크릴아마이드, N-tert-뷰틸메타크릴아마이드, N-N-뷰틸메타크릴아마이드, N-메틸올메타크릴아마이드, N-에틸올메타크릴아마이드, N-tert-뷰틸아크릴아마이드, N-N-뷰틸아크릴아마이드, N-메틸올아크릴아마이드, N-에틸올아크릴아마이드, 4-아크릴로일몰폴린, 비닐 벤조산(모든 이성질체), 다이에틸아미노스타이렌 (모든 이성질체), a-메틸비닐 벤조산(모든 이성질체), 다이에틸아미노 α-메틸스타이렌(모든 이성질체), p-비닐벤젠 설폰산, p-비닐벤젠 설폰나트륨염, 알콕시 및 알킬 실란 작용기 단량체, 말레산 무수물, N-페닐말레이미드, N-뷰틸말레이미드, 부타다이엔, 아이소프렌, 클로로프렌, 에틸렌, 비닐 아세테이트, 비닐폼아마이드, 알릴아민, 비닐피리딘(모든 이성질체), 플루오린화된 아크릴레이트, 메타크릴레이트 및 이들의 조합물을 포함한다. 폴리에틸렌이민 및 폴리에터, 예컨대 폴리에틸렌 옥사이드 및 폴리프로필렌 옥사이드뿐만 아니라 이들의 공중합체를 포함하는, 주요 쇄 헤테로원자 중합체 모이어티가 또한 사용될 수 있다.
하나의 특정 실시형태에서, NHE-저해 분자가 부착된 중합체, 또는 다르게는 이의 부분은 폴리올(예를 들어, 하이드록실-치환된 알킬, 예컨대 -CH(OH)-의 반복 단위를 갖는 중합체)이다. 환원성 또는 환원 가능한 말단기가 있거나 또는 없는 폴리올, 예컨대 단당류 및 이당류는, 예를 들어, 화합물에 실질적으로 비침투성을 부여할 수 있는 추가적인 작용기를 정착시키기 위한 양호한 후보일 수 있다.
하나의 특정 실시형태에서, NHE-저해 분자는 중합체 쇄 말단 중 하나 또는 둘 다에 부착된다. 더 구체적으로, 본 개시내용의 다가 실시형태에 대한 또 다른 대안의 접근에서, 거대분자(예를 들어, 중합체 또는 올리고머)는 일반적인 다음의 예시적 구조를 가지며:
이는 하기 모이어티에 대해 기재된 바와 같이 예시되고/되거나 설계되고/되거나 해석될 수 있다:
상기 제시한 바와 같은 본 발명의 화합물 및 이러한 화합물에서 상기 제시한 바와 같은 임의의 구체적 치환체의 임의의 실시형태는 상기에 구체적으로 제시되지 않은 본 발명의 실시형태를 형성하기 위해 이러한 화합물의 다른 실시형태 및/또는 치환체와 독립적으로 조합될 수 있다는 것이 이해된다. 추가로, 치환체 목록이 특정 실시형태 및/또는 청구범위에서 임의의 특정 치환체에 대해 열거되는 사건에서, 각각의 개개 치환체는 특정 실시형태 및/또는 청구범위로부터 삭제될 수 있고, 치환체의 남아있는 목록은 본 발명의 범위 내인 것으로 고려될 수 있다는 것이 이해된다. 더 나아가, 본 설명에서, 도시된 화학식의 치환체 및/또는 변수의 조합은 이러한 기여가 안정한 화합물을 초래하는 경우에만 허용 가능하다는 것이 이해된다.
B.
침투성
이와 관련하여, 다양한 실시형태에서, 실질적으로 전신으로 생체 이용 가능하지 않은 화합물의 능력은 화합물 전하, 크기 및/또는 다른 물리화학적 매개변수(예를 들어, 극성 표면적, 수소 결합 공여자 및/또는 수용자의 수, 자유롭게 회전 가능한 결합의 수 등)에 기반한다는 것을 주목하여야 한다. 더 구체적으로, 화합물의 흡수 특징은, 예를 들어, "5법칙(the rule of five)"으로서도 알려진 리핀스키 법칙(Lipinski's rule)을 적용함으로써 약력학 원칙을 적용함으로써 선택될 수 있다는 것을 주목하여야 한다. 규칙은 아니지만, 가이드라인으로서, 리핀스키는 소정의 역치값 초과의 (i) 분자량, (ii) 다수의 수소 결합 공여자, (iii) 다수의 수소 결합 수용자, 및/또는 (iv) 물/옥탄올 분배계수(모리구치(Moriguchi) Log P)를 갖는 소분자가 일반적으로 상당한 전신 농도를 나타내지 않는다는 것을 나타낸다(즉, 일반적으로 임의의 상당한 정도로 흡수되지 않는다). (예를 들어, 본 명세서에 참고로 편입된 문헌[Lipinski et al., Advanced Drug Delivery Reviews, 46, 2001 3-26] 참조) 따라서, 실질적으로 전신으로 생체 이용 가능하지 않은 화합물(예를 들어, 실질적으로 전신으로 생체 이용 가능하지 않은 NHE-저해 화합물)은 리핀스키 역치값 중 하나 이상을 초과하는 분자 구조를 갖도록 설계될 수 있다. (또한 본 명세서에 참고로 편입된 문헌[Lipinski et al., Experimental and Computational Approaches to Estimate Solubility and Permeability in Drug Discovery and Development Settings, Adv. Drug Delivery Reviews, 46:3-26 (2001); 및 Lipinski, Drug-like Properties and the Causes of Poor Solubility and Poor Permeability, J. Pharm. & Toxicol. Methods, 44:235-249 (2000)] 참조) 일부 실시형태에서, 예를 들어, 본 개시내용의 실질적으로 비침투성 또는 실질적으로 전신으로 생체 이용 가능하지 않은 NHE-저해 화합물은 다음의 특징 중 하나 이상을 특징으로 하도록 구성될 수 있다: (i) (화합물의 비-염 형태로) 약 500Da, 약 1000Da, 약 2500Da, 약 5000Da, 약 10,000Da 또는 더 큰 수 초과의 MW; (ii) 약 5, 약 10, 약 15 또는 더 큰 수 초과의 NH 및/또는 OH 및/또는 다른 잠재적 수소 결합 공여자의 수; (iii) 약 5, 약 10, 약 15 또는 더 큰 수 초과의 O 원자 및/또는 N 원자 및/또는 다른 잠재적 수소 결합 수용자의 총 수; 및/또는 (iv) 약 105 초과(즉, 약 5, 약 6, 약 7 등 초과의 Log P), 또는 대안적으로 약 10 미만(즉, 1 미만, 또는 심지어 0의 Log P)의 모리구치 분배계수.
상기 언급한 매개변수에 추가로, 극성 원자에 속하는 표면을 특징으로 할 수 있는 분자 극성 표면적(즉, "PSA(polar surface area))은 또한 막을 통한 수동 수송과 상당히 상호 연관되는 것으로 나타난 설명어이며, 따라서, 약물의 수송 특성의 예측을 허용한다. 이는 장 흡수 및 Caco2 세포 단일층 침투의 예측을 위해 성공적으로 적용되었다. (Caco2 세포 단일층 침투 시험 세부사항에 대해, 예를 들어 전문이 모든 적절하고 일관된 목적을 위해 본 명세서에 참고로 편입되는 미국 특허 제6,737,423호의 실시예 31 및 특히 본 개시내용의 화합물의 평가 또는 시험에 대해 적용되는 예일 수 있는 실시예 31의 내용에 제공되는 Caco2 모델의 도시를 참조한다) PSA는 Å2(옹스트롬 제곱)으로 표현하며, 3차원 분자 표현으로부터 컴퓨터 계산한다. 빠른 계산 방법은 이제 데스크탑 컴퓨터 및 켐드로우(ChemDraw)와 같은 상업적으로 입수 가능한 화학 그래프 도구 패키지를 이용하여 이용 가능하다(예를 들어, 문헌[Ertl et al., Journal of Medicinal Chemistry, 2000, 43, 3714-3717] 참조, 이의 전문은 모든 적절하고 일관된 목적을 위해 본 명세서에 참고로 편입됨). 용어 "위상적 PSA"(tPSA)는 이런 빠른 계산 방법에 대해 만들어졌다. tPSA는 통상적인 약물에 의한 인간 흡수 데이터와 상당히 상호 연관된다(예를 들어, 이하의 표 1 참조):
(문헌[Ertl et al., J. Med. Chem., 2000, 43:3714-3717] 참조). 따라서, 일부 바람직한 실시형태에서, (본 명세서의 다른 곳에 정의되는 바와 같이) 화합물이 실질적으로 비침투성 또는 실질적으로 전신으로 생체 이용 가능하지 않도록 본 개시내용의 화합물은 약 100Å2, 약 120Å2, 약 130Å2 또는 약 140Å2, 및 일부 예에서 약 150Å2, 약 200Å2, 약 250Å2, 약 270Å2, 약 300Å2, 약 400Å2, 또는 심지어 약 500Å2 초과의 tPSA 값을 나타내도록 구성될 수 있다.
리핀스키 "법칙" 또는 tPSA 모델을 제외하기 때문에, 본 개시내용의 화합물의 침투성 특성은 실험적으로 선별될 수 있다. 침투성 계수는, 예를 들어, Caco-2 세포 침투성 분석에 의해 그리고/또는 위장 상피세포의 모델로서 인공막을 이용하는 것을 포함하는, 당업자에게 공지된 방법에 의해 결정될 수 있다. (앞서 상기 언급한 바와 같이, 예를 들어, Caco-2 모델에 대해 본 명세서에 참고로 편입된 미국 특허 제6,737,423호, 실시예 31을 참조). 위장 점막의 순 침투성 특징을 모방하는, 예를 들어, 레시틴 및/또는 도데칸으로 침윤된 합성막이 위장 점막의 모델로서 이용될 수 있다. 침투율을 모니터링하는 구획으로부터 본 개시내용의 화합물을 함유하는 구획을 분리시키기 위한 막이 사용될 수 있다. 또한, 평행 인공막 침투성 분석(PAMPA)이 수행될 수 있다. 이러한 시험관내 측정은 생체내 실제 침투성을 합리적으로 나타낼 수 있다. (예를 들어, 본 명세서에 참고로 편입된 문헌[Wohnsland et al., J. Med. Chem., 2001, 44:923-930]; 문헌[Schmidt et al., Millipore Corp. Application Note, 2002, n° AN1725EN00, 및 n° AN1728EN00] 참조)
따라서, 일부 실시형태에서, 본 개시내용의 방법에서 이용되는 화합물은 당업계에 공지된 수단을 이용하여 측정될 때, 약 100×10-6㎝/s 미만, 또는 약 10×10-6㎝/s 미만, 또는 약 1×10-6㎝/s 미만, 또는 약 0.1×10-6㎝/s 미만의 침투계수(Papp)를 가질 수 있다(예를 들어, 본 명세서에 전문이 참고로 편입된 문헌[Wohnsland et al., J. Med. Chem., 2001, 44. 923-930]에 기재된 침투성 실험).
앞서 언급한 바와 같이, 본 개시내용에 따르면, NHE-저해 화합물은 상기 기재한 바와 같이 장 상피세포 층을 통한 순 흡수를 입체 방해하도록 변형되어, 실질적으로 전신으로 생체 이용 가능하지 않은 결과 화합물을 제공한다. 다양한 실시형태에서, 본 개시내용의 화합물은 실질적으로 비침투성 또는 실질적으로 전신으로 생체 이용 가능하지 않다. 더 구체적으로, 얻어진 화합물이 실질적으로 비침투성 또는 실질적으로 전신으로 생체 이용 가능하지 않도록 NHE-저해는 이량체, 다량체 또는 중합체 모이어티일 수 있다. 이량체, 다량체 또는 중합체는 약 500 달톤(Da), 약 1000Da, 약 2500Da, 약 5000Da, 약 10,000Da 또는 더 큰 수 초과의 분자량을 가질 수 있고, 특히 약 1000 달톤(Da) 내지 약 500,000 Da의 범위에서, 또는 약 5000 내지 약 200,000Da의 범위에서 분자량을 가질 수 있으며, 그리고 화합물의 장 상피세포 층을 통해 임의의 순 흡수를 본질적으로 불가능하게 하기에 충분히 높은 분자량을 가질 수 있다.
C. 지속적 저해 효과
다른 실시형태에서, 본 개시내용의 치료 방법에서 이용되는 실질적으로 비침투성 또는 실질적으로 전신으로 생체 이용 가능하지 않은 NHE-저해 화합물은 추가적으로 지속적 저해 효과를 나타낼 수 있다. 화합물이 내강 내용물의 간단한 세척에 의해 고갈된 후에, 상피세포와 평형상태의 소정의 농도에서(예를 들어, 그의 저해 농도 이상에서, IC(inhibitory concentration)) 화합물의 저해 작용이 기준(즉, 저해제가 없는 나트륨 수송)으로 복귀되지 않을 때 이 효과는 그 자체가 분명해진다.
이 효과는 장 상피세포의 장 첨단측에서 NHE 단백질에 대한 NHE-저해 화합물의 밀착 결합 결과로서 해석될 수 있다. 결합은, 화합물이 장 상피세포와 접촉되고 후속적으로 상기 장 상피세포를 세척한 후에, 나트륨 수송의 유입물이 화합물이 없는 대조군에서 여전히 상당히 더 낮은 정도로 준-비가역적으로서 고려될 수 있다. 상부 GI관에서 활성물의 체류 시간이 짧음에도 불구하고 그리고 장-담관 재순환 과정이 작용 부위 근처의 화합물 농도를 보충하는 데 효과적일 때에, 이런 지속적 저해 효과는 GI관 내에서 약물 활성을 유지하는 것의 분명한 이점을 가진다.
이러한 지속적 저해 효과는 환자 순응도에 관해서 뿐만 아니라 GI관 내의 제한적 약물 노출에서 분명한 이점을 가진다.
지속적 효과는 시험관내 방법을 이용하여 결정될 수 있다; 일 예에서, NHE 수송체를 발현시키는 세포주는 상이한 바이알에서 분할되고, 나트륨 흡수율을 측정하기 위해 NHE-저해 화합물 및 나트륨 용액으로 처리할 수 있다. 한 세트의 바이알 내 세포는 저해제를 제거하기 위해 상이한 시간 기간 동안 세척되고, 세척 후에 나트륨 흡수 측정은 반복된다. 다회/긴 세척 단계 후 그들의 저해 효과를 유지하는 화합물은 (세척을 하지 않은 바이알에서 측정한 저해 효과에 비해) 지속적인 저해제이다. 지속 효과는 또한 외번낭(everted sac) 기법을 이용함으로써 생체외에서 특성규명될 수 있고, 이에 의해 Na의 수송은 저해제를 함유하는 용액으로 관류된 GI의 절단 분절을 이용하여 그리고 저해제로부터 무 용액 완충제로 배싱(bathing) 용액을 플러싱한 직후에 모니터링된다. 지속 효과는 또한 저해제 치료가 중단될 때 정상으로 복귀되는 나트륨 균형에 필요한 시간을 관찰함으로써 생체내에서 특성규명될 수 있다. 상기 방법의 제한은 정단 세포(따라서 정단 NHE 수송체)가 장 상피세포의 전형적인 전환 시간인 3 내지 4일의 기간 후에 버려진다는 사실에 의해 야기된다. 지속 효과는 장 상피세포의 정단부 표면에서 활성 화합물의 체류 시간을 증가시킴으로써 달성될 수 있고; 이는 몇몇 NHE-저해 분자 또는 올리고머로 NHE 역수송 저해제를 설계함으로써 얻을 수 있다(본 명세서에서 "몇몇"은 전형적으로 적어도 약 2, 약 4, 약 6 이상을 의미한다). 항생제 반코마이신의 유사체와 관련하여 이러한 구조의 예는 문헌[Griffin, et al., J. Am. Chem. Soc., 2003, 125, 6517-6531]에 제공된다. 대안적으로 화합물은 장 상피세포 표면과의 접촉 시간을 증가시키기 위해 장 상피세포에 관한 친화도를 증가시키는데 기여하는 기를 포함한다. 이러한 기는 "점막접착제"로서 지칭된다. 더 구체적으로, "X" 및 링커 모이어티는 이러한 점막접착기, 예컨대 폴리아크릴레이트, 특히 탈아세틸화된 키토산 또는 폴리알킬렌 글리콜에 의해 치환될 수 있다. (또한 문헌[Patil, S.B. et al., Curr. Drug. Deliv., 2008, Oct. 5(4), pp. 312-8.] 참조)
D. GI 효소 내성
본 개시내용의 치료 방법에서 이용되는 화합물은 실질적으로 전신으로 생체 이용 가능하지 않고, 그리고/또는 지속적 저해 효과를 나타내기 때문에, 장에서 그들의 장기간의 체류 시간 동안, 이들 화합물은 상부 GI관에서 우세한 가수분해 조건을 지속하는 것이 바람직하다. 이러한 실시형태에서, 본 개시내용의 화합물은 효소 대사에 대해 저항성이다. 예를 들어, 투여되는 화합물은 당업계에 일반적으로 공지된 장 점막의 P450 효소, 글루쿠로실 트랜스퍼라제, 설포트랜스퍼라제, 글루타티온 S-트랜스퍼라제 등뿐만 아니라 위(예를 들어, 위 리파제 및 펩신), 췌장(예를 들어, 트립신, 트라이글리세라이드 췌장 리파제, 포스포리파제 A2, 엔도뉴클레아제, 뉴클레오티다제 및 알파-아밀라제), 및 브러시-보더(brush-border) 효소(예를 들어, 알칼리 포스파타제, 글리코시다제 및 프로테아제)의 활성에 대해 내성이 있다.
본 개시내용의 방법에서 이용되는 화합물은 또한 장의 박테리아군에 의한 대사에 대해 내성이 있고; 즉, 화합물은 박테리아군에 의해 생산되는 효소에 대한 기질이 아니다. 추가로, 본 개시내용의 방법에 따라 투여되는 화합물은 위장 박테리아군에 대해 실질적으로 비활성일 수 있고, 박테리아 성장 또는 생존을 방해하지 않는다. 그 결과, 본 명세서의 다양한 실시형태에서, GI 박테리아군에 대한 최소 저해 농도(또는 "MIC")는 바람직하게는 약 15㎍/㎖, 약 30㎍/㎖, 약 60㎍/㎖, 약 120㎍/㎖, 또는 심지어 약 240㎍/㎖ 초과이며, MIC는 다양한 실시형태에서, 예를 들어, 약 16 내지 약 32㎍/㎖, 또는 약 64 내지 약 128㎍/㎖, 또는 약 256㎍/㎖ 초과이다.
의학 화학 분야의 당업자에 대해, 대사 안정성은 다수의 방법으로 달성될 수 있다. P450-매개 산화에 민감한 작용기는, 예를 들어, 할로겐 또는 다른 작용기를 이용하여 대사 지점을 차단함으로써 보호될 수 있다. 대안적으로, 전자 당김기는 화합물의 친전자성을 환원시킴으로써 일반적으로 산화에 대한 보호를 제공하기 위해 접합된 시스템에 첨가될 수 있다. 단백질 분해 안정성은 2차 아마이드 결합을 회피함으로써, 또는 입체화학의 변화 또는 대사 효소에 의해 약물이 달리 기질로서 인식되는 것을 방지하는 다른 변형을 편입시킴으로써 달성될 수 있다.
E. 나트륨 및/또는 유체 산출물
또한 본 개시내용의 다양한 실시형태에서, 본 명세서에 상술된 NHE-저해 화합물 중 하나 이상은 하나 이상의 추가적인 약제학적으로 활성인 화합물 또는 제제(예를 들어, 유체-흡수성 중합체를 포함)와 조합하여 치료가 필요한 환자에게 투여될 때, 적어도 약 20, 약 30m㏖, 약 40m㏖, 약 50m㏖, 약 60m㏖, 약 70m㏖, 약 80m㏖, 약 90m㏖, 약 100m㏖, 약 125m㏖, 약 150m㏖ 이상만큼 환자의 1일 분변 나트륨 배출을 증가시키는 작용을 할 수 있으며, 증가는, 예를 들어 약 20 내지 약 150m㏖/일 또는 약 25 내지 약 100m㏖/일 또는 약 30 내지 약 60m㏖/일의 범위 내인 것을 주목하여야 한다.
추가적으로, 또는 대안적으로, 또한 본 개시내용의 다양한 실시형태에서, 본 명세서에 상술된 NHE-저해 화합물 중 하나 이상은 하나 이상의 추가적인 약제학적으로 활성인 화합물 또는 제제(예를 들어, 유체-흡수성 중합체를 포함)와 조합하여 치료가 필요한 환자에게 투여될 때, 적어도 약 100㎖, 약 200㎖, 약 300㎖, 약 400㎖, 약 500㎖, 약 600㎖, 약 700㎖, 약 800㎖, 약 900㎖, 약 1000㎖ 이상만큼 환자의 1일 유체 배출을 증가시키는 작용을 할 수 있으며, 증가는, 예를 들어 약 100 내지 약 1000㎖/일, 또는 약 150 내지 약 750㎖/일, 또는 약 200 내지 약 500㎖/일의 범위 내인(등장성 유체의 추정) 것을 주목하여야 한다.
F. C
max
및 IC
50
또한 본 개시내용의 다양한 실시형태에서, 본 명세서에 상술된 NHE-저해 화합물 중 하나 이상은 하나 이상의 추가적인 약제학적으로 활성인 화합물 또는 제제(예를 들어, 유체-흡수성 중합체를 포함)와 조합하여 분변 물 함량의 적어도 10% 증가를 초래하는 용량으로 이것이 필요한 환자에게 투여될 때, NHE-3에 대한 IC50 미만, 더 구체적으로는, 약 10X(10배) 미만의 IC50, 그리고 또한 더 구체적으로는, 약 100X(100배) 미만의 IC50인 Cmax를 가진다는 것을 주목하여야 한다.
추가적으로, 또는 대안적으로, 본 개시내용의 다양한 실시형태에서, 본 명세서에 상술된 NHE-저해 화합물 중 하나 이상은 하나 이상의 추가적인 약제학적으로 활성인 화합물 또는 제제(예를 들어, 유체-흡수성 중합체를 포함)와 조합하여 이것이 필요한 환자에게 투여될 때, 약 10ng/㎖, 약 7.5ng/㎖, 약 5ng/㎖, 약 2.5ng/㎖, 약 1ng/㎖, 또는 약 0.5ng/㎖ 미만의 Cmax를 가질 수 있으며, Cmax는, 예를 들어 약 1ng/㎖ 내지 약 10ng/㎖, 또는 약 2.5ng/㎖ 내지 약 7.5ng/㎖ 범위 이내 인 것을 주목하여야 한다.
추가적으로, 또는 대안적으로, 본 개시내용의 다양한 실시형태에서, 본 명세서에 상술된 NHE-저해 화합물 중 하나 이상은 하나 이상의 추가적인 약제학적으로 활성인 화합물 또는 제제(예를 들어, 유체-흡수성 중합체를 포함)와 조합하여 이것이 필요한 환자에게 투여될 때, 약 10μM, 약 7.5μM, 약 5μM, 약 2.5μM, 약 1μM, 또는 약 0.5μM, 미만의 IC50을 가질 수 있으며, IC50은, 예를 들어 약 1μM 내지 약 10μM, 또는 약 2.5μM내지 약 7.5μM 범위 이내 인 것을 주목하여야 한다.
추가적으로, 또는 대안적으로, 또한 본 개시내용의 다양한 실시형태에서, 본 명세서에 상술된 NHE-저해 화합물 중 하나 이상은, 이것이 필요한 환자에게 투여될 때, IC50:Cmax의 비를 가질 수 있되, IC50 및 Cmax는 적어도 약 10, 약 50, 약 100, 약 250, 약 500, 약 750 또는 약 1000의 동일한 단위에 관해 표현된다는 것을 주목하여야 한다.
추가적으로, 또는 대안적으로, 또한 본 개시내용의 다양한 실시형태에서, 본 명세서에 상술된 NHE-저해 화합물 중 하나 이상은 치료적 범위 또는 농도 내에서 이것이 필요한 환자에게 경구로 투여되며, Cmax로서 정의되는 혈청에서 검출된 최대 화합물 농도는 상기 화합물의 NHE 저해 농도 IC50보다 더 낮다는 것을 주목하여야 한다. 앞서 언급한 바와 같이, 본 명세서에 사용되는 바와 같이, IC50은 세포 기반 분석에서 NHE-매개 Na/H 역수송 활성의 50%를 저해하는 데 필요한 화합물의 농도를 나타내는 정량적 특성으로 정의된다.
III.
약제학적 조성물 및 치료 방법
A. 조성물 및 방법
1. 체액저류 및/또는 염 과부하 장애
본 발명의 다른 양상은 나트륨 및 수소 이온의 NHE-매개 역수송을 저해하는 방법에 관한 것이다. 상기 방법은 상기 역수송 저해가 필요한 포유류에게 약제학적 유효량의 화학식 I의 화합물 또는 약제학적 조성물을 투여하는 단계를 포함한다. 일 실시형태에서, 상기 방법은 약제학적 유효량의 화합물 Ia, Ib, Ic, Id, Ie, If 또는 Ig 또는 이들의 조합물을 상기 역수송 저해가 필요한 포유류에게 투여하는 단계를 포함한다.
본 발명의 다른 양상은 체액저류 또는 염 과부하와 관련된 장애를 치료하기 위한 방법에 관한 것이다. 상기 방법은 치료가 필요한 포유류에게 약제학적 유효량의 화학식 I의 화합물 또는 약제학적 조성물을 투여하는 단계를 포함한다. 일 실시형태에서, 체액저류 또는 염 과부하와 관련된 장애를 치료하는 방법은 치료가 필요한 포유류에게 약제학적 유효량의 화합물 Ia, Ib, Ic, Id, Ie, If, Ig, Ih 또는 Ii 또는 이들의 조합물을 투여하는 단계를 포함한다.
일 실시형태에서, 심부전(예컨대 울혈성 심부전), 만성 신장병, 말기 신질환, 간질환, 및 페록시좀 증식체-활성화 수용체(PPAR) 감마 작용제-유발성 체액저류로 이루어진 군으로부터 선택된 장애를 치료하는 방법이 제공되며, 상기 방법은 치료가 필요한 포유류에게 약제학적 유효량의 상기 제시한 바와 같은 화합물 또는 약제학적 조성물을 투여하는 단계를 포함한다. 다른 실시형태에서, 장애는 위장 운동 장애, 과민성 장 증후군, 만성 변비, 만성 특발성 변비, 낭성 섬유증 환자에서 생기는 만성 변비, 만성 신장병 환자에서 생기는 만성 변비, 골다공증성 환자에서의 칼슘-유도성 변비, 오피오이드-유발성 변비, 기능성 위장 장애, 위식도역류질환, 기능성 가슴쓰림, 소화불량, 기능성 소화불량, 비궤양성 소화불량, 위마비, 만성 가성 장폐색증, 크론병, 염증성 장 증후군으로서 지칭되는 궤양성 대장염 및 관련된 질환, 결장 가성 폐색증, 위궤양, 감염성 설사,암(결장직장), "장 누수 증후군", 낭성 섬유증 위장 질환, 다기관 부전, 미세장염, 괴사성 장염, 알레르기 - 아토피, 식품 알레르기, 감염(호흡기), 급성 염증(예를 들어, 패혈증, 전신 염증 반응 증후군), 만성 염증(관절염), 비만-유발성 대사 질환(예를 들어, 비알코올성 지방간염, I형 당뇨병, II형 당뇨병, 심혈관 질환), 신장 질환, 당뇨성 신장 질환, 간경변증, 비알코올성 지방간염, 비알코올성 지방산 간질환, 지방증, 원발성 경화성 담관염, 원발성 담즙성 담관염, 문맥 고혈압, 자가면역 질환(예를 들어, 1형 당뇨병, 강직성 척추염, 루푸스, 원형 탈모증, 류마티스성 관절염, 류마티스성 다발근통, 섬유근육통, 만성 피로 증후군, 쇼그렌 증후군, 백반증, 갑상선염, 혈관염, 심마진(두드러기), 레이노 증후군), 조현병, 자폐 범주성 장애, 간성뇌증, 소장 박테리아 과성장, 만성 알코올 중독 등이지만, 이들로 제한되지 않는다.
다른 실시형태에서, 고혈압을 치료하는 방법이 제공되며, 상기 방법은 치료가 필요한 포유류에게 약제학적 유효량의 상기 제시한 바와 같은 화합물 또는 약제학적 조성물을 투여하는 단계를 포함한다.
추가 실시형태에서, 상기 방법은 나트륨 및/또는 유체의 포유류의 1일 배설물을 증가시키기 위해 포유류에 약제학적 유효량의 화합물을 투여하는 단계를 포함한다. 추가 실시형태에서, 상기 방법은 나트륨 및/또는 유체의 포유류의 1일 배설물을 적어도 약 30m㏖만큼, 그리고/또는 유체를 적어도 약 200㎖만큼 증가시키기 위해 포유류에 약제학적 유효량의 화합물을 투여하는 단계를 포함한다. 추가 실시형태에서, 나트륨 및/또는 유체의 포유류의 배설물은 이온 교환 공정을 통해 화학량론적으로 또는 거의 화학량론적 방식으로 다른 유형의 양이온을 도입하는 일 없이 증가된다. 추가 실시형태에서, 상기 방법은 나트륨 이온 및 수소 이온의 NHE-매개 역수송을 저해하기 위해 위장관에서 실질적으로 활성인 화합물의 사용으로부터 초래된 분변 유체를 흡수하기 위해 포유류에 유체-흡수성 중합체를 투여하는 단계를 추가로 포함한다.
추가 실시형태에서, 화합물 또는 조성물은 고혈압을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 식이성 염 섭취와 관련된 고혈압을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물의 투여는 포유류가 더 맛 좋은 규정식을 섭취하도록 허용한다. 추가 실시형태에서, 화합물 또는 조성물은 유체 과부하를 치료하기 위해 투여된다. 추가 실시형태에서, 유체 과부하는 울혈성 심부전과 관련된다. 추가 실시형태에서, 유체 과부하는 말기 신장 질환과 관련된다. 추가 실시형태에서, 유체 과부하는 페록시좀 증식체-활성화 수용체(PPAR) 감마 작용제 요법과 관련된다. 추가 실시형태에서, 화합물 또는 조성물은 나트륨 과부하를 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 ESRD 환자에서 투석간 체중 증가를 감소시키기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 부종을 치료하기 위해 투여된다. 추가 실시형태에서, 부종은 화학요법, 월경전 유체 과부하 또는 자간전증에 의해 야기된다.
추가 실시형태에서, 화합물 또는 조성물은 위궤양을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 감염성 설사를 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 암(결장직장)을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 "장 누수 증후군"을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 낭성 섬유증 위장 질환을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 다기관 부전을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 미세장염을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 괴사성 장염을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 아토피를 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 식품 알레르기를 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 호흡기 감염을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 급성 염증(예를 들어, 패혈증, 전신 염증 반응 증후군)을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 만성 염증(예를 들어, 관절염)을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 비만-유발성 대사 질환(예를 들어, 비알코올성 지방간염, I형 당뇨병, II형 당뇨병, 심혈관 질환)을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 신장 질환을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 당뇨성 신장 질환을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 간경변증을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 지방간염을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 비알코올성 지방산 간질환을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 지방증을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 원발성 경화성 담관염을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 원발성 담즙성 담관염을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 문맥 고혈압을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 자가면역 질환(예를 들어, 1형 당뇨병, 강직성 척추염, 루푸스, 원형 탈모증, 류마티스성 관절염, 류마티스성 다발근통, 섬유근육통, 만성 피로 증후군, 쇼그렌 증후군, 백반증, 갑상선염, 혈관염, 심마진(두드러기), 또는 레이노 증후군)을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 조현병을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 자폐 범주성 장애를 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 간성뇌증을 치료하기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 만성 알코올 중독을 치료하기 위해 투여된다.
추가 실시형태에서, 화합물 또는 조성물은 경구로, 직장 좌약에 의해 또는 관장으로 투여된다.
추가 실시형태에서, 상기 방법은 하나 이상의 추가적인 약제학적으로 활성인 화합물 또는 제제와 조합하여 약제학적 유효량의 화합물 또는 조성물을 투여하는 단계를 포함한다. 추가 실시형태에서, 하나 이상의 추가적인 약제학적으로 활성인 화합물 또는 제제는 이뇨제, 강심 배당체, ACE 저해제, 안지오텐신-2 수용체 길항제, 알도스테론 길항제, 알도스테론 신타제 저해제, 레닌 저해제, 칼슘 통로 차단제, 베타 차단제, 알파 차단제, 중심 알파 작용제, 혈관확장제, 혈액 희석제, 항-혈소판제, 지질-저하제 및 페록시좀 증식체-활성화 수용체(PPAR) 감마 작용제로 이루어진 군으로부터 선택된다. 추가 실시형태에서, 이뇨제는 고효능 루프 이뇨제, 벤조티아다이아자이드 이뇨제, 칼륨 보존 이뇨제, 및 삼투성 이뇨제로 이루어진 군으로부터 선택된다. 추가 실시형태에서, 약제학적 유효량의 화합물 또는 조성물 및 하나 이상의 추가적인 약제학적으로 활성인 화합물 또는 제제는 단일 약제학적 제제의 부분으로서 투여된다. 추가 실시형태에서, 약제학적 유효량의 화합물 또는 조성물 및 하나 이상의 추가적인 약제학적으로 활성인 화합물 또는 제제는 개개 약제학적 제제로서 투여된다. 추가 실시형태에서, 개개 약제학적 제제는 순차적으로 투여된다. 추가 실시형태에서, 개개 약제학적 제제는 동시에 투여된다.
다른 실시형태에서, 위장관 장애를 치료하기 위한 방법이 제공되며, 상기 방법은 치료가 필요한 포유류에게 상기 제시한 바와 같은 약제학적 유효량의 화합물 또는 약제학적 조성물을 투여하는 단계를 포함한다.
추가 실시형태에서, 위장관 장애는 위장 운동 장애이다. 추가 실시형태에서, 위장관 장애는 과민성 장 증후군이다. 추가 실시형태에서, 위장관 장애는 만성 변비이다. 추가 실시형태에서, 위장관 장애는 만성 특발성 변비이다. 추가 실시형태에서, 위장관 장애는 낭성 섬유증 환자에서 생기는 만성 변비이다. 추가 실시형태에서, 위장관 장애는 오피오이드-유발성 변비이다. 추가 실시형태에서, 위장관 장애는 기능성 위장 장애이다. 추가 실시형태에서, 위장관 장애는 만성 가성 장폐색증 및 결장 가성 폐색증으로 이루어진 군으로부터 선택된다. 추가 실시형태에서, 위장관 장애는 크론병이다. 추가 실시형태에서, 위장관 장애는 궤양성 대장염이다. 추가 실시형태에서, 위장관 장애는 염증성 장 질환으로서 지칭되는 질환이다. 추가 실시형태에서, 위장관 장애는 만성 신장병(4 또는 5기)과 관련된다. 추가 실시형태에서, 위장관 장애는 칼슘 보충제에 의해 유도되는 변비이다. 추가 실시형태에서, 위장관 장애는 변비이고, 치료될 변비는 치료제의 사용과 관련된다. 추가 실시형태에서, 위장관 장애는 변비이고, 치료될 변비는 신경병 장애와 관련된다. 추가 실시형태에서, 위장관 장애는 변비이고, 치료될 변비는 수술후 변비(수술후 장 폐색증)이다. 추가 실시형태에서, 위장관 장애는 변비이고, 치료될 변비는 특발성(기능성 변비 또는 느린 수송 변비)이다. 추가 실시형태에서, 위장관 장애는 변비이고, 치료될 변비는 신경병, 대사 또는 내분비 장애(예를 들어, 진성 당뇨병, 신부전, 갑상선 기능 저하증, 갑상선 기능 항진증, 저칼슘혈증, 다발성 경화증, 파킨슨병, 척수 병변, 신경섬유종증, 자율신경병증, 샤가스병, 히르쉬스프룽병 또는 낭성 섬유증 등)과 관련된다. 추가 실시형태에서, 위장관 장애는 변비이고, 치료될 변비는 진통제(예를 들어, 오피오이드), 항고혈압제, 항경련제, 항우울제, 진경제 및 항정신병약으로부터 선택된 약물의 사용에 기인한다.
다른 실시형태에서, 위장관 장애는 위궤양, 감염성 설사, 암(결장직장), "장 누수 증후군", 낭성 섬유증 위장 질환, 다기관 부전, 미세장염, 괴사성 장염, 알레르기 - 아토피, 식품 알레르기, 감염(호흡기), 급성 염증(예를 들어, 패혈증, 전신 염증 반응 증후군), 만성 염증(예를 들어, 관절염), 비만-유발성 대사 질환(예를 들어, 비알코올성 지방간염, I형 당뇨병, II형 당뇨병, 심혈관 질환), 신장 질환, 당뇨성 신장 질환, 간경변증, 비알코올성 지방간염, 비알코올성 지방산 간질환, 지방증, 원발성 경화성 담관염, 원발성 담즙성 담관염, 문맥 고혈압, 자가면역(예를 들어, 1형 당뇨병, 강직성 척추염, 루푸스, 원형 탈모증, 류마티스성 관절염, 류마티스성 다발근통, 섬유근육통, 만성 피로 증후군, 쇼그렌 증후군, 백반증, 갑상선염, 혈관염, 심마진(두드러기), 또는 레이노 증후군), 조현병, 자폐 범주성 장애, 간성뇌증, 소장 박테리아 과성장, 또는 만성 알코올 중독과 관련된다.
다른 실시형태에서, 과민성 장 증후군을 치료하는 방법이 제공되며, 상기 방법은 치료가 필요한 포유류에게 약제학적 유효량의 상기 제시한 바와 같은 화합물 또는 약제학적 조성물을 투여하는 단계를 포함한다.
상기 실시형태의 추가 실시형태에서, 화합물 또는 조성물은 위장관 장애와 관련된 통증을 치료하거나 또는 이를 감소시키기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 위장관 장애와 관련된 내장 과민증을 치료하거나 또는 이를 감소시키기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 위장관의 염증을 치료하거나 또는 이를 감소시키기 위해 투여된다. 추가 실시형태에서, 화합물 또는 조성물은 위장 수송 시간을 감소시키기 위해 투여된다.
추가 실시형태에서, 화합물 또는 조성물은 경구로 또는 직장 좌약에 의해 투여된다.
추가 실시형태에서, 상기 방법은 하나 이상의 추가적인 약제학적으로 활성인 화합물 또는 제제와 조합하여 약제학적 유효량의 화합물 또는 조성물을 투여하는 단계를 포함한다. 추가 실시형태에서, 하나 이상의 추가적인 약제학적으로 활성인 제제 또는 화합물은 진통제 펩타이드 또는 제제이다. 추가 실시형태에서, 하나 이상의 추가적인 약제학적으로 활성인 제제 또는 화합물은 벌크-생성제(예를 들어, 차전자 겉껍질(섬유질 보충제)), 메틸셀룰로스(시트루셀), 폴리카보필, 식이섬유, 사과, 대변 연화제/계면활성제(예를 들어, 도쿠세이트, 콜라세, 디옥토), 수화 또는 삼투제(예를 들어, 이염기성인산나트륨, 시트르산마그네슘, 수산화마그네슘 (마그네시아 유제), 황산마그네슘(에프솜염), 일염기성 인산나트륨, 이염기성나트륨), 및 고삼투압제(예를 들어, 글리세린 좌약, 솔비톨, 락툴로스, 및 폴리에틸렌 글리콜(PEG))로부터 선택된 완화제로 이루어진 군으로부터 선택된다. 추가 실시형태에서, 약제학적 유효량의 화합물 또는 조성물 및 하나 이상의 추가적인 약제학적으로 활성인 화합물 또는 제제는 단일 약제학적 제제의 부분으로서 투여된다. 추가 실시형태에서, 약제학적 유효량의 화합물 또는 조성물 및 하나 이상의 추가적인 약제학적으로 활성인 화합물 또는 제제는 개개 약제학적 제제로서 투여된다. 추가 실시형태에서, 개개 약제학적 제제는 순차적으로 투여된다. 추가 실시형태에서, 개개 약제학적 제제는 동시에 투여된다.
본 발명의 다른 양상은 화학식 I의 화합물 및 약제학적으로 허용 가능한 담체를 포함하는 약제학적 조성물에 관한 것이다. 일 실시형태에서, 약제학적 조성물은 화학식 Ia, Ib, Ic, Id, Ie, If, Ig, Ih 또는 Ii의 화합물 및 약제학적으로 허용 가능한 담체를 포함한다. 다른 실시형태에서, 본 명세서에 기재된 약제학적 조성물은 나트륨 및 수소 이온의 NHE-매개 역수송을 저해하기 위해 사용될 수 있다. 다른 실시형태에서, 본 명세서에 기재된 약제학적 조성물은 체액저류 또는 염 과부하와 관련된 장애를 치료하기 위해 사용될 수 있다.
위장관에서 체액저류 및/또는 염 과부하와 관련된 다양한 장애(예를 들어, 고혈압, 심부전(특히, 울혈성 심부전), 만성 신장병, 말기 신질환, 간질환 및/또는 페록시좀 증식체-활성화 수용체(PPAR) 감마 작용제-유발성 체액저류)의 치료를 위한 본 개시내용에 따라 사용될 수 있는 약제학적 조성물 또는 제제는, 일반적으로, 본 개시내용의 실질적으로 비침투성 또는 실질적으로 전신으로 생체 이용 가능하지 않은 NHE-저해 화합물뿐만 아니라 본 명세서에서 이하에 추가로 상술하는 바와 같은 다양한 다른 선택적 성분(예를 들어, 약제학적으로 허용 가능한 부형제 등)을 포함한다. 본 개시내용의 치료 방법에서 이용되는 화합물뿐만 아니라 그들을 포함하는 약제학적 조성물은 따라서 단독으로, 또는 (본 명세서의 다른 곳에 추가로 상술되는 바와 같은) 다른 유리한 화합물의 투여 또는 사용을 포함하는 치료 프로토콜 또는 섭생의 부분으로서 투여될 수 있다. 일부 특정 실시형태에서, 화합물을 포함하는 임의의 약제학적 조성물을 포함하는 NHE-저해 화합물은 유체 흡수성 중합체(이하에 더 완전하게 기재하는 바와 같음)와 함께 투여된다.
본 개시내용의 화합물에 의한 "치료가 필요한" 대상체 또는 "NHE 저해가 필요한" 대상체는 유리한 치료적 그리고/또는 예방적 결과를 달성하기 위해 유체-흡수성 중합체와 함께 또는 이것 없이 실질적으로 비침투성 또는 실질적으로 전신으로 생체 이용 가능하지 않은 NHE-저해 화합물로 치료될 수 있는 질환 및/또는 병태를 갖는 대상체를 포함한다. 유리한 결과는 질환 또는 병태의 증상 중증도의 감소 또는 증상의 개시의 지연, 증가된 지속성 및/또는 더 빠른 또는 더 완전한 해결을 포함한다. 예를 들어, 치료가 필요한 대상체는 고혈압으로; 식이성 염 섭취로부터 초래될 수 있는 염-민감성 고혈압으로; 고혈압으로 초래되는 심혈관 장애(예를 들어, 심근 경색, 울혈성 심부전 등)의 위험으로; 유체 또는 염 과부하를 초래하는 심부전(예를 들어, 울혈성 심부전)으로; 유체 또는 염 과부하를 초래하는 만성 신장병으로, 유체 또는 염 과부하를 초래하는 말기 신장 질환으로; 페록시좀 증식체-활성화 수용체(PPAR) 감마 작용제-유발성 체액저류로부터의 유체 또는 염 과부하를 초래하는 간질환으로; 또는 울혈성 심부전 또는 말기 신장 질환으로부터 초래된 부종으로 고통받을 수 있다. 다양한 실시형태에서, 치료가 필요한 대상체 전형적으로 울혈성 심부전, 신부전 또는 간 비대증의 통상적인 특징인 염 및 체액저류로부터 초래되는 혈량과다 징후를 나타낸다. 체액저류 및 염 저류는 그 자체가 숨가쁨, 부종, 복수 또는 투석간 체중 증가의 발생에 의해 나타난다. 치료가 유리한 대상체의 다른 예는 울혈성 심부전으로 고통받는 대상체 및 고혈압 환자 및, 특히, 이뇨제에 의한 치료에 내성이 있는 대상체, 즉, 매우 소수의 치료적 선택사항만을 이용 가능한 환자이다. "치료가 필요한" 대상체는 또한 고혈압, 염-민감성 혈압이 있는 대상체 및 약 130-139/85-89㎜Hg 초과의 심장 수축기/확장기 혈압이 있는 대상체를 포함한다.
유체-흡수성 중합체의 투여와 함께 또는 이의 투여가 없는 NHE-저해 화합물의 투여는 규정식을 자유롭게 하도록 한편, 중성 또는 약간 음성의 나트륨 균형(즉, 염의 전반적인 흡수가 분비된 염 이하임)을 유지하기 위해 "염이 첨가되지 않은" 식이 섭생(즉, 1일당 60-100m㏖의 Na) 중인 환자에 대해 유리할 수 있다. 상기 내용에서, "규정식을 자유롭게 하는"은 치료되는 환자가 그들의 식사에 염을 첨가하여 그들의 음식을 더 맛 좋게 만들 수 있고/있거나 염-함유 식품으로 그들의 규정식을 다양화시키고, 따라서 양호한 영양 상태를 유지하는 한편, 그들의 삶의 질을 개선시키는 것을 의미한다.
본 명세서에 기재된 치료 방법은 또한 화학요법, 월경전 유체 과부하 및 자간전증(임신-유발성 고혈압)과 관련된 부종이 있는 환자에게 도움이 될 수 있다.
따라서, 본 개시내용은 추가로 본 개시내용의 화합물, 또는 이러한 화합물을 포함하는 약제학적 조성물의 투여를 수반하는 치료 방법에 관한 것임을 주목하여야 한다. 이러한 방법은, 예를 들어, 고혈압을 치료하는 방법을 포함할 수 있으며, 환자에게 실질적으로 비침투성 또는 실질적으로 전신으로 생체 이용 가능하지 않은 NHE-저해 화합물, 또는 이를 포함하는 약제학적 조성물을 투여하는 단계를 포함한다. 상기 방법은 심부전(특히, 울혈성 심부전)과 관련한 유체 과부하를 감소시키기 위한 것일 수 있으며, 상기 방법은 환자에게 실질적으로 비침투성 또는 실질적으로 전신으로 생체 이용 가능하지 않은 NHE-저해 화합물 또는 이를 포함하는 약제학적 조성물을 투여하는 단계를 포함한다. 상기 방법은 말기 신장 질환과 관련된 유체 과부하를 감소시키기 위한 것일 수 있으며, 상기 방법은 환자에게 실질적으로 비침투성 또는 실질적으로 전신으로 생체 이용 가능하지 않은 NHE-저해 화합물 또는 이를 포함하는 조성물을 투여하는 단계를 포함한다. 상기 방법은 페록시좀 증식체-활성화 수용체(PPAR) 감마 작용제 요법과 관련된 유체 과부하를 감소시키기 위한 것일 수 있으며, 상기 방법은 환자에게 실질적으로 비침투성 또는 실질적으로 전신으로 생체 이용 가능하지 않은 NHE-저해 화합물 또는 이를 포함하는 조성물을 투여하는 단계를 포함한다. 추가적으로, 또는 대안적으로, 상기 방법은 환자에서 장 NHE 수송체의 활성을 감소시키기 위한 것일 수 있으며, 상기 방법은 환자에게 실질적으로 비침투성 또는 실질적으로 전신으로 생체 이용 가능하지 않은 NHE-저해 화합물 또는 이를 포함하는 조성물을 투여하는 단계를 포함한다. 다른 실시형태에서, 치료될 질환은 심부전(예컨대 울혈성 심부전), 만성 신장병, 말기 신질환, 간질환, 및 페록시좀 증식체-활성화 수용체(PPAR) 감마 작용제-유발성 체액저류, 위장 운동 장애, 과민성 장 증후군, 만성 변비, 만성 특발성 변비, 낭성 섬유증 환자에서 생기는 만성 변비, 만성 신장병 환자에서 생기는 만성 변비, 골다공증성 환자에서의 칼슘-유도성 변비, 오피오이드-유발성 변비, 기능성 위장 장애, 위식도역류질환, 기능성 가슴쓰림, 소화불량, 기능성 소화불량, 비궤양성 소화불량, 위마비, 만성 가성 장폐색증, 크론병, 염증성 장 증후군으로서 지칭되는 궤양성 대장염 및 관련된 질환, 결장 가성 폐색증, 위궤양, 감염성 설사, 암(결장직장), "장 누수 증후군", 낭성 섬유증 위장 질환, 다기관 부전, 미세장염, 괴사성 장염, 알레르기 - 아토피, 식품 알레르기, 감염(호흡기), 급성 염증(예를 들어, 패혈증, 전신 염증 반응 증후군), 만성 염증(관절염), 비만-유발성 대사 질환(예를 들어, 비알코올성 지방간염, I형 당뇨병, II형 당뇨병, 심혈관 질환), 신장 질환, 당뇨성 신장 질환, 간경변증, 비알코올성 지방간염, 비알코올성 지방산 간질환, 지방증, 원발성 경화성 담관염, 원발성 담즙성 담관염, 문맥 고혈압, 자가면역 질환(예를 들어, 1형 당뇨병, 강직성 척추염, 루푸스, 원형 탈모증, 류마티스성 관절염, 류마티스성 다발근통, 섬유근육통, 만성 피로 증후군, 쇼그렌 증후군, 백반증, 갑상선염, 혈관염, 심마진(두드러기), 레이노 증후군), 조현병, 자폐 범주성 장애, 간성뇌증, 소장 박테리아 과성장, 만성 알코올 중독 등을 포함하지만, 이들로 제한되지 않는다.
2. 위장관 장애
본 발명의 다른 양상은 위장관과 관련된 장애를 치료하기 위한 방법에 관한 것이다. 상기 방법은 치료가 필요한 포유류에게 약제학적 유효량의 화학식 I의 화합물 또는 약제학적 조성물을 투여하는 단계를 포함한다. 일 실시형태에서, 위장관과 관련된 장애를 치료하는 방법은 치료가 필요한 포유류에게 약제학적 유효량의 화합물 Ia, Ib, Ic, Id, Ie, If, Ig, Ih 또는 Ii 또는 이들의 조합물을 투여하는 단계를 포함한다.
위장관 장애과 관련된 통증의 치료 또는 감소를 포함하는 다양한 위장관 장애의 치료를 위한 본 개시내용에 따라 사용될 수 있는 약제학적 조성물 또는 제제는 본 개시내용의 실질적으로 비침투성 또는 실질적으로 전신으로 생체 이용 가능하지 않은 NHE-저해 화합물뿐만 아니라 본 명세서에 이하에 추가로 상술되는 다양한 다른 선택적 성분(예를 들어, 약제학적으로 허용 가능한 부형제 등)을 포함한다. 본 개시내용의 치료 방법에서 이용되는 화합물뿐만 아니라 그들을 포함하는 약제학적 조성물은 따라서 단독으로, 또는 (본 명세서의 다른 곳에 추가로 상술되는 바와 같은) 다른 유리한 화합물의 투여 또는 사용을 포함하는 치료 프로토콜 또는 섭생의 부분으로서 투여될 수 있다. 일부 특정 실시형태에서, 화합물을 포함하는 임의의 약제학적 조성물을 포함하는 NHE-저해 화합물은 유체 흡수성 중합체(이하에 더 완전하게 기재하는 바와 같음)와 함께 투여된다.
본 개시내용의 화합물에 의한 "치료가 필요한" 대상체 또는 "NHE 저해가 필요한" 대상체는 유리한 치료적 그리고/또는 예방적 결과를 달성하기 위해 유체-흡수성 중합체와 함께 또는 이것 없이 실질적으로 비침투성 또는 실질적으로 전신으로 생체 이용 가능하지 않은 NHE-저해 화합물로 치료될 수 있는 질환 및/또는 병태를 갖는 대상체를 포함한다. 유리한 결과는 질환 또는 병태의 증상 중증도의 감소 또는 증상의 개시의 지연, 증가된 지속성 및/또는 더 빠른 또는 더 완전한 해결을 포함한다. 예를 들어, 치료가 필요한 대상체는 위장관 장애에 걸렸고; 환자는 위장 운동 장애, 과민성 장 증후군, 만성 변비, 만성 특발성 변비, 낭성 섬유증 환자에서 생기는 만성 변비, 만성 신장병 환자에서 생기는 만성 변비, 골다공증성 환자에서의 칼슘-유도성 변비, 오피오이드-유발성 변비, 기능성 위장 장애, 위식도역류질환, 기능성 가슴쓰림, 소화불량, 기능성 소화불량, 비궤양성 소화불량, 위마비, 만성 가성 장폐색증, 크론병, 염증성 장 증후군으로서 지칭되는 궤양성 대장염 및 관련된 질환, 결장 가성 폐색증, 위궤양, 감염성 설사, 암(결장직장), "장 누수 증후군", 낭성 섬유증 위장 질환, 다기관 부전, 미세장염, 괴사성 장염, 아토피, 식품 알레르기, 감염(호흡기), 급성 염증(예를 들어, 패혈증, 전신 염증 반응 증후군), 만성 염증(예를 들어, 관절염), 비만-유발성 대사 질환(예를 들어, 비알코올성 지방간염, I형 당뇨병, II형 당뇨병, 심혈관 질환), 신장 질환, 당뇨성 신장 질환, 간경변증, 비알코올성 지방간염, 비알코올성 지방산 간질환, 지방증, 원발성 경화성 담관염, 원발성 담즙성 담관염, 문맥 고혈압, 자가면역 질환(예를 들어, 1형 당뇨병, 강직성 척추염, 루푸스, 원형 탈모증, 류마티스성 관절염, 류마티스성 다발근통, 섬유근육통, 만성 피로 증후군, 쇼그렌 증후군, 백반증, 갑상선염, 혈관염, 심마진(두드러기), 레이노 증후군), 조현병, 자폐 범주성 장애, 간성뇌증, 소장 박테리아 과성장 및 만성 알코올 중독 등으로 이루어진 군으로부터 선택된 장애에 걸렸다.
다양한 바람직한 실시형태에서, 치료될 변비는 치료제의 사용과 관련되고; 신경병 장애와 관련되며; 수술 후 변비(수술후 장 폐색증)와 관련되고; 위장관 장애와 관련되며; 특발성(기능성 변비 또는 느린 수송 변비); 신경병, 대사 또는 내분비 장애(예를 들어, 진성 당뇨병, 신부전, 갑상선 기능 저하증, 갑상선 기능 항진증, 저칼슘혈증, 다발성 경화증, 파킨슨병, 척수 병변, 신경섬유종증, 자율신경병증, 샤가스병, 히르쉬스프룽병 또는 낭성 섬유증 등)와 관련된다. 변비는 또한 수술 결과(수술후 장 폐색증) 또는 약물 예컨대 진통제(예를 들어, 오피오이드), 항고혈압제, 항경련제, 항우울제, 진경제 및 항정신병약의 사용에 기인할 수 있다.
또 다른 실시형태에서, 변비는 위궤양, 감염성 설사, 암(결장직장), "장 누수 증후군", 낭성 섬유증 위장 질환, 다기관 부전, 미세장염, 괴사성 장염, 아토피, 식품 알레르기, 감염(호흡기), 급성 염증(예를 들어, 패혈증, 전신 염증 반응 증후군), 만성 염증(예를 들어, 관절염), 비만-유발성 대사 질환(예를 들어, 비알코올성 지방간염, I형 당뇨병, II형 당뇨병, 심혈관 질환), 신장 질환, 당뇨성 신장 질환, 간경변증, 비알코올성 지방간염, 비알코올성 지방산 간질환, 지방증, 원발성 경화성 담관염, 원발성 담즙성 담관염, 문맥 고혈압, 자가면역 질환(예를 들어, 1형 당뇨병, 강직성 척추염, 루푸스, 원형 탈모증, 류마티스성 관절염, 류마티스성 다발근통, 섬유근육통, 만성 피로 증후군, 쇼그렌 증후군, 백반증, 갑상선염, 혈관염, 심마진(두드러기), 레이노 증후군), 조현병, 자폐 범주성 장애, 간성뇌증, 소장 박테리아 과성장, 및 만성 알코올 중독 등과 관련된다.
따라서, 본 개시내용은 추가로 본 개시내용의 화합물, 또는 이러한 화합물을 포함하는 약제학적 조성물의 투여를 수반하는 치료 방법에 관한 것임을 주목하여야 한다. 이러한 방법은, 예를 들어, 환자에서 위장 운동성을 증가시키기 위한 방법을 포함할 수 있으며, 상기 방법은 환자에게 실질적으로 비-침투성 또는 실질적으로 생체 이용 가능하지 않은 NHE-저해 화합물, 또는 이를 포함하는 약제학적 조성물을 투여하는 단계를 포함한다. 추가적으로, 또는 대안적으로, 상기 방법은 환자에서 장 NHE 수송체의 활성을 감소시키기 위한 것일 수 있으며, 상기 방법은 환자에게 실질적으로 비-침투성 또는 실질적으로 생체 이용 가능하지 않은 NHE-저해 화합물, 또는 이를 포함하는 약제학적 조성물을 투여하는 단계를 포함한다. 추가적으로, 또는 대안적으로, 상기 방법은 위장관 장애, 위장 운동 장애, 과민성 장 증후군, 만성 골다공증성 환자에서의 칼슘-유도성 변비, 낭성 섬유증 환자에서 생기는 만성 변비, 만성 신장병 환자에서 생기는 만성 변비, 기능성 위장 장애, 위식도역류질환, 기능성 가슴쓰림, 소화불량, 기능성 소화불량, 비궤양성 소화불량, 위마비, 만성 가성 장폐색증, 결장 가성 폐색증, 크론병, 궤양성 대장염, 염증성 장 질환을 치료하기 위한 것일 수 있으며, 상기 방법은 경구로 또는 직장 좌약에 의해 장 NHE의 길항제, 및 더 구체적으로는 실질적으로 비-침투성 또는 실질적으로 생체 이용 가능하지 않은 NHE-저해 화합물, 또는 이를 포함하는 약제학적 조성물을 투여하는 단계를 포함한다. 추가적으로, 또는 대안적으로, 상기 방법은 내장 통증, 위장관 장애와 관련된 통증 또는 일부 다른 장애와 관련된 통증을 포함하는 통증을 치료하거나 또는 감소시키기 위한 것일 수 있으며, 상기 방법은 환자에게 실질적으로 비-침투성 또는 실질적으로 생체 이용 가능하지 않은 NHE-저해 화합물 또는 이를 포함하는 약제학적 조성물을 투여하는 단계를 포함한다. 추가적으로, 또는 대안적으로, 상기 방법은 위장관의 염증을 포함하는 염증, 예를 들어, 위장관 장애 또는 감염 또는 일부 다른 장애와 관련된 염증을 치료하기 위한 것일 수 있으며, 상기 방법은 환자에게 실질적으로 비-침투성 또는 실질적으로 생체 이용 가능하지 않은 NHE-저해 화합물 또는 이를 포함하는 약제학적 조성물을 투여하는 단계를 포함한다.
3.
대사 장애
II형 진성 당뇨병(T2DM), 대사 증후군, 및/또는 이러한 장애와 관련된 증상의 치료 또는 감소를 포함하는 다양한 대사 장애의 치료를 위해 본 개시내용에 따라 사용될 수 있는 약제학적 조성물 또는 제제는 일반적으로, 본 개시내용의 실질적으로 비침투성 또는 실질적으로 전신으로 생체 이용 가능하지 않은 NHE-저해 화합물뿐만 아니라 본 명세서에서 이하에 추가로 상술하는 바와 같은 다양한 다른 선택적 성분(예를 들어, 약제학적으로 허용 가능한 부형제 등)을 포함한다. 본 개시내용의 치료 방법에서 이용되는 화합물뿐만 아니라 그들을 포함하는 약제학적 조성물은 따라서 단독으로, 또는 (본 명세서의 다른 곳에 추가로 상술되는 바와 같은) 다른 유리한 화합물의 투여 또는 사용을 포함하는 치료 프로토콜 또는 섭생의 부분으로서 투여될 수 있다. 다른 실시형태에서, 약제학적 조성물은 다른 대사 질환, 예컨대 비알코올성 지방간염, I 및 II형 당뇨병, 및 심혈관 질환을 치료하기 위해 사용될 수 있다.
비만은 세계적으로 유행하고 있다. 미국에서, 집단의 대략 2/3는 과체중(체질량지수 [BMI] 25 내지 29.9) 또는 비만(BMI ≥ 30)이다(Ogden, CL et al, "Prevalence of overweight and obesity in the united states, 1999-2004" JAMA 2006, 295, 1549-1555). 비만은 당뇨병, 및 심혈관 질환 및 만성 신장병(CKD)을 포함하는 관련된 합병증의 진행에 대한 주된 위험 인자이다. T2DM의 유병률은 미국에서 놀랄 만큼 증가되었다. 미국 당뇨병 협회(ADA)는 미국에서 2천 3백만명 이상의 20세 이상의 성인이 당뇨병을 가지며, T2DM은 이들 사례의 대략 95%를 차지한다는 것을 추정한다. 세계 보건 기구(WHO)는 당뇨병을 갖는 사람의 수를 전세계적으로 대략 1억 7천만명으로 본다(Campbell, R. K. "Type 2 diabetes: where we are today: an overview of disease burden, current treatments, and treatment strategies" Journal of the American Pharmacists Association 2009, 49(5), S3-S9).
비만은 또한 대사증후군의 발생, 및 후속적으로 CKD의 발생에 대한 주된 위험 인자이다. 이전에 증후군 X, 다대사 증후군, 이상대사 증후군 및 다른 명칭으로서 알려진 대사 증후군은 복부 비만, 고중성지질혈증, 저수준의 고밀도 지방단백질(HDL) 콜레스테롤, 상승된 혈압(BP) 및 공복 혈당의 상승을 포함하는 대사 이상의 집단화 또는 당뇨병으로 이루어진다(Townsend, R. R. et al "Metabolic Syndrome, Components, and Cardiovascular Disease Prevalence in Chronic Kidney Disease: Findings from the Chronic Renal Insufficiency Cohort (CRIC) Study" American Journal of Nephrology 2011, 33, 477-484). 대사 증후군은 CKD 및 CKD의 발생 및 진행에 대한 중요한 위험 인자를 갖는 환자에서 통상적이다.
혈류역학적 인자는 비만-유발성 신기능장애에서 상당한 역할을 하는 것으로 나타난다. 비만과 밀접하게 관련된 고혈압은 비만환자에서 신기능장애의 주된 원인인 것으로 나타난다 (Wahba, I. M. et al "Obesity and obesity-initiated metabolic syndrome: mechanistic links to chronic kidney disease" Clinical Journal of the American Society of Nephrology 2007, 2, 550-562). 동물에서 그리고 인간에서 연구는 비만이 상승된 사구체 여과율(GFR) 및 증가된 신혈류량과 관련된다는 것을 나타낸다. 이는 상승된 안지오텐신 II 수준의 결과로서 수출성 신소동맥 혈관수축과 결합된 근위 염 재흡수로서 수출성 소동맥 확장 때문에 일어날 가능성이 있다. 이들 효과는 과잉여과, 사구체비대 및 이후의 병소 사구체 경화증에 기여할 수 있다. GFR은 비만에서 증가되지만, 식염수 부하에 반응한 소변 나트륨 배설은 종종 지연되며, 개체는 비정상적 압력 나트륨배설증가를 나타내는데, 이는 열심인 근위세뇨관 나트륨 재흡수를 나타낸다. 추가로, 증가된 지방 분포는 증가된 복내 압력을 야기하여, 신정맥 압박을 야기하고, 따라서 신정맥 압력을 상승시키고 신장 관류를 감소시킬 수 있다. 다양한 메커니즘을 통해 증가된 지방은 상승된 신장 간질액 정역학적 유체를 야기할 수 있으며, 신장 나트륨 저류를 자극함으로써, 고혈압에 기여할 수 있다(Wahba_2007).
상기를 고려하여, 신장을 회피하거나 또는 정상 신장 기능에 의존하지 않는 메커니즘을 통해 대상체로부터 나트륨 및 유체를 우회시킬 수 있는 제제에 대한 당업계의 필요가 존재한다. T2DM, 대사 증후군 등을 포함하는 대사 질환을 갖는 대상체는 인간이지만, 또한 본 개시내용의 화합물에 의한 치료가 필요한 동물, 예를 들어, 반려 동물(예를 들어, 개, 고양이 등), 농장 동물(예를 들어, 소, 돼지, 말 등) 및 실험실 동물(예를 들어, 래트, 마우스, 기니픽 등)일 수 있다.
본 개시내용의 치료 방법에서 이용되는 화합물뿐만 아니라 이들을 포함하는 약제학적 조성물은 따라서 단독으로, 또는 T2DM 및 대사 증후군과 같은 대사 장애의 치료와 관련된 다른 치료적 화합물의 투여 또는 사용을 포함하는 병용 요법 또는 섭생의 부분으로서 투여될 수 있다. 일부 특정 실시형태에서, 화합물을 포함하는 임의의 약제학적 조성물을 포함하는 NHE-저해 화합물은 유체 흡수성 중합체와 함께 투여된다.
B.
병용 요법
1. 체액저류 및/또는 염 과부하 장애
앞서 주목한 바와 같이, 본 명세서에 기재된 화합물은 단독으로 또는 다른 제제와 병용하여 사용될 수 있다. 예를 들어, 상기 화합물은 이뇨제(즉, 고효능 루프 이뇨제, 벤조티아다이아자이드 이뇨제, 칼륨 보존 이뇨제, 삼투성 이뇨제), 강심 배당체, ACE 저해제, 안지오텐신-2 수용체 길항제, 알도스테론 길항제, 알도스테론 신타제 저해제, 레닌 저해제, 칼슘 통로 차단제, 베타 차단제, 알파 차단제, 중심 알파 작용제, 혈관확장제, 혈액 희석제, 항-혈소판제, 지질-저하제, 페록시좀 증식체-활성화 수용체(PPAR) 감마 작용제 또는 화합물과 함께 또는 이하에 더 완전하게 기재하는 바와 같은 유체-흡수성 중합체와 함께 투여될 수 있다. 제제는 본 명세서에 기재된 화합물에 공유적으로 부착될 수 있거나 또는 병용 요법에서 본 명세서에 기재된 화합물과 함께 또는 후속적으로 투여되는 별개의 제제일 수 있다.
병용 요법은 2종 이상의 제제, 예를 들어, 본 명세서에 기재된 실질적으로 비-침투성 또는 실질적으로 전신으로 생체 이용 가능하지 않은 NHE-저해 화합물 및 이뇨제, 강심 배당체, ACE 저해제, 안지오텐신-2 수용체 길항제, 알도스테론 길항제, 알도스테론 신타제 저해제, 레닌 저해제, 칼슘 통로 차단제, 베타 차단제, 알파 차단제, 중심 알파 작용제, 혈관확장제, 혈액 희석제, 항-혈소판제 또는 화합물을 투여함으로써 달성될 수 있으며, 이들 각각은 별개로 또는 단일 제형에서 2종 이상의 제제를 투여함으로써 제형화되고 투여된다. 다른 조합은 또한 병용 요법에 의해 포함된다. 예를 들어, 2종의 제제는 함께 제형화될 수 있고, 제3의 제제를 함유하는 별개의 제형과 함께 투여될 수 있다. 병용 요법에서 2종 이상의 제제가 동시에 투여될 수 있지만, 그들이 필요하지는 않다. 예를 들어, 제1 제제(또는 제제의 조합물)의 투여는 분, 시간, 일 또는 주로 제2 제제(또는 제제의 조합물)의 투여에 선행할 수 있다. 따라서, 2 이상의 제제는 서로 수분 이내에 또는 서로 1, 2, 3, 6, 9, 12, 15, 18 또는 24시간 이내에 또는 서로 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14일 이내에 또는 서로 2, 3, 4, 5, 6, 7, 8, 9주 이내에 투여될 수 있다. 일부 경우에, 훨씬 더 긴 간격이 가능하다. 다수의 경우에, 병용 요법에서 사용되는 2 이상의 제제가 동시에 환자의 신체 내에 존재할 수 있지만, 이것이 필요하지는 않다.
병용 요법은 또한 병용하여 사용되는 1종 이상의 제제의 2회 이상의 투여를 포함할 수 있다. 예를 들어, 제제 X와 제제 Y가 병용하여 사용된다면, 예를 들어, X-Y-X, X-X-Y, Y-X-Y, Y-Y-X, X-X-Y-Y 등의 순서로 1회 이상 임의의 조합에서 그들을 순차적으로 투여할 수 있다.
본 명세서에 기재된 화합물은 병용 요법에서 이뇨제와 함께 사용될 수 있다. 유용한 이뇨제 중에, 예를 들어, 하기가 있다: 고효능 루프 이뇨제[푸로세마이드(라식스), 엔타크린산(에데크린), 부메타나이드(부멕스)], 벤조티아다이아자이드 이뇨제[하이드로클로로티아자이드(하이드로디우릴), 클로로티아자이드(디우릴), 클로르탈리돈(하이그로톤), 벤즈티아자이드(아구아프레스), 벤드로플룸티아자이드(나투레틴), 메티클로티아자이드(아구아텐센), 폴리티아자이드(레네세), 인다파마이드(로졸), 사이클로티아자이드(안하이드론), 하이드로플룸티아자이드(디우카르딘), 메톨라존(디울로), 퀴네타존(하이드로목스), 트라이클로르메티아자이드(나쿠아)], 칼륨 보존 이뇨제[스피로노락톤(알닥톤), 트리암테렌(다이레늄), 아밀로라이드(미다모르)], 및 삼투성 이뇨제[만니톨(오스미트롤)]. 다양한 부류의 희석제가 공지되어 있고, 문헌에 기재되어 있다.
강심 배당체(카르데노리드) 또는 다른 강심제 제제가 공동 요법에서 본 개시내용의 화합물과 함께 투여될 수 있다. 유용한 강심 배당체 중에, 예를 들어, 하기가 있다: 디기톡신(크리스토디긴), 디곡신(라녹신) 또는 데슬라노사이드(세딜라니드-D). 다양한 부류의 강심 배당체가 문헌에 기재되어 있다.
안지오텐신 전환 효소 저해제(ACE 저해제)는 공동 요법에서 본 개시내용의 화합물과 함께 투여될 수 있다. 유용한 ACE 저해제 중에, 예를 들어, 하기가 있다: 카토프릴(카포텐), 에날라프릴(바소텍), 리시노프릴(프린빌). 다양한 부류의 ACE 저해제가 문헌에 기재되어 있다.
안지오텐신-2 수용체 길항제(또한 AT1-길항제 또는 안지오텐신 수용체 차단제 또는 ARB로서 지칭됨)는 공동 요법에서 본 개시내용의 화합물과 함께 투여될 수 있다. 유용한 안지오텐신-2 수용체 길항제 중에, 예를 들어, 하기가 있다: 칸데사르탄(아타칸), 에프로사르탄(테베텐), 이르베사르탄(아바프로), 로사르탄(코자르), 텔미사르탄(미카르디스), 발사르탄(디오반). 다양한 부류에서 안지오텐신-2 수용체 길항제는 문헌에 기재되어 있다.
칼슘 통로 차단제, 예컨대 암로디핀(노바스크, 로트렐), 베프리딜(바스코르), 딜티아젬(카르디젬, 티아작), 펠로디핀(플렌딜), 니페디핀(아달랏, 프로카디아), 니모디핀(니모톱), 니솔디핀(술라), 베라파밀(칼란, 이솝틴, 베렐란) 및, 예를 들어, EP 625162B1, 미국 특허 제5,364,842호, 미국 특허 제5,587,454호, 미국 특허 제5,824,645호, 미국 특허 제5,859,186호, 미국 특허 제5,994,305호, 미국 특허 제6,087,091호, 미국 특허 제6,136,786호, WO 93/13128 A1, EP 1336409 A1호, EP 835126 A1, EP 835126 B1, 미국 특허 제5,795,864, 미국 특허 제5,891,849호, 미국 특허 제6,054,429호, WO 97/01351 A1에 기재된 관련된 화합물(이들의 전문은 모든 적절하고 일관된 목적을 위해 본 명세서에 참고로 포함됨)은 본 개시내용의 화합물과 함께 사용될 수 있다.
베타 차단제는 공동 요법에서 본 개시내용의 화합물과 함께 투여될 수 있다. 유용한 베타 차단제 중에, 예를 들어, 하기가 있다: 아세부톨롤(세크트랄), 아테놀롤(네토르민), 베탁솔롤(케를론), 비소프롤롤/하이들클로로티아자이드(지아크), 비소프롤롤(제베타), 카르테올롤(카르트롤), 메토프롤롤(로프레소르, 토프롤 XL), 나돌롤(코가드), 프로프라놀롤(인데랄), 소타롤(베타파스), 티몰롤(블로카덴). 다양한 부류의 베타 차단제가 문헌에 기재되어 있다.
PPAR 감마 작용제, 예컨대 티아졸리딘다이온(또한 글리타존으로 불림)은 공동요법에서 본 개시내용의 화합물과 함께 투여될 수 있다. 유용한 PPAR 작용제 중에, 예를 들어: 로시글리타존(Avandia), 피오글리타존(악토스) 및 리보글리타존이 있다.
알도스테론 길항제는 공동 요법에서 본 개시내용의 화합물과 함께 투여될 수 있다. 유용한 알도스테론 길항제 중에, 예를 들어: 에플레레논, 스피로놀락톤 및 칸레논이 있다.
레닌 저해제는 공동 요법에서 본 개시내용의 화합물과 함께 투여될 수 있다. 유용한 레닌 저해제 중에, 예를 들어, 알리스키렌이 있다.
알파 차단제는 공동 요법에서 본 개시내용의 화합물과 함께 투여될 수 있다. 유용한 알파 차단제 중에, 예를 들어, 하기가 있다: 독사조신 메실레이트(카르두라), 프라조신 하이드로클로라이드(미니프레스). 프라조신 및 폴리티아자이드(미니자이드), 테라조신 하이드로클로라이드(하이트린). 다양한 부류의 알파 차단제가 문헌에 기재되어 있다.
중심 알파 작용제는 공동 요법에서 본 개시내용의 화합물과 함께 투여될 수 있다. 유용한 중심 알파 작용제 중에, 예를 들어, 하기가 있다: 클로니딘 하이드로클로라이드(카파프레스), 클로니딘 하이드로클로라이드 및 클로르탈리돈(클로르프레스, 콤비프레스), 구아나벤즈 아세테이트(와이텐신), 구안파신 하이드로클로라이드(테넥스), 메틸도파(알도메트), 메틸도파 및 클로로티아자이드(알도클로르), 메틸도파 및 하이드로클로로티아자이드(알도릴). 다양한 부류에서 중심 알파 작용제는 문헌에 기재되어 있다.
혈관확장제는 공동 요법에서 본 개시내용의 화합물과 함께 투여될 수 있다. 유용한 혈관확장제 중에, 예를 들어, 하기가 있다: 아이소소르바이드 다이나이트레이트(아이소르딜), 네시리타이드(나트레코르), 하이드랄라진(아프레솔린), 나이트레이트/나이트로글리세린, 미녹시딜(로니텐). 다양한 부류의 혈관확장제가 문헌에 기재되어 있다.
혈액 희석제가 공동 요법에서 본 개시내용의 화합물과 함께 투여될 수 있다. 용한 혈액 희석제 중에, 예를 들어, 하기가 있다: 와파린(쿠마딘) 및 헤파린. 다양한 부류의 혈액희석제가 문헌에 기재되어 있다.
항혈소판제는 공동 요법에서 본 개시내용의 화합물과 함께 투여될 수 있다. 유용한 항-혈소판제 중에, 예를 들어, 하기가 있다: 사이클로옥시게나제 저해제(아스피린), 아데노신 다이포스페이트(ADP) 수용체 저해제[클로피도그렐(플라빅스), 티클로피딘(티클리드)], 포스포다이에스터라제 저해제[실로스타졸(플레탈)], 당단백질 IIB/IIIA 저해제[압식시맙(레오프로), 엡티피바타이드(인테그릴린), 티로피반(아그라스타트), 데피브로타이드], 아데노신 재흡수 저해제 [다이피리다몰(페르산틴)]. 다양한 부류의 항혈소판제가 문헌에 기재되어 있다.
지질저해제는 공동 요법에서 본 개시내용의 화합물과 함께 투여될 수 있다. 유용한 지질-저하제 중에, 예를 들어, 하기가 있다: 스타틴(HMG CoA 환원효소 저해제), [아토르바스타틴(리피토르), 플루바스타틴(레스콜), 로바스타틴(메바코르, 알토프레브), 프라바스타틴(프라바콜), 로수바스타틴 칼슘(크레스토르), 심바스타틴(조코르)], 선택적 콜레스테롤 흡수 저해제[에제티마이브(제티아)], 레진(담즙산 격리제 또는 담즙산 결합 약물)[콜레스티라민(퀘스트란, 퀘스트란 라이트, 프레발라이트, 로콜레스트, 로콜레스트 라이트), 콜레스티폴(콜레스티드), 콜레세벨람 Hcl(WelChol)], 피브레이트(피브르산 유도체)[겜피브로질(로피드), 페노피브레이트(안타라, 로피브라, 트라이코어 및 트라이글라이드), 클로피브레이트(아트로미드-S)], 나이아신(니코틴산). 다양한 부류의 지질저하제가 문헌에 기재되어 있다.
본 개시내용의 화합물은 장 내강 내로의 증가된 염화물 및 중탄산염 분비 및 및 동시 유체 분비와 함께 장에서 구아닐레이트 사이클라제-수용체를 활성화시키고, 세포내 2차 전량, 또는 환식 구아노신 모노포스페이트(cGMP)의 상승을 초래하는 펩타이드 또는 펩타이드 유사체와 조합하여 사용될 수 있다. 이러한 펩타이드의 예는 리나클로타이드(MD-1100 아세테이트), 내인성 호르몬 구아닐린 및 유로구아닐린 및 열 안정성 엔테로톡신 패밀리(ST 펩타이드)의 장 박테리아 펩타이드 및 US 5140102, US 5489670, US 5969097, WO 2006/001931A2, WO 2008/002971A2, WO 2008/106429A2, US 2008/0227685A1 및 US 7041786에 기재되어 있는 것이며, 이들의 전문은 모든 적절하고 일관된 목적을 위해 본 명세서에 참고로 편입된다.
본 개시내용의 화합물은 2형 염화물 통로 작용제, 예컨대 아미티자(루비프로스톤) 및 US 6414016에 기재되어 있는 다른 관련된 화합물과 병용하여 사용될 수 있으며, 이의 전문은 모든 적절하고 일관된 목적을 위해 본 명세서에 참고로 편입된다.
본 명세서에 기재된 화합물은 비만, T2DM, 대사 증후군 등의 치료를 위해 사용되는 제제와의 병용 요법에서 사용될 수 있다. 유용한 제제 중에 인슐린; 인슐린 분비 촉진제, 예컨대 설폰일유레아; 글루코스 저하 효과제, 예컨대 메트포민; 페록시좀 증식체-활성화 수용체 γ(PPARγ)의 활성체, 예컨대 티아졸리딘다이온; 다이펩티딜 펩티다제-4 저해제, 예컨대 시타글립틴 및 합성 인크레틴 모방체, 예컨대 리라글루타이드 및 엑세나타이드를 포함하는 인크레틴계 제제; 알파-글루코시다제 저해제, 예컨대 아카르보스; 글리나이드, 예컨대 레파글리나이드 및 나테글리나이드 등을 포함한다.
본 개시내용의 화합물은 P2Y2 수용체 작용제, 예컨대 모든 적절하고 일관된 목적을 위해 본 명세서에 전문이 참고로 편입된 EP 1196396B1 및 US 6624150에 기재된 것과 병용하여 사용될 수 있다.
다른 제제는 나트륨 이뇨 펩타이드, 예컨대 네시리타이드, 뇌-나트륨 이뇨 펩타이드(BNP) 및 심방-나트륨 이뇨 펩타이드(ANP)의 재조합 형태를 포함한다. 바소프레신 수용체 길항제, 예컨대 톨밥탄 및 코니바탄뿐만 아니라 인산염 결합제, 예컨대 레나겔, 렌레바, 포슬로 및 포스레놀이 공동투여될 수 있다. 다른 제제는 인산염 수송 저해제(미국 특허 4,806,532; 6,355,823; 6,787,528; 7,119,120; 7,109,184; 미국 특허 공개 2007/021509; 2006/0280719; 2006/0217426; 국제 특허 출원 공개 WO 2001/005398, WO 2001/087294, WO 2001/082924, WO 2002/028353, WO 2003/048134, WO 2003/057225, WO2003/080630, WO 2004/085448, WO 2004/085382; 유럽 특허 제1465638호 및 제1485391호; 및 일본 특허 제2007131532호에 기재된 것), 또는 인산염 수송 길항제, 예컨대 니코틴아마이드를 포함한다.
2. 위장관 장애
앞서 주목한 바와 같이, 본 명세서에 기재된 화합물은 단독으로 또는 다른 제제와 병용하여 사용될 수 있다. 예를 들어, 화합물은 진통제 펩타이드 또는 화합물과 함께 투여될 수 있다. 진통제 펩타이드 또는 화합물은 본 명세서에 기재된 화합물에 공유적으로 부착될 수 있거나 또는 병용 요법에서 본 명세서에 기재된 화합물과 함께 또는 후속적으로 투여되는 별개의 제제일 수 있다.
병용 요법은 2종 이상의 제제, 예를 들어, 본 명세서에 기재된 실질적으로 비-침투성 또는 실질적으로 생체 이용 가능하지 않은 NHE-저해 화합물 및 진통제 펩타이드 또는 화합물을 투여함으로써 달성될 수 있으며, 이들 각각은 별개로 또는 단일 제형에서 2종 이상의 제제를 투여함으로써 제형화되고 투여된다. 다른 조합은 또한 병용 요법에 의해 포함된다. 예를 들어, 2종의 제제는 함께 제형화될 수 있고, 제3의 제제를 함유하는 별개의 제형과 함께 투여될 수 있다. 병용 요법에서 2종 이상의 제제가 동시에 투여될 수 있지만, 그들이 필요하지는 않다. 예를 들어, 제1 제제(또는 제제의 조합물)의 투여는 분, 시간, 일 또는 주로 제2 제제(또는 제제의 조합물)의 투여에 선행할 수 있다. 따라서, 2 이상의 제제는 서로 수분 이내에 또는 서로 1, 2, 3, 6, 9, 12, 15, 18 또는 24시간 이내에 또는 서로 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14일 이내에 또는 서로 2, 3, 4, 5, 6, 7, 8, 9주 이내에 투여될 수 있다. 일부 경우에, 훨씬 더 긴 간격이 가능하다. 다수의 경우에, 병용 요법에서 사용되는 2 이상의 제제가 동시에 환자의 신체 내에 존재할 수 있지만, 이것이 필요하지는 않다.
병용 요법은 또한 병용하여 사용되는 1종 이상의 제제의 2회 이상의 투여를 포함할 수 있다. 예를 들어, 제제 X와 제제 Y가 병용하여 사용된다면, 예를 들어, X-Y-X, X-X-Y, Y-X-Y, Y-Y-X, X-X-Y-Y 등의 순서로 1회 이상 임의의 조합에서 그들을 순차적으로 투여할 수 있다.
본 명세서에 기재된 화합물은 진통제, 예를 들어, 진통제 화합물 또는 진통제 펩타이드와 함께 병용 요법으로 사용될 수 있다. 진통제는 선택적으로 본 명세서에 기재된 화합물에 공유적으로 부착될 수 있다. 유용한 진통제 중에, 예를 들어, 하기가 있다: Ca 통로 차단제, 5HT3 작용제(예를 들어, MCK-733), 5HT4 작용제(예를 들어, 테가세로드, 프루칼로프라이드) 및 5HT1 수용체 길항제, 오피오이드 수용체 작용제(로페라마이드, 페도토진 및 펜탄일), NK1 수용체 길항제, CCK 수용체 작용제(예를 들어, 록시글루마이드), NK1 수용체 길항제, NK3 수용체 길항제, 노르에피네프린-세로토닌 재흡수 저해제(NSR1), 바닐로이드 및 칸나바노이드 수용체 작용제 및 시알로르핀. 다양한 부류의 진통제가 문헌에 기재되어 있다.
오피오이드 수용체 길항제 및 작용제는 공동요법에서 본 개시내용의 화합물과 함께 투여될 수 있거나 또는, 예를 들어, 공유 결합에 의해 본 개시내용에 화합물에 연결될 수 있다. 예를 들어, 오피오이드 수용체 길항제, 예컨대 날록손, 날트렉손, 메틸 날로존, 날메펜, 시프리딤, 베타푸날트렉사민, 날록소나진, 날트린돌 및 노르-비날토르피민은 오피오이드-유발성 변비(OIC)의 치료에서 유용한 것으로 생각된다. 길항제의 초기 방출이 중간 내지 원위 소장 및/또는 상행결장에 있도록, 지연 또는 지속된 방출 제형에서 이 유형의 오피오이드 길항제를 제형화하는 것이 유용할 수 있다. 이러한 길항제는 미국 특허 제6,734,188호(WO 01/32180 A2)에 기재되어 있으며, 이의 전문은 모든 적절하고 일관된 목적을 위해 본 명세서에 참고로 편입된다. 엔케팔린 펜타펩타이드(HOE825; Tyr-D-Lys-Gly-Phe-L-호모세린)은 μ- 및 γ-오피오이드 수용체의 작용제이며, 장 운동성을 증가시키는 데 유용한 것으로 생각되고(Eur. J. Pharm., 219:445, 1992), 이 펩타이드는 본 개시내용의 화합물과 함께 사용될 수 있다. 또한 뮤/델타/카파 오피오이드 수용체에 결합하고 모틸린의 방출을 활성화시키며, 가스트린, 혈관작용성 장 펩타이드, 가스트린 및 글루카곤의 방출을 조절하는 것으로 여겨지는 트라이메부틴이 유용하다. Κ-오피오이드 수용체 작용제, 예컨대 페도조진, 케토사이클라조신 및 미국 특허 제2005/0176746호(WO 03/097051 A2)에 기재된 화합물(이의 전문은 모든 적절하고 일관된 목적을 위해 본 명세서에 전문이 참고로 편입됨)은 본 개시내용의 화합물과 함께 사용되거나 또는 이에 연결될 수 있다. 추가로, μ-오피오이드 수용체 작용제, 예컨대 몰핀, 다이페닐옥실레이트, 프라케파마이드(H-Tyr-D-Ala-Phe(F)-Phe-NH2; WO 01/019849 A1에 개시됨, 이의 전문은 모든 적절하고 일관된 목적을 위해 본 명세서에 전문이 참고로 편입됨) 및 로페라마이드가 사용될 수 있다.
Tyr-Arg(쿄토르핀)은 진통제 효과를 유발하기 위해 메트-엔케팔린의 방출을 자극함으로써 작용하는 다이펩타이드이다(J. Biol. Chem. 262:8165, 1987). 코토르핀은 본 개시내용의 화합물과 함께 사용되거나 또는 연결될 수 있다. CCK 수용체 작용제, 예컨대 양서류 및 다른 종으로부터의 세룰레인은 본 개시내용의 화합물과 함께 사용되거나 또는 이에 연결될 수 있는 유용한 진통제이다.
코노톡신 펩타이드는 전압 개폐 Ca 통로, NMDA 수용체 또는 니코틴 수용체에서 작용하는 진통제 펩타이드의 큰 부류를 나타낸다. 이들 펩타이드는 본 개시내용의 화합물과 함께 사용되거나 또는 연결될 수 있다.
티물린의 펩타이드 유사체(미국 특허 제7,309,690호 또는 프랑스 특허 제2830451호, 이의 전문은 모든 적절하고 일관된 목적을 위해 본 명세서에 전문이 참고로 편입됨)는 진통 활성을 가질 수 있고, 본 개시내용의 화합물과 함께 사용되거나 또는 연결될 수 있다.
록시글루마이드 및 덱스록시글루마이드(록시글루마이드의 R-이성질체)를 포함하는 CCK(CCKa 또는 CCKb) 수용체 길항제(미국 특허 제5,130,474호 또는 WO 88/05774, 이의 전문은 모든 적절하고 일관된 목적을 위해 본 명세서에 전문이 참고로 편입됨)는 진통제 활성을 가질 수 있고, 본 개시내용의 화합물과 함께 사용되거나 또는 연결될 수 있다.
다른 유용한 진통제는 5-HT4 작용제, 예컨대 테가세로드/젤놈 및 리렉사프라이드를 포함한다. 이러한 작용제는 EP1321142 A1, WO 03/053432A1, EP 505322 A1, EP 505322 B1, EP 507672 A1, EP 507672 B1, U.S. Pat. No. 5,510,353 및 미국 특허 제5,273,983호에 기재되어 있으며, 이들의 전문은 모든 적절하고 일관된 목적을 위해 본 명세서에 전문이 참고로 편입된다.
칼슘 통로 차단제, 예컨대 지코노타이드 및, 예를 들어, EP 625162B1, 미국 특허 제5,364,842호, 미국 특허 제5,587,454호, 미국 특허 제5,824,645호, 미국 특허 제5,859,186호, 미국 특허 제5,994,305호, 미국 특허 제6,087,091호, 미국 특허 제6,136,786호, WO 93/13128 A1, EP 1336409 A1호, EP 835126 A1, EP 835126 B1, 미국 특허 제5,795,864, 미국 특허 제5,891,849호, 미국 특허 제6,054,429호, WO 97/01351 A1에 기재된 관련된 화합물(이들의 전문은 모든 적절하고 일관된 목적을 위해 본 명세서에 참고로 포함됨)은 본 개시내용의 화합물과 함께 사용되거나 또는 이에 연결될 수 있다.
NK-1, NK-2 및 NK-3 수용체의 다양한 길항제(검토를 위해, 문헌[Giardina et al. 2003 Drugs 6:758] 참조)는 본 개시내용의 화합물과 함께 사용되거나 또는 연결될 수 있다.
NK1 수용체 길항제, 예컨대 아프레피탄트(머크 앤 코 인코포레이티드(Merck & Co Inc)), 보포피탄트, 에즐로피탄트(화이자 인코포레이티드(Pfizer, Inc.)), R-673(호프만-라 로슈 엘티디(Hoffmann-La Roche Ltd)), SR-14033 및, 예를 들어, EP 873753 A1, 미국 특허 제20010006972 A1호, 미국 특허 제20030109417 A1호, WO 01/52844 A1(이의 전문은 모든 적절하고 일관된 목적을 위해 본 명세서에 전문이 참고로 편입됨)에 기재되어 있는 관련된 화합물은 본 개시내용의 화합물과 함께 사용되거나 또는 이에 연결될 수 있다.
NK-2 수용체 길항제, 예컨대 네파두탄트(메나리니 라이서치(Menarini Ricerche) SpA), 사레두탄트(사노피-신텔라보(Sanofi-Synthelabo)), SR-144190 (사노피-신텔라보(Sanofi-Synthelabo)) 및 UK-290795(화이자 인코포레이티드)는 본 개시내용의 화합물과 함께 사용되거나 또는 연결될 수 있다.
NK3 수용체 길항제, 예컨대 오사네탄트(사노피-신텔라보), 탈네탄트 및, 예를 들어, WO 02/094187 A2, EP 876347 A1, WO 97/21680 A1, 미국 특허 제6,277,862호, WO 98/11090, WO 95/28418, WO 97/19927, 및 Boden et al.(J Med. Chem. 39:1664-75, 1996)(이들의 전문은 모든 적절하고 일관된 목적을 위해 본 명세서에 전문이 참고로 편입됨)에 기재되어 있는 관련된 화합물은 본 개시내용의 화합물과 함께 사용되거나 또는 이에 연결될 수 있다.
노르에피네프린-세로토닌 재흡수 저해제, 예컨대 밀나시프란 및 WO 03/077897 A1(이의 전문은 모든 적절하고 일관된 목적을 위해 본 명세서에 전문이 참고로 편입됨)에 기재된 관련된 화합물은 본 개시내용의 화합물과 함께 사용되거나 또는 이에 연결될 수 있다.
바닐로이드 수용체 길항제, 예컨대 아르바닐 및 WO 01/64212 A1(이의 전문은 모든 적절하고 일관된 목적을 위해 본 명세서에 전문이 참고로 편입됨)에 기재되어 있는 관련된 화합물은 본 개시내용의 화합물과 함께 사용되거나 또는 이에 연결될 수 있다.
화합물은 포스포다이에스터라제 저해제와 병용 요법에서 사용될 수 있다(이러한 저해제의 예는 전문이 모든 적절하고 일관된 목적을 위해 본 명세서에 전문이 참고로 편입되는 미국 특허 제6,333,354호에서 찾을 수 있음).
상기 화합물은 변비, 예를 들어, 낭성 섬유증을 야기할 수 있는 염화물 또는 중탄산염 분비와 관련된 장애를 치료하기 위해 단독으로 또는 병용 요법으로 사용될 수 있다.
화합물은 또한 또는 대안적으로 칼슘-유도성 변비 효과를 치료하기 위해 단독으로 또는 병용요법에서 사용될 수 있다. 변비는 칼슘 보충제를 취한 노인, 특히 골다공증이 있는 환자에서 통상적으로 발견된다. 칼슘 보충제는 골밀도를 회복하는데 골다공증 환자에서 유리한 것으로 나타났지만, 이와 관련된 변비 효과 때문에 순응은 불량하다.
본 개시내용의 화합물은 오피오이드와 병용하여 사용될 수 있다. 오피오이드 사용은 GI 장애, 예를 들어 변비인 주목할 만한 부작용과 함께 통증 경감과 주로 관련된다. 이들 제제는 중추 신경계 및 위장관에서 주로 발견되는 오피오이드 수용체에 대한 결합에 의해 작용한다. 이들 두 기관계에서 수용체는 유리한 효과와 바람직하지 않은 부작용(예를 들어, 장 운동성의 감소 및 뒤이은 변비)을 매개한다. 사용에 적합한 오피오이드는 전형적으로 다음의 예시적인 부류 중 하나에 속한다: 천연 오피에이트, 몰핀, 코데인 및 테바인을 포함하는 양귀비의 진에 함유된 알칼로이드; 천연 오피오이드, 예컨대 하이드로몰폰, 하이드로코돈, 옥시코돈, 옥시몰폰, 데소몰핀, 다이아세틸몰핀(헤로인), 니코몰핀, 다이프로파노일몰핀, 벤질몰핀 및 에틸몰핀으로부터 생성된 반합성 오피에이트; 완전히 합성인 오피오이드, 예컨대, 예컨대 펜탄일, 페티딘, 메타돈, 트라마돌 및 프로폭시펜; 신체에서 자연적으로 생성된 내인성 오피오이드 펩타이드, 예컨대 엔돌핀, 엔케팔린, 다이놀핀 및 엔도몰핀.
본 개시내용의 화합물은 신부전(3 내지 5기)이 있는 환자가 접하는 GI 장애를 완화시키기 위해 단독으로 또는 병용 요법으로 사용될 수 있다. 변비는 환자의 해당 범주에서 두 번째로 많이 보고된 증상이다(Murtagh et al., 2006; Murtagh et al., 2007a; Murtagh et al., 2007b). 이론에 의해 구속되는 일 없이, 신부전은 장 Na 재흡수의 자극에 의해 수반되는 것으로 여겨진다(Hatch and Freel, 2008). 본 개시내용의 화합물의 투여에 의한 이러한 수송의 총 또는 부분적 저해는 GI 수송을 개선시키고 복통을 경감시키는 치료적 이점을 가질 수 있다. 해당 내용에서, 본 개시내용의 화합물은 안지오텐신-조절제와 병용하여 사용될 수 있다: 안지오텐신 전환 효소(ACE) 저해제(예를 들어, 카프토프릴, 에날로프릴, 리시노프릴, 라미프릴) 및 안지오텐신 II 수용체 길항제 요법(또한 AT1-길항제 또는 안지오텐신 수용체 차단제, 또는 ARB로서 지칭됨); 이뇨제, 예컨대 루프 이뇨제(예를 들어 푸로세마이드, 부메타나이드), 티아자이드 이뇨제(예를 들어 하이드로클로로티아자이드, 클로르탈리돈, 클로르티아자이드) 및 칼륨 보존 이뇨제: 아밀로라이드; 베타 차단제: 비소프롤, 카르베딜롤, 네비볼롤 및 장기간 방출 메토프롤; 양성 수축변력제: 디곡신, 도부타민; 포스포다이에스터라제 저해제, 예컨대 밀리논;대안의 혈관확장제: 아이소소르바이드 다이나이트레이트/하이드랄라진의 조합; 알도스테론 수용체 길항제: 스피로놀락톤, 에프레레논; 나트륨 이뇨 펩타이드: 네시리타이드, 뇌-나트륨 이뇨 펩타이드(BNP), 심방-나트륨 이뇨 펩타이드(ANP)의 재조합 형태; 바소프레신 수용체 길항제: 톨밥탄 및 코니밥탄; 인산염 결합제(레나겔, 렌레바, 포슬로, 포스렌올); 인산염 수송 저해제, 예컨대 US 4806532, US 6355823, US 6787528, WO 2001/005398, WO 2001/087294, WO 2001/082924, WO 2002/028353, WO 2003/048134, WO 2003/057225, US 7119120, EP 1465638, 미국 특허 출원 제2007/021509호, WO 2003/080630, US 7109184, 미국 특허 출원 제2006/0280719호, EP 1485391, WO 2004/085448, WO 2004/085382, 미국 특허 출원 제2006/0217426호, JP 2007/131532(이들의 전문은 모든 적절하고 일관된 목적을 위해 본 명세서에 전문이 참고로 편입됨)에 기재된 것, 또는 인산염 수송 길항제(니코틴아마이드).
본 개시내용의 화합물은 장 내강 내로의 증가된 염화물 및 중탄산염 분비 및 및 동시 유체 분비와 함께 장에서 구아닐레이트 사이클라제-수용체를 활성화시키고, 세포내 2차 전량, 또는 환식 구아노신 모노포스페이트(cGMP)의 상승을 초래하는 펩타이드 또는 펩타이드 유사체와 조합하여 사용될 수 있다. 이러한 펩타이드의 예는 리나클로타이드(MD-1100 아세테이트), 내인성 호르몬 구아닐린 및 유로구아닐린 및 열 안정성 엔테로톡신 패밀리(ST 펩타이드)의 장 박테리아 펩타이드 및 US 5140102, US 5489670, US 5969097, WO 2006/001931A2, WO 2008/002971A2, WO 2008/106429A2, US 2008/0227685A1 및 US 7041786에 기재되어 있는 것이며, 이들의 전문은 모든 적절하고 일관된 목적을 위해 본 명세서에 참고로 편입된다.
본 개시내용의 화합물은 2형 염화물 통로 작용제, 예컨대 아미티자(루비프로스톤) 및 US 6414016에 기재되어 있는 다른 관련된 화합물과 병용하여 사용될 수 있으며, 이의 전문은 모든 적절하고 일관된 목적을 위해 본 명세서에 참고로 편입된다.
본 개시내용의 화합물은 P2Y2 수용체 작용제, 예컨대 모든 적절하고 일관된 목적을 위해 본 명세서에 전문이 참고로 편입된 EP 1196396B1 및 US 6624150에 기재된 것과 병용하여 사용될 수 있다.
본 개시내용의 화합물은 완화제, 예컨대 벌크-생성제(예를 들어, 차전자 겉껍질(섬유질 보충제)), 메틸셀룰로스(시트루셀), 폴리카보필, 식이섬유, 사과, 대변 연화제/계면활성제(예를 들어, 도쿠세이트(콜라세, 디옥토); 수화제(삼투제), 예컨대, 이염기성인산나트륨, 시트르산마그네슘, 수산화마그네슘(마그네시아 유제), 황산마그네슘(에프솜염), 일염기성 인산나트륨, 이염기성나트륨), 및 고삼투압제: 글리세린 좌약, 솔비톨, 락툴로스, 및 폴리에틸렌 글리콜(PEG))와 병용하여 사용될 수 있다. 본 개시내용의 화합물은 또한 장 연동운동, 예컨대 비사코딜 정제(둘코락스), 카산트라놀, 센나 및 알로에 베라로부터의 알로인을 자극하는 제제와 병용하여 사용될 수 있다.
일 실시형태에서, 본 개시내용의 화합물은 위에서의 체류 시간에 실질적으로 영향을 미치는 일 없이, 즉, 위 사용 시간에 대한 상당한 효과 없이, 위장 수송, 더 구체적으로는 결장에서 가속화된다. 훨씬 더 구체적으로는 본 발명의 화합물은 지연된 위 배출 시간과 관련된 부작용, 예컨대 구역 없이 결장 수송을 회복한다. GI 및 결장 수송은, 예를 들어: 문헌[Burton DD, Camilleri M, Mullan BP, et al., J. Nucl. Med., 1997;38:1807-1810; Cremonini F, Mullan BP, Camilleri M, et al., Aliment. Pharmacol. Ther., 2002;16:1781-1790; Camilleri M, Zinsmeister AR, Gastroenterology, 1992;103:36-42; Bouras EP, Camilleri M, Burton DD, et al., Gastroenterology, 2001;120:354-360; Coulie B, Szarka LA, Camilleri M, et al., Gastroenterology, 2000;119:41-50; Prather CM, Camilleri M, Zinsmeister AR, et al., Gastroenterology, 2000;118:463-468; 및, Camilleri M, McKinzie S, Fox J, et al., Clin. Gastroenterol. Hepatol., 2004;2:895-904]에 보고된 방법을 이용하여 환자에서 측정된다.
C. 중합체 병용 요법
본 명세서에 기재된 NHE-저해 화합물은 유체-흡수성 중합체("FAP")와 병용하여 이것이 필요한 환자에게 투여될 수 있다. 본 개시내용의 실시형태에 따른 투여에 유용한 장 유체-흡수성 중합체는 나트륨 수송 저해제의 작용으로부터 초래되는 장액을 흡수하기 위해 비-흡수성 NHE-저해 화합물(예를 들어, NHE-3 저해제)과 병용하여 경구로 투여될 수 있다. 이러한 중합체는 결장에서 팽창하며, 환자에 대해 허용 가능한 분변에 대한 점조도를 부여하도록 유체에 결합한다. 본 명세서에 기재된 유체-흡수성 중합체는 증량제로서도 지칭되는 완하제 특성을 갖는 중합체(즉, 분변에서 장액의 일부를 보유하고 분변에서 더 높은 정도의 수화를 부여하며 수송을 용이하게 하는 중합체)로부터 선택될 수 있다. 유체-흡수성 중합체는 또한 항-설사 기능을 갖는 약제학적 중합체, 즉, 물변 및 잠재적 실금을 피하기 위해 분변에 대해 일부 점조도를 유지하는 제제로부터 선택적으로 선택될 수 있다.
고함량의 유체를 갖는 분변에서 특정 점조도를 유지하는 중합체의 능력은 그의 "물 보유력"에 의해 특성규명될 수 있다. Wenzl 등(Determinants of decreased fecal consistency in patients with diarrhea; Gastroenterology, v. 108, no. 6, p. 1729-1738 (1995))은 설사가 있는 환자 분변의 점조도를 제어하는 결정소를 연구하였고, 그들은 배설물의 물 보유력과 제한적으로 상관관계가 있다는 것을 발견하였다. 물 보유력은 재구성된 배설물질이 특정 g 숫자에서 원심분리된 후에 특정 수준의 점조도("형성된 대변 대변" 점조도에 대응)를 달성하기 위한 주어진 대변의 물 함량으로서 결정된다. 임의의 특정 이론으로 구속되는 일 없이, 배설물의 물 보유력이 주어진 유체 흡수 프로파일을 갖는 특정 중합체의 섭취에 의해 증가된다는 것을 발견하였다. 더 구체적으로, 상기 중합체의 물 보유력은 그들의 장입 하의 유체 흡수(absorbancy under load: AUL)와 상관 관계가 있으며; 훨씬 더 구체적으로는 상기 중합체의 AUL은 5kPa의 정압 하에서, 또는 10kPa의 정압 하에서 15g 초과의 등장액/g 중합체라는 것이 발견되었다.
본 개시내용의 치료 방법에서 이용되는 FAP는 또한 약 5kPa, 또는 약 10 kPA 하의 정압 하에서 적어도 약 10g, 약 15g, 약 20g, 약 25g 이상의 등장액/g 중합체의 AUL을 가지며, 당업계에 일반적으로 공지된 수단을 이용하여 결정하여 약 20g, 약 25g 이상의 유체 흡수를 가질 수 있다. 추가적으로 또는 대안적으로, 분변의 비수용성 고체 분획이 10% 내지 20%이고, 중합체 농도가 대변 중량의 1% 내지 5%일 때, FAP는 분변물질에 대해 최소 점조도, 일부 실시형태에서, 이하의 시험 방법에서 기재하는 규모로 "무른"으로 등급화된 점조도를 부여할 수 있다. 대변의 분변 비수용성 고체 분획의 결정은 문헌[Wenz et al]에 기재되어 있다. 중합체는 비하전될 수 있거나 또는 낮은 전하 밀도를 가질 수 있다(예를 들어, 1 내지 2 meq/그램). 대안적으로 또는 추가로, 중합체는 식도에서 조기의 팽창을 회피하기 위해 공지된 전달 방법을 이용하여 결장에 직접 전달될 수 있다.
본 개시내용의 일 실시형태에서, FAP는 "고흡수성" 중합체(즉, 아기 기저귀, 여성용 위생제품, 농업 첨가제 등에 사용되는 것과 유사한 약하게 가교된, 부분적으로 중성화된 다가 전해질 하이드로겔)이다. 고흡수성 중합체는 약하게 가교된 폴리아크릴레이트 하이드로겔로 이루어질 수 있다. 중합체의 팽창은 2가지 효과: (i) 중합체 골격의 수화 및 혼합 엔트로피 및 (ii) 겔 내에서 반대 이온(예를 들어, Na 이온)으로부터 생긴 삼투압에 의해 본질적으로 유도된다. 평형상태에서 겔 팽창비는 중합체 네트워크에 고유한 탄성 저항에 의해 그리고 배싱 유체의 화학적 퍼텐셜에 의해 제어되며, 즉, 겔은 배경 전해질이 중합체 상에서 겉보기 전하 밀도를 감소시키고, 삼투압을 유도하는 겔 내부 및 외부의 유리 이온 농도 차이를 감소시키기 때문에 더 높은 염 농도에서 탈팽창할 것이다. 팽창비 SR(g 유체/g 건조 중합체 및 동의어로 "유체 흡수")는 순수한 물의 1000으로부터 생리 식염수(즉, 등장성)를 나타내는 0.9% NaCl 용액 중의 30까지 변할 수 있다. SR은 중화정도를 증가시킬 수 있고, 가교 밀도를 감소시킬 수 있다. SR은 일반적으로 겔 강도에 따른 감소 정도에 의한 부하가 적용됨에 따라, 즉, 가교 밀도에 따라 감소된다. 외부 용액에 비해 겔 내의 염 농도는 내부 전기적 퍼텐셜에 기인하여 도난 효과의 결과로서 낮아질 수 있다.
유체-흡수성 중합체는 유체 흡수제, 예컨대 α,β-에틸렌으로 불포화된 단량체, 예컨대 모노카복실산, 폴리카복실산, 아크릴아마이드 및 그들의 유도체로부터 제조된 것인 가교된 폴리아크릴레이트를 포함할 수 있다. 이들 중합체는 공중합체로서 이러한 반복 단위의 다양한 조합과 함께 아크릴산, 메타크릴산, 아크릴산의 금속염, 아크릴아마이드, 및 아크릴아마이드 유도체(예컨대 2-아크릴아미도-2-메틸프로판설폰산)의 반복 단위를 가질 수 있다. 이러한 유도체는 중합체, 예컨대 폴리비닐 알코올의 친수성 접합체를 포함하는 아크릴 중합체를 포함한다. 적합한 중합체 및 이러한 중합체를 제조하기 위한 겔 중합 공정을 포함하는 공정의 예는 본 명세서에 모든 적절하고 일관된 목적을 위해 참고로 편입된 미국 특허 3,997,484; 3,926,891; 3,935,099; 4,090,013; 4,093,776; 4,340,706; 4,446,261; 4,683,274; 4,459,396; 4,708,997; 4,076,663; 4,190,562; 4,286,082; 4,857,610; 4,985,518; 5,145,906; 5,629,377 및 6,908,609에 개시되어 있다(추가로, 문헌[Buchholz, F. L. and Graham, A. T., "Modern Superabsorbent Polymer Technology," John Wiley & Sons (1998)], 이는 또한 본 명세서에 모든 적절하고 일관된 목적을 위해 참고로 편입됨). NHE-저해제와 병용한 치료를 위한 바람직한 중합체의 부류는 다가전해질이다.
가교 정도는 구체적 중합체 물질에 따라 크게 다를 수 있지만; 그러나, 대부분의 적용에서, 대상 고흡수성 중합체는, 중합체가 생리 식염수(즉, 0.9% 식염수) 중에서 그의 중량의 10배 초과로 여전히 흡수할 수 있는 가교 정도로 단지 가볍게 가교된다. 예를 들어, 이러한 중합체는 전형적으로 약 0.2몰% 미만의 가교제를 포함한다.
일부 실시형태에서, 치료에서 이용되는 FAP는 칼슘 카보필(Registry Number: 9003-97-8, 또한 카보폴 EX-83으로서 지칭됨), 및 카보폴 934P이다.
일부 실시형태에서, 유체-흡수성 중합체는 고내상 에멀션(high internal phase emulsion: "HIPE") 공정에 의해 제조된다. HIPE 공정은 사이가 연결된 거대 보이드(약 100 마이크론)(즉, 개방-셀 구조)의 매우 거대한 다공성 분획을 갖는 중합체 발포 슬래브를 야기한다. 이 기법은 흡기 압력 및 유체 흡수에 의해 가요성 및 접을 수 있는 발포 물질을 생산한다(미국 특허 제5,650,222호; 제5,763,499호 및 제6,107,356호, 이들은 모든 적절하고 일관된 목적을 위해 본 명세서에 편입됨). 따라서, 중합체는 소수성이고, 표면은 수성유체에 의해 습윤화되도록 개질되어야 한다. 이는 계면 장력을 감소시키기 위해 계면활성제에 의해 발포 물질을 후처리함으로써 수행된다. 이들 물질은 부하에 대해 덜 순응성, 즉, 정압 하에서 탈팽창되는 경향이 덜하도록 요구된다.
일부 실시형태에서, 유체-흡수성 겔은 수 중에서 아크릴아마이드 또는 이의 유도체, 가교제(예를 들어, 메틸렌-비스-아크릴아마이드) 및 유리 라디칼 개시제 산화환원 시스템의 수성 유리 라디칼 중합에 의해 제조된다. 물질은 슬라브로서 얻어진다. 전형적으로, 낮은 가교 밀도에서 가교된 폴리아크릴아마이드의 팽창비(예를 들어, 메틸렌-비스-아크릴아마이드의 중량%로서 표현되는 2 내지 4%)는 25 내지 40이다(F. Horkay, Macromolecules, 22, pp. 2007-09 (1989)). 이들 중합체의 팽창 특성은 광범위하게 연구되었고, 고염 농도에서 가교된 폴리아크릴산의 팽창 특성과 본질적으로 동일하다. 해당 조건 하에서, 삼투압은 반대이온의 존재에 기인하여 존재하지 않으며, 팽창은 혼합의 자유 에너지 및 네트워크 탄성 에너지에 의해 제어된다. 중화된 폴리아크릴산과 가교 밀도가 동일한, 상이하게 언급된 가교된 폴리아크릴아마이드는 동일한 팽창비(즉, 유체 흡수 특성)를 나타내며, 압력 하에서 고염 함량(예를 들어, 1M)에서 가교된 다가전해질과 동일한 정도의 탈팽창으로 여겨진다. 중합체가 양호한 용매 조건에 남아있다면, 중성 하이드로겔의 특성(예를 들어, 팽창)은 염 환경에 대해 민감하지 않을 것이다. 임의의 특정 이론으로 구속되는 일 없이, 겔 내에 함유된 유체는 주위 유체와 동일한 염 농도를 갖는 것으로 여겨진다(즉, 도난 효과에 기인하여 염 분할이 없음).
이용될 수 있는 유체-흡수성 중합체의 다른 하위부류는 N-알킬 아크릴아마이드 중합체(예를 들어, N-아이소프로필아크릴아마이드(NIPAM))를 포함하는 하이드로겔 물질이다. 대응하는 수성 폴리NIPAM 하이드로겔은 약 35℃에서 온도 전이를 나타낸다. 이 온도 초과에서 하이드로겔은 붕괴할 수 있다. 메커니즘은 일반적으로 가역적이며, 온도가 실온으로 회복될 때 겔은 그의 본래의 팽창비로 재팽창된다. 이는 에멀션 중합에 의해 나노입자의 생산을 허용한다(R. Pelton, Advances in Colloid and Interface Science, 85, pp. 1-33, (2000)). 수송 온도 미만에서 폴리-NIPAM 나노입자의 팽창 특징이 보고되었고, 폴리NIPAM의 벌크 겔에 대해 보고된 것과 유사하며 폴리아크릴아마이드에 대해 발견된 것과 동등하다(즉, 30-50 g/g) (W. McPhee, Journal of Colloid and Interface Science, 156, pp. 24-30 (1993); 및, K. Oh, Journal of Applied Polymer Science, 69, pp. 109-114(1997)).
일부 실시형태에서, NHE-저해제와 병용하여 치료를 위해 이용되는 FAP는 비만의 치료를 위해(J. Chen, Journal of Controlled Release, 65, pp. 73-82(2000), 또는 단백질을 전달하기 위해 위를 비우는 것을 지연시킬 수 있는 초다공성 겔이다. 거대다공성 구조를 갖는 폴리아크릴레이트계 SAP 구조가 또한 사용될 수 있다. 거대다공성 SAP 및 초다공성 겔은 다공성 구조가 초다공성겔에 대해 건조 상태에서 거의 완전하게 남아있지만, 거대다공성 SAP에 대한 건조 시 사라진다는 점에서 상이하다. 방법 둘 다 발포제(예를 들어, 중합 동안 CO2 버블을 생성하는 탄산염)를 사용하지만, 제조 방법은 상이하다. 초다공성 물질의 전형적인 팽창비(SR)는 대략 10이다. 초다공성 겔은 건조 상태로 거대 내부 기공 용적을 유지한다.
거대다공성 하이드로겔은 또한 중합체 상 분리가 비용매에 의해 유도되는 방법을 이용하여 형성될 수 있다. 중합체는 폴리-NIPAM일 수 있고, 이용되는 비용매는 글루코스(예를 들어, 문헌[Z. Zhang, J. Org. Chem., 69, 23(2004)) 또는 NaCl(예를 들어, 문헌[Cheng et al., Journal of Biomedical Materials Research - Part A, Vol. 67, Issue 1, 1 October 2003, 페이지 96-103] 참조)일 수 있다. NaCl의 존재에 의해 유도되는 상분리는 팽창비의 증가를 야기한다. 이들 물질은, 물질의 팽창비(SR)가 염 등성 용액에서 유지된다면 그리고 겔이 부하 하에서 붕괴되지 않는다면, 바람직하다. "서비스" 온도는, 예를 들어, 수송 온도 현상이 결여된 단량체로 중합체 중의 NIPAM 을 희석시킴으로써, 체온 이상으로 이동되어야 한다.
일부 실시형태에서, 유체-흡수성 중합체는 특정 천연 유래 중합체, 예컨대 탄수화물 모이어티를 함유하는 것으로부터 선택될 수 있다. 바람직한 실시형태에서, 이러한 탄수화물-함유 하이드로겔은 비분해성이며, 저분율의 가용성 물질 및 고분율의 겔-형성 물질을 가진다. 일부 실시형태에서, 유체-흡수성 중합체는 잔탄, 구아, 벨렌, 헤미셀룰로스, 알킬-셀룰로스, 하이드로-알킬-셀룰로스, 카복시-알킬-셀룰로스, 카라기난, 덱스트란, 하이알루론산 및 아가로스로부터 선택된다. 바람직한 실시형태에서, 겔 형성 중합체는 필룸이다. 필룸(또는 "이스파귤라")는 종자가 점질물의 생산을 위해 화학적으로 사용되는 식물속 플란타고(Plantago)의 몇몇 구성원에 대해 사용되는 보통 명칭이다. 유체-흡수성 중합체는 또한 차전자의 겔 형성 분획, 즉, (J. Marlett, Proceedings of the Nutrition Society, 62, pp. 2-7-209 (2003); 및 M. Fischer, Carbohydrate Research, 339, 2009-2012(2004))에서 특성규명되고, 추가로 미국 특허 6,287,609; 7,026,303; 5,126,150; 5,445,831; 7,014,862; 4,766,004; 4,999,200(이들 각각은 모든 적절하고 일관된 목적을 위해 본 명세서에 편입됨)에 기재되는 아라비노스(25%)와 자일로스(75%)의 중성 당류 공중합체, 및 처방전 없이 살 수 있는 차전자-함유 제제, 예컨대 명칭 메타무실(Metamucil)(더 프록터 앤드 감블 컴퍼니(The Procter and Gamble company)) 하에 시판되는 것이다. 차전자-함유 투약 형태는 또한 씹는 작용이 연하 전에 더 작은, 별개의 입자로 붕괴시키지만, 구강 내에서 최소의 겔화를 겪는데 적합하며, 환자에 의해 인식되는 허용 가능한 마우스필(mouthfeel) 및 양호한 미학을 가진다.
차전자-함유 투약 형태는 인간 대상체 및 다른 포유류에 대한 일원화된 투약량으로서 적합한 물리적으로 별개의 단위를 포함하며, 각각은 목적으로 하는 치료 효과를 생성하기 위해 계산된 사전 결정된 양의 활성 물질(예를 들어, 겔-형성 다당류)을 함유한다. 본 조성물에 적합한 고체 경구 투약 형태는 정제, 알약, 캡슐, 로젠지, 씹을 수 있는 정제, 트로키, 사쉐, 펠릿, 웨이퍼 등을 포함한다.
일부 실시형태에서, FAP는 다당류 입자이되, 다당류 성분은 자일로스 및 아라비노스를 포함한다. 자일로스 대 아라비노스의 비는 미국 특허 제6,287,609호; 제7,026,303호 및 제7,014,862호 기재된 바와 같은 중량으로 적어도 약 3:1일 수 있고, 이들 각각은 모든 적절하고 일관된 목적을 위해 본 명세서에 참고로 편입된다.
본 명세서에 기재된 유체-흡수성 중합체는 NHE-저해 화합물 또는 이를 함유하는 약제학적 조성물과 병용하여 사용될 수 있다. NHE-저해 화합물 및 FAP는 또한 본 개시내용의 범주로부터 벗어나는 일 없이 표제 "병용 요법" 하에 기재된 것을 포함하는 다른 제제와 함께 투여될 수 있다. 상기 기재한 바와 같이, NHE-저해 화합물은 유체-흡수성 중합체의 공동 투여가 필요한 상당한 설사 또는 분변 유체 분비를 유발하는 일 없이 증상을 해결하기 위해 유체-흡수성 중합체의 사용 없이 단독으로 투여될 수 있다.
본 명세서에 기재된 유체-흡수성 중합체는 NHE-저해 화합물 또는 이를 함유하는 약제학적 조성물과의 임의의 실질적인 상호작용을 유도하지 않도록 선택될 수 있다. 본 명세서에 사용되는 바와 같은, "실질적인 상호작용이 없는"은 일반적으로 FAP 중합체의 공동 투여가 단독으로 투여되는 NHE-저해 화합물의 약학적 특성을 실질적으로 변경시키지 않는다는 것(즉, 실질적으로 감소시키지도 또는 실질적으로 증가시키지도 않음)을 의미한다. 예를 들어, 음으로 하전된 작용기를 함유하는 FAP, 예컨대 카복실레이트, 설포네이트 등은 잠재적으로 양으로 하전된 NHE-저해 화합물과 이온 상호작용하여, 저해제가 그의 약학적 표적에 도달하는 것을 막을 수 있다. 추가로, FAP의 형상 및 배열은 분자 인식 요소로서 작용할 수 있고, 주어진 저해제의 특정 수소 결합 및/또는 소수성 영역의 인식을 통한 "호스트-게스트" 상호작용을 통해 NHE-저해 화합물을 격리시킬 수 있다는 것이 가능할 수 있다. 따라서, 본 개시내용의 다양한 실시형태에서, FAP 중합체는 (i) (예를 들어, 화합물 그 자체에서 모이어티의 반대 전하를 갖는 그에 존재하는 모이어티에 의해) 본 개시내용의 화합물과 이온에 의해 상호작용 또는 본 개시내용의 화합물에 결합하지 않는다는 것, 그리고/또는 (ii) (예를 들어, 분자 인식 요소로서 작용하고 NHE 저해제 또는 화합물의 저해 모이어티를 격리시킬 수 있는 그에 존재하는 모이어티에 의해) 본 개시내용의 화합물과 "호스트-게스트" 상호작용을 확립하는 것을 가능하게 하는 전하 및/또는 구조적 입체구조(또는 형상 또는 배열)를 갖지 않는다는 것을 보장하도록 본 개시내용의 화합물과 함께 공동 투여 또는 사용을 위해 선택될 수 있다.
D. 투약량
본 명세서에서 사용되는 바와 같은, 본 명세서에 개시된 화합물의 "유효량"(또는 "약제학적 유효량")은 치료가 없을 때에 비해 화합물로 치료 중인 병태의 유리한 임상 결과를 초래하는 양이라는 것을 주목하여야 한다. 투여되는 화합물 또는 화합물들의 양은 질환 또는 병태의 정도, 중증도 및 유형, 목적으로 하는 요법의 양 및 약제학적 제형의 방출 특징에 의존할 것이다. 또한 대상체의 건강, 크기, 체중, 연령, 성별 및 약물에 대한 내약성에 의존할 것이다. 전형적으로, 화합물은 목적으로 하는 치료 효과를 달성하기 위해 충분한 시간 기간 동안 투여된다.
NHE-저해제 화합물과 유체-흡수성 중합체가 둘 다 치료 프로토콜에서 사용되는 실시형태에서, NHE-저해 화합물 및 FAP는 함께 또는 "이중-섭생"에서 투여될 수 있되, 두 치료제는 별개로 투약 및 투여된다. NHE-저해 화합물 및 유체-흡수성 중합체가 별개로 투약될 때, NHE-저해 화합물이 필요한 대상체에게 투여되는 전형적인 투약량은 전형적으로 약 5㎎/일 내지 약 5000㎎/일이고, 다른 실시형태에서, 약 50㎎/일 내지 약 1000㎎/일이다. 이러한 투약량은 약 10m㏖ 내지 약 250m㏖/일, 약 20m㏖ 내지 약 70m㏖/일 또는 심지어 약 30m㏖ 내지 약 60m㏖/일의 나트륨(및 그의 수반하는 음이온)의 분변 배설을 유도할 수 있다.
유체-흡수성 중합체의 전형적인 용량은 비 흡수성 NHE-저해 화합물에 의해 유도되는 분변 분비 정도의 함수이다. 전형적으로, 용량은 장 움직임의 빈도 및 대변의 점조도에 따라 조절된다. 더 구체적으로, 액체 대변을 피하기 위해 그리고 "무른" 또는 반형성 또는 형성된 대변 점조도를 유지하기 위해 용량은 조절된다. 목적으로 하는 대변 점조도를 달성하기 위해 그리고 환자에 대한 복부 경감을 제공하기 위해, NHE- 저해 화합물과 병용하여 투여될 유체-흡수성 중합체의 전형적인 투약량 범위는 약 2g 내지 약 50g/일, 약 5g 내지 약 25 g/일 또는 심지어 약 10g 내지 약 20g/일이다. NHE-저해 화합물 및 FAP가 단일 투약량 섭생으로서 투여될 때, 1일 섭취는 약 2g 내지 약 50g/일, 약 5 g 내지 약 25g/일, 또는 약 10g 내지 약 20g/일일 수 있고, NHE-저해 화합물 때 유체-흡수 중합체의 중량비는 약 1:1000 내지 1:10 또는 심지어 약 1:500 내지 1:5 또는 약 1:100 내지 1:5이다.
FAP 없이 단독으로 사용될 때 실질적으로 비침투성 또는 실질적으로 전신으로 생체 이용 가능하지 않은, NHE-저해 화합물의 전형적은 투약량은 약 0.2 ㎎/일 내지 약 2 g/일, 또는 약 1㎎ 내지 약 1g/일, 또는 약 5㎎ 내지 약 500㎎, 또는 약 10㎎ 내지 약 250㎎/일일 수 있으며, 이는 치료가 필요한 대상체에게 투여된다.
본 명세서에 기재된 치료제의 투여 빈도는 1일 1회(QD) 내지 1일 2회(BID) 또는 1일 3회(TID) 등으로 다를 수 있고, 정확한 투여 빈도는, 예를 들어, 환자의 병태, 투약량 등에 따라 다르다. 예를 들어, 이중 섭생의 경우에, NHE-저해 화합물은 1일 1회 취해질 수 있는 반면, 유체-흡수성 중합체는 각각의 식사에서 취해질 수 있다(TID). 더 나아가, 2012년 1월 9일자로 출원된 미국 특허 출원 제61/584,753호에 개시된 바와 같이, NHE-저해 화합물은 1일 2회(BID), 또는 1일 3회(TID) 투여되고, 일부 더 구체적인 실시형태에서, NHE-저해 화합물은 2 내지 200 ㎎/용량 BID, 또는 2 내지 100㎎/용량 TID 범위의 양으로 투여된다. 더 구체적인 실시형태에, NHE-저해 화합물은 약 15㎎/용량, 약 30㎎/용량, 또는 약 45㎎/용량의 양으로, 더 구체적인 실시형태에서, 15㎎/용량, 30㎎/용량 또는 45㎎/용량의 양으로 투여된다.
E. 투여 방식
본 명세서에 기재된 유체-흡수성 중합체와 함께 또는 이것 없이 본 개시내용의 실질적으로 비침투성 또는 실질적으로 전신으로 생체 이용 가능하지 않은 NHE-저해 화합물은 임의의 적합한 경로에 의해 투여될 수 있다. 화합물은 캡슐, 현탁액, 정제, 알약, 드라제, 액체, 겔, 시럽, 슬러리 등으로 경구로(예를 들어, 식이 요법으로) 투여된다. (예컨대 경질 젤라틴 또는 사이클로덱스트란의 코팅에서) 조성물을 캡슐화하는 방법은 당업계에 공지되어 있다(Baker, et al., "Controlled Release of Biological Active Agents", John Wiley and Sons, 1986). 화합물은 약제학적 조성물의 부분으로서 허용 가능한 약제학적 담체와 함께 대상체에게 투여될 수 있다. 약제학적 조성물의 제형은 선택된 투여 경로에 따라 다를 것이다. 적합한 약제학적 담체는 화합물과 상호작용하지 않는 비활성 성분을 함유할 수 있다. 담체는 생체 적합성, 즉, 투여 부위에서 비독성, 비염증성, 비면역원성이고 다른 원치않는 반응이 없다. 약제학적으로 허용 가능한 담체의 예는, 예를 들어, 식염수, 상업적으로 입수 가능한 비활성 겔, 또는 알부민, 메틸 셀룰로스 또는 콜라겐 기질로 보충된 액체를 포함한다. 표준 약제학적 제형 기법, 예컨대 문헌[Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, Pa]에 기재된 것이 사용될 수 있다.
다른 실시형태에서, NHE-3 저해 화합물은 전신으로 투여될 수 있다. 일 실시형태에서, 본 발명의 화합물은 신장에서 NHE-3을 저해하기 위해 전신으로 투여된다. 임의의 특정 이론으로 구속되는 일 없이, 본 개시내용의 비침투성 NHE-저해 화합물(예를 들어, NHE-3, -2 및/또는 -8 저해제)은 또한 신장에서 NHE3을 저해하기 위해 정맥내, 피하 또는 근육내 주사 또는 주입에 의해 비경구로 투여될 수 있다. NHE3은 신장의 근위세뇨관의 정단부 표면 상에서 고수준으로 발현되고, 세포내 양성자의 분비에 내강 Na 재흡수와 짝지어진다. NHE3은 신장의 나트륨 재흡수의 대략 60 내지 80%를 차지하기 때문에, NHE 저해는 부종을 방지하기 위해 그리고 울혈성 심부전 증상을 해결하기 위해 실질적인 양의 전신 유체 및 나트륨의 제거를 허용할 수 있었다는 것이 예상된다. 이 효과는 요세관사구체 피드백을 저해하기 위해 다른 이뇨제, 구체적으로는 푸로세마이드와 같은 루프 이뇨제와 병용하여 NHE 저해에 의해 달성될 수 있었다. 추가로, 근위세뇨관에서 NHE3을 통한 나트륨 재흡수는 근위세뇨관의 에너지 요구의 큰 비율을 초래하기 때문에, 신장에서 NHE 저해는 근위세뇨관에 대한 감소된 에너지 이용 가능성의 상황, 예컨대 급성 신장 손상을 초래하는 신장 허혈 재관류 손상에서와 같이 신장 저산소증의 결과로서 생기는 것에서 에너지 요구를 감소시킴으로써 그리고 근위세뇨관을 보호함으로써 유리할 수 있다는 것이 예상된다.
경구 사용을 위한 약제학적 제제는 정제 또는 드라제 코어를 얻기 위해 원한다면 적합한 보조제를 첨가한 후에 본 개시내용의 화합물을 고체 부형와 조합하고, 얻어진 혼합물을 선택적으로 그라인딩하고 나서, 과립의 혼합물을 가공함으로써 얻어질 수 있다. 적합한 부형제는, 특히, 락토스, 수크로스, 만니톨 또는 솔비톨; 셀룰로스 제제, 예를 들어, 마이스 전분, 밀 전분, 쌀 전분, 감자 전분, 젤라틴, 트래거캔스 검, 메틸 셀룰로스, 하이드록시프로필메틸셀룰로스, 카복시메틸셀룰로스 나트륨, 및/또는 폴리비닐피롤리돈(PVP)을 포함하는 당과 같은 충전제이다. 원한다면, 붕해제, 예컨대 가교된 폴리비닐 피롤리돈, 한천 또는 알긴산 또는 이의 염, 예컨대 알긴산나트륨이 첨가될 수 있다.
드라제 코어는 적합한 코팅을 구비한다. 이 목적을 위해, 선택적으로 아라비아검, 탤크, 폴리비닐 피롤리돈, 카보폴 겔, 폴리에틸렌 글리콜, 및/또는 이산화티타늄, 래커 용액 및 적합한 유기 용매 또는 용매 혼합물을 함유할 수 있는 농축된 당 용액이 사용될 수 있다. 식별을 위해 또는 활성 화합물 용량의 상이한 조합을 특징짓기 위해 염료 또는 색소가 정제 또는 드라제에 첨가될 수 있다.
경구로 사용될 수 있는 약제학적 제제는 적합한 물질, 예컨대 젤라틴으로 이루어진 푸쉬-핏(push-fit) 캡슐뿐만 아니라 적합한 물질, 예를 들어 젤라틴 및 가소제, 예컨대 글리세롤 또는 솔비롤로 이루어진 연질의 밀봉 캡슐을 포함한다. 푸쉬-핏 캡슐은 충전제, 예컨대 락토스, 결합제, 예컨대 전분, 및/또는 윤활제, 예컨대 탤크 또는 스테아르산마그네슘 및 선택적으로 안정제와 혼합하여 활성 성분을 함유할 수 있다. 연질 캡슐에서, 활성 화합물은 적합한 액체, 예컨대 지방 오일, 액체 파라핀 또는 액체 폴리에틸렌 글리콜 중에 용해되거나 또는 현탁될 수 있다. 추가로, 안정제가 첨가될 수 있다. 경구 투여를 위한 모든 제형은 이러한 투여에 적합한 투약량이어야 한다.
본 개시내용의 소정의 화합물은 상이한 입체이성질체(예를 들어, 부분입체이성질체 및 거울상 이성질체)로서 또는 동위원소로서 얻어질 수 있다는 것과, 본 개시내용은 개시된 화합물의 모든 이성질체 형태, 라세미 혼합물 및 동위원소 및 순수한 이성질체와 이들의 혼합물 둘 다 그리고 라세미 혼합물뿐만 아니라 동위원소를 비롯한, 이들의 혼합물로 대상체를 치료하는 방법을 포함한다는 것이 이해될 것이다. 입체이성질체는 임의의 적합한 방법, 예컨대 크로마토그래피를 이용하여 분리되고 단리될 수 있다.
F. 지연 방출
NHE 단백질은 조직 발현, 막 국소화 및 기능적 역할의 그들의 패턴에서 상당한 다양성을 나타낸다(예를 들어, 문헌[The sodium-hydrogen exchanger - From molecule To Its Role In Disease, Karmazyn, M., Avkiran, M., and Fliegel, L., eds., Kluwer Academics (2003)] 참조).
포유류에서, 9가지의 별개의 NHE 유전자(NHE-1 내지 -9)를 기재하였다. 이들 9가지 중에서, 5가지(NHE-1 내지 -5)는 혈장막에서 원칙적으로 활성인 반면, NHE-6, -7 및 -9는 세포내 구획 내에 우세하게 존재한다.
NHE-1은 편재하여 발현되고, 세포질 산성화 후 정상 상태 세포내 pH의 회복 및 세포 용적의 유지를 초래한다. 최근의 발견은 NHE-1이 기관 기능 및 생존에 중요하다는 것을 나타낸다(예를 들어, NHE-1-널 마우스는 위닝(weaning) 전에 이동 이상, 정신착란 유사 발작 및 상당한 사망률을 나타낸다).
네프론 및 장 상피세포의 기저측부측에서 발현되는 NHE-1과 대조적으로, NHE-2 내지 -4는 신장 및 위장관의 상피조직 첨단측 상에서 우세하게 발현된다. 몇몇 계통의 증거는 NHE-3이 근위세뇨관에 의한 신장의 대량 Na+ 및 유체 재흡수의 주된 기여자라는 것을 나타낸다. 세뇨관의 내강 내로 NHE-3에 의한 H+의 관련된 분비는 또한 신장 HCO3- 재흡수의 약 2/3에 대해 필수적이다. 마우스에서 NHE-3 기능의 완전한 붕괴는 신장에서 HCO3-, Na+ 및 유체 재흡수의 급격한 감소를 야기하는데, 이는 저혈량증 및 산성혈증과 지속적으로 관련된다.
일 실시형태에서, 본 개시내용의 화합물은 장 상피세포층을 가로지르는 실질적인 침투 없이, 그리고/또는 GI관에 우세하게 존재하지 않는 NHE에 대한 실질적인 활성 없이 첨단 NHE 역수송(예를 들어 NHE-3, NHE-2 및 NHE-8)을 표적화하도록 의도된다. 본 발명은 GI 정단부 NHE 역수송체를 선택적으로 저해하는 방법을 제공하고, 변비 상태를 야기하는 비정상적 유체 항상성을 바로잡기 위해 염 및 유체 흡수 저해의 목적으로 하는 효과를 제공한다. 그들의 전신 노출의 부재 때문에, 상기 화합물은 상기 강조한 NHE의 다른 생리학적 역할을 방해하지 않는다. 예를 들어, 본 개시내용의 화합물은 원치않는 전신 효과, 예를 들어 염 세척 또는 장애 중에서도 저나트륨혈증 및 산성혈증을 야기하는 중탄산염 손실을 유발하는 일 없이 치료가 필요한 환자에서 변비를 치료하는 것으로 예상된다.
다른 실시형태에서, 본 개시내용의 화합물은 상부 GI, 예컨대 위 구획 및 십이지장과의 상호작용이 거의 없거나 전혀 없는 소장으로 전달된다. 본 출원인은 위 또는 십이지장에서 화합물의 조기 방출이 위 분비 또는 중탄산염 분비(또한 "중탄산염 덤프"로서 지칭됨)에 대한 뜻밖의 효과를 가질 수 있다는 것을 발견하였다. 본 실시형태에서, 화합물은 십이지장을 지나 활성 형태로 방출되도록 설계된다. 이는 프로드러그 접근에 의해 또는 특정 약물 전달계에 의해 달성될 수 있다.
본 명세서에서 사용되는, "프로드러그"는 상부 GI에서 비활성(또는 상당히 덜 활성)이지만, 일단 투여되면, 예를 들어, 십이지장을 통과한 후에 생체내에서 활성 대사물질로 대사되는 본 명세서에 상술된 화합물의 변형된 형태를 지칭하는 것으로 이해되어야 한다. 따라서, 프로드러그 접근에서, NHE-저해 화합물의 활성은 화합물이 목적으로 하는 위 구획을 통과한 후에 유리되는 일시적 보호기로 가리움될 수 있다. 예를 들어, NHE-저해 화합물의 필수 구아니딘일 작용기의 아실화 또는 알킬화는 생화학적으로 비활성을 제공하지만; 그러나, 장 아미다제, 에스터라제, 포스파타제 등뿐만 아니라 결장의 박테리아군에 존재하는 효소에 의한 이들 작용기의 절단은 활성 모 화합물을 유리시킨다. 프로드러그는 특정 효소에 의한 인식을 위해 프로드러그의 구조를 조심해서 최적화함으로써 이러한 I상 대사 효소의 상대적 발현 및 국소화를 이용하도록 설계될 수 있다. 예로서, 항-염증제 설파살라진은 장 박테리아에 의한 다이아조 결합의 환원에 의해 결장에서 5-아미노살리실레이트로 전환된다.
약물 전달 접근에서, 본 개시내용의 NHE-저해 화합물은 GI의 표적화된 영역, 즉, 공장, 회장 또는 결장, 원위 회장 및 결장, 또는 결장에서 활성물을 방출하는 경구 투여용의 소정의 약제학적 조성물로 제형화된다.
당업자에게 공지된 방법을 이용 가능하다. (예를 들어, 문헌[Kumar, P. and Mishra, B., Colon Targeted Drug Delivery Systems - An Overview, Curr. Drug Deliv., 2008, 5 (3), 186-198; Jain, S. K. and Jain, A., Target-specific Drug Release to the Colon., Expert Opin. Drug Deliv., 2008, 5 (5), 483-498; Yang, L., Biorelevant Dissolution Testing of Colon-Specific Delivery Systems Activated by Colonic Microflora, J. Control Release, 2008, 125 (2), 77-86; Siepmann, F.; Siepmann, J.; Walther, M.; MacRae, R. J.; 및 Bodmeier, R., Polymer Blends for Controlled Release Coatings, J. Control Release 2008, 125 (1), 1-15; Patel, M.; Shah, T.; 및 Amin, A., Therapeutic Opportunities in Colon-Specific Drug-Delivery Systems, Crit. Rev. Ther. Drug Carrier Syst., 2007, 24(2), 147-202; Jain, A.; Gupta, Y.; Jain, S. K., Perspectives of Biodegradable Natural Polysaccharides for Site-specific Drug Delivery to the Colon., J. Pharm. Sci., 2007, 10 (1), 86-128; Van den, M. G., Colon Drug Delivery, Expert Opin. Drug Deliv., 2006, 3(1), 111-125; Basit, A. W., Advances in Colonic Drug Delivery, Drugs 2005, 65 (14), 1991-2007; Chourasia, M. K.; Jain, S. K., Polysaccharides for Colon-Targeted Drug Delivery, Drug Deliv. 2004, 11(2), 129-148; Shareef, M. A.; Khar, R. K.; Ahuja, A.; Ahmad, F. J.; 및 Raghava, S., Colonic Drug Delivery: An Updated Review, AAPS Pharm. Sci. 2003, 5 (2), E17; Chourasia, M. K.; Jain, S. K., Pharmaceutical Approaches to Colon Targeted Drug Delivery Systems, J. Pharm. Sci. 2003, 6 (1), 33-66; 및, Sinha, V. R.; Kumria, R., Colonic Drug Delivery: Prodrug Approach, Pharm. Res. 2001, 18 (5), 557-564.] 참조. 전형적으로, 활성 약제학적 성분(API)은 환경(예를 들어, pH, 효소 활성, 온도 등)의 함수로서, 또는 시간의 함수로서 상기 API를 방출하도록 설계된 정제/캡슐에 함유된다. 이 접근의 일 예는 유드라콜(Eudracol)(상표명)(데구사의 특별 아크릴산 사업 부문의 제약 중합체 사업 부서(Pharma Polymers Business Line of Degussa's Specialty Acrylics Business Unit))이며, 여기서 API-함유 코어 정제는 특정 용해 프로파일로 다양한 중합 코팅에 의해 층상화된다. 제1 층은 정제가 위장을 통과하는 것을 보장하여 그것이 소장을 통해 지속될 수 있도록 보장한다. 위 내의 산성환경으로부터 소장 내 알칼리성 환경으로의 변화는 보호 외부층의 방출을 개시한다. 그것이 결장을 통해 이동함에 따라, 다음층은 알칼리성 및 장액에 의해 침투 가능하게 만들어진다. 이는 유체가 내부층으로 침투하도록 허용하고, 코어로부터 외부까지 확산되는 활성 성분을 방출하는데, 이는 장벽에 의해 흡수될 수 있다. 본 개시내용의 범주로부터 벗어나는 일 없이 다른 방법이 상정된다.
다른 예에서, 본 발명의 약제학적 조성물은 펙틴 및 갈락토만난(둘 다 결장 박테리아 효소에 의해 분해 가능한 다당류임)을 포함하는 약물 담체와 함께 사용될 수 있다. (예를 들어, 미국 특허 제6,413,494호를 참조하며, 이의 전문은 모든 적절하고 일관된 목적을 위해 본 명세서에 전문이 참고로 편입됨.) 펙틴 또는 갈락토만난은, 약물 담체로서 단독으로 사용된다면, 모의 위액 및 모의 장액에서 용이하게 용해되고, 약 7 이상의 pH에서 제조되는 이들 두 다당류의 혼합물은 모의 위액 및 장액에서 용해되지 않는 또는 붕괴되지 않는 강한, 탄성 및 불용성 겔을 생성하며, 따라서 혼합물로 코팅된 보호 약물은 상부 GI관에서 방출된다. 펙틴 및 갈락토만난이 결장에 도달할 때, 이는 결장 박테리아 효소의 상승 작용에 의해 빠르게 분해된다. 또 다른 양상에서, 본 발명의 조성물은 결장 효소에 의해 분해 가능한 젤라틴과 음이온성 다당류(예를 들어, 펙티네이트, 펙테이트, 알기네이트, 황산콘드로이틴, 폴리갈락투론산, 트래거캔스검, 아라비아검 및 이들의 혼합물)의 복합체의 약제학적 기질과 함께 사용될 수 있다(미국 특허 제6,319,518호).
또 다른 실시형태에서, 본 개시내용의 치료 방법에 따라 투여되는 유체-흡수성 중합체는 허용 가능한/쾌적한 감각 수용성 특성, 예컨대, 마우스필, 맛을 제공하기 위해 그리고/또는 입 안에서 그리고 식도에서의 조기 팽창/겔화 및 숨 막힘 또는 폐색 유발을 피하기 위해 제형화된다. 제형은 GI관에서 FAP의 충분한 수화 및 팽창을 보장하기 위해 그리고 덩어리의 형성을 회피하기 위해 이러한 방법으로 설계될 수 있다. FAP에 대한 경구 투약량은, 예를 들어, 분말, 과립, 정제, 웨이퍼, 쿠키 등을 포함하는 다양한 형태로 취할 수 있거나, 또는 상부 GI, 예컨대 위 구획 및 십이지장과의 상호작용이 거의 또는 전혀 없는 소장으로 전달된다.
상기 기재한 접근 또는 방법은 장 하부에서 활성물을 선택적으로 전달하는 것으로 보고된 다수의 방법 중 단지 일부이며, 따라서 본 개시내용의 범주를 한정하거나 또는 제한하는 것으로 고려되어서는 안 된다.
IV.
화합물의 제조
다음의 반응식 I 내지 IV는 본 발명의 화합물, 즉, 화학식 (I)의 화합물을 제조하기 위한 방법을 도시한다. 당업자가 유사한 방법에 의해 또는 당업자에게 공지된 다른 방법을 조합함으로써 이들 화합물을 제조할 수 있다는 것이 이해된다. 또한 당업자는 이하에 기재하는 것과 유사한 방법으로 적절한 출발 성분을 이용하고 필요하다면 합성 매개변수를 변형시킴으로써 이하에 구체적으로 도시하지 않는 화학식 (I)의 다른 화합물을 제조할 수 있다는 것이 이해된다. 본 명세서에 기재된 화합물은 상업적으로 입수 가능한 출발 물질로부터 제조되거나 또는 공지된 유기, 무기 및/또는 효소 공정을 이용하여 합성될 수 있다. 일반적으로, 출발 성분은 시그마 알드리치(Sigma Aldrich), 랑카스터 신테시스 인코포레이티드(Lancaster Synthesis, Inc.), 메이브리지(Maybridge), 매트릭스 사이언티픽(Matrix Scientific), TCI, 및 플루오로켐 USA(Fluorochem USA) 등과 같은 공급사로부터 얻을 수 있거나, 또는 당업자에게 공지된 정보에 따라 합성되거나(예를 들어, 문헌[Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 5th edition (Wiley, December 2000)] 참조) 또는 본 발명에 기재한 바와 같이 제조된다.
일반 반응식 I
일반 반응식 I에 관해, 적절한 벤즈알데하이드 A 및 1차 아민을 상업적으로 얻거나 또는 당업계에 공지된 방법에 따라 합성하고, 수소화붕소나트륨, 트라이아세톡시보로하이드라이드나트륨 또는 사이아노보로하이드라이드나트륨과 같은 시약에 의한 환원성 아미노화를 통해 벤질아민 B로 전환될 수 있다. 아세트산 중의 브로민을 통한 케톤 C(상업적으로 또는 당업계의 공지된 방법을 통해 얻음)의 브로민화는 브로모케톤 D를 제공하고, 이는 이어서 벤질아민 B로 대체되어 아미노케톤 E를 제공하였다. 케톤은 수소화붕소나트륨에 의해 용이하게 F로 환원되고, 염화메틸렌 중의 황산과 같은 산성 조건 하에서 테트라하이드로아이소퀴놀린(THIQ) G로 고리화된다. 이 라세미 물질 G는 타르타르산 유도체 또는 다른 단일 거울상 이성질체 산과의 부분입체이성질체 염 혼합물의 재결정화를 통해 거울상 이성질체로 결정화되어, 카이랄 생성물 H를 제공한다. THIQ의 C8 위치에서 브로민화물은 금속 촉매, 예컨대 Pd(PPh3)4의 존재 하에 사이아나이드와 같은 사이안화 시약과의 반응을 통해 사이아노(CN)로 전환되어 생성물 J를 제공한다. 메틸 및 알킬기, 메톡실 등을 포함하는 다른 치환체는 보론산 및 메탄올을 포함하는 대응하는 시약과의 금속-매개 결합을 통해 유사하게 혼입된다. 아닐린은 이산화황, 구리 촉매 및 염산의 존재 하에 다이아조화를 통해 염화설폰일 L로 전환된다. 이어서, 다이아민 "링커", 예컨대 M은 염기, 예컨대 트라이에틸아민, 피리딘, 탄산나트륨 또는 탄산칼륨 등의 존재 하에 2당량의 염화설폰일 L과 반응되어 구조 (I)의 화합물을 제공한다.
일반 반응식 II
대안적으로, 이 순서는 나이트로 치환체 대신 메톡시 변이체를 이용하여 수행될 수 있다. 메톡시 치환체를 갖는 화합물 A는 일반 반응식 I에 기재되는 것과 유사한 절차를 통해 제조된다. 후속적으로, 이 물질은 타르타르산 유도체 또는 다른 단일 거울상 이성질체산과의 부분입체이성질체 염 혼합물의 재결정화를 통해 거울상 이성질체 순도로 결정화되어, 카이랄 생성물 B를 제공할 수 있다. THIQ의 C8 위치에서 브로민화는 금속 촉매, 예컨대 Pd(PPh3)4의 존재 하에 사이안화아연과 같은 사이안화 시약과의 반응을 통해 사이아노(CN)로 전환되어 생성물 C를 제공한다. 메틸 및 알킬기, 메톡실 등을 포함하는 다른 치환체는 보론산 및 메탄올을 포함하는 대응하는 시약과의 금속-매개 결합을 통해 유사하게 혼입된다. 메톡시는 루이스산 시약, 예컨대 BBr3, AlCl3 등을 통해 또는 HBr 및 HCl 또는 유사한 것을 포함하는 산에 의해 페놀 D로 전환된다. 반응성 트라이플레이트 E로의 전환은 3차 또는 복소환식 아민, 예컨대 트라이에틸아민, 피리딘, 2,6-루티딘 등, 탄산칼륨 또는 수소화나트륨을 포함하는 염기의 존재 하에 트라이플루오로메탄 설폰산 무수물 또는 N,N-비스(트라이플루오로메틸설폰일)아닐린을 포함하는 시약과의 반응에 의해 용이하게 된다. 3차 아민 염기, 예컨대 다이아이소프로필에틸아민 또는 트라이에틸아민 및 리간드를 갖는 Pd2(dba)3을 포함하는 촉매, 예컨대 잔포스(Xantphos)의 존재 하에 승온에서 벤질머캅탄과의 반응으로 티오에터 F를 수득한다. 아세트산/물 중의 N-클로로석신이미드(NCS)또는 염소 기체 중 하나에 의한 티오에터 INT-S8의 산화적 염소화에 의해 염화설폰일 G가 합성된다. 이어서, 이들 시약은 일반 반응식 I에 기재된 방법을 통해 구조 (I)의 화합물로 만들어 질 수 있다.
일반 반응식 I 및 II에 관해, 전형적인 카복실레이트 활성화 시약은 DCC, EDCI, HATU, 염화옥살릴, 염화티오닐 등을 포함한다. 전형적인 염기는 TEA, DIEA, 피리딘, K2CO3, NaH 등을 포함한다. 전형적인 아실화 촉매는 HOBt, HOAt, 4-다이메틸아미노피리딘 등을 포함한다. 수소화를 위한 전형적인 촉매는 탄소상 팔라듐, 탄소상 로듐, 탄소상 백금, 레이니 니켈 등을 포함한다.
당업자는 반응식에 관해 논의된 단계들 및 시약들의 순서에 대한 변형이 가능하다는 것을 인식할 것이다. 화학식 (I) 의 화합물의 제조를 위한 방법은 다음의 비제한적인 예시적 반응식에서 더 상세하게 기재된다.
이는 또한 당업자에 의해 인식될 것이며, 본 명세서에 기재된 공정에서, 중간체 화합물의 작용기는 적합한 보호기에 의해 보호될 필요가 있을 수 있다. 이러한 작용기는 하이드록시, 아미노, 머캅토 및 카복실산을 포함한다. 하이드록시에 대한 적합한 보호기는 트라이알킬실릴 또는 다이아릴알킬실릴(예를 들어, t-뷰틸다이메틸실릴, t-뷰틸다이페닐실릴 또는 트라이메틸실릴), 테트라하이드로피란일, 벤질 등을 포함한다. 아미노, 아미디노 및 구아니디노에 대한 적합한 보호기는 t-뷰톡시카보닐, 벤질옥시카보닐, 트라이플루오로아세틸 등을 포함한다. 카복실산을 위한 적합한 보호기는 알킬, 아릴 또는 아릴알킬 에스터를 포함한다. 보호기는 당업자에게 공지되고 본 명세서에 기재된 바와 같은 표준 기법에 따라 첨가되거나 또는 제거될 수 있다. 보호기의 사용은 문헌[Green, T.W. and P.G.M. Wutz, Protective Groups in Organic Synthesis (1999), 3rd Ed., Wiley]에서 상세하게 기재된다. 당업자에 의해 인식되는 바와 같이, 보호기는 또한 중합체 수지, 예컨대 Wang 수지, Rink 수지 또는 2-클로로트라이틸-클로라이드 수지일 수 있다.
또한 본 발명의 화합물의 이러한 보호된 유도체는 이렇게 해서 약학적 활성을 갖지 않을 수도 있지만, 그들은 포유류에게 투여될 수 있으며, 이후에 약학적으로 활성인 본 발명의 화합물을 형성하기 위해 신체에서 대사된다는 것이 당업자에 의해 인식될 것이다. 따라서 이러한 유도체는 "프로드러그"로서 기재될 수 있다. 본 발명의 화합물의 모든 프로드러그는 본 발명의 범주 내에 포함된다.
본 개시내용을 추가로 예시하기 위해 다음의 비제한적 예를 제공한다.
실시예
할로아세토페논의 합성을 위한 일반적 반응식:
단계 A: 카복실산 A는 A의 활성화된 형태에 N,O-다이메틸하이드록실아민의 첨가를 통해 웨인레브(Weinreb) 아마이드 B로 전환되는데, 이는 염화옥살릴 또는 염화티오닐에 의한 산 염화물 형성에 의해 또는 EDC, CDI, DCC, HATU 등과 같은 결합 시약을 통해 매개된다.
단계 B: 친핵체, 예컨대 유기마그네슘 시약의 아마이드 B에 대한 첨가로 아세토페논 C를 수득한다.
단계 C: 브로민, N-브로모석신이미드(NBS) 또는 N-클로로석신이미드(NCS)와 같은 시약에 의한 아세토페논 B의 브로민화(또는 염소화)는 목적으로 하는 할로아세토페논 INT-KB를 제공한다.
이 경로는 메톡시와 나이트로 유사체 둘 다에 대해 사용될 수 있다. 이 경로를 통해 제조된 유도체는 하기를 포함한다:
치환된 염화설폰일의 합성을 위한 일반 반응식:
단계 A: 적절한 벤즈알데하이드(여기서, X = I, Br 또는 Cl이고, 1차 아민은 상업적으로 또는 당업계에 공지된 방법에 따라 합성되고, 수소화붕소나트륨, 트라이아세톡시보로하이드라이드나트륨 또는 사이아노보로하이드라이드나트륨과 같은 시약에 의한 환원성 아마이드화를 통해 벤질아민 INT-S1로 전환될 수 있다.
단계 B: 케토벤질아민 INT-S2는 임의의 트라이알킬아민(예를 들어, 트라이에틸아민, 다이아이소프로필에틸아민), 탄산칼륨 또는 탄산나트륨, 수소화나트륨 등과 같은 염기의 존재 하에 케토브로마이드 INT-KB에 의한 벤질아민 INT-S1의 알킬화를 통해 얻는다.
단계 C: INT-S2의 케톤은 수소화붕소나트륨, 트라이아세톡시보로하이드라이드나트륨 또는 사이아노보로하이드라이드나트륨과 같은 환원제의 존재 하에 용이하게 환원되어 벤질알코올 INT-S3을 제공한다.
단계 D: INT-S3의 분자내 프리델-크래프트 알킬화(Friedel-Crafts)는 황산 또는 루이스산, 예컨대 염화알루미늄의 존재 하에 용이하게 되어, 테트라하이드로아이소퀴놀린 INT-S4를 제공한다.
단계 E: THIQ INT-S4의 C8 위치에서 브로마이드는 금속 촉매, 예컨대 Pd(PPh3)4의 존재 하에 사이안화 시약, 예컨대 사이안화아연과의 반응을 통해 사이아노(CN)로 전환되어 생성물 INT-S5를 제공한다. 메틸 및 알킬기, 메톡실 등을 포함하는 다른 치환체는 보론산 및 메탄올을 포함하는 대응하는 시약과의 금속-매개 결합을 통해 유사하게 혼입된다.
단계 F: INT-S5의 메톡시 모이어티는 삼브로민화보론, 요오드화나트륨/염화알루미늄 또는 다른 유사한 조건에 의한 처리를 통해 유리 페놀로 전환되어, 페놀 INT-S6을 제공한다.
단계 G: 트라이플레이트 INT-S7은, 3차 또는 복소환식 아민, 예컨대 트라이에틸아민, 피리딘, 2,6-루티딘 등, 탄산칼륨, 또는 수소화나트륨을 포함하는 염기의 존재 하에 트라이플산 무수물 또는 N,N-비스(트라이플루오로메틸설폰일)아닐린과 같은 시약에 의한 처리를 통해 페놀 INT-S6으로 시작하여 생성된다.
단계 H: 트라이플레이트 INT-S7은 리간드를 갖는 Pd2(dba)3과 같은 팔라듐 공급원, 예컨대 잔포스의 존재 하에 승온에서 벤질머캅탄 및 3차 아민 염기, 예컨대 다이아이소프로필에틸아민 또는 트라이에틸아민에 의한 처리를 통해 티오에터 INT-S8로 전환된다.
단계 I: 염화설폰일 INT-S9는 아세트산/물 중의 N-클로로석신이미드(NCS) 또는 염소 기체 중 하나에 의한 티오에터 INT-S8의 산화적 염소화에 의해 합성된다.
본 경로를 통해 제공된 염화설폰일은 하기를 포함한다:
링커 아민 이량체의 합성을 위한 대표적인 반응식:
단계 A: 250㎖ 둥근 바닥 플라스크에 2-(2-클로로에톡시)에탄-1-올(7.8g, 62.62m㏖, 1당량) 및 물(300㎖)을 넣었다. 이 다음에 교반시키면서 물(40㎖) 중의 아자이드화나트륨(7.7g, 118.4m㏖, 2당량) 용액을 적가하였다. 얻어진 용액을 밤새 80℃에서 교반시켰다. 반응 혼합물을 물/얼음욕으로 0℃로 냉각시키고 나서, 3×500㎖의 CH2Cl2로 추출하였다. 유기층을 합하고 나서, 무수 황산나트륨으로 건조시키고, 여과 후, 진공 하에 농축시켜 무색 오일로서 10g(조질)의 2-(2-아지도에톡시)에탄-1-올(INT-Y1)을 제공하였다.
단계 B: 500㎖ 둥근 바닥 플라스크에 아지도알코올 INT-Y1(단계 A로부터의 10g 조질, 이론치 62.6m㏖, 1당량), 다이클로로메탄(300㎖), 4-메틸벤젠-1-염화설폰일(18g, 94.42m㏖, 1.3당량) 및 트라이에틸아민(10㎖, 1.15당량)을 첨가하였다. 얻어진 용액 2시간 동안 실온에서 교반시켰다. 이어서, 반응물을 50㎖의 물의 첨가에 의해 퀀칭시키고 나서, 3×300㎖의 다이클로로메탄으로 추출하였다. 유기층을 합하고 나서, 무수 황산나트륨으로 건조시키고, 여과 후, 진공 하에 농축시켰다. 잔사를 석유 에터/에틸 아세테이트(1:3)를 이용하는 실리카겔 칼럼 상에 적용하여 무색의 오일로서 15g(69%)의 1-[[2-(2-아지도에톡시)에톡시]설폰일]-4-메틸벤젠 (INT-Y2)을 제공하였다.
단계 C: 500㎖ 둥근 바닥 플라스크에 tert-뷰틸 N-[(3R)-피롤리딘-3-일]카바메이트(10g, 53.7m㏖, 1당량), 1-[[2-(2-아지도에톡시)에톡시]설폰일]-4-메틸벤젠 (16.85g, 59.1m㏖, 1.1당량), CH3CN (100㎖) 및 탄산칼륨(22.26g, 161m㏖, 3당량)을 첨가하였다. 얻어진 용액 밤새 60℃에서 교반시켰다. 고체를 여과시키고 나서, 얻어진 혼합물을 진공 하에 농축시켜 황색 오일로서 13g(81%)의 tert-뷰틸 N-[(3R)-1-[2-(2-아지도에톡시)에틸]피롤리딘-3-일]카바메이트(INT-RL1)를 제공하였다.
단계 D: 퍼지한 250㎖ 둥근 바닥 플라스크에 에탄올(100㎖), 레이니 Ni(10g), 아자이드 INT-RL1(6g, 20m㏖, 1당량) 및 NH4OH(10㎖)를 첨가하였다. 상기에 H2(g)를 도입한 후에 퍼징/충전 주기가 이어졌고, H2(g)의 분위기 하에 슬러리를 남겼다. 얻어진 슬러리를 2시간 동안 실온에서 교반시켰다. 고체를 여과시키고 나서, 얻어진 혼합물을 진공 하에 농축시켜 황색 오일로서 4.8g(88%)의 tert-뷰틸 N-[(3R)-1-[2-(2-아미노에톡시)에틸]피롤리딘-3-일]카바메이트(INT-RL2)를 제공하였다.
단계 E: 퍼지하고 질소의 비활성 분위기로 유지한 500㎖ 둥근 바닥 플라스크에 아민 INT-RL2(10g, 36.6m㏖, 1당량), DMF (250㎖) 및 1,4-다이아이소사이아네이토부탄(2.6㎖, 0.45당량)을 첨가하였다. 얻어진 용액을 2시간 동안 60℃에서 교반시켰다. 얻어진 슬러리를 진공 하에 농축시켰다. 잔사를 CH3CN:H2O(35:65)를 이용하는 실리카겔 상에 적용하여 백색 고체로서 9.0g의 tert-뷰틸 N-[(3R)-1-[2-(2-[[(4-[[(2-[2-[(3R)-3-[[(tert-뷰톡시)카보닐]아미노]피롤리딘-1-일]에톡시]에틸)카바모일]아미노]뷰틸)카바모일]아미노]에톡시)에틸]피롤리딘-3-일]카바메이트(INT-RL3)를 제공하였다.
단계 F: 3-(2-[2-[(3R)-3-아미노피롤리딘-1-일]에톡시]에틸)-1-(4-[[(2-[2-[(3R)-3-아미노피롤리딘-1-일]에톡시]에틸)카바모일] 아미노]뷰틸)유레아 하이드로클로라이드. 250㎖ 둥근 바닥 플라스크에 Boc-다이아민 INT-RL3(3.0g, 4.37m㏖, 1당량), CH2Cl2(15㎖), CH3CN(15㎖) 및 염산(4M(aq), 15㎖)을 첨가하였다. 얻어진 용액 2시간 동안 실온에서 교반시켰다. 얻어진 혼합물을 진공 하에 농축시켰다. 이는 갈색 오일로서 2.2099g(91%)의 표제 화합물을 초래하였다. MS (m/z): 487 [M+H]+. 1H NMR (메탄올-d4, 300 MHz) δ 4.29 - 4.12(m, 3H), 4.01 - 3.73(m, 7H), 3.75 - 3.48 (m, 10H), 3.40 (t, J = 4.9 Hz, 6H), 3.19 (d, J = 5.8 Hz, 4H), 2.70 (tt, J = 24.7, 11.1 Hz, 2H), 2.30 (qd, J = 8.0, 3.7 Hz, 2H), 1.60 - 1.49 (m, 4H).
단계 A 내지 F를 통해, 2.2449g(92%)의 3-(2-[2-[(3S)-3-아미노피롤리딘-1-일]에톡시]에틸)-1-(4-[[(2-[2-[(3S)-3-아미노피롤리딘-1-일]에톡시]에틸)카바모일]아미노]뷰틸)유레아 하이드로클로라이드(INT-SL4)를 갈색 고체로서 제조하였다. MS (m/z): 487 [M+1]+. 1H NMR (메탄올-d4, 300 MHz) δ 4.26 (s, 2H), 4.18 (s, 1H), 3.98 (d, J = 12.5 Hz, 2H), 3.83(t, J = 4.5 Hz, 5H), 3.77 - 3.50 (m, 10H), 3.41 (t, J = 5.2 Hz, 5H), 3.26 - 3.16 (m, 4H), 2.74 (s, 2H), 2.31 (ddd, J = 13.8, 8.4, 5.0 Hz, 2H), 1.62 - 1.51 (m, 4H).
유사하게, 1-Boc-4-아미노피페리딘으로 시작하는 단계 A 내지 F는 링커 INT-PL1을 제공한다.
에틸렌글리콜계 다이아민의 합성을 위한 대표적인 반응식:
단계 A: 다이아민 2,2'-(에틸아민)은 무수물 및 적합한 아민, 예컨대 트라이에틸아민 또는 피리딘과의 반응을 통해 tert-뷰틸옥시카바메이트(Boc)와 같은 기로 일보호되어, 목적으로 하는 INT-A1을 제공한다.
단계 B: 일-보호된 INT-A1은 염기의 존재 하에 (필요하다면, 낮은 반응성 또는 아민염의 경우에) 제한된 양(0.4 내지 0.45당량)의 1,4-다이아이소사이아네이토부탄과 반응되어 이량체 INT-A2를 수득하였다.
단계 C: Boc 보호기의 제거는 트라이플루오로아세트산 또는 다른 양성자산, 예컨대 염산 또는 황산에 의해 용이하게 된다. 최종 생성물 다이아민 INT-A3은 염으로서 단리되거나 또는 중화되어 유리 염기를 제공할 수 있다.
THIQ
이량체
생성물의 합성을 위한 일반적 반응식:
염화설폰일 INT-S9 및 아화학량론적 양(0.4 내지 0.45당량)의 다이아민 링커는 트라이메틸아민, 피리딘 등과 같은 염기의 존재 하에 함께 반응되어 구조 (I)의 화합물을 제공한다.
다음의 실시예는 염화설폰일 INT-S9 및 적절한 링커 다이아민 INT-RL4, INT-SL4, INT-PL1 또는 INT-A3으로부터 제조한다.
실시예
1
: N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드].
실시예
2
: N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드].
실시예
3
: N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드].
실시예
4
: N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드].
실시예
5
: N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드].
실시예
6
: N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[5-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드].
실시예
7
: N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[5-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드].
단계 A: 퍼지하고 질소의 비활성 분위기로 유지한 1000㎖ 둥근-바닥 플라스크에 3-메톡시-4-메틸벤조산(20g, 120.36m㏖, 1당량), N,N -다이메틸폼아마이드(200㎖), N,O -다이메틸하이드록실아민 하이드로클로라이드(17.6g, 180.43m㏖, 1.50당량), iPr2EtN(100㎖, 5.00당량)을 넣고 몇몇 배취에서 HATU(34.3g, 90.21m㏖, 1.50당량)를 첨가하였다. 얻어진 용액 밤새 실온에서 교반시켰다. 얻어진 용액을 3×200㎖의 에틸 아세테이트로 추출하고 나서, 유기층을 합하고, 5×200㎖의 염수로 세척하고 나서, Na2SO4로 건조시키고, 여과 후, 농축시켰다. 고체를 오븐에서 감압 하에 건조시켰다. 잔사를 1:1 에틸 아세테이트/헥산을 이용하는 실리카겔 상에 적용하여 무색 액체로서 24g(95%)의 N,3-다이메톡시-N,4-다이메틸벤즈아마이드를 제공하였다.
단계 B: 퍼지하고 질소의 비활성 분위기로 유지한 500㎖ 둥근-바닥 플라스크에 N,3-다이메톡시-N,4-다이메틸벤즈아마이드(24g, 114.70m㏖, 1.00당량), THF(240㎖)를 넣은 다음에 0℃에서 1시간 내에 교반시키면서 CH3MgBr(THF 중의 3 M, 95㎖, 2.50당량)을 적가하였다. 얻어진 용액을 1시간 동안 0℃에서 얼음/염 욕에서 교반시켰다. 반응물을 NH4Cl의 첨가에 의해 반응을 퀀칭시키고 나서, 3×200㎖의 에틸 아세테이트로 추출하였다. 유기층을 합하고 나서, 1×200㎖의 염수로 세척하고, Na2SO4로 건조시키고, 여과 후, 농축시켰다. 고체를 오븐에서 감압 하에 건조시켰다. 잔사를 에틸 아세테이트/헥산(1/10)을 이용하는 실리카겔 칼럼 상에 적용하여 무색의 액체로서 18.55g(98%)의 1-(3-메톡시-4-메틸페닐)에탄-1-온을 제공하였다.
단계 C: 퍼지하고 질소의 비활성 분위기로 유지한 1000㎖ 둥근-바닥 플라스크에 1-(3-메톡시-4-메틸페닐)에탄-1-온(18.55g, 112.97m㏖, 1.00당량), 다이클로로메탄(200㎖), 메탄올(200㎖) 및 트라이메틸페닐암모늄 트라이브로마이드(44.6g, 1.05당량)를 넣었다. 얻어진 용액 2시간 동안 실온에서 교반시켰다. 물의 첨가에 의해 반응을 퀀칭시키고 나서, 3×500㎖의 에틸 아세테이트로 추출하였다. 유기층을 합하고 나서, 1×200㎖의 염수로 세척하고, Na2SO4로 건조시키고, 여과 후, 농축시켰다. 고체를 오븐에서 감압 하에 건조시켰다. 잔사를 에틸 아세테이트/헥산(1/9)을 이용하는 실리카겔 칼럼 상에 적용하여 백색 고체로서 27.46g(100%)의 2-브로모-1-(3-메톡시-4-메틸페닐)에탄-1-온을 제공하였다.
단계 D: 퍼지하고 질소의 비활성 분위기로 유지한 1000㎖ 둥근-바닥 플라스크에 2-브로모-1-(3-메톡시-4-메틸페닐)에탄-1-온(27.46g, 112.96m㏖, 1.00당량), CH3CN(300㎖), [(2-브로모-4-클로로페닐)메틸](메틸)아민(26.75g, 114.06m㏖, 1.01당량) 및 탄산칼륨(39g, 282.18m㏖, 2.50당량)을 넣었다. 얻어진 용액을 밤새 40℃에서 오일욕에서 교반시켰다. 얻어진 혼합물을 진공 하에 농축시켜, 잔사를 에틸 아세테이트/헥산(1/4)을 이용하는 실리카겔 칼럼 상에 적용하였다. 이는 백색 고체로서 39g(87%)의 2-[[(2-브로모-4-클로로페닐)메틸](메틸)아미노]-1-(3-메톡시-4-메틸페닐)에탄-1-온을 초래하였다.
단계 E: 퍼지하고 질소의 비활성 분위기로 유지한 1-L 둥근 바닥 플라스크에 2-[[(2-브로모-4-클로로페닐)메틸](메틸)아미노]-1-(3-메톡시-4-메틸페닐)에탄-1-온(39g, 98.31m㏖, 1.00당량) 및 에탄올(400㎖)을 넣은 다음 몇몇 배취에서 0℃에서 35분에 걸쳐 NaBH4(3.7g, 97.81m㏖, 1.00당량)를 넣었다. 얻어진 용액을 2시간 동안 25℃에서 오일욕에서 교반시켰다. 물의 첨가에 의해 반응을 퀀칭시키고 나서, 슬러리를 진공 하에 농축시켰다. 얻어진 슬러리를 3×200㎖의 에틸 아세테이트로 추출하고 나서, 유기층을 합하고 나서, Na2SO4로 건조시키고, 여과 후, 진공 하에 농축시켰다. 잔사를 에틸 아세테이트/헥산(1/2)을 이용하는 실리카겔 칼럼 상에 적용하여 백색 고체로서 32g(82%)의 2-[[(2-브로모-4-클로로페닐)메틸](메틸)아미노]-1-(3-메톡시-4-메틸페닐)에탄-1-올을 제공하였다.
단계 F: 퍼지하고 질소의 비활성 분위기로 유지한 250㎖의 둥근 바닥 플라스크에 2-[[(2-브로모-4-클로로페닐)메틸](메틸)아미노]-1-(3-메톡시-4-메틸페닐)에탄-1-올(12g, 30.10m㏖, 1.00당량) 및 ClCH2CH2Cl(DCE, 250㎖) 다음에 AlCl3(20g, 5.00당량)을 실온에서 넣었다. 30분 후에 실온에서, 얻어진 용액을 CH2Cl2로 희석시키고 나서, 탄산칼륨을 이용하여 용액의 pH를 9 내지 10으로 조절하였다. 얻어진 용액을 에틸 아세테이트로 추출하고 나서, 유기층을 합하고, Na2SO4로 건조시키고 나서, 여과 후, 진공 하에 농축시켰다. 잔사를 에틸 아세테이트/헥산(1/10)을 이용하는 실리카겔 칼럼 상에 적용하여 황색 오일로서 10g (87%)의 8-브로모-6-클로로-4-(3-메톡시-4-메틸페닐)-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린을 제공하였다.
단계 G: 퍼지하고 질소의 비활성 분위기로 유지한 25㎖의 둥근 바닥 플라스크에 5-(8-브로모-6-클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸페놀(700㎎, 1.91m㏖, 1.00당량), 테트라하이드로퓨란(8㎖), K3PO4(1.56g, 7.35m㏖, 4.00당량), CH3B(OH)2(166㎎, 1.50당량), PPh3(96.3㎎, 0.37m㏖, 0.20당량) 및 Pd(OAc)2(41.37㎎, 0.18m㏖, 0.10당량)를 넣었다. 얻어진 용액을 밤새 80℃에서 오일욕에서 교반시켰다. 슬러리를 에틸 아세테이트로 추출하고, 유기층을 합하고 나서, 염수로 세척하고, Na2SO4로 건조시키고 나서, 여과 후, 진공 하에 농축시켰다. 고체를 오븐에서 감압 하에 건조시켰다. 잔사를 에틸 아세테이트/헥산(1/1)을 이용하는 실리카겔 칼럼 상에 적용하여 백색 고체로서 520㎎(90%)의 5-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸페놀을 제공하였다.
단계 H: 퍼지하고 질소의 비활성 분위기로 유지한 100㎖의 둥근 바닥 플라스크에 6-클로로-4-(3-메톡시-4-메틸페닐)-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린(2.6g, 8.23m㏖, 1.00당량), 톨루엔(26㎖) 및 AlCl3(3.3g)를 넣었다. 얻어진 용액을 오일욕에서 6시간 동안 100℃에서 교반시켰다. 반응 혼합물을 수욕을 이용하여 실온으로 냉각시키고, 100㎖의 CH2Cl2로 희석시킨 후에, 200㎖의 포화 탄산칼륨의 첨가에 의해 퀀칭시켰다. 얻어진 슬러리를 3×200㎖의 에틸 아세테이트로 추출하고 나서, 유기층을 합하고, Na2SO4로 건조시키고 나서, 여과 후, 진공 하에 농축시켰다. 잔사를 에틸 아세테이트/석유 에터(1:1)를 이용하는 실리카겔 상에 적용하여 갈색 고체로서 2.2g(89%)의 5-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸페놀을 제공하였다.
단계 I: 퍼지하고 질소의 비활성 분위기로 유지한 100㎖의 둥근 바닥 플라스크에 5-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸페놀(740㎎, 2.45m㏖, 1.00당량), 다이클로로메탄(25㎖), 트라이에틸아민(1.02㎖, 3.00당량), 4-다이메틸아미노피리딘(30㎎, 0.25m㏖, 0.10당량) 및 1,1,1-트라이플루오로-N-페닐-N-(트라이플루오로메탄)설폰일메탄설폰아마이드(1.75g, 4.90m㏖, 2.00당량)를 넣었다. 얻어진 용액 2시간 동안 실온에서 교반시켰다. 얻어진 혼합물을 진공 하에 농축시키고 나서, 잔사를 에틸 아세테이트/석유 에터(1/2)를 이용하는 실리카겔 칼럼 상에 적용하여 황색 오일로서 1.06g(100%)의 5-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸페닐 트라이플루오로메탄설포네이트를 제공하였다.
단계 J: 퍼지하고 질소의 비활성 분위기로 유지한 50㎖의 둥근 바닥 플라스크에 5-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸페닐 트라이플루오로메탄 설포네이트(1.06g, 2.44m㏖, 1.00당량), BnSH(0.57㎖, 2.00당량), 다이아이소프로필에틸아민(0.8㎖, 2.00당량), 다이옥산(10㎖), 잔포스(170㎎, 0.29m㏖, 0.06당량) 및 Pd2(dba)3·CHCl3(152㎎, 0.06당량)을 넣었다. 얻어진 용액을 밤새 100℃에서 오일욕에서 교반시켰다. 반응 혼합물을 냉각시키고 나서, 3×100㎖의 에틸 아세테이트로 추출하였다. 유기층을 합하고 나서, 1x100㎖의 염수로 세척하고, Na2SO4로 건조시키고 나서, 여과 후, 진공 하에 농축시켰다. 잔사를 에틸 아세테이트/석유 에터(1/5)를 이용하는 실리카겔 상에 적용하여 황색 오일로서 0.31g(31%)의 4-[3-(벤질설판일)-4-메틸페닐]-6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린을 제공하였다.
단계 K: 퍼지하고 질소의 비활성 분위기로 유지한 8㎖의 둥근 바닥 플라스크에 4-[3-(벤질설판일)-4-메틸페닐]-6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린(310㎎, 0.76m㏖, 1.00당량), AcOH(1.55㎖) 및 물(0.041㎖)을 넣은 다음에 몇몇 배취에서 NCS(304㎎, 2.28m㏖, 3.00당량)를 넣었다. 얻어진 용액을 1시간 동안 실온에서 교반시켰다. 슬러리를 100㎖의 에틸 아세테이트로 희석시키고 나서, 3×100㎖의 차가운 H2O 및 3×100㎖의 차가운 염수로 세척하였다. 혼합물을 Na2SO4로 건조시키고 나서, 여과 후, 진공 하에 농축시켰다. 이는 황색 오일로서 384㎎(조질)의 5-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠-1-염화설폰일을 초래하였다.
단계 L: 퍼지하고 질소의 비활성 분위기로 유지한 8㎖의 둥근 바닥 플라스크에 3-[2-[2-(2-아미노에톡시)에톡시]에틸]-1-[4-[([2-[2-(2-아미노에톡시)에톡시]에틸]카바모일) 아미노]뷰틸]유레아(114㎎, 0.26m㏖, 1.00당량), 다이클로로메탄(1.5㎖), 트라이에틸아민(49㎎, 0.48m㏖, 1.87당량), 및 다이클로로메탄(1.5㎖) 중의 5-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠-1-염화설폰일(200㎎, 0.52m㏖, 2.00당량) 용액을 넣었다. 얻어진 용액 밤새 실온에서 교반시켰다. 반응 슬러리를 진공 하에 농축시켰다. 조질의 생성물을 다음의 조건을 이용하는 분취-HPLC에 의해 정제하였다: 칼럼, 엑스브리지 쉴드(XBridge Shield) RP18 OBD 칼럼, 5㎛, 19*150㎜; 이동상, 물(0.05%NH3H2O) 및 CH3CN(10분 내에 48.0% CH3CN 내지 65.0%); 검출기, UV 254㎚. 이는 백색 고체로서 51㎎(17%)의 표제 화합물(실시예 7)을 초래하였다. LC-MS (ES, m/z) [M+1]: 1132. 1H NMR (300 MHz, 메탄올-d4) δ 7.66 (s, 2H), 7.30 (d, J = 1.2 Hz, 4H), 7.03(d, J = 2.1 Hz, 2H), 6.58 (d, J = 1.5 Hz, 2H), 4.30 (t, J = 7.1 Hz, 2H), 3.71 (d, J = 15.7 Hz, 2H), 3.55 - 3.31 (m, 19H), 3.24 (t, J = 5.4 Hz, 4H), 3.03(dt, J = 18.6, 5.3 Hz, 11H), 2.59 (s, 8H), 2.44 (s, 6H), 2.23(s, 6H), 1.49 - 1.39 (m, 4H).
실시예
8
: N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스(5-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드).
메틸화(스즈키(Suzuki)) 조건을 대신하는 이하의 사이안화 절차를 제외하고 실시예 7과 동일한 경로를 통해 표제 화합물을 제조하였다. 사이안화 절차: 퍼지하고 질소의 비활성 분위기로 유지한 50㎖의 둥근 바닥 플라스크에 5-(8-브로모-6-클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸페놀(700㎎, 1.91m㏖, 1.00당량), NMP (7㎖), Zn(CN)2(110㎎, 0.50당량) 및 Pd(PPh3)4(450㎎, 0.39m㏖, 0.20당량)를 넣었다. 얻어진 용액을 밤새 100℃에서 오일욕에서 교반시켰다. 슬러리를 3×100㎖의 에틸 아세테이트로 추출하고 나서, 유기층을 합하고, 3×100㎖의 염수로 세척하고 나서, Na2SO4로 건조시키고, 여과 후, 진공 하에 농축시켰다. 잔사를 에틸 아세테이트/석유 에터(1/1)를 이용하는 실리카겔 칼럼 상에 적용하여 황색 오일로서 400㎎(67%)의 6-클로로-4-(3-하이드록시-4-메틸페닐)-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-8-카보나이트릴을 제공하였다.
LCMS (ES, m/z) [M+1]: 1155. 1H NMR (300 MHz, DMSO-d6) δ 7.91 (d, J = 2.2 Hz, 2H), 7.75 (d, J = 5.9 Hz, 2H), 7.65 (s, 2H), 7.39 - 7.26 (m, 4H), 7.20 (d, J = 2.2 Hz, 2H), 5.89 (t, J = 5.7 Hz, 2H), 5.76 (t, J = 5.8 Hz, 2H), 4.37 (t, J = 5.3 Hz, 2H), 3.83(d, J = 16.1 Hz, 2H), 3.64 (d, J = 16.2 Hz, 2H), 3.45 - 3.30 (m, 8H), 3.29 (d, J = 6.2 Hz, 4H), 3.10 (q, J = 5.8 Hz, 4H), 2.98 - 2.81 (m, 11H), 2.64 (dd, J = 11.7, 5.9 Hz, 2H), 2.52(s, 6H), 2.37 (s, 5H), 2.07 (s, 3H), 1.35 - 1.20 (m, 4H).
실시예
9
: N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드].
실시예
10
: N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드].
실시예
11
: N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드].
실시예
12
: N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드].
실시예
13
: N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드].
실시예
14
: N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드].
실시예
15
: N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드].
실시예
16
: N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드].
실시예
17
: N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드].
실시예
18:
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[5-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드].
실시예
19:
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[5-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드].
퍼지하고 질소의 비활성 분위기로 유지한 25㎖ 둥근-바닥 플라스크에 3-(2-[2-[(3S)-3-아미노피롤리딘-1-일]에톡시]에틸)-1-(4-[[(2-[2-[(3S)-3-아미노피롤리딘-1-일] 에톡시]에틸)카바모일]아미노]뷰틸)유레아(150㎎, 0.31m㏖, 1.00당량), CH2Cl2(4㎖) 및 트라이에틸아민(58.32㎎, 0.58m㏖, 1.87당량)을 넣고 나서, 다이클로로메탄(4㎖) 중의 5-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠-1-염화설폰일(237㎎, 0.62m㏖, 2.00당량) 용액을 교반시키면서 적가하였다. 얻어진 용액 밤새 실온에서 교반시켰다. 슬러리를 진공 하에 농축시켰다. 조질의 생성물을 다음의 조건을 이용하여 분취-HPLC에 의해 정제하였다: 칼럼, 엑스브리지 쉴드 RP18 OBD 칼럼, 5㎛, 19*150㎜; 이동상, 물(0.05% NH3H2O) 및 CH3CN(8분 내에 48.0% CH3CN 내지 66.0%); 검출기, UV 254㎚. 이는 백색 고체로서 28.6㎎(8%)의 표제 화합물을 초래하였다. LCMS (ES, m/z) [M+1]: 1184. 1H NMR (400 MHz, 메탄올-d 4) δ 1.44 - 1.60 (m, 6H), 1.85 - 2.02(m, 2H), 2.28 (s, 6H), 2.40 (td, J = 10.3, 5.3 Hz, 2H), 2.49 (d, J = 1.2 Hz, 8H), 2.54 - 2.72(m, 16H), 3.06 (dt, J = 9.8, 4.4 Hz, 2H), 3.14 (d, J = 6.5 Hz, 4H), 3.33(p, J = 1.7 Hz, 4H), 3.42 - 3.59 (m, 10H), 3.63 - 3.81 (m, 4H), 4.27 - 4.52(m, 2H), 6.62(d, J = 7.0 Hz, 2H), 7.08 (d, J = 2.1 Hz, 2H), 7.33 - 7.43(m, 4H), 7.69 (d, J = 1.7 Hz, 2H).
실시예
20
: N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[5-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드].
실시예 8 및 19로부터의 방법 및 중간체를 이용하여 실시예 20을 제조하였다. LCMS (ES, m/z) [M+1]: 1205. 1H NMR (300 MHz, 메탄올-d4) δ 7.73(d, J = 15.7 Hz, 4H), 7.40 (s, 4H), 7.16 (s, 2H), 4.40 (s, 2H), 3.87 (s, 4H), 3.72(s, 3H), 3.51 (d, J = 18.5 Hz, 10H), 3.29 (s, 3H), 3.14 (s, 2H), 2.75 (s, 1H), 2.65 (s, 9H), 2.52(s, 7H), 2.42(d, J = 5.1 Hz, 1H), 1.97 (s, 2H), 1.51 (s, 7H), 1.32(s, 1H).
실시예
21
: N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드].
실시예
22
: N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드].
실시예
23
: N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드].
실시예
24
: N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드].
실시예
25
: N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드].
실시예
26
: N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드].
실시예
27
: N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드].
실시예
28
: N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드].
실시예 29 : N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드].
실시예
30
: N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[5-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드].
실시예
31
: N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[5-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드].
실시예
32
: N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[5-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드].
실시예
33
: N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드].
실시예
34
: N,N
'-[(
3R,3'R
)-(7,14-
다이옥소
-3,18-
다이옥사
-6,8,13,15-
테트
라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드].
실시예
35
: N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드].
실시예
36
: N,N'-[(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피페리딘-1,4-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드].
실시예
37
: N,N'-[(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피페리딘-1,4-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드].
N
-
아실설폰아마이드
이량체
생성물의 합성을 위한 일반 반응식:
앞서 기재한 염화설폰일 INT-S9로 시작해서, 1차 설폰아마이드 INT-AS1은 수산화암모늄, 메탄올 중의 암모니아 등의 사용을 통한 암모니아 동등물과의 반응으로부터 형성된다. 후속적으로, 보호된 아미노산을 포함하는 카복실산 동등물은 산 염화물(염화옥살릴, 염화티오닐 등을 이용) 또는 활성화된 에스터(결합 시약, 예컨대 CDI, HATU, EDC, DCC, DIC 등을 이용)의 형성을 통해 활성화된다. 이어서, 이들 활성화된기는 단계 B에서 설폰아마이드 INT-AS1로 처리되어 N-아실설폰아마이드 INT-AS2를 제공한다. 보호기 PG는 Boc의 경우에 TFA 또는 HCl과 같은 적합한 조건을 통해 또는 트라이플루오로아세트아마이드의 경우에 NaOH 또는 K2CO3 또는 유사한 것을 통해 제거되어, 단계 C에서 NT-AS3을 수득한다. 최종적으로, 단계 D에서, 이량체 생성물은 1,4-다이아이소사이아네이토부탄 또는 다른 대칭적 활성 시약에 의한 아민 INT-AS3의 처리를 통해 형성되어 구조(II)의 화합물을 제공한다.
다음의 실시예를 구조(II)의 화합물의 제조를 위한 일반 반응식에 따라 제조한다.
실시예
38
: 1,1'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[N-([3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)페닐]설폰일)폼아마이드].
실시예
39
: 1,1'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[N-([3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)페닐]설폰일)폼아마이드].
실시예
40
: 1,1'-(5,12-다이옥소-4,6,11,13-테트라아자헥사데칸-1,16-다이일)비스[N-([3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)페닐]설폰일)피페리딘-4-카복사마이드].
실시예
41
: 1,1'-(5,12-다이옥소-4,6,11,13-테트라아자헥사데칸-1,16-다이일)비스[N-([3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)페닐]설폰일)피페리딘-3-카복사마이드].
실시예
42
: N
1
,N
18
-비스([3-(6,8-다이클로로-2-다이메틸-1,2,3,4-
테트라하이드로아이소퀴놀린-
4-일)페닐]설폰일)-6,13-다이옥소-5,7,12,14-
테트라아자옥타데칸다이아마이드
.
아마이드
링커
이량체
생성물의 합성을 위한 일반 반응식:
구조(III)의 화합물의 합성을 위한 일반 반응식에 따라, 앞서 기재한 염화설폰일 INT-S9를 트라이에틸아민, 피리딘, 탄산나트륨 또는 탄산칼륨 등과 같은 염기의 존재 하에 일-보호된 다이아민 기질(비고리 또는 비환식)과 합하여서, 설폰아마이드 INT-AM1을 수득하였다. 보호기 PG를 Boc 기에 대해 트라이플루오로아세트산 또는 염산 또는 트라이플루오로아세트아마이드에 대해 메탄올 중에서 수산화나트륨 또는 탄산나트륨과 같은 적절한 조건으로 제거한다. 얻은 아민(INT-AM2)을 염화옥살릴 또는 염화티오닐에 의한 산 염화물 형성을 통해 또는 결합 시약, 예컨대 EDC, CDI, DCC, HATU 등을 통해 가리움된 반응성 작용기를 갖는 아미노산 또는 다른 기질과 반응시켜 아마이드 INT-AM3을 수득하였다. Boc 기에 대해 트라이플루오로아세트산 또는 염산 또는 트라이플루오르아세트아마이드에 대해 메탄올 중에서 수산화나트륨 또는 탄산나트륨과 같은 적절한 조건에 의한 보호기 PG의 제거로 단계 D에서 목적으로 하는 아민 INT-AM4를 수득한다. 필요하다면 트라이에틸아민 또는 피리딘 또는 카보네이트와 같은 아민 염기를 포함하는 염기의 존재 하에 적절한 이작용성 "코어" 분자, 예컨대 1,1'-카보닐다이이미다졸 또는 1,4-다이아이소사이아네이토부탄에 의한 이량체화는 구조(III)의 화합물을 제공한다.
적절한 설폰아마이드 INT-S9, 일-보호된 다이아민, 예컨대 (R) 및 (S)-1-Boc-3-아미노피롤리딘 또는 1-Boc-4-아미노피페리딘, 보호된 아미노산, 및 코어 2작용성 화합물을 이용하여 구조(III)의 화합물에 대한 일반 반응식을 통해 다음의 실시예를 합성한다.
실시예
43
: N,N'-[(3S,3'S)-(6,13-다이옥소-5,7,12,14-테트라아자옥타데칸다이오일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드].
실시예
44
: N,N'-[(3S,3'S)-(6,13-다이옥소-5,7,12,14-
테트라아자옥타데칸다이오일
)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-8-사이아노-2-
메틸
-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드].
실시예
45
: N,N'-[(6,13-다이옥소-5,7,12,14-테트라아자옥타데칸다이오일)비스(피페리딘-1,4-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드].
실시예
46
: N,N'-[(6,13-다이옥소-5,7,12,14-
테트라아자옥타데칸다이오일
)비스(피페리딘-1,4-다이일)]비스[3-(6-클로로-8-사이아노-2-
메틸
-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드].
같은자리
다이메틸
링커
이량체
생성물의 합성을 위한 반응식:
단계 A: 퍼지하고 질소의 비활성 분위기로 유지한 100㎖의 3구 둥근 바닥 플라스크에 메틸 3-하이드록시-2,2-다이메틸프로파노에이트(1.32g, 10m㏖, 1당량), CH2Cl2(40㎖) 및 2,6-루티딘(1.6g, 15m㏖, 1.5당량)을 첨가하였다. 이 다음에 트라이플릭 무수물(Tf2O, 3.39g, 12m㏖, 1.2당량)을 -78℃에서 적가하였다. 얻어진 용액을 15분 동안 -78℃에서 교반시키고, 이어서, 3시간에 걸쳐 실온으로 점진적으로 가온시켰다. 얻어진 용액을 100㎖의 에틸 아세테이트로 희석시키고 나서, 1×50㎖의 물, 2 x 40㎖의 2M 염화수소 및 2 x 40㎖의 염수로 순차적으로 세척하였다. 혼합물을 무수 황산나트륨으로 건조시키고 나서, 여과 후, 진공 하에 농축시켰다. 이는 갈색 오일로서 2.64g(100% 조질)의 메틸 2,2-다이메틸-3-[(트라이플루오로메탄)설폰일옥시]프로파노에이트 INT-G1을 초래하였다.
단계 B: 100㎖ 둥근 바닥 플라스크에 트라이플레이트 INT-G1(2.64g, 10m㏖, 2당량), 2-(2-아지도에톡시)에탄-1-올(INT-Y1, 650㎎, 5m㏖, 1당량) 및 DMF(40㎖)를 첨가하였다. 이 다음에 0℃에서 몇 부분으로 수소화나트륨(오일 중에서 60%, 400㎎, 10m㏖, 2당량)을 첨가하였다. 얻어진 슬러리를 14시간 동안 실온에서 교반시켰다. 반응물을 100㎖의 물의 느린 첨가에 의해 퀀칭시키고 나서, 3×50㎖의 에틸 아세테이트로 추출하였다. 합한 유기층을 1×100㎖의 물 및 1×100㎖의 염수로 세척하고 나서, 무수 황산나트륨으로 건조시키고, 여과 후, 진공 하에 농축시켰다. 이는 갈색 오일로서 1.23g(100% 조질)의 메틸 3-[2-(2-아지도에톡시)에톡시]-2,2-다이메틸프로파노에이트(INT-G2)를 초래하였다.
단계 C: 100㎖ 둥근 바닥 플라스크에 에스터 INT-G2(3.68g, 15m㏖, 1당량), 테트라하이드로퓨란(30㎖) 및 물(20㎖)을 첨가하였다. 이 다음에 실온에서 LiOH-H2O(1.26g, 30m㏖, 2당량)을 몇 부분으로 첨가하였다. 얻어진 용액을 4시간 동안 50℃에서 교반시켰다. 반응 혼합물을 실온으로 냉각시키고 나서 물로 희석시켰다. 휘발성 물질을 진공 하에 제거하고 나서, 얻어진 혼합물을 2×30㎖의 석유 에터로 세척하였다. 3M 수성 염산을 이용하여 수층의 pH를 1 내지 2로 조절하고 나서, 3 x 40㎖의 CH2Cl2로 추출하였다. 합한 유기층을 1×50㎖의 물 및 1×50㎖의 염수로 세척하고 나서, 무수 황산나트륨으로 건조시키고, 여과 후, 진공 하에 농축시켰다. 이는 밝은 황색 오일로서 2.4g(69% 조질)의 3-[2-(2-아지도에톡시)에톡시]-2,2-다이메틸프로판산(INT-G3)을 초래하였다.
단계 D: 100㎖ 둥근 바닥 플라스크에 카복실산 INT-G3(2.4g, 10.4m㏖, 1당량), 톨루엔(30㎖) 및 트라이에틸아민(2.1g, 20.8m㏖, 2당량)을 첨가하였다. 이 다음에 실온에서 교반시키면서 DPPA(4.1g, 14.9m㏖, 1.5당량)를 적가하였다. 얻어진 용액을 1시간 동안 실온에서 교반시켰다. 물(10㎖)을 첨가하고 나서, 얻어진 슬러리를 추가 14시간 동안 환류에서 반응시켰다. 얻어진 용액을 40㎖의 물 및 염산(3M(aq), 20㎖)으로 희석시켰다. 얻어진 혼합물을 1×50㎖의 석유 에터로 세척하였다. 수산화나트륨을 이용하여 수층의 pH 값을 13 내지 14로 조절하고, 3×50㎖의 CH2Cl2로 추출하였다. 합한 유기층을 1×50㎖의 물 및 1×50㎖의 염수로 세척하고 나서, 무수 황산나트륨으로 건조시키고, 여과 후, 진공 하에 농축시켰다. 이는 밝은 황색 오일로서 1.5g(71% 조질)의 1-(2-아미노-2-메틸프로폭시)-2-(2-아지도에톡시)에탄(INT-G4)을 초래하였다.
단계 E: 50㎖ 둥근-바닥 플라스크에 아민 INT-G4(202㎎, 1m㏖, 2당량), CH2Cl2(20㎖) 및 트라이에틸아민(102㎎, 1m㏖, 2당량)을 첨가하였다. 이 다음에 3-[(4S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]벤젠-1-염화설폰일 하이드로클로라이드(Charmont et al, WO 2010078449, 210㎎, 0.5m㏖, 0.5당량)를 몇 부분으로 실온에서 첨가하였다. 얻어진 용액 밤새 실온에서 교반시켰다. 얻어진 혼합물을 진공 하에 농축시켰다. 잔사를 에틸 아세테이트/석유 에터(1:2-2:1)를 이용하는 실리카겔 칼럼 상에 적용하여 황색 오일로서 180㎎(66%)의 (4S)-4-[3-([1-[2-(2-아지도에톡시)에톡시]-2-메틸프로판-2-일]설파모일)페닐]-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린(INT-G5)을 제공하였다.
단계 F: 100㎖ 둥근-바닥 플라스크에 아자이드 INT-G5 (300㎎, 0.54m㏖, 1당량), 메탄올(50㎖), 및 탄소 상 팔라듐(30 mg)을 첨가하였다. 상기에 H2(g)를 도입하였다. 얻어진 용액을 3시간 동안 실온에서 격렬하게 교반시켰다. 고체를 여과에 의해 제거하고 나서, 여과액을 진공 하에 농축시켰다. 잔사를 CH2Cl2/메탄올(10:1)을 이용하는 실리카겔 칼럼 상에 적용하여 백색 고체로서 120㎎(42%)의 N-[1-[2-(2-아미노에톡시)에톡시]-2-메틸프로판-2-일]-3-[(4S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]벤젠-1-설폰아마이드(INT-G6)를 제공하였다.
단계 G: To a 100㎖ 둥근-바닥 플라스크에 아민 INT-G6(120㎎, 0.23m㏖, 1당량), DMF (4.8㎖), 1,4-다이아이소사이아네이토부탄(5.8㎎, 0.04m㏖, 0.50당량)을 첨가하였다. 얻어진 용액을 하룻밤 40℃에서 교반시켰다. 고체를 여과시키고 나서, 조질의 생성물을 다음의 조건을 이용하는 분취-HPLC에 의해 정제하였다: 칼럼, 엑스브리지 분취 C18 OBD 칼럼, 19*150㎜; 5㎛; 이동상, 물(10m㏖/ℓ NH4HCO3) 및 ACN(8분 내에 55.0% ACN 내지 95.0%); 검출기, UV 254㎚.
실시예
47
: 3-(2-[2-[2-([3-[(4S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]벤젠]설폰아미도)-2-메틸프로폭시]에톡시]에틸)-1-(4-[[(2-[2-[2-([3-[(4S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]벤젠]설폰아미도)-2-메틸프로폭시]에톡시]에틸)카바모일]아미노]뷰틸)유레아.
단계 A 내지 G는 백색 고체로서 39㎎(14%)의 표제 화합물을 초래하였다. MS (m/ z): 1201.05 [M+H]+. 1H NMR (메탄올-d4, 400 MHz) δ 7.87 - 7.80 (m, 2H), 7.68 (s, 2H), 7.57 - 7.50 (m, 4H), 7.37 (s, 2H), 6.78 (s, 2H), 4.42(t, J = 6.8 Hz, 2H), 3.73(AB q, J = 16.0 Hz, 4H), 3.60 -3.48 (m, 12H), 3.32 - 3.28 (m, 8H), 3.14 - 3.04 (m, 6H), 2.67 (dd, J = 11.6 Hz, 8.0 Hz, 2H), 2.53(s, 6H), 1.47 (s, 4H), 1.11 (d, J = 8.4 Hz, 12H).
아미노알코올 링커
이량체
생성물의 합성을 위한 대표적인 반응식:
단계 A: 250㎖ 둥근 바닥 플라스크에 tert-뷰틸 4-하이드록시피페리딘-1-카복실레이트(564.2㎎, 2.80m㏖, 1당량), DMF(100㎖) 및 INT-Y2(750㎎, 2.63m㏖, 1.1당량)를 첨가하였다. 이 다음에 0℃에서 몇몇 배취에서 60 % 수소화나트륨(260㎎, 6.5m㏖, 2.5당량)을 첨가하였다. 얻어진 용액을 3시간 동안 30℃에서 교반시켰다. 이어서, 반응물을 50㎖의 물의 첨가에 의해 퀀칭시키고 나서, 3×100㎖의 에틸 아세테이트로 추출하였다. 합한 유기층을 3×150㎖의 염수로 세척하고 나서, 무수 황산나트륨으로 건조시키고, 진공 하에 농축시켰다. 이는 무색 오일로서 800㎎(조질)의 tert-뷰틸 4-[2-(2-아지도에톡시)에톡시]피페리딘-1-카복실레이트(INT-AA1)를 초래하였다.
단계 B: 100㎖ 둥근-바닥 플라스크에 INT-AA1(800㎎, 2.54m㏖, 1당량), CH2Cl2(100㎖) 및 트라이플루오로아세트산(10㎖)을 첨가하였다. 얻어진 용액을 30분 동안 실온에서 교반시켰다. 포화 수성 탄산칼륨을 이용하여 용액의 pH를 14로 조절하였고, 3×150㎖의 CH2Cl2로 추출하였다. 합한 유기층을 3×150㎖의 염수로 세척하고 나서, 무수 황산나트륨으로 건조시키고, 진공 하에 농축시켰다. 이는 무색 오일로서 350㎎(조질)의 4-[2-(2-아지도에톡시)에톡시]피페리딘(INT-AA2)을 초래하였다.
단계 C: 250㎖ 둥근 바닥 플라스크에 아민 INT-AA2(350㎎, 1.63m㏖, 2당량), 염화설폰일 INT-SM9(700㎎, 1.79m㏖, 1당량), CH2Cl2(15㎖) 및 트라이에틸아민(3㎖)을 첨가하였다. 얻어진 용액을 30분 동안 실온에서 교반시켰다. 얻어진 혼합물을 진공 하에 농축시켰다. 잔사를 에틸 아세테이트/석유 에터(1:1)를 이용하는 실리카겔 칼럼 상에 적용하여 밝은 황색 고체로서 700㎎(69%)의 (4S)-4-(3-[4-[2-(2-아지도에톡시)에톡시]피페리딘-1-설폰일]페닐)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린(INT-AA3)을 제공하였다.
단계 D: 퍼지하고 질소의 비활성 분위기로 유지한 250㎖ 둥근 바닥 플라스크에 아자이드 INT-AA3(700㎎, 1.23m㏖, 1당량), 테트라하이드로퓨란(150㎖), 물(30㎖) 및 PPh3(645.7㎎, 2.46m㏖, 2당량)을 첨가하였다. 얻어진 용액을 3시간 동안 60℃에서 교반시켰다. 이어서, 반응물을 25㎖의 물의 첨가에 의해 퀀칭시키고 나서, 3×150㎖의 CH2Cl2로 추출하였다. 합한 유기층을 3×250㎖의 염수로 세척하고 나서, 무수 황산나트륨으로 건조시키고, 진공 하에 농축시켰다. 잔사를 CH2Cl2:메탄올:트라이에틸아민(10:1:0.1)을 이용하는 실리카겔 칼럼 상에 적용하여 황색 고체로서 350㎎(52%)의 2-(2-[[1-([3-[(4S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]벤젠]설폰일)피페리딘-4-일]옥시]에톡시)에탄-1-아민(INT-AA4)을 제공하였다.
단계 E: 100㎖ 둥근-바닥 플라스크에 아민 INT-AA4(100㎎, 0.18m㏖, 1당량), DMF(30㎖) 및 1,4-다이아이소사이아네이토부탄(11㎎, 0.08m㏖, 0.45당량)을 첨가하였다. 얻어진 용액을 1시간 동안 60℃에서 교반시켰다. 고체를 여과에 의해 수집하였다. 다음의 조건을 이용하는 분취-HPLC에 의해 조질의 생성물을 정제하였다: 칼럼, 엑스브리지 C18 OBD 분취 칼럼, 19*250 ㎜; 5㎛; 이동상, 물 및 ACN(8분 내에 75.0% ACN 내지 93.0%); 검출기, UV 254㎚.
실시예 48 : 1-[2-(2-[(1-[(3-[(S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐)설폰일]피페리딘-4-일)옥시]에톡시)에틸]-3-[4-(3-[2-(2-[(1-[(3-[(S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐)설폰일]피페리딘-4-일)옥시]에톡시)에틸]유레이도)뷰틸]유레아.
단계 A 내지 E는 백색 고체로서 45.3㎎(20%)의 표제 화합물을 제공하였다. MS (m/ z): 1225.55 [M+H]+. 1H NMR (메탄올-d4, 400 MHz) δ 7.67 (t, J = 3.0 Hz, 2H), 7.62 - 7.50 (m, 6H), 7.36 (d, J = 2.8 Hz, 2H), 6.81 (s, 2H), 4.41 (d, J = 6.8 Hz, 2H), 3.70 (AB q, J = 17.2 Hz, 4H), 3.54 (t, J = 5.4 Hz, 8H), 3.49 - 3.36 (m, 7H), 3.30 - 3.20 (m, 8H), 3.10 (dd, J = 5.6, 5.6 Hz, 4H), 3.10 - 2.98 (m, 2H), 2.85 - 2.70 (m, 4H), 2.66 (dd, J = 6.4, 5.4Hz, 2H), 2.47 (s, 6H), 1.86 (t, J = 5.0 Hz, 4H), 1.62(d, J = 3.6 Hz, 4H), 1.48 (t, J = 4.2Hz, 4H), 1.31 - 1.28 (m, 1H),.
실시예 49 : 1-(2-(2-(((R)-1-((3-((S)-6,8-다이클로로-2- 메틸 -1,2,3,4-테트라하이드로아이소퀴놀린-4-일)페닐)설폰일)피롤리딘-3-일)옥시)에톡시)에틸)-3-(4-(3-(2-(2-(((R)-1-((3-((S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)페닐)설폰일)피롤리딘-3-일)옥시)에톡시)에틸)유레이도)뷰틸)유레아.
1-Boc-3-(R)-하이드록시피롤리딘으로 시작해서, 단계 A 내지 E는 조질의 생성물을 제공하였고, 이는 다음의 조건을 이용하는 분취-HPLC에 의해 정제하였다: 칼럼, 엑스브리지 분취 C18 OBD 칼럼, 5㎛,19*150㎜; 이동상, 물(10m㏖/ℓ NH4HCO3) 및 ACN(8분 내에 40.0% ACN 내지 65.0%); 검출기, UV 254㎚. 이는 백색 고체로서 25.2㎎(7%)의 표제 화합물을 초래하였다. MS (m/ z): 1197.4 [M+H]+. 1H NMR (메탄올-d4, 400 MHz) δ 7.76 - 7.75 (m, 2H), 7.61 - 7.59 (m, 6H), 7.38 (d, J = 2.0 Hz, 2H), 6.84 (s, 2H), 4.46 - 4.42(m, 2H), 4.03 - 4.02(m, 2H), 3.73(AB q, J = 6.0 Hz, 5H), 3.51 - 3.41 (m, 4H), 3.29 - 3.25 (m, 7H), 3.20 - 3.13(m, 6H), 3.05 - 3.03(m, 2H), 2.68 - 2.65 (m, 2H), 2.50 (s, 6H), 1.97 - 1.94 (m, 2H), 1.88 - 1.83(m, 2H), 1.50 - 1.47 (m, 5H), 1.37 - 1.32(m, 2H).
실시예
50
: 1-(2-[2-([(S)-1-[(3-[(S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐)설폰일]피롤리딘-3-일]옥시)에톡시]에틸)-3-(4-[3-(2-[2-([(S)-1-[(3-[(S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐)설폰일]피롤리딘-3-일]옥시)에톡시]에틸)유레이도]뷰틸)유레아.
1-Boc-3-(S)-하이드록시피롤리딘으로 시작해서, 단계 A 내지 E는 조질의 생성물을 제공하였고, 이를 다음의 조건을 이용하는 분취-HPLC에 의해 정제하였다: 칼럼, 엑스브리지 분취 C18 OBD 칼럼, 5㎛, 19*150㎜; 이동상, 물(10m㏖/ℓ NH4HCO3) 및 ACN(8분 내에 60.0% ACN 내지 80.0%); 검출기, UV 254㎚. 이는 백색 고체로서 50.4㎎(12%)의 표제 화합물을 초래하였다. MS (m/z): 1197.3 [M+H]+.
1H NMR (메탄올-d4, 400 MHz) δ 7.77 - 7.65 (m, 2H), 7.65 (s, 2H), 7.58 (d, J = 1.6 Hz, 4H), 7.38 (d, J = 2.0 Hz, 2H), 6.88 (d, J = 1.6 Hz, 2H), 4.89 - 4.43(m, 2H), 4.03 - 4.02(m, 2H), 3.72(AB q, J = 15.2 Hz, 4H), 3.46 - 3.40 (m, 13H), 3.30 - 3.24 (m, 12H), 3.16 - 3.13(m, 4H), 3.06 - 3.02(m, 2H), 2.51 (s, 6H), 2.68 (q, J = 6.4Hz, 2H), 1.96 - 1.93(m, 2H), 1.82 - 1.80 (m, 2H), 1.51 - 1.49 (m, 4H).
α-
알킬
링커
이량체
생성물의 합성을 위한 반응식:
단계 A: 250㎖ 둥근 바닥 플라스크에 염화설폰일 INT-S9M (600㎎, 1.40m㏖, 1당량), (2R)-2-아미노-3-메틸부탄-1-올(507㎎, 4.91m㏖, 3.5당량), CH2Cl2(50㎖) 및 트라이에틸아민(0.9㎖, 5당량)을 첨가하였다. 얻어진 용액을 30분 동안 실온에서 교반시켰다. 얻어진 혼합물을 진공 하에 농축시켰다. 잔사를 CH2Cl2/메탄올(25:1)을 이용하는 실리카겔 상에 적용하여 백색 고체로서 515㎎(80%)의 (2R)-S-[3-[(4S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐]-1-하이드록시-3-메틸부탄-2-설폰아미도 (INT-AA5)를 제공하였다.
단계 B: 퍼지하고 질소의 비활성 분위기에서 유지한 100㎖ 둥근-바닥 플라스크에 알코올 INT-AA5(510㎎, 1.11m㏖, 1당량), 토실레이트 INT-Y2(477㎎, 1.67m㏖, 1.5당량), DMF(20㎖) 및 95% 수소화나트륨(178㎎, 7.42m㏖, 4당량)을 첨가하였다. 얻어진 슬러리를 밤새 30℃에서 교반시켰다. 이어서, 반응물을 50㎖의 물의 첨가에 의해 퀀칭시키고 나서, 3×100㎖의 에틸 아세테이트로 추출하였다. 합한 유기층을 2×50㎖의 염수로 세척하고 나서, 진공 하에 농축시켜, 오븐에서 감압 하에 건조시켰다. 잔사를 CH2Cl2/메탄올(20:1)을 이용하는 실리카겔 상에 적용하여 황색 오일로서 283㎎(44%)의 (4S)-4-(3-[[(2R)-1-[2-(2-아지도에톡시)에톡시]-3-메틸부탄-2-일]설파모일]페닐)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린(INT-AA6)을 제공하였다.
단계 C: 250㎖ 둥근 바닥 플라스크에 아자이드 INT-AA6(270㎎, 0.47m㏖, 1당량), 테트라하이드로퓨란(54㎖), 물(7㎖) 및 트라이페닐포스핀(372㎎, 1.42m㏖, 3당량)을 첨가하였다. 얻어진 용액을 오일욕에서 2시간 동안 60℃에서 교반시켰다. 얻어진 용액을 물로 희석시키고 나서, 3×50㎖의 CH2Cl2로 추출하였다. 합한 유기층을 1×50㎖의 염수로 세척하고 나서, 무수 황산나트륨으로 건조시키고, 진공 하에 농축시켰다. 잔사를 CH2Cl2/메탄올(10:1)을 이용하는 실리카겔 상에 적용하여 황색 오일로서 156㎎(61%)의 N-[(2R)-1-[2-(2-아미노에톡시)에톡시]-3-메틸부탄-2-일]-3-[(4S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]벤젠-1-설폰아마이드(INT-AA7)를 제공하였다.
단계 D: 50㎖ 둥근-바닥 플라스크에 아민 INT-AA7(156㎎, 0.29m㏖, 1당량), DMF (7㎖) 및 1,4-다이아이소사이아네이토부탄(20㎎, 0.14m㏖, 0.5당량)을 첨가하였다. 얻어진 용액을 1시간 동안 60℃에서 오일욕에서 교반시켰다. 반응 혼합물을 진공 하에 농축시켰다.
실시예
51
: 3-[(S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]-N-[(3R,28R)-28-[(3-[(S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐)설폰아미도]-2,29-다이메틸-12,19-다이옥소-5,8,23,26-테트라옥사-11,13,18,20-테트라아자트라이아콘탄-3-일]벤젠설폰아마이드.
조질의 생성물을 다음의 조건을 이용하는 분취-HPLC에 의해 정제하였다: 칼럼, 엑스브리지 C18 OBD 분취 칼럼, 19*250 ㎜; 이동상, 물(10 mmolL/L NH4HCO3) 및 ACN(9분 내에 75.0% ACN 내지 90.0%); 검출기, UV 254㎚. 이는 백색 고체로서 31.6g(18%)의 표제 화합물을 초래하였다. MS (m/ z): 1229.55 [M+H]+. 1H NMR (CDCl3, 400 MHz) δ 7.82 - 7.67 (m, 4H), 7.50 - 7.40 (m, 4H), 7.25 (q, J = 3.4 Hz, 2H), 6.70 (q, J = 3.4 Hz, 2H), 5.95 (d, J = 3.4 Hz, 2H), 5.40 (q, J = 5.6 Hz, 2H), 5.02(s, 2H), 4.30 (s, 2H), 3.82 - 3.48 (m, 15H) 3.45 - 3.30 (m, 6H), 3.25 - 3.10 (m, 7H), 3.05 - 2.95 (m, 4H), 2.72 - 2.60 (m, 2H), 2.48 (s, 6H), 1.90 - 1.80 (m, 2H), 1.46 (s, 4H), 1.25 (s, 1H), 0.81 (q, J = 3.8 Hz, 12H).
유레아
이량체
생성물의 합성을 위한 일반 반응식:
구조(IV)의 화합물의 합성을 위한 일반 반응식에 따라, 상술된 구조, 예컨대 INT-AM2, "단량체"는 1,1'-카보닐다이이미다졸 또는 p-나이트로페닐클로로포메이트 등과의 반응을 통해 대칭적 유레아(IV)로 이량체화된다. 이 단계를 통해, 화합물, 예컨대 실시예 52 및 53이 제조된다.
실시예
52
: N,N'-(10-옥소-3,6,14,17-테트라옥사-9,11-다이아자노나데칸-1,19-다이일)비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드].
실시예
53
: N,N'-[(3S,3'S)-(7-옥소-3,11-다이옥사-6,8-다이아자트라이데칸-1,13-다이일]비스[피롤리딘-1,3-다이일))비스(3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드].
실시예 54: NHE-3 활성에 의한 세포 기반 분석(사전 인큐베이션 저해).
본래 파라다이소(Paradiso)에 의해 보고된 pH 민감 염색 방법의 변형을 이용하여 래트 및 인간 NHE-3-매개 Na+-의존적 H+ 역수송을 측정하였다(Proc. Natl. Acad. Sci. U S A. (1984) 81(23): 7436-7440). 인간 NHE3 및 NHERF2를 안정하게 발현시키는 PS120 섬유아세포를 마크 도노위츠(Mark Donowitz)(메릴랜드주 볼티모어에 소재)로부터 얻었다. 주머니쥐 신장(Opossum kidney: OK) 세포를 ATCC로부터 얻고, 그들의 지침에 따라 증식시켰다. 래트 NHE-3 유전자(젠뱅크 M85300)를 전기천공법을 통해 OK 세포 내로 도입하고 나서, 세포를 96웰 플레이트에 파종시키고 밤새 성장시켰다. 배지를 웰로부터 흡입하고, 이어서, 30분 동안 37℃에서 5μM BCECF-AM을 함유하는 NH4Cl-HEPES 완충제(20mM NH4Cl, 80mM NaCl, 50mM HEPES, 5mM KCl, 2mM CaCl2, 1mM MgCl2, pH 7.4)와 함께 인큐베이션시켰다. 세포를 무 암모늄, 무 Na+ 헤페스(HEPES)(100mM 콜린, 50mM 헤페스, 10mM 글루코스, 5mM KCl, 2mM CaCl2, 1mM MgCl2, pH 7.4)로 1회 세척하고, 10분 동안 실온에서 동일한 완충제에서 인큐베이션시켜 0 내지 30μM 시험 화합물을 이용하여 세포내 pH를 낮추었다. 인큐베이션 후에, 중성 세포내 pH의 NHE-3-매개 회수를 0.4μM 에틸 아이소프로필 아밀로라이드(EIPA, NHE-3을 저해하지 않는 NHE-1 활성의 선택적 길항제)를 함유하는 Na-HEPES 완충제의 첨가에 의해 개시하였다. λex 439 내지 505㎚에서 여기에 의해 FLIPR Tetra(등록상표)(캘리포니아주 서니베일에 소재한 몰레큘러 디바이시즈(Molecular Devices))를 이용하여, 그리고 λem 538㎚에서 BCECF 형광을 측정하여 세포내 pH의 변화를 모니터링하였다. 형광비 변화의 초기 비율을 NHE-매개 Na+/H+ 활성을 측정으로서 사용하였고, 분당 형광비 변화로서 보고하였다. 초기 비율을 평균 2 이상으로서 플롯팅하였고, 그래프패드 프리즘을 이용하여 pIC50 값을 추정하였다.
실시예 55 : NHE-3 활성의 세포 기반 분석(지속적 저해).
적용 및 세척 후에 인간 및 래트 NHE-3-매개 Na+-의존적 H+ 역수송을 저해하기 위한 화합물의 능력을 상기 기재한 pH 민감성 염료 방법의 변형을 이용하여 측정하였다. 인간 NHE3 및 NHERF2를 안정하게 발현시키는 PS120 섬유아세포를 마크 도노위츠(Mark Donowitz)(메릴랜드주 볼티모어에 소재)로부터 얻었다. 주머니쥐 신장(Opossum kidney: OK) 세포를 ATCC로부터 얻고, 그들의 지침에 따라 증식시켰다. 래트 NHE-3 유전자를 전기천공법을 통해 OK 세포 내로 도입하고 나서, 세포를 96웰 플레이트에 파종시키고 밤새 성장시켰다. 배지를 웰로부터 흡입하고 나서, 세포를 NaCl-HEPES 완충제(100mM NaCl, 50mM HEPES, 10mM 글루코스, 5mM KCl, 2mM CaCl2, 1mM MgCl2, pH 7.4)로 1회 세척하고, 이어서, 0 내지 30μM 시험 화합물을 함유하는 NaCl-헤페스 완충제를 더하였다. 실온에서 60분의 인큐베이션 후에, 시험 약물 함유 완충제를 세포로부터 흡입하였다. 흡입 후에, 세포를 약물 없이 NaCl-헤페스 완충제로 1회 세척하였고, 이어서, 5μM BCECF-AM을 함유하는 NH4Cl-헤페스 완충제(20mM NH4Cl, 80mM NaCl, 50mM HEPES, 5mM KCl, 2mM CaCl2, 1mM MgCl2, pH 7.4)로 30분 동안 37℃에서 인큐베이션시켰다. 세포를 무 암모늄, 무 Na+ 헤페스(HEPES)(100mM 콜린, 50mM 헤페스, 10mM 글루코스, 5mM KCl, 2mM CaCl2, 1mM MgCl2, pH 7.4)로 1회 세척하고, 10분 동안 실온에서 동일한 완충제에서 인큐베이션시켜 세포내 pH를 낮추었다. Na-헤페스 완충제의 첨가에 의해 중성 세포내 pH의 NHE-3-매개 회복을 개시하였다(화합물 세척 후 10분). 래트 NHE3 분석에 대해, Na-헤페스 완충제는 0.4μM 에틸 아이소프로필 아밀로라이드(EIPA, NHE-3을 저해하지 않는 NHE-1 활성의 선택적 길항제)를 함유하였다. λex 439 내지 505㎚에서 여기에 의해 FLIPR Tetra(등록상표)(캘리포니아주 서니베일에 소재한 몰레큘러 디바이시즈(Molecular Devices))를 이용하여, 그리고 λem 538㎚에서 BCECF 형광을 측정하여 세포내 pH의 변화를 모니터링하였다. 형광비 변화의 초기 비율을 NHE-매개 Na+/H+ 활성을 측정으로서 사용하였고, 분당 형광비 변화로서 보고하였다. 초기 비율을 평균 2 이상으로서 플롯팅하였고, 그래프패드 프리즘을 이용하여 pIC50 값을 추정하였다.
실시예 56: 인간 오가노이드 단일층 세포 배양물에서 정단부 산 분비의 지속된 저해
기저 배지(Basal media: BM)는 10mM 헤페스(인비트로젠(Invitrogen), 15630-080), 1:100 글루타맥스(인비트로젠, 35050-061) 및 1:100 페니실린/스트렙토마이신(인비트로젠, 15140-122)을 함유하는 진전된 DMEM/F12로 이루어졌다. 보충된 기저 배지(Supplemented basal media: SBM)는 1:100 N2(인비트로젠, 17502-048), 1:50 B27(인비트로젠, 12587-010), 1mM N-아세틸시스테인(시그마(Sigma), A9165) 및 10nM[Leu15]-가스트린 I(시그마, G9145)을 함유하였다. 사용한 성장 인자는 50ng/㎖ 마우스 EGF(페프로테크, 315-09), 100ng/㎖ 마우스 노긴(noggin)(페프로테크(Peprotech), 250-38), 500ng/㎖ 인간 R-스폰딘 1(R-spondin 1)(R&D, 4645-RS), 100ng/㎖ 마우스 Wnt-3a (R&D, 1324-WN), 20μM Y-27632(토크리스(Tocris), 1254), 10mM 니코틴아마이드(시그마, N0636), 500nM A83-01(토크리스, 2939), 10μM SB202190(토크리스, 1264)을 포함하였다. 트랜스웰은 0.4㎛ 기공 폴리에스터 막 24-웰 트랜스웰 삽입물(코닝(Corning))이었다. 배양물을 37℃에서 5% CO2 중에서 인큐베이션시켰다.
인간 회장 오가노이드를 WENRNAS(Wnt, EGF, 노긴, R-스폰딘1, 니코틴아마이드, A83-01, SB202190) 중에서 배양시키고, 전형적으로 7 내지 12일 동안 성장시킨 후 단일점 배양물을 플레이팅하는데 사용하였다. 제0일에, 매트리겔(Matrigel)에 포매된 오가노이드 배양물을 트리플 익스프레스(TrypLE Express)로 처리하여 오가노이드를 작은 조각 및/또는 단일 세포로 분해하였다. 세포를 WENRAY(Wnt, EGF, 노긴, R-스폰딘1, A83-01, Y-27632)을 함유하는 SBM에서 0.5 × 106개의 세포/㎖로 재현탁시켰다. 이 단계 후에, 200㎕의 세포 현탁액을 24-웰 트랜스웰(100,000개의 세포/웰)의 정단부측에 플레이팅하고 나서, WENRAY를 이용하여 600㎕의 SBM을 기저측부측에 첨가하였다. 회장 세포를 제3일에 ENRA(EGF, 노긴, R-스폰딘 1, A83-01)로 분화시켰다. 정단부 구획의 색은 분화 후에 NHE3 발현의 증가에 기인하여 핑크 또는 오렌지색으로부터 황색으로 바뀐다.
각각의 인간 회장 단일층 배양물 웰을 정단부를 화합물 투약 6일 전에 정단부 측 상에서 신선한 SBM으로 2회 세척하였다. 모든 화합물 저장액은 DMSO 중에 용해된 10mM이었다. 각각의 화합물 저장액을 개별적으로 신선한 SBM과 혼합하여 최종 화합물 농도 1μM에 도달하였고, 단일층(총 용적 200㎕)의 정단부 상에만 투약하였다. 동등한 농도에서 DMSO를 비히클 대조군으로서 사용하였다. 2회 중복 웰을 각각의 화합물에 대해 투약하였다. 제8일에, 정단부 배지 pH를 pH 전극에 의해 측정하여, 정단부 구획 내로의 양성자 분비를 방지함으로써 인간 단일층 배양물 내 NHE3 활성의 지속 저해를 생성하는 예시적인 화합물의 능력을 결정하였다. 각각의 예시적 화합물에 대한 각각의 2회 중복 정단부 pH 값을 DMSO 웰의 평균과 비교하였고, 정단부 산 분비의 저해%로서 표현한다.
실시예 57 : 인간 오가노이드 단일층 세포 배양물에서의 증가된 경상피 저항성
기저 배지(Basal media: BM)는 10mM 헤페스(인비트로젠(Invitrogen), 15630-080), 1:100 글루타맥스(인비트로젠, 35050-061) 및 1:100 페니실린/스트렙토마이신(인비트로젠, 15140-122)을 함유하는 진전된 DMEM/F12로 이루어졌다. 보충된 기저 배지(Supplemented basal media: SBM)는 1:100 N2(인비트로젠, 17502-048), 1:50 B27(인비트로젠, 12587-010), 1mM N-아세틸시스테인(시그마(Sigma), A9165) 및 10nM[Leu15]-가스트린 I(시그마, G9145)을 함유하였다. 사용한 성장 인자는 50ng/㎖ 마우스 EGF(페프로테크, 315-09), 100ng/㎖ 마우스 노긴(페프로테크(Peprotech), 250-38), 500ng/㎖ 인간 R-스폰딘 1(R&D, 4645-RS), 100ng/㎖ 마우스 Wnt-3a (R&D, 1324-WN), 20μM Y-27632(토크리스(Tocris), 1254), 10mM 니코틴아마이드(시그마, N0636), 500nM A83-01(토크리스, 2939), 10μM SB202190(토크리스, 1264)을 포함하였다. 트랜스웰은 0.4㎛ 기공 폴리에스터 막 24-웰 트랜스웰 삽입물(코닝(Corning))이었다. 배양물을 37℃에서 5% CO2 중에서 인큐베이션시켰다.
인간 십이지장 오가노이드를 WENRNAS (Wnt, EGF, 노긴, R-스폰딘1, 니코틴아마이드, A83-01, SB202190) 중에서 배양시키고, 전형적으로 7 내지 12일 동안 성장시킨 후 단일점 배양물을 플레이팅하는데 사용하였다. 제0일에, 매트리겔(Matrigel)에 포매된 오가노이드 배양물을 트리플 익스프레스(TrypLE Express)로 처리하여 오가노이드를 작은 조각 및/또는 단일 세포로 분해하였다. 세포를 WENRAY(Wnt, EGF, 노긴, R-스폰딘1, A83-01, Y-27632)을 함유하는 SBM에서 0.5 × 106개의 세포/㎖로 재현탁시켰다. 이 단계 후에, 200㎕의 세포 현탁액을 24-웰 트랜스웰(100,000개의 세포/웰)의 정단부측에 플레이팅하고 나서, WENRAY를 이용하여 600㎕의 SBM을 기저측부측에 첨가하였다. 십이지장 세포를 제3일에 ENA(EGF, 노긴, A83-01)로 분화시켰다. 정단부 구획의 색은 분화 후에 NHE3 발현의 증가에 기인하여 핑크 또는 오렌지색으로부터 황색으로 바뀐다.
각각의 인간 십이지장 단일층 배양물 웰을 정단부를 투약 6일 또는 7일 전에 정단부 측 상에서 신선한 SBM으로 2회 세척하였다. 모든 화합물 저장액은 DMSO 중에 용해된 10mM이었다. 각각의 화합물 저장액을 개별적으로 신선한 SBM과 혼합하여 최종 화합물 농도 1μM에 도달하였고, 단일층(총 용적 200㎕)의 정단부 상에만 투약하였다. 동등한 농도에서 DMSO를 비히클 대조군으로서 사용하였다. 2회 중복 웰을 각각의 화합물에 대해 투약하였다. 경상피 전기 저항(TEER)을 밀착 연접 침투성의 측정을 위한 정량적 기법으로서 사용하였다. 모든 웰에 대해 투약 전 및 투약 후 30분 및 1시간에 TEER 값을 기록하였다(MERS00002, 밀리포어(Millipore)). 처리 후 각각의 2회 중복 TEER 값을 개개의 웰 기준 TEER에 대해 보정하였다. 각각의 예시적 화합물에 대해 기준 보정된 TEER을 비히클 대조군의 DMSO 웰의 평균과 비교하였고, 비히클 대조군의 TEER%로서 표현하였다.
실시예 58: 마우스에서 장 나트륨 흡수의 저해
소변 및 분변 나트륨 배설을 측정하여 장 내강으로부터 나트륨 흡수를 저해하는 선택된 예시적 화합물의 능력을 평가하였다. 추가로, 화합물 치료에 반응한 설사의 부재 또는 부재의 평가를 하였다. 대략 8주령의 수컷, CD-1 마우스를 엔비고(Envigo)(캘리포니아주 리버모어)로부터 구입하였고, 우리 당 6마리를 수용하고 나서, 연구 개시 전에 적어도 48시간 동안 순응시켰다. 동물에 할란 테클라드 글로벌(Harlan Teklad Global) TD.160470 설치류 사료(위스콘신주 메디슨에 소재), 0.4% 무기 인의 첨가와 함께 표준 실험실 설치류 사료 할란 테클라드 글로벌 2018을 공급하였다. 동물은 연구의 지속 기간 동안 사료 및 물에 임의로 접근하였고, 6AM 내지 6PM의 표준 명/암 주기로 온도 및 습도 제어한 방에서 유지하였다. 연구를 개시하기 위해, 마우스의 체중을 재고, 이어서 대사 케이지에 개별적으로 넣었다. 대사 케이지에 대한 3일의 순응 기간 후에, 소변 및 배설물의 24시간 기준 수집을 수행하였다. 이어서, 마우스(n=8/그룹)를 6 AM 및 3 PM에 3연속일 동안 1일 2회 5㎖/㎏의 용량 용적으로 시험 화합물(0.01 내지 15㎎/㎏) 또는 비히클(3mM HCl, 0.01% Tween80)을 이용하는 경구 위관영양법에 의해 투약하였다. 매일, 설사의 임의의 관찰과 함께, 체중의 측정, 24시간 사료 섭취, 물 섭취, 소변 용적 및 습식 분변 중량을 기록하였다. 적어도 3일 동안 동결건조기를 이용하여 분변 샘플을 건조시키고, 이 후에 건조 중량을 기록하고 나서, 습식 대변 중량과 건조 대변 중량 사이의 차이에 기반하여 분변 유체 함량을 기록하였다. 비히클 그룹 평균으로부터의 변화로서 화합물 처리의 제3일에 대변 유체 함량을 계산하였다. 소변 샘플에 대해, 용적을 중량 측정에 의해 결정하였다. 분변 및 소변을 각각 마이크로웨이브 혈장-원자 방출 분광법 또는 이온 크로마토그래피에 의해 나트륨 함량에 대해 분석하였다. 전도도 검출기와 결합된 이온 크로마토그래피 시스템(써모 피셔 ICS-3000 또는 ICS-5000+) 상에서 소변 샘플을 분석하였다. 25mM 메탄설폰산을 이용하는 등용매 용리로 IonPac CS12A(써모 피셔) 2 × 250㎜ 분석 칼럼을 이용하여 양이온의 크로마토그래피 분리를 수행하였다. 농도를 체류 시간 및 피크 면적에 기반하여 나트륨 이온에 대한 표준 곡선(10mM HCl 중에서 제조)으로부터 보간하였다. 마이크로웨이브 플라즈마 원자 방출 분광분석법(MP-AES)에 의한 분변 샘플 분석. 건조 분변 샘플을 균질기 상에서 미세 분말로 분쇄하였고, 분쇄된 샘플(400 내지 600㎎ 알리쿼트 중량)을 마이크로웨이브 방법(Mars 6)에 의해 질산으로 분해하였다. 이들 분해된 샘플을 1% 질산으로 희석시키고 나서, 애질런트(Agilent) 4100 MP-AES 상에서 분석하였다. 신호 강도에 기반하여 나트륨에 대한 표준 곡선(1% 질산 중에서 제조)에 대해 농도를 계산하였다. 588.995㎚ 파장에서 나트륨을 검출하였다. 소변 나트륨 농도에 24-시간 소변 용적을 곱함으로써 24시간 소변 나트륨 배설(㎎/24-시간)을 계산하였다. 분변 나트륨 농도에 24-시간 분변 용적을 곱함으로써 24시간 분변 나트륨 배설(㎎/24-시간)을 계산하였다. 제3일의 화합물 처리에 대한 소변 및 분변 나트륨 배설을 식이성 나트륨 섭취에 대해 정규화시키고 나서, 비히클 평균의 백분율로서 표현하였다.
실시예 59: 래트에서 장 나트륨 흡수의 저해
소변 나트륨 배설 및 분변 형태를 측정하여 장 내강으로부터 나트륨 흡수를 저해하는 선택된 예시적 화합물의 능력을 평가하였다. 8주령의 수컷, 스프래그 돌리 래트를 엔비고(Envigo)(캘리포니아주 리버모어)로부터 구입하였고, 우리 당 2마리를 수용하고 나서, 연구 개시 전에 적어도 48시간 동안 순응시켰다. 동물에 할란 테클라드 글로벌(Harlan Teklad Global) TD.160470 설치류 사료(위스콘신주 메디슨에 소재), 0.4% 무기 인의 첨가와 함께 표준 실험실 설치류 사료 할란 테클라드 글로벌 2018을 공급하였다. 동물은 연구의 지속 기간 동안 사료 및 물에 임의로 접근하였고, 6AM 내지 6PM의 표준 명/암 주기로 온도 및 습도 제어한 방에서 유지하였다. 연구 개시일에, 래트(n=5/그룹)를 5㎖/㎏이 용량 용적으로 시험 화합물 또는 비히클(3mM HCl, 0.01% 트윈80)로 경구 위관영양법에 의해 투약하였다. 용량 투여 직후에 동물을 개개 대사 우리에 넣었다. 13시간 투약 후, 소변 샘플을 수집하였고, 분변 형태를 평가하였다. 추가로, 13-시간 기간에 걸쳐 소모된 음식물의 중량을 측정하고 기록하였다. 케이지의 수집 깔때기에서 습식 검사 관찰에 대해 분변 물의 증가와 관련된 통상적인 규모에 따라 분변 형태를 스코어링하였다(1, 정상 펠릿; 2, 수분 때문에 수집 깔때기 측면에 접착되는 펠릿; 3, 정상 펠릿 형상의 상실; 4, 블롯팅 패턴에 의해 형상의 완전한 상실; 5, 액체 분변 스트림 증거). 그룹 내에서 각각의 개개 래트의 FFS의 중위값으로서 각각의 그룹에 대한 분변 형태 스코어(FFS)를 계산하였고, 표 4에서 보고하였다. 적어도 3일 동안 동결건조기를 이용하여 분변 샘플을 건조시키고, 이 후에 건조 중량을 기록하고 나서, 습식 대변 중량과 건조 대변 중량 사이의 차이에 기반하여 분변 유체 함량을 기록하였다. 비히클 그룹 평균으로부터의 변화로서 대변 유체 함량을 계산하였다. 소변 샘플에 대해, 용적을 중량 측정에 의해 결정하였다. 전도도 검출기와 결합된 이온 크로마토그래피 시스템(써모 피셔 ICS-3000 또는 ICS-5000+) 상에서 소변 샘플을 분석하였다. 25mM 메탄설폰산을 이용하는 등용매 용리로 IonPac CS12A(써모 피셔) 2 × 250㎜ 분석 칼럼을 이용하여 양이온의 크로마토그래피 분리를 수행하였다. 농도를 체류 시간 및 피크 면적에 기반하여 나트륨에 대한 표준 곡선(10mM HCl 중에서 제조)으로부터 보간하였다. 소변 나트륨 농도에 13-시간 소변 용적을 곱함으로써 13-s-시간 소변 나트륨 배설(㎎/13-시간)을 계산하였다. 화합물 처리의 소변 나트륨 배설을 식이성 나트륨 섭취에 대해 정규화하였고, 비히클 평균의 백분율로서 표현하였다.
실시예 60:
래트 균형 모델에서 장 나트륨 및 인 흡수의 저해
장 내강으로부터의 나트륨 및 인의 흡수를 저해하는 선택된 예시적 화합물의 능력을 평가하기 위해 소변 인 배설과 함께 소변 및 분변 나트륨 배설을 측정한다. 추가로, 화합물 처리에 반응한 분변 형태의 평가를 한다. 대략 8주령의 수컷, 스프래그 돌리 래트를 엔비고(캘리포니아주 리버모어)로부터 구입하였고, 우리 당 2마리를 수용하고 나서, 연구 개시 전에 적어도 48시간 동안 순응시킨다. 동물에 할란 테클라드 글로벌(Harlan Teklad Global) TD.160470 설치류 사료(위스콘신주 메디슨에 소재), 0.4% 무기 인의 첨가와 함께 표준 실험실 설치류 사료 할란 테클라드 글로벌 2018을 공급한다. 동물은 연구의 지속 기간 동안 사료 및 물에 임의로 접근하고, 6PM 내지 6AM의 반전된 명/암 주기로 온도 및 습도 제어한 방에서 유지한다. 연구를 개시하기 위해, 래트의 체중을 재고, 대사 케이지에 개별적으로 넣었다. 대사 케이지에 대한 2일의 순응 기간 후에, 소변 및 배설물의 24시간 기준 수집을 수행한다. 이어서, 래트(n=6/그룹)를 6 AM 및 3 PM에 3연속일 동안 1일 2회 5㎖/㎏의 용량 용적으로 시험 화합물 또는 비히클(3mM HCl, 0.01% Tween80)을 이용하는 경구 위관영양법에 의해 투약하였다. 매일, 설사의 임의의 관찰과 함께, 체중의 측정, 24시간 사료 섭취, 물 섭취, 소변 용적 및 습식 분변 중량을 기록한다. 적어도 3일 동안 동결건조기를 이용하여 분변 샘플을 건조시키고, 이 후에 건조 중량을 기록하고 나서, 습식 대변 중량과 건조 대변 중량 사이의 차이에 기반하여 분변 유체 함량을 기록한다. 비히클 그룹 평균으로부터의 변화로서 화합물 처리의 제3일에 대변 유체 함량을 계산한다. 소변 샘플에 대해, 용적을 중량 측정에 의해 결정한다. 분변 및 소변을 각각 마이크로웨이브 혈장-원자 방출 분광법 또는 이온 크로마토그래피에 의해 나트륨 및 인 함량에 대해 분석하였다. 전도도 검출기와 결합된 이온 크로마토그래피 시스템(써모 피셔 ICS-3000 또는 ICS-5000+) 상에서 소변 샘플을 분석한다. 25mM 메탄설폰산을 이용하는 등용매 용리로 IonPac CS12A(써모 피셔) 2 × 250㎜ 분석 칼럼을 이용하여 양이온의 크로마토그래피 분리를 수행한다. 35mM 수산화칼륨을 이용하는 등용매 용리로 IonPac AS18(써모 피셔) 2 × 250㎜ 분석 칼럼을 이용하여 음이온의 크로마토그래피 분리를 수행한다. 농도를 체류 시간 및 피크 면적에 기반하여 각각의 이온에 대한 표준 곡선(10mM HCl 중에서 제조)으로부터 보간한다. 마이크로웨이브 플라즈마 원자 방출 분광분석법(MP-AES)에 의한 분변 샘플 분석. 건조 분변 샘플을 균질기 상에서 미세 분말로 분쇄하고, 분쇄된 샘플(400 내지 600㎎ 알리쿼트 중량)을 마이크로웨이브 방법(Mars 6)에 의해 질산으로 분해한다. 이들 분해된 샘플을 1% 질산으로 희석시키고 나서, 애질런트(Agilent) 4100 MP-AES 상에서 분석한다. 신호 강도에 기반하여 나트륨에 대한 표준 곡선(1% 질산 중에서 제조)으로부터 보간한다. 588.995㎚ 파장에서 나트륨을 검출한다. 각각 소변 나트륨 또는 인 농도에 각각 24시간 소변 용적을 곱함으로써 24-시간 소변 나트륨 및 인 배설(㎎/24-시간)을 계산한다. 분변 나트륨 농도에 24-시간 분변 용적을 곱함으로써 24시간 분변 나트륨 배설(㎎/24-시간)을 계산한다. 제3일의 화합물 처리에 대한 소변 및 분변 나트륨 및 소변 인 배설을 각각 식이성 나트륨 또는 인 섭취에 대해 정규화시키고 나서, 비히클 평균의 백분율로서 표현한다.
실시예 61:
오피오이드 유도 변비에서 위장 운동성의 회복
오피오이드 유도 변비의 모델에서 위장 운동성을 회복하는 선택된 예시적 화합물의 능력을 평가하기 위해 말초 작용성 μ-오피오이드 작용제 로페라마이드로 처리한 마우스에서 위장 수송을 측정하였다. 대략 8주령의 암컷, CD1 래트를 엔비고(캘리포니아주 리버모어)로부터 구입하였고, 우리 당 4마리를 수용하고 나서, 연구 개시 전에 적어도 48시간 동안 순응시킨다. 동물에 표준 실험실 설치류 사료 할란 테클라드 글로발 2018(위스콘신주 메디슨에 소재)을 공급한다. 동물은 순응 기간의 지속 기간 동안 사료 및 물에 임의로 접근하고, 6AM 내지 6PM의 표준 명/암 주기로 온도 및 습도 제어한 방에서 유지한다. 물에 대해 자유롭게 접근하면서 밤새 금식시킨 후에, 동물에 다양한 용량의 시험 화합물 또는 5㎖/㎏ 용량 용적의 비히클(3mM HCl, 0.01% 트윈80)로 경구 위관영양법에 의해 투약하였다. 시험 화합물 또는 비히클의 경구 투약 후 대략 15분에, 동물에 5㎖/㎏의 용량 용적으로 로페라마이드(0.3 내지 6㎎/㎏) 또는 비히클(30:70 PG:0.9% NaCl)로 피하 주사에 의해 투약하였다. 15분 후에, 동물에 100㎕의 용량 용적으로 에반스 블루 염료(6%)에 의해 경구 투약한다. 30분 후에, 동물을 이산화탄소 흡입에 의해 안락사시키고 나서, 유문으로부터 맹장까지의 길이(소장의 전체 길이) 및 유문으로부터 에반스 블루 염료 앞쪽까지의 길이를 측정하고 기록하였다. 개개 동물에 대해, 에반스 블로 염료 앞쪽에 의한 길이 이동을 전체 소장의 길이로 나누고 나서, 유문으로부터 맹장까지 측정하고, 100을 곱하여서 백분율로서 염료에 의해 이동되는 소장의 거리를 제공한다. 비히클로 경구 투약하고 비히클(비히클/비히클)로 피하로 주사한 동물에서, 에반스 블루 염료 앞면은 30분 기간에 대략 70% 길이의 소장을 이동한다. 비히클로 경구 투약하고 로페라마이드(비히클/로페라마이드)로 피하로 주사한 동물에서, 에반스 블루 염료 앞면은 30-분 기간에 소장 길이의 대략 25%를 이동하는데, 이는 로페라마이드에 반응하여 감소된 위장 운동성을 나타낸다. 로페라마이드의 존재 하에 GIT 운동성에 대한 예시적 화합물의 효과를 백분율로서 표현되는 비히클/로페라마이드 수송으로부터 비히클/비히클 수송 거리를 회복하는 능력으로서 계산한다.
실시예 62:
다발성 경화증에서 위장 운동성의 회복
다발성 경화증의 모델에서 위장 운동성을 회복하는 선택된 예시적 화합물의 능력을 평가하기 위해 위장 수송 시간을 측정하였다. 다발성 경화증(MS) 환자는 종종 변비 및 교란된 위장 운동성과 관련된 다른 위장 증상을 경험한다. 실험 자가면역 뇌척수염(EAE) 마우스 모델은 다발성 경화증(MS)을 연구하기 위한 가장 빈번하게 사용되는 동물 모델 중 하나이며, 이때 CNS-특이적 항원에 대한 면역화는 중추 신경계 염증을 초래한다. 이 모델은 다양한 정도의 진행성 마비 및 위장 운동 이상을 초래하는 급성, 만성 및 재발 질환 범위를 초래한다.
동물은 연구 개시 시 8 내지 16주령이고, 표준 실험실 설치류 사료 할란 테클라드 글로발 2018(위스콘신주 메디슨에 소재)을 공급한다. 동물은 연구의 지속 기간 동안 사료 및 물에 임의로 접근하고, 6AM 내지 6PM의 표준 명/암 주기로 온도 및 습도 제어한 방에서 유지한다. EAE는 완전 프로인트 애주번트(CFA) 및 백일해 독소(PTX, IP)에서 항원의 조합물(MOG35-55, S.C.)의 조합물의 주사에 의해 암컷 마우스에서 유도한다. 체성 운동신경 증상이 발생된 후에(일반적으로 면역화 후 10일 이상), EAE 마우스에 다양한 용량(0.01 내지 30㎎/㎏)의 시험 화합물 또는 5㎖/㎏의 용량 용적에서 비히클(3mM HCl, 0.01% Tween80)로 경구 위관영양법에 의해 투약한다. 시험 화합물에 단일 용량으로 또는 다회 용량으로 1일 2회 투여한다. 표준화된 시간 기간(1 내지 24시간) 동안 배설물을 모니터링하고, 분변 펠릿 수, 분변 질량 및 분변 건조 중량으로서 보고한다. 카르민 레드 또는 에반스 블루의 경구 위관영양법에 의해 그리고 배설물에서 나타나는 염료의 잠재기를 계산함으로써 전체 위장 수송 시간을 결정한다. 경구 위관영양법에 의해 카르민 레드 또는 에반스 블루를 투약함으로써 그리고 염료의 경구 투약 후 15분 내지 2시간에 소장의 전체 길이에 비해 염료의 앞 가장자리 길이를 측정함으로써 소장 수송을 측정한다. 원위 결장에 내로 표준화된 거리에 삽입된 단일 유리 비드의 압출에 대한 시간을 측정함으로써 결장 운동성을 평가한다. EAE 마우스에서 GIT 운동성에 대한 예시적 화합물의 효과를 비히클로 처리한 EAE에서 관찰한 것으로부터 대조군 마우스에서 관찰된 것에 대한 수송 거리를 회복하는 능력으로서 계산하고, 백분율로서 표현한다.
실시예 63:
파킨슨병에서 위장 운동성의 회복
파킨슨병의 모델에서 위장 운동성을 회복하는 선택된 예시적 화합물의 능력을 평가하기 위해 위장 수송 시간을 측정하였다. 파킨슨병(PD)은 만성 및 진행성의 운동 장애를 특징으로 하는 신경퇴행성 장애이다. PD 환자는 또한 변비 및 교란된 위장 운동성과 관련된 다른 위장 징후를 포함하는 상당한 비운동 증상을 경험한다. PD에서 새로운 요법을 시험하기 위한 동물 모델을 개발하기 위해 독소인 1-메틸-4-페닐-1,2,3,6-테트라하이드로피리딘(MPTP)을 널리 사용하였다. 이 모델은 PD와 비슷하고 또한 위장 운동장애를 나타내도록 보고된 운동 변화 및 병리를 초래한다(Scientific Reports, 2016 6:30269)
동물은 연구 개시 시 8 내지 16주령이고, 표준 실험실 설치류 사료 할란 테클라드 글로발 2018(위스콘신주 메디슨에 소재)을 공급한다. 동물은 연구의 지속 기간 동안 사료 및 물에 임의로 접근하고, 6AM 내지 6PM의 표준 명/암 주기로 온도 및 습도 제어한 방에서 유지한다. 다중, 일반적으로 4개의, MPTP의 복강내 주사에 의해 PD를 마우스에서 유도한다. MPTP를 주사한 후에(일반적으로 주사 후 4 내지 20일), PD 마우스에 다양한 용량(0.01 내지 30㎎/㎏)의 시험 화합물 또는 5㎖/㎏의 용량 용적에서 비히클(3mM HCl, 0.01% Tween80)로 경구 위관영양법에 의해 투약한다. 시험 화합물에 단일 용량으로 또는 다회 용량으로 1일 2회 투여한다. 표준화된 시간 기간(1 내지 24시간) 동안 배설물을 모니터링하고, 분변 펠릿 수, 분변 질량 및 분변 건조 중량으로서 보고한다. 카르민 레드 또는 에반스 블루의 경구 위관영양법에 의해 그리고 배설물에서 나타나는 염료의 잠재기를 계산함으로써 전체 위장 수송 시간을 결정한다. 경구 위관영양법에 의해 카르민 레드 또는 에반스 블루를 투약함으로써 그리고 염료의 경구 투약 후 15분 내지 2시간에 소장의 전체 길이에 비해 염료의 앞 가장자리 길이를 측정함으로써 소장 수송을 측정한다. 원위 결장에 내로 표준화된 거리에 삽입된 단일 유리 비드의 압출에 대한 시간을 측정함으로써 결장 운동성을 평가한다. PD 마우스에서 GIT 운동성에 대한 예시적 화합물의 효과를 비히클로 처리한 PD에서 관찰한 것으로부터 대조군 마우스에서 관찰된 것에 대한 수송 거리를 회복하는 능력으로서 계산하고, 백분율로서 표현한다.
실시예 64
:
염-민감성 고혈압에서 혈압에 대한 효과
염-민감성 고혈압의 모델에서 고혈압을 약화시키는 선택된 예시적 화합물의 능력을 평가하기 위해 동맥 혈압을 측정한다. Dahl 염 민감성(DSS) 래트는 염-민감성 고혈압 및 말단-기관 손상의 잘 특성규명된 모델이다. 1 내지 4주의 기간 동안 0.49% 내지 4% NaCl의 식이요법의 NaCl 함량을 증가시킴으로써 DSS 래트에서 염-민감성 고혈압이 확립된다. 0.49% NaCl에서 유지된 DSS 래트를 대조군으로서 사용한다. 동물을 연구 개시 시 6 내지 10주령이며, 동물은 연구의 지속 기간 동안 사료 및 물에 임의로 접근하고, 12시간 명/암 주기로 온도 및 습도 제어한 방에서 유지한다. 래트(n=6-8/그룹)에 1 내지 3주 동안 1일 2회로 5㎖/㎏의 용량 용적으로 시험 화합물(0.01 내지 30㎎/㎏) 또는 비히클(3mM HCl, 0.01% Tween80)로 경구 위관 영양법에 의해 투약하는 한편, 4% NaCl 식이요법으로 유지하였다. 꼬리 혈압(tail cuff) 체적기록법에 의해 동맥 혈압을 매주 측정한다. 대사 케이지에 동물을 개개로 넣음으로써 24-시간 소변 수집물을 또한 수집한다.
실시예 65:
심부전의 모델에서 심장 기능에 대한 효과
심부전의 래트 모델에서 심장 기능, 구조 및 신경-체액 활성화를 개선시키는 선택된 예시적 화합물의 능력을 평가하기 위해 심장 기능 및 형상을 측정하기 위해 일련의 심초음파 검사를 사용한다. 영구적 좌측 주관상 동맥성 결찰에 의해 심부전을 유도하기 위해 수컷 Dahl 염 민감성(DSS) 래트 또는 수컷 루이스 래트를 사용한다. 동물을 연구 개시 시 6 내지 10주령이며, 동물은 연구의 지속 기간 동안 사료 및 물에 임의로 접근하고, 12시간 명/암 주기로 온도 및 습도 제어한 방에서 유지한다. 래트(n=6 내지 10마리/그룹)에 1 내지 8주 동안 1일 2회로 5㎖/㎏의 용량 용적으로 시험 화합물(0.01 내지 30㎎/㎏) 또는 비히클(3mM HCl, 0.01% Tween80)로 경구 위관 영양법에 의해 투약하였다. 시간-의존적 심장 리모델링(HWI, LVI, 챔버 크기), 시간-의존적 심장 작업 수행 능력(EF, dP/dt, LVEDP) 변화 및 시간-의존적 심장 형태계측(HWI, LVI, LVEDV, LVESV) 지표를 평가하기 위해 연속 심초음파 검사를 매주 수행한다. 압력-용적 루프 분석을 이용하여 부하-의존적 및 부하-독립적 좌심실 기능의 최종 평가를 한다. 용적 민감성 호르몬 ANP 및 BNP를 측정함으로써 세포외 용적 확장을 평가한다.
실시예 66
:
인간
오가노이드
단일층
세포 배양물에서
TEER에
대한
세포내
pH의 효과
기저 배지(BM)는 10mM HEPES(인비트로젠, 15630-080), 1:100 글루타맥스(Glutamax)(인비트로젠, 35050-061) 및 1:100 페니실린/스트렙토마이신(인비트로젠, 15140-122)을 함유하는 진보된 DMEM/F12로 이루어졌다. 보충된 기저 배지(SBM)는 1:100 N2(인비트로젠, 17502-048), 1:50 B27 (인비트로젠, 12587-010), 1 mM N-아세틸시스테인(시그마(Sigma), A9165) 및 10nM[Leu15]-가스트린 I(시그마, G9145)을 함유하였다. 사용한 성장 인자는 50ng/㎖ 마우스 EGF (Peprotech, 315-09), 100ng/㎖ 마우스 노긴(noggin)(페프로테크(Peprotech), 250-38), 500ng/㎖ 인간 R-스폰딘 1(R&D, 4645-RS), 100ng/㎖ 마우스 Wnt-3a(R&D, 1324-WN), 20μM Y-27632(토크리스, 1254), 10mM 니코틴아마이드(시그마, N0636), 500nM A83-01(토크리스(Tocris), 2939), 10μM SB202190(토크리스, 1264)을 포함하였다. 트랜스웰은 0.4㎛ 기공 폴리에스터 막 24-웰 트랜스웰 삽입물(코닝(Corning))이었다. 배양물을 5% CO2 중에서 37℃에서 인큐베이션시켰다.
인간 회장 오가노이드를 WENRNAS(Wnt, EGF, 노긴, R-스폰딘1, 니코틴아마이드, A83-01, SB202190)에서 배양시키고, 단일층 배양물을 플레이팅하기 위해 사용하기 전에 7 내지 12일 동안 성장시켰다. 제0일에, 오가노이드를 작은 조각 및/또는 단일 세포로 분해하도록 매트리겔에 포매된 오가노이드 배양물을 트리플 익스프레스(TrypLE Express)로 처리하였다. WENRAY를 함유하는 SBM(Wnt, EGF, 노긴, R-스폰딘1, A83-01, Y-27632) 중에서 세포를 0.5 Х 106개의 세포/㎖로 재현탁시켰다. 이 단계 후에, 200㎕의 세포 현탁액을 24-웰 트랜스웰(100,000개의 세포/웰)의 정단부 측에 플레이팅하였고, WENRAY가 있는 600㎕의 SBM을 기저측부에 첨가하였다. 회장 세포를 제3일에 ENRA(EGF, 노긴, R-스폰딘 1, A83-01)으로 분화시켰다. 정단부 구획의 색은 분화 후 NHE3 발현의 증가에 기인하여 핑크 또는 오렌지색으로부터 황색으로 바뀐다.
화합물 투약 6일 전에 정단부 상에서 각각의 인간 회장 단일층 배양물 웰을 신선한 SBM으로 2회 세척하였다. 모든 화합물 저장액을 DMSO 중에서 10mM로 용해시켰다. 각각의 화합물 저장액을 신선한 SBM과 개별적으로 혼합하여 최종 화합물 농도에 도달하였고, 단일층의 정단부 측 상에만 투약하였다(총 용적 200㎕). 동등한 농도에서 DMSO를 비히클 대조군으로서 사용하였다. 2회 중복하여 웰에 각각의 화합물을 투약하였다. 경상피 전기 저항(Transepithelial electrical resistance: TEER)를 정량적 기법으로서 사용하여 밀착연접 침투성을 측정하였다. 모든 웰에 대한 투약 전 및 후에 볼트/옴(ohm) 미터(MERS00002, 밀리포어(Millipore))를 이용하여 TEER 값을 기록하였다. 처리 후 각각의 2회 중복 TEER 값을 개개 웰 기준 TEER에 대해 보정하였다. 각각의 실시예 화합물에 대해 기준 보정된 TEER를 DMSO 웰의 평균과 비교하였고, 비히클 대조군의 TEER% 로서 표현하였다. Na-함유 완충제(120 mM NaCl, 10mM HEPES, 10mM 글루코스, 5 mM KCl, 2mM CaCl2, 1mM MgCl2, pH 7.4)에서 37℃, 5% CO2에서 30분 동안 10μM의 pH 민감성 염료 BCECF-AM(라이프 테크놀로지즈(Life Technologies), 카탈로그# B1150)과 함께 인큐베이션시킨 96 웰 트랜스웰 플레이트 세포 상에서 단일층으로 성장시킨 인간 회장 줄기 세포에서 세포내 pH를 측정하였다. 30분 후에 염료를 흡입하고 나서, Na-함유 완충제를 이용하여 세포를 2회 세척하였다.
공지된 NHE3 저해제인 테나파노르뿐만 아니라 비 NHE3 저해제인 니제리신, BAM15, FCCP 또는 DMSO 대조군을 Na-함유 완충제에 희석시켰고, 트랜스웰의 정단부 구획에 첨가하였다. 495㎚ 및 439㎚의 이중 여기 파장 및 538㎚의 방출 파장(몰레큘러 디바이시즈(Molecular Devices))에서 플렉스스테이션(Flexstation) 마이크로플레이트 상에서 30분의 기간 동안 5분마다 형광 판독치를 획득하였다. pH 표시에 대한 형광비를 2개의 여기 파장(495/439㎚)의 비로부터 계산하였다. 이온운반체 니제리신은 대조군에 비해 세포내 pH를 감소시켰고(도 1A), 테나파노르에 의해 관찰된 바와 같이, 대조군에 비해 TEER의 유사한 증가를 나타내었다(도 1B). 유사하게, 미토콘드리아(도 1C)에서 비결합 산화적 인산화에 의해 세포내 pH를 감소시키는 화합물 BAM15 및 FCCP는 대조군에 비해 TEER를 증가시켰다(도 1D). 게다가, 산 부하 후에 세포내 pH에 의해 평가되는 바와 같이, 니제리신이나 BAM15나 FCCP의 어느 것도 소장세포에서 NHE3 활성을 저해시키지 않았다. 이들 결과는 세포내 pH가 NHE3 활성과 독립적으로 TEER의 직접적인 조절자라는 것을 나타낸다.
실시예 67
:
IBS-C - 래트에서 내장 과민증에서 통증 감소
내장 과민증의 래트 모델에서 풍선 팽창에 대한 결장의 과민증(CRD)을 감소시키는 선택된 예시적 화합물의 능력을 래트의 복부 도피반사(AWR)를 등급화함으로써 그리고 근전도 검사(EMG) 반응을 측정함으로써 측정한다. 10주령의 수컷 스프래그 돌리 래트 새끼에 항문으로부터 결장 2㎝ 내까지 식염수 중의 0.5% 아세트산 용액의 0.2㎖ 주입물로 주사함으로써 내장 과민성을 유도한다. 대조군 래트는 동일한 용적의 식염수를 받는다. 이어서, 내장 과민성을 8 내지 12주령의 성체로서 이들 래트에서 평가한다. 내장 과민증의 평가 전에 래트(n=4 내지 10마리/그룹)에 2주까지 동안 1일 2회로 5㎖/㎏의 용량 용적으로 시험 화합물(0.01 내지 30㎎/㎏) 또는 비히클(3mM HCl, 0.01% Tween80)로 경구 위관 영양법에 의해 투약하였다. CRD에 대한 반응을 등급화함으로써 내장 과민성을 측정한다. 1% 메토헥시탈 나트륨을 이용한 약간의 진정 상태 하에서, 타이곤(Tygon)관에 부착된 가요성 풍선을 항문을 통해 하행결장 및 직장 내 8㎝에 삽입하고, 꼬리에 관을 테이핑함으로써 제자리에 고정시킨다. 대략 30분 후에, 20초 기간 다음에 2분의 휴기 기간 동안 압력 변환기에 연결된 혈압계에 의해 측정된 다양한 압력(10 내지 80㎜Hg)으로 풍선을 빠르게 팽창시킴으로써 CRD를 수행한다. 맹검 관찰자에 의해 AWR을 등급화하고 AWR 스코어를 다음과 같이 부여함으로써 CRD에 대한 거동 반응을 측정한다: 1, 반응이 없는 정상 거동; 2, 복부 근육의 수축; 3, 복부벽의 리프팅; 4, 신체 아칭 및 골반 구조의 리프팅. 외복사근에서 적어도 1주 전에 이식한 2개의 전극을 통해 CDR에 반응한 EMG 반응을 지속적으로 측정하고 CRD에 반응한 EMG의 곡선하 면적으로서 계산한다.
균등론
당업자는 본 단지 일상적인 실험을 이용하여 개시내용에서 구체적으로 기재된 구체적 실시형태에 대한 수많은 등가물을 인식하거나 또는 확인할 수 있다. 이러한 등가물은 다음의 범주에 포함되는 것으로 의도된다.
Claims (48)
- 하기 화학식 I'의 화합물, 또는 이의 약제학적으로 허용 가능한 염, 프로드러그, 용매화물, 수화물, 이성질체 또는 호변이성질체:
식 중:
링커는 -R13-(CHR13)p-[Y-(CH2)r]s-Z-R13-(CH2)t-Z-이며;
Q는 결합 또는 -NHC(O)NH-이고;
Z는 독립적으로, 각각의 경우에, 결합, C(O) 또는 -C(O)NH-이며;
Y는 독립적으로, 각각의 경우에, O, S, NH, N(C1-C3알킬) 또는 -C(O)NH-이고;
X는 결합, NH, O, CR11R12, CR11, C 또는 -NHC(O)NH-이며;
n은 2 내지 4의 정수이며;
r 및 p는 독립적으로, 각각의 경우에, 0 내지 8의 정수이고;
s는 0 내지 4의 정수이며;
t는 0 내지 4의 정수이고;
u는 0 내지 2의 정수이며;
R1 및 R2는 독립적으로 할로겐, OH, CN, C1-C6알킬, C1-C6알콕시, C1-C6할로알킬, C1-C6할로알콕시 또는 -C(O)NR9R10이고;
R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴, N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴, -SR9, -OR9, -NHR9, -NR9R10, -S(O)2N(R9)2-, -S(O)2R9, -C(O)R9, -C(O)OR9, -NR9S(O)2R10, -S(O)R9, -S(O)NR9R10, -NR8S(O)R9이며;
R7은 독립적으로 각각의 경우에, H, C1-C6알킬, 또는 C1-C6할로알킬이고;
R8은 독립적으로 각각의 경우에, 결합, H, C1-C6알킬, C4-C8사이클로알켄일 , C3-C8사이클로알킬, 헤테로사이클릴, 아릴 또는 헤테로아릴이되, 각각의 사이클로알켄일, 사이클로알킬, 헤테로사이클릴, 아릴 또는 헤테로아릴은 하나 이상의 R17로 선택적으로 치환되거나; 또는
R7 및 R8은 그들이 부착된 원자와 함께 조합되어 독립적으로 각각의 경우에, 헤테로사이클릴 또는 N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴을 형성하되, 각각의 헤테로사이클릴 또는 헤테로아릴은 하나 이상의 R17로 선택적으로 치환되며;
R9 및 R10은 독립적으로 H, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴, 또는 N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴이고,
R11 및 R12는 독립적으로 H, C1-C6알킬, OH, NH2, CN 또는 NO2이며;
R13, R14, R15 및 R16은 독립적으로 각각의 경우에, H, OH, NH2 또는 C1-C3 알킬이되, 상기 알킬은 하나 이상의 R17로 선택적으로 치환되고; 그리고
R17은 독립적으로 각각의 경우에, H, OH, NH2, 옥소, C1-C6알킬, C1-C6할로알킬, 또는 C1-C6알콕시이며;
단:
(1) X가 결합, O 또는 CR11R12일 때, n은 2이고;
(2) n이 3일 때, X는 CR11 또는 NH이며;
(3) n이 4일 때, X는 C이고;
(4) Q 또는 X 중 하나만이 이 때에 -NHC(O)NH-이며;
(5) R1 및 R2가 클로로일 때, Q는 -NHC(O)NH-이고, 그리고 R3, R4, R5 및 R6은 H이며, 링커는 이 아니고;
(6) R1 및 R2가 클로로일 때, Q는 -NHC(O)NH-이고, 그리고 R3, R4, R5 및 R6은 H이며, 링커는 이 아니다. - 제1항 내지 제3항 중 어느 한 항에 있어서, R1 및 R2는 C1-C6알킬, CN 또는 할로겐인, 화합물.
- 제1항 내지 제4항 중 어느 한 항에 있어서, R1 및 R2는 할로겐인, 화합물.
- 제1항 내지 제4항 중 어느 한 항에 있어서, R1 및 R2는 C1-C6알킬인, 화합물.
- 제1항 내지 제4항 중 어느 한 항에 있어서, R1 및 R2는 메틸인, 화합물.
- 제1항 내지 제4항 중 어느 한 항에 있어서, R1은 C1-C6알킬이고, R2는 할로겐인, 화합물.
- 제8항에 있어서, R1은 메틸이고, R2는 할로겐인, 화합물.
- 제8항에 있어서, R1은 CN이고, R2는 할로겐인, 화합물.
- 제1항 내지 제9항 중 어느 한 항에 있어서, R3, R4, R5 및 R6은 H, 할로겐 또는 C1-C6알킬인, 화합물.
- 제1항 내지 제10항 중 어느 한 항에 있어서, R3, R4, R5 및 R6은 H인, 화합물.
- 제1항 내지 제10항 중 어느 한 항에 있어서, R3은 메틸 또는 플루오로이고, R4, R5 및 R6은 H인, 화합물.
- 제1항 내지 제10항 중 어느 한 항에 있어서, R5는 메틸이고, R3, R4 및 R6은 H인, 화합물.
- 제1항 내지 제11항 중 어느 한 항에 있어서, Q는 -NHC(O)NH-인, 화합물.
- 제1항 내지 제11항 중 어느 한 항에 있어서, Q는 결합이고, X는 -NHC(O)NH-인, 화합물.
- 제1항 내지 제13항 중 어느 한 항에 있어서, R13, R14, R15 및 R16은 H인, 화합물.
- 제1항 내지 제13항 중 어느 한 항에 있어서, R13 및 R15는 H이고, R14 및 R16은 OH인, 화합물.
- 제1항 내지 제15항 중 어느 한 항에 있어서, Y는 O이고, r은 2이며, s는 1인, 화합물.
- 제1항 내지 제15항 중 어느 한 항에 있어서, Y는 O이고, r은 2이며, s는 2인, 화합물.
- 제1항 내지 제17항 중 어느 한 항에 있어서, s는 0인, 화합물.
- 제1항 내지 제18항 중 어느 한 항에 있어서, Z는 C(O)인, 화합물.
- 제1항 내지 제19항 중 어느 한 항에 있어서, R8은 H이고, C1-C6 알킬, 헤테로사이클릴 또는 헤테로아릴이되, 상기 헤테로사이클릴 또는 헤테로아릴은 하나 이상의 R17로 선택적으로 치환되는, 화합물.
- 제1항 내지 제19항 중 어느 한 항에 있어서, R8은 하나 이상의 R17로 선택적으로 치환되는 헤테로사이클릴인, 화합물.
- 제1항 내지 제21항 중 어느 한 항에 있어서, n은 2인, 화합물.
- 제1항 내지 제21항 중 어느 한 항에 있어서, n은 3 또는 4인, 화합물.
- 제1항에 있어서, 하기로부터 선택되는, 화합물:
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드];
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드];
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드];
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[5-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드];
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[5-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드];
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스(5-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드);
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드];
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드;
N,N'-(10,17-다이옥소-3,6,21,24-테트라옥사-9,11,16,18-테트라아자헥사코산-1,26-다이일)비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[5-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[5-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[5-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-메틸벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[5-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[5-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[5-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드];
N,N'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-4-플루오로벤젠설폰아마이드];
N,N'-[(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피페리딘-1,4-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-[(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피페리딘-1,4-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
1,1'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[N-([3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)페닐]설폰일)폼아마이드];
1,1'-[(3R,3'R)-(7,14-다이옥소-3,18-다이옥사-6,8,13,15-테트라아자아이코산-1,20-다이일)비스(피롤리딘-1,3-다이일)]비스[N-([3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)페닐]설폰일)폼아마이드];
1,1'-(5,12-다이옥소-4,6,11,13-테트라아자헥사데칸-1,16-다이일)비스[N-([3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)페닐]설폰일)피페리딘-4-카복사마이드];
1,1'-(5,12-다이옥소-4,6,11,13-테트라아자헥사데칸-1,16-다이일)비스[N-([3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)페닐]설폰일)피페리딘-3-카복사마이드];
N 1,N 18-비스([3-(6,8-다이클로로-2-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)페닐]설폰일)-6,13-다이옥소-5,7,12,14-테트라아자옥타데칸다이아마이드;
N,N'-[(3S,3'S)-(6,13-다이옥소-5,7,12,14-테트라아자옥타데칸다이오일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-[(3S,3'S)-(6,13-다이옥소-5,7,12,14-테트라아자옥타데칸다이오일)비스(피롤리딘-1,3-다이일)]비스[3-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
1-[2-(2-[(1-[(3-[(S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐)설폰일]피페리딘-4-일)옥시]에톡시)에틸]-3-[4-(3-[2-(2-[(1-[(3-[(S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐)설폰일]피페리딘-4-일)옥시]에톡시)에틸]유레이도)뷰틸]유레아;
1-(2-(2-(((R)-1-((3-((S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)페닐)설폰일)피롤리딘-3-일)옥시)에톡시)에틸)-3-(4-(3-(2-(2-(((R)-1-((3-((S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)페닐)설폰일)피롤리딘-3-일)옥시)에톡시)에틸)유레이도)뷰틸)유레아;
1-(2-[2-([(S)-1-[(3-[(S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐)설폰일]피롤리딘-3-일]옥시)에톡시]에틸)-3-(4-[3-(2-[2-([(S)-1-[(3-[(S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐)설폰일]피롤리딘-3-일]옥시)에톡시]에틸)유레이도]뷰틸)유레아;
3-[(S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]-N-[(3R,28R)-28-[(3-[(S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐)설폰아미도]-2,29-다이메틸-12,19-다이옥소-5,8,23,26-테트라옥사-11,13,18,20-테트라아자트라이아콘탄-3-일]벤젠설폰아마이드;
N,N'-(10-옥소-3,6,14,17-테트라옥사-9,11-다이아자노나데칸-1,19-다이일)비스[3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N,N'-[(3S,3'S)-(7-옥소-3,11-다이옥사-6,8-다이아자트라이데칸-1,13-다이일]비스[피롤리딘-1,3-다이일))비스(3-(6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아마이드];
N 1,N 18-비스(1-[(3-[(S)-6,8-다이클로로-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐)설폰일]피페리딘-4-일)-6,13-다이옥소-5,7,12,14-테트라아자옥타데칸다이아미드;
N 1,N 18-비스(1-[(3-[(S)-6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐)설폰일]피페리딘-4-일)-6,13-다이옥소-5,7,12,14-테트라아자옥타데칸다이아마이드;
N 1,N 18-비스(1-[(3-[(S)-6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일]페닐)설폰일]피페리딘-4-일)-6,13-다이옥소-5,7,12,14-테트라아자옥타데칸다이아마이드;
3-[2-(2-{2-[5-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아미도]에톡시}에톡시)에틸]-1-[4-({[2-(2-{2-[5-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아미도]에톡시}에톡시)에틸]카바모일}아미노)뷰틸]유레아;
3-(2-{2-[(3S)-3-[5-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아미도]피롤리딘-1-일]에톡시}에틸)-1-(4-{[(2-{2-[(3S)-3-[5-(6-클로로-8-사이아노-2-메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아미도]피롤리딘-1-일]에톡시}에틸)카바모일]아미노}뷰틸)유레아;
3-[2-(2-{2-[5-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아미도]에톡시}에톡시)에틸]-1-[4-({[2-(2-{2-[5-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아미도]에톡시}에톡시)에틸]카바모일}아미노)뷰틸]유레아;
3-(2-{2-[(3S)-3-[5-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아미도]피롤리딘-1-일]에톡시}에틸)-1-(4-{[(2-{2-[(3S)-3-[5-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)-2-메틸벤젠설폰아미도]피롤리딘-1-일]에톡시}에틸)카바모일]아미노}뷰틸)유레아;
3-(2-{2-[(3R)-3-[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아미도]피롤리딘-1-일]에톡시}에틸)-1-(4-{[(2-{2-[(3R)-3-[3-(6-클로로-2,8-다이메틸-1,2,3,4-테트라하이드로아이소퀴놀린-4-일)벤젠설폰아미도]피롤리딘-1-일]에톡시}에틸)카바모일]아미노}뷰틸)유레아. - 제1항 내지 제34항 중 어느 한 항의 화합물 및 약제학적으로 허용 가능한 담체를 포함하는 약제학적 조성물.
- 나트륨 및 수소 이온의 NHE-매개 역수송을 저해하는 방법으로서, 이러한 저해가 필요한 환자에게 약제학적 유효량의 제1항 내지 제34항 중 어느 한 항의 화합물 또는 약제학적 조성물을 투여하는 단계를 포함하는, NHE-매개 역수송을 저해하는 방법.
- 체액저류 또는 염 과부하와 관련된 장애를 치료하는 방법으로서, 염 과부하와 관련된 장애의 치료가 필요한 포유류에게 약제학적 유효량의 제1항 내지 제34항 중 어느 한 항의 화합물 또는 약제학적 조성물을 투여하는 단계를 포함하는, 체액저류 또는 염 과부하와 관련된 장애를 치료하는 방법.
- 제37항에 있어서, 상기 장애는 위장 운동 장애, 과민성 장 증후군, 만성 변비, 만성 특발성 변비, 낭성 섬유증에서 생기는 만성 변비, 오피오이드-유발성 변비, 만성 가성 장폐색증, 결장 가성 폐색증, 궤양성 대장염, 염증성 장 질환, 만성 신장병(4기 또는 5기)과 관련된 위장관 장애, 칼슘 보충제에 의해 유발된 변비, 치료제의 사용과 관련된 변비, 신경병 장애(파킨슨병, 다발성 경화증)와 관련된 변비, 수술 후 변비(수술후 장 폐색증), 특발성 변비(기능성 변비 또는 느린 수송 변비), 신경병과 관련된 변비, 대사 또는 내분비 장애, 진통제(예를 들어, 오피오이드), 항고혈압, 항경련제, 항우울제, 진경제 및 항정신병약으로부터 선택된 약물의 사용에 기인하는 변비, 위궤양, 감염성 설사, 장 누수 증후군, 낭성 섬유증 위장 질환, 미세장염, 괴사성 장염, 아토피, 식품 알레르기, 급성 염증, 만성 염증, 비만-유발성 대사 질환, 신장 질환, 만성 신장병, 당뇨성 신장 질환, 심장질환, 심부전, 울혈성 심부전, 고혈압, 본태성 고혈압, 원발성 고혈압, 염-민감성 고혈압, 간질환, 간경변증, 비알코올성 지방간염, 비알코올성 지방 간질환, 지방증, 원발성 경화성 담관염, 원발성 담즙성 담관염, 문맥 고혈압, 1형 당뇨병, 셀리악병, 다발성 경화증, 강직성 척추염, 류마티스성 관절염, 루푸스, 원형 탈모증, 류마티스성 다발근통, 다발성 경화증, 섬유근육통, 만성 피로 증후군, 쇼그렌 증후군, 백반증, 갑상선염, 혈관염, 크론병, 궤양성 대장염, 심마진(두드러기), 레이노 증후군, 조현병, 자폐 범주성 장애, 다발성 경화증, 간성뇌증, 소장 박테리아 과성장, 속발성 부갑상샘 항진증(PTH), 셀리악병, 고인산혈증 및 만성 알코올 중독으로 이루어진 군으로부터 선택되는, 체액저류 또는 염 과부하와 관련된 장애를 치료하는 방법.
- 제37항에 있어서, 상기 급성 염증은 전신 염증 반응 증후군, 패혈증 또는 다장기부전으로부터 선택되는, 체액저류 또는 염 과부하와 관련된 장애를 치료하는 방법.
- 제37항에 있어서, 상기 만성 염증은 관절염인, 체액저류 또는 염 과부하와 관련된 장애를 치료하는 방법.
- 제37항에 있어서, 상기 비만-유발성 대사 질환은 비알코올성 지방간염, 심혈관 질환, I형 당뇨병 또는 II형 당뇨병으로부터 선택되는, 체액저류 또는 염 과부하와 관련된 장애를 치료하는 방법.
- 나트륨 및 수소 이온의 NHE-매개 역수송을 저해하기 위한, 제1항 내지 제33항 중 어느 한 항의 화합물 또는 약제학적 조성물의 용도.
- 체액저류 또는 염 과부하와 관련된 장애를 치료하기 위한, 제1항 내지 제33항 중 어느 한 항의 화합물 또는 약제학적 조성물의 용도.
- 밀착연접에서 양성자의 세포내 축적을 야기하는 제제를 투여하는 단계를 포함하는, 세포사이 침투성과 관련된 질환을 치료하는 방법.
- 제44항에 있어서, 상기 제제는 NHE-3 저해제인, 세포사이 침투성과 관련된 질환을 치료하는 방법.
- 제45항에 있어서, 상기 NHE-3 저해제는 하기 화학식 I의 화합물 또는 이의 약제학적으로 허용 가능한 염, 프로드러그, 용매화물, 수화물, 이성질체, 또는 호변이성질체인, 세포사이 침투성과 관련된 질환을 치료하는 방법:
식 중:
링커는 -(CHR8)p-[Y-(CH2)r]s-Z-R8-(CH2)t-Z-이며;
Q는 결합 또는 -NHC(O)NH-이고;
Z는 독립적으로, 각각의 경우에, 결합, C(O) 또는 -C(O)NH-이며;
Y는 독립적으로, 각각의 경우에, O, S, NH, N(C1-C3알킬) 또는 -C(O)NH-이고;
X는 결합, N, O, CR11R12, CR11, C 또는 -NHC(O)NH-이며;
n은 2 내지 4의 정수이며;
r 및 p는 독립적으로, 각각의 경우에, 0 내지 8의 정수이고;
s는 0 내지 4의 정수이며;
t는 0 내지 4의 정수이고;
u는 0 내지 2의 정수이며;
R1 및 R2는 독립적으로 할로겐, OH, CN, C1-C6알킬, C1-C6알콕시, C1-C6할로알킬, C1-C6할로알콕시 또는 -C(O)NR9R10이고;
R3, R4, R5 및 R6은 독립적으로 H, 할로겐, OH, CN, -NO2, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴, N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴, -SR9, -OR9, -NHR9, -NR9R10, -S(O)2N(R9)2-, -S(O)2R9, -C(O)R9, -C(O)OR9, -NR9S(O)2R10, -S(O)R9, -S(O)NR9R10, -NR8S(O)R9이며;
R7은 독립적으로 각각의 경우에, H, C1-C6알킬, 또는 C1-C6할로알킬이고;
R8은 독립적으로 각각의 경우에, 결합, H, C1-C6알킬, C4-C8사이클로알켄일 , C3-C8사이클로알킬, 헤테로사이클릴, 아릴 또는 헤테로아릴이되, 각각의 사이클로알켄일, 사이클로알킬, 헤테로사이클릴, 아릴 또는 헤테로아릴은 하나 이상의 R17로 선택적으로 치환되거나; 또는
R7 및 R8은 그들이 부착된 원자와 함께 조합되어 독립적으로 각각의 경우에, 헤테로사이클릴 또는 N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴을 형성하되, 각각의 헤테로사이클릴 또는 헤테로아릴은 하나 이상의 R17로 선택적으로 치환되며;
R9 및 R10은 독립적으로 H, C1-C6알킬, C2-C6알켄일, C4-C8사이클로알켄일, C2-C6알킨일, C3-C8사이클로알킬, 헤테로사이클릴, 아릴, 또는 N, S, P 및 O로 이루어진 군으로부터 선택된 1 내지 5개의 헤테로원자를 함유하는 헤테로아릴이고,
R11 및 R12는 독립적으로 H, C1-C6알킬, OH, NH2, CN 또는 NO2이며;
R13, R14, R15 및 R16은 독립적으로 각각의 경우에, H, OH, NH2 또는 C1-C3 알킬이되, 상기 알킬은 하나 이상의 R17로 선택적으로 치환되고; 그리고
R17은 독립적으로 각각의 경우에, H, OH, NH2, 옥소, C1-C6알킬, C1-C6할로알킬, 또는 C1-C6알콕시이며;
단:
(1) X가 결합, O 또는 CR11R12일 때, n은 2이고;
(2) n이 3일 때, X는 CR11 또는 N이며;
(3) n이 4일 때, X는 C이고;
(4) Q 또는 X 중 하나만이 이 때에 -NHC(O)NH-이며;
(5) R1 및 R2가 클로로일 때, Q는 -NHC(O)NH-이고, 그리고 R3, R4, R5 및 R6은 H이며, 링커는 이 아니고;
(6) R1 및 R2가 클로로일 때, Q는 -NHC(O)NH-이고, 그리고 R3, R4, R5 및 R6은 H이며, 링커는 이 아니다. - 제44항에 있어서, 상기 제제는 NHE-3 저해제가 아닌, 세포사이 침투성과 관련된 질환을 치료하는 방법.
- 제44항 내지 제47항 중 어느 한 항에 있어서, 상기 질환은 위장 운동 장애, 과민성 장 증후군, 만성 변비, 만성 특발성 변비, 낭성 섬유증에서 생기는 만성 변비, 오피오이드-유발성 변비, 만성 가성 장폐색증, 결장 가성 폐색증, 궤양성 대장염, 염증성 장 질환, 만성 신장병(4기 또는 5기)과 관련된 위장관 장애, 칼슘 보충제에 의해 유발된 변비, 치료제의 사용과 관련된 변비, 신경병 장애(파킨슨병, 다발성 경화증)와 관련된 변비, 수술 후 변비(수술후 장 폐색증), 특발성 변비(기능성 변비 또는 느린 수송 변비), 신경병과 관련된 변비, 대사 또는 내분비 장애, 진통제(예를 들어, 오피오이드), 항고혈압, 항경련제, 항우울제, 진경제 및 항정신병약으로부터 선택된 약물의 사용에 기인하는 변비, 위궤양, 감염성 설사, 장 누수 증후군, 낭성 섬유증 위장 질환, 미세장염, 괴사성 장염, 아토피, 식품 알레르기, 급성 염증, 만성 염증, 비만-유발성 대사 질환, 신장 질환, 만성 신장병, 당뇨성 신장 질환, 심장질환, 심부전, 울혈성 심부전, 고혈압, 본태성 고혈압, 원발성 고혈압, 염-민감성 고혈압, 간질환, 간경변증, 비알코올성 지방간염, 비알코올성 지방 간질환, 지방증, 원발성 경화성 담관염, 원발성 담즙성 담관염, 문맥 고혈압, 1형 당뇨병, 셀리악병, 다발성 경화증, 강직성 척추염, 류마티스성 관절염, 루푸스, 원형 탈모증, 류마티스성 다발근통, 다발성 경화증, 섬유근육통, 만성 피로 증후군, 쇼그렌 증후군, 백반증, 갑상선염, 혈관염, 크론병, 궤양성 대장염, 심마진(두드러기), 레이노 증후군, 조현병, 자폐 범주성 장애, 다발성 경화증, 간성뇌증, 소장 박테리아 과성장, 속발성 부갑상샘 항진증(PTH), 셀리악병, 고인산혈증 및 만성 알코올 중독으로부터 선택되는, 세포사이 침투성과 관련된 질환을 치료하는 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762444338P | 2017-01-09 | 2017-01-09 | |
| US62/444,338 | 2017-01-09 | ||
| PCT/US2018/013027 WO2018129557A1 (en) | 2017-01-09 | 2018-01-09 | Inhibitors of nhe-mediated antiport |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20190128626A true KR20190128626A (ko) | 2019-11-18 |
Family
ID=61074570
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197023351A KR20190128626A (ko) | 2017-01-09 | 2018-01-09 | Nhe-매개 역수송의 저해제 |
Country Status (14)
| Country | Link |
|---|---|
| US (1) | US11147884B2 (ko) |
| EP (1) | EP3565811A1 (ko) |
| JP (1) | JP2020505333A (ko) |
| KR (1) | KR20190128626A (ko) |
| CN (1) | CN110291082A (ko) |
| AU (1) | AU2018206479B2 (ko) |
| BR (1) | BR112019013963A2 (ko) |
| CA (1) | CA3049679A1 (ko) |
| EA (1) | EA201991676A1 (ko) |
| IL (1) | IL267821B2 (ko) |
| MA (1) | MA47203A (ko) |
| MX (1) | MX2019008171A (ko) |
| WO (1) | WO2018129557A1 (ko) |
| ZA (1) | ZA201904460B (ko) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2020181555A1 (zh) * | 2019-03-14 | 2020-09-17 | 深圳仁泰医药科技有限公司 | Nhe3抑制剂的晶型a及其制备方法和应用 |
| CN112679427B (zh) * | 2019-10-17 | 2023-05-12 | 江苏恒瑞医药股份有限公司 | 四氢异喹啉类衍生物、其制备方法及其在医药上的应用 |
| TWI805137B (zh) * | 2020-12-18 | 2023-06-11 | 大陸商上海濟煜醫藥科技有限公司 | 苯并雜環取代四氫異喹啉類化合物 |
| CN113636960A (zh) * | 2021-08-24 | 2021-11-12 | 上海皓元医药股份有限公司 | 一种2-(氯磺酰基)环己烷-1-烯甲酸乙酯衍生物的制备方法 |
| CN117462525A (zh) * | 2023-09-06 | 2024-01-30 | 广州市第一人民医院(广州消化疾病中心、广州医科大学附属市一人民医院、华南理工大学附属第二医院) | 衣康酸在治疗坏死性小肠结肠炎患者中的应用 |
Family Cites Families (128)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3926891A (en) | 1974-03-13 | 1975-12-16 | Dow Chemical Co | Method for making a crosslinkable aqueous solution which is useful to form soft, water-swellable polyacrylate articles |
| US3935099A (en) | 1974-04-03 | 1976-01-27 | The United States Of America As Represented By The Secretary Of Agriculture | Method of reducing water content of emulsions, suspensions, and dispersions with highly absorbent starch-containing polymeric compositions |
| US3997484A (en) | 1974-04-03 | 1976-12-14 | The United States Of America As Represented By The Secretary Of Agriculture | Highly-absorbent starch-containing polymeric compositions |
| US4090013A (en) | 1975-03-07 | 1978-05-16 | National Starch And Chemical Corp. | Absorbent composition of matter |
| JPS51125468A (en) | 1975-03-27 | 1976-11-01 | Sanyo Chem Ind Ltd | Method of preparing resins of high water absorbency |
| JPS5346389A (en) | 1976-10-07 | 1978-04-25 | Kao Corp | Preparation of self-crosslinking polymer of acrylic alkali metal salt |
| US4190562A (en) | 1977-04-04 | 1980-02-26 | The B. F. Goodrich Company | Improved water absorbent copolymers of copolymerizable carboxylic acids and acrylic or methacrylic esters |
| US4470975A (en) | 1977-10-21 | 1984-09-11 | The Johns Hopkins University | Method and composition for the elimination of water from an animal body |
| US4286082A (en) | 1979-04-06 | 1981-08-25 | Nippon Shokubai Kagaku Kogyo & Co., Ltd. | Absorbent resin composition and process for producing same |
| JPS6025045B2 (ja) | 1980-03-19 | 1985-06-15 | 製鉄化学工業株式会社 | 塩水吸収能のすぐれたアクリル酸重合体の製造方法 |
| JPS57158209A (en) | 1981-03-25 | 1982-09-30 | Kao Corp | Production of bead-form highly water-absorbing polymer |
| JPS5832607A (ja) | 1981-08-20 | 1983-02-25 | Kao Corp | 吸水性に優れた吸水材料の製造法 |
| US4985518A (en) | 1981-10-26 | 1991-01-15 | American Colloid Company | Process for preparing water-absorbing resins |
| JPS6187702A (ja) | 1984-10-05 | 1986-05-06 | Seitetsu Kagaku Co Ltd | 吸水性樹脂の製造方法 |
| US4708997A (en) | 1985-07-22 | 1987-11-24 | The Dow Chemical Company | Suspending agent for the suspension polymerization of water-soluble monomers |
| US4806532A (en) | 1985-10-08 | 1989-02-21 | Mayo Foundation For Medical Education And Research | Inhibition of epithelial phosphate transport |
| DE3544770A1 (de) | 1985-12-18 | 1987-06-19 | Stockhausen Chem Fab Gmbh | Verfahren und vorrichtung zum kontinuierlichen herstellen von polymerisaten und copolymerisaten der acrylsaeure und/oder methacrylsaeure |
| US4766004A (en) | 1986-12-19 | 1988-08-23 | Warner-Lambert Company | Crunchy, highly palatable, bulk-increasing, dietary fiber supplement composition |
| IT1217123B (it) | 1987-02-05 | 1990-03-14 | Rotta Research Lab | Derivati otticamente attivi dell acido 5 pentilammino 5 oxo pentanoico r ad attivita antagonista della colecistochinina e procedimento per la loro preparazione |
| US4999200A (en) | 1987-12-09 | 1991-03-12 | Marion Laboratories | Psyllium tablet composition, method of manufacture and method of use |
| US5149541A (en) | 1988-10-03 | 1992-09-22 | The Procter & Gamble Company | Psyllium-containing produces with a distribution of particle size |
| US5145906A (en) | 1989-09-28 | 1992-09-08 | Hoechst Celanese Corporation | Super-absorbent polymer having improved absorbency properties |
| US5126150A (en) | 1990-10-01 | 1992-06-30 | The Procter & Gamble Company | Compositions containing psyllium |
| HUT64023A (en) | 1991-03-22 | 1993-11-29 | Sandoz Ag | Process for producing aminoguanidine derivatives and pharmaceutical compositions comprising such compounds |
| FR2674849B1 (fr) | 1991-04-02 | 1994-12-23 | Logeais Labor Jacques | Nouveaux derives de n-cyclohexyl benzamides ou thiobenzamides, leurs preparations et leurs applications en therapeutique. |
| US5140102A (en) | 1991-09-23 | 1992-08-18 | Monsanto Company | Pentadecapeptide, guanylin, which stimulates intestinal guanylate cyclase |
| US5824645A (en) | 1991-12-30 | 1998-10-20 | Neurex Corporation | Method of treating inflammation |
| AU689438B2 (en) | 1991-12-30 | 1998-04-02 | Azur Pharma International Limited | Methods of producing analgesia and enhancing opiate analgesia |
| US5969097A (en) | 1992-06-23 | 1999-10-19 | G. D. Searle & Co. | Human guanylin |
| ATE157351T1 (de) | 1993-02-20 | 1997-09-15 | Hoechst Ag | Substituierte benzoylguanidine, verfahren zu ihrer herstellung, ihre verwendung als medikament, als inhibitoren des zellulären na+/h+-austauschs oder als diagnostikum sowie sie enthaltendes medikament |
| US5629377A (en) | 1993-03-10 | 1997-05-13 | The Dow Chemical Company | Water absorbent resin particles of crosslinked carboxyl containing polymers and method of preparation |
| IL109570A0 (en) | 1993-05-17 | 1994-08-26 | Fujisawa Pharmaceutical Co | Guanidine derivatives, pharmaceutical compositions containing the same and processes for the preparation thereof |
| US5489670A (en) | 1993-10-29 | 1996-02-06 | G. D. Searle & Co. | Human uroguanylin |
| US5610145A (en) | 1994-04-15 | 1997-03-11 | Warner-Lambert Company | Tachykinin antagonists |
| US5650222A (en) | 1995-01-10 | 1997-07-22 | The Procter & Gamble Company | Absorbent foam materials for aqueous fluids made from high internal phase emulsions having very high water-to-oil ratios |
| DE19518796A1 (de) | 1995-05-22 | 1996-11-28 | Hoechst Ag | Fluorphenylsubstituierte Alkenylcarbonsäure-guanidine, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament oder Diagnostikum sowie sie enthaltendes Medikament |
| US6054429A (en) | 1996-03-08 | 2000-04-25 | Elan Pharmaceuticals, Inc. | Epidural method of producing analgesia |
| PT835126E (pt) | 1995-06-27 | 2003-07-31 | Elan Pharm Inc | Composicoes e formulacoes para a producao de analgesia e para a inibicao de patologias dolorosas neuropaticas |
| US5795864A (en) | 1995-06-27 | 1998-08-18 | Neurex Corporation | Stable omega conopetide formulations |
| US5550167A (en) | 1995-08-30 | 1996-08-27 | The Procter & Gamble Company | Absorbent foams made from high internal phase emulsions useful for acquiring aqueous fluids |
| US6277862B1 (en) | 1995-11-24 | 2001-08-21 | Smithkline Beecham S.P.A. | Quinoline derivatives |
| GB9524104D0 (en) | 1995-11-24 | 1996-01-24 | Smithkline Beecham Spa | Novel compounds |
| DE19548812A1 (de) | 1995-12-27 | 1997-07-03 | Hoechst Ag | Verwendung von Inhibitoren des zellulären Na·+·/H·+·-Exchangers (NHE) zur Herstellung eines Medikaments zur Atemstimulation |
| EP0837055A1 (en) | 1996-07-30 | 1998-04-22 | Hoechst Aktiengesellschaft | Substituted Indanylidineacetylguanidines, process for their preparation, their use as medicaments or diagnostic and medicaments containing them |
| DE19633966A1 (de) | 1996-08-22 | 1998-02-26 | Hoechst Ag | Phenylsubstituierte Alkenylcarbonsäure-guanidine, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament oder Diagnostikum sowie sie enthaltendes Medikament |
| WO1998011090A2 (en) | 1996-09-16 | 1998-03-19 | Warner-Lambert Company | 3-alkyl-3-phenyl-piperidines |
| AU6823098A (en) | 1997-02-28 | 1998-09-18 | Byk Gulden Lomberg Chemische Fabrik Gmbh | Synergistic combination of pde inhibitors and adenylate cyclase agonists or guanyl cyclyse agonists |
| NZ329807A (en) | 1997-04-23 | 2000-07-28 | Pfizer | NK-1 receptor antagonists and P receptor antagonists 2-Diarylmethyl-3-amino-1-azabicyclo[2.2.2]octane derivatives and amino substituted N-containing rings as agents for treating irritable bowel syndrome |
| KR100219918B1 (ko) | 1997-07-03 | 1999-09-01 | 김윤 | 대장선택적 약물전달용 조성물 |
| US20010006972A1 (en) | 1998-04-21 | 2001-07-05 | Stephen A. Williams | Nk-1 receptor antagonists for the treatment of symptoms of irritable bowel syndrome |
| KR20000011247A (ko) | 1998-07-23 | 2000-02-25 | 김윤 | 다당류를이용한대장선택성약물전달조성물및약학제제 |
| DE19849722A1 (de) | 1998-10-28 | 2000-05-04 | Aventis Pharma Gmbh | Substituierte Phenyl-alkenoylguanidine, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament oder Diagnostikum sowie sie enthaltendes Medikament |
| AU3213200A (en) | 1999-01-21 | 2000-08-07 | Board Of Regents, The University Of Texas System | Inhibitors of intestinal apical membrane na/phosphate co-transportation |
| FR2789493B1 (fr) | 1999-02-09 | 2001-03-09 | Gemplus Card Int | Procede de detection d'objets portables et systeme de mise en oeuvre |
| US6624150B2 (en) | 1999-02-26 | 2003-09-23 | Inspire Pharmaceuticals, Inc. | Method of treating gastrointestinal tract disease with purinergic receptor agonists |
| US6287609B1 (en) | 1999-06-09 | 2001-09-11 | Wisconsin Alumni Research Foundation | Unfermented gel fraction from psyllium seed husks |
| JP2004513870A (ja) | 1999-07-19 | 2004-05-13 | ザ・ユニヴァーシティ・オヴ・ノース・キャロライナ・アト・チャペル・ヒル | ナトリウムチャネルブロッカーの結合物及びその使用法 |
| CO5190714A1 (es) | 1999-07-20 | 2002-08-29 | Smithkline Beecham Corp | Inhibidores del transporte de fosfato |
| US6107356A (en) | 1999-08-23 | 2000-08-22 | The Procter & Gamble Company | High suction polymeric foam materials |
| DE19941764A1 (de) | 1999-09-02 | 2001-03-15 | Aventis Pharma Gmbh | Substituierte Acylguanidine, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikamente oder Diagnostika sowie sie enthaltende Medikamente |
| SE9903291D0 (sv) | 1999-09-15 | 1999-09-15 | Astra Ab | New process |
| DE19945302A1 (de) | 1999-09-22 | 2001-03-29 | Merck Patent Gmbh | Biphenylderivate als NHE-3-Inhibitoren |
| ES2244474T3 (es) * | 1999-09-29 | 2005-12-16 | Ortho-Mcneil Pharmaceutical, Inc. | Isonipecotamida para el tratamiento de trastornos mediados por integrina. |
| US6887870B1 (en) | 1999-10-12 | 2005-05-03 | Bristol-Myers Squibb Company | Heterocyclic sodium/proton exchange inhibitors and method |
| EP1225897B1 (en) | 1999-11-01 | 2004-09-08 | RHODES, John | Composition for treatment of constipation and irritable bowel syndrome |
| AUPQ514600A0 (en) | 2000-01-18 | 2000-02-10 | James Cook University | Brain injury treatment |
| WO2001064212A1 (en) | 2000-03-01 | 2001-09-07 | University College London | Modulators of the endocannabinoid uptake and of the vallinoid receptors |
| DE10015248A1 (de) | 2000-03-28 | 2001-10-04 | Merck Patent Gmbh | Bisamidino-Verbindungen als NHE-3 Inhibitoren |
| DE10019062A1 (de) | 2000-04-18 | 2001-10-25 | Merck Patent Gmbh | 2-Guanidino-4-aryl-chinazoline als NHE-3 Inhibitoren |
| WO2001082924A1 (en) | 2000-05-02 | 2001-11-08 | Smithkline Beecham Corporation | Phosphate transport inhibitors |
| HUP0302234A2 (hu) | 2000-05-12 | 2003-11-28 | Smithkline Beecham Corp. | Foszfát-transzport inhibitorok, ezeket tartalmazó gyógyszerkészítmények és alkalmazásuk |
| DE10043667A1 (de) | 2000-09-05 | 2002-03-14 | Merck Patent Gmbh | 2-Guanidino-4-aryl-chinazoline |
| US6414016B1 (en) | 2000-09-05 | 2002-07-02 | Sucampo, A.G. | Anti-constipation composition |
| DE10046993A1 (de) | 2000-09-22 | 2002-04-11 | Aventis Pharma Gmbh | Substituierte Zimtsäureguanidide, Verfahren zur ihrer Herstellung, ihre Verwendung als Medikament sowie sie enthaltendes Medikament |
| WO2002028353A2 (en) | 2000-10-05 | 2002-04-11 | Smithkline Beecham Corporation | Phosphate transport inhibitors |
| EP1381376B1 (en) | 2000-11-20 | 2008-01-02 | Sorbent Therapeutics, Inc. | Water-absorbent polymers and their use |
| DE10063294A1 (de) | 2000-12-19 | 2002-07-04 | Aventis Pharma Gmbh | Substituierte Heterocyclo-Norbornylamino-Derivate, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament oder Diagnostikum sowie sie enthaltendes Medikament |
| CA2441970C (en) | 2001-03-29 | 2013-01-22 | Synergy Pharmaceuticals, Inc. | Guanylate cyclase receptor agonists for the treatment of tissue inflammation and carcinogenesis |
| US6736705B2 (en) | 2001-04-27 | 2004-05-18 | Hitachi Global Storage Technologies | Polishing process for glass or ceramic disks used in disk drive data storage devices |
| US20030216449A1 (en) | 2001-05-11 | 2003-11-20 | Joseph Weinstock | Phosphate transport inhibitors |
| MY134211A (en) | 2001-05-18 | 2007-11-30 | Smithkline Beecham Corp | Novel use |
| JP2007131532A (ja) | 2001-09-28 | 2007-05-31 | Kirin Brewery Co Ltd | 生体内リン輸送を阻害する化合物およびそれを含んでなる医薬 |
| FR2830451B1 (fr) | 2001-10-09 | 2004-04-30 | Inst Nat Sante Rech Med | Utilisation de peptides analogues de la thymuline(pat)pour la fabrication de medicaments contre la douleur |
| US6911453B2 (en) | 2001-12-05 | 2005-06-28 | Aventis Pharma Deutschland Gmbh | Substituted 4-phenyltetrahydroisoquinolinium, process for their preparation, their use as a medicament, and medicament containing them |
| JPWO2003048134A1 (ja) | 2001-12-05 | 2005-04-14 | 日本たばこ産業株式会社 | トリアゾール化合物及びその医薬用途 |
| IL162316A0 (en) | 2001-12-05 | 2005-11-20 | Aventis Pharma Gmbh | Substituted 4-phenyltetrahydroisoquinolines, method for the production thereof, the use thereof as medicaments, in addition t |
| DE10161767A1 (de) | 2001-12-15 | 2003-06-26 | Merck Patent Gmbh | 2-Guanidino-4-heterocyclyl-chinazoline |
| EP1321142A1 (en) | 2001-12-21 | 2003-06-25 | Novartis AG | Solid pharmaceutical composition for oral administration of Tegaserod |
| US6703405B2 (en) | 2001-12-22 | 2004-03-09 | Aventis Pharma Deutschland Gmbh | Substituted 4-phenyltetrahydroisoquinolinium salts, process for their preparation, their use as a medicament, and medicament containing them |
| DE10163992A1 (de) | 2001-12-24 | 2003-07-03 | Merck Patent Gmbh | 4-Aryl-chinazoline |
| US7119120B2 (en) | 2001-12-26 | 2006-10-10 | Genzyme Corporation | Phosphate transport inhibitors |
| EP1485078B1 (en) | 2002-03-15 | 2012-09-26 | Cypress Bioscience, Inc. | Milnacipran for the treatment of irritable bowel syndrome |
| DE60307799T2 (de) | 2002-03-19 | 2007-08-16 | Genzyme Corp., Cambridge | Hemmer des phosphattransports |
| CN101310723A (zh) | 2002-05-17 | 2008-11-26 | 迪欧加药品公司 | 有效的选择性阿片受体调制剂化合物的用途 |
| US7014862B2 (en) | 2002-05-20 | 2006-03-21 | The Procter & Gamble Company | Chewable compositions containing a gel-forming extract of psyllium |
| US6923466B2 (en) | 2002-12-17 | 2005-08-02 | James Tsai | Collapsible handcart capable of extending the area of carrier by operating handle |
| US7304036B2 (en) | 2003-01-28 | 2007-12-04 | Microbia, Inc. | Methods and compositions for the treatment of gastrointestinal disorders |
| US20050054705A1 (en) | 2003-02-04 | 2005-03-10 | Aventis Pharma Deutschland Gmbh | N-substituted (benzoimidazol-2-yl) phenylamines, process for their preparation, their use as medicament or diagnostic aid, and medicament comprising them |
| US7026303B2 (en) | 2003-02-18 | 2006-04-11 | The Procter & Gamble Company | Compositions comprising a polysaccharide component and one or more coating layers |
| WO2004085448A2 (en) | 2003-03-19 | 2004-10-07 | Genzyme Corporation | Unsaturated phosphinyl-phosphonate phosphate transport inhibitors |
| DE10312963A1 (de) | 2003-03-24 | 2004-10-07 | Aventis Pharma Deutschland Gmbh | Substituierte 4-Phenyltetrahydroisochinoline, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament, sowie sie enthaltendes Medikament |
| US7241775B2 (en) | 2003-03-24 | 2007-07-10 | Sanofi-Aventis Deutschland Gmbh | Composition, process of making, and medical use of substituted 4-phenyltetrahydroisoquinolines |
| JP4926473B2 (ja) | 2003-03-27 | 2012-05-09 | 協和発酵キリン株式会社 | 生体内リン輸送を阻害する化合物およびそれを含んでなる医薬 |
| US20050244367A1 (en) | 2004-05-03 | 2005-11-03 | Ilypsa, Inc. | Phospholipase inhibitors localized in the gastrointestinal lumen |
| MXPA06013236A (es) | 2004-05-14 | 2007-02-28 | Univ North Carolina | Prouroguanilina, y analogos sinteticos o productos de escision proteolitica derivados de la misma, como agentes terapeuticos y de diagnostico para enfermedades que comprenden hemeostasis de sales y/o fluidos. |
| DE102004046492A1 (de) | 2004-09-23 | 2006-03-30 | Sanofi-Aventis Deutschland Gmbh | Substituierte 4-Phenyltetrahydroisochinoline, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament, sowie sie enthaltendes Medikament |
| DE102004054847A1 (de) | 2004-11-13 | 2006-05-24 | Sanofi-Aventis Deutschland Gmbh | Substituierte Benzoylguanidine, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament oder Diagnostikum sowie sie enthaltendes Medikament |
| DE102005001411A1 (de) | 2005-01-12 | 2006-07-27 | Sanofi-Aventis Deutschland Gmbh | Substituierte 4-Phenyltetrahydroisochinoline, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament, sowie sie enthaltendes Medikament |
| DE102005044817A1 (de) | 2005-09-20 | 2007-03-22 | Sanofi-Aventis Deutschland Gmbh | Substituierte 4-Phenyltetrahydroisochinoline, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament, sowie sie enthaltendes Medikament |
| DE102005044815A1 (de) | 2005-09-20 | 2007-03-22 | Sanofi-Aventis Deutschland Gmbh | Verwendung von Inhibitoren des Na+/H+ Austauschers, Subtyp 5 (NHE5) zur Gedächtnisverbesserung |
| JP2009514893A (ja) | 2005-11-03 | 2009-04-09 | イリプサ, インコーポレイテッド | 多価インドール化合物およびホスホリパーゼa2インヒビターとしてのその使用 |
| MX2008005661A (es) | 2005-11-03 | 2008-12-15 | Ilypsa Inc | Inhibidores de fosfolipasa, que incluyen inhibidores de fosfolipasa multivalente, y uso de los mismos, que incluyen como inhibidores de fosfolipasa localizadas en el lumen. |
| US20120283411A9 (en) | 2006-06-29 | 2012-11-08 | Ironwood Pharmaceuticals, Inc. | Methods and compositions for the treatment of gastrointestinal disorders |
| US8779090B2 (en) | 2007-02-26 | 2014-07-15 | Ironwood Pharmaceuticals, Inc. | Methods and compositions for the treatment of heart failure and other disorders |
| US20120040025A9 (en) | 2007-05-04 | 2012-02-16 | Currie Mark G | Compositions and Methods for Treating Disorders Associated with Salt or Fluid Retention |
| EP2342178B1 (en) | 2008-09-02 | 2016-09-28 | Sanofi | Substituted aminoindanes and analogs thereof, and the pharmaceutical use thereof |
| PL2384318T3 (pl) * | 2008-12-31 | 2018-04-30 | Ardelyx, Inc. | Związki i sposoby inhibicji mediowanego przez NHE antyportu w leczeniu zaburzeń związanych z retencją płynów lub nadmiarem soli i chorób przewodu pokarmowego |
| US10543207B2 (en) | 2008-12-31 | 2020-01-28 | Ardelyx, Inc. | Compounds and methods for inhibiting NHE-mediated antiport in the treatment of disorders associated with fluid retention or salt overload and gastrointestinal tract disorders |
| EP2591354B1 (en) | 2010-07-07 | 2016-09-07 | Ardelyx, Inc. | Compounds and methods for inhibiting phosphate transport |
| EP2590655B1 (en) | 2010-07-07 | 2015-06-24 | Ardelyx, Inc. | Compounds and methods for inhibiting phosphate transport |
| EP2590656B1 (en) | 2010-07-07 | 2017-11-15 | Ardelyx, Inc. | Compounds and methods for inhibiting phosphate transport |
| WO2012006477A1 (en) | 2010-07-07 | 2012-01-12 | Ardelyx, Inc. | Compounds and methods for inhibiting phosphate transport |
| CN103889983B (zh) * | 2011-09-14 | 2015-12-09 | 普罗克西梅根有限公司 | 酶抑制剂化合物 |
| CN104902930A (zh) | 2012-08-21 | 2015-09-09 | 阿德利克斯公司 | 在治疗与液体潴留或盐分过载相关的疾病和胃肠道疾病中用于抑制nhe-介导的反向转运的化合物和方法 |
| CN104837503B (zh) * | 2012-08-21 | 2018-11-09 | 阿德利克斯公司 | 在治疗与液体潴留或盐分过载相关的疾病和胃肠道疾病中用于抑制nhe-介导的反向转运的化合物和方法 |
| WO2014169094A2 (en) | 2013-04-12 | 2014-10-16 | Ardelyx, Inc | Nhe3-binding compounds and methods for inhibiting phosphate transport |
| ME03311B (me) * | 2014-07-25 | 2019-10-20 | Taisho Pharmaceutical Co Ltd | Fenil teтrahidroizokvinolinsko jedinjenje supsтituisano heteroarilom |
| MX2019008170A (es) * | 2017-01-09 | 2020-02-07 | Ardelyx Inc | Compuestos útiles para tratar transtornos del tracto gastrointestinal. |
-
2018
- 2018-01-09 AU AU2018206479A patent/AU2018206479B2/en active Active
- 2018-01-09 WO PCT/US2018/013027 patent/WO2018129557A1/en unknown
- 2018-01-09 CA CA3049679A patent/CA3049679A1/en active Pending
- 2018-01-09 BR BR112019013963A patent/BR112019013963A2/pt not_active Application Discontinuation
- 2018-01-09 US US16/476,835 patent/US11147884B2/en active Active
- 2018-01-09 KR KR1020197023351A patent/KR20190128626A/ko not_active Application Discontinuation
- 2018-01-09 EP EP18701988.0A patent/EP3565811A1/en not_active Withdrawn
- 2018-01-09 MX MX2019008171A patent/MX2019008171A/es unknown
- 2018-01-09 MA MA047203A patent/MA47203A/fr unknown
- 2018-01-09 CN CN201880011759.6A patent/CN110291082A/zh active Pending
- 2018-01-09 EA EA201991676A patent/EA201991676A1/ru unknown
- 2018-01-09 JP JP2019537134A patent/JP2020505333A/ja active Pending
-
2019
- 2019-07-03 IL IL267821A patent/IL267821B2/en unknown
- 2019-07-08 ZA ZA2019/04460A patent/ZA201904460B/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| ZA201904460B (en) | 2022-05-25 |
| WO2018129557A1 (en) | 2018-07-12 |
| IL267821B2 (en) | 2023-02-01 |
| US11147884B2 (en) | 2021-10-19 |
| IL267821B (en) | 2022-10-01 |
| JP2020505333A (ja) | 2020-02-20 |
| CN110291082A (zh) | 2019-09-27 |
| MA47203A (fr) | 2019-11-13 |
| AU2018206479A1 (en) | 2019-07-25 |
| BR112019013963A2 (pt) | 2020-04-28 |
| AU2018206479B2 (en) | 2022-07-14 |
| IL267821A (en) | 2019-09-26 |
| US20190374649A1 (en) | 2019-12-12 |
| MX2019008171A (es) | 2020-02-05 |
| EA201991676A1 (ru) | 2020-01-30 |
| CA3049679A1 (en) | 2018-07-12 |
| EP3565811A1 (en) | 2019-11-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101766619B1 (ko) | 체액 저류 또는 염 과부하와 연관된 장애 및 위장관 장애의 치료 시에 nhe-매개된 역수송을 억제하는 화합물 및 방법 | |
| JP7292207B2 (ja) | 消化管障害を処置するために有用な化合物 | |
| KR20190128626A (ko) | Nhe-매개 역수송의 저해제 | |
| KR102138391B1 (ko) | 체액 저류 또는 염 과부하와 연관된 장애 및 위장관 장애의 치료에서 nhe-매개된 역수송 저해를 위한 화합물 및 방법 | |
| US20200268741A1 (en) | Compounds and methods for inhibiting nhe-mediated antiport in the treatment of disorders associated with fluid retention or salt overload and gastrointestinal tract disorders | |
| JP6392754B2 (ja) | 体液貯留又は塩過負荷に関係する疾患及び消化管疾患の治療におけるnhe仲介の逆輸送を阻害するための化合物並びに方法 | |
| KR102669987B1 (ko) | 위장관 장애를 치료하는 데 유용한 화합물 | |
| US10376481B2 (en) | Compounds and methods for inhibiting NHE-mediated antiport in the treatment of disorders associated with fluid retention or salt overload and gastrointestinal tract disorders |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |