KR20190084264A - Cd160 막 횡단 동형체에 결합하는 단클론 항체 - Google Patents
Cd160 막 횡단 동형체에 결합하는 단클론 항체 Download PDFInfo
- Publication number
- KR20190084264A KR20190084264A KR1020197014634A KR20197014634A KR20190084264A KR 20190084264 A KR20190084264 A KR 20190084264A KR 1020197014634 A KR1020197014634 A KR 1020197014634A KR 20197014634 A KR20197014634 A KR 20197014634A KR 20190084264 A KR20190084264 A KR 20190084264A
- Authority
- KR
- South Korea
- Prior art keywords
- antibody
- seq
- monoclonal antibody
- cells
- cell
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/06—Antianaemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/6811—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a protein or peptide, e.g. transferrin or bleomycin
- A61K47/6817—Toxins
- A61K47/6819—Plant toxins
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/55—Fab or Fab'
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/732—Antibody-dependent cellular cytotoxicity [ADCC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/734—Complement-dependent cytotoxicity [CDC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
Abstract
본 발명은 CD160-TM 동형에 결합하는 단클론 항체에 관한 것이다. 본 발명자들은 CD160-TM 동형에 결합하지만, CD160 GPI-고정된 동형이나 CD160 가용성 동형에는 결합하지 않는 신규의 단클론 항체를 개발하였다. 특히, 본 발명의 항체는 NK 세포 활성화 및 따라서 NK 세포 세포독성 기능을 증폭시키기에 적합하다.
Description
본 발명은 CD160-TM 동형(isoform)에 결합하는 항체(바람직하게는 단클론 항체(monoclonal antibody))에 관한 것이다.
CD160은 처음에 말초 혈액 NK 세포상에서 주로 발현되는 GPI-고정된(CD160-GPI) MHC-I 부류 활성화 수용체로서 동정되었다. CD160 유전자의 선택적 이어맞추기로부터 생성되는 CD160 막관통 동형(CD160-TM)의 동정이 추가로 보고되었다. CD160-TM 표면 발현은 NK 세포로 고도로 제한되며 활성화-의존적임이 확립되었다(Giustiniani J et al. J Immunol. 2009 Jan 1;182(1):63-71). 실제로, CD160-TM은 오직 활성화된 NK 세포에 의해서만 발현되는 반면, CD160-GPI는 NK 세포(활성화되거나 활성화되지 않은) 및 T 세포의 상이한 부분집합들에 의해서 발현된다. 또한, CD160-TM은 그의 관여시 관찰되는 증가된 CD107a NK 세포 표면 동원에 의해 평가된 바와 같이, 신규의 활성화 수용체를 나타낸다는 증거가 제공되었다(Giustiniani J et al. 2009).
상응하게, CD160 GPI-고정된 동형이나 상기 CD160-GPI 동형의 단백질 분해 절단으로부터 생성될 수 있는 CD160 가용성 동형에는 결합하지 않고 CD160-TM 동형에 결합하는 항체는, 예를 들어 생체내에서 NK 세포 활성화 및 따라서 NK 세포의 효과기 기능(세포독성, 사이토킨 분비 등)의 증폭 또는 CD160-TM 발현 세포(특히 활성화된 NK 세포)의 고갈 유도에 적합할 수 있다. 특히, 상기 CD160-TM 동형에 결합할 수 있지만 CD160-GPI 동형에는 결합할 수 없는 항체를 사용하면 사이토킨 폭풍 위험과 같은 임의의 전신 독성이 회피될 것이다.
WO2008/009711은 CD160-GPI에 결합 가능한 IgG1인 항체 CL1-R2를 기재한다.
문헌[Giustiniani J. et al. (Curr Mol Med. 2012 Feb;12(2):188-98]은 CD160-TM 동형에 결합하는 단클론 항체를 기재한다. 그러나, 상기 항체는 또한 CD160의 가용성 동형에도 결합한다.
WO2008/155363은 CD160-GPI 동형에 결합하지 않는, CD160-TM에 대한 다클론 항체의 생성을 기재한다. 상기 항체는 토끼를 CD160-TM의 아미노산 144-158(KQRQHLEFSHNNEGTL, 서열번호 32)을 포함하는 펩티드(펩티드 2)로 면역시킴으로써 획득되었다.
본 발명에서, 발명자들은 CD160-TM 동형에 결합하지만 CD160-GPI 또는 가용성 CD160 동형에는 결합하지 않는 신규의 항체를 개발하였다.
발명의 요약
본 발명은 CD160-TM 동형에 결합하는 인간 항체(바람직하게는 단클론 항체)에 관한 것이다. 특히, 본 발명은 청구항들에 의해 정의된다.
특히, 본 발명은 CD160-TM 동형의 세포외 도메인에 결합하는 단클론 항체에 관한 것이며, 여기에서 상기 항체는 GPI-고정된 동형이나 CD160 가용성 동형에는 결합하지 않고, 상기 단클론 항체의 에피토프는 서열번호 1의 아미노산 잔기 175 내지 189 로부터의 적어도 하나의 아미노산 잔기를 포함한다.
하나의 실시태양에서, 상기 에피토프는 서열번호 1의 아미노산 잔기 62 내지 85 로부터의 적어도 하나의 아미노산 잔기를 추가로 포함한다.
하나의 실시태양에서, 본 발명의 단클론 항체는 키메라 항체(chimeric antibody), 인간화된 항체 또는 인간 항체이다.
하나의 실시태양에서, 본 발명의 단클론 항체는 하기의 CDR 중 적어도 하나를 포함하는 경쇄: i) 서열번호 6에 제시된 바와 같은 VL-CDR1(여기에서 X11은 Y 또는 S이고, X12는 G 또는 Y이다), ii) 서열번호 7에 제시된 바와 같은 VL-CDR2 및 iii) 서열번호 8에 제시된 바와 같은 VL-CDR3(여기에서 X3은 S 또는 Y이다), 및/ 하기의 CDR 중 적어도 하나를 포함하는 중쇄: i) 서열번호 9에 제시된 바와 같은 VH-CDR1(여기에서 X3은 S 또는 Y이다), ii) 서열번호 10에 제시된 바와 같은 VH-CDR2(여기에서 X1은 Y 또는 G이고 X10은 N 또는 S이다) 및 iii) 서열번호 11에 제시된 바와 같은 VH-CDR3을 포함한다.
하나의 실시태양에서, 본 발명의 단클론 항체는 하기의 CDR을 포함하는 경쇄: i) 서열번호 6에 제시된 바와 같은 VL-CDR1(여기에서 X11은 Y 또는 S이고, X12는 G 또는 Y이다), ii) 서열번호 7에 제시된 바와 같은 VL-CDR2 및 iii) 서열번호 8에 제시된 바와 같은 VL-CDR3(여기에서 X3은 S 또는 Y이다), 또는 하기의 CDR을 포함하는 중쇄: i) 서열번호 9에 제시된 바와 같은 VH-CDR1(여기에서 X3은 S 또는 Y이다), ii) 서열번호 10에 제시된 바와 같은 VH-CDR2(여기에서 X1은 Y 또는 G이고 X10은 N 또는 S이다) 및 iii) 서열번호 11에 제시된 바와 같은 VH-CDR3을 포함한다.
하나의 실시태양에서, 본 발명의 단클론 항체는 하기의 CDR: i) VL-CDR1: AGTSSDVGGYYGVS (서열번호 20), ii) VL-CDR2: YDSYRPS (서열번호 7) 및 iii) VL-CDR3: SSSTYYSTRV (서열번호 24)를 포함하는 경쇄를 포함하고, A12 항체의 중쇄는 하기의 CDR i) VH-CDR1: NYSMN (서열번호 26), ii) VH-CDR2: YIYGSSRYISYADFVKG (서열번호 29) 및 iii) VH-CDR3: GMDV (서열번호 11)를 포함한다.
하나의 실시태양에서, 본 발명의 단클론 항체는 하기의 CDR: i) VL-CDR1: AGTSSDVGGYSYVS (서열번호 23), ii) VL-CDR2: YDSYRPS (서열번호 7) 및 iii) VL-CDR3: SSYTYYSTRV (서열번호 25)를 포함하는 경쇄를 포함하고, A12 항체의 중쇄는 하기의 CDR i) VH-CDR1: NYYMN (서열번호 27), ii) VH-CDR2: GIYGSSRYINYADFVKG (서열번호 30) 및 iii) VH-CDR3: GMDV (서열번호 11)를 포함한다.
하나의 실시태양에서, 본 발명의 단클론 항체는 서열번호 12 또는 서열번호 14와 적어도 70%의 동일성(identity)을 갖는 중쇄 및 서열번호 13 또는 서열번호 15와 적어도 70%의 동일성을 갖는 경쇄를 포함한다. 하나의 실시태양에서, 본 발명의 단클론 항체는 서열번호 12 또는 서열번호 14와 동일한 중쇄 및 서열번호 13 또는 서열번호 15와 동일한 경쇄를 포함한다.
하나의 실시태양에서, 본 발명의 단클론 항체는 본 명세서에서 상기에 기재된 바와 같은 항체와 CD160-TM 동형에의 결합에 대해 교차-경쟁한다.
하나의 실시태양에서, 본 발명의 단클론 항체는 세포독성 부분(cytotoxic moiety)에 접합된다.
본 발명은 또한 본 명세서에서 상기에 기재된 바와 같은 단클론 항체를 포함하는 융합 단백질에 관한 것이다.
본 발명은 또한 본 명세서에서 상기에 기재된 바와 같은 항체의 중쇄 또는 경쇄를 암호화하는 핵산 분자에 관한 것이다. 하나의 실시태양에서, 본 발명의 핵산 분자는 서열번호 16, 서열번호 17, 서열번호 18 또는 서열번호 19와 70%의 동일성을 갖는 핵산 서열을 포함한다.
본 발명은 또한 본 명세서에서 상기에 기재된 바와 같은 핵산에 의해 형질감염되었거나, 감염되었거나 또는 형질전환된 숙주 세포에 관한 것이다.
하나의 실시태양에서, 본 발명의 단클론 항체는 항체 의존적인 세포 세포독성, 보체 의존적인 세포독성 또는 항체-의존적인 식세포작용을 매개한다.
본 발명은 또한 암의 치료 방법에 사용하기 위한(여기에서 암 세포는 CD160-TM을 발현한다), 바람직하게는 NK 백혈병 또는 NK 림프종, 예를 들어 림프절외 및 비-림프절외 NK/T 림프종; NK 세포 유래된 암; 및 급성 NK 백혈병의 치료를 위한 본 명세서에서 상기에 기재된 바와 같은 단클론 항체에 관한 것이다.
본 발명은 또한 치료가 필요한 대상체(subject)에게 치료 유효량의 본 명세서에서 상기에 기재된 바와 같은 단클론 항체를 전달함을 포함하는, 상기 대상체에서 CD160-TM 동형을 발현하는 세포의 집단, CD160-TM 동형을 발현하는 악성 NK 세포의 집단 또는 A12 또는 B6 항체에 의해 인식된 에피토프를 발현하는 세포의 집단을 고갈시키는 방법에 관한 것이다.
하나의 실시태양에서, 본 발명의 단클론 항체는 항체 의존적인 세포 세포독성, 보체 의존적인 세포독성 또는 항체-의존적인 식세포작용을 매개하지 않는다.
본 발명은 또한 암, 감염성 질병 또는 자가면역 및/또는 염증성 질병의 치료 방법에 사용하기 위한, 본 명세서에서 상기에 기재된 바와 같은 단클론 항체에 관한 것이다.
본 발명은 또한 치료가 필요한 대상체에게 치료 유효량의 본 명세서에서 상기에 기재된 바와 같은 항체를 투여함을 포함하는, 상기 대상체에서 NK 세포 활성을 증대시키는 방법에 관한 것이다.
하나의 실시태양에서, 상기 대상체는 암, 감염성 질병 또는 자가면역 및/또는 염증성 질병을 앓고 있다.
본 발명은 또한 치료가 필요한 대상체에게 항체를 본 발명의 단클론 항체와 함께 투여함을 포함하는, 상기 대상체에서 상기 항체의 NK 세포 항체-의존적인 세포 세포독성(ADCC)을 증대시키는 방법에 관한 것이다.
본 발명은 또한 CD160-TM을 본 명세서에서 상기에 기재된 바와 같은 단클론 항체와 접촉시킴을 포함하는, CD160-TM의 그의 리간드로의 결합을 억제하는 방법에 관한 것이다.
본 발명은 또한 치료가 필요한 대상체에게 치료 유효량의 본 명세서에서 상기에 기재된 바와 같은 단클론 항체를 투여함을 포함하여, 상기 대상체에서 발작성 야간 혈색소뇨증(Paroxysmal Nocturnal Hemoglobinuria)을 치료하는 방법에 관한 것이며, 여기에서 상기 항체는 Fab이다.
본 발명은 또한 본 명세서에서 상기에 기재된 바와 같은 항체 및 약학적으로 허용 가능한 담체를 포함하는 약학 조성물에 관한 것이다.
본 발명에서, 하기의 용어들은 하기의 의미를 갖는다:
본 발명과 관련하여, 통상적으로 존재하는 핵산 염기에 관한 하기의 약어들이 사용된다. "A"는 아데닌을 지칭하고, "C"는 시토신을 지칭하고, "G"는 구아닌을 지칭하고, "T"는 티민을 지칭하고, "U"는 우라실을 지칭한다.
"하나의"란 용어는 상기 관사의 문법적 대상 중 하나 또는 하나 초과(즉 적어도 하나)를 지칭한다. 예로서, "요소"는 하나의 요소 또는 하나 초과의 요소를 의미한다.
"약"이란 용어는 양, 시간적 지속기간 등과 같은 측정 가능한 값을 지칭하는 경우 명시된 값의 ±20% 또는 일부의 경우에 ±10%, 또는 일부의 경우에 ±5%, 또는 일부의 경우에 ±1%, 또는 일부의 경우에 ±0.1%의 변화를 포함함을 의미하며, 이와 같은 변화는 개시된 방법을 수행하기에 적합하다.
"핵산" 또는 "폴리뉴클레오티드"란 용어는 단일- 또는 이중-가닥 형태의, 포스포디에스테르 결합에 의해 공유 결합된 뉴클레오티드의 중합체, 예를 들어 데옥시리보핵산(DNA) 또는 리보핵산(RNA)을 지칭한다. 특별히 제한되지 않는 한, 상기 용어는 참조 핵산과 유사한 결합 성질을 갖는 천연 뉴클레오티드의 공지된 유사체를 함유하는 핵산을 포함하며 천연 뉴클레오티드와 유사한 방식으로 대사된다. 달리 지시되지 않는 한, 특정한 핵산 서열은 또한 그의 보존적으로 변형된 변체(예를 들어 축퇴 코돈 치환), 대립유전자, 상동체, SNP, 및 상보성 서열뿐만 아니라 명백히 지시된 서열을 암묵적으로 포함한다. 구체적으로, 축퇴 코돈 치환은 하나 이상의 선택된(또는 모든) 코돈의 세 번째 위치가, 혼합된-염기 및/또는 데옥시이노신 잔기로 치환된 서열을 생성시킴으로써 성취될 수 있다(Batzer et al., Nucleic Acid Res. 19:5081 (1991); Ohtsuka et al., J. Biol. Chem. 260:2605-2608 (1985); 및 Rossolini et al., Mol. Cell. Probes 8:91-98 (1994)).
"펩티드", "폴리펩티드" 및 "단백질"이란 용어들은 호환 가능하게 사용되며, 펩티드 결합에 의해 공유 결합된 아미노산 잔기들로 구성된 화합물을 지칭한다. 폴리펩티드는 특정한 길이로 제한되지 않는다: 상기는 적어도 2개의 아미노산을 함유해야 하며, 폴리펩티드의 서열을 포함할 수 있는 아미노산의 최대수에 대한 제한은 없다. 펩티드, 올리고펩티드 및 단백질이 폴리펩티드의 정의내에 포함되며, 상기와 같은 용어들은 특별히 달리 지시되지 않는 한 본 명세서에서 호환 가능하게 사용될 수 있다. 본 명세서에서 사용되는 바와 같이, 상기 용어는 단쇄(또한 통상적으로 당해 분야에서 펩티드, 올리고펩티드 및 올리고머로서 지칭된다), 및 보다 긴 쇄(일반적으로 당해 분야에서 단백질로서 지칭되며, 다수의 유형이 존재한다) 모두를 지칭한다. 하나의 실시태양에서, 본 명세서에서 사용되는 바와 같이, "펩티드"란 용어는 바람직하게는 약 50 아미노산 잔기 미만의 쇄 길이를 갖는, 펩티드 결합에 의해 함께 결합된 아미노산들의 선형 중합체를 지칭하며; "폴리펩티드"는 펩티드 결합에 의해 함께 결합된 적어도 50 아미노산의 선형 중합체를 지칭하고; 단백질은 특별히 하나 이상의 펩티드 또는 폴리펩티드(임의로 글리코실화된), 및 임의로 비-폴리펩티드 보조인자로 형성된 기능성 개체를 지칭한다. 상기 용어는 또한 상기 폴리펩티드의 발현-후 변형, 예를 들어 글리코실화, 아세틸화, 인산화 등뿐만 아니라 당해 분야에 공지된 다른 변형들(천연 및 비-천연 모두)은 제외시킨다. 폴리펩티드는 전체 단백질 또는 그의 하위서열일 수 있다. "폴리펩티드"는 예를 들어 특히, 생물학적으로 활성인 단편, 실질적으로 상동성인 폴리펩티드, 올리고펩티드, 동종이량체, 이종이량체, 폴리펩티드의 변체, 변형된 폴리펩티드, 유도체, 유사체, 융합 단백질을 포함한다. 폴리펩티드는 천연 펩티드, 재조합 펩티드, 또는 그의 조합을 포함한다. 본 발명과 관련하여 중요한 특정 폴리펩티드는 CDR을 포함하고 항원과 결합할 수 있는 아미노산 하위서열이다.
"대상체"란 용어는 온혈 동물, 바람직하게는 포유동물(인간, 가축 및 농장 동물, 및 동물원, 스포츠 또는 반려 동물, 예를 들어 개, 고양이, 소, 말, 양, 돼지, 염소, 토끼 등) 및 보다 바람직하게는 인간을 지칭한다. 하나의 실시태양에서, 대상체는 의료를 받기를 기다리고 있거나 의료를 받고 있는 중이거나 의학적 시술의 대상이었거나/대상이거나/대상일, 또는 질병의 발달에 대해 모니터되는 "환자", 즉 온혈 동물, 보다 바람직하게는 인간일 수 있다. 하나의 실시태양에서, 상기 대상체는 성인(예를 들어 18세를 초과하는 대상체)이다. 또 다른 실시태양에서, 상기 대상체는 아동(예를 들어 18세 미만의 대상체)이다. 하나의 실시태양에서, 상기 대상체는 남성이다. 또 다른 실시태양에서, 상기 대상체는 여성이다.
본 발명의 첫 번째 목적은 CD160-TM 동형에 결합하지만 CD160 GPI-고정된 동형에는 결합하지 않는 항체에 관한 것이다.
하나의 실시태양에서, 본 발명의 항체는 CD160-TM 동형의 세포외 도메인에 결합한다.
하나의 실시태양에서, 본 발명의 항체는 가용성 CD160 동형에 결합하지 않는다.
따라서, 하나의 실시태양에서, 본 발명은 CD160-TM 동형의 세포외 도메인에 결합하지만 CD160 GPI-고정된 동형이나 가용성 CD160 동형에는 결합하지 않는 항체에 관한 것이다.
하나의 실시태양에서, 상기 항체는 단클론 항체이다. 따라서, 하나의 실시태양에서, 본 발명은 CD160-TM 동형의 세포외 도메인에 결합하지만 CD160 GPI-고정된 동형이나 가용성 CD160 동형에는 결합하지 않는 단클론 항체에 관한 것이다.
또 다른 실시태양에서, 상기 항체는 다클론 항체이다.
본 명세서에 사용되는 바와 같이 "항체" 또는 "면역글로불린"이란 용어는 동일한 의미를 가지며, 본 발명에서 동등하게 사용될 것이다. 본 명세서에 사용되는 바와 같은 "항체"란 용어는 면역글로불린 분자 및 면역글로불린 분자의 면역학적으로 활성인 부분, 즉 항원에 면역특이적으로 결합하는 항원 결합 부위를 함유하는 분자를 지칭한다. 이와 같이 항체란 용어는 전체 항체 분자뿐만 아니라 항체 단편, 및 항체 및 항체 단편(예를 들어 Fab, Fab', F(ab')2 또는 scFv...)의 변체(유도체 포함)를 포함한다. 천연 항체에서, 2개의 중쇄가 디설파이드 결합에 의해 서로 연결되며 각각의 중쇄는 디설파이드 결합에 의해 경쇄에 연결된다. 2가지 유형의 경쇄, 람다(l) 및 카파(k)가 존재한다. 항체 분자의 기능 활성을 결정하는 5개의 주요 중쇄 부류(또는 아이소타입): IgM, IgD, IgG, IgA 및 IgE가 존재한다. 각각의 쇄는 별개의 서열 도메인을 함유한다. 경쇄는 2개의 도메인, 가변 도메인(VL) 및 불변 도메인(CL)을 포함한다. 중쇄는 4개의 도메인, 가변 도메인(VH) 및 3개의 불변 도메인(CH1, CH2 및 CH3, 집합적으로 CH라 칭한다)을 포함한다. 경쇄(VL) 및 중쇄(VH) 모두의 가변 영역은 항원에 대한 결합 인식 및 특이성을 결정한다. 경쇄(CL) 및 중쇄(CH)의 불변 영역 도메인은 중요한 생물학적 성질들, 예를 들어 항체 쇄 회합, 분비, 태반-통과 이동성, 보체 결합, 및 Fc 수용체(FcR)에의 결합을 부여한다. Fv 단편은 면역글로불린의 Fab 단편의 N-말단 부분이며 하나의 경쇄 및 하나의 중쇄의 가변 부분들로 이루어진다. 상기 항체의 특이성은 항체 결합 부위 및 항원 결정인자간의 구조적 상보성에 있다. 항체 결합 부위는 주로 고가변성 또는 상보성 결정 영역(CDR)으로부터 유래하는 잔기들로 구성된다. 때때로, 비고가변성 또는 프레임워크 영역(FR)으로부터의 잔기들이 상기 항체 결합 부위에 참여하거나 또는 전체 도메인 구조 및 따라서 결합 부위에 영향을 미칠 수 있다. 상보성 결정 영역 또는 CDR은 본래의 면역글로불린 결합 부위의 천연 Fv 영역의 결합 친화성 및 특이성을 함께 한정하는 아미노산 서열들을 지칭한다. 면역글로불린의 경쇄 및 중쇄는 각각, VL-CDR1, VL-CDR2, VL-CDR3 및 VH-CDR1, VH-CDR2, VH-CDR3라 각각 표시되는 3개의 CDR을 갖는다. 따라서, 항원-결합 부위는 전형적으로 각각의 중쇄 및 경쇄 V 영역으로부터의 CDR 세트를 포함하는 6개의 CDR을 포함한다. 프레임워크 영역(FR)은 CDR들 사이에 삽입된 아미노산 서열을 지칭한다. 항체 가변 도메인 중의 잔기들은 통상적으로 카밧(Kabat) 등에 의해 고안된 체계에 따라 넘버링된다. 상기 체계는 문헌[Kabat et al., 1987, in Sequences of Proteins of Immunological Interest, US Department of Health and Human Services, NIH, USA](이후부터 "카밧 등")에 제시되어 있다. 상기 넘버링 체계가 본 명세서에서 사용된다. 상기 카밧 잔기 표시는 서열번호의 아미노산 잔기의 선형 넘버링과 항상 직접적으로 상응하지는 않는다. 실제 선형 아미노산 서열은 기본적인 가변 도메인 구조의 구성 성분(프레임워크든 또는 상보성 결정 영역(CDR)이든)의 축약 또는 상기 성분내로의 삽입에 상응하는 엄격한 카밧 넘버링에서보다 더 적거나 추가적인 아미노산을 함유할 수 있다. 잔기의 정확한 카밧 넘버링은 주어진 항체에 대해 "표준" 카밧 넘버링된 서열과 상기 항체의 서열 중 상동성인 잔기들의 정렬에 의해 결정될 수 있다. 중쇄 가변 도메인의 CDR은 카밧 넘버링 체계에 따라 31-35B (VH-CDR1) 잔기, 50-65 (VH-CDR2) 잔기 및 95-102 (VH-CDR3) 잔기에 위치한다. 경쇄 가변 도메인의 CDR은 카밧 넘버링 체계에 따라 24-34 (VL-CDR1) 잔기, 50-56 (VL-CDR2) 잔기 및 89-97 (VL-CDR3) 잔기에 위치한다.
"완전한" 항체는 항원-결합 부위뿐만 아니라 CL 및 적어도 중쇄 불변 도메인, CH1, CH2 및 CH3을 포함하는 것이다. 불변 도메인은 본래 서열 불변 도메인(예를 들어 인간 본래 서열 불변 도메인) 또는 그의 아미노산 서열 변체일 수 있다.
"가변"이란 용어는 V 도메인의 몇몇 분절이 항체마다 서열이 광범위하게 상이하다는 사실을 지칭한다. 상기 V 도메인은 항원 결합을 매개하며 특정 항체의 그의 특정 항원에 대한 특이성을 한정한다. 그러나, 상기 가변성은 가변 도메인의 110 내지 130-아미노산 폭에 걸쳐 고르게 분포되지는 않는다. 대신에, 상기 V 영역은, 각각 9 내지 12 아미노산 길이인 "고가변 영역"이라 칭하는 대단히 가변성인 보다 짧은 영역들에 의해 분리된, 15 내지 30 아미노산의 프레임워크 영역(FR)이라 지칭되는 비교적 불변인 신장부들로 이루어진다. 본래의 중쇄 및 경쇄의 가변 도메인은 각각, 3개의 고가변 영역([베타]-시트 구조를 연결하는, 및 일부의 경우 상기 구조의 부분을 형성하는 고리를 형성한다)에 의해 연결된, 주로 [베타]-시트 배열을 채용하는 4개의 FR을 포함한다. 각 쇄 중의 고가변 영역들은 상기 FR에 의해, 및 다른 쇄로부터의 고가변 영역들과 함께 가깝게 유지되며, 항체의 항원-결합 부위의 형성에 기여한다(문헌[Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)]을 참조하시오). 상기 불변 도메인은 항체가 항원에 결합하는데 직접적으로 관여하는 것이 아니라, 다양한 효과기 기능, 예를 들어 항체 의존적인 세포 세포독성(ADCC)에서 상기 항체의 참여를 나타낸다.
항체의 "가변 영역" 또는 "가변 도메인"은 상기 항체의 중쇄 또는 경쇄의 아미노-말단 도메인을 지칭한다. 상기 중쇄의 가변 도메인은 "VH"라 지칭될 수 있다. 상기 경쇄의 가변 도메인은 "VL"이라 지칭될 수 있다. 이들 도메인은 일반적으로 항체의 가장 가변적인 부분이며 항원-결합 부위를 함유한다.
"고가변 영역"이란 용어는 본 명세서에 사용될 때 항원 결합을 담당하는 항체의 아미노산 잔기를 지칭한다. 상기 고가변 영역은 일반적으로 "상보성 결정 영역" 또는 "CDR"로부터의 아미노산 잔기(카밧 넘버링 체계; Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)에 따라 넘버링될 때, 예를 들어 VL 중 대략 24-34(L1), 50-56(L2) 및 89-97(L3) 부근의 잔기, 및 VH 중 대략 31-35(H1), 50-65(H2) 및 95-102(H3) 부근의 잔기)를 포함한다.
하나의 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 전체 항체, 인간화된 항체, 단쇄 항체, 이량체성 단쇄 항체, Fv, scFv, Fab, F(ab)'2, 탈퓨코실화된 항체, 이중특이성 항체, 디아바디, 트리아바디, 테트라바디로 이루어지는 그룹 중에서 선택된 항체 분자이다.
또 다른 실시태양에서, 상기 항체는 유니바디, 도메인 항체, 및 나노바디로 이루어지는 그룹 중에서 선택된 항체 단편이다.
또 다른 실시태양에서, 상기 항체는 애피바디, 애필린, 애피틴, 애드넥틴, 애트리머, 에바신, DARPin, 안티칼린, 애비머, 피노머, 베르사바디 및 듀오칼린으로 이루어지는 그룹 중에서 선택된 항체 모방물질이다.
"베르사바디"는 당해 분야에 주지되어 있으며 항체 모방 기술을 지칭한다. 상기는 >15% 시스테인을 갖는 3 내지 5 kDa의 작은 단백질이며, 높은 디설파이드 밀도 스캐폴드를 형성하고, 전형적인 단백질들이 갖는 소수성 코어를 대체한다.
"나노바디"는 당해 분야에 주지되어 있으며 천연 중쇄 항체의 특유의 구조적 및 기능적 성질을 함유하는 항체-유래된 치료학적 단백질을 지칭한다. 상기 중쇄 항체는 단일 가변 도메인(VHH) 및 2개의 불변 도메인(CH2 및 CH3)을 함유한다. 본 명세서에 사용되는 바와 같이, "유래된"이란 용어는 첫 번째와 두 번째 분자간의 관계를 가리킨다. 상기는 일반적으로 첫 번째 분자와 두 번째 분자간의 구조적 유사성을 지칭하며 두 번째 분자로부터 유래되는 첫 번째 분자상의 가공 또는 공급원 제한을 함축하거나 포함하지 않는다.
"디아바디"란 용어는 V 도메인들의 쇄-간(쇄-내가 아닌) 짝짓기가 성취되어 2가 단편, 즉 2개의 항원 결합 부위를 갖는 단편을 생성시키도록 VH와 VL 도메인 사이에 짧은 링커(약 5 내지 10 잔기)를 갖는 sFv 단편을 구성함으로써 제조된 작은 항체 단편을 지칭한다. 이중특이성 디아바디는 2개 항체의 VH 및 VL 도메인이 상이한 폴리펩티드 쇄상에 존재하는 2개의 "크로스오버" sFv 단편의 이종이량체이다. 디아바디는 예를 들어 EP 0404097; WO 93/11161; 및 문헌[Holliger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)]에 보다 충분히 기재되어 있다.
"애피바디"는 당해 분야에 주지되어 있으며 스타필로코커스 단백질 A의 IgG 결합 도메인 중 하나로부터 유래된, 58 아미노산 잔기 단백질 도메인을 기본으로 하는 친화성 단백질을 지칭한다.
"안티칼린"은 당해 분야에 주지되어 있으며 항체 모방 기술을 지칭하고, 여기에서 결합 특이성은 리포칼린으로부터 유래된다. 안티칼린은 또한 듀오칼린이라 칭하는 이중 표적화 단백질로서 포맷팅될 수 있다.
"애비머"는 당해 분야에 주지되어 있으며 항체 모방 기술을 지칭한다.
"도메인 항체"는 당해 분야에 주지되어 있으며 항체의 중쇄 또는 경쇄의 가변 영역에 상응하는, 항체의 최소 기능 결합 단위를 지칭한다.
"유니바디"는 당해 분야에 주지되어 있으며 IgG4 항체의 힌지 영역이 결여된 항체 단편을 지칭한다. 상기 힌지 영역의 결실은, 전통적인 IgG4 항체의 크기의 필수적으로 절반이고 IgG4 항체의 2가 결합 영역이라기보다는 1가 결합 영역을 갖는 분자를 생성시킨다.
DARPin(설계된 안키린 반복 단백질)은 당해 분야에 주지되어 있으며 비-항체 폴리펩티드의 결합 능력을 활용하기 위해 개발된 항체 모방 DRP(설계된 반복 단백질) 기술을 지칭한다.
"항체 단편"이란 용어는 항원의 에피토프와 특이적으로 상호작용하는 능력을 유지하는(예를 들어 결합, 입체 장애, 안정화/탈안정화, 공간 분배에 의해) 완전 항체의 적어도 하나의 부분, 바람직하게는 상기 완전 항체의 항원 결합 영역 또는 가변 영역을 지칭한다. 항체 단편의 예는 비제한적으로 Fab, Fab', F(ab')2, Fv 단편, 단쇄 항체 분자, 특히 scFv 항체 단편, 디설파이드-결합된 Fvs(sdFv), VH 및 CH1 도메인으로 이루어지는 Fd 단편, 선형 항체, 단일 도메인 항체, 예를 들어 sdAb(VL 또는 VH), 카멜리드 VHH 도메인, 항체 단편들로부터 형성된 다중특이성 항체, 예를 들어 힌지 영역에서 디설파이드 가교에 의해 연결된 2개의 Fab 단편을 포함하는 2가 단편, 및 항체의 단리된 CDR 또는 다른 에피토프 결합 단편을 포함한다. 항원 결합 단편을 또한 단일 도메인 항체, 맥시바디, 미니바디, 나노바디, 인트라바디, 디아바디, 트리아바디, 테트라바디, v-NAR 및 비스-scFv에 통합시킬 수 있다(예를 들어 문헌[Hollinger and Hudson, Nature Biotechnology 23:1126-1136, 2005]을 참조하시오). 항원 결합 단편을 또한 III형 피브로넥틴과 같은 폴리펩티드를 기본으로 하는 스캐폴드내에 접목시킬 수 있다(미국특허 제 6,703,199 호를 참조하시오; 피브로넥틴 폴리펩티드 미니바디를 기재한다). 항체의 파파인 절단은 "Fab" 단편 및 잔여 "Fc" 단편(쉽게 결정화하는 능력을 반영하는 명칭이다)이라 칭하는 2개의 동일한 항원-결합 단편을 생성시킨다.
본 명세서에 사용되는 바와 같이, "항체의 기능성 단편 또는 유사체"는 완전-길이 항체와 마찬가지로 정성적인 생물학적 활성을 갖는 화합물이다. 예를 들어, 항-IgE 항체의 기능성 단편 또는 유사체는, 상기와 같은 분자의 능력이 고 친화성 수용체, Fc[입실론]RI에 결합하는 능력을 갖는 것을 방지하거나 또는 상기 능력을 실질적으로 감소시키도록 하는 방식으로 IgE 면역글로불린에 결합할 수 있는 것이다.
항체의 "Fc" 단편은 디설파이드에 의해 함께 유지된 2개의 H 쇄 모두의 카복시-말단 부분을 포함한다. 항체의 효과기 기능은 상기 Fc 영역 중의 서열들에 의해 결정되며, 상기 영역은 또한 몇몇 유형의 세포상에서 발견되는 Fc 수용체(FcR)에 의해 인식되는 부분이다.
"Fv"는 완전 항원-인식 및 -결합 부위를 함유하는 최소 항체 단편이다. 상기 단편은 단단한, 비-공유 회합의 하나의 중쇄 및 하나의 경쇄 가변 영역 도메인의 이량체로 이루어진다. 이들 2개 도메인의 폴딩으로부터, 항원 결합을 위한 아미노산 잔기를 부여하고 항체에 항원 결합 특이성을 제공하는 6개의 고가변성 고리(각각 H 및 L 쇄로부터 3개의 고리)가 나온다. 그러나, 심지어 단일 가변 도메인(또는 항원에 특이적인 단지 3개의 CDR만을 포함하는 Fv의 절반)조차, 전체 결합 부위보다는 낮은 친화성이지만, 항원을 인식하고 결합하는 능력을 갖는다.
본 발명의 항체의 단편 및 유도체(문맥상 달리 서술되거나 명백히 반박되지 않는 한, 본 출원에 사용된 바와 같은 "항체"란 용어에 의해 포함된다)는 당해 분야에 공지된 기법에 의해 생성될 수 있다. "단편"은 완전 항체의 일부, 일반적으로 항원 결합 부위 또는 가변 영역을 포함한다. 항체 단편의 예는 Fab, Fab', Fab'-SH, F(ab')2 및 Fv 단편; 디아바디; 연속적인 아미노산 잔기들의 하나의 중단되지 않은 서열로 이루어지는 1차 구조를 갖는 폴리펩티드인 임의의 항체 단편(본 명세서에서 "단쇄 항체 단편" 또는 "단쇄 폴리펩티드"로서 지칭된다), 예를 들어 비제한적으로 (1) 단쇄 Fv 분자 (2) 관련된 중쇄 부분 없이, 단지 하나의 경쇄 가변 도메인을 함유하는 단쇄 폴리펩티드, 또는 상기 경쇄 가변 도메인의 3개의 CDR을 함유하는 그의 단편 및 (3) 관련된 경쇄 부분 없이, 단지 하나의 중쇄 가변 영역을 함유하는 단쇄 폴리펩티드, 또는 상기 중쇄 가변 영역의 3개의 CDR을 함유하는 그의 단편; 및 항체 단편들로부터 형성된 다중특이성 항체를 포함한다. 본 발명 항체의 단편을 표준 방법을 사용하여 획득할 수 있다.
예를 들어, Fab 또는 F(ab')2 단편을 통상적인 기법에 따라, 단리된 항체의 프로테아제 절단에 의해 생성시킬 수 있다. 면역반응성 단편을 공지된 방법을 사용하여, 예를 들어 생체내 제거를 늦추고 보다 바람직한 약동학적 프로파일을 획득하도록 변형시킬 수 있으며, 상기 단편을 폴리에틸렌 글리콜(PEG)로 변형시킬 수 있음을 알 것이다. PEG를 Fab' 단편에 결합시키고 부위-특이적으로 접합시키는 방법이 예를 들어 문헌[Leong et al., Cytokines 16 (3): 106-119 (2001)] 및 문헌[Delgado et al., Br. J. Cancer 5 73 (2): 175- 182 (1996)](이들의 내용은 본 명세서에 참고로 인용된다)에 기재되어 있다.
하나의 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)를 단리한다. 본 명세서에 사용되는 바와 같이, "단리된 항체"는 그의 자연 환경 성분으로부터 분리되고/되거나 회수된 것이다. 그의 자연 환경의 오염 성분은 상기 항체의 진단학적 또는 치료학적 용도를 방해할 수 있는 물질이며 효소, 호르몬, 및 다른 단백질성 또는 비-단백질성 성분을 포함할 수 있다. 바람직한 실시태양에서, 상기 항체를 (1) 로우리법에 의해 측정시 항체의 95 중량%, 및 가장 바람직하게는 99 중량%를 초과하거나; (2) 회전 컵 서열분석기의 사용에 의해 N-말단 또는 내부 아미노산 서열의 적어도 15개 잔기를 수득하기에 충분한 정도로; 또는 (3) 환원 또는 비-환원 조건하에서 SDS-PAGE에 의해 및 쿠마씨 블루 또는 바람직하게는 은 염색을 사용하여 입증된 바와 같은 동종성으로 정제한다. 단리된 항체는 상기 항체의 자연 환경의 적어도 하나의 성분이 존재하지 않을 것이기 때문에 재조합 세포내 원 위치에 상기 항체를 포함한다. 그러나, 통상적으로, 단리된 항체는 적어도 하나의 정제 단계에 의해 제조될 것이다.
본 명세서에 사용되는 바와 같이, "CD160"이란 용어는 당해 분야에서 그의 일반적인 의미를 가지며 CD160 분자를 지칭한다. CD160 유전자는 인간 염색체 1상에 위치하는 것으로 밝혀졌으며, 상응하는 단백질은 원래 글리코실포스파티딜이노시톨(GPI)-고정된 세포 표면 분자로서 특성화되었다. 3개의 CD160 동형이 존재한다: CD160-TM 동형, CD-160 GPI-고정된 동형 및 가용성 CD160 동형. CD160-GPI는 장 상피내 T 림프구에 의해서 및 NK 세포, TCRγδ 및 세포독성 효과기 CD8brightCD28- T 림프구를 포함한 순환하는 림프구의 소수의 부분집합에 의해서 발현된다(ANUMANTHAN et al., 1998, J Immunol; 161:2780-2790; MAIZA et al., J. Exp. Med., vol. 178, p: 1121-1126, 1993). 상기 CD160 막관통 동형("CD160-TM")은 문헌[Giustiniani J et al. (J Immunol. 2009 Jan 1;182(1):63-71)]뿐만 아니라 국제 특허 출원 WO2008155363에 기재되어 있으며 서열번호 1에 제시된 바와 같은 아미노산 서열에 의해 특성화된다. 상기 CD160-TM 동형의 세포외 도메인을 서열번호 1의 26번 위치의 아미노산 잔기에서부터 189번 위치의 아미노산 잔기에 이르는 범위의 아미노산 서열에 의해 한정할 수 있다. 상기 CD160 GPI-고정된 동형("CD160-GPI")은 문헌[Nikolova M. et al. (Int Immunol. 2002 May;14(5):445-51]뿐만 아니라 국제 특허 출원 WO2006015886에 기재되어 있으며 C 말단 단부에서 GPI 앵커에 융합된 서열번호 2에 제시된 바와 같은 아미노산 서열에 의해 특성화된다. 상기 CD160 가용성 동형은 문헌[Giustiniani J. et al. (J Immunol. 2007 Feb 1;178(3):1293-300)]에 기재되어 있으며 서열번호 3에 제시된 바와 같은 아미노산 서열에 의해 특성화된다. 서열번호 1 내지 3에서, 아미노산 1 내지 25는 신호 펩티드에 상응하며, 결과적으로 발현된 단백질로부터 존재하지 않을 수 있다.
서열번호 1: CD160-TM 동형
MLLEPGRGCCALAILLAIVDIQSGGCINITSSASQEGTRLNLICTVWHKKEEAEGFVVFLCKDRSGDCSPETSLKQLRLKRDPGIDGVGEISSQLMFTISQVTPLHSGTYQCCARSQKSGIRLQGHFFSILFTETGNYTVTGLKQRQHLEFSHNEGTLSSGFLQEKVWVMLVTSLVALQGMSKRAVSTPSNEGAIIFLPPWLFSRRRRLERMSRGREKCYSSPGYPQESSNQFH
서열번호 2 CD160 GPI-고정된 동형
MLLEPGRGCCALAILLAIVDIQSGGCINITSSASQEGTRLNLICTVWHKKEEAEGFVVFLCKDRSGDCSPETSLKQLRLKRDPGIDGVGEISSQLMFTISQVTPLHSGTYQCCARSQKSGIRLQGHFFSILFTETGNYTVTGLKQRQHLEFSHNEGTLSS
서열번호 3: CD160 가용성 동형
MLLEPGRGCCALAILLAIVDIQSGGCINITSSASQEGTRLNLICTVWHKKEEAEGFVVFLCKDRSGDCSPETSLKQLRLKRDPGIDGVGEISSQLMFTISQVTPLHSGTYQCCARSQKSGIRLQGHFFSILFTETGNYTVTGLKQRQHLEFSHNEGTLSS
본 명세서에 사용되는 바와 같은 "결합"이란 용어는 예를 들어 공유, 정전기, 소수성, 및 이온 및/또는 수소-결합 상호작용, 예를 들어 염 가교 및 수 가교와 같은 상호작용에 기인한, 2개 분자간의 직접적인 회합을 지칭한다. 특히, 본 명세서에 사용되는 바와 같이, 소정의 항원 또는 에피토프에의 항체의 결합과 관련하여 "결합"이란 용어는 전형적으로 약 10-7 M 이하, 예를 들어 약 10-8 M 이하, 예를 들어 약 10-9 M 이하, 약 10-10 M 이하, 또는 약 10-11 M 이하의 KD에 상응하는 친화성을 갖는 결합이다. 항체의 KD의 측정 방법은 당해 분야에 주지되어 있으며 비제한적으로 리간드로서 항원의 가용성 형태 및 분석물로서 항체를 사용하는 BIAcore 3000 장비에서의 표면 플라스몬 공명(SPR) 기술을 포함한다. BIACORE(등록상표)(GE 헬쓰케어, 미국 뉴저지주 피스카타웨이 소재)는 단클론 항체의 에피토프 저장 패널에 통상적으로 사용되는 다양한 표면 플라스몬 공명 분석 포맷 중 하나이다. 항체의 친화성을 다른 통상적인 기법, 예를 들어 문헌[Scatchard et al., (Ann. N.Y. Acad. Sci. USA 51:660 (1949))]에 기재된 기법을 사용하여 쉽게 측정할 수 있다. 항원, 세포 또는 조직에 대한 항체의 결합 성질을 면역검출 방법, 예를 들어 면역형광-기재 분석, 예를 들어 면역조직화학(IHC) 및/또는 형광-활성화된 세포 분류(FACS)를 사용하여 일반적으로 측정하고 평가할 수 있다. 전형적으로, 항체는 소정의 항원에, 비특이적인 항원(예를 들어 BSA, 카제인)(상기 소정의 항원과 동일하거나 밀접하게 관련되지 않는다)에의 결합에 대한 그의 KD보다 적어도 10배 이하, 예를 들어 적어도 100배 이하, 예를 들어 적어도 1000배 이하, 예를 들어 적어도 10,000배 이하, 예를 들어 적어도 100,000배 이하의 KD에 상응하는 친화성으로 결합한다. 상기 항체의 KD가 매우 낮은 경우(즉, 상기 항체가 높은 친화성을 갖는 경우), 상기 항체가 항원과 결합하는 KD는 전형적으로 비특이적인 항원에 대한 그의 KD보다 적어도 10,000배 더 낮다. 항체는 상기와 같은 결합이 검출되지 않거나(예를 들어 리간드로서 항원의 가용성 형태 및 분석물로서 항체를 사용하는 BIAcore 3000 장비에서의 표면 플라스몬 공명(SPR) 기술을 사용하여), 또는 상이한 화학 구조 또는 아미노산 서열을 갖는 항원 또는 에피토프 및 상기 항체에 의해 검출된 결합보다 100배, 500배, 1000배 또는 1000배 넘게 적은 경우 항원 또는 에피토프에 필수적으로 결합하지 않는다고 한다.
본 명세서에 사용되는 바와 같이, "특이성"이란 용어는 상기 CD160 GPI-고정된 동형 및 상기 CD160 가용성 동형과 같은 비-CD160-TM 단백질과 비교적 거의 검출되지 않는 반응성을 갖는 반면, CD160-TM과 같은 항원상에 제공된 에피토프에는 검출 가능하게 결합하는 항체의 능력을 지칭한다. 특이성은 예를 들어 Biacore 장비를 사용하여, 본 명세서의 어딘가에 기재된 바와 같은 결합 또는 경쟁 결합 분석에 의해 상대적으로 측정될 수 있다. 특이성은 특이적인 항원 대 다른 관련되지 않은 분자에 대한 비특이적인 결합에 있어서 예를 들어 약 10:1, 약 20:1, 약 50:1, 약 100:1, 10.000:1 또는 그 이상의 친화성/결합활성 비로 나타낼 수 있다(이 경우 상기 특이적인 항원은 CD160-TM 폴리펩티드이다). 본 명세서에 사용되는 바와 같은 "친화성"이란 용어는 에피토프에 대한 항체의 결합 강도를 의미한다. 항체의 친화성은 [Ab] x [Ag] / [Ab-Ag] (여기에서 [Ab-Ag]는 항체-항원 복합체의 몰 농도이고, [Ab]는 결합되지 않은 항체의 몰 농도이고 [Ag]는 결합되지 않은 항원의 몰 농도이다)로서 정의되는 해리 상수 Kd에 의해 제공된다. 친화성 상수 Ka는 1/Kd에 의해 정의된다. mAb의 친화성의 바람직한 측정 방법은 문헌[Harlow, et al., Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1988], 문헌[Coligan et al., eds., Current Protocols in Immunology, Greene Publishing Assoc. and Wiley Interscience, N.Y., (1992, 1993)], 및 문헌[Muller, Meth. Enzymol. 92:589-601 (1983)](이들 참고문헌은 내용 전체가 본 명세서에 참고로 인용된다)에서 찾을 수 있다. mAb의 친화성의 측정에 대해 당해 분야에 주지된 하나의 바람직한 표준 방법은 Biacore 장비의 사용이다.
하나의 실시태양에서, 본 발명의 항체는 서열번호 1의 아미노산 잔기 175 내지 189, 또는 서열번호 1의 아미노산 잔기 175 내지 189에 대해 적어도 60%, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98%, 99%의 동일성을 공유하는 서열로부터의 적어도 하나의 아미노산 잔기를 포함하는 에피토프에 결합한다. 서열번호 1의 아미노산 잔기 175 내지 189는 서열번호 5의 서열(LVALQGMSKRAVSTP)에 상응한다.
본 명세서에 사용되는 바와 같이, "에피토프"란 용어는 항체가 결합하는 단백질 또는 단백질들상에 위치하는 아미노산의 특정한 배열을 지칭한다. 에피토프는 종종 아미노산 또는 당 측쇄와 같은 분자들의 화학적으로 활성인 표면 그룹들로 이루어지며, 특정한 3차원 구조 특징뿐만 아니라 특정한 전하 특징을 갖는다. 에피토프는 선형이거나 또는 입체형태적이다, 즉 반드시 연속적일 필요는 없는 항원의 다양한 영역들 중의 2개 이상의 아미노산 서열을 수반할 수 있다.
하나의 실시태양에서, 본 발명의 항체는 서열번호 1의 아미노산 잔기 175 내지 189, 또는 서열번호 1의 아미노산 잔기 175 내지 189에 대해 적어도 60%, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98%, 99%의 동일성을 공유하는 서열로부터 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 또는 15 아미노산 잔기를 포함하는 에피토프에 결합한다.
하나의 실시태양에서, 본 발명의 항체는 서열번호 5에 제시된 바와 같은 아미노산 서열 (LVALQGMSKRAVSTP) 또는 서열번호 5에 대해 적어도 60%, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98%, 99%의 동일성을 공유하는 아미노산 서열을 포함하는 에피토프에 결합한다.
하나의 실시태양에서, 본 발명의 항체는 서열번호 1의 아미노산 잔기 62 내지 85, 또는 서열번호 1의 아미노산 잔기 62 내지 85에 대해 적어도 60%, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98%, 99%의 동일성을 공유하는 서열로부터의 적어도 하나의 아미노산 잔기를 포함하는 에피토프에 결합한다. 서열번호 1의 아미노산 잔기 62 내지 85는 서열번호 4의 서열(KDRSGDCSPETSLKQLRLKRDPGI)에 상응한다.
하나의 실시태양에서, 본 발명의 항체는 서열번호 1의 아미노산 잔기 62 내지 85, 또는 서열번호 1의 아미노산 잔기 62 내지 85에 대해 적어도 60%, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98%, 99%의 동일성을 공유하는 서열로부터 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 또는 24 아미노산 잔기를 포함하는 에피토프에 결합한다.
하나의 실시태양에서, 본 발명의 항체는 서열번호 4에 제시된 바와 같은 아미노산 서열 (KDRSGDCSPETSLKQLRLKRDPGI) 또는 서열번호 4에 대해 적어도 60%, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98%, 99%의 동일성을 공유하는 아미노산 서열을 포함하는 에피토프에 결합한다.
하나의 실시태양에서, 본 발명의 항체는 입체형태적 에피토프에 결합한다.
하나의 실시태양에서, 본 발명의 항체는
- 서열번호 1의 아미노산 잔기 175 내지 189, 또는 서열번호 1의 아미노산 잔기 175 내지 189에 대해 적어도 60%, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98%, 99%의 동일성을 공유하는 서열로부터의 적어도 하나의 아미노산 잔기, 및
- 서열번호 1의 아미노산 잔기 62 내지 85, 또는 서열번호 1의 아미노산 잔기 62 내지 85에 대해 적어도 60%, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98%, 99%의 동일성을 공유하는 서열로부터의 적어도 하나의 아미노산 잔기
를 포함하는 입체형태적 에피토프에 결합한다.
하나의 실시태양에서, 본 발명의 항체는
- 서열번호 1의 아미노산 잔기 175 내지 189, 또는 서열번호 1의 아미노산 잔기 175 내지 189에 대해 적어도 60%, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98%, 99%의 동일성을 공유하는 서열로부터 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 또는 15 아미노산 잔기, 및
- 서열번호 1의 아미노산 잔기 62 내지 85, 또는 서열번호 1의 아미노산 잔기 62 내지 85에 대해 적어도 60%, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98%, 99%의 동일성을 공유하는 서열로부터 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 또는 24 아미노산 잔기
를 포함하는 입체형태적 에피토프에 결합한다.
하나의 실시태양에서, 본 발명의 항체는
- 서열번호 5에 제시된 바와 같은 아미노산 서열 (LVALQGMSKRAVSTP) 또는 서열번호 5에 대해 적어도 60%, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98%, 99%의 동일성을 공유하는 아미노산 서열, 및
- 서열번호 1의 아미노산 잔기 62 내지 85, 또는 서열번호 1의 아미노산 잔기 62 내지 85에 대해 적어도 60%, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98%, 99%의 동일성을 공유하는 서열로부터 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 또는 24 아미노산 잔기
를 포함하는 입체형태적 에피토프에 결합한다.
하나의 실시태양에서, 본 발명의 항체는
- 서열번호 5에 제시된 바와 같은 아미노산 서열 (LVALQGMSKRAVSTP) 또는 서열번호 5에 대해 적어도 60%, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98%, 99%의 동일성을 공유하는 아미노산 서열, 및
- 서열번호 4에 제시된 바와 같은 아미노산 서열(KDRSGDCSPETSLKQLRLKRDPGI) 또는 서열번호 4에 대해 적어도 60%, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98%, 99%의 동일성을 공유하는 아미노산 서열
을 포함하거나 이들 서열로 이루어지는 입체형태적 에피토프에 결합한다.
일부 실시태양에서, 본 발명의 단클론 항체는 서열번호 4에 제시된 바와 같은 아미노산 서열 (KDRSGDCSPETSLKQLRLKRDPGI) 및 서열번호 5에 제시된 바와 같은 아미노산 서열 (LVALQGMSKRAVSTP) 중의 CD160-TM 동형의 세포외 도메인에 결합한다.
본 명세서에 사용된 바와 같은 "단클론 항체", "단클론 Ab", "단클론 항체 조성물", "mAb" 등의 용어는 단일 분자 조성의 항체 분자 제제를 지칭한다. 단클론 항체는 실질적으로 동종의 항체 집단으로부터 수득된다, 즉 상기 집단 중에 포함된 개별적인 항체들은 소량으로 존재할 수도 있는 가능한 천연 돌연변이를 제외하고 동일하다. 단클론 항체 조성물은 특정한 에피토프에 대해 단일의 결합 특이성 및 친화성을 나타낸다. 단클론 항체를 문헌[Kohler and Milstein (Nature, 256:495, 1975)]의 방법을 사용하여 생성시킬 수 있다. 본 발명에 유용한 단클론 항체를 제조하기 위해서, 마우스 또는 다른 적합한 숙주 동물을 적합한 간격(예를 들어 매주 2회, 매주, 매달 2회 또는 매달)으로, 적합한 항원 형태(즉 CD160-TM 폴리펩티드)로 면역시킨다. 상기 동물에게 사후 1주일 내에 항원의 최종 "추가면역"을 투여할 수 있다. 종종 면역 중에 면역학적 항원보강제를 사용하는 것이 바람직할 수 있다. 적합한 면역학적 항원보강제는 프로인트 완전 항원보강제, 프로인트 불완전 항원보강제, 알룸, Ribi 항원보강제, 헌터스 티터맥스(Hunter's Titermax), 사포닌 항원보강제, 예를 들어 QS21 또는 퀼(Quil) A, 또는 CpG-함유 면역자극 올리고뉴클레오티드를 포함한다. 다른 적합한 항원보강제는 당해 분야에 주지되어 있다. 상기 동물을 피하, 복강내, 근육내, 정맥내, 비내 또는 다른 경로에 의해 면역시킬 수 있다. 주어진 동물을 다중 경로에 의해 다수 형태의 항원으로 면역시킬 수 있다. 그러나, 수식어 "단클론"을 임의의 특정한 방법에 의해 상기 항체의 생성을 요하는 것으로서 해석해서는 안 된다. 예를 들어, 단클론 항체를 또한 문헌[Kohler et al., Nature, 256:495 (1975)]에 최초로 기재된 하이브리도마 방법에 의해 제조하거나, 또는 세균, 진핵생물 동물 또는 식물 세포에서 재조합 DNA 방법을 사용하여 제조할 수 있다(예를 들어 미국특허 제 4,816,567 호를 참조하시오). "단클론 항체"를 또한 예를 들어 문헌[Clackson et al., Nature, 352:624-628 (1991)] 및 문헌[Marks et al., J. Mol. Biol., 222:581-597 (1991)]에 기재된 기법을 사용하여 파지 항체 라이브러리로부터 단리시킬 수 있다.
일부 실시태양에서, 본 발명의 단클론 항체는 키메라 항체, 특히 키메라 마우스/인간 항체이다. 본 명세서에 사용되는 바와 같이, "키메라 항체"란 용어는 비-인간 항체의 VH 도메인 및 VL 도메인 및 인간 항체의 CH 도메인 및 CL 도메인을 포함하는 항체를 지칭한다. 하나의 실시태양에서, "키메라 항체"는 (a) 불변 영역(즉 중쇄 및/또는 경쇄) 또는 그의 일부가, 항원 결합 부위(가변 영역)가 상이한 또는 변경된 부류, 효과기 기능 및/또는 종의 불변 영역, 또는 키메라 항체에 새로운 성질을 부여하는 완전히 상이한 분자, 예를 들어 효소, 독소, 호르몬, 성장 인자, 약물 등에 결합하도록 변경되거나, 대체되거나 교환된; 또는 (b) 가변 영역, 또는 그의 일부가 상이한 또는 변경된 항원 특이성을 갖는 가변 영역으로 변경되거나, 대체되거나 교환된 항체 분자이다. 키메라 항체는 또한 영장류화된 및 특히 인간화된 항체를 포함한다. 더욱 또한, 키메라 항체는 수용자 항체 또는 공여자 항체에서 발견되지 않는 잔기들을 포함할 수 있다. 이러한 변형은 항체 성능을 더욱 개선시키기 위해 수행된다. 추가의 상세한 내용에 대해서, 문헌[Jones et al., Nature 321:522-525 (1986)]; 문헌[Riechmann et al., Nature 332:323-329 (1988)]; 및 문헌[Presta, Curr. Op. Struct. Biol. 2:593-596 (1992)]을 참조하시오. (미국특허 제 4,816,567 호; 및 문헌[Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)]을 참조하시오).
일부 실시태양에서, 본 발명의 단클론 항체는 인간화된 항체이다. 특히, 상기 인간화된 항체에서, 가변 도메인은 인간 수용자 프레임워크 영역, 및 임의로 인간 불변 도메인(존재하는 경우), 및 비-인간 공여자 CDR, 예를 들어 마우스 CDR을 포함한다. 본 발명에 따라, "인간화된 항체"란 용어는 인간 항체로부터의 가변 영역 프레임워크 및 불변 영역을 갖지만 선행의 비-인간 항체의 CDR을 보유하는 항체를 지칭한다. 하나의 실시태양에서, 인간화된 항체는 비-인간 면역글로불린으로부터 유래된 최소 서열을 함유한다. 대개, 인간화된 항체 및 그의 항체 단편은 수용자의 상보성-결정 영역(CDR)으로부터의 잔기가 목적하는 특이성, 친화성 및 능력을 갖는 비-인간 종(공여자 항체), 예를 들어 마우스, 래트 또는 토끼의 CDR로부터의 잔기에 의해 대체된 인간 면역글로불린(수용자 항체 또는 항체 단편)일 수 있다. 일부 예에서, 인간 면역글로불린의 Fv 프레임워크 영역(FR) 잔기는 상응하는 비-인간 잔기에 의해 대체된다. 더욱 또한, 인간화된 항체/항체 단편은 수용자 항체에서도 발견되지 않고 수입된 CDR 또는 프레임워크 서열에서도 발견되지 않는 잔기들을 포함할 수 있다. 상기와 같은 항체는 결합 영역이 유래된 비-인간 항체의 결합 특이성을 유지하지만, 상기 비-인간 항체에 대한 면역 반응은 피하도록 설계된다. 이들 변형은 항체 또는 항체 단편 성능을 더욱 개선시키고 최적화할 수 있다. 일반적으로, 상기 인간화된 항체 또는 그의 항체 단편은 적어도 하나, 및 전형적으로 2개의 가변 도메인을 실질적으로 전부 포함할 것이며, 여기에서 상기 CDR 영역의 전부 또는 실질적으로 전부는 비-인간 면역글로불린의 것들에 상응하고 상기 FR 영역의 전부 또는 상당 부분은 인간 면역글로불린 서열의 것들이다. 상기 인간화된 항체 또는 항체 단편은 또한 면역글로불린 불변 영역(Fc)의 적어도 일부, 전형적으로는 인간 면역글로불린의 상기 부분을 포함할 수 있다. 추가의 상세한 내용에 대해서 문헌[Jones et al., Nature, 321: 522-525, 1986]; 문헌[Reichmann et al., Nature, 332: 323-329, 1988]; 문헌[Presta, Curr. Op. Struct. Biol., 2: 593-596, 1992]을 참조하시오.
일부 실시태양에서, 상기 단클론 항체는 인간 단클론 항체이다. 본 명세서에 사용되는 바와 같이, "인간 단클론 항체"란 용어는 인간 면역글로불린 서열로부터 유래된 가변 및 불변 영역을 갖는 항체를 포함하고자 한다. 본 발명의 인간 항체는 인간 면역글로불린 서열에 의해 암호화되지 않은 아미노산 잔기(예를 들어 시험관내에서 무작위 또는 부위-특이적 돌연변이유발에 의해 또는 생체내에서 체세포 돌연변이에 의해 도입된 돌연변이)를 포함할 수 있다. 그러나, 하나의 실시태양에서, 본 명세서에 사용되는 바와 같은 "인간 단클론 항체"란 용어는 또 다른 포유동물 종, 예를 들어 마우스의 생식계열세포로부터 유래된 CDR 서열이 인간 프레임워크 서열상에 접목된 항체를 포함하고자 하지 않는다.
하나의 실시태양에서, 본 발명의 항체는 하기의 CDR 중 적어도 하나 또는 적어도 2개를 포함하는 경쇄를 포함한다:
- VL-CDR1: AGTSSDVGGY-X11-X12-VS, 여기에서 X11 은 Y 또는 S이고 X12 는 G 또는 Y이다 (서열번호 6);
- VL-CDR2: YDSYRPS (서열번호 7); 및
- VL-CDR3: SS-X3-TYYSTRV, 여기에서 X3 는 S 또는 Y이다 (서열번호 8).
하나의 실시태양에서, 본 발명의 항체는 하기의 CDR을 포함하는 경쇄를 포함한다:
- VL-CDR1: AGTSSDVGGY-X11-X12-VS, 여기에서 X11 은 Y 또는 S이고 X12 는 G 또는 Y이다 (서열번호 6);
- VL-CDR2: YDSYRPS (서열번호 7); 및
- VL-CDR3: SS-X3-TYYSTRV, 여기에서 X3 는 S 또는 Y이다 (서열번호 8).
하나의 실시태양에서, VL-CDR1은 AGTSSDVGGYYGVS (서열번호 20), AGTSSDVGGYYYVS (서열번호 21), AGTSSDVGGYSGVS (서열번호 22), 및 AGTSSDVGGYSYVS (서열번호 23) 중에서 선택된 서열을 갖는다.
하나의 실시태양에서, VL-CDR3은 SSSTYYSTRV (서열번호 24) 및 SSYTYYSTRV (서열번호 25) 중에서 선택된다.
하나의 실시태양에서, 본 발명의 항체는 3개의 하기의 CDR을 포함하는 경쇄를 포함한다:
- VL-CDR1: AGTSSDVGGYYGVS (서열번호 20);
- VL-CDR2: YDSYRPS (서열번호 7); 및
- VL-CDR3: SSSTYYSTRV (서열번호 24).
하나의 실시태양에서, 본 발명의 항체는 3개의 하기의 CDR을 포함하는 경쇄를 포함한다:
- VL-CDR1: AGTSSDVGGYYGVS (서열번호 20);
- VL-CDR2: YDSYRPS (서열번호 7); 및
- VL-CDR3: SSYTYYSTRV (서열번호 25).
하나의 실시태양에서, 본 발명의 항체는 3개의 하기의 CDR을 포함하는 경쇄를 포함한다:
- VL-CDR1: AGTSSDVGGYYYVS (서열번호 21);
- VL-CDR2: YDSYRPS (서열번호 7); 및
- VL-CDR3: SSSTYYSTRV (서열번호 24).
하나의 실시태양에서, 본 발명의 항체는 3개의 하기의 CDR을 포함하는 경쇄를 포함한다:
- VL-CDR1: AGTSSDVGGYYYVS (서열번호 21);
- VL-CDR2: YDSYRPS (서열번호 7); 및
- VL-CDR3: SSYTYYSTRV (서열번호 25).
하나의 실시태양에서, 본 발명의 항체는 3개의 하기의 CDR을 포함하는 경쇄를 포함한다:
- VL-CDR1: AGTSSDVGGYSGVS (서열번호 22);
- VL-CDR2: YDSYRPS (서열번호 7); 및
- VL-CDR3: SSSTYYSTRV (서열번호 24).
하나의 실시태양에서, 본 발명의 항체는 3개의 하기의 CDR을 포함하는 경쇄를 포함한다:
- VL-CDR1: AGTSSDVGGYSGVS (서열번호 22);
- VL-CDR2: YDSYRPS (서열번호 7); 및
- VL-CDR3: SSYTYYSTRV (서열번호 25).
하나의 실시태양에서, 본 발명의 항체는 3개의 하기의 CDR을 포함하는 경쇄를 포함한다:
- VL-CDR1: AGTSSDVGGYSYVS (서열번호 23);
- VL-CDR2: YDSYRPS (서열번호 7); 및
- VL-CDR3: SSSTYYSTRV (서열번호 24).
하나의 실시태양에서, 본 발명의 항체는 3개의 하기의 CDR을 포함하는 경쇄를 포함한다:
- VL-CDR1: AGTSSDVGGYSYVS (서열번호 23);
- VL-CDR2: YDSYRPS (서열번호 7); 및
- VL-CDR3: SSYTYYSTRV (서열번호 25).
하나의 실시태양에서, 본 발명의 항체는 하기의 CDR 중 적어도 하나 또는 적어도 2개를 포함하는 중쇄를 포함한다:
- VH-CDR1: NY-X3-MN, 여기에서 X3 는 S 또는 Y이다 (서열번호 9)
- VH-CDR2: X1-IYGSSRYI-X10-YADFVKG, 여기에서 X1 은 Y 또는 G이고 X10 은 N 또는 S이다 (서열번호 10); 및
- VH-CDR3: GMDV (서열번호 11).
하나의 실시태양에서, 본 발명의 항체는 하기의 CDR을 포함하는 중쇄를 포함한다:
- VH-CDR1: NY-X3-MN, 여기에서 X3 는 S 또는 Y이다 (서열번호 9)
- VH-CDR2: X1-IYGSSRYI-X10-YADFVKG, 여기에서 X1 은 Y 또는 G이고 X10 은 N 또는 S이다 (서열번호 10); 및
- VH-CDR3: GMDV (서열번호 11).
하나의 실시태양에서, VH-CDR1은 NYSMN (서열번호 26) 및 NYYMN (서열번호 27) 중에서 선택된 서열을 갖는다.
하나의 실시태양에서, VH-CDR2는 YIYGSSRYINYADFVKG (서열번호 28), YIYGSSRYISYADFVKG (서열번호 29), GIYGSSRYINYADFVKG (서열번호 30) 및 GIYGSSRYISYADFVKG (서열번호 31) 중에서 선택된 서열을 갖는다.
하나의 실시태양에서, 본 발명의 항체는 3개의 하기의 CDR을 포함하는 중쇄를 포함한다:
- VH-CDR1: NYSMN (서열번호 26);
- VH-CDR2: YIYGSSRYINYADFVKG (서열번호 28); 및
- VH-CDR3: GMDV (서열번호 11).
하나의 실시태양에서, 본 발명의 항체는 3개의 하기의 CDR을 포함하는 중쇄를 포함한다:
- VH-CDR1: NYSMN (서열번호 26);
- VH-CDR2: YIYGSSRYISYADFVKG (서열번호 29); 및
- VH-CDR3: GMDV (서열번호 11).
하나의 실시태양에서, 본 발명의 항체는 3개의 하기의 CDR을 포함하는 중쇄를 포함한다:
- VH-CDR1: NYSMN (서열번호 26);
- VH-CDR2: GIYGSSRYINYADFVKG (서열번호 30); 및
- VH-CDR3: GMDV (서열번호 11).
하나의 실시태양에서, 본 발명의 항체는 3개의 하기의 CDR을 포함하는 중쇄를 포함한다:
- VH-CDR1: NYSMN (서열번호 26);
- VH-CDR2: GIYGSSRYISYADFVKG (서열번호 31); 및
- VH-CDR3: GMDV (서열번호 11).
하나의 실시태양에서, 본 발명의 항체는 3개의 하기의 CDR을 포함하는 중쇄를 포함한다:
- VH-CDR1: NYYMN (서열번호 27);
- VH-CDR2: YIYGSSRYINYADFVKG (서열번호 28); 및
- VH-CDR3: GMDV (서열번호 11).
하나의 실시태양에서, 본 발명의 항체는 3개의 하기의 CDR을 포함하는 중쇄를 포함한다:
- VH-CDR1: NYYMN (서열번호 27);
- VH-CDR2: YIYGSSRYISYADFVKG (서열번호 29); 및
- VH-CDR3: GMDV (서열번호 11).
하나의 실시태양에서, 본 발명의 항체는 3개의 하기의 CDR을 포함하는 중쇄를 포함한다:
- VH-CDR1: NYYMN (서열번호 27);
- VH-CDR2: GIYGSSRYINYADFVKG (서열번호 30); 및
- VH-CDR3: GMDV (서열번호 11).
하나의 실시태양에서, 본 발명의 항체는 3개의 하기의 CDR을 포함하는 중쇄를 포함한다:
- VH-CDR1: NYYMN (서열번호 27);
- VH-CDR2: GIYGSSRYISYADFVKG (서열번호 31); 및
- VH-CDR3: GMDV (서열번호 11).
일부 실시태양에서, 본 발명의 단클론 항체는 i) 서열번호 6에 제시된 바와 같은 VL-CDR1(여기에서 X11은 Y 또는 S이고 X12는 G 또는 Y이다), ii) 서열번호 7에 제시된 바와 같은 VL-CDR2 및 iii) 서열번호 8에 제시된 바와 같은 VL-CDR3(여기에서 X3는 S 또는 Y이다)을 포함하는 경쇄, 및 i) 서열번호 9에 제시된 바와 같은 VH-CDR1(여기에서 X3는 S 또는 Y이다), ii) 서열번호 10에 제시된 바와 같은 VH-CDR2(여기에서 X1은 Y 또는 G이고 X10은 N 또는 S이다) 및 iii) 서열번호 11에 제시된 바와 같은 VH-CDR3를 포함하는 중쇄를 포함한다.
본 발명에 따라, 상기 중쇄 및 경쇄의 CDR 1, 2 및 3 중 어느 하나는 상응하는 서열번호에 나열된 특정한 CDR 또는 CDR들의 세트와 적어도 60%, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98%, 99%의 동일성을 공유하는 아미노산 서열을 가짐을 특징으로 할 수 있다.
일부 실시태양에서, 본 발명의 단클론 항체는 i) A12의 VL-CDR1, ii) A12의 VL-CDR2 및 iii) A12의 VL-CDR3를 포함하는 경쇄, 및 i) A12의 VH-CDR1, ii) A12의 VH-CDR2 및 iii) A12의 VH-CDR3를 포함하는 중쇄를 포함한다.
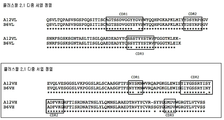
본 발명에 따라, 상기 A12 항체의 VH 영역은 서열번호 12의 서열로 이루어진다. 상응하게, 상기 A12의 VH-CDR1은 서열번호 12의 31번 위치의 아미노산 잔기에서부터 35번 위치의 아미노산 잔기에 이르는 범위의 서열에 의해 한정된다. 상응하게, 상기 A12의 VH-CDR2는 서열번호 12의 50번 위치의 아미노산 잔기에서부터 66번 위치의 아미노산 잔기에 이르는 범위의 서열에 의해 한정된다. 상응하게, 상기 A12의 VH-CDR3은 서열번호 12의 103번 위치의 아미노산 잔기에서부터 106번 위치의 아미노산 잔기에 이르는 범위의 서열에 의해 한정된다.
서열번호 12: A12 항체의 VH 영역 FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4
EVQLVESGGSLVKPGGSLRLSCAASGFTFSNYSMNWVRQAPGKGLEWISYIYGSSRYISYADFVKGRFTISRDNATNSLYLQMNSLRAEDTAVYYCVRSYYGGMDVWGRGTLVTVSS
본 발명에 따라, 상기 A12 항체의 VL 영역은 서열번호 13의 서열로 이루어진다. 상응하게, 상기 A12의 VL-CDR1은 서열번호 13의 23번 위치의 아미노산 잔기에서부터 36번 위치의 아미노산 잔기에 이르는 범위의 서열에 의해 한정된다. 상응하게, 상기 A12의 VL-CDR2는 서열번호 13의 52번 위치의 아미노산 잔기에서부터 58번 위치의 아미노산 잔기에 이르는 범위의 서열에 의해 한정된다. 상응하게, 상기 A12의 VL-CDR3은 서열번호 13의 91번 위치의 아미노산 잔기에서부터 100번 위치의 아미노산 잔기에 이르는 범위의 서열에 의해 한정된다.
서열번호 13: A12 항체의 VL 영역 FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4
QSVLTQPASVSGSPGQSITISCAGTSSDVGGYYGVSWYQQHPGKAPKLMIYYDSYRPSGVSNRFSGSKSGNTASLTISGLQAEDEADYYCSSSTYYSTRVFGGGTKLEK
하나의 실시태양에서, 상기 A12 항체의 경쇄는 하기의 CDR: i) VL-CDR1: 서열번호 20, ii) VL-CDR2: 서열번호 7 및 iii) VL-CDR3: 서열번호 24를 포함하고, 상기 A12 항체의 중쇄는 하기의 CDR: i) VH-CDR1: 서열번호 26, ii) VH-CDR2: 서열번호 29 및 iii) VH-CDR3: 서열번호 11을 포함한다.
일부 실시태양에서, 본 발명의 단클론 항체는 i) B6의 VL-CDR1, ii) B6의 VL-CDR2 및 iii) B6의 VL-CDR3를 포함하는 경쇄, 및 i) B6의 VH-CDR1, ii) B6의 VH-CDR2 및 iii) B6의 VH-CDR3를 포함하는 중쇄를 포함한다.
본 발명에 따라, 상기 B6 항체의 VH 영역은 서열번호 14의 서열로 이루어진다. 상응하게, 상기 B6의 VH-CDR1은 서열번호 14의 31번 위치의 아미노산 잔기에서부터 35번 위치의 아미노산 잔기에 이르는 범위의 서열에 의해 한정된다. 상응하게, 상기 B6의 VH-CDR2는 서열번호 14의 50번 위치의 아미노산 잔기에서부터 66번 위치의 아미노산 잔기에 이르는 범위의 서열에 의해 한정된다. 상응하게, 상기 B6의 VH-CDR3은 서열번호 14의 103번 위치의 아미노산 잔기에서부터 106번 위치의 아미노산 잔기에 이르는 범위의 서열에 의해 한정된다.
서열번호 14: B6 항체의 VH 영역 FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4
EVQLVESGGSLVKPGGSLRLSCAASGFTFSNYYMNWVRQAPGKGLEWISGIYGSSRYINYADFVKGRFTISRDNATNSLYLQMNSLRAEDTAVYYCVRSYYGGMDVWGRGTLVTVSS
본 발명에 따라, 상기 B6 항체의 VL 영역은 서열번호 15의 서열로 이루어진다. 상응하게, 상기 B6의 VL-CDR1은 서열번호 15의 23번 위치의 아미노산 잔기에서부터 36번 위치의 아미노산 잔기에 이르는 범위의 서열에 의해 한정된다. 상응하게, 상기 B6의 VL-CDR2는 서열번호 15의 52번 위치의 아미노산 잔기에서부터 58번 위치의 아미노산 잔기에 이르는 범위의 서열에 의해 한정된다. 상응하게, 상기 B6의 VL-CDR3은 서열번호 15의 91번 위치의 아미노산 잔기에서부터 100번 위치의 아미노산 잔기에 이르는 범위의 서열에 의해 한정된다.
서열번호 15: B6 항체의 VL 영역 FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4
QSVLTQPASVSGSPGQSITISCAGTSSDVGGYSYVSWYQQHPGKAPKLMIYYDSYRPSGVSNRFSGSKSGNTASLTISGLQAEDEADYYCSSYTYYSTRVFGGGTKLEK
하나의 실시태양에서, 상기 B6 항체의 경쇄는 하기의 CDR: i) VL-CDR1: 서열번호 23, ii) VL-CDR2: 서열번호 7 및 iii) VL-CDR3: 서열번호 25를 포함하고, 상기 B6 항체의 중쇄는 하기의 CDR: i) VH-CDR1: 서열번호 27, ii) VH-CDR2: 서열번호 30 및 iii) VH-CDR3: 서열번호 11을 포함한다.
일부 실시태양에서, 본 발명의 인간 단클론 항체는 서열번호 12 또는 서열번호 14와 적어도 70%의 동일성을 갖는 중쇄를 포함하는 항체이다.
일부 실시태양에서, 본 발명의 인간 단클론 항체는 서열번호 13 또는 서열번호 15와 적어도 70%의 동일성을 갖는 경쇄를 포함하는 항체이다.
일부 실시태양에서, 본 발명의 인간 단클론 항체는 서열번호 12 또는 서열번호 14와 적어도 70%의 동일성을 갖는 중쇄 및 서열번호 13 또는 서열번호 15와 적어도 70%의 동일성을 갖는 경쇄를 포함하는 항체이다.
본 발명에 따라, 제2 아미노산 서열과 적어도 70%의 동일성을 갖는 제1 아미노산 서열은 상기 제1 서열이 상기 제2 아미노산 서열과 70; 71; 72; 73; 74; 75; 76; 77; 78; 79; 80; 81; 82; 83; 84; 85; 86; 87; 88; 89; 90; 91; 92; 93; 94; 95; 96; 97; 98; 99 또는 100%의 동일성을 가짐을 의미한다. 서열 동일성은 흔히 동일성(또는 유사성 또는 상동성) 백분율에 의해 측정되며; 상기 백분율이 높을수록 2개의 서열은 보다 유사하다. 비교를 위한 서열의 정렬 방법은 당해 분야에 주지되어 있다. 다양한 프로그램 및 정렬 알고리즘은 하기의 문헌들에 기재되어 있다: Smith and Waterman, Adv. Appl. Math., 2:482, 1981; Needleman and Wunsch, J. Mol. Biol., 48:443, 1970; Pearson and Lipman, Proc. Natl. Acad. Sci. U.S.A., 85:2444, 1988; Higgins and Sharp, Gene, 73:237-244, 1988; Higgins and Sharp, CABIOS, 5:151-153, 1989; Corpet et al. Nuc. Acids Res., 16:10881-10890, 1988; Huang et al., Comp. Appls Biosci., 8:155-165, 1992; 및 Pearson et al., Meth. Mol. Biol., 24:307-31, 1994). 문헌[Altschul et al., Nat. Genet., 6:119-129, 1994]은 서열 정렬 방법 및 상동성 계산에 대한 상세한 고려사항을 제공한다. 예로서, 정렬 도구 ALIGN(Myers and Miller, CABIOS 4:11-17, 1989) 또는 LFASTA(Pearson and Lipman, 1988)를 사용하여 서열 비교를 수행할 수 있다(Internet Program® 1996, W. R. Pearson and the University of Virginia, fasta20u63 version 2.0u63, release date December 1996). ALIGN은 전체 서열을 서로에 대해 비교하는 반면, LFASTA는 국소 영역들의 유사성을 비교한다. 이들 정렬 도구 및 그들 각각의 사용 안내 프로그램을 예를 들어 인터넷 상에서 NCSA 웹사이트에서 입수할 수 있다. 한편으로, 약 30 아미노산 초과의 아미노산 서열들의 비교를 위해서, 디폴트 매개변수, (11의 끊김 존재 비용, 및 1의 잔기당 끊김 비용)에 대해 지정된 디폴트 BLOSUM62 행렬을 사용하는 Blast 2 서열 함수를 사용할 수 있다. 짧은 펩티드(대략 30 아미노산 미만)를 정렬하는 경우, 상기 정렬을 디폴트 매개변수 (끊김 9, 확장 끊김 1 벌점)에 대해 지정된 PAM30 행렬을 사용하는 Blast 2 서열 함수를 사용하여 수행해야 한다. 상기 BLAST 서열 비교 시스템을 예를 들어 NCBI 웹 사이트로부터 입수할 수 있다: 또한 하기의 문헌들을 참조하시오: Altschul et al., J. Mol. Biol., 215:403-410, 1990; Gish. & States, Nature Genet., 3:266-272, 1993; Madden et al. Meth. Enzymol., 266:131-141, 1996; Altschul et al., Nucleic Acids Res., 25:3389-3402, 1997; 및 Zhang & Madden, Genome Res., 7:649-656, 1997.
일부 실시태양에서, 본 발명의 인간 단클론 항체는 서열번호 12 또는 서열번호 14와 일치하는 중쇄를 포함하는 항체이다.
일부 실시태양에서, 본 발명의 인간 단클론 항체는 서열번호 13 또는 서열번호 15와 일치하는 경쇄를 포함하는 항체이다.
일부 실시태양에서, 본 발명의 인간 단클론 항체는 서열번호 12 또는 서열번호 14와 일치하는 중쇄 및 서열번호 13 또는 서열번호 15와 일치하는 경쇄를 포함하는 항체이다.
하나의 실시태양에서, 본 발명의 인간 단클론 항체는 서열번호 12와 일치하는 중쇄 및 서열번호 13과 일치하는 경쇄를 포함하는 항체이다. 하나의 실시태양에서, 본 발명의 인간 단클론 항체는 서열번호 12와 일치하는 중쇄 및 서열번호 15와 일치하는 경쇄를 포함하는 항체이다. 하나의 실시태양에서, 본 발명의 인간 단클론 항체는 서열번호 14와 일치하는 중쇄 및 서열번호 13과 일치하는 경쇄를 포함하는 항체이다. 하나의 실시태양에서, 본 발명의 인간 단클론 항체는 서열번호 14와 일치하는 중쇄 및 서열번호 15와 일치하는 경쇄를 포함하는 항체이다.
하나의 실시태양에서, 본 발명의 항체의 중쇄 및/또는 경쇄는 본 명세서에서 상기에 정의된 서열번호와 비교하여 보존적 서열 변형, 예를 들어 1 내지 10의 보존적 서열 변형을 포함한다. "보존적 서열 변형"이란 용어는 아미노산 서열을 함유하는 단백질의 생물학적 기능에 현저하게 영향을 미치지 않거나 상기 기능을 변경시키지 않는 상기 아미노산의 변형을 지칭한다. 상기와 같은 보존적 변형은 아미노산 치환, 부가 및 결실을 포함한다. 변형을 당해 분야에 공지된 표준 기법, 예를 들어 부위-지향된 돌연변이유발 및 PCR-매개된 돌연변이유발에 의해 단백질에 도입시킬 수 있다. "보존적 치환"은 아미노산이 유사한 성질을 갖는 또 다른 아미노산 대신 치환된 것이며, 따라서 펩티드 화학 분야의 숙련가는 폴리펩티드의 2차 구조 및 수치료 성질이 실질적으로 변하지 않음을 예상할 것이다. 따라서 아미노산 치환은 일반적으로 상기 아미노산 측쇄 치환체의 상대적인 유사성, 예를 들어 그의 소수성, 친수성, 전하, 크기 등에 근거한다. 상기 특징들을 고려하는 예시적인 치환은 당해 분야의 숙련가들에게 주지되어 있으며 아르기닌 및 리신; 글루타메이트 및 아스파테이트; 세린 및 쓰레오닌; 글루타민 및 아스파라진; 및 발린, 류신 및 이소류신을 포함한다. 아미노산 치환은 또한 잔기의 극성, 전하, 용해도, 소수성, 친수성 및/또는 양극성 성질을 근거로 이루어질 수 있다. 예를 들어, 음으로 하전된 아미노산은 아스파트산 및 글루탐산을 포함하고; 양으로 하전된 아미노산은 리신 및 아르기닌을 포함하며; 유사한 친수성 값을 갖는 하전되지 않은 극성 헤드기를 갖는 아미노산은 류신, 이소류신 및 발린; 글리신 및 알라닌; 아스파라진 및 글루타민; 및 세린, 쓰레오닌, 페닐알라닌 및 티로신을 포함한다. 보존적 변화를 나타낼 수 있는 아미노산의 다른 그룹들은 하기를 포함한다: (1) ala, pro, gly, glu, asp, gln, asn, ser, thr; (2) cys, ser, tyr, thr; (3) val, ile, leu, met, ala, phe; (4) lys, arg, his; 및 (5) phe, tyr, trp, his. 유사한 측쇄를 갖는 아미노산 잔기의 다른 과들이 당해 분야에서 정의되었다. 이들 과는 염기성 측쇄(예를 들어 리신, 아르기닌, 히스티딘), 산성 측쇄(예를 들어 아스파트산, 글루탐산), 하전되지 않은 극성 측쇄(예를 들어 글리신, 아스파라진, 글루타민, 세린, 쓰레오닌, 티로신, 시스테인, 트립토판), 비극성 측쇄(예를 들어 알라닌, 발린, 류신, 이소류신, 프롤린, 페닐알라닌, 메티오닌), 베타-분지된 측쇄(예를 들어 쓰레오닌, 발린, 이소류신) 및 방향족 측쇄(예를 들어 티로신, 페닐알라닌, 트립토판, 히스티딘)를 갖는 아미노산들을 포함한다. 따라서, 본 발명의 항체내의 하나 이상의 아미노산 잔기를 동일한 측쇄 과로부터의 다른 아미노산 잔기로 대체할 수 있으며 변경된 항체를 CD160-TM에의 결합에 대해 시험할 수 있다.
일부 실시태양에서, 본 발명의 단클론 항체는 Fab, F(ab')2, Fab' 및 scFv의 그룹 중에서 선택된다. 본 명세서에 사용되는 바와 같이, "Fab"란 용어는 약 50,000의 분자량 및 항원 결합 활성을 갖는 항체 단편을 나타내며, 여기에서 IgG를 프로테아제, 파파인으로 처리함으로써 수득된 단편들 중에서, H 쇄의 N-말단 부분의 대략 절반 및 전체 L 쇄가 디설파이드 결합을 통해 함께 결합된다. "F(ab')2"는 약 100,000의 분자량 및 항원 결합 활성을 갖는 항체 단편을 지칭하며, 상기는 IgG를 프로테아제, 펩신으로 처리함으로써 수득된 단편들 중에서, 힌지 영역의 디설파이드 결합을 통해 결합된 Fab보다 약간 더 크다. "Fab'"란 용어는 약 50,000의 분자량 및 항원 결합 활성을 갖는 항체 단편을 지칭하며, 상기는 상기 F(ab')2의 힌지 영역의 디설파이드 결합을 절단함으로써 수득된다. Fab'-SH는 본 명세서에서 불변 도메인의 시스테인 잔기(들)가 유리 티올기를 갖는 Fab'의 명칭이다. 단쇄 Fv("scFv") 폴리펩티드는, 펩티드-암호화 링커에 의해 연결된 VH 및 VL 암호화 유전자를 포함하는 유전자 융합으로부터 대개 발현되는 공유 결합된 VH::VL 이종이량체이다. 본 발명의 scFv 단편은 바람직하게는 유전자 재조합 기법을 사용함으로써 적합한 입체형태로 유지되는 CDR을 포함한다.
일부 실시태양에서, 본 발명의 단클론 항체는 CD160-TM 동형에의 결합에 대해서 i) 서열번호 6에 제시된 바와 같은 VL-CDR1(여기에서 X11은 Y 또는 S이고, X12는 G 또는 Y이다), ii) 서열번호 7에 제시된 바와 같은 VL-CDR2 및 iii) 서열번호 8에 제시된 바와 같은 VL-CDR3(여기에서 X3은 S 또는 Y이다)을 포함하는 경쇄, 및 i) 서열번호 9에 제시된 바와 같은 VH-CDR1(여기에서 X3은 S 또는 Y이다), ii) 서열번호 10에 제시된 바와 같은 VH-CDR2(여기에서 X1은 Y 또는 G이고 X10은 N 또는 S이다)(서열번호 10) 및 iii) 서열번호 11에 제시된 바와 같은 VH-CDR3을 포함하는 중쇄를 포함하는 단클론 항체와 교차-경쟁한다.
일부 실시태양에서, 본 발명의 단클론 항체는 CD160-TM 동형에의 결합에 대해서 상기 정의된 바와 같은 A12의 CDR을 포함하는 단클론 항체와 교차-경쟁한다.
일부 실시태양에서, 본 발명의 단클론 항체는 CD160-TM 동형에의 결합에 대해서 상기 정의된 바와 같은 B6의 CDR을 포함하는 단클론 항체와 교차-경쟁한다.
"교차-경쟁하다"란 용어는 항원의 특정한 영역에 결합하는 능력을 공유하는 단클론 항체들을 지칭한다. 본 개시에서 "교차-경쟁하는" 단클론 항체는 표준 경쟁 결합 분석에서 항원에 대한 또 다른 단클론 항체의 결합을 방해하는 능력을 갖는다. 상기와 같은 단클론 항체는 비-제한적인 이론에 따르면, 상기와 경쟁하는 항체와 동일하거나 관련된 또는 부근의(예를 들어 구조적으로 유사하거나 공간적으로 근접한) 에피토프에 결합할 수 있다. 교차-경쟁은 항체 A가 항체 B의 결합을, 상기 항체들 중 하나가 없는 양성 대조용과 비교하여, 적어도 60%까지, 특히 적어도 70%까지 및 보다 특히 적어도 80%까지 감소시키는 경우 및 이와 역의 경우에 나타난다. 숙련가가 이해하는 바와 같이, 경쟁을 상이한 분석 셋업에서 평가할 수 있다. 하나의 적합한 분석은 Biacore 기술(표면 플라스몬 공명 기술을 사용하여 상호작용의 정도를 측정할 수 있다)의 사용(예를 들어 BIAcore 3000 장비(비아코어(Biacore), 스웨덴 웁살라 소재)를 사용함으로써)을 수반한다. 교차-경쟁을 측정하기 위한 또 다른 분석은 ELISA-기반 접근법을 사용한다. 더욱 또한 교차-경쟁에 기반한 항체 "구간화(binning)"를 위한 대량 자료처리 공정이 국제 특허 출원 제 WO2003/48731 호에 기재되어 있다.
본 발명에 따라, 상술한 바와 같은 교차-경쟁 항체는 i) 서열번호 6에 제시된 바와 같은 VL-CDR1(여기에서 X11은 Y 또는 S이고, X12는 G 또는 Y이다), ii) 서열번호 7에 제시된 바와 같은 VL-CDR2 및 iii) 서열번호 8에 제시된 바와 같은 VL-CDR3(여기에서 X3은 S 또는 Y이다)을 포함하는 경쇄, 및 i) 서열번호 9에 제시된 바와 같은 VH-CDR1(여기에서 X3은 S 또는 Y이다), ii) 서열번호 10에 제시된 바와 같은 VH-CDR2(여기에서 X1은 Y 또는 G이고 X10은 N 또는 S이다) 및 iii) 서열번호 11에 제시된 바와 같은 VH-CDR3을 포함하는 중쇄를 포함하는 단클론 항체의 활성을 유지한다. 특히, 상기 교차-경쟁 항체는 A12 또는 B6 항체의 활성을 유지한다. 당해 분야에 주지된 임의의 분석이 상기 교차-경쟁 항체가 목적하는 활성을 유지하는지의 여부를 식별하는데 적합할 것이다. 예를 들어, 항체의 탈과립 활성을 증가시키는 능력을 측정하는 실시예 4에 기재된 분석이, 항체가 NK 세포 활성, 특히 NK 세포 사멸 활성을 증가시키는 능력을 유지하는지의 여부를 측정하는데 적합할 것이다.
실시예 1에 나타낸 바와 같이, 본 발명의 단클론 항체는 CD160 GPI-고정된 동형에의 결합에 대해서 CLI-R2 항체와 교차-경쟁하지 않는다. 환언하면, 상기 CL1-R2 항체는 CD160-TM 동형에의 결합에 대해서 본 발명의 단클론 항체와 교차-경쟁하지 않는다. CL1-R2 항체는 2004년 4월 28일자로 부다페스트 조약에 따라 파스퇴르 연구소 국립 미생물 배양물 콜렉션 C.N.C.M(the Collection Nationale de Cultures de Microorganismes C.N.C.M. Institut Pasteur)에 기탁된 하이브리도마에 의해 수득될 수 있다(C.N.C.M. Institut Pasteur 25, rue du Docteur Roux F-75724 Paris Cedex 15 France). 상기 기탁된 하이브리도마는 CNCM 기탁물 번호 I-3204를 갖는다.
더욱 또한, 실시예 1에 나타낸 바와 같이, 본 발명의 단클론 항체는 CD160 GPI-고정된 동형에의 결합에 대해서 BY55 항체와 교차-경쟁하지 않는다. 환원하면, 상기 BY55 항체는 CD160-TM 동형에의 결합에 대해서 본 발명의 단클론 항체와 교차-경쟁하지 않는다. BY55를 예를 들어 애브캠(Abcam)(참조 번호 ab81388) 및 써모피셔 사이언티픽(ThermoFisher Scientific)(참조 번호 12-1609-42)으로부터 수득할 수 있다.
하나의 실시태양에서, 본 발명은 또한 본 명세서에서 상기에 기재된 바와 같은 A12 또는 B6 항체와 필수적으로 동일한 에피토프에 결합하는 항체를 제공한다. 본 발명에서, A12 또는 B6 항체와 필수적으로 동일한 에피토프에 결합하는 항체를 각각 A12-유사 또는 B6-유사 항체라 칭할 것이다.
본 발명의 항체를 당해 분야에 공지된 임의의 기법에 의해, 예를 들어 비제한적으로 임의의 화학적, 생물학적, 유전학적 또는 효소적 기법 단독에 의해 또는 이들의 조합에 의해 생성시킨다. 전형적으로, 목적하는 서열의 아미노산 서열을 알고 있으면, 당해 분야의 숙련가는 상기 항체를, 폴리펩티드의 생성에 대한 표준 기법에 의해 쉽게 생성시킬 수 있다. 예를 들어, 상기를 주지된 고상 방법을 사용하여, 바람직하게는 상업적으로 입수할 수 있는 펩티드 합성 기구(예를 들어 어플라이드 바이오시스템스(Applied Biosystems, 미국 캘리포니아주 포스터시티 소재)에 의해 제조된 것)를 사용하여 제조사의 설명에 따라 합성할 수 있다. 한편으로, 본 발명의 항체를 당해 분야에 주지된 재조합 DNA 기법에 의해 합성할 수 있다. 예를 들어, 항체를, 상기 항체를 암호화하는 DNA 서열의 발현 벡터내로의 통합 및 상기와 같은 벡터의 적합한 진핵생물 또는 원핵생물 숙주(목적하는 항체를 발현할 것이며, 상기 숙주로부터 상기 항체를 나중에 주지된 기법을 사용하여 단리할 수 있다)내로의 도입 후에 DNA 발현 산물로서 수득할 수 있다.
상응하게, 본 발명의 추가의 목적은 본 발명에 따른 항체를 암호화하는 핵산 분자에 관한 것이다. 보다 특히, 상기 핵산 분자는 본 발명의 항체의 중쇄 또는 경쇄를 암호화한다. 보다 특히 상기 핵산 분자는 서열번호 16, 서열번호 17, 서열번호 18 또는 서열번호 19와 70%의 동일성을 갖는 핵산 서열을 포함한다.
서열번호 16 중쇄: A12의 DNA 서열
AGGTGCAGCTGGTGGAGTCTGGGGGAAGCCTGGTCAAGCCTGGGGGGTCCCTGAGACTCTCCTGTGCAGCTCTGGATTCACCTTCAGTAACTATAGTATGAACTGGGTCCGCCAGGCTCCAGGGAAGGGCTGGAGTGGATCTCATATATTTATGGTAGTAGTAGATATATAAGTTACGCAGACTTCGTGAAGGGCGATTCACCATCTCCAGAGACAACGCCACGAACTCACTGTACCTGCAAATGAACAGCCTAGAGCCGAGGACACGGCTGTTTATTACTGTGTGAGATCCTATTATGGCGGTATGGACGTCTGGGGCAGGGCACCCTGGTCACCGTCTCCTCA
서열번호 17 경쇄: A12의 DNA 서열
CAGTCTGTGCTGACTCAGCCTGCCTCCGTGTCTGGGTCTCCTGGACAGTCGATCACCATCTCCTGCGCTGAACCAGCAGTGACGTTGGTGGTTATTATGGCGTCTCCTGGTACCAACAACACCCAGGAAAGCCCCCAAACTCATGATTTATTATGACAGTTATCGGCCCTCAGGGGTTTCTAATCGCTTCTCTGGCCCAAGTCTGGCAACACGGCCTCCCTGACAATCTCTGGGCTCCAGGCTGAGGACGAGGCGATTATTACTGCAGCTCAAGTACATATTATAGCACTCGAGTTTTCGGCGGAGGGACCAAGCTGGAGATAAA
서열번호 18 중쇄: B6의 DNA 서열
GAGGTGCAGCTGGTGGAGTCTGGGGGAAGCCTGGTCAAGCCTGGGGGGTCCCTGAGACTCTCCTGTGCAGCCTCTGGATTCACCTTCAGTAACTATTATATGAACTGGGTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTGGATCTCAGGCATTTATGGTAGTAGTAGATATATAAACTACGCAGACTTCGTGAAGGGCCGATTCACCATCTCCAGAGACAACGCCACGAACTCACTGTACCTGCAAATGAACAGCCTGAGAGCCGAGGACACGGCTGTTTATTACTGTGTGAGATCCAGTGGCTATGGCGGTATGGACGTCTGGGGCAGAGGCACCCTGGTCACCGTCTCCTCA
서열번호 19 경쇄: B6의 DNA 서열
CAGTCTGTGCTGACTCAGCCTGCCTCCGTGTCTGGGTCTCCTGGACAGTCGATCACCATCTCCTGCGCTGGAACCAGCAGTGACGTTGGTGGTTATAGTTATGTCTCCTGGTACCAACAACACCCAGGCAAAGCCCCCAAACTCATGATTTATTATGACAGTTATCGGCCCTCAGGGGTTTCTAATCGCTTCTCTGGCTCCAAGTCTGGCAACACGGCCTCCCTGACAATCTCTGGGCTCCAGGCTGAGGACGAGGCTGATTATTACTGCAGCTCATATACATATTATAGCACTCGAGTTTTCGGCGGAGGGACCAAGCTGGAGATCAAA
"암호화"란 용어는 뉴클레오티드(예를 들어 rRNA, tRNA 및 mRNA)의 한정된 서열 또는 아미노산의 한정된 서열 및 상기로부터 생성되는 생물학적 성질을 갖는 생물학적 과정 중의 다른 중합체 및 거대분자의 합성에 주형으로서 제공되는 폴리뉴클레오티드, 예를 들어 유전자, cDNA 또는 mRNA 중의 뉴클레오티드의 특정 서열의 고유의 성질을 지칭한다. 따라서, 유전자, cDNA 또는 RNA는 상기 유전자에 따른 mRNA의 전사 및 번역이 세포 또는 다른 생물계에서 단백질을 생성시키는 경우 단백질을 암호화한다. 암호화 가닥(상기 mRNA 서열과 동일하고 대개는 서열 목록 중에 제공되는 뉴클레오티드 서열) 및 비-암호화 가닥(유전자 또는 cDNA의 전사를 위한 주형으로서 사용되는) 모두 상기 유전자 또는 cDNA의 단백질 또는 다른 생성물을 암호화하는 것으로서 지칭될 수 있다. 달리 명시되지 않는 한, "아미노산 서열을 암호화하는 뉴클레오티드 서열"은, 서로의 축퇴 버전이며 동일한 아미노산 서열을 암호화하는 모든 뉴클레오티드 서열을 포함한다. "단백질 또는 RNA를 암호화하는 뉴클레오티드 서열"이란 어구는 또한 상기 단백질을 암호화하는 뉴클레오티드 서열이 일부 버전에서 인트론(들)을 함유할 수 있는 정도로 인트론을 포함할 수 있다.
전형적으로, 상기 핵산은 DNA 또는 RNA 분자이며, 이들은 임의의 적합한 벡터, 예를 들어 플라스미드, 코스미드, 에피솜, 인공 염색체, 파지 또는 바이러스 벡터 중에 포함될 수 있다. 본 명세서에 사용되는 바와 같이, "벡터", "클로닝 벡터" 및 "발현 벡터"란 용어는 DNA 또는 RNA 서열(예를 들어 외래 유전자)을 숙주 세포내로 도입시켜, 상기 숙주를 형질전환시키고 상기 도입된 서열의 발현(예를 들어 전사 및 번역)을 촉진시킬 수 있는 비히클을 의미한다. 따라서, 본 발명의 추가의 목적은 본 발명의 핵산을 포함하는 벡터에 관한 것이다. 상기와 같은 벡터는 대상체에게 투여시 상기 항체의 발현을 야기하거나 지시하는 조절 요소, 예를 들어 프로모터, 인헨서, 종결자 등을 포함할 수 있다. 동물 세포에 대한 발현 벡터에 사용되는 프로모터 및 인헨서의 예는 SV40의 초기 프로모터 및 인헨서, 몰로니 마우스 백혈병 바이러스의 LTR 프로모터 및 인헨서, 면역글로불린 H 쇄의 프로모터 및 인헨서 등을 포함한다. 인간 항체 C 영역을 암호화하는 유전자가 삽입되고 발현될 수 있는 한, 동물 세포에 대한 임의의 발현 벡터를 사용할 수 있다. 적합한 벡터의 예는 pAGE107, pAGE103, pHSG274, pKCR, pSG1 베타 d2-4 등을 포함한다. 플라스미드의 다른 예는 복제 기원을 포함하는 복제 플라스미드, 또는 편입 플라스미드, 예를 들어 pUC, pcDNA, pBR 등을 포함한다. 바이러스 벡터의 다른 예는 아데노바이러스, 레트로바이러스, 헤르페스 바이러스 및 AAV 벡터를 포함한다. 상기와 같은 재조합 바이러스를 당해 분야에 공지된 기법에 의해, 예를 들어 패키징 세포를 형질감염시키거나 또는 헬퍼 플라스미드 또는 바이러스에 의한 일시 형질감염에 의해 생성시킬 수 있다. 바이러스 패키징 세포의 전형적인 예는 PA317 세포, PsiCRIP 세포, GPenv+ 세포, 293 세포 등을 포함한다. 상기와 같은 복제-결함 재조합 바이러스의 생성에 대한 상세한 프로토콜을 예를 들어 WO 95/14785, WO 96/22378, US 5,882,877, US 6,013,516, US 4,861,719, US 5,278,056 및 WO 94/19478에서 찾을 수 있다.
"프로모터/조절 서열"이란 용어는 폴리뉴클레오티드 서열의 특정한 전사를 개시시킨 다음 프로모터/조절 서열에 작동적으로 연결되는 유전자 산물의 발현을 허용하는데 필요한, 세포의 합성 기구 또는 도입된 합성 기구에 의해 인식되는 핵산 서열(예를 들어 DNA 서열)을 지칭한다. 일부 예에서, 상기 서열은 코어 프로모터 서열일 수 있으며 다른 예에서 상기 서열은 또한 인헨서 서열 및 상기 유전자 산물의 발현에 필요한 다른 조절 요소를 포함할 수 있다. 상기 프로모터/조절 서열은 예를 들어 조직 특이적인 방식으로 상기 유전자 산물을 발현하는 것일 수 있다.
"작동적으로 연결된" 또는 "전사 조절"이란 용어는 이종 핵산 서열의 발현을 생성시키는, 조절 서열과 상기 핵산 서열간의 기능적 연결을 지칭한다. 예를 들어, 제1 핵산 서열은, 상기 제1 핵산 서열이 제2 핵산 서열과 기능적 관계로 놓일 때 상기 제2 핵산 서열과 작동적으로 연결된다. 예를 들어, 프로모터는 상기 프로모터가 암호화 서열의 전사 또는 발현에 영향을 미치는 경우 상기 암호화 서열에 작동적으로 연결된다. 작동적으로 연결된 DNA 서열은 서로 연속적일 수 있으며, 예를 들어 2개의 단백질 암호화 영역을 결합시키는 것이 필요한 경우 동일한 판독 프레임 중에 있다.
본 발명의 추가의 목적은 본 발명에 따른 핵산 및/또는 벡터에 의해 형질감염되었거나, 감염되었거나 형질전환된 숙주 세포에 관한 것이다. 본 명세서에 사용되는 바와 같이, "형질전환"이란 용어는 "외래"(즉 외부적인 또는 세포외) 유전자, DNA 또는 RNA 서열의 숙주 세포로의 도입을 의미하며, 따라서 상기 숙주 세포는 상기 도입된 유전자 또는 서열을 발현하여 목적하는 물질, 전형적으로는 상기 도입된 유전자 또는 서열에 의해 암호화된 단백질 또는 효소를 생성시킬 것이다. 도입된 DNA 또는 RNA를 수용하고 발현하는 숙주 세포는 "형질전환되었다".
본 발명의 핵산을 사용하여 적합한 발현 시스템 중에 본 발명의 항체를 생성시킬 수 있다. "발현 시스템"이란 용어는 예를 들어 벡터에 의해 운반되고 숙주 세포에 도입된 외래 DNA에 의해 암호화된 단백질의 발현에 적합한 조건하의 숙주 세포 및 양립성 벡터를 의미한다. 통상적인 발현 시스템은 이 콜라이 숙주 세포 및 플라스미드 벡터, 곤충 숙주 세포 및 바큘로바이러스 벡터, 및 포유동물 숙주 세포 및 벡터를 포함한다. 숙주 세포의 다른 예는 비제한적으로 원핵생물 세포(예를 들어 세균) 및 진핵생물 세포(예를 들어 효모 세포, 포유동물 세포, 곤충 세포, 식물 세포 등)를 포함한다. 구체적인 예는 이 콜라이, 클루이베로마이세스 또는 사카로마이세스 효모, 포유동물 세포주(예를 들어 베로 세포, CHO 세포, 3T3 세포, COS 세포 등)뿐만 아니라 1차 또는 확립된 포유동물 세포 배양물(예를 들어 림프아세포, 섬유아세포, 배아세포, 상피세포, 신경세포, 지방세포 등)을 포함한다. 예는 또한 마우스 SP2/0-Ag14 세포(ATCC CRL1581), 마우스 P3X63-Ag8.653 세포(ATCC CRL1580), 디하이드로폴레이트 리덕타제 유전자(본 명세서에서 이후부터 "DHFR 유전자"라 칭함)가 결함성인 CHO 세포(Urlaub G et al; 1980), 래트 YB2/3HL.P2.G11.16Ag.20 세포(ATCC CRL1662, 본 명세서에서 이후부터 "YB2/0 세포"라 칭한다) 등을 포함한다. 본 발명은 또한 본 발명에 따른 항체를 발현하는 재조합 숙주 세포의 생성 방법에 관한 것이며, 상기 방법은 (i) 상술한 바와 같은 재조합 핵산 또는 벡터를 시험관내에서 또는 생체외에서 수용성 숙주 세포내로 도입시키고, (ii) 시험관내에서 또는 생체외에서 상기 수득된 재조합 숙주 세포를 배양하고, (iii) 임의로, 상기 항체를 발현 및/또는 분비하는 세포를 선택하는 단계들을 포함한다. 상기와 같은 재조합 숙주 세포를 본 발명 항체의 생성에 사용할 수 있다.
벡터의 예는 당해 분야에 공지된 모든 벡터, 예를 들어 비제한적으로 상기 재조합 폴리뉴클레오티드를 포함하는 코스미드, 플라스미드(예를 들어 네이키드 또는 리포솜 중에 함유된) 및 바이러스(예를 들어 렌티바이러스, 레트로바이러스, 아데노바이러스 및 아데노-관련 바이러스)를 포함한다.
본 발명의 항체를 적합하게는 통상적인 면역글로불린 정제 과정, 예를 들어 단백질 A-세파로스, 하이드록시아파타이트 크로마토그래피, 젤 전기영동, 투석, 또는 친화성 크로마토그래피에 의해 배양 배지로부터 분리시킨다.
본 발명은 또한 본 발명의 항체, 바람직하게는 B6-유사 또는 A12-유사 항체를 포함하거나, 이들로 이루어지거나 또는 이들로 필수적으로 이루어지는 조성물에 관한 것이다.
본 명세서에 사용되는 바와 같은 "로 필수적으로 이루어지는"은 조성물과 관련하여, 본 명세서에서 상기에 기재된 바와 같은 본 발명의 적어도 하나의 항체가 상기 조성물 내에서 생물학적 활성을 갖는 유일한 하나의 치료제 또는 작용제임을 의미한다.
하나의 실시태양에서, 본 발명의 조성물은 약학 조성물이며 약학적으로 허용 가능한 담체를 추가로 포함한다.
본 발명은 또한 본 발명의 항체, 바람직하게는 B6-유사 또는 A12-유사 항체를 포함하거나, 이들로 이루어지거나 또는 이들로 필수적으로 이루어지는 약제에 관한 것이다.
본 발명의 조작된 항체는 예를 들어 항체의 성질을 개선시키기 위해서, VH 및/또는 VL 내의 프레임워크 잔기에 대해 변형이 이루어진 것들을 포함한다. 전형적으로 상기와 같은 프레임워크 변형은 상기 항체의 면역원성을 감소시키기 위해 이루어진다. 예를 들어 하나의 접근법은 하나 이상의 프레임워크 잔기를 상응하는 생식계열세포 서열로 "역돌연변이"시키는 것이다. 보다 구체적으로, 체세포 돌연변이를 겪은 항체는 상기 항체가 유래된 생식계열세포 서열과 상이한 프레임워크 잔기를 함유할 수 있다. 상기와 같은 잔기는 항체 프레임워크 서열을 상기 항체가 유래된 생식계열세포 서열과 비교함으로써 식별될 수 있다. 상기 프레임워크 영역 서열을 그의 생식계열세포 배열로 복귀시키기 위해서, 체세포 돌연변이를 예를 들어 부위-지향된 돌연변이유발 또는 PCR-매개된 돌연변이유발에 의해 생식계열세포 서열로 "역돌연변이"시킬 수 있다. 상기와 같은 "역돌연변이된" 항체를 또한 본 발명에 포함시키고자 한다. 또 다른 유형의 프레임워크 변형은 상기 프레임워크 영역내, 또는 심지어 하나 이상의 CDR 영역내 하나 이상의 잔기를 T 세포-에피토프를 제거하도록 돌연변이시켜 상기 항체의 잠재적인 면역원성을 감소시킴을 포함한다. 상기 접근법을 또한 "역면역화"라 칭하며 이는 칼(Carr) 등의 미국특허 공보 제 20030153043 호에 더욱 상세히 기재되어 있다.
일부 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 항체-의존적인 세포-매개된 세포독성을 매개하는 Fc 영역을 포함한다. 본 명세서에 사용되는 바와 같이, "항체-의존적인 세포-매개된 세포독성" 또는 "ADCC"란 용어는 비-특이적인 세포독성 세포(예를 들어 자연 살해(NK) 세포, 호중구 및 대식세포)가 표적 세포상의 결합된 항체를 인식하고 후속적으로 상기 표적 세포의 용해를 야기하는 세포-매개된 반응을 지칭한다. 임의의 특정한 작용 기전에 얽매이고자 하는 것은 아니지만, 이들 ADCC를 매개하는 세포독성 세포는 일반적으로 Fc 수용체(FcR)를 발현한다.
본 명세서에 사용되는 바와 같이, "Fc 영역"은 제1 불변 영역 면역글로불린 도메인을 제외한 항체의 불변 영역을 포함하는 폴리펩티드를 포함한다. 따라서 Fc는 IgA, IgD 및 IgG의 최종 2개의 불변 영역 면역글로불린 도메인, 및 IgE 및 IgM의 최종 3개의 불변 영역 면역글로불린 도메인, 및 이들 도메인에 N-말단인 가요성 힌지를 지칭한다. IgA 및 IgM의 경우 Fc는 J 쇄를 포함할 수 있다. IgG의 경우 Fc는 면역글로불린 도메인 C감마2 및 C감마3(Cγ2 및 Cγ3) 및 C감마1(Cγ1)과 C감마 2(Cγ2) 사이의 힌지를 포함한다. 상기 Fc 영역의 경계는 변할 수 있지만, 인간 IgG 중쇄 Fc 영역은 대개 그의 카복시-말단에 잔기 C226 또는 P230을 포함하는 것으로 한정되며, 여기에서 상기 넘버링은 카밧 등에서와 같은 EU 지수에 따른다(1991, NIH Publication 91-3242, National Technical Information Service, Springfield, Va.). 상기 "카밧에 제시된 바와 같은 EU 지수"는 상기 카밧 등에 기재된 바와 같은 인간 IgG1 EU 항체의 잔기 넘버링을 지칭한다. Fc는 단리시 상기 영역, 또는 항체, 항체 단편 또는 Fc 융합 단백질과 관련하여 상기 영역을 지칭한다. Fc 변형 단백질은 항체, Fc 융합, 또는 Fc 영역을 포함하는 임의의 단백질 또는 단백질 도메인일 수 있다. Fc 영역의 비-천연 변체인 변형 Fc 영역을 포함하는 단백질이 특히 바람직하다. 비-천연 Fc 영역(또한 본 명세서에서 "변형 Fc 영역"이라 칭한다)의 아미노산 서열은 야생형 아미노산 서열과 비교하여 적어도 하나의 아미노산 잔기의 치환, 삽입 및/또는 결실을 포함한다. 삽입 또는 치환의 결과로서 변형 Fc 영역의 서열 중에 나타나는 임의의 새로운 아미노산 잔기를 비-천연 아미노산 잔기라 칭할 수 있다. 주: 다형성이 다수의 Fc 위치들, 예를 들어 비제한적으로 카밧 270, 272, 312, 315, 356, 및 358에서 관찰되었으며, 따라서 본 발명의 서열 및 종래 기술의 서열들간에 약간의 차이가 존재할 수도 있다.
"Fc 수용체" 또는 "FcR"이란 용어는 항체의 Fc 영역에 결합하는 수용체를 기재하는데 사용된다. ADCC를 매개하는 1차 세포, NK 세포는 FcγRIII를 발현하는 반면 단핵세포는 FcγRI, FcγRII, FcγRIII 및/또는 FcγRIV를 발현한다. 조혈세포상에서의 FcR 발현은 문헌[Ravetch and Kinet, Annu. Rev. Immunol., 9:457-92 (1991)]에 요약되어 있다. 분자의 ADCC 활성을 평가하기 위해서, 시험관내 ADCC 분석, 예를 들어 미국특허 제 5,500,362 호 또는 미국특허 제 5,821,337 호에 기재된 분석을 수행할 수 있다. 상기와 같은 분석에 유용한 효과기 세포는 말초 혈액 단핵세포(PBMC) 및 자연 살해(NK) 세포를 포함한다. 한편으로, 또는 추가로, 관심 분자의 ADCC 활성을 생체내에서, 예를 들어 문헌[Clynes et al., Proc. Natl. Acad. Sci. (USA), 95:652-656 (1998)]에 개시된 바와 같은 동물 모델에서 평가할 수 있다. 본 명세서에 사용되는 바와 같이, "효과기 세포"란 용어는 하나 이상의 FcR을 발현하고 효과기 기능을 수행하는 백혈구이다. 상기 세포는 적어도 FcγRI, FcγRII, FcγRIII 및/또는 FcγRIV를 발현하고 ADCC 효과기 기능을 수행한다. ADCC를 매개하는 인간 백혈구의 예는 말초 혈액 단핵세포(PBMC), 자연 살해(NK) 세포, 단핵세포, 세포독성 T 세포 및 호중구를 포함한다.
일부 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 완전길이 항체이다. 일부 실시태양에서, 상기 완전길이 항체는 IgG1 항체이다. 일부 실시태양에서, 상기 완전길이 항체는 IgG3 항체이다.
일부 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 FcγRIA, FcγRIIA, FcγRIIB, FcγRIIIA, FcγRIIIB 및/또는 FcγRIV에 대해 증가된 친화성을 갖는 변형 Fc 영역을 포함한다. 일부 실시태양에서, 본발명의 항체(바람직하게는 단클론 항체)는 적어도 하나의 아미노산 치환, 삽입 또는 결실을 포함하는 변형 Fc 영역을 포함하며, 여기에서 상기 적어도 하나의 아미노산 잔기 치환, 삽입 또는 결실은 FcγRIA, FcγRIIA, FcγRIIB, FcγRIIIA, FcγRIIIB 및 FcγRIV에 대해 증가된 친화성을 생성시킨다. 일부 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 적어도 하나의 아미노산 치환, 삽입 또는 결실을 포함하는 변형 Fc 영역을 포함하며, 여기에서 상기 적어도 하나의 아미노산 잔기는 잔기 239, 330 및 332로 이루어지는 그룹 중에서 선택되고, 여기에서 아미노산 잔기는 EU 지수에 따라 넘버링된다. 일부 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 적어도 하나의 아미노산 치환을 포함하는 변형 Fc 영역을 포함하며, 여기에서 상기 적어도 하나의 아미노산 치환은 S239D, A330L, A330Y, 및 1332E로 이루어지는 그룹 중에서 선택되고, 여기에서 아미노산 잔기는 EU 지수에 따라 넘버링된다.
일부 실시태양에서, 본 발명의 항체의 글리코실화를 변형시킨다. 예를 들어, 아글리코실화된 항체를 제조할 수 있다(즉 항체가 글리코실화가 없다). 글리코실화를, 예를 들어 항원에 대한 항체의 친화성을 증가시키거나 항체의 ADCC 활성을 변경시키기 위해 변경시킬 수 있다. 상기와 같은 탄수화물 변형을, 예를 들어 항체 서열내 하나 이상의 글리코실화 부위를 변경시킴으로써 수행할 수 있다. 예를 들어, 하나 이상의 가변 영역 프레임워크 글리코실화 부위를 제거하여 상기 부위에서의 글리코실화를 제거하는 하나 이상의 아미노산 치환을 수행할 수 있다. 상기와 같은 아글리코실화는 항원에 대한 항체의 친화성을 증가시킬 수 있다. 상기와 같은 접근법은 코(Co) 등의 미국특허 제 5,714,350 호 및 미국특허 제 6,350,861 호(본 명세서에 참고로 인용된다)에 더욱 상세히 기재되어 있다. 추가로, 또는 한편으로, 변경된 유형의 글리코실화를 갖는 항체, 예를 들어 감소된 양의 퓨코실 잔기를 갖거나 또는 퓨코실 잔기가 없는 저퓨코실화된 또는 퓨코실화되지 않은 항체 또는 증가된 양분성 GlcNac 구조를 갖는 항체를 제조할 수 있다. 상기와 같은 변경된 퓨코실화 패턴은 항체의 ADCC 능력을 증가시키는 것으로 입증되었다. 상기와 같은 탄수화물 변형을, 예를 들어 상기 항체를 변경된 글리코실화 기구를 갖는 숙주 세포에서 발현시킴으로써 수행할 수 있다. 변경된 글리코실화 기구를 갖는 세포는 당해 분야에 기재되었으며 본 발명의 재조합 항체를 발현시켜 변경된 글리코실화를 갖는 항체를 생성시키는 숙주 세포로서 사용될 수 있다. 예를 들어 행(Hang) 등의 EP1176195(본 명세서에 참고로 인용된다)는 퓨코실 트랜스퍼라제를 암호화하는 기능적으로 붕괴된 FUT8 유전자를 갖는 세포주를 기재하며, 따라서 상기와 같은 세포주에서 발현된 항체들은 저퓨코실화를 나타내거나 또는 퓨코실 잔기가 없다. 따라서, 일부 실시태양에서, 본 발명의 인간 항체(바람직하게는 단클론 항체)를 저퓨코실화 또는 비-퓨코실화 패턴을 나타내는 세포주, 예를 들어 퓨코실트랜스퍼라제를 암호화하는 FUT8 유전자의 결함성 발현을 갖는 포유동물 세포주에서 재조합 발현에 의해 생성시킬 수 있다. 프레스타(Presta)의 PCT 공보 WO 03/035835(본 명세서에 참고로 인용된다)는 퓨코스를 Asn(297)-결합된 탄수화물에 부착시키는 능력이 감소된(이는 또한 항체의 저퓨코실화를 숙주세포에서 발현시킨다) 변형 CHO 세포주, Lecl3 세포를 기재한다(또한 문헌[Shields, R.L. et al, 2002 J. Biol. Chem. 277:26733-26740]을 참조하시오). 우마나(Umana) 등의 PCT 공보 WO 99/54342(본 명세서에 참고로 인용된다)는 조작된 세포주에서 발현된 항체가 상기 항체의 증가된 ADCC 활성을 생성시키는 증가된 양분성 GlcNac 구조를 나타내도록 당단백질-변형 글리코실 트랜스퍼라제(예를 들어 베타(1,4)-N 아세틸글루코스아미닐트랜스퍼라제 III(GnTIII))를 발현하도록 조작된 세포주를 기재한다(또한 문헌[Umana et al, 1999 Nat. Biotech. 17: 176-180]을 참조하시오). 유레카 쎄라퓨틱스(Eureka Therapeutics)는 퓨코실 잔기가 없는 변경된 포유동물 글리코실화 패턴을 갖는 항체를 생산할 수 있는 유전자 조작된 CHO 포유동물 세포를 추가로 기재한다(http://www.eurekainc.com/a&boutus/companyoverview.html). 한편으로, 본 발명의 인간 항체(바람직하게는 단클론 항체)를, 포유동물-유사 글리코실화 패턴에 대해 조작되고 글리코실화 패턴으로서 퓨코스가 없는 항체를 생산할 수 있는 효모 또는 섬유상 진균에서 생성시킬 수 있다(예를 들어 EP1297172B1을 참조하시오).
일부 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 보체 의존적인 세포독성을 매개하는 Fc 영역을 포함한다. "보체 의존적인 세포독성" 또는 "CDC"는 보체 활성화를 개시시키고 보체의 존재하에서 표적을 용해시키는 분자의 능력을 지칭한다. 상기 보체 활성화 경로는 보체계의 제1 성분(C1q)의, 동족 항원과 복합체화된 분자(예를 들어 항체)에의 결합에 의해 개시된다. 보체 활성화를 평가하기 위해서, 예를 들어 문헌[Gazzano-Santaro et al., J. Immunol. Methods, 202:163 (1996)]에 기재된 바와 같은 CDC 분석을 수행할 수 있다.
일부 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 항체-의존적인 식세포작용을 매개하는 Fc 영역을 포함한다. 본 명세서에 사용되는 바와 같이, "항체-의존적인 식세포작용" 또는 "옵소닌화"란 용어는 FcγR을 발현하는 비특이적인 세포독성 세포가 표적 세포상의 결합된 항체를 인식하고 후속적으로 상기 표적 세포의 식세포작용을 야기하는 세포-매개된 반응을 지칭한다.
일부 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 ADCC 또는 CDC 또는 항체-의존적인 식세포작용을 유도하는 Fc 영역을 포함한다. 결과적으로, 대상체에게 상기와 같은 항체의 투여는 CD160-TM을 발현하는 세포, 예를 들어 CD160-TM 발현 종양 세포의 고갈을 유도할 수 있다(예를 들어 CD160-TM+ NK 세포의 수의 10%, 20%, 50%, 60% 또는 그 이상의 제거 또는 감소를 유도한다).
따라서 본 발명의 추가의 목적은 치료가 필요한 대상체에게 치료 유효량의 본 발명의 항체(바람직하게는 단클론 항체)를 전달함을 포함하는, 상기 대상체에서 CD160-TM 동형을 발현하는 세포의 집단을 고갈시키는 방법에 관한 것이다. 하나의 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 ADCC 또는 CDC 또는 항체-의존적인 식세포작용을 유도하는 Fc 영역을 포함한다.
본 발명의 추가의 목적은 치료가 필요한 대상체에게 치료 유효량의 본 발명의 항체(바람직하게는 단클론 항체)를 전달함을 포함하는, 상기 대상체에서 CD160-TM 동형을 발현하는 악성 NK 세포의 집단을 고갈시키는 방법에 관한 것이다. 하나의 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 ADCC 또는 CDC 또는 항체-의존적인 식세포작용을 유도하는 Fc 영역을 포함한다.
본 발명의 추가의 목적은 치료가 필요한 대상체에게 치료 유효량의 본 발명의 항체(바람직하게는 단클론 항체)를 전달함을 포함하는, 상기 대상체에서 A12 또는 B6 항체에 의해 인식되는 에피토프를 발현하는 세포의 집단을 고갈시키는 방법에 관한 것이다. 하나의 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 ADCC 또는 CDC 또는 항체-의존적인 식세포작용을 유도하는 Fc 영역을 포함한다.
본 명세서에 사용되는 바와 같이, 세포의 집단에 대해 "고갈시키다"란 용어는 대상체에서 상기 세포의 수의 측정 가능한 감소를 지칭한다. 상기 감소는 적어도 약 10%, 예를 들어 적어도 약 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% 이상일 수 있다. 일부 실시태양에서, 상기 용어는 대상체 중 또는 샘플 중 상기 세포의 수의 검출 가능한 한계 미만의 양까지의 감소를 지칭한다.
하나의 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 항체 의존적인 세포 세포독성, 보체 의존적인 세포독성 및 항체-의존적인 식세포작용을 매개한다.
본 발명의 추가의 목적은 암세포가 CD160-TM을 발현하는 상기 암의 치료 방법에 관한 것이다. 특히, 암세포가 CD160-TM을 발현하는 암의 예는 비제한적으로 NK 백혈병 또는 NK 림프종, 예를 들어 림프절외 및 비-림프절외 NK/T 림프종; NK 세포 유래된 암; 및 급성 NK 백혈병을 포함한다.
따라서 본 발명은 또한 암세포가 CD160-TM을 발현하는 암의 치료에 사용하기 위한 본 발명의 항체, 조성물, 약학 조성물 또는 약제에 관한 것이다.
일부 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 항체-의존적인 세포-매개된 세포독성을 매개하는 Fc 영역을 포함하지 않으며 따라서 항체 의존적인 세포 세포독성(ADCC)을 유도하는 Fc 부분을 포함하지 않는다. 하나의 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 CDC 또는 항체-의존적인 식세포작용을 유도하는 Fc 영역을 포함하지 않는다. 일부 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 CD160-TM 폴리펩티드를 발현하는 NK 세포의 고갈을 직접적으로 또는 간접적으로 유도하지 않는다(예를 들어 CD160-TM+ NK 세포의 수의 10%, 20%, 50%, 60% 이상의 제거 또는 감소를 유도하지 않는다). 일부 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 FcγRIIIA(CD16) 폴리펩티드에 실질적으로 결합할 수 있는 Fc 도메인을 포함하지 않는다. 일부 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 Fc 도메인이 없거나(예를 들어 CH2 및/또는 CH3 도메인이 없거나) IgG2 또는 IgG4 아이소타입의 Fc 도메인을 포함한다. 일부 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 상기 항체의 ADCC 활성의 부재를 생성시키는 변경된 글리코실화 프로파일을 갖는 Fc 도메인(예를 들어 IgG1의)을 포함한다. 일부 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 Fab, Fab', Fab'-SH, F(ab')2, Fv, 디아바디, 단쇄 항체 단편, 또는 다수의 상이한 항체 단편을 포함하는 다중특이성 항체로 이루어지거나 또는 이들을 포함한다. 일부 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 독성 부분에 연결되지 않는다. 일부 실시태양에서, 아미노산 잔기 중에서 선택된 하나 이상의 아미노산을, 항체가 변경된 C2q 결합 및/또는 감소되거나 제거된 보체 의존적인 세포독성(CDC)을 갖도록 상이한 아미노산 잔기로 대체할 수 있다. 상기 접근법은 이두소기(Idusogie) 등의 미국특허 제 6,194,551 호에 더욱 상세히 기재되어 있다.
본 발명의 추가의 목적은 치료가 필요한 대상체에게 치료 유효량의 본 발명의 항체를 투여함을 포함하는, 상기 대상체에서 NK 세포 활성 또는 NK 세포 효과기 기능, 특히 NK 세포 사멸 활성을 증대시키는 방법에 관한 것이나, 단 상기 항체는 항체 의존적인 세포 세포독성, 보체 의존적인 세포독성 또는 항체-의존적인 식세포작용을 매개하지 않는다.
본 명세서에 사용되는 바와 같이, "NK 세포"는 타고난 또는 비-통상적인 면역성과 관련된 림프구의 아집단을 지칭한다. NK 세포를 몇몇 특징 및 생물학적 성질, 예를 들어 인간 NK 세포에 대한 CD56 및/또는 CD16을 포함하는 특정한 표면 항원의 발현, 세포 표면상의 알파/베타 또는 감마/델타 TCR 복합체의 부재, 특정한 세포용해 기구의 활성화에 의해 "자기" MHC/HLA 항원을 발현하지 못하는 세포에 결합하여 상기 세포를 사멸시키는 능력, NK 활성화 수용체에 대한 리간드를 발현하는 종양 세포 또는 다른 병든 세포를 사멸시키는 능력, 및 면역 반응을 자극하거나 억제하는 사이토킨이라 칭하는 단백질 분자를 방출하는 능력("NK 세포 활성")에 의해 식별할 수 있다. NK 세포의 임의의 아집단이 또한 NK 세포란 용어에 포함될 것이다. 본 발명의 상황내에서, "활성" NK 세포는 생물학적으로 활성인 NK 세포, 예를 들어 표적 세포를 용해시키거나 다른 세포의 면역 기능을 증대시키는 능력을 갖는 NK 세포를 표시한다. 예를 들어, "활성" NK 세포는 NK 수용체를 활성화시키는 리간드를 발현하고/하거나 NK 세포상의 KIR에 의해 인식된 MHC/HLA 항원을 발현하지 못하는 세포를 사멸시킬 수 있다.
NK 세포 활성, 특히 NK 세포 사멸 활성을 증대시키는 본 발명의 항체(바람직하게는 단클론 항체)의 능력을 당해 분야에 주지된 임의의 분석에 의해 측정할 수 있다. 전형적으로 상기 분석은 NK 세포를 표적 세포(예를 들어 NK 세포에 의해 인식되고/되거나 용해되는 표적 세포)와 접촉시키는 시험관내 분석이다. 예를 들어, 항체를, NK 세포에 의한 비용해를, 본 발명의 항체(바람직하게는 단클론 항체)에 의해 접촉되는 NK 세포 또는 NK 세포주와 동일한 효과기:표적 세포비로 획득된 비용해의 약 20% 초과, 바람직하게는 적어도 약 30%, 적어도 약 40%, 적어도 약 50%, 또는 그 이상까지 증가시키는 능력에 대해 선택할 수 있다. 고전적인 세포독성 분석을 위한 프로토콜의 예는 예를 들어 하기의 문헌들에 기재되어 있다: Pessino et al, J. Exp. Med, 1998, 188 (5): 953-960; Sivori et al, Eur J Immunol, 1999. 29:1656-1666; Brando et al, (2005) J. Leukoc. Biol. 78:359-371; El-Sherbiny et al, (2007) Cancer Research 67(18):8444-9; 및 Nolte-'t Hoen et al, (2007) Blood 109:670-673). 전형적으로, NK 세포 세포독성을 실시예에 기재된 임의의 분석에 의해 측정한다. NK 세포 세포독성을 세포독성의 고전적인 시험관내 크로뮴 방출 시험에 의해 측정할 수 있다. 효과기 세포는 전형적으로 건강한 공여자로부터의 신선한 PB-NK이다. 상기 표적 세포는 전형적으로 쥐 비만세포종 P815 세포 또는 EBV-감염된 B 세포주이다. 상응하게, 본 발명의 항체(바람직하게는 단클론 항체)가 표적 세포(감염된 세포, 종양 세포, 염증전 세포 등)에 대한 NK 세포의 반응성 또는 세포독성의 증가, NK 세포에서 증가된 활성화, 활성화 마커(예를 들어 CD107 발현) 및/또는 IFN감마 생성, 및/또는 상기와 같은 활성화된, 반응성, 세포독성 및/또는 활성화된 NK 세포의 생체내 증가된 빈도를 야기하는 경우 상기 항체가 선택된다.
일부 실시태양에서, 상기 대상체는 암 또는 감염성 질병을 앓고 있다. 상응하게, 본 발명의 추가의 목적은 치료가 필요한 대상체에게 치료 유효량의 본 발명의 항체를 투여함을 포함하는 상기 대상체에서 암 또는 감염성 질병을 치료하는 방법에 관한 것이다. 바람직하게, 상기 실시태양에 따라, 본 발명의 항체는 ADCC, CDC 또는 항체-유도된 식세포작용을 매개하는 Fc 영역을 포함하지 않는다.
따라서 본 발명은 또한 암, 감염성 질병 또는 염증성 및/또는 자가면역 질병의 치료에 사용하기 위한 본 발명의 항체, 조성물, 약학 조성물 또는 약제에 관한 것이다.
본 명세서에 사용되는 바와 같이, "치료" 또는 "치료하는"은 임상 결과를 포함하여 이롭거나 목적하는 결과를 획득하기 위한 접근법이다. 본 발명의 목적을 위해서, 이롭거나 또는 목적하는 임상 결과는 비제한적으로 하기 중 하나 이상을 포함한다: 질병으로부터 발생하는 하나 이상의 증상의 완화, 질병의 정도의 감소, 질병의 안정화(예를 들어 질병 악화의 예방 또는 지연), 질병 확산(예를 들어 전이)의 예방 또는 지연, 질병 재발의 예방 또는 지연, 질병 진행의 지연 또는 지체, 질병 상태의 개선, 질병 관해(부분적인 또는 전적인)의 제공, 질병 치료에 필요한 하나 이상의 다른 투약 용량의 감소, 질병 진행의 지연, 삶의 질 증가, 및/또는 생존 연장. "치료"는 또한 암의 병적인 결과의 감소를 포함한다. 본 발명의 방법은 이들 치료 태양 중 임의의 하나 이상을 고려한다. 하나의 실시태양에서, "치료하는" 또는 "치료"란 용어는 치료학적 치료 및 예방학적 또는 예방적 수단을 모두 지칭하며; 여기에서 목적은 표적화된 질병을 예방하거나 늦추는(줄이는) 것이다. 따라서, 하나의 실시태양에서, 치료가 필요한 사람들은 이미 질환이 있는 사람들뿐만 아니라 상기 질환의 소인이 있는 사람들 또는 상기 질환을 예방하고자 하는 사람들을 포함한다.
본 명세서에 사용되는 바와 같이, "암"이란 용어는 당해 분야에서의 그의 일반적인 의미를 가지며 비제한적으로 고형 종양 및 혈액성 종양을 포함한다. 암이란 용어는 피부, 조직, 기관, 뼈, 연골, 혈액 및 혈관의 질병을 포함한다. "암"이란 용어는 1차 및 전이암을 모두 추가로 포함한다. 본 발명의 방법 및 조성물에 의해 치료될 수 있는 암의 예는 비제한적으로 방광, 혈액, 뼈, 골수, 뇌, 유방, 결장, 식도, 위장, 잇몸, 두부, 신장, 간, 폐, 비인두, 목, 난소, 전립선, 피부, 위, 고환, 혀 또는 자궁으로부터의 암세포를 포함한다. 또한, 상기 암은 구체적으로 하기의 조직학적 유형의 것일 수 있지만, 이들로 제한되지 않는다: 악성 신생물(neoplasm, malignant); 암종(carcinoma); 미분화 암종(carcinoma, undifferentiated); 거대 및 방추세포 암종(giant and spindle cell carcinoma); 소세포 암종(small cell carcinoma); 유두암종(papillary carcinoma); 편평세포 암종(squamous cell carcinoma); 림프상피 암종(lymphoepithelial carcinoma); 기저세포 암종(basal cell carcinoma); 모기질 암종(pilomatrix carcinoma); 이행세포 암종(transitional cell carcinoma); 유두 이행세포 암종(papillary transitional cell carcinoma); 선암종(adenocarcinoma); 악성 가스트린종(gastrinoma, malignant); 담관암종(cholangiocarcinoma); 간세포암종(hepatocellular carcinoma); 복합 간세포암종 및 담관암종(combined hepatocellular carcinoma and cholangiocarcinoma); 소주골 선암종(trabecular adenocarcinoma); 선양 낭성 암종(adenoid cystic carcinoma); 선종 폴립 중 선암종(adenocarcinoma in adenomatous polyp); 가족성 대장 폴립증 선암종(adenocarcinoma, familial polyposis coli); 고형 암종(solid carcinoma); 악성 암양종(carcinoid tumor, malignant); 기관지 폐포 선암종(branchiolo-alveolar adenocarcinoma); 유두선암종(papillary adenocarcinoma); 혐색소 암종(chromophobe carcinoma); 호산성 암종(acidophil carcinoma); 호산소성 선암종(oxyphilic adenocarcinoma); 호염기성 암종(basophil carcinoma); 투명세포 선암종(clear cell adenocarcinoma); 과립세포 암종(granular cell carcinoma); 여포성 선암종(follicular adenocarcinoma); 유두 및 여포성 선암종(papillary and follicular adenocarcinoma); 비-피막성 경화 암종(non-encapsulating sclerosing carcinoma); 부신 외피 암종(adrenal cortical carcinoma); 자궁내막 암종(endometroid carcinoma); 피부 부속기 암종(skin appendage carcinoma); 아포크린 선암종(apocrine adenocarcinoma); 피지선종(sebaceous adenocarcinoma); 귀지선종(ceruminous; adenocarcinoma); 점막상피암종(mucoepidermoid carcinoma); 낭선암종(cystadenocarcinoma); 유두 낭선암종(papillary cystadenocarcinoma); 유두 장액 낭선암종(papillary serous cystadenocarcinoma); 점액성 낭선암종(mucinous cystadenocarcinoma); 점액성 선암종(mucinous adenocarcinoma); 반지세포 암종(signet ring cell carcinoma); 침윤성 도관 암종(infiltrating duct carcinoma); 수질암종(medullary carcinoma); 소엽암종(lobular carcinoma); 염증성 암종(inflammatory carcinoma); 유방 파제트병(paget's disease, mammary); 세엽세포 암종(acinar cell carcinoma); 선편평 암종(adenosquamous carcinoma); 편평화생을 갖는 선암종(adenocarcinoma w/squamous metaplasia); 악성 흉선종(thymoma, malignant); 악성 난소 기질 종양(ovarian stromal tumor, malignant); 악성 협막세포종(thecoma, malignant); 악성 과립막 세포종양(granulosa cell tumor, malignant); 및 악성 로블라스토마(roblastoma, malignant); 세르톨리세포 암종(Sertoli cell carcinoma); 악성 라이디히세포 종양(leydig cell tumor, malignant); 악성 지질세포 종양(lipid cell tumor, malignant); 악성 부신결절종(paraganglioma, malignant); 악성 유방외 부신결절종(extra-mammary paraganglioma, malignant); 크롬친화성세포종(pheochromocytoma); 사구맥관육종(glomangiosarcoma); 악성 흑색종(malignant melanoma); 무멜라닌성 흑색종(amelanotic melanoma); 표재 확장성 흑색종(superficial spreading melanoma); 거대색소 모반의 악성 흑색종(malign melanoma in giant pigmented nevus); 상피세포 흑색종(epithelioid cell melanoma); 악성 청색모반(blue nevus, malignant); 육종(sarcoma); 섬유육종(fibrosarcoma); 악성 섬유성 조직구증(fibrous histiocytoma, malignant); 점액육종(myxosarcoma); 지방육종(liposarcoma); 평활문근육종(leiomyosarcoma); 횡문근육종(rhabdomyosarcoma); 배아성 횡문근육종(embryonal rhabdomyosarcoma); 포상 횡문근육종(alveolar rhabdomyosarcoma); 기질육종(stromal sarcoma); 악성 혼합종양(mixed tumor, malignant); 뮬러관 혼합종양(mullerian mixed tumor); 신아세포종(nephroblastoma); 간모세포종(hepatoblastoma); 암육종(carcinosarcoma); 악성 간엽종(mesenchymoma, malignant); 악성 브레너 종양(brenner tumor, malignant); 악성 엽상종(phyllodes tumor, malignant); 활막육종(synovial sarcoma); 악성 중피종(mesothelioma, malignant); 미분화배세포종(dysgerminoma); 배아성 암종(embryonal carcinoma); 악성 기형종(teratoma, malignant); 악성 난소갑상선종(struma ovarii, malignant); 융모암종(choriocarcinoma); 악성 중신종(mesonephroma, malignant); 혈관육종(hemangiosarcoma); 악성 혈관내피종(hemangioendothelioma, malignant); 카포시육종(kaposi's sarcoma); 악성 혈관주위세포종(hemangiopericytoma, malignant); 림프혈관육종(lymphangiosarcoma); 골육종(osteosarcoma); 피질주위 골육종(juxtacortical osteosarcoma); 연골육종(chondrosarcoma); 악성 연골모세포종(chondroblastoma, malignant); 중간엽 연골육종(mesenchymal chondrosarcoma); 거대세포 골 종양(giant cell tumor of bone); 유잉 육종(ewing's sarcoma); 악성 치원성 종양(odontogenic tumor, malignant); 사기질모세포 치아종(ameloblastic odontosarcoma); 악성 사기질모세포종(ameloblastoma, malignant); 사기질모세포 섬유육종(ameloblastic fibrosarcoma); 악성 송과체종(pinealoma, malignant); 척색종(chordoma); 악성 신경교종(glioma, malignant); 상의세포종(ependymoma); 성상세포종(astrocytoma); 원형질 성상세포종(protoplasmic astrocytoma); 원섬유 성상세포종(fibrillary astrocytoma); 성모세포종(astroblastoma); 교모세포종(glioblastoma); 핍지교종(oligodendroglioma); 핍지모세포종(oligodendroblastoma); 원시신경외배엽(primitive neuroectodermal); 소뇌 육종(cerebellar sarcoma); 신경절아세포종(ganglioneuroblastoma); 신경모세포종(neuroblastoma); 망막모세포종(retinoblastoma); 후각 신경원성 종양(olfactory neurogenic tumor); 악성 수막종(meningioma, malignant); 신경섬유육종(neurofibrosarcoma); 악성 신경초종(neurilemmoma, malignant); 악성 과립세포 종양(granular cell tumor, malignant); 악성 림프종(malignant lymphoma); NK 백혈병 또는 NK 림프종, 예를 들어 림프절외 및 비-림프절외 NK/T 림프종(extranodal and non-extranodal NK/T lymphomas); NK 세포 유래 암; 및 급성 NK 백혈병; 호지킨병(Hodgkin's disease); 호지킨 림프종(Hodgkin's lymphoma); 부육아종(paragranuloma); 소 림프구성 악성 림프종(malignant lymphoma, small lymphocytic); 거대세포 미만성 악성 림프종(malignant lymphoma, large cell, diffuse); 여포성 악성 림프종(malignant lymphoma, follicular); 균상 식육종(mycosis fungoides); 다른 명시된 비-호지킨 림프종; 악성 조직구증(malignant histiocytosis); 다발성 골수종(multiple myeloma); 비만세포 육종(mast cell sarcoma); 면역증식성 소장 질환(immunoproliferative small intestinal disease); 백혈병(leukemia); 림프성 백혈병(lymphoid leukemia); 원형질세포 백혈병(plasma cell leukemia); 적백혈병(erythroleukemia); 림프육종세포 백혈병(lymphosarcoma cell leukemia); 골수성 백혈병(myeloid leukemia); 호염기성 백혈병(basophilic leukemia); 호산성 백혈병(eosinophilic leukemia); 단핵구성 백혈병(monocytic leukemia); 비만세포 백혈병(mast cell leukemia); 거핵모세포성 백혈병(megakaryoblastic leukemia); 골수성 육종(myeloid sarcoma); 및 털세포 백혈병(hairy cell leukemia).
본 명세서에 사용되는 바와 같이 "감염성 질병"이란 용어는 바이러스, 세균, 원생동물, 곰팡이 또는 진균에 의해 유발되는 임의의 감염을 포함한다. 일부 실시태양에서, 상기 바이러스 감염은 아레나비리다에, 아스트로비리다에, 비르나비리다에, 브로모비리다에, 분야비리다에, 칼리시비리다에, 클로스테로비리다에, 코모비리다에, 시스토비리다에, 플라비비리다에, 플렉시비리다에, 헤페비루스, 레비비리다에, 루테오비리다에, 모노네가비랄레스, 모자이크 비루세스, 니도비랄레스, 노다비리다에, 오쏘믹소비리다에, 피코비르나비루스, 피코르나비리다에, 포티비리다에, 레오비리다에, 레트로비리다에, 세퀴비리다에, 테누이비루스, 토가비리다에, 톰부스비리다에, 토티비리다에, 티모비리다에, 헤파드나비리다에, 헤르페스비리다에, 파라믹소비리다에 또는 파필로마비리다에 바이러스로 이루어지는 그룹 중에서 선택된 하나 이상의 바이러스에 의한 감염을 포함한다. RNA 바이러스의 관련된 분류과는 비제한적으로 아스트로비리다에, 비르나비리다에, 브로모비리다에, 칼리시비리다에, 클로스테로비리다에, 코모비리다에, 시스토비리다에, 플라비비리다에, 플렉시비리다에, 헤페비루스, 레비비리다에, 루테오비리다에, 모노네가비랄레스, 모자이크 비루세스, 니도비랄레스, 노다비리다에, 오쏘믹소비리다에, 피코비르나비루스, 피코르나비리다에, 포티비리다에, 레오비리다에, 레트로비리다에, 세퀴비리다에, 테누이비루스, 토가비리다에, 톰부스비리다에, 토티비리다에 및 티모비리다에 바이러스를 포함한다. 일부 실시태양에서, 상기 바이러스 감염은 아데노바이러스, 리노바이러스, 간염, 면역결핍 바이러스, 폴리오, 홍역, 에볼라, 콕삭키, 리노, 웨스트 나일, 천연두, 뇌염, 황열, 뎅기열, 인플루엔자(인간, 조류 및 돼지 포함), 라싸, 림프구성 맥락수막염, 후닌, 마쿠포, 구아나리토, 한타바이러스, 리프트 밸리열, 라크로스, 캘리포니아 뇌염, 크림-콩고, 말버그, 일본 뇌염, 키아사누 포레스트, 베네주엘라 말 뇌염, 동부 말 뇌염, 서부 말 뇌염, 중증 급성 호흡기 증후군(SARS), 파라인플루엔자, 호흡기 합포체, 푼타 토로, 타카리베, 파친다에 바이러스, 아데노바이러스, 뎅기열, 인플루엔자 A 및 인플루엔자 B(인간, 조류 및 돼지 포함), 후닌, 홍역, 파라인플루엔자, 피킨데, 푼타 토로, 호흡기 합포체, 리노바이러스, 리프트 밸리열, 중증 급성 호흡기 증후군(SARS), 타카리베, 베네주엘라 말 뇌염, 웨스트 나일 및 황열 바이러스, 진드기-매개 뇌염 바이러스, 일본 뇌염 바이러스, 세인트루이스 뇌염 바이러스, 머레이 밸리 바이러스, 포와싼 바이러스, 로치오 바이러스, 도약병 바이러스, 반지 바이러스, 일례우스 바이러스, 코코베라 바이러스, 쿤진 바이러스, 알푸이 바이러스, 소 설사 바이러스, 및 키아사누 포레스트병으로 이루어지는 그룹 중에서 선택된 하나 이상의 바이러스에 의한 감염을 포함한다. 본 발명에 따라 치료될 수 있는 세균 감염은 비제한적으로 스타필로코커스; 스트렙토코커스 피오게네스를 포함한 스트렙토코커스; 엔테로코커스; 바실러스 안트라시스를 포함한 바실러스, 및 락토바실러스; 리스테리아; 코리네박테리움 디프테리아에; 가르드네렐라 바기날리스를 포함한 가르드네렐라; 노카르디아; 스트렙토마이세스; 써모액티노마이세스 불가리스; 트레포네르나; 캄필로박터, 아에루기노사를 포함한 슈도모나스; 레지오넬라; 네이쎄리아 고노로에아에 및 네이쎄리아 메닌지티데스를 포함한 네이쎄리아; 플라보박테리움 메닌고세프티쿰 및 플라보박테리움 오도라투른을 포함한 플라보박테리움; 브루셀라; 보르데텔라 페르투시스 및 보르데텔라 브론키세프티카를 포함한 보르데텔라; 에스케리키아 콜라이를 포함한 에스케리키아, 클렙시엘라; 엔테로박터, 세라티아 마르세센스 및 세라티아 리퀘파시엔스를 포함한 세라티아; 에드와르드시엘라; 프로테우스 미라빌리스 및 프로테우스 불가리스를 포함한 프로테우스; 스트렙토바실러스; 리켓챠세에아 픽켓츠피를 포함한 리켓챠세아에, 클라미디아 프시티키 및 클라미디아 트라코르나티스를 포함한 클라미디아; 마이코박테리움 투베르쿨로시스, 마이코박테리움 인트라셀룰라레, 마이코박테리움 폴루이투른, 마이코박테리움 라프라에, 마이코박테리움 아비움, 마이코박테리움 보비스, 마이코박테리움 아프리카눔, 마이코박테리움 칸사시이, 마이코박테리움 인트라셀룰라레, 및 마이코박테리움 레프라에르누리움을 포함한 마이코박테리움; 및 노카르디아에 의해 유발된 감염을 포함한다. 본 발명에 따라 치료될 수 있는 원생동물 감염은 비제한적으로 리슈마니아, 콕지디오아 및 트리파노소마에 의해 유발된 감염을 포함한다. 감염성 질병의 완전한 목록을 질병 방제 센터(CDC)의 국립 감염성 질병 센터(NCID) 웹사이트(World Wide Web (www) at cdc.gov/ncidod/diseases/)에서 찾을 수 있으며, 상기 목록은 본 명세서에 참고로 인용된다. 상기 질병은 모두 본 발명에 따른 조성물을 사용하는 치료 후보이다.
염증성 질병의 예는 비제한적으로 관절염(arthritis), 류머티스성 관절염(rheumatoid arthritis), 강직성 척추염(ankylosing spondylitis), 골관절염(osteoarthritis), 건선성 관절염(psoriatic arthritis), 소아 특발성 관절염(juvenile idiopathic arthritis), 소아 류머티스성 관절염(juvenile rheumatoid arthritis), 통풍성 관절염(arthritis uratica), 통풍(gout), 만성 다발성 관절염(chronic polyarthritis), 어깨관절주위염(periarthritis humeroscapularis), 경부 관절염(cervical arthritis), 요천추부 관절염(lumbosacral arthritis), 장병성 관절염(enteropathic arthritis) 및 강직성 척추염(ankylosing spondylitis), 천식(asthma), 피부염(dermatitis), 건선(psoriasis), 피부경화증(scleroderma), 다발성근염(polymyositis), 피부근염(dermatomyositis), 소아 피부근염(juvenila dermatomyositis), 원발성 담즙성 경변증(prmimary biliary cirrhosis), 섬유증(fibrosis), 낭성 섬유증(cystic fibrosis), 폐섬유증(pulmonary fibrosis), 간경변증(cirrhosis), 심내막심근 섬유증(endomyocardial fibrosis), 종격동 섬유증(dediastinal fibrosis), 골수섬유증(myelofibrosis), 후복막 섬유증(retroperitoneal fibrosis), 신원발성 섬유증(nephrogenic fibrosis), 켈로이드(Keloids), 피부경화증(scleroderma), 관절섬유증(arthrofibrosis), 이식후 말기 및 만성 고형 기관 거부(post transplantation late and chronic solid organ rejection), 다발성 경화증(multiple sclerosis), 전신 홍반성 루푸스(systemic lupus erythematosus), 루푸스 신염(lupus nephritis), 천포창(pemphigus), 심상성 천포창(Pemphigus vulgaris), 수포창 피부염(Pemphigus herpetiformis), 증식성 천포창(Pemphigus vegetans), IgA 천포창(pemphigus), 홍반성 천포창(Pemphigus erythematosus), 수포성 유사천포창(bullous pemphigoid), 천포창양 임신(Pemphigoid gestationis), 점막 피부증(Mucous membrane dermatosis), 천포창양 소결절(Pemphigoid nodularis), 선형 IgA 수포성 피부증(Linear IgA bullous dermatosis), 수포성 편평 태선(Bullous lichen planus), 후천성 표피 수포증(Epidermolysis bullosa acquisita), 자가면역 당뇨병(autoimmune diabetes), 당뇨성 망막병증(diabetic retinopathy), 당뇨성 신병증(diabetic nephropathy), 당뇨성 혈관병증(diabetic vasculopathy), 안 염증(ocular inflammation), 포도막염(uveitis), 비염(rhinitis), 허혈성 재관류 손상(ischemia-reperfusion injury), 혈관성형술 후 재협착증(post-angioplasty restenosis), 만성 폐쇄성 폐질병(chronic obstructive pulmonary disease)(COPD), 사구체신염(glomerulonephritis), 그레이브스병(Graves disease), 위장 알러지(gastrointestinal allergies), 결막염(conjunctivitis), 죽상경화증(atherosclerosis), 관상동맥 질병(coronary artery disease), 협심증(angina), 소동맥 질병(small artery disease), 급성 파종성 뇌척수염(acute disseminated encephalomyelitis), 특발성 혈소판감소성 자반(idiopathic thrombocytopenic purpura), 다발성 경화증(multiple sclerosis), 전신 경화증(systemic sclerosis), 항인지질 증후군(antiphospholipid syndrome), 쇼그렌 증후군(Sjoegren's syndrome), 자가면역 용혈성 빈혈(autoimmune hemolytic anemia), 대장염(colitis), 크론병(Crohn's Disease), 궤양성 대장염(ulcerative colitis), 염증성 장 질병(Inflammatory Bowel Disease)(IBD), 색전증(embolism), 폐 색전증(pulmonary embolism), 동맥 색전증(arterial embolism), 정맥 색전증(venous embolism), 알러지성 염증(allergic inflammation), 심혈관 질병(cardiovascular disease), 이식편-관련 질병(graft-related diseases), 이식편대 숙주병(graft versus host disease)(GVHD), 이식편 이식 거부와 관련된 질환(disorders associated with graft transplantation rejection), 만성 거부(chronic rejection), 및 조직 또는 세포 동종이식편 또는 이종이식편(tissue or cell allografts or xenografts), 자가면역 질병(autoimmune diseases), 외상후 퇴행(degeneration after trauma), 뇌졸중(stroke), 이식 거부(transplant rejection), 알러지 상태 및 과민증(allergic conditions and hypersensitivity), 예를 들어 알러지성 비염(allergic rhinitis), 알러지성 습진(allergic eczema) 등, 피부 질환, 피부 염증성 질환, 또는 이들의 임의의 조합을 포함한다.
자가면역 질병의 예는 비제한적으로 루푸스(예를 들어 홍반성 루푸스, 루푸스 신염), 하시모토 갑상선염(Hashimoto's thyroiditis), 베게너병(Wegener's disease); 원발성 점액수종(primary myxedema), 그레이브스병, 악성 빈혈(pernicious anemia), 자가면역 위축성 위염(autoimmune atrophic gastritis), 애디슨병(Addison's disease), 당뇨병(예를 들어 인슐린 의존성 당뇨병, I형 당뇨병, II형 당뇨병), 굿파스쳐 증후군(good pasture's syndrome), 중증 근무력증(myasthenia gravis), 천포창, 장 염증 상태, 예를 들어 크론병 및 궤양성 대장염; 교감성 안염(sympathetic ophthalmia), 자가면역 포도막염(autoimmune uveitis), 다발성 경화증, 자가면역 용혈성 빈혈, 특발성 혈소판감소증, 원발성 간경변증, 만성 활동성 간염(chronic action hepatitis), 궤양성 대장염, 쇼그렌 증후군, 관절염 상태, 예를 들어 류머티스성 관절염, 건선성 관절염, 강직성 척추염 및 소아 특발성 관절염; 다발성 근염, 피부경화증, 건선, 원발성 경화성 담관염(primary sclerosing cholangitis); 천식, 이식 거부(숙주 대 이식편병); 이식편 대 숙주병 및 혼합 결합조직병(mixed connective tissue disease)을 포함한다.
본 발명은 또한 본 발명의 항체를 적어도 하나의 추가적인 치료제, 예를 들어 암 치료용 치료제와 함께 사용하는 치료 용도를 제공한다. 상기와 같은 투여는 동시, 별도 또는 연속적일 수 있다. 동시 투여를 위해서, 상기 작용제들을 적합한 대로 하나의 조성물로서 또는 별도의 조성물로서 투여할 수 있다. 상기 추가의 치료제는 전형적으로 치료하려는 질환과 관련된다. 예시적인 치료제는 다른 항암 항체, 세포독성제, 화학요법제, 혈관형성 방지제, 항암 면역원, 세포주기 조절/세포사멸 조절제, 호르몬 조절제, 및 하기에 기재된 다른 작용제들을 포함한다.
일부 실시태양에서, 상기 제2 작용제는 CD160-TM 이외의 NK 세포 활성화 수용체에 결합하여 상기 수용체를 활성화시키는 항체 또는 NK 세포 활성화의 천연 리간드이다. 일부 실시태양에서, 상기 작용제는 표적 세포(예를 들어 감염된 세포 또는 종양 세포)의 표면상의 NK 세포 활성화 수용체의 천연 리간드의 존재를 증가시키는 작용제이다. 하나의 실시태양에서, 본 발명의 항체는 ADCC, CDC 또는 항체-유도된 식세포작용을 매개하는 Fc 영역을 포함하지 않으며 (i) CD160-TM 이외의 NK 세포 활성화 수용체에 결합하여 상기 수용체를 활성화시키는 항체 또는 NK 세포 활성화의 천연 리간드이고/이거나 (ii) 표적 세포의 표면상의 NK 세포 활성화 수용체의 천연 리간드의 존재를 증가시키는 제2 작용제와 함께 사용된다. NK 세포 활성화 수용체는 예를 들어 NKG2D 또는 활성화 KIR 수용체(KIR2DS 수용체, KIR2DS2, KIR2DS4)를 포함한다. 본 명세서에 사용되는 바와 같이, "활성화 NK 수용체"란 용어는 자극시 NK 활성, 예를 들어 사이토킨(예를 들어 IFN-γ 및 TNF-α) 생산, 세포내 무칼슘 수준의 증가, 예를 들어 본 명세서의 다른 어딘가에 기재된 바와 같은 재지시된 사멸 분석에서 세포를 표적화하는 능력, 또는 NK 세포 증식을 자극하는 능력과 관련 것으로서 당해 분야에 공지된 임의의 성질 또는 활성의 측정 가능한 증가를 야기하는 NK 세포의 표면상의 임의의 분자이다. "활성화 NK 수용체"란 용어는 비제한적으로 활성화 형태 또는 KIR 단백질(예를 들어 KIR2DS 단백질), NKG2D, IL-2R, IL-12R, IL-15R, IL-18R 및 IL-21R을 포함한다. 활성화 수용체에서 작용물질로서 작용하는 리간드의 예는 예를 들어 IL-2, IL-15, IL-21 폴리펩티드를 포함한다. 일부 실시태양에서, 상기 제2 항체는 CD137에 특이적이다. 본 명세서에 사용되는 바와 같이 "CD137"이란 용어는 당해 분야에서의 그의 일반적인 의미를 가지며, 또한 Ly63, ILA 또는 4-1BB라 지칭될 수 있다. CD137은 종양 괴사 인자(TNF) 수용체과의 일원이다. 상기 수용체과의 일원 및 그의 구조적으로 관련된 리간드는 광범위하게 다양한 생리학적 과정의 중요한 조절제이며 면역 반응의 조절에 중요한 역할을 한다. CD137은 활성화된 NK 세포, T 및 B 림프구 및 단핵세포/대식세포에 의해 발현된다. 상기 유전자는 세포외 도메인 중에 3개의 시스테인-풍부 동기(상기 수용체과의 특징), 막관통 영역, 및 잠재적인 인산화 부위를 함유하는 짧은 N-말단 세포질 부분을 갖는 255-아미노산 단백질을 암호화한다. 1차 세포에서의 발현은 엄격하게 활성화 의존적이다. 상기 수용체에 대한 리간드는 TNFSF9이다. 인간 CD137은 오직 그의 리간드에만 결합하는 것으로 보고되고 있다. 작용물질은 본래의 리간드(TNFSF9), 앱타머(문헌[McNamara et al. (2008) J. Clin. Invest. 1 18: 376-386]을 참조하시오) 및 항체를 포함한다.
일부 실시태양에서, 본 발명의 항체를, ADCC를 통해 제2 항체가 결합하는 항원을 발현하는 세포의 사멸을 유도하는 상기 제2 항체와 함께 사용한다. 하나의 실시태양에서, 본 발명의 항체는 ADCC, CDC 또는 항체-유도된 식세포작용을 매개하는 Fc 영역을 포함하지 않으며 ADCC를 통해 제2 항체가 결합하는 항원을 발현하는 세포의 사멸을 유도하는 상기 제2 항체와 함께 사용한다. 하나의 실시태양에서, 본 발명의 항체는 ADCC를 통해 제2 항체가 결합하는 항원을 발현하는 세포의 사멸을 유도하는 상기 제2 항체에 접합된다. NK 세포는 ADCC를 유도하는데 중요한 역할을 가지며 NK 세포의 증가된 반응성이 상기와 같은 제2 작용제의 사용을 통해 표적 세포를 향할 수 있다. 일부 실시태양에서, 상기 제2 작용제는 세포 표면 항원, 예를 들어 막항원에 특이적인 항체이다. 일부 실시태양에서, 상기 제2 항체는 본 명세서에 기재된 바와 같은 종양 항원(예를 들어 종양 세포에 의해 특이적으로 발현된 분자), 예를 들어 CD20, CD52, ErbB2(또는 HER2/Neu), CD33, CD22, CD25, MUC-1, CEA, KDR, αVβ3 등, 특히 림프종 항원(예를 들어 CD20)에 특이적이다. 상응하게, 본 발명은 또한 종양 항원(들)에 대한 단클론 항체의 항-종양 효과를 증대시키는 방법을 제공한다. 본 발명의 방법에서, ADCC 기능이 특별히 증대되며, 이는 차례로 하나 이상의 종양 항원에 대한 항체, 및 본 발명의 항체의 연속 투여에 의해 표적 세포 사멸을 증대시킨다.
상응하게, 추가의 목적은 치료가 필요한 대상체에게 항체를 투여하고 상기 대상체에게 본 발명의 항체를 투여함을 포함하는, 상기 대상체에서 상기 항체의 NK 세포 항체-의존적인 세포 세포독성(ADCC)을 증대시키는 방법에 관한 것이며, 여기에서 바람직하게 본 발명의 항체는 ADCC, CDC 또는 항체-유도된 식세포작용을 매개하는 Fc 영역을 포함하지 않는다.
본 발명의 추가의 목적은 치료가 필요한 대상체에게 암세포 항원에 선택성인 제1 항체를 투여하고 상기 대상체에게 본 발명의 항체를 투여함을 포함하는, 상기 대상체에서 암을 치료하는 방법에 관한 것이며, 여기에서 바람직하게 본 발명의 항체는 ADCC, CDC 또는 항체-유도된 식세포작용을 매개하는 Fc 영역을 포함하지 않는다.
다수의 항체가 현재 암 치료를 위한 임상적 용도에 사용되며, 다른 것들은 다양한 임상 개발 단계에 있다. 본 발명의 방법에 중요한 항체는 ADCC를 통해 작용하며, 전형적으로는 종양 세포에 대해 선택성이지만, 당해 분야의 숙련가는 일부 임상적으로 유용한 항체가 비-종양 세포, 예를 들어 CD20상에서 작용함을 알 것이다. B 세포암의 치료를 위한 다수의 항원 및 상응하는 단클론 항체가 존재한다. 하나의 인기있는 표적 항원은 CD20이며, 이는 B 세포암에서 발견된다. 리툭시맵은 상기 CD20 항원에 대한 접합되지 않은 키메라 단클론 항체이다. CD20은 B 세포 활성화, 증식 및 분화에 중요한 기능적인 역할을 갖는다. CD52 항원은 만성적인 림프구성 백혈병의 치료에 지시되는 단클론 항체 알렘투주맵에 의해 표적화된다. CD22는 다수의 항체에 의해 표적화되며, 최근에 화학요법-내성 털세포 백혈병에서 독소와 병용된 효능이 입증되었다. CD20을 표적화하는 단클론 항체는 또한 토시투모맵 및 이브리투모맵을 포함한다. 고형 종양에 사용되어 온 본 발명의 방법에 유용한 단클론 항체는 비제한적으로 에드레콜로맵 및 트라스투주맵(허셉틴)을 포함한다. 에드레콜로맵은 결장 및 직장암에서 보이는 17-1 A 항원을 표적화하며, 유럽에서 상기 적응증에 대해 사용이 승인되었다. 그의 항종양 효과는 ADCC, CDC 및 항-유전자형 네트워크의 유도를 통해 매개된다. 트라스투주맵은 HER-2/neu 항원을 표적화한다. 상기 항원은 유방암의 25% 내지 35%에서 발견된다. 트라스투주맵은 다양한 방식으로 작용하는 것으로 생각된다: HER-2 수용체 발현의 하향조절, HER-2 단백질을 과발현하는 인간 종양 세포의 증식의 억제, HER-2 단백질을 과발현하는 종양 세포에 대한 ADCC 및 면역 보충의 증대, 및 혈관형성 인자의 하향조절. 알렘투주맵(캄패쓰)은 만성 림프구성 백혈병; 결장암 및 폐암의 치료에 사용되며, 젬투주맵(마일로타르그)은 급성 골수성 백혈병의 치료에 사용되고; 이브리투모맵(제발린)은 비-호지킨 림프종의 치료에 사용되며; 파니투무맵(벡티빅스)은 결장암의 치료에 사용된다. 세툭시맵(에르비툭스)은 또한 본 발명의 방법에 중요하게 사용된다. 상기 항체는 EGF 수용체(EGFR)에 결합하며, 결장암 및 두경부의 편평세포 암종(SCCHN)을 포함한 고형 종양의 치료에 사용되어 왔다.
하나의 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)를 적어도 하나의 면역 관문 억제제(ICI)와 함께 사용한다. 다양한 종양이 상기 종양을 면역계에 의한 공격으로부터 보호하는 분자 인자를 발현할 수 있으며, 따라서 면역계 감시 통제를 성공적으로 벗어날 수 있다. 상기 "종양 면역 탈출"은 주로 면역세포 리간드에 의해 표적화된 수용체 및 결합 부위의 길항성 차단에 기인한다. 면역 관문 억제제는 종양성 세포에 의해 발달된 이러한 종류의 억제 기전을 특별히 표적화하는 분자이다. ICI의 예는 비제한적으로 CTLA-4의 억제제(예를 들어 이필루맵 및 트레멜리무맵), PD-1의 억제제(예를 들어 펨브로리주맵, 피딜리주맵, 니볼루맵 및 AMP-224), PD-L1의 억제제(예를 들어 아테졸리주맵, 아벨루맵, 두르발루맵 및 BMS-936559), LAG3의 억제제(예를 들어 IMP321) 및 B7-H3의 억제제(예를 들어 MGA271)를 포함한다. 하나의 실시태양에서, 본 발명의 항체는 ADCC, CDC 또는 항체-유도된 식세포작용을 매개하는 Fc 영역을 포함하지 않으며 적어도 하나의 면역 관문 억제제(ICI)와 함께 사용된다.
하나의 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 CD160-TM의 그의 리간드 중 하나, 예를 들어 MHC I 부류 분자에의 결합을 억제한다. 본 명세서에 사용되는 바와 같이, "리간드"란 용어는 리간드/수용체 쌍의 구성원을 지칭하며 상기 쌍의 다른 구성원에 결합한다. CD160-TM의 그의 리간드 중 하나에의 결합의 억제는 따라서 CD160-TM을 발현하는 NK 세포의 기능성을 억제할 수 있다.
상기와 같은 억제는 발작성 야간 혈색소뇨증 또는 염증성 및/또는 자가면역 질병의 치료에 유용할 수 있다. 염증성 및/또는 자가면역 질병의 예는 본 명세서에서 상기에 나열된다.
따라서 본 발명의 추가의 목적은 발작성 야간 혈색소뇨증의 치료가 필요한 대상체에게 치료 유효량의 본 발명의 항체(바람직하게는 단클론 항체)를 투여함을 포함하는 상기 대상체에서 상기 질병을 치료하는 방법에 관한 것이다. 본 명세서에 사용되는 바와 같이, "발작성 야간 혈색소뇨증" 또는 "PNH"란 용어는 당해 분야에서의 그의 일반적인 의미를 가지며 미립자 용혈성 빈혈, 골수 부전 및 빈번한 혈전증 사건을 특징으로 하는 후천적인 클론성 조혈모세포 질환을 지칭한다. 일부 실시태양에서, 상기 대상체는 PIGA 유전자(포스파티딜이노시톨 글리칸 앵커 생합성 A 부류, 유전자 ID: 5277)에 대해 돌연변이되지 않는다.
따라서 본 발명은 또한 PNH의 치료에 사용하기 위한 항체, 조성물, 약학 조성물 또는 약제에 관한 것이다.
하나의 실시태양에서, PNH의 치료에 사용될 때 본 발명의 항체(바람직하게는 단클론 항체)는 ADCC, CDC 또는 항체-유도된 식세포작용을 매개하는 Fc 영역을 포함하지 않는다. 하나의 실시태양에서, PNH의 치료에 사용될 때 본 발명의 항체(바람직하게는 단클론 항체)는 Fab, Fab', Fab'-SH, F(ab')2, Fv, 디아바디, 단쇄 항체 단편, 또는 다수의 상이한 항체 단편을 포함하는 다중특이성 항체들로 이루어지거나 또는 이들을 포함한다. 바람직하게, 상기 실시태양에 따라, 본 발명의 항체(바람직하게는 단클론 항체)는 Fab이다.
본 발명은 또한 본 발명의 항체(바람직하게는 단클론 항체)를 포함하는 융합 단백질에 관한 것이다.
일부 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 치료학적 부분, 즉 약물에 접합된다. 상기 치료학적 부분은 예를 들어 세포독소, 화학요법제, 사이토킨, 면역억제제, 면역자극제, 가용성 펩티드, 또는 방사성동위원소일 수 있다. 상기와 같은 접합체를 본 명세서에서 "항체-약물 접합체" 또는 "ADC"라 칭한다. 하나의 실시태양에서, 본 발명의 항체는 ADCC, CDC 또는 항체-유도된 식세포작용을 매개하는 Fc 영역을 포함하지 않으며 치료학적 부분에 접합된다.
일부 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 세포독성 부분에 접합된다. 하나의 실시태양에서, 본 발명의 항체는 ADCC, CDC 또는 항체-유도된 식세포작용을 매개하는 Fc 영역을 포함하지 않으며 세포독성 부분에 접합된다. 상기 세포독성 부분은 예를 들어 탁솔; 사이토칼라신 B; 그라미시딘 D; 에티디움 브로마이드; 에메틴; 미토마이신; 에토포시드; 테노포시드; 빈크리스틴; 빈블라스틴; 콜히친; 독소루비신; 다우노루비신; 디하이드록시 안트라신 디온; 튜불린-억제제, 예를 들어 메이탄신 또는 그의 유사체 또는 유도체; 유사분열방지제, 예를 들어 모노메틸 아우리스타틴 E 또는 F 또는 그의 유사체 또는 유도체; 돌라스타틴 10 또는 15 또는 그의 유사체; 이리노테칸 또는 그의 유사체; 미톡산트론; 미트라마이신; 액티노마이신 D; 1-데하이드로테스토스테론; 글루코코르티코이드; 프로카인; 테트라카인; 리도카인; 프로프라놀올; 퓨로마이신; 칼리키아미신 또는 그의 유사체 또는 유도체; 대사길항물질, 예를 들어 메토트렉세이트, 6 머캅토퓨린, 6 티오구아닌, 시타라빈, 플루다라빈, 5 플루오로우라실, 데카바진, 하이드록시우레아, 아스파라기나제, 젬시타빈, 또는 클라드리빈; 알킬화제, 예를 들어 메클로르에타민, 티오에파, 클로람부실, 멜팔란, 카머스틴(BSNU), 로머스틴(CCNU), 사이클로포스파미드, 부설판, 디브로모만니톨, 스트렙토조토신, 다카바진(DTIC), 프로카바진, 미토마이신 C; 백금 유도체, 예를 들어 시스플라틴 또는 카보플라틴; 듀오카마이신 A, 듀오카마이신 SA, 라켈마이신(CC-1065), 또는 그의 유사체 또는 유도체; 항생제, 예를 들어 닥티노마이신, 블레오마이신, 다우노루비신, 독소루비신, 이다루비신, 미트라마이신, 미토마이신, 미톡산트론, 플리카마이신, 안트라마이신(AMC); 피롤로[2,1-c][1,4]-벤조디아제핀(PDB); 디프테리아 독소 및 관련된 분자, 예를 들어 디프테리아 A 쇄 및 그의 활성 단편 및 하이브리드 분자, 리신 독소, 예를 들어 리신 A 또는 탈글리코실화된 리신 A 쇄 독소, 콜레라 독소, 시가-형 독소, 예를 들어 SLT I, SLT II, SLT IIV, LT 독소, C3 독소, 시가 독소, 백일해 독소, 파상풍 독소, 대두 보우만-브릭 프로테아제 억제제, 슈도모나스 외독소, 알로린, 사포린, 모데신, 젤라닌, 아브린 A 쇄, 모데신 A 쇄, 알파-사르신, 유동 단백질, 디안틴 단백질, 미국자리공 단백질, 예를 들어 PAPI, PAPII 및 PAP-S, 여주 억제제, 큐르신, 크로틴, 사파오나리아 오피시날리스 억제제, 젤로닌, 미토젤린, 레스트릭토신, 페노마이신 및 에노마이신 독소; 리보뉴클레아제(RNase); DNase I, 스타필로코커스 장독소 A; 미국자리공 항바이러스 단백질; 디프테린 독소; 및 슈도모나스 내독소로 이루어지는 그룹 중에서 선택될 수 있다.
일부 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 아우리스타틴 또는 그의 펩티드 유사체, 유도체 또는 전구약물에 접합된다. 하나의 실시태양에서, 본 발명의 항체는 ADCC, CDC 또는 항체-유도된 식세포작용을 매개하는 Fc 영역을 포함하지 않으며 아우리스타틴 또는 그의 펩티드 유사체, 유도체 또는 전구약물에 접합된다. 아우리스타틴은 미세소관 동역학, GTP 가수분해 및 핵 및 세포 분열을 방해하고(Woyke et al (2001) Antimicrob. Agents and Chemother. 45(12): 3580-3584) 항암(US5663149) 및 항진균 활성(Pettit et al., (1998) Antimicrob. Agents and Chemother. 42: 2961-2965)을 갖는 것으로 입증되었다. 예를 들어, 아우리스타틴 E는 파라-아세틸 벤조산 또는 벤조일발레르산과 반응하여 각각 AEB 및 AEVB를 생성시킬 수 있다. 다른 전형적인 아우리스타틴 유도체는 AFP, MMAF(모노메틸 아우리스타틴 F) 및 MMAE(모노메틸 아우리스타틴 E)를 포함한다. 적합한 아우리스타틴 및 아우리스타틴 유사체, 유도체 및 전구약물뿐만 아니라 Ab에의 아우리스타틴의 접합에 적합한 링커들이 예를 들어 미국특허 제 5,635,483 호, 미국특허 제 5,780,588 호 및 미국특허 제 6,214,345 호 및 국제 특허 출원 공보 WO02088172, WO2004010957, WO2005081711, WO2005084390, WO2006132670, WO03026577, WO200700860, WO207011968 및 WO205082023에 기재되어 있다.
일부 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 피롤로[2,1-c][1,4]-벤조디아제핀(PDB) 또는 그의 유사체, 유도체 또는 전구약물에 접합된다. 하나의 실시태양에서, 본 발명의 항체는 ADCC, CDC 또는 항체-유도된 식세포작용을 매개하는 Fc 영역을 포함하지 않으며 PDB 또는 그의 유사체, 유도체 또는 전구약물에 접합된다. 적합한 PDB 및 PDB 유도체, 및 관련된 기술들이 예를 들어 하기의 문헌들에 기재되어 있다: Hartley J. A. et al., Cancer Res 2010; 70(17) : 6849-6858; Antonow D. et al., Cancer J 2008; 14(3) : 154-169; Howard P.W. et al., Bioorg Med Chem Lett 2009; 19: 6463-6466 및 Sagnou et al., Bioorg Med Chem Lett 2000; 10(18) : 2083-2086.
일부 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 안트라사이클린, 메이탄신, 칼리키아미신, 듀오카마이신, 라켈마이신(CC-1065), 돌라스타틴 10, 돌라스타틴 15, 이리노테칸, 모노메틸 아우리스타틴 E, 모노메틸 아우리스타틴 F, PDB, 또는 이들 중 어느 하나의 유사체, 유도체 또는 전구약물로 이루어지는 그룹 중에서 선택된 세포독성 부분에 접합된다. 하나의 실시태양에서, 본 발명의 항체는 ADCC, CDC 또는 항체-유도된 식세포작용을 매개하는 Fc 영역을 포함하지 않으며 안트라사이클린, 메이탄신, 칼리키아미신, 듀오카마이신, 라켈마이신(CC-1065), 돌라스타틴 10, 돌라스타틴 15, 이리노테칸, 모노메틸 아우리스타틴 E, 모노메틸 아우리스타틴 F, PDB, 또는 이들 중 어느 하나의 유사체, 유도체 또는 전구약물로 이루어지는 그룹 중에서 선택된 세포독성 부분에 접합된다.
일부 실시태양에서, 본 발명의 항체(바람직하게는 단클론 항체)는 안트라사이클린 또는 그의 유사체, 유도체 또는 전구약물에 접합된다. 일부 실시태양에서, 상기 항체는 메이탄신 또는 그의 유사체, 유도체 또는 전구약물에 접합된다. 일부 실시태양에서, 상기 항체는 칼리키아미신 또는 그의 유사체, 유도체 또는 전구약물에 접합된다. 일부 실시태양에서, 상기 항체는 듀오카마이신 또는 그의 유사체, 유도체 또는 전구약물에 접합된다. 일부 실시태양에서, 상기 항체는 라켈마이신(CC-1065) 또는 그의 유사체, 유도체 또는 전구약물에 접합된다. 일부 실시태양에서, 상기 항체는 돌라스타틴 10 또는 그의 유사체, 유도체 또는 전구약물에 접합된다. 일부 실시태양에서, 상기 항체는 돌라스타틴 15 또는 그의 유사체, 유도체 또는 전구약물에 접합된다. 일부 실시태양에서, 상기 항체는 모노메틸 아우리스타틴 E 또는 그의 유사체, 유도체 또는 전구약물에 접합된다. 일부 실시태양에서, 상기 항체는 모노메틸 아우리스타틴 F 또는 그의 유사체, 유도체 또는 전구약물에 접합된다. 일부 실시태양에서, 상기 항체는 피롤로[2,1-c][1,4]-벤조디아제핀 또는 그의 유사체, 유도체 또는 전구약물에 접합된다. 일부 실시태양에서, 상기 항체는 이리노테칸 또는 그의 유사체, 유도체 또는 전구약물에 접합된다.
항체에 분자를 접합시키는 기법은 당해 분야에 주지되어 있다(예를 들어 하기 문헌들을 참조하시오: Arnon et al., "Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy," in Monoclonal Antibodies And Cancer Therapy (Reisfeld et al. eds., Alan R. Liss, Inc., 1985); Hellstrom et al., "Antibodies For Drug Delivery," in Controlled Drug Delivery (Robinson et al. eds., Marcel Deiker, Inc., 2nd ed. 1987); Thorpe, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review," in Monoclonal Antibodies '84: Biological And Clinical Applications (Pinchera et al. eds., 1985); "Analysis, Results, and Future Prospective of the Therapeutic Use of Radiolabeled Antibody In Cancer Therapy," in Monoclonal Antibodies For Cancer Detection And Therapy (Baldwin et al. eds., Academic Press, 1985); 및 Thorpe et al., 1982, Immunol. Rev. 62:119-58. 또한 예를 들어 PCT 공보 WO 89/12624를 참조하시오. 전형적으로, 상기 핵산 분자는 각각 N-하이드록시숙신이미드 에스테르 또는 말레이미드 작용기를 통해 상기 항체상의 리신 또는 시스테인에 공유적으로 부착된다. 조작된 시스테인 또는 비천연 아미노산의 통합을 사용하는 접합 방법이 접합체의 동종성을 개선시키는 것으로 보고되었다(Axup, J.Y., Bajjuri, K.M., Ritland, M., Hutchins, B.M., Kim, C.H., Kazane, S.A., Halder, R., Forsyth, J.S., Santidrian, A.F., Stafin, K., et al. (2012). Synthesis of site-specific antibody-drug conjugates using unnatural amino acids. Proc. Natl. Acad. Sci. USA 109, 16101-16106.; Junutula, J.R., Flagella, K.M., Graham, R.A., Parsons, K.L., Ha, E., Raab, H., Bhakta, S., Nguyen, T., Dugger, D.L., Li, G., et al. (2010). Engineered thio-trastuzumab-DM1 conjugate with an improved therapeutic index to target humanepidermal growth factor receptor 2-positive breast cancer. Clin. Cancer Res.16, 4769-4778.). 주누툴라 등(Junutula et al. (2008))은 통상적인 접합 방법에 비해 개선된 치료 지수를 나타내는 것으로 주장된 "THIOMAB"(TDC)이라 칭하는 시스테인-기재 부위-특이적 접합을 개발하였다. 항체내에 통합된 비천연 아미노산에의 접합이 또한 ADC에 대해 탐구 중이나; 상기 접근법의 일반성은 여전히 확립되어야 한다(Axup et al., 2012). 특히 당해 분야의 숙련가는 또한 아실 공여체 글루타민-함유 태그(예를 들어 Gin-함유 펩티드 태그 또는 Q-태그) 또는 폴리펩티드 조작에 의해(예를 들어 폴리펩티드상의 아미노산 결실, 삽입, 치환 또는 돌연변이를 통해) 반응성으로 만든 내인성 글루타민으로 조작된 Fc-함유 폴리펩티드를 고려할 수 있다. 이어서 트랜스글루타미나제를 아민 공여제(예를 들어 반응성 아민을 포함하거나 상기에 부착된 소분자)와 공유적으로 가교결합시켜 조작된 Fc-함유 폴리펩티드 접합체의 안정하고 균일한 집단을 형성시킬 수 있으며 이때 상기 아민 공여제는 상기 아실 공여체 글루타민-함유 태그 또는 접근가능한/노출된/반응성 내인성 글루타민을 통해 Fc-함유 폴리펩티드에 부위-특이적으로 접합된다(WO 2012059882).
본 명세서에 사용되는 바와 같이, "치료 유효량"이란 용어는 필요한 투여량 및 기간 동안 목적하는 치료학적 결과를 성취하기에 유효한 양을 지칭한다. 따라서, "치료 유효량"이란 용어는 표적에 대해 현저한 부정적인 효과 또는 부작용을 야기하지 않으면서, (1) 표적 질병의 개시를 지연시키거나 예방하거나; (2) 표적 질병의 하나 이상의 증상의 진행, 심각화 또는 악화를 늦추거나 정지시키거나; (3) 표적 질병의 증상의 개선을 일으키거나; (4) 표적 질병의 중증도 또는 발병률을 감소시키거나; 또는 (5) 표적 질병을 치유하는 것을 목적으로 하는 항체의 수준 또는 양을 의미할 수 있다. 치료 유효량을 예방학적 또는 예방 작용을 위해 상기 표적 질병의 개시 전에 투여할 수 있다. 한편으로, 또는 추가로, 상기 치료 유효량을 치료학적 작용을 위해서 상기 표적 질병의 개시 후에 투여할 수도 있다.
본 발명의 항체(바람직하게는 단클론 항체)의 치료 유효량은 개인의 질병 상태, 연령, 성별 및 체중, 및 개인에서 목적하는 반응을 이끌어내기 위한 본 발명의 항체(바람직하게는 단클론 항체)의 능력과 같은 인자들에 따라 변할 수 있다. 치료 유효량은 또한 상기 항체 또는 항체 부분의 임의의 독성 또는 유해 효과가 치료학적으로 이로운 효과에 의해 압도되는 것이다. 본 발명의 항체(바람직하게는 단클론 항체)에 효율적인 투여량 및 투여량 섭생은 치료하고자 하는 질병 또는 상태에 따라 변하며 당해 분야의 숙련가에 의해 결정될 수 있다. 당해 분야의 통상적인 기술을 갖는 의사는 필요한 약학 조성물의 유효량을 쉽게 결정하여 처방할 수 있다. 예를 들어, 상기 의사는 목적하는 치료학적 효과를 성취하고 상기 목적하는 효과가 성취될 때까지 투여량을 점차적으로 증가시키기 위해서 상기 필요량보다 낮은 수준으로 상기 약학 조성물 중에 사용되는 본 발명의 항체(바람직하게는 단클론 항체)의 용량을 시작할 수 있다. 일반적으로, 본 발명의 조성물의 적합한 용량은 특정한 투여량 섭생에 따라 치료 효과를 생성시키기에 유효한 최저 용량인 상기 화합물의 양일 것이다. 상기와 같은 유효 용량은 일반적으로 상술한 인자들에 따라 변할 것이다. 예를 들어, 치료학적 용도를 위한 치료 유효량을 질병 진행을 안정화시키는 그의 능력에 의해 측정할 수 있다. 전형적으로, 암을 억제하는 화합물의 능력을 예를 들어 인간 종양에서의 효능을 예측하는 동물 모델 시스템에서 평가할 수 있다. 한편으로, 조성물의 상기 성질을 숙련가에게 공지된 시험관내 분석에 의해 세포독성을 유도하는 상기 화합물의 능력을 검사함으로써 평가할 수 있다. 치료학적 화합물의 치료 유효량은 대상체에서 종양 크기를 감소시키거나, 또는 달리 증상을 개선시킬 수 있다. 당해 분야의 통상적인 숙련가는 대상체의 크기, 상기 대상체의 증상의 중증도, 및 선택된 특정한 조성물 또는 투여 경로와 같은 인자를 근거로 상기와 같은 양을 결정할 수 있을 것이다. 본 발명의 항체의 치료 유효량에 대한 예시적인 비제한적인 범위는 약 0.1-100 ㎎/㎏, 예를 들어 약 0.1-50 ㎎/㎏, 예를 들어 약 0.1-20 ㎎/㎏, 예를 들어 약 0.1-10 ㎎/㎏, 예를 들어 약 0.5, 예를 들어 약 0.3, 약 1, 약 3 ㎎/㎏, 약 5 ㎎/㎏ 또는 약 8 ㎎/㎏이다. 본 발명의 항체의 치료 유효량에 대한 예시적인 비제한적인 범위는 0.02-100 ㎎/㎏, 예를 들어 약 0.02-30 ㎎/㎏, 예를 들어 약 0.05-10 ㎎/㎏ 또는 0.1-3 ㎎/㎏, 예를 들어 약 0.5-2 ㎎/㎏이다. 투여는 예를 들어 정맥내, 근육내, 복강내 또는 피하일 수 있으며, 예를 들어 표적 부위에 인접하여 투여될 수 있다. 상기 치료 및 사용 방법에서 투여량 섭생을 최적의 목적하는 반응(예를 들어 치료학적 반응)을 제공하도록 조절한다. 예를 들어, 단일 일시주사를 투여하거나, 수회의 분할 용량을 시간에 걸쳐 투여하거나, 또는 상기 용량을 치료 상황의 위급성에 의해 지시되는 대로 비례하여 감소시키거나 증가시킬 수 있다. 일부 실시태양에서, 상기 치료의 효능을 상기 치료법 동안, 예를 들어 소정의 시점에서 모니터한다. 일부 실시태양에서, 상기 효능을 질병 부위의 시각화에 의해, 또는 본 명세서에 추가로 기재된 다른 진단 방법에 의해, 예를 들어 하나 이상의 PET-CT 스캔을 수행함으로써, 예를 들어 본 발명의 표지된 항체, 본 발명의 항체(바람직하게는 단클론 항체)로부터 유래된 단편 또는 미니-항체를 사용하여 모니터할 수 있다. 경우에 따라, 약학 조성물의 유효 1일 용량을, 임의로 단위 투여형으로, 당일 전체를 통해 적합한 간격으로 별도로, 2, 3, 4, 5, 6 또는 그 이상의 하위용량으로 투여할 수 있다. 일부 실시태양에서, 본 발명의 인간 항체(바람직하게는 단클론 항체)를 임의의 원치않는 부작용을 최소화하기 위해서 긴 기간에 걸쳐, 예를 들어 24시간 넘게 느린 연속 주입에 의해 투여한다. 본 발명의 항체의 유효 용량을 또한 매주, 격주 또는 3주마다의 투여 기간을 사용하여 투여할 수 있다. 상기 투여 기간을 예를 들어 8주, 12주 또는 임상적 진행이 확립될 때까지로 제한할 수 있다. 비제한적인 예로서, 본 발명에 따른 치료를 본 발명의 항체의 1일 투여량으로서, 단일 또는 분할 용량을 사용하여 매 24, 12, 8, 6, 4, 또는 2시간마다 또는 이들의 임의의 조합으로, 치료 개시 후 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 또는 40일 중 적어도 하나, 또는 한편으로 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 또는 20주 중 적어도 하나, 또는 이들의 임의의 조합에서, 하루에 약 0.1 내지 100 ㎎/㎏, 예를 들어 0.2, 0.5, 0.9, 1.0, 1.1, 1.5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 40, 45, 50, 60, 70, 80, 90 또는 100 mg/kg의 양으로 제공할 수 있다.
전형적으로, 본 발명의 항체(바람직하게는 단클론 항체)를 약학적으로 허용 가능한 담체를 포함하는 약학 조성물의 형태로 대상체에게 투여한다.
"약학적으로 허용 가능한 담체"란 용어는 동물, 바람직하게는 인간에게 투여시 불리하거나, 알러지성이거나 또는 다른 뜻밖의 반응을 생성시키지 않는 부형제를 지칭한다. 상기는 모든 용매, 분산 매질, 코팅제, 항균 및 항진균제, 등장성 및 흡수 지연제 등을 포함한다. 인간 투여의 경우, 제제는 규제 관청, 예를 들어 FDA 관청 또는 EMA에 의해 요구되는 바와 같은 멸균성, 발열원성, 일반적인 안전성 및 순도 표준을 충족시켜야 한다.
이들 조성물에 사용될 수 있는 약학적으로 허용 가능한 담체는 비제한적으로 이온 교환제, 알루미나, 알루미늄 스테아레이트, 레시틴, 혈청 단백질, 예를 들어 인간 혈청 알부민, 완충제 물질, 예를 들어 포스페이트, 글리신, 소르브산, 칼륨 소르베이트, 포화된 식물성 지방산의 부분적인 글리세라이드 혼합물, 수, 염 또는 전해질, 예를 들어 프로타민 설페이트, 이나트륨 수소 포스페이트, 칼륨 수소 포스페이트, 염화 나트륨, 아연염, 콜로이드 실리카, 마그네슘 트리실리케이트, 폴리비닐 피롤리돈, 셀룰로스-기재 물질, 폴리에틸렌 글리콜, 나트륨 카복시메틸셀룰로스, 폴리아크릴레이트, 왁스, 폴리에틸렌-폴리옥시프로필렌-블록 중합체, 폴리에틸렌 글리콜 및 라놀린을 포함한다. 환자에게 투여하기 위한 용도의 경우, 상기 조성물은 상기 환자에의 투여를 위해 제형화될 것이다. 본 발명의 조성물을 경구로, 비경구로, 흡입 분무에 의해, 국소로, 직장으로, 코로, 구강으로, 질로 또는 이식된 저장소를 통해 투여할 수 있다. 본 명세서 사용되는 것은 피하, 정맥내, 근육내, 관절내, 활액내, 흉골내, 척추강내, 간내, 병변내 및 두개내 주사 또는 주입 기법을 포함한다. 본 발명 조성물의 멸균 주사성 형태는 수성 또는 유성 현탁액일 수 있다. 이들 현탁액을 적합한 분산제 또는 습윤제 및 현탁제를 사용하여 당해 분야에 공지된 기법에 따라 제형화할 수 있다. 상기 멸균 주사성 제제는 또한 무독성의 비경구적으로 허용 가능한 희석제 또는 용매 중의 멸균 주사성 용액 또는 현탁액, 예를 들어 1,3-부탄디올 중의 용액일 수 있다. 상기 사용될 수 있는 허용 가능한 비히클 및 용매 중에는 물, 링거액 및 등장성 염화 나트륨 용액이 있을 수 있다. 또한, 멸균 고정유가 용매 또는 현탁 매질로서 통상적으로 사용된다. 상기 목적을 위해서, 합성 모노- 또는 디글리세라이드를 포함한 임의의 블랜드 고정유가 사용될 수 있다. 지방산, 예를 들어 올레산 및 그의 글리세라이드 유도체가 천연의 약학적으로 허용 가능한 오일, 예를 들어 올리브 오일 또는 피마자 오일, 특히 이들의 폴리옥시에틸화된 버전과 같이 주사성 물질의 제조에 유용하다. 이들 오일 용액 또는 현탁액은 또한 장쇄 알콜 희석제 또는 분산제, 예를 들어 카복시메틸 셀룰로스 또는 유화액 및 현탁액을 포함한 약학적으로 허용 가능한 투여형의 제형에 통상적으로 사용되는 유사한 분산제를 함유할 수 있다. 다른 통상적으로 사용되는 계면활성제, 예를 들어 트윈, 스판, 및 약학적으로 허용 가능한 고체, 액체 또는 다른 투여형의 제조에 통상적으로 사용되는 다른 유화제 또는 생체이용률 향상제를 또한 제형화를 목적으로 사용할 수 있다. 본 발명의 조성물을 임의의 경구적으로 허용 가능한 투여형, 예를 들어 비제한적으로 캡슐, 정제, 수성 현탁액 또는 용액 중에서 경구로 투여할 수 있다. 경구용 정제의 경우에, 통상적으로 사용되는 담체는 락토스 및 옥수수 전분을 포함한다. 윤활제, 예를 들어 마그네슘 스테아레이트가 또한 전형적으로 첨가된다. 캡슐 형태의 경구 투여의 경우, 유용한 희석제는 예를 들어 락토스를 포함한다. 수성 현탁액이 경구용으로 필요한 경우, 활성 성분을 유화제 및 현탁제와 병용한다. 경우에 따라, 몇몇 감미제, 풍미제 또는 착색제를 또한 첨가할 수 있다. 한편으로, 본 발명의 조성물을 직장 투여를 위해 좌약의 형태로 투여할 수 있다. 상기는 작용제를 실온에서 고체이나 직장 온도에서는 액체인, 따라서 직장에서 용융되어 약물을 방출하는 적합한 비-자극성 부형제와 혼합함으로써 제조된다. 상기와 같은 물질은 코코아 버터, 밀납 및 폴리에틸렌 글리콜을 포함한다. 본 발명의 조성물을 또한, 특히 치료 표적이 눈, 피부 또는 하부 장관의 질병을 포함하여 국소 적용에 의해 쉽게 접근될 수 있는 부위 또는 기관을 포함하는 경우 국소적으로 투여할 수 있다. 적합한 국소 제형은 이들 각각의 부위 또는 기관을 위해 쉽게 제조된다. 국소 적용을 위해서, 상기 조성물을 하나 이상의 담체 중에 현탁되거나 용해된 활성 성분을 함유하는 적합한 연고로 제형화할 수 있다. 본 발명의 화합물의 국소 투여를 위한 담체는 비제한적으로 무기 오일, 액체 석유, 바셀린, 프로필렌 글리콜, 폴리옥시에틸렌, 폴리옥시프로필렌 화합물, 유화 왁스 및 물을 포함한다. 한편으로, 상기 조성물을 하나 이상의 약학적으로 허용 가능한 담체 중에 현탁되거나 용해된 활성 성분을 함유하는 적합한 로션 또는 크림으로 제형화할 수 있다. 적합한 담체는 비제한적으로 무기 오일, 솔비탄 모노스테아레이트, 폴리솔베이트 60, 세틸 에스테르 왁스, 세테아릴 알콜, 2-옥틸도데칸올, 벤질 알콜 및 물을 포함한다. 하부 장관에 대한 국소 적용을 직장 좌약 제형(상기 참조) 또는 적합한 관장제 제형으로 수행할 수 있다. 패치를 또한 사용할 수 있다. 본 발명의 조성물을 또한 코 에어로졸 또는 흡입에 의해 투여할 수 있다. 상기와 같은 조성물을 약학 제형 분야에 주지된 기법에 따라 제조하며 벤질 알콜 또는 다른 적합한 보존제, 생체이용률을 증대시키기 위한 흡수 촉진제, 플루오로카본, 및/또는 다른 통상적인 용해 또는 분산제를 사용하여, 염수 중의 용액으로서 제조할 수 있다. 예를 들어, 본 발명의 약학 조성물 중에 존재하는 항체를 100 ㎎(10 ㎖) 또는 500 ㎎(50 ㎖) 일회용 바이알 중에서 10 ㎎/㎖의 농도로 공급할 수 있다. 상기 생성물을 9.0 ㎎/㎖ 염화 나트륨, 7.35 ㎎/㎖ 나트륨 시트레이트 디하이드레이트, 0.7 ㎎/㎖ 폴리솔베이트 80, 및 멸균 주사용수 중에서 IV 투여를 위해 제형화한다. pH를 6.5로 조절한다. 본 발명의 약학 조성물 중의 항체에 적합한 예시적인 투여량 범위는 약 1 ㎎/㎡ 내지 500 ㎎/㎡일 수 있다. 그러나, 이들 스케줄은 예시적인 것이며 최적의 스케줄 및 섭생을 임상 시험에서 결정될 것임에 틀림없는 상기 약학 조성물 중의 특정 항체의 친화성 및 허용성을 고려하여 적합화할 수 있다. 주사용(예를 들어 근육내, i.v.)의 본 발명의 약학 조성물을, 멸균 완충수(예를 들어 근육내의 경우 1 ㎖), 및 약 1 ng 내지 약 100 ㎎, 예를 들어 약 50 ng 내지 약 30 ㎎ 또는 보다 바람직하게, 약 5 ㎎ 내지 약 25 ㎎의 본 발명의 항-CD160-TM 항체를 함유하도록 제조할 수 있다.
본 발명의 또 다른 목적은 시험관내에서 또는 생체내에서, 샘플, 바람직하게는 생물학적 샘플 중의 CD160-TM을 검출하기 위한 본 발명의 적어도 하나의 항체의 용도이다. 본 발명의 또 다른 목적은 시험관내에서 또는 생체내에서, 샘플, 바람직하게는 생물학적 샘플 중의 활성화된 NK 세포를 검출하기 위한 본 발명의 적어도 하나의 항체의 용도이다.
본 발명의 항체가 사용될 수 있는 분석의 예는 비제한적으로 ELISA, 샌드위치 ELISA, RIA, FACS, 조직 면역조직화학, 웨스턴-블럿, 및 면역침전을 포함한다.
본 발명의 또 다른 목적은 샘플을 본 발명의 항체와 접촉시키고 CD160-TM에 결합된 항체를 검출함(이에 의해 상기 샘플 중 CD160-TM의 존재가 지시된다)을 포함하는, 상기 샘플 중의 CD160-TM의 검출 방법이다. 본 발명의 또 다른 목적은 샘플을 본 발명의 항체와 접촉시키고 CD160-TM에 결합된 항체를 검출함(이에 의해 상기 샘플 중 활성화된 NK 세포의 존재가 지시된다)을 포함하는, 상기 샘플 중의 활성화된 NK 세포의 검출 방법이다.
본 발명의 하나의 실시태양에서, 상기 샘플은 생물학적 샘플이다. 생물학적 샘플의 예는 비제한적으로 병든 조직, 체액, 바람직하게는 혈액, 보다 바람직하게는 혈청, 혈장, 활막액, 기관지폐포 세척액, 객담, 림프, 복수, 소변, 양수, 복막액, 뇌척수액, 흉수, 심낭액, 및 폐포 대식세포로부터 제조된 조직 용해물 및 추출물을 포함한다.
본 발명의 하나의 실시태양에서, "샘플"이란 용어는 임의의 분석에 앞서 개인으로부터 채집한 샘플을 의미하고자 한다.
본 발명의 하나의 실시태양에서, 본 발명의 항체를 검출 가능한 표지로 직접 표지하고 직접 검출할 수 있다. 또 다른 실시태양에서, 본 발명의 항체를 표지하지 않고(제1/1차 항체로서 지칭한다) 항-CD160-TM 항체에 결합할 수 있는 2차 항체 또는 다른 분자를 표지한다. 당해 분야에 공지된 바와 같이, 상기 1차 항체의 특정한 종 및 부류에 특이적으로 결합할 수 있는 2차 항체를 선택한다.
상기 샘플 중 항-CD160-TM 항체/CD160 복합체의 존재를, 상기 표지된 2차 항체의 존재를 검출함으로써 검출 및 측정할 수 있다. 예를 들어, 상기 1차 항체/항원 복합체를 포함하는 웰로부터 또는 상기 복합체를 포함하는 멤브레인(예를 들어 니트로셀룰로스 또는 나일론 멤브레인)으로부터 결합되지 않은 2차 항체를 세척한 후에, 결합된 2차 항체를 전개시키고 예를 들어 상기 표지의 화학발광을 근거로 상기 항체를 검출할 수 있다.
상기 항-CD160-TM 항체 또는 2차 항체에 대한 표지는 비제한적으로 다양한 효소, 보결기, 형광 물질, 발광 물질, 마그네틱제 및 방사성 물질을 포함한다. 상기와 같은 효소의 예는 비제한적으로 양고추냉이 페록시다제, 알칼리성 포스파타제, 베타-갈락토시다제 또는 아세틸콜린에스테라제를 포함하며; 보결기 복합체의 예는 비제한적으로 스트렙트아비딘/비오틴 및 아비딘/비오틴을 포함하고; 형광 물질의 예는 비제한적으로 움벨리페론, 플루오레세인, 플루오레세인 이소티오시아네이트, 로다민, 디클로로트리아지닐아민 플루오레세인, 단신 클로라이드 또는 피코에리쓰린을 포함하며; 발광 물질의 예는 비제한적으로 루미날을 포함하고; 마그네틱제의 예는 가돌리늄을 포함하며; 적합한 방사성 물질의 예는 125I, 131I, 35S 또는 3H를 포함한다.
본 발명의 또 다른 목적은 세포 샘플을 본 발명의 항체와 접촉시킴을 포함하는, CD160-TM 발현 세포로부터(예를 들어 활성화된 NK 세포로부터) 상기 세포 샘플 또는 세포 집단을 고갈시키기 위한 시험관내 방법이다.
본 발명의 또 다른 목적은 세포 샘플을 본 발명의 항체와 접촉시킴을 포함하는, 상기 세포 샘플 또는 세포 집단으로부터 CD160-TM 발현 세포(예를 들어 활성화된 NK 세포)를 단리시키기 위한 시험관내 방법이다.
본 발명의 또 다른 목적은 NK 세포를 본 발명의 항체와 접촉시킴을 포함하는, NK 세포를 활성화시키기 위한 시험관내 방법이다.
본 발명의 또 다른 목적은 본 발명의 적어도 하나의 항-CD160-TM 항체, 바람직하게는 단클론 항-CD160-TM 항체를 포함하는 키트이다.
"키트"는 특별히 CD160-TM의 발현을 검출하기 위한, 적어도 하나의 시약, 바람직하게는 항체를 포함하는 임의의 제품(예를 들어 패키지 또는 용기)을 의미한다.
상기 키트는 본 발명의 방법을 수행하기 위한 단위로서 홍보되거나, 배급되거나 또는 판매될 수 있다. 더욱 또한, 상기 키트 시약의 전부를 외부 환경으로부터 보호하는 용기내에, 예를 들어 밀폐된 용기 중에 제공할 수 있다.
상기 키트는 또한 상기 키트 및 그의 사용 방법을 기술하는 패키지 삽입지를 함유할 수 있다.
본 발명을 하기의 도면과 실시예에 의해 추가로 예시할 것이다. 그러나, 이들 실시예 및 도면을 본 발명의 범위를 어떠한 식으로도 제한하는 것으로서 해석해서는 안 된다.
[도면의 간단한 설명]
도 1: CD160-GPI 대 CD160TM 발현 세포상에서 A12 및 B6 항체의 결합 특이성. 각각 CD160-GPI 또는 CD160TM 동형을 발현하도록 강제된 CHO 또는 HEK 세포를 CL1-R2 단클론 항체 또는 BY55 항체(둘 다 CD160-GPI에 특이적임) 또는 A12 또는 B6 항체(흰색 막대그래프)로 표지하였다. 마우스 또는 인간 아이소타입 대조용 Ig를 음성 대조용(검은색 막대그래프)으로서 사용하였다. 결합된 항체들은 적합한 PE-접합된 2차 시약으로 드러났다.
도 2: IL2-처리된 인간 PBMC상의 A12의 결합 특이성. PBMC는 처리되지 않은 채로 두거나(0일째) 또는 IL2와 배양되었다. 면역-표지화를 지시된 시점들에서 아이소타입 대조용 IgG(검은색 막대그래프) 또는 A12 항체(회색 막대그래프) + PE-결합된 염소 항-인간 IgG 항체로 수행하였다. 림프구 부분집합들이 CD8-FITC, CD56-PC5, CD3-APC 및 CD4-PC7 mAb의 혼합물의 첨가에 의해 추가로 식별되었다. 각각의 게이팅된 림프구 집단상에서 획득된 표지화를 도시한다.
도 3: 면역침전에 의한 A12 특이성의 평가. 후-핵 용해물을 HEK-CD160TM 세포로부터 제조하고 마우스(mu IgG) 또는 인간(huIg) 아이소타입 대조용 IgG, 키메라 쥐 A12(mu A12) 또는 완전한 인간 A12(hu A12) 항체에 의한 면역침전을 가하였다. 면역-침전된 단백질들을 비환원 조건하에서 SDS-10% PAGE에 의해 분리시키고, 니트로셀룰로스상으로 옮기고, 항-Flag mAb를 사용하여 웨스턴 블럿에 의해 드러내었다. 화살표는 CD160TM-관련된 신호들을 가리킨다.
도 4: sCD160은 항체 CL1-R2, R&D 6700 및 RB312(A12는 아닌)에 의해 인식된다. 웰당 1 ug의 항체를 96 웰 맥시솝 플레이트상에서 밤새 코팅하였다. PBS-5% BSA로 포화 후에, 10 ng의 재조합 가용성 CD160-His 태그를 각 웰에 가하고 실온에서 2h 동안 배양하였다. 세척 후에, 항-His-HRP, 이어서 TMB 기질에 의해 드러내었다. 실험 조건을 3회 중복하여 수행하였으며 각 항체에 대해 나타난 결과들을 각각의 OD Ig 대조용의 공제 후에 획득하였다(OD = OD 포획 항체 - OD 각각의 Ig 대조용).
도 5는 A12 및 B6 항체의 VH 및 VL 서열의 정렬을 도시한다.
도 6은 A12 및 B6 항체 인식된 입체형태 에피토프가 2개의 펩티드로로 구성됨을 도시한다. 펩티드들을 굵은 글씨로 밑줄을 그어 나타낸다. CD160-TM 동형의 상이한 도메인도 또한 나타낸다.
도 7: A12는 NK 세포 탈과립 및 활성화를 유도한다. NK92 세포주를 아이소타입 대조용 muIgG 또는 인간 A12 항체의 키메라 Fc 쥐 버전(muA12) + 토끼 항-마우스 IgG 항체와 예비-배양하였다. 이어서 효과기 세포를 지시된 E/T 비에서 NK 감수성 표적 세포(K562 세포주)의 존재하에서 배양하였다. 상기 NK 세포주 NK92 세포 탈과립 및 활성화를 각각 멤브레인 결합된 CD107a(A) 및 CD137(B)의 검출에 의해 모니터하였다. muIgG 대조용(원) 또는 muA12(사각형)에 의해 전-처리된 양성 세포의 백분율을 제공한다.
실시예 1: A12 항체의 특성화
물질 및 방법
세포
CHO 또는 HEK 세포를 각각 CD160-GPI 또는 Flag-태그된 CD160-TM cDNA를 포함하는 진핵생물 발현 벡터로 형질감염시켰다. 적합한 항생제에 의한 선택에 의해 안정한 형질감염체를 수득하고 이후에 CHO-CD160-GPI 및 HEK-CD160TM이라 명명하였다. CD160 동형의 적합한 발현을 항-CD160-GPI 특이적 mAb CL1R2 또는 항-Flag mAb + PE-결합된 염소 항-마우스 IgG를 사용하여 유식 세포측정에 의해 평가하였다.
PBMC를 건강한 자원자 정맥혈로부터 구배 밀도에 의해 수득하였다. 재조합 인간 IL2(100 U/㎖)의 첨가에 의해 활성화가 성취되었다.
A12 완전한 인간 항체의 선택
완전한 인간 아글리코실화된 항-CD160TM 항체를 HEK-CD160TM 세포상에서 파지 디스플레이에 의해 선택하였다. 상기 수득된 항체 중에서, A12는 유식 세포측정에 의해 HEK-CD160TM 세포상에 최상의 인식 프로파일을 제공하는 것으로서 식별되었다. A12 항체의 쥐 키메라 버전(여기에서 인간 IgG1 Fc 부분이 쥐 IgG2a Fc 단편에 대해 교환되었다)을 또한 생성시켰다.
유식 세포측정
CHO 및 HEK 형질감염된 세포를 항-CD160-GPI mAb CL1-R2 또는 BY55, 완전한 인간 A12 또는 B6 항체 또는 이들의 상응하는 아이소타입 대조용 IgG로 표지하였다. 결합된 항체들이 PE-결합된 염소 항-마우스 또는 항-인간 IgG의 첨가에 의해 추가로 드러났다. 사이토플렉스(CytoFlex) 세포계상에서 세포 획득을 수행하였으며 결과를 플로우조(FlowJo) 소프트웨어로 분석하였다.
PBMC에 대해서, CD160 표지화를 상기와 같이 수행하였다. 세척 및 정상적인 마우스 혈청의 첨가에 이어서, 세포를 CD8-FITC, CD56-PC5, CD3-APC 및 CD4-PC7 mAb의 혼합물과 배양하였다. 세포 획득 후에, 분석을 수행하여 CD3+CD4+ 및 CD3+CD8+ T 림프구, 및 상기 림프구 집단내 CD3-CD56+ NK 세포를 구별하였다.
면역-침전 및 웨스턴 블럿
CD160TM 동형의 Flag-태그된 버전을 발현하는 HEK-CD160TM 세포를 1% NP40 용해 완충제에 용해시켰다. 후-핵 용해물을 제조하고 완전한 인간 A12 항체 또는 마우스 키메라 A12에 의한 면역-침전을 가하였다. 인간 및 마우스 IgG를 각각 음성 대조용으로서 사용하였다. 면역 복합체를 단백질 G 세파로스 비드로 추가로 수집하였다. 세척에 이어서, 비-환원 샘플 완충제(환원제 없음)를 가하고 샘플을 최종적으로 열-변성시켰다. 단백질을 SDS-10% PAGE에 의해 분리시키고, 니트로셀룰로스 멤브레인상으로 전기적으로 옮기고, 항-Flag mAb + HRP-결합된 염소 항-마우스 IgG에 의한 면역-블럿팅을 가하였다. 이미지콴트(ImageQuant) LAS 장치에 의해 포착된 상 및 증대된 화학발광에 의해 정보가 제공되었다.
결과
HEK-CD160TM 세포상에서 선택 후에, CD160TM 동형에 대한 A12 및 B6 특이성을 먼저 CD160-GPI 및 CD160TM 발현 형질감염체 모두상에서 유식 세포측정에 의해 확인하였다. 도 1에 도시된 바와 같이, HEK-CD160TM 세포상에서(CHO-CD160-GPI 세포상에서는 아닌) A12 및 B6 항체에 의해 양성 표지화가 획득되었다. 환언하면, 항-CD160-GPI mAb CL1-R2 또는 BY55는 오직 CD160-GPI-발현 세포상에서만 양성 표지화를 제공하였으며, 이는 A12 및 B6 음성이 CHO 형질감염체상의 CD160-GPI의 비-발현에 관련될 가능성을 배제시켰다.
CD160TM 동형에 대한 A12 특이성을 추가로 확인하기 위해서, 면역-표지화를 인간 PBMC상에서 수행하였다. CD160TM 주요 특징은 활성화시 NK 세포상에서의 그의 특유의 발현이므로, 유식 세포측정 분석을 처리되지 않은 또는 IL2-활성화된 세포상에서 수행하였다. 상응하는 결과는 가장 최근의 활성화 시점에서조차 A12에 의한 CD4+ 및 CD8+ T 세포의 인식을 나타내지 않았다(도 2). 대조적으로 15일까지 가시적으로 남아있었던 활성화의 시작 후 2일째에 NK 세포 집단의 부분상에서 양성 신호가 검출되었다. 따라서 A12 항체는 특이적인 CD160TM 항체가 되기 위한 특징을 충족시켰다.
CD160TM을 인식하는 A12 항체의 능력을 면역-침전 실험을 수행함으로써 추가로 시험하였다. 상기 목적을 위해서 Flag-태그된 CD160TM 수용체를 발현한 HEK-CD160TM 세포를 용해시키고 완전한 인간 A12 항체 또는 그의 키메라 쥐 상대에 의한 면역-침전을 가하였다. 인간 또는 마우스 IgG를 음성 대조용으로서 사용하였다. 면역 복합체를 비-환원 조건하에서 젤 전기영동에 의해 분리시켜 다량체화 상태에 따른 CD160TM의 검출을 허용하였다. 항-Flag mAb에 의한 웨스턴 블럿에 의한 단백질 정보는 대조용 인간 IgG와 비교시 완전한 인간 A12로 수행된 면역-침전에서 특정한 신호를 보이지 않았으며, 이는 상기 항체가 부분적으로 변성될 때 CD160TM을 인식할 수 없음을 암시한다(도 3). 대조적으로, 쥐 키메라 A12 항체의 사용은 34-38, 56 및 100 kDa의 겉보기 분자량(각각 상기 수용체의 단량체, 이량체 및 사량체 형태에 상응하는 듯하다)을 갖는 단백질 밴드의 검출을 유도하였다.
최종적으로 우리는 A12가 가장 최근의 종래 기술의 항체, 즉 문헌[Giustiniani J. et al. (Curr Mol Med. 2012 Feb;12(2):188-98](도 4를 참조하시오)에 기재된 RB312와 대조적으로 CD160 가용성 동형을 인식하지 않음을 보인다. 같은 결과를 B6 항체에 의해서 획득하였다(데이터 도시 안 됨).
실시예 2: B6 항체의 특성화
B6 항체를 또한 실시예 1에 기재된 바와 같은 파지 디스플레이 선택으로부터 생성시킨다. B6는 유식 세포측정에 의해 HEK-CD160TM 세포상의 매우 양호한 인식 프로파일을 제공하는 것으로서 식별되었다. B6 항체의 쥐 키메라 버전(이때 인간 IgG1 Fc 부분이 쥐 IgG2a Fc 단편에 대해 교환되었다)을 또한 생성시켰다. 도 5는 A12 및 B6 항체의 VH 및 VL 서열의 정렬을 도시하며 우리는 B6가 A12와 매우 유사하다는 결론을 내릴 수 있다.
실시예 3: A12 및 B6에 의해 인식된 에피토프의 특성화
A12 및 B6의 에피토프 맵핑을 공개된 프로토콜에 따라 수행하였다(Sloostra et al, Mol. Divers. (1996), Timmerman et al, J. Mol. Recognit. 20 5J:283-299 (2007)). 간단히, 각각의 펩티드에 대한 항체의 결합을 PEPSCAN-기반 ELISA에서 시험하였다. 놀랍게도, 우리는 A12 및 B6 항체에 의해 인식된 에피토프가 2개 펩티드: 서열번호 4 및 서열번호 5로 구성된 입체형태적 에피토프임을 발견하였다. 첫 번째 펩티드가 CD160-GPI 및 CD160TM에 의해 공통으로 공유된다는 사실에도 불구하고, 두 번째 펩티드가 CD160TM에 특이적이며, 이는 상기 CD160-TM 동형에 대한 B6 및 A12 항체 모두의 특이성을 설명한다.
실시예 4: NK 세포 활성화 및 CD107a 분석
방법:
혈액 유래된 인간 만성 골수성 백혈병 세포주 K562(표적 세포) 및 NK 세포 림프종 유래된 NK92 세포주(효과기 세포)를 완전한 RPMI 1640(10% FCS, 2% 글루타민, 1% 항생제)에서 증식시키고 NK92 세포주의 경우 IL-2(200UI/㎖)가 보충되었다.
효과기 세포를 아이소타입 대조용 muIgG 또는 20 ㎍/㎖로 희석된 키메라 A12(muA12) 및 토끼 항-마우스 IgG(3 μ/시험)와 30분 배양 후에 상이한 비(E/T: 10/1, 5/1, 2.5/1, 1/1)로 표적세포와 공-배양하였다. 5h의 공-배양 후에, 세포를 PBS로 세척하고 이어서 CD3-FITC, CD137-PE, CD107-APC 및 CD56-PC7로 염색하였다. CD137 및 CD107a 발현을 게이팅된 CD3- CD56+ 세포상에서 분석하였다.
결과:
CD160-TM과 본 발명의 항체(muA12 항체)와의 관여는 CD137의 발현 및 K652 세포에 대한 세포 세포독성(CD107a의 발현)을 증대시킨다(도 7). 최상의 결과는 낮은 E/T 비(1/1 및 2.5/1)에서 획득된다. 유사한 결과를 muB6 항체에 의해 획득하였다(데이터 도시 안 됨).
SEQUENCE LISTING
<110> INSERM (Institut National de la Sante et de la Recherche Medicale)
UNIVERSITE PARIS DIDEROT-PARIS 7
UNIVERSITE DE MONTPELLIER
INSTITUT JEAN GODINOT
Institut regional du Cancer de Montpellier - Val d’Aurelle
<120> MONOCLONAL ANTIBODIES BINDING TO THE CD160 TRANSMEMBRANE ISOFORM
<130> IPA190646-FR
<150> EP 16306392.8
<151> 2016-10-25
<160> 32
<170> BiSSAP 1.3.6
<210> 1
<211> 234
<212> PRT
<213> Artificial Sequence
<220>
<223> CD160 transmembrane isoform
<300>
<301> Giustiniani J., Bensussan A., Marie-Cardine A.
<302> Identification and characterization of a transmembrane isoform of
Identification and characterization of a transmembrane isoform o
f CD160 (CD160-TM), a unique activating receptor selectively Iden
tification and characterization of a transmembrane isoform of Ide
<303> J Immunol
<304> 182
<305> 1
<306> 63-71
<307> 2009
<300>
<310> WO2008155363
<311> 18/06/2008
<312> 24/12/2008
<400> 1
Met Leu Leu Glu Pro Gly Arg Gly Cys Cys Ala Leu Ala Ile Leu Leu
1 5 10 15
Ala Ile Val Asp Ile Gln Ser Gly Gly Cys Ile Asn Ile Thr Ser Ser
20 25 30
Ala Ser Gln Glu Gly Thr Arg Leu Asn Leu Ile Cys Thr Val Trp His
35 40 45
Lys Lys Glu Glu Ala Glu Gly Phe Val Val Phe Leu Cys Lys Asp Arg
50 55 60
Ser Gly Asp Cys Ser Pro Glu Thr Ser Leu Lys Gln Leu Arg Leu Lys
65 70 75 80
Arg Asp Pro Gly Ile Asp Gly Val Gly Glu Ile Ser Ser Gln Leu Met
85 90 95
Phe Thr Ile Ser Gln Val Thr Pro Leu His Ser Gly Thr Tyr Gln Cys
100 105 110
Cys Ala Arg Ser Gln Lys Ser Gly Ile Arg Leu Gln Gly His Phe Phe
115 120 125
Ser Ile Leu Phe Thr Glu Thr Gly Asn Tyr Thr Val Thr Gly Leu Lys
130 135 140
Gln Arg Gln His Leu Glu Phe Ser His Asn Glu Gly Thr Leu Ser Ser
145 150 155 160
Gly Phe Leu Gln Glu Lys Val Trp Val Met Leu Val Thr Ser Leu Val
165 170 175
Ala Leu Gln Gly Met Ser Lys Arg Ala Val Ser Thr Pro Ser Asn Glu
180 185 190
Gly Ala Ile Ile Phe Leu Pro Pro Trp Leu Phe Ser Arg Arg Arg Arg
195 200 205
Leu Glu Arg Met Ser Arg Gly Arg Glu Lys Cys Tyr Ser Ser Pro Gly
210 215 220
Tyr Pro Gln Glu Ser Ser Asn Gln Phe His
225 230
<210> 2
<211> 160
<212> PRT
<213> Artificial Sequence
<220>
<223> CD160 GPI-anchored isoform
<300>
<301> Nikolova M., Marie-Cardine A., Boumsell L., Bensussan A.
<302> BY55/CD160 acts as a co-receptor in TCR signal transduction of a
BY55/CD160 acts as a co-receptor in TCR signal transduction of a
human circulating cytotoxic effector T lymphocyte subset lacking
BY55/CD160 acts as a co-receptor in TCR signal transduction of a
<303> Int Immunol.
<304> 14
<305> 5
<306> 445-51
<307> 2002
<300>
<310> WO2006015886
<311> 09/08/2005
<312> 16/02/2006
<400> 2
Met Leu Leu Glu Pro Gly Arg Gly Cys Cys Ala Leu Ala Ile Leu Leu
1 5 10 15
Ala Ile Val Asp Ile Gln Ser Gly Gly Cys Ile Asn Ile Thr Ser Ser
20 25 30
Ala Ser Gln Glu Gly Thr Arg Leu Asn Leu Ile Cys Thr Val Trp His
35 40 45
Lys Lys Glu Glu Ala Glu Gly Phe Val Val Phe Leu Cys Lys Asp Arg
50 55 60
Ser Gly Asp Cys Ser Pro Glu Thr Ser Leu Lys Gln Leu Arg Leu Lys
65 70 75 80
Arg Asp Pro Gly Ile Asp Gly Val Gly Glu Ile Ser Ser Gln Leu Met
85 90 95
Phe Thr Ile Ser Gln Val Thr Pro Leu His Ser Gly Thr Tyr Gln Cys
100 105 110
Cys Ala Arg Ser Gln Lys Ser Gly Ile Arg Leu Gln Gly His Phe Phe
115 120 125
Ser Ile Leu Phe Thr Glu Thr Gly Asn Tyr Thr Val Thr Gly Leu Lys
130 135 140
Gln Arg Gln His Leu Glu Phe Ser His Asn Glu Gly Thr Leu Ser Ser
145 150 155 160
<210> 3
<211> 160
<212> PRT
<213> Artificial Sequence
<220>
<223> CD160 soluble isoform
<300>
<301> Giustiniani J., Marie-Cardine A., Bensussan A.
<302> A soluble form of the MHC class I-specific CD160 receptor is A so
luble form of the MHC class I-specific CD160 receptor is released
from human activated NK lymphocytes and inhibits A soluble form
of the MHC class I-specific CD160 receptor is A soluble form of t
<303> J Immunol.
<304> 178
<305> 3
<306> 1293-300
<307> 2007
<400> 3
Met Leu Leu Glu Pro Gly Arg Gly Cys Cys Ala Leu Ala Ile Leu Leu
1 5 10 15
Ala Ile Val Asp Ile Gln Ser Gly Gly Cys Ile Asn Ile Thr Ser Ser
20 25 30
Ala Ser Gln Glu Gly Thr Arg Leu Asn Leu Ile Cys Thr Val Trp His
35 40 45
Lys Lys Glu Glu Ala Glu Gly Phe Val Val Phe Leu Cys Lys Asp Arg
50 55 60
Ser Gly Asp Cys Ser Pro Glu Thr Ser Leu Lys Gln Leu Arg Leu Lys
65 70 75 80
Arg Asp Pro Gly Ile Asp Gly Val Gly Glu Ile Ser Ser Gln Leu Met
85 90 95
Phe Thr Ile Ser Gln Val Thr Pro Leu His Ser Gly Thr Tyr Gln Cys
100 105 110
Cys Ala Arg Ser Gln Lys Ser Gly Ile Arg Leu Gln Gly His Phe Phe
115 120 125
Ser Ile Leu Phe Thr Glu Thr Gly Asn Tyr Thr Val Thr Gly Leu Lys
130 135 140
Gln Arg Gln His Leu Glu Phe Ser His Asn Glu Gly Thr Leu Ser Ser
145 150 155 160
<210> 4
<211> 24
<212> PRT
<213> Artificial Sequence
<220>
<223> Epitope
<400> 4
Lys Asp Arg Ser Gly Asp Cys Ser Pro Glu Thr Ser Leu Lys Gln Leu
1 5 10 15
Arg Leu Lys Arg Asp Pro Gly Ile
20
<210> 5
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Epitope
<400> 5
Leu Val Ala Leu Gln Gly Met Ser Lys Arg Ala Val Ser Thr Pro
1 5 10 15
<210> 6
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR1
<220>
<221> SITE
<222> 11
<223> X is Y or S
<220>
<221> SITE
<222> 12
<223> X is G or Y
<400> 6
Ala Gly Thr Ser Ser Asp Val Gly Gly Tyr Xaa Xaa Val Ser
1 5 10
<210> 7
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR2
<400> 7
Tyr Asp Ser Tyr Arg Pro Ser
1 5
<210> 8
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR3
<220>
<221> SITE
<222> 3
<223> X is S or Y
<400> 8
Ser Ser Xaa Thr Tyr Tyr Ser Thr Arg Val
1 5 10
<210> 9
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> VH-CDR1
<220>
<221> SITE
<222> 3
<223> X is S or Y
<400> 9
Asn Tyr Xaa Met Asn
1 5
<210> 10
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> SITE
<222> 1
<223> X is Y or G
<220>
<223> VH-CDR2
<220>
<221> SITE
<222> 10
<223> X is N or S
<400> 10
Xaa Ile Tyr Gly Ser Ser Arg Tyr Ile Xaa Tyr Ala Asp Phe Val Lys
1 5 10 15
Gly
<210> 11
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> VH-CDR3
<400> 11
Gly Met Asp Val
1
<210> 12
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> VH region of A12 antibody
<400> 12
Glu Val Gln Leu Val Glu Ser Gly Gly Ser Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Ser Tyr Ile Tyr Gly Ser Ser Arg Tyr Ile Ser Tyr Ala Asp Phe Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Thr Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Ser Tyr Tyr Gly Gly Met Asp Val Trp Gly Arg Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 13
<211> 109
<212> PRT
<213> Artificial Sequence
<220>
<223> VL region of A12 antibody
<400> 13
Gln Ser Val Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Ala Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Tyr Gly Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Tyr Asp Ser Tyr Arg Pro Ser Gly Val Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Ser Thr Tyr Tyr
85 90 95
Ser Thr Arg Val Phe Gly Gly Gly Thr Lys Leu Glu Lys
100 105
<210> 14
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> VH region of B6 antibody
<400> 14
Glu Val Gln Leu Val Glu Ser Gly Gly Ser Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Tyr Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Ser Gly Ile Tyr Gly Ser Ser Arg Tyr Ile Asn Tyr Ala Asp Phe Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Thr Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Ser Tyr Tyr Gly Gly Met Asp Val Trp Gly Arg Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 15
<211> 109
<212> PRT
<213> Artificial Sequence
<220>
<223> VL region of B6 antibody
<400> 15
Gln Ser Val Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Ala Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Ser Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Tyr Asp Ser Tyr Arg Pro Ser Gly Val Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Thr Tyr Tyr
85 90 95
Ser Thr Arg Val Phe Gly Gly Gly Thr Lys Leu Glu Lys
100 105
<210> 16
<211> 345
<212> DNA
<213> Artificial Sequence
<220>
<223> VH region of A12 antibody
<400> 16
aggtgcagct ggtggagtct gggggaagcc tggtcaagcc tggggggtcc ctgagactct 60
cctgtgcagc tctggattca ccttcagtaa ctatagtatg aactgggtcc gccaggctcc 120
agggaagggc tggagtggat ctcatatatt tatggtagta gtagatatat aagttacgca 180
gacttcgtga agggcgattc accatctcca gagacaacgc cacgaactca ctgtacctgc 240
aaatgaacag cctagagccg aggacacggc tgtttattac tgtgtgagat cctattatgg 300
cggtatggac gtctggggca gggcaccctg gtcaccgtct cctca 345
<210> 17
<211> 325
<212> DNA
<213> Artificial Sequence
<220>
<223> VL region of A12 antibody
<400> 17
cagtctgtgc tgactcagcc tgcctccgtg tctgggtctc ctggacagtc gatcaccatc 60
tcctgcgctg aaccagcagt gacgttggtg gttattatgg cgtctcctgg taccaacaac 120
acccaggaaa gcccccaaac tcatgattta ttatgacagt tatcggccct caggggtttc 180
taatcgcttc tctggcccaa gtctggcaac acggcctccc tgacaatctc tgggctccag 240
gctgaggacg aggcgattat tactgcagct caagtacata ttatagcact cgagttttcg 300
gcggagggac caagctggag ataaa 325
<210> 18
<211> 354
<212> DNA
<213> Artificial Sequence
<220>
<223> VH region of B6 antibody
<400> 18
gaggtgcagc tggtggagtc tgggggaagc ctggtcaagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt aactattata tgaactgggt ccgccaggct 120
ccagggaagg ggctggagtg gatctcaggc atttatggta gtagtagata tataaactac 180
gcagacttcg tgaagggccg attcaccatc tccagagaca acgccacgaa ctcactgtac 240
ctgcaaatga acagcctgag agccgaggac acggctgttt attactgtgt gagatccagt 300
ggctatggcg gtatggacgt ctggggcaga ggcaccctgg tcaccgtctc ctca 354
<210> 19
<211> 330
<212> DNA
<213> Artificial Sequence
<220>
<223> VL region of B6 antibody
<400> 19
cagtctgtgc tgactcagcc tgcctccgtg tctgggtctc ctggacagtc gatcaccatc 60
tcctgcgctg gaaccagcag tgacgttggt ggttatagtt atgtctcctg gtaccaacaa 120
cacccaggca aagcccccaa actcatgatt tattatgaca gttatcggcc ctcaggggtt 180
tctaatcgct tctctggctc caagtctggc aacacggcct ccctgacaat ctctgggctc 240
caggctgagg acgaggctga ttattactgc agctcatata catattatag cactcgagtt 300
ttcggcggag ggaccaagct ggagatcaaa 330
<210> 20
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR1
<400> 20
Ala Gly Thr Ser Ser Asp Val Gly Gly Tyr Tyr Gly Val Ser
1 5 10
<210> 21
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR1
<400> 21
Ala Gly Thr Ser Ser Asp Val Gly Gly Tyr Tyr Tyr Val Ser
1 5 10
<210> 22
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR1
<400> 22
Ala Gly Thr Ser Ser Asp Val Gly Gly Tyr Ser Gly Val Ser
1 5 10
<210> 23
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR1
<400> 23
Ala Gly Thr Ser Ser Asp Val Gly Gly Tyr Ser Tyr Val Ser
1 5 10
<210> 24
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR3
<400> 24
Ser Ser Ser Thr Tyr Tyr Ser Thr Arg Val
1 5 10
<210> 25
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR3
<400> 25
Ser Ser Tyr Thr Tyr Tyr Ser Thr Arg Val
1 5 10
<210> 26
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> VH-CDR1
<400> 26
Asn Tyr Ser Met Asn
1 5
<210> 27
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> VH-CDR1
<400> 27
Asn Tyr Tyr Met Asn
1 5
<210> 28
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> VH-CDR2
<400> 28
Tyr Ile Tyr Gly Ser Ser Arg Tyr Ile Asn Tyr Ala Asp Phe Val Lys
1 5 10 15
Gly
<210> 29
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> VH-CDR2
<400> 29
Tyr Ile Tyr Gly Ser Ser Arg Tyr Ile Ser Tyr Ala Asp Phe Val Lys
1 5 10 15
Gly
<210> 30
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> VH-CDR2
<400> 30
Gly Ile Tyr Gly Ser Ser Arg Tyr Ile Asn Tyr Ala Asp Phe Val Lys
1 5 10 15
Gly
<210> 31
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> VH-CDR2
<400> 31
Gly Ile Tyr Gly Ser Ser Arg Tyr Ile Ser Tyr Ala Asp Phe Val Lys
1 5 10 15
Gly
<210> 32
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Peptide 2 - amino acids 144-158 of CD160-TM
<300>
<310> WO2008155363
<311> 18/06/2008
<312> 24/12/2008
<400> 32
Lys Gln Arg Gln His Leu Glu Phe Ser His Asn Asn Glu Gly Thr Leu
1 5 10 15
Claims (26)
- CD160-TM 동형(isoform)의 세포외 도메인에 결합하는 단클론 항체(monoclonal antibody)로서, GPI-고정된 동형이나 CD160 가용성 동형에는 결합하지 않고, 상기 단클론 항체의 에피토프가 서열번호 1의 아미노산 잔기 175 내지 189로부터의 적어도 하나의 아미노산 잔기를 포함하는 단클론 항체.
- 제1항에 있어서,
에피토프가 서열번호 1의 아미노산 잔기 62 내지 85로부터의 적어도 하나의 아미노산 잔기를 추가로 포함하는 단클론 항체. - 제1항 또는 제2항에 있어서,
키메라 항체(chimeric antibody), 인간화된 항체 또는 인간 항체인 단클론 항체. - 제1항 내지 제3항 중 어느 한 항에 있어서,
하기의 CDR 중 적어도 하나를 포함하는 경쇄: i) 서열번호 6에 제시된 바와 같은 VL-CDR1(여기에서 X11은 Y 또는 S이고, X12는 G 또는 Y이다), ii) 서열번호 7에 제시된 바와 같은 VL-CDR2 및 iii) 서열번호 8에 제시된 바와 같은 VL-CDR3(여기에서 X3은 S 또는 Y이다), 및/또는 하기의 CDR 중 적어도 하나를 포함하는 중쇄: i) 서열번호 9에 제시된 바와 같은 VH-CDR1(여기에서 X3은 S 또는 Y이다), ii) 서열번호 10에 제시된 바와 같은 VH-CDR2(여기에서 X1은 Y 또는 G이고 X10은 N 또는 S이다) 및 iii) 서열번호 11에 제시된 바와 같은 VH-CDR3을 포함하는 단클론 항체. - 제1항 내지 제4항 중 어느 한 항에 있어서,
하기의 CDR을 포함하는 경쇄: i) 서열번호 6에 제시된 바와 같은 VL-CDR1(여기에서 X11은 Y 또는 S이고, X12는 G 또는 Y이다), ii) 서열번호 7에 제시된 바와 같은 VL-CDR2 및 iii) 서열번호 8에 제시된 바와 같은 VL-CDR3(여기에서 X3은 S 또는 Y이다), 및 하기의 CDR을 포함하는 중쇄: i) 서열번호 9에 제시된 바와 같은 VH-CDR1(여기에서 X3은 S 또는 Y이다), ii) 서열번호 10에 제시된 바와 같은 VH-CDR2(여기에서 X1은 Y 또는 G이고 X10은 N 또는 S이다) 및 iii) 서열번호 11에 제시된 바와 같은 VH-CDR3을 포함하는 단클론 항체. - 제1항 내지 제5항 중 어느 한 항에 있어서,
하기의 CDR: i) VL-CDR1: AGTSSDVGGYYGVS (서열번호 20), ii) VL-CDR2: YDSYRPS (서열번호 7) 및 iii) VL-CDR3: SSSTYYSTRV (서열번호 24)를 포함하는 경쇄를 포함하고, A12 항체의 중쇄가 하기의 CDR i) VH-CDR1: NYSMN (서열번호 26), ii) VH-CDR2: YIYGSSRYISYADFVKG (서열번호 29) 및 iii) VH-CDR3: GMDV (서열번호 11)를 포함하는 단클론 항체. - 제1항 내지 제5항 중 어느 한 항에 있어서,
하기의 CDR: i) VL-CDR1: AGTSSDVGGYSYVS (서열번호 23), ii) VL-CDR2: YDSYRPS (서열번호 7) 및 iii) VL-CDR3: SSYTYYSTRV (서열번호 25)를 포함하는 경쇄를 포함하고, A12 항체의 중쇄가 하기의 CDR i) VH-CDR1: NYYMN (서열번호 27), ii) VH-CDR2: GIYGSSRYINYADFVKG (서열번호 30) 및 iii) VH-CDR3: GMDV (서열번호 11)를 포함하는 단클론 항체. - 제1항 내지 제7항 중 어느 한 항에 있어서,
서열번호 12 또는 서열번호 14와 적어도 70%의 동일성(identity)을 갖는 중쇄 및 서열번호 13 또는 서열번호 15와 적어도 70%의 동일성을 갖는 경쇄를 포함하는 단클론 항체. - 제1항 내지 제8항 중 어느 한 항에 있어서,
서열번호 12 또는 서열번호 14와 동일한 중쇄 및 서열번호 13 또는 서열번호 15와 동일한 경쇄를 포함하는 단클론 항체. - 제1항 내지 제9항 중 어느 한 항에 있어서,
제5항 내지 제9항 중 어느 한 항의 항체와 CD160-TM 동형에의 결합에 대해 교차-경쟁하는 단클론 항체. - 제1항 내지 제10항 중 어느 한 항에 있어서,
세포독성 부분(cytotoxic moiety)에 접합되는 단클론 항체. - 제1항 내지 제11항 중 어느 한 항의 단클론 항체를 포함하는 융합 단백질.
- 제1항 내지 제11항 중 어느 한 항의 항체의 중쇄 또는 경쇄를 암호화하는 핵산 분자.
- 제13항에 있어서,
서열번호 16, 서열번호 17, 서열번호 18 또는 서열번호 19와 70%의 동일성을 갖는 핵산 서열을 포함하는 핵산 분자. - 제13항 또는 제14항의 핵산에 의해 형질감염되었거나, 감염되었거나 또는 형질전환된 숙주 세포.
- 제1항 내지 제11항 중 어느 한 항에 있어서,
항체 의존적인 세포 세포독성, 보체 의존적인 세포독성 또는 항체-의존적인 식세포작용을 매개하는 단클론 항체. - 제16항에 있어서,
바람직하게는 NK 백혈병 또는 NK 림프종, 예를 들어 림프절외 및 비-림프절외 NK/T 림프종; NK 세포 유래된 암; 및 급성 NK 백혈병의 치료를 위한, 암세포가 CD160-TM을 발현하는 암의 치료 방법에 사용하기 위한 단클론 항체. - 치료가 필요한 대상체(subject)에게 치료 유효량의 제16항의 단클론 항체를 전달함을 포함하는, 상기 대상체에서 CD160-TM 동형을 발현하는 세포의 집단, CD160-TM 동형을 발현하는 악성 NK 세포의 집단 또는 A12 또는 B6 항체에 의해 인식된 에피토프를 발현하는 세포의 집단을 고갈시키는 방법.
- 제1항 내지 제11항 중 어느 한 항에 있어서,
항체 의존적인 세포 세포독성, 보체 의존적인 세포독성 또는 항체-의존적인 식세포작용을 매개하지 않는 단클론 항체. - 제19항에 있어서,
암, 감염성 질병 또는 자가면역 및/또는 염증성 질병의 치료 방법에 사용하기 위한 단클론 항체. - 치료가 필요한 대상체에게 치료 유효량의 제19항의 항체를 투여함을 포함하는, 상기 대상체에서 NK 세포 활성을 증대시키는 방법.
- 제20항에 있어서,
대상체가 암, 감염성 질병 또는 자가면역 및/또는 염증성 질병을 앓고 있는 방법. - 치료가 필요한 대상체에게 항체를 제20항의 단클론 항체와 함께 투여함을 포함하는, 상기 대상체에서 상기 항체의 NK 세포 항체-의존적인 세포 세포독성(ADCC)을 증대시키는 방법.
- CD160-TM을 제1항 내지 제11항 중 어느 한 항의 단클론 항체와 접촉시킴을 포함하는, CD160-TM의 그의 리간드로의 결합을 억제하는 방법.
- 치료가 필요한 대상체에게 치료 유효량의 제20항의 단클론 항체를 투여함을 포함하여, 상기 대상체에서 발작성 야간 혈색소뇨증(Paroxysmal Nocturnal Hemoglobinuria)을 치료하는 방법으로, 바람직하게는 상기 항체가 Fab인 방법.
- 제1항 내지 제11항 중 어느 한 항의 항체 및 약학적으로 허용 가능한 담체를 포함하는 약학 조성물.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP16306392 | 2016-10-25 | ||
| EP16306392.8 | 2016-10-25 | ||
| PCT/EP2017/077261 WO2018077926A1 (en) | 2016-10-25 | 2017-10-25 | Monoclonal antibodies binding to the cd160 transmembrane isoform |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20190084264A true KR20190084264A (ko) | 2019-07-16 |
Family
ID=57570549
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197014634A KR20190084264A (ko) | 2016-10-25 | 2017-10-25 | Cd160 막 횡단 동형체에 결합하는 단클론 항체 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US11186635B2 (ko) |
| EP (1) | EP3532502A1 (ko) |
| JP (1) | JP2019535306A (ko) |
| KR (1) | KR20190084264A (ko) |
| CN (1) | CN110121508A (ko) |
| AU (1) | AU2017351764A1 (ko) |
| BR (1) | BR112019008345A8 (ko) |
| CA (1) | CA3080270A1 (ko) |
| WO (1) | WO2018077926A1 (ko) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20210108978A (ko) | 2018-12-21 | 2021-09-03 | 오제 이뮈노테라프틱스 | 이작용성 항-pd-1/il-7 분자 |
| WO2020165374A1 (en) | 2019-02-14 | 2020-08-20 | Ose Immunotherapeutics | Bifunctional molecule comprising il-15ra |
| WO2021122866A1 (en) | 2019-12-17 | 2021-06-24 | Ose Immunotherapeutics | Bifunctional molecules comprising an il-7 variant |
| GB202103706D0 (en) * | 2021-03-17 | 2021-04-28 | Ucl Business Ltd | CD160 binding domain |
| EP4320155A1 (en) | 2021-04-09 | 2024-02-14 | Ose Immunotherapeutics | New scaffold for bifunctional molecules with improved properties |
| WO2022214652A1 (en) | 2021-04-09 | 2022-10-13 | Ose Immunotherapeutics | Scaffold for bifunctioanl molecules comprising pd-1 or cd28 and sirp binding domains |
| WO2023170207A1 (en) * | 2022-03-09 | 2023-09-14 | Alderaan Biotechnology | Anti-cd160 transmembrane isoform antibodies |
| WO2024028386A1 (en) | 2022-08-02 | 2024-02-08 | Ose Immunotherapeutics | Multifunctional molecule directed against cd28 |
Family Cites Families (46)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US4861719A (en) | 1986-04-25 | 1989-08-29 | Fred Hutchinson Cancer Research Center | DNA constructs for retrovirus packaging cell lines |
| IL85035A0 (en) | 1987-01-08 | 1988-06-30 | Int Genetic Eng | Polynucleotide molecule,a chimeric antibody with specificity for human b cell surface antigen,a process for the preparation and methods utilizing the same |
| US5094941A (en) * | 1987-12-31 | 1992-03-10 | Zymogenetics, Inc. | Monoclonal antibodies to PDGF |
| US5278056A (en) | 1988-02-05 | 1994-01-11 | The Trustees Of Columbia University In The City Of New York | Retroviral packaging cell lines and process of using same |
| WO1989012624A2 (en) | 1988-06-14 | 1989-12-28 | Cetus Corporation | Coupling agents and sterically hindered disulfide linked conjugates prepared therefrom |
| DE3920358A1 (de) | 1989-06-22 | 1991-01-17 | Behringwerke Ag | Bispezifische und oligospezifische, mono- und oligovalente antikoerperkonstrukte, ihre herstellung und verwendung |
| US5670488A (en) | 1992-12-03 | 1997-09-23 | Genzyme Corporation | Adenovirus vector for gene therapy |
| LU91067I2 (fr) | 1991-06-14 | 2004-04-02 | Genentech Inc | Trastuzumab et ses variantes et dérivés immuno chimiques y compris les immotoxines |
| DE69233528T2 (de) | 1991-11-25 | 2006-03-16 | Enzon, Inc. | Verfahren zur Herstellung von multivalenten antigenbindenden Proteinen |
| US5714350A (en) | 1992-03-09 | 1998-02-03 | Protein Design Labs, Inc. | Increasing antibody affinity by altering glycosylation in the immunoglobulin variable region |
| US5635483A (en) | 1992-12-03 | 1997-06-03 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Tumor inhibiting tetrapeptide bearing modified phenethyl amides |
| US5780588A (en) | 1993-01-26 | 1998-07-14 | Arizona Board Of Regents | Elucidation and synthesis of selected pentapeptides |
| EP0689601B1 (en) | 1993-02-22 | 2006-10-04 | The Rockefeller University | Production of high titer helper-free retroviruses by transient transfection |
| US6214345B1 (en) | 1993-05-14 | 2001-04-10 | Bristol-Myers Squibb Co. | Lysosomal enzyme-cleavable antitumor drug conjugates |
| FR2712812B1 (fr) | 1993-11-23 | 1996-02-09 | Centre Nat Rech Scient | Composition pour la production de produits thérapeutiques in vivo. |
| US5663149A (en) | 1994-12-13 | 1997-09-02 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Human cancer inhibitory pentapeptide heterocyclic and halophenyl amides |
| IL116816A (en) | 1995-01-20 | 2003-05-29 | Rhone Poulenc Rorer Sa | Cell for the production of a defective recombinant adenovirus or an adeno-associated virus and the various uses thereof |
| US6013516A (en) | 1995-10-06 | 2000-01-11 | The Salk Institute For Biological Studies | Vector and method of use for nucleic acid delivery to non-dividing cells |
| CA2290485C (en) | 1997-05-21 | 2008-08-05 | Biovation Limited | Method for the production of non-immunogenic proteins |
| US6673901B2 (en) | 1997-06-12 | 2004-01-06 | Research Corporation Technologies, Inc. | Artificial antibody polypeptides |
| US6194551B1 (en) | 1998-04-02 | 2001-02-27 | Genentech, Inc. | Polypeptide variants |
| DK1071700T3 (da) | 1998-04-20 | 2010-06-07 | Glycart Biotechnology Ag | Glykosylerings-modifikation af antistoffer til forbedring af antistofafhængig cellulær cytotoksicitet |
| DK2270150T4 (da) | 1999-04-09 | 2019-08-26 | Kyowa Hakko Kirin Co Ltd | Fremgangsmåde til at kontrollere aktiviteten af immunologisk funktionelt molekyle. |
| ES2252261T3 (es) | 2000-06-28 | 2006-05-16 | Glycofi, Inc. | Metodos para producir glicoproteinas modificadas. |
| US6884869B2 (en) | 2001-04-30 | 2005-04-26 | Seattle Genetics, Inc. | Pentapeptide compounds and uses related thereto |
| WO2003026577A2 (en) | 2001-09-24 | 2003-04-03 | Seattle Genetics, Inc. | P-amidobenzylethers in drug delivery agents |
| KR100988949B1 (ko) | 2001-10-25 | 2010-10-20 | 제넨테크, 인크. | 당단백질 조성물 |
| WO2003048731A2 (en) | 2001-12-03 | 2003-06-12 | Abgenix, Inc. | Antibody categorization based on binding characteristics |
| ES2369542T3 (es) | 2002-07-31 | 2011-12-01 | Seattle Genetics, Inc. | Conjugados de auristatina y su uso para tratar cáncer, una enfermedad autoinmune o una enfermedad infecciosa. |
| ES2697327T3 (es) | 2003-11-06 | 2019-01-23 | Seattle Genetics Inc | Compuesto intermedio para la preparación de conjugados que comprenden derivados de auristatina y un enlazador |
| WO2005082023A2 (en) | 2004-02-23 | 2005-09-09 | Genentech, Inc. | Heterocyclic self-immolative linkers and conjugates |
| EP1725586B1 (en) | 2004-03-02 | 2015-01-14 | Seattle Genetics, Inc. | Partially loaded antibodies and methods of their conjugation |
| EP1626059A1 (en) | 2004-08-09 | 2006-02-15 | Institut National De La Sante Et De La Recherche Medicale (Inserm) | Angiogenic and immunologic applications of anti-CD160 specific compounds obtainable from mAb CL1-R2 |
| AU2005332660A1 (en) | 2004-11-12 | 2006-12-14 | Seattle Genetics, Inc. | Auristatins having an aminobenzoic acid unit at the N terminus |
| EP1898529A1 (en) | 2005-06-28 | 2008-03-12 | Pioneer Corporation | Broadcast receiving apparatus, interference detecting apparatus and interference detecting method |
| EP4026840A1 (en) | 2005-07-18 | 2022-07-13 | Seagen Inc. | Beta-glucuronide-linker drug conjugates |
| EP1880729A1 (en) | 2006-07-20 | 2008-01-23 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Use of soluble CD160 to suppress immunity |
| NZ577085A (en) * | 2006-11-15 | 2012-06-29 | Medarex Inc | Human monoclonal antibodies to btla and methods of use |
| EP2006299A1 (en) | 2007-06-18 | 2008-12-24 | Institut National De La Sante Et De La Recherche Medicale (Inserm) | Identification of new isoforms of the MHC-class I specific receptor CD160 and uses thereof |
| EP2210903A1 (en) * | 2009-01-21 | 2010-07-28 | Monoclonal Antibodies Therapeutics | Anti-CD160 monoclonal antibodies and uses thereof |
| WO2011116276A2 (en) * | 2010-03-18 | 2011-09-22 | Matthew Delisa | Engineering correctly folded antibodies using inner membrane display of twin-arginine translocation intermediates |
| US9045544B2 (en) * | 2010-05-28 | 2015-06-02 | Inserm (Institut National De La Sante Et De La Recherche Medicale) | Anti-CD160 specific antibodies for the treatment of eye disorders based on neoangiogenesis |
| JP6105477B2 (ja) | 2010-11-05 | 2017-03-29 | ライナット ニューロサイエンス コーポレイション | 操作されたポリペプチドコンジュゲートおよびトランスグルタミナーゼを用いてそれを作製する方法 |
| WO2013072714A1 (en) * | 2011-11-15 | 2013-05-23 | Centre National De La Recherche Scientifique (Cnrs) | Antibodies for molecular imaging of vulnerable plaques in atherosclerosis |
| JP2018508191A (ja) * | 2015-01-16 | 2018-03-29 | アンスティチュ ナショナル ドゥ ラ サンテ エ ドゥ ラ ルシェルシュ メディカル | オレキシン受容体1型に対するヒトモノクローナル抗体 |
-
2017
- 2017-10-25 JP JP2019542804A patent/JP2019535306A/ja active Pending
- 2017-10-25 AU AU2017351764A patent/AU2017351764A1/en not_active Abandoned
- 2017-10-25 CA CA3080270A patent/CA3080270A1/en not_active Abandoned
- 2017-10-25 KR KR1020197014634A patent/KR20190084264A/ko not_active Application Discontinuation
- 2017-10-25 WO PCT/EP2017/077261 patent/WO2018077926A1/en unknown
- 2017-10-25 CN CN201780080063.4A patent/CN110121508A/zh active Pending
- 2017-10-25 EP EP17797084.5A patent/EP3532502A1/en active Pending
- 2017-10-25 US US16/343,889 patent/US11186635B2/en active Active
- 2017-10-25 BR BR112019008345A patent/BR112019008345A8/pt unknown
Also Published As
| Publication number | Publication date |
|---|---|
| CN110121508A (zh) | 2019-08-13 |
| BR112019008345A8 (pt) | 2023-03-07 |
| AU2017351764A1 (en) | 2019-06-06 |
| US11186635B2 (en) | 2021-11-30 |
| JP2019535306A (ja) | 2019-12-12 |
| WO2018077926A1 (en) | 2018-05-03 |
| EP3532502A1 (en) | 2019-09-04 |
| US20190256595A1 (en) | 2019-08-22 |
| CA3080270A1 (en) | 2018-05-03 |
| BR112019008345A2 (pt) | 2019-10-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR102365972B1 (ko) | 항-pd-1 항체 및 이의 용도 | |
| KR20190084264A (ko) | Cd160 막 횡단 동형체에 결합하는 단클론 항체 | |
| KR102384845B1 (ko) | 항-pd-l1 항체 및 그의 용도 | |
| JP6847037B2 (ja) | 抗cd73抗体とa2a受容体阻害薬とを含む併用治療薬及びその使用 | |
| JP6141639B2 (ja) | 抗体 | |
| TWI751397B (zh) | 抗 lag-3 抗體及其用途 | |
| JP2022516140A (ja) | 白血球免疫グロブリン様受容体2中和抗体 | |
| US20230331847A1 (en) | Anti-phosphotyrosinylated programmed death 1 (pd-1) monoclonal antibodies, methods of making and methods of using thereof | |
| KR20220062500A (ko) | 항-cd39 항체 조성물 및 방법 | |
| WO2019129137A1 (zh) | 抗lag-3抗体及其用途 | |
| CN114401992A (zh) | 结合igsf11(vsig3)的igc2的抗体及其用途 | |
| CN112424231B (zh) | 抗pd-1抗体及其剂量和用途 | |
| US11673963B2 (en) | CRTAM antibodies and methods of treating cancer | |
| WO2019129136A1 (zh) | 抗pd-l1抗体及其用途 | |
| KR20220030937A (ko) | 항체 및 사용 방법 | |
| US20240132614A1 (en) | Crtam antibodies and methods of treating cancer | |
| WO2023170207A1 (en) | Anti-cd160 transmembrane isoform antibodies | |
| JP2022523145A (ja) | 抗trem1抗体及び関連方法 | |
| TW202411252A (zh) | 抗pd-1抗體及其用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |