본 발명은 미오신 조절성 경쇄 폴리펩타이드(이하 Myl로 기재됨) 9에 결합하는 항-Myl9 항체에 관한 것이다.
본 발명에 사용되는 항-Myl9 항체는, Myl9를 인지하고 결합할 수 있는 항체이며, 하기 기재된 바와 같이 상기 항체는 온전한(intact) 항체일 수 있다. 대안적으로, 본 발명에 사용되는 항-Myl9 항체는, Myl9에 대한 결합 친화성을 갖고 있는 한 재조합 항체(예컨대 키메라 항체, 인간화된 항체 또는 인간 항체) 또는 화학적으로 합성된 항체, 뿐만 아니라 이의 항원 결합 단편일 수 있다. 본원에서 Myl9는 인간 또는 마우스로부터 유래된 Myl9를 지칭하는 것으로 이해될 수 있다. 인간 또는 마우스로부터 유래된 Myl9의 아미노산 서열은 공공의 데이터베이스로부터 수득될 수 있으며, 여기서, 유전자 및 아미노산 서열 정보는 미국 생명공학 정보 센터에 의해 제공되는 Genbank와 같이 등록되어 있거나, 아미노산 서열은, 밀접하게 관련된 동물 종의 Myl9의 염기 서열 정보를 기반으로 프라이머를 디자인하고, 요망되는 동물 종으로부터 추출된 RNA로부터의 클로닝에 의해 수득되는 Myl9 유전자의 서열 정보로부터 확인될 수 있다. 예를 들어, 인간 및 마우스 Myl9의 아미노산 서열 정보는 각각 Genbank 등록 번호 NP_006088.2(SEQ ID NO. 2) 및 Genbank 등록 번호 NP_742116.1(SEQ ID NO. 1)로서 데이터베이스에 등록되어 있다.
본 발명의 일 양태에서, Myl9는 SEQ ID NO. 1로 제시된 아미노산 서열로 표시되는 펩타이드, 또는 상기 아미노산 서열에 하나 또는 다수의 아미노산 치환, 첨가 또는 결실을 가진 아미노산 서열로 표시되는 펩타이드를 포함한다. Myl9와 관련하여 본원에 사용된 바와 같이 "다수의"는, 이의 본래의 아미노산 서열로 표시되는 펩타이드와 동등한 기능적 특성들이 보유되는 한 한정되지 않고, 2 내지 20, 예를 들어 2 내지 15, 2 내지 10, 2 내지 9, 2 내지 8, 2 내지 7, 2 내지 6, 또는 2 내지 5이다. 본 발명의 또 다른 양태에서, Myl9는 SEQ ID NO. 1로 제시된 아미노산 서열과 적어도 90%, 예를 들어 91%, 92%, 93%, 94% 또는 95%의 상동성을 가진 아미노산 서열에 의해 표시되는 펩타이드를 포함한다.
본원에 사용된 바와 같이, 아미노산 서열의 "상동성"은 하기 파라미터 설정 하에 CLUSTALW 알고리즘을 사용하여 페어와이즈 정렬(Pairwise Alignment)에 의해 계산된 상동성을 의미한다:
K-투플(tuple)(워드) 크기: 1
윈도우 크기: 5
갭 페널티: 3
상부 다이아고날(Top Diagonal)의 수: 5
배점 방법: 퍼센트.
본 발명의 일 양태에서, Myl9는 SEQ ID NO. 2로 제시된 아미노산 서열로 표시되는 펩타이드, 또는 상기 아미노산 서열에 하나 또는 다수의 아미노산 치환, 첨가 또는 결실을 갖는 아미노산 서열로 표시되는 펩타이드를 포함한다. Myl9와 관련하여 본원에 사용된 바와 같이 "다수의"는, 이의 본래의 아미노산 서열로 표시되는 펩타이드와 동등한 기능적 특성들이 보유되는 한 한정되지 않고, 2 내지 20, 예를 들어 2 내지 15, 2 내지 10, 2 내지 9, 2 내지 8, 2 내지 7, 2 내지 6, 또는 2 내지 5이다. 본 발명의 또 다른 양태에서, Myl9는 SEQ ID NO. 2로 제시된 아미노산 서열과 적어도 90%, 예를 들어 91%, 92%, 93%, 94% 또는 95%의 상동성을 가진 아미노산 서열에 의해 표시되는 펩타이드를 포함한다.
본 발명의 일 양태에서, Myl9는 SEQ ID NO. 3으로 제시된 아미노산 서열로 표시되는 펩타이드, 또는 상기 아미노산 서열에 하나 또는 다수의 아미노산 치환, 첨가 또는 결실을 갖는 아미노산 서열로 표시되는 펩타이드를 포함한다. Myl9와 관련하여 본원에 사용된 바와 같이 "다수의"는, 이의 본래의 아미노산 서열로 표시되는 펩타이드와 동등한 기능적 특성들이 보유되는 한 한정되지 않고, 2 내지 20, 예를 들어 2 내지 15, 2 내지 10, 2 내지 9, 2 내지 8, 2 내지 7, 2 내지 6, 또는 2 내지 5이다. 본 발명의 또 다른 양태에서, Myl9는 SEQ ID NO. 3으로 제시된 아미노산 서열과 적어도 90%, 예를 들어 91%, 92%, 93%, 94% 또는 95%의 상동성을 가진 아미노산 서열에 의해 표시되는 펩타이드를 포함한다.
본 발명의 일 양태에서, 마우스 Myl9와 마우스 Myl12a, 및 마우스 Myl9와 마우스 Myl12b의 아미노산 서열들은 각각 94.2% 및 93.6% 상동성을 가지고, 마우스 Myl12a 및 마우스 Myl12b는 97.7%의 상동성을 가진다. 인간 Myl9와 인간 Myl12a, 및 인간 Myl9와 인간 Myl12b의 아미노산 서열들은 각각 91.8% 및 93.0%의 상동성을 가지고, 인간 Myl12a 및 인간 Myl12b는 96.5%의 상동성을 가진다. 이러한 이유에서, Myl9를 인지하는 항체는 이따금 Myl12a를 인지한다. 더욱이, Myl9를 인지하는 항체는 이따금 Myl12b를 인지한다. 따라서, 본 발명의 일 실시형태에서, 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편은 또한, Myl12a 및/또는 Myl12b를 인지할 수 있다.
본 발명의 일 양태에서, 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편은 Myl9와 CD69의 세포외 영역 사이의 결합을 저해하는 항체이다. 예를 들어, 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편은, CD69 세포외 영역의 임의의 일부와, SEQ ID NO. 4로 제시된 아미노산 서열로 표시되는 펩타이드 또는 상기 아미노산 서열에 하나 또는 다수의 아미노산 치환, 첨가 또는 결실을 갖는 아미노산 서열로 표시되는 펩타이드를 포함하는 Myl9 사이의 결합을 저해하는 항체 또는 항원 결합 단편일 수 있다. CD69의 세포외 영역과 관련하여 본원에 사용된 바와 같이 "다수의"는 2 내지 15, 예를 들어 2 내지 14, 2 내지 13, 2 내지 12, 2 내지 11, 2 내지 10, 2 내지 9, 2 내지 8, 2 내지 7, 2 내지 6, 또는 2 내지 5이지만, 이들로 한정되지 않는다. 본 발명의 또 다른 양태에서, 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편은, SEQ ID NO. 4로 제시된 아미노산 서열과 적어도 90%, 예를 들어 91%, 92%, 93%, 94% 또는 95%의 상동성을 가진 아미노산 서열로 표시되는 펩타이드를 포함하는 CD69 세포외 영역의 임의의 일부와 Myl9 사이의 결합을 저해하는 항체 또는 항원 결합 단편일 수 있다.
본 발명의 또 다른 양태에서, 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편은 Myl12a 및/또는 Myl12b와 CD69의 세포외 영역 사이의 결합을 저해하는 항체이다. 예를 들어, 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편은, SEQ ID NO. 97로 제시된 아미노산 서열로 표시되는 펩타이드 또는 상기 아미노산 서열에 하나 또는 다수의 아미노산 치환, 첨가 또는 결실을 갖는 아미노산 서열로 표시되는 펩타이드를 포함하는 CD69 세포외 영역의 임의의 일부와 Myl12a 및/또는 Myl12b 사이의 결합을 저해하는 항체 또는 항원 결합 단편일 수 있다. 본 발명의 또 다른 양태에서, 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편은, SEQ ID NO. 97로 제시된 아미노산 서열과 적어도 90%, 예를 들어 91%, 92%, 93%, 94% 또는 95%의 상동성을 가진 아미노산 서열로 표시되는 펩타이드를 포함하는 CD69 세포외 영역의 임의의 일부와 Myl12a 및/또는 Myl12b 사이의 결합을 저해하는 항체 또는 항원 결합 단편일 수 있다.
본 발명의 일 양태에서, 항-Myl9 항체 또는 이의 Myl9 결합 단편은 포유류(예를 들어 마우스, 래트와 같은 설치류 또는 토끼, 원숭이, 소, 말, 염소, 인간 등)의 Myl9에 결합하여 Myl9와 CD69 사이의 상호작용을 저해할 수 있고, 바람직하게는 인간 Myl9에 결합하여 인간 Myl9와 인간 CD69 사이의 상호작용을 저해할 수 있다. 본원에서 "Myl9와 CD69 사이의 상호작용을 저해한다"는 것은 Myl9와 CD69 사이의 상호작용의 소멸 또는 저하를 의미한다. Myl9와 CD69 사이의 상호작용은, Myl9 및 CD69가 공존(예를 들어 Myl9의 작용으로 인한 CD69 기능의 발현 또는 증강, 또는 CD69 기능의 변화로 인한 생리학적 기능) 하에 작동함으로써 유발되는 CD69 기능의 변화를 측정하거나, 골수로의 CD69를 발현한 CD4T 세포의 이동을 측정함으로써 평가될 수 있다.
본 발명의 또 다른 양태에서, 항-Myl9 항체 또는 이의 Myl9 결합 단편은 또한, 포유류(예를 들어 마우스, 래트와 같은 설치류 또는 토끼, 원숭이, 소, 말, 염소, 인간 등)의 Myl12a 및/또는 Myl12b에 결합하여 Myl12a 및/또는 Myl12b와 CD69 사이의 상호작용을 저해할 수 있고, 바람직하게는 또한 인간 Myl12a 및/또는 인간 Myl12b에 결합하여 인간 Myl12a 및/또는 인간 Myal12b와 인간 CD69 사이의 상호작용을 저해할 수 있다. 본원에서 "Myl12a 및/또는 Myl12b와 CD69 사이의 상호작용을 저해한다"는 것은 Myl12a 및/또는 Myl12b와 CD69 사이의 상호작용의 소멸 또는 저하를 의미한다. Myl12a 및/또는 Myl12b와 CD69 사이의 상호작용은, Myl12a 및/또는 Myl12b 및 CD69가 공존(예를 들어 Myl12a 및/또는 Myl12b의 작용으로 인한 CD69 기능의 발현 또는 증강, 또는 CD69 기능의 변화로 인한 생리학적 기능) 하에 작동함으로써 유발되는 CD69 기능의 변화를 측정하거나, 골수로의 CD69를 발현한 CD4T 세포의 이동을 측정함으로써 평가될 수 있다.
항체 또는 이의 항원 결합 단편의 항원 결합 특성(예컨대 결합 친화성 및 종간(cross-species) 반응성)을 측정하는 데 이용되는 방법은 당업자에게 잘 공지된 방법일 수 있다. 예를 들어, 결합 친화성은 Biacore® 바이오센서, KinExA 바이오센서, 섬광 근접 검정(scintillation proximity assay), ELISA, ORIGEN 면역검정법(IGEN Inc.), 유세포분석, 형광 소광(fluorescence quenching), 형광 전이(fluorescence transition), 효모 디스플레이 또는 면역염색 등을 이용하여 측정될 수 있으나, 이들로 한정되는 것은 아니다. Myl9와 CD69 사이의 결합에 대한 항체 또는 이의 항원 결합 단편의 중화 활성은 Biacore® 바이오센서, ELISA 또는 유세포분석 등에 의해 측정될 수 있으나, 이들로 한정되는 것은 아니다.
본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편은 바람직하게는, Myl9, 또는 상기 항체에 대한 Myl9의 결합 영역의 아미노산 서열을 가진 다른 펩타이드 분자에 결합하는 모노클로날 항체, 폴리클로날 항체 또는 이의 Myl9 결합 단편 중 임의의 것일 수 있다.
본원에서 모노클로날 항체는 실질적으로 균일한 항체들의 집단으로부터 수득되는 항체를 의미할 수 있다. 즉, 상기 집단에 함유되는 개별 항체는, 존재할 수 있는 약간의 양의 천연적으로 존재하는 돌연변이체를 제외하고는 동일하다. 모노클로날 항체는 단일 항원 부위에 대한 것이다. 나아가, 상이한 항원들 또는 상이한 에피토프들을 표적화하는 전형적인 폴리클로날 항체와는 대조적으로, 각각의 모노클로날 항체는 항원의 단일 에피토프를 표적화한다. 수식어 "모노클로날"은 실질적으로 균일한 항체 집단으로부터 수득되는 항체의 특성을 가리키고, 특정한 방법에 의한 항체의 생성의 요구로 한정되는 것으로 이해되어서는 안된다.
본원에서 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편은 임의의 부류, 예컨대 IgG, IgA 또는 IgM(또는 이의 하위부류)일 수 있고, 특정 부류로 한정되지 않는다. 면역글로불린은 중쇄(이따금 H 사슬로 지칭됨)의 불변 영역의 항체 아미노산 서열에 따라 상이한 부류들로 분류된다. 5가지 주요 면역글로불린 부류들: IgA, IgD, IgE, IgG 및 IgM이 존재하고, 이들 중 일부는 IgG1, IgG2, IgG3, IgG4, IgA1 및 IgA2와 같이 하위부류(이소타입)로 더 하위구분될 수 있다. 상이한 부류의 면역글로불린들에 상응하는 중쇄의 불변 영역은 각각 α, δ, ε, γ 및 μ로 지칭된다. 더욱이, 항체의 경쇄(이따금 L 사슬로 지칭됨)의 유형은 λ 및 κ 사슬을 포함한다.
일 양태에서, 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편은 IgG 항체, 예를 들어 IgG1 항체 또는 IgG2 항체 등일 수 있다. 더욱이, 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편은 단량체, 이량체 또는 다량체 형태일 수 있다.
본원에서 Myl9 결합 단편은 항-Myl9 항체의 기능적이며 구조적인 단편이고, Myl9에 대한 결합 능력을 갖고 있는 한 특정하게 한정되지 않는다. 이러한 Myl9 결합 단편의 예로는, Fab, Fab', F(ab')2, Fv, 단쇄(scFv), 이의 변이체, 항체 부분을 포함하는 융합 단백질 또는 융합 펩타이드, Myl9 인지 부위를 포함하는 면역글로불린 분자의 다른 변형된 구조물 등이 있을 수 있으나, 이들로 한정되는 것은 아니다.
항-Myl9 항체의 Myl9 결합 단편은 예를 들어 파파인 또는 펩신과 같은 프로테아제에 의한 완전 항체의 단백분해성 절단을 통해 수득될 수 있거나, 재조합 숙주 세포(예를 들어 진핵생물, 예컨대 효모 세포, 식물 세포, 곤충 세포 또는 포유류 세포, 또는 원핵생물, 예컨대 이. 콜라이)에 의해 직접적으로 생성될 수 있다. 예를 들어, F(ab')2 단편은 이. 콜라이로부터 Fab'-SH 단편들을 직접적으로 수합하고 이들 단편을 화학적 결합 처리함으로써 직접적으로 형성될 수 있다. F(ab')2는 F(ab')2 분자의 어셈블리를 촉진하는 루신 지퍼 GCN4를 사용함으로써 형성될 수도 있다. 더욱이, scFv가 화학적 합성 기술에 의해 생성되는 경우 자동 합성기가 사용될 수 있다. scFv가 유전적 재조합 기술에 의해 생성되는 경우, scFv를 인코딩하는 폴리뉴클레오타이드를 포함하는 적절한 플라스미드가 적절한 숙주 세포(예를 들어 진핵생물, 예컨대 효모 세포, 식물 세포, 곤충 세포 또는 포유류 세포, 또는 원핵생물, 예컨대 이. 콜라이) 내로 도입될 수 있다. 관심 scFv를 인코딩하는 폴리뉴클레오타이드는 폴리뉴클레오타이드 연결과 같은 잘 공지된 작업에 의해 생성될 수 있다. 그 결과 생성된 scFv는 당업계에 잘 공지된 표준 단백질 정제 기술을 사용하여 단리될 수 있다.
본원에서 항체의 가변 영역은 항체 경쇄의 가변 영역, 항체 중쇄의 가변 영역 또는 둘 다를 의미한다. 더욱이, 본원에서 항체의 불변 영역은 항체 경쇄의 불변 영역, 항체 중쇄의 불변 영역 또는 둘 다를 의미한다. 중쇄 및 경쇄의 가변 영역은 각각, 초가변 영역으로도 공지된 3개의 CDR들에 의해 연결된 4개의 골격 영역(FR)들로 구성된다. 각각의 사슬 내 CDR은 FR 부근에 보유되고, 다른 사슬 내의 CDR들과 함께 항체의 항원 결합 부위의 형성에 기여한다. CDR의 확인 기술로는 예를 들어, (1) 종간 서열 가변성을 기반으로 한 접근법(예컨대 문헌[Kabat et al, Sequences of Proteins of Immunological Interest, 5th ed., 1991], 미국 메릴랜드주 베세스다 소재의 국립보건원]); 및 (2) 항원-항체 복합체의 결정 구조 조사를 기반으로 한 접근법(문헌[Al-lazikani et al., 1997 J. Molec. Biol. 273:927-948]) 등이 있을 수 있으나, 이들로 한정되는 것은 아니다. 이들 또는 다른 접근법들을 조합하여 이용할 수 있다.
본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편은 재조합 항체(예컨대 키메라 항체, 인간화된 항체 또는 인간 항체) 또는 화학적으로 합성된 항체, 비-인간 포유류(예를 들어 마우스, 래트와 같은 설치류 또는 토끼, 원숭이, 소, 말, 염소 등) 항체 또는 이의 Myl9 결합 단편이다. 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편은 인간화된 항체 또는 키메라 항체, 바람직하게는 인간화된 항체이다. 키메라 항체는 예를 들어, 비-인간(예컨대 마우스 또는 래트) 항체의 가변 영역이 인간 항체의 불변 영역 내로 도입된 항체이고, 예를 들어 가변 영역이 비-인간 항체로부터 유래되고 불변 영역이 인간 항체로부터 유래된 항체를 지칭한다. 인간화된 항체는 예를 들어, 비-인간 항체의 초가변 영역이 인간 항체 내로 도입된 항체이고, 예를 들어 CDR이 비-인간 항체로부터 유래되고 잔여 항체 영역이 인간 항체로부터 유래된 항체를 지칭한다. 본 발명에서, 키메라 항체와 인간화된 항체 사이의 경계는 본질적으로 명확할 필요가 없으며, 항체는 키메라 항체 또는 인간화된 항체로 지칭될 수 있는 상태로 존재할 수 있음을 주지한다. 본원에서 바람직한 인간화된 항체의 일 양태는, CDR이 설치류 항체로부터 유래되고 잔여 항체 영역이 인간 항체로부터 유래되는 항체이며, 특히 바람직하게는 CDR이 마우스 항체로부터 유래되고 잔여 항체 영역이 인간 항체로부터 유래되는 항체이다. 인간화는 또한, 예를 들어 설치류의 항체로부터 유래된 CDR 서열을 인간 항체의 상응하는 부위 내로 CDR 그래프팅 방법(grafting method)을 이용하여 도입함으로써 수행될 수 있다(문헌[Jones et al., Nature 321:522-525(1986); Riechmann et al., Nature 332:323-327(1988); 및 Verhoeyen et al., Science 239:1534-1536(1988); Kontermann and Dubel, Antibody Engineering, Springer Lab Manual(2001) 및 Tsurushita et al., Methods 36:69-83(2005)] 참조). 일부 경우, 인간화된 항체는 또한, FR 내의 몇몇 아미노산 잔기들이 비-인간 항체 내의 유사한 부위로부터 유래된 아미노산 잔기에 의해 치환된 인간화된 항체일 수 있다.
항원성을 감소시키기 위해, 인간화된 항체의 생성에서 경쇄 및 중쇄 둘 다에 대해 인간 가변 영역의 사용이 선택되는 것이 중요할 수 있다. 마우스, 래트와 같은 설치류 또는 토끼 항체의 가변 영역의 아미노산 서열은 공지된 인간 FR 서열의 전체 라이브러리에 대해 스크리닝된다. 다음, 설치류 항체의 서열에 가장 근접한 인간 항체의 아미노산 서열은 인간화된 항체의 인간 FR로서 수용된다. 예를 들어, 문헌[O'Brien and Jones, Antibody Engineering(Springer Lab Manual), 567-590]이 참조로서 사용될 수 있다. 또 다른 방법에서, 경쇄 또는 중쇄의 특정 하위그룹에서 모든 인간 항체들에 보편적인 서열로부터 유래된 특정 골격이 이용된다. 동일한 골격이 몇몇 상이한 인간화된 항체들에 대해 이용될 수 있다. 예를 들어, 문헌[Carter et al., Proc. Natl. Acad. Sci. USA 89:4285-4289(1992)] 및 문헌[Presta et al., J. Immunol. 151:2623-2632(1993)]이 참조로서 사용될 수 있다.
나아가, 인간화된 항체는 일반적으로, 항원에 대한 높은 결합 친화성 및 다른 바람직한 생물학적 성질들을 보유하는 것이 바람직하다. 이러한 목적을 달성하기 위해, 일 방법에 따르면, 인간화된 항체는 부모 서열 및 인간화된 서열의 3차원 모델을 이용하여 부모 서열 및 다양한 개념적인 인간화된 생성물을 분석하는 단계에 의해 제조된다. 일반적으로, 3차원 면역글로불린 모델은 사용을 위해 입수 가능하고, 당업자에게 공지되어 있다. 선택된 후보 면역글로불린 서열의 잠재적인 3차원 구조를 예시하고 나타내는 컴퓨터 프로그램은 사용을 위해 입수 가능하다. 이들 예시된 3차원 구조들을 조사함으로써, 후보 면역글로불린이 이의 항원에 결합하는 능력에 영향을 미치는 아미노산 잔기의 분석이 가능하다. 이러한 방법에 의해, FR 잔기는, 단일 또는 다수의 표적 항원(들)(예컨대 Myl9 또는 이의 단편)에 대한 결합 친화성의 보유와 같은 바람직한 항체 특성이 달성되도록 디자인될 수 있다.
상기 예시된 키메라 항체 또는 인간화된 항체가 상기 항체의 기능을 보유하면서도(또는 상기 항체의 기능을 부가하거나 개선하기 위해) 적절하게 변경(예를 들어 항체의 변형, 또는 항체의 아미노산 서열의 부분적인 치환, 첨가 또는 결실)된 항체 또한, 본 발명의 항체에 포함된다. 구체적으로는, 항체-생성 세포에 의해 생성되는 항체의 불균일성을 감소시키기 위해 중쇄의 카르복시 말단(C-말단)에 위치한 라이신(Lys)이 인공적인 방법, 예컨대 유전적 변형에 의해 결실된 항체가 또한, 본 발명의 범위에 포함된다. 다른 부분적인 치환의 예로는, 중쇄 내 위치 234의 아미노산 잔기가 발린(V)으로부터 알라닌(A)으로 돌연변이화된 항체, 중쇄 내 위치 237의 아미노산 잔기가 글리신(G)으로부터 알라닌(A)으로 돌연변이화된 항체, 뿐만 아니라 이들의 조합 등이 포함될 수 있으나, 이들로 한정되는 것은 아니다. 상기 돌연변이는 본원에서 각각 V234A 및 G237A로 기재됨을 주지한다.
본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편은 요망되는 바와 같이 변형될 수 있다. 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편의 변형은 (a) 변형된 영역에서 아미노산 서열의 3차원 구조, 예컨대 병풍 또는 나선 구조; (b) 표적 부위에서 분자의 전하 또는 소수성 상태; 또는 (c) 측쇄 부피의 유지에 미치는 변형의 효과를 변화시키는 변형일 수 있거나, 대안적으로 이들 변화가 평이하게 관찰되지 않는 변형이 실시될 수 있다.
본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편의 변형은 구성하는 아미노산 잔기의 예를 들어 치환, 결실, 첨가 등에 의해 달성될 수 있다.
본원에서 아미노산은 이의 가장 광범위한 의미로 이용되고, 천연 아미노산, 예컨대 세린(Ser), 아스파라긴(Asn), 발린(Val), 루신(Leu), 이소루신(Ile), 알라닌(Ala), 티로신(Tyr), 글리신(Gly), 라이신(Lys), 아르기닌(Arg), 히스티딘(His), 아스파르트산(Asp), 글루탐산(Glu), 글루타민(Gln), 트레오닌(Thr), 시스테인(Cys), 메티오닌(Met), 페닐알라닌(Phe), 트립토판(Trp) 및 프롤린(Pro), 뿐만 아니라 비-천연 아미노산, 예컨대 아미노산 변이체 및 유도체 등을 포함한다. 당업자는 이러한 광범위한 정의의 측면에서, 본원에서 아미노산의 예들로는, L-아미노산; D-아미노산; 화학적으로 변형된 아미노산, 예컨대 아미노산 변이체 및 유도체; 생체내에서 단백질을 구성하는 물질이 아닌 아미노산, 예컨대 노르루신, β-알라닌 및 오르니틴; 및 당업자에게 잘 공지된 아미노산의 특성들을 가진 화학적으로 합성된 화합물 등이 있을 수 있음을 인지할 것이다. 비-천연 아미노산의 예로는, α-메틸아미노산(예컨대 α-메틸알라닌), D-아미노산(예컨대 D-아스파르트산 및 D-글루탐산), 히스티딘-유사 아미노산(예컨대 2-아미노-히스티딘, β-하이드록시-히스티딘, 호모히스티딘, α-플루오로메틸-히스티딘 및 α-메틸-히스티딘), 측쇄에 과량의 메틸렌을 갖는 아미노산(호모아미노산), 및 측쇄 내 카르복실레이트 관능기 아미노산이 설포네이트기(예컨대 시스테산)로 치환된 아미노산 등이 있을 수 있다.
천연 발생 아미노산 잔기는 예를 들어, 일반적인 측쇄 특성을 기반으로 하기 그룹들로 분류될 수 있다:
(1) 소수성: Met, Ala, Val, Leu 및 Ile;
(2) 중성 친수성: Cys, Ser 및 Thr;
(3) 산성: Asp 및 Glu;
(4) 염기성: Asn, Gln, His, Lys 및 Arg;
(5) 사슬 배향에 영향을 미치는 잔기: Gly 및 Pro; 및
(6) 방향족: Trp, Tyr 및 Phe.
항체 또는 이의 항원 결합 단편을 구성하는 아미노산 서열의 비보존적 치환은 이들 그룹 중 하나에 속하는 아미노산을 또 다른 그룹에 속하는 아미노산으로 교환함으로써 수행될 수 있다. 더 보존적인 치환은 이들 그룹 중 하나에 속하는 아미노산을 동일한 그룹에 속하는 또 다른 아미노산으로 교환함으로써 수행될 수 있다. 유사하게는, 아미노산 서열의 결실 또는 치환은 적절하게 수행될 수 있다.
항체 또는 이의 항원 결합 단편을 구성하는 아미노산의 변형은 예를 들어, 번역후 변형, 예컨대 당에 의한 글리코실화, 아세틸화 또는 인산화일 수 있다. 항체는 이러한 항체의 불변 영역 내 보존된 위치에서 글리코실화될 수 있다. 항체의 글리코실화는 N-연결 또는 O-연결된다. N-연결은 당 모이어티를 아스파라긴 잔기의 측쇄에 연결하는 것을 의미한다. 트리펩타이드 서열 아스파라긴-X-세린, 아스파라긴-X-트레오닌 및 아스파라긴-X-시스테인(여기서, X는 프롤린 이외의 임의의 아미노산임)은 당 모이어티를 아스파라긴 측쇄에 효소적으로 첨가하기 위한 인지 서열이다. 이들 트리펩타이드 서열 중 임의의 서열이 항체 또는 이의 항원 결합 단편에 존재하는 경우, 잠재적인 글리코실화 부위가 존재한다. O-연결된 글리코실화는 N-아세틸갈락토스아민, 갈락토스 또는 자일로스를 하이드록시 아미노산(예컨대 세린 또는 트레오닌)에 연결하는 것일 수 있고, 일부 경우 5-하이드록시 프롤린 또는 5-하이드록시 라이신에 연결하는 것일 수 있다. 글리코실화 조건(예를 들어 글리코실화가 생물학적 수단에 의해 수행되는 경우, 숙주 세포 또는 세포 배지의 유형, pH 등)은 목적에 따라 당업자에 의해 적절하게 선택될 수 있다.
본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편은 당업자에게 잘 공지된 기술적인 보편적인 의미를 기반으로 다른 변형 방법 단독 또는 조합에 의해 추가로 변형될 수 있다.
본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편은 당업자에게 잘 공지된 방법에 의해 생성될 수 있다. 예를 들어, 항체는 본 발명의 Myl9 항체 또는 이의 Myl9 결합 단편을 생성하는 하이브리도마를 이용하여 생성될 수 있거나, 항체는 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편을 인코딩하는 유전자를 발현 벡터 내로 통합시키고, 상기 발현 벡터를 이. 콜라이 세포, 원숭이 COS 세포, 차이니즈 햄스터 난소(CHO) 세포 등 내로 도입함으로써 생성될 수 있다. 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편을 인코딩하는 유전자는 바람직하게는 신호 서열을 인코딩하는 DNA를 가지고, 보다 바람직하게는 신호 서열을 인코딩하는 DNA를 중쇄 가변 영역을 인코딩하는 DNA 및 경쇄 가변 영역을 인코딩하는 DNA의 5' 말단에 가진다. 신호 서열은 단백질의 N-말단에 존재하는 아미노산 잔기로서, 분비 단백질 또는 내재막 단백질이 리보좀에서 합성된 후 지질 이중층을 통과하는 데 필요하다. 본원에서 신호 서열은, 이러한 기능을 갖고 있는 서열인 한 특별히 제한되지 않는다. 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편에 함유될 수 있는 신호 서열은 인간, 마우스, 래트, 토끼, 당나귀, 염소, 말, 조류, 개, 고양이, 효모 등으로부터 유래된 신호 서열을 포함할 수 있다. 신호 서열의 하나의 구체적인 양태는, SEQ ID NO. 12로 표시되는 아미노산 서열을 중쇄와 관련된 신호 서열로서 포함하는 펩타이드, 및 SEQ ID NO. 14로 표시되는 아미노산 서열을 경쇄와 관련된 신호 서열로서 포함하는 펩타이드를 포함할 수 있다. 더욱이, 하나 또는 다수의(예컨대 2, 3, 4 또는 5개의) 아미노산의 치환, 첨가 또는 결실은, 이것이 기능적으로 동등한 한, SEQ ID NO. 12로 표시되는 아미노산 서열 또는 SEQ ID NO. 14로 표시되는 아미노산 서열에 존재할 수 있다.
본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편은 당업자에게 잘 공지된 방법에 따라 단리되거나 정제되는 것들일 수 있다. 본원에서, "단리된" 또는 "정제된"은, 이것이 천연 상태로부터 인공적으로 단리되거나 정제되는 것을 의미한다. 분자 또는 조성물이 천연적으로 발생하는 경우, 이는, 이것이 원래 존재하는 환경으로부터 변하였거나 제거되거나 둘 다인 경우, "단리된" 또는 "정제된"인 것을 의미한다. 단리 또는 정제 방법의 예로는, 전기영동, 분자생물학적, 면역학적 또는 크로마토그래피 수단 등, 구체적으로는 이온 교환 크로마토그래피, 소수성 크로마토그래피, 역상 HPLC 크로마토그래피 또는 등전집초법(isoelectric focusing) 등이 있을 수 있으나, 이들로 한정되는 것은 아니다.
본원에서 "면역 체크포인트 저해제"는, T 세포 활성화를 억제하기 위한 시스템인 면역 체크포인트 메커니즘에 참여하는 면역 체크포인트 분자에 대한 저해제를 의미하고, PD-1 저해제 및 CTLA-4 저해제를 포함한다. 용어 "면역 체크포인트 분자"는 면역 체크포인트로서 작용하는 수용체 및 리간드를 둘 다 포함한다.
본원에서 용어 "면역 체크포인트 저해제와 조합하여 사용되는"은, 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편 및 약제학적으로 허용 가능한 담체 또는 첨가제를 포함하는 약제학적 조성물이 치료 계획의 일부로서 면역 체크포인트 저해제와 함께 거의 동시에, 종양을 가진 환자에게 투여되는 것을 의미한다. 약제학적 조성물 및 면역 체크포인트 저해제는 조합되어 투여되는 경우 각각의 유효량으로 동시에, 개별적으로, 연속적으로 또는 동일한 간격으로 환자에게 투여될 수 있다. 치료 계획은 또 다른 항암제를 포함할 수 있다. 약제학적 조성물 및 면역 체크포인트 저해제는 개별 투여 사이클로 환자에게 투여될 수 있다. 약제학적 조성물 및 면역 체크포인트 저해제가 동시에 투여되는 경우, 이들을 포함하는 단일 조합 조제물이 투여될 수 있다.
본원에서 "PD-1 저해제"는 PD-1의 T 세포 억제 작용을 저해하기 위해 PD-1에 직접적으로 또는 간접적으로 작용하는 성분을 의미한다. PD-1 저해제는, PD-1의 T 세포 억제 작용을 저해하기 위해 PD-1에 결합하는 저분자 화합물, 펩타이드 및 항-PD-1 항체, 뿐만 아니라 PD-1의 T 세포 억제 작용을 저해하기 위해 PD-L1에 결합하고 이의 PD-1 결합 활성을 저해하는 저분자 화합물, 펩타이드 및 항-PD-L1 항체를 포함한다. 항-PD-1 항체로는, 펨브롤리주맙(pembrolizumab), 니볼루맙(nivolumab) 및 MEDI0680(AMP-514) 등이 있으나 이들로 한정되는 것은 아니다. 항-PD-L1 항체로는, 아테졸리주맙(atezolizumab), 두르발루맙(durvalumab) 및 아벨루맙(avelumab) 등이 있으나 이들로 한정되는 것은 아니다.
본원에서 "CTLA-4 저해제"는, CTLA-4의 T 세포 억제 작용을 저해하기 위해 CTLA-4에 작용하는 성분을 의미한다. CTLA-4 저해제로는, CTLA-4의 T 세포 억제 작용을 저해하기 위해 CTLA-4에 결합하는 저분자 화합물, 펩타이드 및 항-CTLA-4 항체가 있다. 항-CTLA-4 항체로는, 이필리무맙(ipilimumab) 및 트레멜리무맙(tremelimumab) 등이 있으나 이들로 한정되는 것은 아니다.
본원에서 "악성 림프종"은 림프 조직으로부터 발병하는 혈액 악성 종양 그룹을 의미한다. 악성 림프종으로는 호지킨 림프종 및 비호지킨 림프종 등이 있고, 비호지킨 림프종으로는 광범위 큰(diffuse large) B-세포 림프종 등이 있다.
본원에서 "두경부암"은 얼굴부터 목까지의 영역에서 발병하는 일반적인 악성 종양을 의미하고, 두경부의 편평세포암을 일부로서 포함한다.
본원에서 "요로상피암"은 요로상피 세포로부터 발병하는 상피 악성 종양을 의미하고, 더 좁은 용어로서 신우요관암(renal pelvic cancer), 요로암 및 방광암을 포함한다.
본원에서 "유방암"은 유방 조직에서 발병하는 암종을 의미한다. 유방암의 일부는 에스트로겐 수용체, 프로게스테론 수용체 및 인간 표피 성장 인자 수용체 2(HER-2)를 발현하지 않는 삼중 음성 유방암(triple negative breast cancer)이다.
본 발명의 또 다른 바람직한 실시형태에서, 항-Myl9 항체 또는 이의 Myl9 결합 단편은 하기 CDR을 가진다:
(a) SEQ ID NO. 28로 제시된 아미노산 서열로 표시되는 펩타이드로 구성된 중쇄 CDR1;
(b) SEQ ID NO. 30으로 제시된 아미노산 서열로 표시되는 펩타이드로 구성된 중쇄 CDR2;
(c) SEQ ID NO. 32로 제시된 아미노산 서열로 표시되는 펩타이드로 구성된 중쇄 CDR3;
(d) SEQ ID NO. 33으로 제시된 아미노산 서열로 표시되는 펩타이드로 구성된 경쇄 CDR1;
(e) SEQ ID NO. 34로 제시된 아미노산 서열로 표시되는 펩타이드로 구성된 경쇄 CDR2; 및
(f) SEQ ID NO. 35로 제시된 아미노산 서열로 표시되는 펩타이드로 구성된 경쇄 CDR3.
본 발명의 또 다른 바람직한 실시형태에서, 항-Myl9 항체 또는 이의 Myl9 결합 단편은 중쇄 및 경쇄를 포함하며, 상기 중쇄의 가변 영역은 SEQ ID NO. 55, 56, 57, 58, 59, 60, 61, 62, 63 또는 64로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하고, 상기 경쇄의 가변 영역은 SEQ ID NO. 65, 66, 67 또는 68로 제시된 아미노산 서열로 표시되는 펩타이드를 포함한다.
상기 중쇄 또는 경쇄의 가변 영역의 아미노산 서열은 상기 서열 내에 하나 또는 다수의 아미노산의 치환, 첨가 또는 결실을 포함할 수 있다. 본원에 사용된 바와 같이 "다수의"는, Myl9에 대한 결합 친화성이 보유되고 Myl9와 CD69 사이의 상호작용이 저해되는 한 한정되지 않으며, 2 내지 15, 보다 바람직하게는 2 내지 10, 예를 들어 9, 8, 7, 6, 5, 4, 3 또는 2이다. 대안적으로, 상기 중쇄 또는 경쇄의 가변 영역의 아미노산 서열은, 상기 서열과 적어도 90%, 예를 들어 91%, 92%, 93%, 94% 또는 95% 상동성을 가진 아미노산 서열로 표시되는 펩타이드를 포함한다.
본 발명의 또 다른 바람직한 실시형태에서, 항-Myl9 항체 또는 이의 Myl9 결합 단편은 하기 조합들로 구성된 중쇄 및 경쇄 가변 영역들을 포함하는 항체이다:
(1) SEQ ID NO. 64로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 66으로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체;
(2) SEQ ID NO. 63으로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 66으로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체;
(3) SEQ ID NO. 56으로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 66으로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체;
(4) SEQ ID NO. 57로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 66으로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체;
(5) SEQ ID NO. 55로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 66으로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체;
(6) SEQ ID NO. 58로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 66으로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체;
(7) SEQ ID NO. 59로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 66으로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체;
(8) SEQ ID NO. 60으로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 66으로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체;
(9) SEQ ID NO. 61로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 66으로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체;
(10) SEQ ID NO. 64로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 68로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체;
(11) SEQ ID NO. 63으로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 68로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체;
(12) SEQ ID NO. 56으로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 68로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체;
(13) SEQ ID NO. 57로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 68로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체;
(14) SEQ ID NO. 55로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 68로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체;
(15) SEQ ID NO. 58로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 68로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체;
(16) SEQ ID NO. 59로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 68로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체;
(17) SEQ ID NO. 60으로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 68로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체;
(18) SEQ ID NO. 61로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 68로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체;
(19) SEQ ID NO. 62로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 65로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체;
(20) SEQ ID NO. 62로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 67로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체;
(21) SEQ ID NO. 62로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 66으로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체; 및
(22) SEQ ID NO. 62로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 중쇄 가변 영역 및 SEQ ID NO. 68로 제시된 아미노산 서열로 표시되는 펩타이드를 포함하는 경쇄 가변 영역을 포함하는 항체.
일 양태에서, 본 발명은 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편을 포함하는 약제학적 조성물에 관한 것이다.
본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편을 수성 또는 건성 조제물 형태에 포함하는 약제학적 조성물은 약제학적으로 허용 가능한 담체, 부형제 및/또는 안정화제를 추가로 포함할 수 있다. 허용 가능한 담체, 부형제 또는 안정화제의 예로는, 식염수; 완충제, 예컨대 인산, 시트르산 또는 다른 유기 산; 아스코르브산을 포함하는 항산화제; 저분자량 폴리펩타이드; 단백질(예컨대 혈청 알부민, 젤라틴 또는 면역글로불린); 친수성 중합체, 예컨대 폴리비닐피롤리돈; 아미노산; 글루코스, 만노스 또는 덱스트린을 포함하는 단당류, 이당류 및 다른 탄수화물; 킬레이트제, 예컨대 EDTA; 당 알코올, 예컨대 만니톨 또는 소르비톨; 염을 형성하는 반대 이온, 예컨대 나트륨; 또는 비이온성 계면활성제, 예컨대 TWEENTM, PLURONICSTM 또는 PEG 등이 있다.
본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편을 포함하는 약제학적 조성물은 예를 들어, 마이크로캡슐, 콜로이드성 약물 전달 시스템(예컨대 리포좀, 알부민 마이크로스피어, 마이크로에멀젼, 나노입자 또는 나노캡슐) 또는 마크로에멀젼에서 캡슐화될 수 있다. 항체의 서방성 투여가, 항체의 투여를 필요로 하는 임의의 질병에 적합한 방출 특성을 가진 조제물에 요망되는 경우, 항체의 마이크로캡슐화가 의도될 수 있다. 서방성 매트릭스의 예로는, 폴리에스테르, 하이드로겔(예컨대 폴리(2-하이드록시에틸-메타크릴레이트) 또는 폴리(비닐 알코올)), 폴리락트산, L-글루탐산과 γ 에틸-L-글루타메이트의 공중합체, 비분해 가능한 에틸렌-비닐 아세테이트, 분해 가능한 락트산-글리콜산 공중합체, 예컨대 LUPRON DEPOTTM(락트산-글리콜산 공중합체 및 류프롤라이드 아세테이트로 구성된 주사 가능한 마이크로스피어) 및 폴리-D-(-)-3-하이드록시 부티르산 등이 있다.
상기 기재된 바와 같이, 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편은 Myl9와 CD69 사이의 상호작용을 저해할 수 있다. 이에, 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편을 포함하는 약제학적 조성물은 Myl9와 CD69 사이의 상호작용으로 인한 질병, 예를 들어 알레르기성 기도 염증, 예컨대 천식, 만성 알레르기 비염, 또는 일부 부비동염, 기도 염증 질병, 예컨대 알레르기성 기도 염증에 포함되지 않는 부비동염, 및 염증성 장질환, 예컨대 궤양성 대장염, 크론병, 베체트병 및 호산구 위장 기능 장애의 치료에 유용할 수 있다. 즉, 또 다른 양태에서, 본 발명은 치료적 유효량의 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편을 피험자에게 투여하는 단계를 포함하는, 기도 염증 질병 또는 염증성 장질환의 치료 방법을 포함한다. 나아가 또 다른 양태에서, 본 발명은 기도 염증 질병 또는 염증성 장질환 치료용 약물의 제조를 위한 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편의 용도를 포함한다. 또 다른 양태에서, 본 발명은 기도 염증 질병 또는 염증성 장질환의 치료 방법에 사용하기 위한 항-Myl9 항체 또는 이의 Myl9 결합 단편을 포함한다. 더욱이 또 다른 양태에서, 본 발명은 기도 염증 질병 또는 염증성 장질환 치료를 위한 약제의 제조를 위한 항-Myl9 항체 또는 이의 Myl9 결합 단편을 포함한다.
본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편을 포함하는 약제학적 조성물은 면역 체크포인트 저해제와 조합된 경우 종양, 예컨대 결장직장암, 악성 흑색종, 비소세포폐암, 신세포암종, 악성 림프종, 다발성 골수종, 두경부암, 요로상피암, 유방암, 간세포암종, 위암, 식도암, 난소암, 소세포폐암, 중피종 및 자궁내막암의 치료에 유용할 수 있다. 즉 또 다른 양태에서, 본 발명은 치료적 유효량의 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편을 피험자에게 투여하는 단계를 포함하는 종양 치료 방법을 포함하며, 여기서, 항-Myl9 항체 또는 이의 Myl9 결합 단편은 면역 체크포인트 저해제와 조합하여 피험자에게 투여된다. 나아가 또 다른 양태에서, 본 발명은 면역 체크포인트 저해제와 조합하여 사용되는, 종양 치료용 약물의 제조를 위한 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편의 용도를 포함한다. 또 다른 양태에서, 본 발명은 면역 체크포인트 저해제와 조합하여 투여되는, 종양 치료 방법에 사용되기 위한 항-Myl9 항체 또는 이의 Myl9 결합 단편을 포함한다. 더욱이 또 다른 양태에서, 본 발명은 면역 체크포인트 저해제와 조합하여 사용되는, 종양 치료를 위한 약제의 제조를 위한 항-Myl9 항체 또는 이의 Myl9 결합 단편을 포함한다.
본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편을 포함하는 약제학적 조성물이 종양 치료를 위해 면역 체크포인트 저해제와 조합하여 사용되는 경우, 항-Myl9 항체 또는 이의 Myl9 결합 단편은 바람직하게는, Myl12a 및/또는 Myl12b 및 CD69 사이의 상호작용을 또한 저해하는 항체 또는 이의 결합 단편이다.
본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편은 치료 방법에 단독으로 또는 다른 제제 또는 조성물과 조합하여 이용될 수 있다(종양 치료 방법에서, 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편은 면역 체크포인트 저해제와 조합하여 투여됨). 예를 들어, 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편은 또 다른 제제와 동시에 또는 상이한 시점에 투여될 수 있다. 이러한 조합 요법은 조합된 투여(2개 이상의 제제들이 동일한 조제물 또는 개별 조제물에 함유됨) 및 개별 투여(예를 들어 동시에 또는 순차적으로)를 포함한다. 2개 이상의 제제들이 개별적으로 투여되는 경우, 본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편의 투여는 수반되는 치료 방법 이전에 또는 이후에 수행될 수 있다.
본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편을 포함하는 약제학적 조성물이 투여되는 피험자는 한정되지 않고, 본 발명은 인간 또는 비-인간 포유류(마우스, 래트와 같은 설치류 또는 토끼, 원숭이, 소, 말, 염소 등)에 이용된다.
본 발명의 항-Myl9 항체 또는 이의 Myl9 결합 단편을 포함하는 약제학적 조성물을 피험자에게 투여하는 방법(예컨대 투여 경로, 용량, 1일 당 투여 빈도 및 투여 시점)은 한정되지 않고, 피험자의 건강 상태, 질병의 정도, 조합하여 사용되는 제제의 유형 등에 따라 당업자(예컨대 의사)에 의해 적절하게 결정될 수 있다.
본원에 기재된 임의의 및 모든 양태들 중 임의의 하나 이상의 양태는 기술적으로 상충되지 않는 한, 본 발명을 수행하기 위해 적절하게 조합될 수 있다. 나아가, 본원에 기재된 임의의 및 모든 바람직하거나 유리한 양태들은 기술적으로 상충되지 않는 한, 본 발명을 수행하기 위해 적절하게 조합되는 것이 바람직해야 한다.
본원에 인용된 문헌들의 모든 개시내용들은 원용에 의해 본 명세서에 명백하게 포함되는 것으로 여겨져야 하고, 당업자는 이들 문헌과 관련하여 개시된 내용을 본 발명의 범위로부터 벗어나지 않으면서 본원의 맥락에 따라 본 명세서의 일부로서 포함할 수 있다.
본원에 인용된 문헌들은 본 출원의 출원일을 선행하는 관련된 기술을 개시하기 위해서만 제공되고, 본 발명이 선행 발명으로 인해 또는 임의의 다른 이유에서 상기 개시내용을 선행하기 위한 권리를 갖지 않음을 본 발명자들이 인정하는 것으로 간주되어서는 안 된다. 이들 문헌들의 모든 상세한 설명은 본 출원인들에게 입수 가능한 정보를 기반으로 하고, 이들 상세한 설명이 옳다는 인정을 임의의 방식으로 설정하는 것이 아니다.
본원에 사용된 용어들은 특정한 실시형태를 기재하기 위해 이용되었고, 본 발명을 제한하려는 것이 아니다.
문맥상 명확하게 다르게 이해될 것을 가리키지 않는 한, 본원에 사용된 바와 같이 용어 "포함하다"는 기재된 항목(예컨대 구성성분, 단계, 요소 또는 숫자)의 존재를 의도하고, 다른 항목(예컨대 구성성분, 단계, 요소 및 숫자)의 존재를 배제하지 않는다. 용어 "구성되다"는 용어 "구성된다" 및/또는 "본질적으로 구성된다"에 의해 기재된 양태들을 포함한다.
본원에 사용된 바와 같이 용어 "중화 활성"은, Myl9와 CD69 사이의 결합을 저해하기 위한 활성, 및/또는 Myl9와 CD69 사이의 상호작용으로 인해 인체 내에서 유도되는 세포의 신호 전달, 분자 발현 반응 또는 기능성 변화를 낮추기 위한 활성을 의미한다.
다르게 정의되지 않는 한, 본원에 사용되는 모든 용어들(기술적 용어 및 과학적 용어를 포함함)은 본 발명이 속한 기술 분야의 당업자에게 광범위하게 인지되는 것과 동일한 의미를 가진다. 본원에 사용되는 용어는 다르게 명시적으로 정의되지 않는 한, 본원 및 관련된 기술 분야에서의 의미와 일관되는 의미를 갖는 것으로 간주되어야 하고, 이상화되거나(idealized) 과도하게 형식적인 의미를 갖는 것으로 간주되어서는 안된다.
제1 및 제2와 같은 용어들은 다양한 요소들을 표시하기 위해 이용되고, 이들 요소가 이들 용어 자체에 의해 한정되어서는 안된다는 것이 인지되어야 한다. 이들 용어는 하나의 요소를 다른 요소로부터 구별하기 위해서만 이용되고, 예를 들어 본 발명의 범위로부터 벗어나지 않으면서 제1 요소를 제2 요소로서 기재하고, 유사하게는 제2 요소를 제1 요소로서 기재하는 것이 가능하다.
구성성분 함량 또는 수치 범위 등을 가리키기 위해 본원에 이용되는 수치는 명시적으로 가리키지 않는 한, 용어 "약"에 의해 수식되는 것으로 이해되어야 한다. 예를 들어, 명시적으로 가리키지 않는 한, "4℃"는 "약 4℃"를 의미하는 것으로 인지되고, 당업자는 기술적인 보편적인 의미 및 본 명세서의 맥락에 따라 이의 정도를 자연적이고 합리적으로 인지할 수 있다.
문맥상 명확하게 다르게 의미하지 않는 한, 본원의 명세서 및 청구항에 사용되는 경우, 단수형으로 표시된 각각의 양태는 이것이 기술적으로 상충하지 않는 한 복수형일 수도 있으며, 그 반대이기도 한다는 것이 인지되어야 한다.
이제, 본 발명은 실시예를 참조로 하여 보다 상세히 기재될 것이다. 그러나, 본 발명은 다양한 양태들에 의해 구현될 수 있고, 본원에 기재된 실시예로 한정되는 것으로 간주되어서는 안된다. 관련된 기술 분야의 당업자는 본 발명의 범위를 변경하지 않으면서 다양한 변형, 첨가, 결실, 치환 등을 포함한 본 발명을 실시할 수 있다.
실시예
실시예 1: 항-마우스/인간 Myl9 모노클로날 항체의 생성
마우스 항-마우스/인간 Myl9 모노클로날 항체의 생성
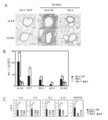
마우스 Myl9(Genbank 등록 번호 NP_742116.1, SEQ ID NO. 1) 및 인간 Myl9(Genbank 등록 번호 NP_006088.2, SEQ ID NO. 2)에 대한 모노클로날 항체를 생성하기 위해, 마우스 Myl9 및 인간 Myl9(위치 1 내지 27)에 보편적인 N-말단 서열의 C-말단에 첨가된 시스테인(Cys)을 가진 펩타이드(이하 마우스/인간 Myl9 펩타이드로서 지칭됨)(SEQ ID NO. 3) 및 이에 융합된 키홀 림펫 헤모시아닌(KLH; keyhole limpet hemocyanin)을 가진 단백질(이하 "마우스/인간 Myl9 펩타이드-KLH"로 지칭됨)을 하기 단계들에 의해 제조하였다. 마우스 Myl9 및 인간 Myl9 서열의 비교를 도 1a의 A에 나타낸다.
우선, 마우스/인간 Myl9 펩타이드(SEQ ID NO. 3)를 TORAY Research Center, Inc사에 위탁함으로써 합성하였고, 마우스/인간 Myl9 펩타이드-KLH를 임젝트(Imject) 말레이미드-활성화된 mcKLH 스핀 키트(Thermo Fisher Scientific사)를 이용하여 생성하였다.
10 ㎍의 마우스/인간 Myl9 펩타이드-KLH를 동일한 양의 GERBU 보조제(GERBU Biotechnik GmbH사)와 함께 혼합하고, C57BL/6J 마우스의 발바닥에 피하 주사하였다. 그런 다음, 마우스/인간 Myl9 펩타이드-KLH를 제3일, 제7일 및 제10일에 유사하게 투여하였다. GERBU 보조제(GERBU Biotechnik GmbH사)를 제3일 및 제10일에 사용하였다. 마우스를 제13일에 안락사시키고, 말초 림프절을 수합하여 림프절 세포를 제조하였다. GenomeONE-CF(Ishihara Sangyo Kaisha, Ltd사)의 존재 하에, 림프절 세포를 제조하고, P3U1 골수종 세포(교토 대학교 준 시미주(Jun Shimizu) 교수로부터 기부받았음)를 5:1의 비율로 융합하였다. 상기 융합된 세포를 96-웰 플라스틱 플레이트에서 배양하였다. 7일간의 인큐베이션(5% CO2, 37℃) 후, 배양 상층액을 수합하였다.
수득된 배양 상층액을 이용하여, 마우스/인간 Myl9 펩타이드에 대한 반응성, 뿐만 아니라 마우스 CD69 세포외 영역 단백질과 마우스 Myl9 사이의 결합에 대해 저해 활성을 가진 웰을 골라내었다.
마우스/인간 Myl9 펩타이드에 대한 반응성을, 마우스/인간 Myl9 펩타이드(SEQ ID NO. 3)에 융합된 소 혈청 알부민(BSA)을 가진 단백질(이하 마우스/인간 Myl9 펩타이드-BSA)을 이용하여 ELISA에 의해 평가하였다.
마우스/인간 Myl9 펩타이드(SEQ ID NO. 3)를 TORAY Research Center, Inc사에 위탁함으로써 합성하고, 마우스/인간 Myl9 펩타이드-BSA를 임젝트 말레이미드-활성화된 BSA 스핀 키트(Thermo Fisher Scientific사)를 이용하여 생성하였다.
N-말단에 첨가된 Flag 태그를 가진 마우스 CD69 세포외 영역 단백질(위치 62-199)(SEQ ID NO. 4)을 인코딩하는 플라스미드(이하 3 x Flag-마우스 CD69 EC)를 치바 대학교로부터 기부받았고, 이 플라스미드를 ExpiFectamine 293 형질감염 키트(Thermo Fisher Scientific/Gibco사)를 이용하여 Expi293F 세포(Invitrogen/LifeTechnologies사) 내로 형질감염시켰다. 4일간의 인큐베이션(8% CO2, 37℃) 후, 배양 상층액을 수합하였다. 수합된 배양 상층액으로부터, 3 x Flag-마우스 CD69 EC를, 항-Flag M2 친화성 겔(SIGMA사)을 이용하여 정제하였다. 정제 후, 당 사슬 절단 처리를, PNGase F(New England BioLabs)를 이용하여 수행하였다.
글루타티온-S-트랜스퍼라제(GST)-His-마우스 Myl9(이하 GST-His 마우스 Myl9)의 경우, 치바 대학교로부터 기부받은 플라스미드를 이. 콜라이 BL21-Gold(DE3) pLys(Agilent Technologies사)에서 발현시키고, 글루타티온 세파로스 4 패스트 플로우(Fast Flow)(GE Healthcare사)를 이용하여 정제하였다.
마우스/인간 Myl9 펩타이드-BSA를 이용하는 ELISA를 하기 단계들에 따라 수행하였다. 마우스/인간 Myl9 펩타이드-BSA를 96-웰 플레이트(Nunc사)의 웰 상으로 코팅하였다. 4℃에서 밤새 인큐베이션한 후, 웰들을 1 x 블록 에이스(Block Ace)(DS Pharma Biomedical Co., Ltd사)를 이용하여 실온에서 1시간 동안 블로킹시켰다. 0.02% Tween 20/PBS를 이용하여 3회 세척한 후, 상기 융합된 세포의 배양 상층액을 웰에 첨가하였다. 실온에서 1시간 동안 인큐베이션하고 3회 세척한 후, 호스래디쉬 퍼옥시다제-표지된 항-마우스 IgG 항체(Jackson ImmunoResearch Laboratories사)를 첨가하고, 이를 실온에서 1시간 동안 인큐베이션하였다. 5회 세척한 후, TMBZ(3,3',5,5'-테트라메틸벤지딘) 용액을 웰에 첨가하고, 이를 실온에서 5분 내지 20분 동안 인큐베이션하였다. 동일한 양의 반응 소광 용액(2 N H2SO4)을 웰에 첨가하고, 450 nm에서의 흡광도를 마이크로플레이트 판독기(PerkinElmer사)를 이용하여 판독하였다.
마우스 CD69 세포외 영역 단백질과 마우스 Myl9 사이의 결합에 대한 저해 활성의 평가를 하기 단계들에 따라 수행하였다. GST-His-마우스 Myl9를 96-웰 플레이트(Nunc사)의 웰 상으로 코팅하였다. 4℃에서 밤새 인큐베이션한 후, 웰들을 1 x 블록 에이스(DS Pharma Biomedical Co., Ltd사)를 이용하여 실온에서 1시간 동안 블로킹시켰다. 0.02% Tween 20/PBS를 이용하여 3회 세척한 후, 상기 융합된 세포의 배양 상층액을 웰에 첨가하였다. 이를 실온에서 1시간 동안 인큐베이션하였다. 당 사슬 절단 처리를 받은 3 x Flag-마우스 CD69 EC를 웰에 첨가하였다. 실온에서 1시간 동안 인큐베이션하고 3회 세척한 후, 호스래디쉬 퍼옥시다제-표지된 항-Flag 항체(SIGMA사)를 첨가하고, 이를 실온에서 1시간 동안 인큐베이션하였다. 5회 세척한 후, TMBZ(3,3',5,5'-테트라메틸벤지딘) 용액을 웰에 첨가하고, 이를 실온에서 5분 내지 20분 동안 인큐베이션하였다. 동일한 양의 반응 소광 용액(2 N H2SO4)를 웰에 첨가하고, 450 nm에서의 흡광도를 마이크로플레이트 판독기(PerkinElmer사)를 이용하여 판독하였다.
하이브리도마를, 마우스/인간 Myl9 펩타이드에 대한 반응 활성뿐만 아니라 마우스 CD69 세포외 영역 단백질과 마우스 Myl9 사이의 결합에 대한 저해 활성을 가진 마우스 항-마우스/인간 Myl9 항체를 발현하는 하이브리도마 클론을 궁극적으로 수득하기 위해 희석 방법을 한정함으로써 상기 단계들을 통해 골라낸 웰들로부터 클로닝하였다.
수득된 하이브리도마 클론을 배양하고, 항-마우스/인간 Myl9 항체("항체 A"(이따금 "mAb A"로 기재됨))를 단백질 A(GE Healthcare사)를 이용하여 배양 상층액으로부터 정제하였다. 항체 A 이소타입은 모노클로날 항체 이소타이핑 키트(Serotec)를 이용하여 IgG2c, κ인 것으로 확인되었다.
마우스/인간 Myl9 단백질에 대한 항체 A의 결합 능력의 분석
마우스 및 인간 Myl9에 대한 항체 A의 결합 능력을 ELISA에 의해 평가하였다. 하기 단계들에 따라, 마우스 Myl3(Genbank 등록 번호 NP_034989.1, SEQ ID NO. 5), 마우스 Myl9, 인간 Myl3(Genbank 등록 번호 NP_000249.1, SEQ ID NO. 6) 및 인간 Myl9의 각각의 C-말단에 결합된 히스티딘 태그를 가진 단백질들(이하 각각 마우스 Myl3-His, 마우스 Myl9-His, 인간 Myl3-His 및 인간 Myl9-His로 지칭됨)을 생성하였다. 마우스 Myl3과 인간 Myl3(도 1a의 B), 마우스 Myl3과 마우스 Myl9(도 1b의 C), 뿐만 아니라 인간 Myl3과 인간 Myl9(도 1b의 D) 사이의 아미노산 서열의 비교를 나타낸다.
마우스 Myl3 및 마우스 Myl9 단백질을 인코딩하는 유전자들을 치바 대학교로 부터 기부받았다. 인간 Myl3 및 인간 Myl9 단백질을 인코딩하는 유전자들을 인간 심장 cDNA로부터 PCR에 의해 증폭시켰다. 이들 유전자를, 삽입된 PreScission 프로테아제(GE Healthcare사)의 절단 서열을 인코딩하는 유전자를 가진 pET42b 벡터(Merck)의 BglII/BamHI 부위 내로 삽입하였다. 생성된 벡터를 이. 콜라이 균주 BL21-Gold(DE3) pLys(Agilent Technologies사) 내로 형질변환시켜, GST 태그가 부착된 마우스 Myl3-His, 마우스 Myl9-His, 인간 Myl3-His 및 인간 Myl9-His의 발현을 허용하였다. 발현된 단백질을 글루타티온 세파로스 4 패스트 플로우(GE Healthcare사)에 의해 정제하고, GST 태그를 PreScission 프로테아제에 의해 절단하고, 마우스 Myl3-His, 마우스 Myl9-His, 인간 Myl3-His 및 인간 Myl9-His를 TALON Superflow 금속 친화성 수지(CLONTECH사)에 의해 정제하였다.
마우스/인간 Myl9에 대한 결합 능력을 하기 단계들에 따라 ELISA에 의해 평가하였다. 마우스 Myl3-His, 마우스 Myl9-His, 인간 Myl3-His 및 인간 Myl9-His를 96-웰 플레이트(Nunc사)의 웰 상으로 코팅하였다. 4℃에서 밤새 인큐베이션한 후, 웰들을 1 x 블록 에이스(DS Pharma Biomedical Co., Ltd사)를 이용하여 실온에서 1시간 동안 블로킹시켰다. 0.02% Tween 20/PBS를 이용하여 3회 세척한 후, 4배의 항체 A에 의한 10개의 단계 희석물을 10 ㎍/mL의 농도로부터 제조하고, 웰에 첨가하였다. 실온에서 1시간 동안 인큐베이션하고 3회 세척한 후, 호스래디쉬 퍼옥시다제-표지된 항-마우스 IgG 항체(Jackson ImmunoResearch Laboratories사)를 첨가하고, 이를 실온에서 1시간 동안 인큐베이션하였다. 5회 세척한 후, TMBZ(3,3',5,5'-테트라메틸벤지딘) 용액을 웰에 첨가하고, 이를 실온에서 5분 내지 20분 동안 인큐베이션하였다. 동일한 양의 반응 소광 용액(2 N H2SO4)를 웰에 첨가하고, 450 nm에서의 흡광도를 마이크로플레이트 판독기(PerkinElmer사)를 이용하여 판독하였다.
항체 A는 마우스 및 인간 Myl9에 대해 농도-의존적 결합을 보여주었으나, 마우스 및 인간 Myl9와 낮은 상동성을 가진 마우스 및 인간 Myl3에는 결합하지 않았다(도 2).
마우스 CD69 세포외 영역 단백질과 마우스 Myl9 사이의 결합에 대한 항체 A의 저해 활성의 평가
마우스 CD69 세포외 영역 단백질과 마우스 Myl9 사이의 결합에 대한 항체 A의 저해 활성의 평가를 경쟁적 ELISA에 의해 수행하였다. 우선, 마우스 CD69 세포외 영역 단백질 및 마우스 Myl9 단백질을 생성하였다.
구체적으로, 마우스 Myl3 및 Myl9 각각을 골수 및 심근 조직의 cDNA로부터 클로닝하고, pET42b 벡터(Merck)의 멀티클로닝 부위 내로 삽입하였다. 생성된 발현 벡터를 로제타 컴피턴트(Rosetta Competent) 세포(Merck) 내로 형질변환하고, 발현 벡터를 가진 클론을 선별하였다. 각각의 예비-배양된 클론 배양 배지를, 카나마이신을 포함하는 LB 용액 500 mL에 첨가하고, 이 배지를 쉐이커 내에서 37℃에서 배양하였다. 1 mM의 최종 농도의 IPTG(Nacalai)를 OD600 = 0.4에서 첨가하고, 마우스 Myl3 및 Myl9 단백질의 유도된 발현을 37℃에서 3시간 동안 수행하였다. 3시간 후, 세포를 원심분리에 의해 수합하고, 용해 완충제[Tris-HCl(pH 8.0) 및 150 mM NaCl]를 이용하여 용해시킨 다음, 얼음 상에서 냉각시키면서 소니케이터를 이용하여 균질화하였다. 불용성 분획을 원심분리에 의해 제거하고, 이를 0.45 ㎛ 필터(Corning사)를 통해 통과시킨 다음, Ni-NTA 비드(Qiagen사)가 패킹된(packed) 컬럼을 이용하여 정제하였다. 비드를 세척 완충제[Tris-HCl(pH 8.0), 150 mM NaCl 및 10 mM 이미다졸]를 이용하여 세척한 다음, 결합된 단백질을 용리 완충제[Tris-HCl(pH 8.0), 150 mM NaCl 및 500 mM 이미다졸]를 이용하여 용리시켰다. 수득된 GST-His-마우스 Myl3 및 GST-His-마우스 Myl9 단백질들을, PD10(GE Healthcare사)을 포함하는 PBS로 용액 교환하였다. 브래드포드(Bradford) 용액(BIO-RAD)을 정제된 단백질의 농도의 측정에 이용하였다.
다음, 마우스 Myl9와 마우스 CD69 사이의 연계의 존재 또는 부재를 분석하기 위해 ELISA를 수행하였다(도 3의 A 및 도 3의 B). 구체적으로, GST-His-마우스 Myl3 단백질 및 GST-His-마우스 Myl9 단백질을 5 ㎍/mL의 농도로 첨가하였고, 이를 4℃에서 밤새 인큐베이션하여, 이들 단백질을 ELISA 플레이트 상에 고정하였다. 다음날, 블록 에이스(Sumitomo Dainippon Pharma Co., Ltd.)를 이용하여 실온에서 1시간 동안 블로킹시키고, 그런 다음 이를 세척 완충제(50 mM HEPES(pH 6.5), 150 mM NaCl 및 0.02% Tween 20)로 3회 세척하였다. 상이한 농도의 3 x Flag 마우스 CD69 EC 단백질들을 각각의 웰에 첨가하고, 이를 실온에서 1시간 30분 동안 반응시켰다. 도 3의 B에서, N-연결된 당 사슬이 PNGase F(NEB)에 의해 절단된 3 x Flag 마우스 CD69 EC 단백질을 이용하였다. N-연결된 당 사슬의 절단 처리를, 4 ㎍의 3 x Flag 마우스 CD69 EC 단백질에 대해 1,000 U의 PNGase F를 이용함으로써 수행하였다. 세척 완충제로 3회 세척한 후, HRP-표지된 항-Flag(M2) 항체(SIGMA사)를 첨가하고, 이를 실온에서 1시간 동안 반응시킨 다음, 세척 완충제로 5회 세척하였다. TMB 용액(BIO-RAD)을 발색 기질로서 사용하고, 반응을 1 N H2SO4를 이용하여 소광시켰다. SpectraMAX Paradigm(Molecular Device)을 이용하여, 450 nm에서 값을 측정하였다.
도 3의 A 및 도 3의 B에 나타낸 바와 같이, 마우스 Myl9에 대한 마우스 CD69의 농도-의존적 결합이 유의하게 검출되었다.
마우스 CD69 세포외 영역 단백질과 마우스 Myl9 사이의 결합에 대한 항체 A의 저해 활성을 평가하기 위해 경쟁적 ELISA를 수행하였다. 구체적으로, GST 단백질(Abcam) 및 GST-His-마우스 Myl9 단백질을 글루타티온-코팅된 플레이트(Thermo)에 첨가하여, 이들 단백질을 고정하였다. 각각의 웰을 블록 에이스를 이용하여 실온에서 1시간 동안 블로킹시킨 다음, 세척 완충제(PBS 및 0.02% Tween 20)로 3회 세척하였다. 항체 A 및 항-Myl9/12 폴리클로날 항체를 도 3의 C에 기재된 농도로 첨가하고, 이를 실온에서 1시간 동안 반응시켰다. PNGase F-처리된 3 x Flag 마우스 CD69 EC 단백질을 첨가하고, 이를 4℃에서 밤새 반응시키고, 세척 완충제로 3회 세척하였다. HRP-표지된 항-Flag(M2) 항체(SIGMA사)를 첨가하고, 이를 실온에서 1시간 동안 반응시킨 다음, 세척 완충제로 5회 세척하였다. TMB 용액(BIO-RAD)을 발색 기질로서 사용하고, 반응을 1 N H2SO4를 이용하여 소광시켰다. SpectraMAX Paradigm(Molecular Device)을 이용하여 450 nm에서 값을 측정하였다.
도 3의 C에 나타낸 바와 같이, 마우스 CD69와 마우스 Myl9 사이의 결합은 농도-의존적이었으며, 항체 A의 존재 하에 유의하게 저해되었다. 이러한 저해 활성은 항-Myl9/12 폴리클로날 항체보다 더 높은 경향이 있었다.
항체 A의 서열 분석
항체 A의 중쇄 및 경쇄 뿐만 아니라 가변 영역의 신호 서열을 인코딩하는 DNA 서열들을 5'-RACE(cDNA 말단부(end)의 5'-신속 증폭) 방법에 의해 증폭시켰다. 총 RNA를 상기 하이브리도마로부터 RNeasy 미니 키트(Qiagen사)를 이용하여 제조하고, DNase(QIAGEN, RNase 프리(free) DNase 세트)로 처리하였다. 이중 가닥 cDNA를 상기 총 RNA로부터 cDNA 합성 키트(TAKARA)를 이용하여 제조하였다. oligoDNA ad29S(ACATCACTCCGT)(SEQ ID NO. 7) 및 oligoDNA ad29AS(ACGGAGTGATGTCCGTCGACGTATCTCTGCGTTGATACTTCAGCGTAGCT)(SEQ ID NO. 8)의 어닐링에 의해 수득된 5' 어댑터를 상기 cDNA에 첨가하였다. 수득된 cDNA를 5' 포워드 프라이머(5'-PCR4 프라이머, AGCTACGCTGAAGTATCAACGCAGAG)(SEQ ID NO. 9) 및 3' 리버스 프라이머(GCCAGTGGATAGACTGATGG(SEQ ID NO. 10)를 마우스 IgG 중쇄의 증폭에 이용하고, GATGGATACAGTTGGTGCAGC(SEQ ID NO. 11)를 마우스 Igκ 경쇄의 증폭에 이용하였음)에 의해 증폭시켰다. 증폭된 cDNA를 pCR2.1 벡터(Invitrogen/LifeTechnologies사) 내에 삽입하였다. 항체 A의 유전자 서열을 ABI3130XL(SEQ ID NO. 12 내지 19)을 이용하여 분석하였다.
항체 A의 중쇄 및 경쇄의 전장 서열을 하기 단계들에 의해 수득하였다. 총 RNA를 상기 하이브리도마로부터 RNeasy 미니 키트(Qiagen사)를 이용하여 제조하고, DNase(QIAGEN, RNase 프리 DNase 세트)를 처리하였다. cDNA를 상기 총 RNA로부터 cDNA 합성 키트(TAKARA)를 이용하여 제조하였다. 주형으로서 수득된 cDNA를 이용하여, 항체 A의 중쇄 및 경쇄를 인코딩하는 유전자 서열을 5' 포워드 프라이머(GCGAAGCTTGCCGCCACCATGGAATGGAGCTGGGTCTTTC(SEQ ID NO. 20)를 중쇄의 증폭에 사용하고, GCGAAGCTTGCCGCCACCATGAAGTTGCCTGTTAGGCTG(SEQ ID NO. 21)를 경쇄의 증폭에 사용하였음) 및 3' 리버스 프라이머(GCGGAATTCATCATTTACCCAGAGACCGGGAGATGG(SEQ ID NO. 22)를 중쇄의 증폭에 사용하고, GCGGAATTCACTAACACTCATTCCTGTTGAAGCTCTTGAC(SEQ ID NO. 23)를 경쇄의 증폭에 사용하였음)를 이용한 PCR에 의해 증폭시키고, 각각을 pEE6.4 및 pEE12.4 벡터(Lonza) 내로 클로닝하였다. 유전자 서열을 ABI3130XL(SEQ ID NO. 12 내지 19 및 24 내지 27)을 이용하여 분석하였다.
항체 A의 CDR에 대해, 항체 A의 아미노산 서열을 Abysis 소프트웨어(UCL로부터 라이센스를 받음)를 이용하여 카바트(Kabat) 넘버링 시스템에 따라 넘버링하고, 이러한 넘버링을 기반으로, CDR을 CDR 식별(SEQ ID NO. 28 내지 43)을 위한 카바트 정의 또는 AbM 정의 방법에 따라 확인하였다.
실시예 2: OVA-유도된 마우스 기도 염증 모델에서 항체 A의 약물 효과의 평가
정제된 마우스 항-마우스/인간 Myl9 항체(항체 A)의 생체내 투여가 알레르기성 기도 염증에 미치는 효과를 OVA-유도된 기도 염증 모델을 이용하여 입증하였다.
우선, 기도 염증 시에 유도된 기관지 주변에서의 세포 침윤에 대한 항체 A의 투여에 의한 억제 효과를 조사하였다. 구체적으로, 면역화를 위해 4 mg/마우스의 Alum(Thermo)과 함께 100 ㎍/마우스(SIGMA사)의 오브알부민(OVA)을 야생형 BALB/c 마우스에게 복강내 투여하였다. 제1 투여일을 제0일로서 설정하고, 제2 투여를 제7일에 수행하였다. 제14일 및 제16일에 초음파 분무기(Omron)를 이용하여 1% OVA 용액(10 mg/mL 식염수)을 마우스에게 30분 동안 분무 흡입(OVA 흡입)시켜, 기도 염증을 유도하였다. OVA를 흡입하지 않은 그룹을 대조군으로서 제조하였다(흡입 없음). 항체 A 또는 대조군용 마우스 IgG2a, κ 항체(BioLegend)를 제13일 및 제15일에 각각 100 ㎍으로 복강내 투여하였다. 제18일에, 마우스 폐를 절제하고, 10% 포르말린 용액으로 고정한 다음, 파라핀에 포매시켜, 조직 절편을 생성하고, 헤마톡실린/에오신 염색(H & E 염색) 및 PAS(과요오드산-시프; Periodic Acid-Schiff) 염색을 수행하였다(도 4a의 A).
도 4a의 A에 나타낸 바와 같이, OVA를 흡입한 대조군 항체 투여군에서 기관지 주변으로 심각한 세포 침윤이 관찰되었으나, OVA를 흡입한 항체 A 투여군에서는 세포 침윤이 유의하게 억제되었다(도 4a의 A 상부). 더욱이, PAS에 대해 양성으로 염색된 점액의 생성이 OVA를 흡입한 대조군 항체 투여군에서 기관지 내에서 관찰되었으나, OVA를 흡입한 항체 A 투여군에서는 점액의 생성이 또한 유의하게 억제되었다(도 4a의 A 하부).
후속적으로, 기도 염증 유도 후 제17일에 기관지폐포 세척을 수행하고, 기관지폐포 세척액(BALF)에서 관찰되는 침윤하는 세포의 수 및 침윤하는 세포 유형을 항체 A 투여군과 대조군 항체 투여군 사이에서 비교하였다. 마취를 위해 펜토바르비탈 Na(70 내지 90 mg/kg)를 마우스에게 복강내 투여한 다음, 기도를 절개하여 캐뉼러(Becton Dickinson)를 삽입하고, 식염수(Otsuka Pharmaceutical)를 폐에 주사하여 세포를 수합함으로써, 기관지폐포 세척을 수행하였다. 수합된 세포(모든 세포)에 대해 세포의 수를 계수하였다. 더욱이, 이들 세포를 태아 송아지 혈청(FCS)에 현탁하고, 사이토스핀(Cytospin) 3(Thermo Fisher Scientific사)을 이용하여 슬라이드 유리 상에 페이스트(paste)하였다. 염색을 위해 May-Gruenwald Giemsa(MERCK) 시약을 이용하고, 세포들을 형태적인 기준에 따라 호산구, 중성구, 림프구 및 대식세포로 식별하였다.
도 4a의 B에 나타낸 바와 같이, 대조군 항체 투여군과 비교하여 항체 A 투여군에서, 침윤하는 세포의 총 수가 유의하게 감소하였고, 호산구, 중성구, 림프구 및 대식세포의 다양한 세포의 수가 또한, 유의하게 감소되었다.
후속적으로, 수합된 기관지폐포 세척액에 함유된 다양한 사이토카인들(IL-4, IL-5, IL-6, IL-13 및 RANTES)을 항체 A 투여군과 대조군 항체 투여군 사이에서 비교하였다. 사이토메트릭 비드 어레이(BD Biosciences)를 측정에 사용하였다.
도 4a의 C에 나타낸 바와 같이, 사이토카인들(IL-4, IL-5, IL-6, IL-13 및 RANTES) 중 임의의 사이토카인의 생성이 대조군 항체 투여군과 비교하여 항체 A 투여군에서 감소되었다.
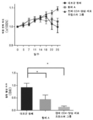
후속적으로, 기도 염증을 유도한 후 제17일에 메타콜린-유도된 기도 저항을 항체 A 투여군(도 4b의 D), 항-Myl9/12 폴리클로날 항체 투여군(도 4b의 E) 및 대조군 항체 투여군 사이에서 비교하였다.
도 4b의 D에 나타낸 바와 같이, 기도 저항이 대조군 항체 투여군에서 메타콜린 농도-의존적으로 상승된 반면, 이러한 상승은 항체 A 투여군에서 유의하게 억제되었다. 더욱이, 도 4b의 E에 나타낸 바와 같이, 항-Myl9/12 폴리클로날 항체 투여군에서, 기도 저항의 메타콜린 농도-의존적 상승의 억제가 관찰되긴 하지만, 이의 효과에서는 유의한 차이가 관찰되지 않았다. 항체 A가 항-Myl9/12 폴리클로날 항체보다 더 강력한 항-기도 염증 효과를 가진 것으로 제안되었다.
실시예 3: 마우스 결장염 모델에서 항체 A의 약물 효과의 평가
문헌[Powrie et al., Int. Immunol., 5, 1461-1471, 1993]이 CD4-양성 CD45RB-강양성(CD4 + CD45RBhigh) T 림프구 트랜스퍼 염증성 장질환 모델의 생성을 위해 참조되었다. 암컷 8 내지 10 주령의 Balb/c 마우스(Charles River Laboratories Japan, Inc.)의 비장을 절제하고, 그라운드 유리(ground glass)를 이용하여 분쇄하여, 비장 세포를 분리하였다. 분리된 비장 세포에, 1개 비장 당 155 mM 암모늄 클로라이드, 10 mM 카르본산 하이드로겐 포타슘 및 80 μM EDTA-4 Na를 함유하는 증류수 5 mL을 첨가하고, 이를 실온에서 5분 동안 방치하여 적혈구를 용해시켰다. 2배 부피의 PBS를 비장 세포 용액에 첨가하고, 이 용액을 1500 rpm에서 5분 동안 원심분리한 다음, 침전물을 수합하였다. CD4 T 림프구를 분리된 비장 세포로부터 CD4 T 세포 단리 키트(Miltenyi사)에 의해 정제하였다. CD4-양성 CD45RB-강양성 T 림프구를 분리하기 위해, 정제된 CD4 T 림프구를 피코에리트린(PE)-표지된 항-CD4 항체(eBioscience사) 및 플루오레세인 이소티오시아네이트(FITC)-표지된 항-CD45RB 항체(eBioscience사)를 이용하여 이중 염색하였다. 이중 염색 후, CD4-양성 CD45RB-강양성 세포를 FACSAria(Becton, Dickinson and Company사)를 이용하여 소팅하여, 관심 세포를 수합하였다. 수합된 세포를 PBS로 세척한 후, 이들 세포를 PBS 내에 2 x 106개 세포/mL의 세포 농도까지 현탁하였다. 암컷 8주령의 SCID 마우스(CLEA Japan, Inc.)의 복강에, 각각 250 ㎕, 즉 상기와 같이 제조된 5 x 105개 세포/마우스의 CD4-양성 CD45RB-강양성 세포를 트랜스퍼하였다. 트랜스퍼된 CD4-양성 CD45RB-강양성 세포를 가진 SCID 마우스의 그룹 당 8마리의 동물에게, 500 ㎍의 대조군 항체(마우스 IgG) 및 500 ㎍의 항체 A(PBS 용액 중 항체)를 세포 트랜스퍼 후 제11일로부터 출발하여 매주 2회 투여하였다. 투여가 꼬리 정맥으로부터였음을 주지한다. 더욱이, 음성 대조군으로서, CD4 T 세포 단리 키트(Miltenyi사)를 이용하여 정제되었으나 CD45RB 발현 강도(전체 CD4-양성 세포)에 대해 분리되지 않은 마우스 CD4 T 림프구를 5 x 105개 세포/마우스로 트랜스퍼하였다. 세포 트랜스퍼 후 27일째에 부검을 수행하여, 체중 손실 및 대장 내 대변의 성질의 점수를 매기고 평가하였다. 덱스트란 소듐 설페이트-유도된 결장염(문헌[Cooper et al., Lab. Invest., 69, 238-249, 1993])에 이용된 대변의 성질에 대한 배점을 대변 성질에 대한 배점에 사용하였다.
대조군 항체 투여군과 비교하여 항체 A 투여군에서 질병 활성 지수(DAI)의 유의한 감소가 존재하였다(도 5).
실시예 4: 항체 A로부터 키메라 항체 및 인간화된 항체의 생성
키메라 항체 및 인간화된 항체의 제조
우선, 키메라 항체용 발현 벡터를 구축하였다. 중쇄로서, 항체 A의 중쇄의 신호 서열을 인코딩하는 유전자 서열(SEQ ID NO. 16) 및 가변 영역을 인코딩하는 유전자 서열(SEQ ID NO. 17)을, 돌연변이 V234A 및 G237A 및 및 C-말단 라이신 잔기 결실(SEQ ID NO. 44)을 가진 인간 IgG2의 불변 영역을 인코딩하는 유전자 서열(SEQ ID NO. 45)을 포함하는 발현 벡터(pcDNA3.4) 내로 삽입하고, 경쇄로서, 항체 A의 경쇄의 신호 서열을 인코딩하는 유전자 서열(SEQ ID NO. 18) 및 가변 영역을 인코딩하는 유전자 서열(SEQ ID NO. 19)을, 인간 Igκ의 불변 영역(SEQ ID NO. 46)을 인코딩하는 유전자 서열(SEQ ID NO. 47)을 포함하는 발현 벡터(pcDNA3.4) 내로 삽입함으로써, 키메라 항체용 발현 벡터를 구축하였다. 키메라 항체를 생성하기 위해 Expi293 발현 시스템(Gibco/ThermoFisher사)을 사용하여, 상기 발현 벡터를 Expi293F 세포(Gibco/ThermoFisher사) 내로 형질감염시켰다. 상층액을 수합하고, 단백질 A(GE Healthcare사)를 이용하여 정제하였다. 여기서, "V234A"는 위치 234에서 발린이 알라닌으로 치환되는 돌연변이를 나타내고, "G237A"는 위치 237에서 글리신이 알라닌으로 치환되는 돌연변이를 나타낸다.
후속적으로, 인간화된 항체의 가변 영역을 디자인하였다. 항체 A의 골격 영역(FR)과의 높은 상동성을 기반으로, 인간 항체의 FR, 경쇄에 대해 IGKV2-28*01(SEQ ID NO. 48) 또는 IGKV2-24*01(SEQ ID NO. 49) 및 JK4(SEQ ID NO. 50), 및 중쇄에 대해 IGHV1-69*02(SEQ ID NO. 51), IGHV1-46*01(SEQ ID NO. 52) 또는 IGHV7-4-1*02(SEQ ID NO. 53) 및 JH4(SEQ ID NO. 54)를 인간화된 항체용 FR로서 선택하였다. 그런 다음, 마우스 항체 A의 3D 구조 예측 모델을 이용하여 CDR의 아미노산과 상호작용하는 FR 내 아미노산을 예측하고, CDR(SEQ ID NO. 28 내지 35)과 함께 그래프팅하였다. 돌연변이 V234A 및 G237A를 갖고 C-말단 라이신 잔기 결실(SEQ ID NO. 44)을 가진 인간 IgG2의 불변 영역, 및 인간 Igκ의 불변 영역(SEQ ID NO. 46)을 각각 중쇄 및 경쇄의 불변 영역으로서 이용하였다. HK1-4(SEQ ID NO. 55), HK1-5(SEQ ID NO. 56), HK1-6(SEQ ID NO. 57), HK1-A(SEQ ID NO. 58), HK2-5(SEQ ID NO. 59), HK2-6(SEQ ID NO. 60), HK2-9(SEQ ID NO. 61) 및 HK3-2(SEQ ID NO. 62)를 인간화된 항체의 중쇄 가변 영역으로서 디자인하며, 이러한 가변 영역 내에 카바트 정의 방법에 의해 확인된 CDR들(SEQ ID NO. 28, 30 및 32)을 그래프팅하고, HA1-4(SEQ ID NO. 63) 및 HA1-6(SEQ ID NO. 64)을 인간화된 항체의 중쇄 가변 영역으로서 디자인하며, 이러한 가변 영역 내에 AbM 정의 방법에 의해 확인된 CDR들(SEQ ID NO. 29, 31, 32)을 그래프팅하고, HK1-4, HK1-5, HK1-6, HK1-A, HA1-4 및 HA1-6을 IGHV1-69*02 및 JH4를 이용하는 인간화된 항체의 중쇄 가변 영역으로서 디자인하고, HK2-5, HK2-6 및 HK2-9를 IGHV1-46*01 및 JH4를 이용하는 인간화된 항체의 중쇄 가변 영역으로서 디자인하며, HK3-2를 IGHV7-4-1*02 및 JH4를 이용하는 인간화된 항체의 중쇄 가변 영역으로서 디자인하고, L1-4(SEQ ID NO. 65), L1-5(SEQ ID NO. 66) 및 L1-A(SEQ ID NO. 67)를 IGKV2-28*01 및 JK4를 이용하는 인간화된 항체의 경쇄 가변 영역으로서 디자인하고, L4-2(SEQ ID NO. 68)를 IGKV2-24*01 및 JK4를 이용하는 인간화된 항체의 경쇄 가변 영역으로서 디자인하였다.
HK1-4, HK1-5 및 HK1-6의 아미노산 서열을 인코딩하는 유전자 서열을, 항체 A의 중쇄 CDR들(SEQ ID NO. 28, 30 및 32)이 IGHV1-69*02(SEQ ID NO. 51) 및 JH4(SEQ ID NO. 54) 내로 그래프팅되고 신호 서열(SEQ ID NO. 69)이 N-말단에 첨가된 아미노산 서열을 디자인하고, 디자인된 아미노산 서열을 유전자 서열로 전환시키고, 이러한 유전자 서열을 GenScript USA Inc사에 의해 합성한 다음, 돌연변이를 PCR에 의해 도입함으로써, 생성하였다(HK1-4: SEQ ID NO. 70, HK1-5: SEQ ID NO. 71, HK1-6: SEQ ID NO. 72, 신호 서열: SEQ ID NO. 73). HK1-A의 아미노산 서열을 인코딩하는 유전자 서열을, HK1-A의 N-말단에 첨가된 신호 서열(SEQ ID NO. 69)을 가진 아미노산 서열로부터 전환시키고, GenScript USA Inc사에 의해 합성하였다(HK1-A: SEQ ID NO. 74, 신호 서열: SEQ ID NO. 75). HK2-5, HK2-6 및 HK2-9의 아미노산 서열을 인코딩하는 유전자 서열을, 항체 A의 중쇄 CDR들(SEQ ID NO. 28, 30 및 32)이 IGHV1-46*01(SEQ ID NO. 52) 및 JH4(SEQ ID NO. 54) 내로 그래프팅되고 신호 서열(SEQ ID NO. 69)이 N-말단에 첨가된 아미노산 서열을 디자인하고, 디자인된 아미노산 서열을 유전자 서열로 전환시키고, 이러한 유전자 서열을 GenScript USA Inc사에 의해 합성한 다음, 돌연변이를 PCR에 의해 도입함으로써, 생성하였다(HK2-5: SEQ ID NO. 76, HK2-6: SEQ ID NO. 77, HK2-9: SEQ ID NO. 78, 신호 서열: SEQ ID NO. 79). HK3-2의 아미노산 서열을 인코딩하는 유전자 서열을, HK3-2의 N-말단에 첨가된 신호 서열(SEQ ID NO. 69)을 가진 아미노산 서열을 GenScript USA Inc사에 의한 유전자 서열(HK3-2: SEQ ID NO. 80, 신호 서열: SEQ ID NO. 81)로 전환시켜 합성하였다. HA1-4 및 HA1-6의 아미노산 서열을 인코딩하는 유전자 서열을, 항체 A의 중쇄 CDR들(SEQ ID NO. 29, 31 및 32)이 IGHV1-69*02(SEQ ID NO. 51) 및 JH4(SEQ ID NO. 54) 내로 그래프팅되고 신호 서열(SEQ ID NO. 69)이 N-말단에 첨가된 아미노산 서열을 디자인하고, 유전자 서열로 전환시키고, 이러한 유전자 서열을 GenScript USA Inc사에 의해 합성한 다음, 돌연변이를 PCR에 의해 도입함으로써, 생성하였다(HA1-4: SEQ ID NO. 82, HA1-6: SEQ ID NO. 83, 신호 서열: SEQ ID NO. 84). L1-4 및 L1-5의 아미노산 서열을 인코딩하는 유전자 서열을, 항체 A의 경쇄 CDR들(SEQ ID NO. 33 내지 35)이 IGKV2-28*01(SEQ ID NO. 48) 및 JK4(SEQ ID NO. 50) 내로 그래프팅되고 신호 서열(SEQ ID NO. 85)이 N-말단에 첨가된 아미노산 서열을 디자인하고, 유전자 서열로 전환시키고, 이러한 유전자 서열을 GenScript USA Inc사에 의해 합성한 다음, 돌연변이를 PCR에 의해 도입함으로써, 생성하였다(L1-4: SEQ ID NO. 86, L1-5: SEQ ID NO. 87, 신호 서열: SEQ ID NO. 88). L1-A 및 L4-2의 아미노산 서열을 인코딩하는 유전자 서열을, L1-A 및 L4-2의 N-말단에 첨가된 신호 서열(SEQ ID NO. 85)을 가진 아미노산 서열을 GenScript USA Inc사에 의해 유전자 서열로 전환시킴으로써 합성하였다(L1-A: SEQ ID NO. 89, L1-A의 신호 서열: SEQ ID NO. 90, L4-2: SEQ ID NO. 91, L4-2의 신호 서열: SEQ ID NO. 92). 이들 인간화된 중쇄 가변 영역 및 신호 서열을 인코딩하는 유전자들을, 돌연변이 V234A 및 G237A를 갖고 C-말단 라이신 잔기 결실(SEQ ID NO. 44)을 가진 인간 IgG2의 불변 영역을 인코딩하는 유전자 서열(SEQ ID NO. 45)을 포함하는 발현 벡터(pcDNA3.4) 내에 삽입하였다. 이들 인간화된 경쇄 가변 영역 및 신호 서열을 인코딩하는 유전자들을, 인간 Igκ의 불변 영역(SEQ ID NO. 46)을 인코딩하는 유전자 서열(SEQ ID NO. 47)을 포함하는 발현 벡터(pcDNA3.4) 내에 삽입하였다. 여기서, "V234A"는 위치 234에서 발린이 알라닌으로 치환되는 돌연변이를 나타내고, "G237A"는 위치 237에서 글리신이 알라닌으로 치환되는 돌연변이를 나타낸다. Expi293 발현 시스템(Gibco/ThermoFisher사)을 사용하여 항체를 생성하기 위해, 상기 발현 벡터를 표 1에 나타낸 조합들에서 Expi293F 세포(Gibco/ThermoFisher사) 내로 형질감염시켰다. 상층액을 수합하고, 단백질 A(GE Healthcare사)를 이용하여 정제하였다.
| 인간화된 항체 번호 |
H 사슬 |
L 사슬 |
| 가변 영역 |
가변 영역 |
| 명칭 |
아미노산 서열(SEQ ID NO.) |
핵산 서열
(SEQ ID NO.) |
명칭 |
아미노산 서열(SEQ ID NO.) |
핵산 서열
(SEQ ID NO.) |
| 110 |
HA1-6 |
64 |
83 |
L1-5 |
66 |
87 |
| 111 |
HA1-4 |
63 |
82 |
L1-5 |
66 |
87 |
| 112 |
HK1-5 |
56 |
71 |
L1-5 |
66 |
87 |
| 113 |
HK1-6 |
57 |
72 |
L1-5 |
66 |
87 |
| 114 |
HK1-4 |
55 |
70 |
L1-5 |
66 |
87 |
| 115 |
HK1-A |
58 |
74 |
L1-5 |
66 |
87 |
| 116 |
HK2-5 |
59 |
76 |
L1-5 |
66 |
87 |
| 117 |
HK2-6 |
60 |
77 |
L1-5 |
66 |
87 |
| 118 |
HK2-9 |
61 |
78 |
L1-5 |
66 |
87 |
| 121 |
HA1-6 |
64 |
83 |
L4-2 |
68 |
91 |
| 122 |
HA1-4 |
63 |
82 |
L4-2 |
68 |
91 |
| 123 |
HK1-5 |
56 |
71 |
L4-2 |
68 |
91 |
| 124 |
HK1-6 |
57 |
72 |
L4-2 |
68 |
91 |
| 125 |
HK1-4 |
55 |
70 |
L4-2 |
68 |
91 |
| 126 |
HK1-A |
58 |
74 |
L4-2 |
68 |
91 |
| 127 |
HK2-5 |
59 |
76 |
L4-2 |
68 |
91 |
| 128 |
HK2-6 |
60 |
77 |
L4-2 |
68 |
91 |
| 129 |
HK2-9 |
61 |
78 |
L4-2 |
68 |
91 |
| 131 |
HK3-2 |
62 |
80 |
L1-4 |
65 |
86 |
| 132 |
HK3-2 |
62 |
80 |
L1-A |
67 |
89 |
| 133 |
HK3-2 |
62 |
80 |
L1-5 |
66 |
87 |
| 134 |
HK3-2 |
62 |
80 |
L4-2 |
68 |
91 |
인간 Myl9 단백질에 대한, 항체 A로부터 제조된 키메라 항체 및 인간화된 항체의 결합 능력의 분석
인간 Myl9에 대한, 항체 A로부터 제조된 키메라 항체 및 인간화된 항체의 결합 능력을 ELISA에 의해 평가하였다. 인간 Myl3-His 및 인간 Myl9-His 단백질들을 실시예 1에 기재된 방법에 의해 제조하였다.
인간 Myl9에 대한 결합 능력을 하기 단계들에 따라 ELISA에 의해 평가하였다. 인간 Myl3-His 및 인간 Myl9-His를 96-웰 플레이트(Nunc사)의 웰 상으로 코팅하였다. 4℃에서 밤새 인큐베이션한 후, 웰들을 1 x 블록 에이스(DS Pharma Biomedical Co., Ltd사)를 이용하여 실온에서 1시간 동안 블로킹시켰다. 0.02% Tween 20/PBS를 이용하여 3회 세척한 후, 키메라 항체 및 인간화된 항체의 6배에 의한 7개의 단계 희석물들을 10 ㎍/mL 농도로부터 제조하고, 웰에 첨가하였다. 실온에서 1시간 동안 인큐베이션하고 3회 세척한 후, 호스래디쉬 퍼옥시다제-표지된 항-인간 IgG 항체(Jackson ImmunoResearch Laboratories사)를 첨가하고, 이를 실온에서 1시간 동안 인큐베이션하였다. 5회 세척한 후, TMBZ(3,3',5,5'-테트라메틸벤지딘) 용액을 웰에 첨가하고, 이를 실온에서 5분 내지 20분 동안 인큐베이션하였다. 동일한 양의 반응 소광 용액(2 N H2SO4)를 웰에 첨가하고, 450 nm에서의 흡광도를 마이크로플레이트 판독기(PerkinElmer사)를 이용하여 판독하였다.
표 1의 모든 인간화된 항체들은 키메라 항체와 동일한 정도로 인간 Myl9에 농도-의존적으로 결합하였고, 인간 Myl3에는 결합하지 않았다(도 6a 내지 도 6c).
실시예 5: 마우스/인간 Myl12a 및 Myl12b 단백질에 대한 항체 A 및 이의 키메라 항체 및 인간화된 항체의 결합 능력
마우스/인간 Myl12a 및 Myl12b 단백질의 제조
하기 단계들에 따라, 마우스 Myl12a(Genbank 등록 번호 NP_080340.2, SEQ ID NO. 93), 마우스 Myl12b(Genbank 등록 번호 NP_075891.1, SEQ ID NO. 94), 인간 Myl12a(Genbank 등록 번호 NP_001289976.1, SEQ ID NO. 95) 및 인간 Myl12b(Genbank 등록 번호 NP_001138416.1 SEQ ID NO. 96)의 각각의 C-말단에 결합된 히스티딘 태그를 가진 단백질들(이하 각각 마우스 Myl12a-His, 마우스 Myl12b-His, 인간 Myl12a-His 및 인간 Myl12b-His로 지칭됨)을 생성하였다. 마우스 Myl9, Myl12a 및 Myl12b(도 7의 A), 뿐만 아니라 인간 Myl9, Myl12a 및 Myl12b(도 7의 B) 사이의 아미노산 서열 비교가 나타나 있다.
마우스 Myl12a 및 Myl12b 단백질들을 인코딩하는 유전자들은 치바 대학교로부터 기부받았다. 인간 Myl12a 및 Myl12b 단백질들을 인코딩하는 유전자들을 인간 심장 또는 소장 cDNA로부터 PCR에 의해 증폭시켰다. 이들 유전자를, 삽입된 PreScission 프로테아제(GE Healthcare사)의 절단 서열을 인코딩하는 유전자를 가진 pET42b 벡터(Merck)의 BglII/BamHI 부위 내에 삽입하였다. 생성된 벡터를 이. 콜라이 균주 BL21-Gold(DE3) pLys(Agilent Technologies사) 내에 형질변환시켜, GST 태그가 부착된 마우스 Myl12a-His, 마우스 Myl12b-His, 인간 Myl12a-His 및 인간 Myl12b-His를 발현시켰다. 발현된 단백질을 글루타티온 세파로스 4 패스트 플로우(GE Healthcare사)에 의해 정제하고, GST 태그를 PreScission 프로테아제를 이용하여 절단하고, 마우스 Myl12a-His, 마우스 Myl12b-His, 인간 Myl12a-His 및 인간 Myl12b-His를 TALON 슈퍼플로우 금속 친화성 수지(CLONTECH사)에 의해 정제하였다.
실시예 1에서 정제된 마우스 Myl12a-His, 마우스 Myl12b-His, 인간 Myl12a-His, 인간 Myl12b-His, 또는 마우스 Myl3-His, 마우스 Myl9-His, 인간 Myl3-His, 인간 Myl9-His에 다이티오트레이톨(Wako사)을 50 mM의 최종 농도로 첨가하고, 4℃에서 1시간 동안 인큐베이션하여, 단량체를 수득하였다. 인큐베이션 후, PBS를 이용하여 투석을 수행하였다.
마우스/인간 Myl12a 및 Myl12b 단백질에 대한 항체 A의 결합 능력의 분석
마우스/인간 Myl12a 및 Myl12b에 대한 항체 A의 결합 능력을 하기 단계들에 따라 ELISA에 의해 평가하였다. 마우스 Myl3-His, 마우스 Myl9-His, 마우스 Myl12a-His, 마우스 Myl12b-His, 인간 Myl3-His, 인간 Myl9-His, 인간 Myl12a-His 및 인간 Myl12b-His를 96-웰 플레이트(Nunc사)의 웰 상으로 코팅하였다. 4℃에서 밤새 인큐베이션한 후, 웰들을 1 x 블록 에이스(DS Pharma Biomedical Co., Ltd사)를 이용하여 실온에서 1시간 동안 블로킹시켰다. 0.02% Tween 20/PBS를 이용하여 3회 세척한 후, 항체 A의 4배에 의한 11개의 단계 희석물들을 10 ㎍/mL 농도로부터 제조하고, 웰에 첨가하였다. 실온에서 1시간 동안 인큐베이션하고 3회 세척한 후, 호스래디쉬 퍼옥시다제-표지된 항-마우스 IgG 항체(Jackson ImmunoResearch Laboratories사)를 첨가하고, 이를 실온에서 1시간 동안 인큐베이션하였다. 5회 세척한 후, TMBZ(3,3',5,5'-테트라메틸벤지딘) 용액을 웰에 첨가하고, 이를 실온에서 5분 내지 20분 동안 인큐베이션하였다. 동일한 양의 반응 소광 용액(2 N H2SO4)를 웰에 첨가하고, 450 nm에서의 흡광도를 마이크로플레이트 판독기(Thermo Scientific사)를 이용하여 판독하였다.
항체 A는 마우스 및 인간 Myl9와 높은 상동성을 가진 Myl12a 및 Myl12b에 농도-의존적 결합을 보여주었으나, 마우스 및 인간 Myl9와 낮은 상동성을 가진 마우스 및 인간 Myl3에는 결합하지 않았다(도 8의 A 및 도 8의 B).
인간 Myl12a 및 Myl12b 단백질에 대한, 항체 A로부터 제조된 키메라 항체 및 인간화된 항체의 결합 능력의 분석
인간 Myl12a 및 Myl12b에 대한, 항체 A로부터 제조된 키메라 항체 및 인간화된 항체의 결합 능력을 하기 단계들에 따라 ELISA에 의해 평가하였다. 인간 Myl3-His, 인간 Myl9-His, 인간 Myl12a-His 및 인간 Myl12b-His를 96-웰 플레이트(Nunc사)의 웰 상으로 각각 코팅하였다. 4℃에서 밤새 인큐베이션한 후, 웰들을 1 x 블록 에이스(DS Pharma Biomedical Co., Ltd사)를 이용하여 실온에서 1시간 동안 블로킹시켰다. 0.02% Tween 20/PBS를 이용하여 3회 세척한 후, 키메라 항체 및 인간화된 항체를 각각 0.01, 0.1 및 1 ㎍/mL의 농도로 희석하고, 웰에 첨가하였다. 실온에서 1시간 동안 인큐베이션하고 3회 세척한 후, 호스래디쉬 퍼옥시다제-표지된 항-인간 IgG 항체(Jackson ImmunoResearch Laboratories사)를 첨가하고, 이를 실온에서 1시간 동안 인큐베이션하였다. 5회 세척한 후, TMBZ(3,3',5,5'-테트라메틸벤지딘) 용액을 웰에 첨가하고, 이를 실온에서 5분 내지 20분 동안 인큐베이션하였다. 동일한 양의 반응 소광 용액(2 N H2SO4)를 웰에 첨가하고, 450 nm에서의 흡광도를 마이크로플레이트 판독기(Thermo Scientific사)를 이용하여 판독하였다.
키메라 항체 및 인간화된 항체는 인간 Myl9와 높은 상동성을 가진 Myl12a 및 Myl12b에 농도-의존적 결합을 보여주었으나, 인간 Myl9와 낮은 상동성을 가진 인간 Myl3에는 결합하지 않았다(도 9a 내지 9c).
실시예 6: 인간 Myl9, 인간 Myl12a 및 인간 Myl12b와 인간 CD69 세포외 영역 단백질 사이에서 결합 활성에 대한 항체 A 및 이의 키메라 항체 및 인간화된 항체의 저해 효과
인간 Myl9, Myl12a 및 Myl12b 단백질과 인간 CD69 세포외 영역 단백질 사이의 결합
인간 Myl9, Myl12a 및 Myl12b 단백질과 인간 CD69 세포외 영역 단백질의 결합을 ELISA에 의해 평가하였다. 인간 CD69 단백질의 세포외 영역(위치 64-199, SEQ ID NO. 97)의 N-말단에 첨가된 Flag 태그를 가진 단백질(이하 3 x Flag-인간 CD69 EC 단백질)을 하기 단계들에 따라 생성하였다. 인간 CD69 단백질, 세포외 영역과 마우스 CD69 단백질, 세포외 영역 사이의 아미노산 서열의 비교(도 10)가 나타나 있다.
3 x Flag-인간 CD69 EC 단백질을 인코딩하는 유전자를 포함하는 발현 플라스미드는 치바 대학교로부터 기부받았고, 이 플라스미드를 ExpiFectamine 293 형질감염 키트(Thermo Fisher Scientific/Gibco사)를 이용하여 Expi293F 세포(Invitrogen/LifeTechnologies사) 내로 형질감염시켰다. 4일간의 인큐베이션(8% CO2, 37℃) 후, 배양 상층액을 수합하였다. 수합된 배양 상층액으로부터, 3 x Flag-인간 CD69 EC 단백질을 항-Flag M2 친화성 겔(SIGMA사)을 이용하여 정제하였다. 정제 후, 이량체화된 단백질을 Superdex200 또는 Superdex75를 사용하여 수합하였다.
인간 Myl9, Myl12a 및 Myl12b와 인간 CD69 세포외 영역 단백질 사이의 결합의 평가를 ELISA에 의해 수행하였다. 실시예 5에서 제조된 인간 Myl3-His, 인간 Myl9-His, 인간 Myl12a-His 및 인간 Myl12b-His를 각각 96-웰 플레이트(Nunc사)의 웰 상으로 코팅하였다. 4℃에서 밤새 인큐베이션한 후, 웰들을 1 x 블록 에이스(DS Pharma Biomedical Co., Ltd사)를 이용하여 실온에서 1시간 동안 블로킹시켰다. 0.02% Tween 20/PBS를 이용하여 3회 세척한 후, 3 x Flag-인간 CD69 EC 단백질의 3배에 의한 6개의 단계 희석물들을 10 ㎍/mL의 농도로부터 50 mM NaOAc(pH 5.5)/150 mM NaCl/0.02% Tween 20에 의해 제조하고, 웰에 첨가하였다. 실온에서 1시간 30분 동안 인큐베이션하고 50 mM NaOAc(pH 5.5)/150 mM NaCl/0.02% Tween 20으로 3회 세척한 후, 호스래디쉬 퍼옥시다제-표지된 항-Flag(M2) 항체(SIGMA사)를 첨가하고, 이를 실온에서 1시간 동안 인큐베이션하였다. 5회 세척한 후, TMBZ(3,3',5,5'-테트라메틸벤지딘) 용액을 웰에 첨가하고, 이를 실온에서 5분 내지 20분 동안 인큐베이션하였다. 동일한 양의 반응 소광 용액(2 N H2SO4)를 웰에 첨가하고, 450 nm에서의 흡광도를 마이크로플레이트 판독기(Thermo Scientific사)를 이용하여 판독하였다.
인간 CD69 세포외 영역 단백질은 인간 Myl9와 높은 상동성을 가진 인간 Myl9, Myl12a 및 Myl12b에는 농도-의존적 결합을 보여주었으나, 인간 Myl9와 낮은 상동성을 가진 인간 Myl3에는 결합하지 않았다(도 11).
인간 Myl9, 인간 Myl12a 및 인간 Myl12b와 인간 CD69 세포외 영역 단백질의 결합 활성에 대한 항체 A의 저해 활성의 평가
인간 Myl9, 인간 Myl12a 및 인간 Myl12b와 인간 CD69 세포외 영역 단백질 사이의 결합에 대한 항체 A의 저해 활성의 평가를 하기 단계들에 따라 ELISA에 의해 수행하였다. 실시예 5에서 제조된 인간 Myl9-His, 인간 Myl12a-His 및 인간 Myl12b-His를 각각 96-웰 플레이트(Nunc사)의 웰 상으로 코팅하였다. 4℃에서 밤새 인큐베이션한 후, 웰들을 1 x 블록 에이스(DS Pharma Biomedical Co., Ltd사)를 이용하여 실온에서 1시간 동안 블로킹시켰다. 0.02% Tween 20/PBS를 이용하여 3회 세척한 후, 항체 A 또는 대조군 항체(항-다이니트로페놀 항체, 마우스 IgG2c, κ)의 3배에 의한 7개의 단계 희석물들을 30 ㎍/mL의 농도로부터 50 mM NaOAc(pH 5.5)/150 mM NaCl/0.02% Tween 20에 의해 제조하고, 웰에 첨가하였다. 실온에서 1시간 동안 인큐베이션하고 3회 세척한 후, 3 x Flag-인간 CD69 EC 단백질을 10 ㎍/mL의 농도까지 50 mM NaOAc(pH 5.5)/150 mM NaCl/0.02% Tween 20에 의해 희석시키고, 웰에 첨가하였다. 실온에서 1시간 30분 동안 인큐베이션하고 50 mM NaOAc(pH 5.5)/150 mM NaCl/0.02% Tween 20으로 3회 세척한 후, 호스래디쉬 퍼옥시다제-표지된 항-Flag(M2) 항체(SIGMA사)를 첨가하고, 이를 실온에서 1시간 동안 인큐베이션하였다. 5회 세척한 후, TMBZ(3,3',5,5'-테트라메틸벤지딘) 용액을 웰에 첨가하고, 이를 실온에서 5분 내지 20분 동안 인큐베이션하였다. 동일한 양의 반응 소광 용액(2 N H2SO4)를 웰에 첨가하고, 450 nm에서의 흡광도를 마이크로플레이트 판독기(Thermo Scientific사)를 이용하여 판독하였다.
항체 A는 인간 Myl9, 인간 Myl12a 및 인간 Myl12b와 인간 CD69 세포외 영역 단백질 사이의 결합에 대해 농도-의존적 저해를 보여주었다(도 12). 대조군 항체는 저해 활성을 보여주지 않았다. 도면에서 백그라운드는, 인간 Myl9-His, 인간 Myl12a-His 또는 인간 Myl12b-His가 고정되지 않은 웰 내에서 3 x Flag-인간 CD69 EC 단백질과 호스래디쉬 퍼옥시다제-표지된 항-Flag(M2) 항체(SIGMA사) 사이의 착색화(colorization)를 의미한다.
인간 Myl9와 인간 CD69 세포외 영역 단백질의 결합 활성에 대한, 항체 A로부터 제조된 키메라 항체 및 인간화된 항체의 저해 활성의 평가
인간 Myl9와 인간 CD69 세포외 영역 단백질 사이에서의 결합에 대한, 항체 A로부터 제조된 키메라 항체 및 인간화된 항체의 저해 활성의 평가를 하기 단계들에 따라 ELISA에 의해 수행하였다. 실시예 5에서 제조된 인간 Myl9-His를 96-웰 플레이트(Nunc사)의 웰 상으로 코팅하였다. 4℃에서 밤새 인큐베이션한 후, 웰들을 1 x 블록 에이스(DS Pharma Biomedical Co., Ltd사)를 이용하여 실온에서 1시간 동안 블로킹시켰다. 0.02% Tween 20/PBS를 이용하여 3회 세척한 후, 항체 A, 키메라 항체, 인간화된 항체 또는 대조군 항체(인간 IgG2, κ, SIGMA사)의 3배에 의한 7개의 단계 희석물들을 30 ㎍/mL의 농도로부터 50 mM NaOAc(pH 5.5)/150 mM NaCl/0.02% Tween 20에 의해 제조하고, 웰에 첨가하였다. 실온에서 1시간 동안 인큐베이션하고 3회 세척한 후, 3 x Flag-인간 CD69 EC 단백질을 10 ㎍/mL의 농도까지 50 mM NaOAc(pH 5.5)/150 mM NaCl/0.02% Tween 20에 의해 희석시키고, 웰에 첨가하였다. 실온에서 1시간 30분 동안 인큐베이션하고 50 mM NaOAc(pH 5.5)/150 mM NaCl/0.02% Tween 20으로 3회 세척한 후, 호스래디쉬 퍼옥시다제-표지된 항-Flag(M2) 항체(SIGMA사)를 첨가하고, 이를 실온에서 1시간 동안 인큐베이션하였다. 5회 세척한 후, TMBZ(3,3',5,5'-테트라메틸벤지딘) 용액을 웰에 첨가하고, 이를 실온에서 5분 내지 20분 동안 인큐베이션하였다. 동일한 양의 반응 소광 용액(2 N H2SO4)를 웰에 첨가하고, 450 nm에서의 흡광도를 마이크로플레이트 판독기(Thermo Scientific사)를 이용하여 판독하였다.
항체 A로부터 제조된 키메라 항체 및 인간화된 항체는 인간 Myl9와 인간 CD69 세포외 영역 단백질 사이의 결합에 대해 농도-의존적 저해를 보여주었다(도 13a 내지 13e). 대조군 항체는 저해 활성을 보여주지 않았다. 도면에서 백그라운드는, 인간 Myl9-His가 고정되지 않은 웰 내에서 3 x Flag-인간 CD69 EC 단백질과 호스래디쉬 퍼옥시다제-표지된 항-Flag(M2) 항체(SIGMA사) 사이의 착색화를 의미한다.
인간 Myl12a 및 인간 Myl12b와 인간 CD69 세포외 영역 단백질의 결합 활성에 대한, 항체 A로부터 제조된 키메라 항체 및 인간화된 항체의 저해 활성의 평가
인간 Myl12a 및 인간 Myl12b와 인간 CD69 세포외 영역 단백질의 결합에 대한, 항체 A로부터 제조된 키메라 항체 및 인간화된 항체의 저해 활성의 평가를 하기 단계들에 따라 ELISA에 의해 수행하였다. 실시예 5에서 제조된 인간 Myl12a-His 및 Myl12b-His를 각각 96-웰 플레이트(Nunc사)의 웰 상으로 코팅하였다. 4℃에서 밤새 인큐베이션한 후, 웰들을 1 x 블록 에이스(DS Pharma Biomedical Co., Ltd사)를 이용하여 실온에서 1시간 동안 블로킹시켰다. 0.02% Tween 20/PBS를 이용하여 3회 세척한 후, 항체 A, 키메라 항체, 인간화된 항체 또는 대조군 항체(인간 IgG2, κ, SIGMA사)를 0.1, 1 및 10 ㎍/mL의 농도까지 50 mM NaOAc(pH 5.5)/150 mM NaCl/0.02% Tween 20에 의해 희석시키고, 웰에 첨가하였다. 실온에서 1시간 동안 인큐베이션하고 3회 세척한 후, 3 x Flag-인간 CD69 EC 단백질을 10 ㎍/mL의 농도까지 50 mM NaOAc(pH 5.5)/150 mM NaCl/0.02% Tween 20에 의해 희석시키고, 웰에 첨가하였다. 실온에서 1시간 30분 동안 인큐베이션하고 50 mM NaOAc(pH 5.5)/150 mM NaCl/0.02% Tween 20으로 3회 세척한 후, 호스래디쉬 퍼옥시다제-표지된 항-Flag(M2) 항체(SIGMA사)를 첨가하고, 이를 실온에서 1시간 동안 인큐베이션하였다. 5회 세척한 후, TMBZ(3,3',5,5'-테트라메틸벤지딘) 용액을 웰에 첨가하고, 이를 실온에서 5분 내지 20분 동안 인큐베이션하였다. 동일한 양의 반응 소광 용액(2 N H2SO4)를 웰에 첨가하고, 450 nm에서의 흡광도를 마이크로플레이트 판독기(Thermo Scientific사)를 이용하여 판독하였다.
항체 A로부터 제조된 키메라 항체 및 인간화된 항체는 인간 Myl12a 및 Myl12b와 인간 CD69 세포외 영역 단백질 사이의 결합에 대해 농도-의존적 저해를 보여주었다(도 14a 내지 도 14d). 대조군 항체는 저해 활성을 보여주지 않았다. 도면에서 백그라운드는, 인간 Myl12a-His 또는 인간 Myl12b-His가 고정되지 않은 웰 내에서 3 x Flag-인간 CD69 EC 단백질과 호스래디쉬 퍼옥시다제-표지된 항-Flag(M2) 항체(SIGMA사) 사이의 착색화를 의미한다.
실시예 7: 항체 A 및 항-PD-1 항체의 병용 투여의 항-종양 효과
10% FBS 및 페니실린/스트렙토마이신를 함유하는 RPMI1640 배양 배지 내에서 배양된 마우스 결장직장암 세포주 CT26.WT(ATCC No. CRT-2638)를 인산염 완충 식염수 내에서 현탁시켜, 1 x 107개 세포/mL 농도의 세포 현탁액을 수득하였다. 이러한 세포 현탁액을 6주령의 마우스(BALB/c, 암컷, Charles River Laboratories Japan, Inc.사)의 우측 등 영역에 0.1 mL의 투여량으로 피하 이식하였다. 이식 후 6일째에, 종양의 최장 직경 및 단축을 전자 디지털 칼리퍼(Digimatic(TM) Caliper, Mitutoyo Corporation사)를 이용하여 측정하였다. 종양 부피를 하기 계산식에 의해 계산하였다.
종양 부피(mm3) = 최장 직경(mm) x 단축(mm) x 단축(mm) / 2
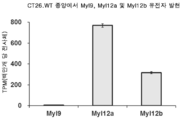
도 15는 마우스 결장직장암 세포주 CT26.WT의 피하 종양 조직의 유전자 발현 분석 결과를 보여준다. 핵산을 CT26.WT 유래의 종양 조직으로부터 TRIzol(등록 상표) 시약(Thermo Fisher Scientific사)에 의해 추출하고, 총 RNA를 Rneasy 미니 키트(Qiagen사)에 의해 제조하였다. 총 RNA로부터, 라이브러리를 RNASeq 분석을 위해 SureSelect 가닥 특이적 RNA 라이브러리 제조 키트(Agilent Technologies사)에 의해 제조하고, 시퀀싱을 HiSeq4000(illumine사)에 의해 수행하였다. 시퀀싱에 의해 수득된 Fastq 파일을 TPM(백만개 당 전사체; Transcript Per Million) 방법에 의해 정규화하고, Myl9, Myl12a 및 Myl12b의 발현을 측정하였다. 종양 조직에서 Myl9의 발현은 낮았고, Myl12a 및 Myl12b의 발현은 높았다.
마우스를, 각각의 그룹의 종양 부피의 평균값이 투여 첫날 종양 부피를 기반으로 거의 동일하도록, 그룹들로 나누었다. 항체 A 및 항-PD-1 항체(BoXCell사, 카탈로그 번호: BE0146)를 인산염 완충 식염수에 의해 2 mg/mL의 용액으로 제조하고, 마우스에게 0.1 mL/마우스의 투여량으로 7일 당 2회 총 4회(암세포 이식 후 제6일, 제9일, 제13일 및 제16일) 복강내 투여하였다. 대조군에서, 인산염 완충 식염수를 마우스에게 0.2 mL/마우스의 투여량으로 7일 당 2회 총 4회(암세포 이식 후 제6일, 제9일, 제13일 및 제16일) 복강내 투여하였다. 각각의 그룹은 7 내지 8 마리의 마우스를 포함하였다.
도 16은 대조군(A), 항체 A 투여군(B), 항-PD-1 항체 투여군(C), 및 항체 A와 항-PD-1 항체의 병용 투여군(D)에서 계산된 종양 부피의 변화를 시험 마지막날(제30일)까지 경과일(passage of day)에 따라 보여준다. 도 16의 B에 보여진 바와 같이, 항체 A는 종양 성장을 거의 저해하지 않았다. 항-PD-1 항체 단독은 대조군과 비교하여 종양 성장을 약간 저해하였다(도 16의 C). 항체 A와 항-PD-1 항체의 병용 투여는 종양 성장을 유의하게 저해하였으며, 종양-소멸 마우스(2/10)가 확인되었다(도 16의 D). 상기 결과는 항체 A와 항-PD-1 항체의 병용 투여에 의한 상승작용 효과를 제안한다.
산업상 이용 가능성
Myl9에 결합하고 Myl9와 CD69 사이의 상호작용을 저해할 수 있는 항-Myl9 항체 또는 이의 Myl9 결합 단편, 뿐만 아니라 이들을 포함하는 약제학적 조성물이 제공될 수 있다. 본 발명에 따른 항체 또는 약제학적 조성물은 Myl9와 CD69 사이의 상호작용으로 인한 질병, 예를 들어 알레르기성 기도 염증, 예컨대 천식, 만성 알레르기 비염, 또는 일부 부비동염, 기도 염증 질병, 예컨대 알레르기성 기도 염증에 포함되지 않는 부비동염, 및 염증성 장질환, 예컨대 궤양성 대장염, 크론병, 베체트병, 및 호산구 위장 기능 장애의 치료에 유용할 수 있다. 본 발명에 따른 항체는 또한, Myl12와 CD69 사이의 상호작용을 저해할 수 있다. 이에, 본 발명에 따른 항체 또는 약제학적 조성물은 면역 체크포인트 저해제와 조합된 경우, Myl9 및/또는 Myl12와 CD69 사이의 상호작용과 연관된 질병, 예를 들어 종양, 예컨대 결장직장암, 악성 흑색종, 비소세포폐암, 신세포암종, 악성 림프종, 다발성 골수종, 두경부암, 요로상피암, 유방암, 간세포암종, 위암, 식도암, 난소암, 소세포폐암, 중피종 및 자궁내막암의 치료에 유용할 수 있다.