KR20180086431A - L-오르니틴 페닐아세테이트의 제제 - Google Patents
L-오르니틴 페닐아세테이트의 제제 Download PDFInfo
- Publication number
- KR20180086431A KR20180086431A KR1020187016373A KR20187016373A KR20180086431A KR 20180086431 A KR20180086431 A KR 20180086431A KR 1020187016373 A KR1020187016373 A KR 1020187016373A KR 20187016373 A KR20187016373 A KR 20187016373A KR 20180086431 A KR20180086431 A KR 20180086431A
- Authority
- KR
- South Korea
- Prior art keywords
- plasma
- phenylacetylglutamine
- phenylacetate
- oral
- pharmaceutical preparation
- Prior art date
Links
- LRSYFEZBIMVWRY-VWMHFEHESA-N (2s)-2,5-diaminopentanoic acid;2-phenylacetic acid Chemical compound NCCC[C@H](N)C(O)=O.OC(=O)CC1=CC=CC=C1 LRSYFEZBIMVWRY-VWMHFEHESA-N 0.000 title claims abstract description 96
- 238000002360 preparation method Methods 0.000 title claims abstract description 8
- WLJVXDMOQOGPHL-UHFFFAOYSA-N phenylacetic acid Chemical compound OC(=O)CC1=CC=CC=C1 WLJVXDMOQOGPHL-UHFFFAOYSA-N 0.000 claims abstract description 156
- 238000000034 method Methods 0.000 claims abstract description 67
- 208000007386 hepatic encephalopathy Diseases 0.000 claims abstract description 28
- 208000019423 liver disease Diseases 0.000 claims abstract description 22
- IPBVNPXQWQGGJP-UHFFFAOYSA-N acetic acid phenyl ester Natural products CC(=O)OC1=CC=CC=C1 IPBVNPXQWQGGJP-UHFFFAOYSA-N 0.000 claims abstract description 21
- 229940049953 phenylacetate Drugs 0.000 claims abstract description 21
- 208000019425 cirrhosis of liver Diseases 0.000 claims abstract description 14
- 206010020575 Hyperammonaemia Diseases 0.000 claims abstract description 13
- 208000007232 portal hypertension Diseases 0.000 claims abstract description 7
- 208000007788 Acute Liver Failure Diseases 0.000 claims abstract description 5
- 206010000804 Acute hepatic failure Diseases 0.000 claims abstract description 5
- 206010019663 Hepatic failure Diseases 0.000 claims abstract description 5
- 231100000836 acute liver failure Toxicity 0.000 claims abstract description 5
- 208000007903 liver failure Diseases 0.000 claims abstract description 5
- 231100000835 liver failure Toxicity 0.000 claims abstract description 5
- JFLIEFSWGNOPJJ-JTQLQIEISA-N N(2)-phenylacetyl-L-glutamine Chemical compound NC(=O)CC[C@@H](C(O)=O)NC(=O)CC1=CC=CC=C1 JFLIEFSWGNOPJJ-JTQLQIEISA-N 0.000 claims description 80
- 229960003424 phenylacetic acid Drugs 0.000 claims description 66
- 239000003279 phenylacetic acid Substances 0.000 claims description 65
- 239000000203 mixture Substances 0.000 claims description 52
- 238000009472 formulation Methods 0.000 claims description 40
- 239000002552 dosage form Substances 0.000 claims description 26
- 239000008183 oral pharmaceutical preparation Substances 0.000 claims description 24
- 239000012729 immediate-release (IR) formulation Substances 0.000 claims description 21
- 239000008194 pharmaceutical composition Substances 0.000 claims description 20
- 238000006243 chemical reaction Methods 0.000 claims description 17
- 239000000825 pharmaceutical preparation Substances 0.000 claims description 12
- 239000008203 oral pharmaceutical composition Substances 0.000 claims description 8
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 6
- 239000003937 drug carrier Substances 0.000 claims description 5
- 239000003826 tablet Substances 0.000 claims description 5
- 239000007788 liquid Substances 0.000 claims description 4
- 239000006193 liquid solution Substances 0.000 claims description 4
- 239000002775 capsule Substances 0.000 claims description 3
- 239000000843 powder Substances 0.000 claims description 3
- 208000028547 Inborn Urea Cycle disease Diseases 0.000 claims description 2
- 239000008188 pellet Substances 0.000 claims description 2
- 239000006187 pill Substances 0.000 claims description 2
- 208000030954 urea cycle disease Diseases 0.000 claims description 2
- PTSRBZOZSRJCKX-JTQLQIEISA-N N-Phenylacetylglutamic acid Chemical compound OC(=O)CC[C@@H](C(O)=O)NC(=O)CC1=CC=CC=C1 PTSRBZOZSRJCKX-JTQLQIEISA-N 0.000 claims 4
- 238000011282 treatment Methods 0.000 abstract description 53
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 abstract description 9
- 208000035475 disorder Diseases 0.000 abstract description 7
- 208000030090 Acute Disease Diseases 0.000 abstract description 4
- 230000001154 acute effect Effects 0.000 abstract description 4
- 206010028980 Neoplasm Diseases 0.000 abstract 1
- 201000011510 cancer Diseases 0.000 abstract 1
- ZSDBFLMJVAGKOU-UHFFFAOYSA-N glycerol phenylbutyrate Chemical compound C=1C=CC=CC=1CCCC(=O)OCC(OC(=O)CCCC=1C=CC=CC=1)COC(=O)CCCC1=CC=CC=C1 ZSDBFLMJVAGKOU-UHFFFAOYSA-N 0.000 description 29
- 210000002700 urine Anatomy 0.000 description 23
- 229940115145 ravicti Drugs 0.000 description 20
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 18
- 239000003814 drug Substances 0.000 description 18
- 229940079593 drug Drugs 0.000 description 15
- 238000013265 extended release Methods 0.000 description 13
- 238000013270 controlled release Methods 0.000 description 12
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 11
- 238000001990 intravenous administration Methods 0.000 description 10
- 229940100688 oral solution Drugs 0.000 description 10
- 150000003839 salts Chemical class 0.000 description 10
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 9
- 229910021529 ammonia Inorganic materials 0.000 description 9
- 239000008280 blood Substances 0.000 description 9
- 210000004369 blood Anatomy 0.000 description 9
- JCQLYHFGKNRPGE-FCVZTGTOSA-N lactulose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 JCQLYHFGKNRPGE-FCVZTGTOSA-N 0.000 description 9
- 229960000511 lactulose Drugs 0.000 description 9
- PFCRQPBOOFTZGQ-UHFFFAOYSA-N lactulose keto form Natural products OCC(=O)C(O)C(C(O)CO)OC1OC(CO)C(O)C(O)C1O PFCRQPBOOFTZGQ-UHFFFAOYSA-N 0.000 description 9
- 229960003104 ornithine Drugs 0.000 description 9
- 230000029142 excretion Effects 0.000 description 8
- 235000020937 fasting conditions Nutrition 0.000 description 8
- 229960002815 glycerol phenylbutyrate Drugs 0.000 description 8
- 206010016654 Fibrosis Diseases 0.000 description 7
- 150000001875 compounds Chemical class 0.000 description 7
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 6
- 230000000670 limiting effect Effects 0.000 description 6
- 239000002207 metabolite Substances 0.000 description 6
- 239000006186 oral dosage form Substances 0.000 description 6
- 239000000651 prodrug Substances 0.000 description 6
- 229940002612 prodrug Drugs 0.000 description 6
- 239000003795 chemical substances by application Substances 0.000 description 5
- 230000004087 circulation Effects 0.000 description 5
- 210000004185 liver Anatomy 0.000 description 5
- 230000001225 therapeutic effect Effects 0.000 description 5
- 208000012671 Gastrointestinal haemorrhages Diseases 0.000 description 4
- 238000009825 accumulation Methods 0.000 description 4
- 230000007882 cirrhosis Effects 0.000 description 4
- 208000030304 gastrointestinal bleeding Diseases 0.000 description 4
- 238000001727 in vivo Methods 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 210000005228 liver tissue Anatomy 0.000 description 4
- 239000008177 pharmaceutical agent Substances 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 206010048962 Brain oedema Diseases 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 206010040047 Sepsis Diseases 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 150000001412 amines Chemical class 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 208000006752 brain edema Diseases 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 230000004761 fibrosis Effects 0.000 description 3
- 230000003908 liver function Effects 0.000 description 3
- 235000016709 nutrition Nutrition 0.000 description 3
- 230000036470 plasma concentration Effects 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- OBKXEAXTFZPCHS-UHFFFAOYSA-N 4-phenylbutyric acid Chemical compound OC(=O)CCCC1=CC=CC=C1 OBKXEAXTFZPCHS-UHFFFAOYSA-N 0.000 description 2
- 229940121848 Ammonia scavenger Drugs 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- BPYKTIZUTYGOLE-IFADSCNNSA-N Bilirubin Chemical compound N1C(=O)C(C)=C(C=C)\C1=C\C1=C(C)C(CCC(O)=O)=C(CC2=C(C(C)=C(\C=C/3C(=C(C=C)C(=O)N\3)C)N2)CCC(O)=O)N1 BPYKTIZUTYGOLE-IFADSCNNSA-N 0.000 description 2
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 2
- 206010010071 Coma Diseases 0.000 description 2
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- 208000034486 Multi-organ failure Diseases 0.000 description 2
- 208000010718 Multiple Organ Failure Diseases 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 201000009454 Portal vein thrombosis Diseases 0.000 description 2
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- IXUZXIMQZIMPSQ-ZBRNBAAYSA-N [(4s)-4-amino-4-carboxybutyl]azanium;(2s)-2-amino-4-hydroxy-4-oxobutanoate Chemical compound OC(=O)[C@@H](N)CCC[NH3+].[O-]C(=O)[C@@H](N)CC(O)=O IXUZXIMQZIMPSQ-ZBRNBAAYSA-N 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 239000002671 adjuvant Substances 0.000 description 2
- 230000017531 blood circulation Effects 0.000 description 2
- 239000011575 calcium Substances 0.000 description 2
- 229910052791 calcium Inorganic materials 0.000 description 2
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Chemical compound [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 230000018044 dehydration Effects 0.000 description 2
- 238000006297 dehydration reaction Methods 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 235000013305 food Nutrition 0.000 description 2
- 230000037406 food intake Effects 0.000 description 2
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 2
- 230000001771 impaired effect Effects 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 150000007529 inorganic bases Chemical class 0.000 description 2
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 230000003340 mental effect Effects 0.000 description 2
- 150000007522 mineralic acids Chemical class 0.000 description 2
- 208000029744 multiple organ dysfunction syndrome Diseases 0.000 description 2
- 230000000050 nutritive effect Effects 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 150000007530 organic bases Chemical class 0.000 description 2
- 108010049063 ornithylaspartate Proteins 0.000 description 2
- 229950009215 phenylbutanoic acid Drugs 0.000 description 2
- 239000011591 potassium Substances 0.000 description 2
- 229910052700 potassium Inorganic materials 0.000 description 2
- 230000001172 regenerating effect Effects 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 231100000241 scar Toxicity 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 239000003440 toxic substance Substances 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- WLJVXDMOQOGPHL-PPJXEINESA-N 2-phenylacetic acid Chemical compound O[14C](=O)CC1=CC=CC=C1 WLJVXDMOQOGPHL-PPJXEINESA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 208000002467 Acute-On-Chronic Liver Failure Diseases 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- BMFMQGXDDJALKQ-BYPYZUCNSA-N Argininic acid Chemical compound NC(N)=NCCC[C@H](O)C(O)=O BMFMQGXDDJALKQ-BYPYZUCNSA-N 0.000 description 1
- 206010003445 Ascites Diseases 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 1
- 208000007204 Brain death Diseases 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 206010010356 Congenital anomaly Diseases 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 108010010256 Dietary Proteins Proteins 0.000 description 1
- 102000015781 Dietary Proteins Human genes 0.000 description 1
- 241000792859 Enema Species 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 208000000624 Esophageal and Gastric Varices Diseases 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 208000026350 Inborn Genetic disease Diseases 0.000 description 1
- 206010023126 Jaundice Diseases 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- -1 L-ornithine cation Chemical class 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- 206010067125 Liver injury Diseases 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- GXCLVBGFBYZDAG-UHFFFAOYSA-N N-[2-(1H-indol-3-yl)ethyl]-N-methylprop-2-en-1-amine Chemical compound CN(CCC1=CNC2=C1C=CC=C2)CC=C GXCLVBGFBYZDAG-UHFFFAOYSA-N 0.000 description 1
- 229930193140 Neomycin Natural products 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 208000001647 Renal Insufficiency Diseases 0.000 description 1
- 208000004756 Respiratory Insufficiency Diseases 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 229920002125 Sokalan® Polymers 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 208000010513 Stupor Diseases 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 240000006474 Theobroma bicolor Species 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- 206010056091 Varices oesophageal Diseases 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- 210000001015 abdomen Anatomy 0.000 description 1
- 239000003070 absorption delaying agent Substances 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 239000008186 active pharmaceutical agent Substances 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 230000009798 acute exacerbation Effects 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 229940064746 ammonul Drugs 0.000 description 1
- 238000000540 analysis of variance Methods 0.000 description 1
- 125000000129 anionic group Chemical group 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000003466 anti-cipated effect Effects 0.000 description 1
- 230000002421 anti-septic effect Effects 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid group Chemical group C(C1=CC=CC=C1)(=O)O WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 230000008499 blood brain barrier function Effects 0.000 description 1
- 210000001218 blood-brain barrier Anatomy 0.000 description 1
- 229940057372 buphenyl Drugs 0.000 description 1
- 239000007894 caplet Substances 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 230000003920 cognitive function Effects 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 208000027744 congestion Diseases 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 239000011162 core material Substances 0.000 description 1
- 235000005687 corn oil Nutrition 0.000 description 1
- 239000002285 corn oil Substances 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- WZHCOOQXZCIUNC-UHFFFAOYSA-N cyclandelate Chemical compound C1C(C)(C)CC(C)CC1OC(=O)C(O)C1=CC=CC=C1 WZHCOOQXZCIUNC-UHFFFAOYSA-N 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 235000021245 dietary protein Nutrition 0.000 description 1
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 1
- 230000003292 diminished effect Effects 0.000 description 1
- 239000002612 dispersion medium Substances 0.000 description 1
- 230000002526 effect on cardiovascular system Effects 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 239000007920 enema Substances 0.000 description 1
- 229940095399 enema Drugs 0.000 description 1
- 208000024170 esophageal varices Diseases 0.000 description 1
- 201000010120 esophageal varix Diseases 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 208000016361 genetic disease Diseases 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- 231100000234 hepatic damage Toxicity 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 239000006207 intravenous dosage form Substances 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 230000002427 irreversible effect Effects 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 201000006370 kidney failure Diseases 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 239000006194 liquid suspension Substances 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 230000008818 liver damage Effects 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- WPBNNNQJVZRUHP-UHFFFAOYSA-L manganese(2+);methyl n-[[2-(methoxycarbonylcarbamothioylamino)phenyl]carbamothioyl]carbamate;n-[2-(sulfidocarbothioylamino)ethyl]carbamodithioate Chemical compound [Mn+2].[S-]C(=S)NCCNC([S-])=S.COC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OC WPBNNNQJVZRUHP-UHFFFAOYSA-L 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 235000012054 meals Nutrition 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 230000001338 necrotic effect Effects 0.000 description 1
- 229960004927 neomycin Drugs 0.000 description 1
- 230000002887 neurotoxic effect Effects 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 229940000673 orphan drug Drugs 0.000 description 1
- 239000002859 orphan drug Substances 0.000 description 1
- 235000019629 palatability Nutrition 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 206010034674 peritonitis Diseases 0.000 description 1
- WLJVXDMOQOGPHL-UHFFFAOYSA-M phenylacetate Chemical compound [O-]C(=O)CC1=CC=CC=C1 WLJVXDMOQOGPHL-UHFFFAOYSA-M 0.000 description 1
- 239000008055 phosphate buffer solution Substances 0.000 description 1
- 231100000614 poison Toxicity 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229920001592 potato starch Polymers 0.000 description 1
- 230000001376 precipitating effect Effects 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 150000003141 primary amines Chemical class 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 235000013772 propylene glycol Nutrition 0.000 description 1
- 235000018102 proteins Nutrition 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 239000002516 radical scavenger Substances 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 201000004193 respiratory failure Diseases 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 238000005070 sampling Methods 0.000 description 1
- 230000037390 scarring Effects 0.000 description 1
- 150000003335 secondary amines Chemical class 0.000 description 1
- 208000013223 septicemia Diseases 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- WXMKPNITSTVMEF-UHFFFAOYSA-M sodium benzoate Chemical compound [Na+].[O-]C(=O)C1=CC=CC=C1 WXMKPNITSTVMEF-UHFFFAOYSA-M 0.000 description 1
- 239000004299 sodium benzoate Substances 0.000 description 1
- 235000010234 sodium benzoate Nutrition 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- VPZRWNZGLKXFOE-UHFFFAOYSA-M sodium phenylbutyrate Chemical compound [Na+].[O-]C(=O)CCCC1=CC=CC=C1 VPZRWNZGLKXFOE-UHFFFAOYSA-M 0.000 description 1
- 229960002232 sodium phenylbutyrate Drugs 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 235000010356 sorbitol Nutrition 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 230000001839 systemic circulation Effects 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 150000003512 tertiary amines Chemical class 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 231100000167 toxic agent Toxicity 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 108700012359 toxins Proteins 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- YFTHZRPMJXBUME-UHFFFAOYSA-N tripropylamine Chemical compound CCCN(CCC)CCC YFTHZRPMJXBUME-UHFFFAOYSA-N 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5073—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals having two or more different coatings optionally including drug-containing subcoatings
- A61K9/5078—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals having two or more different coatings optionally including drug-containing subcoatings with drug-free core
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/192—Carboxylic acids, e.g. valproic acid having aromatic groups, e.g. sulindac, 2-aryl-propionic acids, ethacrynic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/197—Carboxylic acids, e.g. valproic acid having an amino group the amino and the carboxyl groups being attached to the same acyclic carbon chain, e.g. gamma-aminobutyric acid [GABA], beta-alanine, epsilon-aminocaproic acid or pantothenic acid
- A61K31/198—Alpha-amino acids, e.g. alanine or edetic acid [EDTA]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0087—Galenical forms not covered by A61K9/02 - A61K9/7023
- A61K9/0095—Drinks; Beverages; Syrups; Compositions for reconstitution thereof, e.g. powders or tablets to be dispersed in a glass of water; Veterinary drenches
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/02—Drugs for disorders of the urinary system of urine or of the urinary tract, e.g. urine acidifiers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5005—Wall or coating material
- A61K9/5021—Organic macromolecular compounds
- A61K9/5031—Organic macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyethylene glycol, poly(lactide-co-glycolide)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5005—Wall or coating material
- A61K9/5021—Organic macromolecular compounds
- A61K9/5036—Polysaccharides, e.g. gums, alginate; Cyclodextrin
- A61K9/5042—Cellulose; Cellulose derivatives, e.g. phthalate or acetate succinate esters of hydroxypropyl methylcellulose
Landscapes
- Health & Medical Sciences (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Gastroenterology & Hepatology (AREA)
- Hematology (AREA)
- Diabetes (AREA)
- Physiology (AREA)
- Nutrition Science (AREA)
- Heart & Thoracic Surgery (AREA)
- Urology & Nephrology (AREA)
- Cardiology (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Obesity (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicinal Preparation (AREA)
Abstract
본 발명의 일부 구체예는 L-오르니틴 페닐아세테이트의 경구 제제 및 이를 이용하는 방법에 관한 것이다. 이러한 경구 제제는 다양한 급성 및 만성 간 질환 및 장애, 예를 들어, 급성 간 부전, 간 경화, 간 대상부전, 문맥 고혈압, 간성뇌증을 가진 환자, 또는 요소 순환 장애를 가진 환자에서 고암모니아혈증을 치료하기 위한 L-오르니틴 페닐아세테이트의 표준 정맥 내 투여에 대해 대안적인 투여 경로를 제공한다.
Description
본 출원은 L-오르니틴 페닐아세테이트의 경구 제제를 포함하는 약학적 조성물 및 다양한 급성 및 만성 간 질환 및 장애, 예를 들어, 급성 간 부전(liver failure), 간 경화(liver cirrhosis), 간 대상부전(liver decompensation), 문맥 고혈압(portal hypertension), 간성뇌증(hepatic encephalopathy)을 가지는 환자, 또는 요소 순환 장애(urea cycle disorder) 환자에서 고암모니아혈증(hyperammonemia)을 치료하기 위한 투여 방법 및 용도에 관한 것이다.
간 질환은 시간에 걸쳐 간 조직의 점진적인 파괴로 특징지어지며, 건강하고 재생되는 간 조직은 천천히 흉터 및 괴사 조직으로 대체된다. 이는 간 경화로 알려져 있다. 정상적인 간 기능이 손상되고 흉터 조직이 점차적으로 간을 통한 혈류를 감소시킨다. 정상적인 재생 간 조직이 손실되면서, 영양분, 호르몬, 약물 및 독소가 더 이상 효과적으로 처리되지 않는다. 이는 암모니아의 축적으로 이어지는, 장관을 통해 흡수된 단백질의 비정상적 제거; 황달(jaundice)을 생성하는, 혈액 내 빌리루빈(bilirubin)의 축적으로 이어지는, 비정상적 배설; 복부 내 액체 축적(복수(ascites))으로 이어지는, 증가된 사인곡선적(sinusoidal) 압력; 및 증가된 문맥 혈압 및 식도 정맥류로 이어지는, 흉터 간 조직이 혈류 장벽으로서 역학을 하는 문맥 고혈압(및 문맥전신션트(portosystemic shunting))를 포함하는 증상을 야기한다.
만성 간 질환 환자는 꽤 안정한 임상 상태에 있을 수 있으며 증상이 거의 또는 전혀 나타나지 않을 수 있다. 그러나, 이러한 환자들은 급성-만성(acute-on-chronic) 간 부전을 야기할 수 있는, 상태의 급격한 악화의 위험이 있다. 비록 감소된 수준이긴 하나, 간이 기능을 할 수 있는 "대상성(compensated)" 상태로부터 간 기능이 실패하는 "비대상성(decompensated)" 상태로의 이러한 전환은 촉발성 이벤트(precipitating event)의 효과를 포함한다. 만성 간 질환과 관련된 촉발성 이벤트는 위장관 출혈, 감염(패혈증(sepsis)), 문맥 혈전증(portal vein thrombosis) 및 탈수를 포함한다.
간성뇌증(HE)은 비대상성 간경화의 일반적인 합병증이다; 이는 심지어 간 이식 후에도 생존에 상당한 부정적인 영향을 가지고 인지 기능에서 돌이킬 수 없는 손상과 관련 있다. 간경화 환자의 약 60 내지 70%는 적어도 신경인지 손상의 미묘한 징후를 가지며, HE는 입원 환자에서 주요 진단이다. 현성(overt) HE는 간경화 인구의 대략 30%의 유병률(prevalence)을 가지며, 미국에서 매년 약 150,000건의 입원을 차지한다.
간성뇌증(HE)은 급성 또는 만성 간 질환 및 자발적 문맥전신션트(portosystemic venous shunting)와 같은 다양한 임상적 상황에서 발생하는 복잡한 신경정신 장애이다. 간성뇌증의 초기 단계에서, 집중력 저하, 혼란 및 방향감장애와 같은 미묘한 정신적 변화가 발생한다. 심한 경우, 간성뇌증은 혼미(stupor), 혼수(coma), 뇌 부기(뇌 부종(cerebral edema)) 및 사망으로 이어질 수 있다. 만성 간 질환의 결과로서 HE 발생한 환자의 경우, HE의 발명은 종종 위장관 출혈, 감염(패혈증(sepsis)), 문맥 혈전증(portal vein thrombosis) 또는 탈수와 같은 임상적으로 촉발성 이벤트의 결과이다.
위장관 출혈은 및 문맥전신션트는 보통 간에 의해 대사되는 독성 물질이 간을 우회하여 체순환계(systemic circulation)로 들어가 혈액-뇌 장벽을 가로지르게 하여 중추 신경계에 직접 또는 간접적인 신경독소 효과를 발휘한다. 암모니아 축적은 간성뇌증 및 다기관 부전(호흡 부전, 심혈관 부전, 신장 부전)의 진행에 중요한 역할을 하는 것으로 생각된다. 암모니아 외에, 위장관 출혈 직후 발생하는 패혈증(septicaemia)(또는 세균성 복막염(bacterial peritonitis)) 또한 간성뇌증에 기여하는 요인일 수 있다.
간 대상부전은 다기관 부전 및 간성뇌증으로 이어질 수 있다. 간성뇌증의 초기 단계에서, 집중력 저하 또는 간단한 물체를 만들 수 없는 것과 같은 미묘한 정신적 변화가 발생한다. 심한 경우, 간성뇌증은 혼미, 혼수, 뇌 부기 및 사망으로 이어질 수 있다.
요소 순환 장애 또는 요소 순환 결함은 혈류로부터 암모니아를 제거하는 책임이 있는 요소 순환에서의 효소 중 하나가 결핍됨으로써 발생하는 유전적 장애이다. 일반적으로, 요소는 소변으로 옮겨져 체내에서 제거된다. 요소 순환 장애에서, 질소는 독성 물질인 암모니아 형태로 축적되고 체내에서 제거되지 않는다. 소듐 페닐부티레이트가 이러한 상태의 관리에 사용될 수 있다고 보고되었다. 예를 들어, Batshaw, M.L. et al., "요소 순환 장애를 위한 대안적 경로 치료: 20년 후", J. Pediatr. (2001) 138 (1 Suppl): S46-S55 참고.
간성뇌증 환자를 위한 일반적인 치료는 암모니아의 농도를 감소시키는 전략을 포함한다. 이들은 식이 단백질 섭취의 제한; 락툴로스, 네오마이신, L-오르니틴 L-아스파르테이트(LOLA), 또는 소듐 벤조에이트의 투여; 및 청결한 관장(enema)을 포함한다. 요소 순환 장애(UCDs)로 인한 고암모니아혈증의 치료를 위한, 페닐아세트산(예, AMMONUL®) 또는 예를 들어, 페닐부티레이트(BUPHENYL®)와 같은 페닐아세트산의 프로드러그(prodrug) 또는 암모니아 스캐빈저(scavenger)로서 글리세롤 페닐부티레이트(RAVICTI®)를 포함하는 현재 시판되는 제품이 있다. RAVICTI®는 또한 임상 시험에서 평가되어 간성뇌증의 치료를 위한 예비 효능을 보여주었다. 예를 들어, Rockey D. et al., "간성뇌증에서의 글리세롤 페닐부티레이트의 무작위, 이중-블라인드, 대조 연구", Hepatology, 2014, 59(3):1073-1083 참고. 또한, L-오르니틴 페닐아세테이트는 고암모니아혈증 및 간성뇌증의 효과적인 치료제로 보고되었다. Jalan 등은 L-오르니틴 페닐아세테이트가 암모니아 강하에 유용하다는 것을 데이터가 임상 연구를 보고하였다. Jalan et al., "L-오르니틴 페닐아세테이트(OP): 고암모니아혈증 및 간성뇌증을 위한 신규한 치료제", Med Hypotheses 2007; 69(5):1064-69 참고. 또한, 미국 출원 Nos. 2008/0119554, 2010/0280119, 및 2013/0211135 참고, 이들 각각은 그 전체가 본원에 참고로 인용된다.
L-오르니틴 페닐아세테이트는 미국 식품의약국(FDA)에 의해 희귀 의약품(orphan drug) 지위를 승인 받았고, 고암모니아혈증 및 이로 인한 간성뇌증의 치료를 위해 신속심사권(fast track designation)을 승인 받았다. 현재, L-오르니틴 페닐아세테이트는 비대상성 간 경화 환자에서 현성 HE의 치료를 위한 임상 연구 중이다. 환자는 간 손상의 기본 심각도에 따라 5일 동안 하루에 10, 15 또는 20 g의 복용량으로 L-오르니틴 페닐아세테이트의 지속정맥주입(continuous intravenous infusion)을 받는다.
전형적으로, L-오르니틴 페닐아세테이트는 물 또는 수용액에서 우수한 용해도를 가진다. 급성 또는 만성 간 질환의 치료를 위한 L-오르니틴 페닐아세테이트의 모든 공지된 임상 연구에서, L-오르니틴 페닐아세테이트는 인간 연구에서 예를 들어, 1일 또는 5일까지의 기간에 걸쳐 정맥주입에 의해 투여된다. 환자 편의를 향상시키기 위한 대안적 투여 경로를 개발할 필요가 존재한다.
본 발명의 일부 구체예는 약 0.1 g 내지 약 10 g의 경구 복용량의 L-오르니틴 페닐아세테이트, 및 하나 또는 그 이상의 약학적으로 허용 가능한 부형제 또는 담체를 포함하는 경구 약학적 제제에 관한 것이다. 일부 구체예에서, 상기 제제는 경구 투여 시 L-오르니틴 페닐아세테이트의 즉각적인 방출 프로파일을 제공한다. 일부 구체예에서, 상기 L-오르니틴 페닐아세테이트의 경구 복용량은 약 2 g 내지 약 8 g이다. 일 구체예에서, 상기 L-오르니틴 페닐아세테이트의 경구 복용량은 약 5 g이다. 또 다른 구체예에서, 상기 L-오르니틴 페닐아세테이트의 경구 복용량은 약 2.5 g이다. 일부 다른 구체예에서, 상기 경구 약학적 제제는 L-오르니틴 페닐아세테이트의 제어된 방출을 제공한다.
본 발명의 일부 구체예는 고암모니아혈증을 치료 또는 개선하기 위한 방법으로서, 본원에 기재된 바와 같은 L-오르니틴 페닐아세테이트를 포함하는 경구 약학적 제제를 이를 필요로 하는 대상에게 투여하는 것을 포함하는 방법에 관한 것이다. 일부 구체예에서, 상기 대상은 급성 간 부전 또는 만성 간 질환을 가진다. 일부 구체예에서, 상기 대상은 간 경화 또는 간 대상부전을 가진다. 일부 구체예에서, 상기 대상은 간성뇌증을 가진다. 여전히 일부 구체예에서, 상기 대상은 문맥 고혈압을 가진다. 일부 추가 구체예에서, 상기 만성 간 질환 또는 간 경화는 차일드-퓨(Child-Pugh) 등급 A, B 또는 C로 분류된다.
본 발명의 일부 구체예는 고암모니아혈증을 치료하기 위한 방법으로서, L-오르니틴 페닐아세테이트를 포함하는 약학적 제제를 이를 필요로 하는 대상에게 투여하는 것을 포함하고, 상기 약학적 제제는 약 10 μg/mL 내지 약 150 μg/mL 범위의 페닐아세트산의 혈장 Cmax를 제공하는 것인 방법에 관한 것이다. 일부 구체예에서, 상기 약학적 제제는 또한 약 5 μg/mL 내지 약 100 μg/mL 범위의 페닐아세틸글루타민의 혈장 Cmax를 제공한다. 일부 구체예에서, 상기 L-오르니틴 페닐아세테이트의 경구 약학적 제제는 투여 후 L-오르니틴 페닐아세테이트의 제어된 방출을 제공한다. 일부 다른 구체예에서, 상기 L-오르니틴 페닐아세테이트의 경구 약학적 제제는 투여 후 L-오르니틴 페닐아세테이트의 즉각적인 방출을 제공한다. 일부 구체예에서, 상기 약학적 제제는 약 0.1 g 내지 약 10 g의 경구 복용량으로 L-오르니틴 페닐아세테이트를 포함한다.
본 발명의 일부 구체예는 L-오르니틴 페닐아세테이트의 경구 제제에 관한 것이다. 상기 제제의 일부 구체예는 RAVICTI®과 비교하여 동등한 페닐아세테이트를 훨씬 적은 복용량으로 사용하여, 저용량 제제를 제공한다. 이러한 일부 구체예는 즉각적인 방출 제제이다. 상기 제제의 다른 구체예는 제어된 방출 또는 연장된 방출 시스템을 제공한다.
정의
본원에서 사용되는 섹션 제목은 단지 조직적인 목적을 위한 것이며, 기재된 내용을 제한하는 것으로 해석되어서는 안 된다.
달리 정의되지 않는 한, 본원에서 사용된 모든 기술적 및 과학적 용어는 통상의 당업자 중 하나가 일반적으로 이해하는 것과 동일한 의미를 가진다. 용어 "포함하는(including)"뿐만 아니라 "포함하다(include)", "포함하다(includes)", 및 "포함된(included)"과 같은 다른 형태의 사용은 제한적이지 않다. 용어 "가지는(having)"뿐만 아니라 "가지다(have)", "가지다(has)", 및 "가진(had)"과 같은 다른 형태의 사용은 제한적이지 않다. 즉, 상기 용어들은 문구 "적어도 가지는" 또는 "적어도 포함하는"과 동의어로 해석되어야 한다. 예를 들어, 과정의 맥락에서 사용된 경우, 용어 "포함하는(comprising)"은 과정이 적어도 인용된 단계를 포함하지만, 추가 단계를 포함할 수 있음을 의미한다. 화합물, 조성물, 제제, 또는 장치의 맥락에서 사용된 경우, 용어 "포함하는(comprising)"은 화합물, 조성물, 제제, 또는 장치가 적어도 인용된 특징 또는 성분을 포함하지만, 추가 특징 또는 성분을 포함할 수 있음을 의미한다.
본원에서 사용된, 일반적인 유기 약어는 다음과 같이 정의된다:
AUC
곡선 아래 면적
AUC0-t
농도 대 시간 곡선 아래 면적, 시간 = 0(영)부터 최종 정량 가능한 농도의 시간까지
AUC0-inf 시간에 따른 혈장 농도 곡선 아래 면적, 무한 시간으로 외삽
CL
총 혈장 제거
C12
약물 투여 후 12시간에서의 약물 농도
Cmax
최대 혈장 농도
F
절대 생체이용률(bioavailability) 값(%)
Hr
시간
IR
즉각적인 방출
ORN
오르니틴
PAA
페닐아세트산(또는 페닐아세테이트의 짝염기
PAGN
페닐아세틸글루타민
PD
약역학
PK
약동학
본원에서 사용된 용어 "즉각적인 방출"은 당업자가 이해하는 통상의 의미를 가지며, 비-제한적 예로서, 투여 후 상대적으로 단기간에 복용 형태로부터 약물의 방출을 포함한다.
본원에서 사용된 용어 "제어된 방출" 및 용어 "연장된 방출"은 당업자가 이해하는 통상의 의미를 가지며, 비-제한적 예로서, 연장된 기간에 걸쳐 복용 형태로부터 약물의 제어된 방출을 포함한다. 예를 들어, 일부 구체예에서, 제어된 방출 또는 연장된 방출 제제는 비교 가능한 즉각적인 방출 형태의 방출 속도보다 실질적으로 더 긴 방출 속도를 가지는 것들이다. 두 용어는 상호 교환하여 사용할 수 있다.
본원에서 사용된 용어 "약"은 양(quantity), 값, 수, 백분율, 양(amount), 또는 중량의 해당 유형을 위한 통상의 당업자 중 하나가 수용 가능한 것으로 고려되는 편차에 의해 기준 양(quantity), 값, 수, 백분율, 양(amount), 또는 중량으로부터 변화하는 양(quantity), 값, 수, 백분율, 양(amount), 또는 중량을 지칭한다. 다양한 구체예에서, 용어 "약"은 기준 양(quantity), 값, 수, 백분율, 양(amount), 또는 중량에 대해 20, 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 또는 1%의 편차를 지칭한다.
본원에서 사용된 용어 "경구 복용 형태"는 당업자가 이해하는 통상의 의미를 가지며, 비-제한적 예로서, 필, 정제, 코어, 캡슐, 당의정(caplet), 루스 파우더(loose powder), 액체 용액 또는 현탁액을 포함하는, 인간에게 경구적으로 투여 가능한 형태의 약물 또는 약물들의 제제를 포함한다.
본원에서 사용된 용어 "페닐아세틸글루타민"은 페닐아세트산 및 글루타민의 컨쥬게이션에 의해 형성된 생성물을 지칭한다. 이는 인간 소변에서 발견될 수 있는 통상의 대사산물이다. 이는 다음과 같은 화학 구조를 가진다: .
본원에서 사용된, 용어 "24시간에 걸쳐 페닐아세테이트의 페닐아세틸글루타민으로의 전환 백분율(%)"은 환자에게 투여된 페닐아세테이트의 질량 백분율(%)를 지칭하며, 이는 소변에서 24시간에 걸쳐 수집된 페닐아세틸글루타민으로 전환된다.
용어 "약학적으로 허용 가능한 담체" 또는 "약학적으로 허용 가능한 부형제"는 임의의 및 모든 용매, 분산 매질, 코팅. 항균제 및 항진균제, 등장제 및 흡수 지연제 등을 포함한다. 약학적 활성 물질을 위한 이러한 매질 및 제제(agent)의 용도는 당해 업계에 공지되어 있다. 임의의 통상적인 매질 또는 제제가 활성 성분과 양립 불가능한 경우를 제외하고, 치료 조성물 또는 제제에서의 이들의 사용은 고려된다. 보충적 활성 성분 또한 조성물 또는 제제에 포함될 수 있다. 또한, 당해 업계에서 통상적으로 사용되는 것과 같은 다양한 애주번트(adjuvant)가 포함될 수 있다. 이들 및 다른 이러한 화합물은 문헌, 예를 들어, Merch Index(Merck & Company, Rahway,NJ)에 기재되어 있다. 약학적 조성물에 다양한 성분의 포함에 대한 고려사항은, 예를 들어, Gilman et al. (Eds.) (1990); Goodman and Gilman's: 치료법의 약리학 기초, 8판., Pergamon Press에 기재되어 있다.
용어 "약학적으로 허용 가능한 염"은 생물학적으로 또는 달리 바람직하지 않은, 바람직한 구체예의 화합물의 생물학적 유효성 및 특성을 보유하는 염을 지칭한다. 많은 경우에서, 바람직한 구체예의 화합물은 아미노기 및/또는 카르복실기 또는 이와 유사한 기의 존재 때문에 산 및/또는 염기 염을 형성할 수 있다. 약학적으로 허용 가능한 산 첨가 염은 무기산 또는 유기산으로 형성될 수 있다. 염이 유도될 수 있는 무기산은, 예를 들어, 염산, 브롬화수소 산, 황산, 질산, 인산 등을 포함한다. 염이 유도될 수 있는 유기산은, 예를 들어, 아세트산, 프로피온산, 글리콜산, 피루브산, 옥살산, 말레산, 말론산, 숙신산, 푸마르산, 타르타르산, 시트르산, 벤조산, 신남산, 만델산, 메탄술폰산, 에탄술폰산, p-톨루엔술폰산, 살리실산 등을 포함한다. 약학적으로 허용 가능한 염기 첨가 염은 무기 및 유기 염기로 형성될 수 있다. 염이 유도될 수 있는 무기 염기는, 예를 들어, 나트륨, 칼륨, 리튬, 암모늄, 칼슘, 마그네슘, 철, 아연, 구리, 망간, 알루미늄 등을 포함한다; 특히 바람직하게는 암모늄, 칼륨, 나트륨, 칼슘 및 마그네슘 염이다. 염이 유도될 수 있는 유기 염기는, 예를 들어, 1차, 2차, 및 3차 아민, 자연 발생 치환 아민을 포함하는 치환 아민, 고리형 아민, 염기성 이온 교환 수지 등, 구체적으로는 이소프로필아민, 트리메틸아민, 디에틸아민, 트리에틸아민, 트리프로필아민, 및 에탄올아민을 포함한다. 많은 이러한 1987년 9월 11일에 공개된 염은 Johnson 등의 WO 87/05297(그 전체가 본원에 참고로 인용됨)에 기재된 바와 같이 당해 업계에 공지되어 있다.
본원에서 사용된 "대상"은 인간 또는 비-인간 포유류, 예를 들어, 개, 고양이, 마우스, 랫트, 소, 양, 돼지, 염소, 비-인간 영장류 또는 조류, 예를 들어, 닭, 뿐만 아니라 임의의 다른 척추동물 또는 무척추동물을 의미한다.
본원에서 사용된 "치료하다(treat)", "치료(treatment)", 또는 "치료하는(treating)"은 예방적 및/또는 치료적 목적으로 약학적 조성물/제제를 투여하는 것을 지칭한다. 용어 "예방적 처치"는 아직 질환으로 고통 받고 있지는 않지만 특정 간 질환이 의심되거나 위험이 있는 환자를 처치하는 것을 지칭하며, 상기 처치는 환자에게 간 질환이 발생할 가능성을 감소시킨다. 용어 "치료적 처치"는 이미 간 질환으로 고통 받고 있는 환자에게 치료제를 투여하는 것을 지칭한다.
본원에 기재된 조성물 또는 제제는 바람직하게는 단위 복용 형태로 제공된다. 본원에 사용된, "단위 복용 형태"는 양호한 의학적 진료에 따라, 단일 투여로, 동물, 바람직하게는 포유류 대상에 투여하기에 적합한 화합물의 양을 포함하는 조성물/제제이다. 그러나, 단일 또는 단위 복용 형태의 제조는 용량 형태가 하루에 1회 또는 치료 과정 당 1회 투여되거나 또는 단위 복용 형태가 한번에 투여될 모든 복용량을 포함하는 것을 의미하지 않는다. 이러한 복용 형태는 하루에 1회, 2회, 3회 또는 그 이상 투여될 것으로 고려되며, 단일 투여가 분명하게 배제되지 않더라도, 치료 과정 동안 1회 보다 많이 주어질 수 있다. 또한, 다수 단위 복용 형태는 의도된 전 복용량을 달성하기 위해 실질적으로 동일한 시간에 투여될 수 있다(예를 들어, 둘 또는 그 이상의 정제가 완전한 복용량을 달성하기 위해 환자에 의해 삼켜질 수 있다). 당업자는 제제가 전체 치료 과정을 구체적으로 고려하지 않고, 이러한 결정은 제제보다는 치료 분야의 당업자에게 남겨진다는 것을 인식할 것이다.
본원에서 사용된, "제공하는" 행위는 본원에 기재된 조성물을 공급, 취득, 또는 투여(자가 투여를 포함)하는 것을 포함한다.
본원에서 사용된, 용어 약물을 "투여하는"은 스스로 약물을 얻고 복용하는 개인을 포함한다. 예를 들어, 일부 구체예에서, 개인은 약국으로부터 약물을 얻고, 본원에서 제공된 방법에 따라 약물을 자가-투여한다.
본원에 기재된 임의의 구체예에서, 치료의 방법은 대안적으로 스위스-형 용도 청구항과 같은 용도 청구항을 수반할 수 있다. 예를 들어, 섬유증을 조성물로 치료하는 방법은 대안적으로 섬유증의 치료를 위한 약제의 제조에서의 조성물의 사용, 또는 섬유증의 치료를 위한 조성물의 사용을 수반할 수 있다.
당업자는 약동학적 변수는, 예를 들어, 본원에 제시된 실시예에서 기재한 바와 같이 당업자에 의해 공지되고 받아들여지는 공지된 임상 시험 방법을 사용하여 참고 표준과 비교함으로써 결정될 수 있다는 것을 이해할 것이다. 약물의 약동학이 환자마다 변화할 수 있으므로, 이러한 임상 시험은 일반적으로 다수 환자 및 결과 데이터의 적절한 통계학적 분석을 포함한다(예를 들어, 90% 신뢰도에서 ANOVA). 약동학 변수의 비교는 당업자에 의해 이해되는 바와 같이 복용량-조정 기준(dose-adjusted basis)에서 일 수 있다.
저용량 제제
본 발명의 일부 구체예는 약 0.1 g 내지 약 10 g의 경구 복용량의 L-오르니틴 페닐아세테이트, 및 하나 또는 그 이상의 약학적으로 허용 가능한 부형제 또는 담체를 포함하는 경구 약학적 제제에 관한 것이다. 일부 구체예에서, 상기 제제는 경구 투여 시 L-오르니틴 페닐아세테이트의 즉각적인 방출 프로파일을 제공한다(예를 들어, 액체 용액 또는 현탁액의 형태인 즉각-방출 경구 제제). 다른 구체예는 제어된-방출 또는 연장된 방출 프로파일을 제공한다. 바람직한 구체예에서, 약학적 제제는 경구 약학적 제제이다. 일부 구체에에서, 상기 L-오르니틴 페닐아세테이트는 약 0.5 g, 약 1 g, 약 1.5 g, 약 2 g, 약 2.5 g, 약 3 g, 약 3.5 g, 약 4 g, 약 4.5 g, 약 5 g, 약 5.5 g, 약 6 g, 약 6.5 g, 약 7 g, 약 7.5 g, 약 8 g, 약 8.5 g, 약 9 g, 약 9.5 g, 또는 약 10 g의 복용량, 또는 이전의 임의의 두 값에 의해 정의된 복용량 범위이다(예를 들어, 약 1 g 내지 약 9 g, 약 2 g 내지 약 8 g, 약 3 g 내지 약 7 g, 약 4 g 내지 약 6 g, 약 1 g 내지 약 6 g, 약 1 g 내지 약 5 g, 약 1 g 내지 약 4 g, 약 1 g 내지 약 3 g, 약 2 g 내지 약 6 g, 약 2 g 내지 약 5 g, 약 2 g 내지 약 4 g). 일 구체예에서, 상기 경구 복용량은 약 2.5 g이다. 또 다른 구체예에서, 상기 경구 복용량은 약 5 g이다.
일부 구체예에서, 약학적 제제는 단일 단위 복용 형태이다. 일부 다른 구체예에서, 약학적 제제는 둘 또는 그 이상의 단위 복용 형태(즉, 분할 복용)이다. 예를 들어, 경구 복용량이 약 5 g인 경우, 각각 약 1.25 g 또는 1 g의 L-오르니틴 페닐아세테이트를 포함하는 네 개 또는 다섯 개의 정제 형태로 제공될 수 있다. 일부 구체예에서, 단위 복용 형태는 정제, 캡슐, 필, 펠렛(pellet), 자유-유동(free-flowing) 분말, 또는 액체이다. 일 구체예에서, 단위 복용 형태는 5 g의 L-오르니틴 페닐아세테이트를 포함하는 액체 용액이다.
일부 구체예에서, 약학적 제제는 24시간에 걸쳐 약 30%를 초과하는, 약 40%를 초과하는, 약 50%를 초과하는, 약 60%를 초과하는, 약 70%를 초과하는, 약 80%를 초과하는, 또는 약 90%를 초과하는 페닐아세테이트의 페닐아세틸글루타민으로의 전환을 제공한다. 일부 추가 구체예에서, 제제는 24시간에 걸쳐 약 80%를 초과하는 페닐아세테이트의 페닐아세틸글루타민으로의 전환을 제공한다. 일부 구체예에서, 전환 효율은 배설된 소변의 페닐아세틸글루타민에 기초하여 결정된다.
일부 구체예에서, 약학적 제제는 12시간에 걸쳐 약 30%를 초과하는, 약 40%를 초과하는, 약 50%를 초과하는, 약 60%를 초과하는, 약 70%를 초과하는, 약 80%를 초과하는, 또는 약 90%를 초과하는 페닐아세테이트의 페닐아세틸글루타민으로의 전환을 제공한다. 일부 추가 구체예에서, 제제는 12시간에 걸쳐 약 60%를 초과하는 페닐아세테이트의 페닐아세틸글루타민으로의 전환을 제공한다. 일부 구체예에서, 전환 효율은 배설된 소변의 페닐아세틸글루타민에 기초하여 결정된다.
본원에 기재된 저용량 약학적 제제는 임의의 적합한 경로에 의해 투여될 수 있으며, 예를 들어, 경구, 정맥 내, 위 내, 복강 내 또는 혈관 내 경로에 의해 투여될 수 있다. 바람직한 구체예에서, L-오르니틴의 약학적 제제는 경구 복용 형태, 예를 들어, 경구 용액이다. 또 다른 구체예에서, 약학적 제제는 정맥 내 복용 형태이다.
치료의 방법
본 발명의 일부 구체예는 고암모니아혈증을 치료 또는 개선하기 위한 방법으로서, 본원에 기재된 바와 같은 L-오르니틴 페닐아세테이트의 유효량을 포함하는 약학적 제제, 특히 본원에 기재된 경구 약학적 제제를 이를 필요로 하는 대상에게 경구 투여하는 것을 포함하는 방법에 관한 것이다. 일부 구체예에서, 상기 대상은 급성 간 부전 또는 만성 간 질환을 가진다. 일부 구체예에서, 상기 대상은 간 경화 또는 간 대상부전을 가진다. 여전히 일부 구체예에서, 상기 대상은 문맥 고혈압을 가진다. 일부 이러한 구체예에서, 상기 만성 간 질환 또는 간 경화는 차일드-퓨(Child-Pugh) 등급 A, B 또는 C의 분류를 가진다. 일부 구체예는 차일드-퓨 A의 분류로 간 질환을 가지는 것으로 대상을 확인한 다음 본원에 기재된 조성물을 투여하는 것을 포함한다. 일부 구체예는 차일드-퓨 B의 분류로 간 질환을 가지는 것으로 대상을 확인한 다음 본원에 기재된 조성물을 투여하는 것을 포함한다. 일부 구체예에서, 상기 대상은 간성뇌증을 가진다. 일부 구체예는 차일드-퓨 C의 분류로 간 질환을 가지는 것으로 대상을 확인한 다음 본원에 기재된 조성물을 투여하는 것을 포함한다. 여전히 일부 구체예에서, 상기 대상은 문맥 고혈압을 가진다. 일부 구체예에서, 상기 대상은 요소 순환 장애를 가진다. 일부 다른 구체예에서, 상기 대상은 최근 락툴로스의 치료를 중단하였으며, 예를 들어, 대상은 1일, 2일, 3일, 4일, 5일, 6일, 1주, 2주, 3주, 4주, 또는 그 이상 동안 락툴로스의 치료를 중단하였다.
본원에 기재된 방법의 일부 구체예에서, 본원에 기재된 방법은 약 10 μg/mL 내지 약 150 μg/mL 범위의 페닐아세트산의 혈장 Cmax를 제공한다. 일부 이러한 구체예에서, 페닐아세트산의 혈장 Cmax는 약 20 μg/mL 내지 약 140 μg/mL이다. 일부 이러한 구체예에서, 페닐아세트산의 혈장 Cmax는 약 30 μg/mL 내지 약 130 μg/mL이다. 일부 이러한 구체예에서, 페닐아세트산의 혈장 Cmax는 약 40 μg/mL 내지 약 120 μg/mL이다. 일부 추가 구체예에서, 페닐아세트산의 혈장 Cmax는 약 50 μg/mL 내지 약 110 μg/mL이다.
본원에 기재된 방법의 일부 구체예에서, 대사산물 페닐아세틸글루타민의 혈장 Cmax는 약 5 μg/mL 내지 약 100 μg/mL 범위이다. 일부 이러한 구체예에서, 대사산물 페닐아세틸글루타민의 혈장 Cmax는 약 10 μg/mL 내지 약 80 μg/mL이다. 일부 이러한 구체예에서, 대사산물 페닐아세틸글루타민의 혈장 Cmax는 약 20 μg/mL 내지 약 60 μg/mL이다. 일부 이러한 구체예에서, 대사산물 페닐아세틸글루타민의 혈장 Cmax는 약 25 μg/mL 내지 약 50 μg/mL이다. 일부 추가 구체예에서, 대사산물 페닐아세틸글루타민의 혈장 Cmax는 약 30 μg/mL 내지 약 45 μg/mL이다.
본 발명의 일부 구체예는 고암모니아혈증을 치료하기 위한 방법으로서, L-오르니틴 페닐아세테이트를 포함하는 경구 약학적 제제를 이를 필요로 하는 대상에게 투여하는 것을 포함하고, 상기 약학적 제제는 약 10 μg/mL 내지 약 150 μg/mL 범위의 페닐아세트산의 혈장 Cmax를 제공하는 것인 방법에 관한 것이다. 특히, L-오르니틴 페닐아세테이트를 포함하는 경구 약학적 제제는 약 10 μg/mL, 약 15 μg/mL, 약 20 μg/mL, 약 25 μg/mL, 약 30 μg/mL, 약 35 μg/mL, 약 40 μg/mL, 약 45 μg/mL, 약 50 μg/mL, 약 55 μg/mL, 약 60 μg/mL, 약 65 μg/mL, 약 70 μg/mL, 약 75 μg/mL, 약 80 μg/mL, 약 85 μg/mL, 약 90 μg/mL, 약 95 μg/mL, 약 100 μg/mL, 약 105 μg/mL, 약 110 μg/mL, 약 115 μg/mL, 약 120 μg/mL, 약 125 μg/mL, 약 130 μg/mL, 약 135 μg/mL, 약 140 μg/mL, 약 145 μg/mL, 또는 약 150 μg/mL, 또는 이전의 두 임의의 값에 의해 정의된 범위의 페닐아세트산의 혈장 Cmax를 제공한다. 일 구체예에서, 페닐아세트산의 혈장 Cmax 수준은 약 20 μg/mL 내지 약 140 μg/mL이다. 또 다른 구체예에서, 페닐아세트산의 혈장 Cmax 수준은 약 30 μg/mL 내지 약 130 μg/mL이다. 여전히 또 다른 구체예에서, 페닐아세트산의 혈장 Cmax 수준은 약 40 μg/mL 내지 약 120 μg/mL이다. 추가 구체예에서, 페닐아세트산의 혈장 Cmax 수준은 약 50 μg/mL 내지 약 110 μg/mL이다. 일부 구체예에서, 페닐아세트산의 혈장 AUC0-t 또는 AUC0-inf는 약 100 내지 약 1000 hr*μg/mL, 약 150 hr*μg/mL 내지 약 900 hr*μg/mL, 약 200 hr*μg/mL 내지 약 800 hr*μg/mL, 약 250 hr*μg/mL 내지 약 700 hr*μg/mL, 약 300 hr*μg/mL 내지 약 650 hr*μg/mL, 약 350 hr*μg/mL 내지 약 600 hr*μg/mL, 또는 약 400 hr*μg/mL 내지 약 550 hr*μg/mL이다. 일부 구체예에서, 약학적 제제는 또한 약 5 μg/mL 내지 약 100 μg/mL 범위의 페닐아세틸글루타민의 혈장 Cmax를 제공한다. 특히, L-오르니틴 페닐아세테이트를 포함하는 경구 약학적 제제는 약 5 μg/mL, 약 10 μg/mL, 약 15 μg/mL, 약 20 μg/mL, 약 25 μg/mL, 약 30 μg/mL, 약 35 μg/mL, 약 40 μg/mL, 약 45 μg/mL, 약 50 μg/mL, 약 55 μg/mL, 약 60 μg/mL, 약 65 μg/mL, 약 70 μg/mL, 약 75 μg/mL, 약 80 μg/mL, 약 85 μg/mL, 약 90 μg/mL, 약 95 μg/mL, 또는 약 100 μg/mL, 또는 이전의 두 임의의 값에 의해 정의된 범위의 페닐아세틸글루타민의 혈장 Cmax를 제공한다. 일 구체예에서, 페닐아세틸글루타민의 혈장 Cmax 수준은 약 10 μg/mL 내지 약 80 μg/mL이다. 또 다른 구체예에서, 페닐아세틸글루타민의 혈장 Cmax 수준은 약 20 μg/mL 내지 약 60 μg/mL이다. 그러나 또 다른 구체예에서, 페닐아세틸글루타민의 혈장 Cmax 수준은 약 25 μg/mL 내지 약 50 μg/mL이다. 일부 구체예에서, 페닐아세틸글루타민의 혈장 AUC0-t는 약 25 hr*μg/mL 내지 약 500 hr*μg/mL, 약 50 hr*μg/mL 내지 약 300 hr*μg/mL, 약 100 hr*μg/mL 내지 약 200 hr*μg/mL, 또는 약 120 hr*μg/mL 내지 약 180 hr*μg/mL이다. 일부 구체예에서, 페닐아세틸글루타민의 혈장 AUC0-inf는 약 25 hr*μg/mL 내지 약 500 hr*μg/mL, 약 50 hr*μg/mL 내지 약 400 hr*μg/mL, 약 75 hr*μg/mL 내지 약 300 hr*μg/mL, 약 100 hr*μg/mL 내지 약 250 hr*μg/mL, 또는 약 150 hr*μg/mL 내지 약 200 hr*μg/mL 이다.
본원에 기재된 방법의 일부 구체예에서, 경구 약학적 제제는 공복 상태 하에서 투여된다. 일부 다른 구체예에서, 경구 약학적 제제는 영양 상태 하에서, 예를 들어, 동시에 또는 식사 후 60분 이내에 투여된다.
본원에 기재된 방법의 일부 구체예에서, L-오르니틴 페닐아세테이트의 경구 약학적 제제 투여 후 L-오르니틴 페닐아세테이트의 제어된 방출을 제공한다. 일부 다른 구체예에서, L-오르니틴 페닐아세테이트의 경구 약학적 제제는 투여 후 L-오르니틴 페닐아세테이트의 즉각적인 방출을 제공한다.
본원에 기재된 방법의 일부 구체예에서, L-오르니틴 페닐아세테이트는 하루에 약 0.1 g 내지 약 50 g, 하루에 약 0.5 g 내지 약 15 g, 하루에 약 1 g 내지 약 40 g, 하루에 약 1.5 g 내지 약 35 g, 하루에 약 2 g 내지 약 30 g, 하루에 약 2.5 g 내지 약 25 g, 하루에 약 3 g 내지 약 20 g, 또는 하루에 약 5 g 내지 약 15 g의 양으로 투여된다. 일부 구체예에서, 약학적 제제는 하루에 적어도 1회 투여를 위한 것이다. 일부 추가 구체예에서, 약학적 제제는 하루에 2회 또는 그 이상 투여를 위한 것이다. 일 구체예에서, 약학적 제제는 1일 3회 경구 투여를 위한 것이다.
본원에 기재된 방법의 일부 구체예에서, L-오르니틴 페닐아세테이트는 약 0.1 g 내지 약 10.0 g의 양으로 단일 복용으로서 투여된다. 일부 추가 구체예에서, L-오르니틴 페닐아세테이트는 약 2 g 내지 약 8 g의 양으로 단일 복용으로서 투여된다. 다양한 다른 구체예에서, L-오르니틴 페닐아세테이트는 약 1 g 내지 약 9 g, 약 2 g 내지 약 8 g, 약 3 g 내지 약 7 g, 약 4 g 내지 약 6 g, 약 1 g 내지 약 6 g, 약 1 g 내지 약 5 g, 약 1 g 내지 약 4 g, 약 1 g 내지 약 3 g, 약 2 g 내지 약 6 g, 약 2 g 내지 약 5 g, 또는 약 2 g 내지 약 4 g의 범위로 단일 복용으로서 투여된다. 일부 구체예에서, L-오르니틴 페닐아세테이트는 약 2.5 g의 양으로 단일 복용으로서 투여된다. 또 다른 구체예에서, L-오르니틴 페닐아세테이트는 약 5 g의 양으로 단일 복용으로서 투여된다. 일부 이러한 구체예에서, L-오르니틴 페닐아세테이트의 이러한 양을 포함하는 약학적 제제는 단일 경구 복용 형태이다. 일부 다른 이러한 구체예에서, L-오르니틴 페닐아세테이트의 이러한 양을 포함하는 약학적 제제는 2 또는 그 이상 단위 복용 형태이다. 예를 들어, 일부 구체예는 각각 약 0.1 g 내지 약 2 g의 L-오르니틴 페닐아세테이트를 포함하는 1 내지 5 단위 복용 형태, 또는 각각 약 0.5 g 내지 약 1.25 g의 L-오르니틴 페닐아세테이트를 포함하는 약 2 내지 4 단위 복용 형태를 투여하는 것을 포함한다. 일부 구체예는 각각 약 1.25 g의 L-오르니틴 페닐아세테이트를 포함하는 4 단위 복용 형태를 투여하는 것을 포함한다. 일부 구체예는 각각 약 1 g의 L-오르니틴 페닐아세테이트를 포함하는 5 단위 복용 형태를 투여하는 것을 포함한다. 일부 다른 구체예는 약 5 g의 L-오르니틴 페닐아세테이트를 포함하는 1 단위 복용 형태를 투여하는 것을 포함한다. 일 구체예에서, 약학적 제제는 하루에 3회 투여된다. 예를 들어, 한 번에 다수 단위 복용 형태가 투여되는 경우, 다수 단위 복용 투여가 하루에 3회 반복된다. 또 다른 구체예에서, 약학적 제제는 하루에 1회 투여된다.
본원에 기재된 방법의 일부 구체예에서, 약학적 제제는 24시간에 걸쳐 약 30%를 초과하는, 약 40%를 초과하는, 약 50%를 초과하는, 약 60%를 초과하는, 약 70%를 초과하는, 약 80%를 초과하는, 또는 약 90%를 초과하는 페닐아세테이트의 페닐아세틸글루타민으로의 전환을 제공한다. 일부 추가 구체예에서, 약학적 제제는 24시간에 걸쳐 약 80%를 초과하는 페닐아세테이트의 페닐아세틸글루타민으로의 전환을 제공한다. 일부 구체예에서, 전환 효율은 배설된 소변의 페닐아세틸글루타민에 기초하여 결정된다.
본원에 기재된 방법의 일부 구체예에서, 약학적 제제는 12시간에 걸쳐 약 30%를 초과하는, 약 40%를 초과하는, 약 50%를 초과하는, 약 60%를 초과하는, 약 70%를 초과하는, 약 80%를 초과하는, 또는 약 90%를 초과하는 페닐아세테이트의 페닐아세틸글루타민으로의 전환을 제공한다. 일부 추가 구체예에서, 약학적 제제는 12시간에 걸쳐 약 60%를 초과하는 페닐아세테이트의 페닐아세틸글루타민으로의 전환을 제공한다. 일부 구체예에서, 전환 효율은 배설된 소변의 페닐아세틸글루타민에 기초하여 결정된다.
본원에 기재된 혈장 Cmax 또는 AUC 값의 임의의 구체예에서, 이러한 값은 평균 또는 중간 혈장 Cmax 또는 AUC 값으로부터 선택될 수 있다. 일부 구체예에서, 본원에 기재된 혈장 Cmax 및 AUC는 L-오르니틴 페닐아세테이트의 경구 약학적 제제의 단일 복용 투여 후 달성된다. 일부 구체예에서, 본원에 기재된 혈장 Cmax 및 AUC는 L-오르니틴 페닐아세테이트의 경구 약학적 제제의 다수 복용 투여 후 달성되는 정상-상태(stead-state) Cmax 및 AUC이다. 일부 구체예에서, 본원에 기재된 혈장 Cmax 및 AUC는 공복 상태에서 측정된다. 일부 다른 구체예에서, 이러한 PK 변수는 영양 상태에서 측정된다.
이의 약학적으로 허용 가능한 담체 또는 부형제로서 작용할 수 있는 물질의 일부 예는, 락토스, 글루코스, 및 수크로스와 같은, 당; 옥수수 전분 및 감자 전분과 같은, 전분; 소듐 카르복시메틸 셀룰로스, 에틸 셀룰로스, 및 메틸 셀룰로스와 같은, 셀룰로스 및 이의 유도체; 분말 트라가칸트(tragacanth); 몰트; 젤라틴; 탈크; 스테아르산 및 마그네슘 스테아레이트와 같은, 고체 윤활제; 칼슘 설페이트; 땅콩 오일, 목화씨 오일, 참깨 오일, 올리브 오일, 옥수수 오일, 및 코코아버터(theobroma)의 오일과 같은, 식물성 오일; 프로필렌 글리콜, 글리세린, 소르비톨, 만니톨, 및 폴리에틸렌 글리콜과 같은, 폴리올; 아르긴산; TWEENS와 같은, 유화제; 소듐 라우릴 설페이트와 같은, 습윤제; 착색제; 감미제; 정제화제, 안정제; 항산화제; 방부제; 파이로젠-없는(pyrogen-free) 물; 등장성 염수; 및 포스페이트 버퍼 용액이다.
일부 구체예에서, L-오르니틴 페닐아세테이트의 경구 복용 형태는 액체, 특히 액체 용액의 형태일 수 있다. 경구 복용 제제는 또한 본원에서 논의된 경구 용액 제제에 통상적으로 사용되는 것들을 포함하는 통상적인 약학적으로 양립 가능한 보조제, 부형제 또는 담체를 포함할 수 있다.
일부 구체예에서, 본원에 기재된 경구 제제는 이전에 예상했던 것보다 저용량으로 제공한다. 예를 들어, RAVICTI® (글리세롤 페닐부티레이트, 페닐아세테이트의 프로드러그)는 간성뇌증 이벤트의 발생을 낮추기 위해 하루에 2회 6 mL의 복용량(약 1.02 g/mL의 페닐부티레이트를 전달)으로 임상 연구에서 발견되었다. 본원에 기재된 L-오르니틴 페닐아세테이트의 즉각적인 방출 및 제어된 방출 경구 약학적 제제 모두는 RAVICTI® 또는 다른 페닐아세테이트 제제와 비교하여, 실질적으로 낮은 API 복용량의 사용을 허락하면서, PAGN 소변의 배설의 유사한 비율을 제공한다.
우선권 출원에 대한 참고로의 인용
본 출원은 2015년 11월 13일에 제출된 미국 가 특허 출원 No. 62/225,300; 2016년 1월 8일에 제출된 미국 가 특허 출원 No. 62/276,754; 및 2016년 4월 19일에 제출된 미국 출원 No. 15/133,087에 대한 우선권의 이익을 주장한다; 이들 모두는 그 전체가 본원에 참고로 인용된다.
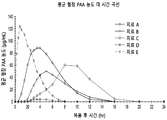
도 1은 제어-방출 제제 A, B, 및 C, RAVICTI®, 및 L-오르니틴 페닐아세테이트의 즉각-방출 경구 제제의 투여 후, 인간에서 페닐아세트산(PAA)의 생체 내(in vivo) 혈장 약동학적 프로파일을 나타내는 선 도표이다.
도 2는 제어-방출 제제 A, B, 및 C, RAVICTI®, 및 L-오르니틴 페닐아세테이트의 즉각-방출 경구 제제의 투여 후, 인간에서 페닐아세틸글루타민(PAGN)의 생체 내 대용 혈장 약역학적 프로파일을 나타내는 선 도표이다.
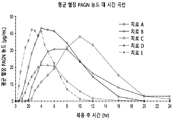
도 3은 4가지 상이한 치료법 하에서, 5 g L-오르니틴 페닐아세테이트 단일 복용량의 투여 후, 만성 간 질환 분류 차일드-퓨 등급 A인 대상에서 페닐아세트산(PAA)의 생체 내 혈장 약동학적 프로파일을 나타내는 선 도표이다.
도 4는 4가지 상이한 치료법 하에서, 5 g L-오르니틴 페닐아세테이트 단일 복용량의 투여 후, 만성 간 질환 분류 차일드-퓨 등급 A인 대상에서 페닐아세틸글루타민(PAGN)의 생체 내 대용 혈장 약역학적 프로파일을 나타내는 선 도표이다.
도 2는 제어-방출 제제 A, B, 및 C, RAVICTI®, 및 L-오르니틴 페닐아세테이트의 즉각-방출 경구 제제의 투여 후, 인간에서 페닐아세틸글루타민(PAGN)의 생체 내 대용 혈장 약역학적 프로파일을 나타내는 선 도표이다.
도 3은 4가지 상이한 치료법 하에서, 5 g L-오르니틴 페닐아세테이트 단일 복용량의 투여 후, 만성 간 질환 분류 차일드-퓨 등급 A인 대상에서 페닐아세트산(PAA)의 생체 내 혈장 약동학적 프로파일을 나타내는 선 도표이다.
도 4는 4가지 상이한 치료법 하에서, 5 g L-오르니틴 페닐아세테이트 단일 복용량의 투여 후, 만성 간 질환 분류 차일드-퓨 등급 A인 대상에서 페닐아세틸글루타민(PAGN)의 생체 내 대용 혈장 약역학적 프로파일을 나타내는 선 도표이다.
실험 및 달성된 결과를 포함하는, 다음의 실시예는 설명의 목적으로만 제공되며, 본원을 제한하는 것으로 해석되어서는 안 된다.
실시예 1 - 건강한 인간에 대한 제Ⅰ상 약동학 연구
페닐아세트산의 프로드러그인 RAVICTI®(글리세롤 페닐부티레이트)와 비교하여, L-오르니틴 페닐아세테이트의 3가지 연장된-방출 경구 복용 형태 후 페닐아세트산 및 페닐아세틸글루타민의 약동학을 평가하기 위해 개방-표지(open-label), 5가지-치료, 5-기간 단일-복용 크로스오버 제1상 인간 임상 연구를 수행하였다. 이 연구는 또한 L-오르니틴 페닐아세테이트의 즉각적인 방출 경구 용액의 단일 복용과 비교하여, L-오르니틴 페닐아세테이트의 3가지 연장된-방출 경구 복용 형태의 단일 복용의 약동학 및 안전성을 비교하였다.
5가지 치료는 다음과 같다: 각각 치료 A, B, 및 C는 10 g 제형 A, B 및 C(각각은 약 5 g PAA와 등가물이다)를 지칭하고, 이러한 제제의 성분은 아래 표 1에 요약하였다; 치료 D는 6 mL RAVICTI®(약 5 g PAA의 등가물)의 단일 경구 복용을 지칭한다; 치료 E는 5 g L-오르니틴 페닐아세테이트(약 2.5 g PAA의 등가물)의 즉각적인 방출 제제의 단일 경구 복용을 지칭한다.
1차적 목적은, 건강한 인간 대상에서 L-오르니틴 페닐아세테이트의 경구 용액 및 페닐아세트산(글리세롤 페닐부티레이트, RAVICTI®)의 프로드러그와 비교하여, L-오르니틴 페닐아세테이트의 3가지 연장된-방출 제제의 단일 경구 복용 후 페닐아세트산(강력한 암모니아 스캐빈저), 오르니틴 및 페닐아세틸글루타민(암모니아 제거에 책임이 있는 최종-생성물)의 혈장 프로파일 및 약동학을 평가하는 것이다. 2차적 목적은 건강한 대상에서 3가지 연장된-방출 제제의 안전성, 내성 및 기호성(palatability)을 결정하는 것이다.
적격인 건강한 성인 남성 및 여성 대상은 균형 잡힌 4×4 라틴장방설계(Latin Square design)를 이용하여 치료 사이에 적어도 7-일 휴약 간격(washout interval)을 가지면서, 크로스오버 방식으로 4 복용 기간에 걸쳐 4가지 치료(치료 A-D)를 처음으로 받도록 등록되었고, 이 후, 최소 7-일 휴약 간격 후 다섯 번째(마지막) 복용 기간에 모든 대상은 치료 E를 받는다. 각각 복용 기간에 복용 후, 대상은 PK 평가를 위해 24시간 까지 연속적인 혈액 및 소변 샘플링을 받았다.
PK 평가
치료 A, B, C, 또는 D가 투여(L-오르니틴의 ER 제제 또는 RAVICTI®)된 복용 기간에, 정맥혈 샘플(각각 5 mL)을 다음과 같은 시점에 수집하였다: 복용 직전(15분 이내), 및 복용 후 0.5, 1, 1.5, 2, 2.5, 3, 3.5, 4, 5, 6, 8, 10, 12, 16, 20 및 24시간. L-오르니틴 페닐아세테이트의 즉각적인 방출 제제가 투여된 복용 기간에, 정맥혈 샘플(각각 5 mL)을 다음과 같은 시점에 수집하였다: 복용 직전(15분 이내), 및 복용 후 0.25, 0.5, 0.75, 1, 1.5, 2, 2.5, 3, 3.5, 4, 4.5, 5, 6, 7, 8, 10, 및 12시간.
또한, 소변 샘플을 다음과 같은 시간 간격으로 수집하였다: 복용 전 1시간 이내(현장 샘플), 및 복용 후 0 내지 4, 4 내지 8, 8 내지, 12, 및 12 내지 24시간의 간격에 걸쳐 누적적으로. 혈장 샘플은 혈액 수집 1시간 이내 원심분리법에 의해 분리하였고, 분석할 때까지 약 -80℃에서 보관하였다. 각각 수집 간격에 대한 총 소변량을 측정하여 기록하였고, 소변의 부분표본은 분석할 때까지 -80℃에서 보관하였다.
생물분석 방법
혈장 샘플은 검증된 LC-MS/MS 방법을 이용하여 페닐아세트산(PAA), 페닐아세틸글루타민(PAGN) 및 오르니틴(ORN)의 농도를 위해 분석하였다. 모든 소변 샘플은 검증된 LC-MS/MS 방법을 이용하여 PAGN의 농도를 위해 분석하였다.
종말점
약동학: 각각 연구 약물의 단일 경구 복용 후, 페닐아세테이트, 오르니틴, 및 페닐아세틸글루타민의 혈장 농도 대 시간 프로파일을 비구획(noncompartmental) PK 방법에의해 분석하였다. 측정된 약동학 변수는 Cmax, tmax, AUC0-t, AUC0-∞, C12 및 t12를 포함한다. 각각 수집 간격 및 전체 24시간 간격에 걸쳐, 소변으로 배설된 PAGN의 양 및 PAGN으로서 소변으로 배설된 PAA 복용량의 백분율 역시 측정되었다.
도 1 및 도 2는 제1상 연구로부터 각각 PAA 및 PAGN의 평균 혈장 프로파일을 도시한다. 도 1은 즉각-방출 용액 및 글리세롤 페닐부티레이트와 비교하여 제어된 방출 제제의 단일 경구 복용 투여 후 평균 혈장 PAA 농도 대 시간 곡선을 나타낸다. 도 2는 즉각-방출 용액 및 글리세롤 페닐부티레이트와 비교하여 제어된 방출 제제의 단일 경구 복용 투여 후 평균 혈장 PAGN 농도 대 시간 곡선을 나타낸다.
3가지 연장된-방출 제제로부터의 혈장 PAA의 평균 최대 농도(Cmax)는 복용 후 4 내지 9시간에 걸쳐 다양한 시점에서 발생하는 약 50 내지 90 μg/mL의 범위였다. 비교를 위해, RAVICTI®은 복용 후 4 내지 6시간에 약 10 μg/mL의 평균 혈장 PAA Cmax를 나타냈다. 6 mL RAVICTI®의 단일 경구 복용 후 혈장 PAA 데이터는 건강한 대상에서 발표된 데이터와 일치한다. 또한, L-오르니틴 페닐아세테이트의 연장된-방출 제제를 사용한 PAA 노출은 RAVICTI®보다 대상간(inter-subject) 변동성이 낮았다.
암모니아 제거의 최종-생성물인 PAGN의 혈장 프로파일은 또한 PAA 프로파일과 유사한 패턴을 보여주었다. L-오르니틴 페닐아세테이트의 3가지 연장된-방출 제제로부터의 혈장 PAGN의 평균 Cmax는 복용 후 4 내지 10시간에 걸쳐 다양한 시점에서 발생하는 약 30 내지 45 μg/mL의 범위였다. 비교를 위해, RAVICTI®은 복용 후 약 5시간에 약 20 내지 25 μg/mL의 평균 혈장 PAGN Cmax를 나타냈다. 이러한 데이터는 또한 건강한 대상에서 발표된 데이터와 일치한다.
24시간에 걸쳐 PAGN의 총 소변의 배설 데이터는 아래 표 2에 요약되어 있다. 평균 PAGN 배설량은 치료 A에서 C까지 비교되었으며, 각각 24시간에 걸쳐 약 80% PAA가 PAGN으로 전환되었다. 대조적으로, RAVICTI®를 사용한 치료 D는 거의 동일한 몰 PAA 복용량에서 치료 A부터 C까지와 비교하여 단지 약 40% 전환 효율을 나타냈다(RAVICTI®의 경우, PAA는 글리세롤 페닐부티레이트 프로드러그로부터 제공된다). 놀랍게도, 즉각적인 방출 제제 치료 E는 또한 약 80% 전환 효율을 나타냈으며, RAVICTI® 군에서 투여된 PAA의 몰 복용량의 거의 절반에서 유사한 평균 PAGN 배설량을 나타냈다.
결론: 제어된-방출 및 즉각적인 방출 제제는 관찰된 독성 또는 심각한 부작용이 없었고, 연구 전반에 걸쳐 내성이 우수했다. 결과는 투여 후 적어도 24시간 동안 모든 시점에서 RAVICTI®(글리세롤 페닐부티레이트)로 얻은 결과를 넘는 평균 혈장 PAA 농도를 가지는 모든 3가지 연장된-방출 제제에 대한 견고하고 연장된-방출 패턴을 나타냈다. 또한, 평균 혈장 PAGN 농도 및 소변의 PAGN 배설은 거의 동일한 몰 PAA 복용량에서 RAVICTI®보다 모든 3가지 연장된-방출 복용에 대해 더 컸다. 또한, L-오르니틴 페닐아세테이트의 즉각적인 방출 제제에 대한 소변의 PAGN 배설은 RAVICTI®에 대해 거의 두 배의 효율을 나타냈다.
실시예 2 - 차일드-퓨 등급 A 대상에서 제Ⅰ상 약동학 연구
이 실시예에서, 5명의 간경화(차일드-퓨 등급 A) 대상에서 영양 상태, 공복 상태하에서 또는 락툴로스의 중단 후 공복상태하에서 투여된 5 g L-오르니틴 페닐아세테이트 경구 용액을 평가하기 위한 단일-복용, 부분적 무작위 임상 실험. 목적은 간경화(차일드-퓨 등급 A) 대상에서 공복 조건하에 L-오르니틴 페닐아세테이트의 단일 5 g 정맥 내 복용과 비교하여, 영양 상태, 공복 상태하에서, 또는 락툴로스의 중단 후 공복 상태하에서 투여된 L-오르니틴 페닐아세테이트 경구 용액의 단일 5 g 복용 후 PAA 및 PAGN의 약동학을 결정하는 것이다.
치료는 다음과 같이 요약된다: 치료 A는 공복 상태하에서 투여된 L-오르니틴 페닐아세테이트 경구 용액의 단일 5 g 경구 복용이다; 치료 B는 영양 상태하에서 투여된 L-오르니틴 페닐아세테이트 경구 용액의 단일 5 g 경구 복용이다; 치료 C는 공복 상태하에서 1시간에 걸쳐 주입된 L-오르니틴 페닐아세테이트 경구 용액의 단일 5 g 정맥 내 복용이다; 및 치료 D는 락툴로스의 중단 후 공복 상태하에서 투여된 L-오르니틴 페닐아세테이트 경구 용액의 단일 5 g 경구 복용이다.
적격인 대상은 1일에 연구 약물의 단일 복용을 받았다. 대상은 약동학 평가를 위한 최종 혈액 샘플이 얻어질 때까지, -1일에 입원에서 제1상 단위로 제한되었다. 복용 기간 1에서, 모든 대상은 정맥 내 L-오르니틴 페닐아세테이트를 받았고(치료 C), 복용 기간 4에서, 모든 대상은 락툴로스의 중단 후 L-오르니틴 페닐아세테이트 경구 용액의 단일 복용을 받았다(치료 D). 치료 A 및 B는 복용 기간 2 및 3 동안 무작위 방식으로 투여되었다. 복용 기간 1, 2, 및 3의 말기에, 대상은 다음 복용 기간을 위해 병동으로 돌아왔다. 복용 기간 3의 말기에, 모든 대상은 락툴로스를 중단하였다. 연속 복용 기간 사이에 최소 4-일 휴약 간격이 있었다.
약동학 평가
각각 경구 복용(치료 A, B, 및 D) 후, 정맥혈 샘플(각각 5 mL)을 다음과 같은 시점에 수집하였다: 복용 직전(15분 이내), 및 복용 후 0.25, 0.5, 0.75, 1, 1.5, 2, 2.5, 3, 3.5, 4, 5, 6, 7, 8, 10, 및 12시간. 치료 D(복용 기간 4)를 위해, 복용 후 24시간에 추가 혈액 샘플을 얻었다. 정맥 내 복용(치료 C) 후, 정맥혈 샘플(각각 5 mL)을 다음과 같은 시점에 수집하였다: 주입의 시작 직전(15분 이내), 및 주입의 시작 후 0.5시간, 및 주입의 끝 직전, 이어서 주입의 끝 후 10, 20, 30, 45 및 60분, 및 주입의 끝 후 1.5, 2, 2.5, 3, 4, 6, 8, 10, 12, 및 24시간.
또한, 소변 샘플을 각각 치료에 대해 다음과 같은 시간 간격에서 수집하였다: 복용 전 1시간 이내(현장 샘플), 및 복용 후 0 내지 4, 4 내지 8, 및 8 내지, 12시간의 간격에 걸쳐 누적적으로. 치료 C 및 D(복용 기간 1 및 4)를 위해, 소변은 또한 복용 후 12 내지 24시간의 간격에 걸쳐 수집하였다.
도 3 및 도 4는 제1상 연구로부터 각각 PAA 및 PAGN의 평균 혈장 프로파일을 도시한다. 도 3은 상기 기재된 4가지 치료(치료 A, B, C 및 D)의 투여 후 평균 혈장 PAA 농도 대 시간 곡선을 나타낸다. 도 4는 상기 기재된 4가지 치료 치료 A, B, C 및 D)의 투여 후 평균 혈장 PAGN 농도 대 시간 곡선을 나타낸다. PAA 및 PAGN의 약동학 변수는 표 3 및 표 4에 요약되어 있다.
5 g의 L-오르니틴 페닐아세테이트의 단일 경구 복용 후 차일드-퓨 A 대상에서 PAA의 혈장 노출 데이터 및 PK 변수 추정치는 건강한 대상에서의 이전 데이터로부터의 예상에 기초하여 기대한 바였다.
소수의 대상을 기초로 한 연구는, 차일드-퓨 A 대상에게 5 g의 L-오르니틴 페닐아세테이트의 단일 경구 복용 후 평균 최대 혈장 PAA 농도 (Cmax)는 약간(20%) 낮았고, PAA에 대한 전체 혈장 노출(AUC0-inf)는 건강한 대상보다 약 30% 높았다는 것을 나타냈다. 차일드-퓨 A 대상에서 약간 높은 AUC 값은, 차일드-퓨 A 대상의 느린 신진대사 및 건강한 대상의 약 0.9시간에서 차일드-퓨 A 대상의 1.4시간으로 증가한, 긴 PAA의 반감기 때문일 가능성이 크다. L-오르니틴 페닐아세테이트의 정맥 내 또는 경구 투여 후 혈장 PAA 노출에서 큰 대상간 변동성이 있었다.
L-오르니틴 페닐아세테이트의 경구 복용 후, PAA는 PAA에 대해 96%의 절대 생체이용률 값(F)으로 나타난 바와 같이, 거의 완전하게 생체이용 가능한데, 이는 정맥 내 복용과 비교하여 L-오르니틴 페닐아세테이트의 단일 5 g 경구 복용 후 차일드-퓨 A 대상에서 측정되었다.
락툴로스의 대상은 락툴로스의 휴약 전후 L-오르니틴 페닐아세테이트의 단일 경구 복용의 투여화 유사한 PAA 및 PAGN 혈장 프로파일 및 약동학을 가지는 것으로 나타났다.
PAGN의 혈장 노출 및 약동학 프로파일은 4가지 치료 사이, 즉, 차일드-퓨 A 대상에서 정맥 내 또는 음식물 섭취와 경구 또는 음식물 섭취 없이 경구 또는 락툴로스 없이 5 g L-오르니틴 페닐아세테이트의 단일 경구 복용 후 비교되었다. PAGN의 평균 AUC0-inf는 차일드-퓨 A 대상에서 건강한 대상보다 약간(~10%) 낮았다. 차일드-퓨 대상에서 PAGN의 평균 혈장 반감기는 2.6시간으로 건강한 대상자의 반감기인 1.4시간보다 길었다.
소변의 배설 데이터는 PAGN으로서 소변에서 회수된 평균 백분율 PAA 복용량은 L-오르니틴 페닐아세테이트의 단일 Ⅳ 복용 후 78.3%, 및 L-오르니틴 페닐아세테이트의 단일 경구 복용(치료 D) 후 84.7%임을 보여준다. 치료 A 및 B에서 PAGN으로서 소변에서 회수된 낮은 백분율 PAA 복용량은 짧은 소변 수집 간격, 즉, 12시간 때문일 수 있다.
Claims (51)
- 약 0.1 g 내지 약 10 g의 경구 복용량의 L-오르니틴 페닐아세테이트, 및 하나 또는 그 이상의 약학적으로 허용 가능한 부형제 또는 담체를 포함하는 경구 약학적 제제.
- 제1항에 있어서, 상기 제제는 경구 투여 시 L-오르니틴 페닐아세테이트의 즉각적인 방출 프로파일을 제공하는 것인, 경구 약학적 제제.
- 제1항에 있어서, 상기 L-오르니틴 페닐아세테이트의 경구 복용량이 약 2.5 g인 것인, 경구 약학적 제제.
- 제1항에 있어서, 상기 L-오르니틴 페닐아세테이트의 경구 복용량이 약 5 g인 것인, 경구 약학적 제제.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 상기 제제는 단일 단위 복용 형태인 것인, 경구 약학적 제제.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 상기 제제는 둘 또는 그 이상의 단위 복용 형태인 것인, 경구 약학적 제제.
- 제6항에 있어서, 상기 단위 복용 형태는 정제, 캡슐, 필, 펠렛(pellet), 자유-유동(free-flowing) 분말, 또는 액체인 것인, 경구 약학적 제제.
- 제7항에 있어서, 상기 단위 복용 형태는 액체 용액인 것인, 경구 약학적 제제.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 상기 제제는 24시간에 걸쳐 약 30%를 초과하는 페닐아세테이트의 페닐아세틸글루타민으로의 전환을 제공하는 것인, 경구 약학적 제제.
- 제9항에 있어서, 상기 제제는 24시간에 걸쳐 약 50%를 초과하는 페닐아세테이트의 페닐아세틸글루타민으로의 전환을 제공하는 것인, 경구 약학적 제제.
- 제10항에 있어서, 상기 제제는 24시간에 걸쳐 약 80%를 초과하는 페닐아세테이트의 페닐아세틸글루타민으로의 전환을 제공하는 것인, 경구 약학적 제제.
- 고암모니아혈증(hyperammonemia)을 치료 또는 개선하기 위한 방법으로서, 제1항 내지 제11항 중 어느 한 항에 따른 경구 약학적 제제를 이를 필요로 하는 대상에게 경구 투여하는 것을 포함하는, 방법.
- 제12항에 있어서, 상기 경구 약학적 제제는 약 10 μg/mL 내지 약 120 μg/mL의 페닐아세트산의 혈장 Cmax를 제공하는 것인, 방법.
- 제13항에 있어서, 상기 페닐아세트산의 혈장 Cmax는 약 20μg/mL 내지 약 110 μg/mL인 것인, 방법.
- 제12항 내지 제14항 중 어느 한 항에 있어서, 상기 경구 약학적 제제는 약 10 μg/mL 내지 약 80 μg/mL의 페닐아세틸글루타민의 혈장 Cmax를 제공하는 것인, 방법.
- 제15항에 있어서, 상기 페닐아세틸글루타민의 혈장 Cmax는 20μg/mL 내지 약 45 μg/mL인 것인, 방법.
- 고암모니아혈증(hyperammonemia)을 치료 또는 개선하기 위한 방법으로서, L-오르니틴 페닐아세테이트를 포함하는 약학적 제제를 이를 필요로 하는 대상에게 경구 투여하는 것을 포함하고, 상기 투여는 약 10 μg/mL 내지 약 150 μg/mL 범위의 페닐아세트산의 혈장 Cmax를 제공하는 것인, 방법.
- 제17항에 있어서, 상기 페닐아세트산의 혈장 Cmax 수준이 약 20 μg/mL 내지 약 140 μg/mL인 것인, 방법.
- 제18항에 있어서, 상기 페닐아세트산의 혈장 Cmax 수준이 약 30 μg/mL 내지 약 130 μg/mL인 것인, 방법.
- 제19항에 있어서, 상기 페닐아세트산의 혈장 Cmax 수준이 약 40 μg/mL 내지 약 120 μg/mL인 것인, 방법.
- 제17항 내지 제20항 중 어느 한 항에 있어서, 상기 투여는 약 5 μg/mL 내지 약 100 μg/mL 범위의 페닐아세틸글루타민의 혈장 Cmax를 제공하는 것인, 방법.
- 제21항에 있어서, 상기 페닐아세틸글루타민의 혈장 Cmax는 약 10 μg/mL 내지 약 80 μg/mL인 것인, 방법.
- 제22항에 있어서, 상기 페닐아세틸글루타민의 혈장 Cmax는 약 20 μg/mL 내지 약 60 μg/mL인 것인, 방법.
- 제23항에 있어서, 상기 페닐아세틸글루타민의 혈장 Cmax는 약 25 μg/mL 내지 약 50 μg/mL인 것인, 방법.
- 고암모니아혈증(hyperammonemia)을 치료 또는 개선하기 위한 방법으로서, L-오르니틴 페닐아세테이트를 포함하는 약학적 제제를 이를 필요로 하는 대상에게 경구 투여하는 것을 포함하고, 상기 투여는 약 100 hr*μg/mL 내지 약 1000 hr*μg/mL 범위의 페닐아세트산의 혈장 AUC0-t 또는 AUC0-inf를 제공하는 것인, 방법.
- 제25항에 있어서, 상기 페닐아세트산의 혈장 AUC0-t 또는 AUC0-inf는 약 200 hr*μg/mL 내지 약 800 hr*μg/mL인 것인, 방법.
- 제26항에 있어서, 상기 페닐아세트산의 혈장 AUC0-t 또는 AUC0-inf는 약 350 hr*μg/mL 내지 약 600 hr*μg/mL인 것인, 방법.
- 제26항에 있어서, 상기 페닐아세트산의 혈장 AUC0-t 또는 AUC0-inf는 약 400 hr*μg/mL 내지 약 550 hr*μg/mL인 것인, 방법.
- 제25항 내지 제28항 중 어느 한 항에 있어서, 상기 페닐아세틸글루타민의 혈장 AUC0-t 또는 AUC0-inf는 약 25 hr*μg/mL 내지 약 500 hr*μg/mL인 것인, 방법.
- 제29항에 있어서, 상기 페닐아세틸글루타민의 혈장 AUC0-t는 약 50 hr*μg/mL 내지 약 300 hr*μg/mL인 것인, 방법.
- 제30항에 있어서, 상기 페닐아세틸글루타민의 혈장 AUC0-t는 약 100 hr*μg/mL 내지 약 200 hr*μg/mL인 것인, 방법.
- 제31항에 있어서, 상기 페닐아세틸글루타민의 혈장 AUC0-t는 약 120 hr*μg/mL 내지 약 180 hr*μg/mL인 것인, 방법.
- 제29항에 있어서, 상기 페닐아세틸글루타민의 혈장 AUC0-inf는 약 50 hr*μg/mL 내지 약 400 hr*μg/mL인 것인, 방법.
- 제33항에 있어서, 상기 페닐아세틸글루타민의 혈장 AUC0-inf는 약 75 hr*μg/mL 내지 약 300 hr*μg/mL인 것인, 방법.
- 제34항에 있어서, 상기 페닐아세틸글루타민의 혈장 AUC0-inf는 약 100 hr*μg/mL 내지 약 250 hr*μg/mL인 것인, 방법.
- 제35항에 있어서, 상기 페닐아세틸글루타민의 혈장 AUC0-inf는 약 150 hr*μg/mL 내지 약 200 hr*μg/mL인 것인, 방법.
- 제25항 내지 제36항 중 어느 한 항에 있어서, 상기 약학적 제제는 제1항 내지 제11항 중 어느 한 항으로부터 선택되는 것인, 방법.
- 제12항 내지 제37항 중 어느 한 항에 있어서, 상기 대상은 급성 간 부전 또는 만성 간 질환을 가지는 것인, 방법.
- 제38항에 있어서, 상기 대상은 간 경화 또는 간 대상부전을 가지는 것인, 방법.
- 제38항 또는 제39항에 있어서, 상기 만성 간 질환 또는 간 경화는 차일드-퓨(Child-Pugh) 등급 A, B 또는 C의 분류를 가지는 것인, 방법.
- 제12항 내지 제37항 중 어느 한 항에 있어서, 상기 대상은 간성뇌증(hepatic encephalopathy)을 가지는 것인, 방법.
- 제12항 내지 제37항 중 어느 한 항에 있어서, 상기 대상은 문맥고혈압(portal hypertension)을 가지는 것인, 방법.
- 제12항 내지 제37항 중 어느 한 항에 있어서, 상기 대상은 요소 순환 장애(urea cycle disorder)를 가지는 것인, 방법.
- 제12항 내지 제43항 중 어느 한 항에 있어서, 상기 경구 약학적 제제는 L-오르니틴 페닐아세테이트의 즉각적인 방출을 제공하는 것인, 방법.
- 제12항 내지 제44항 중 어느 한 항에 있어서, 상기 경구 약학적 제제는 적어도 하루에 1회 투여되는 것인, 방법.
- 제12항 내지 제45항 중 어느 한 항에 있어서, 상기 경구 약학적 제제는 하루에 2회 또는 그 이상 투여되는 것인, 방법.
- 제12항 내지 제46항 중 어느 한 항에 있어서, 상기 투여는 24시간에 걸쳐 약 30%를 초과하는 페닐아세테이트의 페닐아세틸글루타민으로의 전환을 제공하는 것인, 방법.
- 제47항에 있어서, 상기 투여는 24시간에 걸쳐 약 50%를 초과하는 페닐아세테이트의 페닐아세틸글루타민으로의 전환을 제공하는 것인, 방법.
- 제48항에 있어서, 상기 투여는 24시간에 걸쳐 약 80%를 초과하는 페닐아세테이트의 페닐아세틸글루타민으로의 전환을 제공하는 것인, 방법.
- 제12항 내지 제49항 중 어느 한 항에 있어서, 각각 약 0.1 g 내지 2 g의 L-오르니틴 페닐아세테이트를 포함하는 1 내지 5 단위 복용 형태를 경구 투여하는 것을 포함하는 것인, 방법.
- 제12항 내지 제50항 중 어느 한 항에 있어서, 각각 약 0.5 g 내지 1.25 g의 L-오르니틴 페닐아세테이트를 포함하는 2 내지 4 단위 복용 형태를 경구 투여하는 것을 포함하는 것인, 방법.
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562255300P | 2015-11-13 | 2015-11-13 | |
| US62/255,300 | 2015-11-13 | ||
| US201662276754P | 2016-01-08 | 2016-01-08 | |
| US62/276,754 | 2016-01-08 | ||
| US15/133,087 US20160338982A1 (en) | 2015-04-20 | 2016-04-19 | Formulations of l-ornithine phenylacetate |
| US15/133,087 | 2016-04-19 | ||
| PCT/US2016/061678 WO2017083758A1 (en) | 2015-11-13 | 2016-11-11 | Formulation of l-ornithine phenylacetate |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20180086431A true KR20180086431A (ko) | 2018-07-31 |
Family
ID=58695607
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187016373A KR20180086431A (ko) | 2015-11-13 | 2016-11-11 | L-오르니틴 페닐아세테이트의 제제 |
Country Status (12)
| Country | Link |
|---|---|
| EP (1) | EP3373923A4 (ko) |
| JP (2) | JP7294807B2 (ko) |
| KR (1) | KR20180086431A (ko) |
| CN (2) | CN108366983A (ko) |
| AU (2) | AU2016353350B2 (ko) |
| BR (1) | BR112018009349A8 (ko) |
| CA (1) | CA3004331A1 (ko) |
| IL (1) | IL258630B2 (ko) |
| MX (2) | MX2018005088A (ko) |
| RU (1) | RU2018113801A (ko) |
| SG (1) | SG11201802987UA (ko) |
| WO (1) | WO2017083758A1 (ko) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JOP20190146A1 (ar) | 2016-12-19 | 2019-06-18 | Axcella Health Inc | تركيبات حمض أميني وطرق لمعالجة أمراض الكبد |
| WO2019036471A1 (en) | 2017-08-14 | 2019-02-21 | Axcella Health Inc. | AMINO ACIDS BRANCHED FOR THE TREATMENT OF LIVER DISEASE |
| AR115585A1 (es) | 2018-06-20 | 2021-02-03 | Axcella Health Inc | Composiciones y métodos para el tratamiento de la infiltración de grasa en músculo |
| CA3157376A1 (en) * | 2019-10-16 | 2021-04-22 | Ocera Therapeutics, Inc. | Dosages and uses of ornithine phenylacetate for treating hyperammonemia |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4783443A (en) | 1986-03-03 | 1988-11-08 | The University Of Chicago | Amino acyl cephalosporin derivatives |
| GB0426141D0 (en) * | 2004-11-26 | 2004-12-29 | Ucl Biomedica Plc | Treatment |
| CN102512408B (zh) | 2004-11-26 | 2015-11-25 | Ucl商业有限公司 | 用于治疗肝性脑病的含有鸟氨酸和苯基乙酸或苯基丁酸的组合物 |
| DE102007009243A1 (de) * | 2007-02-22 | 2008-09-18 | Evonik Röhm Gmbh | Pellets mit einer Wirkstoff-Matrix und einem Polymerüberzug, sowie ein Verfahren zur Herstellung der Pellets |
| AU2015221466B2 (en) | 2009-04-03 | 2017-02-02 | Ocera Therapeutics, Inc. | L-ornithine phenyl acetate and methods of making thereof |
| EP2413924B1 (en) * | 2009-04-03 | 2017-09-27 | Ocera Therapeutics, Inc. | L-ornithine phenyl acetate and methods of making thereof |
| CN102625699B (zh) * | 2009-06-08 | 2014-08-20 | Ucl商业有限公司 | 使用l-鸟氨酸苯乙酸盐治疗门静脉高压和恢复肝功能 |
| AU2014250643B2 (en) | 2009-06-08 | 2016-07-14 | Ocera Therapeutics, Inc. | Treatment of portal hypertension and restoration of liver function using L-ornithine phenylacetate |
| EP2625162B1 (en) * | 2010-10-06 | 2019-03-13 | Ocera Therapeutics, Inc. | Methods of making l-ornithine phenyl acetate |
| CN103705490B (zh) * | 2013-10-31 | 2016-08-17 | 蚌埠丰原医药科技发展有限公司 | 一种门冬氨酸鸟氨酸的缓释制剂及其制备工艺 |
| EP4205735A1 (en) | 2015-04-20 | 2023-07-05 | Ocera Therapeutics, Inc. | Formulations of l-ornithine phenylacetate |
-
2016
- 2016-11-11 BR BR112018009349A patent/BR112018009349A8/pt not_active Application Discontinuation
- 2016-11-11 CA CA3004331A patent/CA3004331A1/en active Pending
- 2016-11-11 JP JP2018524369A patent/JP7294807B2/ja active Active
- 2016-11-11 AU AU2016353350A patent/AU2016353350B2/en not_active Ceased
- 2016-11-11 CN CN201680066488.5A patent/CN108366983A/zh active Pending
- 2016-11-11 SG SG11201802987UA patent/SG11201802987UA/en unknown
- 2016-11-11 RU RU2018113801A patent/RU2018113801A/ru not_active Application Discontinuation
- 2016-11-11 EP EP16865158.6A patent/EP3373923A4/en not_active Withdrawn
- 2016-11-11 KR KR1020187016373A patent/KR20180086431A/ko not_active Application Discontinuation
- 2016-11-11 MX MX2018005088A patent/MX2018005088A/es unknown
- 2016-11-11 WO PCT/US2016/061678 patent/WO2017083758A1/en active Application Filing
- 2016-11-11 CN CN202111062923.6A patent/CN113768863A/zh active Pending
-
2018
- 2018-04-11 IL IL258630A patent/IL258630B2/en unknown
- 2018-04-25 MX MX2022001517A patent/MX2022001517A/es unknown
-
2021
- 2021-12-21 AU AU2021290236A patent/AU2021290236A1/en not_active Abandoned
- 2021-12-28 JP JP2021213640A patent/JP2022058446A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| CA3004331A1 (en) | 2017-05-18 |
| MX2018005088A (es) | 2019-05-16 |
| IL258630B1 (en) | 2023-04-01 |
| IL258630A (en) | 2018-06-28 |
| JP2018533601A (ja) | 2018-11-15 |
| EP3373923A4 (en) | 2019-07-03 |
| SG11201802987UA (en) | 2018-05-30 |
| IL258630B2 (en) | 2023-08-01 |
| EP3373923A1 (en) | 2018-09-19 |
| CN113768863A (zh) | 2021-12-10 |
| WO2017083758A1 (en) | 2017-05-18 |
| BR112018009349A8 (pt) | 2019-02-26 |
| MX2022001517A (es) | 2022-11-16 |
| BR112018009349A2 (pt) | 2018-11-13 |
| AU2016353350B2 (en) | 2021-09-23 |
| CN108366983A (zh) | 2018-08-03 |
| RU2018113801A (ru) | 2019-12-16 |
| JP2022058446A (ja) | 2022-04-12 |
| AU2021290236A1 (en) | 2022-02-10 |
| AU2016353350A1 (en) | 2018-05-10 |
| JP7294807B2 (ja) | 2023-06-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20220202755A1 (en) | Formulations of l-ornithine phenylacetate | |
| US20220184014A1 (en) | Formulations of l-ornithine phenylacetate | |
| AU2012221704B2 (en) | Flumazenil complexes, compositions comprising same and uses thereof | |
| JP2022058446A (ja) | L-オルニチンフェニルアセテート製剤 | |
| CN112188890A (zh) | 治疗铁超负荷的组合物和方法 | |
| KR20120089623A (ko) | 정맥내 투여용 이부프로펜을 이용한 환자의 치료 | |
| KR20120138229A (ko) | 정맥내 투여용 이부프로펜을 이용한 중증 환자의 치료 | |
| US20170290793A1 (en) | Formulations for treating pain | |
| JP5128003B2 (ja) | 腹膜透析患者用の経口医薬組成物及びその用法 | |
| WO2017192458A1 (en) | Compositions and methods of providing thyroid hormone or analogs thereof | |
| CN114432426A (zh) | 肾毒素诱发的肾损伤的治疗和预防 | |
| WO2023245470A1 (zh) | Mdp类似物在制备用于治疗炎症性肠病的药物中的用途 | |
| US10772882B2 (en) | Pulmonary hypertension preventative or therapeutic agent containing crude drug | |
| EP3452077A1 (en) | Compositions and methods of providing thyroid hormone or analogs thereof | |
| IL227742A (en) | Plumzanil complexes, compounds containing them and their uses |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal |