KR20170092543A - 슈퍼-인핸서 부위에서 전사 조절을 표적화하는 방법 - Google Patents
슈퍼-인핸서 부위에서 전사 조절을 표적화하는 방법 Download PDFInfo
- Publication number
- KR20170092543A KR20170092543A KR1020177013707A KR20177013707A KR20170092543A KR 20170092543 A KR20170092543 A KR 20170092543A KR 1020177013707 A KR1020177013707 A KR 1020177013707A KR 20177013707 A KR20177013707 A KR 20177013707A KR 20170092543 A KR20170092543 A KR 20170092543A
- Authority
- KR
- South Korea
- Prior art keywords
- inhibitor
- cyclin
- dependent kinase
- kinase inhibitor
- super
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/352—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom condensed with carbocyclic rings, e.g. methantheline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/403—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil condensed with carbocyclic rings, e.g. carbazole
- A61K31/404—Indoles, e.g. pindolol
- A61K31/4045—Indole-alkylamines; Amides thereof, e.g. serotonin, melatonin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/451—Non condensed piperidines, e.g. piperocaine having a carbocyclic group directly attached to the heterocyclic ring, e.g. glutethimide, meperidine, loperamide, phencyclidine, piminodine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/453—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a six-membered ring with oxygen as a ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
- A61K31/551—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole having two nitrogen atoms, e.g. dilazep
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
- A61K31/551—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole having two nitrogen atoms, e.g. dilazep
- A61K31/5513—1,4-Benzodiazepines, e.g. diazepam or clozapine
- A61K31/5517—1,4-Benzodiazepines, e.g. diazepam or clozapine condensed with five-membered rings having nitrogen as a ring hetero atom, e.g. imidazobenzodiazepines, triazolam
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/713—Double-stranded nucleic acids or oligonucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Abstract
2개 이상의 치료제를 투여함으로써 슈퍼 인핸서를 표적화하는 방법이 제공된다. 상기 방법은 다양한 슈퍼-인핸서-매개된 질환 및 병증, 예컨대 암의 치료에 유용하다. 2개 이상의 치료제를 포함하는 조성물이 또한 제공된다. 요약하면, 본 발명의 실시형태는 슈퍼-인핸서의 2개 이상의 성분의 억제제를 투여함을 포함하는, 질환의 치료 방법을 제공한다.
Description
본 발명은 일반적으로 슈퍼-인핸서 (super-enhancer)로 매개되는 질환의 치료 방법 및 이를 위한 조성물에 관한 것이다.
슈퍼-인핸서는 세포 식별 (cell indentity)을 조절하는 유전자의 발현을 유도하는 DNA의 전사적 활성 부위의 거대 클러스터이다. 슈퍼-인핸서는 암을 포함하나 이에 제한되지 않는 여러 질병 상태에서 이상조절된다. 슈퍼-인핸서는 전사 인자, 보조인자, 염색질 조절자, 신호전달 효소 (예: 키나제) 및 선형 DNA에 대해 반드시 근접해 있지는 않은 다수의 유전자 발현을 동시에 조절하는 거대 컴플렉스를 형성하는 전사 기구 (예: RNA 폴리머라제 II)를 동원한다 [Smith and Shilatifard, 2014, Nature Structural and Molecular Biology 21(3):210-219]. 슈퍼-인핸서는 세포 식별을 결정하거나 유지하기 위해 협력하여 작동하는 유전자 그룹을 조절하는데 세포가 효능을 가지도록 한다. 암세포는 슈퍼-인핸서 컴플렉스를 재프로그램화하여 종양형성, 전이, 및 질환 진행을 야기하는 암 세포의 전사 활성을 변경하는 것으로 입증되었다. 사실상, 암 외의 다양한 질환이 슈퍼-인핸서 컴플렉스 기능에 장애가 생긴 결과 발생한 것으로 추정된다 [Cell 2013, Nov 7;155(4):934-47].
슈퍼-인핸서 컴플렉스의 공지된 성분으로는 사이클린-의존성 키나제 (예: Cdk9), 브로모 및 측외 (bromo and extra terminal: BET) 도메인 단백질 (예: Brd4), 히스톤 데아세틸라제 (HDAC), 히스톤 아세틸트랜스퍼라제 (예: p300), 히스톤 데메틸라제 (예: Lsd1) 및 히스톤 메틸트랜스퍼라제 (예: Dot1L) 등을 포함한다. 이러한 성분들은 보통 일반적인 전사 조절과 관련된다. 그러나, 슈퍼-인핸서 성분의 기능을 억제하는 것은, 일반적인 인핸서 요소로 조절되는 유전자에 비해, 슈퍼-인핸서 조절된 유전자에 대해 보다 지대한 영향을 갖는 것으로 나타났다 [Loven et al., 2013,.Cell 153(2):320-334]. 이러한 관측에 관한 가능한 한가지 요인은, 일반적인 인핸서와 비교하여, 슈퍼-인핸서에 전사 및 염색질 변형 단백질이 풍부하다는 것이다. 예를 들어, 매개체 컴플렉스 (Cdk8 포함) 및 Brd4는 슈퍼-인핸서 및 일반 인핸서 모두에 존재한다. 그러나, 슈퍼-인핸서에서의 매개체 양은 일반 인핸서와 비교하여 25배 더 많은 것으로 밝혀졌다 [Hnisz, et al., 2013, Cell 155:934-947]. 유사하게, 슈퍼-인핸서에서의 Brd4 수준은 일반 인핸서에서의 수준보다 약 20배 더 높은 것으로 밝혀졌다 [Hnisz, et al., 2013, Cell 155:934-947].
슈퍼-인핸서로부터 발현된 유전자는 일부 암에서 질환 진행을 매개하는 것으로 밝혀졌다. 예를 들어, 다발성 골수종 (MM) 종양 세포는 종종 슈퍼-인핸서 요소를 MYC 유전자에 근접하게 배치하는 전좌를 갖는다 [Hnisz, et al., 2013, Cell 155:934-947]. 유사한 변경이 급성 림프구 백혈병 (T-ALL), 폐암, 췌장암, 결장 직장암, 유방암, 만성 골수성 백혈병 (CML), 교모세포종, 림프아구성 (lymphoblastoid), 자궁경부암 및 전립선암을 앓는 환자에서 발견되었다.
진전이 이뤄졌으나, 여전히 슈퍼 인핸서를 표적화하는 개선된 기술 및 슈퍼 인핸서에 의해 매개된 질환을 치료하는 방법이 요구된다. 본 발명은 이러한 필요를 충족시키며 관련된 이점을 제공한다.
요약하면, 본 발명의 실시형태는 슈퍼-인핸서의 2개 이상의 성분의 억제제를 투여함을 포함하는, 질환의 치료 방법을 제공한다. 일 실시형태에서, 본 개시는 슈퍼-인핸서-매개된 질환의 치료를 필요로 하는 포유동물에게 유효량의 적어도 2개의 하기 치료제를 투여함을 포함하는, 상기 포유동물에서 슈퍼-인핸서-매개된 질환을 치료하는 방법을 제공한다:
i) 사이클린-의존성 키나제 억제제;
ii) 브로모도메인 억제제;
iii) 히스톤 메틸트랜스퍼라제 억제제;
iv) 히스톤 데아세틸라제 억제제; 및
v) 히스톤 데메틸라제 억제제.
적어도 2개의 전술한 치료제를 포함하는 약제학적 조성물이 또한 제공된다.
본 발명의 이러한 양태 및 다른 양태는 하기의 상세한 설명의 참조시 명백해 질 것이다. 이를 위하여, 보다 상세한 특정 배경 정보, 절차, 화합물 및/또는 조성물을 설명하는 다양한 참조문헌이 본원에 기재되며, 이들 각각은 그 전체가 본원에 참조로 원용된다.
도면에서, 동일한 참조 번호는 유사한 요소를 식별한다. 도면 내 요소의 크기 및 상대적 위치는 반드시 일정한 비율로 도시되는 것은 아니며, 일부 이러한 요소는 임의로 확대되고 배치되어 그림의 가독성을 향상시킨다. 추가로, 도시된 요소의 특정 형상은 특정 요소의 실제 형상에 관한 임의의 정보를 전달하기 위한 것이 아니며, 단지 도면에서의 용이한 인식을 위해 선택된 것이다.
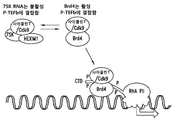
도 1은 전사 개시 부위로의 Cdk9의 Brd4 동원 (recruitment)에 관한 제안된 메커니즘을 예시한다.
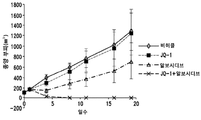
도 2는 Cdk9 및 Brd4 억제제 간의 상승적 효과에 관한 증거를 도시한다.
도 3은 비히클, 알보시디브 (alvocidib), JQ1 또는 알보시디브 및 JQ1의 조합으로 처리된 마우스의 체중 증가를 도시한다.
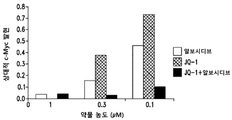
도 4는 슈퍼-인핸서 매개된 전사 수준에서의 Cdk9 및 Brd4 간의 상승적 효과에 관한 증거를 제공한다.
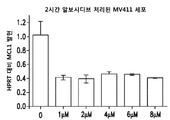
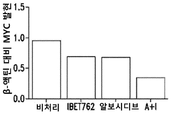
도 5A 및 도 5B는 MV4-11 세포에서 알보시디브에 의한 MYC (도 5A) 및 MCL-1 (도 5B) 발현의 억제를 도시한 막대 그래프이다.
도 6은 알보시디브 또는 BRD4 억제제를 단독으로 및 이들을 조합하여 처리한 MV4-11 세포에 대한 세포자멸 데이터를 나타낸다.
도 7A-C는 단독 작용제로서의 알보시디브, JQ1 (7A), OTX (7B) 및 IBET762 (7C)의 존재 및 이들 조합의 존재 하에서의 MYC 발현을 도시한 그래프이다.
도 8A-C는 단독 작용제로서의 알보시디브, JQ1 (8A), OTX (8B) 및 IBET762 (8C)의 존재 및 이들 조합의 존재 하에서의 MYC 발현에 관한 웨스턴 블롯이다.
도 9A-C는 도 8A-C의 웨스턴 블롯의 정량화를 도시한 막대 그래프이다. JQ1에 관한 데이터는 도 8A에 제공되고, OTX015 데이터는 도 8B에 제공되며, IBET762에 관한 데이터는 도 9C에 제공된다.
도 10A는 알보시디브로 처리한 MV4-11 세포에 관한 대표적인 웨스턴 블롯이다. 도 10B는 도 10A의 웨스턴 블롯의 정량화를 제공한다.
도 11A는 알보시디브로 처리한 MV4-11 세포에서의 용량 증가 실험 (dose escalation experiment)에 관한 대표적인 웨스턴 블롯이다. 도 11B는 도 11A의 웨스턴 블롯의 정량화를 제공한다.
도 12A는 상이한 용량의 알보시디브로 2시간 동안 처리한 MV4-11 세포에 관한 대표적인 웨스턴 블롯이다. 도 12B는 도 12A의 웨스턴 블롯의 정량화를 제공한다.
도 13A는 알보시디브로 처리한 A549 세포에서의 용량 증가 실험에 관한 대표적 웨스턴 블롯이다. 도 13B는 특정한 기간 동안 알보시디브로 처리한 A549 세포의 대표적인 웨스턴 블롯이다.
도 14A는 알보시디브로 처리한 A549 세포에 관한 시간 의존적 실험에 관한 대표적 웨스턴 블롯이다. 도 14B는 SK-N-AS 세포에 대해 동일 처리한 것을 도시한다.
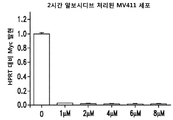
도 15는 시간 의존적 방식으로 알보시디브를 처리한 MV4-11 세포에서의 mRNA 발현의 정량화를 제공한다.
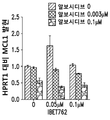
도 16A-C는 단독 작용제로서의 알보시디브, JQ-1 (16A), OTX (16B) 및 IBET762 (16C)의 존재 및 이들 조합의 존재하에서의 MCL-1 발현을 도시한 그래프이다.
도 17은 다양한 용량 농도의, 단독 작용제로서의 알보시디브 및 JQ-1의 존재 및 이들 조합의 존재하에서의 MCL-1 발현을 도시한 그래프이다.
도 18은 단독 작용제로서의 알보시디브 및 JQ-1의 존재 및 이들 조합의 존재하에서의 A549 세포의 c-MYC 발현을 도시한 대표적인 웨스턴 블롯이다.
도 19는 알보시디브 또는 JQ-1 억제제를 단독으로 및 이들을 조합한 존재하에서의 A549 세포에 관한 세포자멸 데이터를 나타낸다.
도 20은 디나시클리브 (dinaciclib) 또는 JQ-1 억제제를 단독으로 및 이들을 조합한 존재하에서의 A549 세포에 관한 세포자멸 데이터를 나타낸다.
도 21A 및 도 21B는 다양한 용량 농도 범위의 알보시디브의 존재하의 A549 세포에서의 MYC 및 MCL-1 발현을 도시하는 그래프이다.
도 22A는 비처리된, 비-표적화 siRNA로 처리된, 및 CDK9-특이적 siRNA로 처리된 CDK9 수준을 도시하는 대표적인 웨스턴 블롯이다. 도 22B는 BET 억제제로 처리되고, 비-표적화 또는 CDK9-특이적 siRNA로 처리된 경우의 A549 세포에 관한 세포자멸 데이터를 나타낸다.
도 1은 전사 개시 부위로의 Cdk9의 Brd4 동원 (recruitment)에 관한 제안된 메커니즘을 예시한다.
도 2는 Cdk9 및 Brd4 억제제 간의 상승적 효과에 관한 증거를 도시한다.
도 3은 비히클, 알보시디브 (alvocidib), JQ1 또는 알보시디브 및 JQ1의 조합으로 처리된 마우스의 체중 증가를 도시한다.
도 4는 슈퍼-인핸서 매개된 전사 수준에서의 Cdk9 및 Brd4 간의 상승적 효과에 관한 증거를 제공한다.
도 5A 및 도 5B는 MV4-11 세포에서 알보시디브에 의한 MYC (도 5A) 및 MCL-1 (도 5B) 발현의 억제를 도시한 막대 그래프이다.
도 6은 알보시디브 또는 BRD4 억제제를 단독으로 및 이들을 조합하여 처리한 MV4-11 세포에 대한 세포자멸 데이터를 나타낸다.
도 7A-C는 단독 작용제로서의 알보시디브, JQ1 (7A), OTX (7B) 및 IBET762 (7C)의 존재 및 이들 조합의 존재 하에서의 MYC 발현을 도시한 그래프이다.
도 8A-C는 단독 작용제로서의 알보시디브, JQ1 (8A), OTX (8B) 및 IBET762 (8C)의 존재 및 이들 조합의 존재 하에서의 MYC 발현에 관한 웨스턴 블롯이다.
도 9A-C는 도 8A-C의 웨스턴 블롯의 정량화를 도시한 막대 그래프이다. JQ1에 관한 데이터는 도 8A에 제공되고, OTX015 데이터는 도 8B에 제공되며, IBET762에 관한 데이터는 도 9C에 제공된다.
도 10A는 알보시디브로 처리한 MV4-11 세포에 관한 대표적인 웨스턴 블롯이다. 도 10B는 도 10A의 웨스턴 블롯의 정량화를 제공한다.
도 11A는 알보시디브로 처리한 MV4-11 세포에서의 용량 증가 실험 (dose escalation experiment)에 관한 대표적인 웨스턴 블롯이다. 도 11B는 도 11A의 웨스턴 블롯의 정량화를 제공한다.
도 12A는 상이한 용량의 알보시디브로 2시간 동안 처리한 MV4-11 세포에 관한 대표적인 웨스턴 블롯이다. 도 12B는 도 12A의 웨스턴 블롯의 정량화를 제공한다.
도 13A는 알보시디브로 처리한 A549 세포에서의 용량 증가 실험에 관한 대표적 웨스턴 블롯이다. 도 13B는 특정한 기간 동안 알보시디브로 처리한 A549 세포의 대표적인 웨스턴 블롯이다.
도 14A는 알보시디브로 처리한 A549 세포에 관한 시간 의존적 실험에 관한 대표적 웨스턴 블롯이다. 도 14B는 SK-N-AS 세포에 대해 동일 처리한 것을 도시한다.
도 15는 시간 의존적 방식으로 알보시디브를 처리한 MV4-11 세포에서의 mRNA 발현의 정량화를 제공한다.
도 16A-C는 단독 작용제로서의 알보시디브, JQ-1 (16A), OTX (16B) 및 IBET762 (16C)의 존재 및 이들 조합의 존재하에서의 MCL-1 발현을 도시한 그래프이다.
도 17은 다양한 용량 농도의, 단독 작용제로서의 알보시디브 및 JQ-1의 존재 및 이들 조합의 존재하에서의 MCL-1 발현을 도시한 그래프이다.
도 18은 단독 작용제로서의 알보시디브 및 JQ-1의 존재 및 이들 조합의 존재하에서의 A549 세포의 c-MYC 발현을 도시한 대표적인 웨스턴 블롯이다.
도 19는 알보시디브 또는 JQ-1 억제제를 단독으로 및 이들을 조합한 존재하에서의 A549 세포에 관한 세포자멸 데이터를 나타낸다.
도 20은 디나시클리브 (dinaciclib) 또는 JQ-1 억제제를 단독으로 및 이들을 조합한 존재하에서의 A549 세포에 관한 세포자멸 데이터를 나타낸다.
도 21A 및 도 21B는 다양한 용량 농도 범위의 알보시디브의 존재하의 A549 세포에서의 MYC 및 MCL-1 발현을 도시하는 그래프이다.
도 22A는 비처리된, 비-표적화 siRNA로 처리된, 및 CDK9-특이적 siRNA로 처리된 CDK9 수준을 도시하는 대표적인 웨스턴 블롯이다. 도 22B는 BET 억제제로 처리되고, 비-표적화 또는 CDK9-특이적 siRNA로 처리된 경우의 A549 세포에 관한 세포자멸 데이터를 나타낸다.
하기의 설명에서, 본 발명의 다양한 실시형태에 관한 완전한 이해를 제공하기 위하여 특정 구체적인 세부사항이 명시된다. 그러나, 당업자는 본 발명이 이러한 세부사항 없이 실시될 수 있다는 것을 이해할 것이다.
하기의 설명에서, 본 발명의 다양한 실시형태에 관한 완전한 이해를 제공하기 위하여 특정 구체적인 세부사항이 명시된다. 그러나, 당업자는 본 발명이 이러한 세부사항 없이 실시될 수 있다는 것을 이해할 것이다.
본 명세서 전반에 걸쳐 "일 실시형태" 또는 "하나의 실시형태"는 실시예와 관련하여 기재된 특이한 특징, 구조 또는 특성이 본 발명의 적어도 하나의 실시형태에 포함된다는 것을 의미한다. 따라서, 본 명세서 전반에 걸친 다양한 부분에서 "일 실시형태에서" 또는 "하나의 실시형태에서"와 같은 문구가 등장함은 반드시 모두 동일한 실시형태를 지칭하는 것은 아니다. 또한, 특이한 특징 또는 특성이 하나 이상의 실시형태에 임의의 적합한 방식으로 조합될 수 있다.
"포유동물"은 인간 및 실험실 동물 및 애완 동물과 같은 가축 (예: 고양이, 개, 돼지, 소, 양, 염소, 말, 토끼), 및 야생 동물과 같은 비-가축 모두를 포함한다.
"약제학적 조성물"은 본 발명의 조성물의 제형 및 생물학적으로 활성인 화합물을 표유동물, 예컨대, 인간에게 전달하기 위해 당업계에 일반적으로 용인되는 배지를 지칭한다. 이러한 배지는 이를 위한 모든 약제학적으로 허용 가능한 담체, 희석제 또는 부형제를 포함한다.
"유효량" 또는 "치료학적 유효량"은, 하기 정의된 바와 같이, 포유동물, 바람직하게는 인간에서의 슈퍼-인핸서 관련된 병증 또는 질환을 치료하기에 충분히 효과적인 본 발명의 화합물의 양을 지칭한다. "치료학적 유효량"을 구성하는 본 발명의 화합물의 양은 화합물, 병증 및 이의 중중도, 투여 방식, 치료될 포유동물의 연령에 따라 달라질 것이나, 당해 분야의 숙련가는 일반적으로 본인의 지식 및 본 개시 내용을 고려하여 이를 결정할 수 있다.
본원에서 사용된 "치료하다" 또는 "치료"는 목적하는 질환 또는 병증을 갖는 목적하는 포유동물, 바람직하게는 인간의 질환 또는 병증의 치료를 포괄하며, 하기를 포함한다:
(i) 포유동물, 특히, 상기 병증을 앓을 가능성이 있으나, 이로 진단되지는 않은 경우의 포유동물에서 발생하는 질환 또는 병증을 예방;
(ii) 상기 질환 또는 병증을 억제, 즉 이의 진행을 정지;
(iii) 상기 질환 또는 병증을 완화, 즉, 상기 질환 또는 병증을 경감; 또는
(iv) 상기 질환 또는 병증에서 비롯한 증상을 완화, 즉, 근본적인 질환 또는 병증을 다루지 않고 통증을 완화.
본원에서 사용된 바와 같이, 용어 "질환" 및 "병증"은 상호교환적으로 사용되거나, 특정 병 또는 병증이 공지된 원인제를 가질 수 없어 (병인이 아직 밝혀지지 않아) 아직 질환으로 인식되지는 않지만 바람직하지 않은 병증 또는 증상으로만 인식된다는 점에서 상이할 수 있으며, 여기서 대개 구체적인 일련의 증상은 임상의에 의해 확인된 것이다.
I. 방법
특정 실시형태에서, 상기 방법은 슈퍼-인핸서 기능을 방해하는데 및/또는 슈퍼-인핸서 기능과 관련된 (바람직하게는 인간에게 영향을 미치는) 질환, 장애, 또는 병리학적 상태와 연관된 증상을 예방, 치료, 또는 개선시키는데 유용하다. 슈퍼-인핸서의 2개 이상의 성분의 활성을 억제하는 화합물이 함께 또는 연속적으로 투여되는 경우, 이는 암, 예컨대 급성 골수성 백혈병 (AML) 및 폐암의 증상 또는 진행을 예방, 치료, 개선, 또는 감소시키는데 유용할 것이다. 본 발명은, 이를 필요로 하는 대상체에게 본원에 기재된 슈퍼-인핸서 성분의 2개 이상의 억제제를 투여함을 포함하는, 슈퍼-인핸서를 억제하는 방법을 제공한다. 대상체는 인간, 비-인간 영장류, 설치류, 개과, 고양이과, 유제류, 소과, 말과 또는 다른 종일 수 있다.
따라서, 일 실시형태에서, 본 개시는 슈퍼-인핸서-매개된 질환의 치료를 필요로 하는 포유동물에게 유효량의 적어도 2개의 하기 치료제를 투여함을 포함하는, 포유동물에서 슈퍼-인핸서-매개된 질환을 치료하는 방법을 제공한다:
i) 사이클린-의존성 키나제 억제제;
ii) 브로모도메인 억제제;
iii) 히스톤 메틸트랜스퍼라제 억제제;
iv) 히스톤 데아세틸라제 억제제; 및
v) 히스톤 데메틸라제 억제제.
일부 실시형태에서, 상기 방법은 사이클린-의존성 키나제 억제제 및 브로모도메인 (BET) 억제제를 투여함을 포함한다.
2개 이상의 치료제는 동시-투여되거나 연속적으로 투여될 수 있다. 예를 들어, 제1 치료제가 투여되고 충분한 기간 후 제2 치료제가 투여될 수 있다. 당해 분야의 숙련가는 일반적인 기술 및 지식에 근거하여 적절한 용량 스케줄을 도출할 수 있다.
특정 실시형태에서, 적어도 하나의 치료제는 사이클린-의존성 키나제 (Cdk) 단백질, 예컨대, Cdk4, Cdk6, Cdk7, Cdk8, Cdk9, Cdk10 및/또는 Cdk11을 억제할 것이다. 일부 실시형태에서, 상기 사이클린-의존성 키나제 억제제는 Cdk7, Cdk9 또는 이 둘 모두를 억제한다. 일부 실시형태에서, 상기 치료제는 디나시클리브 (ACS Med. Chem. Lett. 2010 May 17;1(5):204-8; Mol. Cancer Ther. 2010 Aug;9(8):2344-53; Merck, Sharp and Dohme), AT7519 (J. Med. Chem. 2008 Aug 28;51(16):4986-99; Astex Pharmaceutical), 팔보시클리브 (palbociclib)(J. Med. Chem. 2005 Apr 7;48(7):2388-406; Pfizer) 또는 알보시디브 (Int. J. Oncol. 1996 Dec 9(6):1143-68)이고, 예를 들어 알보시디브이다. 일부 실시형태에서, 적어도 하나의 치료제는 CDK9-특이적 siRNA, 알보시디브 또는 디나시클리브이다. 일부 실시형태에서, 적어도 하나의 치료제는 알보시디브이다.
다른 실시형태에서, 적어도 하나의 치료제는 브로모도메인 단백질, 예컨대, Brd2, Brd3, Brd4 및/또는 BrdT, 예를 들어, Brd4를 억제할 것이다. 일부 이러한 실시형태에서, 상기 치료제는 JQ-1 (Nature 2010 Dec 23;468(7327):1067-73), BI2536 (ACS Chem. Biol. 2014 May 16;9(5):1160-71; Boehringer Ingelheim), TG101209 (ACS Chem. Biol. 2014 May 16;9(5):1160-71), OTX015 (Mol. Cancer Ther. November 201312; C244; Oncoethix), IBET762 (J Med Chem. 2013 Oct 10;56(19):7498-500; GlaxoSmithKline), IBET151 (Bioorg. Med. Chem. Lett. 2012 Apr 15;22(8):2968-72; GlaxoSmithKline), CPI-0610 (Constellation Pharmaceuticals)의 PFI-1 (J. Med. Chem. 2012 Nov 26;55(22):9831-7; Cancer Res. 2013 Jun 1;73(11):3336-46; Structural Genomics Consortium)이다. 추가의 실시형태에서, 상기 적어도 하나의 치료제는 히스톤 데아세틸라제 (HDAC) 단백질을 억제할 것이다. HDAC 단백질은 효모 HDAC 단백질에 대한 상동성에 근거하여, HDAC1, HDAC2, HDAC3 및 HDAC 8로 구성된 클래스 I; HDAC4, HDAC5, HDAC7 및 HDAC 9로 구성된 클래스 IIa; HDAC6 및 HDAC10로 구성된 클래스 IIb; 및 HDAC11로 구성된 클래스 IV 등의 클래스로 분류될 수 있다. 일부 이러한 실시형태에서, 상기 치료제는 트리코스타틴 A (trichostatin A), 보리노스탯 (vorinostat) (Proc. Natl. Acad. Sci. U.S.A. 1998 Mar 17;95(6):3003-7), 기비노스탯 (givinostat), 아벡시노스탯 (abexinostat) (Mol. Cancer Ther. 2006 May;5(5):1309-17), 벨리노스탯(belinostat) (Mol. Cancer Ther. 2003 Aug;2(8):721-8), 파노비노스탯 (panobinostat) (Clin. Cancer Res. 2006 Aug 1;12(15):4628-35), 레스미노스탯 (resminostat) (Clin. Cancer Res. 2013 Oct 1;19(19):5494-504), 퀴시노스탯 (quisinostat) (Clin. Cancer Res. 2013 Aug 1;19(15):4262-72), 뎁시펩타이드 (depsipeptide) (Blood. 2001 Nov 1;98(9):2865-8), 엔티노스탯 (entinostat) (Proc. Natl. Acad. Sci. U.S.A. 1999 Apr 13;96(8):4592-7), 모세티노스탯 (mocetinostat) (Bioorg. Med. Chem. Lett. 2008 Feb 1;18(3):1067-71) 또는 발프로산 (EMBO J. 2001 Dec 17;20(24):6969-78)이다. 예를 들어, 일부 실시형태에서의 치료제는 파노비노스탯이다. 다른 실시형태에서, 상기 적어도 하나의 치료제는 파노비노스탯 또는 SAHA이다.
또 다른 실시예에서, 상기 적어도 하나의 치료제는 히스톤 메틸트랜스퍼라제 단백질, 예컨대, DOT1-유사 히스톤 메틸트랜스퍼라제 (Dot1L)를 억제할 것이다. 일부 이러한 실시형태에서, 치료제는 EPZ004777, EPZ-5676 (Blood. 2013 Aug 8;122(6):1017-25) 또는 SGC0946 (Nat. Commun. 2012;3:1288)이고, 예를 들면 EPZ-5676이다.
일부 실시형태에서, 상기 선택된 치료제 중 하나는 히스톤 데메틸라제, 예를 들어, 리신-특이적 데메틸라제, 예컨대, 리신-특이적 데메틸라제 1A (Lsd1)를 억제할 것이다. 일부 이러한 실시형태에서, 상기 치료제는 HCI-2509 (BMC Cancer. 2014 Oct 9;14:752), 트라닐시프로민 또는 ORY-1001 (J. Clin. Oncol 31, 2013 (suppl; abstr e13543)이다. 다른 실시형태에서, 상기 치료제는 HCI-2509이다.
일부 다른 실시형태에서, 상기 방법은 포유동물에게 유효량의 사이클린-의존성 키나제 억제제 및 브로모도메인 억제제를 투여함을 포함한다. 예를 들어, 일부 실시형태에서 사이클린-의존성 키나제 억제제는 CDK9-특이적 siRNA 또는 알보시디브이다. 전술한 다른 실시형태에서, 상기 브로모도메인 억제제는 JQ1이다. 전술한 다른 실시형태에서, 상기 브로모도메인 억제제는 IBET762이다. 전술한 또 다른 실시형태에서, 상기 브로모도메인 억제제는 OTX015이다.
따라서, 일부 실시형태에서, 상기 방법은 포유동물에게 유효량의 알보시디브 및 유효량의 JQ1를 투여함을 포함한다. 다른 실시형태에서, 상기 방법은 포유동물에게 유효량의 알보시디브 및 유효량의 IBET762를 투여함을 포함한다. 또 다른 실시형태에서, 상기 방법은 포유동물에게 유효량의 알보시디브 및 유효량의 OTX015를 투여함을 포함한다.
다른 구체적인 실시형태에서, 상기 방법은 포유동물에게 유효량의 사이클린-의존성 키나제 억제제 및 히스톤 데아세틸라제 억제제를 투여함을 포함한다. 일부 이러한 실시형태에서, 상기 사이클린-의존성 키나제 억제제는 알보시디브이다. 전술한 다른 실시형태에서, 상기 히스톤 데아세틸라제 억제제는 파노비노스탯이다.
다른 구체적인 실시형태에서, 상기 방법은 포유동물에게 유효량의 사이클린-의존성 키나제 억제제 및 히스톤 메틸트랜스퍼라제 억제제를 투여함을 포함한다. 일부 이러한 실시형태에서, 상기 사이클린-의존성 키나제 억제제는 알보시디브이다.
다른 구체적인 실시형태에서, 상기 방법은 포유동물에게 유효량의 사이클린-의존성 키나제 억제제 및 히스톤 데메틸라제 억제제를 투여함을 포함한다. 일부 이러한 실시형태에서, 상기 사이클린-의존성 키나제 억제제는 알보시디브이다.
고형 종양 및 백혈병 (예: 급성 골수성 백혈병)을 비롯한 다양한 종류의 암이 본원에 기재된 방법에 적용된다. 다양한 실시형태에서 치료될 수 있는 암의 종류는 다음을 포함하나 이에 제한되지 않는다: 유방, 전립선 및 결장 선암종; 모든 형태의 폐 기관지원성 암종; 골수성; 흑색종; 간암; 신경모세포종; 유두종; 아푸도마 (apudoma); 분리종; 브랜키오마 (branchioma); 악성 카르시노이드 증후군; 카르시노이드 심장병; 및 암종 [예: 워커 (Walker), 기저 세포, 기저 편평, 브라운-피어스 (Brown-Pearce), 관 (ductal), 에를리히 종양, Krebs 2, 메르켈 세포, 점액, 비-소세포 폐, 귀리 세포, 유두, 경성 (scirrhous), 세기관지, 기관지원성, 편평 세포, 및 이행 세포]. 치료될 수 있는 추가적인 암 종류로는 다음을 포함한다: 조직구 장애; 백혈병; 악성조직구증; 호지킨병; 소 면역증식성; 비호지킨 림프종; 형질세포종; 망상내피증; 흑색종; 연골모세포종; 연골종; 연골육종; 섬유종; 섬유육종; 거대세포 종양; 조직구종; 지방종; 지방육종; 중피종; 점액종; 점액 육종; 골종; 골육종; 척삭종; 두개인두종; 미분화세포종; 과오종; 중간엽종; 중신종; 근육종; 에나멜모세포종; 시멘트종; 치아종; 기형종; 흉선종; 융모 종양. 추가로, 하기의 암 종류가 또한 치료에 적용되는 것으로 간주된다: 선종; 담관종; 진주종; 사이클린드로마 (cyclindroma); 낭선암종; 낭선종; 과립세포종양; 음양모세포종; 간암; 한선종; 섬세포종양; 라이디히세포 종양; 유두종; 세르토리세포 종양; 난포막세포 종양; 평활근종; 평활근육종; 근모세포종; 근종; 근육종; 횡문근종; 횡문근육종; 뇌실막종; 신경절신경종; 교종; 수모세포종; 수막종; 신경집종; 신경모세포종; 신경상피종; 신경섬유종; 신경종; 부신경절종; 비크롬친화성 부신경절종. 치료될 수 있는 암 종류는 또한 다음을 포함하나 이에 제한되지 않는다: 혈관각화종; 호산구증가증을 동반한 혈관림프구 과다형성; 경화혈관종; 혈관종증; 사구맥관종; 혈관내피종; 혈관종; 혈관주위세포종; 혈관육종; 림프관종; 림프관근종; 림프관육종; 송과체종; 암육종; 연골육종; 엽상육종; 섬유육종; 혈관육종; 평활근육종; 백혈육종; 지방육종; 림프관육종; 근육종; 점액 육종; 난소성 암종; 횡문근육종; 육종; 신생물; 신경섬유종증; 및 자궁목 형성이상.
II. 약제학적 조성물
다른 실시형태는 약제학적 조성물에 관한 것이다. 상기 약제학적 조성물은 전술한 억제제 중 임의의 2개 (또는 그 이상) 억제제 및 약제학적으로 허용 가능한 담체를 포함한다. 예를 들어, 일부 실시형태에서, 상기 약제학적 조성물은 약제학적으로 허용 가능한 담체 또는 부형제 및 적어도 2개의 하기 치료제를 포함한다:
i) 사이클린-의존성 키나제 억제제;
ii) 브로모도메인 억제제;
iii) 히스톤 메틸트랜스퍼라제 억제제;
iv) 히스톤 데아세틸라제 억제제; 및
v) 히스톤 데메틸라제 억제제.
상기 치료제는 본원에 기재된 것들 중 임의의 것이거나 당해 분야에 공지된 것일 수 있다. 일부 실시형태에서, 상기 조성물은 사이클린-의존성 키나제 억제제, 예컨대, 알보시디브 또는 디나시클리브를 포함한다.
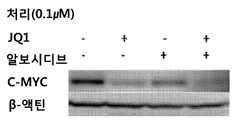
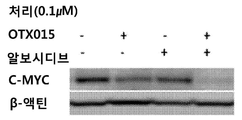
다른 구체적인 실시형태에서, 상기 약제학적 조성물은 사이클린-의존성 키나제 억제제 및 브로모도메인 억제제를 포함한다. 예를 들어, 일부 이러한 실시형태에서, 상기 사이클린-의존성 키나제 억제제는 알보시디브이다. 전술한 다른 실시형태에서, 상기 브로모도메인 억제제는 JQ1이다. 전술한 다른 실시형태에서, 상기 브로모도메인 억제제는 IBET762이다. 전술한 또 다른 실시형태에서, 상기 브로모도메인 억제제는 OTX015이다.
따라서, 일부 실시형태에서, 상기 약제학적 조성물은 약제학적으로 허용 가능한 담체 또는 부형제, 알보시디브 및 JQ1을 포함한다. 다른 실시형태에서, 상기 약제학적 조성물은 약제학적으로 허용 가능한 담체 또는 부형제, 알보시디브 및 IBET762를 포함한다. 또 다른 실시형태에서, 상기 약제학적 조성물은 약제학적으로 허용 가능한 담체 또는 부형제, 알보시디브 및 OTX015를 포함한다.
다른 실시형태에서, 상기 약제학적 조성물은 사이클린-의존성 키나제 억제제 및 히스톤 데아세틸라제 억제제를 포함한다. 일부 이러한 실시형태에서, 상기 사이클린-의존성 키나제 억제제는 알보시디브이다. 전술한 다른 실시형태에서, 상기 히스톤 데아세틸라제 억제제는 파노비노스탯이다.
다른 실시형태에서, 상기 약제학적 조성물은 사이클린-의존성 키나제 억제제 및 히스톤 메틸트랜스퍼라제 억제제를 포함한다. 일부 이러한 실시형테에서, 상기 사이클린-의존성 키나제 억제제는 알보시디브이다.
다른 실시형태에서, 상기 약제학적 조성물은 사이클린-의존성 키나제 억제제 및 히스톤 데메틸라제 억제제를 포함한다. 일부 이러한 실시형태에서, 상기 사이클린-의존성 키나제 억제제는 알보시디브이다.
일부 실시형태에서, 상기 약제학적 조성물은 경구 투여용으로 제형화된다. 다른 실시형태에서, 상기 약제학적 조성물은 주사용으로 제형화된다.
적합한 투여 경로는 경구, 정맥내, 직장, 에어로졸, 비경구, 눈, 폐, 점막, 경피, 질, 귀, 비강 및 국소 투여를 포함하나, 이에 제한되지 않는다. 또한, 단지 예시로써, 비경구 전달은 근육내, 피하, 정맥내, 골수내 주사뿐만 아니라 척수내, 직접 심실내, 림프내 (intralymphatic), 및 비강내 주사를 포함한다.
특정 실시형태에서, 본원에 기재된 화합물은 국소적 방식이 아닌 전신적 방식으로, 예를 들어, 종종 데포제 또는 서방성 제형 (sustained release formulation)의 화합물의 직접 주사를 통해 기관으로 투여된다. 구체적인 실시형태에서, 지속성 제형은 이식 (예: 피하 또는 근육내) 또는 근육내 주사로 투여된다. 또한, 다른 실시형태에서, 상기 약물은 표적화된 약물 전달 시스템, 예를 들어, 기관-특이적 항체로 코팅된 리포좀 내로 전달된다. 이러한 실시형태에서, 상기 리포좀은 기관에 의해 표적화되며 선택적으로 받아들여진다. 또 다른 실시형태에서, 본원에 기재된 화합물은 속방성 제형 (rapid release formulation)의 형태, 연장 방출성 제형 (extended release formulation)의 형태, 또는 중간 방출성 제형 (intermediate release formulation)의 형태로 제공된다. 또 다른 실시형태에서, 본원에 기재된 화합물은 국소적으로 투여된다.
본 발명에 따른 화합물은 넓은 용량 범위에 걸쳐 효과적이다. 예를 들어, 성인 인간 치료에서, 1일당 0.01 내지 1000 mg, 0.5 내지 100 mg, 1 내지 50 mg, 및 5 내지 40 mg의 용량은 일부 실시형태에서 사용된 용량의 예이다. 예시적인 용량은 1일당 10 내지 30 mg이다. 정확한 용량은 투여 경로, 투여되는 화합물의 형태, 치료될 대상체, 치료될 대상체의 체중, 및 주치의의 선호도 및 경험에 따라 다를 것이다.
일부 실시형태에서, 본 발명의 화합물은 단일 용량으로 투여된다. 전형적으로, 이러한 투여는 신속하게 작용제를 도입하기 위하여, 주사, 예를 들어, 정맥내 주사에 의한 것일 수 있다. 그러나, 다른 경로 또한 적절하게 사용된다. 본 발명의 화합물의 단일 용량은 또한 급성 병증의 치료에 사용될 수 있다.
일부 실시형태에서, 본 발명의 화합물은 다중 용량으로 투여된다. 일부 실시형태에서, 용량은 약 1일당 1회, 2회, 3회, 4회, 5회, 6회 이상이다. 다른 실시형태에서, 용량은 약 1달 1회, 2주 1회, 1주 1회, 또는 2일 1회이다. 또 다른 실시형태에서, 본 발명의 화합물 및 또 다른 작용제는 1일당 1회 내지 1일 6회로 함께 투여된다. 또 다른 실시형태에서, 본 발명의 화합물 및 작용제의 투여는 약 7일 미만으로 지속된다. 또 다른 실시형태에서, 상기 투여는 약 6, 10, 14, 28일 초과, 2달 초과, 6달 초과 또는 1년 초과로 지속된다. 일부 경우, 필요에 따라 지속 용량이 이루어지고 유지된다.
본 발명의 화합물의 투여는 필요에 따라 지속될 수 있다. 일부 실시형태에서, 본 발명의 화합물은 1, 2, 3, 4, 5, 6, 7, 14, 또는 28일 초과 동안 투여된다. 일부 실시형태에서, 본 발명의 화합물은 28, 14, 7, 6, 5, 4, 3, 2, 또는 1일 미만 동안 투여된다. 일부 실시형태에서, 본 발명의 화합물은 장기간 (chronically) 지속적으로, 예를 들어 장기간의 치료 효과를 위하여 투여된다.
일부 실시형태에서, 본 발명의 화합물은 투여량으로 투여된다. 화합물 약물 동태학에서의 상호 주관적 변동성으로 인해, 투여량 요법의 개별화가 특정 실시형태에 제공된다. 본 발명의 화합물의 용량은 본 개시내용을 고려하여 통상적 실험에 의해 확립되고/되거나 당업자에 의해 유도될 수 있다.
일부 실시형태에서, 본원에 기재된 화합물은 약제학적 조성물로 제형화된다. 구체적인 실시형태에서, 약제학적 조성물은, 활성 화합물의 약제학적으로 사용될 수 있는 제제 내로의 가공을 용이하게 하는 부형제 및 보조제 (auxiliaries)를 포함하는 하나 이상의 생리학적으로 허용가능한 담체를 사용한 종래 방식으로 제형화된다. 적절한 제형은 선택된 투여 경로에 따라 달라진다. 임의의 약제학적으로 허용가능한 기술, 담체, 및 부형제가 본원에 기재된 약제학적 조성물을 제제화하기에 적합한 것으로 사용된다 [Remington: The Science and Practice of Pharmacy, Nineteenth Ed (Easton, Pa.: Mack Publishing Company, 1995); Hoover, John E., Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pennsylvania 1975; Liberman, H.A. and Lachman, L., Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N.Y., 1980; and Pharmaceutical Dosage Forms and Drug Delivery Systems, Seventh Ed. (Lippincott Williams & Wilkins1999)].
하기 중에서 선택된 적어도 2개의 슈퍼-인핸서 성분을 표적화하는 억제제를 포함하는 약제학적 조성물이 본원에 제공된다: i) 사이클린-의존성 키나제 (Cdk); ii) 브로모도메인 단백질의 브로모도메인 및 측외 (BET) 서브패밀리; iii) DOT1-유사 히스톤 메틸트랜스퍼라제 (Dot1L); iv) 클래스 I, II 및 IV 히스톤 데아세틸라제 (HDAC); 및 v) 리신-특이적 데메틸라제 1A (Lsd1) 및 약제학적으로 허용가능한 희석제, 부형제, 또는 담체. 하기 부분 및 본 명세서 전반의 전술한 조합 요법에서의 활성제의 모든 조합에 본원에 포함된다.
본원에 사용된 바와 같은 약제학적 조성물은 다른 화학 성분, 예컨대, 담체, 안정화제, 희석제, 분산제, 현탁제, 증점제 (thickening agent), 및/또는 부형제와 함께 적어도 2개의 슈퍼-인핸서를 표적화하는 억제제의 혼합물을 지칭한다. 특정 실시형태에서, 약제학적 조성물은 유기체로의 화합물 투여를 용이하게 한다. 일부 실시형태에서, 치료 방법 또는 사용 방법을 실시하는 것이 본원에 제공되며, 본원에 제공된 적어도 2개의 슈퍼-인핸서 성분을 표적화하는, 치료학적 유효량의 2개 이상의 억제제는 치료될 질환, 장애 또는 의학적 상태를 갖는 포유동물에게 약제학적 조성물로 투여된다. 구체적인 실시형태에서, 상기 포유동물은 인간이다. 특정 실시형태에서, 치료학적 유효량은 질환의 중증도, 대상체의 연령 및 관련 건강상태, 사용된 화합물의 효능 및 다른 요인들에 따라 다르다. 본원에 기재된 화합물은 단독으로 또는 혼합물의 성분으로서 1개 이상의 치료제와 조합하여 사용된다.
일 실시형태에서, 2개 이상의 슈퍼-인핸서 성분을 표적화하는 억제제가 수용액 중에서 제형화된다. 구체적인 실시형태에서, 상기 수용액은, 단지 예로써, 생리학적으로 호환가능한 완충액, 예컨대, 행크 용액 (Hank's solution), 링거액, 또는 생리 식염수 중에서 선택된다. 다른 실시형태에서, 2개 이상의 슈퍼-인핸서 성분을 표적화하는 억제제가 점막내 투여용으로 제형화된다. 구체적인 실시형태에서, 점막내 제형은 침투되는 장벽에 적절한 침투물을 포함한다. 또 다른 실시형태에서, 본원에 기재된 화합물은 다른 비경구 주사용으로 제형화되며, 적절한 제형으로는 수용액 또는 비수용액을 포함한다. 구체적인 실시형태에서, 이러한 용액은 생리학적으로 호환가능한 완충액 및/또는 부형제를 포함한다.
또 다른 실시형태에서, 본원에 기재된 화합물은 경구 투여용으로 제형화된다. 본원에 기재된 화합물은 활성 화합물을, 예를 들어, 약학적으로 허용가능한 담체 또는 부형제와 함께 조합하여 제형화된다. 다양한 실시형태에서, 본원에 기재된 화합물은 단지 예로써, 정제, 분말, 알약, 당제 (dragee), 캡슐, 액제, 젤, 시럽, 엘릭서 (elixir), 슬러리, 현탁액 등을 포함하는 경구 투약 형태로 제형화된다.
특정 실시형태에서, 경구 사용을 위한 약제학적 제제는, 1개 이상의 고형 부형제와 본원에 기재된 1개 이상의 화합물을 혼합하고, 임의로 생성된 혼합물을 분쇄하고, 및 과립의 혼합물을 가공하고, 이후에 원하는 경우 적합한 보조제를 첨가하여 정제 또는 당제 코어를 수득함으로써 얻어진다. 적합한 부형제는 특히 충전제, 예컨대, 락토스, 슈크로스, 만니톨, 또는 소르비톨을 비롯한 당; 예를 들어, 옥수수 전분, 밀 전분, 쌀 전분, 감자 전분, 젤라틴, 트라가칸트 검, 메틸셀룰로스, 미정질 셀룰로스, 하이드록시프로필메틸셀룰로스, 나트륨 카복시메틸셀룰로스와 같은 셀룰로스 제제; 또는 폴리비닐피롤리딘 (PVP 또는 포비돈) 또는 칼슘 포스페이트와 같은 이외의 것들이다. 구체적인 실시형태에서, 붕해제가 임의로 첨가된다. 붕해제는, 단지 예로써, 가교-결합된 크로스카멜로스 나트륨, 폴리비닐피롤리돈, 아가, 또는 알긴산 또는 이의 염, 예컨대, 나트륨 알기네이트를 포함한다.
일 실시형태에서, 투약 형태, 예컨대, 당제 코어 및 정제는 1개 이상의 적합한 코팅제와 함께 제공된다. 구체적인 실시형태에서, 농축된 당액 (sugar solution)은 투약 형태를 코팅하는데 사용된다. 상기 당액은, 임의로, 단지 예로써, 아라비아 검, 탈크, 폴리비닐피롤리돈, 카르보폴 젤, 폴리에틸렌 글리콜, 및/또는 티타늄 디옥사이드, 광택 용액 (lacquer solution), 및 적합한 유기 용매 또는 용매 혼합물과 같은 추가의 성분을 포함한다. 또한 염료 및/또는 색소가 식별을 목적으로 코팅제에 임의로 첨가된다. 추가적으로, 상기 염료 및/또는 색소는 상이한 조합의 활성 화합물 용량을 특징짓는데 사용된다.
특정 실시형태에서, 본원에 기재된 적어도 2개의 슈퍼-인핸서 성분을 표적화하는 치료학적 유효량의 억제제는 다른 경구 투약 형태로 제형화된다. 경구 투약 형태는 젤라틴으로 구성된 끼워맞춤형 (push-fit) 캡슐뿐만 아니라 젤라틴으로 구성된 연질의 밀봉된 캡슐 및 가소제 예컨대 글리세롤 또는 소르비톨을 포함한다. 구체적인 실시형태에서, 끼워맞춤형 캡슐은 활성 성분을 하나 이상의 충전제와 혼합하여 포함한다. 충전제는, 단지 예로써, 락토스, 결합제, 예컨대, 전분, 및/또는 윤활제, 예컨대, 탈크 또는 마그네슘 스테아레이트 및, 임의로 안정제를 포함한다. 다른 실시형태에서, 연질 캡슐은 적합한 액체 중에 용해되거나 현탁화된 하나 이상의 활성 화합물을 포함한다. 적합한 액체로는, 단지 예로써, 하나 이상의 지방유, 유동 파라핀, 또는 액체 폴리에틸렌 글리콜을 포함한다. 추가로, 안정제가 임의로 첨가된다.
다른 실시형태에서, 본원에 기재된 적어도 2개의 슈퍼-인핸서 성분을 표적화하는 치료학적 유효량의 억제제는 구강 또는 설하 투여용으로 제형화된다. 구강 또는 설하 투여에 적합한 제형은, 단지 예로써, 정제, 로렌지, 또는 젤을 포함한다. 또 다른 실시형태에서, 본원에 기재된 화합물은 볼루스 주사 또는 지속 주입에 적합한 제형을 비롯한 비경구 주사용으로 제형화된다. 구체적인 실시형태에서, 주사용 제형은 단위 투약 형태 (예: 앰플) 또는 다중-투약 용기 중에 존재한다. 임의로, 주사용 제형에 방부제가 첨가된다. 또 다른 실시형태에서, 약제학적 조성물은 유성 또는 수성 비히클 중의 멸균 현탁액, 용액 또는 에멀젼으로서 비경구 주사에 적합한 형태로 제형화된다. 비경구 주사용 제형은 임의로 제형화제, 예컨대, 현탁화제, 안정화제 및/또는 분산제를 포함한다. 구체적인 실시형태에서, 비경구 투여용 약제학적 제형은 수용성 형태의 활성 화합물 수용액을 포함한다. 추가의 실시형태에서, 활성 화합물 (예: 화학식 I의 화합물)의 현탁액은 적절한 유성 주사 현탁액으로 제조된다. 본원에 기재된 약제학적 조성물에 사용하기 적합한 친유성 용매 또는 비히클은, 단지 예로써, 지방유, 예컨대 참기름, 또는 합성 지방산 에스테르, 예컨대 에틸 올레이트 또는 트리글리세리드, 또는 리포좀을 포함한다. 특정 구체적인 실시형태에서, 수성 주사 현탁액은 현탁액의 점도를 증가시키는 물질, 예컨대, 나트륨 카복시메틸 셀룰로스, 소르비톨, 또는 덱스트란을 포함한다. 임의로, 상기 현탁액은 화합물의 용해도를 증가시켜 고도로 농축된 용액을 형성시키는 적합한 안정화제 또는 작용제를 포함한다. 대안적으로, 다른 실시형태에서, 활성 성분은 사용 전 적합한 비히클, 예를 들어, 멸균 발열원-비함유 물로 구성하기 위한 분말 형태이다.
또 다른 실시형태에서, 적어도 2개의 슈퍼-인핸서 성분을 표적화하는 억제제가 국소적으로 투여된다. 본원에 기재된 화합물은 다양한 국소적으로 투여가능한 조성물, 예컨대, 용액, 현탁액, 로션, 젤, 반죽, 약용 스틱 (medicated stick), 밤 (balm), 크림 또는 연고로 제형화된다. 이러한 약제학적 조성물은 임의로 가용화제, 안정화제, 긴장성 증강제 (tonicity enhancing agent), 완충액 및 방부제를 포함한다.
또 다른 실시형태에서, 적어도 2개의 슈퍼-인핸서 성분을 표적화하는 억제제는 경피 투여용으로 제형화된다. 구체적인 실시형태에서, 경피용 제형은 경피 전달 디바이스 및 경피 전달 패치를 이용하며, 중합체 또는 접착제 중에 용해되고/되거나 분산된 친유성 에멀젼 또는 완충된 수용액일 수 있다. 다양한 실시형태에서, 이러한 패치는 약제의 지속적인, 박동적인, 또는 필요시 전달을 위해 구성된다. 추가의 실시형태에서, 적어도 2개의 슈퍼-인핸서 성분을 표적화하는 억제제의 경피 전달은 이온영동성 패치 등의 수단으로 달성된다. 특정 실시형태에서, 경피 패치는 적어도 2개의 슈퍼-인핸서 성분을 표적화하는 억제제의 조절된 전달을 제공한다. 구체적인 실시형태에서, 흡수 속도는 속도-조절 막을 사용하거나 중합체 매트릭스 또는 젤 내에 화합물을 포획함으로써 느려진다. 대안적인 실시형태에서, 흡수 증강제가 흡수를 증가시키는데 사용된다. 흡수 증강제 또는 담체는 피부를 통과하는 것을 돕는 흡수성의 약제학적으로 허용가능한 용매를 포함한다. 예를 들어, 일 실시형태에서, 경피 장치는 장기간 동안 조절되고 기결정된 속도로 화합물을 숙주 피부에 전달하기 위한, 지지 구성원을 포함하는 밴드, 임의로 담체와 함께 화합물을 포함하는 저장소, 임의로 속도 조절 장벽으로 구성된 형태이며, 이는 장치를 피부에 고정한다는 것을 의미한다.
다른 실시형태에서, 적어도 2개의 슈퍼-인핸서 성분을 표적화하는 억제제는 흡입에 의한 투여용으로 제형화된다. 흡입에 의한 투여에 적합한 다양한 형태는 에어로졸, 미스트 또는 분말을 포함하나 이에 제한되지 않는다. 적어도 2개의 슈퍼-인핸서 성분을 표적화하는 억제제로 구성된 약제학적 조성물은, 적합한 분사제 (예: 디클로로디플루오로메탄, 트리클로로플루오로메탄, 디클로로테트라플루오로에탄, 이산화탄소 또는 다른 적합한 가스)를 사용하여, 가압된 팩 또는 분무기로부터의 에어로졸 스프레이 제제 형태로 용이하게 전달된다. 구체적인 실시형태에서, 가압된 에어로졸의 용량 단위는 계량된 양을 전달하는 밸브를 제공함으로써 측정된다. 특정 실시형태에서, 캡슐 및 카트리지, 예컨대, 단지 예로써, 흡입기 또는 취입기에서의 사용을 위한 젤라틴이 화합물 및 적합한 분말 염기, 예컨대, 락토스 또는 전분의 분말 혼합물을 함유하도록 제형화된다.
또 다른 실시형태에서, 적어도 2개의 슈퍼-인핸서 성분을 표적화하는 억제제는, 통상의 좌제 기제, 예컨대, 코코아 버터 또는 다른 글리세리드뿐만 아니라 합성 중합체, 예컨대, 폴리비닐피롤리돈, PEG 등을 함유하는 직장 조성물, 예컨대, 관장제, 직장용 젤, 직작용 발포제, 직장용 에어로졸, 좌약, 젤리형 좌약, 또는 정체 관장제 (retention enemas)로 제형화된다. 조성물의 좌약 형태에서, 저융점 왁스, 예컨대, 이에 제한되지 않고, 지방산 글리세리드와 임의로 코코아 버터와 조합된 혼합물이 먼저 용해된다.
특정 실시형태에서, 약제학적 조성물은, 활성 화합물의 약제학적으로 사용될 수 있는 제제로의 가공을 용이하게 하는 부형제 및 보조제를 포함하는 하나 이상의 생리학적으로 허용가능한 담체를 사용하는 임의의 종래 방식으로 제형화된다. 적절한 제형은 투여 경로에 따라 달라진다. 임의의 약제학적으로 허용가능한 기술, 담체, 및 부형제가 적합하게는 임의로 사용된다. 적어도 2개의 슈퍼-인핸서 성분을 표적화하는 억제제를 포함하는 약제학적 조성물은 종래의 방식, 예컨대, 단지 예로써, 혼합, 용해, 과립화, 당제화, 균질화, 에멀젼화, 캡슐화, 포획화 또는 압축화 과정으로 제조된다.
약제학적 조성물은 적어도 하나의 약제학적으로 허용가능한 담체, 희석제 또는 부형제 및 활성 원료로서 본원에 기재된 적어도 2개의 슈퍼-인핸서 성분을 표적화하는 억제제를 포함한다. 활성 원료는 유리-산 또는 유리-염기 형태이거나 약제학적으로 허용가능한 염 형태이다. 또한, 본원에 기재된 방법 및 약제학적 조성물은 결정형의 N-옥사이드 (다형체라고도 알려짐)뿐만 아니라 동일한 유형의 활성을 갖는 이러한 화합물의 활성 대사 산물의 사용을 포함한다. 본원에 기재된 화합물의 모든 토토머형은 본원에 나타난 화합물의 범주 내에 포함된다. 추가적으로, 본원에 기재된 화합물은 비용매화된 형태뿐만 아니라 용매화된 형태의 약제학적으로 허용가능한 용매, 예컨대, 물, 에탄올 등을 포함한다. 본원에 나타난 적어도 2개의 슈퍼-인핸서 성분을 표적화하는 억제제의 용매화된 형태가 또한 본원에 개시된 것으로 간주된다. 또한, 약제학적 조성물은 임의로 다른 의학적 또는 약제학적 작용제, 담체, 애주번트, 예컨대, 보존제, 안정화제, 습윤제 또는 유화제, 용액 프로모터, 삼투압 조절용 염, 완충제, 및/또는 다른 치료학적으로 가치있는 물질을 포함한다.
본원에 기재된 적어도 2개의 슈퍼-인핸서 성분을 표적화하는 억제제를 포함하는 조성물의 제조 방법은, 화합물을 하나 이상의 불활성 약제학적으로 허용가능한 부형제 또는 담체와 함께 제형화하여 고체, 반고체, 또는 액체를 형성시키는 것을 포함한다. 고체 조성물은 분말, 정제, 분산성 과립, 캡슐, 샤세, 및 좌약을 포함하나, 이에 제한되지 않는다. 액체 조성물은 화합물이 용해된 용액, 화합물을 포함하는 에멀젼, 또는 본원에 기재된 화합물을 포함하는 리포좀, 미셀, 또는 나노입자를 함유하는 용액을 포함한다. 반고체 조성물은 젤, 현탁액 및 크림을 포함하나, 이에 제한되지 않는다. 본원에 기재된 약제학적 조성물의 형태는 액체 용액 또는 현탁액, 사용전 액체 용액 또는 현탁액에 적합한 고체 형태, 또는 에멀젼을 포함한다. 이러한 조성물은 또한 임의로 미량의 비독성 보조제, 예컨대 습윤제 또는 유화제, pH 완충제 등을 함유한다.
일부 실시형태에서, 적어도 2개의 슈퍼-인핸서 성분을 표적화하는 억제제를 포함하는 약제학적 조성물은 예시적으로 용액 내, 현탁액 내, 또는 이 둘 중에 존재하는 작용제가 액체인 형태를 취한다. 전형적으로, 조성물이 용액 또는 현탁액으로 투여되는 경우, 작용제의 제1 부분은 용액 내 존재하며, 작용제의 제2 부분은 특히 액체 매트릭스 중 현탁액의 형태로 존재한다. 일부 실시형태에서, 액체 조성물은 젤 제형을 포함한다. 다른 실시형태에서, 상기 액체 조성물은 수성이다.
특정 실시형태에서, 유용한 수성 현탁액은 현탁제로서 하나 이상의 중합체를 함유한다. 유용한 중합체는 수용성 중합체, 예컨대, 셀룰로스 중합체, 예를 들어, 하이드록시프로필 메틸셀룰로스, 및 비수용성 중합체, 예컨대, 가교결합된 카복시-함유 중합체를 포함한다. 본원에 기재된 특정 약제학적 조성물은 예를 들어, 카복시메틸셀룰로스, 카보머 (아크릴산 중합체), 폴리(메틸메타크릴레이트), 폴리아크릴아미드, 폴리카보필, 아크릴산/부틸 아크릴레이트 공중합체, 나트륨 알기네이트 및 덱스트란으로부터 선택된 점막부착성 중합체를 포함한다.
유용한 약제학적 조성물은 또한 임의로 적어도 2개의 슈퍼-인핸서 성분을 표적화하는 억제제의 용해도를 돕는 가용화제를 포함한다. 용어 "가용화제"란 일반적으로 작용제의 미셀 용액 또는 참 용액 (true solution)을 형성하게 하는 작용제를 포함한다. 예를 들어, 폴리소르베이트 80와 같이 특정한 허용가능한 비이온성 계면활성제는, 안과적으로 허용가능한 글리콜, 폴리글리콜, 예를 들어, 폴리에틸렌 글리콜 400, 및 글리콜 에테르와 같이 가용화제로서 유용하다.
추가로, 유용한 약제학적 조성물은 임의로, 산, 예컨대, 아세트산, 붕산, 시트르산, 락트산, 인산 및 염산; 염기, 예컨대, 나트륨 하이드록사이드, 나트륨 포스페이트, 나트륨 보레이트, 나트륨 시트레이트, 나트륨 아세테이트, 나트륨 락테이트 및 트리스-하이드록시메틸아미노메탄; 완충액, 예컨대, 시트레이트/덱스트로스, 나트륨 비카보네이트 및 암모늄 클로라이드를 비롯한, 하나 이상의 pH 조정제 또는 완충제를 포함한다. 이러한 산, 염기 및 완충액은 조성물의 pH를 허용가능한 범위로 유지하는데 요구되는 양으로 포함된다.
추가적으로, 유용한 조성물은 또한 임의로 조성물의 삼투압을 허용가능한 범위로 만드는데 요구되는 양의 하나 이상의 염을 포함한다. 이러한 염으로는 나트륨, 칼륨 또는 암모늄 양이온 및 염화물, 시트레이트, 아스코르베이트, 보레이트, 포스페이트, 비카보네이트, 설페이트, 티오설페이트 또는 비설파이트 음이온을 갖는 염; 나트륨 클로라이드, 칼륨 클로라이드, 나트륨 티오설페이트, 나트륨 비설파이트 및 암모늄 설페이트를 비롯한 적합한 염을 포함한다.
다른 유용한 약제학적 조성물은 임의로 하나 이상의 방부제를 포함하여 미생물 활성을 억제한다. 적합한 방부제로는 수은-함유 물질, 예컨대, 메르펜 및 티오메르살; 안정화된 이산화염소; 및 4차 암모늄 화합물, 예컨대, 벤즈알코늄 클로라이드, 세틸트리메틸암모늄 브로마이드 및 세틸피리디늄 클로라이드를 포함한다.
또 다른 유용한 조성물로는 물리적 안정성을 증강시키기 위한 또는 다른 목적을 위한 하나 이상의 계면 활성제를 포함한다. 적합한 비이온성 계면활성제로는 폴리옥시에틸렌 지방산 글리세리드 및 식물성 오일, 예를 들어, 폴리옥시에틸렌 (60) 수소화된 피마자유; 및 폴리옥시에틸렌 알킬에테르 및 알킬페닐 에테르, 예를 들어, 옥톡시닐 10, 옥톡시놀 40을 포함한다.
또 다른 유용한 화합물로는 필요시 화학적 안정성을 증강시키기 위한 하나 이상의 항산화제를 포함한다. 적합한 항산화제로는, 단지 예로써, 아스코르브산 및 나트륨 메타비설파이드를 포함한다.
특정 실시형태에서, 수성 현탁액 조성물이 단일-용량 비밀폐형 용기에 포장된다. 대안적으로는, 다중-용량 밀폐형 용기는, 조성물 중에 방부제를 포함하는 것이 전형적인 경우에 사용된다.
대안적인 실시형태에서, 소수성 약제학적 조성물을 위한 다른 전달 시스템이 이용된다. 리포좀 및 에멀젼이 본원에서 유용한 전달 비히클 또는 담체의 예이다. 특정 실시형태에서, 유기 용매, 예컨대, N-메틸피롤리돈이 또한 이용된다. 추가의 실시형태에서, 본원에 기재된 화합물은, 서방성 시스템, 예컨대, 치료제를 포함하는 고체 소수성 중합체의 반투과성 매트릭스를 이용하여 전달된다. 다양한 서방성 물질은 본원에서 유용하다. 일부 실시형태에서, 서방성 캡슐은 몇주 동안, 최대 100일에 걸쳐 화합물을 방출한다. 치료제의 화학적 성질 및 생물학적 안정성에 따라, 단백질 안정화를 위한 추가적인 전략이 이용된다.
특정 실시형태에서, 본원에 기재된 제형은 하나 이상의 항산화제, 금속 킬레이트제, 티올 함유 화합물 및/또는 다른 일반적 안정화제를 포함한다. 이러한 안정화제의 예로는 다음을 포함하나 이에 제한되지 않는다: (a) 약 0.5% 내지 약 2% w/v 글리세롤, (b) 약 0.1% 내지 약 1% 메티오닌, (c) 약 0.1% 내지 약 2% w/v 모노티오글리세롤, (d) 약 1 mM 내지 약 10 mM EDTA, (e) 약 0.01% 내지 약 2% w/v 아스코르브산, (f) 0.003% 내지 약 0.02% w/v 폴리소르베이트 80, (g) 0.001% 내지 약 0.05% w/v 폴리소르베이트 20, (h) 알기닌, (i) 헤파린, (j) 덱스트란 설페이트, (k) 사이클로덱스트린, (l) 펜토산 폴리설페이트 및 다른 헤파리노이드, (m) 2가 양이온, 예컨대 마그네슘 및 아연; 또는 (n) 이의 조합.
일부 실시형태에서, 본 발명의 약제학적 조성물에 제공된 하나 이상의 억제제의 농도는 100%, 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0.5%, 0.4%, 0.3%, 0.2%, 0.1%, 0.09%, 0.08%, 0.07%, 0.06%, 0.05%, 0.04%, 0.03%, 0.02%, 0.01%, 0.009%, 0.008%, 0.007%, 0.006%, 0.005%, 0.004%, 0.003%, 0.002%, 0.001%, 0.0009%, 0.0008%, 0.0007%, 0.0006%, 0.0005%, 0.0004%, 0.0003%, 0.0002%, 또는 0.0001% w/w, w/v 또는 v/v 미만이다.
일부 실시형태에서, 본 발명의 하나 이상의 억제제의 농도는 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20%, 19.75%, 19.50%, 19.25% 19%, 18.75%, 18.50%, 18.25% 18%, 17.75%, 17.50%, 17.25% 17%, 16.75%, 16.50%, 16.25% 16%, 15.75%, 15.50%, 15.25% 15%, 14.75%, 14.50%, 14.25% 14%, 13.75%, 13.50%, 13.25% 13%, 12.75%, 12.50%, 12.25% 12%, 11.75%, 11.50%, 11.25% 11%, 10.75%, 10.50%, 10.25% 10%, 9.75%, 9.50%, 9.25% 9%, 8.75%, 8.50%, 8.25% 8%, 7.75%, 7.50%, 7.25% 7%, 6.75%, 6.50%, 6.25% 6%, 5.75%, 5.50%, 5.25% 5%, 4.75%, 4.50%, 4.25%, 4%, 3.75%, 3.50%, 3.25%, 3%, 2.75%, 2.50%, 2.25%, 2%, 1.75%, 1.50%, 125%, 1%, 0.5%, 0.4%, 0.3%, 0.2%, 0.1%, 0.09%, 0.08%, 0.07%, 0.06%, 0.05%, 0.04%, 0.03%, 0.02%, 0.01%, 0.009%, 0.008%, 0.007%, 0.006%, 0.005%, 0.004%, 0.003%, 0.002%, 0.001%, 0.0009%, 0.0008%, 0.0007%, 0.0006%, 0.0005%, 0.0004%, 0.0003%, 0.0002%, 또는 0.0001% w/w, w/v, 또는 v/v 초과이다.
일부 실시형태에서, 본 발명의 하나 이상의 억제제의 농도는 약 0.0001% 내지 약 50%, 약 0.001% 내지 약 40%, 약 0.01% 내지 약 30%, 약 0.02% 내지 약 29%, 약 0.03% 내지 약 28%, 약 0.04% 내지 약 27%, 약 0.05% 내지 약 26%, 약 0.06% 내지 약 25%, 약 0.07% 내지 약 24%, 약 0.08% 내지 약 23%, 약 0.09% 내지 약 22%, 약 0.1% 내지 약 21%, 약 0.2% 내지 약 20%, 약 0.3% 내지 약 19%, 약 0.4% 내지 약 18%, 약 0.5% 내지 약 17%, 약 0.6% 내지 약 16%, 약 0.7% 내지 약 15%, 약 0.8% 내지 약 14%, 약 0.9% 내지 약 12%, 약 1% 내지 약 10% w/w, w/v 또는 v/v의 범위이다.
일부 실시형태에서, 본 발명의 하나 이상의 억제제의 농도는 약 0.001% 내지 약 10%, 약 0.01% 내지 약 5%, 약 0.02% 내지 약 4.5%, 약 0.03% 내지 약 4%, 약 0.04% 내지 약 3.5%, 약 0.05% 내지 약 3%, 약 0.06% 내지 약 2.5%, 약 0.07% 내지 약 2%, 약 0.08% 내지 약 1.5%, 약 0.09% 내지 약 1%, 약 0.1% 내지 약 0.9% w/w, w/v 또는 v/v의 범위이다.
일부 실시형태에서, 본 발명의 하나 이상의 억제제의 양은 10 g, 9.5 g, 9.0 g, 8.5 g, 8.0 g, 7.5 g, 7.0 g, 6.5 g, 6.0 g, 5.5 g, 5.0 g, 4.5 g, 4.0 g, 3.5 g, 3.0 g, 2.5 g, 2.0 g, 1.5 g, 1.0 g, 0.95 g, 0.9 g, 0.85 g, 0.8 g, 0.75 g, 0.7 g, 0.65 g, 0.6 g, 0.55 g, 0.5 g, 0.45 g, 0.4 g, 0.35 g, 0.3 g, 0.25 g, 0.2 g, 0.15 g, 0.1 g, 0.09 g, 0.08 g, 0.07 g, 0.06 g, 0.05 g, 0.04 g, 0.03 g, 0.02 g, 0.01 g, 0.009 g, 0.008 g, 0.007 g, 0.006 g, 0.005 g, 0.004 g, 0.003 g, 0.002 g, 0.001 g, 0.0009 g, 0.0008 g, 0.0007 g, 0.0006 g, 0.0005 g, 0.0004 g, 0.0003 g, 0.0002 g, 또는 0.0001 g 이하이다.
일부 실시형태에서, 본 발명의 하나 이상의 억제제의 양은 0.0001 g, 0.0002 g, 0.0003 g, 0.0004 g, 0.0005 g, 0.0006 g, 0.0007 g, 0.0008 g, 0.0009 g, 0.001 g, 0.0015 g, 0.002 g, 0.0025 g, 0.003 g, 0.0035 g, 0.004 g, 0.0045 g, 0.005 g, 0.0055 g, 0.006 g, 0.0065 g, 0.007 g, 0.0075 g, 0.008 g, 0.0085 g, 0.009 g, 0.0095 g, 0.01 g, 0.015 g, 0.02 g, 0.025 g, 0.03 g, 0.035 g, 0.04 g, 0.045 g, 0.05 g, 0.055 g, 0.06 g, 0.065 g, 0.07 g, 0.075 g, 0.08 g, 0.085 g, 0.09 g, 0.095 g, 0.1 g, , 0.15 g, 0.2 g, , 0.25 g, 0.3 g, , 0.35 g, 0.4 g, 0.45 g, 0.5 g, 0.55 g, 0.6 g, , 0.65 g, 0.7 g, 0.75 g, 0.8 g, 0.85 g, 0.9 g, 0.95 g, 1 g, 1.5 g, 2 g, 2.5, 3 g, 3.5, 4 g, 4.5 g, 5 g, 5.5 g, 6 g, 6.5 g, 7 g, 7.5g, 8 g, 8.5 g, 9 g, 9.5 g, 또는 10 g 초과이다.
일부 실시형태에서, 본 발명의 하나 이상의 억제제의 양은 0.0001-10 g, 0.0005-9 g, 0.001-8 g, 0.005-7 g, 0.01-6 g, 0.05-5 g, 0.1-4 g, 0.5-4 g, 또는 1-3 g의 범위이다.
실시예
실시예
1
종양 부피에 대한 조합 치료 효과
AML 세포주인 MV4-11은 MLL 융합 및 FLT3-ITD 양성이다. MLL 융합은 이러한 세포주를 종양형성을 유도하는 슈퍼-인핸서 기능에 대해 특히 의존적이도록 만든다. MV4-11 세포를 무흉선 (athymic) Nu/Nu 마우스 피하에 이식하고, 이를 종양 부피가 100-200 mm3에 이를 때까지 허용하였다. 종양 부피에 관한 약물의 효과를 측정하기 위하여, BET 단백질 억제제인 JQ-1과 Cdk 억제제인 알보시디브 (alvocidib)를 단독으로 및 조합하여 사용하였다. 동물을 4개 그룹으로 나누고 다음의 4개 치료제 중 1개를 투여하였다: 비히클, 25 mg/kg JQ-1, 2.5 mg/kg 알보시디브, 또는 이러한 용량의 2개 약물의 조합. 상기 약물을 1일 1회로 5일 동안, 총 3주간 복강내 투여하였다. 캘리퍼 측정으로 종양 부피를 1주에 2회 측정하였다. 결과를 도 2에 도시한다. 비히클 대조군으로 이를 면밀히 추적한 결과, 25 mg/kg의 JQ-1는 측정 가능한 활성을 나타내지 않았다. 2.5 mg/kg의 알보시디브는 연구 전반에 걸쳐 비히클 크기의 대략 50% 정도의 종양으로, 중간 정도의 활성을 나타냈다. 놀랍게도, 이러한 용량 수준의 2개 작용제의 조합은 8일에 마우스에서 종양 성장을 완전히 멈추게 하였다. 조합 그룹에서는 연구 종료시 어떤 마우스 (n=8)에서도 종양이 검출되지 않았다. 연구 전반에 걸쳐 모든 동물의 제충은 비슷하였다. 비히클 및 개별 약물-처리된 마우스에서의 체중 증가가 종양 성장에 기인할 수 있다. 조합 치료를 받은 마우스에서의 체중 증가가 마우스의 전반적인 건강 및 음식 섭취에 기인할 수 있다.
이러한 결과는 알보시디브 및 JQ-1 간의 시너지 효과, 및 또한 2개 이상의 지점에서 슈퍼-인핸서 컴플렉스를 표적화하는 개념에 대한 강력한 증거이다.
실시예
2
c-MYC 발현에 대한 조합 치료 효과
c-MYC 유전자는 AML 세포에서 슈퍼-인핸서 컴플렉스에 의해 조절되는 것으로 알려져있다. c-MYC 발현에 관한 약물의 효과를 측정하기 위하여, BET 단백질 억제제인 JQ-1과 Cdk 억제제인 알보시디브를 단독으로 및 조합하여 사용하였다. MV4-11 세포를 다양한 농도의 알보시디브 및/또는 JQ-1으로 2시간 동안 처리하였다. DMSO-처리된 대조군을 또한 포함하였다. RT-qPCR 분석을 위하여 세포를 용해시키고 RNA를 단리시킴으로써 처리를 중단하였다. c-MYC의 발현을 측정하고 하우스키핑 유전자인 HPRT1 및 DMSO-처리된 대조군에 대해 표준화하였다. 결과를 도 3에 도시한다. 단독으로 사용한 경우, 알보시디브 및 JQ-1는 c-MYC의 발현을 하향조절하였으나; 2개 작용제를 조합하여 사용한 경우의 c-MYC의 하향조절이 보다 만연하였다. 마찬가지로, 이러한 데이터는 2개 작용제 간의 강력한 시너지 효과를 입증하며, 다수의 메커니즘을 통해 슈퍼-인핸서 컴플렉스를 표적화하는 접근법에 대한 뛰어난 근거를 제공한다.
실시예
3
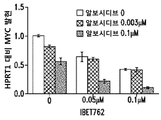
IC50에 대한 조합 치료 효과
AML 세포주인 MOLM13 및 MV4-11은 MLL 융합 및 FLT3-ITD 양성이다. 두 세포주를 20 nM의 알보시디브 (Cdk 억제제)로 48시간 동안 처리하거나, DMSO 대조군으로 처리하고, 이어서 추가 48시간 동안 다양한 농도 (10 μM - 0.0003 μM)의 JQ-1 (BET 단백질 억제제)을 첨가하거나, 다양한 농도 (10 μM - 0.0003 μM)의 파노비노스탯 (HDAC 억제제)을 첨가하였다. 완료시, 셀 타이터 (Cell Titer) GLO 시약으로 세포 생존력을 측정하였다. 저용량의 알보시디브의 존재 및 부재하에서 JQ-1 및 파노비노스탯에 대한 IC50값을 측정하였다. 결과를 표 1에 도시한다. 2배 낮은 IC50 값이 도시된 바와 같이, 20 nM 알보시디브의 첨가로 JQ-1 효능이 증가하였다. 3배 내지 6배 낮은 IC50 값이 입증된 바와 같이, 20 nM 알보시디브의 첨가로 파노비노스탯 (HDAC 억제제)의 효능이 증가하였다. 이러한 데이터는, 개별 억제제에 비해, 조합된 Cdk 및 BET 단백질 억제제 및 Cdk 및 HDAC 억제제에 대한 증가된 활성을 입증한다.
[표 1]
실시예
4
알보시디브에 의한 MYC 및 MCL-1 발현의 억제
알보시디브에 대한 MYC 및 MCL-1 억제 활성을 측정하기 위해서, MV4-11 세포를 알보시디브로 2시간 동안 처리하고, HPRT에 대한 MYC 및 MCL-1의 발현을 측정하였다. 데이터는, 알보시디브가 단독 작용제로서 MV4-11 세포에서의 MYC 발현을 완전히 제거하고 (도 5A), MCL-1 발현을 60%까지 감소시킨다는 것을 나타낸다 (도 5B).
실시예
5
BRD4 억제제와 조합된 알보시디브는 MV4-11 세포에서 세포자멸을 증가시킨다.
MV4-11 세포를 384 웰 플레이트 내 웰당 1×103개 세포로 시딩하였다. BRD4 억제제(IBET762, OTX015 또는 JQ1)를 단일 용량으로 세포에 24시간 동안 첨가하였다. 24시간에 알보시디브를 용량 희석법으로 첨가하였다. 셀 타이터 GLO 및 카스파제 (Caspase) GLO를 첨가하고, 48시간에 발광을 측정하였다. 연속 희석된 알보시디브와 조합된 단일 용량의 BRD4 억제제는 카스파제 활성이 상승적으로 증가함을 입증하였으며, 이는 알보시디브 또는 개별 BRD4 억제제 단독인 경우와 비교하여, BRD4 억제제와 조합된 알보시디브가 MV4-11 암세포에서의 세포자멸을 상승적으로 증가시킨다는 것을 의미한다 (도 6).
실시예
6
BRD4 억제제와 조합된 알보시디브는 개별 처리에서 보다 우수하게 MV4-11 세포에서 MYC 및 MCL-1 발현을 감소시킨다.
MV4-11 세포를 6-웰 플레이트에 시딩하고(1×106개 세포), 알보시디브 또는 BRD4 억제제 (IBET762, OTX015 또는 JQ1)를 단독으로 처리하거나, 알보시디브 및 BDR4 억제제 (IBET762, OTX015 또는 JQ1)를 조합하여 처리하였다. 처리 후 세포를 RT-PCR로 분석하였다. 알보시디브 및 BRD4 억제제의 조합은 개별 처리에서 보다 우수하게 MYC 발현을 감소시켰다 (도 7A-C). 알보시디브 및 BRD4 억제제의 조합은 또한 개별처리에서 보다 우수하게 MCL-1 발현을 감소시켰다 (도 16A-C).
관련 실험에서, MV4-11 세포를 T75 플라스크 중에 시딩하고 (3×106개 세포), 3시간 동안 알보시디브 또는 BRD4 억제제 (IBET762, OTX015 또는 JQ1)를 단독으로 처리하거나, 알보시디브 및 BRD4 억제제 (IBET762, OTX015 또는 JQ1)를 조합하여 처리하였다. 세포를 웨스턴 블롯팅으로 분석하였고, 처리된 모든 샘플에서 MYC 발현이 감소한 것으로 나타났다 (도 8A-C). 웨스턴 블롯의 정량화는 알보시디브 (0.1 mM) 및 BRD4 억제제 (0.1 mM)의 조합이 개별 처리에서 보다 우수하게 MYC 발현을 감소시킨다는 것을 나타낸다 (도 9A-C).
실시예
7
알보시디브는 CDK9 및 HEXIM1 단백질의 회합 (association)을 시간 및 용량 의존적 방식으로 증가시킨다.
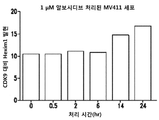
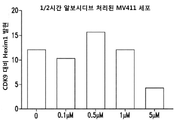
MV4-11 세포를 시딩하고, 동일한 농도 및 용량의 알보시디브로 처리하였다. 세포를 정해진 시간에 수집하고, 고염 용해 완충액을 가하고, 이어서 웨스턴 블롯팅으로 면역침강시켰다. 데이터는, 1 mM의 알보시디브가 CDK9 및 Hexim1의 회합을 시간 의존적 방식으로 증가시킨다는 것을 나타낸다. 대표적인 웨스턴 블롯을 도 10A에 제공하고, 웨스턴 블롯의 정량화를 도 10B에 도시한다. 도 11A 및 도 11B는 상기 일반적 절차에 따라 수행된 용량 증가 연구 (dose escalation study)의 결과를 제공한다. 데이터는, 상이한 용량의 알보시디브가 30분 시점에서 CDK9 및 Hexim1 회합을 변경한다는 것을 나타낸다. 500 nM 용량의 알보시디브는 증가된 CDK9/Hexim1 회합을 입증한다. 도 11A의 대표적인 웨스턴 블롯과 함께 도 11B에 웨스턴 블롯의 정량화를 제공한다.
유사한 실험은 상이한 용량의 알보시디브로 2시간 처리한 것이 CDK9/Hexim1 회합에있어 용량 의존적인 증가를 입증한다는 것을 나타낸다. 도 12A의 대표적인 웨스턴 블롯과 함께 도 12B에 웨스턴 블롯의 정량화를 제공한다.
실시예
8
알보시디브는 슈퍼 인핸서 컴플렉스 조절된 유전자를 시간 및 용량 의존적 방식으로 억제한다.
A549 세포는 II형 폐 상피 모델 (고형 종양)로서 사용되는 선암종 인간 폐포 기저 상피 세포이다. 이러한 세포를 시딩하고, 동일한 농도 및 용량의 알보시디브로 처리하였다. RT-qPCR 분석을 위하여 세포를 용해시키고 RNA를 단리시킴으로써 처리를 중단하였다. 데이터는, 알보시디브가 고형 종양 세포에서 슈퍼 인핸서 컴플렉스 조절된 유전자를 시간 의존적인 방식으로 억제한다는 것을 나타낸다. 대표적인 웨스턴 블롯을 도 13A에 제공한다. mRNA의 발현을 측정하고, β-액틴 및 대조군에 대해 표준화하였다. 알보시디브는 24시간 및 48시간 시점에서 mRNA의 발현을 완전히 하향조절하였다.
도 13B는 이러한 실시예에 제공된 절차에 따라 수행된 용량 증가 연구의 결과를 제공하며, 이는 알보시디브로 처리한 후 2시간에 세포 용해가 일어남을 나타낸다. 용량 범위 (0.05 μM - 8 μM)를 사용하여 A549 세포에 대해 용량 의존적 방식으로 알보시디브에 대한 mRNA 발현 및 회귀 반응을 나타냈다. 데이터는, 0.1 μM 용량의 알보시디브의 현저한 억제와 함께 상이한 용량의 알보시디브가 2시간 시점에서 mRNA 발현을 변경한다는 것을 나타낸다. β-액틴 및 비히클 대조군에 대비하여, 1 μM 내지 8 μM 용량의 분석에서 완전한 억제를 관찰하였다.
실시예
9
알보시디브는 고형 종양 및 신경모세포종 세포에서 시간 의존적 방식으로 단백질 발현을 억제한다.
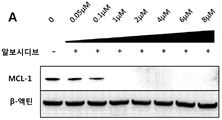
A549 세포 및 SK-N-AS 세포 (인간 부신 신경모세포종 세포주)를 시딩하고, 100 nM 및 300 nM 농도의 알보시디브로 각각 처리하였다. 세포를 정해진 시간에 수집하고, 총 단백질을 추출하고, 웨스턴 블롯팅을 사용하여 이를 검출하였다. 데이터는, 알보시디브가 CDK9을 억제함으로써 시간 의존적 방식으로 MCL-1 및 c-MYC/N-MYC의 단백질 발현을 억제한다는 것을 나타낸다. 대표적인 웨스턴 블롯을 도 14A 및 14B에 제공한다.
실시예
10
알보시디브는 MV4-11 세포에서 시간 의존적 방식으로 mRNA 발현을 억제한다.
MV4-11 세포를 시딩하고 100 nM 농도의 알보시디브로 처리하였다. 처리후 세포를 0.5, 1, 3, 4, 8, 및 16 시간에 수집하였다. 세포를 수확하고 이전 실시예에 기재된 방식의 RT-qPCR 분석을 사용하여 mRNA를 검출하였다. MCL-1의 발현을 대조군 및 비처리된 세포의 발현과 비교하였다. 도 15는 알보시디브가 시간 의존적 방식으로 MCL-1 mRNA 발현을 억제한다는 것을 나타낸다. MCL-1의 발현은 30분 시점에서 억제되고, 투여-1시간 후 억제 최대치에 도달하며, 2시간 시점에서 억제는 감소된다. 3시간 시점까지는 발현을 억제하지 않는 것으로 보인다.
실시예
11
JQ-1와 조합된 알보시디브는 A549 세포에서 개별 처리 보다 우수하게 MCL-1 및 c-MYC 발현을 감소시킨다.
A549 세포를 시딩하고, 0 nM - 100 nM 농도 범위의 알보시디브를 0 nM - 50 nM 농도 범위의 JQ-1과 조합하여 처리하였다. 먼저 세포를 JQ-1로 1시간 동안 처리하고, 이어서 알보시디브로 2시간 동안 처리하였다. 고형 종양 세포를 처리한 후, 세포를 수확하고 이전 실시예에 기재된 방식의 RT-qPCR 분석을 사용하여 mRNA를 검출하였다. 도 17은 알보시디브가 CDK9를 억제함으로써 시간 의존적 방식으로 MCL-1의 mRNA 발현을 억제한다는 것을 나타낸다.
도 18은, 알보시디브가 JQ-1과 조합된 경우, c-MYC의 단백질 발현이 A549 세포에서 억제된다는 것을 나타낸다. 이러한 실시예 내 기재된 것과 동일한 방식으로 세포를 제조하고, 이어서 도 18에 나타난 바와 같이 100 nM의 알보시디브 및 100 nM의 JQ-1로 2시간 동안 처리하였다. 처리 후, 세포를 수확하고 표준 면역블롯팅 기술을 사용하여 단백질을 검출하였다.
실시예
12
JQ-1와 조합된 알보시디브는 A549 세포에서 용량 의존적 방식으로 세포자멸을 증가시킨다.
A549 세포를 0.03 - 10 μM 농도 범위의 JQ-1로 24시간 동안 처리하였다 (도 19). JQ-1로 24시간 동안 처리한 후, 100 nM의 알보시디브를 첨가하였다. 셀 타이터 GLO 및 카스파제 GLO를 첨가하고, 투여-후 48시간에 발광을 측정하였다. 고정된 용량의 알보시디브를 증가하는(escalating) 용량의 JQ-1과 조합하여 카스파제 활성이 상승적으로 증가함을 입증하였다. 1 μM 용량의 JQ-1과 100 nM 용량의 알보시디브를 조합한 경우, 3배 더 높은 세포자멸 반응이 관찰된다. 이러한 증가는, 알보시디브 또는 JQ-1를 단독으로 사용한 경우와 비교하여, 알보시디브를 JQ-1과 조합한 것이 A549 암세포에서의 세포자멸을 상승적으로 증가시킨다는 것을 의미한다 (도 19).
실시예
13
JQ-1와 조합된 디나시클리브는 A549 세포에서 용량 의존적 방식으로 세포자멸을 증가시킨다.
A549 세포를 0.03 - 10 μM 농도 범위의 JQ-1로 24시간 동안 처리하였다 (도 20). JQ-1로 24시간 동안 처리한 후, 3 nM 농도의 디나시클리브를 첨가하였다. 셀 타이터 GLO 및 카스파제 GLO를 첨가하고, 투여-후 48시간에 발광을 측정하였다. 고정된 용량의 디나시클리브를 증가하는 용량의 JQ-1과 조합하여 카스파제 활성이 상승적으로 증가함을 입증하였다. 1 μM 용량의 JQ-1과 3 nM 용량의 디나시클리브를 조합한 경우, 4배 더 높은 세포자멸 반응이 관찰된다. 이러한 증가는, 디나시클리브 또는 JQ-1를 단독으로 사용한 경우와 비교하여, 디나시클리브를 JQ-1과 조합한 것이 A549 암세포에서의 세포자멸을 상승적으로 증가시킨다는 것을 의미한다 (도 20).
실시예
14
알보시디브는 A549 세포에서 MCL-1 및 c-MYC 발현을 감소시킨다.
A549 세포를 시딩하고, 0 μM - 8 μM 농도 범위의 알보시디브로 2시간 동안 처리하였다. 고형 종양 세포를 처리한 후, 세포를 수확하고 이전 실시예에 기재된 방식의 RT-qPCR 분석을 사용하여 mRNA를 검출하였다. 도 21A는 알보시디브가 HPRT1에 대해 용량 의존적 방식으로 MYC의 mRNA 발현을 억제한다는 것을 나타낸다. 도 21B는 알보시디브가 HPRT1에 대해 용량 의존적 방식으로 MCL-1의 mRNA 발현을 억제한다는 것을 나타낸다.
실시예
15
CDK9-특이적 siRNA는 BET 억제제와 상승작용하여 A549 세포에서 단백질 발현을 감소시키고 세포자멸을 증가시킨다.
A549 세포를 시딩하고, 비-표적화 siRNA 또는 CDK9-특이적 siRNA로 48시간 동안 처리하였다. 비처리된 대조군, 비-표적화 siRNA, 및 CDK9-특이적 siRNA의 단백질 발현을 측정하였다. 도 22A는 β-액틴이 일정하게 유지된 반면, 비처리 및 비-표적화 siRNA에 비해 CDK9는 뚜렷하게 감소하였음을 나타낸다.
세포자멸 유도를 평가하기 위하여, 상기에 기재된 절차를 수행하고, 이어서 48시간 동안 BET 억제제 (IBET762, JQ-1, 또는 OTX015)를 0.03 μM의 농도로 처리하였다. BET 억제제로 처리한 48시간 후, 셀 타이터 GLO 및 카스파제 GLO를 첨가하고, 발광을 측정하여 세포 생존력 및 세포자멸을 측정하였다. 도 22B는, BET 억제제와 CDK9-특이적 siRNA과 비교하여, BET 억제제와 비-표적화 siRNA를 조합하여 세포를 처리하는 경우 대략 2-3배로 활성이 증가한다는 것을 나타낸다.
본 명세서에서 언급된 모든 미국 특허, 미국 특허 출원 공보, 미국 특허 출원, 외국 특허, 외국 특허 출원 및 비특허 공보는 본 명세서와 모순되지 않는 범위 내에서 그 전체가 참고 문헌으로 인용된다.
전술한 내용으로부터, 본 발명의 특정 실시 예가 설명의 목적으로 설명되었지만, 본 발명의 사상 및 범위를 벗어나지 않고 다양한 수정이 이루어질 수 있음을 이해할 것이다. 따라서, 본 발명은 첨부된 청구 범위를 제외하고는 제한되지 않는다.
Claims (30)
- 슈퍼-인핸서-매개된 질환의 치료를 필요로 하는 포유동물에게 유효량의 적어도 2개의 하기 치료제를 투여함을 포함하는, 상기 포유동물에서 슈퍼-인핸서-매개된 질환을 치료하는 방법:
i) 사이클린-의존성 키나제 억제제;
ii) 브로모도메인 억제제;
iii) 히스톤 메틸트랜스퍼라제 억제제;
iv) 히스톤 데아세틸라제 억제제; 및
v) 히스톤 데메틸라제 억제제. - 제1항에 있어서,
상기 적어도 하나의 치료제가 사이클린-의존성 키나제 억제제인 것인, 방법. - 제2항에 있어서,
상기 사이클린-의존성 키나제 억제제가 Cdk7, Cdk9 또는 둘 모두를 억제하는 것인, 방법. - 제2항에 있어서,
상기 적어도 하나의 치료제가 CDK9-특이적 siRNA, 알보시디브(alvocidib) 또는 디나시클리브(dinaciclib)인 것인, 방법. - 제1항 내지 제4항 중 어느 한 항에 있어서,
상기 적어도 하나의 치료제가 브로모도메인 억제제인 것인, 방법. - 제5항에 있어서,
상기 브로모도메인 억제제가 Brd4를 억제하는 것인, 방법. - 제5항 또는 제6항에 있어서,
상기 적어도 하나의 치료제가 JQ-1, BI2536, TG101209, OTX015, IBET762, IBET151, CPI-0610 또는 PFI-1인 것인, 방법. - 제1항 내지 제7항 중 어느 한 항에 있어서,
상기 적어도 하나의 치료제가 히스톤 메틸트랜스퍼라제 억제제인 것인, 방법. - 제8항에 있어서,
상기 적어도 하나의 치료제가 Dot1L 또는 EPZ-5676인 것인, 방법. - 제1항 내지 제9항 중 어느 한 항에 있어서,
상기 적어도 하나의 치료제가 히스톤 데아세틸라제 억제제인 것인, 방법. - 제10항에 있어서,
상기 적어도 하나의 치료제가 파노비노스탯(panobinostat) 또는 SAHA인 것인, 방법. - 제1항 내지 제11항 중 어느 한 항에 있어서,
상기 치료제가 히스톤 데메틸라제 억제제인 것인, 방법. - 제12항에 있어서,
상기 적어도 하나의 치료제가 HCI-2509인 것인, 방법. - 제1항에 있어서,
상기 방법이 포유동물에게 유효량의 사이클린-의존성 키나제 억제제 및 브로모도메인 억제제를 투여함을 포함하는, 방법. - 제14항에 있어서,
상기 사이클린-의존성 키나제 억제제가 CDK9-특이적 siRNA 또는 알보시디브인 것인, 방법. - 제14항 또는 제15항에 있어서,
상기 브로모도메인 억제제가 JQ1인 것인, 방법. - 제1항에 있어서,
상기 방법이 포유동물에게 유효량의 사이클린-의존성 키나제 억제제 및 히스톤 데아세틸라제 억제제를 투여함을 포함하는, 방법. - 제17항에 있어서,
상기 사이클린-의존성 키나제 억제제가 알보시디브인 것인, 방법. - 제17항 또는 제18항에 있어서,
상기 히스톤 데아세틸라제 억제제가 파노비노스탯인 것인, 방법. - 제1항 내지 제19항 중 어느 한 항에 있어서,
상기 슈퍼-인핸서-매개된 질환이 암인 것인, 방법. - 제1항 내지 제19항 중 어느 한 항에 있어서,
상기 슈퍼-인핸서-매개된 질환이 급성 골수성 백혈병인 것인, 방법. - 약제학적으로 허용 가능한 담체 또는 부형제 및 적어도 2개의 하기 치료제를 포함하는 약제학적 조성물:
i) 사이클린-의존성 키나제 억제제;
ii) 브로모도메인 억제제;
iii) 히스톤 메틸트랜스퍼라제 억제제;
iv) 히스톤 데아세틸라제 억제제; 및
v) 히스톤 데메틸라제 억제제. - 제22항에 있어서,
상기 조성물이 사이클린-의존성 키나제 억제제를 포함하는, 약제학적 조성물. - 제23항에 있어서,
상기 사이클린-의존성 키나제 억제제가 CDK9-특이적 siRNA, 알보시디브 또는 디나시클리브인 것인, 약제학적 조성물. - 제22항에 있어서,
상기 약제학적 조성물이 사이클린-의존성 키나제 억제제 및 브로모도메인 억제제를 포함하는, 약제학적 조성물. - 제25항에 있어서,
상기 사이클린-의존성 키나제 억제제가 CDK9-특이적 siRNA 또는 알보시디브인 것인, 약제학적 조성물. - 제25항 또는 제26항에 있어서,
상기 브로모도메인 억제제가 JQ1인 것인, 약제학적 조성물. - 제22항에 있어서,
상기 약제학적 조성물이 사이클린-의존성 키나제 억제제 및 히스톤 데아세틸라제 억제제를 포함하는, 약제학적 조성물. - 제28항에 있어서,
상기 사이클린-의존성 키나제 억제제가 알보시디브인 것인, 약제학적 조성물. - 제28항 또는 제29항에 있어서,
상기 히스톤 데아세틸라제 억제제가 파노비노스탯인 것인, 약제학적 조성물.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462077042P | 2014-11-07 | 2014-11-07 | |
| US62/077,042 | 2014-11-07 | ||
| US201562150110P | 2015-04-20 | 2015-04-20 | |
| US62/150,110 | 2015-04-20 | ||
| PCT/US2015/059566 WO2016073913A1 (en) | 2014-11-07 | 2015-11-06 | Methods to target transcriptional control at super-enhancer regions |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170092543A true KR20170092543A (ko) | 2017-08-11 |
Family
ID=55909897
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177013707A KR20170092543A (ko) | 2014-11-07 | 2015-11-06 | 슈퍼-인핸서 부위에서 전사 조절을 표적화하는 방법 |
Country Status (12)
| Country | Link |
|---|---|
| US (2) | US20180280407A1 (ko) |
| EP (1) | EP3215135B1 (ko) |
| JP (1) | JP6689841B2 (ko) |
| KR (1) | KR20170092543A (ko) |
| CN (1) | CN107205959B (ko) |
| AU (1) | AU2015342813B2 (ko) |
| BR (1) | BR112017009552A8 (ko) |
| CA (1) | CA2965690A1 (ko) |
| IL (1) | IL251816B (ko) |
| MX (1) | MX2017005861A (ko) |
| RU (1) | RU2737508C2 (ko) |
| WO (1) | WO2016073913A1 (ko) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6851978B2 (ja) | 2015-04-20 | 2021-03-31 | スミトモ ダイニッポン ファーマ オンコロジー, インコーポレイテッド | ミトコンドリアプロファイリングによるアルボシジブ応答の予測 |
| TR201911032T4 (tr) | 2015-05-18 | 2019-08-21 | Tolero Pharmaceuticals Inc | Artırılmış biyoyararlanıma sahip alvocıdıb ön ilaçları. |
| RU2759963C2 (ru) | 2015-08-03 | 2021-11-19 | Сумитомо Даиниппон Фарма Онколоджи, Инк. | Комбинированные терапии для лечения рака |
| WO2018094275A1 (en) | 2016-11-18 | 2018-05-24 | Tolero Pharmaceuticals, Inc. | Alvocidib prodrugs and their use as protein kinase inhibitors |
| EP3362471B1 (en) | 2016-12-19 | 2021-11-17 | Sumitomo Dainippon Pharma Oncology, Inc. | Profiling peptides and methods for sensitivity profiling |
| US11497756B2 (en) | 2017-09-12 | 2022-11-15 | Sumitomo Pharma Oncology, Inc. | Treatment regimen for cancers that are insensitive to BCL-2 inhibitors using the MCL-1 inhibitor alvocidib |
| WO2019113260A1 (en) * | 2017-12-05 | 2019-06-13 | The Regents Of The University Of Colorado A Body Corporate | Genomic targets of histone deacetylase inhibitors (hdaci) and methods of use thereof |
| EP3758753A1 (en) * | 2018-02-27 | 2021-01-06 | Pfizer Inc | Combination of a cyclin dependent kinase inhibitor and a bet-bromodomain inhibitor |
| US11034710B2 (en) | 2018-12-04 | 2021-06-15 | Sumitomo Dainippon Pharma Oncology, Inc. | CDK9 inhibitors and polymorphs thereof for use as agents for treatment of cancer |
| US11793802B2 (en) | 2019-03-20 | 2023-10-24 | Sumitomo Pharma Oncology, Inc. | Treatment of acute myeloid leukemia (AML) with venetoclax failure |
| WO2023122758A1 (en) * | 2021-12-22 | 2023-06-29 | Cornell University | Prognostic/predictive epigenetic breast cancer signature |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20030026069A (ko) * | 2001-09-24 | 2003-03-31 | 주식회사 엘지생명과학 | 티엔에프계 단백질과 플라보피리돌의 조합에 의한 암세포특이적인 세포사멸 유도용 조성물 |
| RU2438664C2 (ru) * | 2007-05-15 | 2012-01-10 | Пирамал Лайф Сайнсиз Лимитед | Синергическая фармацевтическая комбинация для лечения рака |
| EP2561867A1 (en) * | 2011-08-22 | 2013-02-27 | Lead Discovery Center GmbH | CDK9 inhibitors in the treatment of midline carcinoma |
| US11446309B2 (en) * | 2013-11-08 | 2022-09-20 | Dana-Farber Cancer Institute, Inc. | Combination therapy for cancer using bromodomain and extra-terminal (BET) protein inhibitors |
| WO2016061144A1 (en) * | 2014-10-14 | 2016-04-21 | The Regents Of The University Of California | Use of cdk9 and brd4 inhibitors to inhibit inflammation |
-
2015
- 2015-11-06 RU RU2017118833A patent/RU2737508C2/ru active
- 2015-11-06 WO PCT/US2015/059566 patent/WO2016073913A1/en active Application Filing
- 2015-11-06 AU AU2015342813A patent/AU2015342813B2/en active Active
- 2015-11-06 BR BR112017009552A patent/BR112017009552A8/pt not_active Application Discontinuation
- 2015-11-06 EP EP15857385.7A patent/EP3215135B1/en active Active
- 2015-11-06 KR KR1020177013707A patent/KR20170092543A/ko not_active Application Discontinuation
- 2015-11-06 CA CA2965690A patent/CA2965690A1/en active Pending
- 2015-11-06 JP JP2017523502A patent/JP6689841B2/ja active Active
- 2015-11-06 US US15/524,953 patent/US20180280407A1/en not_active Abandoned
- 2015-11-06 MX MX2017005861A patent/MX2017005861A/es unknown
- 2015-11-06 CN CN201580060262.XA patent/CN107205959B/zh active Active
-
2017
- 2017-04-20 IL IL251816A patent/IL251816B/en unknown
-
2019
- 2019-12-30 US US16/730,810 patent/US20200316084A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| EP3215135A4 (en) | 2018-05-16 |
| IL251816A0 (en) | 2017-06-29 |
| CN107205959B (zh) | 2021-02-12 |
| IL251816B (en) | 2022-03-01 |
| CA2965690A1 (en) | 2016-05-12 |
| RU2737508C2 (ru) | 2020-12-01 |
| AU2015342813A1 (en) | 2017-05-18 |
| MX2017005861A (es) | 2017-06-26 |
| BR112017009552A2 (pt) | 2018-01-02 |
| EP3215135B1 (en) | 2020-05-13 |
| US20180280407A1 (en) | 2018-10-04 |
| JP2017533222A (ja) | 2017-11-09 |
| AU2015342813B2 (en) | 2021-04-22 |
| US20200316084A1 (en) | 2020-10-08 |
| JP6689841B2 (ja) | 2020-04-28 |
| RU2017118833A (ru) | 2018-12-10 |
| WO2016073913A1 (en) | 2016-05-12 |
| EP3215135A1 (en) | 2017-09-13 |
| RU2017118833A3 (ko) | 2019-06-17 |
| BR112017009552A8 (pt) | 2022-10-18 |
| CN107205959A (zh) | 2017-09-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN107205959B (zh) | 靶向在超增强子区域的转录控制的方法 | |
| DE602004007225T2 (de) | Methode zur behandlung von erkrankungen der unteren harnwege | |
| US10583125B2 (en) | Method for treating neurodegenerative diseases | |
| JP6837486B2 (ja) | 加齢に関連する認知障害及び神経炎症を予防及び/又は治療する方法 | |
| JP2018522038A (ja) | がんの処置のための併用療法 | |
| JP2014520856A (ja) | 併用als療法 | |
| JP2022116304A (ja) | 血液がんの治療のためのPPARγアゴニスト | |
| TWI441639B (zh) | 用於治療卵巢癌之包含紫杉醇之組合 | |
| ES2702578T3 (es) | Tratamiento de la inflamación dérmica crónica con norketotifeno | |
| EP2029139B1 (en) | Use of a p38 kinase inhibitor for treating psychiatric disorders | |
| US9839640B2 (en) | Methods of treating eye diseases associated with inflammation and vascular proliferation | |
| EP2371368A2 (en) | Compositions and methods for treatment of inflammation and hyperkeratotic lesions | |
| US20060211672A1 (en) | Use of estrogen receptor-beta selective agonists for radiation-or chemotherapy-induced mucositis and radiation cystitis | |
| JP5788907B2 (ja) | 疾患の治療に使用される化合物 | |
| KR20210084442A (ko) | 포도막 흑색종 치료를 위한 병용 요법 | |
| US20090062395A1 (en) | Renin inhibitors for the treatment of hypertension | |
| US20180064710A1 (en) | Antifungal treatment of psoriasis | |
| JP2010083871A (ja) | 抗アデノウイルス剤を含有する医薬組成物 | |
| TWI515003B (zh) | 醫藥組成物於製備不正常多麩醯胺聚集類疾病之藥物上之用途 | |
| US20070208080A1 (en) | A composition containing a thiourea derivative for preventing or treating pruritic or irritant skin diseases | |
| US9248150B2 (en) | Use of transplatin to prevent hearing loss | |
| CN101014369A (zh) | 利用cox—2选择性抑制剂和ltb4受体拮抗剂的组合用于治疗炎症和疼痛的组合物 | |
| JP2005539058A (ja) | 選択的なホスホジエステラーゼ4−阻害物質による非アレルギー性鼻炎の治療 | |
| KR20150109773A (ko) | 디테르페노이드 화합물을 이용하여 당뇨병을 치료하기 위한 치료 방법 및 조성물 | |
| JP2012082173A (ja) | Nrf2活性化剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |