KR20170003651A - 항-ang2 항체의 사용 방법 - Google Patents
항-ang2 항체의 사용 방법 Download PDFInfo
- Publication number
- KR20170003651A KR20170003651A KR1020167034326A KR20167034326A KR20170003651A KR 20170003651 A KR20170003651 A KR 20170003651A KR 1020167034326 A KR1020167034326 A KR 1020167034326A KR 20167034326 A KR20167034326 A KR 20167034326A KR 20170003651 A KR20170003651 A KR 20170003651A
- Authority
- KR
- South Korea
- Prior art keywords
- antibody
- functional portion
- dose
- administered
- ang2
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/22—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against growth factors ; against growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/337—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having four-membered rings, e.g. taxol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/517—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with carbocyclic ring systems, e.g. quinazoline, perimidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/555—Heterocyclic compounds containing heavy metals, e.g. hemin, hematin, melarsoprol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
- A61K2039/507—Comprising a combination of two or more separate antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Mycology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Oncology (AREA)
- Biomedical Technology (AREA)
- Endocrinology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
본 출원은 항-Ang2 항체 또는 이의 기능성 부분을 단독으로 또는 하나 이상의 추가 치료제와 조합하여 사용하는 암의 치료 및/또는 혈관신생의 억제 방법을 제공한다.
Description
본 출원은 생명공학 및 의학 분야에 관한 것이다.
MEDI1/5는 안지오포이어틴 2(Ang2)에 우선적으로, 그리고 훨씬 적은 정도로 Ang1에 결합하는 인간 IgG1κ 항체이다. Ang2는 인간 종양의 리모델링된 혈관구조에서 광범위한 발현을 나타내지만, 정상 조직에서는 제한된 발현을 보여, 항혈관신생(antiangiogenic) 암요법의 매력적인 후보 표적이 되는, 프로혈관신생 사이토카인이다. Ang2-Tie2 수용기 상호작용의 차단이 고형 종양의 치료를 위해 효과적인 항혈관신생 요법이라는 가설은 증가된 증거들이 뒷받침 해준다.
Ang2는 거의 독점적으로 내피 세포가 발현한다. Ang2 상향조절이 스트레스, 예컨대 저산소를 비롯하여, 히스타민, VEGF 및 FGF에 의한 항혈관신생 자극 및 사이토카인에 대응하여 관찰되었다. 정상 성인 조직에서, Ang2는 혈관 리모델링이 현저한 부위인, 난소, 태반 및 자궁에서 검출될 수 있다. 신생물성 환경에서, 증가된 Ang2 발현은 혈관신생 영역(예를 들어, 유방, 결장, 폐, 신장, 전립선 및 난소 암)과 공간적으로 상호관련되었다. Ang2의 증가된 발현은 종양으로의 Tie2-발현 단핵구(TEM)의 동원을 비롯하여, 추가의 프로혈관신생 사이토카인 예컨대 VEGF에 대응하여 보다 가소성 상태쪽으로 혈관 성장의 균형을 이동시킨다. VEGF처럼, 상승된 Ang2 발현이 신경교종을 비롯해, 신장, 결장, 폐, 유방, 간, 전립선, 위, 난소 및 흑색종 피부 암에서 확인되었다. 게다가, 증가된 Ang2 발현은 다형성 교아세포종(GBM)을 비롯해, 직결장, 위, 유방 및 방광 암에서의 악화된 조직학 등급, 보다 진행된 종양 병기, 및 반대 예후와 상관성이 있었다. 비소세포 폐암(NSCLC)에서, 더 높은 Ang2 발현은 또한 더 나쁜 총 생존률과 상관있었다. 정상 조직에서 그의 제한된 역할과 연결지어 종양 내 혈관 리모델링 부위에서 Ang2의 상승된 발현은 이를 항혈관신생 암요법의 우수한 표적이 되게 한다.
소수의 항혈관신생 약물이 단일요법으로서 유의한 임상적 활성을 보여주었지만, 임상 경험은 항혈관신생 요법이 다른 치료적 중재술과 공동 투여시 보다 더 효과적일 수 있음을 시사한다. 베바시주맙은 직장 또는 결장의 전이성 암종을 갖는 환자에 대한 제1선 세팅으로 정맥내 5-플루오로우라실-기반 화학요법과 조합하여 2004년에 처음 승인되었다. 이는 이후에 비편평 비소세포 폐암(NSCLC)(카보플라틴 및 파클리탁셀과, 제1선 치료), 교아세포종(재발성 질환용 단일 작용제) 및 전이성 신장 세포암종(mRCC)(인터페론 알파 사용)을 포함한 다른 고형 종양을 비롯하여, 직결장 암(CRC)의 제2선 치료와 함께 승인되었다.
따라서, 단독으로 또는 다른 작용제와 조합하여, 항-Ang2 항체 요법의 적절한 치료 계획을 개발하려는 요구가 존재한다.
설명에 따라서, 환자에서 암을 치료하거나 또는 혈관신생을 억제하는 방법을 개시하며, 이 방법은
a. 항-Ang2 항체 또는 이의 기능성 부분을 제공하는 단계,
b. 항-Ang2 항체 또는 이의 기능성 부분을 환자에게 투여하는 단계를 포함하고, 상기 항-Ang2 항체 또는 이의 기능성 부분은 약 200 mg 내지 약 1500 mg의 용량으로 투여된다.
다른 측면에서, 항체 또는 이의 기능성 부분은 MEDI1/5와 동일한 중쇄 및 경쇄 CDR을 포함한다.
일 실시형태에서, 항체 또는 이의 기능성 부분은 MEDI1/5 또는 이의 기능성 부분이다.
하나의 모드에서, 항-Ang2 항체 또는 이의 기능성 부분은 약 200 mg 내지 약 1000 mg의 용량으로 투여된다.
추가 측면에서, 항-Ang2 항체 또는 이의 기능성 부분은 약 300 mg 내지 약 1500 mg의 용량으로 투여된다.
또 다른 실시형태에서, 항-Ang2 항체 또는 이의 기능성 부분은 약 1000 mg 내지 약 1500 mg의 용량으로 투여된다.
더 반복하여, 항-Ang2 항체 또는 이의 기능성 부분은 약 1000 mg의 용량으로 투여된다.
일 실시형태에서, 항-Ang2 항체 또는 이의 기능성 부분은 약 1500 mg의 용량으로 투여된다.
추가 모드에서, 항-Ang2 항체 또는 이의 기능성 부분은 약 60 내지 약 90분 동안 IV 주입으로 투여된다.
일 측면에서, 환자는 다중 용량을 투여받는다.
다른 측면에서, 투여량 주기(dosage cycle)가 약 14일마다이다.
일 실시형태에서, 투여량 주기가 약 21일마다이다.
추가 실시형태에서, 항-Ang2는 하나 이상의 추가 치료제와 공동 투여된다.
추가 모드에서, 하나 이상의 추가 치료제는 카보플라틴, 카페시타빈, 젬시타빈, 또는 파클리탁셀 중 하나 이상으로부터 선택된다.
추가 측면에서, 하나 이상의 추가 치료제는 카보플라틴 및 파클리탁셀이다.
추가 모드에서, 하나 이상의 추가 치료제는 세디라닙이다.
추가 실시형태에서, 하나 이상의 추가 치료제는 항-VEGF 항체 또는 이의 기능성 부분이다.
다른 모드에서, 항체는 베바시주맙이다.
추가 측면에서, 환자는 난소암을 갖는다.
다른 모드에서, 환자는 다형성 교아세포종을 갖는다.
추가의 목적 및 장점은 이하의 설명에서 부분적으로 기재할 것이고, 부분적으로 이러한 설명으로 자명해지거나 또는 실행하여 배울 수 있을 것이다. 목적 및 장점은 첨부된 청구항에서 구체적으로 지적한 성분들 및 조합들을 통해 인식되고 획득될 수 있다.
전술한 일반 설명 및 이하의 상세한 설명은 단지 예시적이고 설명을 위한 것이며 청구항을 제한하려는 것이 아님을 이해해야 한다.
본 명세서의 일부로 편입되고 그를 구성하는 첨부된 도면은 하나(몇몇)의 실시형태(들)를 예시하고, 설명과 함께, 본원에 기술된 원리를 설명하고자 제공된다.
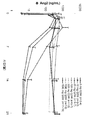
도 1은 전체 임상 실험 디자인을 제공한다.
도 2a는 5, 10, 20, 100, 300, 1000, 및 1500 mg에서 투여된 MEDI1/5에 대한 평균 혈청 MEDI1/5 농도-시간 프로파일을 예시한다. 평균 혈청 농도는 MEDI1/5 용량 수준의 증가에 따라 증가되었다.
도 2b는 60 mg Q2W, 200 mg Q2W, 600 mg Q23W, 및 1000 mg Q2W로 투여된 MEDI1/5에 대한 평균 혈청 MEDI1/5 농도-시간 프로파일을 도시한다. 평균 혈청 농도는 MEDI1/5 용량 수준의 증가에 따라 증가되었다.
도 3은 5, 10, 20, 100, 300, 1000, 및 1500 mg에서 투여된 MEDI1/5에 대한 총 Ang2 수준 농도-시간 프로파일을 예시한다.
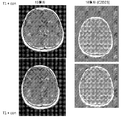
도 4는 신경교육종으로 진단된 환자의 뇌 스캔 결과를 제공한다.
도 5는 다형성 교아세포종으로 진단된 환자의 뇌 스캔 결과를 제공한다.
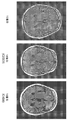
도 6은 도 5의 다형성 교아세포종으로 진단된 환자의 추가 스캔을 제공한다.
도 7은 도 5 및 6의 다형성 교아세포종으로 진단된 환자의 추가 스캔을 제공한다.
서열의 설명
표 1은 본 실시형태에서 참조한 일정 서열의 목록을 제공한다. CDR은 굵게 제공한다.
[표 1]
도 2a는 5, 10, 20, 100, 300, 1000, 및 1500 mg에서 투여된 MEDI1/5에 대한 평균 혈청 MEDI1/5 농도-시간 프로파일을 예시한다. 평균 혈청 농도는 MEDI1/5 용량 수준의 증가에 따라 증가되었다.
도 2b는 60 mg Q2W, 200 mg Q2W, 600 mg Q23W, 및 1000 mg Q2W로 투여된 MEDI1/5에 대한 평균 혈청 MEDI1/5 농도-시간 프로파일을 도시한다. 평균 혈청 농도는 MEDI1/5 용량 수준의 증가에 따라 증가되었다.
도 3은 5, 10, 20, 100, 300, 1000, 및 1500 mg에서 투여된 MEDI1/5에 대한 총 Ang2 수준 농도-시간 프로파일을 예시한다.
도 4는 신경교육종으로 진단된 환자의 뇌 스캔 결과를 제공한다.
도 5는 다형성 교아세포종으로 진단된 환자의 뇌 스캔 결과를 제공한다.
도 6은 도 5의 다형성 교아세포종으로 진단된 환자의 추가 스캔을 제공한다.
도 7은 도 5 및 6의 다형성 교아세포종으로 진단된 환자의 추가 스캔을 제공한다.
서열의 설명
표 1은 본 실시형태에서 참조한 일정 서열의 목록을 제공한다. CDR은 굵게 제공한다.
[표 1]
I. 치료 방법
A. 암을 치료하는 방법
일 실시형태는 환자에서 암을 치료하는 방법을 포함하고, 이 방법은
a. 항-Ang2 항체 또는 이의 기능성 부분을 제공하는 단계,
b. 항-Ang2 항체 또는 이의 기능성 부분을 환자에게 투여하는 단계를 포함하고, 상기 항-Ang2 항체 또는 이의 기능성 부분은 약 300 mg 내지 약 1500 mg의 용량으로 투여된다.
유방암, NSCLC, 난소암, 및 급성 골수성 백혈병에 존재하는 높은 수준의 혈관 내피 성장 인자(VEGF) 및 Ang2는 VEGF 또는 Ang2가 단독으로 상승한 종양 유형에 비해 악화된 예후와 상관있음이 확인되었다. 혈관신생뿐만 아니라, 전이 및 염증에도 관여하는 것으로 보고된 Ang2의 표적화는 항-VEGF의 효능을 향상시킬 수 있다고 가정된다. 혈관신생에서 Ang2의 한가지 역할은 VEGF-A 기능과 협력하는 것으로 보인다. Ang2는 혈관 구조를 불안정하게 만들고 프로혈관신생 인자 예컨대 VEGF 존재 하에서 또는 VEGF-A 부재하에서 혈관신생을 개시한다. Ang2는 또한 내피 세포의 아폽토시스 및 혈관 퇴행을 유도시킨다. 따라서, 일 실시형태에서, 항-Ang2 항체 또는 이의 기능성 부분(예컨대 MEDI1/5)은 항-VEGF 항체인, 베바시주맙과 조합하여 고형 종양에서 혈관신생의 제어를 개선시킬 수 있다. 다른 실시형태에서, 항-Ang2 항체 또는 이의 기능성 부분(예컨대 MEDI1/5)은 단독으로 또는 다른 활성 성분과 조합하여 제공될 수 있다.
이론에 국한되지 않고, MEDI1/5가 결합하는 Ang2 상의 에피토프는 Tie2 수용기에 결합하는 Ang2에 필요한 피브로넥틴 도메인에 대해 맵핑되어서, MEDI1/5를 사용한 치료가 Ang2-Tie2 상호작용을 예방할 것이라고 여겨진다. 이는 MEDI1/5가 인간 Ang1에 비해 인간 Ang2에 대해 실질적으로 더 큰 친화성을 갖는다는 발견으로 더욱 뒷받침된다. 유사하게, MEDI1/5를 사용한 암 환자의 생체 외 치료는, Ang1을 억제하는데 더 높은 농도의 MEDI1/5가 필요했을지라도, 내생성 Ang2 및 또한 내생성 Ang1의 억제를 입증하였다. 생체 내에서, MEDI1/5는 전임상 모델에서 항혈관신생 및 항종양 활성이 입증되었다. 본원에서 제공하는 이러한 증거 및 예시적인 증거는 본원에 개시된 치료 방법을 뒷받침한다.
B. 혈관신생을 억제하는 방법
다른 실시형태는 환자에서 혈관신생을 억제하는 방법을 포함하고, 이 방법은
a. 항-Ang2 항체 또는 이의 기능성 부분을 제공하는 단계,
b. 항-Ang2 항체 또는 이의 기능성 부분을 환자에게 투여하는 단계를 포함하고, 상기 항-Ang2 항체 또는 이의 기능성 부분은 약 300 mg 내지 약 1500 mg의 용량으로 투여된다.
혈관신생을 억제하는 방법의 일 실시형태에서, 환자는 암을 갖는다.
C. 치료 방법에서 사용을 위한 항체
본 발명은 임의의 항-Ang2 항체 또는 이의 기능성 부분을 사용할 수 있다. 일 실시형태에서, 항-Ang2 항체 또는 이의 기능성 부분은 MEDI1/5와 동일한 중쇄 가변 영역 및 경쇄 가변 영역(서열번호 1 및 2)을 갖는다. 다른 실시형태에서, 항-Ang2 항체 또는 이의 기능성 부분은 MEDI1/5와 동일한 중쇄 및 경쇄 CDR(서열번호 1 및 2에 굵게 도시한 CDR)을 갖는다. 다른 모드에서, 항체 또는 이의 기능성 부분은 MEDI1/5와 동일한 에피토프에 결합한다. 다른 측면에서, 항체 기능성 부분은 항체 MEDI1/5의 기능성 부분이다.
다른 실시형태에서, 항-Ang2 항체 또는 이의 기능성 부분은 미국 특허 제8,507,656호, 예를 들어 컬럼 11, 56째줄에서 컬럼 20에 개시되어 있고, 항-Ang2 항체 및 이의 기능성 부분에 관한 설명을 그 전체로 참조하여 본원에 편입시킨다. 일 측면에서, 항체 또는 기능성 부분은 Ang-2에 결합할 수 있고/있거나, 암을 치료하고/하거나, 혈관신생을 억제하고/하거나, Ang-2를 길항하고/하거나 Tie-2를 길항한다.
일 실시형태에서, 항체 또는 이의 기능성 부분은 미국 특허 제8,507,656호에서 참조하여 편입시킨 바와 같이, 3.19.3 경쇄, MEDI1; MEDI2; MEDI3; MEDI4; 및 MEDI6에서 선택된 서열을 포함하는 가변 경쇄를 포함한다. 일 측면에서, 항체 또는 이의 기능성 부분은 IgG1 또는 IgG2 이소타입 항체 또는 이의 기능성 부분이다. 다른 측면에서, 항체 또는 이의 기능성 부분은 미국 특허 제8,507,656호에서 참조하여 편입시킨 바와 같이 3.19.3 중쇄 및 MEDI5에서 선택된 서열을 포함하는 가변 중쇄 영역을 더 포함한다.
일 실시형태에서, 항체 또는 이의 기능성 부분은 미국 특허 제8,507,656호에서 참조하여 편입시킨 바와 같이 3.19.3, MEDI1/5, MEDI2/5, MEDI3/5, MEDI6/5, 및 MEDI4/5에서 선택된 완전한 인간 단일클론 항체 중 어느 하나와 동일한 에피토프에 결합한다. 다른 실시형태에서, 항체는 미국 특허 제8,507,656호에서 참조하여 편입시킨 바와 같이 3.19.3, MEDI1/5, MEDI2/5, MEDI3/5, MEDI6/5, 및 MEDI4/5에서 선택된 완전한 인간 단일클론 항체이다. 다른 실시형태에서, 항체 기능성 부분은 미국 특허 제8,507,656호에서 참조하여 편입시킨 바와 같이 3.19.3, MEDI1/5, MEDI2/5, MEDI3/5, MEDI6/5, 및 MEDI4/5에서 선택된 완전한 인간 단일클론 항체의 기능성 부분이다.
D. 투약
암을 치료하는 방법 또는 혈관신생을 억제하는 방법에서, 다양한 투여량 접근법이 항-Ang2 항체 또는 이의 기능성 부분에 대해 사용될 수 있다.
일 실시형태에서, 항 Ang2-항체 또는 이의 기능성 부분은 약 200 mg 내지 약 1500 mg, 약 1000 mg 내지 약 1500 mg, 약 750 mg 내지 약 1250 mg, 또는 약 900 mg 내지 약 1100 mg의 용량으로 투여될 수 있다. 일 실시형태에서, 이의 기능성 부분은 약 200 mg, 약 300 mg, 약 600 mg, 약 750 mg, 약 1000 mg, 약 1250 mg, 또는 약 1500 mg의 용량으로 투여될 수 있다.
일 실시형태에서, 항-Ang2 항체 또는 이의 기능성 부분은 약 60 내지 약 90분간 IV 주입으로 투여된다. 일 측면에서, IV 주입은 약 60분 동안일 수 있고 투여량은 약 1000 mg 미만일 수 있다. 다른 측면에서, IV 주입은 약 90분 동안일 수 있고 투여량은 약 1000 mg 이상일 수 있다.
하나의 모드에서, 환자는 한 투여량을 투여받는다. 다른 모드에서, 환자는 다중 용량을 투여받는다. 일 실시형태에서, 투여량 주기가 1주, 2주, 3주, 4주, 5주, 또는 6주이다. 일 실시형태에서, 투여량 주기가 약 7일마다, 약 14일마다, 약 21일마다 또는 약 28일마다이다. 21일 투여량 주기란, 예를 들어, 우리가 1일에 용량을 투여받은 후 추가 20일은 용량을 투여받지 않고, 이후 22일에 다음 용량을 투여받는 것 등을 의미한다.
일 실시형태에서, 1500 mg의 용량을 21일마다 제공한다. 다른 실시형태에서, 1000 mg의 용량을 14일마다 제공한다.
일 실시형태에서, 약 300 mg 내지 약 1500 mg의 용량을 21일마다 제공한다. 다른 실시형태에서, 약 200 mg 내지 약 1000 mg의 용량을 14일마다 제공한다.
일 실시형태에서, 적어도 2회 투여량 주기(즉, 환자가 2 용량을 투여받음)가 존재한다. 다른 실시형태에서, 적어도 3, 4, 5, 6, 7, 8, 9, 10, 11, 12회, 또는 12회가 넘는 투여량 주기가 존재한다. 일 실시형태에서, 12 내지 18회 투여량 주기가 존재한다. 다른 실시형태에서, 12 내지 31회 투여량 주기가 존재한다.
E. 하나 이상의 추가 치료제의 공동투여
항-Ang2 항체 또는 이의 기능성 부분은 단독으로 투여될 수 있다. 다른 실시형태에서, 항-Ang2 항체 또는 이의 기능성 부분은 하나 이상의 추가 치료제와 공동투여될 수 있다. 하나의 모드에서, 항-Ang2 항체 또는 기능성 부분은 2 또는 그 이상의 추가 치료제와 공동투여된다. 공동투여는 동시 투여 또는 순차적 투여일 수 있다. 순차적 투여는 동일한 날 또는 다른 날에 일어날 수 있다. 순차적 투여가 다른 날에 일어나는 경우, 동일한 투여량 주기이거나 또는 상이한 투여량 주기로 일어날 수 있다.
일 실시형태에서, 하나 이상의 추가 치료제는 하나 이상의 화학요법제이다. 일정 측면에서, 화학요법제는 카보플라틴, 카페시타빈, 젬시타빈, 또는 파클리탁셀 중 하나 이상으로부터 선택될 수 있다. 일 측면에서, 하나 이상의 화학요법제는 카보플라틴 및 파클리탁셀이다. 일 측면에서, 하나 이상의 화학요법제는 카보플라틴 및 젬시타빈이다.
일 실시형태에서, 추가 치료제의 투여량 주기가 3일, 1주, 2주, 3주, 4주, 5주 또는 6주이다. 일 실시형태에서, 추가 치료제의 투여량 주기가 약 3일마다, 7일, 14일, 21일, 또는 약 28일마다이다.
화학요법제가 파클리탁셀이면, 일 실시형태에서, 약 80 mg/㎡가 투여될 수 있다. 화학요법제가 파클리탁셀이면, 일 실시형태에서, 약 175 mg/㎡가 투여될 수 있다. 화학요법제가 젬시타빈이면, 일 실시형태에서, 약 1000 mg/㎡가 투여될 수 있다. 화학요법제가 카보플라틴이면, 일 실시형태에서, 약 AUC 4 또는 5로 투여될 수 있다.
카보플라틴의 AUC-기반 투약은 카보플라틴 투약 가이드라인에 관해 그 전체로 참조하여 편입시킨, 2010년 10월 14일자, 카보플라틴을 사용하는 국립 암센타가 지원하는 프로토콜의 실행 지시서의 후속편을 사용해 결정할 수 있다. 일 실시형태에서, 다음의 칼버트(Calvert) 식이 사용되고,
총 용량(mg) =(표적 AUC) x(GFR + 25)
이 식에서, GFR은 사구체 여과율이다. 일 실시형태에서, GFR은 혈청 크레아틴 수준을 사용해 추정된다. 일 측면에서, 최대 카보플라틴 용량은 표적 AUC(mg 분/mL) x 150 mL/분을 넘지 않는다. 예를 들어, 일 실시형태에서, 최대 카보플라틴 용량은 5의 AUC에 대해 약 750 mg일 수 있고 4의 AUC에 대해 약 600 mg일 수 있다. 대안적으로, 다른 실시형태에서, 예컨대 근육량이 낮은 환자는, GFR을 직접 측정하거나 또는 0.6 mg/dL의 최소 크레아티닌 수준을 사용할 수 있다.
다른 측면에서, 하나 이상의 추가 치료제는 항체 또는 이의 기능성 부분이다. 예를 들어, 항체 또는 이의 기능성 부분은 항-VEGF 항체 또는 이의 기능성 부분에서 선택될 수 있다. 하나의 모드에서, 항체 또는 이의 기능성 부분은 베바시주맙에서 선택될 수 있다. 하나의 모드에서, 베바시주맙은 약 10 mg/kg 또는 약 15 mg/kg으로 투여될 수 있다. 하나의 모드에서, 베바시주맙은 약 10 mg/kg 내지 약 15 mg/kg으로 투여될 수 있다. 일 측면에서, 베바시주맙은 2주마다 또는 3주마다 투여될 수 있다.
다른 측면에서, VEGF 또는 VEGF 경로를 억제하는 다른 작용제를 선택할 수 있다. 예를 들어, 하나 이상의 추가 치료제는 혈관 내피 성장 인자 수용기의 억제제인, 세디라닙일 수 있다.
F. 치료 후보
하나의 방법에서, 환자는 암을 갖는다. 일 실시형태에서, 환자는 난소암을 갖는다. 다른 실시형태에서, 환자는 다형성 교아세포종을 갖는다.
하나의 방법에서, 암은 유방암, 결장암, 폐암, 신장암, 전립선암, 난소암, 자궁경부암, 간암, 위암, 방광암, 피부암, 백혈병, 또는 뇌암이다. 다른 실시형태에서, 피부암은 흑색종이거나, 뇌암은 신경교종이거나, 뇌암은 다형성 교아세포종이거나, 또는 폐암은 비소세포 폐암이다.
다른 방법에서, 암은 담즙(담관암종), 방광, 혈액, 뼈, 뇌, 유방, 중추 신경계 암, 흉부, 직장, 직결장, 자궁내막 암, 유표피 암종, 식도, 눈, 위식도, 교아세포종, 신경교종, 머리 및 목, 신장, 후두, 백혈병, 간(예컨대 간세포 암종), 폐, 림프절, 림프종, 흑색종, 중피종, 입, 골수종, 비소세포 폐암종, 난소, 췌장, 소아 악성종양, 전립선, 직장, 타액선, 육종, 소장 선암종, 소세포 폐암종, 위, 고환, 인후, 갑상선, 및/또는 자궁 암이다.
추가의 암은 제한없이, 다음을 포함한다: 백혈병 예컨대 제한없이, 급성 백혈병, 급성 림프구성 백혈병, 급성 골수성 백혈병 예컨대 골수아구성, 전골수성, 골수단구성, 단구성, 적백혈병성 백혈병 및 골수이형성 증후군, 만성 백혈병 예컨대 제한없이, 만성 골수성(과립구성) 백혈병, 만성 림프구성 백혈병, 모발 세포 백혈병; 진성 다혈구증; 림프종 예컨대 제한없이 호지킨 질환, 비호지킨 질환; 다발성 골수종 예컨대 제한없이 무증상 다발성 골수종, 비분비성 골수종, 골경화성 골수종, 혈장 세포 백혈병, 고립성 형질세포종 및 골수외 형질세포종; 발덴스트롬 마크로글로불린혈증; 의미불명의 단일클론 감마병증; 양성 단일클론 감마병증; 중쇄 질환; 골암 및 결합 조직 육종 예컨대 제한없이 골육종, 골수종 골질환, 다발성 골수종, 진주종-유도성 뼈 골육종, 뼈의 페제트병, 골육종, 연골육종, 유잉 육종, 악성 거대 세포 종양, 뼈의 섬유육종, 척색종, 골막 육종, 연조직 육종, 혈액육종(혈관육종), 섬유육종, 카포시 육종, 평활근육종, 지방육종, 림프관육종, 신경초종, 횡문근육종, 및 활액막 육종; 뇌종양 예컨대 제한없이, 신경교종, 성상세포종, 뇌간 신경교종, 상의세포종, 핍돌기신경교종, 비교질 종양, 청신경초종, 두개인두종, 수모세포종, 뇌수막종, 송과체세포종, 송과체아세포종, 및 원발성 뇌 림프종; 제한없이 선암종, 소엽(소세포)암종, 관내암종, 수질 유방암, 점액 유방암, 관상 유방암, 유두상 유방암, 페제트병(연소기 페제트병 포함) 및 염증성 유방암을 포함한 유방암; 부신암 예컨대 제한없이 크롬친화세포종 및 부신피질암종; 갑상선암 예컨대 제한없이 유두상 또는 소낭 갑상선암, 수질 갑상선암 및 역행성 갑상선암; 췌장암 예컨대 제한없이, 인슐린종, 가스트리노마, 글루카곤종, 비포마, 소마토스타틴-분비 종양, 및 유암종 또는 섬세포 종양; 뇌하수체암 예컨대 제한없이, 쿠싱병, 프로락틴-분비 종양, 말단비대증, 및 요붕증; 안암 예컨대 제한없이 안구 흑색종 예컨대 홍채 흑색종, 맥락막 흑색종, 및 모양체 흑색종, 및 망막아세포종; 질암 예컨대 편평 세포 암종, 선암종, 및 흑색종; 외음부암 예컨대 편평 세포 암종, 흑색종, 선암종, 기질 세포 암종, 육종, 및 페제트병; 자궁경부암 예컨대 제한없이, 편평 세포 암종, 및 선암종; 자궁암 예컨대 제한없이 자궁내막암종 및 자궁 육종; 난소암 예컨대 제한없이, 난소 상피암종, 경계성 종양, 배세포 종양, 및 기질 종양; 식도 암 예컨대 제한없이, 편평암, 선암종, 선양 낭포암종, 점막표피양암종, 선편평암종, 육종, 흑색종, 형질세포종, 우상암종, 및 연맥 세포(소세포)암종; 위암 예컨대 제한없이, 선암종, 진균양(폴립성), 궤양성, 표재성 확산, 미만성 확산, 악성 림프종, 지질육종, 섬유육종, 및 암육종; 결장암; 직장암; 간암 예컨대 제한없이 간세포암종 및 간아세포종, 담낭암 예컨대 선암종; 담관암종 예컨대 제한없이 유두상, 결절성, 및 미만성; 폐암 예컨대 비소세포 폐암, 편평 세포 암종(유표피암종), 선암종, 거대 세포 암종 및 소세포 폐암; 고환암 예컨대 제한없이 생식 세포 종양, 정상피종, 역형성, 고전적(전형적), 정모세포성, 비정상피종, 배아암종, 기형종암종, 융모막암종(난황낭 종양), 전립선암 예컨대 제한없이, 선암종, 평활근육종, 및 횡문근육종; 음경암; 경구암 예컨대 제한없이 편평 세포 암종; 기저암; 타액선암 예컨대 제한없이 선암종, 점막표피모양암종, 및 선양낭포암종; 인두암 예컨대 제한없이 편평 세포 암, 및 우상; 피부암 예컨대 제한없이, 기저 세포 암종, 편평 세포 암종 및 흑색종, 표재 확산 흑색종, 결절성 흑색종, 흑색점 악성 흑색종, 선단 흑자성 흑색종; 신장암 예컨대 제한없이 신장 세포 암, 선암종, 부신종, 섬유육종, 이행 세포 암(신우 및/또는 수뇨관); 빌름 종양; 방광암 예컨대 제한없이 이행 세포암종, 편평 세포 암, 선암종, 암육종. 또한, 암은 점액육종, 골원성 육종, 내피육종, 림프관내피육종, 중피종, 활액막종, 혈관아세포종, 상피암종, 낭선암종, 기관지원성암종, 땀샘암종, 피지선 암종, 유두상 암종 및 유두상 선암종을 포함한다. 아폽토시스 이상에 의해 야기된 암이 또한 본 발명의 방법 및 조성물로 치료될 수 있음을 역시 고려한다. 이러한 암에는 제한없이, 소포성 림프종, p53 돌연변이 수반 암종, 유방, 전립선 및 난소의 호르몬 의존적 종양, 및 전암성 병변 예컨대 가계성 선종성 용종증, 및 골수이형성 증후군이 포함될 수 있다.
카르노프스키 수행 상태 지수는 그들 기능 손상에 따라 환자를 분류할 수 있다. 카르노프스키 점수가 낮을수록, 대부분의 중증 질병의 생존률이 더 악화된다.
| 표 2: 카르노프스키 수행 상태 | ||
| 범주 | 카노프스키 상태 | 설명 |
| 정상 활동을 수행할 수 있고 일할 수 있음; 특별한 보살핌을 요하지 않음 | 100 | 정상 불편사항 없음; 질환 증거 없음. |
| 90 | 정상 활동 수행가능; 질환의 경미한 징후 또는 증상 | |
| 80 | 노력으로 정상 활동; 질환의 일부 징후 또는 증상 | |
| 일할 수 없음; 집에서 생활할 수 있고 대부분의 개인 욕구를 돌봄; 다양한 도움량을 요함. | 70 | 자신을 돌봄; 정상 활동 수행 불가 또는 활동적인 일 수행 불가. |
| 60 | 가끔 도움을 요하지만, 대부분의 그 개인 욕구를 돌볼 수 있음. | |
| 50 | 상당한 도움과 빈번한 의료를 요함. | |
| 자신을 돌볼수 없음; 기관 또는 병원 보호에 상응하는 것을 요함; 질환이 급속히 진행될 수 있음. | 40 | 장애가 있음; 특별한 보살핌 및 도움을 요함. |
| 30 | 중증 장애; 죽음이 임박하지 않았지만 입원을 권고. | |
| 20 | 매우 아픔; 병원 입원 필수; 적극적인 지지 치료가 필수. | |
| 10 | 빈사상태; 치명적 과정이 급속히 진행. | |
| 0 | 사망 | |
일 실시형태에서, 환자는 카르노프스키 수행 상태가 약 60 이상이다. 다른 실시형태에서, 환자는 카르노프스키 수행 상태가 70 이상이다.
II. 항체 및 이의 기능성 부분을 코딩하는 핵산
A. 항체 또는 이의 기능성 부분을 코딩하는 핵산의 사용 방법
또 다른 실시형태에서, 항체 또는 기능성 부분을 코딩하는 핵산이 투여될 수 있다. 그러한 핵산의 투여시, 항체 또는 기능성 부분은 숙주 기구가 생산한다. 일 측면에서, 생산된 항체 또는 기능성 부분은 Ang-2에 결합하고/하거나, 암을 치료하고/하거나, 혈관신생을 억제하고/하거나, Ang-2를 길항하고/하거나 Tie-2를 길항할 수 있다.
항체의 기능성 부분을 코딩하는 핵산은 항체를 코딩하는 핵산처럼 하나 이상의 발현 특징(양과 같은 것일 필요는 없음)을 포함하는, 적어도 30 염기쌍 길이, 적어도 50 염기쌍 길이, 또는 적어도 100 염기쌍 길이의 핵산을 의미한다. 일 실시형태에서, 항체의 기능성 부분을 코딩하는 핵산은 적어도 본원에 기술된 항체의 2 또는 경우에 따라 3 CDR을 포함하는 핵산 서열을 코딩한다.
III. 항체 및 기능성 부분을 제조하는 방법
항체 또는 기능성 부분을 생산할 수 있는 단리된 핵산 생산 세포를 또한 제공한다. 항체 또는 이의 기능성 부분을 생산하는 일정 방법이 미국 특허 제8,507,656호에서, 예를 들어 컬럼 21, 4째줄에서 컬럼 25의 27째줄에 제공되어 있고, 항체 및 이의 기능성 부분을 제조하는 방법의 설명에 관해 그 전체로 참조하여 본원에 편입시킨다.
본원에 기술된 항체 또는 기능성 부분은 항체 또는 이의 기능성 부분을 분비하는 하이브리도마로부터 또는 항체 또는 기능성 부분을 코딩하는 유전자 또는 유전자들로 형질전환 또는 형질감염된 재조합 생산된 세포로부터 제작될 수 있다.
일 실시형태는 핵산이 항체 또는 이의 기능성 부분을 생산하도록 발현되는 조건 하에서 숙주 세포를 배양시키는 단계, 이어서 항체 또는 이의 기능성 부분을 회수하는 단계에 의해 항체 또는 기능성 부분을 생상하는 방법을 포함한다. 제한없이, 포유동물 세포주를 포함하여, 다양한 세포주가 항체 또는 기능성 부분을 발현시키는데 사용될 수 있다. 일 실시형태에서, 세포주는 인간일 수 있다. 다른 실시형태에서, 박테리아 또는 곤충 세포주가 사용될 수 있다. 일 실시형태에서, 세포주는 중국 햄스터 난소(CHO) 세포, CHO 세포의 변이체(예를 들어, DG44), 293 세포 및 NSO 세포를 포함한다. 다른 실시형태에서, 세포주는 VERY, BHK, HeLa, COS, MDCK, 293F, 293T, 3T3, W138, BT483, Hs578T, HTB2, BT2O 및 T47D, CRL7O3O 및 HsS78Bst 세포를 포함한다.
재조합 발현은 항체 또는 기능성 부분을 코딩하는 폴리뉴클레오티드를 함유하는 발현 벡터의 구성을 이용한다. 폴리뉴클레오티드를 얻으면, 항체 또는 이의 기능성 부분의 생산을 위한 벡터는 당분야에 잘 알려진 재조합 DNA 기술에 의해 생성시킬 수 있다. 발현 벡터는 적절한 전사 및 번역 제어 신호를 포함할 수 있다. 이는 시험관내 재조합 DNA 기술, 합성 기술, 및 생체 내 유전자 재조합을 사용해 수행할 수 있다. 일 실시형태에서, 복제가능한 벡터는 이종성 프로모터에 작동적으로 연결된 항체 또는 기능성 부분을 코딩하는 핵산 서열을 포함한다.
다양한 숙주 발현 벡터 시스템이 미국 특허 제5,807,715호에 기술된 바와 같이 항체 또는 기능성 부분을 발현시키는데 이용될 수 있다. 예를 들어, 포유동물 세포 예컨대 중극 햄스터 난소 세포(CHO)는 인간 사이토메갈로바이러스 유래의 주요 중간 초기 유전자 프로모터 성분과 같은 벡터와 함께, 항체에 효과적인 발현 시스템이다([Foecking et al., Gene, 45:101(1986)]; 및 [Cockett et al., Bio/Technology, 8:2(1990)]). 또한, 숙주 세포주는 삽입된 서열의 발현을 조정하거나, 원하는 특별한 방식으로 유전자 산물을 개질 및 가공하는 것을 선택할 수 있다. 단백질 산물의 그러한 개질(예를 들어, 당화) 및 가공(예를 들어, 절단)은 단백질의 기능에 중요할 수 있다. 상이한 숙주 세포는 단백질 및 유전자 산물의 번역후 가공 및 개질을 위한 특징적이고 특별한 기전을 갖는다. 적절한 세포주 또는 숙주 시스템은 본 발명의 단백질의 올바른 개질 및 가공을 보장하도록 선택될 수 있다. 이러한 목적을 위해, 유전자 산물의 1차 전사체의 적절한 가공, 당화, 및 인산화를 위한 세포 기전을 보유하는 진핵생물 숙주 세포를 사용할 수 있다.
박테리아 시스템에서, 수많은 발현 벡터들이 발현되는 항체 또는 기능성 부분에 대해 의도된 용도에 따라 선택될 수 있다. 예를 들어, 항체 또는 기능성 부분을 포함하는 약학 조성물의 생성을 위해, 대량의 그러한 항체 또는 기능성 부분이 생산되어야 하는 경우, 쉽게 정제되는 높은 수준의 융합 단백질 산물의 발현을 지정하는 벡터가 바람직할 수 있다. 그러한 벡터는 제한없이, 융합 단백질이 생산되도록 코딩 서열이 lacZ 코딩 영역과 인 프레임으로 벡터에 개별적으로 결찰될 수 있는, 이. 콜라이(E. coli) 발현 벡터 pUR278(Ruther et al., EMBO, 12:1791(1983)); pIN 벡터(Inouye & Inouye, 1985, Nucleic Acids Res. 13:3101-3109(1985); Van Heeke & Schuster, 1989, J. Biol. Chem., 24:5503-5509(1989)); 등을 포함한다. pGEX 벡터가 또한 글루타티온-S-트랜스퍼라제(GST)와의 융합 단백질로서 외래 폴리펩티드를 발현하는데 사용될 수 있다. 대체로, 그러한 융합 단백질은 가용성이고 글루타티온-아가로스 친화성 매트릭스에 흡착 및 결합 후 자유 글루타티온 존재 하에 용리하여 용해된 세포로부터 쉽게 정제할 수 있다. pGEX 벡터는 클로닝된 표적 유전자 산물이 GST 모이어티로부터 방출될 수 있도록 트롬빈 및/또는 Xa 프로테아제 절단 부위가 발현되는 폴리펩티드에 도입되게 디자인된다.
곤충 시스템에서, 아우토그라파 칼리포니카(Autographa californica) 핵 다각체병 바이러스(AcNPV)가 외래 유전자를 발현하기 위한 벡터로 사용된다. 이 바이러스는 스포돕테라 프루기페다(Spodoptera frugiperda) 세포에서 성장된다. 단백질 코딩 서열이 개별적으로 바이러스의 불필수 영역(예를 들어, 폴리헤드린 유전자)에 클로닝되어 AcNPV 프로모터(예를 들어, 폴리헤드린 프로모터)의 제어 하에 위치된다.
포유동물 숙주 세포의 경우, 수많은 바이러스 기반 발현 시스템이 이용될 수 있다. 아데노바이러스가 발현 벡터로 사용되는 경우, 관심 코딩 서열은 아데노바이러스 전사/번역 제어 복합체, 예를 들어 후기 프로모터 및 3부 리더 서열에 결찰될 수 있다. 이러한 키메라 유전자는 시험관 내 또는 생체 내 재조합에 의해 아데노바이러스 게놈에 삽입될 수 있다. 바이러스 게놈의 불필수 영역(예를 들어, 영역 E1 또는 E3)으로의 삽입은 감염된 숙주에서 생존할 수 있고 항체 또는 기능성 부분을 발현할 수 있는 재조합 바이러스를 생성하게 된다(예를 들어, 문헌 [Logan & Shenk, Proc. Natl. Acad. Sci. USA, 81:355-359(1984)] 참조). 특별한 개시 신호가 또한 삽입된 항체 또는 기능성 부분 코딩 서열의 효율적인 번역을 위해 필요할 수 있다. 이들 신호는 ATG 개시 코돈 및 인접한 서열을 포함한다. 또한, 개시 코돈은 대체로 전체 삽입부의 번역을 보장하도록 목적 코딩 서열의 리딩 프레임과 인 프레임으로 존재해야 한다. 이들 외생성 번역 제어 신호 및 개시 코돈은 다양한 기원일 수 있고, 천연 및 합성일 수 있다. 발현 효율은 적절한 전사 인핸서 성분, 전사 종료인자 등의 포함에 의해 향상될 수 있다(예를 들어, 문헌 [Bittner et al., Methods in Enzymol., 153:51-544(1987)]을 참조한다).
안정한 발현이 재조합 단백질의 장기간, 고수율 생산에 사용될 수 있다. 예를 들어, 단백질 분자를 안정하게 발현하는 세포주를 생성시킬 수 있다. 숙주 세포를 발현 제어 성분(예를 들어, 프로모터, 인핸서, 전사 종결인자, 폴리아데닐화 부위 등) 및 선별 마커 유전자를 포함하는 적절하게 조작된 벡터로 형질전환시킨다. 외래 DNA의 도입 후, 세포를 강화 배지에서 1-2일 동안 성장시킨 후, 선별 배지로 교체한다. 재조합 플라스미드의 선별 마커는 선별에 내성을 부여하여 그들 염색체에 플라스미드가 안정하게 통합된 세포가 성장해 증식소를 형성할 수 있게 하고 결국에 복제되어 세포주로 확장시킬 수 있다. 항체 또는 기능성 부분을 코딩하는 플라스미드를 사용해 배양 생산에 적합한 임의의 세포주에 유전자/cDNA를 도입시킬 수 있다.
수많은 선별 시스템이 사용될 수 있고, 제한없이, 헤르페스 심플렉스 바이러스 티미딘 키나제(Wigler et al., Cell, 11:223(1977)), 히포잔틴구아닌 포스포리보실트랜스퍼라제(Szybalska & Szybalski, Proc. Natl. Acad. Sci. USA, 48:202(1992)), 및 아데닌 포스포리보실트랜스퍼라제(Lowy et al., Cell, 22:8-17(1980)) 유전자를 포함하여, 각각 tk-, hgprt- 또는 aprT- 세포에 도입시킬 수 있다. 또한, 항대사물질 내성을 다음의 유전자의 선별 기반으로 사용할 수 있다: 메토트렉세이트에 대한 내성을 부여하는, dhfr(Wigler et al., Natl. Acad. Sci. USA, 77:357(1980); O'Hare et al., Proc. Natl. Acad. Sci. USA, 78:1527(1981)); 미코페놀산에 대한 내성을 부여하는, gpt(Mulligan & Berg, Proc. Natl. Acad. Sci. USA, 78:2072(1981)); 아미노글리코시드 G-418에 내성을 부여하는, neo(Wu and Wu, Biotherapy 3:87-95(1991); Tolstoshev, Ann. Rev. Pharmacol. Toxicol. 32:573-596(1993); Mulligan, Science 260:926-932(1993); 및 Morgan and Anderson, Ann. Rev. Biochem. 62:191-217(1993); May, TIB TECH 11(5):155-2 15(1993)); 및 하이그로마이신에 내성을 부여하는, hygro(Santerre et al., Gene, 30:147(1984)). 재조합 DNA 기술 분야에서 공지된 방법이 원하는 재조합 클론을 선별하는데 일상적으로 적용될 수 있고, 그러한 방법들은 예를 들어, 다음의 문헌들에 기술되어 있다: [Ausubel et al.(eds.), Current Protocols in Molecular Biology, John Wiley & Sons, NY(1993)]; [Kriegler, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, NY(1990)]; 및 12장 및 13장에, [Dracopoli et al.(eds.), Current Protocols in Human Genetics, John Wiley & Sons, NY(1994)]; [Colberre-Garapin et al., 1981, J. Mol. Biol., 150:1].
항체 또는 기능성 부분이 재조합 발현으로 생산되면, 면역글로불린 분자의 정제를 위해 당분야에 알려진 임의 방법, 예를 들어, 크로마토그래피(예를 들면, 이온 교환, 친화성, 특히 특이적 항원 단백질 A 또는 단백질 G에 대한 친화성, 크기순 컬럼 크로마토그래피), 원심분리, 차등적 가용화, 또는 단백질 정제의 임의의 다른 표준 기술에 의해 정제될 수 있다. 또한, 본 발명의 단백질 또는 이의 단편은 본원에 기술되거나 또는 아니면 정제를 촉진하는 당분야에 알려진 이종성 폴리펩티드 서열에 융합될 수 있다.
본 발명의 예시적인 실시형태를 이제 상세하게 언급하며, 이의 예들을 첨부된 도면에서 예시한다. 가능한 모든 경우, 동일하거나 또는 유사한 부분을 언급하기 위해 도면 전반에서 동일한 인용 번호를 사용한다. 다른 실시형태는 본원에 개시된 실행 및 명세서를 고려해 보면 당업자에게 자명하다. 실시형태들은 이하의 실시예에서 더욱 설명한다. 이들 실시예는 청구항의 범주를 제한하지 않고, 단지 일정 실시예들을 명확하게 하기 위해 제공된다. 명세서 및 실시예는 오직 예로서 간주되고, 진정한 범주 및 정신은 후속하는 청구항으로 표시하고자 한다.
실시예
실시예 1. 안전성, 내약성, 항종양 활성, 및 약리학 실험
본 실시예는 표준 요법에 불응성이거나 또는 표준 요법이 존재하지 않는 진행성 고형 종양이 있는 성인 피험체에서 단일 작용제 또는 병용 요법으로서 MEDI1/5의 안전성, 내약성, 항종양 활성, 및 약리학을 평가하기 위한 MEDI1/5의 인간에서는 최초인, 1/1b기, 다기관, 라벨-공개, 단일 부문, 용량-증량 및 용량-확대 실험이다.
미국에서 대략 5-15개의 연구 현장이 이 실험의 용량-증량 및 용량-확대 부문에 참가한다. 각 현장의 기관 감사 위원회(IRB) 규제 승인을 기반으로, 현장들은 1기 또는 1b기 용량-증량 및 용량-확대 부문, 또는 실험의 두 시기 모두에 피험체를 등록할 수 있다.
1기 실험은 백금-저항성 난소암(prOC) 및 다형성 교아세포종(GBM)(NCT01248949)으로의 mTx 확대와 함께 진행성 고형 종양을 갖는 성인에서 3+3 용량 증량(단일요법[mTx] 및 병용)이다. 카르노프스키 수행 상태가 ≥70(또는 교아 세포종 환자의 경우 ≥60)이고, 적절한 장기 기능의 환자를 MEDI1/5(M) 단독 또는 카보플라틴/파클리탁셀(CT), 파클리탁셀(T), 또는 베바시주맙(B)과 조합하여 21일 또는 28일 주기로 치료하였다. 목표는 안전성, 약동학, 약력학, 및 항종양 활성을 포함하였다.
1기 용량-증량 부문에서, 피험체는 주기에 따라서, 14일마다 또는 21일마다 MEDI1/5의 7 용량 중 1 용량(5, 10, 20, 100, 300, 1000, 또는 1500 mg)으로 치료되었다. 후원자의 재량으로, 중간 용량은 용량-증량을 위해 선택될 수 있다. MEDI1/5는 허용되지 않는 독성, 질환 진행의 문서 기록, 또는 피험체의 다른 중산 사유까지, 1000 mg 미만의 용량의 경우 60분 IV 주입으로, 또는 1000 mg 이상의 용량의 경우 90분 주입(더 높은 용량시 주입 반응의 가능성 줄이기 위함)으로 치료 각 주기의 1일에 투여하였다. 피험체내 용량-증량은 허용되지 않았지만, 독성에 대한 용량 변경은 허용되었다.
전체 실험 디자인은 도 1에 약술한다.
실시예 2. 진행 중인 실험의 결과
2014년 4월 25일자로, 104명 환자(중위 연령 61.5; 57.7% 여성)가 등록되었다: M mTx에 41명(용량-증량에 25명 및 prOC 용량-확대에 16명), 및 병용 부문에 63명. 표 3은 중위 연령, 성별, KPS, 원발성 질환 부위, 및 진단 병기를 포함한, 환자 인구통계 및 기본 특징을 제공한다.
| 표 3: 환자 인구통계 및 기본 특징 | |||||
| MEDI1/5 단일요법, n(%) | MEDI1/5 병용, n(%) | ||||
| 변수 |
MEDI1/5
단일요법 증량 부문 (n=25) |
난소암
단일요법 확대 부문 (n=16) |
MEDI1/5
단일요법 모든 부문 (n=41) |
MEDI1/5 +
베바시주맙 부문 (n=43) |
MEDI1/5 +
화학요법 부문 * (n=20) |
| 평균 연령, y (범위) |
63(21-81) | 60.5(27-79) | 63(21-81) | 59(25-75) | 60.5(31-79) |
| 여성, n(%) | 10(40) | 16(100) | 26(63) | 21(49) | 13(65) |
| KPS, n(%) | |||||
| 70-80 | 9(36) | 3(23) | 12(29) | 22(51) | 12(60) |
| 90-100 | 16(64) | 10(77) | 26(68) | 21(49) | 8(40) |
| 원발성 질환 부위, n(%) | |||||
| 난소 | 3(12) | 16(100) | 19(46) | 10(23) | 5(25) |
| 비소세포 폐 | 11(44) | 0 | 11(27) | 1(2) | 3(15) |
| 그외 | 7(28) | 0 | 7(17) | 10(23) | 5(25) |
| 직장/결장 | 3(12) | 0 | 3(7) | 6(14) | 0 |
| 신장 세포 암종 | 1(4) | 0 | 1(2) | 3(7) | 0 |
| 식도/위식도 | 0 | 0 | 0 | 3(7) | 1(5) |
| 자궁내막 | 0 | 0 | 0 | 2(5) | 0 |
| 간세포 | 0 | 0 | 0 | 2(5) | 0 |
| 교아세포종 | 0 | 0 | 0 | 2(5) | 0 |
| 전립선 | 0 | 0 | 0 | 1(2) | 0 |
| 후두 | 0 | 0 | 0 | 1(2) | 0 |
| 췌장 | 0 | 0 | 0 | 1(2) | 0 |
| 자궁경부 | 0 | 0 | 0 | 1(2) | 0 |
| 갑상선 | 0 | 0 | 0 | 0 | 2(10) |
| 흑색종 | 0 | 0 | 0 | 0 | 1(5) |
| 고환 | 0 | 0 | 0 | 0 | 1(5) |
| 진단 병기, n(%) | |||||
| I | 0 | 0 | 0 | 1(2) | 2(10) |
| II | 0 | 0 | 0 | 1(2) | 0 |
| III | 4(16) | 12(75) | 16(39) | 7(16) | 7(35) |
| IV | 21(84%) | 3(19%) | 24(59%) | 31(72%) | 11(55%) |
최대 내약 용량은 mTx 또는 병용 부문에서 규정하지 않았다.
mTx 부문에서, 환자의 41명 환자 중 27명(66%)은 치료-관련 부작용 사례(trAE)가 있었다. 모든 27명 환자(66%)는 적어도 하나의 등급 ≤ 2인 사례를 경험하였고 4명 환자(10%)는 적어도 하나의 등급 ≥ 3인 사례를 경험하였다. mTx 부분에서 비혈액학적 등급 ≥ 3인 trAE는 체중 증가(4.9%), 말초 부종(3.1%), 림프부종(2.4%), 흉수(2.4%), 고혈압(2.4%), 및 후두부 가역적 뇌병증 증후군(2.4%)을 포함하였다. prOC 확대 부문의 2명 환자에서 발생된 3등급 말초 부종 및 림프부종이 M의 중단에도 불구하고 지속되었다.
병용 부문에서, 63명 환자 중 49명(78%)이 치료-관련 부작용 사례(trAE)가 있었다. 여기에는 적어도 하나의 등급 ≤ 2인 사례에 45명 환자(71%) 및 적어도 하나의 등급 ≥ 3인 사례에 14명 환자(22%)가 포함되었다. 병용 부문에서 비혈액학적 등급 ≥ 3인 trAE는 다음의 각각에 1명 환자(1.6%)를 포함하였다: 구역질, 급성 췌장염, 구토, 피로, 말초 부종, 주입 관련 반응, 박출률 감소, 트로포닌 증가, 식욕 감소, 탈수, 말초 신경병증, 신증후군, 여성 생식기 누공, 및 음낭 부종. 부가적으로, 2명 환자(3.2%)는 단백뇨를 경험하였고 4명 환자(6.3%)는 고혈압을 경험하였다.
trAE 사례(헴 및 헴이외)는 하기 표에서 전체 환자 수로 요약하였다:
| 표 4: 치료-관련 부작용 사례(trAE) | ||||
| trAE |
MEDI1/5
단일 작용제 (N=41) |
MEDI1/5 병용 |
MEDI1/5
전체 (N=104) |
|
|
+Bev
(N=43) |
+화학요법
(N=20) |
|||
| 등급 ≤2(%) | 27(65.9%) | 28(65.1%) | 17(85.0%) | 72(69.2%) |
| 등급 ≥3(%) | 4(9.8%) | 9(20.9%) | 5(25.0%) | 18(17.3%) |
| 전체(%) | 27(65.9%) | 32(74.4%) | 17(85.0%) | 76(73.1%) |
비혈액학적 등급 ≥ 3인 사례는 하기 표에 총 사례수로 mTx 및 병용 치료에 관해 다음과 같이 요약하였다:
| 표 5: 비혈액학적 등급 ≥ 3 사례 | |||||
| trAE | 등급 |
MEDI1/5
단일 작용제 (N=41) |
MEDI1/5 병용 |
MEDI1/5
전체 (N=104) |
|
|
+Bev
(N=43) |
+화학요법
(N=20) |
||||
| 식욕 감퇴 | 3 | 0(0%) | 0(0%) | 1(5.0%) | 1(1.0%) |
| 탈수 | 3 | 0(0%) | 0(0%) | 1(5.0%) | 1(1.0%) |
| 박출률 감소 | 3 | 0(0%) | 0(0%) | 1(5.0%) | 1(1.0%) |
| 피로 | 4 | 0(0%) | 0(0%) | 1(5.0%) | 1(1.0%) |
| 여성 생식기 누공 | 3 | 0(0%) | 1(2.3%) | 0(0%) | 1(1.0%) |
| 고혈압 | 3 | 1(2.4%) | 4(9.3%) | 0(0%) | 5(4.8%) |
| 주입 관련 반응 | 3 | 0(0%) | 0(0%) | 1(5.0%) | 1(1.0%) |
| 백혈구감소증 | ≥3 | 0(0%) | 0(0%) | 1(5.0%) | 1(1.0%) |
| 림프부종 | 3 | 1(2.4%) | 0(0%) | 0(0%) | 1(1.0%) |
| 구역질 | 3 | 0(0%) | 0(0%) | 1(5.0%) | 1(1.0%) |
| 신증후군 | 3 | 0(0%) | 0(0%) | 1(5.0%) | 1(1.0%) |
| 호중구감소증 | c | 1(2%) | 0(0%) | 3(15%) | 4(3.8%) |
| 급성 췌장염 | 3 | 0(0%) | 1(2.3%) | 0(0%) | 1(1.0%) |
| 말초 부종 | 3 | 1(2.4%) | 1(2.3%) | 0(0%) | 2(1.9%) |
| 말초 신경병증 | 3 | 0(0%) | 1(2.3%) | 0(0%) | 1(1.0%) |
| 흉수 | 3 | 1(2.4%) | 0(0%) | 0(0%) | 1(1.0%) |
| 후두부 가역적 뇌병증 | 3 | 1(2.4%) | 0(0%) | 0(0%) | 1(1.0%) |
| 단백뇨 | 3 | 0(0%) | 2(4.7%) | 0(0%) | 2(1.9%) |
| 음낭 부종 | 3 | 0(0%) | 1(2.3%) | 0(0%) | 1(1.0%) |
| 트로포닌 증가 | 3 | 0(0%) | 0(0%) | 1(5.0%) | 1(1.0%) |
| 구토 | 3 | 0(0%) | 0(0%) | 1(5.0%) | 1(1.0%) |
| 체중 증가 | 3 | 2(4.9%) | 0(0%) | 0(0%) | 2(1.9%) |
| 백혈구 세포 계측치 감소 | ≥3 | 1(2.4%) | 0(0%) | 0(0%) | 1(1.0%) |
| 총합 | - | 9(22.0%) | 11(25.6%) | 13(65%) | 33(31.7%) |
치료-관련 3등급 또는 4등급 부작용 사례의 비율은 단일요법군에서 22%였고 병용요법군에서 총 38%였다.
mTx 부문에서 6명 환자(14.6%), 병용 부문에서 23명 환자(36.5%) 및 전체 29명 환자(27.9%)가 trAE로 인해 치료를 중단하였다. 중단을 초래한 부작용 사례 일부는 호중구감소증, 말초 부종, 체중 증가, 급성 췌장염, 전신 부종, 발열, 단백뇨, 여성 생식기 누공, 주입-관련 반응, 박출률 감소, 트로포닌 감소, 신증후군, 및 관절 종창을 포함하였다.
MEDI1/5를 사용한 치료-관련 3등급 또는 4등급 부작용 사례를 또한 표 6에서 역사상 베바시주맙과 비교하였다.
| 표 6: 역사상 베바시주맙 데이터 대비 MEDI1/5를 사용한 치료-관련 3등급 또는 4등급 부작용 사례의 비교 | ||||
|
부작용 사례,
환자% |
MEDI1/5
단일요법 모든 부문 (n=41) |
MEDI1/5 +
베바시주맙 부문 (N=43) |
MEDI1/5 +
화학요법 부문 * (n=20) |
베바시주맙
‡
(역사적 비율 ) |
| 고혈압 | 2.4% | 9.3% | 0 | 5%-18% |
| 단백뇨 | 0 | 4.7% | 0 | ≤8% |
| 여성 생식기 누공(다른 누공 없음) | 0 | 2.3% | 0 | GI 누공 없음 <1% |
| 말초 부종 | 2.4% | 2.3% | 0 | N/A |
| 체중 증가 | 4.9% | 0 | 0 | N/A |
| 림프부종 | 2.4% | 0 | 0 | N/A |
| 흉수 | 2.4% | 0 | 0 | N/A |
| * 파클리탁셀 및 카보플라틴/파클리탁셀과 조합해 MEDI1/5 포함 ‡Avastin™ 처방 정보에 의함 |
||||
1500 mg 용량 Q3W로 MEDI1/5를 사용한 단일요법은 난소암 서브셋에서 등급3 부종-관련 독성을 야기하였기 때문에, 이후의 난소암 환자에는 1000 mg 용량 Q3W가 선택되었다. 이러한 성질의 부종-관련 사례들은 다른 종양 유형의 환자에서 관찰되지 않았다. 베바시주맙 병용은 허용되는 안전성 프로파일을 가졌다.
mTx 및 병용 부문에 대한 환자 노출 데이터를 하기 표에 나타낸다:
| 표 7: 환자 노출 데이터 | |||
|
MEDI1/5
단일작용제 (N=41) |
MEDI1/5
병용 (N=63) |
MEDI1/5
전체 (N=104) |
|
| 총 주기 수 | |||
| 평균 | 3.4 | 4.6 | 4.1 |
| 중간 | 2.0 | 2.0 | 2.0 |
| 최저-최대 | 1-18 | 1-35 | 1-31 |
| 총 주기 수 | |||
| 1 | 11 | 13 | 24 |
| 2 | 16 | 26 | 42 |
| 3 | 1 | 2 | 3 |
| 4-6 | 9 | 14 | 23 |
| 7-9 | 1 | 1 | 2 |
| 10-12 | 1 | 0 | 1 |
| >12 | 2 | 7 | 9 |
| 용량 강도(%) | |||
| 평균 | 96.26 | 95.21 | 95.62 |
| 중간 | 100.0 | 100.0 | 100.0 |
| 최저-최대 | 66.7-100.0 | 45.9-100.0 | 45.9-100.0 |
용량 강도(%) =(투여받은 실제 총 용량/의도한 총 용량) X 100.
M의 노출은 100 mg Q3W 또는 60 mg Q2W를 넘어서 선형 범위에 접근하였다.
중간 약동학 분석은 2013년 1월 02일자에 수집한 PK 데이터를 기반으로 수행하였다. 입증된 면역검정법을 사용해 그 표적에 결합하지 않는 MEDI1/5의 혈청 농도를 정량하였다. 혈청 MEDI1/5 PK는 1기의 단일 작용제 요법을 비롯하여 1b기의 병용 요법에 대해 결정하였다. MEDI1/5 PK는 일반적으로 동일 용량 계획에 대해 단일 작용제 또는 병용 요법 전반에서 비슷하였다(데이터 도시 않음). 그러므로, 평균 혈청 MEDI1/5 농도-시간 프로파일을 용량 계획으로 모아진 모든 피험체로부터 요약하였다. 5, 10, 20, 100, 300, 1000, 및 1500 mg의 MEDI1/5의 IV 투여 후 제1 용량(1일 내지 22일의 Q3W 계획, 1일 내지 15일의 Q2W 계획) 동안 평균 혈청 MEDI1/5 농도-시간 프로파일을 도 2a 내지 도 2b에 예시하였다. 평균 혈청 농도는 MEDI1/5 용량 수준 증가에 따라 증가하였다.
제1 투약의 혈청 농도 데이터는 비구획 분석을 사용해 분석하였다. 제1 용량 후 Cmax 및 AUC를 기반으로 MEDI1/5의 노출은 용량-비례 증가 이상임을 입증하였다. 용량-의존적 겉보기 청소율 및 최종 반감기를 또한 관찰하였다. MEDI1/5 PK는 대략 100 mg Q3W 또는 60 mg Q2W를 넘어서 선형 범위에 접근하였다. 추산된 평균 PK 매개변수를 하기 표에 제시한다.
| 표 8: MEDI1/5 약동학 매개변수의 요약 | |||||
|
투약
간격 |
용량
(mg) |
C
max
(㎍/mL) |
AUC
(0-γ)
(일·㎍/mL) |
CL
(L/일) |
t
1/2
(일) |
| Q3W | 5 | 1.39±0.25 (n = 3) |
2.17 (n = 1) |
2.25 (n = 1) |
0.625 (n = 1) |
| 10 | 2.44±0.96 (n = 3) |
1.73 (n = 1) |
3.52 (n = 1) |
0.703 (n = 1) |
|
| 20 | 6.63±3.48 (n = 6) |
13.7±15.4 (n = 5) |
2.32±1.49 (n = 5) |
1.10±0.33 (n = 5) |
|
| 100 | 39.7±26.4 (n = 7) |
156±68.9 (n = 6) |
0.622±0.374 (n = 6) |
5.22±3.04 (n = 6) |
|
| 300 | 68.9±16.9 (n = 6) |
517±176 (n = 5) |
0.551±0.259 (n = 5) |
8.14±2.76 (n = 5) |
|
| 1000 | 223±61.8 (n = 10) |
1813±506 (n = 8) |
0.423±0.193 (n = 8) |
12.0±5.47 (n = 8) |
|
| 1500 | 578±294 (n = 7) |
3574±2088 (n = 4) |
0.424±0.251 (n = 4) |
12.8±10.3 (n = 4) |
|
| Q2W | 60 | 44.5±39.3 (n = 7) |
118±68.7 (n = 7) |
0.704±0.487 (n = 7) |
3.93±2.77 (n = 7) |
| 200 | 47.5±23.3 (n = 3) |
227±66.3 (n = 3) |
0.815±0.239 (n = 3) |
5.10±0.45 (n = 3) |
|
| 600 | 107±29.5 (n = 11) |
627±225 (n = 8) |
0.740±0.269 (n = 8) |
7.06±1.27 (n = 8) |
|
| 1000 | 167±60.4 (n = 2) |
N/A | N/A | N/A | |
| Cmax=최대 혈청 농도; AUC(0-γ)=0시부터 투약 간격까지 곡선하 면적; CL=겉보기 전신 청소율; t1/2 =최종 반감기; N/A=적용 불가. 주: 표는 2013년 1월 02일자에 수집한 데이터를 반영함. 매개변수들은 평균±표준편차(샘플 크기)로 나타냄. |
|||||
유리 및 약물 결합된, 전체 Ang2의 혈장 농도는 적격한 면역검정법을 사용하여 약력학 생체마커로서 정량하였다. 전체 Ang2 농도에서 용량 의존적 증가가 MEDI1/5 투여 후에 관찰되었다(도 3). 전체 Ang2 농도는 급속하게 증가되었고 모든 시험된 용량에서 포화 수준에 도달하였다. Ang2 축적의 지속 기간은 용량 의존적이었다. 100 mg Q3W 또는 60 mg Q2W(데이터 도시하지 않음) 및 그 이상 용량에서, 고농도의 전체 Ang2가 투약 간격 전반에서 유지되었다. 전체 Ang2 축적은 제3 용량 후 정상 상태에 도달하였다. Ang2 프로파일은 MEDI1/5 PK 프로파일과 일치하였다.
이 실험의 목적을 위해, 미확인 부분 반응(PRu)은 4주 후에 후속 평가시에 확인되지 않았던 한 평가에 대한 부분 반응으로 정의한다. 각 치료군에서 획득된 최고 전체 반응은 표 9에 나타내었다.
표 9가 실험에 등록된 다양한 유형의 암 환자의 데이타를 제공하지만, 추가 질환-특이적 정보는 다음과 같다. 백금-저항성 난소암 환자(증량 및 확대 부문)에서, 단일요법에 대한 전체 반응율은 12%(n=34)였다. 1명의 난소암 환자는 ≥ 52주 동안 안정한 질환이 지속되었고(MEDI1/5 및 베바시주맙 부문), 1명의 난소암 환자는 ≥ 52주 동안 부분 반응이 지속되었다(MEDI1/5 및 파클리탁셀 부문). 병용 요법 부문에 있어 폐암, 자궁경부암, 및 신장 세포 암종의 환자에서의 반응이 또한 관찰되었다(각각에 한가지 반응).
| 표 9: 최상의 전체 반응 | |||||
| MEDI1/5 단일요법 | MEDI1/5 병용 요법 | ||||
|
반응
(RECIST v1.1) |
MEDI1/5
단일요법 증량 부문 (n=25) |
난소암
단일요법 확대 부문 (n=16) |
MEDI1/5
단일요법 모든 부문 (n=41) |
MEDI1/5 +
베바시주맙 부문 (n=43) |
MEDI1/5 +
화학요법 부문 * (n=20) |
| 기준치 및 ≥1 치료중 스캔 환자수 |
24 | 9 | 33 | 35 | 16 |
| 완전 반응, n(%) | 0 | 0 | 0 | 1(2) | 0 |
| 부분 반응/미확인 부분 반응, n(%) |
0 | 1(6) | 1(2) | 4(9) | 3(15) |
| ≥12주 안정한 질환,‡n(%) |
13(52) | 3(19) | 16(39) | 18(42) | 6(30) |
| ≥ 52주 안정한 질환, n(%) |
1(4) | 0 | 1(2) | 2(5) | 1(5) |
| 진행형 질환, n(%) | 11(44) | 5(31) | 16(39) | 12(28) | 7(35) |
| * 파클리탁셀 및 카보플라틴/파클리탁셀과 MEDI1/5 병용을 포함 ‡MEDI1/5 및 베바시주맙 부문에서 난소암 환자는 ≥ 52주간 안정한 질환이 지속되었고, MEDI1/5 및 파클리탁셀 부문에서 1명 난소암 환자가 ≥ 52주간 부분 반응이 지속되었음. |
|||||
mTx 부문(n=41)에서, prOC 환자 중 1명의 부분 반응이 관찰되었고, 7명 환자는 >12주간 안정한 질환을 가졌다.
병용 부문(n=63)에서 객관적인 반응은 6명의 확인된 부분 반응(PR)을 포함하였다. 이들 반응은 다음의 코호트에서 확인되었다: 백금-불응성 난소암(M/B, M/T, 및 M/CT 각각 1PR), 신장 세포 암(M/B에서 1PR), 자궁경부암(M/B에서 1PR), 폐암(M/T에서 1PR). 부가적으로, GBM(n=3)에서 1 미확인 부분 반응(PRu) 및 1 확인 완전 반응(CR)이 존재하였는데, 1 미확인 부분 반응 및 확인 완전 반응은 MEDI1/5과 베바시주맙 병용 부문이고, 1 미확인 부분 반응 MEDI1/5과 화학요법 부문이다.
일부 객관적 반응에 관한 추가 정보를 표 10에 제공한다. .
| 표 10: 객관적 반응 | |||
| 반응 | 암 유형 |
MEDI1/5 용량
및 주기 |
추가 치료제 투여량 및 주기 |
| 부분 반응 | 백금-불응성 난소암 | 1000mg Q3wk | 없음 |
| 부분 반응 | 백금-불응성 난소암 | 1500mg Q3wk | 베바시주맙 15mg/kg Q3wk |
| 부분 반응 | 백금-불응성 난소암 | 1000mg Q2wk | 파클리탁셀 80mg/㎡ D1,8,15 Q4wk |
| 부분 반응 | 신장 세포 암 | 200mg Q2wk | 베바시주맙 10mg/kg Q2wk |
| 부분 반응 | 자궁경부암 | 600mg Q2wk | 베바시주맙 10mg/kg Q2wk |
| 부분 반응 | 폐암 | 600mg Q2wk | 파클리탁셀 80mg/㎡ D1,8,15 Q4wk |
| 미확인 부분 반응 | 백금-불응성 난소암 | 1000mg Q3wk | 카보플라틴 AUC 5 Q3wk 파클리탁셀 175 mg/㎡ Q3wk |
| 미확인 부분 반응 | 악성 신경교종 | 1000mg Q2wk | 베바시주맙 10mg/kg Q2wk |
| 완전 반응 | 악성 신경교종 | 1000mg Q2wk | 베바시주맙 10mg/kg Q2wk |
| 12주간 안정한 질환 | 백금-불응성 난소암 | 5mg Q3wk | 없음 |
| 12주간 안정한 질환 | 백금-불응성 난소암 | 5mg Q3wk | 없음 |
| 12주간 안정한 질환 | 백금-불응성 난소암 | 20mg Q3wk | 없음 |
| 12주간 안정한 질환 | 백금-불응성 난소암 | 20mg Q3wk | 없음 |
| 12주간 안정한 질환 | 백금-불응성 난소암 | 20mg Q3wk | 없음 |
| 12주간 안정한 질환 | 백금-불응성 난소암 | 100mg Q3wk | 없음 |
| 12주간 안정한 질환 | 백금-불응성 난소암 | 300mg Q3wk | 없음 |
실시예 3. 뇌 스캔 결과
실시예 2에 제시한 일정 환자의 뇌 스캔 결과를 또한 제공한다. 모든 환자는 베바시주맙 투약 경험이 없었다.
첫번째 환자는 다형성 교아세포종(MGMT-)을 진단받고 이를 1월차로 지정하고, 1월차에 외과적 절제술, 및 2월차 동안 보조제 테모달/RT을 받았다. 이 환자는 8주 동안 MEDI1/5(1000 mg q2w) 및 베바시주맙(10 mg/kg q2w)으로 치료받았다. 치료 전반에서 스테로이드는 사용하지 않았다. 기준시(3월차) 및 치료후(6월차)의 뇌 스캔은 도 4에 제공하였고 완전 반응을 보여준다(FLAIR은 부분 반응을 보였음).
두번째 환자는 신경교육종(MGMT+)으로 진단받았고, 이를 1월차로 지정했다. 그녀는 유지 테모달을 10월차에 종료하고 14-15월차에 RT/테모달을 받았다. 이 환자는 8주간 MEDI1/5(1000 mg q2w) 및 베바시주맙(10 mg/kg q2w)으로 치료받았다. 종양의 24% 감소가 스캔 상에서 확인되었고, 도 5(T2 FLAIR에서도 호전)에 도시하였으며, 또한 도 6(C+ 축상), 및 도 7(축상 FLAIR)에서도 확인할 수 있다.
세번째 환자는 다형성 교아세포종(MGMT+)을 진단받았고, 이를 1월차로 지정했으며, 이와 동시에 외과적 절제술을 받고, 2월차에서 13월차까지 보조제 테모달/RT를 받았다. 이 환자는 8주간 MEDI1/5(1000 mg q2w) 및 베바시주맙(10 mg/kg q2w)으로 치료되었다. 이 환자는 스캔 기간 동안 반응이 입증되지 않았다.
실시예 4. 일정 실시형태
다음의 항목들이 본원에 개시된 일정 실시형태를 제공한다.
1. 환자에서 암을 치료하는 방법으로서,
a. 항-Ang2 항체 또는 이의 기능성 부분을 제공하는 단계,
b. 항-Ang2 항체 또는 이의 기능성 부분을 환자에게 투여하는 단계
를 포함하고,
상기 항-Ang2 항체 또는 이의 기능성 부분을 약 200 mg 내지 약 1500 mg의 용량으로 투여하는 방법.
2. 환자에서 혈관신생을 억제하는 방법으로서,
a. 항-Ang2 항체 또는 이의 기능성 부분을 제공하는 단계,
b. 항-Ang2 항체 또는 이의 기능성 부분을 환자에게 투여하는 단계
를 포함하고,
상기 항-Ang2 항체 또는 이의 기능성 부분을 약 200 mg 내지 약 1500 mg의 용량으로 투여하는 방법.
3. 항목 2의 방법에서, 환자는 암을 갖는 것인 방법.
4. 항목 1-3 중 어느 하나의 방법에서, 항체 또는 이의 기능성 부분은 MEDI1/5와 동일한 중쇄 및 경쇄 CDR을 포함하는 것인 방법.
5. 항목 1-3 중 어느 하나의 방법에서, 항체 또는 이의 기능성 부분은 MEDI1; MEDI2; MEDI3; MEDI4; 및 MEDI6을 포함한 가변 경쇄를 포함하는 것인 방법.
6. 항목 1-5의 어느 하나의 방법에서, 항체 또는 이의 기능성 부분은 IgG1 또는 IgG2 이소타입 항체 또는 이의 기능성 부분인 방법.
7. 항목 1-6 중 어느 하나의 방법에서, 항체 또는 이의 기능성 부분은 MEDI5를 포함한 가변 중쇄 영역을 더 포함하는 것인 방법.
8. 항목 1-7 중 어느 하나의 방법에서, 항체 또는 이의 기능성 부분은 3.19.3, MEDI1/5, MEDI2/5, MEDI3/5, MEDI6/5, 및 MEDI4/5에서 선택된 완전한 인간 단일클론 항체 중 어느 하나와 동일한 에피토프에 결합하는 것인 방법.
9. 항목 1-7 중 어느 하나의 방법에서, 항체는 3.19.3, MEDI1/5, MEDI2/5, MEDI3/5, MEDI6/5, 및 MEDI4/5에서 선택된 완전한 인간 단일클론 항체인 방법.
10. 항목 1-7 중 어느 하나의 방법에서, 이의 기능성 부분은 3.19.3, MEDI1/5, MEDI2/5, MEDI3/5, MEDI6/5, 및 MEDI4/5에서 선택된 완전한 인간 단일클론 항체의 기능성 부분인 방법.
11. 항목 4의 방법에서, 항체 또는 이의 기능성 부분은 MEDI1/5와 동일한 에피토프에 결합하는 것인 방법.
12. 항목 11의 방법에서, 항체는 MEDI1/5인 방법.
13. 항목 11의 방법에서, 이의 기능성 부분은 항체 MEDI1/5의 기능성 부분인 방법.
14. 항목 1-13 중 어느 하나의 방법에서, 항-Ang2 항체 또는 이의 기능성 부분을 약 200 mg 내지 약 1000 mg의 용량으로 투여하는 것인 방법.
15. 항목 1-13 중 어느 하나의 방법에서, 항-Ang2 항체 또는 이의 기능성 부분을 약 300 mg 내지 약 1500 mg의 용량으로 투여하는 것인 방법.
16. 항목 15의 방법에서, 항-Ang2 항체 또는 이의 기능성 부분을 약 1000 mg 내지 약 1500 mg의 용량으로 투여하는 것인 방법.
17. 항목 1-13 중 어느 하나의 방법에서, 항-Ang2 항체 또는 이의 기능성 부분을 약 200 mg의 용량으로 투여하는 것인 방법.
18. 항목 1-13 중 어느 하나의 방법에서, 항-Ang2 항체 또는 이의 기능성 부분을 약 300 mg의 용량으로 투여하는 것인 방법.
19. 항목 1-13 중 어느 하나의 방법에서, 항-Ang2 항체 또는 이의 기능성 부분을 약 600 mg의 용량으로 투여하는 것인 방법.
20. 항목 1-13 중 어느 하나의 방법에서, 항-Ang2 항체 또는 이의 기능성 부분을 약 750 mg의 용량으로 투여하는 것인 방법.
21. 항목 1-13 중 어느 하나의 방법에서, 항-Ang2 항체 또는 이의 기능성 부분을 약 1000 mg의 용량으로 투여하는 것인 방법.
22. 항목 1-13 중 어느 하나의 방법에서, 항-Ang2 항체 또는 이의 기능성 부분을 약 1250 mg의 용량으로 투여하는 것인 방법.
23. 항목 1-13 중 어느 하나의 방법에서, 항-Ang2 항체 또는 이의 기능성 부분을 약 1500 mg의 용량으로 투여하는 것인 방법.
24. 항목 1-23 중 어느 하나의 방법에서, 항-Ang2 항체 또는 이의 기능성 부분을 약 60 내지 약 90분 동안 IV 주입으로 투여하는 것인 방법.
25. 항목 24의 방법에서, 항-Ang2 항체 또는 이의 기능성 부분을 약 60분 동안 IV 주입으로서 투여하는 것인 방법.
26. 항목 24의 방법에서, 항-Ang2 항체 또는 이의 기능성 부분을 약 90분 동안 IV 주입으로서 투여하는 것인 방법.
27. 항목 25의 방법에서, 항-Ang2 항체 또는 이의 기능성 부분을 약 60분 동안 IV 주입으로서 투하되고, 투여량은 약 1000 mg 미만인 방법.
28. 항목 26의 방법에서, 항-Ang2 항체 또는 이의 기능성 부분을 약 90분 동안 IV 주입으로서 투여하고, 투여량은 약 1000 mg 보다 많거나 또는 같은 것인 방법.
29. 항목 1-28 중 어느 하나의 방법에서, 환자는 1회 투여량을 투여받는 것인 방법.
30. 항목 1-28 중 어느 하나의 방법에서, 환자는 다중 용량을 투여받는 것인 방법.
31. 항목 30의 방법에서, 투여량 주기가 약 14일마다인 방법.
32. 항목 30의 방법에서, 투여량 주기가 약 21일마다인 방법.
33. 항목 30의 방법에서, 투여량 주기가 약 28일마다인 방법.
34. 항목 30-33 중 어느 하나의 방법에서, 적어도 2회 투여량 주기가 존재하는 것인 방법.
35. 항목 30-33 중 어느 하나의 방법에서, 적어도 3회 투여량 주기가 존재하는 것인 방법.
36. 항목 30-33 중 어느 하나의 방법에서, 적어도 4회 투여량 주기가 존재하는 것인 방법.
37. 항목 30-33 중 어느 하나의 방법에서, 적어도 5회 투여량 주기가 존재하는 것인 방법.
38. 항목 30-33 중 어느 하나의 방법에서, 적어도 6회 투여량 주기가 존재하는 것인 방법.
39. 항목 30-33 중 어느 하나의 방법에서, 적어도 7회 투여량 주기가 존재하는 것인 방법.
40. 항목 30-33 중 어느 하나의 방법에서, 적어도 8회 투여량 주기가 존재하는 것인 방법.
41. 항목 30-33 중 어느 하나의 방법에서, 적어도 9회 투여량 주기가 존재하는 것인 방법.
42. 항목 30-33 중 어느 하나의 방법에서, 적어도 10회 투여량 주기가 존재하는 것인 방법.
43. 항목 30-33 중 어느 하나의 방법에서, 적어도 11회 투여량 주기가 존재하는 것인 방법.
44. 항목 30-33 중 어느 하나의 방법에서, 적어도 12회 투여량 주기가 존재하는 것인 방법.
45. 항목 44의 방법에서, 12회가 넘는 투여량 주기가 존재하는 것인 방법.
46. 항목 44의 방법에서, 12회 내지 18회 주기가 존재하는 것인 방법.
47. 항목 44의 방법에서, 12회 내지 31회 주기가 존재하는 것인 방법.
48. 항목 1-47 중 어느 하나의 방법에서, 항-Ang2를 하나 이상의 추가 치료제와 공동 투여하는 것인 방법.
49. 항목 48의 방법에서, 항-Ang2를 2 또는 그 이상의 추가 치료제와 공동 투여하는 것인 방법.
50. 항목 48-49 중 어느 하나의 방법에서, 공동 투여는 동시 투여 또는 순차적 투여인 방법.
51. 항목 50의 방법에서, 순차적 투여는 동일한 날에 일어나는 것인 방법.
52. 항목 50의 방법에서, 순차적 투여는 다른 날에 일어나는 것인 방법.
53. 항목 52의 방법에서, 순차적 투여는 상이한 투여량 주기에 일어나는 것인 방법.
54. 항목 52의 방법에서, 순차적 투여는 동일 투약 주기에 일어나는 것인 방법.
55. 항목 48-54 중 어느 하나의 방법에서, 하나 이상의 추가 치료제는 하나 이상의 화학요법제인 방법.
56. 항목 55의 방법에서, 화학요법제는 카보플라틴, 카페시타빈, 젬시타빈, 또는 파클리탁셀 중 하나 이상으로부터 선택되는 것인 방법.
57. 항목 54의 방법에서, 화학요법제는 카보플라틴 및 파클리탁셀인 방법.
58. 항목 55-57 중 어느 하나의 방법에서, 화학요법제를 1주마다, 2주마다, 3주마다, 또는 1개월마다 투여하는 것인 방법.
59. 항목 56-57 중 어느 하나의 방법에서, 파클리탁셀을 약 175 mg/㎡로 투여하는 것인 방법.
60. 항목 56의 방법에서, 젬시타빈을 약 1000 mg/㎡로 투여하는 것인 방법.
61. 항목 56-57 중 어느 하나의 방법에서, 카보플라틴을 약 AUC 4 또는 5에서 투여하고, 여기서
총 용량(mg) =(표적 AUC) x(GFR + 25)
이고, 이 식에서 GFR은 혈청 크레아틴 수준을 사용해 추산하는 것인 방법.
62. 항목 61의 방법에서, 5의 AUC에 대한 mg 투여량은 약 750 mg 이하인 방법.
63. 항목 61의 방법에서, 4의 AUC에 대한 mg 투여량은 약 600 mg 이하인 방법.
64. 항목 48-54 중 어느 하나의 방법에서, 하나 이상의 추가 치료제는 세디라닙인 방법.
65. 항목 48-54 중 어느 하나의 방법에서, 하나 이상의 추가 치료제는 하나 이상의 항체 또는 이의 기능성 부분인 방법.
66. 항목 65의 방법에서, 항체 또는 이의 기능성 부분은 항-VEGF 항체 또는 이의 기능성 부분에서 선택되는 것인 방법.
67. 항목 66의 방법에서, 항체는 베바시주맙인 방법.
68. 항목 67의 방법에서, 베바시주맙을 약 10 mg/kg 또는 약 15 mg/kg으로 투여하는 것인 방법.
69. 항목 67-68 중 어느 하나의 방법에서, 베바시주맙을 2주마다 또는 3주마다 투여하는 것인 방법.
70. 항목 1-69 중 어느 하나의 방법에서, 환자는 카르노프스키 수행 상태가 약 60 이상인 방법.
71. 항목 70의 방법에서, 환자는 카르노프스키 수행 상태가 약 70 이상인 방법.
72. 항목 1-71 중 어느 하나의 방법에서, 환자는 유방암, 결장암, 폐암, 신장암, 전립선암, 난소암, 자궁경부암, 간암, 위암, 방광암, 피부암, 백혈병, 또는 뇌암을 갖는 것인 방법.
73. 항목 1-72 중 어느 하나의 방법에서, 환자는 난소암을 갖는 것인 방법.
73. 항목 72의 방법에서, 피부암은 흑색종인 방법.
74. 항목 72의 방법에서, 뇌암은 신경교종인 방법.
75. 항목 72의 방법에서, 뇌암은 다형성 교아세포종인 방법.
76. 항목 72의 방법에서, 폐암은 비소세포 폐암인 방법.
77. 항목 1-71 중 어느 하나의 방법에서, 암은 흑색종, 직장, 결장, 폐, 소세포 폐 암종, 비소세포 폐 암종, 유방, 직장, 위, 신경교종, 전립선, 난소, 고환, 갑상선, 혈액, 신장, 신장 세포 암종, 간, 간세포 암종, 췌장, 뇌, 목, 식도, 위식도, 후두, 교아세포종, 자궁내막 암, 자궁경부, 고환, 및 중추 신경계 암인 방법.
균등물
전술한 서면 명세서는 당업자가 실시형태들을 실행하는데 충분하다고 여겨진다. 전술한 설명 및 실시예는 일정 실시형태들을 열거하고 본 발명자가 고려하는 최적 방식을 설명한다. 그러나, 본문에 얼마나 상세하게 나타내었건 간에, 실시형태들은 많은 방식으로 실행될 수 있고 청구항은 이의 균등물을 포함함을 이해한다.
본원에서 사용하는 용어 약은 예를 들어, 명확하게 표시했건 그렇지 않건, 예를 들어, 전체 수치, 분율, 및 비율을 포함한, 수치값을 의미한다. 용어 약은 대체로 당업자 중 한명이 인용된 값과 균등하다고 여기는 수치값의 범위(예를 들어, 인용된 값의 +/-5-10%)를 의미한다(예를 들어, 동일한 기능 또는 결과를 가짐). 일부 예에서, 용어 약은 가장 근접한 유의한 수치로 반올림한 수치값을 포함할 수 있다.
SEQUENCE LISTING
<110> MEDIMMUNE, LLC
<120> METHODS OF USING ANTI-ANG2 ANTIBODIES
<130> ANGST-200WO1
<140> PCT/US2015/029447
<141> 2015-05-06
<150> 62/005,525
<151> 2014-05-30
<150> 61/989,884
<151> 2014-05-07
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 123
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 1
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asn Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser His Asp Gly Asn Asn Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Ile Asp Phe Trp Ser Gly Leu Asn Trp Phe Asp Pro
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 2
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 2
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Ile Thr Gly Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Thr Gly Ala Ser Ser Trp Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Ser Ser Ser Pro
85 90 95
Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105
Claims (20)
- 환자에서 암을 치료하거나 또는 혈관신생을 억제하는 방법으로서,
a. 항-Ang2 항체 또는 이의 기능성 부분을 제공하는 단계,
b. 항-Ang2 항체 또는 이의 기능성 부분을 환자에게 투여하는 단계
를 포함하고,
상기 항-Ang2 항체 또는 이의 기능성 부분을 약 200 mg 내지 약 1500 mg의 용량으로 투여하는 것인 치료 또는 억제 방법. - 제1항에 있어서, 항체 또는 이의 기능성 부분은 MEDI1/5와 동일한 중쇄 및 경쇄 CDR을 포함하는 것인 치료 또는 억제 방법.
- 제2항에 있어서, 항체 또는 이의 기능성 부분은 MEDI1/5 또는 이의 기능성 부분인 치료 또는 억제 방법.
- 제3항에 있어서, 항-Ang2 항체 또는 이의 기능성 부분을 약 200 mg 내지 약 1000 mg의 용량으로 투여하는 것인 치료 또는 억제 방법.
- 제3항에 있어서, 항-Ang2 항체 또는 이의 기능성 부분을 약 300 mg 내지 약 1500 mg의 용량으로 투여하는 것인 치료 또는 억제 방법.
- 제5항에 있어서, 항-Ang2 항체 또는 이의 기능성 부분을 약 1000 mg 내지 약 1500 mg의 용량으로 투여하는 것인 치료 또는 억제 방법.
- 제6항에 있어서, 항-Ang2 항체 또는 이의 기능성 부분을 약 1000 mg의 용량으로 투여하는 것인 치료 또는 억제 방법.
- 제6항에 있어서, 항-Ang2 항체 또는 이의 기능성 부분을 약 1500 mg의 용량으로 투여하는 것인 치료 또는 억제 방법.
- 제3항에 있어서, 항-Ang2 항체 또는 이의 기능성 부분을 약 60 내지 약 90분 동안 IV 주입으로 투여하는 것인 치료 또는 억제 방법.
- 제3항에 있어서, 환자는 다중 용량을 투여받는 것인 치료 또는 억제 방법.
- 제10항에 있어서, 투여량 주기(dosage cycle)가 약 14일마다인 치료 또는 억제 방법.
- 제10항에 있어서, 투여량 주기가 약 21일마다인 치료 또는 억제 방법.
- 제3항에 있어서, 항-Ang2를 1 이상의 추가 치료제와 공동 투여하는 것인 치료 또는 억제 방법.
- 제13항에 있어서, 1 이상의 추가 치료제는 카보플라틴, 카페시타빈, 젬시타빈, 또는 파클리탁셀 중 1 이상에서 선택되는 것인 치료 또는 억제 방법.
- 제14항에 있어서, 1 이상의 추가 치료제는 카보플라틴 및 파클리탁셀인 치료 또는 억제 방법.
- 제13항에 있어서, 1 이상의 추가 치료제는 세디라닙인 치료 또는 억제 방법.
- 제13항에 있어서, 1 이상의 추가 치료제는 항-VEGF 항체 또는 이의 기능성 부분인 치료 또는 억제 방법.
- 제17항에 있어서, 항체는 베바시주맙인 치료 또는 억제 방법.
- 제3항에 있어서, 환자는 난소암을 갖는 것인 치료 또는 억제 방법.
- 제3항에 있어서, 환자는 다형성 교아세포종을 갖는 것인 치료 또는 억제 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201461989884P | 2014-05-07 | 2014-05-07 | |
| US61/989,884 | 2014-05-07 | ||
| US201462005525P | 2014-05-30 | 2014-05-30 | |
| US62/005,525 | 2014-05-30 | ||
| PCT/US2015/029447 WO2015171747A1 (en) | 2014-05-07 | 2015-05-06 | Methods of using anti-ang2 antibodies |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170003651A true KR20170003651A (ko) | 2017-01-09 |
Family
ID=54392949
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167034326A KR20170003651A (ko) | 2014-05-07 | 2015-05-06 | 항-ang2 항체의 사용 방법 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US20170058025A1 (ko) |
| EP (1) | EP3139956A4 (ko) |
| JP (1) | JP2017514854A (ko) |
| KR (1) | KR20170003651A (ko) |
| CN (1) | CN107206067A (ko) |
| AU (1) | AU2015256052A1 (ko) |
| CA (1) | CA2946906A1 (ko) |
| HK (1) | HK1244445A1 (ko) |
| IL (1) | IL248391A0 (ko) |
| RU (1) | RU2016147521A (ko) |
| SG (1) | SG11201609168PA (ko) |
| WO (1) | WO2015171747A1 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2020175886A1 (ko) * | 2019-02-25 | 2020-09-03 | 주식회사 파멥신 | 항-ang2 항체 및 이의 용도 |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9732131B2 (en) | 2006-02-27 | 2017-08-15 | Calviri, Inc. | Identification and use of novopeptides for the treatment of cancer |
| MA46036A (fr) | 2016-08-23 | 2019-07-03 | Medimmune Ltd | Anticorps anti-vegf-a et anti-ang2 et leurs utilisations |
| WO2018223092A1 (en) | 2017-06-02 | 2018-12-06 | Arizona Board Of Regents On Behalf Of Arizona State University | A method to create personalized cancer vaccines |
| WO2019055618A1 (en) | 2017-09-15 | 2019-03-21 | Arizona Board Of Regents On Behalf Of Arizona State University | METHODS OF CLASSIFYING RESPONSES TO ANTICANCER IMMUNOTHERAPY |
| JP7406129B2 (ja) | 2019-05-08 | 2023-12-27 | ダイキン工業株式会社 | フルオロポリマーの製造方法及びフルオロポリマー |
| EP4038222A4 (en) | 2019-10-02 | 2023-10-18 | Arizona Board of Regents on behalf of Arizona State University | METHODS AND COMPOSITIONS FOR IDENTIFYING NEOANTIGENS FOR USE IN THE TREATMENT AND PREVENTION OF CANCER |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MX2010008099A (es) * | 2008-01-28 | 2010-08-04 | Medimmune Ltd | Anticuerpos y angiopoyetina-2 estabilizados y sus usos. |
| JO3182B1 (ar) * | 2009-07-29 | 2018-03-08 | Regeneron Pharma | مضادات حيوية بشرية عالية الالفة مع تولد الاوعية البشرية - 2 |
| US8980268B2 (en) * | 2009-07-29 | 2015-03-17 | Regeneron Pharamceuticals, Inc. | Methods for treating cancer by administering an anti-Ang-2 antibody |
| MA34059B1 (fr) * | 2010-02-23 | 2013-03-05 | Genentech Inc | Thérapie anti-angiogénique pour le traitement du cancer des ovaires |
| CN102250247B (zh) * | 2011-06-15 | 2013-06-19 | 常州亚当生物技术有限公司 | 一种抗vegf/ang2双特异性抗体及其应用 |
| KR101607038B1 (ko) * | 2011-11-21 | 2016-04-11 | 모토로라 모빌리티 엘엘씨 | 시간 예측을 위한 병치된 픽처의 암시적 결정 및 결합된 암시적 및 명시적 결정 |
| KR20150038593A (ko) * | 2012-08-07 | 2015-04-08 | 제넨테크, 인크. | 교모세포종의 치료를 위한 조합 요법 |
-
2015
- 2015-05-06 SG SG11201609168PA patent/SG11201609168PA/en unknown
- 2015-05-06 WO PCT/US2015/029447 patent/WO2015171747A1/en active Application Filing
- 2015-05-06 EP EP15788683.9A patent/EP3139956A4/en not_active Withdrawn
- 2015-05-06 CA CA2946906A patent/CA2946906A1/en not_active Abandoned
- 2015-05-06 RU RU2016147521A patent/RU2016147521A/ru not_active Application Discontinuation
- 2015-05-06 AU AU2015256052A patent/AU2015256052A1/en not_active Abandoned
- 2015-05-06 CN CN201580035986.9A patent/CN107206067A/zh active Pending
- 2015-05-06 US US15/308,187 patent/US20170058025A1/en not_active Abandoned
- 2015-05-06 KR KR1020167034326A patent/KR20170003651A/ko not_active Application Discontinuation
- 2015-05-06 JP JP2016566641A patent/JP2017514854A/ja active Pending
-
2016
- 2016-10-19 IL IL248391A patent/IL248391A0/en unknown
-
2018
- 2018-03-22 HK HK18103973.5A patent/HK1244445A1/zh unknown
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2020175886A1 (ko) * | 2019-02-25 | 2020-09-03 | 주식회사 파멥신 | 항-ang2 항체 및 이의 용도 |
| CN113728004A (zh) * | 2019-02-25 | 2021-11-30 | 药物抗体公司 | 抗Ang2抗体及其用途 |
| JP2022522195A (ja) * | 2019-02-25 | 2022-04-14 | ファームアブシン・インコーポレイテッド | 抗ang2抗体及びその用途 |
Also Published As
| Publication number | Publication date |
|---|---|
| SG11201609168PA (en) | 2016-12-29 |
| US20170058025A1 (en) | 2017-03-02 |
| EP3139956A1 (en) | 2017-03-15 |
| AU2015256052A1 (en) | 2016-11-10 |
| JP2017514854A (ja) | 2017-06-08 |
| CN107206067A (zh) | 2017-09-26 |
| HK1244445A1 (zh) | 2018-08-10 |
| CA2946906A1 (en) | 2015-11-12 |
| EP3139956A4 (en) | 2017-11-29 |
| RU2016147521A3 (ko) | 2018-12-27 |
| WO2015171747A1 (en) | 2015-11-12 |
| RU2016147521A (ru) | 2018-06-09 |
| IL248391A0 (en) | 2016-11-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20170003651A (ko) | 항-ang2 항체의 사용 방법 | |
| JP7453943B2 (ja) | 長時間作用型fgf21融合タンパク質およびそれを含む医薬組成物 | |
| Shimamoto et al. | Peptibodies: A flexible alternative format to antibodies | |
| JP6379300B2 (ja) | GLP及び免疫グロブリンハイブリッドFc融合ポリペプチド及びその用途 | |
| JP6038650B2 (ja) | Dll4アンタゴニスト及び化学療法剤を用いたがんの治療方法 | |
| BR112018012641A2 (pt) | molécula de penetração de célula portadora de fármaco, métodos para facilitar a incorporação de um composto biologicamente ativo (bac) em uma célula, para melhorar a biodisponibilidade de um fármaco ou bac, para introduzir um fármaco ou bac em um sítio e para alterar a expressão de um gene endógeno ou exógeno, e, composição. | |
| Ribatti | Erythropoietin and tumor angiogenesis | |
| US20130006034A1 (en) | Methods of enhancing the response to radiation in tumor therapy using anti-dll4 antibodies | |
| Liu et al. | Targeted EpCAM-binding for the development of potent and effective anticancer proteins | |
| Wang et al. | An ultra-small bispecific protein augments tumor penetration and treatment for pancreatic cancer | |
| US20130142796A1 (en) | Treatment for angiogenic disorders | |
| US10744186B2 (en) | Method of treating cancer with compositions comprising IL-31 | |
| Brayden | Localised delivery of macromolecules to the large intestine: translation to clinical trials | |
| Macdougall | Development of recombinant erythropoietin and erythropoietin analogs | |
| US20200255506A1 (en) | Treatment of ck8 positive cancers in relation with k-ras gene status | |
| US20230062308A1 (en) | Treatment of ck8 positive cancers in relation with k-ras gene status | |
| US20230212247A1 (en) | Modified cxcl10 for immunotherapy of cancer diseases | |
| CN116802303A (zh) | 用于预防和治疗癌症的沙门氏菌菌株及其用途 | |
| KR20160075107A (ko) | 페길화된 vegf 트랩 및 이의 제조방법 | |
| WO2024002074A1 (zh) | 包含抗ctla4和抗pd1的混合抗体的药物组合物及其治疗用途 | |
| Xu et al. | 31P Integrated safety analysis of anti-programmed cell death-1 (PD-1) antibody penpulimab in advanced solid tumour or lymphoma | |
| CN116437957A (zh) | 用于治疗肺癌的抗PD-L1抗体和c-Met激酶抑制剂的联用药物组合物 | |
| KR20240067131A (ko) | Nkg2a를 표적화하는 암 요법 | |
| CN117085124A (zh) | 一种包含抗PD-L1抗体和c-Met激酶抑制剂的药物组合 | |
| Yang et al. | Comparative study between metronomic chemotherapy and transarterial chemoembolization in patients with Child-Pugh class B advanced hepatocellular carcinoma |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |