KR20160138578A - 핵산 정제 방법 - Google Patents
핵산 정제 방법 Download PDFInfo
- Publication number
- KR20160138578A KR20160138578A KR1020167031367A KR20167031367A KR20160138578A KR 20160138578 A KR20160138578 A KR 20160138578A KR 1020167031367 A KR1020167031367 A KR 1020167031367A KR 20167031367 A KR20167031367 A KR 20167031367A KR 20160138578 A KR20160138578 A KR 20160138578A
- Authority
- KR
- South Korea
- Prior art keywords
- solution
- filter
- alcohol
- nucleic acid
- fluid
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/10—Processes for the isolation, preparation or purification of DNA or RNA
- C12N15/1003—Extracting or separating nucleic acids from biological samples, e.g. pure separation or isolation methods; Conditions, buffers or apparatuses therefor
- C12N15/1017—Extracting or separating nucleic acids from biological samples, e.g. pure separation or isolation methods; Conditions, buffers or apparatuses therefor by filtration, e.g. using filters, frits, membranes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6804—Nucleic acid analysis using immunogens
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2527/00—Reactions demanding special reaction conditions
- C12Q2527/137—Concentration of a component of medium
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Genetics & Genomics (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Analytical Chemistry (AREA)
- Molecular Biology (AREA)
- Microbiology (AREA)
- Biophysics (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Plant Pathology (AREA)
- Crystallography & Structural Chemistry (AREA)
- Pathology (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
Abstract
다중핵산을 필터에 흡착시키고, 그 필터를 수-비혼화성 용액으로 세정하고, 필터로부터 다중핵산을 용리시키는 것을 포함하는, 다중핵산 정제 방법이 개시된다. 이 방법은 정제된 RNA 및/또는 DNA 제조에 이용될 수 있다.
Description
본 발명은 DNA 또는 RNA 와 같은 핵산을 임상 샘플 또는 기타 혈액, 세포 또는 조직 샘플 유형에서 정제하는 것을 비롯해, 이러한 핵산을 정제하는 방법에 관한 것이다.
DNA 및 RNA 샘플을 활용하는 분자 생물 기술은 종종 핵산의 정제된 샘플을 수득하는 것에 의존한다. DNA 또는 RNA 의 다수의 공급원, 예컨대 유기체 (예, 인간, 동물, 식물, 박테리아, 바이러스 등) 로부터 수득될 수 있는, 조직, 세포, 전혈, 혈장, 혈청, 추출물뿐 아니라 실험실에서 개발 또는 보존된 조직 또는 세포 배양물이 존재한다. DNA 또는 RNA 을 추가적으로 사용하기 위해서는 일반적으로 DNA 또는 RNA 를 샘플 공급원 내 다른 성분들로부터 단리시켜 그 다중핵산에 다른 세포 효소, 단백질, 화합물 및/또는 조직파편 (debris) 이 없게 하는 것이 요구된다. 이러한 다른 물질로부터 DNA 또는 RNA 를 단리시킴으로써, 예를 들어 PCR, RT-PCR, TMA, LAMP, LCR, 서열분석, 핵산 하이브리드화 분석, 또는 핵산을 이용하는 하이브리드화 반응 또는 효소 반응을 기반으로 하는 당업계에 공지되어 있는 다양한 임의 기술에 의한 다중핵산의 후속적인 프로세싱이 가능하게 된다.
DNA 또는 RNA 를 단리하는 가장 조기의 기술 중 하나는, 예를 들어 프로테나아제 K 를 이용해 세포 또는 조직 샘플을 분해하고 (lysis), 동등 부피의 페놀/클로로포름 용액을 그 분해물에 첨가해 비(非)핵산 물질 (예, 단백질, 소기관, 등) 을 추출하고, 추가 이용을 위해 핵산을 함유하는 수성 상을 제거하는 것이었다. 통상적으로, 핵산은 에탄올 또는 이소프로판올로의 침전에 의해 수성 상으로부 회수된다. 이 기술의 변형은 추가로 유기 상에 소량의 이소아밀 알코올을 첨가해 RNase 를 탈활성화하는데 보조하고/하거나 무질서유발제 (chaotropic agent), 예컨대 구아니디늄 티오시아네이트를 첨가해 단백질 변성 및 효소 불활성화을 보조하는 것을 포함한다. 페놀/클로로포름 추출은 이것이 제공하는 고 순도 및 고 회수 때문에 비핵산 물질 제거에 의한 핵산 정제에 있어 "최적 표준 (gold standard)" 으로 여겨지나, 수고스럽고, 자동화하기 곤란하며 위험한 유기 용매 이용을 요구하는 것과 같이 이 방법에는 단점이 존재한다.
후속해서, 핵산을 고체 상에 흡수시키고, 원하지 않는 물질을 세정해 제거하고, 핵산을 용리하는 것을 기반으로 하는 기술이 개발된 바 있다. 고체 상은 흔히 실리카 입자이나, 기타 물질, 예컨대 유리 섬유, 비즈 또는 분말, 히드록시아파타이트, 음이온성 교환 수지 및 규조류도 또한 이용된다. 다중핵산은 무질서 염의 존재 하 고체 상에 결합되고, 알코올-함유 용액을 이용하여 비결합된 물질을 세정 제거하고, 최종적으로 다중핵산을 저 이온성 강도 용액을 이용하여 고체 상으로부터 용리시켜 실질적으로 순수한 형태의 다중핵산이 수득된다.
몇몇의 회사는 고체 상 물질의 이용을 특징으로 삼는 DNA 및 RNA 정제용 키트를 제공한다. 키트는 일반적으로 고체 상 물질을 컬럼 또는 막 형태로, 또는 상자성 (paramagnetic) 입자 상 코팅으로서 제공한다. 상자성 입자가 이용되는 경우에는, 세정 또는 용리 버퍼가 제거되는 동안 입자를 격리시키기 위해 자석이 이용된다. 그러나, 상자성 입자는 비교적 비싸고, 입자를 조작하는 것이 자동화 비용을 증가시킨다. 컬럼 또는 막을 고체 상으로서 이용하는 경우에는, 세정액 및 용리 버퍼를 원심분리에 의해 또는 진공 적용으로 인출한다. 컬럼 및 막은 세정 용액이 전체 공동 부피를 통과하는데 유효하게 고안 및 프로세싱될 필요가 있다. 고체 상 내 정체 (hold-up) 되어진 액체, 또는 마찬가지로 고체 상의 공극 공간에서 불충분하게 세정해 내는 것이란, 핵산 생성물을 방해 또는 오염시키는 불순물, 저해제 또는 기타 화합물이 제거되지 않는 것을 의미한다. 원심분리가 종종 사용되어 액체를 균일하게 제거하는 것이 시도되나, 자동화 시스템은 필연적으로 더 커야하고, 보다 복잡하고 비용이 더 든다. 일반적으로, 현 기술보다 더 나은 결과를 내도록 시도한 방법은 여전히 하기의 문제점들 중 하나 이상을 앓고 있다: (1) 핵산 생성물의 낮은 수율, (2) 세정 용액 폐기물의 증가된 부피; (3) 요구되는 것보다 더 희석된 핵산 생성물 용액; (4) 잔류 PCR 저해제; 및 (5) 너무 긴 처리 시간.
따라서, 자동화하기 용이한 단순한 액체-처리 단계를 기반으로 하는 방법이 여전히 요망된다.
유리 마이크로파이버 필터를 핵산 정제용 고체 상 물질로서 이용하면, 표준 프로토콜을 이용해 후속의 효소적-기반 프로세싱에서 이용되기에 충분히 순수한 생성물이 수득되지 못한다는 점을 본 발명자들은 관찰했다. 예를 들어, 세포 샘플을, 분해 버퍼로 처리하고, 압력에 의해 유리 마이크로파이버 필터에 그 분해물을 통과시켜 핵산 (DNA 및 RNA) 를 유리 섬유와 결합시켰다. 이후, 필터를 압력에 의해 수성 에탄올로 2 회 세정하고, 핵산을 뉴클레아제-부재 물을 이용해 용리했다. 수득된 물질을 표적으로서 이용해 PCR 을 행하고자 하는 후속의 시도 결과, 증폭 반응이 실패되었다. 수득된 물질 내 저해제의 존재가 대조군 반응 이용을 통해 확인되었다.
따라서, 핵산 샘플의 신속한, 고 처리량, 고순도 수율을 달성하기 위해, 두껍고/두껍거나 더 크고/더 크거나 가변적인 공극 크기 필터와 융화가능한 핵산 정제 방법뿐 아니라, 간편한 시스템으로 자동화 가능하나 작동 비용을 감축하면서 약 1 mL 이상의 샘플 부피를 처리하는 방법에 대한 요구가 여전히 존재한다.
본 발명의 개요
고체 상으로서 필터 및 압력-구동 조작을 활용하는 다중핵산의 정제 방법이 제공된다. 제 1 구현예는 (1) 다중핵산을 필터에 흡착시키는 것, (2) 필터를 비혼화성 (immiscible) 유체 세정 용액으로 세정하는 것, 및 (3) 폴리뉴클레오티드를 필터로부터 수성-기반 용리 용액을 이용해 용리하여 정제된 다중핵산의 용액을 수득하는 것을 포함한다.
제 2 구현예는 (1) 다중핵산을 필터에 흡착시키는 것, (2) 필터를 알코올-기반 세정 용액으로 세정하는 것, (3) 필터를 비혼화성 유체 세정 용액으로 세정하는 것 및 (4) 폴리뉴클레오티드를 필터로부터 수성-기반 용리 용액을 이용하여 용리해 정제된 다중핵산의 용액을 수득하는 것을 포함한다.
제 3 구현예는 (1) 다중핵산을 필터에 흡착시키는 것, (2) 필터를 비혼화성 유체 세정 용액으로 세정하는 것, (3) 필터를 알코올-기반 세정 용액으로 세정하는 것, (4) 필터를 비혼화성 유체 세정 용액으로 세정하는 것, 및 (5) 폴리뉴클레오티드를 필터로부터 수성-기반 용리 용액을 이용하여 용리해 정제된 다중핵산의 용액을 수득하는 것을 포함한다.
추가의 구현예는 두 종 이상의 상이한 알코올-기반 세정 용액 조성물, 및/또는 두 종 이상의 상이한 비혼화성 유체 세정 용액 조성물로 필터를 세정하는 것을 포함한다.
추가의 구현예는 상기 구현예들 중 임의의 구현예에서 용리 단계 후 필터를 비혼화성 유체 세정 용액으로 세정하는 것을 포함한다.
또 다른 구현예에서, 용리 단계는 수성 기반 용리 용액을 필터의 입구쪽에 두고, 수성-기반 용리 용액 위 또는 아래에 비혼화성 유체 세정 용액으로 층일 이루고, 두 용액을 필터에 통과시켜 수성 상 내 정제된 다중핵산의 용액을 수득함으로써 행해진다.
각종 구현예의 방법이 임의 유형의 다중 핵산, 예컨대 DNA, RNA 및/또는 DNA 와 RNA 의 혼합물 정제에 이용될 수 있다. 다중핵산은 천연 기원의 것 (예를 들어, 임의 유형의 세포로부터 추출) 또는 합성의 것일 수 있다.
고체 상, 및 용기 (이 용기 내에 고체 상을 보유할 수 있는 공극 바닥을 가짐), 하나 이상의 비혼화성 세정 용액, 용리 용액 및 임의로는 알코올-기반 세정 용액을 용기 내 고체 상에 전달하는 액체 전달 수단을 포함하는 시스템이 제공되어, 본 발명의 방법이 행해질 수 있다. 시스템은 용기 안 고체 상을 통해 임의 용액을 구동시키는 압력 헤드를 제공할 수 있는 압력 공급원을 추가로 포함할 수 있다. 시스템은 또한 용기 안 고체 상을 통해 임의 용액의 유동을 유도할 수 있는 진공 공급원을 추가로 포함할 수도 있다. 또 다른 구현예에서, 시스템은 용기 안 고체 상을 통해 임의 용액을 구동하는 원심력을 제공할 수 있는 원심분리기를 추가로 포함할 수 있다.
일부 구현예에서, 당해 방법 수행 기기는 단일 샘플 처리용 구획 및 필터를 갖는 한편, 다른 구현예에서는 다중 구획 및 필터 세트가 다중-샘플 처리를 위해 제공되고, 이때 일부 경우에서는 이는 동시에 실시될 수 있다. 다중-샘플 처리 예로서, 다공성 웰-바닥을 갖는 다중웰 마이크로타이터 플레이트가 용기로서 이용될 수 있고, 각 웰에 필터가 갖춰질 수 있다. 단일-샘플 또는 다중-샘플 프로세싱용 기기는 수동, 반자동, 또는 자동적으로 방법을 수행하기 위한 시스템에 혼입될 수 있다.
본 발명의 이러한 및 기타 목적 및 특징들은, 본 발명의 하기의 상세한 설명과 수반되는 도면을 함께 읽으면, 보다 더 자명해질 것이다.
도면의 간단한 설명
도 1 은 정제 방법의 구현을 수행하기에 유용한 기기의 한 구현을 나타낸다.
도 2A-2B 는 실시예 3 에 기재된 본 발명의 구현예에 따라 수득된 정제된 핵산 샘플의 실시간 RT-PCR 분석에 대한 성장 곡선을 나타낸다.
도 3A-3B 는 실시예 3 에 기재된 본 발명의 구현예에 따라 수득된 정제된 핵산 샘플의 실시간 RT-PCR 분석의 결과물에 대한 용융 곡선을 나타낸다.
도 4A-4B 는 실시예 3 에 기재된 본 발명의 구현예에 따라 제조된 샘플로부터 수득된 PCR 생성물의 전기영동 분석 결과를 나타낸다.
도 5 는 실시예 5 에 기재된 본 발명의 구현예에 따라 수득된 정제된 핵산 샘플의 실시간 PCR 분석에 대한 성장 곡선을 나타낸다.
도 6 는 실시예 5 에 기재된 본 발명의 구현예에 따라 수득된 정제된 핵산 샘플의 실시간 PCR 분석 결과물의 용융 곡선을 나타낸다.
도 7 는 실시예 5 에 기재된 본 발명의 구현예에 따라 제조된 샘플로부터 수득된 PCR 생성물의 전기영동 분석 결과를 나타낸다.
상세한 설명
관심 DNA 또는 RNA 는 모든 유기체, 예컨대 인간, 기타 포유류, 기타 동물, 식물, 박테리아, 바이러스 또는 임의 기타 생물 형태 (살아있거나 죽음) 의 DNA 또는 RNA 를 포함한다. 일부 구현예에서, DNA 또는 RNA 는 천연 발생 다중핵산이고, 본 방법은 다중핵산을, 세포 내부의 그들의 천연 공급원으로부터 추출하기 위한 또는 다중핵산을 분해물로부터 정제하기 위한 프로토콜의 일부로서 이용될 수 있다. 공급원은 임상적 샘플일 수 있고, 다중핵산은 진단 검정의 일부로서 분석되어진다. 천연 발생 다중핵산은 임의 유형의 샘플, 예를 들어 세포 배양물, 조직 샘플, 혈액 샘플 등으로부터 유래될 수 있다. 기타 구현예에서 DNA 또는 RNA 는 분자 생물 반응의 생성물일 수 있다. 예를 들어, 일부 구현예에서, DNA 샘플은 천연 DNA 공급원으로부터, 예컨대 게놈 DNA 증폭에 의해, 또는 천연 RNA 공급원으로부터, 예컨대 RNA 전사 생성물로부터 생성된 cDNA 로부터 유래될 수 있다.
DNA 또는 RNA 다중핵산은 임의의 길이일 수 있고, 방법은 길이들의 조합물에 적용될 수 있다. 전형적으로 핵산은 40 베이스만큼 작을 수 있고, 약 50 킬로베이스만큼 길 수 있다. 핵산은 단일가닥 또는 이중가닥일 수 있거나, 임의의 기타 다중가닥 형태일 수 있다. 일부 구현예에서, DNA 및 RNA 양자 모두는 함께 정제 방법의 주제일 수 있다. 기타 구현예에서, 세정 및 용리 조건은 DNA 또는 RNA 정제를 위해 최적화된다.
방법에서, DNA 및/또는 RNA 는 고체 상에 흡착되고, 다른 물질들은 세정되어 제거되고, 이어서 DNA 및/또는 RNA 가 고체 상에서 용리되어진다. 흡착된 핵산으로부터 불순물을 세정해 내기 위해, 고체 상을 본원에 기재된 바와 같은 비혼화성 유체 세정 용액으로 세정한다. 비혼화성 유체로의 세정은 1 또는 2 회 또는 그 이상 수행될 수 있고, 기타 세정 또한 하기에 기재된 바와 같이 수행될 수 있다. 비혼화성 유체로의 다수의 세정은 연속적으로 수행될 수 있고/될 수 있거나 다른 용액으로의 세정이 개입될 수 있다.
고체 상은 또한 필터로서 언급될 수 있다. 일부 구현예에서, 고체 상은 유리-기재 물질, 예컨대 보로실리케이트 유리이다. 일부 구현예에서, 보로실리케이트 유리 필터는 결합제-부재이다. 예를 들어, 필터는 보로실리케이트 유리 결합제-부재 마이크로파이버로, 이는 임의 형상의 필터 형태일 수 있다. 필터 두께는 50 내지 3000 ㎛ 범위일 수 있고, 예시 구현에는 100 ㎛, 250 ㎛, 500 ㎛, 675 ㎛, 1000 ㎛, 또는 2000 ㎛ 이 포함될 수 있다. 특정 두께는 제작자에 따라 좌우될 수 있다. 나아가, 필터는 고체 상의 전체 두께를 증가시키도록 쌓여질 수 있다 (스태킹; stacking). 예를 들어, 소자의 결합능을 증가시키기 위해 필터를 스태킹하는 것이 이용될 수 있다. 마이크로파이버 필터는 그 구조가 0.5 내지 3.0 ㎛ 범위의 입자 (이의 구현예에는 0.7 ㎛, 1.0 ㎛, 1.5 ㎛, 2.0 ㎛, 또는 2.7 ㎛ 크기가 포함됨) 의 보유력을 제공할 수 있게 형성될 수 있다. 다시, 보유된 특정 입자 크기는 제작자에 좌우될 수 있다. 필터는 하나 초과의 공극 크기를 포함하면서 다층화될 수 있거나, 또는 하나 초과의 필터가 용기 내 스태킹되는 경우, 개개의 필터들은 상동 또는 상이한 공극 크기를 가질 수 있다. 하나의 구현예에서, 필터는 Whatman 유리 마이크로파이버 결합제 부재 필터, 등급 GF/B (675 ㎛ 두께, 1.0 ㎛ 입자 보유 등급) 의 특징을 갖는다. 다른 구현예에서, 필터는 Whatman 마이크로파이버 필터, 등급 GF/A (260 ㎛ 두께, 1.6 ㎛ 입자 보유 등급), GF/C (260 ㎛ 두께, 1.2 ㎛ 입자 보유 등급), GF/D (675 ㎛ 두께, 2.7 ㎛ 입자 보유 등급), 또는 GF/F (420 ㎛ 두께, 0.7 ㎛ 입자 보유 등급) 의 특징을 갖는다.
비혼화성 유체 세정 용액. 비혼화성 유체 세정 용액은 핵산 물질이 필터에 흡착되어진 이후에 필터를 적어도 1 회 세정하는데 사용된다. 비혼화성 유체 세정 용액은 본 발명의 방법을 실시하는 경우와는 별개이고 이를 제외한, (i) 물과 접촉시 물로부터 실질적으로 분리된 상을 형성하고 바람직한 경우 유체와 물 사이의 메니스커스를 형성하는 유체를 포함한다. 바람직한 구현예에서, 유체는 또한 (ii) 물의 비중보다 낮은 비중을 갖고, (iii) 본 정제 방법의 대상인 핵산을 수반하는 효소 반응을 실질적으로 방해하거나 저해하지 않고, (iv) 필터를 수용하는 용기 및 필터와 같은 정제 시스템 장치 부품과 화학적으로 양립가능하다.
비혼화성 유체 세정 용액이 필터의 입구쪽에 위치되어 필터를 헤치며 이동하는 경우, 필터의 공동 공간을 통해 흐르는 방향으로 이 공동 공간을 차지하는 용액을 푸쉬 (push) 하는 작용을 한다. 특히, 비혼화성 유체 세정 용액은 필터 내의 공동 공간을 차지하는 임의의 수성 용액 또는 알코올-기반 세정 용액을 강행 푸쉬시키는 작용을 한다. 또 다른 측면에서, 비혼화성 유체 세정 용액은 필터에서 정체되고 있는 효소 저해제를 제거 또는 그의 양을 실질적으로 감소시키는 기능을 하는데, 그렇지 않은 경우에는 상기 효소 저해제는 핵산 물질과 함께 용리될 것이다. 또 다른 측면에서, 비혼화성 유체 세정 용액은 핵산 물질 검출 방법을 방해할 수 있는 샘플 성분을 제거 또는 그의 양을 실질적으로 감소시키는 기능을 한다. 예를 들어, 예로서 혈청 샘플에서의 빌리루빈이 비혼화성 유체 세정 용액으로의 세정에 의해 제거될 수 있거나 감소될 수 있다.
일부 구현예에서, 비혼화성 유체는 소수성 중합체이다. 중합체는 무기성 중합체일 수 있고, 바람직한 구현예는 실리콘 오일 (또한 실리콘 유체로서 공지) 이다. 일부 구현예에서, 중합체는 유기성 중합체, 예컨대 미네랄 오일, 파라핀 오일, 베이퍼 록 (Vapor Lock; Qiagen Inc., Valencia, CA), 베이비 오일 또는 백유일 수 있다. 중합체는 천연, 합성 또는 반합성 생성물일 수 있다. 기타 예에는 어유 또는 예를 들어, 대두, 올리브, 땅콩, 옥수수 또는 카놀라로부터 유래된 식물성 오일을 포함한다. 비혼화성 유체 세정 용액은 하나 초과의 소수성 중합체 유형을 포함할 수 있다. 일부 구현예에서, 비혼화성 유체는 비중합체성 유기 화합물이다. 일부 구현예에서, 비혼화성 유체 세정 용액은 중합체 및 비중합체 유기 화합물을 포함할 수 있다. 일부 바람직한 구현예에서, 비혼화성 유체는 1 내지 20 cSt 의 범위의 점도를 갖고, 일부 바람직한 구현예에서 점도는 1 내지 10 cSt 범위이다.
비혼화성 유체에 대해 상기 열거된 4 가지 기준 (i)-(iv) 을 충족시키는 것에 덧붙여, 비중합체성 화합물은 또한 정제된 핵산을 수반하는 임의의 다운스트림 프로세싱과 물리적으로 융합가능해야 한다. 예를 들어, 핵산이 고온에서 인큐베이션 또는 고온으로 가열되는 경우, 이때 비혼화성 유체가 샘플 내 잔존하는 경우, 이것이 상기 프로세스를 방해하지 않는 비등점 및 증기압을 가져야 한다. 즉, 비등점은 프로세스 온도보다 적절히 더 커야 하고/하거나 증기압은 휘발성 또는 부피 팽창이 프로세스를 방해하지 않을 정도로 프로세스 온도에서 적절히 낮아야 한다. 예를 들어, 정제된 핵산이 예를 들어 95℃ 에서 변성 단계를 갖는 열순환처리 (thermocycling) 반응에 사용되어지는 경우, 임의의 비혼화성 유체의 비등점은 상기 온도보다 충분하게 더 커야 한다.
비혼화성 유체의 비중은 일반적으로 물의 것보다 낮다. 따라서, 비혼화성 유체 세정 용액이 방법 수행 동안 필터 상에 놓여지는 경우 세정 용액은 필터 내 임의의 수성 용액 위에 잔존하는 경향이 있을 것이다. 이러한 방식으로, 비혼화성 유체 세정 용액은 필터 물질을 통해 이동하고 필터 내 공동에 정체되어진 수성 용액을 푸쉬시킬 수 있다.
비혼화성 유체 세정 용액의 한 가지 기능은 효소 반응을 방해 또는 저해하는 물질을 감소 또는 제거하는 것이다. 정제 방법의 일부 구현예에서, 비혼화성 유체 세정 용액 일부는 용리된 생성물에 잔존할 수 있다. 비혼화성 유체 세정 용액이 생성물에 잔존하는 경우, 용리액 및 비혼화성 유체가 함께 후속 반응에 사용될 수 있고, 여기서 비혼화성 유체는 물보다 낮은 비중 덕택에 샘플의 상부 경계면에 달할 수 있다. 하나의 구현예에서, 비혼화성 유체는 증기 장벽으로서 작용할 수 있다.
정제 방법의 일부 구현예에서, 비혼화성 유체 세정 용액은 용리된 생성물로 수집되는 것이 방지될 수 있다. 다른 예에서, 비혼화성 유체 세정 용액은 상들의 분리, 추출 및 기타 화학적 또는 물리적 기술에 의해 용리된 생성물로부터 제거될 수 있다. 비혼화성 유체 세정 용액이 용리된 생성물 내 잔존 여부와 관계 없이, 비혼화성 유체 세정 용액 그 자체가 또한 그의 임의 다운스트림 효소 반응과의 융화성에 대해 고려되어야 한다.
후보 비혼화성 유체가 다수의 등급에서 이용가능하고, 유사 중합체가 각종 공급원으로부터 제조될 수 있으므로, 그에 따라 비혼화성 유체 및 비혼화성 유체 세정 용액의 임의 의도된 다운스트림 반응과의 융화성은 유체 선택시 또는 용액 제형화시 확인되어져야 한다. 예를 들어, 정제된 핵산 물질이 PCR 반응에서 이용되는 경우, 이때 유체 및 세정 용액은 직접 샘플에 첨가될 수 있고, 저해 효과는 존재한다면 측정될 수 있다.
당업자는 효소 반응에서 시약의 융화성을 확인하기 위한 방법 및 그 필요성에 대해 익히 알고 있다. 본원에서 기재된 정제 방법에 사용하기에 적합한 비혼화성 유체 및 비혼화성 유체 세정 용액은 정제된 생성물을 이용한 효소 반응을 비롯하여 다운스트림 반응을 실질적으로 방해 또는 저해하지 않는 것이다. 예를 들어, 바람직한 세정 용액 유체는 핵산 증폭 반응을 방해하지 않거나 또는 실질적으로 저해하지 않는다. 예의 증폭 반응에는 PCR, RT-PCR, TMA, LAMP, LCR, 등이 포함된다. 반응을 방해 또는 실질적으로 저해한다는 것은, 생성된 생성물의 양 및 유형이 비혼화성 유체(들) 또는 비혼화성 유체 세정 용액의 부재 하에서 생성된 생성물의 양 및 유형과 상이하다는 점을 의미한다. 비혼화성 유체(들) 또는 비혼화성 유체 세정 용액이 후속의 반응에 영향을 미치지 않는 것이 반드시 필요한 것은 아니며, 이것은 단지 의도된 적용에 있어 용인가능한 수준 내로 임의의 영향을 미칠 수 있다.
비혼화성 유체 및 세정 용액은 또한 정제 방법을 수행하는데 사용된 장치와 화학적으로 양립가능해야 한다. 예를 들어, 비혼화성 유체 및 세정 용액은 장치 성분들을 용해, 침출 또는 변형해서는 안된다. 장치는 적어도 필터 및 그 필터를 수용하는 용기를 포함한다.
알코올-기반 세정 용액. 일부 구현예에서, 알코올-기반 세정 용액이 고체 상 세정에 이용된다. 일부 구현예에서, 2 종 이상 유형의 알코올-기반 세정 용액이 이용된다. 알코올-기반 세정 용액은 저급 알칸올, 예컨대 C1-C4 알칸올을 포함한다. 알킬기는 직쇄 또는 분지쇄일 수 있고, 이것은 하나 이상의 히드록실기를 포함할 수 있다. 그 예로, 메탄올, 에탄올, 프로판올, 이소프로판올, 부탄올, 이소부탄올 및 tert-부탄올을 들 수 있다. 추가 예로, 에틸렌 글리콜, 프로필렌 글리콜, 글리세롤 및 기타 폴리올을 들 수 있다. 바람직한 구현예에서, 알코올은 에탄올이다. 1 종 초과의 알코올이 세정 용액에 존재할 수 있다.
알코올-기반 세정 용액은 약 5% 내지 최대 100% 알코올을 포함할 수 있다. 일부 바람직한 구현예에서, 알코올-기반 세정 용액은 10 내지 70% 알코올, 다른 바람직한 구현예에서 20 내지 50% 알코올을 포함한다. 세정 용액이 100% 알코올이 아닌 경우, 또 다른 액체 성분은 물일 수 있다. 일부 구현예에서, 알코올-기반 세정 용액은 수 중 24% 에탄올 또는 수 중 50% 에탄올, 또는 수 중 70% 에탄올 또는 100% 에탄올이다. 일부 구현예에서, 용액은 하나 이상의 염, 버퍼, 비이온성 및/또는 이온성 계면활성제, 친수성 중합체, 보존제 및/또는 항균제를 추가로 함유할 수 있다. 임의 이러한 성분은 이것이 고체 상으로부터의 흡착된 핵산의 실질적 손실을 야기하지 않는 한, 또는 핵산이 고체 상으로부터 용리되면 이들의 임의 다운스트림 프로세싱을 방해하지 않는 한 포함될 수 있다. 일반적으로, 임의의 이러한 성분은 핵산 및 추가의 다운스트림 용도 (핵산을 표적하는 효소 반응 포함) 에 있어 양립가능해야 한다.
이러한 세정 용액뿐 아니라 기타 세정 용액 및 핵산 프로세싱시 사용된 기타 시약에 있어서, 용액에 사용된 물은 일반적으로 증류수이고, 일반적으로 방법 수행의 필요 및 목적에 따라 DNase 및/또는 RNase-부재이다.
염의 바람직한 예에는 염화나트륨, 염화칼륨, 및 아세트산 나트륨, 칼륨 또는 암모늄이 포함되고, 버퍼의 바람직한 예에는 Tris-HCl, HEPES, 및 기타 Good 버퍼가 포함된다. 염 농도는 전형적으로 10 내지 200 mM 이다. 버퍼 농도는 전형적으로 10 내지 500 mM, 바람직하게 20 내지 200 mM 이고, pH 는 6 내지 11, 바람직하게 7 내지 10 이다. 비이온성 계면활성제의 바람직한 예에는 폴리소르베이트 80 (하나의 상표명은 Tween 80®), 기타 폴리소르베이트, Nonidet P-40®, Triton X-100®, 등이 포함된다. 비이온성 계면활성제는 전형적으로 1 내지 10%, 바람직하게 1 내지 5% 의 농도로 존재한다. 친수성 중합체의 바람직한 예에는 폴리에틸렌 글리콜, 예컨대 PEG 8000 가 포함된다. 보존제의 바람직한 예에는 나트륨 아지드, ProClin 150, ProClin 200, 및 ProClin 300 이 포함된다. 보존제는 전형적으로 0.1 내지 10% 의 농도로 존재한다. 염, 버퍼, 계면활성제 및 보존제의 이들 예들은 독점적인 것으로 의미되는 것이 아니라, 대표적인 것이며, 대체물이 당업자에 의해 손쉽게 발견될 수 있다.
일부 구현예에서, 알코올-기반 세정 용액은 100 mM NaCl 수성 용액 중 50% 에탄올, 또는 100 mM NaCl 수성 용액, 10 mM Tris-HCl 중 50% 에탄올, 또는 10 mM Tris-HCl 수성 용액 중 50% 에탄올이다. 일부 구현예에서, 알코올-기반 세정 용액은 pH 7.5 완충된 수성 용액 중 24% 에탄올, 또는 25 mM HEPES (pH 7.5) 수성 용액 중 24% 에탄올, 또는 25 mM HEPES (pH 7.5), 30 mM NaCl 수성 용액 중 24% 에탄올이다. 일부 구현예에서, 알코올-기반 세정 용액은 추가로 8.5% (w/v) PEG 8000 을 포함하고/하거나, 추가로 0.1% (v/v) ProClin 300 을 포함한다. 이들 예는 독점적인 것으로 의도되는 것이 아닌 단지 이용될 수 있는 알코올-기반 세정 용액의 유형 예시인 것으로 의미된다. 당업자는 본원에 기재된 성분, 농도, pH 등의 선택을 달리하여 많은 용액들이 이용될 수 있음을 인지할 것이다.
용리 용액. 수성-기반 용리 용액이 고체 상으로부터 흡착된 핵산을 용리하는데 이용된다. 용리 용액은 수성 용액을 포함하고, 최대 100% 물일 수 있다. 일부 구현예에서, 용리 용액은 염 및/또는 버퍼를 추가로 함유한다. 염의 바람직한 예에는 염화나트륨, 염화칼륨 및 아세트산 나트륨, 칼륨 또는 암모늄이 포함되고, 버퍼의 바람직한 예에는 Tris-HCl, HEPES, 및 기타 Good 버퍼가 포함된다. 염 농도는 전형적으로 50 mM 이하이다. 버퍼 농도는 전형적으로 10 내지 500 mM, 바람직하게 20 내지 200 mM 이고, pH 는 6 내지 11, 바람직하게 7 내지 10 이다. 염 및 버퍼의 이들 예는 독점적인 것이 아닌 대표적인 것을 의미하고, 대체물이 당업자에 의해 손쉽게 발견될 수 있다. 용리 용액에 사용된 물은 일반적으로 증류수이고, 일반적으로 방법 실시의 필요 및 목적에 따라 DNase 및/또는 RNase-부재이다. 한 구현예에서, DNA 용리를 위한 용리 용액은 10 mM (pH 9.0) Tris-HCl 이다. 한 구현예에서, RNA 용리를 위한 용리 용액은 증류수이다. 일부 구현예에서, 저 이온 강도, 예를 들어 50 mM 미만, 수성 용액이 이용된다. 당업자는 고체 상으로부터 방출된 핵산 물질의 수율을 평가함으로써 용리 용액의 적합성을 시험할 수 있다. 일반적으로, 고체 상으로부터 방출된 물질의 수율은 높고, 80% 이상, 또는 90% 이상일 수 있거나 또는 거의 정량적일 수 있다. 방출된 양이 적용 목적에 적합하기만 하면 더 낮은 수율도 허용가능하다.
비혼화성 유체 푸쉬 용액. 비혼화성 유체 푸쉬 용액은 필터를 통해 용리 용액을 이동시키는 것을 보조하는데 이용된다. 비혼화성 유체 푸쉬 용액은 본 발명의 방법을 실시하는 경우와 구분되고 이와 별개로 (i) 물과 접촉시 실질적으로 물로부터 분리된 상을 형성하고, 바람직한 구현예에서는 유체와 물 사이에 메니스커스를 형성하는 유체를 포함한다. 바람직한 구현예에서, 상기 유체는 또한 (ii) 물의 비중보다 낮은 비중을 갖고, (iii) 정제 방법의 대상인 핵산을 수반하는 효소 반응을 실질적으로 방해하지 않거나 저해하지 않고, (iv) 정제 시스템 장치 구성 성분, 예컨대 필터 및 이 필터를 수용하는 용기와 화학적으로 양립가능하다.
비혼화성 유체 푸쉬 용액은 필터의 입구쪽에 위치되어 필터를 통해 이동하는 경우, 필터의 공동 공간을 통해 유동 방향으로 공동 공간을 차지하는 수성-기반 용리 용액을 푸쉬하는 작용을 한다. 용리 용액은 하기에 기술되는 바와 같이, 용리 단계에서 비혼화성 유체 푸쉬 용액을 이용함으로써 효율적으로 수집될 수 있다.
비혼화성 유체 푸쉬 용액은, 비혼화성 유체 세정 용액에 대해 상기 기재된 바와 같이, 소수성 중합체 또는 비-중합체성 유기 화합물 또는 그 조합물일 수 있다. 일부 바람직한 구현예에서, 비혼화성 유체는 1 내지 300 cSt 의 범위의 점도를 갖고, 일부 바람직한 구현예에서, 상기 범위는 10 내지 100 cSt 이고, 다른 바람직한 구현예에서, 상기 범위는 20 내지 50 cSt 이다. 비혼화성 유체 푸쉬 용액을 선택하기 위한 다른 특징 및 고려 사항은 비혼화성 유체 세정 용액에 대해 상기 기재된 것과 동일하다.
본원에 기재된 정제 방법에 있어서, 핵산 물질은 고체 상에 흡착되고, 다른 물질은 수-비혼화성-유체-기반 세정 용액을 이용하여 세정해 제거되고 이후 핵산 물질이 고체 상에서 용리된다.
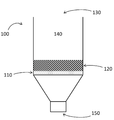
고체 상, 일반적으로 필터는, 용기 안의 한 구획에 첨가되는 용액이 필터를 통과할 수 있게끔 배치되어져 잇는 그 용기 내에 핏팅된다. 이 용기는 단면이 원형, 정사각형, 또는 다면체일 수 있다. 용기는 물질이 튜브 또는 기타 전달 수단을 통해 필터의 입구쪽으로 직접 전달되어지는 폐쇄 또는 부분 폐쇄 시스템의 일부 또는 독립형 단위를 포함할 수 있다. 독립형 구현예의 예는 도 1 에 나타낸다. 용기 100 은 제 1 개구 130 및 제 2 개구 150, 및 용기의 횡단면을 걸치는 다공성 지지체 110 을 갖춰 제공된다. 용기 100 에서 제 1 구획 140 은 용기 벽, 다공성 지지체 110 및 제 1 개구 130 에 의해 정의된 공간 내 존재한다. 편의를 위해 제 1 구획 140 의 부피는 방법에 사용되는 용리 용액 및 세정 용액의 전형적인 부피를 수용하도록 배열될 수 있다. 그럼에도 불구하고, 핵산 물질의 연속적 적용 및 연속의 세정도 또한 고려된다. 상기 구획은 사용될 가장 큰 부피의 용액이 수용되도록 치수를 변경해야 하는 것은 아니다. 일부 구현예에서, 제 1 구획 140 은 50 ㎕ 내지 1000 ㎕ 또는 그 이상의 용액을 수용할 수 있거나, 또는 적어도 200 ㎕ 이하, 또는 적어도 400 ㎕ 이하, 또는 적어도 600 ㎕ 이하, 또는 적어도 800 ㎕ 이하의 용액을 수용할 수 있다. 시험관 내 진단 검정 샘플을 프로세싱하기에 편리한 전형적인 부피의 제 1 구획 140 은 50-1000 ㎕ 또는 그 이상의 범위일 수 있다. 기타 구현예에서, 용기는 세정 용액의 연속 유동을 위해 배열될 수 있다. 이 경우, 세정 용액의 부피는 유동 속도 및 시간에 의해 측정된다.
필터 120 은 제 1 구획 140 내에 제공되며, 필터 120 의 위치를 측정하고 이의 기계적 지지를 제공하는 다공성 지지체 110 에 달려 있다. 필터 120 은 본질적으로 용기의 전체 단면에 걸친다. 필터 120 의 활성 필터 영역은 전 횡단 영역을 차지할 필요가 없다. 그러나, 필터 120 의 형상 및 구조는 단면적을 효율적으로 채워야 하며, 이로써 구획 140 에 놓인 용액이 제 2 개구 150 을 통해 용기 100 을 빠져나가도록 필터 120 을 통과하게 된다.
일반적으로, 구획 140 에 놓인 용액이 필터 120 을 통과하게금 강행되기 위해 압력 구배가 사용된다. 양의 압력이 구획 140 에 제 1 개구 130 을 통해 가해질 수 있다. 다른 구현예에서, 음의 압력이 제 2 개구 150 을 경유하여 필터 120 에서 용액을 끌어당기는데 가해질 수 있다. 일부 구현예에서, 장치는 용기의 출구쪽에서의 음의 압력 또는 입구쪽에서의 양의 압력의 적용 양자 모두 또는 그 중 하나를 제공할 수 있다. 일부 구현예에서, 액체가 필터를 통과하는 절차는 제 1 개구 130 을 통해 양의 압력을 가한 다음 음의 압력을 가하고 이후 양의 압력을 가하는 것을 포함하며, 이때 액체의 적어도 일부는 필터 안으로 이동한 후 필터 뒤로 물러난 다음 필터를 통한다.
필터를 통해 용액을 구동시키는데 필요한 압력의 양은 다수의 인자, 예컨대 필터의 공극 크기 및 공동 부피, 용액의 점도 및 용액이 통과할 때 필터 내 원하는 체류 시간에 따라 가변적이다. 당업자는 용이하게 이들 인자에 따라 압력의 유용한 작동 범위를 측정할 수 있다. 일부 구현예에서, 동일한 작동 압력이 모든 단계에서 이용된다 (예, 흡착, 세정, 용리). 일부 구현예에서, 각 용액에 가해진 압력은 각 용액의 목적 및/또는 특징에 맞게 맞추어진다. 예를 들어, 더 큰 압력 격차가 필터를 통해 더 높은 점도의 용액을 통과시키는데 사용될 수 있다. 그리고, 압력 격차는 용액이 필터와 접촉되는 시간을 조절하는데 이용될 수 있다. 예를 들어, 흡착 단계를 위한 시간은 고체 상으로 핵산 물질이 흡착되기에 충분한 시간을 허용하도록 조절될 수 있다. 상기 시간은 일반적으로 핵산의 크기, 용액 점도, 공동 부피, 공극 크기 등에 따라 좌우되고, 특정 필터에 용이하게 최적화될 수 있다. 압력 및 그에 따른 각 세정 시간은, 프로세스 시기 선택 요건 관점에서, 특히 프로세스가 자동화될 때, 수득된 정제 물질의 수율에 기반해 용이하게 최적화될 수 있다. 전형적으로, 300 kPa 이하의 범위 내 압력이 이 방법에 이용된다. 일부 구현예에서, 중력 및 모세관 작용 하에서 압력차를 활성적으로 가하지 않으면서 용액이 필터를 통과되게 할 수 있다.
일부 구현예에서, 핵산 물질은 용액의 일부로, 이는 예를 들어 관련 핵산 물질을 이용가능하게 만들도록 프로세싱된 임상적 샘플, 세포 분해물, 조직 분해물 또는 기타 용액일 수 있다. 용액은 추가로 일부 구현예에서 당업계에 익히 공지된 바와 같은, pH 버퍼, 염, 변성제 및/또는 무질서제 (chaotrope) 등의, 고체 상으로 핵산 물질의 흡착을 조성하는 물질을 포함한다. 전형적으로, 용액 내 핵산 물질의 농도는 1 내지 10000 카피/1 nL 이다. 전형적으로, 용액으로부터 정제된 핵산 물질의 질량은 1 fg 내지 50 ㎍ 이다.
핵산 물질을 필터 상에 흡착시키기 위해, 핵산 물질을 함유하는 용액을 제 1 구획 140 에 첨가하고, 이어서 압력 구배를 적용시켜 필터를 통과시킨다. 제 1 구획 140 의 부피 및 용액 부피에 따라, 핵산 물질 전부를 프로세스하기 위해서는 프로세스를 1 회 이상 반복시킬 필요가 있을 수 있다. 핵산의 흡착을 극대화하기 위해 필터 물질에 핵산을 접촉 및 결합시키는데 충분한 시간을 허용하도록 샘플 용액의 유동 속도를 최적화하는 것이 일반적이다.
일단 핵산 물질이 흡착되면, 필터를 세정한다. 한 구현예에서, 필터는 비혼화성 유체 세정 용액으로 세정된다. 일정 부피의 세정 용액을 제 1 구획 140 에 놓고, 압력 구배를 적용해 세정 용액이 필터를 밀치고 나아가게 한다. 필터는 1 회 이상 비혼화성 유체 세정 용액으로 세정될 수 있다.
또 다른 구현예에서, 흡착 후, 필터는 먼저 알코올-기반 세정 용액으로 세정되고, 그 다음에 비혼화성 유체 세정 용액으로 세정된다. 알코올이 핵산을 수반하는 임의의 후속 프로세스를 저해하거나 방해한다면 그 알코올이 최종 용리액 내에는 존재하지 않게 보장하는, 알코올 세정 단계를 이용한 임의의 프로토콜이 개발되어야 한다. 예를 들어, 알코올은 역 전사효소 및 폴리머라아제의 저해제인 것으로 인식되고 있으며, 알코올 세정과 용리 사이의 세정 단계가 시스템으로부터 알코올을 제거하기에 충분한 것이 바람직할 수 있다. 각 세정 유형의 부피는 독립적으로 가변적이다. 일부 구현예에서, 하나 이상의 뱃치 (batch) 가 바람직한 부피의 알코올 세정 용액 및 비혼화성 유체 세정 용액에 도달하는데 필요할 수 있다.
또 다른 구현예에서, 흡착 후, 필터는 먼저 비혼화성 유체 세정 용액으로 세정되고, 이후 알코올-기반 세정 용액으로 세정되고, 그 다음에 다시 비혼화성 유체 세정 용액으로 세정된다. 각 세정 유형의 부피는 독립적으로 가변적이다. 일부 구현예에서, 하나 이상의 뱃치가 원하는 부피의 세정 용액에 도달하는데 필요할 수 있다.
세정 단계(들)가 완료된 후, 핵산 물질은 용리 단계에서 필터로부터 용리된다. 물질을 용리하기 위해, 일정 부피의 용리 용액을 제 1 구획 140 에 첨가하고, 압력 구배를 적용하고, 용리된 물질을 그것이 제 2 개구 150 에서 떠날 때 수집한다. 일부 구현예에서, 용리 용액은 수 초 동안 또는 수십초 동안 또는 1 분 이상, 예컨대 5 또는 10 분 이상 압력 구배 적용 이전에 필터 접촉이 허용된다. 일부 구현예에서, 사용된 용리 용액의 부피는 약 20-60 ㎕ 이다. 더 많은 희석 핵산 샘플이 허용가능한 경우 더 큰 부피가 이용될 수 있다. 일부 구현예에서, 예를 들어 실시예에 기재된 바와 같이, 용리 용액 부피는 30-50 ㎕ 이다. 일부 구현예에서, 용리 용액이 통과된 후, 비혼화성 유체 푸쉬 용액이 제 1 구획 140 에 첨가되고, 필터를 통과해 임의의 잔류 용리 용액을 밀어 내어 수집된다. 잔류 용리 용액을 밀어 내기 위한 비혼화성 유체 푸쉬 용액의 이러한 용도는 수집된 정제된 핵산 양이 최대화되는 구현예에서 유용하다. 예를 들어, 용리 용액 부피가 50 ㎕ 이고 10 ㎕ 의 용리액이 후속의 프로세싱 단계에 있어 충분한 경우, 이때 비혼화성 유체 푸쉬 용액은 필수적인 것이 아닐 수 있으나, 더 큰 부피, 예를 들어 25 ㎕ 의 용리액이 요망된다면, 이때 비혼화성 유체 푸쉬 용액이 유익할 수 있다.
용리 단계의 다른 구현예에서, 물질을 용리하기 위해, 일정 부피의 용리 용액이 제 1 구획 140 에 첨가되고, 이어서 일정 부피의 비혼화성 유체 푸쉬 용액이 용리 용액 위에 층을 이루고, 이후 압력 구배가 적용된다. 부가적인 비혼화성 유체 푸쉬 용액은 수성-기반 용리 용액이 필터를 밀치고 나아가는 것을 도우며, 필터 내 잔류의 용리 용액의 정체를 막는 것을 돕는다. 비혼화성 유체 푸쉬 용액의 부피는 용리 용액의 부피의 0.5 내지 2 배, 바람직하게 1 내지 1.5 배이다.
DNA 또는 RNA 정제 방법의 한 구현예에서, DNA 또는 RNA 를 함유하는 용액은 유리 마이크로파이버 필터를 통과해 DNA 또는 RNA 를 마이크로파이버 상에 흡착시키고, 필터는 일정 부피의 비혼화성 유체 세정 용액 (예, 실리콘 오일) 로 세정되고, 이후 용리 용액 (예, 물) 이 필터를 통과해 DNA 또는 RNA 를 수집관 내로 용리시킨다. 임의로는, 비혼화성 유체 푸쉬 용액이 또한 상기 기재된 구현예들 중 임의의 것에 따른 용리 단계에 이용된다.
DNA 정제 방법의 한 구현예는 DNA 를 함유하는 용액을 유리 마이크로파이버 필터를 통과시켜 DNA 를 마이크로파이버 상에 흡착시키고, 그 필터를 알코올-기반 세정 용액 (예, 10 mM Tris/100 mM NaCl 용액 중 50% 에탄올) 로 세정하고, 그 필터를 비혼화성 유체 세정 용액 (예, 실리콘 오일) 로 세정한 다음 흡착된 DNA 를 용리 용액 (예, 10 mM Tris (pH 9.0) 용액) 으로 수집관 내로 용리시키는 것을 포함한다. 임의로는, 비혼화성 유체 푸쉬 용액은 또한 임의의 상기 기재된 구현예에 따른 용리 단계에 이용된다.
RNA 정제 방법의 한 구현예는 RNA 를 함유하는 용액을 유리 마이크로파이버 필터를 통과시켜 RNA 를 마이크로파이버 상에 흡착시키고, 그 필터를 비혼화성 유체 세정 용액 (예, 실리콘 오일) 로 세정하고, 그 필터를 알코올-기반 세정 용액 (예, 10 mM Tris/100 mM NaCl 용액 중 50% 에탄올) 로 세정하고, 필터를 비혼화성 유체 세정 용액 (예, 실리콘 오일) 로 세정한 다음 흡착된 RNA 를 용리 용액 (예, RNase-부재 물) 로 수집관 내로 용리시키는 것을 포함한다. 임의로는 비혼화성 유체 푸쉬 용액이 또한 상기 기재된 구현예 중 임의의 구현예에 따른 용리 단계에 이용된다.
다양한 용액이 이용자의 편의를 위해 키트로서 전체로든 부분으로든 함께 제공될 수 있다. 키트는 낱개의 병에 든 시약으로서 하기의 용액 중 하나, 일부 또는 전부를 포함할 수 있다: 비혼화성 유체 세정 용액, 알코올-기반 세정 용액, 용리 용액 및 비혼화성 유체 푸쉬 용액. 바람직한 구현예에서, 키트는 비혼화성 유체 세정 용액 및 용리 용액을 포함한다. 또 다른 바람직한 구현예에서, 키트는 비혼화성 유체 세정 용액, 알코올-기반 세정 용액 및 용리 용액을 포함한다. 또 다른 바람직한 구현예에서, 키트는 비혼화성 유체 세정 용액, 알코올-기반 세정 용액, 용리 용액, 및 비혼화성 유체 푸쉬 용액을 포함한다. 일부 구현예에서, 동일 시약이 비혼화성 유체 세정 용액과 비혼화성 유체 푸쉬 용액 양자 모두로서 이용될 수 있다. 시약은 용기의 주어진 시스템 및 유형에 맞는 1 내지 25 가지의 정제 조작을 실시하기에 충분한 부피로 제공될 수 있다. 더 큰 부피가 또한 고려되며, 이는 당해 방법이 자동화 장치에 의해 수행되는 경우 바람직할 수 있다.
일부 구현예에서, 시약은 농축 용액으로서, 예를 들어 10x 용액으로서 제공되어 사용 전에 희석되어질 수 있다. 일부 구현예에서, 시약은 고체 성분으로서, 예를 들어 동결건조된 분말로서 제공되어, 사용 전 용액을 위한 액체 성분(들)의 첨가에 의해 재구성될 수 있다. 용액의 희석 또는 재구성용 액체 성분이 또한 키트에 제공될 수 있다. 전형적으로, 희석 또는 재구성을 위한 액체는 물이고, 이는 상기 기재된 바와 같이 적용에 적합한 순도를 갖는다.
키트는 본 발명의 방법에 따른 시약 이용 지시가 첨부된 문헌을 추가로 포함할 수 있다.
상기 구현예들 중 임의의 구현예에서, 키트는 필터를 갖춘 용기를 추가로 포함할 수 있다.
실시예
실시예 1. 필터 소자
필터 소자를, 실린더형 폴리프로필렌 카트리지에 지지 골형 (supporting ribbed) 구조 위 Whatman 유리 마이크로파이버 필터, 등급 GF/B (Whatman, GE Healthcare Life Sciences, Piscataway, NJ) 을 핏팅함으로써 제조하였다. Whatman 필터를 카트리지의 내부 직경 (6.0 mm) 보다 약간 크게 컷팅하고 지지 구조에 맞대게 압입시켰다.
실시예 2. 인간 혈장으로부터 HIV RNA 의 정제
이 실시예에서, 10 종의 비혼화성 유체를, 인간 혈장으로부터의 RNA 의 정제를 위한 비혼화성 세정 용액으로서의 용도에 대해 시험하였다.
HIV 에 대해 음성인 인간 혈장에 HIV-양성 인간 혈장 (Acrometrix OptiQual HIV-1 High Control) 을 부가해 1 mL 당 1000 개의 HIV 입자를 함유하는 인간 혈장 샘플을 제공하였다. 티오글리세롤 K4 분해 버퍼를, 220 ㎕ 1-티오글리세롤 (10 ㎕/mL) 를 21.8 mL K4 분해 버퍼 (4 M 구아니디늄 티오시아네이트, 770 mM 칼륨 아세테이트, 0.78% (w/v) N-라우릴 사르코신, 0.05 M Bis-Tris (pH 6.4)) 에 첨가함으로써 사용하기 직전에 제조하였다.
샘플 (1.0 mL) 을 5 mL 튜브로 분취하고 (aliquoted), 이것에 1.8 mL 티오글리세롤-처리 K4 분해 버퍼를 첨가하고, 용액을 보르텍싱에 의해 혼합했다. 담체 RNA 을 첨가하고 (5 ㎕ 의 10 mg/mL 의 PolyA (Sigma Aldrich, St. Louis, MO)) 용액을 보르텍싱에 의해 혼합했다. 샘플 용액을 10 분 동안 56℃ 에서 인큐베이션 후, 절대 이소프로판올 (1.9 mL) 을 첨가하고, 용액을 보르텍싱에 의해 혼합했다.
용액을 실시예 1 에 따라 제조된 필터 소자에 700 ㎕ 분량으로 옮겼다. 각 용액 분량을 필터 위 액체에 압력을 가해 (~40 kPa) 필터를 통과시키고, 모든 샘플이 필터를 통과할 때까지 프로세스를 반복하여, RNA 를 필터 상에 흡착시켰다.
이어서, 300 ㎕ 의 세정 용액을 필터 위에 첨가하고 이 용액 위에 압력을 가해 필터를 통과시킴으로써 하기 표에 나타낸 비혼화성 유체 세정 용액 중 하나로 각 필터를 세정하였다.
표 1.
이어서, 필터를 알코올-기반 세정 용액으로 세정했다. 수성 에탄올 용액 (70% 에탄올, 700 ㎕) 을 필터 위에 첨가하고, 압력을 가해 필터를 통과시키고, 이 세정 프로세스를 한번 더 반복했다.
필터를 동일 비혼화성 유체 세정 용액을 동량 이용해 다시 세정했다. 이 비혼화성 유체 세정 용액을 이용한 제 2 세정 후, 카트리지를 새 0.5 mL 원심분리관 위 위치시켰다. 물의 용리 용액 (50 ㎕) 을 필터 위에 첨가해 필터와 30 초간 접촉되게 정치시킨 다음, 물 위의 공간에 압력을 가해 필터를 통과시켜 흡착된 핵산을 새 튜브 내로 용리시켰다.
두 종의 대조군을 또한 비교 목적을 위해 제조했다. 먼저, HIV 에 대해 음성인 인간 혈장을, 혈장에 HIV 를 부가하지 않은 채 샘플로서 프로세싱하고 (표적 부재 대조군), 제 2 의 HIV-양성 샘플을 비혼화성 세정 용액으로의 임의 세정을 포함하지 않은 채 프로세싱했다 (비혼화성 세정 부재 대조군).
실시예 3. RT-PCR 에 의한 HIV 샘플의 분석
HIV RNA 검출용 프라이머를 하기의 서열로 합성하고 1-단계 RT-PCR 반응에 이용했다:
SEQ ID NO:1 (전방향 프라이머) 5'-AGTTGGAGACATCAAGCAGCCATGCAAAT
SEQ ID NO:2 (역방향 프라이머) 5'-TGATATGTCAGTTCCCCTTGGTTCTCT.
전방향 프라이머는 HIV RNA 표적에 기반한 cDNA 의 형성을 프라이밍 (prime) 하고, 역방향 프라이머는 프라이머 쌍으로서 작동해 cDNA 가닥 기반의 DNA 생성물을 증폭시킨다. 기대되는 DNA 생성물은 155 bp 이다.
하기를 함유하는 프라이머 프리-믹스 (pre-mix) 용액을 제조했다: 1x SensiFAST™ SYBR No-ROX One-Step 믹스 (Bioline USA, Taunton, MA), 0.6 ㎛ 전방향 프라이머, 0.346 ㎛ 역방향 프라이머, 10U/㎕ RNAse 저해제, 및 0.25 ㎕ 역 전사효소 용액 (25 ㎕ 샘플 당). RT-PCR 반응 용액을, 실시예 2 에 따라 정제된 샘플 (10 ㎕) 과 프라이머 프리-믹스 용액 (15 ㎕) 을 조합함으로써 제조했다. 각 샘플을 RT-PCR 로 중복하여 분석했다. RT-PCR 분석에서 HIV 의 이론적 양은 200 카피/샘플이다.
RT-PCR 분석을, 하기와 같이 SmartCycler® SC1000-1 (Sunnyvale, CA) 에서 수행했다.
RT 단계: 900 초 동안 45℃, 및 120 초 동안 95℃;
PCR 단계: 5 초 동안 95℃, 5 초 동안 61℃, 및 10 초 동안 72℃ 의 40 싸이클.
용융 곡선을, 열순환처리 완료 후 60℃ 에서 95℃ 까지 0.2℃/sec 의 온도 경사 동안 측정하였다.
2100 Bioanalyzer (Agilent Technologies, Santa Clara, CA) 을 이용한 전기 영동으로써 각 샘플의 RT-PCR 생성물을 또한 분석했다.
도 2A-2B 는 성장 곡선을 나타내고, 도 3A-3B 는 10 개의 샘플 (10 개의 상이한 비혼화성 세정 용액으로 세정하여 정제됨) 및 2 개의 대조군의 RT-PCR 증폭 동안 SmartCycler® 에서 측정된 용융 피크 그래프를 나타낸다.
보여지는 바와 같이, 10 개의 샘플 (중복 분석) 각각은 예상되는 생성물을 수득했다. 각 샘플에 대한 싸이클 임계값 (Ct) 은, 샘플 중 8 종에 있어서 약 32 (표 2 참조) 인 것으로 관찰되었다. 각 세정에 대한 유사한 Ct 값이란, 각 비혼화성 세정 용액이 PCR 저해제 제거에 유사하게 효율적이며, 전체적으로 정제 프로토콜이 유사량의 정제된 RNA 표적을 전달할 수 있었음을 지시한다. 두 샘플 (대두 오일 및 올리브 오일) 은 더 높은 Ct 값을 보였는데, 이는 이들 유체가 약간의 저해를 야기한다는 점을 제시한다. 이 정도의 저해가 상당한지에 대해서는 본 출원의 필요성 및 목적에 따라 다르다. "비혼화성 세정 부재" 대조군은 음성이었다; 증폭 생성물이 관찰되지 않았고, 즉 PCR 저해제가 핵산의 필터로의 흡착, 알코올 세정 용액으로의 세정 및 물로의 용리에 의해서 적절히 제거되지 않았음을 지시한다. "표적 부재" 대조군은 음성이었고, 이는 임의 오염의 부재를 지시한다.
표 2.
도 3A-3B 에 나타낸 용융 곡선은 10 개의 샘플에 있어서 약 83-84℃ 에서 하나의 피크를 나타내는 반면, 두 개의 대조군은 피크가 없고, 이는 상기 샘플들이 이중가닥 증폭 생성물을 함유한다는 점을 지시하는 반면 대조군 반응은 그렇지 않음을 지시한다.
도 4A-4B 는 상기 동일한 샘플 및 대조군에 대한 전기영동도를 나타낸다. 약 58 초에서의 피크는 155 bp 증폭 생성물에 상응하고, 약 41 초 및 110 초에서의 피크는 분자 크기 마커이다. 결과의 유사성은 RT-PCR 반응이 예상되는 증폭 생성물을 정제된 샘플 내 다른 비특이적 증폭 반응 없이 재현적으로 산출했음을 확인시킨다.
실시예 4. 인간 혈장으로부터 HBV DNA 의 정제
이 실시예에서는, DNA 샘플 제조를 위한 시판 키트, QuickGene DNA 전혈 키트 S (Fujifilm Corp.) 로부터의 시약과 함께 인간 혈장으로부터 DNA 를 정제하는 것에 대해, 4 종의 상이한 부피의 비혼화성 유체 세정 용액을 비교했다.
HBV 에 대해 음성인 인간 혈장에 HBV-양성 인간 혈장 (Acrometrix OptiQual HBV High Positive Control) 을 부가해, 1 mL 당 28,150 HBV 입자를 함유하는 인간 혈장 샘플을 제공하였다.
QuickGene DB-S 프로테아제 용액 (EDB) (150 ㎕) 을, 5 mL 원뿔형 튜브 바닥에 놓은 다음 상기 부가된 HBV 샘플 (1.0 mL) 을 튜브에 분취하였다. QuickGene DB-S 분해 버퍼 (LDB) (1.25 mL) 를 각 튜브에 첨가하고, 혼합물을 즉시 피펫으로써 혼합하고, 보르텍싱하고 2 분 동안 56℃ 에서 인큐베이션하였다. 절대 에탄올 (1.25 mL) 을 첨가하고, 용액을 보르텍싱으로 혼합했다.
용액을 600 ㎕ 분량으로 실시예 1 에 따라 제조된 필터 소자에 옮겼다. 각 용액 분량을, 필터 위 액체에 압력을 가해 (~40 kPa) 필터에 통과되게 하고, 프로세스를 모든 샘플이 필터를 통과하여 DNA 가 그에 흡착될 때까지 반복했다.
이어서, DNA 가 흡착되어 있는 각 필터를 QuickGene DB-S 알코올-기반 세정 버퍼 (WDB) (750 ㎕) 로 3 회 세정했다. 다음으로, 각 필터를 1 회 비혼화성 유체 세정 용액인, 실리콘 유체 (5 cSt) 로, 50 ㎕, 100 ㎕, 300 ㎕, 또는 750 ㎕ 의 상기 세정 용액을 필터 위에 첨가하고, 그 용액에 압력을 가해 필터를 통과시켜 세정했다.
비혼화성 유체 세정 용액으로의 상기 세정 후, 카트리지를 깨끗한 0.5 mL 원심분리관 위에 위치시켰다. QuickGene DB-S 용리 버퍼 (50 ㎕) 를 필터 위에 첨가하고, 30 초간 필터와 접촉된 채 정치시킨 후, 용액 위 공간의 가압에 의해 필터를 통과시켜, 흡착된 핵산을 깨끗한 튜브 내로 용리시켰다.
2 종의 대조군을 또한 비교 목적으로 제조했다. 먼저, HBV 에 대해 음성인 인간 혈장을, 그 혈장에 HBV 를 부가하지 않은 샘플로서 프로세싱하고 (표적 부재 대조군), 두번째로, HBV-양성 샘플을 프로세싱하고 필터에 흡착시켰으나, 이 필터를 비혼화성 유체 세정 용액으로 세정하지 않았다 ("비혼화성 유체 세정 부재" 대조군).
실시예 5. PCR 에 의한 HBV 샘플의 분석
HBV DNA 검출용 프라이머를, 하기의 서열로 합성하고 PCR 반응에 이용했다:
SEQ ID NO:3 (전방향 프라이머) 5'-GACCACCAAATGCCCCTAT
SEQ ID NO:4 (역방향 프라이머) 5'-TGAGATCTTCTGCGACG.
전방향 및 역방향 프라이머는 프라이머 쌍으로 작동하여 132 bp 서열의 HBV DNA 표적을 증폭시켰다.
하기를 함유하는 프라이머 프리-믹스 용액을 제조했다: 1x SensiFAST™ SYBR No-ROX Kit (Bioline USA, Taunton, MA), 0.4 ㎛ 전방향 프라이머, 및 0.4 ㎛ 역방향 프라이머 (25 ㎕ 샘플 당). PCR 반응 용액을, 실시예 4 에 따라 정제된 샘플 (10 ㎕) 과 프라이머 프리-믹스 용액 (15 ㎕) 을 조합하여 제조했다. 각 샘플을 PCR 로써 중복하여 분석했다. RT-PCR 분석에서 HBV 의 이론적 양은 5630 카피/샘플이다.
PCR 분석을 하기와 같이 SmartCycler® SC1000-1 (Cepheid, Sunnyvale, CA) 에서 수행했다:
초기 변성: 120 초 동안 95℃;
PCR 단계: 5 초 동안 95℃, 10 초 동안 57℃, 및 15 초 동안 72℃ 의 40 싸이클.
용융 곡선을 열순환처리 완료 후 60℃ 에서 98℃ 까지 0.2℃/sec 의 온도 경사 동안 측정했다.
각 샘플의 PCR 생성물을 또한 2100 Bioanalyzer (Agilent Technologies, Santa Clara, CA) 를 이용한 전기영동에 의해 분석했다.
도 5 는 성장 곡선을 나타내고, 도 6 은 4 개의 샘플 (4 가지 상이한 부피의 비혼화성 유체 세정 용액으로 세정하여 정제됨) 및 2 개의 대조군의 PCR 증폭을 위한 SmartCycler® 에서 측정된 용융 피크 그래프를 나타낸다.
보이는 바와 같이, 4 개의 샘플 (중복 분석) 은 각각 예상되는 생성물을 수득하였다. 각 샘플에 대한 싸이클 임계값 (Ct) 은, 4 종의 샘플에 있어서 약 26 (표 2 참조) 인 것으로 관찰되었다. 각종 세정에 대한 유사한 Ct 값은, 각 비혼화성 세정 용액이 PCR 저해제 제거에 유사하게 효율적이며, 전체로서 정제 프로토콜은 유사량의 정제된 DNA 표적을 전달할 수 있었음을 지시한다. 증폭 생성물에 대한 용융 온도는 비혼화성 유체 세정액의 부피 증가와 더불어 약간 증가하는 것을 보인다.
그러나, 흡착된 DNA 샘플을 비혼화성 유체 세정 용액으로 세정하지 않는 경우, 어떠한 증폭 생성물도 수득되지 않는다. "비혼화성 유체 세정 부재" 대조군은 음성이며, 이는 PCR 저해제가 핵산을 필터에 흡착시키고, 시판의 세정 용액으로 세정한 다음 용리 버퍼로 용리하는 표준 프로토콜에 의해 적절하게 제거되지 않았음을 나타낸다. "표적 부재"대조군 중 하나는 소량의 비특이적 증폭 생성물을 나타내나, 그 밖에 음성 대조군은 음성적이었다.
표 3
도 7 은 동일한 샘플 및 대조군에 대한 전기영동도를 나타낸다. 약 58 초에서의 피크는 132 bp 증폭 생성물에 상응한다. 결과의 유사성은, PCR 반응이 정제된 샘플에서 비특이적 증폭 반응 없이 기대되는 증폭 생성물을 재현적으로 산출시킴을 확인시킨다.
실시예 6. 게놈 DNA 수집 효율
(1) 소결핵균 BCG gDNA 의 추출
2% Ogawa 배지 (S) (Kyokuto Pharmaceutical Industries) 에서 28 일 동안 인큐베이션한 소결핵균 BCG (Japanese Society for Bacteriology) 의 콜로니를 수집하고, 멸균수에서 현탁하고 오토클레이브 처리하였다 (20 분 동안 121℃). 다음으로, DNA 를 Qiagen's DNA Genomic-tip 추출-정제 키트를 이용해 정제했다. 카피수를 수득된 정제된 gDNA 의 흡광도를 측정함으로써 확인했다.
(2) 핵산 정제 카트리지에 의한 핵산 정제법
1.7 M 구아니딘 히드로클로라이드 (Wako Pure Chemical) 를 함유하는 40% 이소프로필 알코올 수성 용액 900 μL 중 2 μg 의 연어 정자 DNA (SIGMA) 및 소결핵균 BCG gDNA (3 × 103 의 카피수) 를 함유하는 샘플을 제조했다. 샘플을 실시예 1 에 따라 제조된 필터 소자에 옮기고, 필터 (6 kPa) 에 통과시켜 DNA 를 필터 상으로 흡착시켰다.
먼저 50 mM Tris-HCl (pH 8.0) (Wako Pure Chemical), 150 mM 염화나트륨 (Wako) 및 1% Tween 80 (Wako) 을 함유하는 50% 에탄올 수성 용액으로 이루어진 제 1 세정 용액 700 μL 를 필터에 통과시켜 필터를 세정했다.
이어서, 50 mM Tris-HCl (pH 8.0) (Wako Pure Chemical) 및 150 mM 염화나트륨 (Wako Pure Chemical) 을 함유하는 50 % 에탄올 수성 용액으로 이루어진 제 2 세정 용액 700 μL 로 필터를 세정했다. 다음으로, 실리콘 오일 (점도: 5 cs) (Shin-Etsu Chemical) 로 이루어진 제 1 비혼화성 유체 세정 용액 300 μL 를, 세정 용액 위 압력을 가해 (~25-100 kPa) 필터를 통과시켰다.
DNA 를 용리하기 위해, 먼저 30 μL 의 10 mM Tris-HCl (pH 8.0) (Wako Pure Chemical) 용리 용액을 카트리지에 첨가하고, 1 내지 5 분간 유리 마이크로파이버 필터와 접촉되게 한 다음, 실리콘 오일 (점도: 50 cs, Shin-Etsu Chemical) 로 이루어진 비혼화성 유체 푸쉬 용액 30 μL 를 용리 버퍼 위에 첨가하였다. 용리 용액 및 비혼화성 유체 푸쉬 용액을 그 용액들 위에 압력을 가해 (~25-100 kPa) 필터에 통과시켰다.
(3)
용리된 샘플의 부피 수율
이 실시예의 섹션 (2) 에 기재된 카트리지 정제 방법을 8 종의 샘플에 대해 수행하고, 용리에 의해 수집된 샘플 부피를 측정하였다. 비교로서, 섹션 (2) 의 정제법을 또한 비혼화성 유체 푸쉬 용액을 제외하고 수행했다. 그 결과를 표 4 에 나타낸다.
표 4.
표 4 에 나타낸 바와 같이, 비혼화성 유체 푸쉬 용액을 프로토콜에서 누락시켰을 때 수집된 용리액의 부피는 적고, 다양했다 (5 내지 10 μL). 데이타에 의해 예시되는 바, 비교 방법에서와 같이 오직 수성-기반 용리 용액만을 이용해, 하기 섹션 (4) 에 기재된 정량적 측정을 실행하면 원하는 양의 용리액, 적어도 12.5 μL 이 수득되지 않았다. 비혼화성 유체 세정 용액을 이용하면, 적어도 3 가지의 이점이 제공된다. 수집된 부피가 후속의 분석적 단계의 부피 요건을 충족하고, 용리된 부피가 보다 일관되어 자동화 및 데이타 분석에 도움이 되며, 초기 샘플에서의 핵산량이 보다 정확하게 측정될 수 있는데, 그 이유는 용리된 부피가 보다 거의 정량적이기 때문이다.
(4)
실시간 PCR 에 의한 용리된 샘플의 정량적 분석.
3 × 103 카피의 소결핵균 BCG gDNA 를 함유하는 4 종의 샘플 (900 ㎕) 을, 이 실시예의 섹션 (1) 및 (2) 의 프로토콜에 따라 제조 및 정제하고, 용리액 내 DNA 의 양을 SmartCycler® II (Cepheid) 를 이용하여 실시간 PCR 로써 측정했다.
소결핵균에서 삽입 서열 IS6110 을 측정하기 위한 프라이머를 하기의 서열로 합성했다:
SEQ ID NO:5 (전방향 프라이머) 5'-TGGGTAGCAGACCTCACCTAT
SEQ ID NO:6 (역방향 프라이머) 5'-AACGTCTTTCAGGTCGAGTACG
SEQ ID NO:7 (프로브) 5' FAM-TGGCCATCGTGGAAGCGACCCGC-TAMRA
FAM 은 형광 염료 플루오레세인이고, TAMRA 는 형광 염료 테트라메틸로다민이다. 전방향 및 역방향 프라이머는 프라이머 쌍으로서 작동해 IS6110 표적의 192 bp 서열을 증폭시킨다.
PCR 반응 용액을, (최종 농도): 1x Taq 버퍼 (TaKaRa), 3 mM MgCl2 (TaKaRa), 400 mM dNTP (TaKaRa), 1 단위의 TaKaRa Ex HS 폴리머라아제, 500 nM 전방향 프라이머, 500 nM 역방향 프라이머, 및 280 nM 의 프로브 올리고로 제조했다.
PCR 분석을, 하기와 같이 SmartCycler® II (Cepheid, Sunnyvale, CA) 에서 수행했다:
초기 변성: 60 초 동안 97℃;
PCR 단계: 6 초 동안 97℃, 6 초 동안 61℃ 및 6 초 동안 72℃ 의 40 싸이클.
프로브 올리고로부터 방출된 염료에 의해 생성된 형광을, 4 종의 샘플 각각에 대해 측정했다. SmartCycler® II 상 측정된 Ct 값을 표 5 에 나타낸다. 정제 프로토콜에서 용리액에서 수득된 gDNA 의 수율을, 또한 동일 농도의 gDNA (3 x 103 copies/900 ㎕) 로 제조된 대조군 샘플에 반하는 정량적 결과를 보정함으로써 측정했으나, 섹션 (3) 의 정제 프로토콜에 적용하지는 않았다. 중복 대조군 샘플에 대한 Ct 값은 28.44 및 28.92 였다. 평균, Ct = 28.68 가 100% 수율을 나타내는 것으로 간주된다. DNA 의 산출된 수율에 의해 증명되는 바와 같이, 본질적으로 gDNA 모두, 흡착되고 이어서 정제 프로세스에서 방출되었다.
표 5.
본 발명을 특정 구현예 및 적용에 대해 기재하였으나, 당업자는 본원에 개시된 본 발명의 적용 및 방법의 범위를 이해할 것이다.
SEQUENCE LISTING
<110> Wako Pure Chemical Industries, Ltd.
<120> Nucleic Acid Purification Method
<130> 5882897-0006
<140> PCT/US2015/025335
<141> 2015-04-10
<150> US 61/978,322
<151> 2014-04-11
<160> 7
<170> PatentIn version 3.5
<210> 1
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> primer
<400> 1
agttggagac atcaagcagc catgcaaat 29
<210> 2
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> primer
<400> 2
tgatatgtca gttccccttg gttctct 27
<210> 3
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> primer
<400> 3
gaccaccaaa tgcccctat 19
<210> 4
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<223> primer
<400> 4
tgagatcttc tgcgacg 17
<210> 5
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> primer
<400> 5
tgggtagcag acctcaccta t 21
<210> 6
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> primer
<400> 6
aacgtctttc aggtcgagta cg 22
<210> 7
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> probe
<400> 7
tggccatcgt ggaagcgacc cgc 23
Claims (16)
- 하기를 포함하는, 다중핵산의 정제 방법:
(a) 용기 내에 갖춰진 필터에 다중핵산을 흡수시킴;
(b) 제 1 비혼화성 유체 세정 용액으로 필터를 세정함; 및
(c) 수성-기반 용리 용액을 이용하여 필터로부터 다중핵산을 용리함,
이때, 정제된 다중핵산의 용액이 수득됨. - 제 1 항에 있어서, 추가로 하기를 포함하는 방법:
단계 (a) 이후 및 단계 (b) 이전에, 필터를 알코올-기반 세정 용액으로 세정함. - 제 1 항에 있어서, 추가로 하기를 포함하는 방법:
단계 (a) 이후 및 단계 (b) 이전에, 필터를 제 2 비혼화성 유체 세정 용액으로 세정한 다음 필터를 알코올-기반 세정 용액으로 세정함. - 제 1 항, 제 2 항 또는 제 3 항에 있어서, 다중핵산이 DNA 및/또는 RNA 인 방법.
- 제 1 항, 제 2 항 또는 제 3 항에 있어서, 추가로 하기를 포함하는 방법:
단계 (c) 에서, 다중핵산을 필터로부터 (i) 수성-기반 용리 용액 및 (ii) 비혼화성 유체 푸쉬 용액을 이용하여 용리함. - 제 1 항에 있어서, 필터가 유리 마이크로파이버 필터인 방법.
- 제 2 항에 있어서, 제 1 비혼화성 유체 세정 용액이 (i) 물과 접촉시 실질적으로 물로부터 분리된 상을 형성하고; (ii) 물의 비중 미만의 비중을 갖는 유체를 포함하는 방법.
- 제 7 항에 있어서, 제 1 비혼화성 유체 세정 용액의 비중이 방법에서 사용된 알코올-기반 세정 용액의 비중 미만인 방법.
- 제 2 항에 있어서, 알코올-기반 세정 용액이 에탄올 및 물을 포함하는 방법.
- 제 9 항에 있어서, 알코올-기반 세정 용액이 염 및/또는 버퍼를 추가로 포함하는 방법.
- 제 9 항에 있어서, 알코올-기반 세정 용액이 친수성 중합체를 추가로 포함하는 방법.
- 제 11 항에 있어서, 친수성 중합체가 폴리에틸렌 글리콜 중합체인 방법.
- 제 1 항에 있어서, 수성-기반 용리 용액이 버퍼를 포함하는 방법.
- 제 1 항에 있어서, 수성-기반 용리 용액이 DNase/RNase-부재의 물을 포함하는 방법.
- 비혼화성 유체 세정 용액 및 용리 용액을 포함하는 시약 키트.
- 제 15 항에 있어서, 알코올-기반 세정 용액을 추가로 포함하는 시약 키트.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201461978322P | 2014-04-11 | 2014-04-11 | |
| US61/978,322 | 2014-04-11 | ||
| PCT/US2015/025335 WO2015157650A1 (en) | 2014-04-11 | 2015-04-10 | Nucleic acid purification method |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20160138578A true KR20160138578A (ko) | 2016-12-05 |
Family
ID=53008879
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167031367A KR20160138578A (ko) | 2014-04-11 | 2015-04-10 | 핵산 정제 방법 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20170029810A1 (ko) |
| EP (1) | EP3129498B1 (ko) |
| JP (1) | JP6562389B2 (ko) |
| KR (1) | KR20160138578A (ko) |
| CN (1) | CN106164270A (ko) |
| ES (1) | ES2708205T3 (ko) |
| WO (1) | WO2015157650A1 (ko) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019093652A1 (ko) * | 2017-11-13 | 2019-05-16 | 고려대학교 산학협력단 | 타겟 물질을 추출하기 위한 추출 장치 |
| WO2019066363A3 (ko) * | 2017-09-27 | 2019-06-06 | 고려대학교 산학협력단 | 타겟 물질을 추출하기 위한 추출 장치, 추출 방법 및 추출 시스템 |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN111841677A (zh) * | 2014-11-21 | 2020-10-30 | 澳康姆生物实验室公司 | 用于收集核酸样本的系统和方法 |
| PL413551A1 (pl) * | 2015-08-18 | 2017-02-27 | Curiosity Diagnostics Spółka Z Ograniczoną Odpowiedzialnością | Sposób i system do izolacji kwasów nukleinowych |
| DE102017206155A1 (de) * | 2017-04-11 | 2018-10-11 | Robert Bosch Gmbh | Desorption von Nukleinsäuren |
| WO2020166980A2 (ko) * | 2019-02-14 | 2020-08-20 | 고려대학교 산학협력단 | 타겟 물질을 추출하기 위한 추출 장치, 추출 방법 및 유체 유동 칩 |
| GB2581489B (en) * | 2019-02-15 | 2021-02-24 | Revolugen Ltd | Purification method |
| JP7357063B2 (ja) | 2019-08-23 | 2023-10-05 | 富士フイルム株式会社 | ニューモシスチス・イロベチイ検出用プライマー対、これを用いたニューモシスチス・イロベチイの検出方法及びそのための試薬キット |
| CN110724633A (zh) * | 2019-11-11 | 2020-01-24 | 浙江汇泽医药科技有限公司 | 一种微量细胞核酸提取与扩增系统及工艺 |
| JPWO2021124960A1 (ko) | 2019-12-18 | 2021-06-24 |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2170604C (en) * | 1993-08-30 | 2007-03-13 | Vikas V. Padhye | Nucleic acid purification compositions and methods |
| JP4025399B2 (ja) * | 1997-10-28 | 2007-12-19 | 株式会社日立製作所 | 核酸の回収方法及び装置 |
| WO2001062976A1 (en) * | 2000-02-23 | 2001-08-30 | Wen Shao | Rapid nucleic acid separation, isolation and purification methods |
| US6706858B2 (en) * | 2001-05-11 | 2004-03-16 | Qiagen Gmbh | Use of alkanes for contamination-free purification or separation of biopolymers |
| EP3006934B1 (en) * | 2008-08-01 | 2017-02-01 | BioVentures, Inc., | Device for the purification, isolation, desalting or buffer/solvent exchange of substances |
| MX2012001236A (es) * | 2009-08-04 | 2012-03-16 | Du Pont | Proceso y dispositivo para recolectar acidos nucleicos de microorganismos de una muestra en particulas. |
| ES2617778T3 (es) * | 2010-09-02 | 2017-06-19 | Qiagen Gmbh | Método para aislar un ácido nucleico diana que incluye ácidos nucleicos diana pequeños, con alto rendimiento |
| CN101935648B (zh) * | 2010-09-13 | 2013-04-17 | 原平皓(天津)生物技术有限公司 | 一种提取rna的方法和试剂盒 |
| WO2012155072A2 (en) * | 2011-05-12 | 2012-11-15 | Exact Sciences Corporation | Isolation of nucleic acids |
| JP6278568B2 (ja) * | 2011-12-06 | 2018-02-14 | キアゲン ゲゼルシャフト ミット ベシュレンクテル ハフツング | 多相混合物からの生体分子を含む水相の回収 |
| GB2501238B (en) * | 2012-03-16 | 2018-10-24 | Cambridge Entpr Ltd | Methods for obtaining liquid from a solid phase |
-
2015
- 2015-04-10 ES ES15719064T patent/ES2708205T3/es active Active
- 2015-04-10 CN CN201580019186.8A patent/CN106164270A/zh active Pending
- 2015-04-10 JP JP2017504620A patent/JP6562389B2/ja active Active
- 2015-04-10 WO PCT/US2015/025335 patent/WO2015157650A1/en active Application Filing
- 2015-04-10 KR KR1020167031367A patent/KR20160138578A/ko unknown
- 2015-04-10 US US15/303,062 patent/US20170029810A1/en not_active Abandoned
- 2015-04-10 EP EP15719064.6A patent/EP3129498B1/en not_active Not-in-force
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019066363A3 (ko) * | 2017-09-27 | 2019-06-06 | 고려대학교 산학협력단 | 타겟 물질을 추출하기 위한 추출 장치, 추출 방법 및 추출 시스템 |
| WO2019093652A1 (ko) * | 2017-11-13 | 2019-05-16 | 고려대학교 산학협력단 | 타겟 물질을 추출하기 위한 추출 장치 |
Also Published As
| Publication number | Publication date |
|---|---|
| ES2708205T3 (es) | 2019-04-09 |
| US20170029810A1 (en) | 2017-02-02 |
| EP3129498A1 (en) | 2017-02-15 |
| CN106164270A (zh) | 2016-11-23 |
| WO2015157650A1 (en) | 2015-10-15 |
| JP2017510305A (ja) | 2017-04-13 |
| JP6562389B2 (ja) | 2019-08-21 |
| EP3129498B1 (en) | 2018-12-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20160138578A (ko) | 핵산 정제 방법 | |
| AU745126B2 (en) | Nucleic acid archiving | |
| US10717976B2 (en) | Nucleic acid purification | |
| KR101193765B1 (ko) | 초고속 핵산의 정제방법 | |
| JP4435787B2 (ja) | タンパク質を変性させるための処方物および方法 | |
| JP2008054660A (ja) | 核酸を単離するためのろ過装置 | |
| US10683496B2 (en) | Method and apparatus for isolating nucleic acids | |
| WO2011157678A1 (en) | Method for determination of target cells or tissue for extraction of biomolecules from fixed biological samples | |
| US9169479B2 (en) | Microfluidic device-based nucleic acid purification method | |
| JP2006311803A (ja) | 核酸精製方法、及び核酸精製器具 | |
| US20040126796A1 (en) | Extraction of DNA from biological samples | |
| US10668417B2 (en) | Device having a filter layer and method for extracting nucleic acids from formalin-fixed and paraffin-embedded samples | |
| AU2012220825A1 (en) | Microfluidic device-based nucleic acid purification method | |
| EP2479274A1 (en) | Nucleic acid purification | |
| Thatcher | Nucleic acid isolation | |
| JP2012019723A (ja) | 微生物の回収方法、及び微生物由来dnaの精製方法 | |
| US20230383281A1 (en) | Filtration methods and devices for fast nucleic acid extraction |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| N231 | Notification of change of applicant |