KR20160096640A - 기질 세포 유래 인자-1의 프로테아제-내성 돌연변이를 사용한 조직 손상의 복구 방법 - Google Patents
기질 세포 유래 인자-1의 프로테아제-내성 돌연변이를 사용한 조직 손상의 복구 방법 Download PDFInfo
- Publication number
- KR20160096640A KR20160096640A KR1020167017818A KR20167017818A KR20160096640A KR 20160096640 A KR20160096640 A KR 20160096640A KR 1020167017818 A KR1020167017818 A KR 1020167017818A KR 20167017818 A KR20167017818 A KR 20167017818A KR 20160096640 A KR20160096640 A KR 20160096640A
- Authority
- KR
- South Korea
- Prior art keywords
- sdf
- disease
- peptide
- msdf
- lys
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/195—Chemokines, e.g. RANTES
-
- A61K47/48369—
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/28—Bone marrow; Haematopoietic stem cells; Mesenchymal stem cells of any origin, e.g. adipose-derived stem cells
-
- A61K47/48415—
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/6811—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a protein or peptide, e.g. transferrin or bleomycin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Chemical & Material Sciences (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Zoology (AREA)
- Gastroenterology & Hepatology (AREA)
- Cardiology (AREA)
- Dermatology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Heart & Thoracic Surgery (AREA)
- Diabetes (AREA)
- Molecular Biology (AREA)
- Developmental Biology & Embryology (AREA)
- Cell Biology (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Virology (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- Obesity (AREA)
- Hospice & Palliative Care (AREA)
- Rheumatology (AREA)
- Endocrinology (AREA)
- Emergency Medicine (AREA)
- Vascular Medicine (AREA)
- Pain & Pain Management (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
본 발명은 기질 세포 유래 인자-1 (SDF-1) 펩티드 또는 프로테아제 소화에 내성을 갖도록 돌연변이되었지만, 화학유인물질 활성을 유지하는 돌연변이 SDF-1 펩티드를 포함하는 조성물 (예를 들어, 단리된 펩티드 조성물 또는 이러한 펩티드를 발현하는 줄기 세포)의 정맥내 투여를 사용하여 조직 손상을 치료 또는 개선하는 방법을 특징으로 한다.
Description
전반적으로, 본 발명은 SDF-1 또는 기질 세포 유래 인자-1 (SDF-1)의 프로테아제-내성 돌연변이를 사용하여 조직 손상을 복구하는 방법에 관한 것이다.
SDF-1 (CXCL12로도 알려짐)은 휴지기 T-림프구, 단핵구 및 CD34+ 줄기 세포에 대한 화학유인물질인 케모카인 족의 68 아미노산 구성원이다. SDF-1은 다수의 형태로 생성된다: 차별 mRNA 스플라이싱의 결과인, SDF-1α (CXCL12a), SDF-1β (CXCL12b) 및 SDF-1γ. SDF-1α 및 SDF-1β의 서열은 SDF-1β가 C-말단에서 네 아미노산 (Arg-Phe-Lys-Met)에 의해 연장된 것을 제외하고는, 본질적으로 동일하다. SDF-1γ의 처음 세 엑손은 SDF-1α 및 SDF-1β의 엑손과 동일하다. SDF-1γ의 네 번째 엑손은 SDF-1 유전자자리 상의 세 번째 엑손으로부터 3200 염기쌍 아래에 위치하고, SDF-1β의 세 번째 엑손 및 네 번째 엑손 사이에 놓인다. SDF-1은 활성 펩티드를 만들도록 분해된 시그널 펩티드 (21 아미노산 길이)로 초기에 만들어진다.
SDF-1은 배아발달 동안 및 줄기 세포 이식 후에 골수로의 조혈 줄기 세포의 귀소에서 중요한 역할을 한다. 줄기 세포 귀소에서의 이의 역할에 추가로, SDF-1은 심장발생 및 혈관형성에서도 중요하다. SDF-1-결핍 생쥐는 출생전후기에 죽고, 심장의 심실중격 형성, 골수 조혈 및 기관-특화(organ-specific) 혈관형성에 결함을 갖는다. 비정상적으로 낮은 수준의 SDF-1은 당뇨 환자와 관련된 손상된 상처 치유에 적어도 부분적으로 원인이 된다는 것과 손상이 조직 손상 부위에서의 SDF-1 투여에 의해 회복될 수 있다는 것이 또한 보고되었다.
정상적인 성인 심장에서, SDF-1은 구성적으로 발현되나, 발현은 심근경색증 후 수일 내로 하향조절된다. SDF-1 발현은 G-CSF 요법과 병용되어, SDF-1을 과다발현하면서 안정하게 형질감염된 심장 섬유모세포의 심근내 이식에 의한 심근경색증 8 주 후에 증가한 것이 이미 보여졌다. 이 방법은 보다 많은 골수 줄기 세포 (c-키트 또는 CD34+) 및 심장에서의 상피 세포와 관련되어 있고, 혈관 밀도의 증가 및 좌심실 기능의 향상을 야기시켰다. 이러한 연구는 자연-발생적인 심근 복구 과정의 부족이 부분적으로 부적절한 SDF-1 이용가능성 때문일 수 있다는 것을 시사한다. 따라서, 심근경색증 후에 제어된 방식에서의 SDF-1의 전달은 더 많은 선조 세포를 유인하고, 그렇게 함으로써 조직 복구를 촉진할 수 있다.
기술분야에는 상처 치유 및 조직 복구를 촉진하는 개선된 방법에 대한 필요가 존재한다.
SDF-1은 조혈 줄기 세포의 귀소와 심장발생 및 혈관형성과 관련된다. 이의 줄기 세포 동원 및 상처 치유 효과를 촉진하기 위하여, SDF-1의 국부 구배는 선조 세포 유인 및 혈관재형성과 복구를 촉진하는 데 필요로 하는 것으로 여겨진다. 우리는 SDF-1의 전신 전달 및 구체적으로 정맥내 ("IV") 전달 및 프로테아제 내성 SDF-1 돌연변이가 조직 손상의 치료에 매우 효과적이라는 것을 발견했고, 이는 SDF-1의 국부 구배에 대한 요건을 고려하면 놀라운 결과다. IV 전달은 다른 경로의 투여와 비교하여 전달이 쉬운 점을 포함하나 이에 제한되지 않는, 많은 임상적 장점이 있다. 또한, 우리는 SDF-1 또는 돌연변이 SDF-1 펩티드의 정맥내 투여의 조직 손상 사건 (예를 들어, 심근경색증) 후 수 분 내지 조직 손상 (예를 들어, 심장 조직 손상, 혈관 조직 손상, 또는 상처, 상해, 또는 질병으로부터의 조직 손상)의 시작 후 수 시간, 수 일, 수 주, 또는 수 개월까지의 어디엔가의 지연된 투여가 혈관재형성 및 복구를 촉진하는 데 또한 효과적이라는 것을 발견하였다. 여기서 또한, 지연 기간 후 조성물의 효능에 대한 우리의 발견은 일부 상태 및 질병에서 조직 손상의 급성을 고려할 때 예상치 못한 발견이다.
그리하여, 본 발명은 SDF-1 및 이의 화학유인물질로서 작용하는 능력을 보존하지만, 프로테아제, 특히 매트릭스 금속단백분해효소-2 (MMP-2), 매트릭스 금속단백분해효소-9 (MMP-9), 디펩티딜 펩티드분해효소 IV (DPPIV/CD26), 백혈구 엘라스타아제, 카텝신 G, 카르복시펩티드분해효소 M 및 카르복시펩티드분해효소 N에 의한 불활성에 내성이 있게 만드는 방식으로 돌연변이된 돌연변이 SDF-1 펩티드를 포함하는 조성물의 정맥내 투여를 특징으로 한다. 본 발명의 방법은 예를 들어, 말초혈관병 (말초동맥병 (PAD) 또는 말초동맥폐쇄병 (PAOD)으로도 알려진 PVD); 위장관 또는 다른 곳에서의 궤양; 사고, 수술, 또는 질병으로부터 기인하는 상처; 만성심장기능상실; 조직 손상; 또는 심근경색증이나 다른 심혈관 사건의 결과로서 손상된 심장 조직의 치료에 유용할 수 있다. 본 발명의 방법은 상처, 궤양, 또는 당뇨 환자에서 병변에 의해 야기된 조직 손상의 가능성을 줄이거나 치료하는 데 또한 유용할 수 있다. 추가로, 본 발명의 방법은 기관 (예를 들어 질병 또는 상해로부터 기인하는 콩팥 또는 간과 같은)의 재생 또는 복구, CNS 상해의 복구 및 염증 질병 (예를 들어, 류마티스 관절염, 크론병, 또는 이식편대숙주병)으로부터 기인하는 상해의 복구에 유용할 수 있다.
한 측면에서, 본 발명은 단리된 SDF-1 또는 돌연변이 SDF-1 (mSDF-1), mSDF-1-Yz, Xp-mSDF-1, 또는 Xp-mSDF-1-Yz의 화학식을 갖는 SDF-1 펩티드의 돌연변이 형태를 포함하는 조성물 또는 발현하는 줄기 세포의 정맥내 투여에 의해 이를 필요로 하는 대상에서 조직 손상 (예를 들어, 질병 또는 상태로부터 기인하는 조직 손상)을 치료 또는 개선하는 방법을 특징으로 한다. SDF-1은 서열번호 53의 적어도 아미노산 1-8의 아미노산 서열을 갖는 펩티드이고, 이는 서열번호 53의 남아있는 서열의 모든 또는 임의의 부분에 의하여 C-말단에서 임의적으로 연장될 수 있고, 서열번호 53은 아미노산 서열:
K P X3 X4 X5 X6 Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 53), (여기서 X3, X4, X5 및 X6은 임의의 아미노산임)을 포함하고,
a) Xp는 단백질성 아미노산(들) 또는 프로테아제 방어 유기 군이고, p는 1 내지 4의 임의의 정수이고,
b) Yz는 단백질성 아미노산(들) 또는 프로테아제 방어 유기 군이고, z는 1 내지 4의 임의의 정수이고,
c) mSDF-1 또는 mSDF-1-Yz는 T 세포에 대한 화학유인물질 활성을 유지하고, 천연 SDF-1의 불활성의 속도보다 적어도 50 % 미만인 속도에서 매트릭스 금속단백분해효소-2 (MMP-2), 매트릭스 금속단백분해효소-9 (MMP-9), 백혈구 엘라스타아제 및(또는) 카텝신 G에 의하여 불활성화되고,
d) Xp-mSDF-1 또는 Xp-mSDF-1-Yz는 T 세포에 대한 화학유인물질 활성을 유지하고, 천연 SDF-1이 불활성되는 속도보다 적어도 50 % 미만인 속도에서 디펩티딜 펩티드분해효소 IV (DPPIV)에 의하여 불활성화되고, 천연 SDF-1의 불활성의 속도보다 적어도 50 % 미만인 속도에서 MMP-2, MMP-9, 백혈구 엘라스타아제 및(또는) 카텝신 G에 의하여 불활성화되고,
SDF-1의 단리된 돌연변이 형태는 대상에서 조직 손상을 치료 또는 개선하기에 충분한 양으로 정맥내 투여된다.
한 특정 실시양태에서, SDF-1 펩티드의 단리된 돌연변이 형태는 서열번호 52의 적어도 아미노산 1-8의 아미노산 서열을 포함하지 않는다.
한 실시양태에서, X3은 발린, 히스티딘, 또는 시스테인이다. 또 다른 실시양태에서, X4는 세린 또는 발린이다. 또 다른 실시양태에서, X5는 류신, 프롤린, 트레오닌, 또는 발린이다. 또 다른 실시양태에서, X6은 세린, 시스테인, 또는 글라이신이다.
본 발명의 방법의 소정의 실시양태에서, 펩티드는 X가 세린 및 p가 1인, Xp-mSDF-1 펩티드 또는 Xp-mSDF-1-Yz 펩티드이다. 다른 실시양태에서, 펩티드는 Y가 세린 및 z가 1인, mSDF-1-Yz 펩티드 또는 Xp-mSDF-1-Yz 펩티드이다.
소정의 실시양태에서, Fc 펩티드의 첨가를 포함하여, C-말단 변형은 야생형 SDF-1을 포함하지만 이에 제한되지 않으면서, 본원에서 기재되는 임의의 SDF-1 펩티드에 만들어질 수 있다.
소정의 실시양태에서, SDF-1의 돌연변이 형태는 서열번호 63, 67, 또는 69로 나타낸 서열을 포함한다.
본 발명의 방법은 SDF-1은 A가 SDF-1의 단리된 돌연변이 형태이고, n이 0-3의 정수 (예를 들어, 1)이고, L이 3-9 아미노산의 링커 서열이고, Fc가 면역글로불린의 Fc 영역으로부터의 Fc 펩티드인, 화학식 A-(L)n-Fc를 갖는 융합 단백질인, SDF-1의 돌연변이 형태를 또한 특징으로 한다. 소정의 실시양태에서, L은 GGGGS (서열번호 66)이다. 소정의 실시양태에서, 융합 단백질은 생체적합성 펩티드 막을 형성할 수 있다.
소정의 실시양태에서, SDF-1의 돌연변이 형태는 줄기 세포, 예를 들어, 성체 줄기 세포, 중간엽 줄기 세포, 또는 중간엽 전구 세포에 의해 발현된다.
다른 실시양태에서, 돌연변이 SDF-1 펩티드를 발현하는 줄기 세포 또는 단리된 돌연변이 SDF-1 펩티드를 포함하는 조성물은 외인 줄기 세포, 예를 들어, 성체 줄기 세포, 중간엽 줄기 세포, 또는 중간엽 전구 세포와 함께 공동 투여된다. 외인 줄기 세포는 SDF-1-발현 줄기 세포 또는 SDF-1 펩티드 조성물의 투여와 동시에, 이전에 또는 이후에 투여될 수 있다.
본 발명의 임의의 실시양태에서, 치료되는 질병 또는 상태는 뇌졸중, 하지 허혈, 외상으로 인한 조직 손상, 심근경색증, 말초혈관병, 만성심장기능상실, 당뇨병, 상해 또는 질병으로 인한 CNS 손상, 또는 염증 상태로 인한 손상 (예를 들어, 류마티스 관절염, 크론병, 또는 이식편대숙주병)일 수 있다. 다르게는, 본 발명의 방법은 기관 재생 또는 복구 (예를 들어, 콩팥 또는 간 재생 또는 복구)에 사용될 수 있다.
본 발명의 임의의 실시양태에서, 손상된 조직은 심장 조직 또는 혈관 조직이다.
본 발명의 임의의 실시양태에서, SDF-1 또는 돌연변이 SDF-1 단백질 조성물 또는 발현하는 줄기 세포 조성물은 말초 정맥 (예를 들어, 팔에 있는 정맥, 다리, 손등에 있는 정맥, 또는 팔오금중간정맥) 또는 중심 정맥, 예를 들어, 중심 정맥주사선을 통한 대형 정맥 (예를 들어, 상대정맥 또는 하대정맥 또는 심장의 우심방 내)를 포함하지만 이에 제한되지 않고서, 포유류 체내 임의의 정맥에 투여된다.
본 발명의 임의의 실시양태에서, SDF-1 또는 돌연변이 SDF-1 단백질 조성물 또는 발현하는 줄기 세포 조성물은 조직 손상의 초기 발생 후에 또는 질병 또는 상태의 시작, 인지, 또는 진단 후에 수 분 내로, 또는 1 시간, 2 시간, 3 시간, 4 시간, 6 시간, 12 시간, 24 시간, 48 시간 이상, 3 일 이상, 4 일, 5 일, 6 일, 7 일, 10 일, 2 주, 한 달, 두 달, 세 달, 여섯 달, 일 년, 이 년 이상 이내로 투여된다.
본 발명의 추가적인 실시양태에서, SDF-1 또는 돌연변이 SDF-1 단백질 조성물 또는 발현하는 줄기 세포 조성물은 SDF-1 또는 돌연변이 SDF-1 펩티드 또는 줄기 세포의 이차적인 전달 형태 (예를 들어, 동맥내 또는 관상동맥내 전달 또는 근육내 또는 심근내 전달)와 결합하여 투여된다. 정맥내 투여는 두 번째, 예를 들어, 동맥내 투여 이전 또는 이후일 수 있다. 한 실시예에서, SDF-1 또는 돌연변이 SDF-1 단백질 조성물은 먼저 동맥내 투여되고, 이어서 수 분 내지 1 시간 내지 수 시간, 1 일까지, 1 주까지, 1 달까지, 1년까지 걸치는 시간의 기간 후에, SDF-1 또는 돌연변이 SDF-1 단백질 조성물은 정맥내 투여된다. 동맥내 투여는 정맥내 투여 이전 또는 정맥내 투여 이후 시간의 기간 동안 반복될 수 있다.
SDF-1 또는 돌연변이 SDF-1 단백질 조성물 또는 발현하는 줄기 세포 조성물은 질병 또는 상태의 하나 이상의 증상이 개선되도록 한 번 이상 투여될 수 있다. SDF-1 또는 돌연변이 SDF-1 조성물 또는 발현하는 줄기 세포 조성물은 조직 손상이 감소, 조직이 복구되거나, 새로운 혈관 형성이 일어날 때까지 한 번 이상 투여될 수 있다.
다양한 실시양태에서, 질병 또는 상태는 외상으로 인한 조직 손상, 심근경색증, 말초혈관병이다. 추가적인 실시양태에서, 질병 또는 상태는 심혈관질환이다.
본 발명의 임의의 실시양태에서, 손상된 조직은 심장 조직 또는 혈관 조직이다.
"충분한 양"이란 임상적으로 관련된 방식에서 장애 또는 상태를 치료 또는 개선하는 데 필요로 하는, 단독 또는 다른 치료법과 결합한, 치료제 (예를 들어, mSDF-1 펩티드)의 양을 의미한다. 한 실시예에서, 본 발명의 SDF-1 또는 돌연변이 SDF-1 펩티드의 충분한 양은 상처 치유 또는 조직 복구 또는 새로운 혈관 형성 (예를 들어, 혈관형성)을 촉진하는 양이다. 예컨대, 조직 손상의 치료에 대하여 본 발명을 실시하는 데 사용되는 치료제의 충분한 양은 투여의 방식, 대상의 나이 및 전반적인 건강 상태에 따라 좌우되어 달라진다. 결국, 이러한 치료를 처방하는 의료 전문인이 적절한 양 및 투약법을 결정할 것이다.
"단편"이란 적어도, 예를 들어, 핵산 또는 폴리펩티드의 전체 길이의 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 %, 95 % 이상을 함유하는 핵산 또는 폴리펩티드의 부분을 의미한다. 핵산 단편은 예를 들어, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 또는 200 이상 뉴클레오티드, 핵산의 전체 길이까지 함유할 수 있다. 폴리펩티드 단편은 예를 들어, 10, 20, 30, 40, 50, 또는 60 이상의 아미노산, 폴리펩티드의 전체 길이까지 함유할 수 있다. 단편은 본원에서 기재된 것과 같이 및 기술분야에 공지된 것과 같이 변형될 수 있다.
"정맥내 투여," "정맥내 치료," "IV 투여," 또는 "IV 치료"란 정맥 (예를 들어, 말초 또는 중심)으로의 물질의 투여를 의미한다. 정맥내 투여는 직접 주사기와 연결되거나 관의 한 가닥 및 용기 (예를 들어, 투여될 제약 조성물을 하우징하는 살균 용기)와 연결된 바늘을 통하여 정맥으로의 직접 주사를 포함할 수 있다.
"동맥내 투여"란 동맥 (예를 들어, 관상동맥 (예를 들어, 관상동맥내 투여))으로의 물질의 투여를 의미한다. 동맥내 투여는 동맥내 주사 또는 주입, 또는 동맥내 카테터를 통한 투여를 포함할 수 있다.
"근육내 투여"란 근육으로의 물질의 투여를 의미한다.
"심근내 투여"란 심근, 또는 심장 근육으로의 물질의 투여를 의미한다.
"제약상 허용가능한 운반체"란 함께 투여된 조성물의 치료 성질을 유지하면서, 치료되는 대상에게 생리학상 허용가능한 운반체를 의미한다. 한 예시적인 제약상 허용가능한 운반체 물질은 생리식염수이다. 다른 생리학상 허용가능한 운반체 및 이의 배합물은 당업자에게 알려져 있고, 예를 들어, 문헌 [Remington's Pharmaceutical Sciences (20th edition, ed. A. Gennaro, 2000, Lippincott, Williams & Wilkins, Philadelphia, PA)]에서 기재된다.
"상처 치유 촉진" 또는 "조직 복구 촉진"이란 상처 또는 손상된 조직의 봉합, 치유, 또는 복구를 증대, 향상, 증가, 또는 유도하는 것을 의미한다. 상처 또는 조직 손상은 임의의 장애 또는 상태 (예를 들어, 질병, 상해, 또는 수술)의 결과일 수 있고, 대상에서의 임의의 위치 (예를 들어, 내상 또는 외상)에서 발견될 수 있다. 예를 들어, 상처 또는 조직 손상은 예를 들어, 심근경색증과 같은 심혈관 상태의 결과일 수 있고, 손상된 조직은 심장 조직일 수 있다. 다르게는, 상처 또는 조직 손상은 말초혈관병 또는 당뇨병의 결과일 수 있다.
"단백질," "폴리펩티드," "폴리펩티드 단편," 또는 "펩티드"란 번역 후 변형 (예를 들어, 당화 또는 인산화)과 상관 없이, 자연 발생적인 폴리펩티드 또는 펩티드의 모두 또는 부분을 구성하거나 비-자연 발생적인 폴리펩티드 또는 펩티드를 구성하는, 두 개 이상의 아미노산 잔기의 임의의 사슬을 의미한다. 폴리펩티드 또는 펩티드는 물리적, 기계적, 또는 화학적 방법이 세포 성분으로부터 폴리펩티드를 제거하도록 사용되었을 때, "단리된" 또는 "실질적으로 순수한" 것이라 할 수 있다. "단리된 펩티드," "실질적으로 순수한 폴리펩티드," 또는 "실질적으로 순수한 및 단리된 폴리펩티드"는 그것이 60 중량% 이상 단백질 및 자연적으로 관련된 자연 발생적인 유기 분자가 없을 때 세포 성분으로부터 제거된 것으로 및 실질적으로 순수한 것으로 전형적으로 고려된다. 폴리펩티드는 75 중량%, 80 중량%, 85 중량%, 90 중량%, 95 중량%, 또는 99 중량% 이상 순수할 수 있다. 실질적으로 순수한 폴리펩티드는 표준적인 기술, 예를 들어, 천연 공급원 (예를 들어 세포계 또는 생물학적 유체)으로부터 추출에 의해, 폴리펩티드를 암호화하는 재조합 핵산의 발현에 의해, 또는 폴리펩티드를 화학적으로 합성하는 것에 의해 얻어질 수 있다. 순도는 임의의 적절한 방법에 의해, 예를 들어, 컬럼 크로마토그래피, 폴리아크릴아미드 겔 전기이동, 또는 고압 액체 크로마토그래피 (HPLC) 분석에 의해 측정될 수 있다. 다르게는, 폴리펩티드는 이의 자연적인 부위가 아닌 위치에 놓여진 인간 개입에 의해 변경되었거나, 하나 이상의 세포로 도입되었다면 단리된 것으로 고려된다.
상기 정의된 것과 같이, 본 발명의 펩티드 및 폴리펩티드는 모든 "모방체" 및 "펩티드모방체" 형태를 포함한다. 용어 "모방체" 및 "펩티드모방체"는 본 발명의 펩티드 또는 폴리펩티드의 실질적으로 동일한 구조적인 및(또는) 기능적인 특성을 갖는 합성 화학 컴파운드를 지칭한다. 모방체는 아미노산의 합성, 비-천연 유사체로 전체적으로 구성될 수 있거나 천연 아미노산의 키메라 분자 및 아미노산의 비-천연 유사체일 수 있다. 모방체는 이러한 치환이 모방체의 구조 또는 활성을 실질적으로 변경하지 않는 한, 보존적 치환의 임의의 양을 혼입할 수도 있다.
"예방" 또는 "가능성 감소"란 질병 또는 장애 (예를 들어, 심근경색증 또는 말초혈관병) 또는 이의 증상의 중증도, 빈도 및(또는) 지속기간을 감소시키는 것을 의미한다.
"프로테아제 방어 유기 군"이란 단백질성 아미노산이 아닌, SDF-1 또는 SDF-1의 돌연변이된 형태(mSDF-1)의 N-말단 아미노산에 첨가될 때, 변형되지 않은 SDF-1의 화학유인물질 활성의 예를 들어, 10, 15, 20, 25, 30, 40, 50, 60, 70, 80, 90, 95, 99, 또는 100 % 이상 (예를 들어, 주르카트(Jurkat) T 세포 이동의 측정법 또는 기술분야에서 공지된 화학쏠림성을 측정하는 다른 측정법에 의해 측정됨)을 유지하고 변형되지 않은 SDF-1의 불활성 속도의 예를 들어, 50, 45, 40, 35, 30, 25, 20, 15, 10, 5, 또는 1 % 미만의 속도에서 효소 (예를 들어, DPPIV)에 의해 불활성화된, 변형된 펩티드를 야기시키는 유기 군을 의미한다.
"프로테아제-내성"이란 천연 또는 야생형 펩티드 또는 폴리펩티드 (예를 들어, 천연 또는 야생형 SDF-1)와 비교하여 이의 아미노산의 일차적인 서열에서 하나 이상의 변형을 포함하고, 하나 이상의 아미노산 변형 없이 천연 또는 야생형 펩티드 또는 폴리펩티드와 비교하여 단백질분해에 대해 증가된 내성을 나타내는 펩티드 또는 폴리펩티드를 의미한다. "증가된 프로테아제-내성"이란 아미노산 서열 변화가 없는 펩티드 또는 폴리펩티드와 비교하여, 시험관내 또는 생체내 측정법으로 측정된 증가를 의미한다. 프로테아제에 대한 증가된 내성은 예를 들어 주르카트 T-림프구 이동 측정법, CXCR-4-cAMP 수용체 활성화 측정법 및 CXCR4- 또는 CXCR7-β-아레스틴(arrestin) 측정법과 같은 측정법을 사용하여 특정 프로테아제 (예를 들어, MMP-2, MMP-9, DPPIV, 백혈구 엘라스타아제, 카텝신 G, 카르복시펩티드분해효소 M, 또는 카르복시펩티드분해효소 N)에 뒤이은 노출에서 활성 또는 발현에 대한 시험에 의해 측정될 수 있다. 전형적으로, 프로테아제 내성에서의 증가는 내성을 부여하는 아미노산 서열에서의 변화가 없는, 동일한 펩티드 또는 폴리펩티드와 비교하여 약 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 %, 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 %, 100 %, 200 %, 300 %, 400 %, 500 % 이상이다.
"단백질성"이란 폴리펩티드 또는 펩티드의 아미노산이 알라닌 (A), 아르기닌 (R), 아스파라긴 (N), 아스파트산 (D), 시스테인 (C), 글루탐산 (E), 글루타민 (Q), 글라이신 (G), 히스티딘 (H), 이소류신 (I), 류신 (L), 리신 (K), 메티오닌 (M), 페닐알라닌 (F), 프롤린 (P), 세린 (S), 트레오닌 (T), 트립토판 (W), 티로신 (Y), 또는 발린 (V)의 L-이성질체인 것을 의미한다.
"SDF" 또는 "SDF-1"이란 서열번호 52의 서열 또는 SDF의 임의의 다수 형태 (예를 들어, 동일 유전자의 교호 스플라이싱에 의해 생성된 SDF-1α (CXCL12a), SDF-1β (CXCL12b) 및 SDF-γ)를 포함할 수 있는 기질 세포 유래 인자 펩티드를 의미한다. SDF-1β는 SDF-1α의 C-말단에서 추가적인 네 개의 아미노산 잔기, Arg-Phe-Lys-Met를 포함한다. SDF-1γ의 처음 세 엑손은 SDF-1α 및 SDF-1β의 엑손과 동일하다. SDF-1γ의 네 번째 엑손은 SDF-1 유전자자리 상의 세 번째 엑손으로부터 3200 염기쌍 아래에 위치하고, SDF-1β의 세 번째 엑손 및 네 번째 엑손 사이에 놓인다. 비록 서열번호 52는 SDF-1α의 서열을 보여주지만, 이 서열은 추가적인 아미노산 잔기를 포함하도록 C-말단에서 연장될 수 있다. 본 발명은 SDF-1α, SDF-1β 및 SDF-γ의 돌연변이를 포함한다. 본 발명의 목적에 대하여, 용어 "SDF" 또는 "SDF-1"은 펩티드의 활성 형태, 즉, 시그널 펩티드의 분해 후를 지칭한다.
"mSDF-1," "mSDF," 또는 "SDF(NqN')" (N은 본래 존재했던 아미노산의 한 글자 명칭이고, q는 펩티드의 N-말단으로부터의 이의 위치이고, N'은 N을 대체한 아미노산임)은 돌연변이 SDF-1 펩티드를 의미한다. N-말단에서 아미노산 (예를 들어, 하나 이상의 아미노산)의 첨가에 의해 돌연변이된 펩티드는 "Xp-R" (X는 단백질성 아미노산 또는 프로테아제 방어 유기 군이고, p는 정수이고, R은 연장 이전의 펩티드(예를 들어, SDF-1 또는 mSDF-1)임)로 약칭된다. 예를 들어, "S-SDF-1" 또는 "S-mSDF-1"는 각각 N-말단에서 첨가된 세린 잔기가 있는 SDF-1 또는 mSDF-1 분자이다. C-말단에서 아미노산 (예를 들어, 하나 이상의 아미노산)의 첨가에 의해 돌연변이된 펩티드는 "R-Yz" (Y는 단백질성 아미노산 또는 프로테아제 방어 유기 군이고, z는 정수이고, R은 연장 이전의 펩티드(예를 들어, SDF-1, mSDF-1, 또는 Xp-mSDF-1)임)로 약칭된다. 달리 나타내지 않는 한, 모든 제약상 허용가능한 염을 포함하여, 펩티드의 모든 제약상 허용가능한 형태가 사용될 수 있다.
"본 발명의 SDF-1 또는 돌연변이 SDF-1 펩티드"란 본원에서 기재되는 임의의 야생형 SDF-1 (이소형을 포함하여) 또는 돌연변이 SDF-1 펩티드를 의미한다. 용어에는 본원에서 기재되는 야생형 SDF-1 또는 돌연변이 SDF-1 펩티드를 포함하는 조성물 (예를 들어, 제약 조성물)이 또한 포함된다.
"줄기 세포"란 분화다능성이고, 다양한 분화 세포로 분화할 수 있는, 더 많은 줄기 세포를 생성하도록 추가로 분할할 수 있는 분화되지 않은 생물학적 세포를 의미한다. 이 용어는 배아 줄기 세포, 성체 줄기 세포, 중간엽 줄기 세포 및 중간엽 전구 세포를 포함하는 것을 의미한다. "중간엽 줄기 세포"란 다능성 기질 세포를 의미하고; "중간엽 전구 세포"는 STRO-1 ("STRO-1+"), 세포 표면 표지자의 존재를 특징으로 하는 중간엽계의 전구 세포이다.
"대상"이란 인간 또는 인간이 아닌 포유류 예를 들어 소, 말, 개, 양, 고양이를 포함하지만 이에 제한되지 않는 포유류를 의미한다.
"지속 방출" 또는 "제어된 방출"이란 치료적 활성 성분이 성분의 치료적으로 유익한 수준 (그러나 독성 수준 미만)이 예컨대, 약 12 시간 내지 약 4 주 (예를 들어, 12 시간, 24 시간, 48 시간, 1 주, 2 주, 3 주, 또는 4 주)에 이르는 연장된 시간의 기간에 걸쳐 유지되어, 이에 따라 예를 들어, 12-시간 내지 4-주 투여형을 제공하도록 하는 제어된 속도로 제형으로부터 방출되는 것을 의미한다.
"치료" 또는 "개선"이란 치료 목적으로 제약 조성물을 투여하는 것 또는 대상의 상태를 개선하도록 장애로 이미 고통받는 대상에 치료를 투여하는 것을 의미한다. "장애를 치료하는 것" 또는 "장애를 개선하는 것"이란 장애 및 장애와 관련된 증상이 예를 들어, 완화, 감소, 치유되고, 또는 차도의 상태에 놓이는 것을 의미한다. 치료되지 않은 동등한 대조군과 비교하여, 이러한 개선 또는 치료의 정도는 임의의 표준 기술로 측정될 때, 5 %, 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 %, 95 %, 99 %, 또는 100 % 이상이다.
본 발명의 다른 특징 및 장점은 상세한 기재로부터 및 청구항으로부터 명백할 것이다.
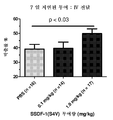
도 1은 SSDF-1(S4V)이 정맥내 전달되었고, 허혈 재관류 상해 후 7 일은 PBS 대조군과 비교하여 10 퍼센트 포인트로 박출률 (EF)을 개선한 것을 보여주는 막대 그래프이다.
도 2는 허혈 재관류 상해의 마이크로 유카탄 돼지 모델(micro Yucatan pig model)에서 경색 4 주 후 SSDF-1(S4V)의 정맥내 투여가 뒤따르는, 경색 후 즉시 SSDF-1(S4V)의 관상동맥내 투여가 PBS 대조군과 비교하여 경색 후 12 주에서도 2.7 퍼센트 포인트로 EF를 개선한 것을 보여주는 그래프이다. 단면 T 시험(1-sided T-test)이 수행되었다; p < 0.05; n = 5 돼지/군.
도 2는 허혈 재관류 상해의 마이크로 유카탄 돼지 모델(micro Yucatan pig model)에서 경색 4 주 후 SSDF-1(S4V)의 정맥내 투여가 뒤따르는, 경색 후 즉시 SSDF-1(S4V)의 관상동맥내 투여가 PBS 대조군과 비교하여 경색 후 12 주에서도 2.7 퍼센트 포인트로 EF를 개선한 것을 보여주는 그래프이다. 단면 T 시험(1-sided T-test)이 수행되었다; p < 0.05; n = 5 돼지/군.
상세한 기재
본 발명은 손상된 조직, 예를 들어, 손상된 심장 조직의 회복이 야생형 SDF-1 또는 효소성 분해 (예를 들어, 하나 이상의 MMP-2, MMP-9, DPPIV, 백혈구 엘라스타아제, 카텝신 G, 카르복시펩티드분해효소 M 또는 카르복시펩티드분해효소 N에 의한 분해)에 대한 내성이 증가하도록 돌연변이된 SDF-1의 정맥내 투여로 촉진된다는 발견을 기초로 한다. 이러한 펩티드는 제약상 허용가능한 운반체가 있거나 없이, 단리된 펩티드로서 투여될 수 있다. 또한, 우리는 놀랍게도 조직 손상의 초기 발생 후 또는 질병 또는 상태의 시작, 인식, 또는 진단 후 수 분 내로부터 조직 손상의 초기 발생 후 또는 질병 또는 상태의 시작, 인식, 또는 진단 후 1 시간, 2 시간, 3 시간, 4 시간, 6 시간, 12 시간, 24 시간, 48 시간 이상, 3 일 이상, 4 일, 5 일, 6 일, 7 일, 10 일, 2 주, 한 달, 두 달, 세 달, 여섯 달, 일 년, 이 년 이상까지 지연된 투여는 손상된 조직의 회복을 촉진하는 데 또한 유용하다는 것을 발견하였다. 이 접근은 임의의 유형의 상해 또는 질병으로부터 기인하는 손상된 조직을 치료하는 데 사용될 수 있다.
정맥내
투여
본 발명의 방법에서 사용되는 SDF-1 또는 돌연변이 SDF-1 펩티드-함유 조성물 또는 발현하는 줄기 세포 조성물은 예를 들어, 정맥내 (IV) 주사에 의해 또는 이식 가능한 장치 (예를 들어, 카테터)를 사용하여 정맥내 투여된다. 정맥내 투여는 일반적으로 말초 정맥 (예를 들어, 팔에 있는 정맥, 다리, 손등에 있는 정맥, 또는 팔오금중간정맥) 또는 중심 정맥을 통한 대형 정맥 (예를 들어, 상대정맥 또는 하대정맥 또는 심장의 우심방 내)을 포함하지만 이에 제한되지 않는, 포유류의 체내에서 임의의 접근 가능한 정맥으로의 주사를 수반한다. 정맥내 투여는 삽입된 중심 카테터, 중심 정맥관, 또는 이식 가능한 포트에 의한 투여도 포함할 수 있다.
말초 IV 관은 예를 들어, 유연한 플라스틱 캐뉼라가 금속 트로카 상에 마운팅되는, 캐뉼라-오버-니들(cannula-over-needle) 장치를 사용하여 피부를 통해 말초 정맥 (예를 들어, 가슴 또는 복부 안에 있지 않은 임의의 정맥)으로 삽입된 짧은 카테터 (몇 센티미터 길이)로 이루어진다. 피부 밖에 남는 카테터 부분은 연결 허브라고 불린다; 이는 주사기 또는 정맥내 주입 관과 연결될 수 있다. 포팅된 캐뉼라는 상부에 본 발명의 SDF-1 돌연변이 SDF-1 펩티드를 투여하는 데 사용될 수 있는 주사 포트를 갖는다.
말초 주입된 중심 카테터 (PICC) 관은 IV 접근을 연장된 시간의 기간에 걸쳐 필요로 할 때 또는 주입될 물질이 빠른 손상 및 말초 IV의 초기 상실을 야기시킬 때 및 통상적인 중심관을 시도하기에 너무 위험할 때 사용된다.
본 발명의 IV 전달 방법에는 예를 들어, 카테터가 쇄골하 내경정맥 또는 대퇴정맥에 삽입되고 그것이 상대정맥 또는 우심방에 도달할 때까지 심장을 향하여 진행하는, 중심 정맥관이 또한 포함된다.
또 다른 중심 IV 전달 방법은 대형 정맥 내, 대개 상대정맥 또는 하대정맥 또는 심장의 우심방 내 이의 끝(tip)으로 카테터를 통하여 흐르는 중심 IV 관의 사용을 통하는 것이다.
본 발명의 IV 전달 방법에서 유용한 또 다른 유형의 중심관은 목적 정맥으로 삽입되고 이어서 짧은 거리로 떨어져 출현하도록 피하에 "터널링된(tunneled)," 히크만관(Hickman line) 또는 브로비악(Broviac) 카테터이다.
이식 가능한 포트는 본 발명의 SDF-1 및 돌연변이 SDF-1 펩티드 컴파운드 또는 줄기 세포의 IV 전달에서 또한 사용된다. 이식 가능한 포트는 외부 연결기가 없는 중심 정맥관이다; 대신에, 그것은 실리콘 고무로 덮인 작은 저장조를 갖고, 피하에 이식된다. 펩티드 컴파운드는 피부를 통하여 작은 바늘을 놓고, 저장조로 실리콘을 뚫는 것에 의해, 간헐적으로 투여된다. 포트는 여러 주, 여러 달, 심지어 여러 해 동안 대상의 체내에 남을 수 있다. 간헐적 주입은 대상이 단지 소정의 시간에서 본 발명의 SDF-1 및 mSDF-1 펩티드 컴파운드 또는 줄기 세포의 투여를 필요로 할 때 사용될 수 있는 정맥내 투여의 또 다른 유형이다.
SDF-1 또는 mSDF-1 펩티드-함유 조성물 또는 발현하는 줄기 세포 조성물은 한 정맥 또는 몇몇 정맥으로 투여될 수 있다. SDF-1 또는 mSDF-1 펩티드-함유 조성물 또는 발현하는 줄기 세포 조성물은 예를 들어 하나 이상의 정맥에 약 1 분, 1 내지 5 분, 10 내지 20 분, 20 내지 30 분의 기간 동안, 또는 임상의에 의해 결정된 충분한 시간 동안 정맥내 투여될 수 있다. 투여는 예상되는 유익함을 달성 또는 유지하도록 간헐적으로 반복될 수 있다. 반복 투여 시기는 예를 들어, 조직 손상과 관련된 증상을 모니터링함에 의해, 대상의 반응에 기초한다. 제공될 SDF-1 또는 mSDF-1 펩티드-함유 조성물 또는 발현하는 줄기 세포 조성물의 치료상 효과적인 투여량 또는 양은 두 개 이상의 투여량으로 나눠질 수 있고, 투여량은 단일 구멍 또는 다수의 구멍으로 두 개 이상의 정맥에 투여될 수 있다.
SDF
-1 및 프로테아제-내성 돌연변이
공식적으로 케모카인 (C-X-C 모티프) 리간드 12 (CXCL12)로 지칭되는 SDF-1은 케모카인 족에 속하는 작은 시토카인이다. SDF-1은 동일 유전자의 교호 스플라이싱에 의해, SDF-1α (CXCL12a), SDF-1β (CXCL12b) 및 SDF-1γ의 다수 형태로 생성된다.
돌연변이되지 않은 SDF-1α는 하기 서열을 갖는다:
K P V S L S Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 52)
본원에서 기재되는 SDF-1 펩티드는 펩티드를 예를 들어, 매트릭스 금속단백분해효소-2 (MMP-2), 매트릭스 금속단백분해효소-9 (MMP-9), 디펩티딜 펩티드분해효소 IV (DPPIV), 백혈구 엘라스타아제, 카텝신 G, 카르복시펩티드분해효소 M, 또는 카르복시펩티드분해효소 N에 대해 내성이 있게 만들도록 한 돌연변이가 있는 SDF-1 펩티드를 포함한다. 본 발명의 방법에서, 돌연변이되지 않은 SDF-1은 조직 손상의 치료 또는 개선에 대한 정맥내 전달에 의해 투여될 수도 있다.
본 발명의 방법은 돌연변이되지 않은 SDF-1의 N-말단으로부터 세 번째, 네 번째, 다섯 번째 및(또는) 여섯 번째 아미노산 잔기에서의 변화를 특징으로 하는 SDF-1 (mSDF-1)의 돌연변이 형태를 특징으로 한다. 본 발명의 mSDF-1 펩티드는 서열번호 53의 적어도 아미노산 1-8을 갖고, 하기 서열을 갖는 서열번호 53의 남아있는 서열의 모든 또는 임의의 부분에 의해 C-말단에서 연장될 수 있다:
K P X3 X4 X5 X6 Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 53) (여기서 X3, X4, X5 및 X6은 임의의 아미노산 잔기이다).
소정의 실시양태에서, X3은 발린, 히스티딘, 또는 시스테인이다.
소정의 실시양태에서, X4는 세린 또는 발린이다.
소정의 실시양태에서, X5는 류신, 프롤린, 트레오닌, 또는 발린이다.
소정의 실시양태에서, X6은 세린, 시스테인, 또는 글라이신이다.
예를 들어, mSDF-1 펩티드는 네 번째 (예를 들어, Ser→Val) 및(또는) 다섯 번째 (예를 들어, Leu→Pro) 아미노산 자리에서 돌연변이를 포함할 수 있다.
K P V V L S Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 63)
K P V S P S Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 64)
K P V V P S Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 65)
또 다른 실시예에서, mSDF-1 펩티드는 세 번째 아미노산 자리에서 Val→His (서열번호 54) 또는 Val→Cys (서열번호 55) 돌연변이를 포함할 수 있다.
K P H S L S Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 54)
K P C S L S Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 55)
다른 실시양태에서, mSDF-1 펩티드는 다섯 번째 아미노산 자리에서 Leu→Thr (서열번호 56) 또는 Leu→Val (서열번호 60) 돌연변이를 포함할 수 있다.
K P V S T S Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 56)
K P V S V S Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 60)
다른 실시양태에서, mSDF-1 펩티드는 여섯 번째 아미노산 자리에서 Ser→Cys (서열번호 61) 또는 Ser→Gly (서열번호 62) 돌연변이를 포함할 수 있다.
K P V S L C Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 61)
K P V S L G Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 62)
본 발명의 방법은 본원에서 기재되는 돌연변이의 임의의 조합을 포괄하는 펩티드를 또한 포함할 수 있다. 예를 들어, mSDF-1 펩티드는 서열번호 53의 세 번째 아미노산 자리에서 Val→Cys 돌연변이 및 서열번호 53의 여섯 번째 아미노산 자리에서 Ser→Cys 돌연변이를 포함할 수 있다.
프로테아제 내성을 부여하도록 SDF-1 펩티드에 행해진 돌연변이는 예를 들어, Xp-mSDF-1를 생성하면서, 예를 들어, mSDF-1 펩티드 (상기)의 N-말단에 모이어티 (예를 들어, 단백질성 아미노산 또는 프로테아제 방어 유기 군)의 첨가를 또한 포함할 수 있다. 예를 들어, X는 R1-(CH2)d- (d는 0-3의 정수이고, R1은 수소 (R1이 수소일 때, d는 반드시 1 이상이어야 하는 규칙이 있음); 직쇄 또는 분지된 C1-C3 알킬; 직쇄 또는 분지된 C2-C3 알케닐; 할로겐, CF3; -CONR5R4; -COOR5; -COR5; -(CH2)qNR5R4; -(CH2)qSOR5; -(CH2)qSO2R5, -(CH2)qSO2NR5R4 및 OR5일 수 있고, 여기서, R4 및 R5는 각각 독립적으로 수소 또는 직쇄 또는 분지된 C1-C3 알킬이다. 유기 군이 X에 대하여 사용된 경우에서, p는 1이어야 한다. X는 단백질성 아미노산을 나타낼 수도 있고, 예를 들어, 1-10 (예를 들어, 1-9, 1-8, 1-7, 1-6, 1-5, 1-4, 1-3, 1-2, 또는 1) 아미노산(들)은 SDF-1 (예를 들어, mSDF-1)의 N-말단에 첨가되고, 이러한 첨가된 아미노산 중 하나 이상은 프로테아제 방어 유기 군으로 치환될 수 있다. 예를 들어, 단백질성 아미노산 (예를 들어, 세린) 또는 프로테아제 방어 유기 군은 화학유인물질 활성 또는 다른 프로테아제 (예를 들어, MMP-2)에 대한 내성을 실질적으로 변경함이 없이 예를 들어, DPPIV 분해에 대한 내성을 부여하도록 SDF-1 (예를 들어, mSDF-1)의 N-말단에 첨가될 수 있다. 하기 서열은 N-말단에 첨가된 세린 아미노산이 있는 예시적인 SDF-1 돌연변이를 나타낸다.
S K P X3 X4 X5 X6 Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 68) (여기서 X3, X4, X5 및 X6은 임의의 아미노산 잔기이다).
소정의 실시양태에서, X3은 발린, 히스티딘, 또는 시스테인이다.
소정의 실시양태에서, X4는 세린 또는 발린이다.
소정의 실시양태에서, X5는 류신, 프롤린, 트레오닌, 또는 발린이다.
소정의 실시양태에서, X6은 세린, 시스테인, 또는 글라이신이다.
서열의 구체적인 예시는 하기를 포함한다:
S K P V V L S Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 69)
S K P V S P S Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 70)
S K P V V P S Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 71)
S K P H S L S Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 72)
S K P C S L S Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 73)
S K P V S T S Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 74)
S K P V S V S Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 75)
S K P V S L C Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 76)
S K P V S L G Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 77)
프로테아제 내성을 부여하도록 SDF-1 펩티드에 행해진 돌연변이는 예를 들어, mSDF-1-Yz 또는 Xp-mSDF-1-Yz를 생성하면서, 예를 들어, mSDF-1 펩티드 (상기)의 C-말단에 모이어티 (예를 들어, 단백질성 아미노산)의 첨가를 또한 포함할 수 있다. Y는 단백질성 아미노산을 나타낼 수 있고, 예를 들어, 1-10 (예를 들어, 1-9, 1-8, 1-7, 1-6, 1-5, 1-4, 1-3, 1-2, 또는 1) 아미노산(들)은 SDF-1 (예를 들어, mSDF-1 또는 Xp-mSDF-1)의 C-말단에 첨가된다. 예를 들어, 단백질성 아미노산 (예를 들어, 세린)은 화학유인물질 활성 또는 다른 프로테아제 (예를 들어, MMP-2)에 대한 내성을 실질적으로 변경함이 없이 예를 들어, 카르복시펩티드분해효소 M 또는 카르복시펩티드분해효소 N 분해에 대한 내성을 부여하도록 SDF-1, mSDF-1, 또는 Xp-mSDF-1의 C-말단에 첨가될 수 있다. 한 실시양태에서, 본 발명은 단리된 mSDF-1-Yz 또는 Xp-mSDF-1-Yz 펩티드를 특징으로 하고, SDF-1은 서열번호 53의 아미노산 서열을 포함한다. 그러나, C-말단 변형은 본원에서 기재되는 임의의 SDF-1 펩티드 및 SDF-1에 행해질 수 있다. 본원에서 기재되는 돌연변이된 SDF-1 펩티드는 화학유인물질로서의 역할을 하는 이의 능력을 유지하나, 효소 (예를 들어, 단백질 가수 분해) 소화에 내성을 갖는다. mSDF-1 펩티드는 적어도, 예를 들어, 돌연변이되지 않은 SDF-1의 민감도의 10, 15, 20, 25, 30, 40, 50, 60, 70, 80, 90, 95, 99, 또는 100 % 민감도 (예를 들어, 주르카트 T 세포 또는 기술분야에서 공지된 임의의 다른 화학쏠림성 측정법의 측정법에서 예컨대, 최대 반응의 50 %를 얻는 데 필요한 효과적인 농도에 의해 측정됨)를 갖는 화학유인물질 활성을 유지한다. 화학유인물질 활성의 손실은 예를 들어, MMP-2, MMP-9, 백혈구 엘라스타아제, DPPIV, 카텝신 G, 카르복시펩티드분해효소 M, 또는 카르복시펩티드분해효소 N의 분해 때문일 수 있다. mSDF-1의 불활성화의 속도는 예를 들어, SDF-1의 불활성화의 속도의 50, 45, 40, 35, 30, 25, 20, 15, 10, 5, 또는 1 % 미만일 수 있다.
돌연변이된 SDF-1 펩티드는 예를 들어, MMP-2, MMP-9, DPPIV, 백혈구 엘라스타아제, 카텝신 G, 카르복시펩티드분해효소 M, 또는 카르복시펩티드분해효소 N에 의한 분해에 내성이 있을 수 있다. 따라서, 이는 예를 들어, 손상된 조직 (예를 들어, 손상된 심장 조직)과 같은 부위에서의 사용에 이상적으로 적당하고, 단백질 분해 효소는 고농도로 존재하고, 또는 혈액 또는 혈장을 통해 부위로 전달된다. 그러므로, 돌연변이된 SDF-1 펩티드는 이러한 펩티드의 개선된 안정성 때문에 정맥내 투여에 적합하다.
본원에서 기재되는 프로테아제-내성 SDF-1 펩티드는 아미노산 또는 자연적인 가공, 예를 들어, 번역 후 가공에 의하거나, 기술분야에 공지된 기술을 사용하는 화학적인 변형에 의해 변형된 서열을 포함할 수 있다. 변형은 폴리펩티드 주쇄, 아미노산 측쇄 및 아미노- 또는 카르복시-말단을 포함하여, 폴리펩티드의 임의의 곳에서 일어날 수 있다. 변형의 동일한 유형은 주어진 폴리펩티드의 몇몇 부위에서 동일 또는 다양한 정도(degree)로 존재할 수 있고, 폴리펩티드는 한 유형 초과의 변형을 포함할 수 있다. 변형은 예를 들어, PEG화, 아세틸화, 아실화, 아세토미도메틸 (Acm) 기의 첨가, ADP-리보실화, 알킬화, 아미드화, 비오티닐화, 카르바모일화, 카르복시에틸화, 에스테르화, 피아빈(fiavin)에의 공유 부착, 헴 모이어티에의 공유 부착, 뉴클레오티드 또는 뉴클레오티드 유도체의 공유 부착, 약물의 공유 부착, 표지자의 공유 부착 (형광 또는 방사성 표지자), 지질 또는 지질 유도체의 공유 부착, 포스파티딜이노시톨의 공유 부착, 가교, 고리화, 디술피드 결합 형성, 탈메틸화, 공유 가교의 형성, 시스틴의 형성, 피로글루타메이트의 형성, 포르밀화, 감마-카르복시화, 글리코실화, GPI 앵커(anchor) 형성, 하이드록시화, 아이오딘화, 메틸화, 미리스토일화(myristoylation), 산화, 단백질 가수 분해 가공, 인산화, 프레닐화(prenylation), 라세미화, 셀레노일화(selenoylation), 황산화, 단백질로의 아미노산의 트랜스퍼-RNA 매개 첨가 (예를 들어, 아르기닐화) 및 유비퀴틴화를 포함한다. 번역 후 변형은 펩티드를 안정화시키도록 또는 약동학 또는 약력학을 개선하도록 하는 중합체의 첨가를 또한 포함한다. 예시적인 중합체는 예를 들어, 폴리(2-히드록시 에틸 메타크릴레이트), 폴리(메틸 메타크릴레이트), 폴리(아크릴산), 폴리(에틸렌-코-비닐 아세테이트), 폴리(메타크릴산), 폴리글리콜리드 (PLG), 폴리무수물, 폴리(N-비닐 피롤리돈), 폴리(비닐 알콜), 폴리아크릴아미드, 폴리(에틸렌 글리콜), 폴리락티드 (PLA), 폴리(락티드-코-글리콜리드) (PLGA), 폴리글루탐산 (PGA) 및 폴리오르소에스테르를 포함한다.
융합 단백질
본 발명의 방법은 본원에서 기재된 SDF-1, mSDF-1, Xp-mSDF-1, mSDF-1-Yz, 또는 Xp-mSDF-1-Yz의 임의의 펩티드 서열이 IgG (예를 들어, 인간 IgG1)의 Fc 영역에 연결된 융합 단백질을 또한 이용할 수 있다. 다르게는, Fc 영역은 돼지, 생쥐, 토끼, 햄스터, 염소, 쥐 및 기니피그를 포함하여, 다른 동물 또는 인간의 IgA, IgM, IgE, 또는 IgD로부터 유도될 수 있다. IgG의 Fc 영역은 IgG 중쇄 및 힌지 영역의 CH2 및 CH3 도메인을 포함한다. 힌지는 분자의 각각의 부분이 독립적으로 기능하도록 하면서, Fc 융합 단백질의 두 부분 사이에서 유연한 스페이서로서 역할을 한다. 본 발명에서 사용되는 Fc 영역은 예를 들어, 단량체 또는 이량체 형태로 제조될 수 있다.
예시적인 Fc 융합 펩티드는 하기 아미노산 서열을 갖는 S-SDF-1(S4V)-Fc이다. GGGGS 링커 (서열번호 66)는 굵게 나타나고, Fc 펩티드는 밑줄이 그어져 있다.
S K P V V L S Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K G G G G S V D K T H T C P P C P A P E L L G G P S V F L F P P K P K D T L Met I S R T P E V T C V V V D V S H E D P E V K F N W Y V D G V E V H N A K T K P R E E Q Y N S T Y R V V S V L T V L H Q D W L N G K E Y K C K V S N K A L P A P I E K T I S K A K G Q P R E P Q V Y T L P P S R D E L T K N Q V S L T C L V K G F Y P S D I A V E W E S N G Q P E N N Y K T T P P V L D S D G S F F L Y S K L T V D K S R W Q Q G N V F S C S V Met H E A L H N H Y T Q K S L S L S P G K (서열번호 67)
Fc 융합 펩티드의 다른 비제한적인 실시예는 예를 들어, SDF-1(S4V)-Fc, SDF-1(L5P)-Fc, SDF-1(S6C)-Fc, SDF-1(V3H)-Fc, SDF-1-Fc, S-SDF-1-Fc 및 SDF-1-Fc를 포함한다.
모든 상기 단백질은 용어 "본 발명의 SDF-1 및 mSDF-1 단백질" 또는 "본 발명의 펩티드"에 포함된다.
펩티드 합성
본 발명의 방법에서 사용되는 SDF-1 또는 프로테아제-내성 돌연변이 SDF-1 펩티드는 예를 들어, 표준 N-tert-부틸옥시카보닐(N-tert-butyoxycarbonyl) (t-Boc)의 화학적 성질을 사용하는 고체상 펩티드 합성 및 n-메틸피롤리돈의 화학적 성질을 사용하는 사이클에 의해 만들어질 수 있다. 펩티드를 합성하는 예시적인 방법은 예를 들어, 본원에서 참조로 포함되는 미국 특허 4,192,798; 4,507,230; 4,749,742; 4,879,371; 4,965,343; 5,175,254; 5,373,053; 5,763,284; 및 5,849,954호에서 발견될 수 있다. 이러한 펩티드는 재조합 DNA 기술을 사용하여 또한 만들어질 수 있다.
일단 펩티드가 합성되면, 이는 예를 들어, 역상 컬럼 상의 HPLC와 같은 방법을 사용하여 정제될 수 있다. 순도는 HPLC로 또한 측정될 수 있고, 올바른 조성물의 존재가 아미노산 분석에 의해 측정될 수 있다. mSDF-1 펩티드에 적합한 정제 방법은 예를 들어, 본원에서 참조로 포함되는 미국 특허 출원 공보 2008/0095758호에 기재된다.
융합 단백질은 화학적으로 합성되거나 재조합 DNA 기술을 사용하여 만들어질 수 있다. Fc 융합 펩티드의 다른 비제한적인 실시예는 예를 들어, SDF-1(S4V)-Fc, SDF-1(L5P)-Fc, SDF-1(S6C)-Fc, SDF-1(V3H)-Fc, SDF-1-Fc, S-SDF-1-Fc 및 SDF-1-Fc를 포함한다.
SDF
-1 펩티드를 발현하는
줄기 세포
본 발명은 예를 들어, 본 발명의 펩티드 (예를 들어, SDF-1 또는 프로테아제-내성 돌연변이 SDF-1 펩티드)를 발현 및(또는) 분비하도록, 줄기 세포 및(또는) 이의 유전자 변형된 자손 세포를 제공한다. 임의의 적합한 줄기 세포는 예를 들어, 성체 줄기 세포, 중간엽 전구 세포 (MPCs) 및 중간엽 줄기 세포 (MSCs)를 포함하여, 본 발명의 펩티드를 발현 및(또는) 분비하도록 유전자 변형될 수 있다. 일부 실시양태에서, 줄기 세포는 야생형 SDF-1의 기저 수준을 자연적으로 발현할 수 있고, 유전자 변형은 줄기 세포가 야생형 SDF-1의 증가된 수준을 발현하도록 및(또는) 프로테아제-내성 돌연변이 SDF1-펩티드를 발현하도록 할 수 있다.
세포, 예를 들어 줄기 세포를 유전자 변형하는 방법은 당업자에게 명백할 것이다. 예를 들어, 세포에서 발현될 핵산은 그 세포에서 발현을 유도하는 프로모터에 작동적으로 연결된다. 예를 들어, 핵산은 예를 들어, 바이러스 프로모터, 예를 들어, CMV 프로모터 (예를 들어, CMV-IE 프로모터) 또는 SV-40 프로모터와 같은 대상의 다양한 세포에서 작동 가능한 프로모터에 연결된다. 다른 경우에서, 프로모터는 특정 유형의 줄기 세포에서 구체적으로 작동 가능할 수 있다. 추가적인 적합한 프로모터는 기술분야에 공지되고 개시의 본 실시예에 필요에 따라 적용될 것이다.
한 실시예에서, 핵산은 발현 구조체의 형태로 제공된다. 본원에서 사용되는 용어 "발현 구조체"는 세포에서 작동적으로 연결된 핵산 (예를 들어, 리포터 유전자 및(또는) 반대-선택 가능한(counter-selectable) 리포터 유전자) 상 발현을 부여하는 능력을 갖는 핵산을 지칭한다. 본 개시와 관련해서, 발현 구조체는 플라스미드, 박테리오파지, 파지미드, 코스미드, 바이러스 서브-게놈 또는 게놈 단편, 또는 발현할 수 있는 포맷에서 이종 DNA를 유지 및(또는) 복제할 수 있는 다른 핵산을 포함할 수 있다는 것이 이해될 것이다.
본 개시의 수행에 적합한 발현 구조체의 구조에 대한 방법은 당업자에게 명백할 것이며, 예를 들어, 아우수벨(Ausubel) 등의 문헌 [Current Protocols in Molecular Biology. Wiley Interscience, ISBN 047 150338, 1987] 또는 샘브룩(Sambrook) 등의 문헌 [Molecular Cloning: Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratories, New York, Third Edition 2001]에서 기재된다. 예를 들어, 발현 구조체의 각각의 성분은 예를 들어, 중합효소 연쇄 반응 (PCR)을 사용하여, 적합한 주형 핵산으로부터 증폭되고, 후속적으로 예를 들면, 플라스미드 또는 파지미드와 같은 적합한 발현 구조체로 클로닝된다.
이러한 발현 구조체에 적합한 벡터는 기술분야에 공지 및(또는) 본원에서 기재되어 있다. 예를 들어, 포유동물 세포에서 본 개시의 방법에 적합한 발현 벡터는 예를 들어, 인비트로젠에 의해 공급된 pcDNA 벡터 스위트의 벡터, pCI 벡터 스위트의 벡터 (프로메가(Promega)), pCMV 벡터 스위트의 벡터 (클론테크(Clontech)), pM 벡터 (클론테크), pSI 벡터 (프로메가), VP 16 벡터 (클론테크) 또는 pcDNA 벡터 스위트의 벡터 (인비트로젠)이다.
당업자는 예를 들어 라이프 테크놀로지스 코포레이션, 클론테크 또는 프로메가와 같은 벡터의 공급원 및 추가적인 이러한 벡터를 알고 있을 것이다.
발현을 위한 세포로 단리된 핵산 및 이를 포함하는 유전자 구조체를 도입하는 방법은 당업자에게 공지되어 있다. 주어진 유기체에 사용되는 기술은 공지된 성공적인 기술에 좌우된다. 세포로 재조합 DNA를 도입하는 방법은 미세주입, DEAE-덱스트란에 의해 매개된 형질감염, 리포솜에 의해 매개된 형질감염, 예를 들어 리포펙타민 (미국, 메릴랜드주, 지브코) 및(또는) 셀펙틴 (미국, 메릴랜드주, 지브코)을 사용한 것, PEG-매개 DNA 유입, 전기천공법, 미세입자 충격 예를 들어, 다른 것들 가운데 DNA-코팅된 텅스텐 또는 금 입자 (미국, 위스콘신주, 아그라세투스)를 사용한 것을 포함한다.
다르게는, 본 개시의 발현 구조체는 바이러스 벡터이다. 적합한 바이러스 벡터는 기술분야에 공지되어 있고, 시판된다. 핵산의 전달 및 숙주 세포 게놈으로의 핵산의 통합에 대한 통상적인 바이러스-기재 시스템은 예를 들어, 레트로바이러스 벡터, 렌티바이러스 벡터 또는 아데노-관련 바이러스 벡터를 포함한다. 다르게는, 아데노바이러스 벡터는 숙주 세포에 에피솜에 남는 핵산을 도입하는 데 유용하다. 바이러스 벡터는 목적 세포 및 조직에서 유전자 전달의 효율적 및 다용도 방법이다. 추가적으로, 높은 형질도입 효율은 많은 상이한 세포 유형 및 목적 조직에서 관찰되었다.
예를 들어, 레트로바이러스 벡터는 일반적으로 외래 서열의 6-10 kb 이하에 대한 패키징 용량을 갖는 시스-작용 장쇄 말단 반복부 (LTR)를 포함한다. 최소 시스-작용 LTR는 이어서 장기 발현을 제공하도록 목적 세포로 발현 구조체를 통합하는 데 사용되는, 벡터의 복제 및 패키징에 충분하다. 널리 사용되는 레트로바이러스 벡터는 뮤린 백혈병 바이러스 (MuLV), 긴팔원숭이 백혈병 바이러스 (GaLV), 원숭이 면역결핍 바이러스 (SrV), 인간 면역결핍 바이러스 (HIV) 및 이의 조합을 기재로 한 것을 포함한다 (예를 들어, 문헌 [Buchscher et al. J. Virol. 56:2731-2739 (1992); Johann et al. J. Virol 65:1635-1640 (1992)]; 문헌 [Sommerfelt et al. Virol 76:58-59 (1990)]; 문헌 [Wilson et al. J. Virol 63:274-2318 (1989)]; 문헌 [Miller et al. J. Virol 65:2220-2224 (1991)]; 문헌 [PCT/US94/05700]; 문헌 [Miller et al. BioTechniques 7:980-990, 1989]; 문헌 [Miller, Human Gene Therapy 7:5-14, 1990]; 문헌 [Scarpa et al. Virology 75:849-852, 1991]; 및 문헌 [Burns et al. Proc. Natl Acad. Sci USA 90:8033-8037, 1993] 참조).
다양한 아데노-관련 바이러스 (AAV) 벡터 시스템은 핵산 전달에 대하여 이미 발전하였다. AAV 벡터는 기술분야에 공지된 기술을 사용하여 손쉽게 구축될 수 있다. 예를 들어, 미국 특허 5,173,414 및 5,139,941호; 국제 공보 WO 92/01070 및 WO 93/03769; 문헌 [Lebkowski et al. Molec. Cell Biol 5:3988-3996, 1988; Vincent et al. (1990) Vaccines 90 (Cold Spring Harbor Laboratory Press)]; 문헌 [Carter, Current Opinion in Biotechnology 5:533-539, 1992]; 문헌 [Muzyczka, Current Topics in Microbiol, and Immunol. 755:97-129, 1992]; 문헌 [Kotin, Human Gene Therapy 5:793-801, 1994]; 문헌 [Shelling et al. Gene Therapy 7:165-169, 1994]; 및 문헌 [Zhou et al. J Exp. Med. 779:1867-1875, 1994]을 참조하여라.
본 개시의 발현 구조체를 전달하는 데 유용한 추가적인 바이러스 벡터는 예를 들어, 폭스(pox) 족으로부터 유도된 것, 예를 들어, 우두 바이러스 및 조류 폭스바이러스 또는 알파바이러스 또는 접합체 바이러스 벡터 (예를 들어 문헌 [Fisher-Hoch et al. Proc. Natl Acad. Sci. USA 56:317-321, 1989]에서 기재된 것)를 포함한다.
외인
줄기 세포와의
공동 투여
본 발명의 방법에서 사용된 임의의 펩티드 또는 줄기 세포 (예를 들어, SDF-1 또는 프로테아제-내성 돌연변이 SDF-1 펩티드를 발현하는 줄기 세포)는 외인 줄기 세포와 투여될 수 있다. 본 발명의 펩티드 또는 유전자 변형 줄기 세포와 함께 투여될 수 있는 세포는 다능성 또는 분화다능성 줄기 세포, 또는 골수 세포에 제한되지 않으면서 이를 포함한다. 적합한 외인 줄기 세포의 실시예는 성체 줄기 세포, 중간엽 전구 세포 (예를 들어, 중간엽 전구 세포 표지자 STRO-1을 발현하는 세포, 예를 들어, 미국 공보 2014/0271567호에서 기재된, STRO-1밝음 세포) 및 중간엽 줄기 세포를 포함한다. 일부 실시양태에서, 외인 줄기 세포는 대상과 동종일 수 있다. 다른 실시양태에서, 외인 줄기 세포는 대상에 대한 자가 유래의 것일 수 있다.
외인 줄기 세포는 본 발명의 조성물과 투여 직전에 또는 잠시 전에 혼합될 수 있거나, 이는 투여 이전에 일정 기간 동안 함께 공동 배양될 수 있다. 다른 경우에서, 외인 줄기 세포는 본 발명의 펩티드 및(또는) 줄기 세포 (예를 들어, SDF-1 또는 프로테아제-내성 SDF-1 펩티드를 발현하는 줄기 세포)와는 별도로 투여될 수 있다. 외인 줄기 세포는 펩티드 또는 발현하는 줄기 세포와 동시에, 이전 또는 이후에 투여될 수 있다.
한 실시예에서, 대상에 투여되는 조성물은 줄기 세포의 효과적인 양 또는 치료상 또는 예방상 효과적인 양을 포함할 수 있다. 투여될 줄기 세포의 예시적인 범위는 약 1x103 세포/kg 내지 약 1x109 세포/kg (예를 들어, 1x103 세포/kg, 1x104 세포/kg, 1x105 세포/kg, 1x106 세포/kg, 1x107 세포/kg, 1x108 세포/kg, 1x109 세포/kg)이다. 예컨대, 조성물은 약 1x105 STRO-1+ 세포/kg 내지 약 1x107 STRO-1+ 세포/kg, 또는 약 1x106 내지 약 5x106 STRO-1+ 세포/kg를 포함할 수 있다. 투여될 세포의 정확한 양은 환자의 나이, 무게, 성별 및 대상에서의 조직 손상의 중증도 및 정도를 포함하는 다양한 인자에 의존한다.
한 실시예에서, 세포는 대상의 무게와 관계 없이 총 세포 개수 투여량으로 투여된다. 예를 들어, 일부 경우에서, 줄기 세포는 대상의 무게와 관계 없이 약 5000만 내지 5억 세포 (e.g., 5000만, 1억, 1억5000만, 2억, 2억5000만, 3억, 3억5000만, 4억, 4억5000 만, 또는 5억 세포)의 투여량으로 투여된다.
일부 경우에서, 줄기 세포는 세포가 대상의 순환으로 나가도록 허용하지 않으나 순환에 진입하도록 세포에 의해 분비된 인자는 허용하는 챔버 내에 포함된다. 이러한 방식에서 가용성 인자는 세포가 대상의 순환으로 인자를 분비하도록 세포를 허용함에 의하여 대상에 투여될 수 있다. 이러한 챔버는 가용성 인자의 국부 수준을 증가시키도록 대상의 부위에 이식, 예를 들어, 대상에서 조직 손상의 부위와 가까운 부위에 이식될 수 있다.
본 발명의 일부 실시예에서, 외인 줄기 세포를 포함하는 조성물로의 치료의 개시 이전에 대상을 면역 억제하는 것은 필요하거나 바람직하지 않을 수 있다. 예를 들어, 동종, 또는 심지어 이종, STRO1+ 세포 또는 이의 후손의 이식은 일부 경우에서 허용될 수 있다.
그러나, 다른 실시예에서 세포 요법 개시 이전에 약리학적으로 환자를 면역 억제 및(또는) 외인 줄기 세포를 포함하는 조성물에 대한 대상의 면역 반응을 감소시키는 것이 바람직하거나 적절할 수 있다. 이는 기술분야에 공지된 다양한, 전신 또는 국부 면역 억제제의 사용을 통하여 달성될 수 있거나, 상기와 같은, 캡슐화된 장치에서 세포를 전달함에 의하여 달성될 수 있다. 세포는 세포가 분비하나 면역 체액 인자 및 세포에 불투과성인 치료 인자(들) 및 세포가 필요로 하는 영양분 및 산소에 투과성인 캡슐로 캡슐화될 수 있다. 예를 들어, 캡슐화 된 것(encapsulant)은 저알레르기성이고, 목적 조직에 쉽고 안정적으로 위치되고, 이식 구조에 추가된 방어를 제공한다. 이식된 세포에 대한 면역 반응을 감소시키거나 제거하는 이러한 및 다른 수단은 기술분야에 공지되어 있다. 대안으로서, 외인 줄기 세포는 이의 면역원성을 감소시키도록 유전자 변형될 수 있다.
제약 조성물 및 투여량
본 발명의 방법에서 사용된 임의의 펩티드 또는 줄기 세포는 임의의 적합한 운반체 물질에서 임의의 적합한 양으로 함유될 수 있고, 프로테아제-내성 펩티드 또는 융합 단백질은 조성물의 총 중량의 일반적으로 1-95 중량%, 예를 들어, 5 %, 10 %, 20 %, 또는 50 %의 양으로 존재한다. 본원에서 기재되는 프로테아제-내성 SDF-1 펩티드 또는 융합 단백질은 예를 들어, 식염수, 물, 링거액 및 다른 약 또는 부형제와 같은, 운반체를 포함하는 제약 조성물로 혼입될 수 있다. 조성물은 정맥내 전달 (예를 들어, 주사 또는 이식 가능한 포트에 의해)을 위해 설계된 것이다. 따라서, 조성물은 예를 들어, 현탁액, 에멀젼, 용액, 또는 주사제의 형태일 수 있다. 모든 조성물은 기술분야에서 표준적인 방법을 사용하여 제조될 수 있다 (예를 들어, 문헌 [Remington's Pharmaceutical Sciences, 16th ed., A. Oslo. ed., Easton, PA (1980)]를 참조하여라).
본 발명의 펩티드는 제어된-방출 또는 지속-방출 시스템에서 전달될 수 있다. 예를 들어, 중합체성 물질은 펩티드의 제어된 또는 지속 방출을 달성하는 데 사용될 수 있다 (예를 들어, 본원에서 참조로 포함되는 문헌 [Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, Fla. (1974)]; 문헌 [Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, N.Y. (1984)]; 미국 특허 5,679,377; 5,916,597; 5,912,015; 5,989,463호; 및 5,128,326; PCT 공보 WO 99/15154 및 WO 99/20253을 참조하여라). 지속-방출 제형에서 사용되는 중합체의 예시는 예를 들어, 폴리(2-히드록시 에틸 메타크릴레이트), 폴리(메틸 메타크릴레이트), 폴리(아크릴산), 폴리(에틸렌-코-비닐 아세테이트), 폴리(메타크릴산), 폴리글리콜리드 (PLG), 폴리무수물, 폴리(N-비닐 피롤리돈), 폴리(비닐 알콜), 폴리아크릴아미드, 폴리(에틸렌 글리콜), 폴리락티드 (PLA), 폴리(락티드-코-글리콜리드) (PLGA), 폴리글루탐산 (PGA) 및 폴리오르소에스테르를 포함한다.
당업자가 임상 의학에서 확실히 자리 잡은 방법을 사용하여 케이스에 따라 펩티드의 투여량을 조절할 수 있다는 것이 예상된다. 최적 투여량은 기술분야에 공지된 방법으로 결정될 수 있고, 치료되는 대상의 나이, 질병 상태, 및 다른 임상적인 관련 인자와 같은 인자들에 의해 영향을 받을 수 있다. 일반적으로, 인간에 투여할 때, 본원에서 기재된 임의의 치료제 (예를 들어, SDF-1 또는 프로테아제-내성 돌연변이 SDF-1 펩티드)의 투여량은 치료제의 성질에 의존할 것이며, 당업자에 의해 손쉽게 결정될 수 있다. 전형적으로, 이러한 투여량은 보통 하루에 약 0.001 ㎍ 내지 2000 mg, 바람직하게 하루에 약 1 mg 내지 1000 mg, 보다 바람직하게 하루에 약 5 mg 내지 500 mg이다. 한 실시양태에서 투여량은 0.01 mg/kg 내지 100 mg/kg, 또는 바람직하게 하루에 1 mg/kg 내지 10 mg/kg (예를 들어, 하루에 1 mg/kg, 2 mg/kg, 3 mg/kg, 4 mg/kg, 5 mg/kg, 6 mg/kg, 7 mg/kg, 8 mg/kg, 9 mg/kg 및 10 mg/kg)이다.
본 발명의 펩티드 또는 줄기 세포는 매일 한 번, 두 번, 세 번, 네 번 또는 다섯 번; 매주 한 번, 매주 두 번, 매주 세 번, 매주 네 번, 매주 다섯 번 또는 매주 여섯 번; 한 달에 한 번, 두 달에 한 번, 세 달에 한 번, 또는 여섯 달에 한 번; 또는 매년 한 번 정맥내 투여될 수 있다. 다르게는, 본 발명의 펩티드 또는 줄기 세포는 한 번 또는 두 번 투여될 수 있고, 반복된 투여가 필요하지 않을 수 있다. 본원에서 기재되는 펩티드 또는 줄기 세포의 투여는 조직 손상 (예를 들어, 심근경색증 또는 말초혈관병으로부터 기인하는 조직 손상)이 치유 또는 개선될 때까지 계속될 수 있다. 치료의 지속시간은 예를 들어, 하루 내지 한 주, 한 주 내지 한 달, 한 주 내지 일 년, 또는 한 주 내지 일 년 초과일 수 있고; 다르게는, 본 발명의 펩티드 또는 줄기 세포는 보다 짧거나 보다 긴 지속시간 동안 투여될 수 있다. 펩티드 또는 줄기 세포의 계속된 1일 투여량은 필요하지 않을 수 있다. 치료법은 조성물이 투여되지 않을, 사이클을 필요로 할 수 있거나, 치료는 필요에 따라 제공될 수 있다.
본 발명의 SDF-1 또는 돌연변이 SDF-1 펩티드 또는 줄기 세포는 조직 손상의 바로 그 시점에서 또는 조직 손상의 초기 발생 후 또는 질병 또는 상태 (예를 들어, 심근경색증 후 또는 급성 기관 손상, 예를 들어 급성 콩팥 또는 간 손상)의 시작, 인식, 또는 진단 후 수 분 내에 전달될 수 있다. 본 발명의 SDF-1 또는 돌연변이 SDF-1 펩티드는 초기 조직 손상이 뒤따르는 짧은 또는 긴 지연 후에 전달될 수도 있다. 예를 들어, 본 발명의 SDF-1 또는 돌연변이 SDF-1 펩티드 또는 줄기 세포는 조직 손상의 초기 발생 후 또는 질병 또는 상태의 시작, 인식, 또는 진단 후 수 분 내지 1 시간 이내, 2 시간, 3 시간, 4 시간, 6 시간, 12 시간, 24 시간, 48 시간 이상, 3 일 이상, 4 일, 5 일, 6 일, 7 일, 10 일, 2 주, 한 달, 두 달, 세 달, 여섯 달, 일 년, 이 년 이상에 이르는 초기 손상 발생 후에 임의의 기간 뒤 전달될 수 있다. PVD, 당뇨병성 상처, 만성 기관 손상 (예를 들어, 만성 콩팥 또는 간 손상) 및 염증 상태 (예를 들어, 류마티스 관절염 또는 크론병)로부터 기인하는 손상을 포함하나 이에 제한되지 않는, 본래 보다 만성이고 기간에 걸쳐 일어나는 조직 손상에 대해, 본 발명의 SDF-1 또는 돌연변이 SDF-1 펩티드 또는 줄기 세포는 손상의 시작 후 즉시 또는 손상 (예를 들어, PVD 또는 당뇨병성 상처)의 진단 또는 초기 또는 후속적인 징조 후 즉시 전달될 수 있다. 이러한 경우에서, 본 발명의 SDF-1 또는 돌연변이 SDF-1 펩티드 또는 줄기 세포의 전달은 조직 손상이 발생한 후 또는 조직 손상 또는 질병 또는 상태의 시작, 인식, 또는 진단 후 삼 일, 칠 일, 일 주, 이 주, 삼 주, 한 달, 두 달, 세 달, 네 달, 다섯 달, 여섯 달, 또는 심지어 일 년 이상 뒤일 수 있다.
본원에서 기재되는 임의의 유형의 조직 손상, 질병, 또는 장애에 대해, 본 발명의 SDF-1 또는 돌연변이 SDF-1 펩티드 또는 줄기 세포의 초기 IV 투여는 조직 손상의 초기 발생, 인식 또는 진단 후 수 분 내지 이 년, 또는 조직 손상의 초기 발생, 인식 또는 진단 후 한 시간 내지 이 년, 조직 손상의 초기 발생, 인식 또는 진단 후 하루 내지 일 년, 조직 손상의 초기 발생, 인식 또는 진단 후 하루 내지 여섯 달, 조직 손상의 초기 발생, 인식 또는 진단 후 한 달 내지 여섯 달, 조직 손상의 초기 발생, 인식 또는 진단 후 하루 내지 한 달, 조직 손상의 초기 발생, 인식 또는 진단 후 한 주 내지 한 달, 조직 손상의 초기 발생, 인식 또는 진단 후 한 주 내지 이 주, 조직 손상의 초기 발생, 인식 또는 진단 후 한 시간 내지 한 주, 조직 손상의 초기 발생, 인식 또는 진단 후 한 시간 내지 삼 일, 또는 조직 손상의 초기 발생, 인식 또는 진단 후 수 분 내지 한 시간에 이르는 시간일 수 있다.
본 발명의 SDF-1 또는 돌연변이 SDF-1 펩티드 또는 줄기 세포는 치료의 지속시간에 걸쳐 한 번 또는 치료의 지속시간에 걸쳐 여러 번 전달될 수 있다. 조직 손상의 중증도에 따라, 본 발명의 SDF-1 또는 돌연변이 SDF-1 펩티드 또는 줄기 세포가 손상된 조직의 복구 또는 회복을 가능하게 하도록 시간에 걸쳐 반복적으로 전달될 수 있다.
또한, 본 발명의 SDF-1 또는 돌연변이 SDF-1 펩티드 또는 줄기 세포의 정맥내 전달은 본 발명의 SDF-1 또는 돌연변이 SDF-1 펩티드 또는 줄기 세포의 전달의 추가적인 형태와 결합될 수 있다. 한 실시예에서, 심근경색증 후와 같이, 본 발명의 SDF-1 또는 돌연변이 SDF-1 펩티드 또는 줄기 세포는 처음에 관상동맥내 또는 동맥내 방법을 통하여 전달될 수 있고, 이어서 그 후에 정맥내 방법을 통하여 SDF-1 또는 돌연변이 SDF-1 펩티드 또는 줄기 세포의 후속적인 전달이 일어난다. 또 다른 실시예에서, SDF-1 또는 돌연변이 SDF-1 펩티드 또는 줄기 세포는 처음에 근육내 또는 심근내 방법을 통하여 전달될 수 있고, 이어서 그 후에 정맥내 방법을 통하여 각각 치료의 후속적인 전달이 일어난다. 임의의 이러한 다수의 전달 방법에서, 정맥내 투여는 처음 전달 후 1 일, 2 일, 3 일, 4 일, 5 일, 6 일, 7 일, 2 주, 1 달, 2 달, 3 달, 4 달, 5 달, 6 달, 일 년 이상 뒤 시작된다. 여기서 또한, 조직 손상의 중증도에 의존하여, 본 발명의 SDF-1 또는 돌연변이 SDF-1 펩티드 또는 줄기 세포는 손상된 조직의 복구 또는 회복을 가능하게 하도록 시간에 걸쳐 반복적으로 전달될 수 있다.
본 발명의 방법에서 사용된 펩티드 또는 줄기 세포의 적절한 투여량은 투여 방법, 장애의 중증도, 치료될 대상의 나이, 무게 및 건강 상태를 포함하여, 여러 인자에 의존한다. 추가적으로, 특정 대상에 대한 약물유전적 정보 (예를 들어, 약동학, 약력학에 미치는 유전자형의 영향, 또는 치료의 효능 프로파일)는 사용하는 투여량에 영향을 줄 수 있다.
진단 및 치료
본 발명의 방법은 조직 손상 (예를 들어, 심근경색증으로부터 기인하는 심장 조직의 손상 또는 말초혈관병으로부터 기인하는 조직 손상) 또는 상처 (예를 들어, 당뇨병성 상처)로부터 고통받거나 이를 진단받은 임의의 대상을 치료하는 데 유용하다. 조직 손상은 예를 들어, 심혈관 상태 (예를 들어, 심근경색증); 말초혈관병 (PVD); 말초동맥병 (PAD); 궤양 (예를 들어, 피부 상처 궤양); 수술; 또는 당뇨의 결과일 수 있다. 조직 손상은 또한 CNS 장애 또는 상해 또는 염증 상태 (예를 들어, 류마티스 관절염, 크론병, 또는 이식편대숙주병)로부터 기인할 수도 있다. 본 발명의 방법은 질병 또는 상해로부터 기인하는 기관 손상 (예를 들어, 콩팥 또는 간 손상)의 복구 또는 재생에 사용될 수도 있다. 본 발명의 방법은 상처 치유 또는 조직 복구를 촉진하는 데 사용될 수 있다. 당업자는 본 발명의 대상이 표준 시험을 당했을 수 있고, 검사 없이, 하나 이상의 위험 인자의 존재 때문에 고위험으로 확인되었을 수 있다는 것을 이해할 것이다. 이러한 장애의 진단은 기술분야에 공지된 임의의 표준 방법을 사용하여 수행될 수 있다.
본원에서 기재되는 방법은 프로테아제 (예를 들어, MMP-2, MMP-9, DPPIV, 백혈구 엘라스타아제, 카텝신 G, 카르복시펩티드분해효소 M 및(또는) 카르복시펩티드분해효소 N)의 고농도를 특징으로 하는 임의의 질병 또는 상태를 치료하는 데 사용될 수도 있고, 여기서 프로테아제-내성 SDF-1 펩티드의 투여 시 줄기 세포의 유인은 재생 또는 치유를 유도할 수 있다. 본 발명의 조성물로 치료될 예시적인 장애는 염증 및 허혈 질병 (예를 들어, 심근경색증, 뇌졸중 또는 하지 허혈), 상처 치유 및 당뇨병성 궤양을 포함한다.
치료의 효능은 예를 들어, 질병 또는 장애의 증상 측정, 물리적인 검사, 조직병리학적 검사, 혈액 화학 성분 분석, 컴퓨터 단층촬영, 세포학적 검사, 자기 공명 영상을 포함하여, 당업자에게 공지된 방법을 사용하여 모니터링될 수 있다. 소정의 실시양태에서, 혈류역학 데이터는 치료의 효능을 측정하도록 수집된다. 혈류역학 시험은 예를 들어, 박출률 (예를 들어, 각 심장 박동에서 심실에서 쏟아내는 혈액의 분율)의 측정, 확장기말압력을 측정하는 것 및 수축기말용적 (예를 들어, 좌심실에 존재하는 혈액의 부피)을 측정하는 것을 포함할 수 있다. 한 실시예에서, 혈류역학 시험은 심근경색증 또는 심장 허혈의 다른 형태로부터 기인하는 조직 손상으로부터 고통받는 대상에서 심장 기능을 모니터링하는 데 사용될 수 있다.
본 발명의 방법은 상처 치유 또는 조직 복구를 촉진하도록 추가적인 치료와 결합하여 사용될 수 있다. 본 발명의 방법과 결합하여 사용될 수 있는 치료 요법은 헤파린, β-차단제 (예를 들어, 아테놀롤, 메토프롤롤, 나돌롤(nadolol), 옥스프레놀롤, 핀돌롤, 프로프라놀롤, 또는 티몰롤), 안지오텐신 전환 효소 (ACE) 억제제 (예를 들어, 캅토프릴, 에날라프릴, 포시노프릴, 리시노프릴, 페린도프릴, 퀴나프릴, 라미프릴, 트란도라프릴, 또는 베나제프릴), 안지오텐신 II 수용체 차단제 (예를 들어, 칸데사르탄, 에프로사르탄, 이베사르탄, 로사르탄, 올메사르탄, 텔미사르탄, 또는 발사르탄), 이뇨제, 아스피린, 콜레스테롤저하제 (예를 들어, HMG-CoA 환원효소 억제제 (예를 들어, 아토르바스타틴, 세리바스타틴, 플루바스타틴, 로바스타틴, 메바스타틴, 피타바스타틴, 프라바스타틴, 로수바스타틴, 또는 심바스타틴)), 세포 치료, 항혈소판제 (예를 들어, 클로피도그렐, 프라수그렐, 티클로피딘, 실로스타졸, 압식시맙, 엡티피바티드, 티로피반, 또는 디피리다몰), 항고혈압제, 항부정맥제 (예를 들어, 퀴니딘, 프로카인아미드(procainamide), 디소피라미드, 리도카인, 멕시레틴, 토카이니드, 페니토인, 모리시진(moricizine), 플레카이니드, 소탈롤, 이부틸리드(ibutilide), 아미오다론, 브레틸리움, 도페틸리드(dofetilide), 딜티아젬 또는 베라파밀), 맥관형성제, 상처 드레싱, PDGF 및(또는) 음압 장치 및 치료를 포함하지만 이에 제한되지 않는다.
실시예
본 발명은 본 발명을 제한할 의도가 아닌, 하기 실시예로 나타난다.
실시예
1. 프로테아제 내성
SDF
-1
변이체의
지연된 및
IV 투여는 설치류 허혈 재관류 모델에서 심장 기능을 개선시킨다
하기 실시예에서, 우리는 mSDF-1 펩티드-함유 조성물의 정맥내 전달 및 장기간 지연된 투여가 허혈 재관류 모델에서 심장 기능을 개선시킨다는 것을 입증하는 실험을 기재하였다.
쥐를 0.05 mg/kg 부프레노르핀 및 2-3 % 이소플루란으로 마취시켰다. 삽관 후, 4 및 5 번 갈비뼈 사이를 개흉하였고, 좌전하행 (LAD) 관상동맥을 90 분 동안 결찰하였다. 90 분 후, 경색증 구역에서 재관류를 개시하도록 봉합사를 LAD로부터 제거하였다. 쥐의 가슴 및 피부를 이후에 닫았다. mSDF-1 펩티드를 경색증 7 일 후 (군 당 >15 쥐) 정맥내 주사로 투여하였다. 정맥내 주사에는, PBS에서 S-SDF-1 (S4V) 100 ㎕ (0, 0.1 및 1.0 mg/kg의 투여량에서)를 쥐의 꼬리 정맥에 주사하였다.
상기 각각의 실험에서, 쥐의 혈류역학 기능을 정맥내 투여 4 주 후 (허혈 재관류 상해 후 5 주) 랜덤화된 및 블라인드 연구로 분석하였다. 쥐를 0.05 mg/kg 부프레노르핀 및 2-3 % 이소플루란으로 마취시켰다. 16G 기관내 튜브를 쥐에 삽입하였고, 기계적 환기를 시작하였다. 왼쪽 목정맥을 고삼투압 식염수 (물에서 25 % NaCl 용액 50 ㎕)를 전달하도록 PE 10으로 캐뉼라 삽입하였다. 고삼투압 식염수를 부피 측정의 평행 전도도를 측정하는 데 사용하였다.
박출률 (EF) 및 심실내 압력을 측정하기 위하여, 오른쪽 목동맥을 캐뉼라 삽입하였다. 압력-부피 카테터를 삽입하였고 좌심실로 통과하도록 하였다. 기저 압력-부피 측정을 얻었다. 고삼투압 식염수 (상기)를 목정맥으로 주사하였고, 이어서 압력-부피 측정을 얻었다.
우리의 결과는 허혈 재관류 상해 7 일 후 S-SDF-1(S4V)의 정맥내 주사가 PBS 대조군과 비교하여 쥐에서의 박출률 10 % 개선을 야기하였다는 것을 보여준다 (도 1).
실시예
2. 프로테아제 내성
SDF
-1
변이체의
지연된 및
IV
투여는 돼지
허혈
재관류
모델에서 심장 기능을
개선시킨다
우리는 또한 마이크로 유카탄 돼지 경색증 모델에서 심장 기능에 미치는 mSDF-1 펩티드-함유 조성물의 정맥내 전달 및 지연된 투여의 영향을 측정하였다.
이러한 실험에서, 돼지를 마취시켰고, 이의 좌전하행 (LAD) 관상동맥을 벌룬 카테터로 차단하였다. 90 분 후, 벌룬 카테터를 경색증 구역에서 재관류를 개시하도록 LAD로부터 제거하였다. 돼지의 가슴 및 피부를 이어서 닫았다. 랜덤화된 및 블라인드 연구를 허혈 후 즉시 관상동맥내 투여를 통한 PBS 대조군 또는 mSDF-1 펩티드 (1 mg/kg 또는 3 mg/kg에서)로 처음 투여를 수행하였다 (세 군의 각각에 대해 n = 5 돼지). 경색증 후 4 주 (한 달)에, PBS 대조군 또는 mSDF-1 펩티드 (1 mg/kg 또는 3 mg/kg에서)의 두 번째 투여를 정맥내 투여하였다.
상기 각각의 실험에서, 박출률 (EF)을 경색증 후 4 주, 경색증 후 8 주, 경색증 후 12 주에서 측정하였다. 우리의 결과는 mSDF-1 펩티드로 3 mg/kg 투여된 돼지의 경색증 후 12 주에서 EF의 상당한 개선을 입증하였다 (도 2). 특히, 우리는 대조군 (단면 T 시험(1-sided T-test), p < 0.05)과 비교하여 3 mg/kg mSDF-1 펩티드로 투여된 돼지의 경색증 후 12 주에서 2.7 % 절대 EF 개선을 관찰하였다. 보다 낮은 투여량 군 (1 mg/kg mSDF-1 펩티드)은 4-12 주 동안 지속되는, EF 개선을 향한 명확한 경향을 보여주었다 (도 2).
다른 실시양태
앞선 기재로부터, 다양한 용도 및 조건에 적용하도록 본원에서 기재된 발명에 변경 및 변형이 행해질 수 있다는 것은 명백하다. 이러한 실시양태는 또한 하기 청구항의 범위 내에 있다.
본 명세서에서 언급된 모든 공보, 특허 출원 및 특허는 각각의 독립적인 공보 또는 특허 출원이 구체적 및 개별적으로 참조로 포함된 것으로 표시된 것과 같은 동일한 정도로 본원에서 참조로 포함된다.
SEQUENCE LISTING
<110> Mesoblast International S?l et al.
<120> METHODS FOR REPAIRING TISSUE DAMAGE USING PROTEASE-RESISTANT
MUTANTS OF STROMAL CELL DERIVED FACTOR-1
<130> 50591-009WO2
<140> PCT/US2014/070010
<141> 2014-12-12
<150> US 61/915,842
<151> 2013-12-13
<160> 77
<170> PatentIn version 3.5
<210> 1
<400> 1
000
<210> 2
<400> 2
000
<210> 3
<400> 3
000
<210> 4
<400> 4
000
<210> 5
<400> 5
000
<210> 6
<400> 6
000
<210> 7
<400> 7
000
<210> 8
<400> 8
000
<210> 9
<400> 9
000
<210> 10
<400> 10
000
<210> 11
<400> 11
000
<210> 12
<400> 12
000
<210> 13
<400> 13
000
<210> 14
<400> 14
000
<210> 15
<400> 15
000
<210> 16
<400> 16
000
<210> 17
<400> 17
000
<210> 18
<400> 18
000
<210> 19
<400> 19
000
<210> 20
<400> 20
000
<210> 21
<400> 21
000
<210> 22
<400> 22
000
<210> 23
<400> 23
000
<210> 24
<400> 24
000
<210> 25
<400> 25
000
<210> 26
<400> 26
000
<210> 27
<400> 27
000
<210> 28
<400> 28
000
<210> 29
<400> 29
000
<210> 30
<400> 30
000
<210> 31
<400> 31
000
<210> 32
<400> 32
000
<210> 33
<400> 33
000
<210> 34
<400> 34
000
<210> 35
<400> 35
000
<210> 36
<400> 36
000
<210> 37
<400> 37
000
<210> 38
<400> 38
000
<210> 39
<400> 39
000
<210> 40
<400> 40
000
<210> 41
<400> 41
000
<210> 42
<400> 42
000
<210> 43
<400> 43
000
<210> 44
<400> 44
000
<210> 45
<400> 45
000
<210> 46
<400> 46
000
<210> 47
<400> 47
000
<210> 48
<400> 48
000
<210> 49
<400> 49
000
<210> 50
<400> 50
000
<210> 51
<400> 51
000
<210> 52
<211> 68
<212> PRT
<213> Homo sapiens
<400> 52
Lys Pro Val Ser Leu Ser Tyr Arg Cys Pro Cys Arg Phe Phe Glu Ser
1 5 10 15
His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr Pro
20 25 30
Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg Gln
35 40 45
Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu Lys
50 55 60
Ala Leu Asn Lys
65
<210> 53
<211> 68
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<220>
<221> MOD_RES
<222> (3)..(6)
<223> Xaa is any amino acid
<400> 53
Lys Pro Xaa Xaa Xaa Xaa Tyr Arg Cys Pro Cys Arg Phe Phe Glu Ser
1 5 10 15
His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr Pro
20 25 30
Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg Gln
35 40 45
Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu Lys
50 55 60
Ala Leu Asn Lys
65
<210> 54
<211> 68
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 54
Lys Pro His Ser Leu Ser Tyr Arg Cys Pro Cys Arg Phe Phe Glu Ser
1 5 10 15
His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr Pro
20 25 30
Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg Gln
35 40 45
Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu Lys
50 55 60
Ala Leu Asn Lys
65
<210> 55
<211> 68
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 55
Lys Pro Cys Ser Leu Ser Tyr Arg Cys Pro Cys Arg Phe Phe Glu Ser
1 5 10 15
His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr Pro
20 25 30
Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg Gln
35 40 45
Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu Lys
50 55 60
Ala Leu Asn Lys
65
<210> 56
<211> 68
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 56
Lys Pro Val Ser Thr Ser Tyr Arg Cys Pro Cys Arg Phe Phe Glu Ser
1 5 10 15
His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr Pro
20 25 30
Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg Gln
35 40 45
Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu Lys
50 55 60
Ala Leu Asn Lys
65
<210> 57
<400> 57
000
<210> 58
<400> 58
000
<210> 59
<400> 59
000
<210> 60
<211> 68
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 60
Lys Pro Val Ser Val Ser Tyr Arg Cys Pro Cys Arg Phe Phe Glu Ser
1 5 10 15
His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr Pro
20 25 30
Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg Gln
35 40 45
Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu Lys
50 55 60
Ala Leu Asn Lys
65
<210> 61
<211> 68
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 61
Lys Pro Val Ser Leu Cys Tyr Arg Cys Pro Cys Arg Phe Phe Glu Ser
1 5 10 15
His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr Pro
20 25 30
Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg Gln
35 40 45
Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu Lys
50 55 60
Ala Leu Asn Lys
65
<210> 62
<211> 68
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 62
Lys Pro Val Ser Leu Gly Tyr Arg Cys Pro Cys Arg Phe Phe Glu Ser
1 5 10 15
His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr Pro
20 25 30
Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg Gln
35 40 45
Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu Lys
50 55 60
Ala Leu Asn Lys
65
<210> 63
<211> 68
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 63
Lys Pro Val Val Leu Ser Tyr Arg Cys Pro Cys Arg Phe Phe Glu Ser
1 5 10 15
His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr Pro
20 25 30
Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg Gln
35 40 45
Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu Lys
50 55 60
Ala Leu Asn Lys
65
<210> 64
<211> 68
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 64
Lys Pro Val Ser Pro Ser Tyr Arg Cys Pro Cys Arg Phe Phe Glu Ser
1 5 10 15
His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr Pro
20 25 30
Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg Gln
35 40 45
Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu Lys
50 55 60
Ala Leu Asn Lys
65
<210> 65
<211> 68
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 65
Lys Pro Val Val Pro Ser Tyr Arg Cys Pro Cys Arg Phe Phe Glu Ser
1 5 10 15
His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr Pro
20 25 30
Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg Gln
35 40 45
Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu Lys
50 55 60
Ala Leu Asn Lys
65
<210> 66
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 66
Gly Gly Gly Gly Ser
1 5
<210> 67
<211> 302
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 67
Ser Lys Pro Val Val Leu Ser Tyr Arg Cys Pro Cys Arg Phe Phe Glu
1 5 10 15
Ser His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr
20 25 30
Pro Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg
35 40 45
Gln Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu
50 55 60
Lys Ala Leu Asn Lys Gly Gly Gly Gly Ser Val Asp Lys Thr His Thr
65 70 75 80
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
85 90 95
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
100 105 110
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
115 120 125
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
130 135 140
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
145 150 155 160
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
165 170 175
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
180 185 190
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
195 200 205
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
210 215 220
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
225 230 235 240
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
245 250 255
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
260 265 270
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
275 280 285
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
290 295 300
<210> 68
<211> 69
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<220>
<221> MOD_RES
<222> (4)..(7)
<223> Xaa is any amino acid
<400> 68
Ser Lys Pro Xaa Xaa Xaa Xaa Tyr Arg Cys Pro Cys Arg Phe Phe Glu
1 5 10 15
Ser His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr
20 25 30
Pro Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg
35 40 45
Gln Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu
50 55 60
Lys Ala Leu Asn Lys
65
<210> 69
<211> 69
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 69
Ser Lys Pro Val Val Leu Ser Tyr Arg Cys Pro Cys Arg Phe Phe Glu
1 5 10 15
Ser His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr
20 25 30
Pro Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg
35 40 45
Gln Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu
50 55 60
Lys Ala Leu Asn Lys
65
<210> 70
<211> 69
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 70
Ser Lys Pro Val Ser Pro Ser Tyr Arg Cys Pro Cys Arg Phe Phe Glu
1 5 10 15
Ser His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr
20 25 30
Pro Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg
35 40 45
Gln Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu
50 55 60
Lys Ala Leu Asn Lys
65
<210> 71
<211> 69
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 71
Ser Lys Pro Val Val Pro Ser Tyr Arg Cys Pro Cys Arg Phe Phe Glu
1 5 10 15
Ser His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr
20 25 30
Pro Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg
35 40 45
Gln Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu
50 55 60
Lys Ala Leu Asn Lys
65
<210> 72
<211> 69
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 72
Ser Lys Pro His Ser Leu Ser Tyr Arg Cys Pro Cys Arg Phe Phe Glu
1 5 10 15
Ser His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr
20 25 30
Pro Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg
35 40 45
Gln Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu
50 55 60
Lys Ala Leu Asn Lys
65
<210> 73
<211> 69
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 73
Ser Lys Pro Cys Ser Leu Ser Tyr Arg Cys Pro Cys Arg Phe Phe Glu
1 5 10 15
Ser His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr
20 25 30
Pro Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg
35 40 45
Gln Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu
50 55 60
Lys Ala Leu Asn Lys
65
<210> 74
<211> 69
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 74
Ser Lys Pro Val Ser Thr Ser Tyr Arg Cys Pro Cys Arg Phe Phe Glu
1 5 10 15
Ser His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr
20 25 30
Pro Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg
35 40 45
Gln Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu
50 55 60
Lys Ala Leu Asn Lys
65
<210> 75
<211> 69
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 75
Ser Lys Pro Val Ser Val Ser Tyr Arg Cys Pro Cys Arg Phe Phe Glu
1 5 10 15
Ser His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr
20 25 30
Pro Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg
35 40 45
Gln Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu
50 55 60
Lys Ala Leu Asn Lys
65
<210> 76
<211> 69
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 76
Ser Lys Pro Val Ser Leu Cys Tyr Arg Cys Pro Cys Arg Phe Phe Glu
1 5 10 15
Ser His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr
20 25 30
Pro Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg
35 40 45
Gln Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu
50 55 60
Lys Ala Leu Asn Lys
65
<210> 77
<211> 69
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 77
Ser Lys Pro Val Ser Leu Gly Tyr Arg Cys Pro Cys Arg Phe Phe Glu
1 5 10 15
Ser His Val Ala Arg Ala Asn Val Lys His Leu Lys Ile Leu Asn Thr
20 25 30
Pro Asn Cys Ala Leu Gln Ile Val Ala Arg Leu Lys Asn Asn Asn Arg
35 40 45
Gln Val Cys Ile Asp Pro Lys Leu Lys Trp Ile Gln Glu Tyr Leu Glu
50 55 60
Lys Ala Leu Asn Lys
65
Claims (40)
- 돌연변이 SDF-1 (mSDF-1), mSDF-1-Yz, Xp-mSDF-1, 또는 Xp-mSDF-1-Yz의 화학식을 포함하는 기질 세포 유래 인자-1 (SDF-1) 펩티드의 단리된 돌연변이 형태를 포함하는 조성물 또는 발현하는 줄기 세포를 정맥내 투여하는 것을 포함하고,
상기 SDF-1은 서열번호 53의 적어도 아미노산 1-8의 아미노산 서열을 포함하는 펩티드이고 서열번호 53의 남아있는 서열의 모든 또는 임의의 부분에 의하여 C-말단에서 임의적으로 연장되며,
상기 서열번호 53은 아미노산 서열:
K P X3 X4 X5 X6 Y R C P C R F F E S H V A R A N V K H L K I L N T P N C A L Q I V A R L K N N N R Q V C I D P K L K W I Q E Y L E K A L N K (서열번호 53) (여기서 X3, X4, X5 및 X6은 임의의 아미노산임)을 포함하고,
a) Xp는 단백질성 아미노산(들) 또는 프로테아제 방어 유기 군이고, p는 1 내지 4의 임의의 정수이고,
b) Yz는 단백질성 아미노산(들) 또는 프로테아제 방어 유기 군이고, z는 1 내지 4의 임의의 정수이고,
c) 상기 mSDF-1 또는 상기 mSDF-1-Yz는 T 세포에 대한 화학유인물질 활성을 유지하고, 천연 SDF-1의 불활성의 속도보다 적어도 50 % 미만인 속도에서 매트릭스 금속단백분해효소-2 (MMP-2), 매트릭스 금속단백분해효소-9 (MMP-9), 백혈구 엘라스타아제 및(또는) 카텝신 G에 의하여 불활성화되고,
d) 상기 Xp-mSDF-1 또는 상기 Xp-mSDF-1-Yz는 T 세포에 대한 화학유인물질 활성을 유지하고, 천연 SDF-1이 불활성되는 속도보다 적어도 50 % 미만인 속도에서 디펩티딜 펩티드분해효소 IV (DPPIV)에 의하여 불활성화되고, 천연 SDF-1의 불활성의 속도보다 적어도 50 % 미만인 속도에서 MMP-2, MMP-9, 백혈구 엘라스타아제 및(또는) 카텝신 G에 의하여 불활성화되고,
상기 SDF-1의 단리된 돌연변이 형태는 이를 필요로 하는 대상에서 조직 손상을 치료 또는 개선하기에 충분한 양으로 정맥내 투여되는 것인,
상기 대상에서, 질병 또는 상태로부터 기인하는 조직 손상을 치료 또는 개선하는 방법. - 제1항에 있어서, 상기 SDF-1 펩티드의 돌연변이 형태는 서열번호 52의 적어도 아미노산 1-8의 아미노산 서열을 포함하지 않는 것인 방법.
- 제1항 또는 제2항에 있어서, 상기 X3은 발린, 히스티딘, 또는 시스테인인 방법.
- 제1항 또는 제2항에 있어서, 상기 X4는 세린 또는 발린인 방법.
- 제1항 내지 제4항 중 어느 한 항에 있어서, X5는 류신, 프롤린, 트레오닌, 또는 발린인 방법.
- 제1항 내지 제5항 중 어느 한 항에 있어서, X6은 세린, 시스테인, 또는 글라이신인 방법.
- 제1항 내지 제6항 중 어느 한 항에 있어서, 상기 펩티드는 X가 세린 및 p가 1인, Xp-mSDF-1 펩티드 또는 Xp-mSDF-1-Yz 펩티드인 방법.
- 제1항 내지 제6항 중 어느 한 항에 있어서, 상기 펩티드는 Y가 세린 및 z가 1인, mSDF-1-Yz 펩티드 또는 Xp-mSDF-1-Yz 펩티드인 방법.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 상기 SDF-1의 돌연변이 형태는 A가 SDF-1의 단리된 돌연변이 형태이고, n이 0-3의 정수이고, L이 3-9 아미노산의 링커 서열이고, Fc가 면역글로불린의 Fc 영역으로부터의 Fc 펩티드인, 화학식 A-(L)n-Fc를 포함하는 융합 단백질인 방법.
- 제9항에 있어서, n은 1이고, L은 GGGGS (서열번호 66)인 방법.
- 제1항 내지 제10항 중 어느 한 항에 있어서, SDF-1의 돌연변이 형태를 발현하는 줄기 세포가 중간엽 줄기 세포 또는 중간엽 전구 세포인 방법.
- 제1항 내지 제11항 중 어느 한 항에 있어서, 외인 줄기 세포를 투여하는 단계를 추가로 포함하는 방법.
- 제12항에 있어서, 외인 줄기 세포는 중간엽 줄기 세포 또는 중간엽 전구 세포인 방법.
- 제1항 내지 제13항 중 어느 한 항에 있어서, 상기 질병 또는 상태는 뇌졸중, 하지 허혈, 외상으로 인한 조직 손상, 심근경색증, 말초혈관병, 만성심장기능상실, 당뇨병, 당뇨병성 상처 치유, 기관 질병 또는 상해, CNS 질병 또는 상해 및 염증 상태로 이루어진 군에서 선택된 것인 방법.
- 제14항에 있어서, 상기 질병 또는 상태는 심근경색증인 방법.
- 제14항에 있어서, 상기 질병 또는 상태는 말초혈관병인 방법.
- 제14항에 있어서, 상기 질병 또는 상태는 당뇨병인 방법.
- 제14항에 있어서, 상기 질병 또는 상태는 당뇨병성 상처 치유인 방법.
- 제14항에 있어서, 기관 질병 또는 상해는 콩팥 또는 간 질병 또는 상해인 방법.
- 제14항에 있어서, 염증 상태는 류마티스 관절염, 크론병, 또는 이식편대숙주병인 방법.
- 제1항 내지 제20항 중 어느 한 항에 있어서, 상기 줄기 세포 또는 조성물은 말초 또는 중심 정맥에 투여되는 것인 방법.
- 제1항 내지 제21항 중 어느 한 항에 있어서, 상기 줄기 세포 또는 조성물은 상기 질병, 상태, 또는 조직 손상의 시작 후 수 분 내에 투여되는 것인 방법.
- 제1항 내지 제21항 중 어느 한 항에 있어서, 상기 줄기 세포 또는 조성물은 상기 질병, 상태, 또는 조직 손상의 시작 후 12 시간 이내에 투여되는 것인 방법.
- 제1항 내지 제21항 중 어느 한 항에 있어서, 상기 줄기 세포 또는 조성물은 상기 질병, 상태, 또는 조직 손상의 시작 또는 진단 후 24 시간 이상 뒤에 투여되는 것인 방법.
- 제1항 내지 제21항 중 어느 한 항에 있어서, 상기 줄기 세포 또는 조성물은 상기 질병, 상태, 또는 조직 손상의 시작 또는 진단 후 48 시간 이상 뒤 투여되는 것인 방법.
- 제1항 내지 제21항 중 어느 한 항에 있어서, 상기 줄기 세포 또는 조성물은 상기 질병, 상태, 또는 조직 손상의 시작 또는 진단 후 7 일 이상 뒤 투여되는 것인 방법.
- 제1항 내지 제21항 중 어느 한 항에 있어서, 상기 줄기 세포 또는 조성물은 상기 질병, 상태, 또는 조직 손상의 시작 또는 진단 후 한 달 이상 뒤 투여되는 것인 방법.
- 제1항 내지 제21항 중 어느 한 항에 있어서, 상기 줄기 세포 또는 조성물은 상기 질병, 상태, 또는 조직 손상의 시작 또는 진단 후 여섯 달 이상 뒤 투여되는 것인 방법.
- 제1항 내지 제28항 중 어느 한 항에 있어서, 상기 방법이 SDF-1 또는 돌연변이 SDF-1 펩티드, 또는 SDF-1 또는 돌연변이 SDF-1 펩티드를 발현하는 줄기세포의 동맥내 투여와 병용되는 방법.
- 제29항에 있어서, 상기 동맥내 투여는 정맥내 투여 이전에 일어나는 것인 방법.
- 제22항 내지 제30항 중 어느 한 항에 있어서, 상기 질병 또는 상태는 외상으로 인한 조직 손상, 기관 질병, 염증 질병, 심근경색증, 또는 말초혈관병인 방법.
- 제22항 내지 제30항 중 어느 한 항에 있어서, 상기 질병 또는 상태는 심혈관질환인 방법.
- 제1항 내지 제32항 중 어느 한 항에 있어서, 상기 줄기 세포 또는 조성물은 상기 조직 손상이 감소, 복구되거나, 새로운 혈관이 형성이 일어날 때까지 한 번 이상 투여되는 것인 방법.
- 제1항 내지 제32항 중 어느 한 항에 있어서, 상기 줄기 세포 또는 조성물은 상기 질병 또는 상태의 하나 이상의 증상이 개선되도록 한 번 이상 투여되는 것인 방법.
- 제1항 내지 제34항 중 어느 한 항에 있어서, 상기 조직은 심장 조직인 방법.
- 제1항 내지 제34항 중 어느 한 항에 있어서, 상기 조직은 혈관 조직인 방법.
- 제1항 내지 제34항 중 어느 한 항에 있어서, 상기 조직은 기관 조직인 방법.
- 제37항에 있어서, 상기 기관은 콩팥 또는 간인 방법.
- 제1항 내지 제38항 중 어느 한 항에 있어서, 상기 SDF-1의 돌연변이 형태는 서열번호 67의 서열을 포함하는 것인 방법.
- 제1항 내지 제38항 중 어느 한 항에 있어서, 상기 SDF-1는 서열번호 69의 서열을 포함하는 것인 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361915842P | 2013-12-13 | 2013-12-13 | |
| US61/915,842 | 2013-12-13 | ||
| PCT/US2014/070010 WO2015089396A1 (en) | 2013-12-13 | 2014-12-12 | Methods for repairing tissue damage using protease-resistant mutants of stromal cell derived factor-1 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20160096640A true KR20160096640A (ko) | 2016-08-16 |
Family
ID=53371868
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167017818A KR20160096640A (ko) | 2013-12-13 | 2014-12-12 | 기질 세포 유래 인자-1의 프로테아제-내성 돌연변이를 사용한 조직 손상의 복구 방법 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US20160303197A1 (ko) |
| EP (1) | EP3079711A4 (ko) |
| JP (1) | JP2017500316A (ko) |
| KR (1) | KR20160096640A (ko) |
| CN (1) | CN106029086A (ko) |
| AU (1) | AU2014362198A1 (ko) |
| CA (1) | CA2933620A1 (ko) |
| IL (1) | IL246182A0 (ko) |
| SG (1) | SG11201604793YA (ko) |
| WO (1) | WO2015089396A1 (ko) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9308277B2 (en) | 2010-02-25 | 2016-04-12 | Mesoblast International Sàrl | Protease-resistant mutants of stromal cell derived factor-1 in the repair of tissue damage |
| JP6145089B2 (ja) | 2011-06-07 | 2017-06-07 | メソブラスト インターナショナル エスエイアールエル | ストロマ細胞由来因子−1のプロテアーゼ耐性変異体を用いた、組織損傷を修復するための方法 |
| US9035277B2 (en) | 2013-08-01 | 2015-05-19 | Taiwan Semiconductor Manufacturing Company, Ltd. | Semiconductor device and fabricating the same |
| CA3055761A1 (en) | 2017-03-30 | 2018-10-04 | Wake Forest University Health Sciences | Methods of treatment for kidney disease |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2003901668A0 (en) * | 2003-03-28 | 2003-05-01 | Medvet Science Pty. Ltd. | Non-haemopoietic precursor cells |
| US20050271639A1 (en) * | 2002-08-22 | 2005-12-08 | Penn Marc S | Genetically engineered cells for therapeutic applications |
| US8516469B2 (en) * | 2005-07-25 | 2013-08-20 | Flexera Software Llc | Function binding method and system |
| US7696309B2 (en) * | 2006-10-23 | 2010-04-13 | The Brigham And Women's Hospital, Inc. | Protease resistant mutants of stromal cell derived factor-1 in the repair of tissue damage |
| US8095290B2 (en) * | 2008-08-01 | 2012-01-10 | GM Global Technology Operations LLC | Method to control vehicular powertrain by monitoring map preview information |
| US20110022413A1 (en) * | 2009-07-27 | 2011-01-27 | Welltrek International | Systems and methods for maintaining comprehensive medical records |
| US9308277B2 (en) * | 2010-02-25 | 2016-04-12 | Mesoblast International Sàrl | Protease-resistant mutants of stromal cell derived factor-1 in the repair of tissue damage |
| JP6145089B2 (ja) * | 2011-06-07 | 2017-06-07 | メソブラスト インターナショナル エスエイアールエル | ストロマ細胞由来因子−1のプロテアーゼ耐性変異体を用いた、組織損傷を修復するための方法 |
| US20150056170A1 (en) * | 2012-03-06 | 2015-02-26 | Sct&B Inc. | Placental stem cells, methods for isolating same and use thereof |
-
2014
- 2014-12-12 US US15/103,153 patent/US20160303197A1/en not_active Abandoned
- 2014-12-12 SG SG11201604793YA patent/SG11201604793YA/en unknown
- 2014-12-12 WO PCT/US2014/070010 patent/WO2015089396A1/en active Application Filing
- 2014-12-12 JP JP2016539145A patent/JP2017500316A/ja active Pending
- 2014-12-12 CA CA2933620A patent/CA2933620A1/en not_active Abandoned
- 2014-12-12 CN CN201480075473.6A patent/CN106029086A/zh active Pending
- 2014-12-12 EP EP14869229.6A patent/EP3079711A4/en not_active Withdrawn
- 2014-12-12 AU AU2014362198A patent/AU2014362198A1/en not_active Abandoned
- 2014-12-12 KR KR1020167017818A patent/KR20160096640A/ko not_active Application Discontinuation
-
2016
- 2016-06-13 IL IL246182A patent/IL246182A0/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| SG11201604793YA (en) | 2016-07-28 |
| EP3079711A4 (en) | 2017-05-17 |
| CA2933620A1 (en) | 2015-06-18 |
| IL246182A0 (en) | 2016-07-31 |
| AU2014362198A1 (en) | 2016-07-07 |
| WO2015089396A1 (en) | 2015-06-18 |
| JP2017500316A (ja) | 2017-01-05 |
| US20160303197A1 (en) | 2016-10-20 |
| EP3079711A1 (en) | 2016-10-19 |
| CN106029086A (zh) | 2016-10-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CA2567177C (en) | Genetically engineered cells for therapeutic applications | |
| DK2913058T3 (en) | Hitherto unknown method of treatment of myocardial infarction using HMGB1 fragment | |
| AU2008232739B2 (en) | Method of treating ischemic disorders | |
| PT1442058E (pt) | Péptidos eficazes no tratamento de tumores e outros estados que exigem a remoção ou a destruição de células | |
| AU2017213440A1 (en) | Methods for repairing tissue damage using protease-resistant mutants of stromal cell derived Factor-1 | |
| KR20160096640A (ko) | 기질 세포 유래 인자-1의 프로테아제-내성 돌연변이를 사용한 조직 손상의 복구 방법 | |
| PT1390403E (pt) | Péptidos derivados a partir de proteínas de filamento neural e a sua utilização médica | |
| JP2022547051A (ja) | 治療用融合タンパク質 | |
| JP2019031511A (ja) | 低酸素誘導因子−1アルファを有する組成物および当該組成物を用いる方法 | |
| BRPI0617384A2 (pt) | polipeptÍdeo, seus sais, derivados e/ou conjugados farmacologicamente aceitÁveis, uso dos mesmos, medicamento, agente para prevenir o aprisionamento de monàcitos, e, Ácido nucleico | |
| WO2012027170A1 (en) | Methods for repairing tissue damage using protease-resistant mutants of stromal cell derived factor-1 | |
| CN107083366A (zh) | 表达水蛭素的过继免疫细胞及其制备方法和用途 | |
| TWI359030B (en) | Treatment of cellular proliferative disorders | |
| KR20210133947A (ko) | 디프테리아 독소-인간 인터루킨-3 접합체를 다른 제제와 조합하여 사용해서 골수증식성 신생물을 치료하는 조합 치료 방법 | |
| KR20170019147A (ko) | 손상 조직으로 이동 능력이 향상된 중간엽 줄기세포 및 이의 제조 방법 | |
| WO2007111350A1 (ja) | 血管新生ならびに癌細胞のmesenchymal型およびamoeboid型浸潤を阻害するための薬剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |