JP2017500316A - ストロマ細胞由来因子−1のプロテアーゼ耐性変異体を用いた、組織損傷を修復する方法 - Google Patents
ストロマ細胞由来因子−1のプロテアーゼ耐性変異体を用いた、組織損傷を修復する方法 Download PDFInfo
- Publication number
- JP2017500316A JP2017500316A JP2016539145A JP2016539145A JP2017500316A JP 2017500316 A JP2017500316 A JP 2017500316A JP 2016539145 A JP2016539145 A JP 2016539145A JP 2016539145 A JP2016539145 A JP 2016539145A JP 2017500316 A JP2017500316 A JP 2017500316A
- Authority
- JP
- Japan
- Prior art keywords
- sdf
- disease
- peptide
- msdf
- tissue damage
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/28—Bone marrow; Haematopoietic stem cells; Mesenchymal stem cells of any origin, e.g. adipose-derived stem cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/195—Chemokines, e.g. RANTES
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/6811—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a protein or peptide, e.g. transferrin or bleomycin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
Abstract
Description
を含み、式中、X3、X4、X5、およびX6は任意のアミノ酸であり、かつ
a)Xpはタンパク質構成(proteinogenic)アミノ酸(複数可)またはプロテアーゼ保護有機基であり、かつpは1〜4の任意の整数であり;
b)Yzはタンパク質構成アミノ酸(複数可)またはプロテアーゼ保護有機基であり、かつzは1〜4の任意の整数であり;
c)mSDF-1またはmSDF-1-Yzは、T細胞に対する化学誘引物質活性を維持し、かつ天然SDF-1の不活性化の割合の少なくとも50%未満である割合でマトリックスメタロプロテイナーゼ-2(MMP-2)、マトリックスメタロプロテイナーゼ-9(MMP-9)、白血球エラスターゼ、および/またはカテプシンGによって不活性化され;ならびに
d)Xp-mSDF-1またはXp-mSDF-1-Yzは、T細胞に対する化学誘引物質活性を維持し、天然SDF-1が不活性化される割合の少なくとも50%未満である割合でジペプチジルペプチダーゼIV(DPPIV)によって不活性化され、かつ天然SDF-1の不活性化の割合の少なくとも50%未満である割合でMMP-2、MMP-9、白血球エラスターゼ、および/またはカテプシンGによって不活性化され;
単離したSDF-1の変異型を、対象における組織損傷を治療するまたは改善するのに十分な量で静脈内に投与する。
本発明の方法に用いられるSDF-1または変異体SDF-1ペプチド含有組成物もしくは発現幹細胞組成物を、例えば静脈内(IV)注射によってまたは埋め込み式デバイス(例えば、カテーテル)を用いて静脈内に投与する。静脈内投与は、一般的に、末梢静脈(例えば、腕の静脈、脚の静脈、手の甲、または肘正中皮静脈)を含むがこれに限定されない、哺乳動物の身体における任意の利用可能な静脈内への注射、または大静脈(例えば、上大静脈もしくは下大静脈、または右心房内)への中心ラインによる注射を伴う。静脈内投与には、末梢挿入中心カテーテル、中心静脈ライン、または埋め込み式ポートによる投与も含まれてよい。
SDF-1は、ケモカイン(C-X-Cモチーフ)リガンド12(CXCL12)と公式に指定されている、ケモカインファミリーに属する小さなサイトカインである。SDF-1は、同じ遺伝子の選択的スプライシングによって、SDF-1α(CXCL12a)、SDF-1β(CXCL12b)、およびSDF-1γという複数の形態で産生される。
を有し、式中、X3、X4、X5、およびX6は任意のアミノ酸残基である、配列番号53の少なくともアミノ酸1〜8を有し、かつC末端において配列番号53の残りの配列のすべてまたは任意の部分伸長していてよい。
式中、X3、X4、X5、およびX6は任意のアミノ酸残基である。
本発明の方法は、本明細書において記載されるSDF-1、mSDF-1、Xp-mSDF-1、mSDF-1-Yz、またはXp-mSDF-1-Yzペプチド配列のいずれかがIgG(例えば、ヒトIgG1)のFc領域に連結されている融合タンパク質も利用してよい。あるいは、Fc領域は、ヒト、またはブタ、マウス、ウサギ、ハムスター、ヤギ、ラット、およびモルモットを含む他の動物のIgA、IgM、IgE、またはIgDに由来してよい。IgGのFc領域には、IgG重鎖のCH2およびCH3ドメイン、ならびにヒンジ領域が含まれる。ヒンジは、Fc融合タンパク質の2つの部分間の柔軟性のあるスペーサーとして働き、分子のそれぞれの部分が独立して機能するのを可能にする。本発明に用いられるFc領域を、例えば単量体型および二量体型に調製することができる。
本発明の方法に用いられるSDF-1またはプロテアーゼ耐性変異体SDF-1ペプチドを、例えば標準的N-tert-ブトキシカルボニル(butyoxycarbonyl)(t-Boc)化学反応を用いた固相ペプチド合成、およびn-メチルピロリドン(methylpyrolidone)化学反応を用いたサイクルによって作製することができる。ペプチドを合成するための例示的な方法は、参照により本明細書に組み入れられる、例えば米国特許第4,192,798号;第4,507,230号;第4,749,742号;第4,879,371号;第4,965,343号;第5,175,254号;第5,373,053号;第5,763,284号;および第5,849,954号において見出される。これらのペプチドを、組換えDNA技術を用いて作製してもよい。
本発明は、例えば、本発明のペプチド(例えば、SDF-1またはプロテアーゼ耐性変異体SDF-1ペプチド)を発現するおよび/または分泌するように、遺伝的に改変された幹細胞および/またはその子孫細胞を提供する。例えば、成体幹細胞、間葉系前駆細胞(MPC)、および間葉系幹細胞(MSC)を含む、任意の適切な幹細胞は、本発明のペプチドを発現するおよび/または分泌するように、遺伝的に改変され得る。いくつかの実施形態において、幹細胞は、野生型SDF-1の基礎レベルを天然に発現してよく、遺伝的改変は、幹細胞に、野生型SDF-1の増加したレベルを発現すること、および/またはプロテアーゼ耐性変異体SDF-1ペプチドを発現することを引き起こしてよい。
本発明の方法において使用される任意のペプチドまたは幹細胞(例えば、SDF-1もしくはプロテアーゼ耐性変異体SDF-1ペプチドを発現する幹細胞)は、外因性の幹細胞と共に投与され得る。本発明のペプチドまたは遺伝的に改変された幹細胞と組み合わせて投与され得る細胞としては、限定されないが、複能性(multipotent)もしくは多能性(pluripotent)幹細胞、または骨髄細胞が挙げられる。好適な外因性幹細胞の例としては、成体幹細胞、間葉系前駆細胞(例えば、US公開第2014/0271567号に記載されているように、間葉系前駆細胞マーカーSTRO-1を発現する細胞、例えば、STRO-1bright細胞)および間葉系幹細胞が挙げられる。いくつかの実施形態では、外因性幹細胞は、対象に対して同種異系(allogeneic)であってよい。他の実施形態では、外因性幹細胞は、対象に対して自家(autologous)であってもよい。
本発明の方法に使用されるペプチドまたは幹細胞のいずれかは、任意の適したキャリア物質中に任意の適切な量で含有されてよく、プロテアーゼ耐性ペプチドまたは融合タンパク質は、概して、組成物の総重量の1〜95重量%、例えば5%、10%、20%、または50%の量で存在している。本明細書において記載されるプロテアーゼ耐性SDF-1ペプチドまたは融合タンパク質を、例えば食塩水、水、リンガー溶液等のキャリア、および他の作用物質または賦形剤を含有している医薬組成物中に組み入れてよい。組成物を静脈内送達(例えば、注射または埋め込み式ポートによる)用に設計する。ゆえに、組成物は、例えば、懸濁液、乳濁液、溶液、または注射物質の形態であってよい。当技術分野において標準的である方法を用いて、すべての組成物を調製してよい(例えば、Remington's Pharmaceutical Sciences, 16th ed., A. Oslo. ed., Easton, PA (1980)を参照されたい)。
本発明の方法は、組織損傷(例えば、心筋梗塞による心臓組織への損傷、または末梢血管疾患によって生じる組織損傷)または創傷(例えば、糖尿病性創傷)を有すると診断されているまたはそれらに罹患している任意の対象を治療するのに有用である。組織損傷は、例えば心血管系の病状(例えば、心筋梗塞);末梢血管疾患(PVD);末梢動脈疾患(PAD);潰瘍(例えば、皮膚創傷潰瘍);手術;または糖尿病の結果であってよい。組織損傷はまた、CNS障害または傷害または炎症状態(例えば、関節リウマチ、クローン病、または移植片対宿主病)によって生じてもよい。本発明の方法は、疾患または傷害によって生じる器官損傷(例えば、腎臓または肝臓損傷)の修復または再生のために使用されてもよい。本発明の方法を用いて、創傷治癒または組織修復を促進し得る。当業者であれば、本発明の対象は標準的試験に供されてよく、または検査なしで1つもしくは複数の危険因子の存在によって危険性が高い者として同定されてよいことを理解する。当技術分野における公知の任意の標準的方法を用いて、これらの障害の診断を実施してよい。
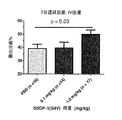
以下の実施例において、本発明者らは、mSDF-1ペプチド含有組成物の静脈内送達および長期遅延投薬が、虚血再灌流モデルにおける心機能を向上させることを実証している実験を記載する。
本発明者らはまた、mSDF-1ペプチド含有組成物の静脈内送達および遅延投薬の、マイクロユカタンブタ梗塞モデルにおける心機能に対する効果を評価した。
前述の記載から、本明細書において記載される発明に変動および修飾を行って、それを様々な用法および条件に採用してよいことは明白である。そのような実施形態も、以下の特許請求の範囲の範囲内にある。
Claims (40)
- それを必要とする対象において組織損傷を治療するまたは改善する方法であって、該組織損傷は疾患または病状によって生じ、該方法は、変異体SDF-1(mSDF-1)、mSDF-1-Yz、Xp-mSDF-1、またはXp-mSDF-1-Yzの式を含む単離したストロマ細胞由来因子-1(SDF-1)ペプチドの変異型を発現する幹細胞または該SDF-1ペプチドの変異型を含む組成物を、静脈内に投与することを含み、該SDF-1は、配列番号53の少なくともアミノ酸1〜8のアミノ酸配列を含み、かつ任意でC末端において配列番号53の残りの配列のすべてまたは任意の部分伸長しているペプチドであり、該配列番号53はアミノ酸配列:
を含み、式中、X3、X4、X5、およびX6は任意のアミノ酸であり、かつ式中、
a)Xpはタンパク質構成アミノ酸またはプロテアーゼ保護有機基であり、かつpは1〜4の任意の整数であり;
b)Yzはタンパク質構成アミノ酸またはプロテアーゼ保護有機基であり、かつzは1〜4の任意の整数であり;
c)該mSDF-1または該mSDF-1-Yzは、T細胞に対する化学誘引物質活性を維持し、かつ天然SDF-1の不活性化の割合の少なくとも50%未満である割合でマトリックスメタロプロテイナーゼ-2(MMP-2)、マトリックスメタロプロテイナーゼ-9(MMP-9)、白血球エラスターゼ、および/またはカテプシンGによって不活性化され;ならびに
d)該Xp-mSDF-1または該Xp-mSDF-1-Yzは、T細胞に対する化学誘引物質活性を維持し、天然SDF-1が不活性化される割合の少なくとも50%未満である割合でジペプチジルペプチダーゼIV(DPPIV)によって不活性化され、かつ天然SDF-1の不活性化の割合の少なくとも50%未満である割合でMMP-2、MMP-9、白血球エラスターゼ、および/またはカテプシンGによって不活性化され;
該単離したSDF-1の変異型を、該対象における該組織損傷を治療するまたは改善するのに十分な量で静脈内に投与する、方法。 - 前記SDF-1ペプチドの変異型が、配列番号52の少なくともアミノ酸1〜8のアミノ酸配列を含まない、請求項1に記載の方法。
- 前記X3がバリン、ヒスチジン、またはシステインである、請求項1または2に記載の方法。
- 前記X4がセリンまたはバリンである、請求項1〜2のいずれか一項に記載の方法。
- 前記X5がロイシン、プロリン、トレオニン、またはバリンである、請求項1〜4のいずれか一項に記載の方法。
- 前記X6がセリン、システイン、またはグリシンである、請求項1〜5のいずれか一項に記載の方法。
- 前記ペプチドがXp-mSDF-1ペプチドまたはXp-mSDF-1-Yzペプチドであって、式中、Xはセリンであり、かつpは1である、請求項1〜6のいずれか一項に記載の方法。
- 前記ペプチドがmSDF-1-YzペプチドまたはXp-mSDF-1-Yzペプチドであって、式中、Yはセリンであり、かつzは1である、請求項1〜6のいずれか一項に記載の方法。
- 前記SDF-1の変異型が、式A-(L)n-Fcを含む融合タンパク質であって、式中、Aは単離したSDF-1の変異型であり;nは0〜3の整数であり;Lは3〜9個のアミノ酸のリンカー配列であり;かつFcは免疫グロブリンのFc領域由来のFcペプチドである、請求項1〜8のいずれか一項に記載の方法。
- n=1かつLがGGGGS(配列番号66)である、請求項9に記載の方法。
- SDF-1の変異型を発現する幹細胞が、間葉系幹細胞または間葉系前駆細胞である、請求項1〜10のいずれか一項に記載の方法。
- 外因性幹細胞を投与することをさらに含む、請求項1〜11のいずれか一項に記載の方法。
- 前記外因性幹細胞が、間葉系幹細胞または間葉系前駆細胞である、請求項12に記載の方法。
- 前記疾患または病状が、脳卒中、肢虚血、外傷による組織損傷、心筋梗塞、末梢血管疾患、慢性心不全、糖尿病、糖尿病性創傷治癒、器官疾患もしくは傷害、CNS疾患もしくは傷害、および炎症状態からなる群より選択される、請求項1〜13のいずれか一項に記載の方法。
- 前記疾患または病状が心筋梗塞である、請求項14に記載の方法。
- 前記疾患または病状が末梢血管疾患である、請求項14に記載の方法。
- 前記疾患または病状が糖尿病である、請求項14に記載の方法。
- 前記疾患または病状が糖尿病性創傷治癒である、請求項14に記載の方法。
- 前記器官疾患または傷害が、腎臓または肝臓の疾患または傷害である、請求項14に記載の方法。
- 前記炎症状態が、関節リウマチ、クローン病、または移植片対宿主病である、請求項14に記載の方法。
- 前記幹細胞または組成物を末梢静脈または中心静脈に投与する、請求項1〜20のいずれか一項に記載の方法。
- 前記幹細胞または組成物を、前記疾患、病状、または組織損傷の発症後数分間以内に投与する、請求項1〜21のいずれか一項に記載の方法。
- 前記幹細胞または組成物を、前記疾患、病状、または組織損傷の発症の12時間以内に投与する、請求項1〜21のいずれか一項に記載の方法。
- 前記幹細胞または組成物を、前記疾患、病状、または組織損傷の発症または診断の24時間後またはそれを上回る時間の後の時点で投与する、請求項1〜21のいずれか一項に記載の方法。
- 前記幹細胞または組成物を、前記疾患、病状、または組織損傷の発症または診断の48時間後またはそれを上回る時間の後に投与する、請求項1〜21のいずれか一項に記載の方法。
- 前記幹細胞または組成物を、前記疾患、病状、または組織損傷の発症または診断の7日後またはそれを上回る時間の後に投与する、請求項1〜21のいずれか一項に記載の方法。
- 前記幹細胞または組成物を、前記疾患、病状、または組織損傷の発症または診断の1ヶ月後またはそれを上回る時間の後に投与する、請求項1〜21のいずれか一項に記載の方法。
- 前記幹細胞または組成物を、前記疾患、病状、または組織損傷の発症または診断の6ヶ月後またはそれを上回る時間の後に投与する、請求項1〜21のいずれか一項に記載の方法。
- 前記方法を、SDF-1もしくは変異体SDF-1ペプチド、またはSDF-1もしくは変異体SDF-1ペプチドを発現する幹細胞の動脈内投与と組み合わせる、請求項1〜28のいずれか一項に記載の方法。
- 前記動脈内投与が、静脈内投与前に生じる、請求項29に記載の方法。
- 前記疾患または病状が、外傷による組織損傷、器官疾患、炎症性疾患、心筋梗塞、または末梢血管疾患である、請求項22〜30のいずれか一項に記載の方法。
- 前記疾患または病状が心血管疾患である、請求項22〜30のいずれか一項に記載の方法。
- 前記組織損傷が軽減される、修復される、または新しい血管形成が生じるまで、前記幹細胞または組成物を1回または複数回投与する、請求項1〜32のいずれか一項に記載の方法。
- 前記疾患または病状の1つまたは複数の症状を改善するために、前記幹細胞または組成物を1回または複数回投与する、請求項1〜32のいずれか一項に記載の方法。
- 前記組織が心臓組織である、請求項1〜34のいずれか一項に記載の方法。
- 前記組織が血管組織である、請求項1〜34のいずれか一項に記載の方法。
- 前記組織が器官組織である、請求項1〜34のいずれか一項に記載の方法。
- 前記器官が腎臓または肝臓である、請求項37に記載の方法。
- 前記SDF-1の変異型が配列番号67の配列を含む、請求項1〜38のいずれか一項に記載の方法。
- 前記SDF-1が配列番号69の配列を含む、請求項1〜38のいずれか一項に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361915842P | 2013-12-13 | 2013-12-13 | |
| US61/915,842 | 2013-12-13 | ||
| PCT/US2014/070010 WO2015089396A1 (en) | 2013-12-13 | 2014-12-12 | Methods for repairing tissue damage using protease-resistant mutants of stromal cell derived factor-1 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2017500316A true JP2017500316A (ja) | 2017-01-05 |
| JP2017500316A5 JP2017500316A5 (ja) | 2018-01-18 |
Family
ID=53371868
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016539145A Pending JP2017500316A (ja) | 2013-12-13 | 2014-12-12 | ストロマ細胞由来因子−1のプロテアーゼ耐性変異体を用いた、組織損傷を修復する方法 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US20160303197A1 (ja) |
| EP (1) | EP3079711A4 (ja) |
| JP (1) | JP2017500316A (ja) |
| KR (1) | KR20160096640A (ja) |
| CN (1) | CN106029086A (ja) |
| AU (1) | AU2014362198A1 (ja) |
| CA (1) | CA2933620A1 (ja) |
| IL (1) | IL246182A0 (ja) |
| SG (1) | SG11201604793YA (ja) |
| WO (1) | WO2015089396A1 (ja) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9308277B2 (en) | 2010-02-25 | 2016-04-12 | Mesoblast International Sàrl | Protease-resistant mutants of stromal cell derived factor-1 in the repair of tissue damage |
| EP2717894B1 (en) | 2011-06-07 | 2018-01-24 | Mesoblast International Sàrl | Methods for repairing tissue damage using protease-resistant mutants of stromal cell derived factor-1 |
| US9035277B2 (en) | 2013-08-01 | 2015-05-19 | Taiwan Semiconductor Manufacturing Company, Ltd. | Semiconductor device and fabricating the same |
| JP2020512338A (ja) * | 2017-03-30 | 2020-04-23 | ウェイク・フォレスト・ユニヴァーシティ・ヘルス・サイエンシズ | 腎臓疾患の治療方法 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007537752A (ja) * | 2004-05-19 | 2007-12-27 | ザ クリーブランド クリニック ファウンデーション | 治療的応用法のための遺伝的に改変された細胞 |
| WO2012170495A1 (en) * | 2011-06-07 | 2012-12-13 | Provasculon, Inc. | Methods for repairing tissue damage using protease-resistant mutants of stromal cell derived factor-1 |
| WO2013131192A1 (en) * | 2012-03-06 | 2013-09-12 | Aris Aziz | Placental stem cells, methods for isolating same and use thereof |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2003901668A0 (en) * | 2003-03-28 | 2003-05-01 | Medvet Science Pty. Ltd. | Non-haemopoietic precursor cells |
| US8516469B2 (en) * | 2005-07-25 | 2013-08-20 | Flexera Software Llc | Function binding method and system |
| US7696309B2 (en) * | 2006-10-23 | 2010-04-13 | The Brigham And Women's Hospital, Inc. | Protease resistant mutants of stromal cell derived factor-1 in the repair of tissue damage |
| US8095290B2 (en) * | 2008-08-01 | 2012-01-10 | GM Global Technology Operations LLC | Method to control vehicular powertrain by monitoring map preview information |
| US20110022413A1 (en) * | 2009-07-27 | 2011-01-27 | Welltrek International | Systems and methods for maintaining comprehensive medical records |
| US9308277B2 (en) * | 2010-02-25 | 2016-04-12 | Mesoblast International Sàrl | Protease-resistant mutants of stromal cell derived factor-1 in the repair of tissue damage |
-
2014
- 2014-12-12 CN CN201480075473.6A patent/CN106029086A/zh active Pending
- 2014-12-12 JP JP2016539145A patent/JP2017500316A/ja active Pending
- 2014-12-12 US US15/103,153 patent/US20160303197A1/en not_active Abandoned
- 2014-12-12 AU AU2014362198A patent/AU2014362198A1/en not_active Abandoned
- 2014-12-12 CA CA2933620A patent/CA2933620A1/en not_active Abandoned
- 2014-12-12 SG SG11201604793YA patent/SG11201604793YA/en unknown
- 2014-12-12 KR KR1020167017818A patent/KR20160096640A/ko not_active Application Discontinuation
- 2014-12-12 EP EP14869229.6A patent/EP3079711A4/en not_active Withdrawn
- 2014-12-12 WO PCT/US2014/070010 patent/WO2015089396A1/en active Application Filing
-
2016
- 2016-06-13 IL IL246182A patent/IL246182A0/en unknown
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007537752A (ja) * | 2004-05-19 | 2007-12-27 | ザ クリーブランド クリニック ファウンデーション | 治療的応用法のための遺伝的に改変された細胞 |
| WO2012170495A1 (en) * | 2011-06-07 | 2012-12-13 | Provasculon, Inc. | Methods for repairing tissue damage using protease-resistant mutants of stromal cell derived factor-1 |
| WO2013131192A1 (en) * | 2012-03-06 | 2013-09-12 | Aris Aziz | Placental stem cells, methods for isolating same and use thereof |
Non-Patent Citations (1)
| Title |
|---|
| THE FASEB JOURNAL, vol. 21, no. 12, JPN6018034235, 2007, pages Pages.3197 - 3207 * |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2015089396A1 (en) | 2015-06-18 |
| EP3079711A1 (en) | 2016-10-19 |
| EP3079711A4 (en) | 2017-05-17 |
| CN106029086A (zh) | 2016-10-12 |
| US20160303197A1 (en) | 2016-10-20 |
| KR20160096640A (ko) | 2016-08-16 |
| AU2014362198A1 (en) | 2016-07-07 |
| CA2933620A1 (en) | 2015-06-18 |
| SG11201604793YA (en) | 2016-07-28 |
| IL246182A0 (en) | 2016-07-31 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CA2567177C (en) | Genetically engineered cells for therapeutic applications | |
| JP6675394B2 (ja) | 疾患及び障害の治療のためにインターロイキン−10を使用する方法 | |
| JP5269411B2 (ja) | 幹細胞をホーミングさせるためのccrリガンド | |
| AU2008232739B2 (en) | Method of treating ischemic disorders | |
| AU2017213440A1 (en) | Methods for repairing tissue damage using protease-resistant mutants of stromal cell derived Factor-1 | |
| JP2017500316A (ja) | ストロマ細胞由来因子−1のプロテアーゼ耐性変異体を用いた、組織損傷を修復する方法 | |
| JP7236446B2 (ja) | コア-シェル構造のマイクロ粒子を有効成分として含む血液凝固因子遺伝子発現増加用組成物 | |
| WO2012027170A1 (en) | Methods for repairing tissue damage using protease-resistant mutants of stromal cell derived factor-1 | |
| TW200908997A (en) | Treatment of cellular proliferative disorders | |
| CN110769861A (zh) | 治疗缺血性组织的方法 | |
| Youyun et al. | Treating cardiovascular diseases by enhancing endogenous stem cell mobilization | |
| WO2007111350A1 (ja) | 血管新生ならびに癌細胞のmesenchymal型およびamoeboid型浸潤を阻害するための薬剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20171201 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20171201 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20180827 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180904 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20181114 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20190508 |