KR20160062166A - 고지혈증을 치료하기 위한 pcsk9 억제제의 용도 - Google Patents
고지혈증을 치료하기 위한 pcsk9 억제제의 용도 Download PDFInfo
- Publication number
- KR20160062166A KR20160062166A KR1020167012099A KR20167012099A KR20160062166A KR 20160062166 A KR20160062166 A KR 20160062166A KR 1020167012099 A KR1020167012099 A KR 1020167012099A KR 20167012099 A KR20167012099 A KR 20167012099A KR 20160062166 A KR20160062166 A KR 20160062166A
- Authority
- KR
- South Korea
- Prior art keywords
- patient
- antibody
- pcsk9
- ldl
- patients
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/20—Carboxylic acids, e.g. valproic acid having a carboxyl group bound to a chain of seven or more carbon atoms, e.g. stearic, palmitic, arachidic acids
- A61K31/202—Carboxylic acids, e.g. valproic acid having a carboxyl group bound to a chain of seven or more carbon atoms, e.g. stearic, palmitic, arachidic acids having three or more double bonds, e.g. linolenic
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/397—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having four-membered rings, e.g. azetidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/455—Nicotinic acids, e.g. niacin; Derivatives thereof, e.g. esters, amides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/40—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Epidemiology (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Hematology (AREA)
- Diabetes (AREA)
- Obesity (AREA)
- Endocrinology (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Peptides Or Proteins (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Emergency Medicine (AREA)
Abstract
본 발명은 스타틴 치료법이 진행 중이 아닌 환자에서의 고지혈증의 치료 방법을 제공한다. 본 발명의 방법은 PCSK9 억제제를 포함하는 약제학적 조성물을 환자에게 투여하는 단계를 포함한다. 특정 구현예에서, PCSK9 억제제는 항-PCSK9 항체, 예를 들어, 본원에 mAb316P로 지칭되는 예시적인 항체이다.
Description
본 발명은 상승된 수준의 지질 및 지질단백질과 관련된 질병 및 장애의 치료적 처치 분야에 관한 것이다. 더욱 구체적으로, 본 발명은 스타틴 비-반응성이거나, 스타틴 치료법으로 불량하게 조절되거나, 스타틴에 불내약성이거나(intolerant), 스타틴 치료법에 유해 반응의 전력을 갖는 환자를 포함하는 스타틴 치료법이 진행 중이 아닌 고지혈증이 있는 환자를 치료하기 위한 PCSK9 억제제의 용도에 관한 것이다.
고콜레스테롤혈증, 특히 저밀도 지질단백질(LDL) 콜레스테롤(LDL-C) 수준의 증가는 죽상동맥경화증 및 관상동맥 심장 질병(CHD)의 주요 발병 위험이 된다(문헌[Sharrett et al., 2001, Circulation 104:1108-1113]). 저밀도 지질단백질 콜레스테롤은 콜레스테롤 저하 치료법의 주요 표적으로 확인되며, 타당한 대용 치료 종점으로 여겨진다. 수많은 연구에 의해, LDL-C 수준의 감소가 CHD의 위험을 감소시키며, LDL-C 수준과 CHD 사례 간에 강력한 직접적인 관계가 있는 것이 입증되었으며; LDL-C의 각각의 1 mmol/ℓ(약 40 ㎎/㎗)의 감소에 있어서, 심혈관 질병(CVD) 사망률 및 이환율은 22% 감소된다. LDL-C의 더 큰 감소는 사례의 더 큰 감소를 야기하며, 집중 스타틴 치료 대 표준 스타틴 치료의 비교 데이터는 LDL-C 수준이 더 낮을수록, 매우 높은 심혈관(CV) 위험에 있는 환자의 이익이 더 커짐을 뒷받침한다.
현재의 LDL-C 저하 약제는 스타틴, 콜레스테롤 흡수 억제제(예를 들어, 에제티미브(ezetimibe)[EZE]), 피브레이트, 니아신 및 담즙산 격리제를 포함한다. 생활방식 및 통상의 약물 치료의 변형이 종종 콜레스테롤 수준을 감소시키는데 성공적이지만, 그러한 방법을 사용하여 모든 환자가 권고된 표적 콜레스테롤 수준을 달성할 수 있는 것은 아니다. 다양한 질환, 예를 들어, 가족성 고콜레스테롤혈증(FH)은 통상적인 치료법의 적극적인 사용에도 불구하고, LDL-C 수준의 저하에 저항성이 있는 것으로 보인다. 구체적으로, 콜레스테롤 합성을 억제하고, 간의 LDL 수용체를 상향조절함으로써 LDL-C를 감소시키는 스타틴을 사용한 치료는 LDL 수용체가 존재하지 않거나 결함이 있는 환자에서 거의 효과를 갖지 않을 수 있다. 더욱이, 많은 환자는 스타틴 비반응성이고/거나 스타틴 치료법으로 불량하게 조절되고/거나, 스타틴에 불내약성이고/거나 스타틴-관련 부작용 때문에 그들의 처방된 치료적 스타틴 섭생을 고수하지 않는다. 고콜레스테롤혈증이 대체로 무증상이기 때문에, 이러한 장애를 관리하기 위해 사용되는 약리학적 작용제의 임의의 불쾌한 효과가 환자 순응도를 약화시킬 수 있다. 몇몇의 코호트 연구에서, 제1년에 보고된 스타틴 치료법에 대한 지속률은 26% 내지 85% 범위였으며, 지속률의 신속한 감소는 전형적으로 처음 수개월 내에 관찰된다.
따라서, 환자에서 LDL-C를 저하시키기 위한 대안적인 선택이 당업계에 필요하다.
본 발명은 예를 들어, 원발성 고지혈증을 포함하는 고지혈증의 치료 방법을 제공한다. 특히, 본 발명의 방법은 스타틴 비반응성이거나 스타틴 치료법으로 불량하게 조절되거나, 스타틴에 불내약성이거나, 스타틴 치료법에 유해 반응의 전력을 갖는 환자를 포함하는 스타틴 치료법이 진행 중이 아닌 고지혈증이 있는 환자를 치료하는데 유용하다.
일 양태에 따르면, 본 발명의 방법은 하나 이상의 용량의 PCSK9 억제제를 스타틴 치료법이 진행 중이 아닌 환자에게 투여하는 단계를 포함한다. 고지혈증이 있는 환자는 그들이 스타틴 비-반응성이거나, 스타틴 치료법으로 불량하게 조절되거나, 스타틴에 불내약성이거나, 스타틴 치료법에 유해 반응의 전력을 갖기 때문에, 또는 임의의 다른 이유로 스타틴 치료법이 진행 중이 아닐 수 있다.
다른 양태에 따르면, 본 발명은 제1 용량의 PCSK9 억제제의 투여 이전에 또는 그와 동시에 백그라운드 스타틴 치료법이 중단된 환자에게 하나 이상의 용량의 PCSK9 억제제를 투여하는 단계를 포함하는 환자에서의 고지혈증의 치료 방법을 포함한다.
일 양태에 따르면, 고지혈증이 있는 환자는 비-가족성 고콜레스테롤혈증, 이형접합 또는 동형접합 가족성 고콜레스테롤혈증 또는 혼합형 이상지질혈증이 있는 환자를 포함한다. 특정 양태에서, 고지혈증이 있는 환자는 또한, 2형 당뇨병을 갖는다.
일부 구현예에서, PCSK9 억제제는 임의의 다른 지질 변형 치료법의 부재하에 단일요법으로 환자에게 투여된다. 일부 구현예에서, PCSK9 억제제는 다른 비-스타틴 지질 변형 치료법과 병용하여 환자에게 투여된다.
일 양태에 따르면, 본 발명의 방법은 하나 이상의 용량의 PCSK9 억제제를 스타틴에 불내약성이거나 스타틴 치료법에 유해 반응의 전력을 갖는 환자에게 투여하는 단계를 포함한다. 스타틴 치료법에 대한 유해 반응의 예는 예를 들어, 골격근 통증, 불쾌감, 쇠약 및/또는 경련을 포함한다. 따라서, 특정 구현예에 따르면, 본 발명은 예를 들어, 환자의 스타틴 치료 섭생을 중단하고, PCSK9 억제제를 환자에게 투여함으로써, 골격근 통증, 불쾌감, 쇠약 또는 경련의 유도 없이, 환자에서 혈청 LDL-C 수준을 감소시키기 위한 방법을 제공한다.
또한, 본 발명은 스타틴에 불내약성이거나 스타틴 치료법에 유해 반응의 전력을 갖는 중등의, 높은 또는 매우 높은 심혈관 위험이 있는 환자를 선택하고, 하나 이상의 용량의 PCSK9 억제제를 환자에게 투여함에 의한 스타틴 불내약성 환자에서의 혈청 LDL-C 수준의 감소 방법을 제공한다.
또한, 본 발명은 매일의 치료적 스타틴 섭생이 진행 중인 동안 시작되거나 증가되는 골격근-관련 증상을 이전에 경험한 적이 있는 중등의, 높은 또는 매우 높은 심혈관 위험이 있는 환자를 선택하고, 하나 이상의 용량의 PCSK9 억제제를 환자에게 투여함에 의한 스타틴에 불내약성이거나 스타틴 치료법에 유해 반응의 전력을 갖는 환자에서의 고지혈증의 치료 방법을 제공한다. 특정 구현예에 따르면, 환자는 적어도 2가지의 개별적인 매일의 치료적 스타틴 섭생(예를 들어, 매일의 치료적 스타틴 섭생 중 적어도 하나는 승인된 가장 낮은 1일 용량의 스타틴임)이 진행 중인 동안 시작되거나 증가된 골격근-관련 증상을 이전에 경험한 적이 있는 것에 기초하여 선택된다.
또한, 본 발명은 스타틴 치료법이 진행 중이 아닌 고지혈증이 있는 환자를 치료하는데 사용하기 위한 PCSK9 억제제를 포함하는 약제학적 조성물을 제공한다.
일 구현예는 (a) 스타틴에 불내약성이거나 스타틴 치료법에 유해 반응의 전력을 갖는 환자를 선택하는 단계; 및 (b) 하나 이상의 용량의 PCSK9 억제제를 환자에게 투여하는 단계를 포함하는, 고콜레스테롤혈증의 치료를 필요로 하는 환자에서의 고콜레스테롤혈증의 치료 방법을 제공한다.
다른 구현예는 (a) 승인된 가장 낮은 1일 용량의 하나 이상의 스타틴을 취하는 동안 시작되거나 증가된 골격근-관련 증상을 경험한 적이 있는 환자를 선택하는 단계; 및 (b) 하나 이상의 용량의 PCSK9 억제제를 환자에게 투여하여, 골격근 통증, 불쾌감, 쇠약 또는 경련의 유도 없이, 환자에서 혈청 LDL-C 수준을 감소시키는 단계를 포함하는 골격근 통증, 불쾌감, 쇠약 또는 경련을 유도하지 않고 환자에서의 혈청 LDL-C 수준의 감소 방법을 제공한다.
다른 구현예는 (a) 스타틴에 불내약성이거나 스타틴 치료법에 유해 반응의 전력을 갖는 중등의, 높은 또는 매우 높은 심혈관 위험이 있는 환자를 선택하는 단계; 및 (b) 하나 이상의 용량의 PCSK9 억제제를 환자에게 투여하는 단계를 포함하는 고콜레스테롤혈증, 스타틴 불내약성 환자에서의 혈청 LDL-C 수준의 감소 방법을 제공한다.
다른 구현예는 (a) 매일의 치료적 스타틴 섭생이 진행 중인 동안 시작되거나 증가된 골격근-관련 증상을 이전에 경험한 적이 있는 중등의, 높은 또는 매우 높은 심혈관 위험이 있는 환자를 선택하는 단계; 및 (b) 하나 이상의 용량의 PCSK9 억제제를 환자에게 투여하는 단계를 포함하는 스타틴에 불내약성이거나 스타틴 치료법에 유해 반응의 전력을 갖는 환자에서의 고콜레스테롤혈증의 치료 방법을 제공한다.
일부 구현예에서, 환자는 적어도 2가지의 개별적인 매일의 치료적 스타틴 섭생이 진행 중인 동안 시작되거나 증가된 골격근-관련 증상을 이전에 경험한 적이 있다. 일부 구현예에서, 매일의 치료적 스타틴 섭생 중 적어도 하나는 승인된 가장 낮은 1일 용량의 스타틴이다. 일부 구현예에서, 매일의 치료적 스타틴 섭생 중 적어도 하나는 매일 5 ㎎의 로수바스타틴(rosuvastatin), 매일 10 ㎎의 아토르바스타틴(atorvastatin), 매일 10 ㎎의 심바스타틴(simvastatin), 매일 20 ㎎의 로바스타틴(lovastatin), 매일 40 ㎎의 프라바스타틴(pravastatin), 매일 40 ㎎의 플루바스타틴(fluvastatin) 및 매일 2 ㎎의 피타바스타틴(pitavastatin)으로 이루어진 군으로부터 선택된다. 일부 구현예에서, PCSK9 억제제는 스타틴 치료법의 부재하에 환자에게 투여된다.
일 구현예는 환자의 혈청 LDL-C 수준을 저하시키면서 스타틴에 불내약성인 고콜레스테롤혈증 환자에서의 스타틴 이용의 배제 방법을 제공하며, 상기 방법은 (a) 매일의 치료적 스타틴 섭생이 진행 중이거나 그것이 진행 중이었으며, 스타틴에 불내약성이거나 스타틴 치료법에 유해 반응의 전력을 갖는 환자를 선택하는 단계; (b) 환자의 매일의 치료적 스타틴 섭생을 중단하는 단계; 및 (c) 하나 이상의 용량의 PCSK9 억제제를 환자에게 투여하는 단계를 포함한다.
일부 구현예에서, 환자는 PCSK9 억제제의 투여 이전에 또는 그의 투여 시에 약 70 ㎎/㎗ 초과의 혈청 저밀도 지질단백질 콜레스테롤(LDL-C) 수준으로 정의되는 고콜레스테롤혈증을 나타낸다. 일부 구현예에서, 환자는 PCSK9 억제제의 투여 이전에 또는 그의 투여 시에 약 100 ㎎/㎗ 초과의 혈청 저밀도 지질단백질 콜레스테롤(LDL-C) 수준으로 정의되는 고콜레스테롤혈증을 나타낸다.
일부 구현예에서, 환자는 이형접합 가족성 고콜레스테롤혈증(heFH)을 갖는다. 일부 구현예에서, 환자는 가족성 고콜레스테롤혈증이 아닌(비-FH) 형태의 고콜레스테롤혈증을 갖는다. 일부 구현예에서, 환자는 PCSK9 억제제의 투여 이전에 또는 그의 투여 시에, 1% 이상 및 5% 미만의 계산된 10년 내 치명적 심혈관 질병 위험 SCORE로 정의되는 중등의 심혈관 위험을 갖는다. 일부 구현예에서, 환자는 PCSK9 억제제의 투여 이전에 또는 그의 투여 시에, 하기의 것 중 하나 이상과 함께, 5% 이상의 계산된 10년 내 치명적 심혈관 질병 위험 SCORE로 정의되는 높은 심혈관 위험을 갖는다: (i) 중등의 만성 신장 질병, (ii) 표적 기관 손상이 없는 1형 당뇨병, (iii) 표적 기관 손상이 없는 2형 당뇨병, 및/또는 (iv) heFH. 일부 구현예에서, 환자는 PCSK9 억제제의 투여 이전에 또는 그의 투여 시에, 하기의 것 중 하나 이상으로 정의되는 매우 높은 심혈관 위험을 갖는다: (i) 문서화된 관상동맥 심장 질병; (ii) 허혈성 뇌졸중; (iii) 말초 뇌졸중(peripheral stroke); (iv) 말초 동맥 질병(PAD); (v) 일과성 허혈 발작(TIA); (vi) 복부대동맥류; (vii) 증상이 없는 50% 초과의 경동맥 폐색; (viii) 경동맥내막절제술; (ix) 경동맥 스텐트 수술; (x) 신장 동맥 협착; (xi) 신장 동맥 스텐트 수술; (xii) 표적 기관 손상이 있는 1형 당뇨병; 및/또는 (xiii) 표적 기관 손상이 있는 2형 당뇨병.
일부 구현예에서, PCSK9 억제제는 PCSK9에 특이적으로 결합하는 항체 또는 항원-결합 단백질이다. 일부 구현예에서, 항체 또는 그의 항원 결합 단편은 SEQ ID NO: 1/6을 포함하는 HCVR/LCVR 아미노산 서열 쌍의 중쇄 및 경쇄 CDR을 포함한다. 일부 구현예에서, 항체 또는 그의 항원-결합 단편은 SEQ ID NO: 2, 3, 4, 7, 8 및 10을 갖는 중쇄 및 경쇄 CDR 아미노산 서열을 포함한다. 일부 구현예에서, 항체 또는 그의 항원-결합 단편은 SEQ ID NO: 1의 아미노산 서열을 갖는 HCVR 및 SEQ ID NO: 6의 아미노산 서열을 갖는 LCVR을 포함한다. 일부 구현예에서, 항체 또는 그의 항원-결합 단편은 SEQ ID NO: 2, 3, 4, 7, 8 및 10을 갖는 중쇄 및 경쇄 CDR 아미노산 서열을 포함하는 항체와 동일한 PCSK9 상의 에피토프에 결합한다. 일부 구현예에서, 항체 또는 그의 항원-결합 단편은 PCSK9로의 결합을 위해 SEQ ID NO: 2, 3, 4, 7, 8 및 10을 갖는 중쇄 및 경쇄 CDR 아미노산 서열을 포함하는 항체와 경쟁한다.
일부 구현예에서, PCSK9에 특이적으로 결합하는 항체 또는 항원-결합 단백질은 2주마다 1회의 빈도로 약 75 ㎎의 용량으로 환자에게 투여된다. 일부 구현예에서, 5회 이상의 투여 후에 측정된 환자의 LDL-C가 70 ㎎/㎗ 미만이면, 약 75 ㎎ 용량을 유지한다. 일부 구현예에서, 5회 이상의 투여 후에 측정된 환자의 LDL-C가 70 ㎎/㎗ 이상으로 유지되면, 약 75 ㎎ 용량을 중단하며, PCSK9에 특이적으로 결합하는 항체 또는 그의 항원-결합 단편을 이후에 2주마다 1회의 빈도로 약 150 ㎎의 용량으로 환자에게 투여한다. 일부 구현예에서, PCSK9에 특이적으로 결합하는 항체 또는 항원-결합 단백질을 2주마다 1회의 빈도로 약 150 ㎎의 용량으로 환자에게 투여한다.
일부 구현예에서, PCSK9 억제제를 비-스타틴 지질 변형 치료법과 병용하여 환자에게 투여한다. 일부 구현예에서, 비-스타틴 변형 치료법은 에제티미브, 피브레이트, 니아신, 오메가-3 지방산 및 담즙산 수지로 이루어진 군으로부터 선택되는 치료제를 포함한다.
일부 구현예에서, 상기 방법은 하기로 이루어진 군으로부터 선택되는 하나 이상의 지질 성분의 혈청 수준을 개선시킨다: (a) 환자의 저밀도 지질단백질 콜레스테롤(LDL-C)의 적어도 35%의 감소; (b) 환자의 아포지질단백질 B(ApoB)의 적어도 25%의 감소; (c) 환자의 비-고밀도 지질단백질 콜레스테롤(비-HDL-C)의 적어도 30%의 감소; (d) 환자의 총 콜레스테롤의 적어도 20%의 감소; 및 (e) 환자의 지질단백질 a(Lp(a))의 적어도 15%의 감소.
일 구현예는 고콜레스테롤혈증, 스타틴 불내약성 환자에서의 하나 이상의 지질 성분의 혈청 수준의 개선 방법을 제공하며, 상기 방법은 (a) 스타틴에 불내약성이거나 스타틴 치료법에 유해 반응의 전력을 갖는 중등의, 높은 또는 매우 높은 심혈관 위험을 갖는 환자를 선택하는 단계; 및 (b) 다중 용량의 항-PCSK9 항체를 용량마다 약 75 내지 150 ㎎의 투여량 및 2주마다 약 1회의 투여 빈도로 환자에게 투여하는 단계로서, 항-PCSK9 항체를 사용한 약 24주의 치료 후에, 하나 이상의 지질 성분의 혈청 수준의 개선이 하기로 이루어진 군으로부터 선택되는 단계를 포함한다: (a) 환자의 저밀도 지질단백질 콜레스테롤(LDL-C)의 적어도 35%의 감소; (b) 환자의 아포지질단백질 B(ApoB)의 적어도 25%의 감소; (c) 환자의 비-고밀도 지질단백질 콜레스테롤(비-HDL-C)의 적어도 30%의 감소; (d) 환자의 총 콜레스테롤의 적어도 20%의 감소; 및 (e) 환자의 지질단백질 a(Lp(a))의 적어도 15%의 감소.
본 발명의 다른 구현예는 단일요법으로서 PCSK9 억제제를 포함하는 약제학적 조성물을 환자에게 투여하여, 그에 의해 환자에서 고콜레스테롤혈증을 치료하는 단계로서, 조성물이 2주마다 투여되고, 환자가 동시에 다른 지질 변형 치료법을 취하지 않는 단계를 포함하는 고콜레스테롤혈증의 치료를 필요로 하는 환자에서의 고콜레스테롤혈증의 치료 방법을 제공한다.
본 발명의 다른 구현예는 단일요법으로서 PCSK9 억제제를 포함하는 약제학적 조성물을 환자에게 투여하여, 그에 의해 환자에서 LDL-C를 감소시키는 단계로서, 조성물이 2주마다 투여되고, 환자가 동시에 다른 지질 변형 치료법을 취하지 않는 단계를 포함하는 저밀도 지질단백질 콜레스테롤(LDL-C)의 감소를 필요로 하는 환자에서의 저밀도 지질단백질 콜레스테롤(LDL-C)의 감소 방법을 제공한다.
본 발명의 다른 구현예는 단일요법으로서 약 75 ㎎의 초기 용량으로 PCSK9 억제제를 포함하는 약제학적 조성물을 환자에게 투여하여, 그에 의해 환자에서 일정한 LDL-C 수준을 유지하는 단계로서, 조성물이 2주마다 투여되고, 환자가 동시에 다른 지질 저하 치료법을 취하지 않는 단계를 포함하는 환자에서의 일정한 저밀도 지질단백질 콜레스테롤(LDL-C) 수준의 유지 방법을 제공한다. 일부 구현예에서, PCSK9 억제제는 적어도 24주 동안 환자에게 투여되며, 환자의 LDL-C 수준은 20주 동안 일정하게 유지된다.
단일요법으로서 PCSK9 억제제의 투여를 제공하는 일부 구현예에서, 환자는 스타틴에 불내약성이거나 스타틴 치료법에 대한 유해 반응의 전력을 갖는다. 일부 구현예에서, 환자는 적어도 2가지의 개별적인 매일의 치료적 스타틴 섭생이 진행 중인 동안 시작되거나 증가된 골격근-관련 증상을 이전에 경험하였다. 일부 구현예에서, 매일의 치료적 스타틴 섭생 중 적어도 하나는 승인된 가장 낮은 1일 용량의 스타틴이다. 일부 구현예에서, 매일의 치료적 스타틴 섭생 중 적어도 하나는 매일 5 ㎎의 로수바스타틴, 매일 10 ㎎의 아토르바스타틴, 매일 10 ㎎의 심바스타틴, 매일 20 ㎎의 로바스타틴, 매일 40 ㎎의 프라바스타틴, 매일 40 ㎎의 플루바스타틴 및 매일 2 ㎎의 피타바스타틴으로 이루어진 군으로부터 선택된다.
단일요법으로서 PCSK9 억제제의 투여를 제공하는 일부 구현예에서, 환자는 PCSK9 억제제의 투여 이전에 또는 그의 투여 시에, 약 70 ㎎/㎗ 초과의 혈청 저밀도 지질단백질 콜레스테롤(LDL-C) 수준으로 정의된 고콜레스테롤혈증을 나타낸다.
단일요법으로서 PCSK9 억제제의 투여를 제공하는 일부 구현예에서, 환자는 PCSK9 억제제의 투여 이전에 또는 그의 투여 시에, 약 100 ㎎/㎗ 초과의 혈청 저밀도 지질단백질 콜레스테롤(LDL-C) 수준으로 정의된 고콜레스테롤혈증을 나타낸다.
단일요법으로서 PCSK9 억제제의 투여를 제공하는 일부 구현예에서, 환자는 이형접합 가족성 고콜레스테롤혈증(heFH)을 갖는다. 단일요법으로서 PCSK9 억제제의 투여를 제공하는 일부 구현예에서, 환자는 가족성 고콜레스테롤혈증이 아닌(비-FH) 형태의 고콜레스테롤혈증을 갖는다. 일부 구현예에서, 환자는 PCSK9 억제제의 투여 이전에 또는 그의 투여 시에, 1% 이상 및 5% 미만의 계산된 10년 내 치명적 심혈관 질병 위험 SCORE로 정의되는 중등의 심혈관 위험을 갖는다. 일부 구현예에서, 환자는 PCSK9 억제제의 투여 이전에 또는 그의 투여 시에, 하기의 것 중 하나 이상과 함께, 5% 이상의 계산된 10년 내 치명적 심혈관 질병 위험 SCORE로 정의되는 높은 심혈관 위험을 갖는다: (i) 중등의 만성 신장 질병, (ii) 표적 기관 손상이 없는 1형 당뇨병, (iii) 표적 기관 손상이 없는 2형 당뇨병, 및/또는 (iv) heFH. 일부 구현예에서, 환자는 PCSK9 억제제의 투여 이전에 또는 그의 투여 시에, 하기의 것 중 하나 이상으로 정의되는 매우 높은 심혈관 위험을 갖는다: (i) 문서화된 관상동맥 심장 질병; (ii) 허혈성 뇌졸중; (iii) 말초 뇌졸중; (iv) 말초 동맥 질병(PAD); (v) 일과성 허혈 발작(TIA); (vi) 복부대동맥류; (vii) 증상이 없는 50% 초과의 경동맥 폐색; (viii) 경동맥내막절제술; (ix) 경동맥 스텐트 수술; (x) 신장 동맥 협착; (xi) 신장 동맥 스텐트 수술; (xii) 표적 기관 손상이 있는 1형 당뇨병; 및/또는 (xiii) 표적 기관 손상이 있는 2형 당뇨병.
단일요법으로서 PCSK9 억제제의 투여를 제공하는 일부 구현예에서, PCSK9 억제제는 PCSK9에 특이적으로 결합하는 항체 또는 항원-결합 단백질이다. 일부 구현예에서, 항체 또는 그의 항원 결합 단편은 SEQ ID NO: 1/6을 포함하는 HCVR/LCVR 아미노산 서열 쌍의 중쇄 및 경쇄 CDR을 포함한다. 일부 구현예에서, 항체 또는 그의 항원-결합 단편은 SEQ ID NO: 2, 3, 4, 7, 8 및 10을 갖는 중쇄 및 경쇄 CDR 아미노산 서열을 포함한다. 일부 구현예에서, 항체 또는 그의 항원-결합 단편은 SEQ ID NO: 1의 아미노산 서열을 갖는 HCVR 및 SEQ ID NO: 6의 아미노산 서열을 갖는 LCVR을 포함한다. 일부 구현예에서, 항체 또는 그의 항원-결합 단편은 SEQ ID NO: 2, 3, 4, 7, 8 및 10을 갖는 중쇄 및 경쇄 CDR 아미노산 서열을 포함하는 항체와 동일한 PCSK9 상의 에피토프에 결합한다. 일부 구현예에서, 항체 또는 그의 항원-결합 단편은 PCSK9로의 결합을 위해 SEQ ID NO: 2, 3, 4, 7, 8 및 10을 갖는 중쇄 및 경쇄 CDR 아미노산 서열을 포함하는 항체와 경쟁한다.
단일요법으로서 PCSK9 억제제의 투여를 제공하는 일부 구현예에서, PCSK9에 특이적으로 결합하는 항체 또는 항원-결합 단백질은 2주마다 1회의 빈도로 약 75 ㎎의 용량으로 환자에게 투여된다. 일부 구현예에서, 5회 이상의 투여 후에 측정되는 환자의 LDL-C가 70 ㎎/㎗ 미만이면, 약 75 ㎎ 용량이 유지된다. 일부 구현예에서, 5회 이상의 투여 후에 측정되는 환자의 LDL-C가 70 ㎎/㎗ 이상으로 유지되면, 약 75 ㎎ 용량이 중단되며, 이후에 PCSK9에 특이적으로 결합하는 항체 또는 그의 항원-결합 단편은 2주마다 1회의 빈도로 약 150 ㎎의 용량으로 환자에게 투여된다. 일부 구현예에서, PCSK9에 특이적으로 결합하는 항체 또는 항원-결합 단백질은 2주마다 1회의 빈도로 약 150 ㎎의 용량으로 환자에게 투여된다.
단일요법으로서 PCSK9 억제제의 투여를 제공하는 일부 구현예에서, 상기 방법은 하기로 이루어진 군으로부터 선택되는 하나 이상의 지질 성분의 혈청 수준을 개선시킨다: (a) 환자의 저밀도 지질단백질 콜레스테롤(LDL-C)의 적어도 35%의 감소; (b) 환자의 아포지질단백질 B(ApoB)의 적어도 25%의 감소; (c) 환자의 비-고밀도 지질단백질 콜레스테롤(비-HDL-C)의 적어도 30%의 감소; (d) 환자의 총 콜레스테롤의 적어도 20%의 감소; 및 (e) 환자의 지질단백질 a(Lp(a))의 적어도 15%의 감소.
일 구현예는 단일요법으로서 항-PCSK9 항체 또는 항원-결합 단백질을 포함하는 약제학적 조성물을 약 75 ㎎의 용량으로 환자에게 투여하여, 그에 의해 환자에서 유리 PCSK9 수준을 감소시키는 단계로서, 조성물이 2주마다 투여되고, 환자가 동시에 다른 지질 저하 치료법을 취하지 않는 단계를 포함하는 환자에서의 유리 PCSK9 수준의 감소 방법을 제공한다.
일 구현예는 단일요법으로서 다중 용량의 항-PCSK9 항체를 2주마다 약 1회의 투여 빈도로, 용량마다 약 75 내지 150 ㎎의 투여량으로 환자에게 투여하는 단계를 포함하는 하나 이상의 지질 성분의 혈청 수준의 개선을 필요로 하는 환자에서의 하나 이상의 지질 성분의 혈청 수준의 개선 방법을 제공하며, 환자는 동시에 다른 지질 변형 치료법을 취하지 않고, 항-PCSK9 항체를 사용한 약 24주의 치료 후에, 하나 이상의 지질 성분의 혈청 수준의 개선은 하기로 이루어진 군으로부터 선택된다: (a) 환자의 저밀도 지질단백질 콜레스테롤(LDL-C)의 적어도 35%의 감소; (b) 환자의 아포지질단백질 B(ApoB)의 적어도 25%의 감소; (c) 환자의 비-고밀도 지질단백질 콜레스테롤(비-HDL-C)의 적어도 30%의 감소; (d) 환자의 총 콜레스테롤의 적어도 20%의 감소; 및 (e) 환자의 지질단백질 a(Lp(a))의 적어도 15%의 감소.
본 발명의 다른 구현예는 다음의 상세한 설명의 검토로부터 명백해질 것이다.
도 1은 실시예 2에 기재된 임상 시험의 연구 설계를 보여준다. 프로토콜이 상향-적정을 위해 100 ㎎/㎗ 이상의 LDL-C 역치를 요구하지만, 70 ㎎/㎗ 이상의 역치가 이러한 연구에 맹검 방식으로 적용되었다. 도면의 하부를 따라 있는 화살표는 평가 시간을 나타낸다. EOT, 처치의 마지막; EZE, 에제티미브; LDL-C, 저밀도 지질단백질 콜레스테롤; NCEP ATP III TCP, 국립 콜레스테롤 교육 프로그램 성인 치료 패널 III; Q2W, 2주마다; W, 주.
도 2는 실시예 2에 기재된 임상 시험의 환자 배치를 보여준다. *생활 사건은 계속하기 너무 어렵게 만들었다. ITT, 치료 의향.
도 3은 실시예 2에 기재된 임상 시험에 대한 LDL-C 수준(㎎/㎗) 대 연구 시점(치료 중 분석)을 보여주는 그래프이다. 제12주 및 제24주 데이터 점 위의 값은 기준선으로부터의 LS 평균(SE) 변화%를 나타낸다. LDL-C, 저밀도 지질단백질 콜레스테롤; LS, 최소 제곱; SE, 표준 오차.
도 4는 실시예 2에 기재된 임상 시험에서, mAb316P(알리로쿠맙(Alirocumab))로 처치된 환자에서의 기준선으로부터 제12주(도 4a) 및 제24주(도 4b)까지, 및 에제티미브(치료 중 모집단)로 처치된 환자에서의 제12주(도 4c) 및 제24주(도 4d)까지의 LDL-C의 변화 백분율의 분포를 보여주는 4개의 그래프의 군이다.
도 5는 실시예 2에 기재된 임상 시험을 위한 인구통계(도 5a) 및 다른 기준선 특성(도 5b)(ITT 모집단)에 따른 제24주의 LDL-C의 기준선으로부터의 변화 백분율의 하위군 분석을 보여주는 2개의 차트의 군이다.
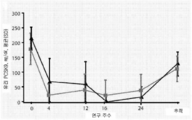
도 6은 실시예 2에 기재된 임상 시험에서 상향적정 상태에 따른 mAb316P 처치된 환자에서의 평균 LDL-C 수준(도 6a), Ctrough 및 Cfollow -up mAb316P(알리로쿠맙) 농도(도 6b) 및 유리 PCSK9 수준(도 6c)을 보여주는 일련의 그래프를 보여준다. Ctrough 값을 이전의 주사 14±6일 후에 취하였으며; Cfollow -up 값을 마지막 주사 21일 초과 후에 취하였다. 삼각형은 제12주에 상향적정된 그룹을 나타낸다. 사각형은 제12주에 비-상향적정된 그룹을 나타낸다.
도 7은 본 명세서에서 실시예 3에 기재된 임상 시험을 보여주는 연구 흐름도이다. "REGN727"은 본 명세서에 알리로쿠맙 또는 mAb316P로 지칭되는 항체에 대한 명칭이다.
도 2는 실시예 2에 기재된 임상 시험의 환자 배치를 보여준다. *생활 사건은 계속하기 너무 어렵게 만들었다. ITT, 치료 의향.
도 3은 실시예 2에 기재된 임상 시험에 대한 LDL-C 수준(㎎/㎗) 대 연구 시점(치료 중 분석)을 보여주는 그래프이다. 제12주 및 제24주 데이터 점 위의 값은 기준선으로부터의 LS 평균(SE) 변화%를 나타낸다. LDL-C, 저밀도 지질단백질 콜레스테롤; LS, 최소 제곱; SE, 표준 오차.
도 4는 실시예 2에 기재된 임상 시험에서, mAb316P(알리로쿠맙(Alirocumab))로 처치된 환자에서의 기준선으로부터 제12주(도 4a) 및 제24주(도 4b)까지, 및 에제티미브(치료 중 모집단)로 처치된 환자에서의 제12주(도 4c) 및 제24주(도 4d)까지의 LDL-C의 변화 백분율의 분포를 보여주는 4개의 그래프의 군이다.
도 5는 실시예 2에 기재된 임상 시험을 위한 인구통계(도 5a) 및 다른 기준선 특성(도 5b)(ITT 모집단)에 따른 제24주의 LDL-C의 기준선으로부터의 변화 백분율의 하위군 분석을 보여주는 2개의 차트의 군이다.
도 6은 실시예 2에 기재된 임상 시험에서 상향적정 상태에 따른 mAb316P 처치된 환자에서의 평균 LDL-C 수준(도 6a), Ctrough 및 Cfollow -up mAb316P(알리로쿠맙) 농도(도 6b) 및 유리 PCSK9 수준(도 6c)을 보여주는 일련의 그래프를 보여준다. Ctrough 값을 이전의 주사 14±6일 후에 취하였으며; Cfollow -up 값을 마지막 주사 21일 초과 후에 취하였다. 삼각형은 제12주에 상향적정된 그룹을 나타낸다. 사각형은 제12주에 비-상향적정된 그룹을 나타낸다.
도 7은 본 명세서에서 실시예 3에 기재된 임상 시험을 보여주는 연구 흐름도이다. "REGN727"은 본 명세서에 알리로쿠맙 또는 mAb316P로 지칭되는 항체에 대한 명칭이다.
본 발명을 기재하기 전에, 특정 방법 및 실험 조건은 변할 수 있으므로, 본 발명은, 기재된 특정 방법 및 실험 조건에 한정되지 않음이 이해되어야 한다. 또한, 본 명세서에 사용된 용어는, 단지 특정 구현예만을 기술하기 위한 목적을 위한 것이며, 본 발명의 범주가 첨부된 청구범위에 의해서만 제한되는 것이므로, 제한하는 것으로 의도되지 않음이 이해되어야 한다.
정의
달리 정의하지 않는 한, 본 명세서에 사용된 모든 기술적 및 과학적 용어는, 해당 분야의 숙련자에 의해 일반적으로 이해되는 바와 동일한 의미를 갖는다.
이러한 명세서 및 첨부된 청구범위에 사용된 바와 같이, 문맥에서 명백하게 다르게 언급되지 않는 한, 단수형("a", "an" 및 "the")이 복수의 참조대상도 또한 포함하는 것이 본 명세서에 언급된다.
용어 "약" 또는 "대략"은, 인용된 특정 수치와 관련하여 사용되는 경우, 당해 값이 인용된 값으로부터 1% 이하까지 변할 수 있음을 의미한다. 예를 들면, 본 명세서에 사용되는 표현 "약 100"은, 99 및 101 및 이들 사이의 모든 값(예를 들면, 99.1, 99.2, 99.3, 99.4 등)을 포함한다.
용어 "투여한다" 또는 "투여"는 체외에 존재하는 바와 같은 물질(예를 들어, 본 발명의 제형)을 환자에게 예를 들어, 점막, 피내, 정맥내, 피하, 근육내 전달 및/또는 본 명세서에 기재되거나 당업계에 공지된 임의의 다른 물리적 전달 방법에 의해 주사하거나 달리 물리적으로 전달하는 행동을 말한다. 질병 또는 그의 증상이 치료되는 경우에, 물질의 투여는 전형적으로 질병 또는 그의 증상의 발병 후에 일어난다. 질병 또는 그의 증상이 예방되는 경우에, 물질의 투여는 전형적으로 질병 또는 그의 증상의 발병 전에 일어난다.
용어 "조성물" 및 "제형"은 특정 성분(예를 들어, 항-PCSK9 항체)을 임의로 명시된 양으로 함유하는 제품, 및 임의로 명시된 양으로 명시된 성분의 조합으로부터 직접적으로 또는 간접적으로 야기되는 임의의 제품을 포함하는 것으로 의도된다.
용어 "부형제"는 약물에 대한 희석제, 비히클, 보존제, 결합제, 안정화제 등으로 통상 사용되는 불활성 물질을 말하고, 단백질(예를 들어, 혈청 알부민 등), 아미노산(예를 들어, 아스파르트산, 글루탐산, 라이신, 아르기닌, 글리신, 히스티딘 등), 지방산 및 인지질(예를 들어, 알킬 설포네이트, 카프릴레이트 등), 계면활성제(예를 들어, SDS, 폴리소르베이트, 비이온성 계면활성제 등), 당류(예를 들어, 수크로스, 말토스, 트레할로스 등) 및 폴리올(예를 들어, 만니톨, 소르비톨 등)을 포함하지만 이들에 한정되지 않는다. 또한 그 전문이 본 명세서에 참고로 포함되는 문헌[Remington's Pharmaceutical Sciences (1990) Mack Publishing Co., Easton, Pa.]을 참조한다.
펩티드 또는 폴리펩티드의 맥락에서, 용어 "단편"은 전장 아미노산 서열보다 작은 서열을 포함하는 펩티드 또는 폴리펩티드를 의미한다. 그러한 단편은 예를 들어 아미노 말단에서의 절단, 카르복시 말단에서의 절단, 및/또는 아미노산 서열로부터 잔기(들)의 내부 결실로부터 야기될 수 있다. 단편은 예를 들어 대안적 RNA 스플라이싱 또는 생체내 프로테아제 활성으로부터 야기될 수 있다. 특정 구현예에서, PCSK9 단편은 PCSK9 폴리펩티드의 아미노산 서열의 적어도 50개, 100개 아미노산 잔기, 적어도 125개의 연속 아미노산 잔기, 적어도 150개의 연속 아미노산 잔기, 적어도 175개의 연속 아미노산 잔기, 적어도 200개의 연속 아미노산 잔기 또는 적어도 250개의 연속 아미노산 잔기의 아미노산 서열을 포함하는 폴리펩티드를 포함한다. 특정 구현예에서, PCSK9 폴리펩티드, 또는 PCSK9 항원에 특이적으로 결합하는 항체의 단편은 전장 폴리펩티드 또는 항체의 적어도 1, 적어도 2, 또는 적어도 3개의 기능을 유지한다.
용어 "약제학적으로 허용되는"은 동물, 더욱 특별히 인간에서 사용하기 위해 연방 정부 또는 주 정부의 관리 기관에 의해 승인되거나 미국 약전, 유럽 약전 또는 다른 일반적으로 인지되어 있는 약전에 열거된 것을 의미한다.
용어 "예방하다", "예방하는" 및 "예방"은 본 명세서에 제공된 치료법 또는 치료법의 병용(예를 들어, 예방 또는 치료제의 병용)의 시행으로부터 야기되는, PCSK9-매개의 질병 및/또는 그와 관련된 증상의 발생, 재발, 발병 또는 확산의 완전한 또는 부분적인 억제를 말한다.
용어 "PCSK9 항원"은 항체가 특이적으로 결합하는 PCSK9 폴리펩티드의 부분을 말한다. 또한, PCSK9 항원은 항체가 특이적으로 결합하는 PCSK9 폴리펩티드 또는 그의 단편의 유사체 또는 유도체를 말한다. 일부 구현예에서, PCSK9 항원은 단량체 PCSK9 항원 또는 삼량체 PCSK9 항원이다. 에피토프에 기여하는 PCSK9 폴리펩티드의 영역은 폴리펩티드의 연속 아미노산일 수 있거나 또는 에피토프는 폴리펩티드의 2개 이상의 비-연속 영역에서 함께 비롯될 수 있다. 에피토프는 항원의 3차원 표면 특징부일 수 있거나 아닐 수 있다. 면역 반응을 유도할 수 있는 PCSK9 항원의 표면상의 국소화된 영역이 PCSK9 에피토프이다. 에피토프는 항원의 3차원 표면 특징부일 수 있거나 아닐 수 있다.
용어 "인간 PCSK9", "hPCSK9" 또는 "hPCSK9 폴리펩티드" 및 유사 용어는 SEQ ID NO: 198의 아미노산 서열을 포함하는 폴리펩티드("폴리펩티드", "펩티드" 및 "단백질"은 본 명세서에 상호교환 가능하게 사용됨) 및 그의 SNP 변이체를 포함하는 관련 폴리펩티드를 말한다. 관련된 폴리펩티드는 바람직하게는 PCSK9 활성을 보유하고/하거나 항-PCSK9 면역 반응을 생성시키기에 충분한 대립형질 변이체(예를 들어, SNP 변이체); 스플라이스 변이체; 단편; 유도체; 치환, 결실 및 삽입 변이체; 융합 폴리펩티드; 및 종간 상동체를 포함한다. 또한, 항-PCSK9 면역학적 반응을 생성시키기에 충분한 가용성 형태의 PCSK9도 포함된다. 당업자가 이해할 바와 같이, 항-PCSK9 항체는 PCSK9 폴리펩티드, 폴리펩티드 단편, 항원, 및/또는 에피토프에 결합할 수 있는데, 이것은 에피토프가 보다 큰 항원의 일부이고, 이 항원은 보다 큰 폴리펩티드 단편의 일부이고, 이 단편은 다시 보다 큰 폴리펩티드의 일부이기 때문이다. hPCSK9는 삼량체(고유) 또는 단량체(변성) 형태로 존재할 수 있다.
용어 "PCSK9-매개의 질병", "PCSK9-매개의 질환" 및 "PCSK9-매개의 장애"는 상호교환 가능하게 사용되며, 전적으로 또는 부분적으로 PCSK9, 예를 들어, hPCSK9에 의해 야기되거나, 또는 그의 결과인 임의의 질병을 말한다. 특정 구현예에서, PCSK9는 비정상적으로(예를 들어, 고도로) 발현된다. 일부 구현예에서, PCSK9는 비정상적으로 상향조절될 수 있다. 다른 구현예에서, 정상, 비정상 또는 과도한 세포 신호전달은 PCSK9 리간드로의 PCSK9 결합에 의해 야기된다. 특정 구현예에서, PCSK9 리간드는 PCSK9 수용체이다. 특정 구현예에서, PCSK9-매개의 질병 또는 질환은 상승된 총 콜레스테롤 수준; 상승된 저밀도 지질단백질 콜레스테롤(LDL-C) 수준; 고지혈증; 이상지질혈증; 고콜레스테롤혈증, 특히 스타틴에 의해 조절되지 않는 고콜레스테롤혈증, 고콜레스테롤혈증, 예를 들어, 가족성 고콜레스테롤혈증 또는 비-가족성 고콜레스테롤혈증 및 스타틴에 의해 조절되지 않는 고콜레스테롤혈증; 죽상경화증; 및 심혈관 질병으로 이루어진 군으로부터 선택된다.
용어 "대상체" 및 "환자"는 상호교환 가능하게 사용된다. 본 명세서에 사용되는 바와 같이, 대상체는 바람직하게는 포유류, 예를 들어 비-영장류(예를 들어, 소, 돼지, 말, 고양이, 개, 랫트 등) 또는 영장류(예를 들어, 원숭이 및 인간), 가장 바람직하게는 인간이다. 일 구현예에서, 대상체는 PCSK9-매개 질병을 갖는 포유류, 바람직하게는 인간이다. 다른 구현예에서, 대상체는 PCSK9-매개의 질병이 발생할 위험이 있는 포유류, 바람직하게는 인간이다.
용어 "치료제"는 PCSK9-매개의 질병 및/또는 그와 관련된 증상의 치료, 관리 또는 개선에 사용될 수 있는 임의의 작용제를 말한다. 특정 구현예에서, 용어 "치료제"는 본 발명의 PCSK9 항체를 말한다. 다른 특정 구현예에서, 용어 "치료제"는 본 발명의 PCSK9 항체 이외의 작용제를 말한다. 바람직하게는, 치료제는 PCSK9-매개의 질병 또는 그와 관련된 하나 이상의 증상의 치료, 관리 또는 개선을 위해 유용한 것으로 알려져 있거나, 그를 위해 사용되어 왔거나, 현재 사용되고 있는 작용제이다.
용어 "치료법"은 PCSK9-매개의 질병(예를 들어, 죽상경화증 또는 고콜레스테롤혈증)의 예방, 관리, 치료 및/또는 개선에 사용될 수 있는 임의의 프로토콜, 방법 및/또는 작용제를 말한다. 특정 구현예에서, 용어 "치료법(들)"은 생물학적 치료법, 지지 요법 및/또는 해당 분야의 숙련자, 예를 들어 의료인에게 알려져 있는, PCSK9-매개의 질병의 예방, 관리, 치료 및/또는 개선에 유용한 다른 치료법을 말한다.
용어 "치료하다", "치료" 및 "치료하는"은 하나 이상의 치료법의 시행(하나 이상의 예방 또는 치료제의 투여를 포함하나 이에 제한되지 않음)으로부터 야기되는 PCSK9-매개의 질병(예를 들어, 죽상경화증)의 진행, 중증도, 및/또는 기간의 감소 또는 개선을 말한다. 특정 구현예에서, 그러한 용어는 PCSK9 리간드로의 PCSK9의 결합의 감소 또는 억제를 말한다.
본 명세서에 기재된 것들과 유사하거나 동등한 임의의 방법 및 물질이 본 발명의 실시에 사용될 수 있지만, 바람직한 방법 및 물질이 이제 기재된다. 본 명세서에 언급된 모든 간행물은 그들 전체가 본 명세서에 설명하기 위한 참조로 포함된다.
환자 선택
본 발명은 특히 스타틴 비반응성이거나, 스타틴 치료법으로 불량하게 조절되거나, 스타틴에 불내약성이거나, 스타틴 치료법에 대한 유해 반응의 전력을 갖는 환자를 포함하는 고지혈증을 갖는, 스타틴 치료법이 진행 중이 아닌 환자를 치료하기에 유용한 방법 및 조성물을 포함한다.
본 발명의 방법은 PCSK9-매개의 질병 또는 질환, 예를 들어, 고지혈증 또는 관련 장애(예를 들어, 죽상경화증)를 갖거나 그것이 발생할 위험이 있는 환자를 선택하는 단계 및 PCSK9 억제제를 포함하는 약제학적 조성물을 이들 환자에게 투여하는 단계를 포함한다. 예를 들어, 환자가 고지혈증 질환, 예를 들어, 이형접합 가족성 고콜레스테롤혈증(heFH), 동형접합 가족성 고콜레스테롤혈증(hoFH), 상염색체 우성 고콜레스테롤혈증(ADH, 예를 들어, PCSK9 유전자의 하나 이상의 기능-획득 돌연변이와 관련된 ADH), 비-가족성 고콜레스테롤혈증(비-FH), 이상지질혈증 및 혼합형 이상지질혈증이 있는 것으로 진단되거나 그것이 발생할 위험에 있는 것으로 확인되면, 환자는 본 발명의 방법을 사용한 치료를 위해 선택될 수 있다. 특정 양태에서, 치료될 환자는 LDL 분리반출법이 필요하다. 특정 양태에서, 고지혈증이 있는 환자는 또한 2형 당뇨병을 갖는다. 특정 양태에서, 치료될 환자는 고콜레스테롤혈증이 있는 것으로 진단되며, 스타틴 불내약성이거나, 스타틴-비반응성이거나, 스타틴으로 비조절된다. 본 명세서에 사용되는 바와 같이, 고지혈증은 원발성 고지혈증, 속발성 고지혈증 및 프레드릭슨 표현형 분류 I 내지 V를 포함한다.
본 명세서에 사용되는 표현 "그를 필요로 하는 환자"는 고지혈증의 하나 이상의 증상 또는 적응증을 나타내거나, 고지혈증이 있는 것으로 진단되거나 다르게는 총 혈청 콜레스테롤, LDL, 트리글리세리드, VLDL, 지질단백질(a)[Lp(a)]의 감소로 이익을 얻거나, HDL의 증가로 이익을 얻을 인간 또는 비인간 동물을 의미한다.
본 발명의 방법은 현재 스타틴 치료법이 진행 중이 아닌 환자를 선택하는 단계를 포함한다. 본 명세서에 사용되는 바와 같이, 스타틴 치료법은 HMG-CoA 환원효소의 억제제이며, 아토르바스타틴, 세리바스타틴(cerivastatin), 플루바스타틴, 로바스타틴, 메바스타틴(mevastatin), 피타바스타틴, 프라바스타틴, 로수바스타틴, 심바스타틴 등을 포함하나 이들에 한정되지 않는다. 일부 구현예에서, PCSK9 억제제의 용량은 제1 용량의 PCSK9 억제제의 투여 이전에 또는 그의 투여와 동시에 이전의(또는 "백그라운드") 스타틴 치료법이 중단된 환자에게 투여된다.
특정 구현예에 따르면, 중등의, 높은 또는 매우 높은 CV 위험을 갖는 것에 기초하여 환자가 선택될 수 있다. CV 위험도는 본 명세서에 개시내용 전문이 참조로 포함되는 문헌[ESC/EAS Guidelines for the Management of Dislipidaemias, European Heart Journal, 2100; 32:1769-1818](본 명세서에 "ESC/EAS 2011"로 지칭)에 기재된 바와 같은 유럽심장학회(ESC) 및 유럽동맥경화학회(EAS)의 이상지질혈증의 관리를 위한 대책 위원회에 의해 정의된, 계산된 10년 내 치명적 심혈관 질병(CVD) 위험 SCORE 값에 관하여 평가되고 표현될 수 있다. 본 명세서에 사용되는 "중등의 CV 위험"은 1% 이상 및 5% 미만의 계산된 10년 내 치명적 CVD 위험 SCORE를 의미한다. 본 명세서에 사용되는 "높은 CV 위험"은 5% 이상의 계산된 10년 내 치명적 CVD 위험 SCORE 및/또는 중등의 신장 질병(CKD) 및/또는 표적 기관 손상이 없는 1형 또는 2형 당뇨병 및/또는 heFH를 의미한다. 본 명세서에 사용되는 "매우 높은 CV 위험"은 문서화된 관상동맥 심장 질병(CHD), 허혈성 뇌졸중, 말초 동맥 질병(PAD), 일과성 허혈 발작(TIA), 복부대동맥류, 증상이 없는 50% 초과의 경동맥 폐색, 경동맥내막절제술 또는 경동맥 스텐트 수술, 신장 동맥 협착, 신장 동맥 스텐트 수술 및/또는 표적 기관 손상이 있는 1형 또는 2형 당뇨병의 전력을 의미한다.
특정 구현예에 따르면, 환자는 관상동맥 심장 질병(CHD)의 전력을 갖는 것에 기초하여 선택될 수 있다. 본 명세서에 사용되는 바와 같이, "CHD의 전력"(또는 "문서화된 CHD의 전력")은 (i) 급성 심근경색(MI); (ii) 무증상 MI; (iii) 불안정협심증; (iv) 관상동맥재개통 수술(예를 들어, 경피 관상동맥 시술[PCI] 또는 관상동맥우회술[CABG]); 및/또는 (v) 침습적 또는 비-침습적 시험(예를 들어, 관상동맥 조영술, 트레드밀(treadmill)을 사용한 부하 시험, 부하 심초음파 또는 핵 영상화)에 의해 진단된 임상적으로 유의미한 CHD 중 하나 이상을 포함한다.
특정 구현예에 따르면, 환자는 연령(예를 들어, 40, 45, 50, 55, 60, 65, 70, 75 또는 80세 이상), 인종, 국적, 성별(남성 또는 여성), 운동 습관(예를 들어, 정기적으로 운동하거나 그렇지 않은 사람), 기타 이전 건강 상태(예를 들어, 2형 당뇨병, 고혈압 등) 및 현재 약물투여 상태(예를 들어, 현재 베타 차단제, 니아신, 에제티미브, 피브레이트, 오메가-3 지방산, 담즙산 수지 등을 섭취)로 이루어진 군으로부터 선택되는 하나 이상의 추가의 위험 인자를 갖는 것에 기초하여 선택될 수 있다.
본 발명의 방법은 하나 이상의 용량의 PCSK9 억제제를 스타틴 치료법이 진행 중이 아닌 환자에게 투여하는 단계를 포함한다. 고지혈증이 있는 환자는 그들이 스타틴 비-반응성이거나, 스타틴 치료법으로 불량하게 조절되거나, 스타틴에 불내약성이거나, 스타틴 치료법에 유해 반응의 전력을 갖기 때문에, 또는 임의의 다른 이유로, 스타틴 치료법이 진행 중이 아닐 수 있다.
생활방식의 변형 및 통상적인 약물 치료가 콜레스테롤 수준을 감소시키는 데에 종종 성공적이지만, 모든 환자가 그러한 방법을 사용하여 권고된 표적 콜레스테롤 수준을 달성할 수 있는 것은 아니다. 가족성 고콜레스테롤혈증(FH)과 같은 다양한 질환은 통상적인 치료법의 적극적 사용에도 불구하고 LDL-C 수준의 저하에 대해 저항성이 있는 것으로 보인다. 동형접합 및 이형접합 가족성 고콜레스테롤혈증(hoFH, heFH)은 조기 죽상경화 혈관 질병과 관련된 질환이다. 그러나 hoFH가 있는 것으로 진단된 환자는 통상적인 약물 치료법에 대해 크게 반응하지 않으며, 제한된 치료 선택을 갖는다. 구체적으로, 콜레스테롤 합성을 억제하고 간 LDL 수용체를 상향조절함으로써 LDL-C를 감소시키는 스타틴을 사용한 치료는 LDL 수용체가 존재하지 않거나 결함이 있는 환자에서 효과를 거의 갖지 않을 수 있다. 단지 약 20% 미만의 평균 LDL-C 감소가 최대 용량의 스타틴을 사용하여 치료된 유전자형-확인 hoFH가 있는 환자에서 최근에 보고되었다. 이러한 섭생에 대한 에제티미브 10 ㎎/일의 부가는 27%의 LDL-C 수준의 총 감소를 초래하며, 이는 여전히 최적이 아니다. 또한, 많은 환자는 스타틴 비-반응성이거나, 스타틴 치료법으로 불량하게 조절된다.
일부 양태에서, 본 발명의 방법은 하나 이상의 용량의 PCSK9 억제제를 "스타틴 불내약성" 또는 "스타틴에 불내약성"인 환자에게 투여하는 단계를 포함한다. 본 명세서에 사용되는 환자는 환자가 매일의 스타틴 치료 섭생이 진행 중인 동안 시작되거나 증가되고, 스타틴 치료법이 중단되는 경우 중지되는 하나 이상의 유해 반응을 경험한 전력을 갖는다면, "스타틴 불내약성" 또는 "스타틴에 불내약성"인 것으로 간주된다. 특정 구현예에서, 유해 반응은 근골격 성질이며, 예를 들어, 골격근 통증, 아픔, 쇠약 또는 경련(예를 들어, 근육통, 근육병증, 횡문근융해 등)이다. 특정 구현예에서, 유해 반응은 운동 또는 활동 후에 발생하거나 심해지는 골격근 통증 또는 아픔이다. 또한, 스타틴-관련 유해 반응은 스타틴 투여와 상호관련된 간, 위장 및 정신의학 증상을 포함한다. 특정 구현예에 따르면, 환자가 적어도 2가지의 상이한, 개별적인 매일의 스타틴 치료 섭생과 관련된 골격근-관련 증상의 전력을 갖는다면, 환자는 "스타틴 불내약성" 또는 "스타틴에 불내약성"인 것으로 간주된다. 특정 구현예에 따르면, 환자가 승인된 가장 낮은 1일의 용량의 하나 이상의 스타틴에 대하여 하나 이상의 스타틴-관련 유해 반응(들)을 나타낸다면, 환자는 "스타틴 불내약성" 또는 "스타틴에 불내약성"이다. 특정 구현예에서, 환자가 승인된 가장 낮은 정제 크기의 7배의 주별 누적 스타틴 용량에 내약성이 없다면, 환자는 "스타틴 불내약성" 또는 "스타틴에 불내약성"이다. 본 발명의 다른 구현예에 따르면, 환자가 저용량 스타틴 치료법에 내약성이 있으나, (예를 들어, 표적화된 LDL-C 수준을 달성하기 위하여) 용량이 증가되는 경우 증상이 발생한다면, 환자는 "스타틴 불내약성" 또는 "스타틴에 불내약성"이다.
본 발명에 따르면, "적어도 2가지의 상이한 개별적인 스타틴을 취하는 것과 관련된 골격근-관련 증상의 전력"은 스타틴 치료법 동안 시작되거나 증가되고, 스타틴 치료법이 중단되는 경우 중지되는 골격근-관련 통증, 아픔, 쇠약 및/또는 경련을 포함한다. 본 발명의 맥락에서, 스타틴 불내약성과 관련된 예시적인 스타틴 치료법은 매일 5 ㎎의 로수바스타틴, 매일 10 ㎎의 아토르바스타틴, 매일 10 ㎎의 심바스타틴, 매일 20 ㎎의 로바스타틴, 매일 40 ㎎의 프라바스타틴, 매일 40 ㎎의 플루바스타틴 및 매일 2 ㎎의 피타바스타틴으로 이루어진 군으로부터 선택되는 매일의 치료적 스타틴 섭생을 포함할 수 있다.
본 발명의 방법으로 치료될 수 있는 환자는 하나 이상의 다른 비-스타틴 지질 변형 치료법을 받을 수 있다. 대안적으로, 그들은 다른 지질 변형 치료법을 받지 않을 수 있으며; 이러한 예에서, PCSK9 억제제의 투여는 단일요법으로 기재될 수 있다. 본 명세서에 사용되는 바와 같이, "단일요법"으로서의 PCSK9 억제제의 이용은 임의의 다른 동시의 지질 변형 치료법의 부재를 의미한다.
고지혈증을 치료하고 혈청 LDL-C 수준을 감소시키기 위한 방법
특정 구현예에 따르면, 본 발명의 방법에 의해 치료 가능한 환자는 고콜레스테롤혈증(때때로, 본 명세서에 "고콜레스테롤혈증 환자"로 지칭됨)을 포함하는 고지혈증을 갖는다. 본 명세서에 사용되는 "고콜레스테롤혈증"은 환자의 심혈관 위험("CV 위험")에 따라, 70 ㎎/㎗ 이상의 혈청 LDL-C 농도 또는 100 ㎎/㎗ 이상의 혈청 LDL-C 농도를 포함한다. 예를 들어, 매우 높은 CV 위험(본 명세서의 다른 곳에 정의된 바와 같음)이 있는 환자에 있어서, 환자의 혈청 LDL-C 농도가 약 70 ㎎/㎗ 이상이면, 환자는 고콜레스테롤혈증을 갖는 것으로 간주된다. 중등의 또는 높은 CV 위험(본 명세서의 다른 곳에 정의된 바와 같음)이 있는 환자에 있어서, 환자의 혈청 LDL-C 농도가 약 100 ㎎/㎗ 이상이면, 환자는 고콜레스테롤혈증을 갖는 것으로 간주된다.
본 발명의 목적을 위하여 고콜레스테롤혈증은 이형접합 가족성 고콜레스테롤혈증(heFH), 동형접합 가족성 고콜레스테롤혈증(hoFH), 상염색체 우성 고콜레스테롤혈증(ADH, 예를 들어, PCSK9 유전자의 하나 이상의 기능-획득 돌연변이와 관련된 ADH), 및 가족성 고콜레스테롤혈증과는 무관한 고콜레스테롤혈증(비-FH)의 발생을 포함한다.
본 발명은 환자에서의 혈청 LDL-C 수준의 감소 방법을 포함한다. 환자는 고콜레스테롤혈증, 스타틴 불내약성 환자 또는 혈청 LDL-C의 감소가 유리하거나 바람직한 것으로 간주되는 임의의 다른 환자일 수 있다. 유사하게, 본 발명은 골격근 통증, 불쾌감, 쇠약 또는 경련을 유도하지 않는, 환자에서의 혈청 LDL-C 수준의 감소 방법을 포함한다. 이러한 맥락에 사용되는 바와 같이, "혈청 LDL-C 수준의 감소"는 환자의 혈청 LDL-C 수준을 적어도 10%(예를 들어, 적어도 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% 이상) 감소되게 야기하는 것을 의미한다.
스타틴
사용의 배제 또는 감소 방법
본 발명은 특히, 고콜레스테롤혈증 환자, 예를 들어, 스타틴에 불내약성인 고콜레스테롤혈증 환자를 포함하는 고지혈증이 있는 환자에서의 스타틴 사용을 배제하거나 감소시키는데 유용한 방법 및 조성물을 포함한다. 본 발명의 이러한 양태에 따른 방법은 (a) 매일의 치료적 스타틴 섭생이 진행 중이거나 진행 중이었고, 스타틴에 불내약성이거나 스타틴 치료법에 유해 반응의 전력을 갖는 환자를 선택하는 단계; 및 (b) 환자의 매일의 치료적 스타틴 섭생을 중단하거나 감소시키는 단계; 및 (c) 하나 이상의 용량의 PCSK9 억제제를 환자에게 투여하는 단계를 포함한다. 본 발명의 이러한 양태의 특정 구현예에 따르면, 환자의 매일의 치료적 스타틴 섭생은 환자로의 하나 이상의 용량의 PCSK9 억제제의 투여를 포함하는 치료적 처치 과정 당시에, 또는 그의 개시 직전에 완전히 중단될 수 있다. 다른 구현예에서, 환자의 매일의 치료적 스타틴 섭생은 환자로의 하나 이상의 용량의 PCSK9 억제제의 투여를 포함하는 치료적 처치 과정 당시에 또는 그의 개시 직전에 점차 감소될 수 있다. 본 발명의 이러한 양태의 맥락에서, 스타틴 섭생의 점차적인 감소는 환자에게 투여되는 스타틴의 양의 감소 및/또는 환자로의 스타틴의 투여 빈도의 감소를 포함할 수 있다. 본 발명의 이러한 양태에 따른, 스타틴 섭생의 점차적인 감소는 환자가 스타틴 대신에 PCSK9 억제제를 받는 동안 환자에 의한 스타틴 이용의 완전한 배제를 야기할 수 있다. 이러한 양태에서, PCSK9 억제제의 투여에 의해 환자에서 고콜레스테롤혈증의 적당한 치료를 가능하게 하면서, 환자에 의한 스타틴 이용을 감소시키거나 배제함으로써 환자에 대한 스타틴의 유해 효과는 감소되거나 제거된다.
치료 효능
본 발명의 방법은 LDL-C, ApoB100, 비-HDL-C, 총 콜레스테롤, VLDL-C, 트리글리세리드, Lp(a) 및/또는 잔여 콜레스테롤로 이루어진 군으로부터 선택되는 하나 이상의 지질 성분의 혈청 수준의 감소 및 ApoA-1의 증가를 야기한다.
본 발명의 특정 구현예에 따르면, 단일요법으로서 고콜레스테롤혈증이 있는 환자로의 PCSK9 억제제를 포함하는 약제학적 조성물의 투여는 임의의 다른 지질 변형 치료법의 부재하에 기준선으로부터 적어도 약 25%, 30%, 40%, 45%, 50%, 60% 이상의 혈청 저밀도 지질단백질 콜레스테롤(LDL-C)의 감소 평균 백분율; 기준선으로부터 적어도 약 25%, 30%, 40%, 50%, 60% 이상의 ApoB100의 감소 평균 백분율; 기준선으로부터 적어도 약 25%, 30%, 40%, 50%, 60% 이상의 비-HDL-C의 감소 평균 백분율; 기준선으로부터 적어도 약 10%, 15%, 20%, 25%, 30%, 35% 이상의 총 콜레스테롤의 감소 평균 백분율; 및/또는 기준선으로부터 적어도 약 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10% 이상의 ApoA-1의 증가 평균 백분율을 야기할 것이다. 상기 기재된 바와 같은 다양한 지질 파라미터의 감소 백분율은 본 명세서에 개시된 바와 같은 PCSK9 억제제의 투여를 포함하는 치료적 섭생(예를 들어, 2주마다 1회 투여되는 75 ㎎ 또는 150 ㎎의 mAb316P, 또는 다른 유사 투여 섭생; 예를 들어, 본 명세서의 실시예 2 참조)의 개시 후 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30주 이상에 달성될 수 있다.
특정 구체적인 구현예에 따르면, 본 발명은 임의의 다른 지질 변형 치료법의 부재 하에 고콜레스테롤혈증 환자에서의 혈청 LDL-C 수준의 감소 방법을 포함한다. 본 발명의 이러한 양태에 따른 방법은 (a) 중등의 심혈관 위험이 있고, 임의의 다른 지질 변형 치료법을 받고 있지 않는 100 ㎎/㎗(2.59 mmol/ℓ) 내지 190 ㎎/㎗(4.9 mmol/ℓ)의 LDL-C가 있는 환자를 선택하는 단계; 및 (b) 다중 용량의 항-PCSK9 항체를 용량당 약 75 내지 150 ㎎의 투여량 및 2주마다 약 1회의 투여 빈도로 환자에게 투여하는 단계로서, 항-PCSK9 항체를 사용한 약 24주의 치료 후에, 환자는 하기로 이루어진 군으로부터 선택되는 하나 이상의 지질 파라미터 개선을 나타내는 단계를 포함한다: 기준선으로부터 약 47%의 LDL-C 수준의 감소, 기준선으로부터 약 41%의 비-HDL-C 수준의 감소, 기준선으로부터 약 37%의 Apo B 수준의 감소 및/또는 기준선으로부터 약 30%의 총 콜레스테롤 수준의 감소. 본 발명의 이러한 양태에 따른 방법은 항-PCSK9 항체를 사용한 치료의 개시 이전에 또는 그와 동시에 환자의 백그라운드 지질 변형 치료법을 중단하는 단계를 포함할 수 있다.
본 발명의 방법은 LDL-C, ApoB100, 비-HDL-C, 총 콜레스테롤, VLDL-C, 트리글리세리드, Lp(a) 및/또는 잔류 콜레스테롤로 이루어진 군으로부터 선택되는 하나 이상의 지질 성분의 혈청 수준의 감소를 야기한다. 예를 들어, 본 발명의 특정 구현예에 따르면, 스타틴에 불내약성이거나, 스타틴 치료법에 유해 반응의 전력을 갖는 고콜레스테롤혈증이 있는 환자(본 명세서에 "고콜레스테롤혈증, 스타틴-불내약성 환자"로도 지칭)로의 PCSK9 억제제를 포함하는 약제학적 조성물의 투여는 기준선으로부터 적어도 약 25%, 30%, 40%, 45%, 50%, 60% 이상의 혈청 저밀도 지질단백질 콜레스테롤(LDL-C)의 평균 감소 백분율; 기준선으로부터 적어도 약 25%, 30%, 40%, 50%, 60% 이상의 ApoB100의 평균 감소 백분율; 기준선으로부터 적어도 약 25%, 30%, 40%, 50%, 60% 이상의 비-HDL-C의 평균 감소 백분율; 기준선으로부터 적어도 약 10%, 15%, 20%, 25%, 30%, 35% 이상의 총 콜레스테롤의 평균 감소 백분율; 기준선으로부터 적어도 약 5%, 10%, 15%, 20%, 25%, 30% 이상의 VLDL-C의 평균 감소 백분율; 기준선으로부터 적어도 약 5%, 10%, 15%, 20%, 25%, 30%, 35% 이상의 트리글리세리드(예를 들어, 공복 트리글리세리드)의 평균 감소 백분율; 및/또는 기준선으로부터 적어도 약 5%, 10%, 15%, 20%, 25% 이상의 Lp(a)의 평균 감소 백분율을 야기할 것이다. 상기 기재된 바와 같은 다양한 지질 파라미터의 감소 백분율은 본 명세서에 개시된 바와 같은 PCSK9 억제제의 투여를 포함하는 치료적 섭생(예를 들어, 2주마다 1회 투여되는 75 ㎎ 또는 150 ㎎ mAb316P 또는 다른 유사한 투여 섭생; 예를 들어, 본 명세서의 실시예 3 참조)의 개시 후 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30주 이상에 달성될 수 있다.
특정 구체적인 구현예에 따르면, 본 발명은 고콜레스테롤혈증 스타틴 불내약성 환자에서의 혈청 LDL-C 수준의 감소 방법을 포함한다. 본 발명의 이러한 양태에 따른 방법은 (a) 스타틴에 불내약성이거나 스타틴 치료법에 유해 반응의 전력을 갖는 중등의, 높은 또는 매우 높은 심혈관 위험이 있는 환자를 선택하는 단계; 및 (b) 다중 용량의 항-PCSK9 항체를 용량마다 약 75 내지 150 ㎎의 투여량 및 2주마다 약 1회의 투여 빈도로 환자에게 투여하는 단계로서, 항-PCSK9 항체를 사용한 약 24주의 치료 후에, 환자는 하기로 이루어진 군으로부터 선택되는 하나 이상의 지질 파라미터 개선을 나타내는 단계를 포함한다: 기준선으로부터 약 45%의 LDL-C 수준의 감소, 기준선으로부터 약 40%의 비-HDL-C 수준의 감소, 기준선으로부터 약 36%의 Apo B 수준의 감소 및/또는 기준선으로부터 약 26%의 Lp(a) 수준의 감소. 본 발명의 이러한 양태에 따른 방법은 항-PCSK9 항체를 사용한 치료의 개시 이전에 또는 그와 동시에 환자의 백그라운드 스타틴 치료법을 중단하는 단계를 포함할 수 있다.
PCSK9
억제제
본 발명의 방법은 PCSK9 억제제를 포함하는 치료적 조성물을 환자에게 투여하는 단계를 포함한다. 본 명세서에 사용되는 "PCSK9 억제제"는 시험관내 또는 생체내에서 인간 PCSK9에 결합하거나 그와 상호작용하며, PCSK9의 정상의 생물학적 기능을 억제하는 임의의 작용제이다. PCSK9 억제제의 부류의 비제한적인 예는 소분자 PCSK9 길항제, 펩티드-기반의 PCSK9 길항제(예를 들어, "펩티바디(peptibody)" 분자) 및 인간 PCSK9에 특이적으로 결합하는 항체 또는 항체의 항원-결합 단편을 포함한다.
본 명세서에 사용되는 용어 "인간 프로단백질 전환효소 서브틸리신/켁신 9형" 또는 "인간 PCSK9" 또는 "hPCSK9"는 SEQ ID NO: 197에 나타낸 핵산 서열에 의해 인코딩되며, SEQ ID NO: 198의 아미노산 서열을 포함하는 PCSK9 또는 그의 생물학적 활성 단편을 말한다.
본 명세서에 사용되는 용어 "항체"는 4개의 폴리펩티드 쇄, 이황화 결합에 의해 상호-연결되는 2개의 중(H) 쇄 및 2개의 경(L) 쇄를 포함하는 면역글로불린 분자, 및 그의 다량체(예를 들어, IgM)를 말하고자 한다. 각각의 중쇄는 중쇄 가변 영역(본 명세서에서 HCVR 또는 VH로 약칭됨) 및 중쇄 불변 영역을 포함한다. 중쇄 불변 영역은 3개의 도메인, CH1, CH2 및 CH3을 포함한다. 각각의 경쇄는 경쇄 가변 영역(본 명세서에서 LCVR 또는 VL로 약칭됨) 및 경쇄 불변 영역을 포함한다. 경쇄 불변 영역은 1개의 도메인(CL1)을 포함한다. VH 및 VL 영역은 추가로 보다 보존된, 프레임워크 영역(FR)으로 명명된 영역이 산재된, 상보성 결정 영역(CDR)으로 명명된, 초가변성의 영역으로 세분될 수 있다. 각각의 VH 및 VL은 아미노-말단으로부터 카복시-말단으로, 다음 순서: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4로 배열된, 3개의 CDR 및 4개의 FR로 이루어진다. 본 발명의 상이한 구현예에서, 항-PCSK9 항체(또는 그의 항원-결합 부분)의 FR은 인간 생식계 서열과 동일할 수 있거나, 천연적으로 또는 인공적으로 변형될 수 있다. 아미노산 공통 서열은 2개 이상의 CDR의 병렬 분석을 기준으로 정의될 수 있다.
본 명세서에 사용되는 용어 "항체"는 또한 전체 항체 분자의 항원-결합 단편을 포함한다. 본 명세서에 사용되는 용어 항체의 "항원-결합 부분", 항체의 "항원-결합 단편" 등은 항원과 특이적으로 결합하여 복합체를 형성하는 임의의 천연적으로 발생하는, 효소적으로 수득 가능한, 합성, 또는 유전자 조작된 폴리펩티드 또는 당단백질을 포함한다. 항체의 항원-결합 단편은, 예를 들어 항체 가변 및 선택적으로 불변 도메인을 인코딩하는 DNA의 조작 및 발현을 수반하는 단백질 분해 또는 재조합 유전자 조작 기술과 같은 임의의 적합한 표준 기술을 사용하여 전체 항체 분자로부터 유래될 수 있다. 그러한 DNA는, 예를 들어 상업적 공급처, DNA 라이브러리(예를 들어, 파지-항체 라이브러리를 포함)로부터 알려져 있고/거나 그로부터 용이하게 이용 가능하거나, 합성될 수 있다. DNA를 시퀀싱하고, 화학적으로 또는 분자 생물학 기술을 사용하여 조작하여, 예를 들어 하나 이상의 가변 및/또는 불변 도메인을 적합한 배치로 배열하거나 코돈을 도입하거나, 시스테인 잔기를 생성하거나, 아미노산을 변형, 부가 또는 결실시킬 수 있다.
항원-결합 단편의 비-제한적인 예는 (i) Fab 단편; (ii) F(ab')2 단편; (iii) Fd 단편; (iv) Fv 단편; (v) 단쇄 Fv(scFv) 분자; (vi) dAb 단편; 및 (vii) 항체의 초가변 영역을 모방하는 아미노산 잔기로 이루어진 최소 인식 단위(예를 들어, 단리된 상보성 결정 영역(CDR), 예를 들어, CDR3 펩티드) 또는 구속된 FR3-CDR3-FR4 펩티드를 포함한다. 다른 조작된 분자, 예를 들어, 도메인 특이적 항체, 단일 도메인 항체, 도메인-결실 항체, 키메라 항체, CDR-이식 항체, 디아바디(diabody), 트리아바디(triabody), 테트라바디(tetrabody), 미니바디(minibody), 나노바디(nanobody)(예를 들어, 1가 나노바디, 2가 나노바디 등), 소형 모듈 면역약제(SMIP) 및 상어 가변 IgNAR 도메인도 또한 본 명세서에 사용되는 표현 "항원-결합 단편" 내에 포함된다.
항체의 항원-결합 단편은 전형적으로 적어도 하나의 가변 도메인을 포함할 것이다. 가변 도메인은 임의의 크기 또는 아미노산 조성의 것일 수 있고, 일반적으로 하나 이상의 프레임워크 서열에 인접하거나 그와 프레임 내에 존재하는 적어도 하나의 CDR을 포함할 것이다. VL 도메인과 회합되는 VH 도메인을 가지는 항원-결합 단편에서, VH 및 VL 도메인은 임의의 적합한 배열로 서로에 대해 위치할 수 있다. 예를 들어, 가변 영역은 이량체일 수 있고, VH-VH, VH-VL 또는 VL-VL 이량체를 함유할 수 있다. 대안적으로, 항체의 항원-결합 단편은 단량체 VH 또는 VL 도메인을 함유할 수 있다.
특정 구현예에서, 항체의 항원-결합 단편은 적어도 하나의 불변 도메인에 공유 결합된 적어도 하나의 가변 도메인을 함유할 수 있다. 비-제한적인 본 발명의 항체의 항원-결합 단편 내에서 발견될 수 있는 가변 및 불변 도메인의 예시적인 배치는 (i) VH-CH1; (ii) VH-CH2; (iii) VH-CH3; (iv) VH-CH1-CH2; (v) VH-CH1-CH2-CH3; (vi) VH-CH2-CH3; (vii) VH-CL; (viii) VL-CH1; (ix) VL-CH2; (x) VL-CH3; (xi) VL-CH1-CH2; (xii) VL-CH1-CH2-CH3; (xiii) VL-CH2-CH3; 및 (xiv) VL-CL을 포함한다. 상기 열거한 예시적인 임의의 배치를 포함하는 가변 및 불변 도메인의 임의의 배치에서, 가변 및 불변 도메인은 서로 직접적으로 연결될 수 있거나, 또는 전체 또는 부분 힌지 또는 링커 영역에 의해 연결될 수 있다. 힌지 영역은 단일 폴리펩티드 분자에서 인접한 가변 및/또는 불변 도메인 사이의 유연성 또는 준-유연성 결합을 초래하는 적어도 2개(예를 들어, 5, 10, 15, 20, 40, 60개 이상)의 아미노산으로 이루어질 수 있다. 게다가, 본 발명의 항체의 항원-결합 단편은 (예를 들어, 이황화 결합(들)에 의해) 서로 및/또는 하나 이상의 단량체 VH 또는 VL 도메인과 비-공유 회합된 상기 열거된 임의의 가변 및 불변 도메인 배치의 동종-이량체 또는 이종-이량체(또는 기타 다량체)를 포함할 수 있다.
전체 항체 분자와 같이, 항원-결합 단편은 단일특이적 또는 다중특이적(예를 들어, 이중특이적)일 수 있다. 항체의 다중특이적 항원-결합 단편은 전형적으로 적어도 2개의 상이한 가변 도메인을 포함할 것이며, 각각의 가변 도메인은 개별 항원 또는 동일한 항원 상의 상이한 에피토프에 특이적으로 결합할 수 있다. 본 명세서에 개시되는 예시적인 이중특이적 항체 포맷을 포함하는 임의의 다중특이적 항체 포맷은 당업계에서 이용 가능한 통상적인 기술을 사용하여 본 발명의 항체의 항원-결합 단편의 맥락의 용도를 위해 조정될 수 있다.
항체의 불변 영역은 보체를 고정하고 세포-의존적 세포독성을 매개하는 항체의 능력에서 중요하다. 따라서, 항체의 이소형은 항체가 세포독성을 매개하는 것이 바람직한지 여부에 기초하여 선택될 수 있다.
본 명세서에 사용되는 용어 "인간 항체"는 인간 생식계 면역글로불린 서열로부터 유래되는 가변 및 불변 영역을 가지는 항체를 포함하는 것으로 의도된다. 그럼에도 불구하고, 본 발명의 인간 항체는, 예를 들어 CDR 및 특히 CDR3에서 인간 생식계 면역글로불린 서열에 의해 인코딩되지 않는 아미노산 잔기(예를 들어, 시험 관내에서 무작위 또는 위치-지정 돌연변이유발에 의해 도입되는 돌연변이 또는 생체내 체세포 돌연변이)를 포함할 수 있다. 그러나, 본 명세서에 사용되는 용어 "인간 항체"는 마우스와 같은 다른 포유동물 종의 생식계로부터 유래된 CDR 서열이 인간 프레임워크 서열에 이식된 항체를 포함하는 것으로 의도되지 않는다.
본 명세서에 사용되는 용어 "재조합 인간 항체"는 재조합 수단에 의해 제조되거나, 발현되거나, 생성되거나 또는 단리된 모든 인간 항체, 예를 들어, 숙주 세포에 트랜스펙션된 재조합 발현 벡터를 사용하여 발현된 항체(하기에서 추가로 설명), 재조합, 조합 인간 항체 라이브러리로부터 단리된 항체(하기에서 추가로 설명), 인간 면역글로불린 유전자에 대해 트랜스제닉인 동물(예를 들어, 마우스)로부터 단리된 항체(예를 들어, 문헌[Taylor et al. (1992) Nucl. Acids Res. 20:6287-6295] 참조) 또는 다른 DNA 서열로의 인간 면역글로불린 유전자 서열의 스플라이싱을 수반하는 임의의 다른 수단에 의해 제조되거나, 발현되거나, 생성되거나 또는 단리된 항체를 포함하는 것으로 의도된다. 그러한 재조합 인간 항체는 인간 생식계 면역글로불린 서열로부터 유래된 가변 및 불변 영역을 갖는다. 그러나 특정 구현예에서, 그러한 재조합 인간 항체는 시험관내 돌연변이유발(또는, 인간 Ig 서열에 대해 트랜스제닉인 동물이 사용되는 경우, 생체내 체세포 돌연변이유발)을 겪고, 이에 따라 재조합 항체의 VH 및 VL 영역의 아미노산 서열은 인간 생식계 VH 및 VL 서열로부터 유래되고 그와 관련되는 한편, 생체내 인간 항체 생식계 레퍼토리 내에서 천연적으로 존재하지 않을 수 있는 서열이다.
인간 항체는 힌지 이질성과 관련된 2가지 형태로 존재할 수 있다. 한 형태에서, 면역글로불린 분자는 이량체가 사슬간 중쇄 이황화 결합에 의해 함께 유지되는 대략 150 내지 160 kDa의 안정한 4개의 사슬 작제물을 포함한다. 제2 형태에서, 이량체는 사슬간 이황화 결합을 통해 연결되지 않고, 약 75 내지 80 kDa의 분자는 공유 결합된 경쇄 및 중쇄(절반의 항체)로 이루어지도록 형성된다. 이들 형태는 친화성 정제 후에도 분리하는 것이 극도로 어렵다.
다양한 무손상(intact) IgG 이소형에서 제2 형태의 출현 빈도는, 제한되는 것은 아니지만, 항체의 힌지 영역 이소형과 관련된 구조적 차이에 기인한다. 인간 IgG4 힌지의 힌지 영역에서의 단일의 아미노산 치환은 인간 IgG1 힌지를 사용하여 전형적으로 관찰되는 수준으로 제2 형태의 출현을 상당히 감소시킬 수 있다(문헌[Angal et al. (1993) Molecular Immunology 30:105]). 본 발명은, 예를 들어 생성시 원하는 항체 형태의 수율을 개선시키는데 바람직할 수 있는 힌지, CH2 또는 CH3 영역 내의 하나 이상의 돌연변이를 갖는 항체를 포함한다.
본 명세서에 사용되는 "단리된 항체"는 확인되고, 그의 천연 환경의 적어도 하나의 구성성분으로부터 분리되고/거나 회수된 항체를 의미한다. 예를 들어, 항체가 천연적으로 존재하거나, 천연적으로 생성된 유기체의 적어도 하나의 구성성분으로부터, 조직 또는 세포로부터 분리 또는 제거된 항체는 본 발명의 목적을 위한 "단리된 항체"이다. 단리된 항체는 또한 재조합 세포내의 동소 항체를 포함한다. 단리된 항체는 적어도 하나의 정제 또는 단리 단계로 처리되는 항체이다. 특정 구현예에 따르면, 단리된 항체는 다른 세포 물질 및/또는 화학물질이 실질적으로 없을 수 있다.
용어 "특이적으로 결합하는" 등은 생리적 조건 하에서 상대적으로 안정한 항원과 복합체를 형성하는 항체 또는 그의 항원-결합 단편을 의미한다. 항체가 항원에 특이적으로 결합하는지 여부를 결정하는 방법은 당업계에 잘 알려져 있고, 예를 들어 평형 투석, 표면 플라스몬 공명 등을 포함한다. 예를 들어, 본 발명의 맥락에서 사용되는 PCSK9에 "특이적으로 결합하는" 항체는 표면 플라스몬 공명 검정으로 측정시 약 1000 nM 미만, 약 500 nM 미만, 약 300 nM 미만, 약 200 nM 미만, 약 100 nM 미만, 약 90 nM 미만, 약 80 nM 미만, 약 70 nM 미만, 약 60 nM 미만, 약 50 nM 미만, 약 40 nM 미만, 약 30 nM 미만, 약 20 nM 미만, 약 10 nM 미만, 약 5 nM 미만, 약 4 nM 미만, 약 3 nM 미만, 약 2 nM 미만, 약 1 nM 미만 또는 약 0.5 nM 미만의 KD로 PCSK9 또는 그의 부분에 결합하는 항체를 포함한다. 그러나 인간 PCSK9에 특이적으로 결합하는 단리된 항체는 다른(비-인간) 종 유래의 PCSK9 분자와 같은 다른 항원과 교차-반응성을 갖는다.
본 발명의 방법에 유용한 항-PCSK9 항체는 항체가 유래되는 상응하는 생식계 서열과 비교하여 중쇄 및 경쇄 가변 도메인의 프레임워크 및/또는 CDR 영역 내의 하나 이상의 아미노산 치환, 삽입 및/또는 결실을 포함할 수 있다. 그러한 돌연변이는 본 명세서에 개시된 아미노산 서열을 예를 들어, 공개 항체 서열 데이터베이스로부터 입수 가능한 생식계 서열과 비교함으로써 용이하게 확인될 수 있다. 본 발명은 본 명세서에 개시된 아미노산 서열 중 임의의 것으로부터 유래된 항체 및 그의 항원-결합 단편의 이용을 수반하는 방법을 포함하며, 하나 이상의 프레임워크 및/또는 CDR 영역 내의 하나 이상의 아미노산은 항체가 유래되는 생식계 서열의 상응하는 잔기(들) 또는 다른 인간 생식계 서열의 상응하는 잔기(들) 또는 상응하는 생식계 잔기(들)의 보존적 아미노산 치환(그러한 서열 변화는 본 명세서에서 집합적으로 "생식계 돌연변이"로 지칭됨)으로 돌연변이된다. 당업자는 본 명세서에 개시된 중쇄 및 경쇄 가변 영역 서열로 시작하여, 하나 이상의 개별 생식계 돌연변이 또는 그들의 조합을 포함하는 수많은 항체 및 항원-결합 단편을 용이하게 생성할 수 있다. 특정 구현예에서, VH 및/또는 VL 도메인 내의 프레임워크 및/또는 CDR 잔기 모두는 항체가 유래되는 원래의 생식계 서열에서 관찰되는 잔기로 다시 돌연변이된다. 다른 구현예에서, 오직 특정 잔기만이, 예를 들어, FR1의 처음 8개 아미노산 내에서 또는 FR4의 마지막 8개 아미노산 내에서 관찰되는 돌연변이된 잔기만이 또는 CDR1, CDR2 또는 CDR3 내에서 관찰되는 돌연변이된 잔기만이 원래의 생식계 서열로 다시 돌연변이된다. 다른 구현예에서, 프레임워크 및/또는 CDR 잔기(들) 중 하나 이상은 상이한 생식계 서열(즉, 항체가 원래 유래되는 생식계 서열과 상이한 생식계 서열)의 상응하는 잔기(들)로 돌연변이된다. 추가로, 본 발명의 항체는 프레임워크 및/또는 CDR 영역 내의 2개 이상의 생식계 돌연변이의 임의의 조합을 함유할 수 있으며, 예를 들어, 여기서, 특정 개별 잔기는 특정 생식계 서열의 상응하는 잔기로 돌연변이되는 한편, 원래 생식계 서열과 상이한 특정 다른 잔기는 유지되거나, 상이한 생식계 서열의 상응하는 잔기로 돌연변이된다. 하나 이상의 생식계 돌연변이를 함유하는 항체 및 항원-결합 단편은 일단 수득되면, 하나 이상의 요망되는 특성, 예를 들어, 개선된 결합 특이성, 증가된 결합 친화성, 개선되거나 향상된 길항성 또는 효능성 생물학적 특성(경우에 따라), 감소된 면역원성 등에 대하여 용이하게 시험될 수 있다. 이러한 일반적 방식으로 수득되는 항체 및 항원-결합 단편의 용도는 본 발명에 포함된다.
또한, 본 발명은 하나 이상의 보존적 치환을 갖는 본 명세서에 개시된 HCVR, LCVR 및/또는 CDR 아미노산 서열 중 임의의 것의 변이체를 포함하는 항-PCSK9 항체의 이용을 수반하는 방법을 포함한다. 예를 들어, 본 발명은 본 명세서에 개시된 HCVR, LCVR 및/또는 CDR 아미노산 서열 중 임의의 것에 비하여 예를 들어, 10개 이하, 8개 이하, 6개 이하, 4개 이하 등의 보존적 아미노산 치환을 갖는 HCVR, LCVR 및/또는 CDR 아미노산 서열을 갖는 항-PCSK9 항체의 용도를 포함한다.
본 명세서에 사용되는 용어 "표면 플라스몬 공명"은 예를 들어 BIAcore™ 시스템(Biacore Life Sciences division of GE Healthcare, Piscataway, NJ)을 사용하여 바이오센서 매트릭스 내의 단백질 농도의 변경의 검출에 의해 실시간 상호작용의 분석을 가능하게 하는 광학 현상을 말한다.
본 명세서에 사용되는 용어 "KD"는 특정 항체-항원 상호작용의 평형 해리 상수를 말하는 것으로 의도된다.
용어 "에피토프"는 파라토프로서 알려져 있는 항체 분자의 가변 영역 내의 특정 항원 결합 부위와 상호작용하는 항원 결정기를 말한다. 단일의 항원은 하나 초과의 에피토프를 가질 수 있다. 따라서, 상이한 항체는 항원의 상이한 영역에 결합할 수 있고, 상이한 생물학적 효과를 가질 수 있다. 에피토프는 입체형태 또는 선형 중 어느 하나일 수 있다. 입체형태 에피토프는 선형 폴리펩티드 사슬의 상이한 세그먼트로부터 공간적으로 병치된 아미노산에 의해 생성된다. 선형 에피토프는 폴리펩티드 사슬 내의 인접 아미노산 잔기에 의해 생성되는 것이다. 특정 상황에서, 에피토프는 항원 상의 당류, 포스포릴기, 또는 술포닐기의 모이어티를 포함할 수 있다.
특정 구현예에 따르면, 본 발명의 방법에 사용되는 항-PCSK9 항체는 pH-의존적 결합 특징을 갖는 항체이다. 본 명세서에 사용되는 표현 "pH-의존적 결합"은 항체 또는 그의 항원-결합 단편이 "산성 pH에서 중성 pH에 비하여 감소된 PCSK9로의 결합"을 나타내는 것을 의미한다(본 개시내용의 목적을 위해, 둘 모두의 표현은 상호교환 가능하게 사용될 수 있다). 예를 들어, "pH-의존적 결합 특징을 갖는" 항체는 산성 pH에서보다 중성 pH에서 더 큰 친화성으로 PCSK9에 결합하는 항체 및 그의 항원-결합 단편을 포함한다. 특정 구현예에서, 본 발명의 항체 및 항원-결합 단편은 산성 pH에서보다 중성 pH에서 적어도 3, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100배 또는 그 이상 더 큰 친화성으로 PCSK9에 결합한다.
본 발명의 이러한 양태에 따르면, pH-의존적 결합 특징을 갖는 항-PCSK9 항체는 모체 항-PCSK9 항체와 비교하여 하나 이상의 아미노산 변이를 가질 수 있다. 예를 들어, pH-의존적 결합 특징을 갖는 항-PCSK9 항체는 예를 들어, 모체 항-PCSK9 항체의 하나 이상의 CDR 내에 하나 이상의 히스티딘 치환 또는 삽입을 함유할 수 있다. 따라서, 본 발명의 특정 구현예에 따르면, 모체 항체의 하나 이상의 CDR의 하나 이상의 아미노산이 히스티딘 잔기로 치환된 것을 제외하고, 모체 항-PCSK9 항체의 CDR 아미노산 서열과 동일한 CDR 아미노산 서열(예를 들어, 중쇄 및 경쇄 CDR)을 포함하는 항-PCSK9 항체를 투여하는 단계를 포함하는 방법이 제공된다. pH-의존적 결합을 갖는 항-PCSK9 항체는 모체 항체의 단일의 CDR 내의 또는 모체 항-PCSK9 항체의 다수의(예를 들어, 2, 3, 4, 5 또는 6개의) CDR의 도처에 분포된 예를 들어, 1, 2, 3, 4, 5, 6, 7, 8, 9개 또는 그 이상의 히스티딘 치환을 가질 수 있다. 예를 들어, 본 발명은 모체 항-PCSK9 항체의 HCDR1 내의 하나 이상의 히스티딘 치환, HCDR2 내의 하나 이상의 히스티딘 치환, HCDR3 내의 하나 이상의 히스티딘 치환, LCDR1 내의 하나 이상의 히스티딘 치환, LCDR2 내의 하나 이상의 히스티딘 치환 및/또는 LCDR3 내의 하나 이상의 히스티딘 치환을 포함하는 pH-의존적 결합을 갖는 항-PCSK9 항체의 용도를 포함한다.
본 명세서에 사용되는 표현 "산성 pH"는 6.0 이하(예를 들어, 약 6.0 미만, 약 5.5 미만, 약 5.0 미만 등)의 pH를 의미한다. 표현 "산성 pH"는 약 6.0, 5.95, 5.90, 5.85, 5.8, 5.75, 5.7, 5.65, 5.6, 5.55, 5.5, 5.45, 5.4, 5.35, 5.3, 5.25, 5.2, 5.15, 5.1, 5.05, 5.0 또는 그 이하의 pH 값을 포함한다. 본 명세서에 사용되는 표현 "중성 pH"는 약 7.0 내지 약 7.4의 pH를 의미한다. 표현 "중성 pH"는 약 7.0, 7.05, 7.1, 7.15, 7.2, 7.25, 7.3, 7.35 및 7.4의 pH 값을 포함한다.
본 발명의 맥락에서 사용될 수 있는 항-PCSK9 항체의 비제한적인 예는 예를 들어, 알리로쿠맙, 에볼로쿠맙(evolocumab), 보코시주맙(bococizumab) 또는 그의 항원-결합 부분을 포함한다.
인간 항체의 제조
트랜스제닉 마우스에서 인간 항체를 생성하는 방법은 당업계에 알려져 있다. 임의의 그러한 알려져 있는 방법을 본 발명의 맥락에서 사용하여 인간 PCSK9에 특이적으로 결합하는 인간 항체를 제조할 수 있다.
VELOCIMMUNE™ 기술(예를 들어, US 6,596,541호(Regeneron Pharmaceuticals) 참조) 또는 모노클로널 항체를 생성하기 위한 다른 알려져 있는 임의의 방법을 사용하여, 인간 가변 영역 및 마우스 불변 영역을 갖는, PCSK9에 대한 고친화성 키메라 항체를 먼저 단리한다. VELOCIMMUNE® 기술은 마우스가 항원 자극에 반응성인 인간 가변 영역 및 마우스 불변 영역을 포함하는 항체를 생성하게 하는, 내인성 마우스 불변 영역 유전자좌에 작동 가능하게 연결된 인간 중쇄 및 경쇄 가변 영역을 포함하는 게놈을 갖는 트랜스제닉 마우스의 생성을 수반한다. 항체의 중쇄 및 경쇄의 가변 영역을 인코딩하는 DNA를 단리하고, 인간 중쇄 및 경쇄 불변 영역을 인코딩하는 DNA에 작동 가능하게 연결한다. 그 다음, DNA를 전체 인간 항체를 발현할 수 있는 세포에서 발현시킨다.
일반적으로, VELOCIMMUNE® 마우스를 대상 항원으로 시험감염시키고, 림프 세포(예를 들어, B-세포)를 항체를 발현하는 마우스로부터 회수한다. 림프 세포를 골수종 세포주와 융합시켜, 불멸화 하이브리도마 세포주를 제조할 수 있으며, 그러한 하이브리도마 세포주를 스크리닝하고, 선택하여, 대상 항원에 특이적인 항체를 생성하는 하이브리도마 세포주를 확인한다. 중쇄 및 경쇄의 가변 영역을 인코딩하는 DNA를 단리하고, 중쇄 및 경쇄의 바람직한 이소형 불변 영역에 연결할 수 있다. 그러한 항체 단백질은 세포, 예를 들어, CHO 세포에서 생성될 수 있다. 대안적으로, 항원-특이적 키메라 항체 또는 경쇄 및 중쇄의 가변 도메인을 인코딩하는 DNA를 항원-특이적 림프구로부터 직접 단리할 수 있다.
먼저, 인간 가변 영역 및 마우스 불변 영역을 갖는 고 친화성 키메라 항체를 단리한다. 항체를 특성화하고, 당업자에게 알려져 있는 표준 절차를 사용하여, 친화성, 선택성, 에피토프 등을 포함하는 바람직한 특징에 대하여 선택한다. 마우스 불변 영역을 요망되는 인간 불변 영역으로 대체하여, 본 발명의 전체 인간 항체, 예를 들어, 야생형 또는 변형된 IgG1 또는 IgG4를 생성한다. 선택된 불변 영역은 특정 용도에 따라 달라질 수 있지만, 고 친화성 항원-결합 및 표적 특이성 특징은 가변 영역에 존재한다.
일반적으로, 본 발명의 방법에 사용될 수 있는 항체는 고체상에 고정화되거나 용액 상 중의 항원으로의 결합에 의해 측정시, 상기 기재된 바와 같이 높은 친화성을 갖는다. 마우스 불변 영역을 요망되는 인간 불변 영역으로 대체하여, 본 발명의 전체 인간 항체를 생성한다. 선택된 불변 영역이 특정 용도에 따라 달라질 수 있지만, 고 친화성 항원-결합 및 표적 특이성 특징은 가변 영역에 존재한다.
본 발명의 방법의 맥락에 사용될 수 있는 PCSK9에 특이적으로 결합하는 인간 항체 또는 항체의 항원-결합 단편의 구체적인 예는 SEQ ID NO: 1 및 11로 이루어진 군으로부터 선택되는 아미노산 서열 또는 적어도 90%, 적어도 95%, 적어도 98% 또는 적어도 99% 서열 동일성을 갖는 그의 실질적으로 유사한 서열을 갖는 중쇄 가변 영역(HCVR) 내에 함유된 3개의 중쇄 CDR(HCDR1, HCDR2 및 HCDR3)을 포함하는 임의의 항체 또는 항원-결합 단편을 포함한다. 대안적으로, 본 발명의 방법의 맥락에 사용될 수 있는 PCSK9에 특이적으로 결합하는 인간 항체 또는 항체의 항원-결합 단편의 구체적인 예는 SEQ ID NO: 37, 45, 53, 61, 69, 77, 85, 93, 101, 109, 117, 125, 133, 141, 149, 157, 165, 173, 181 및 189로 이루어진 군으로부터 선택되는 아미노산 서열 또는 적어도 90%, 적어도 95%, 적어도 98% 또는 적어도 99% 서열 동일성을 갖는 그의 실질적으로 유사한 서열을 갖는 중쇄 가변 영역(HCVR) 내에 함유된 3개의 중쇄 CDR(HCDR1, HCDR2 및 HCDR3)을 포함하는 임의의 항체 또는 항원-결합 단편을 포함한다. 항체 또는 항원-결합 단편은 SEQ ID NO: 6 및 15로 이루어진 군으로부터 선택되는 아미노산 서열 또는 적어도 90%, 적어도 95%, 적어도 98% 또는 적어도 99% 서열 동일성을 갖는 그의 실질적으로 유사한 서열을 갖는 경쇄 가변 영역(LCVR) 내에 함유된 3개의 경쇄 CDR(LCVR1, LCVR2, LCVR3)을 포함할 수 있다. 대안적으로, 항체 또는 항원-결합 단편은 SEQ ID NO: 41, 49, 57, 65, 73, 81, 89, 97, 105, 113, 121, 129, 137, 145, 153, 161, 169, 177, 185 및 193으로 이루어진 군으로부터 선택되는 아미노산 서열 또는 적어도 90%, 적어도 95%, 적어도 98% 또는 적어도 99% 서열 동일성을 갖는 그의 실질적으로 유사한 서열을 갖는 경쇄 가변 영역(LCVR) 내에 함유된 3개의 경쇄 CDR(LCVR1, LCVR2, LCVR3)을 포함할 수 있다.
2개의 아미노산 서열 간의 서열 동일성을 최적의 서열 정렬을 사용하여 참조 아미노산 서열, 즉, SEQ ID NO로 확인된 아미노산 서열의 전체 길이에 걸쳐 및/또는 2개의 아미노산 서열 간의 최적의 서열 정렬의 영역에 걸쳐 결정하며, 여기서, 최적의 서열 정렬은 표준 설정, 바람직하게는 EMBOSS::needle, Matrix: Blosum62, 갭 오픈(Gap Open) 10.0, 갭 연장(Gap Extend) 0.5를 사용하여 당업계에 알려져 있는 툴, 예를 들어, Align으로 수득될 수 있다.
본 발명의 특정 구현예에서, 항체 또는 항원-결합 단백질은 SEQ ID NO: 1/6 및 11/15로 이루어진 군으로부터 선택되는 중쇄 및 경쇄 가변 영역 아미노산 서열 쌍(HCVR/LCVR) 유래의 6개의 CDR(HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3)을 포함한다. 대안적으로, 본 발명의 특정 구현예에서, 항체 또는 항원-결합 단백질은 SEQ ID NO: 37/41, 45/49, 53/57, 61/65, 69/73, 77/81, 85/89, 93/97, 101/105, 109/113, 117/121, 125/129, 133/137, 141/145, 149/153, 157/161, 165/169, 173/177, 181/185 및 189/193으로 이루어진 군으로부터 선택되는 중쇄 및 경쇄 가변 영역 아미노산 서열 쌍(HCVR/LCVR) 유래의 6개의 CDR(HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 및 LCDR3)을 포함한다.
본 발명의 특정 구현예에서, 본 발명의 방법에 사용될 수 있는 항-PCSK9 항체 또는 항원-결합 단백질은 SEQ ID NO: 2/3/4/7/8/10(mAb316P["REGN727" 또는 "알리로쿠맙"으로도 지칭]) 및 12/13/14/16/17/18(mAb300N)(미국 특허 출원 공개 제2010/0166768호 참조) 및 12/13/14/16/17/18로부터 선택되는 HCDR1/HCDR2/HCDR3/LCDR1/LCDR2/LCDR3 아미노산 서열을 가지며, 여기서, SEQ ID NO: 16은 아미노산 잔기 30에서 류신에 대한 히스티딘의 치환(L30H)을 포함한다.
본 발명의 특정 구현예에서, 항체 또는 항원-결합 단백질은 SEQ ID NO: 1/6 및 11/15로 이루어진 군으로부터 선택되는 HCVR/LCVR 아미노산 서열 쌍을 포함한다. 특정 예시적인 구현예에서, 항체 또는 항원-결합 단백질은 SEQ ID NO: 1의 HCVR 아미노산 서열 및 SEQ ID NO: 6의 LCVR 아미노산 서열을 포함한다. 특정 예시적인 구현예에서, 항체 또는 항원-결합 단백질은 SEQ ID NO: 11의 HCVR 아미노산 서열 및 SEQ ID NO: 15의 LCVR 아미노산 서열을 포함한다. 특정 예시적인 구현예에서, 항체 또는 항원-결합 단백질은 SEQ ID NO: 11의 HCVR 아미노산 서열 및 아미노산 잔기 30에서 류신에 대한 히스티딘의 치환(L30H)을 포함하는 SEQ ID NO: 15의 LCVR 아미노산 서열을 포함한다.
약제학적 조성물 및 투여 방법
본 발명은 PCSK9 억제제를 환자에게 투여하는 단계를 포함하는 방법을 포함하며, 여기서, PCSK9 억제제가 약제학적 조성물 내에 함유된다. 본 발명의 약제학적 조성물은 적합한 담체, 부형제 및 적합한 전달, 운반, 내약성 등을 제공하는 다른 작용제와 함께 제형화된다. 다수의 적절한 제형은 모든 약제 화학자에게 알려져 있는 의약품집에서 찾을 수 있다: 문헌[Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, PA]. 이들 제형은 예를 들어, 분말, 페이스트, 연고, 젤리, 왁스, 오일, 지질, 지질(양이온성 또는 음이온성) 함유 소포(예컨대 LIPOFECTIN™), DNA 컨쥬게이트, 무수 흡착 페이스트, 수중유 및 유중수 에멀젼, 에멀젼 카르보왁스(다양한 분자량의 폴리에틸렌 글리콜), 반-고체 겔, 및 카르보왁스를 함유하는 반-고체 혼합물을 포함한다. 또한 문헌[Powell et al. "Compendium of excipients for parenteral formulations" PDA (1998) J Pharm Sci Technol 52:238-311]을 참조한다.
다양한 전달 시스템, 예를 들어, 리포좀, 마이크로입자, 마이크로캡슐, 돌연변이 바이러스를 발현시킬 수 있는 재조합 세포, 수용체 매개 엔도시토시스(예를 들어, 문헌[Wu et al., 1987, J. Biol. Chem. 262:4429-4432] 참조)가 알려져 있고, 본 발명의 약제학적 조성물을 투여하기 위해 사용될 수 있다. 투여 방법은, 제한되는 것은 아니지만, 피내, 근육내, 복막내, 정맥내, 피하, 비강내, 경막외 및 경구 경로를 포함한다. 조성물은 임의의 편리한 경로, 예를 들어 주입 또는 볼루스 주사에 의해, 상피 또는 점막피부 라이닝(예를 들어, 경구 점막, 직장 및 장 점막 등)을 통한 흡착에 의해 투여될 수 있고, 다른 생물학적 활성제와 함께 투여될 수 있다.
본 발명의 약제학적 조성물은 표준 주사바늘 및 주사기를 사용하여 피하 또는 정맥내 전달될 수 있다. 또한, 피하 전달에 관하여, 펜형 전달 장치는 용이하게 본 발명의 약제학적 조성물을 전달하는데 응용을 갖는다. 그러한 펜형 전달 장치는 재사용 가능하거나 또는 일회용일 수 있다. 재사용 가능한 펜형 전달 장치는 일반적으로 약제학적 조성물을 함유하는 교체 가능한 카트리지를 이용한다. 일단 카트리지 내의 모든 약제학적 조성물이 투여되어, 카트리지가 비워지면, 빈 카트리지는 용이하게 폐기될 수 있고, 약제학적 조성물을 함유하는 새로운 카트리지로 교체될 수 있다. 그 다음에 펜형 전달 장치는 재사용될 수 있다. 일회용 펜형 전달 장치에서, 교체 가능한 카트리지는 없다. 오히려, 일회용 펜형 전달 장치는 장치 내의 저장소에 보유된 약제학적 조성물로 사전에 채워진다. 일단 저장소의 약제학적 조성물이 비워지면, 전체 장치가 폐기된다.
수많은 재사용 가능한 펜형 및 자기주사기 전달 장치는 본 발명의 약제학적 조성물의 피하 전달에 응용을 갖는다. 예는 몇 가지만을 말하면, AUTOPEN™(Owen Mumford, Inc., Woodstock, UK), DISETRONIC™ 펜(Disetronic Medical Systems, Bergdorf, Switzerland), HUMALOG MIX 75/25™ 펜, HUMALOG™ 펜, HUMALIN 70/30™ 펜(Eli Lilly and Co., Indianapolis, IN), NOVOPEN™ I, II 및 III(Novo Nordisk, Copenhagen, Denmark), NOVOPEN JUNIOR™(Novo Nordisk, Copenhagen, Denmark), BD™ 펜(Becton Dickinson, Franklin Lakes, NJ), OPTIPEN™, OPTIPEN PRO™, OPTIPEN STARLET™ 및 OPTICLIK™(sanofi-aventis, Frankfurt, Germany)을 포함하나 이들에 한정되지 않는다. 본 발명의 약제학적 조성물의 피하 전달에 응용을 갖는 일회용 펜형 전달 장치의 예는 몇 가지만을 말하면, SOLOSTAR™ 펜(sanofi-aventis), FLEXPEN™(Novo Nordisk) 및 KWIKPEN™(Eli Lilly), SURECLICK™ 자기주사기(Amgen, Thousand Oaks, CA), PENLET™(Haselmeier, Stuttgart, Germany), EPIPEN(Dey, L.P.) 및 HUMIRA™ 펜(Abbott Labs, Abbott Park IL)을 포함하나 이들에 한정되지 않는다.
특정 상황에서, 약제학적 조성물은 조절 방출 시스템에서 전달될 수 있다. 일 구현예에서, 펌프가 사용될 수 있다(상기 문헌[Langer]; 문헌[Sefton, 1987, CRC Crit. Ref. Biomed. Eng. 14:201] 참조). 다른 구현예에서, 폴리머 물질이 사용될 수 있으며; 문헌[Medical Applications of Controlled Release, Langer and Wise (eds.), 1974, CRC Pres., Boca Raton, Florida]을 참조한다. 또 다른 구현예에서, 조절 방출 시스템을 조성물의 표적에 인접하게 배치하여, 전신 용량의 오직 소정의 분율만을 필요로 할 수 있다(예를 들어, 문헌[Goodson, 1984, in Medical Applications of Controlled Release, supra, vol. 2, pp. 115-138] 참조). 다른 조절 방출 시스템은 문헌[Langer, 1990, Science 249:1527-1533]에 의한 검토에 논의되어 있다.
주사 가능한 제제는 정맥내, 피하, 피내 및 근육내 주사, 점적 주입 등을 위한 투여형을 포함할 수 있다. 이들 주사 가능한 제제는 알려져 있는 방법에 의해 제조될 수 있다. 예를 들어, 주사 가능한 제제는 예를 들어, 상기 기재된 항체 또는 그의 염을 주사를 위해 통상적으로 사용되는 멸균 수성 매질 또는 유성 매질에 용해시키거나, 현탁화시키거나, 유화시킴으로써 제조될 수 있다. 주사용 수성 매질로서, 예를 들어, 생리 식염수, 글루코스를 함유하는 등장성 용액 및 다른 보조제 등이 있으며, 이들은 알코올(예를 들어 에탄올), 폴리알코올(예를 들어 프로필렌 글리콜, 폴리에틸렌 글리콜), 비이온성 계면활성제[예를 들어 폴리소르베이트 80, HCO-50(수소화된 피마자유의 폴리옥시에틸렌(50 mol) 부가물)] 등과 같은 적절한 가용화제와 병용하여 사용될 수 있다. 유성 매질로서, 참기름, 대두유 등이 사용될 수 있으며, 이들은 벤질 벤조에이트, 벤질 알코올 등과 같은 가용화제와 병용하여 사용될 수 있다. 이에 따라, 제조된 주사제는 바람직하게는 적절한 앰풀 내에 충전된다.
유리하게는, 상기 기재된 경구 또는 비경구 이용을 위한 약제학적 조성물은 활성 성분의 용량을 맞추기에 적합한 단위 용량의 투여형으로 제조된다. 그러한 단위 용량의 투여형은 예를 들어, 정제, 환제, 캡슐제, 주사제(앰풀), 좌제 등을 포함한다.
본 발명의 방법의 맥락에서 사용될 수 있는 항-PCSK9 항체를 포함하는 예시적인 약제학적 제형은 예를 들어, 개시내용 전문이 본 명세서에 참조로 포함되는 US 2013/0189277호에 기재되어 있다.
투여량
본 발명의 방법에 따라 환자에게 투여되는 PCSK9 억제제(예를 들어, 항-PCSK9 항체)의 양은 일반적으로 치료적 유효량이다. 본 명세서에 사용되는 어구 "치료적 유효량"은 LDL-C, ApoB100, 비-HDL-C, 총 콜레스테롤, VLDL-C, 트리글리세리드, Lp(a) 및 잔여 콜레스테롤로 이루어진 군으로부터 선택되는 하나 이상의 파라미터의 검출 가능한 감소(기준선으로부터 적어도 약 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% 이상)를 야기하는 PCSK9 억제제의 용량을 의미한다.
항-PCSK9 항체의 경우에, 치료적 유효량은 약 0.05 ㎎ 내지 약 600 ㎎, 예를 들어, 약 0.05 ㎎, 약 0.1 ㎎, 약 1.0 ㎎, 약 1.5 ㎎, 약 2.0 ㎎, 약 10 ㎎, 약 20 ㎎, 약 30 ㎎, 약 40 ㎎, 약 50 ㎎, 약 60 ㎎, 약 70 ㎎, 약 75 ㎎, 약 80 ㎎, 약 90 ㎎, 약 100 ㎎, 약 110 ㎎, 약 120 ㎎, 약 130 ㎎, 약 140 ㎎, 약 150 ㎎, 약 160 ㎎, 약 170 ㎎, 약 180 ㎎, 약 190 ㎎, 약 200 ㎎, 약 210 ㎎, 약 220 ㎎, 약 230 ㎎, 약 240 ㎎, 약 250 ㎎, 약 260 ㎎, 약 270 ㎎, 약 280 ㎎, 약 290 ㎎, 약 300 ㎎, 약 310 ㎎, 약 320 ㎎, 약 330 ㎎, 약 340 ㎎, 약 350 ㎎, 약 360 ㎎, 약 370 ㎎, 약 380 ㎎, 약 390 ㎎, 약 400 ㎎, 약 410 ㎎, 약 420 ㎎, 약 430 ㎎, 약 440 ㎎, 약 450 ㎎, 약 460 ㎎, 약 470 ㎎, 약 480 ㎎, 약 490 ㎎, 약 500 ㎎, 약 510 ㎎, 약 520 ㎎, 약 530 ㎎, 약 540 ㎎, 약 550 ㎎, 약 560 ㎎, 약 570 ㎎, 약 580 ㎎, 약 590 ㎎ 또는 약 600 ㎎의 항-PCSK9 항체일 수 있다. 특정 구현예에서, 치료적 유효량은 75 ㎎의 항-PCSK9 항체이다. 특정 구현예에서, 치료적 유효량은 150 ㎎의 항-PCSK9 항체이다.
개별 용량에 포함되는 항-PCSK9 항체의 양은 환자 체중 킬로그램당 항체 밀리그램(즉, ㎎/㎏)에 관하여 표현될 수 있다. 예를 들어, 항-PCSK9 항체는 약 0.0001 내지 약 10 ㎎/㎏(환자 체중)의 용량으로 환자에게 투여될 수 있다.
병용 요법
본 발명의 특정 구현예에 따르면, 하나 이상의 비-스타틴 지질 변형 치료법은 PCSK9 억제제와 병용하여 환자에게 시행될 수 있다. 그러한 비-스타틴 지질 변형 치료법의 예는 예를 들어, (1) 콜레스테롤 흡수 억제제를 억제하는 작용제(예를 들어, 에제티미브); (2) 지질단백질 이화작용을 증가시키는 작용제(예를 들어, 니아신 및 서방형 니아신을 포함하는 니코틴산); (3) 피브린산, (4) 담즙산 격리제 및/또는 (5) 콜레스테롤 제거에서 역할을 수행하는 LXR 전사 인자의 활성화제(예를 들어, 22-하이드록시콜레스테롤)를 포함한다.
투여 섭생
본 발명의 특정 구현예에 따르면, 다중 용량의 PCSK9 억제제(즉, PCSK9 억제제를 포함하는 약제학적 조성물)는 (예를 들어, 매일의 치료적 스타틴 섭생 대신에) 정의된 시간 경과에 걸쳐 환자에게 투여될 수 있다. 본 발명의 이러한 양태에 따른 방법은 다중 용량의 PCSK9 억제제를 환자에게 순차적으로 투여하는 단계를 포함한다. 본 명세서에 사용되는 "순차적으로 투여하는"은 PCSK9 억제제의 각 용량이 상이한 시점에 예를 들어, 소정의 간격(예를 들어, 수시간, 수일, 수주 또는 수개월)으로 분리된 상이한 날에 환자에게 투여되는 것을 의미한다. 본 발명은 단일의 초기 용량의 PCSK9 억제제 이후에 하나 이상의 제2 용량의 PCSK9 억제제 이후에 선택적으로 하나 이상의 제3 용량의 PCSK9 억제제를 환자에게 순차적으로 투여하는 단계를 포함하는 방법을 포함한다.
용어 "초기 용량", "제2 용량" 및 "제3 용량"은 개별 용량의 PCSK9 억제제를 포함하는 약제학적 조성물의 투여의 시간적 순서를 말한다. 이에 따라, "초기 용량"은 치료 섭생의 시작 시에 투여되는 용량("기준선 용량"으로도 지칭)이며; "제2 용량"은 초기 용량 후에 투여되는 용량이며; "제3 용량"은 제2 용량 후에 투여되는 용량이다. 초기, 제2 및 제3 용량은 모두 동일한 양의 PCSK9 억제제를 함유할 수 있지만, 일반적으로 투여의 빈도의 면에서 서로 상이할 수 있다. 그러나 특정 구현예에서, 초기, 제2 및/또는 제3 용량에 함유되는 PCSK9 억제제의 양은 치료 경과 동안 서로 달라진다(예를 들어, 적절한 대로 상향 또는 하향 조정). 특정 구현예에서, 둘 이상(예를 들어, 2, 3, 4 또는 5가지) 용량이 "로딩 용량"으로서 치료 섭생의 시작시에 투여된 다음, 덜 빈번하게 투여되는 이후의 용량(예를 들어, "유지 용량")으로 이어진다.
본 발명의 예시적인 구현예에 따르면, 각각의 제2 및/또는 제3 용량은 직전 용량 후 1 내지 26주(예를 들어, 1, 1½, 2, 2½, 3, 3½, 4, 4½, 5, 5½, 6, 6½, 7, 7½, 8, 8½, 9, 9½, 10, 10½, 11, 11½, 12, 12½, 13, 13½, 14, 14½, 15, 15½, 16, 16½, 17, 17½, 18, 18½, 19, 19½, 20, 20½, 21, 21½, 22, 22½, 23, 23½, 24, 24½, 25, 25½, 26, 26½주 이상)에 투여된다. 본 명세서에 사용되는 어구 "직전 용량"은 다수의 투여 순서에서, 개재 용량이 없는 순서의 바로 다음의 용량의 투여 이전에 환자에게 투여되는 항원-결합 분자의 용량을 의미한다.
본 발명의 이러한 양태에 따른 방법은 임의의 수의 제2 및/또는 제3 용량의 PCSK9 억제제를 환자에게 투여하는 단계를 포함할 수 있다. 예를 들어, 특정 구현예에서, 오직 단일의 제2 용량만이 환자에게 투여된다. 다른 구현예에서, 2개 이상(예를 들어, 2, 3, 4, 5, 6, 7, 8개 이상)의 제2 용량이 환자에게 투여된다. 마찬가지로, 특정 구현예에서, 오직 단일의 제3 용량만이 환자에게 투여된다. 다른 구현예에서, 2개 이상(예를 들어, 2, 3, 4, 5, 6, 7, 8개 이상)의 제3 용량이 환자에게 투여된다.
다수의 제2 용량을 수반하는 구현예에서, 각 제2 용량은 다른 제2 용량과 동일한 빈도로 투여될 수 있다. 예를 들어, 각 제2 용량은 직전 용량 이후 1 내지 2, 4, 6, 8주 이상에 환자에게 투여될 수 있다. 유사하게, 다수의 제3 용량을 수반하는 구현예에서, 각 제3 용량은 다른 제3 용량과 동일한 빈도로 투여될 수 있다. 예를 들어, 각 제3 용량은 직전 용량 이후 1 내지 2, 4, 6, 8주 이상에 환자에게 투여될 수 있다. 대안적으로, 제2 및/또는 제3 용량이 환자에게 투여되는 빈도는 치료 섭생의 과정에 걸쳐 달라질 수 있다. 또한, 투여의 빈도는 임상 시험 후에 개별 환자의 요구에 따라 내과의에 의해 치료의 과정 동안 조정될 수 있다.
본 발명의 특정 구현예에 따르면, 약 75 ㎎의 항-PCSK9 항체를 포함하는 다중 용량의 약제학적 조성물이 2주마다 1회의 빈도로 환자에게 투여된다.
본 발명의 특정 구현예에 따르면, 약 150 ㎎의 항-PCSK9 항체를 포함하는 다중 용량의 약제학적 조성물이 2주마다 1회의 빈도로 환자에게 투여된다.
본 발명의 특정 구현예에 따르면, 약 75 ㎎의 항-PCSK9 항체를 포함하는 다중 용량의 약제학적 조성물이 4주마다 1회의 빈도로 환자에게 투여된다.
본 발명의 특정 구현예에 따르면, 약 150 ㎎의 항-PCSK9 항체를 포함하는 다중 용량의 약제학적 조성물이 4주마다 1회의 빈도로 환자에게 투여된다.
본 발명에는 상향적정(up-titration) 선택(본 명세서에 "용량 조정"으로도 지칭)을 포함하는 투여 섭생이 포함된다. 본 명세서에 사용되는 "상향적정 선택"은 특정 수의 용량의 PCSK9 억제제를 제공한 뒤 환자가 하나 이상의 정의된 치료 파라미터에서 특정 감소를 달성하지 않는다면, 이후에 PCSK9 억제제 용량을 증가시킨다는 의미이다. 예를 들어, 2주마다 1회의 빈도로의 환자에게 75 ㎎ 용량의 항-PCSK9 항체의 투여를 포함하는 치료 섭생의 경우, 8주(즉, 제0주, 제2주 및 제4주, 제6주 및 제8주에 5개 용량 투여) 이후에 환자에서 70 ㎎/㎗ 미만의 혈청 LDL-C 농도가 달성되지 않는다면, 이후에(예를 들어, 제10주 또는 제12주 이후에 시작하여) 항-PCSK9 항체 용량을 예를 들면 2주마다 1회 150 ㎎으로 증가시켜서 투여된다.
특정 구현예에서, 항-PCSK9 항체는 예를 들어, 적어도 3회의 용량 동안 2주마다, 약 75 ㎎의 용량으로 환자에게 투여된다.
특정 구현예에서, 항-PCSK9 항체는 예를 들어, 적어도 3회의 용량 동안 2주마다, 약 150 ㎎의 용량으로 환자에게 투여된다.
일부 구현예에서, 항체는 12주 동안 2주마다 약 75 ㎎의 용량으로 환자에게 투여되며, 제8주에 환자의 LDL-C 값이 100 ㎎/㎗ 미만이고, LDL-C의 30% 감소되면, 용량은 2주마다 75 ㎎으로 유지된다.
다른 구현예에서, 항체는 12주 동안 2주마다 약 75 ㎎의 용량으로 환자에게 투여되며, 제8주에 환자의 LDL-C 값이 100 ㎎/㎗ 이상이면, 용량은 2주마다 약 150 ㎎으로 상향 적정된다.
일부 구현예에서, 항체는 12주 동안 2주마다 약 75 ㎎의 용량으로 환자에게 투여되며, 제8주에 환자의 LDL-C 값이 70 ㎎/㎗ 미만이고, LDL-C의 30% 감소되면, 용량은 2주마다 75 ㎎으로 유지된다.
다른 구현예에서, 항체는 4주마다 약 300 ㎎의 용량으로 환자에게 투여된다.
추가의 구현예에서, 항체는 총 3회의 용량에 대하여 4주마다 약 300 ㎎의 용량으로 환자에게 투여되며, 제8주에 환자가 소정의 치료 목적을 달성하지 못하거나 환자가 기준선으로부터 LDL-C의 적어도 30% 감소를 갖지 않으면, 용량은 다시 36주 동안 2주마다 150 ㎎으로 변경된다.
특정 구현예에서, 항-PCSK9 항체는 적어도 3회의 용량에 대하여 4주마다 약 150 ㎎의 용량으로 환자에게 투여된다.
일부 구현예에서, 항체는 12주 동안 4주마다 약 150 ㎎의 용량으로 환자에게 투여되며, 제8주에 환자의 LDL-C 값이 100 ㎎/㎗ 미만이고, LDL-C의 30% 감소되면, 용량은 4주마다 150 ㎎으로 유지된다.
다른 구현예에서, 항체는 12주 동안 4주마다 약 150 ㎎의 용량으로 환자에게 투여되며, 제8주에 환자의 LDL-C 값이 100 ㎎/㎗ 이상이면, 용량은 2주마다 약 300 ㎎으로 상향 적정된다.
일부 구현예에서, 항체는 12주 동안 4주마다 약 150 ㎎의 용량으로 환자에게 투여되며, 제8주에 환자의 LDL-C 값이 70 ㎎/㎗ 미만이고, LDL-C의 30% 감소되면, 용량은 다시 12주 동안 4주마다 150 ㎎으로 유지된다.
다른 구현예에서, 항체는 4주마다 약 300 ㎎의 용량으로 환자에게 투여된다.
추가의 구현예에서, 항체는 총 3회의 용량에 대하여 4주마다 약 300 ㎎의 용량으로 환자에게 투여되며, 제8주에 환자가 소정의 치료 목적을 달성하지 못하거나 환자가 기준선으로부터 LDL-C의 적어도 30% 감소를 갖지 않으면, 용량은 다시 36주 동안 2주마다 150 ㎎으로 변경된다.
실시예
하기의 실시예는 본 발명의 방법 및 조성물을 제조하고 사용하는 방법에 대한 완전한 개시내용 및 설명을 당업자에게 제공하기 위해 제시되고 본 발명자들이 그들의 발명으로 간주하는 것의 범위를 제한하고자 하는 것이 아니다. 사용된 수치(예를 들어 양, 온도, 등)와 관련하여 정확성을 보장하기 위한 노력이 이루어졌으나 일부 실험적 오차 및 편차가 고려되어야만 한다. 달리 지시되지 않는 경우, 부는 중량부이고, 분자량은 중량 평균 분자량이고, 온도는 섭씨 온도이고, 압력은 대기압 또는 이의 근처이다.
실시예
1. 인간
PCSK9에
대한 인간 항체의 생성
인간 항-PCSK9 항체를 미국 특허 제8,062,640호에 기재된 바와 같이 생성하였다. 하기의 실시예에 사용되는 예시적인 PCSK9 억제제는 "REGN727" 또는 "알리로쿠맙"으로도 알려져 있는 "mAb316P"로 표기된 인간 항-PCSK9 항체이다. mAb316P는 하기의 아미노산 서열 특징을 갖는다: SEQ ID NO: 5를 포함하는 중쇄 및 SEQ ID NO: 9를 포함하는 경쇄; SEQ ID NO: 1을 포함하는 중쇄 가변 영역(HCVR) 및 SEQ ID NO: 6을 포함하는 경쇄 가변 도메인(LCVR); SEQ ID NO: 2를 포함하는 중쇄 상보성 결정 영역 1(HCDR1), SEQ ID NO: 3을 포함하는 HCDR2; SEQ ID NO: 4를 포함하는 HCDR3, SEQ ID NO: 7을 포함하는 경쇄 상보성 결정 영역 1(LCDR1), SEQ ID NO: 8을 포함하는 LCDR2 및 SEQ ID NO: 10을 포함하는 LCDR3.
실시예
2: 고콜레스테롤혈증이 있는
환자에서의
항-
PCSK9
항체("
mAb316P
") 대 에제티미브를 사용한 단일요법: 24주, 이중-맹검, 무작위화 3상 시험의 결과
백그라운드
고콜레스테롤혈증, 특히 저밀도 지질단백질 콜레스테롤(LDL-C) 수준의 증가는 서양에서의 사망 및 장애의 주요 원인인 죽상동맥경화증 및 CHD의 발생을 위한 주요 위험이 된다. LDL-C는 콜레스테롤 저하 치료법의 주요 표적으로 확인되며, 유효한 대용 종점으로 여겨진다. 수많은 연구에 의해, 주로 스타틴을 사용한 3-하이드록시-3-메틸-글루타릴-CoA 환원효소(HMG CoA)를 통한 LDL-C 수준의 감소가 CHD의 위험을 감소시키며, LDL-C 수준과 CHD 사건 간에 강력한 직접적인 관계가 있는 것이 입증되었으며; LDL-C의 각각의 1 mmol/ℓ(약 40 ㎎/㎗) 감소에 대하여, 심혈관 질병(CVD) 사망률 및 이환율이 22% 감소된다.
mAb316P를 사용하여 3가지의 1상 연구를 행하고, 안전성, 내약성 및 PK/PD 프로파일을 평가하였다. 2가지 연구는 스타틴 치료법이 권고되지 않는 100 ㎎/㎗ 초과의 LDL-C가 있는 건강한 대상체에서 행한 단일 용량 투여(하나의 연구는 0.3 ㎎ 내지 12 ㎎/㎏의 용량의 정맥내 투여를 사용하며, 다른 연구는 50 ㎎ 내지 250 ㎎의 용량의 피하 투여를 사용함)였다. 제3 연구를 10 ㎎ 내지 40 ㎎/일의 안정적인 용량의 아토르바스타틴에 대한 추가로서 또는 단일요법으로서 50 ㎎, 100 ㎎, 150 ㎎ 및 200 ㎎의 단일 내지 다수의 피하 투여를 사용하여 고콜레스테롤혈증 환자(가족성 또는 비-가족성)에서 행하였다.
이들 1상 연구의 결과에 의해, 건강한 대상체 및 환자에게 정맥내 또는 피하 투여에 의해 투여되는 mAb316P가 일반적으로 모든 용량에서 널리 내약성이 있는 것이 나타났으며; 치료후 발생 유해 사례(TEAE)는 용량 관련성을 나타내지 않았다. 약물과 관련된 유해 사례(AE)의 패턴이 확인되지 않았다. 모든 이들 1상 연구에서, MAb316P의 투여는 기준선으로부터 60%까지의 LDL-C의 신속하고, 실질적이며, 지속적인 감소를 유도하였다. 이들 감소의 크기 및 기간은 투여되는 용량과 긍정적으로 관련이 있었다. 또한, 제3 연구에서, 결과가 가족성 및 비가족성 고콜레스테롤혈증 환자에서 유사하였음이 주목되어야 한다. 전반적으로, 총 109명의 대상체를 이들 3가지의 1상 연구에서 적어도 1개 용량의 mAb316P에 노출시켰다.
3가지의 2상 연구도 또한 행하였다. 이들 연구의 결과는 이전에 보고되어 있다.
도입
본 실시예에서, 3상 임상 시험을 행하여, 단일요법으로 투여되는 경우 mAb316P의 효능 및 안전성을 평가하였다.
이러한 연구의 목적은 조사 산물 mAb316P가 단일요법으로 사용되는 경우, 효과의 크기 및 안전성 프로파일에 대한 정보를 제공하는 것이었다. mAb316P의 단일의 효능 및 안전성에 대한 데이터를 수득하는 것은 그것이 스타틴에 대하여 추가로 사용되는 경우 수득되는 데이터를 균형감 있게 이해하는데 중요하다.
이러한 연구의 다른 목적은 스타틴-불내약성 환자에서 mAb316P의 평가를 지지하는 단일요법 데이터를 제공하는 것이었다. 스타틴이 부적절하거나 불내약성인 것으로 여겨지는 경우 단일요법으로 사용될 수 있는 현재의 LDL-C-저하 약제는 에제티미브, 니아신 및 담즙산 격리제를 포함한다. 단일요법에 사용될 수 있는 그들 선택은 약 20% LDL-C 감소와 관련이 있다.
이러한 연구를 위해 선택되었던 대조군은 매일 경구의 에제티미브 10 ㎎이었다. 이는 mAb316P를 통상적인 임상 시험에 이용 가능한 치료 선택(즉, 에제티미브)에 대하여 비교하는 연구를 가능하게 하였다.
이러한 특정 연구를 행하여, 중등의 CV 위험이 있고, 100 ㎎/㎗(2.59 mmol/ℓ) 내지 190 ㎎/㎗(4.9 mmol/ℓ)의 LDL-C가 있는 환자에서 단일요법으로서 2주마다의 mAb316P 75 ㎎ 및/또는 150 ㎎이 에제티미브에 비하여 통계적으로 유의미하고 임상적으로 의미있는 LDL-C의 감소를 야기하는 것을 입증하였다.
연구 모집단
단일요법 연구를 위한 연구 모집단은 100 ㎎/㎗(2.59 mmol/ℓ) 내지 190 ㎎/㎗(4.9 mmol/ℓ)의 LDL-C가 있는 환자였다.
이러한 연구는 SCORE 차트에 기초하여 1% 이상 및 5% 미만의 10년 내 CVD 사망 위험에 의해 정의되는 바와 같은 중등의 CV 위험이 있고, 확립된 CHD 또는 동등한 CHD 위험이 없는 환자를 포함하였다. SCORE와 같은 위험 차트는 임상 또는 전임상 질병의 징후가 없는 겉보기에 건강한 사람에서 위험 평가를 용이하게 하는 것으로 의도된다. SCORE는 총 콜레스테롤, 연령, 성별, 흡연 및 수축기 혈압에 기초하여 CV의 10년 위험을 측정한다. 이러한 위험 수준은 비스타틴 활성 비교제를 사용한 단일요법 연구의 맥락에서 적절한 것으로 여겨졌다.
24주의 이중-맹검 연구 처치 기간을 사용한 100명의 환자의 시료 크기(그룹마다 50명의 환자)는 0.05 양측 유의성 수준과 함께, 25%의 통상 SD 및 5% 평가 가능하지 않은 일차 종점을 가정하고, 기준선으로부터 제24주까지의 LDL-C의 평균 변화 백분율의 20%의 치료 차이를 검출하고자 하였다.
용량의 선택
모든 환자를 초기에 2주마다 75 ㎎으로 처치하고, LDL-C 수준이 처치 8주 후에 100 ㎎/㎗ 이상으로 유지되는 환자만을 제12주부터 2주마다의 150 ㎎으로 상향-적정하였다.
용량, 투여 빈도 및 상향-적정 방법의 선택은 CV 질병 감소의 면에서 최적의 이익을 제공하는데 필요한 LDL-C 감소 및 낮은 LDL-C 값에 관한 잠재적인 안전성 고려사항에 기초한다. 2개의 용량 결정 연구의 결과에 기초하여, 2주마다의 투여 섭생은 투여간 간격 동안 일정한 LDL-C 저하를 유지하고, 최대 효능이 제12주에 2주마다의 150 ㎎ 투여에 의해 제공되는 것으로 예상된다. 그러나 많은 환자에 있어서, 2주마다의 150 ㎎ 용량으로 관찰되는 효과의 크기는 표적 LDL-C 목적을 달성하는데 필요하지 않을 수 있으며, 보다 낮은 용량을 사용한 출발이 수행될 수 있다. 용량 반응 모델을 사용하여, 2주마다의 75 ㎎을 선택하여, 기준선으로부터 대략 50%의 LDL-C의 감소를 제공하였다: 모든 환자를 초기에 2주마다 75 ㎎으로 처치하고, LDL-C 수준이 8주의 처치 후에 100 ㎎/㎗ 이상으로 유지되는 환자만을 용량을 (제12주에) 2주마다의 150 ㎎으로 상향-적정하였다. 이러한 처치 섭생을 사용하여, 원발성 고콜레스테롤혈증이 있는 대부분의 환자는 그들의 표적 LDL-C 수준을 달성하며, 소수의 환자가 25 ㎎/㎗ 미만의 수준에 도달하는 것으로 예상되었다.
2상 연구로부터의 예비 PK 데이터는 mAb316P로의 노출이 이중-맹검 처치 기간 후의 8주 추적 기간 동안 감소되고, mAb316P의 총 혈청 농도가 매우 낮은 수준이지만, 여전히 검출가능함을 보여주었다. 따라서, 충분히 낮은, 효과 없는 혈청 mAb316P 농도를 보장하기 위하여, 8주(즉, 마지막 투여 후 10주)의 추적 기간 동안 환자를 추적하였다. mAb316P의 효과를 약화시키는 스타틴 백그라운드가 존재하지 않기 때문에, 이러한 시험에서 약동학 결과가 중요하다.
연구 목적
단일요법 연구의 일차 목적은 중등의 심혈관(CV) 위험에 있는 고콜레스테롤혈증이 있는 환자에서 24주의 처치 후에, 매일의 에제티미브(EZE) 10 ㎎과 비교하여, 단일요법으로서 2주마다(Q2W)의 mAb316P에 의한 저밀도 지질단백질 콜레스테롤(LDL-C)의 감소를 입증하는 것이었다.
단일요법 연구의 이차 목적은 하기와 같았다. (1) 12주의 처치 후에, LDL-C에 대한, EZE에 비한 mAb316P 75 ㎎의 효과를 평가하기 위한 목적. (2) 다른 지질 파라미터(즉, Apo B, 비-HDL-C, 총-C, Lp(a), HDL-C, TG 수준 및 Apo A-1 수준)에 대한 mAb316P의 효과를 평가하기 위한 목적. (3) MAb316P의 안전성 및 내약성을 평가하기 위한 목적. (4) 항-MAb316P 항체의 발생을 평가하기 위한 목적. (5) MAb316P의 약동학(PK)을 평가하기 위한 목적.
연구 설계
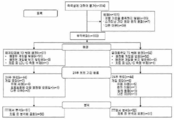
이것은 고콜레스테롤혈증 및 10년 위험 점수(SCORE) 21% 및 5% 미만이 있는 환자에서 mAb316P의 효능 및 안전성을 평가하기 위한 무작위화, 이중-맹검, 병렬-그룹, 이중 위약(double dummy), 에제티미브-조절, 평형(1:1, mAb316P:에제티미브), 다기관, 다국가 연구였다. 무작위화를 DM 상태에 따라 계층화시켰다. 무작위화 후에, 환자에 24주의 기간에 걸쳐 2주마다 이중-맹검 연구 처치(mAb316P 또는 위약 중 어느 하나) 및 매일의 경구 에제티미브 및 에제티미브에 대한 위약을 제공하였다. 제8주 LDL-C 수준에 따른 용량 상향-적정은 mAb316P로 무작위화된 환자에 대하여 제12주에 발생할 수 있다. 환자를 이중 맹검 처치 기간(DBTP)의 마지막 방문 후 8주 동안 추적하였다. 연구 설계는 도 1에 나타나 있다.
프로토콜의 설명
연구는 3가지 기간으로 이루어졌다: 스크리닝, 이중-맹검 처치 및 추적.
스크리닝 기간 - 환자(또는 다른 지정된 사람, 예를 들어, 배우자, 친인척 등)를 mAb316P에 대한 위약을 자가-주사/주사하도록 훈련시키는 동안 중간 방문을 포함하는 최대 2주의 기간. 적격성 평가를 수행하여, 연구로의 환자의 무작위화를 가능하게 하였다. 조사자는 무작위화 방문 이전에 추가의 자가-주사 훈련을 필요로 하는 환자를 위한 mAb316P에 대한 위약의 제2 훈련 키트를 제공하는 선택을 가졌다. 환자 또는 조사자는 가정에서 또는 연구 장소에서 환자에게 주사하는 것을 선택할 수 있었다.
이중-맹검 처치 기간(DBTP) - 24주의 무작위화, 이중-맹검 이중 위약 연구 처치 기간. 이중-맹검 기간 동안의 처음의 주사를 무작위화 날(제0주[D1]-V3)에, 그리고 연구로의 무작위화를 위한 IVRS/IWRS로의 호출 후에 가능한 한 빨리 상기 장소에서 행하였다. 이후의 주사를 환자-선호 장소(집 등)에서 환자(자가-주사) 또는 다른 지정된 사람(예를 들어, 배우자, 친인척 등)이 행하였다. mAb316P로 무작위화된 환자에게, 무작위화(V3)로부터 제12주(V6)까지(즉, 제0주, 제2주, 제4주, 제6주, 제8주 및 제10주), 75 ㎎의 용량의 mAb316P + 에제티미브에 대한 위약을 매일 경구로 제공하였다. 제12주 방문(V6) 시에, 이들 환자는 맹검 방식으로, (1) 제8주 LDL-C가 100 ㎎/㎗(1.81 mmol/ℓ) 미만이면, (제12주부터 제22주의 마지막 주사까지 계속) 2주마다의 mAb316P 75 ㎎을 계속하거나, (2) 제8주 LDL-C가 2100 ㎎/㎗(1.81 mmol/ℓ)이면, (제12주부터 제22주의 마지막 주사까지 계속) 2주마다 mAb316P 150 ㎎으로 용량을 상향-적정한다. 에제티미브에 무작위화된 환자에는, 무작위화(V3)로부터 제24주(V8)까지 2주마다 주사되는 mAb316P 위약 + 매일 경구의 에제티미브 10 ㎎을 제공하였다.
추적 기간 - 이중-맹검 처치 기간의 종료 후 8주의 기간.
연구 참여 기간
연구 기간은 최대 2주의 스크리닝 기간, 효능 및 안전성 평가를 위한 24주의 이중 맹검 처치 기간 및 DBTP의 마지막 방문 후 모든 환자에 대한 8주의 처치후 추적 기간을 포함하였다. 따라서, 환자마다 연구 기간은 약 34주였다.
환자 선택
이러한 연구를 위한 표적 모집단은 체계적 관상동맥 위험 평가(SCORE)에 기초하여 1% 이상 및 5% 미만의 10년 위험 점수로 정의된 중등의 심혈관(CV) 위험에서 고콜레스테롤혈증이 있고, 서명이 있는 기재된 사전 동의를 포함하는 환자였다.
상기 포함 기준 전부를 충족하는 환자를 하기의 3가지 세부항목으로 분류되고 넘버링된 하기의 배제 기준에 대하여 스크리닝하였다:
A. 연구 방법과 관련된 배제 기준
1. 제2주(스크리닝, V1)에, 100 ㎎/㎗ 미만 또는 190 ㎎/㎗ 초과(각각 2.59 mmol/ℓ 미만 또는 4.9 mmol/ℓ 초과)의 LDL-C.
2. 하기로 정의된 바와 같은 확립된 CHD 또는 동등한 CHD 위험의 전력: (A). 문서화된 CHD의 전력(다음 중 하나 이상을 포함): (1) 급성 심근경색증(MI); (2) 무증상 MI; (3) 불안정협심증; (4) 관상동맥재개통술(예를 들어, 경피적 관상동맥중재술[PCI] 또는 관상동맥 우회술[CABG]); (5) 침습적 또는 비-침습적 시험(예를 들어, 관상동맥 조영술, 트레드밀을 사용한 부하 시험, 부하 심초음파 또는 핵 영상화)에 의해 진단되는 임상적으로 유의미한 CHD (B) 동등한 CHD 위험은 죽상경화 질병의 비관상동맥 형태의 임상 소견을 포함한다: (1) 유증상 말초 동맥 질병; (2) 복부 대동맥류; 또는 (3) 일과성 허혈 발작 또는 허혈 뇌졸중 및 "침습적 또는 비-침습적 시험(예를 들어, 혈관조영술 또는 초음파)에 의한 임상적으로 유의미한 경동맥 폐색".
3. 5% 이상의 위험 SCORE와 관련된 DM 또는 임의의 추가의 위험 인자(하기 열거된 바와 같음)이 있는 환자: (1) 문서화된 0.90 이하의 발목상완지수의 전력; (2) 미세알부민뇨증 또는 다알부민뇨증의 문서화된 전력(30) 또는 스크리닝 방문(제-2주) 시에 2+ 초과의 단백질이 있는 딥스틱 요검사; 또는 (3) 문서화된 전증식성 또는 증식성 망막병증 또는 망막병증에 대한 레이저 처치의 전력.
4. 스크리닝 방문(제-2주, V1)의 4주 이내 또는 스크리닝과 무작위화 방문 사이의 매일 1000 ㎎ 초과의 용량의 스타틴, 니코틴산, 담즙산-결합 격리제, 장 콜레스테롤 흡수(ICA) 차단제(즉, 에제티미브) 또는 오메가-3 지방산의 이용.
5. 스크리닝 방문(제-2주, V1)의 6주 이내 또는 스크리닝과 무작위화 방문 사이의 피브레이트의 이용.
6. 스크리닝 방문(제-2주) 이전 적어도 4주 동안 또는 스크리닝과 무작위화 방문 사이의, 안정적인 용량/양으로 존재하지 않는 지질에 영향을 미칠 수 있는 기능식품 또는 일반의약 치료법의 이용.
7. 스크리닝 방문(제-2주)의 4주 이내 또는 스크리닝과 무작위화 방문 사이의, 홍국 제품의 이용.
8. 연구 동안 예정된 PCI, CABG, 경동맥 또는 말초혈관 재관류를 수행할 계획.
9. 스크리닝(제-2주, V1) 또는 무작위화(제0주) 방문 시에 160 mmHg 초과의 수축기 혈압(BP) 또는 100 mmHg 초과의 확장기 혈압.
10. 지난 12개월 내의 뉴욕 심장 학회(NYHA) 분류 III 또는 IV 심부전의 전력.
11. 알려져 있는 출혈성 뇌졸중의 전력.
12. 스크리닝 방문(제-2주) 시의 18세 또는 법정 성년 연령 중 어느 쪽이든 더 큰 연령 미만의 연령.
13. 스크리닝 방문(제-2주) 이전에, 콜레스테롤-저하 식이가 이전에 지시되지 않은 환자.
14. 새로 진단되거나(무작위화 방문[제0주] 이전 3개월 이내), 불량하게 조절되는(스크리닝 방문[제-2주]시에 8.5% 초과의 HbA1c) 당뇨병.
15. 혈청 지질 또는 지질단백질에 영향을 미치는 것으로 알려져 있는 임의의 임상적으로 유의미한 조절되지 않는 내분비 질병의 존재. 주의: 투여량이 스크리닝 이전 적어도 12주 동안 안정적이었으며, 스크리닝 방문 시에 TSH 수준이 중앙 연구소의 정상 범위 이내라면, 갑상선 대체 요법이 진행 중인 환자가 포함될 수 있다.
16. 스크리닝 방문(제-2주) 이전 12개월 내의 비만대사 수술의 전력.
17. 스크리닝 방문(제-2주) 이전 2개월 내의 5 ㎏ 초과의 변동으로 정의되는 불안정한 체중.
18. 알려져 있는 동형접합 또는 이형접합 가족성 고콜레스테롤혈증이 전력.
19. 알려져 있는 PCSK9의 기능의 소실(즉, 유전적 돌연변이 또는 서열 변이)의 전력.
20. 무작위화 방문(제0주) 이전 적어도 6주 동안의 안정적인 섭생을 사용한 뇌하수체/부신 질병에 대한 대체 요법으로 사용되지 않는 한, 전신 코르티코스테로이드의 이용. 주의: 국소, 관절내, 경비, 흡입형 및 안과용 스테로이드 치료법은 '전신'으로 간주되지 않고, 허용된다.
21. 스크리닝 방문(제-2주) 이전 지난 6주 내에 섭생이 안정적이고, 연구 동안 섭생을 변경할 계획이 없는 경우 외에, 지속적 에스트로겐 또는 테스토스테론 호르몬 대체 요법의 이용.
22. 적당하게 처치된 기저 세포 피부암, 편평세포 피부암 또는 동소 자궁경부암을 제외하고, 지난 5년 이내의 암의 전력.
23. 알려져 있는 HIV 양성의 전력.
24. 1개월이나 5 반감기 중 어느 것이든 더 긴 기간 이내에, MAb316P 훈련 위약 키트 이외의 임의의 조사 약물을 취한 적이 있는 환자.
25. 이전에 MAb316P의 임의의 임상 시험 또는 임의의 다른 항-PCSK9 치료법에 참여한 적이 있는 환자.
26. 스크리닝 기간 동안 동의를 중단한 환자(기꺼이 계속하지 않거나 복귀하지 않은 환자).
27. 질환/상황, 예를 들어, (1) 시험자 또는 임의의 시험담당자의 판단 하에, 연구의 안전한 완료를 불가능하게 하거나 종점 평가를 제한할, 스크리닝 시에 확인된 임의의 임상적으로 유의미한 비정상, 예를 들어, 주요 전신 질병, 짧은 기대 수명을 갖는 환자; 또는 (2) 시험자 또는 임의의 시험담당자에 의해, 임의의 이유로, 이러한 연구에 부적절한 것으로 여겨지는 환자, 예를 들어, (a) 특정 프로토콜 요건, 예를 들어, 예정된 방문을 충족시킬 수 없는 것으로 여겨짐; (b) 환자 또는 시험자에 따라 장기간 주사를 투여할 수 없거나 그에 불내약성인 것으로 여겨짐; (c) 프로토콜의 수행 등에 직접 연루되는 시험자 또는 임의의 시험담당자, 약사, 연구 코디네이터, 다른 연구 스태프 또는 그의 관계자 등; 또는 (d) 시험자가 연구 기간 동안 환자의 참여를 제한하거나 한정할 것으로 느끼는, 실제의 또는 예상되는 임의의 다른 조건(예를 들어, 지리학적, 사회학적)의 존재.
28. 스크리닝 기간 동안의 검사 소견(무작위화 제0주 검사는 포함하지 않음): (1) B형 간염 표면 항원 또는 C형 간염 항체에 대한 양성 시험(반사적(reflexive) 시험에 의해 확인); (2) 가임 여성에서 양성의 혈청 베타-hCG 또는 소변 임신 검사(제0주 포함); (3) 400 ㎎/㎗ 초과(4.52 mmol/ℓ 초과)의 트리글리세리드(1회의 반복 검사가 허용됨); (4) 4-변량 MDRD 연구 식에 따라 60 ㎖/분/1.73 m2 미만의 eGFR(중앙 연구소에 의해 계산); (5) ULN 3배 초과의 ALT 또는 AST(1회 반복 검사가 허용됨); (6) ULN 3배 초과의 CPK(1회 반복 검사가 허용됨); 또는 (7) LLN 미만 또는 ULN 초과의 TSH.
B. 백그라운드 치료법과 관련된 배제 기준
29. 활성 비교제(에제티미브)에 대한 모든 금기 또는 각각의 국가 제품 표시에 나타낸 바와 같은 사용 경고/주의(적절한 경우).
C.
MAb316P와
관련된 배제 기준
30. 알려져 있는 모노클로널 항체 치료제에 대한 과민증.
31. 임산부 또는 수유중인 여성.
32. 효율적인 산아 제한 피임 방법을 사용하지 않고/거나 임신에 대하여 시험하려고 하지 않거나 그에 대하여 시험할 수 없는 가임 여성.
주의: 가임 여성은 스크리닝 및 무작위화 방문 시에 음성 임신 검사가 확인되어야 한다. 그들은 연구 내내 효과적인 피임 방법을 사용하고, 지정된 방문 시에 소변 임신 검사의 반복에 동의해야 한다. 적용된 피임 방법은 약제를 위한 마켓팅 권한부여 및 인간 임상 시험의 수행을 위한 비-임상 안전성 연구에 대한 지침을 위한 주의에 따라 매우 효율적인 산아 제한 방법에 대한 기준을 충족시켜야 한다. 폐경후 여성은 적어도 12개월 동안 무월경이어야 한다.
연구 처치
조사 의약품(IMP) 및 투여
멸균 mAb316P 약물 제품을 75 ㎎/㎖ 및 150 ㎎/㎖의 농도로, 둘 모두 자기-주사기에서 1 ㎖ 부피로 공급하였다. mAb316P에 대한 멸균 위약을 자기-주사기에서 1 ㎖ 부피로서 단백질의 첨가 없이 mAb316P와 동일한 제형으로 제조하였다.
오버-캡슐화된(over-encapsulated) 에제티미브 10 ㎎ 정제. 에제티미브에 대한 위약 캡슐.
mAb316P IMP는 자가-주사에 의해 또는 다른 지정된 사람(예를 들어, 배우자, 친인척 등)에 의해 투여될 수 있다. 사용되는 자기-주사기는 환자에게 제공되었던 샤프스 컨테이너(sharps container)에 폐기하였다.
환자는 mAb316P IMP를 냉장고에 보관할 것을 요청받았다. IMP는 투여 전에, 약 30 내지 40분 동안 실온에 안전한 장소에 바깥에 놓아야 한다. 그 후에, IMP를 가능한 한 빨리 투여해야 한다.
이중-맹검 처치 기간 동안, mAb316P 또는 mAb316P에 대한 위약을 제0주에 시작하여, 이중 맹검 처치 기간의 마지막 2주 전 마지막 주사(제22주)까지 계속하여, 2주마다 피하 투여하였다.
MAb316P IMP 주사제를 이상적으로 당일의 대략 동일한 시간에 2주마다 피하 투여하였지만; ±3일의 윈도우 기간(window period)을 갖는 것이 허용 가능하였다.
에제티미브 10 ㎎ 또는 에제티미브에 대한 위약 캡슐을 음식과 함께 또는 음식 없이, 당일의 대략 동일한 시간에 1일 1회 경구로 취하였다.
연구 종점
일차 효능 종점
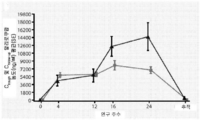
일차 효능 종점은 기준선으로부터 제24주까지의 계산된 LDL-C의 변화 백분율이었으며, 이는 다음과 같이 정의된다: 100×(제24주의 계산된 LDL-C 값 - 기준선에서의 계산된 LDL-C 값)/기준선에서의 계산된 LDL-C 값.
기준선의 계산된 LDL-C 값은 처음의 이중-맹검 주사 일 및 처음의 캡슐 복용 사이에 가장 빠른 것으로 정의되는 처음의 이중-맹검 IMP 전에 수득된 마지막 LDL-C 수준이었다.
제24주의 계산된 LDL-C는 24주 시간 윈도우 내에 그리고 주요 효능 기간 동안 수득된 LDL-C 수준이었다. 주요 효능 기간은 처음의 이중-맹검 IMP로부터 마지막 이중-맹검 IMP 주사 후 21일까지나 24주 분석 윈도우의 상한까지 중 먼저 일어나는 시간까지의 시간으로 정의되었다.
모든 계산된 LDL-C 값(예정되거나 예정되지 않은, 공복이거나 공복이 아닌)을 사용하여 상기 정의에 따라 적절하다면 일차 효능 종점에 대한 값을 제공할 수 있다.
이차 효능 종점
주요 이차 효능 종점
(1) 기준선으로부터 제12주까지의 계산된 LDL-C의 변화 백분율: 제12주에 계산된 LDL-C가 12주 분석 윈도우 내에, 그리고 12주 효능 기간 동안 수득되는 LDL-C 수준이었음을 제외하고, 상기와 유사한 정의 및 규칙. 12주 효능 기간은 처음의 이중-맹검 IMP로부터 제6 방문 재공급 IVRS 접촉까지나 마지막 이중-맹검 IMP 주사 후 21일까지 중 먼저 일어나는 시간까지의 시간으로 정의되었다. 제6 방문 재공급 IVRS 접촉의 날에 수집한 혈액 시료추출을 적정 이전으로 간주하였다.
(2) 기준선으로부터 제24주까지의 Apo B의 변화 백분율. 일차 종점에 대한 것과 동일한 정의 및 규칙.
(3) 기준선으로부터 제24주까지의 비-HDL-C의 변화 백분율. 일차 종점에 대한 것과 동일한 정의 및 규칙.
(4) 기준선으로부터 제24주까지의 총-C의 변화 백분율. 일차 종점에 대한 것과 동일한 정의 및 규칙.
(5) 기준선으로부터 제12주까지의 Apo B의 변화 백분율. 기준선으로부터 제12주까지의 계산된 LDL-C의 변화 백분율에 대한 것과 동일한 정의 및 규칙.
(6) 기준선으로부터 제12주까지의 비-HDL-C의 변화 백분율. 기준선으로부터 제12주까지의 계산된 LDL-C의 변화 백분율에 대한 것과 동일한 정의 및 규칙.
(7) 기준선으로부터 제12주까지의 총-C의 변화 백분율. 기준선으로부터 제12주까지의 계산된 LDL-C의 변화 백분율에 대한 것과 동일한 정의 및 규칙.
(8) 일차 종점에 대하여 사용된 정의 및 규칙을 사용하여 제24주에 100 ㎎/㎗(2.59 mmol/ℓ) 미만의 LDL-C 목표에 도달한 환자의 비.
(9) 일차 종점에 대하여 사용된 정의 및 규칙을 사용하여 제24주에 70 ㎎/㎗(1.81 mmol/ℓ) 미만의 LDL-C 목표에 도달한 환자의 비.
(10) 기준선으로부터 제24주까지의 Lp(a)의 변화 백분율. 일차 종점에 대한 것과 동일한 정의 및 규칙.
(11) 기준선으로부터 제24주까지의 HDL-C의 변화 백분율. 일차 종점에 대한 것과 동일한 정의 및 규칙.
(12) 기준선으로부터 제12주까지의 HDL-C의 변화 백분율. 기준선으로부터 제12주까지의 계산된 LDL-C의 변화 백분율에 대한 것과 동일한 정의 및 규칙.
(13) 기준선으로부터 제12주까지의 Lp(a)의 변화 백분율. 기준선으로부터 제12주까지의 계산된 LDL-C의 변화 백분율에 대한 것과 동일한 정의 및 규칙.
(14) 기준선으로부터 제24주까지의 공복 TG의 변화 백분율. 일차 종점에 대한 것과 동일한 정의 및 규칙.
(15) 기준선으로부터 제12주까지의 공복 TG의 변화 백분율. 기준선으로부터 제12주까지의 계산된 LDL-C의 변화 백분율에 대한 것과 동일한 정의 및 규칙.
(16) 기준선으로부터 제24주까지의 Apo A-1의 변화 백분율. 일차 종점에 대한 것과 동일한 정의 및 규칙.
(17) 기준선으로부터 제12주까지의 Apo A-1의 변화 백분율. 기준선으로부터 제12주까지의 계산된 LDL-C의 변화 백분율에 대한 것과 동일한 정의 및 규칙.
기타 이차 효능 종점
(18) 제12주에 100 ㎎/㎗(2.59 mmol/ℓ) 미만의 LDL-C에 도달하는 환자의 비.
(19) 제12주에 70 ㎎/㎗(1.81 mmol/ℓ) 미만의 LDL-C에 도달하는 환자의 비.
(20) 기준선으로부터 제12주 및 제24주까지의 LDL-C의 절대치 변화(㎎/㎗ 및 mmol/ℓ).
(21) 기준선으로부터 제12주 내지 제24주까지의 Apo B/Apo A-1 비의 변화.
(22) 제12주 및 제24주에 80 ㎎/㎗(0.8 g/ℓ) 미만의 Apo B가 있는 환자의 비.
(23) 제12주 및 제24주에 100 ㎎/㎗(2.59 mmol/ℓ) 미만의 비-HDL-C가 있는 환자의 비.
(24) 제12주 및 제24주에 70 ㎎/㎗(1.81 mmol/ℓ) 미만의 LDL-C 및/또는 LDL-C의 ?50% 감소(LDL-C ?70 ㎎/㎗[1.81 mmol/ℓ]이면)가 있는 환자의 비.
효능 평가 방법
지질 파라미터
총-C, HDL-C, TG, Apo B, Apo A-1 및 Lp(a)를 직접 측정하였다. LDL-C를 모든 방문(제-1주 및 추적 방문 제외) 시에 프리데발트(Friedewald) 식을 사용하여 계산하였다. TG 값이 400 ㎎/㎗(4.52 mmol/ℓ) 초과이면, 중앙 연구소는 LDL-C를 계산하기보다는 LDL-C를 (베타 정량화 방법을 통해) 반사적으로 측정하였다. HDL-C를 총-C로부터 제함으로써 비-HDL-C를 계산하였다. Apo B/Apo A-1 비를 계산하였다.
안전성 종점 - 관찰 기간
안전성 데이터의 관찰은 다음과 같았다:
사전처치 기간: 사전처치 관찰 기간은 서명이 있는 사전 동의로부터 제1 용량의 이중-맹검 IMP까지로 정의하였다.
TEAE 기간: TEAE 관찰 기간을 제1 용량의 이중-맹검 IMP로부터 마지막 용량의 이중-맹검 IMP 주사까지의 시간 + 70일(10주)로 정의하였는데, 이는 이중-맹검 IMP 주사의 중지 이후 10주까지 MAb316P의 잔류 효과가 예상되기 때문이다.
처치후 기간: 처치후 관찰 기간을 TEAE 기간의 마지막 후의 날에서 시작하여, 연구의 마지막까지의 시간으로 정의하였다.
안전성 종점 - 안전성 연구소
임상 연구소 데이터는 요검사 및 혈액 검사, 혈액학(감별 혈구 계수를 사용하여 RBC 계수, 적혈구 분포폭(RDW), 망상적혈구 계수, 헤모글로빈, 적혈구용적율, 혈소판, WBC 계수), 표준 화학물질(글루코스, 나트륨, 칼륨, 염화물, 중탄산염, 칼슘, 인, 요소 질소, 크레아티닌, 요산, 총 단백질, LDH, 알부민, γ 글루타밀 트랜스퍼라제[γGT]), C형 간염 항체, 간 패널(ALT, AST, ALP 및 총 빌리루빈) 및 CPK로 이루어졌다.
안전성 종점 - 활력 징후 측정: 포함되는 활력 징후: 앉은 자세에서의 HR, 수축기 및 확장기 BP.
다른 종점 항- MAb316P 항체 평가: 항-mAb316P 항체는 항체 상태(양성/음성) 및 항체 역가를 포함한다.
시료추출 시간: 항-mAb316P 항체 결정을 위한 혈청 시료를 연구 내내 주기적으로 채혈하였다. 무작위화 방문 시에 처음의 예정된 시료를 IMP 주사 전에 수득하였다(투여전).
추적 방문 시에 항-mAb316P 항체에 대하여 240의 또는 240 초과의 역가를 갖는 환자는 마지막 투여 후 6 내지 12개월 및 그 후 역가가 240 미만으로 복귀될 때까지 약 3 내지 6개월마다 추가의 항체 시료(들)를 가졌다. 연구의 맹검을 유지하기 위하여, 연구후 항-mAb316P 항체의 시료 수집을 위한 요청은 추적 방문 시에 240 미만의 역가를 갖는 환자에서 이루어졌다.
시료추출 절차: 오(5) ㎖의 부피의 혈액을 각각의 항-mAb316P 항체 시료에 대하여 수집하였다.
생물분석 방법: 모든 항-mAb316P 항체(ADA; 항-약물 항체) 시료를 분석하였다.
항-mAb316P 항체 시료를 입증된 비-정량적, 역가-기반의 가교 면역검정을 사용하여 분석하였다. 그것은 초기 스크린, 약물 특이성에 기초한 확인 검정 및 시료에서의 항-MAb316P 항체의 역가의 측정을 수반한다. 검출의 하한은 대략 1.5 ng/㎖였다.
ADA 검정에서 양성이었던 시료를 입증된, 비-정량적, 경쟁적 리간드 결합 검정을 사용하여 중화 항체에 대하여 평가하였다. 모노클로널 양성 대조군 중화 항체에 기초한 검출의 하한은 390 ng/㎖이다.
hs- CRP: 기준선으로부터 제12주 및 제24주까지의 hs-CRP의 변화 백분율.
HbA1C: 기준선으로부터 제12주 및 제24주까지의 HbA1c의 절대치 변화(%).
EQ-5D 환자 설문: EQ-5D는 간단하고 일반적인 건강 측정을 임상적 및 경제적으로 평가하기 위해 EuroQOl Group이 개발한 건강 상태의 표준화된 척도이다. 건강 관련 삶의 질 척도로서의 EQ-5D는 다음과 같은 5개 차원에서 건강을 정의한다: 이동성(mobility), 자가 돌봄(self-care), 일반 활동(usual activities), 통증/불쾌감(pain/discomfort), 불안/우울증(anxiety/depression). 각 차원은 다음과 같은 3가지 반응(3가지 중증도 순위 수준) 중 하나를 취할 수 있다: '문제 없음'(1), "약간의 문제"(2), "심각한 문제"(3). 전체 건강 상태는 5자리 숫자로 정의된다. 5차원 분류에 의해 정의된 건강 상태는 건강 상태를 정량화하는 해당 지수 점수로 변환될 수 있으며, 여기서, 0은 '사망'을 내타내고, 1은 "완벽한 건강"을 나타낸다. 하나 이상의 차원에 대한 반응이 소실되면, 지수 점수는 소실될 것이다.
EQ-5D 변수는 각 EQ-5D 항목의 반응, 지수 점수 및 기준선으로부터 지수 점수의 변화를 포함하였다.
약동학: 약동학 변수는 총 혈청 mAb316P 농도를 포함하였다. 필요에 따라, 총 및 유리 PCSK9 농도는 동일한 PK 시료로부터 측정될 수 있다.
시료추출 시간: 총 mAb316P 농도를 위한 혈청 시료를 제0주(무작위화 방문)에 IMP 이전(투여전), 그 다음, 추적 기간의 마지막까지 몇몇의 방문 시에 수집하였다. 흡수 단계에 대한 정보를 수집하기 위하여, 선택적 PK 시료를 대상체가 치료 중인 동안 제22주 IMP 주사 후 5일(± 2) 또는 임의의 이후의 IMP 주사 후 5일(± 2)에 수집하였다.
시료추출 절차: 오(5) ㎖ 부피의 혈액을 각 PK 시료를 위해 수집하였다.
생물분석 방법: 모든 PK 시료를 입증된 효소-연결 면역흡착 검정(ELISA)을 사용하여 총 mAb316P 농도(즉, 유리 mAb316P 및 PCSK9:mAb316P 복합체에 존재하는 mAb316P)의 결정을 위해 분석하였다. 이러한 검정에 대한 정량화의 하한(LLQ)은 0.078 ㎍/㎖이다.
필요에 따라, PK 시료를 입증된 ELISA를 사용하여 총 및 유리 PCSK9 수준의 결정을 위해 분석할 수 있다. LLQ는 총 PCSK9 검정에 대하여 0.156 ㎍/㎖이고, 유리 PCSK9 검정에 대하여 0.0312 ㎍/㎖이다.
연구 절차
제1일/제0주(무작위화 방문) 후의 모든 방문에 대하여, 특정 일수의 기간을 허용하였다. 제12주 및 제24주의 방문에 대한 윈도우 기간은 ±3일이었으며, 이중-맹검 처치 기간 및 추적 기간 동안의 모든 다른 장소 방문에 대하여 윈도우 기간은 ±7일이었다. 무작위화 방문(제1일/제0주)에 대하여, 그리고 주사 훈련을 위한 스크리닝 방문(제-1주)에 대하여, +3일의 윈도우 기간을 허용하였다.
혈액 시료추출: 지질 파라미터(즉, 총-C, LDL-C, HDL-C, TG, 비-HDL-C, Apo B, Apo A-1, Apo B/Apo A-1 비, Lp [a])의 결정을 위한 혈액 시료추출을 연구 내내 모든 장소 방문에 대하여 아침에, 공복 상태에서(즉, 밤새, 적어도 10 내지 12시간 공복 및 흡연의 자제) 수행해야 한다. 혈액 시료추출 이전의 48시간 이내의 알코올 소모 및 24시간 이내의 강렬한 신체 운동을 막았다.
연구소 시험: 혈액학; 화학; 간 패널(정상 범위를 넘어서는 총 빌리루빈 값의 경우에, 컨쥬게이트된 및 비-컨쥬게이트된 빌리루빈으로의 분화가 자동적으로 발생할 것임); 크레아틴 포스포키나제(CPK); B형 간염 표면 항원; C형 간염 항체(반사적 시험을 사용하여 양성의 시험을 확인하였음); 및 혈청 임신 검사를 포함하는 연구소 데이터를 수집하고, 중앙 연구소로 전달하였다.
소변 시료추출: 요검사 - 딥스틱을 중앙 연구소에서 수행하고, pH, 비중, 및 혈액, 단백질, 당, 케톤, 질산염, 백혈구 에스테라제, 유로-빌리노겐 및 빌리루빈에 대하여 평가하였다. 딥스틱이 비정상이었으면, 표준 현미경검사를 행할 것이다.
다른 종점 평가 방법: 모든 다른 혈액 파라미터를 연구 동안 중앙 연구소에서 측정하였다. 혈액 시료추출 이전의 48시간 이내의 알코올 소모 및 24시간 이내의 강렬한 신체 운동을 막았다. 혈당 파라미터(HbA1c 및 혈청 글루코스)를 연구 내내 주기적으로 중앙 연구소에서 측정하였다. 염증 파라미터, hs-CRP를 위한 혈액 시료추출을 연구 내내 주기적으로 수집하였다.
약동학 시료: mAb316P 농도의 평가를 위한 혈청 시료를 연구 내내 주기적으로 수득하였다.
신체 검사: 일반적인 신체 검사를 수행해야 한다.
혈압(BP)/심박수: BP를 (환자가 적어도 5분 동안 앉은 자세에서 편안하게 휴식한 후) 표준화된 조건하에 앉은 자세에서, 당일의 대략 동일한 시간에, 동일한 팔에, 동일한 장치를 사용하여 측정해야 한다. 값을 e-CRF에 기록해야 하며; 수축기 혈압 및 확장기 혈압 둘 모두를 기록해야 한다. 처음의 스크리닝 방문 시에, BP를 양팔에서 측정해야 한다. 가장 높은 확장기 혈압을 갖는 팔을 이러한 방문 시에 결정할 것이며, BP를 연구 내내 이 팔에서 측정해야 한다. 이러한 가장 높은 값은 e-CRF에 기록할 것이다. 심박수는 BP의 측정 시에 측정할 것이다.
심전도: 적어도 10분의 휴식 후에 앙와위에서 12-분극(lead) ECG를 수행해야 한다.
체중 및 신장: 체중을 속옷 또는 매우 가벼운 옷을 입고, 신을 신지 않고, 방광을 비운 환자에서 수득하여야 한다.
통계적 분석
처치군마다 45명의 환자의 시료 크기는 이전의 mAb316P 시험(문헌[McKenney et al., "Safety and efficacy of a monoclonal antibody to proprotein convertase subtilisin/kexin type 9 serine protease, SAR236553/REGN727, in patients with primary hypercholesterolemia receiving ongoing stable atorvastatin therapy", J Am Coll Cardiol, vol. 59, pp. 2344-2353 (2012)])에 기초하여 25%의 통상의 표준 편차(SD)를 가정하고, 예측되는 5%의 배제율과 함께, 5% 유의성을 갖는 2-측 t-검정을 사용하여, 기준선으로부터 제24주까지의 20%의 LDL-C 변화 백분율의 mAb316P와 에제티미브 간의 평균 차이의 95%의 검출력을 갖는 것으로 계산되었다.
일차 종점을 기준선 및 제4주로부터 제24주까지의 계획된 시점 중 하나에서 LDL-C 값이 적어도 1회 계산된 모든 무작위화된 환자를 포함하는 치료 의향(ITT) 모집단에서 평가하였다. 또한, 기준선에서, 및 제1 용량의 연구 처치와, 마지막 주사 후 21일까지나 마지막 캡슐 복용 후 3일 중 먼저 일어나는 시간 사이의 기간으로 정의되는, 치료 중 제4주 내지 제24주의 계획된 시점 중 하나에서 LDL-C 값이 적어도 1회 계산된 모든 무작위화 및 처치된 환자를 포함하여 치료 중 분석(변형된 ITT 또는 mITT에 해당)을 수행하였다.
소실 데이터를 반복 측정을 사용한 혼합형 효과 모델(MMRM) 방법의 수단에 의해 설명하였다(문헌[Siddiqui et al., MMRM vs. LOCF: a comprehensive comparison based on simulation study and 25 NDA datasets", J Biopharm Stat, vol. 19, pp. 227-246 (2009)]; 문헌[National Research Council, "The Prevention and Treatment of Missing Data in Clinical Trials" Panel on Handling Missing Data in Clinical Trials. Committee on National Statistics, Division of Behavioral and Social Sciences and Education. 2010], 문헌[Washington, DC: The National Academies Press; Andersen et al., "On the practical application of mixed effects models for repeated measures to clinical trial data", Pharm Stat., vol. 12, pp.7-16 (2013)]). ITT 분석을 위하여, 제4주로부터 제24주(제4주, 제8주, 제12주, 제16주 및 제24주를 의미)의 계획된 시점에 모든 이용 가능한 측정을 그들의 상태가 치료 중이든 비치료 상태이든, MMRM에서 사용하였다. 하나의 MMRM 모델을 LDL-C를 위해 사용하여, 제24주 및 제12주에, 최소-제곱 평균 추정치 및 처치군 간의 비교를 제공하였다. 모델에 대한 추가의 상세사항이 하기 제공되어 있다. 치료 중 분석을 위하여, 제4주로부터 제24주의 계획된 시점에 모든 이용 가능한 치료 중 측정(즉, 마지막 주사 후 21일/마지막 캡슐 후 3일까지 중 어느 것이나 먼저 일어나는 것)을 MMRM 모델에서 사용하였다. ITT 분석을 위한 것과 동일한 방식으로, 하나의 모델을 사용하여, 치료 중 분석을 위해 제24주 및 제12주에 추정치 및 비교를 제공하였다. Lp(a) 및 트리글리세리드 이외의 연속 주요 이차 종점을 일차 종점과 유사한 방식으로 분석하였으며, 이차 종점 및 하위군 분석을 위한 통계적 방법의 설명은 하기에 제공된다.
안전성 분석은 모든 무작위화된 및 처치된 환자를 포함하였다. 안전성 데이터를 기술 통계학에 의해 분석하였다. SAS® 버전 9.2 또는 그 이후 버전(SAS Institute Inc., Cary, NC)을 사용하여 모든 통계 분석을 행하였다.
반복 측정을 사용한 혼합형 효과 모델(
MMRM
)
MMRM은 처치군(mAb316P 대 에제티미브), 시점(제4주, 제8주, 제12주, 제16주 및 제24주) 및 시점에 의한 치료 상호작용, 및 기준선 저밀도 지질단백질 콜레스테롤(LDL-C) 값 및 시점에 의한 기준선 값 상호작용의 연속 고정된 공변량의 고정 범주형 효과를 포함하였다. 모델로부터의 출력은 그들의 상응하는 표준 오차(SE)와 함께 둘 모두의 처치군에 대한 제24주의 기준선-조정된 최소-제곱(LS) 평균 추정치였다. 적절한 콘트라스트(contrast) 표현을 사용하여, 2-측 5% 알파 수준에서 이들 추정치 간의 차이를 시험하였다. 일차 분석의 강건성을 평가하고, 그룹 간의 치료 중 결과를 비교하기 위하여, MMRM 모델을 치료 중에 수집된 LDL-C 값에도 적용하였다.
하위그룹 분석
다양한 하위그룹에 걸친 처치 효과의 동질성을 평가하기 위하여, 하위그룹에 의한 처치 인자, 하위그룹에 의한 시점 인자 및 하위그룹에 의한 시점에 의한 처치 인자 상호작용 용어 및 하위그룹 인자 용어를 일차 MMRM 모델에 부가하였다. 관심있는 하위그룹은 30 ㎏/㎡ 이상의 체질량지수(BMI); 성별; 지역(북아메리카, 서유럽); 65세 이상의 연령; 기준선 LDL-C(130 ㎎/㎗ 이상 또는 160 ㎎/㎗ 이상); 40 ㎎/㎗ 미만의 기준선 고밀도 지질단백질 콜레스테롤(HDL-C); 150 ㎎/㎗ 이상의 기준선 공복 트리글리세리드; 30 ㎎/㎗ 이상의 기준선 지질단백질(a)[Lp(a)]; 및 기준선 유리 프로단백질 전환효소 서브틸리신/켁신 9형(PCSK9) 수준(중간값 미만/초과)을 포함하였다.
주요 이차 종점의 통계적 분석
주요 이차 종점을 분석하기 위하여, 계층 절차를 사용하여, 제I종 오류 및 취급 다양성을 조절하였다. 이차 효능 종점을 치료 의향 모집단에서 상기 주어진 순서를 사용하여 순차적으로 시험하였다. Lp(a) 및 트리글리세리드를 제외한 연속 주요 이차 종점(제12주의 이차 종점을 포함)을 처치군, 제24주까지의 계획된 시점, 시점에 의한 치료 상호작용, 및 상응하는 기준선 값 및 시점에 의한 기준선 값 상호작용의 연속 고정 공변량의 고정 범주형 효과와 함께, 일차 종점에 대한 것과 동일한 MMRM 모델을 사용하여 분석하였다. Lp(a) 및 트리글리세리드(비-가우스 분포를 가짐) 및 이원 종점(100 ㎎/㎗ 미만 및 70 ㎎/㎗ 미만의 LDL-C를 갖는 환자의 비)을 결측치의 처리를 위해 다중 대체법을 사용하여 분석하였다. Lp(a) 및 트리글리세리드에 있어서, 다중 대체법은, 효과로서 처치군 및 상응하는 기준선 값을 갖는 강력한 회귀 모델로 이어졌다. 이원 종점에 있어서, 다중 대체법은, 효과로서 처리군 및 공변량으로서 상응하는 기준선 값을 갖는 로지스틱 회귀로 이어졌다. 주요 이차 종점의 감수성 분석을 치료 중 값을 사용하여 상기 기술된 것과 동일한 통계 방법을 사용하여 적용하였다.
결과
스크리닝된 204명의 환자 중에, 103명이 연구에 대한 적격성 기준을 충족하였으며, 무작위화시켰다(mAb316P 군으로 52명 및 에제티미브 군으로 51명; 도 2). 기준선 특징 및 지질 파라미터를 일반적으로 2개의 연구 군에 걸쳐 균등하게 분포시켰다(표 1). 총 4명의 환자가 스크리닝에서 당뇨병을 갖는 것으로 확인되었다(mAb316P 군에서 3명 및 에제티미브 군에서 1명). 평균 기준선 LDL-C 수준은 mAb316P 군에서 141.1 ㎎/㎗(3.65 mmol/ℓ)였으며, 에제티미브 군에서 138.3 ㎎/㎗(3.58 mmol/ℓ)였다(표 1).
mAb316P 군의 14명의 환자의 제8주 LDL-C가 70 ㎎/㎗이상이었고; 이들 환자 중 오직 1명만이 100 ㎎/㎗ 초과의 LDL-C를 가졌기 때문에, 그들을 제12주에 맹검 방식으로 2주마다의 150 ㎎ 투여 섭생으로 상향-적정하였다. 평균 기준선 LDL-C 값은 2주마다 mAb316P 150 ㎎으로 상향-적정시킨 환자에서 153.2 ㎎/㎗(3.96 mmol/ℓ)였고, 상향-적정시키지 않은 환자에서 134.7 ㎎/㎗(3.48 mmol/ℓ)였다. 환자가 상향-적정되는지에 따른 다른 지질 값의 기준선 값은 표 2에 나타나 있다.
종합하여, mAb316P 군에서 44/52명(85%)의 환자 및 에제티미브 군에서 44/51명(86%)의 환자는 24주 처치 기간을 완료하였다(도 2). 연구 처치 중단의 주요 이유는 둘 모두의 처치 군에서 TEAE였다(도 2). 처치를 조기에 중단한 15명의 환자 중에, mAb316P 군에서 3명(6%)의 환자 및 에제티미브 군에서 5명(10%)의 환자는 제24주에 계산된 LDL-C 값을 갖지 않았다.
각 군에서 48명의 환자는 모든 주사를 위해 자가-주사하였다(에제티미브 군에서 94%, mAb316P 군에서 92%). 에제티미브 군에서 3명의 환자 및 mAb316P 군에서 4명의 환자는 일부 주사에 대해서는 자가-주사하고, 다른 주사에 대해서는 다른 사람에게 주사하기를 요청하였다. 다른 사람에게 그들의 모든 주사를 수행하기를 요청한 환자는 없었다.
모든 무작위화 환자에는 적어도 1회 용량의 그들의 할당된 약물을 제공하였으며, 치료 의향(ITT) 및 안전성 모집단에 포함시켰다(도 2). 임의의 무작위화후 LDL-C 측정이 이루어지기 전에 각 처치군으로부터 1명의 환자를 처치로부터 빼냈으며, 그래서 치료 중 분석으로부터 배제시켰다. 그러나 그들은 연구를 계속하였으며, 비-치료 중에 그리고 24주 연구 기간의 종료 이전에 LDL-C 측정을 취하여, ITT 분석에 포함시켰다.
[표 1]
[표 2]
효능 결과
일차 효능 분석(ITT 분석)을 위하여, 기준선으로부터 제24주까지의 LDL-C의 최소-제곱(LS) 평균(SE) 감소 백분율은 mAb316P 그룹에서 47(3)%인 데 비해, 에제티미브 그룹에서 16(3)%였으며, 그룹 간의 통계적으로 유의미한 LS 평균(SE) 차이는 -32(4)%였다(P<0.0001)(표 3). 치료 중 분석으로부터의 결과는 ITT 분석으로부터의 것들과 유사하였다: 기준선으로부터 제24주까지의 LS 평균(SE) LDL-C 감소는 각각 mAb316P 및 에제티미브에서 54(2)% 대 17(2)%였다(P<0.0001)(표 3).
제12주에, mAb316P 군에서 모든 환자가 2주마다 75 ㎎을 제공받는 경우, LDL-C 수준은 ITT 분석에서, mAb316P를 사용하여 48(3)% 감소된 데 비해, 에제티미브를 사용하여 20(3)% 감소되었으며, 그룹 간의 LS 평균(SE) 차이는 -28(4)%(P<0.0001)였다. 제12주의 치료 중 분석에서의 상응하는 LDL-C 감소는 mAb316P를 사용하여 53(2)%에 비해 에제티미브를 사용하여 20(2)%였으며, 그룹 간의 LS 평균(SE) 차이는 -33(3)%였다.
도 3은 mAb316P 및 에제티미브로 처치된 환자에 대한 연구 기간에 걸친 LDL-C 수준의 변화의 시간-경과를 보여준다. 드롭 아웃에 의한 임의의 혼선 없이 약물 효과의 지속성을 이해하는 것이 목적이기 때문에, 치료 중 값이 본 명세서에 나타나 있다. mAb316P를 제공받은 환자에서 기준선으로부터 제4주까지 LDL-C의 현저한 감소가 있었으며, 강력한 LDL-C 감소가 제4주로부터 제24주의 처치 기간의 마지막까지 유지되었다. MMRM 모델에서 치료와 시점 간의 상호작용의 통계적 분석은 유의미하지 않았으며, 이는 시간에 따른 mAb316P 대 에제티미브의 LDL-저하 효과의 안정성을 시사한다(도 3에 예시된 바와 같음).
상향-적정 전에 제12주에 50% 이상의 LDL-C 감소를 갖는 환자의 추정된 비는 에제티미브 군(ITT)의 환자의 3%에 비하여 mAb316P 군에서 58%였다. 치료 중 분석에서의 상응하는 값은 mAb316P 군에서 65%이고, 에제티미브 군에서 2%였다. 모든 환자는 치료에 노출되는 동안(치료 중 모집단) mAb316P에 반응하였다(도 4).
일차 효능 파라미터에 대한, 100 ㎎/㎗ 이상 대신에 70 ㎎/㎗ 이상의 LDL-C에 기초한 상향-적정의 영향을 추정하기 위하여, 100 ㎎/㎗ 미만의 LDL-C 값을 가짐에도 불구하고 상향-적정된 13명의 환자에 대한 상향-적정 후 LDL-C 값을 배제하고, 추가의 분석을 수행하였으며; 이러한 분석은 전체 ITT 분석과 유사한 결과를 제공하였다(표 4).
Apo B, 총 콜레스테롤 및 비-HDL-C의 기준선으로부터의 감소 백분율은 제24주에 에제티미브에 비해 mAb316P에 대하여 유의미하게 더 컸으며, ITT 및 치료 중 분석에서 유사하였다(표 5). Lp(a), TG의 중등의 감소 및 HDL-C의 증가는 둘 모두의 연구 처치 후에 관찰되었으며, mAb316P 및 에제티미브 군 간에는 차이가 없었다(표 5).
하위그룹 분석에 의해, 다양한 파라미터에 대하여 ITT 모집단에서 에제티미브에 비한 mAb316P 효능에서 주요 차이가 제시되지 않았다(도 5).
[표 3]
[표 4]
[표 5]
안전성 결과
적어도 하나의 TEAE를 경험한 환자의 전체 백분율은 mAb316P 군에서 69%였고, 에제티미브 군에서 78%였다(표 6). 사망은 없었다. TEAE 기간 동안 2건의 SAE가 보고되었다: 3개월 동안 2주마다 mAb316P 75 ㎎을 제공받고, 심방 세동 및 만성 폐쇄성 폐 장애의 전력을 갖는 1명의 환자는 폐색전증을 경험하였으며; 연구 처치를 중단하고, 환자를 입원시키고, 여기서 그를 회복시켰다. 관절염의 병력을 갖는 에제티미브 군에서의 1명의 환자는 관절 미란을 경험하였으며, 수술을 위해 입원시켰다(어깨 관절성형술). 환자를 병원에서 회복시키고, 연구를 완료하였다. 조사자는 SAE 중 어느 것도 연구 처치와 관련이 있는 것으로 여겨지지 않았다. 어느 하나의 처치군에서 5% 이상의 환자에서 발생하는 TEAE는 표 6에 나타나 있다.
9명의 환자는 하나 이상의 TEAE 후에 연구 처치를 조기에 중단하였다(mAb316P 군에서 5[10%]명의 환자 및 에제티미브 군에서 4[8%]명의 환자). 에제티미브 그룹에서, 중단을 야기하는 TEAE는 1명의 환자에서의 통풍, 1명의 환자에서의 피로, 요통 및 빈뇨, 1명의 환자에서의 비정상 경련 및 주사 부위 반응 및 1명의 환자에서의 생생한 꿈이었다. mAb316P 그룹에서, 중단을 야기하는 TEAE는 1명의 환자에서의 폐색전증, 1명의 환자에서의 구역, 피로, 두통 및 홍조, 1명의 환자에서의 관절통(전신 통증), 1명의 환자에서의 주사 부위 반응 및 1명의 다른 환자에서의 설사였다.
가장 흔한 부류의 TEAE는 대개 호흡에 의한 감염이었다(42.3% mAb316P 대 39.2% 에제티미브). 근육-관련 TEAE는 mAb316P 환자 중 2명(4%) 및 에제티미브 환자 중 2명(4%)에서 발생하였다. 정상 상한의 10배가 넘는 상승된 크레아틴 키나제 수준이 에제티미브 그룹에서 1명의 환자에서 보고되었다(표 6). 3명의 환자는 국소 주사 부위 반응을 경험하였다(mAb316P 그룹에서 1[2%]명의 환자 및 에제티미브 그룹에서 2[4%]명의 환자). 이들 사례는 온건한 세기의 것이었다. mAb316P 군에서 환자는 연속 주사 후 3회의 에피소드의 국소 주사 부위 반응을 경험하였다. 2주마다 mAb316P 75 ㎎으로 처치된 3명의 환자는 적어도 1회의 25 ㎎/㎗ 미만의 LDL-C 값을 경험하였으며; 낮은 LDL-C 수준과 관련된 특정 안전성 염려는 이들 3명의 환자에서 관찰되지 않았다.
에제티미브 그룹에서 소수의(2명 이하의) 환자가 활력 징후(혈압, 심박수)의 비정상을 나타내었으며, mAb316P 그룹에서는 환자가 활력 징후(혈압, 심박수)의 비정상을 나타내지 않았다. 또한, 알라닌 아미노트랜스퍼라제 또는 아스타르트산염 아미노트랜스퍼라제에서 정상 상한의 3배를 넘는 증가가 존재하지 않았다(표 6). 에제티미브 군에서보다 mAb316P 군에서 더 많은 환자가 126 ㎎/㎗(7 mmol/ℓ) 이상의 혈당을 가졌다(6명의 환자 대 1명의 환자; 표 6). 처치 기간 동안 고혈당을 경험한 mAb316P 군의 6명의 환자는 스크리닝 또는 기준선에서 비정상 공복 혈당을 가졌으며, 스크리닝으로부터 제24주까지 혈당 또는 HbA1c의 변화에서 패턴이 관찰되지 않았다(표 7).
처치후 발생 항-약물 항체가 mAb316P 군의 6명(12%)의 환자에서 관찰되었으며, 에제티미브 군의 환자에서 관찰되지 않았다. 모든 항-약물 항체-양성 환자에 있어서, 역가가 낮았으며(사용된 검정에서 240 이하), mAb316P 약동학, LDL-C 효과 또는 안전성에 영향을 미칠 수 있는 중화 항-약물 항체가 검출되지 않았다.
[표 6]
[표 7]
이것은 mAb316P의 처음의 3상 연구, mAb316P의 처음의 단일요법 연구 및 2주마다 75 ㎎ 투여 섭생을 사용하기 위한 처음의 연구였다. mAb316P는 24주의 처치에 걸쳐 단일요법에서 에제티미브에 비하여 더 뛰어난 효능을 입증하였다. ITT 분석에서, 2주마다 mAb316P 75 ㎎을 제공받은 환자에서 제12주(상향-적정 이전)에 48%의 LDL-C 감소가 관찰되었으며, 이는 매일의 에제티미브 10 ㎎에 대한 20%와 비교된다. 치료 중인 환자에 대한 상응하는 감소는 2주마다의 mAb316P 75 ㎎에서 53%인데 반해, 에제티미브에서 20%였다.
mAb316P 효능은 LDL-C 및 PCSK9 수준을 포함하는 기준선 파라미터 및 인구 통계에 걸쳐 일관성이 있었다. 실제로, 모든 mAb316P-처치된 환자는 치료 중 분석에서 단일요법에서 2주마다의 75 ㎎에 반응하였다. mAb316P 단일요법은 제4주부터 제24주까지 지속적인 LDL-저하 효과를 보였다.
LDL-C의 현저한 감소와 일치하게, mAb316P는 또한, 총 콜레스테롤, Apo B 및 비-HDL-C의 강력한 감소를 제공하였다. mAb316P는 현 연구에서 Lp(a)의 18% 감소를 야기하였으며, 이는 에제티미브 군에서의 12%와 비교된다.
mAb316P는 에제티미브와 유사한 내약성 및 안전성을 보였다. 근육-관련 AE가 둘 모두의 처치군에서 유사한 빈도로 발생하였다(mAb316P 환자의 4% 및 에제티미브 환자의 4%). 또한, mAb316P 처치 환자에서의 항-약물 항체의 발생은 낮았다.
요약하자면, 이것은 처음 6-개월 기간, 3상, PCSK9 억제제의 맹검 평가이다. 단일요법 모집단에서 제12주에 약 50%의 LDL-C의 감소가 mAb316P 75 ㎎ Q2W 군에서 관찰되었으며, 이는 에제티미브 군에서 관찰되었던 것(20%)보다 상당히 더 컸다. 이러한 연구는 사용 및 내약성을 제한하는 것으로 보이는 안전성 신호의 증거가 없는, 2상 시험으로부터의 안전성 관찰을 포함한다. 또한, 이것은 일회용 자기주사기를 사용하는 주사 가능한 PCSK9에 대한 모노클로널 항체의 처음의 무작위화, 조절된 시험이었으며, 이는 주사 관련 AE를 거의 야기하지 않았다(mAb316P 환자의 2% 미만 및 에제티미브 환자의 4% 미만).
약동학적 결과
mAb316P 단일요법을 제공받는 환자에서 mAb316P, 유리 PCSK9 및 LDL-C 농도 간의 연관성을 평가하였다. 또한, 유리 PCSK9 및 LDL-C의 변화를 에제티미브 군에서 평가하였다.
혈청 mAb316P 및 유리 PCSK9 수준은 입증된 효소-연결 면역흡착 검정을 사용하여 결정하였다.
제12주 이전에 중단되지 않은 mAb316P 처치군의 46명의 환자에서 약동학적 분석을 행하였다(표 8). 46명의 mAb316P-처치된 환자 중에, 32명의 환자는 제8주에 70 ㎎/㎗ 미만의 LDL-C를 달성하였으며, mAb316P 75 ㎎ Q2W에서 유지하였으며, 14명의 환자를 mAb316P 150 ㎎ Q2W로 상향적정하였다.
기준선 LDL-C 수준은 비-상향적정된 mAb316P 환자에 비해 상향적정된 mAb316P 환자에서 더 컸다(P=0.044)(표 9). 비-상향적정된 그룹에서, 제4주에 관찰된 LDL-C 감소는 제24주까지 유지되었다(도 6a). 또한, 상향적정된 그룹에서, LDL-C 수준은 제4주까지 감소되었으나, 비-상향적정된 그룹보다 상대적으로 더 적은 정도로 감소되었다(도 6a). mAb316P를 사용한 LDL-C의 감소는 mAb316P 용량이 제12주에 상향적정되는지에 상관없이 제12주 및 제24주에서 유사하였으며(도 6a), 에제티미브를 사용한 것보다 지속적으로 더 높았다(표 9).
모든 환자가 75 ㎎ 용량을 제공받는 경우 혈청 mAb316P 수준은 연구의 처음 12주 동안 상향적정된 그룹 및 비-상향적정된 그룹에서 유사하였으며, 제12주에 상향적정된 환자에서 대략 2배가 되었다(도 6b; 표 9).
기준선 유리 및 총 PCSK9 수준은 비-상향적정된 그룹 및 에제티미브 그룹에 비해 상향적정된 그룹에서 약간 더 컸다(표 9). 유리 PCSK9 수준은 비-상향적정된 그룹에서 제4주에 최저점에 도달하였으며; 유리 PCSK9 수준은 또한 상향적정된 그룹에서 제4주 내지 제12주에 감소되었으나, 비-상향적정된 그룹에서보다 2 내지 3배 더 높았다(도 6c; 표 9). 제12주에 mAb316P 150 ㎎ Q2W로의 상향적정은 추가의 유리 PCSK9 수준의 억제와 관련이 있었으며; 감소는 제24주까지 유지되었다(도 6c; 표 9). 유리 PCSK9 수준은 에제티미브 그룹에서 기준선으로부터 제12주까지 상대적으로 변하지 않고 유지되었으나, 제24주에 감소되었다(표 9). mAb316P로의 처치 후에 총 PCSK9 수준이 증가하였으나, 에제티미브로의 처치 후에는 그렇지 않았는데(표 9), 이는 아마도 항체:PCSK9 복합체가 유리 PCSK9보다 더 긴 반감기를 갖기 때문이었을 것이다.
제24주까지 mAb316P 75 ㎎ Q2W 단일요법으로 유지된 환자에서, 유리 PCSK9 수준은 제4주까지 최대로 감소되었으며; LDL-C 저하 효능은 제4주로부터 제24주까지 유지되었다. 제12주에 mAb316P 150 ㎎ Q2W로 상향적정된 환자에서, 예상된 바와 같이 mAb316P 혈청 농도가 증가하였으며, 유리 PCSK9 수준의 추가의 감소가 존재하였으나, LDL-C에 추가의 효과가 거의 없었다. 결과는 mAb316P 75 ㎎ Q2W를 사용한 단일요법이 스타틴 또는 다른 지질 변형 치료법을 제공하지 않은 대부분의 환자에서 24주에 걸쳐 유리 PCSK9를 차단하고 LDL-C 저하 효능을 유지하는데 충분함을 시사한다. mAb316P의 표적-매개의 제거가 유리 PCSK9로의 그의 결합에 의해 가속화되기 때문에, 환자가 동시 스타틴 또는 유리 PCSK9를 증가시키는 다른 지질 변형제를 제공받고 있는 임상 환경에서 더 높은 용량의 mAb316P가 필요할 수 있다.
본 발명은 본 명세서에 기재된 특정 구현예에 의해 범주가 제한되지 않는다. 실제로, 본 명세서에 기재된 것들에 더하여 본 발명의 다양한 변형이 전술한 설명 및 첨부된 도면으로부터 당업자에게 명백해질 것이다. 그러한 변형은 첨부된 청구범위의 범주 내에 속하는 것으로 의도된다.
[표 8]
[표 9]
실시예
3:
스타틴에
불내약성
인
원발성 고콜레스테롤혈증이 있는
환자에서의
항-PCSK9 항체("
mAb316P
")의 효능 및 안전성의
무작위화
, 이중-
맹검
연구
도입
본 연구의 목적은 스타틴에 불내약성인 원발성 고콜레스테롤혈증(heFH 및 비-FH)이 있는 환자에서 LDL-C를 감소시키는 항-PCSK9 항체(REGN727 또는 알리로쿠맙으로도 알려져 있는 "mAb316P")의 능력을 에제티미브(EZE)에 비해 평가하는 것이었다.
높은 치료 고수 및 스타틴 내약성을 갖는 고도로 선택된 환자 그룹을 수반하는 임상 시험에서 근육-관련 증상은 관찰 연구에서의 결과에 의해 입증되는 바와 같이 임상에서 근육통의 실제 유병률에 영향을 미치지 않을 수 있다. 근육-관련 유해 사례(AE)의 발생의 차이는 다중의 약제를 사용하는 AE를 경험한 일부 환자에게 부차적일 수 있으며, 이는 스타틴에 대한 진정의 불내약성을 나타내지 않을 수 있다. 따라서, 다수의 약제에 AE를 가질 수 있고, 이제 막 스타틴을 복용 중이 아닌 환자를 설명하기 위하여, 충분한 수의 환자를 스크리닝하고 본 연구의 단일-맹검 위약 도입(run-in) 기간에 등록시켜, 250명 환자의 이중-맹검 처치 기간 시료 크기를 보장하였다(100:100:50; mAb316P:EZE:아토르바스타틴).
24주의 이중-맹검 연구 처치 기간을 사용하는 250명의 환자(100:100:50; mAb316P:EZE:아토르바스타틴)의 시료 크기는 효능에 대한 정보를 수득하고, 일반적으로 안전성 사례, 모든 골격근-관련 사례 및 특히 골격근 사례-관련 중단이 있는 서술적 경험을 얻으려는 의도였다. 중등의, 높은 또는 매우 높은 CV 위험이 있는 스타틴 불내약성 환자를 LDL-C 목표 달성이 비-스타틴 대안만을 사용하는 경우 달성되기 더욱 어려운 모집단으로서 본 연구에 포함시켰다. CV 위험의 정의는 기존의 지침에 기초한다(예를 들어, 문헌[The Task Force for the management of dyslipidaemias of the European Society of Cardiology [ESC] and the European Atherosclerosis Society [EAS], ESC/EAS Guidelines for the management of dislipidaemias. European Heart Journal 2011; 32:1769-1818)]; 문헌[Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive summary of the Third Report of the National Cholesterol Education Program [NCEP] Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults [Adult Treatment Panel III], JAMA 2001; 285:2486-2497] 참조).
2주 휴약 기간의 사용에 의해, 비교군에 대한 백그라운드 치료법의 이월 효과가 존재하지 않았음을 보장하였다.
4주 위약 도입 기간을 사용하여 위약을 포함하는 다른 약제에 대한 근육-관련 증상이 발생할 수 있는 환자를 배제하였다.
mAb316P의 2상 연구로부터의 예비 약동학 데이터에 의해, mAb316P로의 노출이 이중-맹검 처치 기간 후의 8주 추적 기간 동안 감소된 것으로 나타났으며, mAb316P의 총 혈청 농도는 여전히 검출 가능하였지만, 매우 낮은 수준이었다. 따라서, 충분히 낮은 효율적이지 않은 혈청 mAb316P 농도를 보장하기 위하여, 환자를 8주의 추적 기간(즉, 마지막 투여 후 10주) 동안 추적하였다.
에제티미브는 스타틴에 불내약성인 환자에 대한 현재의 관리 표준이기 때문에, 그를 활성 비교제로 사용하였으며, 연구의 일차 목적은 24주 후에, EZE에 비하여 mAb316P에 대한 LDL-C의 감소를 평가하기 위한 것이었다. 또한, 골격근-관련 AE로 인한 중단의 발생률 및 빈도를 평가함으로써, 아토르바스타틴을 연구에서 선택되는 모집단이 실제로 스타틴 불내약성인 모집단인 것을 결정하기 위한 비교제로 포함시켰다(문헌[Fung and Crook, Cardiovasc. Ther. 2012 Oct, 30(5):e212-218]).
2가지 용량의 mAb316P를 본 연구에 사용하였다: 격주로(Q2W) 피하 투여되는 75 ㎎ 및 150 ㎎. 용량의 선택은 1상 및 2상 프로그램으로부터의 데이터에 기초하였다. 또한, 용량, 투여 빈도 및 상향-적정 방법의 선택은 CVD 감소에 관하여 최적의 이익을 제공하는데 필요한 LDL-C 감소 및 낮은 LDL-C 값에 관한 잠재적인 안전성 고려사항에 기초하였다.
Q2W 투여 섭생은 투여 사이 간격 내내 일정한 LDL-C 저하를 유지하는 것으로 예상되며, 제12주의 최대 효능은 2주마다의 150 ㎎ 용량에 의해 제공된다. 그러나 많은 환자에 있어서, 2주마다의 150 ㎎ 용량으로 관찰되는 효과의 세기는 LDL-C 목표를 달성하는데 필요하지 않을 수 있으며, 처치는 더 낮은 용량으로 시작할 수 있다. 따라서, 본 연구에서, 모든 환자를 처음에 2주마다 75 ㎎으로 처치하고, 8주의 처치 후에 높은 및 매우 높은 CV 위험 및 70 ㎎/㎗ 이상의 LDL-C가 있는 환자 및 중등의 CV 위험 및 100 ㎎/㎗ 이상의 LDL-C를 갖는 환자만을 제12주에 2주마다 150 ㎎으로 용량 상향-적정으로 처리하였다.
본 연구의 시작 시에 이용 가능한 임상 데이터에 기초하여, mAb316P로의 처치에 의해 유의미한 LDL-C 저하 효과가 입증되었으며, 비-가족성 고콜레스테롤혈증이 있거나 이형접합 가족성 고콜레스테롤혈증이 있는 환자 모집단에서 일반적으로 널리 내약성이 있었다. LDL-C 저하에 대한 효능은 총-C, ApoB, 비-HDL-C 및 ApoB/ApoA-1 비의 일정한 결과, 및 HDL-C, TG 및 Lp(a)에 대한 긍정적인 경향과 관련이 있었다. mAb316P가 다른 심혈관(CV) 위험 인자, 예를 들어, 체중, 혈압, 글루코스 또는 C-반응성 단백질에 불리하게 영향을 미친다는 증거가 없었다.
연구 목적
연구의 일차적 목적은 스타틴에 불내약성이었던 원발성 고콜레스테롤혈증(heFH 및 비-FH)이 있는 환자에서 24주 후에 하루에 1회 경구의 EZE 10 ㎎에 비하여 mAb316P에 의한 LDL-C의 감소를 입증하는 것이었다.
연구의 이차 목적은 (1) 12주의 처치 후에 EZE에 비한 mAb316P 75 ㎎의 LDL-C에 대한 효과를 평가하는 것; (2) 다른 지질 파라미터(예를 들어, ApoB, 비-HDL-C, 총-C, Lp(a), HDL-C, TG 수준 및 ApoA-1 수준)에 대한 mAb316P의 효과를 평가하는 것; (3) 골격근-관련 AE의 발생률 및 처치 중단율의 특성화를 포함하여, mAb316P의 안전성 및 내약성을 평가하는 것; 및 (4) 항-mAb316P 항체의 발생을 평가하는 것이었다.
연구 설계
본 연구는 스타틴에 불내약성인, 원발성 고콜레스테롤혈증 및 중등의, 높은 또는 매우 높은 CV 위험이 있는 환자에서의 무작위화, 이중-맹검, 이중-위약, 활성-조절된, 병행-그룹, 다국가, 다기관 연구였다. 연구 설계는 도 7에 예시되어 있다.
스타틴 불내약성은 스타틴 치료법 동안 시작되거나 증가하고, 스타틴 치료법을 중단하는 경우 중지되는 염좌 또는 외상으로 인한 것들 외의 골격근-관련 증상, 예를 들어, 통증, 아픔, 쇠약 또는 경련으로 인하여 승인된 가장 낮은 1일 용량에서 적어도 2회의 이전의 스타틴을 용인할 수 없는 것으로 정의되었다.
연구는 5가지 기간으로 이루어졌다: 스크리닝; 휴약; 단일 맹검 위약 도입; 이중-맹검 처치; 및 추적.
(1) 스크리닝:
스크리닝은 대략 1주 지속되었다(제-7주). 환자에게 스크리닝 시에 시작하여 처치 방문의 마지막까지 연구의 기간 내내 미국 국립 콜레스테롤 교육 프로그램 성인 치료 패널 III(NCEP-ATP III) 치료적 생활양식 변화(TLC) 식이와 동등한 안정적인 식이를 진행하도록 요청하였다.
(2) 휴약 :
모든 스크리닝 포함 및 배제 기준을 충족시키는 환자를 EZE, 스타틴(승인되지 않은 용량 또는 섭생을 취하는 환자에 대한) 및 홍국의 2주(제-6주 내지 제-4주) 휴약 기간에 참여시켰다.
(3) 단일- 맹검 위약 도입:
휴약 후에, 환자를 mAb316P에 대한 위약 Q2W(총 2회 용량) + EZE/아토르바스타틴에 대한 위약 캡슐 PO QD(28회 용량)로의 4주의 처치로 이루어진 4주(제-4주 내지 제0주), 단일-맹검(오직 환자만이 처치를 모른다) 위약 도입 기간에 참여시켰다.
단일-맹검 위약 도입 기간 동안 염좌 또는 외상으로 인한 것들 이외의 골격근-관련 AE를 경험하지 않은 환자만이 하기 기재된 이중-맹검 처치 기간에 참여할 자격이 있었다.
4주 단일-맹검 위약 도입 기간 동안 염좌 또는 외상으로 인한 것들 이외의 골격근-관련 AE를 경험한 환자는 치료법을 중지하고 연구를 중단하도록 지시하였다.
단일-맹검 위약 도입 기간(제-4주)의 처음 예정된 방문 시에, 환자(또는 그들의 케어기버(Caregiver))에게 mAb316P에 대한 위약을 함유하는 단일-맹검 자기-주사기를 사용한 연구 약물의 투여를 지시하고, 진료소에서 제1 용량(제-4주)을 자가-투여하였다. 단일-맹검 위약 도입 기간(제-2주) 동안 제2 용량의 연구 약물을 가정에서 mAb316P에 대한 위약의 제2 단일-맹검 자기-주사기를 사용하여 환자 또는 케어기버가 투여하였다. 환자는 위약 도입 기간 동안 4주 동안 EZE/아토르바스타틴에 대한 위약 캡슐을 1일 1회 취하였다.
(4) 이중- 맹검 처치:
모든 포함 기준을 충족시키고, 4주 단일-맹검 위약 도입 기간 동안 염좌 또는 외상에 기인한 것 이외의 골격근-관련 AE를 경험한 적이 있는 것을 포함하는 배제 기준 중 어느 것도 충족시키지 않는 환자를 (A) mAb316P 75 ㎎ SC Q2W + EZE/아토르바스타틴에 대한 위약 PO QD; 또는 (B) EZE 10 ㎎ PO QD + mAb316P에 대한 위약 SC Q2W; 또는 (C) 아토르바스타틴 20 ㎎ PO QD + mAb316P에 대한 위약 SC Q2W 중 어느 하나를 제공받도록 무작위화시켰다.
10 ㎎의 에제티미브 및 20 ㎎의 아토르바스타틴을 캡슐에 오버-캡슐화시켜, 위약을 EZE/아토르바스타틴에 일치시켜, 이중-맹검을 보장하였다. 10 ㎎의 에제티미브, 20 ㎎의 아토르바스타틴 및 위약은 서로 구별 가능하지 않았다.
무작위화를 문서화된 심근경색(MI) 또는 허혈성 뇌졸중의 전력에 의해 계층화시켰다(예/아니오).
이중-맹검 처치 기간 동안 처음의 주사를 무작위화 일에(제0주[제1일] - 제4 방문) 및 연구로의 무작위화를 위한 상호 음성 반응 시스템(IVRS)/상호 웹 반응 시스템(IWRS)으로의 호출 후에 가능한 한 빨리 상기 장소에서 투여하였다. 이후의 주사를 환자가 선호하는 장소(예를 들어, 집 또는 작업장)에서 환자(자가-주사) 또는 지정된 케어기버(배우자, 친인척 등)가 투여하였다. 환자가 2주마다 상기 장소로 되돌아가서 연구 인원이 투여하는 것을 선택하게 하였다. mAb316P로 무작위화된 환자는 무작위화로부터 제12주(제0주, 제2주, 제4주, 제6주, 제8주 및 제10주)까지 75 ㎎의 연구 약물을 제공받았다.
제12주 방문 시에, 제8주의 그들의 LDL-C 및 기준선 CV 위험(본원의 다른 곳에 정의됨)에 기초하여, 환자에게 2주마다 mAb316P 75 ㎎을 계속 제공하거나 하기와 같이 그들의 용량을 상향-적정하였다:
(A) 매우 높은 CV 위험이 있는 환자는 맹검 방식으로 (i) 그들의 제8주 LDL-C가 70 ㎎/㎗(1.81 mmol/ℓ) 미만이었다면, 제12주로부터 제22주의 마지막 주사까지 2주마다 mAb316P 75 ㎎을 계속 제공하거나; (ii) 그들의 제8주 LDL-C가 70 ㎎/㎗(1.81 mmol/ℓ) 이상이었다면, 제12주부터 제22주의 마지막 주사까지 2주마다 mAb316P 150 ㎎으로 상향-적정된 용량을 제공하였다.
(B) 높은 또는 중등의 CV 위험이 있는 환자는 맹검 방식으로 (i) 그들의 제8주 LDL-C가 100 ㎎/㎗(2.59 mmol/ℓ) 미만이었다면, 제12주로부터 제22주의 마지막 주사까지 2주마다 mAb316P 75 ㎎을 계속 제공하거나; (ii) 그들의 제8주 LDL-C가 100 ㎎/㎗(2.59 mmol/ℓ) 이상이었다면, 제12주부터 제22주의 마지막 주사까지 2주마다 mAb316P 150 ㎎으로 상향-적정된 용량을 제공하였다.
(5) 추적:
환자를 이중-맹검 처치 기간의 마지막 후 또는 연구 처치의 조기 중단 후 8주의 기간 동안 추적하였다.
연구 내내:
환자에게 연구 내내 그들의 백그라운드 지질 변형 치료법(LMT)(EZE, 스타틴, 홍국 및 피브레이트[페노피브레이트 외에] 제외)을 계속 취하도록 지시하였다.
허용된 LMT는 (적용 가능하다면) 우선적인 관심사(중앙 연구소에 의해 보고되는 TG 경고를 포함하나 이에 한정되지 않음)가 조사관의 판단에 따라 그러한 변화를 타당하게 만드는 이례 상황을 제외하고 스크리닝으로부터 처치 방문의 마지막 내내 안정적이었다(용량 포함).
환자마다 최대 연구 기간은 대략 최대 39주(9개월)였다: 스크리닝을 위해 최대 1주; 휴약을 위해 2주; 단일-맹검 위약 도입을 위해 4주; 이중-맹검 처치를 위해 24주; 및 8주의 추적. 연구의 마지막을 프로토콜에 따라 예정된 바와 같이 마지막 환자의 마지막 장소 방문으로 정의하였다.
환자 선택
충분한 수의 환자를 스크리닝하고, 단일-맹검 위약 등록 기간에 참여시켜, 적어도 250명의 환자(100:100:50; mAb316P:EZE:아토르바스타틴)가 이중-맹검 처치 기간에서 무작위화되기에 적격하게 보장하였다.
연구 모집단: 연구 모집단은 스타틴에 불내약성이었던 고콜레스테롤혈증(heFH 또는 비-FH) 및 중등의, 높은 또는 매우 높은 CV 위험이 있는 환자로 이루어진다. 중등의 CV 위험은 1 이상 및 5% 미만의 계산된 10년 내 치명적 심혈관 질병 위험 SCORE로 정의되었다(ESC/EAS 2011). 높은 CV 위험은 5% 이상의 계산된 10년 내 치명적 CVD 위험 SCORE(ESC/EAS 2011), 중등의 만성 신장 질병(CKD), 표적 기관 손상이 없는 1형 또는 2형 당뇨병, 또는 heFH로 정의되었다. 매우 높은 CV 위험은 문서화된 CHD, 허혈성 뇌졸중, 말초 동맥 질병(PAD), 일과성 허혈 발작(TIA), 복부대동맥류, 증상이 없는 50% 초과의 경동맥 폐색, 경동맥내막절제술 또는 경동맥 스텐트 수술, 신장 동맥 협착, 신장 동맥 스텐트 수술, 표적 기관 손상이 있는 1형 또는 2형 당뇨병의 전력으로 정의되었다.
문서화된 CHD의 전력은 다음 중 하나 이상의 발생으로 정의되었다: (i) 급성 MI; (ii) 무증상 MI; (iii) 불안정협심증; (iv) 관상동맥재개통술(예를 들어, 경피적 관상동맥중재술[PCI] 또는 관상동맥 우회술[CABG]); 및/또는 (v) 침습적 또는 비-침습적 시험(예를 들어, 관상동맥 조영술, 트레드밀을 사용한 부하 시험, 부하 심초음파 또는 핵 영상화)에 의해 진단되는 임상적으로 유의미한 CHD.
포함 기준: 본 연구에 적격하기 위하여, 환자는 중등의, 높은 또는 매우 높은 심혈관 위험 및 스타틴 불내약성의 전력과 함께 원발성 고콜레스테롤혈증(heFH 또는 비-FH)을 가져야 한다.
heFH의 진단을 유전자형 검사에 의해 또는 임상 기준에 의해 행하였다. 유전자형 분석되지 않은 환자에 있어서, 임상 진단이 확정/특정 진단일 필요가 있으며, 시몬 브룸(Simon Broome) 기준 또는 WHO/네덜란드 지질 네트워크 기준 중 어느 하나에 기초할 수 있다. 중등의, 높은 및 매우 높은 CV 위험은 상기 정의된 바와 같았다.
스타틴 불내약성의 정의: 스타틴 치료법 동안 시작되거나 증가되며, 스타틴 치료법이 중단된 경우 중지되는 염좌 또는 외상으로 인한 것들 이외의 골격근-관련 증상, 예를 들어, 통증, 아픔, 쇠약 또는 경련으로 인하여, 승인된 가장 낮은 1일의 용량의 적어도 2회의 이전의 스타틴을 용인할 수 없음.
배제 기준: 하기의 기준(하기에서 항목 A, B 및 C 하에 하위분류) 중 임의의 것을 만족시키는 예상되는 환자를 연구에서 배제시켰다:
A. 연구 방법과 관련된 배제 기준:
1. 스크리닝 방문(제-7주) 시에 70 ㎎/㎗(1.81 mmol/ℓ) 미만의 계산된 혈청 LDL-C 및 매우 높은 CV 위험(본원의 다른 곳에 정의된 바와 같음);
2. 스크리닝 방문(제-7주) 시에 100 ㎎/㎗(2.59 mmol/ℓ) 미만의 계산된 혈청 LDL-C 및 높은 또는 중등의 CV 위험(본원의 다른 곳에 정의된 바와 같음);
3. 스크리닝 방문(제-7주) 시에 1% 미만의 10년 내 치명적 CVD 위험 SCORE;
4. 스크리닝 방문(제-7주) 이전 4주 내에 승인된 가장 낮은 1일 용량의 또는 그를 초과하는 스타틴의 이용;
5. 4주 단일-맹검 위약 도입 동안 염좌 또는 외상으로 인한 것들 외의 골격근-관련 유해 사례(AE) 경험;
6. 스크리닝 시에(제-7주), 단일-맹검 위약 도입 기간의 시작 시에(제-4주) 또는 제1일/제0주에 염좌 또는 외상으로 인한 것들 외의 골격근-관련 AE(들) 경험;
7. 적용 가능한 경우 스크리닝 방문(제-7주) 이전 또는 적용 가능한 경우 스크리닝으로부터 무작위화까지 적어도 4주 동안 안정한 용량의 지질 변형 치료법(LMT) 및/또는 적어도 6주 동안 페노피브레이트가 진행 중이 아님;
8. 스크리닝 방문(제-7주) 6주 이내의 페노피브레이트 이외의 피브레이트의 이용;
9. 스크리닝 방문(제-7주) 이전 또는 스크리닝 방문과 무작위화 방문 사이에 적어도 4주 동안 안정적이지 않은 용량/양에서 지질에 영향을 미치는 것으로 알려져 있는 기능식품 또는 일반의약 치료법의 이용;
10. 스크리닝 방문(제-7주)으로부터 연구 방문의 마지막(제32주)까지의 홍국의 이용;
11. 용량이 스크리닝 방문으로부터 연구 방문의 마지막(제32주)까지 안정적인 것으로 계획되지 않은 진통제의 이용;
12. 섬유근육통의 진단;
13. 중증의 신경병증성 통증의 전력;
14. 스타틴 불내약성의 증상과 혼동될 수 있는 증상과 관련된 류마티스 질병의 전력(예를 들어, 류마티스 관절염);
15. 스타틴 치료법 이외의 LMT로의 처치 동안 시작되거나 증가되며 LMT가 중단되는 경우 중지되는 근육통 또는 근육병증의 전력;
16. 알려져 있는 발작 장애의 전력;
17. 이전의 이식 수술의 전력;
18. 연구 동안 근육내 투여 또는 계획된 근육내 주사를 필요로 하는 약제의 이용;
19. 스타틴-관련 근육병증 이외의 알려져 있는 근육병증의 전력;
20. 횡문근융해증의 전력(크레아틴 키나제가 10,000 IU/ℓ 초과인 기관 손상의 증거로 정의됨);
21. 혈청 지질 또는 지질단백질에 영향을 미치는 것으로 알려져 있는 임의의 임상적으로 유의미한 비조절된 내분비 질병의 존재[주의: 티록신의 투여량이 스크리닝 이전 적어도 12주 동안 안정적이며, 스크리닝 방문(제-7주) 시에 갑상선-자극 호르몬(TSH) 수준이 중앙 연구소의 정상 범위 이내라면, 갑상선 대체 요법이 진행 중인 환자가 포함될 수 있다];
22. 스크리닝 방문(제-7주) 이전 12개월 내의 비만대사 수술의 전력;
23. 스크리닝 방문(제-7주) 이전 2개월 내의 불안정한 체중(5 ㎏ 초과의 변동);
24. 알려져 있는 PCSK9의 기능의 소실(예를 들어, 유전적 돌연변이 또는 서열 변이)의 전력;
25. 알려져 있는 동형접합 FH의 전력;
26. 새로 진단된(무작위화 방문[제0주/제1일] 이전 3개월 이내) 당뇨병 또는 불량하게 조절되는(8.5% 초과의 헤모글로빈 A1c[HbA1c]) 당뇨병;
27. 무작위화 이전 적어도 6주 동안 안정적인 섭생을 사용한 뇌하수체/부신 질병에 대한 대체 요법으로 사용되지 않는 한, 전신 코르티코스테로이드의 이용. 주의: 국소, 관절내, 경비, 흡입형 및 안과용 스테로이드 치료법은 "전신"으로 간주되지 않으며, 허용된다;
28. 스크리닝 방문(제-7주) 이전 6주에 섭생이 안정적이고, 연구 동안 섭생을 변경할 계획이 없는 경우 외에, 에스트로겐 또는 테스토스테론 요법의 이용;
29. 스크리닝 방문(제-7주) 이전 2개월 이내의 혈장분리교환술 처치를 겪은 전력 또는 연구 동안 혈장분리교환술을 수행할 계획;
30. 스크리닝 방문(제-7주) 시에 또는 무작위화(제0주/제1일) 시에 160 mm Hg 초과의 수축기 혈압 또는 100 mm Hg 초과의 확장기 혈압;
31. 심근경색증(MI), 입원을 야기하는 불안정협심증, 관상동맥 우회술(CABG), 경피적 관상동맥중재술(PCI), 조절되지 않은 심부정맥, 경동맥 수술 또는 스텐팅, 뇌졸중, 일과성 허혈 발작, 경동맥 재관류술, 스크리닝 방문(제-7주) 이전 3개월 이내의 말초 혈관 질병을 위한 혈관내 수술 또는 외과적 중재술의 전력;
32. 현재 재활 또는 운동 프로그램에 참여 중인 환자;
33. 지난 12개월 내의 뉴욕 심장 학회 분류 III 또는 IV 심부전의 전력;
34. 스크리닝 방문(제-7주) 시의 18세 또는 법정 성년 연령 중 어느 쪽이든 더 큰 연령 미만의 연령;
35. 스크리닝 방문(제-7주) 전에, 콜레스테롤-저하 식이가 이전에 지시되지 않음;
36. 알려져 있는 출혈성 뇌졸중의 전력;
37. 적당하게 처치된 기저 세포 피부암, 편평세포 피부암 또는 동소 자궁경부암을 제외하고, 지난 5년 이내의 암의 전력;
38. 알려져 있는 HIV 양성의 전력;
39. 1개월 또는 5 반감기, 어느 것이든 더 긴 기간 이내의 임의의 활성 조사 약물의 이용;
40. mAb316P(알리로쿠맙) 또는 임의의 다른 항-PCSK9 모노클로널 항체의 임의의 임상 시험의 이전의 참여;
41. 질환/상황, 예를 들어, (A) 시험자 또는 임의의 시험담당자의 판단 하에, 연구의 안전한 완료를 불가능하게 하거나 종점 평가를 제한할, 스크리닝 시에 확인된 임의의 임상적으로 유의미한 비정상; 예를 들어, 주요 전신 질병, 짧은 기대 수명이 있는 환자; (B) 시험자 또는 임의의 시험담당자에 의해, 임의의 이유로 이러한 연구에 부적절한 것으로 여겨짐, 예를 들어, (i) 특정 프로토콜 요건, 예를 들어, 예정된 방문을 충족시킬 수 없는 것으로 여겨짐; (ii) 환자 또는 시험자에 따라 장기간 주사를 투여하거나 용인할 수 없는 것으로 여겨짐; (iii) 프로토콜의 수행 등에 직접 연루되는 시험자 또는 임의의 시험담당자, 약사, 연구 코디네이터, 다른 연구 스태프 또는 그의 관계자 등; (iv) 시험자가 연구 기간 동안 환자의 참여를 제한하거나 한정할 것으로 느끼는, 실제의 또는 예상되는 임의의 다른 조건(예를 들어, 지리학, 사회학)의 존재;
42. 스크리닝 기간 동안의 실험실 결과(무작위화 실험을 포함하지 않음): (A) B형 간염 표면 항원 및/또는 C형 간염 항체에 대한 양성 시험; (B) 가임 여성에서 양성의 혈청 베타-hCG 또는 소변 임신 검사; (C) 400 ㎎/㎗ 초과(3.95 mmol/ℓ 초과)의 TG(1회의 반복 검사가 허용됨); (D) 4-변량 MDRD 연구 식에 따라 30 ㎖/분/1.73 m2 미만의 eGFR(중앙 연구소에 의해 계산); (E) 정상 상한(ULN) 3배 초과의 알라닌 아미노트랜스퍼라제(ALT) 또는 아스파르트산염 아미노트랜스퍼라제(AST)(1회 반복 검사가 허용됨); (F) ULN 2배 초과의 CPK; (G) 정상 하한(LLN) 미만 또는 중앙 연구소의 ULN 초과의 TSH; (H) 20 ng/㎖[50 nmol/ℓ] 미만의 비타민 D3;
B. 활성
비교제
또는 다른 연구 약물과 관련된 배제 기준:
43. 다른 연구 약물(아토르바스타틴 및 EZE)에 대한 모든 금기 또는 각각의 국가 제품 표시에 나타낸 바와 같은 사용 경고/주의(적절한 경우);
C. 활성제(
mAb316P
)와 관련된 배제 기준:
44. 알려져 있는 모노클로널 항체 치료제에 대한 과민증;
45. 임산부 또는 수유중인 여성;
46. 효율적인 산아 제한 피임 방법을 사용하지 않고/거나 임신에 대하여 시험하려고 하지 않거나 그에 대하여 시험할 수 없는 가임 여성.
조기에 연구를 중단한 환자를 대체하지 않았다.
연구 처치
연구 처치는 자기-주사기에 제공되고, 복부, 넓적다리 또는 상박의 외측 영역에 투여되는 75 또는 150 ㎎ 용량의 mAb316P 또는 위약에 대한 1 ㎖의 단일의 피하(SC) 주사였다. 이중-맹검 처치 기간(제0주 내지 제24주) 동안, 자격이 있는 환자를 (1) mAb316P 75 ㎎, SC, 2주마다 1회(Q2W) + 에제티미브(EZE)/아토르바스타틴에 대한 위약, 경구, 1일 1회(PO QD); 또는 (2) EZE 10 ㎎ PO QD + mAb316P에 대한 위약 SC Q2W; 또는 (3) 아토르바스타틴 20 ㎎ PO QD + mAb316P에 대한 위약 SC Q2W를 제공받도록 무작위화시켰다.
10 ㎎의 에제티미브 및 20 ㎎의 아토르바스타틴을 캡슐에 오버-캡슐화시켜, 위약을 EZE/아토르바스타틴에 일치시켜, 이중-맹검을 보장하였다. 10 ㎎의 에제티미브, 20 ㎎의 아토르바스타틴 및 위약은 서로 구별 가능하지 않았다. 연구 약물을 제0주에 시작하고, 마지막 주사(제22주), 이중-맹검 처치 기간의 마지막 이전 2주까지 계속하여, 2주마다 피하 주사에 의해 투여하였다.
이중-맹검 연구 약물의 처음의 주사를 환자를 연구로 무작위화시킨 후에 가능한 한 빨리 진료 장소에서 투여하였다. 환자를 처음의 주사 후 30분 동안 진료 장소에서 관찰하였다. 환자/케어기버가 투여 스케쥴에 따라 진료소의 외부에서 이후의 주사를 투여하였다. 임상 연구 방문이 투여와 일치하는 날에, 연구 약물의 용량을 모든 연구 평가를 수행하고, 모든 실험실 시료를 수집한 후에 투여하였다.
연구 약물을 이상적으로 당일의 대략 동일한 시간에 2주마다 피하 투여하였지만; ±3일의 윈도우 기간을 갖는 것이 허용 가능한 것으로 여겨졌다. 상기 하루 중 시간은 환자의 선호에 기초하였다.
주사가 7일을 초과하여 지연되거나 그를 완전히 거른 사례에서, 환자에게 추가의 주사를 투여하지 않고, 원래의 연구 약물 투여의 스케쥴로 복귀하도록 지시하였다. 지연이 거른 날로부터 7일 이하였다면, 환자에게 지연된 주사를 투여한 다음, 원래의 투여 스케쥴을 재개하도록 지시하였다. 연구 장소 스태프가 주사를 투여하고, 그들의 주사를 위하여 2주마다 상기 장소로 오는 것을 환자가 선택하도록 허용하였다. EZE/아토르바스타틴에 대한 위약, EZE 10 ㎎ 또는 아토르바스타틴 20 ㎎ 캡슐을 1일 1회 경구로 취하였다. 연구 약물의 수송, 저장, 제제 및 투여에 대한 상세한 설명서는 상기 장소에 의해 환자/케어기버에게 제공될 것이다.
용량 변형("상향-적정 선택")
제12주 방문 시에, 제8주의 그들의 LDL-C 및 기준선 CV 위험(본원의 다른 곳에 정의됨)에 기초하여, 환자에게 2주마다 mAb316P 75 ㎎을 계속 제공하거나 하기와 같이 그들의 용량을 상향-적정하였다:
(A) 매우 높은 CV 위험이 있는 환자는 맹검 방식으로 (1) 그들의 제8주 LDL-C가 70 ㎎/㎗(1.81 mmol/ℓ) 미만이었다면, 제12주로부터 제22주의 마지막 주사까지 2주마다 mAb316P 75 ㎎을 계속 제공하거나; (2) 그들의 제8주 LDL-C가 70 ㎎/㎗(1.81 mmol/ℓ) 이상이었다면, 제12주부터 제22주의 마지막 주사까지 2주마다 mAb316P 150 ㎎으로 상향-적정된 용량을 제공하였다.
(B) 높은 또는 중등의 CV 위험이 있는 환자는 맹검 방식으로 (1) 그들의 제8주 LDL-C가 100 ㎎/㎗(2.59 mmol/ℓ) 미만이었다면, 제12주로부터 제22주의 마지막 주사까지 2주마다 mAb316P 75 ㎎을 계속 제공하거나; (2) 그들의 제8주 LDL-C가 100 ㎎/㎗(2.59 mmol/ℓ) 이상이었다면, 제12주부터 제22주의 마지막 주사까지 2주마다 mAb316P 150 ㎎으로 상향-적정된 용량을 제공하였다.
주사 훈련
단일-맹검 위약 도입 기간의 처음의 예정된 방문(제-4주) 동안 환자에게 mAb316P에 대한 위약을 함유하는 단일-맹검 자기-주사기를 사용한 연구 약물의 투여를 지시하고, 진료소에서 제1 용량을 자가-투여하였다. 단일-맹검 위약 도입 기간(제-2주) 동안 제2 용량의 연구 약물을 가정에서 mAb316P에 대한 위약의 제2 단일-맹검 자기-주사기를 사용하여 환자 또는 케어기버에 의해 투여하였다.
이중-맹검 처치 기간 동안 처음의 주사를 키트 유래의 자기-주사기를 사용하여 환자가 무작위화되는 무작위화 일에(제0주[제1일] - 제4 방문) 및 연구로의 무작위화 후에 가능한 한 빨리 상기 장소에서 투여하였다. 이후의 주사를 환자(자가-주사) 또는 지정된 케어기버가 투여하거나, 환자는 주사가 연구 인원에 의해 투여되도록 2주마다 상기 장소로 되돌아오는 선택을 가졌다. 연구 약물을 주사하도록 계획된 모든 환자 또는 케어기버는 주사를 투여하기 이전에 연구 스태프가 훈련하였다.
조사 처치
멸균 mAb316P 약제품을 자기-주사기 내에, 히스티딘, pH 6.0, 폴리소르베이트 20 및 수크로스 중 75 ㎎/㎖ 또는 150 ㎎/㎖의 농도로 공급하였다. mAb316P와 일치하는 위약을 자기-주사기에서 단백질의 첨가 없이 mAb316P와 동일한 제형으로 공급하였다. 에제티미브 10 ㎎ 및 아토르바스타틴 20 ㎎을 캡슐에 오버-캡슐화시켜, 위약을 EZE/아토르바스타틴에 일치시키고, 이중-맹검을 보장하였다. 에제티미브 10 ㎎, 아토르바스타틴 20 ㎎ 및 위약은 서로 구별 가능하지 않았다.
백그라운드 처치
환자에게 스크리닝 방문(제-7주) 이전 적어도 4주 동안(페노피브레이트에 대하여 6주) 안정한 LMT에 있도록 요청하였다. 환자에게 연구 내내 그들의 백그라운드 LMT(EZE, 스타틴, 홍국 및 피브레이트[페노피브레이트 외에] 제외)를 계속 취하도록 지시하였다. 무작위화 후에 수득되는 시료로부터의 지질 프로파일 값을 맹검하였다. 환자의 백그라운드 LMT의 변화가 스크리닝 방문(제-7주)으로부터 연구 방문의 마지막(제32주)까지 이루어지지 않았다. 우선적인 관심사가 조사관의 판단에 따라 그러한 변화를 타당하게 만드는 이례 상황을 제외하고 다른 LMT(금지된 LMT 포함)의 용량 조정, 중단 또는 개시는 발생하지 않았다.
약술하면, 백그라운드 LMT는 스크리닝으로부터 추적 방문까지 변형되지 않았다. 연구에서 허용된 다른 백그라운드 처치는 담즙산-결합 격리제(예를 들어, 콜레스티라민(cholestyramine), 콜레스티폴(colestipol), 콜레세브이람(colesevelam); 니코틴산; 페노피브레이트; 및 오메가-3 지방산(매일 1000 ㎎ 이상)를 포함하였다.
무작위화
환자를 순열식-블록 무작위화를 사용하여, 이중-맹검 연구 처치 기간 동안 2:2:1의 비를 사용하여 mAb316P, EZE 또는 아토르바스타틴을 제공받도록 무작위화시켰다. 무작위화를 문서화된 MI 또는 허혈성 뇌졸중의 전력에 따라 계층화시켰다[예/아니오].
맹검
단일- 맹검 위약 도입. 단일-맹검 위약 도입을 위해, 그리고 단일-맹검 설계에 따라, 오직 연구 약물만이 처치에 맹검 유지되었으며; 조사자는 연구 처치를 맹검하지 않았다. mAb316P에 대한 위약을 자기-주사기에 공급하였다. EZE/아토르바스타틴에 대한 경구 위약을 캡슐에 공급하여, 맹검을 유지하였다.
이중- 맹검 처치 기간. 이중-맹검 처치 기간 동안, mAb316P 및 mAb316P에 대한 위약을 동일하게 일치되는 자기-주사기에 제공하고, 포장하고, 동일하게 표지하여, 맹검을 유지하였다. 에제티미브 및 아토르바스타틴을 캡슐에서 오버-캡슐화시켜, 위약을 EZE/아토르바스타틴에 일치시켜, 이중-맹검을 보장하였다. 에제티미브 10 ㎎, 아토르바스타틴 20 ㎎ 및 위약은 서로 구별 가능하지 않았다.
각각의 이중-맹검 처치 키트를 컴퓨터 프로그램에 의해 생성된 번호로 표지하였다. 처치 키트 번호를 환자 무작위화 및 1일 24시간, 1주 7일 이용 가능한 집중화 처치 배정 시스템을 통해 예정된 이후의 환자 방문 시에 조사자가 수득하였다.
이중-맹검 설계에 따라, 연구 환자, 조사자 및 연구 장소 인력은 연구 처치에 맹검 유지하고, 특별히 정의된 환경을 제외하고, 무작위화에 접근하지 않았다(처치 코드).
그들이 달성되는 LDL-C 수준에 기초하여 그들의 환자의 처치군을 추론할 수 없도록, 중앙 연구소에 의해 분석되는 무작위화 방문 후에 수득되는 혈액 시료로부터의 지질 파라미터 값을 상기 장소에 전달하지 않았다. 후원자의 운영팀은 무작위화 후에 그리고 최종 데이터베이스 잠금이 발생한 후까지 지질 파라미터에 접근하지 않았다. 장소 및 후원자 운영팀은 환자가 상향-적정에 대한 기준을 충족시키는 사례에서, 75 ㎎으로부터 150 ㎎까지의 용량 상향-적정을 모르도록 했다. 약제 넘버링 시스템으로 암호화된 맹검 연구 약물 키트를 사용하였다. 맹검을 유지하기 위하여, 이들 코드를 제품 롯트 번호와 연결하는 목록은 연구 수행에 연루되는 개인이 접근 가능하지 않았다.
항-약물 항체(ADA) 결과를 상기 장소에 전달하지 않았으며, 후원자 운영팀은 최종 데이터베이스 잠금 후까지 환자 식별과 관련된 결과에 접근하지 않았다. 추적 방문 시에 항-mAb316P 항체에 대하여 240 이상의 역가를 갖는 환자는 마지막 용량 후 6 내지 12개월 및 그 후 역가가 240 미만으로 돌아갈 때까지 약 3 내지 6개월마다 수득되는 추가의 항체 시료(들)를 가졌다. 연구의 맹검을 유지하기 위하여, 연구-후 항-mAb316P 항체의 시료 수집을 위한 요청을 추적 방문 시에 240 미만의 역가를 갖는 환자에서 행하였다.
동시 약제
환자의 복지에 필요하고, 연구 약물을 간섭할 것 같지 않은 것으로 여겨지면, 동시 약제(연구 동안 금지되는 것들 이외의 것)가 안정한 용량으로(가능한 경우) 조사자의 재량으로 제공되게 하였다. 임의의 다른 동시 약제(들)를 허용하고 적절한 경우 기록하였다.
그들이 스크리닝 방문(제-7주) 이전 적어도 4주 동안 안정한 용량으로 사용되고, 스크리닝 방문으로부터 연구의 마지막(제32주)까지 유지되었다면, 지질에 영향을 미칠 수 있는 기능식품 또는 일반의약 치료법을 허용하였다. 그러한 기능식품 또는 일반의약 치료법의 예는 1000 ㎎ 미만의 용량의 오메가-3 지방산, 베네콜(Benecol), 아마기름 및 차전자(psyllium)에서 관찰되는 것과 같은 식물 스타놀을 포함하였다.
초기 스크리닝 방문으로부터 추적 방문까지의 금지된 동시 약제는 다음을 포함하였다: 스타틴; 페노피브레이트 이외의 피브레이트; EZE; 및 홍국 제품.
연구 종점
기준선 특징은 표준 인구학(예를 들어, 연령, 인종, 체중, 신장 등), 병력을 포함하는 질병 특징 및 각 환자에 대한 투약 전력을 포함하였다. 스타틴, 용량 및 "스타틴 불내약성"의 진단을 야기하는 실제 골격근 관련 사례에 관한 역사적 정보를 병력/수술력의 부분으로 수집하였다.
일차 효능 종점: 일차 효능 종점은 기준선으로부터 제24주까지의 계산된 LDL-C의 변화 백분율였으며, 이는 다음과 같이 정의된다: 100×(제24주의 계산된 LDL-C 값 - 기준선에서의 계산된 LDL-C 값)/기준선에서의 계산된 LDL-C 값. 기준선의 계산된 LDL-C 값이 처음의 이중-맹검 연구 약물 주사 이전에 수득되는 마지막 LDL-C 수준이었기 때문에, 각 환자에 대하여 기준선 LDL-C 값이 필요하였다.
제24주의 계산된 LDL-C는 24주 분석 윈도우 내에 그리고 주요 효능 기간 동안 수득된 LDL-C 수준이었다. 주요 효능 기간은 처음의 이중-맹검 연구 약물 주사로부터 마지막 이중-맹검 연구 약물 주사 후 21일까지나 24주 분석 윈도우의 상한까지 중 먼저 일어나는 시간까지의 시간으로 정의되었다.
모든 계산된 LDL-C 값(예정되거나 예정되지 않은, 공복이거나 공복이 아닌)을 사용하여 적절하다면 상기 정의에 따라 일차 효능 종점에 대한 값을 제공하였다. 측정에 시점을 할당하기 위해 사용되는 분석 윈도우를 통계적 분석 계획(SAP)에서 정의하였다.
이차 효능 종점: 본 연구의 이차 종점은 다음을 포함한다:
(1) 기준선으로부터 제12주까지의 계산된 LDL-C의 변화 백분율: 제12주에 계산된 LDL-C가 12주 분석 윈도우 내에, 그리고 12주 효능 기간 동안 수득되는 LDL-C 수준이었다. 12주 효능 기간은 처음의 이중-맹검 연구 약물의 주사로부터 제6 방문 접촉까지나 마지막 이중-맹검 연구 약물의 주사 후 21일까지 중 먼저 일어나는 시간까지의 시간으로 정의된다.
(2) 기준선으로부터 제24주까지의 ApoB의 변화 백분율.
(3) 기준선으로부터 제24주까지의 비-HDL-C의 변화 백분율.
(4) 기준선으로부터 제24주까지의 총-C의 변화 백분율.
(5) 기준선으로부터 제12주까지의 Apo B의 변화 백분율.
(6) 기준선으로부터 제12주까지의 비-HDL-C의 변화 백분율.
(7) 기준선으로부터 제12주까지의 총-C의 변화 백분율.
(8) 일차 종점에 대하여 사용된 정의 및 규칙을 사용하여 제24주에 LDL-C 목표; 예를 들어, (제24주에 계산된 LDL-C 값이 LDL-C 목표에 도달한 환자의 수/변형된 치료 의향[mITT] 모집단 내의 환자의 수)*100으로 정의되는 매우 높은 CV 위험의 경우에 70 ㎎/㎗(1.81 mmol/ℓ) 미만의 LDL-C 또는 중등의 또는 높은 CV 위험이 있는 환자에 대하여 100 ㎎/㎗(2.59 mmol/ℓ) 미만의 LDL-C에 도달한 환자의 비.
(9) 제24주에 70 ㎎/㎗(1.81 mmol/ℓ) 미만의 LDL-C에 도달한 환자의 비.
(10) 기준선으로부터 제24주까지의 Lp(a)의 변화 백분율.
(11) 기준선으로부터 제24주까지의 HDL-C의 변화 백분율.
(12) 기준선으로부터 제12주까지의 HDL-C의 변화 백분율.
(13) 기준선으로부터 제12주까지의 Lp(a)의 변화 백분율.
(14) 기준선으로부터 제24주까지의 공복 TG의 변화 백분율.
(15) 기준선으로부터 제12주까지의 공복 TG의 변화 백분율.
(16) 기준선으로부터 제24주까지의 Apo A-1의 변화 백분율.
(17) 기준선으로부터 제12주까지의 Apo A-1의 변화 백분율.
(18) 제12주에 LDL-C 목표에 도달한 환자의 비; 예를 들어, (제12주에 계산된 LDL-C 값이 LDL-C 목표에 도달한 환자의 수/mITT 모집단 내의 환자의 수)*100으로 정의되는 매우 높은 CV 위험의 경우에 70 ㎎/㎗(1.81 mmol/ℓ) 미만의 LDL-C 및 중등의 또는 높은 CV 위험의 경우에 100 ㎎/㎗(2.59 mmol/ℓ) 미만의 LDL-C.
(19) 제24주에 100 ㎎/㎗(2.59 mmol/ℓ) 미만의 LDL-C에 도달하는 환자의 비.
(20) 제12주에 100 ㎎/㎗(2.59 mmol/ℓ) 미만의 LDL-C에 도달하는 환자의 비.
(21) 제12주에 70 ㎎/㎗(1.81 mmol/ℓ) 미만의 LDL-C에 도달하는 환자의 비.
(22) 기준선으로부터 제12주 및 제24주까지의 계산된 LDL-C의 절대치 변화(㎎/㎗ 및 mmol/ℓ).
(23) 기준선으로부터 제12주 및 제24주까지의 Apo B/Apo A-1 비의 변화.
(24) 제12주 및 제24주에 80 ㎎/㎗(0.8 mmol/ℓ) 미만의 Apo B가 있는 환자의 비.
(25) 제12주 및 제24주에 100 ㎎/㎗ 미만의 비-HDL-C가 있는 환자의 비.
(26) 제12주 및 제24주에 70 ㎎/㎗(1.81 mmol/ℓ) 미만의 계산된 LDL-C 및/또는 계산된 LDL-C의 50% 이상의 감소(계산된 LDL-C가 70 ㎎/㎗[1.81 mmol/ℓ] 이상이면)가 있는 환자의 비.
다른 종점: (1) 연구 내내 평가되는 항-mAb316P 항-약물-항체 상태(양성/음성) 및 역가; (2) 기준선으로부터 제24주까지의 높은 감수성 C-반응성 단백질(hs-CRP)의 변화 백분율; (3) 기준선으로부터 제24주까지의 HbA1c의 절대치 변화(%).
연구 절차
소정의 용량의 연구 약물을 투여하기 전에 모든 실험실 시료를 수집하였다. 지질 패널에 대한 혈액 시료를 모든 진료소 방문에 대하여 아침에 공복 상태에서(즉, 밤새, 적어도 10시간 공복 및 흡연의 자제) 수집해야 한다. 혈액 시료추출 이전의 48시간 이내의 알코올 소모 및 24시간 이내의 강렬한 신체 운동을 막았다. 주의: 환자가 공복 상태가 아니면, 혈액 시료를 수집하지 않고, 혈액 시료를 공복(적어도 10시간) 상태 하에 채혈해야 함을 상기시키면서 다음날로(또는 이 날짜에 가능한 한 근접하게) 새로운 약속을 정하였다.
총-C, HDL-C, TG, ApoB, ApoA-1 및 Lp(a)를 사전결정된 계획에 따라 중앙 연구소에서 직접 측정하였다. 저밀도 지질단백질 콜레스테롤을 모든 방문(제-15주 및 추적 방문 제외) 시에 프리데발트 식을 사용하여 계산하였다. TG 값이 400 ㎎/㎗(4.52 mmol/ℓ)를 초과하면, 중앙 연구소는 LDL-C를 계산하기 보다는 LDL-C를 측정하였다(베타 정량화 방법을 통해). 총-C로부터 HDL-C를 감산함으로써 비-HDL-C를 계산하였다. ApoB/ApoA-1 비를 계산하였다.
지질 패널(공복): 지질 패널(총-C, TG, HDL-C 및 계산된 LDL-C)을 위한 혈액 시료를 사전-특정된 시점에 적어도 10시간 공복 후에 수집하였다.
전문 지질 패널(공복): 전문 지질 패널(ApoB, ApoA-1, ApoB/ApoA-1 비 및 Lp[a])에 대한 혈액 시료를 사전-특정된 시점에 적어도 10시간 공복 후에 수집하였다.
혈압 및 심박수: 혈압 및 심박수를 사전-특정된 시점에 평가하였다. (환자가 적어도 5분 동안 앉은 자세에서 편안하게 휴식한 후) 혈압을 바람직하게는 표준화된 조건하에 앉은 자세에서, 당일의 대략 동일한 시간에, 동일한 팔에서, 동일한 장치를 사용하여 측정하였다. 처음의 스크리닝 방문 시에, 혈압을 양팔에서 측정하였다. 가장 높은 확장기 혈압을 갖는 팔을 이러한 방문시에 결정할 것이며, 혈압을 연구 내내 이 팔에서 측정하였다. 이러한 가장 높은 값을 전자 증례 기록서(eCRF)에 기록하였다. 심박수를 혈압의 측정시에 측정하였다.
신체 검사: 신장 및 체중을 포함하는 철저하고 완전한 신체 검사를 스크리닝 방문(제1 방문) 시에 수행하였다. 체중을 사용한 신체 검사를 사전-특정된 시점에 수행하였다.
체중 및 신장: 체중을 속옷 또는 매우 가벼운 옷을 입고, 신을 신지 않고, 방광을 비운 환자에서 수득하였다. 동일한 저울을 바람직하게 연구 내내 사용하였다. 가능하다면, 밸런스 교정 저울의 사용이 권고되었다.
심전도: 채혈을 필요로 하는 방문 동안 혈액을 빼내기 전에 심전도를 수행하였다. 표준 12-분극 ECG를 사전-특정된 시점에 수행하였다. 적어도 10분의 휴식 후에 앙와위에서 12-분극 ECG를 수행하였다. 전극을 연구 내내 각각의 ECG 기록을 위해 가능한 한 동일한 위치에 배치시켰다. ECG를 조사자가 국소적으로 해석하였다. 각각의 트레이스를 스크리닝 기록 트레이스와 비교하여 분석하였다.
실험실 시험: 모든 실험실 시료를 소정의 용량의 연구 약물을 투여하기 전에 수집하였다. 실험실 시험을 위한 시료를 사전-특정 시점에 수집하고, 연구 동안 중앙 연구소가 분석하였다.
결과
대상체
배치
총 519명의 환자를 이러한 연구를 위해 스크리닝하였으며, 그 중 361명(69.6%)의 환자는 스크리닝을 완료하고 단일-맹검 위약 도입 기간에 참여하였다. 단일-맹검 위약 도입 기간에 참여한 환자에 있어서, 47명(13%)의 환자는 위약 처치를 조기에 중단하였으며, 그 중 29명(8%)의 환자는 (즉, 특정 배제 기준을 만족시키는) 골격근 관련 유해 사례로 인하여 중단하였다. 따라서, 314명의 환자(87%)는 도입 기간을 완료하였으며, 이중-맹검 기간으로 무작위화될 자격이 있었다.
총 314명의 환자를 무작위화시켰고(아토르바스타틴 그룹에 63명, 에제티미브 그룹에 125명 및 mAb316P 그룹에 126명), 에제티미브 그룹에서 단일의 환자는 무작위화되지만 "다른"(필요한 프로토콜 방문 계획에 대한 우려) 이유로 연구 처치를 제공받지 않았다. 따라서, 안전성 모집단은 313명의 환자를 포함하였다. 이러한 환자는 그 후 어떠한 평가를 위해서도 돌아오지 않았으며, 이런 이유로 ITT 모집단에 포함되지 않는다. 추가로, 3명 이상의 환자, 기준선 LDL-C 값의 결여로 인하여 1명(에제티미브 그룹에서) 및 기준선-후 평가의 결여로 인하여 다른 2명(아토르바스타틴 그룹에서 1명 및 에제티미브 그룹에서 1명)을 ITT 모집단으로부터 배제하였다. 마지막으로, 9명의 추가의 환자(아토르바스타틴 그룹에서 2명, 에제티미브 그룹에서 4명 및 mAb316P 그룹에서 3명)를 치료 중 기준선-후 평가의 결여로 인하여 mITT 모집단으로부터 배제시켰다.
제1 단계 데이터 컷-오프로부터, 연구 동안 환자의 상태는 하기와 같았다:
220명(70.1%)의 환자가 24주 이중-맹검 처치 기간을 완료하였다: 아토르바스타틴 그룹에서 42명(66.7%), 에제티미브 그룹에서 82명(65.6%) 및 mAb316P 그룹에서 96명(76.2%).
93명(29.6%)의 환자가 이중-맹검 처치 기간을 완료하기 전에 연구 처치를 조기에 중단하였다: 아토르바스타틴 그룹에서 21명(33.3%), 에제티미브 그룹에서 42명(33.6%) 및 mAb316P 그룹에서 30명(23.8%). 70명(22.3%)의 환자가 유해 사례로 인하여 연구 처치를 조기에 중단하였다: 아토르바스타틴 그룹에서 16명(25.4%), 에제티미브 그룹에서 31명(24.8%) 및 mAb316P 그룹에서 23명(18.3%). 2명(3.2%)의 환자가 불량한 프로토콜 순응으로 인하여 연구 처치를 조기에 종결하였으며, 둘 모두의 환자는 아토르바스타틴 그룹에 있었다. 21명(6.7%)의 환자는 다양한 다른 이유로 인하여 연구 처치를 조기에 종결하였다: 아토르바스타틴 그룹에서 3명(4.8%), 에제티미브 그룹에서 11명(8.8%) 및 mAb316P 그룹에서 7명(5.6%).
281명(89.5%)의 환자에게 적어도 1회의 개방-표지 mAb316P 처치를 시행하고, 이에 따라, OLE 모집단에 포함시켰다.
이러한 KRM에 대한 데이터 컷-오프로부터, OLE 기간에서 9명(3.2%)의 환자가 연구 처치를 종결하였으며, 그들 환자 중 8명(2.8%)이 유해 사례로 인하여 종결하였다.
OLE 모집단에 남아 있는 272명(96.8%)의 환자가 진행 중이며, OLE 기간에 연구 처치를 제공받았다.
본 연구에 참여한 환자의 기준선 특징은 표 10에 요약되어 있다.
[표 10]
기준선 지질 파라미터는 표 11에 요약되어 있다.
[표 11]
효능 결과
위약 도입은 87.0%(314/361)의 환자에 의해 완료되었다. 일반적으로, 인구학 특징, 기준선 질병 특징, 스타틴 불내약성 설문, 기준선 효능 지질 파라미터, LMT 전력 및 백그라운드 LMT 사용은 3개의 연구 처치 그룹의 각각에 무작위화된 환자 간에 비슷하였다. 환자의 15%는 이형접합 FH를 가졌다. 평균 기준선 LDL-C는 아토르바스타틴 그룹에서 187.3 ㎎/㎗, 에제티미브 그룹에서 194.2 ㎎/㎗ 및 mAb316P 그룹에서 191.1 ㎎/㎗였다. 통틀어, 무작위화된 환자 중 89.5%는 개방-표지 확대에 참여하였다.
상기 프로토콜에 특정된 바와 같은 통계적 계층 시험(다중의 시험은 0.05 유의성 수준에서 조절됨)의 순서로 이중-맹검 기간 효능 종점 분석 결과가 표 12에 나타나 있다. 일차 및 주요 이차 효능 분석을 수행하여, mAb316P-처치된 환자를 에제티미브-처치된 환자와 비교하였다. 명확성을 위하여, ITT 분석은 ITT 모집단 내의 환자를 위하여 정의되며, 연구 처치 투여 상태와 관계없이, 분석 윈도우에서 모든 종점 평가를 포함한다(즉, 처치후 평가 포함). 치료 중 분석은 mITT 모집단 내의 환자를 위하여 정의되며, 제1 이중-맹검 연구 약물(캡슐이나 주사 중 어느 것이나 먼저 행하는 것)로부터 마지막 이중-맹검 연구 약물 주사 후 21일까지나 마지막 캡슐 복용 후 3일까지 중 어느 것이든 먼저 오는 시간까지의 모든 종점 평가를 포함한다(즉, 효능 처치 기간에서의 평가 포함). 주의: 계층 시험의 순에서 p-값이 0.05 이하이면, 결과는 통계적으로 유의미하다.
[표 12]
mAb316P로 처치된 환자에 있어서, 제24주의 LS 평균 LDL-C 값은 108.5 ㎎/㎗였으며, 이는 기준선으로부터 -84 ㎎/㎗(즉, -45.0%)의 LDL-C 수준의 변화를 나타낸다. 대조적으로, EZE로 처치된 환자에 있어서, 제24주의 LS 평균 LDL-C 값은 159.9 ㎎/㎗였으며, 이는 기준선으로부터 -33 ㎎/㎗(즉, -14.6%)의 LDL-C 수준의 변화를 나타낸다. mAb316P-처치된 환자 대 에제티미브-처치된 환자에 대한 제24주의 LDL-C의 LS 평균 차이%는 -30.4%(SE = 3.1, p<0.0001)였다.
52명의 mAb316P 환자(41.9%)는 제24주에 LDL-C 목표에 도달한 한편, 오직 5명의 EZE 환자(4.4%)만이 제24주에 LDL-C 목표에 도달하였다(p 값 <0.0001). 본 연구의 목적을 위하여, LDL-C 목표는 매우 높은 위험 환자에 대하여 70 ㎎/㎗ 미만 및 중등의 및 높은 위험 환자에 대하여 100 ㎎/㎗ 미만으로 정의되었다. 또한, 54명/109명의 mAb316P 환자(49.5%)를 제12주에 75 ㎎ Q2W로부터 150 ㎎ Q2W까지 상향적정으로 처리하였다(제8주 LDL-C 수준에 기초).
제24주의 선택된 이차 지질 파라미터(비-HDL-C, Apo B 및 Lp(a))의 감소의 요약은 표 13에 나타나 있다.
[표 13]
일차 효능 종점 및 3분의 2를 초과하는 주요 이차 효능 종점이 계층적 시험 절차에 따라 mAb316P-처치 환자에 유리하게 통계적으로 유의미한 이익을 달성하였다.
안전성 결과
총 313명의 환자를 무작위화시키고, 적어도 부분적인 용량의 이중-맹검 연구 처치(안전성 모집단)를 제공하였으며, 281명의 환자에게 OLE 연구 처치를 제공하였다(OLE 모집단). 총 29명의 환자, 구체적으로, 아토르바스타틴 처치군에서 7명(11.1%)의 환자, 에제티미브 처치군에서 10명(8.1%)의 환자 및 mAb316P 처치군에서 12명(9.5%)의 환자에서 치료후 발생 SAE가 발생하였다. 에제티미브 처치군에서 비-심장 흉통을 보고하는 4명(3.2%)의 환자의 단일의 예외와 함께, 3개의 처치군의 각각에 대한 임의의 사례 우선 용어의 1개 이하의 보고가 존재하였다.
총 70명(22.4%)의 환자가 TEAE로 인하여 조기에 연구 처치를 중단하였다. 구체적으로, 아토르바스타틴 처치군에서 16명(25.4%)의 환자, 에제티미브 처치군에서 31명(25.0%)의 환자 및 mAb316P 처치군에서 23명(18.3%)의 환자는 조기에 연구 처치를 종결하였다. 조기 종결을 야기하는 가장 일반적인 사례는 근골격 및 연결 조직 장애 SOC에 포함되었으며(아토르바스타틴 그룹에서 14명[22.2%]의 환자, 에제티미브 그룹에서 26명[21.0%]의 환자 및 mAb316P 그룹에서 20명[15.9%]의 환자), 근육통은 가장 빈번하게 보고되는 우선 용어이다.
환자 사망이 중간 분석 시에 보고되지 않았다.
TEAE는 아토르바스타틴 처치군에서 54명(85.7%)의 환자, 에제티미브 처치군에서 100명(80.6%)의 환자 및 mAb316P 처치군에서 104명(82.5%)의 환자에서 발생하였다. 임의의 처치군에서 환자의 5% 이상에서 발생하는 TEAE는 다음과 같다: - 비인두염(각각 아토르바스타틴 / 에제티미브 / mAb316P에 대하여 3.2% / 8.1% / 6.3%); - 상기도 감염(각각 아토르바스타틴 / 에제티미브 / mAb316P에 대하여 3.2% / 4.0% / 5.6%); - 두통(각각 아토르바스타틴 / 에제티미브 / mAb316P에 대하여 6.3% / 4.8% / 4.8%); - 감각이상(각각 아토르바스타틴 / 에제티미브 / mAb316P에 대하여 6.3% / 0 / 3.2% ); - 관절통(각각 아토르바스타틴 / 에제티미브 / mAb316P에 대하여 7.9% / 7.3% / 5.6%); - 요통(각각 아토르바스타틴 / 에제티미브 / mAb316P에 대하여 7.9% / 5.6% / 4.0%); - 근경련(각각 아토르바스타틴 / 에제티미브 / mAb316P에 대하여 11.1% / 7.3% / 4.0%); - 근육 위약(각각 아토르바스타틴 / 에제티미브 / mAb316P에 대하여 6.3% / 1.6% / 0.8%); - 근육통(각각 아토르바스타틴 / 에제티미브 / mAb316P에 대하여 27% / 23.4% / 24.6%); - 및 피로(각각 아토르바스타틴 / 에제티미브 / mAb316P에 대하여 7.9% / 3.2% / 4.8%).
mAb316P 그룹에서 5% 이상의 환자 빈도 및 아토르바스타틴 및 EZE 처치군 둘 모두에 비하여 mAb316P 그룹에서 더 높은 빈도를 갖는 SOC는 다음과 같았다: "정신의학 장애"가 아토르바스타틴 처치군에서 2명(3.2%) 및 EZE 처치군에서 5명(4.0%)의 환자에 비하여 mAb316P 처치군에서 9명(7.1%)의 환자에서 발생하였다. 가장 흔한 사례는 mAb316P 처치 군에서의 5건(4.0%)의 불면증 대 아토르바스타틴 처치군에서의 1건(1.6%)의 그러한 사례 대 에제티미브 처치군에서의 2건(1.6%)의 그러한 보고였다. "귀 및 미로 장애"는 mAb316P 처치군에서의 8명(6.3%)의 환자 대 아토르바스타틴 처치군에서의 1명(1.6%)의 환자 및 EZE 처치군에서의 4명(3.2%)의 환자에서 발생하였다. 가장 흔한 사례는 mAb316P 처치군에서의 6건(4.8%)의 현기증의 보고 대 아토르바스타틴 처치군에서의 1건(1.6%)의 그러한 보고 대 에제티미브 처치군에서의 2건(1.6%)의 그러한 보고였다. "심장 장애"는 mAb316P 처치군에서 10명(7.9%)의 환자 대 아토르바스타틴 처치군에서 2명(3.2%)의 환자 및 EZE 처치군에서 6명(4.8%)의 환자에서 발생하였다. 가장 흔한 사례는 mAb316P 처치군에서 4건(3.2%)의 두근거림 대 아토르바스타틴 처치군에서 0건의 그러한 보고 대 에제티미브 처치군에서 2건(1.6%)의 그러한 보고였다. mAb316P 처치군에서 9명(7.1%)의 환자 대 아토르바스타틴 처치군에서 3명(4.8%)의 환자 및 EZE 처치군에서 7명(5.6%)의 환자에서 "조사"가 일어났다. mAb316P 처치군에 비하여 아토르바스타틴 및 EZE 처치군 둘 모두에서 더 높은 빈도를 갖는 단일의 SOC는 근골격 및 연결 조직 장애였다.
특히 흥미있는 TEAE(AESI)에 있어서, 결과는 사전-정의된 SMQ 또는 CMQ 우선 용어 그룹화에 의해 제시된다: 치료후 발생 주사 부위 반응(ISR)은 아토르바스타틴 처치군에서 1명(1.6%)의 환자, 에제티미브 처치군에서 6명(4.8%)의 환자 및 mAb316P 처치군에서 6명(4.8%)의 환자에서 발생하였다. "과민증"의 MedDRA SMQ를 통해 확인된 일반적인 알러지성 TEAE가 아토르바스타틴 처치군에서 4명(6.3%)의 환자, 에제티미브 처치군에서 9명(7.3%)의 환자 및 mAb316P 처치군에서 12명(9.5%)의 환자에서 발생하였다. 치료후 발생 신경학적 AE는 아토르바스타틴 처치군에서 8명(12.7%)의 환자, 에제티미브 처치군에서 4명(3.2%)의 환자 및 mAb316P 처치군에서 11명(8.7%)의 환자에서 발생하였다. 가장 흔한 우선 용어는 감각이상(각각 아토르바스타틴 / 에제티미브 / mAb316P에 대하여 6.3% / 0 / 3.2%) 및 근육 위약(각각 아토르바스타틴 / 에제티미브 / mAb316P에 대하여 6.3% / 1.6% / 0.8%)이었다. 치료후 발생 신경인지 장애는 아토르바스타틴 처치군에서 0명의 환자, 에제티미브 처치군에서 2명(1.6%)의 환자 및 mAb316P 처치군에서 3명(2.4%)의 환자에서 발생하였다.
판정을 위해 확인된 심혈관 사례가 있는 환자에 있어서, 1명(0.8%)의 환자는 비-치명적인 MI에 대해 양으로 판정되었으며, 이러한 환자는 mAb316P 처치군에 있었다.
25 ㎎/㎗ 미만의 2개의 연속 계산된 LDL-C 측정치가 있는 환자의 빈도에 관하여, 환자는 3가지 처치군 중 어떤 군에서도 발생하지 않았다.
골격근-관련 TEAE는 본 연구를 위해, 특히 골격근-관련 CRF에서 수집된 사례를 위해 그리고 다시 CMQ(프로토콜 부록에 정의된 바와 같음)에 의해 2회 정의된다. 총 99명(31.6%)의 환자, 구체적으로, 아토르바스타틴 처치군에서 25명(39.7%)의 환자, 에제티미브 처치군에서 40명(32.3%)의 환자 및 mAb316P 처치군에서 34명(27.0%)의 환자가 CMQ 우선 용어를 보고하였다. 골격근-관련 사례를 야기하는 가장 일반적인 CMQ 정의된 우선 용어는 근육통(각각 아토르바스타틴 / 에제티미브 / mAb316P에 대하여 27% / 23.4% / 24.6%), 근육연축(각각 아토르바스타틴 / 에제티미브 / mAb316P에 대하여 11.1% / 7.3% / 4.0%) 및 근육 위약(각각 아토르바스타틴 / 에제티미브 / mAb316P에 대하여 6.3% / 1.6% / 0.8%)이었으며, 그들 모두는 근골격 및 연결 조직 장애 SOC에 포함된다.
조기 치료 중단을 야기하는 처치후 발생 골격근-관련 사례는 55명(17.6%)의 환자, 구체적으로 아토르바스타틴 처치군에서 13명(20.6%)의 환자, 에제티미브 처치군에서 23명(18.5%)의 환자 및 mAb316P 처치군에서 19명(15.1%)의 환자에서 보고되었다. 치료후 발생 중증 골격근-관련 사례는 임의의 처치군에서 보고되지 않았다. 어떠한 처치군에서도 TEAE 골격근-관련 사례로 인한 환자 사망이 보고되지 않았다.
결론
본 연구는 근육-관련 증상으로 인하여 가장 낮은 용량의 하나의 스타틴을 포함하는 적어도 2개의 상이한 스타틴에 불내약성의 전력을 갖는 환자를 평가하였다. 환자가 mAb316P, 에제티미브 또는 아토르바스타틴 20 ㎎(교정군)을 제공받도록 무작위화시켰다. 이러한 연구에서 처치된 환자는 그들이 처음 시험에 참여하였을 때 매우 높은 LDL-C 수준을 가졌다(평균하여 187 내지 193.5 ㎎/㎗). 임상 시험에서, 환자의 10 내지 25%는 환자에 불내약성을 보고한다.
본 연구는 에제티미브-처치 환자(LS 평균 = -14.6%)에 비하여 mAb316P-처치된 환자(LS 평균 = -45.0%)에서 계산된 기준선 LDL-C로부터의 변화 백분율의 통계적으로 유의미한 감소의 ITT 모집단에서의 일차 효능 종점을 달성하였으며, 처치군들 간의 LS 평균 차이는 -30.4%였다. 3분의 2를 넘는 주요 이차 효능 종점에 대하여, 이러한 연구는 에제티미브-처치 환자에 비하여 mAb316P-처치 환자에서 통계적으로 유의미한 이익을 달성하였다. 이러한 연구로부터의 이용 가능한 데이터에 기초하여, 스타틴에 불내약성인 원발성 고콜레스테롤혈증(heFH 및 비 FH)이 있는 환자에서의 mAb316P의 피하 투여는 일반적으로 안전하고 잘 용인되었다. mAb316P-처치 환자에 대한 골격근-관련 AE의 비는 어느 하나의 대조군에서 더 낮았으며, 이러한 차이는 20 ㎎의 아토르바스타틴으로 처치된 환자에서 통계적으로 유의미한 것으로 결정되었다(처음의 골격근 AE까지의 시간에 의해 평가되는 바와 같음, p=0.042). 추가로, mAb316P-처치 환자에 대한 골격근-관련 AE의 연구 중단율은 2개의 대조군보다 더 낮았다. 모든 처치군의 유사한 비(mAb316 82.5%, 에제티미브 81%, 아토르바스타틴 86%)의 AE가 본 연구에서 관찰되었다. 가장 흔한 AE는 근육통(25% mAb316, 23% 에제티미브, 27% 아토르바스타틴), 비인두염(6% mAb316, 8% 에제티미브, 3% 아토르바스타틴), 관절통(6% mAb316, 7% 에제티미브, 8% 아토르바스타틴) 및 상기도 감염(6% mAb316, 4% 에제티미브, 3% 아토르바스타틴)이었다.
본 발명은 본 명세서에 기재된 특정 구현예에 의해 범주가 제한되지 않는다. 실제로, 본 명세서에 기재된 것들에 더하여 본 발명의 다양한 변형이 전술한 설명 및 첨부된 도면으로부터 당업자에게 명백해질 것이다. 그러한 변형은 첨부된 청구범위의 범주 내에 속하는 것으로 의도된다.
SEQUENCE LISTING
<110> BACCARA-DINET, MARIE
BESSAC, LAURENCE
CHAUDHARI, UMESH
HANOTIN, CORINNE
PORDY, ROBERT C.
SASIELA, WILLIAM J.
SCHWEMMER GIPE, DANIEL A.
<120> USE OF A PCSK9 INHIBITOR TO TREAT HYPERLIPIDEMIA
<130> US2013/257 PCT
<140>
<141>
<160> 198
<170> PatentIn version 3.5
<210> 1
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 1
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Asn Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Asp Trp Val
35 40 45
Ser Thr Ile Ser Gly Ser Gly Gly Thr Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Ile Ile Ser Arg Asp Ser Ser Lys His Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Ser Asn Trp Gly Asn Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 2
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 2
Gly Phe Thr Phe Asn Asn Tyr Ala
1 5
<210> 3
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 3
Ile Ser Gly Ser Gly Gly Thr Thr
1 5
<210> 4
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 4
Ala Lys Asp Ser Asn Trp Gly Asn Phe Asp Leu
1 5 10
<210> 5
<211> 447
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
REGN727 heavy chain polypeptide
<400> 5
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Asn Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Asp Trp Val
35 40 45
Ser Thr Ile Ser Gly Ser Gly Gly Thr Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Ile Ile Ser Arg Asp Ser Ser Lys His Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Ser Asn Trp Gly Asn Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 6
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 6
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Arg
20 25 30
Ser Asn Asn Arg Asn Phe Leu Gly Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Asn Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Thr Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 7
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 7
Gln Ser Val Leu Tyr Arg Ser Asn Asn Arg Asn Phe
1 5 10
<210> 8
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 8
Trp Ala Ser
1
<210> 9
<211> 220
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
REGN727 light chain polypeptide
<400> 9
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Arg
20 25 30
Ser Asn Asn Arg Asn Phe Leu Gly Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Asn Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Thr Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 10
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 10
Gln Gln Tyr Tyr Thr Thr Pro Tyr Thr
1 5
<210> 11
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 11
Glu Met Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser His
20 25 30
Trp Met Lys Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asn Ile Asn Gln Asp Gly Ser Glu Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Ile Val Leu Met Val Tyr Asp Met Asp Tyr Tyr Tyr Tyr
100 105 110
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 12
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 12
Gly Phe Thr Phe Ser Ser His Trp
1 5
<210> 13
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 13
Ile Asn Gln Asp Gly Ser Glu Lys
1 5
<210> 14
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 14
Ala Arg Asp Ile Val Leu Met Val Tyr Asp Met Asp Tyr Tyr Tyr Tyr
1 5 10 15
Gly Met Asp Val
20
<210> 15
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 15
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Asn Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Thr
85 90 95
Leu Gln Thr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 16
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 16
Gln Ser Leu Leu His Ser Asn Gly Asn Asn Tyr
1 5 10
<210> 17
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 17
Leu Gly Ser
1
<210> 18
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 18
Met Gln Thr Leu Gln Thr Pro Leu Thr
1 5
<210> 19
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 19
Gly Phe Thr Phe Ser Ser His Trp
1 5
<210> 20
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 20
Ile Asn Gln Asp Gly Ser Glu Lys
1 5
<210> 21
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 21
Ala Arg Asp Ile Val Leu Met Val Tyr Asp Met Asp Tyr Tyr Tyr Tyr
1 5 10 15
Gly Met Asp Val
20
<210> 22
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 22
Gln Ser Leu His His Ser Asn Gly Asn Asn Tyr
1 5 10
<210> 23
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 23
Leu Gly Ser
1
<210> 24
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 24
Met Gln Thr Leu Gln Thr Pro Leu Thr
1 5
<210> 25
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 25
Gly Phe Thr Phe Ser Ser His Trp
1 5
<210> 26
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 26
Ile Asn Gln Asp Gly Ser Glu Lys
1 5
<210> 27
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 27
Ala Arg Asp Ile Val Leu Met Val Tyr His Met Asp Tyr Tyr Tyr Tyr
1 5 10 15
Gly Met Asp Val
20
<210> 28
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 28
Gln Ser Leu Leu His Ser Asn Gly Asn Asn Tyr
1 5 10
<210> 29
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 29
Leu Gly Ser
1
<210> 30
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 30
Met Gln Thr Leu Gln Thr Pro Leu Thr
1 5
<210> 31
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 31
Gly Phe Thr Phe Ser Ser His Trp
1 5
<210> 32
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 32
Ile Asn Gln Asp Gly Ser Glu Lys
1 5
<210> 33
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 33
Ala Arg Asp Ile Val Leu Met Val Tyr His Met Asp Tyr Tyr Tyr Tyr
1 5 10 15
Gly Met Asp Val
20
<210> 34
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 34
Gln Ser Leu His His Ser Asn Gly Asn Asn Tyr
1 5 10
<210> 35
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 35
Leu Gly Ser
1
<210> 36
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 36
Met Gln Thr Leu Gln Thr Pro Leu Thr
1 5
<210> 37
<211> 131
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
VH; m2CX1D05 polypeptide
<400> 37
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Asn Ser His
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Asn Pro Ile Leu Gly Ile Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg His Tyr Glu Ile Gln Ile Gly Arg Tyr Gly Met Asn Val Tyr
100 105 110
Tyr Leu Met Tyr Arg Phe Ala Ser Trp Gly Gln Gly Thr Leu Val Thr
115 120 125
Val Ser Ser
130
<210> 38
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
VH CDR1; m2CX1D05 peptide
<400> 38
Gly Gly Thr Phe Asn Ser His Ala Ile Ser
1 5 10
<210> 39
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
VH CDR2; m2CX1D05 peptide
<400> 39
Trp Met Gly Gly Ile Asn Pro Ile Leu Gly Ile Ala Asn Tyr Ala Gln
1 5 10 15
Lys Phe Gln Gly
20
<210> 40
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
VH CDR3; m2CX1D05 peptide
<400> 40
His Tyr Glu Ile Gln Ile Gly Arg Tyr Gly Met Asn Val Tyr Tyr Leu
1 5 10 15
Met Tyr Arg Phe Ala Ser
20
<210> 41
<211> 213
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
LC; m2CX1D05 polypeptide
<400> 41
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Ser Ala
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asn Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Phe Asp Gly Asp Pro Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Ala
210
<210> 42
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
VL CDR 1; m2CX1D05 peptide
<400> 42
Arg Ala Ser Gln Gly Ile Arg Ser Ala Leu Asn
1 5 10
<210> 43
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
VL CDR2; m2CX1D05 peptide
<400> 43
Leu Leu Ile Tyr Asn Gly Ser Thr Leu Gln Ser
1 5 10
<210> 44
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
VL CDR3; m2CX1D05 peptide
<400> 44
Gln Gln Phe Asp Gly Asp Pro
1 5
<210> 45
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
VH; 1B20 polypeptide
<400> 45
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Trp Ile Ser Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Gly Asp Ser Tyr Thr Asn Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Asp Tyr Trp Tyr Lys Pro Leu Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 46
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
VH CDR1; 1B20 peptide
<400> 46
Gly Tyr Ser Phe Thr Asn Tyr Trp Ile Ser
1 5 10
<210> 47
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
VH CDR2; 1B20 peptide
<400> 47
Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Tyr Thr Asn Tyr Ser Pro
1 5 10 15
Ser Phe Gln Gly
20
<210> 48
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
VH CDR3; 1B20 peptide
<400> 48
Asp Tyr Trp Tyr Lys Pro Leu Phe Asp Ile
1 5 10
<210> 49
<211> 220
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
LC; 1B20 polypeptide
<400> 49
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Ser Ser Phe Pro Ile Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Ala
210 215 220
<210> 50
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
VL CDR1; 1B20 peptide
<400> 50
Arg Ser Ser Gln Ser Val Leu Tyr Ser Ser Asn Asn Lys Asn Tyr Leu
1 5 10 15
Ala
<210> 51
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
VL CDR2; 1B20 peptide
<400> 51
Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser
1 5 10
<210> 52
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
VL CDR3; 1B20 peptide
<400> 52
Gln Gln Tyr Ser Ser Phe Pro Ile
1 5
<210> 53
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
variable heavy antibody region polypeptide
<400> 53
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Ser Tyr
20 25 30
Gly Met Tyr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Asp Pro Gly Ser Gly Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Arg Tyr Gly Tyr Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser
115 120
<210> 54
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX132 heavy chain CDR1 antibody region peptide
<400> 54
Lys Ala Ser Gly Tyr Thr Phe Ser Ser Tyr Gly Met Tyr Trp Val Arg
1 5 10 15
<210> 55
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX132 heavy chain CDR2 antibody region peptide
<400> 55
Trp Ile Gly Trp Ile Asp Pro Gly Ser Gly Gly Thr Lys Tyr Asn Glu
1 5 10 15
Lys Phe Lys Gly Lys Ala Thr
20
<210> 56
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX132 heavy chain CDR3 antibody region peptide
<400> 56
Cys Ala Arg Glu Arg Tyr Gly Tyr Tyr Phe Asp Tyr Trp Gly Gln
1 5 10 15
<210> 57
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
variable light antibody region polypeptide
<400> 57
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Ile Thr Cys Arg Ala Ser Gln Tyr Val Gly Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Val Trp Asp Ser Ser Pro Pro
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 58
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX213 and AX132 light chain CDR1 antibody region peptide
<400> 58
Ile Thr Cys Arg Ala Ser Gln Tyr Val Gly Ser Tyr Leu Asn Trp Tyr
1 5 10 15
Gln
<210> 59
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX213 and AX132 light chain CDR2 antibody region peptide
<400> 59
Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro
1 5 10
<210> 60
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX132 & AX213 light chain CDR3 antibody region peptide
<400> 60
Tyr Tyr Cys Gln Val Trp Asp Ser Ser Pro Pro Val Val Phe Gly Gly
1 5 10 15
<210> 61
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
variable heavy antibody region polypeptide
<400> 61
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Arg Tyr
20 25 30
Gly Ile Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Gly Asn Gly Gly Thr Arg Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Asn Asp Gly Tyr Ser Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser
115 120
<210> 62
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX213 heavy chain CDR1 antibody region peptide
<400> 62
Lys Ala Ser Gly Tyr Thr Phe Ser Arg Tyr Gly Ile Asn Trp Val Arg
1 5 10 15
<210> 63
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX213 heavy chain CDR2 antibody region peptide
<400> 63
Trp Ile Gly Arg Ile Asp Pro Gly Asn Gly Gly Thr Arg Tyr Asn Glu
1 5 10 15
Lys Phe Lys Gly Lys Ala Thr
20
<210> 64
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX213 heavy chain CDR3 antibody region peptide
<400> 64
Cys Ala Arg Ala Asn Asp Gly Tyr Ser Phe Asp Tyr Trp Gly Gln
1 5 10 15
<210> 65
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
variable light antibody region polypeptide
<400> 65
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Ile Thr Cys Arg Ala Ser Gln Tyr Val Gly Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Val Trp Asp Ser Ser Pro Pro
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 66
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX213 and AX132 light chain CDR1 antibody region peptide
<400> 66
Ile Thr Cys Arg Ala Ser Gln Tyr Val Gly Ser Tyr Leu Asn Trp Tyr
1 5 10 15
Gln
<210> 67
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX213 and AX132 light chain CDR2 antibody region peptide
<400> 67
Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro
1 5 10
<210> 68
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX132 & AX213 light chain CDR3 antibody region peptide
<400> 68
Tyr Tyr Cys Gln Val Trp Asp Ser Ser Pro Pro Val Val Phe Gly Gly
1 5 10 15
<210> 69
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX1 VH antibody sequence polypeptide
<400> 69
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asn Pro Asp Ser Gly Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Leu Ser Trp Asp Phe Asp Val Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 70
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX1 VH CDR1 antibody sequence peptide
<400> 70
Lys Ala Ser Gly Phe Thr Phe Thr Ser Tyr Tyr Met His Trp Val Arg
1 5 10 15
<210> 71
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX1 VH CDR2 antibody sequence peptide
<400> 71
Trp Ile Gly Arg Ile Asn Pro Asp Ser Gly Ser Thr Lys Tyr Asn Glu
1 5 10 15
Lys Phe Lys Gly Arg Ala Thr
20
<210> 72
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX1 VH CDR3 antibody sequence peptide
<400> 72
Cys Ala Arg Gly Gly Arg Leu Ser Trp Asp Phe Asp Val Trp Gly Gln
1 5 10 15
<210> 73
<211> 109
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX1 VL antibody sequence polypeptide
<400> 73
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Arg Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Ala Ala Tyr Asp Tyr Ser Leu Gly
85 90 95
Gly Tyr Val Phe Gly Asp Gly Thr Lys Val Glu Ile Lys
100 105
<210> 74
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX1 VL CDR1 antibody sequence peptide
<400> 74
Arg Ala Ser Gln Asp Ile Ser Arg Tyr Leu Ala
1 5 10
<210> 75
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX1 AX9 AX189 VL CDR2 antibody sequence peptide
<400> 75
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 76
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX1 VL CDR3 antibody sequence peptide
<400> 76
Ala Ala Tyr Asp Tyr Ser Leu Gly Gly Tyr Val
1 5 10
<210> 77
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX9 AX189 VH antibody sequence polypeptide
<400> 77
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Tyr Asn Gly Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Gly Tyr Tyr Leu Gly Ser Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 78
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX9 AX189 VH CDR1 antibody sequence peptide
<400> 78
Lys Ala Ser Gly Tyr Thr Phe Ser Ser Tyr Trp Met His Trp Val Arg
1 5 10 15
<210> 79
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX9 AX189 VH CDR2 antibody sequence peptide
<400> 79
Trp Ile Gly Arg Ile Asp Pro Tyr Asn Gly Gly Thr Lys Tyr Asn Glu
1 5 10 15
Lys Phe Lys Gly Lys Ala Thr
20
<210> 80
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX9 AX189 VH CDR3 antibody sequence peptide
<400> 80
Cys Ala Arg Tyr Gly Tyr Tyr Leu Gly Ser Tyr Ala Met Asp Tyr Trp
1 5 10 15
Gly Gln
<210> 81
<211> 109
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX189 VL antibody sequence polypeptide
<400> 81
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Arg Tyr
20 25 30
Leu Thr Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Ala Tyr Asp Tyr Ser Leu Ser
85 90 95
Gly Tyr Val Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 82
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX189 VL CDR1 antibody sequence peptide
<400> 82
Arg Ala Ser Gln Asp Val Ser Arg Tyr Leu Thr
1 5 10
<210> 83
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX1 AX9 AX189 VL CDR2 antibody sequence peptide
<400> 83
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 84
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
AX189 VL CDR3 antibody sequence peptide
<400> 84
Gln Ala Tyr Asp Tyr Ser Leu Ser Gly Tyr Val
1 5 10
<210> 85
<211> 115
<212> PRT
<213> Homo sapiens
<400> 85
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Leu Thr Ser Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Val Ser Phe Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Leu
50 55 60
Gln Gly Arg Gly Thr Met Thr Thr Asp Pro Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 86
<211> 5
<212> PRT
<213> Homo sapiens
<400> 86
Ser Tyr Gly Ile Ser
1 5
<210> 87
<211> 17
<212> PRT
<213> Homo sapiens
<400> 87
Trp Val Ser Phe Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Leu Gln
1 5 10 15
Gly
<210> 88
<211> 6
<212> PRT
<213> Homo sapiens
<400> 88
Gly Tyr Gly Met Asp Val
1 5
<210> 89
<211> 109
<212> PRT
<213> Homo sapiens
<400> 89
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Ser Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Ser Asn Arg Pro Ser Gly Val Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Asn Ser Tyr Thr Ser Thr
85 90 95
Ser Met Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 90
<211> 14
<212> PRT
<213> Homo sapiens
<400> 90
Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr Asn Ser Val Ser
1 5 10
<210> 91
<211> 7
<212> PRT
<213> Homo sapiens
<400> 91
Glu Val Ser Asn Arg Pro Ser
1 5
<210> 92
<211> 9
<212> PRT
<213> Homo sapiens
<400> 92
Asn Ser Tyr Thr Ser Thr Ser Met Val
1 5
<210> 93
<211> 123
<212> PRT
<213> Homo sapiens
<400> 93
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Ser Ser Ser Ser Tyr Ile Ser Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Asp Tyr Asp Phe Trp Ser Ala Tyr Tyr Asp Ala Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 94
<211> 10
<212> PRT
<213> Homo sapiens
<400> 94
Gly Phe Thr Phe Ser Ser Tyr Ser Met Asn
1 5 10
<210> 95
<211> 17
<212> PRT
<213> Homo sapiens
<400> 95
Ser Ile Ser Ser Ser Ser Ser Tyr Ile Ser Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 96
<211> 14
<212> PRT
<213> Homo sapiens
<400> 96
Asp Tyr Asp Phe Trp Ser Ala Tyr Tyr Asp Ala Phe Asp Val
1 5 10
<210> 97
<211> 111
<212> PRT
<213> Homo sapiens
<400> 97
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ala Gly
20 25 30
Tyr Asp Val His Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu
35 40 45
Leu Ile Ser Gly Asn Ser Asn Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Ser Ser
85 90 95
Leu Ser Gly Ser Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 98
<211> 14
<212> PRT
<213> Homo sapiens
<400> 98
Thr Gly Ser Ser Ser Asn Ile Gly Ala Gly Tyr Asp Val His
1 5 10
<210> 99
<211> 7
<212> PRT
<213> Homo sapiens
<400> 99
Gly Asn Ser Asn Arg Pro Ser
1 5
<210> 100
<211> 11
<212> PRT
<213> Homo sapiens
<400> 100
Gln Ser Tyr Asp Ser Ser Leu Ser Gly Ser Val
1 5 10
<210> 101
<211> 114
<212> PRT
<213> Homo sapiens
<400> 101
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Ala Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Tyr Tyr Asp Gly Ile Asn Lys His Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Gly Leu Asp Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 102
<211> 10
<212> PRT
<213> Homo sapiens
<400> 102
Gly Phe Thr Phe Ser Ser Tyr Gly Met His
1 5 10
<210> 103
<211> 17
<212> PRT
<213> Homo sapiens
<400> 103
Val Ile Tyr Tyr Asp Gly Ile Asn Lys His Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 104
<211> 5
<212> PRT
<213> Homo sapiens
<400> 104
Asp Arg Gly Leu Asp
1 5
<210> 105
<211> 113
<212> PRT
<213> Homo sapiens
<400> 105
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Ser Lys Asn Tyr Leu Val Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Thr Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 106
<211> 17
<212> PRT
<213> Homo sapiens
<400> 106
Lys Ser Ser Gln Ser Val Leu Tyr Ser Ser Asn Ser Lys Asn Tyr Leu
1 5 10 15
Val
<210> 107
<211> 7
<212> PRT
<213> Homo sapiens
<400> 107
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 108
<211> 9
<212> PRT
<213> Homo sapiens
<400> 108
Gln Gln Tyr Tyr Ser Thr Pro Trp Thr
1 5
<210> 109
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
anti-PCSK9 monoclonal antibody pJG04 (clones LGT-209 and
LGT-210) Vh heavy chain variable region (FR1-FR4)
polypeptide
<400> 109
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Thr Met
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Ala Asn Glu His Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Thr Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Tyr Tyr Tyr Tyr Asn Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 110
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
anti-PCSK9 monoclonal antibody clones LGT-209,
LGT-210 and LGT-211 heavy chain CDR1 peptide
<400> 110
Thr Met Tyr Met Ser
1 5
<210> 111
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
anti-PCSK9 monoclonal antibody clones LGT-209,
LGT-210 and LGT-211 heavy chain CDR2 peptide
<400> 111
Arg Ile Asp Pro Ala Asn Glu His Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 112
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
anti-PCSK9 monoclonal antibody pJG04(clones
LGT-209 and LGT-210) Vh heavy chain complementarity
determining region 3 (CDR3) peptide
<400> 112
Ser Tyr Tyr Tyr Tyr Asn Met Asp Tyr
1 5
<210> 113
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
anti-PCSK9 monoclonal antibody pJG10(clones
LGT-209 and LGT-211) Vk light chain variable
region (FR1-FR4) polypeptide
<400> 113
Gln Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
35 40 45
Gly Val Phe Arg Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Gly Arg Leu Glu Pro Glu
65 70 75 80
Asp Phe Ala Val Tyr Tyr Cys Leu Gln Trp Ser Ser Asp Pro Pro Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 114
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
anti-PCSK9 monoclonal antibody clones LGT-209,
LGT-210 and LGT-211 light chain CDR1 peptide
<400> 114
Arg Ala Ser Gln Ser Val Ser Tyr Met His
1 5 10
<210> 115
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
anti-PCSK9 monoclonal antibody clones LGT-209,
LGT-210 and LGT-211 light chain CDR1 peptide
<400> 115
Gly Val Phe Arg Arg Ala Thr
1 5
<210> 116
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
mouse anti-PCSK9 monoclonal antibody LFU720 and
anti-PCSK9 monoclonal antibody clones LGT-209,
LGT-210 and LGT-211 light chain CDR3 peptide
<400> 116
Leu Gln Trp Ser Ser Asp Pro Pro Thr
1 5
<210> 117
<211> 118
<212> PRT
<213> Homo sapiens
<400> 117
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile Ser Pro Phe Gly Gly Arg Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Arg Pro Leu Tyr Ala Ser Asp Leu Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 118
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 118
Gly Tyr Thr Phe Thr Ser Tyr
1 5
<210> 119
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 119
Ser Pro Phe Gly Gly Arg
1 5
<210> 120
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
variable heavy chain CDR peptide
<400> 120
Glu Arg Pro Leu Tyr Ala Ser Asp Leu
1 5
<210> 121
<211> 107
<212> PRT
<213> Homo sapiens
<400> 121
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Ala
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Arg Tyr Ser Leu Trp Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 122
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
variable light chain CDR peptide
<400> 122
Arg Ala Ser Gln Gly Ile Ser Ser Ala Leu Ala
1 5 10
<210> 123
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
variable light chain CDR peptide
<400> 123
Ser Ala Ser Tyr Arg Tyr Thr
1 5
<210> 124
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
variable light chain CDR peptide
<400> 124
Gln Gln Arg Tyr Ser Leu Trp Arg Thr
1 5
<210> 125
<211> 118
<212> PRT
<213> Homo sapiens
<400> 125
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile His Pro Ser Gly Gly Arg Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Arg Pro Leu Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 126
<211> 10
<212> PRT
<213> Homo sapiens
<400> 126
Gly Tyr Thr Phe Thr Ser Tyr Tyr Met His
1 5 10
<210> 127
<211> 17
<212> PRT
<213> Homo sapiens
<400> 127
Glu Ile His Pro Ser Gly Gly Arg Thr Asn Tyr Asn Glu Lys Phe Lys
1 5 10 15
Ser
<210> 128
<211> 9
<212> PRT
<213> Homo sapiens
<400> 128
Glu Arg Pro Leu Tyr Ala Met Asp Tyr
1 5
<210> 129
<211> 107
<212> PRT
<213> Homo sapiens
<400> 129
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val His Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr His Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Arg Tyr Ser Leu Trp Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 130
<211> 11
<212> PRT
<213> Homo sapiens
<400> 130
Lys Ala Ser Gln Asp Val His Thr Ala Val Ala
1 5 10
<210> 131
<211> 7
<212> PRT
<213> Homo sapiens
<400> 131
His Ala Ser Tyr Arg Tyr Thr
1 5
<210> 132
<211> 9
<212> PRT
<213> Homo sapiens
<400> 132
Gln Gln Arg Tyr Ser Leu Trp Arg Thr
1 5
<210> 133
<211> 118
<212> PRT
<213> Homo sapiens
<400> 133
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile His Pro Ser Gly Gly Arg Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Arg Pro Leu Tyr Ala Ser Asp Leu Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 134
<211> 10
<212> PRT
<213> Homo sapiens
<400> 134
Gly Tyr Thr Phe Thr Ser Tyr Tyr Met His
1 5 10
<210> 135
<211> 17
<212> PRT
<213> Homo sapiens
<400> 135
Glu Ile His Pro Ser Gly Gly Arg Thr Asn Tyr Asn Glu Lys Phe Lys
1 5 10 15
Ser
<210> 136
<211> 9
<212> PRT
<213> Homo sapiens
<400> 136
Glu Arg Pro Leu Tyr Ala Ser Asp Leu
1 5
<210> 137
<211> 107
<212> PRT
<213> Homo sapiens
<400> 137
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val His Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr His Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Arg Tyr Ser Leu Trp Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 138
<211> 11
<212> PRT
<213> Homo sapiens
<400> 138
Lys Ala Ser Gln Asp Val His Thr Ala Val Ala
1 5 10
<210> 139
<211> 7
<212> PRT
<213> Homo sapiens
<400> 139
His Ala Ser Tyr Arg Tyr Thr
1 5
<210> 140
<211> 9
<212> PRT
<213> Homo sapiens
<400> 140
Gln Gln Arg Tyr Ser Leu Trp Arg Thr
1 5
<210> 141
<211> 118
<212> PRT
<213> Mus musculus
<400> 141
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn Pro Ser Asn Gly Arg Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Arg Pro Leu Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 142
<211> 7
<212> PRT
<213> Mus musculus
<400> 142
Gly Tyr Thr Phe Thr Ser Tyr
1 5
<210> 143
<211> 6
<212> PRT
<213> Mus musculus
<400> 143
Asn Pro Ser Asn Gly Arg
1 5
<210> 144
<211> 9
<212> PRT
<213> Mus musculus
<400> 144
Glu Arg Pro Leu Tyr Ala Met Asp Tyr
1 5
<210> 145
<211> 108
<212> PRT
<213> Mus musculus
<400> 145
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln Arg Tyr Ser Thr Pro Arg
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 146
<211> 11
<212> PRT
<213> Mus musculus
<400> 146
Lys Ala Ser Gln Asp Val Ser Thr Ala Val Ala
1 5 10
<210> 147
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
variable light chain CDR peptide
<400> 147
Ser Ala Ser Tyr Arg Tyr Thr
1 5
<210> 148
<211> 9
<212> PRT
<213> Mus musculus
<400> 148
Gln Gln Arg Tyr Ser Thr Pro Arg Thr
1 5
<210> 149
<211> 115
<212> PRT
<213> Mus musculus
<400> 149
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Asn Gly Gly Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Tyr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Trp Leu Leu Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ala
115
<210> 150
<211> 7
<212> PRT
<213> Mus musculus
<400> 150
Gly Tyr Thr Phe Thr Asp Tyr
1 5
<210> 151
<211> 6
<212> PRT
<213> Mus musculus
<400> 151
Asn Pro Asn Asn Gly Gly
1 5
<210> 152
<211> 6
<212> PRT
<213> Mus musculus
<400> 152
Trp Leu Leu Phe Ala Tyr
1 5
<210> 153
<211> 108
<212> PRT
<213> Mus musculus
<400> 153
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Ala Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Val Leu Ser
65 70 75 80
Glu Asp Leu Ala Glu Tyr Phe Cys Gln Gln Phe Tyr Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 154
<211> 11
<212> PRT
<213> Mus musculus
<400> 154
Lys Ala Ser Gln Asn Val Gly Thr Asn Val Ala
1 5 10
<210> 155
<211> 7
<212> PRT
<213> Mus musculus
<400> 155
Ser Ala Ser Tyr Arg Tyr Ser
1 5
<210> 156
<211> 9
<212> PRT
<213> Mus musculus
<400> 156
Gln Gln Phe Tyr Ser Tyr Pro Tyr Thr
1 5
<210> 157
<211> 123
<212> PRT
<213> Mus musculus
<400> 157
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Gly Gly Gly Ile Tyr Tyr Arg Tyr Asp Arg Asn Tyr Phe Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 158
<211> 7
<212> PRT
<213> Mus musculus
<400> 158
Gly Tyr Thr Phe Thr Asp Tyr
1 5
<210> 159
<211> 6
<212> PRT
<213> Mus musculus
<400> 159
Asn Pro Asn Asn Gly Gly
1 5
<210> 160
<211> 14
<212> PRT
<213> Mus musculus
<400> 160
Gly Gly Ile Tyr Tyr Arg Tyr Asp Arg Asn Tyr Phe Asp Tyr
1 5 10
<210> 161
<211> 107
<212> PRT
<213> Mus musculus
<400> 161
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Ser Ala Ser Gln Gly Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Lys Leu Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 162
<211> 11
<212> PRT
<213> Mus musculus
<400> 162
Ser Ala Ser Gln Gly Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 163
<211> 7
<212> PRT
<213> Mus musculus
<400> 163
Tyr Thr Ser Ser Leu His Ser
1 5
<210> 164
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 164
Gln Gln Tyr Ser Lys Leu Pro Phe Thr
1 5
<210> 165
<211> 117
<212> PRT
<213> Mus musculus
<400> 165
Glu Val Lys Leu Val Glu Ser Glu Gly Gly Leu Val Gln Pro Gly Ser
1 5 10 15
Ser Met Lys Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ala Trp Val Arg Gln Val Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Asn Ile Asn Tyr Asp Gly Ser Asn Thr Ser Tyr Leu Asp Ser Leu
50 55 60
Lys Ser Arg Phe Ile Ile Ser Arg Asp Asn Ala Lys Asn Ile Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Phe Ala Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser
115
<210> 166
<211> 7
<212> PRT
<213> Mus musculus
<400> 166
Gly Phe Thr Phe Ser Asp Tyr
1 5
<210> 167
<211> 6
<212> PRT
<213> Mus musculus
<400> 167
Asn Tyr Asp Gly Ser Asn
1 5
<210> 168
<211> 8
<212> PRT
<213> Mus musculus
<400> 168
Glu Lys Phe Ala Ala Met Asp Tyr
1 5
<210> 169
<211> 108
<212> PRT
<213> Mus musculus
<400> 169
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Phe Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Asn Ala
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly His Ser Pro Lys Leu Leu Ile
35 40 45
Phe Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 170
<211> 11
<212> PRT
<213> Mus musculus
<400> 170
Lys Ala Ser Gln Asp Val Ser Asn Ala Leu Ala
1 5 10
<210> 171
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
variable light chain CDR peptide
<400> 171
Ser Ala Ser Tyr Arg Tyr Thr
1 5
<210> 172
<211> 9
<212> PRT
<213> Mus musculus
<400> 172
Gln Gln His Tyr Ser Thr Pro Trp Thr
1 5
<210> 173
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 173
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Arg His
20 25 30
Thr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Ser Pro Ala Asn Gly Asn Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Trp Ile Gly Ser Arg Glu Leu Tyr Ile Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 174
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 174
Gly Phe Thr Phe Thr Arg His Thr Ile His
1 5 10
<210> 175
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 175
Arg Ile Ser Pro Ala Asn Gly Asn Thr Asn Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 176
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 176
Trp Ile Gly Ser Arg Glu Leu Tyr Ile Met Asp Tyr
1 5 10
<210> 177
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 177
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Arg Ile Gln Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 178
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 178
Arg Ala Ser Gln Asp Val Ser Thr Ala Val Ala
1 5 10
<210> 179
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 179
Ser Ala Ser Phe Leu Tyr Ser
1 5
<210> 180
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 180
Gln Gln Ser Tyr Arg Ile Gln Pro Thr
1 5
<210> 181
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 181
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Thr
20 25 30
Ala Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Ser Pro Ala Asn Gly Asn Thr Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Trp Ile Gly Ser Arg Glu Leu Tyr Ile Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 182
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 182
Gly Phe Thr Phe Ser Ser Thr Ala Ile His
1 5 10
<210> 183
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 183
Arg Ile Ser Pro Ala Asn Gly Asn Thr Asn Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 184
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 184
Trp Ile Gly Ser Arg Glu Leu Tyr Ile Met Asp Tyr
1 5 10
<210> 185
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 185
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Pro Ala Leu His
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 186
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 186
Arg Ala Ser Gln Asp Val Ser Thr Ala Val Ala
1 5 10
<210> 187
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 187
Ser Ala Ser Phe Leu Tyr Ser
1 5
<210> 188
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 188
Gln Gln Ser Tyr Pro Ala Leu His Thr
1 5
<210> 189
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 189
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Pro Phe Ser Lys Leu
20 25 30
Gly Met Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Ser Gly Gly Gly Tyr Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Ile Ser Phe Gln Gly Gly Thr Tyr Thr Tyr Val Met
100 105 110
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 190
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 190
Gly Phe Pro Phe Ser Lys Leu Gly Met Val
1 5 10
<210> 191
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 191
Thr Ile Ser Ser Gly Gly Gly Tyr Thr Tyr Tyr Pro Asp Ser Val Lys
1 5 10 15
Gly
<210> 192
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 192
Glu Gly Ile Ser Phe Gln Gly Gly Thr Tyr Thr Tyr Val Met Asp Tyr
1 5 10 15
<210> 193
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 193
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu His Arg
20 25 30
Asn Gly Ile Thr Tyr Ser Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Leu Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Tyr Gln Asn
85 90 95
Leu Glu Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 194
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 194
Arg Ser Ser Lys Ser Leu Leu His Arg Asn Gly Ile Thr Tyr Ser Tyr
1 5 10 15
<210> 195
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 195
Gln Leu Ser Asn Leu Ala Ser
1 5
<210> 196
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 196
Tyr Gln Asn Leu Glu Leu Pro Leu Thr
1 5
<210> 197
<211> 2076
<212> DNA
<213> Homo sapiens
<400> 197
atgggcaccg tcagctccag gcggtcctgg tggccgctgc cactgctgct gctgctgctg 60
ctgctcctgg gtcccgcggg cgcccgtgcg caggaggacg aggacggcga ctacgaggag 120
ctggtgctag ccttgcgttc cgaggaggac ggcctggccg aagcacccga gcacggaacc 180
acagccacct tccaccgctg cgccaaggat ccgtggaggt tgcctggcac ctacgtggtg 240
gtgctgaagg aggagaccca cctctcgcag tcagagcgca ctgcccgccg cctgcaggcc 300
caggctgccc gccggggata cctcaccaag atcctgcatg tcttccatgg ccttcttcct 360
ggcttcctgg tgaagatgag tggcgacctg ctggagctgg ccttgaagtt gccccatgtc 420
gactacatcg aggaggactc ctctgtcttt gcccagagca tcccgtggaa cctggagcgg 480
attacccctc cacggtaccg ggcggatgaa taccagcccc ccgacggagg cagcctggtg 540
gaggtgtatc tcctagacac cagcatacag agtgaccacc gggaaatcga gggcagggtc 600
atggtcaccg acttcgagaa tgtgcccgag gaggacggga cccgcttcca cagacaggcc 660
agcaagtgtg acagtcatgg cacccacctg gcaggggtgg tcagcggccg ggatgccggc 720
gtggccaagg gtgccagcat gcgcagcctg cgcgtgctca actgccaagg gaagggcacg 780
gttagcggca ccctcatagg cctggagttt attcggaaaa gccagctggt ccagcctgtg 840
gggccactgg tggtgctgct gcccctggcg ggtgggtaca gccgcgtcct caacgccgcc 900
tgccagcgcc tggcgagggc tggggtcgtg ctggtcaccg ctgccggcaa cttccgggac 960
gatgcctgcc tctactcccc agcctcagct cccgaggtca tcacagttgg ggccaccaat 1020
gcccaagacc agccggtgac cctggggact ttggggacca actttggccg ctgtgtggac 1080
ctctttgccc caggggagga catcattggt gcctccagcg actgcagcac ctgctttgtg 1140
tcacagagtg ggacatcaca ggctgctgcc cacgtggctg gcattgcagc catgatgctg 1200
tctgccgagc cggagctcac cctggccgag ttgaggcaga gactgatcca cttctctgcc 1260
aaagatgtca tcaatgaggc ctggttccct gaggaccagc gggtactgac ccccaacctg 1320
gtggccgccc tgccccccag cacccatggg gcaggttggc agctgttttg caggactgta 1380
tggtcagcac actcggggcc tacacggatg gccacagccg tcgcccgctg cgccccagat 1440
gaggagctgc tgagctgctc cagtttctcc aggagtggga agcggcgggg cgagcgcatg 1500
gaggcccaag ggggcaagct ggtctgccgg gcccacaacg cttttggggg tgagggtgtc 1560
tacgccattg ccaggtgctg cctgctaccc caggccaact gcagcgtcca cacagctcca 1620
ccagctgagg ccagcatggg gacccgtgtc cactgccacc aacagggcca cgtcctcaca 1680
ggctgcagct cccactggga ggtggaggac cttggcaccc acaagccgcc tgtgctgagg 1740
ccacgaggtc agcccaacca gtgcgtgggc cacagggagg ccagcatcca cgcttcctgc 1800
tgccatgccc caggtctgga atgcaaagtc aaggagcatg gaatcccggc ccctcaggag 1860
caggtgaccg tggcctgcga ggagggctgg accctgactg gctgcagtgc cctccctggg 1920
acctcccacg tcctgggggc ctacgccgta gacaacacgt gtgtagtcag gagccgggac 1980
gtcagcacta caggcagcac cagcgaaggg gccgtgacag ccgttgccat ctgctgccgg 2040
agccggcacc tggcgcaggc ctcccaggag ctccag 2076
<210> 198
<211> 692
<212> PRT
<213> Homo sapiens
<400> 198
Met Gly Thr Val Ser Ser Arg Arg Ser Trp Trp Pro Leu Pro Leu Leu
1 5 10 15
Leu Leu Leu Leu Leu Leu Leu Gly Pro Ala Gly Ala Arg Ala Gln Glu
20 25 30
Asp Glu Asp Gly Asp Tyr Glu Glu Leu Val Leu Ala Leu Arg Ser Glu
35 40 45
Glu Asp Gly Leu Ala Glu Ala Pro Glu His Gly Thr Thr Ala Thr Phe
50 55 60
His Arg Cys Ala Lys Asp Pro Trp Arg Leu Pro Gly Thr Tyr Val Val
65 70 75 80
Val Leu Lys Glu Glu Thr His Leu Ser Gln Ser Glu Arg Thr Ala Arg
85 90 95
Arg Leu Gln Ala Gln Ala Ala Arg Arg Gly Tyr Leu Thr Lys Ile Leu
100 105 110
His Val Phe His Gly Leu Leu Pro Gly Phe Leu Val Lys Met Ser Gly
115 120 125
Asp Leu Leu Glu Leu Ala Leu Lys Leu Pro His Val Asp Tyr Ile Glu
130 135 140
Glu Asp Ser Ser Val Phe Ala Gln Ser Ile Pro Trp Asn Leu Glu Arg
145 150 155 160
Ile Thr Pro Pro Arg Tyr Arg Ala Asp Glu Tyr Gln Pro Pro Asp Gly
165 170 175
Gly Ser Leu Val Glu Val Tyr Leu Leu Asp Thr Ser Ile Gln Ser Asp
180 185 190
His Arg Glu Ile Glu Gly Arg Val Met Val Thr Asp Phe Glu Asn Val
195 200 205
Pro Glu Glu Asp Gly Thr Arg Phe His Arg Gln Ala Ser Lys Cys Asp
210 215 220
Ser His Gly Thr His Leu Ala Gly Val Val Ser Gly Arg Asp Ala Gly
225 230 235 240
Val Ala Lys Gly Ala Ser Met Arg Ser Leu Arg Val Leu Asn Cys Gln
245 250 255
Gly Lys Gly Thr Val Ser Gly Thr Leu Ile Gly Leu Glu Phe Ile Arg
260 265 270
Lys Ser Gln Leu Val Gln Pro Val Gly Pro Leu Val Val Leu Leu Pro
275 280 285
Leu Ala Gly Gly Tyr Ser Arg Val Leu Asn Ala Ala Cys Gln Arg Leu
290 295 300
Ala Arg Ala Gly Val Val Leu Val Thr Ala Ala Gly Asn Phe Arg Asp
305 310 315 320
Asp Ala Cys Leu Tyr Ser Pro Ala Ser Ala Pro Glu Val Ile Thr Val
325 330 335
Gly Ala Thr Asn Ala Gln Asp Gln Pro Val Thr Leu Gly Thr Leu Gly
340 345 350
Thr Asn Phe Gly Arg Cys Val Asp Leu Phe Ala Pro Gly Glu Asp Ile
355 360 365
Ile Gly Ala Ser Ser Asp Cys Ser Thr Cys Phe Val Ser Gln Ser Gly
370 375 380
Thr Ser Gln Ala Ala Ala His Val Ala Gly Ile Ala Ala Met Met Leu
385 390 395 400
Ser Ala Glu Pro Glu Leu Thr Leu Ala Glu Leu Arg Gln Arg Leu Ile
405 410 415
His Phe Ser Ala Lys Asp Val Ile Asn Glu Ala Trp Phe Pro Glu Asp
420 425 430
Gln Arg Val Leu Thr Pro Asn Leu Val Ala Ala Leu Pro Pro Ser Thr
435 440 445
His Gly Ala Gly Trp Gln Leu Phe Cys Arg Thr Val Trp Ser Ala His
450 455 460
Ser Gly Pro Thr Arg Met Ala Thr Ala Val Ala Arg Cys Ala Pro Asp
465 470 475 480
Glu Glu Leu Leu Ser Cys Ser Ser Phe Ser Arg Ser Gly Lys Arg Arg
485 490 495
Gly Glu Arg Met Glu Ala Gln Gly Gly Lys Leu Val Cys Arg Ala His
500 505 510
Asn Ala Phe Gly Gly Glu Gly Val Tyr Ala Ile Ala Arg Cys Cys Leu
515 520 525
Leu Pro Gln Ala Asn Cys Ser Val His Thr Ala Pro Pro Ala Glu Ala
530 535 540
Ser Met Gly Thr Arg Val His Cys His Gln Gln Gly His Val Leu Thr
545 550 555 560
Gly Cys Ser Ser His Trp Glu Val Glu Asp Leu Gly Thr His Lys Pro
565 570 575
Pro Val Leu Arg Pro Arg Gly Gln Pro Asn Gln Cys Val Gly His Arg
580 585 590
Glu Ala Ser Ile His Ala Ser Cys Cys His Ala Pro Gly Leu Glu Cys
595 600 605
Lys Val Lys Glu His Gly Ile Pro Ala Pro Gln Glu Gln Val Thr Val
610 615 620
Ala Cys Glu Glu Gly Trp Thr Leu Thr Gly Cys Ser Ala Leu Pro Gly
625 630 635 640
Thr Ser His Val Leu Gly Ala Tyr Ala Val Asp Asn Thr Cys Val Val
645 650 655
Arg Ser Arg Asp Val Ser Thr Thr Gly Ser Thr Ser Glu Gly Ala Val
660 665 670
Thr Ala Val Ala Ile Cys Cys Arg Ser Arg His Leu Ala Gln Ala Ser
675 680 685
Gln Glu Leu Gln
690
Claims (58)
- (a) 스타틴에 불내약성이거나 스타틴 치료법에 유해 반응의 전력을 갖는 환자를 선택하는 단계; 및 (b) 하나 이상의 용량의 PCSK9 억제제를 상기 환자에게 투여하는 단계를 포함하는 고콜레스테롤혈증의 치료를 필요로 하는 환자에서의 고콜레스테롤혈증의 치료 방법.
- (a) 승인된 가장 낮은 1일 용량의 하나 이상의 스타틴을 취하는 동안 시작되거나 증가된 골격근-관련 증상을 경험한 적이 있는 환자를 선택하는 단계; 및 (b) 하나 이상의 용량의 PCSK9 억제제를 상기 환자에게 투여함으로써, 골격근 통증, 불쾌감 쇠약 또는 경련을 유도하지 않고 상기 환자에서 혈청 LDL-C 수준을 감소시키는 단계를 포함하는 골격근 통증, 불쾌감, 쇠약 또는 경련의 유도 없이 환자에서의 혈청 LDL-C 수준의 감소 방법.
- (a) 스타틴에 불내약성이거나 스타틴 치료법에 유해 반응의 전력을 갖는 중등의, 높은 또는 매우 높은 심혈관 위험이 있는 환자를 선택하는 단계; 및 (b) 하나 이상의 용량의 PCSK9 억제제를 상기 환자에게 투여하는 단계를 포함하는 고콜레스테롤혈증, 스타틴 불내약성 환자에서의 혈청 LDL-C 수준의 감소 방법.
- (a) 매일의 치료적 스타틴 섭생이 진행 중인 동안 시작되거나 증가되는 골격근-관련 증상을 이전에 경험한 적이 있는 중등의, 높은 또는 매우 높은 심혈관 위험이 있는 환자를 선택하는 단계; 및 (b) 하나 이상의 용량의 PCSK9 억제제를 상기 환자에게 투여하는 단계를 포함하는 스타틴에 불내약성이거나 스타틴 치료법에 유해 반응의 전력을 갖는 환자에서의 고콜레스테롤혈증의 치료 방법.
- 제4항에 있어서, 상기 환자가 적어도 2개의 개별적인 매일의 치료적 스타틴 섭생이 진행 중인 동안 시작되거나 증가된 골격근-관련 증상을 이전에 경험한 방법.
- 제5항에 있어서, 상기 매일의 치료적 스타틴 섭생의 적어도 하나가 승인된 가장 낮은 1일 용량의 스타틴인 방법.
- 제5항 또는 제6항에 있어서, 상기 매일의 치료적 스타틴 섭생 중 적어도 하나가 매일의 5 ㎎ 로수바스타틴(rosuvastatin), 매일의 10 ㎎ 아토르바스타틴(atorvastatin), 매일의 10 ㎎ 심바스타틴(simvastatin), 매일의 20 ㎎ 로바스타틴(lovastatin), 매일의 40 ㎎ 프라바스타틴(pravastatin), 매일의 40 ㎎ 플루바스타틴(fluvastatin) 및 매일의 2 ㎎ 피타바스타틴(pitavastatin)으로 이루어진 군으로부터 선택되는 방법.
- 제1항 내지 제7항 중 어느 한 항에 있어서, 상기 PCSK9 억제제가 스타틴 치료법의 부재하에 상기 환자에게 투여되는 방법.
- (a) 매일의 치료적 스타틴 섭생이 진행 중이거나 진행 중이었으며, 스타틴에 불내약성이거나 스타틴 치료법에 유해 반응의 전력을 갖는 환자를 선택하는 단계; (b) 상기 환자의 매일의 치료적 스타틴 섭생을 중단하는 단계; 및 (c) 하나 이상의 용량의 PCSK9 억제제를 상기 환자에게 투여하는 단계를 포함하는 환자의 혈청 LDL-C 수준의 저하와 동시에 스타틴에 불내약성인 고콜레스테롤혈증 환자에서의 스타틴 사용의 배제 방법.
- 제1항 내지 제9항 중 어느 한 항에 있어서, 상기 환자가 상기 PCSK9 억제제의 투여 이전 또는 그의 투여 시에, 약 70 ㎎/㎗ 초과의 혈청 저밀도 지질단백질 콜레스테롤(LDL-C) 수준으로 정의되는 고콜레스테롤혈증을 나타내는 방법.
- 제1항 내지 제9항 중 어느 한 항에 있어서, 상기 환자가 상기 PCSK9 억제제의 투여 이전에 또는 그의 투여 시에 약 100 ㎎/㎗ 초과의 혈청 저밀도 지질단백질 콜레스테롤(LDL-C) 수준으로 정의되는 고콜레스테롤혈증을 나타내는 방법.
- 제1항 내지 제11항 중 어느 한 항에 있어서, 상기 환자가 이형접합 가족성 고콜레스테롤혈증(heFH)을 갖는 방법.
- 제1항 내지 제11항 중 어느 한 항에 있어서, 상기 환자가 가족성 고콜레스테롤혈증이 아닌(비-FH) 형태의 고콜레스테롤혈증을 갖는 방법.
- 제1항 내지 제13항 중 어느 한 항에 있어서, 상기 환자가 상기 PCSK9 억제제의 투여 이전에 또는 그의 투여 시에 1% 이상 및 5% 미만의 계산된 10년 내 치명적 심혈관 질병 위험 SCORE로 정의되는 중등의 심혈관 위험을 갖는 방법.
- 제1항 내지 제13항 중 어느 한 항에 있어서, 상기 환자가 상기 PCSK9 억제제의 투여 이전에 또는 그의 투여 시에, (i) 중등의 만성 신장 질병, (ii) 표적 기관 손상이 없는 1형 당뇨병, (iii) 표적 기관 손상이 없는 2형 당뇨병 및/또는 (iv) heFH 중 하나 이상과 함께, 5% 이상의 계산된 10년 내 치명적 심혈관 질병 위험 SCORE로 정의되는 높은 심혈관 위험을 갖는 방법.
- 제1항 내지 제13항 중 어느 한 항에 있어서, 상기 환자가 상기 PCSK9 억제제의 투여 이전에 또는 그의 투여 시에, (i) 문서화된 관상동맥 심장 질병; (ii) 허혈성 뇌졸중; (iii) 말초 뇌졸중(peripheral stroke); (iv) 말초 동맥 질병(PAD); (v) 일과성 허혈 발작(TIA); (vi) 복부대동맥류; (vii) 증상이 없는 50% 초과의 경동맥 폐색; (viii) 경동맥내막절제술; (ix) 경동맥 스텐트 수술; (x) 신장 동맥 협착; (xi) 신장 동맥 스텐트 수술; (xii) 표적 기관 손상이 있는 1형 당뇨병; 및/또는 (xiii) 표적 기관 손상이 있는 2형 당뇨병 중 하나 이상으로 정의되는 매우 높은 심혈관 위험을 갖는 방법.
- 제1항 내지 제16항 중 어느 한 항에 있어서, 상기 PCSK9 억제제가 PCSK9에 특이적으로 결합하는 항체 또는 항원-결합 단백질인 방법.
- 제17항에 있어서, 상기 항체 또는 그의 항원 결합 단편이 SEQ ID NO: 1/6을 포함하는 HCVR/LCVR 아미노산 서열 쌍의 중쇄 및 경쇄 CDR을 포함하는 방법.
- 제18항에 있어서, 상기 항체 또는 그의 항원-결합 단편이 SEQ ID NO: 2, 3, 4, 7, 8 및 10을 갖는 중쇄 및 경쇄 CDR 아미노산 서열을 포함하는 방법.
- 제19항에 있어서, 상기 항체 또는 그의 항원-결합 단편이 SEQ ID NO: 1의 아미노산 서열을 갖는 HCVR 및 SEQ ID NO: 6의 아미노산 서열을 갖는 LCVR을 포함하는 방법.
- 제17항에 있어서, 상기 항체 또는 그의 항원-결합 단편이 SEQ ID NO: 2, 3, 4, 7, 8 및 10을 갖는 중쇄 및 경쇄 CDR 아미노산 서열을 포함하는 항체와 동일한, PCSK9 상의 에피토프에 결합하는 방법.
- 제17항에 있어서, 상기 항체 또는 그의 항원-결합 단편이 PCSK9로의 결합을 위해 SEQ ID NO: 2, 3, 4, 7, 8 및 10을 갖는 중쇄 및 경쇄 CDR 아미노산 서열을 포함하는 항체와 경쟁하는 방법.
- 제17항에 있어서, PCSK9에 특이적으로 결합하는 상기 항체 또는 항원-결합 단백질이 2주마다 1회의 빈도로 약 75 ㎎의 용량으로 상기 환자에게 투여되는 방법.
- 제23항에 있어서, 5회 이상의 용량 후에 측정된 상기 환자의 LDL-C가 70 ㎎/㎗ 미만이면, 상기 약 75 ㎎ 용량이 유지되는 방법.
- 제23항에 있어서, 5회 이상의 용량 후에 측정된 상기 환자의 LDL-C가 70 ㎎/㎗ 이상으로 유지되면, 상기 약 75 ㎎ 용량을 중단한 후에, PCSK9에 특이적으로 결합하는 항체 또는 그의 항원-결합 단편이 2주마다 1회의 빈도로 약 150 ㎎의 용량으로 상기 환자에게 투여되는 방법.
- 제17항에 있어서, PCSK9에 특이적으로 결합하는 상기 항체 또는 항원-결합 단백질이 2주마다 1회의 빈도로 약 150 ㎎의 용량으로 상기 환자에게 투여되는 방법.
- 제1항 내지 제26항 중 어느 한 항에 있어서, 상기 PCSK9 억제제가 비-스타틴 지질 변형 치료법과 병용하여 상기 환자에게 투여되는 방법.
- 제27항에 있어서, 상기 비-스타틴 지질 변형 치료법이 에제티미브, 피브레이트, 니아신, 오메가-3 지방산 및 담즙산 수지로 이루어진 군으로부터 선택되는 치료제를 포함하는 방법.
- 제1항 내지 제28항 중 어느 한 항에 있어서, 상기 방법이 하기로 이루어진 군으로부터 선택되는 하나 이상의 지질 성분의 혈청 수준을 개선시키는 방법:
(a) 상기 환자의 저밀도 지질단백질 콜레스테롤(LDL-C)의 적어도 35%의 감소;
(b) 상기 환자의 아포지질단백질 B(ApoB)의 적어도 25%의 감소;
(c) 상기 환자의 비-고밀도 지질단백질 콜레스테롤(비-HDL-C)의 적어도 30%의 감소;
(d) 상기 환자의 총 콜레스테롤의 적어도 20%의 감소; 및
(e) 상기 환자의 지질단백질 a(Lp(a))의 적어도 15%의 감소. - (a) 스타틴에 불내약성이거나 스타틴 치료법에 유해 반응의 전력을 갖는 중등의, 높은 또는 매우 높은 심혈관 위험이 있는 환자를 선택하는 단계; 및 (b) 다중 용량의 항-PCSK9 항체를 용량당 약 75 내지 150 ㎎의 투여량 및 2주마다 약 1회의 투여 빈도로 상기 환자에게 투여하는 단계로서, 상기 항-PCSK9 항체를 사용한 약 24주의 치료 후에 하나 이상의 지질 성분의 혈청 수준의 개선이 하기로 이루어진 군으로부터 선택되는 단계를 포함하는 고콜레스테롤혈증, 스타틴 불내약성 환자에서의 하나 이상의 지질 성분의 혈청 수준의 개선 방법:
(a) 상기 환자의 저밀도 지질단백질 콜레스테롤(LDL-C)의 적어도 35%의 감소;
(b) 상기 환자의 아포지질단백질 B(ApoB)의 적어도 25%의 감소;
(c) 상기 환자의 비-고밀도 지질단백질 콜레스테롤(비-HDL-C)의 적어도 30%의 감소;
(d) 상기 환자의 총 콜레스테롤의 적어도 20%의 감소; 및
(e) 상기 환자의 지질단백질 a(Lp(a))의 적어도 15%의 감소. - 단일요법으로서 PCSK9 억제제를 포함하는 약제학적 조성물을 환자에게 투여하여 그에 의해 상기 환자에서 고콜레스테롤혈증을 치료하는 단계로서, 상기 조성물이 2주마다 투여되며, 상기 환자가 동시에 다른 지질 변형 치료법을 취하지 않는 단계를 포함하는 고콜레스테롤혈증의 치료를 필요로 하는 환자에서의 고콜레스테롤혈증의 치료 방법.
- 단일요법으로서 PCSK9 억제제를 포함하는 약제학적 조성물을 환자에게 투여하여 그에 의해 상기 환자에서 LDL-C를 감소시키는 단계로서, 상기 조성물이 2주마다 투여되며, 상기 환자가 동시에 다른 지질 변형 치료법을 취하지 않는 단계를 포함하는 저밀도 지질단백질 콜레스테롤(LDL-C)의 감소를 필요로 하는 환자에서의 저밀도 지질단백질 콜레스테롤(LDL-C)의 감소 방법.
- 단일요법으로서 PCSK9 억제제를 포함하는 약제학적 조성물을 약 75 ㎎의 초기 용량으로 환자에게 투여하여 그에 의해 상기 환자에서 일정한 LDL-C 수준을 유지하는 단계로서, 상기 조성물이 2주마다 투여되며, 상기 환자가 동시에 다른 지질 저하 치료법을 취하지 않는 단계를 포함하는 환자에서의 일정한 저밀도 지질단백질 콜레스테롤(LDL-C) 수준의 유지 방법.
- 제33항에 있어서, 상기 PCSK9 억제제가 적어도 24주 동안 상기 환자에게 투여되며, 상기 환자의 LDL-C 수준이 20주 동안 일정하게 유지되는 방법.
- 제31항 내지 제34항 중 어느 한 항에 있어서, 상기 환자가 스타틴에 불내약성이거나 스타틴 치료법에 유해 반응의 전력을 갖는 방법.
- 제35항에 있어서, 상기 환자가 적어도 2개의 개별적인 매일의 치료적 스타틴 섭생이 진행 중인 동안 시작되거나 증가된 골격근-관련 증상을 이전에 경험한 방법.
- 제36항에 있어서, 상기 매일의 치료적 스타틴 섭생 중 적어도 하나가 승인된 가장 낮은 1일 용량의 스타틴인 방법.
- 제36항 또는 제37항에 있어서, 상기 매일의 치료적 스타틴 섭생 중 적어도 하나가 매일 5 ㎎의 로수바스타틴, 매일 10 ㎎의 아토르바스타틴, 매일 10 ㎎의 심바스타틴, 매일 20 ㎎의 로바스타틴, 매일 40 ㎎의 프라바스타틴, 매일 40 ㎎의 플루바스타틴 및 매일 2 ㎎의 피타바스타틴으로 이루어진 군으로부터 선택되는 방법.
- 제31항 내지 제38항 중 어느 한 항에 있어서, 상기 환자가 상기 PCSK9 억제제의 투여 이전에 또는 그의 투여 시에 약 70 ㎎/㎗ 초과의 혈청 저밀도 지질단백질 콜레스테롤(LDL-C) 수준으로 정의되는 고콜레스테롤혈증을 나타내는 방법.
- 제31항 내지 제39항 중 어느 한 항에 있어서, 상기 환자가 상기 PCSK9 억제제의 투여 이전에 또는 그의 투여 시에 약 100 ㎎/㎗ 초과의 혈청 저밀도 지질단백질 콜레스테롤(LDL-C) 수준으로 정의되는 고콜레스테롤혈증을 나타내는 방법.
- 제31항 내지 제40항 중 어느 한 항에 있어서, 상기 환자가 이형접합 가족성 고콜레스테롤혈증(heFH)을 갖는 방법.
- 제31항 내지 제40항 중 어느 한 항에 있어서, 상기 환자가 가족성 고콜레스테롤혈증이 아닌(비-FH) 형태의 고콜레스테롤혈증을 갖는 방법.
- 제30항 내지 제42항 중 어느 한 항에 있어서, 상기 환자가 상기 PCSK9 억제제의 투여 이전에 또는 그의 투여 시에 1% 이상 및 5% 미만의 계산된 10년 내 치명적 심혈관 질병 위험 SCORE로 정의되는 중등의 심혈관 위험을 갖는 방법.
- 제30항 내지 제42항 중 어느 한 항에 있어서, 상기 환자가 상기 PCSK9 억제제의 투여 이전에 또는 그의 투여 시에 (i) 중등의 만성 신장 질병, (ii) 표적 기관 손상이 없는 1형 당뇨병, (iii) 표적 기관 손상이 없는 2형 당뇨병 및/또는 (iv) heFH 중 하나 이상과 함께, 5% 이상의 계산된 10년 내 치명적 심혈관 질병 위험 SCORE로 정의되는 높은 심혈관 위험을 갖는 방법.
- 제30항 내지 제42항 중 어느 한 항에 있어서, 상기 환자가 PCSK9 억제제의 투여 이전에 또는 그의 투여 시에 (i) 문서화된 관상동맥 심장 질병; (ii) 허혈성 뇌졸중; (iii) 말초 뇌졸중; (iv) 말초 동맥 질병(PAD); (v) 일과성 허혈 발작(TIA); (vi) 복부대동맥류; (vii) 증상이 없는 50% 초과의 경동맥 폐색; (viii) 경동맥내막절제술; (ix) 경동맥 스텐트 수술; (x) 신장 동맥 협착; (xi) 신장 동맥 스텐트 수술; (xii) 표적 기관 손상이 있는 1형 당뇨병; 및/또는 (xiii) 표적 기관 손상이 있는 2형 당뇨병 중 하나 이상으로 정의되는 매우 높은 심혈관 위험을 갖는 방법.
- 제30항 내지 제45항 중 어느 한 항에 있어서, 상기 PCSK9 억제제가 PCSK9에 특이적으로 결합하는 항체 또는 항원-결합 단백질인 방법.
- 제46항에 있어서, 상기 항체 또는 그의 항원 결합 단편이 SEQ ID NO: 1/6을 포함하는 HCVR/LCVR 아미노산 서열 쌍의 중쇄 및 경쇄 CDR을 포함하는 방법.
- 제47항에 있어서, 상기 항체 또는 그의 항원-결합 단편이 SEQ ID NO: 2, 3, 4, 7, 8 및 10을 갖는 중쇄 및 경쇄 CDR 아미노산 서열을 포함하는 방법.
- 제48항에 있어서, 상기 항체 또는 그의 항원-결합 단편이 SEQ ID NO: 1의 아미노산 서열을 갖는 HCVR 및 SEQ ID NO: 6의 아미노산 서열을 갖는 LCVR을 포함하는 방법.
- 제46항에 있어서, 상기 항체 또는 그의 항원-결합 단편이 SEQ ID NO: 2, 3, 4, 7, 8 및 10을 갖는 중쇄 및 경쇄 CDR 아미노산 서열을 포함하는 항체와 동일한, PCSK9 상의 에피토프에 결합하는 방법.
- 제46항에 있어서, 상기 항체 또는 그의 항원-결합 단편이 PCSK9로의 결합을 위해 SEQ ID NO: 2, 3, 4, 7, 8 및 10을 갖는 중쇄 및 경쇄 CDR 아미노산 서열을 포함하는 항체와 경쟁하는 방법.
- 제46항에 있어서, PCSK9에 특이적으로 결합하는 상기 항체 또는 항원-결합 단백질이 2주마다 1회의 빈도로 약 75 ㎎의 용량으로 상기 환자에게 투여되는 방법.
- 제52항에 있어서, 5회 이상의 용량 후에 측정된 상기 환자의 LDL-C가 70 ㎎/㎗ 미만이면, 상기 약 75 ㎎ 용량이 유지되는 방법.
- 제52항에 있어서, 5회 이상의 용량 후에 측정된 상기 환자의 LDL-C가 70 ㎎/㎗ 이상으로 유지되면, 상기 약 75 ㎎ 용량을 중단한 후에, PCSK9에 특이적으로 결합하는 항체 또는 그의 항원-결합 단편이 2주마다 1회의 빈도로 약 150 ㎎의 용량으로 상기 환자에게 투여되는 방법.
- 제46항에 있어서, PCSK9에 특이적으로 결합하는 상기 항체 또는 항원-결합 단백질이 2주마다 1회의 빈도로 약 150 ㎎의 용량으로 상기 환자에게 투여되는 방법.
- 제31항 내지 제55항 중 어느 한 항에 있어서, 상기 방법이 하기로 이루어진 군으로부터 선택되는 하나 이상의 지질 성분의 혈청 수준을 개선시키는 방법:
(a) 상기 환자의 저밀도 지질단백질 콜레스테롤(LDL-C)의 적어도 35%의 감소;
(b) 상기 환자의 아포지질단백질 B(ApoB)의 적어도 25%의 감소;
(c) 상기 환자의 비-고밀도 지질단백질 콜레스테롤(비-HDL-C)의 적어도 30%의 감소;
(d) 상기 환자의 총 콜레스테롤의 적어도 20%의 감소; 및
(e) 상기 환자의 지질단백질 a(Lp(a))의 적어도 15%의 감소. - 단일요법으로서 항-PCSK9 항체 또는 항원-결합 단백질을 포함하는 약제학적 조성물을 약 75 ㎎의 용량으로 환자에게 투여하여, 그에 의해 상기 환자에서 유리 PCSK9 수준을 감소시키는 단계로서, 상기 조성물이 2주마다 투여되며, 상기 환자가 동시에 다른 지질 저하 치료법을 취하지 않는 단계를 포함하는 환자에서의 유리 PCSK9 수준의 감소 방법.
- 단일요법으로서 다중 용량의 항-PCSK9 항체를 용량당 약 75 내지 150 ㎎의 투여량 및 2주마다 약 1회의 투여 빈도로 환자에게 투여하는 단계로서, 상기 환자가 동시에 다른 지질 변형 치료법을 취하지 않고, 항-PCSK9 항체를 사용한 약 24주의 치료 후에 하나 이상의 지질 성분의 혈청 수준의 개선이 하기로 이루어진 군으로부터 선택되는 단계를 포함하는 하나 이상의 지질 성분의 혈청 수준의 개선을 필요로 하는 환자에서의 하나 이상의 지질 성분의 혈청 수준의 개선 방법:
(a) 환자의 저밀도 지질단백질 콜레스테롤(LDL-C)의 적어도 35%의 감소;
(b) 환자의 아포지질단백질 B(ApoB)의 적어도 25%의 감소;
(c) 환자의 비-고밀도 지질단백질 콜레스테롤(비-HDL-C)의 적어도 30%의 감소;
(d) 환자의 총 콜레스테롤의 적어도 20%의 감소; 및
(e) 환자의 지질단백질 a(Lp(a))의 적어도 15%의 감소.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020227011822A KR20220048051A (ko) | 2013-10-11 | 2014-10-10 | 고지혈증을 치료하기 위한 pcsk9 억제제의 용도 |
Applications Claiming Priority (17)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361890154P | 2013-10-11 | 2013-10-11 | |
| US61/890,154 | 2013-10-11 | ||
| US201461923103P | 2014-01-02 | 2014-01-02 | |
| US61/923,103 | 2014-01-02 | ||
| US201461955514P | 2014-03-19 | 2014-03-19 | |
| US61/955,514 | 2014-03-19 | ||
| US201462004620P | 2014-05-29 | 2014-05-29 | |
| US62/004,620 | 2014-05-29 | ||
| US201462025104P | 2014-07-16 | 2014-07-16 | |
| US62/025,104 | 2014-07-16 | ||
| EP14306221.4 | 2014-07-31 | ||
| EP14306221 | 2014-07-31 | ||
| US201462054571P | 2014-09-24 | 2014-09-24 | |
| US62/054,571 | 2014-09-24 | ||
| EP14306584.5 | 2014-10-09 | ||
| EP14306584 | 2014-10-09 | ||
| PCT/US2014/060109 WO2015054619A2 (en) | 2013-10-11 | 2014-10-10 | Use of a pcsk9 inhibitor to treat hyperlipidemia |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020227011822A Division KR20220048051A (ko) | 2013-10-11 | 2014-10-10 | 고지혈증을 치료하기 위한 pcsk9 억제제의 용도 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20160062166A true KR20160062166A (ko) | 2016-06-01 |
Family
ID=52813751
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020227011822A KR20220048051A (ko) | 2013-10-11 | 2014-10-10 | 고지혈증을 치료하기 위한 pcsk9 억제제의 용도 |
| KR1020167012099A KR20160062166A (ko) | 2013-10-11 | 2014-10-10 | 고지혈증을 치료하기 위한 pcsk9 억제제의 용도 |
| KR1020237026483A KR20230119045A (ko) | 2013-10-11 | 2014-10-10 | 고지혈증을 치료하기 위한 pcsk9 억제제의 용도 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020227011822A KR20220048051A (ko) | 2013-10-11 | 2014-10-10 | 고지혈증을 치료하기 위한 pcsk9 억제제의 용도 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020237026483A KR20230119045A (ko) | 2013-10-11 | 2014-10-10 | 고지혈증을 치료하기 위한 pcsk9 억제제의 용도 |
Country Status (14)
| Country | Link |
|---|---|
| US (1) | US20150140002A1 (ko) |
| EP (2) | EP3055333B1 (ko) |
| JP (2) | JP6846931B2 (ko) |
| KR (3) | KR20220048051A (ko) |
| CN (3) | CN105814085A (ko) |
| AU (2) | AU2014331754B2 (ko) |
| CA (1) | CA2926942A1 (ko) |
| EA (1) | EA037526B1 (ko) |
| ES (1) | ES2914978T3 (ko) |
| IL (1) | IL244995B (ko) |
| MX (3) | MX2016004580A (ko) |
| PL (2) | PL3055333T4 (ko) |
| TW (1) | TWI669131B (ko) |
| WO (1) | WO2015054619A2 (ko) |
Families Citing this family (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20130064834A1 (en) | 2008-12-15 | 2013-03-14 | Regeneron Pharmaceuticals, Inc. | Methods for treating hypercholesterolemia using antibodies to pcsk9 |
| JO3672B1 (ar) | 2008-12-15 | 2020-08-27 | Regeneron Pharma | أجسام مضادة بشرية عالية التفاعل الكيماوي بالنسبة لإنزيم سبتيليسين كنفرتيز بروبروتين / كيكسين نوع 9 (pcsk9). |
| WO2012101251A1 (en) | 2011-01-28 | 2012-08-02 | Sanofi | Human antibodies to pcsk9 for use in methods of treatment based on particular dosage regimens |
| AR087305A1 (es) | 2011-07-28 | 2014-03-12 | Regeneron Pharma | Formulaciones estabilizadas que contienen anticuerpos anti-pcsk9, metodo de preparacion y kit |
| CN111789944A (zh) | 2011-09-16 | 2020-10-20 | 瑞泽恩制药公司 | 用前蛋白转化酶枯草溶菌素-9(PCSK9)抑制剂降低脂蛋白(a)水平的方法 |
| US9255154B2 (en) | 2012-05-08 | 2016-02-09 | Alderbio Holdings, Llc | Anti-PCSK9 antibodies and use thereof |
| US10058630B2 (en) * | 2012-10-22 | 2018-08-28 | Concievalve, Llc | Methods for inhibiting stenosis, obstruction, or calcification of a stented heart valve or bioprosthesis |
| US10111953B2 (en) | 2013-05-30 | 2018-10-30 | Regeneron Pharmaceuticals, Inc. | Methods for reducing remnant cholesterol and other lipoprotein fractions by administering an inhibitor of proprotein convertase subtilisin kexin-9 (PCSK9) |
| WO2014197752A1 (en) | 2013-06-07 | 2014-12-11 | Regeneron Pharmaceuticals, Inc. | Methods fo inhibting atherosclerosis by administering an inhibitor of pcsk9 |
| AU2014348765A1 (en) | 2013-11-12 | 2016-06-09 | Regeneron Pharmaceuticals, Inc. | Dosing regimens for use with PCSK9 inhibitors |
| CA2954767A1 (en) * | 2014-07-14 | 2016-01-21 | Amgen Inc. | Crystalline antibody formulations |
| KR20230074283A (ko) | 2014-07-16 | 2023-05-26 | 사노피 바이오테크놀로지 | 이형접합성 가족성 고콜레스테롤혈증(heFH) 환자의 치료방법 |
| JP2018516624A (ja) * | 2015-04-15 | 2018-06-28 | コンシーヴァルブ エルエルシー | 自然心臓弁、ステント装着された心臓弁またはバイオプロテーゼの狭窄、閉塞または石灰化を抑制するためのデバイスおよび方法 |
| CN104861071B (zh) * | 2015-04-27 | 2019-04-12 | 南京师范大学 | 针对pcsk9的全人源单克隆抗体的可变区基因及其应用 |
| CN107922507B (zh) | 2015-08-18 | 2022-04-05 | 瑞泽恩制药公司 | 抗pcsk9抑制性抗体用来治疗接受脂蛋白单采的高脂血症患者 |
| JP2020502991A (ja) | 2016-09-20 | 2020-01-30 | ウーシー バイオロジクス アイルランド リミテッド | 新規抗pcsk9抗体 |
| WO2018189705A1 (en) | 2017-04-13 | 2018-10-18 | Cadila Healthcare Limited | Novel peptide based pcsk9 vaccine |
| EP3615694B1 (en) | 2017-04-25 | 2022-03-30 | The Brigham and Women's Hospital, Inc. | Il-8, il-6, il-1b and tet2 and dnmt3a in atherosclerosis |
| CN107090474A (zh) * | 2017-05-22 | 2017-08-25 | 山东大学 | 一种腹主动脉瘤疾病动物模型的制备方法 |
| WO2018228406A1 (zh) * | 2017-06-14 | 2018-12-20 | 江苏恒瑞医药股份有限公司 | Pcsk9抗体、其抗原结合片段及其医药用途 |
| WO2019173530A1 (en) * | 2018-03-06 | 2019-09-12 | Sanofi Biotechnology | Use of pcsk9 inhibitor for reducing cardiovascular risk |
| WO2020150473A2 (en) | 2019-01-18 | 2020-07-23 | Dogma Therapeutics, Inc. | Pcsk9 inhibitors and methods of use thereof |
| IL292973A (en) * | 2019-11-18 | 2022-07-01 | Ad Pharmaceuticals Co Ltd | Anti-pcsk9 antibody and its use |
| KR20220125249A (ko) * | 2019-12-10 | 2022-09-14 | 리제너론 파아마슈티컬스, 인크. | 동형접합 가족성 고콜레스테롤혈증을 치료하기 위한 pcsk9 억제제의 용도 |
| CN114277032A (zh) * | 2021-12-31 | 2022-04-05 | 华中科技大学同济医学院附属协和医院 | 一种低密度脂蛋白受体基因突变体及其应用 |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6596541B2 (en) | 2000-10-31 | 2003-07-22 | Regeneron Pharmaceuticals, Inc. | Methods of modifying eukaryotic cells |
| US8357371B2 (en) * | 2008-12-15 | 2013-01-22 | Regeneron Pharmaceuticals, Inc. | Methods for treating hypercholesterolemia using antibodies to PCSK9 |
| US20130064834A1 (en) * | 2008-12-15 | 2013-03-14 | Regeneron Pharmaceuticals, Inc. | Methods for treating hypercholesterolemia using antibodies to pcsk9 |
| JO3672B1 (ar) * | 2008-12-15 | 2020-08-27 | Regeneron Pharma | أجسام مضادة بشرية عالية التفاعل الكيماوي بالنسبة لإنزيم سبتيليسين كنفرتيز بروبروتين / كيكسين نوع 9 (pcsk9). |
| WO2012101251A1 (en) * | 2011-01-28 | 2012-08-02 | Sanofi | Human antibodies to pcsk9 for use in methods of treatment based on particular dosage regimens |
| JOP20200043A1 (ar) * | 2011-05-10 | 2017-06-16 | Amgen Inc | طرق معالجة أو منع الاضطرابات المختصة بالكوليسترول |
| US20130006482A1 (en) * | 2011-06-30 | 2013-01-03 | Ramadev Burigsay Hukkeri | Guidance system for a mobile machine |
| AR087305A1 (es) | 2011-07-28 | 2014-03-12 | Regeneron Pharma | Formulaciones estabilizadas que contienen anticuerpos anti-pcsk9, metodo de preparacion y kit |
| CN111789944A (zh) * | 2011-09-16 | 2020-10-20 | 瑞泽恩制药公司 | 用前蛋白转化酶枯草溶菌素-9(PCSK9)抑制剂降低脂蛋白(a)水平的方法 |
| TWI682780B (zh) * | 2013-05-30 | 2020-01-21 | 美商再生元醫藥公司 | 醫藥組成物用於製造治療與pcsk9功能獲得性突變有關之體染色體顯性高膽固醇血症的藥物之用途 |
-
2014
- 2014-10-10 PL PL14802527T patent/PL3055333T4/pl unknown
- 2014-10-10 EP EP14802527.3A patent/EP3055333B1/en active Active
- 2014-10-10 CN CN201480066894.2A patent/CN105814085A/zh active Pending
- 2014-10-10 CN CN202210729601.0A patent/CN115154599A/zh active Pending
- 2014-10-10 KR KR1020227011822A patent/KR20220048051A/ko not_active Application Discontinuation
- 2014-10-10 KR KR1020167012099A patent/KR20160062166A/ko not_active IP Right Cessation
- 2014-10-10 PL PL19210918T patent/PL3689913T3/pl unknown
- 2014-10-10 ES ES19210918T patent/ES2914978T3/es active Active
- 2014-10-10 AU AU2014331754A patent/AU2014331754B2/en active Active
- 2014-10-10 MX MX2016004580A patent/MX2016004580A/es active IP Right Grant
- 2014-10-10 US US14/511,975 patent/US20150140002A1/en not_active Abandoned
- 2014-10-10 KR KR1020237026483A patent/KR20230119045A/ko not_active Application Discontinuation
- 2014-10-10 EA EA201690754A patent/EA037526B1/ru unknown
- 2014-10-10 CA CA2926942A patent/CA2926942A1/en active Pending
- 2014-10-10 EP EP19210918.9A patent/EP3689913B1/en active Active
- 2014-10-10 WO PCT/US2014/060109 patent/WO2015054619A2/en active Application Filing
- 2014-10-10 CN CN202210762455.1A patent/CN115192704A/zh active Pending
- 2014-10-10 JP JP2016521604A patent/JP6846931B2/ja active Active
- 2014-10-13 TW TW103135495A patent/TWI669131B/zh active
-
2016
- 2016-04-08 MX MX2022013172A patent/MX2022013172A/es unknown
- 2016-04-08 MX MX2020004023A patent/MX2020004023A/es unknown
- 2016-04-10 IL IL244995A patent/IL244995B/en active IP Right Grant
-
2019
- 2019-08-09 JP JP2019146940A patent/JP6994484B2/ja active Active
-
2020
- 2020-06-02 AU AU2020203636A patent/AU2020203636B2/en active Active
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2020203636B2 (en) | Use of a PCSK9 inhibitor to treat hyperlipidemia | |
| US20230406957A1 (en) | Dosing regimens for use with pcsk9 inhibitors | |
| US20180296672A1 (en) | Methods for Treating Patients with Hypercholesterolemia that is not Adequately Controlled by Moderate-Dose Statin Therapy | |
| KR20160132459A (ko) | 심혈관 위험을 감소시키는 방법 | |
| US20150283236A1 (en) | Methods for treating subjects with primary hypercholesterolemia that is not adequately controlled | |
| KR20170028441A (ko) | 고콜레스테롤혈증이 있는 심혈관 위험이 높은 환자를 치료하는 방법 | |
| AU2016308111A1 (en) | Anti-PCSK9 inhibitory antibodies for treating patients with hyperlipidemia undergoing lipoprotein apheresis | |
| IL271456A (en) | A pharmaceutical composition containing PCSK9 inhibitor for use in the treatment of hyperlipidemia |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| AMND | Amendment | ||
| E902 | Notification of reason for refusal | ||
| AMND | Amendment | ||
| E601 | Decision to refuse application | ||
| AMND | Amendment | ||
| X601 | Decision of rejection after re-examination |