KR20150126595A - 간 질환 또는 증상의 치료를 위한 용도 및 방법 - Google Patents
간 질환 또는 증상의 치료를 위한 용도 및 방법 Download PDFInfo
- Publication number
- KR20150126595A KR20150126595A KR1020157019648A KR20157019648A KR20150126595A KR 20150126595 A KR20150126595 A KR 20150126595A KR 1020157019648 A KR1020157019648 A KR 1020157019648A KR 20157019648 A KR20157019648 A KR 20157019648A KR 20150126595 A KR20150126595 A KR 20150126595A
- Authority
- KR
- South Korea
- Prior art keywords
- liver
- pentamidine
- administered
- diamidine
- metastasis
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/155—Amidines (), e.g. guanidine (H2N—C(=NH)—NH2), isourea (N=C(OH)—NH2), isothiourea (—N=C(SH)—NH2)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/095—Sulfur, selenium, or tellurium compounds, e.g. thiols
- A61K31/10—Sulfides; Sulfoxides; Sulfones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/28—Compounds containing heavy metals
- A61K31/282—Platinum compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/337—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having four-membered rings, e.g. taxol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/706—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom
- A61K31/7064—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines
- A61K31/7068—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines having oxo groups directly attached to the pyrimidine ring, e.g. cytidine, cytidylic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P39/00—General protective or antinoxious agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P39/00—General protective or antinoxious agents
- A61P39/02—Antidotes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Abstract
본원은 간 질환 또는 증상의 치료를 위한 경구의 다이아미딘 또는 이의 약학적으로 허용가능한 염의 방법 및 용도에 관한 것이다.
Description
본원은 간 질환 또는 증상의 치료를 위한 용도, 방법 및 약학 조성물에 관한 것이다.
펜타미딘은 항원충제로서 비경구 투여(정맥내 및 기도내)용으로 승인되었다. 비경구(정맥내) 펜타미딘은 또한 현재 폐암, 췌장암 및 결장암용으로 개발되고 있다.
과학 문헌에 기초하면, 펜타미딘은 그 불량한 흡수율로 인해 경구 투여용으로 적합하지 않다는 것이 널리 인식되어 있다(문헌[Sieve et al.:JOPON, Vol.11, Vol.2 (April) 1994: pp85-87; Masur H: N. Eng J. Med. 327: 1853-1860 (1992)]; [Abdi et al. Handbook of Drugs for tropical parasitic Infections ISBN0-7484-0168-7; pp117-122]).
그러나, 경구 형태로 환자에게 제공하는 것이 바람직하다. 경구 형태와 관련된 이점은 높은 환자 순응도 및 투여 용이성을 들 수 있다.
하나의 양태에서, 간 증상의 치료를 필요로 하는 환자에게, 치료 효과량의 하나 이상의 다이아미딘 유사체 또는 이의 약학적으로 허용가능한 염을 경구 투여하는 단계를 포함하는 하나 이상의 간 증상의 표적 치료 방법이 제공되며, 이때 상기 간 증상은 간암, 간 전이, 고 콜레스테롤, 알코올성 간 질환, 간경변, 낭종, 지방간 질환(NAFLD), 섬유증, 황달, 원발성 경화성 담관염(PSC), 혈색소 침착증, 원발성 담즙성 간경변 또는 알파-1 항트립신 결핍증이다.
하나의 양태에서, 간 증상의 치료를 필요로 하는 환자의 하나 이상의 간 증상의 표적 치료를 위한, 치료 효과량의 하나 이상의 다이아미딘 유사체 또는 이의 약학적으로 허용가능한 염의 경구 용도가 제공되며, 이때 상기 간 증상은 간암, 간 전이, 고 콜레스테롤, 알코올성 간 질환, 간경변, 낭종, 지방간 질환(NAFLD), 섬유증, 황달, 원발성 경화성 담관염(PSC), 혈색소 침착증, 원발성 담즙성 간경변 또는 알파-1 항트립신 결핍증이다.
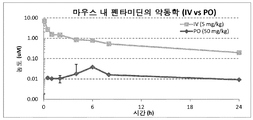
도 1은 마우스 내 펜타미딘의 약동학(IV 대 PO)을 나타낸다.
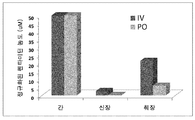
도 2는 간, 신장 및 근육 조직에 PO 투여 후 펜타미딘 수준을 나타낸다.
도 3은 상이한 투여 처방(IV 단독 대 IV에 이은 PO) 후 펜타미딘 마우스 간 농도를 나타낸다.
도 4는 상이한 투여 처방(IV 단독 대 IV에 이은 PO) 후 펜타미딘 마우스 근육 농도를 나타낸다.
도 5는 상이한 투여 처방(IV 단독 대 IV에 이은 PO) 후 펜타미딘 마우스 신장 농도를 나타낸다.
도 6은 상이한 투여 처방(IV 단독 대 IV에 이은 PO) 후 펜타미딘 마우스 폐 농도를 나타낸다.
도 7은 투여 처방에 따른 개 내 펜타미딘의 약동학을 나타낸다.
도 8은 상이한 투여 처방(2일간 IV 대 3일간 PO) 후 펜타미딘 조직 분포를 나타낸다.
도 9는 최종 투여 후 24시간에서 생체분포 프로파일(50 μM의 등가의 간 농도에 대해 표준화됨): 펜타미딘(PENTAMIDINE) PO 투여 대 IV 투여를 나타낸다.
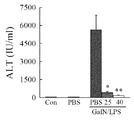
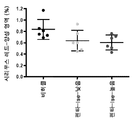
도 10은 비주사 대조용(Con) 및 PBS 단독 주사(PBS) 마우스, 및 GaIN/LPS-처리되고 25 및 40 mg/kg의 PBS 또는 펜타미딘으로 공-처리된 마우스의 혈청 ALT를 나타낸다(PBS + GaIN/LPS에 대비하여 *P<0.006, **P<0.0005; n=3-7).
도 11은 마우스에 대한 조직 개선을 나타낸다. 간에 무-비히클(PBS)(A), 또는 GaIN/LPS 공격 후 비히클(PBS) 처리(C), 25 또는 40 mg/kg의 펜타미딘 처리(B)(D) 후 마우스의 ALT 수준을 나타낸다.
도 12는 TUNEL-양성 세포의 개수가 펜타미딘에 의해 현저하게 감소되었음을 나타낸다. 대조용 및 처리된 마우스(PBS + GalN/LPS에 대비하여 *P<0.0002; n=6-7)의 간 내 고 전력 전계(HPF; 200X) 당 TUNEL-양성 세포의 개수를 나타낸다.
도 13은 기재된 바와 같이 PBS, 펜타미딘 이세티오네이트 40 mg/kg, 또는 펜타-HCL 및 펜타-Tos 20 및 40 mg/kg으로 전처리한 후 GaIN/LPS(PBS + GalN/LPS에 대비하여 *P<0.008; n=3-5) 투여한 마우스의 혈청 ALT를 나타낸다.
도 14는 이세티오네이트 염(◇), HCl 염(□) 및 토실레이트 염(△)에 대해 마우스에 200 mg/kg의 PO 투여 후 혈액 펜타미딘 PK 프로파일을 나타낸다.
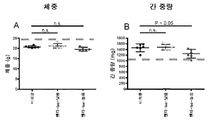
도 15는 비히클 또는 펜타미딘으로 처리된 마우스에 대한 체중(A) 및 간 중량(B)을 나타낸다. 도 15a 및 15b에서 점선은 과거 대조용에 의해 수득된 평균값을 나타낸다.
도 16은 비히클 또는 펜타미딘으로 처리된 간의 시리우스 레드 염색(Sirius Red Staining)을 나타낸다.
도 2는 간, 신장 및 근육 조직에 PO 투여 후 펜타미딘 수준을 나타낸다.
도 3은 상이한 투여 처방(IV 단독 대 IV에 이은 PO) 후 펜타미딘 마우스 간 농도를 나타낸다.
도 4는 상이한 투여 처방(IV 단독 대 IV에 이은 PO) 후 펜타미딘 마우스 근육 농도를 나타낸다.
도 5는 상이한 투여 처방(IV 단독 대 IV에 이은 PO) 후 펜타미딘 마우스 신장 농도를 나타낸다.
도 6은 상이한 투여 처방(IV 단독 대 IV에 이은 PO) 후 펜타미딘 마우스 폐 농도를 나타낸다.
도 7은 투여 처방에 따른 개 내 펜타미딘의 약동학을 나타낸다.
도 8은 상이한 투여 처방(2일간 IV 대 3일간 PO) 후 펜타미딘 조직 분포를 나타낸다.
도 9는 최종 투여 후 24시간에서 생체분포 프로파일(50 μM의 등가의 간 농도에 대해 표준화됨): 펜타미딘(PENTAMIDINE) PO 투여 대 IV 투여를 나타낸다.
도 10은 비주사 대조용(Con) 및 PBS 단독 주사(PBS) 마우스, 및 GaIN/LPS-처리되고 25 및 40 mg/kg의 PBS 또는 펜타미딘으로 공-처리된 마우스의 혈청 ALT를 나타낸다(PBS + GaIN/LPS에 대비하여 *P<0.006, **P<0.0005; n=3-7).
도 11은 마우스에 대한 조직 개선을 나타낸다. 간에 무-비히클(PBS)(A), 또는 GaIN/LPS 공격 후 비히클(PBS) 처리(C), 25 또는 40 mg/kg의 펜타미딘 처리(B)(D) 후 마우스의 ALT 수준을 나타낸다.
도 12는 TUNEL-양성 세포의 개수가 펜타미딘에 의해 현저하게 감소되었음을 나타낸다. 대조용 및 처리된 마우스(PBS + GalN/LPS에 대비하여 *P<0.0002; n=6-7)의 간 내 고 전력 전계(HPF; 200X) 당 TUNEL-양성 세포의 개수를 나타낸다.
도 13은 기재된 바와 같이 PBS, 펜타미딘 이세티오네이트 40 mg/kg, 또는 펜타-HCL 및 펜타-Tos 20 및 40 mg/kg으로 전처리한 후 GaIN/LPS(PBS + GalN/LPS에 대비하여 *P<0.008; n=3-5) 투여한 마우스의 혈청 ALT를 나타낸다.
도 14는 이세티오네이트 염(◇), HCl 염(□) 및 토실레이트 염(△)에 대해 마우스에 200 mg/kg의 PO 투여 후 혈액 펜타미딘 PK 프로파일을 나타낸다.
도 15는 비히클 또는 펜타미딘으로 처리된 마우스에 대한 체중(A) 및 간 중량(B)을 나타낸다. 도 15a 및 15b에서 점선은 과거 대조용에 의해 수득된 평균값을 나타낸다.
도 16은 비히클 또는 펜타미딘으로 처리된 간의 시리우스 레드 염색(Sirius Red Staining)을 나타낸다.
본 발명자들은 다이아미딘(예컨대, 펜타미딘)의 경구 투여(통상의 비경구 투여 대비)가 간에 우선적으로 분포됨을 확인하였다.
본 발명자들은 다이아미딘(예컨대, 펜타미딘)의 경구 투여(통상의 비경구 투여 대비)가 치료 농도에서 간에 우선적으로 분포됨을 확인하였다.
경구 투여는 다이아미딘 유사체를 입으로 투여하는 것을 의미한다. 하나의 양태에서, 환자는 다이아미딘 유사체를 삼킨다. 경구 투여는 정제, 캡슐, 엘릭시르 또는 용액, 또는 다이아미딘 유사체의 다른 액체 형태를 입으로 투여하는 것을 포함한다. 하나의 양태에서, 경구 투여는 또한 구강(buccal)(볼 내측에 용해됨), 구순하(입술 밑에 용해됨) 및 설하 투여(혀 밑에 용해됨)를 포함한다.
하나의 실시양태에서, 다이아미딘(예컨대, 펜타미딘)의 수준은 다른 조직 및 기관의 다이아미딘(예컨대, 펜타미딘) 수준에 비해 환자의 간에서 증가한다.
하나의 실시양태에서, 하나 이상의 간 증상 또는 질환을 앓는 환자의 간에 하나 이상의 다이아미딘 유사체(예컨대, 펜타미딘)를 선택적으로 전달하기 위한 치료 효과량의 하나 이상의 다이아미딘 유사체(예컨대, 펜타미딘) 또는 이의 약학적으로 허용가능한 염의 경구 형태의 용도가 제공된다.
하나의 실시양태에서, 치료 효과량의 하나 이상의 다이아미딘 유사체(예컨대, 펜타미딘) 또는 이의 약학적으로 허용가능한 염을 경구 투여하는 것을 포함하는 하나 이상의 간 증상 또는 질환을 앓는 환자의 간에 하나 이상의 다이아미딘 유사체(예컨대, 펜타미딘)를 선택적으로 전달하기 위한 방법이 제공된다.
하나의 실시양태에서, 간 손상의 감소 또는 방지를 필요로 하는 환자에게, 치료 효과량의 하나 이상의 다이아미딘 유사체(예컨대, 펜타미딘) 또는 이의 약학적으로 허용가능한 염을 경구 투여하는 것을 포함하는 간 손상을 감소 또는 방지하기 위한 방법이 제공된다.
간암 및 간 전이의 치료
다이아미딘(예컨대, 펜타미딘)은 경구 투여 후 치료 농도가 간에 우선적으로 축적되기 때문에, 이는 간암 또는 간 전이의 치료를 위해 경구로 사용될 수 있다.
하나의 양태에서, 간암은 간내 담도암 또는 간암종이다.
하나의 양태에서, 간 전이는 간 지배적 암 전이 또는 간 제한적 암 전이이다.
종양학에서, 대부분의 전이는 중요한 기관인 간에서 발생한다. 신속하게도, 간에 전이된 1차 암은 생명을 위협하게 된다. 이 때문에, 항암제를 간에 직접적으로 전달하는 것을 목적으로 하는 것이 바람직하다. 많은 항암 약물이 신체 모든 곳의 건강한 세포에 2차 영향, 즉 그 작용과 관련된 독성을 가질 수 있기 때문에, 간에 항암제를 표적 전달하는 것이 바람직하다. 하나의 실시양태에서, 간 전이, 간 지배적 암 전이 또는 간 제한적 암 전이의 표적 치료를 필요로 하거나 또는 간 전이, 간 지배적 암 전이 또는 간 제한적 암 전이의 진단을 받은 환자를 위한, 치료 효과량의 하나 이상의 다이아미딘(예컨대, 펜타미딘) 또는 이의 약학적으로 허용가능한 염의 경구 용도가 제공된다.
하나의 실시양태에서, 간 지배적 대장암 전이를 치료하기 위한 본원에 정의된 용도 또는 방법이 제공된다.
간 지배적 암 전이는 간에 주로 위치하는 전이(예컨대, 병변의 크기, 개수 및 유형의 결정)를 의미한다.
간 제한적 전이는 간에만 위치하는 전이(예컨대, 병변의 크기, 개수 및 유형의 결정)를 의미한다.
하나의 양태에서, 환자의 암 증상 또는 상태는 고형 종양의 반응 평가 기준(Response Evaluation Criteria in Solid Tumours, RECIST)에 따라 결정한다. 예를 들어, 문헌[EUROPEAN JOURNAL OF CANCER 45 (2009) 228-247]을 참조한다.
하나의 실시양태에서, 전이된 암을 치료하기 위한 본원에 정의된 용도 또는 방법이 제공된다.
하나의 양태에서, 환자는 다음 중 하나 이상의 증상을 갖는다:
a. 수술이 불가능한 간 종양, 사소한 폐 또는 뼈 전이, 또는 비정상적인 간 효소 수준.
하나의 실시양태에서, 1차 암이 편평 세포 암종 세포, 림프절 세포의 큰 세포 암종, 유방암 세포, 대장암 세포, 폐암 세포, 흑색종 세포, 췌장암 세포, 백혈병 세포, 비-소세포 폐암 세포, 대장암 세포, 중추 신경계(CNS) 암 세포, 난소암 세포, 신장암 세포 또는 전립선암 세포로부터 유래하는 본원에 정의된 용도 또는 방법이 제공된다.
하나의 양태에서, 암 환자는 상기 질환이 안정되거나 종양 진행(예컨대, 질병의 진행, 새로운 병변의 출현 등)이 존재하는 한 치료된다.
하나의 실시양태에서, 1차 암이 췌장암 세포, 결장암 세포, 유방암 세포 또는 난소암 세포로부터 유래하는 본원에 정의된 용도 또는 방법이 제공된다.
하나의 실시양태에서, 다이아미딘 유사체(예컨대, 펜타미딘)는 표준 화학 요법과 조합하여 사용된다.
하나의 실시양태에서, 하나 이상의 다이아미딘 유사체(예컨대, 펜타미딘) 또는 이의 약학적으로 허용가능한 염 및 암 치료용으로 표시된 하나 이상의 추가적인 치료제를 포함하는 경구용 약학 조성물이 제공된다.
하나의 실시양태에서, 하나 이상의 다이아미딘 유사체(예컨대, 펜타미딘) 또는 이의 약학적으로 허용가능한 염 및 암 세포의 증식을 억제하거나 또는 암 치료를 위한 하나 이상의 추가적인 치료제를 포함하는 경구용 약학 조성물이 제공된다.
기타 간 증상 또는 질환
다이아미딘(예컨대, 펜타미딘)은 경구 투여 후 간에 우선적으로 축적되기 때문에, 이는 또한 간과 관련된 다른 증상의 치료에 사용될 수도 있다. 하나의 실시양태에서, 간 증상은 고 콜레스테롤, 알코올성 간 질환(예컨대, 급성 알코올성 간염), 간경변, 낭종, 원발성 담즙성 간경변, 지방간 질환(NAFLD), 섬유증, 황달, 원발성 경화성 담관염(PSC), 혈색소 침착증, 원발성 담즙성 간경변, 또는 알파-1 항트립신 결핍증이다. 간 증상에 대해서는 웹 사이트 [http://www.rightdiagnosis.com/l/liver/basics.htm]를 참조한다.
하나의 양태에서, 간 손상은 표준 간 기능 검사에 의하거나 영상(CT, X-레이, MRI 등)에 의해 결정한다. 간 기능 검사는 빌리루빈, 암모니아, 감마-글루타밀 트랜스퍼라제(GGT), 알라닌 아미노전이효소(ALT 또는 SGPT), 아스파르테이트 아미노트랜스퍼라제(AST 또는 SGOT) 및 알칼리 포스파타제(ALP)를 포함한다.
하나의 양태에서, 본원에 정의된 용도 또는 방법에서, 환자는 바이러스성 간염(예컨대, A, B, C, D, E 또는 G)의 치료를 추구하지 않는다.
비-알코올성 지방간 질환(
NAFLD
) 및 비-알코올
성
지방간염(
NASH
)
NAFLD 및 이의 더 심각한 형태인 NASH는 공통 인자로서 인슐린 저항성을 갖는 여러 질환(비만, 제2형 당뇨, 이상지질혈증 및 고혈압)과 관련되어 있다. 이들 증상은 함께 심혈관 합병증에 대한 고 위험을 수반하는 인슐린 저항성 또는 대사 증후군을 형성한다. NASH 자체뿐만 아니라 순수한 지방간은 추가적인 대사 장애를 갖는 환자에서뿐만 아니라 빈약한 환자에서도 인슐린 저항성 상태이다.
NASH의 조직병리학이 알코올 유도성 지방간염(ASH)의 그것과 유사하기 때문에, 이들 2가지 증상은 공통의 병원성 양태를 공유한다. 면역학적 메커니즘은 ASH의 발병에 중추적인 역할을 한다. 이는 환자 및 실험 동물의 연구에 의해 충분히 입증되었다. 심각한 ASH 및 NASH를 갖는 입원 환자에서, TNF-α 등 여러 가지 전-염증성 사이토카인의 혈청 수치가 현저히 증가한다. 사이토카인 수치는 간 질환의 중증도와 충분한 상관 관계가 있다.
TNF-α 발현이 비만 중에 증가하는 것으로 널리 인정되고 있지만, 비만 인간의 TNF-α의 만성적인 과잉 생산을 유도하는 메커니즘은 아직 명확하지 않다. 그러나, 결과적으로 만성적인 염증 상태는 종종 비만을 동반하는 대사 증후군의 병인과 연루되어 있다. 비만-관련 NASH의 면역학적 병인은 ob/ob 마우스 모델에서 광범위하게 연구되어왔다. 상기 연구는 ob/ob 세포 내 사이토카인 생산 세포가 Th1 편광되는 것을 명확히 보여주었다. 이러한 미세환경은 염증 신호의 지속성을 뒷받침한다. TNFα의 억제는 양쪽 키나아제의 간 활성을 상당히 감소시킴으로써, 과잉의 TNFα가 렙틴-결핍된 마우스의 간 인슐린 저항성에 기여한다고 하는 개념을 뒷받침한다. 많은 실험 동물 및 인간에서 간 인슐린 저항성과 NASH 간에 강한 양의 상관관계가 나타난다.
혈액 검사가 높은 간 효소 수치를 나타내면 NAFLD 및 NASH 초기가 의심된다. 전형적으로 NAFLD 진단을 위해 초음파를 사용한다.
하나의 양태에서, 본원에 기재된 용도 및 방법에서, NASH 또는 NAFLD 환자는 간 손상을 방지 또는 제어하거나 또는 감소시키기 위해 다이아미딘 유사체에 의해 경구로 처리된다.
하나의 양태에서, 본원에 기재된 용도 및 방법에서, 환자는 간경변으로 발전된 NASH 또는 NAFLD 환자이다.
하나의 양태에서, 본원에 기재된 용도 및 방법에서, NASH 또는 NAFLD 환자는 과체중 또는 비만이거나, 당뇨병, 고 콜레스테롤 또는 고 중성 지방이 있다.
고 콜레스테롤
높은 혈중 콜레스테롤 수치는 심장 발작 및 뇌졸중을 앓을 위험이 증가하는 것과 관련이 있다.
하나의 양태에서, 환자는 혈중 고 콜레스테롤 수치를 갖는 환자이다.
하나의 양태에서, 고 콜레스테롤 수치는 200 mg/dL 초과, 또는 220 mg/dL 초과, 또는 240 mg/dL를 초과하는 혈중 총 콜레스테롤 수치이다.
하나의 양태에서, 본원에 기재된 용도 및 방법에서, 환자는 혈중 총 콜레스테롤 수치를 200 mg/dL 미만, 220 mg/dL 미만 또는 240 mg/dL 미만으로 감소시키거나 유지하기 위해 다이아미딘 유사체에 의해 경구로 처리된다.
알코올성 간 질환(
ALD
)
알코올성 간 질환은 수년간의 과음 후에 발생한다. 알코올은 간에 염증을 일으킬 수 있다. ALD는 3가지 단계: 1) 알코올성 지방간 질환; 2) 알코올성 간염; 및 3) 간경변을 갖는다.
알코올성 간염(전염성 간염과는 무관)은 ALD의 두 번째로 더 심각한 단계이다. 장기간에 걸친 알코올 남용이 간 조직에 염증을 일으키는 경우에 발생한다.
알코올성 지방간 질환 또는 알코올성 간염에 의한 손상은 일반적으로 알코올의 사용을 멈추면 역전될 수 있다.
간경변은 알코올-관련 간 질환의 최종 단계로서 이는 간이 크게 손상된 경우에 발생한다. 간경변은 일반적으로 비가역적이지만, 음주를 중지하면 추가 손상을 방지할 수 있고 예상 수명을 상당히 증가시킬 수 있다.
하나의 양태에서, ALD는 혈액 검사, 간 생검(biopsy) 또는 영상(초음파 스캔, 컴퓨터 단층 촬영(CT) 스캔)으로 진단한다.
하나의 양태에서, 본원에 기재된 용도 및 방법에서, ALD 환자는 간 손상을 방지 또는 제어하거나 감소시키기 위해 다이아미딘 유사체에 의해 경구로 처리된다.
간경변
간경변은 여러 형태의 간 질환 및 증상 예를 들어 간염 및 만성 알코올 남용에 의해 유발되는 간의 반흔(scarring)이다.
하나의 양태에서, ALD는 혈액 검사, 간 생검 또는 영상(초음파 스캔, 컴퓨터 단층 촬영(CT) 스캔)으로 진단한다.
하나의 양태에서, 본원에 기재된 용도 및 방법에서, 간경변 환자는 간 손상을 방지 또는 제어하거나 감소시키기 위해 다이아미딘 유사체에 의해 경구로 처리된다.
낭종
낭종은 유체를 함유하는 얇은 벽 구조이다. 대부분의 낭종은 하나이지만, 몇몇 환자는 여러 개를 가질 수 있다. 간 낭종과 관련된 증상은 상복부 팽만, 불편함 또는 통증을 포함한다.
낭종은 초음파(US) 또는 컴퓨터 단층 촬영(CT 스캔)에 의해 일반적으로 발견된다.
하나의 양태에서, 본원에 기재된 용도 및 방법에서, 낭종 환자는 간 낭종 및/또는 간 낭종과 관련된 증상을 방지 또는 제어하거나 감소시키기 위해 다이아미딘 유사체에 의해 경구로 처리된다.
섬유증
간 섬유증은 부상에 대한 간의 반응을 나타내는 반흔 과정이다.
간 섬유증은 생검에 의해 일반적으로 발견된다.
하나의 양태에서, 본원에 기재된 용도 및 방법에서, 간 섬유증 환자는 간 섬유화 또는 간 섬유화와 관련/유발된 염증을 방지 또는 제어하거나 감소시키기 위해 다이아미딘 유사체에 의해 경구로 처리된다.
간내
(
intra
-
hepatic
) 또는
간후
(
post
-
hepatic
) 황달
몸에서 빌리루빈의 정상적인 제거를 중단시키는 원인이 무엇인지에 따라 세 가지 유형의 황달이 있다.
하나의 양태에서, 본원에 기재된 용도 및 방법에서, 황달 환자는 다음과 같은 황달을 앓고 있는 환자이다:
a. 간내 황달(또한 간세포 황달이라고도 함) - 상기 중단은 간 내부에서 발생한다. 이는 예를 들어 길버트 증후군, 간경변 또는 기타 간 손상과 같은 증상에 의해 발생할 수 있다.
b. 간후 황달(또한 폐쇄성 황달이라고도 함) - 상기 중단은 담즙(및 그 안의 빌리루빈)이 담낭으로부터 소화계로 배출되는 것을 방지한다. 이는 예를 들어 담석 또는 종양과 같은 증상으로 인해 발생할 수 있다.
하나의 양태에서, 본원에 기재된 용도 및 방법에서, 간내 또는 간후 환자는 간 손상을 제어 또는 감소시키기 위해 다이아미딘 유사체에 의해 경구로 처리된다.
하나의 양태에서, 본원에 기재된 용도 및 방법에서, 황달 환자는 간내 황달을 앓고 있다.
원발성 경화성 담관염(
PSC
)
PSC는 담관 질환이다. 원발성 경화성 담관염에서 용어 "담관염"은 담관의 염증을 의미하고, 용어 "경화성"은 만성 염증으로 인한 담관의 경화 및 반흔을 의미한다.
원발성 경화성 담관염은 간 손상과 결국에는 간 기능 부전을 유발하는 진행성 질환이다.
하나의 양태에서, 본원에 기재된 용도 및 방법에서, PSC 환자는 간 손상을 감소 또는 제어하거나 방지하기 위해 다이아미딘 유사체에 의해 경구로 처리된다.
혈색소
침착증
혈색소 침착증은 과잉의 철 흡수를 특징으로 하는 유전적인 증상이다. 과잉의 철은 기관, 특히 간, 심장 및 췌장에 저장된다. 과잉의 철은 이들 기관을 피독시킬 수 있어서, 예를 들어 암, 심부정맥 및 간경변과 같은 생명을 위협하는 증상으로 이어진다.
하나의 양태에서, 본원에 기재된 용도 및 방법에서, PSC 환자는 간 손상을 제어 또는 방지하거나 감소시키기 위해 다이아미딘 유사체에 의해 경구로 처리된다.
알파-1
항트립신
결핍증
알파-1 항트립신(AAT) 결핍증의 유전적 결함은 알파-1 항트립신 분자의 구조를 변경시키고 간세포 방출을 막는다. 그 결과, 알파-1 항트립신의 혈청 수치는 감소해서, 낮은 폐포 농도를 낳고, 여기서 알파-1 항트립신 분자는 항단백효소를 보호하는 역할을 한다. 폐포 내 생성된 과잉의 단백효소는 폐포 벽을 파괴하고 폐기종을 발생시킨다. 과잉의 알파-1 항트립신의 간세포 내 축적은 또한 이들 세포를 파괴시키고 궁극적으로는 임상 간 질환으로 이어질 수 있다.
하나의 양태에서, 본원에 기재된 용도 및 방법에서, AAT 환자는 간 손상을 예방 또는 제어하거나 감소시키기 위해 다이아미딘 유사체에 의해 경구로 처리된다.
원발성 담즙성 간경변(
PBC
)
PBC는 간 내 담관을 진행성 파괴시킬 수 있는 만성 간 질환이다. 몸은 간내 담관 내벽의 세포가 몸 자신에 대해 외래종인 것처럼 간내 담관 내벽의 세포를 공격한다. 이러한 손상은 담즙산의 배수를 불량하게 하여 바깥쪽으로 누출시킴으로써 정상적인 간 세포를 손상시킨다. 이는 몇 년 후 광범위해질 수 있는 염증 및 반흔을 일으킨다. 이러한 광범위한 손상 및 반흔을 일반적으로 간경변이라고 한다.
PBC는 일반적으로 혈액 검사로 진단한다. AMA(항미토콘드리아 항체)의 존재는 PBC를 나타낸다.
하나의 양태에서, 본원에 기재된 용도 및 방법에서, PBC 환자는 간 손상을 예방 또는 제어하거나 감소시키기 위해 다이아미딘 유사체에 의해 경구로 처리된다.
하나의 양태에서, 본원에 기재된 용도 및 방법에서, PBC 환자는 AMA 양성 판정을 받는다.
다이아미딘
유사체
하나의 양태에서, 다이아미딘 유사체는 프로파미딘, 부타미딘, 펜타미딘, 헥사미딘, 헵타미딘, 데카미딘 등, 또는 스틸바미딘, 푸라미딘, 파푸라미딘, 또는 4,4'(다이아조아미노)다이벤즈아미딘 다이아세투레이트이다.
하나의 양태에서, 다이아미딘 유사체는 펜타미딘이다.
펜타미딘은 유리(free) 화합물 또는 상기 화합물의 염 형태, 예를 들어 비스(2-하이드록시에탄설포네이트) 또는 이세티오네이트 염, HCl, 토실레이트, 메실레이트, 글루코네이트 또는 임의의 다른 약학적으로 허용가능한 염을 의미한다.
하나의 양태에서, 펜타미딘은 유리 화합물 또는 상기 화합물의 염 형태, 예를 들어 비스(2-하이드록시에탄설포네이트) 또는 이세티오네이트 염, 메실레이트, 글루코네이트 또는 임의의 다른 약학적으로 허용가능한 염을 지칭한다.
펜타미딘은 하기 화학식으로 표시된다:
하나의 실시양태에서, 펜타미딘은 펜타미딘 비스(2-하이드록시에탄설포네이트) 또는 펜타미딘 이세티오네이트이다.
펜타미딘은 추가적인 항염증 활성을 갖는 항원충제 약물이다. 펜타미딘은 주화성 사이토카인(케모킨) 인터루킨(IL)-8, 성장 관련 유전자 알파(GRO 알파) 및 단핵구 주화성 단백질-1(MCP-1)의 인간 전혈 생성을 억제하는 것으로 보고되어 있다. 표제 화합물은 이들 케모킨의 리포폴리사카라이드(LPS)- 및 피토헤마글루티닌(PHA)-자극 전혈 생성을 용량-독립적으로 억제한다. 상기 억제는 특이적이다: 10 μM에서 시험하는 경우, 펜타미딘은, IL-6의 부분적 억제 경우를 제외하고, 비-주화성 사이토카인 종양 괴사 인자-알파(TNF-알파), IL-1 베타, IL-2, IL-4, IL-5, IL-10 및 인터페론-감마(IFN-감마)의 PHA-유도 발생에 대해 유의한 억제 효과를 갖지 않는다. 이러한 연구 결과는 펜타미딘이 인간 케모카인 생성의 후-전사 작용 억제제임을 나타낸다. 이러한 활성은 펜타미딘으로 인한 항-염증성 작용에 기여할 수 있다.
정의
하나의 양태에서, 펜타미딘의 전달을 언급할 경우에 "선택적"이라는 용어 및 경구용 펜타미딘을 사용하여 처리하는 경우에 "표적"이라는 용어는, 펜타미딘의 양이 정맥내 투여 후 분포에 비해, 경구 투여 후, 다른 조직 및 기관(예컨대, 근육, 폐, 신장 및 심장)의 펜타미딘의 양에 비해 환자의 간에서 증가하는 것을 의미한다. 또 하나의 양태에서, 간에서 검색되는 양은 치료 효과량이다.
본원에 사용된 용어 "환자"는 인간을 의미한다.
용어 "치료학적으로 허용가능한 양"은 연구원 또는 임상의가 추구하는 조직, 시스템 또는 동물의 생물학적 또는 의학적 반응을 유도하는 약물 또는 약제의 양을 의미한다.
용어 "치료"(및 상응하는 용어 "처리" 및 "처리하는 것")는 환자의 완화적, 회복적 및 예방적 치료를 포함한다.
용어 "간 손상을 제어하는"는 증상을 치료하지 않고 환자의 증상의 영향 또는 강도를 완화하거나 감소시키는 치료를 의미한다.
용어 "간 손상을 방지하는"(및 상응하는 용어 "예방" 및 "예방적 치료")는 환자의 증상 발생을 방지하는 치료를 의미한다.
용어 "간 손상을 감소하는"는 환자의 증상의 진행을 중단시키거나 그 증상의 병리학적 징후를 감소시키는 치료를 의미한다.
본 발명은 상기 화합물의 모든 약학적으로 허용가능한 이온화된 형태(예컨대, 염) 및 용매화물(예컨대, 수화물)을 포함하는 것으로 의도되며, 약제를 이온화된 또는 용매화된 형태로 투여하는 것은 당해 분야에 널리 공지되어 있기 때문에 상기 이온화된 형태 및 용매화물의 특정 여부에 개의치 않음에 유의한다. 또한, 특정 화학양론이 구체화되지 않는 한, 화합물에 대한 언급은 이 화합물이 독립적인 이성질체 또는 이성질체들의 혼합물로서 존재하는 것과는 관계없이 모든 가능한 입체 이성질체(예컨대, 키랄 중심의 개수에 따른 거울상 이성질체 또는 부분 입체 이성질체)를 포함하는 것으로 의도됨에 유의한다.
또한, 본원에 기재된 화합물의 약학적으로 허용가능한 염이 제공된다. 용어 "약학적으로 허용가능한 염"은 약학적으로 허용가능한 무기 및 유기 산 및 염기로부터 유도되는 것들을 의미한다. 적합한 산의 예는 염산, 브롬화 수소산, 황산, 질산, 과염소산, 푸마르산, 말레산, 인산, 글리콜산, 락트산, 살리실산, 숙신산, 톨루엔-p-술폰산, 타르타르산, 아세트산, 트라이플루오로아세트산, 시트르산, 메탄술폰산, 포름산, 벤조산, 말론산, 나프탈렌-2-술폰산 및 벤젠술폰산을 포함한다. 아미노산으로부터 유도된 염(예컨대, L- 아르기닌, L- 리신)이 또한 포함된다. 적절한 염기로부터 유도된 염은 알칼리 금속(예컨대, 나트륨, 리튬, 칼륨) 및 알칼리 토금속(예컨대, 칼슘, 마그네슘)을 포함한다.
약학적으로 허용가능한 염에 대해서는 문헌[Berge et al., Pharmaceutical Salts, J. of Phar. Sci., vol. 66, no. 1, January 1977, pp. 1-19]의 표 I에 열거된 FDA 승인의 상업적으로 입수가능한 염의 목록을 참조한다.
화합물이 서로 다른 다형성 형태로 존재할 수 있음은 당해 분야 숙련자는 이해할 수 있을 것이다. 당해 분야에 공지된 바와 같이, 다형성은 화합물이 하나 이상의 별개의 결정 또는 "다형성" 종으로 결정화하는 능력이다. 다형체는 고체 상태의 화합물 분자가 2개 이상의 다른 배열 또는 다형성 형태를 갖는 화합물의 고체 결정 상이다. 임의의 주어진 화합물의 다형성 형태는 동일한 화학식 또는 조성에 의해 정의되고, 2개의 상이한 화학적 화합물의 결정 구조만큼 화학 구조에서 차이가 있다.
치료에 사용하기 위해 필요한 화합물의 양은 선택되는 특정 화합물에 의해서뿐만 아니라 투여 경로, 치료가 필요한 증상의 특성 및 환자의 연령 및 상태에 따라 다르고, 궁극적으로는 담당 의사의 재량에 따라 달라짐을 이해할 수 있을 것이다.
원하는 투여량은 편리하게는 단일 용량으로 또는 적절한 간격 예를 들어 하루에 2, 3, 4 또는 그 이상으로 투여되는 분할 투여량으로 제공될 수 있다. 치료에 사용하기 위해 상기 화합물을 원료 화합물로서 투여하는 것이 가능하지만, 약학 조성물로서 활성 성분을 제공하는 것이 바람직하다. 따라서, 본 발명은 또한 본원에 기재된 화합물 또는 이의 약학적으로 허용가능한 염을, 이에 대한 하나 이상의 약학적으로 허용가능한 담체 및 임의로는 다른 치료 및/또는 예방 성분과 함께 한 약학 조합물 또는 조성물을 제공한다. 담체는 상기 제형의 다른 성분들과 상용성이고 이의 수혜자에게 해가 없어야 한다는 의미에서 "허용가능"해야 한다.
본원에서 사용된 표현 "허용가능한 담체"는 부작용 없이 환자에게 투여될 수 있는 본원에 기재된 조합물 및 화합물에 대한 비히클(vehicle)을 의미한다. 당해 분야에 공지된 적합한 담체는 금 입자, 멸균수, 염수, 글루코스, 덱스트로스 또는 완충 용액을 포함하나 이들에 국한되지 않는다. 담체는 보조제 예를 들어 희석제, 안정화제(즉, 당 및 아미노산), 보존제, 습윤제, 유화제, pH 완충제, 점도 향상 첨가제, 착색제 등을 포함하나 이들에 국한되지 않는다.
다이아미딘
유사체의 약학 조성물
하나의 실시양태에서, 하나 이상의 다이아미딘 유사체(예컨대, 펜타미딘) 또는 이의 약학적으로 허용가능한 염 및 하나 이상의 약학적으로 허용가능한 담체를 포함하는 경구용 약학 조성물이 제공된다.
펜타미딘의 약학 조성물은 경구 투여용으로 적합한 것들을 포함한다. 상기 조성물은, 적절한 경우, 편리하게는 개별 투여 단위로 제공될 수 있으며 약학 분야에서 널리 공지된 임의의 방법에 의해 제조될 수 있다. 모든 방법은 활성 성분을 액체 담체 또는 미분된 고체 담체 또는 이들 모두와 회합시키는 단계 및 이어서, 필요한 경우, 생성물을 원하는 조성물로 형상화하는 단계를 포함한다.
경구 투여에 적합한 약학 조성물은 편리하게는 각각 소정 양의 활성 성분을 함유하는 예를 들어 캡슐, 카시에(cachet) 또는 정제와 같은 별개의 단위로서; 분말 또는 과립으로서; 용액, 현탁액 또는 에멀젼으로서 제공될 수 있다. 활성 성분은 또한 볼루스, 연약 또는 페이스트로서 제공될 수 있다. 경구 투여용 정제 및 캡슐은 통상의 부형제 예를 들어 결합제, 충전제, 윤활제, 붕해제 또는 습윤제를 함유할 수 있다. 정제는 당해 분야에 널리 공지된 방법에 따라 코팅될 수 있다. 경구 액체 제제는 예를 들어 수성 또는 유성 현탁액, 용액, 에멀젼, 시럽 또는 엘릭시르 형태이거나, 또는 사용 전에 물 또는 다른 적합한 비히클을 갖는 구성용 무수 생성물로서 제공될 수 있다. 이러한 액체 제제는 통상의 첨가제 예를 들어 현탁화제, 유화제, 비-수성 비히클(식용 오일을 포함할 수 있음) 또는 보존제를 함유할 수 있다. 약학 조성물은 경구 투여에 적합한 것들을 포함한다. 상기 조성물은, 적절한 경우, 편리하게는 개별 투여 단위로 제공될 수 있으며 약학 분야에 널리 공지된 임의의 방법에 의해 제조될 수 있다. 모든 방법은 활성 성분을 액체 담체 또는 미분된 고체 담체 또는 이들 모두와 회합시키는 단계 및 이어서, 필요한 경우, 생성물을 원하는 조성물로 형상화하는 단계를 포함한다.
다이아미딘은 편리하게는 단위 투여 형태 예를 들어 단위 투여 형태당 1 내지 3000 mg, 1 내지 2000 ㎎, 10 내지 1500 ㎎, 편리하게는 20 내지 1000 ㎎, 가장 편리하게는 50 내지 700 mg의 활성 성분으로 투여될 수 있다.
다이아미딘은 편리하게는 적어도 이틀에 한번, 매일 1회, 2회 또는 3회로 투여될 수 있다. 선택되는 치료에 따라, 다이아미딘은 15일 초과, 30일 초과 또는 45일 초과 동안 연속적으로 투여된다.
펜타미딘의 전형적인 하루 IV 투여는 2 내지 8 mg/kg 인간 체중이다. 하나의 실시양태에서, 펜타미딘의 투여량은 전형적인 IV 투여량보다 적을 수 있다. 펜타미딘은 편리하게는 단위 투여 형태 예를 들어 단위 투여 형태당 1 내지 3000 mg, 1 내지 2000 ㎎, 10 내지 1500 ㎎, 편리하게는 20 내지 1000 ㎎, 가장 편리하게는 50 내지 700 mg의 활성 성분으로 투여될 수 있다.
하나의 양태에서, 본원에 기재된 용도 및 방법에서, 환자는 진균 또는 원충 감염(예컨대, 리슈만 편모충, 주폐포자충(카리니) 또는 트리파노소마 감염), 바이러스성 간염(예컨대, 간염 A, B, C, D, E 또는 G), 면역 결핍증(HIV), 폐렴 또는 다발성 경화증을 앓고 있지 않다.
다이아미딘과
조합하여 사용되는 (순차 또는 동시 투여되는) 추가적인 치료제의 약학 조성물
본 발명의 하나의 실시양태는 다이아미딘 유사체(예컨대, 펜타미딘) 및 간 증상의 치료용으로 표시된 하나 이상의 부가적인 추가 제제를 포함하는 방법 및 용도를 포함한다.
본 발명의 하나의 실시양태는 다이아미딘 유사체(예컨대, 펜타미딘)를 간 증상의 치료용으로 개시된 표준 요법과 조합하여 포함하는 방법 및 용도를 포함한다.
간 증상이 간암인 경우, 표준 요법은 암의 유형에 대해 개시된 표준 화학요법(예컨대, 진료 표준)을 포함할 것이다.
본 발명의 하나의 실시양태는 펜타미딘 및 암 세포의 증식을 억제하거나 또는 암 치료를 필요로 하는 환자의 암 치료를 위한 하나 이상의 부가적인 추가 항암제를 포함하는 방법 및 용도를 포함한다.
하나의 실시양태에서, 상기 추가 제제는 표준 화학요법을 포함한다. 표준 화학요법은 치료할 암의 치료에 사용되는 화학요법 치료를 의미한다.
하나의 실시양태에서, 상기 추가 제제는 옥살리플라틴, 시스플라틴, 미토마이신 C, 멜팔란, 카르무스틴, 아드리아마이신, 파클리탁셀, 도세탁셀, 5-플루오로우라실, 베바시주맙, 세툭시맙, 카페시타빈, 엽산(또한 류코보린이라고도 함), 이온화 조사, 블레오마이신, 카보플라틴, 이리노토칸 및/또는 젬시타빈을 포함하나 이들에 국한되지 않는다.
또 하나의 실시양태에서, 상기 추가 제제는 카보플라틴 및/또는 젬시타빈이다.
하나의 실시양태에서, 다이아미딘 유사체(예컨대, 펜타미딘)는 간 증상의 치료용으로 표시된 표준 요법과 조합하여 사용된다.
하나의 실시양태에서, 다이아미딘 유사체(예컨대, 펜타미딘)는 사이토카인 또는 과립구/대식세포 자극 인자(인터페론 α, β 또는 γ, 또는 IL-2)와 조합하여 사용되지 않는다.
본원에 개시된 조합물에 사용되는 조합 파트너가 단일 약물로서 시판되는 형태로 적용되는 경우, 그 투여량 및 투여 방식은, 본원에서 달리 언급하지 않으면, 본원에 기재된 유리한 효과를 얻기 위해 각각의 시판되는 약물의 포장 삽입물 상에 제공된 정보에 따라 행해질 수 있다.
본 발명의 하나의 실시양태는 본원에 기재된 조합물 및 조성물을 포함하며, 이때 화합물은 순차적으로 또는 동시에 사용된다.
약학 조성물은 경구, 직장, 비강, 국소(예컨대 구강 및 설하), 경피, 질 또는 비경구(예컨대, 근육내, 피하 및 정맥내) 투여에 적합한 것들 또는 흡입 또는 주입에 의해 투여하기에 적합한 형태의 것들을 포함한다. 조성물은, 적절한 경우, 편리하게는 개별 투여 단위로 제공될 수 있으며 약학 분야에 널리 공지된 임의의 방법에 의해 제조될 수 있다. 모든 방법은 활성 성분을 액체 담체 또는 미분된 고체 담체 또는 이들 모두와 회합시키는 단계 및 이어서, 필요한 경우, 생성물을 원하는 조성물로 형상화하는 단계를 포함한다.
상기 화합물은 또한 (예를 들어, 주사 예컨대 볼루스 주사 또는 연속 주입에 의해) 비경구 투여용으로 제형화될 수 있으며 앰플, 사전-충전된 주사기, 소 부피 주입 또는 보존제가 첨가된 다중-투여량 용기의 단위 투여 형태로 제공될 수 있다. 상기 조성물은 유성 또는 수성 비히클 중의 현탁액, 용액 또는 에멀젼과 같은 형태를 취할 수 있으며, 예를 들어 현탁화제, 안정화제 및/또는 분산제와 같은 제형화제를 함유할 수 있다. 다르게는, 활성 성분은 사용 전에 적합한 비히클 예를 들어 무균 무-발열원 수와 구성되는 멸균 고체의 무균 단리에 의하거나 용액으로부터의 동결 건조에 의해 수득되는 분말 형태일 수 있다.
표피에 국소 투여하기 위해, 상기 화합물은 연고, 크림 또는 로션으로서 또는 경피 패치로서 제형화될 수 있다. 이러한 경피 패치는 침투 촉진제 예를 들어 리날로올, 카바크롤, 티몰, 시트랄, 멘톨 및 t-아네톨 등을 함유할 수 있다. 연고 및 크림은 예를 들어 적합한 증점제 및/또는 겔화제가 첨가된 수성 또는 유성 베이스로 제형화될 수 있다. 로션은 수성 또는 유성 베이스로 제형화될 수 있으며, 일반적으로 또한 하나 이상의 에멀젼화제, 안정화제, 분산제, 현탁화제, 증점제 또는 착색제를 함유할 것이다.
구강 내 국소 투여에 적합한 조성물은 활성 성분을 착향 베이스, 일반적으로 수크로오스 및 아카시아 또는 트라가칸트 중에 포함하는 로젠지; 활성 성분을 불활성 베이스 예를 들어 젤라틴 및 글리세린 또는 수크로오스 및 아카시아 중에 포함하는 패스틸(pastilles); 및 활성 성분을 적합한 액체 담체 중에 포함하는 구강 세정제를 들 수 있다.
담체가 고체인 직장 투여에 적합한 약학 조성물은 예를 들어 단위 투여 좌약으로서 제공된다. 적합한 담체는 코코아 버터 및 당해 분야에서 일반적으로 사용되는 다른 물질을 포함하고, 편리하게는 활성 성분을 연화 또는 용융된 담체와 혼합한 다음, 냉각시키고 금형에서 성형시킴으로써 형성될 수 있다.
질 투여에 적합한 조성물은 활성 성분 외에 당해 분야에서 적절한 것으로 공지되어 있는 담체를 함유하는 페서리(pessary), 탐폰(tampon), 크림(cream), 겔(gel), 페이스트(paste), 포움(foam) 또는 스프레이(spray)로서 제공될 수 있다.
비강내 투여를 위해, 상기 화합물 또는 조합물은 액체 스프레이 또는 분산 분말로서 사용되거나 드롭(drop) 형태로 사용될 수 있다. 드롭은 또한 하나 이상의 분산제, 용해제 또는 현탁화제를 포함하는 수성 또는 비-수성 베이스와 함께 제형화될 수 있다. 액체 스프레이는 편리하게는 압축 팩(pack)으로 제공된다.
흡입 투여를 위해, 상기 화합물 또는 조합물은 편리하게는 취입기, 분무기 또는 압축 팩, 또는 에어로졸 스프레이를 전달하는 다른 편리한 수단으로 제공된다. 압축 팩은 적합한 추진제 예를 들어 다이클로로다이플루오로메탄, 트라이클로로플루오로메탄, 다이클로로테트라플루오로에탄, 이산화탄소 또는 다른 적합한 기체를 포함할 수 있다. 압축 에어로졸의 경우, 투여 단위는 계량된 양을 전달하기 위한 밸브를 제공함으로써 결정될 수 있다.
다르게는, 흡입 또는 주입 투여를 위해, 상기 화합물 또는 조합물은 건조 분말 조성물 예를 들어 상기 화합물과 적합한 분말 베이스 예컨대 락토스 또는 전분의 분말 혼합물의 형태를 취할 수 있다. 분말 조성물은 흡입기 또는 주입기의 도움으로 분말을 투여할 수 있는 예를 들어 캡슐 또는 카트리지, 또는 예를 들어 젤라틴 또는 블리스터 팩의 단위 투여 형태로 제공될 수 있다.
치료에 사용하기 위해 필요한 화합물의 양은 선택되는 특정 화합물에 의해서뿐만 아니라 투여 경로, 치료가 필요한 증상의 특성 및 환자의 연령 및 상태에 따라 다르고, 궁극적으로는 담당 의사의 재량에 따라 달라짐을 이해할 수 있을 것이다. 그러나, 일반적으로, 적합한 투여량은 하루에 약 0.1 내지 약 759 mg/kg 체중, 예를 들어 0.5 내지 60 mg/kg/day, 또는 예를 들어 1 내지 20 mg/kg/day 범위일 것이다. 다른 제제는 편리하게는 예를 들어 단위 투여 형태당 5 내지 2000 mg, 10 내지 1500 mg, 편리하게는 20 내지 1000 mg, 가장 편리하게는 50 내지 700 mg의 활성 성분을 함유하는 단위 투여 형태로 투여된다.
본 발명은 하기 실시예를 참조하여 더욱 쉽게 이해될 것이다. 실시예는 본 발명의 폭넓은 적용가능성을 예시하고 있으며 그 범위를 제한하려는 의도는 아니다. 본 발명의 진의 및 범주를 벗어나지 않고 변형 및 변화가 이루어질 수 있다. 본원에 기재된 것과 유사하거나 균등한 임의의 방법 및 물질을 본 발명의 시험 실시에 사용할 수 있지만, 하기 방법 및 물질을 기술한다. 본원에 인용된 공고 특허, 공개된 특허 출원 및 문헌은 각각 구체적으로 및 개별적으로 본원에 참고로 인용되는 것과 동일한 정도로 본원에 참고로 인용된다. 상충되는 경우, 본원의 개시내용이 우선한다.
실시예
및 결과:
달리 명시하지 않으면, 모든 실험은 펜타미딘 비스(2-하이드록시에탄설포네이트)로 수행된다.
PO는 구강 또는 경구를 의미한다.
IV는 정맥내를 의미한다.
실시예
1:
IV
및
PO
투여 후
펜타미딘의
약동학
암컷 폭스 체이스(Fox Chase) SCID CB17 마우스(평균 동물 중량 0.025 kg).
약동학 및 생체이용률(F): 5 mg/kg의 IV 투여 대 50 mg/kg의 POS 투여(펜타미딘). 마우스의 결과는 약 1%의 낮은 생체이용률(F)을 나타내었다(도 1).
DMSO(5%) 및 나트륨 카프레이트(2%) 현탁액을 사용한 50 mg/kg의 펜타미딘의 경구 투여(PO)는 상당한 농도의 조직 내 펜타미딘을 제공했다. 간 및 신장 수치는 PO 투여 후 현저했고, 혈액 수치의 몇 배였다. 근육 같은 조직은 또한 혈액에서 발견되는 농도의 몇 배를 함유했다. 이 결과는 펜타미딘이 경구로 투여되는 경우에 마우스에서 현저히 흡수됨을 나타낸다(도 2).
실시예
2: 암컷
폭스
체이스
SCID
CB17
마우스(평균 동물 중량 0.025 kg)에 반복 경구 투여
이 실험에서는, 모든 그룹의 마우스를 먼저 1일째에 IV 경로를 통해 펜타미딘을 주사하였다(5 mg/kg). 조직 농도를 24시간 후(2일째)에 측정하고, 그 후 주마다(7일 및 14일) 측정하고, 이후 펜타미딘을 투여하지 않았다. 2일째부터 시작하여, 그룹 2 및 3에 대해 각각 하루에 한 번(QD) 또는 하루에 두 번(BID) 펜타미딘을 제공했고, 조직 수치를 24시간 후(3일째)에 측정하고, 그 후 매주 2주 동안 측정했다.
결과는 경구 투여 경로를 사용하여 간을 표적하는 것이 가능함을 명확히 나타내었다. 펜타미딘은 명확히 흡수되었고, 간 농도는 경구 투여 요법(예컨대, QD 및 BID)에 따라 원하는 농도로 유지될 수 있었다(도 3).
신장은 IV 투여에 의해 표적되었고, 경구 투여에 의해서는 매우 소량 표적되었다. 신장 수치는 경구 투여에 의해서는 영향을 받지 않았는데, 이는 낮은 전신 노출을 의미한다. 폐 및 근육에 대해서도 동일했으며, 이는 모든 지점에서 경구 투여 후 간에서 우수한 경구 생체이용률 및 높은 1회-통과 추출을 나타낸다.
다른 조직(신장, 폐 및 근육)에서의 펜타미딘 농도는 경구 투여에 의해 간만큼 영향받지 않았다. 이는 모든 다른 조직에서 IV 투여 후 시간 경과에 따라 유사한 펜타미딘 농도 감소로 나타났다. PO 투여 유무, 및 QD 또는 BID PO 투여에 따른 그룹들 간의 큰 차이는 없었다(도 4, 5 및 6).
실시예
3: 반복 투여 경구 캡슐 투여 또는
정맥내
주입
수컷 비글 개에서의 약동학 실험을 수행하였다. 3가지의 경구 제형을 시험하였다.
이 실시예에서는, 약동학 및 생체분포를 수컷 비글 개에서 실험하였다. 개는 상이한 기관(주로 간)으로부터의 제거 속도가 사람에서 관찰되는 것과 유사하기 때문에 연관 모델이다. 3개의 경구 제형을 시험하고 주사 제형과 비교하였다.
PO2 캡슐: 이 제형은 흡수 촉진제 또는 침투 촉진제로서 겔루시르(Gelucire), 솔루톨(Solutol) 및 비타민 E TPGS를 사용했다. 펜타미딘/ PEG400/ 겔루시르 44/14/ 솔루톨 HS 15/ 비타민 E TPGS/ SLS(19.5%/16.1%/32.2%/24.2%/4.0%/4.0%) 분산물을 사용했다.
PO3 캡슐: 흡수 또는 침투 촉진제로서 나트륨 카프레이트 및 L-아르기닌을 갖는 분무-건조 분말(70% 펜타미딘/30% PVP K30)을 사용했다.
PO4 캡슐: 이 제형은 어떠한 흡수 또는 침투 촉진제도 함유하지 않았고, 펜타미딘/글리세롤/SLS(19.5%/76.4%/4.1%)의 비정형 분산물(분무-건조됨)을 함유했다.
PK 실험용
펜타미딘
분무-건조 제형(그룹
P02
)
PK 실험용
PEG400
펜타미딘
비스
(2-
하이드록시에탄설포네이트
)
분산물
제형(그룹
PO3
)
글리세롤-계 비정형
펜타미딘
비스
(2-
하이드록시에탄설포네이트
)
분산물
제형(그룹
PO4
)
실험 설계
아래에 나타낸 바와 같이, 시험 항목을, 3일 동안 경구 캡슐 투여에 의해 하루 2회 또는 2일 동안 2시간 말초 정맥내 주입에 의해 하루 1회 투여하였다.
용량 제형의 투여
그룹 1( IV 주입):
시험 항목의 용량 제형을, 연속 2일 동안 주사기에 부착된 임시 말초 정맥 카테터(catheter)를 사용하여, 주입 펌프를 사용하여 요측피 정맥 및/또는 복재 정맥을 통해 2시간 정맥 주입으로 하루에 1회 투여하였다. 투여량은 모든 동물에 대해 4 mL/kg이고 주입 속도는 2 mL/kg/hr였다. 각 동물에 투여된 실제 투여량을 계산하고 각 동물의 가장 최근의 실제 체중에 기초하여 조정하였다. 카테터를 0.9%의 주사용 염화나트륨, USP(염수)로 세정하여, 의도된 총 용량을 동물에게 투여하고, 그 후 임시 카테터를 제거하고 폐기하였다.
투여량 계량을 위해, 투여 기간 동안 주입 주사기의 중량을 각각의 투여 시작 전과 끝에서 기록하였다. 동물들은 매 2시간 투여 건(occasion) 동안 슬링(sling)에 매달았다.
그룹 PO2 , 3 및 4(경구 캡슐 투여):
시험 항목을, 금식 동물(투여 전 적어도 4시간)에게 연속 3일 동안 경구 캡슐 투여에 의해 매일 2회(표적 시간: 12시간 간격) 투여하였다. 투여 후 2시간 뒤에 음식을 다시 주었다.
각 동물에게 투여되는 캡슐의 개수는 2 캡슐/동물/건으로 고정하였다. 필요한 경우, 투여 후, 구강을 적절한 양의 역삼투압 물로 세정하여 용이하게 삼키도록 하였다. 투여 후 캡슐을 삼키었는지 확인하기 위해 구강을 검사하였다.
결과
약동학 및 생체이용률(F) 면에서 3가지 제형 간의 유의한 차이는 없었다. 평균 생체이용률은 PO 대 IV 그룹의 AUC를 사용하여 계산할 때 0.4%였다. 이러한 명백히 낮은 생체이용률은 간에서 표적되는 약물의 현저한 흡수를 은폐한다(도 7 및 8).
도 7 및 8에서 알 수 있는 바와 같이, 펜타미딘의 경구 흡수는 우선적으로 간에서 이루어지고, 간에서 우선적으로 분배되는 IV 흡수에 비해 다른 기관 및 조직에서는 훨씬 덜하지만, 다른 기관에서 훨씬 더 농도가 높다. 비교하여, 경구 흡수는 명확히 간을 표적으로 한다.
하기 표는 IV 및 PO 그룹에 대해 상이한 약동학적 파라미터, 상이한 조직에서의 펜타미딘의 농도, 및 조직 대 혈액과 조직 대 간 농도 비율을 제시하고 있다. 이러한 데이터는 또한 간에 대한 표적 전달을 입증하고 있다. 혈액 구획 및 다른 조직에 대한 펜타미딘의 전신 노출은 표적 기관의 이득으로 현저히 감소한다.
표 I -
비글
개에 2시간
IV
투여 후 혈액 중
펜타미딘의
약동학 파라미터 - 1일째
표 Ⅱ -
비글
개에
PO
투여 후 혈액 중
펜타미딘의
약동학 파라미터 - 1일째
표 Ⅲ -
비글
개에
PO
투여 후 혈액 중
펜타미딘의
약동학 파라미터 - 3일째
표
IV
- 조직 내
펜타미딘의
약동학 파라미터 -
IV
투여 1일째
표 V - 조직-대-혈액 비율의 요약
표 VI - 조직-대-간의 요약
표
VIIa
, b 및 c - 개별 데이터 - 조직 농도 및 비율 -
정맥내
투여
표
VIIa
표
VIIb
표
VIIc
표
VIIIa
, b 및 c - 개별 데이터 - 조직 농도 및 비율 - 경구 투여
표
VIIIa
표
VIIIb
표
VIIIc
실시예
4: 반복 용량 경구 정제 투여 또는
정맥내
주입
암컷 비글 개에 대해 경구 정제에 의해 3일 동안 하루 2회 또는 주입에 의해 2일 동안 하루 1회(2시간 말초 정맥내(IV) 주입) 반복 용량 투여 후, 펜타미딘(펜타미딘 이세티오네이트)의 약동학 프로파일 및 제거를 결정했다. 이 실시예에서 시험한 조직 제거 기간은 56일 동안 지속되었다. 이 실시예에서 시험한 정제 제형은 임의의 흡수 또는 침투 촉진제를 함유하지 않았다.
실험 설계
펜타미딘은, 아래와 같이, 3일 동안 경구 정제 투여에 의해 하루 2회 또는 2일 동안 2시간 말초 정맥내 주입에 의해 하루 1회 투여하였다:
결과
순간-방출 정제를 사용하여 PO 투여 후 기관 내 펜타미딘의 생체분포는 1회-통과 추출에 의해 아마도 간에 우선적이었다. 간 농도를 정규화함으로써, IV 투여 대비 PO 투여로부터 지속되는 주요 기관 노출을 결정할 수 있다. 하기 및 도 9에서 알 수 있는 바와 같이, 펜타미딘 IV의 공지의 표적 기관인 췌장 및 신장에 대한 현저히 낮은 노출이 관찰되었다.
실시예 3 및 4의 IV 투여 결과를 사용하여, 더 높은 등급의 동물 예를 들어 개에서 긴 간 제거 반감기를 확인할 수 있었다. 간으로부터의 제거 반감기가 약 28일로 계산되어서, 최소한의 전신 노출에 의한 간 내 치료 활성 농도의 축적 및 유지가 가능하였다.
실시예
5:
GaIN
/
LPS
전격성 간 손상: 항-염증성, 항-
TNF
α,
간보호
모델
펜타미딘의 항-염증성, 항-TNFα, 간보호 특성을 평가하기 위해, 갈락토사민/리포사카라이드(GaIN/LPS) 전격성 간 손상 모델을 사용했다. GaIN/LPS와 같은 전격성 손상 모델, 마우스 내 펜타미딘의 생물학적 특성을 시험하기 위해, 이를 위한 복강내 투여(IP)는 간에 대한 최적의 약물 노출을 제공할 것이고, 이는 개와 사람이 경구 투여 후 갖게 될 노출과 가능한 최상으로 흡사할 것이다.
25 및 40 mg/kg 용량의 비히클, 화합물 펜타미딘(이세티오네이트 염)으로 전처리되거나 미처리된 마우스에 대해 3가지 별개의 실험을 행했다. 펜타미딘을 IP 30분 투여 후, 간세포독성 GaIN 및 면역 자극제 LPS의 저독성(subtoxic) 용량으로 공-처리하였다. 분석을 위해 GaIN/LPS 후 6.5시간에서 마우스를 희생시켰다. 알라닌 트랜스아미나제(ALT) 혈청 수준의 분석 및 과거 관찰에 의해 간세포-보호성, 항-TNF-α, 항-염증성 및/또는 항-섬유증 활성을 평가하였다.
결과
25 mg/kg 또는 40 mg/kg의 펜타미딘 IP 투여 후 수득된 혈청 ALT 수준은 PBS 비히클로 처리한 것에 비해 각각 93% 및 97% 감소하였다. 이 결과는 펜타미딘이 간 손상을 차단함을 명확하게 나타낸다(결과: PBS 5,632 +/- 1,223; 펜타미딘 25 ㎎/㎏ = 402 +/- 105; 펜타미딘 40 ㎎/㎏ = 177 +/- 44)(도 10 내지 12 참조).
실시예
6:
GaIN
/
LPS
전격성 간 손상 모델: 항-염증성, 항-
TNF
α,
간보호
모델 내
펜타미딘
염
펜타미딘 비스-HCl(펜타-HCl) 및 펜타미딘 토실레이트(penta-Tos)와 같은 상이한 펜타미딘의 항-염증성, 항-TNFα, 간보호 특성을 평가하기 위해, 갈락토사민/리포사카라이드(GalN/LPS) 전격성 간 손상 모델을 사용하였다.
펜타미딘 HCl 및 토실레이트를 IP 30분 투여 후, 간세포독성 GaIN 및 면역 자극제 LPS의 저독성 용량으로 공-처리하였다. 분석을 위해 GaIN/LPS 후 6.5시간에서 마우스를 희생시켰다. 알라닌 트랜스아미나제(ALT) 혈청 수준의 분석 및 과거 관찰에 의해 간세포-보호성, 항-TNF-α, 항-염증성 및/또는 항-섬유증 활성을 평가하였다.
결과
결과는 펜타미딘 염이 고유 활성을 또한 가짐을 나타내었다(도 13 참조).
실시예
7:
펜타미딘
염의 경구 생체이용률
이 실험에서, 펜타미딘의 HCl, 이세티오네이트 및 토실레이트 염을 마우스에 경구 투여하고, 이의 PK 및 조직 축적을 비교하였다.
마우스에 200 kg/mg의 경구 투여 후 펜타미딘 염에 대한 PK 파라미터
200 mg/kg의 PO 투여 후 24시간에서 마우스 내 펜타미딘 염의 생체분포
펜타미딘의 상이한 염은, 제형 및/또는 이의 고유 용해도에 의해 영향을 받을 수 있는 상이한 생체이용률을 갖는다(도 14 참조).
실시예
8: 당뇨병 및 고-지방 다이어트 모델
이 실험에서는, NASH-유사 병리를, 생후 2일째에 200 ㎍ 스트렙토조토신의 단일 피하 주사하고, 4주 연령 후 고 지방 다이어트(HFD, 57 kcal% 지방, 카탈로그 #: HFD32, CLEA 일본)를 공급하는 것에 의해 C57BL/6 마우스(STAM 마우스)에서 유도하였다. 비히클 또는 펜타미딘 치료는 6 내지 9주 연령에서 주 3회 투여하였다. 비히클(0.9% NaCl) 및 펜타미딘을 10 mL/kg의 부피로 복강내 경로로 투여하였다.
결과:
이 실험으로부터 얻은 결과는 NASH의 처리에서 펜타미딘을 사용하는 이점의 경향을 나타낸다. 고 용량 투여 그룹의 간 중량은 정상적인 마우스 대조용 값과 유사했지만(도 15), 섬유증 형성은 펜타미딘 고 용량 투여 그룹에서 감소하는 경향을 보였다(도 16).
실시예
9:
GalN
/
LPS
전격성 간 손상 생존 연구에서의 방향족
다이아미딘
이 실험에서는, 2가지 다른 방향족 다이아미딘(펜타미딘 이세티오네이트(C5) 및 데카미딘 이세티오네이트(C10))으로 처리하거나 처리하지 않은 경우에 C57BL/6 마우스에 대한 8시간 생존율을 평가하였다. 상기 두 화합물을, GalN/LPS-유도된 간 손상 이전에, 그의 MTD 30분에 근접한 용량으로 복강내 투여하였다. 결과는 방향족 다이아민이 간보호의 가능성을 가짐을 나타낸다.
참고문헌:
1. 문헌[Copaci I, Micu L, Voiculesciu M The Role of Cytokines in Non-Alcoholic Steatohepatitis : A Systematic Review. J Gastrointestin Liver Dis 2006 ;15 (4):363-373].
2. 문헌[Quay J, Rosenthal G, Becker S. Effect of pentamidine on cytokine (IL-1 beta, TNF alpha, IL-6) production by human alveolar macrophages in vitro. Exp Lung Res. 1993 Jul-Aug;19(4):429-43].
3. 문헌[Van Wauwe J, Aerts F, Van Genechten H, Blockx H, Deleersnijder W, Walter H. The inhibitory effect of pentamidine on the production of chemotactic cytokines by in vitro stimulated human blood cells. Inflamm Res. 1996 Jul;45(7):357-63].
Claims (62)
- 하나 이상의 간 증상의 표적 치료를 필요로 하는 인간 환자에게, 치료 효과량의 하나 이상의 다이아미딘 유사체 또는 이의 약학적으로 허용가능한 염을 경구 투여하는 단계를 포함하는 하나 이상의 간 증상의 표적 치료 방법으로서,
상기 간 증상이 간암, 간 전이, 고 콜레스테롤, 알코올성 간 질환, 간경변, 낭종, 지방간 질환(NAFLD), 섬유증, 황달, 원발성 경화성 담관염(PSC), 혈색소 침착증, 원발성 담즙성 간경변 또는 알파-1 항트립신 결핍증인, 방법. - 제 1 항에 있어서,
상기 다이아미딘의 수준이 다른 조직 또는 기관에서의 수준에 비해 간에서 증가되는, 방법. - 제 1 항 또는 제 2 항에 있어서,
상기 다이아미딘이 펜타미딘인, 방법. - 제 1 항 또는 제 2 항에 있어서,
상기 다이아미딘이 데카미딘인, 방법. - 제 1 항 또는 제 2 항에 있어서,
상기 다이아미딘이 펜타미딘 비스(2-하이드록시에탄설포네이트), 펜타미딘 이세티오네이트, 펜타미딘 HCl 또는 펜타미딘 토실레이트인, 방법. - 제 1 항 또는 제 2 항에 있어서,
상기 다이아미딘이 펜타미딘 이세티오네이트인, 방법. - 제 1 항 내지 제 6 항 중 어느 한 항에 있어서,
상기 다이아미딘이 약 1 mg 내지 약 3000 mg의 투여량으로 하루에 적어도 1회 투여되는, 방법. - 제 1 항 내지 제 6 항 중 어느 한 항에 있어서,
상기 다이아미딘이 약 1 mg 내지 약 2000 mg의 투여량으로 하루에 적어도 1회 투여되는, 방법. - 제 1 항 내지 제 6 항 중 어느 한 항에 있어서,
상기 다이아미딘이 약 50 mg 내지 약 700 mg의 투여량으로 하루에 적어도 1회 투여되는, 방법. - 제 1 항 내지 제 9 항 중 어느 한 항에 있어서,
상기 다이아미딘이 연속적인 15일 초과 동안 투여되는, 방법. - 제 1 항 내지 제 9 항 중 어느 한 항에 있어서,
상기 다이아미딘이 연속적인 60일 초과 동안 투여되는, 방법. - 제 1 항 내지 제 9 항 중 어느 한 항에 있어서,
상기 다이아미딘이 연속적인 120일 초과 동안 투여되는, 방법. - 제 1 항 내지 제 9 항 중 어느 한 항에 있어서,
상기 다이아미딘이 연속적인 365일 초과 동안 투여되는, 방법. - 제 1 항 내지 제 13 항 중 어느 한 항에 있어서,
상기 다이아미딘이 고체 투여 형태로서 경구로 투여되는, 방법. - 제 1 항 내지 제 13 항 중 어느 한 항에 있어서,
상기 다이아미딘이 순간 방출 고체 투여 형태로서 경구로 투여되는, 방법. - 제 1 항 내지 제 15 항 중 어느 한 항에 있어서,
상기 치료가, 비경구적으로 투여된 등가의 다이아미딘 투여량에 비해 감소된 독성을 초래하는, 방법. - 제 1 항 내지 제 15 항 중 어느 한 항에 있어서,
상기 치료가, 비경구적으로 투여된 등가의 다이아미딘 투여량에 비해 감소된 신장, 심장 또는 췌장 독성을 초래하는, 방법. - 제 16 항 또는 제 17 항에 있어서,
상기 등가의 다이아미딘 투여량이 정맥내로 투여되는, 방법. - 제 1 항 내지 제 18 항 중 어느 한 항에 있어서,
상기 간암이 간내 담도암 또는 간암종인, 방법. - 제 1 항 내지 제 18 항 중 어느 한 항에 있어서,
상기 간 전이가 간 지배적 암 전이 또는 간 제한적 암 전이인, 방법. - 제 1 항 내지 제 18 항 중 어느 한 항에 있어서,
상기 간 전이가 간 지배적 대장암 전이(liver dominant colorectal cancer metastasis)인, 방법. - 제 1 항 내지 제 21 항 중 어느 한 항에 있어서,
상기 다이아미딘이 표준 화학요법과 조합하여 투여되는, 방법. - 제 1 항 내지 제 21 항 중 어느 한 항에 있어서,
상기 다이아미딘이 시스플라틴, 옥살리플라틴, 미토마이신 C, 멜팔란, 카르무스틴, 아드리아마이신, 파클리탁셀, 도세탁셀, 5-플루오로우라실, 베바시주맙, 세툭시맙, 카페시타빈, 엽산(또한 류코보린이라고도 함), 이온화 조사, 블레오마이신, 카보플라틴, 이리노토칸 또는 젬시타빈과 조합하여 투여되는, 방법. - 제 1 항 내지 제 21 항 중 어느 한 항에 있어서,
추가적인 제제가 카보플라틴 또는 젬시타빈인, 방법. - 제 1 항 내지 제 18 항 중 어느 한 항에 있어서,
상기 간 증상이 알코올성 간 질환인, 방법. - 제 1 항 내지 제 18 항 중 어느 한 항에 있어서,
상기 간 증상이 급성 알코올성 간염인, 방법. - 제 1 항 내지 제 18 항 중 어느 한 항에 있어서,
상기 간 증상이 원발성 담즙성 간경변증인, 방법. - 제 1 항 내지 제 18 항 중 어느 한 항에 있어서,
상기 간 증상이 지방간 질환(NAFLD)인, 방법. - 제 1 항 내지 제 18 항 중 어느 한 항에 있어서,
상기 간 증상이 알파-1 항트립신 결핍증인, 방법. - 제 1 항 내지 제 18 항 중 어느 한 항에 있어서,
상기 간 증상이 원발성 경화성 담관염(PSC)인, 방법. - 제 1 항 내지 제 18 항 및 제 25 항 내지 제 30 항 중 어느 한 항에 있어서,
상기 다이아미딘이 하나 이상의 간 증상의 치료용으로 표시된 추가적인 제제와 조합하여 투여되는, 방법. - 하나 이상의 간 증상의 표적 치료를 필요로 하는 인간 환자의 하나 이상의 간 증상의 표적 치료를 위한, 치료 효과량의 하나 이상의 다이아미딘 유사체 또는 이의 약학적으로 허용가능한 염의 경구 용도로서,
상기 간 증상이 간암, 간 전이, 고 콜레스테롤, 알코올성 간 질환, 간경변, 낭종, 지방간 질환(NAFLD), 섬유증, 황달, 원발성 경화성 담관염(PSC), 혈색소 침착증, 원발성 담즙성 간경변 또는 알파-1 항트립신 결핍증인, 용도. - 제 32 항에 있어서,
상기 다이아미딘의 수준이 다른 조직 또는 기관에서의 수준에 비해 간에서 증가되는, 용도. - 제 32 항 또는 제 33 항에 있어서,
상기 다이아미딘이 펜타미딘인, 용도. - 제 32 항 또는 제 33 항에 있어서,
상기 다이아미딘이 데카미딘인, 용도. - 제 32 항 또는 제 33 항에 있어서,
상기 다이아미딘이 펜타미딘 비스(2-하이드록시에탄설포네이트), 펜타미딘 이세티오네이트, 펜타미딘 HCl 또는 펜타미딘 토실레이트인, 용도. - 제 32 항 또는 제 33 항에 있어서,
상기 다이아미딘이 펜타미딘 이세티오네이트인, 용도. - 제 32 항 내지 제 37 항 중 어느 한 항에 있어서,
상기 다이아미딘이 약 1 mg 내지 약 3000 mg의 투여량으로 하루에 적어도 1회 투여되는, 용도. - 제 32 항 내지 제 37 항 중 어느 한 항에 있어서,
상기 다이아미딘이 약 1 mg 내지 약 2000 mg의 투여량으로 하루에 적어도 1회 투여되는, 용도. - 제 32 항 내지 제 37 항 중 어느 한 항에 있어서,
상기 다이아미딘이 약 50 mg 내지 약 700 mg의 투여량으로 하루에 적어도 1회 투여되는, 용도. - 제 32 항 내지 제 40 항 중 어느 한 항에 있어서,
상기 다이아미딘이 연속적인 15일 초과 동안 사용되는, 용도. - 제 32 항 내지 제 40 항 중 어느 한 항에 있어서,
상기 다이아미딘이 연속적인 60일 초과 동안 사용되는, 용도. - 제 32 항 내지 제 40 항 중 어느 한 항에 있어서,
상기 다이아미딘이 연속적인 120일 초과 동안 사용되는, 용도. - 제 32 항 내지 제 40 항 중 어느 한 항에 있어서,
상기 다이아미딘이 연속적인 365일 초과 동안 사용되는, 용도. - 제 32 항 내지 제 44 항 중 어느 한 항에 있어서,
상기 다이아미딘이 고체 투여 형태로서 사용되는, 용도. - 제 1 항 내지 제 13 항 중 어느 한 항에 있어서,
상기 다이아미딘이 순간 방출 고체 투여 형태로서 사용되는, 용도. - 제 32 항 내지 제 46 항 중 어느 한 항에 있어서,
상기 치료가, 비경구적으로 투여된 등가의 다이아미딘 투여량에 비해 감소된 독성을 초래하는, 용도. - 제 32 항 내지 제 46 항 중 어느 한 항에 있어서,
상기 치료가, 비경구적으로 투여된 등가의 다이아미딘 투여량에 비해 감소된 신장, 심장 또는 췌장 독성을 초래하는, 용도. - 제 47 항 또는 제 48 항에 있어서,
상기 등가의 다이아미딘 투여량이 정맥내로 투여되는, 용도. - 제 32 항 내지 제 49 항 중 어느 한 항에 있어서,
상기 간암이 간내 담도암 또는 간암종인, 용도. - 제 32 항 내지 제 49 항 중 어느 한 항에 있어서,
상기 간 전이가 간 지배적 암 전이 또는 간 제한적 암 전이인, 용도. - 제 32 항 내지 제 49 항 중 어느 한 항에 있어서,
상기 간 전이가 간 지배적 대장암 전이인, 용도. - 제 32 항 내지 제 52 항 중 어느 한 항에 있어서,
상기 다이아미딘이 표준 화학요법과 조합하여 사용되는, 용도. - 제 32 항 내지 제 52 항 중 어느 한 항에 있어서,
상기 다이아미딘이 시스플라틴, 옥살리플라틴, 미토마이신 C, 멜팔란, 카르무스틴, 아드리아마이신, 파클리탁셀, 도세탁셀, 5-플루오로우라실, 베바시주맙, 세툭시맙, 카페시타빈, 엽산(또한 류코보린이라고도 함), 이온화 조사, 블레오마이신, 카보플라틴, 이리노토칸 또는 젬시타빈과 조합하여 사용되는, 용도. - 제 32 항 내지 제 52 항 중 어느 한 항에 있어서,
추가적인 제제가 카보플라틴 또는 젬시타빈인, 용도. - 제 32 항 내지 제 49 항 중 어느 한 항에 있어서,
상기 간 증상이 알코올성 간 질환인, 용도. - 제 32 항 내지 제 49 항 중 어느 한 항에 있어서,
상기 간 증상이 급성 알코올성 간염인, 용도. - 제 32 항 내지 제 49 항 중 어느 한 항에 있어서,
상기 간 증상이 원발성 담즙성 간경변증인, 용도. - 제 32 항 내지 제 49 항 중 어느 한 항에 있어서,
상기 간 증상이 지방간 질환(NAFLD)인, 용도. - 제 32 항 내지 제 49 항 중 어느 한 항에 있어서,
상기 간 증상이 알파-1 항트립신 결핍증인, 용도. - 제 32 항 내지 제 49 항 중 어느 한 항에 있어서,
상기 간 증상이 원발성 경화성 담관염(PSC)인, 용도. - 제 32 항 내지 제 49 항 및 제 56 항 내지 제 61 항 중 어느 한 항에 있어서,
상기 다이아미딘이 하나 이상의 간 증상의 치료용으로 표시된 추가적인 제제와 조합하여 사용되는, 용도.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261745011P | 2012-12-21 | 2012-12-21 | |
| US61/745,011 | 2012-12-21 | ||
| PCT/CA2013/051003 WO2014094176A1 (en) | 2012-12-21 | 2013-12-20 | Uses and methods for the treatment of liver diseases or conditions |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20150126595A true KR20150126595A (ko) | 2015-11-12 |
Family
ID=50977490
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020157019648A KR20150126595A (ko) | 2012-12-21 | 2013-12-20 | 간 질환 또는 증상의 치료를 위한 용도 및 방법 |
Country Status (12)
| Country | Link |
|---|---|
| US (2) | US9375411B2 (ko) |
| EP (1) | EP2934501A4 (ko) |
| JP (1) | JP6370801B2 (ko) |
| KR (1) | KR20150126595A (ko) |
| CN (1) | CN104968340A (ko) |
| AU (1) | AU2013362755B2 (ko) |
| BR (1) | BR112015014836A2 (ko) |
| CA (1) | CA2894466A1 (ko) |
| HK (1) | HK1216721A1 (ko) |
| MX (1) | MX2015007945A (ko) |
| RU (1) | RU2015126505A (ko) |
| WO (1) | WO2014094176A1 (ko) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019036382A1 (en) * | 2017-08-15 | 2019-02-21 | Progenity Inc. | INFLAMMATORY DISEASE TREATMENT INVOLVING AN INGREDIENT DEVICE FOR RELEASING AN IMMUNOMODULATOR |
| JP7153734B2 (ja) * | 2017-11-16 | 2022-10-14 | モンドレックス・インコーポレーテッド | モノアミジン及びジアミジンのエンド-エキソヌクレアーゼ阻害剤とエンド-エキソヌクレアーゼ活性を阻害する方法 |
| CN110478340A (zh) * | 2018-05-14 | 2019-11-22 | 复旦大学 | 喷他嘧啶羟乙基磺酸盐在制备肝癌药物方面的应用 |
| EP3844169A4 (en) | 2019-08-16 | 2021-12-15 | Applied Molecular Transport Inc. | COMPOSITIONS, FORMULATIONS AND PRODUCTION AND PURIFICATION OF INTERLEUKINS |
Family Cites Families (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA388674A (en) * | 1940-05-14 | The B. F. Goodrich Company | Brake structure | |
| GB1288376A (ko) | 1968-10-29 | 1972-09-06 | ||
| DE2833135A1 (de) | 1978-07-28 | 1980-02-07 | Henkel Kgaa | Verwendung von substituierten oligocarbamidinen als mikrobistatika sowie diese enthaltende antimikrobielle mittel |
| US5204113A (en) | 1987-04-09 | 1993-04-20 | Fisons Plc | Pharmaceutical compositions containing pentamidine |
| US5084480A (en) | 1987-11-06 | 1992-01-28 | Fujisawa Usa, Inc. | Pentamidine salts useful in the treatment of pneumocystis carinii pneumonia |
| US4853416A (en) | 1988-04-25 | 1989-08-01 | Fisons Corporation | Solutions of pentamidine |
| US5162361A (en) * | 1990-04-10 | 1992-11-10 | The United States Of America As Represented By The Secretary, Department Of Health And Human Services | Method of treating diseases associated with elevated levels of interleukin 1 |
| DE4321444A1 (de) | 1993-06-28 | 1995-01-05 | Bernd Prof Dr Clement | Pharmazeutische Zubereitung |
| JPH08333324A (ja) | 1995-06-08 | 1996-12-17 | Terumo Corp | ベンゼン誘導体およびそれを含有する医薬製剤 |
| JP3540457B2 (ja) | 1995-09-11 | 2004-07-07 | テルモ株式会社 | 抗血栓性を賦与した医療用基材 |
| UA70966C2 (uk) | 1998-11-10 | 2004-11-15 | Янссен Фармацевтика Н.В. | Піримідини, що інгібують реплікацію віл |
| US7884090B2 (en) | 1999-03-17 | 2011-02-08 | Ernest L. Bonner, Jr. | Compositions and methods for the treatment of arthritis |
| US7115665B1 (en) | 2000-11-16 | 2006-10-03 | Onocozyme Pharma, Inc. | Inhibitors of endo-exonuclease activity for treating cancer |
| US6569853B1 (en) | 2000-11-06 | 2003-05-27 | Combinatorx, Incorporated | Combinations of chlorpromazine and pentamidine for the treatment of neoplastic disorders |
| US6693125B2 (en) | 2001-01-24 | 2004-02-17 | Combinatorx Incorporated | Combinations of drugs (e.g., a benzimidazole and pentamidine) for the treatment of neoplastic disorders |
| US20040010045A1 (en) | 2001-09-07 | 2004-01-15 | Taolin Yi | Therapeutic compositions comprised of pentamidine and methods of using same to treat cancer |
| CA2459793A1 (en) | 2001-09-07 | 2003-08-28 | The Cleveland Clinic Foundation | Therapeutic compositions and methods useful in modulating protein tyrosine phosphatases |
| WO2003092616A2 (en) * | 2002-05-01 | 2003-11-13 | The Cleveland Clinic Foundation | Therapeutic compositions comprised of pentamidine and methods of using same to treat cancer |
| US20050054708A1 (en) | 2003-07-28 | 2005-03-10 | Nichols Matthew James | Combinations of drugs for the treatment of neoplasms |
| CA2559208A1 (en) | 2004-03-17 | 2005-09-29 | Mpex Pharmaceuticals, Inc. | Use and administration of bacterial efflux pump inhibitors |
| US7994225B2 (en) | 2004-03-17 | 2011-08-09 | Rempex Pharmaceuticals, Inc. | Bacterial efflux pump inhibitors for the treatment of ophthalmic and otic infections |
| US20060122279A1 (en) | 2004-11-12 | 2006-06-08 | Mediquest Therapeutics, Inc. | Hydrophobic polyamine amides as potent lipopolysaccharide sequestrants |
| TW200719903A (en) | 2005-04-19 | 2007-06-01 | Combinatorx Inc | Compositions for the treatment of neoplasms |
| US7199267B1 (en) | 2005-10-21 | 2007-04-03 | Mediquest Therapeutics, Inc. | Recognition of oligiosaccaride molecular targets by polycationic small molecule inhibitors and treatment of immunological disorders and infectious diseases |
| WO2007100663A2 (en) | 2006-02-22 | 2007-09-07 | University Of Kansas | Polyamines and their use as antibacterial and sensitizing agents |
| US20080226596A1 (en) | 2006-06-19 | 2008-09-18 | Taolin Yi | Therapeutic compositions and methods useful in treating hepatitis |
| EP2550963B1 (de) * | 2011-07-25 | 2016-10-12 | Dritte Patentportfolio Beteiligungsgesellschaft mbH & Co. KG | Pentamidin-Amidoximsäureesters als Prodrugs und ihre Verwendung als Arzneimittel |
| DE102008007381A1 (de) * | 2008-02-01 | 2009-08-13 | Dritte Patentportfolio Beteiligungsgesellschaft Mbh & Co.Kg | Amidine und Guanidine und deren Derivate zur Behandlung von Krankheiten |
| DE102008007426A1 (de) | 2008-02-01 | 2009-08-06 | Rheinische Friedrich-Wilhelms-Universität Bonn | Unbenetzbare Oberflächen |
| US8436049B2 (en) | 2008-02-21 | 2013-05-07 | State Of Oregon Acting By And Through The State Board Of Higher Education On Behalf Of The University Of Oregon | Uses of pentamidine and related compounds |
| WO2010125462A2 (en) * | 2009-05-01 | 2010-11-04 | Oncozyme Pharma Inc. | Pentamidine combinations for treating cancer |
| WO2011035225A1 (en) | 2009-09-21 | 2011-03-24 | President And Fellows Of Harvard College | Synergistic combination therapy |
| WO2012044936A1 (en) | 2010-09-30 | 2012-04-05 | Portola Pharmaceuticals, Inc. | Combination therapy with 4-(3-(2h-1,2,3-triazol-2-yl)phenylamino)-2-((1r,2s)-2-aminocyclohexylamino)pyrimidine-5-carboxamide |
| WO2014009592A1 (en) * | 2012-07-11 | 2014-01-16 | Waterbox Oy | Apparatus for providing rotating movement |
-
2013
- 2013-12-20 CN CN201380067678.5A patent/CN104968340A/zh active Pending
- 2013-12-20 JP JP2015548129A patent/JP6370801B2/ja not_active Expired - Fee Related
- 2013-12-20 MX MX2015007945A patent/MX2015007945A/es unknown
- 2013-12-20 RU RU2015126505A patent/RU2015126505A/ru not_active Application Discontinuation
- 2013-12-20 BR BR112015014836A patent/BR112015014836A2/pt not_active Application Discontinuation
- 2013-12-20 WO PCT/CA2013/051003 patent/WO2014094176A1/en active Application Filing
- 2013-12-20 CA CA2894466A patent/CA2894466A1/en not_active Abandoned
- 2013-12-20 EP EP13865316.7A patent/EP2934501A4/en not_active Withdrawn
- 2013-12-20 US US14/653,807 patent/US9375411B2/en not_active Expired - Fee Related
- 2013-12-20 AU AU2013362755A patent/AU2013362755B2/en not_active Ceased
- 2013-12-20 KR KR1020157019648A patent/KR20150126595A/ko active Search and Examination
-
2016
- 2016-04-27 HK HK16104784.4A patent/HK1216721A1/zh unknown
- 2016-06-09 US US15/178,301 patent/US9827211B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| EP2934501A1 (en) | 2015-10-28 |
| BR112015014836A2 (pt) | 2017-07-11 |
| US9375411B2 (en) | 2016-06-28 |
| US9827211B2 (en) | 2017-11-28 |
| JP2016503035A (ja) | 2016-02-01 |
| CA2894466A1 (en) | 2014-06-26 |
| WO2014094176A1 (en) | 2014-06-26 |
| CN104968340A (zh) | 2015-10-07 |
| MX2015007945A (es) | 2016-02-16 |
| AU2013362755B2 (en) | 2018-09-13 |
| HK1216721A1 (zh) | 2016-12-02 |
| EP2934501A4 (en) | 2016-06-01 |
| US20160287535A1 (en) | 2016-10-06 |
| RU2015126505A (ru) | 2017-01-27 |
| US20150297540A1 (en) | 2015-10-22 |
| AU2013362755A1 (en) | 2015-07-02 |
| JP6370801B2 (ja) | 2018-08-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP3013335B1 (en) | Combination therapy for the treatment of cancer comprising eribulin and lenvatinib | |
| JP4386635B2 (ja) | 消化管間質腫瘍の処置 | |
| US9827211B2 (en) | Uses and methods for the treatment of liver diseases or conditions | |
| US20120108641A1 (en) | Antitumor combination including ave8062 and sorafenib | |
| KR20110132371A (ko) | Rdea119/bay 869766을 포함하는 특정 암의 치료를 위한 제약 조합물 | |
| JP2009520774A (ja) | コンブレタスタチンおよび抗癌剤を含む組合せ | |
| JP2001504085A (ja) | チルホスチンを含む製薬学的組成物 | |
| US10933030B2 (en) | Use of paeonol for inhibiting angiogenesis or for enhancing radiosensitization | |
| WO2019242688A1 (zh) | 3-羟基氨基苯甲酸与索拉非尼联合用药治疗肿瘤 | |
| CN107137417B (zh) | 一种用于治疗恶病质的药物组合物及其应用 | |
| US11628163B2 (en) | 1-piperidinepropionic acid for treating a fibrosing disease | |
| TW202320758A (zh) | 組合 | |
| BRPI0720963A2 (pt) | Utilização terapêutica para o tratamento das leucemias. | |
| US20200375943A1 (en) | Cytocidal method of cancer cells selectively in human patients clinically by depletion of l-ascorbic acid, primarily, with its supplementation alternately augmenting its cytocidal effect | |
| JP2004517821A (ja) | 癌治療のためのカンプトセシン及びスチルベン誘導体からなる組合せ | |
| RU2804771C1 (ru) | Комплексное антиангиогенное и гипоксия-ориентированное противоопухолевое средство | |
| KR20210039414A (ko) | 암의 치료를 위한 병용 요법 | |
| JP4156028B2 (ja) | 進行癌の処置のためのテモゾロミドとα−IFNの組合せ | |
| CN110227083A (zh) | 一种含氯化钆和双胍类降糖药的药物组合物及其用途 | |
| CN111728960B (zh) | 富马酸比索洛尔联合多西他赛在制备抗肿瘤药物中的应用 | |
| US11382902B2 (en) | Treatment of cancer by stimulation of IL-12 production | |
| US20060166957A1 (en) | Methods of treating obesity and related disorders using tellurium selenium compounds | |
| Tiwary et al. | Exploring the Role of Curcumin in Cancer: A Long Road Ahead | |
| JP2004231557A (ja) | エピネフリン含有抗腫瘍剤 | |
| CN117357534A (zh) | 包含维甲酸的药物组合物在制备治疗肝细胞癌伴腹腔转移的药物中的用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination |