KR20150082623A - 에너지 대사를 증가시키기 위한 조성물 및 방법 - Google Patents
에너지 대사를 증가시키기 위한 조성물 및 방법 Download PDFInfo
- Publication number
- KR20150082623A KR20150082623A KR1020157015622A KR20157015622A KR20150082623A KR 20150082623 A KR20150082623 A KR 20150082623A KR 1020157015622 A KR1020157015622 A KR 1020157015622A KR 20157015622 A KR20157015622 A KR 20157015622A KR 20150082623 A KR20150082623 A KR 20150082623A
- Authority
- KR
- South Korea
- Prior art keywords
- composition
- leucine
- subject
- pde
- inhibitor
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/04—Nitro compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/045—Hydroxy compounds, e.g. alcohols; Salts thereof, e.g. alcoholates
- A61K31/05—Phenols
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/197—Carboxylic acids, e.g. valproic acid having an amino group the amino and the carboxyl groups being attached to the same acyclic carbon chain, e.g. gamma-aminobutyric acid [GABA], beta-alanine, epsilon-aminocaproic acid, pantothenic acid
- A61K31/198—Alpha-aminoacids, e.g. alanine, edetic acids [EDTA]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4415—Pyridoxine, i.e. Vitamin B6
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/4965—Non-condensed pyrazines
- A61K31/497—Non-condensed pyrazines containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/506—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
- A61K31/675—Phosphorus compounds having nitrogen as a ring hetero atom, e.g. pyridoxal phosphate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7048—Compounds having saccharide radicals and heterocyclic rings having oxygen as a ring hetero atom, e.g. leucoglucosan, hesperidin, erythromycin, nystatin, digitoxin or digoxin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/54—Mixtures of enzymes or proenzymes covered by more than a single one of groups A61K38/44 - A61K38/46 or A61K38/51 - A61K38/53
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Abstract
지방산 산화 또는 미토콘드리아 생물발생 증가의 유도, 체중 증가의 감소, 체중 감소의 유도, 또는 Sirt1, Sirt3 또는 AMPK 활성의 증가에 유용한 조성물 및 방법이 본원에 제공된다. 이러한 조성물은 PDE 5 억제제, 예컨대 실데나필 또는 이카리인, 및 레스베라트롤, 및 분지형 아미노산, 예컨대 류신 또는 그의 대사물의 조합을 포함한다.
Description
상호 참조
본원은 2012년 11월 13일에 출원된 미국 가출원 번호 61/726,006을 우선권 주장하며, 이는 모든 목적을 위해 그 전문이 본원에 참조로 포함된다.
발명의 배경
모든 유기체는 그의 섭취 및 에너지 대사와 유기체의 그의 소비 요구량의 균형을 이룸으로써 에너지 항상성을 유지하는 정교한 대사 경로를 발전시켰다. 포유동물에서, 이들 경로는 음식물 섭취, 글루코스 항상성, 지방 및/근육 내 에너지 저장, 및 예를 들어, 신체 활동에 의한 에너지 동원을 조절한다. 종종 에너지 소비량에 비한 과량의 에너지 섭취로부터 기인하는 이러한 경로의 오작동은 에너지 항상성의 불균형으로 이어지며, 이는 넓은 범위의 대사 장애로 이어질 수 있다. 이 중 비만, 당뇨병, 고혈압, 동맥경화증, 고콜레스테롤 및 고지혈증이 있다.
인간에서 대사 장애의 높은 발생률 및 건강과 사망률에 대한 관련 영향은 공중 보건에 상당한 부담을 제시한다. 예를 들어, 체질량 지수 30 kg/m2 초과로서 임상적으로 정의되는 비만은, 미국 성인 인구의 35.7%에게서 발생하는 것으로 추정된다. 비만은 심장 질환 및 제II형 당뇨병과 같은 많은 질병의 가능성을 증가시키고, 비만은 전세계에게 주요 예방가능한 사망 원인 중 하나이다. 미국에서, 비만은 매년 대략 110,000-365,000의 사망을 야기하는 것으로 추정된다. 당뇨병은 높은 혈액 글루코스 수준 또는 낮은 글루코스 내성을 특징으로 하는 대사 장애이고, 미국 인구의 8%에게서 발생하는 것으로 추정된다. 당뇨병은 또한 혈관 질환, 암, 신질환, 감염성 질환, 외부 원인, 고의적 자해, 신경계 장애, 및 만성 폐질환으로부터의 더 높은 사망 위험과 상당히 관련된다 (N Engl J Med 2011; 364:829-841). 대상체에 중심부 비만 및 2개 이상의 다른 대사 장애 (예컨대 고콜레스테롤, 고혈압 또는 당뇨병)가 존재하는 대사 증후군은, 미국 인구의 25%에게서 발생하는 것으로 추정된다.
시르투인은 하등 모델 유기체, 예컨대 효모, C.엘레간스 및 드로소필라의 수명을 연장시키는 것으로 나타난 고도로 보존된 단백질 데아세틸라제 및/또는 ADP-리보실트랜스퍼라제이다. 포유동물에서, 시르투인은 다중 에너지 항상성 경로를 조절하는 유전자의 활성을 조정하기 위해 환경 신호에 반응하는, 대사 센서로서 작용하는 것으로 나타났다. 예를 들어, 연구는 시르투인 활성화가, 수명을 상당히 연장시키는 것으로 입증된 개입인 칼로리 제한의 효과를 모방하고, 지방산 산화에 의한 지방의 에너지로의 전환 및 글루코스 항상성을 개선하는 유전자를 활성화하는 것임을 나타내었다.
시르투인 경로는 또한 포스포디에스테라제 (PDE)를 포함한다. PDE는 시클릭 아데노신 모노포스페이트 (cAMP) 및 시클릭 구아노신 모노포스페이트 (cGMP)와 상호작용하는 효소이다. 효소의 PDE 패밀리는 인간의 PDE 1-11을 비롯한 다수의 하위부류를 포함한다. 이러한 포스포디에스테라제의 억제제는 cAMP 및 cGMP의 불활성화를 방지할 수 있고, 다양한 상이한 생리학적 효과를 가질 수 있다. PDE 억제제는 또 다른 하위부류와 비교하여 하나의 PDE 하위부류를 우선적으로 억제함으로써 선택적이거나, 또는 개별적 PDE 하위부류에 대해 실질적으로 더 낮은 선택도를 갖는 것인 비-선택적일 수 있다. 실데나필은 PDE 5의 선택적 억제를 나타내는 선택적 PDE 억제제의 예이다. 실데나필은 폐고혈압, 발기 기능장애 및 고산병을 치료하는데 사용되는 제약 활성제이다.
특이적 에너지 대사 경로를 표적화함으로써 대사 장애를 위한 치료법을 개발하려는 많은 노력이 시도되었다. 이러한 시도는, 예를 들어, 이소플라본 (미국 특허 출원 번호 20110165125), 테트라히드로립스타틴 (미국 특허 번호 6,004,996), 및 SIRT1 및 AMPK 경로를 조절하는 조성물 (미국 특허 출원 번호 20100210692, 20100009992, 20070244202 및 20080176822)의 개발을 유도하였다. 그러나, 이들의 노력은 성공에는 한계가 있다. 예를 들어, 인간에서 SIRT1 활성화제 레스베라트롤의 사용은 그의 한정된 생체이용률에 의해 방해되어, 안전성 우려를 일으키는 고 투여량을 필요하게 한다. 따라서, 대사 경로를 안전하게 조절함으로써 광범위한 대사 장애를 해결할 수 있는 치료법에 대한 큰 필요성이 남아있다.
본 발명은 일반적으로 에너지 대사의 조절 분야에 관한 것이다. 일부 실시양태에서, 본 발명은 PDE 억제제, 예컨대 PDE 5, 및 분지쇄 아미노산을 사용하여 에너지 대사를 조절하기 위한 조성물, 방법 및 키트를 제공한다.
PDE 억제제를 포함하는 조성물은 PDE가 시르투인 경로의 성분이기 때문에 에너지 대사를 조절하는데 효과적일 수 있다. 이러한 PDE 억제제가 시르투인 경로에 영향을 미칠 수 있기 때문에, 선택적 및 비-선택적 둘 다의 PDE 억제제를 포함하는 조성물은 에너지 대사의 조절에 유익한 효과를 가질 수 있다.
본 발명은 에너지 대사를 조절하기 위한 개선된 조성물 및 보충제에 대한 필요를 다룬다. 에너지 대사의 조절은 체중 또는 지방 조직의 감소, 지방 산화 또는 인슐린 감수성의 증가 및/또는 염증 또는 산화성 스트레스의 감소를 가능하게 할 수 있다. 이러한 효과는 세포 대사 및 미토콘드리아 생물발생을 비롯한, 에너지 대사의 증가 또는 조절의 방식에 의한 것일 수 있다.
본원은 대상체에서 지방산 산화 및 미토콘드리아 생물발생의 증가를 유도하기에 유용한 조성물을 제공한다. 조성물은 또한 Sirt1 및 Sirt3의 활성화를 유발하며, 그로 인해 당뇨병, 심혈관 질환 및 염증성 질환의 예방 및 치료를 비롯한 유익한 하류 효과를 매개한다. 이러한 조성물은 PDE5 억제제, 예컨대 아바나필, 아이오데나필, 미로데나필, 실데나필, 타달라필, 이카리인, 바르데나필, 우데나필 또는 자프린스트를 포함하나 이에 제한되지는 않는 PDE 억제제를 분지쇄 아미노산 및/또는 그의 대사물 (예를 들어 베타-히드록시메틸부티레이트 (HMB), 류신, 케토-이소카프로산 (KIC) 또는 HMB, KIC 및/또는 류신의 조합)과 조합으로 함유한다. 분지쇄 및 아미노산은 류신일 수 있고 대사물은 HMB 및 KIC일 수 있다. 본원은 또한 개시된 조성물의 투여를 포함하는, 대상체에서 지방산 산화를 증가시키는 방법을 제공한다.
본 발명의 한 측면은 (a) PDE 억제제, 예를 들어, PDE5 억제제; 및 (b) 류신 및/또는 류신 대사물을 포함하는, 에너지 대사를 향상시키기에 효과적인 조성물을 제공한다. 일부 실시양태에서, 조성물은 성분 (a) 또는 (b)를 단독으로 대상체에 투여하는 것과 비교하여 대상체에서 에너지 대사를 더 큰 정도로 향상시킨다. 일부 실시양태에서, 류신 및/또는 류신 대사물은 유리 아미노산 및/또는 유리 아미노산 대사물 형태로 존재한다. 예를 들어, 류신은 펩티드 결합을 포함하지 않는 형태로 존재할 수 있다.
일부 실시양태에서, 향상된 에너지 대사는 적어도 약 300%의 지방세포의 지방산 산화의 증가, 적어도 150%의 지방세포의 글루코스 활용의 증가, 적어도 60% 변화의 지방세포의 글루코스 활용의 증가 또는 적어도 약 15%의 미토콘드리아 바이오매스의 증가에 의해 측정된다.
일부 실시양태에서, 향상된 에너지 대사는 적어도 20%의 식후 혈액 글루코스의 감소, 적어도 30%의 식후 인슐린의 감소, 적어도 40%의 공복 혈액 글루코스의 감소, 적어도 40%의 공복 인슐린의 감소, 적어도 15%의 글루코스 부하에 대한 혈액 글루코스 반응의 감소, 인슐린 내성 결과의 2배의 개선, 또는 적어도 20%의 염증성 스트레스의 감소에 의해 측정된다. 일부 실시양태에서, 글루코스 부하에 대한 혈액 글루코스 반응은 글루코스 내성 곡선 하의 면적에 의해 측정된다.
일부 실시양태에서, PDE 5 억제제는 아바나필, 아이오데나필, 미로데나필, 실데나필, 타달라필, 이카리인, 바르데나필, 우데나필 또는 자프린스트이다. 다른 실시양태에서, PDE 5 억제제는 실데나필 또는 이카리인이다. 일부 실시양태에서, PDE 5 억제제는 이카리인이다. 일부 실시양태에서, 성분 (b)는 HMB이다. 일부 실시양태에서, 성분 (b)는 유리 류신이다. 다른 실시양태에서, 조성물은 비-선택적 PDE 억제제를 추가로 포함한다. 다른 실시양태에서, 조성물은 비타민 B6을 추가로 포함한다.
일부 실시양태에서, 조성물은 제약 활성제를 추가로 포함한다. 조성물은 2종의 제약 활성제를 추가로 포함할 수 있다. 2종의 제약 활성제 중 하나는 실데나필일 수 있다. 일부 실시양태에서, 조성물은 경구 소비를 위해 제제화된다.
조성물은 치료량 미만의 성분 (a)를 포함하는 단위 투여량일 수 있다. 치료량 미만의 성분 (a)는 약 0.1 내지 20 mg의 실데나필일 수 있다. 치료량 미만의 성분 (a)는 약 0.1 내지 10 mg의 실데나필일 수 있다. 치료량 미만의 성분 (a)는 약 0.5- 50 mg의 아바나필, 0.05 - 10 mg의 아이오데나필, 0.25- 25 mg의 미로데나필, 0.01 - 1.25 mg의 타달라필, 0.01 - 1.25 mg의 바르데나필, 0.5 - 50 mg의 우데나필, 0.5-50 mg의 자프린스트 또는 0.05-100 mg의 이카리인일 수 있다. 성분 (b)는 약 500 mg 이상의 류신을 포함할 수 있다. 성분 (b)는 약 200 mg 이상의 HMB를 포함할 수 있다. 일부 실시양태에서, 성분 (b)는 50-1000 mg의 유리 류신을 포함한다. 성분 (b)는 500-700 mg의 유리 류신을 포함할 수 있다.
본 발명의 또 다른 측면은 (a) PDE 5 억제제; 및 (b) 폴리페놀을 포함하고, 성분 (a) 또는 (b)를 단독으로 대상체에 투여한 것과 비교하여 대상체에서 에너지 대사를 더 큰 정도로 향상시키는, 에너지 대사를 향상시키기에 효과적인 조성물을 제공한다. 폴리페놀은 레스베라트롤일 수 있다.
폴리페놀은 스틸벤 또는 히드록시신남산일 수 있다. 폴리페놀은 클로로겐산, 레스베라트롤, 카페인산, 피세아타놀, 엘라그산, 에피갈로카테킨 갈레이트 (EGCG), 포도씨 추출물 또는 그의 임의의 유사체일 수 있다. 조성물은 류신 및/또는 류신 대사물을 추가로 포함할 수 있다.
본 발명의 한 측면은 본원에 기재된 조성물을 에너지 대사의 조절이 필요한 대상체에게 투여하는 것을 포함하는, 대상체에서 에너지 대사를 조절하는 방법을 제공한다. 조성물은 경구로 투여될 수 있다.
본 발명의 또 다른 측면은 비만 또는 당뇨병을 갖고 있거나 또는 그에 걸리기 쉬운 대상체를 확인하고, 본원에 기재된 조성물을 대상체에게 투여하는 것을 포함하는, 에너지 대사를 조절하는 방법을 제공한다.
본 발명은 또한 치료량 미만의 PDE 억제제, 예를 들어, PDE 5 억제제 및 적어도 약 500 mg의 류신 또는 200 mg의 HMB를 포함하는 단위 투여량을 에너지 대사의 조절이 필요한 대상체에게 투여하는 것을 포함하는, 대상체에서 에너지 대사를 조절하는 방법을 제공한다. 치료량 미만의 PDE 억제제, 예를 들어, PDE 5 억제제는 약 10 mg/일 미만일 수 있다. PDE 5 억제제는 실데나필일 수 있다. 류신은 유리 아미노산 형태, 예를 들어, 무손상 형태일 수 있다. 예를 들어, 류신은 펩티드 결합을 포함하지 않는 형태로 존재할 수 있다.
본 발명의 한 측면은 본원에 기재된 조성물을 선택된 투여 수준으로 투여하는 것을 포함하며, 여기서 선택된 투여 수준은 대상체에서 약 1 nM 실데나필 및 약 0.5 mM 류신의 순환 수준을 유도하는 것인, 대상체에서 에너지 대사를 증가시키는 방법을 제공한다. 류신은 유리 아미노산 형태, 예를 들어, 무손상 형태일 수 있다. 예를 들어, 류신은 펩티드 결합을 포함하지 않는 형태로 존재할 수 있다. 일부 경우에, 본원의 임의의 방법은 1주 이상 동안, 2주 이상 동안, 또는 6주 이상 동안 조성물을 투여하는 것을 포함한다.
본 발명은 또한 PDE 5 억제제; 및 유리 아미노산 형태의 분지쇄 아미노산 또는 그의 유리 대사물을 포함하는 치료상 유효한 조성물을 당뇨병의 치료를 필요로 하는 대상체에게 투여하는 것을 포함하는, 대상체에서 당뇨병을 치료하는 방법을 제공한다. 당뇨병은 예를 들어 제I형 당뇨병 또는 제II형 당뇨병일 수 있다. 예를 들어, 조성물의 투여는 대상체에서 인슐린 감수성을 개선할 수 있다. 제I형 당뇨병은 제I형 당뇨병이 없는 대상체와 비교하여 인슐린을 생산하는 능력의 감소를 특징으로 할 수 있다. 본원에 기재된 조성물의 투여는 제I형 당뇨병을 갖는 대상체의, 대상체에 의해 생산되거나 대상체에게 투여되는 인슐린에 대한 감수성을 개선할 수 있다. 개선된 감수성은 조성물의 투여 전에 측정된 대상체의 감수성보다 더 클 수 있다. 제II형 당뇨병은 인슐린에 대한 감수성의 감소를 특징으로 할 수 있다. 따라서, 본원에 기재된 조성물의 투여는 제II형 당뇨병을 갖는 대상체에서 인슐린 감수성을 개선할 수 있다. 당뇨병은 식이-유발 당뇨병일 수 있다. 일부 실시양태에서, 분지쇄 아미노산은 유리 류신이다. 일부 실시양태에서, 분지쇄 아미노산 대사물은 HMB이다. 치료상 유효한 조성물은 본원에 기재된 임의의 조성물일 수 있는 것으로 이해된다.
일부 실시양태에서, PDE5 억제제는 이카리인이다. 일부 실시양태에서, PDE5 억제제는 실데나필이다. 일부 실시양태에서, PDE5 억제제는 타달라필이다. 일부 실시양태에서, PDE5 억제제는 바르데나필이다. 일부 실시양태에서, PDE5 억제제는 우데나필이다. 일부 실시양태에서, PDE5 억제제는 자프린스트이다.
일부 실시양태에서, 방법은 치료상 유효한 조성물을 경구로 투여하는 것을 포함한다. 일부 실시양태에서, 방법은 치료상 유효한 조성물을 1주 이상 동안 투여하는 것을 포함한다. 일부 실시양태에서, 방법은 치료상 유효한 조성물을 2주 이상 동안 투여하는 것을 포함한다. 일부 실시양태에서, 방법은 치료상 유효한 조성물을 6주 이상 동안 투여하는 것을 포함한다.
일부 실시양태에서, 치료상 유효한 조성물을 투여하는 것은 대상체에서 당뇨병의 증상을 개선한다. 당뇨병의 증상은 제I형 및/또는 제II형 당뇨병의 증상일 수 있다. 당뇨병 증상의 개선은 적어도 20%의 식후 혈액 글루코스의 감소, 적어도 30%의 식후 인슐린의 감소, 적어도 40%의 공복 혈액 글루코스의 감소, 적어도 40%의 공복 인슐린의 감소, 적어도 15%의 글루코스 부하에 대한 혈액 글루코스 반응의 감소, 인슐린 내성 결과의 2배의 개선 또는 적어도 20%의 염증성 스트레스의 감소에 의해 측정될 수 있다. 일부 실시양태에서, 글루코스 부하에 대한 혈액 글루코스 반응는 글루코스 내성 곡선 하의 면적에 의해 측정된다.
본 발명의 또 다른 측면은 본원에 기재된 조성물의 단위 투여량의 복수 일 공급물 및 복수 일의 기간 동안 상기 복수 일 공급물의 투여를 지시하는 지침서를 포함하는 키트를 제공한다. 일부 실시양태에서, 키트는 착용가능한 활동 모니터를 추가로 포함한다.
참조에 의한 포함
본 명세서에서 언급된 모든 공개물, 특허 및 특허 출원은, 각각의 개별 공개물, 특허 또는 특허 출원이 구체적으로 및 개별적으로 참조로 포함된 것으로 나타내어진 것과 동일한 정도로 본원에 참조로 포함된다.
본 발명의 신규한 특징은 특히 첨부된 특허청구범위에 기재되어 있다. 본 발명의 특징 및 이점의 보다 우수한 이해는, 본 발명의 원리가 이용되는 예시적 실시양태를 기재하는 하기 상세한 설명, 및 첨부되는 도면(들)을 참조하여 획득될 것이다:
도 1은 시르투인 경로를 나타내는 다이어그램을 도시한다.
도 2는 C2C12 근관에서 지방산 산화에 대한 실데나필과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 도시한다. 지방산 산화는 팔미테이트 주입에 대한 O2 소비 반응으로서 측정되었고, 주입-전 기준선으로부터의 % 변화로 표현된다. 수직 선은 팔미테이트 주입의 시간을 나타내고; 이 선의 왼편의 데이터 점은 기준선 측정치이고 이 선의 오른편의 것은 O2 소비 반응을 나타낸다.
도 3은 C2C12 근관에서 지방산 산화에 대한 실데나필과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 나타낸다. 데이터는 대조군 값으로부터의 % 변화로 나타내었다. *p=0.013; **p=0.015.
도 4는 3T3-L1 지방세포에서 지방산 산화에 대한 실데나필과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 도시한다. 데이터는 대조군 값으로부터의 % 변화로 나타내었다. *p<0.05.
도 5는 C2C12 근관에서 글루코스 활용에 대한 실데나필과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 도시한다. 글루코스 활용은 글루코스 주입에 대한 세포외 산성화 반응으로서 측정되었다. *p=0.04.
도 6은 3T3-L1 지방세포에서 글루코스 활용에 대한 실데나필과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 도시한다. 글루코스 활용은 글루코스 주입에 대한 세포외 산성화 반응으로서 측정되었다. *p=0.05.
도 7은 C2C12 근관에서 지방산 산화에 대한 이카리인과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 도시한다. 지방산 산화는 팔미테이트 주입에 대한 O2 소비 반응으로서 측정되었고, 주입-전 기준선으로부터의 % 변화로 표현된다. 수직선은 팔미테이트 주입의 시간을 나타내고; 이 선의 왼편의 데이터 점은 기준선 측정치이고 이 선의 오른편의 것은 O2 소비 반응을 나타낸다.
도 8은 C2C12 근관에서 지방산 산화에 대한 이카리인과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 나타낸다. 데이터는 대조군 값으로부터의 % 변화로 나타내었다. *p=0.03; **p=0.002.
도 9는 3T3-L1 지방세포에서 지방산 산화에 대한 이카리인과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 도시한다. 데이터는 대조군 값으로부터의 % 변화로 나타내었다. *p<0.05.
도 10은 C2C12 근관에서 산화질소 생산에 대한 실데나필과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 도시한다. *대조군과 비교하여 p<0.0001; **다른 모든 치료와 비교하여 p=0.0003.
도 11은 C2C12 근관에서 산화질소 생산에 대한 이카리인과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 도시한다. 대조군과 비교하여 p<0.0001; **다른 모든 치료와 비교하여 p=0.00013.
도 12는 C2C12 근관에서, 미토콘드리아 질량으로서 측정되는, 미토콘드리아 생물발생에 대한 실데나필과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 도시한다. *대조군과 비교하여 p<0.0001; **다른 모든 치료와 비교하여 p=0.0003.
도 13은 C2C12 근관에서, 미토콘드리아 질량으로서 측정되는, 미토콘드리아 생물발생에 대한 이카리인 (1 nM)과 HMB (5 μM), 류신 및 레스베라트롤의 상호작용 효과를 도시한다. 대조군과 비교하여 p<0.0001; **다른 모든 치료와 비교하여 p=0.00013.
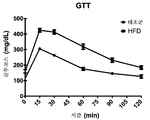
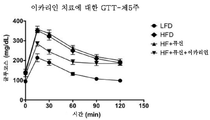
도 14는 저지방 또는 고지방 식이에 대한 6주 후 마우스에서의 복강내 글루코스 내성 검사로부터의 결과를 도시한다.
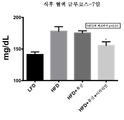
도 15는 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 식후 혈액 글루코스 수준에 대한 7일의 류신 또는 류신 + 이카리인 치료의 효과를 도시한다.
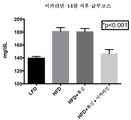
도 16은 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 식후 혈액 글루코스 수준에 대한 14일의 류신 또는 류신 + 이카리인 치료의 효과를 도시한다.
도 17은 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 식후 혈장 인슐린에 대한 14일의 류신 또는 류신 + 이카리인 치료의 효과를 도시한다.
도 18은 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 인슐린 저항성 측정의 항상성 평가에 대한 14일의 류신 또는 류신 + 이카리인 치료의 효과를 도시한다.
도 19는 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 28일의 류신 또는 류신 + 이카리인 치료 후 1.2 U 인슐린/kg 체중에 대한 혈액 글루코스 반응을 도시한다.
도 20은 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 28일의 류신 또는 류신 + 이카리인 치료 후 1.2 U 인슐린/kg 체중에 대한 30분 혈액 글루코스 반응을 도시한다.
도 21은 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 류신 또는 류신 + 이카리인으로의 치료 5주에 측정된 글루코스 내성 검사로부터의 결과를 도시한다.
도 22는 도 21에 도시된 글루코스 내성 검사로부터 획득된, 시간에 걸친 글루코스 부하에 대한 계산된 적분 혈액 글루코스 반응을 도시한다.
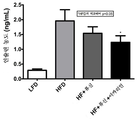
도 23은 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 류신 또는 류신 + 이카리인으로의 치료 6주 후 공복 혈액 글루코스 수준을 도시한다.
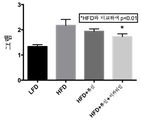
도 24는 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 류신 또는 류신 + 이카리인으로의 치료 6주 후 공복 인슐린 수준을 도시한다.
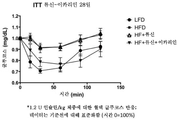
도 25는 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 류신 또는 류신 + 이카리인으로의 치료 6주 후 인슐린 저항성의 항상성 평가를 도시한다.
도 26은 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 류신 또는 류신 + 이카리인으로의 치료 6주 후 간 질량을 도시한다.
도 27은 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 류신 또는 류신 + 이카리인으로의 치료 6주 후 염증 마커 C-반응성 단백질의 수준을 도시한다.
도 1은 시르투인 경로를 나타내는 다이어그램을 도시한다.
도 2는 C2C12 근관에서 지방산 산화에 대한 실데나필과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 도시한다. 지방산 산화는 팔미테이트 주입에 대한 O2 소비 반응으로서 측정되었고, 주입-전 기준선으로부터의 % 변화로 표현된다. 수직 선은 팔미테이트 주입의 시간을 나타내고; 이 선의 왼편의 데이터 점은 기준선 측정치이고 이 선의 오른편의 것은 O2 소비 반응을 나타낸다.
도 3은 C2C12 근관에서 지방산 산화에 대한 실데나필과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 나타낸다. 데이터는 대조군 값으로부터의 % 변화로 나타내었다. *p=0.013; **p=0.015.
도 4는 3T3-L1 지방세포에서 지방산 산화에 대한 실데나필과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 도시한다. 데이터는 대조군 값으로부터의 % 변화로 나타내었다. *p<0.05.
도 5는 C2C12 근관에서 글루코스 활용에 대한 실데나필과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 도시한다. 글루코스 활용은 글루코스 주입에 대한 세포외 산성화 반응으로서 측정되었다. *p=0.04.
도 6은 3T3-L1 지방세포에서 글루코스 활용에 대한 실데나필과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 도시한다. 글루코스 활용은 글루코스 주입에 대한 세포외 산성화 반응으로서 측정되었다. *p=0.05.
도 7은 C2C12 근관에서 지방산 산화에 대한 이카리인과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 도시한다. 지방산 산화는 팔미테이트 주입에 대한 O2 소비 반응으로서 측정되었고, 주입-전 기준선으로부터의 % 변화로 표현된다. 수직선은 팔미테이트 주입의 시간을 나타내고; 이 선의 왼편의 데이터 점은 기준선 측정치이고 이 선의 오른편의 것은 O2 소비 반응을 나타낸다.
도 8은 C2C12 근관에서 지방산 산화에 대한 이카리인과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 나타낸다. 데이터는 대조군 값으로부터의 % 변화로 나타내었다. *p=0.03; **p=0.002.
도 9는 3T3-L1 지방세포에서 지방산 산화에 대한 이카리인과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 도시한다. 데이터는 대조군 값으로부터의 % 변화로 나타내었다. *p<0.05.
도 10은 C2C12 근관에서 산화질소 생산에 대한 실데나필과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 도시한다. *대조군과 비교하여 p<0.0001; **다른 모든 치료와 비교하여 p=0.0003.
도 11은 C2C12 근관에서 산화질소 생산에 대한 이카리인과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 도시한다. 대조군과 비교하여 p<0.0001; **다른 모든 치료와 비교하여 p=0.00013.
도 12는 C2C12 근관에서, 미토콘드리아 질량으로서 측정되는, 미토콘드리아 생물발생에 대한 실데나필과 HMB, 류신 및 레스베라트롤의 상호작용 효과를 도시한다. *대조군과 비교하여 p<0.0001; **다른 모든 치료와 비교하여 p=0.0003.
도 13은 C2C12 근관에서, 미토콘드리아 질량으로서 측정되는, 미토콘드리아 생물발생에 대한 이카리인 (1 nM)과 HMB (5 μM), 류신 및 레스베라트롤의 상호작용 효과를 도시한다. 대조군과 비교하여 p<0.0001; **다른 모든 치료와 비교하여 p=0.00013.
도 14는 저지방 또는 고지방 식이에 대한 6주 후 마우스에서의 복강내 글루코스 내성 검사로부터의 결과를 도시한다.
도 15는 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 식후 혈액 글루코스 수준에 대한 7일의 류신 또는 류신 + 이카리인 치료의 효과를 도시한다.
도 16은 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 식후 혈액 글루코스 수준에 대한 14일의 류신 또는 류신 + 이카리인 치료의 효과를 도시한다.
도 17은 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 식후 혈장 인슐린에 대한 14일의 류신 또는 류신 + 이카리인 치료의 효과를 도시한다.
도 18은 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 인슐린 저항성 측정의 항상성 평가에 대한 14일의 류신 또는 류신 + 이카리인 치료의 효과를 도시한다.
도 19는 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 28일의 류신 또는 류신 + 이카리인 치료 후 1.2 U 인슐린/kg 체중에 대한 혈액 글루코스 반응을 도시한다.
도 20은 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 28일의 류신 또는 류신 + 이카리인 치료 후 1.2 U 인슐린/kg 체중에 대한 30분 혈액 글루코스 반응을 도시한다.
도 21은 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 류신 또는 류신 + 이카리인으로의 치료 5주에 측정된 글루코스 내성 검사로부터의 결과를 도시한다.
도 22는 도 21에 도시된 글루코스 내성 검사로부터 획득된, 시간에 걸친 글루코스 부하에 대한 계산된 적분 혈액 글루코스 반응을 도시한다.
도 23은 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 류신 또는 류신 + 이카리인으로의 치료 6주 후 공복 혈액 글루코스 수준을 도시한다.
도 24는 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 류신 또는 류신 + 이카리인으로의 치료 6주 후 공복 인슐린 수준을 도시한다.
도 25는 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 류신 또는 류신 + 이카리인으로의 치료 6주 후 인슐린 저항성의 항상성 평가를 도시한다.
도 26은 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 류신 또는 류신 + 이카리인으로의 치료 6주 후 간 질량을 도시한다.
도 27은 미치료된 저지방 식이 마우스와 비교하여, 고지방 식이 마우스에서 류신 또는 류신 + 이카리인으로의 치료 6주 후 염증 마커 C-반응성 단백질의 수준을 도시한다.
본 발명의 여러 측면은 설명을 위해 예시적인 적용과 관련하여 하기 기재된다. 다양한 상세한 설명, 관계 및 방법은 본 발명의 완전한 이해를 제공하기 위해 설명되는 것임을 이해하여야 한다. 그러나, 관련 분야의 통상의 기술자는, 본 발명을 상세한 설명 중 하나 이상이 없이도 또는 다른 방법으로도 실행할 수 있다는 것을 용이하게 인식할 것이다. 일부 작용이 다양한 순서로 및/또는 다른 작용 또는 사건과 동시에 발생할 수 있기 때문에, 달리 언급되지 않는 한, 본 발명은 작용 또는 사건의 예시된 순서에 의해 제한되지 않는다. 더욱이, 설명된 작용 또는 사건 모두가 본 발명에 따른 방법론을 시행하는 것을 필요로 하는 것은 아니다. 개시된 조성물 중의 다양한 성분의 농도는 예시적이고 열거된 농도 자체로 제한되는 것을 의미하지는 않는다.
본원에 사용된 바와 같이, 용어 "대상체" 또는 "개체"는 포유동물을 포함한다. 포유동물의 비제한적 예는 인간, 및 트랜스제닉 및 비-트랜스제닉 마우스를 비롯한 마우스를 포함한다. 본원에 기재된 방법은 전임상 인간 치료 및 수의학적 적용 모두에서 유용할 수 있다. 일부 실시양태에서 대상체는 포유동물이고, 일부 실시양태에서 대상체는 인간이다. 다른 포유동물은 유인원, 침팬지, 오랑우탄, 원숭이; 길들여진 동물 (애완 동물), 예컨대 개, 고양이, 기니 피그, 햄스터, 마우스, 래트, 토끼 및 페릿; 길들여진 가축, 예컨대 소, 버팔로, 들소, 말, 당나귀, 돼지, 양 및 염소; 또는 전형적으로 동물원에 있는 외래 동물, 예컨대 곰, 사자, 호랑이, 표범, 코끼리, 하마, 리노세로스, 기린, 영양, 나무늘보, 가젤영양, 얼룩말, 누, 프레리 도그, 코알라, 캥거루, 팬더, 자이언트 팬더, 하이에나, 바다표범, 바다사자, 및 코끼리 바다물범을 포함하고 이에 제한되지는 않는다.
용어 "투여하다", "투여된", 및 "투여하는"는, 정맥내, 동맥내, 경구, 비경구, 협측, 국소, 경피, 직장, 근육내, 피하, 골내, 경점막 또는 복강내 투여 경로를 포함하나 이에 제한되지는 않는, 관련 기술분야에 공지된 경로를 통해 대상체에게 조성물을 제공하는 것으로서 정의된다. 본원의 특정 실시양태에서, 조성물을 투여하는 경구 경로가 바람직할 수 있다.
본원에 사용되는 "작용제" 또는 "생물학적 활성제"는 생물학적, 제약적, 또는 화학적 화합물 또는 다른 모이어티를 지칭한다. 비제한적 예는 단일 또는 복합 유기 또는 무기 분자, 펩티드, 단백질, 펩티드 핵산 (PNA), 올리고뉴클레오티드 (예를 들어, 압타머 및 폴리뉴클레오티드 포함), 항체, 항체 유도체, 항체 단편, 비타민 유도체, 탄수화물, 독소, 또는 화학요법 화합물을 포함한다. 다양한 화합물, 예를 들어 소분자 및 올리고머 (예를 들어, 올리고펩티드 및 올리고뉴클레오티드), 및 다양한 코어 구조에 기초한 합성 유기 화합물이 합성될 수 있다. 또한, 다양한 천연 공급원이 식물 또는 동물 추출물 등과 같은 스크리닝을 위한 화합물을 제공할 수 있다. 통상의 기술자는 본 발명의 작용제의 구조적 본질에 관해서는 어떤 제한도 없음을 용이하게 인식할 수 있다.
용어 "유효량" 또는 "치료 유효량"은, 하기 정의된 바와 같은 질환 치료를 포함하나 이제 제한되지는 않는 의도된 적용을 실시하기에 충분한, 본원에 기재된 화합물의 양을 지칭한다. 치료 유효량은 의도된 적용 (시험관내 또는 생체내), 또는 치료될 대상체 및 질환 상태, 예를 들어 대상체의 체중 및 연령, 질환 상태의 중증도, 투여 방식 등에 따라 달라질 수 있으며, 이는 통상의 기술자에 의해 용이하게 결정될 수 있다. 이 용어는 또한 표적 세포에서 특정한 반응, 예를 들어, 증식의 감소 또는 표적 단백질의 활성의 하향 조절을 유도할 것인 용량에 적용된다. 구체적인 용량은 선택된 특정 화합물, 이어질 투여 요법, 다른 화합물과의 조합 투여 여부, 투여 시점, 투여될 조직 및 수행될 물리적 전달 시스템에 따라 달라질 것이다.
본원에 사용되는 용어 "에너지 대사"는 세포 대사 및 미토콘드리아 생물발생을 비롯한 신체에서 생화학적 반응을 수반하는 에너지의 변환을 지칭한다. 에너지 대사는 본원에 기재된 다양한 측정, 예를 들어 및 비제한적으로, 체중-손실, 지방-손실, 인슐린 감수성, 지방산 산화, 글루코스 활용, 트리글리세리드 함량, Sirt 1 발현 수준, AMPK 발현 수준, 산화성 스트레스 및 미토콘드리아 바이오매스를 사용하여 정량화될 수 있다.
본 발명의 성분, 예를 들어 실데나필 및 이카리인을 포함하나 이에 제한되지는 않는 PDE 5 억제제, 류신 및 류신 대사물 (예컨대 HMB), 및 레스베라트롤에 적용되는 용어 "단리된"은, 물질 또는 유사한 물질이 자연적으로 발생하거나 초기에 수득되었을 때 또한 존재할 수 있는 다른 성분 중 적어도 일부가 결여된 물질의 제제를 지칭한다. 따라서, 예를 들어, 단리된 물질은 공급원 혼합물로부터 그것을 농후하게 하기 위한 정제 기술을 사용하여 제조될 수 있다. 농후화는 절대적 기준, 예컨대 용액의 부피당 중량으로 측정될 수 있거나, 또는 공급원 혼합물에 존재하는 제2 잠재적 간섭 물질과 관련하여 측정될 수 있다. 본 발명의 실시양태의 농후화를 증가시키는 것은 갈수록 더 바람직하다. 따라서, 예를 들어, 2배 농후화는 바람직하고, 10배 농후화는 더 바람직하고, 100배 농후화는 더 바람직하고, 1000배 농후화는 더욱 더 바람직하다. 물질은 또한 인공 어셈블리의 과정에 의해, 예컨대 화학적 합성에 의해 단리된 상태로 제공될 수 있다.
경로의 "조절제"는 동일한 특이적 신호 전달 경로에 맵핑되는 하나 이상의 세포 단백질의 활성을 조절하는 물질 또는 작용제를 지칭한다. 조절제는 신호전달 분자의 활성 및/또는 발현 수준 또는 패턴을 증대 또는 억제할 수 있다. 조절제는 성분에 직접 결합함으로써 경로 내 성분을 활성화할 수 있다. 조절제는 또한 하나 이상의 연관 성분과 상호작용함으로써 경로 내 성분을 간접적으로 활성화할 수 있다. 경로의 아웃풋은 단백질의 발현 또는 활성 수준의 관점에서 측정될 수 있다. 경로 내 단백질의 발현 수준은 상응하는 mRNA 또는 관련 전사 인자의 수준뿐만 아니라 세포하 위치의 단백질의 수준에 의해 반영될 수 있다. 예를 들어, 특정 단백질은 핵, 미토콘드리아, 엔도솜, 리소솜 또는 세포의 다른 막 구조를 포함하지만 이에 제한되지 않는 특정 세포하 성분의 안밖으로의 전위에 의해 활성화된다. 경로의 아웃풋은 또한 생리학적 효과, 예컨대 미토콘드리아 생물발생, 지방산 산화, 또는 글루코스 흡수의 관점에서 측정될 수 있다.
"활성화제"는 경로 아웃풋을 증가시키는 방식으로 경로에 영향을 주는 조절제를 지칭한다. 특정 표적의 활성화는 직접 (예를 들어 표적과의 상호작용에 의해) 또는 간접 (예를 들어 표적을 포함하는 신호전달 경로 중 표적의 상류의 단백질과의 상호작용에 의해)일 수 있다.
생물학적 활성제로 지칭되는 용어 "선택적 억제" 또는 "선택적으로 억제하다"는 표적과의 직접 또는 간접 상호작용을 통해 표적을 벗어난 신호전달 활성과 비교하여 표적 신호전달 활성을 우선적으로 감소시키는 작용제의 능력을 지칭한다.
"억제제"는 경로 아웃풋을 감소시키는 방식으로 경로에 영향을 주는 조절제일 수 있다.
본원에 사용되는 용어 "실질적으로 없는"은 약 10% 미만, 약 5% 미만, 약 1% 미만, 약 0.5% 미만, 0.1% 미만 또는 그 미만의 명시된 성분을 갖는 조성물을 지칭한다. 예를 들어 비-분지쇄 아미노산이 실질적으로 없는 조성물은 약 1% 미만의 비-분지쇄 아미노산 리신을 가질 수 있다. 예를 들어, 비-분지쇄 아미노산이 실질적으로 없는 것은 주어진 조성물 내의 아미노산의 나머지와 비교할 때 1% 미만의 비-분지쇄 아미노산에 의해 입증될 수 있다.
작용제, 활성화제 또는 치료제의 "치료량 미만"은, 그 작용제, 활성화제 또는 치료제에 대한 유효량 미만의 양이지만, 유효량 또는 치료량 미만의 또 다른 작용제 또는 치료와 조합할 경우, 예를 들어, 생성되는 효과적인 효과, 및/또는 감소된 부작용에서 상승작용으로 인해, 원하는 결과를 초래할 수 있다.
"상승작용적" 또는 "상승작용" 효과는 조합 조성물의 하나 이상의 효과가 비슷한 투여 수준의 각 성분 단독의 하나 이상의 효과보다 크거나, 또는 각 성분이 독립적으로 작용한다고 가정할 때, 비슷한 투여 수준의 모든 성분의 효과의 예측된 합계보다 더 클 수 있도록 할 수 있다. 상승작용 효과는 성분 중 하나 단독으로 대상체에 미치는 효과, 또는 성분 각각의 개별 투여시 측정되는 상가 효과의 약 10, 20, 30, 50, 75, 100, 110, 120, 150, 200, 250, 350, 또는 500% 이상, 또는 그 초과일 수 있다. 이 효과는 본원에 기재된 임의의 측정가능한 효과일 수 있다.
본원에 사용되는 용어 "유리 아미노산 형태" 또는 "개별 아미노산 형태"는, 다른 아미노산에, 예를 들어, 펩티드 결합에 의해 결합되지 않은 아미노산을 지칭할 수 있다. 예를 들어, "유리" 또는 "개별" 류신은 펩티드 결합에 의해 다른 아미노산에 결합되지 않은 류신을 지칭한다.
조성물
본 발명의 조성물은 선택적 포스포디에스테라제 (PDE) 억제제를 포함할 수 있다. PDE 억제제는 하나 이상의 PDE 효소 또는 표적에 대한 선택성을 가질 수 있다. 예를 들어, PDE 억제제는 PDE 1, 2, 3, 4, 5, 6, 9 또는 11 선택적 억제제일 수 있다. 시르투인 경로는, 비제한적으로, 신호전달 분자, 예컨대, Sirt1, Sirt3 및 AMPK를 포함한다. PDE 억제제는 상승작용 효과를 제공하는 또 다른 성분과 조합될 수 있고, 예를 들어, PDE 억제제는 류신 및/또는 그의 대사물과 조합될 수 있다. 일부 실시양태에서, 조성물은 PDE 5 억제제, 예컨대 실데나필 또는 이카리인, 및 류신 및/또는 그의 대사물, 예컨대 히드록시메틸부티레이트 (HMB)를 포함할 수 있다.
본 발명은 시르투인 경로의 아웃풋을 증가 또는 조절할 수 있는 조성물을 제공한다. 경로의 아웃풋은 발현 수준 및/또는 경로의 활성 및/또는 생리학적 효과에 의해 결정될 수 있다. 일부 실시양태에서, Sirt1 경로의 활성화는 PGC1-α의 자극 및/또는 미토콘드리아 생물발생 및 지방산 산화의 후속 자극을 포함한다. 일반적으로, 시르투인 경로 활성화제는 시르투인 경로의 하나 이상의 성분을 활성화 또는 증가시키는 화합물이다. 시르투인 경로의 증가 또는 활성화는 경로 성분 단백질의 활성의 증가에 의해 관찰될 수 있다. 예를 들어, 단백질은 Sirt1, PGC1-α, AMPK, Epac1, 아데닐릴 시클라제, Sirt3, 또는 임의의 다른 단백질 및 도 1에 도시된 신호전달 경로에 따르는 각각의 연관 단백질일 수 있다 (Park et al., "Resveratrol Ameliorates Aging-Related Metabolic Phenotypes by Inhibiting cAMP Phosphodiesterases," Cell 148, 421-433 February 3, 2012). 시르투인 경로 아웃풋의 척도로서 작용할 수 있는 생리학적 효과의 비제한적 예는 미토콘드리아 생물발생, 미토콘드리아 바이오매스, 지방산 산화, 글루코스 흡수, 산화질소 생산, 팔미테이트 섭취, 산소 소비, 이산화탄소 생산, 체중 감소, 열 생산, 내장 지방 조직 손실, 호흡 교환 비, 인슐린 감수성, 염증 마커 수준, 혈관확장, 지방 세포의 갈변, 및 이리신 생산을 포함한다. 지방 세포의 갈변의 징후의 예는, 비제한적으로, 증가된 지방산 산화, 및 하나 이상의 갈색-지방-선택적 유전자 (예를 들어 Ucp1, Cidea, Prdm16 및 Ndufs1)의 발현을 포함한다. 일부 실시양태에서, 시트루인 경로 아웃풋의 척도의 역할을 할 수 있는 하나 이상의 생리학적 효과의 변화는, 예컨대 본 발명의 조성물을 투여함으로써 이리신 생산을 증가시킴으로써 유도된다.
미토콘드리아 생물발생의 증가는 새로운 미토콘드리아 형성의 증가, 미토콘드리아 바이오매스의 증가 및/또는 미토콘드리아 기능의 증가, 예컨대 대상체에서 증가된 지방산 산화, 증가된 열 발생, 증가된 인슐린 감수성, 증가된 글루코스 흡수, 증가된 혈관확장, 감소된 체중, 감소된 지방 부피, 및 감소된 염증 반응 또는 마커에 의해 증명된다.
조성물은 하나 이상의 상승작용적 성분을 포함할 수 있는 조합 조성물일 수 있다. 복수의 성분을 포함하는 조성물은 상승작용 효과가 세포 대사에서 증대되고 세포 대사가, 본원에서 또한 예측 상가 효과로도 지칭되는, 각 성분이 그의 효과를 독립적으로 발휘하는 것으로 측정된 각 성분을 투여하는 효과의 합과 비교하여 더 큰 정도로 증가하도록 할 수 있다. 예를 들어, 성분 (a)를 포함하는 조성물이 세포 대사의 20% 개선 효과를 수득하고, 성분 (b)를 포함하는 조성물이 세포 대사의 50% 개선 효과를 수득하는 경우에, 성분 (a) 및 성분 (b) 둘 다를 포함하는 조성물은 조합 조성물의 세포 대사에 대한 효과가 70%보다 크다면 상승작용 효과를 가질 것이다.
상승작용적 조합 조성물은 각 성분이 그의 효과를 독립적으로 발휘하는 것처럼 조합 조성물의 각 성분을 단독으로 투여하는 예측 상가 효과보다 큰 효과를 가질 수 있다. 예를 들어, 예측 상가 효과가 70% 이면, 140%의 실제 효과는 예측 상가 효과보다 70% 더 크거나, 예측 상가 효과보다 1배 더 크다. 상승작용 효과는 예측 상가 효과보다 적어도 약 20, 50, 75, 90, 100, 150, 200 또는 300% 더 클 수 있다. 대안적으로, 상승작용 효과는 예측 상가 효과보다 적어도 약 0.2, 0.5, 0.9, 1.1, 1.5, 1.7, 2 또는 3배 더 클 수 있다.
일부 실시양태에서, 조합 조성물의 상승작용 효과는 투여량을 감소시키는 것을 가능하게 할 수 있고, 이로써 대상체에 대한 부작용의 감소 및 치료 비용의 감소를 이끌어낼 수 있다. 다른 실시양태에서, 상승작용 효과는 임의의 다른 통상적인 치료를 통해 달성할 수 없는 결과를 가능하게 할 수 있다. 본 발명의 조합 조성물은 에너지 대사의 조절에 상당한 개선을 제공한다.
일부 실시양태에서, 조성물은 하나 이상의 분지쇄 아미노산 및/또는 그의 대사물의 조합 조성물일 수 있고 시르투인 경로 활성화제는 하나 이상의 특징을 가질 수 있다. 하나 이상의 분지형 아미노산은 유리 아미노산 형태일 수 있다. 조합 조성물은 (a) 시르투인 경로 아웃풋의 증가에서 상승작용 효과를 가질 수 있고, (b) 시르투인 경로 아웃풋을 적어도 약 1, 2, 5, 7, 10, 또는 20배 증가시킬 수 있고, (c) 약 20초과의 시르투인 경로 아웃풋에 대한 분지쇄 아미노산 및/또는 그의 대사물의 몰비를 가질 수 있고, (d) 시르투인 경로 활성화제가 폴리페놀 분자의 실질적으로 균질한 집단인 경구 섭취용 단위 투여량으로서 제제화될 수 있고, (e) 상승작용 효과를 갖고 식품 담체를 추가로 포함할 수 있다. 본원에 기재된 임의의 조성물은 이들 특징 중 하나 이상을 가질 수 있다. 하나 이상의 분지쇄 아미노산과 조합으로 사용되는 시르투인 경로 활성화제의 예는 미국 특허 출원 일련 번호 13/549,381 및 13/549,399에 기재되어 있으며, 이는 각각 그의 전문으로 참조로 포함된다.
일부 실시양태에서, 본 발명은 (a) 1종 이상의 분지형 아미노산 및/또는 그의 대사물 및 (b) 치료량 미만으로 존재하는 선택적 PDE 억제제를 포함하고, 단독으로 사용되는 경우 성분 (a) 또는 (b)와 비교하여 시르투인 경로 아웃풋을 적어도 약 5, 10, 50, 100, 200, 500배 이상 증가시키기에 상승작용적으로 유효한 조성물을 제공한다. 조성물 중 분지쇄 아미노산은 유리 아미노산 형태일 수 있다.
포스포디에스테라제 억제제
일부 실시양태에서, 시르투인 경로 활성화제는 포스포디에스테라제 (PDE)의 활성을 조절한다. 시르투인 경로 활성화제는 PDE 억제제로서 PDE의 활성을 조절할 수 있다. PDE 억제제는 선택적이거나 비-선택적일 수 있다. PDE 억제제는 PDE 하위부류, 예를 들어 PDE 5에 대한 선택적 억제를 나타낼 수 있다. 선택적 PDE 억제제의 예는 PDE 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 또는 11에 대한 억제제를 포함한다. 비-선택적 PDE 억제제는 포스포디에스테라제의 하위부류 중에 구별되지 않는 것일 수 있다. 또한 일부 비-선택적 PDE 억제제는 하나 초과의 대사 경로와 상호작용할 수 있다. 시험을 위해, 일부 비-선택적 PDE 억제제는 크산틴 유도체이고, 아데노신 길항제의 역할을 하고, 다른 대사 경로와의 공지되지 않은 상호작용을 가질 수 있다. 선택적 PDE 억제제는 선택된 PDE와의 우선적 상호작용을 나타내는 PDE 억제제일 수 있다. 예를 들어, PDE 억제제는 PDE 5와의 강한 상호작용 및 다른 PDE 하위부류와의 매우 적은 상호작용을 가질 수 있다.
선택적으로 및 음성적으로 PDE 하위부류, 예컨대 PDE 5의 발현 또는 활성을 조절하는 임의의 작용제는 본 발명의 조성물 및 방법에서 선택적 PDE 억제제로서 사용될 수 있다.
예를 들어, 선택적 PDE 억제제는 대안적으로 적어도 1, 2, 3종 이상의 다른 PDE 하위부류에 대한 억제제의 IC50보다 적어도 10배, 적어도 20배, 적어도 50배, 적어도 100배, 적어도 1000배, 적어도 10,000배 더 낮은, PDE 하위부류, 예컨대 PDE 5에 대한 50% 억제 농도 (IC50)를 나타내는 작용제일 수 있다. 일부 실시양태에서, 선택적 PDE 억제제는 적어도 모든 다른 PDE 하위부류에 대한 억제제의 IC50보다 적어도 10배 적어도 20배, 적어도 50배, 적어도 100배, 적어도 1000배, 적어도 10,000배 이상 더 낮은, PDE 하위부류, 예컨대 PDE 5에 대한 50% 억제 농도 (IC50)를 나타내는 작용제일 수 있다.
한 측면에서, IC50은 주어진 PDE 중 50%가 세포-기반 검정에서 억제되는 농도를 결정한다. IC50 결정은 관련 기술분야에 공지된 임의의 통상의 기술을 사용하여 달성될 수 있다. 일반적으로, IC50은 연구 하의 농도 범위의 억제제의 존재 하에 주어진 효소의 활성을 측정함으로써 결정될 수 있다. 이어서, 실험적으로 획득된 효소 활성 값을 사용된 억제제 농도에 대하여 플롯팅한다. 50% 효소 활성 (임의의 억제제의 부재 하의 활성과 비교하여)을 나타내는 억제제의 농도를 "IC50" 값으로 취한다. 유사하게, 다른 억제 농도가 적절한 활성 결정을 통해 규정될 수 있다. 예컨대, 일부 설정에서, 90% 억제 농도, 즉 IC90 등을 확립하는 것이 바람직할 수 있다.
PDE 억제제의 선택성을 측정하기 위한 방법은 ["Phosphodiesterase-5 Gln-817 is critical for cGMP, vardenafil, or sildenafil affinity: its orientation impacts cGMP but not cAMP affinity" by Zoraghi (2006) 및 "Cyclic Nucleotide Phosphodiesterases: Molecular Regulation to Clinical Use" by Bender (2006)]에 기재되어 있으며, 이는 그 전문으로 본원에 참조로 포함된다.
세포-기반 검정 또는 시험관내 키나제 검정에서 확인되는 바와 같이, 본 발명의 생물학적 활성제는 약 100 nM 이하, 바람직하게는 약 50 nM, 약 25 nM, 약 10 nM, 약 5nM, 약 1 nM, 100 pM, 50 pM, 25 pM, 10 pM, 1 pM 이하의 IC50 값으로 PDE 활성을 억제할 수 있다.
일부 실시양태에서, 시르투인 경로 활성화제는 PDE 1 억제제, 예컨대 니모디핀, 비노포세틴 및 IC224이다. PDE 1 억제제는 cAMP 및 cGMP 둘 다를 저하시키는 역할을 하는 Ca2+/칼모듈린-조절 포스포디에스테라제인 PDE 1과 상호작용할 수 있다. 비노포세틴은 페리윙클 추출물로부터 유도될 수 있고, 이는 뇌혈관 확장제로서의 역할을 할 수 있다. 비노포세틴은 식이 보충제의 형태일 수 있다.
다른 실시양태에서, 시르투인 경로 활성화제는 PDE 3 억제제, 예컨대 메리벤단, 아리논 및 실로스타미드이다. 시르투인 경로 활성화제는 PDE 4 억제제, 예컨대 아프레밀라스트, 메셈브린, 이부딜라스트, 피클라밀라스트, 루테올린, 로플루밀라스트, 실로밀라스트, 디아제팜, 롤리프람 및 YM796일 수 있다. 시르투인 경로 활성화제는 PDE 4 억제제, 예컨대 롤리프람 및 YM796일 수 있다. PDE 4 억제제는 면역 세포에서 우세한 cAMP-특이적 포스포디에스테라제인 PDE 4와 상호작용할 수 있다.
일부 실시양태에서, 시르투인 경로 활성화제는 PDE 5 억제제, 예컨대 아바나필, 아이오데나필, 미로데나필, 실데나필, 타달라필, 이카리인, 바르데나필, 우데나필 또는 자프린스트이다. 다른 실시양태에서, 시르투인 경로 활성화제는 실데나필 또는 이카리인이다. PDE 5 억제제는 cGMP-특이적 PDE인 PDE 5와 상호작용할 수 있다. cGMP 신호전달의 증가는 미토콘드리아 생물발생을 시험관내 및 생체내 모두에서 증가시킬 수 있다. PDE 5 억제제는 산화질소 신호전달을 증가시키고 효과적인 혈관확장제일 수 있다. PDE 5 억제제의 예는 미국 특허 번호 5,250,534 및 6,469,012에서 기재되어 있으며, 이는 각각 그 전문으로 참조로 포함된다.
일부 실시양태에서, 시르투인 경로 활성화제는 선택적 PDE 억제제일 수 있다. 다른 실시양태에서, 시르투인 경로 활성화제는 비-선택적 PDE 억제제이다. PDE 억제제는 자연 발생 또는 비-자연 발생 (예를 들어 제조됨)일 수 있고, PDE 억제제 또는 그의 추출물 (예를 들어 정제됨)을 포함하는 천연 공급원 형태로 제공될 수 있다. 비-선택적 PDE 억제제의 예는 카페인, 테오필린, 테오브로민, 3-이소부틸-1-메틸크산틴 (IBMX), 펜톡시필린 (3,7-디히드로-3,7-디메틸-1-(5옥소헥실)-1H-퓨린-2,6-디온), 아미노필린, 파라크산틴 및 그의 염, 유도체, 대사물, 이화물, 동화물, 전구체 및 그의 유사체를 포함하나, 이에 제한되지는 않는다. PDE 억제제의 천연 공급원의 비제한적 예는 커피, 차, 과라나, 예르바 마테, 코코아 및 초콜릿 (예를 들어 다크 초콜릿)을 포함한다.
추가의 시르투인 경로 활성화제
일부 실시양태에서, 폴리페놀, 예컨대 레스베라트롤, 또는 또 다른 시르투인 경로 활성화제는 PDE-5 억제제에 대신하여 또는 그에 더하여 투여된다. 일부 실시양태에서, 본원에 기재된 하나 이상의 성분을 포함하는 조성물은 레스베라트롤 또는 다른 시르투인 경로 활성화제에 대신하여 또는 더하여 PDE 억제제를 포함한다. 전형적으로, PDE 억제제는 조성물 또는 치료 방법의 하나 이상의 다른 성분과 상승작용적인 양으로 제공된다.
폴리페놀은 스틸벤 또는 히드록시신남산일 수 있다. 일부 실시양태에서, 시르투인 경로 활성화제 또는 AMPK 경로 활성화제는 폴리페놀일 수 있다. 예를 들어, 폴리페놀은 클로로겐산, 레스베라트롤, 카페인산, 피세아타놀, 엘라그산, 에피갈로카테킨 갈레이트 (EGCG), 포도씨 추출물, 또는 그의 임의의 유사체일 수 있다. 일부 실시양태에서, 활성화제는 레스베라트롤, 그의 유사체, 또는 그의 대사물일 수 있다. 예를 들어, 활성화제는 프테로스틸벤 또는 레스베라트롤의 소분자 유사체일 수 있다. 레스베라트롤의 소분자 유사체의 예는 미국 특허 출원 번호 20070014833, 20090163476 및 20090105246에 기재되어 있으며, 이는 그 전문이 본원에 참조로 포함된다.
폴리페놀은 폴리페놀의 실질적으로 균질한 집단일 수 있다. 폴리페놀은 1 유형의 폴리페놀일 수 있으며, 여기서 조성물은 모든 다른 유형의 폴리페놀을 배제할 수 있다. 다른 실시양태에서, 조성물은 2, 3, 또는 4 유형의 폴리페놀을 포함할 수 있고, 모든 다른 유형의 폴리페놀을 배제할 수 있다. 일부 실시양태에서, 조성물은 1, 2, 3, 또는 4 유형의 폴리페놀 및 0.1, 0.5, 1, 또는 2% 미만의 임의의 다른 유형의 폴리페놀을 포함할 수 있다.
다양한 다른 실시양태에서, 조성물은 하기 성분 중 하나 이상을 함유하지 않도록 (또는 배제하도록) 제제화된다: 카페인, 녹차 추출물 또는 과라나씨 또는 과라나 식물로부터의 추출물.
다른 실시양태에서, 시르투인 경로 활성화제 또는 AMPK 경로 활성화제는 이리신, 퀸산, 신남산, 페룰산, 푸코크산틴, 비구아니드 (예컨대 메트포르민), 로시글리타존, 또는 그의 임의의 유사체일 수 있다. 대안적으로 시르투인 경로 활성화제 또는 AMPK 경로 활성화제는 이소플라본, 피롤로퀴놀린 (PQQ), 케르세틴, L-카르니틴, 리포산, 코엔자임 Q10, 피루베이트, 5-아미노이미다졸-4-카르복사미드 리보티드 (ALCAR), 베즈피브레이트, 올티프라즈 및/또는 게니스테인일 수 있다. 일부 실시양태에서, 시르투인 경로 활성화제는 PDE 억제제이다.
일부 실시양태에서, 조성물은 선택적 PDE-5 억제제를 하나 이상의 다음의 조합으로 포함할 수 있다: 메트포르민, 레스베라트롤, 및 분지쇄 아미노산 또는 그의 대사물 (예를 들어 HMB의 수준).
일부 실시양태에서, 조성물은 시르투인 경로 활성화제의 상승작용 조합물을 포함할 수 있다. 예를 들어, 조성물은 상승작용적 양의 메트포르민 및 PDE 억제제를 포함할 수 있다. 일부 실시양태에서, 조성물은 메트포르민 및 카페인을 포함한다.
일부 실시양태에서, PDE-5 억제제와 조합될 수 있는 시르투인 경로 활성화제는 Fndc5, PGC1-α 또는 Ucp1의 발현을 자극하는 작용제를 포함한다. 발현은 유전자 또는 단백질 발현 수준의 관점에서 측정될 수 있다. 대안적으로, 시르투인 경로 활성화제는 이리신일 수 있다. 이리신 수준을 증가시키는 방법은 [Bostroem et al., "A PGC1-α-dependent myokine that drives brown-fat-like development of white fat 및 thermogenesis," Nature, Jan 11, 2012]에 기재되어 있다.
일부 실시양태에서, 이와 같이 조합될 수 있는 시르투인 경로 활성화제는 플라본 또는 칼콘이다. 한 실시양태에서, 예시적인 시르투인 활성화제는 [Howitz et al. (2003) Nature 425: 191]에 기재된 것이고, 예를 들어, 레스베라트롤 (3,5,4'-트리히드록시-트랜스-스틸벤), 부테인 (3,4,2',4'-테트라히드록시칼콘), 피세아타놀 (3,5,3',4'-테트라히드록시-트랜스-스틸벤), 이소리퀴리티게닌 (4,2',4'-트리히드록시칼콘), 피세틴 (3,7,3',4'-테트라히드록시플라본), 퀘르세틴 (3,5,7,3',4'-펜타히드록시플라본), 디옥시라폰틴 (3,5-디히드록시-4'-메톡시스틸벤 3-O-β-D-글루코시드); 트랜스-스틸벤; 라폰틴 (3,3',5-트리히드록시-4'-메톡시스틸벤 3-O-β-D-글루코시드); 시스-스틸벤; 부테인 (3,4,2',4'-테트라히드록시칼콘); 3,4,2'4'6'-펜타히드록시칼콘; 칼콘; 7,8,3',4'-테트라히드록시플라본; 3,6,2',3'-테트라히드록시플라본; 4'-히드록시플라본; 5,4'-디히드록시플라본; 5,7-디히드록시플라본; 모린 (3,5,7,2',4'- 펜타히드록시플라본); 플라본; 5-히드록시플라본; (-)-에피카테킨 (히드록시 부위: 3,5,7,3',4'); (-)-카테킨 (히드록시 부위: 3,5,7,3',4'); (-)-갈로카테킨 (히드록시 부위: 3,5,7,3',4',5') (+)-카테킨 (히드록시 부위: 3,5,7,3',4'); 5,7,3',4',5'-펜타히드록시플라본; 루테올린 (5,7,3',4'-테트라히드록시플라본); 3,6,3',4'-테트라히드록시플라본; 7,3',4',5'-테트라히드록시플라본; 캠페롤 (3,5,7,4'-테트라히드록시플라본); 6-히드록시아피게닌 (5,6,7,4'-테트라히드록시플라본); 스쿠텔라레인); 아피게닌 (5,7,4'-트리히드록시플라본); 3,6,2',4'-테트라히드록시플라본; 7,4'-디히드록시플라본; 다이드제인 (7,4'-디히드록시이소플라본); 게니스테인 (5,7,4'-트리히드록시플라바논); 나리게닌 (5,7,4'-트리히드록시플라바논); 3,5,7,3',4'-펜타히드록시플라바논; 플라바논; 페라르고니딘 클로라이드 (3,5,7,4'-테트라히드록시플라빌리움 클로라이드); 히노키티올 (b-투야플리신; 2-히드록시-4-이소프로필-2,4,6-시클로헵타리엔-1-온); L-(+)-에르고티오네인 ((S)-a-카르복시-2,3-디히드로-N,N,N-트리메틸-2-티옥소-1H-이미다졸-4-에탄아미늄 내부 염); 카페인산 페닐 에스테르; MCI-186 (3-메틸-1-페닐-2-피라졸린-5-온); HBED (N,N'-디-(2-히드록시벤질) 에틸렌디아민-N,N'-디아세트산-H2O); 암브록솔 (트랜스-4-(2-아미노-3,5-디브로모벤질아미노) 시클로헥산-HCl; 및 U-83836E ((-)-2-((4-(2,6-디-1-피롤리디닐-4-피리미디닐)-1-피페라지닐)메틸)-3,4-디히드로-2,5,7,8-테트라메틸-2H-1-벤조피란-6-올.2HCl)를 포함한다. 그의 유사체 및 유도체는 또한 사용될 수 있다.
본원은 대상체에서 지방산 산화 및 미토콘드리아 생물발생의 증가를 유도하기에 유용한 조성물을 제공한다. 이러한 조성물은: HMB를 레스베라트롤과 조합하여; 류신을 레스베라트롤과 조합하여; 류신 및 HMB 둘 다를 레스베라트롤과 조합하여; KIC를 레스베라트롤과 조합하여; KIC 및 HMB 둘 다를 레스베라트롤과 조합하여; KIC 및 류신 둘 다를 레스베라트롤과 조합하여; 또는 KIC, HMB 및 류신을 레스베라트롤과 조합하여 함유한다.
분지쇄 아미노산
PDE-5 억제제와 조합될 수 있는 분지쇄 아미노산은 2개 이상의 다른 원자와 결합된 분지 탄소 원자를 갖는 지방족 측쇄를 갖는다. 다른 원자는 탄소 원자일 수 있다. 분지쇄 아미노산의 예는 류신, 이소류신 및 발린을 포함한다. 분지쇄 아미노산은 또한 다른 화합물, 예컨대 4-히드록시이소류신을 포함할 수 있다. 일부 실시양태에서, 조성물은 비-분지쇄 아미노산 중 하나 이상 또는 전부가 실질적으로 없다. 일부 실시양태에서, 조성물은 유리 아미노산 형태의 비-분지쇄 아미노산 중 하나 이상 또는 전부가 실질적으로 없다. 예를 들어, 조성물은 알라닌, 아르기닌, 아스파라긴, 아스파르트산, 시스테인, 글루탐산, 글루타민, 글리신, 히스티딘, 리신, 메티오닌, 페닐알라닌, 프롤린, 세린, 트레오닌, 트립토판 및/또는 티로신이 실질적으로 없을 수 있다. 조성물은 유리 아미노산 형태의 알라닌, 아르기닌, 아스파라긴, 아스파르트산, 시스테인, 글루탐산, 글루타민, 글리신, 히스티딘, 리신, 메티오닌, 페닐알라닌, 프롤린, 세린, 트레오닌, 트립토판 및/또는 티로신이 실질적으로 없을 수 있다. 일부 실시양태에서, 분지쇄 아미노산은 류신이다. 일부 실시양태에서, 조성물은 유리 형태에 있을 수 있는, 이소류신 및/또는 발린이 실질적으로 없을 수 있다. 류신과 PDE5 억제제 사이의 상승작용 효과는, 본원에 기재된 바와 같이, 류신이 이소류신 및 발린으로 치환될 때는 관찰되지 않는다. 임의의 특정 이론에 의해 제한하고자 하는 것 없이, 이소류신, 발린 및 류신은 수송 및/또는 흡수에 대해 서로 경쟁하고, 조성물 중 이소류신 및 발린의 포함은 조성물 중 임의의 류신의 효능을 감소시킬 것이다. 또한, 이소류신 및 발린은 각각, Sirt1 및/또는 AMPK를 비롯한, sirt 신호전달 경로를 활성화시키는 실질적인 능력이 결핍된다.
분지쇄 아미노산은 유리 아미노산 형태로 조성물 중에 존재할 수 있다. 조성물은 유리 아미노산 형태의 알라닌, 아르기닌, 아스파라긴, 아스파르트산, 시스테인, 글루탐산, 글루타민, 글리신, 히스티딘, 이소류신, 리신, 메티오닌, 페닐알라닌, 프롤린, 세린, 트레오닌, 트립토판, 티로신 또는 발린이 실질적으로 없을 수 있다. 일부 실시양태에서, 조성물은 유리 형태에 있지 않은 비-분지쇄 아미노산 (예를 들어, 다른 아미노산과 펩티드 결합을 형성한 비-분지쇄 아미노산)이 실질적으로 없다.
이론에 얽매이지 않고, 분지쇄 아미노산, 예컨대 류신의 섭취는, mTOR-의존성 및 -비의존성 경로 둘 다를 통해 조직 단백질 합성을 자극할 뿐만 아니라, 항단백질분해 효과를 발휘할 수 있다. 이러한 효과는 근육에서 우세하지만, 지방 조직을 비롯한 다른 조직에서도 나타날 수 있다. 단백질 합성 및 전환의 에너지 비용을 고려할 때, 류신은 지방산 산화 및 순 에너지 이용을 증가시키고 지방증을 약화시킬 수 있다. 사실상, 류신은 열 발생 효과를 발휘하고 에너지 제한 동안 체중 및 지방 조직 감소를 증대시키는 것으로 보고되었다. 또한, 류신 및 류신-풍부 식이는 지방세포 및 마우스에서 염증성 시토카인 패턴을 유리하게 조절할 수 있다.
일부 실시양태에서, 본원에 기재된 임의의 조성물은 임의의 분지쇄 아미노산의 염, 유도체, 대사물, 이화물, 동화물, 전구체 및 유사체를 포함할 수 있다. 대사물은 류신의 대사물, 예컨대 HMB일 수 있다. 예를 들어, 분지쇄 아미노산의 대사물은 히드록시메틸부티레이트 (HMB), α-히드록시이소카프로산, 및 케토-이소카프로산 (KIC), 케토 이소발레레이트, 및 케토 이소카프로산을 포함할 수 있다. 분지쇄 아미노산의 비-제한적인 예시적인 동화물은 글루타메이트, 글루타민, 트레오닌, α-케토부티레이트, α-아세토-α-히드록시 부티레이트, α,β-디히드록시-β-메틸발레레이트, α-케토-β-메틸발레레이트, α,β-디히드록시 이소발레레이트, 및 α-케토 이소발레레이트를 포함할 수 있다.
본 발명의 특정 실시양태에서, 본원에 개시된 임의의 조성물은 조성물이 리신, 글루타메이트, 프롤린, 아르기닌, 발린, 이소류신, 아스파르트산, 아스파라긴, 글리신, 트레오닌, 세린, 페닐알라닌, 티로신, 히스티딘, 알라닌, 트립토판, 메티오닌, 글루타민, 타우린, 카르니틴, 시스틴 및 시스테인으로 이루어진 군으로부터 선택된 하나 이상의 아미노산을 함유하지 않도록 (또는 배제하도록) 제제화될 수 있다. 본 발명의 특정 실시양태에서, 본원에 개시된 임의의 조성물은 조성물이 리신, 글루타메이트, 프롤린, 아르기닌, 발린, 이소류신, 아스파르트산, 아스파라긴, 글리신, 트레오닌, 세린, 페닐알라닌, 티로신, 히스티딘, 알라닌, 트립토판, 메티오닌, 글루타민, 타우린, 카르니틴, 시스틴 및 시스테인으로 이루어진 군으로부터 선택된 하나 이상의 유리 아미노산을 함유하지 않도록 (또는 배제하도록) 제제화될 수 있다. 일부 경우에서, 조성물은 임의의 비-분지쇄 아미노산을 함유하지 않는다. 일부 경우에서, 조성물은 유리 아미노산 형태의 임의의 비-분지쇄 아미노산을 함유하지 않는다. 비분지쇄 아미노산의 질량 또는 몰량은 총 조성물의 0.01, 0.1, 0.5, 1, 2, 또는 5% 미만일 수 있다. 유리 아미노산 형태의 비분지쇄 아미노산의 질량 또는 몰량은 총 조성물의 0.01, 0.1, 0.5, 1, 2, 또는 5% 미만일 수 있다. 류신 또는 그의 대사물과는 별도로, 임의의 분지쇄 아미노산 또는 그의 대사물의 질량 또는 몰량은 총 조성물의 0.01, 0.1, 0.5, 1, 2 또는 5% 미만일 수 있다. 류신 또는 그의 대사물과는 별도로, 유리 아미노산 형태의 임의의 분지쇄 아미노산 또는 그의 대사물의 질량 또는 몰량은 총 조성물의 0.01, 0.1, 0.5, 1, 2 또는 5% 미만일 수 있다.
비타민 B6
일부 실시양태에서, 본원에 기재된 조성물은 PDE 5 억제제, 류신 및/또는 류신 대사물, 및 비타민 B6을 포함할 수 있다. 다른 실시양태에서, 조성물은 실데나필, 레스베라트롤, 및 비타민 B6을 포함할 수 있다. 류신은 유리 아미노산 형태일 수 있다.
임의의 특정 이론 또는 작용 방식에 얽매이지 않고, 활성 B6 대사물 (피리독살 포스페이트)은 지방세포 칼슘 채널의 긴장 및 활성을 감소시킬 수 있다. 세포내 유리 Ca2+는 지방세포 지방산 신타제 발현 및 활성의 1차 조절제이며, 이는 지방산 신타제의 발현 및 합성 둘 다를 억제할 수 있고, 이는 결국 지방세포에서 중성 지질 합성의 속도 제한 단계 중 하나이다.
본원에 사용되는 비타민 B6은 피리독신, 피리독신 5'-포스페이트, 피리독살, 피리독살 포스페이트, 피리독살 5'-포스페이트, 피리독사민, 피리독사민 5'-포스페이트를 비롯한 그의 다양한 형태를 포함한다. 다른 실시양태에서, 비타민 B6은 또한, 분비되는 비타민 B6의 상기 형태의 이화물인 4-피리독스산을 포함할 수 있다. 본원에 기재된 조성물은 비타민 B6의 이러한 형태 중 임의의 하나 이상을 포함할 수 있다.
체내 비타민 B6의 활성 형태는 피리독살 5-포스페이트이며, 이는 모든 아미노교환 및 일부 탈카르복실화 및 탈아미노화 반응을 위한 조효소이다. 더욱이, 피리독살 5-포스페이트는 체내에서 일어나는 모든 아미노교환 반응을 위한 조효소로서 필요하다 (Peterson D L, Martinez-Carrion M. The mechanism of transamination. Function of the histidyl residue at the active site of supernatant aspartate transaminase. J Biol Chem. 1970 Feb. 25; 245(4):806-13).
일부 실시양태에서, 본원에 기재된 임의의 조성물은 비타민 B6의 임의의 형태의 염, 유도체, 대사물, 이화물, 동화물, 전구체 및 유사체를 포함할 수 있다. 비타민 B6의 예시적인 이화물은 2-메틸-3-히드록시-5-포르밀피리딘-4-카르복실레이트 및 3-히드록시-2-메틸피리딘-4,5-디카르복실레이트를 포함한다. 비타민 B6의 예시적인 유사체는 미국 특허 번호 7,230,009, 및 6,369,042에 기재되어 있다. 비타민 B6의 예시적인 전구체는 미국 특허 번호 7,495,101에 기재되어 있다.
제약 활성제
본 발명의 조성물은 PDE-5 억제제 이외의 하나 이상의 제약 활성제를 추가로 포함할 수 있다. 치료 활성제의 예는 이부프로펜, 알도릴, 및 겜페브로질, 베라파밀, 막스지드, 디클로페낙 및 메트롤롤, 마프로틸린, 트리아졸람 및 미녹시딜을 포함한다. 예를 들어, 조합 조성물은 제약 활성 항당뇨병제, 체중 감소제 또는 칼슘 조절제를 포함할 수 있다. 둘 다 본원에 참조로 포함된 미국 특허 번호 7,109,198 및 미국 특허 출원 번호 20090142336은 본원에 기재된 조합 조성물 중에 포함되기에 적합한 다양한 제약 활성제 또는 치료 활성제를 기재한다. 항당뇨병제의 예는 비구아니드 (예컨대 메트포르민), 티아졸라딘디온 및 메글리티니드 (예컨대 레파글리니드, 피오글리타존, 및 로시글리타존), 알파 글루코시다제 억제제 (예컨대 아카르보스), 술포닐우레아 (예컨대 톨부타미드, 아세토헥사미드, 톨라자미드, 클로르프로파미드, 글리피지드, 글리부리드, 글리메피리드, 글리클라지드), 인크레틴, 에르고트 알칼로이드 (예컨대 브로모크립틴), 및 DPP 억제제 (예컨대 시타글립틴, 빌다글립틴, 삭사글립틴, 린글립틴, 두토글립틴, 게미글립틴, 알로글립틴, 및 베르베린)를 포함한다. 항당뇨병제는 경구 항당뇨병제일 수 있다. 항당뇨병제는 또한 인슐린, 아밀린 유사체 (예컨대 프람린티드), 및 인레틴 모방체 (예컨대 엑세나타이드 및 리라글루티드)를 비롯한 주사가능 항당뇨병 약물일 수 있다. 항비만증 치료제의 예는 리파제 억제제 (예컨대 오를리스타트), 도파민성, 노르아드레날린성, 및 세로토닌성 화합물, 카나비노이드 수용체 길항제 (예컨대 리모나반트), 엑세나티드, 프람린티드, 및 CNS 작용제 (예컨대 토피메레이트)를 포함한다. 이들 예는 단지 논의 목적으로 제공되고, 매우 다양한 약물로의 본 발명의 광범위한 적용가능성을 증명하고자 한다. 이는 임의의 방식으로 본 발명의 범위를 제한하고자 하지는 않는다.
일부 실시양태에서, PDE-5 억제제는 다음과 같은 한 쌍의 제약 활성제와 조합될 수 있다: 글리피지드와 메트포르민; 글리부리드와 메트포르민; 피오글리타존과 글리메피리드; 피오글리타존과 메트포르민; 레파글리니드와 메트포르민; 로시글리타존과 글리메피리드; 로시글리타존과 메트포르민; 및 시타글립틴과 메트포르민.
본원에 기재된 조합 조성물에 사용된 제약 작용제 또는 임의의 다른 성분의 양은 치료상 유효한 양으로 사용될 수 있다. 본원에 기재된 조합 조성물에 사용된 제약 작용제 또는 임의의 다른 성분의 양은 치료량 미만의 양으로 사용될 수 있다. 일부 실시양태에서, 치료량 미만의 작용제 또는 성분을 사용하는 것은 작용제의 부작용을 감소시킬 수 있다. 치료량 미만의 사용은, 특히 다른 작용제 또는 성분과 상승작용적으로 사용시 여전히 효과적일 수 있다.
치료량 미만의 작용제 또는 성분은 이것이 치료제로 간주될 수 있는 양 미만이도록 할 수 있다. 예를 들어, FDA 지침은 특정한 상태를 치료하기 위해 명시된 수준의 투여를 제시할 수 있고, 치료량 미만은 FDA 제시된 투여 수준 미만인 임의의 수준일 것이다. 치료량 미만은 치료량으로 간주되는 양의 약 1, 5, 10, 15, 20, 25, 30, 35, 50, 75, 90, 또는 95% 미만일 수 있다. 치료량은 개별 대상체, 또는 대상체의 군에 대해 평가할 수 있다. 대상체의 군은 모든 잠재적인 대상체, 또는 특정한 특징, 예컨대 연령, 체중, 인종, 성별, 또는 신체 활동 수준을 갖는 대상체일 수 있다.
메트포르민 히드로클로라이드의 경우에, 의사가 제시한 출발 용량은 1일 1000 mg이고, 대상체 특이적 투여는 1일 500 mg 내지 최대 2500 mg의 범위를 갖는다 (메트포르민 히드로클로라이드 장기 방출 정제 표지 www.accessdata.fda.gov/drugsatfda docs/label/2008/021574s010lbl.pdf). 대상체에 관한 특정 투여는 용량을 적정하고 치료 반응을 측정함으로써 임상의에 의해 결정될 수 있다. 치료 투여 수준은 공복 혈장 글루코스 수준을 측정하고 글리코실화 헤모글로빈을 측정함으로써 결정될 수 있다. 치료량 미만은 메트포르민의 권장 투여 미만일 수 있는 임의의 수준일 수 있다. 예를 들어, 대상체의 치료 투여 수준이 1일 700 mg으로 결정되는 경우, 600 mg 용량은 치료량 미만일 것이다. 대안적으로, 치료량 미만은 개별 대상체보다는 대상체의 군에 대해 결정될 수 있다. 예를 들어, 체중이 300 lb 초과인 대상체에 대해 메트포르민의 평균 치료량이 2000 mg이라면, 치료량 미만은 2000 mg 미만의 임의의 양일 수 있다. 일부 실시양태에서, 투여는 환자의 의사, 간호사, 영양학자, 약사, 또는 다른 건강 관리 전문가를 포함하지만 이에 제한되지는 않는 건강 관리 제공자에 의해 권장될 수 있다. 건강 관리 전문가는 건강 관리 시스템과 관련된 개인 또는 실체를 포함할 수 있다. 건강 관리 전문가의 예는 외과의, 치과의, 청능 훈련사, 언어병리학자, 의사 (일반의 및 전문의 포함), 의료 보조자, 간호원, 조산사, 제약전문가/약사, 영양사, 치료사, 심리학자, 물리 치료사, 사혈 전문의, 직업 치료사, 검안사, 척추 지압사, 임상 관리자, 응급 구조 대원, 준 의료 활동 종사자, 의무 실험실 기술자, 방사선 촬영기사, 의료 보철 기술자, 사회 복지사, 및 건강 관리 서비스의 일부 유형을 제공하기 위해 훈련된 매우 다양한 다른 인적 자원을 포함할 수 있다.
투여량
본 발명은 하나 이상의 공급원으로부터 단리된, 단리된 성분, 예컨대 류신, 류신의 대사물, 예컨대 HMB, 실데나필, 이카리인 및 레스베라트롤의 조합인 조성물을 제공한다. 본 발명은 류신, 류신의 대사물, 예컨대 HMB, 실데나필, 이카리인 및/또는 레스베라트롤이 농후화된 조성물을 제공한다. 성분은 천연 공급원으로부터 단리되거나 합성 공급원으로부터 생성되고, 이어서, 성분의 순도를 증가시키기 위해 농후화될 수 있다. 예를 들어, 실데나필은 합성 공급원으로부터 생성된 후 하나 이상의 정제 방법에 의해 농후화될 수 있다. 추가로, 류신 (예를 들어, 유리 류신)은 천연 공급원으로부터 단리되고, 이어서 하나 이상의 분리에 의해 농후화될 수 있다. 단리되고 농후화된 성분, 예컨대 실데나필 및 류신은 이어서 대상체에 투여를 위해 조합되고 제제화될 수 있다.
일부 실시양태에서, 조성물은 선택적 PDE 억제제 (예를 들어, 실데나필 또는 이카리인을 포함하나 이에 제한되지는 않는 PDE-5 억제제)의 양을 포함한다. PDE 억제제의 양은 치료량 미만 및/또는 조성물 중 하나 이상의 다른 화합물 또는 조성물과 동시에 또는 바로 가까이에 투여된 화합물 중 하나 이상과 상승작용적인 양일 수 있다. 일부 실시양태에서, PDE 억제제는 저용량, 중용량 또는 고용량으로 투여되며, 이는 두 용량 사이의 관계를 기술하고, 일반적으로 임의의 특별한 용량 범위를 규정하지 않는다.
실데나필의 1일 용량은 약 0.05, 0.1, 0.5, 1, 2, 5, 10, 20, 40, 60, 80 또는 100 mg 또는 그 미만의 실데나필일 수 있다. 다른 실시양태에서, 이카리인의 1일 용량은 약 1, 10, 20, 50, 100, 150, 300, 400, 500, 750, 1000, 1500 또는 2000 mg 또는 그 미만의 이카리인일 수 있다. 레스베라트롤의 1일 저용량은 약 0.5mg/kg, 1 mg/kg, 2.5mg/kg, 5mg/kg, 7.5mg/kg, 10mg/kg, 12.5mg/kg, 15mg/kg, 20mg/kg, 25mg/kg, 50mg/kg, 75mg/kg, 100mg/kg 이상, 그 미만, 또는 그 초과를 포함할 수 있고; 레스베라트롤의 1일 중용량은 약 20mg/kg, 25mg/kg, 50mg/kg, 75mg/kg, 100mg/kg, 125mg/kg, 150mg/kg, 175mg/kg, 200mg/kg, 250mg/kg 이상, 그 미만, 또는 그 초과를 포함할 수 있고; 레스베라트롤의 1일 고용량은 약 150mg/kg, 175mg/kg, 200mg/kg, 225mg/kg, 250mg/kg, 300mg/kg, 350mg/kg, 400mg/kg 이상, 그 미만, 또는 그 초과를 포함할 수 있다.
본 발명의 또 다른 측면은 류신, HMB, KIC, 비타민 D, 비타민 K2, 및/또는 레스베라트롤과 조합으로, PDE-5 억제제, 예컨대 실데나필 및 이카리인의 상승작용량을 포함하는 조성물을 제공한다. 이러한 상승작용량은 다음과 같을 수 있다: 류신 약 0.5 - 3.0 g/일 (예를 들어 0.5, 0.75, 1, 1.25, 1.5, 1.75, 2, 2.5, 3 이상의 g/일), 그 미만, 또는 그 초과; HMB 약 0.20 - 3.0 g/일 (예를 들어 0.2, 0.4, 0.5, 0.75, 1, 1.5, 2, 2.5, 3 이상의 g/일), 그 미만, 또는 그 초과; KIC 약 0.2 - 3.0 g/일 (예를 들어 0.2, 0.4, 0.5, 0.75, 1, 1.25, 1.5, 1.75, 2, 2.5, 3 이상의 g/일), 그 미만, 또는 그 초과; 비타민 D 약 2.5-25 μg/일 (예를 들어 2.5, 5, 7.5, 10, 12.5, 15, 17.5, 20, 25 이상의 μg/일), 그 미만, 또는 그 초과; 비타민 K2 약 5-200 μg/일 (예를 들어 5, 10, 25, 50, 75, 100, 150, 200 이상의 μg/일), 그 미만, 또는 그 초과; 실데나필 약 0.05-100 mg/일 (예를 들어, 0.05, 0.1, 0.5, 1, 2, 5, 10, 20, 40, 60, 80 또는 100 mg/일), 그 미만, 또는 그 초과; 이카리인 약 1-2000mg (예를 들어, 1, 10, 20, 50, 100, 150, 300, 400, 500, 750, 1000, 1500, 또는 2000 mg/일), 그 미만, 또는 그 초과, 및/또는 레스베라트롤 약 10 - 500 mg/일 (예를 들어 10, 25, 50, 51, 75, 100, 150, 200, 250, 300, 350, 400, 450, 500 mg/일 이상), 그 미만, 또는 그 초과. 따라서, 한 실시양태는 약 0.75 내지 약 3.0 g (0.75 내지 3.0 g) 양의 류신 및 약 0.05 내지 약 100 mg (또는 0.05 내지 100 mg) 양의 실데나필을 포함하는 조성물을 제공한다. 또 다른 실시양태는 0.40 - 3.0 g (또는 0.40 내지 3.0 g) 양의 HMB 및 0.05 - 100 mg (또는 0.050 내지 100 mg) 양의 실데나필을 포함하는 조성물을 제공한다. 또 다른 실시양태는 약 0.75 - 약 3.0 g (또는 0.75 내지 3.0 g) 양의 류신, 약 0.40 내지 약 3.0 g (또는 0.40 내지 3.0 g) 양의 HMB 및 약 0.05 내지 약 100 mg (또는 0.05 내지 100 mg) 양의 실데나필을 포함하는 조성물을 제공한다. PDE 억제제를 포함하는 조성물 또는 (하나 이상의 다른 성분과 개별적으로 또는 동시에) PDE 억제제의 투여를 포함하는 방법에서, PDE 억제제는 약 0.1, 1, 5, 10, 25, 50, 100, 500, 1000, 2500, 5000, 10000 이상의 nM, 그 미만, 또는 그 초과의 최대 혈장 농도를 생산하는 양으로 제공될 수 있다.
또 다른 실시양태는 HMB 또는 류신과 조합으로, 실데나필 및 레스베라트롤의 상승작용량을 함유하는 조성물을 제공한다. 이러한 조성물에서, 조성물 내의 류신 및 HMB의 총량은 3.0 g 미만 (또는 약 3.0 g 미만; 예를 들어 약 0.7, 0.75, 1, 1.5, 2, 2.5, 3 그램 미만) 및 0.70 g 이상 (또는 약 0.70 g 이상; 예를 들어 약 0.7, 0.75, 1, 1.5, 2, 2.5, 3 그램 이상)일 수 있다. 류신 및 HMB를 둘 다 포함하는 조성물은 조성물 내에 총합이 약 0.70 g 내지 3.0 g (약 0.70 g 내지 약 3.0 g; 예를 들어 0.7, 1, 1.25, 1.5, 1.75, 2, 2.5, 3 이상의 그램), 0.75 g 내지 3.0 g (약 0.75 g 내지 약 3.0 g), 또는 1.0 g 내지 3.0 g (약 1.0 g 내지 약 3.0 g), 그 미만, 또는 그 초과인 류신 및 HMB의 양 및 상승작용량의 레스베라트롤 (35 mg 이상의 레스베라트롤 및 500 (또는 약 500) mg 이하의 레스베라트롤 (예를 들어 약 35, 50, 75, 100, 150, 200, 250, 300, 350, 400, 450, 또는 500 mg, 그 미만, 또는 그 초과의 레스베라트롤)) 또는 50 내지 500 mg (또는 약 50 내지 약 500 mg)의 레스베라트롤의 양을 함유할 수 있다.
일부 실시양태에서 단위 투여량은 PDE 5 억제제, 예컨대 실데나필을 하나 이상의 다른 성분과 조합으로 포함할 수 있다. 일부 실시양태에서, 단위 투여량은 다음 중 하나 이상을 포함한다: 약 0.05, 0.1, 0.5, 1, 2, 5, 10, 20, 40, 60, 80 또는 100 mg, 그 미만, 또는 그 초과의 선택적 PDE-5 억제제 (예를 들어, 실데나필); 약 50, 100, 200, 300, 400, 500 이상의 mg, 그 미만, 또는 그 초과의 HMB; 약 10, 20, 30, 40, 50, 75, 100 이상의 mg, 그 미만, 또는 그 초과의 레스베라트롤; 약 2.5, 5, 7.5, 10, 12.5, 15, 17.5, 20 이상의 mg, 그 미만, 또는 그 초과의 비타민 B6; 약 2.5, 5, 7.5, 10, 12.5, 15, 17.5, 20, 25 이상의 μg, 그 미만, 또는 그 초과의 비타민 D; 약 5, 10, 25, 50, 75, 100, 150, 200 이상의 μg, 그 미만, 또는 그 초과의 비타민 K2; 및 약 400, 500, 600, 700, 800, 900, 1000, 1100, 1250, 1500 이상의 mg, 그 미만, 또는 그 초과의 류신. 단위 투여량은 약 500 mg, 그 미만, 또는 그 초과의 베타 히드록실, 베타 메틸 부티레이트 및 약 50 mg, 그 미만, 또는 그 초과의 레스베라트롤을 포함할 수 있다. 단위 투여량은 약 500 mg, 그 미만, 또는 그 초과의 베타 히드록시, 베타 메틸 부티레이트; 및 약 50 mg, 그 미만, 또는 그 초과의 레스베라트롤; 및 약 15 mg, 그 미만, 또는 그 초과의 비타민 B6을 포함할 수 있다.
일부 실시양태에서, 단위 투여량은 약 0.1 - 10 mg 의 실데나필을 포함할 수 있다. 일부 실시양태에서, 단위 투여량은 약 0.5 - 100 mg의 아바나필, 0.05 - 20 mg의 아이오데나필, 0.25- 50 mg의 미로데나필, 0.01 - 2.5 mg의 타달라필, 0.01 - 2.5 mg의 바르데나필, 0.5 - 100 mg의 우데나필, 또는 0.5-100 mg의 자프린스트를 포함할 수 있다. 일부 실시양태에서, 단위 투여량은 약 0.5 - 50 mg의 아바나필, 0.05 - 10 mg의 아이오데나필, 0.25- 25 mg의 미로데나필, 0.01 - 1.25 mg의 타달라필, 0.01 - 1.25 mg의 바르데나필, 0.5 - 50 mg의 우데나필, 또는 0.5-50 mg의 자프린스트를 포함할 수 있다.
일부 실시양태에서, 단위 투여량은 클로로겐산 (예를 들어 약 25, 50, 75, 100, 150, 200 이상의 mg, 그 미만, 또는 그 초과)을 약 지시된 양, 그 미만, 또는 그 초과의 하나 이상의 다른 성분과 조합으로 포함할 수 있다. 단위 투여량은 500 mg 베타 히드록시, 베타 메틸 부티레이트 (예를 들어 50, 100, 200, 300, 400, 500 이상의 mg) 및 100 mg 클로로겐산을 포함할 수 있다. 단위 투여량은 500 mg 베타 히드록시, 베타 메틸 부티레이트 (예를 들어 50, 100, 200, 300, 400, 500 이상의 mg); 및 100 mg 클로로겐산; 및 15 mg 비타민 B6을 포함할 수 있다. 단위 투여량은 1.125 g 류신 (예를 들어 400, 500, 600, 700, 800, 900, 1000, 1100, 1250 이상의 mg) 및 100 mg 클로로겐산을 포함할 수 있다. 단위 투여량은 1.125 g 류신 (예를 들어 400, 500, 600, 700, 800, 900, 1000, 1100, 1250 이상의 mg); 100 mg 클로로겐산; 및 15 mg 비타민 B6 (예를 들어 2.5, 5, 7.5, 10, 12.5, 15, 17.5, 20 이상의 mg)을 포함할 수 있다. 단위 투여량은 750 mg 류신, 75 mg 클로로겐산 및 10 mg 비타민 B6을 포함할 수 있다.
일부 실시양태에서 단위 투여량은 약 지시된 양, 그 미만, 또는 그 초과의 퀸산 (예를 들어 10, 15, 20, 25, 30, 40, 50 이상의 mg)을, 약 지시된 양, 그 미만, 또는 그 초과의 하나 이상의 다른 성분과 조합으로 포함할 수 있다. 단위 투여량은 500 mg 베타 히드록시, 베타 메틸 부티레이트 (예를 들어 50, 100, 200, 300, 400, 500 이상의 mg) 및 25 mg 퀸산을 포함할 수 있다. 단위 투여량은 500 mg 베타 히드록시, 베타 메틸 부티레이트 (예를 들어 50, 100, 200, 300, 400, 500 이상의 mg), 25 mg 퀸산 및 15 mg 비타민 B6 (예를 들어 2.5, 5, 7.5, 10, 12.5, 15, 17.5, 20 이상의 mg)을 포함할 수 있다. 단위 투여량은 1.125 g 류신 (예를 들어 400, 500, 600, 700, 800, 900, 1000, 1100, 1250 이상의 mg) 및 25 mg 퀸산을 포함할 수 있다. 단위 투여량은 1.125 g 류신 (예를 들어 400, 500, 600, 700, 800, 900, 1000, 1100, 1250 이상의 mg), 25 mg 퀸산 및 15 mg 비타민 B6 (예를 들어 2.5, 5, 7.5, 10, 12.5, 15, 17.5, 20 이상의 mg)을 포함할 수 있다. 단위 투여량은 750 mg 류신, 15 mg 퀸산 및 10 mg 비타민 B6을 포함할 수 있다.
일부 실시양태에서, 단위 투여량은 약 지시된 양, 그 미만, 또는 그 초과의 푸코크산틴 (예를 들어 0.5, 0.75, 1, 1.25, 1.5, 1.75, 2, 2.25, 2.5, 3, 5 이상의 mg)을, 약 지시된 양, 그 미만, 또는 그 초과의 하나 이상의 다른 성분과 조합하여 포함할 수 있다. 단위 투여량은 500 mg 베타 히드록시, 베타 메틸 부티레이트 (예를 들어 50, 100, 200, 300, 400, 500 이상의 mg) 및 2.5 mg 푸코크산틴을 포함할 수 있다. 단위 투여량은 500 mg 베타 히드록시, 베타 메틸 부티레이트 (예를 들어 50, 100, 200, 300, 400, 500 이상의 mg), 2.5 mg 푸코크산틴 및 15 mg 비타민 B6 (예를 들어 2.5, 5, 7.5, 10, 12.5, 15, 17.5, 20 이상의 mg)을 포함할 수 있다. 단위 투여량은 1.125 g 류신 (예를 들어 400, 500, 600, 700, 800, 900, 1000, 1100, 1250 이상의 mg) 및 2.5 mg 푸코크산틴을 포함할 수 있다. 단위 투여량은 1.125 g 류신 (예를 들어 400, 500, 600, 700, 800, 900, 1000, 1100, 1250 이상의 mg), 2.5 mg 푸코크산틴 및 15 mg 비타민 B6 (예를 들어 2.5, 5, 7.5, 10, 12.5, 15, 17.5, 20 이상의 mg)을 포함할 수 있다. 단위 투여량은 750 mg 류신, 1.5 mg 푸코크산틴 및 10 mg 비타민 B6을 포함할 수 있다.
일부 실시양태에서, 조성물은 항당뇨병제, 예컨대 비구아니드 (예를 들어 메트포르민)의 양을 포함한다. 항당뇨병제의 양은 치료량 미만, 및/또는 조성물과 동시에 또는 일시적으로 아주 근접하게 투여되는 조성물 중 하나 이상의 다른 화합물 또는 조성물 중 하나 이상과 상승작용적인 양일 수 있다. 일부 실시양태에서, 항당뇨병제는 매우 저용량, 저용량, 중용량, 또는 고용량으로 투여되고, 이는 두 용량 간의 관계를 기술하고, 일반적으로 임의의 특정 용량 범위를 규정하지 않는다. 예를 들어, 메트포르민의 1일 매우 저용량은 약 5 mg/kg, 10 mg/kg, 25 mg/kg, 50 mg/kg, 75 mg/kg, 100 mg/kg 이상, 그 미만, 또는 그 초과를 포함할 수 있고; 메트포르민의 1일 저용량은 약 75 mg/kg, 100 mg/kg, 150 mg/kg, 175 mg/kg, 200 mg/kg 이상, 그 미만, 또는 그 초과를 포함할 수 있고; 메트포르민의 1일 중용량은 약 150 mg/kg, 175 mg/kg, 200 mg/kg, 250 mg/kg, 300 mg/kg, 그 미만, 또는 그 초과를 포함할 수 있고; 메트포르민의 1일 고용량은 약 200 mg/kg, 250 mg/kg, 300 mg/kg, 350 mg/kg, 400 mg/kg, 500 mg/kg, 700 mg/kg 이상, 그 미만, 또는 그 초과를 포함할 수 있다.
일부 실시양태에서, 단위 투여량은 약 지시된 양, 그 미만, 또는 그 초과의 메트포르민 (예를 들어 25, 50, 100, 150, 200, 250, 300, 400, 500 이상의 mg)을 약 지시된 양, 그 미만, 또는 그 초과의 하나 이상의 다른 성분 (예컨대 10, 20, 30, 40, 50, 75, 100 이상의 mg의 레스베라트롤; 50, 100, 200, 300, 400, 500 이상의 mg의 HMB; 및/또는 400, 500, 600, 700, 800, 900, 1000, 1100, 1250 이상의 mg의 류신)과 조합하여 포함할 수 있다. 단위 투여량은 약 50 mg 메트포르민, 500 mg 베타 히드록시, 베타 메틸 부티레이트 및 50 mg 레스베라트롤, 그 미만 또는 그 초과를 포함할 수 있다. 단위 투여량은 약 50 mg 메트포르민, 1.125 g 류신 및 50 mg 레스베라트롤, 그 미만 또는 그 초과를 포함할 수 있다. 단위 투여량은 약 100 mg 메트포르민, 500 mg 베타 히드록시, 베타 메틸 부티레이트 및 50 mg 레스베라트롤, 그 미만 또는 그 초과를 포함할 수 있다. 단위 투여량은 약 100 mg 메트포르민, 1.125 g 류신 및 50 mg 레스베라트롤, 그 미만 또는 그 초과를 포함할 수 있다. 단위 투여량은 약 250 mg 메트포르민, 500 mg 베타 히드록시, 베타 메틸 부티레이트 및 50 mg 레스베라트롤, 그 미만 또는 그 초과를 포함할 수 있다. 단위 투여량은 약 250 mg 메트포르민, 1.125 g 류신 및 50 mg 레스베라트롤, 그 미만 또는 그 초과를 포함할 수 있다. 일부 실시양태에서, 조성물은 PDE 억제제를 상승작용량으로 추가로 포함한다. 일부 실시양태에서, 메트로프핀 조성물은 선택적 PDE 억제제를 상승작용량으로 추가로 포함한다.
일부 실시양태에서, 단위 투여량은 류신 및 이카리인을 포함한다. 단위 투여량은 약 500 내지 약 2000 mg의 류신을 포함할 수 있다. 단위 투여량은 약 700 내지 약 1500 mg의 류신을 포함할 수 있다. 단위 투여량은 약 900 내지 약 1300 mg의 류신을 포함할 수 있다. 류신에 대한 이카리인의 중량비는 0.01-0.1일 수 있다. 류신에 대한 이카리인의 중량비는 0.02-0.06일 수 있다. 류신에 대한 이카리인의 중량비는 0.03-0.05일 수 있다. 류신 및 이카리인을 포함하는 단위 투여량의 예시적인 제제는 하기 표 1에 나타내었다.
<표 1>
제제 1
일부 실시양태에서, 단위 투여량은 류신, 이카리인 및 레스베라트롤을 포함한다. 단위 투여량은 약 500 내지 약 2000 mg의 류신을 포함할 수 있다. 단위 투여량은 약 700 내지 약 1500 mg의 류신을 포함할 수 있다. 단위 투여량은 약 900 내지 약 1300 mg의 류신을 포함할 수 있다. 류신에 대한 이카리인의 중량비는 0.01-0.1일 수 있다. 류신에 대한 이카리인의 중량비는 0.02-0.06일 수 있다. 류신에 대한 이카리인의 중량비는 0.03-0.05일 수 있다. 류신에 대한 레스베라트롤의 중량비는 0.01-0.1일 수 있다. 류신에 대한 레스베라트롤의 중량비는 0.02-0.06일 수 있다. 류신에 대한 레스베라트롤의 중량비는 0.03-0.05일 수 있다. 류신, 이카리인 및 레스베라트롤을 포함하는 단위 투여량의 예시적인 제제는 하기 표 2에 나타내었다.
<표 2>
제제 2
일부 실시양태에서, 단위 투여량은 류신, 이카리인 및 메트포르민을 포함한다. 단위 투여량은 약 500 내지 약 2000 mg의 류신을 포함할 수 있다. 단위 투여량은 약 700 내지 약 1500 mg의 류신을 포함할 수 있다. 단위 투여량은 약 900 내지 약 1300 mg의 류신을 포함할 수 있다. 류신에 대한 이카리인의 중량비는 0.01-0.1일 수 있다. 류신에 대한 이카리인의 중량비는 0.02-0.06일 수 있다. 류신에 대한 이카리인의 중량비는 0.03-0.05일 수 있다. 류신에 대한 메트포르민의 중량비는 0.01-0.6일 수 있다. 류신에 대한 메트포르민의 중량비는 0.1-0.5일 수 있다. 류신에 대한 메트포르민의 중량비는 0.15-0.3일 수 있다. 류신에 대한 메트포르민의 중량비는 0.22-0.23일 수 있다. 류신, 이카리인 및 메트포르민을 포함하는 단위 투여량의 예시적인 제제는 하기 표 3에 나타내었다.
<표 3>
제제 3
일부 실시양태에서, 단위 투여량은 류신 및 실데나필을 포함한다. 단위 투여량은 약 500 내지 약 2000 mg의 류신을 포함할 수 있다. 단위 투여량은 약 700 내지 약 1500 mg의 류신을 포함할 수 있다. 단위 투여량은 약 900 내지 약 1300 mg의 류신을 포함할 수 있다. 류신에 대한 실데나필의 중량비는 0.00001-0.05일 수 있다. 류신에 대한 실데나필의 중량비는 0.0001-0.03일 수 있다. 류신에 대한 실데나필의 중량비는 0.001-0.02일 수 있다. 류신에 대한 실데나필의 중량비는 0.005-0.015일 수 있다. 류신 및 실데나필을 포함하는 단위 투여량의 예시적인 제제는 하기 표 4에 나타내었다.
<표 4>
제제 4
일부 실시양태에서, 단위 투여량은 류신, 레스베라트롤 및 실데나필을 포함한다. 단위 투여량은 약 500 내지 약 2000 mg의 류신을 포함할 수 있다. 단위 투여량은 약 700 내지 약 1500 mg의 류신을 포함할 수 있다. 단위 투여량은 900-1300 mg의 류신을 포함할 수 있다. 류신에 대한 레스베라트롤의 중량비는 0.00001-0.05일 수 있다. 류신에 대한 레스베라트롤의 중량비는 0.0001-0.03일 수 있다. 류신에 대한 레스베라트롤의 중량비는 0.001-0.02일 수 있다. 류신에 대한 실데나필의 중량비는 0.00001-0.05일 수 있다. 류신에 대한 실데나필의 중량비는 0.0001-0.03일 수 있다. 류신에 대한 실데나필의 중량비는 0.001-0.02일 수 있다. 류신에 대한 실데나필의 중량비는 0.005-0.015일 수 있다. 류신, 레스베라트롤 및 실데나필을 포함하는 단위 투여량의 예시적인 제제는 하기 표 5에 나타내었다.
<표 5>
제제 5
일부 실시양태에서, 단위 투여량은 HMB 및 이카리인을 포함한다. 단위 투여량은 약 50-1000 mg의 HMB를 포함할 수 있다. 단위 투여량은 약 100-500 mg의 HMB를 포함할 수 있다. 단위 투여량은 150-400 mg의 HMB를 포함할 수 있다. 단위 투여량은 200-300 mg의 HMB를 포함할 수 있다. HMB에 대한 이카리인의 중량비는 0.05-0.5일 수 있다. HMB에 대한 이카리인의 중량비는 0.07-0.4일 수 있다. HMB에 대한 이카리인의 중량비는 0.1-0.3일 수 있다. HMB 및 이카리인을 포함하는 단위 투여량의 예시적인 제제는 하기 표 6에 나타내었다.
<표 6>
제제 6
일부 실시양태에서, 단위 투여량은 HMB, 이카리인 및 레스베라트롤을 포함한다. 단위 투여량은 약 50-1000 mg의 HMB를 포함할 수 있다. 단위 투여량은 약 100-500 mg의 HMB를 포함할 수 있다. 단위 투여량은 약 150-400 mg의 HMB를 포함할 수 있다. 단위 투여량은 200-300 mg의 HMB를 포함할 수 있다. HMB에 대한 이카리인의 중량비는 0.05-0.5일 수 있다. HMB에 대한 이카리인의 중량비는 0.07-0.4일 수 있다. HMB에 대한 이카리인의 중량비는 0.1-0.3일 수 있다. HMB에 대한 레스베라트롤의 중량비는 0.05-0.5일 수 있다. HMB에 대한 레스베라트롤의 중량비는 0.07-0.4일 수 있다. HMB에 대한 레스베라트롤의 중량비는 0.1-0.3일 수 있다. HMB, 이카리인 및 레스베라트롤을 포함하는 단위 투여량의 예시적인 제제는 하기 표 7에 나타내었다.
<표 7>
제제 7
일부 실시양태에서, 단위 투여량은 HMB, 이카리인 및 메트포르민을 포함한다. 단위 투여량은 약 50 내지 약 1000 mg의 HMB를 포함할 수 있다. 단위 투여량은 약 100 내지 약 500 mg의 HMB를 포함할 수 있다. 단위 투여량은 약 150 내지 약 400 mg의 HMB를 포함할 수 있다. 단위 투여량은 약 200 내지 약 300 mg의 HMB를 포함할 수 있다. HMB에 대한 이카리인의 중량비는 0.05-0.5일 수 있다. HMB에 대한 이카리인의 중량비는 0.07-0.4일 수 있다. HMB에 대한 이카리인의 중량비는 0.1-0.3일 수 있다. HMB에 대한 메트포르민의 중량비는 0.2-4일 수 있다. HMB에 대한 메트포르민의 중량비는 0.5-2일 수 있다. HMB에 대한 메트포르민의 중량비는 0.75-1.25일 수 있다. HMB, 이카리인 및 메트포르민을 포함하는 단위 투여량의 예시적인 제제는 하기 표 8에 나타내었다.
<표 8>
제제 8
일부 실시양태에서, 단위 투여량은 HMB 및 실데나필을 포함한다. 단위 투여량은 약 50-1000 mg의 HMB를 포함할 수 있다. 단위 투여량은 약 100-500 mg의 HMB를 포함할 수 있다. 단위 투여량은 약 150-400 mg의 HMB를 포함할 수 있다. 단위 투여량은 200-300 mg의 HMB를 포함할 수 있다. HMB에 대한 실데나필의 중량비는 0.01-0.1일 수 있다. HMB에 대한 실데나필의 중량비는 0.02-0.08일 수 있다. HMB에 대한 실데나필의 중량비는 0.03-0.05일 수 있다. HMB 및 실데나필을 포함하는 단위 투여량의 예시적인 제제는 하기 표 9에 나타내었다.
<표 9>
제제 9
일부 실시양태에서, 단위 투여량은 HMB, 실데나필 및 레스베라트롤을 포함한다. 단위 투여량은 약 50-1000 mg의 HMB를 포함할 수 있다. 단위 투여량은 약 100-500 mg의 HMB를 포함할 수 있다. 단위 투여량은 약 150-400 mg의 HMB를 포함할 수 있다. 단위 투여량은 200-300 mg의 HMB를 포함할 수 있다. HMB에 대한 실데나필의 중량비는 0.01-0.1일 수 있다. HMB에 대한 실데나필의 중량비는 0.02-0.08일 수 있다. HMB에 대한 실데나필의 중량비는 0.03-0.05일 수 있다. HMB에 대한 레스베라트롤의 중량비는 0.01-0.1일 수 있다. HMB에 대한 레스베라트롤의 중량비는 0.02-0.08일 수 있다. HMB에 대한 레스베라트롤의 중량비는 0.03-0.05일 수 있다. HMB 및 실데나필을 포함하는 단위 투여량의 예시적인 제제는 하기 표 10에 나타내었다.
<표 10>
제제 10
일부 실시양태에서, 예를 들어 표 1-10에 기재된 본원의 임의의 단위 투여량은 비타민 B6을 추가로 포함한다. 일부 실시양태에서, 예를 들어 표 1-10에 기재된 본원의 임의의 단위 투여량은 15 mg의 비타민 B6을 추가로 포함한다. 단위 투여량은 약 5-50 mg의 비타민 B6을 추가로 포함할 수 있다. 존재한다면, HMB에 대한 비타민 B6의 중량비는 약 0.06, 0.002-0.18, 0.03-0.12, 또는 0.05-0.07일 수 있다. 존재한다면, 류신에 대한 비타민 B6의 중량비는 약 0.0135, 0.005-0.03, 0.007-0.025, 또는 0.01-0.017일 수 있다.
일부 실시양태에서, 본원에 기재된 조성물은 하나 이상의 명시된 성분이 실질적으로 없거나, 이러한 성분의 명시된 수준을 가질 수 있다. 조성물, 예를 들어 표 1-10에 기재된 조성물은 혈당 탄수화물이 실질적으로 없거나, 총 중량을 기준으로 이를 40, 20, 10, 15, 5, 또는 1% 미만으로 포함할 수 있다. 조성물은 비제한적으로 글루코스, 덱스트로스, 프룩토스 및 수크로스를 비롯한 당이 실질적으로 없거나, 총 중량을 기준으로 이를 40, 20, 10, 15, 5, 또는 1% 미만으로 포함할 수 있다. 조성물은 고 혈당 지수 탄수화물이 실질적으로 없거나, 총 중량을 기준으로 이를 40, 20, 10, 15, 5, 또는 1% 미만으로 포함할 수 있다. 조성물은 복합 탄수화물이 실질적으로 없거나, 총 중량을 기준으로 이를 40, 20, 10, 15, 5, 또는 1% 미만으로 포함할 수 있다. 조성물은 단순 탄수화물이 실질적으로 없거나, 총 중량을 기준으로 이를 40, 20, 10, 15, 5, 또는 1% 미만으로 포함할 수 있다. 조성물은 전분, 옥수수 시럽, 단립종 백미, 백색 밀가루가 실질적으로 없거나, 총 중량을 기준으로 이를 40, 20, 10, 15, 5, 또는 1% 미만으로 포함할 수 있다.
본 발명의 일부 실시양태에서, 조합 조성물은 선택적 PDE 억제제에 대한 분지쇄 아미노산 및/또는 그의 대사물의 명시된 비를 가질 수 있다. 명시된 비는 에너지 대사의 유효하고/거나 상승작용적 조절을 제공할 수 있다. 예를 들어, 명시된 비는 대상체의 체중 증가의 감소, 대상체의 내장 지방 부피의 감소, 대상체의 지방 산화의 증가, 대상체의 인슐린 감수성의 증가, 대상체의 근육에서의 글루코스 흡수의 증가, 염증 마커의 감소, 혈관확장의 증가, 및/또는 체온의 증가를 유발할 수 있다. 이러한 유익한 효과는, 부분적으로, 미토콘드리아 생물발생의 증가, 또는 에너지 대사 경로에서의 다양한 다른 변화로 인한 것일 수 있다. 선택적 PDE 억제제에 대한 분지쇄 아미노산 및/또는 그의 대사물의 비는 질량비, 몰비, 또는 부피비일 수 있다.
일부 실시양태에서, (b) 선택적 PDE 억제제에 대한 (a) 분지쇄 아미노산 및/또는 그의 대사물의 몰비는 약 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 100, 120, 또는 150 이상이다. 다른 실시양태에서, 본 발명의 조성물에 함유된 선택적 PDE 억제제에 대한 하나 이상의 분지쇄 아미노산 및/또는 그의 대사물의 몰비는 약 20, 30, 40, 50, 60, 70, 80, 90, 95, 90, 95, 100, 105, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 220, 250, 300, 350, 400, 또는 500 이상이다. 일부 실시양태에서, 상기 조성물 중 성분 (b)에 대한 성분 (a)의 몰비는 약 20, 40, 60, 80, 100, 120, 또는 150 초과이다. 일부 실시양태에서, 상기 조성물 중 성분 (b)에 대한 성분 (a)의 몰비는 약 80, 100, 120, 또는 150 초과이다. 일부 실시양태에서, 상기 조성물 중 성분 (b)에 대한 성분 (a)의 몰비는 약 80, 100, 120, 또는 150 초과이다. 일부 실시양태에서, 상기 조성물 중 성분 (b)에 대한 성분 (a)의 몰비는 약 200, 250, 또는 300 초과이다. 일부 실시양태에서, 상기 조성물 중 성분 (b)에 대한 성분 (a)의 몰비는 약 40, 150, 250, 또는 500 초과이다.
일부 실시양태, 류신, 류신의 임의의 대사물, PDE 억제제 (예컨대 실데나필과 같은 PDE 5 억제제)의 투여는 류신, 류신의 대사물 및/또는 PDE 5 억제제의 명시된 생리학적 농도 또는 순환 수준을 달성하도록 설계될 수 있다. 생리학적 농도는 대상체의 혈류로 측정되는 순환 수준일 수 있다. 대상체는 인간 또는 동물일 수 있다. 선택된 투여는 대상체의 특성, 예컨대 체중, 에너지 대사율, 유전적 특징, 민족성, 신장 또는 임의의 다른 특성을 기준으로 변경될 수 있다. 단위 용량 내의 류신의 양은 대상체에서 류신의 순환 수준이 약 0.25 mM, 0.5 mM, 0.75 mM 또는 1 mM 이상이도록 할 수 있다. 약 1,125 mg 류신 (예를 들어, 유리 류신)의 투여는, 약 0.5 mM인 대상체에서의 류신의 순환 수준을 달성할 수 있다. 약 300 mg 류신 (예를 들어, 유리 류신)의 투여는, 약 0.25 mM인 대상체에서의 류신의 순환 수준을 달성할 수 있다. 약 실데나필의 투여는 약 0.1, 0.5, 1, 2, 5 또는 10 nM 이하의 순환 농도를 달성할 수 있다. 일부 실시양태에서, 실데나필의 표적 또는 달성된 순환 농도는 약 1 nM 미만이다. 약 20 mg의 실데나필의 단위 용량은 약 100 nM의 실데나필의 순환 농도를 달성할 수 있다. 약 0.2 mg의 실데나필의 단위 용량은 약 1 nM의 실데나필의 순환 농도를 달성할 수 있다. 약 이카리인의 투여는 약 0.1, 0.5, 1, 2, 5 또는 10 nM 이하의 순환 농도를 달성할 수 있다. 일부 실시양태에서, 이카리인의 표적 또는 달성된 순환 농도는 약 1 nM 미만이다. 약 20 mg의 이카리인의 단위 용량은 약 100 nM의 이카리인의 순환 농도를 달성할 수 있다. 약 0.1 mg의 이카리인의 단위 용량은 약 1 nM의 이카리인의 순환 농도를 달성할 수 있다.
일부 실시양태에서, 몰비 또는 질량비는 하나 이상의 조성물을 대상체에게 투여 후 달성되는 순환 몰비 또는 질량비이다. 조성물은 본원에 기재된 조합 조성물일 수 있다. 투여 형태의 조합 조성물의 몰비를 조정하여 원하는 순환 몰비를 달성할 수 있다. 몰비를 조정하여 조합 조성물의 하나 이상의 성분의 생체이용률, 흡수, 및 대사 프로세싱을 설명할 수 있다. 예를 들어, 성분의 생체이용률이 낮으면, 그 성분의 몰량은 조합 조성물 내의 다른 성분에 비하여 증가될 수 있다. 일부 실시양태에서, 순환 몰비 또는 질량비는 투여 후 약 0.1, 0.5, 0.75, 1, 3, 5, 또는 10, 12, 24, 또는 48시간 내에 달성된다. 순환 몰비 또는 질량비는 약 0.1, 1, 2, 5, 10, 12, 18, 24, 36, 48, 72, 또는 96시간 이상의 기간 동안 유지될 수 있다.
일부 실시양태에서, 실데나필에 대한 류신의 순환 몰비는 약 100,000, 250,000, 500,000, 750,000 이상 또는 그 초과이다. 일부 실시양태에서, 실데나필에 대한 HMB의 순환 몰비는 약 1,000, 2,500, 5,000, 7,500 이상 또는 그 초과이다. 일부 실시양태에서, 실데나필에 대한 레스베라트롤의 순환 몰비는 약 50, 100, 200, 400, 800 이상 또는 그 초과이다.
조성물은 대상체가 조성물의 선택된 총 1일 용량을 투여받도록 대상체에 투여될 수 있다. 총 1일 용량은 24시간의 기간에 걸쳐 투여된 용량의 합계에 의해 결정될 수 있다. 조성물의 총 1일 용량은 약 0.05, 0.1, 0.5, 1, 2, 5, 10, 20, 40, 60, 80 또는 100 mg의 실데나필을 포함할 수 있다. 조성물의 총 1일 용량은 약 1, 10, 20, 50, 100, 150, 300, 400, 500, 750, 1000, 1500, 또는 2000 mg의 이카리인을 포함할 수 있다. 조성물의 총 1일 용량은 적어도 약 250, 500, 750, 1000, 1125, 2000, 2250 mg 이상의 분지쇄 아미노산 또는 그의 대사물을 포함할 수 있다. 분지쇄 아미노산은 류신, HMB 또는 본원에 기재된 임의의 다른 분지쇄 아미노산일 수 있다. 조성물의 총 1일 용량은 적어도 약 3, 7.5, 15, 30, 45, 90 mg 이상의 비타민 B6을 포함할 수 있다. 조성물의 총 1일 용량은 약 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 100, 110, 120, 130, 140, 150, 175, 200, 250, 500, 750, 1000 이상, 그 초과, 또는 그 미만인 비타민 B6에 대한 분지쇄 아미노산 또는 그의 대사물의 질량 비를 가질 수 있다.
일부 실시양태에서, 조성물의 선택된 용량은 대상체가 조성물의 원하는 순환 수준을 달성하도록 대상체에 투여될 수 있다. 조성물의 원하는 순환 수준은 적어도 약 0.25, 0.5, 0.75, 1 mM 이상의 류신일 수 있다. 조성물의 원하는 순환 수준은 적어도 약 10, 25, 50, 100, 150 또는 200 nM 이상의 B6일 수 있다. 조성물의 원하는 순환 수준은 약 0.1, 0.5, 1, 2, 5, 10 nM 이상의 실데나필일 수 있다. 조성물의 원하는 순환 수준은 약 0.1, 0.5, 1, 2, 5, 10 nM 이상의 이카리인일 수 있다. 선택된 용량은 대상체의 특성, 예컨대 체중, 신장, 민족성 또는 유전적 특성을 기준으로 선택될 수 있다.
투여 형태
본원에 기재된 조성물은 다양한 상이한 투여 형태로 배합할 수 있다. 이는 정제, 저작성 정제, 캐플릿, 캡슐, 연질 젤라틴 캡슐, 로젠지 또는 용액으로서 경구로 사용될 수 있다. 이는 또한 그의 용액 형태인 경우에 주사용으로 또는 비강용 스프레이로서 사용될 수 있다. 일부 실시양태에서, 조성물은 경구 소비에 적합한 액체 조성물일 수 있다. 경구 투여에 적합한 본 발명의 조성물은, 이산 투여 형태, 예컨대 캡슐, 카쉐, 또는 정제, 또는 액체 또는 에어로졸 스프레이 (각각은 예정된 양의 활성 성분을 분말로서 또는 과립으로 함유), 용액, 또는 수성 또는 비수성 액체 중 현탁액, 수중유 에멀젼, 또는 유중수 액체 에멀젼 (액체 투여 형태 (예를 들어 현탁액 또는 슬러리), 및 경구 고체 투여 형태 (예를 들어 정제 또는 벌크 분말) 포함)으로서 존재할 수 있다. 경구 투여 형태는 치료될 환자 또는 개인에 의한 경구 섭취를 위해 정제, 환제, 당의정, 캡슐, 에멀젼, 친지성 및 친수성 현탁액, 액체, 겔, 시럽, 슬러리, 현탁액 등으로서 제제화될 수 있다. 이러한 투여 형태는 임의의 제제화 방법에 의해 제조될 수 있다. 예를 들어, 활성 성분은, 하나 이상의 필수 구성성분을 구성하는 담체와 회합될 수 있다. 경구 투여에 적합한 캡슐은 젤라틴으로 제조된 푸시-피트(push-fit) 캡슐뿐만 아니라, 젤라틴 및 가소제, 예컨대 글리세롤 또는 소르비톨로 제조된 연질의 밀봉 캡슐이 포함된다. 푸시-피트 캡슐은 활성 성분을 충전제, 예컨대 락토스, 결합제, 예컨대 전분, 및/또는 윤활제, 예컨대 활석 또는 스테아르산마그네슘, 및 임의로 안정화제와의 혼합물로 함유할 수 있다. 임의로, 경구용 본 발명의 조성물은 조성물을 고체 부형제와 혼합하고, 임의로 생성 혼합물을 분쇄하고, 원하는 경우, 적합한 보조제를 첨가한 후, 과립의 혼합물을 가공하여 정제 또는 당제 코어를 수득함으로써 수득될 수 있다. 적합한 부형제는, 특히, 충전제, 예컨대 락토스, 수크로스, 만니톨, 또는 소르비톨을 비롯한 당; 셀룰로스 제제, 예컨대, 예를 들어, 옥수수 전분, 밀 전분, 쌀 전분, 감자 전분, 젤라틴, 트라가칸트 검, 메틸 셀룰로스, 히드록시프로필메틸-셀룰로스, 소듐 카르복시메틸셀룰로스, 및/또는 폴리비닐피롤린 (PVP)이다. 일반적으로, 조성물은 활성 성분을 액체 담체 또는 미분된 고체 담체 또는 둘 다와 균일하고 친밀하게 혼합한 후, 필요한 경우에, 생성물을 원하는 외형으로 형상화함으로써 제조된다. 예를 들어, 정제는 임의로 하나 이상의 부 성분과 함께 압축 또는 몰딩함으로써 제조될 수 있다. 압축 정제는 활성 성분을 자유 유동 형태, 예컨대 분말 또는 과립으로, 임의로, 예컨대 결합제, 윤활제, 불활성 희석제 및/또는 표면 활성화제 또는 분산제이지만 이에 제한되지눈 않는 부형제와 혼합하여, 적합한 기계에서 압축함으로써 제조될 수 있다. 몰딩된 정제는 불활성 액체 희석제로 습윤화된 분말화 화합물의 혼합물을 적합한 기계에서 몰딩함으로써 제조될 수 있다.
본원에 개시된 제제가 경구 투여를 위해 또는 주사에 의해 혼입될 수 있는 액체 형태는, 수용액, 적합하게 향미 시럽, 수성 또는 오일 현탁액, 및 향미 에멀젼과 식용 오일, 예컨대 목화씨 오일, 참깨 오일, 코코넛 오일, 또는 땅콩 오일뿐만 아니라 엘릭시르 및 유사 제약 비히클을 포함한다. 수성 현탁액에 적합한 분산제 또는 현탁제는 합성 천연 검, 예컨대 트라가칸트, 아카시아, 알기네이트, 덱스트란, 소듐 카르복시메틸 셀룰로스, 메틸셀룰로스, 폴리비닐피롤린 또는 젤라틴을 포함한다.
대상체는 주상가능한 조성물 및 경구로 섭취된 조성물의 조합에 의해 치료될 수 있다.
경구 투여용 액체 제제는, 예를 들어, 용액, 시럽 또는 현탁액의 형태를 취할 수 있거나, 이들은 사용전 물 또는 다른 적합한 비히클로 재구성하기 위한 건조 제품으로서 존재할 수 있다. 이러한 액체 제제는 제약상 허용되는 첨가제, 예컨대 현탁제 (예를 들어 소르비톨 시럽, 메틸 셀룰로스 또는 수소화 식용 지방); 유화제 (예를 들어 레시틴 또는 아카시아); 비수성 비히클 (예를 들어 아몬드 오일, 유성 에스테르 또는 에틸 알콜); 보존제 (예를 들어 메틸 또는 프로필 p-히드록시벤조에이트 또는 소르브산); 및 인공 또는 천역 색소 및/또는 감미제를 사용하여 통상적인 방식에 의해 제조될 수 있다.
본 발명의 제약 조성물의 제조는 제약 제제의 제조에 관해 일반적으로 허용되는 절차에 따라 수행한다. 예를 들어, [Remington's Pharmaceutical Sciences 18th Edition (1990), E. W. Martin ed., Mack Publishing Co., PA]를 참조한다. 투여의 의도된 용도 및 방식에 따라, 제약 조성물의 제조에서 마그네슘-반대이온 화합물을 추가로 가공하는 것이 바람직할 수 있다. 적절한 가공은 적절한 무독성 및 무간섭 성분의 혼합, 멸균, 용량 단위로의 분할, 전달 장치 내의 봉입을 포함할 수 있다.
본 발명은 활성 성분을 포함하는 무수 조성물 및 투여 형태를 추가로 포괄하는데, 이는 물이 일부 화합물의 분해를 용이하게 할 수 있기 때문이다. 예를 들어, 물은 시간 경과에 따른 제제의 특징, 예컨대 보관-수명 또는 안정성을 결정하기 위해 장기 저장을 시뮬레이션하는 수단으로서 관련 기술분야에서 첨가될 수 있다 (예를 들어 5%). 본 발명의 무수 조성물 및 투여 형태는 무수 또는 저수분 함유 성분 및 저수분 또는 저습도 조건을 사용하여 제조될 수 있다. 락토스를 함유하는 본 발명의 조성물 및 투여 형태는, 제조, 포장, 및/또는 저장 동안 수분 및/또는 습도와 실질적인 접촉이 예상되는 경우 무수 상태로 만들 수 있다. 무수 조성물은 그의 무수 성질이 유지될 수 있도록 제조되고 저장될 수 있다. 따라서, 무수 조성물은 이들이 적합한 규정 키트에 포함될 수 있도록 물에 노출되는 것을 방지하기 위해 공지된 물질을 사용하여 포장될 수 있다. 적합한 포장의 예는 기밀 포일, 플라스틱 등, 단위 투여 용기, 블리스터 팩 및 스트립 팩을 포함하나, 이에 제한되지는 않는다.
본원에 기재된 구성성분은 통상적인 제약 배합 기술에 따라 제약 담체와 친밀 혼합물로 조합될 수 있다. 담체는 투여에 원하는 제제의 형태에 따라 매우 다양한 형태를 취할 수 있다. 경구 투여 형태를 위한 조성물 제조에서, 임의의 통상의 제약 매질은, 경구 액체 제제 (예컨대 현탁액, 용액 및 엘릭시르) 또는 에어로졸의 경우에 담체, 예컨대, 예를 들어, 물, 글리콜, 오일, 알콜, 향미제, 보존제, 착색제 등으로서 이용될 수 있거나; 담체, 예컨대 전분, 당, 미세결정질 셀룰로스, 희석제, 과립화제, 윤활제, 결합제, 및 붕해제는 락토스의 사용을 이용하지 않는 일부 실시양태에서 경구 고체 제제의 경우에 사용될 수 있다. 예를 들어, 적합한 담체는, 고체 경구 제제와 함께 분말, 캡슐, 및 정제를 포함한다. 바람직한 경우에, 정제는 표준 수성 또는 비수성 기술에 의해 코팅될 수 있다.
제약상 허용되는 담체의 역할을 할 수 있는 물질의 일부 예는 다음을 포함한다: (1) 당, 예컨대 락토스, 글루코스 및 수크로스; (2) 전분, 예컨대 옥수수 전분 및 감자 전분; (3) 셀룰로스 및 그의 유도체, 예컨대 소듐 카르복시메틸 셀룰로스, 에틸 셀룰로스 및 셀룰로스 아세테이트; (4) 분말화 트라가칸트; (5) 맥아; (6) 젤라틴; (7) 활석; (8) 부형제, 예컨대 코코아 버터 및 좌제 왁스; (9) 오일, 예컨대 땅콩 오일, 목화씨 오일, 홍화 오일, 참깨 오일, 올리브 오일, 옥수수 오일 및 대두 오일; (10) 글리콜, 예컨대 프로필렌 글리콜; (11) 폴리올, 예컨대 글리세린, 소르비톨, 만니톨 및 폴리에틸렌 글리콜; (12) 에스테르, 예컨대 에틸 올레에이트 및 에틸 라우레이트; (13) 한천; (14) 완충제, 예컨대 수산화마그네슘 및 수산화알루미늄; (15) 알긴산; (16) 발열원 무함유 물; (17) 등장성 염수; (18) 링거액; (19) 에틸 알콜; (20) 포스페이트 완충제 용액; 및 (21) 제약 제제에 사용되는 다른 비-독성 상용성 물질.
투여 형태로 사용하기에 적합한 결합제는, 옥수수 전분, 감자 전분, 또는 다른 전분, 젤라틴, 천연 및 합성 검 예컨대 아카시아, 알긴산나트륨, 알긴산, 다른 알기네이트, 분말화 트라가칸트, 구아 검, 셀룰로스 및 그의 유도체 (예를 들어 에틸 셀룰로스, 셀룰로스 아세테이트, 카르복시메틸 셀룰로스 칼슘, 소듐 카르복시메틸 셀룰로스), 폴리비닐 피롤린, 메틸 셀룰로스, 예비-젤라틴화 전분, 히드록시프로필 메틸 셀룰로스, 미세결정질 셀룰로스, 및 그의 혼합물을 포함하나, 이에 제한되지는 않는다.
본 발명의 조성물 및 투여 형태를 형성하기 위해 사용될 수 있는 윤활제는 스테아르산칼슘, 스테아르산마그네슘, 미네랄 오일, 경질 미네랄 오일, 글리세린, 소르비톨, 만니톨, 폴리에틸렌 글리콜, 다른 글리콜, 스테아르산, 소듐 라우릴 술페이트, 활석, 수소화 식물성 오일 (예를 들어, 땅콩 오일, 목화씨 오일, 해바라기 오일, 참깨 오일, 올리브 오일, 옥수수 오일, 및 대두 오일), 스테아르산아연, 에틸 올레에이트, 에틸 라우레이트, 한천, 또는 그의 혼합물을 포함하나, 이에 제한되지는 않는다. 추가적인 윤활제는, 예를 들어 실로이드 실리카 겔, 합성 실리카의 응집 에어로졸 또는 그의 혼합물을 포함한다. 윤활제는 조성물의 약 1 중량 퍼센트 미만의 양으로 임의로 첨가될 수 있다.
윤활제는 또한 조직 장벽과 함께 사용될 수 있으며, 이는 폴리사카라이드, 폴리글리칸, 세프라필름, 인터시드 및 히알루론산을 포함하나 이에 제한되지는 않는다.
붕해제는 본 발명의 조성물에 사용되어 수성 환경에 노출시 붕괴하는 정제를 제공한다. 너무 많은 붕해제는 병 속에서 붕괴할 수 있는 정제를 초래할 수 있다. 너무 적은 경우는 붕괴가 일어나기에는 불충분할 수 있고 따라서 투여 형태로부터 활성 성분(들)의 방출 속도 및 정도를 변경할 수 있다. 따라서, 너무 적지도 또는 너무 많지도 않아 활성 성분(들)의 방출을 불리하게 변경시키지 않는 충분량의 붕해제를 사용하여 본원에 개시된 화합물의 투여 형태를 형성할 수 있다. 사용된 붕해제의 양은 제제의 유형 및 투여의 방식을 기준으로 다양할 수 있고, 통상의 기술자에게 용이하게 인식될 수 있다. 약 0.5 내지 약 15 중량 퍼센트의 붕해제, 또는 약 1 내지 약 5 중량 퍼센트의 붕해제가 제약 조성물에서 사용될 수 있다. 본 발명의 조성물 및 투여 형태를 형성하기 위해 사용될 수 있는 붕해제는 한천-한천, 알긴산, 탄산칼슘, 미세결정질 셀룰로스, 크로스카르멜로스 소듐, 크로스포비돈, 폴라크릴린 포타슘, 소듐 전분 글리콜레이트, 감자 또는 타피오카 전분, 다른 전분, 예비-젤라틴화 전분, 다른 전분, 점토, 다른 알긴, 다른 셀룰로스, 검 또는 그의 혼합물을 포함하나, 이에 제한되지는 않는다.
본원에 개시된 조성물 및 투여 형태에 사용하기에 적합한 충전제의 예는 활석, 탄산칼슘 (예를 들어 과립 또는 분말), 미세결정질 셀룰로스, 분말화 셀룰로스, 덱스트레이트, 카올린, 만니톨, 규산, 소르비톨, 전분, 예비-젤라틴화 전분 및 그의 혼합물 포함하나, 이에 제한되지는 않는다.
수성 현탁액 및/또는 엘릭시르가 경구 투여에 바람직한 경우, 그 안의 활성 성분은 다양한 감미제 또는 향미제, 착색 물질 또는 염료 및, 원한다면, 유화제 및/또는 현탁제와, 물, 에탄올, 프로필렌 글리콜, 글리세린 및 그의 다양한 조합물과 같은 희석제와 함께 조합할 수 있다.
정제는 공지된 기술에 의해 코팅되지 않거나 코팅될 수 있어 위장관에서의 붕괴 및 흡수를 지연시키고 그로 인해 장기간에 걸쳐 지속 작용을 제공할 수 있다. 예를 들어, 시간 지연 물질, 예컨대 글리세릴 모노스테아레이트 또는 글리세릴 디스테아레이트가 사용될 수 있다. 경구용 제제는 또한 경질 젤라틴 캡슐 (여기서 활성 성분은 불활성 고체 희석제, 예를 들어, 탄산칼슘, 인산칼슘 또는 카올린과 혼합됨), 또는 연질 젤라틴 캡슐 (여기서 활성 성분은 물 또는 오일 매질, 예를 들어, 땅콩 오일, 액상 파라핀 또는 올리브 오일과 혼합됨)로서 존재할 수 있다.
한 실시양태에서, 조성물은 가용화제를 포함하여 본 발명의 화합물의 양호한 가용화 및/또는 용해를 보장하고 본 발명의 화합물의 침전을 최소화할 수 있다. 이는 비경구용 조성물, 예를 들어, 주사용 조성물에 특히 중요할 수 있다. 가용화제가 또한 첨가되어 친수성 약물 및/또는 다른 성분, 예컨대 계면활성화제의 용해도를 증가시키거나, 조성물을 안정하거나 균질한 용액 또는 분산액으로서 유지할 수 있다.
조성물은 하나 이상의 제약상 허용되는 첨가제 및 부형제를 추가로 포함할 수 있다. 이러한 첨가제 및 부형제는, 비제한적으로, 점착 감소제, 소포제, 완충제, 중합체, 항산화제, 보존제, 킬레이트제, 점도 조절제, 긴장제, 향미제, 착색제, 부취제, 불투명화제, 현탁화제, 결합제, 충전제, 가소제, 윤활제, 및 그의 혼합물이 포함된다. 부형제의 예의 비포괄적 열거는 모노글리세리드, 스테아르산마그네슘, 개질된 식품 전분, 젤라틴, 미세결정질 셀룰로스, 글리세린, 스테아르산, 실리카, 황색 밀랍, 레시틴, 히드록시프로필셀룰로스, 크로스카르멜로스 소듐 및 크로스포비돈을 포함한다.
본원에 기재된 조성물은 또한 하나 이상의 성분이 시간 경과에 따라 방출되도록 연장 방출, 지속 방출 또는 기간 방출로서 제제화될 수 있다. 지연 방출은 다양한 물질의 매트릭스에서 하나 이상의 성분을 제제화함으로써 또는 미세캡슐화에 의해 달성될 수 있다. 조성물은 4, 6, 8, 12, 16, 20, 또는 24시간의 기간에 걸쳐 하나 이상의 성분을 방출하도록 제제화될 수 있다. 하나 이상의 성분은 일정한 또는 변하는 속도로 방출될 수 있다.
본원에 제공된 제어 방출 투여를 사용하여, 하나 이상의 보조인자는 동일 양의 성분의 즉시 방출 제제에 관해 관찰된 것보다 느린 속도로 그의 투여 형태로 방출될 수 있다. 일부 실시양태에서, 제어 방출 제제에 대한 최대 농도에 이르기까지 투여로부터 명시된 기간에 걸친 농도의 변화로서 측정된 생물학적 샘플의 변화 속도는 즉시 방출 제형 속도의 약 80%, 70%, 60%, 50%, 40%, 30%, 20%, 또는 10% 미만이다. 더욱이, 일부 실시양태에서, 시간 경과에 따른 농도의 변화 속도는 즉시 방출 제제에 관한 속도의 약 80%, 70%, 60%, 50%, 40%, 30%, 20%, 또는 10% 미만이다.
일부 실시양태에서, 시간 경과에 따른 농도의 변화 속도는 비교적 비례적인 방식으로 최대 농도에 이르기까지의 시간을 증가시킴으로써 감소된다. 예를 들어, 최대 농도에 대한 시간의 2배 증가는 농도의 변화 속도를 대략 2배만큼 감소시킬 수 있다. 결과적으로, 하나 이상의 보조인자가 제공되어 그것이 즉시 방출 투여 형태에 비해 상당히 감소된 속도로 그의 최대 농도에 이르도록 할 수 있다. 본 발명의 조성물을 24시간, 16시간, 8시간, 4시간, 2시간, 또는 적어도 1시간까지 최대 농도의 이동을 제공하도록 제제화할 수 있다. 농도의 변화 속도에서의 관련 감소는 약 0.05, 0.10, 0.25, 0.5 또는 적어도 0.8배일 수 있다. 특정 실시양태에서, 이는 하나 이상의 보조인자의 약 30%, 50%, 75%, 90%, 또는 95% 미만을 이러한 투여의 1시간 이내에 순환으로 방출시킴으로써 달성된다.
임의로, 제어 방출 제제는 동일 보조인자의 동일 투여의 즉시 방출 제제의 것의 75%, 50%, 40%, 30%, 20% 또는 10% 미만의 초기 (예를 들어 투여 후 2시간 내지 투여 후 4시간) 경사를 갖는 혈장 농도 곡선을 나타낸다.
일부 실시양태에서, 용해 연구에서 측정된 보조인자의 방출 속도는 최초 1, 2, 4, 6, 8, 10, 또는 12시간에 걸쳐 동일 보조인자의 즉시 방출 제제에 관한 속도의 약 80%, 70%, 60%, 50%, 40%, 30%, 20%, 또는 10% 미만이다.
본원에 제공된 제어 방출 제제는 다양한 포맷을 취할 수 있다. 일부 실시양태에서, 제제는 본원에 기재된 것과 같으나 이에 제한되지는 않는, 액체 투여 형태 (예를 들어 현탁액 또는 슬러리), 및 경구 고체 투여 형태 (예를 들어 정제 또는 벌크 분말)를 비롯한 경구 투여 형태이다.
본원에 개시된 제제의 제어 방출 정제는 매트릭스, 저장소 또는 삼투 시스템일 수 있다. 상기 세 시스템 중 임의의 것이 적합하지만, 후자의 두 시스템이 비교적 큰 질량을 캡슐화하는데, 개인의 유전자 구성에 따라, 예컨대 대량의 단일 보조인자의 개재를 위해, 또는 복수의 보조인자의 개재를 위해, 더 최적의 용량을 가질 수 있다. 일부 실시양태에서, 서방성 정제는 저장소 시스템을 기반으로 하며, 여기서 하나 이상의 보조인자를 함유하는 코어는, 수화시, 하나 이상의 보조 인자가 이를 통해 확산가능한 다공성 막 코팅에 의해 캡슐화된다. 유효 성분의 합해진 질량이 일반적으로 그램 양이기 때문에, 효율적인 전달 시스템은 최적의 결과를 제공할 수 있다.
따라서, 정제 또는 환제가 또한 코팅될 수 있거나 그렇지 않으면 배합되어 지속성 작용의 이점을 제공하는 투여 형태를 제공할 수 있다. 예를 들어, 정제 또는 환제는 내부 투여 성분 및 외부 투여 성분을 포함할 수 있으며, 후자는 전자 위의 외피의 형태이다. 두 성분은 장용 층에 의해 분리될 수 있으며 이는 위에서의 붕괴에 저항하는 역할을 하고 내부 성분이 십이지장 내로 온전하게 들어가거나 방출이 지연되도록 할 수 있다. 다양한 물질이 이러한 장용 층 또는 코팅물에 사용될 수 있으며, 이러한 물질은 다수의 중합체산 및 중합체산과 쉘락, 세틸 알콜 및 셀룰로스 아세테이트와 같은 물질의 혼합물을 포함한다. 일부 실시양태에서, 복수의 보조인자를 포함하는 제제는 상이한 속도 또는 상이한 시간으로 방출되는 상이한 보조인자를 가질 수 있다. 예를 들어, 장용 층에 산재된 추가의 층의 보조인자가 존재할 수 있다.
지속 방출 정제의 제조 방법은 관련 기술분야에 공지되어 있고, 예를 들어, 미국 특허 공개 2006/051416 및 2007/0065512, 또는 본원에 개시된 다른 참조문헌을 참조한다. 미국 특허 번호 4,606,909, 4,769,027, 4,897,268 및 5,395,626에 기재된 바와 같은 방법을 사용하여 개인의 유전자 구성에 의해 결정되는 하나 이상의 보조인자의 지속 방출 제제를 제조할 수 있다. 일부 실시양태에서, 제제는 미국 특허 번호 6,919,373, 6,923,800, 6,929,803, 및 6,939,556에 기재된 바와 같은 OROS® 기술을 사용하여 제조된다. 미국 특허 번호 6,797,283, 6,764,697, 및 6,635,268에 기재된 바와 같은 다른 방법을 또한 본원에 개시된 제제를 제조하는데 사용할 수 있다.
일부 실시양태에서, 조성물은 식품 조성물로 제제화될 수 있다. 예를 들어, 조성물은 식품 담체가 있거나 없는, 음료 또는 다른 액체, 고체 식품, 반고체 식품일 수 있다. 예를 들어, 조성물은 본원에 기재된 임의의 조성물로 보충된 홍차를 포함할 수 있다. 조성물은 본원에 기재된 임의의 조성물로 보충된 유제품일 수 있다. 일부 실시양태에서, 조성물은 식품 조성물로 제제화될 수 있다. 예를 들어, 조성물은 음료, 고체 식품, 반고체 식품, 또는 식품 담체를 포함할 수 있다.
일부 실시양태에서, 액체 식품 담체를, 예컨대 음료, 예컨대 보충 쥬스, 커피, 차, 탄산수, 향미 물 등의 형태로 사용할 수 있다. 예를 들어, 음료는 제제뿐만 아니라 통상적인 음료에 존재하는 액체 성분, 예컨대 다양한 탈취제 또는 천연 탄수화물을 포함할 수 있다. 천연 탄수화물의 예는, 모노사카라이드, 예컨대 글루코스 및 프럭토스; 디사카라이드, 예컨대 말토스 및 수크로스; 통상의 당, 예컨대 덱스트린 및 시클로덱스트린; 및 당 알콜, 예컨대 자일리톨 및 에리트리톨을 포함하나, 이에 제한되지는 않는다. 천연 탈취제, 예컨대 타우마틴, 스테비아 추출물, 레바우디오시드 A, 글리시리진, 및 합성 탈취제, 예컨대 사카린 및 아스파르탐을 또한 사용할 수 있다. 작용제, 예컨대 향미제, 착색제 등을 또한 사용할 수 있다. 예를 들어, 펙트산 및 그의 염, 알긴산 및 그의 염, 유기산, 보호 콜로이드성 접착제, pH 제어제, 안정화제, 보존제, 글리세린, 알콜, 또는 탄화제를 또한 사용할 수 있다. 과일 및 채소를 또한 본원에 논의된 제제를 포함하는 식품 또는 음료를 제조하는데 사용할 수 있다.
대안적으로, 조성물은 본원에 기재된 임의의 조성물로 보충된 스낵바일 수 있다. 예를 들어, 스낵바는 초콜릿바, 그래놀라바, 또는 트레일 믹스바(trail mix bar)일 수 있다. 또 다른 실시양태에서, 본 식이 보충제 또는 식품 조성물을 소비를 위해 적합하고 바람직한 맛, 식감 및 점도를 갖도록 제제화할 수 있다. 임의의 적합한 식품 담체를 본 식품 조성물에서 사용할 수 있다. 본 발명의 식품 담체는 실제로 임의의 식품 제품을 포함한다. 이러한 식품 담체의 예는 식품 바 (그래놀라바, 단백질바, 캔디바 등), 시리얼 제품 (오트밀, 아침 식사용 시리얼, 그래놀라 등), 베이커리 제품 (빵, 도넛, 크래커, 베이글, 패스트리, 케이크 등), 음료 (우유-함유 음료, 스포츠 음료, 과일 쥬스, 알콜성 음료, 병에 든 생수), 파스타, 곡물 (벼, 옥수수, 귀리, 호밀, 밀, 밀가루 등), 난제품, 스낵 (캔디, 칩, 검, 초콜릿 등), 육류, 과일, 및 야채를 포함하나, 이에 제한되지는 않는다. 한 실시양태에서, 본원에 이용된 식품 담체는 바람직하지 않은 맛 (예를 들어 쓴 맛)을 차폐할 수 있다. 원하는 경우, 본원에 제시된 식품 조성물은 본원에 기재된 임의의 성분보다 더 바람직한 식감 및 향기를 나타낸다. 예를 들어, 액체 식품 담체를 본 발명에 따라 사용하여 음료, 예컨대 보충 쥬스, 커피, 차 등의 형태로 본 식품 조성물을 수득할 수 있다. 다른 실시양태에서, 고체 식품 담체를 본 발명에 따라 사용하여 식사 대용물, 예컨대 보충 스낵 바, 파스타, 빵 등의 형태로 본 식품 조성물을 수득할 수 있다. 또 다른 실시양태에서, 반고체 식품 담체를 본 발명에 따라 사용하여 검, 츄잉 캔디 또는 스낵 등의 형태로 본 식품 조성물을 수득할 수 있다.
조합 조성물의 투여는 1일 약 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 이상의 횟수, 그 미만, 또는 그 초과로 투여될 수 있다. 대상체는 약 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 이상의 일, 주 또는 개월, 그 미만, 또는 그 초과의 기간 동안 투여를 받을 수 있다. 단위 용량은 1일 용량의 분할분, 예컨대 1일당 투여될 단위 용량의 수로 나눈 1일 용량일 수 있다. 단위 용량은 1일 용량의 분할분일 수 있고 이는 1일에 투여될 단위 용량의 수로 나누고 추가로 투여당 단위 용량 (예를 들어 정제)의 수로 나눈 1일 용량이다. 투여당 단위 용량의 수는 약 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 이상, 그 미만, 또는 그 초과일 수 있다. 1일당 용량의 수는 약 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 이상, 그 미만, 또는 그 초과일 수 있다. 1일 당 단위 용량의 수는 1일 용량을 단위 용량으로 나눔으로써 결정될 수 있고, 1일 당 약 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 6, 17, 18, 19, 20 이상의 단위 용량, 그 미만, 또는 그 초과일 수 있다. 예를 들어, 단위 용량은 약 1/2, 1/3, 1/4, 1/5, 1/6, 1/7, 1/8, 1/9, 1/10일 수 있다. 단위 용량은 1일 양의 약 3분의 1이고 대상체에게 1일 3회 투여될 수 있다. 단위 용량은 1일 양의 약 2분의 1이고 대상체에게 1일 2회 투여될 수 있다. 단위 용량은 1일 양의 약 4분의 1일 수 있고 여기서 2개의 단위 용량은 대상체에게 1일 2회 투여된다. 일부 실시양태에서, 단위 용량은 약 50 mg, 그 미만, 또는 그 초과의 레스베라트롤을 포함한다. 일부 실시양태에서, 단위 용량은 약 550 mg, 그 미만, 또는 그 초과의 류신을 포함한다. 일부 실시양태에서, 단위 용량은 약 200 mg, 그 미만, 또는 그 초과의 하나 이상의 류신 대사물을 포함한다. 일부 실시양태에서, 단위 용량 (예를 들어 류신을 포함하는 단위 용량)은 1일당 2회 2개의 단위 용량으로서 투여된다. 일부 실시양태에서, 단위 용량 (예를 들어 하나 이상의 류신 대사물, 예컨대 HMB를 포함하는 단위 용량)은 1일당 2회 1개의 단위 용량으로서 투여된다.
본원에 개시된 조성물은 향미제를 추가로 포함할 수 있고 고체, 액체, 겔 또는 에멀젼일 수 있다.
방법
본원은 선택적 PDE 억제제를 사용하는 대상체에서 (시르투인 경로의 신호전달 분자인 AMPK 포함) 시르투인 경로 아웃풋을 증가시키는 방법을 제공한다. 본원에 기재된 바와 같이, 시르투인 경로의 아웃풋은 분자 수준에서 또는 생성되는 생리학적 효과에 의해 특성화될 수 있다. 일부 실시양태에서, 본 발명은 대상체에게 본원에 개시된 조성물의 투여를 포함하는, 대상체에서 지방산 산화를 증가시키는 방법을 제공한다. 본 발명의 다양한 실시양태에서, 조성물은 대상체의 세포 내에 지방산 산화를 증가시키기에 충분한 하나 이상의 분지형 아미노산 또는 그의 대사물, 예컨대 류신 또는 HMB 및 PDE 5 억제제, 예컨대 실데나필 또는 이카리인의 상승작용량을 전달하는 양으로 대상체에 투여된다.
본원에 기재된 방법은 다양한 적용에 유용할 수 있다. 이러한 적용은 (a) 시르투인 경로 아웃풋의 증가, (b) 미토콘드리아 생물발생의 증가, (c) 새로운 미토콘드리아 형성의 증가, (d) 미토콘드리아 기능의 증가, (e) 지방산 산화의 증가, (f) 열 발생의 증가, (g) 인슐린 감수성의 증가, (h) 글루코스 흡수의 증가, (i) 혈관확장의 증가, (j) 체중의 감소, (k) 지방 부피의 감소, (l) 대상체에서 염증 반응 또는 마커의 감소, 및 (m) 이리신 생산의 증가를 포함한다. 이러한 적용 중 임의의 것은 본원에 기재된 하나 이상의 조성물을 투여함으로써 달성될 수 있다.
따라서, 본 발명은 (a) 하나 이상의 유형의 분지형 아미노산 및/또는 그의 대사물 및 (b) 치료량 미만으로 존재하는 선택적 PDE 억제제를 포함하고, 단독으로 사용되는 경우와 비교하여 성분 (a) 또는 (b)가 시르투인 경로 아웃풋을 적어도 약 5배 증가시키기에 상승작용적으로 효과적인 조성물을 투여하는 방법을 제공한다.
경로의 아웃풋은 본원에 개시되고/거나 관련 기술분야에 공지된 하나 이상의 방법을 사용하여 측정할 수 있다. 예를 들어, 지방산 산화는 산소 소비, 또는 3H-표지된 팔미테이트 산화를 측정함으로써 결정될 수 있다. 미토콘드리아 생물발생은 형광을 사용함으로써 미토콘드리아 프로브를 사용하여 측정할 수 있다. AMPK 활성은 웨스턴 블롯에 의해 또는 ELISA 검정을 통해 AMPK 인산화를 측정함으로써 결정될 수 있다. Sirt1 활성은 형광단을 사용하여 검출될 수 있는, 기질의 탈아세틸화를 측정함으로써 결정될 수 있다.
sirt1, sirt2, 또는 sirt3의 증가는 시험관내 수행된 상응하는 탈아세틸화 검정에서 상응하는 기질을 적용함으로써 관찰된다. SIRT1 활성을 측정하기 위한 기질은 관련 기술분야에 공지된 임의의 기질 (예를 들어 인간 p53의 아미노산 379-382 (Arg-His-Lys-Lys[Ac])를 함유하는 펩티드)일 수 있다. SIRT3 활성을 측정하기 위한 기질은 관련 기술분야에 공지된 임의의 기질 (예를 들어 인간 p53의 아미노산 317-320 (Gin-Pro-Lys-Lys[Ac])을 함유하는 펩티드)일 수 있다. 일부 경우에, 본원에 기재된 하나 이상의 조합 조성물의 존재하에 수행된 하나 이상의 검정에서 sirt 활성의 증가는 조합 조성물의 단지 하나의 성분의 존재하에 측정된 활성과 비교하여, 적어도 약 1, 2, 3, 5, 또는 10배의 활성 증가를 초래한다. 예를 들어, (a) 시르투인 경로 활성화제 (예컨대 레스베라트롤) 및 (b) 분지쇄 아미노산 또는 그의 대사물 (예컨대 HMB)을 포함하는 조합 조성물의 사용은 성분 (a) 또는 (b)의 단독의 존재하에 측정된 활성과 비교하여 적어도 약 5배의 sirt3 활성의 증가를 초래한다. 또한, 본 발명의 조성물의 사용은 조성물의 단지 하나의 성분의 측정된 활성보다 1.5, 2, 5 또는 10배 더 큰 sirt1 활성의 증가를 초래한다.
본 발명은 (a) 하나 이상의 유형의 분지형 아미노산 및/또는 그의 대사물, 및 (b) 선택적 PDE 억제제를 포함하는 조성물을 투여하는 방법으로서, 여기서 상기 조성물 중 성분 (b)에 대한 성분 (a)의 표적 또는 달성된 몰비는 약 100,000, 200,000 또는 500,000초과이고, 여기서 조성물은 이를 필요로 하는 대상체에게 투여될 때 대상체의 체중 증가의 감소, 대상체의 내장 지방 부피의 감소, 대상체의 지방 산화의 증가, 대상체의 인슐린 감수성의 증가, 대상체의 근육에서의 글루코스 흡수의 증가, 염증 마커의 감소, 혈관확장의 증가, 및/또는 체온의 증가에 의해 측정되는 에너지 대사를 상승작용적으로 향상시키는 것인 방법을 제공한다.
본 발명은 (a) 하나 이상의 유형의 분지형 아미노산 및/또는 그의 대사물; (b) 선택적 PDE 억제제 (예를 들어, 실데나필 또는 이카리인); 및 (c) 식품 담체를 포함하며, 여기서 (a) 및 (b)는 대상체의 체중 증가의 감소, 대상체의 내장 지방 부피의 감소, 대상체의 지방 산화의 증가, 대상체의 인슐린 감수성의 증가, 대상체의 근육에서의 글루코스 흡수의 증가, 혈관확장의 증가, 산화성 스트레스의 감소, 염증 스트레스의 감소, 및/또는 체온의 증가를 상승작용적으로 실시하는 양으로 존재하는 것인 식품 조성물을 투여하는 방법을 제공한다.
본 발명은 (a) 하나 이상의 유형의 분지형 아미노산 및/또는 그의 대사물; 및 (b) PDE-5 억제제의 조합물을 포함하고, 비분지형 아미노산이 실질적으로 없는 조성물을 투여하는 방법으로서, 여기서 조합물은 이를 필요로 하는 대상체에게 투여시 대상체에게 성분 (a) 또는 성분 (b)를 단독으로 투여하는 것과 비교하여 미토콘드리아 생물발생을 더 큰 정도로 향상시키고, 여기서 향상된 미토콘드리아 생물발생은 대상체의 체중 감소, 대상체의 내장 지방 부피의 감소, 대상체의 지방 산화의 증가, 대상체의 인슐린 감수성의 증가, 대상체의 근육에서의 글루코스 흡수의 증가, 혈관확장의 증가, 산화성 스트레스의 감소, 염증 스트레스의 감소 및/또는 체온의 증가에 의해 측정되는 것인 방법을 제공한다. 일부 실시양태를 위해, (a)의 양 및 (b)의 양은 상승작용적이다.
본 발명은 (a) 하나 이상의 유형의 분지형 아미노산 및/또는 그의 대사물; 및 (b) PDE-5 억제제의 조합물을 포함하고, 비분지형 아미노산이 실질적으로 없는 조성물을 투여하는 방법으로서, 여기서 조합물은 이를 필요로 하는 대상체에게 투여시 대상체에게 성분 (a) 또는 성분 (b)를 단독으로 투여하는 것과 비교하여 미토콘드리아 생물발생을 더 큰 정도로 향상시키고, 여기서 향상된 미토콘드리아 생물발생은 대상체의 체중 감소, 대상체의 내장 지방 부피의 감소, 대상체의 지방 산화의 증가, 대상체의 인슐린 감수성의 증가, 대상체의 근육에서의 글루코스 흡수의 증가, 혈관확장의 증가, 산화성 스트레스의 감소, 염증 스트레스의 감소 및/또는 체온의 증가에 의해 측정되는 것인 방법을 제공한다. 일부 실시양태에서, (a)의 양 및 (b)의 양은 상승작용적이다.
본 발명은 본원에 기재된 임의의 조성물을 기간에 걸쳐 지방 산화의 향상을 필요로 하는 대상체에게 투여하는 것을 포함하며, 여기서 대상체에서의 지방 산화는 상기 기간에 걸쳐 증가되는 것인, 대상체에서 지방 산화를 향상시키는 방법을 제공한다. 지방 산화는 약 5, 10, 15, 20, 50, 100, 200, 또는 500% 이상 증가될 수 있다.
본 발명은 본원에 기재된 임의의 조성물을 기간에 걸쳐 염증 반응의 감소를 필요로 하는 대상체에게 투여하는 것을 포함하며, 여기서 대상체에서의 염증 반응은 상기 기간에 걸쳐 감소되는 것인, 대상체에서 염증 반응을 감소시키는 방법을 제공한다. 염증 반응 약 5, 10, 15, 20, 50, 또는 100% 이상 감소될 수 있다.
염증 마커 및 혈장 내 시토카인 수준 (IL-6, 아디포넥틴, TNF-α 및 CRP 수준을 포함하나 이에 제한되지는 않음)은 면역 검정, 예컨대 ELISA (어세이 디자인스(Assay Designs), 미국 미시간주 앤 아버 소재; 링코 리서치(Linco Research), 미국 미주리주 세인트 찰스 소재; 및 바이오사이언스(Bioscience), 미국 캘리포니아주 샌 디에고 소재)에 의해 결정될 수 있다.
본 발명은 본원에 기재된 임의의 조성물을 기간에 걸쳐 대상체에게 투여하는 것을 포함하며, 여기서 대상체의 체온은 상기 기간에 걸쳐 증가되거나 유지되는 것인, 대상체의 체온을 증가시키거나 유지시키는 방법을 제공한다. 체온은 약 1, 2, 3, 4, 5, 10, 15, 또는 20% 이상 증가될 수 있다.
본 발명은 본원에 기재된 임의의 조성물을 기간에 걸쳐 대상체에게 투여하는 것을 포함하며, 여기서 대상체의 혈관확장은 상기 기간에 걸쳐 유도되는 것인, 혈관확장을 유도하는 방법을 제공한다. 혈관의 혈관확장은 약 1, 2, 3, 5, 10, 20, 50, 또는 100% 이상 증가될 수 있다. 혈관확장은 임의로, 혈관제한을 측정함으로써, 또는 다양한 다른 기술에 의해 측정될 수 있다. 이러한 기술은 침습성 전완 기술, 상완동맥 초음파 기술, 및 맥파 분석을 포함한다. 혈관확장을 측정하는 방법은 [Lind et al., "Evaluation of four different methods to measure endothelium-dependent vasodilation in the human peripheral circulation," Clinical Science 20O2, 1O2, 561-567]에 기재되어 있다.
본 발명은 본원에 기재된 임의의 조성물을 기간에 걸쳐 대상체에게 투여하는 것을 포함하며, 여기서 대상체의 이리신 생산은 상기 기간에 걸쳐 증가하는 것인, 이리신 생산을 증가시키는 방법을 제공한다. 일부 실시양태에서, 이리신 생산 (또는 그의 증거를 제공하는 지표)의 증가는 약 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 125%, 150%, 175%, 200% 이상, 또는 그 초과의 증가이다. 일부 실시양태에서, 이리신 생산 (또는 그의 증거를 제공하는 지표)의 증가는 약 1배, 3배, 5배, 6배, 8배, 10배, 15배, 20배, 50배 이상, 또는 그 초과의 증가이다. 일부 실시양태에서, 이리신 생산의 증가는 FNDC5 발현의 증가 (예를 들어 mRNA 및/또는 단백질 수준으로부터 측정됨)에 의해 증명된다. 일부 실시양태에서, 이리신 생산의 증가는 지방 세포 갈변의 하나 이상의 징후의 증가 (예를 들어 지방산 산화, 및/또는 지방 조직에서 하나 이상의 갈색 지방 선택적 유전자의 발현의 증가)에 의해 증명된다. 갈색 지방 선택적 유전자의 비제한적 예는 Ucp1, Cidea, Prdm16 및 Ndufs를 포함한다. 일부 실시양태에서, 이리신 생산의 증가는 세포로부터 이리신의 증가된 분비 (예를 들어 세포가 배양되는 배지로부터, 또는 대상체에서 순환 혈장으로부터 측정됨)에 의해 증명된다. 유전자 수준의 증가는 직접적으로 (예를 들어 mRNA 또는 단백질 수준의 변화) 또는 간접적으로 (발현 증가와 관련된 효과의 변화, 예컨대 하류 유전자의 증가된 발현) 측정될 수 있다. 유전자 발현 수준의 변화를 검출하는 방법은 관련 기술분야에 공지되어 있고, 비제한적으로, mRNA의 검출 (예를 들어 RT-PCR, 노던 블롯, 및 마이크로어레이 혼성화), 단백질 생상물의 검출 (예를 들어 웨스턴 블롯, 및 ELISA), 번역된 단백질의 하나 이상의 활성의 검출 (예를 들어 효소 활성 검정) 방법을 포함한다.
본 발명은 본원에 기재된 임의의 조성물을 기간에 걸쳐 당뇨병성 대상체, 예를 들어, 제I형 당뇨병, 제II형 당뇨병 및/또는 식이-유발 당뇨병을 갖는 대상체에게 투여하는 것을 포함하는, 대상체를 치료하는 방법을 제공한다. 당뇨병은 감소된 인슐린 수준, 인슐린 저항성 또는 둘 다의 조합을 특징으로 할 수 있다. 일부 실시양태에서, 투여는 대상체에서 당뇨병의 증상을 개선하는데 효과적이다. 예를 들어, 조성물의 투여는 대상체에서 인슐린 감수성을 향상시킬 수 있다. 제I형 당뇨병은 제I형 당뇨병이 없는 대상체와 비교하여 감소된 인슐린 생산을 특징으로 할 수 있다. 본원에 기재된 조성물의 투여는 제I형 당뇨병을 갖는 대상체 (예를 들어, 감소된 인슐린을 가짐)의 대상체에 의해 생산되거나 대상체에게 투여된 인슐린에 대한 감수성을 개선할 수 있다. 제II형 당뇨병은 인슐린에 대한 감소된 감수성을 특징으로 할 수 있다. 따라서, 본원에 기재된 조성물의 투여는 제II형 당뇨병을 갖는 대상체에서 인슐린 감수성을 개선할 수 있다.
당뇨병의 예시적인 증상은 감소된 인슐린 감수성이다. 인슐린 감수성은 관련 기술분야에 공지된 임의의 수단에 의해 결정될 수 있다. 예를 들어, 인슐린 감수성은 일부 경우 인슐린의 볼루스의 투여 후, 기간에 걸쳐, 대상체에서 혈액 글루코스 수준을 측정함으로써 결정될 수 있다. 감소된 인슐린 감수성을 갖는 대상체는 전형적으로 정상 인슐린 감수성을 갖는 대상체와 비교하여 인슐린 투여 후 혈액 글루코스 수준의 감쇠된 강하를 나타낸다. 본원에 기재된 조성물의 투여는 대상체에서 인슐린 감수성을 증가시킬 수 있다. 본원에 기재된 조성물의 투여는 예를 들어 투여 전의 대상체의 인슐린 감수성의 수준과 비교하여 대상체에서 인슐린 감수성을 증가시킬 수 있다. 인슐린 감수성은 조성물의 투여 전의 대상체의 인슐린 감수성의 수준과 비교하여 약 1, 2, 3, 5, 10, 20, 50, 100 또는 200% 이상 증가할 수 있다.
당뇨병의 또 다른 예시적인 증상은 감소된 글루코스 내성이다. 글루코스 내성은 관련 기술분야에 공지된 임의의 수단에 의해 결정될 수 있다. 예를 들어, 글루코스 내성은 글루코스의 볼루스의 투여 후, 일부 경우에 기간에 걸쳐서, 대상체의 혈액 글루코스 수준을 측정함으로써 결정될 수 있다. 감소된 글루코스 내성을 갖는 대상체는 전형적으로 정상 글루코스 내성을 갖는 대상체와 비교하여 혈액으로부터 상승된 혈액 글루코스 수준 및/또는 글루코스의 더 느린 클리어런스를 나타낸다. 본원에 기재된 조성물의 투여는 대상체에서 글루코스 내성을 증가시킬 수 있다. 본원에 기재된 조성물의 투여는 예를 들어 투여 전의 대상체의 글루코스 내성의 수준과 비교하여 대상체에서 글루코스 내성을 증가시킬 수 있다. 글루코스 내성은 예를 들어 투여 전의 대상체의 글루코스 내성의 수준과 비교하여 약 1, 2, 3, 5, 10, 20, 50, 100 또는 200% 이상 증가할 수 있다.
당뇨병의 또 다른 증상은 상승된 식후 또는 공복 혈액 글루코스 수준이다. 혈액 글루코스 수준은 관련 기술분야에 공지된 임의의 수단에 의해 결정될 수 있다. 예를 들어, 혈액 글루코스 수준은 예를 들어 글루코스 모니터에 의해 결정될 수 있다. 상승된 혈액 글루코스는 당뇨병이 없는 대상체 또는 대조 집단의 혈액 글루코스 수준과 비교하여 당뇨병을 갖는 대상체에서의 예를 들어 혈액 글루코스 수준의 증가일 수 있다. 본원에 기재된 조성물의 투여는 대상체에서 혈액 글루코스 수준 (예를 들어, 식후 및/또는 공복 혈액 글루코스)을 감소시킬 수 있다. 본원에 기재된 조성물의 투여는 예를 들어 투여 전의 대상체의 혈액 글루코스의 수준과 비교하여 대상체에서 혈액 글루코스 수준 (예를 들어, 식후 및/또는 공복 혈액 글루코스)을 감소시킬 수 있다. 본원에 기재된 조성물의 투여는 투여 전의 대상체의 혈액 글루코스 수준과 비교하여 혈액 글루코스 수준을 약 1, 2, 3, 5, 10, 20, 50, 60, 70, 80, 90 또는 100% 이상 감소시킬 수 있다. 본원에 기재된 조성물의 투여는 정상 수준, 예를 들어, 당뇨병을 갖지 않는 대조 집단에서 발견되는 수준으로 혈액 글루코스 수준을 감소시킬 수 있다.
당뇨병의 또 다른 증상은 상승된 인슐린 저항성의 항상성 평가 (HOMAIR)이다. HOMAIR은 관련 기술분야에 공지된 임의의 수단에 의해, 예를 들어, 하기 식에 의해 결정될 수 있다: HOMAIR = [인슐린 (uU/mL) X 글루코스 (mM)]/22.5. 본원에 기재된 조성물의 투여는 대상체에서 HOMAIR 수준을 감소시킬 수 있다. 상승된 HOMAIR은 당뇨병이 없는 대상체 또는 대조 집단의 HOMAIR 수준과 비교하여 당뇨병을 갖는 대상체에서의 예를 들어 HOMAIR 수준의 증가일 수 있다. 본원에 기재된 조성물의 투여는 대상체에서 HOMAIR 수준을 감소시킬 수 있다. 본원에 기재된 조성물의 투여는 예를 들어 본원에 기재된 조성물의 투여 전의 대상체의 HOMAIR 수준과 비교하여 대상체에서 HOMAIR 수준을 감소시킬 수 있다. 조성물의 투여는 HOMAIR 수준을 조성물의 투여 전의 대상체의 HOMAIR 수준과 비교하여 약 1, 2, 3, 5, 10, 20, 50, 60, 70, 80, 90 또는 100% 이상 감소시킬 수 있다. HOMAIR 수준은 정상 수준, 예를 들어, 당뇨병을 앓지 않는 대조 집단에서 발견된 수준으로 감소될 수 있다.
당뇨병의 또 다른 증상은 상승된 간 질량이다. 간 질량은 관련 기술분야에 공지된 임의의 수단에 의해, 예를 들어, 영상화에 의해 또는 생검에 의해 추정될 수 있다. 상승된 간 질량은 당뇨병이 없는 대상체 또는 대조 집단의 간 질량과 비교하여 당뇨병을 갖는 대상체에서의 예를 들어 간 질량의 증가일 수 있다. 본원에 기재된 조성물의 투여는 대상체에서 간 질량을 감소시킬 수 있다. 본원에 기재된 조성물의 투여는 예를 들어 본원에 기재된 조성물의 투여 전의 대상체의 간 질량과 비교하여 대상체에서 간 질량을 감소시킬 수 있다. 조성물의 투여는 조성물의 투여 전의 대상체의 간 질량과 비교하여 간 질량을 약 1, 2, 3, 5, 10, 20, 50, 60, 70, 80, 90 또는 100% 이상 감소시킬 수 있다. 조성물의 투여는 정상으로, 예를 들어 당뇨병을 갖지 않는 대조 집단에서 발견된 평균 간 질량으로 대상체의 간 질량을 감소시킬 수 있다.
당뇨병의 또 다른 증상은 상승된 염증이다. 대상체에서 염증은 대상체에서 또는 대상체로부터 획득된 생물학적 샘플에서 관련 기술분야에 공지된 임의의 수단에 의해, 예를 들어, 염증과 관련된 마커의 분석에 의해서 추정될 수 있다. 염증과 관련된 마커는 관련 기술분야에 공지되어 있고, 예를 들어 염증 세포 유형, 단백질 수용체, 염증성 분자 및 염증성 경로에 관련된 다른 지표를 포함한다. 염증과 관련된 예시적인 마커는 시토카인, IL-6, 아디포넥틴, MCP-1 및 C-반응성 단백질 (CRP)을 포함하나, 이에 제한되지는 않는다. 생물학적 샘플은 예를 들어 전혈, 혈장, 혈청, 타액, 객담, 소변, 분변, 피부, 모발 또는 조직 생검일 수 있다. 생물학적 샘플은 관련 기술분야에 공지된 임의의 수단에 의해 획득될 수 있다. 마커는 관련 기술분야에 공지된 임의의 수단에 의해, 예를 들어, 영상화에 의해, 면역형광에 의해, 면역조직화학에 의해, 유전자 발현 분석에 의해, 계내 혼성화에 의해, RNase 보호 검정에 의해, 리포터 검정에 의해, ELISA에 의해 또는 임의의 방법에 의해 검출되고/거나 평가된다. 본원에 기재된 조성물의 투여는 대상체에서 염증을 감소시킬 수 있다. 본원에 기재된 조성물의 투여는 예를 들어 투여 전의 대상체의 염증 수준과 비교하여 대상체에서 염증을 감소시킬 수 있다. 상승된 염증은 당뇨병이 없는 대상체 또는 대조 집단에서의 염증 수준과 비교하여 당뇨병을 갖는 대상체에서의 예를 들어 염증 수준의 증가일 수 있다. 본원에 기재된 조성물의 투여는 투여 전의 대상체에서의 염증 수준과 비교하여 약 1, 2, 3, 5, 10, 20, 50, 60, 70, 80, 90 또는 100% 이상 감소시킬 수 있다. 본원에 기재된 조성물의 투여는 정상 수준으로, 예를 들어, 당뇨병을 앓지 않는 대조 집단에서 발견된 평균 염증 수준으로 대상체에서 염증을 감소시킬 수 있다.
일부 실시양태에서, 인슐린 신호전달을 또한 측정할 수 있다. 인슐린 신호전달은 인비트로겐 라이프 사이언스(Invitrogen Life Science)로부터의 루미넥스 키트(Luminex Kit) "Akt 패스웨이 토탈 7-플렉스 패널(Akt Pathway Total 7-Plex Panel)" (Cat# LHO0002) 및 "Akt 패스웨이 포스포 7-플렉스 패널(Akt Pathway Phospho 7-Plex Panel)" (Cat# LHO0001)을 통해 조직 용해물 중 총 및 인산화 Akt, GSK-3β, IGF-1R, IR, IRS-1, p70S6K 및 PRAS40을 측정함으로써 측정할 수 있다.
일부 실시양태에서, 분지쇄 아미노산 (또는 그의 대사물) 및/또는 선택적 PDE 억제제는 대상체에 대한 메트포르민의 치료 유효 용량을 감소시키는 양으로 투여된다. 일부 실시양태에서, 메트포르민의 치료 유효 용량은 약 50%, 60%, 70%, 80%, 90%, 95%, 97.5%, 99.9%, 99.99% 이상, 또는 그 초과 감소된다. 일부 실시양태에서, 본 발명의 조성물의 투여는 체지방 (예를 들어 내장 지방)을 약 5%, 10%, 15%, 20%, 25%, 50% 이상, 또는 그 초과 감소시킨다.
본원은 또한 본원에 개시된 조성물의 대상체에게의 투여를 포함하는, 대상체에서 미토콘드리아 생물발생을 증가시키는 방법을 제공한다. 본 발명의 다양한 실시양태에서, 조성물은 대상체의 세포 내에서 미토콘드리아 생물발생을 증가시키기에 충분한 상승작용량의 선택적 PDE 억제제를 전달하는 양으로 대상체에게 투여된다. 또 다른 실시양태는 대상체의 세포 내에서 미토콘드리아 생물발생을 증가시키기에 충분한 양으로 대상체에게 상승작용량의 류신 및 PDE 억제제 (예를 들어, PDE-5 억제제)를 포함하는 조성물을 투여하는 것을 제공한다. 또 다른 실시양태는 대상체에서 미토콘드리아 생물발생을 증가시키기에 충분한 양으로 대상체에게 상승작용량의 류신, PDE 억제제 (예를 들어, PDE-5 억제제) 및 레스베라트롤을 포함하는 조성물을 투여하는 것을 제공한다. 미토콘드리아 생물발생 및 지방 산화는 근육 세포 및 지방세포를 비롯한 다양한 세포에서 유도될 수 있다.
본 발명의 또 다른 측면은 본원에 개시된 조성물의 투여를 포함하는, 대상체에서 체중 증가를 감소시키거나 지방 부피를 감소시키는 방법을 제공한다. 체중은 보정된 척도로 측정할 수 있고 신장은 벽에 설치된 스타디오미터로 측정할 수 있고, 체질량 지수는 표준 식 (kg/m2)을 통해 계산할 수 있다. 지방 질량은 기준선, 및 12 및 24주에서 이중 에너지 X선 흡수계측법을 통해 평가될 수 있다. 루나 프로디지(LUNAR Prodigy) 이중 에너지 X선 흡수계측법 시스템 (GE 헬스케어(GE Healthcare), 미국 위스콘신주 매디슨 소재), 또는 관련 기술분야에 공지된 임의의 다른 X선 흡수계측법 시스템을 유지하고 사용을 위해 보정할 수 있다. 스파인 팬텀(spine phantom)을 매일 평가하여 기계 중의 임의의 추이(drift)가 일어나는지를 결정한 후, 1일 보정 블록을 평가하였다.
본 발명의 이러한 측면에서, 조성물은 대상체에서 체중 증가를 감소시키기에 충분한 류신, HMB 및 레스베라트롤 중 하나 이상과 조합으로 선택적 PDE 억제제의 상승작용량을 전달하는 양으로 대상체에게 투여된다.
SIRT1 및 SIRT3 활성을 증가시키는 본원에 개시된 조성물의 투여는 지방세포 또는 그의 근육, 예를 들어, 골격근, 평활근 또는 심근 또는 그의 근육 세포 중 하나 이상의 대사 활성화가 필요한 임의의 대상체에 유용할 수 있다. 대상체는 악액질 또는 근육 소모를 갖는 대상체일 수 있다. SIRT3 활성의 증가는 또한, 예를 들어, 저체온 대상체에서 체온을 증가 또는 유지하기 위해 사용될 수 있고, Sirt1 활성의 증가는 대상체에서 당뇨병 (제2형 당뇨병) 및 손상된 글루코스 내성을 치료하고 염증 반응을 감소시키기에 유익하다.
SIRT3 활성의 증가는 또한 심혈관 질환의 치료 또는 예방, 혈관확장에 의한 혈압 저하, 심혈관 건강의 증가, 및 혈관 조직, 예를 들어, 혈관 및 동맥 (예를 들어 평활근에 작용함으로써)의 수축 기능을 증가시키는데 사용할 수 있다. 일반적으로, SIRT3의 활성화는 지방세포 또는 임의의 유형의 근육, 예를 들어, 소화관 또는 소화기 계통, 또는 요로의 근육의 대사를 자극하는데 사용할 수 있고 그로 인해 장 운동성, 예를 들어, 변비, 및 실금을 제어하는데 사용할 수 있다. SIRT3 활성화는 또한 발기 부전에 유용할 수 있다. 이는 또한, 예를 들어, 정자 운동성을 자극하는데 사용할 수 있고, 임신 촉진제로서 사용될 수 있다. SIRT3을 증가시키기에 유용할 것인 다른 실시양태는 예컨대 수술 또는 사고 후 근육의 회복, 근육 질량의 증가; 및 운동 능력의 증가를 포함한다.
따라서 본 발명은 하나 이상의 근육 세포를 세포에서 단백질 또는 SIRT3의 활성 수준을 증가시키는 작용제와 접촉시킴으로써 유익한 효과가 초래되는 방법을 제공한다. 이들 방법은 다음 중 하나 이상을 효과적으로 용이하게 하거나, 증가시키거나, 자극한다: 근육 세포에서 칼로리 제한 또는 운동의 이익의 모방, 미토콘드리아 생물발생 또는 대사의 증가, 미토콘드리아 활성 및/또는 근육 세포의 지구력의 증가, 글루코스 흡수로의 근육 세포의 감작, 근육 세포에서 지방산화 증가, 근육 세포에서 활성 산소 종 (ROS)의 감소, 근육 세포에서 PGC-1α 및/또는 UCP3 및/또는 GLUT4 발현의 증가, 및 근육 세포에서 AMP 활성화 단백질 키나제 (AMPK)의 활성화. 다양한 유형의 근육 세포가 본 발명에 따라 접촉될 수 있다. 일부 실시양태에서, 근육 세포는 골격근 세포이다. 특정 실시양태에서, 근육 세포는 지근의 세포, 예컨대 가자미근 세포이다.
안정 대사율(RMR)/기질 산화는 센서메딕스(SensorMedics) Vmax 29n 대사 카트 (센서 메딕스(Sensor Medics), 미국 캘리포니아주 애너하임 소재)를 이용하여 12시간 단식 및 48시간 운동 삼가 후 6 AM 내지 10 AM 시간 사이의 개방 회로 기술을 사용하여 간접 열량 측정법에 의해 측정한다. 배뇨 후, 참가자는 온도 제어된 (21-24℃) 환경으로 격리된 방에서 30분 동안 조용히 휴식한다. 그 다음 대상체를, 정상 상태가 달성될 때까지 환기 후드에 최소 30분 동안 위치시킨다. 유효 측정의 기준은 정상 상태의 최소한의 15분일 수 있고, 여기서 정상 상태는 분시 환기량 및 산소 소비에서 10% 미만의 변동 및 호흡률에서의 5% 미만의 변동으로서 결정된다. 대사율은 위어(Weir) 식을 사용하여 계산하고, RQ는 CO2 생성/O2 소비로서 계산하고, 기질 산화는 요 질소 손실에 대한 보정 후 RQ로부터 계산한다.
글루코스 흡수는 생체내 또는 시험관내 기술을 사용하여 측정할 수 있다. 예를 들어, 글루코스 흡수는 표지된 글루코스 또는 글루코스 유사체와 함께 PET 스캔을 사용하여 생체내에서 측정할 수 있다. 글루코스 흡수의 측정은 PET 스캔으로부터 또는 관련 기술분야에 공지된 임의의 다른 방법에 의해 정량화될 수 있다. 일부 실시양태에서, 글루코스 흡수는 PET를 통해 외인성으로 투여된 18-F-데옥시글루코스 흡수의 정량화에 의해 측정할 수 있다.
ROS/산화성 스트레스는 EDTA-처리 관으로 채혈하고, 원심분리하여 혈장을 분리하고, 개별 검정을 위해 샘플을 분취함으로써 측정할 수 있다. 혈장은 질소하에 -80℃에서 유지하여 측정 이전의 산화적 변화를 저지할 수 있다. 혈장 말론알데히드 (MDA)는 형광측정 검정을 사용하여 측정할 수 있고, 혈장 8-이소프로스탄 F2α는 ELISA (어세이 디자인스, 미국 미시간주 앤 아버 소재)에 의해 측정하였다.
또 다른 실시양태는 대상체의 세포 내에서 지방산 산화를 증가시키기에 충분한 양으로 대상체에게 상승작용량의 류신 및 레스베라트롤을 포함하는 조성물을 투여하는 것을 제공한다. 또 다른 실시양태는 대상체에서 지방산 산화를 증가시키기에 충분한 양으로 대상체에게 상승작용량의 류신, HMB 및 레스베라트롤을 포함하는 조성물을 투여하는 것을 제공한다. 류신은 유리 아미노산 형태일 수 있다.
조성물은 대상체에게 경구 또는 임의의 다른 방법에 의해 투여될 수 있다. 경구 투여의 방법은 조성물을 식이 보충제 또는 식료품의 형태로 취해질 수 있는, 액체, 고체, 또는 반고체로서 투여하는 것을 포함한다.
조성물은 주기적으로 투여될 수 있다. 예를 들어, 조성물은 1일 1, 2, 3, 4회, 또는 더 빈번히 투여될 수 있다. 대상체는 1, 2, 3, 4, 5, 6 또는 7일 마다 투여받을 수 있다. 일부 실시양태에서, 조성물은 1일 3회 투여된다. 투여는 대상체의 식사 시간과 동시에 이루어질 수 있다. 치료 또는 식이 보충의 주기는 약 1, 2, 3, 4, 5, 6, 7, 8 또는 9일, 1주 이상, 2주 이상, 6주 이상, 1-11개월 이상, 또는 1년 이상, 2년 이상, 5년 이상 동안일 수 있다. 본 발명의 일부 실시양태에서, 대상체에게 투여되는 투여량은 치료의 기간에 걸쳐 변화되거나 일정하게 유지될 수 있다. 예를 들어, 1일 투여량은 투여의 기간에 걸쳐 증가되거나 감소될 수 있다.
유익한 효과가 유지되도록, 조성물은 장기간에 걸쳐 치료상 유효할 수 있다. 유익한 효과는 적어도 약 4, 6, 8, 10 또는 12주, 또는 적어도 약 4, 6, 12, 24, 48 또는 72개월의 기간 동안 본원에 기재된 조성물의 투여에 의해 유지될 수 있다.
본원에 기재된 바와 같이, 조성물은 대상체가 조성물의 선택된 총 1일 용량을 투여받도록 투여되도록 대상체에 투여될 수 있다. 예를 들어, 조성물의 총 1일 용량은 약 0.05, 0.1, 0.5, 1, 2, 5, 10, 20, 40, 60, 80 또는 100 mg의 실데나필을 포함할 수 있다.
일부 실시양태에서, 본원에 기재된 바와 같이, 조성물의 선택된 용량은 대상체가 조성물의 원하는 순환 수준을 달성하도록 대상체에 투여될 수 있다. 예를 들어, 조성물의 원하는 순환 수준은 약 0.1, 0.5, 1, 2, 5, 10 nM 이상의 실데나필일 수 있고, 조성물의 원하는 순환 수준은 적어도 약 0.25, 0.5, 0.75, 1 mM 이상의 류신일 수 있다. 선택된 용량은 대상체의 특성, 예컨대 체중, 신장, 민족성 또는 유전적 특성을 기준으로 선택될 수 있다.
또 다른 측면에서, 본 발명은 본원에 기재된 조성물, 예컨대 선택적 PDE 억제제를 포함하는 조성물을 에너지 대사의 증가를 필요로 하는 대상체에 대상체의 에너지 대사가 증가하는 기간 동안 투여하는 것을 포함하는, 대상체에서 에너지 대사를 증가시키는 방법을 제공한다. 본 발명은 또한 본원에 기재된 조성물을 기간에 걸쳐 하루에 적어도 2회 투여하는 것을 포함하며, 여기서 대상체에서의 지방 산화는 상기 기간 이전의 대상체에서의 지방 산화와 비교하여 상기 기간에 걸쳐 증가하는 것인, 지방 산화의 향상을 필요로 하는 대상체에서 지방 산화를 향상시키는 방법을 제공한다. 대상체의 에너지 대사는 대상체의 에너지 대사가 증가하는지를 결정하기 위해 치료 이전 및 치료 이후에 측정될 수 있다. 대안적으로, 대상체는 시험 및 대조군으로 풀링될 수 있으며, 에너지 대사의 증가는 두 군 사이에서 측정된다.
투여 기간의 길이 및/또는 투여량은 의사, 영양학자, 또는 임의의 다른 유형의 임상의에 의해 결정될 수 있다. 기간은 1, 2, 3, 4주 이상일 수 있다. 대안적으로, 기간은 1, 2, 3, 4, 5, 6개월 이상일 수 있다.
또 다른 측면에서, 본 발명은 본원에 기재된 조성물을 선택된 투여 수준으로 투여하는 것을 포함하며, 여기서 선택된 투여 수준은 대상체에서 약 0.5 mM 류신 및 약 1 nM 실데나필의 순환 수준을 유도하는 것인, 대상체에서 에너지 대사를 증가시키는 방법을 제공한다. 투여 수준은 대상체의 특성, 예컨대 체중, 신장, 민족성, 유전적 특성 또는 기준선 에너지 대사 수준을 기준으로 조절될 수 있다.
의사, 영양학자 또는 임상의는 투여된 조성물에 대한 대상체의 반응을 관찰하고 대상체의 행동 또는 류신, PDE 5 억제제 또는 조성물의 임의의 다른 성분의 측정된 순환 수준을 기준으로 투여를 조절할 수 있다. 예를 들어, 투여 수준은 원하는 표적 수준 미만의 PDE 5 억제제 또는 류신의 에너지 조절 또는 순환 수준에서의 감소된 효과를 나타내는 대상체에 대해 증가될 수 있다.
일부 실시양태에서, 대상체에게 투여된 조성물은 주어진 대상체에 대해 최적화할 수 있다. 예를 들어, 선택적 PDE 억제제에 대한 분지쇄 아미노산의 비 또는 조합 조성물 중 특정한 성분은 조절될 수 있다. 비 및/또는 특정한 성분은 선택적 PDE 억제제에 대한 분지쇄 아미노산의 다양한 비 또는 다양한 조합 조성물 성분을 갖는 하나 이상의 조성물이 투여된 후의 대상체의 평가 후에 선택될 수 있다
일부 실시양태에서, 본원에 기재된 방법은 본 발명의 조성물을 단독으로 투여하는 것을 포함한다. 그러나, 본원에 기재된 임의의 방법은 조합 요법을 포함할 수 있다. 조합 요법은 본원에 기재된 조성물 (예를 들어, 분지쇄 아미노산 또는 그의 대사물 및 PDE 억제제를 포함하는 조성물)을 추가의 치료제와 조합으로 투여하는 것을 포함할 수 있다. 추가의 치료제는 예를 들어 당뇨병의 치료를 위한 치료제일 수 있다. 본원에 사용된 용어 "공-투여", "조합으로 투여된" 및 그의 문법적 등가물은 단일 대상체에 본 발명 조성물 및 추가의 치료제의 투여를 포함하도록 의도되고, 조성물 및 추가의 치료제가 동일하거나 상이한 투여 경로에 의해 또는 동일하거나 상이한 시점에 투여된 치료 요법을 포함하도록 의도한다. 일부 실시양태에서 본원에 기재된 조성물은 하나 이상의 추가의 치료제와 공-투여된다. 이러한 용어는 본 발명의 조성물, 추가의 치료제 및/또는 그의 대사물의 활성 성분이 동시에 대상체에 존재하도록 대상체에 본 발명의 조성물 및 추가의 치료제를 투여하는 것을 포함한다. 이는 개별 조성물로의 동시 투여, 개별 조성물로의 상이한 시간에서의 투여, 및/또는 PDE 억제제, 분지쇄 아미노산 및 추가의 치료제가 존재하는 단일 조성물로의 투여를 포함한다. 따라서, 일부 실시양태에서, PDE 억제제, 분지쇄 아미노산 및 추가의 치료제는 단일 조성물로 투여된다. 일부 실시양태, PDE 억제제, 분지쇄 아미노산 및 추가의 치료제는 단일 조성물 중에서 혼합된다. 예시적인 추가의 치료제는 본원에 기재되어 있다.
일부 실시양태에서, 추가의 치료제는 비구아니드이다. 일부 경우에서, 비구아니드는 혈액 및/또는 혈장 글루코스 수준을 감소시킨다. 비구아니드의 예는 메트포르민, 부포르민, 펜포르민, 프로구아닐 등을 포함하나, 이에 제한되지는 않는다.
일부 실시양태에서, 추가의 치료제는 인크레틴 모방체이다. 일부 실시양태에서, 인크레틴 모방체는 식품의 섭취에 대한 췌장 반응을 증대시킨다. 일부 경우에, 본원에 기재된 임의의 화합물과 조합된 인크레틴 모방체의 투여는 혈액 및/또는 혈장 글루코스 수준을 낮춘다. 인크레틴 모방체의 예는 엑세나티드 (바이에타(Byetta)®)를 포함하고 이에 제한되지는 않는다. 당뇨병의 치료를 위한 현재 사용되는 요법은 엑세나티드 (바이에타®)의 피하 주사이다.
일부 실시양태에서, 추가의 치료제는 티아졸리딘디온이다. 일부 경우 티아졸리딘디온은 인슐린 저항성을 반전시키고 혈액 및/또는 혈장 글루코스 수준을 낮춘다. 티아졸리딘디온의 예는 로시글리타존(Rosiglitazone) (아반디아(Avandia)), 피오글리타존(Pioglitazone) (악토스(Actos)), 트로글리타존(Troglitazone) (레줄린(Rezulin)), MCC-555, 리보글리타존, 시글리타존 등을 포함하고 이에 제한되지는 않는다.
일부 실시양태에서, 추가의 치료제는 장내분비 펩티드이다. 일부 실시양태에서, 장내분비 펩티드는 인슐린 저항성을 반전시키고 혈액 및/또는 혈장 글루코스 수준을 낮춘다. 추가의 치료제로서 투여된 장내분비 펩티드의 예는 GLP-1 또는 GLP-1 유사체, 예컨대 타스포글루티드(Taspoglutide)® (입센(Ipsen)) 등을 포함하고 이에 제한되지는 않는다.
구체적 실시양태에서, 추가의 치료제는 L-세포 장내분비 펩티드의 분해를 억제한다. 특정 실시양태에서, 추가의 치료제는 DPP-IV 억제제이다. 본원에 기재된 방법으로 사용하기에 적합한 DPP-IV 억제제는 (2S)-1-{2-[(3-히드록시-1-아다만틸)아미노]아세틸}피롤리딘-2-카르보니트릴 (빌다글립틴), (3R)-3-아미노-1-[9-(트리플루오로메틸)-1,4,7,8-테트라아자비시클로[4.3.0]노나-6,8-디엔-4-일]-4-(2,4,5-트리플루오로페닐)부탄-1-온 (시타글립틴), (1S,3S,5S)-2-[(2S)-2-아미노-2-(3-히드록시-1-아다만틸)아세틸]-2-아자비시클로[3.1.0]헥산-3-카르보니트릴 (삭사글립틴) 및 2-({6-[(3R)-3-아미노피페리딘-1-일]-3-메틸-2,4-디옥소-3,4-디히드로피리미딘-1(2H)-일}메틸)벤조니트릴 (알로글립틴)을 포함하고 이에 제한되지는 않는다. 당뇨병의 치료를 위한 현재 표준 치료인 또 다른 요법은 메트포르민 또는 메트포르민 및 시타글립틴의 조합 (자누메트(Janumet)®)이다.
일부 실시양태에서, 화합물의 특정한 선택은 담당의의 진단, 및 개체의 상태 및 적절한 치료 프로토콜에 관한 담당의의 판단에 따라 달라진다. 화합물은 임의로 질환, 장애 또는 상태의 특성, 개체의 상태, 및 사용된 화합물의 실제 선택에 따라, 공동으로 (예를 들어, 동시에, 본질적으로 동시에, 또는 동일한 치료 프로토콜 내에), 또는 순차적으로 투여된다. 특정 경우에서, 치료 프로토콜 동안의 각각의 치료제의 투여 순서 및 투여 반복 횟수는 치료할 질환 및 개체의 상태의 평가를 기초로 하여 결정된다.
일부 실시양태에서, 약물이 치료 조합물로 사용되는 경우에 치료 유효 투여량은 다양하다. 조합 치료 요법에 사용하기 위한 약물 및 다른 작용제의 치료 유효 투여량을 실험적으로 결정하는 방법은 문헌에 기재되어 있다.
본원에 기재된 조합 요법의 일부 실시양태에서, 공-투여되는 화합물의 투여량은 이용되는 공-약물의 유형, 이용되는 특정 약물, 치료할 질환 또는 상태 등에 따라 달라진다. 또한, 하나 이상의 생물학적 활성제와 공-투여되는 경우에, 본원에 제공된 화합물은 생물학적 활성제(들)와 동시에 또는 순차적으로 임의로 투여된다. 특정 경우에서, 순차적으로 투여되는 경우에, 담당의는 추가의 치료제와 조합되는 본원에 기재된 치료 화합물의 적절한 순서를 결정할 것이다.
다중 치료제는 임의의 순서로 또는 심지어 동시에 임의로 투여된다. 동시인 경우에, 치료제는 임의로 단일, 일체 형태로 또는 다수의 형태로 (단지 예를 들어, 단일 환제로서 또는 2개의 별개의 환제로서) 제공된다. 특정 경우에서, 치료제 중 하나는 다중 용량으로 임의로 제공된다. 다른 경우에서, 둘 다는 다중 용량으로 임의로 제공된다. 동시가 아닌 경우에, 다중 용량들 사이의 시점은 임의의 적합한 시점, 예를 들어 0주 초과 내지 4주 미만이다. 또한, 조합 방법, 조성물 및 제제는 2종의 제제만을 사용하는 것으로 제한되지 않으며; 다수의 치료제 조합 (본원에 기재된 2종 이상의 화합물 포함)울 사용하는 것도 고려될 수 있다.
특정 실시양태에서, 완화가 요구되는 상태(들)를 치료하거나, 예방하거나, 또는 호전시키기 위한 투여 요법은 다양한 인자에 따라 변형된다. 이러한 인자는 대상체가 앓고 있는 장애 뿐만 아니라, 대상체의 연령, 체중, 성별, 식이 및 의학적 상태를 포함한다. 따라서, 다양한 실시양태에서, 실제로 이용되는 투여 요법은 다양하며, 본원에 기재된 투여 요법과 편차가 있다.
일부 실시양태에서, 본원에 개시된 조합 요법을 구성하는 제약 작용제는 조합된 투여 형태 또는 실질적으로 동시 투여를 위해 의도된 별개의 투여 형태로 제공된다. 특정 실시양태에서, 조합 요법을 구성하는 제약 작용제는 2단계 투여를 필요로 하는 요법에 의해 투여될 치료 화합물과 순차적으로 투여된다. 일부 실시양태에서, 2단계 투여 요법은 활성제들의 순차적 투여 또는 별개의 활성제들의 간격을 둔 투여를 필요로 한다. 특정 실시양태에서, 다중 용량 단계들 사이의 기간은 각각의 제약 작용제의 특성, 예컨대 제약 작용제의 효력, 용해도, 생체이용률, 혈장 반감기 및 동역학적 프로파일에 따라, 비제한적인 예로서, 몇분 내지 수시간 범위에서 변동한다.
일부 실시양태에서, 본원의 방법은 본원에 기재된 조성물의 투여 및 신체적 활동 요법을 포함한다. 신체적 활동 요법은 운동 요법일 수 있다. 신체적 활동 요법은 예를 들어 보호자에 의해 대상체에게 권고될 수 있거나, 대상체의 자체 주도 하에 대상체에 의해 수행될 수 있다. 신체적 활동 요법은, 단지 일례로서, 워킹, 파워 워킹, 하이킹, 백패킹, 러닝, 조깅, 프리러닝, 파쿠르, 바이킹, 수영, 산책, 트레드밀링, 스피닝, 로잉, 요가, 줌바, 역도, 댄싱, 체조, 무도, 육상 활동, 운동 경기, 스포츠, 예컨대, 예를 들어, 축구, 야구, 소프트볼, 크리켓, 킥볼, 피구, 축구, 농구, 하키, 빙상 스케이팅, 롤러스케이팅, 롤러블레이딩, 스케이트보딩, 써핑, 볼링, 스킹, 폴로, 워터 폴로, 라크로스, 스노우보딩, 럭비, 레슬링, 복싱, 에어로빅, 양궁, 펜싱, 배드민턴, 테니스, 탁구, 스쿼시, 다이빙, 프리스비, 극한 프리스비, 등반, 예를 들어, 암벽 등반, 당구, 승마, 골프, 오리엔티어링, 서커스 예술, 예컨대, 예를 들어, 트램폴리닝, 공중 그네, 비틀기, 져글링, 에어리얼 패브릭 등을 비롯한 임의의 종류의 신체 활동 또는 운동의 1회 이상의 에피소드 또는 시합을 포함할 수 있다. 1회의 에피소드 또는 시합은 예를 들어, 1-10분, 5-20분, 15-30분, 30-60분 (1시간), 2시간, 4시간, 8시간, 12시간, 24시간, 또는 24시간 초과의 시간 길이 동안 수행될 수 있다. 신체적 활동의 시합은 30분 이하일 수 있다. 대상체는 매달, 매주 1회 시합, 매주 2회, 매주 3회 이상의 시합, 1일 1회, 1일 2회, 또는 1일 2회 초과의 시합의 신체 활동에 관여할 수 있다. 신체적 활동 요법은, 단지 일례로서, 매일 1회 시합의 신체적 활동을 포함할 수 있으며, 여기서 1회 시합의 신체적 활동은 예를 들어 20분 동안 행한다. 신체적 활동 요법과 조합된 본원에 기재된 조성물의 투여는 대상체에 대한 상승작용적 유익한 효과, 예를 들어, 상승작용적 치료 효과를 가질 수 있다.
본원에 기재된 조성물, 예컨대 조합 조성물의 대상체에의 투여는, 대상체의 에너지 대사의 조절 또는 유지를 가능하게 할 수 있다. 에너지 대사의 조절 또는 유지는 대상체가 다수의 유익한 효과를 경험하는 것을 가능하게 할 수 있다. 이러한 유익한 효과는 체중의 감소, 지방 조직의 감소, 지방산 산화의 증가, 인슐린 감수성의 증가, 산화성 스트레스의 감소 및/또는 염증의 감소를 포함한다. 치료전의 기준선과 비교하여, 이러한 효과는 약 5, 10, 15, 20, 30, 40, 50, 75, 100, 125, 150, 200, 250, 300, 400 또는 500% 이상의 개선을 일으킬 수 있다. 대안적으로, 본원에 기재된 조성물의 투여는 대상체의 체중, 지방 조직의 양, 지방산 산화의 양, 인슐린 감수성의 수준, 산화성 스트레스 수준, 및/또는 염증의 수준을 유지하는 것을 가능하게 할 수 있다. 이러한 양 및/또는 수준은 투여의 개시에서의 양 및/또는 수준의 0, 1, 5, 또는 10% 이내로 유지될 수 있다.
본 발명의 또 다른 측면은 본원에 기재된 조합 조성물을 명시된 기간 동안 투여 후 하나 이상의 대상체에서 원하는 효과를 달성하는 것을 제공한다.
조성물의 6주의 투여 기간 후, (a) PDE 5 억제제의 투여 수준 및 HMB의 투여 수준 또는 (b) PDE 억제제, 예를 들어, PDE 5 억제제의 투여 수준 및 류신 (예를 들어, 유리 류신)의 투여 수준을 포함하는 조합 조성물은 하나 이상의 대상체에서 체중 증가를 적어도 약 10, 15, 20, 또는 20.5% 감소시킬 수 있다. p-값은 0.05 미만 (예를 들어 약 0.05, 0.03, 0.02, 0.01, 0.001, 0.0001 미만, 또는 그 미만)일 수 있다. 성분 (실데나필, 이카리인, 레스베라트롤, 류신 또는 HMB) 중 하나의 동일 투여 수준으로 치료된 하나 이상의 대상체는 미미한 체중 감소, 또는 약 0, 5, 또는 10% 미만의 체중 감소를 가질 수 있다.
2주의 투여 기간 후, (a) PDE 억제제, 예를 들어, PDE 5 억제제의 투여 수준 및 HMB의 투여 수준 또는 (b) 레스베라트롤의 투여 수준 및 류신 (예를 들어, 유리 류신)의 투여 수준을 포함하는 조성물은 하나 이상의 대상체에서 전신 지방 산화를 적어도 약 10, 15, 또는 20% 증가시킬 수 있다. p-값은 0.05 미만 (예를 들어 약 0.05, 0.03, 0.02, 0.01, 0.001, 0.0001 미만, 또는 그 미만)일 수 있다. 전신 지방 산화의 증가는, 대상체에게 조성물이 투여되는 동안, 또는 적어도 2, 4, 6, 10, 13, 26, 또는 52주의 기간 동안, 지속될 수 있다. 성분 (실데나필, 이카리인, 레스베라트롤, 류신 또는 HMB) 중 하나의 동일 투여 수준으로 치료된 하나 이상의 대상체는 전신 지방 산화의 미미한 증가, 또는 약 0, 5, 또는 10% 미만의 전신 지방 산화의 증가를 가질 수 있다.
2주의 투여 기간 후, (a) PDE 억제제, 예를 들어, PDE 5 억제제의 투여 수준 및 HMB의 투여 수준 또는 (b) 레스베라트롤의 투여 수준 및 류신 (예를 들어, 유리 류신)의 투여 수준을 포함하는 조성물은 하나 이상의 대상체에서 음식물의 발열 효과를 적어도 약 10, 15, 17, 또는 20% 증가시킬 수 있다. p-값은 0.05 미만 (예를 들어 약 0.05, 0.03, 0.02, 0.01, 0.001, 0.0001 미만, 또는 그 미만)일 수 있다. 음식물의 발열 효과의 증가는, 대상체에게 조성물이 투여되는 동안, 또는 적어도 2, 4, 6, 10, 13, 26, 또는 52주의 기간 동안, 지속될 수 있다. 성분 (실데나필, 이카리인, 레스베라트롤, 류신 또는 HMB) 중 하나의 동일 투여 수준으로 치료된 하나 이상의 대상체는 음식물의 발열 효과의 미미한 증가, 또는 약 0, 5, 또는 10% 미만의 음식물의 발열 효과의 증가를 가질 수 있다.
2주의 투여 기간 후, (a) PDE 억제제, 예를 들어, PDE 5 억제제의 투여 수준 및 HMB의 투여 수준 또는 (b) PDE 억제제, 예를 들어, PDE 5 억제제의 투여 수준 및 류신 (예를 들어, 유리 류신)의 투여 수준을 포함하는 조성물은 하나 이상의 대상체에서 총 에너지 소비량을 적어도 약 10, 15, 17, 또는 20% 증가시킬 수 있다. p-값은 0.05 미만 (예를 들어 약 0.05, 0.03, 0.02, 0.01, 0.001, 0.0001 미만, 또는 그 미만)일 수 있다. 총 에너지 소비량의 증가는, 대상체에게 조성물이 투여되는 동안, 또는 적어도 2, 4, 6, 10, 13, 26, 또는 52주의 기간 동안, 지속될 수 있다. 성분 (실데나필, 이카리인, 레스베라트롤, 류신 또는 HMB) 중 하나의 동일 투여 수준으로 치료된 하나 이상의 대상체는 총 에너지 소비량의 미미한 증가, 또는 약 0, 5, 또는 10% 미만의 총 에너지 소비량의 증가를 가질 수 있다.
본원에 기재된 조성물, 예컨대 조합 조성물의 대상체에의 투여는, 대상체의 에너지 대사의 조절 또는 유지를 가능하게 할 수 있다. 에너지 대사의 조절 또는 유지는 대상체가 다수의 유익한 효과를 경험하는 것을 가능하게 할 수 있다. 이들 유익한 효과는 체중의 감소, 지방 조직의 감소, 지방산화의 증가, 지방 조직의 갈변의 증가 (지방 세포 갈변의 하나 이상의 징후에 의해 나타내어짐), 인슐린 감수성의 증가, 산화성 스트레스의 감소, 및/또는 염증의 감소를 포함한다. 치료 이전의 기준선과 비교하여, 이러한 효과는 약 5%, 10%, 15%, 20%, 30%, 40%, 50%, 75% 이상, 또는 그 초과의 개선을 초래할 수 있다. 일부 실시양태에서, 치료 이전의 기준선과 비교하여, 이러한 효과는 약 100%, 125%, 150%, 200%, 250%, 300%, 400%, 500% 이상, 또는 그 초과의 개선을 초래할 수 있다. 대안적으로, 본원에 기재된 조성물의 투여는 대상체의 체중, 지방 조직의 양, 지방산 산화의 양, 인슐린 감수성의 수준, 산화성 스트레스 수준, 및/또는 염증의 수준을 유지하는 것을 가능하게 할 수 있다. 이러한 양 및/또는 수준은 투여의 개시에서의 양 및/또는 수준의 약 0%, 1%, 5%, 또는 10% 이내로 유지될 수 있다
본 발명은 치료받을 수 있는 대상체의 풀을 확인하는 것을 포함하는, 대상체의 치료 방법을 제공한다. 확인 단계는 하나 이상의 선별 시험 또는 검정을 포함할 수 있다. 예를 들어, 당뇨병으로, 인슐린 저항성을 갖는 것으로 확인되거나 평균 초과의 또는 상당히 초과된 평균 체질량 지수 및/또는 체중을 갖는 대상체를 치료를 위해 선택할 수 있다. 확인 단계는 대상체가 치료받을 수 있음을 시사하는, 하나 이상의 유전적 변이체를 확인하는 유전자 검사를 포함할 수 있다. 이어서, 확인된 대상체는 본원에 기재된 하나 이상의 조성물로 치료할 수 있다. 한 실시양태에서, 본 발명은 (a) 비만 또는 당뇨병을 갖고 있거나 또는 그에 걸리기 쉬운 대상체를 확인하고; (b) 제1항 내지 제29항 중 어느 한 항의 조성물을 대상체에게 투여하는 것을 포함하는, 에너지 대사를 조절하는 방법을 제공한다. 예를 들어, 이들은 선택적 PDE 억제제, 예컨대 PDE 5 억제제 및 분지쇄 아미노산을 포함하는 조합 조성물로 치료될 수 있다.
본 발명은 또한 본원에 기재된 조성물의 제조 방법을 제공한다. 일부 실시양태에서, 본원에 기재된 조성물의 제조는 둘 이상의 성분을 혼합하거나 조합하는 것을 포함한다. 이러한 성분은 PDE 5 억제제를 포함하나 이에 제한되지는 않는 선택적 PDE 억제제를 류신 (예를 들어, 유리 류신) 및/또는 류신 대사물과 조합으로 포함할 수 있다. 조성물은 추가적의 시르투인 또는 AMPK 경로 활성화제 (예컨대 레스베라트롤, 클로로겐산, 카페인산, 신남산, 페룰산, EGCG, 피세아타놀 또는 포도씨 추출물과 같은 폴리페놀 또는 폴리페놀 전구체 또는 퀸산 및 푸코잔틴과 같은 또 다른 작용제)를 추가로 포함할 수 있다. 일부 실시양태에서, 시르투인 활성화제는 폴리페놀이다. 다른 실시양태에서, 시르투인 활성화제는 폴리페놀 전구체이다. 성분의 양 또는 비는 본원에 기재된 바와 같은 것일 수 있다.
일부 실시양태에서, 조성물은 PDE-5 억제제, 담체 및/또는 부형제 이외의 제약 활성제와 조합되거나 혼합될 수 있다. 이러한 성분의 예는 본원에 기재되어 있다. 조합된 조성물은 정제, 캡슐, 겔 캡슐, 서방성 정제 등으로서 단위 투여량으로 형성될 수 있다.
일부 실시양태에서, 조성물은, 하나 이상의 성분이 조성물 전체에 걸쳐 골고루 분산되어, 조성물이 동등하게 유효한 단위 투여 형태, 예컨대 정제, 환제 및 캡슐로 용이하게 세분될 수 있도록, 하나 이상의 성분의 실질적으로 균질인 혼합물을 함유하는 고체 조성물이 달성되도록 제조된다.
키트
본 발명은 또한 키트를 제공한다. 키트는 적합한 포장 내에 본원에 기재된 하나 이상의 조성물, 및 사용상의 주의, 임상 연구의 논의, 부작용의 열거 등을 포함할 수 있는 설명서를 포함할 수 있다. 이러한 키트는 또한 정보, 예컨대 학술 참고문헌, 패키지 삽입 물질, 임상 실험 결과 및/또는 그의 요약서 등을 포함할 수 있으며, 이는 조성물의 활성 및/또는 이점을 나타내거나 수립하고/하거나 용량, 투여법, 부작용, 약물 상호작용, 또는 건강 관리자에게 유용한 다른 정보를 기재한다. 이러한 정보는 다양한 연구, 예를 들어 생체내 모델을 수반하는 실험 동물을 사용한 연구 및 인간 임상 실험을 바탕으로 하는 연구의 결과를 기초로 할 수 있다. 키트는 또 다른 작용제를 추가로 함유할 수 있다. 일부 실시양태에서, 본 발명의 화합물 및 작용제는 키트 내에 개별 용기에서 개별 조성물로서 제공된다. 일부 실시양태에서, 본 발명의 화합물 및 작용제는 키트 내의 용기 내에서 단일 조성물로서 제공된다. 적합한 포장 및 사용을 위한 추가의 물품 (예를 들어 액체 제제를 위한 측정 컵, 공기로의 노출을 최소화하기 위한 포일 래핑(wrapping) 등)은 관련 기술분야에 공지되어 있고 키트에 포함될 수 있다. 본원에 기재된 키트는 전문의, 간호사, 약사, 처방전 취급인 등을 비롯한 건강 관리자에게 제공, 판매 및/또는 홍보될 수 있다. 키트는 또한, 일부 실시양태에서, 소비자에게 직접적으로 판매될 수 있다.
일부 실시양태에서, 키트는 단위 투여량의 복수 일 공급물을 포함할 수 있다. 단위 투여량은 본원에 기재된 임의의 단위 투여량일 수 있다. 키트는 복수 일 기간 동안 복수 일 공급물의 투여를 지시하는 지침서를 포함할 수 있다. 복수 일 공급물은 1개월 공급, 30일 공급 또는 여러 주 공급일 수 있다. 복수 일 공급물은 90일, 180일, 3개월 또는 6개월 공급일 수 있다. 키트는 포장된 1일 단위 투여량, 예컨대 1, 2, 3, 4 또는 5 단위 투여량의 패키지를 포함할 수 있다. 키트는 다른 식이 보충제, 비타민, 식사 대체 바, 혼합물, 및 음료와 함께 포장될 수 있다.
일부 실시양태에서, 키트는 착용가능한 활동 모니터를 추가로 포함할 수 있다. 착용가능한 활동 모니터는 신체적 및/또는 보해 활동을 만보계, 가속도계를 통해 모니터링할 수 있다. 예시적인 착용가능한 활동 모니터는 특히, 예를 들어, 핏빗(Fitbit)®, 조본(Jawbone) UP®, 라크라이프(LarkLife)™, 나이키 퓨얼밴드(Nike FuelBand), 스트리브 플레이(Striiv Play), 바디미디어 핏코어(BodyMedia FitCore)를 포함한다. 이러한 착용가능한 활동 모니터는 미국 특허 번호 8,403,845; 8,398,546; 8,382,590; 8,369,936; 8,275,635; 8,157,731; 8,073,707; 7,959,567; 7,689,437; 7,502,643; 7,285,090; 7,261,690; 7,153,262; 7,020,508; 6,605,038; 6,595,929; 6,527,711; 8,562,489; 8,517,896; 8,469,862; 8,408,436; 8,370,549; 8,088,044; 8,088,043, 및 미국 특허 출원 공개 번호 20130158369 및 20130151196에 기재되어 있으며, 이들 전부는 본원에 참조로 포함된다. 이러한 키트는 조성물의 사용 지침서에 더하여 신체적 활동 요법에 관여하기 위한 대상체에 대한 지침서를 추가로 포함할 수 있다. 이러한 키트는 착용가능한 활동 모니터의 사용을 위한 지침서를 추가로 포함할 수 있다. 이러한 키트는 또한 착용가능한 활동 모니터 액세서리, 예컨대, 예를 들어, 충전기 및/또는 활동 모니터에서 컴퓨터 또는 서버로의 데이터 통신을 위한 포트 또는 무선을 포함할 수 있다.
실시예
실시예 1 - 에너지 대사를 조절하기 위한 PDE 1 억제제
PDE 1 억제제인 비노포세틴을 류신, HMB 및 레스베라트롤과 조합하여 에너지 대사에 대한 그의 효과에 대해 시험하였다. 용량-반응은 0.1 nM 이하의 비노포세틴의 농도가 효과를 발휘하지 않음을 나타내었고; 따라서, 이는 본 실험에서 사용된 농도였다. 비노포세틴은 지방 산화 또는 글루코스 활용 어느 하나에 대해 류신 (0.5 mM) 또는 HMB (5 μM)와 상승작용을 나타내지 않았지만, 저용량 레스베라트롤 (200 nM)과는 상승작용 효과를 나타내어, 지방세포에서 글루코스 활용의 70% 증가 (p=0.03)를 결과하였다.
실시예 2 - 에너지 대사를 조절하기 위한 PDE 3 억제제
암리논 및 실로스타미드의 2종의 PDE 3 억제제를 류신 및 HMB와 조합하여 에너지 대사에 대한 그의 효과에 대해 연구하였다. 용량-반응은 어느 PDE 3 억제제에 대해서도 10 nM 이하의 농도가 효과를 발휘하지 않음을 나타내었고; 따라서, PDE 3 억제제에 대해 이 농도를 본 실험에서 사용하였다. 암리논은 류신 또는 HMB와 유의한 상승작용을 발휘하지 않았다. 그러나, 류신 (0.5 mM) 또는 HMB (5 μM)와 실로스타미드의 조합은 근육 세포에서의 지방 산화의 92% 증가 (p<0.05) 및 지방세포에서의 58% 증가 (p<0.05)를 결과하였다. 실로스타미드-HMB 블렌드는 근육 세포에서 글루코스 활용을 202% (p=0.024)만큼, 지방세포에서 83% (p=0.05)만큼 상승작용적으로 증가시켰고, 반면에 실로스타미드-류신 블렌드는 효과를 발휘하지 않았다.
실시예 3 - 에너지 대사를 조절하기 위한 PDE 4 억제제
롤리프람 및 YM796의 2종의 PDE 4 억제제를 류신 및 HMB와 조합하여 에너지 대사에 대한 그의 효과에 대해 연구하였다. 용량-반응은 0.1 nM 이하의 롤리프람 및 YM796의 농도가 효과를 발휘하지 않음을 나타내었고; 따라서, 이는 본 실험에서 사용된 농도였다. 근육 세포에서 지방 산화, 글루코스 활용 또는 AMPK 활성에 대한 롤리프람과 류신, HMB 또는 레스베라트롤의 상승작용 효과는 존재하지 않았으나; 롤리프람은 AMPK 인산화를 활성화시켰고, 이 효과는 류신 또는 HMB의 존재에 의해 증대되지 않았다. 그러나, 지방 산화 상승작용은 지방세포에서, 롤리프람-류신 조합에 반응하여 지방 산화의 125% 증가 (p=0.026) 및 롤리프람-HMB 조합에 반응하여 63% 증가로 입증되었다. 그러나, 글루코스 활용 또는 AMPK 활성화에 대한 상승작용은 발견되지 않았다.
실시예 4 - 에너지 대사를 조절하기 위한 PDE 5 억제제
세포를 실데나필 (1 nM), 이카리인 (1 nM), 류신 (0.5 mM), HMB (5 μM) 및 레스베라트롤 (200 nM)의 조합으로 처리하였다. 0.5 mM 류신으로의 처리는 인간 대상체에 약 1,125 mg의 식이 류신의 투여에 의해 달성되는 동일한 몰농도의 순환 수준에 상응한다. 0.25 mM 류신으로의 처리는 인간 대상체에 약 300 mg의 식이 류신의 투여에 의해 달성되는 동일한 몰농도의 순환 수준에 상응한다. 1 nM 실데나필로의 처리는 인간 대상체에 약 0.2 mg의 식이 실데나필의 투여에 의해 달성되는 동일한 몰농도의 순환 수준에 상응한다. 1 nM 실데나필로의 처리는 인간 대상체에 약 0.1 mg의 식이 실데나필의 투여에 의해 달성되는 동일한 몰농도의 순환 수준에 상응한다.
실데나필 용량-반응 곡선은 1 nM 미만의 농도가 효과를 발휘하지 않는 것을 나타내고; 따라서, 이는 상승작용 실험에 사용된 농도였다. 이는 저용량의 약물 (20 mg)에 반응하여 달성된 최대 혈장 농도 (~100 nM)의 대략 1%이다. 실데나필 단독으로의 C2C12 근관의 처리는 약 50%의, 기준선으로부터의 지방산 산화 변화를 결과하였다. 류신 단독으로의 처리는 지방산 산화를 73% (p<0.05)까지 자극한다. 이 농도의 실데나필은 HMB (203% 증가, p=0.003) 및 류신 (232% 증가, p=0.015) 둘 다와 근관 지방 산화를 자극하는데 유의한 상승작용을 발휘하였지만, 근육 세포에서 레스베라트롤과는 어떤 상호작용도 나타내지 않았다 (도 2 및 도 3).
3T3-L1 지방세포에서, 류신으로의 처리는 지방산 산화를 27% (p<0.05)까지 증가시키고, HMB로의 처리는 지방산 산화를 29% (p<0.05)까지 자극한다. C2C12 세포에서와 같이, 실데나필-류신 및 실데나필-HMB는 지방세포에서의 지방 산화를 각각 137% 및 240%만큼 상승작용적으로 증가시켰다 (p<0.05; 도 4). 실데나필-류신 또는 실데나필-HMB에의 레스베라트롤 (200 nM)의 첨가는 추가의 효과를 발휘하지 않았고, 레스베라트롤의 부재하의 이러한 혼합물과 유의하게 다르지 않았다.
실데나필은 또한 근관 및 지방세포 둘 다에서의 글루코스 활용의 자극에서 류신 및 HMB와 상승작용을 나타내었다. 류신 단독으로의 C2C12 근관의 처리는 글루코스 활용을 9.3%로 증가시킨다. 실데나필-류신 및 실데나필-HMB는 근관 글루코스 활용을 각각 53 및 66%만큼 상승작용적으로 증대시키고 (p=0.04, 도 5), 실데나필은 또한 레스베라트롤과 상승작용을 나타내어 유사한 증대를 생성하였다 (53%, p=0.04). 류신으로의 처리는 3T3-L1 세포에서 글루코스 활용을 48.6% (p<0.05)까지 자극한다. 3T3-L1 지방세포에서, 실데나필-류신은 글루코스 활용을 285% (p=0.05, 도 6)만큼 증가시켰고, HMB 또는 레스베라트롤 어느 것도 실데나필과의 임의의 유의한 상호작용을 발휘하지 않았다.
이카리인은 유의한 PDE 5 억제 활성을 갖는 자연 발생 플라보놀이다. 용량-반응은 1 nM 미만의 이카리인 농도가 효과를 발휘하지 않는 것을 나타내고; 따라서, 이는 상승작용 실험에 사용된 농도였다. 류신 단독으로의 C2C12 근관의 처리는 지방산 산화를 73% (p<0.05)까지 자극한다. 이 농도의 이카리인은 C2C12 근관 지방 산화를 자극하는데 HMB (75% 증가) 및 류신 (77% 증가) 둘 다와 유의한 상승작용을 발휘하였고 (p=0.03, 도 7 및 도 8), 반면에 레스베라트롤은 독립적인 상승작용 효과를 발휘하였다 (157% 증가, p=0.002, 도 8). 유사한 데이터가 지방세포에서 획득되었지만 (p<0.05; 도 9); 이카리인은 글루코스 활용에 대한 유의한 상승작용을 나타내지 않았다.
산화질소 생산에 대해 실데나필 및 이카리인 둘 다와 류신, HMB, 레스베라트롤 및 그의 조합 사이의 유의한 상승작용적 상호작용이 존재하였다. 도 10은 실데나필과 류신, HMB 및 레스베라트롤 사이의 상호작용을 도시하고, 도 11은 이카리인과 류신, HMB 및 레스베라트롤 사이의 상호작용을 도시한다. 류신, HMB 및 레스베라트롤은 각각 저용량 실데나필 (1 nM)과 상호작용하여 산화질소 생산에서 적당한 유의한 증가를 유도하고 (15-30% 증가, p<0.0001), 실데나필, 류신 및 레스베라트롤의 조합은 보다 확고한 반응을 유도하였다 (52% 증가, 다른 모든 치료와 비교하여 p=0.0003, 도 10). 이카리인에서 유사한 효과가 주목되며, 류신, HMB 및 레스베라트롤 각각과 상호작용하여 적당한 유의한 효과 (p<0.0001)를 유도하고, 실데나필, 류신 및 레스베라트롤의 조합에 의해 보다 확고한 효과가 발견되었다 (도 11; p=0.00013).
산화질소는 PGC1α를 조절하고 그에 의해 미토콘드리아 생물발생을 자극하는 것으로 증명되어 있으며; 따라서, 본 발명자들은 미토콘드리아 바이오매스를 측정함으로써, 미토콘드리아 생물발생에 대한 류신, HMB 및 레스베라트롤과의 실데나필 및 이카리인 조합의 효과를 평가하였다. 류신 단독으로 처리한 C2C12 세포는 22.05 +/- 0.4 AFU/μg 단백질, p<0.05의 미토콘드리아 바이오매스를 가지고, 도 12는 류신-실데나필 및 류신-HMB가 미토콘드리아 바이오매스에서 각각 유의한 증가 (p<0.01)를 자극하고, 반면에 이 상호작용에 대한 레스베라트롤의 유의한 효과는 존재하지 않기 때문에, 실데나필 (1 nM)과 류신 또는 HMB 사이의 유의한 상승작용을 증명한다. 유사하게, 이카리인은 미토콘드리아 생물발생을 상향 조절하기 위해 류신 및 HMB 둘 다와 유의한 상승작용을 나타내었고 (p<0.001), 반면에 레스베라트롤은 유의한 상호작용을 나타내지 않았다 (도 13).
산화성 대사의 증대에서 류신/HMB과 실데나필 사이에 관찰된 상승작용은, 최근 보고가 이 약물 부류의 밀접하게 관련된 구성원인 타달라필(Tadalafil) (상표명 시알리스(Cialis))이 동일 세포 시스템 (C2C12 근관)에서 호기성 대사를 억제한다고 보고한 바 있듯이, 자명한 것이 아니다. 그러나, 급성 투여가 효과 없었을지라도, 실데나필의 만성 (12주) 투여는 증가된 에너지 소비, 감소된 체중 및 지방 증가, 및 증가된 인슐린 감수성을 야기하였다. 본 데이터는 발기 기능장애의 치료에 사용된 것보다 실질적으로 더 낮은 농도를 류신 또는 HMB와 조합하는 것이 당뇨병 관리를 위한 유용한 치료 전략일 것임을 제안한다. 실데나필에 대한 대안으로서, 이카리인은 에피미디움(Epimedium) 패밀리 (호니 고트 위드)의 식물에서 발견된 자연 발생 플라보놀이며, 이는 또한 PDE5 억제 활성을 갖고 유사한 효과를 발휘한다.
실시예 5-당혈증 및 인슐린 감수성에 대한 PDE 5 억제제의 생체내 효과
당혈증 및 인슐린 감수성에 대한, 특이적 PDE5 억제 특성을 갖는 플라바놀인 이카리인의 상호작용 효과는 제2형 당뇨병의 뮤린 모델로서 사용될 수 있는 식이-유발 비만 마우스에서 평가되었다.
방법
수컷 C57/BL6 마우스를 6주령에 표준 저-지방 음식 (대조군; 지방으로부터의 10% 에너지) 또는 고지방 (지방으로부터의 60% 에너지, 리서치 다이어츠(Research Diets) #D12492, 미국 뉴저지주 뉴브런즈윅 소재의 리서치 다이어츠, 인크(Research Diets, Inc))에 배치하여 인슐린 저항성을 유도하였다. 고지방 식이 마우스는 저지방 식이 마우스와 비교하여 노출의 6주 후에 글루코스 내성 장애를 나타내었다 (도 14 참조).
이어서, 동물을 그룹당 10마리 동물로, 추가적 6주 동안 하기 식이에 대해 무작위화하였다: 저지방 식이 (LFD) 대조군; 고지방 식이 (HFD) 대조군; HFD+류신 (24 g/kg 식이, 대조군 수준에 비해 2배 증가); HFD+류신 (24 g/kg 식이) +이카리인 (25 mg/kg 식이). 이카리인의 이전 발표된 연구는 선택된 수준 (25 mg/kg 식이; ~4 mg/kg 체중)의 효과를 증명하지 않았다.
마우스는 공복 혈액 글루코스, 인슐린 및 글루코스 내성의 측정 전에 밤새 (~16시간) 단식시켰다. 글루코스 내성을 글루코스 (1.2 g/kg 체중)의 복강내 투여에 이은 15, 30, 60, 90 및 120분에서의 혈액 글루코스 측정을 통한 공복 글루코스의 측정에 따라 결정하였다. 식후 글루코스는 섭식 정지 1시간 내에 측정하였다. 인슐린 내성은 인슐린 내성 검사 (ITT)를 통해 측정하였다. 식품을 ITT 4-6시간 전에 제거하였고, 기준선 혈액 글루코스를 측정하였다. 이어서, 마우스에 인슐린 (1.2 U/kg 체중)을 복강내로 주사하였고 혈액 글루코스 인슐린 주사 15, 30, 60, 90 및 120분 후에 측정하였다. 인슐린 저항성의 항상성 모델 평가 (HOMAIR)는 인슐린 감수성의 변화의 스크리닝 지수로서 사용되었다. HOMAIR은 공복 혈장 인슐린 및 글루코스로부터 다음과 같이 표준 식을 통해 계산하였다: HOMAIR = [인슐린 (uU/mL) X 글루코스 (mM)]/22.5. 혈장 글루코스 및 인슐린 농도는 각각 바이오비전(Biovision) (미국 캘리포니아주 밀피타스 소재)으로부터의 글루코스 어세이 키트(Glucose Assay Kit) 및 밀리포어(Millipore) (미국 매사추세츠주 빌러리카 소재)로부터의 인슐린 키트(Insulin kit)를 사용하여 측정하였다. 혈장 내 CRP 수준은 ELISA (CRP:라이프 다이고노스틱스(Life Diagnostics), 미국 펜실베이니아주 웨스터 체스터 소재)에 의해 결정하였다.
데이터는 1원 분산 분석을 통해 분석하였다; ANOVA가 유의차를 나타낼 때, 평균은 터키(Tukey)의 다중 비교 시험 (그래프패드 프리즘(Graphpad Prism), 버전 6.0)을 통해 분리하였다. 0.05 미만의 p-값은 일반적으로 통계학적으로 유의한 것으로 고려된다.
결과
식후 글루코스는 치료 제7일까지 고지방 식이에 반응하여 현저하게 상승하였다 (도 15). 류신이 글루코스에 대한 독립적 효과를 발휘하지 않더라도, 류신 및 이카리인의 조합은 미치료된 HFD 마우스와 비교하여 치료 7일 후에 식후 글루코스에서 약 10%의 유의한 감소를 유발하였다 (HFD와 비교하여 p<0.01, 도 15). 이 효과는 14일 후에 약 20%로 규모가 증가하였고, HFD 마우스에서 류신-이카리인 조합 치료는 저-지방 식이 마우스에서 관찰된 수준으로 식후 글루코스를 감소시켰다 (HFD와 비교하여 p<0.001, 도 16).
식후 인슐린 또는 순환 인슐린 수준은 치료 14일 후 모든 실험군에서 측정하였다. HFD 마우스는 LFD 마우스와 비교하여 순환 인슐린에서 ~5배 상승을 나타내었다 (도 17). 그러나, 인슐린 단독으로의 HFD 마우스의 14일 치료는 미치료된 HFD 마우스와 비교하여 순환 인슐린을 ~30%만큼 감소시켰다 (도 17). 류신 및 이카리인으로의 HFD 마우스의 14일 치료는 미치료된 HFD 마우스와 비교하여 순환 인슐린 수준을 약 50%만큼 추가로 감소시켰다 (HFD와 비교하여 p<0.01, 도 17).
인슐린 감수성은 치료 14일 후 모든 실험군에서 인슐린 저항성의 항상성 평가 (HOMAIR)를 통해 측정하였다. (HOMAIR= 인슐린 (uU/mL) X 글루코스 (mM)/22.5). HFD 마우스는 LFD 마우스와 비교하여 HOMAIR의 10배 상승을 나타내었다 (도 18). 그러나, 인슐린 단독으로의 HFD 마우스의 14일 치료는 미치료된 HFD 마우스와 비교하여 HOMAIR을 ~40%만큼 감소시켰다 (HFD와 비교하여 p<0.001, 도 18). 류신 및 이카리인으로의 HFD 마우스의 14일 치료는 미치료된 HFD 마우스와 비교하여 HOMAIR 수준을 약 65%만큼 추가로 감소시켰다 (모두와 비교하여 p<0.001, 도 18).
인슐린 감수성은 치료 28일 후 모든 실험군에서 인슐린 내성 시험을 통해 측정하였다. 도 19에 나타난 바와 같이, 류신 및 이카리인의 고지방 식이에의 첨가는 저지방 식이에서 발견되는 것과 대등한 수준으로 인슐린에 대한 반응을 개선하였다. 혈액 글루코스의 최대 감소가 30분에서 발견되었기 때문에, 통계적 분석은 30분에 혈액 글루코스의 변화에 대해 실행하였다 (도 20). 인슐린 내성 검사 30분 시점의 분석은 HFD 마우스 내의 글루코스 클리어런스가 LFD 마우스와 비교하여 약 50%만큼 감소되었음을 나타낸다 (도 20). 그러나, 류신 및 이카리인으로의 HFD 마우스의 치료는 글루코스 클리어런스를, 류신 및 이카리인으로 미치료된 HFD 마우스와 비교하여 2배 변화인 LFD 마우스에서 관찰된 수준으로 완전히 복귀시킨다 (HFD와 비교하여 p<0.02, 도 20). 이 분석은 고지방 식이에 의해 유발된 인슐린에 대한 무딘 반응이 류신-이카리인 조합의 첨가에 의해 완전히 역전되었음을 나타낸다.
글루코스 내성은 치료 5주 후에 모든 실험군에서 평가하였다. 도 21은 치료 5주에 측정된 글루코스 내성 검사로부터의 결과를 도시하고, 글루코스 시험접종에 대한 혈액 글루코스 반응에서 유의한 감소를 보여준다. 곡선하 면적 (AUC) 측정을 도 21의 글루코스 농도 곡선에 대해 실행하여 시간 경과에 따른 글루코스 부하에 대한 적분된 글루코스 반응의 측정 값을 획득하였다. AUC는 LFD 마우스와 비교하여 ~75%만큼 증가하였다 (p<0.01, 도 22). 류신 및 이카리인으로의 HFD 마우스의 치료는 미치료된 HFD 마우스와 비교하여 글루코스 부하를 약 40%만큼 현저하게 감소시켰다 (HFD 마우스와 비교하여 p<0.01, 도 22).
6주 연구 종결 시, 공복 혈액 글루코스 수준, 인슐린 수준, HOMAIR, 간 질량 및 순환 C-반응성 단백질 (염증의 바이오마커)을 모든 실험군에서 평가하였다 (도 23-27). 6주 연구 종결 시 공복 혈액 글루코스의 평가는 HFD 마우스가 LFD 마우스와 비교하여 공복 글루코스에서 ~1배 증가를 나타내었음을 드러내었다 (도 23). 류신 단독으로의 HFD 마우스의 6주 치료는 미치료된 HFD 마우스와 비교하여 공복 글루코스를 ~20%만큼 감소시켰다 (도 23). 류신 + 이카리인으로의 HFD 마우스의 6주 치료는 미치료된 HFD 마우스와 비교하여 공복 글루코스를 약 40%만큼 감소시켰다 (HFD와 비교하여 p=0.0014, 도 23). 6주 연구의 종결 시 공복 인슐린 수준의 평가는 HFD 마우스가 LFD 마우스와 비교하여 순환 인슐린의 8배 증가를 나타내었음을 드러내었다 (도 24). 류신 단독으로의 HFD 마우스의 6주 치료는 미치료된 HFD 마우스와 비교하여 공복 동안의 순환 인슐린을 ~25%만큼 감소시켰다 (도 24). 류신 + 이카리인으로의 HFD 마우스의 6주 치료는 미치료된 HFD 마우스와 비교하여 공복 동안의 순환 인슐린을 약 40%만큼 감소시켰다 (HFD와 비교하여 p<0.05, 도 24). 6주 연구 종결 시 HOMAIR의 평가는 HFD 마우스가 LFD 마우스와 비교하여 순환 인슐린의 ~10배 증가를 나타내었음을 드러내었다 (도 25). 류신 단독으로의 HFD 마우스의 6주 치료는 미치료된 HFD 마우스와 비교하여 HOMAIR을 ~30%만큼 감소시켰다 (도 25). 류신 + 이카리인으로의 HFD 마우스의 6주 치료는 미치료된 HFD 마우스와 비교하여 HOMAIR을 약 45%만큼 감소시켰다 (HFD와 비교하여 p<0.03, 도 25). 이러한 결과는 분지쇄 아미노산 (예를 들어, 유리 류신) 및 PDE5 억제제의 조합 투여가 마우스에서 심지어 6주 투여 후에도 유효성의 소실 없이, 당뇨병에 대하여 장기간 동안 치료상 유효하게 유지되는 것을 증명하였다. 실험실 마우스의 기대 수명 대 평균 인간의 기대 수명을 고려할 때, 마우스에서의 이러한 유효성은 분지형 아미노산 (예를 들어, 유리 류신) 및 PDE5 억제제의 조합 투여가 4년 이상 동안 (예를 들어, 당뇨병에 대하여) 치료상 유효하게 유지될 수 있을 것임을 제시한다.
만성 고지방 식이는 다른 유해한 결과와 연관된다. 예를 들어, 만성 고지방 식이는 아마 간에서의 지방 축적으로부터 유래하는 것인 간 질량을 증가시킬 수 있다. 만성 고지방 섭식은 또한 수많은 질환에 기여할 수 있는 만성 염증과 관련된다. 고지방 섭식의 추가적 결과에 대한 류신 또는 류신 + 이카리인 투여의 효과를 결정하기 위해, 간 질량 및 C-반응성 단백질 (염증의 바이오마커)을 6주 연구의 종결 시에 모든 실험군에서 평가하였다. 6주 연구의 종결 시에 간 질량의 평가는 HFD 마우스가 LFD 마우스와 비교하여 간 질량의 ~40% 증가를 나타내었음을 드러냈다 (p=0.01, 도 26). 류신 단독으로의 HFD 마우스의 6주 치료는 미치료된 HFD 마우스와 비교하여 간 질량을 ~10%만큼 감소시켰다 (도 26). 류신 + 이카리인으로의 HFD 마우스의 6주 치료는 미치료된 HFD 마우스와 비교하여 간 질량을 약 25%만큼 감소시켰다 (HFD와 비교하여 p<0.01, 도 26). 6주 연구의 종결 시에 c-반응성 단백질의 평가는 HFD 마우스가 LFD 마우스와 비교하여 간 질량의 ~30% 증가를 나타내었음을 드러냈다 (도 27). 류신 + 이카리인으로의 HFD 마우스의 6주 치료는 미치료된 HFD 마우스와 비교하여 C-반응성 단백질 수준을 약 20%만큼 감소시켰다 (HFD와 비교하여 p<0.05, 도 27).
이러한 데이터는 모두, 류신과 조합으로 저용량의 이카리인에 반응하여 공복 및 식후 글루코스, 글루코스 내성 및 인슐린 감수성의 유의한 강건한 개선을 증명한다. 이러한 개선은 이러한 동물 모델에서 항당뇨병제약의 것과 비교할 만하며, 이는 이러한 조합물의 치료 잠재력을 나타낸다. 더욱이, 이러한 조합물은 간 질량 및 염증성 바이오마커 c-반응성 단백질에서 유의한 개선을 제공한다.
상기한 내용으로부터 특정 실행이 예시되고 설명되지만, 그에 대한 다양한 변형이 이루어질 수 있고 본원에서 고려됨을 이해해야 한다. 또한, 본 발명은 명세서 내에서 제공된 구체적인 예에 의해 제한되는 것으로 의도되지 않는다. 본 발명은 상기한 명세서를 참조하여 설명되었지만, 상세한 설명 및 본원에서 바람직한 실시양태의 예시가 제한하는 의미로 해석되는 것을 의미하지는 않는다. 또한, 본 발명의 모든 측면은 다양한 조건 및 변수에 의존적인 본원에 제시된 구체적인 서술, 배열형태 또는 상대적인 비율에 제한되지 않음을 이해해야 한다. 본 발명의 실시양태의 형태의 다양한 변형 및 상세한 내용은 관련 기술 분야의 통상의 기술자에게 자명해질 것이다. 따라서, 본 발명은 임의의 이러한 변형, 변이 및 등가물을 또한 포함할 것으로 고려된다.
Claims (47)
- a) 포스포디에스테라제 5 (PDE 5) 억제제; 및
b) 류신 및/또는 류신 대사물
울 포함하는, 에너지 대사를 향상시키기에 효과적인 조성물. - 제1항에 있어서, 성분 (a) 또는 성분 (b)를 단독으로 대상체에 투여한 것과 비교하여 대상체에서 에너지 대사를 더 큰 정도로 향상시키는 조성물.
- 제2항에 있어서, 향상된 에너지 대사가 적어도 약 300%의 지방세포의 지방산 산화의 증가, 적어도 150%의 지방세포의 글루코스 활용의 증가, 적어도 60% 변화의 지방세포의 글루코스 활용의 증가, 또는 적어도 약 15%의 미토콘드리아 바이오매스의 증가에 의해 측정되는 것인 조성물.
- 제2항에 있어서, 향상된 에너지 대사가 적어도 20%의 식후 혈액 글루코스의 감소, 적어도 30%의 식후 인슐린의 감소, 적어도 40%의 공복 혈액 글루코스의 감소, 적어도 40%의 공복 인슐린의 감소, 적어도 15%의 글루코스 부하에 대한 혈액 글루코스 반응의 감소, 인슐린 내성 결과의 2배의 개선, 또는 적어도 20%의 염증성 스트레스의 감소에 의해 측정되는 것인 조성물.
- 제4항에 있어서, 글루코스 부하에 대한 혈액 글루코스 반응의 감소가 글루코스 내성 곡선 하의 면적에 의해 입증되는 것인 조성물.
- 제1항에 있어서, PDE 5 억제제가 아바나필, 아이오데나필, 미로데나필, 실데나필, 타달라필, 이카리인, 바르데나필, 우데나필 또는 자프린스트인 조성물.
- 제1항에 있어서, PDE 5 억제제가 실데나필 또는 이카리인인 조성물.
- 제1항에 있어서, PDE 5 억제제가 이카리인인 조성물.
- 제1항에 있어서, 성분 (b)가 HMB인 조성물.
- 제1항에 있어서, 성분 (b)가 유리 류신인 조성물.
- 제1항에 있어서, 비-선택적 PDE 억제제를 추가로 포함하는 조성물.
- 제1항에 있어서, 비타민 B6을 추가로 포함하는 조성물.
- 제1항에 있어서, PDE 5 억제제 이외의 제약 활성제를 추가로 포함하는 조성물.
- 제1항에 있어서, 유리 아미노산 형태의 알라닌, 아르기닌, 아스파라긴, 아스파르트산, 시스테인, 글루탐산, 글루타민, 글리신, 히스티딘, 이소류신, 리신, 메티오닌, 페닐알라닌, 프롤린, 세린, 트레오닌, 트립토판, 티로신 또는 발린이 실질적으로 없는 조성물.
- 제1항에 있어서, 유리 아미노산 형태의 이소류신 및 발린이 실질적으로 없는 조성물.
- 제1항에 있어서, 경구 소비를 위해 제제화된 조성물.
- 제1항에 있어서, 치료량 미만의 성분 (a)를 포함하는 단위 투여량인 조성물.
- 제17항에 있어서, 치료량 미만의 성분 (a)가 약 0.1 내지 약 20 mg의 실데나필인 단위 투여량.
- 제17항에 있어서, 치료량 미만의 성분 (a)가 약 0.1 내지 약 10 mg의 실데나필인 단위 투여량.
- 제17항에 있어서, 치료량 미만의 성분 (a)가 약 0.5 - 약 50 mg의 아바나필, 약 0.05 - 약 10 mg의 아이오데나필, 약 0.25 - 약 25 mg의 미로데나필, 약 0.01 - 약 1.25 mg의 타달라필, 약 0.01 - 약 1.25 mg의 바르데나필, 약 0.5 - 약 50 mg의 우데나필, 약 0.5 - 약 50 mg의 자프린스트, 또는 약 0.05 - 약 100 mg의 이카리인인 단위 투여량.
- 제17항에 있어서, 성분 (b)가 약 50 내지 약 1000 mg의 유리 류신을 포함하는 것인 단위 투여량.
- 제17항에 있어서, 성분 (b)가 약 500 내지 약 700 mg의 유리 류신을 포함하는 것인 단위 투여량.
- 제17항에 있어서, 성분 (b)가 약 500 mg 이상의 유리 류신을 포함하는 것인 단위 투여량.
- 제17항에 있어서, 성분 (b)가 약 200 mg 이상의 HMB를 포함하는 것인 단위 투여량.
- a) PDE 5 억제제; 및
b) 폴리페놀
을 포함하고,
성분 (a) 또는 성분 (b)를 단독으로 대상체에 투여한 것과 비교하여 대상체에서 에너지 대사를 더 큰 정도로 향상시키는, 에너지 대사를 향상시키기에 효과적인 조성물. - 제25항에 있어서, 폴리페놀이 레스베라트롤인 조성물.
- 제25항에 있어서, 폴리페놀이 스틸벤 또는 히드록시신남산인 조성물.
- 제25항에 있어서, 폴리페놀이 클로로겐산, 레스베라트롤, 카페인산, 피세아타놀, 엘라그산, 에피갈로카테킨 갈레이트 (EGCG), 포도씨 추출물 또는 그의 임의의 유사체인 조성물.
- 제25항에 있어서, 류신 및/또는 류신 대사물을 추가로 포함하는 조성물.
- 제1항 내지 제29항 중 어느 한 항의 조성물을 에너지 대사의 조절이 필요한 대상체에게 투여하는 것을 포함하는, 대상체에서 에너지 대사를 조절하는 방법.
- 제30항에 있어서, 조성물이 경구로 투여되는 것인 방법.
- a) 비만 또는 당뇨병을 갖고 있거나 또는 그에 걸리기 쉬운 대상체를 확인하고;
b) 제1항 내지 제29항 중 어느 한 항의 조성물을 대상체에게 투여하는 것
을 포함하는, 에너지 대사를 조절하는 방법. - 치료량 미만의 PDE 5 억제제, 및 적어도 약 500 mg의 류신 또는 약 200 mg의 HMB를 포함하는 단위 투여량을 에너지 대사의 조절이 필요한 대상체에게 투여하는 것을 포함하는, 대상체에서 에너지 대사를 조절하는 방법.
- 제33항에 있어서, 치료량 미만의 PDE 5 억제제가 약 10 mg/일 미만인 방법.
- 제33항에 있어서, PDE 5 억제제가 실데나필인 방법.
- 제1항 내지 제29항 중 어느 한 항의 조성물을 선택된 투여 수준으로 대상체에게 투여하는 것을 포함하며, 여기서 선택된 투여 수준은 대상체에서 약 1 nM 실데나필 및 약 0.5 mM 류신의 순환 수준을 유도하는 것인, 대상체에서 에너지 대사를 증가시키는 방법.
- a) PDE 억제제; 및
b) 유리 아미노산 형태의 분지쇄 아미노산 또는 그의 유리 대사물
을 포함하는 치료상 유효한 조성물을 당뇨병의 치료를 필요로 하는 대상체에게 투여하는 것을 포함하는, 대상체에서 당뇨병을 치료하는 방법. - 제37항에 있어서, 분지쇄 아미노산이 유리 류신인 방법.
- 제37항에 있어서, 대사물이 HMB인 방법.
- 제37항에 있어서, PDE 억제제가 PDE5 억제제인 방법.
- 제37항에 있어서, PDE 5 억제제가 아바나필, 아이오데나필, 미로데나필, 실데나필, 타달라필, 이카리인, 바르데나필, 우데나필 또는 자프린스트인 방법.
- 제37항에 있어서, 치료상 유효한 조성물을 경구로 투여하는 것을 포함하는 방법.
- 제37항에 있어서, 치료상 유효한 조성물을 1, 2 또는 6주 이상 동안 투여하는 것을 포함하는 방법.
- 제37항에 있어서, 투여가 대상체에서 당뇨병의 증상을 개선하는 것인 방법.
- 제44항에 있어서, 당뇨병 증상의 개선이 적어도 20%의 식후 혈액 글루코스의 감소, 적어도 30%의 식후 인슐린의 감소, 적어도 40%의 공복 혈액 글루코스의 감소, 적어도 40%의 공복 인슐린의 감소, 적어도 15%의 글루코스 부하에 대한 혈액 글루코스 반응의 감소, 인슐린 내성 결과의 2배의 개선, 또는 적어도 20%의 염증성 스트레스의 감소에 의해 측정되는 것인 방법.
- 제45항에 있어서, 글루코스 부하에 대한 혈액 글루코스 반응의 감소가 글루코스 내성 곡선 하의 면적에 의해 입증되는 것인 방법.
- 제1항 내지 제29항 중 어느 한 항의 조성물의 단위 투여량의 복수 일 공급물 및 복수 일의 기간 동안 상기 복수 일 공급물의 투여를 지시하는 지침서를 포함하는 키트.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261726006P | 2012-11-13 | 2012-11-13 | |
| US61/726,006 | 2012-11-13 | ||
| PCT/US2013/069957 WO2014078459A1 (en) | 2012-11-13 | 2013-11-13 | Compositions and methods for increasing energy metabolism |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20150082623A true KR20150082623A (ko) | 2015-07-15 |
Family
ID=50731663
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020157015622A KR20150082623A (ko) | 2012-11-13 | 2013-11-13 | 에너지 대사를 증가시키기 위한 조성물 및 방법 |
Country Status (15)
| Country | Link |
|---|---|
| US (3) | US9943517B2 (ko) |
| EP (1) | EP2919772B1 (ko) |
| JP (1) | JP6469015B2 (ko) |
| KR (1) | KR20150082623A (ko) |
| CN (3) | CN108452311A (ko) |
| AU (2) | AU2013344753B2 (ko) |
| BR (1) | BR112015010947A2 (ko) |
| CA (1) | CA2891335C (ko) |
| HK (1) | HK1212594A1 (ko) |
| IL (1) | IL238726B (ko) |
| MX (1) | MX2015006023A (ko) |
| PH (1) | PH12015501062A1 (ko) |
| RU (1) | RU2655794C2 (ko) |
| SG (2) | SG10201709195TA (ko) |
| WO (1) | WO2014078459A1 (ko) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20190114500A (ko) * | 2018-03-30 | 2019-10-10 | 건국대학교 산학협력단 | 에피갈로카테킨 갈레이트 프로드러그, 이의 제조방법 및 이를 포함하는 미토콘드리아 생합성 촉진용 조성물 |
| KR20200108399A (ko) * | 2018-10-24 | 2020-09-18 | 전남대학교산학협력단 | 녹차 카테킨을 포함하는 중성지방 저감용 식품 조성물, 대사성 질환 개선용 식품 조성물 및 대사성 질환 예방 또는 치료용 약학 조성물 |
Families Citing this family (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2012284267B2 (en) | 2011-07-15 | 2017-06-29 | Nusirt Sciences, Inc. | Compositions and methods for modulating metabolic pathways |
| US9943517B2 (en) | 2012-11-13 | 2018-04-17 | Nusirt Sciences, Inc. | Compositions and methods for increasing energy metabolism |
| AU2014236687A1 (en) | 2013-03-15 | 2015-09-10 | Nusirt Sciences, Inc. | Leucine and nicotinic acid reduces lipid levels |
| CN106456997B (zh) | 2014-02-27 | 2018-12-28 | 纽斯尔特科学公司 | 用于减少或预防肝性脂肪变性的组合物和方法 |
| KR20170066334A (ko) | 2014-08-12 | 2017-06-14 | 주식회사 메지온 | 유데나필 조성물을 이용하여 폰탄 환자에서 심근 성능을 개선시키는 방법 |
| WO2016081035A1 (en) * | 2014-11-21 | 2016-05-26 | Schoenwetter Phillip E | Novel antioxidant formulations |
| CN107427488A (zh) * | 2014-12-19 | 2017-12-01 | 光环生命科学有限公司 | 鞣花酸二水合物在食品和保健品中的用途 |
| MX2017015418A (es) * | 2015-06-01 | 2018-08-24 | Metabolic Tech Inc | Composiciones y metodos de uso de beta-hidroxi-beta-metilbutirato (hmb) para reducir grasa corporal. |
| MX2018002318A (es) | 2015-08-28 | 2018-08-15 | Algahealth Ah Ltd | Proceso mejorado para producir fucoxantina y/o polisacaridos de microalgas. |
| CN106854643B (zh) * | 2015-12-08 | 2021-01-26 | 台湾粒线体应用技术股份有限公司 | 植物萃取物用于提升粒线体活性的用途 |
| JP6718470B2 (ja) * | 2016-01-25 | 2020-07-08 | サントリーホールディングス株式会社 | エラグ酸ゼラチンカプセルを含有する組成物 |
| CN105920057A (zh) * | 2016-06-03 | 2016-09-07 | 通化师范学院 | 一种淫羊藿苷的用途 |
| CN108144062A (zh) * | 2017-12-15 | 2018-06-12 | 上海交通大学医学院 | 调控senp1磷酸化修饰化合物和sirt3 sumo化修饰化合物及其应用 |
| CA3047099A1 (en) * | 2018-06-14 | 2019-12-14 | University Health Network | Composition and methods for regulating extracellular matrix accumulation |
| US10568352B1 (en) | 2018-10-25 | 2020-02-25 | Wiser Concepts, LLC | Nutritional compositions and methods of treatment therewith |
| CA3214950A1 (en) * | 2021-04-07 | 2022-10-13 | Ralf Jager | 1-methylxanthine-based bioactive composition and method of use thereof |
| WO2022251683A1 (en) * | 2021-05-27 | 2022-12-01 | Allen Gregory Seth | Weight loss formulation and methods |
| US20230113817A1 (en) * | 2021-10-12 | 2023-04-13 | Ingenious Ingredients, LP | Dileucine compositions and methods of use thereof for fat loss |
| CN115181721A (zh) * | 2022-07-13 | 2022-10-14 | 山东省农业科学院畜牧兽医研究所 | 一种抑制肉羊皮下脂肪细胞增殖和脂肪合成代谢的方法 |
Family Cites Families (220)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3936527A (en) | 1969-12-19 | 1976-02-03 | Damon Corporation | Treatment of pets |
| US3810994A (en) | 1972-06-01 | 1974-05-14 | Ethyl Corp | Method and composition for treating obesity |
| NL7804375A (nl) | 1977-05-16 | 1978-11-20 | Ralston Purina Co | Voedsel voor dieren. |
| DK150008C (da) | 1981-11-20 | 1987-05-25 | Benzon As Alfred | Fremgangsmaade til fremstilling af et farmaceutisk oralt polydepotpraeparat |
| US4769027A (en) | 1984-08-15 | 1988-09-06 | Burroughs Wellcome Co. | Delivery system |
| IE58246B1 (en) | 1984-12-21 | 1993-08-11 | Byk Gulden Lomberg Chem Fab | Theophylline sustained release formulation |
| US4897268A (en) | 1987-08-03 | 1990-01-30 | Southern Research Institute | Drug delivery system and method of making the same |
| US5087624A (en) | 1989-03-21 | 1992-02-11 | Nutrition 21 | Chromic picolinate treatment |
| US5886012A (en) | 1989-03-22 | 1999-03-23 | Peter K. T. Pang | Method of treatment for disease associated with excessive PHF using combination therapy involving exogenous calcium and calcium channel blockers |
| GB8919131D0 (en) | 1989-08-23 | 1989-10-04 | Riker Laboratories Inc | Inhaler |
| US4992470A (en) | 1990-02-08 | 1991-02-12 | Iowa State University Research Foundation, Inc. | Method of enhancing immune response of mammals |
| US5250534A (en) | 1990-06-20 | 1993-10-05 | Pfizer Inc. | Pyrazolopyrimidinone antianginal agents |
| US6764697B1 (en) | 1991-06-27 | 2004-07-20 | Alza Corporation | System for delaying drug delivery up to seven hours |
| US5419283A (en) | 1992-04-08 | 1995-05-30 | Ciuffo Gatto S.R.L. | Animal chew toy of starch material and degradable ethylene copolymer |
| JP3219838B2 (ja) | 1992-05-12 | 2001-10-15 | 沖電気工業株式会社 | 半導体素子の製造方法 |
| GB9311920D0 (en) | 1993-06-09 | 1993-07-28 | Pfizer Ltd | Therapeutic agents |
| LU88369A1 (fr) | 1993-07-12 | 1994-04-01 | Michel Urso Prof Medecin Et Ch | Acides aminés à chaînes ramifiées |
| US5339771A (en) | 1993-09-15 | 1994-08-23 | Axelrod Herbert R | Animal chew toy containing animal meal |
| US6676967B1 (en) | 1993-09-20 | 2004-01-13 | Kos Pharmaceuticals, Inc. | Methods for reducing flushing in individuals being treated with nicotinic acid for hyperlipidemia |
| US5395626A (en) | 1994-03-23 | 1995-03-07 | Ortho Pharmaceutical Corporation | Multilayered controlled release pharmaceutical dosage form |
| US5616569A (en) | 1994-03-28 | 1997-04-01 | The Iams Company | Pet food product containing fermentable fibers and process for treating gastrointestinal disorders |
| US6048903A (en) | 1994-05-03 | 2000-04-11 | Robert Toppo | Treatment for blood cholesterol with trans-resveratrol |
| US5776913A (en) | 1995-10-10 | 1998-07-07 | Colgate Palmolive Company | Therapeutic diet for metabolic abnormalities found in animals with lymphoma |
| EP0873754B1 (en) | 1996-01-09 | 2003-07-30 | Riken | Amino acid compositions |
| US6395292B2 (en) | 1996-02-02 | 2002-05-28 | Alza Corporation | Sustained delivery of an active agent using an implantable system |
| US6919373B1 (en) | 1996-11-12 | 2005-07-19 | Alza Corporation | Methods and devices for providing prolonged drug therapy |
| ES2164299T5 (es) | 1997-01-09 | 2009-03-01 | Societe Des Produits Nestle S.A. | Producto cereal que contiene probioticos. |
| US6004996A (en) | 1997-02-05 | 1999-12-21 | Hoffman-La Roche Inc. | Tetrahydrolipstatin containing compositions |
| IT1291113B1 (it) | 1997-03-20 | 1998-12-29 | Sigma Tau Ind Farmaceuti | Composizione nutritiva terapeutica per soggetti affetti da diabete mellito |
| MY125849A (en) | 1997-07-25 | 2006-08-30 | Alza Corp | Osmotic delivery system, osmotic delivery system semipermeable body assembly, and method for controlling delivery rate of beneficial agents from osmotic delivery systems |
| US6063414A (en) | 1997-08-18 | 2000-05-16 | Seal Rock Technologies Incorporated | Combination container and dry pet food for increased shelf life, freshness, palatability, and nutritional value |
| JP3611456B2 (ja) | 1997-09-30 | 2005-01-19 | 日研化学株式会社 | テオフィリン徐放性錠剤 |
| BR9910207A (pt) | 1998-05-04 | 2001-01-09 | Andreas Johannes Kesel | Produtos de condensação de knoevenagel monoméricos, oligoméricos e poliméricos |
| US6387419B1 (en) | 1998-06-02 | 2002-05-14 | Biofiber-Damino A/S | Piglet feeding method |
| US6031000A (en) | 1998-06-23 | 2000-02-29 | Iowa State University Research Foundation, Inc. | Composition comprising β-hydroxy-β-methylbutyric acid and at least one amino acid and methods of use |
| US6403142B1 (en) | 1998-12-11 | 2002-06-11 | Ralston Purina Company | Hypoallergenic pet food |
| EP1140012B1 (en) | 1998-12-17 | 2004-03-03 | Alza Corporation | Conversion of liquid filled gelatin capsules into controlled release systems by multiple coatings |
| US6797283B1 (en) | 1998-12-23 | 2004-09-28 | Alza Corporation | Gastric retention dosage form having multiple layers |
| BR0008857A (pt) | 1999-03-08 | 2001-12-18 | Medicure Inc | Análogos de piridoxal para distúrbios da vitaminab-6 |
| FR2790645B1 (fr) | 1999-03-12 | 2001-06-08 | Arkopharma Laboratoires | Complement alimentaire et procede de traitement cosmetique a base d' un extrait de raisin riche en polyphenols |
| AU7596100A (en) | 1999-09-21 | 2001-04-24 | Rutgers, The State University | Resveratrol analogs for prevention of disease |
| US6527711B1 (en) | 1999-10-18 | 2003-03-04 | Bodymedia, Inc. | Wearable human physiological data sensors and reporting system therefor |
| CN1303671A (zh) * | 1999-11-26 | 2001-07-18 | 深圳市御康实业有限公司湖南省分公司 | 肉桂酸用于制备治疗糖尿病的药物 |
| US6280779B1 (en) | 1999-12-28 | 2001-08-28 | Colgate-Palmolive Company | Pet food for maintaining normal bowel health |
| EP1250052A1 (en) | 2000-01-25 | 2002-10-23 | Juvenon, Inc. | Nutritional supplements for aged pets |
| EG22407A (en) | 2000-02-17 | 2003-01-29 | Iams Company | Method for improving bone modeling and chondrocyte functioning in growing canines |
| US6605038B1 (en) | 2000-06-16 | 2003-08-12 | Bodymedia, Inc. | System for monitoring health, wellness and fitness |
| US7261690B2 (en) | 2000-06-16 | 2007-08-28 | Bodymedia, Inc. | Apparatus for monitoring health, wellness and fitness |
| US7689437B1 (en) | 2000-06-16 | 2010-03-30 | Bodymedia, Inc. | System for monitoring health, wellness and fitness |
| EP2363061A1 (en) | 2000-06-16 | 2011-09-07 | BodyMedia, Inc. | System for monitoring and managing body weight and other physiological conditions including iterative and personalized planning, intervention and reporting capability |
| JP2002047699A (ja) | 2000-07-31 | 2002-02-15 | Toto Ltd | 給水の配管システム |
| US20020165237A1 (en) * | 2000-08-11 | 2002-11-07 | Fryburg David Albert | Treatment of the insulin resistance syndrome |
| KR20030023747A (ko) * | 2000-08-11 | 2003-03-19 | 화이자 인코포레이티드 | 인슐린 저항성 증후군의 치료 |
| US6384087B1 (en) | 2000-09-01 | 2002-05-07 | University Of Tennesseee Research Corporation, Inc. | Materials and methods for the treatment or prevention of obesity |
| TWI329516B (en) | 2000-12-12 | 2010-09-01 | Kaneka Corp | Composition for preventing or ameliorating multiple risk factor syndromes and visceral fat-type obesity |
| DK1345500T3 (da) | 2000-12-29 | 2008-11-24 | Martin Francis Gannon | Foderprodukt til dyr |
| WO2002071874A2 (en) | 2001-03-09 | 2002-09-19 | Societe Des Produits Nestle S.A. | Composition improving age-related physiological deficits and increasing longevity |
| US6338862B1 (en) * | 2001-03-26 | 2002-01-15 | Sarfaraz K Niazi | Composition and method of use in treating sexual dysfunction using cGMP-specific phosphodiesterase type 5 inhibitors |
| US6595929B2 (en) | 2001-03-30 | 2003-07-22 | Bodymedia, Inc. | System for monitoring health, wellness and fitness having a method and apparatus for improved measurement of heat flow |
| US20060110478A1 (en) * | 2004-11-22 | 2006-05-25 | Mccleary Edward L | Delivery system and method for supporting and promoting healthy sexual function and prevention and treatment of sexual dysfunction |
| JP3591492B2 (ja) * | 2001-07-18 | 2004-11-17 | 日本電気株式会社 | パケット振分装置およびパケット振分プログラム |
| BR0213424A (pt) | 2001-10-19 | 2004-12-14 | Pharma Mar Sa | Uso aperfeiçoado de composto antitumoral na terapia contra câncer |
| EP1525323B1 (en) | 2001-11-09 | 2015-01-21 | Dana-Farber Cancer Institute, Inc. | Pgc-1beta, a novel pgc-1 homologue and uses therefor |
| US20030181461A1 (en) | 2002-01-25 | 2003-09-25 | Lautt Wilfred Wayne | Use of phosphodiesterase antagonists to treat insulin resistance |
| US20030187055A1 (en) | 2002-02-25 | 2003-10-02 | Riker Donald K. | Synergistic pharmaceutical combinations for treating obesity |
| US20040009216A1 (en) | 2002-04-05 | 2004-01-15 | Rodrigueza Wendi V. | Compositions and methods for dosing liposomes of certain sizes to treat or prevent disease |
| EP1505967B1 (en) | 2002-05-17 | 2016-07-13 | Duke University | Method for treating obesity |
| MXPA05000224A (es) | 2002-06-26 | 2005-06-03 | Alza Corp | Piston de volumen eficiente, minimamente deformable, para sistemas de suministro osmotico de farmacos. |
| FR2841784B1 (fr) | 2002-07-08 | 2007-03-02 | Composition a base de derives de 1,3-diphenylprop-2en-1-one substitues, preparation et utilisations | |
| US7020508B2 (en) | 2002-08-22 | 2006-03-28 | Bodymedia, Inc. | Apparatus for detecting human physiological and contextual information |
| US20050181097A1 (en) | 2002-09-16 | 2005-08-18 | Mars, Inc. | Nutritionally complete pet food and method of feeding and manufacturing same |
| RU2335927C2 (ru) | 2002-09-20 | 2008-10-20 | Новартис Аг | Обогащенные лейцином питательные композиции |
| DK1551282T3 (en) | 2002-10-09 | 2016-02-22 | Bodymedia Inc | DEVICE FOR RECEIVING, RECEIVING, DETERMINING AND DISPLAYING PHYSIOLOGICAL AND CONTEXTUAL INFORMATION ON A HUMAN |
| US20050064070A1 (en) | 2002-10-11 | 2005-03-24 | Jeffrey Liebrecht | Beverage compositions for use in rehydration and nutrition during athletic exercise and methods of making same |
| US7744930B2 (en) * | 2002-11-22 | 2010-06-29 | Shaklee Corporation | Compositions, methods and kits for enhancing weight loss while inhibiting loss of lean body mass |
| JP2004305201A (ja) | 2002-11-27 | 2004-11-04 | Hayashibara Biochem Lab Inc | アクリルアミドの生成抑制方法とその用途 |
| CN1504424A (zh) | 2002-12-05 | 2004-06-16 | 上海金创投资管理有限公司 | 含亮氨酸婴儿饮用水 |
| US20040254357A1 (en) | 2002-12-19 | 2004-12-16 | Zaloga Gary P. | Fatty acid phenolic conjugates |
| US7288570B2 (en) | 2002-12-20 | 2007-10-30 | Nutricia N.V. | Stimulation of in vivo production of proteins |
| US20040120983A1 (en) | 2002-12-23 | 2004-06-24 | Philip Connolly | Nutritional supplement |
| AU2004221875B2 (en) | 2003-03-13 | 2010-11-11 | Vector Usa Inc. | A film having a liquid absorbed therein |
| US20040186046A1 (en) * | 2003-03-17 | 2004-09-23 | Pfizer Inc | Treatment of type 1 diabetes with PDE5 inhibitors |
| JP2006520777A (ja) * | 2003-03-17 | 2006-09-14 | ファイザー・プロダクツ・インク | Pde5阻害剤を用いる1型糖尿病の治療 |
| US20060159746A1 (en) | 2003-03-18 | 2006-07-20 | Troup John P | Compositions comprising fatty acids and amino acids |
| US7160565B2 (en) | 2003-03-31 | 2007-01-09 | Breakthru Products, Llc | Hydration beverage and method of delivering nutrients |
| US20050042362A1 (en) | 2003-04-02 | 2005-02-24 | Clark Harry M. | Pet food composition and method |
| JP4353982B2 (ja) | 2003-05-14 | 2009-10-28 | インダス バイオテック ピーブイティ. エルティーディー. | 糖尿病処置用相乗作用組成物 |
| WO2005003766A2 (en) | 2003-06-13 | 2005-01-13 | Whitehead Institute For Biomedical Research | Methods of regulating metabolism and mitochondrial function |
| FR2856407B1 (fr) | 2003-06-19 | 2007-10-12 | Inst Nat Sante Rech Med | Procede de production d'une proteine recombinante d'interet et proteine produite |
| US20080024272A1 (en) * | 2003-07-18 | 2008-01-31 | Fiske Michael S | Biometric authentication lock machine |
| US8633247B2 (en) | 2003-08-11 | 2014-01-21 | Hill's Pet Nutrition, Inc. | Method for decreasing cartilage damage in dogs |
| JP2005097273A (ja) | 2003-08-19 | 2005-04-14 | Toyo Shinyaku:Kk | 運動能力向上組成物 |
| KR101084554B1 (ko) | 2003-09-12 | 2011-11-17 | 보디미디어 인코퍼레이티드 | 심장 관련 파라미터를 측정하기 위한 방법 및 장치 |
| RU2398446C2 (ru) | 2003-11-03 | 2010-09-10 | Хилл'С Пет Ньютришн, Инк. | Покрытая кормовая композиция |
| JP2007511558A (ja) | 2003-11-19 | 2007-05-10 | ディーエスエム アイピー アセッツ ビー.ブイ. | ビタミンb6の製造 |
| EP1685833A1 (en) | 2003-11-21 | 2006-08-02 | Ajinomoto Co., Inc. | Remedy for diabetes |
| AU2004294958B2 (en) | 2003-11-26 | 2011-02-03 | Hill's Pet Nutrition, Inc. | Method to reduce odor of excreta from companion animals |
| US8017634B2 (en) | 2003-12-29 | 2011-09-13 | President And Fellows Of Harvard College | Compositions for treating obesity and insulin resistance disorders |
| EP1708689A2 (en) | 2003-12-29 | 2006-10-11 | The President and Fellows of Harvard College | Compositions for treating or preventing obesity and insulin resistance disorders |
| US20050215882A1 (en) | 2004-03-23 | 2005-09-29 | The Regents Of The University Of Michigan | Noninvasive method to determine fat content of tissues using MRI |
| MXPA06014587A (es) | 2004-06-17 | 2007-04-27 | Forest Laboratories | Formulaciones de liberacion modificada de formulaciones de dosificacion oral de memantina. |
| US20070244202A1 (en) | 2004-06-28 | 2007-10-18 | Kao Corporation | Ampk Activator |
| WO2006013750A1 (ja) | 2004-08-04 | 2006-02-09 | Tokyo University Of Marine Science And Technology | 脂質代謝調節作用を有する食品素材、健康食品、動物用飼料及び動物の飼育方法 |
| EP1786428B1 (en) | 2004-08-17 | 2012-05-16 | The Johns Hopkins University | Pde5 inhibitor compositions and methods for treating cardiac indications |
| EP3326543B1 (en) | 2004-08-24 | 2019-07-24 | DePuy Mitek, LLC | Expandable needle suture apparatus and associated handle assembly with rotational suture manipulation system |
| US8252321B2 (en) | 2004-09-13 | 2012-08-28 | Chrono Therapeutics, Inc. | Biosynchronous transdermal drug delivery for longevity, anti-aging, fatigue management, obesity, weight loss, weight management, delivery of nutraceuticals, and the treatment of hyperglycemia, alzheimer's disease, sleep disorders, parkinson's disease, aids, epilepsy, attention deficit disorder, nicotine addiction, cancer, headache and pain control, asthma, angina, hypertension, depression, cold, flu and the like |
| US8252314B2 (en) | 2004-09-24 | 2012-08-28 | Hill's Pet Nutrition, Inc. | Hypoallergenic composition |
| CN1287801C (zh) * | 2004-10-29 | 2006-12-06 | 杨世杰 | 治疗前列腺炎的药物组合物 |
| US20080004335A1 (en) | 2004-11-29 | 2008-01-03 | Kinya Takagaki | Athletic Ability Enhancing Composition |
| EP1832284A4 (en) | 2004-12-28 | 2008-07-30 | Ajinomoto Kk | INDUCER OR SECRETAGOGUE OF ADIPONECTIN |
| JP2008527020A (ja) * | 2005-01-18 | 2008-07-24 | ディーエスエム アイピー アセッツ ビー.ブイ. | 新規な栄養補助組成物 |
| WO2006079021A2 (en) | 2005-01-20 | 2006-07-27 | Sirtris Pharmaceuticals, Inc. | Use of sirtuin-activating compounds for treating flushing and drug induced weight gain |
| US20060165824A1 (en) | 2005-01-26 | 2006-07-27 | The Procter & Gamble Company | Compositions, kits, and methods for enhancing gastrointestinal health |
| RU2395285C2 (ru) | 2005-02-11 | 2010-07-27 | Арджента Дискавери Лимитед | Комбинация соединений метилксантина и стероидов для лечения хронических респираторных заболеваний |
| US20060188611A1 (en) | 2005-02-18 | 2006-08-24 | Emine Unlu | Edible pet chew |
| US20090163476A1 (en) | 2005-03-03 | 2009-06-25 | Sirtris Pharmaceuticals, Inc. | N-Phenyl Benzamide Derivatives as Sirtuin Modulators |
| US20070014833A1 (en) | 2005-03-30 | 2007-01-18 | Sirtris Pharmaceuticals, Inc. | Treatment of eye disorders with sirtuin modulators |
| US20100233312A9 (en) | 2005-04-11 | 2010-09-16 | The Procter & Gamble Company | Compositions comprising probiotic and sweetener components |
| JP5197358B2 (ja) | 2005-05-13 | 2013-05-15 | ネステク ソシエテ アノニム | 植物種からのグルコサミンの製造 |
| AU2006259619A1 (en) | 2005-06-16 | 2006-12-28 | Forest Laboratories, Inc. | Modified and immediate release memantine bead formulation |
| EP1898897A2 (en) | 2005-07-07 | 2008-03-19 | Sirtris Pharmaceuticals, Inc. | Methods and related compositions for treating or preventing obesity, insulin resistance disorders, and mitochondrial-associated disorders |
| JP2007039367A (ja) | 2005-08-02 | 2007-02-15 | Kyoto Univ | 細胞の分化を促進する組成物およびその利用 |
| US8093401B2 (en) | 2005-08-04 | 2012-01-10 | Sirtris Pharmaceuticals, Inc. | Sirtuin modulating compounds |
| US7855289B2 (en) | 2005-08-04 | 2010-12-21 | Sirtris Pharmaceuticals, Inc. | Sirtuin modulating compounds |
| US8088928B2 (en) | 2005-08-04 | 2012-01-03 | Sirtris Pharmaceuticals, Inc. | Sirtuin modulating compounds |
| AU2006278396A1 (en) | 2005-08-04 | 2007-02-15 | Sirtris Pharmaceuticals, Inc. | Benzimidazole derivatives as sirtuin modulators |
| WO2007041643A1 (en) | 2005-10-03 | 2007-04-12 | University Of Tennessee Research Foundation | Dietary calcium for reducing the production of reactive oxygen species |
| RU2414897C2 (ru) | 2005-11-30 | 2011-03-27 | Нестек С.А. | Способы лечения потери мышечной массы |
| US20090136588A1 (en) | 2005-12-02 | 2009-05-28 | Hill's Pet Nutrition, Inc. | Methods For Altering Food Intake, Modifying Nutrient Digestibility and Altering Stool Quality and/or Stool Frequency |
| JP5329229B2 (ja) | 2005-12-02 | 2013-10-30 | ヒルズ・ペット・ニュートリシャン・インコーポレーテッド | 糞便の質および/または排便回数を改変するための方法 |
| WO2007069744A1 (ja) | 2005-12-16 | 2007-06-21 | Ajinomoto Co., Inc. | メタボリックシンドローム予防・改善用組成物 |
| CA2635655C (en) | 2006-01-10 | 2011-09-06 | Hill's Pet Nutrition, Inc. | Compositions and methods for promoting fat loss |
| WO2007100695A2 (en) | 2006-02-28 | 2007-09-07 | Trustees Of Boston University | Metabolic regulators and uses thereof |
| JP5222482B2 (ja) | 2006-04-07 | 2013-06-26 | 花王株式会社 | 脂肪分解促進剤 |
| DE102006016903A1 (de) | 2006-04-11 | 2007-10-25 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Inhalator |
| WO2007128461A1 (en) | 2006-05-10 | 2007-11-15 | Dsm Ip Assets B.V. | Animal food composition comprising genistein and polyunsaturated fatty acids |
| JP2007306851A (ja) | 2006-05-18 | 2007-11-29 | 仁 ▲吉▼井 | 食塩組成物およびその製造方法 |
| US20070286909A1 (en) | 2006-06-07 | 2007-12-13 | Daniel S. Smith | Amino acid compositions |
| US20090291958A1 (en) | 2006-06-08 | 2009-11-26 | Auspex Pharmaceuticals, Inc. | Substituted PDE5 inhibitors |
| WO2008008433A2 (en) | 2006-07-12 | 2008-01-17 | University Of Tennessee Research Foundation | Substituted acylanilides and methods of use thereof |
| ITRM20060427A1 (it) | 2006-08-04 | 2008-02-05 | Nuraging Biotech S R L | Composizioni antiossidanti comprendenti estratti di rosmarino e mirto |
| JP2008063328A (ja) | 2006-08-07 | 2008-03-21 | Kowa Co | 糸球体疾患治療剤 |
| JP5507802B2 (ja) | 2006-08-10 | 2014-05-28 | 花王株式会社 | 筋肉老化抑制剤 |
| US8703174B2 (en) | 2006-09-15 | 2014-04-22 | I Did It Inc | Joint preserving nutritional vitamin, mineral and herbal pet supplement |
| US20080102137A1 (en) | 2006-10-31 | 2008-05-01 | Guffey Manning V R | Composition and method for etiological treatment and prevention of diseases and/or complications associated with chronic glucose metabolism destabilization |
| WO2008083330A2 (en) | 2006-12-29 | 2008-07-10 | The Salk Institute For Biological Studies | Methods for enhancing exercise performance |
| AU2008206328B2 (en) | 2007-01-16 | 2013-10-31 | Ipintl, Llc | Novel composition for treating metabolic syndrome |
| US20080319786A1 (en) | 2007-02-16 | 2008-12-25 | Stivoric John M | Publishing and insurance applications of lifeotypes |
| ES2345461T3 (es) | 2007-02-23 | 2010-09-23 | Hill's Pet Nutrition, Inc. | Composiciones y metodos para controlar el peso de animales. |
| US20080233245A1 (en) | 2007-03-19 | 2008-09-25 | Lesley Joan White | Liquid nutrient composition for improving performance |
| US7850997B2 (en) | 2007-03-21 | 2010-12-14 | Tim Romero | Dietary compositions and methods of enhancing lean body mass and exercise performance |
| US20080242727A1 (en) * | 2007-03-27 | 2008-10-02 | Tim Romero | Dietary compositions containing alpha amino n-butyrate and methods of enhancing lean body mass |
| US20100210692A1 (en) | 2007-03-28 | 2010-08-19 | Farmer Stephen R | Methods of treatment using sirt modulators and compositions containing sirt1 modulators |
| US20080268038A1 (en) | 2007-04-26 | 2008-10-30 | Wolfe Robert R | Compositions and Approaches for Increasing Diet Induced Thermogenesis, Inducing Weight Loss and Maintaining Muscle Mass and Strength |
| MX2009011754A (es) | 2007-04-30 | 2009-12-01 | Abbott Lab | Inhibidores de enzima de diacilglicerol o-aciltransferasa tipo 1. |
| WO2008143182A1 (ja) | 2007-05-17 | 2008-11-27 | Kaneka Corporation | 甘草ポリフェノールを含有する組成物 |
| JP5121308B2 (ja) | 2007-05-28 | 2013-01-16 | ハウスウェルネスフーズ株式会社 | メタボリックシンドロームの予防、改善または治療組成物 |
| US20100204204A1 (en) | 2007-06-06 | 2010-08-12 | University Of South Florida | Nutraceutical co-crystal compositions |
| WO2008157537A2 (en) | 2007-06-19 | 2008-12-24 | Ironwood Pharmaceuticals, Inc | Compositions and methods of use for treating or preventing lipid related disorders |
| TW200918542A (en) | 2007-06-20 | 2009-05-01 | Sirtris Pharmaceuticals Inc | Sirtuin modulating compounds |
| CL2008001822A1 (es) | 2007-06-20 | 2009-03-13 | Sirtris Pharmaceuticals Inc | Compuestos derivados de tiazolo[5,4-b]piridina; composicion farmaceutica que comprende a dichos compuestos; y uso del compuesto en el tratamiento de la resistencia a la insulina, sindrome metabolico, diabetes, entre otras. |
| WO2009002867A2 (en) | 2007-06-26 | 2008-12-31 | Nutrition 21, Inc. | Multiple unit dosage form having a therapeutic agents in combination with a nutritional supplement |
| US7989007B2 (en) | 2007-07-03 | 2011-08-02 | Vincent James Enterprises, Llc | Weight loss composition |
| WO2009003798A1 (en) | 2007-07-05 | 2009-01-08 | Unilever N.V. | Food composition comprising trans-resveratrol and its use to control blood pressure |
| WO2009008991A2 (en) * | 2007-07-06 | 2009-01-15 | Government Of The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services National Institutes Of Health | Dna-pkcs modulates energy regulation and brain function |
| US8529965B2 (en) | 2007-07-09 | 2013-09-10 | Hill's Pet Nutrition, Inc. | Compositions and methods for altering stool quality in an animal |
| EP2200722B1 (en) | 2007-09-07 | 2019-01-23 | NIKE Innovate C.V. | Wearable device assembly having athletic functionality |
| US7820618B2 (en) | 2007-10-04 | 2010-10-26 | Northern Innovations and Formulations | Energy status of an individual by enhanced usage of an endogenous fuel source |
| CA2702471A1 (en) | 2007-10-22 | 2009-04-30 | The Coca-Cola Company | Neutralized juice-based beverages and method of making same |
| WO2009054994A2 (en) | 2007-10-23 | 2009-04-30 | President And Fellows Of Harvard College | Sirt-3 related methods and compositions for mimicking exercise |
| US20090110674A1 (en) | 2007-10-24 | 2009-04-30 | Loizou Nicos C | Health supplement |
| US20090156648A1 (en) | 2007-12-12 | 2009-06-18 | Iovate T. & P. Inc. | Preparations containing pyridoxine and alpha-hydroxyisocaproic acid (HICA) |
| AU2008345571B2 (en) | 2007-12-21 | 2011-10-13 | Hill's Pet Nutrition, Inc. | Pet food composition |
| US8716249B2 (en) | 2008-01-31 | 2014-05-06 | Energy Light Llc | Compositions and methods for improving cardiovascular health |
| AU2009212462B2 (en) | 2008-02-04 | 2012-09-13 | Mercury Therapeutics, Inc. | AMPK modulators |
| WO2009111472A2 (en) | 2008-03-03 | 2009-09-11 | Nike, Inc. | Interactive athletic equipment system |
| WO2009117403A1 (en) | 2008-03-17 | 2009-09-24 | The Procter & Gamble Company | User-customizable dosing system |
| EP2700434A3 (en) | 2008-04-02 | 2014-07-02 | Nike International Ltd. | Wearable device assembly having athletic functionality |
| EP2308493A4 (en) | 2008-07-07 | 2013-05-01 | Mochida Pharm Co Ltd | ENHANCING OR THERAPEUTIC AGENT FOR DYSLIPIDEMIA |
| US7968431B2 (en) * | 2008-07-15 | 2011-06-28 | Taiwan Semiconductor Manufacturing Company, Ltd. | Diffusion region routing for narrow scribe-line devices |
| ES2524475T3 (es) | 2008-07-18 | 2014-12-09 | Hill's Pet Nutrition, Inc. | Composiciones y métodos para tratar trastornos asociados con animales con sobrepeso |
| US20100021573A1 (en) | 2008-07-22 | 2010-01-28 | Michael J Gonzalez | Compositions and methods for the prevention of cardiovascular disease |
| RU2513133C2 (ru) | 2008-08-15 | 2014-04-20 | Нестек С.А. | Способы усиления энергетического обмена |
| FR2938732B1 (fr) | 2008-11-21 | 2011-04-01 | Holymark | Composition nutritive pour sportif, en particulier pour pratiquant d'une activite physique superieure a une heure. |
| CN102300578A (zh) | 2008-12-01 | 2011-12-28 | 延寿有限责任公司 | 用于改变健康、安康和寿命的方法和组合物 |
| US20120035105A1 (en) | 2009-01-09 | 2012-02-09 | Sdg, Inc. | Insulin Therapies for the Treatment of Diabetes, Diabetes Related Ailments, and/or Diseases or Conditions Other Than Diabetes or Diabetes Related Ailments |
| CN102449561B (zh) | 2009-04-26 | 2014-06-18 | 耐克国际有限公司 | 在运动手表系统中的gps特征和功能 |
| US20100303966A1 (en) | 2009-05-28 | 2010-12-02 | Gregory Dean Sunvold | Pet Food in the Form of a Coated Kibble |
| US20100303967A1 (en) | 2009-05-28 | 2010-12-02 | Gregory Dean Sunvold | Pet Food Having Improved Animal Preference |
| CA2761704C (en) | 2009-05-28 | 2015-04-07 | The Iams Company | Pet food in the form of a coated kibble |
| CN102573496B (zh) | 2009-07-01 | 2015-08-26 | 玛格塞蒂克斯公司 | 缓释镁组合物及其用途 |
| US20120129785A1 (en) | 2009-07-21 | 2012-05-24 | Hill's Pet Nutrition, Inc. | Companion animal nutrition system |
| US8691303B2 (en) | 2009-07-31 | 2014-04-08 | The Iams Company | Dusted animal food |
| US20110027417A1 (en) | 2009-07-31 | 2011-02-03 | Patrick Joseph Corrigan | Process for Dusting Animal Food |
| US20110064712A1 (en) | 2009-09-16 | 2011-03-17 | Daniel Moses Amato | Dietary Supplement Compositions and Methods of Making and Using the Same |
| US20110070258A1 (en) | 2009-09-18 | 2011-03-24 | Polifenoles Naturales, S.L. | Method of slowing the aging process by activating sirtuin enzymes |
| WO2011051974A1 (en) | 2009-10-29 | 2011-05-05 | Nutracryst Therapeutics Private Limited | Metformin and a-amino acids |
| US8173181B2 (en) | 2009-11-09 | 2012-05-08 | Bio-Engineered Supplements & Nutrition, Inc. | Method and composition for improved anabolism |
| RU2513262C2 (ru) | 2009-12-29 | 2014-04-20 | Хилл'С Пет Ньютришн, Инк. | Композиции, включающие пируват, для животных-компаньонов и способы их применения |
| JP5820819B2 (ja) | 2010-01-06 | 2015-11-24 | ネステク ソシエテ アノニム | カロリー制限の模倣に有効な食餌療法 |
| US20110208153A1 (en) | 2010-02-24 | 2011-08-25 | John Alvey | Formulations and methods for nutrient delivery |
| EP2564858A4 (en) | 2010-04-28 | 2013-10-30 | Nihon Pharmaceutical Co Ltd | COMPOSITION FOR THE TREATMENT OF ASTHENOPIA |
| US20120058088A1 (en) | 2010-06-28 | 2012-03-08 | Resveratrol Partners, Llc | Resveratrol-Containing Compositions And Methods Of Use |
| CN102077936B (zh) | 2010-09-20 | 2013-04-24 | 王强 | 一种糖尿病患者专用的海洋特膳食品 |
| US9167991B2 (en) | 2010-09-30 | 2015-10-27 | Fitbit, Inc. | Portable monitoring devices and methods of operating same |
| AU2012204162B2 (en) | 2011-01-07 | 2017-04-20 | Anji Pharmaceuticals Inc. | Chemosensory receptor ligand-based therapies |
| WO2012097064A1 (en) | 2011-01-13 | 2012-07-19 | Abbott Laboratories | Nutritional compositions and methods for controlling blood glucose |
| CN102228521A (zh) * | 2011-06-29 | 2011-11-02 | 田景振 | 一种治疗早中期糖尿病肾病的中药新药 |
| AU2012284267B2 (en) | 2011-07-15 | 2017-06-29 | Nusirt Sciences, Inc. | Compositions and methods for modulating metabolic pathways |
| CA2845829A1 (en) | 2011-08-19 | 2013-02-28 | Musclepharm Corporation | Compositions and methods for use in promoting lean body mass |
| US9198454B2 (en) | 2012-03-08 | 2015-12-01 | Nusirt Sciences, Inc. | Compositions, methods, and kits for regulating energy metabolism |
| KR101409330B1 (ko) | 2012-05-11 | 2014-06-18 | 안국약품 주식회사 | 복용순응도가 향상된 서방성 당뇨병 치료용 복합제제 및 이의 제조방법 |
| US9943517B2 (en) | 2012-11-13 | 2018-04-17 | Nusirt Sciences, Inc. | Compositions and methods for increasing energy metabolism |
| CN105101958B (zh) | 2013-01-15 | 2019-05-17 | 纽斯尔特科学公司 | 治疗肺病状 |
| AU2014236687A1 (en) | 2013-03-15 | 2015-09-10 | Nusirt Sciences, Inc. | Leucine and nicotinic acid reduces lipid levels |
| CA2903752A1 (en) | 2013-03-15 | 2014-09-25 | Nusirt Sciences, Inc. | Treatment of pets with sirtuin activators |
| EP3054940B1 (en) | 2013-10-07 | 2020-09-23 | Mochida Pharmaceutical Co., Ltd. | Compositions and methods for treating non-alcoholic steatohepatitis |
| CN106456997B (zh) | 2014-02-27 | 2018-12-28 | 纽斯尔特科学公司 | 用于减少或预防肝性脂肪变性的组合物和方法 |
| EP3197437A4 (en) | 2014-09-24 | 2018-05-23 | NuSirt Sciences, Inc. | Compositions, methods and kits for treatment of diabetes and/or hyperlipidemia |
| WO2017040407A1 (en) | 2015-09-01 | 2017-03-09 | Nusirt Sciences, Inc. | Compositions and methods for the reduction or prevention of non-alcoholic steatohepatitis (nash) |
-
2013
- 2013-11-13 US US14/442,711 patent/US9943517B2/en active Active
- 2013-11-13 CN CN201810199650.1A patent/CN108452311A/zh active Pending
- 2013-11-13 RU RU2015122755A patent/RU2655794C2/ru active
- 2013-11-13 BR BR112015010947A patent/BR112015010947A2/pt not_active IP Right Cessation
- 2013-11-13 CN CN201810199503.4A patent/CN108295058A/zh active Pending
- 2013-11-13 EP EP13854549.6A patent/EP2919772B1/en active Active
- 2013-11-13 CA CA2891335A patent/CA2891335C/en active Active
- 2013-11-13 AU AU2013344753A patent/AU2013344753B2/en not_active Ceased
- 2013-11-13 WO PCT/US2013/069957 patent/WO2014078459A1/en active Application Filing
- 2013-11-13 SG SG10201709195TA patent/SG10201709195TA/en unknown
- 2013-11-13 CN CN201380070248.9A patent/CN104918610B/zh not_active Expired - Fee Related
- 2013-11-13 KR KR1020157015622A patent/KR20150082623A/ko not_active Application Discontinuation
- 2013-11-13 MX MX2015006023A patent/MX2015006023A/es unknown
- 2013-11-13 JP JP2015542039A patent/JP6469015B2/ja active Active
- 2013-11-13 SG SG11201503774PA patent/SG11201503774PA/en unknown
-
2015
- 2015-05-10 IL IL238726A patent/IL238726B/en active IP Right Grant
- 2015-05-13 PH PH12015501062A patent/PH12015501062A1/en unknown
-
2016
- 2016-01-15 HK HK16100472.9A patent/HK1212594A1/zh unknown
-
2018
- 2018-02-07 US US15/891,324 patent/US10646489B2/en active Active
- 2018-11-17 AU AU2018264157A patent/AU2018264157A1/en not_active Abandoned
-
2020
- 2020-04-08 US US16/843,132 patent/US20200338078A1/en not_active Abandoned
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20190114500A (ko) * | 2018-03-30 | 2019-10-10 | 건국대학교 산학협력단 | 에피갈로카테킨 갈레이트 프로드러그, 이의 제조방법 및 이를 포함하는 미토콘드리아 생합성 촉진용 조성물 |
| KR20200108399A (ko) * | 2018-10-24 | 2020-09-18 | 전남대학교산학협력단 | 녹차 카테킨을 포함하는 중성지방 저감용 식품 조성물, 대사성 질환 개선용 식품 조성물 및 대사성 질환 예방 또는 치료용 약학 조성물 |
Also Published As
| Publication number | Publication date |
|---|---|
| IL238726A0 (en) | 2015-06-30 |
| US9943517B2 (en) | 2018-04-17 |
| CN104918610B (zh) | 2018-04-10 |
| RU2655794C2 (ru) | 2018-05-29 |
| EP2919772B1 (en) | 2019-03-27 |
| JP6469015B2 (ja) | 2019-02-13 |
| SG11201503774PA (en) | 2015-06-29 |
| CN108452311A (zh) | 2018-08-28 |
| AU2018264157A1 (en) | 2018-12-06 |
| BR112015010947A2 (pt) | 2018-06-05 |
| AU2013344753B2 (en) | 2018-09-27 |
| CN108295058A (zh) | 2018-07-20 |
| HK1212594A1 (zh) | 2016-06-17 |
| US20180235970A1 (en) | 2018-08-23 |
| SG10201709195TA (en) | 2017-12-28 |
| IL238726B (en) | 2020-02-27 |
| US10646489B2 (en) | 2020-05-12 |
| MX2015006023A (es) | 2016-03-31 |
| EP2919772A1 (en) | 2015-09-23 |
| CN104918610A (zh) | 2015-09-16 |
| RU2015122755A (ru) | 2017-01-10 |
| EP2919772A4 (en) | 2016-06-08 |
| CA2891335C (en) | 2021-05-04 |
| PH12015501062A1 (en) | 2015-08-17 |
| CA2891335A1 (en) | 2014-05-22 |
| US20200338078A1 (en) | 2020-10-29 |
| AU2013344753A1 (en) | 2015-06-04 |
| JP2015537002A (ja) | 2015-12-24 |
| US20160279130A1 (en) | 2016-09-29 |
| WO2014078459A1 (en) | 2014-05-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20200338078A1 (en) | Compositions and methods for increasing energy metabolism | |
| US10383837B2 (en) | Compositions and methods for modulating metabolic pathways | |
| US9724319B2 (en) | Compositions and methods for the reduction or prevention of hepatic steatosis | |
| US20180235917A1 (en) | Compositions, methods and kits for treatment of diabetes and/or hyperlipidemia |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |