KR20140067368A - 염산 에페리손의 제조방법 - Google Patents
염산 에페리손의 제조방법 Download PDFInfo
- Publication number
- KR20140067368A KR20140067368A KR1020120134515A KR20120134515A KR20140067368A KR 20140067368 A KR20140067368 A KR 20140067368A KR 1020120134515 A KR1020120134515 A KR 1020120134515A KR 20120134515 A KR20120134515 A KR 20120134515A KR 20140067368 A KR20140067368 A KR 20140067368A
- Authority
- KR
- South Korea
- Prior art keywords
- hydrochloride
- reaction
- paraformaldehyde
- piperidine hydrochloride
- ketone compound
- Prior art date
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/04—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms
- C07D295/10—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by doubly bound oxygen or sulphur atoms
- C07D295/104—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by doubly bound oxygen or sulphur atoms with the ring nitrogen atoms and the doubly bound oxygen or sulfur atoms attached to the same carbon chain, which is not interrupted by carbocyclic rings
- C07D295/108—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by doubly bound oxygen or sulphur atoms with the ring nitrogen atoms and the doubly bound oxygen or sulfur atoms attached to the same carbon chain, which is not interrupted by carbocyclic rings to an acyclic saturated chain
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4453—Non condensed piperidines, e.g. piperocaine only substituted in position 1, e.g. propipocaine, diperodon
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C49/00—Ketones; Ketenes; Dimeric ketenes; Ketonic chelates
- C07C49/04—Saturated compounds containing keto groups bound to acyclic carbon atoms
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Hydrogenated Pyridines (AREA)
Abstract
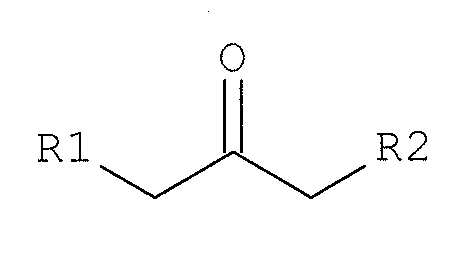
원-폿(one-pot) 반응 및 여과 공정 만으로 염산 에페리손을 제조하는 방법이 개시된다. 상기 염산 에페리손의 제조방법은, 유기 용매 중에서, 4'-에틸프로피오페논, 파라포름알데하이드, 및 염산 피페리딘을 반응시켜, 염산 에페리손을 합성하고, 상기 반응 혼합물에 하기 화학식 2로 표시되는 케톤 화합물을 첨가하여, 미반응 파라포름알데하이드 및 염산 피페리딘과 반응시키는 단계,
[화학식 2]
상기 화학식 2에서, R1은 수소 또는 메틸기이고, R2는 메틸 또는 에틸기를 나타낸다; 및 상기 반응에서 생성된 결정을 여과하는 단계를 포함한다.
[화학식 2]
상기 화학식 2에서, R1은 수소 또는 메틸기이고, R2는 메틸 또는 에틸기를 나타낸다; 및 상기 반응에서 생성된 결정을 여과하는 단계를 포함한다.
Description
본 발명은 염산 에페리손의 제조방법에 관한 것으로서, 더욱 상세하게는, 원-폿(one-pot) 반응 및 여과 공정 만으로 염산 에페리손을 제조하는 방법에 관한 것이다.
염산 에페리손(Eperisone hydrochloride)은 항-트레모린(anti-tremorine) 및 항-니코틴(anti-nicotine) 활성을 가지는 화합물로서(미국특허출원 530,499호, 미국특허 3995047호, 미국특허 4181803호 등 참조), 최근까지 근이완제로 유용하게 사용되고 있다. 염산 에페리손의 합성방법은 미국특허 3995047호, 미국특허 4181803호 등에 개시되어 있으며, 상기 특허들에 개시된 방법에 있어서는, 이소프로필알코올(IPA, isopropyl alcohol) 용매 중에서, 4'-에틸프로피오페논, 파라포름알데하이드 (paraformaldehyde) 및 염산 피페리딘(piperidine.HCl)을 환류(reflux) 반응시켜 염산 에페리손을 합성한다. 그러나, 상기 반응에 있어서는, 고온에서 다량의 미확인 부산물이 생성될 뿐만 아니라, 이소프로필알코올 및 아세톤(acetone)에 대한 용해도가 낮은 미반응 파라포름알데하이드 및 염산 피페리딘이 존재하므로, 재결정에 의하여 염산 에페리손을 추가로 정제하는 공정이 필요하다. 따라서, 상술한 종래의 염산 에페리손의 합성 방법은, 공정이 길고, 수율이 낮은 단점이 있다.
따라서, 본 발명의 목적은, 상술한 종래 기술의 단점을 해소하여, 추가적인 정제 공정이 불필요하고, 원-폿(one-pot) 반응 및 여과 공정 만으로 목적하는 염산 에페리손을 제조하는 방법을 제공하는 것이다.
본 발명의 다른 목적은, 고수율 및 고순도로 염산 에페리손을 대량 생산할 수 있는 방법을 제공하는 것이다.
상기 목적을 달성하기 위하여, 본 발명은, 유기 용매 중에서, 4'-에틸프로피오페논, 파라포름알데하이드, 및 염산 피페리딘을 반응시켜, 염산 에페리손을 합성하고, 상기 반응 혼합물에 하기 화학식 2로 표시되는 케톤 화합물을 첨가하여, 미반응 파라포름알데하이드 및 염산 피페리딘과 반응시키는 단계,
[화학식 2]
상기 화학식 2에서, R1은 수소 또는 메틸기이고, R2는 메틸 또는 에틸기를 나타낸다; 및 상기 반응에서 생성된 결정을 여과하는 단계를 포함하는 염산 에페리손의 제조방법을 제공한다.
본 발명에 따른 염산 에페리손의 제조 방법은, 원-폿(one-pot) 반응으로 반응을 수행할 수 있으므로, 공정이 단순하고, 케톤 화합물을 이용하여, 파라포름알데하이드 및 염산피페리딘을 반응시켜 제거함으로써, 추가적인 정제 공정이 불필요하며, 고수율 및 고순도로 염산 에페리손을 제조할 수 있다.
이하, 본 발명을 상세히 설명한다.
본 발명에 따른 염산 에페리손의 제조방법은, 하기 반응식 1에 나타낸 바와 같이, 종래의 방법과 유사하게, 4'-에틸프로피오페논, 파라포름알데하이드, 및 염산 피페리딘을 반응시켜, 염산 에페리손의 합성 반응을 진행하고(단계 1), 상기 반응 혼합물에 케톤 화합물을 첨가하여, 잔류하는, 즉, 미반응 파라포름알데하이드 및 염산 피페리딘과 반응시킨(단계 2) 다음, 반응에서 생성된 결정을 여과함으로서, 고순도 및 고수율로 하기 화학식 1로 표시되는 염산 에페리손을 대량 생산할 수 있다. 여기서, 상기 단계 1 및 2는 원-폿(one-pot) 반응으로 수행될 수 있고, 상기 여과 단계는 반응 혼합물을 실온으로 냉각한 후 수행될 수 있다.
[반응식 1]
종래의 방법에 있어서는, 상기 반응식 1의 단계 1에서, 이소프로필알코올 (IPA, isopropyl alcohol) 및 아세톤에 대한, 파라포름알데하이드 및 염산 피페리딘의 용해도가 매우 낮으며, 이를 보완하기 위하여, 파라포름알데하이드 및 염산 피페리딘을 과량 사용하면, 반응 후 상당량의 파라포름알데하이드 및 염산 피페리딘이 잔류하게 된다. 또한, 이소프로필알코올 중에서, 고온 환류(reflux) 반응을 수행하면, 다량의 미확인 부산물이 생성되어, 추가적인 정제 공정이 필요하게 된다.
본 발명에 있어서는, 용해도가 낮은 파라포름알데하이드 및 염산 피페리딘과 반응할 수 있는, 하기 화학식 2로 표시되는 케톤 화합물(ketone compound)을 첨가하여, 반응 혼합물로부터 미반응 파라포름알데하이드 및 염산 피페리딘를 제거한다.
[화학식 2]
상기 화학식 2에서, R1은 수소 또는 메틸기이고, R2는 메틸 또는 에틸기를 나타낸다. 상기 화학식 2로 표시되는 케톤 화합물로는 2-부타논(2-Butanone, methylethylketone), 2-펜타논(pentanone), 3-펜타논, 이들의 혼합물 등의 화합물을 예시할 수 있다.
상기 화학식 2로 표시되는 케톤 화합물과 파라포름알데하이드 및 염산 피페리딘를 혼합하고, 가열 환류에 의하여 반응시키면, 하기 반응식 2에 나타낸 바와 같이, 용해도가 증가된 화학식 3으로 표시되는 화합물이 생성된다. 상기 화학식 3으로 표시되는 화합물은, 냉각 및 여과에 의하여 염산 에페리손 결정을 얻는 최종 단계에서, 용액 중에 용해되어 제거되므로, 재결정 등, 추가적인 정제공정이 없이도, 고순도 및 고수율로 염산 에페리손을 제조할 수 있다.
[반응식 2]
본 발명에 따른 염산 에페리손의 제조방법에 있어서, 파라포름알데하이드의 사용량은, 염산 피페리딘 1 당량에 대하여, 파라포름알데하이드의 포름알데하이드 함량 기준으로 1.0 ~ 1.5 당량, 바람직하게는 1.2 ~ 1.3 당량이 되도록 사용될 수 있다. 상기 파라포름알데하이드의 사용량이 너무 적으면, 염산 에페리손의 수율이 저하되고, 상기 파라포름알데하이드의 사용량이 너무 많으면, 추가적인 장점이 없이, 최종 목적 화합물에 미량의 파라포름알데하이드가 잔류할 우려가 있다. 상기 4'-에틸프로피오페논의 사용량은, 염산 피페리딘에 1 당량에 대하여, 1.0 ~ 1.3 당량, 바람직하게는 1.1 ~ 1.2 당량을 사용할 수 있다. 상기 4'-에틸프로피오페논의 사용량이 너무 적으면, 염산 에페리손의 수율이 저하되고, 염산 피페리딘의 잔류량이 증가하며, 상기 4'-에틸프로피오페논의 사용량이 너무 많으면, 추가적인 장점이 없이, 경제적으로 불리하다. 본 발명에 따른 염산 에페리손의 제조방법에 사용될 수 있는 용매로는 이소프로필알코올, 에탄올, 메탄올, 프로필알코올 등의 저급 알코올 용매를 사용할 수 있으며, 바람직하게는 이소프로필알코올을 사용할 수 있다. 상기 용매의 사용량은, 반응속도, 경제성 등을 고려하여 적절히 설정할 수 있지만, 비한정적으로, 염산 피페리딘의 사용량에 대하여, 0.4 ~ 0.8 배 (w/v, 염산 피페리딘 질량(g)에 대한 용매의 부피(ml) 비율), 바람직하게는 0.5 ~ 0.6 배 (w/v)를 사용할 수 있다.
본 발명에 따른 염산 에페리손의 제조 반응의 반응 온도는, 특히 한정하는 것은 아니나, 바람직하게는 80 ~ 90 ℃이고, 더욱 바람직하게는 84 ~ 87 ℃이다. 상기 반응 온도가 너무 높으면, 반응 부산물이 생성될 우려가 있고, 상기 반응 온도가 너무 낮으면, 반응 시간이 길어질 우려가 있다. 반응 시간도, 특히 한정하는 것은 아니나, 바람직하게는 약 4 ~ 8 시간이며, 더욱 바람직하게는 약 6 ~ 7 시간이다. 상기 반응 시간이 너무 짧으면, 반응이 충분히 진행되지 않아, 수율이 저하될 우려가 있고, 상기 반응 시간이 너무 길면, 특별한 이익이 없이, 경제적으로 바람직하지 못하다.
상기 화학식 2로 표시되는 케톤 화합물의 사용량은, 미반응 파라포름알데하이드 및 염산 피페리딘과 반응할 수 있는 양으로서, 반응 혼합물에 잔류하는 파라포름알데하이드 및 염산 피페리딘의 양에 따라 달라질 수 있으나, 이소프로필알코올 등의 용매 사용량에 대하여, 바람직하게는 약 3 내지 15 배(v/v), 더욱 바람직하게는 약 7 내지 11 배(v/v), 더더욱 바람직하게는 8 ~ 9 배 (v/v)를 사용할 수 있다. 상기 케톤 화합물의 사용량이 너무 적으면, 용매에 대한 용해도가 낮은 파라포름알데하이드 및 염산 피페리딘를 충분히 제거할 수 없고, 상기 케톤 화합물의 사용량이 너무 많아도, 추가적인 장점이 없이, 경제적으로 바람직하지 못하다. 상기 화학식 2로 표시되는 케톤 화합물과 파라포름알데하이드 및 염산 피페리딘의 반응은, 가열 환류하면서, 예를 들면, 가열 환류 온도에서 수행되는 것이 바람직하다. 이때, 상기 케톤 화합물의 반응 시간은 바람직하게는 약 30 분 ~ 2시간, 더욱 바람직하게는 1 ~ 1.5 시간이며, 반응 온도는 바람직하게는 70 내지 85 ℃, 더욱 바람직하게는 75 내지 80 ℃이다. 상기 반응 시간이 너무 짧거나, 반응 온도가 너무 낮으면, 반응이 불충분하게 진행되어, 포름알데하이드 및 염산 피페리딘이 생성물인 염산 에페리손에 잔류할 우려가 있고, 상기 반응 시간이 너무 길거나, 반응 온도가 너무 높으면, 추가적인 장점이 없이, 부산물이 생성될 우려가 있다. 상기 케톤 화합물로서 아세톤을 사용하는 경우, 가열 환류 온도가 낮아, 파라포름알데하이드 및 염산 피페리딘의 제거 반응이 효율적으로 진행되지 않고, 최종 염산 에페리손에 이들 화합물이 잔류하는 문제가 있다. 한편, 상기 케톤 화합물로서 2-펜타논 또는 3-펜타논을 사용하면, 상기 화합물들의 끓는점이 약 100 ℃ 이므로, 가열 환류 온도를 약 75 내지 85 ℃, 바람직하게는 80 ℃로 조절할 필요가 있고, 건조에 의한 제거가 용이하지 않은 단점이 있다. 따라서, 상기 화학식 2의 케톤 화합물로는, 적절한 끓는점을 가져, 가열 환류 시 적절한 반응 온도를 설정할 수 있는 2-부타논을 사용하는 것이 가장 바람직하다.
이하, 실시예 및 비교예를 통해 본 발명을 더욱 상세하게 설명하나, 본 발명이 하기 실시예에 한정되는 것은 아니다.
[비교예] 염산 에페리손의 제조
미국특허 3995047호, 미국특허 4181803호 등에 개시된 방법에 따라, 60 ml의 이소프로필알코올에 120 g의 4'-에틸프로피오페논, 28.8 g의 파라포름알데하이드, 107 g의 염산 피페리딘을 넣고 가열 환류 반응시켰다. 반응 혼합물에 고체가 형성되면, 500 ml의 아세톤을 첨가하고 냉각시켰다. 생성된 고체를 분쇄 및 여과하고, 아세톤으로 세척하여 조생성물 144 g을 얻었다(수율: 65.8%). 얻어진 조생성물을 분석한 결과, 염산 피페리딘의 함량은 0.2 중량%를 많이 초과하였고, 파라포름알데하이드의 함량은 100 ppm을 초과하였다.
[실시예 1] 염산 에페리손의 제조
1000 ml 용량의 반응기에, 4'-에틸프로피오페논 93 g, 파라포름알데하이드 18 g, 염산 피페리딘 61 g 및 이소프로필알코올 46 ml를 넣고, 80 ~ 85 ℃에서, 8시간 동안 반응시켰다. 반응이 완결된 후, 메틸에틸케톤(MEK) 373 ml를 재빨리 첨가하고, 60분 동안 환류(reflux)시켰다. 반응 혼합물을 실온으로 냉각한 후, 생성된 결정을 여과하고, 아세톤으로 세척하고, 60 ℃에서 건조하여, 목적 화합물 125.7 g을 얻었다(수율: 85%). 얻어진 생성물을 분석한 결과, 융점(m.p.)은 167 ~ 168 ℃였고, 염산 피페리딘의 함량은 0.2 중량% 미만, 파라포름알데하이드의 함량은 0 ppm 이었고, HPLC(high performance liquid chromatography )에 의한 순도(purity)는 99.98%였다.
[실시예 2] 염산 에페리손의 제조
1000 ml 용량의 반응기에, 4'-에틸프로피오페논 93 g, 파라포름알데하이드 18 g, 염산 피페리딘 61 g 및 이소프로필알코올 46 ml를 넣고, 80 ~ 85 ℃에서, 8시간 동안 반응시켰다. 반응이 완결된 후, 2-펜타논(pentanone) 373 ml를 재빨리 첨가하고, 80 ℃에서 60분 동안 반응시켰다. 반응 혼합물을 실온으로 냉각한 후, 생성된 결정을 여과하고, 아세톤으로 세척하고, 60 ℃에서 건조하여, 목적 화합물 116.7 g을 얻었다(수율: 79%). 얻어진 생성물을 분석한 결과, 융점(m.p.)은 166 ~ 167 ℃였고, 염산 피페리딘의 함량은 0.2 중량% 미만, 파라포름알데하이드의 함량은 0 ppm 이었고, HPLC(high performance liquid chromatography )에 의한 순도(purity)는 99.98%였다.
[실시예 3] 염산 에페리손의 제조
1000 ml 용량의 반응기에, 4'-에틸프로피오페논 93 g, 파라포름알데하이드 18 g, 염산 피페리딘 61 g 및 이소프로필알코올 46 ml를 넣고, 80 ~ 85 ℃에서, 8시간 동안 반응시켰다. 반응이 완결된 후, 3-펜타논(pentanone) 373 ml를 재빨리 첨가하고, 80 ℃에서 60분 동안 반응시켰다. 반응 혼합물을 실온으로 냉각한 후, 생성된 결정을 여과하고, 아세톤으로 세척하고, 60 ℃에서 건조하여, 목적 화합물 118.2 g을 얻었다(수율: 80%). 얻어진 생성물을 분석한 결과, 융점(m.p.)은 166 ~ 167 ℃였고, 염산 피페리딘의 함량은 0.2 중량% 미만, 파라포름알데하이드의 함량은 0 ppm 이었고, HPLC(high performance liquid chromatography )에 의한 순도(purity)는 99.97%였다.
Claims (4)
- 청구항 1에 있어서, 상기 케톤 화합물은 2-부타논, 2-펜타논, 3-펜타논 및 이들의 혼합물로 이루어진 군으로부터 선택되는 것인, 염산 에페리손의 제조방법.
- 청구항 1에 있어서, 상기 케톤 화합물의 사용량은 상기 유기 용매의 사용량에 대하여 3 내지 15 배(v/v)인 것인, 염산 에페리손의 제조방법.
- 청구항 1에 있어서, 상기 케톤 화합물의 반응 시간은 30 분 ~ 2시간이며, 반응 온도는 70 내지 85 ℃인 것인, 염산 에페리손의 제조방법.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020120134515A KR101462468B1 (ko) | 2012-11-26 | 2012-11-26 | 염산 에페리손의 제조방법 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020120134515A KR101462468B1 (ko) | 2012-11-26 | 2012-11-26 | 염산 에페리손의 제조방법 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20140067368A true KR20140067368A (ko) | 2014-06-05 |
| KR101462468B1 KR101462468B1 (ko) | 2014-11-18 |
Family
ID=51123622
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020120134515A KR101462468B1 (ko) | 2012-11-26 | 2012-11-26 | 염산 에페리손의 제조방법 |
Country Status (1)
| Country | Link |
|---|---|
| KR (1) | KR101462468B1 (ko) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN110845443A (zh) * | 2019-12-11 | 2020-02-28 | 嘉实(湖南)医药科技有限公司 | 一种制备高纯度盐酸托哌酮的方法 |
| CN117209455A (zh) * | 2023-08-31 | 2023-12-12 | 北京沃邦医药科技有限公司 | 一种盐酸乙哌立松的精制纯化方法 |
| CN117209455B (zh) * | 2023-08-31 | 2024-05-28 | 北京沃邦医药科技有限公司 | 一种盐酸乙哌立松的精制纯化方法 |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3995047A (en) | 1973-12-14 | 1976-11-30 | Eisai Co., Ltd. | Propiophenone derivatives in the treatment of pathological muscular conditions |
| HU33131A (ko) | 1984-01-26 | 1984-10-29 | ||
| JPH03115267A (ja) | 1989-09-28 | 1991-05-16 | Maruho Kk | プロピオフエノン誘導体、その製造方法、それを含む中枢性筋弛緩剤および抗痙攣剤 |
| CA2815460C (en) | 2011-01-13 | 2017-04-18 | Bio-Pharm Solutions Co., Ltd. | Process for preparation of phenyl carbamate derivatives |
-
2012
- 2012-11-26 KR KR1020120134515A patent/KR101462468B1/ko active IP Right Grant
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN110845443A (zh) * | 2019-12-11 | 2020-02-28 | 嘉实(湖南)医药科技有限公司 | 一种制备高纯度盐酸托哌酮的方法 |
| CN110845443B (zh) * | 2019-12-11 | 2023-09-05 | 嘉实(湖南)医药科技有限公司 | 一种制备高纯度盐酸托哌酮的方法 |
| CN117209455A (zh) * | 2023-08-31 | 2023-12-12 | 北京沃邦医药科技有限公司 | 一种盐酸乙哌立松的精制纯化方法 |
| CN117209455B (zh) * | 2023-08-31 | 2024-05-28 | 北京沃邦医药科技有限公司 | 一种盐酸乙哌立松的精制纯化方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| KR101462468B1 (ko) | 2014-11-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP3728215B1 (en) | One-pot process for the preparation of racemic nicotine by reaction of ethyl nicotinate with n-vinylpyrrolidone in the presence of sodium ethanolate or potassium ethanolate or mixtures thereof | |
| KR20130129180A (ko) | 아미노벤조일벤조푸란 유도체의 제조 방법 | |
| KR101462468B1 (ko) | 염산 에페리손의 제조방법 | |
| JPS6112658A (ja) | アゼチジン誘導体の製法およびその中間体 | |
| CA1127647A (fr) | Procede d'isomerisation des derives de la vinyl-3 piperidine | |
| JP5071795B2 (ja) | ベンゾオキサチイン化合物の製造方法 | |
| JP4587202B2 (ja) | フェニルオキサジアゾール類の製造法 | |
| CN112430205B (zh) | 芳基吡咯类化合物的制备方法 | |
| JP2007515403A5 (ko) | ||
| KR20140124880A (ko) | 다이(아미노구아니듐) 4,4’,5,5’-테트라나이트로-2,2’-바이이미다졸 및 이의 제조 방법 | |
| JP7367147B2 (ja) | テルペノイドアミノアルコール誘導体を精製するための方法 | |
| JP4144223B2 (ja) | クロモン誘導体の製造方法 | |
| KR20170080190A (ko) | 1,5-쌍극자의 [5+3] 고리화 첨가 반응을 이용한 8원 헤테로 고리 화합물의 제조 방법 및 이에 의해 제조된 8원 헤테로 고리 화합물 | |
| JP2007176952A (ja) | 2−アミノ−2−アリールエタノールおよび新規中間体の製造方法 | |
| JPS63152336A (ja) | プロパルギルアルコ−ル類と第三級ジアミン類との結晶性錯化合物及びそれを用いるプロパルギルアルコ−ル類の分離精製方法 | |
| CN117402144A (zh) | 一种3cl蛋白酶抑制剂的制备方法 | |
| JP5142241B2 (ja) | ニコチン酸エステル化合物の製造方法 | |
| JP5843106B2 (ja) | 4−置換ピペリジン−2−カルボニトリル類の製造方法及び4−置換ピペリジン−2−カルボン酸類鉱酸塩の製造方法 | |
| KR100902236B1 (ko) | 펜에틸 벤조에이트 유도체 및 그의 제조방법 | |
| RU2673237C2 (ru) | Способ получения очищенного соединения | |
| EP3339300A1 (en) | Method for preparing thienyl alanine having optical activity | |
| JPH0543512A (ja) | ジシクロペンタジエン誘導体 | |
| KR101438538B1 (ko) | 리코찰콘 d의 전합성 방법 | |
| EP3256456A1 (en) | Process of production of cyclo-dehydrolinalool (ii) | |
| JPS6377843A (ja) | N,n,n′,n′−テトラアリ−ルベンジジン化合物の製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20171107 Year of fee payment: 4 |
|
| FPAY | Annual fee payment |
Payment date: 20181112 Year of fee payment: 6 |