KR20140063829A - 오차 보상을 갖는 바이오센서 - Google Patents
오차 보상을 갖는 바이오센서 Download PDFInfo
- Publication number
- KR20140063829A KR20140063829A KR1020147010121A KR20147010121A KR20140063829A KR 20140063829 A KR20140063829 A KR 20140063829A KR 1020147010121 A KR1020147010121 A KR 1020147010121A KR 20147010121 A KR20147010121 A KR 20147010121A KR 20140063829 A KR20140063829 A KR 20140063829A
- Authority
- KR
- South Korea
- Prior art keywords
- function
- output signal
- sample
- error
- signal processing
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/19—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles lyophilised, i.e. freeze-dried, solutions or dispersions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/197—Carboxylic acids, e.g. valproic acid having an amino group the amino and the carboxyl groups being attached to the same acyclic carbon chain, e.g. gamma-aminobutyric acid [GABA], beta-alanine, epsilon-aminocaproic acid, pantothenic acid
- A61K31/198—Alpha-aminoacids, e.g. alanine, edetic acids [EDTA]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
- G01N27/26—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating electrochemical variables; by using electrolysis or electrophoresis
- G01N27/28—Electrolytic cell components
- G01N27/30—Electrodes, e.g. test electrodes; Half-cells
- G01N27/327—Biochemical electrodes, e.g. electrical or mechanical details for in vitro measurements
- G01N27/3271—Amperometric enzyme electrodes for analytes in body fluids, e.g. glucose in blood
- G01N27/3274—Corrective measures, e.g. error detection, compensation for temperature or hematocrit, calibration
Abstract
바이오센서 시스템은 분석물의 광식별성 종 또는 산화환원 반응으로부터 발생되는 출력 신호로부터 분석물 농도를 결정한다. 그러한 바이오센서는 예를 들어 혈액 내 포도당 농도를 결정할 수 있다. 바이오센서 시스템은 일차 함수로 출력 신호에서의 총 오차의 50% 이상을 보상하고, 하나 이상의 잔여 함수로 잔여 오차의 일부를 보상할 수 있다. 세그먼트화 신호 처리(SSP)에 기초한 함수는 일차 함수, 제1 잔여 함수, 또는 제2 잔여 함수로 작용할 수 있다. 바람직하게, SSP 함수가 제1 잔여 함수로 작용할 때, SSP 함수는 일차 보상 후에 남는 잔여 오차의 50% 이상을 보상한다. 바람직하게, SSP 함수가 제2 잔여 함수로 작용할 때, SSP 함수는 일차 및 제1 잔여 보상 후에 남는 잔여 오차의 50% 이상을 보상한다. 일차 함수, 제1 잔여 함수 및 제2 잔여 함수에 의해 제공되는 오차 보상은 함수 가중 계수로 조정될 수 있다.
Description
관련 출원에 대한 참조
본원은 2011년 9월 21일자로 출원된, 발명의 명칭이 "세그먼트화 신호 처리를 포함하는 분석 보상(Analysis Compensation Including Segmented Signal Processing)"인 미국 가특허출원 번호 제61/537,145호의 이익을 주장하며, 이의 전문이 본원에 참조 인용된다.
바이오센서 시스템은 생물학적 유체 시료, 예컨대 혈액, 혈청, 혈장, 소변, 타액, 장내 유체 또는 세포내 유체의 분석을 제공한다. 전형적으로, 상기 시스템은 시험 센서 내에 있는 시료를 분석하는 측정 장치를 포함한다. 시료는 통상 액체 형태이고, 생물학적 유체 외에도, 생물학적 유체의 유도체, 예컨대 추출액, 희석액, 여액 또는 재구성 석출액일 수 있다. 바이오센서 시스템에 의해 수행되는 분석으로써, 생물학적 유체 내 하나 이상의 분석물, 예컨대 알코올, 포도당, 요산, 락트산염, 콜레스테롤, 빌리루빈, 유리 지방산, 트리글리세라이드, 단백질, 케톤, 페닐알라닌 또는 효소의 존재 및/또는 농도가 결정된다. 분석은 생리학적 이상의 진단 및 치료에 유용할 수 있다. 예를 들어, 당뇨가 있는 사람은 바이오센서 시스템을 이용하여, 식이법 및/또는 의약물 처치에 맞게 조정하도록 혈액 내 포도당 수준을 결정할 수 있다.
헤모글로빈(Hb)을 포함하는 혈액 시료 내, 총 헤모글로빈 및 당화 헤모글로빈(HbA1c)의 존재 및/또는 농도가 결정될 수 있다. HbA1c(A1c %)는 당뇨 환자에서의 포도당 조절 상태를 반영하는 것으로서, 시험 전 3개월간에 걸친 평균 포도당 조절을 명찰할 수 있게 한다. 당뇨 개체에 있어, A1c %의 정확한 측정은 혈액 내 포도당 수준의 결정을 돕고, 식이 및/또는 의료에 대한 조정이 그 수준에 기초한다.
바이오센서 시스템은 하나 이상의 분석물을 분석하도록 설계될 수 있고, 상이한 부피의 생물학적 유체를 이용할 수 있다. 몇몇 시스템은 한 방울의 혈액, 예컨대 부피가 0.25 내지 15 마이크로리터(μL)인 혈액을 이용할 수 있다. 바이오센서 시스템은 벤치-탑(bench-top) 장치, 휴대용 장치등의 측정 장치를 이용하여 수행될 수 있다. 휴대형 측정 장치는 손에 잡히는 크기이고, 이로써 시료 내 하나 이상의 분석물의 확인 및/또는 정량화가 가능하다. 휴대형 측정 시스템의 예에는 바이엘 헬스케어(Bayer HealthCare; 미국 뉴욕주 태리타운 소재)제의 엘리트(Elite) 미터가 포함되고, 한편 벤치-탑 측정 시스템의 예에는 CH 인스트루먼츠(CH Instruments; 미국 텍사스주 오스틴 소재)로부터 입수가능한 일렉트로케미탈 워크스테이션(Electrochemical Workstation)이 포함된다.
바이오센서 시스템은 광학 및/또는 전기화학 방법을 이용하여, 생물학적 유체를 분석할 수 있다. 몇몇 광학 시스템에서, 분석물 농도는 광식별성 종, 예컨대 분석물이나 분석물과 반응하는 화학 지시약(chemical indicator)로부터 형성된 반응 또는 생성물과 상호작용하거나 그것에 의해 흡수된 빛을 측정함으로써 결정된다. 다른 광학 시스템에서, 화학 지시약은 여기 빔을 조사할 때 분석물에 대응하여 형광을 방출하거나 발광한다. 빛은 전기 출력 신호, 예컨대 전류 또는 전위로 변환될 수 있고, 이는 마찬가지로 전기화학 시스템으로부터 출력 신호로 처리될 수 있다. 어느 광학 시스템에서도, 시스템이 빛을 측정하여, 이를 시료의 분석물 농도와 상관시킨다.
흡광 광학 시스템에서, 화학적 지시약은 빛을 흡수하는 반응 생성물을 생성시킨다. 디아포라제와 같은 효소와 함께 테트라졸륨과 같은 화학 지시약이 사용될 수 있다. 테트라졸륨은 통상 분석물의 산화환원 반응에 대응하여 포르마잔(크로마젠)을 형성한다. 광원으로부터의 입사 입력 빔은 시료 쪽으로 유도된다. 광원은 레이저, 발광 다이오드 등일 수 있다. 입사 빔은 반응 생물에 의한 흡수를 위해 선택된 파장을 가질 수 있다. 입사 빔이 시료를 통과할 때, 반응 생성물은 입사 빔의 부분을 흡수하고, 이에 따라 입사 빔의 강도를 감쇠시키거나 감소시킨다. 입사 빔은 시료를 통해 검출기로부터 다시 반사되거나 검출기를 통해 투과될 수 있다. 검출기는 감쇠된 입사 빔(출력 신호)을 수집하고 측정한다. 반응 생성물에 의해 감쇠되는 빛의 양은 시료 내 분석물의 농도를 가리킨다.
광 발생 광학 시스템에서, 화학 검출기는 분석물 산화반응 반응에 대응하여 형광을 발하거나 발광한다. 검출기는 발생된 빛(출력 신호)을 수집하고 측정한다. 화학 지시약에 의해 생성된 빛의 양은 시료 내 분석물 농도를 가리킨다.
반사도를 이용하는 광학 시스템의 한 예는 혈액 내 A1c 헤모글로빈의 농도를 결정하는 층상 유동 A1c 시스템이다. 이 시스템은, 혈액이 시험 센서에 도입되어 시약과 반응한 후, 시약 막을 따라 유동하게 되는 면역검정 화학을 이용한다. 혈액과 접촉 시, A1c 항체 코팅 칼라 비드가 방출되어, 혈액 시료를 따라 검출 구역 1로 이동한다. 혈액 시료 내 A1c와 칼라 비드에 대한 검출 구역 1에 존재하는 A1c 펩티드 간의 경쟁으로 인해, A1c 항체에 부착되지 않은 칼라 비드는 구역 1에서 포획되어, 반사도 변화로부터 A1c 신호로서 검출된다. 또한 혈액 시료 내 총 헤모글로빈(THb)도 다른 혈액 처리 시약과 반응하여, 검출 구역 2로 하향류 이동하며, 그 구역에서 상이한 파장으로 측정된다. 혈액 시료 내 A1c의 농도를 결정하기 위해, 반사도 신호는 A1c 분석물 농도(A1c %)에 비례한다. 그러나, THb 측정을 위해, 구역 2 내의 반사도는 검출 시스템에 대해 THb(mg/dL)에 반비례한다.
전기화학 시스템에서, 분석물 농도는 시료에 입력 신호를 인가할 때 분석물의 산화/환원, 즉 산화환원 반응, 또는 분석물에 대응하는 종에 의해 발생된 전기 신호로부터 결정된다. 입력 신호는 전위 또는 전류일 수 있고, 예컨대 AC 신호가 DC 신호 오프셋과 함께 인가될 때와 같이, 신호는 불변, 가변, 또는 그의 조합일 수 있다. 입력 신호는 단일 펄스로서 인가되거나, 혹은 다중 펄스, 순서, 또는 주기로 인가될 수 있다. 효소 또는 유사 종은 산화환원 반응 동안 제1 종에서 제2 종으로의 전자 전달을 증진시키기 위해 시료에 첨가될 수 있다. 효소 또는 유사 종은 단일 분석물과 반응할 수 있고, 이에 따라 발생된 출력 신호의 부분에 특이성을 제공한다. 매개자를 사용하여, 효소의 산화 상태를 유지하고/하거나 분석물에서 전극으로의 전자 전달을 보조할 수 있다
전기화학 바이오센서 시스템은 통상 시험 센서의 전기 도체와 연결된 전기 접점을 가지는 측정 장치를 포함한다. 도체는 도전성 물질, 예컨대 고체 금속, 금속 페이스트, 도전성 탄소, 도전성 탄소 페이스트, 도전성 중합체 등으로 이루어질 수 있다. 전기 도체는 전형적으로 작동 전극, 상대 전극, 기준 전극, 및/또는 시료 저장소로 확장된 기타 전극에 연결된다. 하나 이상의 전기 도체가 또한 시료 저장소에 확장되어, 전극에 의해 제공되지 않는 작용성을 제공할 수도 있다.
측정 장치는 전기 접점을 통해 입력 신호를 시험 센서의 전기 도체에 인가한다. 전기 도체는 입력 신호를 전극을 통해 시료 저장소 내에 존재하는 시료에 전달한다. 분석물의 산화환원 반응은 입력 신호에 대응하여 전기 출력 신호를 발생시킨다. 시험 센서로부터의 전기 출력 신호는 전류(전류측정법(amperometry) 또는 전압-전류측정법(voltammetry)에 의해 발생), 전위(전위차법/검류법(potentiometry/galvanometry)에 의해 발생), 또는 누적 전하(전해측정법(coulometry)에 의해 발생)일 수 있다. 측정 장치는 출력 신호를 측정하고, 이를 시료 내 하나 이상의 분석물의 존재 및/또는 농도와 상관시키는 처리능을 가질 수 있다.
전해측정법에서, 전위를 시료에 인가하여, 분석물을 완전히 산화 또는 환원시킨다. 전해측정법을 이용한 바이오센서 시스템이 미국 특허 제6,120,676호에 기재되어 있다. 전류측정법에서는, 일정 전위(전압)의 전기 신호를 시험 센서의 전기 도체에 인가하고, 한편 측정된 출력 신호는 전류이다. 전류측정법을 이용한 바이오센서 시스템이 미국 특허 제5,620,579호; 제5,653,863호; 제6,153,069호; 및 제6,413,411호에 기재되어 있다. 전압-전류측정법에서, 변화하는 전위의 전기 신호를 생물학적 유체의 시료에 인가하고, 한편 측정된 출력은 전류이다. 개폐식(gated) 전류측정 및 개폐식 전압-전류측정에서는, WO 2007/013915 및 WO 2007/040913 각각에 기재된 바와 같은 펄스식 입력이 사용된다.
시료의 분석물 농도에 대응하는 출력 신호 값에는 분석 입력 신호로부터 수득된 값들이 포함된다. 시료의 분석물 농도에 대응하는 값에 실질적으로 독립적인 출력 신호 값에는 온도에 대응하는 값 및 간섭값, 예컨대 분석물이 예를 들어 포도당일 때 혈액 시료의 적혈구용적율 또는 아세트아미노펜 함량에 실질적으로 대응하는 값이 포함된다. 분석물 농도에 실질적으로 대응하지 않는 출력 신호는 이차 출력 신호로 칭해질 수 있는 바, 이는 분석물 또는 분석물에 대응하는 지시자에 의한 광 변경, 분석물, 또는 분석물에 대응하는 산화환원 매개자의 전기화학 산화환원 반응에 대응하는 일차 출력 신호가 아니기 때문이다. 이차 출력 신호는 시료 또는 다른 공급원, 예컨대 열전대로부터 발생할 수 있다.
많은 바이오센서 시스템들에서, 시험 센서가 생물 유기체의 외부, 내부 또는 부분적으로 내부에 사용하기 위해 적합화될 수 있다. 생물 유기체 외부에 사용될 때, 생물학적 유체의 시료가 시험 센서 내 시료 저장소에 도입될 수 있다. 시험 센서는 분석용 시료의 도입 전, 후 또는 중에 측정 장치 내에 배치될 수 있다. 생물 유기체의 내부 또는 부분적으로 내부에 있을 때, 시험 센서가 시료 내에 연속으로 침지될 수 있거나, 시료는 간헐적으로 시험 센서에 도입될 수 있다. 시험 센서는 시료의 부피를 부분적으로 단리하는 저장소를 포함하거나, 시료에 개방될 수 있다. 개방 시에, 시험 센서는 생물학적 유체와 접촉하도록 배치된 섬유 또는 다른 구조의 형태를 취할 수 있다. 마찬가지로, 시료는 분석을 위해, 예컨대 연속 모니터링을 위해 시험 센서를 통과하여 연속 유동되거나, 예컨대 간헐적 모니터링을 위해 개입되어, 분석될 수 있다.
바이오센서 시스템의 측정 성능은 정확도 및 정밀도의 측면에서 정의된다. 정확도는 무작위 및 계통 오차 성분의 조합 효과를 반영한다. 계통 오차 혹은 진도(trueness)는 바이오센서 시스템으로부터 결정되는 평균 값과 생물학적 유체의 분석물 농도에 대해 수용된 하나 이상의 기준 값 사이의 차이이다. 진도는 평균은 평균 바이어스로 표시될 수 있고, 이 때 보다 큰 평균 바이어스 값은 보다 낮은 진도를 나타내고,이에 따라 보다 낮은 정확도에 기여한다. 정밀도는 평균에 대한 다중 분석물 판독값들 중의 일치 근접도이다. 분석에서의 하나 이상의 오차는 바이오센서 시스템에 의해 결정되는 분석물 농도의 바이어스 및/또는 비정밀도에 기여한다. 그러므로, 바이오센서 시스템의 분석 오차의 감소는 정확도의 증가를 초래하고, 이에 따라 측정 성능의 향상을 초래한다.
바이어스는 "절대 바이어스" 또는 "바이어스 %(percent bias)"로 표시될 수 있다. 절대 바이어스는 mg/dL와 같은 측정 단위로 표시될 수 있고, 한편 바이어스 %는 100 mg/dL 또는 시료의 기준 분석물 농도에 대한 절대 바이어스 값의 백분율로 표시될 수 있다. 100 mg/dL 미만의 포도당 농도에 대해, 바이어스 %는 (100 mg/dL에 대한 절대 바이어스)*100로 정의된다. 100 mg/dL 이상의 포도당 농도에 대해, 바이어스 %는 기준 분석물 농도에 대한 절대 바이어스*100로 정의된다. 혈액 시료 내 분석물 포도당에 대해 수용된 기준 값은 기준 기기, 예컨대 YSI 인코포레이티드(YSI Inc.)(미국 오하이오주 옐로우 스프링즈 소재)로부터 입수가능한 YSI 2300 스타트 플러스(STAT PLUS)™로 수득될 수 있다. 바이어스 %를 결정하는 다른 기준 기기 및 방식이 다른 분석물에 대해 사용될 수 있다. A1c % 측정에 대해서는, 오차가 4 내지 12%의 치료 범위에 있어서 A1c % 기준 값에 대한 절대 바이어스 또는 바이어스 %로서 표시될 수 있다. 혈액 시료 내 A1c %에 대한 수용 기준 값은 기준 기기, 예컨대 일본 토소 코포레이션(Tosoh Corp, Japan)으로부터 입수가능한 토소(Tosoh) G7 기기로 수득될 수 있다.
적혈구용적율(hematocrit) 바이어스는, 상이한 적혈구용적율 수준을 함유하는 시료에 대해 실험적 포도당 판독값과 기준 기기로 수득된 기준 포도당 농도와의 바이오센서 시스템으로부터 수득된 평균 차이(계통 오차)를 지칭한다. 기준과 시스템으로부터 수득된 값 사이의 차이는 특정 혈액 시료들 간의 다양한 적혈구용적율 수준으로부터 비롯되고, 일반적으로 하기 방정식에 의해 백분율로서 표시될 수 있다: % Hct-바이어스=100%×(Gm-Gref)/Gref(여기서, Gm은 특정 적혈구용적율 수준에서의 결정된 포도당 농도이고, Gref는 기준 적혈구용적율 수준에서의 기준 포도당 농도임). % Hct-바이어스의 절대 값이 클수록, 시료의 적혈구용적율 수준(% Hct, 적혈 세포 부피/시료 부피 백분율로 표시됨)이 더 크고, 이는 포도당 농도의 정확도를 감소시킨다.
예를 들어, 동일한 포도당 농도를 함유하나 20, 40, 및 60%의 적혈구용적율 수준을 가지는 혈액 시료를 분석할 경우, 3개의 상이한 포도당 농도를 한 세트의 검정 상수(예를 들어, 혈액 시료를 함유하는 40% 적혈구용적율의 기울기 및 절편)에 기초한 시스템에 의해 보고할 것이다. 따라서, 혈액 포도당 농도가 동일하더라도, 시스템은, 20% 적혈구용적율 시료가 40% 적혈구용적율 시료보다 더 많은 포도당을 함유하고, 60% 적혈구용적율 시료는 40% 적혈구용적율 시료보다 더 적은 포도당을 함유함을 보고할 것이다. "적혈구용적율 감도"는 분석에 대해 바이어스 값에 영향을 미치게 되는 시료의 적혈구용적율 수준의 변화 정도를 표시한다. 적혈구용적율 감도는 적혈구용적율 % 당 바이어스 %의 수치, 즉 바이어스/% Hct 당 %-바이어스로서 정의될 수 있다.
바이오센서 시스템은 다중 오차 공급원(error source)으로부터의 오차를 포함하는 생물학적 유체의 분석 동안 출력 신호를 제공할 수 있다. 상기 오차 공급원은 총 오차에 기여하고, 이는 예컨대 하나 이상의 부분 또는 전체 출력 신호가 시료의 분석물 농도에 대응하지 않거나, 적절하지 않게 대응할 때와 같이, 이상 출력 신호에 반영될 수 있다.
출력 신호에서의 총 오차는 하나 이상의 오차 기여자, 예컨대 시료의 물리적 특성, 시료의 환경적 측면, 시스템의 작동 조건, 시험 센서 로트들 사이의 제조 변동 등으로부터 비롯될 수 있다. 시료의 물리적 특성에는 적혈구용적율(적혈 세포) 농도, 간섭 물질, 예컨대 지질 및 단백질 등이 포함된다. 간섭 물질에는 아스코르브산, 요산, 아세트아미노펜 등이 포함된다. 시료의 환경적 측면에는 온도 등이 포함된다. 시스템의 작동 조건에는 시료 크기가 충분히 크지 않을 때의 언더필 조건, 시료의 저속 충전, 시험 센서 내 시료와 하나 이상의 전극 사이의 간헐적 전기 접점, 분석물과 상호 작용하는 시약의 사전 분해 등이 포함된다. 시험 센서 로트 간의 제조 변동에는 시약의 양 및/또는 활성의 변화, 전극 면적 및/또는 공간의 변화, 도체 및 전극의 전기 전도성의 변화 등이 포함된다. 시험 센서 로트는 바람직하게 로트-대-로트 제조 변동이 실질적으로 감소되거나 제거되는 단일 제조 수행으로 이루어진다. 제조 변동은 또한, 시약의 활성이 시험 센서가 제조되는 시간과 분석에 사용되는 시간 사이에 변화하거나 분해될 때 도입될 수 있다. 분석에서 오차를 유발하는 다른 기여자 또는 기여자들의 조합이 있을 수 있다.
바이어스 %, 바이어스 % 표준 편차, 평균 바이어스 %, 상대 오차 및 적혈구용적율 감도는 바이오센서 시스템의 측정 성능을 표시하는 독립적 방식이다. 바이오센서 시스템의 측정 성능을 표시하기 위해 부가 방식이 사용될 수 있다.
바이어스 %는 기준 분석물 농도에 대한 바이오센서 시스템의 정확도를 나타내고, 한편 바이어스 % 표준 편차는 시료의 물리적 특성, 시료의 환경적 측면, 및 시스템의 작동 조건에서 생기는 오차에 대해, 다중 분석의 정확도를 반영한다. 따라서, 바이어스 % 표준 편차의 감소는 다중 분석에 걸친 바이오센서 시스템의 측정 성능의 증가를 나타낸다.
단일 로트로부터의 시험 센서를 이용하여 다중 분석에서 결정된 바이어스 %에 대해 평균을 결정하여, 다중 분석에 대한 "평균 바이어스 %"를 제공할 수 있다. 서브세트의 로트, 예컨대 100 내지 140개의 시험 센서를 이용함으로써 시험 센서의 단일 로트에 대한 평균 바이어스 %를 결정함으로써, 다중 혈액 시료를 분석할 수 있다.
상대 오차는 [ΔG/Gref(상대 오차)=(G계산-Gref)/Gref=G계산/Gref-1](여기서, ΔG는 기준 분석물 농도에 대한 분석으로 결정된 분석물 농도에 존재하는 오차이고; G계산은 분석 중에 시료로부터 결정된 분석물 농도이며; Gref는 기준 기기에 의해 결정되는 시료의 분석물 농도임)로 표시될 수 있는 오차의 일반적 표현이다.
상기 공급원 또는 기타 공급원로부터의 오차를 줄임에 의한 바이오센서 시스템의 측정 성능의 증가는, 예를 들어 혈중 포도당을 모니터링할 때 환자에 의한 정확한 치료법에 바이오센서 시스템에 의해 결정되는 분석물 농도가 더 많이 사용될 수 있다는 것을 의미한다. 부가적으로, 시험 센서를 폐기하고 환자에 의한 분석을 반복할 필요도 감소될 수 있다.
한 시험 사례는 동일 로트로부터의 시험 센서를 이용하는 실질적으로 동일한 시험 조건 하에 일어나는 다중 분석(데이터 집합)의 집합체이다. 예를 들어, 결정된 분석물 농도 값은 전형적으로 건강 관리 전문가(health care professional)("HCP")) 시험에 대해서보다 사용자 자가-시험에 대해 더 열한 측정 성능을 나타냈고, 조절 환경 시험보다 HCP-시험에 더 열한 측정 성능을 나타냈다. 이러한 측정 성능의 차이는, HCP-시험 또는 조절 환경 시험을 통해 결정된 분석물 농도에 비해 사용자 자가-시험을 통해 결정된 분석물 농도에 대한 바이어스 % 표준 편차가 보다 크다는 것으로 반영될 수 있다. 조절 환경은, 시료의 물리적 특성 및 환경적 측면이 조절될 수 있는 환경, 바람직하게 실험실 설정이다. 따라서, 한 조절 환경에서, 적혈구용적율 농도가 고정될 수 있고, 실제 시료 온도가 알려져 보상될 수 있다. 한 HCP 시험 사례에서, 작동 조건 오차가 감소되거나 제거될 수 있다. 한 사용자 자가-시험의 시험 사례, 예컨대 임상 실험에서, 결정된 분석물 농도는 모든 유형의 오차 공급원으로부터의 오차를 포함할 가능성이 크다.
바이오센서 시스템은 분석물의 산화환원 또는 광 기초 반응에 대응하는 비보정 출력 값의 단일 공급원, 예컨대 전기화학 시스템의 상대 전극 및 작동 전극을 가질 수 있다. 바이오센서 시스템은 또한, 예컨대 하나 이상의 열전대 또는 다른 수단을 이용하여 온도를 결정하거나 평가하는 임의적 능력을 가질 수 있다. 이 시스템들에 부가하여, 바이오센서 시스템은 또한 분석물, 또는 분석물에 대응하는 매개자로부터의 값의 외부 부가 출력 값을 발생시키는 능력을 가질 수도 있다. 예를 들어, 전기화학 시험 센서에서, 하나 이상의 전기 도체는 또는 시료 저장소로 연장되어, 작동 전극 및 상대 전극에 의해 제공되지 않는 작용성을 제공할 수 있다. 그러한 도체에는 작동 전극 시약 중 하나 이상, 예컨대 매개자가 결여될 수 있고, 이에 따라 작동 전극 신호로부터 배경 간섭 신호가 빠지게 된다.
많은 바이오센서 시스템은 분석과 연관된 오차를 보상하기 위한 하나 이상의 방법을 포함하고, 이에 따라 바이오센서 시스템의 측정 성능을 향상시키는 것을 시도하게 된다. 보상 방법은 바이오센서 시스템에 부정확한 분석에 대해 보상하는 능력을 제공함으로써 바이오센서 시스템의 측정 성능을 증가시킬 수 있고, 이에 따라 시스템에서 수득되는 농도 값의 정확도 및/또는 정확도가 증가하게 된다. 그러나, 이 방법들은 시료의 분석물 농도와 상관되는, 종점 판독(end-point reading)에서 종결되는 실질적으로 연속되는 출력 신호로부터 수득된 분석물 값을 보상하는 데 곤란하였다.
많은 연속 공정들, 예컨대 상대적으로 긴 기간의 전위 입력 신호로부터 기록된 전위 입력 코트렐 붕괴(Cottrell decay)에 있어, 출력 신호의 붕괴 특성은 붕괴 상수가 있는 기존 이론으로부터 기술될 수 있다. 그러나, 이 상수는 시료의 물리적 특성 또는 시스템의 작동 조건에 민감하지 않거나 덜 민감할 수 있다.
오차 보상을 수행하는 한 방법은 실질적으로 연속적인 입력 신호에 반대되는 개폐식 입력 신호를 사용하는 것이다. 이 개폐식 또는 펄스식 시스템에서, 입력 신호의 변화는 보상 정보가 수득되도록 시료의 반응을 교란한다. 그러나, 반응(통상 전기화학 전해측정법 또는 코트렐-붕괴 전류측정법)을 구동하도록 실질적으로 연속적 입력 신호를 사용하는 분석 시스템, 또한 종점이 도달될 때 까지 개시되어 관찰되는 반응을 관찰하는 분석 시스템(통상 광학)에 있어, 시료의 반응 교란으로부터 수득되는 보상 정보는 입수가능하지 않다. 개폐식 입력 신호에 의해 교란되는 시료에서도, 부가적 보상 정보는 입력 신호의 연속 부분 중에 입수가능할 수 있고, 이는 다른 경우라면 통상적 오차 보상 기법에 의해 사용될 수 있다.
따라서, 향상된 바이오센서 시스템, 특히 실질적으로 연속적인 출력 신호로부터의 종점 판독이 시료의 분석물 농도와 상관될 때, 또한/또는 보상 정보가 반응의 교란으로부터 입수가능하지 않을 때, 시료 분석물 농도의 결정이 점차 더 정확해지도록 할 수 있는 바이오센서 시스템에 대한 필요가 현재 존재한다. 본 발명의 시스템, 장치 및 방법은 통상적 바이오센서 시스템과 관련된 결점들 중 하나 이상을 해소한다.
발명의 개요
한 측면에서, 본 발명은 분석물을 포함하는 시료에 입력 신호를 인가하는 단계; 시료 내 분석물의 농도 및 입력 신호에 대응하는 출력 신호를 발생시키는 단계; 변환 함수(conversion function) 및 세그먼트화 신호 처리 함수(segmented signal prcoessing function)에 대응하여 출력 신호로부터 보상된 값을 결정하는 단계; 및 보상된 값으로 시료 내 분석물 농도를 결정하는 단계를 포함하는, 시료 내 분석물 농도를 결정하는 방법을 제공한다. 변환 함수를 이용하여, 값을 보상하기 전에 출력 신호를 비보상 값으로 변환할 수 있다. 비보상 값은 비보상 분석물 농도 값일 수 있다.
본 발명의 또 다른 측면에서, 시료 내 분석물의 농도 및 입력 신호에 대응하는 출력 신호를 발생시키는 단계; 변환 함수, 일차 함수 및 세그먼트화 신호 처리 함수에 대응하여 출력 신호로부터 보상된 값을 결정하는 단계; 및 보상된 값으로부터 시료 내 분석물 농도를 결정하는 단계를 포함하는, 시료 내 분석물 농도를 결정하는 방법이 있다.
본 발명의 또 다른 측면에서, 시료 내 분석물의 농도 및 입력 신호에 대응하는 출력 신호를 발생시키는 단계; 변환 함수, 일차 함수, 제1 잔여 함수 및 세그먼트화 신호 처리 함수에 대응하여 출력 신호로부터 보상된 값을 결정하는 단계; 및 보상된 값으로부터 시료 내 분석물 농도를 결정하는 단계를 포함하는, 시료 내 분석물 농도를 결정하는 방법이 있다. 일차 함수는 인덱스 함수(index function) 또는 복합 인덱스 함수(complex index function)를 포함할 수 있고, 바람직하게 혈액 시료 내 적혈구용적율 수준과 온도로부터 또는 온도와 총 헤모글로빈 수준으로부터 생기는 오차를 보정한다.
본 발명의 또 다른 측면에서, 시험 센서에 의해 형성된 저장소와 전기적으로 또는 광학적으로 소통하는 시료 인터페이스를 가지는 시험 센서 및 신호 발생기를 통해 센서 인터페이스에 연결된 프로세서를 가지는 측정 장치를 포함하는, 시료 내 분석물 농도를 결정하기 위한 바이오센서 시스템으로서, 상기 센서 인터페이스는 시료 인터페이스와 전기적으로 또는 광학적으로 소통하고, 상기 프로세서는 저장 매체와 전기적으로 소통하는 바이오센서 시스템이 있다. 상기 프로세서는 신호 발생기가 전기 입력 신호를 센서 인터페이스에 인가하도록 명령하고, 센서 인터페이스로부터의 시료 내 분석물의 농도에 대응하는 출력 신호 값을 결정하며, 일차 함수로 출력 신호 값에서의 총 오차의 50% 이상을 보상한다. 일차 함수가 세그먼트화 신호 처리 함수가 아닌 경우, 프로세서는 저장 매체 내에 사전 저장된 세그먼트화 신호 처리 함수로 출력 신호에서의 잔여 오차의 5% 이상을 보상하여, 보상된 값을 결정하고, 보상된 값으로부터 시료 내 분석물 농도를 결정한다. 바이오센서 시스템의 측정 장치는 바람직하게 휴대용이다.
본 발명의 또 다른 측면에서, 세그먼트화 신호 처리 함수에서의 잠재적 항으로서의 다중 세그먼트화 신호 처리 매개변수를 선택하는 단계; 잠재적 항에 대한 제1 배제 값을 결정하는 단계; 잠재적 항에 대한 제1 배제 값에 대응하는 배제 시험을 적용하여, 세그먼트화 신호 처리 함수로부터 배제하기 위한 잠재적 항들 중 하나 이상을 확인하는 단계; 및 세그먼트화 신호 처리 함수로부터 하나 이상의 확인된 잠재적 항을 배제하는 단계를 포함하는, 세그먼트화 신호 처리 함수를 결정하는 방법이 있다.
본 발명은 하기 도면 및 발명의 상세한 설명을 참조하여 더욱 잘 이해될 수 있다. 도면 내 구성요소들은 반드시 척도에 비례하는 것은 아니며, 그 대신 본 발명의 원리를 설명할 때에는 강조되어진다.
도 1a은 세그먼트화 신호 처리(SSP)를 이용하여 생물학적 유체의 시료 내 분석물 농도를 결정하는 방법을 나타낸다.
도 1b는 출력 신호를 세그먼트화하는 방법을 나타낸다.
도 1b-1은 시료 내 분석물 농도가 결정될 수 있도록 하는 종점 판독에서 연속 출력 신호 종결을 나타낸다.
도 1b-2는 2회의 이완에 의해 분리되는 3회의 입력 여기(input excitation)로부터 측정된 전류를 포함하는 개폐식 출력 신호를 나타낸다.
도 1c는 출력 신호 세그먼트를 처리하는 방법을 나타낸다.
도 1d는 SSP 함수로 작용할 수 있는 복합 인덱스 함수에 포함시키기 위한 항을 선택하는 방법을 나타낸다.
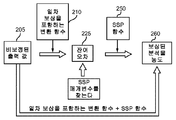
도 2a는 일차 보상 및 SSP 매개변수 보상을 도입하는 변환 함수를 포함하는 오차 보상 방법을 나타낸다.
도 2b는 변환 함수 및 SSP 매개변수 보상을 포함하는 오차 보상 방법을 나타낸다.
도 2c는 SSP 매개변수 보상에 의해 제공되는 변환 함수, 일차 보상, 제1 잔여 보상 및 제2 잔여 보상을 포함하는 오차 보상 방법을 나타낸다.
도 3a 및 도 3b는 화학 반응 및 광학 검출의 2개의 통로가 동일 분석을 수행하여 정확도를 증가시키는 광학 층상 유동 시스템으로부터 시간의 함수로서의 반사도 형태의 출력 신호를 나타낸다.
도 3c는 변환 및 일차 보상 후의 잔여 오차를, 통로 1에 대한 시료의 기준 A1c % 농도와 관계되는 잔여 오차를 기술하는 SSP 함수의 능력에 관계시키는 상관 플롯을 도시한다.
도 3d는 변환 및 일차 보상 후의 잔여 오차를, 통로 3에 대한 시료의 기준 A1c % 농도와 관계되는 잔여 오차를 기술하는 SSP 함수의 능력에 상관시키는 상관 플롯을 도시한다.
도 3e 및 도 3f는 변환 및 내부화 대수 일차 보상을 이용한 분석으로부터의 결과를, 내부화 대수 일차 보상에 부가하여 SSP 함수를 사용한 후의 보상된 분석물 농도와 비교한다.
도 4a는 상대적으로 긴 이완에 의해 분리되는 2개의 상대적으로 긴 여기를 포도당 함유 혈액의 시료에 인가할 때, 전기화학적 전류측정 분석으로부터의 출력 신호를 나타낸다.
도 4b는 상기 분석을 대략 25℃에서, 단 20%, 40%, 및 60%의 적혈구용적율 함량 및 0 내지 700 mg/dL의 포도당 농도를 가지는 다중 혈액 시료에 대해 수행할 때의 용량 반응 선을 도시한다.
도 4c는 제2 여기의 종점 값에 의해 정규화된 각 출력 신호 세그먼트의 차이(differentials)를 플로팅한다.
도 4d는 세그먼트 값을 기록하게 되는 여기의 종점 값에 의해 정규화되는 각 출력 신호 세그먼트의 차이를 플로팅한다.
도 4e는 세그먼트 값을 기록하게 되는 여기의 종점 값에 의해 정규화되는 각 출력 신호 세그먼트의 시간 베이스 차이(time base differential)를 플로팅한다.
도 4f는 20% 내지 60%(부피/부피) 적혈구용적율 및 대략 25℃에서 대략 50 내지 700 mg/dL의 포도당 농도를 포함하는 다중 혈액 시료로부터 결정되는 비보상 분석물 농도와 SSP 함수 보상 분석물 농도의 총 상대 오차(ΔG/G)를 비교한다.
도 5a는 6회의 상대적으로 짧은 여기가 변동 시간의 5회의 이완에 의해 분리되는, 전기화학적 개폐식 전류측정 분석을 위한 시험 센서에 인가되는 입력 신호를 나타낸다.
도 5b는 6회의 여기 및 이차 출력 신호로부터 기록되는 출력 전류 값을 나타낸다.
도 6a는 일차 함수만을 이용하여 결정된 분석물 농도의 예측 오차와 총 오차를 비교하는 상관 플롯이다.
도 6b는 일차 함수 및 제1 잔여 함수를 이용하여 결정된 분석물 농도의 예측 오차와 총 오차를 비교하는 상관 플롯이다.
도 6c는 일차 함수, 제1 잔여 함수, 및 SSP 함수를 이용하여 결정된 분석물 농도의 예측 오차와 총 오차를 비교하는 상관 플롯이다.
도 6d 및 도 6e는 SSP 함수로 일차+제1 잔여 및 부가적 보상으로부터의 보상 결과를 부가적 보상과 비교한다.
도 7a는 전기화학적 조합된 개폐식 전류측정 및 개폐식 전압-전류측정 분석을 위한 시험 센서의 작업 전극 및 상대 전극에 인가된 입력 신호를 나타낸다.
도 7b는 2회의 전류측정 여기(amperometric excitation) 및 5회의 전압-전류측정 여기(voltammetric exxcitation)를 가지는 7회의 여기 입력 신호의 제3 전압-전류측정 여기로부터 다중 분석에 대해 수득된 전류를 도시한다.
도 7c는 혈액 시료가 약 400 mg/dL 포도당을 포함할 때, 제3 전압-전류측정 여기로부터 수득된 전류를 도시한다.
도 7d는 제3 전압-전류측정 여기로부터의 출력 전류가 어떻게 세그먼트화되어, 여기로부터 3개의 출력 신호 세그먼트를 제공하게 되는 지를 나타낸다.
도 7e는 약 80 mg/dL, 170 mg/dL, 275 mg/dL, 또는 450 mg/dL 포도당을 포함하고 적혈구용적율 수준이 25 부피%, 40 부피% 또는 55 부피 %인 혈액 시료에 대해 제3 개폐식 전압-전류측정 여기로부터 5.2초에 측정되는 전류를 도시한다.
도 7f는 SSP 함수에 의해 제공되는 보상을 가지거나 가지지 않는 측정 장치로부터 수득된 포도당 판독값을 도시한다.
도 7g는 혈액 시료로부터의 결정된 SSP 보상 포도당 분석물 농도와 비보상 포도당 분석물 농도 간의 상대 오차를 비교한다.
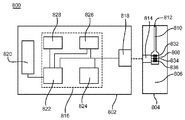
도 8은 생물학적 유체의 시료 내 분석물 농도를 결정하는 바이오센서 시스템의 개략도를 나타낸다.
도 1a은 세그먼트화 신호 처리(SSP)를 이용하여 생물학적 유체의 시료 내 분석물 농도를 결정하는 방법을 나타낸다.
도 1b는 출력 신호를 세그먼트화하는 방법을 나타낸다.
도 1b-1은 시료 내 분석물 농도가 결정될 수 있도록 하는 종점 판독에서 연속 출력 신호 종결을 나타낸다.
도 1b-2는 2회의 이완에 의해 분리되는 3회의 입력 여기(input excitation)로부터 측정된 전류를 포함하는 개폐식 출력 신호를 나타낸다.
도 1c는 출력 신호 세그먼트를 처리하는 방법을 나타낸다.
도 1d는 SSP 함수로 작용할 수 있는 복합 인덱스 함수에 포함시키기 위한 항을 선택하는 방법을 나타낸다.
도 2a는 일차 보상 및 SSP 매개변수 보상을 도입하는 변환 함수를 포함하는 오차 보상 방법을 나타낸다.
도 2b는 변환 함수 및 SSP 매개변수 보상을 포함하는 오차 보상 방법을 나타낸다.
도 2c는 SSP 매개변수 보상에 의해 제공되는 변환 함수, 일차 보상, 제1 잔여 보상 및 제2 잔여 보상을 포함하는 오차 보상 방법을 나타낸다.
도 3a 및 도 3b는 화학 반응 및 광학 검출의 2개의 통로가 동일 분석을 수행하여 정확도를 증가시키는 광학 층상 유동 시스템으로부터 시간의 함수로서의 반사도 형태의 출력 신호를 나타낸다.
도 3c는 변환 및 일차 보상 후의 잔여 오차를, 통로 1에 대한 시료의 기준 A1c % 농도와 관계되는 잔여 오차를 기술하는 SSP 함수의 능력에 관계시키는 상관 플롯을 도시한다.
도 3d는 변환 및 일차 보상 후의 잔여 오차를, 통로 3에 대한 시료의 기준 A1c % 농도와 관계되는 잔여 오차를 기술하는 SSP 함수의 능력에 상관시키는 상관 플롯을 도시한다.
도 3e 및 도 3f는 변환 및 내부화 대수 일차 보상을 이용한 분석으로부터의 결과를, 내부화 대수 일차 보상에 부가하여 SSP 함수를 사용한 후의 보상된 분석물 농도와 비교한다.
도 4a는 상대적으로 긴 이완에 의해 분리되는 2개의 상대적으로 긴 여기를 포도당 함유 혈액의 시료에 인가할 때, 전기화학적 전류측정 분석으로부터의 출력 신호를 나타낸다.
도 4b는 상기 분석을 대략 25℃에서, 단 20%, 40%, 및 60%의 적혈구용적율 함량 및 0 내지 700 mg/dL의 포도당 농도를 가지는 다중 혈액 시료에 대해 수행할 때의 용량 반응 선을 도시한다.
도 4c는 제2 여기의 종점 값에 의해 정규화된 각 출력 신호 세그먼트의 차이(differentials)를 플로팅한다.
도 4d는 세그먼트 값을 기록하게 되는 여기의 종점 값에 의해 정규화되는 각 출력 신호 세그먼트의 차이를 플로팅한다.
도 4e는 세그먼트 값을 기록하게 되는 여기의 종점 값에 의해 정규화되는 각 출력 신호 세그먼트의 시간 베이스 차이(time base differential)를 플로팅한다.
도 4f는 20% 내지 60%(부피/부피) 적혈구용적율 및 대략 25℃에서 대략 50 내지 700 mg/dL의 포도당 농도를 포함하는 다중 혈액 시료로부터 결정되는 비보상 분석물 농도와 SSP 함수 보상 분석물 농도의 총 상대 오차(ΔG/G)를 비교한다.
도 5a는 6회의 상대적으로 짧은 여기가 변동 시간의 5회의 이완에 의해 분리되는, 전기화학적 개폐식 전류측정 분석을 위한 시험 센서에 인가되는 입력 신호를 나타낸다.
도 5b는 6회의 여기 및 이차 출력 신호로부터 기록되는 출력 전류 값을 나타낸다.
도 6a는 일차 함수만을 이용하여 결정된 분석물 농도의 예측 오차와 총 오차를 비교하는 상관 플롯이다.
도 6b는 일차 함수 및 제1 잔여 함수를 이용하여 결정된 분석물 농도의 예측 오차와 총 오차를 비교하는 상관 플롯이다.
도 6c는 일차 함수, 제1 잔여 함수, 및 SSP 함수를 이용하여 결정된 분석물 농도의 예측 오차와 총 오차를 비교하는 상관 플롯이다.
도 6d 및 도 6e는 SSP 함수로 일차+제1 잔여 및 부가적 보상으로부터의 보상 결과를 부가적 보상과 비교한다.
도 7a는 전기화학적 조합된 개폐식 전류측정 및 개폐식 전압-전류측정 분석을 위한 시험 센서의 작업 전극 및 상대 전극에 인가된 입력 신호를 나타낸다.
도 7b는 2회의 전류측정 여기(amperometric excitation) 및 5회의 전압-전류측정 여기(voltammetric exxcitation)를 가지는 7회의 여기 입력 신호의 제3 전압-전류측정 여기로부터 다중 분석에 대해 수득된 전류를 도시한다.
도 7c는 혈액 시료가 약 400 mg/dL 포도당을 포함할 때, 제3 전압-전류측정 여기로부터 수득된 전류를 도시한다.
도 7d는 제3 전압-전류측정 여기로부터의 출력 전류가 어떻게 세그먼트화되어, 여기로부터 3개의 출력 신호 세그먼트를 제공하게 되는 지를 나타낸다.
도 7e는 약 80 mg/dL, 170 mg/dL, 275 mg/dL, 또는 450 mg/dL 포도당을 포함하고 적혈구용적율 수준이 25 부피%, 40 부피% 또는 55 부피 %인 혈액 시료에 대해 제3 개폐식 전압-전류측정 여기로부터 5.2초에 측정되는 전류를 도시한다.
도 7f는 SSP 함수에 의해 제공되는 보상을 가지거나 가지지 않는 측정 장치로부터 수득된 포도당 판독값을 도시한다.
도 7g는 혈액 시료로부터의 결정된 SSP 보상 포도당 분석물 농도와 비보상 포도당 분석물 농도 간의 상대 오차를 비교한다.
도 8은 생물학적 유체의 시료 내 분석물 농도를 결정하는 바이오센서 시스템의 개략도를 나타낸다.
발명의 상세한 설명
이전의 연속 출력 신호의 종점으로부터 결정된 분석물 농도의 분석 오차 및 얻어지는 바이어스는 사전 연속 출력 신호의 세그먼트화 신호 처리(SSP)에 의해 감소될 수 있다. 연속 출력 신호를 세그먼트들로 나누고, 세그먼트 중 하나 이상을 SSP 매개변수로 변환함으로써, SSP 함수를 결정할 수 있다. SSP 함수는 단독으로 또는 다른 함수와 조합하여 사용되어, 분석에서의 총 오차를 줄일 수 있다. 바이오센서 시스템으로부터의 오차는 부분적으로 또는 전체적으로 독립적인 상이한 공정/거동으로부터 생기는 다중 오차 공급원 또는 기여자를 가질 수 있다.
SSP 보상이 다른 연속 출력 신호의 세그먼트화로부터 생기므로, 분석 오차는 분석물이나, 분석물에 대응하는 측정가능한 종으로부터의 출력 신호에 기초하는 보상이 이전에 입수가능하지 않았던 바이오센서 시스템에서 보상될 수 있다. 또한, 심지어 섭동 시스템, 예컨대 개폐식 전류측정법 또는 전압-전류측정법에 기초하는 시스템에서도, SSP 보상은 개폐식 입력 신호로부터 생기는 섭동에 의존하지 않는 보상을 수행할 수 있다.
잔여 오차 보상은 오차가 무작위가 될 때까지 분석에서의 총 오차를 실질적으로 보상할 수 있다. 무작위 오차는, 어떠한 오차 기여자에 의해서도 기인하지 않고 통계학적으로 유의한 것으로 간주되는 수준으로 잔여 함수에 의해 기술되지도 않는 오차이다. SSP 함수는 일차 보상 또는 잔여 보상을 오차 보정 시스템에 제공할 수 있다. 대안적으로, SSP 함수는 제1 잔여 함수와 함께 이용되어, 제2 잔여 함수 보상을 오차 보정 시스템에 제공할 수 있다. 각각의 상기 예에서, SSP 함수는 다른 보상에 의해 보상되는 것과 상이한 오차 매개변수를 보정하는 데 초점을 둔다.
도 1a는 세그먼트화 신호 처리(SSP)를 이용하여 생물학적 유체의 시료 내 분석물 농도를 결정하는 방법을 나타낸다. 110에서, 바이오센서 시스템은 분석물의 광식별성 종 또는 산화/환원(산화환원) 반응에 대응하여 생물학적 유체의 시료 내 분석물 농도에 대응하여 출력 신호를 발생시킨다. 120에서, 바이오센서 시스템은 시료로부터의 분석물 농도에 대응하는 출력 신호를 측정한다. 130에서, 바이오센서 시스템은 출력 신호의 적어도 일부를 세그먼트화한다. 140에서, 바이오센서 시스템은 출력 신호 세그먼트 중 하나 이상을 처리하여, 하나 이상의 SSP 매개변수를 발생시킨다. 150에서, 바이오센서 시스템은 하나 이상의 SSP 매개변수 및 출력 신호를 포함하는 보상 방법으로부터 분석물 농도를 결정한다. 160에서, 보상된 분석물 농도는 표시되고/되거나, 추가 기준을 위해 저장되고/되거나, 추가 계산을 위해 사용될 수 있다.
도 1a의 110에서, 바이오센서 시스템은 생물학적 유체의 시료 내 분석물의 광식별성 종 또는 산화/환원(산화환원) 반응에 대응하여 출력 신호를 발생시킨다. 출력 신호는 광학 센서 시스템, 전기화학 센서 시스템 등을 이용하여 발생될 수 있다.
도 1a의 120에서, 바이오센서 시스템은 시료에 인가된 입력 신호에 대응하여, 예컨대 분석물의 산화환원 반응으로부터, 분석물에 의해 발생된 출력 신호를 측정한다. 상기 시스템은 연속 또는 개폐식 여기로부터 연속적으로 또는 간헐적으로 출력 신호를 측정할 수 있다. 예를 들어, 상기 시스템은 종점 판독이 수득될 때까지 광학 활성 종의 존재 또는 농도에 대응하는 광학 검출기로부터의 전기 신호를 연속적으로 측정할 수 있다. 유사하게, 시스템은 종점 판독이 수득될 때까지 산화환원 종의 존재 또는 농도에 대응하는 전극으로부터의 전기 신호를 연속적으로 측정할 수 있다.
바이오센서 시스템은 또한 개폐식 전류측정 또는 전압-전류측정 입력 신호의 여기 동안에 출력 신호 연속적으로 또는 간헐적으로 측정할 수 있고, 이로써 각 여기 중에 다중 전류 값이 기록된다. 이 방식으로, 다중 입력 여기 중 하나 이상의 종료 시에 종점 판독이 수득될 수 있다. 바이오센서는 전기화학 매개자로부터 직접적으로 또는 간접적으로 출력 신호를 측정할 수 있다. 광학 시스템에서, 검출기는 출력 신호를 제공하기 위해 분석물 또는 시료 내의 분석물의 농도에 대응하는 광학 활성 종으로부터 직접적으로 광을 측정할 수 있다.
종점 판독은 진행 중이었던 출력 신호에 대해 측정된 마지막 작동 데이터이다. "마지막 작동"이란, 실제 마지막 데이터 점, 예를 들어 두 번째에서 마지막 데이터 점, 또는 세 번째에서 마지막 데이터 점이 사용될 수 있으나, 종점 판독은 선행 입력 신호에 대한 분석의 마지막 상태를 반영하는 데이터 점임을 의미한다. 바람직하게, 종점 판독은 전기화학 시스템에 대한 입력 신호의 특정 여기로부터 측정된 마지막 데이터 점일 것이다. 바람직하게, 종점 판독은 광학 또는 다른 연속 입력 시스템에 대한 입력 신호로부터 측정된 마지막 데이터 점일 것이다.
도 1a의 130에서, 바이오센서 시스템은 출력 신호의 적어도 일부를 세그먼트화한다. 바이오센서 시스템의 측정 장치는 예비 결정된 세그먼트화 루틴에 대응하여 출력 신호의 적어도 일부를 세그먼트화한다. 따라서, SSP 매개변수 결정을 위한 특정한 세그먼트를 나타내는, 측정하고자 하는 출력 신호 값은 분석 전에 예비 결정된다. 출력 신호의 세그먼트화는 도 1b와 연관하여 이하에 추가 논의된다.
도 1a의 140에서, 바이오센서 시스템은 SSP 매개변수 처리 방법으로 출력 신호 값을 처리하여, 하나 이상의 SSP 매개변수를 발생시킨다. 바람직하게, 하나 이상의 SSP 매개변수가 각 세그먼트로부터 발생된다. 출력 신호의 세그먼트로부터 SSP 매개변수를 발생시키는 것이 도 1c와 연관하여 이하에 추가 논의된다. 또 다른 종점 판독을 보상하기 위해 한 종점 판독을 이용하는 보상 시스템과 달리, SSP 매개변수는 종점 판독이 수득되기 전에, 또한 중간 종점 판독이 수득되기 전 및 후에 결정되는 값으로부터 비롯된다.
도 1a의 150에서, 바이오센서 시스템은 하나 이상의 SSP 매개변수 및 출력 신호를 포함하는 오차 보상 방법으로부터 시료의 분석물 농도를 결정한다. 오차 보상 방법은 기울기 기초 방법 또는 또 다른 방법일 수 있다. 하나 이상의 SSP 매개변수는 변환 함수에 의존하는 오차 보상 방법, 일차 보상을 내부화하는 변환 함수에 기초하는 오차 보상 방법, 구분된 변환 함수 및 구분된 일차 보상에 의존하는 오차 보상 방법, 및 제1 잔여 함수 보상 및/또는 제2 잔여 함수 보상도 또한 포함하는 상기 오차 방법들 중 임의의 것에 도입될 수 있다. 바람직하게, 다중 SSP 매개변수로부터 발생된 복합 인덱스 함수는 출력 신호 값과 조합하여 사용되어, 시료의 분석물 농도를 결정한다. SSP 매개변수는 바람직하게 출력 신호가 변환 함수에 의해 분석물 농도로 전환되는 중 또는 후에 보상하기 위해 사용되나, SSP 매개변수는 신호가 분석물 농도로 변환되기 전에 출력 신호에 적용될 수 있다.
SSP 함수는 시험 센서로부터 측정된 출력 신호에서의 3개 이상의 유형의 오차를 보상할 수 있다. SSP 함수는, 변환 함수를 사용하여 임의의 오차 기여자에 대한 보상이 부족된 기준 상관에 대응하여 출력 신호를 시료 분석물 농도로 변환할 때, 출력 신호에 존재하는 총 오차를 직접 보상하기 위해 사용될 수 있다. SSP 함수는 또한, 변환 및 일차 보상을 사용하여 주요 오차 기여자, 예컨대 온도, 적혈구용적율 및 헤모글로빈에 기여하는 오차를 감소시킬 때 보상하도록 사용될 수 있다. SSP 함수는 또한 변환, 일차 보상, 및 제1 잔여 보상을 사용하여, 이에 따라 일차 보상이 주요 오차를 감소시키고 잔여 보상이 부가적 오차, 예컨대 사용자 자가 시험 오차를 감소시킬 때, 보상하도록 사용될 수 있다. 따라서, SSP 함수는, 변환 및 SSP 보상으로, 변환, 일차 보상 및 SSP 보상으로, 또는 변환, 일차 보상, 잔여 보상, 및 SSP 보상으로, 시료로부터 결정되는 분석물 농도에서의 상대 오차를 보상하는 것으로 간주될 수 있다.
도 1b는 도 1a의 130에 따라 사용하기 위한 출력 신호를 세그먼트화하는 방법을 나타낸다. 132에서, 출력 신호는 시간과 연관된다. 시간이 바람직할 때, 또 다른 일관적으로 변화하는 미터법이 사용될 수 있다. 134에서, 시간 또는 다른 일관되게 변화하는 미터법에 대한 규칙 또는 불규칙 세그먼트화 간격이 선택된다. 출력 신호를 세그먼트화하는 간격 유형은 선택된 시간에서 가장 큰 절대 변화를 나타내는 출력 신호의 부분에 기초하여 바람직하게 선택된다. 136에서, 출력 신호의 값은 규칙 또는 불규칙 세그먼트화 간격에 대응하여 개별 세그먼트로 세그먼트화된다. 바람직하게, 출력 신호는 3개 이상의 세그먼트, 더욱 바람직하게는 4개 이상의 세그먼트로 세그먼트화된다. 일단 요망되는 세그먼트가 바이오센서 시스템에 대해 결정되면, 이는 측정 장치에서 세그먼트화 루틴으로서 수행될 수 있다. 이 방식으로, 측정 장치는 SSP 매개변수 결정을 위해 세그먼트화하는 할당 출력 신호를 선택한다.
도 1b-1는 시료 내 분석물 농도가 결정될 수 있도록 하는 종점 판독에서의 연속 출력 신호 종결을 나타낸다. 이 도시에서, 출력 신호는 출력 신호 세그먼트 (a) 내지 (k)로 세그먼트화되었다. 따라서, 세그먼트 (a)는 출력 신호 개시 시의 시간부터 시작되고, 세그먼트 (k)는 종점 판독이 분석 종료 전에 이루어지는 시간부터 시작된다. 종점 판독은 일차 또는 비일차 관계를 통해 시료의 분석물 농도와 상관될 수 있다. 출력 신호는 시간에 대해 규칙 또는 불규칙 간격으로 세그먼트화될 수 있다.
도 1b-2는 2회 이완에 의해 분리되는 3회의 입력 여기로부터 측정되는 전류를 포함하는 개폐식 전류측정 입력 신호로부터의 출력 신호를 나타낸다. 각 여기는 분석과 연관된 분석물 농도 또는 또 다른 값이 결정될 수 있도록 하는 종점 판독에서 종결된다. 이 도시에, 각각의 3개의 출력 신호는 출력 신호 세그먼트 (a) 내지 (d)로 세그먼트화되었다. 따라서, 세그먼트 1a는 첫 번째 여기로부터의 출력 신호가 개시된 시간으로부터 시작되고, 세그먼트 1d는 첫 번째 이완 시간 전에 첫 번째 여기에 대한 종점 판독을 기록한 시간부터 시작된다. 종점 판독은 일차 또는 비일차 관계를 통해, 분석과 연관된 시료의 분석물 농도 또는 기타 값, 예컨대 오차 매개변수와 상관될 수 있다. 출력 신호는 시간에 대해 규칙 또는 불규칙 간격으로 세그먼트화될 수 있다.
도 1c는 도 1a의 140에 따라 SSP 매개변수를 제공하기 위해 출력 신호 세그먼트를 처리하는 방법을 나타낸다. 142에서, 하나 이상의 SSP 매개변수와 분석의 오차 기여자 간의 상관은 예비 결정되었다. 상관은 전위 SSP 매개변수와 일차 오차 공급원, 예컨대 적혈구용적율, 온도, 및 혈액 시료 내 총 헤모글로빈으로부터 또는 일차 보상 후에 남는 잔여 오차 공급원으로부터 생기는 오차 간에 실험실에서 결정될 수 있다. 144에서, 세그먼트화 신호 처리는 하나 이상의 예비 결정된 세그먼트에 상응하는 출력 신호 값에 적용된다. 바람직하게, 2개 이상의 세그먼트로부터의 출력 신호 값이 처리된다. 더욱 바람직하게는, 3개 이상의 세그먼트로부터의 출력 신호 값이 처리된다. 146에서, SSP 매개변수는 1개 이상의 세그먼트에 상응하는 출력 신호 값으로부터 발생된다. 하나 이상의 예비 결정된 세그먼트로부터 바람직하게 2개 이상의 SSP 매개변수 값이 발생되고, 더욱 바람직하게는 3개 이상의 SSP 매개변수가 발생된다.
다중 출력 값을 단일 매개변수로 변환하는 임의의 방법을 이용하여, SSP 매개변수를 결정할 수 있으나, 바람직한 SSP 매개변수 결정 방법은 세그먼트 내의 신호들의 평균을 구하는 것, 세그먼트 내로부터의 신호 값의 비를 결정하는 것, 세그먼트로부터의 신호 값의 차이를 결정하는 것, 시간 베이스 차이(time base differetial)를 결정하는 것, 정규화 차이(normalized differetial)를 결정하는 것, 시간 베이스 정규화 차이(time-based normalized differential)를 결정하는 것, 하나 이상의 붕괴 상수를 결정하는 것, 및 하나 이상의 붕괴 속도를 결정하는 것을 포함한다. 예를 들어, 정규화 차이 방법은 각 세그먼트에 대한 첫 번째 데이터 점과 마지막 데이터 점(예를 들어, 전류 값) 간의 차이를 수득한 후, 출력 신호의 종점 판독을 이용한 정규화 또는 예를 들어 각 세그먼트의 중간 종점 판독에 의해 또는 또 다른 세그먼트로부터 수행될 수 있다. 따라서, 정규화 차이 방법은 다음과 같이 표시될 수 있다: (전류의 변화/상응하는 시간의 변화)/정규화를 위해 선택되는 종점. 각각의 이들 SSP 매개변수 결정 방법을 나타내는 일반 방정식은 다음과 같다:
세그먼트 내로부터의 신호 값들의 평균 구하기: (Avg)=(in+im)/2(여기서, in은 세그먼트의 제1 출력 신호 값이고, im은 세그먼트의 제2 출력 신호 값이고, 이 때 in은 im보다 큰 것이 바람직하다:
세그먼트 내로부터의 신호 값의 비 결정:
(비)=im/in;
세그먼트 내로부터의 신호 값의 차이 결정:
(Diff)=in-im,
시간 베이스 차이 결정: 시간 베이스 차이 (TD)=(in-im)/(tm-tn)(여기서, tm은 im 출력 신호 값을 측정한 시간이고, tn은 in 출력 신호 값을 측정한 시간임);
정규화 차이의 결정: 정규화 차이(Nml Diff)=(in-im)/iend(여기서, iend는 세그먼트의 종점 출력 신호 값이거나, 이하 추가 기재되는 바와 같다;
시간 베이스 정규화 차이의 결정: 시간 베이스 정규화 차이(TnD)=(in-im)/(tm-tn)/iend;
하나 이상의 붕괴 상수의 결정: i=A*tK(여기서, ln는 대수 수학 작동자를 나타내고, "A"는 분석물 농도 정보를 포함하는 상수를 나타내며, "t"는 시간을 나타내고, "K"는 붕괴 상수를 나타냄)에 의해 분석물 농도로의 시간 함수로서 붕괴하는 출력 신호 전류 값에 관한 일반 함수에 있어, 붕괴 상수 (K)=[ln(in)-ln(im)]/[ln(tm)-ln(tn)]=Δln(i)/[-Δln(t)]; 또한
하나 이상의 붕괴 속도의 결정: i=A*exp(R/t)(여기서, "exp"는 지수 함수의 작동자를 나타내고, "R"는 붕괴 속도를 나타냄)의 지수 함수에 있어, 붕괴 속도 (R)=[ln(im) -ln(in)]/(1/tm-1/tn).
정규화를 위해 바람직하게 사용되는 종점 판독은, 여기에 대해 기록되는 마지막 전류가 세그먼트화되고, 마지막 전류가 분석을 위해 기록되며, 전류가 시료의 기저 분석물 농도와 최적 상관되는 것이다. 정규화 값을 위해 다른 값이 선택될 수 있다. 정규화는 바람직하게 예비 결정된 SSP 매개변수에 대한 상이한 시료 분석물 농도의 영향을 감소시키는 작용을 한다.
도 1d는 SSP 함수로서 작용할 수 있는 복합 인덱스 함수에 포함시키기 위한 항을 선택하는 방법을 나타낸다. 152에서, 다중 SSP 매개변수는 복합 인덱스 함수에 잠재적으로 포함시키기 위한 항으로서 선택된다. SSP 매개변수에 부가하여, 하나 이상의 오차 또는 기타 매개변수도 또한 함수 내에 포함될 수 있다. SSP 매개변수에서와 같이, 오차 매개변수는 광식별성 종에 대응하는 출력 신호로부터 또는 생물학적 유체의 시료 내의 분석물의 산화환원 반응으로부터 수득될 수 있다. 오차 매개변수는 또한 출력 신호, 예컨대 열전대로부터 독립적으로 수득될 수 있다. 복합 인덱스 함수의 항들에는 시료 등 내의 분석물의 비보상 농도를 나타내는 값을 포함하는, SSP 및 오차 매개변수 외의 값이 포함된다. 154에서, 하나 이상의 수학적 기법을 사용하여, 각 선택된 항에 대한 제1 배제 값을 결정한다. 수학적 기법에는 회귀, 다중 변수 회귀 등이 포함될 수 있다. 배제 값은 p-값 등일 수 있다. 수학적 기법은 또한 선택된 항에 대한 가중 계수, 상수 및 기타 값을 제공할 수 있다.
156에서, 하나 이상의 배제 시험을 배제 값에 적용하여, 복합 인덱스 함수로부터 배제하기 위한 하나 이상의 항을 확인할 수 있다. 시험 하에 하나 이상의 항이 배제된다. 바람직하게, 하나 이상의 배제 시험을 이용하여, 함수에 대해 원하는 항이 수득될 때까지 복합 인덱스 함수로부터 통계학적으로 비유의적인 항을 제거한다. 157에서, 하나 이상의 수학적 기법을 반복하여 나머지 항을 위한 제2 배제 값을 확인한다. 158에서, 제2 배제 값이 하나 이상의 배제 시험 하에 복합 인덱스 함수로부터 배제하기 위한 나머지 항을 확인하지 못하는 경우, 나머지 항이 복합 인덱스 함수에 포함된다. 159에서, 제2 배제 값이 하나 이상의 배제 시험 하에 복합 인덱스 함수로부터 배제하는 나머지 항을 확인하는 경우, 157의 하나 이상의 수학적 기법을 반복하여, 나머지 항을 위한 제3 배제 값을 확인할 수 있다. 이 나머지 항은 158에서와 같이 복합 인덱스 함수에 포함될 수 있거나, 그 공정은 배제 시험이 배제할 하나 이상의 항을 확인하지 못할 때까지 159에서와 같이 반복될 수 있다. 복합 인덱스 함수를 위한 항 및 가중 계수를 결정하기 위해 배제 시험을 사용하는 것과 관련된 부가적 정보는 발명의 명칭이 "언더필 오차를 포함한 잔여 보상(Residual Compensation Including Underfill Error)"인, 2011년 3월 22일자로 출원된 미국 특허출원 제13/053,722호에서 찾아볼 수 있다.
도 2a는 일차 보상 210 및 SSP 매개변수 보상을 도입하는 변환 함수를 포함하는 오차 보상 방법을 나타낸다. 일차 보상 210을 도입하고 잔여 오차 225를 포함하는 변환 함수로부터의 출력은 SSP 함수 250의 형태의 SSP 매개변수로 보상된다. 따라서, SSP 함수 250은 변환 및 일차 보상 후에 비보상 출력 값 205를 보상한다. 총 오차 215는 분석에서의 모든 오차들, 예컨대 무작위 및/또는 기타 유형의 오차를 포함한다. 변환 함수 210 및 SSP 함수 250는 2개의 분리된 수학 방정식, 단일 수학 방정식, 또는 기타 방정식으로서 수행될 수 있다. 예를 들어, 변환 함수 210은 제1 수학 방정식으로서 수행될 수 있고, SSP 함수 250은 제2 수학 방정식으로서 수행될 수 있다.
도 2a에서, 비보상 출력 값 205는 전류 성분을 가지는 출력 신호를 발생시키는 광학 또는 전기 입력 신호에 대응하는 출력 전류일 수 있다. 비보상 출력 값은 광학 시스템의 하나 이상의 검출기에 의해 검출되는 광에 대해 대응하는 전류 또는 전위 성분을 가지는 출력 신호일 수 있다. 비보상 출력 값은 잠재적 성분을 가지는 출력 신호를 발생시키는 전위차법, 검류법 또는 기타 입력 신호에 대응하는 출력 전위일 수 있다. 출력 신호는 시료 내 측정가능한 종에 대응한다. 측정가능한 종은 관심 분석물, 분석물에 관한 종, 관심 분석물의 농도에 대응하는 시료 내 농도를 가지는 전기화학 매개자, 또는 관심 분석물의 농도에 대응하는 시료 내 농도를 가지는 광식별성 종일 수 있다.
변환 함수 210은 바람직하게 측정 장치로부터의 입력 신호에 대응하여 시료로부터 발생되는 비보상 출력 값 205와 시료의 기지의 물리학적 특성 및 환경적 측면에 대해 결정된 하나 이상의 기준 분석물 농도 간의 예비 결정된 기준 상관(predetermined reference correlation)으로부터 비롯된다. 예를 들어, 변환 함수 210은 분석을 25℃의 일정한 온도에서 수행할 때 적혈구용적율 함량이 42%인 시료 기재의 출력 값 205로부터 혈액 시료 내 포도당 농도를 결정할 수 있다. 또 다른 예에서, 변환 함수 210은 분석을 23℃의 일정한 온도에서 수행할 때 특이적 총 헤모글로빈 함량을 가지는 시료 기재의 출력 값 205로부터 혈액 시료 내 포도당 농도를 결정하는 것일 수 있다. 기지의 시료 분석물 농도와 비보상 출력 신호 값 간의 기준 상관은 그래프에 의해, 수학적으로, 이를 조합하여, 또는 기타 방식으로 나타내어질 수 있다. 기준 상관은 바이오센서 시스템의 측정 장치에 예비 결정되어 저장되는, 프로그램 수(program number)(PNA) 표, 또 다른 룩-업(look-up) 표 등에 의해 나타내어질 수 있다.
변환 함수 210에 도입된 일차 보상은 비보상 출력 값 205에 오차를 도입하는 주요 오차 기여자를 실질적으로 보상한다. 따라서, 혈액 내 A1c %를 결정하는 광학 바이오센서 시스템에서, 주요 오차 기여자는 온도 및 총 헤모글로빈이다. 이와 유사하게, 혈액 내 포도당 농도를 결정하는 전기화학 바이오센서 시스템에서, 주요 오차 기여자는 온도 및 적혈구용적율이다.
일차 보상을 제공하는 일차 함수는 성질상 대수이고, 이에 따라 일차 또는 비일차 대수 방정식을 사용하여, 비보상 출력 값과 오차 기여자 간의 관계를 표시할 수 있다. 예를 들어, A1c % 바이오센서 시스템에서, 온도(T) 및 총 헤모글로빈(THb)은 주요 오차 기여자이다. 혈액 포도당 분석에서의 적혈구용적율 오차와 유사하게, 혈액 시료의 상이한 총 헤모글로빈 함량은 상이한 A1c 신호를 초래할 수 있고, 이에 따라 동일한 기저 A1c 농도에 대해 상이한 A1c 농도가 결정된다. 따라서, 이 오차를 보상하는 대수 방정식은 A1c=a1*SA1c+a2/SA1c+a3*THb+a4*THb2(여기서, A1c은 비보상 출력 값의 변환 및 총 헤모글로빈에 대한 일차 보상 후의 분석물 농도이고, SA1C은 A1c를 나타내는 온도 보상된 출력 값(예를 들어, 반사도 또는 흡수도)이며, THb는 THb=d0+d1/STHb+d2/STHb 2+d3/STHb 3(여기서, STHb는 시험 센서로부터 수득된 온도 보정 THb 반사도 신호임)에 의해 계산되는 총 헤모글로빈 값이다. SA1c 및 STHb는 대수 관계식 SA1c=SA1c(T)+[b0+b1*(T-Tref)+b2*(T-Tref)2] 및 STHb=[STHb(T)c0+c1*(T-Tref)]/[c2*(T-Tref)2]로 보정된다. 대수 치환에 의해, 일차 보상된 분석물 농도 A는 비보상 출력 값의 변환 및 온도의 주요 오차 기여자에 대한 일차 보상, 및 단일 대수 방정식으로 적분되는 총 헤모글로빈으로 계산된다.
일차 함수는 또한 기울기 기초 함수, 복합 인덱스 함수, 또는 온도 및 적혈구용적율 또는 온도 및 총 헤모글로빈과 같은 오차의 감소에 초점을 둔 보상 함수를 포함할 수 있다. 기울기 기초의 포도당 분석물 예에 대해, 측정 장치 및 시험 센서를 포함하는 바이오센서 시스템의 관찰된 총 오차는 ΔS/S(정규화 기울기 편차) 또는 ΔG/G(상대 포도당 오차)로 표시될 수 있다. 적당한 기울기 기초 일차 보상 기법은 예를 들어, 발명의 명칭이 "기울기 기초 보상(Slope-Based Compensation)"인 2008년 12월 6일자로 출원된 국제 특허출원 공보 제WO 2009/108239호, 및 발명의 명칭이 "복합 인덱스 함수(Complex Index Functions)"인 2009년 12월 8일자로 출원된 국제 특허출원 공보 제WO2010/077660호에서 찾아볼 수 있다.
기울기 기초 보상을 수행하는 바람직한 일차 함수는 분석물의 분석으로부터의 오차 매개변수 값, 예컨대 출력 신호에 대응하는 분석물, 또는 분석물에 대응하는 출력 신호와 독립적인 공급원, 예컨대 열전대, 부가 전극 등으로부터의 중간 신호를 이용하여 결정될 수 있는 인덱스 함수이다. 오차 매개변수는 출력 신호에서의 하나 이상의 오차에 대응하는 임의의 값일 수 있다. 따라서, 오차 매개변수는 분석의 출력 신호로부터 직접적으로 또는 간접적으로 추출되고/되거나, 분석 출력 신호로부터 독립적으로 수득될 수 있다. 기타 오차 매개변수는 상기 분석 신호, 또는 다른 분석 또는 이차 출력 신호로부터 결정될 수 있다. 임의의 오차 매개변수를 또한 사용하여, 예컨대 발명의 명칭이 "기울기 기초 보상(Slope-Based Compensation)"인 2008년 12월 6일자로 출원된 국제 특허출원 공보 제WO 2009/108239호 등에 기재된 것과 같은 인덱스 함수를 구성하는 항 또는 항들을 형성할 수 있다.
인덱스 함수는 하나 이상의 오차 매개변수에 대응한다. 인덱스 함수는 오차 매개변수, 예컨대 적혈구용적율 또는 온도와 상관된 계산된 수를 발생시킬 수 있고, 바이어스에 대한 상기 오차 매개변수의 영향을 나타낸다. 인덱스 함수는 기준 기울기 및 오차 매개변수로부터의 편차들 간의 플롯의 회귀 또는 다른 방정식으로서 실험적으로 결정될 수 있다. 따라서, 인덱스 함수는 분석에서의 총 오차에서 생기는 기울기 편차, 정규화된 기울기 편차, 또는 바이어스 %에 대한 오차 매개변수의 영향을 나타낸다.
인덱스 함수는, 그것이 가중 계수에 의해 수정된 항들의 조합을 포함할 때 복합적이다. 복합 인덱스 함수는 항 가중 계수에 의해 각각 수정된 2개 이상의 항을 가진다. 조합은 바람직하게 일차적 조합이나, 항에 대한 가중 계수를 제공하는 다른 조합 방법들을 사용할 수 있다. 예를 들어, 복합 인덱스 함수는 항들의 이하와 같은 가중 계수와의 일차적 조합을 가질 수 있다:
f(ComplexIndex)=a1+(a2)(R3/2)+(a3)(R4/3)+(a4)(R5/4)+(a5)(R3/2)(G)+(a6)(R4/3)(G)+(a7)(R3/2)(Temp)+(a8)(R4/3)(Temp)+(a9)(Temp)+(a10)(G)+...(여기서, a1은 상수이나 가중 계수가 아니고, a2-a10은 독립적으로 항 가중 계수이며, G는 보상을 하지 않은 시료의 결정된 분석물 농도이고, Temp는 온도임). 각각의 항 가중 계수 (a2-a10) 후에 이와 연관된 항, 즉 (R3/2), (R4/3), (R5/4), (R3/2)(G), (R4/3)(G), (R3/2)(Temp), (R4/3)(Temp), (Temp) 및 (G)이 온다. 항의 가중 계수와의 일차적 조합 및 기타 조합을 포함하는 기타 복합 인덱스 함수를 사용할 수 있다.
항 가중 계수(term weighing coefficient)는 각 항을 함수에 할당한다. 따라서, 이는 각 항이 함수로의 상이한 할당을 가지도록 한다. 항 가중 계수들 중 2개 이상은 각 항의 함수에 대한 동일하거나 유사한 할당일 수 있다. 그러나, 2개 이상의 가중 계수는 상이하거나, 각 항의 함수로의 상이한 할당이다. 이러한 식으로, 항 가중 계수는 전체 함수와 연관된 항들 간의 영향을 허용하도록 선택되고, 이로써 복합 인덱스 함수가 사용될 때 항들의 상호작용으로부터의 오차를 감소시키거나 소거한다. 항 가중 계수는 임의의 값, 바람직하게는 1 또는 0 이외의 수치일 수 있으며, 이는 1의 가중 계수가 항의 기여를 할당하지 않을 수 있고, 0의 가중 계수는 항의 배제를 초래할 것이기 때문이다. 항 가중 계수는 모든 항에 대한 대수 배치에 의해 적용될 수 있는 단일 값 또는 상수가 아니다. 항 가중 계수는 다중 분석물 농도, 상이한 적혈구용적율 수준, 상이한 총 헤모글로빈 수준, 상이한 온도 등의 조합으로부터 수집되는 데이터의 통계학적 처리를 통해 결정될 수 있다.
부가적으로, 복합 인덱스 함수는 단지 수학적 의미의 "복합 함수"이기만 한 것이 아니므로, 허수(음성수의 제곱근을 가지는 수)의 사용을 필요로 하거나 함축한다. 복합 인덱스 함수는 하나 이상의 허수, 예컨대 항 또는 가중 계수 중 하나를 포함하나, 어떠한 허수를 가지도록 제한되거나 국한되지 않는다.
복합 인덱스 함수에서의 각 항은 하나 이상의 오차 매개변수를 포함할 수 있다. 상기 항은 하나 이상의 배제 시험으로 선택될 수 있다. 보다 바람직하게, 일차 함수는 복합 인덱스 함수, 예컨대 발명의 명칭이 "복합 인덱스 함수(Complex Index Functions)"인 2009년 12월 8일자로 출원된 국제 특허출원 공보 제WO2010/077660호에 기재된 복합 인덱스 함수가 포함된다. 다른 일차 보상 기법이 사용될 수 있다.
잔여 오차 225는 일반적으로 잔여 오차=총 오차 관찰된-일차 함수 보정 오차에 의해 표시될 수 있다. 일차 함수에 의해 보상되지 않은 분석물 농도에 남는 잔여 오차 225는 작동 조건, 제조 변동 및/또는 무작위 오차로부터 생기는 것으로 간주될 수 있다. 비보상 출력 값 205의 총 오차에 있어, 일차 보상은 보상된 분석물 농도 225로부터 상기 오차의 40% 이상, 바람직하게는 50% 이상을 제거한다. 바람직하게, 일차 보상은 비보상 출력 값에서의 총 오차의 40% 내지 75%, 더욱 바람직하게는 50% 내지 85%를 제거한다.
도 2b는 변환 함수 210 및 SSP 매개변수 보상을 포함하는 오차 보상 방법을 나타낸다. 총 오차 215를 포함하는 변환 함수 210으로부터의 출력은 SSP 함수 250 형태의 SSP 매개변수로 보상되어, 일차 보상을 제공한다. 따라서, SSP 함수 250은 변환 후에 비보상 출력 값 205를 보상한다. 총 오차 215는 일차 및 잔여 오차를 포함한다. 총 오차 215는 또한 무작위 및/또는 기타 유형의 오차를 포함할 수 있다. 변환 함수 210 및 SSP 함수 250은 2개의 분리된 수학 방정식, 단일 수학 방정식, 또는 기타 방정식으로서 수행될 수 있다. 예를 들어, 변환 함수 210은 조합된 제1 수학 방정식으로 수행될 수 있고, SSP 함수 250은 제2 수학 방정식으로서 수행될 수 있다.
도 2b에서, 변환 함수 210 및 비보상 출력 값 205은 변환 함수 210가 일차 보상을 내부화하지 않는 것을 제외하고는 도 2a에 관하여 논의된 것과 유사한 것으로 간주될 수 있다. 시료가 혈액이고, 분석물이 포도당일 때, SSP 함수 250에 의해 제공되는 보상은 온도 및/또는 적혈구용적율로부터 생기는 분석 오차에 대한 보상에 실질적으로 제한될 수 있다. 따라서, 온도 및/또는 적혈구용적율 변화에 대한 바이오센서 시스템을 특징화함으로써, 온도 및/또는 적혈구용적율로부터의 효과는 SSP 함수 250에 의해 보상될 수 있다.
도 2c는 SSP 함수 보상에 의해 제공되는 변환 함수 210, 일차 보상, 제1 잔여 보상, 및 제2 잔여 보상을 포함하는 오차 보상 방법을 나타낸다. 나머지 잔여 오차 225는 사용자 자가 시험 오차에 대응하는 제1 잔여 함수 230의 형태로 잔여 보상으로 보상된다. 나머지 잔여 오차 235는 SSP 함수 250의 형태로 SSP 매개변수로 보상된다. 따라서, SSP 함수 250은 변환 후의 비보상 출력 값 205, 일차 보상, 및 제1 잔여 보상을 보상한다. 총 오차 215는 일차 및 잔여 오차를 포함한다. 총 오차 215는 또한 무작위 및/또는 기타 유형의 오차를 포함할 수 있다. 이 예에서 제2 잔여 함수로 작용하는, 변환 함수 210, 일차 함수 220, 제1 잔여 함수 230, 및 SSP 함수 250는 4개의 분리된 수학 방정식, 단일 수학 방정식, 또는 기타 방정식으로서 수행될 수 있다. 예를 들어, 변환 함수 210은 제1 수학 방정식으로서 수행될 수 있으나, 일차 함수 220, 제1 잔여 함수 230, 및 SSP 함수 250은 조합되어 제2 수학 방정식으로서 수행될 수 있다.
도 2c에서, 변환 함수 210 및 비보상 출력 값 205는 도 2a에 관하여 논의된 것과 유사한 것으로 간주될 수 있다. 일차 함수 220은 이미 논의된 바와 같이, 기울기 기초 보상을 수행하는 복합 인덱스 함수로서 간주될 수 있다. 잔여 보상의 적어도 일부를 제공하는 제1 잔여 함수 230은 일차 함수 220으로 주요 오차를 보상하는 것에 부가하여 적용된다.
관찰된 잔여 오차는 일차 함수 220의 값에 의해 총 오차로부터 제거된 오차가 실질적으로 결여되었다. 총 오차는 조절 환경(잔여 함수에 의해 실질적으로 기재됨) 및 제조 변동의 외부로부터 비롯되는 작동 조건 오차와 대비하는, 실질적으로 상이한 공급원 및/또는 시험 사례로부터의 오차, 예컨대 조절 환경(잔여 함수에 의해 실질적으로 기재됨)에서의 온도 및 적혈구용적율 오차를 포함한다. 비숙련 대상에 의한 사용자 자가 시험과 같은 특별한 상황에 잔여 오차에 초점을 두고, 잔여 오차와 연관된 하나 이상의 잔여 함수를 찾음으로써, 바이오센서 시스템의 측정 성능을 향상시킬 수 있다. 제1 잔여 함수 230의 적용 후에 남는 잔여 오차는 SSP 함수 250 형태의 제2 잔여 함수의 적용으로 더욱 감소될 수 있다.
이 예에서, SSP 함수에 기재되는 오차는 조절 환경 또는 비조절 환경으로부터 나올 수 있으나, 오차는 바람직하게 일차 보상, 변환 함수+일차 보상을 포함하는 변환 함수의 사용 후에 남는 비조절 환경으로부터의 비무작위 오차, 및/또는 변환 함수+일차 및 제1 잔여 함수 보상의 사용 후에 남는 오차이다. 제2 잔여 함수는 일차 또는 일차 및 제1 잔여 함수에 의해 제공되는 보상에서의 계통 결핍을 보상하도록 선택될 수 있다. 바람직하게, SSP 함수에 의해 보정되는 오차는 SSP 함수의 경우보다 일차 및/또는 제1 잔여 함수와의 더 낮은 상관을 보여준다.
일차 보상, 제1 잔여 보상, 및 하나 이상의 SSP 보상을 포함하는 것에 부가하여, 도 2c에 나타낸 오차 보상 방법은 SSP 보상에 의해 제공되는 보상과 연관하여 잔여 보상에 의해 제공되는 보상과 연관하여 일차 보상에 의해 제공되는 보상을 제공하는 능력을 포함할 수 있다. 잔여 보상은 또한 SSP 보상에 의해 제공되는 보상과 연관하여 제1 잔여 함수에 의해 제공되는 보상을 제공하는 능력을 포함할 수 있다.
제1 잔여 보상을 구성하는 함수 또는 함수들이 제한된 온도 및/또는 적혈구용적율 범위에 대해 데이터베이스 또는 기타로서의 측정 장치에 저장되는 예비 결정된 값으로부터 취할 수 있으나, 일차 및 SSP 함수는 전 범위의 시료 온도 및 적혈구용적율 함량으로부터 결정될 수 있기 때문에, 잔여 및 SSP 보상에 의해 제공되는 보상과 연관하여 일차 보상에 의해 제공되는 오차 보상은 조절될 수 있다. 따라서, 일차 및 SSP 함수는 시료를 분석하는 동안에 습득된 입력으로부터 결정될 수 있으나, 제한된 수의 제1 잔여 함수는 측정 장치에서 예비 결정되어 저장될 수 있다. 또한, 몇몇 중첩이 일차, SSP, 및 하나 이상의 잔여 함수에 의해 기술되는 오차들 간에 일어날 수 있기 때문에, 제1 잔여 보상에 의해 제공된 보상과 연관하여 일차 및 SSP 보상에 의해 제공된 오차 보상이 조정될 수 있다. 잔여 보상에 의해 제공된 보상과 연관하여 일차 및 SSP 보상에 의해 제공된 오차 보상을 조정하기 위한 다른 이유들이 있을 수 있다.
제1 잔여 보상에 의해 제공된 보상과 연관하여 제1 보상에 의해 제공된 오차 보상을 조정하는 한 방법은 함수 가중 계수를 포함한다. 일차 및 SSP 보상에 의해 제공되는 오차 보상이 잔여 보상에 의해 제공되는 보상과 연관하여 조정되는, 일반적 형태의 보상은 [일차 함수+WC1*잔여 함수+WC2*SSP 함수(여기서, WC1 및 WC2는 함수 가중 계수임)]로 표시될 수 있다. 함수 가중 계수 WC는 제1 잔여 함수 및 SSP 함수로부터의 다양한 보상 기여에 대한 온도 및/또는 적혈구용적율의 함수로서 선택될 수 있다. 유사하게, 하나 이상의 잔여 함수 및 SSP 함수를 포함하는 보상(여기서, 잔여 함수 각각은 함수 가중 계수에 의해 변경됨)은 하기 일반적 형태를 취할 수 있다:
보상 분석물 농도=전류 nA/(기울기Cal*(1+일차 함수+WC1*잔여 1+WC2*잔여2...+WC3*SSP 함수)), 혹은 하기 대안적 일반적 형태의 잔여를 이용한다:
보상 분석물 농도=전류 nA/(기울기Cal*(1+일차 함수)*(1+WC1*잔여 1)*(1+WC2*잔여 2)*(1+WC3*SSP 함수)
여기서, WC1, WC2, 및 WC3는 0 내지 1의 값을 가지는 함수 가중 계수이고, 조건이 잔여 함수 전개에 사용된 조건 이외의 범위일 때, 잔여 함수 및 SSP 함수의 효과가 감소되거나 제거되도록 한다. 상기 논의된 항 가중 계수에 대한 작업과 유사하나, 총 오차에 대한 총 보상에의 각 보상 함수의 기여를 할당한다.
잔여 1은 일차 보상 함수 후의 잔여 보상의 제1 수준이고, 한편 잔여 2는 그 다음의 잔여 보상 수준이나, 오차 공급원/인덱스 함수가 나타나지 않을 경우에는 이용가능하지 않을 수 있다. 잔여 1 및 잔여 2는 바람직하게 상호 독립적이고, 제1 함수와 독립적이다. 바람직하게, SSP 함수는 일차 및 잔여 함수와 독립적이다.
일차 보상 대 제1 잔여 보상 대 SSP 보상에 대한 함수 가중 계수는 표의 형태로 또는 다른 수단을 통해 측정 장치에서 예비 결정되어 저장될 수 있다. 예를 들어, WC1, WC2 및 WC3 값은 온도 및 적혈구용적율의 함수로서 이차원 표로 특징화될 수 있다. 이러한 식으로, 함수 가중 계수 표는 시료의 적혈구용적율 함량 및 분석이 수행되는 온도가, 변환 함수 210을 결정하는 데 사용된 데이터 수득 시의 조건에 비교적 근접할 때, 결정된 분석물 농도에 대한 잔여 함수 또는 함수들의 영향을 감소시킴으로써, 바이오센서 시스템의 측정 성능을 향상시키도록 구성될 수 있다. 잔여 보상 및 가중 계수를 해결하는 부가적 정보는 발명의 명칭이 "언더필 오차를 포함한 잔여 보상(Residual Compensation Including Underfill Error)"인, 2011년 3월 22일자로 출원된 미국 특허출원 제13/053,722호에서 찾아볼 수 있다.
분석물 또는 그 분석물에 대응하는 매개자/광식별성 종으로부터의 값에 대해 외부적인 부가적 출력 값을 발생시키는 능력을 가지는 바이오센서 시스템은 전술된 오차 보상 방법으로부터 이익을 받을 수 있다. 이 유형의 시스템은 일반적으로 몇몇 방식으로 부가적 출력 값 또는 값을 분석물에 대응하는 출력 신호로부터 차감함으로써 간섭자 및 기타 기여자를 보상하기 위해 부가적 출력 값 또는 값들을 사용한다. 오차 매개변수는 분석의 출력 신호로부터 직접적으로 또는 간접적으로 추출하고/하거나, 출력 신호로부터 독립적으로 수득될 수 있다. 따라서, 분석물 또는 분석물에 대응하는 매개자로부터의 값에 대해 외부적인 부가적 출력 값을 사용하여, 발명의 명칭이 "기울기 기초 보상(Slope-Based Compensation)"인 2008년 12월 6일자로 출원된 국제 특허출원 공보 제WO 2009/108239호 등에 기재된 항과 같은 항들을 형성할 수 있다.
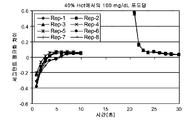
도 3a 및 도 3b는 화학적 반응 및 광학 검출의 2개 통로를 정확도를 증가시키기 위해 동일한 분석을 수행하는 광학 층상 유동 시스템으로부터의 시간의 함수로서의 반사도 형태의 출력 신호를 나타낸다. 각 검출 통로는 A1c 및 총 적혈구용적율(THb) 반사도 신호 모두를 검출한다. 도 3a는 층상 유동 시험 센서 내 2개의 분리된 스트립으로부터 각각의 통로 1와 2, 및 3과 4에 대한 반사도 프로파일의 전형적 반응을 도시한다. 통로 1과 3은 A1c 반사도 출력 신호이고, 한편 통로 2와 4는 총 헤모글로빈 반사도 출력 신호이다. 도 3b는 통로 1과 3에 대한 보다 긴 시간 베이스를 도시한다. 각 통로에 대한 종점 신호를 가져, SSP는 각 통로에 대한 연속 반사도 프로파일에 적용되었다. 출력 신호(A1c 반사도 프로파일)는 통로 1 A1c 판독 스폿(CH1)에 대해서는 D1-1, D1-2, D1-3, D1-4 및 D1-5로 표시되고 통로 3 A1c 판독 스폿(CH3)에 대해서는 D3-1, D3-2, D3-3, D3-4 및 D3-5으로 표시되는 5개의 세그먼트로 세그먼트화되었다.
플롯은 최소의 반사도(Min-R)(D1-1 및 D1-2) 전의 2개의 세그먼트, Min-R (D1-3) 직후의 1개의 세그먼트, 정지 상태(D1-4)에 접근하는 개시 단계의 1개의 세그먼트, 및 종점 신호 R-100(D1-5) 쪽으로의 마지막 단계를 나타내는 1개의 세그먼트를 나타낸다. 출력 신호를 단위가 시간 베이스 차이, 무단위인 ΔR/Δt를 이용하여 세그먼트화하여 처리하였다. 출력 신호를 세그먼트화하고 처리하는 다른 방법이 사용될 수 있다.
도 3a 및 도 3b에서, x 축은 불규칙 데이터 습득 간격으로 인해 수치 내부화 시간으로 표시된다. Min-R 전 및 직후, 시간 단위는 ~0.25 당 0.3초이다. Min-R가 경과한 후, 각 수치는 3초를 나타내고, 이는 종점 판독 R-100에서 300초를 초래한다. 따라서, x 축 상의 시간 베이스 수 2 내지 7에 있어, 각 수는 0.3초에 의해 분리되는 4개의 데이터 점(4개의 데이터 점은 x 축을 따라 2 내지 3 사이에 포함됨)을 포함한다. 유사하게, x 축 상의 시간 베이스 수 7 내지 42에 있어서, 시간 베이스 수 당, 3초에 의해 분리되는 1개의 데이터 점이 포함된다. 실제 분석 길이에 대해, 도 3a의 x 축 상의 시간 베이스 수 10은 분석 개시 이후 약 30초가 경과하였음을 나타낸다. 도 3b에서, x 축 상의 시간 베이스 수 40은 분석의 개시 이후 대략 120초가 경과하였음을 나타내며, 시간 베이스 수 40은 반응의 개시 이후 대략 300초의 경과를 나타낸다.
이어서, 출력 신호 세그먼트를 처리하여, SSP 매개변수 및 이의 교차항을 제공하고, SSP 함수로서 작용한 복합 인덱스 함수에 잠재적으로 포함시키기 위한 항으로 간주되었다. 이하 표 1에는 SSP 매개변수를 부가적 값과 조합하는 교차항 및 SSP 매개변수의 다중 변수 회귀로부터 수득되는 배제 시험의 측면에서 선택되는 가중 계수들이 열거되어 있다. 미니탭(MINITAB) 버전 14 소프트웨어를 다중 가변 회귀를 수행하기 위해 선택된 다중 변수 옵션의 일차 조합의 다중 가변 회귀와 함께 사용하였다. 다른 통계학적 분석 또는 회귀 옵션을 사용하여, 항에 대한 가중 계수를 결정할 수도 있다.
[표 1]
통로 1의 출력 신호로부터의 광학 다중 변수 회귀의 결과.
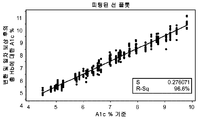
통로 1에 대한 SSP 함수로 작용한, 생성된 복합 인덱스 함수는 다음과 같이 나타내어질 수 있다:
여기서, -0.88664는 상수이고, T는 온도이며, MR1은 통로 1로부터의 최소 반사도(Min-R)에서의 반사도이고, A1는 변환 함수 내부화 일차 보상을 이용하여 통로 1로부터 결정되는 A1c 농도이며, A3은 통로 3으로부터의 A1c 값이고, D1-1 내지 D1-5는 도 3a에서의 출력 신호 세그먼트 D1-1 내지 D1-5로부터의 SSP 매개변수이고, Mt1은 Min-R 반사도가 통로 1로부터 기록되게 되는 시간이다.
도 3c는 변환 및 일차 보상 후의 잔여 오차를, 통로 1에 대한 시료의 기준 A1c 농도 %와 연관되는 잔여 오차를 기술하는 SSP 함수의 능력과 연관시키는 상관 플롯을 도시한다. 따라서, 통로 1에 대한 SSP 함수는, 비보상 출력 값을 변환하고 일차 보상을 온도 및 총 헤모글로빈 오차를 보상하도록 적용한 후에 남는 오차의 대략 60%(R2=59.3)를 기술할 수 있었다. 바람직하게, SSP 함수는 변환 및 일차 보상 함수를 시험 센서로부터 비보상 출력 값에 적용한 후에 남는 잔여 오차의 50% 이상을 기술할 것이다.
통로 3으로부터의 출력 신호에 대해 유사 공정을 반복하였다. 결과가 이하 표 2에 제시되어 있다.
[표 2]
통로 3의 출력 신호로부터의 광학 다중 변수 회귀의 결과.
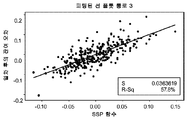
통로 3에 대한 SSP 함수로 작용한, 생성된 복합 인덱스 함수는 다음과 같이 나타내어질 수 있다:
도 3d는 변환 및 일차 보상 후의 잔여 오차를, 통로 3에 대한 시료의 기준 A1c % 농도와 연관하여 잔여 오차를 기술하는 SSP 함수의 능력과 연관시키는 상관 플롯을 도시한다. 이 역시 통로 3에 대한 SSP 함수는 비보상 출력 값을 변환하고 일차 보상을 적용한 후에 남는 오차의 대략 60%(R2=57.8)를 기술할 수 있었다. SSP CH1 및 CH3 함수 모두는 통로 1 및 3(ΔA1c/A1c)1, (ΔA1c/A1c)3의 상대 오차를 나타내는 보상 함수였다. 보상을 다음과 같이 수행하였다: A1ccomp1=A1craw1/(1+SSP1) 및 A1ccomp3=A1craw1/(1+SSP3). 최종 A1c 값을 일반 관계식 A1cfinal=(A1ccomp1+A1ccomp3)/2으로 결정하였고, 통로 1 및 3로부터의 평균이었다.
도 3e 및 도 3f는 내부화 대수 일차 보상을 가지는 변환 함수를 이용하는 분석으로부터의 결과 대(vs) 내부화 일차 보상 및 SSP 함수 보상의 부가와 함께 동일한 변환 함수를 이용한 분석으로부터의 결과를 비교한다. 시험 센서들의 5개의 상이한 로트를 분석에 사용하였고, 그 데이터를 조합하였다. SSP 함수에 의해 제공된 분석들 간의 바이어스 % 표준 편차의 향상은 약 10%이었고, 측정 성능의 부가적 향상은 0에 더욱 근접하게 이동하는 평균 바이어스 %로부터 생겼다(-0.011 대 0.043). 바람직하게, SSP 함수는 5% 이상, 더욱 바람직하게는 8% 이상의 향상을 제공하였다. 이는 시험 센서들의 5개의 상이한 로트에 대해 바이어스 % 표준 편차의 향상이었다.
이하 표 3은 개별 로트 성능을 요약한다. 각 로트의 시험 센서에 대해, 측정 성능의 향상은 바이어스 % 표준 편차, 0에 더 근접하게 이동하는 평균 바이어스 %, 또는 둘 다의 감소로부터 생긴다.
[표 3]
개별 시험 센서 로트의 성능의 측정
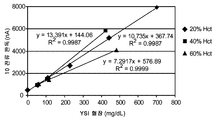
도 4a는 상대적으로 긴 이완에 의해 분리되는 2개의 상대적으로 긴 여기를 포도당 함유 혈액 시료에 적용할 때, 전기화학적 전류측정 분석으로부터의 출력 신호를 나타낸다. 그러한 분석은 측정 장치 및 시험 센서를 이용하여 혈액 시료에 대해 수행될 수 있다. 혈액 시료는 100 mg/Dl의 포도당 및 40%(중량/중량) 적혈구용적율을 포함하였다. 입력 신호의 제1 여기는 출력 전류 1를 발생시켰고, 한편 입력 신호의 제2 여기는 출력 전류 2를 발생시켰다. 제1 여기는 시료(혈액) 내의 분석물 (포도당)의 농도를 결정하기 위해 사용되지 않으나, 주로 시험 센서의 저장 중에 환원을 겪은 매개자 산화하는 기능을 한다. (30초에서의) 출력 전류 2의 최종 전류는 종점 판독이고, 변환 함수와 함께 사용하여, 시료의 분석물 농도를 결정한다. 대략 25℃에서 분석을 수행하였다.
도 4b는, 이 분석을 대략 25℃에서 다중 혈액 시료에 대해 수행하나, 적혈구용적율 함량이 20%, 40%, 및 60%이고, 포도당 농도가 0 내지 700 mg dL인 용량 반응 선을 도시한다. 각 분석에 대해, 제2 여기의 종점 판독으로부터, 이에 따라 도 4a와 연관하여 30초에서 시료의 분석물 농도를 직접적으로 결정하였다. 선들 사이의 발산에서 볼 수 있는 바와 같이, 적혈구용적율 효과는 혈장 내 YSI 기준 기기로 결정되는 기준 농도 대비, ±30% 이하 바이어스를 초래할 수 있다.
제1 및 제2 여기로부터의 출력 전류를 세그먼트화하였다. 제1 여기로부터의 출력 전류를 하기 세그먼트들로 나누었다:
세그먼트 1("0.9"로 표시됨): 데이터 점 1 내지 3. 이 데이터 점을, 입력 신호를 시료에 적용하는 0.9초 내에 측정하였고, 이 때 데이터 점은 0.3초 간격으로 측정하였다. 이 세그먼트는 총 3 데이터 점을 포함하였다.
세그먼트 2("1.8"로 표시됨): 데이터 점 4 내지 6. 데이터 점 1.8은 측정한 6 번째 데이터 점이고, 이 세그먼트에 포함된 마지막 데이터 점이다. 따라서, 세그먼트 2는 입력 신호를 시료에 초기 적용한 후로부터 1.8초에 기록한 데이터 점을 비롯한 그 이하의 0.9초 기록 데이터 점(이는 세그먼트 1에 포함됨) 후에 기록된 데이터 점들을 포함한다. 이 세그먼트는 총 3개의 데이터 점을 포함하였다.
세그먼트 3("2.7"로 표시됨): 데이터 점 7 내지 9. 이 세그먼트는 총 3 데이터 점을 포함하였다.
세그먼트 4("3.6"으로 표시됨): 데이터 점 10 내지 12. 이 세그먼트는 총 3 데이터 점을 포함하였다.
세그먼트 5("4.8"로 표시됨): 데이터 점 13 내지 16. 이 세그먼트는 4 데이터 점을 포함하였다.
세그먼트 6("6"으로 표시됨): 데이터 점 17 내지 20. 이 세그먼트는 4 데이터 점을 포함하였다.
세그먼트 7("7.2"로 표시됨): 데이터 점 21 내지 24. 이 세그먼트는 4 데이터 점을 포함하였다.
세그먼트 8("8.4"로 표시됨): 데이터 점 25 내지 28. 이 세그먼트는 4 데이터 점을 포함하였다.
세그먼트 9("9.9"로 표시됨): 데이터 점 30 내지 33. 이 세그먼트는 4 데이터 점을 포함하였다.
불규칙 세그먼트화 간격을 사용하여, 2개의 입력 여기로부터 출력 신호를 세그먼트화하였다. 세그먼트화 간격은 0.9초(세그먼트 1 내지 세그먼트 4)에서 시작하여, 1.2초(세그먼트 5 내지 세그먼트 8)를 증가하였고, 1.5초 간격(세그먼트 9)에서 종결하였다. 출력 신호 전류 내의 붕괴가 더 얕아짐에 따라, 상대적으로 보다 긴 세그먼트화 간격을 사용하여, 생성된 SSP 매개변수에 보다 나은 정의를 제공하였다. 따라서, SSP 매개변수들 간의 정의를 증가시키는 세그먼트화 간격이 바람직하다.
제1 여기를 시료 내 분석물의 농도를 결정하는 데 사용하지 않기 때문에, 제2 여기를 세그먼트화하여, 전술된 바와 같이 연속 출력 신호로 유사하게 처리하였다. 제2 여기로부터의 출력 전류를 유사하게 하기 세그먼트들로 나누었다: 20.9, 2 1.8, 22.7, 23.6, 24.8, 26, 2 7.2, 28.4 및 29.9. 동일한 불규칙 세그먼트화 간격을 사용하여, 제2 여기로부터 출력 전류를 격리하였다.
이어서, 출력 신호 세그먼트를 처리하여, SSP 매개변수를 제공하였다. 정규화 차이 방법을 사용하여, 각 세그먼트에 대한 제1 데이터 점과 마지막 데이터 점(전류 값) 간의 차이를 수득한 후, 29.9초에서 측정한 연속 출력 신호의 종점 판독으로 정규화함으로써, 출력 신호 세그먼트를 SSP 매개변수로 처리하였다. 도 4c는 제2 여기의 종점 판독에 의한 각 출력 신호 세그먼트 정규화의 차이를 플로팅한다. 예를 들어, "9.9" 세그먼트를 (i9sec-i9.9sec)/i29.9sec로 결정하였고, "20.9" 세그먼트를 (i20.3sec-i20.9sec)/i29.9sec로 결정하였다.
도 4d는 세그먼트 값을 기록하도록 한 여기의 종점 판독에 의해 정규화된 각 출력 신호 세그먼트의 차이를 플로팅한다. 예를 들어, 세그먼트 정규화 차이를 이용하여, "9.9snd" 세그먼트=(i9sec-i9.9sec)/i9.9sec(여기서, 9.9초 전류 값은 제1 입력 여기로부터 기록된 마지막 전류 값임), "20.9snd" 세그먼트=(i20.3sec-i20.9sec)/i29.9sec(여기서, 29.9초 전류 값은 제2 입력 여기로부터 기록된 마지막 전류 값임)이다.
도 4e는 세그먼트 값을 기록하도록 한 여기의 종점 판독에 의해 정규화된 각 출력 신호 세그먼트의 시간 베이스 차이를 플로팅한다. 예를 들어, 시간 베이스 정규화 차이는 "9.9tnd"=(i9sec-i9.9sec)/(9s-9.9s)/i9.9sec 및 "20.9tnd"=(i20.3sec-i20.9sec)/(20.3s-20.9s)/i29.9sec로 나타내어질 수 있다. 이는 세그먼트 종점 판독에 의한 정규화를 이용한 각 세그먼트 내의 구배(전류를 시간으로 나눔)이다. 다른 방법을 사용하여, 출력 신호 세그먼트를 처리한다.
일단 SSP 매개변수로 처리되면, 다중 SSP 매개변수, 오차 매개변수, 및 시료 내 비보상 분석물 농도를 나타내는 값은 SSP 함수로 작용한, 복합 인덱스 함수에 잠재적으로 포함시키기 위한 항으로서 간주될 수 있다. 이하 표 4에는 도 4a에 나타낸 바와 같이, 제2 여기의 종점 전류 2로부터 결정되는, SSP 매개변수, 오차 매개변수, 및 비보상 포도당 농도의 다중 변수 회귀로부터의 배제 시험의 측면에서 선택되는 가중 계수들이 열거되어 있다. 미니탭 버전 14 소프트웨어를 다중 가변 회귀를 수행하기 위해 선택된 다중 변수 옵션의 일차 조합의 다중 가변 회귀와 함께 사용하였다. 다른 통계학적 분석 또는 회귀 옵션을 사용하여, 항에 대한 가중 계수를 결정할 수도 있다.
[표 4]
2 여기 다중 변수 회귀의 결과.
SSP 함수로 작용한, 생성된 복합 인덱스 함수는 다음과 같이 나타내어질 수 있다:
여기서, G는 시료의 비보상 포도당 농도이고, R2/1는 제1 여기로부터의 출력의 종점 판독에 대한 제2 여기로부터의 출력의 종점 판독이고, R2는 제1 여기로부터의 출력의 초기 판독에 대한 제2 여기로부터의 출력의 초기 판독이다. SSP 함수는 ΔS/S 형태의 시스템 총 오차를 나타내는, 함수 내의 모든 매개변수들로부터의 값을 발생시킨다. 따라서, Gcomp=(iraw-lnt)/[(Scal*(1+SSP))]이며, 이는 적혈구용적율 보상된 포도당 값이며, 여기서 iraw는 시료의 분석물 농도를 결정하는 데 사용되는 출력 신호 값이고, lnt은 0일 수 있다.
도 4f는 대략 25℃에서 20% 내지 60% (부피/부피) 적혈구용적율 및 대략 50 내지 700 mg/dL의 포도당 농도를 포함하는 다중 혈액 시료로부터 결정되는, 비보상 및 SSP 함수 보상된 분석물 농도의 총 상대 오차(ΔG/G)를 비교한다. 도면에서 도시되는 바와 같이, SSP 함수가 일차 보상을 제공했을 때, 대략 50%의 상대 오차 감소가 제공되었다. 바람직하게, SSP 함수는 결정된 분석물 농도에, 출력 신호 및 변환 함수로부터 결정된 비보상 분석물 보상보다 30% 더 적은 상대 오차, 바람직하게는 40% 더 적은 상대 오차, 더욱 더 바람직하게는 50% 더 적은 상대 오차를 제공한다.
도 5a는 6회의 상대적으로 짧은 여기가 가변 기간의 5회 이완에 의해 분리되는, 전기화학 개폐식 전류측정 분석을 위해 시험 센서에 적용되는 입력 신호를 나타낸다. 작업 전극 및 상대 전극에 부가되는 6회 여기에 부가하여, 제2 입력 신호를 부가적 전극에 인가하여, 이차 출력 신호를 발생시킨다. 작업 전극과 상대 전극 사이에 인가된 분석 입력 신호의 완료 후에 입력 신호를 부가적 전극에 인가하였으나, 다른 시기에 인가될 수 있다. 부가적 전극에 인가된 입력 신호는 7 번째 보다 높은 전압 펄스를 포함하였다. 솔리드 선은 실질적으로 일정한 입력 전위를 기술하나, 중첩된 도트는 전류 측정 회수를 가리킨다. 이 입력 신호를 다중 내부 임상 연구로부터 혈액의 포도당 농도를 결정하기 위해 사용되는 다중 시험 센서에 인가하였다. 그러한 분석은 측정 장치 및 시험 센서를 이용하여 혈액 시료에 대해 수행될 수 있다.
도 5a의 분석 입력 신호의 여기는 약 0.2초, 약 0.4초 및 약 0.5초의 펄스-폭을 포함하였다. 다른 펄스-폭이 사용될 수 있으나, 약 0.1초 내지 약 0.5초의 펄스 폭이 바람직하다. 2초 초과의 펄스-폭이 덜 바람직하다. 분석 여기가 약 0.5초 및 약 1초의 이완에 의해 분리되며, 개방 회로에 의해 제공되었다. 다른 이완-폭도 사용될 수 있으나, 약 0.3초 내지 약 1.5 초의 이완-폭이 바람직하다. 분석물의 농도가 결정되도록 하는 전류 측정을 포함하는 여기에 바로 선행하는 이완-폭은 바람직하게 1.5 초 미만이다. 5초 초과의 이완-폭이 덜 바람직하다. 개방 회로에 부가하여, 이완은 분석물 및/또는 매개자가 전기화학 산화환원 반응을 겪도록 정확히 유발하는 전위를 인가하지 않는 다른 방법에 의해 제공될 수 있다. 바람직하게, 분석 입력 신호의 인가 및 시료로부터의 연관 출력 전류의 측정은 7초 이하 내에 완료된다.
부가 전극으로부터의 전류 형태의 이차 출력 신호는 혈액 시료의 적혈구용적율 함량을 기술하는 오차 매개변수로 간주될 수 있다. 시료의 적혈구용적율 함량은, 농도 값에서의 오차가 기준 상관 결정 시의 적혈구용적율 함량과는 다른 적혈구용적율 함량에서 분석을 수행함에 따라 비롯될 수 있기 때문에, 오차 매개변수로 간주될 수 있다. 시료의 적혈구용적율 함량은 임의의 공급원, 예컨대 전극, 계산 평가값 등으로부터 결정될 수 있다.
도 5b는 6개의 전류측정 여기 및 이차 출력 신호로부터 기록되는 출력 전류 값을 나타낸다. 전류 i5.4에 의한 각 세그먼트화 신호의 차이를 정규화함으로써 이 출력 신호로부터 SSP 매개변수를 결정하였고, 이는 분석의 종점 판독을 나타내기 위해 사용된다. i5.4 전류는 기록된 다중 전류 값의 경우와 같이 종점 판독을 나타내도록 사용되었고, 이 전류 판독은 시료의 분석물 농도를 최적으로 기술하였다. 정규화를 위한 종점 판독으로서 또 다른 값을 선택할 수 있으나, 바람직하게 정규화를 위해 사용되는 종점 판독은 시료의 기저 분석물 농도와 최적으로 상관되는 종점 판독이다.
개별 여기로부터의 출력 전류를 세그먼트화하여, 다음과 같이 SSP 매개변수로 변환하였다: d12=(i1,1-i1,2)/i5,4, d13=(i1,2-i1,3)/i5,4, d14=(i1,3-i1,4)/i5,4, d15=(i1,4-i1,5)/i5,4,... 이차 출력 신호로부터의 출력 전류를 i7,4에 의해 정규화하였다. 도 5b로부터 결정된 SSP 매개변수는 d12, d13, d14, d15, d22, d32, d33, d34, d42, d43, d44, d52, d53, d54, d62, d63, d64, d72, d73, d74이었다. 다른 SSP 매개변수를 사용할 수 있다.
일차 및 제1 잔여 함수에 의한 보상 후에 존재하는 나머지 잔여 오차 (RRE)는 일반적으로 이하와 같이 나타내어질 수 있다: dG/G_1=(Gcomp1-Gref)/Gref. 일단 SSP 매개변수로 처리되면, 다중 SSP 매개변수, SSP 매개변수의 교차항, 및 시료의 비보상 분석물 농도를 나타내는 값은 SSP 함수로 작용한 복합 인덱스 함수에 잠재적으로 포함시키기 위한 항으로 간주될 수 있다. 하기 표 5는 다중 변수 회귀로부터 수득되는 배제 시험의 측면에서 선택되는 가중 계수들을 열거한다. 미니탭 버전 14 소프트웨어를 다중 변수 회귀를 수행하도록 선택되는 다중 변수 옵션의 선형 조합의 다중 가변 회귀와 함께 사용하였다. 다른 통계학적 분석 또는 회귀 옵션을 사용하여, 항에 대한 가중 계수를 결정할 수 있다.
[표 5]
다중 여기 다중 변수 회귀의 결과
SSP 함수로서 작용한, 생성된 복합 인덱스 함수를 다음과 같이 나타낼 수 있다:
여기서, G는 시료의 비보상 포도당 농도이고, T는 온도이며, 7d13은 7번째 펄스 시간 d13의 종점 판독에 의해 형성되는 교차항의 한 예이고, d22d54G는 d22, d54, 및 G를 곱함으로써 형성되는 교차항이다.
대략 158개의 분석들을 수행하기 위한 시험 센서의 4개의 상이한 제조 로트를 이용하여, 분석을 수행하였다. 이 분석들 중 대략 79개가 HCP-시험으로부터 생긴 반면, 나머지 대략 79개의 분석은 사용자 자가 시험으로부터 생긴 것이었다. 동일한 입력 신호 및 시료 분석물 농도에 대응하여 동일한 출력 신호를 재생가능하게 생성시키는 능력이 로트별로 다양하다. 바이오센서 시험 센서는 변환 함수에 대한 단일 기준 상관을 측정 장치에 장착하는 것이 바람직하나, 이러한 장착은 시험 센서의 상이한 로트들 간에 일어날 수 있는 제조 변동을 제한한다.
도 6a는 일차 함수만을 이용하여 결정되는 분석물 농도의 예측 오차와 총 오차를 비교하는 상관 플롯이다. 도 6b는 일차 및 제1 잔여 함수를 이용하여 결정되는 분석물 농도의 예측 오차와 총 오차를 비교하는 상관 플롯이다. 도 6c는 일차, 제1 잔여, 및 SSP 함수를 이용하여 결정되는 분석물 농도의 예측 농도와 총 오차를 비교하는 상관 플롯이다.
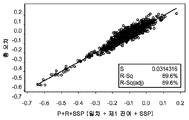
측정 성능의 점진적 향상은 일차 함수 보상 단독에 연관하여 제1 잔여 함수 및 SSP 함수로부터 관찰되었다. 이는 특히 분산된 데이터 점의 경우였다. 총 오차(dG/G)의 회귀선 또는 상관 계수 R2 값의 증가(71.7%, 81.1 % 및 89.6%)에 대한 바이어스 % 표준 편차 항 S(SD 값, 0.0518, 0.0423, 0.0314)의 점진적 감소에서 향상을 볼 수 있다.
따라서, 보상된 분석물 농도는 일반적으로 (일차 및 제1 잔여 보상으로부터 결정된 농도)/(1+SSP 함수)의 관계로부터 결정될 수 있다. 도 6d 및 도 6e는 SSP 함수와 함께 일차+제1 잔여 및 부가적 보상으로부터의 보상 결과를 비교한다. 도 6d에서, %-바이어스는 순수 %로 표시되고, 즉 %-바이어스=100%×(Gfinal-Gref)/Gref이고, 이 때 100 mg/dL 후, 확장 경계는 ±100%×(10/Gref)이다. 도 6e에서, %-바이어스는 G > 100 mg/dL에 대해서는 순수 %로 표시되고, G < 100 mg/dL에 대해서는 바이어스(Gfinal-Gref)로 표시되며, 이 때 고정 경계는 ±10%이다. 이 2개의 표현은 동등하나, 도 6d는 SSP 함수 보상을 부가한 저포도당 영역에서의 측정 성능의 향상을 더욱 용이하게 도시한다.
도 7a는 전기화학적 조합된 개폐식 전류측정 및 개폐식 전압-전류측정 분석을 위해 시험 센서의 작업 전극 및 상대 전극에 인가된 입력 신호를 나타낸다. 입력 신호는 2회의 전류측정 여기 및 이에 이은 5회의 전압-전류측정 여기를 포함하였다. 여기는 다양한 기간의 6회 이완에 의해 분리되었다. 파선은 입력 신호를 나타내고, 이는 전류측정 여기가 실질적으로 일정한 전압/전위로 인가되나, 전압-전류측정 여기는 삼각형의 형상이어서, 전위가 시간에 따라 변화한다. 이 예에서, 전압 스캔 속도는 전압-전류측정 여기에 대해 0.5 V/초였으나, 다른 스캔 속도들도 사용될 수 있다. 각 여기에 대해 시료로부터 측정되는 출력 전류(마이크로암페어(uA))는 상응하는 솔리드 선으로 표시된다. 출력 전류 값을 각 전압-전류측정 여기에 대해 약 10 밀리초마다 기록하였다. 전류측정 여기는 연속 붕괴를 생성시켰으나, 전압-전류측정 여기는 각 전압-전류측정 여기의 전방 부분 및 역방 부분으로부터 시간에 대한 2단계 붕괴를 제공하였다. 그러한 분석은 측정 장치 및 시험 센서를 이용하여 혈액 시료에 대해 수행될 수 있다.
도 7a의 입력 신호의 전류측정 여기는 약 0.5초 및 0.25초의 펄스-폭을 가진다. 분석 입력 신호의 전압-전류측정 여기는 약 0.4초의 펄스-폭을 포함하였다. 다른 펄스-폭을 사용할 수 있으나, 약 0.1초 내지 약 0.5초의 펄스 폭이 바람직하다. 2초 초과의 펄스-폭이 덜 바람직하다. 바람직하게, 시료의 분석물 농도가 결정되도록 하는 전압-전류측정 여기의 스캔 범위는 측정가능한 종의 정체기 범위 내에 있어, 측정가능한 종의 전기화학 산화환원 반응이 실질적으로 확산 제한된다.
전압-전류측정 분석 여기는 약 1초의 이완에 의해 분리되었고, 개방 회로에 의해 제공되었다. 다른 이완-폭이 사용될 수 있으나, 약 0.3초 내지 약 1.5초의 이완-폭이 바람직하다. 분석물의 농도가 결정되도록 하는 전류 측정을 포함하는 여기에 바로 선행하는 이완-폭은 바람직하게 1.5초 미만이다. 3초 초과의 이완-폭이 덜 바람직하다. 개방 회로에 부가하여, 이완은 이완 중에 분석물 및/또는 매개자로 하여금 전기화학 산화환원 반응을 겪도록 현저히 유발하는 전위를 인가하지 않는 다른 방법에 의해 제공될 수 있다. 바람직하게, 분석 입력 신호의 인가 및 시료부터의 연관된 출력 전류의 측정은 8초 이하 경과 시에 완료된다.
도 7b는 2회의 전류측정 여기 및 5회의 전압-전류측정 여기를 가지는 7개의 여기 입력 신호의 제3 전압-전류측정 여기의 다중 분석에 대해 수득된 전류를 도시한다. 분석물로서의 약 80 mg/dL의 포도당 및 25 부피%, 40 부피%, 또는 55 부피% 적혈구용적율을 포함하는 혈액 시료에 대해 분석을 수행하였다. 하기 표 6은 시료에 대한 입력 신호의 인가로부터의 시간, 및 제3 전압-전류측정 여기로부터 기록된 출력 신호 전류 값에 대한 펄스 내의 시간을 도시한다.
[표 6]
도 7c는 혈액 시료가 약 400 mg/dL 포도당을 포함했을 때, 제3 전압-전류측정 여기로부터 수득된 전류를 도시한다. 도면에서 볼 수 있는 바와 같이, 시료의 적혈구용적율 함량은 보다 큰 포도당 농도 혈액 시료에 대한 출력 전류에 대해 더 큰 영향을 미쳤다.
도 7d는 제3 전압-전류측정 여기로부터의 출력 전류를 어떻게 세그먼트화하여, 여기로부터 3개의 출력 신호 세그먼트 "4.8", "4.85", 및 "5"를 제공하는지를 나타낸다. 세그먼트를, 세그먼트의 제1 전류 값에 상응하는 입력 신호를 개시한 후의 시간을 라벨링하였다.
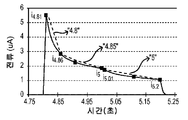
이 예에서, 5개의 개폐식 전압-전류측정 여기로부터의 출력 전류를 여기의 전방 부분에 대해서는 2개의 세그먼트로 세그먼트화하였고, 여기의 후방 부분에 대해서는 2개의 세그먼트로 세그먼트화하였다. 따라서, 각 개폐식 전압-전류측정 여기로부터 3개의 SSP 매개변수를 결정하였다. 여기의 전방 부분 또는 역방 부분에 대해 여기 중 하나 이상으로부터 부가적 SSP 매개변수를 계산할 수 있다.
이어서, 제3 전압-전류측정 여기로부터의 출력 전류로부터 SSP 매개변수를 결정하였다. 다른 SSP 매개변수 결정 방법을 사용할 수 있으나, 전술된 방법들을 사용하여, 하기 표 7에서와 같이 제3 전압-전류측정 여기에 대한 3개의 SSP 매개변수 "4.8", "4.85" 및 "5"를 제공하였다.
[표 7]
보상을 수행하기 위해, 제3 여기의 종점 판독을 나타내고 입력 신호를 시료에 인가 개시한지 5.2초 후에 측정된, 전류 i5.2에 의해 각 세그먼트화 신호의 차이를 정규화함으로써 시간 베이스 정규화 차이 SSP 매개변수 발생 방법을 이용하여, 나머지 전압-전류측정 여기로부터의 세그먼트로부터 SSP 매개변수를 결정하였다. 이 개폐식 입력 신호에 대해, 각 여기로부터의 출력 신호를 여기의 종점 판독으로 정규화하였다. 따라서, 도 7a에 나타내어진 5개의 전압-전류측정 여기로부터 3개의 SSP 매개변수를 결정하였다. 여기로부터의 각 중간 종점에 반대되는 분석 종점을 사용하여 SSP 매개변수를 결정한 경우, i8은 정규화 값이었다.
따라서, 시간 베이스 정규화 차이 SSP 매개변수 발생 방법, [Δi/(-Δt)/iEP](여기서, 정규화에 사용된 IEP 값은 각 여기의 종점 전류였음)를 사용하였디. 개별 전압-전류측정 여기로부터의 출력 전류를 세그먼트화하여, 한 예로서 다음과 같이 SSP 매개변수로 변환시켰다: 4.8=(i4.81-i4.86)/(4.86-4.81)/i5.2, 4.85=(i4.86-i5)/(5-4.86)/i5.2, 및 5=(i5.01-i5.2)/(5.2-5.01)/i5.2. 이 일반적 방법을 도 7a의 5회 전압-전류측정 여기로부터의 출력 전류에 인가하여, 하기 표 8에서와 같이 SSP 매개변수를 생성시켰다.
[표 8]
SSP 함수를 제공하기 위해 상기 SSP 매개변수로부터 결정된 복합 인덱스 함수는 하기와 같이 나타내어질 수 있다:
여기서, G는 시료의 비보상 포도당 농도이고, "2.0"*G는 "2.0" SSP 매개변수와 시료의 비보상 포도당 농도의 곱에 의해 형성된 교차항의 한 예이다.
일반 관계식 G=(i5.2-lnt)/Scal(여기서, i5.2는 제3 개폐식 전압-전류측정 여기로부터의 입력 신호 개시 5.2초 후에 측정된 전류 값이고, lnt는 기준 상관의 절편이며, 이는 0일 수 있고, Scal는 측정 장치로부터의 출력 전류를 기준 기기로 결정되는 기지의 시료 분석물 농도와 연관시키는 기준 상관임)으로 시료의 비보상 포도당 농도를 결정하였다. 이 예에서, 제3 전압-전류측정 여기의 종점 전류를 사용하여, 시료의 분석물 농도를 결정하였으나; 여기 내로부터의 중간 전류를 사용하여, 시료의 분석물 농도를 결정할 수 있다. 하기 표 9는 시료 분석물 농도가 어떻게 5.0초 시의 중간 전류로부터 또한 제3 전압-전류측정 여기의 5.2초 종점 전류로부터 결정되었는지를 도시한다. 표 9에서의 기울기 및 절편을 다중 포도당 수준에서의 다중 전류 판독의 회귀로부터 예비 결정하였다.
[표 9]
YSI 기준 기기를 이용하여 시료에 대한 기준 분석물 농도를 결정하였다. 기준 상관에 대한 기울기 및 절편 값을 175 mg/dL의 기지의 포도당 농도 및 40%의 적혈구용적율 함량을 포함하는 혈액 시료에 대해 예비 결정하였다. 5.0초 및 5.2초에서의 시료에 대해 기록된 출력 전류 값을 기준 상관과 함께 사용하여, 시료 분석물 농도를 결정하였다. 결정된 분석물 농도에 대한 바이어스 %를 기준 분석물 농도와 연관하여 결정하였다.
개폐식 전압-전류측정 입력 신호에 대한 SSP 함수에 부가하여 보상을 사용할 수 있으나, 이 예에서는 SSP 함수를 사용하여, 일반적으로 일반 관계식 Gcomp=G/(1+SSP 함수)(여기서, Gcomp는 시료의 SSP 매개변수 보상된 분석물 농도임)에 따라 일차 보상을 제공하였다. 표 7로부터의 G_5.0 또는 G_5.2 결정 분석물 농도는 이러한 식으로 보상될 수 있다. 상기 논의된 SSP 보상 방법은 또한 이러한 식으로 결정된 분석물 농도와 함께 사용될 수 있다.
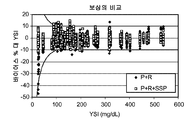
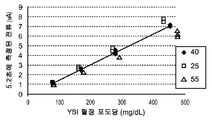
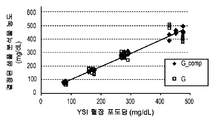
도 7e는 25 부피%, 40 부피%, 또는 55 부피%의 적혈구용적율 수준과 함께 약 80 mg/dL, 1 70 mg/dL, 275 mg/dL, 또는 450 mg/dL 포도당을 포함하는 혈액 시료에 대한 제3 개폐식 전압-전류측정 여기로부터 5.2초에 측정된 전류를 도시한다. 그래프로부터 볼 수 있는 바와 같이, 보다 높은 포도당 농도에서 25% 및 55% Hct 시료에 의해 40% Hct 선으로부터의 더 큰 발산이 있다. 실험실에서 YSI 기준 기기를 이용하여 시료의 기준 포도당 농도를 결정하였다.
도 7f는 SSP 함수에 의해 제공된 보상을 이용하거나 이용하지 않는 측정 장치로부터 수득된 포도당 판독을 도시한다. 각 시료의 비보상 분석물 농도(G)를 일반 관계식 G=(i5.2-lnt/Scal(여기서, lnt 및 Scal는 다중 분석으로부터의 YSI 기준 기기와 함께 실험실에서 결정되는 기준 상관으로부터의 것임)에 의해 결정하였다. 일반 관계식 Gcomp-G/(1+SSP 함수)를 이용하여 각 시료의 보상된 분석물 농도(G_comp)를 결정하였다. 도면에서 볼 수 있는 바와 같이, 보상된 분석물 농도는 상이한 분석물 농도 및 Hct 부피에 대해 더욱 자세히 그룹화한다.
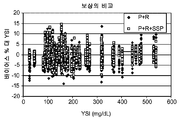
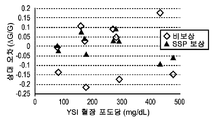
도 7g는 혈액 시료에 대한 결정된 SSP 보상과 비보상 포도당 분석물 농도 간의 상대 오차를 비교한다. 높은 포도당 농도에서도, SSP 보상 결정된 분석물 농도는 특히 비보상 결정된 분석물 농도에 비해, 0 오차 선에 근접한다. 비보상 결정된 분석물 농도에 대한 바이어스 % 표준 편차는 13.5%인 반면, SSP 함수 보상된 결정된 분석물 농도는 5.9%였다. 따라서, SSP 함수 보상은 SSP 보상 없이 결정된 분석물 농도에 비해, 상대 오차의 대략 56% (13.5-5.9/13.5*100) 감소를 제공하였다.
도 8은 생물학적 유체의 시료 내 분석물 농도를 결정하는 바이오센서 시스템 800의 모식도를 나타낸다. 바이오센서 시스템 800은 측정 장치 802 및 시험 센서 804를 포함한다. 측정 장치 802는 벤치-탑 장치, 휴대용 또는 손에 잡히는 크기의 장치 등을 포함한 임의의 분석 기기 내에서 수행될 수 있다. 측정 장치 802 및 시험 센서 804는 전기화학 센서 시스템, 광학 센서 시스템, 이의 조합 등을 수행하도록 적합화될 수 있다.
바이오센서 시스템 800은 하나 이상의 변환 함수, 하나 이상의 SSP 함수, 및 출력 신호를 포함하는 오차 보상 방법으로부터 시료의 분석물 농도를 결정한다. 오차 보상 방법은 시료의 분석물 농도를 결정할 때, 바이오센서 시스템 800의 측정 성능을 향상시킬 수 있다. 바이오센서 시스템 800을 이용하여, 포도당, 요산, 락트산염, 콜레스테롤, 빌리루빈 등의 농도를 포함한 분석물 농도를 결정할 수 있다. 특별한 구성이 나와 있으나, 바이오센서 시스템 800은 부가 성분들을 이용하는 구성을 비롯한 다른 구성을 가질 수 있다.
시험 센서 804는 개구 812와 함께 저장소 808 및 통로 810을 형성하는 기재 806를 가진다. 저장소 808 및 통로 810은 통기구가 있는 뚜껑으로 덮을 수 있다. 저장소 808은 부분적으로 닫힌 부피를 한정한다. 저장소 808은 수팽창성 중합체 또는 다공성 중합체 기질과 같은 액체 시료를 보유하는 것을 보조하는 조성물을 함유할 수 있다. 시약은 저장소 808 및/또는 통로 810에 침착될 수 있다. 시약은 하나 이상의 효소, 결합제, 매개자 등의 종을 포함할 수 있다. 시약은 광학 시스템에 대한 화학 지시약을 포함할 수 있다. 시험 센서 804는 다른 구성을 가질 수 있다.
광학 센서 시스템에서, 시료 인터페이스 814는 시료를 나타내기 위한 광학 포탈 또는 구경(aperture)을 가진다. 광학 포탈은 본질적으로 투명한 물질에 의해 덮혀 있을 수 있다. 시료 인터페이스 814는 저장소 808의 반대측에 광학 포탈을 가질 수 있다.
전기화학 시스템에서, 시료 인터페이스 814는 분석 출력 신호가 측정될 수 있도록 하는 작동 전극 832 및 상대 전극 834에 연결된 도체를 가진다. 시료 인터페이스 814는 또한 이차 출력 신호가 측정될 수 있도록 하는 하나 이상의 부가 전극 836에 연결된 도체도 포함할 수 있다. 전극은 실질적으로 동일한 판 또는 하나 초과 판에 있을 수 있다. 전극은 저장소 808을 형성하는 기재 806의 표면에 배치될 수 있다. 전극은 저장소 808에 연장되거나 돌출될 수 있다. 유전층이 도체 및/또는 전극을 부분적으로 덮을 수 있다. 시료 인터페이스 814는 다른 전극 및 도체를 가질 수 있다.
측정 장치 802는 센서 인터페이스 818 및 디스플레이 820에 연결된 전기 회로 816을 포함한다. 전기 회로 816은 신호 발생기 824, 임의적 온도 센서 826, 및 저장 매체 828에 연결된 프로세서 822를 포함한다.
신호 발생기 824는 프로세서 822에 대응하여 센서 인터페이스 818에 전기 입력 신호를 제공한다. 광학 시스템에서, 전기 입력 신호를 사용하여, 센서 인터페이스 818에서 검출기 및 광원을 작동시키거나 조절할 수 있다. 전기화학 시스템에서, 전기 입력 신호는 센서 인터페이스 818에 의해 시료 인터페이스 814에 투과되어, 전기 입력 신호를 생물학적 유체의 시료에 인가할 수 있다. 전기 입력 신호는 전위 또는 전류일 수 있고, 예컨대 AC 신호가 DC 신호 오프셋으로 인가될 때와 같이, 불변, 가변, 또는 이들의 조합일 수 있다. 전기 입력 신호는 단일 펄스로서 인가되거나, 혹은 다중 펄스, 순서대로 또는 주기로 인가될 수 있다. 신호 발생기 824는 또한 발생기-기록기로서 센서 인터페이스로부터 출력 신호를 기록할 수 있다.
임의적 온도 센서 826은 시험 센서 804의 저장소 내 시료의 온도를 결정한다. 시료의 온도를 측정하거나, 출력 신호로부터 계산하거나, 혹은 바이오센서 시스템을 수행하는 장치의 주변 온도 또는 온도들과 동일하거나 유사한 것으로 간주될 수 있다. 온도는 써미스터, 온도계 또는 다른 온도 감지 장치를 이용하여 측정될 수 있다. 다른 기법을 사용하여, 시료 온도를 결정할 수 있다.
저장 매체 828은 자기, 광학 또는 반도체 메모리, 또 다른 저장 장치 등일 수 있다. 저장 매체 828은 고정 메모리 장치, 제거가능한 메모리 장치, 예컨대 메모리 카드이거나, 원격 어세스 등일 수 있다.
프로세서 822는 저장 매체 828에 저장된 컴퓨터로 판독가능한 소프트웨어 코드 및 데이터를 이용하여 분석물 분석 및 데이터 처리를 수행한다. 프로세서 822는 센서 인터페이스 818에서의 시험 센서 804의 존재, 시험 센서 804에 대한 시료의 적용, 사용자 입력 등에 대응하여, 분석물 분석을 시작할 수 있다. 프로세서 822는 신호 발생기 824에 대해 전기 입력 신호를 센서 인터페이스 818에 제공하도록 지정한다. 프로세서 822는 온도 센서 826으로부터 시료 온도를 받는다. 프로세서 822는 센서 인터페이스 818로부터 출력 신호를 받는다. 출력 신호는 시료 내 분석물의 반응에 대응하여 발생된다. 출력 신호는 광학 시스템, 전기화학 시스템 등을 이용하여 발생될 수 있다. 프로세서 822는 전술된 바와 같은 변환 함수 및 하나 이상의 SSP 함수를 포함하는 보상 방법을 이용하여 출력 신호로부터 분석물 농도를 결정한다. 일단 요망되는 세그먼트가 바이오센서 시스템에 대해 결정되면, 그것은 측정 장치에서 세그먼트화 루틴으로서 수행될 수 있다. 프로세서 822는 출력 신호의 어느 값이 저장 매체 828 내 저장된 예비 결정된 세그먼트화 루틴에 기초하여 SSP 매개변수 처리를 위한 2개 이상의 세그먼트를 위해 처리하는지 선택한다. 분석물 분석의 결과는 디스플레이 820에 출력될 수 있고, 저장 매체 828에 저장될 수 있다. 분석물 분석의 결과는 디스플레이 820, 원격 수신기(도시되지 않음)에 출력될 수 있고/있거나, 저장 매체 828에 저장될 수 있다.
기준 분석물 농도와 측정 장치 802 및 기타 상관으로부터의 출력 신호 간의 기준 상관은 그래프로, 수학적으로, 이의 조합으로, 혹은 기타 방식으로 나타내어질 수 있다. 상관 방정식은 저장 매체 828에 저장된 프로그램 수(PNA) 표, 또 다른 룩-업(look-up) 표 등에 의해 나타내어질 수 있다. 상수 및 가중 계수는 또한 저장 매체 828에 저장될 수 있다.
분석물 분석의 수행에 대한 사용설명서는 저장 매체 828에 저장된 컴퓨터로 판독가능한 소프트웨어 코드에 의해 제공될 수 있다. 코드는 목적 코드 또는 본원에 기재된 작용성을 기술하거나 조절하는 임의의 다른 코드일 수 있다. 분석물 분석으로부터의 데이터는, 프로세서 822에서의 붕괴 속도, K 상수, 비, 함수 등의 결정을 비롯한, 하나 이상의 데이터 처리에 적용될 수 있다.
전기화학 시스템에서, 센서 인터페이스 818은 시험 센서 804의 시료 인터페이스 814에서 도체와 연결되어 있거나 전기적으로 소통하는 접점을 가진다. 센서 인터페이스 818은 접점을 통해 신호 발생기 824로부터의 전기 입력 신호를 시료 인터페이스 814 내의 커넥터에 투과시킨다. 센서 인터페이스 818은 또한 접점을 통해 시료로부터의 출력 신호를 프로세서 822 및/또는 신호 발생기 824에 투과시킨다.
광-흡수 및 광-발생 광학 시스템에서, 센서 인터페이스 818은 빛을 수집하고 측정하는 검출기를 포함한다. 검출기는 시료 인터페이스 814에서 광학 포탈을 통해 액체 센서로부터 빛을 받는다. 광-흡수 광학 시스템에서, 센서 인터페이스 818은 또한 레이저, 발광 다이오드 등과 같은 광원을 포함한다. 입사 빔은 반응 산물에 의한 흡수를 위해 선택된 파장을 가질 수 있다. 센서 인터페이스 818은 시료 인터페이스 814에서 광학 포탈을 통해 광원으로부터의 입사 빔을 유도한다. 검출기는 광학 포탈과 45°와 같은 각을 이루도록 위치하여, 시료로부터 재반사된 빛을 받을 수 있다. 검출기는 광원으로부터 시료의 다른 측에 있는 광학 포탈에 인접하게 위치하여, 시료를 통해 투과된 빛을 받을 수 있다. 검출기는 또 다른 지점에 위치하여, 반사 및/또는 투과된 빛을 받을 수 있다.
디스플레이 820은 아날로그 또는 디지털일 수 있다. 디스플레이 820은 LCD, LED, OLED, 진공 형광제, 또는 수치 판독값을 보여주기 위해 적합화된 다른 디스플레이를 포함할 수 있다. 다른 디스플레이 기술이 사용될 수 있다. 디스플레이 820은 프로세서 822와 전기적으로 소통한다. 디스플레이 820은 예컨대 프로세서 822과 무선 소통할 때와 같이, 측정 장치 802로부터 제거될 수 있다. 이와 달리, 디스플레이 820은, 예컨대 측정 장치 802가 원격 연산 장치, 의약 투약 펌프 등과 전기적으로 소통할 때와 같이 측정 장치 802로부터 제거될 수 있다.
사용 시에, 분석용 액체 시료는 개구 812에 액체를 도입함으로써 저장소 808내로 전달된다. 액체 시료는, 미리 포함되어 있던 기체를 배출하면서 통로 810을 통해 유동하여 저장소 808을 충전한다. 액체 시료는 통로 810 및/또는 저장소 808 내에 침착된 시약과 화학적으로 반응한다.
시험 센서 802는 시료 인터페이스 814가 센서 인터페이스 818과 전기적으로 또한/또는 광학적으로 소통하도록 측정 장치 802와 연관하여 배치된다. 전기적 소통에는 센서 인터페이스 818 내 접점과 시료 인터페이스 814 내 도체 간의 입력 및/또는 출력 신호의 전달이 포함된다. 광학적 소통에는 시료 인터페이스 814 내 광학 포탈과 센서 인터페이스 818 내 검출기 간의 빛 전달이 포함된다. 광학적 소통은 또한 시료 인터페이스 814 내 광학 포탈과 센서 인터페이스 818 내 광원 간의 빛의 전달이 포함된다.
프로세서 822는 신호 발생기 824에 대해 입력 신호를 센서 인터페이스 818에 제공하도록 지정한다. 광학 시스템에서, 센서 인터페이스 818은 입력 신호에 대응하여 검출기 및 광원을 작동한다. 전기화학 시스템에서, 센서 인터페이스 818은 시료 인터페이스 814를 통해 입력 신호를 시료에 제공한다. 프로세서 822는 상기 논의된 바와 같이 시료 내 분석물의 산화환원 반응에 대응하여 발생된 출력 신호를 수신한다.
프로세서 822는 변환 함수 및 하나 이상의 SSP 함수를 포함하는 보상 시스템을 이용하여 출력 신호로부터 시료의 분석물 농도를 결정한다. 프로세서 822는 보상 시스템에서 일차 및/또는 잔여 함수를 수행할 수 있다. 다른 보상 및 함수도 또한 프로세서 822에 의해 수행될 수 있다.
본 발명의 각종 실시양태들이 기술되어 있으나, 본 발명의 범주 내에서 다른 실시양태 및 수행이 가능하다는 것이 당업자에게 자명할 것이다.
Claims (58)
- 분석물을 포함하는 시료에 입력 신호를 인가하는 단계;
시료 내 분석물의 농도 및 입력 신호에 대응하는 출력 신호를 발생시키는 단계;
변환 함수(conversion function) 및 세그먼트화 신호 처리 함수(segmented signal prcocessing function)에 대응하여 출력 신호로부터 보상된 값을 결정하는 단계; 및
보상된 값으로 시료 내 분석물 농도를 결정하는 단계
를 포함하는, 시료 내 분석물 농도를 결정하는 방법. - 제1항에 있어서, 세그먼트화 신호 처리 함수는 예비 결정되고, 출력 신호로부터 발생된 2개 이상의 세그먼트화 신호 처리 매개변수를 포함하는 것인 방법.
- 제2항에 있어서, 세그먼트화 신호 처리 매개변수는 출력 신호 및 매개변수 결정 방법으로부터 결정되고, 여기서 매개변수 결정 방법은 종점 값 전에 실질적으로 연속적인 출력 신호를 세그먼트화하는 것인 방법.
- 제2항에 있어서, 입력 신호는 개폐식(gated)이고, 세그먼트화 신호 처리 매개변수는 출력 신호 및 매개변수 결정 방법으로부터 결정되고, 여기서 매개변수 결정 방법은 적어도 제1 출력 신호의 제1 중간 종점 값 전의 제1 출력 신호, 및 제2 출력 신호의 제2 중간 종점 값 전의 제2 출력 신호를 세그먼트화하는 것인 방법.
- 제3항 또는 제4항에 있어서, 2개 이상의 세그먼트화 신호 처리 매개변수는 세그먼트 내의 신호의 평균을 구하는 것, 세그먼트 내로부터의 신호 값의 비를 결정하는 것, 세그먼트 내로부터의 신호 값의 차이를 취하는 것, 시간 베이스 차이(time base differential)를 결정하는 것, 정규화 차이(normalized differential)를 결정하는 것, 시간 베이스 정규화 차이(time-based normalized differential)를 결정하는 것, 하나 이상의 붕괴 상수를 결정하는 것, 및 하나 이상의 붕괴 속도를 결정하는 것으로 이루어진 군으로부터 선택되는 매개변수 결정 방법으로 출력 신호로부터 결정되는 것인 방법.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 세그먼트화 신호 처리 함수를 적용하기 전에 변환 함수를 이용하여 출력 신호를 변환하는 단계로서, 여기서 변환 함수는 출력 신호를 기지의 시료 분석물 농도와 연관시키는 예비 결정된 기준 상관(predetermined reference correlation)을 포함하는 것인 단계를 추가로 포함하는 방법.
- 제6항에 있어서, 변환 함수 및 세그먼트화 신호 처리 함수에 대응하여 출력 신호로부터 보상된 값을 결정하는 단계는 일차 함수에 대응하여 출력 신호로부터 보상된 값을 결정하는 과정으로서, 여기서 일차 함수는 세그먼트화 신호 처리 함수가 아닌 것인 과정을 추가로 포함하는 것인 방법.
- 제7항에 있어서, 일차 함수는 인덱스 함수(index function)를 포함하고, 여기서 인덱스 함수는 3개 이상의 오차 매개변수를 총 오차의 사전 결정된 표시와 연관시키는 것인 방법.
- 제7항에 있어서, 일차 함수는 복합 인덱스 함수(complex index function)를 포함하고, 복합 인덱스 함수는
적혈구용적율(hematocrit) 오차 매개변수를 가지는 하나 이상의 항, 및
온도 오차 매개변수를 가지는 하나 이상의 항
을 포함하는 것인 방법. - 제9항에 있어서, 복합 인덱스 함수는 첫 번째 항 및 두 번째 항을 포함하고, 여기서 첫 번째 항 및 두 번째 항 각각은 상이한 복합 인덱스 함수 항 가중 계수에 의해 수정되고, 첫 번째 항 및 두 번째 항 각각은 오차 매개변수를 포함하며, 오차 매개변수는 중간 출력 신호 값, 출력 신호에 대해 외부적인 값, 또는 둘 다로부터 독립적으로 선택되는 것인 방법.
- 제1항 내지 제7항 및 제9항 중 어느 한 항에 있어서, 세그먼트화 신호 처리 함수는 적어도 첫 번째 항 및 두 번째 항을 총 오차의 사전 결정된 표시와 연관시키는 인덱스 함수를 포함하는 것인 방법.
- 제11항에 있어서, 인덱스 함수는 복합적이고, 2개 이상의 항은 세그먼트화 출력 신호 값들로부터 독립적으로 선택되는 세그먼트화 신호 처리 매개변수이고, 2개 이상의 항 각각은 상이한 복합 인덱스 함수 항 가중 계수에 의해 수정되는 것인 방법.
- 제11항에 있어서, 인덱스 함수는 복합적이고, 복합 인덱스 함수는
적혈구용적율 오차 매개변수 또는 헤모글로빈 오차 매개변수를 가지는 하나 이상의 항, 및
온도 오차 매개변수를 가지는 하나 이상의 항
을 포함하는 것인 방법. - 제13항에 있어서, 첫 번째 항 및 두 번째 항 각각은 상이한 복합 인덱스 함수 항 가중 계수에 의해 수정되고, 첫 번째 항 및 두 번째 항 각각은 세그먼트화 신호 처리 매개변수를 포함하며, 세그먼트화 신호 처리 매개변수는 세그먼트화 출력 신호 값들로부터 독립적으로 선택되는 것인 방법.
- 시험 센서에 의해 형성된 저장소와 전기적으로 또는 광학적으로 소통하는 시료 인터페이스를 가지는 시험 센서; 및
신호 발생기를 통해 센서 인터페이스에 연결된 프로세서를 가지는 측정 장치로서, 여기서 센서 인터페이스는 시료 인터페이스와 전기적으로 또는 광학적으로 소통하고, 프로세서는 저장 매체와 전기적으로 소통하는 것인 측정 장치
를 포함하는, 시료 내 분석물 농도를 결정하기 위한 바이오센서 시스템으로서,
프로세서는 신호 발생기가 전기 또는 광학 입력 신호를 센서 인터페이스에 인가하도록 지시하고,
프로세서는 입력 신호 및 센서 인터페이스로부터의 시료 내 분석물의 농도에 대응하는 출력 신호를 결정하며,
프로세서는 출력 신호에서의 총 오차의 50% 이상을 일차 함수로 보상하고,
일차 함수가 세그먼트화 신호 처리 함수가 아닌 경우, 프로세서는 출력 신호에서의 잔여 오차의 5% 이상을 세그먼트화 신호 처리 함수로 보상하며,
프로세서는 보상된 값을 결정하고,
프로세서는 보상된 값으로부터 시료 내 분석물 농도를 결정하는 것인 바이오센서 시스템. - 제15항에 있어서, 측정 장치는 휴대용인 것인 시스템.
- 제15항에 있어서,
프로세서는 온도 및 적혈구용적율 값 또는 온도 및 헤모글로빈 값을 일차 함수에 제공하고,
일차 함수는 저장 매체 내에 저장되는 것인 방법. - 시료 내 분석물의 농도에 대응하는 출력 신호를 발생시키는 단계로서, 여기서 출력 신호는 종점 판독(end-point reading)을 포함하는 것인 단계;
출력 신호를 시간에 대해 규칙 또는 불규칙 세그먼트화 간격으로 3개 이상의 출력 신호 세그먼트로 세그먼트화하는 단계;
3개 이상의 출력 신호 세그먼트를 3개 이상의 세그먼트화 신호 처리 매개변수로 변환하는 단계;
다중 세그먼트화 신호 처리 매개변수를 세그먼트화 신호 처리 함수에서의 잠재적 항으로서 선택하는 단계로서, 여기서 세그먼트화 신호 처리 매개변수는 출력 신호에서의 총 오차의 적어도 일부를 기술하는 것인 단계;
잠재적 항에 대한 제1 배제 항을 결정하는 단계;
잠재적 항에 대한 제1 배제 값에 대응하는 배제 시험을 적용하는 단계;
세그먼트화 신호 처리 함수로부터 배제하기 위한 잠재적 항들 중 하나 이상을 확인하는 단계;
세그먼트화 신호 처리 함수로부터 하나 이상의 확인된 잠재적 항을 배제하는 단계; 및
요망되는 세그먼트화 신호 처리 함수를 결정하는 단계
를 포함하는, 시료의 분석물 농도를 보상하기 위한, 요망되는 세그먼트화 신호 처리 함수를 결정하는 방법. - 본원에 개시된 각각의 모든 신규 특성.
- 분석물을 포함하는 시료에 입력 신호를 인가하는 단계;
시료 내 분석물의 농도 및 입력 신호에 대응하는 출력 신호를 발생시키는 단계;
변환 함수 및 세그먼트화 신호 처리 함수에 대응하여 출력 신호로부터 보상된 값을 결정하는 단계; 및
보상된 값으로부터 시료 내 분석물 농도를 결정하는 단계
를 포함하는, 시료 내 분석물 농도를 결정하는 방법. - 제20항에 있어서, 출력 신호는 시료 내 측정가능한 종의 농도에 대응하고, 여기서 시료 내 측정가능한 종의 농도는 시료 내 분석물의 농도에 대응하는 것인 방법.
- 제21항에 있어서, 시료 내 측정가능한 종의 농도는 분석물, 효소 및 매개자 간의 화학적 반응에 대응하고, 여기서 화학적 반응은 산화환원 반응인 것인 방법.
- 제21항에 있어서, 측정가능한 종은 광식별성인 것인 방법.
- 제20항에 있어서, 분석 종점에 도달할 때까지 입력 신호를 시료에 연속적으로 인가하는 단계를 추가로 포함하는 방법.
- 제24항에 있어서, 출력 신호로부터 3개 이상의 출력 신호 값을 측정하는 단계를 추가로 포함하는 방법.
- 제20항에 있어서, 입력 신호는 개폐식이고, 2개 이상의 여기(excitation)를 포함하며, 여기서 각각의 여기는 중간 분석 종점에 도달할 때까지 인가되는 것인 방법.
- 제26항에 있어서, 2개 이상의 여기 각각의 출력 신호로부터 2개 이상의 출력 신호 값을 측정하는 단계를 추가로 포함하는 방법.
- 제20항에 있어서, 세그먼트화 신호 처리 함수는 예비 결정되고, 출력 신호로부터 발생되는 2개 이상의 세그먼트화 신호 처리 매개변수를 포함하는 것인 방법.
- 제28항에 있어서, 2개 이상의 세그먼트화 신호 처리 매개변수는 세그먼트 내의 신호의 평균을 구하는 것, 세그먼트 내로부터의 신호 값의 비를 결정하는 것, 세그먼트 내로부터의 신호 값의 차이를 결정하는 것, 시간 베이스 차이를 결정하는 것, 정규화 차이를 결정하는 것, 시간 베이스 정규화 차이를 결정하는 것, 하나 이상의 붕괴 상수를 결정하는 것, 및 하나 이상의 붕괴 속도를 결정하는 것으로 이루어진 군으로부터 선택되는 매개변수 결정 방법으로 출력 신호로부터 결정되는 것인 방법.
- 제28항에 있어서, 2개 이상의 세그먼트화 신호 처리 매개변수는 세그먼트 내로부터의 신호 값의 차이를 결정하는 것, 시간 베이스 차이를 결정하는 것, 정규화 차이를 결정하는 것, 및 시간 베이스 정규화 차이를 결정하는 것으로 이루어진 군으로부터 선택되는 매개변수 결정 방법을 이용하여 결정되는 것인 방법.
- 제28항에 있어서, 2개 이상의 세그먼트화 신호 처리 매개변수는 시간 베이스 차이를 결정하는 것 및 시간 베이스 정규화 차이를 결정하는 것으로 이루어진 군으로부터 선택되는 매개변수 결정 방법을 이용하여 결정되는 것인 방법.
- 제28항에 있어서, 세그먼트화 신호 처리 매개변수는 출력 신호 및 매개변수 결정 방법으로부터 결정되고, 여기서 매개변수 결정 방법은 종점 값 전에 실질적으로 연속적인 출력 신호를 세그먼트화하는 것인 방법.
- 제20항에 있어서, 입력 신호는 개폐식이고, 세그먼트화 신호 처리 매개변수는 출력 신호 및 매개변수 결정 방법으로부터 결정되고, 여기서 매개변수 결정 방법은 적어도 제1 출력 신호의 제1 중간 종점 값 전의 제1 출력 신호, 및 제2 출력 신호의 제2 중간 종점 값 전의 제2 출력 신호를 세그먼트화하는 것인 방법.
- 제20항에 있어서, 세그먼트화 신호 처리 함수를 적용하기 전에 변환 함수를 이용하여 출력 신호를 변환하는 단계로서, 여기서 변환 함수는 출력 신호를 기지의 시료 분석물 농도와 연관시키는 기준 상관을 포함하는 것인 단계를 추가로 포함하는 방법.
- 제20항에 있어서, 보상된 값으로부터 결정된 분석물 농도는, 분석물 농도가 출력 신호 및 세그먼트화 신호 처리 함수가 없는 변환 함수로부터 결정된 경우보다 30% 더 적은 상대 오차를 포함하는 것인 방법.
- 제20항에 있어서, 보상된 값으로부터 결정된 분석물 농도는, 분석물 농도가 출력 신호 및 세그먼트화 신호 처리 함수가 없는 변환 함수로부터 결정된 경우보다 30% 더 적은 상대 오차를 포함하는 것인 방법.
- 제34항에 있어서, 변환 함수 및 세그먼트화 신호 처리 함수에 대응하여 출력 신호로부터 보상된 값을 결정하는 단계는 일차 함수에 대응하여 출력 신호로부터 보상된 값을 결정하는 과정으로서, 여기서 세그먼트화 신호 처리 함수는 일차 함수가 아닌 것인 과정을 추가로 포함하는 것인 방법.
- 제37항에 있어서, 세그먼트화 신호 처리 함수에 의해 기술되는 오차는 일차 함수에 의해 기술되는 오차와 실질적으로 상이한 것인 방법.
- 제37항에 있어서, 세그먼트화 신호 처리 함수 및 일차 함수를 함수 가중 계수로 수정하는 단계를 추가로 포함하는 방법.
- 제37항에 있어서, 일차 함수는 인덱스 함수를 포함하고, 여기서 인덱스 함수는 3개 이상의 오차 매개변수를 총 오차의 사전 결정된 표시와 연관시키는 것인 방법.
- 제37항에 있어서, 세그먼트화 신호 처리 함수는 일차 함수가 출력 신호를 보상한 후에 보상된 값에서의 잔여 오차의 50% 이상을 기술하는 것인 방법.
- 제37항에 있어서, 인덱스 함수는 복합적이고, 복합 인덱스 함수는
적혈구용적율 오차 매개변수를 가지는 하나 이상의 항. 및
온도 오차 매개변수를 가지는 하나 이상의 항
을 포함하는 것인 방법. - 제42항에 있어서, 복합 인덱스 함수는 첫 번째 항 및 두 번째 항을 포함하고, 여기서 첫 번째 항 및 두 번째 항 각각은 상이한 복합 인덱스 함수 항 가중 계수에 의해 수정되고, 첫 번째 항 및 두 번째 항 각각은 오차 매개변수를 포함하며, 오차 매개변수는 중간 출력 신호 값, 출력 신호에 대해 외부적인 값, 또는 둘 다로부터 독립적으로 선택되는 것인 방법.
- 제37항에 있어서, 잔여 함수에 대응하여 출력 신호로부터 보상된 값을 결정하는 단계로서, 여기서 잔여 함수는 세그먼트화 신호 처리 함수가 아니고, 잔여 함수는 일차 함수가 아닌 것인 단계를 추가로 포함하는 방법.
- 제44항에 있어서, 세그먼트화 신호 처리 함수, 일차 함수, 및 잔여 함수를 함수 가중 계수로 수정하는 단계를 추가로 포함하는 방법.
- 제44항에 있어서, 세그먼트화 신호 처리 함수에 의해 기술되는 오차는 잔여 함수에 의해 기술된 오차와 실질적으로 상이한 오차이고, 세그먼트화 신호 처리 함수에 의해 기술되는 오차는 일차 함수에 의해 기술되는 오차와 실질적으로 상이한 것인 방법.
- 제20항에 있어서, 세그먼트화 신호 처리 함수는 적어도 첫 번째 항 및 두 번째 항을 총 오차의 사전 결정된 표시와 연관시키는 인덱스 함수를 포함하는 것인 방법.
- 제47항에 있어서, 인덱스 함수는 복합적이고, 2개 이상의 항은 세그먼트화 출력 신호 값들로부터 독립적으로 선택되는 세그먼트화 신호 처리 매개변수이고, 2개 이상의 항 각각은 상이한 복합 인덱스 함수 항 가중 계수에 의해 수정되는 것인 방법.
- 제47항에 있어서, 인덱스 함수는 복합적이고, 복합 인덱스 함수는
적혈구용적율 오차 매개변수 또는 헤모글로빈 오차 매개변수를 가지는 하나 이상의 항, 및
온도 오차 매개변수를 가지는 하나 이상의 항
을 포함하는 것인 방법. - 제49항에 있어서, 첫 번째 항 및 두 번째 항 각각은 상이한 복합 인덱스 함수 항 가중 계수에 의해 수정되고, 첫 번째 항 및 두 번째 항 각각은 세그먼트화 신호 처리 매개변수를 포함하며, 세그먼트화 신호 처리 매개변수는 세그먼트화 출력 신호 값들로부터 독립적으로 선택되는 것인 방법.
- 제20항에 있어서, 시료는 혈액이고, 분석물은 포도당인 것인 방법.
- 제20항에 있어서, 보상된 값을 결정하는 단계는 변환 함수의 기준 상관을 신호 처리 함수로부터 결정된 기울기 값의 변화로 변경하는 과정으로서, 여기서 기준 상관은 출력 신호를 기지의 시료 분석물 농도와 연관시키는 것인 과정을 포함하는 것인 방법.
- 시험 센서에 의해 형성된 저장소와 전기적으로 또는 광학적으로 소통하는 시료 인터페이스를 가지는 시험 센서; 및
신호 발생기를 통해 센서 인터페이스에 연결된 프로세서를 가지는 측정 장치로서, 여기서 센서 인터페이스는 시료 인터페이스와 전기적으로 또는 광학적으로 소통하고, 프로세서는 저장 매체와 전기적으로 소통하는 것인 측정 장치
를 포함하는, 시료 내 분석물 농도를 결정하기 위한 바이오센서 시스템으로서,
프로세서는 신호 발생기가 전기 또는 광학 입력 신호를 센서 인터페이스에 인가하도록 지시하고,
프로세서는 입력 신호 및 센서 인터페이스로부터의 시료 내 분석물의 농도에 대응하는 출력 신호를 결정하며,
프로세서는 출력 신호에서의 총 오차의 50% 이상을 일차 함수로 보상하고,
일차 함수가 세그먼트화 신호 처리 함수가 아닌 경우, 프로세서는 출력 신호에서의 잔여 오차의 5% 이상을 세그먼트화 신호 처리 함수로 보상하며,
프로세서는 보상된 값을 결정하고,
프로세서는 보상된 값으로부터 시료 내 분석물 농도를 결정하는 것인 바이오센서 시스템. - 제53항에 있어서, 측정 장치는 휴대용인 것인 시스템.
- 제53항에 있어서,
프로세서는 온도 및 적혈구용적율 값 또는 온도 및 헤모글로빈 값을 일차 함수에 제공하고,
일차 함수는 저장 매체 내에 저장되는 것인 시스템. - 제53항에 있어서, 프로세서가 시험 센서들의 5개 상이한 로트로부터의 시험 센서를 이용하여 시료 내 분석물 농도를 결정할 때, 결정된 분석물 농도의 바이어스 % 표준 편차의 향상은 세그먼트화 신호 처리 함수가 없는 동일 시스템에 비해 5% 이상인 것인 시스템.
- 시료 내 분석물의 농도 및 입력 신호에 대응하는 출력 신호를 발생시키는 단계;
출력 신호를 세그먼트화 신호 처리 함수로 보상하는 단계; 및
보상된 출력 신호로부터 시료 내 분석물 농도를 결정하는 단계
를 포함하는, 시료 내 분석물 농도를 결정하는 방법. - 시료 내 분석물의 농도에 대응하는 출력 신호를 발생시키는 단계로서, 여기서 출력 신호는 종점 판독을 포함하는 것인 단계;
출력 신호를 시간에 대해 규칙 또는 불규칙 세그먼트화 간격으로 3개 이상의 출력 신호 세그먼트로 세그먼트화하는 단계;
3개 이상의 출력 신호 세그먼트를 3개 이상의 세그먼트화 신호 처리 매개변수로 변환하는 단계;
다중 세그먼트화 신호 처리 매개변수를 세그먼트화 신호 처리 함수 내 잠재적 항으로서 선택하는 단계로서, 여기서 세그먼트화 신호 처리 매개변수는 출력 신호에서의 총 오차의 적어도 일부를 기술하는 것인 단계;
잠재적 항에 대한 제1 배제 항을 결정하는 단계;
잠재적 항에 대한 제1 배제 값에 대응하는 배제 시험을 적용하는 단계;
세그먼트화 신호 처리 함수로부터 배제하기 위한 잠재적 항들 중 하나 이상을 확인하는 단계;
세그먼트화 신호 처리 함수로부터 하나 이상의 확인된 잠재적 항을 배제하는 단계; 및
요망되는 세그먼트화 신호 처리 함수를 결정하는 단계
를 포함하는, 시료의 분석물 농도를 보상하기 위한, 요망되는 세그먼트화 신호 처리 함수를 결정하는 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161537145P | 2011-09-21 | 2011-09-21 | |
| US61/537,145 | 2011-09-21 | ||
| PCT/US2012/056280 WO2013043839A1 (en) | 2011-09-21 | 2012-09-20 | Biosensor with error compensation |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140063829A true KR20140063829A (ko) | 2014-05-27 |
Family
ID=47881000
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147010121A KR20140063829A (ko) | 2011-09-21 | 2012-09-20 | 오차 보상을 갖는 바이오센서 |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US9775806B2 (ko) |
| EP (3) | EP2758039B1 (ko) |
| JP (1) | JP6082396B2 (ko) |
| KR (1) | KR20140063829A (ko) |
| ES (2) | ES2663097T3 (ko) |
| MX (1) | MX350696B (ko) |
| TW (1) | TWI600892B (ko) |
| WO (1) | WO2013043839A1 (ko) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2550530A1 (en) * | 2010-03-22 | 2013-01-30 | Bayer HealthCare LLC | Residual compensation for a biosensor |
| CA2902545A1 (en) | 2013-03-14 | 2014-10-02 | Bayer Healthcare Llc | Progressive approximation of sample analyte concentration |
| JP6280203B2 (ja) | 2013-03-14 | 2018-02-14 | バイエル・ヘルスケア・エルエルシーBayer HealthCare LLC | 分析物濃度決定のシステム誤差補償 |
| EP3276355B1 (en) | 2013-03-14 | 2020-05-06 | Ascensia Diabetes Care Holdings AG | Normalized calibration of analyte concentration determinations |
| US10551362B2 (en) | 2013-03-26 | 2020-02-04 | Waters Technologies Corporation | Method for extending the dynamic range of absorbance detectors |
| GB2531728A (en) * | 2014-10-27 | 2016-05-04 | Cilag Gmbh Int | Method for determining diffusion |
| JP6789246B2 (ja) | 2015-05-15 | 2020-11-25 | アセンシア・ダイアベティス・ケア・ホールディングス・アーゲーAscensia Diabetes Care Holdings AG | 改善されたバイオセンサシステム検体測定 |
| JP7066673B2 (ja) | 2016-07-12 | 2022-05-13 | アセンシア・ダイアベティス・ケア・ホールディングス・アーゲー | 2つの電極からの交替する出力信号の使用による電気化学分析のための方法 |
| WO2018104835A1 (en) * | 2016-12-05 | 2018-06-14 | Ascensia Diabetes Care Holdings Ag | Risk factor monitoring |
| JP2022519854A (ja) | 2019-02-05 | 2022-03-25 | アセンシア・ディアベティス・ケア・ホールディングス・アーゲー | 連続的分析物感知および自動較正のセンサ動作を精査するための装置および方法 |
| US11666253B2 (en) | 2019-02-22 | 2023-06-06 | Ascensia Diabetes Care Holdings Ag | Methods and apparatus for analyte concentration monitoring using harmonic relationships |
| CN109884150B (zh) * | 2019-03-08 | 2021-05-14 | 武汉璟泓科技股份有限公司 | 一种红细胞积压校正方法及存储介质 |
| US11963763B2 (en) | 2019-09-10 | 2024-04-23 | Ascensia Diabetes Care Holdings Ag | Methods and apparatus information gathering, error detection and analyte concentration determination during continuous analyte sensing |
| CN112432988B (zh) * | 2020-11-25 | 2023-03-03 | 重庆迈联医疗科技有限公司 | 电化学测试系统的温度校正方法 |
| CN114777888A (zh) * | 2022-04-28 | 2022-07-22 | 四川泛华航空仪表电器有限公司 | 一种基于光纤光栅压力传感器液位测量误差补偿修正方法 |
Family Cites Families (64)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4431004A (en) | 1981-10-27 | 1984-02-14 | Bessman Samuel P | Implantable glucose sensor |
| US4750496A (en) | 1987-01-28 | 1988-06-14 | Xienta, Inc. | Method and apparatus for measuring blood glucose concentration |
| US5243516A (en) | 1989-12-15 | 1993-09-07 | Boehringer Mannheim Corporation | Biosensing instrument and method |
| US5508171A (en) | 1989-12-15 | 1996-04-16 | Boehringer Mannheim Corporation | Assay method with enzyme electrode system |
| FR2701117B1 (fr) | 1993-02-04 | 1995-03-10 | Asulab Sa | Système de mesures électrochimiques à capteur multizones, et son application au dosage du glucose. |
| US5366609A (en) | 1993-06-08 | 1994-11-22 | Boehringer Mannheim Corporation | Biosensing meter with pluggable memory key |
| US5352351A (en) | 1993-06-08 | 1994-10-04 | Boehringer Mannheim Corporation | Biosensing meter with fail/safe procedures to prevent erroneous indications |
| IE72524B1 (en) | 1994-11-04 | 1997-04-23 | Elan Med Tech | Analyte-controlled liquid delivery device and analyte monitor |
| US6153069A (en) | 1995-02-09 | 2000-11-28 | Tall Oak Ventures | Apparatus for amperometric Diagnostic analysis |
| US5582697A (en) | 1995-03-17 | 1996-12-10 | Matsushita Electric Industrial Co., Ltd. | Biosensor, and a method and a device for quantifying a substrate in a sample liquid using the same |
| US5620579A (en) | 1995-05-05 | 1997-04-15 | Bayer Corporation | Apparatus for reduction of bias in amperometric sensors |
| US5723284A (en) | 1996-04-01 | 1998-03-03 | Bayer Corporation | Control solution and method for testing the performance of an electrochemical device for determining the concentration of an analyte in blood |
| ES2184236T3 (es) | 1997-02-06 | 2003-04-01 | Therasense Inc | Sensor in vitro de analitos de pequeño volumen. |
| US6391558B1 (en) | 1997-03-18 | 2002-05-21 | Andcare, Inc. | Electrochemical detection of nucleic acid sequences |
| US5798031A (en) | 1997-05-12 | 1998-08-25 | Bayer Corporation | Electrochemical biosensor |
| US6391645B1 (en) | 1997-05-12 | 2002-05-21 | Bayer Corporation | Method and apparatus for correcting ambient temperature effect in biosensors |
| WO1998058250A2 (en) | 1997-06-16 | 1998-12-23 | Elan Corporation, Plc | Methods of calibrating and testing a sensor for in vivo measurement of an analyte and devices for use in such methods |
| HU222809B1 (hu) | 1997-10-03 | 2003-10-28 | 77 Elektronika Műszeripari Kft. | Eljárás és készülék kémiai összetevőnek anyagmintából, különösen vér glükóztartalmának vérmintából történő meghatározásához |
| US6645368B1 (en) | 1997-12-22 | 2003-11-11 | Roche Diagnostics Corporation | Meter and method of using the meter for determining the concentration of a component of a fluid |
| US7494816B2 (en) * | 1997-12-22 | 2009-02-24 | Roche Diagnostic Operations, Inc. | System and method for determining a temperature during analyte measurement |
| DE69914319T2 (de) | 1998-05-13 | 2004-11-18 | Cygnus, Inc., Redwood City | Signalverarbeitung zur messung von physiologischen analyten |
| JP4256588B2 (ja) | 1998-05-20 | 2009-04-22 | アークレイ株式会社 | 統計的手法を用いた電気化学的測定方法および測定装置 |
| US6475372B1 (en) | 2000-02-02 | 2002-11-05 | Lifescan, Inc. | Electrochemical methods and devices for use in the determination of hematocrit corrected analyte concentrations |
| CA2305922C (en) | 1999-08-02 | 2005-09-20 | Bayer Corporation | Improved electrochemical sensor design |
| DE60037592T2 (de) | 1999-09-20 | 2009-01-22 | Roche Diagnostics Gmbh | Methode zur Messung eines Analyten mit Hilfe eines elektrochemischen Biosensors, der durch Anlegen eines Potentials abgeschaltet werden kann |
| US6616819B1 (en) | 1999-11-04 | 2003-09-09 | Therasense, Inc. | Small volume in vitro analyte sensor and methods |
| JP4050434B2 (ja) | 1999-11-29 | 2008-02-20 | 松下電器産業株式会社 | サンプルの弁別方法 |
| EP2202511A3 (en) | 2001-01-17 | 2010-09-29 | ARKRAY, Inc. | Quantitative analyzing method and quantitative analyzer using sensor |
| US6562625B2 (en) | 2001-02-28 | 2003-05-13 | Home Diagnostics, Inc. | Distinguishing test types through spectral analysis |
| US6541266B2 (en) | 2001-02-28 | 2003-04-01 | Home Diagnostics, Inc. | Method for determining concentration of an analyte in a test strip |
| AU784254B2 (en) | 2001-05-21 | 2006-03-02 | Bayer Corporation | Improved electrochemical sensor |
| US6982178B2 (en) | 2002-06-10 | 2006-01-03 | E Ink Corporation | Components and methods for use in electro-optic displays |
| US6797150B2 (en) | 2001-10-10 | 2004-09-28 | Lifescan, Inc. | Determination of sample volume adequacy in biosensor devices |
| JP4246633B2 (ja) | 2001-10-12 | 2009-04-02 | アークレイ株式会社 | 濃度測定方法および濃度測定装置 |
| CA2419213C (en) | 2002-03-07 | 2011-06-21 | Bayer Healthcare Llc | Improved electrical sensor |
| US6964871B2 (en) | 2002-04-25 | 2005-11-15 | Home Diagnostics, Inc. | Systems and methods for blood glucose sensing |
| US6946299B2 (en) | 2002-04-25 | 2005-09-20 | Home Diagnostics, Inc. | Systems and methods for blood glucose sensing |
| AU2003234944A1 (en) | 2002-08-27 | 2004-03-18 | Bayer Healthcare, Llc | Methods of Determining Glucose Concentration in Whole Blood Samples |
| US7132041B2 (en) | 2003-02-11 | 2006-11-07 | Bayer Healthcare Llc | Methods of determining the concentration of an analyte in a fluid test sample |
| US7452457B2 (en) | 2003-06-20 | 2008-11-18 | Roche Diagnostics Operations, Inc. | System and method for analyte measurement using dose sufficiency electrodes |
| US7488601B2 (en) | 2003-06-20 | 2009-02-10 | Roche Diagnostic Operations, Inc. | System and method for determining an abused sensor during analyte measurement |
| WO2005022143A2 (en) | 2003-08-21 | 2005-03-10 | Agamatrix, Inc. | Method and apparatus for assay of electrochemical properties |
| JP4449431B2 (ja) | 2003-11-19 | 2010-04-14 | パナソニック株式会社 | 基質濃度の測定方法 |
| US7862695B2 (en) * | 2004-02-06 | 2011-01-04 | Bayer Healthcare, Llc | Electrochemical biosensor |
| EP3115777B1 (en) | 2004-04-19 | 2020-01-08 | PHC Holdings Corporation | Method for measuring blood components |
| TW200608019A (en) | 2004-05-14 | 2006-03-01 | Bayer Healthcare Llc | Methods for performing hematocrit adjustment in glucose assays and devices for same |
| CA2887517C (en) | 2004-10-12 | 2017-09-12 | Bayer Healthcare Llc | Concentration determination in a diffusion barrier layer |
| GB0428547D0 (en) | 2004-12-31 | 2005-02-09 | Euroflow Uk Ltd | Methods and apparatus for observing vessel contents |
| GB0501826D0 (en) | 2005-01-28 | 2005-03-09 | Melys Diagnostics Ltd | Apparatus for measurement of analyte concentration |
| CA2603542C (en) | 2005-04-08 | 2014-01-14 | Bayer Healthcare Llc | Oxidizable species as an internal reference in control solutions for biosensors |
| US7517439B2 (en) | 2005-04-15 | 2009-04-14 | Agamatrix, Inc. | Error detection in analyte measurements based on measurement of system resistance |
| RU2441238C2 (ru) | 2005-07-20 | 2012-01-27 | БАЙЕР ХЕЛТКЭА ЭлЭлСи | Стробированная амперометрия |
| CN103048442B (zh) | 2005-09-30 | 2015-04-08 | 拜尔健康护理有限责任公司 | 门控伏特安培法 |
| CN101374455B (zh) | 2006-02-27 | 2013-10-16 | 拜尔健康护理有限责任公司 | 用于生物传感器系统的温度调节的分析物测定 |
| US7966859B2 (en) | 2006-05-03 | 2011-06-28 | Bayer Healthcare Llc | Underfill detection system for a biosensor |
| CN101437443B (zh) | 2006-05-08 | 2011-11-30 | 拜尔健康护理有限责任公司 | 生物传感器用的异常输出检测系统 |
| CA2656952C (en) * | 2006-07-05 | 2014-09-23 | Panasonic Corporation | Liquid sample measurement method and apparatus |
| US20080248581A1 (en) | 2007-04-06 | 2008-10-09 | Bayer Healthcare Llc | Method for performing correction of blood glucose assay bias using blood hemoglobin concentration |
| AU2008279070B2 (en) | 2007-07-26 | 2012-12-13 | Nipro Diagnostics, Inc. | System and methods for determination of analyte concentration using time resolved amperometry |
| US8101062B2 (en) | 2007-07-26 | 2012-01-24 | Nipro Diagnostics, Inc. | System and methods for determination of analyte concentration using time resolved amperometry |
| EP2223104B1 (en) | 2007-12-10 | 2018-08-29 | Ascensia Diabetes Care Holdings AG | Slope-based compensation |
| EP2373984B1 (en) | 2008-12-08 | 2022-11-30 | Ascensia Diabetes Care Holdings AG | Biosensor signal adjustment |
| WO2011059670A1 (en) | 2009-11-10 | 2011-05-19 | Bayer Healthcare Llc | Underfill recognition system for a biosensor |
| CN103210310B (zh) | 2010-06-07 | 2015-03-18 | 拜尔健康护理有限责任公司 | 包含次级输出信号的基于斜率的补偿 |
-
2012
- 2012-09-20 EP EP12779189.5A patent/EP2758039B1/en active Active
- 2012-09-20 ES ES12779189.5T patent/ES2663097T3/es active Active
- 2012-09-20 MX MX2014003015A patent/MX350696B/es active IP Right Grant
- 2012-09-20 EP EP19190242.8A patent/EP3586831A1/en active Pending
- 2012-09-20 JP JP2014531954A patent/JP6082396B2/ja active Active
- 2012-09-20 ES ES17206329T patent/ES2757909T3/es active Active
- 2012-09-20 US US13/623,654 patent/US9775806B2/en active Active
- 2012-09-20 WO PCT/US2012/056280 patent/WO2013043839A1/en active Application Filing
- 2012-09-20 KR KR1020147010121A patent/KR20140063829A/ko not_active Application Discontinuation
- 2012-09-20 EP EP17206329.9A patent/EP3315123B1/en active Active
- 2012-09-21 TW TW101134661A patent/TWI600892B/zh not_active IP Right Cessation
-
2017
- 2017-08-29 US US15/690,014 patent/US10646445B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| US9775806B2 (en) | 2017-10-03 |
| MX350696B (es) | 2017-09-14 |
| ES2757909T3 (es) | 2020-04-30 |
| EP3315123B1 (en) | 2019-08-21 |
| MX2014003015A (es) | 2014-05-07 |
| ES2663097T3 (es) | 2018-04-11 |
| WO2013043839A1 (en) | 2013-03-28 |
| JP2014527186A (ja) | 2014-10-09 |
| JP6082396B2 (ja) | 2017-02-15 |
| TWI600892B (zh) | 2017-10-01 |
| US20170360712A1 (en) | 2017-12-21 |
| EP3315123A1 (en) | 2018-05-02 |
| US10646445B2 (en) | 2020-05-12 |
| EP3586831A1 (en) | 2020-01-01 |
| EP2758039B1 (en) | 2018-01-24 |
| US20130071869A1 (en) | 2013-03-21 |
| TW201314195A (zh) | 2013-04-01 |
| EP2758039A1 (en) | 2014-07-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10646445B2 (en) | Analysis compensation including segmented signals converted into signal processing parameters for describing a portion of total error | |
| CA2798938C (en) | Slope-based compensation including secondary output signals | |
| JP5738770B2 (ja) | 信号調整を持つバイオセンサシステム | |
| CA2708038A1 (en) | Slope-based compensation | |
| JP6494813B2 (ja) | 分析物濃度決定のシステム誤差補償 | |
| KR20130016311A (ko) | 바이오센서를 위한 잔여 보상 | |
| EP3276355B1 (en) | Normalized calibration of analyte concentration determinations | |
| JP2016517517A5 (ko) | ||
| JP6446023B2 (ja) | 試料分析物濃度の逐次近似 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Withdrawal due to no request for examination |