KR20130084327A - 바람직하게는 오피오이드의 다중미립자 및 압축을 이용한 제조 방법 - Google Patents
바람직하게는 오피오이드의 다중미립자 및 압축을 이용한 제조 방법 Download PDFInfo
- Publication number
- KR20130084327A KR20130084327A KR1020137016849A KR20137016849A KR20130084327A KR 20130084327 A KR20130084327 A KR 20130084327A KR 1020137016849 A KR1020137016849 A KR 1020137016849A KR 20137016849 A KR20137016849 A KR 20137016849A KR 20130084327 A KR20130084327 A KR 20130084327A
- Authority
- KR
- South Korea
- Prior art keywords
- oxycodone
- multiparticulates
- release
- extrusion
- hours
- Prior art date
Links
- 238000001125 extrusion Methods 0.000 title abstract description 36
- 238000004519 manufacturing process Methods 0.000 title description 7
- 239000004480 active ingredient Substances 0.000 claims abstract description 33
- 239000000546 pharmaceutical excipient Substances 0.000 claims abstract description 14
- 229920003023 plastic Polymers 0.000 claims abstract description 7
- 239000004033 plastic Substances 0.000 claims abstract description 7
- 239000000203 mixture Substances 0.000 abstract description 76
- 239000004014 plasticizer Substances 0.000 abstract description 45
- 239000000314 lubricant Substances 0.000 abstract description 17
- 238000013270 controlled release Methods 0.000 abstract description 12
- BRUQQQPBMZOVGD-XFKAJCMBSA-N Oxycodone Chemical compound O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(OC)C2=C5[C@@]13CCN4C BRUQQQPBMZOVGD-XFKAJCMBSA-N 0.000 description 112
- 229960002085 oxycodone Drugs 0.000 description 96
- 238000000034 method Methods 0.000 description 63
- 238000009472 formulation Methods 0.000 description 47
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 33
- 230000008569 process Effects 0.000 description 32
- 239000003814 drug Substances 0.000 description 28
- 229940079593 drug Drugs 0.000 description 27
- GLDOVTGHNKAZLK-UHFFFAOYSA-N octadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCCCO GLDOVTGHNKAZLK-UHFFFAOYSA-N 0.000 description 27
- 229920001577 copolymer Polymers 0.000 description 22
- 230000035699 permeability Effects 0.000 description 21
- 239000002775 capsule Substances 0.000 description 20
- -1 anilridine Chemical compound 0.000 description 16
- 238000004090 dissolution Methods 0.000 description 16
- 229940105606 oxycontin Drugs 0.000 description 16
- 238000000338 in vitro Methods 0.000 description 13
- 150000003839 salts Chemical class 0.000 description 13
- GOQYKNQRPGWPLP-UHFFFAOYSA-N n-heptadecyl alcohol Natural products CCCCCCCCCCCCCCCCCO GOQYKNQRPGWPLP-UHFFFAOYSA-N 0.000 description 12
- 238000003860 storage Methods 0.000 description 11
- BQNSLJQRJAJITR-UHFFFAOYSA-N 1,1,2-trichloro-1,2-difluoroethane Chemical compound FC(Cl)C(F)(Cl)Cl BQNSLJQRJAJITR-UHFFFAOYSA-N 0.000 description 10
- 229960003617 oxycodone hydrochloride Drugs 0.000 description 10
- 229920000642 polymer Polymers 0.000 description 10
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 9
- 239000003607 modifier Substances 0.000 description 9
- DQCKKXVULJGBQN-XFWGSAIBSA-N naltrexone Chemical compound N1([C@@H]2CC3=CC=C(C=4O[C@@H]5[C@](C3=4)([C@]2(CCC5=O)O)CC1)O)CC1CC1 DQCKKXVULJGBQN-XFWGSAIBSA-N 0.000 description 9
- 229960003086 naltrexone Drugs 0.000 description 9
- 230000009467 reduction Effects 0.000 description 9
- 229920001223 polyethylene glycol Polymers 0.000 description 8
- 229920001169 thermoplastic Polymers 0.000 description 8
- 229920003160 Eudragit® RS PO Polymers 0.000 description 7
- 230000000694 effects Effects 0.000 description 7
- 238000010828 elution Methods 0.000 description 7
- 230000000202 analgesic effect Effects 0.000 description 6
- BXWNKGSJHAJOGX-UHFFFAOYSA-N hexadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO BXWNKGSJHAJOGX-UHFFFAOYSA-N 0.000 description 6
- 239000000843 powder Substances 0.000 description 6
- 238000012360 testing method Methods 0.000 description 6
- 229920003156 Eudragit® RL PO Polymers 0.000 description 5
- 229920003134 Eudragit® polymer Polymers 0.000 description 5
- 239000004705 High-molecular-weight polyethylene Substances 0.000 description 5
- 239000008118 PEG 6000 Substances 0.000 description 5
- 229920002584 Polyethylene Glycol 6000 Polymers 0.000 description 5
- 235000021355 Stearic acid Nutrition 0.000 description 5
- 239000000463 material Substances 0.000 description 5
- 239000011159 matrix material Substances 0.000 description 5
- 238000002156 mixing Methods 0.000 description 5
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 5
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 5
- 239000007787 solid Substances 0.000 description 5
- 239000008117 stearic acid Substances 0.000 description 5
- VVQNEPGJFQJSBK-UHFFFAOYSA-N Methyl methacrylate Chemical compound COC(=O)C(C)=C VVQNEPGJFQJSBK-UHFFFAOYSA-N 0.000 description 4
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 4
- ZFOZVQLOBQUTQQ-UHFFFAOYSA-N Tributyl citrate Chemical compound CCCCOC(=O)CC(O)(C(=O)OCCCC)CC(=O)OCCCC ZFOZVQLOBQUTQQ-UHFFFAOYSA-N 0.000 description 4
- 239000005557 antagonist Substances 0.000 description 4
- OROGSEYTTFOCAN-DNJOTXNNSA-N codeine Chemical compound C([C@H]1[C@H](N(CC[C@@]112)C)C3)=C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC OROGSEYTTFOCAN-DNJOTXNNSA-N 0.000 description 4
- XYYVYLMBEZUESM-UHFFFAOYSA-N dihydrocodeine Natural products C1C(N(CCC234)C)C2C=CC(=O)C3OC2=C4C1=CC=C2OC XYYVYLMBEZUESM-UHFFFAOYSA-N 0.000 description 4
- 238000005429 filling process Methods 0.000 description 4
- 210000004051 gastric juice Anatomy 0.000 description 4
- 230000009477 glass transition Effects 0.000 description 4
- OROGSEYTTFOCAN-UHFFFAOYSA-N hydrocodone Natural products C1C(N(CCC234)C)C2C=CC(O)C3OC2=C4C1=CC=C2OC OROGSEYTTFOCAN-UHFFFAOYSA-N 0.000 description 4
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 4
- 238000001727 in vivo Methods 0.000 description 4
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 4
- 229940016286 microcrystalline cellulose Drugs 0.000 description 4
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 4
- 239000008108 microcrystalline cellulose Substances 0.000 description 4
- BQJCRHHNABKAKU-KBQPJGBKSA-N morphine Chemical compound O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O BQJCRHHNABKAKU-KBQPJGBKSA-N 0.000 description 4
- 230000036407 pain Effects 0.000 description 4
- 239000002245 particle Substances 0.000 description 4
- 239000008188 pellet Substances 0.000 description 4
- 239000004416 thermosoftening plastic Substances 0.000 description 4
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 3
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 3
- PYGXAGIECVVIOZ-UHFFFAOYSA-N Dibutyl decanedioate Chemical compound CCCCOC(=O)CCCCCCCCC(=O)OCCCC PYGXAGIECVVIOZ-UHFFFAOYSA-N 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- DOOTYTYQINUNNV-UHFFFAOYSA-N Triethyl citrate Chemical compound CCOC(=O)CC(O)(C(=O)OCC)CC(=O)OCC DOOTYTYQINUNNV-UHFFFAOYSA-N 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 239000000654 additive Substances 0.000 description 3
- 230000015556 catabolic process Effects 0.000 description 3
- 229940082500 cetostearyl alcohol Drugs 0.000 description 3
- 229960000541 cetyl alcohol Drugs 0.000 description 3
- 239000011248 coating agent Substances 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 238000005520 cutting process Methods 0.000 description 3
- 238000006731 degradation reaction Methods 0.000 description 3
- 238000013461 design Methods 0.000 description 3
- 238000010586 diagram Methods 0.000 description 3
- 239000000499 gel Substances 0.000 description 3
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 3
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 3
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 3
- 239000012729 immediate-release (IR) formulation Substances 0.000 description 3
- 230000000968 intestinal effect Effects 0.000 description 3
- 229940005483 opioid analgesics Drugs 0.000 description 3
- MUZQPDBAOYKNLO-RKXJKUSZSA-N oxycodone hydrochloride Chemical compound [H+].[Cl-].O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(OC)C2=C5[C@@]13CCN4C MUZQPDBAOYKNLO-RKXJKUSZSA-N 0.000 description 3
- 230000003285 pharmacodynamic effect Effects 0.000 description 3
- 230000036470 plasma concentration Effects 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 125000001453 quaternary ammonium group Chemical group 0.000 description 3
- 239000000600 sorbitol Substances 0.000 description 3
- 229940012831 stearyl alcohol Drugs 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 229960004793 sucrose Drugs 0.000 description 3
- 238000013268 sustained release Methods 0.000 description 3
- 239000012730 sustained-release form Substances 0.000 description 3
- OULAJFUGPPVRBK-UHFFFAOYSA-N tetratriacontyl alcohol Natural products CCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCO OULAJFUGPPVRBK-UHFFFAOYSA-N 0.000 description 3
- 239000001069 triethyl citrate Substances 0.000 description 3
- VMYFZRTXGLUXMZ-UHFFFAOYSA-N triethyl citrate Natural products CCOC(=O)C(O)(C(=O)OCC)C(=O)OCC VMYFZRTXGLUXMZ-UHFFFAOYSA-N 0.000 description 3
- 235000013769 triethyl citrate Nutrition 0.000 description 3
- FJLGEFLZQAZZCD-JUFISIKESA-N (3S,5R)-fluvastatin Chemical compound C12=CC=CC=C2N(C(C)C)C(\C=C\[C@H](O)C[C@H](O)CC(O)=O)=C1C1=CC=C(F)C=C1 FJLGEFLZQAZZCD-JUFISIKESA-N 0.000 description 2
- TVYLLZQTGLZFBW-ZBFHGGJFSA-N (R,R)-tramadol Chemical compound COC1=CC=CC([C@]2(O)[C@H](CCCC2)CN(C)C)=C1 TVYLLZQTGLZFBW-ZBFHGGJFSA-N 0.000 description 2
- OKMWKBLSFKFYGZ-UHFFFAOYSA-N 1-behenoylglycerol Chemical compound CCCCCCCCCCCCCCCCCCCCCC(=O)OCC(O)CO OKMWKBLSFKFYGZ-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- IJVCSMSMFSCRME-KBQPJGBKSA-N Dihydromorphine Chemical compound O([C@H]1[C@H](CC[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O IJVCSMSMFSCRME-KBQPJGBKSA-N 0.000 description 2
- ULGZDMOVFRHVEP-RWJQBGPGSA-N Erythromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)C(=O)[C@H](C)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 ULGZDMOVFRHVEP-RWJQBGPGSA-N 0.000 description 2
- 229940121710 HMGCoA reductase inhibitor Drugs 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 2
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 2
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 239000004098 Tetracycline Substances 0.000 description 2
- NIXOWILDQLNWCW-UHFFFAOYSA-N acrylic acid group Chemical group C(C=C)(=O)O NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 2
- 229940035676 analgesics Drugs 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 239000000730 antalgic agent Substances 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 229940088710 antibiotic agent Drugs 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 239000012062 aqueous buffer Substances 0.000 description 2
- WZPBZJONDBGPKJ-VEHQQRBSSA-N aztreonam Chemical compound O=C1N(S([O-])(=O)=O)[C@@H](C)[C@@H]1NC(=O)C(=N/OC(C)(C)C(O)=O)\C1=CSC([NH3+])=N1 WZPBZJONDBGPKJ-VEHQQRBSSA-N 0.000 description 2
- 229960003644 aztreonam Drugs 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- MYSWGUAQZAJSOK-UHFFFAOYSA-N ciprofloxacin Chemical compound C12=CC(N3CCNCC3)=C(F)C=C2C(=O)C(C(=O)O)=CN1C1CC1 MYSWGUAQZAJSOK-UHFFFAOYSA-N 0.000 description 2
- 229960004126 codeine Drugs 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- 229960000920 dihydrocodeine Drugs 0.000 description 2
- RBOXVHNMENFORY-DNJOTXNNSA-N dihydrocodeine Chemical compound C([C@H]1[C@H](N(CC[C@@]112)C)C3)C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC RBOXVHNMENFORY-DNJOTXNNSA-N 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- 230000009977 dual effect Effects 0.000 description 2
- 235000012438 extruded product Nutrition 0.000 description 2
- 229960002428 fentanyl Drugs 0.000 description 2
- PJMPHNIQZUBGLI-UHFFFAOYSA-N fentanyl Chemical compound C=1C=CC=CC=1N(C(=O)CC)C(CC1)CCN1CCC1=CC=CC=C1 PJMPHNIQZUBGLI-UHFFFAOYSA-N 0.000 description 2
- 238000011049 filling Methods 0.000 description 2
- 238000010579 first pass effect Methods 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 description 2
- 230000002496 gastric effect Effects 0.000 description 2
- 239000003349 gelling agent Substances 0.000 description 2
- 229940049654 glyceryl behenate Drugs 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- LLPOLZWFYMWNKH-CMKMFDCUSA-N hydrocodone Chemical compound C([C@H]1[C@H](N(CC[C@@]112)C)C3)CC(=O)[C@@H]1OC1=C2C3=CC=C1OC LLPOLZWFYMWNKH-CMKMFDCUSA-N 0.000 description 2
- 229960000240 hydrocodone Drugs 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 230000001788 irregular Effects 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 229960001375 lactose Drugs 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 235000019359 magnesium stearate Nutrition 0.000 description 2
- 239000000155 melt Substances 0.000 description 2
- 230000003278 mimic effect Effects 0.000 description 2
- 229960005181 morphine Drugs 0.000 description 2
- UZHSEJADLWPNLE-GRGSLBFTSA-N naloxone Chemical compound O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(O)C2=C5[C@@]13CCN4CC=C UZHSEJADLWPNLE-GRGSLBFTSA-N 0.000 description 2
- 229960004127 naloxone Drugs 0.000 description 2
- 239000008194 pharmaceutical composition Substances 0.000 description 2
- 239000000825 pharmaceutical preparation Substances 0.000 description 2
- 229920001343 polytetrafluoroethylene Polymers 0.000 description 2
- 239000004810 polytetrafluoroethylene Substances 0.000 description 2
- 229960002920 sorbitol Drugs 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 235000012222 talc Nutrition 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- 235000019364 tetracycline Nutrition 0.000 description 2
- 150000003522 tetracyclines Chemical class 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 229960004380 tramadol Drugs 0.000 description 2
- TVYLLZQTGLZFBW-GOEBONIOSA-N tramadol Natural products COC1=CC=CC([C@@]2(O)[C@@H](CCCC2)CN(C)C)=C1 TVYLLZQTGLZFBW-GOEBONIOSA-N 0.000 description 2
- LLPOLZWFYMWNKH-UHFFFAOYSA-N trans-dihydrocodeinone Natural products C1C(N(CCC234)C)C2CCC(=O)C3OC2=C4C1=CC=C2OC LLPOLZWFYMWNKH-UHFFFAOYSA-N 0.000 description 2
- URAYPUMNDPQOKB-UHFFFAOYSA-N triacetin Chemical compound CC(=O)OCC(OC(C)=O)COC(C)=O URAYPUMNDPQOKB-UHFFFAOYSA-N 0.000 description 2
- CABVTRNMFUVUDM-VRHQGPGLSA-N (3S)-3-hydroxy-3-methylglutaryl-CoA Chemical compound O[C@@H]1[C@H](OP(O)(O)=O)[C@@H](COP(O)(=O)OP(O)(=O)OCC(C)(C)[C@@H](O)C(=O)NCCC(=O)NCCSC(=O)C[C@@](O)(CC(O)=O)C)O[C@H]1N1C2=NC=NC(N)=C2N=C1 CABVTRNMFUVUDM-VRHQGPGLSA-N 0.000 description 1
- VDSBXXDKCUBMQC-HNGSOEQISA-N (4r,6s)-6-[(e)-2-[2-(4-fluoro-3-methylphenyl)-4,4,6,6-tetramethylcyclohexen-1-yl]ethenyl]-4-hydroxyoxan-2-one Chemical compound C1=C(F)C(C)=CC(C=2CC(C)(C)CC(C)(C)C=2\C=C\[C@H]2OC(=O)C[C@H](O)C2)=C1 VDSBXXDKCUBMQC-HNGSOEQISA-N 0.000 description 1
- SGKRLCUYIXIAHR-AKNGSSGZSA-N (4s,4ar,5s,5ar,6r,12ar)-4-(dimethylamino)-1,5,10,11,12a-pentahydroxy-6-methyl-3,12-dioxo-4a,5,5a,6-tetrahydro-4h-tetracene-2-carboxamide Chemical compound C1=CC=C2[C@H](C)[C@@H]([C@H](O)[C@@H]3[C@](C(O)=C(C(N)=O)C(=O)[C@H]3N(C)C)(O)C3=O)C3=C(O)C2=C1O SGKRLCUYIXIAHR-AKNGSSGZSA-N 0.000 description 1
- FFTVPQUHLQBXQZ-KVUCHLLUSA-N (4s,4as,5ar,12ar)-4,7-bis(dimethylamino)-1,10,11,12a-tetrahydroxy-3,12-dioxo-4a,5,5a,6-tetrahydro-4h-tetracene-2-carboxamide Chemical compound C1C2=C(N(C)C)C=CC(O)=C2C(O)=C2[C@@H]1C[C@H]1[C@H](N(C)C)C(=O)C(C(N)=O)=C(O)[C@@]1(O)C2=O FFTVPQUHLQBXQZ-KVUCHLLUSA-N 0.000 description 1
- NWXMGUDVXFXRIG-WESIUVDSSA-N (4s,4as,5as,6s,12ar)-4-(dimethylamino)-1,6,10,11,12a-pentahydroxy-6-methyl-3,12-dioxo-4,4a,5,5a-tetrahydrotetracene-2-carboxamide Chemical compound C1=CC=C2[C@](O)(C)[C@H]3C[C@H]4[C@H](N(C)C)C(=O)C(C(N)=O)=C(O)[C@@]4(O)C(=O)C3=C(O)C2=C1O NWXMGUDVXFXRIG-WESIUVDSSA-N 0.000 description 1
- GUXHBMASAHGULD-SEYHBJAFSA-N (4s,4as,5as,6s,12ar)-7-chloro-4-(dimethylamino)-1,6,10,11,12a-pentahydroxy-3,12-dioxo-4a,5,5a,6-tetrahydro-4h-tetracene-2-carboxamide Chemical compound C1([C@H]2O)=C(Cl)C=CC(O)=C1C(O)=C1[C@@H]2C[C@H]2[C@H](N(C)C)C(=O)C(C(N)=O)=C(O)[C@@]2(O)C1=O GUXHBMASAHGULD-SEYHBJAFSA-N 0.000 description 1
- WDLWHQDACQUCJR-ZAMMOSSLSA-N (6r,7r)-7-[[(2r)-2-azaniumyl-2-(4-hydroxyphenyl)acetyl]amino]-8-oxo-3-[(e)-prop-1-enyl]-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylate Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@@H]3N(C2=O)C(=C(CS3)/C=C/C)C(O)=O)=CC=C(O)C=C1 WDLWHQDACQUCJR-ZAMMOSSLSA-N 0.000 description 1
- SMZOUWXMTYCWNB-UHFFFAOYSA-N 2-(2-methoxy-5-methylphenyl)ethanamine Chemical compound COC1=CC=C(C)C=C1CCN SMZOUWXMTYCWNB-UHFFFAOYSA-N 0.000 description 1
- QCQCHGYLTSGIGX-GHXANHINSA-N 4-[[(3ar,5ar,5br,7ar,9s,11ar,11br,13as)-5a,5b,8,8,11a-pentamethyl-3a-[(5-methylpyridine-3-carbonyl)amino]-2-oxo-1-propan-2-yl-4,5,6,7,7a,9,10,11,11b,12,13,13a-dodecahydro-3h-cyclopenta[a]chrysen-9-yl]oxy]-2,2-dimethyl-4-oxobutanoic acid Chemical compound N([C@@]12CC[C@@]3(C)[C@]4(C)CC[C@H]5C(C)(C)[C@@H](OC(=O)CC(C)(C)C(O)=O)CC[C@]5(C)[C@H]4CC[C@@H]3C1=C(C(C2)=O)C(C)C)C(=O)C1=CN=CC(C)=C1 QCQCHGYLTSGIGX-GHXANHINSA-N 0.000 description 1
- WMHRYMDGHQIARA-UHFFFAOYSA-N 4-hydroxyoxan-2-one Chemical compound OC1CCOC(=O)C1 WMHRYMDGHQIARA-UHFFFAOYSA-N 0.000 description 1
- USSIQXCVUWKGNF-UHFFFAOYSA-N 6-(dimethylamino)-4,4-diphenylheptan-3-one Chemical compound C=1C=CC=CC=1C(CC(C)N(C)C)(C(=O)CC)C1=CC=CC=C1 USSIQXCVUWKGNF-UHFFFAOYSA-N 0.000 description 1
- LJIZUXQINHXGAO-UHFFFAOYSA-N 6-[2-[4-(4-fluorophenyl)-6-phenyl-2-propan-2-ylpyridin-3-yl]ethenyl]-4-hydroxyoxan-2-one Chemical compound C1C(O)CC(=O)OC1C=CC=1C(C(C)C)=NC(C=2C=CC=CC=2)=CC=1C1=CC=C(F)C=C1 LJIZUXQINHXGAO-UHFFFAOYSA-N 0.000 description 1
- DVOXAESDMBPGCL-UHFFFAOYSA-N 6-[4,4-bis(2-fluorophenyl)-3-(1-methyltetrazol-5-yl)buta-1,3-dienyl]-4-hydroxyoxan-2-one Chemical compound CN1N=NN=C1C(C=CC1OC(=O)CC(O)C1)=C(C=1C(=CC=CC=1)F)C1=CC=CC=C1F DVOXAESDMBPGCL-UHFFFAOYSA-N 0.000 description 1
- WZPBZJONDBGPKJ-UHFFFAOYSA-N Antibiotic SQ 26917 Natural products O=C1N(S(O)(=O)=O)C(C)C1NC(=O)C(=NOC(C)(C)C(O)=O)C1=CSC(N)=N1 WZPBZJONDBGPKJ-UHFFFAOYSA-N 0.000 description 1
- XUKUURHRXDUEBC-KAYWLYCHSA-N Atorvastatin Chemical compound C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CC[C@@H](O)C[C@@H](O)CC(O)=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1 XUKUURHRXDUEBC-KAYWLYCHSA-N 0.000 description 1
- XUKUURHRXDUEBC-UHFFFAOYSA-N Atorvastatin Natural products C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CCC(O)CC(O)CC(O)=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1 XUKUURHRXDUEBC-UHFFFAOYSA-N 0.000 description 1
- 239000004322 Butylated hydroxytoluene Substances 0.000 description 1
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-M Butyrate Chemical compound CCCC([O-])=O FERIUCNNQQJTOY-UHFFFAOYSA-M 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-N Butyric acid Natural products CCCC(O)=O FERIUCNNQQJTOY-UHFFFAOYSA-N 0.000 description 1
- 239000004099 Chlortetracycline Substances 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 229920002785 Croscarmellose sodium Polymers 0.000 description 1
- FMTDIUIBLCQGJB-UHFFFAOYSA-N Demethylchlortetracyclin Natural products C1C2C(O)C3=C(Cl)C=CC(O)=C3C(=O)C2=C(O)C2(O)C1C(N(C)C)C(O)=C(C(N)=O)C2=O FMTDIUIBLCQGJB-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- OGDVEMNWJVYAJL-LEPYJNQMSA-N Ethyl morphine Chemical compound C([C@H]1[C@H](N(CC[C@@]112)C)C3)=C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OCC OGDVEMNWJVYAJL-LEPYJNQMSA-N 0.000 description 1
- OGDVEMNWJVYAJL-UHFFFAOYSA-N Ethylmorphine Natural products C1C(N(CCC234)C)C2C=CC(O)C3OC2=C4C1=CC=C2OCC OGDVEMNWJVYAJL-UHFFFAOYSA-N 0.000 description 1
- 229920003155 Eudragit® RL 100 Polymers 0.000 description 1
- 229920003159 Eudragit® RS 100 Polymers 0.000 description 1
- 229920003161 Eudragit® RS 30 D Polymers 0.000 description 1
- UIOFUWFRIANQPC-JKIFEVAISA-N Floxacillin Chemical compound N([C@@H]1C(N2[C@H](C(C)(C)S[C@@H]21)C(O)=O)=O)C(=O)C1=C(C)ON=C1C1=C(F)C=CC=C1Cl UIOFUWFRIANQPC-JKIFEVAISA-N 0.000 description 1
- 229930182566 Gentamicin Natural products 0.000 description 1
- CEAZRRDELHUEMR-URQXQFDESA-N Gentamicin Chemical compound O1[C@H](C(C)NC)CC[C@@H](N)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](NC)[C@@](C)(O)CO2)O)[C@H](N)C[C@@H]1N CEAZRRDELHUEMR-URQXQFDESA-N 0.000 description 1
- GVGLGOZIDCSQPN-PVHGPHFFSA-N Heroin Chemical compound O([C@H]1[C@H](C=C[C@H]23)OC(C)=O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4OC(C)=O GVGLGOZIDCSQPN-PVHGPHFFSA-N 0.000 description 1
- 239000004610 Internal Lubricant Substances 0.000 description 1
- ALFGKMXHOUSVAD-UHFFFAOYSA-N Ketobemidone Chemical compound C=1C=CC(O)=CC=1C1(C(=O)CC)CCN(C)CC1 ALFGKMXHOUSVAD-UHFFFAOYSA-N 0.000 description 1
- GSDSWSVVBLHKDQ-JTQLQIEISA-N Levofloxacin Chemical compound C([C@@H](N1C2=C(C(C(C(O)=O)=C1)=O)C=C1F)C)OC2=C1N1CCN(C)CC1 GSDSWSVVBLHKDQ-JTQLQIEISA-N 0.000 description 1
- 229920000161 Locust bean gum Polymers 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- CERQOIWHTDAKMF-UHFFFAOYSA-N Methacrylic acid Chemical compound CC(=C)C(O)=O CERQOIWHTDAKMF-UHFFFAOYSA-N 0.000 description 1
- PCZOHLXUXFIOCF-UHFFFAOYSA-N Monacolin X Natural products C12C(OC(=O)C(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 PCZOHLXUXFIOCF-UHFFFAOYSA-N 0.000 description 1
- GNJCUHZOSOYIEC-GAROZEBRSA-N Morphine-6-glucuronide Chemical compound O([C@H]1C=C[C@H]2[C@H]3CC=4C5=C(C(=CC=4)O)O[C@@H]1[C@]52CCN3C)[C@@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O GNJCUHZOSOYIEC-GAROZEBRSA-N 0.000 description 1
- OVBPIULPVIDEAO-UHFFFAOYSA-N N-Pteroyl-L-glutaminsaeure Natural products C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-UHFFFAOYSA-N 0.000 description 1
- 229930193140 Neomycin Natural products 0.000 description 1
- ONBWJWYUHXVEJS-ZTYRTETDSA-N Normorphine Chemical compound C([C@@H](NCC1)[C@@H]2C=C[C@@H]3O)C4=CC=C(O)C5=C4[C@@]21[C@H]3O5 ONBWJWYUHXVEJS-ZTYRTETDSA-N 0.000 description 1
- 239000008896 Opium Substances 0.000 description 1
- 102000004316 Oxidoreductases Human genes 0.000 description 1
- 108090000854 Oxidoreductases Proteins 0.000 description 1
- 239000004100 Oxytetracycline Substances 0.000 description 1
- 241001442654 Percnon planissimum Species 0.000 description 1
- TUZYXOIXSAXUGO-UHFFFAOYSA-N Pravastatin Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(O)C=C21 TUZYXOIXSAXUGO-UHFFFAOYSA-N 0.000 description 1
- ZTVQQQVZCWLTDF-UHFFFAOYSA-N Remifentanil Chemical compound C1CN(CCC(=O)OC)CCC1(C(=O)OC)N(C(=O)CC)C1=CC=CC=C1 ZTVQQQVZCWLTDF-UHFFFAOYSA-N 0.000 description 1
- RYMZZMVNJRMUDD-UHFFFAOYSA-N SJ000286063 Natural products C12C(OC(=O)C(C)(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 RYMZZMVNJRMUDD-UHFFFAOYSA-N 0.000 description 1
- AJLFOPYRIVGYMJ-UHFFFAOYSA-N SJ000287055 Natural products C12C(OC(=O)C(C)CC)CCC=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 AJLFOPYRIVGYMJ-UHFFFAOYSA-N 0.000 description 1
- 229920001800 Shellac Polymers 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- WKDDRNSBRWANNC-UHFFFAOYSA-N Thienamycin Natural products C1C(SCCN)=C(C(O)=O)N2C(=O)C(C(O)C)C21 WKDDRNSBRWANNC-UHFFFAOYSA-N 0.000 description 1
- HJLSLZFTEKNLFI-UHFFFAOYSA-N Tinidazole Chemical compound CCS(=O)(=O)CCN1C(C)=NC=C1[N+]([O-])=O HJLSLZFTEKNLFI-UHFFFAOYSA-N 0.000 description 1
- 229920002494 Zein Polymers 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 229920006243 acrylic copolymer Polymers 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 229920013820 alkyl cellulose Polymers 0.000 description 1
- KGYFOSCXVAXULR-UHFFFAOYSA-N allylprodine Chemical compound C=1C=CC=CC=1C1(OC(=O)CC)CCN(C)CC1CC=C KGYFOSCXVAXULR-UHFFFAOYSA-N 0.000 description 1
- 229950004361 allylprodine Drugs 0.000 description 1
- UVAZQQHAVMNMHE-XJKSGUPXSA-N alphaprodine Chemical compound C=1C=CC=CC=1[C@@]1(OC(=O)CC)CCN(C)C[C@@H]1C UVAZQQHAVMNMHE-XJKSGUPXSA-N 0.000 description 1
- 229960001349 alphaprodine Drugs 0.000 description 1
- 229960004821 amikacin Drugs 0.000 description 1
- LKCWBDHBTVXHDL-RMDFUYIESA-N amikacin Chemical compound O([C@@H]1[C@@H](N)C[C@H]([C@@H]([C@H]1O)O[C@@H]1[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O1)O)NC(=O)[C@@H](O)CCN)[C@H]1O[C@H](CN)[C@@H](O)[C@H](O)[C@H]1O LKCWBDHBTVXHDL-RMDFUYIESA-N 0.000 description 1
- 229940126575 aminoglycoside Drugs 0.000 description 1
- 229960003022 amoxicillin Drugs 0.000 description 1
- LSQZJLSUYDQPKJ-NJBDSQKTSA-N amoxicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=C(O)C=C1 LSQZJLSUYDQPKJ-NJBDSQKTSA-N 0.000 description 1
- 229960000723 ampicillin Drugs 0.000 description 1
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 1
- 230000036592 analgesia Effects 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 229960005370 atorvastatin Drugs 0.000 description 1
- DZGUJOWBVDZNNF-UHFFFAOYSA-N azanium;2-methylprop-2-enoate Chemical compound [NH4+].CC(=C)C([O-])=O DZGUJOWBVDZNNF-UHFFFAOYSA-N 0.000 description 1
- 229960004099 azithromycin Drugs 0.000 description 1
- MQTOSJVFKKJCRP-BICOPXKESA-N azithromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)N(C)C[C@H](C)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 MQTOSJVFKKJCRP-BICOPXKESA-N 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- RDJGWRFTDZZXSM-RNWLQCGYSA-N benzylmorphine Chemical compound O([C@@H]1[C@]23CCN([C@H](C4)[C@@H]3C=C[C@@H]1O)C)C1=C2C4=CC=C1OCC1=CC=CC=C1 RDJGWRFTDZZXSM-RNWLQCGYSA-N 0.000 description 1
- FLKWNFFCSSJANB-UHFFFAOYSA-N bezitramide Chemical compound O=C1N(C(=O)CC)C2=CC=CC=C2N1C(CC1)CCN1CCC(C#N)(C=1C=CC=CC=1)C1=CC=CC=C1 FLKWNFFCSSJANB-UHFFFAOYSA-N 0.000 description 1
- 229960004611 bezitramide Drugs 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000002051 biphasic effect Effects 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000004067 bulking agent Substances 0.000 description 1
- 229940095259 butylated hydroxytoluene Drugs 0.000 description 1
- 235000010354 butylated hydroxytoluene Nutrition 0.000 description 1
- PPKJUHVNTMYXOD-PZGPJMECSA-N c49ws9n75l Chemical compound O=C([C@@H]1N(C2=O)CC[C@H]1S(=O)(=O)CCN(CC)CC)O[C@H](C(C)C)[C@H](C)\C=C\C(=O)NC\C=C\C(\C)=C\[C@@H](O)CC(=O)CC1=NC2=CO1.N([C@@H]1C(=O)N[C@@H](C(N2CCC[C@H]2C(=O)N(C)[C@@H](CC=2C=CC(=CC=2)N(C)C)C(=O)N2C[C@@H](CS[C@H]3C4CCN(CC4)C3)C(=O)C[C@H]2C(=O)N[C@H](C(=O)O[C@@H]1C)C=1C=CC=CC=1)=O)CC)C(=O)C1=NC=CC=C1O PPKJUHVNTMYXOD-PZGPJMECSA-N 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 229940041011 carbapenems Drugs 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 235000019438 castor oil Nutrition 0.000 description 1
- 229960001139 cefazolin Drugs 0.000 description 1
- MLYYVTUWGNIJIB-BXKDBHETSA-N cefazolin Chemical compound S1C(C)=NN=C1SCC1=C(C(O)=O)N2C(=O)[C@@H](NC(=O)CN3N=NN=C3)[C@H]2SC1 MLYYVTUWGNIJIB-BXKDBHETSA-N 0.000 description 1
- 229960002580 cefprozil Drugs 0.000 description 1
- 229960000484 ceftazidime Drugs 0.000 description 1
- NMVPEQXCMGEDNH-TZVUEUGBSA-N ceftazidime pentahydrate Chemical compound O.O.O.O.O.S([C@@H]1[C@@H](C(N1C=1C([O-])=O)=O)NC(=O)\C(=N/OC(C)(C)C(O)=O)C=2N=C(N)SC=2)CC=1C[N+]1=CC=CC=C1 NMVPEQXCMGEDNH-TZVUEUGBSA-N 0.000 description 1
- 229960004755 ceftriaxone Drugs 0.000 description 1
- VAAUVRVFOQPIGI-SPQHTLEESA-N ceftriaxone Chemical compound S([C@@H]1[C@@H](C(N1C=1C(O)=O)=O)NC(=O)\C(=N/OC)C=2N=C(N)SC=2)CC=1CSC1=NC(=O)C(=O)NN1C VAAUVRVFOQPIGI-SPQHTLEESA-N 0.000 description 1
- 229940106164 cephalexin Drugs 0.000 description 1
- ZAIPMKNFIOOWCQ-UEKVPHQBSA-N cephalexin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@@H]3N(C2=O)C(=C(CS3)C)C(O)=O)=CC=CC=C1 ZAIPMKNFIOOWCQ-UEKVPHQBSA-N 0.000 description 1
- 229960005110 cerivastatin Drugs 0.000 description 1
- SEERZIQQUAZTOL-ANMDKAQQSA-N cerivastatin Chemical compound COCC1=C(C(C)C)N=C(C(C)C)C(\C=C\[C@@H](O)C[C@@H](O)CC(O)=O)=C1C1=CC=C(F)C=C1 SEERZIQQUAZTOL-ANMDKAQQSA-N 0.000 description 1
- 238000002144 chemical decomposition reaction Methods 0.000 description 1
- CYDMQBQPVICBEU-UHFFFAOYSA-N chlorotetracycline Natural products C1=CC(Cl)=C2C(O)(C)C3CC4C(N(C)C)C(O)=C(C(N)=O)C(=O)C4(O)C(O)=C3C(=O)C2=C1O CYDMQBQPVICBEU-UHFFFAOYSA-N 0.000 description 1
- 229960004475 chlortetracycline Drugs 0.000 description 1
- CYDMQBQPVICBEU-XRNKAMNCSA-N chlortetracycline Chemical compound C1=CC(Cl)=C2[C@](O)(C)[C@H]3C[C@H]4[C@H](N(C)C)C(O)=C(C(N)=O)C(=O)[C@@]4(O)C(O)=C3C(=O)C2=C1O CYDMQBQPVICBEU-XRNKAMNCSA-N 0.000 description 1
- 235000019365 chlortetracycline Nutrition 0.000 description 1
- 229960003405 ciprofloxacin Drugs 0.000 description 1
- 229960002626 clarithromycin Drugs 0.000 description 1
- AGOYDEPGAOXOCK-KCBOHYOISA-N clarithromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)C(=O)[C@H](C)C[C@](C)([C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)OC)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 AGOYDEPGAOXOCK-KCBOHYOISA-N 0.000 description 1
- 229960002227 clindamycin Drugs 0.000 description 1
- KDLRVYVGXIQJDK-AWPVFWJPSA-N clindamycin Chemical compound CN1C[C@H](CCC)C[C@H]1C(=O)N[C@H]([C@H](C)Cl)[C@@H]1[C@H](O)[C@H](O)[C@@H](O)[C@@H](SC)O1 KDLRVYVGXIQJDK-AWPVFWJPSA-N 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 238000007906 compression Methods 0.000 description 1
- 230000006835 compression Effects 0.000 description 1
- 238000013267 controlled drug release Methods 0.000 description 1
- 238000012937 correction Methods 0.000 description 1
- 229960001681 croscarmellose sodium Drugs 0.000 description 1
- 229960000913 crospovidone Drugs 0.000 description 1
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 1
- 229950003040 dalvastatin Drugs 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 229960002398 demeclocycline Drugs 0.000 description 1
- WDEFBBTXULIOBB-WBVHZDCISA-N dextilidine Chemical compound C=1C=CC=CC=1[C@@]1(C(=O)OCC)CCC=C[C@H]1N(C)C WDEFBBTXULIOBB-WBVHZDCISA-N 0.000 description 1
- 229960003701 dextromoramide Drugs 0.000 description 1
- INUNXTSAACVKJS-OAQYLSRUSA-N dextromoramide Chemical compound C([C@@H](C)C(C(=O)N1CCCC1)(C=1C=CC=CC=1)C=1C=CC=CC=1)N1CCOCC1 INUNXTSAACVKJS-OAQYLSRUSA-N 0.000 description 1
- 229960004193 dextropropoxyphene Drugs 0.000 description 1
- XLMALTXPSGQGBX-GCJKJVERSA-N dextropropoxyphene Chemical compound C([C@](OC(=O)CC)([C@H](C)CN(C)C)C=1C=CC=CC=1)C1=CC=CC=C1 XLMALTXPSGQGBX-GCJKJVERSA-N 0.000 description 1
- 229960002069 diamorphine Drugs 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 238000000113 differential scanning calorimetry Methods 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- RHUWRJWFHUKVED-UHFFFAOYSA-N dimenoxadol Chemical compound C=1C=CC=CC=1C(C(=O)OCCN(C)C)(OCC)C1=CC=CC=C1 RHUWRJWFHUKVED-UHFFFAOYSA-N 0.000 description 1
- 229950011187 dimenoxadol Drugs 0.000 description 1
- CANBGVXYBPOLRR-UHFFFAOYSA-N dimethylthiambutene Chemical compound C=1C=CSC=1C(=CC(C)N(C)C)C1=CC=CS1 CANBGVXYBPOLRR-UHFFFAOYSA-N 0.000 description 1
- 229950005563 dimethylthiambutene Drugs 0.000 description 1
- SVDHSZFEQYXRDC-UHFFFAOYSA-N dipipanone Chemical compound C=1C=CC=CC=1C(C=1C=CC=CC=1)(C(=O)CC)CC(C)N1CCCCC1 SVDHSZFEQYXRDC-UHFFFAOYSA-N 0.000 description 1
- 229960002500 dipipanone Drugs 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 238000011143 downstream manufacturing Methods 0.000 description 1
- 229960003722 doxycycline Drugs 0.000 description 1
- 230000005611 electricity Effects 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 238000005538 encapsulation Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 229960003276 erythromycin Drugs 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- MORSAEFGQPDBKM-UHFFFAOYSA-N ethylmethylthiambutene Chemical compound C=1C=CSC=1C(=CC(C)N(C)CC)C1=CC=CS1 MORSAEFGQPDBKM-UHFFFAOYSA-N 0.000 description 1
- 229950006111 ethylmethylthiambutene Drugs 0.000 description 1
- 229960004578 ethylmorphine Drugs 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 150000002191 fatty alcohols Chemical class 0.000 description 1
- 239000010419 fine particle Substances 0.000 description 1
- 229960004273 floxacillin Drugs 0.000 description 1
- 229960003765 fluvastatin Drugs 0.000 description 1
- 229960000304 folic acid Drugs 0.000 description 1
- 235000019152 folic acid Nutrition 0.000 description 1
- 239000011724 folic acid Substances 0.000 description 1
- 239000012458 free base Substances 0.000 description 1
- 239000005350 fused silica glass Substances 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 229960002518 gentamicin Drugs 0.000 description 1
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 1
- 239000001087 glyceryl triacetate Substances 0.000 description 1
- 235000013773 glyceryl triacetate Nutrition 0.000 description 1
- 238000005469 granulation Methods 0.000 description 1
- 230000003179 granulation Effects 0.000 description 1
- 239000011874 heated mixture Substances 0.000 description 1
- 150000003840 hydrochlorides Chemical class 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- 239000008172 hydrogenated vegetable oil Substances 0.000 description 1
- WVLOADHCBXTIJK-YNHQPCIGSA-N hydromorphone Chemical compound O([C@H]1C(CC[C@H]23)=O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O WVLOADHCBXTIJK-YNHQPCIGSA-N 0.000 description 1
- 229960001410 hydromorphone Drugs 0.000 description 1
- 239000002471 hydroxymethylglutaryl coenzyme A reductase inhibitor Substances 0.000 description 1
- 229960002182 imipenem Drugs 0.000 description 1
- ZSKVGTPCRGIANV-ZXFLCMHBSA-N imipenem Chemical compound C1C(SCC\N=C\N)=C(C(O)=O)N2C(=O)[C@H]([C@H](O)C)[C@H]21 ZSKVGTPCRGIANV-ZXFLCMHBSA-N 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- 229960003029 ketobemidone Drugs 0.000 description 1
- 238000004898 kneading Methods 0.000 description 1
- 229960003376 levofloxacin Drugs 0.000 description 1
- 229940041028 lincosamides Drugs 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 235000010420 locust bean gum Nutrition 0.000 description 1
- 239000000711 locust bean gum Substances 0.000 description 1
- IMYHGORQCPYVBZ-NLFFAJNJSA-N lofentanil Chemical compound CCC(=O)N([C@@]1([C@@H](CN(CCC=2C=CC=CC=2)CC1)C)C(=O)OC)C1=CC=CC=C1 IMYHGORQCPYVBZ-NLFFAJNJSA-N 0.000 description 1
- 229950010274 lofentanil Drugs 0.000 description 1
- 229960004844 lovastatin Drugs 0.000 description 1
- PCZOHLXUXFIOCF-BXMDZJJMSA-N lovastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 PCZOHLXUXFIOCF-BXMDZJJMSA-N 0.000 description 1
- QLJODMDSTUBWDW-UHFFFAOYSA-N lovastatin hydroxy acid Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(C)C=C21 QLJODMDSTUBWDW-UHFFFAOYSA-N 0.000 description 1
- 230000001050 lubricating effect Effects 0.000 description 1
- 239000003120 macrolide antibiotic agent Substances 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 229960000365 meptazinol Drugs 0.000 description 1
- JLICHNCFTLFZJN-HNNXBMFYSA-N meptazinol Chemical compound C=1C=CC(O)=CC=1[C@@]1(CC)CCCCN(C)C1 JLICHNCFTLFZJN-HNNXBMFYSA-N 0.000 description 1
- 229960002260 meropenem Drugs 0.000 description 1
- DMJNNHOOLUXYBV-PQTSNVLCSA-N meropenem Chemical compound C=1([C@H](C)[C@@H]2[C@H](C(N2C=1C(O)=O)=O)[C@H](O)C)S[C@@H]1CN[C@H](C(=O)N(C)C)C1 DMJNNHOOLUXYBV-PQTSNVLCSA-N 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- YEOTYALSMRNXLJ-UHFFFAOYSA-N metazosin Chemical compound C1CN(C(=O)C(C)OC)CCN1C1=NC(N)=C(C=C(OC)C(OC)=C2)C2=N1 YEOTYALSMRNXLJ-UHFFFAOYSA-N 0.000 description 1
- 125000005397 methacrylic acid ester group Chemical group 0.000 description 1
- 125000005395 methacrylic acid group Chemical group 0.000 description 1
- 229960001797 methadone Drugs 0.000 description 1
- NSZBOSJMBQKKKB-UHFFFAOYSA-N methyl 3,5-dihydroxy-9,9-diphenylnona-6,8-dienoate Chemical compound C=1C=CC=CC=1C(=CC=CC(O)CC(O)CC(=O)OC)C1=CC=CC=C1 NSZBOSJMBQKKKB-UHFFFAOYSA-N 0.000 description 1
- 229960000282 metronidazole Drugs 0.000 description 1
- VAOCPAMSLUNLGC-UHFFFAOYSA-N metronidazole Chemical compound CC1=NC=C([N+]([O-])=O)N1CCO VAOCPAMSLUNLGC-UHFFFAOYSA-N 0.000 description 1
- AJLFOPYRIVGYMJ-INTXDZFKSA-N mevastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=CCC[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 AJLFOPYRIVGYMJ-INTXDZFKSA-N 0.000 description 1
- 229950009116 mevastatin Drugs 0.000 description 1
- BOZILQFLQYBIIY-UHFFFAOYSA-N mevastatin hydroxy acid Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CCC=C21 BOZILQFLQYBIIY-UHFFFAOYSA-N 0.000 description 1
- 239000011859 microparticle Substances 0.000 description 1
- 229960004023 minocycline Drugs 0.000 description 1
- 238000000465 moulding Methods 0.000 description 1
- 229960000805 nalbuphine Drugs 0.000 description 1
- NETZHAKZCGBWSS-CEDHKZHLSA-N nalbuphine Chemical compound C([C@]12[C@H]3OC=4C(O)=CC=C(C2=4)C[C@@H]2[C@]1(O)CC[C@@H]3O)CN2CC1CCC1 NETZHAKZCGBWSS-CEDHKZHLSA-N 0.000 description 1
- MHWLWQUZZRMNGJ-UHFFFAOYSA-N nalidixic acid Chemical compound C1=C(C)N=C2N(CC)C=C(C(O)=O)C(=O)C2=C1 MHWLWQUZZRMNGJ-UHFFFAOYSA-N 0.000 description 1
- 229960000210 nalidixic acid Drugs 0.000 description 1
- 239000003887 narcotic antagonist Substances 0.000 description 1
- 229960004927 neomycin Drugs 0.000 description 1
- 229960004300 nicomorphine Drugs 0.000 description 1
- HNDXBGYRMHRUFN-CIVUWBIHSA-N nicomorphine Chemical compound O([C@H]1C=C[C@H]2[C@H]3CC=4C5=C(C(=CC=4)OC(=O)C=4C=NC=CC=4)O[C@@H]1[C@]52CCN3C)C(=O)C1=CC=CN=C1 HNDXBGYRMHRUFN-CIVUWBIHSA-N 0.000 description 1
- 150000004957 nitroimidazoles Chemical class 0.000 description 1
- 229960004013 normethadone Drugs 0.000 description 1
- WCJFBSYALHQBSK-UHFFFAOYSA-N normethadone Chemical compound C=1C=CC=CC=1C(CCN(C)C)(C(=O)CC)C1=CC=CC=C1 WCJFBSYALHQBSK-UHFFFAOYSA-N 0.000 description 1
- 229950006134 normorphine Drugs 0.000 description 1
- WCDSHELZWCOTMI-UHFFFAOYSA-N norpipanone Chemical compound C=1C=CC=CC=1C(C=1C=CC=CC=1)(C(=O)CC)CCN1CCCCC1 WCDSHELZWCOTMI-UHFFFAOYSA-N 0.000 description 1
- 229950007418 norpipanone Drugs 0.000 description 1
- 229940127240 opiate Drugs 0.000 description 1
- 229960001027 opium Drugs 0.000 description 1
- 229960000625 oxytetracycline Drugs 0.000 description 1
- IWVCMVBTMGNXQD-PXOLEDIWSA-N oxytetracycline Chemical compound C1=CC=C2[C@](O)(C)[C@H]3[C@H](O)[C@H]4[C@H](N(C)C)C(O)=C(C(N)=O)C(=O)[C@@]4(O)C(O)=C3C(=O)C2=C1O IWVCMVBTMGNXQD-PXOLEDIWSA-N 0.000 description 1
- 235000019366 oxytetracycline Nutrition 0.000 description 1
- LSQZJLSUYDQPKJ-UHFFFAOYSA-N p-Hydroxyampicillin Natural products O=C1N2C(C(O)=O)C(C)(C)SC2C1NC(=O)C(N)C1=CC=C(O)C=C1 LSQZJLSUYDQPKJ-UHFFFAOYSA-N 0.000 description 1
- 238000012856 packing Methods 0.000 description 1
- 239000001814 pectin Substances 0.000 description 1
- 229920001277 pectin Polymers 0.000 description 1
- 235000010987 pectin Nutrition 0.000 description 1
- 238000005453 pelletization Methods 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 229940056360 penicillin g Drugs 0.000 description 1
- 150000002960 penicillins Chemical class 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 229940127557 pharmaceutical product Drugs 0.000 description 1
- LOXCOAXRHYDLOW-UHFFFAOYSA-N phenadoxone Chemical compound C=1C=CC=CC=1C(C=1C=CC=CC=1)(C(=O)CC)CC(C)N1CCOCC1 LOXCOAXRHYDLOW-UHFFFAOYSA-N 0.000 description 1
- 229950004540 phenadoxone Drugs 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 229960002292 piperacillin Drugs 0.000 description 1
- WCMIIGXFCMNQDS-IDYPWDAWSA-M piperacillin sodium Chemical compound [Na+].O=C1C(=O)N(CC)CCN1C(=O)N[C@H](C=1C=CC=CC=1)C(=O)N[C@@H]1C(=O)N2[C@@H](C([O-])=O)C(C)(C)S[C@@H]21 WCMIIGXFCMNQDS-IDYPWDAWSA-M 0.000 description 1
- 229960002797 pitavastatin Drugs 0.000 description 1
- VGYFMXBACGZSIL-MCBHFWOFSA-N pitavastatin Chemical compound OC(=O)C[C@H](O)C[C@H](O)\C=C\C1=C(C2CC2)N=C2C=CC=CC2=C1C1=CC=C(F)C=C1 VGYFMXBACGZSIL-MCBHFWOFSA-N 0.000 description 1
- 229940096701 plain lipid modifying drug hmg coa reductase inhibitors Drugs 0.000 description 1
- 235000013809 polyvinylpolypyrrolidone Nutrition 0.000 description 1
- 229920000523 polyvinylpolypyrrolidone Polymers 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 229940069328 povidone Drugs 0.000 description 1
- 229960002965 pravastatin Drugs 0.000 description 1
- TUZYXOIXSAXUGO-PZAWKZKUSA-N pravastatin Chemical compound C1=C[C@H](C)[C@H](CC[C@@H](O)C[C@@H](O)CC(O)=O)[C@H]2[C@@H](OC(=O)[C@@H](C)CC)C[C@H](O)C=C21 TUZYXOIXSAXUGO-PZAWKZKUSA-N 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- XJKQCILVUHXVIQ-UHFFFAOYSA-N properidine Chemical compound C=1C=CC=CC=1C1(C(=O)OC(C)C)CCN(C)CC1 XJKQCILVUHXVIQ-UHFFFAOYSA-N 0.000 description 1
- 229950004345 properidine Drugs 0.000 description 1
- DTPOQEUUHFQKSS-UHFFFAOYSA-N pyrrolo[2,1,5-cd]indolizine Chemical compound C1=CC(N23)=CC=C3C=CC2=C1 DTPOQEUUHFQKSS-UHFFFAOYSA-N 0.000 description 1
- 150000007660 quinolones Chemical class 0.000 description 1
- 229940052337 quinupristin/dalfopristin Drugs 0.000 description 1
- 229960003394 remifentanil Drugs 0.000 description 1
- 238000012827 research and development Methods 0.000 description 1
- 229960000672 rosuvastatin Drugs 0.000 description 1
- BPRHUIZQVSMCRT-VEUZHWNKSA-N rosuvastatin Chemical compound CC(C)C1=NC(N(C)S(C)(=O)=O)=NC(C=2C=CC(F)=CC=2)=C1\C=C\[C@@H](O)C[C@@H](O)CC(O)=O BPRHUIZQVSMCRT-VEUZHWNKSA-N 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 229940113147 shellac Drugs 0.000 description 1
- 239000004208 shellac Substances 0.000 description 1
- ZLGIYFNHBLSMPS-ATJNOEHPSA-N shellac Chemical compound OCCCCCC(O)C(O)CCCCCCCC(O)=O.C1C23[C@H](C(O)=O)CCC2[C@](C)(CO)[C@@H]1C(C(O)=O)=C[C@@H]3O ZLGIYFNHBLSMPS-ATJNOEHPSA-N 0.000 description 1
- 235000013874 shellac Nutrition 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 235000012239 silicon dioxide Nutrition 0.000 description 1
- 229960002855 simvastatin Drugs 0.000 description 1
- RYMZZMVNJRMUDD-HGQWONQESA-N simvastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)C(C)(C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 RYMZZMVNJRMUDD-HGQWONQESA-N 0.000 description 1
- 229940079832 sodium starch glycolate Drugs 0.000 description 1
- 229920003109 sodium starch glycolate Polymers 0.000 description 1
- 239000008109 sodium starch glycolate Substances 0.000 description 1
- 238000007711 solidification Methods 0.000 description 1
- 230000008023 solidification Effects 0.000 description 1
- 230000003068 static effect Effects 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 229960000468 sulfalene Drugs 0.000 description 1
- KXRZBTAEDBELFD-UHFFFAOYSA-N sulfamethopyrazine Chemical compound COC1=NC=CN=C1NS(=O)(=O)C1=CC=C(N)C=C1 KXRZBTAEDBELFD-UHFFFAOYSA-N 0.000 description 1
- 229940124530 sulfonamide Drugs 0.000 description 1
- 150000003456 sulfonamides Chemical class 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 229960001367 tartaric acid Drugs 0.000 description 1
- IWVCMVBTMGNXQD-UHFFFAOYSA-N terramycin dehydrate Natural products C1=CC=C2C(O)(C)C3C(O)C4C(N(C)C)C(O)=C(C(N)=O)C(=O)C4(O)C(O)=C3C(=O)C2=C1O IWVCMVBTMGNXQD-UHFFFAOYSA-N 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 229930101283 tetracycline Natural products 0.000 description 1
- 229940040944 tetracyclines Drugs 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 229960001402 tilidine Drugs 0.000 description 1
- 229960005053 tinidazole Drugs 0.000 description 1
- 229960000707 tobramycin Drugs 0.000 description 1
- NLVFBUXFDBBNBW-PBSUHMDJSA-N tobramycin Chemical compound N[C@@H]1C[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N NLVFBUXFDBBNBW-PBSUHMDJSA-N 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 229960002622 triacetin Drugs 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- IEDVJHCEMCRBQM-UHFFFAOYSA-N trimethoprim Chemical compound COC1=C(OC)C(OC)=CC(CC=2C(=NC(N)=NC=2)N)=C1 IEDVJHCEMCRBQM-UHFFFAOYSA-N 0.000 description 1
- 229960001082 trimethoprim Drugs 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 239000001993 wax Substances 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 239000000230 xanthan gum Substances 0.000 description 1
- 229920001285 xanthan gum Polymers 0.000 description 1
- 235000010493 xanthan gum Nutrition 0.000 description 1
- 229940082509 xanthan gum Drugs 0.000 description 1
- 239000005019 zein Substances 0.000 description 1
- 229940093612 zein Drugs 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1617—Organic compounds, e.g. phospholipids, fats
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/485—Morphinan derivatives, e.g. morphine, codeine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/141—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1635—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4841—Filling excipients; Inactive ingredients
- A61K9/4866—Organic macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
- A61P29/02—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID] without antiinflammatory effect
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B29—WORKING OF PLASTICS; WORKING OF SUBSTANCES IN A PLASTIC STATE IN GENERAL
- B29C—SHAPING OR JOINING OF PLASTICS; SHAPING OF MATERIAL IN A PLASTIC STATE, NOT OTHERWISE PROVIDED FOR; AFTER-TREATMENT OF THE SHAPED PRODUCTS, e.g. REPAIRING
- B29C48/00—Extrusion moulding, i.e. expressing the moulding material through a die or nozzle which imparts the desired form; Apparatus therefor
- B29C48/03—Extrusion moulding, i.e. expressing the moulding material through a die or nozzle which imparts the desired form; Apparatus therefor characterised by the shape of the extruded material at extrusion
- B29C48/04—Particle-shaped
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B29—WORKING OF PLASTICS; WORKING OF SUBSTANCES IN A PLASTIC STATE IN GENERAL
- B29C—SHAPING OR JOINING OF PLASTICS; SHAPING OF MATERIAL IN A PLASTIC STATE, NOT OTHERWISE PROVIDED FOR; AFTER-TREATMENT OF THE SHAPED PRODUCTS, e.g. REPAIRING
- B29C48/00—Extrusion moulding, i.e. expressing the moulding material through a die or nozzle which imparts the desired form; Apparatus therefor
- B29C48/25—Component parts, details or accessories; Auxiliary operations
- B29C48/36—Means for plasticising or homogenising the moulding material or forcing it through the nozzle or die
- B29C48/50—Details of extruders
- B29C48/505—Screws
- B29C48/63—Screws having sections without mixing elements or threads, i.e. having cylinder shaped sections
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/141—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers
- A61K9/145—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers with organic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/141—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers
- A61K9/146—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers with organic macromolecular compounds
Landscapes
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Life Sciences & Earth Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Mechanical Engineering (AREA)
- Emergency Medicine (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Pain & Pain Management (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Neurosurgery (AREA)
- Rheumatology (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
약학적 활성 성분을 함유하는 혼합물의 압출은 가소제로 작용하고 또한 활택제로도 작용하기에 충분한 양으로 가소성 부형제를 이용하여 달성 가능함으로써, 활택제를 포함해야 할 필요성이 없게 된다.
본 발명은 제어 방출형 특성을 가지면서, 활택제를 실질적으로 함유하지 않은 다중미립자를 제공한다.
본 발명은 제어 방출형 특성을 가지면서, 활택제를 실질적으로 함유하지 않은 다중미립자를 제공한다.
Description
본 발명은 압출된 약학적 제품, 특히 다중미립자의 제조 방법에 관한 것이고, 구체적으로 약학적 활성 성분의 제어된 방출성을 제공하는 압출된 제품, 특히 다중미립자에 관한 것이다.
제어 방출형 약학적 제제(preparation)를 생산하기 위한 압출 공정은 제조가 연속적 또는 반-연속적 기반으로 수행되어질 수 있게 할 뿐만 아니라, 제제를 제조하는 데 필요한 공정 단계들을 감소시키는 장점을 갖고 있는 것으로 인지된다. 활성 성분을 포함하는 연화된 혼합물의 이러한 압출은 대개 용융 압출(melt extrusion)이라 언급된다. 용융 압출 기술의 기본은 매트릭스 내에 용액 또는 분산 형태로 함침되어 있는 약물에 대한 결합제로 작용하는 열가소성 물질의 적용에 있다. 낮은 유리 전이 온도(Tg)를 갖는 열가소성 폴리머들이 용융 압출 공정에 바람직하다. 낮은 공정 온도는 열에 민감한 약물 및 다른 필수적인 부형제의 안정성의 측면에서 바람직하다. 저온에서 공정을 용이하게 하기 위해 가소제를 임의적으로 첨가하여 폴리머 유리 전이 온도를 감소시킬 수 있다.
적절한 폴리머 및 첨가제를 선택함으로써, 용융 압출 기술은 제어 방출형 제품에 있어서 물에 보통 정도 내지 매우 잘 녹는 약물에 대한 약물 방출을 지연하는 데 이용될 수 있을 뿐만 아니라, 물에 난용성인 약물의 용해도 및 이에 따른 생체이용효율 둘 다를 향상시키는 데도 이용될 수 있다.
조절된 약물 방출 특성을 가진 균일한 치수의 다중미립자는 이러한 용융 압출 기술에 의해 쉽게 제조될 수 있다.
예로, 국제공개공보 제96 14058호는 경구 투여에 적절한 서방형 약학적 압출물을 제조하는 용융 압출 방법을 개시한다. 그 방법은;
치료적 활성 성분을 (1) 알킬셀룰로스, 아크릴릭 및 메타크릴산 폴리머 및 코폴리머, 쉘락, 제인(zein), 수소화 피마자유, 수소화 식물유, 및 이들의 혼합물로 구성되는 군으로부터 선택되는 물질 및 (2) 천연 또는 합성 왁스, 지방산, 지방 알콜 및 이들의 혼합물로 구성되는 군으로부터 선택되는 가용성 담체와 함께 혼합하는 단계로서, 상기 지연 물질은 융점이 30 내지 200℃이고 치료적 활성 성분의 방출을 추가적으로 지연하는데 충분한 양으로 포함되어 있는 것인 단계;
상기 혼합물을 충분히 연화하여 압출시키기에 충분한 온도로 상기 혼합물을 가열하는 단계;
상기 가열된 혼합물을 직경 0.1 내지 3mm의 스트랜드(strand)로 압출하고, 상기 스트랜드를 냉각하며, 그리고 상기 스트랜드를 분할하여 길이 0.1 내지 5mm의 상기 압출물의 비-구형 다중미립자를 형성하는 단계; 및
상기 비-구형 다중미립자를 상기 치료적 활성 성분의 유효량을 함유하는 단위 용량(unit dose)으로 분할하는 단계로서, 상기 단위 용량은 약 8 내지 약 24시간의 기간 동안 상기 치료적 활성 성분의 서방성을 제공하는 것인 단계
를 포함한다.
이 방법을 설명하는 데 이용된 실시예에서는, 용융된 제형(formulation) 내의 활택제로서 스테아르산이 사용된다. 예를 들어 실시예 1 내지 6에서 제형은 20 중량%의 스테아르산을 함유하고, 제어 방출성 물질은 다양하게 에틸 셀룰로스 및 유드라짓(Eudragit) RS PO이다. 압출 온도는 85℃ 내지 105℃ 범위이다.
그러나, 열가소성 물질의 단점은 Tg가 너무 높아서 활성 성분 및/또는 부형제의 분해를 피하기에 충분히 낮은 온도에서는 공정을 수행할 수 없다는 점이다.
이 문제점을 경감하는 데 이용되는 한 해결책은 가소성 효과를 가지는 부형제 물질을 첨가하여 열가소성 폴리머의 Tg를 낮추는 것이다. 그 부형제는 폴리머의 내부 활택을 제공함으로써 응집력을 감소시키는 작용을 한다.
다중미립자를 발명의 명칭으로 하여 2004년 6월 27일자로 출원한 본 출원과 함께 동시 계류 중인 본 출원인의 PCT 특허출원 국제특허공개 제2005/000310호에서, 본 발명자들은 가소제, 특히 스테아릴 알콜, 및 활택제, 즉 스테아르산이, 비교적 높은 수준으로, 아크릴 코폴리머 및 활성 성분으로 옥시코돈 하이드로클로라이드와 함께 사용된 제형의 실시예를 기술하고 있다. 이러한 제형을 압출하는 데 요구되는 온도는 전형적으로 75℃ 내지 95℃의 범위이다. 이런 온도에서 압출물은 가속화된 저장 조건(40℃/75% 상대 습도) 하에서 저장 후에 좋은 화학적 안정성을 갖지만, 제형으로부터 활성 성분의 방출률은 시간 경과에 따라 변하는 것으로 시험관적 테스트에서 확인되었다. 초기에, 스테아르산은 상이한 pH의 완충액에서 방출률에 영향을 주는 것으로 발견되었고, 따라서 대체 활택제를 위한 연구가 진행되었다. 글리세릴 베헤네이트가 효과적인 것으로 확인되었다.
방출률의 불안정성을 결과적으로 야기할 수 있는 통상적인 성분이 배제될 수 있는 제형의 압출을 허용할 뿐만 아니라, 열에 민감하거나 또는 열에 불안정한 제형의 활성 성분 또는 제형의 다른 성분의 분해 위험을 야기하지 않는 상대적으로 저온 또는 중간 정도의 온도, 예를 들어, 75℃ 내지 95℃ 범위의 온도에서 제어 방출형 제형의 압출을 허용하는 새로운 공정 및 제형의 이용가능성에 대한 수요가 여전히 남아 있다.
이하 도면에 대해 참조된다;
도 1은 실시예에서 사용된 라이스트리쯔 마이크로 18 트윈 스크류 압출기의 스크류 트레인(train)중 하나에 대한 개략도이다
도 2 내지 5는 지시된 제품에 대한 시험관내 방출률이다.
도 1은 실시예에서 사용된 라이스트리쯔 마이크로 18 트윈 스크류 압출기의 스크류 트레인(train)중 하나에 대한 개략도이다
도 2 내지 5는 지시된 제품에 대한 시험관내 방출률이다.
발명의 개요
놀랍게도, 본 발명자들은 가소성 효과(plasticising effect)를 나타내는 부형제들이 또한 유용한 활택성(lubricating property)도 가질 수 있다는 것을 발견하게 되었다. 활택성은 압출기 내에서 매트릭스 물질의 압출 챔버 벽, 오리피스(orifice) 벽, 스크류의 표면 및 압출기 내의 다른 부재로의 점착을 감소시킨다. 이런 감소의 효과는 압출에 요구되는 토크(torque) 및 모터에 공급되는 전력을 감소시킨다.
보다 구체적으로, 국제특허공개 제2005/000310호로 귀결된 연구개발과 관련해서, 예기치 못할 정도로, 본 발명자들은 활택제 성분을 완전히 배제하고 가소제 농도를 증가시킴으로써, 향상된 pH 용출 안정성을 갖는 압출된 제형이 얻어진다는 점을 발견하게 되었다. 그러나, 일부 열 용출 불안정성이 관찰되었다. 가소제 농도의 감소는 열 용출 불안정성을 감소시켰지만 높은 공정 온도 및 증가된 토크에 대한 요건을 야기하였다. 놀랍게도, 본 발명자들은 가소제 농도를 적절히 조절함으로써, 우수한 열 용출 안정성 및 우수한 pH 용출 안정성을 갖는 압출된 제품을 생산하는 공정을 저온 내지 중간 정도의 온도에서 수행할 수 있다는 점을 발견하게 되었다.
본 발명에 따라, 본 발명자들은 다중미립자로도 불리는, 약학적 유효 성분(pharmaceutical active agent)을 함유하는 다수의 입자들을 제공한다. 이 약학적 유효 성분은 일반적으로 약학적으로 허용가능한 염의 형태이다. 다중미립자는 가소제에 추가로 활택제를 포함시킬 필요 없이 압출에 의해 만들어질 수 있다.
한 양태에서, 본 발명은 압출된 약학 조성물의 제조 방법으로서, 가소성 및 활택성을 제공하는 가소성 부형제를 선택하는 단계, 약학적 활성 성분 및 가소성 부형제를 포함하는 혼합물을 압출하는 단계를 포함하고, 상기 가소성 부형제는 혼합물에 대해 가소제로 작용하면서 혼합물에 대해 활택제로도 작용하기에 효과적인 양으로 사용하는 것인 제조 방법을 제공한다. 상기 혼합물은 혼합물을 활택하는 데 작용하는 추가적인 부형제를 실질적으로 함유하지 않는 것이 바람직하다.
따라서, 본 발명에 의하면, 약학적 활성 성분 및 활택성을 갖는 가소성 부형제를 함유하면서, 추가적인 활택제를 실질적으로 함유하지 않은 다중미립자를 제조하는 것이 가능하다.
본 발명의 다중미립자는 부수적으로 활택제로 작용하는 가소제를 이용한다. 따라서, 예를 들어, 다중미립자는 약학적 활성 성분, 암모늄 메타크릴레이트 코폴리머, 비-지배적 가소제(non-dominating plasticiser)인 가소제, 및 수 침투성 조절제를 함유한다. 본 발명자들이 의미하는 비-지배적 가소제란, 저온 내지 중간 온도에서 다이-헤드 오리피스를 통해 압출을 가능하게 하기 위해서 유리 전이 온도(Tg) 및 열가소성 용융 점도에 지배적으로 영향을 미치는 양으로 첨가되었을 때, 또한 증가된 토크 및 모터에 대한 전원공급에 의해 야기될 수 있는 압출기에 대한 불필요한 스트레스를 생성하는 것을 피하기에 충분한 활택성을 갖고 있는 가소제를 의미한다.
구체적인 양태에서, 본 발명의 다중미립자는, 바람직하게는 옥시코돈이며 일반적으로 약학적으로 허용가능한 염의 형태인 약학적 활성 성분, 암모늄 메타크릴레이트 코폴리머, 수 침투성 조절제 및 비-지배적 가소제를 함유하거나 이들로 필수적으로 구성된다.
수 침투성 조절제는 바람직하게는 pH-비의존성 수 침투성 조절제이다. 보다 구체적으로, 본 발명자들은 수 침투성 조절제의 용해도가 실질적으로 위 및 장 환경에서와 동일하다는 점을 취하고 있다.
본 발명의 다중미립자는 공정 중에 적어도 상당한 양의 활택을 제공하는 양으로, 지배적 또는 비-지배적 활택제를 함유하지 않는다. 본 발명자들이 의미하는 지배적 활택제(dominating lubricant)란 열가소성 폴리머의 Tg을 현저히 감소시키는 없이 열가소성 폴리머의 압출기 표면으로의 점착을 현저히 감소시키는 물질을 말한다. 비-지배적 활택제는 점착은 현저히 감소시키지만 Tg는 약간 정도로 감소시킨다.
본 발명의 다중미립자는 캅셀 중에 충진되어서 사용될 수 있다. 따라서, 본 발명은 1일 1회 또는 1일 2회 투여에 적합한 캅셀을 제공한다. 제어 방출형 제형의 다른 제형(dosage form)도 제공될 수 있다.
본 발명의 다른 양태에서, 본 발명의 제어 방출형 제형으로 환자를 치료하는 방법이 제공된다. 상기 방법은 본 발명의 제형, 바람직하게는 옥시코돈 또는 그의 염을 함유하는 본 발명의 제형을 적절한 요법, 특히 옥시코돈 진통 요법(analgesic therapy)를 필요로 하는 환자에게 투여하는 단계를 포함한다. 이와 관련된 양태에서, 본 발명은 환자에게 진통작용(analgeisa)을 제공하는 방법으로서, 본 발명의 다중미립자를 포함하는 제어 방출형 제형의 유효한 양을 투여하는 단계를 포함하고, 상기 약학적 활성 성분은 진통제인 것인 방법을 제공한다. 추가로, 본 발명은 진통작용을 환자에게 제공하는 방법을 위한 단위 용량의 제조에 있어서의 진통작용의 약학적 유효 성분의 용도로서, 상기 방법은 본 발명의 다중미립자를 포함하는 제어 방출형 제형의 유효량을 투여하는 단계를 포함하고, 상기 약학적 활성 성분은 진통제인 것인 용도를 제공한다.
다중미립자는 바람직하게 압출가능한 혼합물의 압출에 의해 얻어질 수 있다. 이러한 압출은, 용융 압출이라고도 불리는, 국제공개특허 제9614058호에 개시된 종류일 수 있다. 실제로, 폴리머는 연화하지만 실제로 용융하지는 않을 수 있다.
관련된 양태에서, 본 발명자들은 활성 성분, 바람직하게는 옥시코돈 또는 그의 염을 함유하는 다중미립자의 제조 방법을 제공하며, 상기 방법은 일반적으로 약학적으로 허용가능한 염의 형태인 활성 성분, 암모늄 메타크릴레이트 코폴리머, 비-지배적 가소제, 및 수 침투성 조절제로 된 압출가능한 혼합물의 압출 단계를 포함한다.
바람직한 본 발명의 방법은 활택제로도 작용하는 1 이상의 가소제를 이용하여 압출가능한 혼합물을 압출하여 다중미립자를 형성시키는 단계를 포함한다.
추가로, 본 발명은 열-민감성 약학적 활성 성분, 암모늄 메타크릴레이트 코폴리머, 가소제, 활택제 및 수 침투성 조절제를 포함하는 압출가능한 혼합물의 압출에 있어서 열 분해를 피하는 방법에 관한 것으로, 상기 방법은 활택제로도 작용하는 가소제의 충분한 양을 선택하는 단계를 포함한다. 관련된 양태에서, 본 발명은 열에 민감한 약학적 활성 성분을 포함하는 압출가능한 혼합물을 압출하는 방법을 제공하며, 상기 방법은 활택제로도 작용하는 가소제의 충분한 양을 이용하는 것을 포함하며, 응집력 및 점착력을 충분히 감소시킴으로써 고온에서 압출할 필요를 필요성이 없다.
발명에 관한 상세한 설명
본 발명의 바람직한 다중미립자는 (a) 활성 성분, (b) 수-불용성 암모늄 메타크릴레이트 코폴리머, (c) 비-지배적 가소제, 및 (d) 수 침투성 조절제를 함유한다.
본 발명의 제형 및 방법에 사용될 수 있는 활성 성분은 약 95 내지 100℃ 이상 온도에서 열에 민감한 것들이 바람직하다. 이러한 활성 성분에는 예를 들어 오피오이드(opioid), HMGCoA 환원효소 저해제(스타틴 계열) 및 항생제가 포함된다.
후보물질 오피오이드 또는 오피에이트에는 알페타닐, 알릴프로딘, 알파프로딘, 아닐레리딘, 벤질몰핀, 벤지트라미드, 부프레놀핀, 부톨파놀, 클로니타젠, 코데인, 싸이크라조신, 데스몰핀, 덱스트로모라미드, 데조신, 디아세틸몰핀, 디암프로미드, 디히드로코데인, 디히드로몰핀, 디메녹사돌, 디메펩타놀, 디메틸티암부텐, 디옥사페틸 부티레이트, 디피파논, 엡타조신, 에토헵타진, 에틸메틸티암부텐, 에틸몰핀, 에토니타젠, 펜타닐, 히드로코돈, 히드로몰폰, 히드록시페티딘, 이소메타돈, 케토베미돈, 레보파놀, 레보펜아실몰핀, 로펜타닐, 메페리딘, 멥타지놀, 메타조신, 메타돈, 메토폰, 몰핀, 몰핀-6-글루쿠로나이드, 미로핀, 날부핀, 날세인, 니코몰핀, 노르레보파놀, 노르메타돈, 노르몰핀, 노르피파논, 노르옥시몰폰, 오피움, 옥시코돈, 옥시몰폰, 파파베레툼, 펜타조신, 페나독손, 페노몰판, 페나조신, 페노페리딘, 피미노딘, 피리트라미드, 프로펩타진, 프로메돌, 프로페리딘, 프로피암, 프로폭시펜, 레미펜타닐, 수페타닐, 틸리딘, 트라마돌, 및 이들의 약학적으로 허용가능한 염이 포함된다.
바람직한 오피오이드/오피에이트는 부프레놀핀, 코데인, 디히드로코데인, 디히드로몰핀, 펜타닐, 히드로코돈, 히드로몰폰, 몰핀, 옥시코돈, 옥시몰폰 및 트라마돌, 및 이들의 약학적으로 허용가능한 염이다.
후보물질 히드록시메틸글루타릴 조효소 A 환원효소 억제형에는 아토르바스타틴, 6-[4,4-비스(플루오로페닐)-3-(l-메틸-lH-테트라졸-5-일)-1,3-부타디에닐]-3,4,5,6-테트라히드로-4-히드록시-2H-피란-2-온, 3-(12-카르복시-12-메틸트리데실)-3-히드록시글루타르산, 세리바스타틴, 달바스타틴, 3,5-디히드록시-9,9-디페닐-6,8-노나디에노산 메틸 에스테르, 플루인도스타틴, 플루바스타틴, 6-[2-(4'-플루오로-3,3',5-트리메틸-2-바이페닐릴}비닐]~4-히드록시-2-옥소테트라히드로피란, 6-[2-[4-(4-플루오로페닐)-2-이소프로필-6-페닐-3-피리딜]비닐]-3,4,5,6-테트라히드로-4-히드록시-2H-피란-2-온, 로바스타틴, 메바스타틴, 메비놀린산, 모나콜린 J, 모나콜린 L, 피타바스타틴, 프라바스타틴, 로수바스타틴, 심바스타틴, 및 이들의 약학적으로 허용가능한 염이 포함된다.
후보물질 항생제에는 아미카신, 겐타마이신, 네오마이신, 네틸마이신, 토브라마이신 등의 아미노글리코사이드계; 이미페넴, 메로페넴 등의 카바페넴계; 세파클러, 세파드록실, 세파만돌, 세픽심, 세포탁심, 세프피롬, 페프포독심, 세프프로질, 세프타지딤, 세프트리악손, 세퓨록심, 세팔렉신, 세파졸린, 세프라딘 등의 세팔로스포린계; 세폭시틴 등의 세파마이신계; 트리메토프림 등의 엽산 억제형; 클린다마이신 같은 린코사미드계; 아지스로마이신, 클래리스로마이신, 에리스로마이신, 텔리스로마이신 등의 마크롤라이드계: 아즈트레오남 등의 모노박탐계; 메트로니다졸, 티니다졸 등의 니트로이미다졸계; 아목시실린, 암피실린, 피페라실린, 페니실린 G, 플루클록사실린, 티카실린 등의 페니실린계; 시프로플록사신, 레보플록사신, 날리딕식 산, 오플록사신 등의 퀴놀론계; 퀴누프리스틴/달포프리스틴 등의 스트렙토그라민계; 설파메토피라진 등의 설폰아미드계; 및 데메클로사이클린, 독시사이클린, 리메사이클린, 미노사이클린, 옥시테트라사이클린, 테트라사이클린, 클로르테트라사이클린 등의 테트라사이클린계; 및 이들의 약학적으로 허용가능한 염이 포함된다.
바람직한 활성 성분은 옥시코돈으로서, 유리 염기 또는 그의 약학적으로 허용가능한 염, 특히 하이드로클로라이드 염이다. 옥시코돈에 대한 추가적인 정보는, 본 명세서에 참고 인용되어 있는, 다중미립자라는 발명의 명칭으로 본 출원과 함께 동시 계류 중인 본 출원인의 PCT 특허출원 국제특허공개 제2005/000310를 참고한다. 다른 바람직한 활성 성분은 옥시몰폰으로서, 유리 염기 또는 그의 약학적으로 허용가능한 염, 특히 하이드로클로라이드 염이다.
수-불용성 암모니오 메타크릴레이트 코폴리머라고도 불리는, 수-불용성 암모늄 메타크릴레이트 코폴리머는 바람직하게는 미세 분말로 분쇄된 유드라짓 RS PO, 또는 유드라짓 RS 100이다. 그 코폴리머는 하기 특성들:
ㆍ불용성 내지 수난용성,
ㆍ낮은 수 침투성,
ㆍ다양한 약물 및 다른 첨가제들과의 혼화성,
ㆍ분해없이 중간 온도에서 또는 적절한 가소제 존재하에 낮은 온도에서 압출가능성,
ㆍ계획된 저장 기간 및 조건에서 안정성,
ㆍ열 안정성
을 제공한다.
특히, 유드라짓 RS PO는 매트릭스 내에 함침된 옥시코돈의 방출을 현저히 지연할 수 있는 낮은 수 침투성의 열가소성 코폴리머이다. 이는 매트릭스 제형에 대한 낮은 침투성을 갖는 pH 비의존적 폴리머 분말로서 설명된다. 그 코폴리머는 침투성을 제어하기 위해 낮은 함량의 4급 암모늄 기를 함유하고 평균 분자량이 약 150,000인 아크릴과 메타크릴산 에스테르의 코폴리머이다.
비-지배적 가소제는 불용성 암모늄 메타크릴레이트 코폴리머를 연화해서 코폴리머를 압출하는 것을 보다 용이하게 하는 작용을 한다. 이 경우, 전형적인 가소제는 불용성 암모늄 메타크릴레이트 코폴리머와 혼화가능하여 폴리머의 인장강도 감소, 연화 온도 저하 및 유리 전이 온도(Tg)의 감소를 생성하게 된다. 그 가소제는 폴리머의 내부적 활택을 제공함으로써 응집을 감소시키는 작용을 한다. 가소제는 세틸 알콜, 스테아릴 알콜 및 세토스테아릴 알콜 같은 수 불용성 고체; 솔비톨 및 자당, 그리고 고 분자량 폴리에틸렌 글리콜 같은 수용성 고체; 디부틸 세바케이트 및 트리부틸 시트레이트 같은 수 불용성 액체; 및 트리에틸 시트레이트, 프로필렌 글리콜 및 저 분자량 폴리에틸렌 글리콜 같은 수용성 액체로부터 일반적으로 선택된다. 실온에서 고체인 가소제가 바람직하다. 스테아릴 알콜이 바람직한 가소제이다. 다른 바람직한 가소제는 PEG 6000 같이 바람직하게 4000 내지 10000 범위의 분자량을 갖는 고 분자량 폴리에틸렌 글리콜이다.
더 일반적으로, 본 발명에 따라 사용될 수 있는 다른 가소제에는 언급되는 전형적인 가소제 중 하나와 유사한 유사체일 수 있는 가소제가 포함한다. 따라서 그러한 다른 가소제는 세틸 알콜, 스테아릴 알콜, 세토스테아릴 알콜, 솔비톨, 자당, PEG 6000 같이 바람직하게는 4000 내지 10000 범위의 분자량을 갖는 고 분자량 폴리에틸렌 글리콜, 디부틸 세바케이트, 트리부틸 시트레이트, 트리에틸 시트레이트, 프로필렌 글리콜 및 저 분자량 폴리에틸렌 글리콜로부터 선택되는 물질의 가소성 및 활택성에 근접한 가소성 및 활택성을 갖는다. 예를 들어, 적절한 다른 가소제는 세틸 알콜, 스테아릴 알콜, 세토스테아릴 알콜, 솔비톨, 자당, PEG 6000 같이 바람직하게는 4000 내지 10000 범위내의 분자량을 갖는 고 분자량 폴리에틸렌 글리콜, 디부틸 세바케이트, 트리부틸 시트레이트, 트리에틸 시트레이트, 프로필렌 글리콜, 저 분자량 폴리에틸렌 글리콜의 가소성 및 활택성에 근접한 가소성 및 활택성을 갖는다. 스테아릴 알콜 또는 PEG 6000에 근접하는 것이 바람직하다.
이와 같이 전형적인 가소제의 가소성 및 활택성에 근접한 가소성 및 활택성을 지닌 그 다른 가소제는 다음의 기준들에 의해 확인할 수 있다:
(a) 유드라짓 RS PO의 주어진 농도에서 시차주사열량계에 의해 가소성 효과가 테스트 되었을 때, 그 다른 가소제는 전형적인 가소제의 동일 농도에 의해 제공되는 Tg 감소의 ± 50% 내에서 유드라짓 폴리머의 Tg (℃로 측정)를 감소시킨다.
(b) 유드라짓 RS PO의 주어진 농도에서 IKA® MKD 0,6 - H 60 고성능 계측 니더(high-performance measuring kneader)에서 활택 효과가 테스트 되었을 때, 그 다른 가소제는 전형적인 가소제의 동일 농도에 의해 제공되는 토크 감소의 ± 50% 내에서 토크(Nm으로 측정됨)를 감소시킨다(여기서 Tg 및 토크의 수치는 3회 테스트 결과의 평균치이다).
(a)에서 감소는 전형적인 가소제에 의해 제공되는 감소의 ± 25% 이내인 것이 바람직하다.
(b)에서 감소는 전형적인 가소제에 의해 제공되는 감소의 ± 25% 이내인 것이 바람직하다.
따라서, 적합한 다른 가소제는 테스트 (a)의 가소성 효과 및 테스트 (b)의 활택 효과를 주는 것이 사용될 수 있다.
수 침투성 조절제는 제형으로부터 약물의 분비를 조절한다. 전형적으로 수 침투성 조절제는 약물 방출, 특히 특히 용출의 후반 단계(later stage)에서 약물 방출을 향상시키는 작용을 하고, 한편 본 발명자들은 또한 수 침투성 조절제가 일부 실제 예에서 서방성에 중요한 역할을 할 수 있다는 점도 고려한 것이다. 압출된 다중미립자의 수 침투성을 조절하기 위해 사용되는 성분의 예에는 불용성 친수성 위킹제(wicking agent), 수화되어 겔을 형성함으로써 수 이동성을 조절하는 겔화제, PEG 6000 같은 고분자량 폴리에틸렌 글리콜, 또는 미세한 분말로 분쇄된 유드라짓 RL PO 또는 유드라짓 RL 100 같이 암모니오 메타크릴레이트 코폴리머로도 언급되는 수 침투성 암모늄 메타크릴레이트 코폴리머가 포함된다. 유드라짓 RL PO는 매트릭스 제형에 있어 고 침투성 pH 비의존성 폴리머 분말로 개시된다. 그 조절제는 침투성을 제공하는 4급 암모늄 기의 함량을 갖고 있으며 평균 분자량이 약 150,000인 아크릴과 메타크릴산 에스테르의 코폴리머이다.
예를 들어, 미세결정 셀룰로스, 고 점도의 히드록시프로필메틸셀룰로스 및 고점도 폴리(에틸렌옥사이드) 같은 고 분자량 하이드로겔, 및 수 침투성 암모늄 메타크릴레이트 코폴리머는 활성 성분의 총 방출을 증가시키는 데 사용될 수 있다. 이러한 최종 관점에서, 수 침투성을 조절하기 위한 성분 (d)으로 사용된 암모늄 메타크릴레이트 코폴리머는 성분 (b)로 사용된 수 불용성 암모늄 메타크릴레이트 코폴리머와 동일한 코폴리머가 아니며, 4급 암모늄 기에 의한 상이한 치환 정도에 기인하여 보다 우수한 수 침투성을 갖는다.
*미세결정 셀룰로스는 물 확산 및 교환을 향상시킴으로써 약물 방출을 증가시킨다. 미세결정 셀룰로스는 불용성이지만 친수성인 위킹제로 작용한다. 미세결정 셀룰로스의 대체물질은 크로스카멜로스 소듐, 크로스포비돈 또는 소듐 스타치 글리콜레이트이다.
고 분자량급 (고 점성) 히드록시프로필메틸셀룰로스(HPMC)는 초기에 수 이동성을 제어하기 위해 수화되어 고점성의 겔을 형성한다. 이어서, 수화된 겔은 점차적으로 시간에 걸쳐 용출 및/또는 침식하여 다공성이고 고 침투성인 구조를 남긴다. 이 가설에 의하면, 고 점성 HPMC는 보다 초반기 시점에는 약물 방출을 현저하게 증가시키지 않지만 후반기 시점에서는 방출을 증가시키는 것으로 간주된다. 다른 겔화제로는 폴리에틸렌옥사이드, 펙틴, 로커스트 빈 검 또는 잔탄 검을 비롯한 후보물질이 있다.
유드라짓 RL PO는 대단히 높은 수 침투성 유사체이며, 방출률 및 총 약물 방출을 현저하게 향상시킬 수 있다.
성분 (a) 내지 (d)의 적절한 백분률 양은 4가지 성분의 총 중량을 기초로 하여, 하기 표에 주어진다.
또한, 일련의 미리 결정된 명세사항 내에서 다른 첨가제도 사용하여 다중미립자를 생성시킬 수 있다. 증량제(bulking agent), 예를 들어 락토스 및 칼슘 포스페이트는 널리 사용되는 약학적 부형제인 것으로, 본 발명에서 방출률 및/또는 총 방출을 조절하기 위해 사용될 수 있다. 방출률을 조절하고/하거나 총 방출을 증가시키기 위해서는 다른 방출 조절제도 고려할 수 있다. 또한, 부틸레이티드 히드록시톨루엔 같은 항산화제도 사용하여 더 높은 제조 온도에서 열에 민감하거나 또는 열에 불안정한 활성 성분 또는 부형제의 화학적 분해를 방지하거나 감소시킴으로써 본 발명의 제형을 안정화시킬 수 있다.
본 발명의 다중미립자는 공정 중에 현저한 양 또는 유용한 양의 활택을 제공하기에 충분한 지배적 활택제 또는 비-지배적 활택제의 양을 포함하지 않는다. 전형적인 지배적 또는 비-지배적 활택제는 스테아르산, 글리세릴 베헤네이트, 마그네슘 스테아레이트, 칼슘 스테아레이트, 탈크 또는 실리콘 다이옥사이드 (용융 실리카) 같은 고체이다.
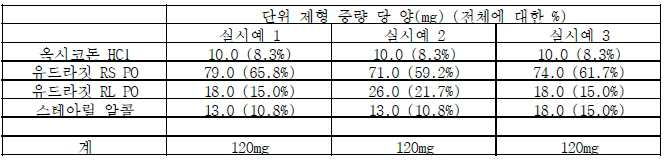
특히 바람직한 제형은 7.5 내지 9% w/w, 바람직하게는 약 8.3% w/w의 옥시코돈 하이드로클로라이드; 55 내지 70% w/w, 바람직하게는 약 61.7% w/w의 유드라짓 RS PO; 10 내지 20% w/w, 바람직하게는 약 15% w/w의 유드라짓 RL PO; 및 10 내지 20% w/w, 바람직하게는 약 15% w/w의 스테아릴 알콜을 포함한다.
더욱이, 크기 1 캅셀을 이용하여 40mg 및 80 mg 농도 1일 2회 복용 캅셀을 제공하기 위한 요건은 약물 로드의 추가적인 재할당을 유발하는 데, 이와 관련하여 본 발명자들은 하기 표에서, 4가지 성분의 총 중량을 기초로 한, 주어진 성분 (a) 내지 (d)에 적절한 백분율 양을 확인하여 하기 제시한다.
본 발명에 따라, 예를 들어, 8.3% w/w 옥시코돈 하이드로클로로아드를 함유하는 바람직한 제형은, 25℃/60% 상대습도(RH), 또는 30℃/65% RH에서 3개월까지 저장될 때, 본 명세서에 개시된 방법에 의해 테스트 되었을 때 용출 변화를 나타내지 않거나 무시해도 좋을 정도로 나타낸다. 40℃/75% RH에서 테스트될 때, 1개월 저장 후에는 예를 들어 3 내지 5% 감소로 경미한 용출 변화가 관찰되나, 지속적으로 저장하는 동안에는 추가적인 변화가 없다.
본 발명의 방법에서 성분들이 혼합되고 압출된다. 이런 절차에 관한 상세한설명은 본 명세서에 그 전체 내용이 특별히 참고 인용되어 있는 국제특허공개 제9614058에 제시되어 있다.
본 발명에서는, 공회전(co-roating) 또는 역회전(counter-rotating) 스크류를 구비할 수 있는 트윈 스크류 압출기를 사용하는 것이 바람직하다. 기본적으로, 혼합물은 보통 상대적인 저온, 예를 들어 10-20 ℃에서, 공급기(feeder)에 의해 배럴의 제 1 세그먼트 내로 분말로서 공급하여 고온 배럴에 대한 일정한 분말 유동을 보장한다. 그 공급기는 압출기에 혼합물의 균일한 흐름을 제공한다. 불규칙적이고 가변적인 공급 속도가 밀도 및 다공성 같은 다양한 물리적 성질을 지닌 다중미립자를 생성할 수 있기 때문에, 그러한 일정한 공급이 바람직하다.
바람직한 압출기는 혼합물의 운반, 혼합, 압축, 가열, 연화하는 작업을 수행하기 위해서 트윈 스크류, 바람직하게는 역회전 스크류를 구비하도록 디자인된다. 혼합물 성분 및 압출 조건의 선택에 따라, 혼합물은 연화될 뿐만 아니라 용융될 수 있다. 이 압출 공정의 상당한 부분을 수행하는 스크류는 다양한 스크류 부재 및 니더 부재로부터 선택된 상이한 더 작은 부재들로 구성된다. 스크류 부재 및 경우에 따라서는 니더 부재의 타입, 길이 및 배열을 변화시킴으로써 혼합 및 반죽(kneading) 시간을 유의적으로 변경시킬 수 있다. 짧은 체류 시간 및 중간 정도 내지 낮은 정도의 전단력은 안전한 공정 및 심지어는 열 에민감성 약물에 대해서도 안정한 제품을 제공할 수 있다. 입수 가능한 압출기의 예로는 라이스트리쯔(Leistritz), 브라벤더(Brabender), 랜드캐슬(Randcastle) 및 쿠리모토사(Kurimoto Co. Ltd.)에 의해 제조된 것, 예를 들어 라이스트리쯔(Leistritz) 마이크로 18 머신을 비롯한 것들이 포함된다.
스크류 회전 속도는 생산된 다중미립자의 품질에 일부 기여할 수 있다. 혼합물 공급 속도의 적절한 보정 없는 고 회전 속도는 가변적인 약물 방출을 지닌 고 다공성 다중미립자를 생산할 수 있다. 반면, 서행 스크류 회전은 불필요한 긴 체류 시간을 야기한다. 압출기 배럴에 연결된 진공은 연화된 혼합물 내에 포획된 공기를 제거하는데 바람직하며, 따라서 조밀한 저다공성 다중미립자를 생성하게 된다.
압출 헤드는 전형적으로 고정 직경의 다중 스트랜드를 제공하도록 디자인된다. 오리피스의 수, 형상 및 직경은 미리 결정된 명세사항에 적합하도록 변경될 수 있다.
스크류 속도 이외에도, 다른 주요한 영향력 있는 파라미터는 스크류 토크, 개별 배럴 온도, 및 압출 헤드 압력 및 온도이다.
본 발명의 한가지 절단 절차에 따라, 압출 스트랜드는 컨베이어상의 다이-헤드로부터 운반된다. 스트랜드 직경은 혼합물 공급 속도, 스크류 속도, 배럴 온도, 다이-헤드 디자인 및 오리피스 직경, 운반 속도 및 닙 롤 속도에 영향을 받는다. 운반 공정은 예를 들어 1.0 mm와 같은 소정의 직경을 모니터링하는 레이저 게이지 또는 다른 계측 장치로 압출된 스트랜드를 운반하는 것이 적합하다. 이러한 운반 공정 중에 스트랜드는 서서히 냉각되지만, 본질적으로 유연성을 유지한다. 유연한 스트랜드는 레이저 계측 장치 위에서, 펠레타이저 공급 닙 롤 사이에서, 그리고 및펠레타이저로의 유입 중에 그 일체성을 유지한다. 제형에 따라, 급속 냉각된 스트랜드는 닙 롤 및 펠레타이저를 통과하는 동안 그 일체성을 잃고 비균일한 형상 및 불규칙한 크기의 다중미립자로 분쇄될 수 있다.
그 스트랜드는 닙 롤에 의해 펠레타이저로 공급된다. 펠레타이저는, 예를 들어 회전식 나이프 커터를 사용하여 공급 스트랜드를 미리 결정된 길이, 예컨대 1.0 mm로 절단한다. 스트랜드의 공급 속도 및 펠레타이저 커터 속도는 다중미립자의 길이를 결정한다.
전체적으로, 분말 공급기, 압출기, 컨베이어, 레이저 게이지 및 펠레타이저 간의 조정작용/상호작용이 최종 다중미립자 제품의 양, 품질 및 재현성에 영향을 미치는 중요한 파라미터이다.
압출된 스트랜드가 다이-헤드로부터 운반되는 상기 절단 절차에 의해 제조된 다중미립자는 전형적으로 실린더형을 취한다.
다른 바람직한 절단 절차에서는, 압출 혼합물이 다이 플레이트의 오리피스로부터 여전히 연화된 상태로 압력하에 빠져 나올 때, 커터가 상기 혼합물을 절단한다. 커터는 다이-헤드 표면을 급히 지나 오리피스를 통과하는 하나 이상의 블레이드를 구비한 회전식 커터인 것이 적합하다. 두개가 정반대로 배치된 블레이드가 바람직하다. 이상적으로, 압출 오리피스의 내부 및 외부 표면 경계는 비점착성 물질, 예를 들어 폴리테트라플루오로에틸렌(PTFE)으로 코팅되어 있다. 절단된 압출물 입자가 팽창 및 냉각됨에 따라, 입자는 둥근 표면을 형성하려는 경향이 있다. 다이-헤드 압출 압력, 압출 속도, 다이-헤드 디자인 및 오리피스 직경 및 오리피스 수 및 커터 블레이드의 속도를 적절히 조정함으로써, 구형 또는 거의 구형에 가까운 다중미립자가 얻어지도록 하는 것이 가능하다. 대안으로, 원한다면, 이러한 공정은 로드형을 생산하도록 조작할 수도 있다. 한 구체예에서는, 기류를 다이-헤드 표면으로 향하게 하는데, 그 공기는 감소된 온도로 존재하여 압출물을 냉각하고 고형화를 가속함으로써 점착성을 감소시킨다.
상기 방법에 의해 제조된 구형 다중미립자는 하기의 다수의 가능한 이점들:
보다 향상된 배치(batch) 대 배치(batch) 재현성,
요구되는 보다 용이한 코팅 및 보다 낮은 코팅 중량,
보다 향상된 캅셀 충진 및 보다 높은 수율,
상승된 저장 온도에서 보다 높아진 안정성,
보다 향상된 템퍼 내성,
줄어든 하류 공정 처리,
스트랜드를 운반 및 펠렛화하는 동안 야기되는 일부 문제, 예컨대 상이한 길이 펠렛으로 분쇄되는 스트랜드 및 정전기의 감소 또는 제거
를 제공한다.
다중미립자는, 각 개별 단위 용량이 진통작용을 포유동물, 바람직하게는 인간 환자에게 제공하기에 충분한 옥시코돈 용량을 포함하도록, 단위 용량으로 분할될 수 있다. 옥시코돈의 적합한 용량은 5 내지 400 mg, 특히 5 mg, 10 mg, 20 mg, 40 mg, 80 mg, 120 mg, 또는 160 mg 단위 용량이다. 이와 관련하여, 단위 용량은 환자의 통증을 경감시키고/시키거나 진통작용을 가져오기에 유효한 양의 치료적 활성 성분을 함유한다. 환자에 투여되는 옥시코돈의 투여량은 투여되는 임의의 다른 치료제의 성질과 함께 환자의 체중, 통증 중증도, 대사 상태, 및 내성을 비롯한 다수의 인자에 따라 달라진다.
바람직한 일 구체예에서, 다중미립자는 각각 단위 용량을 함유하는 경질 젤라틴 캅셀에 충진된다. 캅셀내 충진 중량은 바람직하게는 80 내지 500 mg, 더 바람직하게는 120 내지 500 mg이다. 본 발명의 한 변형에서, 다중미립자의 단위 용량은, 다른 고체 약학적 제형 내로 혼입될 수 있는데, 예를 들어 압축 또는 성형을 이용하여 정제 내로 혼입되거나, 샤세트(sachet) 내로 충진되거나, 또는 압출 생성물을 좌약 형태로 성형될 수 있다.
본 발명에 따른 성분을 선택하면, 본 발명의 바람직한 양태에서, 그리고 하기 구체예에서 설명된 바와 같이 옥시콘틴® 타블릿의 시험관내, 바람직하게는 생체내 방출 특성을 모방하는 옥시코돈 하이드로클로라이드를 함유하는 다중미립자 및 이어서 캅셀을 제조하는 것이 가능하게 된다. 특히, 그 조합은 용출의 후반부(later hours)에서 활성 성분의 높은 총 방출을 유지하는 동시에, 전반부 (early hours)의 적절한 초기 방출을 가능하게 한다. 바람직한 형태에서 이러한 제형은 가속 조건 하에서 저장 후 시험관내 테스트에서 우수한 열적 화학 안정성 및 열적 물리 안정성/용출 속도 안정성을 나타낸다.
옥시코돈 하이드로클로라이드가 옥시코돈의 바람직한 형태이지만, 다른 약학적으로 허용가능한 염이 사용될 수 있다.
옥시코돈은 중간 정도 내지 심한 정도 통증의 치료에 지시된다. 제어 방출형 옥시코돈 제품은 장기간 동안 지속적이고 24시간 내내 진통제가 공급되는 것이 필요할 때 통증 조절을 가능하게 한다.
옥시코돈의 제어 방출성을 제공하는 옥시코돈 제형이 예를 들어 국제특허공개 제9310765호에 기술되어 있다. 과립화 절차가 전형적으로 이용된다. 실시예 3에서, 10 mg의 옥시코돈 하이드로클로라이드를 함유하는 정제는 옥시코돈 하이드로클로라이드, 락토스, 포비돈, 유드라짓 RS 30 D, 트리아세틴, 스테아릴 알콜, 탈크 및 마그네슘 스테아레이트로 된 혼합물로부터 제조한다. 실시예 4에서는 동일한 성분들을 조정된 양으로 사용하여 20 mg의 옥시코돈 하이드로클로라이드를 함유하는 정제를 제조한다. 결과적인 제품은 상이한 약동학적 및 약력학적 특성을 나타낸다.
예시적으로, 국제특허공개 제9310765호에 제시된 10 mg 및 20 mg의 옥시코돈 정제에 대한 시험관내 방출률은 다음과 같다:
이 종류 및 상기 방출률을 갖는 정제는 상업적 제품을 위한 기초를 형성한다. 제어 방출형 옥시코돈 정제는 옥시콘틴(등록 상표) 정제로 입수 가능하며, 이는 12시간에 걸친 옥시코돈의 제어된 전달을 제공하기 위해 디자인되어 있다.
옥시코돈은 경구 생체내이용률 60% 내지 87%로 옥시콘틴® 정제로부터 잘 흡수된다. 즉시 방출형 경구 제형에 대한 옥시콘틴® 정제의 상대적인 경구 생체내이용률은 100%이다. 약동학 연구에서 정상 지원자에서 반복 투여시, 정상상태는 24 내지 36시간 내에 도달되었다.
하기 데이터에 의해 나타낸 바와 같이, 최고 혈장 농도(Cmax) 및 흡수도(생체이용효율) 둘다, 그리고 AUC에 관해서는 10 mg, 20 mg, 40 mg, 80 mg 및 160 mg 정제 농도에서 용량 비율이 확립되었다.
평균[계수 변동 %]
옥시코돈은 광범위하게 대사되어 결합된(conjugated) 대사산물 및 비-결합된(non-conjugated) 대사산물 둘 다로서 주로 소변으로 소실된다. 옥시콘틴® 정제의 투여 후 옥시코돈의 겉보기 소실 반감기는 속방형 옥시코돈의 경우 3.2시간인데 비해 4.5시간이었다.
비경구 용량에 비하면 옥시코돈 경구 용량의 약 60% 내지 87%가 중앙 컴파트먼트에 도달한다. 이와 같이 높은 경구 생체이용효율은 낮은 전-전신성(pre-systemic) 및/또는 초회-통과 대사에 기인한다. 정상 지원자에서, 속방형 경구 옥시코돈에 대한 흡수 반감기는 0.4 시간이다. 이에 반해, 옥시콘틴® 정제는 0.6 및 6.9 시간의 두 겉보기 흡수 반감기를 갖는 2상의 흡수 패턴을 나타내며, 이는 정제로부터 옥시코돈이 초기 방출되고 이어서 장기간 방출된다는 것을 의미한다.
본 발명의 바람직한 양태에 따라, 본 발명자들은 옥시코돈 다중미립자로도 지칭되는 다수의 옥시코돈 입자를 제공한다.
한 양태에서, 본 발명자들은 옥시코돈의 높은 초기 방출 및 옥시코돈의 총 방출을 갖는 옥시코돈 다중미립자를 제공한다. 방출 특성은 예를 들어 인간 위액 또는 인간 장 환경을 모방한 제어된 시험관내 조건하에서 옥시코돈의 방출로서 나타내어질 수 있다. 생리학적 pH, 예를 들어 pH 약 1.2 또는 약 6.8에서의 방출이 테스트될 수 있다. 테스트 절차는 또한 몸을 통과하는 동안 위에서 장으로의 변화를 반영하도록 디자인될 수 있다.
특히, 본 발명자들은 수 침투성 조절제를 포함시키는 것이 옥시콘틴® 정제와 어느 정도 생물학적 동등성(bioequivalence)을 나타내는 옥시코돈의 다중미립자의 압출을 허용할 수 있다는 점을 발견하게 되었다. 다중미립자는 옥시콘틴® 정제의 것에 근접한 약동학적 및/또는 약력학적 성질을 가질 수 있다. 특히, 다중미립자는 옥시콘틴® 정제의 것에 근접한 시험관내 방출률을 가질 수 있다.
관련된 양태에서, 본 발명자들은 일반적으로 약학적으로 허용되는 염 형태의 옥시코돈, 암모늄 메타크릴레이트 코폴리머, 활택제로도 작용하는 가소제, 및 수 침투성 조절제를 함유하는 옥시코돈 다중미립자를 제공한다
옥시코돈 다중미립자를 이용한 제형은 바람직하게는 단위 제형이며, 바람직하게는 옥시콘틴® 정제와 다소 생물학적 동등성을 나타낸다. 제형은 옥시콘틴® 정제의 것에 근접한 약동학적 및/또는 약력학적 성질을 가질 수 있다. 특히, 제형은 옥시콘틴® 정제의 것과 근접한 시험관내 방출률을 가질 수 있다.
본 발명의 옥시코돈 다중미립자는 옥시콘틴® 정제의 것에 근접한 시험관내 방출률을 제공하는 것이 바람직하다. 옥시콘틴® 정제의 방출률은 초기 방출이 높고 총 방출이 높다는 점에서 주목할만하다. 옥시코돈의 방출은 약 1 내지 약 7의 pH 범위에서 실질적으로 pH-비의존성인 것이 바람직하다. 이 경우, 실질적으로 pH-비의존성 방출이란 주어진 제형에 있어서 pH 6.8의 모의 장액에서 임의의 주어진 시점에 테스트 될 때 제형 중 원래 양의 옥시코돈에 대한 백분률로 방출된 옥시코돈의 양이 pH 1.2의 모의 위액에서 테스트 될 때 제형 중 원래 양의 옥시코돈에 기초한 방출된 옥시코돈의 백분율 양과 실질적으로 동일하다는 것을 의미할 수 있다. 각각의 양이 ±30%, 보다 바람직하게는 ±20% 및 가장 바람직하게는 ±15% 차이가 나는 경우 방출은 실질적으로 동등하다.
달리 언급되지 않으면, 본 발명자들은 효소를 함유하지 않는 pH 1.2 USP 모의 위액 900 ml에서 37 ℃, 100 rpm으로 Ph. Eur. 바스켓 용출 장치를 사용하는 것을 포함하는 규정 방법으로 방출률을 측정한다. 한 변형에서, 용출 매질은 효소를 함유하지 않는 pH 6.8의 모의 장액이다.
pH 1.2의 모의 위액의 경우, 본 발명의 옥시코돈 다중미립자는 전형적으로 1 시간 후 적어도 15%의 옥시코돈을 방출하며, 이는 높은 초기 방출을 반영한다. 바람직하게, 그 다중미립자는 1 시간 후 적어도 20%, 보다 바람직하게는 적어도 25% 및 가장 바람직하게는 적어도 35%의 옥시코돈을 방출한다.
본 발명의 옥시코돈 다중미립자는 전형적으로 2 시간 후 적어도 30%의 옥시코돈을 방출하며, 이는 높은 초기 방출을 반영한다. 바람직하게, 그 다중미립자는 2 시간 후 적어도 40%, 보다 바람직하게는 적어도 50% 및 가장 바람직하게는 적어도 55%의 옥시코돈을 방출한다.
본 발명의 옥시코돈 다중미립자는 전형적으로 4 시간 후 적어도 60%의 옥시코돈을 방출하며, 이는 높은 초기 방출을 반영한다. 바람직하게, 그 다중미립자는 4 시간 후 적어도 70%, 보다 바람직하게는 적어도 75% 및 가장 바람직하게는 적어도 80%의 옥시코돈을 방출한다.
본 발명의 옥시코돈 다중미립자는 전형적으로 10 시간 후 적어도 75%의 옥시코돈을 방출하며, 이는 높은 총 방출을 반영한다. 바람직하게, 그 다중미립자는 10 시간 후 적어도 80%, 보다 바람직하게는 적어도 90% 및 가장 바람직하게는 적어도 95%의 옥시코돈을 방출한다.
게다가, 8 시간 후 적어도 85%의 옥시코돈을 방출하는 것이 바람직하다. 본 발명의 옥시코돈 다중미립자는 12 시간 후 100%의 옥시코돈을 방출할 수 있으며, 이는 높은 총 방출을 반영한다.
본 발명의 바람직한 다중미립자는 (a) 옥시코돈, (b) 수불용성 암모늄 메타크릴레이트 코폴리머, (c) 가소제, 및 (d) 수 침투성 조절제를 함유한다. 이러한 성분들을 선택함으로써, 옥시콘틴® 정제의 시험관내, 바람직하게는 생체내 방출 특성을 모방하는 옥시코돈을 함유하는 다중미립자 및 이어서 캅셀을 제조하는 것이 가능해진다. 특히, 수 침투성 조절제를 포함하는 조합은 용출의 후반부에 활성 성분의 높은 총 방출을 유지하는 동시에 옥시코돈의 적절한 초반부 방출을 가능하게 한다.
본 발명의 캅셀 또는 다른 단위 용량은 바람직하게는 약 12 시간 간격으로 투여되도록 디자인된다. 이 경우, 단위 용량은, 900 ml의 수성 완충액(pH 1.6 내지 7.2 ) 중에서 37 ℃에서 100 rpm으로 USP 패들 방법 (미국 약전 XXII 1990 참조)에 의해 측정될 때, 시험관내 옥시코돈 용출률로서, 1 시간 후 방출된 12.5 내지 42.5% (중량%)의 옥시코돈, 2 시간 후 방출된 25 내지 56%(중량%)의 옥시코돈, 4 시간 후에 방출된 45 내지 75%(중량%)의 옥시코돈, 6 시간 후에 방출된 55 내지 85%(중량%)의 옥시코돈을 갖는 것이 적합하다. 나아가, 생체내 얻어지는 옥시코돈의 최대 혈장 농도는 제형 투여 후 2 내지 4.5 시간 사이에서 발생하는 것이 바람직하다.
상기 옥시코돈 제형에 대한 바람직한 특성에 대한 더 많은 정보는 본 명세서에 전체 내용이 특별히 참고 인용되어 있는 국제특허공개 제9310765호에서 얻을 수 있다.
pH 1.2의 모의 위액에서 본 발명의 특정 방법을 이용하면, 방출률은 다음과 같은 한계 값을 갖는 것이 바람직하다.
바람직한 한계 값
pH 6.8의 모의 장액에서 본 발명의 특정 방법을 이용하면, 방출률은 다음과 같은 한계 값을 갖는 것이 바람직하다:
바람직한 한계 값
가장 바람직한 한계 값
약 12 시간 간격 투여에 대한 대안으로서, 본 발명의 캅셀 또는 다른 단위 용량은 약 24 시간 간격으로 투여되도록 디자인된다. 이 경우, 단위 용량은, 900 ml의 수성 완충액(pH 1.6 내지 7.2) 중에 37 ℃에서 100 rpm으로 USP 바스켓 방법에 의해 측정될 때, 시험관내 옥시코돈 용출률로서, 1 시간째에 0% 내지 약 40%, 4 시간째에 약 8% 내지 약 70%, 8 시간째에 약 20% 내지 약 80%, 12 시간째에 약 30% 내지 약 95%, 18 시간째에 약 35% 내지 약 95% 및 24 시간째에 약 50% 초과를 갖는 것이 바람직하다. 또한, 생체내 얻어지는 옥시코돈의 최고 혈장 농도는 제형 투여 후 약 2 내지 약 17 시간에서 제형의 정상 상태에 도달하는 것이 바람직하다.
상기 옥시코돈 제형에 대한 바람직한 특성에 대해 더 많은 정보는 본 명세서에 그 전체 내용이 특별히 참고 인용되어 있는 국제특허공보 제02087512호에서 얻을 수 있다.
한 변형으로, 본 발명은 옥시코돈 및 탬퍼링(tampering)을 방지하기에 유효한 옥시코돈 길항제를 함유하는 단위 용량을 제공한다. 이와 관련하여, 본 명세서에 그 전체 내용이 특별히 참고 인용되어 있는 국제특허공보 제0313433호를 참조한다. 특히, 단위 용량은 옥시코돈 및 날트렉손을 함유할 수 있다. 당업계에 알려진 다른 오피오이드 길항제, 예를 들어 날록손이 사용될 수 있다.
이 경우, 본 발명의 다른 양태는 옥시코돈의 압출된 다중미립자 및 날트렉손 또는 날록손 같은 옥시코돈 길항제의 압출된 다중미립자를 제공한다. 날트렉손 다중미립자는 통상적인 투여시에 날트렉손을 방출하지 않으며, 예를 들어 비-방출 코팅을 가진다. 두 군들은 바람직하게는 시각적으로 및 물리적으로 동일하다.
본 발명의 중요한 양태는 최대 약 350 mg의 옥시코돈 다중미립자 및 최대 약 200 mg의 탬퍼-방지 옥시코돈 길항제 다중미립자를 포함하는, 500 mg 미만의 단위 용량이 충진된 캅셀이다. 예를 들어, 옥시코돈 다중미립자 120 내지 300 mg 및 탬퍼-방지 옥시코돈 길항제 다중미립자 125 내지 175 mg이 존재할 수 있다.
[실시예]
표준화 조건
하기 실험적 작업에서, 표준화 조건이 옥시코돈 하이드로클로라이드 혼합물의 압출에 대한 확립되었다. 달리 상술되지 않으면, 압출기는 스크류 속도 140 rpm, 공급 속도 2.6 kg/h에서 작동하여, 직경 1 mm 및 길이 1 mm의 펠렛을 생산하는 라이스트리쯔 마이크로 18이었다.
도매업자 라이스트리쯔 USA의 제조 코드에 표시된 부품들을 사용한 스크류 디자인이 도 1에 도시되었다. 이 목적은 혼합 문제를 피하기 위해서 여분의 혼합 부재 'GGC2' 또는 'ZS'를 추가하여 혼합물을 최적화하고, 습윤 문제를 피하기 위해서 'FD' 부재를 포함시켜 체류 시간을 증가시키는 것이다.
압출기는 10 개의 존을 포함하였고, 존 1은 도 1에서 0 에서 5D까지 걸쳐 있고; 존 2는 도 1에서 5D에서 10D로 걸쳐 있으며; 이러한 방식으로 존 8까지는 35D에서 40D로 걸쳐 있고; 이어서 존 9 및 10은 압출기 헤드에 위치하였다.
전형적인 배치(batch) 존 온도는 후에 제시하였다.
방출률 연구
실시예 1 내지 7의 압출된 옥시코돈 다중미립자는 효소를 함유하지 않는 pH 1.2 USP 모의 위액(GSF) 900 ml에서 37 ℃, 100 rpm으로 Ph. Eur. 바스켓 용출 장치를 사용하여 용출에 대해 테스트되었다. 표준 HPLC 절차가 분석에 사용되었다.
추가적으로, 실시예 2의 압출된 옥시코돈 다중미립자는 효소를 함유하지 않는 pH 6.8 USP 모의 장액(SIF) 900 ml에서 37 ℃, 100 rpm으로 Ph. Eur. 바스켓 용출 장치를 사용하여 용출에 대해 테스트 되었다. 역시, 표준 HPLC 절차가 분석에 사용되었다.
시험관내 방출률을 측정하고, 결과는 도 2 내지 5에 좌표로 나타내었다.
실시예 1 내지 3
8.3% w/w의 약물 로드를 갖는 하기 시험적 배치가 제조되었다. 중량은 단위 용량 당 mg이었다.
실시예 1 내지 3의 제형화 공정에 사용된 전형적인 배치 존 온도 (℃), 용융 압력 및 토크는 하기와 같이 하였다:
실시예 3의 제형은 현재 바람직한 8.3% w/w 약물 로드 제품이었다.
실시예 4 및 5
크기 1 캅셀 내로 132mg 용량 중량 중 40mg 및 264mg 용량량 중량 중 80mg을 충진하는 것을 가능하기 하기 위해서, 30.3% w/w 약물 로드로 12시간 제형이 제조되었다. 부품 수준은 상대적으로 낮은 공정 온도가 얻어질 수 있도록 하였다. 컨베이어 및 펠레타이저 속도는 공정 중에 최적화되었다. 실시예 4 및 5에 대한 공정 조건은 아래와 같이 하였다.
실시예 4는 바람직한 30.3% w/w의 약물 로드 제품이었다.
단위 용량 중량 당 양(mg) (총 중량에 대한 %)
실시예4 실시예 5
옥시코돈 HCL 40.0 (30.3%) 40.0 (30.3%)
유드라짓 RS PO 68.0 (51.5%) 66.0 (50.0%)
유드라짓 RL PO 8.0 (6.1 %) 7.0 (5.3%)
스테아릴 알콜 16.0 (12.1%) 19.0 (14.4%)
총 132 mg 132 mg
실시예4: 압출기 공정 조건:
압출기: 라이스트리쯔 마이크로 18
스크류 배열(configuration): 도 1의 디아그램 참조
공급 속도 (kg/시간): 2.0
스크류 속도 (rpm): 120
다이 플레이트 오리피스 직경 (mm): 1.0 ( 8 오리피스 플레이트)
펠렛 치수: 1.0mm x 1.0mm (범위 0.8 ~ 1.2 mm)
실시예
4:
실시예 5: 압출기 공정 조건:
압출기: 라이스트리쯔 마이크로 18
스크류 배열: 도 1의 디아그램 참조
공급 속도 (kg/시간): 2.6
스크류 속도 (rpm): 140
다이 플레이트 오리피스 직경 (mm): 1.0 ( 8 오리피스 플레이트)
펠렛 치수: 1.0mm x 1.0mm (범위 0.8 - 1.2 mm)
실시예 5:
실시예 6
가소제의 조정된 수준을 갖는 실시예 5의 배치에 기초하여 제형이 제조되었다. 이 배치의 공정은 2.4 mm의 오리피스 깊이를 갖는 압출 다이 플레이트를 이용해 수행되었다. 압출 다이 플레이트 깊이를 3.7mm 내지 2.4mm로 조정한 후, 공정 조건, 즉, 용융압력 및 스크류 토크에서 추가적인 개선이 얻어졌다. 사용된 온도 및 다이 플레이트 조건은 아래 제시하였다.
단위 용량 중량 당 양(mg) (총 중량에 대한 %)
배치 번호 실시예 6
옥시코돈 HCl 40.0 (30.3%)
유드라짓 RSPO 70.0 (53.0%)
유드라짓 RLPO 4.0 ( 3.0%)
스테아릴 알콜 18.0 (13.6%)
총 132 mg
실시예
6:
실시예 6의 캅셀 (F764/61라고도 칭함)에 대한 용출 시험이 수행되었다. 도 5에서 보듯이, 이 제형으로부터의 옥시코돈 용출 프로파일은 지정된 PN2797 (캡슐화된 제품) 표적 프로파일과 잘 비교되었다. 옥시콘틴® 40mg 정제의 상업적 배치에 대한 프로파일도 도 5에 제시하였다.
실시예 7
스테아릴 알콜의 감소된 용량을 갖는 다른 제형이, 저장에 대한 향상된 안정성 및 저장 중 용출 프로파일 변화 최소화를 확보하기 위해 고안되었다. 본 접근법은 10/20mg 용량 제품 제형, 예를 들면 120mg 캅셀 충진 중량 중 10mg 옥시코돈 하이드로클로라이드 및 240mg 캅셀 충진 중량 중 20mg 옥시코돈 하이드로클로라이드에 대한 가속화된 저장 조건 하에서 용출률의 안정성을 향상시키는 것으로 앞에서 제시하였다.
실시예 7은 바람직한 30.3% w/w 약물 로드 제품이었다. 상기 제형으로 도달된 최고 토크 한계로 인해 라이스트리쯔 마이크로 18 압출기에서 만족스러운 압출 공정 조건은 확립될 수 없었다. 그러나, 본 제형은 더 높은 토크 수준을 조절할 수 있는 라이스트리쯔 마이크로 27 압출기에서의 공정에 추천되었으며, 향상된 저장 안정성을 갖는 제품을 생성하였다.
단위 용량 중량 당 양(mg) (총 중량에 대한 %)
배치 번호 실시예 7
옥시코돈 HCl 40.0 (30.3%)
유드라짓 RSPO 71.0 (53.8%)
유드라짓 RLPO 5.0 ( 3.8%)
스테아릴 알콜 16.0 (12.1%)
총 132 mg
실시예 8
압출된 옥시코돈 다중미립자 및 압출된 날트렉손 다중미립자의 동시-캡슐화는 탬퍼 방지 복합 제품에 이용할 수 있었다.
국제특허공개 제03013433호에 개시된 대로 옥시코돈 다중미립자 및 날트렉손 다중미립자는 단일 또는 이중 단계 충진 공정을 이용해 캅셀 내로 충진될 수 있었다. 충진될 수 있는 날트렉손 다중미립자의 양은 날트렉손 8 mg을 포함한 150 mg이었다. 10mg 내지 40mg에 범위의 옥시코돈 용량을 달성하기 위한 옥시코돈 다중미립자의 추천 충진 중량은 하기와 같이 하였다{또한 하기 표 참조}:
1. 각각 10 mg 및 20 mg의 옥시코돈 용량에 대해 8.3%(w/w)의 약물이 로드된 다중미립자 120 mg 및 240 mg.
2. 40 mg의 옥시코돈 용량에 대해 25%(w/w)의 약물이 로드된 다중미립자 160 mg.
3. 40 mg의 옥시코돈 용량에 대해 30.3%(w/w)의 약물이 로드된 다중미립자 132 mg.
또한, 5 mg 및 80 mg의 옥시코돈 용량은 각각의 캅셀 충진 중량에 대해 또 다음과 같이 고려될 수도 있었다:
1. 5 mg의 옥시코돈 용량에 대해 8.3%(w/w)의 약물이 로드된 다중미립자 60 mg.
2. 80 mg의 옥시코돈 용량에 대해 25%(w/w)의 약물이 로드된 다중미립자 320 mg.
3. 80 mg의 옥시코돈 용량에 대해 30.3%(w/w)의 약물이 로드된 다중미립자 264 mg.
단일 단계 공정 또는 바람직하게는 이중 단계 충진 공정을 이용하여 요구되는 비율의 옥시코돈 및 날트렉손 다중미립자의 캅셀 충진이 수행될 수 있었다. 단일 단계 충진 공정의 경우, 각 비율의 다중미립자가 예비 혼합되고, 수동으로 또는 바람직하게는 자동화된 공정으로 캅셀에 충진 될 수 있었다. 바람직한 이중 단계 충진 공정에 의해, 제 1 단계에서 제 1 타입의 다중미립자가 수동 또는 바람직하게는 자동화 된 공정으로 충진될 수 있었다. 그 후, 제 2 단계에서 제 2 타입의 다중미립자가 수동 또는 바람직하게는 자동화 된 공정으로 충진될 수 있었다.
약물 로딩에 기초한 캅셀 함량 범위에 대한 이론적 충진 중량을 다음 표에 나타내었다.
Claims (1)
- 약제학적 활성 성분 및 활택성을 갖는 가소성 부형제를 함유하고, 추가적인 활택제를 실질적으로 함유하지 않는 다중미립자.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB0419296A GB2418854B (en) | 2004-08-31 | 2004-08-31 | Multiparticulates |
| GB0419296.9 | 2004-08-31 | ||
| PCT/GB2005/050140 WO2006024881A2 (en) | 2004-08-31 | 2005-08-31 | Multiparticulates of preferably an opioid, and method of manufacturing using extrusion |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020077003915A Division KR101306500B1 (ko) | 2004-08-31 | 2005-08-31 | 바람직하게는 오피오이드의 다중미립자 및 압축을 이용한제조 방법 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20130084327A true KR20130084327A (ko) | 2013-07-24 |
| KR101526779B1 KR101526779B1 (ko) | 2015-06-05 |
Family
ID=33104837
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137016849A KR101526779B1 (ko) | 2004-08-31 | 2005-08-31 | 바람직하게는 오피오이드의 다중미립자 및 압축을 이용한 제조 방법 |
| KR1020077003915A KR101306500B1 (ko) | 2004-08-31 | 2005-08-31 | 바람직하게는 오피오이드의 다중미립자 및 압축을 이용한제조 방법 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020077003915A KR101306500B1 (ko) | 2004-08-31 | 2005-08-31 | 바람직하게는 오피오이드의 다중미립자 및 압축을 이용한제조 방법 |
Country Status (17)
| Country | Link |
|---|---|
| US (1) | US9259872B2 (ko) |
| EP (2) | EP1809249A2 (ko) |
| JP (3) | JP2008511604A (ko) |
| KR (2) | KR101526779B1 (ko) |
| CN (2) | CN103462904A (ko) |
| AU (1) | AU2005278919B2 (ko) |
| BR (1) | BRPI0514474B1 (ko) |
| CA (1) | CA2576275C (ko) |
| EA (1) | EA017435B1 (ko) |
| GB (1) | GB2418854B (ko) |
| IL (1) | IL180928A (ko) |
| MX (1) | MX2007001904A (ko) |
| NO (1) | NO20070871L (ko) |
| NZ (1) | NZ552845A (ko) |
| SG (1) | SG155880A1 (ko) |
| WO (1) | WO2006024881A2 (ko) |
| ZA (1) | ZA200701056B (ko) |
Families Citing this family (47)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6375957B1 (en) | 1997-12-22 | 2002-04-23 | Euro-Celtique, S.A. | Opioid agonist/opioid antagonist/acetaminophen combinations |
| PT1685839E (pt) | 1997-12-22 | 2013-07-08 | Euro Celtique Sa | Forma de dosagem farmacêutica por via oral compreendendo uma combinação de um agonista opióide e de um antagonista opióide |
| DE60238756D1 (de) | 2001-05-11 | 2011-02-10 | Endo Pharmaceuticals Inc | Opioid enthaltende arzneiform gegen missbrauch |
| US20030068375A1 (en) * | 2001-08-06 | 2003-04-10 | Curtis Wright | Pharmaceutical formulation containing gelling agent |
| DE20308437U1 (de) | 2002-04-05 | 2003-11-13 | Euroceltique S.A., Luxemburg/Luxembourg | Matrix zur verzögerten, gleichbleibenden und unabhängigen Freisetzung von Wirkstoffen |
| DE10361596A1 (de) | 2003-12-24 | 2005-09-29 | Grünenthal GmbH | Verfahren zur Herstellung einer gegen Missbrauch gesicherten Darreichungsform |
| DE102005005446A1 (de) | 2005-02-04 | 2006-08-10 | Grünenthal GmbH | Bruchfeste Darreichungsformen mit retardierter Freisetzung |
| CA2569958C (en) | 2004-06-12 | 2016-03-22 | Jane C. Hirsh | Abuse-deterrent drug formulations |
| DE102004032049A1 (de) | 2004-07-01 | 2006-01-19 | Grünenthal GmbH | Gegen Missbrauch gesicherte, orale Darreichungsform |
| GB2418854B (en) * | 2004-08-31 | 2009-12-23 | Euro Celtique Sa | Multiparticulates |
| DE102005005449A1 (de) | 2005-02-04 | 2006-08-10 | Grünenthal GmbH | Verfahren zur Herstellung einer gegen Missbrauch gesicherten Darreichungsform |
| EP1702558A1 (en) | 2005-02-28 | 2006-09-20 | Euro-Celtique S.A. | Method and device for the assessment of bowel function |
| US8852638B2 (en) | 2005-09-30 | 2014-10-07 | Durect Corporation | Sustained release small molecule drug formulation |
| EP1832281A1 (en) * | 2006-03-10 | 2007-09-12 | Abbott GmbH & Co. KG | Process for producing a solid dispersion of an active ingredient |
| CN101801415B (zh) | 2007-05-25 | 2015-09-23 | Rb医药品有限公司 | 利培酮化合物的持续递送制剂 |
| DE102007026550A1 (de) * | 2007-06-08 | 2008-12-11 | Bayer Healthcare Ag | Extrudate mit verbesserter Geschmacksmaskierung |
| SI2180882T1 (sl) | 2007-10-19 | 2013-05-31 | Otsuka Pharmaceutical Co., Ltd. | Trdni matriksni farmacevtski pripravek |
| US9226907B2 (en) | 2008-02-01 | 2016-01-05 | Abbvie Inc. | Extended release hydrocodone acetaminophen and related methods and uses thereof |
| PT2405915T (pt) | 2009-03-10 | 2019-01-29 | Euro Celtique Sa | Composições farmacêuticas de libertação imediata compreendendo oxicodona e naloxona |
| GB0909680D0 (en) | 2009-06-05 | 2009-07-22 | Euro Celtique Sa | Dosage form |
| US10668060B2 (en) | 2009-12-10 | 2020-06-02 | Collegium Pharmaceutical, Inc. | Tamper-resistant pharmaceutical compositions of opioids and other drugs |
| EP2540318B1 (en) | 2010-02-22 | 2018-10-24 | Daiichi Sankyo Company, Limited | Sustained-release solid preparation for oral use |
| EP2540317A4 (en) * | 2010-02-22 | 2014-04-16 | Daiichi Sankyo Co Ltd | SOLID PREPARATION WITH DELAYED RELEASE FOR ORAL ADMINISTRATION |
| CN102946870A (zh) | 2010-05-10 | 2013-02-27 | 欧洲凯尔特公司 | 包含氢吗啡酮和纳洛酮的药物组合物 |
| US9901540B2 (en) | 2010-05-10 | 2018-02-27 | Euro-Celtique S.A. | Combination of active loaded granules with additional actives |
| EP2568968B1 (en) | 2010-05-10 | 2017-07-12 | Euro-Celtique S.A. | Manufacturing of active-free granules and tablets comprising the same |
| GB2513060B (en) | 2010-06-08 | 2015-01-07 | Rb Pharmaceuticals Ltd | Microparticle buprenorphine suspension |
| US9272044B2 (en) | 2010-06-08 | 2016-03-01 | Indivior Uk Limited | Injectable flowable composition buprenorphine |
| PE20181177A1 (es) | 2010-12-22 | 2018-07-20 | Purdue Pharma Lp | Formas de dosis de liberacion controlada encerradas resistentes a manipulaciones indebidas |
| CN103327969A (zh) | 2010-12-23 | 2013-09-25 | 普渡制药公司 | 抗篡改固体口服剂型 |
| LT2736495T (lt) | 2011-07-29 | 2017-11-10 | Grünenthal GmbH | Sugadinimui atspari tabletė, pasižyminti greitu vaisto atpalaidavimu |
| CN103857386A (zh) | 2011-07-29 | 2014-06-11 | 格吕伦塔尔有限公司 | 提供药物立即释放的抗破碎片剂 |
| WO2013191668A1 (en) * | 2012-06-22 | 2013-12-27 | Sanovel Ilac Sanayi Ve Ticaret Anonim Sirketi | Compositions preventing hypertension comprising soluplus |
| ES2706994T3 (es) | 2012-09-03 | 2019-04-02 | Daiichi Sankyo Co Ltd | Composición farmacéutica de liberación prolongada de administración oral que contiene clorhidrato de hidromorfona |
| EA201500742A1 (ru) | 2013-02-05 | 2015-12-30 | Пердью Фарма Л.П. | Защищенные от нецелевого использования фармацевтические композиции |
| US10751287B2 (en) | 2013-03-15 | 2020-08-25 | Purdue Pharma L.P. | Tamper resistant pharmaceutical formulations |
| CN105682643B (zh) | 2013-07-12 | 2019-12-13 | 格吕伦塔尔有限公司 | 含有乙烯-醋酸乙烯酯聚合物的防篡改剂型 |
| NZ716267A (en) | 2013-07-23 | 2017-05-26 | Euro Celtique Sa | A combination of oxycodone and naloxone for use in treating pain in patients suffering from pain and a disease resulting in intestinal dysbiosis and/or increasing the risk for intestinal bacterial translocation |
| WO2015023675A2 (en) | 2013-08-12 | 2015-02-19 | Pharmaceutical Manufacturing Research Services, Inc. | Extruded immediate release abuse deterrent pill |
| WO2015071380A1 (en) | 2013-11-13 | 2015-05-21 | Euro-Celtique S.A. | Hydromorphone and naloxone for treatment of pain and opioid bowel dysfunction syndrome |
| US10172797B2 (en) | 2013-12-17 | 2019-01-08 | Pharmaceutical Manufacturing Research Services, Inc. | Extruded extended release abuse deterrent pill |
| US9492444B2 (en) | 2013-12-17 | 2016-11-15 | Pharmaceutical Manufacturing Research Services, Inc. | Extruded extended release abuse deterrent pill |
| GB201404139D0 (en) | 2014-03-10 | 2014-04-23 | Rb Pharmaceuticals Ltd | Sustained release buprenorphine solution formulations |
| AU2015290098B2 (en) | 2014-07-17 | 2018-11-01 | Pharmaceutical Manufacturing Research Services, Inc. | Immediate release abuse deterrent liquid fill dosage form |
| WO2016064873A1 (en) | 2014-10-20 | 2016-04-28 | Pharmaceutical Manufacturing Research Services, Inc. | Extended release abuse deterrent liquid fill dosage form |
| EP3346991A1 (en) | 2015-09-10 | 2018-07-18 | Grünenthal GmbH | Protecting oral overdose with abuse deterrent immediate release formulations |
| WO2017222575A1 (en) | 2016-06-23 | 2017-12-28 | Collegium Pharmaceutical, Inc. | Process of making more stable abuse-deterrent oral formulations |
Family Cites Families (40)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BE795766A (fr) * | 1972-02-22 | 1973-08-22 | Lilly Co Eli | Particules de napsylate de propoxyphene retard et procede de fabrication de ces particules |
| US4861598A (en) | 1986-07-18 | 1989-08-29 | Euroceltique, S.A. | Controlled release bases for pharmaceuticals |
| US4970075A (en) | 1986-07-18 | 1990-11-13 | Euroceltique, S.A. | Controlled release bases for pharmaceuticals |
| JP3125221B2 (ja) * | 1990-09-01 | 2001-01-15 | 大正製薬株式会社 | ソファルコン含有固形製剤 |
| US5266331A (en) | 1991-11-27 | 1993-11-30 | Euroceltique, S.A. | Controlled release oxycodone compositions |
| US5656295A (en) | 1991-11-27 | 1997-08-12 | Euro-Celtique, S.A. | Controlled release oxycodone compositions |
| ES2109377T3 (es) * | 1991-12-18 | 1998-01-16 | Warner Lambert Co | Proceso para la preparacion de una dispersion solida. |
| US5286493A (en) | 1992-01-27 | 1994-02-15 | Euroceltique, S.A. | Stabilized controlled release formulations having acrylic polymer coating |
| US5580578A (en) | 1992-01-27 | 1996-12-03 | Euro-Celtique, S.A. | Controlled release formulations coated with aqueous dispersions of acrylic polymers |
| US7070806B2 (en) | 1992-01-27 | 2006-07-04 | Purdue Pharma Lp | Controlled release formulations coated with aqueous dispersions of acrylic polymers |
| DE4227385A1 (de) * | 1992-08-19 | 1994-02-24 | Kali Chemie Pharma Gmbh | Pankreatinmikropellets |
| IL110014A (en) | 1993-07-01 | 1999-11-30 | Euro Celtique Sa | Solid controlled-release oral dosage forms of opioid analgesics |
| US7740881B1 (en) | 1993-07-01 | 2010-06-22 | Purdue Pharma Lp | Method of treating humans with opioid formulations having extended controlled release |
| KR100354702B1 (ko) | 1993-11-23 | 2002-12-28 | 유로-셀티크 소시에떼 아노뉨 | 약학조성물의제조방법및서방형조성물 |
| US5891471A (en) | 1993-11-23 | 1999-04-06 | Euro-Celtique, S.A. | Pharmaceutical multiparticulates |
| EP0654263B1 (en) | 1993-11-23 | 2002-01-23 | Euro-Celtique S.A. | Method for preparing a sustained release composition |
| ES2199981T3 (es) | 1994-02-16 | 2004-03-01 | Abbott Laboratories | Modo de preparacion de formulaciones farmaceuticas de particulas finas. |
| US20020006438A1 (en) | 1998-09-25 | 2002-01-17 | Benjamin Oshlack | Sustained release hydromorphone formulations exhibiting bimodal characteristics |
| US5965161A (en) | 1994-11-04 | 1999-10-12 | Euro-Celtique, S.A. | Extruded multi-particulates |
| IL139728A (en) | 1995-01-09 | 2003-06-24 | Penwest Pharmaceuticals Compan | Aqueous slurry composition containing microcrystalline cellulose for preparing a pharmaceutical excipient |
| DE19536394A1 (de) * | 1995-09-29 | 1997-04-03 | Basf Ag | Feste Arzneiformen, erhältlich durch Extrusion einer Isomalt enthaltenden Polymer-Wirkstoff-Schmelze |
| SE9600071D0 (sv) * | 1996-01-08 | 1996-01-08 | Astra Ab | New oral formulation of two active ingredients I |
| EP0888111B1 (en) | 1996-03-08 | 2003-05-21 | Nycomed Danmark A/S | Modified release multiple-units dosage composition |
| WO1997045091A2 (en) | 1996-05-31 | 1997-12-04 | Euro-Celtique, S.A. | Sustained release oxycodone formulations with no fed/fast effect |
| FR2795326B1 (fr) | 1999-06-28 | 2001-08-31 | Adir | Composition pharmaceutique solide thermoformable a liberation controlee |
| KR20130010512A (ko) | 1999-10-29 | 2013-01-28 | 유로-셀티크 소시에떼 아노뉨 | 서방성 하이드로코돈 제형 |
| US6716449B2 (en) | 2000-02-08 | 2004-04-06 | Euro-Celtique S.A. | Controlled-release compositions containing opioid agonist and antagonist |
| AU776904B2 (en) * | 2000-02-08 | 2004-09-23 | Euro-Celtique S.A. | Controlled-release compositions containing opioid agonist and antagonist |
| FR2818552B1 (fr) | 2000-12-26 | 2003-02-07 | Servier Lab | Compositions pharmaceutique solide thermoformable pour la liberation controlee d'ivabradine |
| UA81224C2 (uk) * | 2001-05-02 | 2007-12-25 | Euro Celtic S A | Дозована форма оксикодону та її застосування |
| AU2002324624A1 (en) | 2001-08-06 | 2003-02-24 | Euro-Celtique S.A. | Sequestered antagonist formulations |
| EP1423092A2 (en) | 2001-09-05 | 2004-06-02 | Vectura Limited | Functional powders for oral delivery |
| US7939102B2 (en) | 2002-06-07 | 2011-05-10 | Torrent Pharmaceuticals Ltd. | Controlled release formulation of lamotrigine |
| CA2498798A1 (en) | 2002-09-20 | 2004-04-01 | Alpharma, Inc. | Sustained-release opioid formulations and methods of use |
| MY135852A (en) * | 2003-04-21 | 2008-07-31 | Euro Celtique Sa | Pharmaceutical products |
| US20060165790A1 (en) | 2003-06-27 | 2006-07-27 | Malcolm Walden | Multiparticulates |
| TWI357815B (en) * | 2003-06-27 | 2012-02-11 | Euro Celtique Sa | Multiparticulates |
| TWI350762B (en) * | 2004-02-12 | 2011-10-21 | Euro Celtique Sa | Particulates |
| GB2418854B (en) * | 2004-08-31 | 2009-12-23 | Euro Celtique Sa | Multiparticulates |
| CN102888347B (zh) * | 2011-07-22 | 2014-03-26 | 中国科学院烟台海岸带研究所 | 小球藻突变株及其应用 |
-
2004
- 2004-08-31 GB GB0419296A patent/GB2418854B/en not_active Expired - Fee Related
-
2005
- 2005-08-31 CN CN2013104365518A patent/CN103462904A/zh active Pending
- 2005-08-31 BR BRPI0514474A patent/BRPI0514474B1/pt not_active IP Right Cessation
- 2005-08-31 NZ NZ552845A patent/NZ552845A/en not_active IP Right Cessation
- 2005-08-31 MX MX2007001904A patent/MX2007001904A/es unknown
- 2005-08-31 EP EP05781628A patent/EP1809249A2/en not_active Withdrawn
- 2005-08-31 SG SG200905776-1A patent/SG155880A1/en unknown
- 2005-08-31 CN CNA2005800377469A patent/CN101052379A/zh active Pending
- 2005-08-31 WO PCT/GB2005/050140 patent/WO2006024881A2/en active Application Filing
- 2005-08-31 JP JP2007529005A patent/JP2008511604A/ja active Pending
- 2005-08-31 EA EA200700340A patent/EA017435B1/ru not_active IP Right Cessation
- 2005-08-31 CA CA2576275A patent/CA2576275C/en not_active Expired - Fee Related
- 2005-08-31 KR KR1020137016849A patent/KR101526779B1/ko not_active IP Right Cessation
- 2005-08-31 EP EP10180087A patent/EP2269582A3/en not_active Withdrawn
- 2005-08-31 AU AU2005278919A patent/AU2005278919B2/en not_active Ceased
- 2005-08-31 KR KR1020077003915A patent/KR101306500B1/ko active IP Right Grant
- 2005-08-31 US US11/661,478 patent/US9259872B2/en not_active Expired - Fee Related
-
2007
- 2007-01-24 IL IL180928A patent/IL180928A/en not_active IP Right Cessation
- 2007-02-05 ZA ZA200701056A patent/ZA200701056B/en unknown
- 2007-02-15 NO NO20070871A patent/NO20070871L/no not_active Application Discontinuation
-
2013
- 2013-02-28 JP JP2013039559A patent/JP2013129663A/ja active Pending
-
2015
- 2015-11-02 JP JP2015215977A patent/JP6306554B2/ja not_active Expired - Fee Related
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101306500B1 (ko) | 바람직하게는 오피오이드의 다중미립자 및 압축을 이용한제조 방법 | |
| EP1644002B1 (en) | Multiparticulates | |
| US20060165790A1 (en) | Multiparticulates | |
| EP1348429B1 (en) | Melt-extruded orally administrable opioid formulations | |
| CN104428002A (zh) | 热成形的抗篡改含锌药物剂型 | |
| ZA200600772B (en) | Multiparticulates |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A107 | Divisional application of patent | ||
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| AMND | Amendment | ||
| E90F | Notification of reason for final refusal | ||
| E601 | Decision to refuse application | ||
| AMND | Amendment | ||
| J201 | Request for trial against refusal decision | ||
| E90F | Notification of reason for final refusal | ||
| B701 | Decision to grant | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20180525 Year of fee payment: 4 |
|
| LAPS | Lapse due to unpaid annual fee |