KR20120043028A - 혈관 신생 억제 화합물 - Google Patents
혈관 신생 억제 화합물 Download PDFInfo
- Publication number
- KR20120043028A KR20120043028A KR1020127005049A KR20127005049A KR20120043028A KR 20120043028 A KR20120043028 A KR 20120043028A KR 1020127005049 A KR1020127005049 A KR 1020127005049A KR 20127005049 A KR20127005049 A KR 20127005049A KR 20120043028 A KR20120043028 A KR 20120043028A
- Authority
- KR
- South Korea
- Prior art keywords
- seq
- group
- formula
- antibody
- substituted
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/18—Growth factors; Growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/475—Growth factors; Growth regulators
- C07K14/515—Angiogenesic factors; Angiogenin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Zoology (AREA)
- Gastroenterology & Hepatology (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Toxicology (AREA)
- Oncology (AREA)
- Vascular Medicine (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Immunology (AREA)
- Communicable Diseases (AREA)
- Rheumatology (AREA)
- Hematology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Dermatology (AREA)
- Urology & Nephrology (AREA)
- Ophthalmology & Optometry (AREA)
- Epidemiology (AREA)
- Physical Education & Sports Medicine (AREA)
- Peptides Or Proteins (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
본 발명은 항체의 결합 부위에 연결된 AA(anti-angiogenic) 표적화제-연결기 컨쥬게이트를 포함하는 AA 표적화 화합물을 제공한다. 비정상적인 혈관 신생에 관련된 장애를 치료하는 방법을 비롯한 본 화합물의 다양한 용도가 제공된다.
Description
본 발명은 혈관 신생 억제 활성을 갖는 신규 화합물 및 이들 화합물을 제조 및 사용하는 방법에 관한 것이다.
혈관 신생은 새로운 혈관을 생성시키는 기본 과정이며, 재생, 발생 및 상처 치유 같은 다양한 정상적인 신체 활성에 필수적이다. 혈관 신생은 정상적인 조건하에서는 고도로 통제되는 과정이지만, 통제되지 않은 혈관 신생에 의해 다수의 질환("혈관 신생 질환"으로서 기술됨)이 발병되거나 악화된다. 예를 들면, 눈의 신혈관 생성은 실명의 가장 흔한 원인으로서 관련되어 왔다. 관절염 같은 특정의 기존 질병에서, 새롭게 생성되는 모세혈관은 관절에 침습하여 연골을 파괴한다. 당뇨병에서는, 망막에 형성되는 새로운 모세혈관이 유리체를 침범하고 출혈시키고 실명을 야기한다. 고형암의 성장 및 전이도 혈관 신생에 의존한다[폴크맨(J. Folkman), Cancer Res., 46:467-473 (1986); 폴크맨, J. Natl. Cancer Inst., 82:4-6 (1989)]. 예를 들어, 2mm 이상까지 커지는 종양은 새로운 모세혈관의 성장을 유도함으로써 혈액을 공급받는 것으로 밝혀졌다. 이들 새로운 혈관이 종양 내에 존재하게 되면, 이들은 종양 세포가 순환을 개시하고 간, 폐 및 골 같은 멀리 떨어진 부위로 전이되도록 하는 수단을 제공한다[웨이드너(N. Weidner) 등, N. Engl. J. Med., 324:1-8 (1991)].
혈관 신생 관련 인자 안지오포이에틴-2("Ang-2")에 결합되는 다양한 펩타이드가 확인되었다[올리너(Oliner, J.) 등, Cancer Cell, 204(6), 507-516 (2004)]. Ang-2 결합 펩타이드는 혈관 신생 억제 활성을 갖는 것으로 밝혀졌다.
본원에서 임의의 기술에 대한 인용은 인용된 기술이 일반 상식의 일부를 형성한다는 임의의 형식 또는 암시를 인정하는 것이 아니며 또한 그렇게 인정하는 것으로 간주되어서도 안된다.
본 발명은 혈관 신생 억제 활성을 갖는 신규 화합물 및 이들 화합물을 제조 및 사용하는 방법을 제공하기 위한 것이다.
발명의 개요
본 발명은 독특한 특이성 및 다수의 용도에 유용한 생물학적 특성을 갖는 Ang-2 결합 펩타이드를 기제로 하는 혈관 신생 억제 표적화 화합물(AA 표적화 화합물)을 제공한다. 항체의 결합 부위에 혈관 신생 억제제를 공유 결합시킴으로써 본 발명의 혈관 신생 억제 표적화 화합물을 생성시킨다. 본 발명의 표적화 화합물 및 약학적으로 허용가능한 담체를 포함하는 약학 조성물도 제공된다. 일부 실시양태에서, 본 발명은 하기 서열 번호:161에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함하는 표적화제를 제공한다:
x1x2x3x4x5x6Dx8x9x10x11x12x13x14x15x16x17x18x19x20x21x22 (서열 번호:161)
상기 서열에서,
x1은 임의의 잔기일 수 있고,
x2는 임의의 잔기일 수 있으며,
x3은 임의의 방향족 아미노산 잔기일 수 있고,
x4는 임의의 잔기일 수 있고,
x5는 P, hP, dhP 또는 BnHP일 수 있고,
x6은 임의의 잔기일 수 있으며,
x8은 D 또는 E일 수 있고,
x9는 친핵성 또는 친전자성 측쇄를 포함하는 임의의 잔기일 수 있으며,
x10은 D 또는 E일 수 있으며,
x11은 친핵성 또는 친전자성 측쇄를 포함하는 임의의 잔기일 수 있고,
x12는 임의의 잔기일 수 있고,
x13은 L, HL, Nva, I, HchA, HF 및 ThA로 이루어진 군으로부터 선택될 수 있으며,
x14는 임의의 방향족 아미노산 잔기일 수 있으며,
x15는 D 또는 E일 수 있으며,
x16은 임의의 잔기일 수 있고,
x17은 임의의 방향족 아미노산 잔기일 수 있고,
x18은 임의의 잔기일 수 있고,
x19는 임의의 잔기일 수 있고,
x20은 임의의 잔기일 수 있거나, 또는 x22 및 x21이 존재하지 않는 경우 존재하지 않을 수 있으며,
x21은 임의의 잔기일 수 있거나, 또는 x22가 존재하지 않는 경우 존재하지 않을 수 있으며,
x22는 임의의 잔기일 수 있거나, 또는 존재하지 않을 수 있다.
x1은 Q일 수 있다. x1은 T일 수 있다. x1은 S일 수 있다. x1은 R일 수 있다. x1은 H일 수 있다. x2는 K일 수 있다. x2는 N일 수 있다. x2는 R일 수 있다. x2는 H일 수 있다. x2는 AcK일 수 있다. x2는 Nick일 수 있다. x2는 CbcK일 수 있다. 일부 실시양태에서, x2는 K, N, R, H, Ack, Nick 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 N, R, H, AcK, Nick 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 R, H, AcK, Nick 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 R, H, AcK 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 R, H 또는 AcK로 이루어진 군으로부터 선택될 수 있다. x3은 F일 수 있다. x3은 Y일 수 있다. x3은 W일 수 있다. x3은 BPA일 수 있다. x3은 CF일 수 있다. x3은 NF일 수 있다. x4는 Q일 수 있다. x4는 M일 수 있다. x4는 E일 수 있다. x4는 K일 수 있다. x5는 P일 수 있다. x5는 HP일 수 있다. x5는 DHP일 수 있다. x5는 BnHP일 수 있다. x6은 M일 수 있다. x6은 L일 수 있다. x6은 I일 수 있다. x8은 E일 수 있다. x8은 D일 수 있다. x9는 L일 수 있다. x9는 I일 수 있다. x9는 TA일 수 있다. x9는 ThA일 수 있다. x9는 K일 수 있다. x9는 AcK일 수 있다. x10은 E일 수 있다. x10은 D일 수 있다. x11은 Q일 수 있다. x11은 N일 수 있다. x11은 C일 수 있다. x11은 K일 수 있다. x11은 AcK일 수 있다. x11은 Dab일 수 있다. x11은 Dap일 수 있다. x12는 T일 수 있다. x12는 R일 수 있다. x12는 K일 수 있다. x13은 L일 수 있다. x13은 HL일 수 있다. x13은 Nva일 수 있다. x13은 I일 수 있다. x13은 HchA일 수 있다. x13은 HF일 수 있다. x13은 ThA일 수 있다. x13은 K일 수 있다. 일부 실시양태에서, x13은 L, HL, Nva, I, HchA, HF 및 ThA로 이루어진 군으로부터 선택될 수 있다. 일부 실시양태에서, x13은 L, HL 및 Nva로 이루어진 군으로부터 선택될 수 있다. x14는 F일 수 있다. x14는 Y일 수 있다. x14는 W일 수 있다. x14는 BPA일 수 있다. x14는 CF일 수 있다. x14는 NF일 수 있다. x15는 D일 수 있다. x15는 E일 수 있다. x16은 Q일 수 있다. x16은 N일 수 있다. x17은 F일 수 있다. x17은 Y일 수 있다. x17은 W일 수 있다. x17은 BPA일 수 있다. x17은 CF일 수 있다. x17은 NF일 수 있다. x18은 M일 수 있다. x19는 L일 수 있다. x19는 I일 수 있다. x20은 Q일 수 있다. x20은 N일 수 있다. x21은 Q일 수 있다. x21은 N일 수 있다. x22는 G일 수 있다.
일부 실시양태에서, 본 발명은 하기 서열 번호:162에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함하는 표적화제를 제공한다:
x1x2x3x4x5x6DEx9Dx11x12x13x14Dx16x17x18x19x20x21x22 (서열 번호:162)
상기 서열에서,
x1, x2, x4, x6, x12, x16, x18, x19는 각각 개별적으로 임의의 잔기일 수 있고,
x3, x14 및 x17은 각각 개별적으로 임의의 방향족 아미노산 잔기일 수 있으며,
x5는 P, hP, dhP 또는 BnHP중 하나일 수 있으며,
x9 및 x11은 각각 개별적으로 친핵성 또는 친전자성 측쇄를 포함하는 임의의 잔기일 수 있으며,
x13은 L, HL, Nva, I, HchA, HF 및 ThA로 이루어진 군으로부터 선택될 수 있고,
x20은 임의의 잔기일 수 있거나, 또는 x22 및 x21이 존재하지 않는 경우 존재하지 않을 수 있으며,
x21은 임의의 잔기일 수 있거나, 또는 x22가 존재하지 않는 경우 존재하지 않을 수 있고,
x22는 임의의 잔기일 수 있거나, 또는 존재하지 않을 수 있다.
x1은 Q일 수 있다. x1은 T일 수 있다. x1은 S일 수 있다. x1은 R일 수 있다. x1은 H일 수 있다. x2는 K일 수 있다. x2는 N일 수 있다. x2는 R일 수 있다. x2는 H일 수 있다. x2는 AcK일 수 있다. x2는 Nick일 수 있다. x2는 CbcK일 수 있다. 일부 실시양태에서, x2는 K, N, R, H, Ack, Nick 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 N, R, H, AcK, Nick 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 R, H, AcK, Nick 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 R, H, AcK 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 R, H 또는 AcK로 이루어진 군으로부터 선택될 수 있다. x3은 F일 수 있다. x3은 Y일 수 있다. x3은 W일 수 있다. x3은 BPA일 수 있다. x3은 CF일 수 있다. x3은 NF일 수 있다. x4는 Q일 수 있다. x4는 M일 수 있다. x4는 E일 수 있다. x4는 K일 수 있다. x5는 P일 수 있다. x5는 HP일 수 있다. x5는 DHP일 수 있다. x5는 BnHP일 수 있다. x6은 M일 수 있다. x6은 L일 수 있다. x6은 I일 수 있다. x9는 L일 수 있다. x9는 I일 수 있다. x9는 TA일 수 있다. x9는 ThA일 수 있다. x9는 K일 수 있다. x9는 AcK일 수 있다. x11은 Q일 수 있다. x11은 N일 수 있다. x11은 C일 수 있다. x11은 K일 수 있다. x11은 AcK일 수 있다. x11은 Dab일 수 있다. x11은 Dap일 수 있다. x12는 T일 수 있다. x12는 R일 수 있다. x12는 K일 수 있다. x13은 L일 수 있다. x13은 HL일 수 있다. x13은 Nva일 수 있다. x13은 I일 수 있다. x13은 HchA일 수 있다. x13은 HF일 수 있다. x13은 ThA일 수 있다. 일부 실시양태에서, x13은 L, HL, Nva, I, HchA, HF 및 ThA로 이루어진 군으로부터 선택될 수 있다. 일부 실시양태에서, x13은 L, HL 및 Nva로 이루어진 군으로부터 선택될 수 있다. x14는 F일 수 있다. x14는 Y일 수 있다. x14는 W일 수 있다. x14는 BPA일 수 있다. x14는 CF일 수 있다. x14는 NF일 수 있다. x16은 Q일 수 있다. x16은 N일 수 있다. x17은 F일 수 있다. x17은 Y일 수 있다. x17은 W일 수 있다. x17은 BPA일 수 있다. x17은 CF일 수 있다. x17은 NF일 수 있다. x18은 M일 수 있다. x19는 L일 수 있다. x19는 I일 수 있다. x20은 Q일 수 있다. x20은 N일 수 있다. x21은 Q일 수 있다. x21은 N일 수 있다. x22는 G일 수 있다.
일부 실시양태에서, 본 발명은 하기 서열 번호:163에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함하는 표적화제를 제공한다:
x1AcKx3x4x5x6DEx9Dx11x12x13x14Dx16x17x18x19x20x21x22 (서열 번호:163)
상기 서열에서,
x1, x4, x6, x12, x16, x18, x19는 각각 개별적으로 임의의 잔기일 수 있고,
x3, x14 및 x17은 각각 개별적으로 임의의 방향족 아미노산 잔기일 수 있으며,
x5는 P, hP, dhP 또는 BnHP일 수 있고,
x9 및 x11은 각각 개별적으로 친핵성 또는 친전자성 측쇄를 포함하는 임의의 잔기일 수 있으며,
x13은 L, HL, Nva, I, HchA, HF 및 ThA로 이루어진 군으로부터 선택될 수 있고,
x20은 임의의 잔기일 수 있거나, 또는 x22 및 x21이 존재하지 않는 경우 존재하지 않을 수 있으며,
x21은 임의의 잔기일 수 있거나, 또는 x22가 존재하지 않는 경우 존재하지 않을 수 있고,
x22는 임의의 잔기일 수 있거나, 또는 존재하지 않을 수 있다.
표 7의 화합물 22, 24, 29, 30, 31, 32, 33, 44, 45, 56, 57, 58, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 34, 35 및 42는 이 식에 의해 포괄되는 본 발명의 양태를 예시한다.
x1은 Q일 수 있다. x1은 T일 수 있다. x1은 S일 수 있다. x1은 R일 수 있다. x1은 H일 수 있다. x3은 F일 수 있다. x3은 Y일 수 있다. x3은 W일 수 있다. x3은 BPA일 수 있다. x3은 CF일 수 있다. x3은 NF일 수 있다. x4는 Q일 수 있다. x4는 M일 수 있다. x4는 E일 수 있다. x4는 K일 수 있다. x5는 P일 수 있다. x5는 HP일 수 있다. x5는 DHP일 수 있다. x5는 BnHP일 수 있다. x6은 M일 수 있다. x6은 L일 수 있다. x6은 I일 수 있다. x9는 L일 수 있다. x9는 I일 수 있다. x9는 TA일 수 있다. x9는 ThA일 수 있다. x9는 K일 수 있다. x9는 AcK일 수 있다. x11은 Q일 수 있다. x11은 N일 수 있다. x11은 C일 수 있다. x11은 K일 수 있다. x11은 AcK일 수 있다. x11은 Dab일 수 있다. x11은 Dap일 수 있다. x12는 T일 수 있다. x12는 R일 수 있다. x12는 K일 수 있다. x13은 L일 수 있다. x13은 HL일 수 있다. x13은 Nva일 수 있다. x13은 I일 수 있다. x13은 HchA일 수 있다. x13은 HF일 수 있다. x13은 ThA일 수 있다. 일부 실시양태에서, x13은 L, HL, Nva, I, HchA, HF 및 ThA로 이루어진 군으로부터 선택될 수 있다. 일부 실시양태에서, x13은 L, HL 및 Nva로 이루어진 군으로부터 선택될 수 있다. x14는 F일 수 있다. x14는 Y일 수 있다. x14는 W일 수 있다. x14는 BPA일 수 있다. x14는 CF일 수 있다. x14는 NF일 수 있다. x16은 Q일 수 있다. x16은 N일 수 있다. x17은 F일 수 있다. x17은 Y일 수 있다. x17은 W일 수 있다. x17은 BPA일 수 있다. x17은 CF일 수 있다. x17은 NF일 수 있다. x18은 M일 수 있다. x19는 L일 수 있다. x19는 I일 수 있다. x20은 Q일 수 있다. x20은 N일 수 있다. x21은 Q일 수 있다. x21은 N일 수 있다. x22는 G일 수 있다.
일부 실시양태에서, 본 발명은 하기 서열 번호:164에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함하는 표적화제를 제공한다:
x1Nx3x4x5x6DEx9Dx11x12x13x14Dx16x17x18x19x20x21x22 (서열 번호:164)
상기 서열에서,
x1, x4, x6, x12, x16, x18, x19는 각각 개별적으로 임의의 잔기일 수 있고,
x3, x14 및 x17은 각각 개별적으로 임의의 방향족 아미노산 잔기일 수 있으며,
x5는 P, hP, dhP 또는 BnHP일 수 있으며,
x9 및 x11은 각각 개별적으로 친핵성 또는 친전자성 측쇄를 포함하는 임의의 잔기일 수 있으며,
x13은 L, HL, Nva, I, HchA, HF 및 ThA로 이루어진 군으로부터 선택될 수 있고,
x20은 임의의 잔기일 수 있거나, 또는 x22 및 x21이 존재하지 않는 경우 존재하지 않을 수 있으며,
x21은 임의의 잔기일 수 있거나, 또는 x22가 존재하지 않는 경우 존재하지 않을 수 있고,
x22는 임의의 잔기일 수 있거나, 또는 존재하지 않을 수 있다.
표 7의 화합물 23, 25, 28, 56, 57 및 58은 본 발명의 이들 양태를 예시한다.
x1은 Q일 수 있다. x1은 T일 수 있다. x1은 S일 수 있다. x1은 R일 수 있다. x1은 H일 수 있다. x3은 F일 수 있다. x3은 Y일 수 있다. x3은 W일 수 있다. x3은 BPA일 수 있다. x3은 CF일 수 있다. x3은 NF일 수 있다. x4는 Q일 수 있다. x4는 M일 수 있다. x4는 E일 수 있다. x4는 K일 수 있다. x5는 P일 수 있다. x5는 HP일 수 있다. x5는 DHP일 수 있다. x5는 BnHP일 수 있다. x6은 M일 수 있다. x6은 L일 수 있다. x6은 I일 수 있다. x9는 L일 수 있다. x9는 I일 수 있다. x9는 TA일 수 있다. x9는 ThA일 수 있다. x9는 K일 수 있다. x9는 AcK일 수 있다. x11은 Q일 수 있다. x11은 N일 수 있다. x11은 C일 수 있다. x11은 K일 수 있다. x11은 AcK일 수 있다. x11은 Dab일 수 있다. x11은 Dap일 수 있다. x12는 T일 수 있다. x12는 R일 수 있다. x12는 K일 수 있다. x13은 L일 수 있다. x13은 HL일 수 있다. x13은 Nva일 수 있다. x13은 I일 수 있다. x13은 HchA일 수 있다. x13은 HF일 수 있다. x13은 ThA일 수 있다. 일부 실시양태에서, x13은 L, HL, Nva, I, HchA, HF 및 ThA로 이루어진 군으로부터 선택될 수 있다. 일부 실시양태에서, x13은 L, HL 및 Nva로 이루어진 군으로부터 선택될 수 있다. x14는 F일 수 있다. x14는 Y일 수 있다. x14는 W일 수 있다. x14는 BPA일 수 있다. x14는 CF일 수 있다. x14는 NF일 수 있다. x16은 Q일 수 있다. x16은 N일 수 있다. x17은 F일 수 있다. x17은 Y일 수 있다. x17은 W일 수 있다. x17은 BPA일 수 있다. x17은 CF일 수 있다. x17은 NF일 수 있다. x18은 M일 수 있다. x19는 L일 수 있다. x19는 I일 수 있다. x20은 Q일 수 있다. x20은 N일 수 있다. x21은 Q일 수 있다. x21은 N일 수 있다. x22는 G일 수 있다.
일부 실시양태에서, 본 발명은 하기 서열 번호:165에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함하는 표적화제를 제공한다:
x1x2x3x4x5x6DEx9DKx12x13x14Dx16x17x18x19x20x21x22 (서열 번호:165)
상기 서열에서,
x1, x2, x4, x6, x12, x16, x18, x19는 각각 개별적으로 임의의 잔기일 수 있고,
x3, x14 및 x17은 각각 개별적으로 임의의 방향족 아미노산 잔기일 수 있으며,
x5는 P, hP, dhP 또는 BnHP일 수 있으며,
x9는 임의의 잔기일 수 있고, 군 L, I, K, ThA 및 AcK로부터 선택될 수 있으며,
x13은 L, HL, Nva, I, HchA, HF 및 ThA로 이루어진 군으로부터 선택될 수 있고,
x20은 임의의 잔기일 수 있거나, 또는 x22 및 x21이 존재하지 않는 경우 존재하지 않을 수 있으며,
x21은 임의의 잔기일 수 있거나, 또는 x22가 존재하지 않는 경우 존재하지 않을 수 있고,
x22는 임의의 잔기일 수 있거나, 또는 존재하지 않을 수 있다.
x1은 Q일 수 있다. x1은 T일 수 있다. x1은 S일 수 있다. x1은 R일 수 있다. x1은 H일 수 있다. x2는 K일 수 있다. x2는 N일 수 있다. x2는 R일 수 있다. x2는 H일 수 있다. x2는 AcK일 수 있다. x2는 Nick일 수 있다. x2는 CbcK일 수 있다. 일부 실시양태에서, x2는 K, N, R, H, AcK, Nick 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 N, R, H, AcK, Nick 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 R, H, AcK, Nick 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 R, H, AcK 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 R, H 또는 AcK로 이루어진 군으로부터 선택될 수 있다. x3은 F일 수 있다. x3은 Y일 수 있다. x3은 W일 수 있다. x3은 BPA일 수 있다. x3은 CF일 수 있다. x3은 NF일 수 있다. x4는 Q일 수 있다. x4는 M일 수 있다. x4는 E일 수 있다. x4는 K일 수 있다. x5는 P일 수 있다. x5는 HP일 수 있다. x5는 DHP일 수 있다. x5는 BnHP일 수 있다. x6은 M일 수 있다. x6은 L일 수 있다. x6은 I일 수 있다. x9는 L일 수 있다. x9는 I일 수 있다. x9는 TA일 수 있다. x9는 ThA일 수 있다. x9는 K일 수 있다. x9는 AcK일 수 있다. x12는 T일 수 있다. x12는 R일 수 있다. x12는 K일 수 있다. x13은 L일 수 있다. x13은 HL일 수 있다. x13은 Nva일 수 있다. x13은 I일 수 있다. x13은 HchA일 수 있다. x13은 HF일 수 있다. x13은 ThA일 수 있다. 일부 실시양태에서, x13은 L, HL, Nva, I, HchA, HF 및 ThA로 이루어진 군으로부터 선택될 수 있다. 일부 실시양태에서, x13은 L, HL 및 Nva로 이루어진 군으로부터 선택될 수 있다. x14는 F일 수 있다. x14는 Y일 수 있다. x14는 W일 수 있다. x14는 BPA일 수 있다. x14는 CF일 수 있다. x14는 NF일 수 있다. x16은 Q일 수 있다. x16은 N일 수 있다. x17은 F일 수 있다. x17은 Y일 수 있다. x17은 W일 수 있다. x17은 BPA일 수 있다. x17은 CF일 수 있다. x17은 NF일 수 있다. x18은 M일 수 있다. x19는 L일 수 있다. x19는 I일 수 있다. x20은 Q일 수 있다. x20은 N일 수 있다. x21은 Q일 수 있다. x21은 N일 수 있다. x22는 G일 수 있다.
일부 실시양태에서, 본 발명은 하기 서열 번호:166에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함하는 표적화제를 제공한다:
Qx2x3Qx5LDEx9Dx11Tx13x14DQx17MLQQG (서열 번호:166)
상기 서열에서,
x2는 AcK, N, R, H, Nick, CbcK일 수 있고,
x3, x14 및 x17은 각각 개별적으로 임의의 방향족 아미노산 잔기일 수 있으며,
x5는 P, hP, dhP 또는 BnHP일 수 있으며,
x9는 K, AcK, Ile, L 또는 ThA중 임의의 하나일 수 있으며,
x11은 K, Dab, Dap, AcK, C 또는 R중 임의의 하나일 수 있고,
x13은 L, HL, Nva, I, HchA, HF 및 ThA로 이루어진 군으로부터 선택될 수 있다.
x2는 K일 수 있다. x2는 N일 수 있다. x2는 R일 수 있다. x2는 H일 수 있다. x2는 AcK일 수 있다. x2는 Nick일 수 있다. x2는 CbcK일 수 있다. 일부 실시양태에서, x2는 K, N, R, H, AcK, Nick 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 N, R, H, AcK, Nick 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 R, H, AcK, Nick 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 R, H, AcK 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 R, H 또는 AcK로 이루어진 군으로부터 선택될 수 있다. x3은 F일 수 있다. x3은 Y일 수 있다. x3은 W일 수 있다. x3은 BPA일 수 있다. x3은 CF일 수 있다. x3은 NF일 수 있다. x5는 P일 수 있다. x5는 HP일 수 있다. x5는 DHP일 수 있다. x5는 BnHP일 수 있다. x9는 L일 수 있다. x9는 I일 수 있다. x9는 TA일 수 있다. x9는 ThA일 수 있다. x9는 K일 수 있다. x9는 AcK일 수 있다. x11은 Q일 수 있다. x11은 N일 수 있다. x11은 C일 수 있다. x11은 K일 수 있다. x11은 AcK일 수 있다. x11은 Dab일 수 있다. x13은 L일 수 있다. x13은 HL일 수 있다. x13은 Nva일 수 있다. x13은 I일 수 있다. x13은 HchA일 수 있다. x13은 HF일 수 있다. x13은 ThA일 수 있다. 일부 실시양태에서, x13은 L, HL, Nva, I, HchA, HF 및 ThA로 이루어진 군으로부터 선택될 수 있다. 일부 실시양태에서, x13은 L, HL 및 Nva로 이루어진 군으로부터 선택될 수 있다. x14는 F일 수 있다. x14는 Y일 수 있다. x14는 W일 수 있다. x14는 BPA일 수 있다. x14는 CF일 수 있다. x14는 NF일 수 있다. x17은 F일 수 있다. x17은 Y일 수 있다. x17은 W일 수 있다. x17은 BPA일 수 있다. x17은 CF일 수 있다. x17은 NF일 수 있다.
일부 실시양태에서, 본 발명은 하기 서열 번호:167에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함하는 표적화제를 제공한다:
Qx2x3Qx5LDEx9DKTx13x14DQx17MLQQG (서열 번호:167)
상기 서열에서,
x2는 K, N, R, H, AcK, Nick 또는 CbcK중 하나일 수 있고,
x3, x14 및 x17은 각각 개별적으로 임의의 방향족 아미노산 잔기일 수 있으며,
x5는 P, hP, dhP 또는 BnHP일 수 있으며,
x9는 K, AcK, Ile, L 또는 ThA중 임의의 하나일 수 있으며,
x13은 L, HL, Nva, I, HchA, HF 및 ThA로 이루어진 군으로부터 선택될 수 있다.
x2는 K일 수 있다. x2는 N일 수 있다. x2는 R일 수 있다. x2는 H일 수 있다. x2는 AcK일 수 있다. x2는 Nick일 수 있다. x2는 CbcK일 수 있다. 일부 실시양태에서, x2는 K, N, R, H, AcK, Nick 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 N, R, H, AcK, Nick 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 R, H, AcK, Nick 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 R, H, AcK 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 R, H 또는 AcK로 이루어진 군으로부터 선택될 수 있다.
x3은 F일 수 있다. x3은 Y일 수 있다. x3은 W일 수 있다. x3은 BPA일 수 있다. x3은 CF일 수 있다. x3은 NF일 수 있다. x5는 P일 수 있다. x5는 HP일 수 있다. x5는 DHP일 수 있다. x5는 BnHP일 수 있다. x9는 L일 수 있다. x9는 I일 수 있다. x9는 TA일 수 있다. x9는 ThA일 수 있다. x9는 K일 수 있다. x9는 AcK일 수 있다. x13은 L일 수 있다. x13은 HL일 수 있다. x13은 Nva일 수 있다. x13은 I일 수 있다. x13은 HchA일 수 있다. x13은 HF일 수 있다. x13은 ThA일 수 있다. 일부 실시양태에서, x13은 L, HL, Nva, I, HchA, HF 및 ThA로 이루어진 군으로부터 선택될 수 있다. 일부 실시양태에서, x13은 L, HL 및 Nva로 이루어진 군으로부터 선택될 수 있다. x14는 F일 수 있다. x14는 Y일 수 있다. x14는 W일 수 있다. x14는 BPA일 수 있다. x14는 CF일 수 있다. x14는 NF일 수 있다. x17은 F일 수 있다. x17은 Y일 수 있다. x17은 W일 수 있다. x17은 BPA일 수 있다. x17은 CF일 수 있다. x17은 NF일 수 있다.
일부 실시양태에서, 본 발명은 하기 서열 번호:168에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함하는 표적화제를 제공한다:
QAcKx3Qx5LDEx9DKTx13x14DQx17MLQQG (서열 번호:168)
상기 서열에서,
x3, x14 및 x17은 각각 개별적으로 임의의 방향족 아미노산 잔기일 수 있으며,
x5는 P, hP, dhP 또는 BnHP일 수 있으며,
x9는 K, AcK, Ile, L 또는 ThA중 임의의 하나일 수 있으며,
x13은 L, HL, Nva, I, HchA, HF 및 ThA로 이루어진 군으로부터 선택될 수 있다.
x3은 F일 수 있다. x3은 Y일 수 있다. x3은 W일 수 있다. x3은 BPA일 수 있다. x3은 CF일 수 있다. x3은 NF일 수 있다. x5는 P일 수 있다. x5는 HP일 수 있다. x5는 DHP일 수 있다. x5는 BnHP일 수 있다. x9는 L일 수 있다. x9는 I일 수 있다. x9는 TA일 수 있다. x9는 ThA일 수 있다. x9는 K일 수 있다. x9는 AcK일 수 있다. x13은 L일 수 있다. x13은 HL일 수 있다. x13은 Nva일 수 있다. x13은 I일 수 있다. x13은 HchA일 수 있다. x13은 HF일 수 있다. x13은 ThA일 수 있다. 일부 실시양태에서, x13은 L, HL, Nva, I, HchA, HF 및 ThA로 이루어진 군으로부터 선택될 수 있다. 일부 실시양태에서, x13은 L, HL 및 Nva로 이루어진 군으로부터 선택될 수 있다. x14는 F일 수 있다. x14는 Y일 수 있다. x14는 W일 수 있다. x14는 BPA일 수 있다. x14는 CF일 수 있다. x14는 NF일 수 있다. x17은 F일 수 있다. x17은 Y일 수 있다. x17은 W일 수 있다. x17은 BPA일 수 있다. x17은 CF일 수 있다. x17은 NF일 수 있다.
일부 실시양태에서, 본 발명은 하기 서열 번호:169에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함하는 표적화제를 제공한다:
QNx3Qx5LDEx9DKTx13x14DQx17MLQQG (서열 번호:169)
상기 서열에서,
x3, x14 및 x17은 각각 개별적으로 임의의 방향족 아미노산 잔기일 수 있으며,
x5는 P, hP, dhP 또는 BnHP일 수 있으며,
x9는 K, AcK, Ile, L 또는 ThA중 임의의 하나일 수 있으며,
x13은 L, HL, Nva, I, HchA, HF 및 ThA로 이루어진 군으로부터 선택될 수 있다.
일부 실시양태에서, 본 발명은 하기 서열 번호:170에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함하는 표적화제를 제공한다:
x1x2x3x4x5x6DEx9Dx11x12Lx14Dx16x17x18x19x20x21x22 (서열 번호:170)
상기 서열에서,
x1, x4, x6, x12, x16, x18 및 x19는 각각 개별적으로 임의의 잔기일 수 있으며,
x2는 AcK, N, R, H, Nick, CbcK일 수 있고,
x3, x14 및 x17은 각각 개별적으로 임의의 방향족 아미노산 잔기일 수 있으며,
x5는 P, hP, dhP 또는 BnHP중 하나일 수 있으며,
x9 및 x11은 각각 개별적으로 친핵성 또는 친전자성 측쇄를 포함하는 임의의 잔기일 수 있으며,
x20은 임의의 잔기일 수 있거나, 또는 x22 및 x21이 존재하지 않는 경우 존재하지 않을 수 있고,
x21은 임의의 잔기일 수 있거나, 또는 x22가 없는 경우 존재하지 않을 수 있으며,
x22는 임의의 잔기일 수 있거나, 또는 존재하지 않을 수 있다.
일부 실시양태에서, 본 발명은 하기 서열 번호:171에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함하는 표적화제를 제공한다:
x1AcKx3x4x5x6DEx9Dx11x12Lx14Dx16x17x18x19x20x21x22 (서열 번호:171)
상기 서열에서,
x1, x4, x6, x12, x16, x18 및 x19는 각각 개별적으로 임의의 잔기일 수 있으며,
x3, x14 및 x17은 각각 개별적으로 임의의 방향족 아미노산 잔기일 수 있으며,
x5는 P, hP, dhP 또는 BnHP일 수 있으며,
x9 및 x11은 각각 개별적으로 친핵성 또는 친전자성 측쇄를 포함하는 임의의 잔기일 수 있으며,
x20은 임의의 잔기일 수 있거나, 또는 x22 및 x21이 존재하지 않는 경우 존재하지 않을 수 있고,
x21은 임의의 잔기일 수 있거나, 또는 x22가 없는 경우 존재하지 않을 수 있으며,
x22는 임의의 잔기일 수 있거나, 또는 존재하지 않을 수 있다.
표 7의 화합물 22, 24, 29, 30, 33, 34, 35, 36, 37, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 54, 55 및 62는 이 식에 의해 포괄되는 본 발명의 양태를 예시한다.
일부 실시양태에서, 본 발명은 하기 서열 번호:172에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함하는 표적화제를 제공한다:
x1Nx3x4x5x6DEx9Dx11x12Lx14Dx16x17x18x19x20x21x22 (서열 번호:172)
상기 서열에서,
x1, x4, x6, x12, x16, x18 및 x19는 각각 개별적으로 임의의 잔기일 수 있으며,
x3, x14 및 x17은 각각 개별적으로 임의의 방향족 아미노산 잔기일 수 있으며,
x5는 P, hP, dhP 또는 BnHP일 수 있으며,
x9 및 x11은 각각 개별적으로 친핵성 또는 친전자성 측쇄를 포함하는 임의의 잔기일 수 있으며,
x20은 임의의 잔기일 수 있거나, 또는 x22 및 x21이 존재하지 않는 경우 존재하지 않을 수 있고,
x21은 임의의 잔기일 수 있거나, 또는 x22가 없는 경우 존재하지 않을 수 있으며,
x22는 임의의 잔기일 수 있거나, 또는 존재하지 않을 수 있다.
표 7의 화합물 23, 25, 28, 56, 57 및 58은 이 식으로 포괄되는 본 발명의 양태를 예시한다.
일부 실시양태에서, 본 발명은 하기 서열 번호:173에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함하는 표적화제를 제공한다:
x1x2x3x4x5x6DEx9DKx12Lx14Dx16x17x18x19x20x21x22 (서열 번호:173)
상기 서열에서,
x1, x4, x6, x12, x16, x18 및 x19는 각각 개별적으로 임의의 잔기일 수 있으며,
x2는 AcK, N, R, H, Nick, CbcK일 수 있고,
x3, x14 및 x17은 각각 개별적으로 임의의 방향족 아미노산 잔기일 수 있으며,
x5는 P, hP, dhP 또는 BnHP일 수 있으며,
x9는 임의의 잔기일 수 있고, 군 L, I, K, ThA 및 AcK로부터 선택될 수 있으며,
x20은 임의의 잔기일 수 있거나, 또는 x22 및 x21이 존재하지 않는 경우 존재하지 않을 수 있고,
x21은 임의의 잔기일 수 있거나, 또는 x22가 없는 경우 존재하지 않을 수 있으며,
x22는 임의의 잔기일 수 있거나, 또는 존재하지 않을 수 있다.
일부 실시양태에서, 본 발명은 하기 서열 번호:174에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함하는 표적화제를 제공한다:
Qx2x3Qx5LDEx9Dx11TLx14DQx17MLQQG (서열 번호:174)
상기 서열에서,
x2는 AcK, N, R, H, Nick, CbcK일 수 있고,
x3, x14 및 x17은 각각 개별적으로 임의의 방향족 아미노산 잔기일 수 있으며,
x5는 P, hP, dhP 또는 BnHP일 수 있으며,
x9는 K, AcK, Ile, L 또는 ThA중 임의의 하나일 수 있으며,
x11은 K, Dab, AcK, C 또는 R중 임의의 하나일 수 있다.
일부 실시양태에서, 본 발명은 하기 서열 번호:175에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함하는 표적화제를 제공한다:
Qx2x3Qx5LDEx9DKTLx14DQx17MLQQG (서열 번호:175)
상기 서열에서,
x2는 K, N, R, H, AcK, Nick, 또는 CbcK일 수 있고,
x3, x14 및 x17은 각각 개별적으로 임의의 방향족 아미노산 잔기일 수 있으며,
x5는 P, hP, dhP 또는 BnHP일 수 있으며,
x9는 K, AcK, Ile, L 또는 ThA중 임의의 하나일 수 있다.
일부 실시양태에서, 본 발명은 하기 서열 번호:176에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함하는 표적화제를 제공한다:
QAcKx3Qx5LDEx9DKTLx14DQx17MLQQG (서열 번호:176)
상기 서열에서,
x3, x14 및 x17은 각각 개별적으로 임의의 방향족 아미노산 잔기일 수 있으며,
x5는 P, hP, dhP 또는 BnHP일 수 있으며,
x9는 K, AcK, Ile, L 또는 ThA중 임의의 하나일 수 있다.
일부 실시양태에서, 본 발명은 하기 서열 번호:177에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함하는 표적화제를 제공한다:
QNx3Qx5LDEx9DKTLx14DQx17MLQQG (서열 번호:177)
상기 서열에서,
x3, x14 및 x17은 각각 개별적으로 임의의 방향족 아미노산 잔기일 수 있으며,
x5는 P, hP, dhP 또는 BnHP일 수 있으며,
x9는 K, AcK, Ile, L 또는 ThA중 임의의 하나일 수 있다.
본 발명의 화합물은 아미노-말단(N-말단) 캡핑 기 또는 카복시-말단(C-말단) 캡핑 기를 포함할 수 있다. N-말단 캡핑 기는 "ac": C(O)CH3일 수 있다(예를 들어, 표 7의 화합물 21, 22, 23, 24, 25, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63). 본 발명의 화합물은 N-말단 캡핑 기로서 DBC 기를 포함할 수 있다(예컨대, 표 7의 화합물 49). 본 발명의 화합물은 N-말단 캡핑 기로서 DFB 기를 포함할 수 있다(예를 들어, 표 7의 화합물 50). 본 발명의 화합물은 N-말단 캡핑 기로서 PyC 기를 포함할 수 있다(예를 들면, 표 7의 화합물 51). 본 발명의 화합물은 N-말단 캡핑 기로서 2-PEG 기를 포함할 수 있다(예를 들어, 표 7의 화합물 52). C-말단 캡핑 기는 "am": NH2일 수 있다.
몇몇 실시양태에서, 본 발명은 하기 서열 번호:178에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함하는 안지오포이에틴 수용체-길항제(AA) 표적화제를 제공한다:
Q1x2Y3Q4x5L6D7E8x9D10x11T12x13x14x15x16F17x18x19Q20Q21G22 (서열 번호:178)
상기 서열에서,
x2는 K, N, R, H, Ack, Nick, CbcK 및 연결 잔기로 이루어진 군으로부터 선택되고,
x5는 P, hP, dhP 또는 BnHP로 이루어진 군으로부터 선택되며,
x9는 L, I, ThA, AcK 및 연결 잔기로 이루어진 군으로부터 선택되고,
x11은 Q, N, C, K, AcK, Dab, Dap 및 연결 잔기로 이루어진 군으로부터 선택되고,
x13은 L, HL, Nva, I, HchA, HF, ThA 및 연결 잔기로 이루어진 군으로부터 선택되고,
x14는 방향족 잔기 및 연결 잔기로 이루어진 군으로부터 선택되고,
x15는 D 및 연결 잔기로 이루어진 군으로부터 선택되며,
x16은 Q, N 및 연결 잔기로 이루어진 군으로부터 선택되며,
x18은 M 및 연결 잔기로 이루어진 군으로부터 선택되고,
x19는 L, I 및 연결 잔기로 이루어진 군으로부터 선택되며,
Q1, x9, x11, x13, x15, x16, x18, x19 및 G22중 하나는 항체의 결합 부위에 직접 또는 중간 연결기를 거쳐 공유 결합될 수 있는 친핵성 측쇄를 포함하는 연결 잔기이며, 이 연결 잔기는 K, R, Y, C, T 및 S, 또는 N-말단 또는 C-말단을 포함하는 군으로부터 선택된다.
몇몇 실시양태에서, 본 발명은 하기 서열 번호:193에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함하는 안지오포이에틴 수용체-길항제(AA) 표적화제를 제공한다:
Q1x2Y3Q4x5L6D7x8x9D10x11x12x13x14x15x16F17x18x19Q20Q21G22 (서열 번호:193)
상기 서열에서,
x2는 K, N, R, H, Ack, Nick, CbcK 및 연결 잔기로 이루어진 군으로부터 선택되고,
x5는 P, hP, dhP 또는 BnHP로 이루어진 군으로부터 선택되며,
x8은 E 또는 연결 잔기이고,
x9는 L, I, ThA, AcK 및 연결 잔기로 이루어진 군으로부터 선택되고,
x11은 Q, N, C, K, AcK, Dab, Dap 및 연결 잔기로 이루어진 군으로부터 선택되고,
x12는 T 또는 연결 잔기이며,
x13은 L, HL, Nva, I, HchA, HF, ThA로 이루어진 군으로부터 선택되고,
x14는 방향족 잔기 및 연결 잔기로 이루어진 군으로부터 선택되고,
x15는 D 및 연결 잔기로 이루어진 군으로부터 선택되며,
x16은 Q, N 및 연결 잔기로 이루어진 군으로부터 선택되며,
x18은 M 및 연결 잔기로 이루어진 군으로부터 선택되고,
x19는 L, I 및 연결 잔기로 이루어진 군으로부터 선택되며,
Q1, x9, x8, x11, x12, x15, x16, x18, x19 및 G22중 하나는 항체의 결합 부위에 직접 또는 중간 연결기를 거쳐 공유 결합될 수 있는 친핵성 측쇄를 포함하는 연결 잔기이며, 이 연결 잔기는 K, R, Y, C, T, S, Dap, Dab, S의 동종체, C의 동종체, K의 동종체, 또는 N-말단 또는 C-말단을 포함하는 군으로부터 선택된다.
연결 잔기는 K, Y, T, Dap 및 Dab로 이루어진 군으로부터 선택될 수 있다. 연결 잔기는 x9, x11, x12, x15, x16, x18 및 x19중 하나에 위치할 수 있다. 일부 실시양태에서, x11은 연결 잔기이다. 표 7 및 8은 상이한 연결 잔기에서 h38C2의 결합 부위에 공유 결합되는 본 발명의 화합물의 예를 제공한다.
x2는 K, N, AcK로 이루어진 군으로부터 선택될 수 있다. x2가 N인 본 발명의 예시적인 화합물은 23, 25, 28, 56, 57 및 58이다. x2가 AcK인 본 발명의 예시적인 화합물은 22, 24, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 43(a), 44, 45, 46, 47, 48, 49, 50, 51, 52, 54, 55, 62, 63, 64, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87 및 91이다.
x5는 P, hP 및 dhP로 이루어진 군으로부터 선택될 수 있다. x5가 P인 본 발명의 예시적인 화합물은 21, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 35, 36, 37, 38, 39, 40, 41, 42, 43, 43(a), 44, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90 및 91이다. x5가 HP인 본 발명의 예시적인 화합물은 35, 45, 46 및 47이다. x5가 DHP인 본 발명의 예시적인 화합물은 34이다.
x8은 E일 수 있다.
x11은 K, AcK, Dab 및 Dap로 이루어진 군으로부터 선택될 수 있다. x11이 AcK인 본 발명의 예시적인 화합물은 30 및 32이다. x11이 Dab인 본 발명의 예시적인 화합물은 54이다. x11이 Dap인 본 발명의 예시적인 화합물은 55이다.
x12는 T일 수 있다.
x13은 K, L, HL, Nva 및 I로 이루어진 군으로부터 선택될 수 있다. x13이 K인 본 발명의 예시적인 화합물은 31 및 32이다. x13이 HL인 본 발명의 예시적인 화합물은 42이다. x13이 Nva인 본 발명의 예시적인 화합물은 41이다. x13이 I인 본 발명의 예시적인 화합물은 36이다.
x14는 F, Y, W, BPA, CF 및 NF로 이루어진 군으로부터 선택될 수 있다. x14가 F인 본 발명의 예시적인 화합물은 44이다. x14가 BPA인 본 발명의 예시적인 화합물은 46 및 56이다. x14가 CF인 본 발명의 예시적인 화합물은 47, 57 및 62이다. x14가 NF인 본 발명의 예시적인 화합물은 45, 48 및 58이다.
본 발명의 AA 표적화제는 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 43(a), 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90 및 91로 이루어진 군으로부터 선택되는 하나 이상의 화합물에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함할 수 있다.
본 발명의 AA 표적화제는 24, 25, 26, 27, 28, 29, 30, 34, 35, 37, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 54, 55, 56, 57, 58, 59, 60, 61, 62, 75, 76, 77, 78 및 79로 이루어진 군으로부터 선택되는 하나 이상의 화합물에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함할 수 있다.
본 발명의 AA 표적화제는 24, 25, 27, 28, 29, 30, 34, 35, 37, 41, 42, 43, 44, 45, 46, 47, 48, 56, 57, 58, 60, 62, 75, 76, 77, 78 및 79로 이루어진 군으로부터 선택되는 하나 이상의 화합물에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함할 수 있다.
본 발명의 AA 표적화제는 22, 34, 41, 43, 44, 48 및 91로 이루어진 군으로부터 선택되는 하나 이상의 화합물에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함할 수 있다.
본 발명의 AA 표적화제는 27, 28, 29, 43, 45 및 48로 이루어진 군으로부터 선택되는 하나 이상의 화합물에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함할 수 있다.
본 발명의 화합물은 Ang2를 표적화하는데 유용하고, 기존 Ang2-표적화제에 비해 유리한 특성을 나타낸다. 본 발명의 일부 양태에서, 본 발명의 유리한 약제와 화합물은 반감기와 IC50 값 사이에서 우수한 평형을 제공한다.
본 발명의 몇몇 실시양태에서, x9 및 x11중 하나 이상의 잔기는 측쇄가 각각 친전자체 또는 친핵체를 포함하는 화학적 기에 공유 결합될 수 있는 아미노산을 포함하는 연결 잔기이다.
연결 잔기의 존재는 골격(scaffold), 거대분자 및 다른 잔기로의 연결 면에서 융통성이 큰 본 발명의 표적화제를 제공한다. 구체적으로, 본 발명의 화합물은 항체 같은 골격에 신뢰성 있게, 단단히 또한 효율적으로 공유 결합될 수 있다. 놀랍게도, 펩타이드의 특정 핵심 위치에 연결 잔기가 존재하면 펩타이드의 안정성 및/또는 결합력이 증가하는 것으로 밝혀졌다.
연결 잔기는 연결 잔기의 아미노 말단, 카복시 말단 또는 측쇄를 통한 공유 결합에 이용될 수 있는 아미노산 잔기이다. 연결 잔기는 K일 수 있다. 다른 실시양태에서, 연결 잔기는 Y일 수 있다. 다른 실시양태에서, 연결 잔기는 T일 수 있다. 연결 잔기는 Dab일 수 있다. 연결 잔기는 Dap일 수 있다. 일부 실시양태에서, 연결 잔기는 K, Dab, Dap, Y 및 T로 이루어진 군으로부터 선택된다.
다른 실시양태에서, 연결 잔기는 C일 수 있다. 연결 잔기는 R일 수 있다. 연결 잔기는 S일 수 있다. 연결 잔기는 N일 수 있다. 연결 잔기는 Q일 수 있다. 연결 잔기는 D일 수 있다. 연결 잔기는 E일 수 있다.
연결 잔기는 임의의 한 잔기일 수 있다. 몇몇 실시양태에서, 연결 잔기는 x9일 수 있다. 연결 잔기는 x11일 수 있다. 몇몇 실시양태에서, 연결 잔기로서 리신 및 개질된 리신 잔기의 측쇄를 사용하면, 이 위치에서의 특이적이고 신뢰성 있으며 지향성이고 효율적인 화학적 공유 결합이 가능해짐을 비롯한 특정 이점을 제공하는 것으로 밝혀졌다.
상기 식(서열 번호:161 내지 178, 및 서열 번호:193)과 관련하여, 또한 더욱 일반적으로는 다음과 같다:
x1은 Q일 수 있다. x1은 T일 수 있다. x1은 S일 수 있다. x1은 R일 수 있다. x1은 H일 수 있다. x2는 N일 수 있다. x2는 R일 수 있다. x2는 H일 수 있다. x2는 AcK일 수 있다. x2는 Nick일 수 있다. x2는 CbcK일 수 있다. 일부 실시양태에서, x2는 K, N, R, H, Ack, Nick 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 N, R, H, AcK, Nick 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 R, H, AcK, Nick 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 R, H, AcK 또는 CbcK로 이루어진 군으로부터 선택될 수 있다. x2는 R, H 또는 AcK로 이루어진 군으로부터 선택될 수 있다. 연결기 및 항체를 포함하는 본 발명의 일부 실시양태에서, x2는 K일 수 있다. x3은 F일 수 있다. x3은 Y일 수 있다. x3은 W일 수 있다. x3은 BPA일 수 있다. x3은 CF일 수 있다. x3은 NF일 수 있다. x4는 Q일 수 있다. x4는 M일 수 있다. x4는 E일 수 있다. x4는 K일 수 있다. x6은 M일 수 있다. x6은 L일 수 있다. x6은 I일 수 있다. x8은 E일 수 있다. x8은 D일 수 있다. x9는 L일 수 있다. x9는 I일 수 있다. x9는 TA일 수 있다. x9는 ThA일 수 있다. x9는 K일 수 있다. x9는 AcK일 수 있다. X9는 연결 잔기일 수 있다. x10은 E일 수 있다. x10은 D일 수 있다. x11은 Q일 수 있다. x11은 N일 수 있다. x11은 C일 수 있다. x11은 K일 수 있다. x11은 AcK일 수 있다. x11은 Dab일 수 있다. x11은 Dap일 수 있다. X11은 연결 잔기일 수 있다. x12는 T일 수 있다. x12는 R일 수 있다. x12는 K일 수 있다. x13은 L일 수 있다. x13은 HL일 수 있다. x13은 Nva일 수 있다. x13은 I일 수 있다. x13은 HchA일 수 있다. x13은 HF일 수 있다. x13은 ThA일 수 있다. 일부 실시양태에서, x13은 L, HL, Nva, I, HchA, HF 및 ThA로 이루어진 군으로부터 선택될 수 있다. 일부 실시양태에서, x13은 L, HL 및 Nva로 이루어진 군으로부터 선택될 수 있다. x14는 F일 수 있다. x14는 Y일 수 있다. x14는 W일 수 있다. x14는 BPA일 수 있다. x14는 CF일 수 있다. x14는 NF일 수 있다. x15는 D일 수 있다. x15는 E일 수 있다. x16은 Q일 수 있다. x16은 N일 수 있다. x17은 F일 수 있다. x17은 Y일 수 있다. x17은 W일 수 있다. x17은 BPA일 수 있다. x17은 CF일 수 있다. x17은 NF일 수 있다. x18은 M일 수 있다. x19는 L일 수 있다. x19는 I일 수 있다. x20은 Q일 수 있다. x20은 N일 수 있다. x21은 Q일 수 있다. x21은 N일 수 있다. x22는 G일 수 있다.
본 발명의 일부 양태에서, 본 발명의 AA 표적화제는 임의의 안지오포이에틴 2 길항제를 포함할 수 있다.
본 발명의 일부 양태에서, 본 발명의 AA 표적화제는 서열 번호:21, 서열 번호:22, 서열 번호:23, 서열 번호:24, 서열 번호:25, 서열 번호:26, 서열 번호:27, 서열 번호:28, 서열 번호:29, 서열 번호:30, 서열 번호:31, 서열 번호:32, 서열 번호:33, 서열 번호:34, 서열 번호:35, 서열 번호:36, 서열 번호:37, 서열 번호:38, 서열 번호:39, 서열 번호:40, 서열 번호:41, 서열 번호:42, 서열 번호:43, 서열 번호:44, 서열 번호:45, 서열 번호:46, 서열 번호:47, 서열 번호:48, 서열 번호:49, 서열 번호:50, 서열 번호:51, 서열 번호:52, 서열 번호:53, 서열 번호:54, 서열 번호:55, 서열 번호:56, 서열 번호:57, 서열 번호:58, 서열 번호:59, 서열 번호:60, 서열 번호:61, 서열 번호:62, 서열 번호:63, 서열 번호:64, 서열 번호:65, 서열 번호:66, 서열 번호:67, 서열 번호:68, 서열 번호:69, 서열 번호:70, 서열 번호:71, 서열 번호:72, 서열 번호:73, 서열 번호:74, 서열 번호:75, 서열 번호:76, 서열 번호:77, 서열 번호:78, 서열 번호:79, 서열 번호:80, 서열 번호:81, 서열 번호:82, 서열 번호:83, 서열 번호:84, 서열 번호:85, 서열 번호:86, 서열 번호:87, 서열 번호:88, 서열 번호:89, 서열 번호:90, 서열 번호:91, 서열 번호:92, 서열 번호:93, 서열 번호:94, 서열 번호:95, 서열 번호:96, 서열 번호:97, 서열 번호:98, 서열 번호:99, 서열 번호:100, 서열 번호:101, 서열 번호:102, 서열 번호:103, 서열 번호:104, 서열 번호:105, 서열 번호:106, 서열 번호:107, 서열 번호:108, 서열 번호:109, 서열 번호:110, 서열 번호:111, 서열 번호:112, 서열 번호:113, 서열 번호:114, 서열 번호:115, 서열 번호:116, 서열 번호:117, 서열 번호:118, 서열 번호:119, 서열 번호:120, 서열 번호:121, 서열 번호:122, 서열 번호:123, 서열 번호:124, 서열 번호:125, 서열 번호:126, 서열 번호:127, 서열 번호:128, 서열 번호:129, 서열 번호:130, 서열 번호:131, 서열 번호:132, 서열 번호:133, 서열 번호:134, 서열 번호:135, 서열 번호:136, 서열 번호:137, 서열 번호:138, 서열 번호:139, 서열 번호:140, 서열 번호:141, 서열 번호:142, 서열 번호:143, 서열 번호:144, 서열 번호:145, 서열 번호:146, 서열 번호:147, 서열 번호:148, 서열 번호:149, 서열 번호:150, 서열 번호:151, 서열 번호:152, 서열 번호:153, 서열 번호:154, 서열 번호:155, 서열 번호:156, 서열 번호:157, 서열 번호:158, 서열 번호:159, 서열 번호:160, 서열 번호:161, 서열 번호:162, 서열 번호:163, 서열 번호:164, 서열 번호:165, 서열 번호:166, 서열 번호:167, 서열 번호:168, 서열 번호:169, 서열 번호:170, 서열 번호:171, 서열 번호:172, 서열 번호:173, 서열 번호:174, 서열 번호:175, 서열 번호:176, 서열 번호:177, 서열 번호:178, 서열 번호:191, 서열 번호:192, 및 서열 번호:193으로 이루어진 군으로부터 선택되는 하나 이상의 서열에 실질적으로 상동인 서열을 포함하는 펩타이드를 포함할 수 있다.
일부 양태에서, 본 발명은 하기 서열들로 이루어진 군으로부터 선택되는 AA 표적화제를 제공한다:
R1-Q(AcK)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:29)
R1-QNY QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:28)
R1-Q(AcK)Y QPL DEK D(AcK)T LYD QFM LQQ G-R2; (서열 번호:30)
R1-Q(AcK)Y QPL DEK DET LYD QFM LQQ G-R2; (서열 번호:33)
R1-Q(AcK)Y Q(DHP)L DEL DKT LYD QFM LQQ G-R2; (서열 번호:34)
R1-Q(AcK)Y Q(HP)L DEL DKT LYD QFM LQQ G-R2; (서열 번호:35)
R1-Q(AcK)Y QPL DEL DKT IYD QFM LQQ G-R2; (서열 번호:36)
R1-Q(AcK)Y QPL DEI DKT LYD QFM LQQ G-R2; (서열 번호:37)
R1-Q(AcK)Y QPL DEL DKT (HChA)YD QFM LQQ G-R2; (서열 번호:38)
R1-Q(AcK)Y QPL DEL DKT (HF)YD QFM LQQ G-R2; (서열 번호:39)
R1-Q(AcK)Y QPL DEL DKT (ThA)YD QFM LQQ G-R2; (서열 번호:40)
R1-Q(AcK)Y QPL DEL DKT (Nva)YD QFM LQQ G-R2; (서열 번호:41)
R1-Q(AcK)Y QPL DEL DKT (HL)YD QFM LQQ G-R2; (서열 번호:42)
R1-Q(AcK)Y QPL DE(AcK) DKT LYD QFM LQQ G-R2; (서열 번호:43)
R1-Q(AcK)Y QPL DEL DKT LFD QFM LQQ G-R2; (서열 번호:44)
R1-Q(AcK)Y Q(HP)L DE(ThA) DKT L(NO2F)D QFM LQQ G-R2; (서열 번호:45)
R1-Q(AcK)Y Q(HP)L DE(ThA) DKT L(BPA)D QFM LQQ G-R2; (서열 번호:46)
R1-Q(AcK)Y Q(HP)L DE(ThA) DKT L(CO2H)FD QFM LQQ G-R2; (서열 번호:47)
R1-Q(AcK)Y QPL DE(AcK) DKT L(NO2F)D QFM LQQ G-R2; (서열 번호:48)
R1-Q(AcK)Y QPL DE(AcK) DKT LFD QFM LQQ G-R2 (서열 번호:63)
DCB-Q(AcK)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:49)
DFB-Q(AcK)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:50)
PyC-Q(AcK)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:51)
아미도 2-PEG-Q(AcK)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:52)
R1-Q(ClBn카밤에이트K)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:53)
R1-Q(AcK)Y QPL DEL D(Dab)T LYD QFM LQQ G-R2; (서열 번호:54)
R1-Q(AcK)Y QPL DEL D(Dap)T LYD QFM LQQ G-R2; (서열 번호:55)
R1-Q(AcK)Y QPL DEL DKT L(NO2F)D QFM LQQ G-R2; (서열 번호:91)
R1-QNY QPL DEL DKT L(BPA)D QFM LQQ G-R2; (서열 번호:56)
R1-QNY QPL DEL DKT L(CF)D QFM LQQ G-R2; (서열 번호:57)
R1-Q(Nick)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:61)
R1-Q(AcK)Y QPL DE(AcK) DKT L(CF)D QFM LQQ G-R2; (서열 번호:62) 및
R1-Q(AcK)Y QPL DE(AcK) DKT LFD QFM LQQ G-R2; (서열 번호:63)
상기 서열에서,
R1은 CH3, C(O)CH3, C(O)CH3, C(O)CH2CH3, C(O)CH2CH2CH3, C(O)CH(CH3)CH3, C(O)CH2CH2CH2CH3, C(O)CH(CH3)CH2CH3, C(O)C6H5, C(O)CH2CH2(CH2CH2O)1-5Me, 다이클로로벤조일(DCB), 다이플루오로벤조일(DFB), 피리딘일 카복실레이트(PyC) 또는 아미도-2-PEG, 아미노 보호기, 지질 지방산기 또는 탄수화물이고;
R2는 OH, NH2, NH(CH3), NHCH2CH3, NHCH2CH2CH3, NHCH(CH3)CH3, NHCH2CH2CH2CH3, NHCH(CH3)CH2CH3, NHC6H5, NHCH2CH2OCH3, NHOCH3, NHOCH2CH3, 카복시 보호기, 지질 지방산기 또는 탄수화물이다.
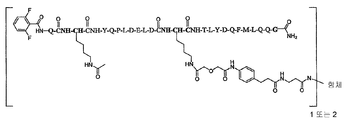
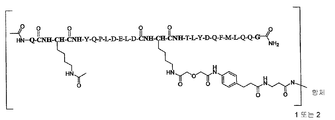
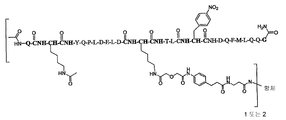
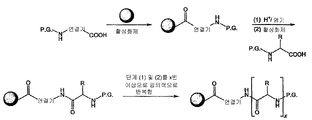
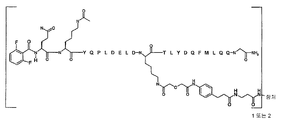
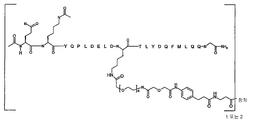
일부 양태에서, 본 발명은 하기 화학식 I로 표시되는 AA 표적화제-연결기 컨쥬게이트(conjugate), 및 그의 약학적으로 허용가능한 염, 입체 이성질체, 호변 이성질체, 용매화물 및 전구약물을 제공한다:
[화학식 I]
L-[AA 표적화제]
상기 식에서,
[AA 표적화제]는
R1-QKY QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:21)
R1-Q(AcK)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:22)
R1-QNY QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:23)
R1-Q(AcK)Y QPL DEK D(AcK)T LYD QFM LQQ G-R2; (서열 번호:30)
R1-Q(AcK)Y QPL DEK DET LYD QFM LQQ G-R2; (서열 번호:33)
R1-Q(AcK)Y Q(DHP)L DEL DKT LYD QFM LQQ G-R2; (서열 번호:34)
R1-Q(AcK)Y Q(HP)L DEL DKT LYD QFM LQQ G-R2; (서열 번호:35)
R1-Q(AcK)Y QPL DEL DKT IYD QFM LQQ G-R2; (서열 번호:36)
R1-Q(AcK)Y QPL DEI DKT LYD QFM LQQ G-R2; (서열 번호:37)
R1-Q(AcK)Y QPL DEL DKT (HChA)YD QFM LQQ G-R2; (서열 번호:38)
R1-Q(AcK)Y QPL DEL DKT (HF)YD QFM LQQ G-R2; (서열 번호:39)
R1-Q(AcK)Y QPL DEL DKT (ThA)YD QFM LQQ G-R2; (서열 번호:40)
R1-Q(AcK)Y QPL DEL DKT (Nva)YD QFM LQQ G-R2; (서열 번호:41)
R1-Q(AcK)Y QPL DEL DKT (HL)YD QFM LQQ G-R2; (서열 번호:42)
R1-Q(AcK)Y QPL DE(AcK) DKT LYD QFM LQQ G-R2; (서열 번호:43)
R1-Q(AcK)Y QPL DEL DKT LFD QFM LQQ G-R2; (서열 번호:44)
R1-Q(AcK)Y Q(HP)L DE(ThA) DKT L(NO2F)D QFM LQQ G-R2; (서열 번호:45)
R1-Q(AcK)Y Q(HP)L DE(ThA) DKT L(BPA)D QFM LQQ G-R2; (서열 번호:46)
R1-Q(AcK)Y Q(HP)L DE(ThA) DKT L(CO2H)FD QFM LQQ G-R2; (서열 번호:47)
R1-Q(AcK)Y QPL DE(AcK) DKT L(NO2F)D QFM LQQ G-R2; (서열 번호:48)
R1-Q(AcK)Y QPL DE(AcK) DKT LFD QFM LQQ G-R2; (서열 번호:68)
DCB-Q(AcK)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:49)
DFB-Q(AcK)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:50)
PyC-Q(AcK)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:51)
아미도 2-PEG-Q(AcK)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:52)
R1-Q(ClBn카밤에이트K)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:53)
R1-Q(AcK)Y QPL DEL D(Dab)T LYD QFM LQQ G-R2; (서열 번호:54)
R1-Q(AcK)Y QPL DEL D(Dap)T LYD QFM LQQ G-R2; (서열 번호:55)
R1-Q(AcK)Y QPL DEL DKT L(NO2F)D QFM LQQ G-R2; (서열 번호:91)
R1-QNY QPL DEL DKT L(BPA)D QFM LQQ G-R2; (서열 번호:56)
R1-QNY QPL DEL DKT L(CF)D QFM LQQ G-R2; (서열 번호:57)
R1-QNY QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:58)
R1-Q(Nick)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:61)
R1-Q(AcK)Y QPL DE(AcK) DKT L(CF)D QFM LQQ G-R2; (서열 번호:62) 및
R1-Q(AcK)Y QPL DE(AcK) DKT LFD QFM LQQ G-R2; (서열 번호:63)으로 이루어진 군으로부터 선택되는 펩타이드이고;
R1은 표적화제의 아미노 말단 잔기의 아미노기 부분을 나타내고, NH2, NHC(O)CH3, NHC(O)CH2CH3, NHC(O)CH2CH2CH3, NHC(O)CH(CH3)CH3, NHC(O)CH2CH2CH2CH3, NHC(O)CH(CH3)CH2CH3, NHC(O)C6H5, NH(CH3)C(O)CH2CH2(CH2CH2O)1-5Me, 아미노 보호기, 지질 지방산기 또는 탄수화물이고;
R2는 표적화제의 카복시 말단 잔기의 카복시 말단 부분을 가리키며, COOH, C(O)NH2, C(O)NH(CH3), C(O)NHCH2CH3, C(O)NHCH2CH2CH3, C(O)NHCH(CH3)CH3, C(O)NHCH2CH2CH2CH3, C(O)NHCH(CH3)CH2CH3, C(O)NHC6H5, C(O)NHCH2CH2OCH3, C(O)NHOCH3, C(O)NHOCH2CH3, 카복시 보호기, 지질 지방산기 또는 탄수화물이며;
L은 화학식 -X-Y-Z-로 표시되는 연결 잔기이고;
X는 임의적으로 존재하고, AA 표적화제를 구성하는 잔기중 하나에 부착된 생물학적으로 양립가능한 중합체, 블록 공중합체 C, H, N, O, P, S, 할로겐(F, Cl, Br, I) 또는 그의 염, 알킬, 알켄일, 알킨일, 옥소알킬, 옥소알켄일, 옥소알킨일, 아미노알킬, 아미노알켄일, 아미노알킨일, 설포알킬, 설포알켄일, 설포알킨일, 포스포알킬, 포스포알켄일 또는 포스포알킨일기이며;
Y는 하나 이상의 고리 구조를 포함하는 임의적으로 존재하는 인식 기이고;
Z는 항체의 결합 부위의 측쇄에 공유 결합될 수 있는 반응성 기이다.
상기와 같은 본 발명의 양태를 기재함에 있어서, 최초의 NH 기 또는 R1은 해당 펩타이드의 N-말단 아미노산 잔기에 의해 제공되며, 따라서 NHC(O)CH3는 펩타이드의 N-말단에 공유 결합된 C(O)CH3 기를 나타내고, 본 상세한 설명 및 청구의 범위 전체에 걸쳐 다른 곳에서는 C(O)CH3 등으로 기재될 수 있다. 따라서, R1은 다음과 같이 기재될 수 있다:
R1은 CH3, C(O)CH3, C(O)CH3, C(O)CH2CH3, C(O)CH2CH2CH3, C(O)CH(CH3)CH3, C(O)CH2CH2CH2CH3, C(O)CH(CH3)CH2CH3, C(O)C6H5, C(O)CH2CH2(CH2CH2O)1-5Me, 다이클로로벤조일(DCB), 다이플루오로벤조일(DFB), 피리딘일 카복실레이트(PyC) 또는 아미도-2-PEG, 아미노 보호기, 지질 지방산기 또는 탄수화물이다.
유사하게, 상기와 같은 본 발명의 양태를 기재함에 있어서, R2의 최초 C(O)기는 해당 펩타이드의 C-말단 아미노산 잔기에 의해 제공되며, 따라서 C(O)NH2는 펩타이드의 C-말단에 공유 결합된 NH2 기를 나타내고, 다른 곳에서는 NH2 등으로 표기될 수 있다. 따라서, R2는 다음과 같이 표기될 수 있다:
R2는 OH, NH2, NH(CH3), NHCH2CH3, NHCH2CH2CH3, NHCH(CH3)CH3, NHCH2CH2CH2CH3, NHCH(CH3)CH2CH3, NHC6H5, NHCH2CH2OCH3, NHOCH3, NHOCH2CH3, 카복시 보호기, 지질 지방산기 또는 탄수화물이다.
나열된 펩타이드 서열에서, 비-표준 아미노산 잔기는 괄호 안에 넣어져 있다. 일부 경우, 펩타이드의 아미노 말단은 하기 캡핑 기중 하나에 부착된다: 다이클로로벤조일(DCB), 다이플루오로벤조일(DFB), 피리딘일 카복실레이트(PyC) 또는 아미도-2-PEG.
다른 양태에서, 본 발명은 다음과 같은 화합물을 제공한다:
하기 서열들로 이루어진 군으로부터 선택된 서열을 갖는 화합물:
R1-Q(AcK)Y QPL DEL DK(L)T LYD QFM LQQ G-R2 (서열 번호:132);
R1-Q(AcK)Y QPL DEL DK(L)T L(N02F)D QFM LQQ G-R2 (서열 번호:133);
R1-Q(AcK)Y QPL DEK(L) DK(Ac)T LYD QFM LQQ G-R2 (서열 번호:134); 및
R1-Q(AcK)Y QPL DEK(Ac) DK(L)T LYD QFM LQQ G-R2 (서열 번호:135)
상기 식에서,
R1은 CH3, C(O)CH3, C(O)CH3, C(O)CH2CH3, C(O)CH2CH2CH3, C(O)CH(CH3)CH3, C(O)CH2CH2CH2CH3, C(O)CH(CH3)CH2CH3, C(O)C6H5, C(O)CH2CH2(CH2CH2O)1-5Me, 다이클로로벤조일(DCB), 다이플루오로벤조일(DFB), 피리딘일 카복실레이트(PyC) 또는 아미도-2-PEG, 아미노 보호기, 지질 지방산기 또는 탄수화물이고;
R2는 OH, NH2, NH(CH3), NHCH2CH3, NHCH2CH2CH3, NHCH(CH3)CH3, NHCH2CH2CH2CH3, NHCH(CH3)CH2CH3, NHC6H5, NHCH2CH2OCH3, NHOCH3, NHOCH2CH3, 카복시 보호기, 지질 지방산기 또는 탄수화물이며;
K(L)은 연결기 L에 부착된 리신 잔기이고;
L은 항체의 결합 부위의 아미노산 측쇄와 공유 결합을 형성할 수 있다.
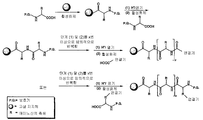
일부 실시양태에서, K(L)은 하기 화합물이다:
상기 식에서,
L은 화학식 -X-Y-Z-로 표시되는 연결 잔기이고;
X는 하기 화학식 X로 표시되며:
[화학식 X]
[상기 식에서,
v 및 w는 X의 주쇄 길이가 원자 6 내지 12개가 되도록 선택된다.];
Y는 하나 이상의 고리 구조를 포함하는 인식 기이고;
Z는 알돌라제 항체의 결합 부위의 아미노산 측쇄와 공유 결합을 형성할 수 있는 반응성 기이다.
일부 실시양태에서, Y는 임의적으로 치환되는 하기 화학식 IV 또는 V로 표시된다:
[화학식 IV]
[화학식 V]
상기 식에서,
a, b, c, d 및 e는 독립적으로 탄소 또는 질소이고;
f는 탄소, 질소, 산소 또는 황이고;
Y는 충분한 원자가를 갖는 임의의 2개의 고리 위치에서 독립적으로 X 및 Z에 부착되고,
a, b, c, d, e 또는 f중 4개 이하는 동시에 질소이다.
일부 실시양태에서, Z는 치환된 1,3-다이케톤 또는 아실 베타-락탐으로 이루어진 군으로부터 선택된다.
일부 실시양태에서, Z는 하기 화학식 VI 또는 VII로 표시된다:
[화학식 VI]
[화학식 VII]
상기 식에서, q는 0, 1, 2, 3, 4 또는 5이다.
다른 실시양태에서, q는 1, 2 또는 3이다.
화학식 I의 화합물의 일부 실시양태에서, X는 하기와 같다:
-R22-P-R23- 또는 -R22-P-R21-P'-R23-
상기 식에서,
P 및 P'는 폴리에틸렌 옥사이드 같은 폴리옥시알킬렌 옥사이드, 폴리에틸옥사졸린, 폴리-N-비닐 피롤리돈, 폴리비닐 알콜, 폴리하이드록시에틸 아크릴레이트, 폴리하이드록시 에틸메타크릴레이트 및 폴리아크릴아마이드; 폴리리신, 폴리오르니틴, 폴리아르기닌 및 폴리히스티딘 같은 중합체 주쇄 또는 중합체 측쇄 상에 아민기를 갖는 폴리아민; 폴리아미노스타이렌, 폴리아미노아크릴레이트, 폴리(N-메틸 아미노아크릴레이트), 폴리(N-에틸아미노아크릴레이트), 폴리(N,N-다이메틸 아미노아크릴레이트), 폴리(N,N-다이에틸아미노아크릴레이트), 폴리(아미노메타크릴레이트), 폴리(N-메틸 아미노-메타크릴레이트), 폴리(N-에틸 아미노메타크릴레이트), 폴리(N,N-다이메틸 아미노메타크릴레이트), 폴리(N,N-다이에틸 아미노메타크릴레이트), 폴리(에틸렌이민) 같은 비-펩타이드 폴리아민; 폴리(N,N,N-트라이메틸아미노아크릴레이트 클로라이드), 폴리(메타크릴아미도프로필트라이메틸 암모늄 클로라이드) 같은 4급 아민의 중합체; 콘드로이틴 설페이트-A (4-설페이트), 콘드로이틴 설페이트-C (6-설페이트) 및 콘드로이틴 설페이트-B 같은 프로테오글라이칸; 폴리세린, 폴리트레오닌, 폴리글루타민 같은 폴리펩타이드; 키토산, 하이드록시 에틸 셀룰로즈 같은 천연 또는 합성 다당류; 및 지질로 이루어진 군으로부터 독립적으로 선택되고;
R21, R22 및 R23은 각각 독립적으로 공유 결합, -O-, -S-, -NRb-, 아마이드, 치환되거나 치환되지 않은 직쇄 또는 분지쇄 C1 -50 알킬렌, 또는 치환되거나 치환되지 않은 직쇄 또는 분지쇄 C1 -50 헤테로알킬렌이며;
Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이며;
R21, R22 및 R23은 X의 주쇄 길이가 원자 약 200개 이하로 유지되도록 선택된다.
화학식 I의 화합물의 일부 실시양태에서, X는 [AA 표적화제]의 아미노산 잔기에 부착되고, 임의적으로 치환되는 -R22-[CH2-CH2-O]t-R23-, -R22-사이클로알킬-R23-, -R22-아릴-R23- 또는 -R22-헤테로사이클릴-R23-이며, 이 때 t는 0 내지 50이다.
화학식 I의 화합물의 일부 실시양태에서, R22는 -(CH2)v-, -(CH2)u-C(O)-(CH2)v-, -(CH2)u-C(O)-O-(CH2)v-, -(CH2)u-C(S)-NRb-(CH2)v-, -(CH2)u-C(O)-NRb-(CH2)v-, -(CH2)u-NRb-(CH2)v-, -(CH2)u-O-(CH2)v-, -(CH2)u-S(O)0-2-(CH2)v-, -(CH2)u-S(O)0-2-NRb-(CH2)v-, 또는 -(CH2)u-P(O)(ORb)-O-(CH2)v-이고; 이 때, u 및 v는 독립적으로 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 또는 20이다.
화학식 I의 화합물의 몇몇 실시양태에서, R21 및 R23은 독립적으로 -(CH2)s-, -(CH2)r-C(O)-(CH2)s-, -(CH2)r-C(O)-O-(CH2)v-, -(CH2)r-C(S)-NRb-(CH2)s-, -(CH2)r-C(O)-NRb-(CH2)s-, -(CH2)r-NRb-(CH2)s-, -(CH2)r-O-(CH2)s-, -(CH2)r-S(O)0-2-(CH2)s-, -(CH2)r-S(O)0-2-NRb-(CH2)s-, 또는 -(CH2)r-P(O)(ORb)-O-(CH2)s-이고; 이 때, r, s, 및 v는 독립적으로 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 또는 20이다.
화학식 I의 일부 실시양태에서, t>1이거나 또는 X가 -R22-[CH2-CH2-O]t-R23-, -R22-사이클로알킬-R23-, -R22-아릴-R23-, 또는 -R22-헤테로사이클릴-R23-인 경우에는, Y가 존재한다.
R1이 NHC(O)CH3 또는 DFB이고, R2가 C(O)NH2이며, 연결 잔기의 X 부분이 "O" PEG인 화학식 I에 따른 예시적인 화합물은 하기 화합물을 포함한다:
하기 화학식 II로 도시되는 본 발명의 다른 양태는 중간 연결기 L'를 통해 항체의 결합 부위에 공유 결합된 AA 표적화제를 포함하는 AA 표적화 화합물, 및 그의 약학적으로 허용가능한 염, 입체 이성질체, 호변 이성질체, 용매화물 및 전구약물이다. AA 표적화 화합물의 항체 부분은 이 용어가 본원에서 사용될 때 전체(전장) 항체, 독특한 항체 단편, 또는 항체의 임의의 다른 형태를 포함할 수 있다. 하나의 실시양태에서, 항체는 인간의 IgG, IgA, IgM, IgD 또는 IgE 항체로부터의 불변 영역을 포함하는 쥣과 동물의 알돌라제 항체의 인간화된 형태이다. 다른 실시양태에서, 항체는 쥣과 동물의 알돌라제 항체로부터의 가변 영역 및 인간의 IgG, IgA, IgM, IgD 또는 IgE 항체로부터의 불변 영역을 포함하는 키메라 항체이다. 또 다른 실시양태에서, 항체는 천연 또는 천연 발생 인간의 IgG, IgA, IgM, IgD 또는 IgE 항체로부터의 폴리펩타이드 서열을 포함하는 쥣과 동물의 알돌라제 항체의 완전 인간 형태이다.
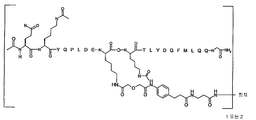
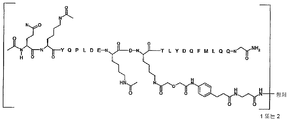
[화학식 II]
항체-L'-[AA 표적화제]
상기 식에서,
[AA 표적화제]는
R1-QKY QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:21)
R1-Q(AcK)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:22)
R1-QNY QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:23)
R1-Q(AcK)Y QPL DEK D(AcK)T LYD QFM LQQ G-R2; (서열 번호:30)
R1-Q(AcK)Y QPL DEK DET LYD QFM LQQ G-R2; (서열 번호:33)
R1-Q(AcK)Y Q(DHP)L DEL DKT LYD QFM LQQ G-R2; (서열 번호:34)
R1-Q(AcK)Y Q(HP)L DEL DKT LYD QFM LQQ G-R2; (서열 번호:35)
R1-Q(AcK)Y QPL DEL DKT IYD QFM LQQ G-R2; (서열 번호:36)
R1-Q(AcK)Y QPL DEI DKT LYD QFM LQQ G-R2; (서열 번호:37)
R1-Q(AcK)Y QPL DEL DKT (HChA)YD QFM LQQ G-R2; (서열 번호:38)
R1-Q(AcK)Y QPL DEL DKT (HF)YD QFM LQQ G-R2; (서열 번호:39)
R1-Q(AcK)Y QPL DEL DKT (ThA)YD QFM LQQ G-R2; (서열 번호:40)
R1-Q(AcK)Y QPL DEL DKT (Nva)YD QFM LQQ G-R2; (서열 번호:41)
R1-Q(AcK)Y QPL DEL DKT (HL)YD QFM LQQ G-R2; (서열 번호:42)
R1-Q(AcK)Y QPL DE(AcK) DKT LYD QFM LQQ G-R2; (서열 번호:43)
R1-Q(AcK)Y QPL DEL DKT LFD QFM LQQ G-R2; (서열 번호:44)
R1-Q(AcK)Y Q(HP)L DE(ThA) DKT L(NO2F)D QFM LQQ G-R2; (서열 번호:45)
R1-Q(AcK)Y Q(HP)L DE(ThA) DKT L(BPA)D QFM LQQ G-R2; (서열 번호:46)
R1-Q(AcK)Y Q(HP)L DE(ThA) DKT L(CO2H)FD QFM LQQ G-R2; (서열 번호:47)
R1-Q(AcK)Y QPL DE(AcK) DKT L(NO2F)D QFM LQQ G-R2; (서열 번호:48)
R1-Q(AcK)Y QPL DE(AcK) DKT LFD QFM LQQ G-R2; (서열 번호:68)
DCB-Q(AcK)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:49)
DFB-Q(AcK)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:50)
PyC-Q(AcK)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:51)
아미도 2-PEG-Q(AcK)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:52)
R1-Q(ClBn카밤에이트K)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:53)
R1-Q(AcK)Y QPL DEL D(Dab)T LYD QFM LQQ G-R2; (서열 번호:54)
R1-Q(AcK)Y QPL DEL D(Dap)T LYD QFM LQQ G-R2; (서열 번호:55)
R1-Q(AcK)Y QPL DEL DKT L(NO2F)D QFM LQQ G-R2; (서열 번호:91)
R1-QNY QPL DEL DKT L(BPA)D QFM LQQ G-R2; (서열 번호:56)
R1-QNY QPL DEL DKT L(CF)D QFM LQQ G-R2; (서열 번호:57)
R1-QNY QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:58)
R1-Q(Nick)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:61)
R1-Q(AcK)Y QPL DE(AcK) DKT L(CF)D QFM LQQ G-R2; (서열 번호:62) 및
R1-Q(AcK)Y QPL DE(AcK) DKT LFD QFM LQQ G-R2; (서열 번호:63)으로 이루어진 군으로부터 선택되는 펩타이드이고;
R1은 CH3, C(O)CH3, C(O)CH3, C(O)CH2CH3, C(O)CH2CH2CH3, C(O)CH(CH3)CH3, C(O)CH2CH2CH2CH3, C(O)CH(CH3)CH2CH3, C(O)C6H5, C(O)CH2CH2(CH2CH2O)1-5Me, 다이클로로벤조일(DCB), 다이플루오로벤조일(DFB), 피리딘일 카복실레이트(PyC) 또는 아미도-2-PEG, 아미노 보호기, 지질 지방산기 또는 탄수화물이고;
R2는 OH, NH2, NH(CH3), NHCH2CH3, NHCH2CH2CH3, NHCH(CH3)CH3, NHCH2CH2CH2CH3, NHCH(CH3)CH2CH3, NHC6H5, NHCH2CH2OCH3, NHOCH3, NHOCH2CH3, 카복시 보호기, 지질 지방산기 또는 탄수화물이며;
L'는 화학식 -X-Y-Z'-로 표시되는 연결 잔기이고;
X는 AA 표적화제를 구성하는 잔기중 하나에 부착된 생물학적으로 양립가능한 중합체 또는 블록 공중합체이고;
Y는 하나 이상의 고리 구조를 포함하는 임의적으로 존재하는 인식 기이고;
Z는 항체의 결합 부위의 측쇄에 공유 결합된 기이다.
나열된 펩타이드 서열에서, 비-표준 아미노산 잔기는 괄호 안에 들어가 있다. 일부 경우, 펩타이드의 아미노 말단은 하기 캡핑 기중 하나에 부착된다: 다이클로로벤조일(DCB), 다이플루오로벤조일(DFB), 피리딘일 카복실레이트(PyC) 또는 아미도-2-PEG.
화학식 II의 화합물의 일부 실시양태에서, X는 하기와 같다:
-R22-P-R23- 또는 -R22-P-R21-P'-R23-
상기 식에서,
P 및 P'는 폴리에틸렌 옥사이드 같은 폴리옥시알킬렌 옥사이드, 폴리에틸옥사졸린, 폴리-N-비닐 피롤리돈, 폴리비닐 알콜, 폴리하이드록시에틸 아크릴레이트, 폴리하이드록시 에틸메타크릴레이트 및 폴리아크릴아마이드; 폴리리신, 폴리오르니틴, 폴리아르기닌 및 폴리히스티딘 같은 중합체 주쇄 또는 중합체 측쇄 상에 아민기를 갖는 폴리아민; 폴리아미노스타이렌, 폴리아미노아크릴레이트, 폴리(N-메틸 아미노아크릴레이트), 폴리(N-에틸아미노아크릴레이트), 폴리(N,N-다이메틸 아미노아크릴레이트), 폴리(N,N-다이에틸아미노아크릴레이트), 폴리(아미노메타크릴레이트), 폴리(N-메틸 아미노-메타크릴레이트), 폴리(N-에틸 아미노메타크릴레이트), 폴리(N,N-다이메틸 아미노메타크릴레이트), 폴리(N,N-다이에틸 아미노메타크릴레이트), 폴리(에틸렌이민) 같은 비-펩타이드 폴리아민; 폴리(N,N,N-트라이메틸아미노아크릴레이트 클로라이드), 폴리(메타크릴아미도프로필트라이메틸 암모늄 클로라이드) 같은 4급 아민의 중합체; 콘드로이틴 설페이트-A (4-설페이트), 콘드로이틴 설페이트-C (6-설페이트) 및 콘드로이틴 설페이트-B 같은 프로테오글라이칸; 폴리세린, 폴리트레오닌, 폴리글루타민 같은 폴리펩타이드; 키토산, 하이드록시 에틸 셀룰로즈 같은 천연 또는 합성 다당류; 및 지질로 이루어진 군으로부터 독립적으로 선택되고;
R21, R22 및 R23은 각각 독립적으로 공유 결합, -O-, -S-, -NRb-, 치환되거나 치환되지 않은 직쇄 또는 분지쇄 C1 -50 알킬렌, 또는 치환되거나 치환되지 않은 직쇄 또는 분지쇄 C1 -50 헤테로알킬렌이며;
Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이며;
R21, R22 및 R23은 X의 주쇄 길이가 원자 약 200개 이하로 유지되도록 선택된다.
화학식 II의 화합물의 일부 실시양태에서, X는 [AA 표적화제]의 아미노산 잔기에 부착되고, 임의적으로 치환되는 -R22-[CH2-CH2-O]t-R23-, -R22-사이클로알킬-R23-, -R22-아릴-R23- 또는 -R22-헤테로사이클릴-R23-이며, 이 때 t는 0 내지 50이다.
화학식 II의 화합물의 일부 실시양태에서, R22는 -(CH2)v-, -(CH2)u-C(O)-(CH2)v-, -(CH2)u-C(O)-O-(CH2)v-, -(CH2)u-C(S)-NRb-(CH2)v-, -(CH2)u-C(O)-NRb-(CH2)v-, -(CH2)u-NRb-(CH2)v-, -(CH2)u-O-(CH2)v-, -(CH2)u-S(O)0-2-(CH2)v-, -(CH2)u-S(O)0-2-NRb-(CH2)v-, 또는 -(CH2)u-P(O)(ORb)-O-(CH2)v-이고; 이 때, u 및 v는 독립적으로 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 또는 20이다.
화학식 II의 화합물의 몇몇 실시양태에서, R21 및 R23은 독립적으로 -(CH2)s-, -(CH2)r-C(O)-(CH2)s-, -(CH2)r-C(O)-O-(CH2)v-, -(CH2)r-C(S)-NRb-(CH2)s-, -(CH2)r-C(O)-NRb-(CH2)s-, -(CH2)r-NRb-(CH2)s-, -(CH2)r-O-(CH2)s-, -(CH2)r-S(O)0-2-(CH2)s-, -(CH2)r-S(O)0-2-NRb-(CH2)s-, 또는 -(CH2)r-P(O)(ORb)-O-(CH2)s-이고; 이 때, r, s, 및 v는 독립적으로 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 또는 20이다.
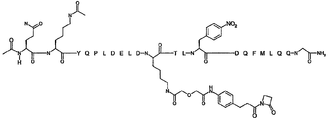
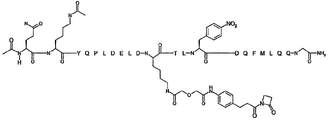
본 발명의 몇몇 양태는 하기 화합물로 이루어진 군으로부터 선택되는 화합물을 제공한다:
R1-Q(AcK)Y QPL DEL DK(L')T LYD QFM LQQ G-R2; (서열 번호:136)
R1-Q(AcK)Y QPL DEL DK(L')T L(NO2F)D QFM LQQ G-R2; (서열 번호:137)
R1-Q(AcK)Y QPL DEK(L') DK(Ac)T LYD QFM LQQ G-R2; (서열 번호:138) 및
R1-Q(AcK)Y QPL DE(AcK) DK(L')T LYD QFM LQQ G-R2; (서열 번호:139)
상기 서열에서,
R1은 CH3, C(O)CH3, C(O)CH3, C(O)CH2CH3, C(O)CH2CH2CH3, C(O)CH(CH3)CH3, C(O)CH2CH2CH2CH3, C(O)CH(CH3)CH2CH3, C(O)C6H5, C(O)CH2CH2(CH2CH2O)1-5Me, 다이클로로벤조일(DCB), 다이플루오로벤조일(DFB), 피리딘일 카복실레이트(PyC) 또는 아미도-2-PEG, 아미노 보호기, 지질 지방산기 또는 탄수화물이고;
R2는 OH, NH2, NH(CH3), NHCH2CH3, NHCH2CH2CH3, NHCH(CH3)CH3, NHCH2CH2CH2CH3, NHCH(CH3)CH2CH3, NHC6H5, NHCH2CH2OCH3, NHOCH3, NHOCH2CH3, 카복시 보호기, 지질 지방산기 또는 탄수화물이며;
K(L')는 연결기 L'에 부착된 리신 잔기이고,
L은 항체의 결합 부위의 아미노산 측쇄와 공유 결합된다.
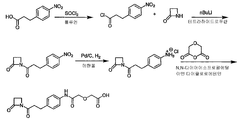
일부 실시양태에서, K(L')는 하기 화학식 XI로 표시된다:
[화학식 XI]
상기 식에서,
L'는 화학식 -X-Y-Z'-로 표시되는 연결 잔기이며;
X는 하기 화학식 X로 표시되고:
화학식 X
[상기 식에서,
v 및 w는 X의 주쇄 길이가 원자 6 내지 12개가 되도록 선택된다.];
Y는 하나 이상의 고리 구조를 포함하는 인식 기이고;
Z'는 항체의 결합 부위의 아미노산 측쇄로의 공유 결합을 구성하는 부착 잔기이다.
일부 실시양태에서, Y는 임의적으로 치환되는 하기 화학식 IV 또는 V로 표시된다:
화학식 IV
화학식 V
상기 식에서,
a, b, c, d 및 e는 독립적으로 탄소 또는 질소이고;
f는 탄소, 질소, 산소 또는 황이며;
Y는 충분한 원자가를 갖는 임의의 두 고리 위치에서 독립적으로 X 및 Z'에 부착되고;
a, b, c, d, e 또는 f중 4개 이하는 동시에 질소이다.
일부 실시양태에서, Z'는 하기 화학식 VIII 또는 IX로 표시된다:
[화학식 VIII]
[화학식 IX]
상기 식에서,
q는 0, 1, 2, 3, 4 또는 5이고,
-N-항체는 아미노기를 갖는 항체의 결합 부위의 아미노산 측쇄로의 공유 결합을 일컫는다.
다른 양태에서, q는 1, 2 또는 3이다.
하기 화학식 III으로 도시되는 본 발명의 다른 양태는 동일하거나 상이할 수 있는 두 AA 표적화제가 각각 항체의 결합 부위에 공유 결합된 AA 표적화 화합물이다. AA 표적화 화합물의 항체 부분은 이 용어가 본원에서 사용될 때 전체(전장) 항체, 독특한 항체 단편, 또는 항체의 임의의 다른 형태를 포함할 수 있다. 하나의 실시양태에서, 항체는 인간의 IgG, IgA, IgM, IgD 또는 IgE 항체로부터의 불변 영역을 포함하는 쥣과 동물의 알돌라제 항체의 인간화된 형태이다. 다른 실시양태에서, 항체는 쥣과 동물의 알돌라제 항체로부터의 가변 영역 및 인간의 IgG, IgA, IgM, IgD 또는 IgE 항체로부터의 불변 영역을 포함하는 키메라 항체이다. 또 다른 실시양태에서, 항체는 천연 또는 천연 발생 인간의 IgG, IgA, IgM, IgD 또는 IgE 항체로부터의 폴리펩타이드 서열을 포함하는 쥣과 동물의 알돌라제 항체의 완전 인간 형태이다.
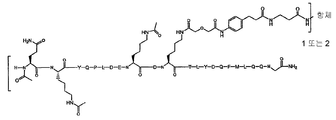
[화학식 III]
항체[-L'-[AA 표적화제]]2
상기 식에서,
[AA 표적화제], 항체 및 L'는 화학식 II에 따라 정의된 바와 같다.
본 발명의 AA 표적화 화합물을 전달 또는 투여하는 방법 및 본 발명의 AA 표적화 화합물을 사용하는 치료 방법도 제공된다. 예를 들어, 개체(subject)에서 비정상적인 혈관 신생을 나타내는 질환 또는 질병을 치료(예방 포함)하는 방법은 본 발명의 AA 표적화 화합물 치료 효과량을 개체에 투여함을 포함한다. 치료될 수 있는 질환 및 질병은 암, 관절염, 고혈압, 신장 질환, 건선, 안과 장애를 갖는 눈의 혈관 신생, 감염 또는 외과 수술, 황반 변성, 당뇨병성 망막병증 등을 포함한다.
본 발명의 다른 양태는 진단 목적을 위해 본 발명의 AA 표적화 화합물을 사용하는 방법을 포함한다. 암, 관절염, 건선, 안과 장애를 갖는 눈의 혈관 신생, 감염 또는 외과 수술, 황반 변성, 당뇨병성 망막병증 등을 비롯한 비정상적인 혈관 신생을 나타내는 질환 또는 질병을 진단하기 위하여 AA 표적화 화합물을 사용할 수 있다.
정의
하기 약어, 용어 및 구는 본원에서 아래 정의된 바와 같이 사용된다.
표적화제의 모든 아미노-함유 측쇄는 본원에서 정의된 R1에 의해 종결될 수 있다. 표적화제의 모든 COOH/COO--함유 측쇄는 본원에서 정의된 R2에 의해 종결될 수 있다.
"D" 접두사로 달리 표시되지(예컨대, D-Ala 또는 N-Me-D-Ile) 않는 한, 본 상세한 설명 및 첨부된 청구의 범위에 기재되는 펩타이드의 아미노산 및 아미노아실 잔기의 알파-탄소의 입체 화학은 중성 또는 "L" 배위이다. 칸-인골드-프렐로그(Cahn-Ingold-Prelog) "R" 및 "S" 명칭을 사용하여 펩타이드의 N-말단에서의 특정한 아실 치환기의 키랄 중심의 입체 화학을 규정한다. 명칭 "R,S"는 두 거울상 이성질체 형태의 라세미 혼합물을 나타내는 의미이다. 이 명명법은 칸(R. S. Cahn) 등의 문헌[Angew. Chem. Int. Ed. Engl., 5:385-415 (1966)]에 기재되어 있는 바를 따른다.
"폴리펩타이드", "펩타이드" 및 "단백질"을 호환성 있게 사용하여 아미노산 잔기의 중합체를 일컫는다. 본원에 사용되는 이들 용어를, 하나 이상의 아미노산 잔기가 상응하는 천연 발생 아미노산의 인공적인 화학적 유사체인 아미노산 중합체에 적용한다. 이들 용어를 또한 천연 발생 아미노산 중합체에도 적용한다. 아미노산은 펩타이드의 결합 기능이 유지되는 한 L 또는 D 형태일 수 있다. 펩타이드는 펩타이드 내에 2개의 인접하지 않은 아미노산 사이에 분자내 결합을 갖는 환상일 수 있다(예컨대, 주쇄 대 주쇄, 측쇄 대 주쇄 및 측쇄 대 측쇄 환화). 당해 분야에 널리 공지되어 있는 방법에 의해 환상 펩타이드를 제조할 수 있다. 미국 특허 제 6,013,625 호 참조.
모든 펩타이드 서열은 알파-N-말단 아미노산 잔기가 왼쪽에 또한 알파-C-말단 아미노산 잔기가 오른쪽에 있도록 통상적으로 허용되는 관행에 따라 기재된다. 본원에 사용되는 용어 "N-말단"은 펩타이드의 아미노산의 자유 알파-아미노기를 말하고, 용어 "C-말단"은 펩타이드의 아미노산의 자유 α-카복실산 말단을 가리킨다. 하나의 기로 N-종결된 펩타이드는 N-말단 아미노산 잔기의 알파-아미노 질소 상에 기를 갖는 펩타이드를 나타낸다. 하나의 기로 N-종결된 아미노산은 알파-아미노 질소 상에 기를 갖는 아미노산을 나타낸다.
"실질적으로 상동"은 펩타이드 서열의 한정된 길이에 걸쳐 약 75% 이상(바람직하게는 약 80% 이상, 더욱 바람직하게는 약 90% 이상, 가장 바람직하게는 약 95% 이상)의 아미노산 잔기가 매치됨을 의미한다. 실질적으로 상동인 서열은 그들의 길이에 걸쳐 아미노산 잔기의 65% 이상을 공유하는 서열을 포함하며, 이 때 공유되지 않은 서열의 10% 이상이 보존적 치환(conservative substitution)이다. ncbi.nlm.nih.gov에서 내셔널 캔서 센터 포 바이오테크놀로지 인포메이션(National Cancer Center for Biotechnology Information)으로부터 구입가능한 BLAST 프로그램 같은, 서열 데이터 뱅크에서 입수가능한 표준 소프트웨어를 이용하여 서열을 비교함으로써, 실질적으로 상동인 서열을 확인할 수 있다.
일반적으로, "치환된"은 그에 함유된 수소 원자로의 하나 이상의 결합이 F, Cl, Br 및 I 같은 할로겐 원자; 하이드록실기, 알콕시기, 아릴옥시기 및 에스터기 같은 기 중의 산소 원자; 티올기, 알킬 및 아릴 설파이드기, 설폰기, 설폰일기 및 설폭사이드기 같은 기 중의 황 원자; 아민, 아마이드, 알킬아민, 다이알킬아민, 아릴아민, 알킬아릴아민, 다이아릴아민, N-옥사이드, 이미드 및 엔아민 같은 기 중의 질소 원자; 트라이알킬실릴기, 다이알킬아릴실릴기, 알킬다이아릴실릴기 및 트라이아릴실릴기 같은 기 중의 규소 원자; 및 다양한 다른 기 중의 다른 헤테로원자 등의(이들로 한정되지는 않음) 수소 또는 탄소가 아닌 원자에 의해 대체된 아래 정의된 기를 일컫는다. 치환된 알킬기 및 치환된 사이클로알킬기 등은 또한 탄소(들) 또는 수소(들) 원자로의 하나 이상의 결합이 카본일, 카복실 및 에스터기 중의 산소; 이민, 옥심, 하이드라존 및 나이트릴 같은 기 중의 질소 등의 헤테로원자로의 결합에 의해 대체된 기를 포함한다. 본원에 사용되는 "임의적으로 치환되는" 기는 치환될 수 있거나 또는 치환되지 않을 수 있다. 그러므로, 예컨대 "임의적으로 치환되는 알킬"은 치환된 알킬기 및 치환되지 않은 알킬기 둘 다를 나타낸다.
구 "치환되지 않은 알킬"은 헤테로원자를 함유하지 않는 알킬기를 가리킨다. 따라서, 이 구는 메틸, 에틸, 프로필, 뷰틸, 펜틸, 헥실, 헵틸, 옥틸, 노닐, 데실, 운데실, 도데실 등과 같은 직쇄 알킬기를 포함한다. 이 구는 또한 예로서 제공되는 하기 기를 포함하지만 이들로 한정되지는 않는, 직쇄 알킬기의 분지쇄 이성질체를 포함한다: -CH(CH3)2, -CH(CH3)(CH2CH3), -CH(CH2CH3)2, -C(CH3)3, -C(CH2CH3)3, -CH2CH(CH3)2, -CH2-CH(CH3)(CH2CH3), -CH2CH(CH2CH3)2, -CH2C(CH3)3, -CH2C(CH2CH3)3, -CH(CH3)CH(CH3)(CH2CH3), -CH2CH2CH(CH3)2, -CH2CH2CH(CH3)(CH2CH3), -CH2CH2CH(CH2CH3)2, -CH2CH2C(CH3)3, -CH2CH2C(CH2CH3)3, -CH(CH3)CH2CH(CH3)2, -CH(CH3)CH(CH3)CH(CH3)2, -CH(CH2CH3)CH(CH3)CH(CH3)(CH2CH3) 등. 이 구는 사이클로알킬기를 포함하지 않는다. 그러므로, 치환되지 않은 알킬기라는 구는 1급 알킬기, 2급 알킬기 및 3급 알킬기를 포함한다. 치환되지 않은 알킬기는 모 화합물의 하나 이상의 탄소 원자(들), 산소 원자(들), 질소 원자(들) 및/또는 황 원자(들)에 결합될 수 있다. 가능한 치환되지 않은 알킬기는 1 내지 20개의 탄소 원자를 갖는 직쇄 및 분지쇄 알킬기를 포함한다. 다르게는, 이러한 치환되지 않은 알킬기는 1 내지 10개의 탄소 원자를 갖거나, 또는 1 내지 약 6개의 탄소 원자를 갖는 저급 알킬기이다. 다른 치환되지 않은 알킬기는 1 내지 3개의 탄소 원자를 갖는 직쇄 및 분지쇄 알킬기를 포함하고, 메틸, 에틸, 프로필 및 -CH(CH3)2를 포함한다.
구 "치환된 알킬"은 탄소(들) 또는 수소(들)로의 하나 이상의 결합이 F, Cl, Br, I 같은 할라이드 중의 할로겐 원자; 하이드록실기, 알콕시기, 아릴옥시기 및 에스터기 같은 기 중의 산소 원자; 티올기, 알킬 및 아릴 설파이드기, 설폰기, 설폰일기 및 설폭사이드기 같은 기 중의 황 원자; 아민, 아마이드, 알킬아민, 다이알킬아민, 아릴아민, 알킬아릴아민, 다이아릴아민, N-옥사이드, 이미드 및 엔아민 같은 기 중의 질소 원자; 트라이알킬실릴기, 다이알킬아릴실릴기, 알킬다이아릴실릴기 및 트라이아릴실릴기 같은 기 중의 규소 원자; 및 다양한 다른 기 중의 다른 헤테로원자 등의(이들로 한정되지는 않음) 수소 또는 탄소가 아닌 원자에 의해 대체된 알킬기를 일컫는다. 치환된 알킬기는 또한 탄소(들) 또는 수소(들) 원자로의 하나 이상의 결합이 카본일, 카복실 및 에스터기 중의 산소; 이민, 옥심, 하이드라존 및 나이트릴 같은 기 중의 질소 등의 헤테로원자로의 결합에 의해 대체된 기를 포함한다. 치환된 알킬기는 특히 탄소 또는 수소 원자로의 하나 이상의 결합이 플루오르 원자로의 하나 이상의 결합에 의해 대체된 알킬기를 포함한다. 치환된 알킬기의 한 예는 트라이플루오로메틸기 및 트라이플루오로메틸기를 함유하는 다른 알킬기이다. 다른 알킬기는 탄소 또는 수소 원자로의 하나 이상의 결합이 산소 원자로의 결합에 의해 대체되어 치환된 알킬기가 하이드록실, 알콕시, 아릴옥시기 또는 헤테로사이클릴옥시기를 함유하는 기를 포함한다. 또 다른 알킬기는 아민, 알킬아민, 다이알킬아민, 아릴아민, (알킬)(아릴)아민, 다이아릴아민, 헤테로사이클릴아민, (알킬)(헤테로사이클릴)아민, (아릴)(헤테로사이클릴)아민 또는 다이헤테로사이클릴아민기를 갖는 알킬기를 포함한다.
구 "치환되지 않은 알킬렌"은 2가의 상기 정의된 치환되지 않은 알킬기를 말한다. 그러므로, 메틸렌, 에틸렌 및 프로필렌이 치환되지 않은 알킬렌의 각 예이다. 구 "치환된 알킬렌"은 2가의 상기 정의된 치환된 알킬기를 나타낸다. 치환되거나 또는 치환되지 않은 저급 알킬렌기는 1 내지 약 6개의 탄소를 갖는다.
구 "치환되지 않은 사이클로알킬"은 사이클로프로필, 사이클로뷰틸, 사이클로펜틸, 사이클로헥실, 사이클로헵틸 및 사이클로옥틸, 및 상기 정의된 직쇄 및 분지쇄 알킬기로 치환된 이들 고리 같은 환상 알킬기를 일컫는다. 이 구는 또한 아다만틸 노본일 및 바이사이클로[2.2.2]옥틸 등, 및 상기 정의된 직쇄 및 분지쇄 알킬기로 치환된 이들 고리 같은 다환상 알킬기도 포함한다. 그러므로, 이 구는 특히 메틸사이클로헥실기를 포함한다. 이 구는 헤테로원자를 함유하는 환상 알킬기를 포함하지 않는다. 치환되지 않은 사이클로알킬기는 모 화합물의 하나 이상의 탄소 원자(들), 산소 원자(들), 질소 원자(들) 및/또는 황 원자(들)에 결합될 수 있다. 일부 실시양태에서, 치환되지 않은 사이클로알킬기는 3 내지 20개의 탄소 원자를 갖는다. 다른 실시양태에서, 이러한 치환되지 않은 알킬기는 3 내지 8개의 탄소 원자를 갖는 한편, 또 다른 실시양태에서 이들 기는 3 내지 7개의 탄소 원자를 갖는다.
구 "치환된 사이클로알킬"은 치환된 알킬기가 치환되지 않은 알킬기와 관련하여 갖는 것과 동일한 의미를 치환되지 않은 사이클로알킬기와 관련하여 갖는다. 그러므로, 이 구는 옥소사이클로헥실, 클로로사이클로헥실, 하이드록시사이클로펜틸 및 클로로메틸사이클로헥실기를 포함하지만, 이들로 국한되지는 않는다.
구 "치환되지 않은 아릴"은 헤테로원자를 함유하지 않는 아릴기를 나타낸다. 따라서, 이 구는 예로서 페닐, 바이페닐, 안트라센일 및 나프텐일 같은 기를 포함하지만 이들로 한정되지는 않는다. 구 "치환되지 않은 아릴"이 나프탈렌 같은 축합 고리를 함유하는 기를 포함하기는 하지만, 이는 고리 일원중 하나에 결합된 알킬 또는 할로기 같은 다른 기를 갖는 아릴기를 포함하지는 않는데, 톨릴 같은 아릴기는 본원에서 아래 기재되는 치환된 아릴기인 것으로 간주되기 때문이다. 전형적으로, 치환되지 않은 아릴은 6 내지 약 10개의 탄소 원자를 갖는 저급 아릴일 수 있다. 하나의 치환되지 않은 아릴기는 페닐이다. 그러나, 치환되지 않은 아릴기는 모 화합물의 하나 이상의 탄소 원자(들), 산소 원자(들), 질소 원자(들) 및/또는 황 원자(들)에 결합될 수 있다.
구 "치환된 아릴기"는 치환된 알킬기가 치환되지 않은 알킬기와 관련하여 갖는 것과 동일한 의미를 치환되지 않은 아릴기와 관련하여 갖는다. 그러나, 치환된 아릴기는 또한 방향족 탄소중 하나가 상기 기재된 탄소 또는 수소가 아닌 원자중 하나에 결합된 아릴기도 포함하고, 또한 아릴기의 하나 이상의 방향족 탄소가 본원에 정의된 치환되고/되거나 치환되지 않은 알킬, 알켄일 또는 알킨일기에 결합된 아릴기도 포함한다. 이는 아릴기의 두 탄소 원자가 알킬, 알켄일 또는 알킨일기의 두 원자에 결합되어 융합된 고리 시스템(예컨대, 다이하이드로나프틸 또는 테트라하이드로나프틸)을 나타내는 결합 배열을 포함한다. 그러므로, 구 "치환된 아릴"은 특히 톨릴 및 하이드록시페닐을 포함하지만 이들로 국한되지는 않는다.
구 "치환되지 않은 알켄일"은 하나 이상의 이중 결합이 두 탄소 원자 사이에 존재하는 것을 제외하고는 상기 정의된 치환되지 않은 알킬기와 관련하여 기재된 것과 같은 직쇄 및 분지쇄 및 환상 기를 나타낸다. 예로는 특히 비닐, -CH=C(H)(CH3), -CH=C(CH3)2, -C(CH3)=C(H)2, -C(CH3)=C(H)(CH3), -C(CH2CH3)=CH2, 사이클로헥센일, 사이클로펜텐일, 사이클로헥사다이엔일, 뷰타다이엔일, 펜타다이엔일 및 헥사다이엔일이 있으나 이들로 한정되지는 않는다. 치환되지 않은 저급 알켄일기는 1 내지 약 6개의 탄소를 갖는다.
구 "치환된 알켄일"은 치환된 알킬기가 치환되지 않은 알킬기와 관련하여 갖는 것과 동일한 의미를 치환되지 않은 알켄일기와 관련하여 갖는다. 치환된 알켄일기는 탄소 또는 수소가 아닌 원자가 다른 탄소에 이중 결합된 탄소에 결합된 알켄일기, 및 탄소 또는 수소가 아닌 원자중 하나가 다른 탄소로의 이중 결합에 관련되지 않은 탄소에 결합된 것을 포함한다. 예를 들어, -CH=CH-OCH3 및 -CH=CH-CH2-OH는 둘 다 치환된 알켄일이다. CH2 기가 카본일에 의해 치환된, -CH=CH-C(O)-CH3 같은 옥소알켄일도 치환된 알켄일이다.
구 "치환되지 않은 알켄일렌"은 2가의 상기 정의된 치환되지 않은 알켄일기를 의미한다. 예컨대, -CH=CH-는 예시적인 치환되지 않은 알켄일렌이다. 구 "치환된 알켄일렌"은 2가의 상기 정의된 치환된 알켄일기를 말한다.
구 "치환되지 않은 알킨일"은 하나 이상의 삼중 결합이 두 탄소 원자 사이에 존재함을 제외하고는 상기 정의된 치환되지 않은 알킬기와 관련하여 기재된 것과 같은 직쇄 및 분지쇄 기를 말한다. 예는 특히 -C≡C(H), -C≡C(CH3), -C≡C(CH2CH3), -C(H2)C≡C(H), -C(H)2C≡C(CH3) 및 -C(H)2C≡C(CH2CH3)를 포함하지만 이들로 국한되지는 않는다. 치환되지 않은 저급 알킨일기는 1 내지 약 6개의 탄소를 갖는다.
구 "치환된 알킨일"은 치환된 알킬기가 치환되지 않은 알킬기와 관련하여 갖는 것과 동일한 의미를 치환되지 않은 알킨일기와 관련하여 갖는다. 치환된 알킨일기는 탄소 또는 수소가 아닌 원자가 다른 탄소에 삼중 결합된 탄소에 결합된 알킨일기, 및 탄소 또는 수소가 아닌 원자가 다른 탄소로의 삼중 결합에 연관되지 않은 탄소에 결합된 것을 포함한다. 예로는 CH2 기가 카본일에 의해 대체된, -C(O)-CH≡CH-CH3 및 -C(O)-CH2-CH≡CH 같은 옥소알킨일이 있으나, 이들로 국한되지는 않는다.
구 "치환되지 않은 알킨일렌"은 2가의 상기 정의된 치환되지 않은 알킨일기를 나타낸다. -C≡C-는 치환되지 않은 알킨일렌의 예이다. 구 "치환된 알킨일렌"은 2가의 상기 정의된 치환된 알킨일기를 의미한다.
구 "치환되지 않은 아르알킬"은 치환되지 않은 알킬기의 수소 또는 탄소 결합이 상기 정의된 아릴기로의 결합으로 대체된 상기 정의된 치환되지 않은 알킬기를 일컫는다. 예를 들어, 메틸(-CH3)은 치환되지 않은 알킬기이다. 메틸의 탄소가 벤젠의 탄소에 결합된 경우와 같이, 메틸기의 수소 원자가 페닐기로의 결합에 의해 대체되는 경우, 이 화합물은 치환되지 않은 아르알킬기(즉, 벤질기)이다. 따라서, 이 구는 벤질, 다이페닐메틸 및 1-페닐에틸(-CH(C6H5)(CH3)) 같은 기를 포함하지만, 이들로 한정되지는 않는다.
구 "치환된 아르알킬"은 치환된 아릴기가 치환되지 않은 아릴기와 관련하여 갖는 것과 동일한 의미를 치환되지 않은 아르알킬기와 관련하여 갖는다. 그러나, 치환된 아르알킬은 또한 기의 알킬 부분의 탄소 또는 수소 결합이 탄소 또는 수소가 아닌 원자로의 결합에 의해 대체된 기도 포함한다. 치환된 아르알킬기의 예는 -CH2C(=O)(C6H5) 및 -CH2(2-메틸페닐)을 포함하지만, 이들로 한정되지는 않는다.
구 "치환되지 않은 아르알켄일"은 치환되지 않은 알켄일기의 수소 또는 탄소 결합이 상기 정의된 아릴기로의 결합으로 대체된 상기 정의된 치환되지 않은 알켄일기를 말한다. 예컨대, 비닐은 치환되지 않은 알켄일기이다. 비닐의 탄소가 벤젠의 탄소에 결합된 경우와 같이, 비닐기의 수소 원자가 페닐기로의 결합에 의해 대체되는 경우, 이 화합물은 치환되지 않은 아르알켄일기(즉, 스타이릴기)이다. 따라서, 이 구는 스타이릴, 다이페닐비닐 및 1-페닐에텐일(-C(C6H5)(CH2)) 같은 기를 포함하지만, 이들로 한정되지는 않는다.
구 "치환된 아르알켄일"은 치환된 아릴기가 치환되지 않은 아릴기와 관련하여 갖는 것과 동일한 의미를 치환되지 않은 아르알켄일기와 관련하여 갖는다. 치환된 아르알켄일기는 또한 기의 알켄일 부분의 탄소 또는 수소 결합이 탄소 또는 수소가 아닌 원자에 의해 대체된 기도 포함한다. 치환된 아르알켄일기의 예는 -CH=C(Cl)(C6H5) 및 -CH=CH(2-메틸페닐)을 포함하지만, 이들로 한정되지는 않는다.
구 "치환되지 않은 아르알킨일"은 치환되지 않은 알킨일기의 수소 또는 탄소 결합이 상기 정의된 아릴기로의 결합으로 대체된 상기 정의된 치환되지 않은 알킨일기를 나타낸다. 예를 들어, 아세틸렌은 치환되지 않은 알킨일기이다. 아세틸렌의 탄소가 벤젠의 탄소에 결합된 경우와 같이, 아세틸렌기의 수소 원자가 페닐기로의 결합에 의해 대체되는 경우, 이 화합물은 치환되지 않은 아르알킨일기이다. 따라서, 이 구는 -C≡C-페닐 및 -CH2-C≡C-페닐을 포함하지만 이들로 국한되지는 않는다.
구 "치환된 아르알킨일"은 치환된 아릴기가 치환되지 않은 아릴기와 관련하여 갖는 것과 동일한 의미를 치환되지 않은 아르알킨일기와 관련하여 갖는다. 그러나, 치환된 아르알킨일기는 기의 알킨일 부분의 탄소 또는 수소 결합이 탄소 또는 수소가 아닌 원자로의 결합에 의해 대체된 기도 포함한다. 치환된 아르알킨일기의 예는 -C≡C-C(Br)(C6H5) 및 -C≡C(2-메틸페닐)을 포함하지만 이들로 한정되지는 않는다.
구 "치환되지 않은 헤테로알킬"은 탄소 쇄가 N, O 및 S로부터 선택된 하나 이상의 헤테로원자에 의해 차단된 상기 정의된 치환되지 않은 알킬기를 나타낸다. N을 함유하는 치환되지 않은 헤테로알킬은 탄소 쇄에 NH 또는 N(치환되지 않은 알킬)을 가질 수 있다. 예를 들어, 치환되지 않은 헤테로알킬은 알콕시, 알콕시알킬, 알콕시알콕시, 티오에터, 알킬아미노알킬, 아미노알킬옥시 및 다른 이러한 기를 포함한다. 전형적으로, 치환되지 않은 헤테로알킬기는 1 내지 5개의 헤테로원자, 특히 1 내지 3개의 헤테로원자를 함유한다. 일부 실시양태에서, 치환되지 않은 헤테로알킬은 예컨대 에틸옥시에틸옥시에틸옥시 같은 알콕시알콕시알콕시기를 포함한다.
구 "치환된 헤테로알킬"은 치환된 알킬기가 치환되지 않은 알킬기와 관련하여 갖는 것과 동일한 의미를 치환되지 않은 헤테로알킬기와 관련하여 갖는다.
구 "치환되지 않은 헤테로알킬렌"은 2가의 상기 정의된 치환되지 않은 헤테로알킬기를 나타낸다. 예를 들어, -CH2-O-CH2- 및 -CH2-NH-CH2-CH2-는 둘 다 예시적인 치환되지 않은 헤테로알킬렌이다. 구 "치환된 헤테로알킬렌"은 2가의 상기 정의된 치환된 헤테로알킬기를 말한다.
구 "치환되지 않은 헤테로알켄일"은 탄소 쇄가 N, O 및 S로부터 선택된 하나 이상의 헤테로원자에 의해 차단된 상기 정의된 치환되지 않은 알켄기를 일컫는다. N을 함유하는 치환되지 않은 헤테로알켄일은 탄소 쇄에 NH 또는 N(치환되지 않은 알킬 또는 알켄)을 가질 수 있다. 구 "치환된 헤테로알켄일"은 치환된 헤테로알킬기가 치환되지 않은 헤테로알킬기와 관련하여 갖는 것과 동일한 의미를 치환되지 않은 헤테로알켄일기와 관련하여 갖는다.
구 "치환되지 않은 헤테로알켄일렌"은 2가의 상기 정의된 치환되지 않은 헤테로알켄일기를 나타낸다. 따라서, -CH2-O-CH=CH-는 치환되지 않은 헤테로알켄일렌의 예이다. 구 "치환된 헤테로알켄일렌"은 2가의 상기 정의된 치환된 헤테로알켄일기를 의미한다.
구 "치환되지 않은 헤테로알킨일"은 탄소 쇄가 N, O 및 S로부터 선택된 하나 이상의 헤테로원자에 의해 차단된 상기 정의된 치환되지 않은 알킨일기를 일컫는다. N을 함유하는 치환되지 않은 헤테로알킨일은 탄소 쇄에 NH 또는 N(치환되지 않은 알킬, 알켄 또는 알킨)를 가질 수 있다. 구 "치환된 헤테로알킨일"은 치환된 헤테로알킬기가 치환되지 않은 헤테로알킬기와 관련하여 갖는 것과 동일한 의미를 치환되지 않은 헤테로알킨일기와 관련하여 갖는다.
구 "치환되지 않은 헤테로알킨일렌"은 2가의 상기 정의된 치환되지 않은 헤테로알킨일기를 나타낸다. 그러므로, -CH2-O-CH2-C≡C-는 치환되지 않은 헤테로알킨일렌의 예이다. 구 "치환된 헤테로알킨일렌"은 2가의 상기 정의된 치환된 헤테로알킨일기를 말한다.
구 "치환되지 않은 헤테로사이클릴"은 하나 이상이 N, O 및 S 같은(이들로 한정되지는 않음) 헤테로원자인 3개 이상의 고리 일원을 함유하는 퀴누클리딜 같은(이것으로 국한되지는 않음) 일환상, 이환상 및 다환상 고리 화합물을 비롯한 방향족 및 비방향족 고리 화합물을 말한다. 구 "치환되지 않은 헤테로사이클릴"이 벤즈이미다졸릴 같은 축합된 헤테로환상 고리를 포함하기는 하지만, 이는 고리 일원중 하나에 결합된 알킬 또는 할로기 같은 다른 기를 갖는 헤테로사이클릴기를 포함하지 않는데, 2-메틸벤즈이미다졸릴 같은 화합물은 치환된 헤테로사이클릴기이기 때문이다. 헤테로사이클릴기의 예는 하기를 포함하지만 이들로 국한되는 것은 아니다: 피롤릴, 피롤린일, 이미다졸릴, 피라졸릴, 피리딜, 다이하이드로피리딜, 피리미딜, 피라진일, 피리다진일, 트라이아졸릴(예컨대, 4H-1,2,4-트라이아졸릴, 1H-1,2,3-트라이아졸릴, 2H-1,2,3-트라이아졸릴 등), 테트라졸릴(예를 들어, 1H-테트라졸릴, 2H-테르라졸릴 등) 같은(이들로 한정되지는 않음) 1 내지 4개의 질소 원자를 함유하는 불포화 3 내지 8원 고리; 피롤리딘일, 이미다졸리딘일, 피페리딘일, 피페라진일 같은(이들로 한정되지는 않음) 1 내지 4개의 질소 원자를 함유하는 포화 3 내지 8원 고리; 인돌릴, 아이소인돌릴, 인돌린일, 인돌리진일, 벤즈이미다졸릴, 퀴놀릴, 아이소퀴놀릴, 인다졸릴, 벤조트라이아졸릴 같은(이들로 국한되지는 않음) 1 내지 4개의 질소 원자를 함유하는 축합된 불포화 헤테로환상 기; 옥사졸릴, 아이속사졸릴, 옥사다이아졸릴(예컨대, 1,2,4-옥사다이아졸릴, 1,3,4-옥사다이아졸릴, 1,2,5-옥사다이아졸릴 등) 같은(이들로 국한되지는 않음) 1 내지 2개의 산소 원자 및 1 내지 3개의 질소 원자를 함유하는 불포화 3 내지 8원 고리; 모폴린일 같은(이것으로 한정되지는 않음) 1 내지 2개의 산소 원자 및 1 내지 3개의 질소 원자를 함유하는 포화 3 내지 8원 고리; 1 내지 2개의 산소 원자 및 1 내지 3개의 질소 원자를 함유하는 불포화 축합 헤테로환상 기, 예를 들어 벤족사졸릴, 벤족사다이아졸릴, 벤족사진일(예컨대, 2H-1,4-벤족사진일 등); 티아졸릴, 아이소티아졸릴, 티아다이아졸릴(예컨대, 1,2,3-티아다이아졸릴, 1,2,4-티아다이아졸릴, 1,3,4-티아다이아졸릴, 1,2,5-티아다이아졸릴 등) 같은(이들로 한정되지는 않음) 1 내지 3개의 황 원자 및 1 내지 3개의 질소 원자를 함유하는 불포화 3 내지 8원 고리; 티아졸로딘일 같은(이것으로 한정되지는 않음) 1 내지 2개의 황 원자 및 1 내지 3개의 질소 원자를 함유하는 포화 3 내지 8원 고리; 티엔일, 다이하이드로다이티인일, 다이하이드로다이티온일, 테트라하이드로티오펜, 테트라하이드로티오피란 같은(이들로 국한되지는 않음) 1 내지 2개의 황 원자를 함유하는 포화 및 불포화 3 내지 8원 고리; 벤조티아졸릴, 벤조티아다이아졸릴, 벤조티아진일(예컨대, 2H-1,4-벤조티아진일 등), 다이하이드로벤조티아진일(예컨대, 2H-3,4-다이하이드로벤조티아진일 등) 같은(이들로 국한되지는 않음) 1 내지 2개의 황 원자 및 1 내지 3개의 질소 원자를 함유하는 불포화 축합 헤테로환상 고리; 퓨릴 같은(이것으로 국한되지는 않음) 산소 원자를 함유하는 불포화 3 내지 8원 고리; 벤조다이옥솔릴(예컨대, 1,3-벤조다이옥솔릴 등) 같은 1 내지 2개의 산소 원자를 함유하는 불포화 축합 헤테로환상 고리; 다이하이드로옥사티인일 같은(이것으로 국한되지는 않음) 산소 원자 및 1 내지 2개의 황 원자를 함유하는 불포화 3 내지 8원 고리; 1,4-옥사티에인 같은 1 내지 3개의 산소 원자 및 1 내지 2개의 황 원자를 함유하는 포화 3 내지 8원 고리; 벤조티엔일, 벤조다이티인일 같은 1 내지 2개의 황 원자를 함유하는 불포화 축합 고리; 및 벤족사티인일 같은 산소 원자 및 1 내지 3개의 산소 원자를 함유하는 불포화 축합 헤테로환상 고리. 헤테로사이클릴기는 또한 고리의 하나 이상의 S 원자가 1 또는 2개의 산소 원자에 이중 결합된(설폭사이드 및 설폰) 상기 기재된 것을 포함한다. 예를 들면, 헤테로사이클릴기는 테트라하이드로티오펜, 테트라하이드로티오펜 옥사이드 및 테트라하이드로티오펜 1,1-다이옥사이드를 포함한다. 일부 실시양태에서, 헤테로사이클릴기는 5 또는 6개의 고리 일원을 함유한다. 다른 실시양태에서, 헤테로사이클릴기는 모폴린, 피페라진, 피페리딘, 피롤리딘, 이미다졸, 피라졸, 1,2,3-트라이아졸, 1,2,4-트라이아졸, 테트라졸, 티오모폴린, 티오모폴린의 S 원자가 하나 이상의 O 원자에 결합된 티오모폴린, 피롤, 호모피페라진, 옥사졸리딘-2-온, 피롤리딘-2-온, 옥사졸, 퀴누클리딘, 티아졸, 아이속사졸, 퓨란 및 테트라하이드로퓨란을 포함한다.
구 "치환된 헤테로사이클릴"은 치환된 알킬기 및 치환된 아릴기와 관련하여 상기 기재된 것과 같이 고리 일원중 하나가 수소가 아닌 원자에 결합된 상기 정의된 치환되지 않은 헤테로사이클릴기를 일컫는다. 예로는 2-메틸벤즈이미다졸릴, 5-메틸벤즈이미다졸릴, 5-클로로벤즈티아졸릴, 1-메틸 피페라진일 및 2-클로로피리딜이 있으나, 이들로 국한되지는 않는다.
구 "치환되지 않은 헤테로아릴"은 상기 정의된 치환되지 않은 방향족 헤테로사이클릴기를 의미한다. 그러므로, 치환되지 않은 헤테로아릴기는 퓨릴, 이미다졸릴, 옥사졸릴, 아이속사졸릴, 피리딘일, 벤즈이미다졸릴 및 벤조티아졸릴을 포함하지만, 이들로 한정되지는 않는다. 구 "치환된 헤테로아릴"은 상기 정의된 치환된 방향족 헤테로사이클릴기를 말한다.
구 "치환되지 않은 헤테로사이클릴알킬"은 치환되지 않은 알킬기의 수소 또는 탄소 결합이 상기 정의된 헤테로사이클릴기로의 결합으로 대체된 상기 정의된 치환되지 않은 알킬기를 가리킨다. 예를 들면, 메틸(-CH3)은 치환되지 않은 알킬기이다. 메틸의 탄소가 피리딘의 탄소 2(피리딘의 N에 결합된 탄소중 하나) 또는 피리딘의 탄소 3 또는 4에 결합된 경우와 같이, 메틸기의 수소 원자가 헤테로사이클릴기로의 결합에 의해 대체되는 경우, 화합물은 치환되지 않은 헤테로사이클릴알킬기이다.
구 "치환된 헤테로사이클릴알킬"은 치환된 아르알킬기가 치환되지 않은 아르알킬기와 관련하여 갖는 것과 동일한 의미를 치환되지 않은 헤테로사이클릴알킬기와 관련하여 갖는다. 치환된 헤테로사이클릴알킬기는 또한 수소가 아닌 원자가 헤테로사이클릴알킬기의 헤테로사이클릴기중 헤테로원자(예컨대, 피페리딘일알킬기의 피페리딘 고리중 질소 원자, 이것으로 한정되지는 않음)에 결합된 기를 포함한다.
구 "치환되지 않은 헤테로사이클릴알켄일"은 치환되지 않은 알켄일기의 수소 또는 탄소 결합이 상기 정의된 헤테로사이클릴기로의 결합으로 대체된 상기 정의된 치환되지 않은 알켄일기를 가리킨다. 예를 들어, 비닐은 치환되지 않은 알켄일기이다. 비닐의 탄소가 피리딘의 탄소 2 또는 피리딘의 탄소 3 또는 4에 결합된 경우와 같이, 비닐기의 수소 원자가 헤테로사이클릴기로의 결합에 의해 대체되는 경우, 화합물은 치환되지 않은 헤테로사이클릴알켄일기이다.
구 "치환된 헤테로사이클릴알켄일"은 치환된 아르알켄일기가 치환되지 않은 아르알켄일기와 관련하여 갖는 것과 동일한 의미를 치환되지 않은 헤테로사이클릴알켄일기와 관련하여 갖는다. 그러나, 치환된 헤테로사이클릴알켄일기는 또한 수소가 아닌 원자가 헤테로사이클릴알켄일기의 헤테로사이클릴기중 헤테로원자(예컨대, 피페리딘일알켄일기의 피페리딘 고리중 질소 원자, 이것으로 국한되지는 않음)에 결합된 기를 포함한다.
구 "치환되지 않은 헤테로사이클릴알킨일"은 치환되지 않은 알킨일기의 수소 또는 탄소 결합이 상기 정의된 헤테로사이클릴기로의 결합으로 대체된 상기 정의된 치환되지 않은 알킨일기를 일컫는다. 예를 들면, 아세틸렌은 치환되지 않은 알킨일기이다. 아세틸렌의 탄소가 피리딘의 탄소 2 또는 피리딘의 탄소 3 또는 4에 결합된 경우와 같이, 아세틸렌기의 수소 원자가 헤테로사이클릴기로의 결합에 의해 대체되는 경우, 화합물은 치환되지 않은 헤테로사이클릴알킨일기이다.
구 "치환된 헤테로사이클릴알킨일"은 치환된 아르알킨일기가 치환되지 않은 아르알킨일기와 관련하여 갖는 것과 동일한 의미를 치환되지 않은 헤테로사이클릴알킨일기와 관련하여 갖는다. 치환된 헤테로사이클릴알킨일기는 또한 수소가 아닌 원자가 헤테로사이클릴알킨일기의 헤테로사이클릴기중 헤테로원자(예컨대, 피페리딘일알킨일기의 피페리딘 고리중 질소 원자, 이것으로 한정되지는 않음)에 결합된 기를 포함한다.
구 "치환되지 않은 알콕시"는 수소 원자로의 결합이 상기 정의된 달리 치환되지 않은 알킬기의 탄소 원자로의 결합에 의해 대체된 하이드록실기(-OH)를 의미한다.
구 "치환된 알콕시"는 수소 원자로의 결합이 상기 정의된 달리 치환된 알킬기의 탄소 원자로의 결합에 의해 대체된 하이드록실기(-OH)를 가리킨다.
"약학적으로 허용가능한 염"은 무기 염기, 유기 염기, 무기 산, 유기 산, 또는 염기성 또는 산성 아미노산과의 염을 포함한다. 무기 염기의 염은 예를 들어 나트륨 또는 칼륨 같은 알칼리금속; 칼슘 및 마그네슘 또는 알루미늄 같은 알칼리토금속; 및 암모니아를 포함한다. 유기 염기의 염은 예컨대 트라이메틸아민, 트라이에틸아민, 피리딘, 피콜린, 에탄올아민, 다이에탄올아민 및 트라이에탄올아민을 포함한다. 무기 산의 염은 예를 들어 염산, 붕화수소산(hydroboric acid), 질산, 황산 및 인산을 포함한다. 유기 산의 염은 예컨대 폼산, 아세트산, 트라이플루오로아세트산, 퓨마르산, 옥살산, 타타르산, 말레산, 시트르산, 석신산, 말산, 메테인설폰산, 벤젠설폰산 및 p-톨루엔설폰산을 포함한다. 염기성 아미노산의 염은 예를 들어 아르기닌, 리신 및 오르니틴을 포함한다. 산성 아미노산은 예컨대 아스파르트산 및 글루탐산을 포함한다.
"호변 이성질체"는 서로 평형 상태인 화합물의 이성질체 형태를 일컫는다. 이성질체 형태의 농도는 화합물이 발견되는 환경에 따라 달라지며, 예를 들어 화합물이 고체인지 또는 유기 용액 또는 수용액인지의 여부에 따라 상이할 수 있다. 예를 들어, 수용액에서, 케톤은 전형적으로 이들의 에놀 형태와 평형 상태에 있다. 그러므로, 케톤과 이들의 에놀은 상호간의 호변 이성질체로 일컬어진다. 당해 분야의 숙련자에 의해 용이하게 이해되는 바와 같이, 다양한 작용기 및 다른 구조는 호변 이성질체 형성을 나타낼 수 있으며, 화학식 I, II 및 III의 화합물의 호변 이성질체는 모두 본 발명이 영역 내에 속한다.
본 발명에 따른 화합물은 용매화, 특히 수화될 수 있다. 화합물 또는 화합물을 포함하는 조성물을 제조하는 동안 수화가 일어날 수 있거나, 또는 화합물의 흡습성 때문에 시간이 경과함에 따라 수화가 이루어질 수 있다.
특정 실시양태는 전구약물로서 일컬어지는 유도체이다. "전구약물"이라는 표현은 예컨대 약물에 비해 향상된 전달 및 치료 가치 같은 향상된 특징을 갖고 효소에 의한 과정 또는 화학적 과정에 의해 약물로 변형될 수 있는, 약학적으로 또는 치료 면에서 활성인 약물의 유도체, 예컨대 에스터 및 아마이드를 나타낸다. 예를 들어, 노터리(R. E. Notari)의 문헌[Methods Enzymol. 112:309-323 (1985)]; 보더(N. Bodor)의 문헌[Drugs of the Future 6:165-182 (1981)]; 번드가드(H. Bundgaard)의 문헌[Chapter 1, Design of Prodrugs (번드가드 편집), Elsevier, 뉴욕 (1985)]; 및 길맨(A. G. Gilman) 등의 문헌[Goodman And Gilman's The Pharmacological Basis of Therapeutics, 제8판, McGraw-Hill (1990)] 참조. 따라서, 전구약물은 약물의 대사 안정성 또는 수송 특징을 변화시키거나, 약물의 부작용 또는 독성을 마스킹하거나, 약물의 향미를 개선시키거나, 또는 약물의 다른 특징 또는 특성을 변화시키도록 디자인될 수 있다.
본 발명의 화합물은 기술내용으로부터 명백한 바와 같이 임의의 또는 모든 비대칭 원자에서의 풍부해지거나 분할된 광학 이성질체를 포함한다. 라세미 혼합물 및 부분입체 이성질체 혼합물 둘 다 뿐만 아니라, 상응하는 거울상 이성질체 또는 부분입체 이성질체를 실질적으로 함유하지 않도록 하기 위하여 개별 광학 이성질체를 단리 또는 합성할 수 있다. 이러한 입체 이성질체는 모두 본 발명의 영역 내에 속한다.
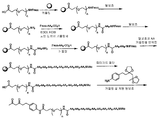
본원에 사용되는 용어 "카복시 보호기"는 화합물의 다른 작용 부위를 포함하는 반응을 수행하는 동안 카복실산 작용기를 차단 또는 보호하기 위하여 사용되는 카복실산 보호 에스터기를 일컫는다. 카복시 보호기는 예를 들어 본원에 참고로 인용된 그린(Greene)의 문헌[Protective Groups in Organic Synthesis, pp. 152-186, John Wiley & Sons, 뉴욕 (1981)]에 개시되어 있다. 또한, 카복시 보호기를 전구약물로서 사용할 수 있으며, 이로써 예컨대 효소에 의한 가수분해에 의해 카복시 보호기를 용이하게 절단하여 생물학적 활성 모 화합물을 방출할 수 있다. 히구치(T. Higuchi) 및 스텔라(V. Stella)는 본원에 참고로 인용된 문헌["Pro-drugs as Novel Delivery Systems", A.C.S. Symposium Series의 Vol. 14, American Chemical Society (1975)]에서 전구약물의 개념에 대해 논의한다. 이러한 카복시 보호기는 본원에 참고로 인용된 미국 특허 제 3,840,556 호 및 제 3,719,667 호, 쿠콜자(S. Kukolja)의 문헌[J. Am. Chem. Soc. 93:6267-6269 (1971)] 및 구토스키(G.E. Gutowski)의 문헌[Tetrahedron Lett. 21:1779-1782 (1970)]에 기재되어 있는 바와 같이, 페니실린 및 세팔로스포린 분야에서 카복실기의 보호에 광범위하게 사용되는 것으로 당해 분야의 숙련자에게 널리 공지되어 있다. 카복실기를 함유하는 화합물의 전구약물로서 유용한 에스터의 예는 예컨대 본원에 참고로 인용된 문헌[Bioreversible Carriers in Drug Design : Theory and Application (로슈 등 편집), Pergamon Press, 뉴욕 (1987)]의 14 내지 21쪽에서 찾아볼 수 있다. 대표적인 카복시 보호기는 C1 내지 C8 알킬(예컨대, 메틸, 에틸 또는 3급 뷰틸 등); 할로알킬; 알켄일; 사이클로헥실, 사이클로펜틸 등과 같은 사이클로알킬 및 그의 치환된 유도체; 사이클로헥실메틸, 사이클로펜틸메틸 등과 같은 사이클로알킬알킬 및 그의 치환된 유도체; 예컨대 펜에틸 또는 벤질 같은 아릴알킬, 및 알콕시벤질 또는 나이트로벤질기 등과 같은 그의 치환된 유도체; 아릴알켄일, 예를 들어 페닐에텐일 등; 아릴 및 그의 치환된 유도체, 예를 들어 5-인단일 등; 다이알킬아미노알킬(예컨대, 다이메틸아미노에틸 등); 아세톡시메틸, 뷰티릴옥시메틸, 발레리톡시메틸, 아이소뷰티릴옥시메틸, 아이소발레릴옥시메틸, 1-(프로피온일옥시)-1-에틸, 1-(피발로일옥실)-1-에틸, 1-메틸-1-(프로피온일옥시)-1-에틸, 피발로일옥시메틸, 프로피온일옥시메틸 등과 같은 알카노일옥시알킬기; 사이클로프로필카본일옥시메틸, 사이클로뷰틸카본일옥시메틸, 사이클로펜틸카본일옥시메틸, 사이클로헥실카본일옥시메틸 등과 같은 사이클로알카노일옥시알킬기; 벤조일옥시메틸, 벤조일옥시에틸 등과 같은 아로일옥시알킬; 벤질카본일옥시메틸, 2-벤질카본일옥시에틸 등과 같은 아릴알킬카본일옥시알킬; 메톡시카본일메틸, 사이클로헥실옥시카본일메틸, 1-메톡시카본일-1-에틸 등과 같은 알콕시카본일알킬; 메톡시카본일옥시메틸, 3급-뷰틸옥시카본일옥시메틸, 1-에톡시카본일옥시-1-에틸, 1-사이클로헥실옥시카본일옥시-1-에틸 등과 같은 알콕시카본일옥시알킬; 3급-뷰틸옥시카본일아미노메틸 등과 같은 알콕시카본일아미노알킬; 메틸아미노카본일아미노메틸 등과 같은 알킬아미노카본일아미노알킬; 아세틸아미노메틸 등과 같은 알카노일아미노알킬; 4-메틸피페라진일카본일옥시메틸 등과 같은 헤테로환상 카본일옥시알킬; 다이메틸아미노카본일메틸, 다이에틸아미노카본일메틸 등과 같은 다이알킬아미노카본일알킬; (5-3급-뷰틸-2-옥소-1,3-다이옥솔렌-4-일)메틸 등과 같은 (5-(알킬)-2-옥소-1,3-다이옥솔렌-4-일)알킬; 및 (5-페닐-2-옥소-1,3-다이옥솔렌-4-일)메틸 등과 같은 (5-페닐-2-옥소-1,3-다이옥솔렌-4-일)알킬이다.
본원에 사용되는 용어 "N-보호기" 또는 "N-보호된"은 합성 절차 동안 원치 않는 반응에 대하여 아미노산 또는 펩타이드의 N-말단을 보호하거나 아미노기를 보호하고자 하는 기를 일컫는다. 통상적으로 사용되는 N-보호기는 예를 들어 본원에 참고로 인용된 그린의 문헌[Protective Groups in Organic Synthesis, John Wiley & Sons, 뉴욕 (1981)]에 개시되어 있다. 예를 들어, N-보호기는 폼일, 아세틸, 프로피온일, 피발로일, 3급-뷰틸아세틸, 2-클로로아세틸, 2-브로모아세틸, 트라이플루오로아세틸, 트라이클로로아세틸, 프탈릴, o-나이트로페녹시아세틸, a-클로로뷰티릴, 벤조일, 4-클로로벤조일, 4-브로모벤조일, 4-나이트로벤조일 등과 같은 아실기; 벤젠설폰일, p-톨루엔설폰일 등과 같은 설폰일기; 벤질옥시카본일, p-클로로벤질옥시카본일, p-메톡시벤질옥시카본일, p-나이트로벤질옥시카본일, 2-나이트로벤질옥시카본일, p-브로모벤질옥시카본일, 3,4-다이메톡시벤질옥시카본일, 3,5-다이메톡시벤질옥시카본일, 2,4-다이메톡시벤질옥시카본일, 4-메톡시벤질옥시카본일, 2-나이트로-4,5-다이메톡시벤질옥시카본일, 3,4,5-트라이메톡시벤질옥시카본일, 1-(p-바이페닐릴)-1-메틸에톡시카본일, α,α-다이메틸-3,5-다이메톡시벤질옥시카본일, 벤즈하이드릴옥시카본일, 3급-뷰틸옥시카본일, 다이아이소프로필메톡시카본일, 아이소프로필옥시카본일, 에톡시카본일, 메톡시카본일, 알릴옥시카본일, 2,2,2-트라이클로로에톡시카본일, 페녹시카본일, 4-나이트로페녹시카본일, 플루오렌일-9-메톡시카본일, 사이클로펜틸옥시카본일, 아다만틸옥시카본일, 사이클로헥실옥시카본일, 페닐티오카본일 등과 같은 카밤에이트 형성 기; 벤질, 트라이페닐메틸, 벤질옥시메틸 등과 같은 알킬기; 및 트라이메틸실릴 등과 같은 실릴기를 포함할 수 있다. 일부 실시양태에서, N-보호기는 폼일, 아세틸, 벤조일, 피발로일, 3급-뷰틸아세틸, 페닐설폰일, 벤질, 9-플루오렌일메틸옥시카본일(Fmoc), 3급-뷰틸옥시카본일(Boc) 및 벤질옥시카본일(Cbz)이다.
본원에 사용되는 "할로", "할로겐" 또는 "할라이드"는 F, Cl, Br 또는 I를 일컫는다.
본원에 사용되는 임의의 보호기, 아미노산 또는 다른 화합물의 약어는 달리 표시되지 않는 한 이들의 통상적인 용도, 승인된 약어, 또는 생화학적 명명법에 대한 IUPAC-IUB 위원회[Biochem. 11:942-944 (1972)]에 따른다.
본원에 사용되는 "실질적으로 순수한"이란, 이러한 순도를 평가하기 위하여 당해 분야의 숙련자가 사용하는 박층 크로마토그래피(TLC), 겔 전기영동 및 고성능 액체 크로마토그래피(HPLC) 같은 표준 분석 방법에 의해 결정할 때 용이하게 검출될 수 있는 불순물을 함유하지 않는 것으로 보이기에 충분히 균질이거나, 또는 추가의 정제시 물질의 효소 활성 및 생물학적 활성 같은 물리적 및 화학적 특성이 검출될 수 있을 정도로 변화되지 않기에 충분히 순수함을 의미한다. 실질적으로 순수함은 AA 표적화제 또는 AA 표적화 화합물이 조성물중 성분의 약 50% 이상, 약 60% 이상, 약 70% 이상, 약 80% 이상, 약 90% 이상, 또는 약 95% 이상을 구성하는 것과 같이 조성물의 주성분을 형성하는 조성물을 포함한다. 실질적으로 화학적으로 순수한 화합물을 생성시키기 위한 화합물의 정제 방법은 당해 분야의 숙련자에게 공지되어 있다. 그러나, 실질적으로 화학적으로 순수한 화합물은 입체 이성질체의 혼합물일 수 있다. 이러한 경우에는, 추가 정제시 화합물의 비활성이 증가될 수 있다. 그러나, AA 표적화제가 항상 특정한 정제된 상태로 제공되어야 할 필요는 없다. 특정 실시양태에서 목적하는 용도에 따라 부분 정제된 조성물이 사용되기도 한다. 예를 들어, AA-표적화제의 총 회수율을 더 높일 수 있는 정제 방법은 더 낮은 상대적 정제도를 제공할 수 있다.
본원에 사용되는 "생물학적 활성"은 화합물, 조성물 또는 다른 혼합물의 생체내 투여시 발생되는 화합물, 조성물 또는 다른 혼합물의 생체내 활성 또는 생리학적 반응을 말한다. 따라서, 생물학적 활성은 이러한 화합물, 조성물 및 혼합물의 치료 효과, 진단 효과 및 약학적 활성을 포괄한다. 폴리펩타이드를 함유하는 본 발명의 AA 표적화제 또는 그의 조성물에 대한 수식어로서 사용될 때 용어 "생물학적 활성" 또는 "기능성"은 AA 표적화제의 특징이거나 AA 표적화제와 유사한 하나 이상의 활성을 나타내는 폴리펩타이드를 가리킨다.
본원에 사용되는 "약동학"은 시간의 경과에 따른 혈청중 투여된 화합물의 농도를 말한다. 약력학은 시간의 경과에 따른 표적 조직 및 비표적 조직중 투여된 화합물의 농도, 및 표적 조직에 대한 효과(예컨대, 효능)와 비표적 조직에 대한 효과(예컨대, 독성)를 일컫는다. 불안정한 연결기를 사용함으로써, 또는 임의의 연결기의 화학적 특성을 변화시킴으로써(예를 들어, 용해도, 전하 등을 변화시킴으로써), 특정 표적화제 또는 생물학적 약제에 대하여 예를 들어 약동학 또는 약력학에서의 개선을 디자인할 수 있다.
본원에 사용되는 구 "효과량" 및 "치료 효과량"은 AA 표적화제의 하나 이상의 생물학적 활성 특징의 수준에서의 관측가능한 변화를 뒷받침하기에 유용하거나 상기 변화를 뒷받침할 수 있는 AA 표적화제 또는 AA 표적화제를 포함하는 화합물의 양, 또는 유익한 효과(예를 들어, 이를 섭취하는 환자의 증상의 경감)를 부여하기에 충분한 투여량을 가리킨다. 임의의 특정 개체에 특이적인 치료 효과 투여량 수준은 치료되는 증상 또는 장애, 증상 또는 장애의 중증도, 특정 화합물의 활성, 투여 경로, 화합물의 클리어런스(clearance) 속도, 치료 지속 기간, 조합에 사용되거나 화합물과 부합하는 약물, 개체의 연령, 체중, 성별, 식이 및 전반적인 건강을 비롯한 다양한 인자뿐만 아니라 의학 분야 및 과학계에 널리 공지되어 있는 다른 인자에 따라 달라질 것이다. 치료 효과량은 치료되는 조직에서의 혈관 신생의 측정가능한 억제를 야기하기에 충분한 AA 표적화제의 양, 즉 혈관 신생-억제량일 수 있다. 면역 조직 화학에 의해 또는 당해 분야의 숙련자에게 알려져 있는 다른 방법에 의해 혈관 신생의 억제를 측정할 수 있다. "치료 효과량"을 결정함에 있어서 고려되는 다양하고 일반적인 고려사항은 당해 분야의 숙련자에게 공지되어 있으며, 예를 들어 길맨(Gilman, A. G.) 등의 문헌[Goodman And Gilman's The Pharmacological Basis of Therapeutics, 제8판, McGraw-Hill (1990)] 및 문헌[Remington's Pharmaceutical Sciences, 제17판, Mack Publishing Co., 펜실베이니아주 이스턴 (1990)]에 기재되어 있다.
한 양태에서, 본 발명은 AA 표적화제가 항체의 결합 부위에 공유 결합된 다양한 표적화 화합물을 제공한다.
다른 양태에서, 본 발명은 AA 표적화제의 하나 이상의 물리적 또는 생물학적 특징을 개질시키는 방법을 포함한다. 방법은 AA 표적화제를 항체의 결합 부위에 직접 또는 연결기를 통해 공유 결합시킴을 포함한다. 개질될 수 있는 AA 표적화제의 특징은 결합 친화력, 열화에 대한 감수성(예컨대, 프로테아제에 의한), 약동학, 약력학, 면역원성, 용해도, 친유성, 친수성, 소수성, 안정성(더 안정하거나 덜 안정함, 또한 계획적 열화), 강성, 가요성, 항체 결합의 조절 등을 포함하지만 이들로 국한되지는 않는다. 또한, 항체에 의해 제공되는 작동체 기능(들)을 부가함으로써 특정 AA 표적화제의 생물학적 효능을 증가시킬 수 있다. 예를 들어, 항체는 보체 매개 작동체 기능 같은 작동체 기능을 제공한다. 임의의 이론에 얽매이고자 하지 않으면서, AA 표적화 화합물의 항체 부분은 일반적으로 생체 내에서 작은 크기의 AA 표적화제의 반감기를 연장시킬 수 있다. 그러므로, 한 양태에서, 본 발명은 AA 표적화제의 유효 순환 반감기를 증가시키는 방법을 제공한다.
또 다른 양태에서, 본 발명은 AA 표적화제를 항체의 결합 부위에 공유 결합시킴으로써 항체의 결합 활성을 조절하는 방법을 제공한다. 임의의 이론에 얽매이고자 하지는 않지만, 항원이 항체의 결합 부위와 접촉하지 못하도록 입체적으로 방해하는 연결된 AA 표적화제(들)로 인해 항원으로의 항체 결합이 실질적으로 감소할 수 있다. 다르게는, 공유 결합에 의해 개질된 항체 결합 부위의 아미노산 측쇄가 항원으로의 결합에 중요한 경우에 항원 결합이 실질적으로 감소될 수 있다. 대조적으로, 연결된 AA 표적화제(들)가 항원이 항체 결합 부위와 접촉하는 것을 입체적으로 방해하지 않고/않거나 공유 결합에 의해 개질된 항체 결합 부위의 아미노산 측쇄가 항원으로의 결합에 중요하지 않을 때에는, 항원으로의 항체 결합이 실질적으로 증가할 수 있다.
또 다른 양태에서, 본 발명은 Ang-2에 대한 결합 특이성을 생성시키기 위하여 항체의 결합 부위를 개질시키는 방법을 포함한다. 이러한 방법은 AA 표적화제가 Ang-2 결합 펩타이드에 기초하는 본원에 기재된 AA 표적화제-연결기 화합물의 연결기상의 화학적 잔기에 항체의 결합 부위의 반응성 아미노산 측쇄를 공유 결합시킴을 포함한다. 연결기의 화학적 잔기는 AA 표적화제-연결기 화합물이 항체 결합 부위에 공유 결합될 때 AA 표적화제가 그의 동족체에 결합할 수 있도록 AA 표적화제로부터 충분히 떨어져 위치한다. 전형적으로, 항체는 표적 분자에 특이적인 것으로 생각되지 않는다. 특정 실시양태에서, 공유 결합 전의 항체는 약 1×10- 5몰/리터 미만의 Ang-2에 대한 친화력을 갖는다. 그러나, 항체가 AA 표적화제-연결기 화합물에 공유 결합된 후, 개질된 항체는 바람직하게는 약 1×10- 6몰/리터 이상, 다르게는 1×10- 7몰/리터 이상, 다르게는 1×10- 8몰/리터 이상, 다르게는 1×10- 9몰/리터 이상, 또는 다르게는 약 1×10- 10몰/리터 이상의 표적 분자에 대한 친화력을 갖는다.
AA 표적화제
AA 표적화제는 하기 서열들로 이루어진 군으로부터 선택되는 펩타이드이다:
R1-Q(AcK)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:29)
R1-QNY QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:28)
R1-Q(AcK)Y QPL DEK D(AcK)T LYD QFM LQQ G-R2; (서열 번호:30)
R1-Q(AcK)Y QPL DEK DET LYD QFM LQQ G-R2; (서열 번호:33)
R1-Q(AcK)Y Q(DHP)L DEL DKT LYD QFM LQQ G-R2; (서열 번호:34)
R1-Q(AcK)Y Q(HP)L DEL DKT LYD QFM LQQ G-R2; (서열 번호:35)
R1-Q(AcK)Y QPL DEL DKT IYD QFM LQQ G-R2; (서열 번호:36)
R1-Q(AcK)Y QPL DEI DKT LYD QFM LQQ G-R2; (서열 번호:37)
R1-Q(AcK)Y QPL DEL DKT (HChA)YD QFM LQQ G-R2; (서열 번호:38)
R1-Q(AcK)Y QPL DEL DKT (HF)YD QFM LQQ G-R2; (서열 번호:39)
R1-Q(AcK)Y QPL DEL DKT (ThA)YD QFM LQQ G-R2; (서열 번호:40)
R1-Q(AcK)Y QPL DEL DKT (Nva)YD QFM LQQ G-R2; (서열 번호:41)
R1-Q(AcK)Y QPL DEL DKT (HL)YD QFM LQQ G-R2; (서열 번호:42)
R1-Q(AcK)Y QPL DE(AcK) DKT LYD QFM LQQ G-R2; (서열 번호:43)
R1-Q(AcK)Y QPL DEL DKT LFD QFM LQQ G-R2; (서열 번호:44)
R1-Q(AcK)Y Q(HP)L DE(ThA) DKT L(NO2F)D QFM LQQ G-R2; (서열 번호:45)
R1-Q(AcK)Y Q(HP)L DE(ThA) DKT L(BPA)D QFM LQQ G-R2; (서열 번호:46)
R1-Q(AcK)Y Q(HP)L DE(ThA) DKT L(CO2H)FD QFM LQQ G-R2; (서열 번호:47)
R1-Q(AcK)Y QPL DE(AcK) DKT L(NO2F)D QFM LQQ G-R2; (서열 번호:48)
R1-Q(AcK)Y QPL DE(AcK) DKT LFD QFM LQQ G-R2; (서열 번호:63)
DCB-Q(AcK)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:49)
DFB-Q(AcK)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:50)
PyC-Q(AcK)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:51)
아미도 2-PEG-Q(AcK)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:52)
R1-Q(ClBn카밤에이트K)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:53)
R1-Q(AcK)Y QPL DEL D(Dab)T LYD QFM LQQ G-R2; (서열 번호:54)
R1-Q(AcK)Y QPL DEL D(Dap)T LYD QFM LQQ G-R2; (서열 번호:55)
R1-Q(AcK)Y QPL DEL DKT L(NO2F)D QFM LQQ G-R2; (서열 번호:91)
R1-QNY QPL DEL DKT L(BPA)D QFM LQQ G-R2; (서열 번호:56)
R1-QNY QPL DEL DKT L(CF)D QFM LQQ G-R2; (서열 번호:57)
R1-Q(Nick)Y QPL DEL DKT LYD QFM LQQ G-R2; (서열 번호:61)
R1-Q(AcK)Y QPL DE(AcK) DKT L(CF)D QFM LQQ G-R2; (서열 번호:62) 및
R1-Q(AcK)Y QPL DE(AcK) DKT LFD QFM LQQ G-R2; (서열 번호:63)
상기 서열에서,
R1은 CH3, C(O)CH3, C(O)CH3, C(O)CH2CH3, C(O)CH2CH2CH3, C(O)CH(CH3)CH3, C(O)CH2CH2CH2CH3, C(O)CH(CH3)CH2CH3, C(O)C6H5, C(O)CH2CH2(CH2CH2O)1-5Me, 다이클로로벤조일(DCB), 다이플루오로벤조일(DFB), 피리딘일 카복실레이트(PyC) 또는 아미도-2-PEG, 아미노 보호기, 지질 지방산기 또는 탄수화물이고;
R2는 OH, NH2, NH(CH3), NHCH2CH3, NHCH2CH2CH3, NHCH(CH3)CH3, NHCH2CH2CH2CH3, NHCH(CH3)CH2CH3, NHC6H5, NHCH2CH2OCH3, NHOCH3, NHOCH2CH3, 카복시 보호기, 지질 지방산기 또는 탄수화물이다.
당해 분야에 널리 공지되어 있는 기법을 이용하여 AA 표적화 화합물을 제조할 수 있다. 전형적으로, 펩타이딜 AA 표적화제의 합성이 제 1 단계이고, 이는 본원에 기재되어 있는 바와 같이 수행된다. 이어, 표적화제를 연결 구성요소(연결기)로의 결합을 위해 유도체화시킨 다음, 이를 항체와 결합시킨다. 당해 분야의 숙련자는 이용되는 구체적인 합성 단계가 3가지 구성요소의 정확한 특성에 따라 달라짐을 용이하게 알게 될 것이다. 그러므로, 본원에 기재된 AA 표적화제-연결기 컨쥬게이트 및 AA 표적화 화합물은 용이하게 합성될 수 있다.
당해 분야의 숙련자에게 공지되어 있는 다수의 기법에 의해 AA 표적화제 펩타이드를 합성할 수 있다. 고상 펩타이드 합성의 경우, 예시적인 기법의 개요를 문헌[Chemical Approaches to the Synthesis of Peptides and Proteins (윌리엄즈 등 편집), CRC Press, 플로리다주 보카 레이턴 (1997)]에서 찾아볼 수 있다.
전형적으로, 당해 분야에 널리 공지되어 있는 절차에 따라 고상에서 연속적으로 목적하는 펩타이드성 AA 표적화제를 합성한다. 예를 들어 미국 특허원 제 2003/0045477 호 참조. 연결기를 고상에서 부분적으로 또는 완전히 펩타이드에 부착시킬 수 있거나, 또는 수지로부터 펩타이드를 제거한 후 용액상 기법을 이용하여 연결기를 부가할 수 있다(도 6a 및 도 6b 참조). 예를 들어, N-보호된 아미노 및 카복실산-함유 연결 잔기를 4-하이드록시메틸-페녹시메틸-폴리(스타이렌-1% 다이비닐벤젠) 같은 수지에 부착할 수 있다. 적절한 산(예컨대, Boc의 경우 TFA) 또는 염기(예컨대, Fmoc의 경우 피페리딘)에 의해 N-보호기를 제거하고, 통상적인 C-말단에서 N-말단으로의 방식으로 펩타이드 서열을 생성시킬 수 있다(도 6a 참조). 다르게는, 펩타이드 서열을 먼저 합성하고 그 후 연결기를 N-말단 아미노산 잔기에 부가할 수 있다(도 6b 참조). 또 다른 방법은 합성 동안 적절한 측쇄를 탈보호시키고 적합하게 반응성인 연결기로 유도체화시킴을 포함한다. 예를 들어, 리신 측쇄를 탈보호시키고 활성 에스터를 갖는 연결기와 반응시킬 수 있다. 다르게는, 측쇄(도 6b 참조) 또는 일부 경우 알파-아미노 질소에 이미 부착된 적합하게 보호된 연결 잔기를 갖는 아미노산 유도체를 성장하는 펩타이드 서열의 일부로서 부가할 수 있다.
고상 합성 후, 표적화제-연결기 컨쥬게이트를 수지로부터 제거하고 연속적으로 또는 단일 작업으로 탈보호시킨다. 수지-결합된 펩타이드-연결기 컨쥬게이트를 절단 시약, 예를 들어 티아니솔, 물 또는 에테인다이티올 같은 소거제를 함유하는 트라이플루오로아세트산으로 처리함으로써 단일 작업으로 표적화제-연결기 컨쥬게이트를 제거하고 탈보호시킬 수 있다. 탈보호 및 표적화제의 방출 후, 표적화제 펩타이드를 추가로 유도체화시킬 수 있다.
하기 유형중 임의의 것 또는 모두를 이용하는 일련의 크로마토그래피 단계에 의해 완전히 탈보호된 표적화제-연결기 컨쥬게이트를 정제한다: 아세테이트 형태의 약염기성 수지상에서의 이온 교환; 유도체화되지 않은 폴리스타이렌-다이비닐벤젠 상에서의 소수성 흡착 크로마토그래피[예를 들어, 앰벌라이트 재드(AMBERLITE XAD)]; 실리카겔 흡착 크로마토그래피; 카복시메틸셀룰로즈 상에서의 이온 교환 크로마토그래피; 예를 들어 세파덱스(SEPHADEX) G-25, LH-20 상에서의 분배 크로마토그래피, 또는 역류 분포; 고성능 액체 크로마토그래피(HPLC), 특히 옥틸- 또는 옥타데실실릴-실리카 결합된 상 칼럼 팩킹 상에서의 역상 HPLC.
항체
본원에 사용되는 "항체"는 면역 반응 활성을 갖는 중질 쇄 및/또는 경질 쇄를 포함하는 폴리펩타이드 분자를 포함한다. 항체는 B 세포와 이들의 변이체의 산물인 면역 글로불린, 및 T 세포와 이들의 변이체의 산물인 T 세포 수용체(TcR)를 포함한다. 면역 글로불린은 면역 글로불린 카파 및 람다, 알파, 감마, 델타, 엡실론 및 뮤 불변 영역 유전자뿐만 아니라 무수한 면역 글로불린 가변 영역 유전자에 의해 실질적으로 코딩되는 하나 이상의 폴리펩타이드를 포함하는 단백질이다. 경질 쇄는 카파 또는 람다로 분류된다. 중질 쇄는 감마, 뮤, 알파, 델타 또는 엡실론으로 분류되고, 이들은 다시 각각 면역 글로불린 부류 IgG, IgM, IgA, IgD 및 IgE를 한정한다. 중질 쇄의 아부류도 알려져 있다. 예를 들어, 인간에서 IgG 중질 쇄는 IgG1, IgG2, IgG3 및 IgG4 아부류중 임의의 것일 수 있다.
전형적인 면역 글로불린 구조 단위는 사량체를 포함하는 것으로 알려져 있다. 각각의 사량체는 동일한 두 쌍의 폴리펩타이드 쇄로 구성되며, 각각의 쌍은 하나의 "경질"(약 25kD) 쇄 및 하나의 "중질"(약 50 내지 70kD) 쇄를 갖는다. 각 쇄의 N-말단은 항원 인식을 주로 담당하는 약 100 내지 110개 이상의 아미노산의 가변 영역을 한정한다. 용어 가변 경질 쇄(VL) 및 가변 중질 쇄(VH)는 각각 이들 경질 쇄 및 중질 쇄를 일컫는다. 항체의 아미노산은 천연적으로 발생할 수 있거나 또는 천연적으로 발생하지 않을 수 있다.
2개의 결합 부위를 함유하는 항체는 이들이 2개의 상보성 또는 항원 인식 부위를 갖는다는 점에서 2가이다. 전형적인 천연 2가 항체는 IgG이다. 척추동물 항체는 통상적으로 2개의 중질 쇄와 2개의 경질 쇄를 갖지만, 중질 쇄만 갖는 항체도 알려져 있다. 뮐더맨스(Muyldermans) 등의 문헌[TRENDS, Biochem. Sci. 26(4):230-235 (1991)] 참조. 이러한 항체는 2가이고, 중질 쇄 접합(pairing)에 의해 형성된다. 항체는 또한 IgA의 이량체 형태 및 오량체 IgM 분자의 경우에서와 같이 다가일 수도 있다. 항체는 또한 항체 쇄가 인용된 포유동물 항체 쇄와 개별적으로 상동인 혼성 항체도 포함한다. 중질 쇄와 경질 쇄의 한 쌍은 하나의 항원에 특이적인 결합 부위를 갖고, 중질 쇄와 경질 쇄의 다른 한 쌍은 상이한 항원에 특이적인 결합 부위를 갖는다. 이러한 항체는 이들이 동시에 2개의 상이한 항원과 결합할 수 있기 때문에 양특이성(bi-specific)으로 불린다. 항체는 또한 예컨대 Fab 또는 Fab' 단편의 경우에서와 같이 1가일 수도 있다.
항체는 전장 완전 항체로서 또는 다양한 펩티다제 또는 화학약품을 사용한 소화에 의해 생성된 그 특징이 널리 알려진 다수의 단편으로서 존재한다. 따라서, 예를 들어 펩신은 힌지 영역에서 다이설파이드 연결기 아래에서 항체를 소화시켜 다이설파이드 결합에 의해 VH-CH1에 연결된 경질 쇄인 Fab의 이량체인 F(ab')2를 생성시킨다. F(ab')2를 온화한 조건하에서 환원시켜 힌지 영역에서 다이설파이드 연결기를 파괴함으로써 F(ab')2 이량체를 Fab' 단량체로 전환시킬 수 있다. Fab' 단량체는 본질적으로 힌지 영역의 일부를 갖는 Fab 단편이다[다른 항체 단편에 대한 더욱 상세한 설명은 예를 들어 Fundamental Immunology (폴 편집), Raven Press, 뉴욕 (1993)을 참조함]. 다른 예로서, 파파인으로 부분적으로 소화시켜 1가 Fab/c 단편을 생성시킬 수 있다. 글레니(M. J. Glennie) 등의 문헌[Nature 295:712-714 (1982)] 참조. 다양한 항체 단편이 완전한 항체의 소화 면에서 정의되지만, 당해 분야의 숙련자는 화학적으로 또는 재조합 DNA 바업을 이용함으로써 다양한 임의의 항체 단편을 새롭게 합성할 수 있음을 알게 될 것이다. 그러므로, 본원에 사용되는 용어 항체는 또한 전체 항체의 개질에 의해 생성되거나, 새롭게 합성되거나, 또는 재조합 DNA 방법으로부터 수득되는 항체 단편도 포함한다. 당해 분야의 숙련자는 전체 항체보다 항체 단편을 사용하는 것이 유리한 상황이 있음을 인식하게 될 것이다. 예를 들면, 항체 단편의 더 작은 크기로 인해 클리어런스가 신속하게 이루어질 수 있고 고형 암으로의 접근이 개선될 수 있다.
재조합 항체는 통상적인 전장 항체, 하이브리드 항체, 중질 쇄 항체, 단백질 분해성 소화로부터 알려진 항체 단편, Fv 또는 단일 쇄 Fv(scFv) 같은 항체 단편, VH 또는 VL 같은 단일 도메인 단편, 다이어바디(diabody), 도메인 결실된 항체, 미니바디(minibody) 등일 수 있다. Fv 항체는 크기가 약 50kD이고, 경질 쇄 및 중질 쇄의 가변 영역을 포함한다. 경질 쇄 및 중질 쇄를, 이들이 Fv 단편으로 조립되는 세균 내에서 발현시킬 수 있다. 다르게는, 두 쇄를 처리하여 쇄간 다이설파이드 결합을 형성시킴으로써 dsFv를 제공할 수 있다. 폴리펩타이드가 절첩될 때 생성되는 3차 구조가 항원 결합 부위의 구조를 모방하도록, 단일 쇄 Fv("scFv")는 중간 연결기 서열에 의해 연결된 VH 및 VL 서열 도메인을 포함하는 단일 폴리펩타이드이다. 허스턴(J. S. Huston) 등의 문헌[Proc. Nat. Acad. Sci. U.S.A. 85:5879-5883 (1988)] 참조. 당해 분야의 숙련자는 특정 발현 방법 및/또는 목적하는 항체 분자에 따라, 재조합 항체의 적절한 가공을 수행하여 목적하는 재구성 또는 재조립 항체를 수득할 수 있음을 인식하게 될 것이다. 예를 들어, 전세계적인 웹 URL microbialcellfactories.com/content/3/1/11에서 입수가능한 발레조(Vallejo) 및 리나스(Rinas)의 문헌[Biomed Central.]을 참조한다.
단일 도메인 항체는 중질 VH 또는 경질 VL 쇄중 하나의 가변 영역에 상응하는, 항체의 가장 작은 기능성 결합 단위(크기 약 13kD)이다. 미국 특허 제 6,696,245 호, WO 04/058821 호, WO 04/003019 호 및 WO 03/002609 호 참조. 단일 도메인 항체는 세균, 효모 및 다른 저급 진핵생물 발현 시스템에서 잘 발현된다. 도메인 결실된 항체는 전장 항체와 비교하여 CH2 같은 도메인이 결실되어 있다. 많은 경우, 이러한 도메인 결실된 항체, 특히 CH2 결실된 항체는 이들의 전장 대응물에 비해 개선된 클리어런스를 제공한다. 2개의 VH 도메인을 포함하는 제 1 융합 단백질과 2개의 VL 도메인을 포함하는 제 2 융합 단백질을 연합시킴으로써 다이어바디를 생성시킨다. 전장 항체와 마찬가지로 다이어바디는 2가이고 양특이성일 수 있다. 미니바디는 직접 또는 중간 IgG 힌지를 통해 CH3에 연결된 VH, VL 또는 scFv를 포함하는 융합 단백질이다. 올라프센(T. Olafsen) 등의 문헌[Protein Eng. Des. Sel. 17:315-323 (2004)] 참조. 도메인 결실된 항체와 마찬가지로 미니바디를 처리하여 전체-길이 항체의 결합 특이성을 보존하지만 이들의 더 작은 분자량으로 인해 클리어런스가 개선된다.
T 세포 수용체(TcR)는 2개의 쇄로 구성된 다이설파이드 연결된 헤테로이량체이다. 2개의 쇄는 일반적으로 항체 힌지 영역과 닮은 짧은 연장된 아미노산 신장부에서 T 세포 세포막 바로 바깥에 다이설파이드-결합된다. 각각의 TcR 쇄는 하나의 항체-유사 가변 도메인 및 하나의 불변 도메인으로 이루어진다. 전체 TcR은 약 95kD의 분자량을 갖고, 개별적인 쇄는 크기가 35kD 내지 47kD으로 변한다. 예컨대 당해 분야에 널리 공지되어 있는 방법을 이용하여 가용성 단백질로서 생성될 수 있는 가변 영역 같은 수용체의 일부도 TcR의 의미에 포괄된다. 예를 들어, 미국 특허 제 6,080,840 호 및 슬라네츠(A. E. Slanetz) 및 보쓰웰(A. L. Bothwell)의 문헌[Eur. J. Immunol. 21:179-183 (1991)]에는 TcR의 세포외 도메인을 Thy-1의 글라이코실 포스파티딜이노시톨(GPI) 막 앵커 서열에 접합(splicing)시킴으로써 제조된 가용성 T 세포 수용체가 기재되어 있다. 분자는 세포 표면 상에서 CD3의 부재하에 발현되고, 포스파티딜이노시톨 특이적 포스포리파제 C(PI-PLC)로 처리함으로써 막으로부터 절단될 수 있다. 가용성 TcR은 또한 본질적으로 미국 특허 제 5,216,132 호 및 바시(G. S. Basi) 등의 문헌[J. Immunol. Methods 155:175-191 (1992)]에 기재되어 있는 바와 같이 항체 중질 쇄 CH2 또는 CH3 도메인에 TcR 가변 도메인을 커플링시킴으로써, 또는 슈스타(Shusta) 등의 문헌[Nat. Biotechnol. 18:754-759 (2000)] 또는 홀러(P. D. Holler) 등의 문헌[Proc. Natl. Acad. Sci. U.S.A. 97:5387-5392 (2000)]에 기재되어 있는 바와 같이 가용성 TcR 단일 쇄로서 제조될 수도 있다. 본 발명의 특정 실시양태는 가용성 항체로서 TcR "항체"를 사용한다. 항체에 대해 상기 논의된 것과 동일한 방법을 이용하여 CDR 영역 및 다른 구조형성 잔기를 참조함으로써 TcR의 결합 부위를 확인할 수 있다.
결합 부위는 항원 결합에 참여하는 항체 분자의 부분을 말한다. 중질("H") 및 경질("L") 쇄의 N-말단 가변("V") 영역의 아미노산 잔기에 의해 항원 결합 부위가 형성된다. 항체 가변 영역은 "구조형성 영역"(FR)으로 알려진 더욱 보존된 플랭킹(flanking) 신장부 사이에 끼워진 "초가변 영역" 또는 "상보성 결정 영역"(CDR)으로 일컬어지는 3개의 고도의 분기형 신장부를 포함한다. 경질 쇄의 3가지 초가변 영역(LCDR1, LCDR2 및 LCDR3) 및 중질 쇄의 3가지 초가변 영역(HCDR1, HCDR2 및 HCDR3)을 3차원 공간에서 서로에 대해 배치하여 항원 결합 표면 또는 포켓을 형성한다. 중질-쇄 항체 또는 VH 도메인에서는, 중질 쇄의 3가지 초가변 영역에 의해 항원 결합 부위를 형성한다. VL 도메인에서는, 경질 쇄의 3가지 초가변 영역에 의해 항원 결합 부위를 형성한다.
당해 분야에 널리 공지되어 있는 방법을 이용하여, 결합 부위를 구성하는 특정 항체의 아미노산 잔기의 정체를 결정할 수 있다. 예를 들어, 항체 CDR은 캐뱃(Kabat) 등에 의해 최초로 정의된 초가변 영역으로서 확인될 수 있다. 캐뱃(E. A. Kabat) 등의 문헌[Sequences of Proteins of Immunological Interest, 제5판, Public Health Service, NIH, 워싱턴 디.씨. (1992)] 참조. CDR의 위치는 또한 초티아(Chothia) 등에 의해 최초로 기재된 구조적 루프 구조체로서 확인될 수 있다. 예를 들어, 초티아(C. Chothia) 및 레스크(A. M. Lesk)의 문헌[J. Mol. Biol. 196:901-917(1987)]; 초티아 등의 문헌[Nature 342:877-883 (1989)]; 및 트라몬타노(A. Tramontano) 등의 문헌[J. Mol. Biol. 215:175-182 (1990)] 참조. 다른 방법은 캐뱃과 초티아 사이의 절충안이고 옥스포드 몰레큘라(Oxford Molecular)의 AbM 항체 모델링 소프트웨어[현재, 액설리즈(Accelrys)]를 이용하여 유도되는 "AbM 정의", 또는 맥칼럼(R. M. MacCallum) 등의 문헌[J. Mol. Biol. 262:732-745 (1996)]에 기재되어 있는 CDR의 "접촉 정의"를 포함한다. 표 2는 다양한 공지 정의에 기초한 CDR을 나타낸다:
서열로부터 항체의 CDR을 단독으로 확인할 수 있는 일반적인 지침은 다음과 같다:
LCDR1:
출발-대략 잔기 24.
이전 잔기는 항상 Cys이다.
이후 잔기는 항상 Trp이고, 그 후는 전형적으로 Tyr-Gln뿐만 아니라 Leu-Gln, Phe-Gln 또는 Tyr-Leu이다.
길이는 10 내지 17개의 잔기이다.
LCDR2:
출발-L1 종결 이후 16개의 잔기.
이전 서열은 일반적으로 Ile-Tyr이지만, 또한 Val-Tyr, Ile-Lys 또는 Ile-Phe일 수도 있다.
길이는 통상 7개의 잔기이다.
LCDR3:
출발-L2 종결 이후 33개의 잔기.
이전 잔기는 Cys이다.
이후 서열은 Phe-Gly-X-Gly이다.
길이는 7 내지 11개의 잔기이다.
HCDR1:
출발-대략 잔기 26, 초티아/AbM 정의하에 Cys 후 4개의 잔기; 출발은 캐뱃 정의하에 5개의 잔기 이후이다.
이전 서열은 Cys-X-X-X이다.
이후 잔기는 Trp이고, 그 후 전형적으로 Val뿐만 아니라 Ile 또는 Ala이다.
길이는 AbM 정의하에 10 내지 12개의 잔기이고; 초티아 정의는 마지막 4개의 잔기를 제외한다.
HCDR2:
출발-CDR-H1의 캐뱃/AbM 정의 종결 후 15개의 잔기.
이전 서열은 전형적으로 Leu-Glu-Trp-Ile-Gly이지만, 다수의 변형이 가능하다.
이후 서열은 Lys/Arg-Leu/Ile/Val/Phe/Thr/Ala-Thr/Ser/Ile/Ala이다.
길이는 캐뱃 정의하에 16 내지 19개의 잔기이고; AbM 정의는 마지막 7개의 잔기를 제외한다.
HCDR3:
출발-CDR-H2의 종결 후 33개의 잔기(Cys 후 2개의 잔기)
이전 서열은 Cys-X-X(전형적으로는 Cys-Ala-Arg)이다.
이후 서열은 Trp-Gly-X-Gly이다.
길이는 3 내지 25개의 잔기이다.
CDR의 외부에 있지만, 그럼에도 불구하고 결합 부위의 라이닝의 일부인(즉, 결합 부위를 통해 연결에 이용될 수 있는) 측쇄를 가짐으로써 결합 부위의 일부를 구성하는 특정 항체의 아미노산 잔기의 정체는, 분자 모델링 및 X-선 결정법 같은 당해 분야에 널리 공지되어 있는 방법을 이용하여 결정될 수 있다. 예를 들어 리치맨(L. Riechmann) 등의 문헌[Nature 332:323-327 (1988)] 참조.
논의된 바와 같이, 항체에 기초한 AA 표적화 화합물을 제조하는데 사용될 수 있는 항체는 항체 결합 부위에 반응성 측쇄를 필요로 한다. 반응성 측쇄는 천연적으로 존재할 수 있거나 또는 돌연변이에 의해 항체에 위치될 수 있다. 예컨대 잔기가 항체를 제조하기 위해 최초로 확인된 림프구성 세포에 존재하는 핵산에 의해 코딩될 때, 항체 결합 부위의 반응성 잔기가 항체와 연합될 수 있다. 다르게는, 특정 잔기를 코딩하기 위하여 DNA를 의도적으로 돌연변이시킴으로써 아미노산 잔기를 생성시킬 수 있다[예컨대, 미어즈(Meares) 등의 WO 01/22922 호 참조]. 본원에서 논의된 바와 같이 반응성 잔기는 예를 들어 독특한 코돈, tRNA, 및 아미노아실-tRNA를 사용하는 생합성 혼입에 의해 생성되는 비-천연 잔기일 수 있다. 다른 방법에서는, 아미노산 잔기 또는 그의 반응성 작용기(예컨대, 친핵성 아미노기 또는 설프하이드릴기)를 항체 결합 부위의 아미노산 잔기에 부착할 수 있다. 따라서, 본원에서 사용되는 "항체의 결합 부위의 아미노산 잔기를 통해" 발생되는 항체와의 공유 결합은 결합이 항체 결합 부위의 아미노산 잔기로 직접 이루어질 수 있거나 또는 항체 결합 부위의 아미노산 잔기의 측쇄에 연결된 화학적 잔기를 통해 이루어질 수 있음을 의미한다.
촉매적 항체는 하나 이상의 반응성 아미노산 측쇄를 포함하는 결합 부위를 갖는 항체의 한 공급원이다. 이러한 항체는 알돌라제 항체, 베타 락타마제 항체, 에스테라제 항체, 아미다제 항체 등을 포함한다.
한 실시양태는 마우스 단클론 항체 mAb 38C2 또는 mAb 33F12뿐만 아니라 이러한 항체의 적합하게 인간화된 형태 및 키메라 형태 같은 알돌라제 항체를 포함한다. 마우스 mAb 38C2는 HCDR3 가까이에 그러나 외부에 반응성 리신을 갖고, 반응성 면역화에 의해 발생되고 기계적으로 천연 알돌라제 효소를 모방하는 촉매적 항체의 신규 부류의 원형(prototype)이다. 바바스 3세(C. F. Barbas 3rd) 등의 문헌[Science 278:2085-2092 (1997)] 참조. 사용될 수 있는 다른 알돌라제 촉매적 항체는 ATCC 수납 번호 PTA-1015를 갖는 하이브리도마 85A2; ATCC 수납 번호 PTA-1014를 갖는 하이브리도마 85C7; ATCC 수납 번호 PTA-1017을 갖는 하이브리도마 92F9; ATCC 수납 번호 PTA-823을 갖는 하이브리도마 93F3; ATCC 수납 번호 PTA-824를 갖는 하이브리도마 84G3; ATCC 수납 번호 PTA-1018을 갖는 하이브리도마 84G11; ATCC 수납 번호 PTA-1019를 갖는 하이브리도마 84H9; ATCC 수납 번호 PTA-825를 갖는 하이브리도마 85H6; ATCC 수납 번호 PTA-1016을 갖는 하이브리도마 90G8에 의해 생성되는 항체를 포함한다. 반응성 리신을 통해, 이들 항체는 천연 알돌라제의 엔아민 기작을 이용하여 알돌 및 레트로-알돌 반응을 촉진시킨다. 예를 들어, 와그너(J. Wagner) 등의 문헌[Science 270:1797-1800 (1995)]; 바바스 3세 등의 문헌[Science 278:2085-2092 (1997)]; 종(G. Zhong) 등의 문헌[Angew. Chem. Int. Ed. Engl. 38:3738-3741 (1999)]; 칼스트롬(A. Karlstrom) 등의 문헌[Proc. Natl. Acad. Sci. U.S.A., 97:3878-3883 (2000)] 참조. 알돌라제 항체 및 알돌라제 항체를 생성시키는 방법은 미국 특허 제 6,210,938 호, 제 6,368,839 호, 제 6,326,176 호, 제 6,589,766 호, 제 5,985,626 호 및 제 5,733,757 호에 개시되어 있다.
티오에스테라제 및 에스테라제 촉매적 항체의 결합 부위에서 발견되는 것과 같은 반응성 시스테인에 AA 표적화제를 연결시킴으로써도 AA 표적화 화합물을 형성시킬 수 있다. 적합한 티오에스테라제 촉매적 항체는 잔다(K. D. Janda) 등의 문헌[Proc. Natl. Acad. Sci. U.S.A. 91:2532-2536 (1994)]에 기재되어 있다. 적합한 에스테라제 항체는 워싱(P. Wirshing) 등의 문헌[Science, 270:1775-1782 (1995)]에 기재되어 있다. 항체 결합 부위 잔기를 돌연변이시켜 반응성 아미노산을 코딩하거나 또는 항체 결합 부위의 아미노산 측쇄를 반응성 기를 함유하는 연결기로 화학적으로 유도체화시킴을 비롯한 당해 분야에 널리 공지되어 있는 수단에 의해 반응성 아미노산-함유 항체를 제조할 수 있다.
통상적인 면역화, 생체 내에서의 반응성 면역화 또는 파지 디스플레이(phage display)를 사용하는 것과 같은 시험관 내에서의 반응성 선택에 의해 본원에 사용하기 적합한 항체를 수득할 수 있다. 또한, 하이브리도마 또는 세포 융합 방법 또는 시험관내 숙주 세포 발현 시스템에 의해서도 항체를 수득할 수 있다. 인간 또는 다른 동물 종에서 항체를 생성시킬 수 있다. 하나의 동물 종으로부터의 항체를 개질시켜 다른 동물 종을 반영할 수 있다. 예를 들어, 인간 키메라 항체는 항체의 하나 이상의 영역이 인간 면역 글로불린으로부터 유래된 것이다. 인간 키메라 항체는 전형적으로 인간 면역 글로불린과 상동인 아미노산 서열을 갖는 불변 영역과 함께 인간이 아닌 동물, 예컨대 설치류 동물에 상동인 가변 영역 아미노산 서열을 갖는 것으로 생각된다. 대조적으로, 인간화된 항체는 가변 구조형성 영역 서열중 대부분 또는 전부와 불변 영역 서열 전부가 인간 면역 글로불린으로부터 유래되는, 비-인간 항체로부터의 CDR 서열을 사용한다. CDR 그라프팅 방법[예를 들어, 하드맨(N. Hardman) 등, Int. J. Cancer 44:424-433 (1989); 퀸(C. Queen) 등, Proc. Natl. Acad. Sci. U.S.A. 86:10029-10033 (1989) 참조], 쇄 섞음(chain shuffling) 전략[예를 들어, 레이더(Rader) 등, Proc. Natl. Acad. Sci. U.S.A. 95:8910-8915 (1998) 참조], 유전 공학 분자 모델링 전략[예컨대, 로거스카(M. A. Roguska) 등, Proc. Natl. Acad. Sci. U.S.A. 91:969-973 (1994) 참조] 등을 비롯한 당해 분야에 널리 공지되어 있는 방법에 의해 키메라 항체 및 인간화된 항체를 제조할 수 있다.
비-인간 항체를 인간화시키는 방법은 당해 분야에 기재되어 있다. 바람직하게는, 인간화된 항체는 인간이 아닌 공급원으로부터 그 안으로 도입된 하나 이상의 아미노산 잔기를 갖는다. 이들 비-인간 아미노산 잔기는 종종 "임폴트(import)" 잔기로 일컬어지는데, 이는 전형적으로 "임폴트" 가변 도메인으로부터 취해진다. 인간 항체의 상응하는 서열을 초가변 영역 서열로 치환함으로써 윈터(Winter) 및 동료들의 방법에 따라 인간화를 본질적으로 수행할 수 있다[예를 들어, 존스(P. T. Jones) 등, Nature 321:522-525 (1986); 리치맨 등, Nature 332:323-327 (1988); 버호이엔(M. Verhoeyen) 등, Science 239:1534-1536 (1988) 참조]. 따라서, 이러한 "인간화된" 항체는 완전한 인간 가변 도메인보다 실질적으로 적은 부분이 비-인간 종으로부터의 상응하는 서열에 의해 치환된 키메라 항체이다. 실제로, 인간화된 항체는 전형적으로 일부 초가변 영역 잔기 및 가능하게는 일부 구조형성(FR) 잔기가 설치류 항체의 유사한 부위로부터의 잔기에 의해 치환된 인간 항체이다.
인간화된 항체를 제조하는데 사용되는 경질 및 중질 인간 가변 도메인의 선택은 항체가 인간 치료 용도로 의도되는 경우 항원성 및 인간 항-마우스 항체(HAMA) 반응을 감소시키는데 매우 중요하다. 소위 "최적(best-fit)" 방법에 따라, 인간화에 사용되는 인간 가변 도메인은 해당 설치류 가변 영역과의 고도의 상동성에 기초하여 공지 도메인의 라이브러리로부터 선택된다[심스(M. J. Sims) 등, J. Immunol., 151:2296-2308 (1993); 초티아 및 레스크(A. M. Lesk), J. Mol. Biol. 196:901-917 (1987)]. 다른 방법에서는 경질 또는 중질 쇄의 특정 아군의 모든 인간 항체의 컨센서스 서열로부터 유도되는 구조형성 영역을 사용한다. 몇몇 상이한 인간화된 항체에 동일한 구조형성 영역을 사용할 수 있다[예로서, 카터(P. Carter) 등, Proc. Natl. Acad. Sci. U.S.A. 89:4285-4289 (1992); 프레스타(L. G. Presta) 등, J. Immunol., 151:2623-2632 (1993) 참조].
Z 기에 대해 높은 결합 친화력을 보유하면서 항체를 인간화시키는 것이 또한 중요하다. 이러한 목적을 달성하기 위하여, 한 방법에 따라, 모 서열 및 인간화된 서열의 3차원 모델을 이용하여 모 서열 및 다양한 개념상의 인간화된 생성물을 분석함으로써 인간화된 항체를 제조한다. 3차원 면역 글로불린 모델이 통상적으로 이용될 수 있고, 당해 분야의 숙련자는 이들에 정통하다. 선택된 후보 면역 글로불린 서열의 가능한 3차원 배좌 구조를 도시 및 표시하는 컴퓨터 프로그램을 이용할 수 있다. 이들 디스플레이를 검사하면 Z 기로의 연결과 관련하여 후보 면역 글로불린 서열의 기능 발휘 면에서 잔기의 가능한 역할을 분석할 수 있다. 이러한 방식으로, 수령 및 임폴트 서열로부터 FR 잔기를 선택하여 결합시킴으로써, 표적 항원(들)에 대한 친화력 증가 같은 목적하는 항체 특징을 달성할 수 있다.
인간화된 쥣과 동물 알돌라제 항체의 다양한 형태가 고려된다. 한 실시양태에서는 인간 불변 도메인 C□ 및 C□11을 갖는 인간화된 알돌라제 촉매적 항체 h38c2 IgG1 또는 h38c2 Fab를 이용한다. 레이더 등의 문헌[J. Mol. Bio. 332:889-899 (2003)]에는 h38c2 Fab 및 h38c2 IgG1을 생성시키는데 사용될 수 있는 유전자 서열 및 벡터가 개시되어 있다. 인간 생식계 Vκ 유전자 DPK-9 및 인간 Jκ 유전자 JK4를 m38c2의 카파 경질 쇄 가변 도메인의 인간화를 위한 구조형성 영역으로서 사용하였고, 인간 생식계 유전자 DP47 및 인간 JH 유전자 JH4를 m38c2의 중질 쇄 가변 도메인의 인간화를 위한 구조형성 영역으로서 사용하였다. 도 7a는 m38c2, h38c2 및 인간 생식계의 가변 경질 및 중질 쇄 사이의 서열 정렬을 도시한다. h38c2는 임의의 동종이형(allotype)을 비롯하여 IgG1, IgG2, IgG3 또는 IgG4 불변 도메인을 이용할 수 있다. 도 7b는 G1m(f) 동종이형을 이용하는 h38c2 IgG1의 한 실시양태를 도시하는데, 이 도면에는 이 h38c2 IgG1의 경질 및 중질 쇄 아미노산 서열이 기재되어 있다. 항체가 G1m(f) 동종이형을 갖는 h38c2 IgG1인 화학식 II 또는 III의 AA 표적화 화합물의 특정 실시양태에서, Z는 중질 쇄의 위치 99에서 리신 잔기의 측쇄에 결합한다. 이 잔기는 도 7b에 굵은 글씨로 표시되어 있다. 다른 실시양태에서는 h38c2의 가변 도메인(VL 및 VH) 및 IgG1, IgG2, IgG3 또는 IgG4로부터의 불변 도메인을 포함하는 키메라 항체를 사용한다.
인간화된 알돌라제 항체 단편의 다양한 형태도 고려된다. 하나의 실시양태에서는 h38c2 F(ab')2를 이용한다. h38c2 IgG1의 단백질 분해성 소화에 의해 h38c2 F(ab')2를 생성시킬 수 있다. 다른 실시양태는 중간 연결기 (Gly4Ser)3에 의해 임의적으로 연결되는 h38c2로부터의 VL 및 VH 도메인을 포함하는 h38c2 scFv를 이용한다.
인간화에 대한 대안으로서, 인간 항체를 생성시킬 수 있다. 예를 들어, 최근 면역화(또는 촉매적 항체의 경우 반응성 면역화)시에 내재적인 면역 글로불린 생산 없이 인간 항체의 전체 레퍼토리를 생성시킬 수 있는 형질 전환 동물(예컨대, 마우스)을 생성시킬 수 있게 되었다. 예를 들어, 이러한 생식계 돌연변이 마우스 내로 키메라 및 생식계 면역 글로불린 유전자 어레이의 항체 중질-쇄 연결 영역(J H ) 유전자를 동질접합 결실시키면 항원 투여시 인간 항체가 생성되는 것으로 기재되어 있다. 예컨대, 코헨(B. D. Cohen) 등의 문헌[Clin. Cancer Res. 11:2063-2073 (2005)]; 틸링(J. L. Teeling) 등의 문헌[Blood 104:1793-1800 (2004)]; 론버그(N. Lonberg) 등의 문헌[Nature 368:856-859 (1994)]; 자코보비츠(A. Jakobovits) 등의 문헌[Proc. Natl. Acad. Sci. U.S.A. 90:2551-2555 (1993)]; 자코보비츠 등의 문헌[Nature 362:255-258 (1993)]; 브러그맨(M. Bruggemann) 등의 문헌[Year Immunol. 7:33-40 (1993)]; 테일러(L. D. Taylor) 등의 문헌[Nucleic Acids Res. 20:6287-6295 (1992)]; 브러그맨 등의 문헌[Proc. Natl. Acad. Sci. U.S.A. 86:6709-6713 (1989)]; 및 WO 97/17852 호 참조.
다르게는, 파지 디스플레이 기법[예를 들어, 맥카퍼티(J. McCafferty) 등, Nature 348:552-553 (1990); 드 하드(H. J. de Haard) 등, J Biol Chem 274, 18218-18230 (1999); 및 칸픽(A. Kanppik) 등, J Mol Biol, 296, 57-86 (2000) 참조]을 이용하여, 면역화되지 않은 공여자로부터의 면역 글로불린 가변(V) 도메인 유전자 레퍼토리를 사용하여 시험관 내에서 인간 항체 및 항체 단편을 생성시킬 수 있다. 이 기법에 따라, 항체 V 도메인 유전자는 M13 또는 fd 같은 섬사상 박테리오파지의 다수 또는 소수 외피 단백질 유전자 내로 프레임내(in-frame) 클로닝되고, 파지 입자의 표면 상에 기능성 항체 단편으로서 표시된다. 섬사상 입자가 파지 게놈의 단일 가닥 DNA 카피를 함유하기 때문에, 항체를 기능성에 기초하여 선택하면 이러한 특성을 나타내는 항체를 코딩하는 유전자가 선택된다. 그러므로, 파지는 B-세포의 특성중 일부를 모방한다. 파지 디스플레이는 다양한 포맷으로 수행될 수 있으며, 존슨(K. S. Johnson) 및 키스웰(D. J. Chiswell)의 문헌[Curr. Opin. Struct. Biol. 3:564-571 (1993)]에서 논의된다. V-유전자 구획의 몇몇 공급원을 파지 디스플레이에 사용할 수 있다. 클랙슨(T. Clackson) 등의 문헌[Nature, 352:624-628 (1991)]에서는 면역화된 마우스의 비장으로부터 유래되는 V 유전자의 작은 무작위적인 조합 라이브러리로부터 항-옥사졸론 항체의 다양한 어레이를 단리하였다. 본질적으로 막스(J. D. Marks) 등의 문헌[J. Mol. Biol. 222:581-597 (1991)] 또는 그리피쓰(A. D. Griffiths) 등의 문헌[EMBO J. 12:725-734 (1993)]에 기재되어 있는 기법에 따라, 면역화되지 않은 인간 공여자로부터의 V 유전자 레퍼토리를 구축할 수 있고, 다양한 항원(자가-항원 포함) 어레이에 대한 항체를 단리할 수 있다. 또한 미국 특허 제 5,565,332 호 및 제 5,573,905 호; 및 제스퍼스(L. S. Jespers) 등의 문헌[Biotechnology 12:899-903 (1994)] 참조.
상기 지적된 바와 같이, 시험관 내에서 활성화된 B 세포에 의해서도 인간 항체를 생성시킬 수 있다. 예를 들면, 미국 특허 제 5,567,610 호 및 제 5,229,275 호; 및 보리백(C. A. K. Borrebaeck) 등의 문헌[Proc. Natl. Acad. Sci. U.S.A. 85:3995-3999 (1988)] 참조.
본원에 기재된 항체의 아미노산 서열 개질(들)이 고려된다. 예를 들어, 항체의 결합 친화력 및/또는 다른 생물학적 특성을 개선하는 것이 바람직할 수 있다. 항체 핵산 내로 적절한 뉴클레오타이드 변화를 도입함으로써, 또는 펩타이드 합성에 의해, 항체의 아미노산 서열 변이체를 제조한다. 이러한 개질은 예를 들어 항체의 아미노산 서열로부터의 결실, 항체의 아미노산 서열로의 삽입 및/또는 항체의 아미노산 서열 내의 잔기의 치환을 포함한다. 결실, 삽입 및 치환을 임의적으로 조합하여 최종 구조물에 도달하도록 하는데, 단 최종 구조물은 목적하는 특징을 갖는다. 아미노산 변화는 또한 글라이코실화 부위의 수 또는 위치 변화 같은 항체의 번역-후 과정을 변화시킬 수도 있다.
돌연변이 유발에 바람직한 위치인 항체의 특정 잔기 또는 영역을 확인하는데 유용한 방법은 커닝햄(B. C. Cunningham) 및 웰스(J. A. Wells)의 문헌[Science 244:1081-1085 (1989)]에 기재되어 있는 바와 같이 "알라닌 주사 돌연변이 유발"로 불린다. 여기에서는, 표적 잔기의 잔기 또는 기를 확인하고(예컨대, Arg, Asp, His, Lys 및 Glu 같은 하전된 잔기), 중성 또는 음으로 하전된 아미노산(가장 바람직하게는 Ala 또는 폴리알라닌)으로 대체시켜 아미노산을 연결기의 Z 기와 상호작용시킨다. 이어, 치환 부위에 추가적인 변이체 또는 다른 변이체를 도입함으로써, 치환에 대한 기능적 감수성을 나타내는 이들 아미노산 위치를 다듬는다. 따라서, 아미노산 서열 변이를 도입하기 위한 부위는 미리 결정되는 반면, 돌연변이 자체의 특성은 미리 결정될 필요가 없다. 예를 들어, 소정 부위에서의 돌연변이의 성능을 분석하기 위하여, 표적 코돈 또는 영역에서 알라닌 주사 또는 무작위적인 돌연변이 유발을 수행하고, 발현된 항체 변이체를 Z와 공유 결합을 형성하는 능력에 대하여 선별한다.
아미노산 서열 삽입은 길이 면에서 하나의 잔기로부터 100개 이상의 잔기를 함유하는 폴리펩타이드에 이르는 아미노- 및/또는 카복실-말단 융합뿐만 아니라 단일 또는 복수개의 아미노산 잔기의 서열내 삽입을 포함한다. 말단 삽입의 예는 N-말단 메티오닐 잔기를 갖는 항체 또는 세포독성 폴리펩타이드에 융합된 항체를 포함한다. 항체 분자의 다른 삽입 변이체는 항체의 혈청 반감기를 증가시키는 효소 또는 폴리펩타이드에 대한 항-항체의 N- 또는 C-말단으로의 융합을 포함한다.
다른 유형의 변이체는 아미노산 치환 변이체이다. 이들 변이체는 상이한 잔기로 대체된 항체 분자의 하나 이상의 아미노산 잔기를 갖는다. 치환에 의한 돌연변이 유발을 위한 가장 흥미로운 부위는 초가변 영역을 포함하지만, FR 변화도 고려된다. 표 3에는 "바람직한 치환"이라는 제목 밑에 보존성 치환이 기재되어 있다. 이러한 치환이 생물학적 활성을 변화시키면, 아미노산 부류의 인용에서 아래 추가로 기재되는 "예시적인 치환"으로 불리는 더욱 실질적인 변화를 도입할 수 있고 생성물을 선별할 수 있다.
(a) 치환 구역에서 폴리펩타이드 주쇄의 구조를 예컨대 시트 또는 나선형 구조로서 유지시키거나, (b) 표적 부위에서 분자의 전하 또는 소수성을 유지시키거나, 또는 (c) 측쇄의 나머지 부분을 유지시키는데 있어서의 효과가 상당히 상이한 치환을 선택함으로써, 항체의 생물학적 특성을 실질적으로 개질시킨다. 천연 발생 잔기는 통상적인 측쇄 특성에 기초하여 하기 군으로 나뉘어진다:
(1) 소수성: Nle, Met, Ala, Val, Leu, Ile;
(2) 중성 친수성: Cys, Ser, Thr;
(3) 산성: Asp, Glu;
(4) 염기성: Asn, Gln, His, Lys, Arg;
(5) 쇄 배향에 영향을 끼치는 잔기: Gly, Pro; 및
(6) 방향족: Trp, Tyr, Phe.
비-보존성 치환은 이들 부류중 하나의 일원을 다른 부류의 일원과 교환함을 포함한다.
항체의 적절한 구조를 유지하는데 관여하지 않는 임의의 시스테인 잔기를 통상 세린으로 치환시켜, 분자의 산화에 대한 안정성을 개선하고 이상 가교결합을 방지할 수 있다. 반대로, 시스테인 결합(들)을 항체에 부가하여 그의 안정성을 개선할 수 있다(특히, 항체가 Fv 단편 같은 항체 단편인 경우).
치환 변이체의 한 유형은 모 항체(예컨대, 인간화된 항체 또는 인간 항체)의 하나 이상의 초가변 영역 잔기를 치환시킴을 포함한다. 일반적으로, 추가적인 개발을 위해 선택되는 생성되는 변이체(들)는 이들이 발생된 모 항체에 비해 개선된 생물학적 특성을 가질 것이다. 이러한 치환 변이체를 생성시키는데 편리한 방법은 파지 디스플레이를 이용한 친화력 성숙(maturation)을 포함한다. 간략히, 몇몇 초가변 영역 부위(예컨대, 6 내지 7개의 부위)를 돌연변이시켜 각 부위에서 가능한 모든 아미노 치환을 생성시킨다. 이렇게 생성된 항체 변이체를 각 입자 내에 포장된 M13의 유전자 III 생성물로의 융합으로서 섬사상 파지 입자로부터 1가 방식으로 표시한다. 이어, 파지-표시된 변이체를 본원에 개시된 바와 같이 생물학적 활성(예컨대, 결합 친화력)에 대해 선별한다. 개질을 위한 후보 초가변 영역 부위를 확인하기 위하여, 알라닌 주사 돌연변이 유발을 수행하여, 항원 결합에 상당히 기여하는 초가변 영역 잔기를 확인할 수 있다. 다르게는, 또는 덧붙여, 항체 컨쥬게이트 착체의 구조를 분석하여 항체와 Z 기 사이의 접촉 지점을 확인하는 것이 유리할 수 있다. 이러한 접촉 잔기 및 이웃하는 잔기는 본원에 설명된 기법에 따른 치환 후보이다. 이러한 변이체를 생성시킨 후에는, 변이체 패널을 본원에 기재된 바와 같이 선별하고, 추가로 개발하기 위하여 하나 이상의 관련 검정법에서 탁월한 특성을 갖는 항체를 선택할 수 있다.
항체의 아미노산 변이체의 다른 유형은 항체에서 발견되는 하나 이상의 탄수화물 잔기를 결실시키고/시키거나 항체에 존재하지 않는 하나 이상의 글라이코실화 부위를 부가함으로써 항체의 원래 글라이코실화 패턴을 변화시킨다.
항체의 글라이코실화는 전형적으로 N-연결되거나 또는 O-연결된다. N-연결은 아스파라긴 잔기의 측쇄로의 탄수화물 잔기의 부착을 말한다. 트라이펩타이드 서열 Asn-X"-Ser 및 Asn-X"-Thr(여기에서, X"은 프롤린을 제외한 임의의 아미노산임)은 일반적으로 탄수화물 잔기의 아스파라긴 측쇄로의 효소적 부착을 위한 인식 서열이다. 따라서, 폴리펩타이드 내에서의 이들 트라이펩타이드 서열의 존재는 잠재적인 글라이코실화 부위를 생성시킨다. O-연결된 글라이코실화는 당 N-아세틸갈락토즈아민, 갈락토즈 또는 자일로즈중 하나의 하이드록시아미노산, 가장 통상적으로는 세린 또는 트레오닌으로의 부착을 가리킨다(5-하이드록시프롤린 또는 5-하이드록시리신도 사용할 수 있음).
아미노산 서열이 상기 기재된 트라이펩타이드 서열중 하나 이상을 함유하도록 아미노산 서열을 변화시킴으로써, 글라이코실화 부위의 항체로의 부가를 편리하게 달성한다(N-연결된 글라이코실화 부위의 경우). 또한, 하나 이상의 세린 또는 트레오닌 잔기를 원래 항체의 서열에 부가하거나 치환시킴으로써도 변화시킬 수 있다(O-연결된 글라이코실화 부위의 경우).
작동체 기능과 관련하여 항체를 개질시켜 예컨대 항체의 항원-의존성 세포-매개되는 세포 독성(ADCC) 및/또는 보체 의존성 세포독성(CDC)을 향상시키는 것이 바람직할 수 있다. 하나 이상의 아미노산 치환을 항체의 Fc 영역에 도입함으로써 이를 달성할 수 있다. 다르게는, 이중 Fc 영역을 갖는 항체를 처리할 수 있으며, 이로써 항체는 향상된 보체 용해 및 ADCC능을 가질 수 있다. 스티븐슨(G. T. Stevenson) 등의 문헌[Anticancer Drug Des. 3:219-230 (1989)] 참조.
항체의 혈청 반감기를 증가시키기 위하여, 예를 들어 미국 특허 제 5,739,277 호에 기재되어 있는 바와 같이 항체(특히 항체 단편) 내로 구조 수용체 결합 항원결정기를 혼입시킬 수 있다. 본원에 사용되는 용어 "구조 수용체 결합 항원결정기"는 IgG 분자의 생체내 혈청 반감기 증가를 담당하는 IgG 분자(예를 들어, IgG1, IgG2, IgG3 또는 IgG4)의 Fc 영역의 항원결정기를 나타낸다.
전체 항체 및 항체 단편을 생성시키기 위하여 다양한 기법이 개발되었다. 전통적으로는, 완전한 항체의 단백질 분해성 소화를 통해 항체 단편을 유도하였다[예를 들어, 모리모토(K. Morimoto) 및 이노우에(K. Inouye), J. Biochem. Biophys. Methods 24:107-117 (1992); 브레난(M. Brennan) 등, Science 229:81-83 (1985) 참조]. 그러나, 최근에는 재조합 숙주 세포에 의해 이들 단편을 직접 생성시킬 수 있다. 아래 상세하게 기재되는 바와 같이 Fab, Fv, VH, VL 및 scFv 항체 단편을 모두 이. 콜라이(E. coli)에서 발현시킬 수 있고, 이. 콜라이로부터 분비시킬 수 있으며, 따라서 이들 단편을 다량으로 용이하게 생성시킬 수 있다. 상기 논의된 항체 파지 라이브러리로부터 항체 단편을 단리할 수 있다. 다르게는, Fab'-SH 단편을 이. 콜라이로부터 직접 회수하고 화학적으로 커플링시켜 F(ab')2 단편을 생성시킬 수 있다[카터 등, Biotechnology 10:163-167 (1992)]. 다른 방법에 따라, 재조합 숙주 세포 배지로부터 F(ab')2 단편을 직접 단리할 수 있다.
다양한 발현 벡터/숙주 시스템을 이용하여 항체를 발현시킬 수 있다. 이들 시스템은 재조합 박테리오파지, 플라스미드 또는 코스미드 DNA 발현 벡터로 형질전환된 세균; 효모 발현 벡터로 형질전환된 효모; 바이러스 발현 벡터(예컨대, 바큘로바이러스)로 감염된 곤충 세포 시스템; 바이러스 발현 벡터(예를 들어, 콜리플라워 모자이크 바이러스, CaMV; 담배 모자이크 바이러스, TMV)로 형질감염되거나 또는 세균 발현 벡터(예를 들어, Ti 또는 pBR322 플라스미드)로 형질전환된 식물 세포 시스템; 또는 동물 세포 시스템 같은 미생물을 포함하지만, 이들로 한정되지는 않는다.
재조합 항체 발현에 유용한 포유동물 세포는 VERO 세포, HeLa 세포, 차이니즈 햄스터 난소(CHO) 세포주, COS 세포(예컨대, COS-7), W138, BHK, HepG2, 3T3, RIN, MDCK, A549, PC12, K562 및 293 세포뿐만 아니라 본원에 기재되는 하이브리도마 세포주를 포함하지만, 이들로 국한되지는 않는다. 전형적으로 글라이코실화되고 활성을 위해 적절한 재절첩(refolding)을 필요로 하는 항체의 제조에 포유동물 세포가 바람직하다. 바람직한 포유동물 세포는 CHO 세포, 하이브리도마 세포 및 골수 세포를 포함한다.
항체의 재조합 발현을 위한 몇몇 예시적인 절차가 아래 본원에 기재된다.
용어 "발현 벡터" 또는 "벡터"는 DNA(RNA) 서열로부터의 폴리펩타이드를 발현하기 위한 플라스미드, 파지, 바이러스 또는 벡터를 말한다. 발현 벡터는 (1) 유전자 발현을 조절하는 하나 이상의 조절 서열, 예컨대 프로모터 또는 인핸서(enhancer), (2) 하나 이상의 폴리펩타이드를 코딩하는 하나 이상의 서열, 및 (3) 적절한 전사 개시 및 종결 서열을 포함하는 전사 단위를 포함할 수 있다. 효모 또는 진핵 생물 발현 시스템에 사용하고자 하는 발현 벡터는 바람직하게는 숙주 세포에 의한 번역된 단백질의 세포외 분비를 가능하게 하는 리더(leader) 서열을 포함한다. 다르게는, 항체 폴리펩타이드(들)가 리더 또는 수송 서열 없이 발현되는 경우, 이는 아미노 말단 메티오닌 잔기를 포함할 수 있다. 이 잔기는 최종 항체 생성물을 제공하기 위하여 발현된 재조합 단백질로부터 후속 절단되거나 절단되지 않을 수 있다.
항체, 구체적으로는 항체 단편을 이. 콜라이 같은 원핵 생물 시스템에서 발현시킬 수 있다. 다른 예에서는, 특이적인 결합제 펩타이드를 코딩하는 DNA 서열을 PCR에 의해 증폭시키고 예컨대 pGEX-3x[파마시아(Pharmacia)] 같은 적절한 벡터 내로 클로닝시킬 수 있다. pGEX 벡터는 벡터에 의해 코딩되는 글루타티온-S-트랜스퍼라제(GST) 및 벡터의 클로닝 부위 내로 삽입되는 DNA 단편에 의해 코딩되는 펩타이드를 포함하는 융합 단백질을 생성시키도록 디자인된다. PCR을 위한 프라이머를 생성시켜 예컨대 적절한 절단 부위를 포함시킬 수 있다. pGEX-3x 항체 펩타이드 구조물을 이. 콜라이 XL-1 Blue 세포[스트라타진(Stratagene), 캘리포니아주 라 졸라] 내로 형질전환시키고, 개별적인 형질전환체를 단리 및 생육시킨다. 이어, 발현된 펩타이드 융합 단백질을 융합 단백질의 GST 부분으로부터 절단할 수 있다.
상기 기재된 재조합 시스템을 사용하여 폴리뉴클레오타이드 코딩 항체를 발현시키면, 생물학적으로 활성이기 위하여 "재절첩"시켜야 하는(다양한 다이설파이드 가교를 적절하게 생성시키기 위하여) 항체 또는 이들의 단편을 생성시킬 수 있다.
세균 세포에서 생성된 항체, 구체적으로 항체 단편은 세균 내의 불용성 봉입체로서 생성될 수 있다. 이러한 항체를 다음과 같이 정제할 수 있다. 원심분리에 의해 숙주 세포를 죽이고; 0.15M NaCl, 10mM 트리스(Tris), pH 8, 1mM EDTA 중에서 세척하고; 0.1mg/ml 라이소자임[시그마(Sigma), 미주리주 세인트 루이스]으로 실온에서 15분간 처리할 수 있다. 용해물을 초음파 처리에 의해 청정화시키고, 12,000×g에서 10분간 원심분리시킴으로써 세포 찌꺼기를 펠렛화시킬 수 있다. 항체를 함유하는 펠렛을 50mM 트리스, pH 8 및 10mM EDTA에 재현탁시키고, 50% 글라이세롤 상에 층상화시킨 다음 6000×g에서 30분간 원심분리시킬 수 있다. Mg 및 Ca 이온을 함유하지 않는 표준 포스페이트 완충된 염수 용액(PBS)에 펠렛을 재현탁시킬 수 있다. 재현탁된 펠렛을 변성 SDS 폴리아크릴아마이드 겔[샘브룩(Sambrook) 등, 상기 문헌]에서 분별시킴으로써 항체를 추가로 정제할 수 있다. 겔을 0.4M KCl에 침지시켜 단백질을 가시화시킬 수 있고, 이를 절제하여 SDS를 함유하지 않는 겔-작동(gel-running) 완충액 중에서 전기 용리시킬 수 있다.
항체를 발현시키기 위한 포유동물 숙주 시스템은 당해 분야의 숙련자에게 널리 공지되어 있다. 발현된 단백질을 가공하거나 단백질 활성을 제공하는데 유용한 특정 번역후 개질을 생성시키는 특별한 능력에 대하여 숙주 세포 균주를 선택할 수 있다. 폴리펩타이드의 이러한 개질은 아세틸화, 카복실화, 글라이코실화, 포스포릴화, 지질화 및 아실화를 포함하지만, 이들로 국한되는 것은 아니다. CHO, HeLa, MDCK, 293, W138 같은 상이한 숙주 세포뿐만 아니라 하이브리도마 세포주 등은 특이적인 세포 조직 및 이러한 번역후 활성을 위한 특징적인 기작을 가지며, 도입된 외래 단백질의 올바른 개질 및 가공을 확실히 하기 위하여 선택될 수 있다.
다수의 선택 시스템을 이용하여 재조합 항체 생성을 위해 형질전환된 세포를 회수할 수 있다. 이러한 선택 시스템은 각각 tk-, hgprt- 또는 aprt-세포의 HSV 티미딘 키나제, 하이포잔틴-구아닌 포스포리보실트랜스퍼라제 및 아데닌 포스포리보실트랜스퍼라제 유전자를 포함하지만, 이들로 한정되지는 않는다. 또한, 메토트렉세이트에 대한 저항성을 부여하는 DHFR; 마이코페놀산에 대한 저항성을 제공하는 gpt; 아미노글라이코사이드 G418에 대한 저항성을 부여하고 클로르설퓨론에 대한 저항성을 제공하는 neo; 및 하이그로마이신에 대한 저항성을 제공하는 hygro를 선택하기 위한 기준으로서 항-대사산물 저항성을 이용할 수 있다. 유용할 수 있는 추가의 선택가능한 유전자는 세포가 트립토판 대신 인돌을 사용하도록 하는 trpB, 또는 세포가 히스티딘 대신 히스틴올을 사용하도록 하는 hisD를 포함한다. 형질전환체를 확인하기 위한 가시적인 표시를 제공하는 마커는 안토사이아닌, 베타-글루쿠로니다제와 그의 기질인 GUS, 및 루시페라제와 그의 기질인 루시페린을 포함한다.
일부 경우, 상기 기재된 절차를 이용하여 생성된 항체는 "재절첩"되고 적절한 3차 구조로 산화될 필요가 있을 수 있으며, 생물학적으로 활성이기 위하여 다이설파이드 연결기를 생성시키도록 할 필요가 있을 수 있다. 당해 분야에 널리 공지되어 있는 절차를 이용하여 재절첩을 달성할 수 있다. 이러한 방법은 예를 들어 무질서 유발제의 존재하에서 통상 7보다 높은 pH에 가용화된 폴리펩타이드 약제를 노출시킴을 포함한다. 무질서 유발제의 선택은 봉입체 가용화에 이용되는 선택과 유사하다. 그러나, 무질서 유발제가 전형적으로 더 낮은 농도에서 사용된다. 예시적인 무질서 유발제는 구아니딘이다. 대부분의 경우, 재절첩/산화 용액은 또한 환원제와 그의 산화된 형태를 특이적인 비로 함유하여 시스테인 가교를 생성시키기 위하여 다이설파이드 섞임이 이루어지도록 하는 특정 산화환원 전위를 생성시킨다. 일부 통상적으로 사용되는 산화환원 쌍은 시스테인/시스타민, 글루타티온/다이티오비스GSH, 염화제2구리, 다이티오트레이톨 DTT/다이티에인 DTT, 및 2-머캅토에탄올(bME)/다이티오-bME를 포함한다. 다수의 경우, 보조 용매를 사용하여 재절첩 효율을 증가시킬 수 있다. 통상적으로 사용되는 보조 용매는 글라이세롤, 다양한 분자량의 폴리에틸렌 글라이콜 및 아르기닌을 포함한다.
연결기 및 연결된 화합물
AA 표적화제는 직접 또는 연결기를 거쳐 항체의 결합 부위에 공유 결합될 수 있다. 적절한 연결기는 표적화제와 항체 사이에 충분한 거리를 제공하도록 선택될 수 있다. AA 표적화 화합물을 제조하는데 사용하기 위한 연결기의 실시양태의 일반적인 디자인은 화학식 -X-Y-Z-로 표시되는데, 이 때 X는 연결 쇄이고, Y는 인식 기이며, Z는 반응성 기이다. 연결기는 선형 또는 분지형일 수 있고, 하나 이상의 탄소환상 또는 헤테로환상 기를 임의적으로 포함한다. 연결기 길이는 선형 원자의 수에 의하여 보여질 수 있는데, 방향족 고리 등과 같은 환상 잔기는 고리 둘레의 가장 짧은 경로를 취함으로써 계산된다. 일부 실시양태에서, 연결기는 원자 5 내지 15개, 다른 실시양태에서는 원자 15 내지 30개, 또 다른 실시양태에서는 원자 30 내지 50개, 또 다른 실시양태에서는 원자 50 내지 100개, 또 다른 실시양태에서는 원자 100 내지 200개의 선형 신장부를 갖는다. 다른 연결기 고려사항은 생성되는 AA 표적화 화합물 또는 AA 표적화제-연결기의 물리적 또는 약동학적 특성, 예컨대 용해도, 친유성, 친수성, 소수성, 안정성(더 안정하거나 덜 안정함, 또한 계획적인 열화), 강성, 가요성, 면역원성, 항체 결합의 조절, 미셀 또는 리포솜 내로 혼입되는 능력 등에 대한 효과를 포함한다.
연결기의 연결 쇄 X는 군 C, H, N, O, P, S, 할로겐(F, Cl, Br, I)으로부터의 임의의 원자 또는 이들의 염을 포함한다. X는 또한 알킬, 알켄일, 알킨일, 옥소알킬, 옥소알켄일, 옥소알킨일, 아미노알킬, 아미노알켄일, 아미노알킨일, 설포알킬, 설포알켄일, 설포알킨일, 포스포알킬, 포스포알켄일 또는 포스포알킨일기 같은 기를 포함할 수 있다. 일부 실시양태에서, X는 하나 이상의 고리 구조를 포함할 수 있다. 일부 실시양태에서, 연결기는 2 내지 100개의 단위를 포함하는 폴리에틸렌 글라이콜 같은 반복 중합체이다.
연결기의 인식 기 Y는 임의적이고, 존재하는 경우 반응성 기와 연결 쇄 사이에 위치한다. 일부 실시양태에서, Y는 Z로부터 원자 1 내지 20개에 위치한다. 임의의 특정 이론에 얽매이고자 하지 않으면서, 인식 기는 반응성 기를 항체 결합 부위 내로 적절하게 위치시켜 반응성 아미노산 측쇄와 반응할 수 있도록 하는 역할을 하는 것으로 생각된다. 예시적인 인식 기는 바람직하게는 5 또는 6개의 원자를 갖는 탄소환상 및 헤테로환상 고리를 포함한다. 그러나, 더 큰 고리 구조도 사용할 수 있다. 일부 실시양태에서, AA 표적화제는 중간 연결기를 사용하지 않고 Y에 직접 연결된다.
Z는 항체 결합 부위의 반응성 측쇄와 공유 결합을 형성할 수 있다. 몇몇 실시양태에서, Z는 다이케톤, 아실 베타-락탐, 활성 에스터, 할로케톤, 사이클로헥실 다이케톤기, 알데하이드, 알레이미드, 활성화된 알켄, 활성화된 알킨 또는 통상적으로 친핵성 또는 친전자성 치환에 감수성인 이탈기를 포함하는 분자를 형성하도록 배열된 하나 이상의 C=O 기를 포함한다. 다른 기는 락톤, 안하이드라이드(anhydride), 알파-할로아세트아마이드, 이민, 하이드라자이드 또는 에폭사이드를 포함할 수 있다. 항체의 결합 부위의 반응성 친핵성 기(예컨대, 리신 또는 시스테인 측쇄)에 공유 결합될 수 있는 예시적인 연결기 친전자성 반응성 기는 아실 베타-락탐, 간단한 다이케톤, 석신이미드 활성 에스터, 말레이미드, 연결기를 갖는 할로아세트아마이드, 할로케톤, 사이클로헥실 다이케톤, 알데하이드, 아미딘, 구아니딘, 이민, 엔아민, 포스페이트, 포스폰에이트, 에폭사이드, 아지리딘, 티오에폭사이드, 마스킹되거나 보호된 다이케톤(예컨대 케탈), 락탐, 설폰에이트 등, 이민, 케탈, 아세탈 같은 마스킹된 C=O 기, 및 임의의 다른 공지되어 있는 친전자성 기를 포함한다. 특정 실시양태에서, 반응성 기는 아실 베타-락탐, 간단한 다이케톤, 석신이미드, 활성 에스터, 말레이미드, 연결기를 갖는 할로아세트아마이드, 할로케톤, 사이클로헥실 다이케톤 또는 알데하이드를 형성하도록 배열된 하나 이상의 C=O 기를 포함한다.
연결기 반응성 기 또는 유사한 이러한 반응성 기는 특정 결합 부위의 반응성 잔기와 함께 사용하도록 선택된다. 예를 들어, 알돌라제 항체에 의한 개질을 위한 화학적 잔기는 케톤, 다이케톤, 베타 락탐, 활성 에스터 할로케톤, 락톤, 안하이드라이드, 말레이미드, 알파-할로아세트아마이드, 사이클로헥실 다이케톤, 에폭사이드, 알데하이드, 아미딘, 구아니딘, 이민, 엔아민, 포스페이트, 포스폰에이트, 에폭사이드, 아지리딘, 티오에폭사이드, 마스킹되거나 보호된 다이케톤(예컨대, 케탈), 락탐, 할로케톤, 알데하이드 등일 수 있다.
항체의 반응성 설프하이드릴기에 의한 공유 개질에 적합한 연결기 반응성 기 화학적 잔기는 다이설파이드, 아릴 할라이드, 말레이미드, 알파-할로아세트아마이드, 아이소사이아네이트, 에폭사이드, 티오에스터, 활성 에스터, 아미딘, 구아니딘, 이민, 엔아민, 포스페이트, 포스폰에이트, 에폭사이드, 아지리딘, 티오에폭사이드, 마스킹되거나 보호된 다이케톤(예컨대, 케탈), 락탐, 할로케톤, 알데하이드 등일 수 있다.
당해 분야의 숙련자는 항체 결합 부위의 반응성 아미노산 측쇄가 AA 표적화제 또는 그의 연결기 상의 친핵성 기와 반응하는 친전자성 기를 가질 수 있는 한편, 다른 실시양태에서는 아미노산 측쇄의 반응성 친핵성 기가 AA 표적화제 또는 연결기의 친전자성 기와 반응함을 쉽게 인지하게 될 것이다.
몇 가지 방법에 의해 AA 표적화 화합물을 제조할 수 있다. 한 방법에서는, 항체의 결합 부위의 아미노산의 측쇄와의 공유 반응을 위해 디자인된 하나 이상의 반응성 기를 포함하는 연결기를 사용하여 AA 표적화제-연결기 화합물을 합성한다. 연결기 반응성 기가 아미노산 측쇄와 공유 결합을 형성하는 조건하에서 표적화제-연결기 화합물과 항체를 결합시킨다.
다른 방법에서는, 항체와 연결기를 포함하는 항체-연결기 화합물을 합성함으로써 연결을 달성할 수 있는데, 이 때 연결기는 AA 표적화제의 적절한 화학적 잔기와 공유 반응하도록 디자인된 하나 이상의 반응성 기를 포함한다. AA 표적화제는 연결기 반응성 기와 반응하기에 적절한 잔기를 제공하도록 개질될 필요가 있을 수 있다. 연결기 반응성 기가 표적화제 및/또는 생물학적 약제에 공유 결합하는 조건하에서 항체-연결기와 AA 표적화제를 결합시킨다.
항체-AA 표적화 화합물을 생성시키는 다른 방법에서는 이중 연결기 디자인을 이용한다. 특정 실시양태에서는, AA 표적화제 및 반응성 기를 갖는 연결기를 포함하는 AA 표적화제-연결기 화합물을 합성한다. 제 1 단계의 AA 표적화제-연결기의 반응성 기와의 반응에 감수성인 화학적 기를 갖는 연결기 및 항체를 포함하는 항체-연결기 화합물을 합성한다. 이어, 연결기가 공유 결합하여 항체-AA-표적화 화합물을 형성하는 조건하에서 이들 두 연결기를 함유하는 화합물을 결합시킨다.
결합에 관여할 수 있는 예시적인 작용기는 예를 들어 에스터, 아마이드, 에터, 포스페이트, 아미노, 케토, 아미딘, 구아니딘, 이민, 엔아민, 포스페이트, 포스폰에이트, 에폭사이드, 아지리딘, 티오에폭사이드, 마스킹되거나 보호된 다이케톤(예컨대, 케탈), 락탐, 할로케톤, 알데하이드, 티오카밤에이트, 티오아마이드, 티오에스터, 설파이드, 다이설파이드, 포스포르아마이드, 설폰아마이드, 우레아, 티오우레아, 카밤에이트, 카본에이트, 하이드록스아마이드 등을 포함한다.
연결기는 군 C, H, N, O, P, S, 할로겐(F, Cl, Br, I)으로부터의 임의의 원자 또는 이들의 염을 포함한다. 연결기는 또한 알킬, 알켄일, 알킨일, 옥소알킬, 옥소알켄일, 옥소알킨일, 아미노알킬, 아미노알켄일, 아미노알킨일, 설포알킬, 설포알켄일, 설포알킨일기, 포스포알킬, 포스포알켄일 또는 포스포알킨일기 같은 기를 포함할 수 있다. 연결기는 또한 하나 이상의 고리 구조를 포함할 수 있다. 본원에 사용되는 "고리 구조"는 포화, 불포화 및 방향족 탄소환상 고리 및 포화, 불포화 및 방향족 헤테로환상 고리를 포함한다. 고리 구조는 일환상, 이환상 또는 다환상일 수 있으며, 융합된 고리 또는 융합되지 않은 고리를 포함한다. 또한, 고리 구조는 할로겐, 옥소, -OH, -CHO, -COOH, -NO2, -CN, -NH2, -C(O)NH2, C1 -6 알킬, C2-6 알켄일, C2 -6 알킨일, C1 -6 옥소알킬, 옥소알켄일, 옥소알킨일, 아미노알킬, 아미노알켄일, 아미노알킨일, 설포알킬, 설포알켄일, 설포알킨일, 포스포알킬, 포스포알켄일 또는 포스포알킨일기를 포함하지만 이들로 한정되지는 않는, 당해 분야에 널리 공지되어 있는 작용기로 임의적으로 치환된다. 상기 기와 고리의 조합도 AA 표적화 화합물의 연결기에 존재할 수 있다.
본 발명의 한 양태는 하기 화학식 I로 표시되는 AA 표적화제-연결기 컨쥬게이트이다:
화학식 I
L-[AA 표적화제]
상기 식에서,
[AA 표적화제]는 AA 표적화제 펩타이드이다.
화학식 I의 화합물에서 연결 잔기 L은 AA 표적화제의 아미노 말단, 카복시 말단 또는 임의의 아미노산 측쇄에 부착될 수 있다. 특정 실시양태에서, L은 AA 표적화제의 카복시 말단에 연결된다. 특정한 다른 실시양태에서, L은 AA 표적화제의 아미노 말단에 연결된다. 또 다른 실시양태에서, L은 친핵성 또는 친전자성 측쇄중 하나에 연결된다. 친전자성 측쇄에 연결되는 경우, L은 친전자성 측쇄와의 공유 반응에 감수성인 친핵성 기를 가져야 한다. 예시적인 친전자성 측쇄는 Asp 및 Glu이다. 예시적인 친핵성 측쇄는 Cys, Lys, Ser, Thr 및 Tyr이다. 친핵성 측쇄에 연결시키는 경우, L은 친핵성 측쇄와의 공유 반응에 감수성인 친전자성 기를 포함해야 한다. 다른 실시양태에서는, 친핵성 아미노산을 AA 표적화제의 카복시 말단 또는 아미노 말단중 하나에 부가하고, 연결기 L을 이 부가 아미노산의 측쇄에 공유 결합시킨다. 특정 실시양태에서는, Lys를 AA 표적화제의 아미노 말단에 부가한다. 다른 특정 실시양태에서는, Lys를 AA 표적화제의 카복시 말단에 부가한다.
그러므로, R1-QKY QPL DEL DKT LYD QFM LQQ G-R2에 기초한 AA 표적화제를 포함하는 실시양태에서, i) D, E, K, T 및 Y의 측쇄 또는 ii) 아미노 또는 카복시 말단중 하나에 연결시킴으로써 생성되는 예시적인 화학식 I의 화합물은 하기를 포함하며, 이 때 아미노산 잔기 뒤의 (Li)는 이 잔기로의 연결을 나타낸다:
Q(Li)KY QPL DEL DKT LYD QFM LQQ G-R2 (서열 번호:140)
R1-QK(Li)Y QPL DEL DKT LYD QFM LQQ G-R2 (서열 번호:141)
R1-QKY(Li) QPL DEL DKT LYD QFM LQQ G-R2 (서열 번호:142)
R1-QKY QPL D(Li)EL DKT LYD QFM LQQ G-R2 (서열 번호:143)
R1-QKY QPL DE(Li)L DKT LYD QFM LQQ G-R2 (서열 번호:144)
R1-QKY QPL DEL D(Li)KT LYD QFM LQQ G-R2 (서열 번호:145)
R1-QKY QPL DEL DK(Li)T LYD QFM LQQ G-R2 (서열 번호:146)
R1-QKY QPL DEL DKT(Li) LYD QFM LQQ G-R2 (서열 번호:147)
R1-QKY QPL DEL DKT LY(Li)D QFM LQQ G-R2 (서열 번호:148)
R1-QKY QPL DEL DKT LYD(Li) QFM LQQ G-R2 (서열 번호:149)
R1-QKY QPL DEL DKT LYD QFM LQQ G(Li) (서열 번호:150)
유사하게, R1-Q-[ACK]-Y QPL DEL DKT LYD QFM LQQ G-R2에 기초한 AA 표적화제를 포함하는 실시양태에서, i) D, E, K, T, 및 Y의 측쇄, 또는 ii) 아미노 또는 카복시 말단중 하나에 연결시킴으로써 생성되는 예시적인 화학식 I의 화합물은 하기를 포함한다:
Q(Li)-[AcK]Y QPL DEL DKT LYD QFM LQQ G-R2 (서열 번호:151)
R1Q-[AcK]-Y(Li) QPL DEL DKT LYD QFM LQQ G-R2 (서열 번호:152)
R1-Q-[AcK]-Y QPL D(Li)EL DKT LYD QFM LQQ G-R2 (서열 번호:153)
R1-Q-[AcK]-Y QPL DE(Li)L DKT LYD QFM LQQ G-R2 (서열 번호:154)
R1-Q-[AcK]-Y QPL DEL D(Li)KT LYD QFM LQQ G-R2 (서열 번호:155)
R1-Q-[AcK]-Y QPL DEL DK(Li)T LYD QFM LQQ G-R2 (서열 번호:156)
R1-Q-[AcK]-Y QPL DEL DKT(Li) LYD QFM LQQ G-R2 (서열 번호:157)
R1-Q-[AcK]-Y QPL DEL DKT LY(Li)D QFM LQQ G-R2 (서열 번호:158)
R1-Q-[AcK]-Y QPL DEL DKT LYD(Li) QFM LQQ G-R2 (서열 번호:159)
R1-Q-[AcK]-Y QPL DEL DKT LYD QFM LQQ G(Li) (서열 번호:160)
화학식 I의 화합물에서, L은 화학식 -X-Y-Z-로 표시되는 연결 잔기이고, 이 때 X는 AA 표적화제를 구성하는 잔기중 하나에 부착된 임의적으로 존재하는 생물학적으로 양립가능한 중합체 또는 블록 공중합체이며, Y는 하나 이상의 고리 구조를 포함하는 임의적으로 존재하는 인식 기이고, Z는 항체의 결합 부위의 측쇄에 공유 결합할 수 있는 반응성 기이다.
화학식 I의 화합물의 일부 실시양태에서, X는 하기와 같다:
-R22-P-R23- 또는 -R22-P-R21-P'-R23-
상기 식에서,
P 및 P'는 폴리에틸렌 옥사이드 같은 폴리옥시알킬렌 옥사이드, 폴리에틸옥사졸린, 폴리-N-비닐 피롤리돈, 폴리비닐 알콜, 폴리하이드록시에틸 아크릴레이트, 폴리하이드록시 에틸메타크릴레이트 및 폴리아크릴아마이드; 폴리리신, 폴리오르니틴, 폴리아르기닌 및 폴리히스티딘 같은 중합체 주쇄 또는 중합체 측쇄 상에 아민기를 갖는 폴리아민; 폴리아미노스타이렌, 폴리아미노아크릴레이트, 폴리(N-메틸 아미노아크릴레이트), 폴리(N-에틸아미노아크릴레이트), 폴리(N,N-다이메틸 아미노아크릴레이트), 폴리(N,N-다이에틸아미노아크릴레이트), 폴리(아미노메타크릴레이트), 폴리(N-메틸 아미노-메타크릴레이트), 폴리(N-에틸 아미노메타크릴레이트), 폴리(N,N-다이메틸 아미노메타크릴레이트), 폴리(N,N-다이에틸 아미노메타크릴레이트), 폴리(에틸렌이민) 같은 비-펩타이드 폴리아민; 폴리(N,N,N-트라이메틸아미노아크릴레이트 클로라이드), 폴리(메타크릴아미도프로필트라이메틸 암모늄 클로라이드) 같은 4급 아민의 중합체; 콘드로이틴 설페이트-A (4-설페이트), 콘드로이틴 설페이트-C (6-설페이트) 및 콘드로이틴 설페이트-B 같은 프로테오글라이칸; 폴리세린, 폴리트레오닌, 폴리글루타민 같은 폴리펩타이드; 키토산, 하이드록시 에틸 셀룰로즈 같은 천연 또는 합성 다당류; 및 지질로 이루어진 군으로부터 독립적으로 선택되고;
R21, R22 및 R23은 각각 독립적으로 공유 결합, -O-, -S-, -NRb-, 치환되거나 치환되지 않은 직쇄 또는 분지쇄 C1 -50 알킬렌, 또는 치환되거나 치환되지 않은 직쇄 또는 분지쇄 C1 -50 헤테로알킬렌이며;
Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이며;
R21, R22 및 R23은 X의 주쇄 길이가 원자 약 200개 이하로 유지되도록 선택된다.
화학식 I의 화합물의 일부 실시양태에서, R22는 -(CH2)v-, -(CH2)u-C(O)-(CH2)v-, -(CH2)u-C(O)-O-(CH2)v-, -(CH2)u-C(S)-NRb-(CH2)v-, -(CH2)u-C(O)-NRb-(CH2)v-, -(CH2)u-NRb-(CH2)v-, -(CH2)u-O-(CH2)v-, -(CH2)u-S(O)0-2-(CH2)v-, -(CH2)u-S(O)0-2-NRb-(CH2)v-, 또는 -(CH2)u-P(O)(ORb)-O-(CH2)v-이고; 이 때, u 및 v는 독립적으로 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 또는 20이다.
화학식 I의 화합물의 또 다른 실시양태에서, R22는 -(CH2)v-, -(CH2)u-C(O)-(CH2)v-, -(CH2)u-C(O)-O-(CH2)v-, -(CH2)u-C(O)-NRb-(CH2)v- 또는 -(CH2)u-NRb-(CH2)v이다. 또 다른 실시양태에서, R22는 -(CH2)u-C(O)-NRb-(CH2)v-이다.
화학식 I의 화합물의 몇몇 실시양태에서, R21 및 R23은 각각 독립적으로 -(CH2)s-, -(CH2)r-C(O)-(CH2)s-, -(CH2)r-C(O)-O-(CH2)v-, -(CH2)r-C(S)-NRb-(CH2)s-, -(CH2)r-C(O)-NRb-(CH2)s-, -(CH2)r-NRb-(CH2)s-, -(CH2)r-O-(CH2)s-, -(CH2)r-S(O)0-2-(CH2)s-, -(CH2)r-S(O)0-2-NRb-(CH2)s-, 또는 -(CH2)r-P(O)(ORb)-O-(CH2)s-이고; 이 때, r, s, 및 v는 각각 독립적으로 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 또는 20이다.
또 다른 실시양태에서, R21 및 R23은 각각 독립적으로 -(CH2)s-, -(CH2)r-C(O)-(CH2)s-, -(CH2)r-C(O)-O-(CH2)s-, -(CH2)r-C(O)-NRb-(CH2)s- 또는 -(CH2)r-NRb-(CH2)s-, 및 -(CH2)r-C(O)-NRb-(CH2)s-이다.
또 다른 실시양태에서, R21 및 R23은 각각 독립적으로 하기 화학식으로 표시된다:
상기 식에서,
p는 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44 또는 45이고;
w, r 및 s는 각각 독립적으로 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 또는 20이며;
Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
H1 및 H1'는 각각 독립적으로 N, O, S 또는 CH2이고;
r 및 s는 각각 독립적으로 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 또는 20이고;
t 및 t'는 각각 독립적으로 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 또는 50이며;
Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
H1 및 H1'는 각각 독립적으로 N, O, S, 또는 CH2이고;
r 및 s는 각각 독립적으로 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 또는 20이며;
t 및 t'는 각각 독립적으로 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 또는 50이고;
Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
H1 및 H1'는 각각 독립적으로 N, O, S, 또는 CH2이고;
r 및 s는 각각 독립적으로 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 또는 20이고;
t 및 t'는 각각 독립적으로 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 또는 50이며;
Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
H1 및 H1'는 각각 독립적으로 N, O, S, 또는 CH2이며;
r 및 s는 각각 독립적으로 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 또는 20이며;
t 및 t'는 각각 독립적으로 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 또는 50이며;
Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
H1 및 H1'는 각각 독립적으로 N, O, S, 또는 CH2이고;
r 및 s는 각각 독립적으로 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 또는 20이고;
t 및 t'는 각각 독립적으로 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 또는 50이며;
Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
H1 및 H1'는 각각 독립적으로 N, O, S, 또는 CH2이며;
r 및 s는 각각 독립적으로 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 또는 20이고;
t 및 t'는 각각 독립적으로 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 또는 50이고;
Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
H1 및 H1'는 각각 독립적으로 N, O, S, 또는 CH2이고;
r 및 s는 각각 독립적으로 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 또는 20이고;
t 및 t'는 각각 독립적으로 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 또는 50이고;
Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
v 및 w는 각각 독립적으로 1, 2, 3, 4, 또는 5이고;
Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다.
이들 실시양태중 특정 실시양태에서, v는 1, 2 또는 3이고, w는 1, 2, 또는 3이며, Rb는 수소이다.
화학식 I의 특정 실시양태에서, L은 화학식 -X-Y-Z-로 표시되는 연결 잔기이며, 이 때 X는 AA 표적화제를 구성하는 잔기중 하나에 부착되고, 임의적으로 치환되는 -R22-[CH2-CH2-O]rR23-, -R22-사이클로알킬-R23-, -R22-아릴-R23-, 또는 -R22-헤테로사이클릴- R23-이며; R22 및 R23은 각각 독립적으로 공유 결합, -O-, -S-, -NRb-, 치환되거나 치환되지 않은 직쇄 또는 분지쇄 C1 -50 알킬렌, 치환되거나 치환되지 않은 직쇄 또는 분지쇄 C1 -50 헤테로알킬렌, 치환되거나 치환되지 않은 직쇄 또는 분지쇄 C2-50 알켄일렌, 또는 치환되거나 치환되지 않은 C2 -50 헤테로알켄일렌이며; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이고; t는 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 또는 50이며; R22 및 R23의 크기는 X의 주쇄 길이가 원자 약 200개 이하로 유지되도록 하는 크기이며; Y는 하나 이상의 고리 구조를 포함하는 임의적으로 존재하는 인식 기이고; Z는 항체의 결합 부위의 측쇄에 공유 결합될 수 있는 반응성 기이다. 화학식 I의 화합물의 일부 실시양태에서는, t>1 또는 -X가 -R22-사이클로알킬-R23-, -R22-아릴-R23-, 또는 -R22-헤테로사이클릴-R23-일 때, Y가 존재한다.
화학식 I의 화합물의 몇몇 실시양태에서, X는 하기 화학식으로 표시된다:
-R22-[CH2-CH2-O]t-R23-
상기 식에서,
R22는 -(CH2)v-, -(CH2)u-C(O)-(CH2)v-, -(CH2)u-C(O)-O-(CH2)v-, -(CH2)u-C(O)-NRb-(CH2)v-, -(CH2)u-C(S)-NRb-(CH2)v-, -(CH2)u-NRb-(CH2)v-, -(CH2)u-O-(CH2)v-, -(CH2)u-S(O)0-2-(CH2)v-, -(CH2)u-S(O)0-2-NRb-(CH2)v- 또는 -(CH2)u-P(O)(ORb)-O-(CH2)v-이고;
u 및 v는 각각 독립적으로 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 또는 20이고;
t는 O 내지 50이며;
p는 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 또는 45이고;
w 및 r은 각각 독립적으로 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 또는 20이고;
s는 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 또는 20이며;
Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이며;
t, u, w, p, v, r 및 s의 값은 X의 주쇄 길이가 원자 약 200개 이하로 유지되도록 하는 값이다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
v, t, w, 및 p의 값은 X의 주쇄 길이가 원자 200개 미만, 다르게는 원자 100개 미만, 다르게는 원자 75개 미만, 다르게는 원자 50개 미만, 다르게는 원자 25개 미만, 또는 다르게는 원자 15개 미만이 되도록 선택된다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
v, t, r, 및 s의 값은 X의 주쇄 길이가 원자 200개 미만, 다르게는 원자 100개 미만, 다르게는 원자 75개 미만, 다르게는 원자 50개 미만, 다르게는 원자 25개 미만, 또는 다르게는 원자 15개 미만이 되도록 선택된다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
u, v, t, w, 및 p의 값은 X의 주쇄 길이가 원자 200개 미만, 다르게는 원자 100개 미만, 다르게는 원자 75개 미만, 다르게는 원자 50개 미만, 다르게는 원자 25개 미만, 또는 다르게는 원자 15개 미만이 되도록 선택된다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
u, v, t, r, 및 s의 값은 X의 주쇄 길이가 원자 200개 미만, 다르게는 원자 100개 미만, 다르게는 원자 75개 미만, 다르게는 원자 50개 미만, 다르게는 원자 25개 미만, 또는 다르게는 원자 15개 미만이 되도록 선택된다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
u, v, t, w, 및 p의 값은 X의 주쇄 길이가 원자 200개 미만, 다르게는 원자 100개 미만, 다르게는 원자 75개 미만, 다르게는 원자 50개 미만, 다르게는 원자 25개 미만, 또는 다르게는 원자 15개 미만이 되도록 선택된다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
u, v, t, r, 및 s의 값은 X의 주쇄 길이가 원자 200개 미만, 다르게는 원자 100개 미만, 다르게는 원자 75개 미만, 다르게는 원자 50개 미만, 다르게는 원자 25개 미만, 또는 다르게는 원자 15개 미만이 되도록 선택된다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
u, v, t, w, 및 p의 값은 X의 주쇄 길이가 원자 200개 미만, 다르게는 원자 100개 미만, 다르게는 원자 75개 미만, 다르게는 원자 50개 미만, 다르게는 원자 25개 미만, 또는 다르게는 원자 15개 미만이 되도록 선택된다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
u, v, t, r, 및 s의 값은 X의 주쇄 길이가 원자 200개 미만, 다르게는 원자 100개 미만, 다르게는 원자 75개 미만, 다르게는 원자 50개 미만, 다르게는 원자 25개 미만, 또는 다르게는 원자 15개 미만이 되도록 선택된다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 구조를 화학식으로 표시된다:
상기 식에서,
u, v, t, w, 및 p의 값은 X의 주쇄 길이가 원자 200개 미만, 다르게는 원자 100개 미만, 다르게는 원자 75개 미만, 다르게는 원자 50개 미만, 다르게는 원자 25개 미만, 또는 다르게는 원자 15개 미만이 되도록 선택된다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
u, v, t, r, 및 s의 값은 X의 주쇄 길이가 원자 200개 미만, 다르게는 원자 100개 미만, 다르게는 원자 75개 미만, 다르게는 원자 50개 미만, 다르게는 원자 25개 미만, 또는 다르게는 원자 15개 미만이 되도록 선택된다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
u, v, t, w, 및 p의 값은 X의 주쇄 길이가 원자 200개 미만, 다르게는 원자 100개 미만, 다르게는 원자 75개 미만, 다르게는 원자 50개 미만, 다르게는 원자 25개 미만, 또는 다르게는 원자 15개 미만이 되도록 선택된다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
u, v, t, r, 및 s의 값은 X의 주쇄 길이가 원자 200개 미만, 다르게는 원자 100개 미만, 다르게는 원자 75개 미만, 다르게는 원자 50개 미만, 다르게는 원자 25개 미만, 또는 다르게는 원자 15개 미만이 되도록 선택된다.
L이 화학식 -X-Y-Z-로 표시되는 화학식 I로 표시되는 화합물에서, Y의 고리 구조는 포화, 불포화 및 방향족 탄소환상 고리, 및 포화, 불포화 및 방향족 헤테로환상 고리를 포함한다. 고리 구조(들)는 일환상, 이환상 또는 다환상일 수 있고, 융합되거나 융합되지 않은 고리를 포함한다. 또한, 고리 구조(들)는 할로겐, 옥소, -OH, -CHO, -COOH, -NO2, -CN, -NH2, 아미딘, 구아니딘, 하이드록실아민, -C(O)NH2, 2급 및 3급 아마이드, 설폰아마이드, 치환되거나 치환되지 않은 알킬, 치환되거나 치환되지 않은 알켄일, 치환되거나 치환되지 않은 알킨일, 옥소알킬, 옥소알켄일, 옥소알킨일, 아미노알킬, 아미노알켄일, 아미노알킨일, 설포알킬, 설포알켄일, 설포알킨일, 포스포알킬, 포스포알켄일, 및 포스포알킨일 기를 포함하지만 이들로 국한되지는 않는, 당해 분야에 널리 공지되어 있는 작용기로 임의적으로 치환된다.
화학식 I로 표시되는 화합물의 일부 실시양태에서, Y의 고리 구조는 임의적으로 치환되는 하기 화학식 IV 또는 V로 표시된다:
화학식 IV
화학식 V
상기 식에서,
a, b, c, d, 및 e는 각각 독립적으로 탄소 또는 질소이고;
f는 탄소, 질소, 산소, 또는 황이며;
Y는 충분한 원자가의 임의의 두 고리 위치에서 독립적으로 X 및 Z에 부착되고;
a, b, c, d, e, 또는 f중 4개 이하는 동시에 질소이다.
고리 구조를 구성하는 원자상에 남아 있는 임의의 빈 원자가는 수소 또는 다른 치환기에 의해, 또는 X 및 Z로의 공유 결합에 의해 채워질 수 있다. 예를 들어, b가 탄소인 경우, 이의 원자가는 수소, 할로겐 같은 치환기, X로의 공유 결합, 또는 Z로의 공유 결합에 의해 채워질 수 있다. 일부 실시양태에서는 a, b, c, d, 및 e가 각각 탄소인 한편, 다른 실시양태에서는 a, c, d 및 f가 각각 탄소이다. 다른 실시양태에서는, a, b, c, d, 또는 e중 하나 이상이 질소이고, 또 다른 실시양태에서는 f가 산소 또는 황이다. 또 다른 실시양태에서, Y의 고리 구조는 치환되지 않는다. 특정 실시양태에서, Y는 페닐이다.
화학식 I의 화합물의 특정 실시양태에서, X-Y는 하기 화학식 XII로 표시된다:
[화학식 XII]
상기 식에서,
v는 1, 2, 3, 4, 또는 5이고; w는 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 다른 특정 실시양태에서, v는 1, 2 또는 3이고, w는 1, 2, 또는 3이다. 또 다른 실시양태에서, v는 1 또는 2이고, w는 1 또는 2이다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
H1 및 H1'는 각각 독립적으로 N, O, S, 또는 CH2이고;
r 및 s는 각각 독립적으로 1, 2, 3, 4, 또는 5이며;
t 및 t'는 각각 독립적으로 0, 1, 2, 3, 4, 또는 5이다.
이들 실시양태중 특정 실시양태에서, H1 및 H1'는 각각 독립적으로 O 또는 CH2이고; r 및 s는 각각 독립적으로 1 또는 2이며; t 및 t'는 각각 독립적으로 0 또는 1이다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
H1 및 H1'는 각각 독립적으로 N, O, S, 또는 CH2이고;
r 및 s는 각각 독립적으로 1, 2, 3, 4, 또는 5이며;
t 및 t'는 각각 독립적으로 0, 1, 2, 3, 4, 또는 5이고;
Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다.
이들 실시양태중 특정 실시양태에서, H1 및 H1'는 각각 독립적으로 O 또는 CH2이고; r 및 s는 각각 독립적으로 1 또는 2이고; t 및 t'는 각각 독립적으로 0 또는 1이다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
H1 및 H1'는 각각 독립적으로 N, O, S, 또는 CH2이고;
r 및 s는 각각 독립적으로 1, 2, 3, 4, 또는 5이며;
t 및 t'는 각각 독립적으로 0, 1, 2, 3, 4, 또는 5이며;
Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다.
이들 실시양태중 특정 실시양태에서, H1 및 H1'는 각각 독립적으로 O 또는 CH2이고; r 및 s는 각각 독립적으로 1 또는 2이며; t 및 t'는 각각 독립적으로 0 또는 1이다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
H1 및 H1'는 각각 독립적으로 N, O, S, 또는 CH2이고;
r 및 s는 각각 독립적으로 1, 2, 3, 4, 또는 5이고;
t 및 t'는 각각 독립적으로 0, 1, 2, 3, 4, 또는 5이며;
Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다.
이들 실시양태중 특정 실시양태에서, H1 및 H1'는 각각 독립적으로 O 또는 CH2이며; r 및 s는 각각 독립적으로 1 또는 2이며; t 및 t'는 각각 독립적으로 0 또는 1이다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
H1 및 H1'는 각각 독립적으로 N, O, S, 또는 CH2이고;
r 및 s는 각각 독립적으로 1, 2, 3, 4, 또는 5이고;
t 및 t'는 각각 독립적으로 0, 1, 2, 3, 4, 또는 5이며;
Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다.
이들 실시양태중 특정 실시양태에서, H1 및 H1'는 각각 독립적으로 O 또는 CH2이고; r 및 s는 각각 독립적으로 1 또는 2이며; t 및 t'는 각각 독립적으로 0 또는 1이다.
화학식 I의 화합물의 특정 실시양태에서, X는 화학식으로 표시된다:
상기 식에서,
H1 및 H1'는 각각 독립적으로 N, O, S, 또는 CH2이고;
r 및 s는 각각 독립적으로 1, 2, 3, 4, 또는 5이며;
t 및 t'는 각각 독립적으로 O, 1, 2, 3, 4, 또는 5이고;
Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다.
이들 실시양태중 특정 실시양태에서, H1 및 H1'는 각각 독립적으로 O 또는 CH2이고; r 및 s는 각각 독립적으로 1 또는 2이며; t 및 t'는 각각 독립적으로 0 또는 1이다.
화학식 I의 화합물의 특정 실시양태에서, X는 하기 화학식으로 표시된다:
상기 식에서,
H1 및 H1'는 각각 독립적으로 N, O, S, 또는 CH2이며;
r 및 s는 각각 독립적으로 1, 2, 3, 4, 또는 5이며;
t 및 t'는 각각 독립적으로 0, 1, 2, 3, 4, 또는 5이다.
이들 실시양태중 특정 실시양태에서, H1 및 H1'는 각각 독립적으로 O 또는 CH2이며; r 및 s는 각각 독립적으로 1 또는 2이며; t 및 t'는 각각 독립적으로 0 또는 1이다.
화학식 I의 화합물의 이들 실시양태중 특정 실시양태에서, X-Y는 하기 화학식 XIIa로 표시된다:
[화학식 XIIa]
상기 식에서,
v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이고; w는 1, 2, 3, 4, 또는 5이며; p는 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이고; w는 1이며; p는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2, 또는 3이고; w는 1이고; p는 1 또는 2이다.
화학식 I의 화합물의 특정 실시양태에서, X-Y는 하기 화학식 XIIb로 표시된다:
[화학식 XIIb]
상기 식에서,
v는 0, 1, 2, 3, 4, 또는 5이며; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이며; Rb는 수소, 치환되거나 치환되지 않은 C1-10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2, 또는 3이며; r은 1이고; s는 1 또는 2이다.
화학식 I의 화합물의 특정 실시양태에서, X-Y는 하기 화학식 XIIc로 표시된다:
[화학식 XIIc]
상기 식에서,
u는 0, 1, 2, 3, 4, 또는 5이고; v는 0, 1, 2, 3, 4, 또는 5이며; t는 1, 2, 3, 4, 5, 또는 6이고; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이며; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이며; v는 0이며; t는 1, 2, 3, 4, 5, 또는 6이고; w는 1이며; p는 3이다. 일부 실시양태에서, u는 0 또는 1이며; v는 0이고; t는 1 또는 2이며; w는 1이며; p는 1 또는 2이다.
화학식 I의 화합물의 특정 실시양태에서, X-Y는 하기 화학식 XIId로 표시된다:
[화학식 XIId]
상기 식에서,
u는 0, 1, 2, 3, 4, 또는 5이고; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이며; s는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이며; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이고; s는 3이다. 일부 실시양태에서, u는 0 또는 1이고; v는 0이며; t는 1, 2, 또는 3이고; r은 1이고; s는 1 또는 2이다.
화학식 I의 화합물의 특정 실시양태에서, X-Y는 하기 화학식 XIIe로 표시된다:
[화학식 XIIe]
상기 식에서,
u는 0, 1, 2, 3, 4, 또는 5이고; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이고; w는 1, 2, 3, 4, 또는 5이며; p는 1, 2, 3, 4, 또는 5이며; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이며; t는 1, 2, 3, 4, 5, 또는 6이고; w는 1이고; p는 3이다. 일부 실시양태에서, u는 0 또는 1이고; v는 0이며; t는 1 또는 2이고; w는 1이며; p는 1 또는 2이다.
화학식 I의 화합물의 특정 실시양태에서, X-Y는 하기 화학식 XIIf로 표시된다:
[화학식 XIIf]
상기 식에서,
u는 0, 1, 2, 3, 4, 또는 5이고; v는 0, 1, 2, 3, 4, 또는 5이며; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이며; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이고; s는 3이다. 일부 실시양태에서, u는 0 또는 1이고; v는 0이며; t는 1, 2, 또는 3이며; r은 1이고; s는 1 또는 2이다.
화학식 I의 화합물의 특정 실시양태에서, X-Y는 하기 화학식 XIIg로 표시된다:
[화학식 XIIg]
상기 식에서,
u는 0, 1, 2, 3, 4, 또는 5이고; v는 0, 1, 2, 3, 4, 또는 5이며; t는 1, 2, 3, 4, 5, 또는 6이고; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이다. 일부 실시양태에서, u는 0 또는 1이고; v는 0이고; t는 1 또는 2이며; w는 1이며; p는 1 또는 2이다.
화학식 I의 화합물의 특정 실시양태에서, X-Y는 하기 화학식 XIIh로 표시된다:
[화학식 XIIh]
상기 식에서,
u는 0, 1, 2, 3, 4, 또는 5이고; v는 0, 1, 2, 3, 4, 또는 5이며; t는 1, 2, 3, 4, 5, 또는 6이고; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 O이고; v는 O이고; t는 1, 2, 3, 4, 5, 또는 6이고; r은 1 또는 2이고; s는 3이다. 일부 실시양태에서, u는 0 또는 1이고; v는 0이며; t는 1, 2, 또는 3이고; r은 1이며; s는 1 또는 2이다.
화학식 I의 화합물의 특정 실시양태에서, X-Y는 하기 화학식 XIIi로 표시된다:
[화학식 XIIi]
상기 식에서,
u는 0, 1, 2, 3, 4, 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이며; t는 1, 2, 3, 4, 5, 또는 6이고; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이며; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이며; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이다. 일부 실시양태에서, u는 0 또는 1이고; v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이다.
화학식 I의 특정 실시양태에서, X-Y는 하기 화학식 XIIj로 표시된다:
[화학식 XIIj]
상기 식에서,
u는 0, 1, 2, 3, 4, 또는 5이고; v는 0, 1, 2, 3, 4, 또는 5이며; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이며; s는 0, 1, 2, 3, 4, 또는 5이며; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이며; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이다. 일부 실시양태에서, u는 0 또는 1이고; v는 0이고; t는 1, 2, 또는 3이며; r은 1이고; s는 1 또는 2이다.
화학식 I의 화합물의 특정 실시양태에서, X-Y는 하기 화학식 XIIk로 표시된다:
[화학식 XIIk]
상기 식에서,
u는 0, 1, 2, 3, 4, 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이고; w는 1이며; p는 3이다. 일부 실시양태에서, u는 0 또는 1이고; v는 0이고; t는 1 또는 2이고; w는 1이고; p는 1 또는 2이다.
화학식 I의 화합물의 특정 실시양태에서, X-Y는 하기 화학식 XIIl으로 표시된다:
[화학식 XIIl]
상기 식에서,
u는 0, 1, 2, 3, 4, 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이며; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이며; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이며; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이고; s는 3이다. 일부 실시양태에서, u는 0 또는 1이고; v는 0이며; t는 1, 2, 또는 3이며; r은 1이고; s는 1 또는 2이다.
L이 화학식 -X-Y-Z-로 표시되는 화학식 I의 화합물에서, 반응성 기 Z는 항체의 결합 부위의 아미노산과 공유 결합을 형성할 수 있는 잔기를 함유한다. 예를 들어, Z는 치환된 알킬, 치환된 사이클로알킬, 치환된 아릴, 치환된 아릴알킬, 치환된 헤테로사이클릴, 또는 치환된 헤테로사이클릴알킬일 수 있으며, 이 때 하나 이상의 치환기는 1,3-다이케톤 잔기, 아실 베타-락탐, 활성 에스터, 알파-할로케톤, 알데하이드, 말레이미드, 락톤, 안하이드라이드, 알파-할로아세트아마이드, 아민, 하이드라자이드 또는 에폭사이드이다. 이들 몇몇 실시양태에서, Z는 치환된 알킬이다.
Z는 가역적이거나 비가역적인 공유 결합을 형성하는 기일 수 있다. 일부 실시양태에서는, 도 8에 도시된 것과 같은 다이케톤 Z 기를 사용하여 가역적인 공유 결합을 형성할 수 있다. 따라서, 구조 A 내지 C는 항체의 결합 부위의 반응성 친핵성 기(예컨대, 리신 또는 시스테인 측쇄)와 가역적인 공유 결합을 형성할 수 있다. 도 8의 구조 A 내지 C의 R'1, R'2, R'3 및 R4는 C, H, N, O, P, S, 할로겐(F, Cl, Br, I) 또는 이들의 염일 수 있는 치환기를 나타낸다. 이들 치환기는 또한 알킬, 알켄일, 알킨일, 옥소알킬, 옥소알켄일, 옥소알킨일, 아미노알킬, 아미노알켄일, 아미노알킨일, 설포알킬, 설포알켄일, 또는 설포알킨일 기, 포스포알킬, 포스포알켄일, 포스포알킨일 기 같은 기를 포함할 수도 있다. R'2 및 R'3은 또한 구조 B 및 C에서 예시되는 바와 같이 고리 구조를 형성할 수 있다. 도 8의 X는 헤테로원자일 수 있다. 가역적인 공유 결합을 형성하는 다른 Z 기는 아미딘, 이민 및 도 8의 구조 G에 의해 포괄되는 다른 반응성 기를 포함한다. 도 9는 가역적인 공유 결합을 형성하는 다른 연결기 반응성 기의 구조, 예를 들어 구조 B,g, H 및 X가 이탈기가 아닌 경우 E 및 F를 포함한다.
항체의 결합 부위와 비가역적인 공유 결합을 형성하는 Z 반응성 기는 도 8의 구조 D 내지 G(예컨대, G가 이미데이트인 경우) 및 도 9의 구조 A, C 및 D를 포함한다. X가 이탈기인 경우, 도 9의 구조 E 및 F도 비가역적인 공유 결합을 형성할 수 있다. 이러한 구조는 반응성 친핵성 기에 대한 표적화제-연결기를 항체의 결합 부위에 비가역적으로 부착하는데 유용하다.
이러한 다른 실시양태에서, Z는 1,3-다이케톤 잔기이다. 또 다른 이들 실시양태에서, Z는 1,3-다이케톤 잔기에 의해 치환된 알킬이다. 특정 실시양태에서, Z는 하기 화학식 VI으로 표시된다:
화학식 VI
상기 식에서,
q는 0 내지 5이다.
특정한 다른 실시양태에서, Z는 하기 화학식으로 표시된다:
AA 표적화 화합물에 사용하기 위한 또한 AA 표적화제-연결기 화합물을 제조하는데 사용하기 위한 하나의 연결기는 Z로서의 1,3-다이케톤 반응성 기를 포함한다. 화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1-10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이고; s는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이며; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1-10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이고; s는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이며; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2 또는 3이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이고; s는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이며; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이고; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이고; v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이고; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이고; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4, 또는 5이고; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이고; s는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이며; v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4, 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이고; s는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이고; v는 0이고; t는 1, 2 또는 3이며; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0 또는 1이며; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이고; s는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이며; v는 0이고; t는 1, 2 또는 3이며; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이고; v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이며; v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이며; v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0-6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이고; s는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이고; v는 0이고; t는 1, 2 또는 3이며; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이고; s는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이며; v는 0이고; t는 1, 2 또는 3이며; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 또는 3이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이고; s는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이며; v는 0이고; t는 1, 2 또는 3이며; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이며; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이고; v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이며; v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이고; v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이며; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이고; s는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이며; v는 0이고; t는 1, 2 또는 3이며; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3-7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이고; s는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이고; v는 0이고; t는 1, 2 또는 3이며; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이고; s는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이며; v는 0이고; t는 1, 2 또는 3이며; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이고; v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이며; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이며; v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이며; v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 I의 특정 실시양태에서, L은 하기 구조를 갖는다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이며; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이고; s는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이며; v는 0이고; t는 1, 2 또는 3이며; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3-7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이고; s는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이며; v는 0이고; t는 1, 2 또는 3이며; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이고; s는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이며; v는 0이고; t는 1, 2 또는 3이며; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이며; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이고; v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이며; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이며; v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이고; v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0-6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이고; s는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이며; v는 0이고; t는 1, 2 또는 3이며; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0-6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이고; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이고; s는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이며; v는 0이고; t는 1, 2 또는 3이며; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I의 특정 실시양태에서, L은 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, u는 0, 1, 2, 3, 4 또는 5이며; v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 또는 3이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, u는 0이며; v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이고; s는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, u는 0 또는 1이며; v는 0이고; t는 1, 2 또는 3이며; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
본원에 사용되는 "AA1-AA2-AAn"은 "AA1"이 N-말단으로부터 측정할 때 AA 표적화제 서열의 제 1 아미노산이고, "AA2"가 N-말단으로부터 측정할 때 AA 표적화제 서열의 제 2 아미노산이며, "AAn"이 N-말단으로부터 측정할 때 AA 표적화제 서열의 n번째 아미노산인 AA 표적화제를 가리킨다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 1, 2, 3, 4, 또는 5이고; w는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 1, 2, 또는 3이고; w는 1, 2, 또는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 1 또는 2이고; w는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 1, 2, 3, 4, 또는 5이고; w는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 또는 3이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 1, 2, 또는 3이며; w는 1, 2, 또는 3이며; q는 0, 1, 2, 3이다. 일부 실시양태에서, v는 1 또는 2이고; w는 1 또는 2이고; q는 2 또는 3이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 1, 2, 3, 4, 또는 5이고; w는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 1, 2, 또는 3이며; w는 1, 2, 또는 3이며; q는 O, 1, 2, 3이다. 일부 실시양태에서, v는 1 또는 2이며; w는 1 또는 2이고; q는 2 또는 3이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이며; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이고; w는 1이고; p는 3이며; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이며, 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1-10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2, 또는 3이며; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1-10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1-10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1-10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 O이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 O이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1-10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1-10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
본원에서 사용되는 는 "AA1"이 N-말단으로부터 측정할 때 AA 표적화제 서열의 제 1 아미노산이고, "AA2"가 N-말단으로부터 측정할 때 AA 표적화제 서열의 제 2 아미노산이며, "AAn"이 N-말단으로부터 측정할 때 AA 표적화제 서열의 n번째 아미노산인 AA 표적화제를 가리킨다. 표적화제는 N-말단으로부터 측정할 때 임의의 위치 m+1에 Lys 잔기를 추가로 포함한다. AA 표적화제의 몸체의 Lys 측쇄에 연결함에 덧붙여, AA 표적화제의 N-말단 또는 C-말단 상의 Lys 측쇄에 연결시킬 수도 있다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 1, 2, 3, 4, 또는 5이고; w는 1, 2, 3, 4, 5, 또는 6이며; q는 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0-6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 1, 2 또는 3이고; w는 1, 2 또는 3이고; q는 1, 2, 또는 3이다. 일부 실시양태에서, v는 1 또는 2이며; w는 1 또는 2이며; q는 2, 또는 3이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 1, 2, 3, 4, 또는 5이고; w는 1, 2, 3, 4, 5, 또는 6이며; q는 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0-6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 1, 2 또는 3이고; w는 1, 2 또는 3이고; q는 1, 2, 또는 3이다. 일부 실시양태에서, v는 1 또는 2이며; w는 1 또는 2이며; q는 2, 또는 3이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 1, 2, 3, 4, 또는 5이고; w는 1, 2, 3, 4, 5, 또는 6이며; q는 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0-6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 1, 2 또는 3이고; w는 1, 2 또는 3이고; q는 1, 2, 또는 3이다. 일부 실시양태에서, v는 1 또는 2이며; w는 1 또는 2이며; q는 2, 또는 3이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1-10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1-10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 O, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 O이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1-10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1-10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 구조를 갖는다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 I에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
면역성 개인에게 AA 표적화 화합물을 투여하면 컨쥬게이트에 대한 항체를 생성시킬 수 있다. 이러한 항체는 항체의 인자형(idiotype)을 비롯한 가변 영역뿐만 아니라 표적화제를 항체에 컨쥬게이션시키는데 사용된 표적화제 또는 임의의 연결기에 대한 것일 수 있다. 장쇄 폴리에틸렌 글라이콜(PEG)계 이격자 등을 AA 표적화 화합물에 부착시키는 것과 같은 당해 분야에 널리 공지되어 있는 방법에 의해 AA 표적화 화합물의 면역원성을 감소시킬 수 있다. 장쇄 PEG 및 다른 중합체는 외래 항원결정기를 마스킹하여 외래 항원결정기를 나타내는 치료용 단백질의 면역원성을 감소시키는 것으로 알려져 있다[케이터(N. V. Katre), J. Immunol. 144:209-213 (1990); 프랜시스(G. E. Francis) 등, Int. J. Hematol. 68:1-18 (1998)]. 다르게는, 또는 덧붙여서, 개별 투여되는 항체-AA 표적화제 컨쥬게이트는 사이클로스포린 A, 항-CD3 항체 등과 같은 면역 역제제를 투여할 수 있다.
한 실시양태에서, AA 표적화 화합물은 화학식 II로 기재되며, 이들의 입체 이성질체, 호변 이성질체, 용매화물, 전구약물 및 약학적으로 허용가능한 염을 포함한다:
화학식 II
항체-L'-[AA 표적화제]
화학식 II의 화합물에서, [AA 표적화제]는 화학식 I에서와 같이 정의된다. L'는 항체를 표적화제에 연결시키고 화학식 -X-Y-Z'-로 표시되는 연결 잔기이다. 화학식 II의 화합물에서, X 및 Y는 화학식 I에서와 같이 정의되고, 항체는 본원에 정의된 바와 같은 항체이다. 도 10 및 도 11은 각각 도 8 및 도 9에 도시된 Z 잔기에 항체의 결합 부위의 반응성 친핵성 측쇄를 부가하는 기작을 도시한다.
항체가 알돌라제 촉매적 항체인 특정 실시양태에서, Z'-항체는 하기 화학식으로 표시된다:
상기 식에서,
HN-항체는 아미노기를 갖는 항체의 결합 부위의 임의적인 측쇄를 가리킨다.
항체가 알돌라제 촉매적 항체인 특정 실시양태에서, Z'-항체는 하기 화학식으로 표시된다:
상기 식에서,
HN-항체는 아미노기를 갖는 항체의 결합 부위의 임의적인 측쇄를 가리킨다.
항체가 알돌라제 촉매적 항체인 특정 실시양태에서, Z'-항체는 하기 화학식으로 표시된다:
상기 식에서,
HN-항체는 아미노기를 갖는 항체의 결합 부위의 임의적인 측쇄를 가리킨다.
항체가 알돌라제 촉매적 항체인 특정 실시양태에서, Z'-항체는 하기 화학식으로 표시된다:
상기 식에서,
HN-항체는 아미노기를 갖는 항체의 결합 부위의 임의적인 측쇄를 가리킨다.
항체가 알돌라제 촉매적 항체인 특정 실시양태에서, Z'-항체는 하기 화학식으로 표시된다:
상기 식에서,
HN-항체는 아미노기를 갖는 항체의 결합 부위의 임의적인 측쇄를 가리킨다.
항체가 알돌라제 촉매적 항체인 특정 실시양태에서, Z'-항체는 하기 화학식으로 표시된다:
상기 식에서,
HN-항체는 아미노기를 갖는 항체의 결합 부위의 임의적인 측쇄를 가리킨다.
항체가 알돌라제 촉매적 항체인 특정 실시양태에서, Z'-항체는 하기 화학식으로 표시된다:
상기 식에서,
HN-항체는 아미노기를 갖는 항체의 결합 부위의 임의적인 측쇄를 가리킨다.
항체가 알돌라제 촉매적 항체인 특정 실시양태에서, Z'-항체는 하기 화학식으로 표시된다:
상기 식에서,
HN-항체는 아미노기를 갖는 항체의 결합 부위의 임의적인 측쇄를 가리킨다.
항체가 알돌라제 촉매적 항체인 특정 실시양태에서, Z'-항체는 하기 화학식으로 표시된다:
상기 식에서,
HN-항체는 아미노기를 갖는 항체의 결합 부위의 임의적인 측쇄를 가리킨다.
항체가 알돌라제 촉매적 항체인 특정 실시양태에서, Z'-항체는 하기 화학식으로 표시된다:
상기 식에서,
HN-항체는 아미노기를 갖는 항체의 결합 부위의 임의적인 측쇄를 가리킨다.
항체가 알돌라제 촉매적 항체인 특정 실시양태에서, Z'-항체는 하기 화학식으로 표시된다:
상기 식에서,
HN-항체는 아미노기를 갖는 항체의 결합 부위의 임의적인 측쇄를 가리킨다.
항체가 알돌라제 촉매적 항체인 특정 실시양태에서, Z'-항체는 하기 화학식으로 표시된다:
상기 식에서,
HN-항체는 아미노기를 갖는 항체의 결합 부위의 임의적인 측쇄를 가리킨다.
항체가 알돌라제 촉매적 항체인 특정 실시양태에서, Z'-항체는 하기 화학식으로 표시된다:
상기 식에서,
HN-항체는 아미노기를 갖는 항체의 결합 부위의 임의적인 측쇄를 가리킨다.
항체가 알돌라제 촉매적 항체인 특정 실시양태에서, Z'-항체는 하기 화학식으로 표시된다:
상기 식에서,
HN-항체는 아미노기를 갖는 항체의 결합 부위의 임의적인 측쇄를 가리킨다.
항체가 알돌라제 촉매적 항체인 특정 실시양태에서, Z'-항체는 하기 화학식으로 표시된다:
상기 식에서,
HN-항체는 아미노기를 갖는 항체의 결합 부위의 임의적인 측쇄를 가리킨다.
화학식 II로 표시되는 화합물에서, Z'는 항체가 부착되는, 공유 결합 및 탄소 원자 0 내지 20개를 포함하는 부착 잔기이다. 이는 연결기가 반응성 기로서 다이케톤 잔기를 갖고 항체 결합 부위의 리신 잔기의 측쇄 아미노기와 연결되는 경우에 대하여 아래에 도시된다. 항체는 표시된 각각의 결합 부위에 대한 반응성 아미노산 측쇄를 갖는 2가로서 개략적으로 도시된다.
아래에 도시되는 다른 실시양태는 연결기가 반응성 기로서 베타 락탐 잔기를 갖고 항체 결합 부위의 리신 잔기의 측쇄 아미노기와 연결이 이루어지는 경우에 대한 것이다. 항체는 표시된 각각의 결합 부위에 대한 반응성 아미노산 측쇄를 갖는 2가로서 개략적으로 도시된다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0-6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 1, 2, 3, 4, 또는 5이고; w는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 1, 2, 또는 3이고; w는 1, 2, 또는 3이고; q는 0, 1, 2, 3이다. 일부 실시양태에서, v는 1 또는 2이며; w는 1 또는 2이며; q는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 1, 2, 3, 4, 또는 5이고; w는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 1, 2, 또는 3이고; w는 1, 2, 또는 3이고; q는 0, 1, 2, 3이다. 일부 실시양태에서, v는 1 또는 2이며; w는 1 또는 2이며; q는 2 또는 3이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 1, 2, 3, 4, 또는 5이고; w는 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0-6 알킬이다. 특정 실시양태에서, v는 1, 2, 또는 3이고; w는 1, 2, 또는 3이다. 일부 실시양태에서, v는 1 또는 2이고; w는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1-10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0-6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1-10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0-6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0-6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1-10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0-6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 1, 2, 3, 4, 또는 5이고; w는 1, 2, 3, 4, 5, 또는 6이며; q는 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0-6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 1, 2 또는 3이고; w는 1, 2 또는 3이고; q는 1, 2, 또는 3이다. 일부 실시양태에서, v는 1 또는 2이며; w는 1 또는 2이며; q는 2, 또는 3이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 1, 2, 3, 4, 또는 5이고; w는 1, 2, 3, 4, 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 1, 2 또는 3이고; w는 1, 2 또는 3이다. 일부 실시양태에서, v는 1 또는 2이며; w는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 1, 2, 3, 4, 또는 5이고; w는 1, 2, 3, 4, 5, 또는 6이며; q는 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0-6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 1, 2 또는 3이고; w는 1, 2 또는 3이고; q는 1, 2, 또는 3이다. 일부 실시양태에서, v는 1 또는 2이며; w는 1 또는 2이며; q는 2, 또는 3이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이며; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0-6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1-10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0-6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1-10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; Rb는 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; q는 O, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이며; q는 2 또는 3이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1, 2, 3, 4, 또는 5이고; p는 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0-6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; w는 1이고; p는 3이다. 일부 실시양태에서, v는 0이고; t는 1 또는 2이며; w는 1이고; p는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 1 또는 2이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; q는 0, 1, 2, 또는 3이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이고; q는 0, 1, 2, 또는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이며; q는 2 또는 3이다.
화학식 II에 따른 특정 실시양태는 하기 화학식으로 표시된다:
이들 실시양태중 특정 실시양태에서, v는 0, 1, 2, 3, 4, 또는 5이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1, 2, 3, 4, 또는 5이고; s는 0, 1, 2, 3, 4, 또는 5이고; Rb는 각각 독립적으로 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C0 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C0 -6 알킬이다. 특정 실시양태에서, v는 0이고; t는 1, 2, 3, 4, 5, 또는 6이며; r은 1 또는 2이며; s는 3이다. 일부 실시양태에서, v는 0이고; t는 1, 2 또는 3이고; r은 1이고; s는 1 또는 2이다.
다르게는, 연결기는 반응성 기로서 아민 또는 하이드라자이드를 가질 수 있고, 다이케톤 잔기를 갖도록 항체를 처리할 수 있다. 당해 분야에 널리 공지되어 있는 기법을 이용하여, 비-천연 다이케톤-함유 아미노산을 항체 결합 부위 내로 용이하게 혼입시킬 수 있고; 비-천연 아미노산을 함유하는 단백질을 효모 및 세균에서 생성시켰다. 예를 들어 친(J. W. Chin) 등의 문헌[Science 301:964-966 (2003)]; 왕(L. Wang) 등의 문헌[Science 292:498-500 (2001)]; 친 등의 문헌[J. Am. Chem. Soc. 124:9026-9027 (2002)]; 왕 등의 문헌[J. Am. Chem. Soc. 124:1836-1837 (2002)]; 친 및 슐츠(P. G. Schultz)의 문헌[Chembiochem. 3:1135-1137 (2002)]; 친 등의 문헌[Proc. Natl. Acad. Sci. U.S.A. 99:11020-11024 (2002)]; 왕 및 슐츠의 문헌[Chem. Commun. (1):1-11 (2002)]; 장(Z. Zhang) 등의 문헌[Angew. Chem. Int. Ed. Engl. 41:2840-2842 (2002)]; 왕의 문헌[Proc. Natl. Acad. Sci. U.S.A. 100:56-61 (2003)] 참조. 따라서, 예를 들어 다이케톤 잔기를 함유하는 비-천연 아미노산을 효모인 사카로마이세스 세레비지애(Saccharomyces cerevisiae)에 삽입하기 위해서는, 독특한 코돈, tRNA 및 아미노아실-tRNA 신테타제(aa RS)를 포함하는 단백질 생합성 기계에 새로운 구성요소를 첨가해야 한다. 예를 들어, 친 등의 문헌[Science 301:964-966 (2003)]에서 진핵 생물에 대해 보고된 바와 같이 이. 콜라이로부터의 앰버(amber) 억제제 타이로실-tRNA 신테타제 (TyrRS)-tRNACUA 쌍을 사용할 수 있다. 앰버 코돈을 사용하여 관심 있는 비-천연 아미노산을 코딩한다. 이어, 돌연변이 TyrRS 및 tRNACUA의 라이브러리를 생성시키고, TyrRS가 관심 있는 비-천연 아미노산, 예컨대 다이케톤-함유 아미노산을 갖는 tRNACUA를 부가시키는 aaRS-tRNACUA 쌍에 대해 선택할 수 있다. 이어, 앰버 코돈을 함유하는 유전자를 클로닝하고 하나 이상의 항체 결합 부위에서 발현시킴으로써, 다이케톤-함유 아미노산을 혼입하는 항체를 생성시킬 수 있다.
화학식 II의 화합물의 몇몇 실시양태에서, 항체는 전장 항체이다. 다른 실시양태에서, 항체는 Fab, Fab', F(ab')2, Fv, VH, VL 또는 scFv이다. 특정 실시양태에서, 항체는 인간 항체, 인간화된 항체 또는 키메라 인간 항체이다. 특정 실시양태에서, 항체는 촉매적 항체이다. 하나의 실시양태에서, 항체는 인간 IgG, IgA, IgM, IgD 또는 IgE 항체로부터의 불변 영역을 포함하는 쥣과 동물 38c2의 인간화된 형태이다. 다른 실시양태에서, 항체는 쥣과 동물 38c2로부터의 가변 영역 및 인간 IgG, IgA, IgM, IgD 또는 IgE 항체로부터의 불변 영역을 포함하는 키메라 항체이다.
몇몇 경우, 둘 이상의 AA 표적화제를 연결시켜 하나의 전장 2가 항체를 생성시킬 수 있다. 이는 아래 화학식 III으로 도시된다:
화학식 III
항체[-L'-[AA 표적화제]]2
또한, 이들의 입체 이성질체, 호변 이성질체, 용매화물, 전구약물 및 약학적으로 허용가능한 염도 제공된다.
화학식 III의 화합물에서, [AA 표적화제], L' 및 항체는 각각 화학식 II에서와 동일하게 정의된다.
본원에 기재된 표적화제-연결기 화합물을 다가 항체의 결합 부위에 공유 결합시킴으로써 화학식 II의 화합물과 같은 표적화 화합물을 용이하게 합성할 수 있다. 예를 들어, 연결기가 다이케톤 반응성 잔기를 포함하는 AA 표적화제-연결기 컨쥬게이트를 h38C2 IgG1 같은 알돌라제 항체 0.5당량과 함께 배양하여 AA 표적화 화합물을 생성시킬 수 있다. 다르게는, 본원에 기재되어 있는 AA 표적화제-연결기 화합물을 2가 항체의 각 결합 부위에 공유 결합시킴으로써 화학식 III의 화합물과 같은 AA 표적화 화합물을 생성시킬 수 있다.
AA
표적화
화합물의 사용 방법
본 발명의 한 양태는 본원에 기재된 AA 표적화 화합물 효과량을 개체에 투여함을 포함하는, 생체 내에서 Ang-2 활성을 조절하는 방법을 제공한다. 개체에서 비정상적인 혈관 신생 또는 혈관 신생-매개되는 질병을 치료하는 방법이 추가로 제공된다. 이러한 방법은 본원에 기재된 AA 표적화 화합물 치료 효과량을 개체에 투여함을 포함한다. 본원에 사용되는 혈관 신생-매개되는 질병은 비정상적인 혈관 신생 활성에 의해 발병되는 질병 또는 혈관 신생 활성을 조절하는 화합물이 치료 용도를 갖는 질병이다. 치료될 수 있는 질환 및 질병은 암, 관절염, 건선, 감염 또는 외과 수술과 관련된 눈의 혈관 신생, 황반 변성 또는 당뇨병성 망막병증을 포함한다. 특히, 암을 치료하는 방법은 유방, 결장, 직장, 폐, 구인두, 하인두, 식도, 위, 췌장, 간, 담낭, 수담관, 소장, 요로, 여성 성기도, 남성 성기도, 내분비선 및 피부의 암종; 혈관종; 흑색종; 육종; 뇌, 신경, 눈 및 뇌막의 종양; 백혈병; 또는 림프종을 포함한다.
약학 조성물 및 투여 방법
본 발명의 다른 양태는 AA 표적화 화합물의 약학 조성물을 제공한다. AA 표적화 화합물을 약학적으로 허용가능한 담체와 혼합하여, 세포 또는 개체에 단독으로 또는 하나 이상의 다른 치료 양식과 조합되어 투여하기 위한 약학 조성물을 제조할 수 있다.
약학 조성물은 일반적으로 의도하는 투여 경로에 적합하도록 제형화된다. 당해 분야의 숙련자는 약학 매질의 선택 및 조성물의 적절한 제조가 의도하는 용도 및 투여 방식에 따라 달라질 것임을 알게 될 것이다. 투여 경로의 예는 비경구(예를 들어, 정맥내, 근육내, 골수내, 피내, 피하), 경구(예컨대, 흡입, 섭취), 비강내, 경피(예컨대, 국부), 경점막, 및 직장 투여를 포함한다. AA 표적화 화합물의 투여 경로는 또한 경막내, 직접적인 뇌실내 및 복강내 전달도 포함할 수 있다. 배합물을 직접 주사함으로써, 또는 생리 식염수, D5W, 락트산 링거 용액 또는 다른 통상적으로 사용되는 주입 매질 같은 주입 기질과 표적화 AA 화합물 배합물의 혼합물을 주입함으로써, 임의의 비경구 경로를 통해 AA 표적화 화합물을 투여할 수 있다.
당해 분야의 숙련자에게 널리 공지되어 있는 기법을 이용하여 AA 표적화 화합물을 투여할 수 있다. 바람직하게는, 약제를 제형화하여 전신 투여한다. 제형화 및 투여 기법은 문헌["Remington's Pharmaceutical Sciences", 제18판, 1990, Mack Publishing Co., 펜실베이니아주 이스턴]에서 찾아볼 수 있다. 주사의 경우, AA 표적화 화합물을 수용액, 수성 유화액 또는 수성 현탁액으로 제형화시킬 수 있다. 시트레이트, 아세테이트, 히스티딘 또는 포스페이트 같은 생리학적으로 양립가능한 완충액을 함유하는 수용액으로 AA 표적화 화합물을 제형화시키는 것이 바람직하다. 필요한 경우, 이러한 배합물은 또한 다양한 긴장성 조절제, 가용화제 및/또는 안정화제(예를 들어, 염화나트륨 같은 염, 또는 슈크로즈, 만니톨 및 트레할로즈 같은 당, 또는 알부민 같은 단백질, 또는 글라이신 및 히스티딘 같은 아미노산, 또는 폴리솔베이트(트윈스) 같은 계면활성제, 또는 에탄올, 폴리에틸렌 글라이콜 및 프로필렌 글라이콜 같은 보조 용매)도 함유할 수 있다.
약학 조성물은 예를 들어 조성물의 pH, 삼투압, 점도, 투명도, 색상, 등장성, 냄새, 무균 상태, 안정성; 용해, 또는 방출, 흡착 또는 침투 속도를 변화, 유지 또는 보존하기 위하여 제형화 물질을 함유할 수 있다. 적합한 제형화 물질은 아미노산(예컨대, 글라이신, 글루타민, 아스파라긴, 아르기닌 또는 리신); 항균제; 산화방지제(예를 들어, 아스코르브산, 아황산나트륨 또는 아황산수소나트륨); 완충액(예컨대, 보레이트, 바이카본에이트, 트리스-HCl, 시트레이트, 포스페이트, 다른 유기 산); 킬레이트화제[예컨대, 에틸렌다이아민 테트라아세트산(EDTA)]; 용매(예를 들어, 글라이세린, 프로필렌 글라이콜 또는 폴리에틸렌 글라이콜); 당 알콜(예컨대, 만니톨 또는 솔비톨); 현탁제; 계면활성제 또는 습윤제(예를 들어, 플루로닉스, PEG, 솔비탄 에스터; 폴리솔베이트 20, 폴리솔베이트 80 같은 폴리솔베이트; 트리톤, 트로메타민, 레시틴, 콜레스테롤, 타일록사팔); 안정성 향상제(슈크로즈 또는 솔비톨); 긴장성 향상제(예컨대, 알칼리금속 할로겐화물, 바람직하게는 염화나트륨 또는 염화칼륨, 만니톨 솔비톨); 전달 비히클; 희석제; 부형제 및/또는 약학 보조제를 포함하지만, 이들로 국한되지는 않는다[Remington's Pharmaceutical Sciences, 제18판, 제나로 편집, Mack Publishing Company, 1990].
비경구 투여가 고려되는 경우, 치료 조성물은 약학적으로 허용가능한 비히클중에 AA 표적화 화합물을 포함하는 발열원을 함유하지 않는 비경구 허용가능한 수용액의 형태일 수 있다. 비경구 주사를 위한 하나의 비히클은 AA 표적화 화합물이 멸균 등장성 용액으로서 제형화되는 멸균 증류수이다. 또 다른 배합물은 저장장치(depot) 주사를 통해 전달될 수 있는 생성물의 조절되거나 지속적인 방출을 제공하는, 주사가능한 미소구, 생분해성 입자, 중합체 화합물(폴리락트산, 폴리글라이콜산), 비드 또는 리포솜 같은 약제와 AA 표적화 화합물을 배합함을 포함할 수 있다. 히알루론산도 사용할 수 있으며, 이는 순환시 지속적인 존속을 촉진시키는 효과를 가질 수 있다. 목적하는 분자를 도입하기에 적합한 다른 수단은 이식가능한 약물 전달 장치를 포함한다.
또 다른 양태에서, 비경구 투여에 적합한 약학 배합물은 바람직하게는 행크스(Hanks') 용액, 링거 용액 또는 생리학적으로 완충된 염수 같은 생리학적으로 양립가능한 완충액중 수용액으로 제형화될 수 있다. 수성 주사 현탁액은 소듐 카복시메틸 셀룰로즈, 솔비톨 또는 덱스트란 같은 현탁액의 점도를 증가시키는 성분을 함유할 수 있다. 적합한 친유성 용매 또는 비히클은 참깨유 같은 지방 오일, 또는 에틸 올리에이트, 트라이글라이세라이드 또는 리포솜 같은 합성 지방산 에스터를 포함한다. 비-지질 다중양이온성 아미노 중합체도 전달을 위해 사용할 수 있다. 임의적으로, 현탁액은 적합한 안정화제, 또는 화합물의 용해도를 높이고 고도로 농축된 용액의 제조를 허용하는 약제를 또한 함유할 수 있다.
생체내 투여에 사용되는 약학 조성물은 전형적으로 멸균성이어야 한다. 멸균 여과 막을 통해 여과함으로써 이를 달성할 수 있다. 화합물이 동결 건조되는 경우에는, 동결 건조 및 용액 재구성 전 또는 후에 이 방법을 이용한 멸균을 수행할 수 있다. 비경구 투여용 조성물은 동결 건조된 형태로 또는 용액으로 저장될 수 있다. 또한, 일반적으로 멸균 접근 포트를 갖는 용기, 예를 들어 정맥내 용액 백 또는 피하 주사 바늘에 의해 뚫릴 수 있는 마개를 갖는 바이알 내에 비경구 조성물을 넣는다.
약학 조성물을 배합한 후에는, 이를 용액, 현탁액, 겔, 유화액, 고체, 또는 탈수되거나 동결 건조된 분말로서 멸균 바이알에 저장할 수 있다. 이러한 배합물은 즉시 사용가능한 형태로 또는 투여하기 전에 용액 재구성을 필요로 하는 형태로(예컨대, 동결 건조) 저장될 수 있다.
한 실시양태는 단일-투여량 투여 단위를 생성시키기 위한 키트에 관한 것이다. 키트는 각각 AA 표적화 화합물을 갖는 제 1 용기 및 수성 배합물을 갖는 제 2 용기 둘 다를 함유할 수 있다. 또한, 단일 약실 및 다중 약실을 갖는 미리 충전된 주사기를 함유하는 키트도 본 발명의 영역 내에 속한다.
장애에 대한 혈관 신생 요소를 갖는 장애를 갖는 인간을 비롯한 포유동물을 치료함에 있어서는, 치료 효과량의 AA 표적화 화합물 또는 약학적으로 허용가능한 유도체를 투여한다. 투여 빈도는 사용되는 배합물중 AA 표적화 화합물의 약동학적 매개변수에 따라 달라질 것이다. 전형적으로는, 목적하는 효과를 달성하는 투여량에 도달할 때까지 조성물을 투여한다. 따라서, 단일 투여로서, 또는 시간의 경과에 따른 다수회 투여(동일하거나 상이한 농도/투여량)로서, 또는 연속적인 주입으로서 조성물을 투여할 수 있다. 조성물의 투여 경로 및 빈도와 투여량은 개인별로 다를 수 있으며, 표준 기법을 이용하여 용이하게 정립될 수 있다. 통상적인 방식으로 적절한 투여량을 더 정밀하게 정한다. 당해 분야의 숙련자는 적절한 투여량-반응 데이터를 사용하여 적절한 투여량을 밝힐 수 있다.
적절한 투여량 및 치료 섭생은 치료 및/또는 예방 면에서의 이익을 제공하기에 충분한 양으로 활성 화합물(들)을 제공한다. 치료되지 않은 환자와 비교하여 치료된 환자에서 개선된 임상적 결과(예컨대, 표적 구역에서의 감소된 혈관 수, 작아진 종양 크기 또는 부피)를 확인함으로써 이러한 반응을 모니터링할 수 있다. 전형적으로, 적합한 투여량은 본원에 기재된 바와 같이 투여될 때 혈관 신생 억제 반응을 촉진시킬 수 있고/있거나 기준선 또는 치료받지 않은 수준보다 10 내지 50% 이상 더 높은 화합물의 양이다.
일부 실시양태에서, 본 발명의 조성물에 대하여 가장 효과적인 투여 방식 및 투여 섭생은 질환의 중증도 및 경과, 환자의 건강 및 치료에 대한 반응, 및 치료하는 의사의 판단에 따라 달라진다. 따라서, 본 발명의 조성물의 투여량은 개별적인 환자에 대해 적정되어야 한다. 화합물의 효과적인 투여량은 1일 기준으로 체중 1kg당 약 0.1ug 내지 약 40mg이다. 약 0.1 내지 약 15mg/kg 체중의 1일 정맥내 주입액으로서 AA 표적화 화합물을 투여할 수 있다. 따라서, 한 실시양태는 약 0.5mg/kg 체중의 투여량을 제공한다. 다른 실시양태는 약 0.75mg/kg 체중의 투여량을 제공한다. 또 다른 실시양태는 약 1.0mg/kg 체중의 투여량을 제공한다. 또 다른 실시양태는 약 2.5mg/kg 체중의 투여량을 제공한다. 또 다른 실시양태는 약 5mg/kg 체중의 투여량을 제공한다. 또 다른 실시양태는 약 10.0mg/kg 체중의 투여량을 제공한다. 또 다른 실시양태는 약 15.0mg/kg 체중의 투여량을 제공한다. 소정 투여량의 AA 표적화 화합물 또는 약학적으로 허용가능한 유도체를 약 하루에 1회 내지 1주에 2회, 또는 다르게는 매주 약 1회 내지 매달 1회의 간격으로 투여해야 한다. 한 실시양태에서는, 약 0.002 내지 30mg/ml의 AA 표적화 화합물 또는 그의 약학적으로 허용가능한 유도체의 피크 혈장 농도를 달성하는 투여량을 투여한다. 적절한 배합물(화학 분야의 숙련자에게 공지되어 있는 임의의 적합한 배합 용액을 사용할 수 있음)중 투여되는 성분의 용액을 멸균 주사함으로써 이를 달성할 수 있다. 인준된 분석 방법에 의해 측정되는 혈장 수준에 의해 확인되는 바와 같이 AA 표적화 화합물의 연속 주입에 의해 바람직한 혈액 수준을 유지할 수 있다.
AA 표적화 화합물을 개인에게 투여하는 하나의 방법은 AA 표적화제-연결기 컨쥬게이트를 개인에게 투여하고 생체 내에서 적절한 항체의 결합 부위와 공유 화합물을 형성하도록 함을 포함한다. 표적화제-연결기 컨쥬게이트를 투여하기 전, 투여함과 동시에 또는 투여한 후, 생체 내에서 형성되는 AA 표적화 화합물의 항체 부분을 개인에게 투여할 수 있다. 이미 논의된 바와 같이, AA 표적화제가 연결기/반응성 잔기를 포함할 수 있거나, 또는 항체 결합 부위를 표적화제에 공유 결합되도록 적합하게 개질시킬 수 있다. 다르게는, 또는 덧붙여서, 항체는 적절한 면역원으로 면역화시킨 후 개인의 순환계에 존재할 수 있다. 예를 들어, 담체 단백질레 컨쥬게이션된 기질의 반응성 중간체로 면역화시킴으로써 촉매적 항체를 생성시킬 수 있다. 러너(R. A. Lerner) 및 바바스 3세의 문헌[Acta Chem. Scand. 50:672-678 (1996)] 참조. 특히, 워싱 등의 문헌[Science 270:1775-1782 (1995)][와그너(J. Wagner) 등, Science 270:1797-1800 (1995)에 대해 언급함]에 기재되어 있는 바와 같이 다이케톤 잔기에 연결된 열쇠 구멍 삿갓조개 헤모사이아닌과 함께 투여함으로써 알돌라제 촉매적 항체를 생성시킬 수 있다.
본 발명은 또한 조직 및 세포에서 Ang-2 또는 혈관 신생 억제 표적(즉, AA-표적화제 수용체)을 가시화 또는 국부화시키는 방법도 제공한다. 하나의 실시양태에서는, 생검 조직을 AA-표적화제 수용체의 존재에 대해 조사할 수 있다. 또 다른 실시양태에서는, 개체에 검출가능한 라벨을 포함하는 AA 표적화제 또는 표적화 화합물을 투여함으로써 개체에서의 신혈관 생성을 영상화시킬 수 있다. 본원에 사용되는 용어 "검출가능한 라벨"은 생체 내에 투여된 후 검출될 수 있는 임의의 분자를 말한다. 예시적인 검출가능한 라벨은 방사성 라벨 및 형광 분자를 포함한다. 예시적인 방사성 핵종은 인듐-111, 테크네튬-99, 탄소-11 및 탄소-13을 포함한다. 형광 분자는 플루오레세인, 알로피코사이아닌, 피코에리트린, 로다민 및 텍사스 레드를 포함하지만 이들로 한정되지는 않는다.
조합 요법
종양 내에서의 혈관은 일반적으로 활발한 혈관 신생 과정을 거쳐서 새로운 혈관을 지속적으로 형성시킴으로써 종양 성장을 뒷받침한다. 이러한 신생 혈관은 신생 혈관이 ∀v∃3 인테그린[브룩스(Brooks), Cell 79:1157-1164 (1994); WO 95/14714 호, 국제 출원일 1994년 11월 22일] 및 혈관 신생 성장 인자에 대한 수용체[머스토넨(Mustonen) 및 알리탈로(Alitalo), J. Cell Biol. 129:895-898 (1995); 라피(Lappi), Semin. Cancer Biol. 6:279-288 (1995)]를 비롯한 독특한 내피 세포 표면 마커를 발현한다는 점에서 성숙한 혈관과는 구별될 수 있다.
본 발명은 또한 하나 이상의 종양 치료제와 함께 하나 이상의 AA 표적화제를 투여함을 포함하며, 이 때 이들 각각은 치료에 적합한 섭생법에 따라 투여된다. 조합 요법의 성분을 동시에 또는 동시가 아니게 투여할 수 있다. 본원에 사용되는 "동시에 투여되는" 및 "동시 투여"는 하나 이상의 AA 표적화 화합물과 하나의 다른 종양 치료제를 실질적으로 동시에 투여함을 포함한다.
본원에 사용되는 용어 "동시가 아닌 투여"는 하나 이상의 AA 표적화 화합물을 임의의 순서대로 겹치든지 아닌지의 여부에 관계없이 상이한 시간에 투여함을 포함한다. 이는 조합의 성분을 사용한 연속 치료(예컨대, 예비 치료, 추후 치료 또는 겹치는 치료), 및 약물이 교대되거나 또는 하나의 성분은 장기 투여하고 다른 성분(들)은 간헐적으로 투여하는 섭생법을 포함하지만, 이들로 한정되지는 않는다. 성분을 동일한 조성물로 또는 별도의 조성물로, 또한 동일하거나 상이한 투여 경로에 의해 투여할 수 있다.
AA 표적화 화합물과 함께 사용될 수 있는 적합한 종량 치료제 및 조합이 표 4 내지 6에 나열된다.
본 발명의 폭넓은 용도가 하기 실시예에 의해 예시되며, 이들 실시예는 본 발명의 전형적인 실시양태를 예시하지만 어떠한 방식으로도 청구의 범위 또는 상세한 설명을 한정하지는 않는다.
본 발명의 AA 표적화 화합물을 사용하여 암, 관절염, 고혈압, 신장 질환, 건선, 안과 장애를 갖는 눈의 혈관 신생, 감염 또는 외과 수술, 황반 변성, 당뇨병성 망막병증 등의 질병을 치료 또는 진단할 수 있다.
도 1은 화학식 II 또는 화학식 III에 따른 하나의 실시양태를 도시한다.
도 2는 화학식 II 또는 화학식 III에 따른 하나의 실시양태를 도시한다.
도 3은 화학식 II 또는 화학식 III에 따른 하나의 실시양태를 도시한다.
도 4a 및 도 4b는 각각 화학식 II 또는 화학식 III에 따른 하나의 실시양태를 도시한다.
도 5a 및 도 5b는 각각 화학식 II 또는 화학식 III에 따른 하나의 실시양태를 도시한다.
도 6a 및 도 6b는 본 발명의 표적화제-연결기 컨쥬게이트의 고상 합성을 도시한다.
도 7a는 m38c2, h38c2 및 인간 생식계의 가변 도메인의 아미노산 서열 정렬을 도시한다. 구조형성 영역(framework region; FR) 및 상보성 결정 영역(CDR)은 캐뱃(Kabat) 등에 따라 결정된다. 별표는 m38c2와 h38c2, 또는 h38c2와 인간 생식계 사이의 차이를 표시한다.
도 7b는 인간화된 38c2 IgG1의 한 실시양태의 경질 쇄 및 중질 쇄의 아미노산 서열(각각 서열 번호:189 및 190)을 도시한다.
도 8은 연결기 반응성 기로서의 역할을 할 수 있는 다양한 구조를 도시한다. 구조 A 내지 C는 항체의 결합 부위의 표면 접근가능한 반응성 친핵성 기(예컨대, 리신 또는 시스테인 측쇄)와 가역적인 공유 결합을 형성한다. 구조 A 내지 C의 R'1, R'2, R'3 및 R4는 예를 들어 C, H, N, O, P, S, 할로겐(F, Cl, Br, I) 또는 이들의 염을 포함하는 치환기를 나타낸다. X는 N, C 또는 임의의 다른 헤테로원자이다. 이들 치환기는 또한 알킬, 알켄일, 알킨일, 옥소알킬, 옥소알켄일, 옥소알킨일, 아미노알킬, 아미노알켄일, 아미노알킨일, 설포알킬, 설포알켄일 또는 설포알킨일기, 포스포알킬, 포스포알켄일, 포스포알킨일기 같은 기도 포함할 수 있다. R'2 및 R'3은 구조 B 및 C에서 예시되는 바와 같이 환상일 수 있는 한편, X는 헤테로원자일 수 있다. 예를 들어, X가 N인 경우 및 R'1과 R3이 환상 구조의 일부를 형성하는 경우 구조 A는 반응성 친핵체와 비가역적인 공유 결합을 형성할 수 있다. 구조 D 내지 G는 항체의 결합 부위의 반응성 친핵성 기와 비가역적인 공유 결합을 형성할 수 있다. 이들 구조에서, R"1 및 R"2는 C, O, N, 할라이드, 또는 메실 또는 토실 같은 이탈기를 나타낸다.
도 9는 항체의 결합 부위의 반응성 아미노산 측쇄와의 반응성 개질에 적합하고, 따라서 연결기 반응성 기로서의 역할을 할 수 있는 다양한 친핵체를 도시한다. 기호: (A) 아실 베타-락탐; (B) 단순 다이케톤; (C) 석신이미드 활성 에스터; (D) 말레이미드; (E) 연결기를 갖는 할로아세트아마이드; (F) 할로케톤; (G) 사이클로헥실 다이케톤; 및 (H) 알데하이드. 구부러진 선은 연결기 또는 표적화제의 나머지로의 부착 지점을 나타낸다. X는 할로겐을 나타낸다.
도 10은 도 8의 화합물 A 내지 G에 항체 결합 부위의 친핵성("nu") 측쇄를 부가함을 도시한다. 항체-Nu-는 항체 결합 부위의 친핵체를 갖는 아미노산 측쇄로의 공유 결합을 가리킨다.
도 11은 도 9의 화합물 A 내지 H에 결합하는 항체의 친핵성 측쇄의 부가를 도시한다. 항체-Nu-는 항체의 결합 부위의 친핵체를 갖는 아미노산 측쇄로의 공유 결합을 가리킨다.
도 12는 의 합성을 도시한다.
도 13은 의 합성을 도시한다.
도 14는 의 합성을 도시한다.
도 15는 의 합성을 도시한다.
도 16은 의 합성을 도시한다.
도 17은 의 합성을 도시한다.
도 18은 의 합성을 도시한다.
도 19는 의 합성을 도시한다.
도 20은 의 합성을 도시한다.
도 21은 및 의 합성을 도시한다.
도 22는 의 합성을 도시한다.
도 23은 의 합성을 도시한다.
도 24는 의 합성을 도시한다.
도 25는 의 합성을 도시한다.
도 26은 의 합성을 도시한다.
도 27은 의 합성을 도시한다.
도 28은 의 합성을 도시한다.
도 29는 본 발명의 하나의 실시양태를 도시한다.
도 30은 본 발명의 하나의 실시양태를 도시한다.
도 31은 본 발명의 하나의 실시양태를 도시한다.
도 32는 본 발명의 하나의 실시양태를 도시한다.
도 33은 본 발명의 하나의 실시양태를 도시한다.
도 34는 본 발명의 하나의 실시양태를 도시한다.
도 35는 본 발명의 하나의 실시양태를 도시한다.
도 36은 본 발명의 하나의 실시양태를 도시한다.
도 37은 본 발명의 하나의 실시양태를 도시한다.
도 38은 본 발명의 하나의 실시양태를 도시한다.
도 39는 본 발명의 하나의 실시양태를 도시한다.
도 40은 본 발명의 하나의 실시양태를 도시한다.
도 41은 본 발명의 하나의 실시양태를 도시한다.
도 2는 화학식 II 또는 화학식 III에 따른 하나의 실시양태를 도시한다.
도 3은 화학식 II 또는 화학식 III에 따른 하나의 실시양태를 도시한다.
도 4a 및 도 4b는 각각 화학식 II 또는 화학식 III에 따른 하나의 실시양태를 도시한다.
도 5a 및 도 5b는 각각 화학식 II 또는 화학식 III에 따른 하나의 실시양태를 도시한다.
도 6a 및 도 6b는 본 발명의 표적화제-연결기 컨쥬게이트의 고상 합성을 도시한다.
도 7a는 m38c2, h38c2 및 인간 생식계의 가변 도메인의 아미노산 서열 정렬을 도시한다. 구조형성 영역(framework region; FR) 및 상보성 결정 영역(CDR)은 캐뱃(Kabat) 등에 따라 결정된다. 별표는 m38c2와 h38c2, 또는 h38c2와 인간 생식계 사이의 차이를 표시한다.
도 7b는 인간화된 38c2 IgG1의 한 실시양태의 경질 쇄 및 중질 쇄의 아미노산 서열(각각 서열 번호:189 및 190)을 도시한다.
도 8은 연결기 반응성 기로서의 역할을 할 수 있는 다양한 구조를 도시한다. 구조 A 내지 C는 항체의 결합 부위의 표면 접근가능한 반응성 친핵성 기(예컨대, 리신 또는 시스테인 측쇄)와 가역적인 공유 결합을 형성한다. 구조 A 내지 C의 R'1, R'2, R'3 및 R4는 예를 들어 C, H, N, O, P, S, 할로겐(F, Cl, Br, I) 또는 이들의 염을 포함하는 치환기를 나타낸다. X는 N, C 또는 임의의 다른 헤테로원자이다. 이들 치환기는 또한 알킬, 알켄일, 알킨일, 옥소알킬, 옥소알켄일, 옥소알킨일, 아미노알킬, 아미노알켄일, 아미노알킨일, 설포알킬, 설포알켄일 또는 설포알킨일기, 포스포알킬, 포스포알켄일, 포스포알킨일기 같은 기도 포함할 수 있다. R'2 및 R'3은 구조 B 및 C에서 예시되는 바와 같이 환상일 수 있는 한편, X는 헤테로원자일 수 있다. 예를 들어, X가 N인 경우 및 R'1과 R3이 환상 구조의 일부를 형성하는 경우 구조 A는 반응성 친핵체와 비가역적인 공유 결합을 형성할 수 있다. 구조 D 내지 G는 항체의 결합 부위의 반응성 친핵성 기와 비가역적인 공유 결합을 형성할 수 있다. 이들 구조에서, R"1 및 R"2는 C, O, N, 할라이드, 또는 메실 또는 토실 같은 이탈기를 나타낸다.
도 9는 항체의 결합 부위의 반응성 아미노산 측쇄와의 반응성 개질에 적합하고, 따라서 연결기 반응성 기로서의 역할을 할 수 있는 다양한 친핵체를 도시한다. 기호: (A) 아실 베타-락탐; (B) 단순 다이케톤; (C) 석신이미드 활성 에스터; (D) 말레이미드; (E) 연결기를 갖는 할로아세트아마이드; (F) 할로케톤; (G) 사이클로헥실 다이케톤; 및 (H) 알데하이드. 구부러진 선은 연결기 또는 표적화제의 나머지로의 부착 지점을 나타낸다. X는 할로겐을 나타낸다.
도 10은 도 8의 화합물 A 내지 G에 항체 결합 부위의 친핵성("nu") 측쇄를 부가함을 도시한다. 항체-Nu-는 항체 결합 부위의 친핵체를 갖는 아미노산 측쇄로의 공유 결합을 가리킨다.
도 11은 도 9의 화합물 A 내지 H에 결합하는 항체의 친핵성 측쇄의 부가를 도시한다. 항체-Nu-는 항체의 결합 부위의 친핵체를 갖는 아미노산 측쇄로의 공유 결합을 가리킨다.
도 12는 의 합성을 도시한다.
도 13은 의 합성을 도시한다.
도 14는 의 합성을 도시한다.
도 15는 의 합성을 도시한다.
도 16은 의 합성을 도시한다.
도 17은 의 합성을 도시한다.
도 18은 의 합성을 도시한다.
도 19는 의 합성을 도시한다.
도 20은 의 합성을 도시한다.
도 21은 및 의 합성을 도시한다.
도 22는 의 합성을 도시한다.
도 23은 의 합성을 도시한다.
도 24는 의 합성을 도시한다.
도 25는 의 합성을 도시한다.
도 26은 의 합성을 도시한다.
도 27은 의 합성을 도시한다.
도 28은 의 합성을 도시한다.
도 29는 본 발명의 하나의 실시양태를 도시한다.
도 30은 본 발명의 하나의 실시양태를 도시한다.
도 31은 본 발명의 하나의 실시양태를 도시한다.
도 32는 본 발명의 하나의 실시양태를 도시한다.
도 33은 본 발명의 하나의 실시양태를 도시한다.
도 34는 본 발명의 하나의 실시양태를 도시한다.
도 35는 본 발명의 하나의 실시양태를 도시한다.
도 36은 본 발명의 하나의 실시양태를 도시한다.
도 37은 본 발명의 하나의 실시양태를 도시한다.
도 38은 본 발명의 하나의 실시양태를 도시한다.
도 39는 본 발명의 하나의 실시양태를 도시한다.
도 40은 본 발명의 하나의 실시양태를 도시한다.
도 41은 본 발명의 하나의 실시양태를 도시한다.
실시예 1: 예시적인 화합물의 합성:
[반응식 1]
Fmoc 화학을 이용한 펩타이드 쇄의 고상 합성
실시예 2: 실시예 1에서 제조된 펩타이드의 수지로부터의 절단
수지로부터의 펩타이드의 절단
실시예 3: 실시예 2에서 제조된 화합물의 연결기로의 커플링
연결기의 커플링
실시예 4: 하기 화합물의 합성이 도 12에 기재되어 있다:
실시예 5: 하기 화합물의 합성이 도 13에 기재되어 있다:
실시예 6: 하기 화합물의 합성이 도 14에 기재되어 있다:
실시예 7: 하기 화합물의 합성이 도 15에 기재되어 있다:
실시예 8: 하기 화합물의 합성이 도 16에 기재되어 있다:
실시예 9: 하기 화합물의 합성이 도 17에 기재되어 있다:
실시예 10: 하기 화합물의 합성이 도 18에 기재되어 있다:
실시예 11: 하기 화합물의 합성이 도 19에 기재되어 있다:
실시예 12: 하기 화합물의 합성이 도 20에 기재되어 있다:
실시예 13: 하기 화합물의 합성이 도 21에 기재되어 있다:
실시예 14: 하기 화합물의 합성이 도 22에 기재되어 있다:
실시예 15: 하기 화합물의 합성이 도 23에 기재되어 있다:
실시예 16: 하기 화합물의 합성이 도 24에 기재되어 있다:
실시예 17: 하기 화합물의 합성이 도 25에 기재되어 있다:
본 실시예에서는 실시예 12의 화합물을 사용하지만, 실시예 13의 화합물도 충분히 사용할 수 있다. 또한, 본 실시예는 N-말단으로의 연결을 도시하지만, 실시예 12 및 13의 화합물의 좌측의 자유 산은 C, K, S, T 또는 Y 측쇄 같은 펩타이드상의 임의의 친핵성 측쇄에 연결될 수도 있다. 본 실시예에 도시되는 바와 같이, 실시예 12 및 13의 화합물의 우측의 Fmoc 보호된 아미노기를 사용하여 아마이드 결합을 통해 인식 기 Y에 연결한다.
실시예 18: 하기 화합물의 합성이 도 26에 기재되어 있다:
본 실시예에서는 실시예 15의 화합물을 사용하지만, 실시예 14 및 16의 화합물도 충분히 사용할 수 있다. 또한, 본 실시예는 N-말단으로의 연결을 도시하지만, 실시예 14 내지 16의 화합물의 좌측의 자유 산은 C, K, S, T 또는 Y 측쇄 같은 펩타이드상의 임의의 친핵성 측쇄에 연결될 수도 있다. 본 실시예에 도시되는 바와 같이, 실시예 14 내지 16의 화합물의 우측의 자유 산을 사용하여 아마이드 결합을 통해 항체 인식 기 Y에 연결한다.
실시예 19: 3-{2-[2-(2-{2-[2-(2-3급-뷰톡시카본일-에톡시)-에톡시]-에톡시}-에톡시)-에톡시]-에톡시}-프로피온산 3급-뷰틸 에스터의 합성
보고된 방법[세이츠(O. Seitz) 및 쿤즈(H. Kunz), J. Org. Chem. 62:813-826 (1997)]을 이용하여 표제 화합물을 제조하였다. THF(200ml)중 테트라(에틸렌 글라이콜)(47.5g, 244밀리몰)의 용액에 나트륨 금속의 작은 조각을 첨가하고, 나트륨이 완전히 용해될 때까지 교반하였다. 이어, 3급-뷰틸 아크릴레이트(94g, 730밀리몰)를 첨가하고, 실온에서 2일간 계속 교반하였다. 3급-뷰틸 아크릴레이트(94g, 730밀리몰)의 다른 배치(batch)를 첨가하고 다시 2일간 계속 교반하였다. 1N HCl 몇 방울로 반응 혼합물을 중화시키고 감압하에서 농축시켰다. 잔류물을 물에 현탁시키고 에틸 아세테이트(3×150ml)로 추출하였다. 합쳐진 유기 층을 염수로 세척하고 황산나트륨 상에서 건조시켰다. 감압하에 휘발성 성분을 증발시켜 조질 생성물을 무색 액체로서 수득하고, 실리카겔 칼럼을 사용하여 이를 정제시켰다(42g, 51%).
실시예 20: 3-{2-[2-(2-{2-[2-(2-카복시-에톡시)-에톡시]-에톡시}-에톡시)-에톡시]-에톡시}-프로피온산의 합성
아니솔(20ml)중 3-{2-[2-(2-{2-[2-(2-3급-뷰톡시카본일-에톡시)-에톡시]-에톡시}-에톡시)-에톡시]-에톡시}-프로피온산 3급-뷰틸 에스터(6g, 18.6밀리몰)의 용액을 빙욕에서 냉각시키고, 트라이플루오로아세트산(65g)을 첨가하였다. 실온에서 3시간 후, 휘발성 성분을 감압하에 제거하고, 잔류물을 에틸 아세테이트(50ml)와 5% 중탄산나트륨 용액 사이에 분배시켰다. 수성 층을 1N HCl로 산성화시키고, NaCl로 포화시킨 다음, 에틸 아세테이트(3×50ml)로 추출하였다. 합쳐진 유기 층을 염수로 세척하고 황산나트륨 상에서 건조시켰다. 감압하에 휘발성 성분을 제거하여, 생성물을 냉장시 고화되는 무색 액체로서 수득하였다(3.8g, 82%).
실시예 21: 3-(2-{2-[2-(2-{2-[2-(4-{2-[2-(2-메틸-[1,3]다이옥솔란-2-일메틸)-[1,3]다이옥솔란-2-일]-에틸}-페닐카밤오일)-에톡시]-에톡시}-에톡시)-에톡시]-에톡시}-에톡시)-프로피온산의 합성
실시예 20으로부터의 화합물(0.6g, 1.8밀리몰)을 다이클로로메테인(10ml)에 용해시키고, 4-{2-[2-(2-메틸-[1,3]다이옥솔란-2-일메틸)-[1,3]다이옥솔란-2-일]-에틸}-페닐아민(0.3g, 1.4밀리몰), 이어 EDCI(0.28g, 1.8밀리몰)를 실온에서 첨가하였다. 실온에서 1시간 후, RM을 물로 세척하고 황산나트륨 상에서 건조시켰다. 휘발성 성분을 증발시키고 다이클로로메테인중 1 내지 15% 메탄올을 사용하여 실리카겔 칼럼 상에서 정제시킴으로써, 표제 화합물을 검으로서 수득하였다(0.47g, 32%).
실시예 22: 4-{2-[2-(2-메틸-[1,3]다이옥솔란-2-일메틸)-[1,3]다이옥솔란-2-일]-에틸}-페닐아민의 합성
깨끗한 오븐 건조된 플라스크에 6-(4-나이트로-페닐)-헥세인-2,4-다이온(3.7g, 15.72밀리몰)을 채우고, 무수 CH2Cl2(20ml), 이어 비스TMS 에틸렌 글라이콜(38.5ml, 157.3ml)을 플라스크에 첨가한 다음, 생성된 용액을 아르곤하에 교반하면서 -5℃로 냉각시켰다. TMSOTf(300μl)를 반응 혼합물에 첨가하고 -5℃에서 6시간동안 교반하였다. 반응물을 피리딘(10ml)으로 급랭시키고 포화 NaHCO3에 부어넣었다. 혼합물을 EtOAc로 추출하고 유기 층을 물, 염수로 세척한 후, 건조시키고(Na2SO4) 농축시켜 황색 고체를 제공하였다. 이 고체를 헥세인으로 분쇄하여 자유 유동 담황색 고체(3.5g, 72%)를 수득하고, 이를 EtOAc(50ml)에 용해시키고 50psi의 수소압에서 출발하는 파르(Parr) 쉐이커 상에서 수소화시켰다. 2시간 후, 반응물을 셀라이트 패드를 통해 여과하고 셀라이트를 CH2Cl2/Me0H로 완전히 세척하고 합쳐진 유기 층을 농축시켜, 표제 화합물(1.46g, 100%)을 정치시 고화되는 오일로서 수득하였다.
실시예 23: 4-[4-(3,5-다이옥소-헥실)-페닐카밤오일]-뷰티르산 2,5-다이옥소피롤리딘-1-일 에스터(10)의 합성
단계 1: 6-(4-나이트로-페닐)-헥세인-2,4-다이온(11)
반응 용기(가열 및 진공 건조되고, 자기 회전 바가 설치됨)에 테트라하이드로퓨란 및 리튬 다이아이소프로필아마이드(2M 헵테인/에틸벤젠/테트라하이드로퓨란; 69.4mL, 138.9밀리몰)를 첨가하였다. 용액을 -78℃로 냉각시켰다. 펜테인-2,4-다이온(7.13mL, 69.4밀리몰)을 적가하고 용액을 -78℃에서 30분간 교반하였다. 4-나이트로벤질 브로마이드(15.0g, 69.4밀리몰)를 한꺼번에 첨가하였다. 용액을 드라이아이스/아세톤 욕으로부터 제거하고, 실온으로 가온시킨 후 16시간 동안 교반하였다. 용액을 약 0℃로 냉각시키고 반응물을 1M HCl로 급랭시켰다. 테트라하이드로퓨란을 감압하에 제거하였다. 조질 물질을 다이클로로메테인에 넣고 1M HCl 및 염수로 세척하였다. 수성 층을 다이클로로메테인으로 다시 세척하였다. 합쳐진 다이클로로메테인 층을 건조시키고(Na2SO4) 감압하에 제거하였다. 5% 내지 15% 에틸 아세테이트/헥세인을 사용하여 구배 플래시 칼럼 크로마토그래피(FCC)를 수행함으로써, 표제 화합물(8.5g, 52%; 황색 고체)을 수득하였다. 1H NMR (CDCl3): δ 8.14 (d, J = 9.0 Hz, 2 H), δ 7.43 (d, J = 8.4 Hz, 2 H), δ 5.45 (s, 1 H), δ 3.06 (t, J = 7.5 Hz, 2 H), δ 2.64 (t, J = 7.8 Hz, 2 H), δ2.04 (s, 3 H).
단계 2: 4-[4-(3,5-다이옥소-헥실)-페닐카밤오일]-뷰티르산(12)
테트라하이드로퓨란 200mL, 6-(4-나이트로-페닐)-헥세인-2,4-다이온(8.0g, 34.0밀리몰) 및 다이하이드로-피란-2,6-다이온(3.88g, 34.0밀리몰)을 반응 용기에 첨가하였다. 반응 용기를 아르곤으로 3회 퍼지시켰다. 팔라듐 약 200mg(활성탄 상에서 10중량%)을 첨가하였다. 벌룬을 통해 도입된 아르곤과 과량의 수소로 반응 용기를 다시 퍼지시켰다. 용액을 실온에서 16시간동안 교반하였다. 수소를 감압하에 제거하고 셀라이트를 통해 여과함으로써 촉매를 제거하였다. 감압하에서 테트라하이드로퓨란을 제거하여 표제 화합물(10.5g, 97%, 황색 고체)을 제공하였다.
단계 3: 4-[4-(3,5-다이옥소-헥실)-페닐카밤오일]-뷰티르산 2,5-다이옥소 피롤리딘-1-일 에스터(10)
반응 용기(가열 및 진공 건조되고, 자기 회전 바가 설치됨)에 4-[4-(3,5-다이옥소-헥실)-페닐카밤오일]-뷰티르산(10.53g, 33.0밀리몰), N-하이드록시석신이미드(3.8g, 33.0밀리몰) 및 1-[3-(다이메틸아미노)프로필]-3-에틸카보다이이미드 하이드로클로라이드(6.3g, 33.0밀리몰) 및 다이클로로메테인(250ml)을 첨가하였다. 용액을 실온에서 질소하에 16시간동안 교반한 다음, 10% 시트르산, 염수로 세척하고 건조시켰다(Na2SO4). 다이클로로메테인을 감압하에 제거하였다. 70% 에틸 아세테이트/헥세인을 사용하여 FCC 시킴으로써, 표제 화합물(7.4g, 황색 고체, 54%)을 수득하였다. 1H NMR (CDCl3): δ 7.87 (s, 1 H), δ 7.43 (d, J = 8.4 Hz, 2 H), δ 7.12 (d, J = 8.4 Hz, 2 H), δ 5.46 (s, 1 H), δ 2.89 (t (& m), J = 8.1 Hz (t의 경우), 7 H), δ 2.73 (t, J = 6.0 Hz, 2 H), δ 2.56 (t, J = 7.2 Hz, 2 H), δ 2.47 (t, J = 6.9 Hz, 2 H), δ 2.21 (p, J = 6.6 Hz, 2 H), δ 2.04 (s, 3 H).
실시예 24: 3-{2-[2-(2-{4-[4-(3,5-다이옥소-헥실)-페닐카밤오일]-뷰티릴아미노}-에톡시)-에톡시]-에톡시}-프로피온산 2,5-다이옥소-피롤리딘-1-일 에스터(20)의 합성
단계 1: 3-{2-[2-(2-하이드록시-에톡시)-에톡시]-에톡시}-프로피온산 3급-뷰틸 에스터
0℃에서 THF(100mL)중 아크릴산 3급-뷰틸 에스터(6.7mL, 46밀리몰) 및 2-[2-(2-하이드록시-에톡시)-에톡시]-에탄올(20.7g, 138밀리몰)의 교반되는 용액에 Na 금속(촉매량)을 첨가하고, 혼합물을 하룻밤동안 교반하였다. 용매를 제거하고 잔류하는 오일을 EtOAc(100mL)에 용해시켰다. 유기 층을 물(3×50mL)로 세척하고 Na2SO4 상에서 건조시킨 다음, 용매를 진공에서 제거하여, 다음 단계에 그대로 사용되는 표제 화합물에 상응하는 오일을 수득하였다. (M + 1) = 279.
단계 2: 3-{2-[2-(2-토실설폰일옥시-에톡시)-에톡시]-에톡시}-프로피온산 3급-뷰틸 에스터
(240mL)중 3-{2-[2-(2-하이드록시-에톡시)-에톡시]-에톡시}-프로피온산 3급-뷰틸 에스터(16.3g, 58.6밀리몰) 및 피리딘 60mL의 교반되는 용액에 토실 클로라이드(22.3g, 117밀리몰)를 소량씩 첨가하고, 혼합물을 하룻밤동안 교반하였다. 반응물을 물(300mL)로 급랭시키고 유기 층을 분리하였다. 수성 층을 CH2Cl2(2×100mL)로 추출하였다. 합쳐진 유기 층을 HCl(1N, 100mL), 물(100mL)로 세척하고, Na2SO4 상에서 건조시킨 다음, 진공에서 용매를 제거하여, 다음 단계에 그대로 사용되는 표제 화합물에 상응하는 오일을 수득하였다. (M+ 1) = 433.
단계 3: 3-{2-[2-(2-아미노-에톡시)-에톡시]-에톡시}-프로피온산 3급-뷰틸 에스터
DMF(150mL)중 3-{2-[2-(2-토실설폰일옥시-에톡시)-에톡시]-에톡시}-프로피온산 3급-뷰틸 에스터(2Og, 46밀리몰)의 교반되는 용액에 NaN3(35g, 538밀리몰)를 첨가하고, 반응물을 하룻밤동안 교반하였다. 반응물을 물(200mL)로 세척하고 EtOAc(4×100mL)로 추출하였다. 유기 층을 물(100mL) 및 염수(100mL)로 세척하고 Na2SO4 상에서 건조시켰다. 용매를 진공에서 제거하여 오일을 수득하였다. 칼럼 크로마토그래피 EtOAc/Hex(1:4)는 3-{2-[2-(2-아지도-에톡시)-에톡시]-에톡시}-프로피온산 3급-뷰틸 에스터에 상응하는 오일을 제공하였다. (M + 1) = 304. 수소(1기압) 하에 EtOAc 중에서 Pd(탄소상 5%)를 사용하여 3일간에 걸쳐 이 오일을 수소화시켰다. 촉매를 여과에 의해 제거하고 용매를 진공에서 제거하여, 표제 화합물에 상응하는 오일을 수득하였다. (M + 1) = 278.
단계 4: 3-{2-[2-(2-{4-[4-(3,5-다이옥소-헥실)-페닐카밤오일]-뷰티릴아미노}-에톡시)-에톡시]-에톡시}-프로피온산 3급-뷰틸 에스터
CH2Cl2(10mL)중 4-[4-(3,5-다이옥소-헥실)-페닐카밤오일]-뷰티르산 2,5-다이옥소-피롤리딘-1-일 에스터(1.5g, 3.6밀리몰), 3-{2-[2-(2-아미노-에톡시)-에톡시]-에톡시}-프로피온산 3급-뷰틸 에스터(1.0g, 3.6밀리몰) 및 DIEA(1.3μL, 7.2밀리몰)의 용액을 실온에서 하룻밤동안 교반하였다. 용매를 진공에서 제거하고, 칼럼 크로마토그래피 EtOAc/MeOH(95:5)를 이용하여 잔류 오일을 정제함으로써, 표제 화합물을 투명한 오일로서 수득하였다. (M + 1) = 579.
단계 5: 3-{2-[2-(2-{4-[4-(3,5-다이옥소-헥실)-페닐카밤오일]-뷰티릴아미노}-에톡시)-에톡시]-에톡시}-프로피온산 2,5-다이옥소-피롤리딘-1-일 에스터
3-{2-[2-(2-{4-[4-(3,5-다이옥소-헥실)-페닐카밤오일]-뷰티릴아미노}-에톡시)-에톡시]-에톡시}-프로피온산 3급-뷰틸 에스터(400mg, 0.692밀리몰)를 TFA/CH2C12(1:1, 3mL)에 용해시키고, 혼합물을 하룻밤동안 교반하였다. 용매를 제거하여 오일을 산 중간체로서 수득하였다. 이 오일을 DIEA(569μL, 3.09밀리몰), N-하이드록시석신이미드(119mg, 1.03밀리몰) 및 EDC(197mg, 1.0밀리몰)를 함유하는 CH2Cl2(4mL)에 용해시키고, 혼합물을 하룻밤동안 교반하였다. 용매를 제거하고, 칼럼 크로마토그래피 EtOAc/MeOH(95:5)를 이용하여 잔류 오일을 정제함으로써, 오일을 표제 화합물로서 수득하였다. (M + 1) = 620.
실시예 25: AA 표적화 화합물의 합성
하기 절차에 의해 실시예 17 또는 18의 화합물을 항체 38c2에 연결할 수 있다: 포스페이트 완충된 염수(10mg/mL)중 항체 38c2 1mL를 AA 표적화제의 10mg/mL 모용액 12μL에 첨가하고, 생성된 혼합물을 사용하기 전에 실온에서 2시간동안 유지시켰다.
실시예 26: 하기 화합물의 합성이 도 27에 도시된다:
본 실시예에서는 실시예 12의 화합물을 사용하지만, 실시예 13의 화합물도 충분히 사용할 수 있다.
실시예 27:
레이더(C. Rader) 등의 문헌[J. Mol. Biol. 332:889-899 (2003)]에서는 h38c2를 제조하는 한 가지 방법을 상세히 기재한다. 하기 내용은 이 참조문헌의 결과, 물질 및 방법을 상세히 기재한 것이다.
인간화:
카파 경질 쇄 가변 도메인의 인간화를 위한 구조형성 영역으로서 인간 Vκ 유전자 DPK-9 및 인간 Jκ 유전자 JK4를 사용하였고, m38C2의 중질쇄 가면 도메인의 인간화를 위한 구조형성 영역으로서 인간 VH 유전자 DP-47 및 인간 JH 유전자 JH4를 사용하였다. 캐뱃 등에 의해 정의된 모든 상보성 결정 영역(CDR) 잔기뿐만 아니라 경질 쇄 및 중질 쇄 가변 도메인의 한정된 구조형성 잔기를 m38C2로부터 인간 구조형성 영역 상으로 그라프팅하였다. 그라프팅되는 구조형성 잔기의 선택은 마우스 mAb 33F12 Fab (PDB 1AXT)의 결정 구조에 기초할 수 있다. mAb 33F12 Fab는 가변 도메인에서 m38c2와 92%의 서열 상동성을 공유하고 동일한 CDR 길이를 갖는다. 뿐만 아니라, 33F12 및 m38C2는 둘 다 유사한 촉매 활성을 갖는다. 구조형성 잔기는 경질 쇄에 5개의 잔기, 중질 쇄에 7개의 잔기로 이루어졌으며(도 7a), m38C2의 촉매 활성에 직접적으로 또는 간접적으로 참여할 수 있는 잔기를 포함하였다. 이들은 m38C2의 반응성 리신 LysH93을 포함하는데, 이는 중질 쇄의 구조형성 영역 3(FR3)에 위치한다. 마우스 mAbs 33F12와 38C2 사이에서 보존되는 6개의 잔기, 즉 SerH35, VaLH37, TrpH47, TrpH103, 및 PheL98는 LysH93의 아미노기의 5Å 반경 내에 있다. 이들 잔기는 인간화에서도 보존되었다. LysH93은 마우스 mAbs 33F12 및 38C2의 고도로 소수성인 기질 결합 부위의 바닥에 놓인다. CDR 잔기에 덧붙여, 다수의 구조형성 잔기가 이 포켓에 정렬된다. 이들 중에서, LeuL37, GlnL42, SerL43, ValL85, PheL87, ValH5, SerH40, GluH42, GlyH88, I1eH89, 및 ThrH94가 인간 구조형성 영역 상으로 그라프팅되었다.
발현:
인간화된 가변 도메인을 인간 불변 도메인 Cκ 및 Cγ11에 융합시킴으로써, h38C2를 이. 콜라이에서 발현된 Fab로서 최초로 생성시켰다. 이어, 포유동물 세포에서 인간 IgG1 발현을 위해 처리된 PIGG 벡터를 사용하여 h38c2 Fab로부터 h38c2 IgG를 생성시켰다. 일시적으로 형질감염된 인간 293T 세포로부터의 상청액을 재조합 단백질 A 상에서 친화력 크로마토그래피시켜, 약 1mg/L의 h38C2 IgG1을 수득하였다. SDS-PAGE 및 후속 쿠마지 블루 염색에 의해 순도를 확인하였다.
β-다이케톤 화합물:
m38c2와 β-다이케톤의 공유 부가에 의해 형성된 엔아민온은 λmax=318nm에서 특징적인 UV 흡광도를 갖는다. m38C2 IgG와 유사하게, h38C2 IgG는 β-다이케톤과 함께 배양한 후 특징적인 엔아민온 흡광도를 나타내었다. 음성 대조용으로서, h38C2와 동일한 IgG1 아이소형을 갖지만 반응성 리신을 갖지 않는 재조합 인간 항-HIV-1 gp 120 mAb b12는 β-다이케톤(2)과 함께 배양한 후 엔아민온 흡광도를 나타내지 않았다. β-다이케톤의 m38C2 및 h38C2로의 결합을 정량적으로 비교하기 위하여, 본 발명자들은 경쟁 ELISA를 이용하였다. β-다이케톤(2, 3)의 농도를 증가시키면서 항체를 배양하고, 부동화된 BSA-컨쥬게이션된 β-다이케톤(1)에 대하여 검정하였다. 겉보기 평형상태 해리 상수는 β-다이케톤(2)의 경우 38μM(m38C2) 및 7.6μM(h38C2)이었고, β-다이케톤(3)의 경우 0.43μM(m38C2) 및 1.0μM(h38C2)이어서, 마우스 및 인간화된 항체의 유사한 β-다이케톤 결합 특성을 나타내었다(도 6).
분자 모델링 - 관련 알돌라제 항체, 즉 마우스 33F12 Fab(단백질 데이터 뱅크 ID:1AXT)를 주형으로서 사용하여 상동성 모델링에 의해 h38C2 Fab의 분자 모델을 구축하였다. 마우스 33F12 Fab의 결정 구조는 2.15Å의 해상도에서 이미 결정되었다. 인사이트(INSIGHT) II 소프트웨어[액설리스(Accelrys)] 내에서 호몰로지 모듈을 사용하여 마우스 33F12 및 38C2 아미노산 서열을 정렬시킨 결과, 두 서열이 고도로 상동성임이 확인되었다. 이들은 두 가변 도메인의 아미노산 226개중 19개만이 서로 상이하고, 이들의 CDR은 동일한 길이를 공유한다. 높은 서열 상동성에 덧붙여, 두 구조는 38C2의 저해상도 결정 구조에 의해 관찰되는 바와 같이 상당한 구조적 유사성을 나타낸다. 모델의 잔기를 돌연변이시켜 h38C2 아미노산 서열과 같게 만들었고, 표준 로타머에 기초하여 측쇄를 위치시켰다. 이어, 각각 가장 가파른 내리막 최소화 후 컨쥬게이트 구배 최소화의 100단계를 이용하여 인사이트 II 내의 디스커버(DISCOVER) 모듈로 이 모델을 최소화시켰다.
h38C2 Fab 의 구축 - m38C2의 가변 경질 쇄 및 중질 쇄 도메인의 서열(각각 서열 번호:15 및 16)뿐만 아니라 인간 생식계 서열 DPK-9의 서열(서열 번호:17), JK4의 서열(서열 번호:18), DP-47의 서열(서열 번호:19) 및 JH4의 서열(서열 번호:20, 187 및 188)(V BASE; http://vbase.mrc-cpe.cam.ac.uk/)을 사용하여 각각 인간화된 Vκ 및 VH의 합성 조립을 위한 중첩되는 올리고뉴클레오타이드를 디자인하였다. 서열 NXS/T를 갖는 N-글라이코실화 부위뿐만 아니라 내부 제한 부위 HindIII, Xbal , SacI , ApaI 및 SfiI를 피하였다. 익스팬드 하이 피델리티 PCR 시스템(Expand High Fidelity PCR System)[로슈 몰레큘라 시스템즈(Roche Molecular Systems)]을 이용함으로써 PCR을 수행하였다. 인간화된 Vκ 올리고뉴클레오타이드는 다음과 같았다: L 플랭크 센스[레이더, 리터(Ritter, G.), 네이던(Nathan, S.), 엘리아(Elia, M.), 고트(Gout, I.), 준블루쓰(Junbluth, A.A.), J. Biol. Chem. 275:13668-13676 (2000)](센스 5'-GAGGAGGAGGAGGAGGGCCCAGGCGGCCGAGCTCCAGATGACCCAGTCTCTCCA-3' 서열 번호:179); h38C2L1 (센스; 5'-GAGCTCCAGATGACCCAGTCTCCATCCTCCCTGTCTGCATCTGTAGGTGACCGCGTCACCATCACTTG-3') (서열 번호:1); h38C2L2 (안티센스; 5'-ATTCAGATATGGGCTGCCATAAGTGTGCAGGAGGCTCTGACTGGAGCGGCAAGTGATGGTGACGCGGTC-3') (서열 번호:2); h38C2L3 (센스; 5'-TATGGCAGCCCATATCTGAATTGGTATCTCCAGAAACCAGGCCAGTCTCCTAAGCTCCTGATCTAT-3') (서열 번호:3); h38C2L4 (안티센스; 5'-CTGAAACGTGATGGGACACCACTGAAACGATTGGACACTTTATAGATCAGGAGCTTAGGAGACTG-3') (서열 번호:4); h38C2L5 (센스; 5'-AGTGGTGTCCCATCACGTTTCAGTGGCAGTGGTTCTGGCACAGATTTCACTCTCACCATCAGCAGTCTGCAACCTGAAGATTTTGCAGTG-3') (서열 번호:5); h38C2L6 (안티센스; 5'-GATCTCCACCTTGGTCCCTCCGCCGAAAGTATAAGGGAGGTGGGTGCCCTGACTACAGAAGTACACTGCAAAATCTTCAGGTTGCAG-3') (서열 번호:6); L 안티센스 플랭크[레이더 등, J. Biol. Chem. 275:13668-13676 (2000)] (안티센스 5'-GACAGATGGTGCAGCCACAGTTCGTTTGATCTCCACCTTGGTCCCTCC-3' 서열 번호:180). 인간화된 VH 올리고뉴클레오타이드는 다음과 같았다: H 플랭크 센스[레이더 등, J. Biol. Chem. 275:13668-13676 (2000)](센스 5'- GCTGCCCAACCAGCCATGGCCGAGGTGCAGCTGGTGGAGTCTGGGGGA-3' 서열 번호:181); h38C2H1 (센스; 5'-GAGGTGCAGCTGGTGGAGTCTGGCGGTGGCTTGGTACAGCCTGGCGGTTCCCTGCGCCTCTCCTGTGCAGCCTCTGGCT-3') (서열 번호:7); h38C2H2 (안티센스; 5'-CTCCAGGCCCTTCTCTGGAGACTGGCGGACCCAGCTCATCCAATAGTTGCTAAAGGTGAAGCCAGAGGCTGCACAGGAGAG-3') (서열 번호:8); h38C2H3 (센스; 5'- TCTCCAGAGAAGGGCCTGGAGTGGGTCTCAGAGATTCGTCTGCGCAGTGACAACTACGCCACGCACTATGCAGAGTCTGTC-3') (서열 번호:9); h38C2H4 (안티센스; 5'-CAGATACAGCGTGTTCTTGGAATTGTCACGGGAGATGGTGAAGCGGCCCTTGACAGACTCTGCATAGTGCGTG-3') (서열 번호:10); h38C2H5 (센스; 5'-CAATTCCAAGAACACGCTGTATCTGCAAATGAACAGCCTGCGCGCCGAGGACACGGGCATTTATTACTGTAAAACG-3') (서열 번호:11); h38C2H6 (안티센스; 5'-TGAGGAGACGGTGACCAGGGTGCCCTGGCCCCAGTAGCTGAAACTGTAGAAGTACGTTTTACAGTAATAAATGCCCGTG-3') (서열 번호:12); H 플랭크 안티센스[레이더 등, J. Biol. Chem. 275:13668-13676 (2000)](안티센스 5'-GACCGATGGGCCCTTGGTGGAGGCTGAGGAGACGGTGACCAGGGTGCC-3' 서열 번호:182). 조립 후, 인간화된 Vκ 및 VH를 각각 인간 Cκ 및 Cγ11에 융합시키고, 생성된 경질 쇄 및 중질 쇄 단편을 융합한 다음, 기재된 바와 같이 파지미드 벡터 pComb3X 내로 SfiI-클로닝시켰다[레이더 등, J. Biol. Chem. 275:13668-13676 (2000); 바바스 3세 등, Phage Display : A laboratory manual, Cold Spring Harbor Laboratory, 뉴욕주 콜드 스프링 하버 (2001)]. 올바른 h38C2 서열로 클론을 풍부하게 하기 위하여, Fab를 파지상에 표시하고, BSA에 컨쥬게이션된 부동화된 β-다이케톤(1)(JW)에 대하여 1회 패닝함으로써 선택하였다. 단일 클론으로부터 가용성 Fab를 생성시키고, 2차 항체로서 고추냉이 퍼옥시다제[잭슨 이뮤노리써치 래보러토리즈(Jackson ImmunoResearch Laboratories)]에 컨쥬게이션된 당나귀 항-인간 F(ab')2 다클론 항체를 사용하여 ELISA에 의해 부동화된 JW-BSA로의 결합에 대해 시험하였다. 각각 프라이머 OMPSEQ (5'-AAGACAGCTATCGCGATTGCAG-3' 서열 번호:183) 및 PELSEQ (5'-CTATTGCCTACGGCAGCCGCTG-3' 서열 번호:184)[바바스 3세 등, Phage Display: A laboratory manual, Cold Spring Harbor Laboratory, 뉴욕주 콜드 스프링 하버 (2001)]를 사용하는 DNA의 서열 결정에 의해 양성 클론의 경질 쇄 및 중질 쇄 코딩 서열을 분석함으로써, h38C2의 조립된 Vκ 및 VH 서열을 확인하였다.
h38C2 IgG1 의 구축, 생성 및 정제 - h38C2 IgG1의 포유동물 발현을 위하여 최근에 기재된 벡터 PIGG[레이더 등, FASEB J., 16:2000-2002 (2002)]를 사용하였다. 포유동물 발현 벡터 PIGG-h38c2는 도 23에 도시되어 있다. 9kb 벡터는 양방향성 CM 프로모터 구조물에 의해 구동되는 중질 쇄 γ1 및 경질 쇄 κ 발현 카세트를 포함한다. 프라이머 PIGG-h38C2H(센스; 5'-GAGGAGGAGGAGGAGGAGCTCACTCCGAGGTGCAGCTGGTGGAGTCTG-3')(서열 번호:13) 및 GBACK (5'-GCCCCCTTATTAGCGTTTGCCATC-3' 서열 번호:185)[바바스 3세 등, Phage Display : A laboratory manual, Cold Spring Harbor Laboratory, 뉴욕주 콜드 스프링 하버 (2001)]를 사용하여, 파지미드 벡터 pComb3X의 h38C2 Fab로부터의 VH 코딩 서열을 증폭시키고, SacI 및 ApaI로 소화시킨 다음, 적절하게 소화된 벡터 PIGG 내로 클로닝하였다. 프라이머 PIGG-h38C2L(센스: 5'-GAGGAGGAGGAGGAGAAGCTTGTTGCTCTGGATCTCTGGTGCCTACGGGGAGCTCCAGATGACCCAGTCTCC-3')(서열 번호:14) 및 LEADB(5'-GCCATGGCTGGTTGGGCAGC-3' 서열 번호:186)[바바스 3세 등, Phage Display : A laboratory manual, Cold Spring Harbor Laboratory, 뉴욕주 콜드 스프링 하버 (2001)]를 사용하여, 파지미드 벡터 pComb3X의 h38C2 Fab로부터의 경질 쇄 코딩 서열을 증폭시키고, HindIII 및 XbaI로 소화시킨 다음, 이미 h38C2 중질 쇄를 함유하는 적절하게 소화된 벡터 PIGG 내로 클로닝하였다. 중간 및 최종 PIGG 벡터 구조물을 이. 콜라이 균주 SURE[스트라타진(Stratagene)]에서 증폭시키고, 퀴아젠 플라스미드 맥시 키트(QIAGEN Plasmid Maxi Kit)로 제조하였다. 리포펙타민 2000[인비트로젠(Invitrogen)]을 사용하여 인간 293T 세포를 일시적으로 형질감염시킴으로써 제조된 최종 PIGG 벡터 구조물로부터 h38C2 IgG1을 생성시켰다. 형질감염된 세포를 RPMI 1640[하이클론(Hyclone)]중 깁코(GIBCO) 10% 초저 IgG(<0.1%) FCS(인비트로젠)에서 2주일간 유지시켰다. 이 시간동안, 배지를 수거하고 3회 교체하였다. 수거된 배지를 재조합 단백질 A 하이트랩(HiTrap) 칼럼[애머샴 바이오사이언시즈(Amersham Biosciences)] 상에서 친화력 크로마토그래피시켰다. 이 정제 단계에 의해, 에펜도르프 바이오포토미터(Eppendorf BioPhotometer)를 이용하여 280nm에서의 광학 밀도를 측정함으로써 결정할 때 수거된 배지 2,000mL로부터 h38C2 IgG1 2.45mg을 수득하였다. 슬라이드-A-라이저(Slide-A-Lyzer) 10K 투석 카셋트[피어스(Pierce)]에서 PBS에 대해 투석하고, 울트라프리-15(Ultrafree-15) 원심분리 여과 장치[UFV2BTK40; 밀리포어(Millipore)]를 이용하여 항체를 760㎍/mL로 농축시키고, 0.2-μm 아크로디스크(Acrodisc) 13MM S-200 주사기 필터[펄(Pall)]를 통해 멸균 여과하였다. 최종 수율은 2.13mg(87%)이었다. 비환원 SDS-PAGE 후 쿠마지 블루 염색에 의해 정제된 h38C2 IgG1을 확인하였다.
엔아민온 형성 - 항체(h38C2 IgG1 또는 b12 IgG1)를 β-다이케톤(2)에 항체 결합 부위 25μM 및 β-다이케톤 125μM의 최종 농도까지 첨가하였다. 이 혼합물을 실온에서 10분간 배양한 다음, 소프트맥스 프로(SOFTmax Pro) 소프트웨어(버전 3.1.2)를 사용하여 스펙트라맥스 플러스(SpectraMax Plus) 384 UV 플레이트 판독기[몰레큘라 디바이시즈(Molecular Devices)] 상에서 UV 스펙트럼을 수득하였다.
결합 검정법 - 달리 표시되지 않는 한 모든 용액은 포스페이트 완충된 염수(pH 7.4)였다. β-다이케톤(2 또는 3)의 2× 용액(50μL)을 항체(h38C2 또는 m38C2) 50μL에 첨가한 다음, 37℃에서 1시간동안 배양하였다. 피펫팅하여 용액을 혼합하였다. 항체의 최종 농도는 항체 결합 부위 0.4 내지 8nM이었으며, β-다이케톤(2 및 3)의 최종 농도는 각각 10-9 내지 10-2M 및 10-10 내지 10-4M이었다. 코스타(Costar) 3690 96개-웰 플레이트[코닝(Corning)]의 각 웰을 TBS중 β-다이케톤( 1)의 BSA 컨쥬게이트 100ng으로 코팅하였다. 이어, 웰을 TBS중 3%(w/v) BSA로 차단하였다. 이어, 항체/β-다이케톤 혼합물 50μL, 이어 고추냉이 퍼옥시다제에 컨쥬게이션된 염소 항-인간 Fc IgG 다클론 항체(피어스) 또는 토끼 항-마우스 Fc IgG 다클론 항체(잭슨 이뮤노리써치 래보러토리즈)의 1:1,000 희석액 50μL를 첨가하였다. 그 후 ABTS 기질 용액 50μL를 첨가하였다. 각각의 첨가 사이에 플레이트를 덮고 37℃에서 1시간동안 배양한 다음, 탈이온화된 H2O로 5회 세척하였다. β-다이케톤을 사용하지 않은 반응이 적절한 값(0.5<A405<1.0)에 도달할 때까지 405nm에서의 흡광도를 상기 기재된 바와 같이 모니터링하였다. 각 웰에 대하여, 하기 수학식 i를 이용하여 ELISA 신호의 분별 억제(vi)를 계산하였다:
[수학식 i]
vi=(A 0 - A i )/(A 0 )
상기 식에서,
A 0 은 β-다이케톤의 부재하에 수득된 ELISA 흡광도이고,
A i 는 β-다이케톤의 존재하에 수득된 흡광도이다.
1가 결합 단백질의 경우, 가용성 β-다이케톤(f)에 결합된 항체의 분율이 vi와 동일하다. 그러나, IgG 항체는 2가이고, ELISA 신호는 1가 결합에 의해서가 아니라 이중 리간드 항체의 존재에 의해서만 억제된다. 따라서, 2가 항체에 대한 스티븐스(Stevens) 보정을 이용하였다:
[수학식 ii]
f i=(vi)½
하기 관계를 이용하여 겉보기 평형상태 해리 상수([ref.37]로부터 변형됨)를 결정하였다:
[수학식 iii]
f i=f min +(f max -f min )(1+K D /a 0 )-1
상기 식에서,
a 0 은 총 β-다이케톤 농도에 상응하고,
K D 는 평형상태 해리 상수이며,
f min 및 f max 는 각각 항체 결합 부위가 점유되지 않거나 포화될 때 실험적으로 결정된 값을 나타낸다.
이 수학식은 K D 값이 항체 농도보다 10배 이상 더 높을 때에만 유효하기 때문에, 수학식 iii으로부터 결정된 K D 값이 이 기준을 충족시킴을 검증하였다. 조정가능한 매개변수로서 K D , f max 및 f min 을 갖는 칼레이다그래프(KaleidaGraph)(버전 3.0.5, 아벨벡 소프트웨어)의 비선형 최소제곱 핏팅 절차를 이용하여 데이터를 핏팅시키고, 하기 수학식 iv를 이용하여 정규화시켰다:
[수학식 iv]
fnorm=(fi-fmin)/(fmax-fmin)
실시예 28:
Tie-2와의 경쟁에 의해 Ang-2와 상호작용하는 Ang-2 결합 단백질의 능력을 측정하였다.
경쟁 ELISA를 위해, 인간 안지오포이에틴-2 단백질 및 Tie-2-Fc[알앤드디 시스템즈(R&D Systems)]를 담체 단백질 없이 재구성하였다. 마우스 항-인간 Tie-2[파민겐(Pharmingen)]를 1차 항체로서 사용하였고, 염소 항-마우스-IgG1-HRP(피어스)를 2차 항체로서 사용하였다. 피어스로부터의 TMB 기질을 사용하였다.
고-결합 하프-웰(half-well) 플레이트를 PBS 50μl중 Ang-2(100ng/웰)로 코팅하고 4℃에서 하룻밤동안 배양하였다. 세척 완충액(0.1% 트윈 20, PBS, pH 7.4)으로 플레이트를 3회 세척하고, 실온("RT")에서 1시간동안 슈퍼블록[사이텍(Scytek)] 100μl/웰로 차단하였다. 차단 용액을 제거한 후, 희석제로서 슈퍼블록을 사용하여 0.25nM hTie-2-Fc의 존재하에서 Ang-2 결합 펩타이드 화합물(1uM 및 5× 연속 희석) 50μl를 첨가하고 실온에서 2시간동안 배양하였다. 플레이트를 세척 완충액으로 3회 세척하였다. 이어, 슈퍼블록중에 희석된 0.1ug/ml 마우스 항-인간 Tie-2 50ul를 첨가하고 실온에서 1시간동안 배양하였다. 배양 후, 슈퍼블록중 염소 항-마우스 IgG-HRP의 1:5,000 희석액 50ul를 첨가하고, 실온에서 1시간동안 배양하였다. 3회 세척한 다음, 50μl(25μl TMB + 25μl H2O2)를 첨가하고 3 내지 5분간 배양하였다. 발색을 모니터링하고, 2M H2SO4 25μl로 중지시켰다. 540nm의 보정 파장으로 OC450nm를 측정하였다. 프리즘 4 소프트웨어[그래프패드(GraphPad)]의 비-선형 S형 투여량-반응 곡선 핏팅 기능을 이용하여 IC50 값(Ang-2-Tie-2 결합의 50% 억제)을 계산하였다.
역형성 경쟁 ELISA를 위하여, 인간 Tie-2-Fc, 안지오포이에틴-2 단백질, 바이오틴일화된 항-인간 Ang-2 항체 및 스트렙트아비딘 HRP(알앤드디 시스템즈) 및 피어스로부터의 TMB 기질을 사용하였다.
고-결합 하프-웰 플레이트를 PBS 50μl중 Tie-2-Fc(50ng/웰)로 코팅하고 4℃에서 하룻밤동안 배양하였다. 세척 완충액(0.1% 트윈 20, PBS, pH 7.4)으로 플레이트를 3회 세척하고, 실온에서 1시간동안 슈퍼블록 150μl/웰로 차단하였다. 플레이트를 3회 세척하였다. 세척 후, 슈퍼블록중 50ng/ml(0.83nM) Ang-2의 존재하에 Ang-2 결합 펩타이드 화합물(50nM, 5× 연속 희석액) 50μl를 첨가하고 실온에서 1시간동안 배양하였다. 플레이트를 3회 세척하고, 슈퍼블록중 1㎍/ml 바이오틴일화된 항-Ang-2 검출 항체 50μl를 첨가하고 실온에서 2시간동안 배양하였다. 플레이트를 3회 세척하고, 스트렙트아비딘 HRP(슈퍼블록중 1:200 희석액) 50μl를 첨가하고 20분간 배양하였다. 플레이트를 3회 세척하고, 기질 용액 50μl(25μl TMB + 25μl H2O2)를 첨가하고, 20 내지 30분간 배양하였다. 발색을 2M H2SO4 25μl로 중지시켰다. 540nm의 보정 파장으로 OD450nm를 측정하였다. 프리즘 4 소프트웨어의 비-선형 S형 투여량-반응 곡선 핏팅 기능을 이용하여 IC50 값(Ang-2-Tie-2 결합의 50% 억제)을 계산하였다.
경쟁 ELISA에 의해 결정된 예시적인 Ang-2 결합 펩타이드 화합물의 IC50 값이 표 7에 제공된다. IC50 값은 달리 명시되지 않는 한 표적화 펩타이드+연결기(도 3, 또는 화합물 24 및 25의 경우 도 2에 도시된 바와 같음)(T) 및 도 3의 연결기를 통해 항체(P)에 연결된 표적화 펩타이드에 대해 제공된다. 표 7에서, 서열 번호:21 내지 23의 화합물은 연결기 또는 연결기-항체에 컨쥬게이션되지 않고 단독으로 Ang-2 결합 펩타이드이고; 서열 번호:65 및 66의 화합물은 연결기-항체에 컨쥬게이션된 Ang-2 결합 펩타이드이며, 이 때 연결기는 4P("4" PEG)이고 도 2에 도시된 연결기의 구조를 갖고; 화합물 26 내지 63은 연결기-항체에 컨쥬게이션된 Ang-2 결합 펩타이드이고, 이 때 연결기는 OP("O" PEG)이고 도 3에 도시된 연결기의 구조를 갖는다. 달리 표시되는 경우를 제외하고는 아래 기재되는 데이터를 수득할 때 화합물 24 내지 63을 인간화된 알돌라제 항체 h38c2 및 도 2(4P) 및 도 3(OP)에 도시된 연결기 구조에 컨쥬게이션시켰다. 표에 도시된 본 발명의 화합물은 달리 표시된 경우(예를 들어, 화합물 26, 49, 50, 51 및 52)를 제외하고는 모두 N-말단에서 아실기로, 또한 C-말단에서 아미노기로 캡핑되었다.
표 7에서, 연결기 OP 또는 4P의 위치를 연결기가 부착되는 내부 아미노산 잔기 다음에 괄호로 표시하면서 펩타이드 화합물의 아미노산 서열을 도시한다. 서열 번호:67의 화합물의 경우, N-말단 "OP" 연결기는 펩타이드 서열이 시작되는 부분에 표시되어 있다.
예를 들어, 표 7의 화합물 24는 하기 서열을 갖는다: QAcKY QPL DEL DK(4P)T LYD QFM LQQ G (서열 번호:65). 이 실시예에서, 두번째 아미노산 잔기는 엡실론 아실 리신이고 그 다음은 티로신이며, 연결 위치(이 경우 4P 연결기)는 리신 잔기 11이고 그 다음이 트레오닌이다. 또한, 화합물 52는 하기 서열을 갖는다: (아미도 2-PEG)QAcKY QPL DEL DK(OP)T LYD QFMLQQ G (서열 번호:93). 이 경우에는, N-말단 글루타민 잔기는 아미도-2-PEG 기로 캡핑되고, 두번째 아미노산 잔기는 엡실론 아실 리신이며, OP 연결기는 리신 잔기 11에 부착된다.
표 7 및 8은 또한 반감기(T½) 및 "선별" 반감기(괄호 안의 결과)도 표시하는데; 이는 본질적으로 보다 짧은 시험 기간에 기초하여 T½을 결정하는 다른 방법이다. "선별" T½의 경우에는, 시험 화합물을 수컷 스위스 웹스터(Swiss Webster) 마우스에 정맥내 투여하였다. 0.08시간, 5시간 및 32시간째에 안와후동 채혈을 통해 각 시점당 마우스 4마리로부터 혈액 샘플을 채취하였다. ELISA에 의해 시험 화합물의 혈중 수준을 결정하였다. 32시간 대 5분에서 시험 화합물의 백분율로서 데이터를 보고하였다. 윈넌린(WinNonlin) 버전 4.1[파사이트 코포레이션(Pharsight Corporation)]을 사용하여 추가적으로 데이터를 분석한 후 유사한 방식으로 정상적인 T½을 계산하였다. 곡선의 형상에 기초하여 데이터를 모델에 핏팅시켰다(즉, 이중-지수함수적 내리막이 2개 구획 모델 등에 핏팅된다). 최적 핏팅(즉, 최저 %CV)의 기준은 반복적인 재가중 최소 제곱에 기초하였다.
역형성 경쟁 ELISA에 의해 결정된 예시적인 Ang-2 결합 펩타이드 화합물의 IC50 값이 표 8에 제공된다. 달리 명시되지 않는 한, 표적화 펩타이드와 연결기(도 3에 도시되는 바와 같음), 및 도 3의 연결기를 통해 항체(P)에 연결된 표적화 펩타이드에 대하여 IC50 값이 제공된다. 표 8에서, 화합물은 도 3에 도시된 인간화된 알돌라제 항체 h38c2 및 연결기 구조에 컨쥬게이션된다.
절단(TRUNCATION) 연구
재조합 인간 Ang-2를 2 내지 8℃에서 하룻밤동안 100μL중 0.5㎍/mL로 미소적정 플레이트 상에 코팅하였다. 모든 단계 사이에서 플레이트를 세척하고, 모든 후속 배양은 실온에서 수행하였다. 슈퍼블록 250μL/웰로 1 내지 3시간동안 플레이트를 차단시켰다. 시험 화합물을 연결기(도 3에 도시된 바와 같음) 및 h38c2에 연결된 화합물 43과 10ng/mL로 미리 혼합하였다. 이어, 100μL중 펩타이드 혼합물을 나열된 최종 농도로 첨가하고, 플레이트를 밀봉한 다음 1 내지 2시간동안 배양하였다. HRP-라벨링된 항-인간 IgG 시약 1:20,000배 희석액 100μL로 1 내지 2시간동안 결합된 화합물 43을 검출하였다. 마지막으로, TMB 기질 100μL를 10분간 첨가하고, 2NH2SO4 중지 용액 100μL로 반응을 중단시켰다. 이어, 플레이트를 650nm에서 보정하면서 450nm에서 판독하였다(IC50 값은 표 9에 도시됨).
이종 이식 연구
10% FBS RPMI 배지를 사용하여 Colo205 세포를 배양하고, 0.1ml 행크스 평형된 염 용액(HBSS) 0.1ml중 3×106개 세포를 털이 없는 마우스의 상부 우측 옆구리 내로 피하 주사하였다. 7 내지 9일 후, 동물을 200 내지 300mm3의 평균 종양 크기를 갖는 적절한 수의 군으로 무작위적으로 나누었다. 이어, 마우스를 요구량의 본 발명의 화합물로 치료하고, 매주 2회씩 종양 부피를 측정하였다. 평균 종양 부피가 2000mm3에 도달하면 동물을 한꺼번에 죽였다. 죽인 후, 종양의 무게를 재고 추가의 조직학적 연구를 위해 보관하였다. 치료군 대 대조군의 종양 부피 차이를 측정함으로써 치료 효능을 평가하였다. 결과는 % T/C로 보고되는데, % T/C는 하기 수학식에서와 같이 계산하였다:
% T/C = (Vt-V0)/(Ct-C0) × 100
상기 식에서,
V0 및 Vt는 군의 개시 및 종결시 치료군의 평균 종양 부피이고,
C0 및 Ct는 군의 개시 및 종결시 대조군의 평균 종양 부피이다(표 10).
실시예 29: 하기 화합물의 합성이 도 28에 도시된다:
그러므로, 본 발명을 광범위하게 개시하였으며, 상기 기재된 대표적인 실시양태를 참조하여 예시하였다. 당해 분야의 숙련자는 본 발명의 원리 및 영역에서 벗어나지 않으면서 본 발명을 다양하게 변화시킬 수 있음을 알게 될 것이다. 각각의 개별적인 간행물, 특허원 또는 허여된 특허가 구체적이고도 개별적으로 참고로 인용되는 것과 같은 한도로 모든 간행물, 특허원 및 허여된 특허가 본원에 참고로 인용된다. 참고로 인용된 문헌 내용에 포함된 정의는 본 개시내용에서의 정의를 반박하는 한도까지는 고려되지 않는다.
명백하게 하기 위하여 별도의 실시양태와 관련하여 기재된 본 발명의 특정 특징은 또한 단일 실시양태에서 조합되어 제공될 수도 있는 것으로 생각된다. 반대로, 간결하게 하기 위하여 단일 실시양태와 관련하여 기재된 본 발명의 다양한 특징은 또한 별도로 또는 임의의 적합한 작은 범위의 조합으로 제공될 수 있다.
본 발명의 한 실시양태와 관련하여 논의된 임의의 제한점이 본 발명의 임의의 다른 실시양태에 적용될 수 있는 것으로 구체적으로 고려된다. 뿐만 아니라, 본 발명의 임의의 조성물을 본 발명의 임의의 방법에 사용할 수 있으며, 본 발명의 임의의 방법을 이용하여 본 발명의 임의의 조성물을 생성시키거나 사용할 수 있다. 특히, 단독으로 또는 하나 이상의 추가적인 청구항 및/또는 상세한 설명의 양태와 함께 청구의 범위에 기재된 본 발명의 임의의 양태는 청구의 범위 및/또는 상세한 설명의 다른 부분에 기재된 본 발명의 다른 양태와 조합될 수 있는 것으로 이해되어야 한다.
개시내용은 어느 한쪽만을 의미하는 정의 및 "및/또는"을 뒷받침하고 있으나, 청구의 범위에서 용어 "또는"을 사용하는 경우에는 어느 한쪽만을 일컫거나 양쪽이 서로 배타적임을 명시적으로 나타내지 않는 한 "및/또는"을 의미한다.
본원의 상세한 설명에 사용되는 단수형은 달리 명확하게 표시되지 않는 한 하나 이상을 의미할 수 있다. 본원의 청구항(들)에 사용되는 단수형 용어는 "포함하는"이라는 용어와 함께 사용될 때 하나 또는 하나보다 많음을 의미할 수 있다. 본원에 사용되는 "다른"은 적어도 두번째 이상을 의미할 수 있다.
용어 "포함한다/포함하는" 및 용어 "갖는/포괄하는"은 본 발명과 관련하여 본원에 사용될 때 언급된 특징, 정수, 단계 또는 구성요소의 존재를 명시하기 위해 사용되지만 하나 이상의 다른 특징, 정수, 단계, 구성요소 또는 이들의 군의 존재 또는 부가를 배제하지는 않는다.
SEQUENCE LISTING
<110> Bradshaw, Curt
Bhat, Abhijit
Lai, Jing Yu
Doppalapudi, Venkata
LIU, Dingguo
<120> Anti-Angiogenic Compounds
<130> 7660-102
<14O> PCT/IE2007/000110
<141> 2007-11-12
<150> US 60/865,360
<151> 2006-11-10
<150> US 60/939,830
<151> 2007-05-23
<150> US 60/945,329
<151> 2007-06-20
<160> 192
<170> PatentIn version 3.3
<210> 1
<211> 68
<212> DNA
<213> Artificial
<220>
<223> Primer for generating humanized Vk
<400> 1
gagctccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggtga ccgcgtcacc 60
atcacttg 68
<210> 2
<211> 69
<212> DNA
<213> Artificial
<220>
<223> Primer for generating humanized Vk
<400> 2
attcagatat gggctgccat aagtgtgcag gaggctctga ctggagcggc aagtgatggt 60
gacgcggtc 69
<210> 3
<211> 66
<212> DNA
<213> Artificial
<220>
<223> Primer for generating humanized Vk
<400> 3
tatggcagcc catatctgaa ttggtatctc cagaaaccag gccagtctcc taagctcctg 60
atctat 66
<210> 4
<211> 65
<212> DNA
<213> Artificial
<220>
<223> Primer for generating humanized Vk
<400> 4
ctgaaacgtg atgggacacc actgaaacga ttggacactt tatagatcag gagcttagga 60
gactg 65
<210> 5
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Primer for generating humanized Vk
<400> 5
agtggtgtcc catcacgttt cagtggcagt ggttctggca cagatttcac tctcaccatc 60
agcagtctgc aacctgaaga ttttgcagtg 90
<210> 6
<211> 87
<212> DNA
<213> Artificial
<220>
<223> Primer for generating humanized Vk
<400> 6
gatctccacc ttggtccctc cgccgaaagt ataagggagg tgggtgccct gactacagaa 60
gtacactgca aaatcttcag gttgcag 87
<210> 7
<211> 79
<212> DNA
<213> Artificial
<220>
<223> Primer for generating humanized VH
<400> 7
gaggtgcagc tggtggagtc tggcggtggc ttggtacagc ctggcggttc cctgcgcctc 60
tcctgtgcag cctctggct 79
<210> 8
<211> 81
<212> DNA
<213> Artificial
<220>
<223> Primer for generating humanized VH
<400> 8
ctccaggccc ttctctggag actggcggac ccagctcatc caatagttgc taaaggtgaa 60
gccagaggct gcacaggaga g 81
<210> 9
<211> 81
<212> DNA
<213> Artificial
<220>
<223> Primer for generating humanized VH
<400> 9
tctccagaga agggcctgga gtgggtctca gagattcgtc tgcgcagtga caactacgcc 60
acgcactatg cagagtctgt c 81
<210> 10
<211> 73
<212> DNA
<213> Artificial
<220>
<223> Primer for generating humanized VH
<400> 10
cagatacagc gtgttcttgg aattgtcacg ggagatggtg aagcggccct tgacagactc 60
tgcatagtgc gtg 73
<210> 11
<211> 76
<212> DNA
<213> Artificial
<220>
<223> Primer for generating humanized VH
<400> 11
caattccaag aacacgctgt atctgcaaat gaacagcctg cgcgccgagg acacgggcat 60
ttattactgt aaaacg 76
<210> 12
<211> 79
<212> DNA
<213> Artificial
<220>
<223> Primer for generating humanized VH
<400> 12
tgaggagacg gtgaccaggg tgccctggcc ccagtagctg aaactgtaga agtacgtttt 60
acagtaataa atgcccgtg 79
<210> 13
<211> 48
<212> DNA
<213> Artificial
<220>
<223> Primer for generating humanized VH
<400> 13
gaggaggagg aggaggagct cactccgagg tgcagctggt ggagtctg 48
<210> 14
<211> 72
<212> DNA
<213> Artificial
<220>
<223> Primer for generating humanized VL
<400> 14
gaggaggagg aggagaagct tgttgctctg gatctctggt gcctacgggg agctccagat 60
gacccagtct cc 72
<210> 15
<211> 336
<212> DNA
<213> Mus musculus
<400> 15
gacgttgtga tgacccagac tccactctcc ctgcctgtcc gtcttggaga tcaagcctcc 60
atctcttgca gatctagtca gagccttcta cacacttatg gaagccccta tttaaattgg 120
tacctgcaga agccaggcca gtcgccaaag ctcctgatct acaaagtttc caaccgcttt 180
tctggggtcc cagacaggtt cagtggcagt ggatcaggga cagatttcac actcaggatc 240
agcagagtgg aggctgagga tctgggagtt tatttctgct ctcaaggtac acatcttccg 300
tacacgttcg gaggggggac caaactggaa atcaaa 336
<210> 16
<211> 351
<212> DNA
<213> Mus musculus
<400> 16
gaggtgaaac tggtggagtc tggaggaggc ttggtgcaac ctggaggaac catgaaactc 60
tcctgtgaaa tttctggatt aactttcaga aattattgga tgtcttgggt ccgccagtct 120
ccagagaagg ggcttgagtg ggttgctgaa attagattga gatctgataa ttatgcaaca 180
cattatgcgg agtctgtgaa agggaagttc accatctcaa gagatgattc caaaagtcgt 240
ctctacctgc aaatgaacag cttaagaact gaagacactg gaatttatta ctgtaaaacc 300
tatttttact cattttctta ctggggccaa gggactctgg tcactgtctc t 351
<210> 17
<211> 287
<212> DNA
<213> Homo sapiens
<400> 17
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggcaagtca gagcattagc agctatttaa attggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctatgct gcatccagtt tgcaaagtgg ggtcccatca 180
aggttcagtg gcagtggatc tgggacagat ttcactctca ccatcagcag tctgcaacct 240
gaagattttg caacttacta ctgtcaacag agttacagta cccctcc 287
<210> 18
<211> 38
<212> DNA
<213> Homo sapiens
<400> 18
gctcactttc ggcggaggga ccaaggtgga gatcaaac 38
<210> 19
<211> 296
<212> DNA
<213> Homo sapiens
<400> 19
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agctatgcca tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagct attagtggta gtggtggtag cacatactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtat attactgtgc gaaaga 296
<210> 20
<211> 48
<212> DNA
<213> Homo sapiens
<400> 20
actactttga ctactggggc caaggaaccc tggtcaccgt ctcctcag 48
<210> 21
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<400> 21
Gln Lys Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 22
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<400> 22
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 23
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<400> 23
Gln Asn Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 24
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<400> 24
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 25
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<400> 25
Gln Asn Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 26
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<400> 26
Gln Lys Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 27
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<400> 27
Gln Lys Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 28
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<400> 28
Gln Asn Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 29
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<400> 29
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 30
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<400> 30
Gln Xaa Tyr Gln Pro Leu Asp Glu Lys Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 31
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<400> 31
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Glu Thr Lys Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 32
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<400> 32
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Lys Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 33
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<400> 33
Gln Xaa Tyr Gln Pro Leu Asp Glu Lys Asp Glu Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 34
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (5)..(5)
<223> Dehydroproline
<400> 34
Gln Xaa Tyr Gln Xaa Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 35
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (5)..(5)
<223> Hydroxyproline
<400> 35
Gln Xaa Tyr Gln Xaa Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 36
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<400> 36
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Ile Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 37
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<400> 37
Gln Xaa Tyr Gln Pro Leu Asp Glu Ile Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 38
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (13)..(13)
<223> Homocyclohexyl alanine
<400> 38
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Xaa Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 39
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (13)..(13)
<223> Homophenyl alanine
<400> 39
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Xaa Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 40
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (13)..(13)
<223> Thiazolyl alanine
<400> 40
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Xaa Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 41
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Nva
<400> 41
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Xaa Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 42
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (13)..(13)
<223> Homoleucine
<400> 42
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Xaa Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 43
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (9)..(9)
<223> Epsilon acyl lysine
<400> 43
Gln Xaa Tyr Gln Pro Leu Asp Glu Xaa Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 44
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<400> 44
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Phe Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 45
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (5)..(5)
<223> Hydroxyproline
<220>
<221> misc_feature
<222> (9)..(9)
<223> Thiazolyl alanine
<220>
<221> misc_feature
<222> (14)..(14)
<223> 4-Nitro phenylalanine
<400> 45
Gln Xaa Tyr Gln Xaa Leu Asp Glu Xaa Asp Lys Thr Leu Xaa Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 46
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (5)..(5)
<223> Hydroxyproline
<220>
<221> misc_feature
<222> (9)..(9)
<223> Thiazolyl alanine
<220>
<221> misc_feature
<222> (14)..(14)
<223> 4-Benzoyl phenylalanine
<400> 46
Gln Xaa Tyr Gln Xaa Leu Asp Glu Xaa Asp Lys Thr Leu Xaa Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 47
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (5)..(5)
<223> Hydroxyproline
<220>
<221> misc_feature
<222> (9)..(9)
<223> Thiazolyl alanine
<220>
<221> misc_feature
<222> (14)..(14)
<223> 4-Carboxy phenylalanine
<400> 47
Gln Xaa Tyr Gln Xaa Leu Asp Glu Xaa Asp Lys Thr Leu Xaa Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 48
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (9)..(9)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (14)..(14)
<223> 4-Nitro phenylalanine
<400> 48
Gln Xaa Tyr Gln Pro Leu Asp Glu Xaa Asp Lys Thr Leu Xaa Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 49
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> Dichlorobenzoyl modified glutamine
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<400> 49
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 50
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> Difluorobenzoyl modified glutamine
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<400> 50
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 51
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> pyridinyl carboxlate modified glutamine
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<400> 51
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 52
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> Amido-2-PEG modified glutamine
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<400> 52
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 53
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon chloro benzyl carbamate lysine
<400> 53
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 54
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> MOD_RES
<222> (11)..(11)
<223> Dbu
<400> 54
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 55
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> MOD_RES
<222> (11)..(11)
<223> Dpr
<400> 55
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 56
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (14)..(14)
<223> 4-Benzoyl phenylalanine
<400> 56
Gln Asn Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Xaa Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 57
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (14)..(14)
<223> 4-Carboxy phenylalanine
<400> 57
Gln Asn Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Xaa Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 58
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<400> 58
Gln Asn Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 59
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<400> 59
Gln Arg Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 60
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<400> 60
Gln His Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 61
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Nictinyl lysine
<400> 61
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 62
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (9)..(9)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (14)..(14)
<223> 4-Carboxy phenylalanine
<400> 62
Gln Xaa Tyr Gln Pro Leu Asp Glu Xaa Asp Lys Thr Leu Xaa Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 63
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (9)..(9)
<223> Epsilon acyl lysine
<400> 63
Gln Xaa Tyr Gln Pro Leu Asp Glu Xaa Asp Lys Thr Leu Phe Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 64
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (14)..(14)
<223> 4-Nitro phenylalanine
<400> 64
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Xaa Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 65
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> 4 PEG modified lysine
<400> 65
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 66
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (11)..(11)
<223> 4 PEG modified lysine
<400> 66
Gln Asn Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 67
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> O PEG modified glutamine
<400> 67
Xaa Lys Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 68
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<400> 68
Gln Lys Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 69
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<400> 69
Gln Asn Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 70
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<400> 70
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 71
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (9)..(9)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<400> 71
Gln Xaa Tyr Gln Pro Leu Asp Glu Xaa Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 72
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (13)..(13)
<223> O PEG modified lysine
<400> 72
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Glu Thr Xaa Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 73
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (13)..(13)
<223> O PEG modified lysine
<400> 73
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Xaa Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 74
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (9)..(9)
<223> O PEG modified lysine
<400> 74
Gln Xaa Tyr Gln Pro Leu Asp Glu Xaa Asp Glu Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 75
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (5)..(5)
<223> Dehydroproline
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<400> 75
Gln Xaa Tyr Gln Xaa Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 76
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (5)..(5)
<223> Hydroxyproline
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<400> 76
Gln Xaa Tyr Gln Xaa Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 77
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<400> 77
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Ile Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 78
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<400> 78
Gln Xaa Tyr Gln Pro Leu Asp Glu Ile Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 79
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (13)..(13)
<223> Homocyclohexyl alanine
<400> 79
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Xaa Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 80
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (13)..(13)
<223> Homophenyl alanine
<400> 80
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Xaa Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 81
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (13)..(13)
<223> Thiazolyl alanine
<400> 81
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Xaa Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 82
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Nva
<400> 82
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Xaa Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 83
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (13)..(13)
<223> Homoleucine
<400> 83
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Xaa Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 84
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (9)..(9)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<400> 84
Gln Xaa Tyr Gln Pro Leu Asp Glu Xaa Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 85
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<400> 85
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Phe Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 86
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (5)..(5)
<223> Hydroxyproline
<220>
<221> misc_feature
<222> (9)..(9)
<223> Thiazolyl alanine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (14)..(14)
<223> 4-Nitro phenylalanine
<400> 86
Gln Xaa Tyr Gln Xaa Leu Asp Glu Xaa Asp Xaa Thr Leu Xaa Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 87
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (5)..(5)
<223> Hydroxyproline
<220>
<221> misc_feature
<222> (9)..(9)
<223> Thiazolyl alanine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (14)..(14)
<223> 4-Benzoyl phenylalanine
<400> 87
Gln Xaa Tyr Gln Xaa Leu Asp Glu Xaa Asp Xaa Thr Leu Xaa Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 88
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (5)..(5)
<223> Hydroxyproline
<220>
<221> misc_feature
<222> (9)..(9)
<223> Thiazolyl alanine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (14)..(14)
<223> 4-Carboxy phenylalanine
<400> 88
Gln Xaa Tyr Gln Xaa Leu Asp Glu Xaa Asp Xaa Thr Leu Xaa Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 89
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (9)..(9)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (14)..(14)
<223> 4-Nitro phenylalanine
<400> 89
Gln Xaa Tyr Gln Pro Leu Asp Glu Xaa Asp Xaa Thr Leu Xaa Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 90
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> Dichlorobenzoyl modified glutamine
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<400> 90
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 91
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> Difluorobenzoyl modified glutamine
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<400> 91
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 92
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> pyridinyl carboxlate modified glutamine
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<400> 92
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 93
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> Amido-2-PEG modified glutamine
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<400> 93
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 94
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon chloro benzyl carbamate lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<400> 94
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 95
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified diaminobutyric acid
<400> 95
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 96
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified diaminopropionic acid
<400> 96
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 97
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (14)..(14)
<223> 4-Benzoyl phenylalanine
<400> 97
Gln Asn Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Xaa Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 98
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (14)..(14)
<223> 4-Carboxy phenylalanine
<400> 98
Gln Asn Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Xaa Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 99
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<400> 99
Gln Asn Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 100
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<400> 100
Gln Arg Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 101
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<400> 101
Gln His Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 102
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Nictinyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<400> 102
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 103
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (9)..(9)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (14)..(14)
<223> 4-Carboxy phenylalanine
<400> 103
Gln Xaa Tyr Gln Pro Leu Asp Glu Xaa Asp Xaa Thr Leu Xaa Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 104
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (9)..(9)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<400> 104
Gln Xaa Tyr Gln Pro Leu Asp Glu Xaa Asp Xaa Thr Leu Phe Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 105
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (2)..(2)
<223> Xaa can be any naturally occurring amino acid
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<400> 105
Lys Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 106
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<400> 106
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 107
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (3)..(3)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<400> 107
Gln Xaa Xaa Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 108
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (4)..(4)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<400> 108
Gln Xaa Tyr Xaa Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 109
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (5)..(5)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<400> 109
Gln Xaa Tyr Gln Xaa Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 110
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (6)..(6)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<400> 110
Gln Xaa Tyr Gln Pro Xaa Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 111
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (7)..(7)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<400> 111
Gln Xaa Tyr Gln Pro Leu Xaa Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 112
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (8)..(8)
<223> O PEG modified aspartic acid
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<400> 112
Gln Xaa Tyr Gln Pro Leu Asp Xaa Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 113
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (10)..(10)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<400> 113
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Xaa Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 114
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (12)..(12)
<223> O PEG modified lysine
<400> 114
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Xaa Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 115
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (14)..(14)
<223> O PEG modified lysine
<400> 115
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Xaa Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 116
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (15)..(15)
<223> O PEG modified lysine
<400> 116
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Xaa Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 117
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (16)..(16)
<223> O PEG modified lysine
<400> 117
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Xaa
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 118
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (17)..(17)
<223> O PEG modified lysine
<400> 118
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Xaa Met Leu Gln Gln Gly
20
<210> 119
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (18)..(18)
<223> O PEG modified lysine
<400> 119
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Xaa Leu Gln Gln Gly
20
<210> 120
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (19)..(19)
<223> O PEG modified lysine
<400> 120
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Xaa Gln Gln Gly
20
<210> 121
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (20)..(20)
<223> O PEG modified lysine
<400> 121
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Xaa Gln Gly
20
<210> 122
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (21)..(21)
<223> O PEG modified lysine
<400> 122
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Xaa Gly
20
<210> 123
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (22)..(22)
<223> O PEG modified lysine
<400> 123
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Xaa
20
<210> 124
<211> 21
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> Acylated
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (9)..(9)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (21)..(21)
<223> Amidated
<400> 124
Gln Xaa Tyr Gln Pro Leu Asp Glu Xaa Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln
20
<210> 125
<211> 20
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> Acylated
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (9)..(9)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (20)..(20)
<223> Amidated
<400> 125
Gln Xaa Tyr Gln Pro Leu Asp Glu Xaa Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln
20
<210> 126
<211> 19
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> Acylated
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (9)..(9)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (19)..(19)
<223> Amidated
<400> 126
Gln Xaa Tyr Gln Pro Leu Asp Glu Xaa Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu
<210> 127
<211> 18
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> Acylated
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (9)..(9)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (18)..(18)
<223> Amidated
<400> 127
Gln Xaa Tyr Gln Pro Leu Asp Glu Xaa Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met
<210> 128
<211> 21
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> Acylated epsilon acyl lysine
<220>
<221> misc_feature
<222> (8)..(8)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (10)..(10)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (21)..(21)
<223> Amidated
<400> 128
Xaa Tyr Gln Pro Leu Asp Glu Xaa Asp Xaa Thr Leu Tyr Asp Gln Phe
1 5 10 15
Met Leu Gln Gln Gly
20
<210> 129
<211> 20
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> Acylated
<220>
<221> misc_feature
<222> (7)..(7)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (9)..(9)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (20)..(20)
<223> Amidated
<400> 129
Tyr Gln Pro Leu Asp Glu Xaa Asp Xaa Thr Leu Tyr Asp Gln Phe Met
1 5 10 15
Leu Gln Gln Gly
20
<210> 130
<211> 19
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> Acylated
<220>
<221> misc_feature
<222> (6)..(6)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (8)..(8)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (19)..(19)
<223> Amidated
<400> 130
Gln Pro Leu Asp Glu Xaa Asp Xaa Thr Leu Tyr Asp Gln Phe Met Leu
1 5 10 15
Gln Gln Gly
<210> 131
<211> 18
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> Acylated
<220>
<221> misc_feature
<222> (5)..(5)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (7)..(7)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (18)..(18)
<223> Amidated
<400> 131
Pro Leu Asp Glu Xaa Asp Xaa Thr Leu Tyr Asp Gln Phe Met Leu Gln
1 5 10 15
Gln Gly
<210> 132
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_features
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_features
<222> (11)..(11)
<223> Linker attached
<400> 132
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 133
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_features
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_features
<222> (11)..(11)
<223> Linker attached
<220>
<221> misc_features
<222> (14)..(14)
<223> 4-Nitro-phenylalanine
<400> 133
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Xaa Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 134
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_features
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_features
<222> (9)..(9)
<223> Linker attached
<220>
<221> misc_features
<222> (11)..(11)
<223> Epsilon acyl lysine
<400> 134
Gln Xaa Tyr Gln Pro Leu Asp Glu Lys Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 135
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_features
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_features
<222> (9)..(9)
<223> Epsilon acyl lysine
<220>
<221> misc_features
<222> (11)..(11)
<223> Linker attached
<400> 135
Gln Xaa Tyr Gln Pro Leu Asp Glu Xaa Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 136
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_features
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_features
<222> (11)..(11)
<223> Linker attached
<400> 136
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 137
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_features
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_features
<222> (11)..(11)
<223> Linker attached
<220>
<221> misc_features
<222> (14)..(14)
<223> 4-Nitro-phenylalanine
<400> 137
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Xaa Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 138
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_features
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_features
<222> (9)..(9)
<223> Linker attached
<220>
<221> misc_features
<222> (11)..(11)
<223> Epsilon acyl lysine
<400> 138
Gln Xaa Tyr Gln Pro Leu Asp Glu Lys Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 139
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_features
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_features
<222> (9)..(9)
<223> Epsilon acyl lysine
<220>
<221> misc_features
<222> (11)..(11)
<223> Linker attached
<400> 139
Gln Xaa Tyr Gln Pro Leu Asp Glu Xaa Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 140
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> Linker attached
<400> 140
Gln Lys Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 141
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Linker attached
<400> 141
Gln Lys Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 142
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (3)..(3)
<223> Linker attached
<400> 142
Gln Lys Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 143
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (7)..(7)
<223> Linker attached
<400> 143
Gln Lys Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 144
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (8)..(8)
<223> Linker attached
<400> 144
Gln Lys Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 145
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (10)..(10)
<223> Linker attached
<400> 145
Gln Lys Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 146
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (11)..(11)
<223> Linker attached
<400> 146
Gln Lys Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 147
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (12)..(12)
<223> Linker attached
<400> 147
Gln Lys Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 148
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (14)..(14)
<223> Linker attached
<400> 148
Gln Lys Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 149
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (15)..(15)
<223> Linker attached
<400> 149
Gln Lys Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 150
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (22)..(22)
<223> Linker attached
<400> 150
Gln Lys Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 151
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> Linker attached
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<400> 151
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 152
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (3)..(3)
<223> Linker attached
<400> 152
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 153
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (7)..(7)
<223> Linker attached
<400> 153
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 154
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (8)..(8)
<223> Linker attached
<400> 154
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 155
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (10)..(10)
<223> Linker attached
<400> 155
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 156
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> Linker attached
<400> 156
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 157
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (12)..(12)
<223> Linker attached
<400> 157
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 158
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (14)..(14)
<223> Linker attached
<400> 158
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 159
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (15)..(15)
<223> Linker attached
<400> 159
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 160
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (22)..(22)
<223> Linker attached
<400> 160
Gln Xaa Tyr Gln Pro Leu Asp Glu Leu Asp Lys Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 161
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(2)
<223> unknown
<220>
<221> VARIANT
<222> (3)..(3)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (4)..(4)
<223> unknown
<220>
<221> VARIANT
<222> (5)..(5)
<223> could also be hydroxyproline, dehydroproline,
(2S,4F)-4-Hydroxyproline
<220>
<221> misc_feature
<222> (6)..(6)
<223> unknown
<220>
<221> VARIANT
<222> (8)..(8)
<223> could also be glutamic acid
<220>
<221> VARIANT
<222> (9)..(9)
<223> could also be isoleucine, lysine or any other amino acid
comprising a nucleophilic or electrophilic side chain
<220>
<221> VARIANT
<222> (10)..(10)
<223> could also be glutamic acid
<220>
<221> VARIANT
<222> (11)..(11)
<223> could also be asparagine, cysteine, lysine or any other amino
acid comprising a nucleophilic or electrophilic side chain
<220>
<221> misc_feature
<222> (12)..(12)
<223> unknown
<220>
<221> VARIANT
<222> (13)..(13)
<223> could also be homoleucine, norvaline, isoleucine, homocyclohexyl
alanine, homophenyl alanine, thiazolyl alanine
<220>
<221> VARIANT
<222> (14)..(14)
<223> could also be any other aromatic amino acid
<220>
<221> VARIANT
<222> (15)..(15)
<223> could also be glutamic acid
<220>
<221> misc_feature
<222> (16)..(16)
<223> unknown
<220>
<221> VARIANT
<222> (17)..(17)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (18)..(19)
<223> unknown
<220>
<221> misc_feature
<222> (20)..(20)
<223> Xaa can be any amino acid, or can be absent when Xaa at position
21 and Xaa at position 22 are absent
<220>
<221> misc_feature
<222> (21)..(21)
<223> Xaa can be any amino acid, or can be absent when Xaa at position
22 is absent
<220>
<221> misc_feature
<222> (22)..(22)
<223> Xaa can be any amino acid, or can be absent
<400> 161
Xaa Xaa Phe Xaa Pro Xaa Asp Asp Leu Asp Gln Xaa Leu Phe Asp Xaa
1 5 10 15
Phe Xaa Xaa Xaa Xaa Xaa
20
<210> 162
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(2)
<223> unknown
<220>
<221> VARIANT
<222> (3)..(3)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (4)..(4)
<223> unknown
<220>
<221> VARIANT
<222> (5)..(5)
<223> could also be hydroxproline, dehydroproline,
(2S,4R)-4-hydroxyproline
<220>
<221> misc_feature
<222> (6)..(6)
<223> unknown
<220>
<221> VARIANT
<222> (9)..(9)
<223> could also be isoleucine, lysine or any other amino acid
comprising a nucleophilic or electrophilic side chain
<220>
<221> VARIANT
<222> (11)..(11)
<223> could also be asparagine, cysteine, lysine or any other amino
acid comprising a nucleophilic or electrophilic side chain
<220>
<221> misc_feature
<222> (12)..(12)
<223> unknown
<220>
<221> VARIANT
<222> (13)..(13)
<223> could also be homoleucine, norvaline, isoleucine, homocyclohexyl
alanine, homophenyl alanine, thiazolyl alanine
<220>
<221> VARIANT
<222> (14)..(14)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (16)..(16)
<223> unknown
<220>
<221> VARIANT
<222> (17)..(17)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (18)..(19)
<223> unknown
<220>
<221> misc_feature
<222> (20)..(20)
<223> Xaa can be any amino acid, or can be absent when Xaa at position
21 and Xaa at position 22 are absent
<220>
<221> misc_feature
<222> (21)..(21)
<223> Xaa can be any amino acid, or can be absent when Xaa at position
22 is absent
<220>
<221> misc_feature
<222> (22)..(22)
<223> Xaa can be any amino acid, or can be absent
<400> 162
Xaa Xaa Phe Xaa Pro Xaa Asp Glu Leu Asp Gln Xaa Leu Phe Asp Xaa
1 5 10 15
Phe Xaa Xaa Xaa Xaa Xaa
20
<210> 163
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> unknown
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> VARIANT
<222> (3)..(3)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (4)..(4)
<223> unknown
<220>
<221> VARIANT
<222> (5)..(5)
<223> could also be hydroxyproline, dehydroproline,
(2S,4R)-4-hydroxyproline
<220>
<221> misc_feature
<222> (6)..(6)
<223> unknown
<220>
<221> VARIANT
<222> (9)..(9)
<223> could also be isoleucine, lysine or any other amino acid
comprising a nucleophilic or electrophilic side chain
<220>
<221> VARIANT
<222> (11)..(11)
<223> could also be asparagine, cysteine, lysine or any other amino
acid comprising a nucleophilic or electrophilic side chain
<220>
<221> misc_feature
<222> (12)..(12)
<223> unknown
<220>
<221> VARIANT
<222> (13)..(13)
<223> could also be homoleucine, norvaline, isoleucine, homocyclohexyl
alanine, homophenyl alanine, thiazolyl alanine
<220>
<221> VARIANT
<222> (14)..(14)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (16)..(16)
<223> unknown
<220>
<221> VARIANT
<222> (17)..(17)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (18)..(19)
<223> unknown
<220>
<221> misc_feature
<222> (20)..(20)
<223> Xaa can be any amino acid, or can be absent when Xaa at position
21 and Xaa at position 22 are absent
<220>
<221> misc_feature
<222> (21)..(21)
<223> Xaa can be any amino acid, or can be absent when Xaa at position
22 is absent
<220>
<221> misc_feature
<222> (22)..(22)
<223> Xaa can be any amino acid, or can be absent
<400> 163
Xaa Lys Phe Xaa Pro Xaa Asp Glu Leu Asp Gln Xaa Leu Phe Asp Xaa
1 5 10 15
Phe Xaa Xaa Xaa Xaa Xaa
20
<210> 164
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> unknown
<220>
<221> VARIANT
<222> (3)..(3)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (4)..(4)
<223> unknown
<220>
<221> VARIANT
<222> (5)..(5)
<223> could also be hydroxyproline, dehydroproline,
(2S,4R)-4-hydroxyproline
<220>
<221> misc_feature
<222> (6)..(6)
<223> unknown
<220>
<221> VARIANT
<222> (9)..(9)
<223> could also be isoleucine, lysine or any other amino acid
comprising a nucleophilic or electrophilic side chain
<220>
<221> VARIANT
<222> (11)..(11)
<223> could also be asparagine, cysteine, lysine or any other amino
acid comprising a nucleophilic or electrophilic side chain
<220>
<221> misc_feature
<222> (12)..(12)
<223> unknown
<220>
<221> VARIANT
<222> (13)..(13)
<223> could also be homoleucine, norvaline, isoleucine, homocyclohexyl
alanine, homophenyl alanine, thiazolyl alanine
<220>
<221> VARIANT
<222> (14)..(14)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (16)..(16)
<223> unknown
<220>
<221> VARIANT
<222> (17)..(17)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (18)..(19)
<223> unknown
<220>
<221> misc_feature
<222> (20)..(20)
<223> Xaa can be any amino acid, or can be absent when Xaa at position
21 and Xaa at position 22 are absent
<220>
<221> misc_feature
<222> (21)..(21)
<223> Xaa can be any amino acid, or can be absent when Xaa at position
22 is absent
<220>
<221> misc_feature
<222> (22)..(22)
<223> Xaa can be any amino acid, or can be absent
<400> 164
Xaa Asn Phe Xaa Pro Xaa Asp Glu Leu Asp Gln Xaa Leu Phe Asp Xaa
1 5 10 15
Phe Xaa Xaa Xaa Xaa Xaa
20
<210> 165
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(2)
<223> unknown
<220>
<221> VARIANT
<222> (3)..(3)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (4)..(4)
<223> unknown
<220>
<221> VARIANT
<222> (5)..(5)
<223> could also be hydroxyproline, dehydroproline,
(2S,4R)-4-hydroxyproline
<220>
<221> misc_feature
<222> (6)..(6)
<223> unknown
<220>
<221> misc_feature
<222> (9)..(9)
<223> unknown
<220>
<221> misc_feature
<222> (12)..(12)
<223> unknown
<220>
<221> VARIANT
<222> (13)..(13)
<223> could also be homoleucine, norvaline, isoleucine, homocyclohexyl
alanine, homophenyl alanine, thiazolyl alanine
<220>
<221> VARIANT
<222> (14)..(14)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (16)..(16)
<223> unknown
<220>
<221> VARIANT
<222> (17)..(17)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (18)..(19)
<223> unknown
<220>
<221> misc_feature
<222> (20)..(20)
<223> Xaa can be any amino acid, or can be absent when Xaa at position
21 and Xaa at position 22 are absent
<220>
<221> misc_feature
<222> (21)..(21)
<223> Xaa can be any amino acid, or can be absent when Xaa at position
22 is absent
<220>
<221> misc_feature
<222> (22)..(22)
<223> Xaa can be any amino acid, or can be absent
<400> 165
Xaa Xaa Phe Xaa Pro Xaa Asp Glu Xaa Asp Lys Xaa Leu Phe Asp Xaa
1 5 10 15
Phe Xaa Xaa Xaa Xaa Xaa
20
<210> 166
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> VARIANT
<222> (2)..(2)
<223> could also be be epsilon acyl lysine, arginine, histidine,
nictinyl lysine, epsilon chloro benzyl carbamate lysine
<220>
<221> VARIANT
<222> (3)..(3)
<223> could also be any other aromatic amino acid
<220>
<221> VARIANT
<222> (5)..(5)
<223> could also be hydroxyproline, dehydroproline,
(2S,4R)-4-hydroxyproline
<220>
<221> VARIANT
<222> (9)..(9)
<223> could also be epsilon acyl lysine, isoleucine, leucine, thiazolyl
alanine
<220>
<221> VARIANT
<222> (11)..(11)
<223> could also be diaminobutyric acid, diaminopropionic acid, epsilon
acyl lysine, cysteine, arginine
<220>
<221> VARIANT
<222> (13)..(13)
<223> could also be homoleucine, norvaline, isoleucine, homocyclohexyl
alanine, homophenyl alanine, thiazolyl alanine
<220>
<221> VARIANT
<222> (14)..(14)
<223> could also be any other aromatic amino acid
<220>
<221> VARIANT
<222> (17)..(17)
<223> could also be any other aromatic amino acid
<400> 166
Gln Asn Phe Gln Pro Leu Asp Glu Lys Asp Lys Thr Leu Phe Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 167
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> VARIANT
<222> (2)..(2)
<223> could also be epsilon acyl lysine, asparagine, arginine,
histidine, nictinyl lysine, epsilon chloro benzyl carbamate
lysine
<220>
<221> VARIANT
<222> (3)..(3)
<223> could also be any other aromatic amino acid
<220>
<221> VARIANT
<222> (5)..(5)
<223> could also be hydroxyproline, dehydroproline,
(2S,4R)-4-hydroxyproline
<220>
<221> VARIANT
<222> (9)..(9)
<223> could also be epsilon acyl lysine, isoleucine, leucine, thiazolyl
alanine
<220>
<221> VARIANT
<222> (13)..(13)
<223> could also be homoleucine, norvaline, isoleucine, homocyclohexyl
alanine, homophenyl alanine, thiazolyl alanine
<220>
<221> VARIANT
<222> (14)..(14)
<223> could also be any other aromatic amino acid
<220>
<221> VARIANT
<222> (17)..(17)
<223> could also be any other aromatic amino acid
<400> 167
Gln Lys Phe Gln Pro Leu Asp Glu Lys Asp Lys Thr Leu Phe Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 168
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> VARIANT
<222> (3)..(3)
<223> could also be any other aromatic amino acid
<220>
<221> VARIANT
<222> (5)..(5)
<223> could also be hydroxyproline, dehydroproline,
(2S,4R)-4-hydroxyproline
<220>
<221> VARIANT
<222> (9)..(9)
<223> could also be epsilon acyl lysine, isoleucine, leucine, thiazolyl
alanine
<220>
<221> VARIANT
<222> (13)..(13)
<223> could also be homoleucine, norvaline, isoleucine, homocyclohexyl
alanine, homophenyl alanine, thiazolyl alanine
<220>
<221> VARIANT
<222> (14)..(14)
<223> could also be any other aromatic amino acid
<220>
<221> VARIANT
<222> (17)..(17)
<223> could also be any other aromatic amino acid
<400> 168
Gln Lys Phe Gln Pro Leu Asp Glu Lys Asp Lys Thr Leu Phe Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 169
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> VARIANT
<222> (3)..(3)
<223> could also be any other aromatic amino acid
<220>
<221> VARIANT
<222> (5)..(5)
<223> could also be hydroxyproline, dehydroproline,
(2S,4R)-4-hydroxyproline
<220>
<221> VARIANT
<222> (9)..(9)
<223> could also be epsilon acyl lysine, isoleucine, leucine, thiazolyl
alanine
<220>
<221> VARIANT
<222> (13)..(13)
<223> homoleucine, norvaline, isoleucine, homocyclohexyl alanine,
homophenyl alanine, thiazolyl alanine
<220>
<221> VARIANT
<222> (14)..(14)
<223> could also be any other aromatic amino acid
<220>
<221> VARIANT
<222> (17)..(17)
<223> could also be any other aromatic amino acid
<400> 169
Gln Asn Phe Gln Pro Leu Asp Glu Lys Asp Lys Thr Leu Phe Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 170
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> unknown
<220>
<221> VARIANT
<222> (2)..(2)
<223> could also be epsilon acyl lysine, arginine, histidine, nictinyl
lysine, epsilon chloro benzyl carbamate lysine
<220>
<221> VARIANT
<222> (3)..(3)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (4)..(4)
<223> unknown
<220>
<221> VARIANT
<222> (5)..(5)
<223> could also be hydroxproline, dehydroproline,
(2S,4R)-4-hydroxyproline
<220>
<221> misc_feature
<222> (6)..(6)
<223> unknown
<220>
<221> VARIANT
<222> (9)..(9)
<223> could also be isoleucine, lysine or any other amino acid
comprising a nucleophilic or electrophilic side chain
<220>
<221> VARIANT
<222> (11)..(11)
<223> could also be asparagine, cysteine, lysine or any other amino
acid comprising a nucleophilic or electrophilic side chain
<220>
<221> misc_feature
<222> (12)..(12)
<223> unknown
<220>
<221> VARIANT
<222> (14)..(14)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (16)..(16)
<223> unknown
<220>
<221> VARIANT
<222> (17)..(17)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (18)..(19)
<223> unknown
<220>
<221> misc_feature
<222> (20)..(20)
<223> Xaa can be any amino acid, or can be absent when Xaa at position
21 and Xaa at position 22 are absent
<220>
<221> misc_feature
<222> (21)..(21)
<223> Xaa can be any amino acid, or can be absent when Xaa at position
22 is absent
<220>
<221> misc_feature
<222> (22)..(22)
<223> Xaa can be any amino acid, or can be absent
<400> 170
Xaa Asn Phe Xaa Pro Xaa Asp Glu Leu Asp Gln Xaa Leu Phe Asp Xaa
1 5 10 15
Phe Xaa Xaa Xaa Xaa Xaa
20
<210> 171
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> unknown
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> VARIANT
<222> (3)..(3)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (4)..(4)
<223> unknown
<220>
<221> VARIANT
<222> (5)..(5)
<223> could also be hydroxyproline, dehydroproline,
(2S,4R)-4-hydroxyproline
<220>
<221> misc_feature
<222> (6)..(6)
<223> unknown
<220>
<221> VARIANT
<222> (9)..(9)
<223> could also be isoleucine, lysine or any other amino acid
comprising a nucleophilic or electrophilic side chain
<220>
<221> VARIANT
<222> (11)..(11)
<223> could also be glutamine, asparagine, cysteine or any other amino
acid comprising a nucleophilic or electrophilic side chain
<220>
<221> misc_feature
<222> (12)..(12)
<223> unknown
<220>
<221> VARIANT
<222> (14)..(14)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (16)..(16)
<223> unknown
<220>
<221> VARIANT
<222> (17)..(17)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (18)..(19)
<223> unknown
<220>
<221> misc_feature
<222> (20)..(20)
<223> Xaa can be any amino acid, or can be absent when Xaa at position
21 and Xaa at position 22 are absent
<220>
<221> misc_feature
<222> (21)..(21)
<223> Xaa can be any amino acid, or can be absent when Xaa at position
22 is absent
<220>
<221> misc_feature
<222> (22)..(22)
<223> Xaa can be any amino acid, or can be absent
<400> 171
Xaa Lys Phe Xaa Pro Xaa Asp Glu Leu Asp Lys Xaa Leu Phe Asp Xaa
1 5 10 15
Phe Xaa Xaa Xaa Xaa Xaa
20
<210> 172
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> unknown
<220>
<221> VARIANT
<222> (3)..(3)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (4)..(4)
<223> unknown
<220>
<221> VARIANT
<222> (5)..(5)
<223> could also be hydroxyproline, dehydroproline,
(2S,4R)-4-hydroxyproline
<220>
<221> misc_feature
<222> (6)..(6)
<223> unknown
<220>
<221> VARIANT
<222> (9)..(9)
<223> could also be isoleucine, lysine or any other amino acid
comprising a nucleophilic or electrophilic side chain
<220>
<221> VARIANT
<222> (11)..(11)
<223> could also be glutamine, asparagine, cysteine or any other amino
acid comprising a nucleophilic or electrophilic side chain
<220>
<221> misc_feature
<222> (12)..(12)
<223> unknown
<220>
<221> VARIANT
<222> (14)..(14)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (16)..(16)
<223> unknown
<220>
<221> VARIANT
<222> (17)..(17)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (18)..(19)
<223> unknown
<220>
<221> misc_feature
<222> (20)..(20)
<223> Xaa can be any amino acid, or can be absent when Xaa at position
21 and Xaa at position 22 are absent
<220>
<221> misc_feature
<222> (21)..(21)
<223> Xaa can be any amino acid, or can be absent when Xaa at position
22 is absent
<220>
<221> misc_feature
<222> (22)..(22)
<223> Xaa can be any amino acid, or can be absent
<400> 172
Xaa Asn Phe Xaa Pro Xaa Asp Glu Leu Asp Lys Xaa Leu Phe Asp Xaa
1 5 10 15
Phe Xaa Xaa Xaa Xaa Xaa
20
<210> 173
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (1)..(1)
<223> unknown
<220>
<221> VARIANT
<222> (2)..(2)
<223> could also be epsilon acyl lysine, arginine, histidine, nictinyl
lysine, epsilon chloro benzyl carbamate lysine
<220>
<221> VARIANT
<222> (3)..(3)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (4)..(4)
<223> unknown
<220>
<221> VARIANT
<222> (5)..(5)
<223> could also be hydroxyproline, dehydroproline,
(2S,4R)-4-hydroxyproline
<220>
<221> misc_feature
<222> (6)..(6)
<223> unknown
<220>
<221> misc_feature
<222> (9)..(9)
<223> unknown
<220>
<221> misc_feature
<222> (12)..(12)
<223> unknown
<220>
<221> VARIANT
<222> (14)..(14)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (16)..(16)
<223> unknown
<220>
<221> VARIANT
<222> (17)..(17)
<223> could also be any other aromatic amino acid
<220>
<221> misc_feature
<222> (18)..(19)
<223> unknown
<220>
<221> misc_feature
<222> (20)..(20)
<223> Xaa can be any amino acid, or can be absent when Xaa at position
21 and Xaa at position 22 are absent
<220>
<221> misc_feature
<222> (21)..(21)
<223> Xaa can be any amino acid, or can be absent when Xaa at position
22 is absent
<220>
<221> misc_feature
<222> (22)..(22)
<223> Xaa can be any amino acid, or can be absent
<400> 173
Xaa Asn Phe Xaa Pro Xaa Asp Glu Xaa Asp Lys Xaa Leu Phe Asp Xaa
1 5 10 15
Phe Xaa Xaa Xaa Xaa Xaa
20
<210> 174
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> VARIANT
<222> (2)..(2)
<223> could also be epsilon acyl lysine, arginine, histidine, nictinyl
lysine, epsilon chloro benzyl carbamate lysine
<220>
<221> VARIANT
<222> (3)..(3)
<223> could also be any other aromatic amino acid
<220>
<221> VARIANT
<222> (5)..(5)
<223> could also be hydroxyproline, dehydroproline,
(2S,4R)-4-hydroxyproline
<220>
<221> VARIANT
<222> (9)..(9)
<223> could also be epsilon acyl lysine, isoleucine, leucine, thiazolyl
alanine
<220>
<221> VARIANT
<222> (11)..(11)
<223> could also be diaminobutyric acid, diaminopropionic acid, epsilon
acyl lysine, cysteine, arginine
<220>
<221> VARIANT
<222> (14)..(14)
<223> could also be any other aromatic amino acid
<220>
<221> VARIANT
<222> (17)..(17)
<223> could also be any other aromatic amino acid
<400> 174
Gln Asn Phe Gln Pro Leu Asp Glu Lys Asp Lys Thr Leu Phe Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 175
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> VARIANT
<222> (2)..(2)
<223> could also be epsilon acyl lysine, asparagine, arginine,
histidine, nictinyl lysine, epsilon chloro benzyl carbamate
lysine
<220>
<221> VARIANT
<222> (3)..(3)
<223> could also be any other aromatic amino acid
<220>
<221> VARIANT
<222> (5)..(5)
<223> could also be hydroxyproline, dehydroproline,
(2S,4R)-4-hydroxyproline
<220>
<221> VARIANT
<222> (9)..(9)
<223> could also be epsilon acyl lysine, isoleucine, leucine, thiazolyl
alanine
<220>
<221> VARIANT
<222> (14)..(14)
<223> could also be any other aromatic amino acid
<220>
<221> VARIANT
<222> (17)..(17)
<223> could also be any other aromatic amino acid
<400> 175
Gln Lys Phe Gln Pro Leu Asp Glu Lys Asp Lys Thr Leu Phe Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 176
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> VARIANT
<222> (3)..(3)
<223> could also be any other aromatic amino acid
<220>
<221> VARIANT
<222> (5)..(5)
<223> could also be hydroxyproline, dehydroproline,
(2S,4R)-4-hydroxyproline
<220>
<221> VARIANT
<222> (9)..(9)
<223> could also be epsilon acyl lysine, isoleucine, leucine, thiazolyl
alanine
<220>
<221> VARIANT
<222> (14)..(14)
<223> could also be any other aromatic amino acid
<220>
<221> VARIANT
<222> (17)..(17)
<223> could also be any other aromatic amino acid
<400> 176
Gln Lys Phe Gln Pro Leu Asp Glu Lys Asp Lys Thr Leu Phe Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 177
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> VARIANT
<222> (3)..(3)
<223> could also be any other aromatic amino acid
<220>
<221> VARIANT
<222> (5)..(5)
<223> could also be hydroxyproline, dehydroproline,
(2S,4R)-4-hydroxyproline
<220>
<221> VARIANT
<222> (9)..(9)
<223> could also be epsilon acyl lysine, isoleucine, leucine, thiazolyl
alanine
<220>
<221> VARIANT
<222> (14)..(14)
<223> could also be any other aromatic amino acid
<220>
<221> VARIANT
<222> (17)..(17)
<223> could also be any other aromatic amino acid
<400> 177
Gln Asn Phe Gln Pro Leu Asp Glu Lys Asp Lys Thr Leu Phe Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 178
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> VARIANT
<222> (2)..(2)
<223> could also be epsilon acyl lysine, asparagine, arginine,
histidine, nictinyl lysine, epsilon chloro benzyl carbamate
lysine
<220>
<221> VARIANT
<222> (5)..(5)
<223> could also be hydroxyproline, dehydroproline,
(2S,4R)-4-hydroxyproline
<220>
<221> VARIANT
<222> (9)..(9)
<223> could also be isoleucine, thiazolyl alanine, epsilon acyl
lysine, a linking residue
<220>
<221> VARIANT
<222> (11)..(11)
<223> could also be asparagine, cysteine, lysine, epsilon acyl lysine,
diaminobutyric acid, diaminopropionic acid, a linking residue
<220>
<221> VARIANT
<222> (13)..(13)
<223> could also be homoleucine, norvaline, isoleucine, homocyclohexyl
alanine, homophenyl alanine, thiazolyl alanine, a linking residue
<220>
<221> VARIANT
<222> (14)..(14)
<223> could also be any other aromatic amino acid, a linking residue
<220>
<221> VARIANT
<222> (15)..(15)
<223> could also be a linking residue
<220>
<221> VARIANT
<222> (16)..(16)
<223> could also be asparagine, a linking residue
<220>
<221> VARIANT
<222> (18)..(18)
<223> could also be a linking residue
<220>
<221> VARIANT
<222> (19)..(19)
<223> could also be isoleucine, a linking residue
<400> 178
Gln Lys Tyr Gln Pro Leu Asp Glu Leu Asp Gln Thr Leu Phe Asp Asn
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 179
<211> 54
<212> DNA
<213> Artificial
<220>
<223> Primer for generating humanized Vk
<400> 179
gaggaggagg aggagggccc aggcggccga gctccagatg acccagtctc tcca 54
<210> 180
<211> 48
<212> DNA
<213> Artificial
<220>
<223> Primer for generating humanized Vk
<400> 180
gacagatggt gcagccacag ttcgtttgat ctccaccttg gtccctcc 48
<210> 181
<211> 48
<212> DNA
<213> Artificial
<220>
<223> Primer for generating humanized VH
<400> 181
gctgcccaac cagccatggc cgaggtgcag ctggtggagt ctggggga 48
<210> 182
<211> 48
<212> DNA
<213> Artificial
<220>
<223> Primer for generating humanized VH
<400> 182
gaccgatggg cccttggtgg aggctgagga gacggtgacc agggtgcc 48
<210> 183
<211> 22
<212> DNA
<213> Artificial
<220>
<223> Sequencing primer
<400> 183
aagacagcta tcgcgattgc ag 22
<210> 184
<211> 22
<212> DNA
<213> Artificial
<220>
<223> Sequencing primer
<400> 184
ctattgccta cggcagccgc tg 22
<210> 185
<211> 24
<212> DNA
<213> Artificial
<220>
<223> Primer for generating humanized VH
<400> 185
gcccccttat tagcgtttgc catc 24
<210> 186
<211> 20
<212> DNA
<213> Artificial
<220>
<223> Primer for generating humanized VL
<400> 186
gccatggctg gttgggcagc 20
<210> 187
<211> 48
<212> DNA
<213> Homo sapiens
<400> 187
actactttga ctactggggc cagggaaccc tggtcaccgt ctcctcag 48
<210> 188
<211> 48
<212> DNA
<213> Homo sapiens
<400> 188
gctactttga ctactggggc caagggaccc tggtcaccgt ctcctcag 48
<210> 189
<211> 219
<212> PRT
<213> Artificial
<220>
<223> Humanized 38c2 light chain
<400> 189
Glu Leu Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Gln Ser Leu Leu His Thr
20 25 30
Tyr Gly Ser Pro Tyr Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Ser Gln Gly
85 90 95
Thr His Leu Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 190
<211> 448
<212> PRT
<213> Artificial
<220>
<223> Humanized 38c2 heavy chain
<400> 190
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ser Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ser Glu Ile Arg Leu Arg Ser Asp Asn Tyr Ala Thr His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Gly Ile Tyr
85 90 95
Tyr Cys Lys Thr Tyr Phe Tyr Ser Phe Ser Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 191
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptid
<220>
<221> misc_feature
<222> (1)..(1)
<223> Acylated
<220>
<221> misc_feature
<222> (2)..(2)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (9)..(9)
<223> Epsilon acyl lysine
<220>
<221> misc_feature
<222> (11)..(11)
<223> O PEG modified lysine
<220>
<221> misc_feature
<222> (22)..(22)
<223> Amidated
<400> 191
Gln Xaa Tyr Gln Pro Leu Asp Glu Xaa Asp Xaa Thr Leu Tyr Asp Gln
1 5 10 15
Phe Met Leu Gln Gln Gly
20
<210> 192
<211> 18
<212> PRT
<213> Artificial
<220>
<223> Anti-angiogenic peptide
<220>
<221> misc_feature
<222> (7)..(7)
<223> O PEG modified lysine
<400> 192
Pro Leu Asp Glu Leu Asp Xaa Thr Leu Tyr Asp Gln Phe Met Leu Gln
1 5 10 15
Gln Gly
Claims (69)
- 하기 서열을 포함하는 펩타이드를 포함하는 화합물 또는 그의 약학적으로 허용가능한 염:
R1-Q1(엡실론 아실 리신)2Y3Q4P5L6D7E8(엡실론 아실 리신)9D10K11T12L13Y14D15Q16F17M18L19Q20Q21G22-R2
상기 서열에서,
R1은 CH3, C(O)CH3, C(O)CH2CH3, C(O)CH2CH2CH3, C(O)CH(CH3)CH3, C(O)CH2CH2CH2CH3, C(O)CH(CH3)CH2CH3, C(O)C6H5, C(O)CH2CH2(CH2CH2O)1-5Me, 다이클로로벤조일(DCB), 다이플루오로벤조일(DFB), 피리딘일 카복실레이트(PyC) 또는 아미도-2-PEG, 지질 지방산기 또는 탄수화물이고;
R2는 OH, NH2, NH(CH3), NHCH2CH3, NHCH2CH2CH3, NHCH(CH3)CH3, NHCH2CH2CH2CH3, NHCH(CH3)CH2CH3, NHC6H5, NHCH2CH2OCH3, NHOCH3, NHOCH2CH3, 지질 지방산기 또는 탄수화물이며;
추가로 연결 잔기를 포함하고, 상기 연결 잔기는 (i) 항체의 결합 부위에 직접적으로 또는 중간 연결기를 통해 공유 결합될 수 있는 친핵성 측쇄를 포함하거나(상기 연결 잔기는 K, Y, T, 리신의 동종체(homolog), 호모시스테인, 호모세린, 다이아미노프로피온산 및 다이아미노뷰티르산으로 이루어진 군으로부터 선택되고, Q1, E8, (엡실론 아실 리신)9, K11, T12, D15, Q16, M18, L19 및 G22 중 하나를 포함하거나 치환한다) (ii) 항체의 결합 부위에 직접적으로 또는 중간 연결기를 통해 공유 결합될 수 있는 N-말단 또는 C-말단을 포함한다. - 제 1 항에 있어서,
연결 잔기가 K, Y, T, 다이아미노프로피온산 및 다이아미노뷰티르산으로 이루어진 군으로부터 선택되는, 화합물. - 제 2 항에 있어서,
연결 잔기가 K인, 화합물. - 제 3 항에 있어서,
(엡실론 아실 리신)9, K11, T12, D15, Q16, M18 및 L19 중 하나가 연결 잔기를 포함하거나 연결 잔기로 치환되는, 화합물. - 제 4 항에 있어서,
(엡실론 아실 리신)9 및 K11 중 하나가 연결 잔기를 포함하거나 연결 잔기로 치환되는, 화합물. - 제 5 항에 있어서,
K11이 연결 잔기를 포함하거나 또는 연결 잔기로 치환되는 화합물. - 제 1 항에 있어서,
R1이 C(O)CH3인, 화합물. - 제 1 항에 있어서,
R2가 NH2인, 화합물. - 하기 화학식 I 또는 IIa로 표시되는 화합물:
화학식 I
L-[AA 표적화제]
[화학식 IIa]
L'-[AA 표적화제]
상기 식에서,
[AA 표적화제]는 제 1 항에 따른 화합물이고;
L은 화학식 -X-Y-Z-를 갖는 직쇄 또는 분지쇄 연결 잔기이며;
L'는 화학식 -X-Y-Z'를 갖는 직쇄 또는 분지쇄 연결 잔기이고;
X는 연결 잔기에 부착되고, 하기 화학식 X로 표시되고;
화학식 X
상기 식에서,
v 및 w는 X의 주쇄 길이가 원자 6 내지 12개가 되도록 선택되고, Rb가 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C1 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C1 -6 알킬이고;
Y는 하기 화학식 IV 또는 V의 구조를 포함하는 인식기이고,
화학식 IV
화학식 V
상기 식에서, a, b, c, d, e 및 f는 각각 독립적으로 탄소이고, Y는 임의의 2개의 고리 위치에서 독립적으로 X 및 Z(또는 Z')에 부착되고;
Z가 존재하는 경우 하기 화학식 VI 또는 VII의 구조를 갖고, Z'가 존재하는 경우 하기 화학식 VIII 또는 IX의 구조를 갖고:
화학식 VI
화학식 VII
화학식 VIII
화학식 IX
상기 식에서,
q는 0 내지 5이고,
항체-N-은 존재하는 경우 항체의 결합 부위에 있는 측쇄와의 공유 결합이다. - 제 9 항에 있어서,
고리 구조 Y가 페닐인, 화합물. - 제 9 항에 있어서,
펩타이드가 서열 번호:139에 따른 서열을 포함하는, 화합물. - 제 9 항에 있어서,
Z 기가 항체의 결합 부위에 공유 결합으로 연결되어 있는, 화합물. - 제 14 항에 있어서,
항체가 촉매 항체인, 화합물. - 제 14 항에 있어서,
항체가 전장 항체; Fab; Fab'; F(ab')2; Fv; dsFv; scFv; VH; 다이어바디(diabody); 또는 h38c2로부터의 VH 및 VL 도메인을 포함하는 미니바디(minibody); 또는 h38c2로부터의 VH 및 VL 도메인, 및 IgG1, IgG2, IgG3 및 IgG4로 이루어진 군으로부터 선택된 불변 도메인을 포함하는 항체인, 화합물. - 제 14 항에 있어서,
항체가 h38c2 IgG1인, 화합물. - 제 14 항에 있어서,
항체가 알돌라제 촉매 항체인, 화합물. - 제 14 항에 있어서,
항체가 서열 번호:189 및 서열 번호:190을 포함하는, 화합물. - 하기 서열의 펩타이드를 포함하는 화합물:
R1-Q1x2x3Q4x5L6D7E8x9D10K11T12L13x14D15Q16x17M18L19Q20Q21G22-R2 (서열 번호:175)
상기 서열에서,
R1은 CH3, C(O)CH3, C(O)CH2CH3, C(O)CH2CH2CH3, C(O)CH(CH3)CH3, C(O)CH2CH2CH2CH3, C(O)CH(CH3)CH2CH3, C(O)C6H5, C(O)CH2CH2(CH2CH2O)1-5Me, 다이클로로벤조일(DCB), 다이플루오로벤조일(DFB), 피리딘일 카복실레이트(PyC) 또는 아미도-2-PEG, 아미노 보호기, 지질 지방산기 또는 탄수화물이고; 및
R2는 OH, NH2, NH(CH3), NHCH2CH3, NHCH2CH2CH3, NHCH(CH3)CH3, NHCH2CH2CH2CH3, NHCH(CH3)CH2CH3, NHC6H5, NHCH2CH2OCH3, NHOCH3, NHOCH2CH3, 카복시 보호기, 지질 지방산기 또는 탄수화물이며;
x2는 K, N, R, H, AcK, Nick 및 CbcK로 이루어진 군으로부터 선택되고,
x5는 P, hP, dhP 또는 BnHP 이고,
x9는 L, I, ThA, AcK로 이루어진 군으로부터 선택되고,
x3, x14 및 x17은 각각 독립적으로 임의의 방향족 아미노산 잔기이고; 및
상기 서열에서, 9번째, 11번째, 12번째, 15번째, 16번째, 18번째 및 19번째 위치의 잔기 중 하나는, 항체의 결합 부위에 중간 연결기 L'를 통해 공유 결합으로 연결된 친핵성 측쇄를 포함하는 연결 잔기이고,
상기 연결 잔기는 K, R, Y, C, T, S, 호모시스테인, 호모세린, Dap, 및 Dab 또는 N-말단 또는 C-말단을 포함하는 군으로부터 선택되고; 및
상기 연결기 L'는 화학식 -X-Y-Z'를 갖고;
X는 연결 잔기에 부착되고, 하기 화학식 X로 표시되고;
화학식 X
상기 식에서,
v 및 w는 X의 주쇄 길이가 원자 6 내지 12개가 되도록 선택되고, Rb가 수소, 치환되거나 치환되지 않은 C1 -10 알킬, 치환되거나 치환되지 않은 C3 -7 사이클로알킬-C1 -6 알킬, 또는 치환되거나 치환되지 않은 아릴-C1 -6 알킬이고; 및
Y는 하기 화학식 IV 또는 V의 구조를 포함하는 인식기이고,
화학식 IV
화학식 V
상기 식에서, a, b, c, d, e 및 f는 각각 독립적으로 탄소이고, Y는 임의의 2개의 고리 위치에서 독립적으로 X 및 Z(또는 Z')에 부착되고; 및
Z'는 하기 화학식 VIII 또는 IX의 구조를 갖고:
화학식 VIII
화학식 IX
상기 식에서,
q는 0 내지 5이고,
항체-N-은 존재하는 경우 항체의 결합 부위에 있는 측쇄와의 공유 결합이다. - 제 22 항에 있어서,
고리 구조 Y가 페닐인, 화합물. - 제 22 항에 있어서,
서열 번호:23, 서열 번호:65, 서열 번호:66, 서열 번호:69, 서열 번호:70, 서열 번호:71, 서열 번호:74, 서열 번호:75, 서열 번호:76, 서열 번호:77, 서열 번호:78, 서열 번호:82, 서열 번호:83, 서열 번호:84, 서열 번호:85, 서열 번호:86, 서열 번호:87, 서열 번호:88, 서열 번호:89, 서열 번호:90, 서열 번호:91, 서열 번호:92, 서열 번호:93, 서열 번호:95, 서열 번호:96, 서열 번호:97, 서열 번호:98, 서열 번호:99, 서열 번호:100, 서열 번호:101, 서열 번호:103, 및 서열 번호:104로 이루어진 군으로부터 선택된 서열을 포함하는, 화합물. - 제 22 항에 있어서,
연결 잔기는 11번째, 16번째 및 18번째 잔기 위치로 이루어진 군에서 선택된 잔기 위치에 위치하는, 화합물. - 제 22 항에 있어서,
연결 잔기는 11번째 잔기 위치에 위치하는, 화합물. - 제 22 항에 있어서,
R1은 C(O)CH3인, 화합물. - 제 22 항에 있어서,
R2는 NH2인, 화합물. - 제 22 항에 있어서,
x3은 Y이고, x17은 F인, 화합물. - 제 22 항에 있어서,
x2는 AcK인, 화합물. - 제 22 항에 있어서,
x5는 P인, 화합물. - 제 22 항에 있어서,
x14는 Y인, 화합물. - 제 22 항에 있어서,
x9는 L 또는 AcK인, 화합물. - 제 22 항에 있어서,
항체가 알돌라제 촉매 항체인, 화합물. - 제 22 항에 있어서,
항체가 전장 항체; Fab; Fab'; F(ab')2; Fv; dsFv; scFv; VH; 다이어바디(diabody); 또는 h38c2로부터의 VH 및 VL 도메인을 포함하는 미니바디(minibody); 또는 h38c2로부터의 VH 및 VL 도메인, 및 IgG1, IgG2, IgG3 및 IgG4로 이루어진 군으로부터 선택된 불변 도메인을 포함하는 항체인, 화합물. - 제 22 항에 있어서,
항체가 h38c2 IgG1인, 화합물. - 제 22 항에 있어서,
항체가 서열 번호:189 및 서열 번호:190을 포함하는, 화합물 - 치료 효과량의 제 1 항에 따른 화합물을 포함하는, 혈관 신생을 억제하거나 감소시키기 위한 약학 조성물.
- 제 40 항에 있어서,
치료 효과량의 하나 이상의 화학 치료제를 추가로 포함하는, 약학 조성물. - 제 41 항에 있어서,
화학 치료제는 알데스류킨, 알렘투주마브, 알리트레티노인, 알로퓨리놀, 알트레타민, 아나스트로졸, 삼산화비소, 아스파라기나제, 베바시주마브, 벡사로텐 캡슐, 벡사로텐 겔, 블레오마이신, 부설판 정맥내용, 부설판 경구용, 칼루스테론, 카페시타빈, 카보플라틴, 카무스틴, 셀레콕시브, 세툭시마브, 클로르암부실, 시나칼쳇, 시스플라틴, 클라드리빈, 클로파라빈, 사이클로포스파마이드, 사이타라빈, 다카바진, 닥티노마이신, 악티노마이신 D, 다니류킨 디프티톡스, 다베포에틴 알파, 다우노루비신, 덱스라족세인, 도세탁셀, 독소루비신, 드로모스타놀론, 프로피온에이트, 엘리옷의 B 용액, 에포에틴 알파/베타, 얼로티니브, 에스트라머스틴, 에토포사이드 포스페이트, 에토포사이드, 엑세메스테인, 필그라스팀, 플록수리딘, 플루다라빈, 플루오로우라실, 풀베스트란트, 겜시타빈, 겜투주마브 오조가미신, 고세렐린 아세테이트, 하이드록시우레아, 이브리투모마브 티욱세탄, 이다루비신, 이포스파마이드, 이마티니브 메실레이트, 인터페론 알파-2a, 이리노테칸, 레트로졸, 류코보린, 레바미솔, 로무스틴, 메클로레타민, 나이트로젠 머스타드, 메게스트롤 아세테이트, 멜팔란, 머캅토퓨린, 메스나, 메토트렉세이트, 메톡살렌, 미토마이신, 미토테인, 미토잔트론, 난드롤론 펜프로피온에이트, 넬라라바인, 노페투모마브, 오프렐베킨, 옥살리플라틴, 파클리탁셀, 팔로노세트론, 파미드로네이트, 페가데마세, 페가스파가세, 페그필그라스팀, 페메트렉세드, 펜토스타틴, 피포브로만, 플리카마이신, 미트라마이신, 포피머 소듐, 프로카바진, 라스버리카제, 리툭시마브, 사그라모스팀, 스트렙토조신, 활석, 타목시펜, 테모졸로마이드, 테니포사이드, 테스토락톤, 티오구아닌, 티오테파, 토포테칸, 토레미펜, 토시투모마브, 트라스투주마브, 트레티노인, 우라실 머스타드, 발루비신, 빈블라스틴, 빈크리스틴, 비노렐빈, 졸레드로네이트, 소라페니브, 수텐트, 탈로미드, 레블리미드, 바탈라니브, ZD-6474, 네오바스타트, GSK-786024, AEE-788, AG-13736, AMG706, AZD-2171, BIBF-1120, CP-547,632, 미도스타우린, SU-6668, CDP-791, PI-88, PCK-3145, 아티프리모드, A6, 안지오스타틴, 실렌기타이드, 에노드스타틴, rPF4, 비타킨, 볼로식시마브, 2-메톡시에스트라다이올, AP-23573, 캔서티니브, 액티미드, 컴브레타스타틴 A4 전구약물, 엔도 택 1, 엔자스타우린, 세플라토닌, 실리파이드, INGN-241, OSI-461, 파투필론, 스쿠알라민, 타세디날린, UCN-01, UK-356202, 프레드니솔론, 메틸-프레드니솔론, 덱사메타손 및 에피루비신으로 이루어진 군으로부터 선택되는, 약학 조성물. - 제 42 항에 있어서,
화학 치료제는 5-플루오로우라실, 이리노테칸, 옥실라플라틴, 베바시주마브 및 세툭시마브로 이루어진 군으로부터 선택된 화합물인, 약학 조성물. - 제 40 항에 있어서,
관절염, 건선, 감염 또는 외과 수술과 관련된 눈의 혈관 신생, 황반 변성, 당뇨병성 망막병증 및 암으로 이루어진 군으로부터 선택된 질환을 치료 또는 예방하는데 사용하기 위한, 약학 조성물. - 제 44 항에 있어서,
암은 유방, 결장, 직장, 폐, 구인두, 하인두, 식도, 위, 췌장, 간, 담낭 및 담관, 소장, 요로, 여성 생식관, 남성 생식관, 내분비선 및 피부의 암종; 혈관종; 흑색종; 육종; 뇌, 신경, 눈 및 뇌막의 종양; 백혈병; 또는 림프종을 포함하는, 약학 조성물. - 치료 효과량의 제 9 항에 따른 화합물을 포함하는, 혈관 신생을 억제하거나 감소시키기 위한 약학 조성물.
- 제 46 항에 있어서,
치료 효과량의 하나 이상의 화학 치료제를 추가로 포함하는, 약학 조성물. - 제 47 항에 있어서,
화학 치료제는 알데스류킨, 알렘투주마브, 알리트레티노인, 알로퓨리놀, 알트레타민, 아나스트로졸, 삼산화비소, 아스파라기나제, 베바시주마브, 벡사로텐 캡슐, 벡사로텐 겔, 블레오마이신, 부설판 정맥내용, 부설판 경구용, 칼루스테론, 카페시타빈, 카보플라틴, 카무스틴, 셀레콕시브, 세툭시마브, 클로르암부실, 시나칼쳇, 시스플라틴, 클라드리빈, 클로파라빈, 사이클로포스파마이드, 사이타라빈, 다카바진, 닥티노마이신, 악티노마이신 D, 다니류킨 디프티톡스, 다베포에틴 알파, 다우노루비신, 덱스라족세인, 도세탁셀, 독소루비신, 드로모스타놀론, 프로피온에이트, 엘리옷의 B 용액, 에포에틴 알파/베타, 얼로티니브, 에스트라머스틴, 에토포사이드 포스페이트, 에토포사이드, 엑세메스테인, 필그라스팀, 플록수리딘, 플루다라빈, 플루오로우라실, 풀베스트란트, 겜시타빈, 겜투주마브 오조가미신, 고세렐린 아세테이트, 하이드록시우레아, 이브리투모마브 티욱세탄, 이다루비신, 이포스파마이드, 이마티니브 메실레이트, 인터페론 알파-2a, 이리노테칸, 레트로졸, 류코보린, 레바미솔, 로무스틴, 메클로레타민, 나이트로젠 머스타드, 메게스트롤 아세테이트, 멜팔란, 머캅토퓨린, 메스나, 메토트렉세이트, 메톡살렌, 미토마이신, 미토테인, 미토잔트론, 난드롤론 펜프로피온에이트, 넬라라바인, 노페투모마브, 오프렐베킨, 옥살리플라틴, 파클리탁셀, 팔로노세트론, 파미드로네이트, 페가데마세, 페가스파가세, 페그필그라스팀, 페메트렉세드, 펜토스타틴, 피포브로만, 플리카마이신, 미트라마이신, 포피머 소듐, 프로카바진, 라스버리카제, 리툭시마브, 사그라모스팀, 스트렙토조신, 활석, 타목시펜, 테모졸로마이드, 테니포사이드, 테스토락톤, 티오구아닌, 티오테파, 토포테칸, 토레미펜, 토시투모마브, 트라스투주마브, 트레티노인, 우라실 머스타드, 발루비신, 빈블라스틴, 빈크리스틴, 비노렐빈, 졸레드로네이트, 소라페니브, 수텐트, 탈로미드, 레블리미드, 바탈라니브, ZD-6474, 네오바스타트, GSK-786024, AEE-788, AG-13736, AMG706, AZD-2171, BIBF-1120, CP-547,632, 미도스타우린, SU-6668, CDP-791, PI-88, PCK-3145, 아티프리모드, A6, 안지오스타틴, 실렌기타이드, 에노드스타틴, rPF4, 비타킨, 볼로식시마브, 2-메톡시에스트라다이올, AP-23573, 캔서티니브, 액티미드, 컴브레타스타틴 A4 전구약물, 엔도 택 1, 엔자스타우린, 세플라토닌, 실리파이드, INGN-241, OSI-461, 파투필론, 스쿠알라민, 타세디날린, UCN-01, UK-356202, 프레드니솔론, 메틸-프레드니솔론, 덱사메타손 및 에피루비신으로 이루어진 군으로부터 선택되는, 약학 조성물. - 제 48 항에 있어서,
화학 치료제는 5-플루오로우라실, 이리노테칸, 옥실라플라틴, 베바시주마브 및 세툭시마브로 이루어진 군으로부터 선택된 화합물인, 약학 조성물. - 제 46 항에 있어서,
관절염, 건선, 감염 또는 외과 수술과 관련된 눈의 혈관 신생, 황반 변성, 당뇨병성 망막병증 및 암으로 이루어진 군으로부터 선택된 질환을 치료 또는 예방하는데 사용하기 위한, 약학 조성물. - 제 50 항에 있어서,
암은 유방, 결장, 직장, 폐, 구인두, 하인두, 식도, 위, 췌장, 간, 담낭 및 담관, 소장, 요로, 여성 생식관, 남성 생식관, 내분비선 및 피부의 암종; 혈관종; 흑색종; 육종; 뇌, 신경, 눈 및 뇌막의 종양; 백혈병; 또는 림프종을 포함하는, 약학 조성물. - 치료 효과량의 제 21 항에 따른 화합물을 포함하는, 혈관 신생을 억제하거나 감소시키기 위한 약학 조성물.
- 제 52 항에 있어서,
치료 효과량의 하나 이상의 화학 치료제를 추가로 포함하는, 약학 조성물. - 제 53 항에 있어서,
화학 치료제는 알데스류킨, 알렘투주마브, 알리트레티노인, 알로퓨리놀, 알트레타민, 아나스트로졸, 삼산화비소, 아스파라기나제, 베바시주마브, 벡사로텐 캡슐, 벡사로텐 겔, 블레오마이신, 부설판 정맥내용, 부설판 경구용, 칼루스테론, 카페시타빈, 카보플라틴, 카무스틴, 셀레콕시브, 세툭시마브, 클로르암부실, 시나칼쳇, 시스플라틴, 클라드리빈, 클로파라빈, 사이클로포스파마이드, 사이타라빈, 다카바진, 닥티노마이신, 악티노마이신 D, 다니류킨 디프티톡스, 다베포에틴 알파, 다우노루비신, 덱스라족세인, 도세탁셀, 독소루비신, 드로모스타놀론, 프로피온에이트, 엘리옷의 B 용액, 에포에틴 알파/베타, 얼로티니브, 에스트라머스틴, 에토포사이드 포스페이트, 에토포사이드, 엑세메스테인, 필그라스팀, 플록수리딘, 플루다라빈, 플루오로우라실, 풀베스트란트, 겜시타빈, 겜투주마브 오조가미신, 고세렐린 아세테이트, 하이드록시우레아, 이브리투모마브 티욱세탄, 이다루비신, 이포스파마이드, 이마티니브 메실레이트, 인터페론 알파-2a, 이리노테칸, 레트로졸, 류코보린, 레바미솔, 로무스틴, 메클로레타민, 나이트로젠 머스타드, 메게스트롤 아세테이트, 멜팔란, 머캅토퓨린, 메스나, 메토트렉세이트, 메톡살렌, 미토마이신, 미토테인, 미토잔트론, 난드롤론 펜프로피온에이트, 넬라라바인, 노페투모마브, 오프렐베킨, 옥살리플라틴, 파클리탁셀, 팔로노세트론, 파미드로네이트, 페가데마세, 페가스파가세, 페그필그라스팀, 페메트렉세드, 펜토스타틴, 피포브로만, 플리카마이신, 미트라마이신, 포피머 소듐, 프로카바진, 라스버리카제, 리툭시마브, 사그라모스팀, 스트렙토조신, 활석, 타목시펜, 테모졸로마이드, 테니포사이드, 테스토락톤, 티오구아닌, 티오테파, 토포테칸, 토레미펜, 토시투모마브, 트라스투주마브, 트레티노인, 우라실 머스타드, 발루비신, 빈블라스틴, 빈크리스틴, 비노렐빈, 졸레드로네이트, 소라페니브, 수텐트, 탈로미드, 레블리미드, 바탈라니브, ZD-6474, 네오바스타트, GSK-786024, AEE-788, AG-13736, AMG706, AZD-2171, BIBF-1120, CP-547,632, 미도스타우린, SU-6668, CDP-791, PI-88, PCK-3145, 아티프리모드, A6, 안지오스타틴, 실렌기타이드, 에노드스타틴, rPF4, 비타킨, 볼로식시마브, 2-메톡시에스트라다이올, AP-23573, 캔서티니브, 액티미드, 컴브레타스타틴 A4 전구약물, 엔도 택 1, 엔자스타우린, 세플라토닌, 실리파이드, INGN-241, OSI-461, 파투필론, 스쿠알라민, 타세디날린, UCN-01, UK-356202, 프레드니솔론, 메틸-프레드니솔론, 덱사메타손 및 에피루비신으로 이루어진 군으로부터 선택되는, 약학 조성물. - 제 53 항에 있어서,
화학 치료제는 5-플루오로우라실, 이리노테칸, 옥실라플라틴, 베바시주마브 및 세툭시마브로 이루어진 군으로부터 선택된 화합물인, 약학 조성물. - 제 52 항에 있어서,
관절염, 건선, 감염 또는 외과 수술과 관련된 눈의 혈관 신생, 황반 변성, 당뇨병성 망막병증 및 암으로 이루어진 군으로부터 선택된 질환을 치료 또는 예방하는데 사용하기 위한, 약학 조성물. - 제 56 항에 있어서,
암은 유방, 결장, 직장, 폐, 구인두, 하인두, 식도, 위, 췌장, 간, 담낭 및 담관, 소장, 요로, 여성 생식관, 남성 생식관, 내분비선 및 피부의 암종; 혈관종; 흑색종; 육종; 뇌, 신경, 눈 및 뇌막의 종양; 백혈병; 또는 림프종을 포함하는, 약학 조성물. - 치료 효과량의 제 22 항에 따른 화합물을 포함하는, 혈관 신생을 억제하거나 감소시키기 위한 약학 조성물.
- 제 58 항에 있어서,
치료 효과량의 하나 이상의 화학 치료제를 추가로 포함하는, 약학 조성물. - 제 59 항에 있어서,
화학 치료제는 알데스류킨, 알렘투주마브, 알리트레티노인, 알로퓨리놀, 알트레타민, 아나스트로졸, 삼산화비소, 아스파라기나제, 베바시주마브, 벡사로텐 캡슐, 벡사로텐 겔, 블레오마이신, 부설판 정맥내용, 부설판 경구용, 칼루스테론, 카페시타빈, 카보플라틴, 카무스틴, 셀레콕시브, 세툭시마브, 클로르암부실, 시나칼쳇, 시스플라틴, 클라드리빈, 클로파라빈, 사이클로포스파마이드, 사이타라빈, 다카바진, 닥티노마이신, 악티노마이신 D, 다니류킨 디프티톡스, 다베포에틴 알파, 다우노루비신, 덱스라족세인, 도세탁셀, 독소루비신, 드로모스타놀론, 프로피온에이트, 엘리옷의 B 용액, 에포에틴 알파/베타, 얼로티니브, 에스트라머스틴, 에토포사이드 포스페이트, 에토포사이드, 엑세메스테인, 필그라스팀, 플록수리딘, 플루다라빈, 플루오로우라실, 풀베스트란트, 겜시타빈, 겜투주마브 오조가미신, 고세렐린 아세테이트, 하이드록시우레아, 이브리투모마브 티욱세탄, 이다루비신, 이포스파마이드, 이마티니브 메실레이트, 인터페론 알파-2a, 이리노테칸, 레트로졸, 류코보린, 레바미솔, 로무스틴, 메클로레타민, 나이트로젠 머스타드, 메게스트롤 아세테이트, 멜팔란, 머캅토퓨린, 메스나, 메토트렉세이트, 메톡살렌, 미토마이신, 미토테인, 미토잔트론, 난드롤론 펜프로피온에이트, 넬라라바인, 노페투모마브, 오프렐베킨, 옥살리플라틴, 파클리탁셀, 팔로노세트론, 파미드로네이트, 페가데마세, 페가스파가세, 페그필그라스팀, 페메트렉세드, 펜토스타틴, 피포브로만, 플리카마이신, 미트라마이신, 포피머 소듐, 프로카바진, 라스버리카제, 리툭시마브, 사그라모스팀, 스트렙토조신, 활석, 타목시펜, 테모졸로마이드, 테니포사이드, 테스토락톤, 티오구아닌, 티오테파, 토포테칸, 토레미펜, 토시투모마브, 트라스투주마브, 트레티노인, 우라실 머스타드, 발루비신, 빈블라스틴, 빈크리스틴, 비노렐빈, 졸레드로네이트, 소라페니브, 수텐트, 탈로미드, 레블리미드, 바탈라니브, ZD-6474, 네오바스타트, GSK-786024, AEE-788, AG-13736, AMG706, AZD-2171, BIBF-1120, CP-547,632, 미도스타우린, SU-6668, CDP-791, PI-88, PCK-3145, 아티프리모드, A6, 안지오스타틴, 실렌기타이드, 에노드스타틴, rPF4, 비타킨, 볼로식시마브, 2-메톡시에스트라다이올, AP-23573, 캔서티니브, 액티미드, 컴브레타스타틴 A4 전구약물, 엔도 택 1, 엔자스타우린, 세플라토닌, 실리파이드, INGN-241, OSI-461, 파투필론, 스쿠알라민, 타세디날린, UCN-01, UK-356202, 프레드니솔론, 메틸-프레드니솔론, 덱사메타손 및 에피루비신으로 이루어진 군으로부터 선택되는, 약학 조성물. - 제 59 항에 있어서,
화학 치료제는 5-플루오로우라실, 이리노테칸, 옥실라플라틴, 베바시주마브 및 세툭시마브로 이루어진 군으로부터 선택된 화합물인, 약학 조성물. - 제 58 항에 있어서,
관절염, 건선, 감염 또는 외과 수술과 관련된 눈의 혈관 신생, 황반 변성, 당뇨병성 망막병증 및 암으로 이루어진 군으로부터 선택된 질환을 치료 또는 예방하는데 사용하기 위한, 약학 조성물. - 제 62 항에 있어서,
암은 유방, 결장, 직장, 폐, 구인두, 하인두, 식도, 위, 췌장, 간, 담낭 및 담관, 소장, 요로, 여성 생식관, 남성 생식관, 내분비선 및 피부의 암종; 혈관종; 흑색종; 육종; 뇌, 신경, 눈 및 뇌막의 종양; 백혈병; 또는 림프종을 포함하는, 약학 조성물. - 치료 효과량의 제 35 항에 따른 화합물을 포함하는, 혈관 신생을 억제하거나 감소시키기 위한 약학 조성물.
- 제 64 항에 있어서,
치료 효과량의 하나 이상의 화학 치료제를 추가로 포함하는, 약학 조성물. - 제 65 항에 있어서,
화학 치료제는 알데스류킨, 알렘투주마브, 알리트레티노인, 알로퓨리놀, 알트레타민, 아나스트로졸, 삼산화비소, 아스파라기나제, 베바시주마브, 벡사로텐 캡슐, 벡사로텐 겔, 블레오마이신, 부설판 정맥내용, 부설판 경구용, 칼루스테론, 카페시타빈, 카보플라틴, 카무스틴, 셀레콕시브, 세툭시마브, 클로르암부실, 시나칼쳇, 시스플라틴, 클라드리빈, 클로파라빈, 사이클로포스파마이드, 사이타라빈, 다카바진, 닥티노마이신, 악티노마이신 D, 다니류킨 디프티톡스, 다베포에틴 알파, 다우노루비신, 덱스라족세인, 도세탁셀, 독소루비신, 드로모스타놀론, 프로피온에이트, 엘리옷의 B 용액, 에포에틴 알파/베타, 얼로티니브, 에스트라머스틴, 에토포사이드 포스페이트, 에토포사이드, 엑세메스테인, 필그라스팀, 플록수리딘, 플루다라빈, 플루오로우라실, 풀베스트란트, 겜시타빈, 겜투주마브 오조가미신, 고세렐린 아세테이트, 하이드록시우레아, 이브리투모마브 티욱세탄, 이다루비신, 이포스파마이드, 이마티니브 메실레이트, 인터페론 알파-2a, 이리노테칸, 레트로졸, 류코보린, 레바미솔, 로무스틴, 메클로레타민, 나이트로젠 머스타드, 메게스트롤 아세테이트, 멜팔란, 머캅토퓨린, 메스나, 메토트렉세이트, 메톡살렌, 미토마이신, 미토테인, 미토잔트론, 난드롤론 펜프로피온에이트, 넬라라바인, 노페투모마브, 오프렐베킨, 옥살리플라틴, 파클리탁셀, 팔로노세트론, 파미드로네이트, 페가데마세, 페가스파가세, 페그필그라스팀, 페메트렉세드, 펜토스타틴, 피포브로만, 플리카마이신, 미트라마이신, 포피머 소듐, 프로카바진, 라스버리카제, 리툭시마브, 사그라모스팀, 스트렙토조신, 활석, 타목시펜, 테모졸로마이드, 테니포사이드, 테스토락톤, 티오구아닌, 티오테파, 토포테칸, 토레미펜, 토시투모마브, 트라스투주마브, 트레티노인, 우라실 머스타드, 발루비신, 빈블라스틴, 빈크리스틴, 비노렐빈, 졸레드로네이트, 소라페니브, 수텐트, 탈로미드, 레블리미드, 바탈라니브, ZD-6474, 네오바스타트, GSK-786024, AEE-788, AG-13736, AMG706, AZD-2171, BIBF-1120, CP-547,632, 미도스타우린, SU-6668, CDP-791, PI-88, PCK-3145, 아티프리모드, A6, 안지오스타틴, 실렌기타이드, 에노드스타틴, rPF4, 비타킨, 볼로식시마브, 2-메톡시에스트라다이올, AP-23573, 캔서티니브, 액티미드, 컴브레타스타틴 A4 전구약물, 엔도 택 1, 엔자스타우린, 세플라토닌, 실리파이드, INGN-241, OSI-461, 파투필론, 스쿠알라민, 타세디날린, UCN-01, UK-356202, 프레드니솔론, 메틸-프레드니솔론, 덱사메타손 및 에피루비신으로 이루어진 군으로부터 선택되는, 약학 조성물. - 제 65 항에 있어서,
화학 치료제는 5-플루오로우라실, 이리노테칸, 옥실라플라틴, 베바시주마브 및 세툭시마브로 이루어진 군으로부터 선택된 화합물인, 약학 조성물. - 제 64 항에 있어서,
관절염, 건선, 감염 또는 외과 수술과 관련된 눈의 혈관 신생, 황반 변성, 당뇨병성 망막병증 및 암으로 이루어진 군으로부터 선택된 질환을 치료 또는 예방하는데 사용하기 위한, 약학 조성물. - 제 68 항에 있어서,
암은 유방, 결장, 직장, 폐, 구인두, 하인두, 식도, 위, 췌장, 간, 담낭 및 담관, 소장, 요로, 여성 생식관, 남성 생식관, 내분비선 및 피부의 암종; 혈관종; 흑색종; 육종; 뇌, 신경, 눈 및 뇌막의 종양; 백혈병; 또는 림프종을 포함하는, 약학 조성물.
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US86536006P | 2006-11-10 | 2006-11-10 | |
| US60/865,360 | 2006-11-10 | ||
| US93983007P | 2007-05-23 | 2007-05-23 | |
| US60/939,830 | 2007-05-23 | ||
| US94532907P | 2007-06-20 | 2007-06-20 | |
| US60/945,329 | 2007-06-20 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020097011924A Division KR101309948B1 (ko) | 2006-11-10 | 2007-11-12 | 혈관 신생 억제 화합물 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120043028A true KR20120043028A (ko) | 2012-05-03 |
Family
ID=39364902
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127005049A KR20120043028A (ko) | 2006-11-10 | 2007-11-12 | 혈관 신생 억제 화합물 |
| KR1020097011924A KR101309948B1 (ko) | 2006-11-10 | 2007-11-12 | 혈관 신생 억제 화합물 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020097011924A KR101309948B1 (ko) | 2006-11-10 | 2007-11-12 | 혈관 신생 억제 화합물 |
Country Status (18)
| Country | Link |
|---|---|
| US (3) | US8288349B2 (ko) |
| EP (2) | EP2089425B1 (ko) |
| JP (2) | JP4897050B2 (ko) |
| KR (2) | KR20120043028A (ko) |
| CN (1) | CN101611053B (ko) |
| AT (1) | ATE520712T1 (ko) |
| AU (1) | AU2007318912B2 (ko) |
| BR (1) | BRPI0718591A2 (ko) |
| CA (1) | CA2669207A1 (ko) |
| DK (1) | DK2089425T3 (ko) |
| IL (1) | IL198581A (ko) |
| MX (1) | MX2009005045A (ko) |
| MY (1) | MY146985A (ko) |
| NO (1) | NO20092203L (ko) |
| NZ (1) | NZ576751A (ko) |
| PL (1) | PL2089425T3 (ko) |
| PT (1) | PT2089425E (ko) |
| WO (1) | WO2008056346A2 (ko) |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MY146985A (en) * | 2006-11-10 | 2012-10-15 | Covx Technologies Ireland Ltd | Anti-angiogenic compounds |
| US20090098130A1 (en) * | 2007-01-05 | 2009-04-16 | Bradshaw Curt W | Glucagon-like protein-1 receptor (glp-1r) agonist compounds |
| US8293714B2 (en) | 2008-05-05 | 2012-10-23 | Covx Technology Ireland, Ltd. | Anti-angiogenic compounds |
| WO2010036930A1 (en) * | 2008-09-26 | 2010-04-01 | Javad Parvizi | Methods and kits for detecting joint infection |
| WO2012007896A1 (en) * | 2010-07-12 | 2012-01-19 | Covx Technologies Ireland, Ltd. | Multifunctional antibody conjugates |
| RU2013118441A (ru) | 2010-11-05 | 2014-12-10 | КовЭкс Текнолоджиз Айэлэнд Лимитед | Антидиабетические соединения |
| EP2726088B1 (en) | 2011-06-29 | 2019-01-02 | Amgen Inc. | Predictive biomarker of survival in the treatment of renal cell carcinoma |
| RU2014124989A (ru) * | 2011-12-20 | 2016-02-10 | Пфайзер Инк. | Улучшенные способы получения пептидных конъюгатов и линкеров |
| EP2802355B1 (en) * | 2012-01-09 | 2018-09-05 | CovX Technologies Ireland Limited | Mutant antibodies and conjugation thereof |
| JP6219923B2 (ja) | 2012-03-28 | 2017-10-25 | アムジェン インコーポレイテッド | Dr5受容体アゴニストの組み合わせ |
| CN111875670A (zh) | 2013-06-12 | 2020-11-03 | 法瑞斯生物技术有限公司 | 对天然cxcr4具有拮抗活性的肽 |
| WO2015014376A1 (en) * | 2013-07-31 | 2015-02-05 | Biontech Ag | Diagnosis and therapy of cancer involving cancer stem cells |
| EA201690780A1 (ru) * | 2013-10-15 | 2016-08-31 | Сиэтл Дженетикс, Инк. | Пегилированные лекарственные средства-линкеры для улучшенной фармакокинетики конъюгатов лиганд-лекарственное средство |
| US20190004048A1 (en) | 2015-06-26 | 2019-01-03 | Amgen Inc. | Biomarker of Survival in the Treatment of Renal Cell Carcinoma with a VEGFR Inhibitor and an Ang2 Inhibitor |
| US11793880B2 (en) | 2015-12-04 | 2023-10-24 | Seagen Inc. | Conjugates of quaternized tubulysin compounds |
| AU2016363013B2 (en) | 2015-12-04 | 2022-03-10 | Seagen Inc. | Conjugates of quaternized tubulysin compounds |
| EA201892040A1 (ru) | 2016-03-25 | 2019-04-30 | Сиэтл Дженетикс, Инк. | Способ получения пегилированных соединений лекарственный препарат - линкер и их промежуточных соединений |
| CN110637027B (zh) | 2017-02-08 | 2024-08-30 | 百时美施贵宝公司 | 包含药代动力学增强子的修饰的松弛素多肽及其用途 |
| CA3056134A1 (en) | 2017-03-24 | 2018-09-27 | Seattle Genetics, Inc. | Process for the preparation of glucuronide drug-linkers and intermediates thereof |
| EP3617235A4 (en) | 2017-04-28 | 2020-12-16 | Ajinomoto Co., Inc. | ASSOCIATION WITH A SUBSTANCE WITH AFFINITY TO SOLUBLE PROTEIN, FITTABLE PART AND REACTIVE GROUP OR SALT THEREOF |
Family Cites Families (28)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3719667A (en) | 1970-08-24 | 1973-03-06 | Lilly Co Eli | Epimerization of 6-acylamido and 6-imido penicillin sulfoxide esters |
| US3840556A (en) | 1971-05-28 | 1974-10-08 | Lilly Co Eli | Penicillin conversion by halogen electrophiles and anti-bacterials derived thereby |
| US5567610A (en) | 1986-09-04 | 1996-10-22 | Bioinvent International Ab | Method of producing human monoclonal antibodies and kit therefor |
| US5216132A (en) | 1990-01-12 | 1993-06-01 | Protein Design Labs, Inc. | Soluble t-cell antigen receptor chimeric antigens |
| DK0527798T3 (da) | 1990-04-06 | 1997-12-15 | Jolla Cancer Res Found | Fremgangsmåde og sammensætning til behandling af thrombose |
| US5229275A (en) | 1990-04-26 | 1993-07-20 | Akzo N.V. | In-vitro method for producing antigen-specific human monoclonal antibodies |
| ES2136092T3 (es) | 1991-09-23 | 1999-11-16 | Medical Res Council | Procedimientos para la produccion de anticuerpos humanizados. |
| US6080840A (en) | 1992-01-17 | 2000-06-27 | Slanetz; Alfred E. | Soluble T cell receptors |
| US5573905A (en) | 1992-03-30 | 1996-11-12 | The Scripps Research Institute | Encoded combinatorial chemical libraries |
| US5981478A (en) | 1993-11-24 | 1999-11-09 | La Jolla Cancer Research Foundation | Integrin-binding peptides |
| US5733757A (en) | 1995-12-15 | 1998-03-31 | The Scripps Research Institute | Aldolase catalytic antibody |
| US5739277A (en) | 1995-04-14 | 1998-04-14 | Genentech Inc. | Altered polypeptides with increased half-life |
| DE19544393A1 (de) | 1995-11-15 | 1997-05-22 | Hoechst Schering Agrevo Gmbh | Synergistische herbizide Mischungen |
| GB9722131D0 (en) | 1997-10-20 | 1997-12-17 | Medical Res Council | Method |
| US6326176B1 (en) | 1997-12-18 | 2001-12-04 | The Scripps Research Institute | Aldol condensations by catalytic antibodies |
| JP2003516121A (ja) | 1999-09-27 | 2003-05-13 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア | 不可逆的に結合するエンジニアリング抗体 |
| US6294374B1 (en) | 1999-10-08 | 2001-09-25 | The Scripps Research Institute | Use of catalytic antibodies for synthesizing epothilone |
| DE60237282D1 (de) | 2001-06-28 | 2010-09-23 | Domantis Ltd | Doppelspezifischer ligand und dessen verwendung |
| US20030045477A1 (en) | 2001-07-26 | 2003-03-06 | Fortuna Haviv | Peptides having antiangiogenic activity |
| US7138370B2 (en) | 2001-10-11 | 2006-11-21 | Amgen Inc. | Specific binding agents of human angiopoietin-2 |
| US7205275B2 (en) * | 2001-10-11 | 2007-04-17 | Amgen Inc. | Methods of treatment using specific binding agents of human angiopoietin-2 |
| EP2428226A1 (en) * | 2001-10-22 | 2012-03-14 | The Scripps Research Institute | Antibody targeting compounds |
| US6737524B2 (en) * | 2002-03-25 | 2004-05-18 | Paul K. Smith | Activated polyethylene glycol compounds |
| DK1517921T3 (da) | 2002-06-28 | 2006-10-09 | Domantis Ltd | Immunglobulin-enkeltvariable antigen-bindende domæner og dobbeltspecifikke konstruktioner deraf |
| CA2511910A1 (en) | 2002-12-27 | 2004-07-15 | Domantis Limited | Dual specific single domain antibodies specific for a ligand and for the receptor of the ligand |
| US8143380B2 (en) | 2004-07-08 | 2012-03-27 | Amgen Inc. | Therapeutic peptides |
| JP5017116B2 (ja) | 2004-09-24 | 2012-09-05 | アムジエン・インコーポレーテツド | 修飾Fc分子 |
| MY146985A (en) * | 2006-11-10 | 2012-10-15 | Covx Technologies Ireland Ltd | Anti-angiogenic compounds |
-
2007
- 2007-11-12 MY MYPI20091889A patent/MY146985A/en unknown
- 2007-11-12 JP JP2009535878A patent/JP4897050B2/ja not_active Expired - Fee Related
- 2007-11-12 US US11/938,766 patent/US8288349B2/en not_active Expired - Fee Related
- 2007-11-12 CA CA002669207A patent/CA2669207A1/en not_active Abandoned
- 2007-11-12 WO PCT/IE2007/000110 patent/WO2008056346A2/en active Application Filing
- 2007-11-12 EP EP07827123A patent/EP2089425B1/en not_active Not-in-force
- 2007-11-12 EP EP20110170480 patent/EP2368908A3/en not_active Withdrawn
- 2007-11-12 KR KR1020127005049A patent/KR20120043028A/ko not_active Application Discontinuation
- 2007-11-12 PT PT07827123T patent/PT2089425E/pt unknown
- 2007-11-12 MX MX2009005045A patent/MX2009005045A/es active IP Right Grant
- 2007-11-12 KR KR1020097011924A patent/KR101309948B1/ko not_active IP Right Cessation
- 2007-11-12 DK DK07827123.6T patent/DK2089425T3/da active
- 2007-11-12 BR BRPI0718591-0A patent/BRPI0718591A2/pt not_active IP Right Cessation
- 2007-11-12 AU AU2007318912A patent/AU2007318912B2/en not_active Ceased
- 2007-11-12 AT AT07827123T patent/ATE520712T1/de active
- 2007-11-12 PL PL07827123T patent/PL2089425T3/pl unknown
- 2007-11-12 NZ NZ576751A patent/NZ576751A/en not_active IP Right Cessation
- 2007-11-12 CN CN200780049649.0A patent/CN101611053B/zh not_active Expired - Fee Related
-
2009
- 2009-05-05 IL IL198581A patent/IL198581A/en active IP Right Grant
- 2009-06-08 NO NO20092203A patent/NO20092203L/no not_active Application Discontinuation
-
2011
- 2011-12-26 JP JP2011283619A patent/JP2012121886A/ja not_active Ceased
-
2012
- 2012-08-13 US US13/584,721 patent/US8912148B2/en not_active Expired - Fee Related
-
2014
- 2014-10-31 US US14/530,444 patent/US20150057431A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| EP2089425B1 (en) | 2011-08-17 |
| CN101611053A (zh) | 2009-12-23 |
| AU2007318912A1 (en) | 2008-05-15 |
| WO2008056346A2 (en) | 2008-05-15 |
| US8288349B2 (en) | 2012-10-16 |
| MY146985A (en) | 2012-10-15 |
| EP2089425A2 (en) | 2009-08-19 |
| EP2368908A3 (en) | 2011-10-12 |
| AU2007318912B2 (en) | 2011-03-03 |
| WO2008056346B1 (en) | 2008-12-04 |
| KR20090090331A (ko) | 2009-08-25 |
| DK2089425T3 (da) | 2011-10-10 |
| IL198581A0 (en) | 2011-08-01 |
| EP2368908A2 (en) | 2011-09-28 |
| BRPI0718591A2 (pt) | 2013-12-03 |
| MX2009005045A (es) | 2009-11-10 |
| CN101611053B (zh) | 2015-06-03 |
| IL198581A (en) | 2015-10-29 |
| JP4897050B2 (ja) | 2012-03-14 |
| WO2008056346A3 (en) | 2008-10-23 |
| JP2012121886A (ja) | 2012-06-28 |
| JP2010509315A (ja) | 2010-03-25 |
| US20080166364A1 (en) | 2008-07-10 |
| ATE520712T1 (de) | 2011-09-15 |
| US8912148B2 (en) | 2014-12-16 |
| PL2089425T3 (pl) | 2012-02-29 |
| NZ576751A (en) | 2011-10-28 |
| US20150057431A1 (en) | 2015-02-26 |
| PT2089425E (pt) | 2011-10-17 |
| US20120301431A1 (en) | 2012-11-29 |
| NO20092203L (no) | 2009-08-10 |
| KR101309948B1 (ko) | 2013-09-23 |
| CA2669207A1 (en) | 2008-05-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5167473B2 (ja) | 抗血管新生化合物 | |
| KR101309948B1 (ko) | 혈관 신생 억제 화합물 | |
| KR101224335B1 (ko) | 글루카곤-유사 단백질-1 수용기(glp-1r) 작용제 화합물 | |
| KR20110004471A (ko) | 항혈관신생 화합물 | |
| AU2006218437B2 (en) | Anti-angiogenic compounds | |
| AU2011202645B2 (en) | Anti-angiogenic compounds | |
| ES2369587T3 (es) | Compuestos anti-angiogénicos. |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A107 | Divisional application of patent | ||
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |