KR20120036851A - 사이클로헥사논의 제조를 위한 유기체 - Google Patents
사이클로헥사논의 제조를 위한 유기체 Download PDFInfo
- Publication number
- KR20120036851A KR20120036851A KR20117029936A KR20117029936A KR20120036851A KR 20120036851 A KR20120036851 A KR 20120036851A KR 20117029936 A KR20117029936 A KR 20117029936A KR 20117029936 A KR20117029936 A KR 20117029936A KR 20120036851 A KR20120036851 A KR 20120036851A
- Authority
- KR
- South Korea
- Prior art keywords
- coa
- syn
- naturally occurring
- microbial organism
- occurring microbial
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N1/00—Microorganisms, e.g. protozoa; Compositions thereof; Processes of propagating, maintaining or preserving microorganisms or compositions thereof; Processes of preparing or isolating a composition containing a microorganism; Culture media therefor
- C12N1/20—Bacteria; Culture media therefor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P7/00—Preparation of oxygen-containing organic compounds
- C12P7/24—Preparation of oxygen-containing organic compounds containing a carbonyl group
- C12P7/26—Ketones
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/52—Genes encoding for enzymes or proenzymes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/70—Vectors or expression systems specially adapted for E. coli
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/16—Hydrolases (3) acting on ester bonds (3.1)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/88—Lyases (4.)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/93—Ligases (6)
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Genetics & Genomics (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biotechnology (AREA)
- Biomedical Technology (AREA)
- General Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Plant Pathology (AREA)
- Physics & Mathematics (AREA)
- Biophysics (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Tropical Medicine & Parasitology (AREA)
- Virology (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Abstract
비-천연 미생물 유기체는 사이클로헥사논 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 사이클로헥사논 경로를 갖는다. 한 경로는 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 2-케토-사이클로헥산-1-카복실레이트 데카복실라제; 및 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용), 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제 및 2-케토사이클로헥산-1-카복실-CoA 신세타제로부터 선택된 효소를 포함한다. 한 경로는 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 6-케토사이클로헥스-1-엔-1-카복실-CoA 신세타제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(티오에스터에 작용), 6-케토사이클로헥스-1-엔-1-카복실-CoA 트랜스퍼라제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 리덕타제, 6-케토사이클로헥스-1-엔-1-카복실레이트 데카복실라제, 6-케토사이클로헥스-1-엔-1-카복실레이트 리덕타제, 2-케토사이클로헥산-1-카복실-CoA 신세타제, 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제, 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용), 2-케토사이클로헥산-1-카복실레이트 데카복실라제 및 사이클로헥사논 데하이드로게나제로부터 선택된 효소를 포함한다. 한 경로는 아디페이트 세미알데하이드 데하이드라타제, 사이클로헥산-1,2-다이올 데하이드로게나제 및 사이클로헥산-1,2-다이올 데하이드라타제를 포함한다. 한 경로는 3-옥소피멜레이트 데카복실라제, 4-아세틸부티레이트 데하이드라타제, 3-하이드록시사이클로헥사논 데하이드로게나제, 2-사이클로헥세논 하이드라타제, 사이클로헥사논 데하이드로게나제; 및 3-옥소피멜로일-CoA 신세타제, 3-옥소피멜로일-CoA 하이드롤라제(티오에스터에 작용) 및 3-옥소피멜로일-CoA 트랜스퍼라제로부터 선택된 효소를 포함한다. 각각의 상기 경로는 PEP 카복시키나제를 포함할 수 있다. 사이클로헥사논을 제조하는 방법은 상기 비-천연 미생물 유기체를 배양하는 것을 포함한다.
Description
본 출원은 그 전체 내용이 본원에 참고로 인용된, 2009년 5월 15일자로 출원된 미국 가출원 제 61/178,791 호를 우선권 주장한다.
본 발명은 일반적으로 유기 화합물을 생성할 수 있는 생합성 방법 및 유기체에 관한 것이다. 보다 특히, 본 발명은 원자재 화학적 사이클로헥사논을 생성할 수 있는 비-천연 유기체에 관한 것이다.
사이클로헥사논은 나일론 6 및 나일론 66의 중요한 화학적 전구체이다. 질산으로 사이클로헥사논을 산화시키면 나일론 66의 핵심 구성 요소인 아디프산이 생성된다. 사이클로헥사논 옥심화 및 후속 벡크만(Beckmann) 재배열은 나일론 6의 전구체인 카프로락탐 제조에 기초를 이룬다.
사이클로헥사논의 비용은 주로 순수한 벤젠의 원료 비용에 따른다. 사이클로헥사논은 코발트 촉매를 사용하여 사이클로헥사논의 산화에 의해 화학적으로 합성되어 사이클로헥사논 및 "KA 오일"로 불리는 사이클로헥산올의 혼합물이 생성된다.
따라서, 저렴하고 재생가능한 공급원료로부터 사이클로헥사논을 생성할 수 있는 미생물 및 그의 사용 방법을 개발할 필요가 존재한다. 본 발명은 상기 필요를 충족시키며 또한 관련된 이점을 제공한다.
일부 태양에서, 본 발명은 사이클로헥사논을 생성하기에 충분한 양으로 발현된 사이클로헥사논 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 갖는 사이클로헥사논 경로를 갖는 미생물 유기체를 포함한, 비-천연 미생물 유기체를 제공한다. 일부 태양에서, 사이클로헥사논 경로는 PEP 카복시키나제, 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 2-케토사이클로헥산-1-카복실레이트 데카복실라제; 및 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용), 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제 및 2-케토사이클로헥산-1-카복실-CoA 신세타제(synthetase)로부터 선택된 효소를 포함한다.
다른 태양에서, 사이클로헥사논 경로는 PEP 카복시키나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 6-케토사이클로헥스-1-엔-1-카복실-CoA 신세타제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(티오에스터에 작용), 6-케토사이클로헥스-1-엔-1-카복실-CoA 트랜스퍼라제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 리덕타제, 6-케토사이클로헥스-1-엔-1-카복실레이트 데카복실라제, 6-케토사이클로헥스-1-엔-1-카복실레이트 리덕타제, 2-케토사이클로헥산-1-카복실-CoA 신세타제, 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제, 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용), 2-케토사이클로헥산-1-카복실레이트 데카복실라제 및 사이클로헥사논 데하이드로게나제로부터 선택된 효소를 포함한다.
또 다른 태양에서, 사이클로헥사논 경로는 PEP 카복시키나제, 아디페이트 세미알데하이드 데하이드라타제, 사이클로헥산-1,2-다이올 데하이드로게나제 및 사이클로헥산-1,2-다이올 데하이드라타제를 포함한다.
또 다른 태양에서, 사이클로헥사논 경로는 PEP 카복시키나제, 3-옥소피멜레이트 데카복실라제, 4-아세틸부티레이트 데하이드라타제, 3-하이드록시사이클로헥사논 데하이드로게나제, 2-사이클로헥세논 하이드라타제, 사이클로헥사논 데하이드로게나제; 및 3-옥소피멜로일-CoA 신세타제, 3-옥소피멜로일-CoA 하이드롤라제(티오에스터에 작용) 및 3-옥소피멜로일-CoA 트랜스퍼라제로부터 선택된 효소를 포함한다.
일부 태양에서, 본 발명은 사이클로헥사논을 생성하기 위한 조건 및 그에 충분한 시간동안, 사이클로헥사논을 생성하기에 충분한 양으로 발현된 사이클로헥사논 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 갖는 사이클로헥사논 경로를 갖는 비-천연 미생물 유기체를 배양하는 것을 포함하는, 사이클로헥사논의 제조 방법을 제공한다. 일부 태양에서, 사이클로헥사논 경로는 PEP 카복시키나제, 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 2-케토사이클로헥산-1-카복실레이트 데카복실라제; 및 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용), 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제 및 2-케토사이클로헥산-1-카복실-CoA 신세타제로부터 선택된 효소를 포함한다.
상기 방법의 다른 태양에서, 사이클로헥사논 경로 효소의 한 세트는 다음으로부터 선택된다: (a) PEP 카복시키나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 6-케토사이클로헥스-1-엔-1-카복실레이트 데카복실라제, 사이클로헥사논 데하이드로게나제; 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 신세타제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(티오에스터에 작용) 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 트랜스퍼라제로부터 선택된 효소; (b) PEP 카복시키나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 6-케토사이클로헥스-1-엔-1-카복실레이트 리덕타제, 2-케토사이클로헥산-1-카복실레이트 데카복실라제; 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 신세타제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(티오에스터에 작용) 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 트랜스퍼라제로부터 선택된 효소; (c) PEP 카복시키나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C에 작용), 6-케토사이클로헥스-1-엔-1-카복실-CoA 리덕타제, 2-케토사이클로헥산-1-카복실레이트 데카복실라제; 및 2-케토사이클로헥산-1-카복실-CoA 신세타제, 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제, 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용)로부터 선택된 효소.
상기 방법의 또 다른 태양에서, 사이클로헥사논 경로는 PEP 카복시키나제, 아디페이트 세미알데하이드 데하이드라타제, 사이클로헥산-1,2-다이올 데하이드로게나제 및 사이클로헥산-1,2-다이올 데하이드라타제를 포함한다.
상기 방법의 또 다른 태양에서, 사이클로헥사논 경로는 PEP 카복시키나제, 3-옥소피멜레이트 데카복실라제, 4-아세틸부티레이트 데하이드라타제, 3-하이드록시사이클로헥사논 데하이드로게나제, 2-사이클로헥세논 하이드라타제, 사이클로헥사논 데하이드로게나제; 및 3-옥소피멜로일-CoA 신세타제, 3-옥소피멜로일-CoA 하이드롤라제(티오에스터에 작용) 및 3-옥소피멜로일-CoA 트랜스퍼라제로부터 선택된 효소를 포함한다.
도 1은 피멜로일-CoA의 사이클로헥사논으로의 전환을 나타낸 것이다. 약어는 다음과 같다: 2-KCH-CoA = 2-케토사이클로헥산-1-카복실-CoA, 2-KCH = 2-케토사이클로헥산-1-카복실레이트.
도 2는 아세토아세틸-CoA의 피멜로일-CoA로의 전환을 나타낸 것이다.
도 3은 3-하이드록시피멜로일-CoA의 사이클로헥사논으로의 전환을 나타낸 것이다. 약어: 6-KCH-CoA = 6-케토사이클로헥스-1-엔-1-카복실-CoA, 6-KCH = 6-카복시헥스-1-엔-1-카복실레이트, 2KCH-CoA = 2-케토사이클로헥산-1-카복실-CoA, 2-KCH = 2-케토사이클로헥산-1-카복실레이트.
도 4는 아디페이트 세미알데하이드의 사이클로헥사논으로의 전환을 나타낸 것이다.
도 5는 3-옥소피멜로일-CoA의 사이클로헥사논으로의 전환을 나타낸 것이다.
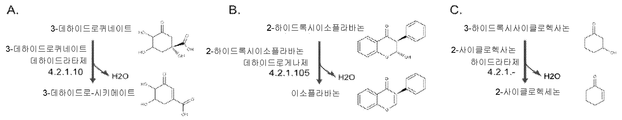
도 6은 A) 3-데하이드로퀴네이트 데하이드라타제, B) 2-하이드록시이소플라바논 데하이드로게나제 및 C) 2-사이클로헥사논 하이드라타제의 효소 활성을 나타낸 것이다.
도 7은 2,6-다이아미노피멜레이트로부터 피멜로일-CoA로의 경로를 나타낸 것이다.
도 2는 아세토아세틸-CoA의 피멜로일-CoA로의 전환을 나타낸 것이다.
도 3은 3-하이드록시피멜로일-CoA의 사이클로헥사논으로의 전환을 나타낸 것이다. 약어: 6-KCH-CoA = 6-케토사이클로헥스-1-엔-1-카복실-CoA, 6-KCH = 6-카복시헥스-1-엔-1-카복실레이트, 2KCH-CoA = 2-케토사이클로헥산-1-카복실-CoA, 2-KCH = 2-케토사이클로헥산-1-카복실레이트.
도 4는 아디페이트 세미알데하이드의 사이클로헥사논으로의 전환을 나타낸 것이다.
도 5는 3-옥소피멜로일-CoA의 사이클로헥사논으로의 전환을 나타낸 것이다.
도 6은 A) 3-데하이드로퀴네이트 데하이드라타제, B) 2-하이드록시이소플라바논 데하이드로게나제 및 C) 2-사이클로헥사논 하이드라타제의 효소 활성을 나타낸 것이다.
도 7은 2,6-다이아미노피멜레이트로부터 피멜로일-CoA로의 경로를 나타낸 것이다.
본 발명은 부분적으로, 재생가능한 당 공급원료로부터 발효에 의한 사이클로헥사논 생성을 촉진하는 효소를 암호화하는 유전자를 발현시키는 비-천연 미생물에 관한 것이다. 원료 물질로서 글루코스로부터 출발한 사이클로헥사논의 이론적 수율은 하기 반응식 1에 나타낸 바와 같이 0.75 몰/글루코스 몰(0.409 g/g)이다:
[반응식 1]
4 C6H12O6 → 3 (CH2)5CO + 6 CO2 + 9 H2O
일부 태양에 따라서, 사이클로헥사논 생합성 경로는 피멜로일-CoA 중간체를 포함한다. 상기 경로는 세균, 고세균 및 일부 진균(168)에서의 비오틴 생합성 경로의 중간체인 피멜로일-CoA의 합성에 플럭스의 채널링을 이용한다. 피멜로일-CoA가 광범위한 대사물이긴 하지만, 상기 중간체를 생성하는데 수반되는 경로는 완전히 밝혀지지 않았다. 일부 태양에서, 본 발명은 피멜로일-CoA를 합성하기 위한 효과적으로 유리한 경로를 제공한다. 피멜로일-CoA의 합성을 위한 본원에 개시된 경로는 중추 대사 전구체로부터 사이클로헥사논을 생성하기 위해 적용될 수 있다. 또 다른 태양에서, 벤조일-CoA 분해 경로에서 효소에 의해 사이클로헥사논을 합성하기 위한 경로가 개시된다. 상기 경로는 중간체로서 피멜로일-CoA를 통해 진행되지 않지만, 가능한 피멜로일-CoA 전구체인 3-하이드록시피멜로일-CoA를 거친다. 다른 태양에서, 본 발명은 아디페이트 세미알데하이드로부터 사이클로헥사논으로의 경로를 제공한다. 상기 경로는 아직 공개되지 않는 미국 특허 출원 제 12/413,355 호에 개시된 바와 같은 아디페이트로의 경로에 관한 본 출원인의 이전 개시내용에 관한 것이다. 또 다른 태양에서, 3-옥소피멜로일-CoA로부터 중간체 4-아세틸부티레이트를 거쳐 사이클로헥사논으로의 경로가 본원에 기술된다.
각각의 경로에 있어, 효소는 그의 상응하는 유전자은행(GenBank) 식별자에 의해 식별한다. 본 보고서에 열거된 효소에 대한 서열을 사용하여 서열 유사성 조사(예, BLASTp)를 통해 유전자은행 또는 다른 데이터베이스에서 상동 단백질을 확인할 수 있다. 결과로 얻은 상동 단백질 및 그의 상응하는 유전자 서열은 에스케리키아 콜라이(Escherichia coli) 또는 다른 미생물로의 형질전환을 위한 추가의 DNA 서열을 제공한다.
본원에서 사용된 바와 같이, 용어 "비-천연"은 본 발명의 미생물 유기체 또는 미생물과 관련하여 사용되는 경우, 미생물 유기체가, 언급된 종의 야생형 균주를 포함하여 언급된 종의 천연 균주에서는 정상적으로 발견되지 않는 유전자 변이를 하나 이상 갖는 것을 의미하는 것이다. 유전자 변이로는, 예를 들면, 대사성 폴리펩티드를 암호화하는 발현가능한 핵산을 도입시키는 변형, 기타 핵산 부가, 핵산 결실 및/또는 미생물 유전 물질의 기타 기능 파괴가 포함된다. 상기 변형은, 예를 들면, 언급된 종에 대한 이종, 상동, 또는 이종 및 상동 폴리펩티드 둘 다에 대한 암호화 영역 및 그의 기능성 단편을 포함한다. 추가의 변형은, 예를 들면, 변형이 유전자 또는 오페론의 발현을 변화시키는 비-암호화 조절 영역을 포함한다. 대표적인 대사성 폴리펩티드로는 사이클로헥사논 생합성 경로 내의 효소 또는 단백질이 포함된다.
대사성 변형은 그의 천연 상태로부터 변화되는 생화학적 반응을 말한다. 그러므로, 비-천연 미생물은 대사성 폴리펩티드를 암호화하는 핵산 또는 그의 기능성 단편에 유전자 변형을 가질 수 있다. 예시적인 대사성 변형이 본원에 개시된다.
본원에서 사용된 바와 같이, 용어 "분리된"은 미생물 유기체와 관련하여 사용되는 경우, 언급된 미생물 유기체가 자연에서 발견될 때 하나 이상의 성분을 실질적으로 갖지 않는 유기체를 의미하는 것이다. 상기 용어는 미생물이 그의 천연 환경에서 발견될 때 일부 또는 모든 성분들이 제거된 미생물 유기체를 포함한다. 상기 용어는 또한 미생물 유기체가 그의 비-천연 환경에서 발견될 때 일부 또는 모든 성분들이 제거된 미생물 유기체를 포함한다. 그러므로, 분리된 미생물 유기체는 천연에서 발견될 때, 또는 비-천연 환경에서 성장하거나 저장되거나 존재할 때 다른 물질들로부터 부분적으로 또는 완전히 분리된다. 분리된 미생물 유기체의 특정 예로는 부분적으로 순수한 미생물, 실질적으로 순수한 미생물 및 비천연 배지에서 배양된 미생물이 포함된다.
본원에서 사용된 바와 같이, 용어 "미생물의", "미생물 유기체" 또는 "미생물"은 고세균, 세균 또는 진핵생물의 영역들내에 포함되는 미세한 세포로서 존재하는 임의의 유기체를 의미하는 것이다. 그러므로, 상기 용어는 현미경 크기를 갖는 원핵 또는 진핵 세포 또는 유기체를 포함하는 것이며, 모든 종의 세균, 고세균 및 진정세균, 및 효모 및 진균과 같은 진핵 미생물을 포함한다. 상기 용어는 또한 생화학물질의 생성을 위해 배양될 수 있는 임의 종의 세포 배양물을 포함한다.
본원에서 사용된 바와 같이, 용어 "CoA" 또는 "코엔자임 A"는 그 존재가 활성 효소 시스템을 형성하기 위한 많은 효소(아포효소)의 활성에 필요한 유기 보조인자 또는 보결분자단(효소의 비단백질 부분)을 의미하는 것이다. 특정 축합 효소에서 코엔자임 A의 기능은 아세틸 또는 기타 아실기 전이에서 및 지방산 합성 및 산화, 피루베이트 산화에서 및 기타 아세틸화에서 작용한다.
본원에서 사용된 바와 같이, 용어 "실질적으로 혐기성인"은 배양 또는 성장 조건과 관련하여 사용되는 경우, 산소의 양이 액체 배지중 용존 산소에 대한 포화도의 약 10% 미만인 것을 의미하는 것이다. 상기 용어는 또한약 1% 미만의 산소 대기하에 유지된 액체 또는 고체 배지의 밀폐 챔버를 포함하는 것이다.
본원에서 사용된 바와 같이, "외인성"은 언급된 분자 또는 언급된 활성이 숙주 미생물 유기체내에 도입되는 것을 의미하는 것이다. 상기 분자는, 예를 들면, 숙주 염색체내 통합에 의해서와 같이 숙주 유전 물질 내에 암호화 핵산이 도입됨으로써, 또는 플라스미드와 같은 비-염색체 유전 물질로서 도입됨으로써 도입될 수 있다. 그러므로, 상기 용어는, 암호화 핵산의 발현과 관련하여 사용될 때, 미생물 유기체내에 발현가능한 형태로 암호화 핵산이 도입되는 것을 말한다. 생합성 활성과 관련하여 사용되는 경우, 상기 용어는 언급된 숙주 유기체내에 도입되는 활성을 말한다. 공급원은, 예를 들면, 숙주 미생물 유기체내에 도입된 후 언급된 활성을 발현하는 상동성 또는 이종 암호화 핵산일 수 있다. 그러므로, 용어 "외인성"은 숙주에 존재하는 언급된 분자 또는 활성을 말한다. 유사하게, 상기 용어는 암호화 핵산의 발현과 관련하여 사용되는 경우, 미생물 유기체내에 함유된 암호화 핵산의 발현을 말한다. 용어 "이종"은 언급된 종 이외의 다른 공급원으로부터 유래된 분자 또는 활성을 말하는 반면, "상동성"은 숙주 미생물 유기체로부터 유래된 분자 또는 활성을 말한다. 따라서, 본 발명의 암호화 핵산의 외인성 발현은 이종 또는 상동성 암호화 핵산 중 어느 하나 또는 둘 다를 사용할 수 있다.
하나 이상의 외인성 핵산이 미생물 유기체에 포함되는 경우, 상기 하나 이상의 외인성 핵산은 상기에서 논의한 바와 같이 언급된 암호화 핵산 또는 생합성 활성을 말하는 것으로 이해해야 한다. 또한, 본원에 개시된 바와 같이, 상기 하나 이상의 핵산은 숙주 미생물 유기체 내에 별도의 핵산 분자상에, 다시스트론성 핵산 분자상에 또는 그의 조합 상에 도입될 수 있으며, 여전히 하나 이상의 외인성 핵산으로 간주될 수 있음을 이해해야 한다. 예를 들면, 본원에 개시된 바와 같이, 미생물 유기체는 목적하는 경로 효소 또는 단백질을 암호화하는 2개 이상의 외인성 핵산을 발현하도록 조작될 수 있다. 목적 활성을 암호화하는 2개의 외인성 핵산이 숙주 미생물 유기체내에 도입되는 경우, 상기 2개의 외인성 핵산은 단일 핵산으로서, 예를 들면, 단일 플라스미드상에, 별도의 플라스미드상에 도입될 수 있고, 숙주 염색체내에 단일 부위에 또는 다중 부위에 통합될 수 있으며, 여전히 2개의 외인성 핵산으로 간주될 수 있음을 이해해야 한다. 유사하게, 2개 이상의 외인성 핵산이 숙주 유기체내에 임의의 바람직한 조합으로, 예를 들면, 단일 플라스미드 상에 또는 별도의 플라스미드 상에 도입될 수 있고, 숙주 염색체내에 단일 부위 또는 다중 부위로서 통합될 수 있으며, 여전히 2개 이상의 외인성 핵산, 예를 들면, 3개의 외인성 핵산으로 간주될 수 있음을 이해해야 한다. 따라서, 언급된 외인성 핵산 또는 생합성 활성의 수는 암호화 핵산의 수 또는 생합성 활성의 수를 말하며, 숙주 유기체내에 도입된 별도의 핵산의 수를 말하는 것이 아니다.
본 발명의 비-천연 미생물 유기체는 안정한 유전자 변이를 함유할 수 있으며, 이것은 변이의 손실없이 5대보다 많은 세대동안 배양될 수 있는 미생물을 말한다. 일반적으로, 안정한 유전자 변이는 10 세대 이상 지속되는 변형을 포함하며, 특히 안정한 변형은 약 25 세대 이상 지속되며, 보다 특히 안정한 유전자 변형은 무기한을 포함하여, 50 세대보다 많이 지속될 것이다.
당해 분야에 숙련된 자라면 본원에 예시된 대사성 변형을 포함하여 유전자 변이가 이. 콜라이와 같은 적합한 숙주 유기체 및 그의 상응하는 대사 반응, 또는 목적하는 대사 경로를 위한 유전자와 같은 바람직한 유전 물질에 적합한 공급원 유기체와 관련하여 기술되는 것을 이해할 것이다. 그러나, 매우 다양한 유기체의 완전한 게놈 서열분석 및 유전체학 분야에서의 높은 수준의 기술이 제공되면, 당해 분야에 숙련된 자라면 본원에 제공된 교지내용 및 지침을 필수적으로 모든 다른 유기체에 용이하게 적용할 수 있을 것이다. 예를 들면, 본원에 예시된 이. 콜라이 대사성 변이는 언급된 종 이외의 다른 종으로부터의 동일하거나 유사한 암호화 핵산을 혼입함으로써 다른 종에 용이하게 적용될 수 있다. 상기 유전자 변이로는, 예를 들면, 일반적으로 종 동족체의 유전자 변이, 및 특히, 이종상동체(ortholog), 상동체(paralog) 또는 비-이종상동성 유전자 변위가 포함된다.
이종상동체는 수직적 혈통에 의해 연관되고, 상이한 유기체에서 실질적으로 동일하거나 일치하는 기능의 원인이 되는 유전자 또는 유전자들이다. 예를 들면, 마우스 에폭시드 하이드롤라제 및 인간 에폭시드 하이드롤라제는 에폭시드의 가수분해의 생물학적 기능에 대해 이종상동체로 간주될 수 있다. 유전자는, 예를 들면, 이들이 상동성임을 나타내기에 충분한 양의 서열 유사성을 공유하는 경우 수직적 혈통에 의해 연관되거나, 또는 공통 선조로부터의 진화에 의해 연관된다. 유전자는 또한, 이들이 1차 서열 유사성이 식별될 수 없을 정도로 공통 선조로부터 진환된 것을 나타내기에 충분한 양의 3차원 구조를 공유하지만 반드시 서열 유사성을 갖는 것은 아닌 경우, 이종상동체로 간주될 수 있다. 이종상동성인 유전자는 약 25 내지 100% 아미노산 서열 동일성의 서열 유사성을 갖는 단백질을 암호화할 수 있다. 25% 미만의 아미노산 유사성을 공유하는 단백질을 암호화하는 유전자도 또한, 그의 3차원 구조가 또한 유사성을 나타내는 경우 수직적 혈통에 의해 발생된 것으로 간주될 수 있다. 조직 플라스미노겐 활성인자 및 엘라스타제를 포함하여 세린 프로테아제 부류 효소의 구성원은 공통 선조로부터의 수직적 혈통에 의해 발생된 것으로 간주된다.
이종상동체는, 예를 들면, 진화를 통해 구조 또는 전체 활성에서 나뉘어진 유전자 또는 그의 암호화된 유전자 산물을 포함한다. 예를 들면, 하나의 종이 2개의 기능을 나타내는 유전자 산물을 암호화하는 경우 및 상기 기능이 제 2의 종에서 별개의 유전자로 분리된 경우, 상기 3개의 유전자 및 그의 상응하는 산물들은 이종상동체인 것으로 간주된다. 생화학 생성물의 제조에 있어, 당해 분야에 숙련된 자는 도입되거나 파괴될 대사 활성을 갖는 이종상동성 유전자가 비-천연 미생물의 구축을 위해 선택되어야 함을 이해할 것이다. 분리가능한 활성을 나타내는 이종상동체의 예는 별개의 활성이 2개 이상의 종 사이에서 또는 단일 종안에서 별개의 유전자 산물로 분리된 경우이다. 특정 예는 세린 프로테아제 활성의 두 유형인 엘라스타제 단백질분해 및 플라스미노겐 단백질분해의 플라스미노겐 활성인자와 엘라스타제로서 별개 분자로의 분리이다. 두 번째 예는 마이코플라스마 5'-3' 엑소뉴클레아제 및 초파리(Drosophila) DNA 폴리머라제 III 활성의 분리이다. 첫번째 종으로부터의 DNA 폴리머라제는 두번째 종으로부터의 엑소뉴클레아제 또는 폴리머라제중 어느 하나 또는 둘 다에 이종상동체인 것으로 간주될 수 있으며 그 반대도 가능하다.
대조적으로, 상동체는, 예를 들면, 복제후 진화적 분기에 의해 관련된 동족체이며, 유사하거나 공통되지만 동일하지는 않은 기능을 갖는다. 상동체는, 예를 들면, 동일 종으로부터 또는 상이한 종으로부터 기원하거나 유래할 수 있다. 예를 들면, 마이크로솜 에폭시드 하이드롤라제(에폭시드 하이드롤라제 I) 및 가용성 에폭시드 하이드롤라제(에폭시드 하이드롤라제 II)는 상동체인 것으로 간주될 수 있는데, 그 이유는 이들이 별개의 반응을 촉진하고 동일 종에서 별개의 기능을 갖는, 공통 선조로부터 공진화된 2개의 별개의 효소를 나타내기 때문이다. 상동체는 서로 상당한 서열 유사성을 갖는 동일 종으로부터의 단백질로서, 이들이 상동성이거나 공통 선조로부터의 공진화를 통해 연관됨을 시사한다. 유사 단백질 부류의 군은 HipA 동족체, 루시퍼라제 유전자, 펩티다제 등을 포함한다.
비-이종상동성 유전자 변위는 상이한 종에서의 언급된 유전자 기능을 대체할 수 있는 한 종으로부터의 비-이종상동성 유전자이다. 대체는, 예를 들면, 상이한 종에서의 언급된 기능에 비해 원래의 종에서 실질적으로 동일하거나 유사한 기능을 수행할 수 있는 것을 포함한다. 일반적으로 비-이종상동성 유전자 변위는 언급된 기능을 암호화하는 알고있는 유전자에 구조적으로 관련되는 것으로 식별가능할 것이지만, 그럼에도 불구하고 구조적으로 덜 관련되지만 기능적으로 유사한 유전자 및 그의 상응하는 유전자 산물은 여전히 본원에서 사용된 바와 같은 상기 용어의 의미내에 포함된다. 기능적 유사성은, 예를 들면, 대체되고자 하는 기능을 암호화하는 유전자에 비해 비이종상동성 유전자 산물의 활성 부위 또는 결합 영역에서 적어도 일부의 구조적 유사성을 필요로 한다. 그러므로, 비이종상동성 유전자는, 예를 들면, 상동체 또는 비관련 유전자를 포함한다.
그러므로, 사이클로헥사논 생합성 능력을 갖는 본 발명의 비-천연 미생물 유기체를 동정하고 제조하는데 있어서, 당해 분야에 숙련된 자라면 본원에 제공된 교지내용 및 지침을 특정 종에 적용하여 대사성 변형의 확인이 이종상동체의 확인 및 혼입 또는 불활성화를 포함할 수 있음을 이해할 것이다. 상동체 및/또는 비이종상동성 유전자 변위가 유사하거나 또는 실질적으로 유사한 대사 반응을 촉진하는 효소를 암호화하는 언급된 미생물에 존재하는 정도로, 당해 분야에 숙련된 자라면 또한 상기 진화적으로 관련된 유전자들을 이용할 수 있다.
이종상동체, 상동체 및 비이종상동성 유전자 변위는 당해 분야에 숙련된 자에게 공지된 방법에 의해 결정될 수 있다. 예를 들면, 두 폴리펩티드에 대한 핵산 또는 아미노산 서열의 조사는 비교 서열간의 서열 동일성 및 유사성을 나타낼 것이다. 상기 유사성을 기초로, 당해 분야에 숙련된 자라면 단백질이 공통 선조로부터 진화를 통해 연관되는 것을 나타낼 만큼 유사성이 충분히 높은지 여부를 결정할 수 있다. 당해 분야에 숙련된 자에게 공지되어 있는 알고리즘, 예를 들면, Align, BLAST, Clustal W 및 기타 알고리즘은 그대로의 서열 유사성 또는 동일성을 비교 및 측정할 수 있으며, 또한 중량 또는 스코어에 할당될 수 있는 서열에 틈(gap)의 존재 또는 의미를 결정한다. 상기 알고리즘은 또한 당해 분야에 공지되어 있으며, 뉴클레오티드 서열 유사성 또는 동일성을 측정하는데에도 유사하게 적용될 수 있다. 연관성을 측정하기에 충분한 유사성을 위한 파라미터는 통계적 유사성, 또는 랜덤 폴리펩티드중 유사한 매치를 발견한 기회 및 측정된 매치의 의미를 산출하기 위한 공지된 방법을 기준으로 산정된다. 2개 이상의 서열의 컴퓨터 비교는, 바람직한 경우, 또한 당해 분야에 숙련된 자에 의해 가시적으로 최적화될 수 있다. 연관된 유전자 산물 또는 단백질은 높은 유사성, 예를 들면, 25 내지 100% 서열 동일성을 가질 것으로 예상할 수 있다. 연관되지 않는 단백질은, 충분한 크기의 데이터베이스가 스캐닝되는 경우(약 5%), 우연히 일어날 것으로 예상되는 바와 필수적으로 같은 동일성을 가질 수 있다. 5 내지 24%의 서열 동일성은 비교된 서열이 연관된다고 결론내리기에 충분한 상동성을 나타낼 수 있다. 데이터 세트의 크기를 제공한 상기 매치의 의미를 결정하기 위한 또 다른 통계적 분석을 수행하여 상기 서열들의 관련성을 측정할 수 있다.
예를 들면, BLAST 알고리즘을 사용하여 2개 이상의 서열의 연관성을 측정하기 위한 예시적인 파라미터는 하기에 나타낸 바와 같을 수 있다. 간략하게, 아미노산 정렬은 BLASTP 버전 2.0.8(1999년 1월 5일) 및 하기의 파라미터들을 사용하여 수행될 수 있다: 매트릭스: 0 BLOSUM62; 틈 개방: 11; 틈 연장:1; x_드롭오프: 50; 익스펙트: 10.0; 워드사이즈: 3; 필터: 온. 핵산 서열 정렬은 BLASTN 버전 2.0.6(1998년 9월 16일) 및 하기의 파라미터를 사용하여 수행할 수 있다.: 매치: 1; 미스매치: -2; 틈 개방: 5; 틈 연장: 2; x_드롭오프: 50; 익스펙트: 10.0; 워드사이즈: 11; 필터: 오프. 당해 분야에 숙련된 자라면, 예를 들면, 비교의 엄격성을 증가 또는 감소시키기 위해 상기 파라미터에 변형이 수행될 수 있고 2개 이상의 서열의 연관성을 결정할 수 있음을 알 것이다.
일부 태양에서, 본 발명은 사이클로헥사논을 생성하기에 충분한 양으로 발현된 사이클로헥사논 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 갖는 사이클로헥사논 경로를 갖는 미생물 유기체를 포함하는 비-천연 미생물 유기체를 제공한다. 사이클로헥사논 경로는 PEP 카복시키나제, 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 2-케토사이클로헥산-1-카복실레이트 데카복실라제; 및 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용), 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제 및 2-케토사이클로헥산-1-카복실-CoA 신세타제로부터 선택된 효소를 포함한다. 상기 미생물 유기체는 또한 각각 사이클로헥사논 경로 효소를 암호화하는 2개의 외인성 핵산을 포함할 수 있다. 다른 태양에서, 상기 유기체는 각각 사이클로헥사논 경로 효소를 암호화하는 3개의 외인성 핵산을 포함할 수 있다. 또 다른 태양에서, 상기 유기체는 각각 사이클로헥사논 경로 효소를 암호화하는 4개의 외인성 핵산을 포함할 수 있다. 임의의 외인성 핵산이 이종 핵산으로 제공될 수 있다. 상기 비-천연 미생물 유기체는 실질적으로 혐기성 배양 배지에 제공(및 그중에서 배양)될 수 있다.
피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 PEP 카복시키나제를 포함할 수 있다. PEP 카복시키나제는 PCK1, pck 및 pckA로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다. 피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(C-C 결합에 작용)를 포함할 수 있다. 상기 효소는 도 1에 나타낸 바와 같이 피멜로일-CoA를 환화시키기 위해 역방향으로 작용된다. 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(C-C 결합에 작용)는 badI, syn_01653, syn_01654, syn_02400, syn_03076, syn_01309 및 menB로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다. 피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 2-케토사이클로헥산-1-카복실레이트 데카복실라제를 포함할 수 있다. 2-케토사이클로헥산-1-카복실레이트 데카복실라제는 adc, cbei_3835, CLL_A2135 및 RBAM_030030으로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다. 피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용)를 포함할 수 있다. 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용)는 acot12, gctA, gctB 및 ACH1로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다. 피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 또한 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제를 포함할 수 있다. 2-케토사이클로헥사논-1-카복실-CoA 트랜스퍼라제는 pcaI, pcaJ, catI, catJ, HPAG1_0676, HPAG1_0677, ScoA, ScoB, OXCT1, OXCT2, ctfA, ctfB, atoA 및 atoD로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다. 피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 또한 2-케토사이클로헥산-1-카복실-CoA 신세타제를 포함할 수 있다. 2-케토사이클로헥산-1-카복실-CoA 신세타제는 AF1211, AF1983, scs, PAE3250, sucC, sucD, aliA, ph1, ph1B, paaF 및 bioW로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
일부 태양에서, 비-천연 미생물 유기체는 천연 피멜로일-CoA 경로를 갖는 한편, 다른 태양에서 피멜로일-CoA 경로는 도 2에 나타낸 바와 같이, 아세토아세틸-CoA로부터 피멜로일-CoA의 생성을 위한 피멜로일-CoA 경로 효소를 암호화하는 추가의 외인성 핵산의 부가에 의해 제공될 수 있다. 따라서, 미생물 유기체는, 피멜로일-CoA를 생성하기에 충분한 양으로 발현된 피멜로일-CoA 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 피멜로일-CoA 경로를 추가로 포함할 수 있다. 피멜로일-CoA 경로는 아세토아세틸-CoA 리덕타제, 3-하이드록시부티릴-CoA 데하이드라타제, 글루타릴-CoA 데하이드로게나제, 옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제, 3-하이드록시피멜로일-CoA 데하이드로게나제, 3-하이드록시피멜로일-CoA 데하이드라타제 및 피멜로일-CoA 데하이드로게나제를 포함한다. 피멜로일-CoA의 생성을 위한 완전한 피멜로일-CoA 경로를 갖는 비-천연 미생물 유기체를 제공하기 위해 임의 수의 효소가 외인적으로 제공될 수 있다. 예를 들면, 유기체는 2개, 3개, 4개, 5개, 6개, 7개의 외인성 핵산, 즉, 각각 피멜로일-CoA 경로 효소를 암호화하는 모든 외인성 핵산을 포함할 수 있다.
아세토아세틸-CoA를 피멜로일-CoA로 전환시키기 위한 피멜로일-CoA 경로를 갖는 유기체는 아세토아세틸-CoA 리덕타제를 포함할 수 있다. 아세토아세틸-CoA 리덕타제는 Fox2, phaB, phbB, hbd, Msed_1423, Msed_0399, Msed_0389, Msed_1993, Hbd2, Hbd1, HSD17B10, pimF, fadB, syn_01310 및 syn_01680으로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
아세토아세틸-CoA를 피멜로일-CoA로 전환시키기 위한 피멜로일-CoA 경로를 갖는 유기체는 3-하이드록시부티릴-CoA 데하이드라타제를 포함할 수 있다. 3-하이드록시부티릴-CoA 데하이드라타제는 crt, crt1, pimF, syn_01309, syn_01653, syn_01654, syn_02400, syn_03076, ech, paaA, paaB, phaA, phaB, maoC, paaF, paaG, fadA, fadB, fadI, fadJ 및 fadR로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
아세토아세틸-CoA를 피멜로일-CoA로 전환시키기 위한 피멜로일-CoA 경로를 갖는 유기체는 글루타릴-CoA 데사이드로게나제를 포함할 수 있다. 글루타릴-CoA 데하이드로게나제는 gcdH, gcdR, PP_0157, gacA, gcd, gcdR, syn_00480, syn_01146, gcdA, gcdC, gcdD, gcdB, FN0200, FN0201, FN204, syn_00479, syn_00481, syn_01431 및 syn_00480으로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
아세토아세틸-CoA를 피멜로일-CoA로 전환시키기 위한 피멜로일-CoA 경로를 갖는 유기체는 옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제를 포함할 수 있다. 옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제는 bktB, pimB, syn_02642, phaA, h16_A1713, pcaF, h16_B1369, h16_A0170, h16_A0170, h16_A0462, h16_A1528, h16_B0381, h16_B0662, h16_B0759, h16_B0668, h16_A1720, h16_A1887, phbA, Rmet_1362, Bphy_0975, atoB, thlA, thlB, ERG10 및 catF로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
아세토아세틸-CoA를 피멜로일-CoA로 전환시키기 위한 피멜로일-CoA 경로를 갖는 유기체는 3-하이드록시피멜로일-CoA 데하이드로게나제를 포함할 수 있다. 3-하이드록시피멜로일-CoA 데하이드로게나제는 Fox2, phaB, phbB, hbd, Msed_1423, Msed_0399, Msed_0389, Msed_1995, Hbd2, Hbd1, HSD17B10, pimF, fadB, syn_01310 및 syn_01680으로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
아세토아세틸-CoA를 피멜로일-CoA로 전환시키기 위한 피멜로일-CoA 경로를 갖는 유기체는 3-하이드록시피멜로일-CoA 데하이드라타제를 포함할 수 있다. 3-하이드록시피멜로일-CoA 데하이드라타제로는 crt, crt1, pimF, syn_01309, syn_01653, syn_01654, syn_02400, syn_03076, ech, paaA, paaB, phaA, phaB, maoC, paaF, paaG, fadA, fadB, fadI, fadJ 및 fadR로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
아세토아세틸-CoA를 피멜로일-CoA로 전환시키기 위한 피멜로일-CoA 경로를 갖는 유기체는 피멜로일-CoA 데하이드로게나제를 포함할 수 있다. 피멜로일-CoA 데하이드로게나제는 bcd, etfA, etfB, TER, TDE0597, syn_02587, syn_02586, syn_01146, syn_00480, syn_02128, syn_01699, syn_02637, syn_02636, pimC, pimD, acadI 및 acad로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
일부 태양에서, 본 발명은 사이클로헥사논을 생성하기에 충분한 양으로 발현된 사이클로헥사논 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 갖는 사이클로헥사논 경로를 갖는 미생물 유기체를 포함하는 비-천연 미생물 유기체를 제공한다. 사이클로헥사논 경로는 PEP 카복시키나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 6-케토사이클로헥스-1-엔-1-카복실-CoA 신세타제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(티오에스터에 작용), 6-케토사이클로헥스-1-엔-1-카복실-CoA 트랜스퍼라제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 리덕타제, 6-케토사이클로헥스-1-엔-1-카복실레이트 데카복실라제, 6-케토사이클로헥스-1-엔-1-카복실레이트 리덕타제, 2-케토사이클로헥산-1-카복실-CoA 신세타제, 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제, 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용), 2-케토사이클로헥산-1-카복실레이트 데카복실라제 및 사이클로헥사논 데하이드로게나제로부터 선택된 효소를 포함한다. 상기 효소들의 혼합물은 도 3에 예시된 바와 같이 3-하이드록시피멜로일-CoA를 사이클로헥사논으로 전환시킬 수 있다.
3-하이드록시피멜로일-CoA를 사이클로헥사논으로 전환시킬 수 있는 비-천연 미생물 유기체는 경로중에 2개, 3개, 4개, 5개, 모든 효소를 포함하여 사이클로헥사논 경로를 완료하기 위한 임의 수의 외인성 효소를 포함할 수 있다. 임의 수의 상기 외인성 핵산은 이종 핵산일 수 있다. 상기 비-천연미생물 유기체는 실질적으로 혐기성 배양 배지 중에 제공(및 그중에서 배양)될 수 있다.
3-하이드록시피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로 효소의 완전한 세트로 이루어지는 효소의 예시적인 세트는, 제한하지 않고 다음을 포함한다: (a) PEP 카복시키나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 6-케토사이클로헥스-1-엔-1-카복실레이트 데카복실라제, 사이클로헥사논 데하이드로게나제; 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 신세타제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(티오에스터에 작용) 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 트랜스퍼라제로 이루어진 군에서 선택된 효소; (b) PEP 카복시키나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 6-케토사이클로헥스-1-엔-1-카복실레이트 리덕타제, 2-케토사이클로헥산-1-카복실레이트 데카복실라제; 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 신세타제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(티오에스터에 작용) 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 트랜스퍼라제로 이루어진 군에서 선택된 효소; 및 (c) PEP 카복시키나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C에 작용), 6-케토사이클로헥스-1-엔-1-카복실-CoA 리덕타제, 2-케토사이클로헥산-1-카복실레이트 데카복실라제; 및 2-케토사이클로헥산-1-카복실-CoA 신세타제, 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제 및 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용)로 이루어진 군에서 선택된 효소.
3-하이드록시피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 PEP 카복시키나제를 포함할 수 있다. PEP 카복시키나제는 PCK1, pck 및 pckA로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
3-하이드록시피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C 결합에 작용)를 포함할 수 있다. 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C 결합에 작용)는 bzdY, oah, bamA, syn_01653, syn_02400, syn_03067 및 syn_01309로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
3-하이드록시피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 6-케토사이클로헥스-1-엔-1-카복실-CoA 신세타제를 포함할 수 있다. 6-케토사이클로헥스-1-엔-1-카복실-CoA 신세타제는 AF1211, AF1983, scs, PAE3250, sucC, sucD, aliA, phl, phlB, paaF 및 bioW로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
3-하이드록시피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(티오에스터에 작용)를 포함할 수 있다. 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(티오에스터에 작용)는 acotl2, gctA, gctB 및 ACH1로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
3-하이드록시피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 6-케토사이클로헥스-1-엔-1-카복실-CoA 트랜스퍼라제를 포함할 수 있다. 6-케토사이클로헥스-1-엔-1-카복실-CoA 트랜스퍼라제는 pcaI, pcaJ, catI, catJ, HPAG1_0676, HPAG1_0677, ScoA, ScoB, OXCT1, OXCT2, ctfA, ctfB, atoA 및 atoD로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
3-하이드록시피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 6-케토사이클로헥스-1-엔-카복실-CoA 리덕타제를 포함할 수 있다. 6-케토사이클로헥스-1-엔-카복실-CoA 리덕타제는 bcd, etfA, etfB, TER, TDE0597, syn_02587, syn_02586, syn_01146, syn_00480, syn_02128, syn_01699, syn_02637, syn_02636, pimC, pimD, acadI 및 acad로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
3-하이드록시피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 6-케토사이클로헥스-1-엔-1-카복실레이트 데카복실라제를 포함할 수 있다. 6-케토사이클로헥스-1-엔-1-카복실레이트 데카복실라제는 adc, cbei_3855, CLL_A2135 및 RBAM_030030으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
3-하이드록시피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 6-케토사이클로헥스-1-엔-1-카복실레이트 리덕타제를 포함할 수 있다. 6-케토사이클로헥스-1-엔-1-카복실레이트 리덕타제는 NtRed1, AtDBR1, P2, PulR, PtPPDBR, YML131W, ispR, AT3G61220, cbr, CBR1, CHO-CR, YIR036C, enr 및 fadH로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
3-하이드록시피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 2-케토사이클로헥산-1-카복실-CoA 신세타제를 포함할 수 있다. 2-케토사이클로헥산-1-카복실-CoA 신세타제는 AF1211, AF1983, scs, PAE3250, sucC, sucD, aliA, ph1, ph1B, paaF 및 bioW로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
3-하이드록시피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제를 포함할 수 있다. 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제는 pcaI, pcaJ, catI, catJ, HPAG1_0676, HPAG1_0677, ScoA, ScoB, OXCT1, OXCT2, ctfA, ctfB, atoA 및 atoD로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
3-하이드록시피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용)를 포함할 수 있다. 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용)는 acotl2, gctA, gctB 및 ACH1로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
3-하이드록시피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 2-케토사이클로헥산-1-카복실레이트 데카복실라제를 포함할 수 있다. 2-케토사이클로헥산-1-카복실레이트 데카복실라제는 adc, cbei_3855, CLL_A2135 및 RBAM_030030로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
3-하이드록시피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 사이클로헥사논 데하이드로게나제를 포함할 수 있다. 사이클로헥사논 데하이드로게나제는 NtRed1, AtDBR1, P2, PulR, PtPPDBR, YML131W, ispR, AT3G61220, cbr, CBR1, CHO-CR, YIR036C, enr 및 fadH로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
3-하이드록시피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 3-하이드록시피멜로일-CoA를 생성하기에 충분한 양으로 발현되는 3-하이드록시피멜로일-CoA 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 3-하이드록시피멜로일-CoA 경로를 포함할 수 있다. 3-하이드록시피멜로일-CoA 경로는, 도 2와 관련하여 앞에서 논의한 바와 같이, 아세토아세틸-CoA, 3-하이드록시부티릴-CoA 데하이드라타제, 글루타릴-CoA 데하이드로게나제, 옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제 및 3-하이드록시피멜로일-CoA 데하이드로게나제를 포함한다. 2개, 3개, 4개, 5개, 즉, 도 2에 나타낸 바와 같이 아세토아세틸-CoA를 3-하이드록시피멜로일-CoA로 전환시키는 모든 효소를 포함하여, 3-하이드록시피멜로일-CoA 효소를 암호화하는 임의 수의 외인성 핵산이 비-천연 미생물 유기체에 제공될 수 있다. 피멜로일-CoA를 생성하기 위해 사용된 최종 탈수 및 환원 단계를 배제하고, 피멜로일-CoA의 생성을 위한 경로에 사용된 유전자들의 동일한 세트를 3-하이드록시피멜로일-CoA 경로에 사용할 수 있다.
또 다른 태양에서, 본 발명은, 도 4에 나타낸 바와 같이, 사이클로헥사논을 생성하기에 충분한 양으로 발현된 사이클로헥사논 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 갖는 사이클로헥사논 경로를 갖는 미생물 유기체를 포함하는 비-천연 미생물 유기체를 제공한다. 사이클로헥사논 경로는 PEP 카복시키나제, 아디페이트 세미알데하이드 데하이드라타제, 사이클로헥산-1,2-다이올 데하이드로게나제 및 사이클로헥산-1,2-다이올 데하이드라타제를 포함한다. 사이클로헥사논 경로에서 임의 수의 상기 효소들은, 완전한 경로에서 각각의 효소를 암호화하는 모든 핵산까지를 포함하여, 적절한 외인성 핵산을 제공함으로써 포함될 수 있다. 비-천연 미생물 유기체는, 예를 들면, 각각 사이클로헥사논 경로 효소를 암호화하는 2개의 외인성 핵산을 포함할 수 있다. 다른 태양에서, 상기 유기체는 각각 사이클로헥사논 경로 효소를 암호화하는 3개의 외인성 핵산을 포함할 수 있다. 또 다른 태양에서, 비-천연 미생물 유기체는 각각 사이클로헥사논 경로 효소를 암호화하는 4개의 외인성 핵산을 포함할 수 있다. 외인적으로 첨가된 임의의 핵산은 이종 핵산으로 제공될 수 있다. 상기 비-천연 미생물 유기체는 실질적으로 혐기성 배양 배지에 제공(및 그중에서 배양)될 수 있다.
아디페이트 세미알데하이드를 사이클로헥사논으로 전환하기 위한 사이클로헥사논 경로를 갖는 유기체는 PEP 카복시키나제를 포함할 수 있다. PEP 카복시키나제는 PCK1 , pck 및 pckA로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
아디페이트 세미알데하이드를 사이클로헥사논으로 전환하기 위한 사이클로헥사논 경로를 갖는 유기체는 사이클로헥산-1,2-다이올 데하이드로게나제를 포함할 수 있다. 사이클로헥산-1,2-다이올 데하이드로게나제는 chnA , Rmert _1335, PP_1946, ARA1 , BDH1 , GCY1 , YPR1 , GRE3 및 YIR036c로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
아디페이트 세미알데하이드를 사이클로헥사논으로 전환하기 위한 사이클로헥사논 경로를 갖는 유기체는 사이클로헥산-1,2-다이올 데하이드라타제를 포함할 수 있다. 사이클로헥산-1,2-다이올 데하이드라타제는 pddC , pddB , pddA , pduC , pduD , pduE, dhaB , dhaC , dhaE , dhaB1 , dhaB2 , rdhtA , rdhtB , ilvD , iolE , ddrA , ddrB , pudG 및 pduH로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
또 다른 태양에서, 본 발명은 사이클로헥사논을 생성하기에 충분한 양으로 발현된 사이클로헥사논 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 갖는 사이클로헥사논 경로를 갖는 미생물 유기체를 포함하는 비-천연 미생물 유기체를 제공한다. 사이클로헥사논 경로는 PEP 카복시키나제, 3-옥소피멜레이트 데카복실라제, 4-아세틸부티레이트 데하이드라타제, 3-하이드록시사이클로헥사논 데하이드로게나제, 2-사이클로헥사논 하이드라타제, 사이클로헥사논 데하이드로게나제; 및 3-옥소피멜로일-CoA 신세타제, 3-옥소피멜로일-CoA 하이드롤라제(티오에스터에 작용) 및 3-옥시피멜로일-CoA 트랜스퍼라제로부터 선택된 효소를 포함한다. 상기 유기체는 도 5에 나타낸 바와 같이 3-옥소피멜로일-CoA를 사이클로헥사논으로 전환시킨다. 미생물 유기체는 각각 사이클로헥사논 경로 효소를 암호화하는 외인성 핵산을 제공함으로써 2개, 3개, 4개, 5개, 6개. 7개, 즉, 사이클로헥사논 경로중 모든 효소까지를 포함할 수 있다. 상기 비-천연 미생물 유기체는 임의 수의 상기 헥산을 이종 핵산으로 제공할 수 있다. 또한, 상기 유기체는 실질적으로 혐기성 배양 배지에 제공(및 그중에서 배양)될 수 있다.
3-옥소피멜로일-CoA를 사이클로헥사논으로 전환하기 위한 사이클로헥사논 경로를 갖는 유기체는 PEP 카복시키나제를 포함할 수 있다. PEP 카복시키나제는 PCK1 , pck 및 pckA로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
3-옥소피멜로일-CoA를 사이클로헥사논으로 전환하기 위한 사이클로헥사논 경로를 갖는 유기체는 3-옥소피멜레이트 데카복실라제를 포함할 수 있다. 3-옥소피멜레이트 데카복실라제는 adc , cbei _3855, CLL _A2135 및 RBAM _030030으로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
3-옥소피멜로일-CoA를 사이클로헥사논으로 전환하기 위한 사이클로헥사논 경로를 갖는 유기체는 3-하이드록시사이클로헥사논 데하이드로게나제를 포함할 수 있다. 3-하이드록시사이클로헥사논 데하이드로게나제는 YMR226c , YDR368w , YOR120w , YGL157w, YGL039w, chnA , Rmet _1335, PP _1946, ARA1 , BDH1 , GCY1 , YPR1 , GRE3 및 Y1R036c로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
3-옥소피멜로일-CoA를 사이클로헥사논으로 전환하기 위한 사이클로헥사논 경로를 갖는 유기체는 2-사이클로헥사논 하이드라타제를 포함할 수 있다. 2-사이클로헥사논 하이드라타제는 aroD , aroQ , HIDH 및 HIDM으로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
3-옥소피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 사이클로헥사논 데하이드로게나제를 포함할 수 있다. 사이클로헥사논 데하이드로게나제는 NtRed1 , AtDBR1 , P2 , PulR , PtPPDBR , YML131W , ispR, AT3G61220 , cbr , CBR1 , CHO - CR , YIR036C , enr 및 fadH로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
3-옥소피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 3-옥소피멜로일-CoA 신세타제를 포함할 수 있다. 3-옥소피멜로일-CoA 신세타제는 AF1211 , AF1983 , scs , PAE3250 , sucC , sucD , aliA , ph1 , ph1B, paaF 및 bioW로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
3-옥소피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 3-옥소피멜로일-CoA 하이드롤라제를 포함할 수 있다. 3-옥소피멜로일-CoA 하이드롤라제는 acotl2 , gctA , gctB 및 ACH1로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
3-옥소피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 3-옥소피멜로일-CoA 트랜스퍼라제를 포함할 수 있다. 3-옥소피멜로일-CoA 트랜스퍼라제는 pcaI , pcaJ , catI , catJ , HPAG1 _0676, HPAG1 _0677, ScoA, ScoB , OXCT1 , OXCT2 , ctfA , ctfB , atoA 및 atoD로부터 선택된 하나 이상의 유전자에 의해 암호화될 수 있다.
3-옥소피멜로일-CoA를 사이클로헥사논으로 전환시키기 위한 사이클로헥사논 경로를 갖는 유기체는 3-옥소피멜로일-CoA를 생성하기에 충분한 양으로 발현된 3-옥소피멜로일-CoA 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 3-옥소피멜로일-CoA 경로를 포함할 수 있다. 3-옥소피멜로일-CoA 경로는, 도 2와 관련하여 앞에서 논의한 바와 같이, 아세토아세틸-CoA, 3-하이드록시부티릴-CoA 데하이드라타제, 글루타릴-CoA 데하이드로게나제 및 옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제를 포함한다. 2개, 3개, 4개, 즉, 도 2에 나타낸 바와 같이 아세토아세틸-CoA를 3-하이드록시피멜로일-CoA로 전환시키는 모든 효소까지를 포함하여, 3-옥소피멜로일-CoA 효소를 암호화하는 임의 수의 외인성 핵산이 비-천연 미생물 유기체에 제공될 수 있다. 피멜로일-CoA를 생성하기 위해 사용된 최종 케톤 환원, 탈수 및 올레핀 환원 단계를 배제하고 피멜로일-CoA의 생성을 위한 경로에 사용된 유전자들의 동일한 세트를 3-하이드록시피멜로일-CoA 경로에 사용할 수 있다.
또 다른 태양에서, 본 발명은 사이클로헥사논 경로를 갖는 비-천연 미생물 유기체를 제공하며, 이때 상기 비-천연 미생물 유기체는, 피멜로일-CoA를 2-케토사이클로헥산-1-카복실-CoA로, 2-케토사이클로헥산-1-카복실-CoA를 2-케토사이클로헥산-1-카복실레이트로, 및 2-케토사이클로헥산-1-카복실레이트를 사이클로헥사논으로 전환시키는 것으로 이루어진 군에서 선택된, 기질을 생성물로 전환시키는 효소 또는 단백질을 암호화하는 하나 이상의 외인성 핵산을 포함한다. 따라서, 본 발명은 도 1에 나타낸 바와 같은, 사이클로헥사논 경로의 기질을 생성물로 전환시키는 효소 또는 단백질을 암호화하는 하나 이상의 외인성 핵산을 함유하는 비-천연 미생물 유기체를 제공한다.
또 다른 태양에서, 본 발명은 피멜로일-CoA논 경로를 갖는 비-천연 미생물 유기체를 제공하며, 이때 상기 비-천연 미생물 유기체는, 아세토아세틸-CoA를 3-하이드록시부티릴-CoA로, 3-하이드록시부티릴-CoA를 크로토닐-CoA로, 크로토닐-CoA를 글루타릴-CoA로, 글루타릴-CoA를 3-옥소피멜로일-CoA로, 3-옥소피멜로일-CoA를 3-하이드록시피멜로일-CoA로, 3-하이드록시피멜로일-CoA를 6-카복시헥스-2-에노일-CoA로, 및 6-카복시헥스-2-에노일-CoA를 피멜로일-CoA로 전환시키는 것으로 이루어진 군에서 선택된, 기질을 생성물로 전환시키는 효소 또는 단백질을 암호화하는 하나 이상의 외인성 핵산을 포함한다. 따라서, 본 발명은 도 2에 나타낸 바와 같은, 사이클로헥사논 경로의 기질을 생성물로 전환시키는 효소 또는 단백질을 암호화하는 하나 이상의 외인성 핵산을 함유하는 비-천연 미생물 유기체를 제공한다.
또 다른 태양에서, 본 발명은 사이클로헥사논 경로를 갖는 비-천연 미생물 유기체를 제공하며, 이때 상기 비-천연 미생물 유기체는, 3-하이드록시피멜로일-CoA를 6-케토사이클로헥스-1-엔-1-카복실-CoA로, 6-케토사이클로헥스-1-엔-1-카복실-CoA를 6-케토사이클로헥스-1-엔-1-카복실레이트로, 6-케토사이클로헥스-1-엔-1-카복실레이트를 2-사이클로헥사논으로 및 2-사이클로헥사논을 사이클로헥사논으로 전환시키는 것으로 이루어진 군에서 선택된, 기질을 생성물로 전환시키는 효소 또는 단백질을 암호화하는 하나 이상의 외인성 핵산을 포함한다. 따라서, 본 발명은 도 3에 나타낸 바와 같은, 사이클로헥사논 경로의 기질을 생성물로 전환시키는 효소 또는 단백질을 암호화하는 하나 이상의 외인성 핵산을 함유하는 비-천연 미생물 유기체를 제공한다.
또 다른 태양에서, 본 발명은 사이클로헥사논 경로를 갖는 비-천연 미생물 유기체를 제공하며, 이때 상기 비-천연 미생물 유기체는, 3-하이드록시피멜로일-CoA를 6-케토사이클로헥스-1-엔-1-카복실-CoA로, 6-케토사이클로헥스-1-엔-1-카복실-CoA를 6-케토사이클로헥스-1-엔-1-카복실레이트로, 6-케토사이클로헥스-1-엔-1-카복실레이트를 2-케토사이클로헥산-1-카복실레이트로, 및 2-케토사이클로헥산-1-카복실레이트를 사이클로헥사논으로 전환시키는 것으로 이루어진 군에서 선택된, 기질을 생성물로 전환시키는 효소 또는 단백질을 암호화하는 하나 이상의 외인성 핵산을 포함한다. 따라서, 본 발명은 도 3에 나타낸 바와 같은, 사이클로헥사논 경로의 기질을 생성물로 전환시키는 효소 또는 단백질을 암호화하는 하나 이상의 외인성 핵산을 함유하는 비-천연 미생물 유기체를 제공한다.
또 다른 태양에서, 본 발명은 사이클로헥사논 경로를 갖는 비-천연 미생물 유기체를 제공하며, 이때 상기 비-천연 미생물 유기체는, 3-하이드록시피멜로일-CoA를 6-케토사이클로헥스-1-엔-1-카복실-CoA로, 6-케토사이클로헥스-1-엔-1-카복실-CoA를 2-케토사이클로헥산-1-카복실-CoA로, 2-케토사이클로헥산-1-엔-1-카복실-CoA를 2-케토사이클로헥산-1-카복실레이트로, 및 2-케토사이클로헥산-1-카복실레이트를 사이클로헥사논으로 전환시키는 것으로 이루어진 군에서 선택된, 기질을 생성물로 전환시키는 효소 또는 단백질을 암호화하는 하나 이상의 외인성 핵산을 포함한다. 따라서, 본 발명은 도 3에 나타낸 바와 같은, 사이클로헥사논 경로의 기질을 생성물로 전환시키는 효소 또는 단백질을 암호화하는 하나 이상의 외인성 핵산을 함유하는 비-천연 미생물 유기체를 제공한다.
또 다른 태양에서, 본 발명은 사이클로헥사논 경로를 갖는 비-천연 미생물 유기체를 제공하며, 이때 상기 비-천연 미생물 유기체는, 아디페이트 세미알데하이드를 사이클로헥산-1,2-다이온으로, 사이클로헥산-1,2-다이온을 2-하이드록시사이클로헥산-1-온으로, 2-하이드록시사이클로헥산-1-온을 사이클로헥산-1,2-다이올로 및 사이클로헥산-1,2-다이올을 사이클로헥사논으로 전환시키는 것으로 이루어진 군에서 선택된, 기질을 생성물로 전환시키는 효소 또는 단백질을 암호화하는 하나 이상의 외인성 핵산을 포함한다. 따라서, 본 발명은 도 4에 나타낸 바와 같은, 사이클로헥사논 경로의 기질을 생성물로 전환시키는 효소 또는 단백질을 암호화하는 하나 이상의 외인성 핵산을 함유하는 비-천연 미생물 유기체를 제공한다.
또 다른 태양에서, 본 발명은 사이클로헥사논 경로를 갖는 비-천연 미생물 유기체를 제공하며, 이때 상기 비-천연 미생물 유기체는, 3-옥소피멜로일-CoA를 3-옥소피멜레이트로, 3-옥소피멜레이트를 4-아세틸부티레이트로, 4-아세틸부티레이트를 1,3-사이클로헥산다이온으로, 1,3-사이클로헥산다이온을 3-하이드록시사이클로헥사논으로, 3-하이드록시사이클로헥사논을 2-사이클로헥사논으로 및 2-사이클로헥사논을 사이클로헥사논으로 전환시키는 것으로 이루어진 군에서 선택된, 기질을 생성물로 전환시키는 효소 또는 단백질을 암호화하는 하나 이상의 외인성 핵산을 포함한다. 따라서, 본 발명은 도 5에 나타낸 바와 같은, 사이클로헥사논 경로의 기질을 생성물로 전환시키는 효소 또는 단백질을 암호화하는 하나 이상의 외인성 핵산을 함유하는 비-천연 미생물 유기체를 제공한다.
또 다른 태양에서, 본 발명은 사이클로헥사논 경로를 갖는 비-천연 미생물 유기체를 제공하며, 이때 상기 비-천연 미생물 유기체는, 2,6-다이아미노헵탄다이오산을 6-아미노헵트-2-엔다이오산으로, 6-아미노헵트-2-엔다이오산을 2-아미노헵탄다이오산으로, 2-아미노헵탄다이오산을 6-카복시헥스-2-에네오에이트로, 6-카복시헥스-2-에네오에이트를 피멜레이트로 및 피멜레이트를 피멜로일-CoA로 전환시키는 것으로 이루어진 군에서 선택된, 기질을 생성물로 전환시키는 효소 또는 단백질을 암호화하는 하나 이상의 외인성 핵산을 포함한다. 따라서, 본 발명은 도 7에 나타낸 바와 같은, 사이클로헥사논 경로의 기질을 생성물로 전환시키는 효소 또는 단백질을 암호화하는 하나 이상의 외인성 핵산을 함유하는 비-천연 미생물 유기체를 제공한다.
본원에서 사이클로헥사논 경로를 함유하는 미생물 유기체로서 일반적으로 기술되었지만, 본 발명은 또한 사이클로헥사논 경로의 중간체를 생성하기에 충분한 양으로 발현된 사이클로헥사논 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 비-천연 미생물 유기체를 제공함을 이해해야 한다. 예를 들면, 본원에 개시된 바와 같이, 사이클로헥사논 경로는 도 1 내지 5 및 7에 예시되어 있다. 그러므로, 사이클로헥사논을 생성하는 사이클로헥사논 경로를 함유하는 미생물 유기체 이외에, 본 발명은 또한 사이클로헥사논 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 비-천연 미생물 유기체를 제공하며, 이때 상기 미생물 유기체는 사이클로헥사논 경로 중간체, 예를 들면, 도 1에 나타낸 바와 같은 2-KCH-CoA 또는 2-KCH, 도 2에 나타낸 바와 같은 3-하이드록시부티릴-CoA, 크로토닐-CoA, 글루타릴-CoA, 3-옥소피멜로일-CoA, 3-하이드록시피멜로일-CoA 또는 피멜로일-CoA, 도 3에 나타낸 바와 같은 2-KCH, 2-KCH-CoA, 6-KCH-CoA, 6-KCH 또는 2-사이클로헥사논, 도 4에 나타낸 바와 같은 사이클로헥산-1,2-다이온, 2-하이드록시사이클로헥산-1-온 또는 사이클로헥산-1,2-다이올, 도 5에 나타낸 바와 같은 3-옥소피멜레이트, 4-아세틸부티레이트, 1,3-사이클로헥산다이온, 3-하이드록시사이클로헥사논 또는 2-사이클로헥사논, 및 도 7에 나타낸 바와 같은 6-아미노헵트-2-엔다이오산, 2-아미노헵탄다이오산, 6-카복시헥스-2-에노에이트 또는 피멜레이트를 생성한다.
도 1 내지 5 및 7의 경로를 포함하여 실시예에 기술되고 도면에 예신되 바와 같은 본원에 개시된 임의의 경로는 목적하는 대로 임의의 경로 중간체 또는 생성물을 생성하는 비-천연 미생물 유기체를 생성하기 위해 사용될 수 있음을 이해해야 한다. 본원에 개시된 바와 같이, 중간체를 생성하는 상기 미생물 유기체는 목적 생성물을 생성하기 위한 하위 경로 효소를 발현하는 또 다른 미생물 유기체와 함께 사용될 수 있다. 그러나, 사이클로헥사논 경로 중간체를 생성하는 비-천연 미생물 유기체는 중간체를 목적 생성물로서 생성하기 위해 사용될 수 있음을 이해해야 한다.
본 발명은 본원에서 일반적으로 대사 반응, 반응물 또는 그의 생성물과 관련하여, 또는 특별히 언급된 대사 반응, 반응물 또는 생성물과 관련되거나 이를 촉진하는 효소, 또는 이들과 관련된 단백질을 암호화하는 하나 이상의 핵산 또는 유전자와 관련하여 기술된다. 본원에서 달리 언급되지 않는 한, 당해 분야에 숙련된 자는 반응에 대한 언급이 또한 반응물 및 상기 반응의 생성물에 대한 언급으로 여겨짐을 이해할 것이다. 유사하게, 본원에 달리 언급되지 않는 한, 반응물 또는 생성물에 대한 언급은 또한 반응을 나타내며, 임의의 상기 대사 구성요소에 대한 언급은 또한 언급된 반응, 반응물 또는 생성물을 촉진하는 효소 또는 이들에 수반되는 단백질을 암호화하는 유전자 또는 유전자들을 나타낸다. 마찬가지로, 대사 생화학, 효소학 및 유전체학의 공지된 분야가 제공될 때, 유전자 또는 암호화 핵산에 대한 본원의 언급은 또한 상응하는 암호화된 효소 및 상기 효소가 촉진하는 반응, 또는 상기 반응과 관련된 단백질 및 상기 반응의 반응물 및 생성물에 대한 언급으로 여겨진다.
일부 태양에서, 사이클로헥사논 경로는 피멜로일-CoA를 도 1에 나타낸 바와 같은 3가지 효소 단계에서 사이클로헥사논으로 전환시키는 효소를 포함한다. 상기 경로에서, 피멜로일-CoA는 2-케토하이클로헥산-1-카복실-CoA 하이드롤라제(C-C 결합에 작용)에 의해 2-케토사이클로헥산-1-카복실-CoA(2KCH-CoA)로 환화된다. 2KCH-CoA 하이드롤라제는 역으로, 즉, 도 1에 나타낸 바와 같이 폐환 방향으로 작용한다. 이어서, CoA 에스터는 2-케토사이클로헥산-1-카복실-CoA와 CoA 신세타제, 하이드롤라제 또는 트랜스퍼라제와의 반응에 의해 케토사이클로헥산-1-카복실레이트로 전환된다. 마지막으로, 2-케토사이클로헥산-1-카복실레이트의 탈카복실화에 의해 사이클로헥사논이 수득된다.
표 1에 나타낸 상기 경로의 에너지학 및 이론적 사이클로헥사논 수율은 다음에 따라 달라진다: 1) 단계 2에서 CoA 잔기를 제거하기 위해 사용된 효소의 유형, 2) 피멜로일-CoA를 생성하기 위한 생합성 경로, 및 3) ATP-생성 방향으로 작용하는 PEP 카복시키나제의 능력.
| 사이클로헥사논 (몰/몰 글루코스) |
최대 수율에서 ATP (몰/몰 글루코스) |
|
| 하이드롤라제 | 0.738 | 0 |
| 하이드롤라제, PPCKr | 0.075 | 0.31 |
| 트랜스퍼라제 | 0.75 | 0.56 |
| 트랜스퍼라제, PPCKr | 0.75 | 1.06 |
본원에 개시된 바와 같은 피멜로일-CoA를 생성하는 균주는 단계 (2)에서의 트랜스퍼라제 또는 신세타제 및 가역적 PEP 카복시키나제를 사용하여, 사용된 글루코스 몰 당 0.75 몰의 사이클로헥사논(0.41 g/g)의 이론적 수율을 갖는다. 상기 균주는 사용된 글루코스 몰 당 0.06 몰 ATP의 에너지 수율을 갖는다.
사이클로헥사논 경로의 각 단계를 위한 효소를 하기에 기술한다. 일부 태양에서, 피멜로일-CoA를 생성하기 위한 천연 경로를 사용할 수 있지만, 다른 태양에서는 중추 대사 전구체로부터 피멜로일-CoA를 합성하기 위한 신규 경로를 사용한다.
상기 경로의 제 1 단계는 도 1의 단계 1에 도시된 바와 같이 피멜로일-CoA로부터 2-케토사이클로헥산-1-카복실-CoA의 생성을 포함한다. 상기 전환은 크로토네이트 상에서의 성장동안 신트로푸스 액시디트로피쿠스( Syntrophus aciditrophicus)에서 폐환 방향으로 일어나는 것으로 나타났다[Mouttaki et al., Appl. Environ. Micobiol. 73:930-938 (2007)]. 상기 효소 활성은 또한 벤조에이트 상에서의 성장동안 또 다른 미생물과 함께 동시-배양중의 신트로푸스 액시디트로피쿠스의 무세포 추출물에서 입증되었다[Elshahed et al., Appl. Environ. Microbiol. 67:1728-1738 (2001)]. 개환 방향으로 상기 활성을 촉진하는 효소는, badI에 의해 암호화되는 로도슈도모나스 팔루스트리스( Rhodopseudomonas palustris)에서 특성화되었다[Pelletier et al., J. Bacteriol. 180:2330-2336 (1998)]. 로도슈도모나스 팔 루스트리스 효소는 이. 콜라이에서 발현되었으며, 여기서 개환 방향으로의 효소 활성에 대해 분석되었다; 그러나, 상기 활성은 관찰되지 않았다[Egland et al., Proc. Natl. Acad. Sci U.S.A. 94:6484-6489 (1997)]. syn _01653(38%), syn_03076(33%), syn _02400(33%), syn _03076(30%) 및 syn _01309(31%)를 포함하여, 신트로푸스 액시디트로피쿠스 게놈 중 여러개의 유전자가 로도슈도모나스 팔루스트 리스의 badI 유전자에 대한 서열 상동성을 갖는다. 예시적인 유전자 산물에 대한 단백질 서열은 하기 표 2에 나타낸 하기의 진뱅크(GenBank) 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| badI | NP_946006.1 | 39933730 | 로도슈도모나스 팔루스트리스 |
| syn _01653 | YP_463074.1 | 85860872 | 신트로푸스 액시디트로피쿠스 |
| syn _01654 | YP_463073.1 | 85860871 | 신트로푸스 액시디트로피쿠스 |
| syn _02400 | YP_462924.1 | 85860722 | 신트로푸스 액시디트로피쿠스 |
| syn _03076 | YP_463118.1 | 85860916 | 신트로푸스 액시디트로피쿠스 |
| syn _01309 | YP_461962.1 | 85859760 | 신트로푸스 액시디트로피쿠스 |
메나퀴논 생합성에 관여하는 효소인 나프토일-CoA 신세타제(EC 4.1.3.36)는 숙시닐-벤조일-CoA의 1,4-다이하이드록시-2-나프토일-CoA로의 폐환 전환을 촉진한다. 로도슈도모나스 팔루스트리스의 badI 유전자 산물은 다른 유기체중의 1,4-다이하이드록시나프토일-CoA 신세타제 동족체와 53% 만큼의 서열 동일성을 공유하며[Eberhard et al., J. Am. Chem. Soc. 126:7188-7189 (2004)], 상기 전환을 촉진하는 효소는 폐환 방향으로 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(C-C 결합에 작용) 활성을 입증할 수 있다. 상기 효소는 에스케리키아 콜라이[Sharma et al., J. Bacteriol. 174:5057-5062 (1992)], 바실러스 서브틸리스( Bacillus subtilis)[Driscoll et al., J. Bacteriol. 174:5063-5071 (1992)], 스태필로코커 스 오레우스( Staphylococcus aureus)[Ulaganathan et al., Acta Crstyallogr. Sect. F. Struct. Biol. Cyst. Commun. 63:908-913 (2007)] 및 게오바실러스 카우스토필러스( Geobacillus kaustophilus)[Kanajunia et al., Acta Crstyallogr. Sect. F. Struct. Biol. Cyst. Commun. 63:103-105 (2007)]에서 발견된다. 또한, 구조적 데이터는 마이코박테리움 투베르큘로시스( Mycobacterium tuberculosis)[Johnston et al., Acta Crstyallogr. Sect. F. Struct. Biol. Cyst. Commun. 61:1199-1206 (2005)], 스태필로코커스 오레우스[Ulaganathan et al., Acta Crstyallogr. Sect. F. Struct. Biol. Cyst. Commun. 63:908-913 (2007)] 및 게오바실러스 카우스토필러스[Kanajunia et al., Acta Crstyallogr. Sect. F. Struct. Biol. Cyst. Commun. 63:103-105 (2007)]로부터의 효소에 대해 이용가능하다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 3에 나타낸 하기 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| menB | AAC75322 | 1788597 | 에스케리키아 콜라이 K12 속 MG1655 |
| menB | AAC37016 | 143186 | 바실러스 서브틸리스 |
| menB | NP_215062 | 15607688 | 마이코박테리움 튜베르큘로시스 |
| menB | BAB57207 | 14246815 | 스태필로코커스 오레우스 |
| menB | BAD77158 | 56381250 | 게오바실러스 카우스토필러스 |
도 1, 단계 2에 나타낸, 2-케토사이클로헥산-1-카복실-CoA의 2-케토사이클로헥산-1-카복실레이트로의 반응은 CoA 하이드롤라제, 트랜스퍼라제 또는 신세타제에 의해 수행될 수 있다. 3-옥소산 CoA 트랜스퍼라제는 3-옥소아디페이트 CoA-트랜스퍼라제(EC 2.8.3.6), 3-옥소산 CoA 트랜스퍼라제(2.8.3.5) 및 아세테이트-아세토아세테이트 CoA-트랜스퍼라제(2.8.3.-)를 포함한다. 3-옥소아디페이트 CoA 트랜스퍼라제(EC 2.8.3.6)는 숙시닐-CoA로부터, 3-옥소피멜레이트에 대해 구조적으로 근접한 분자인 3-옥소아디페이트로의 CoA 잔기의 전이를 촉진한다. 방향족 화합물 분해를 위한 베타-케토아디페이트 경로에 관여하므로[Harwood et al., Annu. Rev. Microbiol. 50:553-590 (1996)], 상기 효소는 슈도모나스 푸티다( Pseudomonas putida)[Parales et al., J. Bacteriol. 174:4657-4666 (1992)], 아시네토박터 칼코아세티쿠스( Acinetobacter calcoaceticus)(속 ADP1)[Dal et al., Appl. Environ. Microboiol. 71:1025-1034 (2005); Yeh et al., J. Biol. Chem. 256:1565-1569 (1981)] 및 슈도모나스 나크무시( Pseudomonas knackmussii)(이전 속 B13)[Gobel et al., J. Bacteriol. 184:216-223 (2002); Kaschabek et al., J. Bacteriol. 184:207-215 (2002)]에서 특성화되었다. 효소 유전자 산물에 대한 단백질 서열은 하기 표 4에 나타낸 하기 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| pcaI | Q01103.2 | 24985644 | 슈도모나스 푸티다 |
| pcaJ | P0A102.2 | 26990657 | 슈도모나스 푸티다 |
| pcaI( catI ) | AAC37146.1 | 684991 | 아시네토박터 칼코아세티쿠스(속. ADP1) |
| pcaJ( catJ ) | AAC37147.1 | 141776 | 아시네토박터 칼코아세티쿠스(속. ADP1) |
| pcaI | Q8VPF3.1 | 75404583 | 슈도모나스 나크무시 |
| pcaJ | Q8VPF2.1 | 75404582 | 슈도모나스 나크무시 |
상기 반응 단계를 위한 또 다른 CoA 트랜스퍼라제는 숙시닐-CoA:3-케토산-CoA 트랜스퍼라제이다. 상기 효소는 3-케토아실-CoA를 3-케토산으로 전환시키는 동시에 숙시네이트를 숙시닐-CoA로 전환시킨다. 예시적 숙시닐-CoA:3-케토산-CoA 트랜스퍼라제는 헬리코박터 필로리( Helicobacter pylori)[Corthesy-Theulaz et al., J. Biol. Chem. 272:25659-25667 (1997)], 바실러스 서브틸리스[Stols et al., Protein. Expr. Purif. 53:396-403 (2007)] 및 호모 사피엔스( Homo sapiens)[Fukao et al., Genomics 68:144-151 (2000); Tanaka et al., Mol. Hum. Reprod. 8:16-23 (2002)]에 존재한다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 5에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| HPAG1 _0676 | YP_627417 | 108563101 | 헬리코박터 파이 롤리 |
| HPAG1 _0677 | YP_627418 | 108563102 | 헬리코박터 파이 롤리 |
| ScoA | NP_391778 | 16080950 | 바실러스 서브틸리스 |
| ScoB | NP_391777 | 16080949 | 바실러스 서브틸리스 |
| OXCT1 | NP_000427 | 4557817 | 호모 사피엔스 |
| OXCT2 | NP_071403 | 11545841 | 호모 사피엔스 |
아세테이트-아세토아세테이트 CoA 트랜스퍼라제는 자연적으로 아세토아세틸-CoA로부터 아세테이트로 CoA 잔기를 전이시켜 아세틸-CoA 및 아세토아세테이트를 생성한다. 예시적인 효소는 클로스트리듐 아세토부틸리컴( Clostridium acetobutylicum)[Weisenborn et al., App. Environ. Microbiol. 55:323-329 (1989)]에서 ctfAB, 에스케리키아 콜라이 K12[Sramek et al., Arch. Biochem. Biophys. 171:14-26 (1975)]로부터의 atoAD 및 클로스트리듐 사카로퍼부틸아세토니컴 ( Clostridium saccharoperbutylacetonicum)[Kosaka et al., Bopsco. Biotechnol. Biochem. 71:58-68 (2007)]으로부터의 ctgAB의 유전자 산물을 포함한다. 클로스트 리듐 아세토부틸리컴 효소는 이. 콜라이에서 기능적으로 발현되었다[Cary et al., Appl. Environ. Microbiol. 56:1576-1583 (1990)]. atoA 및 atoD에 의해 암호화된, 이. 콜라이 K12에서의 CoA 트랜스퍼라제는 매우 광범위한 기질 특이성을 가지며 대체 3-옥소아실-CoA 기질과 반응하는 것으로 밝혀졌다[Sramek et al., Arch. Biochem. Biophys. 171:14-26 (1975)]. 상기 효소는 아세토아세테이트에 의해 전사 수준에서 유도되어, 경로 중 상기 효소를 사용하기 위해 조절 대조군의 변형을 수행할 수 있다[Pauli et al., Euro. J. Biochem. 29:553-562 (1972)]. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 6에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| ctfA | NP_149326.1 | 15004866 | 클로스트리듐 아세토부틸리컴 |
| ctfB | NP_149327.1 | 15004867 | 클로스트리듐 아세토부틸리컴 |
| atoA | NP_416726 | 2492994 | 에스케리키아 콜라이 K12 아주 MG1655 |
| atoD | NP_416725 | 2492990 | 에스케리키아 콜라이 K12 아주 MG1655 |
| ctfA | AAP42564.1 | 31075384 | 클로스트리듐 사카로퍼부틸아세토니컴 |
| ctfB | AAP42565.1 | 31075385 | 클로스트리듐 사카로퍼부틸아세토니컴 |
하나의 APT 신세타제는, 아실-CoA 에스터를 그의 상응하는 산으로의 전환을 APT의 동시 합성과 커플링시키는 효소인 ADP-생성 아세틸-CoA 신세타제(ACD, EC 6.2.1.13)이다. 상기 효소는 기질로서 2-케토사이클로헥산-1-카복실-CoA와 반응하는 것으로 밝혀지진 않았지만, 광범위한 기질 특이성을 갖는 여러 효소가 문헌에 기술되었다. AF1211에 의해 암호화된, 아르케오글로버스 풀지더스( Archaeoglobus fulgidus)로부터의 ACDI은 이소부티레이트, 이소펜타노에이트 및 푸마레이트를 포함하여 다양한 선형 및 분지쇄 기질 상에 작용하는 것으로 밝혀졌다[Musfeldt et al., J. Bacteriol. 184:636-644 (2002)]. AF1983에 의해 암호화된, 아르케오글로 버스 풀지더스에서의 제 2의 가역적 ACD도 또한 사이클릭 화합물 페닐아세테이트 및 인돌아세테이트에 대해 높은 활성을 갖는 광범위한 기질 범위를 갖는 것으로 밝혀졌다[Musfeldt et al., J. Bacteriol. 184:636-644 (2002)]. 할로아르큘라 마리스모르티( Haloarcula marismortui)로부터의 효소(숙시닐-CoA 신세타제로 주석이 달린)는 기질로서 프로피오네이트, 부티레이트 및 분지쇄 산(이소발레레이트 및 이소부티레이트)을 허용하며, 정방향 및 역방향으로 작용하는 것으로 밝혀졌다[Brasen et al., Arch. Microbiol. 182:277-287 (2004)]. 초고온성 크레나르카에온(crenarchaeon)인 피로바큘럼 에로필럼( Pyrobaculum aerophilum)으로부터의 PAE3250에 의해 암호화된 ACD는, 아세틸-CoA, 이소부티릴-CoA(바람직한 기질) 및 페닐아세틸-CoA와 반응하는, 모든 특성화된 ACD의 가장 광범위한 기질 범위를 나타내었다[Brasen et al., Arch. Microbiol. 182:277-287 (2004)]. 방향성 진화 또는 공학기술을 사용하여 상기 효소를 숙주 유기체의 생리 온도에서 작용하도록 변형시킬 수 있다. 아르케오글로버스 풀지더스 , 할로아르큘라 마리스모르티 및 피로바큘 럼 에로필럼으로부터의 효소들을 모두 클로닝하고, 기능적으로 발현시키고, 이. 콜라이에서 특성화시켰다[Brasen et al., Arch. Microbiol. 182:277-287 (2004); Musfeldt et al., J. Bacteriol. 184:636-644 (2002)]. 또 다른 효소가 이. 콜라이에서 scuCD에 의해 암호화되며, 이것은 자연적으로, 생체내에서 가역적인 반응인 한 ATP의 동시 소비와 함께 숙시네이트로부터 숙시닐-CoA의 생성을 촉진한다[Buck et al., Biochemistry 24:6245-6262 (2985)]. 예시적인 유전자 산물에 대한 단백질 서열은 하기 표 7에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| AF1211 | NP_070039.1 | 11498810 | 아르케오글로버스 풀지더스 DSM 4304 |
| AF1983 | NP_070807.1 | 11499565 | 아르케오글로버스 풀지더스 DSM 4304 |
| scs | YP_135572.1 | 55377722 | 할로아르큘라 마리스모르티 ATCC 43049 |
| PAE3250 | NP_560604.1 | 18313937 | 피로바큘럼 에로필럼 아주 IM2 |
| sucC | NP_415256.1 | 16128703 | 에스케리키아 콜라이 |
| sucD | AAC73823.1 | 1786949 | 에스케리키아 콜라이 |
또 다른 가능성은 AMP-생성 CoA 리가제를 역방향으로 작용하도록 돌연변이시키는 것이다. aliA에 의해 암호화된, 로도슈도모나스 팔루스트리스로부터의 AMP-생성 사이클로헥산카복실레이트 CoA-리가제는 2-케토사이클로헥산-1-카복실-CoA와 유사한 기질에 대해 활성이며, 활성 부위의 변이는 효소의 기질 특이성에 영향을 미치는 것으로 밝혀졌다[Samanta et al., Mol. Microbiol. 55:1151-1159 (2005)]. 상기 효소는 또한 혐기성 벤젠 고리 분해시에 사이클로헥스-1-엔-1-카복실레이트 CoA-리가제로서 작용한다[Egland et al., Proc. Natl. Acad. Sci U.S.A. 94:6484-6489 (1997)]. 그러나, 상기 효소의 원래 형태는, 사이클로헥산-1-카복실레이트의 생성에 필요한 바와 같이, ATP-생성 방향으로 작용할 수 있는 것 같지 않다. 단백질 공학 또는 방향성 진화를 이용하여 상기 작용성을 달성할 수 있다. 또 다른 예시적인 CoA 리가제는 페니실리움 크리소게넘( Penicillium crysogenum)으로부터의 2개의 특성화된 페닐아세테이트-CoA 리가제[Lamas-Maceiras et al., Biochem. J. 395:147-155 (2006); Wang et al., Biochem. Biophys. Res. Commun. 360:453-458 (2007)], 슈도모나스 푸티다로부터의 페닐아세테이트-CoA 리가제[Martinez-Blanco et al., J. Biol. Chem. 265:7085-7090 (1990)] 및 바실러스 서브틸리스로부터의 6-카복시헥사노에이트-CoA 리가제[Bower et al., J. Bacteriol. 178:4122-4130 (1996)]를 포함한다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 8에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| aliA | AAC23919 | 2190573 | 로도슈도모나스 팔루스트리스 |
| phI | CAJ15517.1 | 77019264 | 페니실리움 크리소게넘 |
| phIB | ABS19624.1 | 152002983 | 페니실리움 크리소게넘 |
| paaF | AAC24333.2 | 22711873 | 슈도모나스 푸티다 |
| bioW | NP_390902.2 | 50812281 | 바실러스 서브틸리스 |
2-케토사이클로헥산-1-카복실-CoA는 또한 CoA 하이드롤라제에 의해 2-케토사이클로헥산-1-카복실레이트로 가수분해될 수 있다. 여러 진핵 아세틸-CoA 하이드롤라제(EC 3.1.2.1))가 광범위한 기질 특이성을 갖는다. 래터스 노르베기커스( Rattus norvegicus)의 뇌로부터의 효소(131)는 부티릴-CoA, 헥사노일-CoA 및 말로닐-CoA와 반응할 수 있다. 완두 잎의 미토콘드리온으로부터의 효소는 아세틸-CoA, 프로피오닐-CoA, 부티릴-CoA, 팔미토일-CoA, 올레오일-CoA, 숙시닐-CoA 및 크로토닐-CoA를 포함하여 다양한 기질상에 활성이다[Zeiher et al., Plant. Physiol. 94:20-27 (1990)]. 또한, 액시드아미노코커스 퍼멘탄스( Acidaminococcus fermentans)로부터의 글루타코네이트 CoA-트랜스퍼라제는 부위-지향 돌연변이유발에 의해 글루타릴-CoA, 아세틸-CoA 및 3-부테노일-CoA에 대해 활성을 갖는 아실-CoA 하이드롤라제로 전환되었다[Mack et al., FEBS Lett. 405:209-212 (1997)]. 이것은 숙시닐-CoA:3-케토산-COA 트랜스퍼라제 및 아세토아세틸-CoA:아세틸-CoA 트랜스퍼라제를 암호화하는 효소가 또한 CoA 하이드롤라제 효소로 작용할 수 있지만 그의 기능을 변화시키는 특정 돌연변이를 필요로 함을 보여준다. 사카로마이세스 세레비지에( Saccharomyces cerevisiae)로부터의 아세틸-CoA 하이드롤라제, ACH1은 또 다른 하이드롤라제를 나타낸다[Buu et al., J. Biol. Chem. 278:17023-17209 (2003)]. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 9에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| acot12 | _570103.1 | 18543355 | 래터스 노르베기커스 |
| gctA | CAA57199 | 559392 | 액시드아미노코커스 퍼멘탄스 |
| gctB | CAA57200 | 559393 | 액시드아미노코커스 퍼멘탄스 |
| ACH1 | NP_009538 | 6319456 | 사카로마이세스 세레비지에 |
경로의 마지막 단계에서, 사이클로헥사논은 2-케토사이클로헥산 카복실레이트의 탈카복실화(도 2, 단계 3)에 의해 생성된다. 상기 반응은 아세토아세테이트 데카복실라제와 같은 3-옥소산 데카복실라제(EC 4.1.1.4)에 의해 촉진된다. adc에 의해 암호화된, 클로스트리듐 아세토부틸리컴( Clostridium acetobuylicum)으로부터 아세토아세테이트 데카복실라제는 넓은 기질 범위를 가지며, 2-케토사이클로헥산 카복실레이트를 탈카복실화시켜 사이클로헥사논을 생성하는 것으로 나타났다[Benner et al., J. Am. Chem. Soc. 103:993-994 (1981); Rozzel et al., J. Am. Chem. Soc. 106:4937-4941 (1984)]. 무세포 추출액에서 특성화된, 바실러스 폴리믹사( Bacillus polymyxa)로부터의 아세토아세테이트 데카복실라제도 또한 3-케토산에 대해 광범위한 기질 특이성을 가지며, 대체 기질 3-옥소펜타노에이트를 탈카복실화시키는 것으로 밝혀졌다[Matiasek et al., Curr. Microbiol. 42:276-281 (2001)]. 또 다른 아세토아세테이트 데카복실라제 효소가 클로스트리듐 베이저린키( Clostridium beijerinckii)[Ravabnani et al., Mol. Microbiol. 37:1172-1185 (2000)] 및 클로스트리듐 사카로퍼부틸아세토니컴[Kosaka et al., Biosci. Biotechnol. Biochem. 71:58-68 (2007)]에서 발견된다. 클로스트리듐 보툴리 넘( Clostridium botulinum) 및 바실러스 아밀로리쿼파시엔스( Bacillus amyloliquefaciens) FZB42를 포함하여 다른 유기체에서의 유전자들도 서열 상동성에 의해 추정될 수 있다. 3-옥소산의 탈카복실화는 또한 효소의 부재하에서 자발적으로 일어날 수 있다[Matiasek et al., Curr. Microbiol. 42:276-281 (2001)]. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 10에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| adc | NP_149328.1 | 15004868 | 클로스트리듐 아세토부틸리컴 ATCC 824 |
| cbei _3835 | YP_001310906.1 | 150018652 | 클로스트리듐 베이저린키 NCIMB 8052 |
| adc | AAP42566.1 | 31075386 | 클로스트리듐 사카로퍼부틸아세토니컴 |
| CLL _A2135 | YP_001886324.1 | 187933144 | 클로스트리듐 보툴리넘 |
| RBAM _030030 | YP_001422565.1 | 154687404 | 바실러스 아밀로리쿼파시엔스 FZB42 |
포스포엔올피루베이트의 옥살로아세테이트로의 실제 전환은 산화환원-중립이지만, 상기 전환 메카니즘은 사이클로헥사논 생성 경로의 전체 에너지학에 중요하다. PEP의 옥살로아세테이트로의 전환을 위한 한 효소는 PEP를 카복실화시키는 동시에 ATP를 생성하는 PEP 카복시키나제이다. 그러나, 대부분의 유기체에서, PEP 카복시키나제는 글루코스생성 작용을 하며, 한 ATP를 소비하며 옥살로아세테이트를 PEP로 전환시킨다. 사카로마이세스 세레비지에는 그 원래 PEP 카복시키나제, PCK1이 글루코스생성 역할을 하는 하나의 상기 유기체이다[Valdes-Hevia et al., FEBS Lett. 258:313-316 (2989)]. 옥살로아세테이트를 생성하는데 있어 PEP 카복시키나제의 역할이, 아마도 PEP 카복시키나제의 바이카보네이트에 대해 더 높은 Km으로 인해, ATP를 생성하지 않는 PEP 카복실라제에 비해 적은 것으로 여겨지기 때문에, 이. 콜라이가 또 다른 상기 유기체이다[Kim et al., Appl. Environ Microbiol. 70:1238-1241 (2004)]. 그럼에도 불구하고, PEP로부터 옥살로아세테이트로의, 천연 이. 콜 라이 PEP 카복시키나제의 활성은 최근에 이. 콜라이 K-12의 ppc 돌연변이체에서 입증되었다[Kwon et al., J. Microbiol. Biotechnol. 16:1448-1452 (2006)]. 이들 균주는 성장의 결함을 나타내지 않았으며, 높은 NaHCO3 농도에서 증가된 숙시네이트 생성을 나타내었다. 일부 유기체, 특히 반추위 세균에서, PEP 카복시키나제는 PEP로부터 옥살로아세테이트를 생성하고 ATP를 생성하는데 매우 효과적이다. 이. 콜 라이 내에 클로닝된 PEP 카복시키나제 유전자의 예로는 만헤이미아 숙시니시프로듀센스( Mannheimia succiniciproducens)[Lee et al., Biotechnol. Bioprocess. Eng. 7:95-99 (2002)], 언에어로바이오스피릴럼 숙시니시프로듀센스( Anaerobiospirillum succiniciproducens)[Laivenieks et al., Appl. Environ. Microbiol. 63:2273-2280 (1997)] 및 액티노바실러스 숙시노제네스( Actinobacillus succinogenes)[Kim et al., Appl. Environ Microbiol. 70:1238-1241 (2004)]로부터의 유전자들이 포함된다. 내부 실험은 또한 헤모필러스 인플루엔자( Haemophilus influenza)에 의해 암호화된 PEP 카복시키나제 효소가 PEP로부터 옥살로아세테이트를 생성하는데 매우 효과적임을 밝혔다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 11에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| PCK1 | NP_013023 | 6322950 | 사카로마이세스 세레비지에 |
| pck | NP_417862.1 | 16131280 | 에스케리키아 콜라이 |
| pckA | YP_089485.1 | 52426348 | 만헤이미아 숙시니시프로듀센스 |
| pckA | O09460.1 | 3122621 | 언에어로바이오스피릴럼 숙시니시프로듀센스 |
| pckA | Q6W6X5 | 75440571 | 액티노바실러스 숙시노제네스 |
| pckA | P43923.1 | 1172573 | 헤모필러스 인플루엔자 |
피멜로일-CoA는 비오틴 생합성의 중간체이다. 피멜로일-CoA로부터 비오틴 생성을 촉진하는 효소적 단계는 공지되어 있으며, 에스케리키아 콜라이 , 바실러스 서브틸리스 및 바실러스 스패리커스(Bacillus spaericus)를 포함하여 여러 유기체에서 연구되었으나, 피멜로일-CoA를 합성하기 위한 경로는 완전히 밝혀지지 않았다. 이. 콜라이와 같은 그람-음성 세균에서, bioC 및 bioH의 유전자 산물이 피멜로일-CoA 합성에 필요하며, 상기 유전자가 결여된 균주는 성장을 촉진하기 위해 외인성 비오틴의 첨가를 필요로 한다[Del Campillo-Campbell et al., J. Bacteriol. 94:2065-2066(1967)]. bioC 유전자 산물은 말로닐-CoA 단위의 단계적 축합을 촉진하는 특이적 아실-운반 단백질로서 작용하는 것으로 생각된다[Lemoine et al., Mol. Microbiol. 19:645-647 (1996)]. BioH 단백질은 CoA 결합 부위를 함유하며 피멜로일을 BioC로부터 CoA로 이동시키는 아실트랜스퍼라제로서 작용하는 것으로 생각된다[Akatsuka et al., Gene 302:185-192 (2003); Lemoine et al., Mol. Microbiol. 19:645-647 (1996)]. 이어서 BioC의 새로운 특징은 아실-전이를 스타터 말로닐-CoA 단위로 제한되며, 쇄 연장을 2개의 연장제 단위로 한정하는 것이다[Lemoine et al., Mol. Microbiol. 19:645-647 (1996)]. 이. 콜라이에서의 13C 표지 연구는 피멜로일-CoA가 3개의 아세테이트 단위 및 하나의 바이카보네이트 단위로부터 유도되는 것을 입증하여, 합성 메카니즘이 지방산 및 폴리케티드 합성의 메카니즘과 유사함을 시사하였다[Sanyai et al., J. Am. Chem. Soc. 116:2637-2638 (1994)]. 바실러스 서브틸리스 및 바실러스 스패리커스와 같은 그람-양성 세균은 피멜레이트로부터 피멜로일-CoA를 합성하기 위한 상이한 경로를 사용하지만, 상기 경로는 또한 완전히 이해되지 않고 있다. 모든 비오틴-생성 유기체에서, 미결 문제들이 포함된 정확한 대사 전환, 비오틴 오페론에서 유전자 산물의 기능, 전형적인 지방산 생합성 복합체(들)의 역할, 운반 단백질의 성질 및 경로 조절에 관해 남아 있다.
지방산 및 폴리케티드 합성 경로는 잘 인지되어 있다. 지방산 합성의 첫번째 단계로서, 아세틸-CoA 카복실라제는 1 ATP 당량을 소모하여 아세틸-CoA 및 바이카보네이트로부터 말로닐-CoA를 생성한다[Barber et al., Biochim. Biophys. Acta 1733:1-28 (2005)]. 피멜로일-CoA 탄소 골격이 말로닐-CoA의 3개 연장제 단위로 구성되는 경우, 문헌 [Lemoine et al., Mol. Microbiol. 19:645-647 (1996)]에서 제시된 바와 같이, 3 ATP 당량이 필요하다. 다른 필요한 효소 활성(말로닐-CoA 아실트랜스퍼라제, 베타-케토아실 신타제, 베타-케토아실 리덕타제, 베타-하이드록시아실 데하이드라타제 및 에노일-CoA 리덕타제)이 일반적인 지방산 복합체와 유사한 효소에 의해 촉진되는 경우, 3개의 아세틸-CoA 구성 요소로부터 1몰의 피멜로일-CoA를 합성하기 위한 실제 반응은 다음이 된다:
3 아세틸-CoA + 3 ATP + 4 NADH + 바이카보네이트 →
피멜로일-CoA + 4 NAD+ + 3 ADP + 3 Pi + 2 CoA + H+
상기 경로는 에너지 관점에서 비용이 많이 들며, 또한 피멜로일-CoA를 사이클로헥사논으로 전환시키는 효소 활성을 갖는 균주에서 사이클로헥사논의 최대 이론상 수율을 달성할 수 없다. 혐기성 조건하에서, 상기 경로는 사용된 글루코스 몰 당 0.7 몰의 사이클로헥사논의 최대 수율을 달성할 것으로 예상된다. 상기 경로는 에너지적으로 제한되므로, 세포 성장 및 최대 생성물 수율에서의 유지를 뒷받침하기 위해 ATP가 이용가능하지 않다. 이러한 사실들은 지방산 생합성과 유사한 경로를 통해 높은 사이클로헥사논 수율을 달성하기 위해 호기성 조건이 필요함을 시사한다. 또 다른 잠재적인 문제는 상기 경로가 말로닐-CoA 연장제 단위에 대해 공지된 지방산 ACP로부터의 경쟁에 부딪칠 것이라는 것이다.
비오틴-과잉생성 균주를 조작하려고 한 시도는 중간 정도의 성공을 이루었지만, 비용-효과적 균주의 개발은 기술적 문제를 안고 있다[Streit et al., Appl. Microbiol. Biotechnol. 61:21-31 (2003)]. 비오틴 생성을 개선하기 위해 적용된 전략, 예를 들면, 피멜로일-CoA 합성의 초기 단계에 수반되는 유전자의 돌연변이유발, 클로닝 및/또는 과발현은 또한 사이클로헥사논 생성을 개선하기 위해 적용될 수 있다.
본 발명의 일부 태양에 따라서, 피멜로일-CoA는 도 2에 도시된 바와 같은 7개 효소 단계에서 아세토아세틸-CoA로부터 합성된다. 상기 경로는 자연적으로 벤조일-CoA를 분해시키는 일부 유기체에서 일어난다. 상기 경로는 정상적으로 분해성 방향으로 작용하지만, 세균 신트로푸스 액시디트로피쿠스( Syntrophus aciditrophicus)가 탄소 공급원으로 크로토네이트 상에서 성장하고 피멜로일-CoA를 생성할 수 있다는 증거가 존재하여, 상기 경로에서 상기 효소가 합성 방향으로 작용할 수 있다는 증거를 제공한다[Mouttaki et al., Appl. Environ. Micobiol. 73:930-938 (2007)].
도 2에 나타낸 경로에서, 아세토아테실-CoA의 3-케토기는 환원되고 탈수되어 크로토닐-CoA를 생성한다. 글루타릴-CoA는 크로토닐-CoA의 환원성 카복실화로부터 생성된다. 이어서, 베타-케토티올라제는 글루타릴-CoA를 아세틸-CoA와 결합시켜 3-옥소피멜로일-CoA를 생성한다. 환원 및 탈수는 2-에노일-CoA를 생성하며, 이어서 피멜로일-CoA로 환원된다.
아세토아세틸-CoA의 3-하이드록시부티릴-CoA로의 환원은 아세토아세틸-CoA 리덕타제(EC 1.1.1.36)로도 불리는 3-하이드록시아실-CoA 데하이드로게나제에 의해 촉진된다. 상기 효소는 많은 유기체에서 폴리하이드록시부티레이트 생합성에 관여하며, 또한 PHB 및 3-하이드록시이소부티레이트를 과잉생성하기 위한 대사 공학 전략에 사용되었다[Liu et al., Appl. Microbiol. Biotechnol. 76:811-818 (2007); Qui et al., Appl. Microbiol. Biotechnol. 69:537-542 (2006)]. 캔디다 트로피칼리스( Candida tropicalis)로부터의 효소는 퍼옥시좀 지방산 베타-산화 다작용성 효소 타입 2(MFE-2)의 한 성분이다. 상기 단백질의 데하이드로게나제 B 영역은 아세토아세틸-CoA에 대해 촉매적으로 활성이다. 상기 영역은 기능적으로 이. 콜라이에서 발현되었으며, 결정 구조가 이용가능하고, 촉매 메카니즘은 잘 인지되어 있다[Yliantilla et al., J. Mol. Biol. 358:1286-1295 (2006); Ylanttila et al., Biochem. Biophys. Res. Commun. 324:25-30 (2004)]. 아세토아세틸-CoA 리덕타제는 또한 로도박터 스패로이데스( Rhodobacter sphaeroides)에서 아세테이트 동화에서 그의 역할에 대해 연구되었다[Alber et al., Mol. Microbiol. 61:297-309 (2006)]. 주글로에 라미게라(Zoogloea ramigera)로부터의 효소는 아세토아세틸-CoA에 대해 매우 낮은 Km을 가지며, 이. 콜라이에 클로닝되어 과잉생성되었다[Ploux et al., Eur. J. Biochem. 174:177-182 (1988)]. 파라코커스 데니트리피칸스( Paracoccus denitrificans)로부터의 효소는 이. 콜라이에서 기능적으로 발현되고 특성화되었다[Yabutani et al., FEMS Microbiol. Lett. 133:85-90 (1995)]. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 11a에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
[표 11a]
아세토아세틸-CoA의 3-하이드록시부티릴-CoA로의 전환은 또한 3-하이드록시아실 데하이드로게나제(EC 1.1.1.35)로도 알려져 있는 아세토아세틸-CoA 리덕타제에 의해 촉진될 수 있다. 예시적 효소로는 클로스트리듐 아세토부틸리컴으로부터의 hbd[Boynton et al ., J. Bacteriol . 178:3015-3024 (1996)], 클로스트리듐 베이저린키로부터의 hbd[Colgy et al., Appl. Environ Microbiol. 58:3297-3302 (1992)] 및 메탈로스패라 세둘라(Metallosphaera sedula)로부터의 많은 유사한 효소[Berg et al., Science 318:1782-1786 (2007)]가 포함된다. 또 다른 유전자로는 클로스트리듐 클루이베리( Clostridium kluyveri)[Hillmer et al., FEBS Lett. 21:351-354 (1972)]에서의 Hbd1(C-말단 영역) 및 Hbd2(N-말단 영역) 및 보스 타우러스( Bos taurus)[Wakil et al., J. Biol. Chem. 207:631-638 (1954)]에서의 HSD17B10이 포함된다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 12에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| hbd | NP_349314.1 | 15895965 | 클로스트리듐 아세토부틸리컴 |
| hbd | AAM14586.1 | 20162442 | 클로스트리듐 베이저린키 |
| Msed _1423 | YP_001191505 | 146304189 | 메탈로스패라 세둘라 |
| Msed _0399 | YP_001190500 | 146303184 | 메탈로스패라 세둘라 |
| Msed _0389 | YP_001190490 | 146303174 | 메탈로스패라 세둘라 |
| Msed _1993 | YP_001192057 | 146304741 | 메탈로스패라 세둘라 |
| Hbd2 | EDK34807.1 | 146348271 | 클로스트리듐 클루이베리 |
| Hbd1 | EDK32512.1 | 146345976 | 클로스트리듐 클루이베리 |
| HSD17B10 | O02691.3 | 3183024 | 보스 타우러스 |
3-하이드록시아실-CoA 데하이드라타제를 암호화하는 것으로 예상된, 로도슈 도모나스 팔루스트리스( Rhodopseudomonas palustris)에서 pimF의 유전자 산물은 또한 피멜로일-CoA 분해시에 3-하이드록시아실-CoA 데하이드로게나제로 작용할 수 있다[Harrison et al., Microbiology 151:727-736 (2005)]. fadB의 유전자 산물은 이. 콜라이에서 지방산 베타-산화시에 상기 두 기능을 촉진한다[Yang et al., Biochem. 30:6788-6795 (1991)]. 서열 상동성 및 게놈 상황에 의해 추정되는, 신트로푸스 액시디트로피쿠스에서 3-하이드록시아실-CoA 데하이드로게나제 유전자는 syn_01310 및 syn _01680을 포함한다[McInerney et al., Proc. Natl. Acad. Sci. U.S.A. 104:7600-7605 (2007)]. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 13에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| pimF | CAE29158 | 39650635 | 로도슈도모나스 팔루스트리스 |
| fadB | P21177 | 119811 | 에스케리키아 콜라이 |
| syn _01310 | YP_461961 | 85859759 | 신트로푸스 액시디트로피쿠스 |
| syn _01680 | ABC78882 | 85723939 | 신트로푸스 액시디트로피쿠스 |
크로토나제로도 불리는 3-하이드록시부티릴-CoA 데하이드라타제(EC 4.2.1.55)는 3-하이드록시이소부티릴-CoA를 크로토노일-CoA로 탈수시킨다(도 3, 단계 2). 크로토나제 효소는 일부 유기체, 특히 클로스트리듐 종에서 n-부탄올 생성에 필요하며, 또한 설폴로부스 ( Sulfolobus ), 액시디아누스 ( Acidianus ) 및 메탈로스패라 속의 호열호산성 고세균에서 3-하이드록시프로피오네이트/4-하이드록시부티레이트 사이클의 한 단계를 포함한다. 크로토나제 효소를 암호화하는 예시적 유전자는 클로스트리듐 아세토부틸리컴[Atsumi et al., Metab. Eng. 10:305-311 (2007); Boynton et al., J. Bacteriol. 178:3015-3024 (1996)], 클로스트리듐 클루이베리[Hillmer et al., FEBS Lett. 21:351-354 (1972)] 및 메탈로스패라 세둘라[Berg et al., Science 318:1782-1786 (2007)]에서 찾을 수 있다. 로도슈도모나스 팔루 스트리스에서 pimF의 유전자 산물은 피멜로일-CoA 분해에 관여하는 3-하이드록시-아실-CoA 데하이드라타제를 암호화하는 것으로 예상된다[Harrison et al., Microbiol. 151:727-736 (2005)]. 신트로푸스 액시디트로피쿠스에서의 많은 유전자들이 클로스트리듐 아세토부틸리컴 및 클로스트리듐 클루이베리의 3-하이드록시부티릴-CoA 데하이드라타제에 대한 서열 유사성에 의해 확인되었다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 14에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| crt | NP_349318.1 | 15895969 | 클로스트리듐 아세토부틸리컴 |
| crt1 | YP_001393856.1 | 153953091 | 클로스트리듐 클루이베리 |
| pimF | CAE29158 | 39650635 | 로도슈도모나스 팔루스트리스 |
| syn _01309 | YP_461962 | 85859760 | 신트로푸스 액시디트로피쿠스 |
| syn _01653 | YP_463074 | 85860872 | 신트로푸스 액시디트로피쿠스 |
| syn _01654 | YP_463073.1 | 85860871 | 신트로푸스 액시디트로피쿠스 |
| syn _02400 | YP_462924.1 | 85860722 | 신트로푸스 액시디트로피쿠스 |
| syn _03076 | YP_463074.1 | 85860872 | 신트로푸스 액시디트로피쿠스 |
에노일-CoA 하이드라타제(EC 4.2.1.17)는 또한 3-하이드록시아실-CoA 기질의 탈수를 촉진한다[Agnihotri et al., Bioorg. Med. Chem. 11:9-20 (2003); Conrad et al., J. Bacteriol. 118:103-111 (1974); Roberts et al., Arch. Microbiol. 117:99-108 (1978)]. ech에 의해 암호화된, 슈도모나스 푸티다의 에노일-CoA 하이드라타제는 3-하이드록시부티릴-CoA의 크로토닐-CoA로의 전환을 촉진한다[Roberts et al., Arch. Microbiol. 117:99-108 (1978)]. 또 다른 에노일-CoA 하이드라타제는 슈도모나스 푸티다의 phaA 및 phaB, 및 슈도모나스 플루오레센스의 paaA 및 paaB이다[Olivera et al., Proc. Natl. Acad. Sci U.S.A. 95:6419-6424 (1998)]. 마지막으로, maoC[Park et al., J. Bacteriol. 185:5391-5397 (2003)], paaF[Ismail et al., Eur. J. Biochem. 270:3047-3054 (2003); Park et al., Appl. Biochem. Biotechnol. 113:335-346 (2004); Park et al., Biotechnol. Bioeng. 86:681-686 (2004)] 및 paaG[Ismail et al., Eur. J. Biochem. 270:3047-3054 (2003); Park et al., J. Bacteriol. 185:5391-5397 (2003); Park et al., Appl. Biochem. Biotechnol. 113:335-346 (2004)]를 포함하여, 많은 에스케리키아 콜라이 유전자가 에노일-CoA 하이드라타제 작용성을 보이는 것으로 밝혀졌다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 15에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| ech | NP_745498.1 | 26990073 | 슈도모나스 푸티다 |
| phaA | NP_745427.1 | 26990002 | 슈도모나스 푸티다 |
| phaB | NP_745426.1 | 26990001 | 슈도모나스 푸티다 |
| paaA | ABF82233.1 | 106636093 | 슈도모나스 플루오레센스 |
| paaB | ABF82234.1 | 106636094 | 슈도모나스 플루오레센스 |
| maoC | NP_415905.1 | 16129348 | 에스케리키아 콜라이 |
| paaF | NP_415911.1 | 16129354 | 에스케리키아 콜라이 |
| paaG | NP_415912.1 | 16129355 | 에스케리키아 콜라이 |
또는, fadA 및 fadB의 이. 콜라이 유전자 산물은 에노일-CoA 하이드라타제 활성을 나타내는 지방산 산화에 수반되는 다중효소 복합체를 암호화한다[Nakahigashi et al., Nucleic Acids Res. 18:4937 (1990); Yang, S.Y., J. Bacteriol. 173:7405-7406 (1991); Yang et al., Biochemistry 30:6788-6795 (1991)]. fadR에 의해 암호화된 음성 조절자를 손상시키는 것을 이용하여 fadB 유전자 산물을 활성화시킬 수 있다[Sato et al., J. Biosci. Bioeng. 103:38-44 (2007)]. fadI 및 fadJ 유전자는 유사한 기능을 암호화하며 자연적으로 혐기성 조건하에서 발현된다[Campbell et al., Mol. Microbiol. 47:793-805 (2003)]. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 16에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| fadA | YP_026272.1 | 49176430 | 에스케리키아 콜라이 |
| fadB | NP_418288.1 | 16131692 | 에스케리키아 콜라이 |
| fadI | NP_416844.1 | 16130275 | 에스케리키아 콜라이 |
| fadJ | NP_416843.1 | 16130274 | 에스케리키아 콜라이 |
| fadR | NP_415705.1 | 16129150 | 에스케리키아 콜라이 |
글루타릴-CoA 데하이드로게나제(GCD, EC 1.3.99.7 및 EC 4.1.1.70)는 글루타릴-CoA의 크로토닐-CoA로의 산화성 탈카복실화를 촉진하는 이작용성 효소이다(도 3, 단계 3). 이작용성 GCD 효소는 전자 수용체로서 전자 전달 플라빈단백질을 사용하는 단독사량체이다[Hartel et al., Arch. Microbiol. 159:174-181 (1993)]. 상기 효소는 방향족 화합물상에서 성장중의 슈도모나스 균주 KB740 및 K172의 세포 추출물에서 처음 특성화되었지만[Hartel et al., Arch. Microbiol. 159:174-181 (1993)], 상기 유기체에서 관련된 유전자들은 미지이다. 글루타릴-CoA 데하이드로게나제(gcdH) 및 그의 동종 전사 조절자(gcdR)를 암호화하는 유전자는 아조아르커스( Azoarcus) 속 CIB에서 확인되었다[Blazquez et al., Environ. Microbiol. 10:474-482 (2008)]. gcdH 활성이 결여된 아조아르커스 균주를 사용하여 슈도모나스 푸티다로부터의 이종 유전자 gcdH를 확인하였다[Blazquez et al., Environ. Microbiol. 10:474-482 (2008)]. 슈도모나스 푸티다에서 동종 전사 조절자는 확인되지 않았지만, 유전자좌 PP _0157은 아조아르커스 효소에 대해 높은 서열 상동성(> 69% 동일성)을 갖는다. 또 다른 GCD 효소는 슈도모나스 플루오레센스 및 파라코커 스 데니트리피칸스에서 발견된다[Husain et al., J. Bacteriol. 163:709-715 (1985)]. 인간 GCD는 광범위하게 연구되고, 이. 콜라이에서 과발현되고[Dwyer et al., Biochemistry 39:11488-11499 (2000)], 결정화되고, 활성 부위에서 보존 글루타메이트 잔기를 포함하는 촉매 메카니즘이 기술되었다[Fu et al., Biochemistry 43:9674-9684 (2004)]. 신트로푸스 액시디트로피쿠스에서의 GCD는 크로토네이트 상에서 성장중의 CO2-동화 방향으로 작용한다[Mouttaki et al., Appl. Environ. Micobiol. 73:930-938 (2007)]. 신트로푸스 액시디트로피쿠스에서 2개의 GCD 유전자가 아조아르커스 GcdH: syn _00480(31%) 및 syn _01146(31%)에 대한 단백질 서열 상동성에 의해 확인하였다. 아조아르커스 GcdR 조절 단백질에 대해서는 상동성이 별로 발견되지 않았다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 17에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| gcdH | ABM69268.1 | 123187384 | 아조아르커스속 CIB |
| gcdR | ABM69269.1 | 123187385 | 아조아르커스속 CIB |
| gcdH | AAN65791.1 | 24981507 | 슈도모나스 푸티다 KT2440 |
| PP _0157( gcdR ) | AAN65790.1 | 24981506 | 슈도모나스 푸티다 KT2440 |
| gcdH | YP_257269.1 | 70733629 | 슈도모나스 플루오레센스 Pf -5 |
| gcdA( gcdR ) | YP_257268.1 | 70733628 | 슈도모나스 플루오레센스 Pf -5 |
| gcd | YP_918172.1 | 119387117 | 파라코커스 데니트리피칸스 |
| gcdR | YP_918173.1 | 119387118 | 파라코커스 데니트리피칸스 |
| gcd | AAH02579.1 | 12803505 | 호모 사피엔스 |
| syn -00480 | ABC77899 | 85722956 | 신트로푸스 액시디트로피쿠스 |
| syn -01146 | ABC76260 | 85721317 | 신트로푸스 액시디트로피쿠스 |
또는, 크로토닐-CoA의 글루타코닐-CoA로의 카복실화 및 글루타릴-CoA로의 후속 환원은 별도의 효소: 글루타코닐-CoA 데카복실라제 및 글루타코닐-CoA 리덕타제에 의해 촉진될 수 있다. 글루타메이트-발효 혐기성 세균에서 특성화된 글루타코닐-CoA 데카복실라제 효소는 보조인자로서 비오틴을 사용하며 4개의 서브단위(알파, 베타, 감마 및 델타)로 이루어진 나트륨-이온 전좌 데카복실라제이다[Boiangiu et al., J. Mol. Microbiol. Biotechnol. 10:105-119 (2005); Buckel et al., Biochim. Biophys. Acta 1505:15-27 (2001)]. 상기 효소는 푸소박테리움 뉴클레아텀( Fusobacterium nucleatum)[Beatrix et al., Arch. Microbiol. 154:362-369 (1990)] 및 액시드아미노코커스 퍼멘탄스[Braune et al., Mol. Microbiol. 31:473-487 (1999)]에서 특성화되었다. 푸소박테리움 뉴클레아텀 글루타코닐-CoA 데카복실라제 알파, 베타 및 델타 서브단위에 대한 유사체들이 신트로푸스 액시디트로피 쿠스에서 발견된다. 에노일-CoA 데하이드로게나제로 주석이 달린, 또 다른 GCD인 유전자 syn _00480은 비오틴-카복실 운반체(syn _00479) 및 글루타코닐-CoA 데카복실라제 알파 서브단위(syn _00481) 사이의 예상된 오페론에 위치한다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 18에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| gcdA | CAA49210 | 49182 | 액시드아미노코커스 퍼멘탄스 |
| gcdC | AAC69172 | 3777506 | 액시드아미노코커스 퍼멘탄스 |
| gcdD | AAC69171 | 3777505 | 액시드아미노코커스 퍼멘탄스 |
| gcdB | AAC69173 | 3777507 | 액시드아미노코커스 퍼멘탄스 |
| FN0200 | AAL94406 | 19713641 | 푸소박테리움 뉴클레아텀 |
| FN0201 | AAL94407 | 19713642 | 푸소박테리움 뉴클레아텀 |
| FN0204 | AAL94410 | 19713645 | 푸소박테리움 뉴클레아텀 |
| syn -00479 | YP_462066 | 85859864 | 신트로푸스 액시디트로피쿠스 |
| syn -00481 | YP_462068 | 85859866 | 신트로푸스 액시디트로피쿠스 |
| syn -01431 | YP_460282 | 85858080 | 신트로푸스 액시디트로피쿠스 |
| syn -00480 | ABC77899 | 85722956 | 신트로푸스 액시디트로피쿠스 |
글루타코닐-CoA가 크로토닐-CoA 카복실라제 활성을 갖는 효소에 의해 생성되는 경우, 글루타코닐-CoA의 글루타릴-CoA로의 환원은 글루타코닐-CoA 리덕타제 활성을 갖는 효소에 의해 수행될 수 있다. 하기에 기술되는, 6-카복시헥스-2-에노일-CoA의 피멜로일-CoA로의 환원을 촉진하기 위한 에노일-CoA 리덕타제 효소도 또한 여기에 적용가능하다. 상기 단계를 위한 하나의 효소는, 관련 기능을 촉진할 것으로 예상되는 유전자에 인접한 그의 게놈 상황으로 인해, 신트로푸스 액티디트로피 쿠스의 syn _00480이다.
글루타릴-CoA 및 아세틸-CoA는 축합되어 옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제, 베타-케토티올라제(EC 2.3.1.16)에 의해 3-옥소피멜로일-CoA를 생성한다. 상기 전환을 촉진하는 효소는 랄스토니아 유트로파( Ralstonia eutropha)(이전에 알칼리제네스 유트로퍼스(Alcaligenes eutrophus)로 알려짐)에서 발견되고, 유전자 bktB 및 bktC에 의해 암호화된다[Haywood et al., FEMS Microbiol. Lett. 52:91-96 (1988); Slater et al., J. Bacteriol. 180:1979-1987 (1998)]. BktB 단백질의 서열은 알려져 있다; 그러나, BktC 단백질의 서열은 보고된 바가 없다. 로도슈도모나스 팔루스트리스의 pim 오페론은 또한 벤조일-CoA 분해시에 분해 방향으로 상기 전환을 촉진할 것으로 예상되는, pimB에 의해 암호화되는 베타-케토티올라제를 암호화한다[Harrison et al., Microbiol. 151:727-736 (2005)]. 신트로푸스 액시디트로피쿠스에서 베타-케토티올라제 효소는 bktB에 대한 서열 상동성(43% 동일성, e값 = 1e-93)에 의해 확인되었다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 19에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| bktB | YP_725948 | 11386745 | 랄스토니아 유트로파 |
| pimB | CAE29156 | 39650633 | 로도슈도모나스 팔루스트리스 |
| syn _02642 | YP_462685.1 | 85860483 | 신트로푸스 액시디트로피쿠스 |
아세틸-CoA 및 프로피오닐-CoA로부터 베타-케토발레레이트의 생성을 촉진하는 베타-케토티올라제 효소는 또한 3-옥소피멜로일-CoA의 생성을 촉진할 수 있다. 주글로에 라미게라는 프로피오닐-CoA 및 아세틸-CoA로부터 베타-케토발레릴-CoA를 생성할 수 있는 2개의 케토티올라제를 가지며, 랄스토니아 유트로파는 또한 상기 전환을 촉진할 수 있는 베타-산화 케토티올라제를 갖는다(그루이스(Gruys) 등, 미국 특허 제 5,958,745 호). 이들 유전자 또는 그의 번역된 단백질의 서열은 보고되지 않았지만, 랄스토니아 유트로파 , 주글로에 라미게라 또는 다른 유기체 중의 여러 유전자가 랄스토니아 유트로파로부터의 bktB에 대한 서열 상동성을 근거로 확인될 수 있다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 20에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| phaA | YP_725941.1 | 113867452 | 랄스토니아 유트로파 |
| h16 _A1713 | YP_726205.1 | 113867716 | 랄스토니아 유트로파 |
| pcaF | YP_728366.1 | 116694155 | 랄스토니아 유트로파 |
| h16 _B1369 | YP_840888.1 | 116695312 | 랄스토니아 유트로파 |
| h16 _A0170 | YP_724690.1 | 113866201 | 랄스토니아 유트로파 |
| h16 _A0462 | YP_724980.1 | 113866491 | 랄스토니아 유트로파 |
| h16 _A1528 | YP_726028.1 | 113867539 | 랄스토니아 유트로파 |
| h16 _B0381 | YP_728545.1 | 116694334 | 랄스토니아 유트로파 |
| h16 _B0662 | YP_728824.1 | 116694613 | 랄스토니아 유트로파 |
| h16 _B0759 | YP_728921.1 | 116694710 | 랄스토니아 유트로파 |
| h16 _B0668 | YP_728830.1 | 116694619 | 랄스토니아 유트로파 |
| h16 _A1720 | YP_726212.1 | 113867723 | 랄스토니아 유트로파 |
| h16 _A1887 | YP_726356.1 | 113867867 | 랄스토니아 유트로파 |
| phbA | P07097.4 | 135759 | 주글로에 라미게라 |
| bktB | YP_002005382.1 | 194289475 | 큐프리아비더스 타이와네시스 |
| Rmet _1362 | YP_583514.1 | 94310304 | 랄스토니아 메탈리듀란스 |
| Bphy _0975 | YP_001857210.1 | 186475740 | 버크홀데리아 피마텀 |
또 다른 효소로는 아세틸-CoA의 2개 분자를 아세토아세틸-CoA(EC 2.1.3.9)로 전환시키는 것으로 알려진 베타-케토티올라제가 포함된다. 예시적 아세토아세틸-CoA 티올라제 효소는 이. 콜라이[Martin et al., Nat. Biotechnol. 21:796-802 (2003)]로부터의 atoB , 클로스트리듐 아세토부틸리컴[Hanai et al., Appl. Environ. Microbiol. 73:7814-7818 (2007); Winzer et al., J. Mol. Microbiol. Biotechnol. 2:531-541 (2000)]으로부터의 thlA 및 thlB 및 사카로마이세스 세레비 지에[Hiser et al., J. Biol. Chem. 269:31383-31389 (1994)]로부터 ERG10의 유전자 산물을 포함한다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 21에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| atoB | NP_416728 | 16130161 | 에스케리키아 콜라이 |
| thlA | NP_349476.1 | 15896127 | 클로스트리듐 아세토부틸리컴 |
| thlB | NP_149242.1 | 15004782 | 클로스트리듐 아세토부틸리컴 |
| ERG10 | NP_015297 | 6325229 | 사카로마이세스 세레비지에 |
3-옥소아디필-CoA 티올라제로도 불리는 베타-케토아디필-CoAS 티올라제(EC 2.3.1.174)는 베타-케토아디필-CoA를 숙시닐-CoA 및 아세틸-CoA로 전환시키며, 방향족 화합물 분해를 위한 베타-케토아디페이트 경로의 핵심 효소이다. 상기 효소는 슈도모나스 푸티다[Harwood et al., J. Bacteriol. 176:6479-6488 (1994)] 및 아시네토박터 칼코아세티쿠스 ( Acinetobacter calcoaceticus)[Doten et al., J. Bacteriol. 169:3168-3174 (1987)]를 포함하여 토양 세균 및 진균중에 널리 퍼져있다. 슈도모나스 푸티다 효소는 랄스토니아 유트로파에서의 PHB 생합성, 인간 미토콘드리아에 의한 지방산 분해 및 클로스트리듐 아세토부틸리컴에 의한 부티레이트 생성에 포함되는 베타-케토티올라제에 대해 45%의 서열 상동성을 갖는 단독사량체이다[Harwood et al., J. Bacteriol. 176:6479-6g488 (1994)]. 슈도모나스 나크무시(이전 속 B13)에서의 베타-케토아디필-CoA 티올라제도 또한 특성화되었다[Gobel et al., J. Bacteriol. 184:216-223(2002); Kaschabek et al., J. Bacteriol. 184:207-215 (2002)]. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 22에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| pcaF | NP_743536.1 | 506695 | 슈도모나스 푸티다 |
| pcaF | AAC37148.1 | 141777 | 아시네토박터 칼코아세티쿠스 |
| catF | Q8VPF1.1 | 75404581 | 슈도모나스 나크무시 |
3-옥소피멜로일-CoA의 3-하이드록시피멜로일-CoA로의 환원은 3-하이드록시피멜로일-CoA 데하이드로게나제(EC 1.1.1.259)에 의해 촉진된다. 상기 활성은 로도 슈도모나스 팔루스트리스 및 슈도모나스 속의 세포 추출물에서 입증되었지만[Koch et al., Eur. J. Biochem. 211:649-661 (1993); Koch et al., Eur. J. Biochem. 205:195-202 (1992)], 유전자는 보고된 바가 없다. 상기 전환은 또한 크로토네이트상에서의 성장중의 신트로푸스 액시디트로피쿠스에서 일어나는 것으로 예상된다[Mouttaki et al., Appl. Environ. Micobiol. 73:930-938 (2007)]. 3-하이드록시아실-CoA 데하이드로게나제 및/또는 아세토아세틸-CoA 리덕타제 활성을 갖는 효소도 또한 상기 반응을 촉진할 수 있다.
3-하이드록시피멜로일-CoA의 6-카복시헥스-2-에노일-CoA로의 탈수는 크로토네이트 사용동안 신트로푸스 액시디트로피쿠스에서 일어나 사이클로헥산 카복실레이트를 수득하는 것으로 예상된다[Mouttaki et al., Appl. Environ. Micobiol. 73:930-938 (2007)]. 상기 반응은 에노일-CoA 하이드라타제(4.2.1.17) 또는 3-하이드록시부티릴-CoA 데하이드라타제(EC 4.2.1.55)에 의해 촉진될 수 있다.
피멜로일-CoA 데하이드로게나제(EC 1.3.1.62)에 의한 6-카복시헥스-2-에노일-CoA의 피멜로일-CoA로의 환원은 신트로푸스 액시디트로피쿠스 세포 추출물에서 특성화되었다[Elshahed et al., Appl. Environ. Microbiol. 67:1728-1738 (2001)]. 에노일-CoA 리덕타제 효소는 상기 전환을 촉진하기에 적합한 효소이다. 하나의 예시적인 에노일-CoA 리덕타제는 클로스트리듐 아세토부틸리컴으로부터의 bcd의 유전자 산물로[Atsumi et al., Metab. Eng. 10:305-311 (2007); Boynton et al., J. Bacteriol. 178:3015-3024 (1996)], 이것은 자연적으로 크로토닐-CoA의 부티릴-CoA로의 환원을 촉진한다. 상기 효소의 활성은, 전자 전달 플라빈단백질을 암호화하는 클로스트리듐 아세토부틸리컴 etfAB 유전자의 발현과 함께, bcd를 발현시킴으로써 증대될 수 있다. 에노일-CoA 리덕타제 단계를 위한 또 다른 효소는 유글레나 그라실리스( Euglena gracilis)로부터의 미토콘드리아 에노일-CoA이다[Hoffmeister et al., J. Biol. Chem. 280:4329-4388 (2005)]. 그의 미토콘드리아 표적 리더 서열의 제거후 상기 서열로부터 유도된 구조물을 이. 콜라이에 클로닝하여 활성 효소를 수득하였다[Hoffmeister et al., J. Biol. Chem. 280:4329-4388 (2005)]. 상기 접근방법은 진핵세포 유전자, 특히 원핵 유기체에서 특정 세포내 구획에 유전자 산물을 표적화할 수 있는 리더 서열을 갖는 유전자를 발현시키는 분야에서 숙련된 자에게 공지되어 있다. 원핵 트레포네마 덴티콜라(Treponema denticola)로부터 상기 유전자의 밀접한 동족체인 TDE0597은 이. 콜라이에서 클로닝되고 발현된 세번째 에노일-CoA 리덕타제를 나타낸다[Tucci et al., FEBS Lett. 581:1561-1566 (2007)]. 신트로푸스 액시디트로피쿠스에서의 6개의 유전자는 클로스트리듐 아세토부틸리컴 bcd 유전자 산물에 대한 서열 상동성에 의해 확인되었다. 신트로푸스 액시디트로 피쿠스 유전자 syn _02637 및 syn _02636은 클로스트리듐 아세토부틸리컴의 etfAB 유전자에 대해 높은 서열 상동성을 가지며, 전자 전달 플라빈단백질의 알파 및 베타 서브단위를 암호화하는 것으로 예상된다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 23에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| bcd | NP_349317.1 | 15895968 | 클로스트리듐 아세토부틸리컴 |
| etfA | NP_349315.1 | 15895966 | 클로스트리듐 아세토부틸리컴 |
| etfB | NP_349316.1 | 15895976 | 클로스트리듐 아세토부틸리컴 |
| TER | Q5EU90.1 | 62287512 | 유글레나 그라실리스 |
| TDE0597 | NP_971211.1 | 42526113 | 트레포네마 덴티콜라 |
| syn _02587 | ABC76101 | 85721158 | 신트로푸스 액시디트로피쿠스 |
| syn _02586 | ABC76100 | 85721157 | 신트로푸스 액시디트로피쿠스 |
| syn _01146 | ABC76260 | 85721317 | 신트로푸스 액시디트로피쿠스 |
| syn _00480 | ABC77899 | 85722956 | 신트로푸스 액시디트로피쿠스 |
| syn _02128 | ABC76949 | 85722006 | 신트로푸스 액시디트로피쿠스 |
| syn _01699 | ABC78863 | 85723920 | 신트로푸스 액시디트로피쿠스 |
| syn _02637 | ABC78522.1 | 85723579 | 신트로푸스 액시디트로피쿠스 |
| syn _02636 | ABC78523.1 | 85723580 | 신트로푸스 액시디트로피쿠스 |
또 다른 에노일-CoA 리덕타제 효소가 방향족 화합물을 분해하는 유기체에서 발견된다. 벤조에이트 분해를 위한 모델 유기체인 로도슈도모나스 팔루스트리스는 피멜로일-CoA의 베타-산화를 통해 피멜레이트를 분해시키는 효소적 능력을 갖는다. pim 오페론, pimC 및 pimD에서 인접 유전자들은 클로스트리듐 아세토부틸리컴 bcd에 대한 서열 상동성을 가지며, 플라빈-함유 피멜로일-CoA 데하이드로게나제를 암호화하는 것으로 예상된다[Harrison et al., Microbiol. 151:727-736 (2005)]. 질소-고정 대두 공생 브래디리조비움 자포니컴(Bradyrhizobium japonicum)의 게놈도 또한 로도슈도모나스 팔루스트리스의 pimC 및 pimD에 높은 서열 유사성을 갖는 유전자들로 이루어진 pim 오페론을 함유한다[Harrison et al., Microbiol. 151:727-736 (2005)]. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 24에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| pimC | CAE29155 | 39650632 | 로도슈도모나스 팔루스트리스 |
| pimD | CAE29154 | 39650531 | 로도슈도모나스 팔루스트리스 |
| pimC | BAC53083 | 27356102 | 브래디리조비움 자포니컴 |
| pimD | BAC53082 | 27356101 | 브래디리조비움 자포니컴 |
또 다른 효소는 입체 장애 트랜스-에노일-CoA 기질의 환원을 촉진하는 효소인 2-메틸-분지쇄 에노일-CoA 리덕타제(EC 1.3.1.52)이다. 상기 효소는 선충 아스 카리우스 숨( Ascarius suum)에서 분지쇄 지방산 합성에 관여하며 2-메틸부타노일-CoA, 2-메틸펜타노일-CoA, 옥타노일-CoA 및 펜타노일-CoA를 포함한 다양한 선형 및 분지쇄 기질을 환원시킬 수 있다[Duran et al., J. Biol. Chem. 268:22391-22396(1993)]. 유전자 acadI 및 acad에 의해 암호화된 효소의 두 동형체(isoform)가 특성화되었다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 25에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| acadI | AAC48316.1 | 2407655 | 아스카리우스 숨 |
| acad | AAA16096.1 | 347404 | 아스카리우스 숨 |
피멜로일-CoA를 통해 진행되지 않는 3-하이드록시피멜로일-CoA로부터 사이클릭 화합물을 생성하기 위한 대안적 경로가 도 3에 도시되어 있다. 상기 경로는 특히 베타-산화 방향으로 게오박터 메탈리레듀센스 ( Geobacter metallireducens) 및 타우에라 아로마티카(Thauera aromatica)에서 발견된다. 상기 경로에서, 3-하이드록시피멜로일-CoA의 생합성은 전술한 바와 같이 아세토아세틸-CoA로부터 진행된다. 3-하이드록시피멜로일-CoA는 탈수되어 사이클릭 생성물, 6-옥소사이클로헥스-1-엔-1-카복실-CoA(6-KCH-CoA)를 생성한다. 이어서, 6-KCH-CoA는 세가지 효소적 단계: CoA 잔기의 제거, 탈카복실화 및 환원에서 사이클로헥사논으로 전환된다. 가역적 PEP 카복시키나제를 사용하여, 상기 경로는 사이클로헥사논의 이론적 수율(0.75 몰/몰)을 달성하는 것으로 예상되며, 트랜스퍼라제 또는 ATP 신타제를 단계 2에서 사용하는 경우 0.56 몰/몰의 ATP 수율을 달성할 수 있다.
6-KCH-CoA 하이드롤라제(EC 3.7.1.-)는 6-케토사이클로헥스-1-엔-1-카복실-CoA(6-KCH-CoA)를 3-하이드록시피멜로일-CoA로 전환시킨다. 상기 효소는 크로토나제 상과에 속하며, 개환 반응으로 2개의 물 분자를 혼입시키는 점에서 특이하다[Eberhard et al., J. Am. Chem. Soc. 126:7188-7189 (2004)]. 상기 효소는 절대 혐기성균 타우에라 아로마티카[Breese et al., Eur. J. Biochem. 256:148-154 (1998); Laempe et al., Eur. J. Biochem. 263:420-429 (1999)], 게오박터 메탈리레듀센스[Kuntze et al., Environ Microbiol. 10:1547-1556 (2008)], 신트로푸스 액시디트로피쿠스[Kuntze et al., Environ Microbiol. 10:1547-1556 (2008)], 아조 아르커스 에반시( Azoarcus evansii)[Harwood et al., FEBS Microbiol. Rev. 22:439-458 (1999)] 및 아조아르커스 속 균주 CIB[Lopez-Barragan et al., J. Bacteriol. 186:5762-5774 (2004)]에서 혐기성 벤조일-CoA 분해의 맥락에서 연구되었다. 게오박터 메탈리레듀센스로부터 6-KCH-CoA 하이드롤라제 유전자 gmet _2088 및 신트로푸스 액시디트로피쿠스로부터의 syn _01654를 이. 콜라이에서 이종으로 발현되고 특성화되었다[Kuntze et al., Environ Microbiol. 10:1547-1556 (2008)]. 신트로푸스 액시디트로피쿠스 6-KCH-CoA 하이드롤라제(syn_01654)를 개환 방향으로의 활성에 대해 분석하였으나, 상기 활성은 관찰되지 않았다[Kuntze et al., Environ Microbiol. 10:1547-1556 (2008)]. 6-KCH-CoA 하이드롤라제를 암호화하는 또 다른 유전자가 데설포코커스 멀티보란스 ( Desulfococcus multivorans) 및 m-자일렌 분해 증균 배양물에서 확인되었다.[Kuntze et al., Environ Microbiol. 10:1547-1556 (2008)]. 신트로푸스 액시디트로피쿠스에서의 또 다른 하이드롤라제는 syn _01653, syn _02400, syn _03076, 및 syn _01309이다. syn _01653은 syn _01654에 인접하며 동일 오페론에 존재하는 것으로 예상된다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 26에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| bzdY | AAQ08817.1 | 33326786 | 아조아르커스 속 CIB |
| bzdY | CAD21638.1 | 18369665 | 아조아르커스 에반실 |
| oah | CAA12245.1 | 3724166 | 타우에라 아로마티카 |
| bamA ( gmet _2088) | YP_385042.1 | 78223295 | 게오박터 메탈리레듀센스 |
| bamA ( syn _01654) | YP_463073.1 | 85860871 | 신트로푸스 액시디트로피쿠스 |
| N/A | ABY89672.2 | 262284543 | 데설포코커스 멀티보란스 |
| N/A | ABY89673.1 | 166798254 | [세균 증균 배양물 클론 ZzG1mX] |
| syn -01653 | YP_463074.1 | 85860872 | 신트로푸스 액시디트로피쿠스 |
| syn -02400 | YP_462924.1 | 85860722 | 신트로푸스 액시디트로피쿠스 |
| syn -03076 | YP_463118.1 | 85860916 | 신트로푸스 액시디트로피쿠스 |
| syn -01309 | YP_461962.1 | 85859760 | 신트로푸스 액시디트로피쿠스 |
6-KCH-CoA의 탈아실화는, CoA-트랜스퍼라제, 신세타제 또는 하이드롤라제에 의한 2-케토사이클로헥산-1-카복실-CoA(2-KCH-CoA)의 2-케토사이클로헥산-1-카복실레이트(2-KCH)로의 탈아실화와 유사하다. 예시적 효소로는 상기에서 논의한 것들이 포함된다. 6-KCH의 2-사이클로헥사논으로의 탈카복실화(단계 3)는 2-KCH의 탈카복실화(도 1, 단계 3 및 도 3, 단계 7)와 유사하다. 상기 전환에 예시적 효소도 또한 여기에 적용가능하다.
상기 경로의 마지막 단계에서, 2-사이클로헥사논-1-온이 사이클로헥사논 데하이드로게나제(EC 1.3.99.14), NAD(P)H-의존성 엔온 리덕타제에 의해 환원되어 사이클로헥사논을 생성한다. 상기 반응은 사이클로헥산올 상에서의 혐기성 성장동안 탈질소 세균 알리사이클리필러스 데니트리피칸스 ( Alicycliphilus denitrificans ) 속 K601(이전에 슈도모나스 속 K601로 알려짐)의 세포 추출물에서 일어난다[Dangel et al., Arch. Microbiol. 152:271-279; Dangel et al., Arch. Microbiol. 150:358-362 (1988); Mechichi et al., In. J. Syst. Evol. Mcrobiol. 53:147-152 (2003)]. 정제된 사이클로헥사논 데하이드로게나제를 세포 추출물에서 특성화하였다.
자연적으로 사이클릭 화합물과 반응하는, 엔온 리덕타제 활성을 갖는 효소가 원핵세포, 진핵세포 및 식물에서 확인되었다[Shimoda et al., Bulletin of the Chemical Society of Japan 77:2269-2 (2004); Wanner et al., Eur. J. Biochem. 255:271-278 (1998)]. 사카로마이세스 세레비지에의 세포질 분획으로부터의 두 엔온 리덕타제를 정제하고 특성화하였으며, 기질로서 2-사이클로헥센-1-온을 수용하는 것으로 밝혀졌다[Wanner et al., Eur. J. Biochem. 255:271-278 (1998)]. 시아노박테리아 시네코코커스 ( Synechococcus) 속 PCC7942의 세포 추출물은, 2-메틸-2-사이클로헥센-1-온 및 2-에틸-2-사이클로헥센-1-온을 포함하여 다양한 사이클릭 및 비사이클릭 기질을 그의 상응하는 알킬 케톤으로 환원시켰다[Shimoda et al., Bulletin of the Chemical Society of Japan 77:2269-2 (2004)]. 유전자들은 상기 활성과 관련되지 않았다. NtRed1에 의해 암호화되는, 니코티아나 타바쿰( Nicotiana tabacum)으로부터의 재조합 NADPH-의존성 엔온 리덕타제를 이. 콜라 이에서 기능적으로 발현시켰으며 특성화하였다[Matsushima et al., Bioorganic Chemistry 36:23-28 (2008)]. 상기 리덕타제는 고리밖 에노일 케톤상에 작용성이었으나, 입체 장애 고리내 에노일 케톤인 카르본과는 반응하지 않았다[Matsushima et al., Bioorganic Chemistry 36:23-28 (2008)]. 상기 효소는 기질로서 2-사이클로헥센-1-온에 대해서는 시험하지 않았다. 유전자좌 YML131W에서 사카로마이세스 세레비지에 중의 효소는 NtRed1에 대해 30% 동일성을 갖는다(e값 = 1e-26). 고리내 에노에이트 리덕타제 활성은 또한 니코티아나 타바쿰에서도 검출되었다[Hirata et al., Phytochemistry 28:3331-3333 (1989)]. NtRed1의 아미노산 서열은 아라비 돕시스 탈리아나(Arabidopsis thaliana)로부터의 2-알켄알 리덕타제, 아라비돕시스 탈리아나로부터의 제타-결정성 동족체, 멘테 피페리타(Menthe piperita)로부터의 풀레곤(pulegone) 리덕타제 및 피너스 테다(Pinus taeda)로부터의 페닐프로펜알 이중 결합 리덕타제와 상당한 상동성을 공유한다. 이들 효소는 α,β-불포화 케톤 또는 알데하이드의 알켄의 환원을 촉진하는 것으로 알려져 있다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 27에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| NtRed1 | BAA89423 | 6692816 | 니코티아나 타바쿰 |
| AtDBR1 | NP_197199 | 15237888 | 아라비돕시스 탈리아나 |
| P2 | CAA89262 | 886430 | 아라비돕시스 탈리아나 |
| PulR | AAQ75423 | 34559418 | 멘테 피페리타 |
| PtPPDBR | ABG91753 | 110816011 | 피너스 테다 |
| YML131W | AAS56318.1 | 45269874 | 사카로마이세스 세레비지에 |
또 다른 고리내 엔온 리덕타제는 멘테 피페리타에서 모노터펜 생합성에 관여하는 효소인 (-)-이소피페리테논 리덕타제(IspR)이다[Ringer et al., Arch. Biochem. Biophys 418:80-92 (2003)]. 상기 효소의 단백질 서열은 인간, 돼지, CHO-K1/햄스터 세포 및 아라비돕시스 탈리아나에서 추정상의 단쇄 리덕타제에 상당한 상동성을 나타낸다[Ringer et al., Arch. Biochem. Biophys 418:80-92 (2003)]. 멘테 피페리타 IspR 단백질 서열을 사카로마이세스 세레비지에 및 시네코코커스 속 PCC 7942 게놈과 비교하였으나, 고-신뢰도 지수는 확인되지 않았다. IspR에 26% 동일성을 갖는 유전자좌 YIR036C에서 사카로마이세스 세레비지에중의 추정상의 벤질 리덕타제가 가장 근접하였다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 28에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| ispR | AAQ75422.1 | 34559416 | 멘테 피페리타 |
| AT3G61220 | NP_191681.1 | 15233062 | 아라비돕시스 탈리아나 |
| cbr | NP_001748.1 | 4502599 | 호모 사피엔스 |
| CBR1 | NP_999238.1 | 47522960 | 서스 스크로파 |
| CHO - CR | BABO07797.1 | 9711233 | 크리세툴러스 그리세우스 |
| YIR036C | NP_012302.1 | 6322227 | 사카로마이세스 세레비지에 |
2-에노에이트 리덕타제 활성을 갖는 효소(EC 1.3.1.31)도 또한 상기 전환을 촉진할 수 있다. 2-에노에이트 리덕타제 효소는 광범위한 α,β-불포화 카복실산 및 알데하이드의 NADH-의존성 환원을 촉진하는 것으로 알려져 있다[Rohdich et al., J. Biol. Chem. 276:5779-5787 (2001)]. 2-에노에이트 리덕타제는 클로스트리듐 타이로부티리컴 (C. tyrobutyricum) 및 클로스트리듐 터모아세티컴(C. thermoaceticum)(현재는 무어렐라 터모아세티컴( Moorella thermoaceticum)으로 불림)을 포함하여 여러 종의 클로스트리듐에서 enr에 의해 암호화된다[Geisel et al., Arch. Microbiol 135:51-57 (1983); Rohdich et al., J. Biol. Chem. 276:5779-5787 (2001)]. 클로스트리듐 클루이베리의 최근에 발표된 게놈 서열에서, 에노에이트 리덕타제에 대한 9개의 암호화 서열이 보고되었으며, 그 중에서 하나가 특성화되었다[Seedorf et al., Proc. Natl. Acad. Sci. U.S.A. 105:2128-2133 (2008)]. 클로스트리듐 타이로부티리컴 및 무어렐라 터모아세티컴 둘 다로부터의 enr 유전자가 클로닝되고 서열분석되었으며 서로에 대해 59% 동일성을 나타낸다. 앞의 유전자는 또한 클로스트리듐 클루이베리에서의 특성화된 유전자에 약 75% 유사성을 갖는 것으로 밝혀졌다[[Geisel et al., Arch. Microbiol 135:51-57 (1983)]. 상기 서열 결과를 근거로 enr이 이. 콜라이(fadH)에서의 다이에노일 CoA 리덕타제와 매우 유사한 것으로 보고되었다[Rohdich et al., J. Biol. Chem. 276:5779-5787 (2001)]. 클로스트리듐 터모아세티컴 enr 유전자는 또한 이. 콜라이에서 촉매적으로 활성인 형태로 발현되었다[Rohdich et al., J. Biol. Chem. 276:5779-5787 (2001)]. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 29에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| enr | ACA54153.1 | 169405742 | 클로스트리듐 보툴리넘 A3 str |
| enr | CAA71086.1 | 2765041 | 클로스트리듐 타이로부티리컴 |
| enr | CAA76083.1 | 3402834 | 클로스트리듐 클루이베라 |
| enr | YP_430895.1 | 83590886 | 무어렐라 터모아세티카 |
| fadH | NP_417552.1 | 16130976 | 에스케리키아 콜라이 |
6-케토사이클로헥스-1-엔-1-카복실-CoA(6-KCH-CoA)로부터 사이클로헥사논을 합성하기 위한 대안적 경로는 상이한 순서로 적용되는 유사한 효소들을 사용한다. 이 경로에서, 6-KCH-CoA는 먼저 에노일-CoA 리덕타제(EC 1.3.1.-)에 의해 2-케토사이클로헥센-1-카복실-CoA(2-KCH-CoA)로 환원된다(도 3, 단계 5). 예시적인 에노일-CoA 리덕타제 효소는 6-카복시헥스-2-에노일-CoA의 피멜로일-CoA로의 환원에 대해 전술하였다.
도 3의 단계 8에서, 6-KCH는 에노에이트 리덕타제(EC 1.3.1.-)에 의해 2-KCH로 환원된다. 에노에이트 리덕타제에 대한 효소는 2-사이클로헥센-1-온의 사이클로헥사논으로의 환원에 대해 전술하였다. 2-KCH는 이어서 전술한 데카복실라제 효소를 사용하여 2-KCH 데카복실라제에 의해 사이클로헥사논으로 탈카복실화된다.
일부 태양에서, 사이클로헥사논은 아디페이트 세미알데하이드를 사이클로헥사논으로 전환시키기 위한 경로에 의해 생성된다. 아디페이트 세미알데하이드는 에스케리키아 콜라이 및 사카로마이세스 세레비지에와 같은 통상적으로 하용되는 생성 유기체에서 천연 대사물이 아니다. 그러나, 아디페이트 생합성을 위한 많은 생합성 경로가 최근에 개시되었다(미국 특허출원 제 12/413,355 호). 상기 보고에서, 아디페이트 세미알데하이드는 베타-케토티올라제에 의해 연결된, 몰 당량의 아세틸-CoA 및 숙시닐-CoA로부터 생성되어 옥소아디필-CoA를 생성하는 것으로 추정한다. 옥소아디필-CoA는 이어서 세가지 효소적 단계: 케톤의 환원, 탈수 및 에노일-CoA의 환원에서 아디필-CoA로 전환된다. 일단 형성되면, 아디필-CoA는 CoA-의존성 알데하이드 데하이드로게나제에 의해 아디페이트 세미알데하이드로 전환된다.
아디페이트 세미알데하이드로부터 사이클로헥사논으로의 경로는 도 4에 나타낸 바와 같은 4개의 효소적 단계를 수반한다. 첫번째 단계에서, 아디페이트 세미알데하이드는 탈수되고 환화되어 사이클로헥산-1,2-다이온(12-CHDO)을 생성한다. 12-CHDO는 이어서 사이클로헥산-1,2-다이올 데하이드로게나제에 의해 다이올로 환원된다. 마지막으로, 다이올 데하이드라타제는 사이클로헥산-1,2-다이올을 사이클로헥사논으로 전환시킨다.
상기 경로는 고 생성물 및 에너지 수율을 달성할 수 있다. 최대 이론적 사이클로헥사논 수율은 글루코스로부터 0.75 몰/몰이다. 야생형 PPCK 활성을 사용하여, 상기 경로는 최대 사이클로헥사논 수율에서 사용된 글루코스 몰 당 1.362 몰 ATP의 ATP 수율을 달성한다. ATP-생성 방향으로 작용할 수 있는 PEP 카복시키나제를 사용하여, ATP 수율은 2.11 몰/몰로 더 증가된다.
슈도모나스 에루기노사 ( Pseudomonas aeruginosa)[Kulkarni et al., Curr. Microbiol. 37:191-194 (1998); Steffensen et al., Appl. Environ Microbiol 61:2859-2862 (1995)]와 같은, 카프로락탐을 분해하는 유기체에서, 아디페이트는 EC 3.7.1 부류에서의 데하이드라타제에 의해 사이클로헥사-1,2-다이온으로 용이하게 전환된다. 상기 전환은 또한 아조아르커스 종의 세포 추출물에서 혐기성 사이클로헥산-1,2-다이올 분해 경로의 일부로서 확인되었다[Harder, J. Arch. Microbiol. 168:199-203 (1997)]. 유사한 전환이, 사이클릭 다이온 2,3-다이케토-4-데옥시-에피-이노시톨이 다이케토데옥시이노시톨 하이드롤라제(EC 3.7.1.-)에 의해 선형 생성물, 5-데하이드로-2-데옥시-D-글루코네이트로 가수분해되는 미오-이노시톨 분해 경로에서 촉진된다. 상기 반응을 촉진하는 부분적으로 정제된 단백질은 클렙시엘라 에로제네스(Klebsiella aerogenes)에서 연구되었다[Berman et al ., J. Biol. Chem . 241:800-806 (1966)].
사이클로헥산-1,2-다이온의 다이올로의 전환은 사이클로헥산-1,2-다이올 데하이드로게나제(EC 1.1.1.174)에 의해 달성될 수 있다. 상기 효소 활성은 아시네 토박터 TD63에서 입증되었다[Davey et al., Eur. J. Biochem. 74:115-127 (1977)]. 넓은 기질 범위를 갖는 효소인 사이클로헥산올 데하이드로게나제(EC 1.1.1.245)는 상기 전환을 촉진할 수 있는 것으로 나타났다. 로도코커스 속 TK6[Tae-Kang et al., J. Microbiol. Biotechnol. 12:39-45 (2002)], 탈질소 슈도모나스 속[Dangel et al., Arch. Microbiol. 150:358-362 (1988)], 노카르디아 ( Nocardia) 속[Stirling et al., Curr. Micrbiol. 4:37-40 (1980)] 및 잔토박터 ( Xanthobacter) 속[Trower et al., App. Environ. Microbiol. 49:1282-1289 (1985)]으로부터의 사이클로헥산올 데하이드로게나제 효소는 모두 사이클로헥산-1,2-다이올을 사이클로헥산-1,2-다이온으로 전환시키는 것으로 나타났다. 아시네토박터 속 NCIMB9871에서 사이클로헥산올 데하이드로게나제와 관련된 유전자가 2000년에 확인되었다[Cheng et al., J. Bacteriol. 182:4744-4751]. chnA에 의해 암호화된 상기 효소는 사이클로헥산-1,2-다이온 또는 사이클로헥산-1,2-다이올에 대한 활성에 대해서는 시험하지 않았다. 아시네토박터 ChnA 단백질 서열의 BLAST 비교에 의해 랄스 토니아 메탈리레듀센스(57% 동일성) 및 슈도모나스 푸티다(47% 동일성)를 포함하여 다른 유기체로부터의 유전자를 식별한다. 코마모나스 테스토스테로니(Comamonas testosteroni)로부터의 사이클로헥산올 데하이드로게나제 유전자도 또한 이. 콜라이에서 발현되고 특성화되었으며[Van Beilen et al., Environ. Microbiol 5:174-182 (2003)]; 유사한 유전자도 또한 잔토박터 플라버스(Xanthobacter flavus)에서 확인되었다[Van Beilen et al., Environ. Microbiol 5:174-182 (2003)]. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 30에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| chnA | BAC80215.1 | 33284995 | 아시네토박터 속 NCIMB9871 |
| chnA | CAD10799.1 | 16943680 | 코마모나스 테스토스테로니 |
| chnA | CAD10802.1 | 18495819 | 잔토박터 플라버스 |
| Rmet _1335 | YP_583487.1 | 94310277 | 랄스토니아 메탈리레듀센스 |
| PP _1946 | NP_744098.1 | 26988673 | 슈도모나스 푸티다 |
상기 전환을 수행할 수 있는 또 다른 효소는 다이아세틸 리덕타제(EC 1.1.1.5)이다. 자연적으로 다이아세틸(2,3-부탄다이온)의 아세토인으로의 전환 및 2,3-부탄다이올로의 후속 환원을 촉진함으로써, 사카로마이세스 세레비지에로부터의 두 NADPH-의존성 다이아세틸 리덕타제 효소는 또한 기질로서 사이클로헥산-1,2-다이온을 수용하는 것으로 나타났다[Heidlas et al., Eur. J. Biochem. 188:165-174 (1990)]. 상기 연구로부터 (S)-특이적 NADPH-의존성 다이아세틸 리덕타제는 뒤에 ARA1의 유전자 산물인 D-아라비노스 데하이드로게나제로서 확인되었다[Katz et al., Enzyme Microb. Technol. 33:163-172 (2003)]. 사카로마이세스 세레비지 에의 BDH1의 NADH-의존성 유전자 산물도 또한 다이아세틸 리덕타제 작용성을 갖는다[Gonzalez et al., J. Biol. Chem. 275:33876-35885 (2000)]. 유전자 GCY1 , YPR1, YIR036c에 의해 암호화된, 다이케톤 리덕타제 작용성을 갖는 여러 다른 효소들이 효모에서 확인되었다[Johanson et al., FEMS Yeast Res. 5:513-525 (2005)]. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 31에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| ARA1 | NP_009707.1 | 6319625 | 사카로마이세스 세레비지에 |
| BDH1 | NP_009341.1 | 6319258 | 사카로마이세스 세레비지에 |
| GCY1 | NP_014763.1 | 6324694 | 사카로마이세스 세레비지에 |
| YPR1 | NP_010656.1 | 6320576 | 사카로마이세스 세레비지에 |
| GRE3 | NP_011972.1 | 6321896 | 사카로마이세스 세레비지에 |
| YIR036c | AAS56566.1 | 45270370 | 사카로마이세스 세레비지에 |
사이클로헥산-1,2-다이올의 사이클로헥사논으로의 전환은 효소적으로 입증되지 않았다. 유사한 전환이 다이올 데하이드라타제 미오-이노소스-2-데하이드라타제(EC 4.2.1.44)에 의해 촉진된다. 미오-이노소스는 사이클로헥산-1,2-다이올과 유사한, 인접 알콜기를 함유하는 6-원 고리이다. 미오-이노소스-2-데하이드라타제 작용성을 암호화하는 정제된 효소가 미오-이노시톨 분해의 맥락에서 클렙시엘라 에 로제네스에서 연구되었으나[Berman et al., J. Biol. Chem. 241:800-806 (1966)], 현재까지 유전자와 연관되지 못했다.
2급 다이올 2,3-부탄다이올을 메틸 에틸 케톤으로 전환시킬 수 있는 다이올 데하이드라타제 또는 프로판다이올 데하이드라타제 효소(EC 4.2.1.28)가 상기 전환에 적절하다. 아데노실코발아민-의존성 다이올 데하이드라타제는 알파, 베타 및 감마 서브단위를 함유하며, 이들은 모두 효소 기능에 필요하다. 예시적 유전자는 클렙시엘라 뉴모니에( Klebsiella pneumoniae)[Tobimastsu et al., Biosci Biotechnol. Biochem. 62:1774-1777 (1998); Toraya et al., Biochem. Biophys. Res. Commun. 69:475-480 (1976)], 살모넬라 타이피머리움( Salmonella typhimurium)[Bobik et al., J. Bacteriol. 179:6633-6639 (1997)], 클렙시엘라 옥시토카( Klebsiella oxytoca)[Tobimatsu et al., J. Biol. Chem. 270:7142-7148 (1995)] 및 락토바실러스 콜리노이데스( Lactobacillus collinoides)[Sauvageot et al., FEMS Microbiol. Lett. 209:69-74 (2002)]에서 발견된다. 다른 유기체에서 다이올 데하이드라타제를 분리하는 방법은 당해 분야에 공지되어 있다(예를 들면, 미국 특허 제 5,686,276 호). 예시적 유전자 산물에 대한 단백질 서열은 하기 표 32에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| pddC | AAC98386.1 | 4063704 | 클렙시엘라 뉴모니에 |
| pddB | AAC98385.1 | 4063703 | 클렙시엘라 뉴모니에 |
| pddA | AAC98384.1 | 4063702 | 클렙시엘라 뉴모니에 |
| pduC | AAB84102.1 | 2587029 | 살모넬라 타이피머리움 |
| pduD | AAB84103.1 | 2587030 | 살모넬라 타이피머리움 |
| pduE | AAB84104.1 | 2587031 | 살모넬라 타이피머리움 |
| pddA | BAA08099.1 | 868006 | 클렙시엘라 옥시토카 |
| pddB | BAA08100.1 | 868007 | 클렙시엘라 옥시토카 |
| pddC | BAA08101.1 | 868008 | 클렙시엘라 옥시토카 |
| pduC | CAC82541.1 | 18857678 | 락토바실러스 콜리노이데스 |
| pduD | CAC82542.1 | 18857679 | 락토바실러스 콜리노이데스 |
| pduE | CAC01091.1 | 18857680 | 락토바실러스 콜리노이데스 |
글리세롤 데하이드라타제 부류의 효소(EC 4.2.1.30)도 또한 사이클로헥산-1,2-다이올을 사이클로헥사논으로 전환시키는데 사용될 수 있다. 예시적 유전자는 클렙시엘라 뉴모니에(WO 2008/137403 호), 클로스트리듐 파스튜라넘( Clostridium pasteuranum)[Macis et al., FEMS Microbiol. Lett. 164:21-28 (1998)] 및 시트로 박터 프레운디( Citrobacter freundii)[Seyfried et al., J. Bacteriol 178:5793-5796 (1996)]에서 찾을 수 있다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 33에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| dhaB | AAC27922.1 | 3360389 | 클로스트리듐 파스튜라넘 |
| dhaC | AAC27923.1 | 3360390 | 클로스트리듐 파스튜라넘 |
| dhaE | AAC27924.1 | 3360391 | 클로스트리듐 파스튜라넘 |
| dhaB | P45514.1 | 1169287 | 시트로박터 프레운디 |
| dhaC | AAB48851.1 | 1229154 | 시트로박터 프레운디 |
| dhaE | AAB48852.1 | 1229155 | 시트로박터 프레운디 |
B12-의존성 다이올 데하이드라타제를 사용하는 경우, 상응하는 재활성화 인자의 이종 발현을 이용할 수 있다. 이들 인자는 2개-서브단위 단백질이다. 예시적 유전자는 클렙시엘라 옥시토카[Mori et al., J. Biol. Chem. 272:32034-32041 (1997)], 살모넬라 타이피머리움[Bobik et al., J. Bacteriol. 179:6633-6639 (1997)], 락토바실러스 콜리노이데스[Sauvageot et al., FEMS Microbiol. Lett. 209:69-74 (2002)] 및 클렙시엘라 뉴모니에(WO 2008/137403 호)에서 발견된다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 34에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| ddrA | AAC15871 | 3115376 | 클렙시엘라 옥시토카 |
| ddrB | AAC15872 | 3115377 | 클렙시엘라 옥시토카 |
| pduG | AAB84105 | 16420573 | 살모넬라 타이피머리움 |
| pduH | AAD39008 | 16420574 | 살모넬라 타이피머리움 |
| pduG | YP_002236779 | 206579698 | 클렙시엘라 뉴모니에 |
| pduH | YP_002236778 | 206579863 | 클렙시엘라 뉴모니에 |
| pduG | CAD01092 | 29335724 | 락토바실러스 콜리노이데스 |
| pduH | AJ297723 | 29335725 | 락토바실러스 콜리노이데스 |
예시적인 B12-의존성 다이올 데하이드라타제 효소는 글리세롤 데하이드로게나제 및 다이하이드록시산 데하이드라타제(EC 4.2.1.9)를 포함한다. 사이클로헥산-1,2-다이올은 어느 한 효소의 공지된 기질이 아니다. B12-의존성 다이올 데하이드라타제 효소는 보조인자로서 S-아데노실메티오닌(SAM)을 사용하며 절대적으로 혐기성 조건하에서 작용한다. 글리세롤 데하이드로게나제, 및 dhaB1 및 dhaB2에 의해 암호화되는, 클로스트리듐 부티리컴의 상응하는 활성화 인자는 잘 특성화되었다[O'Brien et al., Biochemistry 43:4635-4645 (2004); Rayn명et al., Proc. Natl. Acad. Sci U.S.A 100:5010-5015 (2003)]. 상기 효소는 최근에 이. 콜라이의 1,3-프로판다이올 과잉생성 균주에 사용되었으며, 생성물의 매우 높은 역가를 달성할 수 있었다[Tang et al., Appl. Environ. Microbiol. 75:1628-1634 (2009)]. 로 즈버리아 이눌리니보란스( Roseburia inulinivorans)로부터의 또 다른 B12-의존성 다이올 데하이드라타제 효소 및 활성화 인자는 2,3-부탄다이올의 2-부타논으로의 전환을 촉진하는 것으로 나타났다(US 2009/09155870). 다이하이드록시-산 데하이드라타제(DHAD, EC 4.2.1.9)는 분지쇄 아미노산 생합성에 관여하는 B12-의존성 효소이다. 그의 원래 역할로, 상기 효소는 2,3-다이하이드록시-3-메틸발레레이트를 이소류신의 전구체인 2-케토-3-메틸-발레레이트로 전환시킨다. 발린 생합성에서, 상기 효소는 2,3-다이하이드록시-이소발레레이트의 2-옥소이소발레레이트로의 탈수를 촉진한다. 설폴로버스 솔파타리쿠스( Sulfolobus solfataricus)로부터의 DHAD는 넓은 기질 범위를 가지며, 이. 콜라이에서 발현된 재조합 효소의 활성은 다양한 알돈산에서 입증되었다[KIM et al., J. Biochem. 139:591-596 (2006)]. 설폴로버스 솔파타리쿠스 효소는 많은 다이올 데하이드라타제 효소와 달리 산소를 허용한다. ilvD에 의해 암호화되는 이. 콜라이 효소는 산소에 민감한데, 산소는 그의 철-황 결합체를 불활성화시킨다[Flint et al., J. Biol. Chem. 268:14732-14742 (1993)]. 유사한 효소들이 뉴로스포라 크래사( Neurospora crassa)[Altmiller et al., Arch. Biochem. Biophys. 138:160-170 (1970)] 및 살로넬라 타이피커리움[Armstrong et al., Biochim. Biophys. Acta 498:282-293 (1977)]에서 특성화되었다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 35에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| dhaB1 | AAM54728.1 | 27461255 | 클로스트리듐 부티리컴 |
| dhaB2 | AAM54729.1 | 27461256 | 클로스트리듐 부티리컴 |
| rdhtA | ABC25539.1 | 83596382 | 로즈버리아 이눌리니보란스 |
| rdhtB | ABC25540.1 | 83596383 | 로즈버리아 이눌리니보란스 |
| ilvD | NP_344419.1 | 15899814 | 설폴로버스 솔파타리쿠스 |
| ilvD | AAT48208.1 | 48994964 | 에스케리키아 콜라이 |
| ilvD | NP_462795.1 | 16767180 | 살모넬라 타이피머리움 |
| ilvD | XP_958280.1 | 85090149 | 뉴로스포라 크래사 |
다이올 데하이드라타제 미오-이노소스-2-데하이드라타제(EC 4.2.1.44)는 또 다른 예시적 후보이다. 미오-이노소스는 인접 알콜기를 함유하는 6-원 고리이다. 미오-이노소스-2-데하이드라타제 작용성을 암호화하는 정제된 효소는 미오-이노시톨 분해의 맥락에서 클렙시엘라 에로제네스에서 연구되었으나[Berman et al., J. Biol. Chem. 241:800-806 (1966)], 현재까지 유전자와 연관되지는 못했다. 시노리조븀 프레디(Sinorhizobium fredii)의 미오-이노소스-2-데하이드라타제를 이. 콜라이에 클로닝시키고 기능적으로 발현시켰다[Yoshida et al., Biosci. Biotechnol. Biochem. 70:2957-2964 (2006)]. iolE에 의해 암호화되는, 바실러스 서브틸리스로부터의 유사한 효소도 또한 연구되었다[Yoshida et al., Microbiology 150:571-580 (2004)]. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 36에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| iolE | P42416.1 | 1176989 | 바실러스 서브틸리스 |
| iolE | AAX24114.1 | 60549621 | 시노리조븀 프레디 |
일부 태양에서, 본 발명은 4-아세틸부티레이트(5-옥소헥사노에이트 및 5-옥소카프로산)로부터 사이클로헥사논을 생성하기 위한 경로를 제공한다. 상기 경로에서, 4-아세틸부티레이트는 환화되어 1,3-사이클로헥산다이온을 생성한다. 케토기중 하나의 환원 및 후속 탈수에 의해 2-사이클로헥사논이 생성된다. 이어서, 2-사이클로헥사논은 사이클로헥사논으로 환원된다. 상기 경로의 효소 활성은 자연적으로 사이클로헥산올을 대사시켜 혐기성 조건하에서의 성장을 촉진하는 탈질소 세균 알리사이클리필러스 데니트리피칸스 속 K601(이전에 슈도모나스 속 K601로 알려짐)에 존재한다[Dangel et al., Arch. Microbiol. 152:271-279 (1989); Dangel et al., Arch. Microbiol. 150:358-362 (1988); Mechichi et al., In. J. Syst. Evol. Mcrobiol. 53:147-152 (2003). 경로 중간체 1,3-사이클로헥산다이온 및 4-아세틸부티레이트는 또한 상기 경로를 함유하는 세포의 성장을 촉진할 수 있다[Dangel et al., Arch. Microbiol. 150:358-362 (1988)].
4-아세틸부티레이트는 에스케이키아 콜라이의 세포 추출물에서 검출되었지만, 사이클로헥사논으로의 생합성 경로는 3-옥소피멜로일-CoA로부터 4-아세틸부티레이트를 합성하기 위한 2개의 효소적 단계를 포함한다. 3-옥소피멜로일-CoA는 전술한 바와 같은 피멜로일-CoA를 생성하기 위한 경로에서 중간체이다. 아세토아세틸-CoA로부터 3-옥소피멜로일-CoA를 생성하기 위한 효소는 상기 부분에 기술되어 있다. 3-옥소피멜로일-CoA의 사이클로헥사논으로의 전환(도 5)을 위한 효소를 본원에 기술한다.
상기 경로의 첫 번째 단계는 3-옥소피멜로일-CoA의 CoA 잔기의 제거를 포함하는데, 이것은 CoA-트랜스퍼라제, 신세타제 또는 하이드롤라제에 의해 달성될 수 있다. 3-옥소산에 작용하는 여러 공지된 효소는 대체 기질로서 3-옥소피멜로일-CoA에도 마찬가지로 작용할 수 있다. 다양한 CoA-신세타제, CoA-하이드롤라제(티오에스터에 작용) 및 CoA-트랜스퍼라제 효소가 상기에서 상술되었다.
상기 경로의 두 번째 단계는 아세토아세테이트 데카복실라제(EC 4.1.1.4)와 같은 3-옥소산 데카복실라제에 의한 3-옥소피멜레이트의 4-아세틸부티레이트로의 탈카복실화를 포함한다. 3-옥소산 데카복실라제에 대한 예시적 유전자는 상기에서 열거하였다. 상기 탈카복실화 반응은 또한 효소-촉진되기 보다 자발적으로 일어날 수 있다. 이. 콜라이에서, 아미노산 생합성동안 생성된 여러 3-옥소산은 자발적 탈카복실화가 일어나는 것으로 나타났다[Boylan et al., Biochem Biophysc. Res. Commun. 85:190-197 (1978)].
1,3-사이클로헥산다이온 하이드롤라제(4-아세틸부티레이트 데하이드라타제)의 활성은 알리사이클리필러스 데니트리피칸스에서 가수분해성 고리-분열 방향으로 입증되었다[Dangel et al., Arch. Microbiol. 152:271-279 (1989)]. 상기 단계를 촉진하는 효소는 세포 추출물에서 특성화되었다.
3-하이드록시사이클로헥사논 데하이드로게나제(EC 1.1.99.26)는 사이클로헥산-1,3-다이온의 케톤 중 하나를 3-하이드록시사이클로헥사논으로 환원시킨다. 상기 효소는 알리사이클리필러스 데니트리피칸스의 세포 추출물에서 특성화되었다[Dangel et al., Arch. Microbiol. 152:271-279 (1989)]. 로도코커스 속 TK6[Tae-Kang et al., J. Microbiol. Biotechnol. 12:39-45 (2002)], 노카르디아 속[Stirling et al., Curr. Micrbiol. 4:37-40 (1980)], 잔토박터 속[Trower et al., App. Environ. Microbiol. 49:1282-1289 (1985)]으로부터의 사이클로헥산올 데하이드로게나제 효소는 사이클로헥산-1,3-다이올을 사이클로헥산-1,3-다이온으로 산화시키는 것으로 나타났다. 다이아세틸 리덕타제 및 상기 논의된 또 다른 사이클로헥산올 데하이드로게나제 유전자도 또한 여기에 적용가능하다.
사카로마이세스 세레비지에에서 최근에 확인된 5개의 베타-다이케톤 리덕타제는 바이사이클릭 다이케톤 바이사이클로[2.2.2]옥탄-2,6-다이온(BCO2, 6D)을 상응하는 케토알콜로 환원시킬 수 있다[Katz et al., Biotechnol. Bioeng. 84:573-582 (2003)]. 상기 전환은 사이클로헥산-1,3-다이온의 환원(단계 4, 도 5)과 유사하다. 효소들은 유전자좌 YMR226c, YDR368w, YOR120w, YGL157w 및 YGL039w에서 암호화된다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 37에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| YMR226c | NP_013953.1 | 6323882 | 사카로마이세스 세레비지에 |
| YDR368w | NP_010656.1 | 6320576 | 사카로마이세스 세레비지에 |
| YOR120w | NP_014763.1 | 6324694 | 사카로마이세스 세레비지에 |
| YGL157w | NP_011358.1 | 6321281 | 사카로마이세스 세레비지에 |
| YGL039w | NP_011476.1 | 6321399 | 사카로마이세스 세레비지에 |
상기 경로의 첫 번째 단게에서, 3-하이드록시사이클로헥사논이 탈수되어 2-사이클로헥사논을 생성한다. 상기 전환은 2-사이클로헥사논 하이드라타제에 의해 촉진되며, 알리사이클리필러스 데니트리피칸스 K601의 세포 추출물에서 특성화되었다[Dangel et al., Arch. Microbiol. 152:271-279 (1989)]. 사이클릭 베타-하이드록시 케톤을 탈수시킬 수 있는 또 다른 효소는 데하이드로퀴나제로도 알려진 3-데하이드로퀴네이트 데하이드라타제(EC 4.2.1.10)이다. 상기 효소는 3-데하이드로퀴네이트를 가역적으로 탈수시켜 3-데하이드로-시키메이트를 생성하고(도 6), 항생물질 표적으로 광범위하게 연구되었다. 기질로서 3-하이드록시사이클로헥사논에 대한 활성을 입증되지 않았다. 2개의 별개 유형, I형 및 II형 데하이드로퀴나제는 동일한 반응을 촉진하지만, 아미노산 조성, 구조 및 촉매 메카니즘에 있어 상이하다[Gourley et al., Nat. Struct. Biol. 6:521-525 (1999); Kleanthous et al., Biochem. J. 282(Pt 3):687-695 (1992)]. 고분해 구조 데이터가 살모넬라 타이피[Gourley et al., Nat. Struct. Biol. 6:521-525 (1999)]로부터 I형 효소에 대해 이용가능하고, 마이코박테리움 튜베르큘로시스[Gobel et al., J. Bacteriol. 184:216-223 (2002)] 및 스트렙토마이세스 코엘리콜로(Streptomyces coelicolor)[Roszak et al., Structure 10:493-503 (2002)]로부터 II형 효소에 대해 이용가능하다.
데하이드로퀴나제는 또한 헬리코박터 파이롤리[Bottomley et al., Biochem. J. 319(Pt 2):559-565 (1996)], 살로멜라 타이피 및 에스케리키아 콜라이[Chaudhuri et al., Biochem. J. 275(Pt 1):1-6 (1991)]에서 클로닝되고 정제되고 특성화되었다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 38에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| aroD | NP_416208.1 | 16129649 | 에스케리키아 콜라이 K12 속 MG1655 |
| aroD | CAA38418.1 | 47642 | 살모넬라 엔테리카(살모넬라 타이피) |
| aroQ | NP_626225.1 | 21220446 | 스트렙토마이세스 코엘리콜로 |
| aroD | NP_223105.1 | 15611454 | 헬리코박터 파일로리 |
| aroQ | P0A4Z6.2 | 61219243 | 마이코박테리움 튜베르큘로시스 |
효소 2-하이드록시이소플라바논 데하이드로게나제는 2-하이드록시이소플라바논의 사이클릭 베타-하이드록실기를 탈수시켜 이소플라바논을 생성한다(도 6B). 상기 활성을 갖는 효소는 대두 (글리신 맥스(Glycine max)) 및 글리시리자 에키나타(Glycyrrhiza echinata)[Akashi et al., Plant Physiol. 137:882-891 (2005)]에서 특성화되었다. 대두 효소 HIDH는 대체 기질을 수용하는 것으로 밝혀진 반면, 글리시리자 에키나타 효소 HIDM은 엄격한 기질 특이성을 나타내었다[Akashi et al., Plant Physiol. 137:882-891 (2005)]. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 39에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| HIDH | BAD80840.1 | 56692180 | 글리신 맥스 |
| HIDM | BAD80839.1 | 56692178 | 글리시리자 에키나타 |
최종 경로 단계인 2-사이클로헥세논의 사이클로헥사논으로의 환원은 사이클로헥사논 데하이드로게나제(EC 1.3.99.14)에 의해 촉진된다. 상기 반응은 전술한 경로의 최종 단계와 동일하다.
일부 태양에서, 본 발명은 2,6-다이아미노펜타노에이트로부터 출발하여 피멜로일-CoA로의 대체 경로를 제공한다. 2,6-다이아미노피멜레이트(26-DAP)는 라이신 생합성에서 중간체이며 또한 세균 세포벽 펩티도글리칸의 구성성분이다. 라이신 생합성의 경로 I 내지 IV는 L-아스파테이트로부터 2,6-다이아미노피멜레이트를 생성하는데, 이때 아스파테이트는 아스파테이트-세미알데하이드로 전환되고, 이것은 이어서 피루베이트에 의해 가수분해되어 2,3-다이하이드로피콜리네이트를 생성한다. 2,3-다이하이드로피콜리네이트의 2,6-다이아미노피멜레이트로의 전환은 상이한 효소에 의해 달성될 수 있으며, 상이한 대사 중간체를 수반한다. 이. 콜라이에서, 라이신 생합성 경로 I은 상기 전환을 4개의 효소적 단계로 수행한다.
다음 5개 효소 전환이 2,6-다이아미노피멜레이트를 피멜로일-CoA로 전환시킨다: 2- 및 6- 위치에서 2급 아민의 탈아민화, 생성된 알켄의 환원 및 코엔자임 A와의 티오에스터 결합의 형성(도 7). 티오에스터 결합 형성은 CoA 트랜스퍼라제 또는 리가제에 의해 수행될 수 있다. 파트 2에서 피멜로일-CoA의 사이클로헥사논으로의 경로와 함께, 상기 경로는 사용된 글루코스 몰 당 사이클로헥사논 0.75 몰의 최대 이론상 수율을 달성할 수 있다. 가역적 PEP 카복시키나제를 사용하는 경우에도, 상기 경로는 0.125 몰/몰의 ATP 수율하에 에너지학적으로 제한된다. 수율은 CoA 트랜스퍼라제 작용성을 갖는 효소를 사용한다는 가정하에 산출되었다(도 7, 단계 5, 도 1, 단계 2). 통기가 에너지 수율을 개선하는 것으로는 예상되지 않는다.
2,6-다이아미노피멜레이트 및 2-아미노헵탄다이오에이트의 탈아민화(도 7, 단계 1 및 3)를 암호화하는 효소는 유사한 전환인 아스파테이트의 푸마레이트로의 탈아민화를 촉진하는 아스파타제(EC 4.3.1.1)에 의해 제공될 수 있다[Viola, R.E., Adv. Enzymol. Relat. Areas. Mol. Biol. 74:295-341 (2000)]. aspA에 의해 암호화된 이. 콜라이 아스파타제의 결정 구조는 촉매 메카니즘 및 기질 특이성에 대한 이해를 제공한다[Shi et al., Biochemistry 36:9136-9144 (1997)]. 이. 콜라이 효소는 대체 기질인 아스파테이트페닐메틸에스터, 아스파라진, 벤질-아스파테이트 및 말레이트와 반응하는 것으로 나타났다[Ma et al., Ann. N.Y. Acad. Sce. 672:60-65 (1992)]. 별도의 연구에서, 방향성 진화가 상기 효소에 기질 특이성을 변화시키기 위해 사용되었다[Asano et al., Biomol. Eng. 22:95-101 (2005)]. 아스파타제 작용성을 갖는 효소는 또한 헤모필러스 인플루엔자[Sjostrom et al., Biochim. Biophys. Acta 1324:182-190 (1997)], 슈도모나스 플루오레센스[Takagi et al., J. Biochem. 96:545-552 (1984)], 바실러스 서브틸리스[Sjostrom et al., Biochim. Biophys. Acta 1324:182-190 (1997)] 및 세라티아 마르세스센스[Takagi et al., J. Bacteriol. 161:1-6 (1985)]에서 특성화되었다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 40에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| aspA | NP_418562 | 90111690 | 에스케리키아 콜라이 K12 아속 MG1655 |
| aspA | P44324.1 | 1168534 | 헤모필러스 인플루엔자 |
| aspA | P07346.1 | 114273 | 슈도모나스 플루오레센스 |
| ansB | P26899.1 | 251757243 | 바실러스 서브틸리스 |
| aspA | P33109.1 | 416661 | 세라티아 마르세스센스 |
경로 중간체, 6-아미노헵트-2-엔다이오에이트 및 6-카복시헥스-2-에노에이트의 환원은 전술한 바와 같은 2-에노에이트 리덕타제(EC 1.3.1.31)에 의해 수행될 수 있다.
피멜레이트의 피멜로일-CoA로의 아실화는 6-카복시헥사노에이트-CoA 리가제(EC 6.2.1.14)로도 불리는 피멜로일-CoA 신세타제에 의해 촉진된다. 상기 효소는 AMP 및 피로포스페이트를 동시에 생성하며 피로포스페이트가 가수분해되는 경우 2 ATP 당량을 소비한다. 바실러스 서브틸리스[Bower et al., J. Bacteriol. 178:4122-4130 (1996)], 바실러스 스패리커스[Ploux et al., Biochem. J. 340(pt 3):685-690 (1992)] 및 슈도모나스 멘도시나(Pseudomonas mendocina)[Binieda et al., Biochem. J. 340(pt 3):793-801 (1999)]로부터의 효소를 클로닝하고 서열분석하고 특성화하였다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 41에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| bioW | NP_390902.2 | 50812281 | 바실러스 서브틸리스 |
| bioW | CAA10043.1 | 3850837 | 슈도모나스 멘도시나 |
| bioW | P22822.1 | 115012 | 바실러스 스패리커스 |
CoA 잔기를 아세틸-CoA 또는 숙시닐-CoA로부터 피멜레이트로 전달할 수 있는 효소는 아세테이트-CoA 트랜스퍼라제(EC 2.8.3.8)로도 알려진 이. 콜라이 아실-CoA:아세테이트-CoA 트랜스퍼라제이다. 상기 효소는 이소부티레이트[Matthies et al., Appl. Environ. Microbiol. 58:1435-1439 (1992)], 발레레이트[Vanderwinkle et al., Biochem. Biophys. Res. Commun. 33:902-908 (1968)] 및 부타노에이트[Vanderwinkle et al., Biochem. Biophys. Res. Commun. 33:902-908 (1968)]를 포함하여 다양한 분지쇄 및 선형 아실-CoA 기질로부터 아세테이트로 CoA 잔기를 전달하는 것으로 나타났다. 상기 효소는 이. 콜라이 속 K12[Korolev et al., Acta Crystallogr. D Biol Crystallogr. 58:2116-2121 (2002); Vanderwinkle et al., Biochem. Biophys. Res. Commun. 33:902-908 (1968)]에서 atoA(알파 서브단위) 및 atoD(베타 서브단위)에 의해서, 및 코리네박테리움 글루타미컴 ATCC 13032[Duncan et al., Appl. Environ. Microbiol. 68:5186-5190 (2002)]에서 actA 및 cg0592에 의해 암호화된다. 유사한 효소가 클로스트리듐 아세토부틸리컴[Cary et al., Appl Environ Microbiol 56:1576-1583 (1999)] 및 클로스트리듐 사카로퍼부틸아세토니컴[Kosaka et al., Biosci. Biotechnol Biochem. 71:58-68 (2007)]에 존재한다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 42에 나타낸 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| atoA | P76459.1 | 2492994 | 에스케리키아 콜라이 K12 |
| atoD | P76458.1 | 2492990 | 에스케리키아 콜라이 K12 |
| actA | YP_226809.1 | 62391407 | 코리네박테리움 글루타미컴 ATCC 13032 |
| cg0592 | YP_224801.1 | 62389399 | 코리네박테리움 글루타미컴 ATCC 13032 |
| ctfA | NP_149326.1 | 15004866 | 클로스트리듐 아세토부틸리컴 |
| ctfB | NP_149327.1 | 15004867 | 클로스트리듐 아세토부틸리컴 |
| ctfA | AAP42564.1 | 31075384 | 클로스트리듐 사카로퍼부틸아세토니컴 |
| ctfB | AAP42565.1 | 30175385 | 클로스트리듐 사카로퍼부틸아세토니컴 |
클로스트리듐 클루이베리의 cat1, cat2 및 cat3의 유전자 산물은 유사한 전환을 촉진하여 숙시닐-CoA, 4-하이드록시부티릴-CoA 및 부티릴-CoA를 그의 상응하는 산으로부터 생성한다[Seedorf et al., Proc. Natl. Acad. Sci. U.S.A. 105:2128-2133 (2008); Gourley et al., Nat. Struct. Biol. 6:521-525 (1999)]. 숙시닐-CoA 트랜스퍼라제 활성은 또한 트라이코모나스 바기날리스(Trichomonas vaginalis)[van Grinsven et al., J. Biol. Chem. 283:1311-1418 (2008)] 및 트립파노소마 브루세이(Trypanosoma brucei)[Riviere et al., J. Biol. Chem. 279:45337-45346 (2004)]에도 존재한다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 43에 나타낸 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| cat1 | P38946.1 | 729048 | 클로스트리듐 클루이베리 |
| cat2 | P38942.2 | 172046066 | 클로스트리듐 클루이베리 |
| cat3 | EDK35586.1 | 146349050 | 클로스트리듐 클루이베리 |
| TVAG_395550 | XP_001330176 | 123975034 | 트라이코모나스 바기날리스 G3 |
| Tb11.02.0290 | XP_828352 | 71754875 | 트립파노소마 브루세이 |
2,6-다이아미노펜타노에이트로부터 피멜로일-CoA를 생성하기 위한 대체 경로는 에노산 경로 중간체인 6-아미노헵트-2-엔다이오산 또는 6-카복시헥스-2-에노에이트 중 하나로부터 티오에스터 결합을 형성하는 것을 포함한다. 글루타코네이트 CoA-트랜스퍼라제(EC 2.8.3.12)와 같은 에노일-CoA 트랜스퍼라제는 상기 전환에 우수한 효소이다. 이. 콜라이에서 클로닝되고 기능적으로 발현된[Mack et al., Eur. J. Biochem. 226:41-51 (1994)], 액시드아미노코커스 퍼멘탄스로부터의 상기 효소는 3-부테노일-CoA, 아크릴릴-CoA 및 2-하이드록시글루타릴-CoA를 포함하여 다중 에노일-CoA 기질과 반응한다[Buckel et al., Eur. J. Biochem. 118:315-321 (1981)]. 글루타코네이트 CoA-트랜스퍼라제 활성은 또한 클로스트리듐 스포로스페로이데스(Clostridium sporosphaeroides) 및 클로스트리듐 심비오섬(Clostiridium symbiosum)에서도 검출되었다. 또 다른 글루타코네이트 CoA-트랜스퍼라제 효소는 액시드아미노코커스 퍼멘탄스 단백질 서열에 대한 상동성에 의해 추정될 수 있다. 예시적 유전자 산물에 대한 단백질 서열은 하기 표 44에 나타낸 하기의 진뱅크 등록 번호를 사용하여 찾을 수 있다.
| 단백질 | 진뱅크 ID | GI 번호 | 유기체 |
| gctA | CAA57199.1 | 559392 | 액시드아미노코커스 퍼멘탄스 |
| gctB | CAA57200.1 | 559393 | 액시드아미노코커스 퍼멘탄스 |
| gctA | ACJ24333.1 | 212292816 | 클로스트리듐 심비오섬 |
| gctB | ACJ24326.1 | 212292808 | 클로스트리듐 심비오섬 |
| gctA | NP_603109.1 | 19703547 | 푸소박테리움 뉴클레아텀 |
| gctB | NP_603110.1 | 19703548 | 푸소박테리움 뉴클레아텀 |
6-아미노헵트-2-엔다이오에이트 또는 6-카복시헥스-2-에노에이트로부터 에노일-CoA 중간체가 생성되는 경우, 알켄의 환원은 에노일-CoA 트랜스퍼라제에 의해 수행될 수 있다. 예시적 에노일-CoA 리덕타제 유전자는 전술하였다.
본 발명의 비-천연 미생물 유기체는 하나 이상의 사이클로헥사논 생합성 경로에 관여하는 하나 이상의 효소 또는 단백질을 암호화하는 발현가능한 핵산을 도입함으로써 제조될 수 있다. 생합성을 위해 선택된 숙주 미생물 유기체에 따라, 특정 사이클로헥사논 생합성 경로의 일부 또는 전부에 대한 핵산이 발현될 수 있다. 예를 들면, 선택된 숙주가 목적하는 생합성 경로를 위한 하나 이상의 효소 또는 단백질이 결여된 경우, 결여 효소(들) 또는 단백질(들)에 대한 발현가능한 핵산을 후속 외인성 발현을 위해 숙주내에 도입한다. 또는, 선택된 숙주가 일부 경로 유전자의 외인성 발현을 나타내지만, 다른 유전자는 결여된 경우, 사이클로헥사논 생합성을 달성하기 위해 결여 효소(들) 또는 단백질(들)을 위해 암호화 핵산이 필요하다. 따라서, 본 발명의 비-천연 미생물 유기체는 목적하는 생합성 경로를 얻기 위해 외인성 효소 또는 단백질 활성을 도입함으로써 제조될 수 있거나, 또는 목적하는 생합성 경로는, 하나 이상의 내인성 효소 또는 단백질과 함께 사이클로헥사논과 같은 목적 생성물을 생성하는 하나 이상의 외인성 효소 또는 단백질 활성을 도입함으로써 수득될 수 있다.
선택된 숙주 미생물 유기체의 사이클로헥사논 생합성 경로 구성요소에 따라서, 본 발명의 비-천연 미생물 유기체는 하나 이상의 외인적으로 발현된 사이클로헥사논 경로-암호화 핵산, 및 하나 이상의 사이클로헥사논 생합성 경로에 대한 모든 암호화 핵산을 포함한다. 예를 들면, 사이클로헥사논 생합성은 상응하는 암호화 핵산의 외인성 발현을 통해 경로 효소 또는 단백질이 결여된 숙주에서 확립될 수 있다. 사이클로헥사논 경로의 모든 효소 또는 단백질이 결여된 숙주에서, 경로의 모든 효소 또는 단백질의 외인성 발현이 포함될 수 있지만, 경로의 모든 효소 또는 단백질은 숙주가 하나 이상의 경로 효소 또는 단백질을 함유할 경우에조차 발현될 수 있음을 이해해야 한다. 예를 들면, PEP 카복시키나제, 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 2-케토사이클로헥산-1-카복실레이트 데카복실라제, 및 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용), 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제 및 2-케토사이클로헥산-1-카복실-CoA 신세타제로부터 선택된 효소와 같이, 사이클로헥사논의 생성을 위한 경로에서 모든 효소 또는 단백질의 외인성 발현이 포함될 수 있다. 상기 경로는 또한, 3-하이드록시부티릴-CoA 데하이드라타제, 글루타릴-CoA 데하이드로게나제, 옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제, 3-하이드록시피멜로일-CoA 데하이드로게나제, 3-하이드록시피멜로일-CoA 데하이드라타제 및 피멜로일-CoA 데하이드로게나제를 포함하여, 피멜로일-CoA의 생성을 위한 외인성 효소들의 완전한 세트를 포함할 수 있다.
사이클로헥사논의 생성을 위한 완전한 효소 세트의 다른 예는, 예를 들면, (a) PEP 카복시키나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 6-케토사이클로헥스-1-엔-1-카복실레이트 데카복실라제, 사이클로헥사논 데하이드로게나제; 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 신세타제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(티오에스터에 작용) 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 트랜스퍼라제로부터 선택된 효소; (b) PEP 카복시키나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 6-케토사이클로헥스-1-엔-1-카복실레이트 리덕타제, 2-케토사이클로헥산-1-카복실레이트 데카복실라제; 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 신세타제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(티오에스터에 작용) 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 트랜스퍼라제로부터 선택된 효소; 및 (c) PEP 카복시키나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C에 작용), 6-케토사이클로헥스-1-엔-1-카복실-CoA 리덕타제, 2-케토사이클로헥산-1-카복실레이트 데카복실라제; 및 2-케토사이클로헥산-1-카복실-CoA 신세타제, 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제 및 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용)로부터 선택된 효소. 경로 (a) 내지 (c) 중 임의의 경로는 또한 3-하이드록시피멜로일-CoA 데하이드라타제, 글루타릴-CoA 데하이드로게나제, 옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제 및 3-하이드록시피멜로일-CoA 데하이드로게나제를 암호화하는 핵산의 완전한 세트를 가질 수 있다.
또 다른 예시적 태양에서, 완전한 사이클로헥사논 경로를 암호화하는 핵산의 한 세트는 PEP 카복시키나제, 아디페이트 세미알데하이드 데하이드라타제, 사이클로헥산-1,2-다이올 데하이드로게나제 및 사이클로헥산-1,2-다이올 데하이드라타제를 포함할 수 있다. 또 다른 태양에서, 완전한 사이클로헥사논 경로는 PEP 카복시키나제, 3-옥소피멜레이트 데카복실라제, 4-아세틸부티레이트 데하이드라타제, 3-하이드록시사이클로헥사논 데하이드로게나제, 2-사이클로헥세논 하이드라타제, 사이클로헥사논 데하이드로게나제; 및 3-옥소피멜로일-CoA 신세타제, 3-옥소피멜로일-CoA 하이드롤라제(티오에스터에 작용) 및 3-옥소피멜로일-CoA 트랜스퍼라제로부터 선택된 효소를 암호화하는 핵산을 포함할 수 있다. 일부 태양에서, 상기 후자의 경로는 또한 3-하이드록시아실-CoA 데하이드로게나제, 3-하이드록시부티릴-CoA 데하이드라타제, 글루타릴-CoA 데하이드로게나제 및 옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제를 포함하는 3-옥소피멜로일-CoA 경로를 포함할 수 있다.
본원에 제공된 교지내용 및 지침에 따라서, 당해 분야에 숙련된 자라면 발현가능한 형태로 도입된 암호화 핵산의 수가 적어도 선택된 숙주 미생물 유기체의 사이클로헥사논 경로 결여에 필적할 것임을 이해할 것이다. 그러므로, 본 발명의 비-천연 미생물 유기체는 본원에 개시된 사이클로헥사논 생합성 경로를 구성하는 효소 또는 단백질을 암호화하는 핵산을 1개, 2개, 3개, 4개, 5개, 6개, 7개, 8개, 9개, 10개, 11개, 12개, 13개, 14개, 15개 또는 전부까지를 가질 수 있다. 일부 태양에서, 비-천연 미생물 유기체는 또한 사이클로헥사논 생합성을 촉진하거나 최적화하거나, 또는 숙주 미생물 유기체상에 다른 유용한 기능을 제공하는 다른 유전자 변형을 포함할 수 있다. 하나의 상기 다른 기능은, 예를 들면, 2-케토사이클로헥산-1-카복실레이트, 2-케토사이클로헥산-1-카복실-CoA, 피멜로일-CoA, 6-카복시헥스-2-에노일-CoA, 3-하이드록시피멜로일-CoA, 글루타릴-CoA, 크로토닐-CoA, 3-하이드록시부티릴-CoA, 아세토아세틸-CoA, 6-케토사이클로헥스-1-엔-1-카복실-CoA, 6-케토사이클로헥스-1-엔-1-카복실레이트, 2-사이클로헥사논, 사이클로헥산-1,2-다이올, 2-하이드록시사이클로헥사논, 사이클로헥산-1,2-다이온, 아디페이트 세미알데하이드, 3-하이드록시사이클로헥사논, 1,3-사이클로헥산다이온, 4-아세틸부티레이트 또는 3-옥소피멜레이트와 같은 하나 이상의 사이클로헥사논 경로 전구체의 합성의 증대를 포함할 수 있다.
일반적으로, 숙주 미생물 유기체는, 천연적으로 생성된 분자로서, 또는 목적하는 전구체의 신생 생성 또는 숙주 미생물 유기체에 의해 천연적으로 생성된 전구체의 증가된 생성을 제공하는 조작처리된 생성물로서, 사이클로헥사논 경로의 전구체를 생성하도록 선택된다. 예를 들면, 아세토아세틸-CoA는 이. 콜라이와 같은 숙주 유기체에서 천연적으로 생성된다. 숙주 유기체는 본원에 개시된 바와 같은 전구체의 생성을 증가시키도록 조작처리될 수 있다. 또한, 목적하는 전구체를 생성하도록 조작처리된 미생물 유기체는 숙주 유기체로 사용될 수 있으며, 또한 사이클로헥사논 경로의 효소 또는 단백질을 발현하도록 조작처리될 수 있다.
일부 태양에서, 본 발명의 비-천연 미생물 유기체는 사이클로헥사논을 합성하는 효소적 능력을 갖는 숙주로부터 생성된다. 상기 특정 태양에서, 예를 들면, 사이클로헥사논 경로 반응을 사이클로헥사논 생성으로 유도하도록 사이클로헥사논 경로 생성물의 합성 또는 축적을 증가시키는 것이 유용할 수 있다. 증가된 합성 또는 축적은, 예를 들면, 하나 이상의 전술한 사이클로헥사논 경로 효소 또는 단백질을 암호화하는 핵산의 과발현에 의해 이루어질 수 있다. 사이클로헥사논 경로의 효소 또는 효소들 및/또는 단백질 또는 단백질들의 과발현은, 예를 들면, 내인성 유전자 또는 유전자들의 외인성 발현을 통해, 또는 이종 유전자 또는 유전자들의 외인성 발현을 통해 일어날 수 있다. 그러므로, 천연 유기체는, 예를 들면, 1개, 2개, 3개, 4개, 5개, 6개, 7개, 8개, 9개, 10개, 11개, 12개, 13개, 14개, 15개, 즉, 사이클로헥사논 생합성 경로 효소 또는 단백질을 암호화하는 모든 핵산의 과발현을 통해 사이클로헥사논을 생성하는 본 발명의 비-천연 미생물 유기체가 되도록 용이하게 생성될 수 있다. 또한, 비-천연 유기체는 사이클로헥사논 생합성 경로의 효소 활성의 증가를 야기하는 외인성 유전자의 돌연변이유발에 의해 생성될 수 있다.
특히 유용한 태양에서, 암호화 핵산의 외인성 발현을 이용한다. 외인성 발현은 숙주에게 발현 및/또는 조절 요소들을 요구에 따라 변형시키는 능력 및 사용자에 의해 조절되는 목적하는 발현 수준을 달성하기 위한 적용을 제공한다. 그러나, 외인성 발현은 또한 음성 조절 작동인자의 제거 또는 유도성 프로모터 또는 기타 조절 요소에 연결될 때 유전자의 프로모터의 도입과 같은 다른 태양에 사용될 수 있다. 따라서, 천연 유도성 프로모터를 갖는 외인성 유전자는 적절한 유도제를 제공함으로써 상향조절될 수 있거나, 또는 외인성 유전자의 조절 영역은 유도성 조절 요소를 혼입함으로써 목적하는 시간에 외인성 유전자의 증가된 발현을 조절할 수 있도록 조작처리될 수 있다. 마찬가지로, 유도성 프로모터는 비-천연 미생물 유기체내에 도입된 외인성 유전자에 대한 조절 요소로서 포함될 수 있다.
본 발명의 방법에서, 임의의 하나 이상의 외인성 핵산이 미생물 유기체에 도입되어 본 발명의 비-천연 미생물 유기체를 생성할 수 있는 것으로 이해된다. 핵산은, 예를 들면, 미생물 유기체상에 사이클로헥사논 생합성 경로를 부여하기 위해 도입될 수 있다. 또는, 암호화 핵산은 사이클로헥사논 생합성 능력을 제공하기 위해 필요한 반응의 일부를 촉진하는 생합성 능력을 갖는 중간 미생물 유기체를 생성하기 위해 도입될 수 있다. 예를 들면, 사이클로헥사논 생합성 경로를 갖는 비-천연 미생물 유기체는 목적하는 효소 또는 단백질을 암호화하는 2개 이상의 외인성 핵산, 예를 들면, 2-케토사이클로헥산-1-카복실레이트 데카복실라제 및 2-케토사이클로헥산카복실-CoA 하이드롤라제(C-C 결합에 작용; 반응은 역으로 진행된다), 또는 2-케토사이클로헥산-1-카복실레이트 데카복실라제 및 CoA 신세타제, 하이드롤라제 또는 트랜스퍼라제, 또는 2-케토사이클로헥산카복실-CoA 하이드롤라제(C-C 결합에 작용; 반응은 역으로 진행된다) 및 CoA 신세타제, 하이드롤라제 또는 트랜스퍼라제 등의 조합을 포함할 수 있다. 이들은 단지 예시이며, 당해 분야에 숙련된 자라면 임의의 개시된 경로로부터 2개 효소의 임의의 조합이 외인성 핵산의 도입에 의해 제공될 수 있음을 인지할 것이다. 따라서, 생합성 경로의 2개 이상의 효소 또는 단백질의 임의 조합이 본 발명의 비-천연 미생물 유기체에 포함될 수 있는 것으로 이해된다. 유사하게, 목적하는 생합성 경로의 효소 및/또는 단백질의 조합이 상응하는 목적 생성물의 생성을 제공하는 한, 생합성 경로의 3개 이상의 효소 또는 단백질의 임의의 조합, 예를 들면, 2-케토사이클로헥산-1-카복실레이트 데카복실라제, 2-케토사이클로헥산카복실-CoA 하이드롤라제(C-C 결합에 작용; 반응은 역으로 진행) 및 CoA 신세타제; 또는 2-케토사이클로헥산-1-카복실레이트 데카복실라제, 2-케토사이클로헥산카복실-CoA 하이드롤라제(C-C 결합에 작용; 반응은 역으로 진행) 및 CoA 하이드롤라제; 또는 2-케토사이클로헥산-1-카복실레이트 데카복실라제, 2-케토사이클로헥산카복실-CoA 하이드롤라제(C-C 결합에 작용; 반응은 역으로 진행) 및 CoA 트랜스퍼라제 등이 바람직한 대로 본 발명의 비-쳔연 미생물 유기체에 포함될 수 있음을 주지해야 한다. 마찬가지로, 목적하는 생합성 경로의 효소 및/또는 단백질의 조합이 상응하는 목적 생성물의 생성을 제공하는 한, 4개, 5개, 6개, 7개, 8개, 9개, 10개, 11개, 12개, 13개, 14개, 15개 이상의 본원에 개시된 생합성 경로의 효소 또는 단백질의 임의의 조합이 바람직한 대로 본 발명의 비-천연 미생물 유기체에 포함될 수 있다.
본원에 개시된 사이클로헥사논의 생합성 이외에, 본 발명의 비-천연 미생물 유기체 및 방법은 또한 서로와 및 다른 미생물 유기체 및 다른 경로에 의해 생성물 생합성을 달성하기 위해 당해 분야에 공지된 방법과 다양한 조합으로 사용될 수 있다. 예를 들면, 사이클로헥사논 생산자를 사용하는 것 이외에 사이클로헥사논을 생성하기 위한 하나의 대안은 사이클로헥사논 경로 중간체를 사이클로헥사논으로 전환시킬 수 있는 또 다른 미생물 유기체의 첨가를 통해서이다. 한 상기 절차는, 예를 들면, 사이클로헥사논 경로 중간체를 생성하는 미생물 유기체의 발효를 포함한다. 이어서, 사이클로헥사논 경로 중간체를 사이클로헥사논으로 전환시키는 제 2의 미생물 유기체를 위한 기질로 사이클로헥사논 경로 중간체를 사용할 수 있다. 사이클로헥사논 경로 중간체는 제 2의 유기체의 또 다른 배양물에 직접 첨가될 수 있거나, 또는 사이클로헥사논 경로 중간체 생산자의 원래 배양물은, 예를 들면, 세포 분리에 의해 상기 미생물 유기체를 고갈시킨 다음, 발효액에 제 2 유기체를 연속하여 첨가하는 것을 이용하여 중간체 정제 단계없이 최종 생성물을 생성할 수 있다.
다른 태양으로, 본 발명의 비-천연 미생물 유기체 및 방법은, 예를 들면, 사이클로헥사논의 생합성을 달성하기 위한 매우 다양한 부경로로 조합될 수 있다. 상기 태양들에서, 본 발명의 목적 생성물을 위한 생합성 경로는 상이한 미생물 유기체로 구분될 수 있으며, 상이한 미생물 유기체는 공-배양되어 최종 생성물을 생성할 수 있다. 상기 생합성 방법에서, 한 미생물 유기체의 생성물은 최종 생성물이 합성될 때까지 제 2 미생물 유기체에 기질이다. 예를 들면, 사이클로헥사논의 생합성은, 한 경로 중간체를 또 다른 경로 중간체 또는 생성물로 전환시키기 위한 생합성 경로를 갖는 미생물 유기체를 구축함으로써 수행될 수 있다. 또는, 사이클로헥사논은 또한 동일한 용기에서 두 유기체를 사용하여 공-배양 또는 공-발혀를 통해 미생물 유기체로부터 생합성적으로 생성될 수 있으며, 여기서 첫 번째 미생물 유기체는 피멜로일-CoA와 같은 사이클로헥사논 중간체를 생성하고, 제 2의 미생물 유기체는 중간체를 사이클로헥사논으로 전환시킨다.
본원에 제공된 교지내용 및 지침에 따라서, 당해 분야에 숙련된 자라면 다른 미생물 유기체와, 부경로를 갖는 다른 비-천연 미생물 유기체의 공-배양과 함께, 및 사이클로헥사논을 생성하기 위한 당해 분야에 공지된 다른 화학적 및/또는 생화학적 절차의 조합과 함께 본 발명의 비-천연 미생물 유기체 및 방법에 대해 매우 다양한 조합 및 순열이 존재함을 이해할 것이다.
사이클로헥사논 경로 효소 또는 단백질에 대한 암호화 핵산의 공급원은, 예를 들면, 암호화된 유전자 산물이 엄급된 반응을 촉진할 수 있는 임의의 종을 포함할 수 있다. 상기 종은 고세균 및 진정세균을 포함한 세균, 및 효모, 식물, 곤충, 동물 및 인간을 포함한 포유동물을 포함한 진핵생물을 포함하여(이로 한정되지 않는다) 원핵 및 진핵 유기체 둘 다를 포함한다. 상기 공급원에 예시적인 종으로는, 예를 들면, 에스케리키아 콜라이 , 사카로마이세스 세레비지에 , 클로스트리듐 아세토부틸리컴 , 주글로에 라미게라 , 슈도모나스 푸티다 , 신트로푸스 액시디트로피쿠스 , 헤모필러스 인플루엔자, 아조아르커스속 CIB , 타우에라 아로마티카 , 글리신 맥스 및 아스카리우스 섬, 및 본원에 개시되거나 상응하는 유전자에 대한 공급 유기체로서 이용가능한 다른 예시적 종들이 포함된다. 그러나, 395개 미생물 게놈 및 다양한 효소, 진균류, 식물 및 포유동물 게놈을 포함하여, 현재 550개 종 이상에 대해 이용가능한 완전 게놈 서열을 사용하여(NCBI와 같은 공용 데이터베이스 상에서 이용가능한 상기 종들 중 절반 이상을 사용하여), 예를 들면, 알고 있는 유전자의 동족체, 이종상동체, 상동체 및 비-이종상동성 유전자 변위를 포함하여 관련되거나 또는 별개의 종들에서 하나 이상의 유전자에 대한 필수 사이클로헥사논 생합성 활성을 암호화하는 유전자의 확인, 및 유기체들 간의 유전자 변이의 상호교환은 당해 분야에서 통상적이며 공지되어 있다. 따라서, 이. 콜라이와 같은 특정 유기체와 관련하여 본원에 기술된 사이클로헥사논의 생합성을 가능케하는 대사성 변이는 원핵 및 진핵 유기체 모두 포함하여 다른 미생물들에 용이하게 적용할 수 있다. 본원에 제공된 교지내용 및 지침에 따라서, 당해 분야에 숙련된 자라면 한 유기체에서 예시된 대사성 변이가 다른 유기체에도 동일하게 적용될 수 있다.
일부 경우에서, 예를 들어, 대안적 사이클로헥사논 생합성 경로가 비관련 종들에 존재하는 경우, 사이클로헥사논 생합성은, 예를 들면, 언급된 반응을 대체할 유사하지만 동일하지는 않은 대사 반응을 촉진하는 비관련 종으로부터의 상동체 또는 상동체들의 외인성 발현에 의해, 숙주 종에 제공될 수 있다. 대사 네트워크가운데 특정 차이가 상이한 유기체들 간에 존재하기 때문에, 당해 분야에 숙련된 자라면 상이한 유기체들간에 실제 유전자 이용이 상이할 수 있음을 이해할 것이다. 그러나, 본원에 제공된 교지내용 및 지침에 따라서, 당해 분야에 숙련된 자라면 또한 본 발명의 교지내용 및 방법이 사이클로헥사논을 합성할 해당 종에서 미생물 유기체를 제조하기 위해 본원에 예시된 변이와 유사한 대사성 변이를 이용하는 모든 미생물 유기체에 적용될 수 있음을 이해할 것이다.
숙주 미생물 유기체는, 예를 들면, 세균, 효모, 진균류 또는 발효 공정에 적용가능한 임의의 다양한 다른 미생물로부터 선택될 수 있으며, 그 중에서 비-천연 미생물 유기체가 생성될 수 있다. 대표적 세균으로는 에스케리키아 콜라이 , 클렙 시아 옥시토카 , 언에어로바이오스피릴럼 숙시니시프로듀센스 , 액티노바실러스 숙시 노제네스, 만헤이미아 숙시니시프로듀센스 , 리조븀 에틀리 , 바실러스 서브틸리스 , 코리네박테리움 글루타미컴 , 글루코노박터 옥시단스 , 지모모나스 모빌리스, 락토코 커스 락티스 , 락토바실러스 플랜타룸 , 스트렙토마이세스 코엘리콜로 , 클로스트리듐 아세토부틸리컴, 슈도모나스 플루오레센스 및 슈도모나스 푸티다로부터 선택된 종이 포함된다. 대표적 효모 또는 진균류로는 사카로마이세스 세레비지에 , 쉬조사카로마이세스 폼베 ( Schizosaccharomyces pombe ), 클루이베로마이세스 락티스 , 클루이 베로마이세스 마르지아누스 ( Kluyveromyces marxianus ), 아스퍼질러스 테레우스( Aspergillus terreus ), 아스퍼질러스 니거 ( Aspergillus niger ) 및 피치아 파스토리스( Pichia pastoris)로부터 선택된 종들이 포함된다. 이 콜라이는 유전 공학에 적합한 잘 특성화된 미생물 유기체이므로 특히 유용한 숙주 미생물이다. 다른 특히 유용한 숙주 미생물로는 사카로마이세스 세레비지에와 같은 효모가 포함된다.
비-천연 사이클로헥사논-생성 숙주의 발현 수준을 구성하고 시험하는 방법은, 예를 들면, 당해 분야에 공지된 재조합체 및 결실 방법에 의해 수행될 수 있다. 상기 방법은, 예를 들면, 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, Third Ed., Cold Spring Harbor Laboratory, New York (2001); and Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, MD (1999)]에서 찾을 수 있다.
사이클로헥사논의 생성을 위한 경로에 포함된 외인성 핵산 서열은, 접합, 전기천공, 화학적 형질전환, 형질도입, 형질감염 및 초음파 형질전환을 포함하여(이로 한정되지는 않는다) 당해 분야에 공지된 기술을 사용하여 숙주 세포내에 안정하게 또는 일시적으로 도입될 수 있다. 이. 콜라이 또는 다른 원핵 세포에서의 외인성 발현을 위해, 진핵세포 핵산의 유전자 또는 cDNA 중 일부 핵산 서열은 N-말단 미토콘드리아와 같은 표적화 신호 또는 경우에 따라 원핵성 숙주 세포내에 형질전환되기 전에 제거될 수 있는 다른 표적화 신호를 암호화할 수 있다. 예를 들면, 미토콘드리아 리더 서열의 제거는 이. 콜라이에서 증가된 발현을 유도할 수 있다[Hoffmeister et al., J. Biol. Chem. 280:4329-4338 (2005)]. 효모 또는 다른 진핵 세포에서의 외인성 발현을 위해, 유전자는 리더 서열의 부가없이 세포기질에서 발현될 수 있거나, 또는 숙주 세포에 적합한 미토콘드리아 표적화 또는 분비 신호와 같은 적합한 표적화 서열의 부가에 의해 미토콘드리온 또는 다른 세포소기관에 대해 표적화되거나 또는 분비를 위해 표적화될 수 있다. 따라서, 표적화 서열을 제거하거나 포함시키기 위한 핵산 서열에 대한 적절한 변형이 바람직한 성질을 제공하기 위해 외인성 핵산 서열내에 혼입될 수 있음을 이해해야 한다. 또한, 유전자는 당해 분야에 공지된 기술을 이용하여 코돈 최적화되어 단백질의 최적화된 발현을 달성할 수 있다.
발현 벡터 또는 벡터들은 숙주 유기체에서 작용성인 발현 조절 서열과 작동가능하게 연결된 본원에 예시된 바와 같은 하나 이상의 사이클로헥사논 경로 암호화 핵산을 포함하도록 제작될 수 있다. 본 발명의 미생물 숙주 유기체에 사용하기에 적용가능한 발현 벡터는, 예를 들면, 숙주 염색체내에 안정한 통합을 위해 작동가능한 벡터 및 선택 서열 또는 마커를 포함하여, 플라스미드, 파지 벡터, 바이러스 벡터, 에피솜 및 인공 염색체를 포함한다. 또한, 발현 벡터는 하나 이상의 선택가능한 마커 유전자 및 적절한 발현 조절 서열을 포함할 수 있다. 예를 들면, 항생물질 또는 독소, 보체 영양요구성 결핍에 대한 내성을 제공하거나 또는 배양 배지에 존재하지 않는 부족한 영양소를 공급하는 선택성 마커 유전자가 또한 포함될 수 있다. 발현 조절 서열은 당해 분야에 공지되어 있는 구성성 및 유도성 프로모터, 전사 증폭인자, 전사 종결인자 등을 포함할 수 있다. 2개 이상의 외인성 암호화 핵산이 동시-발현되어야 하는 경우, 두 핵산 모두, 예를 들면, 단일 발현 벡터 또는 별도의 발현 벡터에 삽입될 수 있다. 단일 발현 벡터의 경우, 암호화 핵산은 하나의 공통 발현 조절 서열에 작용가능하게 연결되거나, 또는 상이한 발현 조절 서열, 예를 들면, 하나의 유도성 프로모터 및 하나의 구성성 프로모터에 연결될 수 있다. 대사 또는 합성 경로에 포함되는 외인성 핵산 서열의 형질전환은 당해 분야에 공지된 방법을 이용하여 확인될 수 있다. 상기 방법은, 예를 들면, 핵산 분석, 예를 들어, 노던 블롯(Northern blot) 또는 mRNA의 중합효소 연쇄 반응(PCR) 증폭, 또는 유전자 산물의 발현을 위한 면역블롯팅, 또는 도입된 핵산 서열 또는 그의 상응하는 유전자 산물의 발현을 검사하기 위한 다른 적합한 분석 방법을 포함한다. 당해 분야에 숙련된 자는 외인성 핵산이 목적 생성물을 생성하기에 충분한 양으로 발현됨을 이해하며, 당해 분야에 공지되어 본원에 개시된 바와 같은 방법을 이용하여 충분한 발현을 수득하도록 발현 수준이 최적화될 수 있음을 또한 이해할 것이다.
일부 태양에서, 본 발명은 사이클로헥사논 경로를 갖는 비-천연 미생물 유기체를 배양하는 것을 포함하는, 사이클로헥사논을 제조하는 방법을 제공한다. 상기 경로는 사이클로헥사논을 생성하기에 충분한 시간동안 및 조건하에서, 사이클로헥사논을 생성하기에 충분한 양으로 발현된 사이클로헥사논 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함한다. 상기 사이클로헥사논 경로는 PEP 카복시키나제, 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 2-케토사이클로헥산-1-카복실레이트 데카복실라제; 및 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용), 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제 및 2-케토사이클로헥산-1-카복실-CoA로 이루어진 군에서 선택된 효소를 포함한다.
본 발명은 또한 사이클로헥사논을 생성하기 위한 조건하에서 그에 충분한 시간동안, 사이클로헥사논을 생성하기에 충분한 양으로 발현된 사이클로헥사논 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 사이클로헥사논 경로를 갖는 비-천연 미생물 유기체를 배양하는 것을 포함하는 사이클로헥사논 생성 방법을 제공는데, 여기서 사이클로헥사논 경로는 사이클로헥사논 경로 효소들의 세트를 포함한다. 사이클로헥사논 경로 효소들의 세트는 (a) PEP 카복시키나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 6-케토사이클로헥스-1-엔-1-카복실레이트 데카복실라제, 사이클로헥사논 데하이드로게나제; 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 신세타제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(티오에스터에 작용) 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 트랜스퍼라제로부터 선택된 효소; (b) PEP 카복시키나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 6-케토사이클로헥스-1-엔-1-카복실레이트 리덕타제, 2-케토사이클로헥산-1-카복실레이트 데카복실라제; 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 신세타제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(티오에스터에 작용) 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 트랜스퍼라제로부터 선택된 효소; (c) PEP 카복시키나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C에 작용), 6-케토사이클로헥스-1-엔-1-카복실-CoA 리덕타제, 2-케토사이클로헥산-1-카복실레이트 데카복실라제; 및 2-케토사이클로헥산-1-카복실-CoA 신세타제, 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제, 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용)로부터 선택된 효소로부터 선택된다.
본 발명은 또한 사이클로헥사논을 생성하기에 충분한 시간동안 및 조건하에서, 사이클로헥사논을 생성하기에 충분한 양으로 발현된 사이클로헥사논 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 사이클로헥사논 경로를 갖는 비-천연 미생물 유기체를 배양하는 것을 포함하는, 사이클로헥사논을 생성하기 위한 방법을 제공한다. 상기 사이클로헥사논 경로는 PEP 카복시키나제, 아디페이트 세미알데하이드 데하이드라타제, 사이클로헥산-1,2-다이올 데하이드로게나제 및 사이클로헥산-1,2-다이올 데하이드라타제를 포함한다.
또 다른 태양에서, 본 발명은 사이클로헥사논을 생성하기에 충분한 시간동안 및 조건하에서, 사이클로헥사논을 생성하기에 충분한 양으로 발현된 사이클로헥사논 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 갖는 사이클로헥사논 경로를 갖는 비-천연 미생물 유기체를 배양하는 것을 포함하는, 사이클로헥사논을 생성하기 위한 방법을 제공한다. 상기 태양에서, 사이클로헥사논 경로는 PEP 카복시키나제, 3-옥소피멜레이트 데카복실라제, 4-아세틸부티레이트 데하이드라타제, 3-하이드록시사이클로헥사논 데하이드로게나제, 2-사이클로헥사논 하이드라타제, 사이클로헥사논 데하이드로게나제, 및 3-옥소피멜로일-CoA 신세타제, 3-옥소피멜로일-CoA 하이드롤라제(티오에스터에 작용) 및 3-옥소피멜로일-CoA 트랜스퍼라제로 이루어진 군에서 선택된 효소를 포함한다.
사이클로헥사논의 생성에 대해 시험하기에 적합한 정제 및/또는 분석은 공지된 방법을 사용하여 수행할 수 있다. 삼중 배양물과 같은 적합한 복제물을 시험될 각각의 조작처리된 균주에 대해 성장시킬 수 있다. 예를 들면, 조작처리된 생성 숙주에서의 생성물 및 부산물 생성을 모니터할 수 있다. 최종 생성물 및 중간체, 및 기타 유기 화합물들은 HPLC(고성능 액체 크로마토그래피), GC-MS(가스 크로마토그래피-질량 분광분석) 및 LC-MS(액체크로마토그래피-질량 분광분석)와 같은 방법 또는 당해 분야에 공지된 통상의 절차를 사용하는 기타 적당한 분석 방법에 의해 분석될 수 있다. 발효액에서 생성물의 방출은 또한 배양 상등액을 사용하여 시험할 수 있다. 부산물 및 잔류 글루코스는, 예를 들면, 글루코스 및 알콜용 굴절률 검출기 및 유기산용 UV 검출기[Lin et al., Biotechnol. Bioeng. 90:775-779 (2005)]를 사용하여 HPLC에 의해, 또는 당해 분야에 공지된 기타 적합한 분석 및 검출 방법에 의해 정량화할 수 있다. 외인성 DNA 서열로부터 개별적 효소 또는 단백질 활성도 또한 당해 분야에 공지된 방법을 사용하여 분석할 수 있다. 예를 들면, 사이클로헥사논 데하이드로게나제의 고유 활성은 문헌으로부터 적용된 비색 분석을 이용하여 환원적 방향으로 분석할 수 있다[Durre et al., FEMS Microbiol. Rev. 17:251-262 (1995); Palosaari et al., J. Bacteriol. 170:2971-1976 (1988); Welch et al., Arch. Biochem. Biophys. 273:309-318 (1989)]. 상기 분석에서는, 기질 2-사이클로헥사논 및 NADH를 완충 용액중 세포 추출물에 첨가하고, NADH의 산화후에 규칙적 간격으로 340 nM에서 흡광도를 판독한다. 340 nM에서의 NADH의 몰 흡광 계수(6000) 및 추출물의 단백질 농도와 함께, 분당 340 nM에서의 흡광도로 나타낸, 결과로 얻은 환원의 기울기를 이용하여 사이클로헥사논 데하이드로게나제의 고유 활성을 측정할 수 있다.
사이클로헥사논은 당해 분야에 공지된 다양한 방법을 사용하여 배양물중 다른 성분들로부터 분리될 수 있다. 상기 분리 방법으로는, 예를 들면, 추출 절차, 및 연속 액체-액체 추출, 투과증발, 막 여과, 막 분리, 역삼투압, 전기투석, 증류, 결정화, 원심분리, 추출 여과, 이온 교환 크로마토그래피, 크기 배제 크로마토그래피, 흡착 크로마토그래피 및 한외여과를 포함한 방법들이 포함된다. 상기 방법들은 모두 당해 분야에 공지되어 있다.
본원에 기술된 임의의 비-천연 미생물 유기체는 본 발명의 생합성 생성물을 생성 및/또는 분비하도록 배양될 수 있다. 예를 들면, 사이클로헥사논 생성자를 사이클로헥사논의 생합성 생성을 위해 배양할 수 있다.
사이클로헥사논의 생성을 위해, 재조합 균주를 탄소 공급원 및 기타 필수 영양소를 갖는 배지에서 배양한다. 전체 공정의 비용을 감소시키기 위해 발효조에서 혐기성 조건을 유지하는 것이 매우 바람직하다. 상기 조건은, 예를 들면, 먼저 배지를 질소로 스파징한 후 플라스크를 격막 및 크림프-캡으로 밀봉함으로써 달성할 수 있다. 성장이 혐기적으로 관찰되지 않은 균주의 경우, 제한된 통기를 위해 격막에 작은 구멍을 천공함으로써 미세호기성 조건을 적용할 수 있다. 대표적인 혐기성 조건은 앞에서 기술하였으며 당해 분야에 공지되어 있다. 대표적인 호기성 및 혐기성 조건은, 예를 들면, 2007년 8월 10일자로 출원된 미국 특허출원 제 11/891,602 호에 기술되어 있다. 발효는 본원에 개시된 바와 같이 배치, 유가식, 또는 연속 방식으로 수행할 수 있다.
경우에 따라, 배지의 pH는 바람직한 pH에서 배양 배지를 유지시키기 위해 필요한 대로, NaOH와 같은 염기 또는 기타 염기, 또는 산의 첨가에 의해, 약 7의 pH와 같은 특정 중성 pH에서, 목적 pH에서 유지할 수 있다. 성장률은 분광광도계(600 nm)를 사용하여 광학 밀도를 측정함으로써 결정할 수 있으며, 글루코스 흡수율은 시간당 탄소 공급원 고갈을 모니터함으로서 측정할 수 있다.
성장 배지는, 예를 들면, 비-천연 미생물 유기체에 탄소 공급원을 공급할 수 있음 임의의 탄수화물 공급원을 포함할 수 있다. 상기 공급원으로는, 예를 들면, 글루코스, 자일로스, 아리비노스, 갈락토스, 만노스, 프럭토스 및 전분과 같은 당이 포함된다. 탄수화물의 다른 공급원으로는, 예를 들면, 재생가능한 공급원료 및 바이오매스가 포함된다. 본 발명의 방법에 공급원료로 사용될 수 있는 바이오매스의 예시적 유형으로는 셀룰로스 바이오매스, 헤미셀룰로스 바이오매스 및 리그닌 공급원료 또는 공급원료의 일부가 포함된다. 상기 바이오매스 공급원는, 예를 들면, 글루코스, 자일로스, 아라비노스, 갈락토스, 만노스, 프럭토스 및 전분과 같은 탄소 공급원으로 유용한 탄수화물 기질을 함유한다. 본원에 제공된 교지내용 및 지침에 따라서, 당해 분야에 숙련된 자라면 상기 예시된 것 이외에 다른 재생가능한 공급원료 및 바이오매스는 또한 사이클로헥사논을 생성하기 위한 본 발명의 미생물 유기체를 배양하기 위해 사용될 수 있음을 인지할 것이다.
상기 예시된 것과 같은 재생가능한 공급원료 이외에, 본 발명의 사이클로헥사논 미생물 유기체는 또한 그의 탄소 공급원으로서 합성가스 상에서의 성장을 위해 변형될 수 있다. 상기 특정 태양에서, 하나 이상의 단백질 또는 효소가 사이클로헥사논 생성 유기체에서 발현되어 합성가스 또는 기타 가스상 탄소 공급원의 사용을 위한 대사 경로를 제공한다.
합성가스 또는 생산자 가스로도 알려진 합성 가스는 석탄, 및 농작물 및 잔류물을 포함하여 바이오매스 쿨질과 같은 탄소상 물질의 가스화의 주 생성물이다. 합성가스는 주로 H2 및 CO의 혼합물이며, 석탄, 석유, 천연 가스, 바이오매스 및 폐 유기 물질을 포함하여(이로 한정되지는 않는다) 임의의 유기 공급원료의 가스화로부터 수득될 수 있다. 가스화는 일반적으로 높은 연료 대 산소 비 하에서 수행된다. 주로 H2 및 CO이지만, 합성가스는 또한 CO2 및 기타 가스를 소량으로 포함할 수 있다. 따라서, 합성 가스는 CO, 및 추가로 CO2와 같은 가스상 탄소의 비용 효과적 공급원을 제공한다.
우드-정달(Wood-Ljungdahl) 경로는 CO 및 H2의 아세틸-CoA 및 아세테이트와 같은 기타 생성물로의 전환을 촉진한다. CO 및 합성가스를 이용할 수 있는 유기체는 또한 일반적으로 동일한 기본 세트의 효소 및 우드-정달 경로에 의해 포함되는 형질전환을 통해 CO2 및 CO2/H2 혼합물을 이용하는 능력을 갖는다. 미생물에 의한 CO2의 아세테이트로의 H2-의존성 전환은, CO가 또한 동일 유기체에 의해 사용될 수 있으며 동일 경로가 포함되었음을 밝히기 훨씬 이전에 인지되었다. 많은 아세토겐은 CO2의 존재하에서 성장하며 필요한 환원 당량을 공급하기 위해 수소가 존재하는 한 아세테이트와 같은 화합물을 생성하는 것으로 나타났다(예를 들면, 문헌 [Dreke, Acetogenesis, pp. 3-60, Chapman and Hall, New York (1994)] 참조). 이것은 하기 반응식으로 요약될 수 있다:
2 CO2 + 4 H2 + n ADP + nPi → CH3COOH + 2H2O + n ATP
따라서, 우드-정달 경로를 갖는 비-천연 미생물 유기체는 아세틸-CoA 및 기타 목적 생성물의 생성을 위해 CO2 및 H2 혼합물을 또한 이용할 수 있다. 우드-정달 경로는 당해 분야에 공지되어 있으며, 2개의 분지: (1) 메틸 분지 및 (2) 카보닐 분지로 분리될 수 있는 12개의 반응으로 이루어진다. 메틸 분지는 합성가스를 메틸-테트라하이드로폴레이트(메틸-THF)로 전환시키는 반면, 카보닐 분지는 메틸-THF를 아세틸-CoA로 전환시킨다. 메틸 분지에서의 반응은 하기 효소 또는 단백질에 의해 순서에 따라 촉진된다: 페레독신 옥시도리덕타제, 포메이트 데하이드로게나제, 포밀테트라하이드로폴레이트 신세타제, 메테닐테트라하이드로폴레이트 사이클로하이드라타제, 메틸렌테트라하이드로폴레이트 데하이드로게나제 및 메틸렌테트라하이드로폴레이트 리덕타제. 카보닐 분지에서의 반응은 하기 효소 또는 단백질에 의해 순서에 따라 촉진된다: 메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제(예를 들면, AcsE), 코리노이드 철-황 단백질, 니켈-단백질 결합 단백질(예를 들면, AcsF), 페레독신, 아세틸-CoA 신타제, 일산화탄소 데하이드로게나제 및 니켈-단백질 결합 단백질(예를 들면, CooC). 본원에 제공된 교지내용 및 지침에 따라서 사이클로헥사논 경로를 생성하기 위해 충분한 수의 암호화 핵산을 도입하기 위해, 당해 분야에 숙련된 자라면 적어도 숙주 유기체에 부재하는 우드-정달 효소 또는 단백질을 암호화하는 핵산을 도입하는 것과 관련하여 동일한 공학적 설계를 수행할 수 있음을 이해할 것이다. 그러므로, 변형된 유기체가 완전한 우드-정달 경로를 함유하도록 본 발명의 미생물 유기체중에 하나 이상의 암호화 핵산의 도입은 합성가스 활용 능력을 제공할 것이다.
또한, 일산화탄소 데하이드로게나제 및/또는 하이드로게나제 활성과 커플링된 환원성 (역) 트라이카복실산 사이클도 또한 CO, CO2 및/또는 H2의 아세틸-CoA 및아세테이트와 같은 다른 생성물로의 전환에 사용될 수 있다. 환원성 TCA 경로를 통해 탄소를 고정할 수 있는 유기체는 하나 이상의 다음 효소를 사용할 수 있다: ATP 시트레이트-리아제, 시트레이트 리아제, 아코니타제, 이소시트레이트 데하이드로게나제, 알파-케토글루타레이트:페레독신 옥시도리덕타제, 숙시닐-CoA 신세타제, 숙시닐-CoA 트랜스퍼라제, 푸마레이트 리덕타제, 푸마라제, 말레이트 데하이드로게나제, NAD(P)H:페레독신 옥시도리덕타제, 일산화탄소 데하이드로게나제 및 하이드로게나제. 특히, 일산화탄소 데하이드로게나제 및 하이드로게나제에 의해 CO 및/또는 H2로부터 추출된 환원 당량은 환원성 TCA 사이클을 통해 CO2를 아세틸-CoA 또는 아세테이트로 고정시키는데 이용된다. 아세테이트는 아세틸-CoA 트랜스퍼라제, 아세테이트 키나제/포스포트랜스아세틸라제 및 아세틸-CoA 신세타제와 같은 효소들에 의해 아세틸-CoA로 전환될 수 있다. 아세틸-CoA는 피루베이트:페레독신 옥시도리덕타제 및 글루코스신생합성의 효소들에 의해, 사이클로헥사논 전구체, 글리세르알데하이드-3-포스페이트, 포스포엔올피루베이트 및 피루베이트로 전환될 수 있다. 본원에 제공된 교지내용 및 지침에 따라서 사이클로헥사논 경로를 생성하기 위해 충분한 수의 암호화 핵산을 도입하기 위해, 당해 분야에 숙련된 자라면 적어도 숙주 유기체에 부재하는 환원성 TCA 경로를 암호화하는 핵산을 도입하는 것과 관련하여 동일한 공학적 설계를 수행할 수 있음을 이해할 것이다. 그러므로, 변형된 유기체가 완전한 환원성 PCA 경로를 함유하도록 본 발명의 미생물 유기체중에 하나 이상의 암호화 핵산의 도입은 합성가스 활용 능력을 제공할 것이다.
따라서, 본원에 제공된 교지내용 및 지침에 따라서, 당해 분야에 숙련된 자라면 탄수화물과 같은 탄소 공급원상에서 성장할 때 본 발명의 생합성된 화합물을 분비하는 비-천연 미생물 유기체가 생성될 수 있음을 이해할 것이다. 상기 화합물은, 예를 들면, 사이클로헥사논 및 사이클로헥사논 경로중 임의의 중간 대사물을 포함한다. 필요한 모든 것은, 예를 들면, 사이클로헥사논 생합성 경로의 일부 또는 전부의 혼입을 포함하여, 목적 화합물 또는 중간체의 생합성을 달성하기 위한 하나 이상의 필요한 효소 또는 단백질 활성에서 조작처리하는 것이다. 따라서, 본 발명은 탄수화물 또는 다른 탄소 공급원상에서 성장할 때 사이클로헥사논을 생성 및/또는 분비하고, 탄수화물 또는 다른 탄소 공급원상에서 성장할 때 사이클로헥사논 경로에서 나타낸 임의의 중간 대사물을 생성 및/또는 분비하는 비-천연 미생물 유기체를 제공한다. 본 발명의 사이클로헥사논 생성 미생물 유기체는 임의의 전술한 중간체로부터 합성을 개시할 수 있다.
본 발명의 비-천연 미생물 유기체는 본원에 예시된 바와 같은 당해 분야에 공지된 방법을 이용하여 사이클로헥사논을 생성하기에 충분한 양으로 사이클로헥사논 경로 효소 또는 다백질을 암호화하는 하나 이상의 핵산을 외인적으로 발현하도록 제작된다. 본 발명의 미생물 유기체는 사이클로헥사논을 생성하기에 충분한 조건하에서 배양되는 것으로 이해된다. 본원에 제공된 교지내용 및 지침에 따라서, 본 발명의 비-천연 미생물 유기체는 약 0.1 내지 200 mM 이상의 세포내 농도를 제공하는 사이클로헥사논의 생합성을 달성할 수 있다. 일반적으로, 사이클로헥사논의 세포내 농도는 약 50 mM, 75 mM, 100 mM, 125 mM 이상을 포함하여, 약 3 내지 200 mM, 특히 약 10 내지 175 mM, 보다 특히 약 50 내지 150 mM이다. 각각의 상기 예시적 범위 사이 및 그 이상의 세포내 농도도 또한 본 발명의 비-천연 미생물 유기체로부터 달성될 수 있다.
일부 태양에서, 배양 조건은 혐기성 또는 실질적으로 혐기성 성장 또는 유지 조건을 포함한다. 대표적인 혐기성 조건은 앞에서 기술하였으며 당해 분야에 공지되어 있다. 발효 공정에 대표적인 혐기성 조건은 본원에 기술되어 있으며, 예를 들면, 2007년 8월 10일자로 출원된 미국 특허출원 제 11/891,602 호에 기술되어 있다. 임의의 상기 조건을 상기 비-천연 미생물 유기체 뿐 아니라 당해 분야에 공지된 다른 혐기성 조건에 사용할 수 있다. 상기 혐기성 조건하에서, 사이클로헥사논 생산자는 사이클로헥사논을 5 내지 10 mM 이상의 세포내 농도 및 본원에 예시된 모든 다른 농도로 합성할 수 있다. 상기 설명이 세포내 농도를 언급하고 있지만, 사이클로헥사논 생성 미생물 유기체는 사이클로헥사논을 세포내로 생성하고/하거나 생성물을 배양 배지내에 분비할 수 있음을 이해해야 한다.
배양 조건은, 예를 들면, 액체 배양 절차 및 발효 및 다른 대규모 배양 절차를 포함할 수 있다. 본원에 기술되 바와 같이, 본 발명의 생합성 생성물의 특히 유용한 수율은 혐기성 또는 실질적으로 혐기성 배양 조건하에서 수득될 수 있다.
본원에 기술된 바와 같이, 사이클로헥사논의 생합성을 달성하기 위한 한 예시적 성장 조건은 혐기성 배양 또는 발효 조건을 포함한다. 특정 태양에서, 본 발명의 비-천연 미생물 유기체는 혐기성 또는 실질적으로 혐기성 조건하에서 유지, 배양 또는 발효될 수 있다. 간략하게, 혐기성 조건은 산소가 결여된 환경을 말한다. 실질적으로 혐기성 조건은, 예를 들면, 배지중 용존 산소 농도가 포화도의 0 내지 10%로 유지되는 배양, 배치 발효 또는 연속 발효를 포함한다. 실질적으로 혐기성 조건은 또한 1% 미만의 산소 대기하에 유지되는 밀폐 챔버 내에서 액체 배지 중 또는 고체 아가상에서 세포를 성장 또는 휴지시키는 것을 포함한다. 산소의 퍼센트는, 예를 들면, 배양물에 N2/CO2 혼합물 또는 기타 적당한 비-산소 가스 또는 가스들을 스파징함으로써 유지될 수 있다.
본원에 기술된 배양 조건은 사이클로헥사논의 제조를 위해 연속적으로 확장되고 증대될 수 있다. 예시적인 증대 절차는, 예를 들면, 유가식 발효 및 배치 분리; 유기식 발효 및 연속 분리 또는 연속 발효 및 연속 분리를 포함한다. 이들 공정은 모두 당해 분야에 공지되어 있다. 발효 절차는 상업적 양의 사이클로헥사논의 생합성 생성에 특히 유용하다. 일반적으로 및 비-연속 배양 절차와 마찬가지로, 사이클로헥사논의 연속 및/또는 거의-연속 생성은 증식기에서 성장을 지속 및/또는 거의 지속하기에 충분한 영양소 및 배지에서 본 발명의 비-천연 사이클로헥사논 생성 유기체를 배양하는 것을 포함할 수 있다. 상기 조건하에서의 연속 배양은, 예를 들면, 1, 2, 3, 4, 5, 6 또는 7일 이상을 포함할 수 있다. 또한, 연속 배양은 1, 2, 3, 4 또는 5 주 이상 및 수개월 이하를 포함할 수 있다. 또는, 본 발명의 유기체는 특정 용도에 적합한 경우 수시간동안 배양할 수 있다. 연속 및/또는 거의-연속 배양 조건은 또한 상기 예시적 기간 사이의 모든 시간 간격을 포함할 수 있음을 이해해야 한다. 또한, 본 발명의 미생물 유기체를 배양하는 시간은 충분한 양의 목적 생성물을 생성하기에 충분한 시간동안인 것으로 이해된다.
발효 절차는 당해 분야에 공지되어 있다. 간략하게, 사이클로헥사논의 생합성 생성을 위한 발효는, 예를 들면, 유가식 발효 및 배치 분리; 유가식 발효 및 연속 분리 또는 연속 발효 및 연속 분리에 사용될 수 있다. 배치 및 연속 발효 절차의 예는 당해 분야에 공지되어 있다.
본원에 개시된 배양 및 발효 조건 이외에, 사이클로헥사논의 생합성을 달성하기 위한 성장 조건은 배양 조건에 삼투보호제(osmoprotectant)의 첨가를 포함할 수 있다. 특정 태양에서, 본 발명의 비-천연 미생물 유기체는 삼투보호제의 존재하에서 본원에 기술된 바와 같이 유지, 배양 또는 발효될 수 있다. 간략하게, 삼투보호제는 삼투물질로서 작용하며 본원에 기술된 바와 같은 미생물 유기체가 삼투 스트레스를 견디는 것을 돕는 화합물을 말한다. 삼투보호제로는 베타인, 아미노산 및 당 트레할로스가 포함되나, 이로 한정되지는 않는다. 상기 물질의 비제한 예는 글리신 베타인, 프랄린 베타인, 다이메틸테틴, 다이메틸설포니오프로피오네이트, 3-다이메틸설포니오-2-메틸프로피오네이트, 페페콜산, 다이메틸설포니오아세테이트, 콜린, L-카르니틴 및 에크토인이다. 한 태양에서, 삼투보호제는 글리신 베타인이다. 당해 분야에 통상의 기술을 가진 자에게는 본원에 기술된 미생물 유기체를 삼투 스트레스로부터 보호하기에 적합한 삼투보호제의 양 및 유형이 사용되는 미생물 유기체에 딸라 달라질 것임이 이해될 것이다. 배양 조건중 삼투보호제의 양은, 예를 들면, 약 0.1 mM 이하, 약 0.5 mM 이하, 약 1.0 mM 이하, 약 1.5 mM 이하, 약 3.0 mM 이하, 약 5.0 mM 이하, 약 7.0 mM 이하, 약 10 mM 이하, 약 50 mM 이하, 약 100 mM 이하 또는 약 500 mM 이하일 수 있다.
상당량의 사이클로헥사논의 연속 생성을 위한 본 발명의 사이클로헥사논 생산자를 사용하는 상기 발효 절차 이외에, 사이클로헥사논 생산자는 또한, 예를 들면, 생성물을 다른 화합물로 전환시키기 위한 화학 합성 절차에 동시에 적용될 수 있거나, 또는 생성물을 발효 배양물로부터 분리하고, 경우에 따라 계속해서 생성물의 다른 화합물로의 화학적 전환에 적용할 수 있다.
방향성 진화는 효소의 성질을 개선하고/하거나 변화시키기 위해 특정 유전자를 표적으로 한 돌연변이의 도입을 포함하는 강력한 접근방법이다. 개선되고/되거나 변이된 효소는 많은 효소 변이체(예를 들면, >104)의 자동 스크리닝을 가능케 하는 민감한 고속 처리량 스크리닝 분석법의 개발 및 실행을 통해 확인될 수 있다. 반복 순환의 돌연변이유발 및 스크리닝은 전형적으로 최적화된 성질을 갖는 효소를 수득하기 위해 수행된다. 돌연변이유발을 위한 유전자의 영역을 확인하는 것을 촉진할 수 있는 컴퓨터 알고리즘도 또한 개발되었으며, 생성되고 스크리닝될 필요가 있는 효소 변이체의 수를 상당히 감소시킬 수 있다.
다양한 변이체 라이브러리에서 효과적일 많은 방향성 진화 기술이 개발되었으며(개관을 위해, 문헌 [Hibbert et al., Biomol. Eng 22:11-19 (2005); Huisman et al., Biocatalysis in the pharmaceutical and biotechnology industries, pp.717-742 (2007) CRC Press, R.N. Patel, Ed); Otten et al., Biomol. Eng 22:1-9 (2005); and Sen et al., Appl Biochem. Biotechnol 143:212-223 (2007)]을 참조하시오), 상기 방법들은 많은 효소 부류에 걸쳐 광범위한 성질의 개선에 성공적으로 적용되었다.
방향성 진화 기술에 의해 개선되고/되거나 변이된 효소 특성으로는, 예를 들면, 비-천연 기질의 전환을 위해 - 선택성/특이성; 견실 고온 가공을 위해 - 온도 안정성; 낮거나 높은 pH 조건하에서 생체공정을 위해 - pH 안정성; 높은 생성물 역가가 달성될 수 있도록 - 기질 또는 생성물 내성; 기질 결합을 확장시켜 비-천연 기질을 포함하도록 - 결합도(Km); 생성물, 기질 또는 핵심 중간체에 의한 저해를 배제하도록 - 억제율(Ki); 효소 반응 속도를 증가시켜 목적 플럭스를 달성하도록 - 활성(kcat); 단백질 수율 및 전체 경로 플럭스를 증가시키도록 - 발현 수준; 호기성 조건하에서 공기 민감성 효소의 작업을 위해 - 산소 안정성; 및 산소의 부재하에 호기성 효소의 작업을 위해 - 혐기 활성이 포함된다.
특정 효소의 목적하는 성질을 표적화하기 위해 유전자의 돌연변이유발 및 변이를 위해 하기의 예시적 방법이 개발되었다. 이들중 임의의 방법을 사용하여 테카복실라제 효소의 활성을 변화/최적화시킬 수 있다.
EpPCR[Pritchard et al., J. Theor. Biol. 234:497-509 (2005)]은 Mn2+ 이온의 첨가에 의해, dNTP 농도를 치우치게 함으로써, 또는 다른 조건 변화에 의해, PCT 반응에서 DNA 폴리머라제의 충실도를 감소시킴으로써 무작위 점 돌연변이를 도입시킨다. 해당 표적 유전자로 돌연변이유발을 제한하기 위한 5 단계 클로닝 과정은 다음을 포함한다: 1) 해당 유전자의 변이 유발(error-prone) PCR 증폭; 2) 제한 효소 절단; 3) 목적 DNA 단편의 겔 정제; 4) 벡터내로의 접합; 5) 적합한 숙주내로 유전자 변이체의 형질전환 및 개선된 성능을 위한 라이브러리의 검색. 상기 방법은 단일 유전자에서 동시에 다중 돌연변이를 유발할 수 있으며, 이것은 유용할 수 있다. 많은 수의 돌연변이체가 EpPCR에 의해 생성될 수 있으므로, 고속 처리량 스크리닝 분석 또는 선택 방법(특히, 로봇공학을 이용하여)은 바람직한 특성을 갖는 효소들을 확인하는데 유용하다.
변이 유발 회전 환 증폭(epRCA)[Fujii et al., Nucl. Acids Res 32:e145 (2004); and Fujii et al., Nat. Protoc. 1:2493-2497 (2006)]은, 원형 플라스미드를 주형으로 사용하고 마지막 2개 뉴클레오티드 상에 엑소뉴클레아제 내성 티오포스페이트 결합을 갖는 불규칙 6-량체를 사용하여 플라스미드를 증폭시킨 후 플라스미드가 순차 반복으로 재순환되는 세포내로 형질전환시키는 것을 제외하고 epPCR과 많은 동일한 요소들을 갖는다. Mn2+ 농도를 조정하여 돌연변이율을 다소 변화시킬 수 있다. 상기 기술은 3 내지 4개 돌연변이/kbp를 갖는 플라스미드의 전체 복사체를 생성하기 위한 단순한 변이 유발, 단일-단계 방법을 이용한다. 제한효소 절단 또는 특정 프라이머는 필요하지 않다. 또한, 상기 방법은 전형적으로 키트로서 유용하다.
DNA 또는 가계 재편성(Family Shuffling)[Stemmer, W.P., Proc Natl Acad Sci U.S.A. 91:10747-10751 (1994); and Stemmer, W.P., Nature 370:389-391 (1994)]은 전형적으로 DnaseI 또는 EndoV와 같은 뉴클레아제로 2개 이상의 변이 유전자를 절단시켜 DNA 폴리머라제의 존재하에서 어닐링 및 연장 사이클에 의해 재조립되어 키메라 유전자의 라이브러리를 생성하는 불규칙 단편들의 풀을 생성하는 것을 수반한다. 단편들은 서로 프라이밍되고 하나의 복사체가 다른 복사체를 프라이밍하는 경우(주형 스위치) 재조합이 일어난다. 상기 방법은 >1 kbp DNA 서열에 사용될 수 있다. 단편 재조합에 의해 생성된 돌연변이 재조합체 이외에, 상기 방법은 연장 단계에서 변이 유발 PCR과 유사한 비율로 점 돌연변이를 도입한다. 상기 방법을 이용하여 항원성을 제공할 수 있는 결실성 무작위 중립 돌연변이를 제거할 수 있다.
시차적 연장(Staggered Extension, StEP)[Zhao et al., Nat. Biotechnol16:258-261 (1998)]은 주형 프라이밍 후 변성 및 매우 단기간(5초 정도)의 어닐링/연장하에 2 단계 PCR의 반복 사이클을 포함한다. 성장하는 단편들은 상이한 주형들에 어닐링되고 더 연장되며, 이것은 전장 서열이 완성될 때까지 반복된다. 주형 스위칭은 대부분의 생성된 단편들이 다중 모체를 가짐을 의미한다. 저-충실도 폴리머라제들(Taq 및 뮤타자임)의 조합은 반대 돌연변이 스펙트럼으로 인해 변이-유발 성향을 감소시킨다.
무작위 프라이밍 재조합(RPR)에서는, 무작위 서열 프라이머를 사용하여 주형의 상이한 절편들에 상보성인 많은 짧은 DNA 단편을 생성한다[Shao et al., Nucleic Acids Res 26:681-683 (1998). epPCR에 의한 잘못된 염기 삽입 및 잘못된 프라이밍은 점 돌연변이를 제공한다. 짧은 DNA 단편은 상동성을 기준으로 서로를 프라이밍하고 반복 열순환에 의해 전장 서열로 재조합되고 재조립된다. 상기 단계에 앞서 주형의 제거는 낮은 모 재조합체를 보장한다. 대부분의 다른 방법과 마찬가지로 상기 방법은 수회 반복에 걸쳐 수행되어 독특한 성질을 발전시킨다. 상기 기술은 서열 바이어스를 배제시키며, 유전자 길이와 무관하며, 적용을 위해 매우 적은 모 DNA를 필요로 한다.
헤테로듀플렉스 재조합에서는 선형화된 플라스미드 DNA를 사용하여 미스매치 복구에 의해 복구된 헤테로듀플렉스를 형성한다[Volkov et al., Nucleic Acids Res 27:e18 (1999); and Volkov et al., Methods Enzymol. 328:456-463 (2000)]. 불일치 복구 단계는 적어도 다소 돌연변이유발성이다. 헤테로듀플렉스는 선형 호모듀플렉스보다 더 효과적으로 형질전환시킨다. 상기 방법은 거대 유전자 및 전체 오페론에 적합하다.
과도성 주형상의 무작위 키메라생성(RACHITT)[Coco et al., Nat. Biotechnol 19:354-359 (2001)]은 DnaseI 단편화 및 ssDNA의 크기 분류를 이용한다. 상동성 단편은 폴리머라제의 부재하에 상보성 ssDNA 골격에 하이브리드화된다. 임의의 중복되는 비하이브리드화 단편 말단들은 엑소뉴클레아제에 의해 절단된다. 절단들 사이의 갭은 충전된 후 접합되어 골격(증폭을 막기 위해 U 함유)에 하이브리드화된 전장 역 가닥의 풀을 제공한다. 이어서, 골격은 파괴되고 PCR 증폭에 의해 역 가닥에 상보성인 새 가닥으로 대체된다. 상기 방법은 오직 한 모체로부터 비롯된 하나의 가닥(골격)을 포함하는 한편 프라이밍 단편은 다른 유전자들로부터 유도되며; 모 골격은 반대로 선택된다. 따라서, 모 단편에 재어닐링은 일어나지 않는다. 중복 단편들은 엑소뉴클레아제에 의해 정리된다. 그 외에는, 개념적으로 DNA 재편성 및 StEP와 유사하다. 그러므로, 자매세포가 없어야 하고 비활동체가 거의 없어야 하며 재편성되지 않은 모체가 없어야 한다. 상기 기술은 모 유전자가 거의 또는 전혀 생성되지 않으며 표준 DNA 재편성에 비해 더 많은 교차형이 야기될 수 있다는 점에서 이점을 갖는다.
절두형 주형상의 재조합 연장(RETT)은 주형의 풀로 사용되는 단일방향성 ssDNA 단편의 존재하에 프라이머로부터 가닥을 단일방향성으로 성장시키는 주형 스위칭을 포함한다[Lee et al., J. Molec. Catalysis 26:119-120 (2003)]. DNA 엔도뉴클레아제는 사용되지 않는다. 단일방향성 ssDNA는 무작위 프라이머와 함께 DNA 폴리머라제에 의해 또는 엔도뉴클레아제에 의한 연속 결실에 의해 제조된다. 단일방향성 ssDNA는 오직 주형이며 프라이머가 아니다. 무작위 프라이밍 및 엑소뉴클레아제는 DNA 재편성/RACHITT의 효소 절단의 실재로서 서열 바이어스를 도입하지 않는다. RETT는 매우 짧은 연장 대신에 정상적인 PCR 조건을 사용하기 때문에 StEP보다 최적화하기에 더 용이할 수 있다. 재조합은 직접 재편성이 아니라 PCR 단계의 한 요소로서 일어난다. 상기 방법은 또한 중단의 부재로 인해 StEP보다 더 무작위적일 수 있다.
변성 올리고뉴클레오티드 유전자 재편성(DOGS)에서는, 변성 프라이머를 사용하여 분자간 재조합을 조절한다[Bergquist et al., Methods Mol. Biol 352:191-204 (2007); Bergquist et al., Biomol. Eng 22:63-72 (2005); Gibbs et al., Gene 271:13-20 (2001)]. 상기 기술은 모 유전자를 재생성하는 DNA 재편성과 같은 다른 방법의 경향을 제어하는데 사용될 수 있다. 상기 방법은 선택된 유전자 절편의 무작위 돌연변이유발(epPCR)과 조합될 수 있다. 상기 방법은 모 서열의 재구성을 차단하는 우수한 방법일 수 있다. 엔도뉴클레아제는 필요하지 않다. 제조된 절편의 투입 농도를 조정함으로써, 목적 주쇄쪽으로 편향될 수 있다. 상기 방법은 제한효소 절단없이 비관련 모체로부터 DNA 재편성을 가능케 하며 무작위 돌연변이유발 방법의 선택을 가능케 한다.
하이브리드 효소의 제조를 위한 점증적 절두(ITCHY)는 해당 유전자 또는 유전자 단편의 하나의 염기쌍 결실을 갖는 조합 라이브러리를 제공한다[Ostermeier et al., Proc Natl Acad Sci U.S.A 96:3562-3567 (1999); Ostermeier et al., Nat. Biotechnol 17:1205-1209 (1999)]. 절두는 2개의 상이한 유전자들의 일부상에 반대 방향으로 도입된다. 이들은 서로 접합되고 융합체가 클로닝된다. 상기 기술은 2개의 모 유전자사이에 상동성을 필요로 하지 않는다. ITCHY가 DNA 재편성과 조합되는 경우, 그 시스템은 SCRATCHY(하기 참조)로 불린다. 두 방법의 주요 이점은 모 유전자들간에 상동성을 필요로 하지 않는다는 것이다; 예를 들면, 이. 콜라이와 인간 유전자 사이의 기능적 융합은 ITCHY에 의해 이루어졌다. ITCHY 라이브러리가 제조되면, 모든 가능한 교차형을 포착한다.
하이브리드 효소의 제조를 위한 티오-점증적 절두(THIO-ITCHY)는 포스포티오에이트 dNTP를 이용하여 절두체를 형성하는 것을 제외하고 ITCHY와 거의 동일하다[Lutz et al., Nucleic Acids Res 29:E16 (2001)]. ITCHY에 비해, THIO-ITCHY는 최적화하기에 더 용이할 수 있고 보다 많은 재현도 및 조절능력을 제공할 수 있다.
DNA 재편성과 조합된 SCRATCHY - ITCHY는 DNA 재편성과 ITCHY의 조합이므로; 다중 교차형을 가능케 한다[Lutz et al., Proc Natl Acad Sci U.S.A. 98:11248-11253 (2001)]. SCRATCHY는 ITCHY와 DNA 재편성의 가장 우수한 특징을 결합시킨다. 컴퓨터에 의한 예상을 최적화에 사용할 수 있다. SCRATCHY는 서열 동일성이 80% 미만인 경우 DNA 재편성보다 더 효과적이다.
무작위 드리프트 돌연변이유발(RNDM)에서는 돌연변이가 epPCR 후에 이용가능한 활성을 유지하는 것에 대한 스크리닝/선택에 의해 제조된다[Bergquist et al., Biomol. Eng 22:63-72 (2005)]. 이어서, 상기 돌연변이는 다중 활성 돌연변이체 사이에 또는 활성 돌연변이체와 일부 다른 바람직한 모체 사이에 융합을 갖는 재조합체를 생성하기 위해 DOGS에 사용된다. 중립 돌연변이의 분리를 촉진하기 위해 설계되었으므로; 그 목적은 보유된 촉매 활성에 대해 상기 활성이 원래 유전자에서보다 더 높은지 낮은지를 선별하는 것이다. RNDM은 스크리닝이 배경 이상의 활성을 검출할 수 있는 경우 고속 처리량 분석에서 이용가능하다. RNDM은 다양성을 제공하는데 있어 DOGS에 프런트 엔드로 사용되었다. 상기 기술은 재편성 또는 다른 후속 단계에 앞서 활성에 대한 필요를 부과한다; 중립 드리프트 라이브러리는 보다 작은 라이브러리로부터 활성에서의 보다 높고/보다 빠른 개선을 제공하도록 지시된다. epPCR을 사용하여 공개되었지만, 이것은 다른 대규모 돌연변이유발 방법에 적용될 수 있다.
서열 포화 돌연변이유발(SeSaM)은 1) 포스포티오에티으 뉴클레오티드의 무작위 혼입 및 절단을 이용하여 무작위 길이의 단편의 풀을 생성하고; 상기 풀은 2) 이노신과 같은 "보편적" 염기의 존재하에 연장되기 위한 주형으로 사용되며; 3) 이노신-함유 보체의 복제가 무작위 염기 혼입을 제공하여 결과적으로 돌연변이유발을 일으키는 무작위 돌연변이 방법이다[Wong et al., Biotechnol J 3:74-82 (2008); Wong et al., Nucleic Acids Res 32:e26 (2004); and Wong et al., Anal. Biochem. 341:187-189 (2005)]. 상기 기술을 이용하여 간단한 방법을 사용하여 2 - 3일 이내에 돌연변이체의 거대 라이브러리를 제작하는 것이 가능할 수 있다. 이것은 DNA 폴리머라제의 돌연변이 바이어스에 비해 매우 비-방향적이다. 상기 접근방법에서의 차이가 상기 기술을 epPCR에 대해 보완적(또는 대안적)이게 한다.
합성 재편성에서는, 중복 올리고뉴클레오티드가 "표적에서의 모든 유전자 다양성"을 암호화하도록 설계되며, 재편성된 자손에 있어 매우 고도의 다양성을 가능케 한다[Ness et al., Nat. Biotechnol 20:1251-1255 (2002)]. 상기 기술에서는, 단편이 재편성되도록 설계할 수 있다. 이것은 자손의 야기되는 다양성을 증가시키는 것을 돕는다. 서열/코돈 바이어스가 보다 밀접하게 관련된 서열을 접근시키는 비율로 보다 뚜렷하게 관련된 서열 재조합을 이루도록 설계할 수 있으며, 이것은 주형 유전자를 물리적으로 가질 필요가 없다.
뉴클레오티드 교환 및 삭제 기술인 NexT는 dUTP 혼입의 조합을 이용한 후 우라실 DNA 글리코실라제 및 이어서 피페리딘으로 처리하여 종료점 DNA 단편화를 수행한다[Muller et al., Nucleic Acids Res 33:e117 (2005)]. 유전자는 교정 폴리머라제를 사용한 내부 PCR 프라이머 연장을 이용하여 재조립된다. 재편성을 위한 크기는 다양한 dUTP:dTTP 비를 사용하여 직접 조절가능하다. 이것은 우라실 혼입 및 절단에 간단한 방법을 이용하는 종료점 반응이다. 상기 방법에 8-옥소-구아닌과 같은 다른 뉴클레오티드 유사체를 사용할 수 있다. 또한, 상기 기술은 매우 짧은 단편(86 bp)을 사용하여서도 잘 작업되며 낮은 오차율을 갖는다. DNA의 화학적 절단은 비재편성 클론이 거의 없음을 의미한다.
서열 상동성-의존성 단백질 재조합(SHIPREC)에서는, 링커를 사용하여 2개의 별개/비관련 유전자간의 융합을 촉진하며; 뉴클레아제 처리를 이용하여 두 유전자 사이에 일련의 키메라를 생성한다. 결과는 상기 융합의 단일 교차 라이브러리이다[Sieber et al., Nat. Biotechnol 19:456-460 (2001)]. 이것은 제한된 유형의 재편성을 야기하며; 돌연변이유발은 별도의 공정이다. 상기 기술은 2개의 비관련 모 유전자 각각의 다양한 분획과의 키메라의 라이브러리를 제공할 수 있다. 상동성은 필요하지 않다. SHIPREC는 포유동물 CP450의 N-말단 영역에 융합된 세균 CP450의 헴-결합 영역을 가지고 시험하였으며; 상기 기술은 보다 가용성 효소에서 포유동물 활성을 야기하였다.
유전자 부위 포화 돌연변이유발(GSSM)에서, 출발 물질은 삽입물을 갖는 수퍼코일 dsDNA 플라스미드이고, 2개의 프라이머가 돌연변이에 바람직한 부위에서 변성된다[Kretz et al., Methods Enzymol. 388:3-11 (2004)]. 프라이머는 해당 돌연변이를 가지며 DNA의 대향 가닥상의 동일 서열에 어닐링된다; 프라이머와 각 측면에 접한 정확한 서열의 약 20개 뉴클레오티드의 중간에서의 돌연변이. 프라이머에서의 서열은 NNN 또는 NNK(암호화) 및 MNN(비암호화)(N = 모두 4, K = G, T, M = A, C)이다. 연장후에, DpnI를 사용하여 담(dam)-메틸화 DNA를 절단하여 야생형 주형을 제거한다. 상기 기술은 주어진 유전자좌(즉, 하나의 코돈)에서 모든 가능한 아미노산 치환을 연구한다. 상기 기술은 넌센스 코돈 및 대부분의 가능한 대립유전자의 같거나 거의 같은 표현을 갖는 한 부위에서 모든 가능한 치환의 생성을 촉진한다. 이것은 표적 효소의 구조, 메카니즘 또는 영역에 대한 사전 지식을 요하지 않는다. 재편성 또는 유전자 재조립이 이어지는 경우, 상기 기술은 단일-부위 상향-돌연변이의 모든 가능한 조합을 함유하는 재조합체의 다양한 라이브러리를 제공한다. 상기 기술 조합의 유용성은 50개 이상의 상이한 효소들의 성공적인 진화에 대해서, 및 또한 주어진 효소에서 하나보다 많은 성질에 대해 입증되었다.
조합 카세트 돌연변이유발(CCM)은 제한된 영역들을 많은 가능한 아미노산 서열 변이로 대체하기 위해 짧은 올리고뉴클레오티드 카세트의 사용을 포함한다[Reidhaar-Olson et al., Methods Enzymol. 208:564-586 (1991); and Reidhaar-Olson et al., Science 241:53-57 (1988)]. 2 또는 3번 부위에서 동시 치환이 상기 기술을 사용하여 가능하다. 또한, 상기 방법은 한정된 범위의 부위에서 매우 다양한 가능한 서열 변화를 검사한다. 상기 방법은 람다 리프레서 DNA-결합 영역의 정보 내용을 조사하는데 사용되었다.
조합 다중 카세트 돌연변이유발(CMCM)은 다음과 같이 보다 큰 프로그램의 일부로서 사용되는 것을 제외하고 본질적으로 CCM과 유사하다: 2) ID 열점 및 열 여역에 대해 1) 높은 돌연변이율에서 epPCR의 사용 및 3) 단백질 서열 공간의 한정된 영역을 포함하기 위한 CMCM에 의한 연장[Reetz et al., Angew. Chem. Int. Ed 뚜히 40(3589-3591) (2001)]. CCM의 경우에서와 같이, 상기 방법은 실질적으로 모든 가능한 변이를 표적 영역에 걸쳐 검사할 수 있다. 무작위 돌연변이 및 재편성된 유전자를 생성하기 위한 방법과 함께 사용되는 경우, 상기 방법은 다양한 재편성된 단백질을 생성하는 탁월한 수단을 제공한다. 상기 접근방법은 효소의 거울상선택성을 51배만큼 증가시키는데 성공적이었다.
돌연변이유발 균주 기술에서, 잠정적 ts 돌연변이유발 플라스미드는 선택시에 무작위 및 천연 돌연변이 빈도에서 20- 내지 4000-배의 증가를 허용하며 선택이 필요하지 않은 경우 결실 돌연변이의 축적을 차단하게 한다[Selifonova et al., Appl Envrion Microbiol 67:3645-3649 (2001)]. 상기 기술은 DNA 폴리머라제 III의 돌연변이체 서브단위를 암호화하는 플라스미드-유래 mutD5 유전자를 기초로 한다. 상기 서브단위는 외인성 DNA 폴리머라제 III에 결합하며, 플라스미드를 갖는 임의의 균주에서 폴리머라제 III의 교정 능력을 절충시킨다. 광범위한 염기 치환 및 프레임시프트 돌연변이가 일어난다. 효과적인 사용을 위해, 돌연변이유발 플라스미드는 일단 목적하는 표현형이 달성되면 제거되어야 하며; 이것은 41 ℃에서 플라스미드 큐어링(curing)을 가능케하는 온도 민감성 복제 기점을 통해 달성된다. 돌연변이유발 균주는 매우 잠시동안 탐색되었음을 주지해야 한다(예를 들면, 문헌 [Winter and coworkers, J. Mol. Biol. 260:359-3680 (1996)] 참조). 상기 기술에서, 매우 높은 자발적 돌연변이율이 관찰된다. 잠정적 특성은 바람직하지 않은 배경 돌연변이를 최소화한다. 상기 기술은 돌연변이유발율을 증대시키고 목적하는 표현형을 보다 신속히 달성하기 위해 적응 진화와 결합될 수 있다.
"룩-스루(Look-Through) 돌연변이유발(LTM)은 선택된 아미노산들의 조합 돌연변이를 평가하고 최적화하는 다차원 돌연변이유발 방법이다"[Rajpal et al., Proc Natl Acad Sci U.S.A 102:8466-8471 (2005)]. 각각의 부위를 모든 가능한 아미노산 변화로 포화시키기 보다는, 9개의 한 세트를 선택하여 아미노산 R-군 화학의 범위를 커버한다. 부위당 보다 소수의 변화가 상기 유형의 돌연변이유발에 적용될 다중 부위를 허용한다. 낮은 나노몰내지 피코몰까지의 항체에 대한 결합 친화도에서의 800배가 넘는 증가가 상기 방법을 통해 달성되었다. 상기 방법은 무작위 조합의 수를 최소화하기 위한 합리적인 접근방법이며 스크리닝될 클론의 수를 매우 감소시킴으로써 개선된 특성을 찾는 능력을 증가시켜야 한다. 상기 방법은 특히 결합친화도를 증가시키고/시키거나 분리를 감소시키기 위해 항체 공학에 적용되었다. 상기 기술은 스크리닝 또는 선택과 결합될 수 있다.
유전자 재조립은 동시에 다중 유전자에 적용되 수 있거나 또는 단일 유전자의 키메라(다중 돌연변이)의 거대 라이브러리를 제작하는데 적용될 수 있는 DNA 재편성 방법이다(전세계적으로 verenium.com/Pages/Technology/EnzymeTech/TechEnzy TGR.html 웹). 전형적으로 상기 기술은 목적하는 개선을 위해 나타낸 서열 공간을 확인하기 위한 초고속 처리량 스크리닝과 함께 사용될 수 있다. 상기 기술은 상동성과 무관하게 다중 유전자 재조합을 가능케 한다. 교차 결과물의 정확한 수 및 위치는 생물정보학적 분석을 통해 설계된 단편을 사용하여 미리-결정될 수 있다. 상기 기술은 실질적으로 모 유전자 재구성이 없이 낮은 수준의 불활성 유전자를 가지면서 매우 높은 수준의 다양성을 유도한다. GSSM과 결합되어, 많은 돌연변이를 개선된 활성에 대해 검사할 수 있다. 상기 방법은 DNA 재편성의 "블렌딩" 및 "미세 조정"을 가능케 한다, 예를 들면, 코돈 활용이 최적화될 수 있다.
인실리코(In Silico) 단백질 설계 자동화 PDA는 특별한 접힘을 갖는 구조적으로 정의된 단백질 주쇄를 고정시키고 접힘 및 전체 단백질 에너지학을 안정화시킬 수 있는 아미노산 치환을 위한 서열 공간을 탐색하는 최적화 알고리즘이다[Hayes et al., Proc Natl Acad Sci U.S.A. 99:15926-15931 (2002)]. 상기 기술은 단백질 아미노산 변이에 대한 구조적 내성을 찾기 위해 인실리코 구조-기본 엔트로피 예상을 가능케 한다. 각 위치에서 커플링 상호작용을 산출하기 위해 통계 역학을 적용한다 - 아미노산 치환에 대한 구조적 내성은 커플링의 척도이다. 궁극적으로, 상기 기술은 구조적 특성의 보전성을 유지하면서 단백질 성질의 목적하는 변형을 제공하도록 설계된다. 상기 방법은 매우 많은 수의 가능한 서열변이체(1050)의 필터링을 컴퓨터에 의해 평가하고 가능케 한다. 검사될 서열 변이체의 선택은 가장 유리한 열역학 및 표면상 유일한 안정성을 근거로 한 예상과 관련되거나 또는 안정성과 관련될 수 있는 성질은 상기 기술에 의해 효과적으로 처리될 수 있다. 상기 방법은 일부 치료용 단백질에, 특히 면역글로불린을 조작하는데 성공적으로 사용되었다. 인실리코 예상은 특별히 많은 수의 가능한 변이체를 검사하는 것을 배제시킨다. 존재하는 3차원 구조를 근거로 한 예상은 가상 구조를 근거로 한 예상보다 성공하기 더 쉽다. 상기 기술은 다중 동시 돌연변이의 표적화 스크리닝을 예상하고 가능케하나, 일부는 숫적으로 급격한 증가로 인해 순수한 실험적 기술로는 가능하지 않다.
반복 포화 돌연변이유발(ISM)은 1) 효소 개선을 위해 적당한 부위를 선택하기 위한 구조/기능에 대한 지식의 이용, 2) 스트레이타진 퀵 체인지(Stratagene QuickChange)(또는 다른 적당한 수단)을 사용하여 선택된 부위에서 포화 돌연변이유발, 3) 목적 성질을 위한 스크리닝/선택, 4) 개선된 클론(들)을 가지고 또 다른 부위에서 다시 시작하여 반복을 계속하는 것을 포함한다[Reetz et al., Nat. Protoc. 2:891-903 (2007); and Reetz et al., Angew. Chem. Int. Ed Engl. 45:7745-7751 (2006)]. 상기 방법은 주어진 위치에서 모든 가능한 치환이 스크리닝/선택을 위해 이루어짐을 확인시켜주는 입증된 방법론이다.
돌연변이유발을 위한 임의의 전술한 방법들은 단독으로 또는 임의의 조합으로 사용될 수 있다. 또한, 방향성 진화 방법의 어느 하나 또는 조합을 적응 진화 기술과 함께 사용할 수 있다.
보다 우수한 생산자를 제조하기 위해, 대사성 모델링을 이용하여 성장 조건을 최적화할 수 있다. 모델링은 또한 경로의 이용을 추가로 최적화하는 유전자 결손(gene knockout)을 설계하는데 사용될 수 있다(예를 들면, 미국 특허 공개공보 US 2002/0012939 호, US 2003/0224363 호, US 2004/0029149 호, US 2004/0072723 호, US 2003/0059792 호, US 2002/0168654 호 및 US 2004/0009466 호 및 미국 특허 제 7,127,379 호 참조). 모델링 분석은 대사를 사이클로헥사논의 보다 효과적인 생성으로 유도하는 세포 성장에 대한 효과의 확실한 예상을 가능케 한다.
목적 생성물의 생합성을 유리하게 하는 대사성 변이를 확인하고 설계하기 위한 하나의 컴퓨터적 방법은 옵트녹(OptKnock) 컴퓨터 프레임워크이다[Burgard et al., Biotechnol. Bioeng. 84:647-657 (2003)]. 옵트녹은 표적 생성물을 과잉생성하는 유전적으로 안정한 미생물을 제공하는 유전자 결실 수단을 제시하는 대사 모델링 및 시뮬레이션 프로그램이다. 특히, 상기 프레임워크는 목적하는 생화학 물질이 세포 성장의 필수 부산물이 되도록 하는 유전 조작을 제시하기 위해 미생물의 완전한 대사적 및/또는 생화학적 네트워크를 조사한다. 생화학적 생성을 전략적으로 배치된 유전자 결실 또는 다른 기능성 유전자 파괴를 통해 세포 성장과 연결시킴으로써, 생물반응기에서 장시간 후에 조작처리된 균주상에 부과된 성장 선택 압력이 강제적 성장-연결된 생화학 생성의 결과로서 성능의 개선을 유도한다. 최종적으로, 유전자 결실이 구성되는 경우, 옵트녹에 의해 선택된 유전자가 게놈으로부터 완전히 제거되기 때문에, 설계된 균주가 그의 야생형 상태로 되돌아갈 무시할 정도의 가능성이 존재한다. 그러므로, 상기 컴퓨터에 의한 방법은 목적 생성물의 생합성을 유도하는 대안적 경로를 확인하기 위해 사용되거나, 또는 목적 생성물의 생합성의 추가의 최적화를 위해 비-천연 미생물 유기체와 관련되어 사용될 수 있다.
간략하게, 옵트녹은 세포 대사를 모델링하기 위한 컴퓨터적 방법 및 시스템을 말하기 위해 본원에 사용된 용어이다. 옵트녹 프로그램은 특정 제한을 플럭스 밸런스 분석(FBA) 모델내에 혼입시키는 모델 및 방법의 프레임워크에 관한 것이다. 상기 제한은, 예를 들면, 정성적 동역학적 정보, 정량적 조절 정보 및/또는 DNA 미세배열 실험 데이터를 포함한다. 옵트녹은 또한, 예를 들면, 블럭스 밸런스 모델을 통해 유도된 플럭스 경계를 강화하고 이어서 유전자 부가 또는 결실의 존재하에 대사 네트워크의 성능 한계를 조사함으로써 다양한 대사 문제에 대한 해결책을 추정한다. 옵트녹 컴퓨터적 프레임워크는 대사 네트워크의 성능 한계의 효과적 확인을 가능케하고 야기된 혼성-완전한 선형 프로그램 문제를 해결하기 위한 방법을 제공하는 모델 공식의 구성을 가능하게 한다. 본원에서 옵트녹으로 언급된 대사 모델링 및 시뮬레이션 방법은, 예를 들면, 2002년 1월 10일자로 출원된 미국 공개공보 제 2002/0168654 호, 2002년 1월 10일자로 출원된 국제 특허 PCT/US02/00660 호 및 2007년 8월 10일자로 출원된 미국 공개공보 제 2009/0047719 호에 기술되어 있다.
생성물의 생합성적 생성을 유리하게 하는 대사성 변이를 확인하고 설계하기 위한 또 다른 컴퓨터적 방법은 심페니(SimPheny, 등록상표)로 지칭되는 대사 모델링 및 시뮬레이션 시스템이다. 상기 컴퓨터적 방법 및 시스템은, 예를 들면, 2002년 1월 14일자로 출원된 미국 공개공보 제 2003/0233218 호 및 2003년 1월 13일자로 출원된 국제 특허출원 PCT/US03/18838 호에 기술되어 있다. 심페니(등록상표)는 네트워크 모델을 인실리코로 제작하고, 시스템내 화학 반응의 임의의 및 모든 가능한 작용성을 포함하는 해결 공간을 정의하기 위한 생물학적 시스템의 화학 반응을 통한 질량, 에너지 또는 전하의 플럭스를 시뮬레이션함으로써 생물학적 시스템에 일련의 허용된 활성을 측정하기 위해 사용되 수 있는 컴퓨터 시스템이다. 해결 공간이 포함된 반응의 알고 있는 화학량론 뿐 아니라 반응 전체에 걸친 최대 플럭스와 관련된 반응 열역학 및 용량 제한과 같은 제한에 의해 정의되기 때문에 상기 접근방법은 제한-기초 모델링으로 언급된다. 상기 제한에 의해 정의된 공간은 생물학적 시스템 또는 그의 생화학적 성분의 표현형 능력 및 양태를 결정하기 위해 조사될 수 있다.
상기 컴퓨터적 접근방법은, 생물학적 시스템이 유연하고 많은 상이한 벙법으로 동일한 결과에 이를 수 있기 때문에 생물학적 사실과 양립된다. 생물학적 시스템은 모든 살아있는 시스템이 직면해야 하는 근본적 제한에 의해 제한된 진화적 메카니즘을 통해 설계된다. 그러므로, 제한-기초 모델링 방법은 이러한 일반적인 사실을 포함한다. 또한, 제한의 강화를 통해 네트워크 모델에 추가의 제한을 계속적으로 부과하는 능력은 해결 공간의 크기의 감소를 야기함으로써, 그에 의해 생리학적 성능 또는 표현형이 예상될 수 있는 정확성이 향상된다.
본원에 제공된 교지내용 및 지침에 따라서, 당해 분야에 숙련된 자는 숙주 미생물 유기체에서 목적 화합물의 생합성을 설계하고 실행하기 위한 대사 모델링 및 시뮬레이션을 위한 다양한 컴퓨터 프레임워크를 적용할 수 있을 것이다. 상기 대사 모델링 및 시뮬레이션 방법은, 예를 들면, 상기에서 심페니(등록상표) 및 옵트녹으로 예시된 컴퓨터 시스템을 포함한다. 본 발명의 예시를 위해, 일부 방법을 모델링 및 시뮬레이션을 위한 옵트녹 컴퓨터 프레임워크와 관련하여 본원에 기술하였다. 당해 분야에 숙련된 자라면 당해 분야에 공지된 임의의 상기 다른 대사 모델링 및 시뮬레이션 컴퓨터 프레임워크 및 방법에 옵트녹을 사용하여 대사 변이의 확인, 설계 및 실행을 적용하는 방법을 인지할 것이다.
전술한 방법은 파괴될 한 세트의 대사 반응을 제공할 것이다. 상기 세트내의 각 반응의 제거 또는 대사성 변형은 유기체의 성장 단계동안 필수 생성물로서 목적 생성물을 제공할 수 있다. 반응들은 공지되어 있기 때문에, 이중 옵트녹 문제에 대한 해결은 또한 상기 반응들의 세트내의 각 반응을 촉진하는 하나 이상의 효소를 암호화하는 관련 유전자 또는 유전자들을 제공할 것이다. 한 세트의 반응 및 각 반응에 관여하는 효소를 암호화하는 그의 상응하는 유전자들의 확인은 일반적으로 효소와 암호화 유전자 사이의 관계를 갖는 반응 데이터베이스와 반응의 상호관계를 통해 수행된 달성된 자동화 공정이다.
일단 확인되면, 목적 생성물의 생성을 달성하기 위해 파괴되어야 하는 반응 세트는 그 세트 내의 각 대사 반응을 암호화하는 하나 이상의 유전자의 기능적 파괴에 의해 표적 세포 또는 유기체에서 실행된다. 반응 세트의 기증적 파괴를 달성하기 위한 특히 유용한 한가지 수단은 각 암호화 유전자의 결실에 의한 것이다. 그러나, 일부 경우에서, 예를 들면, 프로모터 또는 조절 인자를 위한 시스 결합 부위와 같은 조절 여역의 돌연변이, 결실을 포함하여 기타 유전자 이상에 의해, 또는 많은 위치중 임의 위치에서 암호화 서열의 절두에 의해 반응을 파괴하는 것이 유리할 수 있다. 유전자 세트의 전체보다 적은 결실을 야기하는 상기 후자의 이상은, 예를 들면, 생성물의 커플링의 신속한 평가가 바람직한 경우 또는 유전자 복귀가 일어날 가능성이 적은 경우에 유용할 수 있다.
파괴될 반응의 추가 세트, 또는 목적 생성물의 성장-연결된 생합성을 포함하여 생합성을 야기할 수 있는 대사성 변형을 초래하는 전술한 이중 옵트녹 문제에 대한 추가의 생산적 해결책을 확인하기 위해, 정수 삭제로 지칭되는 최적화 방법이 실행될 수 있다. 상기 방법은 각 반복시 정수 삭제로 지칭되는 추가 제한의 혼입에 의해 상기 예시된 옵트녹 문제를 반복적으로 해결함으로써 진행된다. 정수 삭제 제한은 해결 절차가 필수적으로 생성물 생합성을 성장과 연결시키는 임의의 사전 반복에서 확인된 반응의 정확히 동일한 세트를 선택하는 것을 효과적으로 방지한다. 예를 들면, 이전에 확인된 성장-연결된 대사 변형이 파괴를 위한 반응 1, 2 및 3을 명시한 경우, 하기의 제한이 후속 해결책에서 동일 반응이 동시에 고려되는 것을 방지한다. 정수 삭제 방법은 당해 분야에 공지되어 있으며, 예를 들면, 문헌 [Burgard et al., Biotechnol. Prog. 17:791-797 (2001)]에서 찾을 수 있다. 대사 모델링 및 시뮬레이션을 위한 옵트녹 컴퓨터 프레임워크와 함께 그의 사용과 관련하여 본원에 기술된 모든 방법들의 경우에서와 같이, 반복 컴퓨터 분석에서 불필요한 중복을 감소시키는 정수 삭제 방법은, 예를 들면, 심페니(등록상표)를 포함하여 당해 분야에 공지된 다른 컴퓨터 프레임워크와 함께 적용될 수 있다.
본원에 예시된 방법들은 표적 생화학 생성물의 생성과 확인된 유전자 변이를 갖도록 조작처리된 세포 또는 유기체의 성장의 필수 연결을 포함하여, 생합성적으로 목적 생성물을 생성하는 세포 및 유기체의 제조를 가능케 한다. 그러므로, 본원에 기술된 컴퓨터적 방법은 옵트녹 도는 심페니(등록상표)로부터 선택된 인실리코 방법에 의해 확인되는 대사 변형의 확인 및 실행을 가능케 한다. 대사성 변형의 세트는, 예를 들면, 하나 이상의 생합성 경로 효소의 부가 및/또는, 예를 들면, 유전자 결실에 의한 파괴를 포함하여 하나 이상의 대사 반응의 기능적 파괴를 포함할 수 있다.
상기에서 논의한 바와 같이, 옵트녹 방법은 돌연변이 미생물 네트워크가 장기간의 성장 선택에 적용되는 경우 그의 컴퓨터에 의해 예상된 최대-성장 표현형쪽으로 진화될 수 있다는 전제상에서 발전되었다. 즉, 상기 접근방법은 선택 압력하에서 자가-최적화되는 유기체의 능력에 영향을 준다. 옵트녹 프레임워크는 네트워크 화학량론을 기준으로 생합성 생성과 세포 성장 사이를 연결시키는 유전자 결실 조합의 철저한 열거를 가능하게 한다. 최적 유전자/반응 결손의 확인은 야기된 네트워크에 대한 최적 성장 해결책이 해당 생화학물질을 과잉생성하도록 활성 반응의 세트를 선택하는 이중 최적화 문제의 해결을 요한다.
이. 콜라이 대사의 인실리코 화학량론적 모델은, 앞에서 예시되고, 예를 들면, 미국 특허 공개공보 US 2002/0012939 호, US 2003/0224363 호, US 2004/0029149 호, US 2004/0072723 호, US 2003/0059792 호, US 2002/0168654 호 및 US 2004/0009466 호, 및 미국 특허 제 7,127,379 호에 기술된 바와 같은 대사 경로를 위한 필수 유전자를 확인하기 위해 사용될 수 있다. 본원에 개시된 바와 같이, 옵트녹 수학적 프레임워크는 목적 생성물의 성장-연결 생성을 초래하는 유전자 결실을 정확히 찾아내기 위해 적용될 수 있다. 또한, 이중 옵트녹 문제의 해결은 한 세트의 결실만을 제공한다. 모든 의미있는 해결, 즉, 성장-연결된 생성물 생성을 초래하는 결손, 최적화 기술, 언급된 정수 삭제의 모든 세트를 실행할 수 있다. 이것은 상기에서 논의한 바와 같이 각각의 반복시 정수 삭제로서 지칭된 추가 제한의 혼입에 의해 옵트녹 문제를 반복적으로 해결하는 것을 포함한다.
실시예 I
피멜로일-CoA 경로를 갖는 사이클로헥사논 생성 미생물 유기체의 제조
본 실시예는 도 1에 나타낸 바와 같이, 피멜로일-CoA로부터 사이클로헥사논을 생성할 수 있는 미생물 유기체의 제조를 기술한다.
에스케리키아 콜라이를 도 1에 나타낸 바와 같이 피멜로일-CoA로부터 사이클로헥사논-생성 경로를 조작처리하기 위한 표적 유기체로서 사용한다. 이. 콜라이는 사이클로헥사논을 생성할 수 있는 비-천연 미생물을 제조하기 위한 우수한 숙주를 제공한다. 이. 콜라이는 유전적 조작에 잘 순응하며, 혐기성 또는 미세호기성 조건하에서 에탄올, 아세트산, 폼산, 락트산 및 숙신산과 같은 다양한 생성물을 효과적으로 생성할 수 있는 것으로 알려져 있다. 또한, 피멜로일-CoA는 천연에서 이. 콜라이에서 비오틴 생합성의 중간체로서 생성된다.
피멜로일-CoA로부터 사이클로헥사논을 생성하도록 조작처리된 이. 콜라이 균주를 생성하기 위해, 전술한, 도 1의 경로에 사용된 효소를 암호화하는 핵산을 공지된 분자 생물학 기술을 사용하여 이. 콜라이에서 발현시킨다(예를 들면, 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, Third Ed., Cold Spring Harbor Laboratory, New York (2001); Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, MD (1999); Roberts et al., Arch. Microbiol. 117:99-108 (1989)] 참조). 특히, 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 2-케토사이클로헥산-1-카복실레이트 데카복실라제, 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제 및 포스포엔올피루베이트 카복시키나제를 각각 암호화하는 syn_01653(YP_463074.1), adc(NP_149328.1), pcaIJ(Q01103.2 및 P0A102.2), 및 pckA(P43923.1) 유전자를 PA1/lacO 프로모터의 조절하에서 pZE13 벡터(익스프레시스(Expressys), 독일 루엘츠하임) 내에 클로닝시킨다. 이어서, 상기 플라스미드를, 이소프로필-베타-D-1-티오갈락토피라노시드(IPTG)의 첨가에 의해 유도성 발현을 가능하게 하는 lacIQ를 함유하는 숙주 균주내에 형질전환시킨다.
생성된 유전자 조작된 유기체를 당해 분야에 공지된 절차에 따라서 글루코스 함유 배지에서 배양한다(예를 들면, 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, Third Ed., Cold Spring Harbor Laboratory, New York (2001)] 참조). 사이클로헥사논 경로 유전자의 발현은, 예를 들면, 노던 블롯, mRNA의 PCR 증폭 및 면역블롯팅을 포함하여, 폴리펩티드 발현 또는 효소 활성을 측정하기 위한 당해 분야에 공지된 방법을 이용하여 확인할 수 있다. 발현된 효소의 효소 활성은 개별적으로 활성에 특이적인 분석을 이용하여 확인한다. 사이클로헥사논을 생성하는 조작처리된 이. 콜라이 균주의 능력은 HPLC, 가스 크로마토그래피-질량 분광분석(GCMS) 또는 액체 크로마토그래피-질량 분광분석(LCMS)을 사용하여 확인한다.
기능적 사이클로헥사논 합성 경로를 갖도록 조작처리된 미생물 균주는 또한 경로의 효과적 사용을 위한 최적화에 의해 증대된다. 간략하게, 조작처리된 균주는 임의의 외인성 유전자가 속도 제한 수준으로 발현되는지 여부를 측정하기 위해 평가된다. 발현은, 예를 들면, 추가 유전자 복사체 수의 도입에 의해 경로 전체에 걸쳐 플럭스를 제한할 수 있는 낮은 수준으로 발현된 임의의 효소에 대해 증가된다. 사이클로헥사논 전구체 피멜로일-CoA의 생성을 개선하기 위해 피멜로일-CoA 합성의 초기 단계에 포함되는 천연 유전자의 돌연변이유발, 클로닝 및/또는 과발현과 같은 방법을 적용한다.
보다 우수한 생산자를 제조하기 위해, 대사 모델링을 이용하여 성장 조건을 최적화한다. 모델링은 또한 경로의 활용을 추가로 최적화시키는 유전자 결손을 설계하는데에도 사용된다(예를 들면, 미국 특허 공개공보 US 2002/0012939 호, US 2003/0224363 호, US 2004/0029149 호, US 2004/0072723 호, US 2003/0059792 호, US 2002/0168654 호 및 US 2004/0009466 호 및 미국 특허 제 7,127,379 호 참조). 모델링 분석은 대사를 사이클로헥사논의 보다 효과적인 생성으로 유도하는 세포 성장에 대한 효과의 확실한 예상을 가능케 한다. 한 모델링 방법은 이중 최적화 접근방법인 옵트녹[Burgard et al., Biotechnol. Bioengineer. 84:647-657 (2003)]으로, 이것은 총괄적으로 사이클로헥사논의 보다 우수한 생성을 야기하는 유전자 결손을 선택하기 위해 적용된다. 적응 진화도 또한, 예를 들면, 피멜로일-CoA 중간체 또는 사이클로헥사논 생성물의 보다 우수한 생산자를 제조하기 위해 사용될 수 있다. 적응 진화는 성장 및 생성 특성 둘 다를 개선하기 위해 수행된다[Fong and Palsson, Nat. Genet. 36:1056-1058 (2004); Alper et al., Science 314:1565-1568 (2006)]. 결과를 기준으로, 모델링, 유전 공학 및 적응 진화의 후속 과정을 사이클로헥사논 생산자에 적용하여 생성을 더 증가시킬 수 있다.
사이클로헥사논의 대규모 생성을 위해, 상기 사이클로헥사논 경로-함유 유기체를 혐기성 조건하에서 유기체의 성장을 촉진하는, 당해 분야에 공지된 배지를 사용하여 발효조에서 배양한다. 발효는 배치식, 유가식 또는 연속식으로 수행한다. 혐기성 조건은 먼저 배지를 질소로 스파징한 후 배양 용기를 밀폐(예를 들면, 플라스크를 격막 및 크림프-캡으로 밀폐할 수 있다)함으로써 유지된다. 제한된 통기를 위해 작은 구멍을 제공함으로써 미세호기성 조건도 또한 이용할 수 있다. 배지의 pH는 H2SO4와 같은 산을 첨가하여 7의 pH에서 유지시킨다. 성장률은 분광광도계(600 nm)를 사용하여 광학 밀도를 측정함으로써 측정하고, 글루코스 흡수율은 시간경과에 따른 탄소 공급원 고갈을 모니터함으로써 측정한다. 바람직하지 않은 알콜, 유기산 및 잔류 글루코스와 같은 부산물은, 글루코스 및 알콜용 굴절률 검출기 및 유기산용 UV 검출기를 사용하여, HPX-087 컬럼(바이오래드)을 갖는 HPLC(시마주)에 의해 정량화할 수 있다[Lin et al., Biotechnol. Bioeng., 775-779 (2005)].
실시예 II
피멜로일-CoA를 거쳐 아세토아세틸-CoA로부터 사이클로헥사논이 유도되는
사이클로헥사논 생성 미생물 유기체의 제조
본 실시예는 도 2에 나타낸, 아세토아세틸-CoA로부터 증대된 수준의 사이클로헥사논 전구체 피멜로일-CoA를 생성하도록 조작처리된 미생물 유기체의 제조를 기술한다. 상기 조작처리된 균주는 이어서 숙주 미생물로 사용되고 도 1의 경로를 거쳐 피멜로일-CoA로부터 사이클로헥사논을 생성하기 위한 효소 또는 단백질을 발현하도록 더 조작처리된다.
에스케리키아 콜라이를 도 1에 나타낸 바와 같은 사이클로헥사논-생성 경로를 조작처리하기 위한 표적 유기체로서 사용한다. 이. 콜라이는 사이클로헥사논을 생성할 수 있는 비-천연 미생물을 제조하기 위한 우수한 숙주를 제공한다. 이. 콜라이는 유전적 조작에 잘 순응하며, 혐기성 또는 미세호기성 조건하에서 에탄올, 아세트산, 폼산, 락트산 및 숙신산과 같은 다양한 생성물을 효과적으로 생성할 수 있는 것으로 알려져 있다.
사이클로헥사논을 생성하도록 조작처리된 이. 콜라이 균주를 생성하기 위해, 전술한, 도 1 및 도 2의 경로에 사용된 효소를 암호화하는 핵산을 공지된 분자 생물학 기술을 사용하여 이. 콜라이에서 발현시킨다(예를 들면, 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, Third Ed., Cold Spring Harbor Laboratory, New York (2001); Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, MD (1999); Roberts et al., Arch. Microbiol. 117:99-108 (1989)] 참조).
특히, 이. 콜라이 균주는 도 2에 개략된 경로에 의해 아세토아세틸-CoA로부터 피멜로일-CoA를 생성하도록 조작처리된다. 경로 구성의 제 1 단계로, 아세토아세틸-CoA를 피멜로일-CoA로 전환시키기 위한(도 2) 효소를 암호화하는 유전자를 벡터상에 조립한다. 특히, 포스포엔올피루베이트 카복시키나제, 아세토아세틸-CoA 리덕타제, 3-하이드록시부티릴-CoA 데하이드라타제, 글루타릴-CoA 데하이드로게나제 및 글루타릴-CoA 데하이드로게나제의 동종 전사 조절자를 각각 암호화하는 유전자 pckA(P43923.1), phbB(P23238), crt(NP_349318.1), gcdH(ABM69268.1) 및 gcdR(ABM69269.1)을 PA1/lacO 프로모터의 조절하에 pZE13 벡터(익스프레시스, 독일 루엘츠하임) 내에 클로닝한다. 옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제, 3-하이드록시피멜로일-CoA 데하이드로게나제, 3-하이드록시피멜로일-CoA 데하이드라타제 및 피멜로일-CoA 데하이드로게나제를 각각 암호화하는 유전자 syn_02642(YP_462685.1), hbd(NP_349314.1), syn_01309(YP_461962) 및 syn_23587(ABC76101)을 PA1/lacO 프로모터의 조절하에 pZA33 벡터(익스프레시스, 독일 루엘츠하임) 내에 클로닝한다. 또한, 전자 전달 플라빈단백질의 알파 및 베타 서브단위를 암호화하는 syn_02637(ABC78522.1) 및 syn_02636(ABC78523.1) 유전자를 PA1/lacO 프로모터의 조절하에 세번째 상용가능한 플라스미드, pZS23 내에 클로닝한다. pZS23은 pZS13 벡터(익스프레시스, 독일 루엘츠하임)의 암피실린 내성 모듈을 공지된 분자 생물학 기술에 의해 카나마이신 내성 모듈로 대체시킴으로써 수득된다. 세 세트의 플라스미드들을 이. 콜라이 균주 MG1655 내에 형질전환시켜 아세토아세틸-CoA로부터의 피멜로일-CoA 합성에 필요한 단백질 및 효소를 발현시킨다.
생성된 유전자 조작된 유기체를 당해 분야에 공지된 절차에 따라서 글루코스 함유 배지에서 배양한다(예를 들면, 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, Third Ed., Cold Spring Harbor Laboratory, New York (2001)] 참조). 피멜로일-CoA 경로 유전자의 발현은, 예를 들면, 노던 블롯, mRNA의 PCR 증폭 및 면역블롯팅을 포함하여, 폴리펩티드 발현 또는 효소 활성을 측정하기 위한 당해 분야에 공지된 방법을 이용하여 확인할 수 있다. 발현된 효소의 효소 활성은 개별적으로 활성에 특이적인 분석을 이용하여 확인한다. 상기 경로를 통해 피멜로일-CoA를 생성하는 조작처리된 이. 콜라이 균주의 능력은 HPLC, 가스 크로마토그래피-질량 분광분석(GCMS) 또는 액체 크로마토그래피-질량 분광분석(LCMS)을 사용하여 확인한다.
아세토아세틸-CoA로부터 기능적 피멜로일-CoA 합성 경로를 갖도록 조작처리된 미생물 균주는 또한 경로의 효과적 사용을 위한 최적화에 의해 증대된다. 간략하게, 조작처리된 균주는 임의의 외인성 유전자가 속도 제한 수준으로 발현되는지 여부를 측정하기 위해 평가된다. 발현은, 예를 들면, 추가 유전자 복사체 수의 도입에 의해 경로 전체에 걸쳐 플럭스를 제한할 수 있는 낮은 수준으로 발현된 임의의 효소에 대해 증가된다.
외인성 효소의 활성에 의해 증대된 피멜로일-CoA 생성이 성공적으로 나타난 후, 이들 효소를 암호화하는 유전자를 당해 분야에 공지된 방법을 이용하여 야생형 이. 콜라이 숙주의 염색체 내에 삽입한다. 상기 방법은, 예를 들면, 순차적 단일 교차[Gay et al., J. Bacteriol. 153:1424-1431 (1983)] 및 진브릿지(GeneBridges)로부터의 Red/ET 방법[Zhang et al., Improved RecT or RecET cloning and subcloning method (2001)]을 포함한다. 염색체 삽입은 보다 큰 안정성 및 경로 유전자의 발현을 공존시키는 능력을 포함하여, 플라스미드-기본 시스템에 비해 여러 이점을 제공한다.
피멜로일-CoA-과잉생성 숙주 균주는 사이클로헥사논을 생성하도록 더 조작처리된다. 사이클로헥사논-생성 균주를 제조하기 위해, 전술한, 도 1의 경로에 사용된 효소를 암호화하는 핵산을 공지된 분자 생물학 기술을 사용하여 숙주에서 발현시킨다(예를 들면, 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, Third Ed., Cold Spring Harbor Laboratory, New York (2001); Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, MD (1999); Roberts et al., Arch. Microbiol. 117:99-108 (1989)] 참조).
특히, 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 2-케토사이클로헥산-1-카복실레이트 데카복실라제 및 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제를 각각 암호화하는 syn_01653(YP_463074.1), adc(NP_149328.1), pcaIJ(Q01103.2 및 P0A102.2) 유전자를 PA1/lacO 프로모터의 조절하에서 pZE13 벡터(익스프레시스, 독일 루엘츠하임) 내에 클로닝시킨다. 이어서, 상기 플라스미드를, 이소프로필-베타-D-1-티오갈락토피라노시드(IPTG)의 첨가에 의해 유도성 발현을 가능하게 하는 lacIQ를 함유하는 숙주 균주내에 형질전환시킨다.
생성된 유전자 조작된 유기체를 당해 분야에 공지된 절차에 따라서 글루코스 함유 배지에서 배양한다(예를 들면, 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, Third Ed., Cold Spring Harbor Laboratory, New York (2001)] 참조). 사이클로헥사논 경로 유전자의 발현은, 예를 들면, 노던 블롯, mRNA의 PCR 증폭 및 면역블롯팅을 포함하여, 폴리펩티드 발현 또는 효소 활성을 측정하기 위한 당해 분야에 공지된 방법을 이용하여 확인할 수 있다. 발현된 효소의 효소 활성은 개별적으로 활성에 특이적인 분석을 이용하여 확인한다. 사이클로헥사논을 생성하는 조작처리된 이. 콜라이 균주의 능력은 HPLC, 가스 크로마토그래피-질량 분광분석(GCMS) 또는 액체 크로마토그래피-질량 분광분석(LCMS)을 사용하여 확인한다.
기능적 사이클로헥사논 합성 경로를 갖도록 조작처리된 미생물 균주는 또한 경로의 효과적 사용을 위한 최적화에 의해 증대된다. 간략하게, 조작처리된 균주는 임의의 외인성 유전자가 속도 제한 수준으로 발현되는지 여부를 측정하기 위해 평가된다. 발현은, 예를 들면, 추가 유전자 복사체 수의 도입에 의해 경로 전체에 걸쳐 플럭스를 제한할 수 있는 낮은 수준으로 발현된 임의의 효소에 대해 증가된다.
보다 우수한 생산자를 제조하기 위해, 대사 모델링을 이용하여 성장 조건을 최적화한다. 모델링은 또한 경로의 활용을 추가로 최적화시키는 유전자 결손을 설계하는데에도 사용된다(예를 들면, 미국 특허 공개공보 US 2002/0012939 호, US 2003/0224363 호, US 2004/0029149 호, US 2004/0072723 호, US 2003/0059792 호, US 2002/0168654 호 및 US 2004/0009466 호 및 미국 특허 제 7,127,379 호 참조). 모델링 분석은 대사를 사이클로헥사논의 보다 효과적인 생성으로 유도하는 세포 성장에 대한 효과의 확실한 예상을 가능케 한다. 한 모델링 방법은 이중 최적화 접근방법인 옵트녹[Burgard et al., Biotechnol. Bioengineer. 84:647-657 (2003)]으로, 이것은 총괄적으로 사이클로헥사논의 보다 우수한 생성을 야기하는 유전자 결손을 선택하기 위해 적용된다. 적응 진화도 또한, 예를 들면, 피멜로일-CoA 중간체 또는 사이클로헥사논 생성물의 보다 우수한 생산자를 제조하기 위해 사용될 수 있다. 적응 진화는 성장 및 생성 특성 둘 다를 개선하기 위해 수행된다[Fong and Palsson, Nat. Genet. 36:1056-1058 (2004); Alper et al., Science 314:1565-1568 (2006)]. 결과를 기준으로, 모델링, 유전 공학 및 적응 진화의 후속 과정을 사이클로헥사논 생산자에 적용하여 생성을 더 증가시킬 수 있다.
사이클로헥사논의 대규모 생성을 위해, 상기 사이클로헥사논 경로-함유 유기체를 혐기성 조건하에서 유기체의 성장을 촉진하는, 당해 분야에 공지된 배지를 사용하여 발효조에서 배양한다. 발효는 배치식, 유가식 또는 연속식으로 수행한다. 혐기성 조건은 먼저 배지를 질소로 스파징한 후 배양 용기를 밀폐(예를 들면, 플라스크를 격막 및 크림프-캡으로 밀폐할 수 있다)함으로써 유지된다. 제한된 통기를 위해 작은 구멍을 제공함으로써 미세호기성 조건도 또한 이용할 수 있다. 배지의 pH는 H2SO4와 같은 산을 첨가하여 7의 pH에서 유지시킨다. 성장률은 분광광도계(600 nm)를 사용하여 광학 밀도를 측정함으로써 결정하고, 글루코스 흡수율은 시간경과에 따른 탄소 공급원 고갈을 모니터함으로써 측정한다. 바람직하지 않은 알콜, 유기산 및 잔류 글루코스와 같은 부산물은, 글루코스 및 알콜용 굴절률 검출기 및 유기산용 UV 검출기를 사용하여, HPX-087 컬럼(바이오래드)을 갖는 HPLC(시마주)에 의해 정량화할 수 있다[Lin et al., Biotechnol. Bioeng., 775-779 (2005)].
실시예 III
사이클로헥사논이 아세토아세틸-CoA로부터 유도되고 3-하이드록시피멜로일-CoA가 경로 중간체인 사이클로헥사논 생성 미생물 유기체의 제조
본 실시예는 중간체로서 3-하이드록시피멜레이트를 거쳐 아세토아세틸-CoA로부터 사이클로헥사논을 생성하도록 조작처리된 미생물 유기체의 제조를 기술한다. 하이드록시피멜레이트는 도 2(단계 1 내지 5)에 나타낸 바와 같이, 아세토아세틸-CoA로부터 5개 효소적 단계로 생성된다. 이어서, 사이클로헥사논이 도 3의 경로(단계 1, 5, 6 및 7)에 나태난 바와 같이 3-하이드록시피멜레이트로부터 생성된다.
에스케리키아 콜라이를 도 2 및 3에 나타낸 바와 같은 사이클로헥사논-생성 경로를 조작처리하기 위한 표적 유기체로서 사용한다. 이. 콜라이는 사이클로헥사논을 생성할 수 있는 비-천연 미생물을 제조하기 위한 우수한 숙주를 제공한다. 이. 콜라이는 유전적 조작에 잘 순응하며, 혐기성 또는 미세호기성 조건하에서 에탄올, 아세트산, 폼산, 락트산 및 숙신산과 같은 다양한 생성물을 효과적으로 생성할 수 있는 것으로 알려져 있다.
사이클로헥사논을 생성하도록 조작처리된 이. 콜라이 균주를 생성하기 위해, 전술한, 도 2(단계 1 내지 5) 및 도 3(단계 1, 5, 6 및 7)의 경로에 사용된 효소를 암호화하는 핵산을 공지된 분자 생물학 기술을 사용하여 이. 콜라이에서 발현시킨다(예를 들면, 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, Third Ed., Cold Spring Harbor Laboratory, New York (2001); Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, MD (1999); Roberts et al., Arch. Microbiol. 117:99-108 (1989)] 참조).
3-하이드록시피멜로일-CoA를 거쳐 아세토아세틸-CoA로부터 사이클로헥사논을 생성하기 위한 이. 콜라이 균주를 제조하기 위해, 아세토아세틸-CoA를 3-하이드록시피멜로일-CoA로(도 2) 및 3-하이드록시피멜로일-CoA를 사이클로헥사논으로(도 3) 전환시키기 위한 효소를 암호화하는 유전자를 벡터상에 조립한다. 특히, 포스포엔올피루베이트 카복시키나제, 아세토아세틸-CoA 리덕타제, 3-하이드록시부티릴-CoA 데하이드라타제, 글루타릴-CoA 데하이드로게나제 및 글루타릴-CoA 데하이드로게나제의 동종 전사 조절자를 각각 암호화하는 유전자 pckA(P43923.1), phbB(P23238), crt(NP_349318.1), gcdH(ABM69268.1) 및 gcdR(ABM69269.1) 유전자를 PA1/lacO 프로모터의 조절하에 pZE13 벡터(익스프레시스, 독일 루엘츠하임) 내에 클로닝한다. 옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제, 3-하이드록시피멜로일-CoA 데하이드로게나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C 결합에 작용) 및 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제를 각각 암호화하는 유전자 syn_02642(YP_462685.1), hbd(NP_349314.1), bamA(YP_463073.1) 및 pcaIJ(Q01103.2 및P0A102.2)를 PA1/lacO 프로모터의 조절하에 pZA33 벡터(익스프레시스, 독일 루엘츠하임) 내에 클로닝한다. 또한, 6-케토사이클로헥스-1-엔-1-카복실-CoA 리덕타제 및 2-케토사이클로헥산-1-카복실레이트 데카복실라제를 각각 암호화하는 유전자 acad1(AAC48316.1), acad(AAA16096.1) 및 adc(NP_149328.1)을 PA1/lacO 프로모터의 조절하에 세번째 상용가능한 플라스미드, pZS23 내에 클로닝한다. pZS23은 pZS13 벡터(익스프레시스, 독일 루엘츠하임)의 암피실린 내성 모듈을 공지된 분자 생물학 기술에 의해 카나마이신 내성 모듈로 대체시킴으로써 수득된다. 세 세트의 플라스미드들을 이. 콜라이 균주 MG1655 내에 형질전환시켜 아세토아세틸-CoA로부터의 사이클로헥사논 합성에 필요한 단백질 및 효소를 발현시킨다.
생성된 유전자 조작된 유기체를 당해 분야에 공지된 절차에 따라서 글루코스 함유 배지에서 배양한다(예를 들면, 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, Third Ed., Cold Spring Harbor Laboratory, New York (2001)] 참조). 사이클로헥사논 경로 유전자의 발현은, 예를 들면, 노던 블롯, mRNA의 PCR 증폭 및 면역블롯팅을 포함하여, 폴리펩티드 발현 또는 효소 활성을 측정하기 위한 당해 분야에 공지된 방법을 이용하여 확인할 수 있다. 발현된 효소의 효소 활성은 개별적으로 활성에 특이적인 분석을 이용하여 확인한다. 사이클로헥사논을 생성하는 조작처리된 이. 콜라이 균주의 능력은 HPLC, 가스 크로마토그래피-질량 분광분석(GCMS) 또는 액체 크로마토그래피-질량 분광분석(LCMS)을 사용하여 확인한다.
기능적 사이클로헥사논 합성 경로를 갖도록 조작처리된 미생물 균주는 또한 경로의 효과적 사용을 위한 최적화에 의해 증대된다. 간략하게, 조작처리된 균주는 임의의 외인성 유전자가 속도 제한 수준으로 발현되는지 여부를 측정하기 위해 평가된다. 발현은, 예를 들면, 추가 유전자 복사체 수의 도입에 의해 경로 전체에 걸쳐 플럭스를 제한할 수 있는 낮은 수준으로 발현된 임의의 효소에 대해 증가된다.
보다 우수한 생산자를 제조하기 위해, 대사 모델링을 이용하여 성장 조건을 최적화한다. 모델링은 또한 경로의 활용을 추가로 최적화시키는 유전자 결손을 설계하는데에도 사용된다(예를 들면, 미국 특허 공개공보 US 2002/0012939 호, US 2003/0224363 호, US 2004/0029149 호, US 2004/0072723 호, US 2003/0059792 호, US 2002/0168654 호 및 US 2004/0009466 호 및 미국 특허 제 7,127,379 호 참조). 모델링 분석은 대사를 사이클로헥사논의 보다 효과적인 생성으로 유도하는 세포 성장에 대한 효과의 확실한 예상을 가능케 한다. 한 모델링 방법은 이중 최적화 접근방법인 옵트녹[Burgard et al., Biotechnol. Bioengineer. 84:647-657 (2003)]으로, 이것은 총괄적으로 사이클로헥사논의 보다 우수한 생성을 야기하는 유전자 결손을 선택하기 위해 적용된다. 적응 진화도 또한, 예를 들면, 3-하이드록시피멜로일-CoA 중간체 또는 사이클로헥사논 생성물의 보다 우수한 생산자를 제조하기 위해 사용될 수 있다. 적응 진화는 성장 및 생성 특성 둘 다를 개선하기 위해 수행된다[Fong and Palsson, Nat. Genet. 36:1056-1058 (2004); Alper et al., Science 314:1565-1568 (2006)]. 결과를 기준으로, 모델링, 유전 공학 및 적응 진화의 후속 과정을 사이클로헥사논 생산자에 적용하여 생성을 더 증가시킬 수 있다.
사이클로헥사논의 대규모 생성을 위해, 상기 사이클로헥사논 경로-함유 유기체를 혐기성 조건하에서 유기체의 성장을 촉진하는, 당해 분야에 공지된 배지를 사용하여 발효조에서 배양한다. 발효는 배치식, 유가식 또는 연속식으로 수행한다. 혐기성 조건은 먼저 배지를 질소로 스파징한 후 배양 용기를 밀폐(예를 들면, 플라스크를 격막 및 크림프-캡으로 밀폐할 수 있다)함으로써 유지된다. 제한된 통기를 위해 작은 구멍을 제공함으로써 미세호기성 조건도 또한 이용할 수 있다. 배지의 pH는 H2SO4와 같은 산을 첨가하여 7의 pH에서 유지시킨다. 성장률은 분광광도계(600 nm)를 사용하여 광학 밀도를 측정함으로써 결정하고, 글루코스 흡수율은 시간경과에 따른 탄소 공급원 고갈을 모니터함으로써 측정한다. 바람직하지 않은 알콜, 유기산 및 잔류 글루코스와 같은 부산물은, 글루코스 및 알콜용 굴절률 검출기 및 유기산용 UV 검출기를 사용하여, HPX-087 컬럼(바이오래드)을 갖는 HPLC(시마주)에 의해 정량화할 수 있다[Lin et al., Biotechnol. Bioeng., 775-779 (2005)].
실시예 IV
사이클로헥사논이 아디페이트 세미알데하이드로부터 유도되는
사이클로헥사논 생성 미생물 유기체의 제조
본 실시예는 도 4에 나타낸 바와 같이, 아디페이트 세미알데하이드로부터 사이클로헥사논을 생성하도록 조작처리된 미생물 유기체의 제조를 기술한다. 먼저, 이. 콜라이 숙주 균주를 미국 특허출원 제 12/413,35 호의 교지내용에 따라서 사이클로헥사논 전구체 아디페이트 세미알데하이드를 과잉생성하도록 조작처리한다. 아디페이트 세미알데하이드-과잉생성 숙주는 사이클로헥사논을 과잉생성하도록 더 조작처리된다.
에스케리키아 콜라이를 도 4에 나타낸 바와 같은 사이클로헥사논-생성 경로를 조작처리하기 위한 표적 유기체로서 사용한다. 이. 콜라이는 사이클로헥사논을 생성할 수 있는 비-천연 미생물을 제조하기 위한 우수한 숙주를 제공한다. 이. 콜라이는 유전적 조작에 잘 순응하며, 혐기성 또는 미세호기성 조건하에서 에탄올, 아세트산, 폼산, 락트산 및 숙신산과 같은 다양한 생성물을 효과적으로 생성할 수 있는 것으로 알려져 있다.
아디페이트 세미알데하이드는 에스케리키아 콜라이에서 천연 대사물이 아니다. 그러나, 아디페이트 생합성을 위한 많은 생합성 경로가 최근에 개시되었다(미국 특허출원 제 12/413,355 호). "역 분해 경로"로 지칭되는 한 경로에서, 아디페이트 세미알데하이드는 옥소아디필-CoA를 생성하기 위해 베타-케토티올라제에 의해 결합된 몰 당량의 아세틸-CoA 및 숙시닐-CoA로부터 생성된다. 옥소아디필-CoA는 이어서 3개의 효소적 단계: 케톤의 환원, 탈수 및 에노일-CoA의 환원으로 아디필-CoA로 전환된다. 일단 생성되면, 아디필-CoA는 CoA-의존성 알데하이드 데하이드로게나제에 의해 아디페이트 세미알데하이드로 전환된다.
아디페이트 세미알데하이드를 생성하도록 조작처리된 이. 콜라이 균주를 생성하기 위해, 역 분해 경로의 효소를 암호화하는 핵산을 공지된 분자 생물학 기술을 사용하여 이. 콜라이에서 발현시킨다(예를 들면, 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, Third Ed., Cold Spring Harbor Laboratory, New York (2001); Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, MD (1999)] 참조). 특히, 숙시닐-CoA:아세틸-CoA 아실 트랜스퍼라제, 3-하이드록시아실-CoA 데하이드로게나제, 3-하이드록시아디필-CoA 데하이드라타제 및 포스포엔올피루베이트 카복시키나제 활성을 각각 암호화하는 paaJ(NP_415915.1), paaH(NP_415913.1), maoC(NP_415905.1) 및 pckA(P43923.1) 유전자를 PA1/lacO 프로모터의 조절하에 pZE13 벡터(익스프레시스, 독일 루엘츠하임) 내에 클로닝한다. 또한, 5-카복시-2-펜테노일-CoA 리덕타제 및 아디필-CoA 알데하이드 데하이드로게나제 활성을 각각 암호화하는 bcd(NP_349317.1), etfA(349315.1) 및 sucD(P38947.1) 유전자를 PA1/lacO 프로모터의 조절하에 pZA33 벡터(익스프레시스, 독일 루엘츠하임) 내에 클로닝한다. 두 세트의 플라스미드들을 이. 콜라이 균주 MG1655 내에 형질전환시켜 역 분해 경로에 의해 아디페이트 합성에 필요한 단백질 및 효소를 발현시킨다.
생성된 유전자 조작된 유기체를 당해 분야에 공지된 절차에 따라서 글루코스 함유 배지에서 배양한다(예를 들면, 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, Third Ed., Cold Spring Harbor Laboratory, New York (2001)] 참조). 아디페이트 세미알데하이드 경로 유전자의 발현은, 예를 들면, 노던 블롯, mRNA의 PCR 증폭 및 면역블롯팅을 포함하여, 폴리펩티드 발현 또는 효소 활성을 측정하기 위한 당해 분야에 공지된 방법을 이용하여 확인할 수 있다. 발현된 효소의 효소 활성은 개별적으로 활성에 특이적인 분석을 이용하여 확인한다. 상기 경로를 통해 아디페이트 세미알데하이드를 생성하는 조작처리된 이. 콜라이 균주의 능력은 HPLC, 가스 크로마토그래피-질량 분광분석(GCMS) 또는 액체 크로마토그래피-질량 분광분석(LCMS)을 사용하여 확인한다.
아세토아세틸-CoA로부터 기능적 아디페이트 세미알데하이드 합성 경로를 갖도록 조작처리된 미생물 균주는 또한 경로의 효과적 사용을 위한 최적화에 의해 증대된다. 간략하게, 조작처리된 균주는 임의의 외인성 유전자가 속도 제한 수준으로 발현되는지 여부를 측정하기 위해 평가된다. 발현은, 예를 들면, 추가 유전자 복사체 수의 도입에 의해 경로 전체에 걸쳐 플럭스를 제한할 수 있는 낮은 수준으로 발현된 임의의 효소에 대해 증가된다.
외인성 효소의 활성에 의해 증대된 아디페이트 세미알데하이드 생성이 성공적으로 나타난 후, 이들 효소를 암호화하는 유전자를 당해 분야에 공지된 방법을 이용하여 야생형 이. 콜라이 숙주의 염색체 내에 삽입한다. 상기 방법은, 예를 들면, 순차적 단일 교차[Gay et al., J. Bacteriol. 153:1424-1431 (1983)] 및 진브릿지로부터의 Red/ET 방법[Zhang et al., Improved RecT or RecET cloning and subcloning method (2001)]을 포함한다. 이어서, 생성된 균주를 사이클로헥사논-과잉생성 경로를 조작처리하는 후속 작업에 사용한다.
아디페이트 세미알데하이드 경로를 사용하는 사이클로헥사논 생성 유기체를 조작처리하기 위한 필요조건은 아디페이트 세미알데하이드 데하이드라타제 활성, 즉, 아디페이트 세미알데하이드를 사이클로헥산-1,2-다이온으로의 탈수 및 동시발생하는 환화를 촉진하는 활성을 갖는 유전자의 확인이다. 상기 활성은 아조아르커스 22Lin[Harder, J. Arch. Microbiol. 168:199-203 (1997)]의 세포 추출물에서 개환 방향으로 입증되었지만, 상기 활성과 관련된 유전자는 현재까지 확인되지 않았다. 아디페이트 세미알데하이드 데하이드라타제 활성을 갖는 효소를 확인하기 위해, 아조아르커스 22Lin 게놈의 단편들로 이루어진 플라스미드-기본 라이브러리를 제작한다. 플라스미드를 이. 콜라이 내에 형질전환시키고 생성된 콜로니를 분리하고, 사이클로헥산-1,2-다이온을 공급하고 아디페이트 세미알데하이드 데하이드라타제 활성에 대해 스크리닝하였다. 효소 활성을 갖는 플라스미드를 함유하는 균주를 분리하고 플라스미드를 서열화하였다. 서열은 가능성 있는 단백질-암호화 개방 해독틀(OFR)을 확인하기 위해 검사한다. 유전자 후보는 잠재적 기능을 측정하기 위해 비-중복 단백질 서열에 대해 BLAST 하였다. 플라스미드(들)에 의해 암호화된 유망한 유전자 후보를 PCR에 의해 분리하고, 새로운 벡터내에 클로닝하고, 이. 콜라이에 형질전환시키고, 아디페이트 세미알데하이드 데하이드라타제 활성에 대해 검사하였다.
전술한 도 4의 경로에 사용된 효소를 암호화하는 핵산을 공지된 분자 생물학 기술을 사용하여 이. 콜라이에서 발현시킨다(예를 들면, 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, Third Ed., Cold Spring Harbor Laboratory, New York (2001); Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, MD (1999); Roberts et al., Arch. Microbiol. 117:99-108 (1989)] 참조). 특히, 사이클로헥산-1,2-다이올 데하이드로게나제 및 사이클로헥산-1,2-다이올 데하이드라타제를 각각 암호화하는 ARA1(NP_009707.1) 및 pddCBA(AAC98386.1, AAC98385.1 및 AAC98384.1) 유전자를 PA1/lacO 프로모터의 조절하에서 pZE13 벡터(익스프레시스, 독일 루엘츠하임) 내에 클로닝시킨다. 또한, 새로 확인된 아디페이트 세미알데하이드 데하이드로게나제 유전자를 PA1/lacO 프로모터의 조절하에서 pZA33 벡터(익스프레시스, 독일 루엘츠하임) 내에 클로닝시킨다. 두 세트의 플라스미드들을 아디페이트 세미알데하이드-과잉생성 이. 콜라이 숙주 내에 형질전환시켜 역 분해 경로에 의해 아디페이트 합성에 필요한 단백질 및 효소를 발현시킨다.
생성된 유전자 조작된 유기체를 당해 분야에 공지된 절차에 따라서 글루코스 함유 배지에서 배양한다(예를 들면, 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, Third Ed., Cold Spring Harbor Laboratory, New York (2001)] 참조). 사이클로헥사논 경로 유전자의 발현은, 예를 들면, 노던 블롯, mRNA의 PCR 증폭 및 면역블롯팅을 포함하여, 폴리펩티드 발현 또는 효소 활성을 측정하기 위한 당해 분야에 공지된 방법을 이용하여 확인할 수 있다. 발현된 효소의 효소 활성은 개별적으로 활성에 특이적인 분석을 이용하여 확인한다. 상기 경로를 통해 사이클로헥사논을 생성하는 조작처리된 이. 콜라이 균주의 능력은 HPLC, 가스 크로마토그래피-질량 분광분석(GCMS) 또는 액체 크로마토그래피-질량 분광분석(LCMS)을 사용하여 확인한다.
기능적 사이클로헥사논 합성 경로를 갖도록 조작처리된 미생물 균주는 또한 경로의 효과적 사용을 위한 최적화에 의해 증대된다. 간략하게, 조작처리된 균주는 임의의 외인성 유전자가 속도 제한 수준으로 발현되는지 여부를 측정하기 위해 평가된다. 발현은, 예를 들면, 추가 유전자 복사체 수의 도입에 의해 경로 전체에 걸쳐 플럭스를 제한할 수 있는 낮은 수준으로 발현된 임의의 효소에 대해 증가된다.
보다 우수한 생산자를 제조하기 위해, 대사 모델링을 이용하여 성장 조건을 최적화한다. 모델링은 또한 경로의 활용을 추가로 최적화시키는 유전자 결손을 설계하는데에도 사용된다(예를 들면, 미국 특허 공개공보 US 2002/0012939 호, US 2003/0224363 호, US 2004/0029149 호, US 2004/0072723 호, US 2003/0059792 호, US 2002/0168654 호 및 US 2004/0009466 호 및 미국 특허 제 7,127,379 호 참조). 모델링 분석은 대사를 사이클로헥사논의 보다 효과적인 생성으로 유도하는 세포 성장에 대한 효과의 확실한 예상을 가능케 한다. 한 모델링 방법은 이중 최적화 접근방법인 옵트녹[Burgard et al., Biotechnol. Bioengineer. 84:647-657 (2003)]으로, 이것은 총괄적으로 사이클로헥사논의 보다 우수한 생성을 야기하는 유전자 결손을 선택하기 위해 적용된다. 적응 진화도 또한, 예를 들면, 사이클로헥산-1,2-다이온 중간체 또는 사이클로헥사논 생성물의 보다 우수한 생산자를 제조하기 위해 사용될 수 있다. 적응 진화는 성장 및 생성 특성 둘 다를 개선하기 위해 수행된다[Fong and Palsson, Nat. Genet. 36:1056-1058 (2004); Alper et al., Science 314:1565-1568 (2006)]. 결과를 기준으로, 모델링, 유전 공학 및 적응 진화의 후속 과정을 사이클로헥사논 생산자에 적용하여 생성을 더 증가시킬 수 있다.
사이클로헥사논의 대규모 생성을 위해, 상기 사이클로헥사논 경로-함유 유기체를 혐기성 조건하에서 유기체의 성장을 촉진하는, 당해 분야에 공지된 배지를 사용하여 발효조에서 배양한다. 발효는 배치식, 유가식 또는 연속식으로 수행한다. 혐기성 조건은 먼저 배지를 질소로 스파징한 후 배양 용기를 밀폐(예를 들면, 플라스크를 격막 및 크림프-캡으로 밀폐할 수 있다)함으로써 유지된다. 제한된 통기를 위해 작은 구멍을 제공함으로써 미세호기성 조건도 또한 이용할 수 있다. 배지의 pH는 H2SO4와 같은 산을 첨가하여 7의 pH에서 유지시킨다. 성장률은 분광광도계(600 nm)를 사용하여 광학 밀도를 측정함으로써 결정하고, 글루코스 흡수율은 시간경과에 따른 탄소 공급원 고갈을 모니터함으로써 측정한다. 바람직하지 않은 알콜, 유기산 및 잔류 글루코스와 같은 부산물은, 글루코스 및 알콜용 굴절률 검출기 및 유기산용 UV 검출기를 사용하여, HPX-087 컬럼(바이오래드)을 갖는 HPLC(시마주)에 의해 정량화할 수 있다[Lin et al., Biotechnol. Bioeng., 775-779 (2005)].
실시예 V
사이클로헥사논이 4-아세틸부티레이트로부터 유도되는
사이클로헥사논 생성 미생물 유기체의 제조
본 실시예는 도 5에 나타낸 바와 같이, 3-옥소피멜로일-CoA를 거쳐 4-아세틸부티레이트로부터 사이클로헥사논을 생성하도록 조작처리된 미생물 유기체의 제조를 기술한다. 본 실시예는 또한 경로 전구체 3-옥소피멜로일-CoA를 과잉생성하는 균주를 조작처리하는 방법을 기술한다.
에스케리키아 콜라이를 도 5에 나타낸 바와 같은 사이클로헥사논-생성 경로를 조작처리하기 위한 표적 유기체로서 사용한다. 이. 콜라이는 사이클로헥사논을 생성할 수 있는 비-천연 미생물을 제조하기 위한 우수한 숙주를 제공한다. 이. 콜라이는 유전적 조작에 잘 순응하며, 혐기성 또는 미세호기성 조건하에서 에탄올, 아세트산, 폼산, 락트산 및 숙신산과 같은 다양한 생성물을 효과적으로 생성할 수 있는 것으로 알려져 있다.
먼저, 이. 콜라이 균주를 도 2에 개략된 경로에 의해 아세토아세틸-CoA로부터 3-옥소피멜로일-CoA를 생성하도록 조작처리한다. 경로 구성의 제 1 단계로, 아세토아세틸-CoA를 3-옥소피멜로일-CoA로 전환시키기 위한(도 2, 단계 1 내지 4) 효소를 암호화하는 유전자를 벡터상에 조립한다. 특히, 아세토아세틸-CoA 리덕타제, 3-하이드록시부티릴-CoA 데하이드라타제, 글루타릴-CoA 데하이드로게나제 및 글루타릴-CoA 데하이드로게나제의 동종 전사 조절자를 각각 암호화하는 유전자 phbB(P23238), crt(NP_349318.1), gcdH(ABM69268.1) 및 gcdR(ABM69269.1)을 PA1/lacO 프로모터의 조절하에 pZE13 벡터(익스프레시스, 독일 루엘츠하임) 내에 클로닝한다. 포스포엔올피루베이트 카복시키나제 및 옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제를 각각 암호화하는 유전자 pckA(P43923.1) 및 syn_02642(YP_462685.1)을 PA1/lacO 프로모터의 조절하에 pZA33 벡터(익스프레시스, 독일 루엘츠하임) 내에 클로닝한다. 두 세트의 플라스미드들을 이. 콜라이 균주 MG1655 내에 형질전환시켜 아세토아세틸-CoA로부터의 3-옥소피멜로일-CoA 합성에 필요한 단백질 및 효소를 발현시킨다.
생성된 유전자 조작된 유기체를 당해 분야에 공지된 절차에 따라서 글루코스 함유 배지에서 배양한다(예를 들면, 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, Third Ed., Cold Spring Harbor Laboratory, New York (2001)] 참조). 3-옥소피멜로일-CoA 경로 유전자의 발현은, 예를 들면, 노던 블롯, mRNA의 PCR 증폭 및 면역블롯팅을 포함하여, 폴리펩티드 발현 또는 효소 활성을 측정하기 위한 당해 분야에 공지된 방법을 이용하여 확인할 수 있다. 발현된 효소의 효소 활성은 개별적으로 활성에 특이적인 분석을 이용하여 확인한다. 상기 경로를 통해 3-옥소피멜로일-CoA를 생성하는 조작처리된 이. 콜라이 균주의 능력은 HPLC, 가스 크로마토그래피-질량 분광분석(GCMS) 또는 액체 크로마토그래피-질량 분광분석(LCMS)을 사용하여 확인한다.
아세토아세틸-CoA로부터 기능적 3-옥소피멜로일-CoA 합성 경로를 갖도록 조작처리된 미생물 균주는 또한 경로의 효과적 사용을 위한 최적화에 의해 증대된다. 간략하게, 조작처리된 균주는 임의의 외인성 유전자가 속도 제한 수준으로 발현되는지 여부를 측정하기 위해 평가된다. 발현은, 예를 들면, 추가 유전자 복사체 수의 도입에 의해 경로 전체에 걸쳐 플럭스를 제한할 수 있는 낮은 수준으로 발현된 임의의 효소에 대해 증가된다.
외인성 효소의 활성에 의해 증대된 3-옥소피멜로일-CoA 생성이 성공적으로 나타난 후, 이들 효소를 암호화하는 유전자를 당해 분야에 공지된 방법을 이용하여 야생형 이. 콜라이 숙주의 염색체 내에 삽입한다. 상기 방법은, 예를 들면, 순차적 단일 교차[Gay et al., J. Bacteriol. 153:1424-1431 (1983)] 및 진브릿지로부터의 Red/ET 방법[Zhang et al., Improved RecT or RecET cloning and subcloning method (2001)]을 포함한다. 염색체 삽입은 보다 큰 안정성 및 경로 유전자의 발현을 공존시키는 능력을 포함하여, 플라스미드-기본 시스템에 비해 여러 이점을 제공한다.
4-아세틸부티레이트 경로를 사용하는 사이클로헥사논 생성 유기체를 조작처리하기 위한 필요조건은 4-아세틸부티레이트 데하이드라타제 활성, 즉, 4-아세틸부티레이트를 사이클로헥산-1,3-다이온으로의 탈수 및 동시발생하는 환화를 촉진하는 활성을 갖는 유전자의 확인이다. 상기 활성은 알리사이클리필러스 데니트리피칸스[Dangel et al., Arch. Microbiol. 152:271-279 (1989)]의 세포 추출물에서 가수분해성 분리(개환) 방향으로 입증되었지만, 상기 활성과 관련된 유전자는 현재까지 확인되지 않았다. 4-아세틸부티레이트 데하이드라타제 활성을 갖는 효소를 확인하기 위해, 알리사이클리필러스 데니트리피칸스 게놈의 단편들로 이루어진 플라스미드-기본 라이브러리를 제작한다. 플라스미드를 이. 콜라이 내에 형질전환시키고 생성된 콜로니를 분리하고, 사이클로헥산-1,3-다이온을 공급하고 4-아세틸부티레이트 데하이드라타제 활성에 대해 스크리닝하였다. 효소 활성을 갖는 플라스미드를 함유하는 균주를 분리하고 플라스미드를 서열화하였다. 서열은 가능성 있는 단백질-암호화 개방 해독틀(OFR)을 확인하기 위해 검사한다. 유전자 후보는 잠재적 기능을 측정하기 위해 비-중복 단백질 서열에 대해 BLAST 하였다. 플라스미드(들)에 의해 암호화된 유망한 유전자 후보를 PCR에 의해 분리하고, 새로운 벡터내에 클로닝하고, 이. 콜라이에 형질전환시키고, 4-아세틸부티레이트 데하이드라타제 활성에 대해 검사하였다.
3-옥소피멜로일-CoA로부터 사이클로헥사논을 생성하도록 조작처리된 이. 콜라이 균주를 제조하기 위해, 전술한 도 5의 경로에 사용된 효소를 암호화하는 핵산을 공지된 분자 생물학 기술을 사용하여 이. 콜라이에서 발현시킨다(예를 들면, 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, Third Ed., Cold Spring Harbor Laboratory, New York (2001); Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, MD (1999); Roberts et al., Arch. Microbiol. 117:99-108 (1989)] 참조). 특히, 3-옥소피멜로일-CoA 트랜스퍼라제, 3-옥소피멜레이트 데카복실라제 및 3-하이드록시사이클로헥사논 데하이드로게나제를 각각 암호화하는 pcaIJ(Q01103.2 및 P0A102.2), adc(NP_149328.1) 및 YMR226c(NP_013953.1) 유전자를 PA1/lacO 프로모터의 조절하에서 pZE13 벡터(익스프레시스, 독일 루엘츠하임) 내에 클로닝시킨다. 또한, 2-사이클로헥세논 하이드라타제 및 사이클로헥사논 데하이드로게나제를 각각 암호화하는 유전자 HIDH(BAD80840.1) 및 YML131W(AAS56318.1)을 PA1/lacO 프로모터의 조절하에서 pZA33 벡터(익스프레시스, 독일 루엘츠하임) 내에 클로닝시킨다. 두 세트의 플라스미드들을 이. 콜라이 균주 MG1655 내에 형질전환시켜 3-옥소피멜로일-CoA로부터 사이클로헥사논 합성에 필요한 단백질 및 효소를 발현시킨다.
생성된 유전자 조작된 유기체를 당해 분야에 공지된 절차에 따라서 글루코스 함유 배지에서 배양한다(예를 들면, 문헌 [Sambrook et al., Molecular Cloning: A Laboratory Manual, Third Ed., Cold Spring Harbor Laboratory, New York (2001)] 참조). 사이클로헥사논 경로 유전자의 발현은, 예를 들면, 노던 블롯, mRNA의 PCR 증폭 및 면역블롯팅을 포함하여, 폴리펩티드 발현 또는 효소 활성을 측정하기 위한 당해 분야에 공지된 방법을 이용하여 확인할 수 있다. 발현된 효소의 효소 활성은 개별적으로 활성에 특이적인 분석을 이용하여 확인한다. 상기 경로를 통해 사이클로헥사논을 생성하는 조작처리된 이. 콜라이 균주의 능력은 HPLC, 가스 크로마토그래피-질량 분광분석(GCMS) 또는 액체 크로마토그래피-질량 분광분석(LCMS)을 사용하여 확인한다.
기능적 사이클로헥사논 합성 경로를 갖도록 조작처리된 미생물 균주는 또한 경로의 효과적 사용을 위한 최적화에 의해 증대된다. 간략하게, 조작처리된 균주는 임의의 외인성 유전자가 속도 제한 수준으로 발현되는지 여부를 측정하기 위해 평가된다. 발현은, 예를 들면, 추가 유전자 복사체 수의 도입에 의해 경로 전체에 걸쳐 플럭스를 제한할 수 있는 낮은 수준으로 발현된 임의의 효소에 대해 증가된다.
보다 우수한 생산자를 제조하기 위해, 대사 모델링을 이용하여 성장 조건을 최적화한다. 모델링은 또한 경로의 활용을 추가로 최적화시키는 유전자 결손을 설계하는데에도 사용된다(예를 들면, 미국 특허 공개공보 US 2002/0012939 호, US 2003/0224363 호, US 2004/0029149 호, US 2004/0072723 호, US 2003/0059792 호, US 2002/0168654 호 및 US 2004/0009466 호 및 미국 특허 제 7,127,379 호 참조). 모델링 분석은 대사를 사이클로헥사논의 보다 효과적인 생성으로 유도하는 세포 성장에 대한 효과의 확실한 예상을 가능케 한다. 한 모델링 방법은 이중 최적화 접근방법인 옵트녹[Burgard et al., Biotechnol. Bioengineer. 84:647-657 (2003)]으로, 이것은 총괄적으로 사이클로헥사논의 보다 우수한 생성을 야기하는 유전자 결손을 선택하기 위해 적용된다. 적응 진화도 또한, 예를 들면, 4-아세틸부티레이트 중간체 또는 사이클로헥사논 생성물의 보다 우수한 생산자를 제조하기 위해 사용될 수 있다. 적응 진화는 성장 및 생성 특성 둘 다를 개선하기 위해 수행된다[Fong and Palsson, Nat. Genet. 36:1056-1058 (2004); Alper et al., Science 314:1565-1568 (2006)]. 결과를 기준으로, 모델링, 유전 공학 및 적응 진화의 후속 과정을 사이클로헥사논 생산자에 적용하여 생성을 더 증가시킬 수 있다.
사이클로헥사논의 대규모 생성을 위해, 상기 사이클로헥사논 경로-함유 유기체를 혐기성 조건하에서 유기체의 성장을 촉진하는, 당해 분야에 공지된 배지를 사용하여 발효조에서 배양한다. 발효는 배치식, 유가식 또는 연속식으로 수행한다. 혐기성 조건은 먼저 배지를 질소로 스파징한 후 배양 용기를 밀폐(예를 들면, 플라스크를 격막 및 크림프-캡으로 밀폐할 수 있다)함으로써 유지된다. 제한된 통기를 위해 작은 구멍을 제공함으로써 미세호기성 조건도 또한 이용할 수 있다. 배지의 pH는 H2SO4와 같은 산을 첨가하여 7의 pH에서 유지시킨다. 성장률은 분광광도계(600 nm)를 사용하여 광학 밀도를 측정함으로써 결정하고, 글루코스 흡수율은 시간경과에 따른 탄소 공급원 고갈을 모니터함으로써 측정한다. 바람직하지 않은 알콜, 유기산 및 잔류 글루코스와 같은 부산물은, 글루코스 및 알콜용 굴절률 검출기 및 유기산용 UV 검출기를 사용하여, HPX-087 컬럼(바이오래드)을 갖는 HPLC(시마주)에 의해 정량화할 수 있다[Lin et al., Biotechnol. Bioeng., 775-779 (2005)].
본 출원 전체에 걸쳐 다양한 출판물이 참조되었다. 이들 출판물의 개시내용은 진뱅크 및 GI 번호 공개를 포함하여 그 전체로, 본 발명이 관련된 당해 분야의 수준을 보다 상세히 설명하기 위해 본 출원에 참고로 인용된다. 본 발명을 상기에 나타낸 실시예와 관련하여 기술하였지만, 본 발명의 진의로부터 벗어나지 않고 다양한 변형을 행할 수 있음을 주지해야 한다.
Claims (185)
- 사이클로헥사논을 생성하기에 충분한 양으로 발현된 사이클로헥사논 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 사이클로헥사논 경로를 갖는 미생물 유기체를 포함하는 비-천연 미생물 유기체로서, 상기 사이클로헥사논 경로가 PEP 카복시키나제, 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 2-케토사이클로헥산-1-카복실레이트 데카복실라제; 및 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용), 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제 및 2-케토사이클로헥산-1-카복실-CoA 신세타제(synthetase)로 이루어진 군에서 선택된 효소를 포함하는, 비-천연 미생물 유기체.
- 제 1 항에 있어서,
각각 사이클로헥사논 경로 효소를 암호화하는 2개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 1 항에 있어서,
각각 사이클로헥사논 경로 효소를 암호화하는 3개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 1 항에 있어서,
각각 사이클로헥사논 경로 효소를 암호화하는 4개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 1 항에 있어서,
하나 이상의 외인성 핵산이 이종 핵산인, 비-천연 미생물 유기체. - 제 1 항에 있어서,
실질적으로 혐기성 배양 배지중에 존재하는 비-천연 미생물 유기체. - 제 1 항에 있어서,
천연 피멜로일-CoA 경로를 갖는 비-천연 미생물 유기체. - 제 1 항에 있어서,
PEP 카복시키나제가 PCK1 , pck 및 pckA로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 1 항에 있어서,
2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(C-C 결합에 작용)가 badI , syn_01653, syn _01654, syn _02400, syn _03076, syn _01309 및 menB로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 1 항에 있어서,
2-케토사이클로헥산-1-카복실레이트 데카복실라제가 adc , cbei _3835, CLL_A2135 및 RBAM _030030으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 1 항에 있어서,
2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용)가 acot12, gctA , gctB 및 ACH1로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 1 항에 있어서,
2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제가 pcaI , pcaJ , catI , catJ , HPAG1_0676, HPAG1 _0677, ScoA , ScoB , OXCT1 , OXCT2 , ctfA , ctfB , atoA 및 atoD로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 1 항에 있어서,
2-케토사이클로헥산-1-카복실-CoA 신세타제가 AF1211 , AF1983 , scs , PAE3250, sucC , sucD , aliA , phl , phlB , paaF 및 bioW로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 1 항 내지 제 4 항 중 어느 한 항에 있어서,
피멜로일-CoA를 생성하기에 충분한 양으로 발현된 피멜로일-CoA 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 피멜로일-CoA 경로를 추가로 포함하고, 상기 피멜로일-CoA 경로가 아세토아세틸-CoA 리덕타제, 3-하이드록시부티릴-CoA 데하이드라타제, 글루타릴-CoA 데하이드로게나제, 옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제, 3-하이드록시피멜로일-CoA 데하이드로게나제, 3-하이드록시피멜로일-CoA 데하이드라타제 및 피멜로일-CoA 데하이드로게나제를 포함하는, 비-천연 미생물 유기체. - 제 14 항에 있어서,
각각 피멜로일-CoA 경로 효소를 암호화하는 2개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 14 항에 있어서,
각각 피멜로일-CoA 경로 효소를 암호화하는 3개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 14 항에 있어서,
각각 피멜로일-CoA 경로 효소를 암호화하는 4개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 14 항에 있어서,
각각 피멜로일-CoA 경로 효소를 암호화하는 5개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 14 항에 있어서,
각각 피멜로일-CoA 경로 효소를 암호화하는 6개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 14 항에 있어서,
각각 피멜로일-CoA 경로 효소를 암호화하는 7개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 14 항에 있어서,
아세토아세틸-CoA 리덕타제가 Fox2 , phaB , phbB , hbd , Msed _1423, Msed_0399, Msed _0389, Msed _1993, Hbd2 , Hbd1 , HSD17B10 , pimF , fadB , syn _01310 및 syn_01680으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 14 항에 있어서,
3-하이드록시부티릴-CoA 데하이드라타제가 crt , crt1 , pimF , syn _01309, syn_01653, syn _01654, syn _20400, syn _03076, ech , paaA , paaB , phaA , phaB , maoC , paaF , paaG , fadA , fadB , fadI , fadJ 및 fadR로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 14 항에 있어서,
글루타릴-CoA 데하이드로게나제가 gcdH , gcdR , PP _0157, gcvA , gcd , gcdR , syn_00480, syn _01146, gcdA , gcdC , gcdD , gcdB , FN0200 , FN0201 , FN204 , syn_00479, syn _00481, syn _01431 및 syn _00480으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 14 항에 있어서,
옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제가 bktB , pimB , syn _02642, phaA, h16 _A1713, pcaF , h16 _B1369, h16 _A0170, h16 _A0462, h16 _A1528, h16 _B0381, h16 _B0662, h16 _B0759, h16 _B0668, h16 _A1720, h16 _A1887, phbA , Rmet_1362, Bphy_0975, atoB, thlA, thlB, ERG10 및 catF로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 14 항에 있어서,
3-하이드록시피멜로일-CoA 데하이드로게나제가 Fox2 , phaB , phbB , hbd , Msed_1423, Msed _0399, Msed _0389, Msed _1993, Hbd2 , Hbd1 , HSD17B10 , pimF , fadB , syn_01310 및 syn_01680으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 14 항에 있어서,
3-하이드록시피멜로일-CoA 데하이드라타제가 crt , crt1 , pimF , syn _01309, syn_01653, syn _01654, syn _20400, syn _03076, ech , paaA , paaB , phaA , phaB , maoC , paaF , paaG , fadA , fadB , fadI , fadJ 및 fadR로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 14 항에 있어서,
피멜로일-CoA 데하이드로게나제가 bcd , etfA , etfB , TER , TDE0597 , syn_02587, syn _02586, syn _01146, syn _00480, syn _02128, syn _01699, syn _02637, syn_02636, pimC, pimD, acad1 및 acad로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 사이클로헥사논을 생성하기에 충분한 양으로 발현된 사이클로헥사논 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 사이클로헥사논 경로를 갖는 미생물 유기체를 포함하는 비-천연 미생물 유기체로서, 상기 사이클로헥사논 경로가 PEP 카복시키나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 6-케토사이클로헥스-1-엔-1-카복실-CoA 신세타제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(티오에스터에 작용), 6-케토사이클로헥스-1-엔-1-카복실-CoA 트랜스퍼라제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 리덕타제, 6-케토사이클로헥스-1-엔-1-카복실레이트 데카복실라제, 6-케토사이클로헥스-1-엔-1-카복실레이트 리덕타제, 2-케토사이클로헥산-1-카복실-CoA 신세타제, 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제, 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용), 2-케토사이클로헥산-1-카복실레이트 데카복실라제 및 사이클로헥사논 데하이드로게나제로 이루어진 군에서 선택된 효소를 포함하는, 비-천연 미생물 유기체.
- 제 28 항에 있어서,
각각 사이클로헥사논 경로 효소를 암호화하는 2개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 28 항에 있어서,
각각 사이클로헥사논 경로 효소를 암호화하는 3개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 28 항에 있어서,
각각 사이클로헥사논 경로 효소를 암호화하는 4개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 28 항에 있어서,
각각 사이클로헥사논 경로 효소를 암호화하는 5개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 28 항에 있어서,
하나 이상의 외인성 핵산이 이종 핵산인, 비-천연 미생물 유기체. - 제 28 항에 있어서,
실질적으로 혐기성 배양 배지중에 존재하는 비-천연 미생물 유기체. - 제 28 항에 있어서,
천연 3-하이드록시피멜로일-CoA 경로를 갖는 비-천연 미생물 유기체. - 제 28 항 내지 제 32 항 중 어느 한 항에 있어서,
사이클로헥사논 경로가 하기 효소들로 이루어진 군에서 선택된 사이클로헥사논 경로 효소들의 세트를 포함하는, 비-천연 미생물 유기체:
(a) PEP 카복시키나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 6-케토사이클로헥스-1-엔-1-카복실레이트 데카복실라제, 사이클로헥사논 데하이드로게나제; 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 신세타제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(티오에스터에 작용) 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 트랜스퍼라제로 이루어진 군에서 선택된 효소;
(b) PEP 카복시키나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 6-케토사이클로헥스-1-엔-1-카복실레이트 리덕타제, 2-케토사이클로헥산-1-카복실레이트 데카복실라제; 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 신세타제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(티오에스터에 작용) 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 트랜스퍼라제로 이루어진 군에서 선택된 효소; 및
(c) PEP 카복시키나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C에 작용), 6-케토사이클로헥스-1-엔-1-카복실-CoA 리덕타제, 2-케토사이클로헥산-1-카복실레이트 데카복실라제; 및 2-케토사이클로헥산-1-카복실-CoA 신세타제, 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제 및 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용)로 이루어진 군에서 선택된 효소. - 제 36 항에 있어서,
PEP 카복시키나제가 PCK1 , pck 및 pckA로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 36 항에 있어서,
6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C 결합에 작용)가 bzdY, oah , bamA , syn _01653, syn _02400, syn _03076 및 syn _01309로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 36 항에 있어서,
6-케토사이클로헥스-1-엔-1-카복실-CoA 신세타제가 AF1211 , AF1983 , scs , PAE3250, sucC , sucD , aliA , phl , phlB , paaF 및 bioW로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 36 항에 있어서,
6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(티오에스터에 작용)가 acot12, gctA , gctB 및 ACH1 로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 36 항에 있어서,
6-케토사이클로헥스-1-엔-1-카복실-CoA 트랜스퍼라제가 pcaI , pcaJ , catI , catJ, HPAG1 _0676, HPAG1 _0677, ScoA , ScoB , OXCT1 , OXCT2 , ctfA , ctfB , atoA 및 atoD로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 36 항에 있어서,
6-케토사이클로헥스-1-엔-1-카복실-CoA 리덕타제가 bcd , etfA , etfB , TER , TDE0597, syn _02587, syn _02586, syn _01146, syn _00480, syn _02128, syn _01699, syn_02637, syn_02636, pimC, pimD, acad1 및 acad로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 36 항에 있어서,
6-케토사이클로헥스-1-엔-1-카복실레이트 데카복실라제가 adc , cbei _3835, CLL_A2135 및 RBAM _030030으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 36 항에 있어서,
6-케토사이클로헥스-1-엔-1-카복실레이트 리덕타제가 NtRed1 , AtDBR1 , P2 , PulR, PtPPDBR , YML131W , ispR , AT3G61220 , cbr , CBR1 , CHO - CR , YIR036C , enr 및 fadH로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 36 항에 있어서,
2-케토사이클로헥산-1-카복실-CoA 신세타제가 AF1211 , AF1983 , scs , PAE3250, sucC , sucD , aliA , phl , phlB , paaF 및 bioW로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 36 항에 있어서,
2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제가 pcaI , pcaJ , catI , catJ , HPAG1_0676, HPAG1 _0677, ScoA , ScoB , OXCT1 , OXCT2 , ctfA , ctfB , atoA 및 atoD로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 36 항에 있어서,
2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용)가 acot12, gctA , gctB 및 ACH1 로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 36 항에 있어서,
2-케토사이클로헥산-1-카복실레이트 데카복실라제가 adc , cbei _3835, CLL_A2135 및 RBAM _030030으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 36 항에 있어서,
사이클로헥사논 데하이드로게나제가 NtRed1 , AtDBR1 , P2 , PulR , PtPPDBR , YML131W, ispR , AT3G61220 , cbr , CBR1 , CHO - CR , YIR036C , enr 및 fadH로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 28 항 내지 제 32 항 중 어느 한 항에 있어서,
3-하이드록시피멜로일-CoA를 생성하기에 충분한 양으로 발현된 3-하이드록시피멜로일-CoA 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 3-하이드록시피멜로일-CoA 경로를 추가로 포함하고, 상기 3-하이드록시피멜로일-CoA 경로가 아세토아세틸-CoA 리덕타제, 3-하이드록시부티릴-CoA 데하이드라타제, 글루타릴-CoA 데하이드로게나제, 옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제 및 3-하이드록시피멜로일-CoA 데하이드로게나제를 포함하는, 비-천연 미생물 유기체. - 제 50 항에 있어서,
각각 3-하이드록시피멜로일-CoA 경로 효소를 암호화하는 2개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 50 항에 있어서,
각각 3-하이드록시피멜로일-CoA 경로 효소를 암호화하는 3개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 50 항에 있어서,
각각 3-하이드록시피멜로일-CoA 경로 효소를 암호화하는 4개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 50 항에 있어서,
각각 3-하이드록시피멜로일-CoA 경로 효소를 암호화하는 5개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 50 항에 있어서,
아세토아세틸-CoA 리덕타제가 Fox2 , phaB , phbB , hbd , Msed _1423, Msed_0399, Msed _0389, Msed _1993, Hbd2 , Hbd1 , HSD17B10 , pimF , fadB , syn _01310 및 syn_01680으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 50 항에 있어서,
3-하이드록시부티릴-CoA 데하이드라타제가 crt , crt1 , pimF , syn _01309, syn_01653, syn _01654, syn _20400, syn _03076, ech , paaA , paaB , phaA , phaB , maoC, paaF, paaG, fadA, fadB, fadI, fadJ 및 fadR로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 50 항에 있어서,
글루타릴-CoA 데하이드로게나제가 gcdH , gcdR , PP _0157, gcvA , gcd , gcdR , syn_00480, syn _01146, gcdA , gcdC , gcdD , gcdB , FN0200 , FN0201 , FN204 , syn_00479, syn_00481, syn_01431 및 syn_00480으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 50 항에 있어서,
옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제가 bktB , pimB , syn _02642, phaA, h16 _A1713, pcaF , h16 _B1369, h16 _A0170, h16 _A0462, h16 _A1528, h16 _B0381, h16_B0662, h16_B0759, h16_B0668, h16_A1720, h16_A1887, phbA, Rmet_1362, Bphy_0975, atoB, thlA, thlB, ERG10 및 catF로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 50 항에 있어서,
3-하이드록시피멜로일-CoA 데하이드로게나제가 Fox2 , phaB , phbB , hbd , Msed_1423, Msed _0399, Msed _0389, Msed _1993, Hbd2 , Hbd1 , HSD17B10 , pimF , fadB , syn_01310 및 syn_01680으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 사이클로헥사논을 생성하기에 충분한 양으로 발현된 사이클로헥사논 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 사이클로헥사논 경로를 갖는 미생물 유기체를 포함하는 비-천연 미생물 유기체로서, 상기 사이클로헥사논 경로가 PEP 카복시키나제, 아디페이트 세미알데하이드 데하이드라타제, 사이클로헥산-1,2-다이올 데하이드로게나제 및 사이클로헥산-1,2-다이올 데하이드라타제를 포함하는 비-천연 미생물 유기체.
- 제 60 항에 있어서,
각각 사이클로헥사논 경로 효소를 암호화하는 2개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 60 항에 있어서,
각각 사이클로헥사논 경로 효소를 암호화하는 3개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 60 항에 있어서,
각각 사이클로헥사논 경로 효소를 암호화하는 4개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 60 항에 있어서,
하나 이상의 외인성 핵산이 이종 핵산인, 비-천연 미생물 유기체. - 제 60 항에 있어서,
실질적으로 혐기성 배양 배지중에 존재하는 비-천연 미생물 유기체. - 제 60 항에 있어서,
PEP 카복시키나제가 PCK1 , pck 및 pckA로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 60 항에 있어서,
사이클로헥산-1,2-다이올 데하이드로게나제가 chnA , Rmet _1335, PP _1946, ARA1, BDH1 , GCY1 , YPR1 , GRE3 및 YIR036c로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 60 항에 있어서,
사이클로헥산-1,2-다이올 데하이드라타제가 pddC , pddB , pddA , pduC , pduD , pduE, dhaB , dhaC , dhaE , dhaB1 , dhaB2 , rdhtA , rdhtB , ilvD , iolE , ddrA , ddrB , pudG 및 pduH로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 사이클로헥사논을 생성하기에 충분한 양으로 발현된 사이클로헥사논 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 사이클로헥사논 경로를 갖는 미생물 유기체를 포함하는 비-천연 미생물 유기체로서, 상기 사이클로헥사논 경로가 PEP 카복시키나제, 3-옥소피멜레이트 데카복실라제, 4-아세틸부티레이트 데하이드라타제, 3-하이드록시사이클로헥사논 데하이드로게나제, 2-사이클로헥사논 하이드라타제, 사이클로헥사논 데하이드로게나제; 및 3-옥소피멜로일-CoA 신세타제, 3-옥소피멜로일-CoA 하이드롤라제(티오에스터에 작용) 및 3-옥소피멜로일-CoA 트랜스퍼라제로 이루어진 군에서 선택된 효소를 포함하는, 비-천연 미생물 유기체.
- 제 69 항에 있어서,
각각 사이클로헥사논 경로 효소를 암호화하는 2개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 69 항에 있어서,
각각 사이클로헥사논 경로 효소를 암호화하는 3개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 69 항에 있어서,
각각 사이클로헥사논 경로 효소를 암호화하는 4개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 69 항에 있어서,
각각 사이클로헥사논 경로 효소를 암호화하는 5개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 69 항에 있어서,
각각 사이클로헥사논 경로 효소를 암호화하는 6개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 69 항에 있어서,
각각 사이클로헥사논 경로 효소를 암호화하는 7개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 69 항에 있어서,
하나 이상의 외인성 핵산이 이종 핵산인, 비-천연 미생물 유기체. - 제 69 항에 있어서,
실질적으로 혐기성 배양 배지중에 존재하는 비-천연 미생물 유기체. - 제 69 항에 있어서,
PEP 카복시키나제가 PCK1 , pck 및 pckA로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 69 항에 있어서,
3-옥소피멜레이트 데카복실라제가 adc , cbei _3835, CLL _A2135 및 RBAM_030030으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 69 항에 있어서,
3-하이드록시사이클로헥사논 데하이드로게나제가 YMR226c , YDR368w , YOR120w, YGL157w , YGL039w , chnA , Rmet _1335, PP _1946, ARA1 , BDH1 , GCY1 , YPR1 , GRE3 및 Y1R036c로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 69 항에 있어서,
2-사이클로헥사논 하이드라타제가 aroD , aroQ , HIDH 및 HIDM으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 69 항에 있어서,
사이클로헥사논 데하이드로게나제가 NtRed1 , AtDBR1 , P2 , PulR , PtPPDBR , YML131W, ispR , AT3G61220 , cbr , CBR1 , CHO - CR , YIR036C , enr 및 fadH로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 69 항에 있어서,
3-옥소피멜로일-CoA 신세타제가 AF1211 , AF1983 , scs , PAE3250 , sucC , sucD , aliA, ph1 , ph1B , paaF 및 bioW로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 69 항에 있어서,
3-옥소피멜로일-CoA 하이드롤라제가 acotl2 , gctA , gctB 및 ACH1 로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 69 항에 있어서,
3-옥소피멜로일-CoA 트랜스퍼라제가 pcaI , pcaJ , catI , catJ , HPAG1 _0676, HPAG1_0677, ScoA , ScoB , OXCT1 , OXCT2 , ctfA , ctfB , atoA 및 atoD로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 68 항 내지 제 74 항 중 어느 한 항에 있어서,
3-옥소피멜로일-CoA를 생성하기에 충분한 양으로 발현된 3-옥소피멜로일-CoA 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 3-옥소피멜로일-CoA 경로를 추가로 포함하고, 상기 3-옥소피멜로일-CoA 경로가 아세토아세틸-CoA 리덕타제, 3-하이드록시부티릴-CoA 데하이드라타제, 글루타릴-CoA 데하이드로게나제 및 옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제를 포함하는, 비-천연 미생물 유기체. - 제 86 항에 있어서,
각각 3-옥소피멜로일-CoA 경로 효소를 암호화하는 2개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 86 항에 있어서,
각각 3-옥소피멜로일-CoA 경로 효소를 암호화하는 3개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 86 항에 있어서,
각각 3-옥소피멜로일-CoA 경로 효소를 암호화하는 4개의 외인성 핵산을 포함하는 비-천연 미생물 유기체. - 제 86 항에 있어서,
아세토아세틸-CoA 리덕타제가 Fox2 , phaB , phbB , hbd , Msed _1423, Msed_0399, Msed _0389, Msed _1993, Hbd2 , Hbd1 , HSD17B10 , pimF , fadB , syn _01310 및 syn_01680으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 86 항에 있어서,
3-하이드록시부티릴-CoA 데하이드라타제가 crt , crt1 , pimF , syn _01309, syn_01653, syn _01654, syn _20400, syn _03076, ech , paaA , paaB , phaA , phaB , maoC, paaF, paaG, fadA, fadB, fadI, fadJ 및 fadR로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 86 항에 있어서,
글루타릴-CoA 데하이드로게나제가 gcdH , gcdR , PP _0157, gcvA , gcd , gcdR , syn_00480, syn _01146, gcdA , gcdC , gcdD , gcdB , FN0200 , FN0201 , FN204 , syn_00479, syn _00481, syn _01431 및 syn _00480으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 제 86 항에 있어서,
옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제가 bktB , pimB , syn _02642, phaA, h16 _A1713, pcaF , h16 _B1369, h16 _A0170, h16 _A0462, h16 _A1528, h16 _B0381, h16_B0662, h16_B0759, h16_B0668, h16_A1720, h16_A1887, phbA, Rmet_1362, Bphy _0975, atoB , thlA , thlB , ERG10 및 catF로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 비-천연 미생물 유기체. - 사이클로헥사논을 생성하기에 충분한 시간동안 및 조건하에서, 사이클로헥사논을 생성하기에 충분한 양으로 발현된 사이클로헥사논 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 사이클로헥사논 경로를 갖는 비-천연 미생물 유기체를 배양하는 것을 포함하는, 사이클로헥사논을 제조하는 방법으로서, 상기 사이클로헥사논 경로가 PEP 카복시키나제, 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 2-케토사이클로헥산-1-카복실레이트 데카복실라제; 및 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용), 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제 및 2-케토사이클로헥산-1-카복실-CoA 신세타제로 이루어진 군에서 선택된 효소를 포함하는 방법.
- 제 94 항에 있어서,
비-천연 미생물 유기체가 각각 사이클로헥사논 경로 효소를 암호화하는 2개의 외인성 핵산을 포함하는, 방법. - 제 94 항에 있어서,
비-천연 미생물 유기체가 각각 사이클로헥사논 경로 효소를 암호화하는 3개의 외인성 핵산을 포함하는, 방법. - 제 94 항에 있어서,
비-천연 미생물 유기체가 각각 사이클로헥사논 경로 효소를 암호화하는 4개의 외인성 핵산을 포함하는, 방법. - 제 94 항에 있어서,
하나 이상의 외인성 핵산이 이종 핵산인, 방법. - 제 94 항에 있어서,
비-천연 미생물 유기체가 실질적으로 혐기성 배양 배지중에 존재하는, 방법. - 제 94 항에 있어서,
비-천연 미생물 유기체가 천연 피멜로일-CoA 경로를 갖는, 방법. - 제 94 항에 있어서,
PEP 카복시키나제가 PCK1 , pck 및 pckA로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 94 항에 있어서,
2-케토사이클로헥산카복실-CoA 하이드롤라제(C-C 결합에 작용)가 badI , syn_01653, syn _01654, syn _02400, syn _03076, syn _01309 및 menB로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 94 항에 있어서,
2-케토사이클로헥산-1-카복실레이트 데카복실라제가 adc , cbei _3835, CLL_A2135 및 RBAM _030030으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 94 항에 있어서,
2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용)가 acot12, gctA , gctB 및 ACH1 로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 94 항에 있어서,
2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제가 pcaI , pcaJ , catI , catJ , HPAG1_0676, HPAG1 _0677, ScoA , ScoB , OXCT1 , OXCT2 , ctfA , ctfB , atoA 및 atoD로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 94 항에 있어서,
2-케토사이클로헥산-1-카복실-CoA 신세타제가 AF1211 , AF1983 , scs , PAE3250, sucC , sucD , aliA , phl , phlB , paaF 및 bioW로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 94 항 내지 제 96 항 중 어느 한 항에 있어서,
비-천연 미생물 유기체가 피멜로일-CoA를 생성하기에 충분한 양으로 발현된 피멜로일-CoA 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 피멜로일-CoA 경로를 추가로 포함하고, 상기 피멜로일-CoA 경로가 아세토아세틸-CoA 리덕타제, 3-하이드록시부티릴-CoA 데하이드라타제, 글루타릴-CoA 데하이드로게나제, 옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제, 3-하이드록시피멜로일-CoA 데하이드로게나제, 3-하이드록시피멜로일-CoA 데하이드라타제 및 피멜로일-CoA 데하이드로게나제를 포함하는, 방법. - 제 107 항에 있어서,
비-천연 미생물 유기체가 각각 피멜로일-CoA 경로 효소를 암호화하는 2개의 외인성 핵산을 포함하는, 방법. - 제 107 항에 있어서,
비-천연 미생물 유기체가 각각 피멜로일-CoA 경로 효소를 암호화하는 3개의 외인성 핵산을 포함하는, 방법. - 제 107 항에 있어서,
비-천연 미생물 유기체가 각각 피멜로일-CoA 경로 효소를 암호화하는 4개의 외인성 핵산을 포함하는, 방법. - 제 107 항에 있어서,
비-천연 미생물 유기체가 각각 피멜로일-CoA 경로 효소를 암호화하는 5개의 외인성 핵산을 포함하는, 방법. - 제 107 항에 있어서,
비-천연 미생물 유기체가 각각 피멜로일-CoA 경로 효소를 암호화하는 6개의 외인성 핵산을 포함하는, 방법. - 제 107 항에 있어서,
비-천연 미생물 유기체가 각각 피멜로일-CoA 경로 효소를 암호화하는 7개의 외인성 핵산을 포함하는, 방법. - 제 107 항에 있어서,
3-하이드록시아실-CoA 데하이드로게나제 아세토아세틸-CoA 리덕타제가 Fox2 , phaB, phbB , hbd , Msed _1423, Msed _0399, Msed _0389, Msed _1993, Hbd2 , Hbd1 , HSD17B10 , pimF , fadB , syn _01310 및 syn _01680으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 107 항에 있어서,
3-하이드록시부티릴-CoA 데하이드라타제가 crt , crt1 , pimF , syn _01309, syn_01653, syn _01654, syn _20400, syn _03076, ech , paaA , paaB , phaA , phaB , maoC, paaF, paaG, fadA, fadB, fadI, fadJ 및 fadR로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 107 항에 있어서,
글루타릴-CoA 데하이드로게나제가 gcdH , gcdR , PP _0157, gcvA , gcd , gcdR , syn_00480, syn _01146, gcdA , gcdC , gcdD , gcdB , FN0200 , FN0201 , FN204 , syn_00479, syn _00481, syn _01431 및 syn _00480으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 107 항에 있어서,
옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제가 bktB , pimB , syn _02642, phaA, h16 _A1713, pcaF , h16 _B1369, h16 _A0170, h16 _A0462, h16 _A1528, h16 _B0381, h16 _B0662, h16 _B0759, h16 _B0668, h16 _A1720, h16 _A1887, phbA , Rmet_1362, Bphy_0975, atoB, thlA, thlB, ERG10 및 catF로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 107 항에 있어서,
3-하이드록시피멜로일-CoA 데하이드로게나제가 Fox2 , phaB , phbB , hbd , Msed_1423, Msed _0399, Msed _0389, Msed _1993, Hbd2 , Hbd1 , HSD17B10 , pimF , fadB , syn_01310 및 syn_01680으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 107 항에 있어서,
3-하이드록시피멜로일-CoA 데하이드라타제가 crt , crt1 , pimF , syn _01309, syn_01653, syn _01654, syn _20400, syn _03076, ech , paaA , paaB , phaA , phaB , maoC, paaF, paaG, fadA, fadB, fadI, fadJ 및 fadR로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 107 항에 있어서,
피멜로일-CoA 데하이드로게나제가 bcd , etfA , etfB , TER , TDE0597 , syn_02587, syn _02586, syn _01146, syn _00480, syn _02128, syn _01699, syn _02637, syn_02636, pimC , pimD , acad1 및 acad로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 사이클로헥사논을 생성하기에 충분한 시간동안 및 조건하에서, 사이클로헥사논을 생성하기에 충분한 양으로 발현된 사이클로헥사논 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 사이클로헥사논 경로를 갖는 비-천연 미생물 유기체를 배양하는 것을 포함하는, 사이클로헥사논을 제조하는 방법으로서, 상기 사이클로헥사논 경로가 하기 효소들로 이루어진 군에서 선택된 사이클로헥사논 경로 효소들의 세트를 포함하는, 방법:
(a) PEP 카복시키나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 6-케토사이클로헥스-1-엔-1-카복실레이트 데카복실라제, 사이클로헥사논 데하이드로게나제; 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 신세타제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(티오에스터에 작용) 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 트랜스퍼라제로 이루어진 군에서 선택된 효소;
(b) PEP 카복시키나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C 결합에 작용), 6-케토사이클로헥스-1-엔-1-카복실레이트 리덕타제, 2-케토사이클로헥산-1-카복실레이트 데카복실라제; 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 신세타제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(티오에스터에 작용) 및 6-케토사이클로헥스-1-엔-1-카복실-CoA 트랜스퍼라제로 이루어진 군에서 선택된 효소; 및
(c) PEP 카복시키나제, 6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C에 작용), 6-케토사이클로헥스-1-엔-1-카복실-CoA 리덕타제, 2-케토사이클로헥산-1-카복실레이트 데카복실라제; 및 2-케토사이클로헥산-1-카복실-CoA 신세타제, 2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제, 2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용)로 이루어진 군에서 선택된 효소. - 제 121 항에 있어서,
비-천연 미생물 유기체가 각각 사이클로헥사논 경로 효소를 암호화하는 2개의 외인성 핵산을 포함하는, 방법. - 제 121 항에 있어서,
비-천연 미생물 유기체가 각각 사이클로헥사논 경로 효소를 암호화하는 3개의 외인성 핵산을 포함하는, 방법. - 제 121 항에 있어서,
비-천연 미생물 유기체가 각각 사이클로헥사논 경로 효소를 암호화하는 4개의 외인성 핵산을 포함하는, 방법. - 제 121 항에 있어서,
비-천연 미생물 유기체가 각각 사이클로헥사논 경로 효소를 암호화하는 5개의 외인성 핵산을 포함하는, 방법. - 제 121 항에 있어서,
하나 이상의 외인성 핵산이 이종 핵산인, 방법. - 제 121 항에 있어서,
비-천연 미생물 유기체가 실질적으로 혐기성 배양 배지중에 존재하는, 방법. - 제 121 항에 있어서,
PEP 카복시키나제가 PCK1 , pck 및 pckA로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 121 항에 있어서,
6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(C-C 결합에 작용)가 bzdY, oah , bamA , syn _01653, syn _02400, syn _03076 및 syn _01309로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 121 항에 있어서,
6-케토사이클로헥스-1-엔-1-카복실-CoA 신세타제가 AF1211 , AF1983 , scs , PAE3250, sucC , sucD , aliA , phl , phlB , paaF 및 bioW로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 121 항에 있어서,
6-케토사이클로헥스-1-엔-1-카복실-CoA 하이드롤라제(티오에스터에 작용)가 acot12, gctA , gctB 및 ACH1 로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 121 항에 있어서,
6-케토사이클로헥스-1-엔-1-카복실-CoA 트랜스퍼라제가 pcaI , pcaJ , catI , catJ, HPAG1 _0676, HPAG1 _0677, ScoA , ScoB , OXCT1 , OXCT2 , ctfA , ctfB , atoA 및 atoD로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 121 항에 있어서,
6-케토사이클로헥스-1-엔-1-카복실-CoA 리덕타제가 bcd , etfA , etfB , TER , TDE0597, syn _02587, syn _02586, syn _01146, syn _00480, syn _02128, syn _01699, syn _02637, syn _02636, pimC , pimD , acad1 및 acad로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 121 항에 있어서,
6-케토사이클로헥스-1-엔-1-카복실레이트 데카복실라제가 adc , cbei _3835, CLL_A2135 및 RBAM _030030으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 121 항에 있어서,
6-케토사이클로헥스-1-엔-1-카복실레이트 리덕타제가 NtRed1 , AtDBR1 , P2 , PulR, PtPPDBR , YML131W , ispR , AT3G61220 , cbr , CBR1 , CHO - CR , YIR036C , enr 및 fadH로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 121 항에 있어서,
2-케토사이클로헥산-1-카복실-CoA 신세타제가 AF1211 , AF1983 , scs , PAE3250, sucC , sucD , aliA , phl , phlB , paaF 및 bioW로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 121 항에 있어서,
2-케토사이클로헥산-1-카복실-CoA 트랜스퍼라제가 pcaI , pcaJ , catI , catJ , HPAG1_0676, HPAG1 _0677, ScoA , ScoB , OXCT1 , OXCT2 , ctfA , ctfB , atoA 및 atoD로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 121 항에 있어서,
2-케토사이클로헥산-1-카복실-CoA 하이드롤라제(티오에스터에 작용)가 acot12, gctA , gctB 및 ACH1 로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 121 항에 있어서,
2-케토사이클로헥산-1-카복실레이트 데카복실라제가 adc , cbei _3835, CLL_A2135 및 RBAM _030030으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 121 항에 있어서,
사이클로헥사논 데하이드로게나제가 NtRed1 , AtDBR1 , P2 , PulR , PtPPDBR , YML131W, ispR , AT3G61220 , cbr , CBR1 , CHO - CR , YIR036C , enr 및 fadH로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 120 항 내지 제 124 항 중 어느 한 항에 있어서,
비-천연 미생물 유기체가 3-하이드록시피멜로일-CoA를 생성하기에 충분한 양으로 발현된 3-하이드록시피멜로일-CoA 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 3-하이드록시피멜로일-CoA 경로를 추가로 포함하고, 상기 3-하이드록시피멜로일-CoA 경로가 아세토아세틸-CoA 리덕타제, 3-하이드록시부티릴-CoA 데하이드라타제, 글루타릴-CoA 데하이드로게나제, 옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제 및 3-하이드록시피멜로일-CoA 데하이드로게나제를 포함하는, 방법. - 제 141 항에 있어서,
비-천연 미생물 유기체가 각각 3-하이드록시피멜로일-CoA 경로 효소를 암호화하는 2개의 외인성 핵산을 포함하는, 방법. - 제 141 항에 있어서,
비-천연 미생물 유기체가 각각 3-하이드록시피멜로일-CoA 경로 효소를 암호화하는 3개의 외인성 핵산을 포함하는, 방법. - 제 141 항에 있어서,
비-천연 미생물 유기체가 각각 3-하이드록시피멜로일-CoA 경로 효소를 암호화하는 4개의 외인성 핵산을 포함하는, 방법. - 제 141 항에 있어서,
비-천연 미생물 유기체가 각각 3-하이드록시피멜로일-CoA 경로 효소를 암호화하는 5개의 외인성 핵산을 포함하는, 방법. - 제 141 항에 있어서,
아세토아세틸-CoA 리덕타제가 Fox2 , phaB , phbB , hbd , Msed _1423, Msed_0399, Msed _0389, Msed _1993, Hbd2 , Hbd1 , HSD17B10 , pimF , fadB , syn _01310 및 syn _01680으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 141 항에 있어서,
3-하이드록시부티릴-CoA 데하이드라타제가 crt , crt1 , pimF , syn _01309, syn_01653, syn _01654, syn _20400, syn _03076, ech , paaA , paaB , phaA , phaB , maoC , paaF , paaG , fadA , fadB , fadI , fadJ 및 fadR로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 141 항에 있어서,
글루타릴-CoA 데하이드로게나제가 gcdH , gcdR , PP _0157, gcvA , gcd , gcdR , syn_00480, syn _01146, gcdA , gcdC , gcdD , gcdB , FN0200 , FN0201 , FN204 , syn_00479, syn _00481, syn _01431 및 syn _00480으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 141 항에 있어서,
옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제가 bktB , pimB , syn _02642, phaA, h16 _A1713, pcaF , h16 _B1369, h16 _A0170, h16 _A0462, h16 _A1528, h16 _B0381, h16 _B0662, h16 _B0759, h16 _B0668, h16 _A1720, h16 _A1887, phbA , Rmet_1362, Bphy_0975, atoB, thlA, thlB, ERG10 및 catF로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 141 항에 있어서,
3-하이드록시피멜로일-CoA 데하이드로게나제가 Fox2 , phaB , phbB , hbd , Msed_1423, Msed _0399, Msed _0389, Msed _1993, Hbd2 , Hbd1 , HSD17B10 , pimF , fadB , syn_01310 및 syn_01680으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 사이클로헥사논을 생성하기에 충분한 시간동안 및 조건하에서, 사이클로헥사논을 생성하기에 충분한 양으로 발현된 사이클로헥사논 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 사이클로헥사논 경로를 갖는 비-천연 미생물 유기체를 배양하는 것을 포함하는, 사이클로헥사논을 제조하는 방법으로서, 상기 사이클로헥사논 경로가 PEP 카복시키나제, 아디페이트 세미알데하이드 데하이드라타제, 사이클로헥산-1,2-다이올 데하이드로게나제 및 사이클로헥산-1,2-다이올 데하이드라타제를 포함하는, 방법.
- 제 151 항에 있어서,
비-천연 미생물 유기체가 각각 사이클로헥사논 경로 효소를 암호화하는 2개의 외인성 핵산을 포함하는, 방법. - 제 151 항에 있어서,
비-천연 미생물 유기체가 각각 사이클로헥사논 경로 효소를 암호화하는 3개의 외인성 핵산을 포함하는, 방법. - 제 151 항에 있어서,
상기 미생물 유기체가, 각각 사이클로헥사논 경로 효소를 암호화하는 4개의 외인성 핵산을 포함하는 방법. - 제 151 항에 있어서,
비-천연 미생물 유기체가 각각 사이클로헥사논 경로 효소를 암호화하는 5개의 외인성 핵산을 포함하는, 방법. - 제 151 항에 있어서,
하나 이상의 외인성 핵산이 이종 핵산인, 방법. - 제 151 항에 있어서,
비-천연 미생물 유기체가 실질적으로 혐기성 배양 배지중에 존재하는, 방법. - 제 151 항에 있어서,
PEP 카복시키나제가 PCK1 , pck 및 pckA로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 151 항에 있어서,
사이클로헥산-1,2-다이올 데하이드로게나제가 chnA , Rmet _1335, PP _1946, ARA1, BDH1 , GCY1 , YPR1 , GRE3 및 YIR036c로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 151 항에 있어서,
사이클로헥산-1,2-다이올 데하이드라타제가 pddC , pddB , pddA , pduC , pduD , pduE, dhaB , dhaC , dhaE , dhaB1 , dhaB2 , rdhtA , rdhtB , ilvD , iolE , ddrA , ddrB , pudG 및 pduH로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 사이클로헥사논을 생성하기에 충분한 시간동안 및 조건하에서, 사이클로헥사논을 생성하기에 충분한 양으로 발현된 사이클로헥사논 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 사이클로헥사논 경로를 갖는 비-천연 미생물 유기체를 배양하는 것을 포함하는, 사이클로헥사논을 제조하는 방법으로서, 상기 사이클로헥사논 경로가 PEP 카복시키나제, 3-옥소피멜레이트 데카복실라제, 4-아세틸부티레이트 데하이드라타제, 3-하이드록시사이클로헥사논 데하이드로게나제, 2-사이클로헥사논 하이드라타제, 사이클로헥사논 데하이드로게나제; 및 3-옥소피멜로일-CoA 신세타제, 3-옥소피멜로일-CoA 하이드롤라제(티오에스터에 작용) 및 3-옥소피멜로일-CoA 트랜스퍼라제로 이루어진 군에서 선택된 효소를 포함하는, 방법.
- 제 161 항에 있어서,
비-천연 미생물 유기체가 각각 사이클로헥사논 경로 효소를 암호화하는 2개의 외인성 핵산을 포함하는, 방법. - 제 161 항에 있어서,
비-천연 미생물 유기체가 각각 사이클로헥사논 경로 효소를 암호화하는 3개의 외인성 핵산을 포함하는, 방법. - 제 161 항에 있어서,
비-천연 미생물 유기체가 각각 사이클로헥사논 경로 효소를 암호화하는 4개의 외인성 핵산을 포함하는, 방법. - 제 161 항에 있어서,
비-천연 미생물 유기체가 각각 사이클로헥사논 경로 효소를 암호화하는 5개의 외인성 핵산을 포함하는, 방법. - 제 161 항에 있어서,
비-천연 미생물 유기체가 각각 사이클로헥사논 경로 효소를 암호화하는 6개의 외인성 핵산을 포함하는, 방법. - 제 161 항에 있어서,
비-천연 미생물 유기체가 각각 사이클로헥사논 경로 효소를 암호화하는 7개의 외인성 핵산을 포함하는, 방법. - 제 161 항에 있어서,
하나 이상의 외인성 핵산이 이종 핵산인, 방법. - 제 161 항에 있어서,
비-천연 미생물 유기체가 실질적으로 혐기성 배양 배지중에 존재하는, 방법. - 제 161 항에 있어서,
PEP 카복시키나제가 PCK1 , pck 및 pckA로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 161 항에 있어서,
3-옥소피멜레이트 데카복실라제가 adc , cbei _3835, CLL _A2135 및 RBAM_030030으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 161 항에 있어서,
3-하이드록시사이클로헥사논 데하이드로게나제가 YMR226c , YDR368w , YOR120w, YGL157w , YGL039w , chnA , Rmet _1335, PP _1946, ARA1 , BDH1 , GCY1 , YPR1 , GRE3 및 Y1R036c로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 161 항에 있어서,
2-사이클로헥사논 하이드라타제가 aroD , aroQ , HIDH 및 HIDM으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 161 항에 있어서,
사이클로헥사논 데하이드로게나제가 NtRed1 , AtDBR1 , P2 , PulR , PtPPDBR , YML131W, ispR , AT3G61220 , cbr , CBR1 , CHO - CR , YIR036C , enr 및 fadH로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 161 항에 있어서,
3-옥소피멜로일-CoA 신세타제가 AF1211 , AF1983 , scs , PAE3250 , sucC , sucD , aliA, ph1 , ph1B , paaF 및 bioW로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 161 항에 있어서,
3-옥소피멜로일-CoA 하이드롤라제(티오에스터에 작용)가 acotl2 , gctA , gctB 및 ACH1 로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 161 항에 있어서,
3-옥소피멜로일-CoA 트랜스퍼라제가 pcaI , pcaJ , catI , catJ , HPAG1 _0676, HPAG1_0677, ScoA , ScoB , OXCT1 , OXCT2 , ctfA , ctfB , atoA 및 atoD로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 160 항 내지 제 166 항 중 어느 한 항에 있어서,
비-천연 미생물 유기체가 3-옥소피멜로일-CoA를 생성하기에 충분한 양으로 발현된 3-옥소피멜로일-CoA 경로 효소를 암호화하는 하나 이상의 외인성 핵산을 포함하는 3-옥소피멜로일-CoA 경로를 추가로 포함하고, 상기 3-옥소피멜로일-CoA 경로가 아세토아세틸-CoA, 3-하이드록시부티릴-CoA 데하이드라타제, 글루타릴-CoA 데하이드로게나제 및 옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제를 포함하는, 방법. - 제 178 항에 있어서,
비-천연 미생물 유기체가 각각 3-옥소피멜로일-CoA 경로 효소를 암호화하는 2개의 외인성 핵산을 포함하는, 방법. - 제 178 항에 있어서,
비-천연 미생물 유기체가 각각 3-옥소피멜로일-CoA 경로 효소를 암호화하는 3개의 외인성 핵산을 포함하는, 방법. - 제 178 항에 있어서,
비-천연 미생물 유기체가 각각 3-옥소피멜로일-CoA 경로 효소를 암호화하는 4개의 외인성 핵산을 포함하는, 방법. - 제 178 항에 있어서,
아세토아세틸-CoA가 Fox2 , phaB , phbB , hbd , Msed _1423, Msed _0399, Msed_0389, Msed _1993, Hbd2 , Hbd1 , HSD17B10 , pimF , fadB , syn _01310 및 syn_01680으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 178 항에 있어서,
3-하이드록시부티릴-CoA 데하이드라타제가 crt , crt1 , pimF , syn _01309, syn_01653, syn _01654, syn _20400, syn _03076, ech , paaA , paaB , phaA , phaB , maoC, paaF, paaG, fadA, fadB, fadI, fadJ 및 fadR로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 178 항에 있어서,
글루타릴-CoA 데하이드로게나제가 gcdH , gcdR , PP _0157, gcvA , gcd , gcdR , syn_00480, syn _01146, gcdA , gcdC , gcdD , gcdB , FN0200 , FN0201 , FN204 , syn_00479, syn_00481, syn_01431 및 syn_00480으로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법. - 제 178 항에 있어서,
옥소피멜로일-CoA:글루타릴-CoA 아실트랜스퍼라제가 bktB , pimB , syn _02642, phaA, h16 _A1713, pcaF , h16 _B1369, h16 _A0170, h16 _A0462, h16 _A1528, h16 _B0381, h16 _B0662, h16 _B0759, h16 _B0668, h16 _A1720, h16 _A1887, phbA , Rmet_1362, Bphy_0975, atoB, thlA, thlB, ERG10 및 catF로 이루어진 군에서 선택된 하나 이상의 유전자에 의해 암호화되는, 방법.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US17879109P | 2009-05-15 | 2009-05-15 | |
| US61/178,791 | 2009-05-15 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120036851A true KR20120036851A (ko) | 2012-04-18 |
Family
ID=43085363
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR20117029936A KR20120036851A (ko) | 2009-05-15 | 2010-05-14 | 사이클로헥사논의 제조를 위한 유기체 |
Country Status (7)
| Country | Link |
|---|---|
| US (2) | US8663957B2 (ko) |
| EP (1) | EP2429587A4 (ko) |
| JP (1) | JP2012526561A (ko) |
| KR (1) | KR20120036851A (ko) |
| AU (1) | AU2010248831A1 (ko) |
| BR (1) | BRPI1012877A2 (ko) |
| WO (1) | WO2010132845A1 (ko) |
Families Citing this family (40)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2009155382A1 (en) | 2008-06-17 | 2009-12-23 | Genomatica, Inc. | Microorganisms and methods for the biosynthesis of fumarate, malate, and acrylate |
| US20100184173A1 (en) * | 2008-11-14 | 2010-07-22 | Genomatica, Inc. | Microorganisms for the production of methyl ethyl ketone and 2-butanol |
| AU2009327490A1 (en) | 2008-12-16 | 2011-07-28 | Genomatica, Inc. | Microorganisms and methods for conversion of syngas and other carbon sources to useful products |
| JP2012526561A (ja) * | 2009-05-15 | 2012-11-01 | ゲノマチカ, インク. | シクロヘキサノンの産生のための生物 |
| WO2010144746A2 (en) * | 2009-06-10 | 2010-12-16 | Genomatica, Inc. | Microorganisms and methods for carbon-efficient biosynthesis of mek and 2-butanol |
| WO2011071682A1 (en) | 2009-12-10 | 2011-06-16 | Genomatica, Inc. | Methods and organisms for converting synthesis gas or other gaseous carbon sources and methanol to 1,3-butanediol |
| SG182686A1 (en) * | 2010-01-29 | 2012-08-30 | Genomatica Inc | Microorganisms and methods for the biosynthesis of p-toluate and terephthalate |
| GB2501143B (en) | 2010-02-12 | 2014-03-26 | Gevo Inc | Yeast microorganisms genetically engineered to improve isobutanol biosynthesis |
| US8637286B2 (en) * | 2010-02-23 | 2014-01-28 | Genomatica, Inc. | Methods for increasing product yields |
| BR112013032517A2 (pt) * | 2011-06-17 | 2017-03-01 | Invista Tech Sarl | método para enriquecer o teor de monômero de uma corrente residual orgânica mista de um processo de oxidação de cicloalcano, composição e método para cultivo contínuo ou em batelada alimentada de microorganismos |
| WO2013003432A1 (en) * | 2011-06-29 | 2013-01-03 | Genomatica, Inc. | Microorganisms for producing succinate and methods related thereto |
| CN104011216A (zh) | 2011-06-30 | 2014-08-27 | 英威达技术有限责任公司 | 用于生产尼龙-7、尼龙-7,7和聚酯的生物转化工艺 |
| CN103998600A (zh) * | 2011-09-07 | 2014-08-20 | 威廉马什莱斯大学 | 通过反向脂肪酸氧化的官能化羧酸和醇 |
| MY197970A (en) | 2011-11-02 | 2023-07-25 | Genomatica Inc | Microorganisms and methods for the production of caprolactone |
| US9102960B2 (en) | 2011-12-16 | 2015-08-11 | Invista North America S.á.r.l. | Methods of producing 6-carbon chemicals via CoA-dependent carbon chain elongation associated with carbon storage |
| US9102958B2 (en) | 2011-12-16 | 2015-08-11 | Invista North America S.á.r.l. | Methods of producing 6-carbon chemicals via CoA-dependent carbon chain elongation associated with carbon storage |
| JP6231011B2 (ja) * | 2011-12-20 | 2017-11-15 | サイエンティスト・オブ・フォーチュン・ソシエテ・アノニム | 3−ヒドロキシアルク−4−エノエートおよび/または3−ホスホノキシアルク−4−エノエートの酵素変換による1,3−ジエンの産生 |
| EP2931907A2 (en) | 2012-12-14 | 2015-10-21 | Invista Technologies S.A R.L. | METHODS OF PRODUCING 7-CARBON CHEMICALS VIA CoA-DEPENDENT CARBON CHAIN ELONGATION ASSOCIATED WITH CARBON STORAGE |
| CN105026569A (zh) | 2012-12-31 | 2015-11-04 | 英威达技术有限责任公司 | 通过丙酮酸和琥珀酸半醛羟醛缩合生产7-碳化学物的方法 |
| CN105189764A (zh) | 2012-12-31 | 2015-12-23 | 英威达技术有限责任公司 | 通过与辅酶b合成相关的c1碳链延伸生产7-碳化学物的方法 |
| US10196657B2 (en) | 2012-12-31 | 2019-02-05 | Invista North America S.A.R.L. | Methods of producing 7-carbon chemicals via methyl-ester shielded carbon chain elongation |
| US9920336B2 (en) | 2012-12-31 | 2018-03-20 | Invista North America S.A.R.L. | Methods of producing 7-carbon chemicals from long chain fatty acids via oxidative cleavage |
| WO2014105796A2 (en) | 2012-12-31 | 2014-07-03 | Invista North America S.A.R.L. | Methods of producing 7-carbon chemicals via aromatic compounds |
| CN105189770A (zh) | 2012-12-31 | 2015-12-23 | 英威达技术有限责任公司 | 通过与环己烷羧酸合成相关的碳链延伸生产7碳化学物的方法 |
| CN105073214A (zh) | 2012-12-31 | 2015-11-18 | 英威达技术有限责任公司 | 通过甲酯保护的碳链延伸生产6碳化学物的方法 |
| EP2971021A4 (en) | 2013-03-15 | 2016-12-21 | Genomatica Inc | MICROORGANISMS AND METHODS FOR PRODUCING BUTADIENE AND RELATED COMPOUNDS BY ASSIMILATING FORMAT |
| PL3077501T3 (pl) | 2013-12-03 | 2022-01-31 | Genomatica, Inc. | Mikroorganizmy i sposoby poprawy wydajności produktu na metanolu z użyciem syntezy acetylo-coa |
| CN113481217A (zh) | 2013-12-13 | 2021-10-08 | 巴斯夫欧洲公司 | 用于精细化学品的改进生产的重组微生物 |
| EP3744830B1 (en) | 2013-12-27 | 2023-11-22 | Genomatica, Inc. | Methods and organisms with increased carbon flux efficiencies |
| EP3143152A1 (en) | 2014-05-15 | 2017-03-22 | Invista Technologies S.à r.l. | Methods of producing 6-carbon chemicals using 2,6-diaminopimelate as precursor to 2-aminopimelate |
| CN106795537A (zh) | 2014-06-16 | 2017-05-31 | 英威达技术有限责任公司 | 用于生物合成化合物的方法、试剂和细胞 |
| CN106795530A (zh) | 2014-06-16 | 2017-05-31 | 英威达技术有限责任公司 | 用于生物合成化合物的方法、试剂和细胞 |
| EP3155111A1 (en) | 2014-06-16 | 2017-04-19 | Invista Technologies S.à r.l. | Process for producing glutarate and glutaric acid methyl ester |
| US9957535B2 (en) | 2014-06-16 | 2018-05-01 | Invista North America S.A.R.L. | Methods, reagents and cells for biosynthesizing compounds |
| US20170298363A1 (en) | 2014-09-18 | 2017-10-19 | Genomatica, Inc | Non-natural microbial organisms with improved energetic efficiency |
| US20210079334A1 (en) | 2018-01-30 | 2021-03-18 | Genomatica, Inc. | Fermentation systems and methods with substantially uniform volumetric uptake rate of a reactive gaseous component |
| US11541105B2 (en) | 2018-06-01 | 2023-01-03 | The Research Foundation For The State University Of New York | Compositions and methods for disrupting biofilm formation and maintenance |
| CN110688745A (zh) * | 2019-09-16 | 2020-01-14 | 北京工业大学 | 基于多目标优化的绿色云数据中心利润最大化方法 |
| CN111662892B (zh) * | 2020-07-29 | 2022-07-01 | 上海市农业科学院 | β-酮己二酸代谢相关三个基因的结构优化与应用 |
| JP7038241B1 (ja) | 2021-03-30 | 2022-03-17 | 旭化成株式会社 | 組換え微生物及びアジピン酸又はその誘導体の製造方法 |
Family Cites Families (122)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3513209A (en) * | 1968-08-19 | 1970-05-19 | Du Pont | Method of making 1,4-cyclohexadiene |
| US4076948A (en) * | 1968-10-10 | 1978-02-28 | El Paso Products Company | Process for treatment of adipic acid mother liquor |
| GB1230276A (ko) | 1968-12-09 | 1971-04-28 | ||
| US3965182A (en) * | 1969-10-02 | 1976-06-22 | Ethyl Corporation | Preparation of aniline from phenol and ammonia |
| JPS4831084B1 (ko) | 1970-09-04 | 1973-09-26 | ||
| GB1344557A (en) | 1972-06-23 | 1974-01-23 | Mitsubishi Petrochemical Co | Process for preparing 1,4-butanediol |
| JPS5543759B2 (ko) * | 1972-06-28 | 1980-11-07 | ||
| DE2455617C3 (de) * | 1974-11-23 | 1982-03-18 | Basf Ag, 6700 Ludwigshafen | Verfahren zur Herstellung von Butandiol und/oder Tetrahydrofuran über die Zwischenstufe des γ-Butyrolactons |
| DE2501499A1 (de) | 1975-01-16 | 1976-07-22 | Hoechst Ag | Verfahren zur herstellung von butandiol-(1.4) |
| US4190495A (en) * | 1976-09-27 | 1980-02-26 | Research Corporation | Modified microorganisms and method of preparing and using same |
| US4301077A (en) * | 1980-12-22 | 1981-11-17 | Standard Oil Company | Process for the manufacture of 1-4-butanediol and tetrahydrofuran |
| JPS60114197A (ja) * | 1983-11-25 | 1985-06-20 | Agency Of Ind Science & Technol | 微生物によるジカルボン酸の製造法 |
| US4871667A (en) * | 1984-11-26 | 1989-10-03 | Agency Of Industrial Science & Technology | Process for preparing muconic acid |
| US4652685A (en) * | 1985-11-15 | 1987-03-24 | General Electric Company | Hydrogenation of lactones to glycols |
| US5168055A (en) | 1986-06-11 | 1992-12-01 | Rathin Datta | Fermentation and purification process for succinic acid |
| US5143834A (en) * | 1986-06-11 | 1992-09-01 | Glassner David A | Process for the production and purification of succinic acid |
| ES2036188T3 (es) * | 1986-06-11 | 1993-05-16 | Michigan Biotechnology Institute | Un procedimiento para la produccion de acido succinico por fermentacion anaerobia. |
| US5182199A (en) * | 1987-05-27 | 1993-01-26 | Hartley Brian S | Thermophilic ethanol production in a two-stage closed system |
| WO1989010410A1 (en) * | 1988-04-27 | 1989-11-02 | Daicel Chemical Industries, Ltd. | Process for preparing optically active 1,3-butanediol |
| AU639237B2 (en) * | 1989-04-27 | 1993-07-22 | Biocontrol Systems, Incorporated | Precipitate test for microorganisms |
| US5192673A (en) * | 1990-04-30 | 1993-03-09 | Michigan Biotechnology Institute | Mutant strain of C. acetobutylicum and process for making butanol |
| US5079143A (en) * | 1990-05-02 | 1992-01-07 | The Upjohn Company | Method of indentifying compounds useful as antiparasitic drugs |
| US5173429A (en) | 1990-11-09 | 1992-12-22 | The Board Of Trustees Of The University Of Arkansas | Clostridiumm ljungdahlii, an anaerobic ethanol and acetate producing microorganism |
| IL100572A (en) | 1991-01-03 | 1997-01-10 | Lepetit Spa | Amides of antibiotic ge 2270 factors their preparation and pharmaceutical compositions containing them |
| US5416020A (en) * | 1992-09-29 | 1995-05-16 | Bio-Technical Resources | Lactobacillus delbrueckii ssp. bulgaricus strain and fermentation process for producing L-(+)-lactic acid |
| US5807722A (en) * | 1992-10-30 | 1998-09-15 | Bioengineering Resources, Inc. | Biological production of acetic acid from waste gases with Clostridium ljungdahlii |
| US6136577A (en) * | 1992-10-30 | 2000-10-24 | Bioengineering Resources, Inc. | Biological production of ethanol from waste gases with Clostridium ljungdahlii |
| FR2702492B1 (fr) * | 1993-03-12 | 1995-05-24 | Rhone Poulenc Chimie | Procédé de production par fermentation d'acide itaconique. |
| US5487987A (en) * | 1993-09-16 | 1996-01-30 | Purdue Research Foundation | Synthesis of adipic acid from biomass-derived carbon sources |
| US5521075A (en) * | 1994-12-19 | 1996-05-28 | Michigan Biotechnology Institute | Method for making succinic acid, anaerobiospirillum succiniciproducens variants for use in process and methods for obtaining variants |
| US5504004A (en) * | 1994-12-20 | 1996-04-02 | Michigan Biotechnology Institute | Process for making succinic acid, microorganisms for use in the process and methods of obtaining the microorganisms |
| US5700934A (en) | 1995-03-01 | 1997-12-23 | Dsm N.V. | Process for the preparation of epsilon-caprolactam and epsilon-caprolactam precursors |
| US5478952A (en) | 1995-03-03 | 1995-12-26 | E. I. Du Pont De Nemours And Company | Ru,Re/carbon catalyst for hydrogenation in aqueous solution |
| US5863782A (en) * | 1995-04-19 | 1999-01-26 | Women's And Children's Hospital | Synthetic mammalian sulphamidase and genetic sequences encoding same |
| US5686276A (en) * | 1995-05-12 | 1997-11-11 | E. I. Du Pont De Nemours And Company | Bioconversion of a fermentable carbon source to 1,3-propanediol by a single microorganism |
| FR2736927B1 (fr) * | 1995-07-18 | 1997-10-17 | Rhone Poulenc Fibres & Polymer | Enzymes a activite amidase, outils genetiques et microorganismes hotes permettant leur obtention et procede d'hydrolyse mettant en oeuvre lesdites enzymes |
| US5573931A (en) * | 1995-08-28 | 1996-11-12 | Michigan Biotechnology Institute | Method for making succinic acid, bacterial variants for use in the process, and methods for obtaining variants |
| US5869301A (en) * | 1995-11-02 | 1999-02-09 | Lockhead Martin Energy Research Corporation | Method for the production of dicarboxylic acids |
| US5770435A (en) * | 1995-11-02 | 1998-06-23 | University Of Chicago | Mutant E. coli strain with increased succinic acid production |
| AU2530797A (en) * | 1996-02-27 | 1997-09-16 | Michigan State University | Cloning and expression of the gene encoding thermoanaerobacter ethanolicus 39E secondary-alcohol dehydrogenase and enzyme biochemical c haracterization |
| US5958745A (en) * | 1996-03-13 | 1999-09-28 | Monsanto Company | Methods of optimizing substrate pools and biosynthesis of poly-β-hydroxybutyrate-co-poly-β-hydroxyvalerate in bacteria and plants |
| JP4101295B2 (ja) * | 1996-07-01 | 2008-06-18 | バイオエンジニアリング・リソーシズ・インコーポレーテツド | 廃ガスからの酢酸の生物学的生産 |
| KR100459818B1 (ko) * | 1996-09-02 | 2004-12-03 | 이. 아이. 두퐁 드 느무르 앤드 컴퍼니 | ε-카프로락탐의 제조방법 |
| US6117658A (en) * | 1997-02-13 | 2000-09-12 | James Madison University | Methods of making polyhydroxyalkanoates comprising 4-hydroxybutyrate monomer units |
| KR100516986B1 (ko) * | 1997-02-19 | 2005-09-26 | 코닌클리즈케 디에스엠 엔.브이. | 6-아미노카프론산 유도체를 과열 수증기와 접촉시킴으로써 촉매 없이 카프로락탐을 제조하는 방법 |
| US6274790B1 (en) * | 1997-04-14 | 2001-08-14 | The University Of British Columbia | Nucleic acids encoding a plant enzyme involved in very long chain fatty acid synthesis |
| KR19990013007A (ko) * | 1997-07-31 | 1999-02-25 | 박원훈 | 형질전환된 대장균 ss373(kctc 8818p)과 이를 이용한숙신산의 생산방법 |
| JPH11103863A (ja) * | 1997-10-08 | 1999-04-20 | Nippon Shokubai Co Ltd | マレイン酸異性化酵素遺伝子 |
| US6280986B1 (en) * | 1997-12-01 | 2001-08-28 | The United States Of America As Represented By The Secretary Of Agriculture | Stabilization of pet operon plasmids and ethanol production in bacterial strains lacking lactate dehydrogenase and pyruvate formate lyase activities |
| BR9909615A (pt) * | 1998-04-13 | 2000-12-12 | Univ Georgia Res Found | Superexpressão de carboxilase de piruvato para a produção intensificada de produtos bioquìmicos derivados de oxaloacetato em células microbianas |
| US20030087381A1 (en) * | 1998-04-13 | 2003-05-08 | University Of Georgia Research Foundation, Inc. | Metabolically engineered organisms for enhanced production of oxaloacetate-derived biochemicals |
| US6159738A (en) | 1998-04-28 | 2000-12-12 | University Of Chicago | Method for construction of bacterial strains with increased succinic acid production |
| US6432686B1 (en) * | 1998-05-12 | 2002-08-13 | E. I. Du Pont De Nemours And Company | Method for the production of 1,3-propanediol by recombinant organisms comprising genes for vitamin B12 transport |
| US6444784B1 (en) * | 1998-05-29 | 2002-09-03 | Exxonmobil Research & Engineering Company | Wax crystal modifiers (LAW657) |
| DE19856136C2 (de) * | 1998-12-04 | 2002-10-24 | Pasteur Institut | Verfahren und Vorrichtung zur Selektion beschleunigter Proliferation lebender Zellen in Suspension |
| EP1147229A2 (en) * | 1999-02-02 | 2001-10-24 | Bernhard O. Palsson | Methods for identifying drug targets based on genomic sequence data |
| US6686310B1 (en) * | 1999-02-09 | 2004-02-03 | E. I. Du Pont De Nemours And Company | High surface area sol-gel route prepared hydrogenation catalysts |
| US6365376B1 (en) * | 1999-02-19 | 2002-04-02 | E. I. Du Pont De Nemours And Company | Genes and enzymes for the production of adipic acid intermediates |
| EP1159435A1 (en) * | 1999-03-05 | 2001-12-05 | Monsanto Technology LLC | Multigene expression vectors for the biosynthesis of products via multienzyme biological pathways |
| EP1183385B1 (en) * | 1999-05-21 | 2006-07-19 | Cargill Dow LLC | Methods and materials for the synthesis of organic products |
| US6852517B1 (en) * | 1999-08-30 | 2005-02-08 | Wisconsin Alumni Research Foundation | Production of 3-hydroxypropionic acid in recombinant organisms |
| US6660857B2 (en) | 2000-02-03 | 2003-12-09 | Dsm N.V. | Process for the preparation of ε-caprolactam |
| US6878861B2 (en) * | 2000-07-21 | 2005-04-12 | Washington State University Research Foundation | Acyl coenzyme A thioesterases |
| MXPA03000711A (es) * | 2000-07-25 | 2003-06-04 | Bioengineering Resources Inc | Metodos para incrementar la produccion de etanol de una fermentacion microbiana. |
| MXPA03004324A (es) * | 2000-11-20 | 2004-01-26 | Cargill Inc | Acido 3-hidroxipropionico y otros compuestos organicos. |
| US7109010B2 (en) * | 2000-11-22 | 2006-09-19 | Nature Works Llc | Methods and materials for the synthesis of organic products |
| CN1358841A (zh) | 2000-12-11 | 2002-07-17 | 云南省微生物研究所 | 云南链霉菌 |
| CN1491282A (zh) * | 2000-12-28 | 2004-04-21 | 丰田自动车株式会社 | 异戊二烯醇的制备方法 |
| EP1362319A2 (en) * | 2001-01-10 | 2003-11-19 | The Penn State Research Foundation | Method and system for modeling cellular metabolism |
| US7127379B2 (en) * | 2001-01-31 | 2006-10-24 | The Regents Of The University Of California | Method for the evolutionary design of biochemical reaction networks |
| CA2439260C (en) * | 2001-03-01 | 2012-10-23 | The Regents Of The University Of California | Models and methods for determining systemic properties of regulated reaction networks |
| US6743610B2 (en) * | 2001-03-30 | 2004-06-01 | The University Of Chicago | Method to produce succinic acid from raw hydrolysates |
| CA2356540A1 (en) * | 2001-08-30 | 2003-02-28 | Emory University | Expressed dna sequences involved in mitochondrial functions |
| CA2466133A1 (en) * | 2001-11-02 | 2003-05-15 | Rice University | Recycling system for manipulation of intracellular nadh availability |
| CA2473716A1 (en) | 2002-01-18 | 2003-07-31 | Cargill, Incorporated | Alanine 2,3- aminomutase |
| EP1473368A4 (en) | 2002-02-06 | 2006-01-25 | Showa Denko Kk | REDUCTASE GENE OF ALPHA SUBSTITUTED ALPHA, BETA-UNSATURATED CARBONYL COMPOUND |
| US20030224363A1 (en) | 2002-03-19 | 2003-12-04 | Park Sung M. | Compositions and methods for modeling bacillus subtilis metabolism |
| RU2205175C1 (ru) * | 2002-03-20 | 2003-05-27 | Институт катализа им. Г.К. Борескова СО РАН | Способ получения циклогексанона |
| AU2003222128A1 (en) * | 2002-03-29 | 2003-10-13 | Genomatica, Inc. | Human metabolic models and methods |
| WO2003095651A1 (fr) | 2002-05-10 | 2003-11-20 | Kyowa Hakko Kogyo Co., Ltd. | Procede de production d'acide mevalonique |
| US7856317B2 (en) | 2002-06-14 | 2010-12-21 | Genomatica, Inc. | Systems and methods for constructing genomic-based phenotypic models |
| AU2003256480B2 (en) * | 2002-07-10 | 2008-03-06 | The Penn State Research Foundation | Method for determining gene knockout strategies |
| US7826975B2 (en) * | 2002-07-10 | 2010-11-02 | The Penn State Research Foundation | Method for redesign of microbial production systems |
| WO2004007688A2 (en) * | 2002-07-15 | 2004-01-22 | Kosan Biosciences, Inc. | Metabolic pathways for starter units in polyketide biosynthesis |
| BRPI0314498B1 (pt) * | 2002-10-04 | 2019-08-20 | E.I. Du Pont De Nemours And Company | Escherichia coli transgênica e método para a bioprodução de 1,3-propanodiol |
| CA2500761C (en) * | 2002-10-15 | 2012-11-20 | Bernhard O. Palsson | Methods and systems to identify operational reaction pathways |
| AU2003287625A1 (en) * | 2002-11-06 | 2004-06-03 | University Of Florida | Materials and methods for the efficient production of acetate and other products |
| WO2004074495A1 (ja) * | 2003-02-24 | 2004-09-02 | Research Institute Of Innovative Technology For The Earth | 微生物による高効率水素製造方法 |
| RU2268300C2 (ru) * | 2003-04-07 | 2006-01-20 | Закрытое акционерное общество "Научно-исследовательский институт Аджиномото-Генетика" | СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИЙ, ОБЛАДАЮЩИХ ПОВЫШЕННОЙ ЭКСПРЕССИЕЙ ГЕНА pckA |
| US7927859B2 (en) * | 2003-08-22 | 2011-04-19 | Rice University | High molar succinate yield bacteria by increasing the intracellular NADH availability |
| BRPI0414300A (pt) | 2003-09-17 | 2006-11-07 | Mitsubishi Chem Corp | método para produzir ácido orgánico não amino |
| US7244610B2 (en) * | 2003-11-14 | 2007-07-17 | Rice University | Aerobic succinate production in bacteria |
| FR2864967B1 (fr) * | 2004-01-12 | 2006-05-19 | Metabolic Explorer Sa | Microorganisme evolue pour la production de 1,2-propanediol |
| DE602005018898D1 (de) * | 2004-01-19 | 2010-03-04 | Dsm Ip Assets Bv | Biochemische synthese von 6-aminocapronsäure |
| US7608700B2 (en) | 2004-03-08 | 2009-10-27 | North Carolina State University | Lactobacillus acidophilus nucleic acid sequences encoding stress-related proteins and uses therefor |
| DE102004031177A1 (de) * | 2004-06-29 | 2006-01-19 | Henkel Kgaa | Neue Geruchsstoffe bildende Genprodukte von Bacillus licheniformis und darauf aufbauende verbesserte biotechnologische Produktionsverfahren |
| WO2006020663A2 (en) * | 2004-08-09 | 2006-02-23 | Rice University | Aerobic succinate production in bacteria |
| US7223567B2 (en) * | 2004-08-27 | 2007-05-29 | Rice University | Mutant E. coli strain with increased succinic acid production |
| WO2006028063A1 (ja) * | 2004-09-09 | 2006-03-16 | Research Institute Of Innovative Technology For The Earth | プロモーター機能を有するdna断片 |
| BRPI0515273A (pt) * | 2004-09-17 | 2008-08-05 | Rice University | bactérias modificadas, célula bacteriana geneticamente planejada, e método para produzir ácidos carbóxilicos em uma cultura bacteriana |
| US7569380B2 (en) * | 2004-12-22 | 2009-08-04 | Rice University | Simultaneous anaerobic production of isoamyl acetate and succinic acid |
| JP2006204255A (ja) * | 2005-01-31 | 2006-08-10 | Canon Inc | アセチル−CoAアシルトランスフェラーゼ遺伝子破壊ポリヒドロキシアルカノエート生産菌、またこれを利用したポリヒドロキシアルカノエート生産方法 |
| EP1874334A4 (en) * | 2005-04-15 | 2011-03-30 | Vascular Biogenics Ltd | COMPOSITIONS WITH BETA 2-GLYCOPROTEIN I-PEPTIDES FOR THE PREVENTION AND / OR TREATMENT OF VASCULAR DISEASES |
| KR100676160B1 (ko) * | 2005-08-19 | 2007-02-01 | 한국과학기술원 | 말릭효소를 코딩하는 유전자로 형질전환된 재조합 미생물 및 이를 이용한 숙신산의 제조방법 |
| KR100679638B1 (ko) * | 2005-08-19 | 2007-02-06 | 한국과학기술원 | 포메이트 디하이드로게나제 d 또는 e를 코딩하는 유전자로 형질전환된 미생물 및 이를 이용한 숙신산의 제조방법 |
| US20070111294A1 (en) * | 2005-09-09 | 2007-05-17 | Genomatica, Inc. | Methods and organisms for the growth-coupled production of succinate |
| US9297028B2 (en) * | 2005-09-29 | 2016-03-29 | Butamax Advanced Biofuels Llc | Fermentive production of four carbon alcohols |
| MX359740B (es) * | 2005-10-26 | 2018-10-09 | Du Pont | Produccion fermentativa de alcoholes de cuatro atomos de carbono. |
| US8962298B2 (en) | 2006-05-02 | 2015-02-24 | Butamax Advanced Biofuels Llc | Recombinant host cell comprising a diol dehydratase |
| US8017364B2 (en) * | 2006-12-12 | 2011-09-13 | Butamax(Tm) Advanced Biofuels Llc | Solvent tolerant microorganisms |
| LT2821494T (lt) * | 2007-03-16 | 2017-04-25 | Genomatica, Inc. | 1,4-butandiolio ir jo pirmtakų biosintezės būdai ir kompozicijos |
| WO2008131286A1 (en) | 2007-04-18 | 2008-10-30 | Gevo, Inc. | Engineered microorganisms for producing isopropanol |
| US20080274522A1 (en) | 2007-05-02 | 2008-11-06 | Bramucci Michael G | Method for the production of 2-butanone |
| WO2008144060A2 (en) * | 2007-05-17 | 2008-11-27 | Tetravitae Bioscience, Inc. | Methods and compositions for producing solvents |
| EP2017344A1 (en) | 2007-07-20 | 2009-01-21 | Nederlandse Organisatie voor toegepast- natuurwetenschappelijk onderzoek TNO | Production of itaconic acid |
| US7947483B2 (en) * | 2007-08-10 | 2011-05-24 | Genomatica, Inc. | Methods and organisms for the growth-coupled production of 1,4-butanediol |
| EP2198039A4 (en) | 2007-10-12 | 2012-05-09 | Univ California | MODIFIED MICROORGANISM FOR PRODUCING ISOPROPANOL |
| CA2712779C (en) | 2008-01-22 | 2021-03-16 | Genomatica, Inc. | Methods and organisms for utilizing synthesis gas or other gaseous carbon sources and methanol |
| CN103555643B (zh) * | 2008-03-27 | 2016-08-10 | 基因组股份公司 | 用于产生己二酸和其他化合物的微生物 |
| WO2009155382A1 (en) * | 2008-06-17 | 2009-12-23 | Genomatica, Inc. | Microorganisms and methods for the biosynthesis of fumarate, malate, and acrylate |
| US8354563B2 (en) * | 2008-10-16 | 2013-01-15 | Maverick Biofuels, Inc. | Methods and apparatus for synthesis of alcohols from syngas |
| JP2012526561A (ja) * | 2009-05-15 | 2012-11-01 | ゲノマチカ, インク. | シクロヘキサノンの産生のための生物 |
-
2010
- 2010-05-14 JP JP2012511059A patent/JP2012526561A/ja active Pending
- 2010-05-14 BR BRPI1012877A patent/BRPI1012877A2/pt not_active IP Right Cessation
- 2010-05-14 KR KR20117029936A patent/KR20120036851A/ko not_active Application Discontinuation
- 2010-05-14 AU AU2010248831A patent/AU2010248831A1/en not_active Abandoned
- 2010-05-14 US US12/780,802 patent/US8663957B2/en active Active
- 2010-05-14 EP EP10775646.2A patent/EP2429587A4/en not_active Withdrawn
- 2010-05-14 WO PCT/US2010/035015 patent/WO2010132845A1/en active Application Filing
-
2014
- 2014-02-04 US US14/172,079 patent/US9139853B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| EP2429587A4 (en) | 2014-10-08 |
| WO2010132845A1 (en) | 2010-11-18 |
| US9139853B2 (en) | 2015-09-22 |
| AU2010248831A1 (en) | 2011-11-24 |
| JP2012526561A (ja) | 2012-11-01 |
| BRPI1012877A2 (pt) | 2016-04-05 |
| US20110014668A1 (en) | 2011-01-20 |
| EP2429587A1 (en) | 2012-03-21 |
| US20140356919A1 (en) | 2014-12-04 |
| US8663957B2 (en) | 2014-03-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US9139853B2 (en) | Organisms for the production of cyclohexanone | |
| US10415063B2 (en) | Semi-synthetic terephthalic acid via microorganisms that produce muconic acid | |
| US20220290192A1 (en) | Organisms for the production of 1,3-butanediol | |
| CN102625845A (zh) | 协同产生异丙醇与伯醇,二元醇和酸的微生物和方法 | |
| KR20120068763A (ko) | 아이소프로판올, n-부탄올 및 아이소부탄올 생산 유기체 | |
| WO2020068900A1 (en) | Aldehyde dehydrogenase variants and methods of using same | |
| US20210079334A1 (en) | Fermentation systems and methods with substantially uniform volumetric uptake rate of a reactive gaseous component | |
| WO2018183640A1 (en) | 3-hydroxybutyryl-coa dehydrogenase variants and methods of use | |
| US20120329111A1 (en) | Microorganisms for Producing Cyclohexanone and Methods Related Thereto | |
| CA3159562A1 (en) | Microorganisms and methods for reducing by-products |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |