KR20110073494A - 시냅스 소포 순환 검정 및 시스템 - Google Patents
시냅스 소포 순환 검정 및 시스템 Download PDFInfo
- Publication number
- KR20110073494A KR20110073494A KR1020117007795A KR20117007795A KR20110073494A KR 20110073494 A KR20110073494 A KR 20110073494A KR 1020117007795 A KR1020117007795 A KR 1020117007795A KR 20117007795 A KR20117007795 A KR 20117007795A KR 20110073494 A KR20110073494 A KR 20110073494A
- Authority
- KR
- South Korea
- Prior art keywords
- platform
- synaptic vesicle
- wells
- neuronal cells
- range
- Prior art date
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/52—Use of compounds or compositions for colorimetric, spectrophotometric or fluorometric investigation, e.g. use of reagent paper and including single- and multilayer analytical elements
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/5044—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics involving specific cell types
- G01N33/5058—Neurological cells
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/483—Physical analysis of biological material
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/536—Immunoassay; Biospecific binding assay; Materials therefor with immune complex formed in liquid phase
- G01N33/542—Immunoassay; Biospecific binding assay; Materials therefor with immune complex formed in liquid phase with steric inhibition or signal modification, e.g. fluorescent quenching
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/58—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6872—Intracellular protein regulatory factors and their receptors, e.g. including ion channels
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2500/00—Screening for compounds of potential therapeutic value
- G01N2500/10—Screening for compounds of potential therapeutic value involving cells
Abstract
본 발명은 부분적으로 시냅스 소포 순환의 양상을 분석하기 위한 플랫폼을 제공한다. 다른 측면에 따라, 본 발명은 시냅스 소포 순환의 양상을 분석하기 위한 뉴런 세포 배양 플랫폼 및 플랫폼들을 제공한다. 다른 측면에 따라, 본 발명은 다수의 세포에서 시냅스 소포 순환의 양상을 측정하는 방법을 제공한다. 다른 측면에 따라, 본 발명은 시냅스 소포 순환의 양상의 조절제로서 시험 물질을 확인하는 방법을 제공한다.
Description
관련 출원
본 출원은 35 U.S.C.§119(e) 하에, 그 전체가 본원에 참조로 포함되어 있는 미국 가출원 번호 제61/094,361호 (2008년 9월 4일 출원)로부터의 우선권을 주장한다.
발명의 분야
본 발명은 시냅스 전달의 조절제를 확인하기 위한 시스템 및 방법에 관한 것이다.
시냅스 소포 순환은 신경 전달에 중요하다. 이 과정은 전형적으로 신경 말단에서 일어나고, 신경 전달 물질을 방출하는 소포 외분비작용 (exocytosis) 단계, 빈 소포의 내분비작용 (endocytosis) 단계, 및 소포의 재순환 및 재사용 단계를 포함한다. 시냅스 소포 내에 함유된 신경 전달 물질 수송체는 신경 전달 물질을 소포에 적재한다. 적재된 소포는 말단 원형질 막으로 전위되고, 여기서 이들은 활성 구역 근처에서 선택적으로 도킹하고, 융합할 수 있게 된다. 전형적으로, 세포내 칼슘 농도의 증가는 소포 융합 및 시냅스 틈새 (cleft)로의 신경 전달 물질의 방출을 개시한다. 이후, 신경 전달 물질은 수용체에 결합하여 수용체를 활성화시킬 수 있다. 융합 후, 소포 단백질 및 막은 클라스린 (clathrin)-매개 내분비작용에 의해 회수되고, 신경 전달 물질로 재충전되고, 후속 방출을 위해서 재순환된다. 따라서, 신경 전달은 외분비작용 및 내분비작용의 반복적인 에피소드를 통한 시냅스 소포의 적당한 순환을 포함한다. 시냅스 소포 순환이 붕괴되면 다양한 정신의학 및 신경학적 장애로 귀결될 수 있다.
발명의 요약
본 발명은 부분적으로 뉴런 세포에서 활동 전위의 자극 및 다수의 뉴런 세포 배양액에서 시냅스 전달의 양상의 검출을 동시에 가능하게 하는 신규한 플랫폼 및 방법의 개발에 기초한다. 일부 측면에서, 본 발명은 고-처리량 형식으로 시냅스 전달을 분석하는 것과 연관된, 오랫동안 지속된 도전과제를 극복한다. 따라서, 본 발명은, 일부 측면에서, 고-처리량 방식의 시냅스 전달 조절제를 확인하기 위한 플랫폼 및 방법을 제공한다. 또한, 본 발명은 본원에 개시된 신규한 플랫폼 및 방법을 사용하여, 시냅스 소포 순환의 양상을, 일부 경우에는, 낮은 개구수의 공기 대물 렌즈의 정렬을 사용하여 고 감도의 고-처리량 방식으로 검출할 수 있다는 발견에 기초한다. 따라서, 일부 측면에서, 본 발명은 고-처리량 방식으로 시냅스 소포 순환의 양상을 분석하기 위한 플랫폼 및 방법을 제공한다. 다른 측면에서, 본 발명은 다중 병렬 배양액에서 시냅스 소포 순환의 양상을 분석하기 위한 뉴런 세포 배양 플랫폼을 제공한다.
본 발명은 시냅스 소포 순환의 조절제를 확인하기 위한 플랫폼, 시스템 및 방법을 제공한다. 그 중에서도, 본 발명의 방법 및 시스템은 시냅스 소포 순환 경로를 특징화하는데 사용하기 위한 시약 및 도구뿐만 아니라 그러한 경로를 모니터링 및/또는 조절하는데 사용하기 위한 진단제 및/또는 치료제를 확인할 수 있다.
몇몇 실시양태에서, 본 발명은, 예를 들어 시냅스 소포 순환 활성의 적어도 하나의 양상에 기초한 시냅스 소포 순환 검정법을 제공한다. 일부 실시양태에서, 시냅스 소포 순환 검정법은 시냅스 소포 순환의 동역학, 효율 및/또는 기타 특징들을 모니터링한다 (예를 들어, 주파수, 지속 시간 및/또는 시냅스 피로).
몇몇 실시양태에서, 본 발명은 본 발명 따른 시냅스 소포 순환 검정법을 사용하여 시냅스 소포 순환을 조절 (예를 들어, 자극 및/또는 억제)하는 작용제를 확인하기 위한 시스템 및 방법을 제공한다.
본 발명에 따른 조절제는 임의 부류의 화학적 개체 (예를 들어, 폴리펩티드, 핵산, 항체, 소분자, 탄수화물, 지질, 미생물 등)일 수 있다.
본 발명에 따라 이용되는 시냅스 소포 순환 검정법은 전형적으로 다수의 세포 (예를 들어, 기능적 시냅스 소포 순환, 또는 시냅스 소포 순환의 적어도 하나의 활성을 발휘하는 전시냅스 말단을 갖는 적어도 하나의 세포를 포함함), 리포터 (예를 들어, 시냅스 소포 순환, 또는 시냅스 소포 순환의 적어도 하나의 활성을 추적하는데 유용한 리포터), 자극 시스템 (예를 들어, 활동 전위 개시를 통해 시냅스 소포 순환을 개시하기 위한 전기, 음향, 초음파 또는 광학 자극 시스템) 및 검출 시스템 (예를 들어, 리포터에 의해 발생되는 신호를 포획하기 위한 영상 시스템)을 포함한다.
몇몇 실시양태에서, 시냅스 소포 순환 검정은 고-처리량 형식으로 배치되고/거나 실시된다. 예를 들어, 본 발명에 따른 방법은 단일 기구를 사용하여 동시에 다수의 시냅스 소포 순환 검정 (예를 들어, 적어도 4, 16회 또는 그 이상의 시냅스 소포 순환 검정)을 측정하는 단계를 포함할 수 있다. 일부 실시양태에서, 본 발명에 따른 방법은 단일 기구 상에서 시간 당 적어도 24회 (예를 들어, 적어도 48, 96, 384회 또는 그 이상) 시냅스 소포 순환 검정을 측정하는 단계를 포함할 수 있다. 일부 실시양태에서, 본 발명에 따라 이용되는 기구를 다중-웰 플레이트 (예를 들어, 24, 48, 96 또는 384-웰 플레이트)의 스크리닝에 적합하게 한다.
본 발명의 일 측면에 따라, 시냅스 소포 순환의 양상을 분석하기 위한 플랫폼이 제공된다. 플랫폼은 a) 다수의 웰; b) 다수의 전극쌍 (여기서, 각 전극쌍은 (i) 웰 내 배치를 위해서, 그리고 (ii) 웰 내 다수의 뉴런 세포에서 시냅스 소포 순환을 유도하기에 적합한 전기장을 생성하도록 배열됨); 및 c) 다수의 검출기를 포함하는 검출 시스템 (여기서, 각 검출기는 웰 중에 존재하는 뉴런 세포의 전시냅스 단백질에 부착된 리포터 분자로부터의 발광 신호를 검출하도록 배열되고, 발광 신호의 존재는 뉴런 세포 중 시냅스 소포 순환의 양상을 나타냄)을 포함한다. 일부 실시양태에서, 다수의 웰은 다수의 뉴런 세포를 포함한다. 일부 실시양태에서, 웰 중 다수의 뉴런 세포는 10 내지 1,000,000개 뉴런 세포의 범위이다. 특정 실시양태에서, 웰 중 다수의 뉴런 세포는 1000 내지 4000개 세포/mm2 (웰 기저부 면적)의 범위이다. 일부 실시양태에서, 다수의 뉴런 세포는 적어도 2종의 상이한 뉴런 세포 유형을 포함한다. 특정 실시양태에서, 뉴런 세포는 일차 뉴런이고, 임의로 일차 뉴런은 래트 (rat) 일차 뉴런이다. 특정 실시양태에서, 뉴런 세포는 글루타메이트성, GABA성, 도파민작용성, 아드레날린성, 세로토닌성 및 콜린성 뉴런 세포로 구성되는 군으로부터 선택된다. 일부 실시양태에서, 전극쌍의 각 전극은 실질적으로 곡선 표면을 갖는다. 일부 실시양태에서, 각 전극쌍의 전극은 실질적으로 동심 원통이고, 여기서 동심 원통은 환상 절연 물질에 의해 분리된다. 일부 실시양태에서, 플랫폼은 또한 다수의 웰 중 하나의 웰로 다수의 전극쌍의 각 전극쌍을 작동가능하게 위치시키도록 배열된 전극 전달 시스템을 포함한다. 특정 실시양태에서, 플랫폼은 또한 다수의 전극에 작동가능하게 연결된 전력원을 포함한다. 일부 실시양태에서, 전력원은 각 전극쌍을 가로질러 미리 결정된 전압을 가하도록 배열된다. 일부 실시양태에서, 전압은 1 V 내지 400 V 범위이다. 특정 실시양태에서, 전압은 5 V 내지 20 V 범위이다. 일부 실시양태에서, 플랫폼은 또한 전원 및 다수의 전극쌍에 작동가능하게 연결된 펄스 발생기를 포함하고, 여기서 펄스 발생기는 각 전극쌍을 가로질러 미리 결정된 전압 펄스를 가하도록 배열된다. 일부 실시양태에서, 펄스 발생기는 미리 결정된 주파수에서 미리 결정된 시간 동안 다수의 미리 결정된 전압 펄스를 가하도록 배열된다. 특정 실시양태에서, 미리 결정된 주파수는 0.2 Hz 내지 100 Hz 범위이다. 일부 실시양태에서, 미리 결정된 주파수는 10 Hz 내지 50 Hz 범위이다. 일부 실시양태에서, 미리 결정된 시간은 최대 2분이다. 일부 실시양태에서, 미리 결정된 시간은 0.1 내지 20초 범위이다. 특정 실시양태에서, 미리 결정된 시간은 5 내지 15초 범위이다. 일부 실시양태에서, 각 펄스의 지속 시간은 최대 10 msec이다. 일부 실시양태에서, 각 펄스의 지속 시간은 0.1 msec 내지 2 msec 범위이다. 일부 실시양태에서, 각 펄스의 개시 사이의 지속 시간은 0.1 내지 5 msec 범위이다. 특정 실시양태에서, 펄스의 수는 1 내지 1000 범위이다. 일부 실시양태에서, 플랫폼은 또한 펄스 발생기에 작동가능하게 연결된 컴퓨터를 포함하고, 여기서 컴퓨터는 전압 펄스를 제어하도록 배열된다. 일부 실시양태에서, 각 검출기는 광학 센서를 포함한다. 일부 실시양태에서, 각 검출기는 웰로부터의 발광 신호를 수집하도록 설정된 대물 렌즈를 포함한다. 특정 실시양태에서, 대물 렌즈는 0.2 mm 내지 5 mm 범위의 필드 (field) 영역으로부터의 발광 신호를 수집하도록 배열된다. 일부 실시양태에서, 대물 렌즈의 개구수는 0.4 내지 1.4 범위이다. 일부 실시양태에서, 대물 렌즈의 개구수는 0.5이다. 특정 실시양태에서, 대물 렌즈는 유침 또는 수침 렌즈가 아니다. 일부 실시양태에서, 검출 시스템은 각 검출기에 작동가능하게 연결된 전하-결합 소자 카메라를 포함한다. 일부 실시양태에서, 다수의 검출기는 다수의 웰로부터의 신호를 동시에 검출하도록 배열된다. 특정 실시양태에서, 검출 시스템은 검출기에 작동가능하게 연결된 컴퓨터를 포함하고, 여기서 컴퓨터는 검출기로부터의 발광 신호를 뉴런 세포에서 시냅스 소포 순환의 양상을 특성화하는 데이터로 변환시키도록 배열된다. 일부 실시양태에서, 각 검출기는 다수의 리포터 분자로부터의 발광 신호를 검출하도록 배열된다. 일부 실시양태에서, 각 검출기는 다수의 시냅스로부터의 발광 신호를 검출하도록 배열된다. 특정 실시양태에서, 각 검출기는 다수의 뉴런 세포로부터의 발광 신호를 검출하도록 배열된다. 일부 실시양태에서, 시냅스 소포 단백질은 VAMP2, vGlut1, 시냅토파이신, 소포 GABA 수송체, 아세틸콜린 수송체, 카테콜아민 수송체 또는 시냅토타그민이다. 일부 실시양태에서, 다수의 뉴런 세포는 내강 부분을 갖는 시냅스 소포 단백질을 발현시키고, 여기서 시냅스 소포 단백질은 리포터 분자에 부착된다. 일부 실시양태에서, 리포터 분자는 시냅스 소포 단백질의 내강 부분에 부착된다. 특정 실시양태에서, 리포터 분자는 pH 민감성 형광 단백질이다. 일부 실시양태에서, 리포터 분자는 플루오린 (pHluorin)이다. 일부 실시양태에서, 리포터 분자는 서열 1 (hSyn-SypHy)에 설명된 서열을 포함한다. 일부 실시양태에서, 7.0 내지 8.0 범위의 pH에서, pH 민감성 리포터는 5.0 내지 6.0 범위의 pH에서보다 유의하게 더 큰 강도로 형광을 낸다. 특정 실시양태에서, 5.0 내지 6.0 범위의 pH에서, pH 민감성 리포터는 7.0 내지 8.0 범위의 pH에서보다 유의하게 더 큰 강도로 형광을 낸다. 일부 실시양태에서, 발광 신호는 475 nm 내지 525 nm 범위의 형광 신호이다.
본 발명의 또다른 측면에 따라, 시냅스 소포 순환의 양상을 분석하기 위한 플랫폼이 제공된다. 플랫폼은 a) 다수의 웰 (여기서, 각 웰은 다수의 뉴런 세포를 포함함); b) 다수의 전극쌍 (여기서, 각 전극쌍은 다수의 웰 중 하나에 위치하고, 각 전극쌍은 웰 중에 존재하는 뉴런 세포에서 시냅스 소포 순환을 유도하기에 충분한 전기장을 생성하도록 배열됨); 및 c) 다수의 검출기를 포함하는 검출 시스템 (여기서, 각 검출기는 적어도 다수의 뉴런 세포의 하위 집합으로부터의 발광 신호를 검출하도록 배열되고, 발광 신호는 시냅스 소포 순환의 양상을 나타냄)을 포함한다. 일부 실시양태에서, 다수의 뉴런 세포는 시냅스 소포 단백질에 부착된 리포터 분자를 포함한다.
본 발명의 또다른 측면에 따라, 시냅스 소포 순환의 양상을 분석하기 위한 플랫폼이 제공되고, 플랫폼은 a) 다수의 웰 (여기서, 각 웰은 다수의 뉴런 세포를 포함하고, 다수의 뉴런 세포는 시냅스 소포 단백질에 부착된 리포터 분자를 포함함); b) 웰 중에 존재하는 뉴런 세포에서 시냅스 소포 순환을 유도하도록 배열된 자극기 시스템; 및 c) 다수의 검출기를 포함하는 검출 시스템 (여기서, 각 검출기는 웰 중에 존재하는 적어도 다수의 뉴런 세포의 하위 집합으로부터의 발광 신호를 검출하도록 설정되고, 발광 신호는 시냅스 소포 순환의 양상을 나타냄)을 포함한다.
특정 실시양태에서, 시냅스 소포 단백질은 내강 부분을 포함한다. 상기 임의의 측면의 일부 실시양태에서, 자극기 시스템은 다수의 전극쌍을 포함하고, 여기서 각 전극쌍은 다수의 웰 중 하나에 위치하고, 각 전극쌍은 웰 중에 존재하는 뉴런 세포에서 시냅스 소포 순환을 유도하기에 충분한 전기장을 생성하도록 배열된다. 상기 임의의 측면의 일부 실시양태에서, 웰 중 다수의 뉴런 세포는 10 내지 100,000개 뉴런 세포의 범위이다. 임의의 상기 플랫폼의 특정 실시양태에서, 웰 중 다수의 뉴런 세포는 1000 내지 4000 세포/mm2 (웰 기저부 면적) 범위이다. 임의의 상기 플랫폼의 일부 실시양태에서, 다수의 뉴런 세포는 적어도 2종의 상이한 뉴런 세포 유형을 포함한다. 임의의 상기 플랫폼의 일부 실시양태에서, 뉴런 세포는 일차 뉴런이고, 임의로 일차 뉴런은 래트 일차 뉴런이다. 임의의 상기 플랫폼의 일부 실시양태에서, 뉴런 세포는 글루타메이트성, GABA성, 도파민작용성, 아드레날린성, 세로토닌성 및 콜린성 뉴런 세포로 구성되는 군으로부터 선택된다. 임의의 상기 플랫폼의 특정 실시양태에서, 뉴런 세포는 리포터 분자에 융합된, 내강 부분을 갖는 시냅스 소포 단백질을 발현시키는 트랜스진(transgene)을 포함한다. 임의의 상기 플랫폼의 일부 실시양태에서, 전극쌍의 각 전극은 실질적으로 곡선 표면을 갖는다. 임의의 상기 플랫폼의 일부 실시양태에서, 각 전극쌍의 전극은 실질적으로 동심 원통이고, 여기서 동심 원통은 환상 절연 물질에 의해 분리된다. 임의의 상기 플랫폼의 일부 실시양태에서, 플랫폼은 또한 다수의 전극쌍의 각 전극쌍을 다수의 웰 중 한 웰로 작동가능하게 위치시키도록 배열된 전극 전달 시스템을 포함한다. 임의의 상기 플랫폼의 특정 실시양태에서, 플랫폼은 또한 다수의 전극에 작동가능하게 연결된 전력원을 포함한다. 임의의 상기 플랫폼의 일부 실시양태에서, 전력원은 각 전극쌍을 가로질러 미리 결정된 전압을 가하도록 배열된다. 임의의 상기 플랫폼의 일부 실시양태에서, 전압은 1 V 내지 400 V 범위이다. 임의의 상기 플랫폼의 특정 실시양태에서, 전압은 5 V 내지 20 V 범위이다. 임의의 상기 플랫폼의 일부 실시양태에서, 플랫폼은 또한 전력원 및 다수의 전극쌍에 작동가능하게 연결된 펄스 발생기를 포함하고, 여기서 펄스 발생기는 각 전극쌍을 가로질러 미리 결정된 전압 펄스를 가하도록 배열된다. 임의의 상기 플랫폼의 일부 실시양태에서, 펄스 발생기는 미리 결정된 주파수에서 미리 결정된 시간 동안 다수의 미리 결정된 전압 펄스를 가하도록 배열된다. 임의의 상기 플랫폼의 특정 실시양태에서, 미리 결정된 주파수는 0.2 Hz 내지 100 Hz 범위이다. 임의의 상기 플랫폼의 일부 실시양태에서, 미리 결정된 주파수는 10 Hz 내지 50 Hz 범위이다. 임의의 상기 플랫폼의 일부 실시양태에서, 미리 결정된 시간은 최대 2분이다. 임의의 상기 플랫폼의 일부 실시양태에서, 미리 결정된 시간은 0.1 내지 20초 범위이다. 임의의 상기 플랫폼의 특정 실시양태에서, 미리 결정된 시간은 5 내지 15초 범위이다. 임의의 상기 플랫폼의 일부 실시양태에서, 각 펄스의 지속 시간은 최대 10 msec이다. 임의의 상기 플랫폼의 일부 실시양태에서, 각 펄스의 지속 시간은 0.1 msec 내지 2 msec 범위이다. 임의의 상기 플랫폼의 특정 실시양태에서, 각 펄스의 개시 사이의 지속 시간은 0.1 내지 5 msec 범위이다. 임의의 상기 플랫폼의 일부 실시양태에서, 펄스의 수는 1 내지 1000 범위이다. 임의의 상기 플랫폼의 일부 실시양태에서, 플랫폼은 또한 펄스 발생기에 작동가능하게 연결된 컴퓨터를 포함하고, 여기서 컴퓨터는 전압 펄스를 제어하도록 배열된다. 임의의 상기 플랫폼의 특정 실시양태에서, 각 검출기는 광학 센서를 포함한다. 임의의 상기 플랫폼의 일부 실시양태에서, 각 검출기는 웰로부터의 발광 신호를 수집하도록 배열된 대물 렌즈를 포함한다. 임의의 상기 플랫폼의 일부 실시양태에서, 대물 렌즈는 0.2 mm 내지 5 mm 범위의 필드 영역으로부터의 발광 신호를 수집하도록 배열된다. 임의의 상기 플랫폼의 일부 실시양태에서, 대물 렌즈의 개구수는 0.4 내지 1.4 범위이다. 임의의 상기 플랫폼의 특정 실시양태에서, 대물 렌즈의 개구수는 0.5이다. 임의의 상기 플랫폼의 일부 실시양태에서, 대물 렌즈는 유침 또는 수침 렌즈가 아니다. 임의의 상기 플랫폼의 일부 실시양태에서, 검출 시스템은 각 검출기에 작동가능하게 연결된 전하-결합 소자 카메라를 포함한다. 임의의 상기 플랫폼의 특정 실시양태에서, 다수의 검출기는 다수의 웰로부터의 신호를 동시에 검출하도록 배열된다. 임의의 상기 플랫폼의 일부 실시양태에서, 검출 시스템은 검출기에 작동가능하게 연결된 컴퓨터를 포함하고, 여기서 컴퓨터는 검출기로부터의 발광 신호를 뉴런 세포에서 시냅스 소포 순환의 양상을 특징화하는 데이터로 변환시키도록 배열된다. 임의의 상기 플랫폼의 일부 실시양태에서, 각 검출기는 다수의 리포터 분자로부터의 발광 신호를 검출하도록 배열된다. 임의의 상기 플랫폼의 일부 실시양태에서, 각 검출기는 다수의 시냅스로부터의 발광 신호를 검출하도록 배열된다. 임의의 상기 플랫폼의 특정 실시양태에서, 각 검출기는 다수의 뉴런 세포로부터의 발광 신호를 검출하도록 배열된다. 임의의 상기 플랫폼의 일부 실시양태에서, 시냅스 소포 단백질은 VAMP2, vGlut1, 시냅토파이신, 소포 GABA 수송체, 아세틸콜린 수송체, 카테콜아민 수송체 또는 시냅토타그민이다. 임의의 상기 플랫폼의 일부 실시양태에서, 리포터 분자는 시냅스 소포 단백질의 내강 부분에 부착된다. 임의의 상기 플랫폼의 특정 실시양태에서, 리포터 분자는 pH 민감성 형광 단백질이다. 임의의 상기 플랫폼의 일부 실시양태에서, 리포터 분자는 플루오린이다. 임의의 상기 플랫폼의 일부 실시양태에서, 리포터 분자는 서열 1 (hSyn-SypHy)에 설명된 서열을 포함한다. 임의의 상기 플랫폼의 특정 실시양태에서, 7.0 내지 8.0 범위의 pH에서, pH 민감성 리포터는 5.0 내지 6.0 범위의 pH에서보다 유의하게 더 큰 강도로 형광을 낸다. 임의의 상기 플랫폼의 일부 실시양태에서, 5.0 내지 6.0 범위의 pH에서, pH 민감성 리포터는 7.0 내지 8.0 범위의 pH에서보다 유의하게 더 큰 강도로 형광을 낸다. 임의의 상기 플랫폼의 일부 실시양태에서, 발광 신호는 475 nm 내지 525 nm 범위의 형광 신호이다.
본 발명의 또다른 측면에서, 시냅스 소포 순환의 양상을 분석하기 위한 플랫폼이 제공된다. 상기 플랫폼은 a) 다수의 웰; b) 다수의 전극쌍 (여기서, 각각의 전극쌍은 (i) 웰 내 배치를 위해서, 및 (ii) 웰 내 다수의 뉴런 세포에서의 시냅스 소포 순환을 유도하는 데 적합한 전기장을 생성하도록 배열됨); 및 c) 웰에 존재하는 뉴런 세포의 시냅스 소포 단백질에 부착된 리포터 분자로부터의 발광 신호를 검출하기 위해 배열된 대물 렌즈를 포함하는 검출 시스템 (여기서 발광 신호의 존재는 뉴런 세포에서의 시냅스 소포 순환의 양상을 나타냄)을 포함한다. 일부 실시양태에서, 다수의 웰은 다수의 뉴런 세포를 포함한다.
본 발명의 또다른 측면에 따라, 시냅스 소포 순환의 양상을 분석하기 위한 뉴런 세포 배양 플랫폼이 제공된다. 상기 플랫폼은 a) 다수의 웰 (여기서, 각각의 웰은 다수의 뉴런 세포를 포함함); b) 다수의 전극쌍 (여기서, 각각의 전극쌍은 다수의 웰 중 하나의 내부에 위치하고, 각각의 전극쌍은 웰에 존재하는 뉴런 세포에서의 시냅스 소포 순환을 유도하기에 충분한 전기장을 생성하도록 배열됨); 및 c) 웰에 존재하는 뉴런 세포의 시냅스 소포 단백질에 부착된 리포터 분자로부터의 발광 신호를 수집하도록 배열된 대물 렌즈를 포함하는 검출 시스템 (여기서 발광 신호의 존재는 뉴런 세포에서의 시냅스 소포 순환의 양상을 나타냄)을 포함한다.
본 발명의 또다른 측면에서, a) 다수의 웰 (여기서, 각각의 웰은 다수의 뉴런 세포를 포함하고, 다수의 뉴런 세포는 소포 단백질에 부착된 리포터 분자를 포함함); b) 웰에 존재하는 뉴런 세포에서의 시냅스 소포 순환을 유도하도록 배열된 자극기 시스템; 및 c) 웰에 존재하는 뉴런 세포의 시냅스 소포 단백질에 부착된 리포터 분자로부터의 발광 신호를 수집하도록 배열된 대물 렌즈를 포함하는 검출 시스템 (여기서 발광 신호의 존재는 뉴런 세포에서의 시냅스 소포 순환의 양상을 나타냄)을 포함하는, 시냅스 소포 순환의 양상을 분석하기 위한 뉴런 세포 배양 플랫폼이 제공된다. 특정 실시양태에서, 상기 자극기 시스템은 다수의 전극쌍을 포함하며, 여기서 각 전극쌍은 다수의 웰 중 하나의 내부에 위치하고, 각 전극쌍은 웰에 존재하는 뉴런 세포에서의 시냅스 소포 순환을 유도하기에 충분한 전기장을 생성하도록 배열된다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 시냅스 소포 단백질은 내강 부분을 포함한다. 본 발명의 상기 임의의 측면의 특정 실시양태에서, 대물 렌즈는 유(油) 또는 수(水) 대물 렌즈이다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 대물 렌즈는 공기 대물 렌즈이다. 본 발명의 상기 임의의 측면의 특정 실시양태에서, 대물 렌즈는 광학 검출기에 작동가능하게 연결된다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 광학 검출기는 전하-결합 소자 카메라이다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 플랫폼은 적어도 5개의 활동 전위를 생성하도록 자극된 뉴런 세포의 시냅스 소포 단백질에 부착된 리포터 분자로부터의 발광 신호를 검출하기 위해 배열된다. 본 발명의 상기 임의의 측면의 특정 실시양태에서, 검출 시스템은 다수의 대물 렌즈를 포함한다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 웰에 존재하는 다수의 뉴런 세포는 10 내지 100,000개 범위의 뉴런 세포이다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 웰에 존재하는 다수의 뉴런 세포는 웰 기저부 면적 mm2 당 1000 내지 4000개 범위의 세포이다. 본 발명의 상기 임의의 측면의 특정 실시양태에서, 다수의 뉴런 세포는 적어도 2종의 상이한 뉴런 세포 유형을 포함한다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 뉴런 세포는 일차 뉴런이고, 임의로는 여기서 상기 일차 뉴런은 래트 일차 뉴런이다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 뉴런 세포는 글루타메이트성, GABA성, 도파민작용성, 아드레날린성, 세로토닌성, 및 콜린성 뉴런 세포로 이루어진 군으로부터 선택된다. 본 발명의 상기 임의의 측면의 특정 실시양태에서, 뉴런 세포는 리포터 분자에 융합된, 내강 부분을 갖는, 시냅스 소포 단백질을 발현하는 트랜스진을 포함한다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 전극쌍의 각 전극은 실질적으로 곡선 표면을 갖는다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 각 전극쌍의 전극은 실질적으로 동심 원통이고, 여기서 상기 동심 원통은 환상 절연 물질에 의해 분리된다. 본 발명의 상기 임의의 측면의 특정 실시양태에서, 상기 플랫폼은 또한 다수의 전극쌍의 각 전극쌍을 다수의 웰 중 한 웰에 작동가능하게 위치하도록 배열된 전극 전달 시스템을 포함한다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 상기 플랫폼은 또한 다수의 전극에 작동가능하게 연결된 전원을 포함한다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 상기 전원은 각 전극쌍을 가로질러 미리 결정된 전압을 가하도록 배열된다. 본 발명의 상기 임의의 측면의 특정 실시양태에서, 전압은 1 V 내지 400 V의 범위이다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 전압은 5 V 내지 20 V의 범위이다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 플랫폼은 또한 전원 및 다수의 전극쌍에 작동가능하게 연결된 펄스 발생기를 포함하며, 여기서 상기 펄스 발생기는 각 전극쌍을 가로질러 미리 결정된 전압을 가하도록 배열된다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 펄스 발생기는 미리 결정된 시간 동안 미리 결정된 주파수에서 다수의 미리 결정된 전압 펄스를 가하도록 배열된다. 본 발명의 상기 임의의 측면의 특정 실시양태에서, 미리 결정된 주파수는 0.2 Hz 내지 100 Hz의 범위이다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 미리 결정된 주파수는 10 Hz 내지 50 Hz의 범위이다 본 발명의 상기 임의의 측면의 일부 실시양태에서, 미리 결정된 시간은 2분 이하이다. 본 발명의 상기 임의의 측면의 특정 실시양태에서, 미리 결정된 시간은 0.1 내지 20초의 범위이다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 미리 결정된 시간은 5 내지 15초의 범위이다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 각 펄스의 기간은 10 msec 이하의 범위이다. 본 발명의 상기 임의의 측면의 특정 실시양태에서, 각 펄스의 기간은 0.1 msec 내지 2 msec의 범위이다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 각 펄스의 개시 사이의 기간은 0.1 내지 5 msec의 범위이다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 펄스의 수는 1 내지 1000의 범위이다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 플랫폼은 또한 펄스 발생기에 작동가능하게 연결된 컴퓨터를 포함하며, 여기서 상기 컴퓨터는 전압 펄스를 제어하도록 배열된다. 본 발명의 상기 임의의 측면의 특정 실시양태에서, 검출 시스템은 광학 센서를 포함한다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 검출 시스템은 웰로부터의 발광 신호를 수집하도록 배열된 대물 렌즈를 포함한다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 대물 렌즈는 0.2 mm 내지 5 mm의 범위의 필드 영역으로부터의 발광 신호를 수집하도록 배열된다. 본 발명의 상기 임의의 측면의 특정 실시양태에서, 대물 렌즈는 0.4 내지 1.4의 범위의 개구수를 갖는다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 대물 렌즈는 0.5의 개구수를 갖는다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 대물 렌즈는 유침 또는 수침 렌즈가 아니다. 본 발명의 상기 임의의 측면의 특정 실시양태에서, 검출 시스템은 다수의 웰로부터의 신호를 동시에 검출하도록 배열된 다수의 검출기를 포함한다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 검출 시스템은 검출기에 작동가능하게 연결된 컴퓨터를 포함하고, 여기서 상기 컴퓨터는 검출기로부터의 발광 신호를 뉴런 세포에서의 시냅스 소포 순환의 양상을 특성화하는 데이터로 변환시키도록 배열된다. 본 발명의 상기 임의의 측면의 특정 실시양태에서, 각각의 검출기는 다수의 리포터 분자로부터의 발광 신호를 검출하도록 배열된다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 각각의 검출기는 다수의 시냅스로부터의 발광 신호를 검출하도록 배열된다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 각각의 검출기는 다수의 뉴런 세포로부터의 발광 신호를 검출하도록 배열된다. 본 발명의 상기 임의의 측면의 특정 실시양태에서, 시냅스 소포 단백질은 VAMP2, vGlut1, 시냅토파이신, 소포 GABA 수송체, 아세틸콜린 수송체, 카테콜아민 수송체 또는 시냅토타그민이다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 리포터 분자는 시냅스 소포 단백질의 내강 부분에 부착된다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 리포터 분자는 pH 민감성 형광 단백질이다. 본 발명의 상기 임의의 측면의 특정 실시양태에서, 리포터 분자는 플루오린이다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 리포터 분자는 서열 1 (hSyn-SypHy)에 기재된 서열을 포함한다. 본 발명의 상기 임의의 측면의 특정 실시양태에서, 7.0 내지 8.0 범위의 pH에서, pH 민감성 리포터는 5.0 내지 6.0 범위의 pH에서보다 유의하게 큰 강도로 형광을 나타낸다. 본 발명의 상기 임의의 측면의 일부 실시양태에서, 5.0 내지 6.0 범위의 pH에서, pH 민감성 리포터는 7.0 내지 8.0 범위의 pH에서보다 유의하게 큰 강도로 형광을 나타낸다. 본 발명의 상기 임의의 측면의 특정 실시양태에서, 발광 신호는 475 nm 내지 525 nm의 범위의 형광 신호이다.
본 발명의 또다른 측면에 따라, 다수의 세포에서의 시냅스 소포 순환의 양상을 측정하는 방법이 제공된다. 상기 방법은 a) 각각의 다수의 웰에서, 전극쌍, 및 시냅스 소포 단백질과 결합된 형광 리포터 분자를 발현하는 다수의 세포를 제공하는 것; b) 전극쌍으로, 세포에서의 시냅스 소포 순환을 개시하기에 충분한 다수의 세포에서의 일련의 활동 전위를 유도하는 것; 및 c) 다수의 웰에서 리포터 분자의 발광 신호를 검출하는 것 (여기서, 리포터 분자의 발광 신호는 시냅스 소포 순환의 양상의 척도임)을 포함한다. 일부 실시양태에서, 다수의 세포는 뉴런 세포이다. 일부 실시양태에서, 웰에 존재하는 다수의 뉴런 세포는 10 내지 100000개 범위의 뉴런 세포이다. 특정 실시양태에서, 웰에 존재하는 다수의 뉴런 세포는 웰 기저부 면적 mm2 당 1000 내지 2000개 범위의 세포이다. 일부 실시양태에서, 다수의 세포는 적어도 2종의 상이한 뉴런 세포 유형을 포함한다. 일부 실시양태에서, 뉴런 세포는 일차 뉴런이고, 임의로는 여기서 상기 일차 뉴런은 래트 일차 뉴런이다. 특정 실시양태에서, 뉴런 세포는 글루타메이트성, GABA성, 도파민작용성, 아드레날린성, 세로토닌성, 및 콜린성 뉴런 세포로 이루어진 군으로부터 선택된다. 일부 실시양태에서, 다수의 뉴런 세포는 리포터 분자에 융합된 시냅스 소포 단백질을 발현한다. 일부 실시양태에서, 전극쌍의 각 전극은 실질적으로 곡선 표면을 갖는다. 특정 실시양태에서, 각 전극쌍의 전극은 실질적으로 동심 원통이고, 여기서 동심 원통은 환상 절연 물질에 의해 분리된다. 일부 실시양태에서, 상기 방법은 또한 전극 전달 시스템을 이용하여, 다수의 전극쌍의 각 전극쌍을 다수의 웰 중 하나의 웰로 위치시키는 것을 포함한다. 특정 실시양태에서, 활동 전위는 다수의 전극에 작동가능하게 연결된 전원에 의해 유도된다. 일부 실시양태에서, 활동 전위는 각 전극쌍을 가로질러 미리 결정된 전압을 가함으로써 유도된다. 일부 실시양태에서, 전압은 1 V 내지 400 V의 범위이다. 특정 실시양태에서, 전압은 5 V 내지 20 V의 범위이다. 일부 실시양태에서, 펄스 발생기는 전원 및 다수의 전극쌍에 작동가능하게 연결되며, 여기서 상기 펄스 발생기는 각 전극쌍을 가로질러 미리 결정된 전압 펄스를 가한다. 일부 실시양태에서, 펄스 발생기는 미리 결정된 시간 동안 미리 결정된 주파수에서 다수의 미리 결정된 전압 펄스를 가한다. 일부 실시양태에서, 미리 결정된 주파수는 0.2 Hz 내지 100 Hz의 범위이다. 특정 실시양태에서, 미리 결정된 주파수는 10 Hz 내지 50 Hz의 범위이다. 일부 실시양태에서, 미리 결정된 시간은 2분 이하이다. 일부 실시양태에서, 미리 결정된 시간은 0.1 내지 20초의 범위이다. 일부 실시양태에서, 미리 결정된 시간은 5 내지 15초의 범위이다. 특정 실시양태에서, 각 펄스의 기간은 10 msec 이하의 범위이다. 일부 실시양태에서, 각 펄스의 기간은 0.1 msec 내지 2 msec의 범위이다. 일부 실시양태에서, 각 펄스의 개시 사이의 기간은 0.1 내지 5 msec의 범위이다. 일부 실시양태에서, 펄스의 수는 1 내지 1000의 범위이다. 특정 실시양태에서, 전압 펄스는 펄스 발생기에 작동가능하게 연결된 컴퓨터에 의해 제어되며, 여기서 상기 컴퓨터는 전압 펄스를 제어하도록 배열된다. 일부 실시양태에서, 발광 신호는 검출기에 의해 검출된다. 일부 실시양태에서, 검출기는 광학 센서를 포함한다. 특정 실시양태에서, 리포터 분자의 발광 신호는 다수의 검출기를 이용하여 검출되며, 여기서 전하-결합 소자 카메라는 각각의 검출기에 작동가능하게 연결된다. 일부 실시양태에서, 각각의 검출기는 웰로부터의 발광 신호를 수집하도록 배열된 대물 렌즈를 포함한다. 일부 실시양태에서, 대물 렌즈는 0.2 mm 내지 5 mm 범위의 필드 영역으로부터의 발광 신호를 수집하도록 배열된다. 특정 실시양태에서, 대물 렌즈는 0.4 내지 1.4 범위의 개구수를 갖는다. 일부 실시양태에서, 대물 렌즈는 0.5의 개구수를 갖는다. 일부 실시양태에서, 다수의 검출기는 다수의 웰로부터의 신호를 동시에 검출한다. 일부 실시양태에서, 컴퓨터는 다수의 검출기에 작동가능하게 연결되고, 검출기로부터의 발광 신호를 뉴런 세포에서의 시냅스 소포 순환의 양상을 특성화하는 데이터로 변환시킨다. 특정 실시양태에서, 각각의 검출기는 다수의 리포터 분자로부터의 발광 신호를 검출한다. 일부 실시양태에서, 각각의 검출기는 다수의 시냅스로부터의 발광 신호를 검출한다. 일부 실시양태에서, 각각의 검출기는 다수의 뉴런 세포로부터의 발광 신호를 검출한다. 일부 실시양태에서, 시냅스 소포 단백질은 VAMP2, vGlut1, 시냅토파이신, 소포 GABA 수송체, 아세틸콜린 수송체, 카테콜아민 수송체 또는 시냅토타그민이다. 특정 실시양태에서, 시냅스 소포 단백질은 내강 부분을 갖는다. 일부 실시양태에서, 발광 리포터 분자는 내강 부분에 부착된다. 일부 실시양태에서, 발광 리포터 분자는 pH 민감성 리포터이다. 일부 실시양태에서, 발광 리포터 분자는 플루오린이다. 특정 실시양태에서, 발광 리포터 분자는 서열 1 (hSyn-SypHy)에 기재된 서열을 포함한다. 일부 실시양태에서, 7.0 내지 8.0 범위의 pH에서, pH 민감성 리포터는 5.0 내지 6.0 범위의 pH에서보다 유의하게 큰 강도로 형광을 나타낸다. 일부 실시양태에서, 7.0 내지 8.0 범위의 pH에서, pH 민감성 리포터는 7.0 내지 8.0 범위의 pH에서보다 유의하게 큰 강도로 형광을 나타낸다. 특정 실시양태에서, 발광 신호는 475 nm 내지 525 nm의 범위이다. 일부 실시양태에서, 상기 방법은 또한 d) 다수의 웰에서의 다수의 세포를 시냅스 소포 순환의 양상을 조절하는 능력에 대해 시험될 하나 이상의 시험 물질과 접촉시키는 것; e) 세포에서의 시냅스 소포 순환을 개시하기에 충분한 세포에서의 제2의 일련의 활동 전위를 유도하는 것; f) 다수의 웰에서의 리포터 분자의 제2 발광 신호를 검출하는 것 (여기서, 단계 (c)에서 검출된 발광 신호와 단계 (f)에서 검출된 발광 신호의 유의한 차이로부터 시험 물질이 시냅스 소포 순환의 양상을 조절하는 것임이 확인됨)을 포함한다. 일부 실시양태에서, 상기 방법은 또한 단계 (b) 이전에, 다수의 웰에서의 다수의 세포를 시냅스 소포 순환의 양상을 조절하는 능력에 대해 시험될 하나 이상의 시험 물질과 접촉시키는 것 (여기서, 단계 (c)에서 검출된 발광 신호와 대조 발광 신호의 유의한 차이로부터 시험 물질이 시냅스 소포 순환의 양상을 조절하는 것임이 확인됨)을 포함한다. 특정 실시양태에서, 상기 방법은 또한 d) 다수의 웰 중 하나 이상의 웰에서의 다수의 세포를 시냅스 소포 순환의 양상을 조절하는 능력에 대해 시험될 하나 이상의 시험 물질과 접촉시키는 것; e) 다수의 웰 중 하나 이상의 웰에서의 다수의 세포를 하나 이상의 대조 물질과 접촉시키는 것 (여기서, 시험 물질을 가진 웰에서 검출된 발광 신호와 대조 물질을 가진 웰에서 검출된 발광 신호의 유의한 차이로부터 시험 물질이 시냅스 소포 순환의 양상을 조절하는 것임이 확인됨)을 포함한다. 일부 실시양태에서, 상기 방법은 또한 d) 다수의 웰 중 하나 이상의 웰에서의 다수의 세포를 시냅스 소포 순환의 양상을 조절하는 능력에 대해 시험될 하나 이상의 시험 물질과 접촉시키는 것 (여기서, 시험 물질을 가진 웰에서 검출된 발광 신호와 음성 대조 웰에서 검출된 발광 신호의 유의한 차이로부터 시험 물질이 시냅스 소포 순환의 양상을 조절하는 것임이 확인됨)을 포함한다. 일부 실시양태에서, 상기 방법은 또한 음성 대조 웰에서의 다수의 세포를 시냅스 소포 순환의 양상을 조절하지 않는 대조 물질과 접촉시키는 것을 포함한다. 특정 실시양태에서, 상기 방법은 또한 d) 다수의 웰 중 하나 이상의 웰에서의 다수의 세포를 시냅스 소포 순환의 양상을 조절하는 능력에 대해 시험될 하나 이상의 시험 물질과 접촉시키는 것 (여기서, 시험 물질을 가진 웰에서 검출된 발광 신호와 양성 대조 웰에서 검출된 발광 신호에 유의한 차이가 없는 것으로부터 시험 물질이 시냅스 소포 순환의 양상을 조절하는 것임이 확인됨)을 포함한다. 일부 실시양태에서, 상기 방법은 또한 양성 대조 웰에서의 다수의 세포를 시냅스 소포 순환의 양상을 조절하는 대조 물질과 접촉시키는 것을 포함한다. 특정 실시양태에서, 시험 물질은 소분자이다. 일부 실시양태에서, 시험 물질은 폴리펩티드이다. 특정 실시양태에서, 시험 물질은 항체이다. 일부 실시양태에서, 시험 물질은 핵산이다. 일부 실시양태에서, 핵산은 DNA, RNA, DNA/RNA 하이브리드, 짧은 간섭 RNA, 짧은 헤어핀 RNA, 마이크로 RNA, 리보자임, 또는 압타머에서 선택된다. 특정 실시양태에서, 시험 물질은 탄수화물이다. 일부 실시양태에서, 시험 물질은 지질이다. 일부 실시양태에서, 지질은 인지질, 트리글리세리드 또는 스테로이드이다. 특정 실시양태에서, 상기 방법은 또한 생체내 모델에서 시냅스 소포 순환의 양상의 조절제라고 확인되는 시험 물질의 독성을 모니터링하는 것을 포함한다. 일부 실시양태에서, 상기 방법은 또한 생체내 모델에서 시냅스 소포 순환의 양상의 조절제라고 확인되는 시험 물질의 효능을 모니터링하는 것을 포함한다. 일부 실시양태에서, 상기 방법은 고-처리량 스크리닝 과정이다. 일부 실시양태에서, 발광 신호는 형광의 수준이다. 특정 실시양태에서, 발광 신호는 미리 규정된 시간에 걸쳐 수득되는 다수의 형광 수준이다. 일부 실시양태에서, 발광 신호는 형광 상승율이다. 일부 실시양태에서, 발광 신호는 형광 붕괴율이다.
본 발명의 또다른 측면에 따라, 시냅스 소포 순환의 양상의 조절제로서 시험 물질을 확인하는 방법이 제공된다. 상기 방법은 a) 다수의 웰 (각각의 웰은 전극쌍을 포함함)에서, 시냅스 소포 단백질과 결합된 형광 리포터 분자를 발현하는 다수의 세포를 제공하는 것; b) 세포에서의 시냅스 소포 순환을 개시하기에 충분한 다수의 세포에서의 제1의 일련의 활동 전위를 유도하는 것; c) 다수의 웰에서 리포터 분자의 제1 발광 신호를 검출하는 것; d) 다수의 웰에서의 다수의 세포를 시냅스 소포 순환의 양상을 조절하는 능력에 대해 시험될 하나 이상의 시험 물질과 접촉시키는 것; e) 세포에서의 시냅스 소포 순환을 개시하기에 충분한 세포에서의 제2의 일련의 활동 전위를 유도하는 것; 및 f) 다수의 웰에서 리포터 분자의 제2 발광 신호를 검출하는 것 (여기서, 리포터 분자의 제1 형광 수준과 제2 형광 수준의 유의한 차이로부터 시험 물질이 시냅스 소포 순환의 양상을 조절하는 것임이 확인됨)을 포함한다.
본 발명의 또다른 측면에 따라, 다수의 세포에서의 시냅스 소포 순환의 양상을 측정하는 방법이 제공된다. 상기 방법은 a) 각각의 다수의 웰에서, 전극쌍, 및 시냅스 소포 단백질과 결합된 형광 리포터 분자를 발현하는 다수의 세포를 제공하는 것; b) 전극쌍으로, 세포에서 시냅스 소포 순환을 개시하기에 충분한 다수의 세포에서의 일련의 활동 전위를 유도하는 것; 및 c) 다수의 웰에서 리포터 분자의 발광 신호를 검출하는 것 (여기서, 리포터 분자의 발광 신호는 시냅스 소포 순환의 양상의 척도임); 및 d) 다수의 웰 중 하나 이상의 웰에서의 다수의 세포를 시냅스 소포 순환의 양상을 조절하는 능력에 대해 시험될 하나 이상의 시험 물질과 접촉시키는 것 (여기서, 시험 물질을 가진 웰에서 검출된 발광 신호와 대조 웰에서 검출된 발광 신호의 비교로부터 시험 물질이 시냅스 소포 순환의 양상을 조절하는 것임이 확인됨)을 포함한다.
본 발명의 또다른 측면에 따라, 다수의 세포에서의 시냅스 소포 순환의 양상을 측정하는 방법이 제공된다. 상기 방법은 a) 각각의 다수의 웰에서, 자극기, 및 시냅스 소포 단백질과 결합된 형광 리포터 분자를 발현하는 다수의 세포를 제공하는 것; b) 상기 자극기로, 세포에서의 시냅스 소포 순환을 개시하기에 충분한 다수의 세포에서의 일련의 활동 전위를 유도하는 것; 및 c) 다수의 웰에서의 리포터 분자의 발광 신호를 검출하는 것 (여기서, 리포터 분자의 발광 신호는 시냅스 소포 순환의 양상의 척도임)을 포함한다.
도 1. 특정 시냅스 전 단백질이 기능을 한다고 여겨지는 것을 나타내는 시냅스 소포 순환의 도식도.
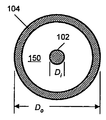
도 2. 뉴런 세포 내에서 시냅스 소포 순환을 흥분시키는 데에 사용될 수도 있는 전극쌍의 정면도. (a) 상기 전극쌍은 내부의 막대형 전극 102 및 외부의 원통형 전극 104를 포함한다. 상기 전극쌍은 뉴런 세포와 접촉되도록 또는 아주 근접하도록 놓여질 수도 있다. (b) (a)에 나타낸 상기 전극쌍의 상면도.
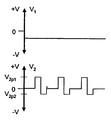
도 3. (a)-(d) 도 2a-b의 전극에 적용될 수도 있는 전압 파형의 몇몇 실시양태도.
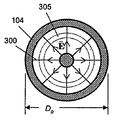
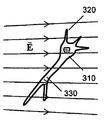
도 4. (a) 전극에 전압을 인가할 때, 이에 반응하여 도 2a-b의 전극 사이에서 일어날 수도 있는 순간 전기장 E. (b) 뉴런 세포의 부근에서 일어날 수도 있는 순간 전기장 E.
도 5. 시냅스 소포 순환을 흥분시키는데 사용될 수 있는 전극 배열의 다양한 실시양태의 도면.
도 6. (a)-(b) 전극 어셈블리의 실시양태도. 상기 전극 102, 104를 플레이트 503으로 지탱하고, 및 전극으로의 전기적 접촉이 도선 510, 512를 통해 이루어진다. (c) 전극 어셈블리의 정면도.
도 7. (a)-(c) 다중웰 플레이트에서, 실질적으로 동시에, 시냅스 소포 순환을 흥분시키기 위해 사용될 수도 있는 다중전극 어셈블리의 도면. (a) 상면도; (b) 정면도; (c) 하면도.
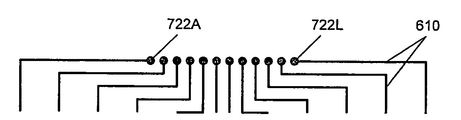
도 8. (a) 전극쌍의 컬럼 또는 줄(row)이 개별적으로 흥분될 수도 있는 다중전극 어셈블리의 실시양태도. (b) 도선 610을 분리하기 위한 국부적인 전기적 접촉 722A-722L.
도 9. 하나 이상의 전극쌍에 전압 파형을 인가하기 위해 사용될 수도 있는 전기 회로의 실시양태의 블록 도면.
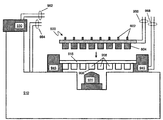
도 10. 시냅스 소포 순환 플랫폼의 실시양태를 예시한 정면도. 상기 플랫폼은 다중웰 플레이트 915, 도립현미경(inverted microscope) 910, 위치 결정 장치 945, 및 다중전극 어셈블리 600을 포함한다. 다양한 실시양태에서, 상기 현미경 910은 웰 908 내에서 일어나는 시냅스 소포 순환 활성의 일부 이상을 보여준다.
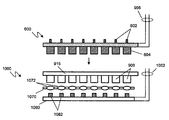
도 11. 시냅스 소포 순환 플랫폼의 실시양태를 예시한 정면도. 상기 플랫폼은 다중웰 플레이트 915, 다중전극 어셈블리 600, 렌즈 어레이 1070, 및 광검출기 어레이 1080을 포함한다. 다양한 실시양태에서, 웰 내에서 시냅스 소포 순환 동안 방출되는 형광 방사선의 일부 이상이 렌즈 1072에 의해 모여지고, 상응하는 광검출기 1082로 향한다. 상기 시냅스 소포 순환 플랫폼의 이러한 실시 양태는 각각의 장치, 예컨데 뉴런 세포를 함유하는 웰에서의 시냅스 소포 순환의 평행 모니터링을 가능하게 한다. 상기 웰은 다중웰 플레이트의 개별 웰일 수 있다.
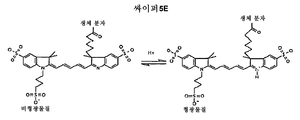
도 12. 싸이퍼(Cypher)5E(지이 헬스케어, GE Healthcare)는 약 pH 5.5에서 형광을 내고, 약 pH 7.4에서 켄칭되는 pH에 민감한 염료이다. 상이한 pH에서 싸이퍼5E의 형광에 차이가 발생하는 것은, pH 5.5에서의 구조(우측)가 pH 7.4에서의 구조(좌측)와 다르기 때문이다.
도 13. 도립현미경으로 관찰된 시냅토플루오린을 발현하는, 아데노 연관 바이러스(adeno-associated virus)에 감염된 일차 뉴런 내의 시냅스 소포 순환을 전체 웰 레벨에서 도시하는 예시적인 결과도.
도 14. 플레이트::비젼 플레이트 판독기로 관찰된 시냅토플루오린을 발현하는, 아데노 연관 바이러스에 감염된 일차 뉴런 내의 시냅스 소포 순환을 전체 웰 레벨에서 도시하는 예시적인 결과도.
도 15. 외부 직경이 6 mm이고, 96 웰 플레이트의 웰에 꼭 맞는 외부 백금 링 전극을 포함하는 예시적인 맞춤형 전극.
도 16. 실험적인 결과(형광 이미지 및 형광 신호선)를 나타내었다. 상기 데이터는 일차 뉴런에서 활동 전위를 자극시켜 얻어졌다. 상기 뉴런 세포를 96-웰 플레이트에서서 함양시켰고, 및 개질되고 상업적으로 얻을 수 있는 전기천공 시스템(셀락세스®CX3, 스웨덴 몰드날 소재의 셀렉트리콘 AB)(Cellaxess®CX3, Cellectricon AB, Moldnal, Sweden)으로 자극을 가하였다. 이러한 결과는 일차 뉴런 배양의 Ca++ 이미징을 측정함으로써, 상기 셀렉트리콘 시스템이 일차 뉴런에서의 활동 전위를 자극시킬 수 있다는 것을 입증한다. 이 도면에서 스케일 바는 100㎛이다.
도 17. 96-웰 플레이트에서 시냅스 소포 순환을 자극시킨 실험으로부터 얻어진 실험적인 결과도(형광 이미지 및 형광 신호선). 전기적 자극 시스템은 도 16의 실험에 사용된 시스템과 동일하다. 이 도면은 일차 뉴런 배양의 시냅토플루오린 이미지를 측정함으로써, 상기 셀렉트리콘 시스템이 일차 뉴런에서의 시냅스 소포 순환을 자극시킬 수 있다는 것을 입증한다.
도 18. 뉴런을 맞춤형 셀렉트리콘 전극으로 자극시킬 때, 플레이트::비젼 플레이트 판독기가 시냅토파이신-플루오린 리포터를 사용하여 시냅스 소포 순환을 측정할 수 있음을 도시하는 예시적인 결과도.
도 19. 플레이트::비젼 플레이트 판독기 시스템이 소수(small number)의 활동 전위에 반응하여 시냅토파이신-플루오린을 성공적으로 감지할 수 있음을 도시하는 예시적인 결과도.
도 20. 예시적인 고함량 스크리닝 시스템의 도식도.
도 21. 시냅스 전 HTS 플랫폼 기구의 예. (상부) 테칸(Tecan) 로봇의 액체를 다루는 머리, 전기적 자극을 제공하는 팁 모듈, 시험 플레이트, 및 플레이트::비젼 플레이트 판독기의 iCCD 카메라의 위치를 나타내는 시냅스 전 HTS 플랫폼 기구의 상부 캐비닛. (기저부) 펄스 발생기, 플레이트 판독기, 플레이트 판독기 램프, 및 다양한 전력 공급 장치의 위치를 나타내는 기저부 캐비닛.
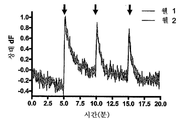
도 22. 시냅스 전 HTS 플랫폼을 사용하여, 96 평행 시냅스 전 시험의 결과를 반응 피크의 평균선으로 나타낸 도면.
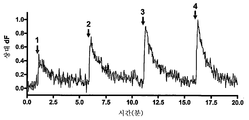
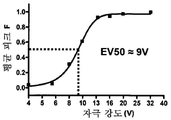
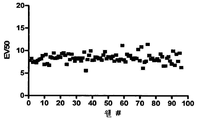
도 23. 시냅스 전 HTS 플랫폼 전기적 자극 시스템의 균등 분석의 예시적인 결과도. (a)는 단일 웰로부터의 일련의 자극(적색 바)에 반응하는 sypHy 형광을 나타낸다. (b)는 자극 전압 및 EV50 측정 도출값의 함수로서의 sypHy 형광 진폭의 피크를 나타낸다. (c)는 96-웰 플레이트 전체의 웰의 함수로서의 EV50을 나타낸다. 상기 전기적 자극 시스템은 96-웰 플레이트 전체에 대해 고도로 균일한 전류 밀도를 나타내도록 한다.
도 24. 시냅스 전 HTS 플랫폼의 민감도 분석으로부터 얻어진 예시적인 결과도.
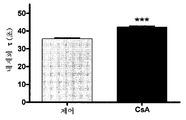
도 25. 시냅스 전 HTS 플랫폼을 갖는 시냅스 소포 순환에서 화합물로부터 유래하는 변화의 검출도.
도 26. 고용량 이미징 시스템을 사용한 시냅스 소포 순환의 측정도.
도 27. 플루오로스칸 아센트 FL 플레이트 판독기(Fluoroskan Ascent FL plate reader)를 사용한 시냅스 소포 순환의 분석의 예시적인 결과도.
도 2. 뉴런 세포 내에서 시냅스 소포 순환을 흥분시키는 데에 사용될 수도 있는 전극쌍의 정면도. (a) 상기 전극쌍은 내부의 막대형 전극 102 및 외부의 원통형 전극 104를 포함한다. 상기 전극쌍은 뉴런 세포와 접촉되도록 또는 아주 근접하도록 놓여질 수도 있다. (b) (a)에 나타낸 상기 전극쌍의 상면도.
도 3. (a)-(d) 도 2a-b의 전극에 적용될 수도 있는 전압 파형의 몇몇 실시양태도.
도 4. (a) 전극에 전압을 인가할 때, 이에 반응하여 도 2a-b의 전극 사이에서 일어날 수도 있는 순간 전기장 E. (b) 뉴런 세포의 부근에서 일어날 수도 있는 순간 전기장 E.
도 5. 시냅스 소포 순환을 흥분시키는데 사용될 수 있는 전극 배열의 다양한 실시양태의 도면.
도 6. (a)-(b) 전극 어셈블리의 실시양태도. 상기 전극 102, 104를 플레이트 503으로 지탱하고, 및 전극으로의 전기적 접촉이 도선 510, 512를 통해 이루어진다. (c) 전극 어셈블리의 정면도.
도 7. (a)-(c) 다중웰 플레이트에서, 실질적으로 동시에, 시냅스 소포 순환을 흥분시키기 위해 사용될 수도 있는 다중전극 어셈블리의 도면. (a) 상면도; (b) 정면도; (c) 하면도.
도 8. (a) 전극쌍의 컬럼 또는 줄(row)이 개별적으로 흥분될 수도 있는 다중전극 어셈블리의 실시양태도. (b) 도선 610을 분리하기 위한 국부적인 전기적 접촉 722A-722L.
도 9. 하나 이상의 전극쌍에 전압 파형을 인가하기 위해 사용될 수도 있는 전기 회로의 실시양태의 블록 도면.
도 10. 시냅스 소포 순환 플랫폼의 실시양태를 예시한 정면도. 상기 플랫폼은 다중웰 플레이트 915, 도립현미경(inverted microscope) 910, 위치 결정 장치 945, 및 다중전극 어셈블리 600을 포함한다. 다양한 실시양태에서, 상기 현미경 910은 웰 908 내에서 일어나는 시냅스 소포 순환 활성의 일부 이상을 보여준다.
도 11. 시냅스 소포 순환 플랫폼의 실시양태를 예시한 정면도. 상기 플랫폼은 다중웰 플레이트 915, 다중전극 어셈블리 600, 렌즈 어레이 1070, 및 광검출기 어레이 1080을 포함한다. 다양한 실시양태에서, 웰 내에서 시냅스 소포 순환 동안 방출되는 형광 방사선의 일부 이상이 렌즈 1072에 의해 모여지고, 상응하는 광검출기 1082로 향한다. 상기 시냅스 소포 순환 플랫폼의 이러한 실시 양태는 각각의 장치, 예컨데 뉴런 세포를 함유하는 웰에서의 시냅스 소포 순환의 평행 모니터링을 가능하게 한다. 상기 웰은 다중웰 플레이트의 개별 웰일 수 있다.
도 12. 싸이퍼(Cypher)5E(지이 헬스케어, GE Healthcare)는 약 pH 5.5에서 형광을 내고, 약 pH 7.4에서 켄칭되는 pH에 민감한 염료이다. 상이한 pH에서 싸이퍼5E의 형광에 차이가 발생하는 것은, pH 5.5에서의 구조(우측)가 pH 7.4에서의 구조(좌측)와 다르기 때문이다.
도 13. 도립현미경으로 관찰된 시냅토플루오린을 발현하는, 아데노 연관 바이러스(adeno-associated virus)에 감염된 일차 뉴런 내의 시냅스 소포 순환을 전체 웰 레벨에서 도시하는 예시적인 결과도.
도 14. 플레이트::비젼 플레이트 판독기로 관찰된 시냅토플루오린을 발현하는, 아데노 연관 바이러스에 감염된 일차 뉴런 내의 시냅스 소포 순환을 전체 웰 레벨에서 도시하는 예시적인 결과도.
도 15. 외부 직경이 6 mm이고, 96 웰 플레이트의 웰에 꼭 맞는 외부 백금 링 전극을 포함하는 예시적인 맞춤형 전극.
도 16. 실험적인 결과(형광 이미지 및 형광 신호선)를 나타내었다. 상기 데이터는 일차 뉴런에서 활동 전위를 자극시켜 얻어졌다. 상기 뉴런 세포를 96-웰 플레이트에서서 함양시켰고, 및 개질되고 상업적으로 얻을 수 있는 전기천공 시스템(셀락세스®CX3, 스웨덴 몰드날 소재의 셀렉트리콘 AB)(Cellaxess®CX3, Cellectricon AB, Moldnal, Sweden)으로 자극을 가하였다. 이러한 결과는 일차 뉴런 배양의 Ca++ 이미징을 측정함으로써, 상기 셀렉트리콘 시스템이 일차 뉴런에서의 활동 전위를 자극시킬 수 있다는 것을 입증한다. 이 도면에서 스케일 바는 100㎛이다.
도 17. 96-웰 플레이트에서 시냅스 소포 순환을 자극시킨 실험으로부터 얻어진 실험적인 결과도(형광 이미지 및 형광 신호선). 전기적 자극 시스템은 도 16의 실험에 사용된 시스템과 동일하다. 이 도면은 일차 뉴런 배양의 시냅토플루오린 이미지를 측정함으로써, 상기 셀렉트리콘 시스템이 일차 뉴런에서의 시냅스 소포 순환을 자극시킬 수 있다는 것을 입증한다.
도 18. 뉴런을 맞춤형 셀렉트리콘 전극으로 자극시킬 때, 플레이트::비젼 플레이트 판독기가 시냅토파이신-플루오린 리포터를 사용하여 시냅스 소포 순환을 측정할 수 있음을 도시하는 예시적인 결과도.
도 19. 플레이트::비젼 플레이트 판독기 시스템이 소수(small number)의 활동 전위에 반응하여 시냅토파이신-플루오린을 성공적으로 감지할 수 있음을 도시하는 예시적인 결과도.
도 20. 예시적인 고함량 스크리닝 시스템의 도식도.
도 21. 시냅스 전 HTS 플랫폼 기구의 예. (상부) 테칸(Tecan) 로봇의 액체를 다루는 머리, 전기적 자극을 제공하는 팁 모듈, 시험 플레이트, 및 플레이트::비젼 플레이트 판독기의 iCCD 카메라의 위치를 나타내는 시냅스 전 HTS 플랫폼 기구의 상부 캐비닛. (기저부) 펄스 발생기, 플레이트 판독기, 플레이트 판독기 램프, 및 다양한 전력 공급 장치의 위치를 나타내는 기저부 캐비닛.
도 22. 시냅스 전 HTS 플랫폼을 사용하여, 96 평행 시냅스 전 시험의 결과를 반응 피크의 평균선으로 나타낸 도면.
도 23. 시냅스 전 HTS 플랫폼 전기적 자극 시스템의 균등 분석의 예시적인 결과도. (a)는 단일 웰로부터의 일련의 자극(적색 바)에 반응하는 sypHy 형광을 나타낸다. (b)는 자극 전압 및 EV50 측정 도출값의 함수로서의 sypHy 형광 진폭의 피크를 나타낸다. (c)는 96-웰 플레이트 전체의 웰의 함수로서의 EV50을 나타낸다. 상기 전기적 자극 시스템은 96-웰 플레이트 전체에 대해 고도로 균일한 전류 밀도를 나타내도록 한다.
도 24. 시냅스 전 HTS 플랫폼의 민감도 분석으로부터 얻어진 예시적인 결과도.
도 25. 시냅스 전 HTS 플랫폼을 갖는 시냅스 소포 순환에서 화합물로부터 유래하는 변화의 검출도.
도 26. 고용량 이미징 시스템을 사용한 시냅스 소포 순환의 측정도.
도 27. 플루오로스칸 아센트 FL 플레이트 판독기(Fluoroskan Ascent FL plate reader)를 사용한 시냅스 소포 순환의 분석의 예시적인 결과도.
정의
작용제: 본원에 사용된 용어 "작용제" (또한 "시험 물질" 또는 "후보 물질"로도 지칭됨)는 가능성 있는 조절제로서 시험받을 수 있는 임의의 화합물 또는 조성물을 지칭한다. 사용될 수 있는 작용제의 예에는, 이들로 한정되지는 않지만, 소분자, 항체, 항체 단편, siRNA, shRNA, 핵산 분자 (RNA, DNA 또는 DNA/RNA 하이브리드), 안티센스 올리고뉴클레오티드, 리보자임, 펩티드, 펩티드 모방체, 탄수화물, 지질, 미생물, 천연 생성물 등이 포함된다. 일부 실시양태에서, 작용제는 단리되거나 단리되지 않을 수 있다. 비제한적인 실시예로서, 작용제는 작용제의 라이브러리일 수 있다. 작용제의 혼합물이 조절제인 것으로 밝혀진다면, 그 집합체를 개별 성분으로 더 정제하여, 어느 성분이 사실상의 표적 활성 조절제인지 결정할 수 있다.
아미노산: 본원에 사용된 용어 "아미노산"은, 그의 가장 광범위한 의미에서, 폴리펩티드 쇄 내로 혼입될 수 있는 임의의 화합물 및/또는 물질을 지칭한다. 일부 실시양태에서, 아미노산은 H2N-C(H)(R)-COOH의 일반 구조를 갖는다. 일부 실시양태에서, 아미노산은 자연-발생 아미노산이다. 일부 실시양태에서, 아미노산은 합성 아미노산이고; 일부 실시양태에서, 아미노산은 D-아미노산이고; 일부 실시양태에서, 아미노산은 L-아미노산이다. "표준 아미노산"은 자연 발생 펩티드에서 통상적으로 발견되는 20종의 표준 L-아미노산 중 어느 하나를 지칭한다. "비표준 아미노산"은, 합성적으로 생성되든지 천연 공급원으로부터 얻어지든지 관계없이 표준 아미노산 이외의 임의의 아미노산을 지칭한다. 본원에 사용된 "합성 아미노산"에는 염, 아미노산 유도체 (예컨대, 아미드), 및/또는 치환체를 비롯한 (이들로 한정되지는 않음) 화학적으로 변형된 아미노산이 포함된다. 펩티드 내 카르복시- 및/또는 아미노-말단 아미노산을 비롯한 아미노산은, 이들의 활성에 악영향을 미치지 않으면서 펩티드의 순환 반감기를 변화시킬 수 있는 메틸화, 아미드화, 아세틸화, 및/또는 기타 화학적 기에 의한 치환에 의해 변형될 수 있다. 아미노산은 디술피드 결합에 참여할 수 있다. 용어 "아미노산"은 "아미노산 잔기"와 호환적으로 사용되며, 유리 아미노산 및/또는 펩티드의 아미노산 잔기를 지칭할 수 있다. 상기 용어가 유리 아미노산을 지칭하는 것인지 펩티드의 잔기를 지칭하는 것인지는 용어가 사용된 문맥으로부터 명백해질 것이다.
동물: 본원에 사용된 용어 "동물"은 동물계의 임의의 구성원을 지칭한다. 일부 실시양태에서, "동물"은 임의의 발생 단계에서의 인간을 지칭한다. 일부 실시양태에서, "동물"은 임의의 발생 단계에서의, 인간이 아닌 동물을 지칭한다. 특정 실시양태에서, 인간이 아닌 동물은 포유동물 (예를 들어, 설치류, 마우스, 래트, 토끼, 원숭이, 개, 고양이, 양, 소, 영장류 및/또는 돼지)이다. 일부 실시양태에서, 동물에는, 이들로 한정되지는 않지만, 포유동물, 조류, 파충류, 양서류, 어류, 곤충류 및/또는 연충류가 포함된다. 일부 실시양태에서, 동물은 트랜스제닉 동물, 유전자-조작 동물 및/또는 클론일 수 있다.
항체: 본원에 사용된 용어 "항체"는, 천연이든지, 전체적으로 또는 부분적으로 합성적으로 생성되든지 간에 임의의 이뮤노글로불린을 지칭한다. 특이적 결합능을 유지하는 모든 그의 유도체도 또한 상기 용어에 포함된다. 또한, 상기 용어에는 이뮤노글로불린 결합 도메인과 상동성이거나 대부분 상동성인 결합 도메인을 갖는 임의의 단백질도 포함된다. 이러한 단백질은 천연 공급원으로부터 유래하거나, 부분적으로 또는 전체적으로 합성적으로 생성된다. 항체는 모노클로날 또는 폴리클로날일 수 있다. 항체는 임의의 인간 클래스: IgG, IgM, IgA, IgD 및 IgE를 비롯한 임의의 이뮤노글로불린 클래스의 구성원일 수 있다. 본원에 사용된 용어 "항체 단편" 또는 "항체의 특징 부분"은 호환적으로 사용되고, 전체-길이보다 짧은 임의의 항체 유도체를 지칭한다. 일반적으로, 항체 단편은 적어도 전체-길이 항체의 특이적 결합능에 중요한 부분을 유지한다. 항체 단편의 예에는, 이들로 한정되지는 않지만, Fab, Fab', F(ab')2, scFv, Fv, dsFv 디아바디(diabody) 및 Fd 단편이 포함된다. 항체 단편은 임의의 수단에 의해 생성될 수 있다. 예를 들어, 항체 단편은 무손상 항체의 단편화에 의해 효소적으로 또는 화학적으로 생성되고/거나, 이는 부분적 항체 서열을 코딩하는 유전자로부터 재조합적으로 생성될 수 있다. 별법으로 또는 추가로, 항체 단편은 전체적으로 또는 부분적으로 합성적으로 생성될 수 있다. 항체 단편은 임의로 단일 쇄 항체 단편을 포함할 수 있다. 별법으로 또는 추가로, 항체 단편은 예를 들어 디술피드 결합에 의해 함께 연결된 다중 쇄를 포함할 수 있다. 항체 단편은 임의로 다분자 복합체를 포함할 수 있다. 기능적 항체 단편은 전형적으로는 약 50개 이상의 아미노산을 포함하고, 보다 전형적으로는 약 200개 이상의 아미노산을 포함한다.
대략: 본원에 사용된 용어 "대략" 또는 "약"은, 관심있는 하나 이상의 값에 적용되는 것으로서, 명시된 기준치와 유사한 값을 지칭한다. 특정 실시양태에서, 용어 "대략" 또는 "약"은, 달리 명시되거나 문맥으로부터 명백하지 않은 한, 명시된 기준치에서 양방향으로 (초과 또는 미만) 25%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 또는 그 미만 이내에 있는 값의 범위를 지칭한다 (이러한 수가 가능한 값의 100%를 초과하는 경우는 제외함).
결합된: 본원에 사용된 용어 "결합된", "접합된", "연결된", "부착된" 및 "구속된"은, 2개 이상의 잔기에 대해 사용된 경우, 잔기가 직접적으로, 또는 연결제로서의 역할을 하는 하나 이상의 추가 잔기를 통해 또다른 잔기와 물리적으로 결합 또는 연결되어, 실질적으로 안정한 (잔기들이 구조가 사용되는 조건, 예를 들어 생리학적 조건 하에서 물리적으로 결합된 상태로 남아있는) 구조를 형성하는 것을 의미한다. 일부 실시양태에서, 잔기는 하나 이상의 공유 결합에 의해 또다른 잔기에 부착된다. 일부 실시양태에서, 잔기는 비-공유 결합 (예를 들어, 수소 결합, 친화성 상호작용, 정전기적 상호작용, 반 데르 발스(Van der Waals) 힘 등)을 수반하는 메카니즘에 의해 또다른 잔기에 부착된다. 일부 실시양태에서, 충분한 수의 보다 약한 상호작용은, 잔기들이 물리적으로 결합된 상태로 남아있기 위한 충분한 안정성을 제공할 수 있다.
생체적합성: 본원에 사용된 용어 "생체적합성"은 세포에 대해 독성이 아닌 물질을 지칭한다. 일부 실시양태에서, 물질은 이를 생체내에서 세포에 첨가하는 것이 생체내에서 염증 및/또는 기타 부작용을 유발하지 않는 경우에 "생체적합성"인 것으로 간주된다. 일부 실시양태에서, 물질은 이를 시험관내 또는 생체내에서 세포에 첨가하는 것이 약 50%, 약 45%, 약 40%, 약 35%, 약 30%, 약 25%, 약 20%, 약 15%, 약 10%, 약 5%, 또는 약 5% 미만 이하의 세포 사멸을 초래하는 경우에 "생체적합성"인 것으로 간주된다.
생분해성: 본원에 사용된 용어 "생분해성"은 생리학적 조건 하에서 분해되는 물질을 지칭한다. 일부 실시양태에서, 생분해성 물질은 세포 기구에 의해 분해되는 물질이다. 일부 실시양태에서, 생분해성 물질은 화학적 공정에 의해 분해되는 물질이다.
대조군: 본원에 사용된 용어 "대조군"은, 비교되는 결과에 대한 표준이라는, 그의 당업계에서 이해되는 의미를 갖는다. 전형적으로, 대조군은 변수에 대한 결론을 내리기 위해 이러한 변수를 분리시킴으로써 실험에서의 무결성을 증대시키기 위해 사용된다. 일부 실시양태에서, 대조군은 비교군을 제공하기 위한 시험 반응 또는 분석과 동시에 수행되는 반응 또는 분석이다. 한 실험에서는, "시험" (즉, 시험하고자 하는 변수)이 적용된다. 제2 실험인 "대조군"에서는, 시험하고자 하는 변수가 적용되지 않는다. 일부 실시양태에서, 대조군은 과거 대조군 (즉, 미리 수행된 시험 또는 분석, 또는 미리 공지된 양 또는 결과)이다. 일부 실시양태에서, 대조군은 출력되거나 달리 저장된 기록이거나, 또는 이를 포함한다. 대조군은 양성 대조군 또는 음성 대조군일 수 있다.
검출 시스템: 본원에 사용된 검출 시스템은 시냅스 소포 순환의 양상을 모니터링하기 위한 시스템이다. 전형적으로, 검출 시스템은 뉴런 세포를 포함하는 웰 내 하나 이상의 영역으로부터의 발광 신호 모니터링을 제공한다. 검출 시스템은 다수의 웰로부터의 발광 신호 (뉴런 세포를 포함하는 웰 내 하나 이상의 영역으로부터의 각각의 발광 신호)의 동시 모니터링을 제공할 수 있다. 검출 시스템은, 웰 내의 뉴런 세포에서 리포터 분자로부터 발광 신호를 검출하도록 배열된 검출기, 예를 들어, 광학 센서, 대물 렌즈, 광전자증배관 등을 포함할 수 있다. 검출 시스템은, 웰 내의 뉴런 세포에서 리포터 분자로부터 발광 신호를 검출하도록 각각 배열된 다수의 검출기, 예를 들어, 광학 센서, 대물 렌즈 등을 포함할 수 있다. 전형적으로, 검출 시스템은 발광 신호를 디지털 전기 신호로 변환시키도록 배열된 감광성 성분을 포함한다. 예를 들어, 검출 시스템은 검출기에 작동가능하게 연결된 전하 결합 시스템 카메라를 포함할 수 있다. 검출 시스템은 발광 신호의 검출을 제어하도록 배열된 컴퓨터에 작동가능하게 연결될 수 있다.
데포스핀: 본원에 사용된 용어 "데포스핀"은, 탈인산화되는 경우에 시냅스 소포 내분비작용을 조절하는 (예를 들어, 시냅스 소포 내분비작용의 효율을 증진시킴) 단백질을 지칭한다. 전형적으로, 데포스핀은 탈인산화되는 경우에 단백질 복합체로 조립된다. 일부 실시양태에서, 데포스핀은 칼시뉴린에 의해 탈인산화된다.
기능이상: 본원에 사용된 용어 "기능이상"은 분자 또는 작용의 비정상적 기능을 지칭한다. 분자 (예를 들어, 단백질)의 기능이상은 이러한 분자와 관련된 활성의 증가 또는 감소에 의해 유발될 수 있다. 분자의 기능이상은 분자 그 자체, 또는 상기 분자와 직접적으로 또는 간접적으로 상호작용하거나 상기 분자를 조절하는 다른 분자와 관련된 결함에 의해 유발될 수 있다. 작용 (예를 들어, 시냅스 소포 순환)의 기능이상은 상기 작용에 직접적으로 연관된 임의의 분자, 또는 이러한 분자와 직접적으로 또는 간접적으로 상호작용하거나 이러한 분자를 조절하는 다른 분자 또는 작용과 관련된 활성의 증가 또는 감소에 의해 유발될 수 있다.
전기 자극 시스템: 본원에 사용된 용어 "전기 자극 시스템"은 뉴런 세포 배양액, 현탁액 및/또는 표본과 접촉하거나 근접하도록 배치될 수 있는 하나 이상의 전극 접합체를 포함하는 장치를 지칭한다. 전기 자극 시스템은 임의로 전압 또는 전류 파형을 생성하는 전기 장비를 추가로 포함할 수 있다.
전극 접합체: 본원에 사용된 용어 "전극 접합체"는 전극쌍을 지지 및 포함하는 장치를 지칭한다. 상기 장치는 전극쌍 내의 각각의 전극에 연결된 전도성 와이어 또는 트레이스(trace)를 추가로 포함할 수 있다.
전극쌍: 본원에 사용된 용어 "전극쌍"은 일반적으로, 한 요소가 환원전극으로서의 기능을 하고, 한 요소가 산화전극으로서의 기능을 하도록 구성된 2개의 전도성 요소를 지칭한다. 특정 실시양태에서 (예를 들어, 도 5H 참조) 용어 "전극쌍"은, 일부 요소는 환원전극으로서의 기능을 하도록 구성되고 일부 요소는 산화전극으로서의 기능을 하도록 구성된 2개를 초과하는 전도성 요소에 적용될 수 있다.
자극 영역: 본원에 사용된 용어 "자극 영역"은 자극 파형이 적용되는 세포 배양액, 현탁액 및 또는 표본 내의 영역을 지칭한다. 자극 파형은 상기 영역 내의 뉴런 세포에서 시냅스 소포 순환을 자극시킬 수 있다.
기능성: 본원에 사용된 "기능성" 생물학적 분자 또는 작용은, 이들을 특징짓는 특성 및/또는 활성을 나타내는 형태의 생물학적 분자 또는 작용이다.
순간 전기장: 본원에 사용된 용어 "순간 전기장"은 시변(time-varying) 전기장의 스냅-샷을 설명하기 위해 사용된다. 예를 들어, 순간 전기장은 일순간의 시변 전기장의 표현이다.
시험관내: 본원에 사용된 용어 "시험관내"는 다세포 유기체보다는 인공적 환경 (예를 들어, 시험관 또는 반응 용기, 세포 배양액 등)에서 일어나는 사건을 지칭한다.
생체내: 본원에 사용된 용어 "생체내"는 다세포 유기체, 예컨대 인간이 아닌 동물 내에서 일어나는 사건을 지칭한다.
단리된: 본원에 사용된 용어 "단리된"은, (1) 최초 생성시 (천연 및/또는 실험적 세팅 어느 쪽에서든지)에는 서로 결합되어 있던 적어도 몇몇 성분으로부터 분리되고/거나 (2) 사람 손에 의해 생성, 제조 및/또는 생산된 물질 및/또는 실체를 지칭한다. 단리된 물질 및/또는 실체는, 최초에는 결합되어 있던 다른 성분의 약 10%, 약 20%, 약 30%, 약 40%, 약 50%, 약 60%, 약 70%, 약 80%, 약 90%, 약 95%, 약 98%, 약 99%, 실질적으로 100% 이상, 또는 100%로부터 분리될 수 있다. 일부 실시양태에서, 단리된 작용제는 약 80%, 약 85%, 약 90%, 약 91%, 약 92%, 약 93%, 약 94%, 약 95%, 약 96%, 약 97%, 약 98%, 약 99%, 실질적으로 100%를 초과하는 만큼, 또는 100% 순수하다. 본원에 사용된 바와 같이, 물질은 실질적으로 다른 성분이 없는 경우에 "순수"하다. 본원에 사용된 용어 "단리된 세포"는 다세포 유기체에 함유되어 있지 않은 세포를 지칭한다. 단리된 세포는 이전에는 생체내에 존재했을 수 있다는 것을 인지하여야 한다 (예를 들어, 일차 세포).
발광 신호: 본원에 사용된 용어 "발광 신호"는 하나 이상의 리포터 분자로부터 방사되는 빛의 양, 또는 하나 이상의 리포터 분자로부터 방사되는 빛의 양을 표시하는 전기 신호, 예를 들어 디지털 전기 신호를 지칭한다. 발광 신호는 하나 이상의 리포터 분자로부터의 발광 세기 (예를 들어, 형광 세기)의 수준, 예를 들어 최대 세기 수준일 수 있다. 발광 신호는 미리 결정된 시간에 걸쳐 발생된 하나 이상의 리포터 분자로부터의 발광 세기 (예를 들어, 형광 세기)의 다수의 수준일 수 있다. 발광 신호는 미리 결정된 시간에 걸친 하나 이상의 리포터 분자로부터의 발광 세기 (예를 들어, 형광 세기)의 수준의 상승 또는 감쇠 비율일 수 있다.
조절제: 본원에 사용된 용어 "조절제"는 활성을 변경 또는 유도하는 작용제, 예를 들어 화합물을 지칭한다. 예를 들어, 조절제의 존재는 조절제 부재 하의 특정 활성 크기에 비한 활성 크기의 증가 또는 감소를 초래할 수 있다. 특정 실시양태에서, 조절제는 하나 이상의 활성의 크기를 감소시키는 억제제이다. 특정 실시양태에서, 억제제는 하나 이상의 생물학적 활성을 완전히 막는다. 특정 실시양태에서, 조절제는 하나 이상의 활성의 크기를 증가시키는 활성화제이다. 특정 실시양태에서, 조절제의 존재는 조절재 부재 하에서 발생하지 않는 활성을 초래한다.
다중-전극 접합체: 본원에 사용된 용어 "다중-전극 접합체"는 다수의 전극쌍을 지지 및 포함하는 장치를 지칭한다. 상기 장치는 임의로 다중-전극 접합체 내의 각각의 전극에 연결된 전도성 와이어 또는 트레이스를 추가로 포함할 수 있다.
뉴런 세포: 본원에 사용된 용어 "뉴런 세포" (또한 "뉴런"으로도 지칭됨)는 시냅스 소포 순환 또는 시냅스 소포 순환의 하나 이상의 측면을 겪는 세포를 지칭한다. 일부 실시양태에서, 뉴런 세포는 시냅스전 말단을 갖거나 형성할 수 있고, 여기서 시냅스전 말단은 기능적 시냅스 소포 순환을 갖거나, 또는 시냅스 소포 순환의 하나 이상의 활성을 겪는다. 일부 실시양태에서, 뉴런 세포는 시험관내에 존재한다. 일부 실시양태에서, 뉴런 세포는 생체내에 존재한다. 일부 실시양태에서, 뉴런 세포는 성장하는 세포의 배양액, 세포의 현탁액, 표면과 결합된 (예를 들어, 표면 상에서 성장하거나, 표면에 부착되거나, 표면에 구속되거나, 기타 등등) 다수의 세포, 생체내 공급원으로부터 실질적으로 정제된 (예를 들어, 동물로부터 수집됨) 다수의 뉴런 세포, 및/또는 세포주에 존재한다. 일부 실시양태에서, 뉴런 세포는 살아있는 동물 (예를 들어, 설치류, 인간 등) 내에 존재한다. 일부 실시양태에서, 뉴런 세포는 일차 뉴런 세포 및/또는 줄기 세포이다. 일부 실시양태에서, 뉴런 세포는 일차 래트 전뇌 뉴런이다. 뉴런 세포는 시냅스전 소포 순환의 하나 이상의 요소를 겪는 세포의 집합체를 포함할 수 있다. 일부 실시양태에서, 뉴런 세포는 시냅스 소포 순환 또는 그의 하나 이상의 활성을 추적하기 위한 원하는 리포터를 흡수하기 위해 형질전환, 형질감염, 감염 및/또는 달리 유도될 수 있다. 일부 실시양태에서, 뉴런 세포는 본 발명에 따른 시냅스 소포 순환 분석에 이용될 수 있다.
뉴런 세포 시스템: 본원에 사용된 용어 "뉴런 세포 시스템" (또한 "뉴런 시스템"으로도 지칭됨)은 시냅스 소포 순환 또는 시냅스 소포 순환의 하나 이상의 활성을 겪는 시스템을 지칭한다. 일부 실시양태에서, 뉴런 시스템은 시냅스전 말단을 갖거나 형성할 수 있는 하나 이상의 세포를 포함하고, 여기서 시냅스전 말단은 기능적 시냅스 소포 순환을 갖거나, 또는 시냅스 소포 순환의 하나 이상의 활성을 겪는다. 일부 실시양태에서, 뉴런 세포 시스템은 시험관내 시스템이다. 일부 실시양태에서, 뉴런 세포 시스템은 생체내 시스템이다. 일부 실시양태에서, 뉴런 세포 시스템은 성장하는 세포의 배양액, 세포의 현탁액, 표면과 결합된 (예를 들어, 표면 상에서 성장하거나, 표면에 부착되거나, 표면에 구속되거나, 기타 등등) 다수의 세포, 생체내 공급원으로부터 실질적으로 정제된 (예를 들어, 동물로부터 수집됨) 다수의 뉴런 세포, 및/또는 세포주를 포함하는 시험관내 시스템이다. 일부 실시양태에서, 뉴런 세포 시스템은 살아있는 동물 (예를 들어, 설치류, 인간 등) 내의 뉴런 세포를 포함한다. 일부 실시양태에서, 뉴런 세포 시스템은 일차 뉴런 배양액 및/또는 줄기 세포를 포함한다. 일부 실시양태에서, 뉴런 세포 시스템은 일차 래트 전뇌 뉴런을 포함할 수 있다. 뉴런 세포 시스템은 시냅스전 소포 순환의 하나 이상의 요소를 겪는 세포의 집합체를 포함할 수 있다. 일부 실시양태에서, 뉴런 세포 시스템 내의 세포는 시냅스 소포 순환 또는 그의 하나 이상의 활성을 추적하기 위한 원하는 리포터를 흡수하기 위해 형질전환, 형질감염, 감염 및/또는 달리 유도될 수 있다. 일부 실시양태에서, 뉴런 세포 시스템은 본 발명에 따른 시냅스 소포 순환 분석에 이용될 수 있다.
핵산: 본원에서 사용되는 용어 "핵산"은, 그의 가장 넓은 의미로, 올리고뉴클레오티드 쇄에 혼입되거나 혼입될 수 있는 임의의 화합물 및/또는 물질을 지칭한다. 일부 실시양태에서, 핵산은 포스포디에스테르 연결기를 통해 올리고뉴클레오티드 쇄에 혼입되거나 혼입될 수 있는 화합물 및/또는 물질이다. 일부 실시양태에서, "핵산"은 개별 핵산 잔류물 (예를 들어, 뉴클레오티드 및/또는 뉴클레오시드)을 지칭한다. 일부 실시양태에서, "핵산"은 개별 핵산 잔류물을 포함하는 올리고뉴클레오티드 쇄를 지칭한다. 본원에서 사용되는 용어 "올리고뉴클레오티드" 및 "폴리뉴클레오티드"는 상호교환하여 사용될 수 있다. 일부 실시양태에서, "핵산"은 RNA, 및 단일 및/또는 이중-가닥 DNA 및/또는 cDNA를 포함한다. 게다가, 용어 "핵산", "DNA", "RNA" 및/또는 유사한 용어는 핵산 유사체, 즉, 포스포디에스테르 주쇄 이외의 다른 것을 갖는 유사체를 포함한다. 예를 들어, 당업계에 공지되고, 주쇄에 포스포디에스테르 결합 대신 펩티드 결합을 갖는 소위 "펩티드 핵산"은 본 발명의 범주 내에 있는 것으로 여겨진다. 용어 "아미노산 서열을 코딩하는 뉴클레오티드 서열"은 서로의 변성형이고/거나 상기 아미노산 서열을 코딩하는 모든 뉴클레오티드 서열을 포함한다. 단백질 및/또는 RNA를 코딩하는 뉴클레오티드 서열은 인트론을 포함할 수 있다. 핵산은 천연 공급원으로부터 정제될 수 있고, 재조합 발현 시스템을 사용하여 생성될 수 있고, 임의로는 화학적으로 정제되고 합성될 수 있다. 적절한 경우, 예를 들어 화학적으로 합성된 분자의 경우, 핵산은 뉴클레오시드 유사체, 예컨대 화학적으로 변형된 염기 또는 당, 주쇄 변형 등을 갖는 유사체를 포함할 수 있다. 핵산 서열은 달리 언급하지 않는 한 5' → 3' 방향으로 존재한다. 본원에서, 용어 "핵산 절편"은 보다 긴 핵산 서열의 일부인 핵산 서열을 지칭하기 위해 사용된다. 다수의 실시양태에서, 핵산 절편은 3 이상, 4 이상, 5 이상, 6 이상, 7 이상, 8 이상, 9 이상, 10 이상 또는 그 이상의 잔류물을 포함한다. 일부 실시양태에서, 핵산은 천연 뉴클레오시드 (예를 들어, 아데노신, 티미딘, 구아노신, 사이티딘, 우리딘, 데옥시아데노신, 데옥시티미딘, 데옥시구아노신 및 데옥시사이티딘); 뉴클레오시드 유사체 (예를 들어, 2-아미노아데노신, 2-티오티미딘, 이노신, 피롤로-피리미딘, 3-메틸 아데노신, 5-메틸사이티딘, C-5 프로피닐-사이티딘, C-5 프로피닐-우리딘, 2-아미노아데노신, C5-브로모우리딘, C5-플루오로우리딘, C5-요오도우리딘, C5-프로피닐-우리딘, C5-프로피닐-사이티딘, C5-메틸사이티딘, 2-아미노아데노신, 7-데아자아데노신, 7-데아자구아노신, 8-옥소아데노신, 8-옥소구아노신, O(6)-메틸구아닌 및 2-티오사이티딘); 화학적으로 변형된 염기; 생물학적으로 변형된 염기 (예를 들어, 메틸화된 염기); 개재된 염기; 변형된 당 (예를 들어, 2'-플루오로리보스, 리보스, 2'-데옥시리보스, 아라비노스 및 헥소스); 및/또는 변형된 포스페이트 기 (예를 들어, 포스포로티오에이트 및 5'-N-포스포르아미다이트 연결기)이거나, 또는 이를 포함한다. 일부 실시양태에서, 본 발명은 전달을 용이하게 하거나 또는 이를 달성하기 위해, 구체적으로, 화학적으로 변형되지 않은 핵산 (예를 들어, 폴리뉴클레오티드, 및 뉴클레오티드 및/또는 뉴클레오시드를 비롯한 잔류물)을 의미하는 "변형되지 않은 핵산"에 관한 것일 수 있다.
시냅스전 단백질: 본원에서 사용되는 용어 "시냅스전 단백질"은 시냅스전 말단에 우세하게 국지화되는 단백질을 지칭한다. 전형적으로, 시냅스전 단백질은 시냅스 소포 순환에 관여한다. 일부 실시양태에서, 시냅스전 단백질은 시냅신, 데포스핀 및 다른 칼시뉴린 기질을 포함한다. 예시적인 시냅스전 단백질로는 본원에서 내인성 소포 단백질이라고도 일컬어지는 시냅스 소포 단백질 (예를 들어, 시냅스 소포 단백질 2 (SV2), 소포 GABA 수송체, 아세틸콜린 수송체, 카테콜아민 수송체, 시냅토파이신, 시냅토타그민, 소포-관련 막 폴리펩티드 (VAMP), 신경전달물질 수송체 (NT 수송체), 시냅토기린, 양성자 펌프), 말초 소포 단백질 (예를 들어, Rab, 시스틴 스트링 단백질 (CSP), 시냅스 원형질 막 단백질 (예를 들어, 칼슘 채널, 25 kDa의 시냅토솜-관련 단백질 (SNAP-25), 신탁신), 세포액 단백질 (예를 들어, SNAP, n-Sec1), 시냅신 (예를 들어, 시냅신 I, II 및 III) 및 데포스핀 (예를 들어, 다이나민 I, PIP5K1γ, 및 시냅토자닌 I)이 포함되나 이들로 한정되지는 않는다.
다수: 본원에서 사용되는 용어 "다수" 또는 "다수의"는 하나 초과를 지칭한다.
단백질: 본원에서 사용되는 용어 "단백질"은 폴리펩티드 (즉, 펩티드 결합에 의해 서로에 연결된 일련의 2개 이상의 아미노산)를 지칭한다. 단백질은 아미노산 이외의 다른 잔기 (예를 들어, 당단백질, 프로테오글리칸 등일 수 있음)를 포함할 수 있고/거나 다르게 가공처리되거나 변형될 수 있다. 당업자는 "단백질"이 세포에 의해 생성된 완전 폴리펩티드 쇄 (신호 서열을 갖거나 갖지 않음)일 수 있거나, 또는 그의 특징적 부분일 수 있음을 인지할 것이다. 당업자는 단백질이 때때로, 예를 들어 하나 이상의 디술파이드 결합에 의해 연결되거나 다른 수단에 의해 결합된 하나 초과의 폴리펩티드 쇄를 포함할 수 있음을 인지할 것이다. 폴리펩티드는 L-아미노산, D-아미노산, 또는 둘 다를 함유할 수 있고, 당업계에 공지된 임의의 각종 아미노산 변형 또는 유사체를 함유할 수 있다. 유용한 변형으로는 예를 들어, 말단 아세틸화, 아미드화 등이 포함된다. 일부 실시양태에서, 단백질은 천연 아미노산, 비-천연 아미노산, 합성 아미노산, 및 그의 조합을 포함할 수 있다. 용어 "펩티드"는 일반적으로 약 100개 미만의 아미노산 길이를 갖는 폴리펩티드를 지칭하기 위해 사용된다.
리포터: 본원에서 사용되는 용어 "리포터" (본원에서 리포터 분자라고도 지칭됨)는 뉴런 세포에 포함되는 경우, 하나 이상의 시냅스 소포 순환 활동의 지표인 검출가능한 신호, 예를 들어 발광 신호, 예를 들어 형광 신호를 제공하는 임의의 물질을 지칭한다. 일부 실시양태에서, 리포터는 바이러스 감염에 의해 뉴런 세포 내에 도입된다. 일부 실시양태에서, 리포터는 뉴런 배양물, 현탁액 및/또는 제제에 외부적으로 첨가된다. 일부 실시양태에서, 뉴런 세포는 리포터 유전자를 발현하는 트랜스제닉 동물로부터 유래된다. 일부 실시양태에서, 리포터는 형광단(fluorophore)이다. 일부 실시양태에서, 리포터는 염료이다.
소분자: 일반적으로, "소분자"는 크기가 약 5 킬로달톤 (Kd) 미만인 유기 분자인 것으로 당업계에서 이해된다. 일부 실시양태에서, 소분자는 약 4 Kd 미만, 약 3 Kd 미만, 약 2 Kd 미만 또는 약 1 Kd 미만이다. 일부 실시양태에서, 소분자는 약 800 달톤 (D) 미만, 약 600 D 미만, 약 500 D 미만, 약 400 D 미만, 약 300 D 미만, 약 200 D 미만 또는 약 100 D 미만이다. 일부 실시양태에서, 소분자는 약 2000 g/mol 미만, 약 1500 g/mol 미만, 약 1000 g/mol 미만, 약 800 g/mol 미만 또는 약 500 g/mol 미만이다. 일부 실시양태에서, 소분자는 비-중합체성이다. 일부 실시양태에서, 소분자는 단백질, 펩티드 또는 아미노산이 아니다. 일부 실시양태에서, 소분자는 핵산 또는 뉴클레오티드가 아니다. 일부 실시양태에서, 소분자는 당류 또는 다당류가 아니다.
자극 시스템: 본원에서 사용되는 용어 "자극 시스템"은 시냅스 소포 순환을 개시하는 임의의 시스템 또는 조성물을 지칭한다. 전형적으로, 자극 시스템은 뉴런 세포에서 활동 전위를 개시함으로써 시냅스 소포 순환을 개시한다. 본 발명에 적합한 자극 시스템은 전기적 자극 시스템, 음향 또는 초음파 자극 시스템, 광학 자극 시스템 또는 생화학적 자극 시스템일 수 있다.
자극 파형: 본원에서 사용되는 용어 "자극 파형"은 일반적으로 배양물, 현탁액 및/또는 다르게 제조된 것 중의 뉴런 세포에 적용되는 시간 경과에 따른 자극을 지칭한다. 예를 들어, 자극은 둘 다 시간에 대해 변경될 수 있는 등급 및 방향을 특징으로 하는 전기장일 수 있다. 자극 파형은 전기적 자극 시스템에서 전극에 인가되는 하나 이상의 전압 파형 또는 전류 파형에 의해 야기될 수 있다.
대상체: 본원에서 사용되는 용어 "대상체" 또는 "환자"는 예를 들어, 실험적, 진단학적, 예방적 및/또는 치료학적 목적을 위해 본 발명에 따른 조성물이 투여될 수 있는 임의의 유기체를 지칭한다. 전형적인 대상체로는 동물 (예를 들어, 포유동물, 예컨대 마우스, 래트, 토끼, 비-인간 영장류, 및 인간; 곤충류; 회충류 등)이 포함된다.
실질적으로: 본원에서 사용되는 용어 "실질적으로"는 관심 특징 또는 특성의 전체 또는 거의 전체 범위 또는 정도를 나타내는 정성(qualitative) 상태를 지칭한다. 생물학 분야의 당업자는, 생물학적 및 화학적 현상이, 간혹 있다고 하더라도 좀처럼 완성 단계에 이르고/거나 완전하게 진행되지 않거나 또는 절대 결과를 달성하거나 방지하지 않는 것으로 이해할 것이다. 따라서, 본원에서 용어 "실질적으로"는 다수의 생물학적 및 화학적 현상에서의 내재적인 완전성의 결여 가능성을 포착하기 위해 사용된다.
~에 민감한: 질환, 장애 및/또는 상태에 "민감한" 개체는 질환, 장애 및/또는 상태를 갖는 것으로 진단되지는 않는다. 일부 실시양태에서, 질환, 장애 및/또는 상태에 민감한 개체는 질환, 장애 및/또는 상태의 증상을 나타내지는 않는다. 일부 실시양태에서, 질환, 장애 및/또는 상태에 민감한 개체에서 질환, 장애 및/또는 상태가 발병할 것이다. 일부 실시양태에서, 질환, 장애 및/또는 상태에 민감한 개체에서 질환, 장애 및/또는 상태는 발병하지 않을 것이다.
시냅스 소포 순환 조절제: 본원에서 사용되는 용어 "시냅스 소포 순환 조절제"는 임의의 시냅스 소포 순환 활동을 변경시키는 임의의 물질을 지칭한다. 일부 실시양태에서, 시냅스 소포 순환과 관련된 활동은 시냅스전 막으로의 시냅스 소포의 동원, 시냅스전 막에서의 도킹(docking), 시냅스전 막과의 융합을 위한 프라이밍(priming), Ca2 + 탐지, 시냅스전 막과의 융합, 시냅스 틈으로의 신경전달물질의 분비, 내분비작용을 통한 시냅스전 말단에서 시냅스 소포의 복구 (클라트린-매개 핵형성 단계, 시냅스전 막의 함입 단계, 시냅스전 막으로부터 시냅스 소포의 분열 단계 및 내분비작용된 시냅스 소포로부터 클라트린의 제거 단계를 포함함), 시냅스전 말단 내 시냅스 소포의 전위, 시냅스전 말단 내 시냅스 소포의 분류, 및 신경전달물질로의 시냅스 소포 내강의 로딩을 포함한다. 일부 실시양태에서, 시냅스 소포 순환 조절제는 시냅스 소포 순환의 하나 이상의 활동을 증진시킨다. 일부 실시양태에서, 시냅스 소포 순환 조절제는 시냅스 소포 순환의 하나 이상의 활동을 억제한다. 예시적인 시냅스 소포 순환 단백질로는, 예를 들어 시냅스 소포 단백질 2 (SV2), 소포 GABA 수송체, 아세틸콜린 수송체, 카테콜아민 수송체, 시냅토파이신, 시냅토타그민, 소포-관련 막 폴리펩티드 (VAMP), 신경전달물질 수송체 (NT 수송체) 및 시냅토기린, 및 양성자 펌프가 포함된다. 다른 시냅스 소포 순환 단백질이 당업자에게 명백할 것이다.
시냅스 소포 순환 플랫폼: 본원에서 사용되는 용어 "시냅스 소포 순환 플랫폼"은 적어도 자극 시스템 (예를 들어, 전자 자극 시스템) 및 검출 시스템을 포함하는 장치를 지칭한다. 일부 실시양태에서, 전기적 자극 시스템은 배양물, 현탁액 및/또는 다르게 제조된 것 중의 뉴런 세포로 자극 파형을 전달한다. 일부 실시양태에서, 검출 시스템은 시냅스 소포 순환과 관련한 활동을 모니터링한다. 일부 실시양태에서, 시냅스 소포 순환 플랫폼을 이용하여 시냅스 소포 순환 검정법(들) (예를 들어, 시냅스 소포 순환의 조절제를 확인하기 위한 검정법)을 수행한다. 일부 실시양태에서, 시냅스 소포 순환 플랫폼은 단일 오퍼레이터에 의해 작동될 수 있다.
시냅스 소포 단백질: 시냅스 소포 단백질은 시냅스 소포와 결합된 시냅스전 단백질이다. 시냅스 소포 단백질은 전형적으로 막횡단 부분을 갖고 있으며, 내강 부분 및/또는 세포질 부분을 가질 수 있다. 시냅스전 단백질의 내강 부분은 시냅스 소포의 내강에 노출되는 단백질 도메인이다. 시냅스 소포가 시냅스 막과 융합되는 경우, 예를 들어 시냅스 소포 순환의 외분비작용 동안, 시냅스 소포 단백질의 내강 부분은 세포외 공간에 노출될 수 있는 것으로 이해된다. 시냅스전 단백질의 세포질 부분은 시냅스 소포가 존재하는 세포의 세포질에 노출되는 단백질 도메인이다. 시냅스 소포가 시냅스 막과 융합되는 경우, 예를 들어 시냅스 소포 순환의 외분비작용 동안, 시냅스 소포 단백질의 내강 부분은 여전히 세포질에 노출된 채로 있을 수 있는 것으로 이해된다. 시냅스전 단백질의 막횡단 부분은 소포 막 내 매몰된 단백질 도메인이다. 시냅스 소포가 시냅스 막과 융합되는 경우, 예를 들어 시냅스 소포 순환의 외분비작용 동안, 시냅스 소포 단백질의 막횡단 부분은 세포 막 내에 매몰되는 것으로 이해된다.
치료제: 본원에서 사용되는 용어 "치료제"는 대상체에게 투여될 때 치료학적 효과를 갖고/거나 원하는 생물학적 및/또는 약리학적 효과를 이끌어내는 임의의 작용제를 지칭한다.
시간 경과에 따른 전기장: 본원에서 사용되는 용어 "시간 경과에 따른 전기장"은 시간에 대해 변화될 수 있는 등급 및 방향을 갖는 전기장을 기재하기 위해 사용된다.
파형: 본원에서 사용되는 용어 "파형"은 일반적으로 다양한 시간 경과에 따른 물리적 양, 예를 들어, 시간 경과에 따른 전압, 시간 경과에 따른 전류, 시간 경과에 따른 전기장, 시간 경과에 따른 형광 방출 등을 지칭하기 위해 사용된다.
본 발명의 특정 실시양태의 상세한 설명
본 발명은 시냅스 소포 순환 조절제를 확인하기 위한 시스템 및 방법을 제공한다. 특히, 본 발명은 시냅스 소포 순환 검정법을 제공한다. 일부 실시양태에서, 시냅스 소포 순환 검정법을 이용하여 시냅스 소포 순환의 속도론, 효율 및/또는 다른 특성을 모니터링한다. 일부 실시양태에서, 시냅스 소포 순환 검정법을 이용하여 시냅스 소포 순환의 하나 이상의 측면에 영향을 미치는 (예를 들어, 자극하고/거나 억제하는) 물질을 확인한다.
시냅스 소포 순환 검정법은 전형적으로, 기능적 시냅스 소포 순환 또는 그의 하나 이상의 활동을 나타내는 시냅스전 말단을 포함하는 세포 또는 세포 배양물, 리포터 (예를 들어, 시냅스 소포 순환 또는 그의 하나 이상의 활동을 추적하는데 유용한 리포터), 자극 시스템 (예를 들어, 활동 전위 개시를 통해 시냅스 소포 순환을 개시하는 전기적, 음향, 초음파, 광학 자극 시스템) 및 검출 시스템 (예를 들어, 리포터에 의해 생성된 신호를 캡쳐하는 영상 장치)을 필요로 한다. 일부 실시양태에서, 시냅스 소포 순환 검정법은 고출력 포맷으로 구축되고/거나 실행될 수 있다.
시냅스 소포 순환
뉴런이 활성화되는 경우, 활동 전위의 달성에 의해 신경전달물질의 분비가 유발되며, 이는 외분비작용을 통해 일어난다. 시냅스전 신경 말단 내의, 신경전달물질을 함유하는 시냅스 소포는 시냅스전 막으로 동원되고, 여기서, 이들은 칼슘 이온 탐지에 대해 그리고 궁극적으로는 시냅스전 막과의 융합에 대해 도킹 및 프라이밍된다. 활동 전위에 도달하면, 활동 전위의 다운 스트로크(down stroke) (꼬리 전류)에서 전압-의존적이고 칼슘-선택적인 이온 채널을 통해 칼슘 이온이 유입된다. 이어서, 칼슘 이온은 생화학적 캐스케이드를 개시하며, 이는 시냅스전 막과 융합하고 신경전달물질을 시냅스 틈으로 분비하는 시냅스 소포를 야기한다. 시냅스 소포 융합은 SNARE로서 공지된 시냅스전 말단 내 한 세트의 단백질의 작용에 의해 구동된다. 상기 융합에 의해 첨가된 막은 이후에, 클라트린-매개 핵형성 단계, 시냅스전 막의 함입 단계, 시냅스전 막으로부터 시냅스 소포의 분열 단계 및 내분비작용된 시냅스 소포로부터 클라트린의 제거 단계를 포함하는 내분비작용에 의해 복구된다. 내분비작용된 시냅스 소포는 시냅스전 말단 내로 전위된 다음 분류되고, 그의 내강은 신경전달물질로 재로딩된다.
칼시뉴린은 시냅스 소포 순환에 관여하는 것으로 알려져 있다. 예를 들어, 칼시뉴린은 시냅스 소포 순환의 조절에 관여하는, 시냅신 및 데포스핀 (이들로 한정되지는 않음)을 비롯한 다양한 시냅스 소포 순환 단백질을 탈인산화시킨다. 시냅신은 시냅스 소포 이동 및 시냅스에서의 신경전달물질 방출을 조절하는 단백질 족이다. 구체적으로, 시냅신은 임의의 주어진 시간에 세포외유출을 통한 방출이 가능한 시냅스 소포의 개수의 조절에 관여하는 것으로 판단된다. 예를 들어, 칼시뉴린에 의한 시냅신 I의 탈인산화는 강력한 자극 동안 시냅스 소포 이동을 증진시키는 것으로 판단된다. 데포스핀은 신경전달물질을 방출한 시냅스 소포의 세포내섭취를 조절한다. 예시적인 데포스핀으로는 다이나민 I, PIP5K1γ, 시냅토자닌 I, Eps15, 엡신, AP2, AP180이 포함되나, 이들로 한정되지는 않는다. 특정 시냅스전 단백질이 기능하는 것으로 판단됨을 나타내는 시냅스 소포 순환의 모식도가 도 1에 제시되어 있다.
시냅스전 말단내 시냅스 소포 내재화를 위한 제한된 용량이 존재할 수 있는 것으로 보고된 바 있다 (본원에 포함되는 문헌 [Balaji, J., et al., (2008). JNeurosci, 28(26):6742-6749]에 기재되어 있음). 낮은 강도의 자극 (예를 들어, 10 Hz 초과에서 개시되는 100 미만의 활동 전위)에서, 용량은 포화되지 않고, 그 범위내에서 증가하는 자극 강도는 세포내섭취의 역학을 변화시키지 않는다. 높은 강도의 자극 (예를 들어, 10 Hz 초과에서 개시되는 100 초과의 활동 전위)에서, 용량은 포화되고, 이에 따라 시냅스 소포의 세포내섭취의 속도가 평균적으로 저하된다. 또한, 시냅스 소포 세포내섭취 용량은 시냅스전 말단내 세포내 Ca++ 농도에 의해 조절되는 것으로 판단된다. 세포내 Ca++ 수준이 증가되면, (아마도 칼시뉴린의 활성화 및 데포스핀의 탈인산화로 인한) 새로운 시냅스 소포 세포내섭취 부위가 구축된다.
조절 물질의 확인 및/또는 특성 분석을 위한 플랫폼 및 방법
본 발명은 시냅스 소포 순환을 조절하는 물질을 확인하기 위한 시스템 및 방법을 제공한다. 이러한 방법은 전형적으로, 기능적 시냅스 소포 순환 또는 시냅스 소포 순환의 하나 이상의 양상을 나타내는 시냅스전 말단, 리포터 (예를 들어, 시냅스 소포 순환 또는 시냅스 소포 순환의 하나 이상의 작용을 추적하는 데 유용한 리포터), 자극 시스템 (예를 들어, (예를 들어, 활동 전위 개시를 통해) 시냅스 소포 순환을 개시하기 위한 전기적, 음향적, 초음파적, 광학적 또는 생화학적 자극 시스템) 및 검출 시스템 (예를 들어, 리포터에 의해 생성된 신호를 포획하기 위한 영상화 장치)을 포함하는 세포 또는 세포 배양물을 포함한다.
시냅스 소포 순환의 분석을 위한 플랫폼 (본원에서 시냅스 소포 순환 플랫폼으로 지칭될 수 있음)이 제공된다. 본원에 개시된 특정 플랫폼은 고효율 방식으로 시냅스 소포 순환을 분석하는 데 적합하다. 플랫폼은 전형적으로, 다수의 뉴런 세포 배양물 각각에서 시냅스 소포 순환의 하나 이상의 양상을 검출하도록 구성된다. 이러한 플랫폼은 다수의 뉴런 세포 배양물 각각에서 활동 전위의 동시적 유도, 및 각 배양물에서 양상 시냅스 소포 순환의 동시적 검출을 위해 구성될 수 있다. 별법으로, 상기 플랫폼은 다수의 뉴런 세포 배양물 각각에서 활동 전위의 순차적 유도, 및 각 배양물에서 양상 시냅스 소포 순환의 순차적 검출을 위해 구성될 수 있다. 본 발명의 몇몇 실시양태에서, 활동 전위는 시냅스 소포 순환의 양상을 나타내는 발광 신호의 검출과 동시에 유도된다.
플랫폼은, 뉴런 세포를 배양하기에 적합한 다수의 용기 (예를 들어, 웰, 튜브 등), 및 용기 (예를 들어, 웰)에서 뉴런 세포의 활동 전위를 개시하거나 유도하도록 구성된 다수의 자극기 (예를 들어, 전극쌍, 청각 장치 등)을 포함할 수 있다. 자극기는 전형적으로, 용기 내에 (또는 용기에 인접하게) 위치하여 용기에서 다수의 뉴런 세포의 시냅스 소포 순환을 유도하도록 구성될 수 있다. 예를 들어, 전극쌍은 웰 내에 위치하여 웰에서 다수의 뉴런 세포의 시냅스 소포 순환을 유도하는 하나 이상의 전압 펄스를 생성하도록 구성될 수 있다. 플랫폼은 또한, 다수의 검출기를 포함하는 검출 시스템을 포함할 수 있다. 각 검출기는 전형적으로, 웰 내에 존재하는 뉴런 세포로부터의 발광 신호를 검출하도록 구성된다. 발광 신호는 전형적으로, 뉴런 세포의 시냅스전 단백질에 부착된 리포터 분자로부터 발산되며, 뉴런 세포의 시냅스 소포 순환의 양상을 나타낸다. 플랫폼의 각 용기 (예를 들어, 웰)는 전형적으로, 다수의 뉴런 세포를 포함한다.
뉴런 세포
시냅스 소포 순환을 조절하는 물질을 확인하기 위한 시스템 및 방법은 전형적으로, 뉴런 세포의 사용을 포함한다. 몇몇 실시양태에서, 뉴런 세포는 시냅스전 말단을 갖고, 이 시냅스전 말단은 기능적 시냅스 소포 순환을 형성한다. 몇몇 실시양태에서, 뉴런 세포는 시냅스전 말단을 갖지 않되, 기능적 시냅스 소포 순환을 갖는 시냅스전 말단을 형성하도록 유도될 수 있다. 세포는, 특정 조건 하에 세포를 배양 및/또는 인큐베이션함으로써 기능적 시냅스 소포 순환을 갖는 시냅스전 말단을 형성하도록 유도될 수 있다.
뉴런 세포 배양물은, 시냅스전 소포 순환의 하나 이상의 요소를 겪는 세포의 집합체를 포함할 수 있다. 몇몇 실시양태에서, 시냅스 소포 순환의 관련 작용에는 시냅스전 막으로 시냅스 소포의 이동, 시냅스전 막에의 결합, 시냅스전 막과의 융합의 개시, Ca2 + 감지, 시냅스전 막과의 융합, 시냅스 간극으로의 신경전달물질 방출, 세포내섭취에 의한 시냅스전 말단내 시냅스 소포의 회수 (클라트린-매개 핵형성의 단계, 시냅스전 막 함입의 단계, 시냅스전 막으로부터의 시냅스 소포 분열의 단계, 및 세포내섭취된 시냅스 소포로부터 클라트린 분리의 단계를 포함함), 시냅스전 말단내 시냅스 소포의 전위, 시냅스전 말단내 시냅스 소포의 정렬, 및 시냅스 소포 강으로의 신경전달물질 로딩이 포함된다. 몇몇 실시양태에서, 다수의 뉴런 세포들의 구성원들은 서로 실질적으로 유사하다. 몇몇 실시양태에서, 다수의 뉴런 세포들의 구성원들은 서로 실질적으로 유사하지 않다.
몇몇 실시양태에서, 뉴런 세포는 살아있는 세포의 시험관내 배양물 중에 있다. 몇몇 실시양태에서, 뉴런 세포 시스템은 시험관내 세포 현탁물 (예를 들어, 완충제, 염, 전해질, 계면활성제 등 중 하나 이상을 포함하는 매질 중에 현탁됨) 중에 있다. 몇몇 실시양태에서, 뉴런 세포는 표면과 결합된 다수의 세포 (예를 들어, 표면 상에서 성장한 세포, 표면에 부착된 세포, 표면에 묶인 세포 등)를 포함하는 시험관내 배양물 중에 있다. 몇몇 실시양태에서, 뉴런 세포는 생체내 공급원으로부터 실질적으로 정제된 (예를 들어, 동물로부터 수확된) 다수의 뉴런 세포를 포함하는 시험관내 배양물 중에 있다. 몇몇 실시양태에서, 뉴런 세포는 인간 또는 동물 공여자의 피질로부터 유래될 수 있다. 몇몇 실시양태에서, 뉴런 세포는 안정적인 세포주이다. 몇몇 실시양태에서, 뉴런 세포는 살아있는 동물 (예를 들어, 설치류, 인간 등) 내에 존재한다.
몇몇 실시양태에서, 뉴런 세포 배양물은 일차 뉴런 배양물이다. 몇몇 실시양태에서, 일차 뉴런 배양물은 설치류 (예를 들어, 마우스, 래트 등), 영장류 (예를 들어, 인간, 원숭이 등), 포유동물 (예를 들어, 고양이, 개 등) 및/또는 무척추동물 (예를 들어, 파리, 벌레 등)의 일차 뉴런으로부터 유래될 수 있다. 몇몇 실시양태에서, 일차 뉴런 배양물은 동물의 전뇌, 해마, 선조체, 소뇌, 신경조절 영역 (예를 들어, 청반, 복측 피개, 흑질, 솔기핵, 마이네르트 기저핵, 중격핵), 척수 또는 소뇌의 일차 뉴런으로부터 유래될 수 있다. 몇몇 실시양태에서, 적합한 뉴런 세포 배양물은 일차 래트 전뇌 뉴런을 포함할 수 있다.
몇몇 실시양태에서, 뉴런 세포는 줄기 세포이다. 몇몇 실시양태에서, 줄기 세포는 신경 줄기 세포이다. 몇몇 실시양태에서, 줄기 세포는 배아 줄기 세포이다. 몇몇 실시양태에서, 줄기 세포는 설치류 (예를 들어, 마우스, 래트 등), 영장류 (예를 들어, 인간, 원숭이 등), 포유동물 (예를 들어, 고양이, 개 등) 및/또는 무척추동물 (예를 들어, 파리, 벌레 등)로부터 유래된다. 몇몇 실시양태에서, 줄기 세포는 시험관내에서 뉴런으로 분화되고, 분화된 뉴런은 기능적 시냅스 소포 순환을 갖는 시냅스전 말단을 포함한다. 문헌 [Fico et al. Stem Cells Dev, 17(3):573-584]를 참조한다.
몇몇 실시양태에서, 뉴런 세포는 세포주이다. 몇몇 실시양태에서, 사용될 수 있는 세포주에는 PC12 세포, 피질 세포주 및/또는 불멸화 신경 세포주가 포함된다.
몇몇 실시양태에서, 뉴런 세포 배양물은, 특정 배양 조건 하에 기능적 시냅스 소포 순환을 나타내는 시냅스전 말단을 형성하지 않으나 다른 배양 조건 하에 기능적 시냅스 소포 순환을 나타내는 시냅스전 말단을 형성하는 세포를 포함할 수 있다. 몇몇 실시양태에서, 뉴런 세포는 모든 배양 조건 하에 기능적 시냅스 소포 순환을 나타내는 시냅스전 말단을 갖거나 형성하는 세포를 포함할 수 있다.
몇몇 실시양태에서, 시냅스 소포 순환 검정은 배양된 뉴런 세포를 포함한다. 몇몇 실시양태에서, 배양 배지는 시냅스 소포 순환 검정에서 사용되는 세포로부터 분리되고, 전기적 자극에 적합한 (예를 들어, 완충제, 염, 전해질, 계면활성제 등 중 하나 이상을 포함하는) 매질 (예를 들어, 바람직한 전기 전도도를 갖는 용액)로 대체된다
몇몇 실시양태에서, 뉴런 세포는 시냅스 소포 순환을 위한 바람직한 리포터를 취하도록 형질전환, 형질감염, 감염 및/또는 달리 유도될 수 있다. 몇몇 실시양태에서, 세포는 리포터를 발현하는 바이러스 (예를 들어, 시냅토플루오린-발현 바이러스)에 감염된다. 몇몇 실시양태에서, 세포는 리포터의 발현을 제어하는 벡터로 형질전환된다. 몇몇 실시양태에서, 세포는 리포터의 발현을 제어하는 발현 카세트를 갖는 트랜스제닉이다. 몇몇 실시양태에서, 리포터의 발현은 (예를 들어, 특정 대사물질을 배양 배지에 첨가함으로써) 발현될 수 있다. 몇몇 실시양태에서, 세포는 리포터 자체를 발현하지 않지만, 대신에 리포터가 (예를 들어, 리포터를 배양 배지 및/또는 현탁 매질에 첨가함으로써) 세포에 직접 투여된다.
플랫폼의 각 용기, 예를 들어 웰, 튜브 등은 전형적으로, 다수의 뉴런 세포를 포함한다. 용기, 예를 들어 웰 중의 다수의 뉴런 세포는 2 내지 100개 뉴런 세포, 100 내지 1,000개 뉴런 세포, 1,000 내지 10,000개 뉴런 세포, 10,000 내지 100,000개 뉴런 세포, 100,000 내지 1,000,000개 뉴런 세포, 또는 1,000,000 내지 10,000,000개 뉴런 세포의 범위일 수 있다. 용기, 예를 들어 웰 중의 다수의 뉴런 세포는 약 2개 뉴런 세포, 약 10개 뉴런 세포, 약 100개 뉴런 세포, 약 1,000개 뉴런 세포, 약 10,000개 뉴런 세포, 약 100,000개 뉴런 세포, 약 1,000,000개 뉴런 세포, 약 10,000,000개 뉴런 세포, 또는 그 이상의 뉴런 세포 개수일 수 있다. 다른 적절한 뉴런 세포 개수는 본 개시에 기초하여 당업자에게 명백할 것이다.
별법으로, 다수의 뉴런 세포는 세포 부착 면적 크기, 예를 들어 웰 기저부 면적을 기준으로 조성될 수 있다. 예를 들어, 다수의 뉴런 세포는 10 내지 100개 뉴런 세포/mm2 부착 면적, 100 내지 1,000개 뉴런 세포/mm2 부착 면적, 1,000 내지 2,000개 뉴런 세포/mm2 부착 면적, 2,000 내지 3,000개 뉴런 세포/mm2 부착 면적, 3,000 내지 4,000개 뉴런 세포/mm2 부착 면적, 4,000 내지 5,000개 뉴런 세포/mm2 부착 면적, 5,000 내지 6,000개 뉴런 세포/mm2 부착 면적, 6,000 내지 7,000개 뉴런 세포/mm2 부착 면적, 7,000 내지 8,000개 뉴런 세포/mm2 부착 면적, 8,000 내지 9,000개 뉴런 세포/mm2 부착 면적, 또는 9,000 내지 10,000개 뉴런 세포/mm2 부착 면적의 범위일 수 있다. 다수의 뉴런 세포는 약 10개 뉴런 세포/mm2 부착 면적, 약 100개 뉴런 세포/mm2 부착 면적, 약 1,000개 뉴런 세포/mm2 부착 면적, 약 10,000개 뉴런 세포/mm2 부착 면적, 또는 그 이상의 뉴런 세포 개수/mm2 부착 면적일 수 있다. 다른 적절한 부착 면적 당 뉴런 세포 개수는 본 개시에 기초하여 당업자에게 명백할 것이다.
다수의 뉴런 세포는 단일 세포 유형 또는 별법으로 2종 이상의 상이한 뉴런 세포 유형을 포함할 수 있다. 뉴런 세포는 본원에서 개시된 임의의 동물로부터 단리된 일차 뉴런, 예를 들어 래트 일차 뉴런일 수 있다. 뉴런 세포는 글루타메이트성, GABA성, 도파민작용성, 아드레날린성, 세로토닌성 및 콜린성 뉴런 세포로 이루어진 군으로부터 선택될 수 있다. 여전히 다른 예시적인 뉴런 세포가 본원에 개시되어 있고, 당업계에 공지되어 있다.
리포터
또한 본원에서 리포터 분자로 지칭되는 본 발명에 적합한 리포터에는 임의의 리포터 단백질, 유전자, 화합물, 또는 하나 이상의 시냅스 소포 순환 활성의 신호 지표를 발생 또는 생성할 수 있는 다른 분자 또는 물질이 포함된다. 예를 들어, FM 염료 (예를 들어, FM1-43, FM2-10, FM4-64 등) 및 시냅스 소포 단백질의 내강 도메인에 형광 태그가 부착된 항체 (예를 들어, 시냅토타그민 항체)는 시냅스 소포 순환을 탐지하는데 사용될 수 있다. FM1-43는 친수성 및 소수성 영역을 모두 갖는 양친성 분자인 스티릴피리디늄 분자 (또한 스티릴 분자 또는 스티릴 염료로 공지됨)이다. 이들 사이에 이중 결합 가교가 있는 두 방향족 고리로 구성된 피리디늄 기 함유 친수성 영역 (전형적으로 헤드로 지칭됨)은 염료 분자의 형광단 부분이다. 이러한 형광단 기는 약 500 나노미터에서 여기되고 약 625 나노미터에서 빛이 방출된다.
FM1-43분자의 소수성 영역 (또한 테일로 지칭됨)은 염료를 세포 또는 시냅스 소포의 원형질 막으로 들어가게 한다. 탄화수소 테일의 상호작용은 또한 신호의 휘도에 변화를 유발할 수 있다. 그러나, 이들 리포터는 전형적으로 백그라운드를 감소시키기 위한 많은 양의 세척을 필요로 한다. 따라서, 이들 리포터는 균일한 세포-기재 검정을 위해 바람직하지 않을 수 있다. 본원에서 사용되는 "균일한 세포-기재 검정"은 세포에 리포터를 적용한 후 세척을 필요로 하지 않는 리포터를 사용하는 검정을 지칭한다. 또한, 세척의 필요로 인해, 세포내 이입은 일반적으로 세척 전 및 세척 동안 발생하기 때문에 이들 리포터는 전형적으로 세포내 이입의 동역학 공정을 탐지하지 못한다. 세척 단계는 또한 높은 처리량 스크리닝을 보다 어렵고 비용이 많이 들게 하며 시간이 걸리게 한다.
몇몇 실시양태에서, 시냅스 소포 순환 검정에서 이용될 수 있는 리포터는 pH-민감성 리포터이다. 전형적으로, 이러한 리포터는 특정 pH 또는 pH 범위에서 특정 특징(들)을 갖고, 상이한 pH 또는 pH 범위에서 다른 특징(들)을 가질 수 있다. 예를 들어, pH-민감성 리포터는 세포외 환경 (약 pH 7.4) 및 시냅스 소포 내강 (약 pH 5.5)에서 상이한 형광 특징을 가질 수 있다. 예를 들어, 본 발명에 적합한 pH-민감성 형광 리포터는 약 pH 7.4에서 형광을 낼 수 있지만, pH 5.5에서는 형광을 낼 수 없다. 본 발명에 적합한 pH-민감성 형광 리포터는 또한 약 pH 5.5에서 형광을 낼 수 있지만, pH 7.4에서는 형광을 낼 수 없다. 이러한 방식으로 작용하는 pH-민감성 리포터는 비흡수된 리포터가 세척 제거될 필요가 없기 때문에 유용하다.
따라서, pH-민감성 리포터는 전형적으로 세척 단계의 필요성을 제거하여, 검정을 균일하게 하고, 세포내 이입을 바로 측정할 수 있게 한다. 이러한 리포터의 예에는 1) 시냅스 소포 단백질의 내강 도메인에 태그로 부착된 플루오린 및 2) 시냅스 소포 단백질의 내강 도메인에 태그로 부착된 pH 민감성 염료 (예를 들어, pHrodo 및 CypHer5E) 또는 제형화되어 시냅스 소포 막에 삽입된 염료 (FM1-43와 유사함)가 포함된다.
플루오린은 pH-민감성 녹색 형광 단백질 (GFP)이다. 플루오린은 시냅스 소포 단백질의 내강 도메인에 태그를 부착하여 시냅스 소포 순환을 탐지하는데 사용할 수 있다. 내강 도메인 태그는 시냅스 소포의 내부에 플루오린을 표적화하는데 도움을 준다. 플루오린은 pH 7.4에서 형광을 나타내며, 형광은 약 pH 5.5에서 켄칭된다. 플루오린은 VAMP2, vGlut1, 시냅토파이신 및 시냅토타그민에 태그로 부착될 수 있다 (Miesenbock, et al. (1998) Nature, 394(6689):192-5; Fernandez-Alfonso et al. (2006) Neuron, 51(2):179-86; Granseth et al. (2006) Neuron, 51(6):773-86; Voglmaier et al. (2006) Neuron, 51(1):71-86 참조). 플루오린은 (예를 들어, 멀티웰 플레이트에서) 플루오린 태그가 부착된 시냅스 소포 단백질을 발현하는 바이러스로 감염시킴, 플루오린 태그가 부착된 시냅스 소포 단백질의 발현을 유도하는 벡터로 형질변환시킴, 또는 플루오린 태그가 부착된 시냅스 소포 단백질을 발현하는 트랜스제닉 동물 (예를 들어, 마우스 또는 래트)의 발생을 비롯한 다양한 방법에 의해 뉴런에 전달될 수 있다.
시냅스 소포 단백질은 시냅스 소포와 관련되는 시냅스 이전 단백질이다. 시냅스 소포 단백질은 전형적으로 막횡단 부분을 갖고 내강 영역 및/또는 세포질 부분을 가질 수 있다. 시냅스 소포 단백질은 VAMP2, vGlut1, 시냅토파이신, 소포 GABA 수송체, 아세틸콜린 수송체, 카테콜아민 수송체 또는 시냅토타그민으로 이루어진 군으로부터 선택될 수 있다. 전형적으로, 시냅스 소포 단백질은 리포터 분자에 부착된다. 예를 들어, 리포터 분자는 시냅스 소포 단백질의 내강 영역에 부착될 수 있다. 전형적으로, 리포터 분자는 pH 민감성 리포터 분자이다. 예를 들어, 리포터 분자는 pH 민감성 형광 단백질, 예를 들어 플루오린일 수 있다.
pH 민감성 리포터 분자, 예를 들어 pH 민감성 형광 단백질, 예를 들어 플루오린은 pH 4.5 내지 5.0, 5.0 내지 5.5, 6.5 내지 7.0, 7.0 내지 7.5, 7.5 내지 8.0, 또는 8.0 내지 8.5에서 피크 방출 세기를 가질 수 있다. pH 민감성 리포터 분자는 약 4.5, 4.5, 5.0, 5.5, 6.0, 6.5, 7.0, 7.5, 8.0, 8.5 또는 그 이상 (이러한 일련의 수들 사이의 모든 값을 포함함)까지의 pH에서 최대 방출 세기를 가질 수 있다. pH 민감성 리포터 분자는 pH 6.5 내지 8.5에서 형광을 낼 수 있으며, 그 세기는 pH 4.5 내지 6.5에서보다, 예를 들어 2배, 5배, 10배, 20배, 30배, 40배, 또는 그 이상으로 상당히 더 높다. pH 민감성 리포터 분자는 pH 6.5 내지 7.5에서 형광을 낼 수 있으며, 그 세기는 pH 5.0 내지 6.0에서보다, 예를 들어 2배, 5배, 10배, 20배, 30배, 40배, 또는 그 이상으로 상당히 더 높다. 별법으로, pH 민감성 리포터 분자는 pH 4.5 내지 6.5에서 형광을 낼 수 있으며, 그 세기는 pH 6.5 내지 8.5에서보다, 예를 들어 2배, 5배, 10배, 20배, 30배, 40배, 또는 그 이상으로 상당히 더 높다. pH 민감성 리포터 분자는 pH 5.5 내지 6.0에서 형광을 낼 수 있으며, 그 세기는 pH 6.5 내지 7.5에서보다, 예를 들어 2배, 5배, 10배, 20배, 30배, 40배, 또는 그 이상으로 상당히 더 높다. pH 민감성 리포터 분자의 피크 방출 세기에 대한 다른 적절한 pH 값은 본 개시 내용에 따라 당업자에게 명백할 것이다.
pH 민감성 리포터 분자의 피크 방출 파장은 350 nm 내지 400 nm, 400 nm 내지 450 nm, 450 nm 내지 500 nm, 500 nm 내지 550 nm, 550 nm 내지 600 nm, 또는 600 nm 내지 650 nm일 수 있다. pH 민감성 리포터의 피크 방출 파장은 약 300 nm, 약 350 nm, 약 400 nm, 약 450 nm, 약 500 nm, 약 550 nm, 약 600 nm, 약 650 nm, 또는 그 이상일 수 있다. pH 민감성 리포터 분자의 다른 적절한 피크 방출 파장은 본 개시 내용에 따라 당업자에게 명백할 것이다.
몇몇 실시양태에서, 본원에서 개시된 플랫폼 및 방법에서 리포터 분자로서 사용될 수 있는 플루오린의 아미노산 서열은 하기와 같다.
다른 적절한 플루오린이 본 개시 내용에 따라 당업자에게 명백할 것이다.
몇몇 실시양태에서, 플루오린은 시냅토파이신에 융합된다. 본원에 개시된 플랫폼 및 방법에서 사용될 수 있는 예시적인 시냅토파이신 기재 플루오린은 하기 핵산 서열에 의해 코딩된다.
몇몇 실시양태에서, 플루오린은 VAMP2에 융합된다. 다른 실시양태에서, 플루오린은 vGlut에 융합된다. 본원에 개시된 플랫폼 및 방법에서 사용될 수 있는 예시적인 vGlut 기재 플루오린은 하기 핵산 서열에 의해 코딩된다.
본원에 개시된 플랫폼 및 방법에서 리포터 분자, 예를 들어 플루오린의 발현을 제어하기 위해 사용될 수 있는 인간 시냅신 I 프로모터의 서열을 하기에 제공한다.
다른 적절한 프로모터가 사용될 수 있다. 예를 들어, 일반적인 발현을 위해 CMV 또는 치킨 (chicken) 베타-액틴 프로모터가 사용될 수 있다. 별법으로, 뉴런-특이적 발현을 위해 뉴런 특이적 에놀라아제 또는 시냅신 I 프로모터가 사용될 수 있다. 글루타메이트성-특이적 발현을 위해 vGlut1 프로모터가 사용될 수 있다. GABA성-특이적 발현을 위해 GAD65, GAD67, 소마토스타틴, 또는 GABA 소낭성 수송체 프로모터가 사용될 수 있다. 여전히 다른 적절한 프로모터가 당업자에게 명백할 것이다.
하기는 본원에 개시된 플랫폼 및 방법에서 사용될 수 있는 인간 시냅신 I 프로모터에 작동가능하게 연결된 시냅토파이신-플루오린을 갖는 예시적인 발현 카세트를 나타낸다.
예시적인 pH-민감성 염료, 예컨대 Cypher5E (지이 헬스케어 (GE Healthcare)) 및 pHrodo (인비트로젠 (Invitrogen))는 약 pH 5.5에서 형광을 내고 약 pH 7.4에서 켄칭되는 소분자 형광단이다. 예를 들어, pH 5.5에서 pH 7.4에서와는 상이한 구조를 갖기 때문에, 상이한 pH에서 Cypher5E의 형광에 차이가 발생한다 (도 12). 일부 실시양태에서, pH-민감성 염료는 소포 세포외 배출, 세포내 이입 및/또는 재산성화를 탐지하기 위해 사용될 수 있다. 전형적으로, pH-민감성 염료는 세포 막 투과성이다.
전형적으로, pH-민감성 염료는 pH-민감성 염료를 시냅스 소포로 바로 수송하고, 시냅스 소포 외부로 확산되는 것을 방지하는 하나 이상의 표적화 잔기와 연결될 수 있다. 일부 실시양태에서, 연결은 공유결합이다. 일부 실시양태에서, 연결은 비공유결합이다 (예를 들어, 수소 결합, 정전기적 상호작용, 친화도 상호작용, 반 데르 발스 (Van der Waals) 힘, 등에 의해 매개됨). 단지 몇몇 예를 들면, pH-민감성 염료는 막 인터칼레이터 (FM1-43과 유사함), 시냅스 소포 단백질(들)의 내강 내 도메인(들)을 인식하는 항체, 시냅스 소포 내강의 외부에 존재하는 것보다 높은 수준으로 시냅스 소포 내강에 존재하는 단백질 태그를 인식하는 항체와 연결될 수 있다. pH-민감성 염료는 또한 큰 막 불투과성 비특이적 분자, 예컨대 덱스트란에 결합될 수 있다. 이들은 소포가 세포의 표면상에 있을 경우, 확산에 의해 시냅스 소포로 들어간다.
전기 자극 시스템
본 발명에 따른 물질 변화 확인 및/또는 특징 규명을 위한 검정은 전형적으로 전기 자극 시스템을 포함한다. 작용 전위 발화의 전장 자극은 세포의 세포 막의 상대적으로 간단한 저항 특성으로 외부 전기장의 물리적 상호작용을 기초로 한다. 전형적 세포체를 내성이 높은 쉘 (원형질 막) 및 내성이 상대적으로 낮은 내부 (세포질)를 갖는 대상체로 생각할 경우, 간단한 정전기 이론을 적용하여, 전기장에 위치할 경우, 이는 전기장 세기 E 및 세포체 d의 크기의 곱셈합에 의해 주어지는, 세포를 가로질러 전압 저하를 가질 것이다. 예를 들어, 전압 저하를 일련의 저항 장치를 가로질러 발생하는 것으로 생각할 경우, 둘은 원형질 막에 상응하고 하나는 세포질에 상응한다. 원형질 막의 내성이 세포질보다 훨씬 높다 가정하면, 이는 실질적으로 모든 전압 저하가 원형질 막을 가로질러 발생할 것임을 암시한다. 세포의 한 단면상의 막은 (E x d)/2로 감극되는 반면, 대향 단면상의 막은 이와 같은 양으로 과분극될 것이다. 뉴런에 대해, 한 단면이 충분히 감극될 경우, 이로 인해 작용 전위가 개시될 것으로 예상된다. 전위 자극은 전형적으로 전기장이 발생하도록 이들 사이의 전압 저하 (예를 들어, 약 10 V/cm)를 갖는 한 쌍의 전극을 포함한다. 비제한적인 예로서, 직경이 50 μm인 전형적 세포체에 대해, 각각의 세포 막을 가로지르는 전압 저하는 약 25 mV이다.
다양한 실시양태에서, 전기 자극 시스템은 뉴런 세포에서 작용 전위를 여기시키기 위해 사용된다. 특정 실시양태에서, 전기 자극 시스템은 뉴런 세포에서 작용 전위를 유도하기에 충분한 세포 막횡단 전위를 제공한다. 일부 실시양태에서, 전기 자극 시스템은 뉴런 세포를 포함하는 다수의 별도의 웰, 예를 들어 멀티웰 플레이트의 다수의 웰에서 실질적으로 동시에 작용 전위를 여기시키도록 개조될 수 있다. 전기 자극 시스템은 다양하거나 또는 맞춤화된 자극 파장형태를 실행가능한 뉴런 세포를 함유하는 하나 이상의 웰에 제공하도록 개조될 수 있다. 자극 파장형태는 시간-변화 전기장을 포함할 수 있다.
전극쌍의 전극은 실질적으로 곡선 표면을 가질 수 있다. 예를 들어, 전극쌍의 전극은 동심 원통으로서 성형될 수 있다. 직경이 상이한 전극쌍의 전극들은, 직경이 보다 작은 전극이 실질적으로 직경이 보다 큰 전극 내강 부분 내에 위치하고; 임의로는 2개의 동심 원통형 전극은 환상 절연 물질에 의해 분리될 수 있다. 상기 내부에 배치되는 플랫폼은 포지셔닝 장치, 예를 들어 다수의 전극쌍들 중 각각의 전극쌍을 다수의 웰들 중 하나의 웰 내에 작동가능하게 위치시키기 위해 배치된 전극 전달 시스템을 포함할 수 있다. 예를 들어, 전극 전달 시스템으로서의 용도를 위해, 상업적으로 입수가능한 멀티웰 플레이트 자동화 기기, 예를 들어 바이오메크(biomek®) 실험실 자동화 기기가 적합할 수 있다.
전기 자극 시스템을 포함하는 플랫폼은 다수의 전극쌍에 작동가능하게 연결된 전원을 포함할 수 있다. 전형적으로, 전원은 각각의 전극쌍을 가로질러 미리 결정된 전압, 예를 들어 전압 펄스를 인가하기 위해 배치된다. 전압은 1 V 내지 400 V, 1 V 내지 300 V, 1 V 내지 200 V, 1 V 내지 100 V, 5 V 내지 100 V, 5 V 내지 50 V, 5 V 내지 20 V, 또는 5 V 내지 10 V의 범위일 수 있다. 전압 펄스는 1 V, 약 2 V, 약 3 V, 약 4 V, 약 5 V, 약 6 V, 약 7 V, 약 8 V, 약 9 V, 약 10 V, 약 20 V, 약 30 V, 약 40 V, 약 50 V, 약 60 V, 약 70 V, 약 80 V, 약 90 V, 약 100 V, 약 200 V, 약 300 V, 약 400 V 이하, 또는 그 초과일 수 있다. 다른 적절한 전압은 본원에 기초한 숙련된 당업자에게 명백할 것이다.
플랫폼은 전원 및 다수의 전극쌍에 작동가능하게 연결된 펄스 발생기를 또한 포함할 수 있다. 전형적으로, 펄스 발생기는 각각의 전극쌍을 가로질러 미리 결정된 전압 펄스를 인가하기 위해 배치된다. 펄스 발생기는 미리 결정된 주파수에서 미리 결정된 시간 동안 미리 결정된 다수의 전압 펄스를 인가하기 위해 배치될 수 있다. 이에 따라, 펄스 발생기가 배치되어 특정 전압 파형이 인가될 수 있다. 예시적인 파형을 본원에 개시한다. 컴퓨터는 펄스 발생기에 작동가능하게 연결될 수 있고, 전압 펄스, 예를 들어 각각의 펄스의 크기, 다수의 펄스와 연관된 파형, 펄스의 지속 기간, 펄스의 주파수 및 각각의 펄스 개시 사이의 기간 등의 다양한 양태를 제어하기 위해 배치될 수 있다.
펄스 발생기에 의해 생성되는 미리 결정된 주파수는 0.2 Hz 내지 200 Hz, 0.2 Hz 내지 100 Hz, 0.2 Hz 내지 50 Hz, 0.2 Hz 내지 40 Hz, 0.2 Hz 내지 30 Hz, 0.2 Hz 내지 20 Hz, 0.2 Hz 내지 10 Hz, 10 Hz 내지 20 Hz, 10 Hz 내지 30 Hz, 10 Hz 내지 40 Hz, 10 Hz 내지 50 Hz, 또는 10 내지 100 Hz의 범위일 수 있다. 미리 결정된 주파수는 0.2 Hz, 약 1 Hz, 약 2 Hz, 약 3 Hz, 약 4 Hz, 약 4 Hz, 약 5 Hz, 약 10 Hz, 약 15 Hz, 약 20 Hz, 약 30 Hz, 약 40 Hz, 약 50 Hz, 약 60 Hz, 약 70 Hz, 약 80 Hz, 약 90 Hz, 약 100 Hz 이하, 또는 그 초과일 수 있다. 다른 적절한 주파수는 본원에 기초한 숙련된 당업자에게 명백할 것이다.
펄스 발생기가 전압 또는 다수의 전압을 생성하는 미리 결정된 시간은 0.1초 내지 2분, 0.1초 내지 1분, 0.1초 내지 45초, 0.1초 내지 30초, 0.1초 내지 20초, 0.1초 내지 15초, 0.1초 내지 10초, 0.1초 내지 5초, 또는 0.1초 내지 1초의 범위일 수 있다. 미리 결정된 시간은 약 0.1초, 약 0.5초, 약 1초, 약 2초, 약 3초, 약 4초, 약 5초, 약 10초, 약 20초, 약 30초, 약 40초, 약 50초, 약 1분, 약 2분, 또는 그 초과일 수 있다. 다른 적절한 시간은 본원에 기초한 숙련된 당업자에게 명백할 것이다.
전압 발생기에 의해 생성되는 펄스의 지속 기간은 다양할 수 있다. 예를 들어, 다수의 펄스 중 각각의 펄스는 실질적으로 동일한 지속 기간을 가질 수 있거나, 다수 중 다른 펄스와 상이한 지속 기간을 가질 수 있다. 펄스의 지속 기간은 0.1 msec 내지 10 msec, 0.1 msec 내지 5 msec, 0.1 msec 내지 4 msec, 0.1 msec 내지 3 msec, 0.1 msec 내지 2 msec, 0.1 msec 내지 1 msec, 또는 0.1 msec 내지 0.5 msec의 범위일 수 있다. 펄스의 지속 기간은 약 0.1 msec, 약 0.2 msec, 약 0.3 msec, 약 0.4 msec, 약 0.5 msec, 약 0.6 msec, 약 0.7 msec, 약 0.8 msec, 약 0.9 msec, 약 1 msec, 약 2 msec, 약 3 msec, 약 4 msec, 약 5 msec, 약 10 msec, 약 20 msec, 또는 그 초과일 수 있다. 다른 적절한 지속 기간은 본원의 교시에 기초한 숙련된 당업자에게 명백할 것이다.
또한, 펄스 발생기에 의해 생성되는 펄스의 개수는, 예를 들어 다수의 펄스로 다양할 수 있다. 펄스의 개수는 1 내지 5000, 1 내지 2000, 1 내지 1000, 1 내지 500, 1 내지 400, 1 내지 300, 1 내지 200, 1 내지 100, 1 내지 50, 1 내지 40, 1 내지 30, 1 내지 20, 1 내지 10, 또는 1 내지 5의 범위일 수 있다. 펄스의 개수는 약 1, 약 2, 약 3, 약 4, 약 5, 약 10, 약 20, 약 30, 약 40, 약 50, 약 100, 약 200, 약 300, 약 400, 약 500, 약 1000, 약 2000, 약 3000, 약 4000, 약 5000, 또는 그 초과일 수 있다. 다른 적절한 펄스 개수는 본원의 교시에 기초한 숙련된 당업자에게 명백할 것이다.
다수의 펄스 중 각각의 펄스의 개시 사이의 시간은 다양할 수 있다. 다수의 펄스 중 각각의 펄스의 개시 사이의 시간은 0.1 msec 내지 20 msec, 0.1 msec 내지 10 msec, 0.1 msec 내지 5 msec, 0.1 msec 내지 4 msec, 0.1 msec 내지 3 msec, 0.1 msec 내지 2 msec, 0.1 msec 내지 1 msec, 또는 0.1 msec 내지 0.5 msec의 범위일 수 있다. 다수의 펄스 중 각각의 펄스의 개시 사이의 시간은 약 0.1 msec, 약 0.2 msec, 약 0.3 msec, 약 0.4 msec, 약 0.5 msec, 약 0.6 msec, 약 0.7 msec, 약 0.8 msec, 약 0.9 msec, 약 1 msec, 약 2 msec, 약 3 msec, 약 4 msec, 약 5 msec, 약 6 msec, 약 7 msec, 약 8 msec, 약 9 msec, 약 10 msec, 약 20 msec, 또는 그 초과일 수 있다. 다른 적절한 지속 기간은 본원의 교시에 기초한 숙련된 당업자에게 명백할 것이다.
다양한 실시양태에서, 뉴런에 대한 자극 파형의 인가는, 시냅스 소포 순환이 제어된 실험실 조건 하에서 연구될 수 있도록 시냅스 소포의 세포외배출 및 내분비작용을 유도한다. 특정 실시양태에서, 자극 파형은 뉴런 세포와 접촉하거나 이와 긴밀하게 근접하여 위치하는 전극쌍에 전압 또는 전류 파형을 인가함으로써 생성된다. 전극에 대한 전압 또는 전류 파형의 인가는 뉴런 세포 내에서 시변(time-varying) 전기장 및/또는 시변 전류 밀도를 생성할 수 있고, 이들 전기장 및/또는 전류 밀도는 세포 막횡단 전위를 변화시킬 수 있고, 뉴런 세포 내에서 작용 전위를 유도할 수 있다.
문헌 [Ryan and Smith (1995, Neuron, 14:983; 본원에 참조로 도입됨)] 및 문헌 [Ryan et al. (1996, Proc. Natl. Acad. Sci., 93:5567; 본원에 참조로 도입됨)]에 기재되어 있는 바와 같이, 배양물, 현탁액 및/또는 다른 제제 중 뉴런은 여기 파형의 인가에 의해 자극될 수 있다. 중요한 인자는, 세포를 둘러싸는 조(bath)의 저항을 증가시키면서 전극과 뉴런을 함유하는 조의 접촉 면적을 최대화하는 것 (및 보다 낮은 접속 저항)이다. 치수 l (길이) 및 횡단면 면적 A의 염수 용액의 슬라브의 저항은 R =ιXρ/A (식 중, ρ는 염수의 전도율임 (포유동물 염수에 대해 약 60 Ωcm))에 의해 주어진다. 멀티웰 플레이트 중 단일 웰에 대해, ι는 대략 웰의 직경 (예를 들어, 96웰 플레이트에 대해 약 5 mm)일 것이다. A의 값은 용액의 깊이를 최소화함으로써 감소될 수 있다. 예를 들어, 웰은 깊이가 최소화되도록 (그리고 이에 따라 R이 증가되도록) 고안될 수 있다. 일부 실시양태에서, 약 0.5 mm의 전체 두께가 사용될 수 있다. 일부 실시양태에서, 2개의 전극 시트가 웰의 양면에 놓이지만 그들 사이에서 용액의 바람직한 깊이 (예를 들어, 약 0.5 mm)를 가능하게 하는 웰에 피팅되는 인서트를 구성할 수 있다.
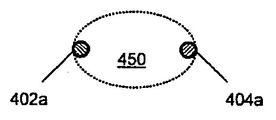
전기 자극 시스템에 유용한 전극쌍 (100)의 특정한 일 예를 도 2A 내지 B에 나타내었다. 나타낸 예에서, 전극 조립체는 내부 전극 (102) 및 외부 전극 (104)인 2개의 전극을 포함한다. 다양한 실시양태에서, 전극 (102, 104)는 전기 전도성이다. 전극은 금속, 반금속, 반도체, 전도성 중합체, 비전도성 중합체 및/또는 이들의 임의의 조합물로부터 제조될 수 있다. 비전도성 물질로부터 형성되는 경우, 전극은 전도성 물질로 코팅될 수 있다. 전극은 생체적합성(biocompatible) 금속 또는 전도성 물질, 예를 들어 금, 은, 스테인리스 강의 다양한 합금, 티타늄, 백금, 전도성 중합체, 인듐 주석 옥시드 (ITO) 및 이들의 조합물 등으로부터 형성될 수 있거나, 이로 도금될 수 있다. 내부 전극 (102)는 고체 막대형 부재, 전선일 수 있거나, 중공 코어를 갖는 원통형 형상일 수 있다. 내부 전극은 도 2A 내지 B에 나타낸 높이 Hi 및 직경 Di를 특징으로 할 수 있다. 다양한 실시양태에서, 외부 전극 (104)는 뉴런 세포 배양물과 접촉하거나 이에 긴밀하게 근접하게 되는 적어도 말단 부위 (190)의 형상이 원통형 또는 환상이다. 외부 전극은 전도성 전선의 고리, 전도성 물질의 얇은 띠로부터 형성되는 원형 밴드, 또는 원통형으로 성형된 전도성 튜브일 수 있다. 외부 전극 (104)는 도 2A 내지 B에 나타낸 높이 Ho 및 직경 Do를 특징으로 할 수 있다. 일부 실시양태에서, Hi Ho 및 Di < Do이다. 일부 실시양태에서, Hi < Ho 및 Di < Do이다. 일부 실시양태에서, Hi > Ho 및 Di < Do이다. 일부 실시양태에서, 내부 전극 (102)는 캐소드로서 기능하고, 외부 전극 (104)는 애노드로서 기능한다. 일부 실시양태에서, 내부 전극 (102)은 애노드로서 기능하고, 외부 전극 전극 (104)는 캐소드로서 기능한다. 다양한 실시양태에서, 여기 영역 (150)은 내부 (102) 및 외부 (104) 전극 사이에 존재한다.
전선 (110, 112) 또는 전기 전도성인 그의 등가물, 예를 들어 회로 기판 상의 전도성 트레이스 및 이중 동축 케이블 등이 내부 (102) 및 외부 (104) 전극에 연결될 수 있다. 다양한 실시양태에서, 전선 (110, 112) 또는 그의 등가물은, 예를 들어 약 100 옴 미만인 낮은 옴 저항 또는 임피던스를 가질 수 있다. 일부 실시양태에서, 전선 또는 그의 등가물은 약 100 옴보다 큰 옴 저항 또는 임피던스를 가질 수 있다. 전선 또는 그의 등가물은 전선에 대한 전압 또는 전류 파형의 인가를 위해 제공하는 멀리 위치하는 커넥터 (120)을 가질 수 있다. 다양한 실시양태에서, 전선 또는 그의 등가물은 하나 이상의 전극쌍 및 하나 이상의 커넥터 사이에서 전기적 연결을 제공한다. 일부 실시양태에서, 전압 파형 V1, V2가 전선 또는 그의 등가물에 인가된다.
다양한 실시양태에서, 커넥터 (120)에 인가되는 전압 파형 V1, V2는 전극 (102, 104)로 전달되고, 전극들 사이의 여기 영역 (150)에서 전기장을 생성한다. 전압 파형 V1, V2 또는 전류 파형 I1, I2는 전자 분야의 숙련된 당업자에게 공지되어 있는 다양한 유형의 전자 기기로부터 유도될 수 있으며, 예를 들어 이들은 함수 발생기, 파형 발생기, 프로그래밍가능한 파형 발생기, 데이터-수집 하드웨어와 조합된 컴퓨터, 컴퓨터의 프로세서로부터의 디지탈 입력을 아날로그 출력으로 변환할 수 있는 아날로그-대-디지탈(analog-to-digital) (A/D) 기판과 조합된 컴퓨터에 의해 생성될 수 있다. 특정 실시양태에서, 전압 파형 V1 및 V2 중 하나 또는 둘 다는 시간에 따라 변화할 것이고, 이의 형상은 사용자에 의해 선택 또는 프로그래밍될 수 있다. 커넥터 (120)에 인가될 수 있고 전극 (102, 104)에 전달될 수 있는 전압 파형의 예를 도 3A 내지 D에 나타내었다. 인가된 파형 V1, V2는 하나 이상의 피크 전압 V1p1, V2p1, V2p2, 전압 오프셋, 파형 형상, 전압의 변화율, 및 반복률 또는 주기성을 특징으로 할 수 있다. 일부 실시양태에서, 파형 V1 또는 V2 중 하나는 도 3A 내지 B에 나타낸 바와 같이 기준 전위, 예를 들어 0 볼트, 0.5 볼트, -1 볼트로 실질적으로 일정하게 유지될 수 있다. 일부 실시양태에서, 이들 두 파형은 도 3C-D에 나타낸 바와 같이 시간에 따라 변화할 수 있다. 상이한 전압 오프셋, 진폭, 형상, 변화율 및 주기성을 갖는 임의의 광범위하게 다양한 파형이 전극쌍 (100)에 인가될 수 있음은 명백할 것이다.
다양한 실시양태에서, 전극쌍에 대한 전압 파형의 인가는 실질적으로 전극 (102)와 (104) 사이에서 여기 영역 (150) 내의 시변 전기장을 생성한다. 전극이 매질 중 뉴런 세포를 함유하는 웰과 접촉하거나 이와 긴밀하게 근접하게 위치하는 경우, 전기장은 매질 내로 커플링될 수 있고, 매질 내에서, 세포 내에서, 세포막을 가로질러, 또는 이들의 임의의 조합에서 이온의 이동에 영향을 미칠 수 있다. 임의의 영역에서의 전기장의 존재는 그 영역에서의 전기 전위의 구배를 수반한다. 뉴런 세포 배양물을 포함하는 웰 내의 전기 전위 및/또는 이온의 이동의 시변 구배는 뉴런 세포에서의 막횡단 전위를 변화시킬 수 있고, 액손의 발화 및 상응하는 시냅스 소포 순환을 자극할 수 있다. 다양한 실시양태에서, 시냅스 소포 순환의 자극은 전극쌍 (100)에 인가되는 전압 또는 전류 파형에 의해 제어된다.
광범위한 전압 또는 전류 파형이 전극쌍에 인가될 수 있다. 일반적으로, 자극이 작용 전위를 촉발하는 곳과 자극이 세포를 전기천공하거나 달리 독성인 곳 사이의 범위 내의 임의의 전압 또는 전류 파형이, 본 발명에 따라 사용될 수 있다. 일부 실시양태에서, 전극쌍 (100)에 의해 뉴런 세포 배양물을 포함하는 웰 내에서 생성되는 전기장 의 크기는 도 4A 내지 B에 나타낸 바와 같이 거시적 영역에 걸쳐 공간적으로 다양할 수 있고, 또한 거시적 영역에 걸쳐 실질적으로 균일할 수 있다. 도 4A 내지 B의 도면은 일시적인 전기장의 대표예이다. 도 4A 내지 B에서, 선 (300)은 한 순간의 전기장 의 방향을 나타내고, 선의 밀도는 그 순간의 전기장의 크기를 나타낸다. 도 4A에 나타낸 바와 같이, 전기장의 크기는 여기 영역 내에서 거시적 영역에 걸쳐 공간적으로 다양할 수 있다. 예를 들어, 선의 밀도는 중앙 전도체 근처에서보다 외부 전도체 (104) 근처에서 작아서, 전기장은 중앙 전도체 근처에서보다 외부 전도체 근처에서 약하다. 도 4B에 나타낸 바와 같이, 전기장의 크기는 단일 세포 근방 내의 거시적 영역에 걸쳐 공간적으로 실질적으로 균일할 수 있다.
다양한 전극이 본 발명에 따라 사용될 수 있다. 예시적인 전극 디자인은 도 2A 내지 B 및 도 5A 내지 H에 나타내었다. 예를 들어, 원형 전극 디자인은 그의 구성 및 적용이 용이하기 때문에 사용될 수 있다. 도 2A 내지 B에 나타낸 원형 전극쌍의 하나의 유용한 특징은 여기 영역 (150) 내에서 세포에 대한 광범위한 전기장 값의 영향이 동시에 관찰될 수 있다는 점이다. 동시에 전극 (102, 104)에 인가된 소정의 세트의 전압 값 V1, V2에 대해, 전기장은 여기 영역 (150) 내에서 광범위한 값을 가질 것이며, 그 값은 도 4A에 나타낸 바와 같이 중앙 전도체 (102) 근처에서 가장 높고, 출력 전도체 (104) 근처에서 가장 낮다. 여기 영역 (150) 내의 다수의 환상 영역 (305)로부터 데이터를 기록함으로써, 상이한 전기장 값에서의 세포에 대한 전기장 여기의 영향의 동시적 관찰이 가능하다.
다양한 실시양태에서, 여기 영역 (150) 내의 환상 영역 (305)에 위치된 뉴런 세포 배양물을 포함하는 웰 내 또는 뉴런 세포의 근처에서의 전기장의 순간값|Eω|은 시간에 따라 약 0 V/cm 내지 약 5 V/cm로 변화할 수 있다. 본원에 기재된 바와 같이, 전기장의 순간값은 시간의 한 순간에서의 전기장의 절대값으로 정의된다. 일부 실시양태에서, 순간값은 일시적으로 약 0 V/cm 내지 약 10 V/cm로 변화할 수 있다. 일부 실시양태에서, 순간값은 일시적으로 약 0 V/cm 내지 약 20 V/cm로 변화할 수 있다. 일부 실시양태에서, 순간값은 약 0 V/cm 내지 약 30 V/cm로 변화할 수 있다. 일부 실시양태에서, 순간값은 약 0 V/cm 내지 약 50 V/cm로 변화할 수 있다. 일부 실시양태에서, 순간값은 약 0 V/cm 내지 약 75 V/cm로 변화할 수 있다. 일부 실시양태에서, 순간값은 약 0 V/cm 내지 약 100 V/cm로 변화할 수 있다. 일부 실시양태에서, 순간값은 약 0 V/cm 내지 약 150 V/cm로 변화할 수 있다. 일부 실시양태에서, 순간값은 약 0 V/cm 내지 약 200 V/cm로 변화할 수 있다. 일반적으로, 웰 내의 주어진 위치에서의 전기장의 순간값은 전극의 기하학적 형상 및 뉴런 세포 배양 배지의 전기적 특성뿐만 아니라 인접 물질에 의한 부분으로 결정된다. 다양한 실시양태에서, 전극 (102, 104)에 적용된 전압 또는 전류 파형을 제어하여 뉴런 세포를 포함하는 웰 내의 전기장의 원하는 순간값 및 시간-변동 프로파일을 얻는다.
몇몇 실시양태에서, 파형의 피크값, 예를 들어 전극에 적용된 피크 전압, 피크 전압들, 피크 전류 또는 피크 전류들은 기기의 성능 및 측정된 시냅스 소포 순환 파라미터를 기초로 결정할 수 있다. 예를 들어, 사각파가 본 발명에 사용될 수 있다. 적합한 사각파는 0 내지 100V 범위의 피크 진폭, 0 내지 100 mA 범위의 피크 전류, 0 내지 100 Hz 범위의 반복률 및 0 내지 1분 범위의 전기 자극 기간을 가질 수 있다. 본 발명에 적합한 예시적인 파라미터를 표 1에 나타내었다.
특정 실시양태에서, 축색 돌기에서의 활동 전위의 자극은 형광 현미경으로부터 결정할 수 있다(문헌 [Ryan and Smith, 1995, Neuron, 14:983]; 본원에 참조로 포함됨). 일부 실시양태에서, 전극쌍에서 전극에 적용된 피크값은 원하는 생물물리학적 결과가 얻어질 때까지, 예를 들어 뉴런 세포에서 활동 전위 점화를 나타내는 형광 신호가 관찰될 때까지 증가시킬 수 있다. 도 2A 내지 B에 도시한 전극쌍에 대하여, 원하는 결과는 내부 전극 (102) 근처에 처음 나타날 수 있다. 일부 실시양태에서, 피크값은 여기 영역 (150)의 원하는 부분으로부터 원하는 결과가 검출될 때까지 증가시킬 수 있고, 이 피크값은 후속 작동값으로 선택될 수 있다. 특정 실시양태에서, 피크값은 "쓰레시홀드값"을 초과하는 초과량, 즉 원하는 생물물리학적 결과가 처음 관찰될 때의 값까지 증가시킬 수 있고, 이 피크값은 후속 작동값으로 사용될 수 있다.
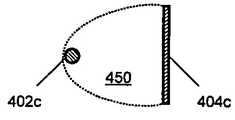
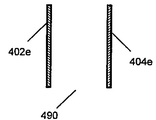
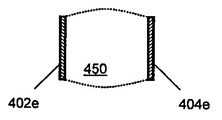
전극은 다양한 기하학적 형상으로 형성될 수 있음을 이해한다. 전극쌍에 대한 다양한 디자인의 예를 도 5A 내지 H에 나타내며, 전극은 말단부 (490) 및 매개 여기 영역 (450)을 갖는다. 도전 와이어 및 커넥터는 도면으로부터 생략하여 도면을 단순화하였다. 다양한 실시양태에서, 전극쌍, 예를 들어 전극 (402a, 404a)는 세포 및 매질을 포함하는 웰에 침지시킬 수 있다. 일부 실시양태에서, 전극 (402a, 404a)는 핀 또는 막대를 포함할 수 있다. 일부 실시양태에서, 전극쌍은 막대 (402c) 및 박막 플레이트 (404c), 또는 평행 플레이트 (402e, 404e)를 포함할 수 있다. 5G 내지 H에 도시한 바와 같이, 전극쌍은 다수의 전극 요소 (402g, 404h), 예를 들어 다발성 핀, 막대 또는 플레이트, 또는 이들의 임의의 조합물을 포함할 수 있다.
다양한 실시양태에서, 하나 이상의 전극쌍은 도 6A 내지 B에 도시한 바와 같이 전극 어셈블리 (500)에 포함된다. 전극 (102, 104)는 공간 내에 보유되거나 고체 물질 (503)에 의해 지지될 수 있다. 특정 실시양태에서, 고체 물질 (503)은 비전도성, 예를 들어 중합체 또는 플라스틱이다. 일부 실시양태에서, 물질 (503)은 투명하여 전극의 배치를 상면 (501)로부터 볼 수 있다. 일부 실시양태에서, 물질 (503)은 불투명하여 빛을 차단한다. 전극 (102, 104)는 접착제, 열적 본딩, 압입 또는 이들의 조합에 의해 물질 (503)에 부착할 수 있다. 다양한 실시양태에서, 도전성 트레이스 (510, 512)는 물질 (503) 상에 배치할 수 있으며, 전극 (102, 104)에 전기적으로 접속되어 있을 수 있다. 전기적 접속 (513)은 솔더, 도전성 접착제 또는 가압 접촉에 의해 트레이스와 전극 사이에 설치할 수 있다. 일부 실시양태에서, 트레이스 (510, 512)는 물질 (503)의 반대면에 있다. 일부 실시양태에서, 트레이스 (510, 512)는 물질 (503)의 동일면 상에 위치할 수 있다. 예를 들어 도 2A 내지 B에 도시된 전극 어셈블리에서, 도 6A에 나타낸 트레이스 (510, 512)의 배열이 부품 조립 목적에 보다 실용적일 수 있다. 도 5A 내지 H에 나타낸 전극 형상에 있어서, 도전성 트레이스는 지지 물질 (503)의 동일면에 또는 물질의 반대면에 위치시킬 수 있다.
전극 어셈블리의 일 특정 예시적인 실시양태를 도 6C의 사진으로 나타낸다. 어셈블리는 도 2A 내지 B에 도시한 것과 유사하고, 그의 말단부 (190)에 위치된 전극쌍을 갖는다. 외부 전극 (104)는 사진에서 볼 수 있다. 원통형 고체 물질 (503)은 내부 전극 (102) 및 외부 전극 (104)를 지지한다. 와이어 (110 및 112)는 각각 내부 및 외부 전극과 접속된다. 커넥터 (120)은 사진에서 와이어의 일단에서 볼 수 있다.
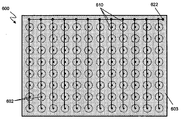
도 7A 내지 C에 따르면, 다양한 실시양태에서, 다수의 전극쌍 (602, 604)는 멀티웰 플레이트, 예를 들어 24-웰 플레이트, 96-웰 플레이트, 384-웰 플레이트에 사용하기 적합한 멀티-전극 어셈블리 (600)에 배열되어 있다. 일부 실시양태에서, 멀티-전극 어셈블리는 상응하는 멀티웰 플레이트의 각 웰에 대하여 전극쌍을 포함한다. 일부 실시양태에서, 멀티-전극 어셈블리는 상응하는 멀티웰 플레이트의 웰의 갯수보다 적은 전극쌍을 포함한다. 전극 (602, 604)는 비도전성 물질의 플레이트 (603)에 의해 지지될 수 있다. 도전성 트레이스 (610)은 플레이트 (603)의 최표면 상에 배치되고 전극 각 쌍 중 하나의 전극 (602)에 전기적 접촉을 제공할 수 있다. 모든 트레이스 (610)은 전기적으로 접속되어 있고, 추가로 접속 정착물 (622), 예를 들어 접촉 패드, 플러그 리셉터클, BNC 잭에 전기적으로 접속되어, 정착물 (622)에의 파형의 적용이 모든 전극 (602)에의 파형의 적용과 실질적으로 동시에 제공될 수 있다. 도전성 트레이스 (612)는 플레이트 (603)의 바닥 표면 상에 배치되고 전극 (604)의 전극 각 쌍에 전기적 접촉을 제공할 수 있다. 모든 트레이스 (612)는 전기적으로 접속되어 있고, 추가로 접속 정착물 (624)에 접속되어, 정착물 (624)에의 파형의 적용이 모든 전극 (604)에의 파형의 적용과 실질적으로 동시에 제공될 수 있다.
몇몇 실시양태에서, 바닥 평면 또는 물질의 도전성층을 사용하여 개별 트레이스 대신에 각 전극쌍에 전극 (602 또는 604) 중 하나에 접속을 설치할 수 있다. 예로서, 플레이트 (603)의 한면은 그 위에 증착된 박막 금속성 또는 도전성 필름을 가질 수 있고, 전극 (602 또는 604) 중 하나는 박막 필름에 솔더할 수 있다. 일부 실시양태에서, 박막 금속성 또는 도전성 필름은 플레이트 (603)의 양면 상에 증착될 수 있고, 필름의 한면이 내부 전극 (602)에 전기적으로 접속되어 있고 필름의 반대면이 각 외부 전극 (604)에 전기적으로 접속되어 있다. 이러한 배열에서, 플레이트 (603)의 한면 상의 각 내부 전극 주위의 필름 영역을, 예를 들어 드릴링 또는 기계 가공에 의해 제거하여, 내부 및 외부 전극이 필름에 의해 쇼트되지 않도록 할 필요가 있다.
다양한 실시양태에서, 전극쌍 (602, 604)는 멀티웰 플레이트의 웰 내에 세포 및 매질을 포함하는 웰 내에 모두 동시에 침지되도록 배열할 수 있다. 예를 들어, 전극쌍의 심심(center-to-center) 스페이싱은 멀티웰 플레이트 상의 웰의 심심 스페이싱과 실질적으로 일치할 것이다. 다양한 실시양태에서, 플레이트 (603)의 기저부 표면을 넘는 전극 (602, 604)의 연장 L은 전극쌍의 말단부 (690)을 접촉시키거나, 멀티웰 플레이트의 각 웰의 바닥으로 근접되게 한다. 다양한 실시양태에서, 외부 전극 (604)의 직경 Do은 멀티웰 플레이트에 실질적으로 일치하게 하거나 웰의 내부 직경보다 작은 크기로 할 것이다. 특정 실시양태에서, 내부 전극의 직경 Di은 약 1 mm이고, 외부 전극의 직경 Do은 약 6 mm일 것이다. 특정 실시양태에서, 내부 전극의 직경 Di은 약 1 mm이고, 외부 전극의 직경 Do은 약 3 mm일 것이다.
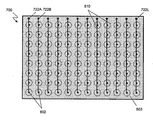
몇몇 실시양태에서, 전극쌍의 각 열은 다른 열과는 독립적으로 활성화시킬 수 있다. 도 8A에 도시된 멀티-전극 어셈블리 (700)은 전극쌍의 열의 독립적인 활성화를 제공하는 실시양태를 나타낸다. 본 실시양태에 있어서, 전극쌍의 각 열은 접속 정착물 (722A 내지 722L) 중 하나로의 파형의 적용에 의해 독립적으로 활성화될 수 있다. 트레이스 (610)은 열대신 행을 따라 배향될 수 있고, 전극쌍의 행은 다른 행과는 독립적으로 활성화될 수 있다는 것을 이해할 것이다.
몇몇 실시양태에서, 접속 정착물 (722A 내지 722L)은 지지 플레이트 (603)의 적어도 일부에 가로질러서 분배될 수 있다. 일부 실시양태에서, 도전성 트레이스 (610)은 패터닝하여 접속 정착물 (722A 내지 722L)을 도 8B에 도시한 바와 같이 국한시킬 수 있다. 일부 실시양태에서, 국한된 접속 정착물은 표준화 전기 커넥터, 예를 들어 멀티-핀 암 또는 수 커넥터에 전기적으로 접속시킬 수 있고, 이는 지지 플레이트 (603) 상에 견고하게 탑재되어 있다. 표준화 커넥터의 사용은 셋업 시간을 감소시키고 멀티-전극 어셈블리 (600, 700)의 교환을 촉진시킬 수 있다.
몇몇 실시양태에서, 멀티-전극 어셈블리 (600, 700) 및 멀티웰 플레이트는 위치 결정 장치 상에 탑재시킬 수 있다. 위치 결정 장치는 멀티-전극 어셈블리 및 멀티웰 플레이트를 선택된 위치에 배치시킬 수 있어 테이터를 하나 이상의 웰로부터 순차적으로 기록할 수 있다. 일부 실시양태에서, 위치 결정 장치는 동작 제어 단계를 포함한다. 일부 실시양태에서, 위치 결정 장치는 자동화될 수 있고, 예를 들어 컴퓨터, 마이크로프로세서 또는 마이크로컨트롤러에 의해 제어될 수 있다.
작동 멀티-전극 어셈블리 (600, 700)에 유용한 전자 제어 시스템 (800)의 일 특정 예시적인 실시양태가 도 9의 블록 다이아그램으로 도시되어 있다. 다양한 실시양태에서, 전자 제어 시스템은 파형 발생기 (810)을 포함한다. 파형 발생기 (810)은 하나 이상의 파형 신호 (818)을 발생시킬 수 있고, 이는 증폭 유닛 (870)으로 전송될 수 있다. 증복 유닛은 하나 이상의 파형 신호를 수신하고 각각의 파형 신호에서 진폭 또는 전류, 또는 진폭 및 전류 둘 다를 증가시킬 수 있다. 이어서, 증폭 유닛 (870)은 증폭된 신호 (878)을 멀티-전극 어셈블리 (600, 700)으로 전송할 수 있다. 증폭 유닛 (870)으로 공급되는 신호 (818)은 다중 분리 와이어 상에 제공될 수 있거나, 무선 송신으로 제공될 수 있거나, 번들형 멀티-와이어 케이블 상에 제공될 수도 있다. 증폭 유닛 (870)으로부터 전송된 신호 (878)은 다중 분리 와이어 상에 제공될 수 있거나, 무선 송신으로 제공될 수 있거나, 번들형 멀티-와이어 케이블 상에 제공될 수도 있다. 각 신호에 대한 전기적 절연은 증폭 유닛 (870)의 입력시에 제공될 수 있거나, 신호의 증폭 후에 제공될 수도 있다. 다양한 실시양태에서, 전기적 절연은 적용된 전기적 신호가 파형 발생기 (810)으로 다시 전파되는 것을 방지한다. 파형 발생기 (810)은 입력 제어 전자 신호 (802), 예를 들어 타이밍 신호를 외부 공급원으로부터 수신하여 하나 이상의 파형의 적용, 진폭 제어 신호, 반복률 제어 신호, 파형 형상 제어 신호를 개시할 수 있다. 파형 발생기 (810)은 출력 제어 전자 신호 (816), 예를 들어 타이밍 신호, 개시 신호, 동기화 신호를 외부 장치로 제공할 수 있다.
몇몇 실시양태에서, 파형 발생기 (810)은 컴퓨터 또는 개인용 컴퓨터 또는 랩탑 컴퓨터일 수 있다. 일부 실시양태에서, 파형 발생기 (810)은 독립형 기능 발생기, 프로그램할 수 있는 파형 발생기, 마이크로프로세서, 마이크로제어기 또는 펄스 발생기일 수 있다. 일부 실시양태에서, 파형은 컴퓨터, 마이크로프로세서 또는 마이크로제어기에서 실행하는 소프트웨어로 발생시킬 수 있고, 컴퓨터, 마이크로프로세서 또는 마이크로제어기의 하나 이상의 출력부에서 전압 또는 전류를 제어할 수 있다. 일부 실시양태에서, 파형 발생기 (810)은 멀티-포트 데이터-포착 기기 또는 멀티-포트 아날로그-투-디지털(analog-to-digital) 보드가 결합된 컴퓨터, 마이크로프로세서 또는 마이크로제어기를 포함할 수 있다.
특정 실시양태에서, 전기 자극 시스템은 변경된 시판 전기천공 시스템을 포함한다. 예로서, CellAxessHT 시스템(셀렉트리콘(Cellectricon), 스웨덴 몬드날 소재)을 조정하여 멀티웰 플레이트의 웰 내의 뉴런 세포에서 활동 전위를 여기시킬 수 있다. CellAxessHT 시스템은, 배양되고, 현탁되고/되거나 384-웰 플레이트의 웰 내에 달리 함유되는 세포의 전기천공용으로 고안된다. 세포의 전기천공을 위해서, 전기장이 세포의 부근에 적용되고, 전기장의 세기는 세포의 막을 통해 수화되는 경로를 생성시키기 충분한 정도로 크다. CellAxessHT 시스템은 384-웰 플레이트의 96 웰에서 동시에 세포를 전기천공할 수 있는 멀티-전극 어셈블리를 갖는다. 특정 실시양태에서, CellAxessHT 멀티-전극 어셈블리는 변경되지 않고 사용되어 384-웰 플레이트 검정의 웰 내의 뉴런 세포에 자극 파형을 제공한다. 특정 실시양태에서, CellAxessHT 멀티-전극 어셈블리는, 예를 들어 전극 크기, 스페이싱 및/또는 변형된 형상으로 변경하여 96-웰 플레이트 검정의 웰 내의 뉴런 세포에 자극 파형을 제공한다.
특정 실시양태 및 추가의 예에서, 변경된 CellAxess CX3 전기천공 시스템(셀리크리콘 AB로부터 입수가능)을 사용하여 웰 내의 뉴런 세포를 전기적으로 자극할 수 있다. 다양한 실시양태에서, 변경된 CX3 시스템은 3쌍의 변경된 전극 및 자체 형광 플라스틱 성분을 포함한다. 전극은 그의 여기 영역 내에서 실질적으로 균일한 장을 제공할 수 있다. 다양한 실시양태에서, 전극을 조정하여 96-웰 플레이트의 웰 내에 맞추고 웰 내의 뉴런 세포에 시냅스 소포 순환을 실질적으로 동시에 자극시킨다. CX3 시스템은 약 1 볼트 내지 약 100 볼트 범위의 피크 전압값을 갖는 여기 전압 파형을 제공할 수 있다.
별도의 자극 시스템
특정 실시양태에서, 청각 또는 초음파 자극이 사용되어 뉴런 세포에서 활동 전위를 여기시킨다. 일부 실시양태에서, 청각 자극은 멀티웰 플레이트의 웰 내의 (하나 이상의) 뉴런 세포(들)에 적용되는 하나 이상의 음파 또는 초음파 펄스를 포함한다. 특정 실시양태에서, 청각 변환기는 (하나 이상의) 뉴런 세포(들)를 포함하는 웰과 접촉시키거나 근접시킬 수 있다. 일부 실시양태에서, 청각 변환기의 어레이는 뉴런 세포를 포함하는 웰의 어레이에 공간적으로 일치시킬 수 있고, 변환기의 어레이는 뉴런 세포를 포함하는 웰의 어레이와 접촉시키거나 근접시킬 수 있다. 특정 실시양태에서, 변환기의 어레이는 뉴런 세포 배양물을 포함하는 웰의 어레이와 공간적으로 일치시킬 필요는 없다. 예를 들어, 변환기 어레이에서 변환기는 뉴런 세포를 포함하는 웰의 어레이에서 제2, 제3 또는 제4 웰마다 공간적으로 일치시킬 수 있다. 일부 실시양태에서, 청각 변환기는 선형 어레이, 예를 들어 멀티웰 플레이트의 행 또는 열에 상응하는 어레이에 배치시킬 수 있다. 다양한 실시양태에서, 초음파 펄스는 뉴런에서 활동 전위의 점화를 개시한다. 청각 또는 초음파 자극 시스템의 예는 웹사이트(arraytherapeutic.com/research/index)에서 찾을 수 있다.
특정 실시양태에서, 활동 전위는 광학적 방법을 통해 뉴런 세포에서 여기된다. 일부 실시양태에서, 광 개폐 이온 채널, 예컨대 채널로돕신이 뉴런 세포에 발현될 수 있다. 이어서, 광의 펄스가 사용되어 광 개폐 이온 채널을 활성화시키고, 뉴런을 탈분극시키고 활동 전위를 개시할 수 있다. 일부 실시양태에서, 활동 전위의 점화는, 배양되고, 현탁되고/되거나 달리 제조된 광 개폐 이온 채널을 갖는 뉴런을 높은 반복률로 광학 펄스를 빠르게 연속적으로 노출시킴으로써 수행된다. 광학 펄스는 하나 이상의 발광 시스템, 예를 들어 발광 다이오드, 다이오드 레이저, 백열 램프, 네온 램프로부터 제공될 수 있다. 다양한 실시양태에서, 하나 이상의 발광 시스템으로부터의 발광은 광 개폐 이온 채널이 감응하는 파장을 제공한다. 다양한 실시양태에서, 하나 이상의 발광 시스템에 의해 방출되는 빛은 하나 이상의 뉴런 세포에 조사한다. 렌즈, 광학 필터, 거울 또는 다른 광학 성분은 하나 이상의 뉴런 세포 상에 방출된 빛을 농축시키고/시키거나 조사할 수 있다.
몇몇 실시양태에서, 광학 성분을 수반하는 발광 기기의 어레이는 뉴런 세포를 포함하는 웰의 어레이 및 뉴런 세포를 포함하는 웰의 어레이를 비추도록 조정된 발광 기기와 공간적으로 일치시킬 수 있다. 특정 실시양태에서, 발광 기기의 어레이는 뉴런 세포를 포함하는 웰의 어레이와 공각적으로 일치시킬 필요는 없다. 예를 들어, 발광 기기 어레이는 뉴런 세포를 포함하는 제2, 제3 또는 제4 웰마다 공간적으로 일치시킬 수 있다. 일부 실시양태에서, 발광 기기는 선형 어레이, 예를 들어 멀티웰 플레이트의 행 또는 열에 상응하는 어레이에 배치시킬 수 있다. 다양한 실시양태에서, 광학 기기의 어레이로부터의 광학 펄스는 뉴런 세포 내의 뉴런에서 활동 전위의 점화를 개시한다.
특정 실시양태에서, 광 활성화 글루타메이트 수용체 LiGluR이 사용되어 활동 전위 점화를 개시한다. 다양한 형태로, 뉴런 세포는 세포외 시스테인을 갖는 변형된 카이네이트 수용체를 포함하고, 이에 광 활성화 리간드가 결합할 수 있다. 선택된 파장에서 테터링된 리간드의 조명은 리간드 형상을 플립시키거나 바꿀 수 있다. 광스위치된 경우 글루타메이트는 수용체의 결합 포켓에 위치하고, 활동 전위의 점화를 개시할 수 있다. 다양한 실시양태에서, 하나 이상의 발광 기기가 사용되어 광 활성화 리간드를 광스위치한다. 광 개폐 이온 채널을 이용하는 상기 기재된 실시양태에 관해 기재된 바와 같이, 발광 기기는 어레이에 배치되고, 추가의 광학 성분을 포함할 수 있다. 특정 실시양태에서, LiGluR 및 광스위치 활성화가 사용되어 뉴런 세포에서 활동 전위의 점화를 고주파수로 유도한다.
일부 실시양태에서, 광전도성 자극이 뉴런에서의 활동 전위를 유도하는데 사용될 수 있다. 광전도는 뉴런과 같은 흥분 세포의 급속한 비침습성 탈분극을 가능하게 하는 기술이다. 전형적으로, 광전도성 자극은 배지에서 배양한 뉴런을 비롯한 뉴런에서 활동 전위를 유도하는데 사용될 수 있다. 세포는 산업 표준 멀티-웰 플레이트 (multi-well plate)에서 배양할 수 있고/있거나 이어서 현미경에서 생생한 관찰을 위해 재사용가능한 디쉬에 올려놓을 수 있다. 제공되는 전자 장치는 사용자가 한정할 수 있는 주파수 및 세기에서 세포를 탈분극화하는데 사용할 수 있다. 전형적으로, 광전도성 자극은 세포에 대한 직접적인 물리적 연결 (예컨대, 전극 또는 트랜지스터 접촉)을 수반하지 않는다. 광전도의 예는 웹사이트 membrasys.com/techynology.asp에서 찾아볼 수 있다.
검출 기법
다양한 실시양태에서, 시냅스 소포 순환 플랫폼은 시냅스 소포 순환과 관련된 활성을 모니터링하기 위한 검출 시스템을 포함한다. 일부 실시양태에서, 검출 시스템은 뉴런 세포, 예를 들어 다수의 웰 내에 있는 뉴런 세포를 이미지화한다. 일부 실시양태에서, 검출 시스템은 뉴런 세포를 포함하는 웰 내의 적어도 한 영역으로부터의 발광을 모니터링한다. 다양한 실시양태에서, 검출 시스템은 전기 자극 시스템과 상호작용하여, 시냅스 소포 순환의 자극 및 검출을 실질적으로 동기화할 수 있다.
특정 실시양태에서, 시냅스 소포 순환 검정은 다음 특징 중 하나 이상을 갖는다: (a) 검정은 형광-기반 동역학 검정이며, 예를 들어 뉴런 세포를 포함하는 웰로부터의 형광의 양은 시냅스 소포 순환 활성 동안의 시간에 따라 변할 수 있다; (b) 리포터로부터의 신호는 증폭되지 않으며, 고-처리율 (high-throughput) 스크리닝 검정에 전형적인 것보다 더 약한 신호를 제공할 수 있다; (c) 시냅스 소포 순환은 제어된 자극 시스템에 의해 활성화된다. 다양한 실시양태에서, 시냅스 소포 순환 시스템을 위한 검출 시스템은 하나 이상의 뉴런 세포로부터 시간에 따라 변하는 낮은 수준의 형광 신호를 검출할 수 있으며, 전기적 흥분 시스템과 조합하여 작동할 수 있도록 시스템의 일부로 물리적으로 포함된다. 일부 실시양태에서, 검출 시스템은 검출된 신호를 감지, 전송 및 분석할 수 있다. 특정 실시양태에서, 검출된 신호의 분석은 약 1분에 완료될 수 있다.
플랫폼은 또한 하나 이상의 검출기를 포함하는 검출 시스템을 또한 포함할 수 있다. 전형적으로 검출기는 웰로부터의 발광 신호를 검출하도록 구성된 광학 센서를 포함한다. 검출기는 또한 웰로부터의 발광 신호를 수집하도록 구성된 대물 렌즈를 포함할 수 있다. 대물 렌즈는 광학 센서, 예를 들어 전하-결합 소자 카메라 등과 작동가능하게 연결될 수 있다. 대물 렌즈는 에어 대물 렌즈일 수 있다. 별법으로, 대물 렌즈는 물 또는 오일 침지 렌즈일 수 있다.
전형적으로, 에어 대물 렌즈는 물 또는 오일 침지 렌즈보다 저급의 개구수 (NA)를 갖는다. NA는 대물 렌즈에 의해 수집되는 방출된 광자의 분획을 직접 제어하기 때문에, 에어 대물 렌즈는 전형적으로 물 또는 오일 침지 렌즈보다 더 적은 광자를 수집한다. 본 발명자들은 예를 들어, 하나 이상의 에어 대물 렌즈의 사용을 포함할 수 있는 고-처리율 플랫폼이 대물 렌즈와 관계된 낮은 수집 효율을 다양한 방식으로 보상할 수 있다는 것을 발견하였다. 예를 들어, 에어 대물 렌즈와 관계된 낮은 수집 효율은 장 (field) 내의 시냅의 수를 증가시킴으로써, 예를 들어, 뉴런 세포 수를 증가시킴으로써, 장 영역 크기를 증가시키는 것 등으로써 및/또는 리포터 단백질 발현의 효율 및 특이성을 증가시킴으로써 보상할 수 있다. 따라서, 본 발명자들은 시냅스 소포 순환의 양태를 높은 감도로 고-처리율 방식에서 검출할 수 있는 것을 발견하였으며, 예를 들어, 낮은 개구수의 에어 대물 렌즈를 하나 이상 사용하여 뉴런 세포에서 5 내지 10의 낮은 활동 전위에 반응하는 시냅스 소포 순환의 양태를 검출할 수 있다는 것을 발견하였다.
대물 렌즈는 5x, 10x, 20x, 40x, 60x 또는 100x의 배율일 수 있다. 다른 적절한 배율은 즉각적인 발견의 교시를 기초로 당업자에게 명백할 것이다. 대물 렌즈는 0.1 NA 내지 1.4 NA, 0.1 NA 내지 1.3 NA, 0.1 NA 내지 1.2 NA, 0.1 NA 내지 1.1 NA, 0.1 NA 내지 1.0 NA, 0.1 NA 내지 0.9 NA, 0.1 NA 내지 0.85 NA, 0.1 NA 내지 0.8 NA, 0.1 NA 내지 0.75 NA, 0.1 NA 내지 0.7 NA, 0.1 NA 내지 0.65 NA, 0.1 NA 내지 0.6 NA, 0.1 내지 0.55 NA, 0.1 내지 0.5 NA, 0.1 내지 0.45 NA, 0.1 내지 0.4 NA, 0.1 NA 내지 0.35 NA, 0.1 NA 내지 0.3 NA, 0.1 NA 내지 0.25 NA, 0.1 NA 내지 0.2 NA, 내지 0.1 NA 내지 0.5 NA의 범위의 개구수를 가질 것이다. 대물 렌즈는 약 0.1 NA, 약 0.15 NA, 약 0.2 NA, 약 0.25 NA, 약 0.3 NA, 약 0.35 NA, 약 0.4 NA, 약 0.45 NA, 약 0.5 NA, 약 0.55 NA, 약 0.6 NA, 약 0.65 NA, 약 0.7 NA, 약 0.75 NA, 약 0.8 NA, 약 0.85 NA, 약 0.9 NA, 약 0.95 NA, 약 1 NA, 약 1.1 NA, 약 1.2 NA, 약 1.3 NA, 약 1.4 NA 이상의 개구수를 가질 것이다. 다른 적절한 개구수는 즉각적인 발견의 교시를 기초로 당업자에게 명백할 것이다.
검출기는 다양한 필드 영역으로부터 발광 신호를 검출하도록 구성될 수 있다. 검출기는 0.1 mm 내지 10 mm, 0.1 mm 내지 9 mm, 0.1 mm 내지 8 mm, 0.1 mm 내지 7 mm, 0.1 mm 내지 6 mm, 0.1 mm 내지 5 mm, 0.1 mm 내지 4 mm, 0.1 mm 내지 3 mm, 0.1 mm 내지 2 mm, 0.1 mm 내지 1 mm 또는 0.1 mm 내지 0.5 mm의 필드 영역으로부터 발광 신호를 검출하도록 구성될 수 있다. 대물 렌즈는 약 0.1 mm, 0.2 mm, 0.3 mm, 0.4 mm, 0.5 mm, 0.6 mm, 0.7 mm, 0.8 mm, 0.9 mm, 1 mm, 2 mm, 3 mm, 4 mm, 5 mm, 6 mm, 7 mm, 8 mm, 9 mm, 10 mm 이상의 필드 영역으로부터 발광 신호를 수집하도록 구성될 수 있다. 다른 적절한 필드 영역은 즉각적인 발견의 교시를 기초로 당업자에게 명백할 것이다.
검출 시스템은 작동가능하게 검출기와 연결된 컴퓨터를 포함할 수 있으며, 여기서 컴퓨터는 검출기로부터의 발광 신호를 뉴런 세포에서의 시냅스 소포 순환의 양태를 특징화하는 데이터로 변환시키도록 구성된다.
검출 시스템의 일부 실시양태에서, 뉴런 세포 내의 시냅스 소포 순환 활성을 광학 부품, 예를 들어 렌즈 및 필터를 사용하여 이미지화할 수 있으며, 형광 방출 신호 또는 형광 방출자의 이미지를 전하-결합 소자 (CCD) 검출기 어레이 (array) 상에서 캡쳐 (capture)할 수 있다. 이미지화 시스템은 리포터 형광단, 예를 들어 시냅스 소포 단백질의 내부-내강 도메인에 부착되는 GFP로부터 방출되는 형광을 검출할 수 있다. 캡쳐한 이미지는 멀티-웰 플레이트의 웰 중 일부의 것일 수 있다. 이미지가 CCD 어레이 상에서 전자적으로 캡쳐되면, 신호는 데이터-처리 소프트웨어를 수행하는 컴퓨터에서 후속적으로 처리될 수 있다. 이미지 또는 신호가 순차적으로 캡쳐되어 시냅스 소포 순환 동안 형광의 동역학적 분석을 제공할 수 있다.
멀티-웰 플레이트의 웰 내에서의 시냅스 소포 순환과 관계된 활성의 이미지를 제공할 수 있는 검출 시스템의 비제한적인 예를 도 10에 묘사하였다. 다양한 실시양태에서, 뉴런 세포를 포함하는 웰 내에서부터의 형광 방출을 이미지화 하는데 도립 에피플루오레센스 (epifluorescence) 현미경 (910)을 사용한다. 예로서, 대물 렌즈 (920), 예를 들어 10X, 0.45 NA 에어 대물 렌즈가 있는 제이스 악시오버트 (Zeiss Axiovert) Z1가 웰 (908)의 적어도 일부 내에서의 시냅스 소포 순환 활성을 이미지화할 수 있다. 다양한 실시양태에서, 각각의 웰의 바닥 (906)의 적어도 일부는 투명하여, 웰 내의 뉴런 세포를 웰의 바닥을 통해 광학적으로 관찰할 수 있다. 현미경과 결합된 CCD 어레이 (930)에서 이미지를 캡쳐할 수 있다. CCD 어레이는 컴퓨터와 소통할 수 있어, 컴퓨터로 이미지를 전송할 수 있고, 임의로 컴퓨터의 메모리에 저장할 수 있다. 이미지를 컴퓨터에 의해 후속적으로 처리하여 시냅스 소포 순환과 관계된 관련 정보를 추출할 수 있다.
다양한 실시양태에서, 이미지화 시스템 (예를 들어, 현미경 (910))은 묘사된 바와 같이 멀티-웰 플레이트 (915)의 웰 (908)로의 개방 접근을 가능하게 하여 다중-전극 어셈블리 (600)가 플레이트 상부로부터의 웰로 위치하도록 할 수 있다. 다양한 실시양태에서, 멀티-웰 플레이트 (915)는 위치 장치 (945) 상에 놓여 멀티-웰 플레이트의 각각의 웰을 차례로 검사할 수 있다. 위치 장치 (945)는 편의를 위해 자동화되고/되거나 컴퓨터로 제어되며, 임의로 전기적 흥분 시스템, 이미지-캡쳐 장치 및/또는 데이터 처리 시스템과 동기화된다. 자동화된 데이터 캡쳐 및 처리를 위해, CCD 어레이 (930), 현미경 (910), 위치 장치 (945) 및 다중-전극 어셈블리 (600)는 유선 또는 무선 연결 (962), (964), (966), (968)를 통해 중앙 제어장치, 예를 들어 컴퓨터, 미세조절장치, 미세처리장치와 소통할 수 있다.
일부 응용에서, 느린 속도의 분석이 실험자 또는 사용자의 필요에 적절할 수 있으며, 도 10에 묘사된 시냅스 소포 순환 시스템의 실시양태의 요소가 특정 응용에 충분할 수 있다. 예를 들어, 일부 실시양태에서, 시냅스 소포 순환은 약 30초 내지 약 150초, 예를 들어 약 30초, 약 40초, 약 50초, 약 60초, 약 70초, 약 80초, 약 90초, 약 100초, 약 110초, 약 120초, 약 130초, 약 140초 또는 약 150초의 시간 동안 연장된다. 따라서, 각각의 웰은 임의의 이들 시간 동안 이미지화될 수 있다. 일부 실시양태에서, 각각의 웰은 이들 시간보다 짧은시간, 예를 들어, 약 5초, 약 10초, 약 20초, 약 30초 또는 약 40초 동안 이미지화될 수 있다. 단일 현미경을 사용하고, 한 시간에 한 웰을 검사하여, 데이터 처리 시간을 추정하는 것은 96개의 웰 플레이트에 대한 이미지화 시간, 데이터 캡쳐 및 처리 시간 (약 1시간 내지 약 4시간, 예를 들어 약 1시간, 약 1.5시간, 약 2시간, 약 2.5시간, 약 3시간, 약 3.5시간 또는 약 4시간일 수 있음)과 비교하여 무시할 수 있다. 보다 빠른 속도의 분석이 필요한 경우, 평형 검출 시스템을 사용할 수 있다.
도 11은 고-처리율 시냅스 소포 순환 시스템의 실시양태를 위해 사용될 수 있는 평형 검출 시스템 (1000)을 묘사한다. 다양한 실시양태에서, 평형 검출 시스템 (1000)은 렌즈 어레이 (1070) 및 검출기 어레이 (1080)을 포함한다. 렌즈 어레이 (1070)은 예를 들어 웰 (906)의 행 또는 열에 있는 다수의 웰에 상응하는 배열로 1차원으로 분포될 수 있거나, 예를 들어 웰의 행 또는 열에 있는 다수의 열에 상응하는 배열로 2차원으로 분포될 수 있는 렌즈 (1072)의 어레이를 포함할 수 있다. 일부 실시양태에서, 렌즈 어레이 (1070)의 렌즈는 멀티-웰 플레이트에서 각각의 웰의 위치와 공간적으로 일치할 수 있다. 렌즈 어레이 (1070)이 행 및/또는 열에 있는 각각의 웰 및 모든 웰과 공각적으로 일치하는 렌즈를 가져야할 필요는 없다. 예를 들어, 렌즈는 행 및/또는 열에서 매 두 번째 웰, 또는 매 세 번째 웰, 매 네 번째 웰, 매 다섯 번째 웰, 매 여섯 번째 웰과 일치할 수 있다. 렌즈가 모든 웰과 일치하지는 않는 경우, 멀티-웰 플레이트 (915)는 판독들 사이에서 인접한 판독되지 않은 웰로 이동할 수 있다.
검출기 어레이 (1080)은 광검출기 (1082)의 어레이를 포함할 수 있다. 광검출기 (1082)는 고감도 검출기, 예를 들어 광전층배관, 애벌런치 광다이오드 (avalanche photodiode), 규소 드리프트 검출기 (silicon drift detector) 등일 수 있다. 예를 들어, 웰 (906) 내의 형광단이 부착된 시편으로부터의 형광 방출의 파장과 상이한 파장으로부터의 방사선을 감소시키기 위해 검출기 상부에 광학 필터가 위치할 수 있다. 일부 실시양태에서, 광검출기 어레이 (1080)의 검출기는 멀티-웰 플레이트의 각각의 웰의 위치와 공간적으로 일치할 수 있다. 일부 실시양태에서, 광검출기 (1082)는 렌즈 어레이 (1070)의 렌즈 (1072)와 일치되는 배열로 분포할 수 있다. 다양한 실시양태에서, 각각의 렌즈 (1072)는 웰 (906)의 적어도 일부로부터 방사되는 형광 방출을 수집하고 수집된 방출을 상응하는 광검출기 (1082)로 보낸다. 각각의 광검출기 (1082)로부터의 신호는 후속 처리를 위해 유선 또는 무선 연결 (1062)을 통해 중앙 제어장치 (예를 들어, 컴퓨터, 미세처리장치, 미세조절장치 등)로 전달될 수 있다. 일부 실시양태에서, 각각의 광검출기 (1082)는 광학 칸막이 또는 불투명한 물질을 사용하여 인접하거나 가까운 웰들로부터 광학적으로 격리될 수 있어, 각각의 광검출기는 그에 상응하는 수집렌즈 (1072)와 정확히 반대쪽에 있는 웰로부터의 형광 방사선만을 받을 수 있다. 다양한 실시양태에서, 렌즈 (1072)는 반사방지 코팅 및/또는 대역통과 코팅 (band-pass coating)으로 코팅될 수 있다.
일부 실시양태에서, 평형에 있는 멀티-웰 (예를 들어, (4), (16), (24), (48), (96), (384) 웰)을 이미지화할 수 있는 플레이트 판독기를 본 발명의 시스템을 위해 사용할 수 있다. 예를 들어, 상업적으로 입수가능한 플레이트 판독기 (예를 들어, 퍼킨 엘머 (Perkin Elmer, 미국 메사추세츠주 월섬 소재)로부터 입수가능한 플레이트::영상 시스템)를 평형 검출 시스템으로서 사용할 수 있다. 상기 플레이트 판독기는 동역학-기반 형광 분석을 할 수 있고, 다중-전극 어셈블리의 통합을 위한 멀티-웰 플레이트의 상부로의 접근을 가능하게 한다. 플레이트::영상 시스템은 높은 수집 효율 광학을 갖고 평형에 있는 96개의 웰을 분석하기 위해 고안된 특별한 광학을 갖는다. 본 발명자들은 평형에 있는 다수의 웰에서의 시냅스 소포 순환을 기록할 수 있는 능력에 대해 플레이트::영상 플레이트 시스템을 평가하였으며, 이는 실시예 부분에 상세히 기재된다. 추가적인 적합한 평형 플레이트 판독기에는 이들로 한정되지는 않지만 플리프르 (FLIPR)TETRA ® (몰레큘라 디바이시스 (Molecular Devices, 미국 캘리포니아주 유니언 시티 소재)), FDSS7000 (하마마츠 (Hamamatsu, 미국 뉴저지주 브릿지워터 소재)), 및 셀럭스 (CellLux) (퍼킨 엘머, 미국 메사추세츠주 월섬 소재)가 포함된다.
다양한 실시양태에서, 도 10에 묘사된 바와 같은 이미지화 시스템, 또는 도 11에 묘사된 바와 같은 평형 검출 시스템으로부터 받은 신호는 시간에 따른 시냅스 소포 순환 또는 시냅스 소포 활성을 평가하기 위해 처리된다. 특정 실시양태에서, 시냅스 소포 순환의 대표적인 신호, 예를 들어 형광 신호를 시간에 따라 기록한다. 신호의 세기 및/또는 반복률을 기록할 수 있다. 이미지화 시스템을 포함하는 실시양태에 잇어서, 하나의 뉴런 세포 배지에 대해 다수의 신호를 기록할 수 있으며, 여기서 각각의 신호는 배지 내의 특정 위치 또는 뉴런에 상응한다. 이미지화 시스템을 포함하는 실시양태에 있어서, 다수의 세포로부터의 신호는 뉴런 세포를 포함하는 웰에 대한 전체 신호 또는 평균 신호를 얻기 위해 조합될 수 있다.
다양한 실시양태에서, 시냅스 소포 순환 또는 신경 활성의 대표적인 신호를 본 발명의 시냅스 소포 순환 검정의 해독으로서 평가할 수 있다. 일부 실시양태에서, 시냅스 전달의 전기생리학적 분석을 본 발명에 따른 신규한 검정의 해독으로서 사용할 수 있다. 예를 들어, 시냅스 피로의 대표적인 신호는 시냅스 전달에 영향을 미치는 화합물을 확인하기 위한 본 발명의 신규한 검정에서의 해독으로서 사용할 수 있다. 특정 실시양태에서, 시냅스 소포 순환 또는 신경 활성의 대표적인 신호, 예를 들어 형광 신호는 진동, 파문, 특정 파형, 지수적 궤도, 예를 들어 포화 또는 회복, 증가 속도 (예를 들어, 형광의 발생 속도), 감소 속도 (예를 들어, 형광의 소멸 속도) 및/또는 노이즈-유사 특징을 나타낼 수 있다. 다양한 실시양태에서, 관찰된 특징을 정량화하기 위해 신호를 분석할 수 있다. 예로서, 시냅스 소포 순환 또는 신경 활성의 대표적인 신호는 지수적인 감소를 나타낼 수 있다. 이러한 신호에 대해, 지수적 감소를 포함하는 수학식, 예를 들어 exp(-t/τ) (여기서, t는 시간를 나타내고 τ는 특징적인 감소 상수를 나타냄)을 τ를 측정하기 위한 관찰된 신호와 피팅할 수 있다.
자극 시스템 및 검출 시스템의 인터페이싱
다양한 실시양태에서, 전기 자극 시스템 및 검출 시스템은, 도 10 (낮은-처리량 플랫폼의 예시적인 묘사) 및 도 11 (높은-처리량 플랫폼의 예시적인 묘사)에 묘사한 바와 같이, 시냅스 소포 순환 시스템에 혼입되고 인터페이싱된다. 다수의 전극 어셈블리 600, 이의 연관 전자 장비, 및 검출 시스템은 통신 회선 966, 962, 964, 968, 1062를 통해 중앙 제어 장치 (예를 들어, 컴퓨터, 마이크로프로세서, 마이크로 제어 장치 등)로 인터페이싱될 수 있어서, 실험 절차, 데이터 수집, 및 데이터 처리가 실질적으로 자동화되거나 반-자동화될 수 있다. 다양한 실시양태에서, 다수의 전극 어셈블리 600의 전극 602, 604은 멀티웰 플레이트보다 높은 방향으로부터 멀티웰 플레이트 915의 웰 906 내에서 뉴런 세포 배양액과 접촉하게 놓이고, 검출 시스템은 웰 아래에 배치된다. 전기 자극 시스템 및 검출 시스템이 중앙 컴퓨터와 인터페이싱되는 자동화된 실험 절차의 예로서, 상기 컴퓨터는 하기 단계를 실행할 수 있다: (a) 장치 945를 현미경 대물 렌즈 920 위의 제1 웰에 위치시키도록 전기적 명령을 내리는 단계, (b) 현미경 작동 파라미터, 예를 들어 렌즈 선택, 필터 설정을 초기화하도록 명령을 내리는 단계, (c) CCD 어레이, 예를 들어 전력 설정, 게인(gain) 설정, 전자 셔터 속도를 초기화하는 단계, (d) CCD 어레이로부터 데이터의 수신을 시작하는 단계, (e) 하나 이상의 파형을 제1 웰 내의 전극에 적용하도록 전기적 자극 시스템에 전기적 명령을 내리는 단계, (f) 파형의 적용을 종결시키도록 명령을 내리는 단계, (g) CCD 어레이로부터 데이터 수신을 종료하는 단계, 및 (h) 장치 945를 또다른 웰에 위치시키고 주기 (b-h)를 반복하도록 전기적 명령을 내리는 단계.
특정 측면에서, 예를 들어 실시예 부분에서 예시되는 바와 같이, 인터페이싱된 시스템은 다양한 전극 설계가 뉴런 세포 내의 시냅스 소포 순환을 개시하는 능력을 평가하는 데에 사용될 수 있다. 비제한적 실시예로서, 96-웰 플레이트내의 배양액에서 일차 뉴런은 시냅토플루오린, vGlut1-플루오린-, 또는 시냅토파이신-플루오린-발현 아데노-연관 바이러스로 감염된다. 배양 기간 후에, 배지는 검정 완충제로 대체될 수 있다. 이어서 상기 플레이트는 시냅스 소포 순환 시스템에 배치될 수 있고, 전극은 웰에 배치될 수 있다. 전압 파형이 적용되고, 시냅토플루오린에 의해 생성된 형광의 적어도 일부는 검출 장치로 향하고 기록될 것이다 (예를 들어 이미지, 이미지의 연속물, 강도 레벨, 및/또는 강도 값의 연속물). 하나 이상의 세포 배양액 내의 시냅스 소포 순환과 관련된 활성의 이미징은 도 10에 묘사된 바와 같이, 도립 현미경으로 실시될 수 있다. 시간-변화 형광 신호의 검출은, 도 11에 묘사된 바와 같이 상기 도립 현미경 또는 렌즈 및 광검출기 어셈블리로 실시될 수 있다. 자극은 상이한 전극 설계에 대해 반복하고 생성된 데이터를 비교하여 다양한 전극 설계의 효율성을 평가한다.
플랫폼
몇몇 실시양태에서, 본 발명에 따르는 시냅스 소포 순환 검정법은 낮은 처리량 플랫폼에서 실시된다. 전형적으로, 낮은 처리량 검정 시스템은 보다 양호한 광학장치 (예를 들어 형광 현미경)를 사용하고 보다 양호한 해상도를 제공한다. 그 결과, 몇몇 실시양태에서, 낮은 처리량 플랫폼은 개별 시냅스를 확인할 수 있다. 전형적으로, 낮은 처리량 플랫폼은 특히 개별 화합물의 효과를 확인하기에 유용하다. 예를 들어, 특정 장애를 치료하는 알려진 약물은 낮은 처리량 플랫폼을 사용하여 상기 약물이 시냅스 소포 순환에 영향을 미치는가를 결정하기 위해 분석될 수 있다. 예시적인 낮은 처리량 플랫폼은 도 10에 묘사되어 있다.
높은 처리량 플랫폼
몇몇 실시양태에서, 본 발명에 따르는 시냅스 소포 순환 검정법은 높은 처리량 플랫폼에서 실시될 수 있다. 높은 처리량 플랫폼은 다수의 후보 물질 또는 시험 물질로부터 시냅스 소포 순환 조절제 (예를 들어, 자극제 및/또는 억제제)를 확인하기 위한 블라인드 스크리닝(blind screening)에 특히 유용하다. 특정 실시양태에서, 높은 처리량 스크리닝 검정법은 하기 단계를 포함할 수 있다: (a) 본원에 기재된 다수의 뉴런 세포를 제공하는 단계, (b) 다수의 시험 물질의 구성원이 다수의 뉴런 세포 각각과 접촉하도록 다수의 시험 물질을 제공하는 단계, (c) 본원에 기재된 시냅스 소포 순환 검정법을 수행하는 단계, 및 (d) 다수의 시험 물질 중 임의의 구성원이 대조군과 비교하여 시냅스 소포 순환과 관련된 하나 이상의 활성을 조절하는 가를 결정하는 단계.
몇몇 실시양태에서, 다수의 뉴런 세포는 다수의 웰에 제공된다. 예를 들어, 멀티웰 플레이트, 예를 들어 24-, 48-, 96-, 또는 384-웰 플레이트는 높은 처리량 검정법에 사용될 수 있다. 예시적인 높은 처리량 스크리닝 시스템은 도 11에 묘사되어 있다.
멀티웰에서 시냅스 소포 순환을 유도하기 위해, 높은 처리량 플랫폼은 전형적으로 웰에서 필드 전위를 생성하기 위해 자극 시스템을 포함한다. 몇몇 실시양태에서, 상기 플레이트의 웰은 상부(top)로부터 접근가능하여 자극 기술을 검정 시스템에 통합시킨다. 몇몇 실시양태에서, 맞춤형(custom developed) 멀티웰 전기 자극제가 사용될 수 있다. 몇몇 실시양태에서, 본 발명에 적합한 멀티웰 전기 자극제는 다수의 뉴런 세포를 포함하는 웰에 배치될 수 있는 다수의 전극쌍을 함유한다. 전극은 외부의 실린더형(cylinder-like) 전도성 전극에 의해 둘러싸인 내부의 막대형(rod-like) 전도성 전극을 포함할 수 있다. 상기 자극 단계는, 전극쌍의 전극 사이의 웰내의 여기(excitation) 영역에 전기장이 생성되도록 하나 이상의 여기 전압 파형을 상기 전극에 적용하는 것을 포함할 수 있다. 다양한 실시양태에서, 상기 자극 단계는 자극 파형의 적용에 의해 시냅스 소포 순환을 유도하는 것을 포함한다.
몇몇 실시양태에서, 적합한 자극 시스템은 멀티웰 플레이트 전기천공 시스템으로부터 변형될 수 있다. 예를 들어, 상업적으로 이용가능한 높은 처리량의 전기천공기 (예를 들어, siRNA를 전달하도록 설계된 셀렉트리콘(Cellectricon)에 의해 제공되는 셀액세스에이치티(CellAxessHT))는 멀티웰 플레이트 (예를 들어 96-웰 플레이트)의 웰의 전기장 전위 커버리지(coverage)를 최대화하도록 최적화되어 본 발명의 높은 처리량 시냅스 소포 순환 검정법의 자극 시스템으로서 사용될 수 있다. 상업적으로 이용가능한 높은 처리량 전기천공기의 맞춤 변형의 비제한적인 실시예는 실시예 부분에 상세하게 기재되어 있다. 높은 처리량 플랫폼에 적합한 추가의 자극 시스템은 본원에 기재되어 있다.
전형적으로, 본 발명에 따르는 높은 처리량 검정법은 형광-기반 동적 검정법이다. 전형적으로, 리포터의 신호는 시냅스 소포 순환 검정법에서 증폭되지 않으므로 약한 신호를 초래한다. 적합한 이미징 시스템은 높은 광자 수집 효율을 가진다. 높은 수집 효율은 동적 판독 동안 개선된 신호 대 노이즈 비율 및 감소된 블리칭(bleaching)을 초래하는데, 이는 형광단을 측정가능하게 여기시키는 데에 보다 적은 빛이 필요하기 때문이다. 다양한 실시양태에서, 본 발명에 적합한 이미징/모니터링 시스템은 시냅스 소포 순환을 나타내는 신호 (예를 들어 형광 방출)에 대해 평행한 다수의 뉴런 세포를 포함하는 다수의 웰을 모니터링할 수 있다. 특정 실시양태에서, 적합한 이미징 시스템은 신경 세포를 포함하는 웰의 적어도 일부를 이미징하고 신경 세포를 포함하는 웰의 일부의 이미지 또는 이미지의 연속물을 수집한다. 특정 실시양태에서, 본 발명에 적합한 이미징/모니터링 시스템은 평행한 다수의 뉴런 세포를 포함하는 다수의 웰로부터의 신호 (예를 들어 형광 복사)의 양을 수집하고 검출한다. 몇몇 실시양태에서, 적합한 모니터링/이미징 시스템은 시냅스 소포 순환의 하나 이상의 측면, 예를 들어 다양한 시냅스 소포 순환 과정의 동력학 (예를 들어 내분비작용, 핵형성, 함입 등)의 임의의 수집된 대표 데이터를 추가로 처리할 수 있다. 전형적으로, 적합한 이미징 시스템은 비교적 짧은 시간 규모 (예를 들어 1분)에 대해 동적 형광 분석을 실시할 수 있다.
몇몇 실시양태에서, 맞춤형 또는 상업적으로 이용가능한 고-함량 스크리닝 시스템 (예를 들어 패쓰웨이(Pathway), 벡톤 디킨슨(Becton Dickinson), 뉴저지주 프랭클린 레이크 소재; 이미지 엑스프레스 마이크로(ImageXpress MICRO) (몰레큘러 디바이스(Molecular Devices), 캘리포니아주 유니온 시티 소재; 오페라(Opera), 퍼킨 엘머(Perkin Elmer), 매사추세츠주 월섬 소재; 어레이스캔(ArraScan), 서모 피셔 사이언티픽(Thermo Fisher Scientific), 매사추세츠주 월섬 소재)가 사용될 수 있다. 상기 고-함량 스크리닝 시스템으로 1시간 당 12회 이상의 시냅스 소포 순환 검정법을 실시하는 것이 고려된다. 몇몇 실시양태에서, 멀티웰 플레이트 판독기는 상기 스크리닝 처리량을 증가시킴으로써 발견된 화합물을 처리할 수 있는 시스템을 제조하는 데에 사용된다. 적합한 멀티웰 플레이트 판독기는 평행한 멀티웰 플레이트의 다수의 웰을 이미징할 수 있다. 적합한 플레이트 판독기는 상업적으로 이용가능한 플레이트 판독기 (예를 들어 퍼킨 엘머에 의해 제공되는 플레이트::비젼(plate::vision))을 포함한다. 전형적으로, 적합한 플레이트 판독기는 동적 형광 분석을 가능하게 하고, 자극 시스템의 통합을 위한 플레이트의 상부에의 접근을 가능하게 하며, 높은 수집 효율의 광학장치, 및/또는 평행한 다수의 웰의 분석을 위해 설계된 특별한 광학장치를 가진다. 추가의 적합한 이미징 시스템은 검출 시스템 부분에 기재되어 있다.
전형적으로, 높은 처리량의 플랫폼은 다수의 시냅스 소포 순환 검정법을 동시에 측정하기 위한 하나의 장치를 사용하는 것을 포함한다. 높은 처리량 플랫폼이 가능한한 많은 시냅스 소포 순환 모드 동안 상기 시냅스 소포 순환의 많은 성분으로 측정하는 능력을 가지는 것이 바람직할 수 있다. 내분비작용의 상이한 모드 (예를 들어 포화 및 불포화) 동안 상기 시냅스 소포 순환을 연구할 수 있기 위해, 검정 시스템이 낮은 및 높은 강도의 자극 트레인(train) 둘 다 동안에 및 이후에 시냅스 소포 순환 리포터 신호를 측정할 수 있는 것이 중요하다. 낮은 강도의 자극 트레인 (예를 들어 100 미만의 활동 전위의 경우 10 Hz 미만)은 불포화 내분비작용의 모드를 유도하는 반면, 높은 강도의 자극 트레인 (예를 들어 100 초과의 활동 전위의 경우 10 Hz 초과)이 포화 내분비작용의 모드를 유도한다. 몇몇 실시양태에서, 10 Hz 이상에서 유도되는 50 이상의 활동 전위에 대한 상기 시냅스 소포 순환 반응 (예를 들어 엑소시토시스)을 측정할 수 있는 장치가 사용된다. 상기 자극 범위는 불포화 및 포화 내분비작용 레짐 둘 다 동안 상기 시냅스 소포 순환의 분석을 허용한다. 몇몇 실시양태에서, 적합한 장치는 적어도 10, 20, 30, 40 또는 50 Hz에서 유도된 적어도 50, 100, 200, 300 또는 그 이상의 활동 전위에 대한 시냅스 소포 순환 반응을 측정할 수 있다.
몇몇 실시양태에서, 본 발명의 검정법의 신호 세기는 웰 1개 당 반응하는 형광단의 수를 최대화함으로써 증가될 수 있다. 예를 들어, 상기 신호 세기는 고밀도에서 뉴런을 플레이팅함으로써 증가될 수 있고, 이는 보다 높은 시냅스 밀도를 야기한다. 몇몇 실시양태에서, 적어도 20,000 뉴런/㎠이 웰 1개 당 플레이팅될 수 있다. 몇몇 실시양태에서, 적어도 50개 (예를 들어 적어도 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1,000, 또는 그 이상)의 시냅스가 동시에 모니터링될 수 있다.
몇몇 실시양태에서, 본 발명의 검정법의 신호 세기는 시냅스 소포 순환을 나타내는 리포터 (예를 들어 시냅토파이신-플루오린)를 발현하는 뉴런의 백분율을 증가시킴으로써 증가될 수 있다. 몇몇 실시양태에서, 본 발명에 이용되는 뉴런의 적어도 90% (예를 들어 적어도 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 100%)는 시냅스 소포 순환을 나타내는 리포터를 발현한다. 뉴런을 리포터로 효율적으로 표지하는 데에 다양한 방법이 사용될 수 있다. 예를 들어, 바이러스성 감염이 사용될 수 있다. 본 발명에 적합한 한 예시적인 바이러스성 발현 시스템은 아데노-연관 바이러스 발현 시스템에 기초한다. 전형적으로, ~90% 초과의 감염률은 상기 아데노-연관 바이러스 발현 시스템을 사용하여 수득될 수 있다. 몇몇 실시양태에서, 흥분성 뉴런 및 억제성 뉴런 모두에서 리포터를 발현할 수 있는 촉진제가 사용된다.
몇몇 실시양태에서, 리포터-표지된 뉴런은 리포터 유전자가 번식하는 트랜스제닉 동물 (예를 들어, 마우스)로부터 수득될 수 있다. 바람직한 리포터 유전자 (예를 들어 시냅토파이신-플루오린)를 발현하는 트랜스제닉 동물은 당업계에 알려진 표준 방법을 사용하여 생성될 수 있다. 트랜스제닉 동물은 신뢰성 있고 매우 재현가능한 표지 및 신호를 제공한다.
몇몇 실시양태에서, 신호 세기는, 시냅스 소포 순환을 나타내는 리포터 (예를 들어 vGlut1-플루오린)로 표지된 기능적 시냅스 소포의 분율을 증가시킴으로써 증가될 수 있다. 예를 들어, 플루오린-표지된 기능적 시냅스 소포의 분율은 예를 들어 V-형 ATP아제 억제제 바필로마이신으로 트래핑하는 알칼리를 사용하여 재순환할 수 있는 소포의 총 개수를 세는 것에 기초하여 평가될 수 있다. 수백의 활동 전위에 의한 자극은 모든 소포가 적어도 한번 융합하는 원형질 막과 융합할 수 있게 한다. 바필로마이신의 존재하에, 플루오린 형광은 향상된 상태로 트래핑된다. 양자 크기로 나눈 형광의 최대값은 각각의 시냅스에서 vGlut1-플루오린으로 표지된 소포의 수를 나타낸다. 상기 수는 FM 1-43 표지를 사용하여 수득된 것과 비교될 수 있다. FM 1-43은 이들이 내분비작용을 겪을 때 시냅스 소포를 표지할 유기 양친매성 형광 추적자이다. 총 소포 풀(pool) 크기는 FM1-43-표지된 소포를 계수함으로써 측정될 수 있다 (문헌 [Ryan et al. Nature (1997) Jul 31;388(6641):478-82], 본원에 참조로 포함됨). 몇몇 실시양태에서, 기능적 시냅스 소포의 적어도 40% (예를 들어, 적어도 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 100%)는 본 발명에 따른 시냅스 소포 순환을 나타내는 리포터로 표지된다.
장치 민감도, 리포터 신호 세기, 및 다른 파라미터의 변형이 본 발명의 검정법의 신호 대 노이즈의 비율을 증가시킬 수 있다는 것은 당업자에게 인식될 것이다.
증가된 신호 대 노이즈의 비율은 적어도 10, 20, 30, 40 또는 50 Hz에서 보다 적은 활동 전위 (예를 들어 40, 20, 10, 5 또는 그보다 적은 활동 전위)에 대한 시냅스 소포 순환 반응의 측정을 가능하게 하고 전체적인 시냅스 소포 순환 이외에 시냅스 소포 순환의 추가적인 과정 (예를 들어 방출 가능성)의 측정을 가능하게 한다. 본원에서 기재한 검정법의 상기 변형 및 변화는 본 발명의 범위내이다.
시험 물질
다양한 후보 물질은 시냅스 소포 순환의 전위 조절제 (예를 들어 억제제 또는 자극제)에 대해 시험될 수 있다. 예시적인 시험 물질에는 화학적 화합물, 저분자, 단백질 또는 펩티드, 항체, 공-결정, 나노-결정, 미생물 (예를 들어, 바이러스, 세균, 균류, 등), 헥산 (예를 들어, DNA, RNA, DNA/RNA 하이브리드, siRNA, shRNA, miRNA, 리보자임, 압타머, 등), 탄수화물 (예를 들어 단당류, 이당류, 또는 다당류), 지질 (예를 들어, 인지질, 트리글리세리드, 스테로이드, 등), 천연 생성물, 이들의 임의의 조합물이 포함되지만, 이에 제한되지는 않는다. 후보 물질은 또한 컴퓨터-기반의 합리적인 약물 설계 방법을 사용하여 설계될 수 있다. 전형적으로, 다수의 시험 물질 (예를 들어, 후보 물질의 라이브러리)은 스크리닝 검정법에서 전위 조절제에 대해 시험된다. 몇몇 실시양태에서, 시험 물질은 생분해가능하고/하거나 생체적합하다.
펩티드
몇몇 실시양태에서, 시냅스 소포 순환의 전위 조절제는 재조합 박테리오파지에 의해 제조된 무작위 펩티드 라이브러리 (예를 들어 문헌 [Scott and Smith, Science, 249:386-390 (1990)]; [Cwirla et al., Proc. Natl. Acad. Sci., 87:6378-6382 (1990)]; [Devlin et al., Science, 249:404-406 (1990)]), 또는 화학적 라이브러리를 스크리닝함으로써 수득될 수 있다. "파지 방법"을 사용하여, 매우 큰 라이브러리가 제조될 수 있다 (106-108의 화학적 독립체). 제2 접근법은 주로 화학적 방법을 사용하고, 이의 예에는 게이슨(Geysen) 방법 (문헌 [Geysen et al., Molecular Immunology 23:709-715 (1986)]; [Geysen et al. J. Immunologic Method 102:259-274 (1987)]) 및 포도르 등(Fodor et al.)의 방법 (문헌 [Science 251:767-773 (1991)])이 있다. 문헌 [Furka et al. 14th International Congress of Biochemistry, Volume 5, Abstract FR:013 (1988)]; [Furka, Int. J. Peptide Protein Res. 37:487-493 (1991)], [Houghton (미국 특허출원 제4,631,211호, 1986년 12월에 허여됨)] 및 [Rutter et al. (미국 특허출원 제5,010,175호, 1991년 4월 23일에 허여됨)]에는 시냅스 소포 순환과 관련된 활성의 조절제로서 시험될 수 있는 펩티드의 혼합물을 제조하는 방법이 기재되어 있다.
몇몇 실시양태에서, 합성 라이브러리 (문헌 [Needels et al., Proc. Natl. Acad. Sci. USA 90:10700-4 (1993)]; [Ohlmeyer et al., Proc. Natl. Acad. Sci. USA 90:10922-10926 (1993)]; [Lam et al., 국제 특허 공보 제WO 92/00252호]; [Kocis et al., 국제 특허 공보 제WO 9428028호], 이들 각각은 이의 전문이 본원에 참조로 포함됨) 등은 본 발명에 따르는 시냅스 소포 순환의 조절제에 대한 스크리닝에 사용될 수 있다. 전위 조절제가 확인되면, 화학적 유사체는 상업적인 판매회사, 예컨대 켐브릿지 라이브러리(ChemBridge Libraries) (chembridge.com), 바이오몰 인터네셔널(BIOMOL International), 아시넥스(ASINEX), 켐디브(ChemDiv), 켐디비(ChemDB), ICCB-롱우드(Longwood)로부터 상업적으로 이용가능하거나 별법으로 새로이 합성되는 화학물질의 라이브러리로부터 선택될 수 있다.
소분자
몇몇 실시양태에서, 소분자 라이브러리 및 그의 동족체는 시냅스 소포 순환의 조절제에 대해 스크리닝 된다. 일부 실시양태에서, 드 노보 (de novo) 합성된 화합물 라이브러리는 시냅스 소포 순환의 조절 기능을 갖는 신규 화합물을 확인하기 위해 스크리닝 될 수 있다. 일부 실시양태에서, 약물 (FDA 승인 약물을 포함함)을 함유하는 공개 라이브러리는 시냅스 소포 순환 조절 활성이 사전에 공지되지 않은 기존 화합물을 확인하기 위해 스크리닝 될 수 있다. 일부 실시양태에서, 실재 화합물의 유도체 또는 동족체를 함유하는 변형 라이브러리는 당업계에 잘 알려진 방법을 사용하여 합성될 수 있고, 시냅스 소포 순환의 신규 또는 개선된 조절제를 확인하기 위해 스크리닝 될 수 있다. 적합한 소분자 화합물 라이브러리는 상업적 판매업체 예컨대 켐브리지 라이브러리즈 (ChemBridge Libraries) (chembridge.com), 바이오몰 인터내셔널 (BIOMOL International), 아시넥스 (ASINEX), 켐디브 (ChemDiv), 켐디비 (ChemDB), 아이씨씨비-롱우드 (ICCB-Longwood)로부터 수득할 수 있다. 일부 실시양태에서, 적합한 소분자 라이브러리는 다양성 및 우수한 "약물 유사" 특성에 대해 선택되는 상업적 화합물의 대규모 컬렉션 (예를 들어, >100,000 화합물)을 함유한다.
안티센스
RNA
및
리보자임
몇몇 실시양태에서, 안티센스 분자는 시냅스 소포 순환의 잠재적 조절제에 대해 스크리닝 될 수 있다. 안티센스 분자는 특정 mRNA에 대해 상보적 뉴클레오티드 서열을 갖는 RNA 또는 단일-가닥 DNA 분자이다. 실험실에서 제조되는 안티센스 분자가, 연구중인 유전자에 의해 전사되는 표준 mRNA를 함유하는 세포로 주사될 경우, 안티센스 분자는 mRNA와 염기쌍이 되어, mRNA의 단백질로의 번역을 방지할 수 있다. 생성된 이중-가닥 RNA 또는 RNA/DNA는 이러한 분자에 특이적으로 부착하는 효소에 의해 소화된다. 따라서, mRNA의 소모가 발생하고, 유전자 생성물의 번역을 차단하여 유해 단백질의 생성을 차단하는 의학에서의 안티센스 분자의 용도를 발견하였다. 안티센스 RNA를 생성하고 이용하는 방법은 당업자에게 잘 알려져 있다 (예를 들어 문헌 [C. Lichtenstein and W. Nellen (Editors), Antisense Technology: A Practical Approach, Oxford University Press (December, 1997); S. Agrawal and S. T. Crooke, Antisense Research and Application (Handbook of Experimental Pharmacology, Volume 131), Springer Verlag (April, 1998); I. Gibson, Antisense and Ribozyme Methodology: Laboratory Companion, Chapman & Hall (June, 1997); J. N. M. Mol and A. R. Van Der Krol, Antisense Nucleic Acids and Proteins, Marcel Dekker; B. Weiss, Antisense Oligonodeoxynucleotides and Antisense RNA Novel Pharmacological and Therapeutic Agents, CRC Press (June, 1997); Stanley et al., Antisense Research and Applications, CRC Press (June, 1993); C. A. Stein and A. M. Krieg, Applied Antisense Oligonucleotide Technology (April, 1998)]를 참조함).
몇몇 실시양태에서, 시냅스 소포 순환 경로를 조절하기에 적합한 안티센스 분자 및 리보자임은 시냅스 소포 순환에서 관련되는 단백질 및 유전자의 서열 정보를 기준으로 고안될 수 있다. 예를 들어, 안티센스 분자 및 리보자임은 내인성 소포 단백질 (예를 들어, 시냅스 소포 단백질 2 (SV2), 시냅토파이신, 시냅토타그민, 소포-관련 막 폴리펩티드 (VAMPs), 신경전달물질 수송체 (NT 수송체), 시냅토자이린, 양성자 펌프), 말초 소포 단백질 (예를 들어, 랩스 (Rabs), 시스틴 스트링 단백질 (CSPs), 시냅신), 시냅스 원형질 막 단백질 (예를 들어, 칼슘 채널, 25 kDa의 시냅토솜-관련 단백질 (SNAP-25), 신탁신), 및 세포질 단백질 (예를 들어, SNAPs, n-Sec1), 시냅신 (예를 들어, 시냅신 I, II 및 III), 탈인화수소 (예를 들어, 디나민 I, PIP5K1γ, 및 시냅토자닌 I)을 비롯하지만 이들로만 한정되지는 않는 시냅스전 단백질을 표적화 하기 위해 고안될 수 있다.
안티센스 분자 및 리보자임은 핵산 분자의 합성에 대해 당업계에 공지된 임의의 방법으로 제조될 수 있다. 이들은 올리고뉴클레오티드를 화학적으로 합성하는 기술, 예컨대 고체 상 포스포라미다이트 화학적 합성을 포함한다. 별법으로, RNA 분자는 UGGT를 코딩하는 DNA 서열의 시험관내 및 생체내 전사에 의해 생성될 수 있다. 이러한 DNA 서열은 적합한 RNA 중합효소 프로모터, 예컨대 T7 또는 SP6을 갖는 다양한 벡터로 혼입될 수 있다. 별법으로, 구성적으로 또는 유도적으로 안티센스 RNA를 합성하는 이들 cDNA 구축물은 세포주, 세포, 또는 조직으로 도입될 수 있다.
RNA 분자는 세포내 안정성 및 반감기를 증가시키키 위해 변형될 수 있다. 가능한 변형은 분자의 5' 및/또는 3' 말단에서 측면 서열의 첨가 또는 분자의 주쇄 내에서 포스포디에스테라제 연결기 대신 포스포로티오에이트 또는 2'O-메틸의 사용을 포함하지만 이들로만 한정되지는 않는다. 이 개념은 종전과 다른 염기, 예컨대 이노신, 퀘오신 (queosine), 및 위부토신 (wybutosine), 및 아세틸-, 메틸-, 티오-, 유사 변형 형태의 아데닌, 시티딘, 구아닌, 티민, 및 우리딘의 포함에 의해 확장될 수 있고, 이들은 내인성 엔도뉴클레아제에 의해 쉽게 인식되지 않는다.
간섭
RNA
RNA 간섭 (RNAi)은 이중-가닥 RNA (dsRNA)에 의해 매개되는 전사후 유전자 사일런싱의 메카니즘이고, 상기 기재한 안티센스 및 리보자임-계 어프로치와는 다르다. dsRNA 분자는 다양한 계보의 세포에서 다이서 (DICER) (문헌 [Bernstein et al., Nature 409:363, 2001])라 지칭되는 RNAe III-유사 효소에 의해 최초 과정을 겪은 후, 각 스트랜드가 5' 포스페이트 기 및 3' 히드록실을 갖고, 다른 가닥과 정확히 상보적인 19 nt 영역을 포함하여 2 nt-3' 돌출부에 의해 플랭킹된 19 nt 이중나선 영역이 있는 두 개의 21 nt 가닥을 포함하는 더 작은 dsRNA 분자로 mRNA의 서열-특이적 분해를 지시하는 것으로 여겨진다. 따라서 RNAi는 각 가닥에서 1-2 뉴클레오티드 3' 돌출부를 갖는 대략 19 뉴클레오티드의 전형적인 길이의 이중-가닥 영역을 전형적으로 포함하여, 대략 21 내지 23 뉴클레오티드의 전형적인 총 길이를 나타내는 짧은 간섭 RNA (siRNA)에 의해 매개된다.
siRNA는 또한 예를 들어, 이중-가닥 부분이 15-29 뉴클레오티드의 범위일 수 있는 길이의 범위를 가질 수 있다고 이해될 것이다. siRNA는 또한 둘 중 하나 또는 둘 다의 말단에서 둔단 또는 3’ 돌출부를 가질 수 있다고 이해될 것이다. 존재하는 경우, 이러한 3’ 돌출부는 종종 1-5 뉴클레오티드의 길이이다.
siRNA는 형질감염, 전기천공, 또는 마이크로인젝션과 같은 상기 방법에 의해 포유동물 세포로 전달되는 경우 또는 임의의 다양한 플라스미드-계 어프로치를 통해 세포에서 발현되는 경우, 유전자 발현을 하향조절하는 것으로 나타난다. siRNA를 사용하는 RNA 간섭은, 예를 들어 문헌 [Tuschl, T., Nat. Biotechnol., 20:446-448, May 2002. See also Yu, J., et al., Proc. Natl. Acad. Sci., 99(9), 6047-6052 (2002); Sui, G., et al., Proc. Nail. Acad. Sci., 99(8), 5515-5520 (2002); Paddison, P., et al., Genes and Dev., 16, 948-958 (2002); Brummelkamp, T. et al., Science, 296, 550-553 (2002); Miyagashi, M. and Taira, K., Nat. Biotech., 20, 497-500 (2002); Paul, C., et al., Nat. Biotech., 20, 505-508 (2002)]에 검토되어 있다.
사실, RNAi에 의한 특정 유전자 발현의 생체내 억제는 포유동물을 비롯한 다양한 유기체에서 수행되어 왔다. 예를 들어, 자가면역 간염을 갖는 실험용 마우스로의 Fas siRNA 화합물의 정맥내 주사가 특이적으로 마우스 간 세포에서 Fas mRNA 수준 및 Fas 단백질의 발현을 감소시킨다고 문헌 [Song et al., Nature Medicine, 9:347-351 (2003)]에 개시되어 있다. 동물에게 siRNA를 전달하는 몇가지 다른 접근법이 또한 성공적으로 입증되어 왔다. 예를 들어, 문헌 [McCaffery et al., Nature, 418:38-39 (2002); Lewis et al., Nature Genetics, 32:107-108 (2002); and Xia et al., Nature Biotech., 20:1006-1010 (2002)]을 참고한다.
siRNA는 머리핀 (stem-loop) 구조를 형성할 수 있는 자가상보적 영역을 갖는 단일 가닥 또는 두 개의 개별 핵산 가닥을 포함할 수 있다. 구조, 길이, 미스매치의 수, 루프의 크기, 돌출부에서 뉴클레오티드의 동일성 등에서의 수많은 변화가 효과적인 siRNA-촉발 유전자 사일런싱과 일치한다. 임의의 이론에 의해 얽매이고자 하는 것은 아니지만, 다양한 상이한 전구체의 세포내 과정 (예를 들어, 다이서에 의함)이 유전자 사일런싱을 효과적으로 매개 가능한 siRNA의 생성을 나타낸다고 이해되어진다. 일반적으로 인트론보다는 엑손을 표적화하는 것이 바람직하고, 또한 표적 전사체의 3' 부분 내의 영역에 상보적인 서열을 선택하는 것이 특히 바람직 할 수 있다. 일반적으로 상이한 뉴클레오티드의 대략의 등몰비를 함유하는 서열을 선택하는 것이 바람직하고, 단일 잔기가 수 회 반복되는 스트레치를 피하는 것이 바람직하다.
따라서 siRNA는 각 가닥에서 1-2 뉴클레오티드 3' 돌출부를 갖는 대략 19 뉴클레오티드의 전형적인 길이의 이중-가닥 영역을 전형적으로 갖는 RNA 분자를 포함할 수 있고, 대략 21 내지 23 뉴클레오티드의 총 길이를 나타낸다. 본원에 사용된 바와 같이, siRNA는 또한 생체내에서 처리되어 상기 분자를 생성할 수 있는 다양한 RNA 구조를 포함한다. 이러한 구조는 서로 혼성화하여 줄기, 루프, 및 임의의 돌출부, 바람직하게는 3' 돌출부를 형성하는 두 개의 상보적 요소를 함유하는 RNA 가닥을 포함한다. 전형적으로, 줄기는 대략 19 bp 길이, 루프는 약 1-20, 바람직하게는 약 4-10, 보다 바람직하게는 약 6-8 뉴클레오티드 길이이고/이거나 돌출부는 전형적으로 약 1-20, 바람직하게는 약 2-15 뉴클레오티드 길이이다. 본 발명의 특정 실시양태에서, 줄기는 최소 19 뉴클레오티드 길이이고, 대략 29 뉴클레오티드 길이까지 될 수 있다. 4 뉴클레오티드 또는 그보다 긴 루프는 더 작은 루프보다 입체적 제약에 덜 영향을 받아서 바람직할 수 있다. 돌출부는 5’ 포스페이트 및 3’ 히드록실을 포함할 수 있다. 돌출부는 다수의 U 잔기, 예를 들어, 1 내지 5 U 잔기를 포함할 수 있지만 그럴 필요는 없다.
몇몇 실시양태에서, siRNA는 시냅스 소포 순환에서 관련되는 단백질 및 유전자의 서열 정보를 기준으로 고안될 수 있다. 예를 들어, siRNA는 내인성 소포 단백질 (예를 들어, 시냅스 소포 단백질 2 (SV2), 시냅토파이신, 시냅토타그민, 소포-관련 막 폴리펩티드 (VAMPs), 신경전달물질 수송체 (NT 수송체), 시냅토자이린, 양성자 펌프), 말초 소포 단백질 (예를 들어, 랩스, 시스틴 스트링 단백질 (CSPs), 시냅신), 시냅스 원형질 막 단백질 (예를 들어, 칼슘 채널, 25 kDa의 시냅토솜-관련 단백질 (SNAP-25), 신탁신), 및 세포질 단백질 (예를 들어, SNAPs, n-Sec1), 시냅신 (예를 들어, 시냅신 I, II 및 III), 탈인화수소 (예를 들어, 디나민 I, PIP5K1γ, 및 시냅토자닌 I)을 비롯하지만 이들로만 한정되지는 않는 시냅스전 단백질을 코딩하는 유전자를 표적화하기 위해 고안될 수 있다.
적합한 siRNA는 통상의 RNA 합성 방법을 사용하여 합성할 수 있다. 예를 들어, 이들은 적절하게 보호되는 리보뉴클레오시드 포스포라미다이트 및 통상의 DNA/RNA 신서사이저를 사용하여 화학적으로 합성할 수 있다. RNA 합성을 위한 다양한 응용 방법이, 예를 들어 문헌 [Usman et al., J. Am. Chem. Soc., 109:7845-7854 (1987) and Scaringe et al., Nucleic Acids Res., 18:5433-5441 (1990)]에 개시되어 있다. 통상의 siRNA 합성 서비스는 상업적 판매업체, 예컨대 앰비온 (Ambion) (미국 텍사스주 오스틴), 다마콘 리서치 (Dharmacon Research) (미국 콜로라도주 라파예트), 피어스 케미칼 (Pierce Chemical) (미국 일리노이주 락포드), 켐진스 (ChemGenes) (미국 매사추세츠주 애쉴랜드), 프롤리고 (Proligo) (독일 함부르크), 및 크루아켐 (Cruachem) (영국 글라스고우)로부터 이용 가능하다.
본 발명의 siRNA는 전적으로 천연 RNA 뉴클레오티드로 구성될 수 있거나, 또는 대신 안티센스 분자에 대해 상기 언급한 바와 같은 하나 이상의 뉴클레오티드 유사체 및/또는 변형을 포함할 수 있다. 예를 들어 siRNA 구조는, 예컨대 엑소뉴클레아제에 의해 소화를 감소시키기 위해 하나 이상의 자유 가닥 말단에서 뉴클레오티드 유사체를 포함함으로서 안정화될 수 있다. 별법으로, siRNA 분자는 관련된 분자를 코딩하는 DNA 서열을 시험관내에서 전사하여 생성될 수 있다. 상기 DNA 서열은 적합한 RNA 중합효소 프로모터, 예컨대 T7, T3, 또는 SP6을 갖는 다양한 벡터로 포함될 수 있다.
항체
몇몇 실시양태에서, 항체는 잠재적 시냅스 소포 순환 조절제에 대해 스크리닝 될 수 있다. 예를 들어, 항체는 시냅스 소포 순환에서 관련된 단백질 및 유전자의 서열 정보를 기준으로 고안될 수 있다. 예를 들어, 항체는 내인성 소포 단백질 (예를 들어, 시냅스 소포 단백질 2 (SV2), 시냅토파이신, 시냅토타그민, 소포-관련 막 폴리펩티드 (VAMPs), 신경전달물질 수송체 (NT 수송체), 시냅토자이린, 양성자 펌프), 말초 소포 단백질 (예를 들어, 랩스, 시스틴 스트링 단백질 (CSPs), 시냅신), 시냅스 원형질 막 단백질 (예를 들어, 칼슘 채널, 25 kDa의 시냅토솜-관련 단백질 (SNAP-25), 신탁신), 및 세포질 단백질 (예를 들어, SNAPs, n-Sec1), 시냅신 (예를 들어, 시냅신 I, II 및 III), 탈인화수소 (예를 들어, 디나민 I, PIP5K1γ, 및 시냅토자닌 I)을 비롯하지만 이들로만 한정되지는 않는 시냅스전 단백질을 표적화하기 위해 고안될 수 있다. 항체는 또한 칼시뉴린, 칼시뉴린 활성화제, 억제제, 및/또는 기질을 표적화하기 위해 고안될 수 있다.
항체는 당업계에 잘 알려진 방법을 사용하여 생성될 수 있다. 예를 들어, 항체 생성에 대한 프로토콜은 문헌 [Harlow and Lane, Antibodies: A Laboratory Manual, (1988)]에 기재되어 있다. 전형적으로, 항체는 마우스, 래트, 기니 피그, 햄스터, 낙타, 라마, 상어, 또는 기타 적절한 숙주에서 생성될 수 있다. 별법으로, 항체는 닭에서 만들어져서 IgY 분자를 생성할 수 있다 (문헌 [Schade et al., (1996) ALTEX 13(5):80-85]). 일부 실시양태에서, 본 발명에 대해 적합한 항체는 유인 영장류 항체이다. 예를 들어, 개코원숭이에서 치료적으로 유용한 항체를 얻기 위한 일반적인 기술은, 예를 들어 문헌 [Goldenberg et al., international patent publication No. WO 91/11465 (1991)], 및 문헌 [Losman et al., Int. J. Cancer 46: 310 (1990)]에서 찾아볼 수 있다. 일부 실시양태에서, 모노클로날 항체는 하이브리도마 방법 (문헌 [Milstein and Cuello, (1983) Nature 305(5934):537-40.])을 사용하여 제조할 수 있다. 일부 실시양태에서, 모노클로날 항체는 또한 재조합 방법 (미국 특허 번호 4,166,452, 1979)에 의해 만들어질 수 있다.
몇몇 실시양태에서, 본 발명에 적합한 항체는 인간화된 항체 또는 인간 항체를 포함할 수 있다. 비-인간 항체의 인간화된 형태는 비-인간 Ig로부터 유래한 최소 서열을 함유하는 키메라 Ig, Ig 쇄 또는 단편 (예컨대, Fv, Fab, Fab', F(ab')2 또는 Ab의 다른 항원-결합 부분서열)이다. 일반적으로, 인간화된 항체는 비-인간 근원으로부터 도입된 하나 이상의 아미노산 잔기를 갖는다. 이러한 비-인간 아미노산 잔기는, 전형적으로 "임포트(import)" 가변 도메인으로부터 얻은 "임포트" 잔기로서 빈번하게 지칭된다. 인간화는 설치류 CDR 또는 CDR 서열을 인간 항체의 상응하는 서열로 치환함으로써 달성한다 (문헌 [Riechmann et al ., Nature 332(6162):323-7, 1988]; [Verhoeyen et al ., Science. 239(4847):1534-6, 1988]). 이러한 "인간화된" 항체는, 무손상의 인간 가변 도메인보다 실질적으로 더 적은 부분이 비-인간 종으로부터의 상응하는 서열에 의해 치환되어 있는 키메라 Ab이다 (미국 특허 번호 4,816,567, 1989). 몇몇 실시양태에서, 인간화된 항체는 전형적으로 몇몇 CDR 잔기 및 가능한 몇몇 FR 잔기가 설치류 Ab 내 유사 부위로부터의 잔기에 의해 치환된 인간 항체이다. 인간화된 항체로는 수용체의 상보성 결정 영역 (CDR)으로부터의 잔기가 비-인간 종 (공여체 항체), 예컨대 마우스, 래트 또는 래빗의 CDR로부터의 잔기에 의해 대체되는 인간 Ig (수용체 항체)를 들 수 있고, 이는 바람직한 특이성, 친화성 및 수용성을 갖는다. 몇몇 예에서, 상응하는 비-인간 잔기는 인간 Ig의 프레임워크 잔기를 대체한다. 인간화된 항체는 수용체 항체나 임포트된 CDR 또는 프레임워크 서열 어디에서도 발견되지 않는 잔기를 포함할 수 있다. 일반적으로, 인간화된 항체는 적어도 1개, 전형적으로는 2개의 가변 도메인을 실질적으로 모두 포함하고, 상기 가변 도메인에서 대부분의 CDR 영역 (모든 영역은 아닐지라도) 은 비-인간 Ig의 CDR 영역에 상응하고, 대부분의 FR 영역 (모든 영역은 아닐지라도)은 인간 Ig 컨센서스(consensus) 서열의 영역에 상응한다. 또한, 인간화된 항체는 최적으로는 적어도 Ig 불변 영역 (Fc)의 일부분, 전형적으로는 인간 Ig의 일부분을 포함한다 (문헌 [Riechmann et al., Nature 332(6162):323-7, 1988]; [Verhoeyen et al ., Science. 239(4847):1534-6, 1988]).
또한, 인간 항체는 파지 디스플레이 라이브러리 (문헌 [Hoogenboom et al ., Mol Immunol . (1991) 28(9):1027-37]; [Marks et al ., J Mol Biol . (1991) 222(3):581-97]) 및 인간 모노클로날 항체의 제법 (문헌 [Reisfeld and Sell, 1985, Cancer Surv . 4(1):271-90])을 비롯한 다양한 기법을 이용하여 제조될 수 있다. 유사하게, 내인성 Ig 유전자가 부분적으로 또는 완전히 비활성화된 트랜스제닉 동물로의 인간 Ig 유전자의 도입은 인간 항체를 합성하는 데 활용될 수 있다. 항원투여시, 인간 항체의 생성이 관찰되고, 이는 유전자 재정렬, 조합, 및 항체 레퍼토리를 비롯한 모든 측면에서 인간에서 보여지는 것과 매우 유사하다 (문헌 [Fishwild et al ., High-avidity human IgG kappa monoclonal antibodies from a novel strain of minilocus transgenic mice, Nat Biotechnol . 1996 July; 14(7):845-51]; [Lonberg et al ., Antigen-specific human antibodies from mice comprising four distinct genetic modifications, Nature 1994 April 28;368(6474):856-9]; [Lonberg and Huszar, Human antibodies from transgenic mice, Int . Rev . Immunol . 1995;13(1):65-93]; [Marks et al ., By-passing immunization: building high affinity human antibodies by chain shuffling. Biotechnology (N Y). 1992 July; 10(7):779-83]).
기타
몇몇 실시양태에서, 천연 생성물 라이브러리는 발명의 검정을 이용하여 스크리닝할 수 있다.
몇몇 실시양태에서, 세포에 자극 (예를 들어, 전기 자극)을 주기 전, 선택된 시간 동안 뉴런 세포를 시험 물질과 함께 인큐베이션할 수 있다. 다양한 실시양태에서, 선택된 양의 시험 물질을 뉴런 세포를 포함한 웰에 첨가한다. 다양한 실시양태에서, 상이한 양 및/또는 유형의 시험 물질을 뉴런 세포를 포함한 상이한 웰에 첨가한다. 다양한 실시양태에서, 실질적으로 동일한 양 및/또는 유형의 시험 물질을 뉴런 세포를 포함한 상이한 웰에 첨가한다.
많은 실시양태에서, 시험 물질을 이용한 검정 결과는 임의의 구성원 제제가 하나 이상의 시냅스 소포 순환 활성을 조절하는지 측정하기 위해 대조군과 비교할 수 있다. 몇몇 실시양태에서, 대조군은 시험 물질로 처리하지 않은 다른 동일한 뉴런 세포에서 검출된 하나 이상의 시냅스 소포 순환 활성과 동일하다. 몇몇 실시양태에서, 뉴런 세포는 시험 물질로 처리되지 않는 한 정상적인 시냅스 소포 순환을 나타낼 수 있다. 몇몇 실시양태에서, 처리하지 않은 뉴런 세포 (예를 들어, 뉴런 장애를 앓고 있는 동물 또는 인간으로부터 단리된 뉴런 세포)는 불완전한 시냅스 소포 순환을 나타낼 수 있다. 몇몇 실시양태에서, 시험 물질은 처리하지 않은 대조군에 대해 시냅스 소포 순환의 촉진을 일으키는 경우에, 잠재적인 시냅스 소포 순환 인핸서로서 간주된다. 몇몇 실시양태에서, 시험 물질은 처리하지 않은 대조군에 대해 시냅스 소포 순환의 억제를 일으키는 경우에, 잠재적인 시냅스 소포 순환 억제제로서 간주된다.
몇몇 실시양태에서, 시냅스 소포 순환의 비(比)활성은 본 발명에 따른 방법을 이용하여 측정될 수 있다. 특히, 다양한 양상의 시냅스 소포 순환 (예를 들어, 외분비작용, 내분비작용, 재순환 등)에서의 활성이 측정될 수 있다. 몇몇 실시양태에서, 외분비작용은, 이들로 한정되지는 않지만, 방출 확률, 방출 트레인, 도킹된 소포, 풀 크기를 포함한 파라미터를 이용하여 측정될 수 있다. 몇몇 실시양태에서, 내분비작용은, 예를 들어 비-포화, 포화 또는 정상 상태를 나타내는 파라미터를 이용하여 측정될 수 있다. 본원에서 사용되는 비-포화는 소포 내재화 부위가 비제한적인 경우의 내분비작용을 나타낸다. 포화는 소포 내재화 부위가 제한적인 경우의 내분비작용을 나타낸다. 몇몇 실시양태에서, 재순환은 제1 반응에 대한 휴지기 (예를 들어, 1분) 후 재자극화 후의 반응 크기를 측정함으로써 측정될 수 있다. 몇몇 실시양태에서, 고주파수 분출(high frequency firing)이 측정될 수 있다. 본원에서 사용되는 용어 "고주파수 분출"은 전형적으로 10 Hz 이상의 주파수에서의 분출을 지칭한다. 전형적으로, 시냅스 소포 방출로 귀결되는 지속적인 고주파수 분출의 기간은 분출의 주파수에 반비례한다. 특정 조건하에, 시냅스 피로가 고주파수 분출 동안 발생할 수 있다. 예를 들어, 시냅스 소포의 쉽게 방출가능한 풀 크기는 제한적인 것 (예를 들어, 10개의 소포)으로 생각된다. 따라서, 10 Hz 이상의 분출 주파수에서, 쉽게 방출가능한 풀이 소비되는 점을 넘어서 (예를 들어, 활동 전위 10을 초과함) 분출이 지속되는 경우에 시냅스 피로가 발생한다. 고주파수 분출은 전기생리학 (예를 들어, 세포외 필드 기록) 또는 영상 분석법 (예를 들어, 시냅토플루오린을 이용함)을 이용하여 측정될 수 있다.
가능성 있는 조절제는 본원에 기재된 적합한 시냅스 소포 순환 검정을 이용하여 조절 효과를 확인하고/하거나 효능을 예측하기 위해 추가로 시험할 수 있다. 또한, 가능성 있는 조절제는 시냅스 소포 순환 또는 신경전달의 신호전달 경로에 대한 이들의 효과를 확인하기 위해 다른 검정을 이용하여 시험할 수 있다. 몇몇 실시양태에서, 가능성 있는 조절제는 디포스핀의 칼시뉴린 및/또는 인산화 상태 또는 다른 시냅스 단백질을 조절하는 이들의 능력을 측정하기 위해 포스포시그너처(phosphosignature) 검정을 이용하여 시험할 수 있다. 몇몇 실시양태에서, 가능성 있는 조절제는 신경학 또는 정신의학 장애, 특히 시냅스 소포 순환 기능이상과 연관된 장애를 치료하는 능력에 대해 추가로 시험할 수 있다. 몇몇 실시양태에서, 가능성 있는 조절제는 동물 모델에서 시험할 수 있다. 예를 들어, 가능성 있는 조절제는 신경학 또는 정신의학 장애 (예를 들어, 정신분열증을 가진 마우스 모델)를 가진 동물 모델에서 시험할 수 있다. 몇몇 실시양태에서, 가능성 있는 조절제는 시냅스 소포 순환 (예를 들어, 시냅스 피로, 시냅스 피로로부터의 회복)과 상관 관계가 있는 전기생리학 검정에서 시험할 수 있다.
본 발명에 따라 확인된 시냅스 소포 순환 조절제는 시냅스 소포 순환과 직접적으로 또는 간접적으로 관련 있는 다양한 단계, 과정 및/또는 생물학적 경로의 조절과 관련 있을 수 있다. 예를 들어, 칼시뉴린 활성화 (예를 들어, 억제제 (즉, DSCR1 또는 카빈(cabin))와의 칼시뉴린의 상호작용에 대한 직접적인 활성화 또는 억제에 의함)는 이동 및 내분비작용을 촉진할 수 있다. 사이클린-의존성 키나제 5 (CDK5) 억제는 시냅스 소포 순환을 촉진할 수 있다. 또한, 이중-특이성 티로신-인산화된 및 조절된 키나제 1A (Dyrk1A) 또는 단백질 키나제 C (PKC) 억제는 시냅스 소포 내분비작용을 촉진할 수 있다. 세포외 신호-조절된 키나제 (ERK) (예를 들어, ERK1)의 억제는 시냅스 소포 내분비작용 및/또는 이동을 촉진할 수 있다. Ca++ 배출제 또는 Ca++를 제거하거나 격리시키는 다른 단백질의 조절을 비롯한 Ca++ 채널의 조절은 임의 부분의 과정을 조절할 수 있다. G-단백질 커플링된 수용체 (GPCR) (무스카린성 아세틸콜린 수용체를 포함함)는 시냅스 소포 순환의 모든 단계를 조절하며, 따라서, 이러한 수용체의 효능제 및 길항제는 시냅스 소포 순환의 다양양상에 대한 조절제로서 확인될 수 있다. 조절제 및 이러한 조절제를 확인하기 위한 검정 파라미터에 의해 영향을 받을 수 있는 시냅스 소포 순환의 예시적인 측면은 표 1에 나타냈다.
치료학적 응용
다른 것들 중에서, 본 발명은 시냅스 소포 순환을 조절하는 물질이 특정 장애 (예를 들어, 시냅스 소포 기능이상과 연관된 장애)의 치료에 유용할 수 있다는 인식을 포함한다. 몇몇 실시양태에서, 본원에서 확인된 시냅스 소포 순환 조절제는 하나 이상의 징후 또는 특징을 갖는, 시냅스 소포 순환 기능이상과 연관된 질환, 장애, 및/또는 병태의 치료 (경감, 개선, 완화, 억제, 예방, 발병 지연, 중증도 감소, 및/또는 발병률 감소)에 사용될 수 있다. 예를 들어, 본 발명은 시냅스 소포 순환의 조절제가 이들로 한정되지는 않지만, 정신분열증, 양극성 장애, 간질을 비롯한 정신의학 장애, 질환 또는 병태; 이들로 한정되지는 않지만, 알츠하이머병, 알콜성 코르사코프(Korsakoff) 질환 (KS), 다발성 경화증, 및 파킨슨 질환을 비롯한 신경학 질환, 장애 또는 병태; 및/또는 이들로 한정되지는 않지만, 다운증후군, 윌리엄스 증후군, 단순 언어 장애 및 주의력 결핍 과잉행동 장애 (ADHD)를 비롯한 다른 질환, 장애 또는 병태의 치료에 유용할 수 있다는 인식을 포함한다.
비제한적인 예로서, 시냅스 소포 순환을 억제 (예를 들어, 흥분성 시냅스 전달의 억제, 또는 억제성 시냅스 소포 순환의 촉진)하는 조절제는 간질의 치료에 이용될 수 있다. 세로토닌성 시냅스 소포 순환을 조절 (예를 들어, 촉진 또는 안정화)하는 조절제는 우울증의 치료에 이용될 수 있다. 도파민작용성 소포 순환을 조절 (예를 들어, 촉진 또는 안정화)하는 조절제는 파킨슨 질환의 치료에 이용될 수 있다. 콜린성 소포 순환을 조절 (예를 들어, 촉진)하는 조절제는 알츠하이머병의 치료에 이용될 수 있다. 글루타메이트성 시냅스 소포 순환을 조절 (예를 들어, 촉진 또는 안정화)하는 조절제는 정신분열증의 치료에 이용될 수 있다. 아드레날린성 또는 비아드레날린성 소포 순환을 조절 (예를 들어, 감소 또는 안정화)하는 조절제는 불안증 장애에 이용될 수 있다.
시냅스 소포 순환 조절제 및/또는 그의 제약 조성물은 질환, 장애, 및/또는 병태 (예를 들어, 시냅스 소포 순환 기능이상과 관련된 질환, 장애, 및/또는 병태)의 치료에 대한 임의의 유효량을 사용하여 대상체에게 투여될 수 있다. 임의의 특정 환자 또는 유기체에 대한 특정 치료 유효 용량 수준은 치료될 장애 및 장애의 중증도; 이용되는 특정 화합물의 활성; 이용되는 특정 조성물; 환자의 연령, 체중, 일반 건강, 성 및 식이요법; 이용되는 특정 화합물의 투여 시간, 투여 경로 및 배설 속도; 치료의 지속기간; 이용되는 특정 화합물과 조합하여 또는 동시적으로 사용되는 약물; 및 의학 업계에서 공지된 요소들을 비롯한 다양한 요소에 따를 것이다.
특정 실시양태에서, 시냅스 소포 순환 조절제 및/또는 그의 조성물은 원하는 치료학적 효과를 얻기 위해 1일당 대상체 체중 1 kg당 약 0.001 mg 내지 약 100 mg, 약 0.01 mg 내지 약 50 mg, 약 0.1 mg 내지 약 40 mg, 약 0.5 mg 내지 약 30 mg, 약 0.01 mg 내지 약 10 mg, 약 0.1 mg 내지 10 mg, 또는 약 1 mg 내지 약 25 mg을 전달하기에 충분한 투여량 수준으로 1일 1회 이상 투여될 수 있다. 원하는 투여량은 1일 3회, 1일 2회, 1일 1회, 2일 1회, 3일 1회, 매주, 2주마다, 3주마다, 또는 4주마다 전달될 수 있다. 특정 실시양태에서, 원하는 투여량은 다회 투여 (예를 들어, 2회, 3회, 4회, 5회, 6회, 7회, 8회, 9회, 10회, 11회, 12회, 13회, 14회, 또는 그 이상의 투여)를 이용하여 전달될 수 있다.
제약 조성물
본 발명은 또한 하나 이상의 제약상 허용되는 부형제와 함께 하나 이상의 시냅스 소포 순환 조절제를 포함하는 제약 조성물을 제공한다. 이러한 제약 조성물은 하나 이상의 부가적인 치료적으로-활성 물질을 임의로 포함할 수 있다.
본원에서 제공된 제약 조성물의 기재가 주로 인간에 대한 윤리적인 투여에 적합한 제약 조성물에 관한 것이지만, 이러한 조성물은 모든 종류의 동물에 대한 투여에 일반적으로 적합하다는 것이 당업자에게 이해될 것이다. 각종 동물에 대한 투여에 적합한 조성물이 되기 위해서 이간에 대한 투여에 적합한 조성물의 변형은 자명하며, 통상의 숙련된 수의학 약리학자는 필요한 경우 단순히 통상적인 실험에 의해 이와 같은 변형을 설계 및/또는 수행하는 것이 가능하다. 제약 조성물의 투여가 고려되는 대상으로는, 예를 들어 인간 및/또는 다른 영장류; 통상 의의 있는 포유동물, 예컨대 소, 돼지, 말, 양, 고양이, 개, 마우스 및/또는 래트를 포함하는 포유동물; 및/또는 통상 의의 있는 새, 예컨대 닭, 오리, 거위 및/또는 칠면조를 포함하는 새 등을 들 수 있지만, 이들로 한정되지는 않는다.
본원에 기재된 제약 조성물의 제제는 공지되거나 이하 약리학 분야에서 개발된 임의의 방법에 의해 제조할 수 있다. 일반적으로, 이와 같은 준비를 위한 방법은 활성 성분을 부형제 및/또는 하나 이상의 다른 부속 성분에 넣는 단계, 및 이후, 필요에 따라 및/또는 바람직하다면, 생성물을 원하는 단일- 또는 다수-복용량 단위로 성형 및/또는 포장하는 단계를 포함한다.
본 발명에 따른 제약 조성물을 대량, 단일 단위 복용량 및/또는 다수의 단일 단위 복용량으로서 제조, 포장 및/또는 판매할 수 있다. 본원에서 사용된 바와 같이, "단위 복용량"은 미리 결정된 양의 활성 성분을 포함하는 제약 조성물의 별개의 양이다. 활성 성분의 양은 일반적으로 대상에게 투여될 활성 성분의 투여량과 동일하고/하거나, 예를 들어 이러한 투여량의 1/2 또는 1/3과 같은 간편한 분수값이다.
본 발명에 따른 제약 조성물 중 활성 성분, 제약상 허용되는 부형제, 및/또는 임의의 부가 성분의 상대량은 유사성, 크기, 및/또는 치료 대상의 상태에 따라, 또한 조성물이 투여되는 경로에 따라 다양하다. 실시예에 의하면, 조성물은 0.1% 내지 100% (w/w)의 활성 성분을 포함할 수 있다.
제약 제제는, 원하는 특정 복용 형태에 적합하도록, 본원에서 사용된 임의의 모든 용매, 분산매, 희석제, 또는 다른 액체 비히클, 분산제 또는 현탁 보조제, 표면 활성제, 등장성제, 증점제 또는 유화제, 보존제, 고체 결합제, 윤활제 등을 비롯한 제약상 허용되는 부형제를 더 포함할 수 있다. 레밍턴 (Remington)의 문헌[The Science and Practice of Pharmacy, 21st Edition, A. R. Gennaro (Lippincott, Williams & Wilkins, Baltimore, MD, 2006; 본원에 참고로 도입됨)]은 제약 조성물을 제제화하는 데 이용되는 각종 부형제 및 그의 제조를 위한 공지된 기술을 개시하고 있다. 임의의 통상의 부형제 매질을 물질 또는 그의 유도체와 혼화하지 않는 한, 예컨대 비바람직한 생물학적 효과를 발생시키거나, 다르게는 제약 조성물의 임의의 다른 성분(들)과 유해한 방식으로 상호작용하는 것을 제외하고는, 그의 사용은 본 발명의 범주 내에서 고려된다.
몇몇 실시양태에서, 제약상 허용되는 부형제는 95% 이상, 96% 이상, 97% 이상, 98% 이상, 99% 이상, 또는 순수 100%이다. 일부 실시양태에서, 부형제는 인간 및 수의학적 용도로의 사용이 승인되어 있다. 일부 실시양태에서, 부형제는 미국 식약청에 의해 승인되어 있다. 일부 실시양태에서, 부형제는 제약 등급이다. 일부 실시양태에서, 부형제는 미국 약전 (USP), 유럽 약전 (EP), 영국 약전, 및/또는 국제 약전의 기준을 만족한다.
제약 조성물의 제조에 사용되는 제약상 허용되는 부형제로는, 예를 들면 불활성 희석제, 분산제 및/또는 과립화제, 표면 활성제 및/또는 유화제, 붕괴제, 결합제, 보존제, 완충제, 활택제, 및/또는 오일 등을 들 수 있지만, 이들로 한정되지는 않는다. 이와 같은 부형제는 임의로 제약 제제 중에 포함될 수 있다. 부형제, 예컨대 코코아 버터 및 좌약 왁스, 착색제, 코팅제, 감미제, 조미제, 및/또는 향신제는 조성물 중에 제조자의 판단에 따라 존재할 수 있다.
제약 제제의 제제화 및/또는 제조에 대한 일반적인 고찰은 예를 들어, 문헌[Remington: The Science and Practice of Pharmacy 21st ed., Lippincott Williams & Wilkins, 2005 (본원에 참고로 도입됨)]에서 확인할 수 있다.
투여
본 발명에 따르면 시냅스 소포 순환 조절제 및/또는 그의 제약 조성물은 임의의 경로로 투여할 수 있다. 일부 실시양태에서, 시냅스 소포 순환 조절제 및/또는 그의 제약 조성물은 경구, 정맥내, 근육내, 동맥내, 골수내, 척추 강내, 피하, 심실내, 경피, 피내, 직장, 질내, 복막내, 국부 (예를 들어 분말, 연고, 크림, 겔, 로션, 및/또는 점적에 의해), 점막, 코, 입, 장, 유리체, 종양내, 설하를 포함하는 하나 이상의 다양한 경로로; 기관내 주입, 기관지 주입, 및/또는 흡입에 의해; 경구 스프레이, 경비 스프레이 및/또는 에어로졸로서, 및/또는 문맥 카테터를 통해 투여한다. 일부 실시양태에서, 시냅스 소포 순환 조절제 및/또는 그의 제약 조성물을 전신성 정맥내 주사로 투여한다. 특정 실시양태에서, 시냅스 소포 순환 조절제 및/또는 그의 제약 조성물을 정맥내로 및/또는 경구로 투여할 수 있다. 특정 실시양태에서, 시냅스 소포 순환 조절제 및/또는 그의 제약 조성물을 시냅스 소포 순환 조절제가 혈액-뇌 장벽을 넘게 하는 방법으로 투여할 수 있다. 다수의 전략을 혈액-뇌 장벽을 넘는 데 이용할 수 있지만, 분자의 소수성 성질을 증가시키는 방법; 분자를 복합체 (conjugate)로서 혈액-뇌 장벽에서 수용체를 표적으로 하는 트렌스페린과 같은 담체에 도입하는 방법 등을 포함하며, 이들로 한정되지는 않는다. 또다른 실시양태에서, 분자는 두개내 또는 더 바람직하게는 심실내로 투여할 수 있다. 또다른 실시양태에서, 혈액-뇌 장벽의 삼투성 붕괴를 이용하여 뇌로의 활성 제제 전달을 유효하게 할 수 있다 (문헌[Neuwelt et al., 1995, Proc. Natl. Acad. Sci. USA "Delivery of herpesvirus and Adenovirus to nude rat intracerebral tumors after osmotic blood-brain barrier disruption," Oct. 10, 1995]). 또다른 실시양태에서, 혈액-뇌 장벽을 표적으로 하는 리포좀 중에 제제를 투여할 수 있다. 리포좀 내 제약 제제의 투여는 공지되어 있다 (문헌[Langer, 1990, Science 249:1527-1533]; Treat et al., in Liposomes in the Therapy of Infectious Disease and Cancer, Lopez-Berestein and Fidler (eds.), Liss, New York, pp. 353-365 (1989); Lopez-Berestein, ibid., pp. 317-327; see generally ibid.]). 이와 같은 방법 모두는 본 발명을 구현한다. 구체적인 실시양태에서, 시냅스 소포 순환 조절제 및/또는 그의 제약 조성물을 문맥 카테터로 투여할 수 있다. 그러나, 본 발명은 약물 전달 과학의 가능한 진보를 고려한 임의의 적절한 경로에 의한 시냅스 소포 순환 조절제 및/또는 그의 제약 조성물의 전달을 아우른다.
일반적으로 투여의 가장 적절한 경로는 시냅스 소포 순환 조절제의 특성 (예를 들어, 위장관, 혈류 등의 환경하에 그의 안정성), 환자의 상태 (예를 들어, 환자가 특정 투여 경로를 견딜 수 있는지의 여부) 등을 비롯한 다양한 인자에 따라 달라진다. 본 발명은 약물 전달 과학의 가능한 진보를 고려한 임의의 적절한 경로에 의한 제약 조성물의 전달을 포함한다.
키트
본 발명은 본 발명의 방법을 편리하게 및/또는 효과적으로 수행하기 위한 다양한 키트를 제공한다. 전형적으로 키트는 성분의 충분한 양 및/또는 개수를 포함하여 사용자가 대상의 다중 치료 및/또는 다중 실험을 수행하게 할 것이다.
몇몇 실시양태에서, 키트는 (i) 시냅스 소포 순환을 추적하는 리포터; (ii) 다수의 뉴런 세포를 배양하기에 적합한 다수의 웰; (iii) 자극 시스템; (iv) 검출 시스템; 및 (v) 하나 이상의 시험 물질을 하나 이상 포함한다. 일부 실시양태에서, 키트는 임의로 (vi) 시냅스 소포 순환을 조절한다고 공지되어 있는 양성 제어 물질; (vii) 시냅스 소포 순환을 조절하지 않는다고 공지되어 있는 음성 제어 물질; 및 (viii) 용법을 하나 이상 추가로 포함할 수 있다..
몇몇 실시양태에서, 키트는 본원에 기재된 바와 같이 시냅스 소포 순환 어세이를 이용하여 확인된 하나 이상의 시냅스 소포 순환 조절제를 포함한다. 일부 실시양태에서, 이와 같은 키트는 질환, 상태, 및/또는 장애 (예를 들어 시냅스 소포 순환 기능이상과 연관된 장애)로 고통받고/받거나 이에 대해 예민한 대상의 치료, 진단, 및/또는 예방에 이용된다. 일부 실시양태에서, 이와 같은 키트는 (i) 시냅스 소포 순환 조절제 또는 그의 제약 조성물을 하나 이상; (ii) 대상에 대한 투여용 시린지, 주사 바늘, 도포용 도구 등; 및 (iii) 용법을 하나 이상 포함한다.
몇몇 실시양태에서, 키트는 상이한 리포터; 세포 유형; 제어 장치; 시험 물질; 시냅스 소포 순환 조절제, 및/또는 그의 제약 조성물 등의 콜렉션을 포함한다.
몇몇 실시양태에서, 키트는 부가 성분 또는 시약을 포함할 수 있다. 예를 들어, 키트는 세포 배양 배지, 조직 배양 배지, 완충액 등을 포함할 수 있다. 일부 실시양태에서, 키트는 용법을 포함할 수 있다. 예를 들어, 용법은 사용자에게 시냅스 소포 순환 조절제를 확인하기 위한 스크린을 수행하는 방법을 알려줄 수 있다. 용법은 사용자에게 조절제를 포함하는 제약 조성물을 제조하는 적절한 방법 및/또는 제약 조성물을 대상에게 투여하는 적절한 방법을 알려줄 수 있다.
몇몇 실시양태에서, 키트는 시냅스 소포 순환 조절제를 포함하는 제약 조성물의 수많은 단위 투여량을 포함한다. 기억 보조 장치는, 예를 들어 투여량을 투여할 수 있는 치료 일정으로 일/회로 표시하는, 숫자, 문자 및/또는 다른 표시의 형태로 및/또는 달력으로 제공될 수 있다. 위약 투여량, 및/또는 칼슘 식이 보충제는 제약 조성물의 투여량과 유사하거나 또는 상이한 형태로 포함되어 투여량을 매일 복용하는 키트를 제공할 수 있다.
키트는 하나 이상의 그릇 또는 용기를 포함하여 일부 개별 성분 또는 시약을 별도로 수납할 수 있다. 키트는 시판용의 상태적으로 밀폐된 개별 용기에 동봉하기 위한 수단을 포함할 수 있다 (예를 들어, 용법, 스티로폼과 같은 포장 재료 등을 동봉할 수 있는 플라스틱 상자).
<실시예>
실시예
1: 플루오린 리포터
이 실시예에서, 시냅스 소포 단백질의 내강의 (intra-lumenal) 도메인으로 태그한 플루오린으로 칭하는 pH-민감성 GFP를 이용하여 시냅스 소포 순환을 연구하였다. 이 방식으로 이용된 소포 단백질은 VAMP, 시냅토타그민, vGlut1 및 시냅토파이신을 포함한다. 시냅스가 움직이지 않는 경우, 이들 단백질은 시냅스 소포 내강에 플루오린을 배치하며, 이는 내부 pH 5.5를 유지하였다. 이 산성 pH에서, 형광을 켄칭하였다. 자극된 경우, 시냅스 소포는 엑소사이토스되고 양성자가 분비되어, pH를 상승시키고, 또한 플루오린이 형광을 내게 하였다. 이후, 소포를 재내면화하고 재산성화하고, 다시 형광을 켄칭하였다. 이 방법으로, 단일 시냅스에서 측정된 형광 변화를 시냅스 소포 순환을 추적하는 데 이용하였다. 이 실시예에서, 시냅토플루오린 (즉, 소포 단백질 VAMP2의 융합 및 vGlut1에 융합된 pH-민감성 GFP의 융합)을 이용하였다.
웰 내의 고 밀도로 도포된 고 백분율의 뉴런으로의 도입에 의해, 집단 수준으로 전체 웰에서 시냅스 소포 순환을 측정하는 데 시냅토플루오린을 이용하였다. 시냅토플루오린을 뉴런에 도입하는 한 방법은 바이러스 감염이다. 시냅토플루오린의 바이러스성 전달은 집단 수준으로 시냅스 소포 순환을 측정하기 위한 능력을 확인하는 데 사용하였다. 아데노-관련 바이러스 (MOI = 1000)는 시험관내 11일간 96-웰의 광학적으로 투명한 플라스틱-바닥의 접시 (넌크(Nunc))에 도포된 래트 초기 피질의 뉴런에 시냅토플루오린을 전달하는 데 사용하였다. 시험관내 21일간, 개별 시냅스를 해결하는 데 불충분한 저 확대율 옵틱 (10X, 0.45 NA 대물렌즈)을 이용하여 형광 현미경을 도치한 차이스 악시오버트 (Zeiss Axiovert) Z1에서 뉴런을 이미징화하였다. 외부 Ca++의 존재 또는 부재하에 뉴런을 이오노마이신, 시냅스 소포 외분비작용을 개시하는 칼슘 이오노포어 및 시냅토플루오린의 생성된 형광으로 처리하였다. 외부 Ca++의 존재하에 이오노마이신으로 처리된 배양물은 시냅토플루오린 신호에서 대략 20% 증가를 나타내며, 외부 Ca++의 부재하의 배양물의 반응은 유의하게 약해진다 (약 3%). 따라서, 이 실시예는 리포터로서 시냅토플루오린을 이용하여 저 확대율 옵틱에서 집단 수준으로 시냅스 소포 순환을 측정할 수 있음을 입증한다.
별법 또는 부가적으로, 뇌에서 리포터 (예를 들어, 시냅토파이신-플루오린)를 발현하는 트랜스제닉 동물 (예를 들어, 마우스 또는 래트)을 생성함으로써 플루오린-계 시냅스 소포 순환 리포터를 다량의 배양된 뉴런으로 도입하였다. 당업자에게 공지되어 있는 임의의 방법을 이용하여 이같은 트랜스제닉 동물을 만들어내는 데 사용할 수 있다.
실시예
2.
pH
-민감성 염료 리포터
시냅스 소포 순환 측정용 2차 예시 리포터는 산성 내부소포 pH 및 산 감지 염료를 이용한다. 내분비작용 리포터는 시판되고 있으며, 이는 7.4의 세포외 pH에서 5.5의 내부소포 pH로 되었을 때 그의 형광이 증가한다. 이러한 염료는 CypHer5E (GE 헬스케어) 및 pHrodo (인비트로젠)를 포함한다. 이 염료는 뉴런이 자극된 경우에 시냅스 소포로 진입함으로써 시냅스 소포 순환의 리포터로서 작용한다. 소포가 내분비작용되어 재산성화되면, 리포터가 형광을 발한다. 이러한 방식에서, 내분비작용은 형광 강도의 증가에 의해 측정되고, 뒤이은 세포외유출은 형광 강도의 감소에 의해 측정된다.
pH-민감성 염료는 임의의 방법을 이용하여 시냅스 소포로 전달된다. pH-민감성 염료는 시냅스 소포 단백질의 관내 도메인을 인식하는 항체 (예를 들어, 시냅토타그민의 관내 도메인을 인식하는 모노클로날 항체; 시냅틱 시스템즈(Synaptic 시스템즈)에 바로 콘쥬게이트되어 있다. 별도로 또는 추가로, 염료는 막 중격 물질 (예를 들어, 스티릴 염료, 예컨대 FM1-43)에 콘쥬게이트되어 있다. pH-민감성 염료를 단독으로 사용하는 경우, 뉴런이 자극되면, 시냅스 소포가 세포외유출되어 염료를 시냅스 소포로 진입시킨다. 이어서, 시냅스 소포가 내분비작용하면, 잔류 표면 염료는 종종 수회 세척 단계에 의해 세척제거한다. pH-민감성 염료를, 예를 들어 FM1-43 염료의 중격 성분에 콘쥬게이트시킴으로써, 세척 단계없이 시냅스 소포 순환을 추적하는 시냅스 소포 순환용 리포터를 생성한다.
염료를 이용하기 위해서는, 전형적으로 세포를 검정 완충제 중에 인큐베이션시킨다. pH-민감성 염료 (예를 들어, 항체에 콘쥬게이트됨, 막 인터칼레이터(intercalater) 등)를 검정 완충제에 첨가한다. 세포를 일련의 전기 전압으로 자극시키면, 시냅스 소포 세포외유출 및 염료의 시냅스 소포로의 진입이 일어난다. 시냅스 소포가 내분비작용되면, 염료는 재형성된 소포 내에 포착된다. 시냅스 소포가 재산성화되면, 염료가 적당한 파장의 광에 의해 여기될 때에 형광을 발한다.
실시예
3. 영상화 시스템
10X, 0.45 NA 대물 렌즈가 장착된 제이스 액시오버트(Zeiss Axiovert) Z1을 이용하여 시냅토플루오린을 발현하는 아데노-관련 바이러스로 감염시킨 일차 뉴런에서 시냅스 소포 순환을 전체 웰 수준에서 영상화하였다 (도 13 참조). 또한, 상기 현미경을 이용하여 플레이트의 웰에 개방 접근하여 자극 시스템을 접근시켰다. 자극 시스템을 이용하여 개별 화합물의 시냅스 소포 순환에 대한 영향을 검출하였다. 시냅스 소포 순환을 영상화하기 위해 형광 현미경(epifluorescence microscope)을 이용하는 과정은 전형적으로 약 2분이 걸리기 때문에, 이러한 구성으로는 96-웰 플레이트의 모든 웰을 영상화하는데 전형적으로 약 2 내지 3시간이 필요하였다.
이용되는 별도의 영상화 시스템은 시판되고 있는 플레이트 판독기 플레이트::비젼 (퍼킨 엘머)이다. 이 플레이트 판독기는 운동-기반 형광 분석을 할 수 있고, 자극 시스템의 통합을 위해 플레이트의 상단에 접근시킬 수 있고, 고 집적 효율 광학을 가지며, 96 웰의 동시 분석을 위해 고안된 특수 광학을 가졌다.
다수의 웰 내에서 시냅스 소포 순환을 동시에 판독하는 플레이트::비젼 플레이트 판독기의 능력에 대하여 평가하였다. 96-웰 플레이트 내의 1차 래트 뉴런 배양물을 시냅토플루오린 아데노-관련 바이러스로 시험관내에서 12일째에 감염시켰다. 외부 Ca++ 함유 또는 무함유 티로드(Tyrode) 용액으로 배양 배지를 교체하였다. 형광의 기준 기록을 플레이트::비젼 플레이트 판독기로 전체 플레이트에서 측정하였다. 이어서, 이오노마이신을 모든 웰에 첨가하고, 형광 변화를 1분 동안 2초마다 측정하였다. 결과는, Ca++의 존재하에 이오노마이신으로 자극시킨 웰에서 형광이 약 20% 증가한 반면, Ca++의 부재는 대체로 형광 증가를 감쇠시키는 것으로 나타났다 (<5%). 이러한 변화는 유사 실험을 제이스(Zeiss) 역형광 현미경으로 수행하였을 때 관찰되는 것과 유사하였다. 상기 데이터는 플레이트::비젼 플레이트 판독기가 96 웰 플레이트의 다수의 웰에서 동시에 시냅스 소포 순환을 측정하였다는 것을 나타낸다 (도 14).
실시예
4. 전기 자극 시스템
시냅스 소포 순환을 가시화하기 위해서, 뉴런을 자극하여 시냅스 소포의 세포외유출과 내분비작용을 유도하였다. 문헌 ([Ryan and Smith, 1995, Neuron, 14:983]; 본원에 참고로 포함됨) 및 ([Ryan et al., 1996, Proc. Natl. Acad. Sci., 93:5567]; 본원에 참고로 포함됨)에 기재된 바와 같이, 배양물 중의 일차 뉴런을 부분적으로 전기장 전위를 인가하여 자극하였다. 본 실시예에서, 포텐셜장을 96 웰 포맷 중의 일차 뉴런에 인가하였다. 96 웰 전기 자극기를 맞춤-발전(custom-developed)시켜 뉴런을 포함하는 웰에 시간-변화 전기장을 발생시켰다. 시냅스 소포 순환을 유발시키는 전극 디자인의 능력을 검출 장치로 측정하였으며, 이 장치는 상기한 바와 같은 제이스 액시오버트 Z1 역형광 현미경 또는 플레이트::비젼 플레이트 판독기였다.
맞춤-발전형 96 웰 전기 자극기
본 실시예에서, 맞춤 전극쌍을 이용하여 시냅스 소포 순환을 자극시켰다. 맞춤 전극쌍은 외경이 약 6 mm인 외부 플래티늄 고리 전극을 가지며, 이는 96 웰 플레이트의 웰에 들어맞는다. 웰의 중앙에는 1 mm 직경의 금선이 배치되어 있다 (도 6C). 금중심선은 캐쏘드로 작동하고, 외부 플래티늄 고리는 애노드로 작용하며, 이들은 플라스틱 장치에 의해 유지된다. 전극을 96-웰 플레이트의 웰에 위치시켜 자극 절연체에 연결시키고, 이를 펄스 발생기와 연결시켰다. 96 웰을 동시에 자극시키기 위해서, 상기 전극쌍 96개를 8X12 어레이에 연결시켰다.
다중-웰 플레이트 전기천공 시스템의 맞춤 변형
CellAxessHT (스웨덴 고텐부르크 소재의 셀렉트리콘 아베(Cellectricon AB)로부터 입수가능)는 384 플레이트에서 siRNA를 세포로 전달하도록 고안된 하이-쓰루풋(high-throughput) 전기천공기이다. 이는 384 웰 플레이트의 웰에 들어맞도록 고안된 개별 전극쌍을 갖는 96 웰 전기천공 헤드를 갖는다. 본 실시예에서 시냅스 소포 순환 검정의 자극 성분으로 작동하기 위해, 상기 시스템의 전극을 변형시키고/시키거나 최적화시켜 96-웰 플레이트의 웰의 전기장 전위 범위를 극대화시켰다.
실시예
5. 맞춤형
셀렉트리콘
CX3
전극 시스템
본 실시예에서, 활동 전위 흥분(firing)의 자극은 시판되고 있는 변형 전기천공 시스템으로 증명하였다. 실험을 위해 맞춤-변형된 CellAxess CX3 전기천공 시스템 (셀렉트리콘 아베로부터 입수가능)을 얻었다. 이 시스템은 96-웰 플레이트의 3개의 웰 내에서 3개의 개별 뉴런 세포 배양물을 실질적으로 동시에 전기적 자극시킬 수 있는 3쌍의 전극을 제공한다. 전극의 여기 영역 내에서 실질적으로 균일한 전기장 및/또는 전류 밀도를 제공하기 위해서 기기의 전극을 변형시켰다. 추가로, 전극을 올리는데 사용되는 플라스틱 성분은 데이타 수득 동안 백그라운드 형광을 최소화하는 저-형광 물질을 포함하도록 변형시켰다.
96-웰 플레이트에서 배양한 뉴런 세포의 활동 전위를 유도하는 능력에 대해 맞춤형 CX3을 시험하였다. 본 실시예에서, 뉴런을 플루오-4 Ca++ 지시약과 함께 로딩하고, CX3 시스템을 이용하여 자극시켰다. 전기 자극을 20 Hz에서 10초 동안 행하는 한편, 10X, 0.3 개구수 대물 렌즈가 장착된 제이스 액시오버트 Z1을 이용하여 저속 촬영한 영상을 수득하였다. 자극 전압을 약 2 볼트와 약 100 볼트 사이에서 바꾸었다. 특정 실험 조건을 도 16A에 나타내었다. 하선은 다수의 뉴런 세포를 포함하는 웰 영역의 액시오버트 Z1의 영상화 지속 시간을 나타낸다. 영상화 기간은 약 1분이었다. 블록은 여기 기간을 나타낸다.
전기 자극을 10 V에서 수행한 경우, 전기장 자극으로 인한 Ca++ 유입에서의 큰 증가가 뉴런 세포의 획득 영상에서 관찰되었다. 도 16B는 Ca++ 유입에서의 증가를 보고한다. t=0초에서 획득한 영상은 전기 자극의 적용 전 뉴런 세포로부터의 기준선 형광 방출을 나타낸다. t=15초에서 획득한 영상은 여기 기간 말의 증가된 형광 방출을 나타낸다. 증가된 형광 방출은 뉴런 내 Ca++ 유입에서의 증가로부터 기인한 것이며, 활동 전위 발화를 가리킨다.
그 다음, 뉴런 세포를 포함하는 웰 내 동력학적 형광 거동을 연구하기 위해 일정 범위의 전압 값에 걸쳐 몇몇 시험을 수행하였다. 상이한 여기 전압에 대해 기록된 상대적인 Fluo-4 신호의 자취를 도 16C에 시간의 함수로서 플로팅하였다. 결과는 5 볼트 내지 약 25 볼트 사이의 광범위한 여기 전압의 존재를 나타내는데, 이는 강력한 Ca++ 유입을 개시하였으며, 이어서 전기 자극의 종결 후에 기준선으로 복귀되었다. 약 50 볼트 초과의 보다 높은 전압에서는, Ca++ 신호가 기준선으로 복귀되지 않았는데, 이는 이들 높은 전압에서의 독성을 가리킨다.
전기-자극 뉴런 세포의 추가적인 생체역학 시험에서는, TTX를 몇몇 웰 시스템에 첨가한 다음, 도 16C에 보고된 동일한 전기 자극을 가하였다. 이 시험에 대한 결과는 도 16D에 나타냈다. 전압-개폐성 나트륨 채널 차단제인 TTX의 첨가는 낮은 전압에서 뉴런 반응을 차단하였고, 이는 이들 주파수에서의 Ca++ 유동이 CX3 전극 자극에 의한 활동 전위의 생성으로 인한 것임을 가리킨다.
맞춤형 CX3 전극 시스템을 96-웰 플레이트에서 뉴런 내 시냅스 소포 순환을 유도하는 그의 능력에 대해 시험하였다. 뉴런을 시냅토플루오린을 발현하는 아데노-연관 바이러스로 감염시켰다. 세포를 약 30 Hz 및 약 10 볼트에서 CX3 전극 시스템으로 자극하면서, 40X, 0.6 개구수 공기 대물 렌즈를 사용하는 자이스 액시오버트(Zeiss Axiovert) Z1으로 저속 영상을 얻었다. 특정 실험 조건은 도 17A에 보고되어 있다. 영상화 기간은 약 120초였고, 전기 자극 기간은 약 10초였다. 도 17B에 나타낸 바와 같이, 형광에서의 증가에 이은 기준선으로의 복귀가 개별 시냅스에 대해 관찰되었다. 피크 형광은 전기 자극 기간 말 근처에서 발생하였고, 그 후 형광 신호는 기준선 근처로 복귀되었다. 도 17C는 도 17B에 도시된 시냅스의 농도계 측정값을 나타내며, 시냅스에 대한 동력학적 형광 거동을 보고한다. 이들 데이터는 CX3 전극이 뉴런 시냅스 96-웰 플레이트에서 시냅스 소포 순환을 유도할 수 있음을 나타낸다.
실시예
6. 기술 통합
선택된 자극 및 검출 시스템을 단일 시냅스 소포 스크리닝 시스템으로 통합시킬 수 있다. 예를 들어, 시냅스 소포 순환을 96개의 웰 내에서 동시에 측정하기 위한 시스템을 개발하였다. 96-웰 플레이트 내 1차 뉴런을 시험관내 12일째에 시냅토파이신-플루오린-발현 아데노-연관 바이러스로 감염시켰다. 시험관내 21일째에, 배양 배지를 검정 완충제로 교체하고, 전극을 웰 내에 위치시켰다. 시간-변동 전기장을 뉴런 세포에 10 V/10 Hz에서 30초 동안 적용하였다. 이 시간 동안, 형광, 예를 들어 시냅토플루오린에 의해 생성된 형광을 검출 장치에 의해 기록하였다.
이 특정한 실시예에서, 본 발명자들은 플레이트::비젼 플레이트 판독기, 맞춤형 셀렉트리콘 CX3 전극 및 시냅토파이신-플루오린 리포터가 성공적으로 통합될 수 있음을 증명하였다. 96-웰 플레이트 내 래트 1차 대뇌피질 뉴런을 7DIV에서 시냅토파이신-플루오린 AAV (MOI 2000)로 감염시켰다. 30DIV에서, 배양물을 플레이트::비젼 플레이트 판독기 상에 로딩하고, 셀렉트리콘 CX3 맞춤 전극을 이들 웰 중 2개 내에 위치시켰다. 동력학적 형광 판독을 2초/영상에서 20분 동안 수행하고, 뉴런을 30 Hz, 20 V 펄스 트레인으로 10초 동안 자극하였다. 이 자극을 5분 간격으로 3회 적용하였다 (적색 화살표). 도 18은 이들 웰로부터의 결과를 나타낸다. 형광에서의 변화 (dF)를 각 웰 내 피크 형광 판독값으로 표준화하였다. 이들 데이터는 뉴런을 맞춤형 셀렉트리콘 전극으로 자극하였을 때 시냅토파이신-플루오린 리포터를 사용하여 플레이트::비젼 플레이트 판독기로 시냅스 소포 순환을 측정할 수 있음을 나타낸다.
본 발명자들은 상기 시스템이 다양한 수의 자극된 활동 전위에 대한 시냅토파이신-플루오린 반응을 성공적으로 검출할 수 있음을 추가로 확립하였다. 상기한 바와 같이, 래트 1차 대뇌피질 뉴런을 96-웰 플레이트 내에서 배양하고, 7DIV에서 시냅토파이신-플루오린 AAV (MOI 2000)로 감염시켰다. 30DIV에서, 배양물을 플레이트::비젼 플레이트 판독기 상에 로딩하고, 셀렉트리콘 CX3 맞춤 전극을 이들 웰 중 2개 내에 위치시켰다. 동력학적 형광 판독을 2초/영상에서 20분 동안 수행하고, 뉴런을 50개 (화살표 1), 100개 (화살표 2), 200개 (화살표 3) 또는 300개 (화살표 4) 자극을 위한 30 Hz, 20 V 펄스 트레인으로 자극하였다 (도 19 참조). 형광에서의 변화 (dF)를 각 웰 내 피크 형광 판독값으로 표준화하였다. 이들 데이터는 플레이트::비젼 플레이트 판독기의 감도 및 적은 수의 활동 전위를 측정하는 그의 수용력을 나타낸다. 자극 트레인 동안의 플레이트::비젼 시스템의 높은 신호 대 잡음비 및 활동 전위 반응의 가중으로 인하여, 플레이트::비젼이 10 Hz 또는 그 이하에서 전달되는 50개 또는 그보다 적은 활동 전위에 대한 시냅토파이신-플루오린 반응을 검출할 수 있는 것으로 여겨졌다.
실시예
7. 시냅스 소포 순환의 다양한 매개변수 측정
시냅스 소포 순환의 다양한 매개변수를 자극 패턴을 변경시킴으로써 측정하였다. 예시적인 매개변수 및 자극 실례를 하기 표 1에 제공하였다.
| 시기 | 매개변수 | 자극 | 지속기간 | 플루오린 측정 |
| 세포외유출 | 방출 가능성 방출 트레인 도킹된 소포 풀 크기 |
.05 Hz >10 Hz 100 Hz 30 Hz |
>10 AP >10 AP 1초 20초 |
소포 방출의 존재 상승기 상승기 정상 상태 수준 |
| 내분비작용 | 비-포화 포화 정상 상태 |
10 Hz 10 Hz 10 Hz |
<10초 >10초 >30초 |
하강기 하강기 정상 상태 수준 |
| 재순환 | 재순환 | 10 Hz | 200 AP 1분 후 재자극 |
제1 반응과 비교한 반응 크기 |
AP: 활동 전위
비-포화는 소포 내재화 부위가 비-제한적인 경우의 내분비작용을 가리킨다.
포화는 소포 내재화 부위가 제한적인 경우의 내분비작용을 가리킨다.
용어 "상승기", "정상 상태 수준" 및 "하강기"는 본원에서 당업자에 의해 이해되는 바와 같은 의미로 사용된다.
실시예
8. 고-함량 스크리닝 시스템
대안적인 영상화 시스템인 BD 패쓰웨이 고 함량 영상화 시스템을 사용하여 고-함량 스크리닝 시스템을 개발하였다. 이러한 고-함량 스크리닝 시스템은 전형적으로 맞춤-제작되거나, 예를 들어, 미국 뉴저지주 프랭클린 레이크스 소재 벡턴 디킨슨(Becton Dickinson)의 패쓰웨이(Pathway); 미국 캘리포니아주 유니언 시티 소재 몰레큘러 디바이시즈(Molecular Devices)의 이미지엑스프레스 마이크로(ImageXpress MICRO); 미국 매사추세츠주 월섬 소재 퍼킨 엘머(Perkin Elmer)의 오페라(Opera); 또는 미국 매사추세츠주 월섬 소재 써모 피셔 사이언티픽(Thermo Fisher Scientific)의 어레이스캔(ArrayScan)으로부터 상업적으로 이용가능하다. 이들 시스템은 동력학적 검정 동안, 높은 광학 감도를 가지며 고 해상도의 저속 영상 스택을 생성시킨다. 결과적으로, 데이터는 단일 시냅스 해상도 및 높은 신호 대 잡음비를 가진다. 그러나, 이들 시스템은 전형적으로 오직 다중 웰 플레이트의 개별 웰을 순차적으로 기록한다. 그러므로, 시냅스 소포 순환을 영상화하는 데 전형적으로 약 2분이 소요되기 때문에, 96-웰 플레이트의 모든 웰을 영상화하는 데는 약 2 내지 3시간이 소요된다. 따라서, 고-함량 스크리닝 시스템은 전형적으로 시간당 약 20개 이상 (예를 들어, 25, 30, 35, 40, 45 또는 50개)의 시냅스 소포 순환 검정을 측정할 수 있다.
고-함량 플레이트 판독기를 단일 웰 내에서 뉴런 내 활동 전위를 개시하는 전기 자극 시스템과 통합하면서, 시냅스 소포 순환을 그 웰 내에서 플레이트 판독기에 의해 모니터링하였다. 시냅스 소포 순환 검정이 인간의 개입 없이 전체 플레이트 상에서 수행될 수 있도록 시스템을 자동화하였다. 또한, 플레이트-핸들링 로봇을 사용하여 단일 기계 상에서 연속된 다중 플레이트의 처리를 자동화하였다. 예시적인 고-함량 스크리닝 시스템을 도 20에 도시하였다.
고 함량 영상화 시스템을 사용하여 시냅스 소포 순환을 측정하였다. 결과는 도 26에 나타냈다. 래트 태아 대뇌피질 뉴런을 그레이너 유클리어(Greiner uClear) 96-웰 플레이트 내에 플레이팅하고, 7DIV에서 sypHy-AAV로 감염시켰다. 25DIV에서, 매질을 검정 완충제로 교체하고, 플레이트를 BD 패쓰웨이 고-함량 영상화 시스템 상에 로딩하였다. 셀렉트리콘 CX3 전극을 3개의 웰 내에 위치시켰다. 뉴런을 패쓰웨이 상에 1 Hz에서 영상화하고, CX3 전극을 사용하여 1 msec 펄스로 30 Hz에서 10초 동안 자극하였다. 일련의 영상 시간을 판독 기간 동안 형광에서의 변화에 대하여 분석하였다. 고 함량 영상화 시스템으로 셀렉트리콘 전극 시스템에 의해 자극된 시냅스 소포 순환을 측정할 수 있었다.
실시예
9: 시냅스이전
HTS
플랫폼 시스템 (
PHTSP
).
시냅스이전 HTS 플랫폼 시스템이 구성되었고 (도 21), 상기 시스템을 사용하여 96 평행 시냅스이전 검정을 수행하였다.
래트 배아 전뇌 뉴런을 그레이너(Greiner) mClear 96-웰 플레이트에 플레이팅(plating)하고, 7DIV에서 hSyn-SypHy 아데노-관련 바이러스에 감염시켰다. 25DIV에서, 뉴런 플레이트로부터의 세포 배양 배지를 플루오린 검정 완충제로 대체하고, 플레이트를 플랫폼 위에 적재하였다. 플레이트를 플레이트::비젼 플레이트 판독기에서 1 Hz로 이미징하고, 맞춤된 CellAxessHT 전극을 사용하여 15V, 185 ms 펄스로 30 Hz에서 10초간 자극하였다. 시냅스 소포 순환을 모든 웰에서 동시에 측정하였다. 도 22는 모든 웰의 결과를 도시하며, 이때 트레이스는 그들의 피크 반응에 대해 정규화되었다. 두개의 이상부는 검정 완충제와의 적절한 전기 접촉을 위한 상기 웰 내에서의 전극의 이상 때문인 것으로 보인다. 이들 데이터는 시냅스이전 HTS 플랫폼이 96-웰 플레이트의 모든 웰에서 동시에 시냅스 소포 순환을 측정할 수 있음을 나타낸다.
시냅스이전 HTS 플랫폼 전기 자극 시스템의 균일성 분석을 수행하였다. 래트 배아 전뇌 뉴런을 그레이너 mClear 96-웰 플레이트에 플레이팅하고, 7DIV에서 hSyn-SypHy 아데노-관련 바이러스에 감염시켰다. 25DIV에서, 뉴런 플레이트로부터의 세포 배양 배지를 플루오린 검정 완충제로 대체하고, 플레이트를 플랫폼 위에 적재하였다. 플레이트를 플레이트::비젼 플레이트 판독기에서 1 Hz로 이미징하고, 맞춤된 CellAxessHT 전극을 사용하여, 전압을 0 V에서 32V로 증가시키면서 185 ms 펄스로 30 Hz에서 10초간 자극하였다. 결과는 도 23에 나타낸다.
시냅스이전 HTS 플랫폼의 민감성 분석을 수행하였다. 래트 배아 전뇌 뉴런을 그레이너 mClear 96-웰 플레이트에 플레이팅하고, 7DIV에서 hSyn-SypHy 아데노-관련 바이러스에 감염시켰다. 25DIV에서, 뉴런 플레이트로부터의 세포 배양 배지를 플루오린 검정 완충제로 대체하고, 플레이트를 플랫폼 위에 적재하였다. 플레이트를 플레이트::비젼 플레이트 판독기에서 1 Hz로 이미징하고, 맞춤된 CellAxessHT 전극을 사용하여 주파수를 1 Hz에서 40 Hz로 증가시키면서 15V, 185 ms 펄스로 10초간 자극하였다 (편향 해치 충전 바(slanted hatch filled bar)). 이들 조건하에서, 시냅스이전 HTS 플랫폼은 시냅스 소포 순환 반응을, 10초간 (2 Hz) 전달된 20 작용 전위만을 측정할 수 있다. (도 24).
시냅스이전 HTS 플랫폼을 사용하여 시냅스 소포 순환에서의 화합물-유도된 변화를 검출하였다. 래트 배아 전뇌 뉴런을 그레이너 mClear 96-웰 플레이트에 플레이팅하고, 7DIV에서 hSyn-SypHy 아데노-관련 바이러스에 감염시켰다. 25DIV에서, 뉴런 플레이트로부터의 세포 배양 배지를 플루오린 검정 완충제로 대체하고, 칼시뉴린 억제제 시클로스포린 A (CsA; 20 μM)를 교호 컬럼에 가하였다. 엣지 웰은 이 실험에서는 기피되었다. 플레이트를 플랫폼 위에 적재하고, 플레이트::비젼 플레이트 판독기에서 1 Hz로 이미징하고, 맞춤된 CellAxessHT 전극을 사용하여 15V, 185 ms 펄스로 30 Hz에서 10초간 자극하였다. 시냅스 소포 순환 파형을 수집하고, 자극 후 시냅스 소포의 재내재화 동안의 시간 상수 (t)를 각 웰에 대해 계산하였다. 칼시뉴린 억제 후의 재내재화 속도가 상당히 줄어들었다 (대조 = 36 ± 0.5초, n = 28; CsA = 42 ± 0.5초, n = 29; p < 0.0001). 도 25에 도시된 이들 데이터는 플랫폼이 시냅스 소포 순환의 동역학에서 화합물-유도된 변동을 검출할 수 있음을 나타낸다.
실시예
10: 플레이트 판독기 기반 검출 시스템
플루오로스캔 어센트(Fluoroskan Ascent) FL 플레이트 판독기가 시냅토파이신-플루오린 리포터 발현 뉴런 세포에서 시냅스 소포 순환의 측면, 예를 들어 세포외유출을 측정할 수 있음이 밝혀졌다. 래트 배아 피질 뉴런을 그레이너 uClear 96-웰 플레이트에 배양하였다. 7DIV에서, 배양물을 sypHy-AAV에 감염시켰다. 33DIV에서, 배양 배지를 검정 완충제로 대체하고, 플레이트를 플루오로스캔 어센트 FL 플레이트 판독기 위에 적재하고, GFP-형광을 5 Hz에서 기록하였다. 이 플레이트 판독기는 광전자증배관 (PMT)을 사용하여 단일 웰에서의 형광 수준을 따로따로 측정한다. 바탕선 형광 수준을 결정하고, 이오노마이신 (10 uM)을 가하여 시냅스 소포 세포외유출을 유도하고, 그로 인한 형광의 변화를 플레이트 판독기로 측정하였다. 이오노마이신은 형광 강도면에서 약 15% 증가하였으며, 이는 그의 PMT 광학기기를 갖는 플루오로스캔 어센트 FL이 sypHy 리포터를 사용하여 시냅스 소포 순환을 측정할 수 있음을 나타낸다. (도 27)
등가물 및 범위
당업자는 통상적인 실험만을 사용하여 본원에 기재된 구체적인 실시양태에 대한 다수의 등가물을 인지하거나, 확인할 수 있을 것이다. 본 발명의 범위는 상기 상세한 설명의 기재로 한정되고자 하는 것이 아니며, 오히려 첨부된 청구항에 기재된 바와 같다.
당업자는 통상적인 실험만을 사용하여 본원에 기재된 본 발명에 따른 구체적인 실시양태에 대한 다수의 등가물을 인지하거나, 확인할 수 있을 것이다. 본 발명의 범위는 상기 상세한 설명의 기재로 한정되고자 하는 것이 아니며, 오히려 첨부된 청구항에 기재된 바와 같다.
청구항에 있어서, 반대로 언급되거나 본문으로부터 명백하지 않는 한, 단수형은 하나 또는 하나 초과를 의미할 수 있다. 군 중 하나 이상의 구성원 사이에서 "또는"을 포함하는 청구항 또는 기재는 반대로 언급되거나 본문으로부터 명백하지 않는 한, 군의 구성원 중 하나, 하나 초과, 또는 모두가 주어진 생성물 또는 공정에 존재하거나, 그에 사용되거나, 다르게는 관련이 있다면 만족되는 것으로 간주된다. 본 발명은 군 중 정확히 하나의 구성원이 주어진 생성물 또는 공정에 존재하거나, 그에 사용되거나, 다르게는 관련이 있는 실시양태를 포함한다. 본 발명은 군의 구성원 중 하나 초과, 또는 모두가 주어진 생성물 또는 공정에 존재하거나, 그에 사용되거나, 다르게는 관련이 있는 실시양태를 포함한다. 게다가, 본 발명은 나열된 하나 이상의 청구항으로부터의 하나 이상의 제한사항, 요소, 구절, 표현 용어 등을 또다른 청구항에 도입한 모든 변경물, 조합물 및 치환물을 포함함이 이해된다. 예를 들어, 또다른 청구항에 종속된 임의의 청구항은 동일한 기본 청구항에 종속된 임의의 다른 청구항에서 발견되는 하나 이상의 제한사항을 포함하도록 변형될 수 있다. 게다가, 청구항이 조성물을 언급하는 경우, 달리 언급되지 않거나 당업자가 반대하거나 모순을 제기할 것이 명백하지 않는 한, 본원에 개시된 임의의 목적을 위해 조성물을 사용하는 방법이 포함되고, 본원에 개시된 임의의 제조 방법 또는 당업계에 공지된 다른 방법에 따라 조성물을 제조하는 방법이 포함된다고 이해된다.
요소가 리스트, 예를 들어 마쿠쉬 군 포맷으로 존재하는 경우, 요소의 각 하위군 또한 개시되고, 임의의 요소(들)이 군으로부터 제거될 수 있음이 이해된다. 일반적으로, 본 발명, 또는 본 발명의 측면은 특정한 요소, 특징 등을 포함하는 것으로 언급되며, 본 발명의 특정 실시양태 또는 본 발명의 측면은 이러한 요소, 특징 등으로 이루어지거나, 이들로 본질적으로 이루어짐이 이해되어야 한다. 간단히 표현하기 위해, 이들 실시양태는 본원의 표현으로 구체적으로 언급되지는 않았다. 용어 "포함하다"는 개방형으로 의도되며, 추가의 요소 또는 단계가 포함될 수 있는 것도 주목된다.
범위가 주어질 경우, 종점이 포함된다. 게다가, 달리 언급되지 않거나 문맥 및 당업자의 이해로부터 명백한 한, 범위로 표현된 값은 본 발명의 여러 실시양태에서 언급된 범위 내의 임의의 구체적인 값 또는 하위 범위를, 명백히 달리 언급되지 않는 한 상기 범위의 하한의 단위의 1/10까지 가정할 수 있음이 이해된다.
또한, 종래 기술의 범위에 들어가는 본 발명의 임의의 특정 실시양태는 하나 이상의 임의의 청구항으로부터 명시적으로 제외될 수 있음이 이해된다. 이러한 실시양태는 당업자에게 공지되어 있을 것으로 여겨지므로, 이들은 본원에 명시적으로 제외된다고 기재되어 있지 않더라도 제외될 수 있다. 본 발명의 조성물의 임의의 특정 실시양태 (예를 들어, 임의의 세포형; 임의의 뉴런 세포; 시냅스 소포 순환의 임의의 리포터; 임의의 전기 자극 시스템; 임의의 영상화 시스템; 임의의 시냅스 소포 순환 검정; 임의의 시냅스 소포 순환 조절제; 임의의 사용 방법 등)는 종래 기술의 존재와 관련이 있든 없든 임의의 이유로 임의의 하나 이상의 청구항으로부터 제외될 수 있다.
SEQUENCE LISTING
<110> Galenea Corp.
Gerber, David J.
Cottrell, Jeffrey R.
Timothy, Ryan A.
Jonathan, Levenson M.
<120> Synaptic Vesicle Cycling Assays and Systems
<130> G0816.70002
<150> US 61/094,361
<151> 2008-09-04
<160> 5
<170> PatentIn version 3.5
<210> 1
<211> 238
<212> PRT
<213> Artificial Sequence
<220>
<223> Recombinant Protein
<400> 1
Met Ser Lys Gly Glu Glu Leu Phe Thr Gly Val Val Pro Ile Leu Val
1 5 10 15
Glu Leu Asp Gly Asp Val Asn Gly His Lys Phe Ser Val Ser Gly Glu
20 25 30
Gly Glu Gly Asp Ala Thr Tyr Gly Lys Leu Thr Leu Lys Phe Ile Cys
35 40 45
Thr Thr Gly Lys Leu Pro Val Pro Trp Pro Thr Leu Val Thr Thr Leu
50 55 60
Thr Tyr Gly Val Gln Cys Phe Ser Arg Tyr Pro Asp His Met Lys Arg
65 70 75 80
His Asp Phe Phe Lys Ser Ala Met Pro Glu Gly Tyr Val Gln Glu Arg
85 90 95
Thr Ile Phe Phe Lys Asp Asp Gly Asn Tyr Lys Thr Arg Ala Glu Val
100 105 110
Lys Phe Glu Gly Asp Thr Leu Val Asn Arg Ile Glu Leu Lys Gly Ile
115 120 125
Asp Phe Lys Glu Asp Gly Asn Ile Leu Gly His Lys Leu Glu Tyr Asn
130 135 140
Tyr Asn Asp His Gln Val Tyr Ile Met Ala Asp Lys Gln Lys Asn Gly
145 150 155 160
Ile Lys Ala Asn Phe Lys Ile Arg His Asn Ile Glu Asp Gly Gly Val
165 170 175
Gln Leu Ala Asp His Tyr Gln Gln Asn Thr Pro Ile Gly Asp Gly Pro
180 185 190
Val Leu Leu Pro Asp Asn His Tyr Leu Phe Thr Thr Ser Thr Leu Ser
195 200 205
Lys Asp Pro Asn Glu Lys Arg Asp His Met Val Leu Leu Glu Phe Val
210 215 220
Thr Ala Ala Gly Ile Thr His Gly Met Asp Glu Leu Tyr Lys
225 230 235
<210> 2
<211> 1665
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic polynucleotide
<220>
<221> synaptophysin (rat)
<222> (1)..(555)
<220>
<221> Super ecliptic pHluorin
<222> (556)..(1269)
<220>
<221> synaptophysin (rat)
<222> (1270)..(1665)
<400> 2
atggacgtgg tgaatcagct ggtggctggg ggtcagttcc gggtggtcaa ggagcccctt 60
ggcttcgtga aggtgctgca gtgggtcttt gccatcttcg cctttgctac gtgtggcagc 120
tacaccgggg agcttcggct gagcgtggag tgtgccaaca agacggagag tgccctcaac 180
atcgaagttg aattcgagta ccccttcagg ctgcaccaag tgtactttga tgcaccctcc 240
tgcgtcaaag ggggcactac caagatcttc ctggttgggg actactcctc gtcggctgaa 300
ttctttgtca ccgtggctgt gtttgccttc ctctactcca tgggggccct ggccacctac 360
atcttcctgc agaacaagta ccgagagaac aacaaagggc ctatgatgga ctttctggct 420
acagccgtgt tcgctttcat gtggctagtt agttcatcag cctgggccaa aggcctgtcc 480
gatgtgaaga tggccacgga cccagagaac attatcaagg agatgcccat gtgccgccag 540
acagggaaca ccggtatgag taaaggagaa gaacttttca ctggagttgt cccaattctt 600
gttgaattag atggtgatgt taatgggcac aaattttctg tcagtggaga gggtgaaggt 660
gatgcaacat acggaaaact tacccttaaa tttatttgca ctactggaaa actacctgtt 720
ccatggccaa cacttgtcac tactttaact tatggtgttc aatgcttttc aagataccca 780
gatcatatga aacggcatga ctttttcaag agtgccatgc ccgaaggtta tgtacaggaa 840
agaactatat ttttcaaaga tgacgggaac tacaagacac gtgctgaagt caagtttgaa 900
ggtgataccc ttgttaatag aatcgagtta aaaggtattg attttaaaga agatggaaac 960
attcttggac acaaattgga atacaactat aacgatcacc aggtgtacat catggcagac 1020
aaacaaaaga atggaatcaa agctaacttc aaaattagac acaacattga agatggaggc 1080
gttcaactag cagaccatta tcaacaaaat actccaattg gcgatgggcc cgtcctttta 1140
ccagacaacc attacctgtt tacaacttct actctttcga aagatcccaa cgaaaagaga 1200
gaccacatgg tccttcttga gtttgtaaca gctgctggga ttacacatgg catggatgaa 1260
ctatacaaaa ccggtcgcca gacagggaac acatgcaagg aactgaggga ccctgtgact 1320
tcaggactca acacctcagt ggtgtttggc ttcctgaacc tggtgctctg ggttggcaac 1380
ttatggttcg tgttcaagga gacaggctgg gcagccccat tcatgcgcgc acctccaggc 1440
gccccggaaa agcaaccagc acctggcgat gcctacggcg atgcgggcta cgggcagggc 1500
cccggaggct atgggcccca agactcctac gggcctcagg gtggttatca acccgattac 1560
gggcagccag ccagcggtgg cggtggctac gggcctcagg gcgactatgg gcagcaaggc 1620
tatggccaac agggtgcgcc cacctccttc tccaatcaga tgtaa 1665
<210> 3
<211> 2472
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic polynucleotide
<400> 3
atggagttca gacaggagga gttccgaaaa cttgcaggcc gagcactggg tcgactgcat 60
cgcttgctgg agaagcggca ggagggagca gaaacactgg agctcagcgc tgacggccgg 120
cccgtcacaa cccacactag agacccacct gtggtagact gtacctgctt tggcctgcct 180
agaaggtata tcattgcaat catgtctggg cttggcttct gcatcagttt tggaattaga 240
tgtaacctgg gggttgcgat tgtgagtatg gtcaataact caacgacaca cagaggaagc 300
acctccggtg gatccggggg gactggggga agcatgtcca aaggcgaaga actgtttaca 360
ggcgtggtgc caatactcgt ggaactcgac ggcgatgtta acggacataa gttttccgtg 420
tccggcgagg gtgagggaga tgctacatat ggaaaactga ctctgaaatt tatttgtacc 480
accgggaaac tgcccgtgcc atggcctacc ctcgtcacta cactgacgta tggggttcaa 540
tgtttcagta ggtatccgga ccacatgaaa agacacgatt tcttcaaaag cgcaatgccc 600
gaaggctacg tacaagaacg cactatattc ttcaaggacg acggcaacta taaaacccgc 660
gcagaggtta aatttgaggg ggacacactg gtaaatcgga tcgagctgaa gggtatcgac 720
tttaaagaag acggaaacat attgggccat aagctggaat acaactataa tgatcatcag 780
gtgtatatca tggccgataa gcagaaaaat ggaatcaagg caaacttcaa aattaggcac 840
aatattgagg atgggggcgt ccagctggcc gaccattacc agcagaatac tccaataggc 900
gatggaccgg tgttgcttcc tgataatcac tacttgttta ccactagcac cctcagtaag 960
gatcccaatg agaagcggga ccacatggtc ctgctggagt tcgtgactgc cgctggcata 1020
actcatggga tggatgagct ctacaaagga gggacagggg gtaccggtgg tagtggtgga 1080
accggcggcc atgtagtggt gcagaaggcc cagttcaatt gggacccaga gacagtgggc 1140
ttgatccacg gctctttctt ttggggttat atcgttactc aaatcccagg cggtttcatt 1200
tgtcagaagt tcgccgccaa cagagtgttc ggcttcgcaa tagtagccac ctccacactg 1260
aacatgctga ttccgtctgc agcccgagtg cactatggct gtgtgatatt cgtgagaatc 1320
ctgcaaggtc ttgtcgaggg cgtgacctac ccagcctgtc acgggatctg gtccaaatgg 1380
gctccaccac tggagcgatc cagactggcg accactgcat tctgtggcag ttacgccggc 1440
gctgtcgtgg ctatgcccct ggctggtgtg ctggtgcagt acagcggatg gagcagcgtg 1500
ttctacgttt atggctcttt cgggatcttt tggtacctct tctggctgct cgtcagctac 1560
gaatcccccg ctctgcaccc ttccatcagc gaggaggagc ggaaatacat tgaagacgca 1620
atcggtgaat cagcaaagct gatgaacccc gtgacgaaat tcaatacacc gtggagacgg 1680
ttttttacct ccatgcccgt gtacgcgata attgttgcaa atttctgccg gagctggaca 1740
ttctatctcc tcctgattag ccaacctgcc tacttcgaag aggtcttcgg gttcgagatc 1800
tctaaagtgg gtcttgtgtc tgcgctccct cacctcgtta tgaccattat tgttcctatc 1860
ggcgggcaga tcgctgattt tcttcggtca agacatatta tgtccactac taatgtgagg 1920
aagctgatga attgcggtgg gtttggcatg gaggcgaccc tgcttctggt ggtgggttac 1980
tctcattcca agggagtggc gatcagtttc ctggtcctgg ccgtgggatt tagcggcttt 2040
gccataagcg gttttaacgt taatcacctt gatattgctc cccgctacgc atccattctc 2100
atggggatca gcaacggagt cgggactctg agtggaatgg tttgcccaat aatagtcgga 2160
gcgatgacta aacataagac ccgagaagaa tggcagtacg tgttcctgat tgctagtctg 2220
gtccattacg gaggcgtcat cttctatggc gtcttcgcct ctggggaaaa acaaccatgg 2280
gcagagcctg aagaaatgtc cgaggaaaaa tgtgggttcg tcgggcacga tcagcttgcc 2340
ggttctgatg agtccgagat ggaggacgag gttgagcccc ctggggcgcc tcctgcaccg 2400
cccccaagct acggcgcaac ccatagcact gtgcagcctc ctcggccacc tcctccagtg 2460
cgggattact aa 2472
<210> 4
<211> 619
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic polynucleotide
<400> 4
actaatctcc ccgcgggcac tgcgtgtgac ctcacccccc tctgtgaggg ggttatttct 60
ctactttcgt gtctctgagt gtgcttccag tgcccccctc cccccaaaaa atgccttctg 120
agttgaatat caacactaca aaccgagtat ctgcagaggg ccctgcgtat gagtgcaagt 180
gggttttagg accaggatga ggcggggtgg gggtgcctac ctgacgaccg accccgaccc 240
actggacaag cacccaaccc ccattcccca aattgcgcat cccctatcag agagggggag 300
gggaaacagg atgcggcgag gcgcgtgcgc actgccagct tcagcaccgc ggacagtgcc 360
ttcgcccccg cctggcggcg cgcgccaccg ccgcctcagc actgaaggcg cgctgacgtc 420
actcgccggt cccccgcaaa ctccccttcc cggccacctt ggtcgcgtcc gcgccgccgc 480
cggcccagcc ggaccgcacc acgcgaggcg cgagataggg gggcacgggc gcgaccatct 540
gcgctgcggc gccggcgact cagcgctgcc tcagtctgcg gtgggcagcg gaggagtcgt 600
gtcgtgcctg agagcgcag 619
<210> 5
<211> 2326
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic polynucleotide
<220>
<221> human synapsin I promoter
<222> (1)..(619)
<220>
<221> UTR
<222> (620)..(661)
<220>
<221> synaptophysin (rat)
<222> (662)..(1216)
<220>
<221> Super ecliptic pHluorin
<222> (1217)..(1930)
<220>
<221> synaptophysin (rat)
<222> (1931)..(2326)
<400> 5
actaatctcc ccgcgggcac tgcgtgtgac ctcacccccc tctgtgaggg ggttatttct 60
ctactttcgt gtctctgagt gtgcttccag tgcccccctc cccccaaaaa atgccttctg 120
agttgaatat caacactaca aaccgagtat ctgcagaggg ccctgcgtat gagtgcaagt 180
gggttttagg accaggatga ggcggggtgg gggtgcctac ctgacgaccg accccgaccc 240
actggacaag cacccaaccc ccattcccca aattgcgcat cccctatcag agagggggag 300
gggaaacagg atgcggcgag gcgcgtgcgc actgccagct tcagcaccgc ggacagtgcc 360
ttcgcccccg cctggcggcg cgcgccaccg ccgcctcagc actgaaggcg cgctgacgtc 420
actcgccggt cccccgcaaa ctccccttcc cggccacctt ggtcgcgtcc gcgccgccgc 480
cggcccagcc ggaccgcacc acgcgaggcg cgagataggg gggcacgggc gcgaccatct 540
gcgctgcggc gccggcgact cagcgctgcc tcagtctgcg gtgggcagcg gaggagtcgt 600
gtcgtgcctg agagcgcagt cgagaattca agctgctagc aaggatccac cggtcgccac 660
catggacgtg gtgaatcagc tggtggctgg gggtcagttc cgggtggtca aggagcccct 720
tggcttcgtg aaggtgctgc agtgggtctt tgccatcttc gcctttgcta cgtgtggcag 780
ctacaccggg gagcttcggc tgagcgtgga gtgtgccaac aagacggaga gtgccctcaa 840
catcgaagtt gaattcgagt accccttcag gctgcaccaa gtgtactttg atgcaccctc 900
ctgcgtcaaa gggggcacta ccaagatctt cctggttggg gactactcct cgtcggctga 960
attctttgtc accgtggctg tgtttgcctt cctctactcc atgggggccc tggccaccta 1020
catcttcctg cagaacaagt accgagagaa caacaaaggg cctatgatgg actttctggc 1080
tacagccgtg ttcgctttca tgtggctagt tagttcatca gcctgggcca aaggcctgtc 1140
cgatgtgaag atggccacgg acccagagaa cattatcaag gagatgccca tgtgccgcca 1200
gacagggaac accggtatga gtaaaggaga agaacttttc actggagttg tcccaattct 1260
tgttgaatta gatggtgatg ttaatgggca caaattttct gtcagtggag agggtgaagg 1320
tgatgcaaca tacggaaaac ttacccttaa atttatttgc actactggaa aactacctgt 1380
tccatggcca acacttgtca ctactttaac ttatggtgtt caatgctttt caagataccc 1440
agatcatatg aaacggcatg actttttcaa gagtgccatg cccgaaggtt atgtacagga 1500
aagaactata tttttcaaag atgacgggaa ctacaagaca cgtgctgaag tcaagtttga 1560
aggtgatacc cttgttaata gaatcgagtt aaaaggtatt gattttaaag aagatggaaa 1620
cattcttgga cacaaattgg aatacaacta taacgatcac caggtgtaca tcatggcaga 1680
caaacaaaag aatggaatca aagctaactt caaaattaga cacaacattg aagatggagg 1740
cgttcaacta gcagaccatt atcaacaaaa tactccaatt ggcgatgggc ccgtcctttt 1800
accagacaac cattacctgt ttacaacttc tactctttcg aaagatccca acgaaaagag 1860
agaccacatg gtccttcttg agtttgtaac agctgctggg attacacatg gcatggatga 1920
actatacaaa accggtcgcc agacagggaa cacatgcaag gaactgaggg accctgtgac 1980
ttcaggactc aacacctcag tggtgtttgg cttcctgaac ctggtgctct gggttggcaa 2040
cttatggttc gtgttcaagg agacaggctg ggcagcccca ttcatgcgcg cacctccagg 2100
cgccccggaa aagcaaccag cacctggcga tgcctacggc gatgcgggct acgggcaggg 2160
ccccggaggc tatgggcccc aagactccta cgggcctcag ggtggttatc aacccgatta 2220
cgggcagcca gccagcggtg gcggtggcta cgggcctcag ggcgactatg ggcagcaagg 2280
ctatggccaa cagggtgcgc ccacctcctt ctccaatcag atgtaa 2326
Claims (226)
- a) 다수의 웰;
b) 다수의 전극쌍
(여기서, 각각의 전극쌍은
(i) 웰 내 배치를 위해서, 및
(ii) 웰 내 다수의 뉴런 세포에서 시냅스 소포 순환을 유도하는 전기장을 생성하도록
배열되고, 다수의 전극쌍은 다수의 웰 내 뉴런 세포에서 시냅스 소포 순환을 실질적으로 동시에 유도함); 및
c) 다수의 검출기를 포함하는 검출 시스템 (여기서, 각각의 검출기는 웰에 존재하는 뉴런 세포의 시냅스 소포 단백질에 부착된 리포터 분자로부터의 발광 신호를 검출하고, 발광 신호의 존재는 뉴런 세포에서의 시냅스 소포 순환의 양상을 나타냄)
을 포함하는, 시냅스 소포 순환의 양상을 분석하기 위한 플랫폼. - 제1항에 있어서, 다수의 웰이 다수의 뉴런 세포를 포함하는 것인 플랫폼.
- 제2항에 있어서, 웰 내 다수의 뉴런 세포가 10 내지 1,000,000개 뉴런 세포의 범위인 플랫폼.
- 제2항 또는 제3항에 있어서, 웰 내 다수의 뉴런 세포가 웰 기저부 1 mm2 당 1000 내지 4000개 세포의 범위인 플랫폼.
- 제2항 내지 제4항 중 어느 한 항에 있어서, 다수의 뉴런 세포가 2종 이상의 상이한 뉴런 세포 유형을 포함하는 것인 플랫폼.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 뉴런 세포가 일차 뉴런이고, 임의로 일차 뉴런이 래트 일차 뉴런인 플랫폼.
- 제2항 내지 제6항 중 어느 한 항에 있어서, 뉴런 세포가 글루타메이트성, GABA성, 도파민작용성, 아드레날린성, 세로토닌성 및 콜린성 뉴런 세포로 이루어진 군으로부터 선택되는 것인 플랫폼.
- 제1항 내지 제7항 중 어느 한 항에 있어서, 전극쌍의 각각의 전극이 실질적으로 곡선 표면을 갖는 것인 플랫폼.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 각각의 전극쌍의 전극이 실질적으로 동심 원통이고, 상기 동심 원통이 환상 절연 물질에 의해 분리되는 것인 플랫폼.
- 제1항 내지 제9항 중 어느 한 항에 있어서, 다수의 전극쌍 중 각각의 전극쌍을 다수의 웰 중 하나의 웰로 작동가능하게 위치시키는 전극 전달 시스템을 추가로 포함하는 플랫폼.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 다수의 전극에 작동가능하게 연결된 전력원을 추가로 포함하는 플랫폼.
- 제11항에 있어서, 전력원이 각각의 전극쌍을 가로질러 미리 결정된 전압을 가하는 것인 플랫폼.
- 제12항에 있어서, 전압이 1 V 내지 400 V의 범위인 플랫폼.
- 제12항에 있어서, 전압이 5 V 내지 20 V의 범위인 플랫폼.
- 제11항 내지 제14항 중 어느 한 항에 있어서, 전원 및 다수의 전극쌍에 작동가능하게 연결된 펼스 발생기를 추가로 포함하고, 여기서 펄스 발생기는 각각의 전극쌍을 가로질러 미리 결정된 전압 펄스를 가하는 것인 플랫폼.
- 제15항에 있어서, 펄스 발생기가 미리 결정된 시간 동안 미리 결정된 주파수에서 다수의 미리 결정된 전압 펄스를 가하는 것인 플랫폼.
- 제16항에 있어서, 미리 결정된 주파수가 0.2 Hz 내지 100 Hz의 범위인 플랫폼.
- 제16항 또는 제17항에 있어서, 미리 결정된 주파수가 10 Hz 내지 50 Hz의 범위인 플랫폼.
- 제16항 내지 제18항 중 어느 한 항에 있어서, 미리 결정된 시간이 2분 이하인 플랫폼.
- 제16항 내지 제19항 중 어느 한 항에 있어서, 미리 결정된 시간이 0.1 내지 20초의 범위인 플랫폼.
- 제16항 내지 제20항 중 어느 한 항에 있어서, 미리 결정된 시간이 5 내지 15초의 범위인 플랫폼.
- 제16항 내지 제21항 중 어느 한 항에 있어서, 각각의 펄스의 지속 기간이 10 msec 이하의 범위인 플랫폼.
- 제16항 내지 제22항 중 어느 한 항에 있어서, 각각의 펄스의 지속 기간이 0.1 msec 내지 2 msec의 범위인 플랫폼.
- 제16항 내지 제23항 중 어느 한 항에 있어서, 각각의 펄스의 개시 사이의 기간이 0.1 내지 5 msec의 범위인 플랫폼.
- 제16항 내지 제24항 중 어느 한 항에 있어서, 펄스의 수가 1 내지 1000의 범위인 플랫폼.
- 제16항 내지 제25항 중 어느 한 항에 있어서, 펄스 발생기에 작동가능하게 연결된 컴퓨터를 추가로 포함하고, 여기서 컴퓨터는 전압 펄스를 제어하는 것인 플랫폼.
- 제16항 내지 제26항 중 어느 한 항에 있어서, 각각의 검출기가 광학 센서를 포함하는 것인 플랫폼.
- 제1항 내지 제27항 중 어느 한 항에 있어서, 각각의 검출기가 웰로부터의 발광 신호를 수집하는 대물 렌즈를 포함하는 것인 플랫폼.
- 제28항에 있어서, 대물 렌즈가 0.2 mm 내지 5 mm의 범위의 필드 영역으로부터 발광 신호를 수집하는 것인 플랫폼.
- 제28항 또는 제29항에 있어서, 대물 렌즈가 0.4 내지 1.4의 범위의 개구수를 갖는 것인 플랫폼.
- 제28항 내지 제30항 중 어느 한 항에 있어서, 대물 렌즈가 0.5의 개구수를 갖는 것인 플랫폼.
- 제28항 내지 제30항 중 어느 한 항에 있어서, 대물 렌즈가 유침 또는 수침 렌즈가 아닌 것인 플랫폼.
- 제1항 내지 제32항 중 어느 한 항에 있어서, 검출 시스템이 각각의 검출기에 작동가능하게 연결된 전하-결합 소자 카메라를 포함하는 것인 플랫폼.
- 제1항 내지 제33항 중 어느 한 항에 있어서, 다수의 검출기가 다수의 웰로부터의 신호를 동시에 검출하는 것인 플랫폼.
- 제1항 내지 제34항 중 어느 한 항에 있어서, 검출 시스템이 검출기에 작동가능하게 연결된 컴퓨터를 포함하고, 상기 컴퓨터가 검출기로부터의 발광 신호를 뉴런 세포에서의 시냅스 소포 순환의 양상을 특성화하는 데이터로 변환시키는 것인 플랫폼.
- 제1항 내지 제35항 중 어느 한 항에 있어서, 각각의 검출기가 다수의 리포터 분자로부터의 발광 신호를 검출하는 것인 플랫폼.
- 제1항 내지 제36항 중 어느 한 항에 있어서, 각각의 검출기가 다수의 시냅스로부터의 발광 신호를 검출하는 것인 플랫폼.
- 제1항 내지 제37항 중 어느 한 항에 있어서, 각각의 검출기가 다수의 뉴런 세포로부터의 발광 신호를 검출하는 것인 플랫폼.
- 제1항 내지 제38항 중 어느 한 항에 있어서, 시냅스 소포 단백질이 VAMP2, vGlut1, 시냅토파이신, 소포 GABA 수송체, 아세틸콜린 수송체, 카테콜아민 수송체 또는 시냅토타그민인 플랫폼.
- 제1항 내지 제39항 중 어느 한 항에 있어서, 다수의 뉴런 세포가 내강 부분을 갖는 시냅스 소포 단백질을 발현하고, 상기 시냅스 소포 단백질은 리포터 분자에 부착되는 것인 플랫폼.
- 제40항에 있어서, 리포터 분자가 시냅스 소포 단백질의 내강 부분에 부착되는 것인 플랫폼.
- 제1항 내지 제41항 중 어느 한 항에 있어서, 리포터 분자가 pH 민감성 형광 단백질인 플랫폼.
- 제1항 내지 제42항 중 어느 한 항에 있어서, 리포터 분자가 플루오린(pHluorin)인 플랫폼.
- 제1항 내지 제42항 중 어느 한 항에 있어서, 리포터 분자가 서열 1로 제시된 서열 (hSyn-SypHy)을 포함하는 것인 플랫폼.
- 제42항에 있어서, 7.0 내지 8.0 범위의 pH에서 pH 민감성 리포터가 5.0 내지 6.0 범위의 pH에서보다 유의하게 큰 강도로 형광을 나타내는 것인 플랫폼.
- 제42항에 있어서, 5.0 내지 6.0 범위의 pH에서 pH 민감성 리포터가 7.0 내지 8.0 범위의 pH에서보다 유의하게 큰 강도로 형광을 나타내는 것인 플랫폼.
- 제46항에 있어서, 발광 신호가 475 nm 내지 525 nm 범위에서의 형광 신호인 플랫폼.
- a) 다수의 웰 (여기서, 각각의 웰은 다수의 뉴런 세포를 포함함);
b) 다수의 전극쌍 (여기서, 각각의 전극쌍은 다수의 웰 중 하나에 위치하고, 각각의 전극쌍은 웰에 존재하는 뉴런 세포에서 시냅스 소포 순환을 유도하기에 충분한 전기장을 생성하고, 다수의 전극쌍은 다수의 웰 내 다수의 뉴런 세포에서 시냅스 소포 순환을 실질적으로 동시에 유도함); 및
c) 다수의 검출기를 포함하는 검출 시스템 (여기서, 각각의 검출기는 적어도 다수의 뉴런 세포의 하위 집합으로부터의 발광 신호를 검출하고, 발광 신호는 시냅스 소포 순환의 양상을 나타냄)
을 포함하는, 시냅스 소포 순환의 양상을 분석하기 위한 플랫폼. - 제48항에 있어서, 다수의 뉴런 세포가 시냅스 소포 단백질에 부착된 리포터 분자를 포함하는 것인 플랫폼.
- a) 다수의 웰 (여기서, 각각의 웰은 다수의 뉴런 세포를 포함하고, 다수의 뉴런 세포는 시냅스 소포 단백질에 부착된 리포터 분자를 포함함);
b) 웰에 존재하는 뉴런 세포에서 시냅스 소포 순환을 실질적으로 동시에 유도하는 자극기 시스템; 및
c) 다수의 검출기를 포함하는 검출 시스템 (여기서, 각각의 검출기는 적어도 웰에 존재하는 다수의 뉴런 세포의 하위 집합으로부터의 발광 신호를 검출하고, 발광 신호는 시냅스 소포 순환의 양상을 나타냄)
을 포함하는, 시냅스 소포 순환의 양상을 분석하기 위한 플랫폼. - 제50항에 있어서, 시냅스 소포 단백질이 내강 부분을 포함하는 것인 플랫폼.
- 제50항 또는 제51항에 있어서, 자극기 시스템이 다수의 전극쌍을 포함하고, 각각의 전극쌍이 다수의 웰 중 하나에 위치하며, 각각의 전극쌍이 웰에 존재하는 뉴런 세포에서 시냅스 소포 순환을 유도하기에 충분한 전기장을 생성하는 것인 플랫폼.
- 제48항 내지 제52항 중 어느 한 항에 있어서, 웰 내 다수의 뉴런 세포가 10 내지 100,000개 뉴런 세포의 범위인 플랫폼.
- 제48항 내지 제53항 중 어느 한 항에 있어서, 웰 내 다수의 뉴런 세포가 웰 기저부 1 mm2 당 1000 내지 4000개 세포의 범위인 플랫폼.
- 제48항 내지 제54항 중 어느 한 항에 있어서, 다수의 뉴런 세포가 2종 이상의 상이한 뉴런 세포 유형을 포함하는 것인 플랫폼.
- 제48항 내지 제55항 중 어느 한 항에 있어서, 뉴런 세포가 일차 뉴런이고, 임의로 일차 뉴런이 래트 일차 뉴런인 플랫폼.
- 제48항 내지 제56항 중 어느 한 항에 있어서, 뉴런 세포가 글루타메이트성, GABA성, 도파민작용성, 아드레날린성, 세로토닌성 및 콜린성 뉴런 세포로 이루어진 군으로부터 선택되는 것인 플랫폼.
- 제48항 내지 제57항 중 어느 한 항에 있어서, 뉴런 세포가 리포터 분자에 융합된, 내강 부분을 갖는 시냅스 소포 단백질을 발현하는 트랜스진(transgene)을 포함하는 것인 플랫폼.
- 제48항 및 제52항 내지 제58항 중 어느 한 항에 있어서, 전극쌍의 각각의 전극이 실질적으로 곡선 표면을 갖는 것인 플랫폼.
- 제48항 및 제52항 내지 제59항 중 어느 한 항에 있어서, 각각의 전극쌍의 전극이 실질적으로 동심 원통이고, 상기 동심 원통이 환상 절연 물질에 의해 분리되는 것인 플랫폼.
- 제48항 및 제52항 내지 제60항 중 어느 한 항에 있어서, 다수의 전극쌍 중 각각의 전극쌍을 다수의 웰 중 하나의 웰로 작동가능하게 위치시키는 전극 전달 시스템을 추가로 포함하는 플랫폼.
- 제48항 및 제52항 내지 제61항 중 어느 한 항에 있어서, 다수의 전극에 작동가능하게 연결된 전력원을 추가로 포함하는 플랫폼.
- 제62항에 있어서, 전력원이 각각의 전극쌍을 가로질러 미리 결정된 전압을 가하는 것인 플랫폼.
- 제63항에 있어서, 전압이 1 V 내지 400 V의 범위인 플랫폼.
- 제63항에 있어서, 전압이 5 V 내지 20 V의 범위인 플랫폼.
- 제62항 내지 제65항 중 어느 한 항에 있어서, 전력원 및 다수의 전극쌍에 작동가능하게 연결된 펼스 발생기를 추가로 포함하고, 여기서 펄스 발생기는 각각의 전극쌍을 가로질러 미리 결정된 전압 펄스를 가하는 것인 플랫폼.
- 제66항에 있어서, 펄스 발생기가 미리 결정된 시간 동안 미리 결정된 주파수에서 다수의 미리 결정된 전압 펄스를 가하는 것인 플랫폼.
- 제67항에 있어서, 미리 결정된 주파수가 0.2 Hz 내지 100 Hz의 범위인 플랫폼.
- 제67항 또는 제68항에 있어서, 미리 결정된 주파수가 10 Hz 내지 50 Hz의 범위인 플랫폼.
- 제67항 내지 제69항 중 어느 한 항에 있어서, 미리 결정된 시간이 2분 이하인 플랫폼.
- 제67항 내지 제70항 중 어느 한 항에 있어서, 미리 결정된 시간이 0.1 내지 20초의 범위인 플랫폼.
- 제67항 내지 제71항 중 어느 한 항에 있어서, 미리 결정된 시간이 5 내지 15초의 범위인 플랫폼.
- 제67항 내지 제72항 중 어느 한 항에 있어서, 각각의 펄스의 지속 기간이 10 msec 이하의 범위인 플랫폼.
- 제67항 내지 제73항 중 어느 한 항에 있어서, 각각의 펄스의 지속 기간이 0.1 msec 내지 2 msec의 범위인 플랫폼.
- 제67항 내지 제74항 중 어느 한 항에 있어서, 각각의 펄스의 개시 사이의 기간이 0.1 내지 5 msec의 범위인 플랫폼.
- 제67항 내지 제75항 중 어느 한 항에 있어서, 펄스의 수가 1 내지 1000의 범위인 플랫폼.
- 제66항 내지 제75항 중 어느 한 항에 있어서, 펄스 발생기에 작동가능하게 연결된 컴퓨터를 추가로 포함하고, 여기서 컴퓨터는 전압 펄스를 제어하는 것인 플랫폼.
- 제48항 내지 제77항 중 어느 한 항에 있어서, 각각의 검출기가 광학 센서를 포함하는 것인 플랫폼.
- 제48항 내지 제78항 중 어느 한 항에 있어서, 각각의 검출기가 웰로부터의 발광 신호를 수집하는 대물 렌즈를 포함하는 것인 플랫폼.
- 제79항에 있어서, 대물 렌즈가 0.2 mm 내지 5 mm의 범위의 필드 영역으로부터 발광 신호를 수집하는 것인 플랫폼.
- 제79항 또는 제80항에 있어서, 대물 렌즈가 0.4 내지 1.4의 범위의 개구수를 갖는 것인 플랫폼.
- 제79항에 있어서, 대물 렌즈가 0.5의 개구수를 갖는 것인 플랫폼.
- 제79항 내지 제82항 중 어느 한 항에 있어서, 대물 렌즈가 유침 또는 수침 렌즈가 아닌 것인 플랫폼.
- 제48항 내지 제83항 중 어느 한 항에 있어서, 검출 시스템이 각각의 검출기에 작동가능하게 연결된 전하-결합 소자 카메라를 포함하는 것인 플랫폼.
- 제48항 내지 제84항 중 어느 한 항에 있어서, 다수의 검출기가 다수의 웰로부터의 신호를 동시에 검출하는 것인 플랫폼.
- 제48항 내지 제85항 중 어느 한 항에 있어서, 검출 시스템이 검출기에 작동가능하게 연결된 컴퓨터를 포함하고, 상기 컴퓨터가 검출기로부터의 발광 신호를 뉴런 세포에서의 시냅스 소포 순환의 양상을 특성화하는 데이터로 변환시키는 것인 플랫폼.
- 제48항 내지 제86항 중 어느 한 항에 있어서, 각각의 검출기가 다수의 리포터 분자로부터의 발광 신호를 검출하는 것인 플랫폼.
- 제48항 내지 제87항 중 어느 한 항에 있어서, 각각의 검출기가 다수의 시냅스로부터의 발광 신호를 검출하는 것인 플랫폼.
- 제48항 내지 제88항 중 어느 한 항에 있어서, 각각의 검출기가 다수의 뉴런 세포로부터의 발광 신호를 검출하는 것인 플랫폼.
- 제49항 내지 제89항 중 어느 한 항에 있어서, 시냅스 소포 단백질이 VAMP2, vGlut1, 시냅토파이신, 소포 GABA 수송체, 아세틸콜린 수송체, 카테콜아민 수송체 또는 시냅토타그민인 플랫폼.
- 제49항 내지 제90항 중 어느 한 항에 있어서, 리포터 분자가 시냅스 소포 단백질의 내강 부분에 부착되는 것인 플랫폼.
- 제49항 내지 제91항 중 어느 한 항에 있어서, 리포터 분자가 pH 민감성 형광 단백질인 플랫폼.
- 제49항 내지 제92항 중 어느 한 항에 있어서, 리포터 분자가 플루오린인 플랫폼.
- 제50항 내지 제93항 중 어느 한 항에 있어서, 리포터 분자가 서열 1로 제시된 서열 (hSyn-SypHy)을 포함하는 것인 플랫폼.
- 제92항 내지 제94항 중 어느 한 항에 있어서, 7.0 내지 8.0 범위의 pH에서 pH 민감성 리포터가 5.0 내지 6.0 범위의 pH에서보다 유의하게 큰 강도로 형광을 나타내는 것인 플랫폼.
- 제92항 내지 제95항 중 어느 한 항에 있어서, 5.0 내지 6.0 범위의 pH에서 pH 민감성 리포터가 7.0 내지 8.0 범위의 pH에서보다 유의하게 큰 강도로 형광을 나타내는 것인 플랫폼.
- 제48항 내지 제96항 중 어느 한 항에 있어서, 발광 신호가 475 nm 내지 525 nm 범위에서의 형광 신호인 플랫폼.
- a) 다수의 웰;
b) 다수의 전극쌍
(여기서, 각각의 전극쌍은
(i) 웰 내 배치를 위해서, 및
(ii) 웰 내 다수의 뉴런 세포에서 시냅스 소포 순환을 유도하는 전기장을 생성하도록
배열되고, 다수의 전극쌍은 다수의 웰 내 뉴런 세포에서 시냅스 소포 순환을 실질적으로 동시에 유도함); 및
c) 웰에 존재하는 뉴런 세포의 시냅스 소포 단백질에 부착된 리포터 분자로부터의 발광 신호를 수집하는 대물 렌즈를 포함한 검출 시스템 (여기서, 발광 신호의 존재는 뉴런 세포에서의 시냅스 소포 순환의 양상을 나타냄)
을 포함하는, 시냅스 소포 순환의 양상을 분석하기 위한 플랫폼. - 제98항에 있어서, 다수의 웰이 다수의 뉴런 세포를 포함하는 것인 플랫폼.
- a) 다수의 웰 (여기서, 각각의 웰은 다수의 뉴런 세포를 포함함);
b) 다수의 전극쌍 (여기서, 각각의 전극쌍은 다수의 웰 중 하나에 위치하고, 각각의 전극쌍은 웰에 존재하는 뉴런 세포에서 시냅스 소포 순환을 유도하기에 충분한 전기장을 생성하고, 다수의 전극쌍은 다수의 웰 내 뉴런 세포에서 시냅스 소포 순환을 실질적으로 동시에 유도함); 및
c) 웰에 존재하는 뉴런 세포의 시냅스 소포 단백질에 부착된 리포터 분자로부터의 발광 신호를 수집하는 대물 렌즈를 포함한 검출 시스템 (여기서, 발광 신호의 존재는 뉴런 세포에서의 시냅스 소포 순환의 양상을 나타냄)
을 포함하는, 시냅스 소포 순환의 양상을 분석하기 위한 뉴런 세포 배양 플랫폼. - a) 다수의 웰 (여기서, 각각의 웰은 다수의 뉴런 세포를 포함하고, 다수의 뉴런 세포는 소포 단백질에 부착된 리포터 분자를 포함함);
b) 웰에 존재하는 뉴런 세포에서 시냅스 소포 순환을 실질적으로 동시에 유도하는 자극기 시스템; 및
c) 웰에 존재하는 뉴런 세포의 시냅스 소포 단백질에 부착된 리포터 분자로부터의 발광 신호를 수집하는 대물 렌즈를 포함한 검출 시스템 (여기서, 발광 신호의 존재는 뉴런 세포에서의 시냅스 소포 순환의 양상을 나타냄)
을 포함하는, 시냅스 소포 순환의 양상을 분석하기 위한 뉴런 세포 배양 플랫폼. - 제101항에 있어서, 자극기 시스템이 다수의 전극쌍을 포함하고, 각각의 전극쌍이 다수의 웰 중 하나에 위치하며, 각각의 전극쌍이 웰에 존재하는 뉴런 세포에서 시냅스 소포 순환을 유도하기에 충분한 전기장을 생성하는 것인 플랫폼.
- 제98항 내지 제102항 중 어느 한 항에 있어서, 시냅스 소포 단백질이 내강 부분을 포함하는 것인 플랫폼.
- 제98항 내지 제102항 중 어느 한 항에 있어서, 대물 렌즈가 오일 또는 수성 대물 렌즈인 플랫폼.
- 제98항 내지 제102항 중 어느 한 항에 있어서, 대물 렌즈가 공기 대물 렌즈인 플랫폼.
- 제98항 내지 제105항 중 어느 한 항에 있어서, 대물 렌즈가 광학 검출기에 작동가능하게 연결된 것인 플랫폼.
- 제104항에 있어서, 광학 검출기가 전하-결합 소자 카메라인 플랫폼.
- 제98항 내지 제107항 중 어느 한 항에 있어서, 5번 이상의 활동 전위를 생성하도록 자극되고 있는 뉴런 세포의 시냅스 소포 단백질에 부착된 리포터 분자로부터의 발광 신호를 검출하기 위해 배열된 플랫폼.
- 제98항 내지 제108항 중 어느 한 항에 있어서, 검출 시스템이 다수의 대물 렌즈를 포함하는 것인 플랫폼.
- 제99항 내지 제109항 중 어느 한 항에 있어서, 웰 내 다수의 뉴런 세포가 10 내지 100,000개 뉴런 세포의 범위인 플랫폼.
- 제99항 내지 제110항 중 어느 한 항에 있어서, 웰 내 다수의 뉴런 세포가 웰 기저부 1 mm2 당 1000 내지 4000개 세포의 범위인 플랫폼.
- 제99항 내지 제111항 중 어느 한 항에 있어서, 다수의 뉴런 세포가 2종 이상의 상이한 뉴런 세포 유형을 포함하는 것인 플랫폼.
- 제99항 내지 제112항 중 어느 한 항에 있어서, 뉴런 세포가 일차 뉴런이고, 임의로 일차 뉴런이 래트 일차 뉴런인 플랫폼.
- 제99항 내지 제113항 중 어느 한 항에 있어서, 뉴런 세포가 글루타메이트성, GABA성, 도파민작용성, 아드레날린성, 세로토닌성 및 콜린성 뉴런 세포로 이루어진 군으로부터 선택되는 것인 플랫폼.
- 제99항 내지 제114항 중 어느 한 항에 있어서, 뉴런 세포가 리포터 분자에 융합된, 내강 부분을 갖는 시냅스 소포 단백질을 발현하는 트랜스진을 포함하는 것인 플랫폼.
- 제98항, 제100항 및 제102항 내지 제115항 중 어느 한 항에 있어서, 전극쌍의 각각의 전극이 실질적으로 곡선 표면을 갖는 것인 플랫폼.
- 제98항, 제100항 및 제102항 내지 제116항 중 어느 한 항에 있어서, 각각의 전극쌍의 전극이 실질적으로 동심 원통이고, 상기 동심 원통이 환상 절연 물질에 의해 분리되는 것인 플랫폼.
- 제98항, 제100항 및 제102항 내지 제117항 중 어느 한 항에 있어서, 다수의 전극쌍 중 각각의 전극쌍을 다수의 웰 중 하나의 웰로 작동가능하게 위치시키는 전극 전달 시스템을 추가로 포함하는 플랫폼.
- 제98항, 제100항 및 제102항 내지 제118항 중 어느 한 항에 있어서, 다수의 전극에 작동가능하게 연결된 전력원을 추가로 포함하는 플랫폼.
- 제119항에 있어서, 전력원이 각각의 전극쌍을 가로질러 미리 결정된 전압을 가하는 것인 플랫폼.
- 제120항에 있어서, 전압이 1 V 내지 400 V의 범위인 플랫폼.
- 제120항에 있어서, 전압이 5 V 내지 20 V의 범위인 플랫폼.
- 제119항 내지 제122항 중 어느 한 항에 있어서, 전력원 및 다수의 전극쌍에 작동가능하게 연결된 펼스 발생기를 추가로 포함하고, 여기서 펄스 발생기는 각각의 전극쌍을 가로질러 미리 결정된 전압 펄스를 가하는 것인 플랫폼.
- 제123항에 있어서, 펄스 발생기가 미리 결정된 시간 동안 미리 결정된 주파수에서 다수의 미리 결정된 전압 펄스를 가하는 것인 플랫폼.
- 제124항에 있어서, 미리 결정된 주파수가 0.2 Hz 내지 100 Hz의 범위인 플랫폼.
- 제124항 또는 제125항에 있어서, 미리 결정된 주파수가 10 Hz 내지 50 Hz의 범위인 플랫폼.
- 제124항 내지 제126항 중 어느 한 항에 있어서, 미리 결정된 시간이 2분 이하인 플랫폼.
- 제124항 내지 제127항 중 어느 한 항에 있어서, 미리 결정된 시간이 0.1 내지 20초의 범위인 플랫폼.
- 제124항 내지 제128항 중 어느 한 항에 있어서, 미리 결정된 시간이 5 내지 15초의 범위인 플랫폼.
- 제124항 내지 제129항 중 어느 한 항에 있어서, 각각의 펄스의 지속 기간이 10 msec 이하의 범위인 플랫폼.
- 제124항 내지 제130항 중 어느 한 항에 있어서, 각각의 펄스의 지속 기간이 0.1 msec 내지 2 msec의 범위인 플랫폼.
- 제124항 내지 제131항 중 어느 한 항에 있어서, 각각의 펄스의 개시 사이의 기간이 0.1 내지 5 msec의 범위인 플랫폼.
- 제124항 내지 제132항 중 어느 한 항에 있어서, 펄스의 수가 1 내지 1000의 범위인 플랫폼.
- 제124항 내지 제133항 중 어느 한 항에 있어서, 펄스 발생기에 작동가능하게 연결된 컴퓨터를 추가로 포함하고, 여기서 컴퓨터는 전압 펄스를 제어하는 것인 플랫폼.
- 제124항 내지 제134항 중 어느 한 항에 있어서, 검출기 시스템이 광학 센서를 포함하는 것인 플랫폼.
- 제124항 내지 제135항 중 어느 한 항에 있어서, 검출기 시스템이 웰로부터의 발광 신호를 수집하는 대물 렌즈를 포함하는 것인 플랫폼.
- 제136항에 있어서, 대물 렌즈가 0.2 mm 내지 5 mm의 범위의 필드 영역으로부터 발광 신호를 수집하는 것인 플랫폼.
- 제135항 또는 제136항에 있어서, 대물 렌즈가 0.4 내지 1.4의 범위의 개구수를 갖는 것인 플랫폼.
- 제138항에 있어서, 대물 렌즈가 0.5의 개구수를 갖는 것인 플랫폼.
- 제136항 내지 제139항 중 어느 한 항에 있어서, 대물 렌즈가 유침 또는 수침 렌즈가 아닌 것인 플랫폼.
- 제98항 내지 제140항 중 어느 한 항에 있어서, 검출 시스템이 다수의 웰로부터의 신호를 동시에 검출하는 다수의 검출기를 포함하는 것인 플랫폼.
- 제141항에 있어서, 검출 시스템이 검출기에 작동가능하게 연결된 컴퓨터를 포함하고, 상기 컴퓨터가 검출기로부터의 발광 신호를 뉴런 세포에서의 시냅스 소포 순환의 양상을 특성화하는 데이터로 변환시키는 것인 플랫폼.
- 제141항 또는 제142항에 있어서, 각각의 검출기가 다수의 리포터 분자로부터의 발광 신호를 검출하는 것인 플랫폼.
- 제141항 내지 제143항 중 어느 한 항에 있어서, 각각의 검출기가 다수의 시냅스로부터의 발광 신호를 검출하는 것인 플랫폼.
- 제141항 내지 제144항 중 어느 한 항에 있어서, 각각의 검출기가 다수의 뉴런 세포로부터의 발광 신호를 검출하는 것인 플랫폼.
- 제98항 내지 제145항 중 어느 한 항에 있어서, 시냅스 소포 단백질이 VAMP2, vGlut1, 시냅토파이신, 소포 GABA 수송체, 아세틸콜린 수송체, 카테콜아민 수송체 또는 시냅토타그민인 플랫폼.
- 제98항 내지 제146항 중 어느 한 항에 있어서, 리포터 분자가 시냅스 소포 단백질의 내강 부분에 부착되는 것인 플랫폼.
- 제98항 내지 제147항 중 어느 한 항에 있어서, 리포터 분자가 pH 민감성 형광 단백질인 플랫폼.
- 제98항 내지 제148항 중 어느 한 항에 있어서, 리포터 분자가 플루오린인 플랫폼.
- 제98항 내지 제149항 중 어느 한 항에 있어서, 리포터 분자가 서열 1로 제시된 서열 (hSyn-SypHy)을 포함하는 것인 플랫폼.
- 제148항 내지 제150항 중 어느 한 항에 있어서, 7.0 내지 8.0 범위의 pH에서 pH 민감성 리포터가 5.0 내지 6.0 범위의 pH에서보다 유의하게 큰 강도로 형광을 나타내는 것인 플랫폼.
- 제148항 내지 제150항 중 어느 한 항에 있어서, 5.0 내지 6.0 범위의 pH에서 pH 민감성 리포터가 7.0 내지 8.0 범위의 pH에서보다 유의하게 큰 강도로 형광을 나타내는 것인 플랫폼.
- 제98항 내지 제152항 중 어느 한 항에 있어서, 발광 신호가 475 nm 내지 525 nm 범위에서의 형광 신호인 플랫폼.
- a) 다수의 웰의 각각에 전극쌍, 및 시냅스 소포 단백질과 결합된 형광 리포터 분자를 발현하는 다수의 세포를 제공하는 단계;
b) 전극쌍을 이용하여 다수의 세포에서 세포 내 시냅스 소포 순환을 개시하기에 충분한 일련의 활동 전위를 실질적으로 동시에 유도하는 단계; 및
c) 다수의 웰에서 리포터 분자의 발광 신호를 검출하는 단계
를 포함하고, 여기서 리포터 분자의 발광 신호가 시냅스 소포 순환의 양상의 척도인,
다수의 세포에서 시냅스 소포 순환의 양상을 측정하는 방법. - 제154항에 있어서, 다수의 세포가 뉴런 세포인 방법.
- 제154항 또는 제155항에 있어서, 웰 내 다수의 뉴런 세포가 10 내지 100000개 뉴런 세포의 범위인 방법.
- 제154항 또는 제155항에 있어서, 웰 내 다수의 뉴런 세포가 웰 기저부 1 mm2 당 1000 내지 2000개 세포의 범위인 방법.
- 제154항 내지 제156항 중 어느 한 항에 있어서, 다수의 세포가 2종 이상의 상이한 뉴런 세포 유형을 포함하는 것인 방법.
- 제155항 내지 제158항 중 어느 한 항에 있어서, 뉴런 세포가 일차 뉴런이고, 임의로 일차 뉴런이 래트 일차 뉴런인 방법.
- 제155항 내지 제159항 중 어느 한 항에 있어서, 뉴런 세포가 글루타메이트성, GABA성, 도파민작용성, 아드레날린성, 세로토닌성 및 콜린성 뉴런 세포로 이루어진 군으로부터 선택되는 것인 방법.
- 제154항 내지 제160항 중 어느 한 항에 있어서, 다수의 뉴런 세포가 리포터 분자에 융합된 시냅스 소포 단백질을 발현하는 것인 방법.
- 제154항 내지 제161항 중 어느 한 항에 있어서, 전극쌍의 각각의 전극이 실질적으로 곡선 표면을 갖는 것인 방법.
- 제154항 내지 제162항 중 어느 한 항에 있어서, 각각의 전극쌍의 전극이 실질적으로 동심 원통이고, 상기 동심 원통이 환상 절연 물질에 의해 분리되는 것인 방법.
- 제154항 내지 제163항 중 어느 한 항에 있어서, 다수의 전극쌍 중 각각의 전극쌍을 전극 전달 시스템을 사용하여 다수의 웰 중 하나의 웰에 위치시키는 단계를 추가로 포함하는 방법.
- 제154항 내지 제164항 중 어느 한 항에 있어서, 활동 전위가 다수의 전극에 작동가능하게 연결된 전력원에 의해 유도되는 것인 방법.
- 제154항 내지 제165항 중 어느 한 항에 있어서, 활동 전위가 각각의 전극쌍을 가로질러 미리 결정된 전압을 가하여 유도되는 것인 방법.
- 제166항에 있어서, 전압이 1 V 내지 400 V의 범위인 방법.
- 제166항에 있어서, 전압이 5 V 내지 20 V의 범위인 방법.
- 제165항 내지 제168항 중 어느 한 항에 있어서, 펄스 발생기가 전력원 및 다수의 전극쌍에 작동가능하게 연결되고, 상기 펄스 발생기가 각각의 전극쌍을 가로질러 미리 결정된 전압 펄스를 가하는 것인 방법.
- 제169항에 있어서, 펄스 발생기가 미리 결정된 시간 동안 미리 결정된 주파수에서 다수의 미리 결정된 전압 펄스를 가하는 것인 방법.
- 제170항에 있어서, 미리 결정된 주파수가 0.2 Hz 내지 100 Hz의 범위인 방법.
- 제170항 또는 제171항에 있어서, 미리 결정된 주파수가 10 Hz 내지 50 Hz의 범위인 방법.
- 제170항 내지 제172항 중 어느 한 항에 있어서, 미리 결정된 시간이 2분 이하인 방법.
- 제170항 내지 제173항 중 어느 한 항에 있어서, 미리 결정된 시간이 0.1 내지 20초의 범위인 방법.
- 제170항 내지 제174항 중 어느 한 항에 있어서, 미리 결정된 시간이 5 내지 15초의 범위인 방법.
- 제170항 내지 제175항 중 어느 한 항에 있어서, 각각의 펄스의 지속 기간이 10 msec 이하의 범위인 방법.
- 제170항 내지 제176항 중 어느 한 항에 있어서, 각각의 펄스의 지속 기간이 0.1 msec 내지 2 msec의 범위인 방법.
- 제170항 내지 제175항 중 어느 한 항에 있어서, 각각의 펄스의 개시 사이의 기간이 0.1 내지 5 msec의 범위인 방법.
- 제170항 내지 제175항 중 어느 한 항에 있어서, 펄스의 수가 1 내지 1000의 범위인 방법.
- 제169항 내지 제179항 중 어느 한 항에 있어서, 전압 펄스가 펄스 발생기에 작동가능하게 연결된 컴퓨터에 의해 제어되는 것인 방법.
- 제155항 내지 제180항 중 어느 한 항에 있어서, 발광 신호가 검출기에 의해 검출되는 것인 방법.
- 제181항에 있어서, 검출기거 광학 센서를 포함하는 것인 방법.
- 제181항 또는 제182항에 있어서, 리포터 분자의 발광 신호가 다수의 검출기를 이용하여 검출되고, 전하-결합 소자 카메라가 각각의 검출기에 작동가능하게 연결된 것인 방법.
- 제181항에 있어서, 각각의 검출기가 웰로부터의 발광 신호를 수집하는 대물 렌즈를 포함하는 것인 방법.
- 제184항에 있어서, 대물 렌즈가 0.2 mm 내지 5 mm의 범위의 필드 영역으로부터 발광 신호를 수집하는 것인 방법.
- 제184항 또는 제185항에 있어서, 대물 렌즈가 0.4 내지 1.4의 범위의 개구수를 갖는 것인 방법.
- 제186항에 있어서, 대물 렌즈가 0.5의 개구수를 갖는 것인 방법.
- 제183항에 있어서, 다수의 검출기가 다수의 웰로부터의 신호를 동시에 검출하는 것인 방법.
- 제183항 내지 제188항 중 어느 한 항에 있어서, 컴퓨터가 다수의 검출기에 작동가능하게 연결되고, 검출기로부터의 발광 신호를 뉴런 세포에서의 시냅스 소포 순환의 양상을 특성화하는 데이터로 변환시키는 것인 방법.
- 제183항 내지 제189항 중 어느 한 항에 있어서, 각각의 검출기가 다수의 리포터 분자로부터의 발광 신호를 검출하는 것인 방법.
- 제183항 내지 제190항 중 어느 한 항에 있어서, 각각의 검출기가 다수의 시냅스로부터의 발광 신호를 검출하는 것인 방법.
- 제183항 내지 제191항 중 어느 한 항에 있어서, 각각의 검출기가 다수의 뉴런 세포로부터의 발광 신호를 검출하는 것인 방법.
- 제154항 내지 제192항 중 어느 한 항에 있어서, 시냅스 소포 단백질이 VAMP2, vGlut1, 시냅토파이신, 소포 GABA 수송체, 아세틸콜린 수송체, 카테콜아민 수송체 또는 시냅토타그민인 방법.
- 제154항 내지 제192항 중 어느 한 항에 있어서, 시냅스 소포 단백질이 내강 부분을 갖는 것인 방법.
- 제194항에 있어서, 발광 리포터 분자가 내강 부분에 부착되는 것인 방법.
- 제154항 내지 제195항 중 어느 한 항에 있어서, 발광 리포터 분자가 pH 민감성 리포터인 방법.
- 제154항 내지 제196항 중 어느 한 항에 있어서, 발광 리포터 분자가 플루오린인 방법.
- 제154항 내지 제196항 중 어느 한 항에 있어서, 발광 리포터 분자가 서열 1로 제시된 서열 (hSyn-SypHy)을 포함하는 것인 방법.
- 제196항에 있어서, 7.0 내지 8.0 범위의 pH에서 pH 민감성 리포터가 5.0 내지 6.0 범위의 pH에서보다 유의하게 큰 강도로 형광을 나타내는 것인 방법.
- 제197항에 있어서, 7.0 내지 8.0 범위의 pH에서 pH 민감성 리포터가 7.0 내지 8.0 범위의 pH에서보다 유의하게 큰 강도로 형광을 나타내는 것인 방법.
- 제154항 내지 제200항 중 어느 한 항에 있어서, 발광 신호가 475 nm 내지 525 nm의 범위인 방법.
- 제154항 내지 제201항 중 어느 한 항에 있어서,
d) 다수의 웰 내 다수의 세포를 시냅스 소포 순환의 양상을 조절하는 그의 능력에 대해 시험할 하나 이상의 시험 물질과 접촉시키는 단계;
e) 세포에서 시냅스 소포 순환을 개시하기에 충분한 세포 내 제2의 일련의 활동 전위를 실질적으로 동시에 유도하는 단계;
f) 다수의 웰에서 제2의 리포터 분자의 발광 신호를 검출하는 단계
를 추가로 포함하고, 여기서 단계 (c)에서 검출된 발광 신호와 단계 (f)에서 검출된 발광 신호 사이의 유의한 차이로 시험 물질이 시냅스 소포 순환의 양상을 조절하는 것임을 확인하는 것인 방법. - 제154항 내지 제201항 중 어느 한 항에 있어서, 단계 (b) 전에 다수의 웰 내 다수의 세포를 시냅스 소포 순환의 양상을 조절하는 그의 능력에 대해 시험할 하나 이상의 시험 물질과 접촉시키는 단계를 추가로 포함하고, 여기서 단계 (c)에서 검출된 발광 신호와 대조 발광 신호 사이의 유의한 차이로 시험 물질이 시냅스 소포 순환의 양상을 조절하는 것임을 확인하는 것인 방법.
- 제154항 내지 제201항 중 어느 한 항에 있어서,
d) 다수의 웰 중 하나 이상의 웰 내 다수의 세포를 시냅스 소포 순환의 양상을 조절하는 그의 능력에 대해 시험할 하나 이상의 시험 물질과 접촉시키는 단계;
e) 다수의 웰 중 하나 이상의 웰 내 다수의 세포를 하나 이상의 대조 물질과 접촉시키는 단계
를 추가로 포함하고, 여기서 시험 물질을 갖는 웰에서 검출된 발광 신호와 대조 물질을 갖는 웰에서 검출된 발광 신호 사이의 유의한 차이로 시험 물질이 시냅스 소포 순환의 양상을 조절하는 것임을 확인하는 것인 방법. - 제154항 내지 제201항 중 어느 한 항에 있어서,
d) 다수의 웰 중 하나 이상의 웰 내 다수의 세포를 시냅스 소포 순환의 양상을 조절하는 그의 능력에 대해 시험할 하나 이상의 시험 물질과 접촉시키는 단계
를 추가로 포함하고, 여기서 시험 물질을 갖는 웰에서 검출된 발광 신호와 음성 대조 웰에서 검출된 발광 신호 사이의 유의한 차이로 시험 물질이 시냅스 소포 순환의 양상을 조절하는 것임을 확인하는 것인 방법. - 제205항에 있어서, 음성 대조 웰 내 다수의 세포를 시냅스 소포 순환의 양상을 조절하지 않는 대조 물질과 접촉시키는 단계를 추가로 포함하는 방법.
- 제154항 내지 제201항 중 어느 한 항에 있어서,
d) 다수의 웰 중 하나 이상의 웰 내 다수의 세포를 시냅스 소포 순환의 양상을 조절하는 그의 능력에 대해 시험할 하나 이상의 시험 물질과 접촉시키는 단계
를 추가로 포함하고, 여기서 시험 물질을 갖는 웰에서 검출된 발광 신호와 양성 대조 웰에서 검출된 발광 신호 사이에 유의한 차이가 없는 것으로 시험 물질이 시냅스 소포 순환의 양상을 조절하는 것임을 확인하는 것인 방법. - 제207항에 있어서, 양성 대조 웰 내 다수의 세포를 시냅스 소포 순환의 양상을 조절하는 대조 물질과 접촉시키는 단계를 추가로 포함하는 방법.
- 제202항 내지 제208항 중 어느 한 항에 있어서, 시험 물질이 소분자인 방법.
- 제202항 내지 제208항 중 어느 한 항에 있어서, 시험 물질이 폴리펩티드인 방법.
- 제202항 내지 제208항 중 어느 한 항에 있어서, 시험 물질이 항체인 방법.
- 제202항 내지 제208항 중 어느 한 항에 있어서, 시험 물질이 핵산인 방법.
- 제212항에 있어서, 핵산이 DNA, RNA, DNA/RNA 하이브리드, 짧은 간섭 RNA, 짧은 헤어핀 RNA, 마이크로 RNA, 리보자임 또는 압타머로부터 선택되는 것인 방법.
- 제202항 또는 제203항에 있어서, 시험 물질이 탄수화물인 방법.
- 제202항 또는 제203항에 있어서, 시험 물질이 지질인 방법.
- 제215항에 있어서, 지질이 인지질, 트리글리세리드 또는 스테로이드인 방법.
- 제202항 내지 216항 중 어느 한 항에 있어서, 생체내 모델에서 시냅스 소포 순환의 양상의 조절제로서 확인된 시험 물질의 독성을 모니터링하는 단계를 추가로 포함하는 방법.
- 제202항 내지 제216항 중 어느 한 항에 있어서, 생체내 모델에서 시냅스 소포 순환의 양상의 조절제로서 확인된 시험 물질의 효능을 모니터링하는 단계를 추가로 포함하는 방법.
- 제154항 내지 제218항 중 어느 한 항에 있어서, 고-처리량 스크리닝 과정인 방법.
- 제154항 내지 제219항 중 어느 한 항에 있어서, 발광 신호가 형광의 수준인 방법.
- 제154항 내지 제219항 중 어느 한 항에 있어서, 발광 신호가 미리 규정된 시간에 걸쳐 수득되는 다수의 형광 수준인 방법.
- 제154항 내지 제219항 중 어느 한 항에 있어서, 발광 신호가 형광 상승율인 방법.
- 제154항 내지 제219항 중 어느 한 항에 있어서, 발광 신호가 형광 붕괴율인 방법.
- a) 다수의 웰을 제공하는 단계 (여기서, 각각의 웰은 전극쌍, 및 시냅스 소포 단백질과 결합된 형광 리포터 분자를 발현하는 다수의 세포를 포함함);
b) 다수의 세포에서 세포 내 시냅스 소포 순환을 개시하기에 충분한 제1의 일련의 활동 전위를 실질적으로 동시에 유도하는 단계;
c) 다수의 웰에서 리포터 분자의 제1 발광 신호를 검출하는 단계;
d) 다수의 웰 내 다수의 세포를 시냅스 소포 순환의 양상을 조절하는 그의 능력에 대해 시험할 하나 이상의 시험 물질과 접촉시키는 단계;
e) 세포에서 시냅스 소포 순환을 개시하기에 충분한 세포 내 제2의 일련의 활동 전위를 실질적으로 동시에 유도하는 단계;
f) 다수의 웰에서 리포터 분자의 제2 발광 신호를 검출하는 단계
를 포함하고, 여기서 리포터 분자의 제1 및 제2 형광 수준의 유의한 차이로 시험 물질이 시냅스 소포 순환의 양상의 조절제임을 확인하는 것인,
시냅스 소포 순환의 양상의 조절제로서 시험 물질을 확인하는 방법. - a) 다수의 웰의 각각에 전극쌍, 및 시냅스 소포 단백질과 결합된 형광 리포터 분자를 발현하는 다수의 세포를 제공하는 단계;
b) 전극쌍을 이용하여 다수의 세포에서 세포 내 시냅스 소포 순환을 개시하기에 충분한 일련의 활동 전위를 실질적으로 동시에 유도하는 단계;
c) 다수의 웰에서 리포터 분자의 발광 신호를 검출하는 단계 (여기서, 리포터 분자의 발광 신호는 시냅스 소포 순환의 양상의 척도임); 및
d) 다수의 웰 중 하나 이상의 웰 내 다수의 세포를 시냅스 소포 순환의 양상을 조절하는 그의 능력에 대해 시험할 하나 이상의 시험 물질과 접촉시키는 단계
를 포함하고, 여기서 시험 물질을 갖는 웰에서 검출된 발광 신호와 대조 웰에서 검출된 발광 신호 사이의 비교로 시험 물질이 시냅스 소포 순환의 양상을 조절하는 것임을 확인하는 것인,
다수의 세포에서 시냅스 소포 순환의 양상을 측정하는 방법. - a) 다수의 웰의 각각에 자극기, 및 시냅스 소포 단백질과 결합된 형광 리포터 분자를 발현하는 다수의 세포를 제공하는 단계;
b) 자극기를 사용하여 다수의 세포에서 세포 내 시냅스 소포 순환을 개시하기에 충분한 일련의 활동 전위를 실질적으로 동시에 유도하는 단계; 및
c) 다수의 웰에서 리포터 분자의 발광 신호를 검출하는 단계
를 포함하는, 다수의 세포에서 시냅스 소포 순환의 양상을 측정하는 방법.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US9436108P | 2008-09-04 | 2008-09-04 | |
| US61/094,361 | 2008-09-04 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20110073494A true KR20110073494A (ko) | 2011-06-29 |
Family
ID=41479300
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020117007795A KR20110073494A (ko) | 2008-09-04 | 2009-08-31 | 시냅스 소포 순환 검정 및 시스템 |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US20120053084A1 (ko) |
| EP (1) | EP2329275A2 (ko) |
| JP (2) | JP5789513B2 (ko) |
| KR (1) | KR20110073494A (ko) |
| CN (1) | CN102203622A (ko) |
| AU (2) | AU2009288657A1 (ko) |
| CA (1) | CA2744804C (ko) |
| WO (1) | WO2010027446A2 (ko) |
Families Citing this family (45)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2009100082A1 (en) * | 2008-02-04 | 2009-08-13 | Bayer Healthcare Llc | Semiconductor based analyte sensors and methods |
| US9217155B2 (en) | 2008-05-28 | 2015-12-22 | University Of Massachusetts | Isolation of novel AAV'S and uses thereof |
| US8734809B2 (en) | 2009-05-28 | 2014-05-27 | University Of Massachusetts | AAV's and uses thereof |
| WO2012027358A1 (en) | 2010-08-23 | 2012-03-01 | President And Fellows Of Harvard College | Optogenetic probes for measuring membrane potential |
| US9207237B2 (en) | 2010-08-23 | 2015-12-08 | President And Fellows Of Harvard College | Systems, methods, and workflows for optogenetics analysis |
| US9488637B2 (en) * | 2011-01-26 | 2016-11-08 | The Curators Of The University Of Missouri | Combination of single-cell electroporation and electrical recording using the same electrode |
| EP3318635A1 (en) | 2011-04-21 | 2018-05-09 | University of Massachusetts | Raav-based compositions and methods for treating alpha-1 anti-trypsin deficiencies |
| CA2856423A1 (en) * | 2011-11-23 | 2013-05-30 | President And Fellows Of Harvard College | Systems and methods for imaging at high spatial and/or temporal precision |
| US9696275B2 (en) | 2012-10-12 | 2017-07-04 | The Curators Of The University Of Missouri | Addressable electrode arrays in multiple fluidic compartments and uses thereof |
| US9772322B2 (en) | 2012-10-25 | 2017-09-26 | Hamamatsu Photonics K.K. | Cell observation device, and cell observation method |
| EP2913390B1 (en) * | 2012-10-25 | 2020-12-09 | Hamamatsu Photonics K.K. | Electrical stimulation device, cell observation device and cell observation method |
| EP3095853B1 (en) * | 2014-01-16 | 2019-01-30 | Hamamatsu Photonics K.K. | Cell observation device, electrostimulation device, and cell observation method |
| US10072251B2 (en) | 2014-02-19 | 2018-09-11 | University Of Massachusetts | Recombinant AAVS having useful transcytosis properties |
| EP3750907A3 (en) | 2014-03-18 | 2021-04-28 | University of Massachusetts | Raav-based compositions and methods for treating amyotrophic lateral sclerosis |
| CA2946514C (en) | 2014-04-22 | 2023-08-29 | Q-State Biosciences, Inc. | Optogenetic analysis of compounds |
| US10975391B2 (en) | 2014-04-25 | 2021-04-13 | University Of Massachusetts | Recombinant AAV vectors useful for reducing immunity against transgene products |
| CA2947771A1 (en) | 2014-06-18 | 2015-12-23 | President And Fellows Of Harvard College | Optogenetic probes for measuring membrane potential |
| US10625234B2 (en) | 2014-08-28 | 2020-04-21 | StemoniX Inc. | Method of fabricating cell arrays and uses thereof |
| WO2016054554A1 (en) | 2014-10-03 | 2016-04-07 | University Of Massachusetts | Heterologous targeting peptide grafted aavs |
| JP6842410B2 (ja) | 2014-10-03 | 2021-03-17 | ユニバーシティ オブ マサチューセッツ | 新規の高効率ライブラリーにより同定されるaavベクター |
| CN107073051B (zh) | 2014-10-21 | 2021-08-24 | 马萨诸塞大学 | 重组aav变体及其用途 |
| US10077463B2 (en) | 2015-01-15 | 2018-09-18 | President And Fellows Of Harvard College | Optical selection of cells |
| EP3256170B1 (en) | 2015-02-13 | 2020-09-23 | University of Massachusetts | Compositions and methods for transient delivery of nucleases |
| US10048275B2 (en) | 2015-03-13 | 2018-08-14 | Q-State Biosciences, Inc. | Cardiotoxicity screening methods |
| CA3019315A1 (en) * | 2015-04-23 | 2016-10-27 | University Of Massachusetts | Modulation of aav vector transgene expression |
| US11046955B2 (en) | 2015-04-24 | 2021-06-29 | University Of Massachusetts | Modified AAV constructs and uses thereof |
| US11248212B2 (en) | 2015-06-30 | 2022-02-15 | StemoniX Inc. | Surface energy directed cell self assembly |
| WO2017066663A1 (en) | 2015-10-15 | 2017-04-20 | Carromeu Cassiano | Method of manufacturing cells using a hollow fiber bioreactor |
| CA3002980A1 (en) | 2015-10-22 | 2017-04-27 | University Of Massachusetts | Prostate-targeting adeno-associated virus serotype vectors |
| DK3364997T3 (da) | 2015-10-22 | 2024-04-22 | Univ Massachusetts | Aspartoacylase genterapi til behandling af canavans sygdom |
| US11826433B2 (en) | 2016-02-02 | 2023-11-28 | University Of Massachusetts | Method to enhance the efficiency of systemic AAV gene delivery to the central nervous system |
| CA3012344A1 (en) | 2016-02-12 | 2017-08-17 | University Of Massachusetts | Anti-angiogenic mirna therapeutics for inhibiting corneal neovascularization |
| EP3225279B1 (en) * | 2016-03-31 | 2023-12-20 | Université de Rennes | Brain tissue stimulation apparatus and computer program |
| WO2017176929A1 (en) | 2016-04-05 | 2017-10-12 | University Of Massachusetts | Compositions and methods for selective inhibition of grainyhead-like protein expression |
| US11413356B2 (en) | 2016-04-15 | 2022-08-16 | University Of Massachusetts | Methods and compositions for treating metabolic imbalance |
| US11882815B2 (en) | 2016-06-15 | 2024-01-30 | University Of Massachusetts | Recombinant adeno-associated viruses for delivering gene editing molecules to embryonic cells |
| US10457940B2 (en) | 2016-09-22 | 2019-10-29 | University Of Massachusetts | AAV treatment of Huntington's disease |
| US11578340B2 (en) | 2016-10-13 | 2023-02-14 | University Of Massachusetts | AAV capsid designs |
| WO2018208972A1 (en) | 2017-05-09 | 2018-11-15 | University Of Massachusetts | Methods of treating amyotrophic lateral sclerosis (als) |
| WO2019060686A1 (en) | 2017-09-22 | 2019-03-28 | University Of Massachusetts | NEW DUAL EXPRESSION VECTORS OF SOD1 AND USES THEREOF |
| JP7065433B2 (ja) * | 2018-08-14 | 2022-05-12 | 日本電信電話株式会社 | 電極及びその製造方法、並びに積層体 |
| US20220205914A1 (en) * | 2020-12-31 | 2022-06-30 | Q-State Biosciences, Inc. | Plate imager |
| US20220203372A1 (en) * | 2020-12-31 | 2022-06-30 | Q-State Biosciences, Inc. | Optical plate controller and reader |
| CA3218924A1 (en) * | 2021-05-04 | 2022-11-10 | Q-State Biosciences, Inc. | Drug fingerprinting |
| WO2023210585A1 (ja) * | 2022-04-25 | 2023-11-02 | 株式会社Jiksak Bioengineering | 標的化剤 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE69913257T2 (de) | 1998-07-17 | 2004-09-02 | Vertex Pharmaceuticals (San Diego) Llc, San Diego | Detektor und Siebvorrichtung für Ionenkanäle |
| US7615356B2 (en) * | 2000-07-10 | 2009-11-10 | Vertex Pharmaceuticals (San Diego) Llc | Ion channel assay methods |
| US6686193B2 (en) * | 2000-07-10 | 2004-02-03 | Vertex Pharmaceuticals, Inc. | High throughput method and system for screening candidate compounds for activity against target ion channels |
| CA2453489A1 (en) | 2001-07-12 | 2003-01-23 | Merck & Co., Inc. | Electrical field stimulation of eukaryotic cells |
| US7221981B2 (en) * | 2002-03-28 | 2007-05-22 | Northstar Neuroscience, Inc. | Electrode geometries for efficient neural stimulation |
| US20070274923A1 (en) | 2005-01-11 | 2007-11-29 | Philippe Brulet | Non-invasive real-time in vivo bioluminescence imaging of local Ca2+ dynamics in living organisms |
-
2009
- 2009-08-31 AU AU2009288657A patent/AU2009288657A1/en not_active Abandoned
- 2009-08-31 CA CA2744804A patent/CA2744804C/en not_active Expired - Fee Related
- 2009-08-31 CN CN2009801440769A patent/CN102203622A/zh active Pending
- 2009-08-31 JP JP2011526037A patent/JP5789513B2/ja not_active Expired - Fee Related
- 2009-08-31 KR KR1020117007795A patent/KR20110073494A/ko active Search and Examination
- 2009-08-31 WO PCT/US2009/004932 patent/WO2010027446A2/en active Application Filing
- 2009-08-31 EP EP09789240A patent/EP2329275A2/en not_active Withdrawn
- 2009-08-31 US US13/062,459 patent/US20120053084A1/en not_active Abandoned
-
2015
- 2015-07-31 JP JP2015151623A patent/JP6106225B2/ja not_active Expired - Fee Related
-
2016
- 2016-04-15 AU AU2016202387A patent/AU2016202387A1/en not_active Abandoned
-
2018
- 2018-01-11 US US15/868,200 patent/US20180136198A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| CA2744804C (en) | 2019-02-05 |
| JP6106225B2 (ja) | 2017-03-29 |
| CN102203622A (zh) | 2011-09-28 |
| JP2012501646A (ja) | 2012-01-26 |
| US20180136198A1 (en) | 2018-05-17 |
| AU2016202387A1 (en) | 2016-05-05 |
| AU2009288657A1 (en) | 2010-03-11 |
| CA2744804A1 (en) | 2010-03-11 |
| WO2010027446A3 (en) | 2010-05-20 |
| EP2329275A2 (en) | 2011-06-08 |
| JP2016019736A (ja) | 2016-02-04 |
| WO2010027446A2 (en) | 2010-03-11 |
| US20120053084A1 (en) | 2012-03-01 |
| JP5789513B2 (ja) | 2015-10-07 |
| WO2010027446A4 (en) | 2010-08-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6106225B2 (ja) | シナプス小胞サイクリングアッセイおよびシステム | |
| Sun et al. | A genetically encoded fluorescent sensor enables rapid and specific detection of dopamine in flies, fish, and mice | |
| Grinevich et al. | Assembling the puzzle: pathways of oxytocin signaling in the brain | |
| CN102448472A (zh) | 包含与中枢神经细胞的增殖和分化相关的核因子的药物组合物 | |
| US20060063202A1 (en) | High throughput method and system for screening candidate compounds for activity against epilepsy and other neurological diseases | |
| Hirbec et al. | Emerging technologies to study glial cells | |
| Zhao et al. | Amigo adhesion protein regulates development of neural circuits in zebrafish brain | |
| US20230384333A1 (en) | Gpcr screening method to identify non-hallucinogenic compounds | |
| Osborne et al. | Lipid receptors in cardiovascular development | |
| Podlasz et al. | Neuroanatomical localization of galanin in zebrafish telencephalon and anticonvulsant effect of galanin overexpression | |
| CN106687588A (zh) | 钙指示基因 | |
| Zhou et al. | Development of a genetically-encoded sensor for probing endogenous nociceptin opioid peptide release | |
| WO2023122254A2 (en) | Methods to elicit desire to mate and mating behavior | |
| WO2019241318A1 (en) | Bioluminescent markers of neural activity | |
| Tian et al. | Unlocking opioid neuropeptide dynamics with genetically-encoded biosensors | |
| Blockus et al. | Synaptogenic activity of the axon guidance molecule Robo2 is critical for hippocampal circuit function | |
| Shindo et al. | Genetically encoded sensors for analysing neurotransmission among synaptically-connected neurons | |
| MX2012003773A (es) | Genes. metodos y composiciones relacionadas con la neurogenesis y su modulacion. | |
| Xue et al. | Hippocampus Insulin Receptors Regulate Episodic and Spatial Memory Through Excitatory/Inhibitory Balance | |
| Cho | Optical imaging of dopamine dynamics and decoding its role in arousal and salience | |
| Krämer | Characterization of CNP-induced cGMP signaling in the gastrointestinal tract and its role in colonic smooth muscle relaxation | |
| Cechová | The effects of opioid ligands on their receptors in model cells (eg lymphocytes, neural cells, cell lines) | |
| US20210246185A1 (en) | Inverted transporter polypeptides and methods of using | |
| Biggane | Alpha1A-Adrenergic Receptor Modulation of Epileptiform Activity and Seizures | |
| Hasan | Lysosome Dynamics in Models of Frontotemporal Dementia and Alzheimer’s Disease |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| AMND | Amendment | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application | ||
| AMND | Amendment |