JP7635154B2 - 糖修飾タンパク質 - Google Patents
糖修飾タンパク質 Download PDFInfo
- Publication number
- JP7635154B2 JP7635154B2 JP2021567318A JP2021567318A JP7635154B2 JP 7635154 B2 JP7635154 B2 JP 7635154B2 JP 2021567318 A JP2021567318 A JP 2021567318A JP 2021567318 A JP2021567318 A JP 2021567318A JP 7635154 B2 JP7635154 B2 JP 7635154B2
- Authority
- JP
- Japan
- Prior art keywords
- amino acid
- acid sequence
- protein
- seq
- lysine
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 102000003886 Glycoproteins Human genes 0.000 title 1
- 108090000288 Glycoproteins Proteins 0.000 title 1
- 108091005608 glycosylated proteins Proteins 0.000 claims description 196
- 102000035122 glycosylated proteins Human genes 0.000 claims description 196
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 193
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 claims description 170
- 239000004472 Lysine Substances 0.000 claims description 170
- 102000004169 proteins and genes Human genes 0.000 claims description 134
- 108090000623 proteins and genes Proteins 0.000 claims description 134
- 150000001413 amino acids Chemical class 0.000 claims description 103
- 125000003277 amino group Chemical group 0.000 claims description 77
- 235000013305 food Nutrition 0.000 claims description 41
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 39
- 235000013361 beverage Nutrition 0.000 claims description 37
- 238000000034 method Methods 0.000 claims description 33
- 235000007340 Hordeum vulgare Nutrition 0.000 claims description 29
- 241000209219 Hordeum Species 0.000 claims description 26
- 239000000796 flavoring agent Substances 0.000 claims description 24
- 235000019634 flavors Nutrition 0.000 claims description 24
- 235000019640 taste Nutrition 0.000 claims description 23
- 239000003795 chemical substances by application Substances 0.000 claims description 21
- 235000013334 alcoholic beverage Nutrition 0.000 claims description 13
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Chemical group OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 claims description 12
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 claims description 12
- AYRXSINWFIIFAE-SCLMCMATSA-N Isomaltose Chemical group OC[C@H]1O[C@H](OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O)[C@@H](O)[C@@H](O)[C@@H]1O AYRXSINWFIIFAE-SCLMCMATSA-N 0.000 claims description 12
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Chemical group O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 claims description 12
- 230000001476 alcoholic effect Effects 0.000 claims description 12
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical group OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 claims description 12
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical group OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 claims description 12
- 239000008103 glucose Substances 0.000 claims description 12
- DLRVVLDZNNYCBX-RTPHMHGBSA-N isomaltose Chemical group O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)C(O)O1 DLRVVLDZNNYCBX-RTPHMHGBSA-N 0.000 claims description 8
- DBTMGCOVALSLOR-UHFFFAOYSA-N 32-alpha-galactosyl-3-alpha-galactosyl-galactose Chemical group OC1C(O)C(O)C(CO)OC1OC1C(O)C(OC2C(C(CO)OC(O)C2O)O)OC(CO)C1O DBTMGCOVALSLOR-UHFFFAOYSA-N 0.000 claims description 7
- RXVWSYJTUUKTEA-UHFFFAOYSA-N D-maltotriose Chemical group OC1C(O)C(OC(C(O)CO)C(O)C(O)C=O)OC(CO)C1OC1C(O)C(O)C(O)C(CO)O1 RXVWSYJTUUKTEA-UHFFFAOYSA-N 0.000 claims description 7
- DBTMGCOVALSLOR-AXAHEAMVSA-N galactotriose Chemical group OC[C@@H]1O[C@@H](O[C@@H]2[C@@H](O)[C@H](CO)O[C@@H](O[C@H]3[C@@H](O)[C@H](O)O[C@@H](CO)[C@@H]3O)[C@@H]2O)[C@H](O)[C@H](O)[C@H]1O DBTMGCOVALSLOR-AXAHEAMVSA-N 0.000 claims description 7
- FBJQEBRMDXPWNX-FYHZSNTMSA-N isomaltotriose Chemical group O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](OC[C@@H]2[C@H]([C@H](O)[C@@H](O)C(O)O2)O)O1 FBJQEBRMDXPWNX-FYHZSNTMSA-N 0.000 claims description 7
- FYGDTMLNYKFZSV-UHFFFAOYSA-N mannotriose Chemical group OC1C(O)C(O)C(CO)OC1OC1C(CO)OC(OC2C(OC(O)C(O)C2O)CO)C(O)C1O FYGDTMLNYKFZSV-UHFFFAOYSA-N 0.000 claims description 7
- FYGDTMLNYKFZSV-BYLHFPJWSA-N β-1,4-galactotrioside Chemical group O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@H](CO)O[C@@H](O[C@@H]2[C@@H](O[C@@H](O)[C@H](O)[C@H]2O)CO)[C@H](O)[C@H]1O FYGDTMLNYKFZSV-BYLHFPJWSA-N 0.000 claims description 7
- 125000003153 isomaltose group Chemical group 0.000 claims 4
- 235000018977 lysine Nutrition 0.000 description 143
- 108090000765 processed proteins & peptides Proteins 0.000 description 130
- 235000018102 proteins Nutrition 0.000 description 98
- 150000002500 ions Chemical class 0.000 description 94
- 235000013405 beer Nutrition 0.000 description 82
- 235000001014 amino acid Nutrition 0.000 description 79
- 239000012634 fragment Substances 0.000 description 35
- 238000004458 analytical method Methods 0.000 description 30
- 108050000761 Serpin Proteins 0.000 description 29
- 102000008847 Serpin Human genes 0.000 description 29
- 239000003001 serine protease inhibitor Substances 0.000 description 29
- 102000007079 Peptide Fragments Human genes 0.000 description 28
- 108010033276 Peptide Fragments Proteins 0.000 description 26
- 239000000243 solution Substances 0.000 description 24
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 22
- 235000000346 sugar Nutrition 0.000 description 22
- 150000002402 hexoses Chemical class 0.000 description 19
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 19
- 230000004048 modification Effects 0.000 description 19
- 238000012986 modification Methods 0.000 description 19
- 102000004196 processed proteins & peptides Human genes 0.000 description 17
- 238000011156 evaluation Methods 0.000 description 16
- 238000001294 liquid chromatography-tandem mass spectrometry Methods 0.000 description 16
- 235000019668 heartiness Nutrition 0.000 description 14
- 230000001953 sensory effect Effects 0.000 description 14
- 239000012460 protein solution Substances 0.000 description 12
- 150000002772 monosaccharides Chemical class 0.000 description 10
- 150000002016 disaccharides Chemical class 0.000 description 9
- 229920001184 polypeptide Polymers 0.000 description 9
- 101710134681 40 kDa protein Proteins 0.000 description 8
- SRBFZHDQGSBBOR-IOVATXLUSA-N D-xylopyranose Chemical compound O[C@@H]1COC(O)[C@H](O)[C@H]1O SRBFZHDQGSBBOR-IOVATXLUSA-N 0.000 description 8
- GXCLVBGFBYZDAG-UHFFFAOYSA-N N-[2-(1H-indol-3-yl)ethyl]-N-methylprop-2-en-1-amine Chemical compound CN(CCC1=CNC2=C1C=CC=C2)CC=C GXCLVBGFBYZDAG-UHFFFAOYSA-N 0.000 description 7
- 235000013339 cereals Nutrition 0.000 description 7
- 238000004519 manufacturing process Methods 0.000 description 7
- 238000007792 addition Methods 0.000 description 6
- PYMYPHUHKUWMLA-UHFFFAOYSA-N arabinose Natural products OCC(O)C(O)C(O)C=O PYMYPHUHKUWMLA-UHFFFAOYSA-N 0.000 description 6
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 description 6
- 230000000694 effects Effects 0.000 description 6
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 6
- 238000000746 purification Methods 0.000 description 6
- NWUYHJFMYQTDRP-UHFFFAOYSA-N 1,2-bis(ethenyl)benzene;1-ethenyl-2-ethylbenzene;styrene Chemical compound C=CC1=CC=CC=C1.CCC1=CC=CC=C1C=C.C=CC1=CC=CC=C1C=C NWUYHJFMYQTDRP-UHFFFAOYSA-N 0.000 description 5
- 239000003729 cation exchange resin Substances 0.000 description 5
- 108091005601 modified peptides Proteins 0.000 description 5
- 150000004043 trisaccharides Chemical class 0.000 description 5
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 4
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 4
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 4
- 230000036252 glycation Effects 0.000 description 4
- 235000019573 kokumi flavor Nutrition 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- 238000005259 measurement Methods 0.000 description 4
- JPXMTWWFLBLUCD-UHFFFAOYSA-N nitro blue tetrazolium(2+) Chemical compound COC1=CC(C=2C=C(OC)C(=CC=2)[N+]=2N(N=C(N=2)C=2C=CC=CC=2)C=2C=CC(=CC=2)[N+]([O-])=O)=CC=C1[N+]1=NC(C=2C=CC=CC=2)=NN1C1=CC=C([N+]([O-])=O)C=C1 JPXMTWWFLBLUCD-UHFFFAOYSA-N 0.000 description 4
- 239000002243 precursor Substances 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 238000000108 ultra-filtration Methods 0.000 description 4
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- 238000009010 Bradford assay Methods 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 240000005979 Hordeum vulgare Species 0.000 description 3
- 101000663392 Hordeum vulgare Serpin-Z4 Proteins 0.000 description 3
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 3
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 3
- 235000011130 ammonium sulphate Nutrition 0.000 description 3
- 238000012217 deletion Methods 0.000 description 3
- 230000037430 deletion Effects 0.000 description 3
- 235000019253 formic acid Nutrition 0.000 description 3
- 238000003780 insertion Methods 0.000 description 3
- 230000037431 insertion Effects 0.000 description 3
- 239000012264 purified product Substances 0.000 description 3
- 239000002994 raw material Substances 0.000 description 3
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 3
- 238000006467 substitution reaction Methods 0.000 description 3
- 150000008163 sugars Chemical class 0.000 description 3
- 239000006228 supernatant Substances 0.000 description 3
- ATRRKUHOCOJYRX-UHFFFAOYSA-N Ammonium bicarbonate Chemical compound [NH4+].OC([O-])=O ATRRKUHOCOJYRX-UHFFFAOYSA-N 0.000 description 2
- 229910000013 Ammonium bicarbonate Inorganic materials 0.000 description 2
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 2
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- 108090000317 Chymotrypsin Proteins 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 101000984946 Hordeum vulgare Serpin-Z7 Proteins 0.000 description 2
- 235000008694 Humulus lupulus Nutrition 0.000 description 2
- 240000007594 Oryza sativa Species 0.000 description 2
- 235000007164 Oryza sativa Nutrition 0.000 description 2
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 235000021307 Triticum Nutrition 0.000 description 2
- 241000209140 Triticum Species 0.000 description 2
- 240000008042 Zea mays Species 0.000 description 2
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 2
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 235000012538 ammonium bicarbonate Nutrition 0.000 description 2
- 239000001099 ammonium carbonate Substances 0.000 description 2
- PYMYPHUHKUWMLA-WDCZJNDASA-N arabinose Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)C=O PYMYPHUHKUWMLA-WDCZJNDASA-N 0.000 description 2
- 239000001110 calcium chloride Substances 0.000 description 2
- 229910001628 calcium chloride Inorganic materials 0.000 description 2
- 229960002376 chymotrypsin Drugs 0.000 description 2
- 239000012141 concentrate Substances 0.000 description 2
- NKLPQNGYXWVELD-UHFFFAOYSA-M coomassie brilliant blue Chemical compound [Na+].C1=CC(OCC)=CC=C1NC1=CC=C(C(=C2C=CC(C=C2)=[N+](CC)CC=2C=C(C=CC=2)S([O-])(=O)=O)C=2C=CC(=CC=2)N(CC)CC=2C=C(C=CC=2)S([O-])(=O)=O)C=C1 NKLPQNGYXWVELD-UHFFFAOYSA-M 0.000 description 2
- 235000005822 corn Nutrition 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 229940088598 enzyme Drugs 0.000 description 2
- -1 lysine amino acids Chemical class 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 239000011347 resin Substances 0.000 description 2
- 229920005989 resin Polymers 0.000 description 2
- 235000009566 rice Nutrition 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 239000001632 sodium acetate Substances 0.000 description 2
- 235000017281 sodium acetate Nutrition 0.000 description 2
- 239000007974 sodium acetate buffer Substances 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- OIZGSVFYNBZVIK-FHHHURIISA-N 3'-sialyllactose Chemical compound O1[C@@H]([C@H](O)[C@H](O)CO)[C@H](NC(=O)C)[C@@H](O)C[C@@]1(C(O)=O)O[C@@H]1[C@@H](O)[C@H](O[C@H]([C@H](O)CO)[C@H](O)[C@@H](O)C=O)O[C@H](CO)[C@@H]1O OIZGSVFYNBZVIK-FHHHURIISA-N 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- SHZGCJCMOBCMKK-UHFFFAOYSA-N D-mannomethylose Natural products CC1OC(O)C(O)C(O)C1O SHZGCJCMOBCMKK-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- 206010013911 Dysgeusia Diseases 0.000 description 1
- 229930091371 Fructose Natural products 0.000 description 1
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 1
- 239000005715 Fructose Substances 0.000 description 1
- RTVRUWIBAVHRQX-PMEZUWKYSA-N Fucosyllactose Chemical compound C([C@H]1O[C@@H]([C@H]([C@@H](O[C@@H]2[C@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)[C@@H]1O)O)OC)O[C@H]1OC[C@@H](O)[C@H](O)[C@@H]1O RTVRUWIBAVHRQX-PMEZUWKYSA-N 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 241000218228 Humulus Species 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- SHZGCJCMOBCMKK-JFNONXLTSA-N L-rhamnopyranose Chemical compound C[C@@H]1OC(O)[C@H](O)[C@H](O)[C@H]1O SHZGCJCMOBCMKK-JFNONXLTSA-N 0.000 description 1
- PNNNRSAQSRJVSB-UHFFFAOYSA-N L-rhamnose Natural products CC(O)C(O)C(O)C(O)C=O PNNNRSAQSRJVSB-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 108010026552 Proteome Proteins 0.000 description 1
- 229920002684 Sepharose Polymers 0.000 description 1
- 101710163037 Serpin-Z4 Proteins 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 230000032683 aging Effects 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- WQZGKKKJIJFFOK-PHYPRBDBSA-N alpha-D-galactose Chemical compound OC[C@H]1O[C@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-PHYPRBDBSA-N 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 238000012870 ammonium sulfate precipitation Methods 0.000 description 1
- 238000003149 assay kit Methods 0.000 description 1
- 235000019658 bitter taste Nutrition 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 235000014171 carbonated beverage Nutrition 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 235000009508 confectionery Nutrition 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- 102000038379 digestive enzymes Human genes 0.000 description 1
- 108091007734 digestive enzymes Proteins 0.000 description 1
- VHJLVAABSRFDPM-QWWZWVQMSA-N dithiothreitol Chemical compound SC[C@@H](O)[C@H](O)CS VHJLVAABSRFDPM-QWWZWVQMSA-N 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 230000006862 enzymatic digestion Effects 0.000 description 1
- 238000001976 enzyme digestion Methods 0.000 description 1
- 238000000855 fermentation Methods 0.000 description 1
- 230000004151 fermentation Effects 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- IXZISFNWUWKBOM-ARQDHWQXSA-N fructosamine Chemical compound NC[C@@]1(O)OC[C@@H](O)[C@@H](O)[C@@H]1O IXZISFNWUWKBOM-ARQDHWQXSA-N 0.000 description 1
- 229930182830 galactose Natural products 0.000 description 1
- 238000001641 gel filtration chromatography Methods 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- PGLTVOMIXTUURA-UHFFFAOYSA-N iodoacetamide Chemical compound NC(=O)CI PGLTVOMIXTUURA-UHFFFAOYSA-N 0.000 description 1
- 238000004255 ion exchange chromatography Methods 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 238000010844 nanoflow liquid chromatography Methods 0.000 description 1
- 229920001542 oligosaccharide Polymers 0.000 description 1
- 150000002482 oligosaccharides Chemical class 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 108010025221 plasma protein Z Proteins 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 238000004007 reversed phase HPLC Methods 0.000 description 1
- 235000019600 saltiness Nutrition 0.000 description 1
- 238000005185 salting out Methods 0.000 description 1
- 230000035807 sensation Effects 0.000 description 1
- 235000019615 sensations Nutrition 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 230000003068 static effect Effects 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 108091007668 trihex Proteins 0.000 description 1
- 235000019583 umami taste Nutrition 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23L—FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES, NOT OTHERWISE PROVIDED FOR; PREPARATION OR TREATMENT THEREOF
- A23L2/00—Non-alcoholic beverages; Dry compositions or concentrates therefor; Preparation or treatment thereof
- A23L2/52—Adding ingredients
- A23L2/56—Flavouring or bittering agents
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23L—FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES, NOT OTHERWISE PROVIDED FOR; PREPARATION OR TREATMENT THEREOF
- A23L2/00—Non-alcoholic beverages; Dry compositions or concentrates therefor; Preparation or treatment thereof
- A23L2/52—Adding ingredients
- A23L2/66—Proteins
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23L—FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES, NOT OTHERWISE PROVIDED FOR; PREPARATION OR TREATMENT THEREOF
- A23L27/00—Spices; Flavouring agents or condiments; Artificial sweetening agents; Table salts; Dietetic salt substitutes; Preparation or treatment thereof
- A23L27/10—Natural spices, flavouring agents or condiments; Extracts thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/415—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from plants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/81—Protease inhibitors
- C07K14/8107—Endopeptidase (E.C. 3.4.21-99) inhibitors
- C07K14/811—Serine protease (E.C. 3.4.21) inhibitors
- C07K14/8121—Serpins
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12C—BEER; PREPARATION OF BEER BY FERMENTATION; PREPARATION OF MALT FOR MAKING BEER; PREPARATION OF HOPS FOR MAKING BEER
- C12C5/00—Other raw materials for the preparation of beer
- C12C5/02—Additives for beer
- C12C5/026—Beer flavouring preparations
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23V—INDEXING SCHEME RELATING TO FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES AND LACTIC OR PROPIONIC ACID BACTERIA USED IN FOODSTUFFS OR FOOD PREPARATION
- A23V2002/00—Food compositions, function of food ingredients or processes for food or foodstuffs
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Food Science & Technology (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Nutrition Science (AREA)
- Polymers & Plastics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Molecular Biology (AREA)
- Medicinal Chemistry (AREA)
- Biophysics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Botany (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- General Engineering & Computer Science (AREA)
- Peptides Or Proteins (AREA)
- Non-Alcoholic Beverages (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Seasonings (AREA)
Description
〔1〕リジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質であって、下記(a1)~(a3)のいずれかに記載のタンパク質の配列番号1に示されるアミノ酸配列の160番目に相当する位置にあるリジン及び/又は189番目に相当する位置にあるリジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質。
(a1)配列番号1に示されるアミノ酸配列からなるタンパク質
(a2)配列番号1に示されるアミノ酸配列において、160番目及び/又は189番目のリジン以外の領域中に1~9個のアミノ酸が欠失、置換、挿入及び/又は付加されたアミノ酸配列からなるタンパク質
(a3)配列番号1に示されるアミノ酸配列に対して98%以上の同一性を有し、かつ、配列番号1に示されるアミノ酸配列の160番目に相当する位置及び/又は189番目に相当する位置にあるアミノ酸がリジンであるアミノ酸配列からなるタンパク質
〔2〕上記(a1)~(a3)に記載のタンパク質が、大麦由来のタンパク質である上記〔1〕に記載の糖修飾タンパク質。
〔3〕リジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質であって、下記(b1)~(b3)のいずれかに記載のタンパク質の配列番号2に示されるアミノ酸配列の117番目に相当する位置にあるリジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質。
(b1)配列番号2に示されるアミノ酸配列からなるタンパク質
(b2)配列番号2に示されるアミノ酸配列において、117番目のリジン以外の領域中に1~9個のアミノ酸が欠失、置換、挿入及び/又は付加されたアミノ酸配列からなるタンパク質
(b3)配列番号2に示されるアミノ酸配列に対して98%以上の同一性を有し、かつ、配列番号2に示されるアミノ酸配列の117番目に相当する位置にあるアミノ酸がリジンであるアミノ酸配列からなるタンパク質
〔4〕上記(b1)~(b3)に記載のタンパク質が、大麦由来のタンパク質である上記〔3〕に記載の糖修飾タンパク質。
〔5〕下記糖修飾タンパク質(A)及び/又は下記糖修飾タンパク質(B)を含む、コク味付与剤。
糖修飾タンパク質(A):リジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質であって、下記(a1)~(a3)のいずれかに記載のタンパク質の配列番号1に示されるアミノ酸配列の160番目に相当する位置にあるリジン及び/又は189番目に相当する位置にあるリジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質
(a1)配列番号1に示されるアミノ酸配列からなるタンパク質
(a2)配列番号1に示されるアミノ酸配列において、160番目及び/又は189番目のリジン以外の領域中に1~9個のアミノ酸が欠失、置換、挿入及び/又は付加されたアミノ酸配列からなるタンパク質
(a3)配列番号1に示されるアミノ酸配列に対して98%以上の同一性を有し、かつ、配列番号1に示されるアミノ酸配列の160番目に相当する位置及び/又は189番目に相当する位置にあるアミノ酸がリジンであるアミノ酸配列からなるタンパク質
糖修飾タンパク質(B):リジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質であって、下記(b1)~(b3)のいずれかに記載のタンパク質の配列番号2に示されるアミノ酸配列の117番目に相当する位置にあるリジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質
(b1)配列番号2に示されるアミノ酸配列からなるタンパク質
(b2)配列番号2に示されるアミノ酸配列において、117番目のリジン以外の領域中に1~9個のアミノ酸が欠失、置換、挿入及び/又は付加されたアミノ酸配列からなるタンパク質
(b3)配列番号2に示されるアミノ酸配列に対して98%以上の同一性を有し、かつ、配列番号2に示されるアミノ酸配列の117番目に相当する位置にあるアミノ酸がリジンであるアミノ酸配列からなるタンパク質
〔6〕ビールテイストアルコール飲料又はノンアルコールビールテイスト飲料にコク味を付与するために使用される上記〔5〕に記載のコク味付与剤。
〔7〕飲食品にコク味を付与するための、上記糖修飾タンパク質(A)及び/又は上記糖修飾タンパク質(B)の使用。
〔8〕飲食品がビールテイストアルコール飲料又はノンアルコールビールテイスト飲料である上記〔7〕に記載の使用。
〔9〕上記糖修飾タンパク質(A)及び/又は上記糖修飾タンパク質(B)を飲食品に添加する、飲食品にコク味を付与する方法。
〔10〕飲食品がビールテイストアルコール飲料又はノンアルコールビールテイスト飲料である上記〔9〕に記載の方法。
(a1)配列番号1に示されるアミノ酸配列からなるタンパク質
(a2)配列番号1に示されるアミノ酸配列において、160番目及び/又は189番目のリジン以外の領域中に1~9個のアミノ酸が欠失、置換、挿入及び/又は付加されたアミノ酸配列からなるタンパク質
(a3)配列番号1に示されるアミノ酸配列に対して98%以上の同一性を有し、かつ、配列番号1に示されるアミノ酸配列の160番目に相当する位置及び/又は189番目に相当する位置にあるアミノ酸がリジンであるアミノ酸配列からなるタンパク質
上記糖修飾タンパク質を、本発明の第一の態様の糖修飾タンパク質ともいう。
本発明の第一の態様の糖修飾タンパク質は、そのアミノ酸配列の、配列番号1に示されるアミノ酸配列の160番目に相当する位置及び/又は189番目に相当する位置のアミノ酸がリジンである。本発明の第一の態様の糖修飾タンパク質は、配列番号1に示されるアミノ酸配列の160番目に相当する位置にあるリジン及び/又は189番目に相当する位置にあるリジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質である。
配列番号1の160番目に相当する位置のリジン及び/又は189番目に相当する位置のリジンの特定は、例えば、ClustalW、NCBIのProtein Blastのような既知の配列比較プログラムを用いて行うことができる。ClustalWは、通常、デフォルトパラメーターを用いることができる。ClustalWは、日本DNAデータバンク(Data Bank of Japan:DDBJ)、欧州バイオインフォマティクス研究所(European Bioinformatics Institute:EBI)等のウェブサイトから利用することができる。比較を行いたい2つのポリペプチドのアミノ酸配列を入力してプログラムを実行することによって、アミノ酸配列の相同性に基づくアラインメントを行うことができる。ここで、配列番号1のアミノ酸配列を、2つのポリペプチドの1つとして入力することによって、任意のポリペプチドの特定位置の残基が、配列番号1のポリペプチドにおいてどの位置に相当するかを容易に特定することができる。
例えば、配列番号2に示されるアミノ酸配列において、配列番号1の189番目に相当する位置にあるアミノ酸は、190番目のリジンである。
糖は、単糖、二糖、三糖以上のオリゴ糖、多糖のいずれであってもよい。好ましくは、単糖、二糖又は三糖であり、より好ましくは、単糖又は二糖である。
単糖としては、還元糖が挙げられ、グルコース、フルクトース、ガラクトース、マンノース、ラムノース、アラビノース、キシロースを含む全ての単糖が挙げられる。単糖は、D型であることが好ましい。
二糖としては、還元糖が挙げられ、例えば、マルトース、イソマルトース、ラクトース等のマルトース型二糖が挙げられる。
三糖としては、マルトトリオース、イソマルトトリオース、セルトリオース、フコシルラクトース、シアリルラクトース等が挙げられる。
一態様において、上記糖として、ビールに含有される糖が好ましい。一態様において、リジンの側鎖アミノ基に結合している単糖として、例えば、グルコース、アラビノース、キシロース等が好ましい。二糖として、マルトース、イソマルトース等が好ましい。三糖として、マルトトリオース、イソマルトトリオース等が好ましい。
上記(a1)に記載のタンパク質において、配列番号1の160番目に相当する位置は、そのアミノ酸配列の160番目であり、189番目に相当する位置は、そのアミノ酸配列の189番目である。
アミノ酸配列の同一性は、例えば、BLAST等の解析ソフトウェアを用いて、デフォルトのパラメータにより算出することができる。
一態様において、本発明の第一の態様の糖修飾タンパク質は、上記(a1)~(a3)のいずれかに記載のタンパク質(好ましくは(a1)のタンパク質)において、配列番号1に示されるアミノ酸配列の160番目に相当する位置にあるリジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質であることが好ましい。
(b1)配列番号2に示されるアミノ酸配列からなるタンパク質
(b2)配列番号2に示されるアミノ酸配列において、117番目のリジン以外の領域中に1~9個のアミノ酸が欠失、置換、挿入及び/又は付加されたアミノ酸配列からなるタンパク質
(b3)配列番号2に示されるアミノ酸配列に対して98%以上の同一性を有し、かつ、配列番号2に示されるアミノ酸配列の117番目に相当する位置にあるアミノ酸がリジンであるアミノ酸配列からなるタンパク質
上記(b1)~(b3)のいずれかに記載のタンパク質の配列番号2に示されるアミノ酸配列の117番目に相当する位置にあるリジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質を、本発明の第二の態様の糖修飾タンパク質ともいう。
本発明の第二の態様の糖修飾タンパク質は、そのアミノ酸配列の、配列番号2に示されるアミノ酸配列の117番目に相当する位置のアミノ酸がリジンである。本発明の第二の態様の糖修飾タンパク質は、配列番号2に示されるアミノ酸配列の117に相当する位置にあるリジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質である。
本発明の第二の態様の糖修飾タンパク質において、リジンの側鎖アミノ基に結合している糖及びその好ましい態様は、上記の第一の態様の糖修飾タンパク質と同じである。
配列番号2に示されるアミノ酸配列の117番目に相当する位置のリジンを、上記(b1)、(b2)又は(b3)の任意のタンパク質(ポリペプチド)において特定することは、容易である。配列番号2の117番目に相当する位置のリジンを、上記(b1)、(b2)又は(b3)のタンパク質(ポリペプチド)において特定する場合、既知の配列比較プログラムを用いて上記の本発明の第一の態様の糖修飾タンパク質の場合と同じ方法で特定することができる。
上記(b1)に記載のタンパク質において、配列番号2の117番目に相当する位置は、そのアミノ酸配列の117番目である。
(b21)配列番号2に示されるアミノ酸配列において、173番目がアラニンであるアミノ酸配列からなるタンパク質
(b22)配列番号2に示されるアミノ酸配列において、292番目がトレオニンであるアミノ酸配列からなるタンパク質
(b23)配列番号2に示されるアミノ酸配列において、303番目がグルタミン酸であるアミノ酸配列からなるタンパク質
(b24)配列番号2に示されるアミノ酸配列において、325番目がロイシンであるアミノ酸配列からなるタンパク質
本発明の糖修飾タンパク質の製造方法は特に制限されない。本発明の糖修飾タンパク質は、例えば、穀類又はこれを原料にして醸造したビール等から精製することができる。穀類は、好ましくは大麦であり、より好ましくは大麦麦芽である。一態様において、麦芽は、北米産麦芽を使用することが好ましい。
得られたタンパク質のリジンのアミノ基がグリケーションされていることの確認は、NBT(Nitroblue tetrazolium)法により、グリケーションされたリジンを比色定量することにより行うことができる。
本発明の糖修飾タンパク質は、飲食品にコク味を付与するために有用である。本発明の糖修飾タンパク質を飲食品に含有させると、当該タンパク質の比率が高いほど、よりコク味を付与することができる。
本発明において、「コク味」とは、5基本味、すなわち、甘味、塩味、酸味、苦味及びうま味では表せない感覚であり、味の強さ(飲み応え)、味の広がり、味の厚み、味の経時変化(余韻又は持続性)等によって表される感覚である。本発明においてコク味を付与するとは、例えば、コク味を有しない飲食品に、コク味を付与すること、コク味を有する飲食品のコク味を増強することを含む。コク味の有無や程度は、官能評価によって評価することができる。
本発明の第一の態様の糖修飾タンパク質(糖修飾タンパク質(A))、及び/又は、本発明の第二の態様の糖修飾タンパク質(糖修飾タンパク質(B))を含むコク味付与剤も、本発明に包含される。
本発明のコク味付与剤は、上記(a1)~(a3)のいずれかに記載のタンパク質の配列番号1に示されるアミノ酸配列の160番目に相当する位置にあるリジン及び/又は189番目に相当する位置にあるリジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質、及び/又は、上記(b1)~(b3)のいずれかに記載のタンパク質の配列番号2に示されるアミノ酸配列の117番目に相当する位置にあるリジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質を含む。
本発明の第一の態様の糖修飾タンパク質(糖修飾タンパク質(A))、及び/又は、本発明の第二の態様の糖修飾タンパク質(糖修飾タンパク質(B))を飲食品に含有させると、当該飲食品にコク味を付与することができる。
第一の態様の糖修飾タンパク質、及び/又は、本発明の第二の態様の糖修飾タンパク質を飲食品に添加する、飲食品にコク味を付与する方法も本発明に包含される。
上記使用及び方法においては、上記(a1)~(a3)のいずれかに記載のタンパク質の配列番号1に示されるアミノ酸配列の160番目に相当する位置にあるリジン及び/又は189番目に相当する位置にあるリジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質、及び/又は、上記(b1)~(b3)のいずれかに記載のタンパク質の配列番号2に示されるアミノ酸配列の117番目に相当する位置にあるリジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質を使用する。
本発明の糖修飾タンパク質を飲食品に添加する方法は特に限定されず、予め製造に用いる原料に混合しておく方法、飲食品の製造工程において、任意の工程で添加する方法等が挙げられる。飲食品にコク味を付与する方法においては、上記コク味付与剤を飲食品に添加することができる。飲食品は、好ましくはビールテイストアルコール飲料又はノンアルコールビールテイスト飲料である。上記使用及び方法においては、本発明の糖修飾タンパク質の少なくとも1種を使用する。本発明の第一の態様の糖修飾タンパク質は、1種を単独で使用してもよく、2種以上を組み合わせて使用してもよい。本発明の第二の態様の糖修飾タンパク質は、1種を単独で使用してもよく、2種以上を組み合わせて使用してもよい。
一態様において、上記使用及び方法においては、本発明の第一の態様の糖修飾タンパク質及び本発明の第二の態様の糖修飾タンパク質を使用することが好ましい。上記使用及び方法においては、本発明の第一の態様の糖修飾タンパク質又は本発明の第二の態様の糖修飾タンパク質を使用してもよい。一態様において、上記使用及び方法においては、上記糖修飾タンパク質(a1)及び/又は糖修飾タンパク質(b1)を使用することが好ましく、糖修飾タンパク質(a1)及び糖修飾タンパク質(b1)を使用することがより好ましい。
北米産麦芽を適当な粒度に粉砕し仕込み槽に入れた後温水と混ぜ合わせた。麦芽酵素に適した温度で、糖化に充分な時間保持し、麦芽の酵素の働きででんぷん質を糖分に変換させ、糖化液を製造した。その後、糖化液をろ過してホップを加え、煮沸し、熱麦汁を製造し、発酵に備えた。熱麦汁を冷却し、これにビール酵母を加えた。数日の間に酵母の働きにより、麦汁中の糖分をアルコールと炭酸ガスに分解させ若ビールを製造した。若ビールを貯酒タンクに移し、低温で数十日間貯蔵した。この間にビールを熟成させ、ビールの味と香りを調和させた。熟成終了後、ビールをろ過し瓶詰を行った。
陽イオン交換樹脂SP Sepharose50mLを空きカラムに入れた。
ビール(I)を樹脂に吸着させた。その後、吸着させた樹脂をカラムに移し替え、20mM酢酸ナトリウム緩衝液(pH4.5)で洗浄、次いで20mM酢酸ナトリウム(pH4.5)+0.5M-NaClで溶出し、画分を集めた。得られた画分をSDS-PAGEで評価し、40kDaの糖修飾タンパク質(40kDaタンパク質)が含まれる画分を集め陽イオン交換樹脂結合画分とした。
水洗浄した限外ろ過ユニット(Merck社製 Amicon Ultra-15 30K)に(1)で得られた陽イオン交換樹脂結合画分を添加し、遠心(3500rpm、10分間、室温)し限外ろ過し濃縮液を得た。
20mMリン酸バッファー(pH7.0)+2M硫酸アンモニウムをビーカーに入れ、これに(2)で得た濃縮液を滴下、攪拌した。次に懸濁液を遠心(2330g、10分間、室温)した。上清を別容器に集めた。集めた溶液は限外ろ過ユニットを用いて濃縮した。濃縮液に20mM酢酸ナトリウム(pH4.5)を加え遠心(2330g、10分間、室温)し、濃縮を行い、40kDaタンパク質の精製品(Bradford定量(ウシ血清アルブミン(BSA)換算)、20.4mg/mL、2.21mL)を得た。得られた40kDaタンパク質の精製品の純度をSDS-PAGEで確認した。
40kDaタンパク質の解析を下記に従い行った。
(1)ゲル片の調製
精製した40kDaタンパク質溶液(濃度1mg/mL、20mM酢酸ナトリウムバッファー(pH4.5))10μLをSDS-PAGEで泳動しCBB(クマシーブリリアントブルー)で染色後、40kDaタンパク質のゲルを切り出した。
切り出したゲル片を細切し、ジチオスレイトールによる還元(56℃、1時間)、ヨードアセトアミドによるカルバミドメチル化(遮光下,室温,45分間)を行った。次いで0.01%ProteaseMax含有10ng/μLキモトリプシン溶液(5mM塩化カルシウム,50mM炭酸水素アンモニウム溶液)15μL、5mM塩化カルシウム、50mM炭酸水素アンモニウム溶液15μLを添加し一晩インキュベートした後、酵素消化液を回収した。回収した溶液を減圧乾固し、0.1%ギ酸溶液に再溶解した。
これをLC-MS/MS分析に使用した。
LC-MS/MSの測定は下記の条件で行った。
使用装置:ダイレクトフローnanoLCシステムEasy-nLC 1000TM (Thermo Scientific)
トラップカラム:Acclaim PepMap(登録商標)(Thermo Scientific)
分析カラム:NANO HPLC CAPILLARY COLUMN(日京テクノス(株))
液体クロマトグラフ質量分析計:Q Exactive Plus(Thermo Scientific)
移動相:A液:0.1%ギ酸/水、B液:0.1%ギ酸/アセトニトリル
流速:300nL/min
グラジエント:0-40%B/0-30min、40-60%B/30-35min、60-90%B/35-37min、90%B/37-45min
注入量:10μL
イオン化モード:ESI Positive
測定範囲:MS1(m/z 350-1750)
Data Dependent Scanモード
タンパク質同定および修飾検索は下記の条件で行った。
検索ソフト:Proteome Discoverer 2.2.0.388(ThermoFisher社製)
生物種:大麦(Hordeum vulgare)、ホップ(Humulus)、酵母(Saccharomyces cerevisiae)
検索条件:消化酵素:Chymotrypsin
修飾(Static):Carbamidomethyl (Cysteine)
修飾(Dynamic):Oxidation(Methionine), Hex(K, R, Protein N-term)、 Hex(2)(K, R, Protein N-term)、Hex(3)(K, R, Protein N-term)、Acetyl(Protein N-term)
プリカーサーイオン質量誤差範囲:Monoisotopic、±10ppm
プロダクトイオン質量誤差範囲:±0.02Da
最大ミスクリベージ数:5
コンフィデンスレベル(Percolator):High(確からしさ3段階のうち最も確率が高いレベル)
データベース:SwissProt
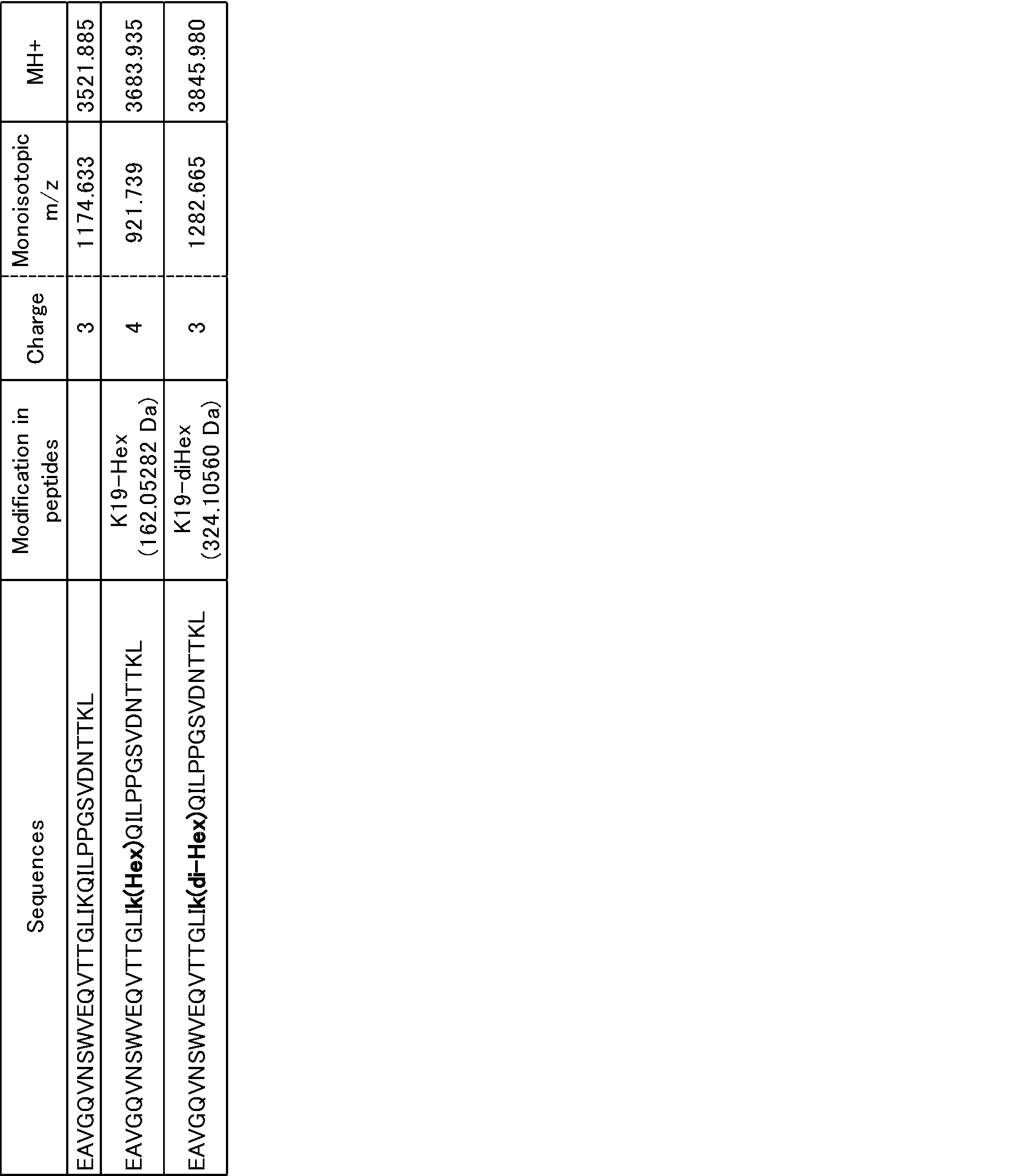
表1~4に、ビールから精製した大麦由来Serpin Z4のアミノ酸配列(配列番号1に示すアミノ酸配列)の142~174番目のアミノ酸からなるペプチド断片
(EAVGQVNSWVEQVTTGLIKQILPPGSVDNTTKL(配列番号3))(Z4(142-174)ペプチドとも記載する)をLC-MS/MSで分析した結果を示す。
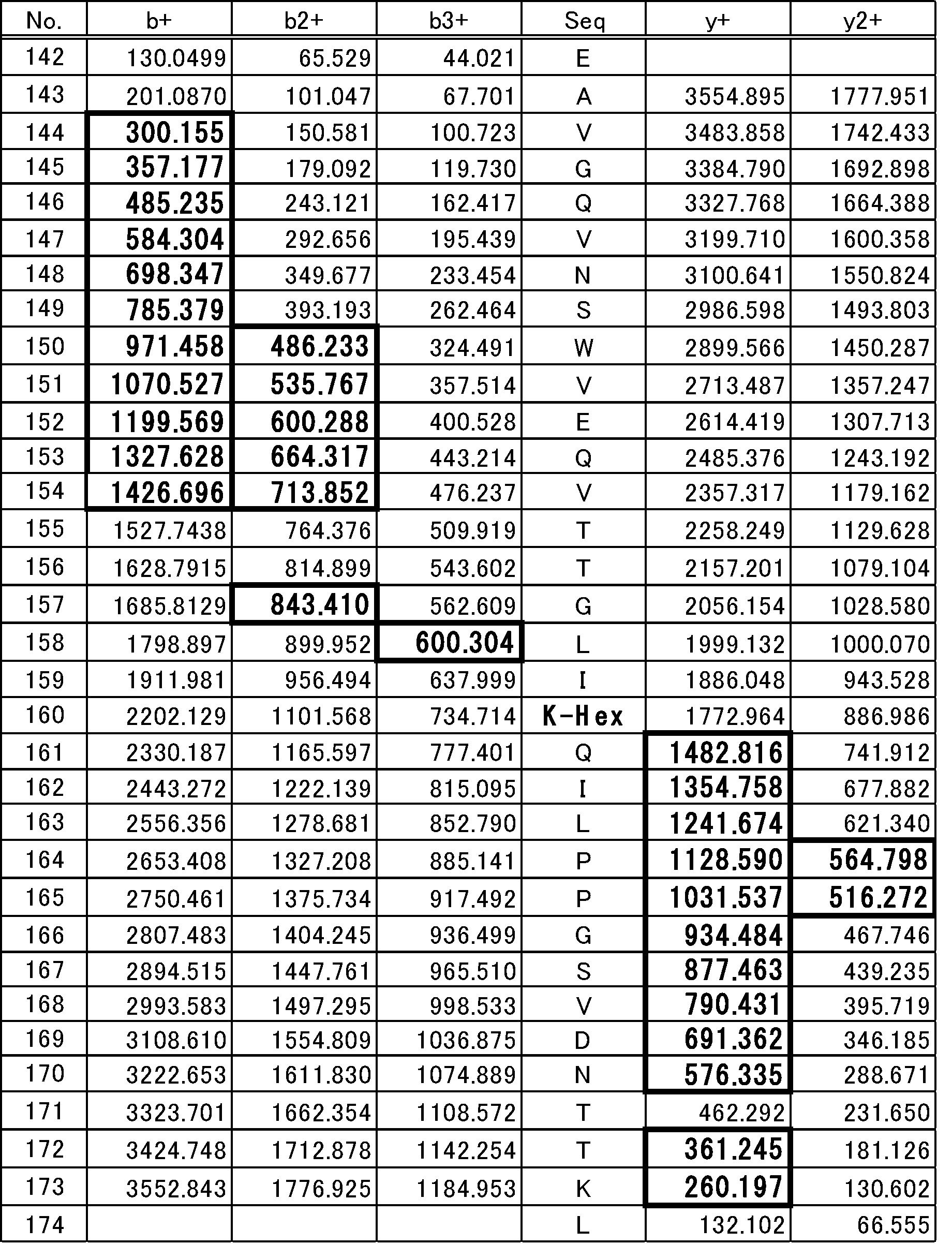
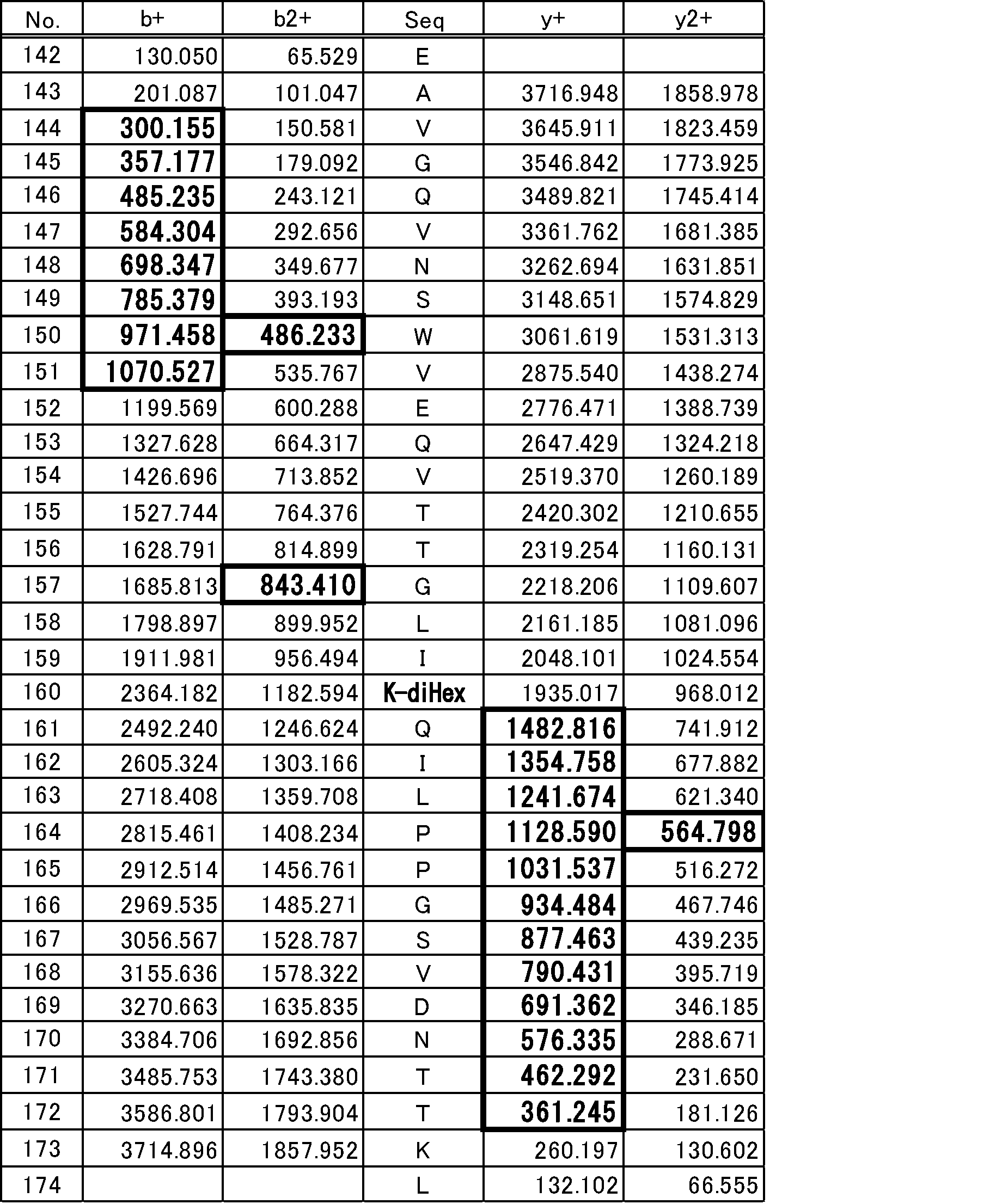
表1には、LC-MSによるペプチド断片のプリカーサーイオンのm/z値を示す。表2~4に、表1に示すLC-MS/MSによるペプチド断片のフラグメントイオンのm/z値を示す。
表2は、表1に示すMH+3521.885Daのペプチドのフラグメントイオンの分析結果である。MH+3521.885Daのペプチドのフラグメントイオンは、糖修飾がないZ4(142-174)ペプチドのフラグメントイオンである。表3は、表1に示すMH+3683.935Daのペプチドのフラグメントイオンの分析結果である。表4は、表1に示すMH+3845.980Daのペプチドのフラグメントイオンの分析結果である。
表2のb+、b2+及びy+の欄の検出されたNo.160~173のm/z値と、表3のb+、b2+及びy+の欄のNo.160~173のm/z値とから、MH+3683.935DaのペプチドのフラグメントイオンのNo.160のリジン(K160)には、ヘキソースに相当する162Daが付加していることが分かった。このことから、MH+3683.935Daのペプチドには、K160にヘキソース1個が付加した修飾配列構造を有するペプチドが含まれることが分かった。表2のb+、b2+及びy+の欄のNo.160~173のm/z値と、表4のb+、b2+及びy+の欄のNo.160~173のm/z値とから、MH+3845.980DaのペプチドのフラグメントイオンのNo.160のリジン(K160)には、ジヘキソースに相当する324Daが付加していることが分かった。よって、MH+3845.980Daのペプチドのフラグメントイオンには、K160にジヘキソースが付加した修飾配列構造を持つペプチドが含まれることがわかった。
表6のb+及びy+の欄のNo.189~199のm/z値と、表7のb+、b2+及びy+の欄のNo.189~199のm/z値とから、MH+2472.064DaのペプチドのフラグメントイオンのNo.189のリジン(K189)には、ヘキソースに相当する162Daが付加していることが分かった。よって、MH+2472.064Daのペプチドのフラグメントイオンには、K189にヘキソース1個が付加した修飾配列構造を有するペプチドが含まれることが分かった。
表6のb+、b2+及びy+の欄のNo.189~199のm/z値と、表8のb+、b2+及びy+の欄のNo.189~199のm/z値とから、MH+2634.118DaのペプチドのフラグメントイオンのNo.189のリジン(K189)には、ジヘキソースに相当する324Daが付加していることが分かった。このことから、MH+2634.118Daのペプチドのフラグメントイオンには、K189にヘキソース2個が付加した修飾配列構造を持つペプチドが含まれることがわかった。配列番号1に示すアミノ酸配列の160番目のリジン(K160)、189番目のリジン(K189)の1以上のリジンのアミノ基がグリケーションされたSerpin Z4は、これまで報告されていないものである。
糖修飾Serpin Z4のリジンに付加しているヘキソースは、グルコース又はキシロースであると推定された。ジヘキソースは、マルトース又はイソマルトースであると推定された。
異なるビール3種より糖修飾タンパクを精製し、精製糖修飾タンパク質をビールに添加して官能評価を行った。大麦由来Serpin Z4における160番目及び/又は189番目のリジンのグリケーションと、コク味付与効果との関連性を調べた。
実施例1のビール(I)からのタンパク精製と同様にして、ビール3種(ビールB、C、D)より40kDaの糖修飾タンパクを精製し、糖修飾タンパク質を含む溶液を得た。
下記の方法により、ビール3種(B、C又はD)より精製した糖修飾タンパクを含む溶液のタンパク質濃度及びグリケーションしたリジンの濃度を求めた。
側鎖アミノ基がグリケーションされたリジンの濃度は、Fructosamine Assay kit(abcam社製品、ab228558)を用いてNBT(Nitroblue tetrazolium)法にて比色定量した。
サンプル及びブランクにつき試験数はn=2として、平均値を採用した。
各ビールから精製した糖修飾タンパクを含む溶液中のグリケーションされたリジンのアミノ基の量(nmol/mL)を求めた。また、各ビールから精製した糖修飾タンパクを含む溶液中のタンパク質濃度(mg/mL)を、Bradford法(BSA換算)で測定した。
糖修飾タンパクを含む溶液中のグリケーションされたリジンのアミノ基の量(nmol/mL)を、タンパク質濃度(mg/mL)で除して、精製糖修飾タンパク質の重量あたりのグリケーションされたリジンのアミノ基の濃度(nmol/mg-protein)を求めた。
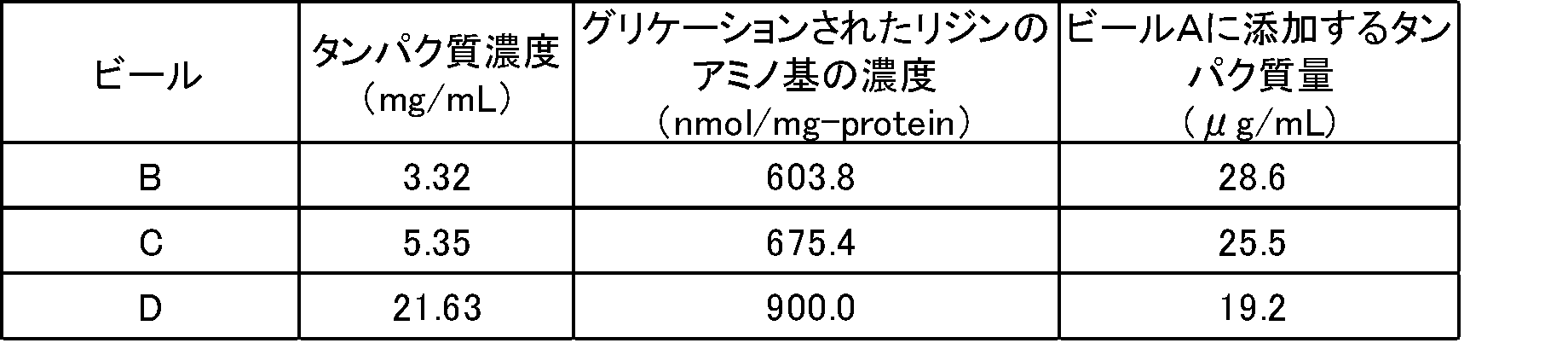
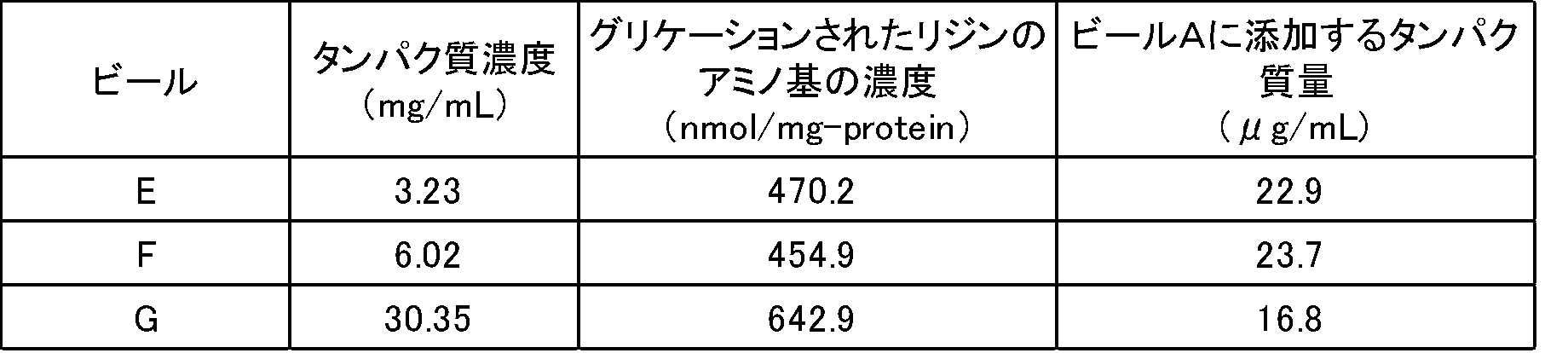
ビール3種(B、C、D)より精製した糖修飾タンパクを含む溶液中のグリケーションされたリジンのアミノ基の濃度およびタンパク質濃度(Bradford法(BSA換算)で測定)の分析結果を表9に示した。なお表9に示すグリケーションされたリジンのアミノ基の濃度は、精製糖修飾タンパク質の重量あたりのグリケーションされたリジンのアミノ基の濃度である。
ビール3種(B、C、D)から精製した糖修飾タンパク質を含む溶液を市販のビールAに添加して官能評価を行った。この際に、官能評価サンプル中のグリケーションされたリジンの濃度が同じになるように、ビールB、C又はDから精製した糖修飾タンパク質溶液をビールAに添加し、サンプルB、サンプルC及びサンプルDを得た。サンプルBは、ビールBから精製した糖修飾タンパク質溶液を添加したサンプルであり、サンプルCは、ビールCから精製した糖修飾タンパク質溶液を添加したサンプルであり、サンプルDは、ビールDから精製した糖修飾タンパク質溶液を添加したサンプルである。市販ビールAの総プリン体濃度は10.39mg/100mLであった。総プリン体濃度は、日本食品分析センターで分解法にて実施した。
市販のビールA(コントロール(添加なし))並びにサンプルB、C及びDの官能評価を行った。官能評価は、糖修飾タンパク質の添加をしていない市販ビールAのコク味を基準点の1.5点とし、専門パネル4名により0.1点刻みでスコア化した。そのスコア値を平均化した。
コク味は以下の基準とした。
0点:全く感じられない
1点:やや感じられる
2点:明確に感じる
3点:非常に強く感じる
ビール3種(B、C、D)より精製した糖修飾タンパク質の修飾解析を実施例1と同様の方法で行った。Serpin Z4(配列番号1)のアミノ酸配列の142~174番目のアミノ酸からなり、糖修飾がされていないペプチド断片(EAVGQVNSWVEQVTTGLIKQILPPGSVDNTTKL(配列番号3)、未修飾Z4(142-174)ペプチド)のLC-MSイオンの面積値および側鎖アミノ基に糖が付加している160番目のリジン(K160)を含む当該ペプチド断片(糖修飾Z4(142-174)ペプチド)のLC-MSイオン面積値を算出した。さらにこれらの面積値をもとに、ビール3種から精製した糖修飾タンパクについて、(糖修飾Z4(142-174)ペプチドのイオン面積値合算)/(未修飾Z4(142-174)ペプチドのイオン面積値)を求め、未修飾のZ4(142-174)ペプチドに対する、K160の側鎖アミノ基がグリケーションされている糖修飾Z4(142-174)ペプチドの割合の比較を行った(図1)。(未修飾体、修飾体のペプチドによってLC-MSのイオン化効率が同じでない可能性も考慮し、ビール3種の各サンプルを横並びで面積比を比較した。)
糖修飾Serpin Z7の詳細な修飾解析には、LC-MS/MSによるターゲットモニタリングを実施した。
実施例1と同じ方法で、LC-MS/MS分析のためのサンプルを調製した。Data Dependent Scanモードをターゲットイオンモニタリングに変更した以外は、実施例1と同様の方法でLC-MS/MS測定を行った。ターゲットイオンはm/z524.788、m/z605.814、m/z686.840、m/z767.868を用いた。
表11には、LC-MSによるペプチド断片のプリカーサーイオンのm/z値を示す。表12~15に、表11に示すLC-MS/MSによるペプチド断片のフラグメントイオンのm/z値を示す。
表12は、表11に示すMH+1048.566Daのペプチドのフラグメントイオンの分析結果である。MH+1048.566Daのペプチドのフラグメントイオンは、糖修飾がないZ7(115-123)ペプチドのフラグメントイオンである。表13は、表11に示すMH+1210.619Daのペプチドのフラグメントイオンの分析結果である。表14は、表11に示すMH+1372.670Daのペプチドのフラグメントイオンの分析結果である。表15は、表11に示すMH+1534.729Daのペプチドのフラグメントイオンの分析結果である。
表12及び表13のb+、b2+及びy+欄の検出されたm/z値から、MH+1210.619DaのペプチドのフラグメントイオンのNo.117のリジン(K117)には、ヘキソースに相当する162Daが付加していることが分かった。このことから、MH+1210.619Daのペプチドのフラグメントイオンには、K117にヘキソース1個が付加した修飾配列構造を有するペプチドが含まれることが分かった。表12及び表13のb+、b2+及びy+欄の検出されたm/z値から、MH+1372.670DaのペプチドのフラグメントイオンのNo.117のリジン(K117)には、ジヘキソースに相当する324Daが付加していることが分かった。よって、MH+1372.670Daのペプチドのフラグメントイオンには、K117にジヘキソースが付加した修飾配列構造を持つペプチドが含まれることがわかった。表12及び表13のb+、b2+及びy+欄の検出されたm/z値から、MH+1534.729DaのペプチドのフラグメントイオンのNo.117のリジン(K117)には、トリヘキソースに相当する486Daが付加していることが分かった。よって、MH+1534.729Daのペプチドのフラグメントイオンには、K117にトリヘキソースが付加した修飾配列構造を持つペプチドが含まれることがわかった。
配列番号2に示すアミノ酸配列の117番目のリジン(K117)のアミノ基がグリケーションされたSerpin Z7は、これまで報告されていないものである。
糖修飾Serpin Z7のリジンに付加しているヘキソースは、グルコース又はキシロースであると推定された。ジヘキソースは、マルトース又はイソマルトースであると推定された。トリヘキソースは、マルトトリオース又はイソマルトトリオースであると推定された。
(ビール3種から糖修飾タンパク40kDaの精製)
実施例1のビール(I)からのタンパク精製と同様にして、ビール3種(ビールE、F、G)より40kDaの糖修飾タンパクを精製し、糖修飾タンパク質を含む溶液を得た。
実施例2と同じ方法で、ビール3種(E、F又はG)より精製した糖修飾タンパクを含む溶液のタンパク質濃度(mg/mL)及び精製糖修飾タンパク質の重量あたりのグリケーションされたリジンのアミノ基の濃度(nmol/mg-protein)を求めた。
ビール3種(E、F又はG)より精製した糖修飾タンパクを含む溶液中のグリケーションされたリジンのアミノ基の濃度およびタンパク質濃度(Bradford法(BSA換算)で測定)の分析結果を表16に示した。なお表16に示すグリケーションされたリジンのアミノ基の濃度は、精製糖修飾タンパク質の重量あたりのグリケーションされたリジンのアミノ基の濃度である。
ビール3種(E、F又はG)から精製した糖修飾タンパク質を含む溶液を市販のビールAに添加して官能評価を行った。この際に、官能評価サンプル中のグリケーションされたリジンの濃度が同じになるように、ビールE、F又はGから精製した糖修飾タンパク質溶液をビールAに添加し、サンプルE、サンプルF及びサンプルGを得た。サンプルEは、ビールEから精製した糖修飾タンパク質溶液を添加したサンプルであり、サンプルFは、ビールFから精製した糖修飾タンパク質溶液を添加したサンプルであり、サンプルGは、ビールGから精製した糖修飾タンパク質溶液を添加したサンプルである。
0.05点刻みでスコア付けをした以外は、実施例2の官能評価と同じ方法で、専門パネル4名により、市販のビールA(コントロール(添加なし))並びにサンプルE、F及びGの官能評価を行い、コク味を評価した。
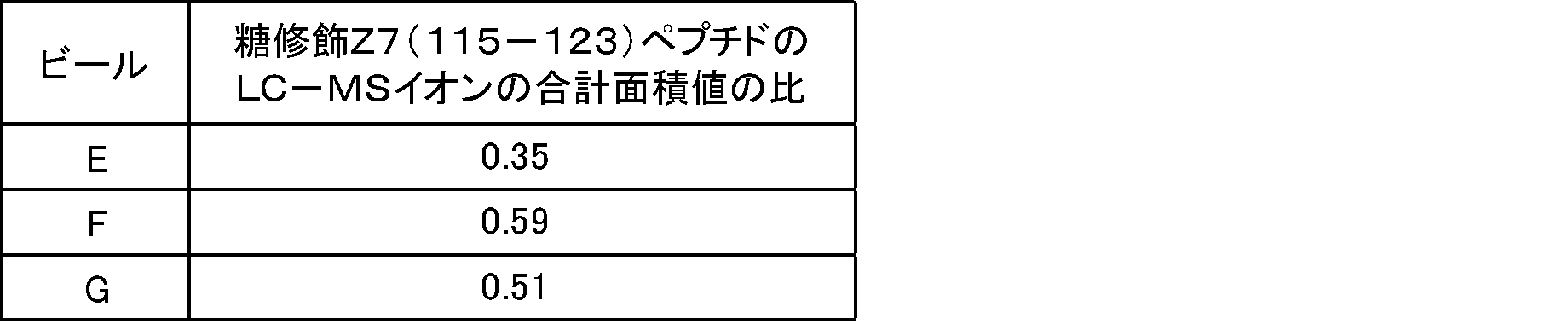
スコアの平均点を表17に示す。表17のコントロール(添加なし)は、糖修飾タンパク質を添加していないビールAである。その結果、表17に示すようにコク味の強度は、サンプルFが一番強く、次いでサンプルG、サンプルEであった。
ビール3種(E、F、G)より精製した糖修飾タンパク質の修飾解析を実施例1と同様の方法で行った。Serpin Z7(配列番号2)のアミノ酸配列の115~123番目のアミノ酸からなり、糖修飾がされていないペプチド断片(SLKPSFQEL(配列番号5)、未修飾Z7(115-123)ペプチド)のLC-MSイオンの面積値および側鎖アミノ基に糖が付加している117番目のリジン(K117)を含む当該ペプチド断片(糖修飾Z7(115-123)ペプチド)のLC-MSイオン面積値を算出した。さらにこられの面積値をもとに、ビール3種から精製した糖修飾タンパクについて、未修飾Z7(115-123)ペプチドのイオン面積値に対する、糖修飾Z7(115-123)ペプチドのイオン面積値合算の比(糖修飾Z7(115-123)ペプチドのイオン面積値合算)/(未修飾Z7(115-123)ペプチドのイオン面積値)を求め、未修飾のZ7(115-123)ペプチドに対する、K117の側鎖アミノ基がグリケーションされている糖修飾Z7(115-123)ペプチドの割合の比較を行った。(未修飾体、修飾体のペプチドによってLC-MSのイオン化効率が同じでない可能性も考慮し、ビール3種の各サンプルを横並びで面積比を比較した。)
表18に、上記の未修飾Z7(115-123)ペプチドのイオン面積値に対する、糖修飾Z7(115-123)ペプチドのイオン面積値合算の比(糖修飾Z7(115-123)ペプチドのLC-MSイオンの合計面積値の比)を示す。
「糖修飾Z7(115-123)ペプチドのイオン面積値合算」は、117番目のリジンの側鎖に単糖(Hex)が結合しているZ7(115-123)ペプチドのイオン面積、当該リジンの側鎖に二糖(diHex)が結合しているZ7(115-123)ペプチドのイオン面積及び当該リジンの側鎖に三糖(triHex)が結合しているZ7(115-123)ペプチドのイオン面積の合計である。「未修飾Z7(115-123)ペプチドのイオン面積値」は、117番目のリジンの側鎖に糖が結合していない(K117の側鎖が未修飾)Z7(115-123)ペプチドのイオン面積である。
Claims (10)
- リジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質であって、下記(a1)~(a3)のいずれかに記載のタンパク質の配列番号1に示されるアミノ酸配列の160番目に相当する位置にあるリジン及び/又は189番目に相当する位置にあるリジンの側鎖アミノ基に、グルコース、マルトース又はイソマルトースが結合している糖修飾タンパク質。
(a1)配列番号1に示されるアミノ酸配列からなるタンパク質
(a2)配列番号1に示されるアミノ酸配列において、160番目及び/又は189番目のリジン以外の領域中に1~9個のアミノ酸が欠失、置換、挿入及び/又は付加されたアミノ酸配列からなるタンパク質
(a3)配列番号1に示されるアミノ酸配列に対して98%以上の同一性を有し、かつ、配列番号1に示されるアミノ酸配列の160番目に相当する位置及び/又は189番目に相当する位置にあるアミノ酸がリジンであるアミノ酸配列からなるタンパク質 - 前記(a1)~(a3)に記載のタンパク質が、大麦由来のタンパク質である請求項1に記載の糖修飾タンパク質。
- リジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質であって、下記(b1)~(b3)のいずれかに記載のタンパク質の配列番号2に示されるアミノ酸配列の117番目に相当する位置にあるリジンの側鎖アミノ基に、グルコース、マルトース、イソマルトース、マルトトリオース又はイソマルトトリオースが結合している糖修飾タンパク質。
(b1)配列番号2に示されるアミノ酸配列からなるタンパク質
(b2)配列番号2に示されるアミノ酸配列において、117番目のリジン以外の領域中に1~9個のアミノ酸が欠失、置換、挿入及び/又は付加されたアミノ酸配列からなるタンパク質
(b3)配列番号2に示されるアミノ酸配列に対して98%以上の同一性を有し、かつ、配列番号2に示されるアミノ酸配列の117番目に相当する位置にあるアミノ酸がリジンであるアミノ酸配列からなるタンパク質 - 前記(b1)~(b3)に記載のタンパク質が、大麦由来のタンパク質である請求項3に記載の糖修飾タンパク質。
- 下記糖修飾タンパク質(A)及び/又は下記糖修飾タンパク質(B)を含む、コク味付与剤。
糖修飾タンパク質(A):リジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質であって、下記(a1)~(a3)のいずれかに記載のタンパク質の配列番号1に示されるアミノ酸配列の160番目に相当する位置にあるリジン及び/又は189番目に相当する位置にあるリジンの側鎖アミノ基に、グルコース、マルトース又はイソマルトースが結合している糖修飾タンパク質
(a1)配列番号1に示されるアミノ酸配列からなるタンパク質
(a2)配列番号1に示されるアミノ酸配列において、160番目及び/又は189番目のリジン以外の領域中に1~9個のアミノ酸が欠失、置換、挿入及び/又は付加されたアミノ酸配列からなるタンパク質
(a3)配列番号1に示されるアミノ酸配列に対して98%以上の同一性を有し、かつ、配列番号1に示されるアミノ酸配列の160番目に相当する位置及び/又は189番目に相当する位置にあるアミノ酸がリジンであるアミノ酸配列からなるタンパク質
糖修飾タンパク質(B):リジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質であって、下記(b1)~(b3)のいずれかに記載のタンパク質の配列番号2に示されるアミノ酸配列の117番目に相当する位置にあるリジンの側鎖アミノ基に、グルコース、マルトース、イソマルトース、マルトトリオース又はイソマルトトリオースが結合している糖修飾タンパク質
(b1)配列番号2に示されるアミノ酸配列からなるタンパク質
(b2)配列番号2に示されるアミノ酸配列において、117番目のリジン以外の領域中に1~9個のアミノ酸が欠失、置換、挿入及び/又は付加されたアミノ酸配列からなるタンパク質
(b3)配列番号2に示されるアミノ酸配列に対して98%以上の同一性を有し、かつ、配列番号2に示されるアミノ酸配列の117番目に相当する位置にあるアミノ酸がリジンであるアミノ酸配列からなるタンパク質 - ビールテイストアルコール飲料又はノンアルコールビールテイスト飲料にコク味を付与するために使用される、請求項5に記載のコク味付与剤。
- 飲食品にコク味を付与するための、下記糖修飾タンパク質(A)及び/又は下記糖修飾タンパク質(B)の使用。
糖修飾タンパク質(A):リジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質であって、下記(a1)~(a3)のいずれかに記載のタンパク質の配列番号1に示されるアミノ酸配列の160番目に相当する位置にあるリジン及び/又は189番目に相当する位置にあるリジンの側鎖アミノ基に、グルコース、マルトース又はイソマルトースが結合している糖修飾タンパク質
(a1)配列番号1に示されるアミノ酸配列からなるタンパク質
(a2)配列番号1に示されるアミノ酸配列において、160番目及び/又は189番目のリジン以外の領域中に1~9個のアミノ酸が欠失、置換、挿入及び/又は付加されたアミノ酸配列からなるタンパク質
(a3)配列番号1に示されるアミノ酸配列に対して98%以上の同一性を有し、かつ、配列番号1に示されるアミノ酸配列の160番目に相当する位置及び/又は189番目に相当する位置にあるアミノ酸がリジンであるアミノ酸配列からなるタンパク質
糖修飾タンパク質(B):リジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質であって、下記(b1)~(b3)のいずれかに記載のタンパク質の配列番号2に示されるアミノ酸配列の117番目に相当する位置にあるリジンの側鎖アミノ基に、グルコース、マルトース、イソマルトース、マルトトリオース又はイソマルトトリオースが結合している糖修飾タンパク質
(b1)配列番号2に示されるアミノ酸配列からなるタンパク質
(b2)配列番号2に示されるアミノ酸配列において、117番目のリジン以外の領域中に1~9個のアミノ酸が欠失、置換、挿入及び/又は付加されたアミノ酸配列からなるタンパク質
(b3)配列番号2に示されるアミノ酸配列に対して98%以上の同一性を有し、かつ、配列番号2に示されるアミノ酸配列の117番目に相当する位置にあるアミノ酸がリジンであるアミノ酸配列からなるタンパク質 - 飲食品がビールテイストアルコール飲料又はノンアルコールビールテイスト飲料である請求項7に記載の使用。
- 下記糖修飾タンパク質(A)及び/又は下記糖修飾タンパク質(B)を飲食品に添加する、飲食品にコク味を付与する方法。
糖修飾タンパク質(A):リジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質であって、下記(a1)~(a3)のいずれかに記載のタンパク質の配列番号1に示されるアミノ酸配列の160番目に相当する位置にあるリジン及び/又は189番目に相当する位置にあるリジンの側鎖アミノ基に、グルコース、マルトース又はイソマルトースが結合している糖修飾タンパク質
(a1)配列番号1に示されるアミノ酸配列からなるタンパク質
(a2)配列番号1に示されるアミノ酸配列において、160番目及び/又は189番目のリジン以外の領域中に1~9個のアミノ酸が欠失、置換、挿入及び/又は付加されたアミノ酸配列からなるタンパク質
(a3)配列番号1に示されるアミノ酸配列に対して98%以上の同一性を有し、かつ、配列番号1に示されるアミノ酸配列の160番目に相当する位置及び/又は189番目に相当する位置にあるアミノ酸がリジンであるアミノ酸配列からなるタンパク質
糖修飾タンパク質(B):リジンの側鎖アミノ基がグリケーションされている糖修飾タンパク質であって、下記(b1)~(b3)のいずれかに記載のタンパク質の配列番号2に示されるアミノ酸配列の117番目に相当する位置にあるリジンの側鎖アミノ基に、グルコース、マルトース、イソマルトース、マルトトリオース又はイソマルトトリオースが結合している糖修飾タンパク質
(b1)配列番号2に示されるアミノ酸配列からなるタンパク質
(b2)配列番号2に示されるアミノ酸配列において、117番目のリジン以外の領域中に1~9個のアミノ酸が欠失、置換、挿入及び/又は付加されたアミノ酸配列からなるタンパク質
(b3)配列番号2に示されるアミノ酸配列に対して98%以上の同一性を有し、かつ、配列番号2に示されるアミノ酸配列の117番目に相当する位置にあるアミノ酸がリジンであるアミノ酸配列からなるタンパク質 - 飲食品がビールテイストアルコール飲料又はノンアルコールビールテイスト飲料である請求項9に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2019239831 | 2019-12-27 | ||
| JP2019239831 | 2019-12-27 | ||
| PCT/JP2020/046833 WO2021131923A1 (ja) | 2019-12-27 | 2020-12-15 | 糖修飾タンパク質 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPWO2021131923A1 JPWO2021131923A1 (ja) | 2021-07-01 |
| JP7635154B2 true JP7635154B2 (ja) | 2025-02-25 |
Family
ID=76574548
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021567318A Active JP7635154B2 (ja) | 2019-12-27 | 2020-12-15 | 糖修飾タンパク質 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20230054264A1 (ja) |
| EP (1) | EP4083055A4 (ja) |
| JP (1) | JP7635154B2 (ja) |
| CN (1) | CN114901675A (ja) |
| AU (1) | AU2020413775A1 (ja) |
| CA (1) | CA3166170A1 (ja) |
| WO (1) | WO2021131923A1 (ja) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2020415695A1 (en) * | 2019-12-27 | 2022-08-11 | Suntory Holdings Limited | Non-alcoholic beer-flavored beverage, rich taste enhancing agent and sourness reducing agent for non-alcoholic beer-flavored beverages, and rich taste enhancing method and sourness reducing method for non-alcoholic beer-flavored beverages |
| WO2022004717A1 (ja) * | 2020-07-01 | 2022-01-06 | サントリーホールディングス株式会社 | ビールテイストアルコール飲料 |
| WO2022004719A1 (ja) * | 2020-07-01 | 2022-01-06 | サントリーホールディングス株式会社 | ノンアルコールビールテイスト飲料 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2016001683A1 (en) | 2014-07-03 | 2016-01-07 | Heriot-Watt University | Protein recovery |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2589435B2 (ja) * | 1991-09-17 | 1997-03-12 | 株式会社ディ・ディ・エス研究所 | 糖修飾ポリリジン誘導体 |
| EP0790316A3 (en) * | 1996-02-16 | 1999-02-10 | Quest International B.V. | Emulsifier from yeast |
| WO2000018249A1 (en) * | 1998-09-28 | 2000-04-06 | New Zealand Dairy Research Institute | Process for controlling maillard-type glycation of whey proteins and products with enhanced functional properties |
| WO2009078359A1 (ja) * | 2007-12-14 | 2009-06-25 | Suntory Holdings Limited | 香味付与剤及びそれを含有するビールテイスト飲料 |
| JP2015519878A (ja) * | 2012-03-26 | 2015-07-16 | プロニュートリア・インコーポレイテッドPronutria, Inc. | 栄養断片、タンパク質、および方法 |
| JP2017012014A (ja) * | 2015-06-26 | 2017-01-19 | キリン株式会社 | ビールらしい飲み応えやバランスを有するビールテイスト飲料 |
| JP6404871B2 (ja) | 2016-08-24 | 2018-10-17 | アサヒビール株式会社 | ビール様飲料用風味改善剤 |
| AU2020415695A1 (en) * | 2019-12-27 | 2022-08-11 | Suntory Holdings Limited | Non-alcoholic beer-flavored beverage, rich taste enhancing agent and sourness reducing agent for non-alcoholic beer-flavored beverages, and rich taste enhancing method and sourness reducing method for non-alcoholic beer-flavored beverages |
-
2020
- 2020-12-15 CN CN202080090628.9A patent/CN114901675A/zh active Pending
- 2020-12-15 EP EP20907310.5A patent/EP4083055A4/en not_active Withdrawn
- 2020-12-15 CA CA3166170A patent/CA3166170A1/en active Pending
- 2020-12-15 US US17/788,948 patent/US20230054264A1/en not_active Abandoned
- 2020-12-15 AU AU2020413775A patent/AU2020413775A1/en not_active Abandoned
- 2020-12-15 WO PCT/JP2020/046833 patent/WO2021131923A1/ja not_active Ceased
- 2020-12-15 JP JP2021567318A patent/JP7635154B2/ja active Active
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2016001683A1 (en) | 2014-07-03 | 2016-01-07 | Heriot-Watt University | Protein recovery |
| US20170145052A1 (en) | 2014-07-03 | 2017-05-25 | Heriot-Watt University | Protein recovery |
Non-Patent Citations (2)
| Title |
|---|
| International Journal of Biological Macromolecules,2018年,Vol.106,p.241-247,doi:10.1016/j.ijbiomac.2017.08.001 |
| journal of Agricultural and Food Chemistry,2014年,Vol.62,p.5643-5650,doi:10.1021/jf405699z |
Also Published As
| Publication number | Publication date |
|---|---|
| CN114901675A (zh) | 2022-08-12 |
| WO2021131923A1 (ja) | 2021-07-01 |
| EP4083055A4 (en) | 2024-01-17 |
| CA3166170A1 (en) | 2021-07-01 |
| EP4083055A1 (en) | 2022-11-02 |
| US20230054264A1 (en) | 2023-02-23 |
| JPWO2021131923A1 (ja) | 2021-07-01 |
| AU2020413775A1 (en) | 2022-08-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7645195B2 (ja) | ノンアルコールビールテイスト飲料、ノンアルコールビールテイスト飲料のコク味増強剤及び酸味低減剤、並びに、ノンアルコールビールテイスト飲料のコク味増強方法及び酸味低減方法 | |
| JP7635154B2 (ja) | 糖修飾タンパク質 | |
| JP6746275B2 (ja) | 低糖質ビールテイストアルコール飲料およびその製造方法 | |
| CN101878293B (zh) | 香味赋予剂及含有其的啤酒风味饮料 | |
| JP6689569B2 (ja) | ビールテイストアルコール飲料およびその製造方法 | |
| JP7362715B2 (ja) | 低糖質ビールテイスト発酵アルコール飲料およびその製造方法 | |
| JP4690959B2 (ja) | 加水分取酵母を用いた発酵飲料の製造方法 | |
| JP2018196336A (ja) | ビールテイスト発酵アルコール飲料およびその製造方法 | |
| JP7646955B1 (ja) | ビールテイストアルコール飲料およびその製法 | |
| JP7313278B2 (ja) | ビールテイストアルコール飲料、ビールテイストアルコール飲料のコク味増強剤及びビールテイストアルコール飲料のコク味増強方法 | |
| HK40076476A (en) | Sugar-modified protein | |
| JP7081905B2 (ja) | ビールテイスト発酵アルコール飲料およびその製造方法 | |
| JP2024090986A (ja) | ビールテイストアルコール飲料およびその製法 | |
| JP7313277B2 (ja) | ビールテイストアルコール飲料、ビールテイストアルコール飲料のコク味増強剤及びビールテイストアルコール飲料のコク味増強方法 | |
| WO2022004724A1 (ja) | ビールテイストアルコール飲料 | |
| WO2022004715A1 (ja) | ビールテイストアルコール飲料 | |
| WO2022004713A1 (ja) | ノンアルコールビールテイスト飲料 | |
| WO2022004725A1 (ja) | ノンアルコールビールテイスト飲料 | |
| WO2022004711A1 (ja) | ノンアルコールビールテイスト飲料 | |
| JP7545475B2 (ja) | ビールテイストアルコール飲料 | |
| JP7709972B2 (ja) | ビールテイストアルコール飲料 | |
| JP7097397B2 (ja) | ビールテイストアルコール飲料およびその製造方法 | |
| JP7699589B2 (ja) | ビールテイストアルコール飲料 | |
| WO2025258583A1 (ja) | ビールテイストアルコール飲料およびその製造方法 | |
| JP2022012538A (ja) | ビールテイストアルコール飲料 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20230309 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240206 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240403 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20240716 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20241016 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20241028 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20250121 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20250212 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7635154 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |