JP7592001B2 - エフロルニチンとスリンダクの固定用量複合製剤 - Google Patents
エフロルニチンとスリンダクの固定用量複合製剤 Download PDFInfo
- Publication number
- JP7592001B2 JP7592001B2 JP2021186911A JP2021186911A JP7592001B2 JP 7592001 B2 JP7592001 B2 JP 7592001B2 JP 2021186911 A JP2021186911 A JP 2021186911A JP 2021186911 A JP2021186911 A JP 2021186911A JP 7592001 B2 JP7592001 B2 JP 7592001B2
- Authority
- JP
- Japan
- Prior art keywords
- composition
- eflornithine
- tablet
- cancer
- sulindac
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/197—Carboxylic acids, e.g. valproic acid having an amino group the amino and the carboxyl groups being attached to the same acyclic carbon chain, e.g. gamma-aminobutyric acid [GABA], beta-alanine, epsilon-aminocaproic acid or pantothenic acid
- A61K31/198—Alpha-amino acids, e.g. alanine or edetic acid [EDTA]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/192—Carboxylic acids, e.g. valproic acid having aromatic groups, e.g. sulindac, 2-aryl-propionic acids, ethacrynic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2009—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2013—Organic compounds, e.g. phospholipids, fats
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2054—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2059—Starch, including chemically or physically modified derivatives; Amylose; Amylopectin; Dextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2095—Tabletting processes; Dosage units made by direct compression of powders or specially processed granules, by eliminating solvents, by melt-extrusion, by injection molding, by 3D printing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/28—Dragees; Coated pills or tablets, e.g. with film or compression coating
- A61K9/2806—Coating materials
- A61K9/2813—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/28—Dragees; Coated pills or tablets, e.g. with film or compression coating
- A61K9/2806—Coating materials
- A61K9/2833—Organic macromolecular compounds
- A61K9/284—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/28—Dragees; Coated pills or tablets, e.g. with film or compression coating
- A61K9/2806—Coating materials
- A61K9/2833—Organic macromolecular compounds
- A61K9/284—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone
- A61K9/2846—Poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/28—Dragees; Coated pills or tablets, e.g. with film or compression coating
- A61K9/2806—Coating materials
- A61K9/2833—Organic macromolecular compounds
- A61K9/2853—Organic macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyethylene glycol, polyethylene oxide, poloxamers, poly(lactide-co-glycolide)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/28—Dragees; Coated pills or tablets, e.g. with film or compression coating
- A61K9/2806—Coating materials
- A61K9/2833—Organic macromolecular compounds
- A61K9/286—Polysaccharides, e.g. gums; Cyclodextrin
- A61K9/2866—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Inorganic Chemistry (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Dermatology (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Description
本発明は概してがん生物学および医学の分野に関する。より具体的には、本発明は、癌の予防および処置のための組成物に関する。
がん細胞は、特定の代謝産物に対するその増大した所要量を満たすために、複数の経路を利用する能力を有する(Vander Heiden, 2011)。アスピリン、イブプロフェン、ピロキシカム(Reddy et al., 1990; Singh et al., 1994)、インドメタシン(Narisawa, 1981)、およびスリンダク(Piazza et al., 1997; Rao et al., 1995)を含む非ステロイド性抗炎症薬(NSAID)は、AOM処置ラットモデルにおける結腸がん発生を効果的に阻害する。NSAIDスリンダクの代謝産物であるスリンダクスルホンはCOX阻害活性を欠くが、それでも腫瘍細胞におけるアポトーシスを誘発し(Piazza et al., 1995; Piazza et al., 1997b)、がん発生のいくつかの齧歯類モデルにおいて、腫瘍発生を阻害する(Thompson et al., 1995; Piazza et al., 1995, 1997a)。
薬学的有効量のエフロルニチンと薬学的有効量の非ステロイド性抗炎症薬(NSAID)またはその代謝産物との固定用量合剤を含む組成物。
[本発明1002]
固定用量合剤が薬学的有効量のエフロルニチンおよび薬学的有効量のスリンダクである、本発明1001の組成物。
[本発明1003]
エフロルニチンがエフロルニチン塩酸塩一水和物である、本発明1002の組成物。
[本発明1004]
エフロルニチン塩酸塩一水和物がその2つのエナンチオマーのラセミ混合物である、本発明1003の組成物。
[本発明1005]
エフロルニチン塩酸塩一水和物が実質的に光学的に純粋な調製物である、本発明1003の組成物。
[本発明1006]
エフロルニチン塩酸塩一水和物ラセミ化合物の量が約10mg~約1000mgである、本発明1004の組成物。
[本発明1007]
エフロルニチン塩酸塩一水和物ラセミ化合物の量が約250mg~約500mgである、本発明1006の組成物。
[本発明1008]
エフロルニチン塩酸塩一水和物ラセミ化合物の量が約300mg~約450mgである、本発明1007の組成物。
[本発明1009]
エフロルニチン塩酸塩一水和物ラセミ化合物の量が約350mg~約400mgである、本発明1008の組成物。
[本発明1010]
エフロルニチン塩酸塩一水和物ラセミ化合物の量が約375mgである、本発明1009の組成物。
[本発明1011]
エフロルニチン塩酸塩一水和物ラセミ化合物の量が375mgである、本発明1010の組成物。
[本発明1012]
エフロルニチン塩酸塩一水和物ラセミ化合物の量が約35~約60重量パーセントである、本発明1004の組成物。
[本発明1013]
エフロルニチン塩酸塩一水和物ラセミ化合物の量が約40~約55重量パーセントである、本発明1012の組成物。
[本発明1014]
エフロルニチン塩酸塩一水和物ラセミ化合物の量が約50~約55重量パーセントである、本発明1013の組成物。
[本発明1015]
エフロルニチン塩酸塩一水和物ラセミ化合物の量が約52~約54重量パーセントである、本発明1014の組成物。
[本発明1016]
エフロルニチン塩酸塩一水和物ラセミ化合物の量が52~54重量パーセントである、本発明1015の組成物。
[本発明1017]
スリンダクの量が約10mg~約250mgである、本発明1002~1016のいずれかの組成物。
[本発明1018]
スリンダクの量が約50mg~約100mgである、本発明1017の組成物。
[本発明1019]
スリンダクの量が約70mg~約80mgである、本発明1018の組成物。
[本発明1020]
スリンダクの量が約75mgである、本発明1019の組成物。
[本発明1021]
スリンダクの量が75mgである、本発明1020の組成物。
[本発明1022]
スリンダクの量が約5~約20重量パーセントである、本発明1002~1016のいずれかの組成物。
[本発明1023]
スリンダクの量が約8~約15重量パーセントである、本発明1022の組成物。
[本発明1024]
スリンダクの量が約10~約12重量パーセントである、本発明1023の組成物。
[本発明1025]
スリンダクの量が10~11重量パーセントである、本発明1024の組成物。
[本発明1026]
賦形剤をさらに含む、本発明1002~1025のいずれかの組成物。
[本発明1027]
賦形剤がデンプン、コロイド状二酸化ケイ素、またはケイ化微結晶セルロースである、本発明1026の組成物。
[本発明1028]
賦形剤がコロイド状二酸化ケイ素である、本発明1026の組成物。
[本発明1029]
第2賦形剤をさらに含む、本発明1028の組成物。
[本発明1030]
第2賦形剤がケイ化微結晶セルロースである、本発明1029の組成物。
[本発明1031]
潤滑剤をさらに含む、本発明1002~1030のいずれかの組成物。
[本発明1032]
潤滑剤がステアリン酸マグネシウム、ステアリン酸カルシウム、ステアリン酸ナトリウム、モノステアリン酸グリセリル、ステアリン酸アルミニウム、ポリエチレングリコール、ホウ酸、または安息香酸ナトリウムである、本発明1031の組成物。
[本発明1033]
潤滑剤がステアリン酸マグネシウムである、本発明1032の組成物。
[本発明1034]
ステアリン酸マグネシウムの量が約0.25~約2重量パーセントである、本発明1033の組成物。
[本発明1035]
ステアリン酸マグネシウムの量が約0.75~約2重量パーセントである、本発明1034の組成物。
[本発明1036]
ステアリン酸マグネシウムの量が約1~約1.5重量パーセントである、本発明1035の組成物。
[本発明1037]
ステアリン酸マグネシウムの量が約1.1重量パーセントである、本発明1036の組成物。
[本発明1038]
ステアリン酸マグネシウムの量が約1.5重量パーセントである、本発明1036の組成物。
[本発明1039]
カプセル剤、錠剤、ミニ錠剤、顆粒剤、ペレット剤、液剤、ゲル剤、クリーム剤、フォーム剤、または貼付剤の形態にある、本発明1002~1038のいずれかの組成物。
[本発明1040]
錠剤の形態にある、本発明1039の組成物。
[本発明1041]
錠剤の重量が約650mg~約1,000mgである、本発明1040の組成物。
[本発明1042]
錠剤の重量が約675mg~約725mgである、本発明1041の組成物。
[本発明1043]
錠剤の重量が約700mgである、本発明1042の組成物。
[本発明1044]
錠剤がコーティングをさらに含む、本発明1040の組成物。
[本発明1045]
コーティングが放出調節コーティングまたは腸溶コーティングである、本発明1044の組成物。
[本発明1046]
コーティングがpH応答性コーティングとさらに定義される、本発明1045の組成物。
[本発明1047]
コーティングが、酢酸フタル酸セルロース(CAP)、酢酸トリメリト酸セルロース(CAT)、ポリ(酢酸ビニル)フタル酸(PVAP)、フタル酸ヒドロキシプロピルメチルセルロース(HP)、ポリ(メタクリレートエチルアクリレート)(1:1)コポリマー(MA-EA)、ポリ(メタクリレートメチルメタクリレート)(1:1)コポリマー(MA MMA)、ポリ(メタクリレートメチルメタクリレート)(1:2)コポリマー、または酢酸コハク酸ヒドロキシプロピルメチルセルロース(HPMCAS)を含む、本発明1045の組成物。
[本発明1048]
コーティングがエフロルニチンの味をマスキングする、本発明1044の組成物。
[本発明1049]
コーティングが、ヒドロキシプロピルメチルセルロース、二酸化チタン、ポリエチレングリコール、および黄色酸化鉄を含む、本発明1049の組成物。
[本発明1050]
コーティングの量が約1~約5重量パーセントである、本発明1044~1049のいずれかの組成物。
[本発明1051]
コーティングの量が約2~約4重量パーセントである、本発明1050の組成物。
[本発明1052]
コーティングの量が約3重量パーセントである、本発明1051の組成物。
[本発明1053]
コーティングの量が約5mg~約30mgである、本発明1044~1049のいずれかの組成物。
[本発明1054]
コーティングの量が約15mg~約25mgである、本発明1053の組成物。
[本発明1055]
コーティングの量が約21mgである、本発明1054の組成物。
[本発明1056]
錠剤の重量が約675mg~約750mgである、本発明1044の組成物。
[本発明1057]
錠剤の重量が約700mg~約725mgである、本発明1056の組成物。
[本発明1058]
錠剤の重量が約721mgである、本発明1057の組成物。
[本発明1059]
その必要がある患者に本発明1002~1058のいずれかの組成物を投与する工程を含む、該患者における疾患または状態を予防および/または処置する方法。
[本発明1060]
本発明1002~1058のいずれかの第2組成物を患者に投与する工程をさらに含み、第1組成物および第2組成物が同じ固定用量合剤を含む、本発明1059の方法。
[本発明1061]
第1投与および第2投与が同時に行われる、本発明1060の方法。
[本発明1062]
第2投与が第1投与の1秒後~1時間後に行われる、本発明1061の方法。
[本発明1063]
第1組成物および第2組成物がどちらも錠剤として製剤化され、同じ量のエフロルニチンおよびスリンダクを含有する、本発明1060~1062のいずれかの方法。
[本発明1064]
疾患ががんである、本発明1059~1063のいずれかの方法。
[本発明1065]
がんが、結腸がん、乳がん、膵がん、脳がん、肺がん、胃がん、血液がん、皮膚がん、精巣がん、前立腺がん、卵巣がん、肝がん、または食道がんである、本発明1064の方法。
[本発明1066]
結腸がんが家族性腺腫性ポリポーシスである、本発明1065の方法。
[本発明1067]
がんが神経芽細胞腫である、本発明1064の方法。
[本発明1068]
状態が皮膚状態である、本発明1059の方法。
[本発明1069]
皮膚状態が顔面多毛症である、本発明1068の方法。
[本発明1070]
組成物が、経口投与、動脈内投与、静脈内投与、または局所投与される、本発明1059の方法。
[本発明1071]
組成物が経口投与される、本発明1059の方法。
[本発明1072]
組成物が12時間ごとに投与される、本発明1059の方法。
[本発明1073]
組成物が24時間ごとに投与される、本発明1059の方法。
[本発明1074]
組成物が少なくとも二度投与される、本発明1059の方法。
[本発明1075]
以下の工程を含む、本発明1040~1058のいずれかの錠剤を生産する方法:
(a)スリンダクと賦形剤とをプレミックスして第1混合物を形成させる工程、
(b)第1混合物をエフロルニチンおよび賦形剤を含む第2混合物と混合してブレンドを形成させる工程、
(c)前記ブレンドを選別して顆粒状ブレンドを形成させる工程、
(d)前記顆粒状ブレンドに潤滑剤を加えて最終ブレンドを得る工程、ならびに
(e)前記最終ブレンドに圧縮力を適用して錠剤を形成させる工程。
[本発明1076]
工程(d)の前に前記顆粒状ブレンドを混合する工程、および、工程(e)の前に前記最終ブレンドを混合する工程をさらに含む、本発明1075の方法。
[本発明1077]
第1混合物に2つの賦形剤が存在し、第1賦形剤はコロイド状二酸化ケイ素であり、第2賦形剤はケイ化微結晶セルロースである、本発明1075の方法。
[本発明1078]
第2混合物の賦形剤がケイ化微結晶セルロースである、本発明1075または本発明1077のいずれかの方法。
[本発明1079]
プレミックスがポリエチレン被覆コンテナ内で行われる、本発明1075の方法。
[本発明1080]
混合が拡散ブレンダー内で行われる、本発明1075または本発明1076の方法。
[本発明1081]
潤滑剤がステアリン酸マグネシウムである、本発明1075~1077のいずれかの方法。
[本発明1082]
ステアリン酸マグネシウムが工程(d)の前にスクリーンを介して篩分けされる、本発明1081の方法。
[本発明1083]
スクリーンが500μmスクリーンである、本発明1082の方法。
[本発明1084]
選別が、前記ブレンドを回転キャリブレータに適用する工程を含む、本発明1075の方法。
[本発明1085]
回転キャリブレータが1.0mmスクリーンを含む、本発明1084の方法。
[本発明1086]
工程(d)後かつ工程(e)前に、前記ブレンドを工程(e)の力よりも弱い力で圧縮してプレ圧縮ブレンドを形成させるプレ圧縮工程をさらに含み、さらに、工程(e)の圧縮力が次に前記プレ圧縮ブレンドに作用することで錠剤が形成される、本発明1075の方法。
[本発明1087]
プレ圧縮工程が錠剤のキャッピングを防止する、本発明1086の方法。
[本発明1088]
プレ圧縮工程の圧縮力が、工程(e)において適用される圧縮力の約5~約15パーセントで適用される、本発明1081の方法。
[本発明1089]
プレ圧縮工程の圧縮力が2.5~3.5kNである、本発明1086~1088のいずれかの方法。
[本発明1090]
プレ圧縮工程の圧縮力が約3kNである、本発明1089の方法。
[本発明1091]
工程(e)の圧縮力が20~35kNである、本発明1075の方法。
[本発明1092]
工程(e)の圧縮力が約25kNである、本発明1091の方法。
[本発明1093]
錠剤をコーティングする工程をさらに含む、本発明1075の方法。
[本発明1094]
コーティングが、ヒドロキシプロピルメチルセルロース、二酸化チタン、ポリエチレングリコール、および黄色酸化鉄を含む、本発明1093の方法。
本発明の他の目的、特徴および利点は、以下の詳細な説明から明らかになるであろう。ただし、本発明の要旨および範囲内にあるさまざまな改変および修飾は、この詳細な説明から当業者には明らかになるであろうから、詳細な説明および具体的実施例は、本発明の好ましい態様を示してはいるものの、単なる例示であることを理解すべきである。
いくつかの局面では、エフロルニチンとスリンダクの固定用量合剤(fixed dose combination)(FDC)のための組成物が提供される。現在の方法に伴う課題を克服する、本発明の固定用量合剤の製造方法も提供される。製造方法は、薬剤-薬剤相互作用、薬剤-賦形剤相互作用、および各薬剤構成要素のブレンド均一性を含む課題を解決するように設計された。したがって、本発明の固定用量合剤は、局所性副作用および/または全身性副作用を最小限に抑え、より効果的な処置を提供し、ポリファーマシーを改善し、より良い患者コンプライアンスを提供するために、使用することができる。
過剰のポリアミン形成は古くから上皮がん発生、特に結腸直腸がん発生に関係づけられてきた。ポリアミンは、例えば転写、RNA安定化、およびイオンチャネルのゲート開閉を含むさまざまなプロセスに関与する小さな遍在性分子である(Wallace, 2000)。ポリアミン合成の最初の酵素であるオルニチンデカルボキシラーゼ(ODC)は、哺乳動物における正常な発生と組織修復にとって不可欠であるが、大半の成体組織ではダウンレギュレートされている(Gerner and Meyskens, 2004)。ポリアミンの代謝および輸送の制御における複数の異常は、いくつかの組織において腫瘍形成を促進しうる増加したポリアミンレベルをもたらす(Thomas and Thomas, 2003)。
単独で文脈なく使用される場合、「エフロルニチン」という用語は、2,5-ジアミノ-2-(ジフルオロメチル)ペンタン酸を指し、その形態は、非塩型および塩型(例えばエフロルニチンHCl)、非塩型および塩型の無水型および水和物型(例えばエフロルニチン塩酸塩一水和物)、非塩型および塩型の溶媒和物、そのエナンチオマー(R体およびS体、これはd体およびl体と同定することもできる)、それらエナンチオマーの混合物(例えばラセミ混合物)を含めて、どれであってもよい。「実質的に光学的に純粋な調製物」とは、第1エナンチオマーの調製物であって、反対エナンチオマーの含有量が約5重量%以下であるものを意味する。エフロルニチンの具体的な形態として、エフロルニチン塩酸塩一水和物(すなわちCAS ID:96020-91-6; MW:236.65)、エフロルニチン塩酸塩(すなわちCAS ID:68278-23-9; MW:218.63)、および無水遊離塩基エフロルニチン(すなわちCAS ID:70052-12-9; MW:182.17)が挙げられる。必要な場合は、エフロルニチンの具体的形態が、さらに指定されている。いくつかの態様において、本開示のエフロルニチンはエフロルニチン塩酸塩一水和物(すなわちCAS ID:96020-91-6)である。用語「エフロルニチン」および「DFMO」は、本明細書では相互可換的に使用される。DFMOはジフルオロメチルオルニチンの略号である。エフロルニチンおよびDFMOの他の同義語として、α-ジフルオロメチルオルニチン、2-(ジフルオロメチル)-DL-オルニチン、2-(ジフルオロメチル)-dl-オルニチン、2-(ジフルオロメチル)オルニチン、DL-α-ジフルオロメチルオルニチン、N-ジフルオロメチルオルニチン、αδ-ジアミノ-α-(ジフルオロメチル)吉草酸、および2,5-ジアミノ-2-(ジフルオロメチル)ペンタン酸が挙げられる。
・アフリカ睡眠病、高用量全身性IV剤形-市販されていない(Sanofi/WHO)
・多毛症(アンドロゲン誘発性過剰発毛)局所剤形。
エフロルニチンの経口製剤はまだFDAによって認可されていないが、外用型および注射型は認可されている。Vaniqa(登録商標)は、局所投与用のクリームに15%w/wエフロルニチン塩酸塩一水和物(11.5%w/w無水エフロルニチン(EU)、13.9%w/w無水エフロルニチン塩酸塩(U.S.)にそれぞれ相当)を含有するクリーム剤である。Ornidyl(登録商標)は注射または注入に適したエフロルニチンHCl溶液である。これは1mlあたり200mgエフロルニチン塩酸塩一水和物(20g/100mL)の強度で供給されている。
NSAIDはステロイドではない抗炎症性作用物質である。NSAIDは、抗炎症性効果に加えて、鎮痛効果、解熱効果、および血小板阻害効果を有するとも報告されている。NSAIDは、例えば慢性関節炎状態ならびに痛みおよび炎症を伴う一定の軟組織障害の処置などに使用される。NSAIDは、アラキドン酸をプロスタグランジンの前駆体である環状エンドペルオキシドに変換するシクロオキシゲナーゼを阻害することでプロスタグランジンの合成を遮断することによって作用すると報告されている。プロスタグランジン合成の阻害は、NSAIDの鎮痛作用、解熱作用、および血小板阻害作用の説明になるが、NSAIDの抗炎症効果には他の機構も寄与しうる。NSAIDには、リポキシゲナーゼ酵素もしくはホスホリパーゼCを阻害するもの、またはT細胞機能を調整するものもある。AMA Drug Evaluations Annual, 1814-5, 1994を参照されたい。
アスピリンは、アセチルサリチル酸とも呼ばれ、軽い疼痛(ache)および痛み(pain)を軽減するために鎮痛薬として、発熱を低減するための解熱薬として、ならびに抗炎症医薬剤として、多用されているサルチル酸薬である。アスピリンは、ドイツ企業Bayerの化学者であるFelix Hoffmannによって1897年に初めて単離された。アスピリンの主要代謝産物であるサリチル酸は、ヒトと動物の代謝の不可分な部分である。ヒトでは大部分が食事に起因しうるが、相当な部分が内因性に合成される。現在、アスピリンは世界中で最も広く使用されている医薬剤の一つであり、推定40,000トンのアスピリンが毎年消費されている。アスピリンがBayer所有の登録商標である国の場合、一般名はアセチルサリチル酸(ASA)である。
スリンダクは、次の化学名を持つ非ステロイド性抗炎症性インデン誘導体である;(Z)-5-フルオロ-2-メチル-1-((4-(メチルスルフィニル)フェニル)メチレン)-1H-インデン-3-酢酸(Physician's Desk Reference, 1999)。理論に拘泥するわけではないが、スルフィニル部分は、インビボでは、スルフィド代謝産物への可逆的還元およびスルホン代謝産物(エクシスリンド)への非可逆的酸化によって変換される。参照により本明細書に組み入れられる米国特許第6,258,845号を参照されたい。Ki-ras活性化も阻害するスリンダクは2つの異なる分子に代謝され、それらは、COXを阻害する能力が異なるものの、どちらもアポトーシスの誘発によって化学予防効果を発揮することができる。スリンダクスルホンはCOX阻害活性を欠き、おそらくプロスタグランジン合成に依存しない形でアポトーシスの誘発を容易にするのであろう。入手できる証拠は、スルフィド誘導体が生物学的活性化合物の少なくとも1つであることを示している。これに基づいて、スリンダクはプロドラッグとみなしうる。
ピロキシカムは、関節リウマチおよび変形性関節症の処置において十分に確立された非ステロイド性抗炎症性作用物質であり、次の化学名を有する:4-ヒドロキシ-2-メチル-N-2-ピリジル-2H-1,2-ベンゾチアジン-3-カルボキサミド1,1-ジオキシド。筋骨格障害、月経困難症、および術後痛の処置におけるその有用性も証明されている。その長い半減期は1日1回の投与を可能にする。この薬剤は、直腸に投与された場合に、有効であることが示されている。胃腸愁訴は最も高頻度に報告される副作用である。
セレコキシブは、変形性関節症、関節リウマチ、急性痛、強直性脊柱炎の処置、ならびにFAP患者における結腸ポリープおよび直腸ポリープの数を低減するための処置において十分に確立された、非ステロイド性抗炎症性作用物質であり、次の化学名を持つ:4-[5-(4-メチルフェニル)-3-(トリフルオロメチル)ピラゾール-1-イル]ベンゼンスルホンアミド。セレコキシブは、Pfizerにより、Celebrex、Celebra、およびOnsenalの商品名で販売されている。セレコキシブは選択的COX-2阻害剤である。セレコキシブの副作用としては、心臓血管疾患率の30%の増加が挙げられる。加えて、胃腸副作用のリスクが80%を上回る。
いくつかの態様では、さまざまなNSAIDの組合せも使用されうる。いくつかの態様では、2つ以上のNSAIDを低用量で使用することにより、高用量の個々のNSAIDに付随する副作用または毒性を低減することが可能である。例えばいくつかの態様において、スリンダクはセレコキシブと一緒に使用することができる。互いに組み合わせて使用しうるNSAIDの例として、イブプロフェン、ナプロキセン、フェノプロフェン、ケトプロフェン、フルルビプロフェン、オキサプロジン、インドメタシン、スリンダク、エトドラク、ジクロフェナク、ピロキシカム、メロキシカム、テノキシカム、ドロキシカム、ロルノキシカム、イソキシカム、メフェナム酸、メクロフェナム酸、フルフェナム酸、トルフェナム酸、セレコキシブ、ロフェコキシブ、バルデコキシブ、パレコキシブ、ルミラコキシブ、およびエトリコキシブが挙げられるが、それらに限定されるわけではない。
本明細書において提供される組成物は、いくつかの態様では、患者において、がん細胞の数を低減し、がん細胞の成長を阻害し、かつ/またはがん細胞の発生を予防するために使用することができる。標的がん細胞として、肺、脳、前立腺、腎臓、肝臓、卵巣、乳房、皮膚、胃、食道、頭頸部、精巣、結腸、子宮頸部、リンパ系および血液のがんが挙げられる。いくつかの態様において、本組成物は、結腸がん、家族性腺腫性ポリポーシス(FAP)、膵がん、および/または神経芽細胞腫を処置および/または予防するために使用することができる。
一局面において、本発明は、薬学的有効量のエフロルニチンと薬学的有効量の非ステロイド性抗炎症薬(NSAID)またはその代謝産物との固定用量合剤を含む組成物を提供する。いくつかの態様において、本固定用量合剤は薬学的有効量のエフロルニチンおよび薬学的有効量のスリンダクである。
いくつかの態様において、本組成物は薬学的に許容される賦形剤をさらに含む。これらの態様の一部において、薬学的に許容される賦形剤には、薬学的に許容される希釈剤、薬学的に許容される崩壊剤、薬学的に許容される結合剤、薬学的に許容される安定剤、薬学的に許容される潤滑剤、薬学的に許容される顔料、または薬学的に許容される流動促進剤(glider)が含まれうる。本発明の固定用量複合製剤では、活性成分を1:0.25~1:20の重量比で薬学的に許容される賦形剤と混合することができる。
本発明のさらなる一局面は、本明細書に開示する錠剤(エフロルニチンおよびスリンダクを含む錠剤を含む)を製造するためのプロセスを提供している。いくつかの態様において、活性作用物質は、少なくとも1つの活性作用物質および1つまたは複数の賦形剤を所望のメッシュサイズの篩でふるい分け、次に、高速ミキサー造粒機、遊星型ミキサー、マスミキサー(mass mixer)、リボンミキサー、流動層プロセッサー、または他の任意の適切な器具を使って混合することによって調製される。ブレンドは、例えば、低せん断または高せん断ミキサー、流動床造粒機などにおいて、アルコール性であれ水アルコール性であれ水性であれ、結合剤を含むまたは結合剤を含まない溶液または懸濁液を加えることによって、あるいは乾式造粒によって、造粒することができる。顆粒は、箱形乾燥機、流動層乾燥機、ロータリーコーン真空乾燥器などを使って乾燥することができる。顆粒は、振動造粒機または粉砕ミルまたは適切なスクリーンを装着した他の任意の従来設備を使ってサイズ分画することができる。あるいは、押出しおよび球形化またはローラーコンパクションによって、顆粒を調製することができる。また、活性作用物質を含有する顆粒の製造は、直接圧縮できる賦形剤との混合またはローラーコンパクションを含みうる。
造粒は、粉末粒子を互いに接着させて、より大きな多粒子体、すなわち顆粒を得るプロセスである。本発明の態様において、乾式または湿式技法によって得られる顆粒は、1種または複数種の潤滑剤および/または接着防止剤(anti-adherant)とブレンドし、次に単一のカプセルに充填するか、または小さい方のカプセルを別の大きい方のカプセルに充填することができるように、異なるサイズの異なるカプセルに充填することができる。
一定の態様では、造粒後に混合物がブレンドされる。固形薬製造におけるブレンドとは、ブレンド均一性を達成し、潤滑剤を分布させることである。一定の局面において、ブレンド工程は、潤滑剤の最終ブレンドの前にすべての構成要素の均質性が達成されるように設計される。しかし、粉末のブレンディングは、粒径、含水率、構造、かさ密度、および流動特徴ゆえに、難題である。調合成功の鍵は添加の順序である。典型的には、構成要素および薬学的に許容される添加剤を、拡散ブレンダーまたは拡散ミキサーなどの適切な容器に送出する。転動ミキサーの一例は、ツインシェルブレンダー(Vブレンダー)または他の任意の形状の転動ミキサーである。
錠剤組成物が調製されたら、それらをさまざまな形状に成形することができる。好ましい態様では錠剤組成物が造形品にプレスされる。このプロセスは、錠剤組成物を型に入れる工程、および組成物が接触している型の表面の形状をとることになるように、組成物に圧力を適用する工程を含みうる。錠剤形への圧縮は打錠機によって遂行することができる。打錠機は、臼に底から収まる下杵と、打錠材料が臼キャビティ中に落ちた後に、上部から臼キャビティに入る、対応する形状および寸法を有する上杵とを含む。錠剤は下杵および上杵に適用された圧力によって形成される。本発明の錠剤は一般に約20kP以下の硬度を有し、好ましくは、錠剤は約15kP以下の硬度を有する。典型的な圧縮圧は約5kN~約40kNであり、これは錠剤の所望のサイズおよび硬度に基づいて変動することになる。いくつかの局面において、圧縮圧は約25kN~約35kNである。特定の局面において、圧縮圧は約37kN以下、例えば約30kN未満、例えば約25kN未満である。Carverプレスなどの液圧プレス、またはStokes Versaプレスなどのロータリー打錠機は、本発明の錠剤組成物を圧縮するのに適した手段である。例示的圧縮力パラメータを表3に示す。
本発明による組成物または固形剤形は、フィルムコーティング、腸溶コーティング、放出調節コーティング、保護コーティング、または接着防止コーティングでコーティングすることもできる。
いくつかの態様では、ルーチンスケジュールで作用物質を投与することができる。本明細書にいうルーチンスケジュールとは予め決定された指定の期間を指す。ルーチンスケジュールは、スケジュールが予め決定されている限り、同一の期間または長さの異なる期間を包含しうる。例えばルーチンスケジュールは、1日2回、毎日、2日ごと、3日ごと、4日ごと、5日ごと、6日ごと、毎週、毎月、またはその間の決められた日数または週数での投与を伴いうる。あるいは、予め決定されたルーチンスケジュールは、最初の1週間は1日2回の投与、その後、数ヶ月間は1日1回の投与などを伴いうる。別の態様において、本発明は、作用物質は経口的に服用することができ、そのタイミングは食品摂取に依存する、または食品摂取に依存しない、と規定する。したがって例えば作用物質は、毎朝および/または毎晩、その対象が食事をした後か、食事をする前かを問わず、服用することができる。
いくつかの態様において、処置方法は、本明細書において提供される組成物の投与を含む抗がん治療の効力を改良し、かつ/またはその毒性を最小限に抑えるために、診断方法で補われる。そのような方法は、例えば米国特許第8,329,636号および同第9,121,852号、米国特許出願公開US2013/0217743およびUS2015/0301060、ならびにPCT特許公報WO2014/070767およびWO2015/195120に記載されており、これらの文献はすべて参照により本明細書に組み入れられる。
本願明細書において使用される場合、「a」または「an」は、1つまたは複数を意味しうる。本願特許請求の範囲において使用される場合、単語「含む(comprising)」と一緒に使用される単語「a」または「an」は、1つまたは1つより大きい数を意味しうる。
本発明の好ましい実施形態を実証するために、以下の実施例を含める。以下の実施例において開示する技法は、本発明の実施においてうまく機能することを本発明者らが発見した技法に相当し、それゆえに、その実施のための好ましい形態を構成するとみなしうることは、当業者には理解されるはずである。しかし、当業者は、本開示に照らして、開示される具体的態様には多くの変更を加えることができ、それでもなお本発明の要旨および範囲から逸脱することなく、同様のまたは類似する結果が得られることを、理解すべきである。
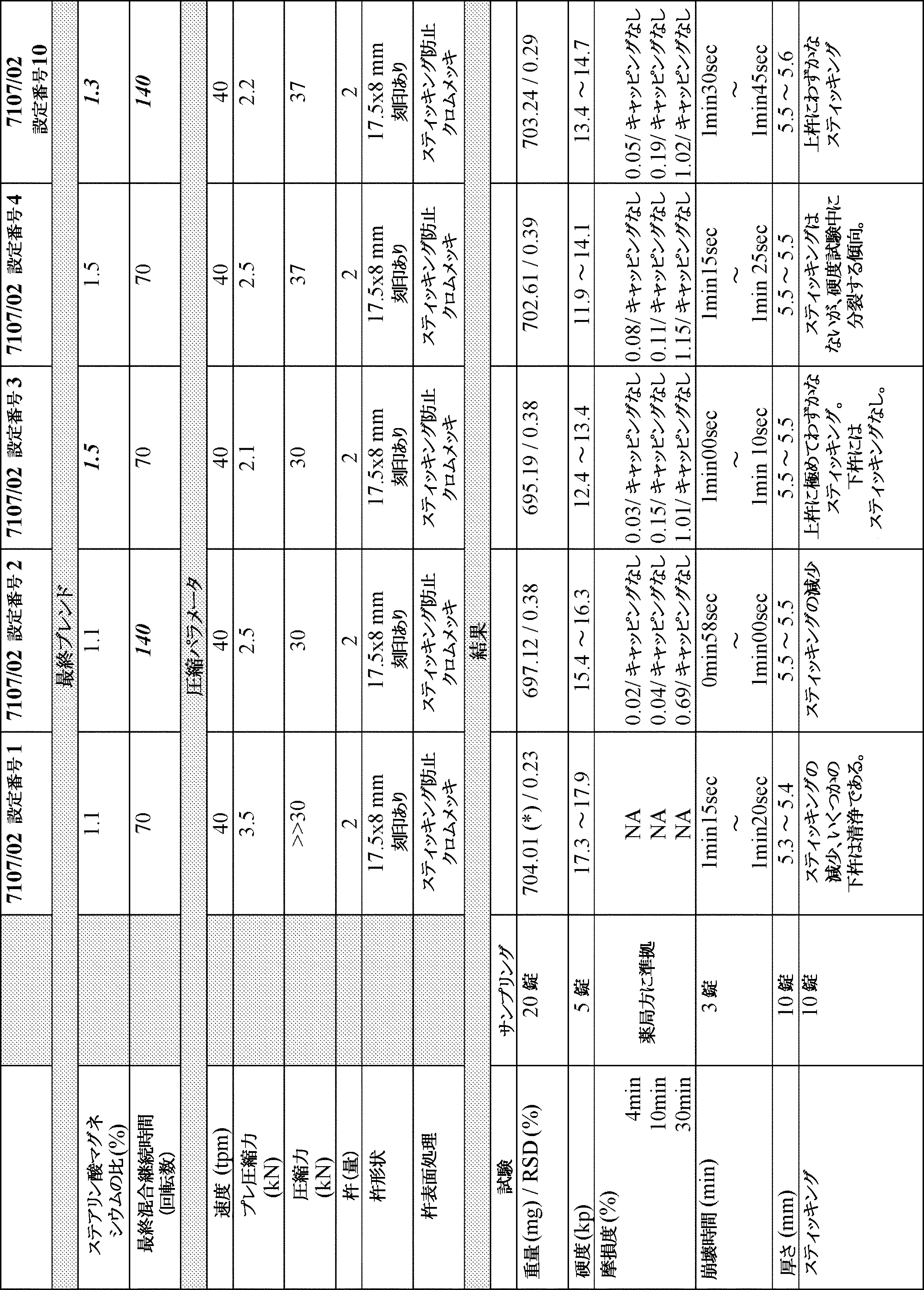
エフロルニチンHClおよびスリンダクを含む固定用量合剤(FDC)錠の開発プロセスにおいて、数種類の製剤を試験した(表1)。試験したパラメータには、錠剤崩壊時間、錠剤硬度、および錠剤摩損度のパーセンテージを含めた。
実施例1から、キャッピングおよびスティッキングを防止するために、どのパラメータを変更することができるかを決定するために、製剤IVをさらに試験した。試験した最初のパラメータは圧縮力および圧縮力の約5~15%でのプレ圧縮力の追加であった(表5)。製剤IV 700mg錠を約20kpの硬度に到達させるための圧縮力およびプレ圧縮力を評価するために、数回の試行を行った。1回目の試行では、設備C(表9)を使って、製剤IV 700mg錠の最終ブレンドを製造した。この製造プロセスでは、CARBOSIL(登録商標)、PROSOLV(登録商標)の第2部分およびスリンダクをPEバック中でプレミックスした。次に、PROSOLV(登録商標)の第1部分の1/2およびエフロルニチンを、10クォートvブレンダーに、前記プレミックスと共に加えた。PROSOLV(登録商標)の第1部分の残り1/2を使ってPEバッグを濯ぎ、vブレンダーに加えた。そのミックスを約7rpmで35分間ブレンドした。次に、そのミックスをブレンダーから取り出し、Frewitt TC150 1.0 mmスクリーンによって崩してから、vブレンダーに戻してさらに35分間ブレンドした。次に、ステアリン酸マグネシウムを500μmスクリーンによって手で選別し、7rpmで10分間の最終ブレンドのために、用手混合によってvブレンダーに加えた。圧縮工程は、5本の17.5×8mm刻印付きクロムメッキ杵を装着したCourtoy Modul P打錠機で行った。17.0~22.5kpの硬度が得られるようにパラメータを設定した。プレ圧縮がない場合は、キャッピングが観察されることがわかった。しかし、プレ圧縮力の使用によって硬度は増加し、キャッピングは回避された(表10)。加えて、プレ圧縮力を使って形成された錠剤は摩耗に対する耐性が高かった(すなわち摩損度が低かった)。加えて、実施例1において使用したKey BBTS 10ステーション打錠機の16.5×8mm杵の方が、摩耗を起こしやすいようだった。
エフロルニチンHCl/スリンダク合剤錠について非cGMP薬剤賦形剤適合性研究を行った。一連の試料を使って外観、HPLCアッセイおよびXRPD特性を評価した。試験した賦形剤には、PVP、HPMC、ラクトース、EXPLOTAB(商標)、Ac-Di-Sol(登録商標)、PROSOLV(登録商標)、STARCH 1500(登録商標)、およびOPADRY(登録商標)Yellowを含めた。賦形剤適合性のために調製された試料は、5:1のエフロルニチンHCl:スリンダク調製物および約6:1:0.3のエフロルニチンHCl:スリンダク:H2O調製物を除いて、すべて、APIと賦形剤との1:1の物理的混合物であった。大半の試料の総質量は約750mgであった。調製では、構成要素を20ccシンチレーションバイアルに量り取り、閉じ、約30秒間ボルテックスした。次に、試料を40℃/75%RHの安定性試験チャンバで4週間貯蔵した。チャンバで貯蔵している間は、バイアルの蓋は緩く閉めて、遮光しておいた。
DE* =[(L*1 - L*2)2 +(a*1- a*2)2+(b*1 - b*2)2]1/2
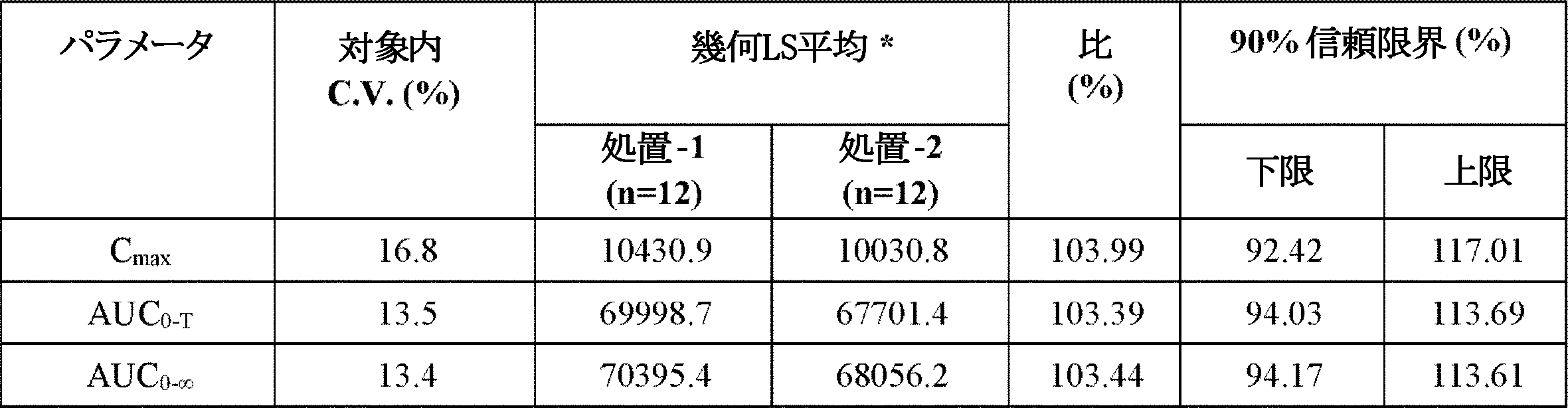
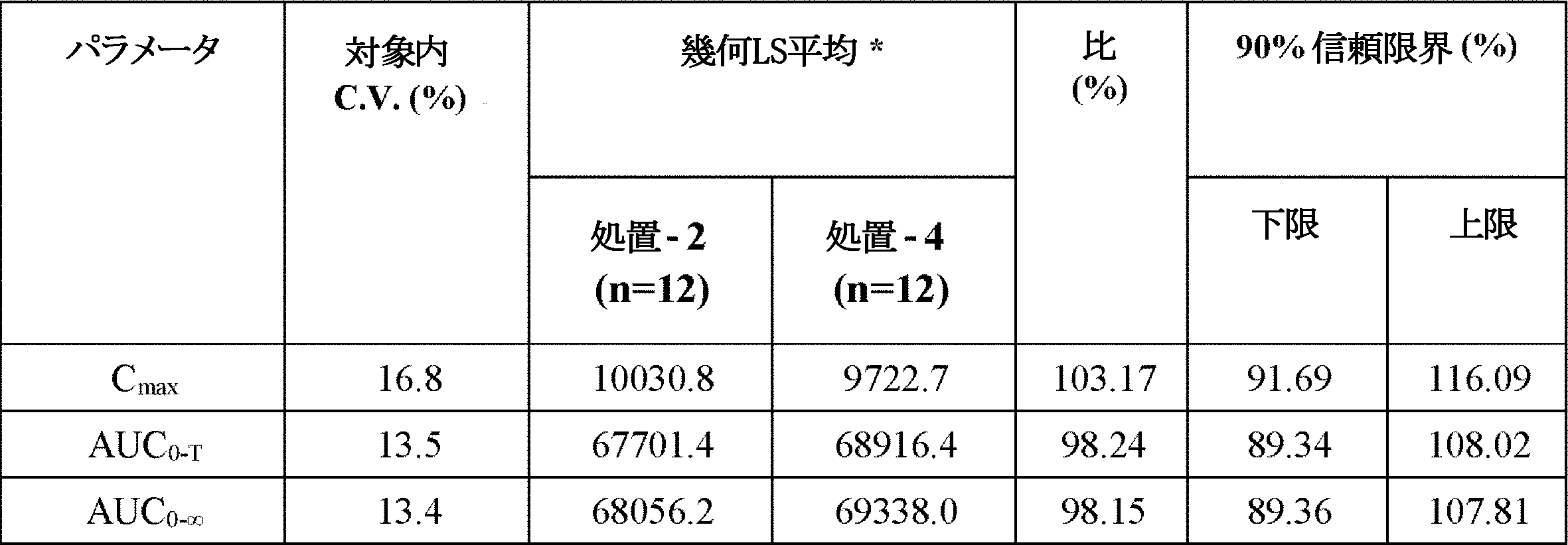
空腹条件下で正常健常対象に単独服用されるか共投与されたエフロルニチンまたはスリンダクを含有する個別錠剤との比較で、エフロルニチン/スリンダクを含有する共製剤化錠剤の経口投与後の血漿におけるエフロルニチン、スリンダク、スリンダクスルフィド、およびスリンダクスルホンの薬物動態パラメータを比較するために、パイロット研究を行った。この研究の二次的目的は、正常健常対象に単独服用されるか共投与された個別製剤との比較で、エフロルニチン/スリンダク共製剤化錠剤の安全性および忍容性を決定することであった。
・処置1:共製剤化されたエフロルニチン375mg/スリンダク75mg錠の単回750/150mg投与(375/75mg錠×2)
・処置2:エフロルニチン250mg錠の単回750mg投与(250mg錠×3)
・処置3:スリンダク150mg錠の単回150mg投与(150mg錠×1)
・処置4:同時に投与されるスリンダク150mg錠の単回150mg投与(150mg錠×1)およびエフロルニチン250mg錠の単回750mg投与(250mg錠×3)。
Claims (28)
- (a)約375mgのエフロルニチン塩酸塩一水和物と、(b)約75mgのスリンダクと、の単一の投与単位の固定用量合剤を含む組成物であって、該組成物が、ステアリン酸マグネシウムおよびコロイド状二酸化ケイ素をさらに含む、組成物。
- 前記組成物が、約0.75~2重量パーセントの量のステアリン酸マグネシウムを含む、請求項1記載の組成物。
- 前記組成物が、約1~1.5重量パーセントの量のステアリン酸マグネシウムを含む、請求項1記載の組成物。
- エフロルニチン塩酸塩一水和物がその2つのエナンチオマーのラセミ混合物である、請求項1記載の組成物。
- エフロルニチン塩酸塩一水和物ラセミ化合物の量が375mgである、請求項4記載の組成物。
- スリンダクの量が75mgである、請求項1記載の組成物。
- 前記コロイド状二酸化ケイ素が約0.2~約5重量パーセントの量である、請求項1記載の組成物。
- 第2賦形剤をさらに含む、請求項1記載の組成物。
- 第2賦形剤がケイ化微結晶セルロースである、請求項8記載の組成物。
- 前記ケイ化微結晶セルロース(MCC)が約30~約35重量パーセントの量である、請求項9記載の組成物。
- カプセル剤、錠剤、ミニ錠剤、顆粒剤、ペレット剤、液剤、またはゲル剤の形態にある、請求項1記載の組成物。
- 錠剤の形態にある、請求項11記載の組成物。
- 錠剤の重量が約675mg~約725mgである、請求項12記載の組成物。
- 錠剤の重量が約700mgである、請求項13記載の組成物。
- 錠剤がコーティングをさらに含む、請求項12記載の組成物。
- コーティングがエフロルニチンの味をマスキングする、請求項15記載の組成物。
- コーティングが、ヒドロキシプロピルメチルセルロース、二酸化チタン、ポリエチレングリコール、および黄色酸化鉄を含む、請求項15記載の組成物。
- コーティングの量が約2~約4重量パーセントである、請求項15記載の組成物。
- 錠剤の重量が約700mg~約725mgである、請求項15記載の組成物。
- 錠剤の重量が約721mgである、請求項19記載の組成物。
- その必要がある患者に組成物を投与する工程を含む、該患者における疾患または状態を予防および/または処置する方法に用いるための、請求項1~20のいずれか一項記載の組成物。
- (a)前記方法が、請求項1~21のいずれか一項記載の組成物を2番目の組成物として患者に投与する工程をさらに含み、最初の組成物および2番目の組成物が同じ固定用量合剤を含むか、
(b)前記方法が、請求項1~21のいずれか一項記載の組成物を2番目の組成物として患者に投与する工程をさらに含み、最初の組成物および2番目の組成物が同じ固定用量合剤を含み、かつ、最初の投与および2番目の投与が同時に行われるか、または
(c)前記方法が、請求項1~21のいずれか一項記載の組成物を2番目の組成物として患者に投与する工程をさらに含み、最初の組成物および2番目の組成物が同じ固定用量合剤を含み、かつ、2番目の投与が最初の投与の1秒後~1時間後に行われる、
請求項21記載の組成物。 - 最初の組成物および2番目の組成物がどちらも錠剤として製剤化され、同じ量のエフロルニチンおよびスリンダクを含有する、請求項22記載の組成物。
- (a)疾患ががんであるか、
(b)疾患が、結腸がん、乳がん、膵がん、脳がん、肺がん、胃がん、血液がん、皮膚がん、精巣がん、前立腺がん、卵巣がん、肝がん、または食道がんから選択されるがんであるか、
(c)疾患が家族性腺腫性ポリポーシスであるか、または
(d)疾患が神経芽細胞腫である、
請求項21~23のいずれか一項記載の組成物。 - 請求項1記載の錠剤を生産する方法であって、
(a)スリンダクと賦形剤とをプレミックスして第1混合物を形成させる工程、
(b)第1混合物をエフロルニチンおよび賦形剤を含む第2混合物と混合してブレンドを形成させる工程、
(c)前記ブレンドを選別して顆粒状ブレンドを形成させる工程、
(d)前記顆粒状ブレンドに潤滑剤を加えて最終ブレンドを得る工程、ならびに
(e)前記最終ブレンドに圧縮力を適用して錠剤を形成させる工程
を含む、方法。 - 工程(d)後かつ工程(e)前に、前記ブレンドを工程(e)の力よりも弱い力で圧縮してプレ圧縮ブレンドを形成させるプレ圧縮工程をさらに含み、さらに、工程(e)の圧縮力が次に前記プレ圧縮ブレンドに作用することで錠剤が形成される、請求項25記載の方法。
- プレ圧縮工程が錠剤のキャッピングを防止する、請求項25記載の方法。
- プレ圧縮工程の圧縮力が、工程(e)において適用される圧縮力の約5~約15パーセントで適用される、請求項25記載の方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2024079276A JP2024102339A (ja) | 2015-10-30 | 2024-05-15 | エフロルニチンとスリンダクの固定用量複合製剤 |
Applications Claiming Priority (10)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562248810P | 2015-10-30 | 2015-10-30 | |
| US62/248,810 | 2015-10-30 | ||
| US201662358698P | 2016-07-06 | 2016-07-06 | |
| US62/358,698 | 2016-07-06 | ||
| EP16306429.8 | 2016-10-28 | ||
| EP16306429 | 2016-10-28 | ||
| EP16306430 | 2016-10-28 | ||
| EP16306430.6 | 2016-10-28 | ||
| JP2018543001A JP2018536707A (ja) | 2015-10-30 | 2016-10-31 | エフロルニチンとスリンダクの固定用量複合製剤 |
| PCT/US2016/059689 WO2017075576A1 (en) | 2015-10-30 | 2016-10-31 | Eflornithine and sulindac, fixed dose combination formulation |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018543001A Division JP2018536707A (ja) | 2015-10-30 | 2016-10-31 | エフロルニチンとスリンダクの固定用量複合製剤 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024079276A Division JP2024102339A (ja) | 2015-10-30 | 2024-05-15 | エフロルニチンとスリンダクの固定用量複合製剤 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2022028814A JP2022028814A (ja) | 2022-02-16 |
| JP7592001B2 true JP7592001B2 (ja) | 2024-11-29 |
Family
ID=57256487
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018543001A Withdrawn JP2018536707A (ja) | 2015-10-30 | 2016-10-31 | エフロルニチンとスリンダクの固定用量複合製剤 |
| JP2021186911A Active JP7592001B2 (ja) | 2015-10-30 | 2021-11-17 | エフロルニチンとスリンダクの固定用量複合製剤 |
| JP2024079276A Pending JP2024102339A (ja) | 2015-10-30 | 2024-05-15 | エフロルニチンとスリンダクの固定用量複合製剤 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018543001A Withdrawn JP2018536707A (ja) | 2015-10-30 | 2016-10-31 | エフロルニチンとスリンダクの固定用量複合製剤 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024079276A Pending JP2024102339A (ja) | 2015-10-30 | 2024-05-15 | エフロルニチンとスリンダクの固定用量複合製剤 |
Country Status (14)
| Country | Link |
|---|---|
| US (4) | US10973790B2 (ja) |
| EP (1) | EP3368029A1 (ja) |
| JP (3) | JP2018536707A (ja) |
| KR (2) | KR20180069068A (ja) |
| CN (1) | CN108366982A (ja) |
| AU (1) | AU2016343851B2 (ja) |
| BR (1) | BR112018008651A2 (ja) |
| CA (1) | CA3003149C (ja) |
| CL (1) | CL2018001157A1 (ja) |
| CO (1) | CO2018005491A2 (ja) |
| HK (1) | HK1258284A1 (ja) |
| IL (1) | IL259009A (ja) |
| MA (1) | MA43114A (ja) |
| MX (1) | MX390899B (ja) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN108366982A (zh) | 2015-10-30 | 2018-08-03 | 癌症预防制药股份有限公司 | 依氟鸟氨酸和舒林酸,固定剂量的组合制剂 |
| NZ752894A (en) * | 2016-10-06 | 2023-05-26 | Orbus Therapeutics Inc | Formulations for administration of eflornithine |
| US10945981B2 (en) | 2019-05-17 | 2021-03-16 | Cancer Prevention Pharmaceuticals, Inc. | Methods for treating familial adenomatous polyposis |
| CN119909027B (zh) * | 2025-01-21 | 2025-11-18 | 福安药业集团宁波天衡制药有限公司 | 一种稳定的舒林酸片及其制备方法 |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2009022670A1 (ja) | 2007-08-10 | 2009-02-19 | Takeda Pharmaceutical Company Limited | 速崩壊性錠剤 |
| US20100120727A1 (en) | 2008-11-12 | 2010-05-13 | Kyphia Pharmaceuticals, Inc. | Eflornithine Prodrugs, Conjugates and Salts, and Methods of Use Thereof |
| JP2012526852A (ja) | 2009-05-14 | 2012-11-01 | アリゾナ ボード オブ リージェンツ オン ビハーフ オブ ザ ユニバーシティー オブ アリゾナ | Odc1の遺伝子型に基づく癌腫診断及び治療 |
| JP2014058547A (ja) | 2007-07-19 | 2014-04-03 | Takeda Chem Ind Ltd | アログリプチンおよび塩酸メトホルミンを含有する固形製剤 |
| WO2015054133A1 (en) | 2013-10-07 | 2015-04-16 | Bristol-Myers Squibb Company | Hiv treatment formulation of atazanavir and cobicistat |
| WO2015102400A1 (en) | 2013-12-30 | 2015-07-09 | Hanmi Pharm. Co., Ltd. | Composite formulation for oral administration comprising ezetimibe and rosuvastatin |
| JP2018536707A (ja) | 2015-10-30 | 2018-12-13 | キャンサー プリベンション ファーマシューティカルズ,インコーポレイテッド | エフロルニチンとスリンダクの固定用量複合製剤 |
Family Cites Families (44)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4330559A (en) | 1977-07-11 | 1982-05-18 | Merrell-Toraude Et Cie | Method of treating benign prostatic hypertrophy |
| US4413141A (en) | 1977-07-11 | 1983-11-01 | Merrell Toraude Et Compagnie | 2-(Difluoromethyl)-2,5-diaminopentanoic acid |
| US4309442A (en) * | 1977-07-11 | 1982-01-05 | Merrell Toraude Et Compagnie | Method for controlling fertility in mammals |
| US4499072A (en) | 1982-11-29 | 1985-02-12 | Merrell Dow Pharmaceuticals Inc. | Process for treating diseases with ODC inhibitors |
| US4859452A (en) | 1986-01-17 | 1989-08-22 | Board Of Regents, The University Of Texas System | Methods for the reduction of difluoromethylornithine associated toxicity |
| US4925835A (en) | 1986-05-01 | 1990-05-15 | Sloan-Kettering Institute For Cancer Research | Aziridinyl putrescine containing compositions and their uses in treating prostate cancer |
| US5002879A (en) | 1986-05-06 | 1991-03-26 | Merrell Dow Pharmaceuticals | Treatment of tumors with autologous LAK cells, interleukin-2 and an ornithine decarboxylase inhibitor |
| FR2706255B1 (fr) | 1993-06-17 | 1995-10-27 | Univ Rennes | Composition à usage alimentaire et/ou pharmaceutique pauvre en polyamines et applications thérapeutiques. |
| US5843929A (en) | 1996-03-22 | 1998-12-01 | Mayo Foundation For Medical Education And Research | Chemoprevention of metachronous adenomatous colorectal polyps |
| CA2241896A1 (en) * | 1996-11-01 | 1998-05-14 | Ze'ev Shaked | Sustained release formulation containing dfmo |
| US6486214B1 (en) | 1997-09-10 | 2002-11-26 | Rutgers, The State University Of New Jersey | Polyanhydride linkers for production of drug polymers and drug polymer compositions produced thereby |
| US6258845B1 (en) | 1998-03-28 | 2001-07-10 | The Regents Of The University Of California | DFMO and sulindac combination in cancer chemoprevention |
| US7700568B2 (en) | 1998-06-30 | 2010-04-20 | Sloan-Kettering Institute For Cancer Research | Uses of DNA-PK |
| JP2002533404A (ja) | 1998-12-23 | 2002-10-08 | ジー・ディー・サール・アンド・カンパニー | 新生物形成の治療における組合わせ療法としてインテグリン拮抗剤及び放射線治療を使用する方法 |
| US20050037090A1 (en) | 1998-12-23 | 2005-02-17 | Mckearn John P. | Combination therapy including a cyclooxygenase-2 inhibitor and an antineoplastic agent |
| US6753422B2 (en) | 1999-03-01 | 2004-06-22 | O'brien Thomas G. | Odc allelic analysis method for assessing carcinogenic susceptibility |
| AU5140300A (en) | 1999-05-17 | 2000-12-05 | Ilex Oncology, Inc. | Dfmo and celecoxib in combination for cancer chemoprevention and therapy |
| US6602910B2 (en) | 2000-03-07 | 2003-08-05 | Ilex Oncology, Inc. | D-enantiomer of DFMO and methods of use therefor |
| WO2001068076A2 (en) | 2000-03-07 | 2001-09-20 | Ilex Oncology, Inc. | D-enantiomer of dfmo and methods of use thereof for treating cancer |
| AU2001285232A1 (en) | 2000-08-24 | 2002-03-04 | Arizona Board Of Regents On Behalf Of The University Of Arizona | Alpha-difluoromethylornithine (dfmo) use in the human prostate |
| GB0125492D0 (en) * | 2001-10-24 | 2001-12-12 | Astrazeneca Ab | Formulation |
| AU2002343609B2 (en) | 2001-11-16 | 2008-12-11 | Als Therapy Development Foundation, Inc. | Treatment of neurodegenerative disorders through the modulation of the polyamine pathway |
| EP1575584A4 (en) * | 2002-11-29 | 2006-02-01 | Forest Laboratories | METHOD FOR THE TREATMENT OF ACUTE CHARACTERIZATION BY UNIFORM FORMING WITH IBUPROFEN AND OXYCODON |
| US20100009929A1 (en) | 2004-03-29 | 2010-01-14 | Cheng Jin Q | Compositions including triciribine and bortezomib and derivatives thereof and methods of use thereof |
| CN101257800B (zh) * | 2005-07-18 | 2012-07-18 | 好利用医疗公司 | 包含法莫替丁和布洛芬的药物 |
| US9072778B2 (en) | 2005-12-20 | 2015-07-07 | University Of Hawaii | Treatment regimen for N-MYC, c-MYC, and L-MYC amplified and overexpressed tumors |
| CA2657928C (en) * | 2006-07-18 | 2014-12-02 | Horizon Therapeutics, Inc. | Methods and medicaments for administration of ibuprofen |
| WO2009015981A2 (en) | 2007-08-01 | 2009-02-05 | Sigma-Tau Industrie Farmaceutiche Riunite S.P.A. | Treatment of pediatric tumors |
| WO2009048932A2 (en) | 2007-10-09 | 2009-04-16 | Children's Medical Center Corporation | Methods to regulate mirna processing by targeting lin-28 |
| WO2009052518A2 (en) * | 2007-10-19 | 2009-04-23 | Aspen Benefits Group, Llc | Methods and compositions directed to reduction of facial hair hirsutism in females |
| AU2009221765B2 (en) | 2008-03-05 | 2015-05-07 | Vicus Therapeutics, Llc | Compositions and methods for mucositis and oncology therapies |
| WO2010077653A2 (en) | 2008-12-08 | 2010-07-08 | The Procter & Gamble Company | Personal care composition in the form of an article having a hydrophobic surface-resident coating |
| CA2762391C (en) | 2009-05-20 | 2017-02-07 | Ranbaxy Laboratories Limited | Liquid dosage forms of isotretinoin |
| CN101898978A (zh) | 2009-05-31 | 2010-12-01 | 徐锋 | 依氟鸟氨酸前药和偶合物及其使用方法 |
| US20110256161A1 (en) | 2010-04-19 | 2011-10-20 | Aminex Therapeutics Inc. | Methods for enhancing immune response |
| WO2011135459A2 (en) | 2010-04-29 | 2011-11-03 | Medical Prognosis Institute A/S | Methods and devices for predicting treatment efficacy |
| EP2568978B1 (en) | 2010-05-14 | 2019-04-24 | Arizona Board of Regents on Behalf of University of Arizona | Cancer prevention and treatment based on dietary polyamine content |
| US8853423B2 (en) * | 2010-06-17 | 2014-10-07 | Seragon Pharmaceuticals, Inc. | Indane estrogen receptor modulators and uses thereof |
| US9315585B2 (en) | 2010-06-19 | 2016-04-19 | Memorial Sloan Kettering Cancer Center | Anti-GD2 antibodies |
| PL2912193T3 (pl) | 2012-10-29 | 2019-03-29 | Arizona Board Of Regents On Behalf Of University Of Arizona | Markery predykcyjne dla terapii przeciwnowotworowej z użyciem inhibitora poliaminy |
| GB2513299A (en) | 2013-03-12 | 2014-10-29 | Cellact Pharma Gmbh Biomedizinzentrum | Compounds for targeting cancer stem cells |
| CA2952771A1 (en) | 2014-06-18 | 2015-12-23 | Arizona Board Of Regents On Behalf Of The University Of Arizona | Carcinoma diagnosis and treatment based on odc1 genotype |
| WO2016130918A1 (en) | 2015-02-12 | 2016-08-18 | The Arizona Board Of Regents On Behalf Of The University Of Arizona | Methods for treating neuroblastoma |
| WO2017075576A1 (en) | 2015-10-30 | 2017-05-04 | Cancer Prevention Pharmaceuticals, Inc. | Eflornithine and sulindac, fixed dose combination formulation |
-
2016
- 2016-10-31 CN CN201680071715.3A patent/CN108366982A/zh active Pending
- 2016-10-31 MA MA043114A patent/MA43114A/fr unknown
- 2016-10-31 JP JP2018543001A patent/JP2018536707A/ja not_active Withdrawn
- 2016-10-31 KR KR1020187015233A patent/KR20180069068A/ko not_active Ceased
- 2016-10-31 MX MX2018005350A patent/MX390899B/es unknown
- 2016-10-31 KR KR1020247034905A patent/KR20240162560A/ko not_active Ceased
- 2016-10-31 CA CA3003149A patent/CA3003149C/en active Active
- 2016-10-31 AU AU2016343851A patent/AU2016343851B2/en active Active
- 2016-10-31 HK HK19100648.5A patent/HK1258284A1/zh unknown
- 2016-10-31 US US15/771,484 patent/US10973790B2/en active Active
- 2016-10-31 BR BR112018008651A patent/BR112018008651A2/pt not_active IP Right Cessation
- 2016-10-31 EP EP16794183.0A patent/EP3368029A1/en active Pending
-
2018
- 2018-04-29 IL IL259009A patent/IL259009A/en unknown
- 2018-04-30 CL CL2018001157A patent/CL2018001157A1/es unknown
- 2018-05-25 CO CONC2018/0005491A patent/CO2018005491A2/es unknown
-
2021
- 2021-03-05 US US17/193,588 patent/US11529326B2/en active Active
- 2021-11-17 JP JP2021186911A patent/JP7592001B2/ja active Active
-
2022
- 2022-11-15 US US18/055,494 patent/US11925613B2/en active Active
-
2024
- 2024-02-07 US US18/435,678 patent/US12350246B2/en active Active
- 2024-05-15 JP JP2024079276A patent/JP2024102339A/ja active Pending
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014058547A (ja) | 2007-07-19 | 2014-04-03 | Takeda Chem Ind Ltd | アログリプチンおよび塩酸メトホルミンを含有する固形製剤 |
| WO2009022670A1 (ja) | 2007-08-10 | 2009-02-19 | Takeda Pharmaceutical Company Limited | 速崩壊性錠剤 |
| US20100120727A1 (en) | 2008-11-12 | 2010-05-13 | Kyphia Pharmaceuticals, Inc. | Eflornithine Prodrugs, Conjugates and Salts, and Methods of Use Thereof |
| JP2012526852A (ja) | 2009-05-14 | 2012-11-01 | アリゾナ ボード オブ リージェンツ オン ビハーフ オブ ザ ユニバーシティー オブ アリゾナ | Odc1の遺伝子型に基づく癌腫診断及び治療 |
| WO2015054133A1 (en) | 2013-10-07 | 2015-04-16 | Bristol-Myers Squibb Company | Hiv treatment formulation of atazanavir and cobicistat |
| WO2015102400A1 (en) | 2013-12-30 | 2015-07-09 | Hanmi Pharm. Co., Ltd. | Composite formulation for oral administration comprising ezetimibe and rosuvastatin |
| JP2018536707A (ja) | 2015-10-30 | 2018-12-13 | キャンサー プリベンション ファーマシューティカルズ,インコーポレイテッド | エフロルニチンとスリンダクの固定用量複合製剤 |
Non-Patent Citations (2)
| Title |
|---|
| CANCER PREVENTION RESEARCH,2008年,1(1):32-38 |
| Phamaceutical Research,1988年,5(10):684-686 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2024102339A (ja) | 2024-07-30 |
| KR20240162560A (ko) | 2024-11-15 |
| JP2018536707A (ja) | 2018-12-13 |
| MA43114A (fr) | 2018-09-05 |
| US20230172887A1 (en) | 2023-06-08 |
| CO2018005491A2 (es) | 2018-06-12 |
| US12350246B2 (en) | 2025-07-08 |
| AU2016343851B2 (en) | 2022-04-07 |
| US10973790B2 (en) | 2021-04-13 |
| CA3003149A1 (en) | 2017-05-04 |
| MX390899B (es) | 2025-03-21 |
| US11529326B2 (en) | 2022-12-20 |
| AU2016343851A1 (en) | 2018-05-10 |
| CA3003149C (en) | 2023-10-31 |
| KR20180069068A (ko) | 2018-06-22 |
| EP3368029A1 (en) | 2018-09-05 |
| JP2022028814A (ja) | 2022-02-16 |
| BR112018008651A2 (pt) | 2018-10-30 |
| US20240173284A1 (en) | 2024-05-30 |
| US20200009098A1 (en) | 2020-01-09 |
| HK1258284A1 (zh) | 2019-11-08 |
| CL2018001157A1 (es) | 2018-09-07 |
| US20210267926A1 (en) | 2021-09-02 |
| CN108366982A (zh) | 2018-08-03 |
| IL259009A (en) | 2018-07-31 |
| MX2018005350A (es) | 2018-08-14 |
| US11925613B2 (en) | 2024-03-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7592001B2 (ja) | エフロルニチンとスリンダクの固定用量複合製剤 | |
| US8449910B2 (en) | Stable compositions of famotidine and ibuprofen | |
| BR112012028035B1 (pt) | formulação de liberação imediata | |
| JP2022033758A (ja) | 生理活性の強い、urat1のインヒビターを含む医薬組成物 | |
| CN111278433A (zh) | 尼拉帕尼制剂 | |
| JP7431886B2 (ja) | 新規テビペネムピボキシルの即放性および調節放出性経口剤形 | |
| WO2017075576A1 (en) | Eflornithine and sulindac, fixed dose combination formulation | |
| TWI743059B (zh) | 二氟甲基鳥氨酸及舒林酸(sulindac),固定劑量組合調配物 | |
| US20150224056A1 (en) | Pharmaceutical compositions of ibuprofen and famotidine | |
| CA3235787A1 (en) | Methods of treating patients having type 1 diabetes with eflornithine | |
| JP2008546830A (ja) | pH依存性の溶解度を有する有効成分の持続放出製剤 | |
| US20130236538A1 (en) | Pharmaceutical compositions of ibuprofen and famotidine | |
| EP4366707A2 (en) | Pharmaceutical composition comprising naproxen and paracetamol | |
| JP2019530755A (ja) | セレコキシブを含む錠剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211216 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20211216 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230201 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230425 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20230726 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230802 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20231017 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20240115 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240515 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240521 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20240516 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20240521 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20240610 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20241003 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20241029 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20241119 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7592001 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |