JP7581345B2 - 2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオンを用いて慢性リンパ性白血病を治療する方法 - Google Patents
2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオンを用いて慢性リンパ性白血病を治療する方法 Download PDFInfo
- Publication number
- JP7581345B2 JP7581345B2 JP2022523519A JP2022523519A JP7581345B2 JP 7581345 B2 JP7581345 B2 JP 7581345B2 JP 2022523519 A JP2022523519 A JP 2022523519A JP 2022523519 A JP2022523519 A JP 2022523519A JP 7581345 B2 JP7581345 B2 JP 7581345B2
- Authority
- JP
- Japan
- Prior art keywords
- compound
- day
- days
- pharmaceutical composition
- dose
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
- A61K9/0056—Mouth soluble or dispersible forms; Suckable, eatable, chewable coherent forms; Forms rapidly disintegrating in the mouth; Lozenges; Lollipops; Bite capsules; Baked products; Baits or other oral forms for animals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2887—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against CD20
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Organic Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Immunology (AREA)
- Epidemiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oncology (AREA)
- Hematology (AREA)
- Physiology (AREA)
- Nutrition Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Engineering & Computer Science (AREA)
- Zoology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Description
特に定義されない限り、本明細書で使用されるすべての技術的および科学的用語は、当業者によって一般的に理解されるのと同じ意味を有する。すべての特許、出願、公開公報および他の刊行物は、出典明示によりその全体が本明細書に組み込まれる。本明細書にて、ある用語について複数の定義がある場合には、特記されない限り、このセクションの定義を優先する。
a 6個以下のリンパ節のプロダクツの合計(臨床試験ではCTスキャンおよび身体検査で、または一般診療では身体検査で評価される)
b 脾臓の大きさは、13cm未満であれば、正常とみなされる。正常な肝臓の大きさについては、国際的なコンセンサスははっきりと確立されていない;従って、臨床試験では画像診断と触診によって肝臓の大きさを評価し、研究プロトコルにおいて使用される定義に従って、記録されるべきである。
出典:Oken Mら、Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol, 5(6):649-655(1982)
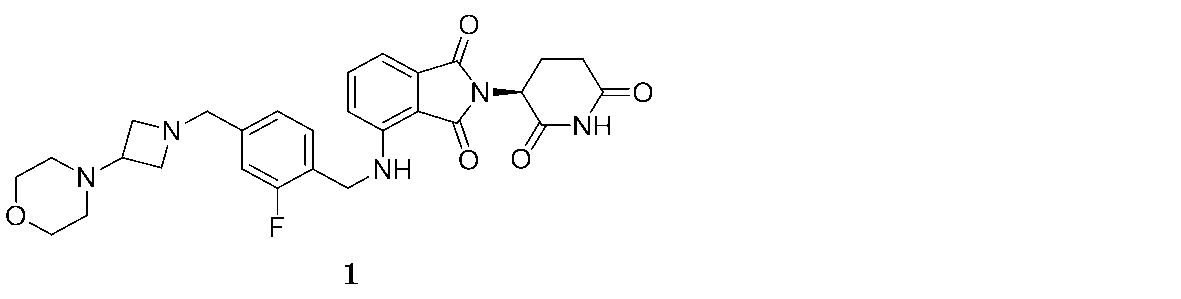
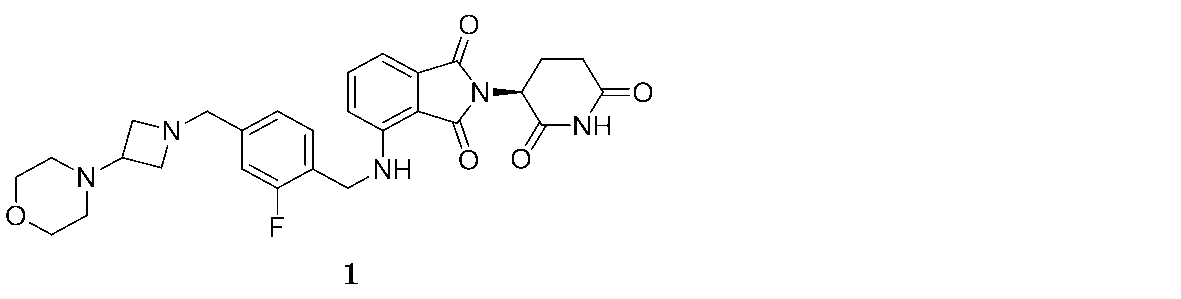
本明細書にて提供される方法にて用いるために提供されるのは、(S)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(「化合物1」と称される):
1の実施態様において、本明細書で提供されるのは、CLL/SLLを治療、予防または管理するために、2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン、あるいはそのエナンチオマー、エナンチオマーの混合物、互変異性体、アイソトポログ、または医薬的に許容される塩を単独で、またはオビヌツズマブと組み合わせて用いる方法である。
本明細書で提供される化合物は、対象に、カプセル、マイクロカプセル、錠剤、顆粒、散剤、トローチ、ピル、坐剤、注射液、懸濁液、シロップ、パッチ、クリーム、ローション、軟膏、ゲル、スプレー、液剤およびエマルジョンなどの従来の形態の製剤にて経口的に、局所的に、または非経口的に投与され得る。適切な製剤は、希釈剤(例、シュークロース、澱粉、マンニトール、ソルビトール、ラクトース、グルコース、セルロース、タルク、リン酸カルシウムまたは炭酸カルシウム)、結合剤(例、セルロース、メチルセルロース、ヒドロキシメチルセルロース、ポリプロピルピロリドン、ポリビニルピロリドン、ゼラチン、アラビアガム、ポリエチレングリコール、シュークロースまたは澱粉)、崩壊剤(例、澱粉、カルボキシメチルセルロース、ヒドロキシプロピルスターチ、低置換度ヒドロキシプロピルセルロース、重炭酸ナトリウム、リン酸カルシウムまたはクエン酸カルシウム)、滑沢剤(例、ステアリン酸マグネシウム、軽質無水ケイ酸、タルクまたはラウリル硫酸ナトリウム)、矯味矯臭剤(例、クエン酸、メントール、グリシンまたはオレンジ粉末)、保存剤(例、安息香酸ナトリウム、重亜硫酸ナトリウム、メチルパラベンまたはプロピルパラベン)、安定剤(例、クエン酸、クエン酸ナトリウムまたは酢酸)、沈殿防止剤(例、メチルセルロース、ポリビニルピロリドンまたはステアリン酸アルミニウム)、分散剤(例、ヒドロキシプロピルメチルセルロース)、水、およびベースワックス(例、ココアバター、白色ペトロラクタムまたはポリエチレングリコール)などの従来の有機または無機添加剤を用いて、一般的に利用される方法によって製造され得る。医薬組成物中の化合物の効果的な量は、経口および非経口投与の両方にて、所望の効果を発揮するであろうレベルとすることができる。
1の実施態様において、オビヌツズマブは、疾患が進行するまで、その後の28日間のサイクルの初日に約1000mgで投与される。1の実施態様において、オビヌツズマブは、本明細書で提供される化合物、例えば、化合物1の投与を開始する少なくとも1週間前に、最初の28日間のサイクルにて約1000mgで投与される。
1の実施態様において、本明細書で提供される方法は、化合物1の初回用量を投与する13日前にオビヌツズマブの初回用量を投与することを含む。1の実施態様において、本明細書で提供される方法は、化合物1の初回用量を投与する14日前にオビヌツズマブの初回用量を投与することを含む。1の実施態様において、本明細書で提供される方法は、化合物1の初回用量を投与する14日前にオビヌツズマブの初回用量を投与し、化合物1の初回用量を投与する13日および7日前にオビヌツズマブの後続的な用量を投与することを含む。1の実施態様において、オビヌツズマブの初回用量は少なくとも1000mgである。1の実施態様において、オビヌツズマブの初回用量は約1000mgである。オビヌツズマブの初回用量は1日に投与される単回用量と、または複数の日数で投与される組み合わせた用量とすることができる。1の実施態様において、本明細書で提供される方法は、最初の28日間のサイクルの15日目に化合物1の初回用量を投与する前に、オビヌツズマブを最初の28日間のサイクルの初日に約100mgの、最初の28日間のサイクルの2日目に約900mgの、および最初の28日間のサイクルの8日目に約1000mgの用量で投与することを含む。1の実施態様において、本明細書で提供される方法は、最初の28日間のサイクルの15日目に化合物1の初回用量を投与する前に、オビヌツズマブを最初の28日間のサイクルの初日および2日目に合わせて約1000mgの、および最初の28日間のサイクルの8日目に約1000mgの用量で投与することを含む。
以下の実施例は、説明のために提示されたものであり、限定されるものではない。化合物は、化学構造については系統的に名称付け、立体化学についてはCahn-Ingold-Prelog規則でサポートする、ChemBiodraw Ultra(Cambridgesoft)から提供されるオートマティック・ネーム・ジェネレーティング・ツールを用いて命名される。当業者であれば、所望の生成物を得るために、例示としての実施例にて示される操作を修飾することができる。
(S)-4-アミノ-2-(2,6-ジオキソピペリジン-3-イル)イソインドリン-1,3-ジオン(5.00g、18.3ミリモル)および2-フルオロ-4-(ヒドロキシメチル)ベンズアルデヒド(2.82g、18.30ミリモル)の2:1 ジオキサン-MeOH(75mL)中懸濁液を0℃に冷却し、B10H14(4.92g、40.3ミリモル)を5分間にわたって少しづつ添加した。反応フラスコにセプタムおよびニードルベント(圧力)を取り付け、10分間にわたって激しく撹拌した。該混合物を外界温度に到達させ、3時間撹拌した。混合物を濃縮し、残渣をシリカゲルクロマトグラフィー(0-10%MeOH-DCM)に付して精製し、(S)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-(ヒドロキシメチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(4.23g、56%)を黄色の固体として得た。LCMS(ESI) m/z 411.8[M+H]+
(S)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-(ヒドロキシメチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(0.727g、1.77ミリモル)の乾燥NMP(6mL)中溶液を0℃に冷却し、塩化メタンスルホニル(0.275mL、3.35ミリモル)およびDIEA(0.617mL、3.53ミリモル)を連続して添加した。反応混合物を外界温度に到達させ、18時間撹拌した。該反応混合物を、激しく混合しながら、0℃に冷却したH2O(60mL)に、ゆっくりと添加した。得られた懸濁液を濾過し、固体を集め、H2OおよびEt2Oで洗浄した。該固体をEtOAcに溶かし、その溶液をMgSO4で乾燥させ、濾過し、濃縮して(S)-4-((4-(クロロメチル)-2-フルオロベンジル)アミノ)-2-(2,6-ジオキソピペリジン-3-イル)イソインドリン-1,3-ジオン(0.600g、79%)を黄色の固体として得た。LCMS(ESI) m/z 430.0[M+H]+
(S)-4-((4-(クロロメチル)-2-フルオロベンジル)アミノ)-2-(2,6-ジオキソピペリジン-3-イル)イソインドリン-1,3-ジオン(300mg、0.698ミリモル)の乾燥DMSO(1.0mL)中溶液に、4-(アゼチジン-3-イル)モルホリン・塩酸塩(125mg、0.698ミリモル)およびDIEA(0.122mL、0.698ミリモル)を添加した。反応混合物を外界温度で18時間撹拌し、DMSO(1mL)で希釈した。該溶液をキラル逆相クロマトグラフィーに付して精製し、(S)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(89mg、24%、97%ee)を得た。LCMS(ESI) m/z 536.2[M+H]+
4-ブロモ-3-フルオロ-安息香酸(15.0g、68.5ミリモル)のTHF(150mL)中溶液を0℃に冷却し、ボラン・ジメチルスルフィド複合体(13.7mL、137ミリモル、THF中10M)を窒素雰囲気下にて滴下して加えた。冷却浴を取り外し、混合物を外界温度で12時間撹拌した。混合物を0℃に冷却し、MeOH(50mL)でクエンチさせ、水(30mL)中に注いだ。該混合物を真空下で濃縮し、残りの水性混合物を酢酸エチル(150mL)および水(150mL)で希釈し、15分間撹拌した。有機相を取り出し、水相を酢酸エチル(150mLx2)で抽出した。有機フラクションを合わせ、無水硫酸ナトリウムで乾燥させ、濾過し、真空下で濃縮した。残渣をシリカゲルカラムクロマトグラフィー(石油エーテル中2-10%酢酸エチル)に付して精製し、(4-ブロモ-3-フルオロ-フェニル)メタノール(13.1g、収率93.3%)を無色の液体として得た。LCMS(ESI) m/z 187.0[MH-18+];1H NMR(400MHz、CDCl3) δ ppm 7.54-7.45(m,1H)、7.14(d,J=9.2Hz,1H)、7.00(d,J=7.9Hz,1H)、4.64(d,J=4.6Hz,2H)、2.20(brs,1H)
(4-ブロモ-3-フルオロ-フェニル)メタノール(13.1g、63.9ミリモル)およびイミダゾール(12.2g、179ミリモル)のDMF(150mL)中溶液を0℃に冷却し、tert-ブチルクロロジメチルシラン(14.4g、95.8ミリモル)を添加した。冷却浴を取り外し、混合物を外界温度で16時間撹拌した。反応物を冷水(30mL)中に注ぎ、酢酸エチル(100mL)および水(100mL)で希釈し、15分間撹拌した。有機相を取り出し、水相を酢酸エチル(150mLx2)で抽出した。有機フラクションを合わせ、飽和NaCl(50mLx2)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空下で濃縮した。残渣をシリカゲルカラムクロマトグラフィー(石油エーテル中0-10%酢酸エチル)に付して精製し、(4-ブロモ-3-フルオロ-フェニル)メトキシ-tert-ブチル-ジメチル-シラン(18.6g、収率91.2%)を無色の液体として得た。1H NMR(400MHz、CDCl3) δ ppm 7.49(dd,J=7.1、8.1Hz,1H)、7.18-7.08(m,1H)、7.01-6.92(m,1H)、4.69(s,2H)、0.96(s,9H)、0.12(s,6H)
窒素雰囲気下、(4-ブロモ-3-フルオロ-フェニル)メトキシ-tert-ブチル-ジメチル-シラン(18.6g、58.3ミリモル)のTHF(150mL)中溶液を-78℃に冷却し、n-BuLi(25.6mL、64.0ミリモル、ヘキサン中2.5M)を滴下して加えた。混合物を-78℃で5分間撹拌し、DMF(5.83mL、75.7ミリモル)を添加した。該混合物を-78℃で2時間撹拌し、外界温度にまで加温させた。反応混合物を0℃に冷却し、飽和塩化アンモニウム(60mL)および水(30mL)でクエンチさせた。該混合物を酢酸エチル(2x150mL)で抽出し、合わせた抽出液を硫酸ナトリウムで乾燥させ、濾過して濃縮した。残渣をシリカゲルカラムクロマトグラフィー(石油エーテル中0-2%酢酸エチル)に付して精製し、4-[[tert-ブチル(ジメチル)シリル]オキシメチル]-2-フルオロ-ベンズアルデヒド(11.5g、収率73.5%)を黄色の液体として得た。MS(ESI) m/z:269.1[M+1]+
4-[[tert-ブチル(ジメチル)シリル]オキシメチル]-2-フルオロ-ベンズアルデヒド(7.50g、27.9ミリモル)および3-アミノフタル酸(5.06g、27.9ミリモル)の1:10 酢酸-MeOH(110mL)中溶液を25℃で30分間撹拌し、0℃に冷却した。ボラン 2-メチルピリジン複合体(4.48g、41.9ミリモル)を加え、混合物を外界温度にまで到達させた。該混合物を外界温度で16時間撹拌し、該混合物を減圧下で濃縮した。残渣を水(25mL)および酢酸エチル(25mL)で希釈し、15分間撹拌した。有機層を取り除き、水層を酢酸エチル(30mLx2)で抽出した。有機フラクションを合わせ、無水硫酸ナトリウムで乾燥させ、濾過し、濃縮した。残渣をシリカゲルカラムクロマトグラフィー(石油エーテル中2-5%酢酸エチル)に付して精製し、3-((4-(((tert-ブチルジメチルシリル)オキシ)メチル)-2-フルオロベンジル)アミノ)フタル酸(9.90g、収率81.8%)を白色の固体として得た。LCMS(ESI) m/z:434.1[M+1]+
3-((4-(((tert-ブチルジメチルシリル)オキシ)メチル)-2-フルオロベンジル)アミノ)フタル酸(11.8g、27.2ミリモル)および3-アミノピペリジン-2,6-ジオン・塩酸塩(6.72g、40.8ミリモル)のピリジン(150mL)中溶液を窒素雰囲気下にて120℃で12時間撹拌した。混合物を減圧下で濃縮し、残渣をシリカゲルカラムクロマトグラフィー(石油エーテル中2-5%酢酸エチル)に付して精製し、4-((4-(((tert-ブチルジメチルシリル)オキシ)メチル)-2-フルオロベンジル)アミノ)-2-(2,6-ジオキソピペリジン-3-イル)イソインドリン-1,3-ジオン(9.90g、収率69.2%)を黄色の固体として得た。LCMS(ESI) m/z:526.2[M+1]+
4-((4(((tert-ブチルジメチルシリル)オキシ)メチル)-2-フルオロベンジル)アミノ)-2-(2,6-ジオキソピペリジン-3-イル)イソインドリン-1,3-ジオン(9.90g、18.8ミリモル)のTHF(100mL)中溶液に、濃硫酸(20.0mL、368ミリモル)を加え、該混合物を外界温度で12時間撹拌した。該混合物を真空下で濃縮し、残渣を1:5 酢酸エチル-石油エーテル(20mL)で処理した。得られた懸濁液を30分間撹拌し、濾過した。固体を集め、1:5 酢酸エチル-石油エーテルで洗浄し、真空下で乾燥させ、2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-(ヒドロキシメチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(6.58g、収率85.2%)を黄色の固体として得た。MS(ESI) m/z:412.0[M+1]+;1H NMR(400MHz、DMSO-d6) δ ppm 11.12(s,1H)、7.54(dd,J=7.3、8.4Hz,1H)、7.33(t,J=7.8Hz,1H)、7.16-7.07(m,3H)、7.05(d,J=7.0Hz,1H)、6.99(d,J=8.5Hz,1H)、5.33-5.25(m,1H)、5.07(dd,J=5.3、12.9Hz,1H)、4.59(d,J=6.3Hz,2H)、4.47(d,J=5.8Hz,2H)、2.95-2.84(m,1H)、2.65-2.52(m,2H)、2.09-2.01(m,1H)
2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-(ヒドロキシメチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(6.58g、16.0ミリモル)のジクロロメタン(200mL)中溶液を0℃に冷却し、塩化チオニル(20.0mL、276ミリモル)を滴下して加えた。添加の終了した後、冷却浴を取り外し、反応混合物を外界温度で2時間撹拌した。該混合物を真空下で濃縮し、残渣をシリカゲルカラムクロマトグラフィー(ジクロロメタン中1.00-1.25%MeOH)に付して精製し、4-((4-(クロロメチル)-2-フルオロベンジル)アミノ)-2-(2,6-ジオキソピペリジン-3-イル)イソインドリン-1,3-ジオン(3.80g、収率55.4%)を黄色の固体として得た。LCMS(ESI) m/z:430.0[M+1]+;1H NMR(400MHz、DMSO-d6) δ ppm 11.12(s,1H)、7.54(dd,J=7.3、8.4 Hz,1H)、7.38(t,J=7.9Hz,1H)、7.32(dd,J=1.5、11.0Hz,1H)、7.24(dd,J=1.6、7.8Hz,1H)、7.16(t,J=6.3Hz,1H)、7.06(d,J=6.9Hz,1H)、6.98(d,J=8.5Hz,1H)、5.08(dd,J=5.3、12.9Hz,1H)、4.74(s,2H)、4.63(d,J=6.3Hz,2H)、2.95-2.85(m,1H)、2.66-2.53(m,2H)、2.09-2.02(m,1H)
4-((4-(クロロメチル)-2-フルオロベンジル)アミノ)-2-(2,6-ジオキソピペリジン-3-イル)イソインドリン-1,3-ジオン(215mg、0.500ミリモル)(本明細書で提供されるように製造される)および4-(アゼチジン-3-イル)モルホリン・塩酸塩(107mg、0.600ミリモル)の乾燥DMSO(1.7mL)中溶液に、DIEA(262μL、1.50ミリモル)を添加し、該混合物を外界温度で48時間撹拌した。該反応混合物をDMSO中20%ギ酸(2.5mL)で希釈し、膜シリンジフィルター(0.45μmナイロン)を通して濾過した。該溶液を標準的方法を用いて精製し、2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(173mg、収率64.6%)を得た。LCMS(ESI) m/z 536.2[M+H]+
以下は、例示的なCLL細胞株(表3)を用いて、本明細書にて記載の化合物の抗増殖活性およびアポトーシス効果を測定するのに使用され得る、細胞ベースのアッセイの例である。本明細書に記載の化合物1のインビトロでの増殖阻害活性を384-ウェルのフローサイトメトリーアッセイを用いて評価した。
表4. 化合物1のCLL細胞株での抗増殖活性および/またはアポトーシス効果
以下は、例示としてのCLL患者の細胞を用い、本明細書に記載の化合物の抗増殖活性およびアポトーシス効果を測定するのに使用され得る、細胞をベースとするアッセイの例である。化合物1のCLL B細胞の生存およびアポトーシスに関する効果をエクスビボモデルを利用して評価した。
オビヌツズマブ(GA101)は、CD20を標的とする、ヒト化された糖鎖改変2型抗体である。オビヌツズマブは、リツキシマブと比較して、直接的細胞死を誘発し、抗体依存性細胞傷害を強化することにより、優れた効能を示した。化合物1をオビヌツズマブと組み合わせて処理することによるCLL B細胞の増殖および生存についての効果を、患者由来の血液からの初代CLL細胞を、96ウェルプレートフォーマットにて、10%ウシ胎児血清(FBS)、5ng/mLの組換えヒトインターフェロン-4(rhIL-4)、10ng/mL組換えヒトインターフェロン-10(rhIL-10)で刺激して増殖させ、表面CD154(CD40L)を発現する線維芽細胞と共培養させる、エクスビボ実験を利用して評価した。
再発性または難治性の慢性リンパ性白血病/小リンパ球性リンパ腫(R/R CLL/SLL)の対象において、化合物1をオビヌツズマブと組み合わせた、安全性、薬物動態性、および予備的な有効性を測定するのに、フェーズ1bの複数の施設でのオープンラベル試験が行われる。
1. インフォームドコンセントフォーム(ICF)に署名する時点で対照は>18歳である。
2. 対象は、試験関連のいずれの評価/操作が行われる前にも、ICFを理解しており、自発的に署名するものでなければならない。
3. 対象は、試験の来院計画、および他のプロトコルの要件を遵守する意思および能力がある。
4. 対象は、治療を必要とするCLL/SLLの文書による診断を受けていなければならない(iwCLL Guidelines for the Diagnosis and Treatment of CLL)(表1および2)。加えて:
a. 列挙される少なくとも1つの因子によって決定される臨床的に測定可能な疾患が存在すること:
- 結節性病変にて、測定して最長寸法(LD)が>1.5cmであり、直交する最長寸法(LPD)が>1.0cmであること、または
- 脾臓にて、測定して最長の垂直寸法(LVD)が>14cmであり、最低でも2cmの拡大があること、または
- 肝臓にて、測定してLVDが>20cmであり、最低でも2cmの拡大があること、または
- 末梢血Bリンパ球数にて、>5000/μLであること
5. 対象は、iwCLLガイドラインに従って、少なくとも2つのラインの先行する療法に対して再発性および/または難治性疾患の基準を満たしていなければならない。
6. 望ましいすべての対象は、少なくとも2つのラインの先行する療法の後に再発するか、またはその療法に対して難治的でなければならず、その療法剤の1つが承認されたBTK阻害剤を含む必要がある。
7. 対象は、Eastern Cooperative Oncology Group(ECOG)の一般状態にて0-2の指標を有する(表2)。
8. 対象は以下の実験室パラメータに合致すること:
a. 絶対好中球数(ANC)が、>1,500細胞/mm3であるか、または疾患による骨髄障害に続発するならば、>1,000細胞/mm3である。
b. 血小板の数が、>100,000細胞/mm3(100x109/L)であるか、または疾患による骨髄障害に続発するならば、>50,000細胞/mm3(50x109/L)である。
c. 血清中アスパラギン酸塩トランスアミナーゼ(AST/SGOT)またはアラニントランスアミナーゼ(ALT/SGPT)が<3.0x正常上限(ULN)である。
d. 血清中ビリルビンが、ジルベール症候群による場合を除き、<1.5xULNである。
e. クレアチニンクリアランス計算値が>60mL/分である。
9. 試験期間中、および試験治療の終了後に、定期的な妊娠検査および妊娠リスク管理計画に同意する必要がある。このことは、対象が異性との接触を真に節制することを実践している場合であっても適用される。妊娠可能な女性(FCBP)とは、1)どこかの時点で初潮を迎えているか、2)子宮摘出術または両側卵管切除術を受けていないか、または3)少なくとも24カ月の連続した間に自然に月経の閉鎖していない(すなわち、過去24カ月の連続した間のいずれかの時点で月経があった)(がん療法した後の無月経は妊娠の可能性を排除するものではない)、女性であり、
a. 試験療法を開始する前に、治験責任医師によって確認されるように、妊娠検査が2回陰性でなければならない。試験期間中、試験療法が終了した後も、妊娠検査を続けることに同意しなければならない。このことは、対象が異性との接触を真に節制することを実践している場合であっても適用される。
b. 異性との接触を真に節制することを誓うか(このことは月単位で確認する必要があり、出所を文書化しなければならない)、またはPPPにて定義され、インフォームドコンセントの時点で、化合物1を開始する28日前に、試験療法(投与中断の間を含む)の間に、および次のいずれかが最後である、試験療法の中断後に28日間にわたって、またはオビヌツズマブを最後に投与してから18ヶ月にわたって、対象に提供される2つの信頼できる形態の避妊法を、中断することなく、使用し、遵守し得ることに同意しなければならない。
1. 対象は、該対象が試験に関与することを妨げるであろう、何らかの有意な病状、検査値異常、または精神疾患を有している。
2. 対象は、彼/彼女が試験に関与するとしたら、検査値異常の存在を含め、該対象を許容できないリスクにさらす、何らかの症状を有している。
3. 対象は、試験からのデータを解釈する能力を損なう、何らかの症状を有している。
4. ICFに署名した12カ月以内に、先行して同種幹細胞移植(SCT)/骨髄移植を受けている。ICFに署名する>12カ月前に、同種SCTを受けた対象も、対宿主移植片疾患(GVHD)が進行しておらず、免疫抑制療法が進んでいないことを条件に、適格となる可能性がある。
5. 非経口用抗生物質を必要とする感染症が進行しているか、または活動中である。
6. 限定されないが、以下の疾病を含む、コントロール不良の併発疾病:
a. コントロール不良の真性糖尿病;糖尿病の対象の標的とする血糖値は、対象の年齢、合併症、余命、および機能状態を考慮し、確立されたガイドライン(例、International Diabetes Federation、the European Diabetes Working Party guidelines、およびthe American Diabetes Association)に従うものとする。若年者(<70歳)または余命(>10年)の対象では、標的とするグリコシル化ヘモグロビンA1C型(HbA1C)は、<7.0%とするべきである。より年配(>70歳)の対象または余命が<10年の対象の場合、その標的とするHbA1Cは<8.0%とすべきである。糖尿病が最適に調節されているかどうかを判断する場合には、内分泌専門医に相談することが推奨される。示唆されている標的よりも高い安定したHbA1Cの対象については、メディカルモニターと協議した上で登録されてもよい。
b. 慢性症候性鬱血性心不全(the New York Heart Association Classification for Heart DiseaseのClass IIIまたはIV);
c. 髄液細胞診または画像診断により証明された活動中の中枢神経系への侵襲;
d. コントロール不良の自己免疫性溶血性貧血または血小板減少症;
e. 許容できない安全性リスクを引き起こすか、またはプロトコルの遵守を損ない得る、他の同時に起こる重篤および/またはコントロール不良の付随する病状がある。
7. 対象は、化合物1の<5半減期、または化合物1での治療を開始する前の4週間に(そのいずれか短い方で)先行する全身性抗がん治療薬(承認薬、または治験薬)を受けている。
8. 対象は、化合物1での治療を開始する、<4週間前までに先行するCAR-Tまたは他のT-細胞標的治療薬(承認薬、または治験薬)を受けている。
9. 対象は、化合物1での治療を開始する、<4週間前までにCRBN調整薬(例、レナリドミド、アバドミド/CC-122、ポマリドミド)での先行する療法を受けている。
10. 余命<2年の別の悪性腫瘍の病歴があるか、または試験結果を混乱させるような療法剤を必要とする。これは次の場合を含まない:
a. 皮膚の基底細胞がん;
b. 皮膚の扁平上皮がん;
c. 子宮頸部上皮内がん;
d. 乳房上皮内がん;
e. 膀胱上皮内がん;
f. 前立腺がんの偶発的な組織学的所見(T1aまたはT1bの腫瘍、結節、転移[TNM]TNM段階)
11. ヒト免疫不全ウイルス(HIV)またはB型またはC型肝炎ウイルス(HBV、HCV)に対して既知の血清反応陽性またはそのウイルスでの活動性ウイルス感染の病歴がある。B型肝炎のスクリーニングはすべての患者に対して必須である(HBsAgおよび抗HBc)。活動性B型肝炎の患者はオビヌツズマブで治療されるべきではない。患者がキャリアであるならば、治療を開始する前に専門医に紹介されるべきである(PIまたはSmPCを参照のこと)。抗HBcおよび/または抗HBsに対して陽性であるが、HBsAgおよびHBV DNAに対して陰性である対象は、肝臓専門医と相談した上で治療を受けてもよい。
12. 末梢神経障害が>グレード2である。
13. 全身性コルチコステロイドを20mg/日のプレドニゾロン相当量よりも多くの用量で使用している。
14. QT延長または心室性不整脈(torsades de pointes)を惹起する可能性の高い薬剤を受けている。このカテゴリーに属する慢性的な薬剤使用の対象は、これらの薬剤の変更が患者の最良の医学的利益にない場合には、医療用モニターを用いて検討した後に、登録することもできる。
15. 免疫調節イミド薬(IMiDs(登録商標))(レナリドミド、ポマリドミド、サリドマイド)に対して過敏症の病歴がある。
16. 心機能障害または臨床的に有意な心疾患(以下のいずれかの疾患を含む)がある:
a. MUGAスキャンまたはECHOで測定した場合に、LVEFが<45%である;
b. 完全左脚ブロック、または二束ブロック;
c. 先天性QT延長症候群;
d. 持続的またはコントロール不良の心室性不整脈または心房細動;
e. スクリーニングECGでQTcFが>470ミリ秒である(三回録音した平均);
f. 化合物1で開始する<6カ月に発症した、不安定狭心症または心筋梗塞;
g. コントロール不良の鬱血性心不全またはコントロール不良の高血圧
17. 医学的な管理に拘わらず、持続的な下痢または吸収不良が>NCI CTCAEグレード2である。
18. 活動性病変(すなわち、リヒター症候群);ICFに署名してから>2年を経過したリヒター症候群の対象が適任である。
19. 既知の急性または慢性膵炎である。
20. 妊娠中または授乳中の女性である。
21. オビヌツズマブ、またはそのいずれかの賦形剤に対して過敏症である。
再発性または難治性の慢性リンパ性白血病/小リンパ球性リンパ腫(R/R CLL/SLL)の対象において、化合物1をオビヌツズマブと組み合わせた、安全性、薬物動態性、および予備的な有効性を測定するのに、フェーズ1bの複数の施設でのオープンラベル試験が行われる。
1. インフォームドコンセントフォーム(ICF)に署名する時点で対照は>18歳である。
2. 対象は、試験関連のいずれの評価/操作が行われる前にも、ICFを理解しており、自発的に署名するものでなければならない。
3. 対象は、試験の来院計画、および他のプロトコルの要件を遵守する意思および能力がある。
4. 対象は、治療を必要とするCLL/SLLの文書による診断を受けていなければならない(iwCLL Guidelines for the Diagnosis and Treatment of CLL)(表1および2)。加えて:
a. 列挙される少なくとも1つの因子によって決定される臨床的に測定可能な疾患が存在すること:
- 結節性病変にて、測定して最長寸法(LD)が>1.5cmであり、直交する最長寸法(LPD)が>1.0cmであること、または
- 脾臓にて、測定して最長の垂直寸法(LVD)が>14cmであり、最低でも2cmの拡大があること、または
- 肝臓にて、測定してLVDが>20cmであり、最低でも2cmの拡大があること、または
- 末梢血Bリンパ球数にて、>5000/μLであること
5. 対象は、iwCLLガイドラインに従って、少なくとも2つのラインの先行する療法に対して再発性および/または難治性疾患の基準を満たしていなければならない。
6. 望ましいすべての対象は、少なくとも2つのラインの先行する療法の後に再発するか、またはその療法に対して難治的でなければならず、その療法剤の1つがB細胞受容体シグナル伝達の阻害剤(承認されたBTK阻害剤iまたはPI3Ki)またはベネトクラクスを含む必要がある。オビヌツズマブを含有するレジメンを用いる先行する療法は許容される。
7. 対象は、Eastern Cooperative Oncology Group(ECOG)の一般状態にて0-2の指標を有する(表2)。
8. 対象は以下の実験室パラメータに合致すること:
a. 絶対好中球数(ANC)が、>1,500細胞/mm3であるか、または疾患による骨髄障害に続発するならば、>1,000細胞/mm3である。
b. 血小板の数が、>100,000細胞/mm3(100x109/L)であるか、または疾患による骨髄障害に続発するならば、>50,000細胞/mm3(50x109/L)である。
c. 血清中アスパラギン酸塩トランスアミナーゼ(AST/SGOT)またはアラニントランスアミナーゼ(ALT/SGPT)が<3.0x正常上限(ULN)である。
d. 血清中ビリルビンが、ジルベール症候群による場合を除き、<1.5xULNである。
e. 血清中クレアチニンクリアランス推定値がコッククロフト-ガウルト(Cockcroft-Gault)の式を用いるか、または24時間にわたって尿を収集する方法によって直接測定した場合に、>60mL/分である。
9. 試験期間中、および試験治療の終了後に、定期的な妊娠検査および妊娠リスク管理計画に同意する必要がある。このことは、対象が異性との接触を真に節制することを実践している場合であっても適用される。妊娠可能な女性(FCBP)とは、1)どこかの時点で初潮を迎えているか、2)子宮摘出術または両側卵管切除術を受けていないか、または3)少なくとも24カ月の連続した間に自然に月経の閉鎖していない(すなわち、過去24カ月の連続した間のいずれかの時点で月経があった)(がん療法した後の無月経は妊娠の可能性を排除するものではない)、女性であり、
a. 試験療法を開始する前に、治験責任医師によって確認されるように、妊娠検査が2回陰性でなければならない。妊娠スクリーニング検査(尿または血清)は、14日目、初日、サイクル1の1日前に行われ、2回目の確認試験(血清)をサイクル1の初日の24時間以内に行う。加えて、妊娠検査は、化合物1を投与する前のサイクル1の15日目の24時間前に行う必要がある。この女性は、試験期間中、試験療法が終了した後も、妊娠検査を続けることに同意しなければならない。このことは、対象が異性との接触を真に節制することを実践している場合であっても適用される。
b. 異性との接触を真に節制することを誓うか(このことは月単位で確認する必要があり、出所を文書化しなければならない)、またはPPPにて定義され、インフォームドコンセントの時点で、化合物1を開始する28日前に、試験療法(投与中断の間を含む)の間に、および次のいずれかが最後である、試験療法の中断後に28日間にわたって、またはオビヌツズマブを最後に投与してから18ヶ月にわたって、対象に提供される2つの信頼できる形態の避妊法を、中断することなく、使用し、遵守し得ることに同意しなければならない。
c. 化合物1を最後に投与した後は28日間妊娠を回避しなければならない。
d. 化合物1を投与している間、およびその中止から28日間は授乳を控えることに同意しなければならない。
e. 化合物1を投与している間、およびその中止から30日間は卵子を提供を控えることに同意しなければならない。
1. 対象は、該対象が試験に関与することを妨げるであろう、何らかの有意な病状、検査値異常、または精神疾患を有している。
2. 対象は、彼/彼女が試験に関与するとしたら、検査値異常の存在を含め、該対象を許容できないリスクにさらす、何らかの症状を有している。
3. 対象は、試験からのデータを解釈する能力を損なう、何らかの症状を有している。
4. ICFに署名した12カ月以内に、先行して同種幹細胞移植(SCT)/骨髄移植を受けている。ICFに署名する>12カ月前に、同種SCTを受けた対象も、対宿主移植片疾患(GVHD)が進行しておらず、免疫抑制療法が進んでいないことを条件に、適格となる可能性がある。
5. 非経口用抗生物質を必要とする感染症が進行しているか、または活動中である。
6. 限定されないが、以下の疾病を含む、コントロール不良の併発疾病:
a. 慢性症候性鬱血性心不全(the New York Heart Association Classification for Heart DiseaseのClass IIIまたはIV);
b. 髄液細胞診または画像診断により証明された活動中の中枢神経系への侵襲;
c. コントロール不良/活動的な自己免疫性溶血性貧血または血小板減少症;
d. 許容できない安全性リスクを引き起こすか、またはプロトコルの遵守を損ない得る、他の同時に起こる重篤および/またはコントロール不良の付随する病状がある。
7. 対象は、化合物1の<5半減期、または化合物1での治療を開始する前の4週間に(そのいずれか短い方で)先行する全身性抗がん治療薬(承認薬、または治験薬)を受けている。
8. 対象は、化合物1での治療を開始する、<4週間前までに先行するCAR-Tまたは他のT-細胞標的治療薬(承認薬、または治験薬)を受けている。
9. 対象は、化合物1での治療を開始する、<4週間前までにCRBN調整薬(例、レナリドミド、アバドミド/CC-122、ポマリドミド)での先行する療法を受けている。
10. 余命<2年の別の悪性腫瘍の病歴があるか、または試験結果を混乱させるような療法剤を必要とする。これは次の場合を含まない:
a. 皮膚の基底細胞がん;
b. 皮膚の扁平上皮がん;
c. 子宮頸部上皮内がん;
d. 乳房上皮内がん;
e. 膀胱上皮内がん;
f. 前立腺がんの偶発的な組織学的所見(T1aまたはT1bの腫瘍、結節、転移(Tumor, Node, Metastasis)[TNM]TNM段階)
11. ヒト免疫不全ウイルス(HIV)またはB型またはC型肝炎ウイルス(HBV、HCV)に対して既知の血清反応陽性またはそのウイルスでの活動性ウイルス感染の病歴がある。B型肝炎のスクリーニングはすべての患者に対して必須である(HBsAgおよび抗HBc)。活動性B型肝炎の患者はオビヌツズマブで治療されるべきではない。患者がキャリアであるならば、治療を開始する前に専門医に紹介されるべきである(Gazyva PIまたはGazyvaro SmPCを参照のこと)。抗HBcおよび/または抗HBsに対して陽性であるが、HBsAgおよびHBV DNAに対して陰性である対象は、肝臓専門医と相談した上で治療を受けてもよい。これは静脈内免疫グロブリン(IVIG)を受けている患者に関する誤った陽性結果を包含するものではない。
12. 末梢神経障害が>グレード2である。
13. 対象が慢性的な全身性免疫抑制療法剤またはコルチコステロイド(例えば、プレドニゾロンまたはその均等物を過去14日以内に10mg/日を超えない用量で受けている)での治療中にあるか、または臨床的に有意なGVHDの対象である。
a.吸入コルチコステロイドの安定した使用を認める;
b.進行中の皮膚または眼のGVHD用の局所的ステロイドの使用は認められる。
14. レナリドミド、ポマリドミド、サリドマイドに対して過敏症の病歴がある。
15. 心機能障害または臨床的に有意な心疾患(以下のいずれかの疾患を含む)がある:
a. MUGAスキャンまたはECHOで測定した場合に、LVEFが<45%である;
b. 完全左脚ブロック、または二束ブロック;
c. 先天性QT延長症候群;
d. 持続的またはコントロール不良の心室性不整脈または心房細動;
e. スクリーニングECGでQTcFが>470ミリ秒である(三回録音した平均);
f. 化合物1で開始する<6カ月に発症した、不安定狭心症または心筋梗塞;
16. 医学的な管理に拘わらず、持続的な下痢または吸収不良が>NCI CTCAEグレード2である。
17. 活動性病変(すなわち、リヒター症候群);ICFに署名してから>2年を経過したリヒター症候群の対象が適任である。
18. 既知の急性または慢性膵炎である。
19. 妊娠中または授乳中の女性である。
20. オビヌツズマブ、またはそのいずれかの賦形剤に対して過敏症である。
21. 強力なCYP3A4/5調節剤の同時投与がある。
Claims (25)
- 式:
- 式:
- 式:
- CLL/SLLが再発性または難治性CLL/SLLである、請求項1~5のいずれか1項に記載の医薬組成物。
- CLL/SLLが少なくとも2種の先行療法剤に対して再発性または難治性である、請求項6に記載の医薬組成物。
- 少なくとも1種の先行療法剤が、ブルトン型チロシンキナーゼ(BTK)阻害剤、ホスホイノシチド3-キナーゼ阻害剤、またはベネトクラクスである、請求項7に記載の医薬組成物。
- BTK阻害剤が、イブルチニブ、アカラブルチニブ、ザヌブルチニブ、またはチラブルチニブである、請求項8に記載の医薬組成物。
- CLLが新たに診断される、請求項1~5のいずれか1項に記載の医薬組成物。
- 医薬組成物が経口的に投与される、請求項1~10のいずれか1項に記載の医薬組成物。
- 医薬組成物が、5日間にわたって1日に1回投与され、つづいて2日間休息させる、請求項1~11のいずれか1項に記載の医薬組成物。
- 医薬組成物が、7日間にわたって1日に1回投与され、つづいて7日間休息させる、請求項1~11のいずれか1項に記載の医薬組成物。
- 医薬組成物が、5日間にわたって1日に1回投与され、つづいて9日間休息させる、請求項1~11のいずれか1項に記載の医薬組成物。
- 医薬組成物が、14日間にわたって1日に1回投与され、つづいて14日間休息させる、請求項1~11のいずれか1項に記載の医薬組成物。
- 医薬組成物が、21日間にわたって1日に1回投与され、つづいて7日間休息させる、請求項1~11のいずれか1項に記載の医薬組成物。
- 医薬組成物が、7日間のサイクルの初日~5日目まで、7日間のサイクルの初日~3日目まで、14日間のサイクルの初日~5日目まで、14日間のサイクルの初日~7日目まで、14日間のサイクルの初日~10日目まで、28日間のサイクルの初日~7日目および15~21日目まで、28日間のサイクルの初日~21日目まで、または28日間のサイクルの初日~14日目まで投与される、請求項1~11のいずれか1項に記載の医薬組成物。
- 化合物が一日当たり約0.1mg、約0.2mg、約0.4mg、約0.6mg、約0.8mg、約1.2mgまたは約1.6mgの量で投与されるように医薬組成物が用いられる、請求項1~17のいずれか1項に記載の医薬組成物。
- 医薬組成物がオビヌツズマブと併用投与される、請求項1~18のいずれか1項に記載の医薬組成物。
- オビヌツズマブが静脈内に投与される、請求項19に記載の医薬組成物。
- オビヌツズマブが、最初の28日間のサイクルの初日に約100mgの用量、最初の28日間のサイクルの2日目に約900mgの用量、および最初の28日間のサイクルの8日および15日目の各々にて、および第2~第6の28日間のサイクルの初日に約1000mgの用量で投与される、請求項19に記載の医薬組成物。
- (i)オビヌツズマブが、最初の28日間のサイクル(「サイクル1」)の初日に約100mgの、2日目に約900mgの、8および15日目の各々に約1000mgの用量で、その後の28日間のサイクルの初日に約1000mgの用量で投与され;および(ii)医薬組成物が、サイクル1の15日目から開始し、7日間にわたって1日1回、つづいて7日間休息するサイクルにて、投与されることを特徴とする、請求項19に記載の医薬組成物。
- (i)オビヌツズマブが、最初の28日間のサイクル(「サイクル1」)の初日に約100mgの、2日目に約900mgの、8および15日目の各々に約1000mgの用量で、その後の28日間のサイクルの初日に約1000mgの用量で投与され;および(ii)医薬組成物が、サイクル1の15日目から開始し、5日間にわたって1日1回、つづいて9日間休息するサイクルにて、投与されることを特徴とする、請求項19に記載の医薬組成物。
- (i)オビヌツズマブが、最初の28日間のサイクル(「サイクル1」)の初日に約100mgの、2日目に約900mgの、8および15日目の各々に約1000mgの用量で、その後の28日間のサイクルの初日に約1000mgの用量で投与され;および(ii)医薬組成物が、サイクル1の15日目から開始し、14日間にわたって1日1回、つづいて14日間休息するサイクルにて、投与されることを特徴とする、請求項19に記載の医薬組成物。
- (i)オビヌツズマブが、最初の28日間のサイクル(「サイクル1」)の初日に約100mgの、2日目に約900mgの、8および15日目の各々に約1000mgの用量で、その後の28日間のサイクルの初日に約1000mgの用量で投与され;および(ii)医薬組成物が、サイクル1の15日目から開始し、21日間にわたって1日1回、つづいて7日間休息するサイクルにて、投与されることを特徴とする、請求項19に記載の医薬組成物。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201962923955P | 2019-10-21 | 2019-10-21 | |
| US62/923,955 | 2019-10-21 | ||
| US202063011147P | 2020-04-16 | 2020-04-16 | |
| US63/011,147 | 2020-04-16 | ||
| PCT/US2020/056409 WO2021080936A1 (en) | 2019-10-21 | 2020-10-20 | Methods of treating chronic lymphocytic leukemia using 2-(2,6-dioxopiperidin-3yl)-4-((2-fluoro-4-((3-morpholinoazetidin-1-yl)methyl)benzyl)amino)isoindoline-1. 3-dione |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2022552881A JP2022552881A (ja) | 2022-12-20 |
| JPWO2021080936A5 JPWO2021080936A5 (ja) | 2023-10-20 |
| JP7581345B2 true JP7581345B2 (ja) | 2024-11-12 |
Family
ID=73452273
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022523519A Active JP7581345B2 (ja) | 2019-10-21 | 2020-10-20 | 2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオンを用いて慢性リンパ性白血病を治療する方法 |
Country Status (11)
| Country | Link |
|---|---|
| US (2) | US11628172B2 (ja) |
| EP (1) | EP4048279B1 (ja) |
| JP (1) | JP7581345B2 (ja) |
| KR (1) | KR20220103953A (ja) |
| CN (2) | CN115919870B (ja) |
| CA (1) | CA3154510A1 (ja) |
| CL (1) | CL2022000991A1 (ja) |
| IL (1) | IL292265B2 (ja) |
| MX (1) | MX2022004727A (ja) |
| WO (1) | WO2021080936A1 (ja) |
| ZA (1) | ZA202204446B (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2022552884A (ja) * | 2019-10-21 | 2022-12-20 | セルジーン コーポレーション | (s)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオンを含む医薬組成物およびその使用方法 |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MX2022004688A (es) * | 2019-10-21 | 2022-05-10 | Celgene Corp | Métodos para tratar un cáncer hematológico y uso de biomarcadores compañeros para 2-(2,6-dioxopiperidin-3-il)-4-((2-fluoro-4-((3-mor folinoazetidin-1-il)metil)bencil)amino)isoindolin-1,3-diona. |
| CN114786665A (zh) | 2019-10-21 | 2022-07-22 | 新基公司 | 取代的4-氨基异二氢吲哚-1,3-二酮化合物和第二种活性剂的组合用途 |
| DK4048278T3 (da) * | 2019-10-21 | 2024-01-08 | Celgene Corp | Fremgangsmåder til behandling af hæmatologiske maligniteter under anvendelse af 2-(2,6-dioxopiperidin-3-yl)-4-((2-fluor-4-((3-morpholinoazetidin-1-yl)methyl)benzyl)amino)isoindolin-1,3-dion |
| JP7581345B2 (ja) * | 2019-10-21 | 2024-11-12 | セルジーン コーポレーション | 2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオンを用いて慢性リンパ性白血病を治療する方法 |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013527249A (ja) | 2010-06-03 | 2013-06-27 | ファーマサイクリックス,インク. | ブルトン型チロシンキナーゼ(Btk)の阻害剤の使用 |
| JP2022527398A (ja) | 2019-04-12 | 2022-06-01 | セルジーン コーポレーション | 2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオンを使用する非ホジキンリンパ腫の処置方法 |
| JP2022552882A (ja) | 2019-10-21 | 2022-12-20 | セルジーン コーポレーション | 2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオンを用いて血液悪性腫瘍を治療する方法 |
| JP2022552884A (ja) | 2019-10-21 | 2022-12-20 | セルジーン コーポレーション | (s)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオンを含む医薬組成物およびその使用方法 |
| JP7458324B2 (ja) | 2018-04-23 | 2024-03-29 | セルジーン コーポレイション | 置換された4-アミノイソインドリン-1,3-ジオン化合物、及びリンパ腫の治療のためのそれらの使用 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2076260B1 (en) | 2006-09-15 | 2011-03-23 | Celgene Corporation | N-methylaminomethyl isoindole compounds and compositions comprising and methods of using the same |
| SG11201507759WA (en) | 2013-04-02 | 2015-10-29 | Celgene Corp | Methods and compositions using 4-amino-2-(2,6-dioxo-piperidine-3-yl)-isoindoline-1,3-dione for treatment and management of central nervous system cancers |
| CN107073122A (zh) | 2014-07-11 | 2017-08-18 | 细胞基因公司 | 恶性肿瘤的联合治疗 |
| MX2022004688A (es) * | 2019-10-21 | 2022-05-10 | Celgene Corp | Métodos para tratar un cáncer hematológico y uso de biomarcadores compañeros para 2-(2,6-dioxopiperidin-3-il)-4-((2-fluoro-4-((3-mor folinoazetidin-1-il)metil)bencil)amino)isoindolin-1,3-diona. |
| CN114786665A (zh) * | 2019-10-21 | 2022-07-22 | 新基公司 | 取代的4-氨基异二氢吲哚-1,3-二酮化合物和第二种活性剂的组合用途 |
| JP7581345B2 (ja) * | 2019-10-21 | 2024-11-12 | セルジーン コーポレーション | 2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオンを用いて慢性リンパ性白血病を治療する方法 |
-
2020
- 2020-10-20 JP JP2022523519A patent/JP7581345B2/ja active Active
- 2020-10-20 MX MX2022004727A patent/MX2022004727A/es unknown
- 2020-10-20 CN CN202310077726.4A patent/CN115919870B/zh active Active
- 2020-10-20 CA CA3154510A patent/CA3154510A1/en active Pending
- 2020-10-20 IL IL292265A patent/IL292265B2/en unknown
- 2020-10-20 WO PCT/US2020/056409 patent/WO2021080936A1/en not_active Ceased
- 2020-10-20 CN CN202080088934.9A patent/CN114885603A/zh active Pending
- 2020-10-20 EP EP20807936.8A patent/EP4048279B1/en active Active
- 2020-10-20 KR KR1020227016738A patent/KR20220103953A/ko active Pending
- 2020-10-20 US US17/075,125 patent/US11628172B2/en active Active
-
2022
- 2022-04-20 CL CL2022000991A patent/CL2022000991A1/es unknown
- 2022-04-20 ZA ZA2022/04446A patent/ZA202204446B/en unknown
-
2023
- 2023-03-09 US US18/119,679 patent/US20230210859A1/en not_active Abandoned
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013527249A (ja) | 2010-06-03 | 2013-06-27 | ファーマサイクリックス,インク. | ブルトン型チロシンキナーゼ(Btk)の阻害剤の使用 |
| JP7458324B2 (ja) | 2018-04-23 | 2024-03-29 | セルジーン コーポレイション | 置換された4-アミノイソインドリン-1,3-ジオン化合物、及びリンパ腫の治療のためのそれらの使用 |
| JP2022527398A (ja) | 2019-04-12 | 2022-06-01 | セルジーン コーポレーション | 2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオンを使用する非ホジキンリンパ腫の処置方法 |
| JP2022552882A (ja) | 2019-10-21 | 2022-12-20 | セルジーン コーポレーション | 2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオンを用いて血液悪性腫瘍を治療する方法 |
| JP2022552884A (ja) | 2019-10-21 | 2022-12-20 | セルジーン コーポレーション | (s)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオンを含む医薬組成物およびその使用方法 |
Non-Patent Citations (1)
| Title |
|---|
| EXPERT OPINION ON INVESTIGATIONAL DRUGS ,2017年,Vol. 26, No. 5,pp. 633-650 |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2022552884A (ja) * | 2019-10-21 | 2022-12-20 | セルジーン コーポレーション | (s)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオンを含む医薬組成物およびその使用方法 |
| JP7662626B2 (ja) | 2019-10-21 | 2025-04-15 | セルジーン コーポレーション | (s)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオンを含む医薬組成物およびその使用方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| CA3154510A1 (en) | 2021-04-29 |
| AU2020369497A1 (en) | 2022-05-19 |
| IL292265B1 (en) | 2025-05-01 |
| CN114885603A (zh) | 2022-08-09 |
| CL2022000991A1 (es) | 2022-11-11 |
| EP4048279A1 (en) | 2022-08-31 |
| CN115919870B (zh) | 2024-07-02 |
| US11628172B2 (en) | 2023-04-18 |
| MX2022004727A (es) | 2022-05-13 |
| US20210113574A1 (en) | 2021-04-22 |
| CN115919870A (zh) | 2023-04-07 |
| IL292265B2 (en) | 2025-09-01 |
| KR20220103953A (ko) | 2022-07-25 |
| IL292265A (en) | 2022-06-01 |
| JP2022552881A (ja) | 2022-12-20 |
| ZA202204446B (en) | 2023-10-25 |
| EP4048279B1 (en) | 2026-01-07 |
| US20230210859A1 (en) | 2023-07-06 |
| WO2021080936A1 (en) | 2021-04-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7581345B2 (ja) | 2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオンを用いて慢性リンパ性白血病を治療する方法 | |
| JP7562557B2 (ja) | 2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオンを使用する非ホジキンリンパ腫の処置方法 | |
| US12178822B2 (en) | Methods of treating hematological malignancies using 2-(2,6-dioxopiperidin-3-yl)-4-((2-fluoro-4-((3-morpholinoazetidin-1-yl)methyl)benzyl)amino)isoindoline-1,3-dion | |
| AU2020369497B2 (en) | Methods of treating chronic lymphocytic leukemia using 2-(2,6-dioxopiperidin-3yl)-4-((2-fluoro-4-((3-morpholinoazetidin-1-yl)methyl)benzyl)amino)isoindoline-1. 3-dione | |
| EA046110B1 (ru) | Способы лечения хронического лимфоцитарного лейкоза с применением 2-(2,6-диоксопиперидин-3-ил)-4-((2-фтор-4-((3-морфолиноазетидин-1-ил)метил)бензил)амино)изоиндолин-1,3-диона | |
| AU2020372330B2 (en) | Methods of treating hematological malignancies using 2-(2,6-dioxopiperidin-3-yl)-4-((2-fluoro-4-((3-morpholinoazetidin-1-yl)methyl)benz yl)amino)isoindoline-1,3-dione | |
| EA047153B1 (ru) | Способы лечения гематологических злокачественных новообразований с применением 2-(2,6-диоксопиперидин-3-ил)-4-((2-фтор-4-((3-морфолиноазетидин-1-ил)метил)бензил)амино)изоиндолин-1,3-диона | |
| HK40077319B (en) | Methods of treating hematological malignancies using 2-(2,6-dioxopiperidin-3-yl)-4-((2-fluoro-4-((3-morpholinoazetidin-1-yl)methyl)benz yl)amino)isoindoline-1,3-dione | |
| HK40077319A (en) | Methods of treating hematological malignancies using 2-(2,6-dioxopiperidin-3-yl)-4-((2-fluoro-4-((3-morpholinoazetidin-1-yl)methyl)benz yl)amino)isoindoline-1,3-dione | |
| EA047955B1 (ru) | Способы лечения неходжкинской лимфомы с использованием 2-(2,6-диоксопиперидин-3-ил)-4-((2-фтор-4-((3-морфолиноазетидин-1-ил)метил)бензил)амино)изоиндолин-1,3-диона |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20231012 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20231012 |
|
| TRDD | Decision of grant or rejection written | ||
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20240930 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20241001 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20241030 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7581345 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |