JP7186400B2 - ゲノム的に再コードした生物におけるセレノ-生物製剤の製造 - Google Patents
ゲノム的に再コードした生物におけるセレノ-生物製剤の製造 Download PDFInfo
- Publication number
- JP7186400B2 JP7186400B2 JP2019531589A JP2019531589A JP7186400B2 JP 7186400 B2 JP7186400 B2 JP 7186400B2 JP 2019531589 A JP2019531589 A JP 2019531589A JP 2019531589 A JP2019531589 A JP 2019531589A JP 7186400 B2 JP7186400 B2 JP 7186400B2
- Authority
- JP
- Japan
- Prior art keywords
- protein
- item
- sequence
- selenocysteine
- seq
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 229960000074 biopharmaceutical Drugs 0.000 title description 24
- 238000004519 manufacturing process Methods 0.000 title description 13
- 108090000623 proteins and genes Proteins 0.000 claims description 156
- 102000004169 proteins and genes Human genes 0.000 claims description 152
- 235000018102 proteins Nutrition 0.000 claims description 149
- 125000001554 selenocysteine group Chemical group [H][Se]C([H])([H])C(N([H])[H])C(=O)O* 0.000 claims description 76
- 108020004566 Transfer RNA Proteins 0.000 claims description 66
- 235000016491 selenocysteine Nutrition 0.000 claims description 51
- FDKWRPBBCBCIGA-UWTATZPHSA-N D-Selenocysteine Natural products [Se]C[C@@H](N)C(O)=O FDKWRPBBCBCIGA-UWTATZPHSA-N 0.000 claims description 49
- ZKZBPNGNEQAJSX-UHFFFAOYSA-N selenocysteine Natural products [SeH]CC(N)C(O)=O ZKZBPNGNEQAJSX-UHFFFAOYSA-N 0.000 claims description 49
- 229940055619 selenocysteine Drugs 0.000 claims description 49
- FDKWRPBBCBCIGA-REOHCLBHSA-N (2r)-2-azaniumyl-3-$l^{1}-selanylpropanoate Chemical compound [Se]C[C@H](N)C(O)=O FDKWRPBBCBCIGA-REOHCLBHSA-N 0.000 claims description 43
- 230000001580 bacterial effect Effects 0.000 claims description 42
- 108020004485 Nonsense Codon Proteins 0.000 claims description 38
- 108020004705 Codon Proteins 0.000 claims description 37
- 235000018417 cysteine Nutrition 0.000 claims description 31
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 claims description 29
- 108020005098 Anticodon Proteins 0.000 claims description 18
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 17
- 241000894006 Bacteria Species 0.000 claims description 8
- 108020005038 Terminator Codon Proteins 0.000 claims description 8
- PBGKTOXHQIOBKM-FHFVDXKLSA-N insulin (human) Chemical class C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@H]1CSSC[C@H]2C(=O)N[C@H](C(=O)N[C@@H](CO)C(=O)N[C@H](C(=O)N[C@H](C(N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=3C=CC(O)=CC=3)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=3C=CC(O)=CC=3)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=3C=CC(O)=CC=3)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=3NC=NC=3)NC(=O)[C@H](CO)NC(=O)CNC1=O)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)NCC(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(O)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O)=O)CSSC[C@@H](C(N2)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](NC(=O)CN)[C@@H](C)CC)[C@@H](C)CC)[C@@H](C)O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CC=1C=CC=CC=1)C(C)C)C1=CN=CN1 PBGKTOXHQIOBKM-FHFVDXKLSA-N 0.000 claims description 8
- 108091005573 modified proteins Proteins 0.000 claims description 4
- 102000035118 modified proteins Human genes 0.000 claims description 4
- 101000976075 Homo sapiens Insulin Proteins 0.000 claims description 3
- 239000003937 drug carrier Substances 0.000 claims description 3
- 238000007920 subcutaneous administration Methods 0.000 claims description 2
- 238000000034 method Methods 0.000 description 70
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 55
- 230000014616 translation Effects 0.000 description 41
- 238000013519 translation Methods 0.000 description 39
- 238000000338 in vitro Methods 0.000 description 35
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 26
- 150000007523 nucleic acids Chemical class 0.000 description 21
- 210000004027 cell Anatomy 0.000 description 17
- 238000013518 transcription Methods 0.000 description 15
- 230000035897 transcription Effects 0.000 description 15
- 235000001014 amino acid Nutrition 0.000 description 14
- 108020004707 nucleic acids Proteins 0.000 description 14
- 102000039446 nucleic acids Human genes 0.000 description 14
- 150000001413 amino acids Chemical class 0.000 description 12
- 238000010348 incorporation Methods 0.000 description 12
- 230000001225 therapeutic effect Effects 0.000 description 12
- 108700028939 Amino Acyl-tRNA Synthetases Proteins 0.000 description 11
- 102000052866 Amino Acyl-tRNA Synthetases Human genes 0.000 description 11
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical class N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 11
- 102000004196 processed proteins & peptides Human genes 0.000 description 11
- 108090000765 processed proteins & peptides Proteins 0.000 description 11
- 241000124008 Mammalia Species 0.000 description 10
- 229920001184 polypeptide Polymers 0.000 description 10
- 239000011541 reaction mixture Substances 0.000 description 10
- 238000012258 culturing Methods 0.000 description 9
- 150000002019 disulfides Chemical class 0.000 description 9
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 9
- 241000588724 Escherichia coli Species 0.000 description 8
- XIMIGUBYDJDCKI-UHFFFAOYSA-N diselenium Chemical compound [Se]=[Se] XIMIGUBYDJDCKI-UHFFFAOYSA-N 0.000 description 8
- 230000006870 function Effects 0.000 description 8
- 230000002068 genetic effect Effects 0.000 description 8
- 230000000069 prophylactic effect Effects 0.000 description 8
- 230000014509 gene expression Effects 0.000 description 7
- 238000012360 testing method Methods 0.000 description 7
- 102000008096 B7-H1 Antigen Human genes 0.000 description 6
- 108010074708 B7-H1 Antigen Proteins 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- 239000000047 product Substances 0.000 description 6
- 238000013459 approach Methods 0.000 description 5
- 239000003638 chemical reducing agent Substances 0.000 description 5
- 239000012634 fragment Substances 0.000 description 5
- 238000012986 modification Methods 0.000 description 5
- 230000004048 modification Effects 0.000 description 5
- 210000002966 serum Anatomy 0.000 description 5
- 230000009870 specific binding Effects 0.000 description 5
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 4
- 125000003130 L-selenocysteinyl group Chemical group O=C([*])[C@@](N([H])[H])([H])C([H])([H])[Se][H] 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- 239000000872 buffer Substances 0.000 description 4
- 125000002228 disulfide group Chemical group 0.000 description 4
- 229940022353 herceptin Drugs 0.000 description 4
- 239000002609 medium Substances 0.000 description 4
- 238000002703 mutagenesis Methods 0.000 description 4
- 231100000350 mutagenesis Toxicity 0.000 description 4
- 238000006722 reduction reaction Methods 0.000 description 4
- JULROCUWKLNBSN-UHFFFAOYSA-N seleno-DL-cystine Natural products OC(=O)C(N)C[Se][Se]CC(N)C(O)=O JULROCUWKLNBSN-UHFFFAOYSA-N 0.000 description 4
- 235000020183 skimmed milk Nutrition 0.000 description 4
- 238000001228 spectrum Methods 0.000 description 4
- 229960005486 vaccine Drugs 0.000 description 4
- 239000013598 vector Substances 0.000 description 4
- 108091026890 Coding region Proteins 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 102000002265 Human Growth Hormone Human genes 0.000 description 3
- 108010000521 Human Growth Hormone Proteins 0.000 description 3
- 239000000854 Human Growth Hormone Substances 0.000 description 3
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 3
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 3
- 102000004877 Insulin Human genes 0.000 description 3
- 108090001061 Insulin Proteins 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 229920001213 Polysorbate 20 Polymers 0.000 description 3
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 230000027455 binding Effects 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 125000001314 canonical amino-acid group Chemical group 0.000 description 3
- 238000005119 centrifugation Methods 0.000 description 3
- 230000000295 complement effect Effects 0.000 description 3
- 210000000172 cytosol Anatomy 0.000 description 3
- 150000003959 diselenides Chemical class 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 238000011534 incubation Methods 0.000 description 3
- 229940125396 insulin Drugs 0.000 description 3
- 238000001819 mass spectrum Methods 0.000 description 3
- 230000000813 microbial effect Effects 0.000 description 3
- 230000002018 overexpression Effects 0.000 description 3
- 239000013612 plasmid Substances 0.000 description 3
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 3
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 3
- 238000000746 purification Methods 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- -1 selenocysteine amino acids Chemical class 0.000 description 3
- 150000003345 selenocysteines Chemical class 0.000 description 3
- 239000011781 sodium selenite Substances 0.000 description 3
- 235000015921 sodium selenite Nutrition 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 238000003786 synthesis reaction Methods 0.000 description 3
- 238000010998 test method Methods 0.000 description 3
- 229930101283 tetracycline Natural products 0.000 description 3
- 238000011282 treatment Methods 0.000 description 3
- 102100021935 C-C motif chemokine 26 Human genes 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 108700039887 Essential Genes Proteins 0.000 description 2
- 101000897493 Homo sapiens C-C motif chemokine 26 Proteins 0.000 description 2
- 229910003424 Na2SeO3 Inorganic materials 0.000 description 2
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 description 2
- 108010074686 Selenoproteins Proteins 0.000 description 2
- 102000008114 Selenoproteins Human genes 0.000 description 2
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 2
- 238000013019 agitation Methods 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- 230000008827 biological function Effects 0.000 description 2
- XPOORPQJSFUEGJ-UHFFFAOYSA-N bis(selanylidene)-lambda4-sulfane Chemical compound [Se]S[Se] XPOORPQJSFUEGJ-UHFFFAOYSA-N 0.000 description 2
- FPPNZSSZRUTDAP-UWFZAAFLSA-N carbenicillin Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)C(C(O)=O)C1=CC=CC=C1 FPPNZSSZRUTDAP-UWFZAAFLSA-N 0.000 description 2
- 229960003669 carbenicillin Drugs 0.000 description 2
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 2
- 229960005091 chloramphenicol Drugs 0.000 description 2
- WIIZWVCIJKGZOK-RKDXNWHRSA-N chloramphenicol Chemical compound ClC(Cl)C(=O)N[C@H](CO)[C@H](O)C1=CC=C([N+]([O-])=O)C=C1 WIIZWVCIJKGZOK-RKDXNWHRSA-N 0.000 description 2
- 150000001945 cysteines Chemical class 0.000 description 2
- 210000000805 cytoplasm Anatomy 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 230000002255 enzymatic effect Effects 0.000 description 2
- 229940088598 enzyme Drugs 0.000 description 2
- 230000007717 exclusion Effects 0.000 description 2
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- 229940127121 immunoconjugate Drugs 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 230000000415 inactivating effect Effects 0.000 description 2
- 239000000411 inducer Substances 0.000 description 2
- 230000010354 integration Effects 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- 239000006166 lysate Substances 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- 239000000178 monomer Substances 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 229910052711 selenium Inorganic materials 0.000 description 2
- 239000011669 selenium Substances 0.000 description 2
- 229940091258 selenium supplement Drugs 0.000 description 2
- 230000014425 selenocysteine incorporation Effects 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 238000000527 sonication Methods 0.000 description 2
- 230000006641 stabilisation Effects 0.000 description 2
- 238000011105 stabilization Methods 0.000 description 2
- 230000001629 suppression Effects 0.000 description 2
- OFVLGDICTFRJMM-WESIUVDSSA-N tetracycline Chemical compound C1=CC=C2[C@](O)(C)[C@H]3C[C@H]4[C@H](N(C)C)C(O)=C(C(N)=O)C(=O)[C@@]4(O)C(O)=C3C(=O)C2=C1O OFVLGDICTFRJMM-WESIUVDSSA-N 0.000 description 2
- 238000002849 thermal shift Methods 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 208000031295 Animal disease Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- 101100028791 Caenorhabditis elegans pbs-5 gene Proteins 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 241000699802 Cricetulus griseus Species 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- SHZGCJCMOBCMKK-UHFFFAOYSA-N D-mannomethylose Natural products CC1OC(O)C(O)C(O)C1O SHZGCJCMOBCMKK-UHFFFAOYSA-N 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 108010024636 Glutathione Proteins 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- SHZGCJCMOBCMKK-JFNONXLTSA-N L-rhamnopyranose Chemical compound C[C@@H]1OC(O)[C@H](O)[C@H](O)[C@H]1O SHZGCJCMOBCMKK-JFNONXLTSA-N 0.000 description 1
- PNNNRSAQSRJVSB-UHFFFAOYSA-N L-rhamnose Natural products CC(O)C(O)C(O)C(O)C=O PNNNRSAQSRJVSB-UHFFFAOYSA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- 102000016943 Muramidase Human genes 0.000 description 1
- 108010014251 Muramidase Proteins 0.000 description 1
- 108010062010 N-Acetylmuramoyl-L-alanine Amidase Proteins 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 229940113231 Neuronal nicotinic receptor antagonist Drugs 0.000 description 1
- 108010049977 Peptide Elongation Factor Tu Proteins 0.000 description 1
- 102000002508 Peptide Elongation Factors Human genes 0.000 description 1
- 108010068204 Peptide Elongation Factors Proteins 0.000 description 1
- 229940124158 Protease/peptidase inhibitor Drugs 0.000 description 1
- 108010039491 Ricin Proteins 0.000 description 1
- 101710184528 Scaffolding protein Proteins 0.000 description 1
- 108010030161 Serine-tRNA ligase Proteins 0.000 description 1
- 102100040597 Serine-tRNA ligase, mitochondrial Human genes 0.000 description 1
- 101710172711 Structural protein Proteins 0.000 description 1
- 101710137500 T7 RNA polymerase Proteins 0.000 description 1
- 239000004098 Tetracycline Substances 0.000 description 1
- 102100036407 Thioredoxin Human genes 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 229940050528 albumin Drugs 0.000 description 1
- DLRVVLDZNNYCBX-CAPXFGMSSA-N allolactose Chemical compound O[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@@H]1OC[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](O)O1 DLRVVLDZNNYCBX-CAPXFGMSSA-N 0.000 description 1
- 238000005571 anion exchange chromatography Methods 0.000 description 1
- 230000001064 anti-interferon Effects 0.000 description 1
- PYMYPHUHKUWMLA-WDCZJNDASA-N arabinose Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)C=O PYMYPHUHKUWMLA-WDCZJNDASA-N 0.000 description 1
- PYMYPHUHKUWMLA-UHFFFAOYSA-N arabinose Natural products OCC(O)C(O)C(O)C=O PYMYPHUHKUWMLA-UHFFFAOYSA-N 0.000 description 1
- 238000003491 array Methods 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 210000004671 cell-free system Anatomy 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 230000001427 coherent effect Effects 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- BVTBRVFYZUCAKH-UHFFFAOYSA-L disodium selenite Chemical compound [Na+].[Na+].[O-][Se]([O-])=O BVTBRVFYZUCAKH-UHFFFAOYSA-L 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 238000000132 electrospray ionisation Methods 0.000 description 1
- 230000002124 endocrine Effects 0.000 description 1
- 238000000855 fermentation Methods 0.000 description 1
- 230000004151 fermentation Effects 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 102000035175 foldases Human genes 0.000 description 1
- 108091005749 foldases Proteins 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- 229960003180 glutathione Drugs 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 230000005484 gravity Effects 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 229960003130 interferon gamma Drugs 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 238000007917 intracranial administration Methods 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- BPHPUYQFMNQIOC-NXRLNHOXSA-N isopropyl beta-D-thiogalactopyranoside Chemical compound CC(C)S[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O BPHPUYQFMNQIOC-NXRLNHOXSA-N 0.000 description 1
- 230000000155 isotopic effect Effects 0.000 description 1
- 238000011031 large-scale manufacturing process Methods 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 1
- 229960000274 lysozyme Drugs 0.000 description 1
- 235000010335 lysozyme Nutrition 0.000 description 1
- 239000004325 lysozyme Substances 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 238000010647 peptide synthesis reaction Methods 0.000 description 1
- 210000001322 periplasm Anatomy 0.000 description 1
- 230000003094 perturbing effect Effects 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 238000006303 photolysis reaction Methods 0.000 description 1
- 102000054765 polymorphisms of proteins Human genes 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 230000019525 primary metabolic process Effects 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 230000012846 protein folding Effects 0.000 description 1
- 239000012460 protein solution Substances 0.000 description 1
- 238000001243 protein synthesis Methods 0.000 description 1
- 238000003753 real-time PCR Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 101150029855 selB gene Proteins 0.000 description 1
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 1
- 238000004904 shortening Methods 0.000 description 1
- 108091006024 signal transducing proteins Proteins 0.000 description 1
- 102000034285 signal transducing proteins Human genes 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- 229960001471 sodium selenite Drugs 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000009469 supplementation Effects 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 235000019364 tetracycline Nutrition 0.000 description 1
- 108700020534 tetracycline resistance-encoding transposon repressor Proteins 0.000 description 1
- 150000003522 tetracyclines Chemical class 0.000 description 1
- 229940126622 therapeutic monoclonal antibody Drugs 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 108060008226 thioredoxin Proteins 0.000 description 1
- 229940094937 thioredoxin Drugs 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 102000003390 tumor necrosis factor Human genes 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 238000010200 validation analysis Methods 0.000 description 1
- 239000011534 wash buffer Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P21/00—Preparation of peptides or proteins
- C12P21/02—Preparation of peptides or proteins having a known sequence of two or more amino acids, e.g. glutathione
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/28—Insulins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/575—Hormones
- C07K14/61—Growth hormone [GH], i.e. somatotropin
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/575—Hormones
- C07K14/62—Insulins
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/16—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from plants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/241—Tumor Necrosis Factors
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/243—Colony Stimulating Factors
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/249—Interferons
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2863—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for growth factors, growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/32—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against translation products of oncogenes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/10—Immunoglobulins specific features characterized by their source of isolation or production
- C07K2317/14—Specific host cells or culture conditions, e.g. components, pH or temperature
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Genetics & Genomics (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biochemistry (AREA)
- Medicinal Chemistry (AREA)
- Biophysics (AREA)
- Engineering & Computer Science (AREA)
- Zoology (AREA)
- Immunology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Endocrinology (AREA)
- Diabetes (AREA)
- Wood Science & Technology (AREA)
- Gastroenterology & Hepatology (AREA)
- General Engineering & Computer Science (AREA)
- Biotechnology (AREA)
- Biomedical Technology (AREA)
- Microbiology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Toxicology (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Emergency Medicine (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Oncology (AREA)
- Botany (AREA)
- Peptides Or Proteins (AREA)
Description
特定の実施形態では、例えば、以下が提供される:
(項目1)
少なくとも2つのセレノシステイン残基を含むタンパク質であって、少なくとも2つの前記セレノシステイン残基の間に少なくとも1つのジセレニド結合を有しており、前記タンパク質が、配列番号1~1630、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される配列を含む前記タンパク質。
(項目2)
少なくとも2つのセレノシステイン残基を含むタンパク質であって、少なくとも2つの前記セレノシステイン残基の間に少なくとも1つのジセレニド結合を有しており、前記タンパク質が、配列番号1631の配列、及び、前記配列と少なくとも80%が同一である配列を含む、項目1に記載のタンパク質。
(項目3)
配列番号472~801、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される重鎖配列と、配列番号812~1131、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される軽鎖配列とを含む抗体分子であって、前記抗体分子でのセレノシステイン残基の0~十五対が、0~十五対のシステイン残基で置換されており、かつ、前記抗体が、前記重鎖と前記軽鎖との間に少なくとも1つのジセレニド結合を含む、前記抗体分子。
(項目4)
配列番号1142、1144、1146、1148、1150、1152、及び、1154から選択される配列、及び、前記配列と少なくとも80%が同一である配列を有するA鎖、配列番号1143、1145、1147、1149、1151、1153、及び、1155から選択される配列、及び、前記配列と少なくとも80%が同一である配列を有するB鎖を含む修飾インスリンタンパク質であって、前記タンパク質が、前記A鎖と前記B鎖との間に少なくとも1つのジセレニド結合を含む、前記修飾インスリンタンパク質。
(項目5)
割り当てがされていないコドンが、対応するアンチコドンを有するセレノシステインtRNAによって認識されるようにゲノム的に再コードした細菌宿主であって、前記細菌宿主は、一対のシステインコドンが、割り当てがされていない前記コドンで置換されたタンパク質の変異型をコードする構築されたDNA配列を含み、前記変異型は、配列番号1~1630、及び、前記前記配列と少なくとも80%が同一である配列からなる群から選択される配列を含む、前記細菌宿主。
(項目6)
割り当てがされていないコドンが、対応するアンチコドンを有するセレノシステインtRNAによって認識されるようにゲノム的に再コードした細菌宿主であって、前記細菌宿主は、一対のシステインコドンが、割り当てがされていない前記コドンで置換されたタンパク質の変異型をコードする構築されたDNA配列を含み、前記変異型は、配列番号1631の配列、及び、前記配列と少なくとも80%が同一である配列を含む、項目5に記載の前記細菌宿主。
(項目7)
前記変異型が、モノクローナル抗体である、項目5または6に記載の細菌宿主。
(項目8)
前記モノクローナル抗体が、配列番号472~801、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される重鎖配列を含む、項目7に記載の細菌宿主。
(項目9)
前記モノクローナル抗体が、配列番号812~1131、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される軽鎖配列を含む、項目7に記載の細菌宿主。
(項目10)
前記モノクローナル抗体が、配列番号16~243、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される重鎖可変領域配列を含む、項目7に記載の細菌宿主。
(項目11)
前記モノクローナル抗体が、配列番号244~471、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される軽鎖可変領域配列を含む、項目7に記載の細菌宿主。
(項目12)
前記モノクローナル抗体が、配列番号1~15、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される定常鎖配列をさらに含む、項目10または11に記載の細菌宿主。
(項目13)
前記変異型が、治療用タンパク質である、項目5または6に記載の細菌宿主。
(項目14)
前記変異型が、予防用タンパク質である、項目5または6に記載の細菌宿主。
(項目15)
割り当てがされていない前記コドンが、UAGである、項目5または6に記載の細菌宿主。
(項目16)
割り当てがされていないコドンが、対応するアンチコドンを有するセレノシステインtRNAによって認識されるようにゲノム的に再コードした細菌宿主であって、前記細菌宿主は、一対のシステインコドンが、割り当てがされていない前記コドンで置換されたモノクローナル抗体の変異型をコードする構築されたDNA配列を含み、前記モノクローナル抗体は、VL鎖を含んでおり、かつ、前記VL鎖の第23位と第88位が、セレノシステイン残基で置換されており、及び、前記モノクローナル抗体は、VH鎖を含んでおり、かつ、前記VH鎖の第22位と第92位が、セレノシステイン残基で置換されている、前記細菌宿主。
(項目17)
割り当てがされていない前記コドンが、UAGである、項目16に記載の細菌宿主。
(項目18)
タンパク質の変異型を製造する方法であって、前記タンパク質が、システイン残基同士の間にジスルフィド結合を有しており、前記変異型が、セレノシステイン残基同士の間にジセレニド結合を有しており、前記方法は、
割り当てがされていないコドンが、対応するアンチコドンを有するセレノシステインtRNAによって認識されるように、ゲノム的に再コードした細菌宿主を培養することを含み、前記細菌宿主は、一対のシステインコドンが、割り当てがされていない前記コドンで置換されている前記タンパク質の変異型をコードする構築されたDNA配列を含み、前記培養は、前記タンパク質の変異型が発現される条件下であり、前記変異型は、配列番号1~1630、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される配列を含む、前記方法。
(項目19)
タンパク質の変異型を製造する項目18に記載の方法であって、前記タンパク質が、システイン残基同士の間にジスルフィド結合を有しており、前記変異型が、セレノシステイン残基同士の間にジセレニド結合を有しており、前記方法は、
割り当てがされていないコドンが、対応するアンチコドンを有するセレノシステインtRNAによって認識されるように、ゲノム的に再コードした細菌宿主を培養することを含み、前記細菌宿主は、一対のシステインコドンが、割り当てがされていない前記コドンで置換されている前記タンパク質の変異型をコードする構築されたDNA配列を含み、前記培養は、前記タンパク質の変異型が発現される条件下であり、前記変異型は、配列番号1631、及び、前記配列と少なくとも80%が同一である配列を含む、項目18に記載
の方法。
(項目20)
培地または前記細菌宿主の細胞に由来する前記タンパク質の前記変異型を回収する工程をさらに含む、項目18または19に記載の方法。
(項目21)
前記変異型が、モノクローナル抗体である、項目18または19に記載の方法。
(項目22)
前記モノクローナル抗体が、配列番号472~801、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される重鎖配列を含む、項目21に記載の方法。
(項目23)
前記モノクローナル抗体が、配列番号812~1131、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される軽鎖配列を含む、項目21に記載の方法。
(項目24)
前記モノクローナル抗体が、配列番号16~243、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される重鎖可変領域配列を含む、項目21に記載の方法。
(項目25)
前記モノクローナル抗体が、配列番号244~471、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される軽鎖可変領域配列を含む、項目21に記載の方法。
(項目26)
前記モノクローナル抗体が、配列番号1~15、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される定常鎖配列をさらに含む、項目24または25に記載の方法。
(項目27)
前記変異型が、治療用タンパク質である、項目18または19に記載の方法。
(項目28)
前記変異型が、予防用タンパク質である、項目18または19に記載の方法。
(項目29)
割り当てがされていない前記コドンが、UAGである、項目18または19に記載の方法。
(項目30)
モノクローナル抗体の変異型を製造する方法であって、前記モノクローナル抗体が、システイン残基同士の間にジスルフィド結合を有しており、前記変異型が、セレノシステイン残基同士の間にジセレニド結合を有しており、前記方法は、
割り当てがされていないコドンが、対応するアンチコドンを有するセレノシステインtRNAによって認識されるように、ゲノム的に再コードした細菌宿主を培養することを含み、前記細菌宿主は、一対のシステインコドンが、割り当てがされていない前記コドンで置換されている前記モノクローナル抗体の変異型をコードする構築されたDNA配列を含み、前記培養は、前記モノクローナル抗体の変異型が発現される条件下であり、前記モノクローナル抗体は、VL鎖を含んでおり、かつ、前記VL鎖の第23位と第88位が、セレノシステイン残基で置換されており、及び、前記モノクローナル抗体は、VH鎖を含んでおり、かつ、前記VH鎖の第22位と第92位が、セレノシステイン残基で置換されている、前記方法。
(項目31)
割り当てがされていない前記コドンが、UAGである、項目30に記載の方法。
(項目32)
タンパク質の変異型で哺乳動物を処置する方法であって、
前記タンパク質の前記変異型を前記哺乳動物に投与する工程を含み、前記タンパク質は、システイン残基同士の間にジスルフィド結合を有しており、前記変異型は、システイン残基同士の間の前記ジスルフィド結合の代わりにセレノシステイン残基同士の間にジセレニド結合を有しており、前記変異型は、配列番号1~1630、及び、前記配列と少なくとも80%が同一である配列からなる群より選択される配列を含む、前記方法。
(項目33)
タンパク質の変異型で哺乳動物を処置する項目32に記載の方法であって、
前記タンパク質の前記変異型を前記哺乳動物に投与する工程を含み、前記タンパク質は、システイン残基同士の間にジスルフィド結合を有しており、前記変異型は、システイン残基同士の間の前記ジスルフィド結合の代わりにセレノシステイン残基同士の間にジセレニド結合を有しており、前記変異型は、配列番号1631、及び、前記配列と少なくとも80%が同一である配列を含む、項目32に記載の方法。
(項目34)
前記投与が、静脈内投与である、項目32または33に記載の方法。
(項目35)
前記タンパク質が、モノクローナル抗体である、項目32または33に記載の方法。
(項目36)
前記タンパク質が、治療用タンパク質である、項目32または33に記載の方法。
(項目37)
前記タンパク質が、予防用タンパク質である、項目32または33に記載の方法。
(項目38)
モノクローナル抗体の変異型で哺乳動物を処置する方法であって、
前記モノクローナル抗体の前記変異型を前記哺乳動物に投与する工程を含み、前記モノクローナル抗体は、システイン残基同士の間にジスルフィド結合を有しており、前記変異型は、システイン残基同士の間の前記ジスルフィド結合の代わりにセレノシステイン残基同士の間にジセレニド結合を有しており、前記モノクローナル抗体は、VL鎖を含んでおり、かつ、前記VL鎖の第23位と第88位が、セレノシステイン残基で置換されており、及び、前記モノクローナル抗体は、VH鎖を含んでおり、かつ、前記VH鎖の第22位と第92位が、セレノシステイン残基で置換されている、前記方法。
(項目39)
前記抗体分子での少なくとも一対のセレノシステイン残基が、一対のシステイン残基で置換されている、項目3に記載の抗体。
(項目40)
前記抗体分子での一対のセレノシステイン残基が、一対のシステイン残基で置換されている、項目3に記載の抗体分子。
(項目41)
前記抗体分子での二対のセレノシステイン残基が、二対のシステイン残基で置換されている、項目3に記載の抗体分子。
(項目42)
前記抗体分子での三対のセレノシステイン残基が、三対のシステイン残基で置換されている、項目3に記載の抗体分子。
(項目43)
前記抗体分子での四対のセレノシステイン残基が、四対のシステイン残基で置換されている、項目3に記載の抗体分子。
(項目44)
前記抗体分子での五対のセレノシステイン残基が、五対のシステイン残基で置換されている、項目3に記載の抗体分子。
(項目45)
前記抗体分子での六対のセレノシステイン残基が、六対のシステイン残基で置換されている、項目3に記載の抗体分子。
(項目46)
前記抗体分子での七対のセレノシステイン残基が、七対のシステイン残基で置換されている、項目3に記載の抗体分子。
(項目47)
前記抗体分子での八対のセレノシステイン残基が、八対のシステイン残基で置換されている、項目3に記載の抗体分子。
(項目48)
前記抗体分子での九対のセレノシステイン残基が、九対のシステイン残基で置換されている、項目3に記載の抗体分子。
(項目49)
前記抗体分子での十対のセレノシステイン残基が、十対のシステイン残基で置換されている、項目3に記載の抗体分子。
(項目50)
前記抗体分子での十一対のセレノシステイン残基が、十一対のシステイン残基で置換されている、項目3に記載の抗体分子。
(項目51)
前記抗体分子での十二対のセレノシステイン残基が、十二対のシステイン残基で置換されている、項目3に記載の抗体分子。
(項目52)
前記抗体分子での十三対のセレノシステイン残基が、十三対のシステイン残基で置換されている、項目3に記載の抗体分子。
(項目53)
前記抗体分子での十四対のセレノシステイン残基が、十四対のシステイン残基で置換されている、項目3に記載の抗体分子。
(項目54)
前記抗体分子での十五対のセレノシステイン残基が、十五対のシステイン残基で置換されている、項目3に記載の抗体分子。
(項目55)
構築された核酸分子とtRNA分子とを含むインビトロ翻訳系またはインビトロ転写及び翻訳系であって、構築された前記核酸分子が、一対のシステイン残基が一対のシステイン残基で置換されたタンパク質の変異型をコードし、前記変異型が、配列番号1~1631、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される配列を含み、前記核酸分子が、割り当てがされていないコドンドンを含み、あるいは、同族コドン抑制を利用して、セレノシステイン残基を取り込み、前記tRNA分子は、割り当てがされていない前記コドンに対応するアンチコドンを有するセレノシステインtRNAである、前記インビトロ翻訳系またはインビトロ転写及び翻訳系。
(項目56)
前記変異型が、モノクローナル抗体である、項目55に記載のインビトロ翻訳系またはインビトロ転写及び翻訳系。
(項目57)
前記モノクローナル抗体が、配列番号472~801、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される重鎖配列を含む、項目55に記載のインビトロ翻訳系またはインビトロ転写及び翻訳系。
(項目58)
前記モノクローナル抗体が、配列番号812~1131、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される軽鎖配列を含む、項目55に記載のインビトロ翻訳系またはインビトロ転写及び翻訳系。
(項目59)
前記モノクローナル抗体が、配列番号16~243、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される重鎖可変領域配列を含む、項目55に記
載のインビトロ翻訳系またはインビトロ転写及び翻訳系。
(項目60)
前記モノクローナル抗体が、配列番号244~471、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される軽鎖可変領域配列を含む、項目55に記載のインビトロ翻訳系またはインビトロ転写及び翻訳系。
(項目61)
前記モノクローナル抗体が、配列番号1~15、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される定常鎖配列をさらに含む、項目55に記載のインビトロ翻訳系またはインビトロ転写及び翻訳系。
(項目62)
前記変異型が、治療用タンパク質である、項目55に記載のインビトロ翻訳系またはインビトロ転写及び翻訳系。
(項目63)
前記変異型が、予防用タンパク質である、項目55に記載のインビトロ翻訳系またはインビトロ転写及び翻訳系。
(項目64)
割り当てがされていない前記コドンが、UAGである、項目55に記載のインビトロ翻訳系またはインビトロ転写及び翻訳系。
(項目65)
構築された核酸分子とtRNA分子とを含むインビトロ翻訳系またはインビトロ転写及び翻訳系であって、前記構築された核酸分子が、モノクローナル抗体の変異型をコードするものであって、同モノクローナル抗体は、VL鎖を含んでおり、かつ、前記VL鎖の第23位と第88位はセレノシステイン残基で置換されており、そして、前記モノクローナル抗体はVH鎖を含んでおり、かつ、前記VH鎖の第22位と第92位はセレノシステイン残基で置換されており、前記構築された核酸分子は、前記核酸分子において割り当てがされていないコドンと置換された少なくとも一対のシステインコドンを含み、前記tRNA分子は、割り当てがされていない前記コドンに相補的なアンチコドンを有するセレノシステインtRNAである、前記インビトロ翻訳系またはインビトロ転写及び翻訳系。
(項目66)
割り当てがされていない前記コドンが、UAGである、項目65に記載のインビトロ翻訳系またはインビトロ転写及び翻訳系。
(項目67)
タンパク質の変異型を製造する方法であって、前記タンパク質が、システイン残基同士の間にジスルフィド結合を有しており、前記変異型が、セレノシステイン残基同士の間にジセレニド結合を有しており、前記方法は、
前記タンパク質の前記変異型をコードする構築された核酸配列をインビトロで翻訳することを含み、前記構築された核酸配列において、一対のシステインコドンが、割り当てがされていないコドンで置換されており、前記変異型は、配列番号1~1630、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される配列を含み、前記翻訳の工程が、割り当てがされていない前記コドンに対応するアンチコドンを有するセレノシステインtRNAを使用する、前記方法。
(項目68)
タンパク質の変異型を製造する項目67に記載の方法であって、前記タンパク質が、システイン残基同士の間にジスルフィド結合を有しており、前記変異型が、セレノシステイン残基同士の間にジセレニド結合を有しており、前記方法は、
前記タンパク質の前記変異型をコードする構築された核酸配列をインビトロで翻訳することを含み、前記構築された核酸配列において、一対のシステインコドンが、割り当てがされていないコドンで置換されており、前記変異型は、配列番号1631、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される配列を含み、前記翻訳の工程が、割り当てがされていない前記コドンに対応するアンチコドンを有するセレノシ
ステインtRNAを使用する、項目67に記載の方法。
(項目69)
前記変異型が、モノクローナル抗体である、項目67または68に記載の方法。
(項目70)
前記モノクローナル抗体が、配列番号472~801、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される重鎖配列を含む、項目69に記載の方法。
(項目71)
前記モノクローナル抗体が、配列番号812~1131、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される軽鎖配列を含む、項目69に記載の方法。
(項目72)
前記モノクローナル抗体が、配列番号16~243、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される重鎖可変領域配列を含む、項目69に記載の方法。
(項目73)
前記モノクローナル抗体が、配列番号244~471、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される軽鎖可変領域配列を含む、項目69に記載の方法。
(項目74)
前記モノクローナル抗体が、配列番号1~15、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される定常鎖配列をさらに含む、項目72または73に記載の方法。
(項目75)
前記変異型が、治療用タンパク質である、項目67または68に記載の方法。
(項目76)
前記変異型が、予防用タンパク質である、項目67または68に記載の方法。
(項目77)
割り当てがされていない前記コドンが、UAGである、項目67または68に記載の方法。
(項目78)
試料を試験する方法であって、
試料を、タンパク質の変異型と接触させて反応混合物を形成する工程であって、前記タンパク質が、システイン残基同士の間にジスルフィド結合を有しており、前記変異型が、システイン残基同士の間の前記ジスルフィド結合の代わりに、セレノシステイン残基同士の間にジセレニド結合を有しており、前記変異型は、配列番号1~1630、及び、前記配列と少なくとも80%が同一である配列からなる群から選択される配列を含む、前記工程、及び
前記反応混合物を試験して、前記タンパク質の前記変異型に結合した特異的結合パートナーを検出する工程、
を含む前記方法。
(項目79)
試料を試験する項目78に記載の方法が、
試料を、タンパク質の変異型と接触させて反応混合物を形成する工程であって、前記タンパク質が、システイン残基同士の間にジスルフィド結合を有しており、前記変異型が、システイン残基同士の間の前記ジスルフィド結合の代わりに、セレノシステイン残基同士の間にジセレニド結合を有しており、前記変異型は、配列番号1631、及び、前記配列と少なくとも80%が同一である配列を含む、前記工程、及び
前記反応混合物を試験して、前記タンパク質の前記変異型に結合した特異的結合パートナーを検出する工程、
を含む項目78に記載の方法。
(項目80)
試料を試験する方法であって、
試料を、モノクローナル抗体の変異型と接触させて反応混合物を形成する工程であって、前記モノクローナル抗体が、システイン残基同士の間にジスルフィド結合を有しており、前記変異型が、システイン残基同士の間の前記ジスルフィド結合の代わりに、セレノシステイン残基同士の間にジセレニド結合を有しており、前記モノクローナル抗体は、VL鎖を含んでおり、かつ、前記VL鎖の第23位と第88位はセレノシステイン残基で置換されており、そして、前記モノクローナル抗体はVH鎖を含んでおり、かつ、前記VH鎖の第22位と第92位はセレノシステイン残基で置換されている、前記工程、及び
前記反応混合物を試験して、前記タンパク質の前記変異型に結合した特異的結合パートナーを検出する工程、
を含む前記方法。
(項目81)
少なくとも1つのジセレニド結合を含む修飾抗体。
(項目82)
前記ジセレニド結合が、存在する特異性が同じ抗体でのジスルフィド結合の位置にある、項目81に記載の修飾抗体。
(項目83)
前記ジセレニド結合が、分子間である、項目81に記載の修飾抗体。
(項目84)
IgA、IgD、IgE、IgG、及び、IgMからなる群から選択されるアイソタイプから選択される、項目81に記載の修飾抗体。
(項目85)
セレノシステインに置換する少なくとも1つのシステインを有する配列番号1630の残基90~110を有するA鎖、セレノシステインに置換する少なくとも1つのシステインを有する配列番号1630の残基25~54を有するB鎖、及び、前記A鎖と前記B鎖との間にある少なくとも1つのジセレニド結合を含む、修飾インスリンタンパク質。
(項目86)
天然のヒトインスリンタンパク質にある2つのシステイン残基を置換する少なくとも2つのセレノシステイン残基を含み、少なくとも2つの前記セレノシステイン残基の間に少なくとも1つのジセレニド結合を有する、修飾ヒトインスリンタンパク質。
(項目87)
組換え細菌において製造される、項目86に記載の修飾ヒトインスリンタンパク質。
(項目88)
セレノシステインtRNAが、前記細菌のアンバーコドンを認識するように前記組換え細菌が再コードされる、項目87に記載の修飾ヒトインスリンタンパク質。
scFvの発現及び精製
システインコドンの代わりにセレノシステインの取り込みを指示するUAGコドンを有する抗-アルファMS2 scFv抗体をコードする遺伝子を担持するプラスミドpACYC-PcaU-aMS2で形質転換したRTΔA 2X310K細胞を、1000μg/mLのカルベニシリン、12.5μg/mLのテトラサイクリン、及び、25μM Na2SeO3を補充した1Lのテリフィック培地で、1/250に希釈し、そして、対数増殖期の中期に、3,4-ジヒドロキシ安息香酸(1mM)で誘導し、続いて、37℃で、一晩、増殖させた。細胞を、8000×gで、10分間、遠心分離して回収し、そして、プロテアーゼ阻害剤カクテル(コンプリート、ミニEDTA不含、Roche)、及び、リゾチーム(0.5mg.mL-1)を含む25mLの洗浄緩衝液(50mM K2HPO4、300mM NaCl、20mM イミダゾール、及び、10% グリセロール、pH8.0)で再懸濁した。穏やかに攪拌しながら、4℃で、20分間インキュベートした後に、細胞を、超音波処理(Model 500、Fisher Scientific)して溶解し、35000×gで、30分間、遠心分離を3度行って浄化した。溶解物を、0.2μmの膜を通して濾過し、Ni-NTA樹脂及び重力流カラムを用いるIMACで、タンパク質を回収した。溶出液を、3mLに濃縮し、そして、pH7.5のTBSに対して透析を行い、続いて、サイズ排除FPLCで、見かけが均一になるまで精製した。有意な割合の試料が透析の際に沈殿し、そして、新たな割合の試料が、安定性の低い/可溶性の二量体の形態で存在した。可溶性aMS2セレノ-scFvモノマーの最終収量は、3mg/Lであった。
質量分析
インタクトなタンパク質試料を、前述の方法を用いて分析した。セレノタンパク質試料を、10kDaの分子量カットオフフィルターを用いて、LC-MSグレードの水に緩衝液交換した。一旦、緩衝液交換が完了次第に、それらの試料を、メタノール/水/ギ酸(50/49/1)溶液で、20μMに希釈した。希釈した後に、タンパク質溶液を、エレクトロスプレーイオン化を介して、Orbitrap Elite質量分析計(Thermo Fisher Scientific Instruments,Bremen,Germany)に、3μL.分-1の速度で注入した。セレノシステインの取り込みを確認するために、インタクトなタンパク質質量分析を、240kの解像度で行い、そして、20回のスキャンを平均した。当該タンパク質配列の特徴決定を、前述のように、Orbitrap質量分析計に接続された193nmエキシマレーザー(Coherent、Inc.)を使用する紫外光解離(UVPD)で行った。各々のUVPDスペクトルについて、2.5mJの2つのレーザーパルスを使用し、そして、250回のスキャンを平均した。Xtractノイズ除去アルゴリズム(Thermo Fisher Scientific)を使用して、MS1スペクトルのノイズを除去した。また、Xtractを使用して、UVPDマススペクトルのノイズを除去した後に、ProsightPC 3.0を使用して分析をした。4つの組み込み部位(ジセレニド結合の形成が故に、1個の水素原子の控除分を含む)で61.9146ダルトンの修飾をセリン残基に付加して、セレノシステインを含有するタンパク質を検索した。組込み効率は、修飾したタンパク質ピークの面積を、修飾されていないタンパク質ピークと修飾したタンパク質ピークとの合計面積で割って算出した。各々のタンパク質に使用したピーク面積は、各同位体クラスターに由来する5つの最も豊富なピークの積分面積の合計であった。
非標準アミノ酸を有するポリペプチドの発現に適したUAGゲノム的に再コードした生物
UAGコドン翻訳機能が完全に除去されているゲノム的に再コードした生物(GRO)を使用して、UAGに非標準アミノ酸(NSAA)を明確に組み込む。本明細書の一部を構成するものとしてその全内容を援用する、Lajoie,M.J. et al., Genomically recoded organisms expand biological functions. Science 342,357-360,doi:10.1126/science. 1241459(2013)を参照されたい。ゲノム的に再コードした生物は、改めて割り当てをした1つ以上のトリプレットコドンを含んでおり、セレノシステインなどの非標準アミノ酸(NSAAa)の組み込みを容易にし得る。当業者に公知の方法を使用して、トリプレットコドンを改めて割り当てて、セレノシステインなどの非標準アミノ酸を組み込むことができる。本明細書の一部を構成するものとしてその全内容を援用する、Lajoie,M.J. et al., Probing the limits of genetic recoding in essential genes. Science 342,361-363,doi:10.1126/science. 1241460(2013)を参照されたい。また、本明細書の一部を構成するものとしてその全内容を援用する、Thyer,R.et al., Evolving tRNASec for Efficient Canonical Incorporation of Selenocysteine,JACS 137(1),46-49,(2015)も参照されたい。また、Ostrov,et al., Design, synthesis, and testing toward a 57-codon genome,Science 353,819-822,2016も参照されたい。あるいは、当業者に公知の方法を使用して、クワドラプレットコドンを用いて、非標準アミノ酸を組み込むことができる。本明細書の一部を構成するものとしてそれらの各々の全内容を援用する、Anderson,J.C.et al. An expanded genetic code with a functional quadruplet codon. Proc. Natl. Acad. Sci. U. S. A. 101, 7566-7571, doi:10.1073/pnas.0401517101(2004), Neumann,H.,Wang,K.,Davis,L.,Garcia-Alai,M.& Chin,J.W.Encoding multiple unnatural amino acids via evolution of a quadruplet-decoding ribosome.Nature 464,441-444,(2010)、及び、Chatterjee,A.,Lajoie,M.J.,Xiao,H.,Church,G.M.& Schultz,P.G.A Bacterial Strain with a Unique Quadruplet Codon Specifying Non-Native Amino Acids.Chembiochem,n/a-n/a,doi:10.1002/cbic.201402104(2014)を参照されたい。非機能的なUAGトリプレットに基づいて、クワドラプレットUAGAコドンを特異的かつ効率的にデコードする直交アミノアシル-tRNAシンテターゼ(aaRS)/tRNA対が開発されており、大きなタンパク質収率をもたらすUAGAコドンに、セレノシステインなどの非標準アミノ酸が着実に組み込まれている。かようなクワドラプレットコドンは、本方法で使用し得る。
方法
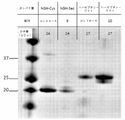
関心のある遺伝子をコードする配列を、Tet-リプレッサーで制御するT7プロモーターを用いて、クロラムフェニコール耐性ベクターにクローニングした。tetオペロンで制御する組み込みをしたT7 RNAポリメラーゼを用いて、ベクターを、2×310k細胞に形質転換した。細胞を、ODが約0.6になるまで増殖させ、室温で、一晩、100ng/mLのaTcで誘導した。誘導した細胞をペレット化し、そして、20mM Tris pH 7.4、100mM NaCl、20mM イミダゾール、及び、0.01% Triton X-100で再懸濁し、続いて、超音波処理をして溶解した。それら溶解物を、遠心分離して分離し、そして、ペレット化した。溶解時と同じ緩衝液で、上清を、Ni-親和性ビーズに対して流した。関心のあるタンパク質に、300mM イミダゾールを添加して、PBS pH 7.4に溶出した。精製した画分を、SDS pageゲルに流した。10個の異なるセレノ生物製剤についての結果を、図4~6に示す。
参考文献
本明細書の一部を構成するものとして引用した参考文献の各々の開示を援用する、ことをここに明示する。
1. Anderson, J. C. et al. An expanded genetic code with a functional quadruplet codon. Proc. Natl. Acad. Sci. U. S. A. 101, 7566-7571, doi:10.1073/pnas.0401517101 (2004),
2. Armishaw, C.J., Daly, N.L., Nevin, S.T., Adams, D.J., Craik, D.J. & Alewood, P.F. Alpha-selenoconotoxins, a new class of potent alpha7 neuronal nicotinic receptor antagonists. J Biol Chem 281, 14136-43 (2006).
3. Chatterjee, A., Lajoie, M. J., Xiao, H., Church, G. M. & Schultz, P. G. A Bacterial Strain with a Unique Quadruplet Codon Specifying Non-native Amino Acids. Chembiochem, n/a-n/a, doi:10.1002/cbic.201402104 (2014)
4. Chatterjee, A., Sun, S. B., Furman, J. L., Xiao, H. & Schultz, P. G. A Versatile Platform for Single- and Multiple-Unnatural Amino Acid Mutagenesis in Escherichia coli. Biochemistry 52, 1828-1837, doi:10.1021/bi4000244 (2013)
5. Lajoie, M. J. et al. Genomically recoded organisms expand biological functions. Science 342, 357-360, doi:10.1126/science.1241459 (2013)
6. Lajoie, M. J. et al. Probing the limits of genetic recoding in essential genes. Science 342, 361-363, doi:10.1126/science.1241460 (2013)
7. Liu, C. C. & Schultz, P. G. Adding new chemistries to the genetic code. An. Rev. Biochem. 79, 413-444, doi:10.1146/annurev.biochem.052308.105824 (2010)
8. Mandell and Lajoie et al., Nature. 2015 Feb 5;518(7537):55-60. doi: 10.1038/nature14121,
9. Muttenthaler, M., Andersson, A., de Araujo, A.D., Dekan, Z., Lewis, R.J. & Alewood, P.F. Modulating oxytocin activity and plasma stability by disulfide bond engineering. J Med Chem 53, 8585-96 (2010).
10. Neumann, H., Wang, K., Davis, L., Garcia-Alai, M. & Chin, J. W. Encoding multiple unnatural amino acids via evolution of a quadruplet-decoding ribosome. Nature 464, 441-444, (2010)
11. Ostrov, et al. Design, synthesis, and testing toward a 57-codon genome, Science 353, 819-822, 2016
12. Safavi-Hemami, H., Gajewiak, J., Karanth, S., Robinson, S.D., Ueberheide, B., Douglass, A.D., Schlegel, A., Imperial, J.S., Watkins, M., Bandyopadhyay, P.K., Yandell, M., Li, Q., Purcell, A.W., Norton, R.S., Ellgaard, L. & Olivera, B.M. Specialized insulin is used for chemical warfare by fish-hunting cone snails. Proc Natl Acad Sci U S A 112, 1743-8 (2015).
13. Thyer, R. et al. Evolving tRNASec for Efficient Canonical Incorporation of Selenocysteine. JACS 137(1), 46-49, (2015)
14. Wang, L., Brock, A., Herberich, B. & Schultz, P. G. Expanding the genetic code of Escherichia coli. Science 292, 498-500 (2001)
15. Young, T. S., Ahmad, I., Yin, J. A. & Schultz, P. G. An enhanced system for unnatural amino acid mutagenesis in E. coli. Journal of Molecular Biology 395, 361-374 (2009),
Claims (8)
- 少なくとも2つのセレノシステイン残基を含む修飾ヒトインスリンタンパク質であって、少なくとも2つの前記セレノシステイン残基の間に少なくとも1つのジセレニド結合を有しており、前記タンパク質が、配列番号1630の残基90~110の配列またはその配列と少なくとも90%が同一である配列を有するA鎖と、配列番号1630の残基25~54の配列またはその配列と少なくとも90%が同一である配列を有するB鎖とを含み、前記少なくとも1つのジセレニド結合がA鎖内に発生する、前記修飾ヒトインスリンタンパク質。
- A鎖とB鎖との間の少なくとも1つのジセレニド結合をさらに含む、請求項1に記載の修飾ヒトインスリンタンパク質。
- 組換え細菌において製造される、請求項2に記載の修飾ヒトインスリンタンパク質。
- セレノシステインtRNAが、前記細菌のアンバーコドンを認識するように前記組換え細菌が再コードされる、請求項3に記載の修飾ヒトインスリンタンパク質。
- 医薬として許容される担体中に請求項1~4のいずれか一項に記載の修飾タンパク質を含む組成物。
- 対象を処置する際に使用するための組成物であって、医薬として許容される担体中に請求項1~4のいずれか一項に記載の修飾タンパク質を含む、組成物。
- 前記組成物が、皮下投与のために製剤化されている、請求項5または6のいずれかに記載の組成物。
- 割り当てがされていないコドンが、対応するアンチコドンを有するセレノシステインtRNAによって認識されるようにゲノム的に再コードした細菌宿主であって、前記細菌宿主は、一対のシステインコドンが、割り当てがされていない前記コドンで置換されたヒトインスリンタンパク質の変異型をコードする構築されたDNA配列を含み、前記変異型は、配列番号1630の残基90~110の配列またはその配列と少なくとも90%が同一である配列を有するA鎖と、配列番号1630の残基25~54の配列またはその配列と少なくとも90%が同一である配列を有するB鎖とを含む、前記細菌宿主。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2022184852A JP7378106B2 (ja) | 2016-08-30 | 2022-11-18 | ゲノム的に再コードした生物におけるセレノ-生物製剤の製造 |
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662381316P | 2016-08-30 | 2016-08-30 | |
| US62/381,316 | 2016-08-30 | ||
| US201762537986P | 2017-07-28 | 2017-07-28 | |
| US62/537,986 | 2017-07-28 | ||
| PCT/US2017/049354 WO2018045018A1 (en) | 2016-08-30 | 2017-08-30 | Production of seleno-biologics in genomically recoded organisms |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022184852A Division JP7378106B2 (ja) | 2016-08-30 | 2022-11-18 | ゲノム的に再コードした生物におけるセレノ-生物製剤の製造 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2020502104A JP2020502104A (ja) | 2020-01-23 |
| JP2020502104A5 JP2020502104A5 (ja) | 2020-10-08 |
| JP7186400B2 true JP7186400B2 (ja) | 2022-12-09 |
Family
ID=61301655
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019531589A Active JP7186400B2 (ja) | 2016-08-30 | 2017-08-30 | ゲノム的に再コードした生物におけるセレノ-生物製剤の製造 |
| JP2022184852A Active JP7378106B2 (ja) | 2016-08-30 | 2022-11-18 | ゲノム的に再コードした生物におけるセレノ-生物製剤の製造 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022184852A Active JP7378106B2 (ja) | 2016-08-30 | 2022-11-18 | ゲノム的に再コードした生物におけるセレノ-生物製剤の製造 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US11492650B2 (ja) |
| EP (1) | EP3506945A4 (ja) |
| JP (2) | JP7186400B2 (ja) |
| CN (1) | CN109803679A (ja) |
| CA (1) | CA3034701A1 (ja) |
| WO (1) | WO2018045018A1 (ja) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9840553B2 (en) | 2014-06-28 | 2017-12-12 | Kodiak Sciences Inc. | Dual PDGF/VEGF antagonists |
| IL290457B1 (en) | 2015-12-30 | 2024-10-01 | Kodiak Sciences Inc | Antibodies and their conjugates |
| US11542332B2 (en) | 2016-03-26 | 2023-01-03 | Bioatla, Inc. | Anti-CTLA4 antibodies, antibody fragments, their immunoconjugates and uses thereof |
| CN109844105A (zh) | 2016-07-11 | 2019-06-04 | 得克萨斯州大学系统董事会 | 包含硒代半胱氨酸的重组多肽及其产生方法 |
| MX2020009152A (es) | 2018-03-02 | 2020-11-09 | Kodiak Sciences Inc | Anticuerpos de il-6 y constructos de fusion y conjugados de los mismos. |
| JP7384906B2 (ja) * | 2018-07-09 | 2023-11-21 | ジーアールオー・バイオサイエンシズ・インコーポレイテッド | 非標準アミノ酸含有組成物とその使用 |
| WO2020214955A1 (en) * | 2019-04-19 | 2020-10-22 | The Trustees Of Indiana University | Stabilization of prandial or basal insulin analogues by an internal diselenide bridge |
| CA3157509A1 (en) | 2019-10-10 | 2021-04-15 | Kodiak Sciences Inc. | Methods of treating an eye disorder |
| EP4106819A1 (en) | 2020-02-21 | 2022-12-28 | Silverback Therapeutics, Inc. | Nectin-4 antibody conjugates and uses thereof |
| CN113512116B (zh) * | 2020-04-10 | 2022-09-20 | 苏州普乐康医药科技有限公司 | 一种抗igf-1r抗体及其应用 |
| CN118076644A (zh) * | 2021-09-30 | 2024-05-24 | 正大天晴药业集团股份有限公司 | 针对免疫检查点的双特异性抗体 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011504187A (ja) | 2007-11-20 | 2011-02-03 | アンブルックス,インコーポレイテッド | 修飾されたインスリンポリペプチドおよびそれらの使用 |
| WO2013009868A1 (en) | 2011-07-11 | 2013-01-17 | Yale University | Compositions and methods for making selenocysteine containing polypeptides |
Family Cites Families (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6849417B1 (en) * | 1998-04-06 | 2005-02-01 | The United States Of America As Represented By The Department Of Health And Human Services | Mammalian selenoprotein differentially expressed in tumor cells |
| AU6987200A (en) | 1999-08-16 | 2001-03-13 | Karolinska Innovations Ab | Methods and means for selenoprotein expression |
| WO2007075438A2 (en) | 2005-12-15 | 2007-07-05 | Codon Devices, Inc. | Polypeptides comprising unnatural amino acids, methods for their production and uses therefor |
| WO2009043051A2 (en) | 2007-09-27 | 2009-04-02 | Biogen Idec Ma Inc. | Cd23 binding molecules and methods of use thereof |
| AU2012216723B2 (en) * | 2007-11-20 | 2014-08-28 | Ambrx, Inc. | Modified insulin polypeptides and their uses |
| JP5572972B2 (ja) * | 2009-03-16 | 2014-08-20 | Jnc株式会社 | インスリン分泌促進剤などの薬物のスクリーニング方法 |
| AU2011301147A1 (en) * | 2010-09-08 | 2013-04-18 | Howard Florey Institute Of Experimental Physiology And Medicine | Modified relaxin polypeptides |
| CN103619875B (zh) * | 2011-01-28 | 2017-03-08 | 加拿大国家研究委员会 | 免疫球蛋白结构域的工程改造 |
| WO2012170969A2 (en) | 2011-06-10 | 2012-12-13 | Biogen Idec Ma Inc. | Pro-coagulant compounds and methods of use thereof |
| US10876142B2 (en) | 2011-07-11 | 2020-12-29 | Yale University | Compositions and methods for making selenocysteine containing polypeptides |
| US10240158B2 (en) | 2011-07-11 | 2019-03-26 | Yale University | Compositions and methods for making selenocysteine containing polypeptides |
| WO2014153164A1 (en) | 2013-03-14 | 2014-09-25 | The California Institute For Biomedical Research | Targeting agent antibody conjugates and uses thereof |
| US20150050682A1 (en) | 2013-08-15 | 2015-02-19 | University Of Vermont And State Agricultural College | Direct assay of thioredoxin reductase activity |
| US10519247B2 (en) * | 2013-11-01 | 2019-12-31 | Board Of Regents,The University Of Texas System | Targeting HER2 and HER3 with bispecific antibodies in cancerous cells |
| US10118950B2 (en) | 2014-08-30 | 2018-11-06 | Northwestern University | Platforms for cell-free protein synthesis comprising extracts from genomically recoded E. coli strains having genetic knock-out mutations in release factor 1 (RF-1) and endA |
| WO2016172269A2 (en) | 2015-04-20 | 2016-10-27 | University Of Utah Research Foundation | Insulin analogs having shortened b chain peptides and associated methods |
| CN105111304B (zh) * | 2015-09-30 | 2018-12-14 | 山东阿华生物药业有限公司 | 重组人胰岛素前体的纯化和酶切转换方法 |
| US10557160B2 (en) | 2015-12-15 | 2020-02-11 | Board Of Regents, The University Of Texas System | Transgenic bacteria with expanded amino acid usage and nucleic acid molecules for use in the same |
| CN109844105A (zh) * | 2016-07-11 | 2019-06-04 | 得克萨斯州大学系统董事会 | 包含硒代半胱氨酸的重组多肽及其产生方法 |
| AU2017298565B2 (en) | 2016-07-22 | 2021-08-19 | The Walter And Eliza Hall Institute Of Medical Research | Insulin analogs |
| CN110072884B (zh) * | 2016-07-22 | 2023-07-28 | 犹他大学研究基金会 | 胰岛素类似物 |
| WO2020214955A1 (en) | 2019-04-19 | 2020-10-22 | The Trustees Of Indiana University | Stabilization of prandial or basal insulin analogues by an internal diselenide bridge |
-
2017
- 2017-08-30 CA CA3034701A patent/CA3034701A1/en active Pending
- 2017-08-30 EP EP17847457.3A patent/EP3506945A4/en active Pending
- 2017-08-30 US US16/329,761 patent/US11492650B2/en active Active
- 2017-08-30 JP JP2019531589A patent/JP7186400B2/ja active Active
- 2017-08-30 CN CN201780053385.XA patent/CN109803679A/zh active Pending
- 2017-08-30 WO PCT/US2017/049354 patent/WO2018045018A1/en unknown
-
2022
- 2022-11-18 JP JP2022184852A patent/JP7378106B2/ja active Active
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011504187A (ja) | 2007-11-20 | 2011-02-03 | アンブルックス,インコーポレイテッド | 修飾されたインスリンポリペプチドおよびそれらの使用 |
| WO2013009868A1 (en) | 2011-07-11 | 2013-01-17 | Yale University | Compositions and methods for making selenocysteine containing polypeptides |
Non-Patent Citations (1)
| Title |
|---|
| 52nd Japanese Peptide Symposium 第52回ペプチド討論会 講演要旨集,2015年,Vol.52,P.78, No.P-021 |
Also Published As
| Publication number | Publication date |
|---|---|
| CA3034701A1 (en) | 2018-03-08 |
| WO2018045018A8 (en) | 2018-05-11 |
| JP7378106B2 (ja) | 2023-11-13 |
| EP3506945A1 (en) | 2019-07-10 |
| WO2018045018A1 (en) | 2018-03-08 |
| EP3506945A4 (en) | 2020-07-15 |
| JP2020502104A (ja) | 2020-01-23 |
| US20190194713A1 (en) | 2019-06-27 |
| CN109803679A (zh) | 2019-05-24 |
| JP2023015347A (ja) | 2023-01-31 |
| US11492650B2 (en) | 2022-11-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7378106B2 (ja) | ゲノム的に再コードした生物におけるセレノ-生物製剤の製造 | |
| US20220213500A1 (en) | Expression Process | |
| US10487133B2 (en) | Codon optimization for titer and fidelity improvement | |
| Du et al. | A bacterial expression platform for production of therapeutic proteins containing human-like O-linked glycans | |
| JP6740244B2 (ja) | ヘテロ多量体タンパク質複合体のアセンブリおよび産生を最適化する方法 | |
| KR20150138273A (ko) | 단백질의 피로글루타민산 형성을 증가시키기 위한 방법 | |
| JPWO2002052029A1 (ja) | 組み換え蛋白質の生産方法及び融合蛋白質 | |
| AU2019263303A1 (en) | A method for optimizing antibody expression | |
| Vyas et al. | Clinical manufacturing of recombinant human interleukin 15. I. Production cell line development and protein expression in E. coli with stop codon optimization | |
| de Araujo et al. | Strategies for over-expression and purification of recombinant full length STAT5B in Escherichia coli | |
| AU2004234282B2 (en) | Chaperonine-target protein complex, method of producing the same, method of stabilizing target protein, method of immobilizing target protein, method of analyzing the structure of target protein, sustained-release preparation and method of producing antibody against target protein | |
| JP2019516371A (ja) | 組み換えタンパク質の生成方法 | |
| Mokhonov et al. | SlyD-deficient Escherichia coli strains: A highway to contaminant-free protein extraction | |
| Yurkova et al. | Production of a toxic polypeptide as a fusion inside GroEL cavity | |
| Zhang et al. | Soluble expression of recombinant human interleukin-2 in Escherichia coli and its facile production | |
| JP2004081199A (ja) | 組換え抗体の製造方法 | |
| JPWO2004031243A1 (ja) | タンパク質ポリマー及びその製造方法 | |
| Galiardi | Split Intein Applications for Downstream Purification and Protein Conjugation | |
| JP5733693B2 (ja) | 組換え型ポリペプチドの製造方法 | |
| JP2001294599A (ja) | 組み換えb型肝炎ウィルス表面抗原 | |
| JP2006166845A (ja) | FKBP型PPIase遺伝子及びFKBP型PPIaseの製造方法、単離されたFKBP型PPIase及びその遺伝子、発現ベクター、形質転換体、融合タンパク質及びその製造方法、目的タンパク質の製造方法、目的タンパク質の再生方法、並びに、目的タンパク質の安定化方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190509 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200831 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200831 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210903 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20211008 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20211008 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211203 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220107 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220406 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220606 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220707 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20221021 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20221118 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7186400 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |