JP7064439B2 - 単一細胞に関連する核酸の解析のための、核酸バーコードの組み合わせセット - Google Patents
単一細胞に関連する核酸の解析のための、核酸バーコードの組み合わせセット Download PDFInfo
- Publication number
- JP7064439B2 JP7064439B2 JP2018543062A JP2018543062A JP7064439B2 JP 7064439 B2 JP7064439 B2 JP 7064439B2 JP 2018543062 A JP2018543062 A JP 2018543062A JP 2018543062 A JP2018543062 A JP 2018543062A JP 7064439 B2 JP7064439 B2 JP 7064439B2
- Authority
- JP
- Japan
- Prior art keywords
- nucleic acid
- barcode
- sequence
- barcodes
- construct
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/10—Processes for the isolation, preparation or purification of DNA or RNA
- C12N15/1034—Isolating an individual clone by screening libraries
- C12N15/1065—Preparation or screening of tagged libraries, e.g. tagged microorganisms by STM-mutagenesis, tagged polynucleotides, gene tags
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/10—Processes for the isolation, preparation or purification of DNA or RNA
- C12N15/1096—Processes for the isolation, preparation or purification of DNA or RNA cDNA Synthesis; Subtracted cDNA library construction, e.g. RT, RT-PCR
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6806—Preparing nucleic acids for analysis, e.g. for polymerase chain reaction [PCR] assay
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2523/00—Reactions characterised by treatment of reaction samples
- C12Q2523/30—Characterised by physical treatment
- C12Q2523/319—Photocleavage, photolysis, photoactivation
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2525/00—Reactions involving modified oligonucleotides, nucleic acids, or nucleotides
- C12Q2525/10—Modifications characterised by
- C12Q2525/173—Modifications characterised by incorporating a polynucleotide run, e.g. polyAs, polyTs
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2525/00—Reactions involving modified oligonucleotides, nucleic acids, or nucleotides
- C12Q2525/10—Modifications characterised by
- C12Q2525/191—Modifications characterised by incorporating an adaptor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2535/00—Reactions characterised by the assay type for determining the identity of a nucleotide base or a sequence of oligonucleotides
- C12Q2535/122—Massive parallel sequencing
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2563/00—Nucleic acid detection characterized by the use of physical, structural and functional properties
- C12Q2563/149—Particles, e.g. beads
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2563/00—Nucleic acid detection characterized by the use of physical, structural and functional properties
- C12Q2563/159—Microreactors, e.g. emulsion PCR or sequencing, droplet PCR, microcapsules, i.e. non-liquid containers with a range of different permeability's for different reaction components
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2563/00—Nucleic acid detection characterized by the use of physical, structural and functional properties
- C12Q2563/179—Nucleic acid detection characterized by the use of physical, structural and functional properties the label being a nucleic acid
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2563/00—Nucleic acid detection characterized by the use of physical, structural and functional properties
- C12Q2563/185—Nucleic acid dedicated to use as a hidden marker/bar code, e.g. inclusion of nucleic acids to mark art objects or animals
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2565/00—Nucleic acid analysis characterised by mode or means of detection
- C12Q2565/50—Detection characterised by immobilisation to a surface
- C12Q2565/514—Detection characterised by immobilisation to a surface characterised by the use of the arrayed oligonucleotides as identifier tags, e.g. universal addressable array, anti-tag or tag complement array
Description
本出願は、その全体が参照によって本明細書に組み入れられる2015年11月4日に出願された米国仮特許出願番号62,250,900の優先権を主張する。
細胞集団のゲノム及びトランスクリプトームのプロファイリングは、バイオテクノロジー及び医学の分野におけるかなりの影響と共に強く高い関心のある領域である。核酸の配列決定技術における最近の進歩によって従来のアプローチの実践的な処理能力をはるかに上回るペースでの規模でプロファイリング研究が可能になっている。単一細胞のゲノムまたはトランスクリプトームのプロファイリングに向けた初期の試みには、ゲノムまたはトランスクリプトームの最適な解析方法を適用することができるFACS選別またはさらにマルチウェルマイクロタイタープレートのウェルのような別個の反応バイアルへの個々の細胞の手選が含まれた。この形式では、別個の反応は個々に操作され、制御され得る。たとえば、各ウェルが単一細胞のみを含有することを確実にするのは比較的簡単である。複数細胞の同時隔離はこれらの細胞のゲノムまたはトランスクリプトームのプロファイリングが互いに巻き込まれ合ってしまい、個々のプロファイリングを解きほぐすことが難しいまたは不可能であるので、このことは重要である。これらの形式の短所は、それらは時間がかかり、試薬がかかり、人手がかかり、これらの理由で相対的に低い処理能力のプロセスしかできないことである。さらに最近のアプローチは細胞の隔離に向かう傾向があり、マイクロウェルまたはナノウェルまたは液滴のようなナノリットルまたはピコリットルの大きさの容器で化学試薬及び分子試薬を必要としている。これらの形式は時間、コスト及び処理能力という点で大幅な改善を可能にするが、細胞及び他の反応成分を容器に正確に負荷するのを制御するのがかなり難題であるという短所を伴う。成分は無作為に容器に割り当てられることが多く、その場合、多数の容器の間での成分の分配はポアソン分布に従う。細胞の場合、たとえば、システムが、細胞の少なくとも95%が単独で隔離される(言い換えれば、細胞を伴う容器のたった5%が2つ以上の細胞を含有するのを容認される)ことを必要とするのであれば、条件は各容器が平均で0.1の細胞を受け取るように設定されなければならない。ポアソン用語では、これは0.1の期待値、または「ラムダ」である。この場合、容器の90.48%は細胞を受け取らず、9.05%の容器は単一細胞を受け取り、0.45%は2個の細胞を受け取り、0.02%は3個の細胞を受け取り、さらに低い比率は4、5、6個等の細胞を受け取るであろう。この場合、細胞を受け取る容器のうち、95.1%は正確に1個の細胞を含有する。反応容器すべての90%を超えるものが細胞を欠いており非生産的なので、そのようなシステムの非効率性は明らかである。これらのポアソン分布の2つ以上の交点が含まれる場合、非効率性は度合を増す。ゲノム及びトランスクリプトームのプロファイリングに対する一般的なアプローチには、細胞を起源とする遺伝子及び/または転写産物にその後付加される核酸バーコードと共にその細胞を隔離することが含まれる。その後、バーコードを用いて各遺伝子または転写産物を起源の細胞に明瞭に割り当て、結果としてその細胞のゲノム及びトランスクリプトームのプロファイルを含む。そのようなスキームの曖昧性解消は、単独で隔離される細胞だけでなく、単独のバーコードのみを受け取る同一容器にも左右される。バーコードは単一の核酸分子であってもよいが、さらに一般的には、その表面が同一核酸バーコードの多数のコピーで官能化されるポリスチレンビーズのような粒子を介して届けられる。いずれの場合も、独特のバーコードの反応容器への無作為な割り当ては、前と同じ負荷統計、すなわち、期待値(ラムダ)によって決定されるポアソン分布に従うであろう。正確に1個の細胞が正確に1つのバーコードと共に同時隔離される容器のみが明白なゲノムまたはトランスクリプトームのプロファイルを生じるであろう。特定のバーコードとの多重細胞隔離は、上流データの解析の際、同時隔離した細胞の個々のプロファイルの結合体である単一のゲノムまたはトランスクリプトームのプロファイルのように見えるであろう。複数細胞の複数バーコードとの同時隔離の場合は一層さらに複雑な曖昧性を生じる。この曖昧性は単一細胞の遺伝子またはトランスクリプトームのプロファイリングを含むあらゆる適用に対して有害な意味合いを有する。たとえば、適用にトランスクリプトームのプロファイルによって特定される特定のクローンの定量が関与するのであれば、複数のバーコードがそのクローン型の細胞と共に同時隔離される場合は下流の解析ではそのクローン型の複数細胞の見掛けを与えるので、試料における細胞の集団全体のその見掛けの比率を人為的に誇張する。細胞とバーコードを受け取る容器の少なくとも95%が正確に1個の細胞と正確に1つのバーコードを受け取ることを要求するこの設計のプロファイリングシステムについては、所望の結果を与える細胞とバーコードのラムダの組み合わせの連続した繋がりがある(容器がそれぞれの少なくとも一方を受け取れなければ、それは非生産性であり、考慮から除外することに留意のこと)。代表的な組み合わせの1つは細胞及びバーコードの双方について0.05のラムダである。この場合、容器は平均で0.05の細胞と0.05のバーコードを受け取るであろう。それぞれ細胞とバーコードのうち、容器の95.12%は何も受け取らず、4.76%は1つ受け取り、0.12%は2つ受け取り、さらに低い比率は3、4、5個等を受け取るであろう。少なくとも1個の細胞を受け取る容器のうち、97.52%が正確に1個の細胞を受け取り、バーコードについても同様である。これら2つの比率を重ね合わせると、97.52%×97.52%=95.1%の正確に1個の細胞と正確に1つのバーコードとしての細胞・バーコード同時隔離の事象を生じる。しかしながら、この基準を達成するために、99.76%を超える容器が細胞を受け取らない、バーコードを受け取らない、または両方とも受け取らないので非生産的である。言い換えれば、0.24%未満の容器が細胞プロファイルを作り出す機会を有するであろう。加えて、5%未満の細胞がバーコードと共に同時隔離されるので、95%を超える細胞が解析から失われる。これはシステムの処理能力を大きく低下させ、これは解析からの細胞の95%の喪失を生じるので、解析する対象とする細胞が稀な細胞である場合、特に有害である。これらのピコリットル及びナノリットル規模の方法は、バーコードを受け取る容器の比率をバーコーディングスキームの忠実性を犠牲にすることなく増やせれば、処理能力(すなわち、処理される細胞の数)及び試料の適用範囲(すなわち、処理される原試料における細胞の総数の比率)という点で意味のある改善を実現してもよい。
[本発明1001]
核酸試料の起源を特定する方法であって、
(a)単一細胞に由来する核酸分子を含む核酸試料とバーコードのセットとを含む反応混合物を形成する工程と、
(b)前記試料の前記核酸分子にバーコードの前記セットを組み込む工程と、
(c)前記単一細胞の前記核酸分子に組み込まれたバーコードの前記セットを特定し、それによって前記核酸試料の起源を特定する工程と
を含む、前記方法。
[本発明1002]
前記反応混合物を形成する工程が、
バーコードの前記セットに前記単一細胞を接触させることと、
前記単一細胞に由来する前記核酸試料を提供するために、前記細胞を溶解することと
を含む、本発明1001の方法。
[本発明1003]
前記反応混合物を形成する工程が、
懸濁緩衝液中の細胞を提供することと、
前記単一細胞とバーコードの前記セットとを含む前記反応混合物を形成するための条件下で、バーコードの前記セットを含むバーコーディング緩衝液に、前記細胞を含む前記懸濁緩衝液を接触させることと
を含む、本発明1001の方法。
[本発明1004]
バーコードの前記セットが、独特の5’バーコードを各構築物が含む1つ以上の5’核酸構築物と、独特の3’バーコードを各構築物が含む1つ以上の3’核酸構築物とを含む、本発明1001~1003のいずれかの方法。
[本発明1005]
前記反応混合物を形成する工程が、
懸濁緩衝液中の細胞を提供することと、
前記単一細胞と少なくとも1つの5’核酸構築物と少なくとも1つの3’核酸構築物とを含む前記反応混合物を形成するための条件下で、前記5’核酸構築物と前記3’核酸構築物とを含むバーコーディング緩衝液に、前記懸濁緩衝液を接触させることと
を含む、本発明1004の方法。
[本発明1006]
前記反応混合物を形成する工程が、
懸濁緩衝液中の細胞を提供することと、
前記単一細胞と少なくとも1つの5’核酸構築物と少なくとも1つの3’核酸構築物とを含む前記反応混合物を形成するための条件下で、前記5’核酸構築物を含む第1のバーコーディング緩衝液及び前記3’核酸構築物を含む第2のバーコーディング緩衝液に、前記懸濁緩衝液を接触させることと
を含む、本発明1004の方法。
[本発明1007]
前記構築物が、独特の分子識別子(UMI)配列をさらに含む、本発明1004~1006のいずれかの方法。
[本発明1008]
各5’核酸構築物が、固体表面に結合された複数コピーで提供される、本発明1004~1007のいずれかの方法。
[本発明1009]
各3’核酸構築物が、固体表面に結合された複数コピーで提供される、本発明1004~1008のいずれかの方法。
[本発明1010]
前記固体表面が、ビーズ、マイクロビーズ、微粒子、ミクロスフェア、ナノ粒子、ナノビーズまたはヒドロゲルである、本発明1008または1009の方法。
[本発明1011]
前記反応混合物が、前記単一細胞に由来する前記核酸試料と、複数コピーの前記5’核酸構築物を含む少なくとも1つのビーズと、複数コピーの前記3’核酸構築物を含む少なくとも1つのビーズとを含む、本発明1004~1010のいずれかの方法。
[本発明1012]
各5’核酸構築物及び3’核酸構築物が、光切断可能なリンカーまたは制限酵素部位をさらに含む、本発明1004~1011のいずれかの方法。
[本発明1013]
各5’核酸構築物が光切断可能なリンカーをさらに含み、且つ各3’核酸構築物が制限酵素部位をさらに含む、本発明1004~1011のいずれかの方法。
[本発明1014]
各5’核酸構築物が制限酵素部位をさらに含み、且つ各3’核酸構築物が光切断可能なリンカーをさらに含む、本発明1004~1011のいずれかの方法。
[本発明1015]
前記反応混合物を制限酵素に接触させる工程と、
前記固体表面から前記5’核酸構築物及び前記3’核酸構築物を遊離させるために、前記反応混合物をUV光に曝露する工程と
をさらに含む、本発明1013または1014の方法。
[本発明1016]
前記5’核酸構築物及び前記3’核酸構築物が制限酵素部位をさらに含み、
前記方法が、
前記固体表面から前記5’核酸構築物及び前記3’核酸構築物を遊離させるために、前記反応混合物を制限酵素に接触させる工程
をさらに含む、本発明1012の方法。
[本発明1017]
前記5’核酸構築物及び前記3’核酸構築物が光切断可能なリンカーをさらに含み、
前記方法が、
前記固体表面から前記5’核酸構築物及び前記3’核酸構築物を遊離させるために、前記反応混合物をUV光に曝露する工程
をさらに含む、本発明1012の方法。
[本発明1018]
前記5’核酸構築物が、プロモータを含む二本鎖核酸構築物であり、且つ前記5’核酸構築物が、複数コピーの前記5’核酸構築物を作り出すための鋳型として役立つ、本発明1004~1017のいずれかの方法。
[本発明1019]
バーコードの前記セットが、1、2、3、4、5、6、7、または8個の5’核酸構築物と、1、2、3、4、5、6、7、または8個の3’核酸構築物とを含む、本発明1001~1018のいずれかの方法。
[本発明1020]
前記核酸試料における5’バーコードと3’バーコードとの組み合わせが、前記核酸試料の起源を特定する、本発明1001~1019のいずれかの方法。
[本発明1021]
前記3’核酸構築物が結合配列をさらに含む、本発明1001~1020のいずれかの方法。
[本発明1022]
前記結合配列がポリ-T配列を含む、本発明1021の方法。
[本発明1023]
前記ポリ-T配列が、前記試料の前記核酸分子におけるポリ-A配列に結合する、本発明1022の方法。
[本発明1024]
前記3’核酸構築物における前記バーコードが、逆転写によって組み込まれる、本発明1001~1023のいずれかの方法。
[本発明1025]
前記逆転写が、前記3’バーコード配列を含む核酸分子を作り出す、本発明1024の方法。
[本発明1026]
前記逆転写酵素が、前記試料の前記核酸分子の末端に2~5個のシステイン残基を付加する、本発明1025の方法。
[本発明1027]
前記2~5個のシステイン残基が、前記5’核酸構築物における結合配列に相補性の結合配列を提供する、本発明1026の方法。
[本発明1028]
前記5’核酸構築物における前記結合配列が、ポリ-G配列を含む、本発明1027の方法。
[本発明1029]
前記5’核酸構築物における前記結合配列が、前記試料の前記核酸分子におけるポリ-C配列に結合する、本発明1028の方法。
[本発明1030]
前記5’核酸構築物が、逆転写酵素を用いて前記核酸試料に組み込まれる、本発明1001~1029のいずれかの方法。
[本発明1031]
前記逆転写酵素がM-MLV酵素である、本発明1024~1030のいずれかの方法。
[本発明1032]
前記逆転写酵素がMMLV H-逆転写酵素である、本発明1031の方法。
[本発明1033]
5’バーコード及び3’バーコードを各配列が含む複数の核酸配列の複数コピーを作り出すために、前記核酸試料がさらに増幅される、本発明1001~1032のいずれかの方法。
[本発明1034]
前記核酸分子がmRNAを含む、本発明1001~1033のいずれかの方法。
[本発明1035]
前記mRNAが、少なくとも1、3、10、30、100、300、1,000、3,000、10,000、30,000、100,000、300,000、または1,000,000個のmRNAを含む、本発明1034の方法。
[本発明1036]
前記核酸試料における前記バーコードが、配列決定によって特定される、本発明1001~1035のいずれかの方法。
[本発明1037]
バーコードの前記セットが、独特の5’バーコードを各構築物が含む少なくとも2つの5’核酸構築物を含む、本発明1001~1003のいずれかの方法。
[本発明1038]
バーコードの前記セットが、独特の3’バーコードを各構築物が含む少なくとも2つの3’核酸構築物を含む、本発明1001~1003のいずれかの方法。
[本発明1039]
前記核酸分子の1つ以上が、2つ以上の独特のバーコードを含む、本発明1001の方法。
[本発明1040]
前記独特のバーコードが、前記核酸分子の5’末端、3’末端、または5’末端と3’末端の双方に位置する、本発明1039の方法。
[本発明1041]
複数の反応混合物を形成する工程を含む、本発明1001~1040のいずれかの方法。
[本発明1042]
2つ以上の独特のバーコードが、前記反応混合物の30%、40%、50%、60%、70%、80%、90%または100%に存在する、本発明1041の方法。
[本発明1043]
前記複数の反応混合物を形成する工程が、0.5、0.6、0.7、0.8、0.9、1.0、2.0、3.0、4.0または5.0より大きいラムダで複数の反応混合物にバーコードの前記セットを加えることを含む、本発明1041の方法。
[本発明1044]
前記反応混合物が液滴である、本発明1001~1040のいずれかの方法。
[本発明1045]
核酸試料の起源を特定する方法であって、
(a)独特の3’バーコード配列と結合配列とバーコード関連配列とを各構築物が含む3’核酸構築物のセットを提供する工程と、
(b)単一細胞に由来する核酸分子を含む核酸試料を提供する工程と、
(c)前記核酸試料を3’核酸構築物の前記セットに接触させる工程と、
(d)前記バーコード関連配列から前記3’バーコード配列及び結合配列を分離する工程と、
(e)前記3’核酸構築物に由来する前記3’バーコード配列を前記核酸分子に組み込む工程と、
(f)前記バーコード関連配列を用いて3’バーコード配列の前記セットを特定し、それによって前記単一細胞に由来する前記核酸試料の起源を特定する工程と
を含む、前記方法。
[本発明1046]
3’核酸構築物の前記セットが、2、3、4、5、6、7または8個の3’核酸構築物を含む、本発明1045の方法。
[本発明1047]
前記3’核酸構築物が、独特の分子識別子(UMI)配列をさらに含む、本発明1045または1046の方法。
[本発明1048]
前記3’核酸構築物が、ヘアピンを形成することができる、本発明1045~1047のいずれかの方法。
[本発明1049]
前記3’バーコード配列及び結合配列が、制限酵素配列または光切断可能なリンカーによって前記バーコード関連セグメントから分離される、本発明1045~1048のいずれかの方法。
[本発明1050]
前記3’核酸構築物の複数コピーが、固体表面に結合される、本発明1045~1049のいずれかの方法。
[本発明1051]
前記固体表面が、ビーズ、マイクロビーズ、微粒子、ミクロスフェア、ナノ粒子、ナノビーズまたはヒドロゲルである、本発明1050の方法。
[本発明1052]
制限酵素が、前記3’バーコード配列を前記固体表面から遊離させ、且つ前記結合配列を前記バーコード関連セグメントから分離する、本発明1051の方法。
[本発明1053]
UV光が、前記3’ バーコード配列を前記固体表面から遊離させ、且つ前記結合配列を前記バーコード関連セグメントから分離する、本発明1051の方法。
[本発明1054]
前記3’核酸構築物における前記結合配列が、ポリ-T配列を含む、本発明1045~1053のいずれかの方法。
[本発明1055]
前記3’核酸構築物の前記結合配列が、前記試料の前記核酸分子におけるポリ-A配列に結合する、本発明1054の方法。
[本発明1056]
前記3’核酸構築物における前記バーコード配列が、逆転写によって組み込まれる、本発明1045~1055のいずれかの方法。
[本発明1057]
前記逆転写が、前記3’バーコード配列を含む核酸分子を作り出す、本発明1056の方法。
[本発明1058]
前記バーコード関連セグメントがプライミング配列を含む、本発明1045~1057のいずれかの方法。
[本発明1059]
前記プライミング配列が回文配列である、本発明1058の方法。
[本発明1060]
一方のバーコード関連セグメントの前記プライミング配列が、前記核酸試料における他の任意のバーコード関連セグメントのプライミング配列と結合することができる、本発明1058の方法。
[本発明1061]
双方のバーコード関連セグメントを単一核酸に組み込むために、互いに接触している前記バーコード関連セグメントが、DNAポリメラーゼによって伸長される、本発明1059の方法。
[本発明1062]
前記核酸分子に組み込まれた前記バーコード配列を特定する工程をさらに含む、本発明1045~1061のいずれかの方法。
[本発明1063]
前記核酸試料における前記バーコード配列が、配列決定によって特定される、本発明1062の方法。
[本発明1064]
前記バーコード関連セグメントが、配列決定によって特定される、本発明1062の方法。
反応容器に単一の独特のバーコードを導入するように試みるのではなく、本出願は、生産反応のほとんどの場合またはすべての場合、その容器にてゲノムまたはトランスクリプトーム標的すべてについて起源の細胞を特定する区別可能なバーコードのセットを形成する複数のバーコードの計画的導入を指向する。これは幾つかの異なる方法のいずれかで実施することができ、決定的な共通する特徴は、対象とするゲノムまたはトランスクリプトーム標的にバーコードを付けることに加えて、単一の容器に複数のバーコードを導入する場合、容器におけるバーコードすべてを直接または間接的にその容器における他のバーコードすべてに関連付けることができるメカニズムも存在することである。単一バーコードではなく複数バーコードが個々の容器に割り当てられると、容器の大半が空なので非生産的であるという要件なしでバーコードの無作為な分配を適用することができる。提供される方法はまた、2つ以上のポアソン分布の交点を適用することの非効率性も低下させる。
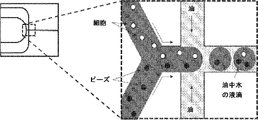
バーコード付きビーズライブラリの2つの違うセット(5’セット及び3’セット)を用いて各細胞のトランスクリプトームにバーコードを付ける。図2を参照のこと。各3’バーコードは制限部位と独特の分子識別子とバーコード配列とmRNA転写産物のポリ-A尾部を標的とするポリ-T配列(従って各真核細胞にて全RNAのかなり大半を構成するリボソームRNA及びtRNAを回避する)とから成る。各5’バーコードは3’ビーズセットの制限部位と同じであってもよい制限部位(RE)と最終的なバーコード配列の相補体と3つのグアニン残基とを含む。対象とする細胞と共にこれら2つのビーズのセットを液滴に封入する。図1にて示すもののような液滴装置を使用することができる。
この実施例は非鋳型切り替え法を記載している。バーコード付きビーズの単一セットしかない。各ビーズはヘアピン構造を形成する一本鎖DNAオリゴを有する。ヘアピンの二本鎖セグメントでは、双方の鎖の制限を指示する制限部位が組み込まれる。これは、転写産物のバーコーディングセグメントと、バーコードと同様に「バーコード関連配列」(BAS)も含有する別のループ状セグメントとの双方を切断する。図8を参照のこと。
細胞にバーコードを付けるためのPBMCの調製。凍結保存したPBMCを解凍し、リン酸緩衝化生理食塩水(Corning,Manassas,VA)で細胞ペレットを3回洗浄し、96ウェルプレートに一回FACS選別した、または25mMのNaClと153mMのベタインを含む等張細胞懸濁緩衝液(CSB)に再浮遊させた。次いで細胞を数え、逆転写のためにウェル当たり平均1個の細胞にCSBで希釈した。
アルゴリズムの工程は以下のとおりだった。
1.グラフの連結成分すべてをコンピュータで計算する。
2.完全な二部グラフ(2クリーク)である連結成分をそれぞれウェル/細胞に割り当てた。
3.他の連結成分を以下のように2クリークの和集合に分解した。
a.成分の部分グラフである2クリークすべてを決定した(以下で説明されるアルゴリズム)
b.3.a.におけるグラフの設定から、最大である(他の2クリークに含まれない)2クリークを選択した。
c.「切り詰め(pruning)」工程を適用してデータに存在しそうにない2クリークを除いた。
上記アルゴリズムの工程3a.は以下のように行った。
1.以下のように集合O及びIが生成された。
a.連結成分における各wID BCについては、辺によってそれに接続され、それを退出(wID BC)と呼ぶoDT BCの集合を決定し、次いでそれをO退出(wID BC)とそのサブセットのすべての双方に加えた。
b.a.と同様の方法で、集合Iを以下のように生成した:連結成分における各oDT BCについては、辺によってそれに接続され、それを進入(oDT BC)と呼ぶwID BCの集合を決定し、次いでそれをI進入(oDT BC)とそのサブセットのすべての双方に加えた。
2.Iにおける各集合i及びOにおける各集合oについて今や、iにおけるwID BCとoにおけるoDT BCとの間の辺すべてがデータに存在するかどうか、及びこれは、2クリークがその成分の部分グラフである2クリークすべての集合に加えられる場合であるかどうかを決定した。
上記アルゴリズムの工程3c.は以下のように行った。
1.λ=2のみで細胞の割合0.0166は所与の種類の5を超えるバーコードを有するであろう。従って、5を超えるwID BCまたはoDT BCを有するアルゴリズムによって構築された2クリークは有効な構築物として拒絶され、フィルターで除去された。
2.単一のwID BCまたは4以上のoDT BCを有するクリーク(または逆もまた同様)はさらに小さい2クリークで構成される曖昧な構築物であることの高い尤度を有した。この曖昧さを考慮して、これらの2クリークは同様にフィルターで除去された。
工程3b.及び3c.の経験則は、各成分をそれが構成する最もありそうな二部クリークに分解する最大尤度法によって置き換えられてもよく、これは結果をさらに改善すると予想される。尤度は、我々の経験則3c.で議論したようなパラメータλに依存し、且つ成分構成する種々の2クリーク間でのwID BC及びoDT BCにおける重複の量にも依存する。
Claims (27)
- 核酸試料の細胞起源を特定する方法であって、
(a)単一細胞に由来する核酸分子を含む核酸試料を含み、かつ独特の5’バーコードを各構築物が含む1つ以上の5’核酸構築物および独特の3’バーコードを各構築物が含む1つ以上の3’核酸構築物を含むバーコードのセットも含むことができる、複数の反応混合物を形成する工程であって、前記1つ以上の独特の5’バーコードおよび3’バーコードが、前記複数の反応混合物の30%、40%、50%、60%、70%、80%、90%または100%に存在し、かつ各5’核酸構築物が、固体表面に結合された複数コピーで提供され、かつ各3’核酸構築物が、固体表面に結合された複数コピーで提供される、工程と、
(b)前記試料の前記核酸分子にバーコードの前記セットを組み込む工程と、
(c)前記単一細胞の前記核酸分子に組み込まれたバーコードの前記セットを特定し、それによって前記核酸試料の細胞起源を特定する工程であって、前記核酸試料における前記1つ以上の独特の5’バーコードと3’バーコードとの組み合わせが、前記核酸試料の細胞起源を特定する、工程
とを含む、前記方法。 - 前記反応混合物を形成する工程が、バーコードの前記セットに前記単一細胞を接触させることと、前記単一細胞に由来する前記核酸試料を提供するために、前記細胞を溶解することとを含む、または
前記反応混合物を形成する工程が、懸濁緩衝液中の細胞を提供することと、前記単一細胞とバーコードの前記セットとを含む前記反応混合物を形成するための条件下で、バーコードの前記セットを含むバーコーディング緩衝液に、前記細胞を含む前記懸濁緩衝液を接触させることとを含む、
請求項1に記載の方法。 - 前記構築物が、独特の分子識別子(UMI)配列をさらに含む、請求項1または2に記載の方法。
- 前記固体表面がビーズである、請求項1または2に記載の方法。
- 各5’核酸構築物及び3’核酸構築物が、光切断可能なリンカーまたは制限酵素部位をさらに含み、前記反応混合物を制限酵素に接触させる工程および/または前記反応混合物をUV光に曝露して、前記固体表面から前記5’核酸構築物及び前記3’核酸構築物を遊離させる工程をさらに含む、請求項1または2に記載の方法。
- 前記5’核酸構築物が、プロモータを含む二本鎖核酸構築物であり、且つ前記5’核酸構築物が、複数コピーの前記5’核酸構築物を作り出すための鋳型として役立つ、請求項1または2に記載の方法。
- バーコードの前記セットが、1、2、3、4、5、6、7、または8個の5’核酸構築物と、1、2、3、4、5、6、7、または8個の3’核酸構築物とを含む、請求項1または2に記載の方法。
- 前記3’核酸構築物が結合配列をさらに含む、請求項1または2に記載の方法。
- 前記結合配列がポリ-T配列を含む、請求項8に記載の方法。
- 前記ポリ-T配列が、前記試料の前記核酸分子におけるポリ-A配列に結合する、請求項9に記載の方法。
- 前記3’核酸構築物における前記バーコードが、逆転写によって組み込まれる、請求項1または2に記載の方法。
- 前記逆転写により、前記試料の前記核酸分子の末端に2~5個のシトシン残基が付加される、請求項11に記載の方法。
- 前記2~5個のシトシン残基が、前記5’核酸構築物における結合配列に相補性の結合配列を提供する、請求項12に記載の方法。
- 前記5’核酸構築物における前記結合配列が、ポリ-G配列を含む、請求項13に記載の方法。
- 前記5’核酸構築物における前記結合配列が、前記試料の前記核酸分子におけるポリ-C配列に結合する、請求項14に記載の方法。
- 前記5’核酸構築物が、逆転写酵素を用いて前記核酸試料に組み込まれる、請求項1または2に記載の方法。
- 前記逆転写酵素がM-MLV酵素である、請求項16に記載の方法。
- 前記逆転写酵素がMMLV H-逆転写酵素である、請求項17に記載の方法。
- 5’バーコード及び3’バーコードを各配列が含む複数の核酸配列の複数コピーを作り出すために、前記核酸試料がさらに増幅される、請求項1または2に記載の方法。
- 前記核酸分子がmRNAを含む、請求項1~19のいずれか1項に記載の方法。
- 前記核酸試料における前記バーコードが、配列決定によって特定される、請求項1~20のいずれか1項に記載の方法。
- 前記核酸分子の1つ以上が、2つ以上の独特のバーコードを含む、請求項1に記載の方法。
- 前記独特のバーコードが、前記核酸分子の5’末端、3’末端、または5’末端と3’末端の双方に位置する、請求項22に記載の方法。
- 複数の反応混合物を形成する工程を含む、請求項1または2に記載の方法。
- 2つ以上の独特のバーコードが、前記反応混合物の30%、40%、50%、60%、70%、80%、90%または100%に存在する、請求項24に記載の方法。
- 前記複数の反応混合物を形成する工程が、0.5、0.6、0.7、0.8、0.9、1.0、2.0、3.0、4.0または5.0より大きいラムダで複数の反応混合物にバーコードの前記セットを加えることを含む、請求項24に記載の方法。
- 前記反応混合物が液滴である、請求項1に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562250900P | 2015-11-04 | 2015-11-04 | |
| US62/250,900 | 2015-11-04 | ||
| PCT/US2016/060576 WO2017079593A1 (en) | 2015-11-04 | 2016-11-04 | Combinatorial sets of nucleic acid barcodes for analysis of nucleic acids associated with single cells |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2018538006A JP2018538006A (ja) | 2018-12-27 |
| JP2018538006A5 JP2018538006A5 (ja) | 2019-12-12 |
| JP7064439B2 true JP7064439B2 (ja) | 2022-05-10 |
Family
ID=57396822
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018543062A Active JP7064439B2 (ja) | 2015-11-04 | 2016-11-04 | 単一細胞に関連する核酸の解析のための、核酸バーコードの組み合わせセット |
Country Status (9)
| Country | Link |
|---|---|
| US (2) | US11098304B2 (ja) |
| EP (1) | EP3371309B1 (ja) |
| JP (1) | JP7064439B2 (ja) |
| KR (1) | KR20180097536A (ja) |
| CN (1) | CN108473984A (ja) |
| AU (1) | AU2016348439B2 (ja) |
| CA (1) | CA3004310A1 (ja) |
| SG (1) | SG11201803646YA (ja) |
| WO (1) | WO2017079593A1 (ja) |
Families Citing this family (77)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8835358B2 (en) | 2009-12-15 | 2014-09-16 | Cellular Research, Inc. | Digital counting of individual molecules by stochastic attachment of diverse labels |
| US11939634B2 (en) | 2010-05-18 | 2024-03-26 | Natera, Inc. | Methods for simultaneous amplification of target loci |
| US9677118B2 (en) | 2014-04-21 | 2017-06-13 | Natera, Inc. | Methods for simultaneous amplification of target loci |
| US20190010543A1 (en) | 2010-05-18 | 2019-01-10 | Natera, Inc. | Methods for simultaneous amplification of target loci |
| SG11201405274WA (en) | 2012-02-27 | 2014-10-30 | Cellular Res Inc | Compositions and kits for molecular counting |
| US20150376609A1 (en) | 2014-06-26 | 2015-12-31 | 10X Genomics, Inc. | Methods of Analyzing Nucleic Acids from Individual Cells or Cell Populations |
| US10400280B2 (en) | 2012-08-14 | 2019-09-03 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US11591637B2 (en) | 2012-08-14 | 2023-02-28 | 10X Genomics, Inc. | Compositions and methods for sample processing |
| US9951386B2 (en) | 2014-06-26 | 2018-04-24 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| MX364957B (es) | 2012-08-14 | 2019-05-15 | 10X Genomics Inc | Composiciones y metodos para microcapsulas. |
| US10323279B2 (en) | 2012-08-14 | 2019-06-18 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US10752949B2 (en) | 2012-08-14 | 2020-08-25 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US9701998B2 (en) | 2012-12-14 | 2017-07-11 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| HUE058723T2 (hu) | 2012-11-19 | 2022-09-28 | Apton Biosystems Inc | Molekuláris analitok digitális elemzése egyetlen molekula kimutatásával |
| US10829816B2 (en) | 2012-11-19 | 2020-11-10 | Apton Biosystems, Inc. | Methods of analyte detection |
| US10533221B2 (en) | 2012-12-14 | 2020-01-14 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| CA2894694C (en) | 2012-12-14 | 2023-04-25 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| CA2900481A1 (en) | 2013-02-08 | 2014-08-14 | 10X Genomics, Inc. | Polynucleotide barcode generation |
| SG10201806890VA (en) | 2013-08-28 | 2018-09-27 | Cellular Res Inc | Massively parallel single cell analysis |
| RU2717641C2 (ru) | 2014-04-21 | 2020-03-24 | Натера, Инк. | Обнаружение мутаций и плоидности в хромосомных сегментах |
| SG11201705615UA (en) | 2015-01-12 | 2017-08-30 | 10X Genomics Inc | Processes and systems for preparing nucleic acid sequencing libraries and libraries prepared using same |
| EP3262407B1 (en) | 2015-02-24 | 2023-08-30 | 10X Genomics, Inc. | Partition processing methods and systems |
| US9727810B2 (en) | 2015-02-27 | 2017-08-08 | Cellular Research, Inc. | Spatially addressable molecular barcoding |
| EP3277843A2 (en) | 2015-03-30 | 2018-02-07 | Cellular Research, Inc. | Methods and compositions for combinatorial barcoding |
| CN107580632B (zh) | 2015-04-23 | 2021-12-28 | 贝克顿迪金森公司 | 用于全转录组扩增的方法和组合物 |
| US11479812B2 (en) | 2015-05-11 | 2022-10-25 | Natera, Inc. | Methods and compositions for determining ploidy |
| KR20180043369A (ko) | 2015-09-11 | 2018-04-27 | 더 제너럴 하스피탈 코포레이션 | 뉴클레아제 dsb의 완전한 호출 및 시퀀싱(find-seq) |
| WO2017044574A1 (en) | 2015-09-11 | 2017-03-16 | Cellular Research, Inc. | Methods and compositions for nucleic acid library normalization |
| US10301677B2 (en) | 2016-05-25 | 2019-05-28 | Cellular Research, Inc. | Normalization of nucleic acid libraries |
| US10202641B2 (en) | 2016-05-31 | 2019-02-12 | Cellular Research, Inc. | Error correction in amplification of samples |
| US10640763B2 (en) | 2016-05-31 | 2020-05-05 | Cellular Research, Inc. | Molecular indexing of internal sequences |
| WO2018058073A2 (en) | 2016-09-26 | 2018-03-29 | Cellular Research, Inc. | Measurement of protein expression using reagents with barcoded oligonucleotide sequences |
| US10011870B2 (en) | 2016-12-07 | 2018-07-03 | Natera, Inc. | Compositions and methods for identifying nucleic acid molecules |
| EP4029939B1 (en) | 2017-01-30 | 2023-06-28 | 10X Genomics, Inc. | Methods and systems for droplet-based single cell barcoding |
| CN110382708A (zh) | 2017-02-01 | 2019-10-25 | 赛卢拉研究公司 | 使用阻断性寡核苷酸进行选择性扩增 |
| CN114921537A (zh) | 2017-03-17 | 2022-08-19 | 雅普顿生物系统公司 | 测序和高分辨率成像 |
| US11530436B2 (en) * | 2017-05-23 | 2022-12-20 | President And Fellows Of Harvard College | Multiplex end-tagging amplification of nucleic acids |
| CN116064732A (zh) | 2017-05-26 | 2023-05-05 | 10X基因组学有限公司 | 转座酶可接近性染色质的单细胞分析 |
| US10400235B2 (en) | 2017-05-26 | 2019-09-03 | 10X Genomics, Inc. | Single cell analysis of transposase accessible chromatin |
| CA3059559A1 (en) | 2017-06-05 | 2018-12-13 | Becton, Dickinson And Company | Sample indexing for single cells |
| JP2020532967A (ja) | 2017-08-23 | 2020-11-19 | ザ ジェネラル ホスピタル コーポレイション | 変更されたPAM特異性を有する遺伝子操作されたCRISPR−Cas9ヌクレアーゼ |
| US20200217850A1 (en) * | 2017-09-15 | 2020-07-09 | Apton Biosystems, Inc. | Heterogeneous single cell profiling using molecular barcoding |
| WO2019075197A1 (en) | 2017-10-11 | 2019-04-18 | The General Hospital Corporation | METHODS OF DETECTION OF INDIVIDUAL SITE-SPECIFIC PARASITE GENOMIC DEAMINATION BY BASE EDITING TECHNOLOGIES |
| SG11201913654QA (en) | 2017-11-15 | 2020-01-30 | 10X Genomics Inc | Functionalized gel beads |
| US10829815B2 (en) | 2017-11-17 | 2020-11-10 | 10X Genomics, Inc. | Methods and systems for associating physical and genetic properties of biological particles |
| CN110770352B (zh) * | 2017-11-17 | 2023-12-15 | 10X基因组学有限公司 | 用于关联生物颗粒的物理和遗传特性的方法和系统 |
| EP3728636A1 (en) | 2017-12-19 | 2020-10-28 | Becton, Dickinson and Company | Particles associated with oligonucleotides |
| WO2019191321A1 (en) * | 2018-03-28 | 2019-10-03 | 10X Genomics, Inc. | Nucleic acid enrichment within partitions |
| SG11202009889VA (en) | 2018-04-06 | 2020-11-27 | 10X Genomics Inc | Systems and methods for quality control in single cell processing |
| WO2019200341A1 (en) * | 2018-04-13 | 2019-10-17 | The Board Of Trustees Of The Leland Stanford Junior University | Nucleic acid quantification using concentration-specific barcodes |
| CN112313241A (zh) | 2018-04-17 | 2021-02-02 | 总医院公司 | 核酸结合、修饰、和切割试剂的底物偏好和位点的灵敏体外试验 |
| US11773441B2 (en) | 2018-05-03 | 2023-10-03 | Becton, Dickinson And Company | High throughput multiomics sample analysis |
| JP7358388B2 (ja) | 2018-05-03 | 2023-10-10 | ベクトン・ディキンソン・アンド・カンパニー | 反対側の転写物末端における分子バーコーディング |
| US11525159B2 (en) | 2018-07-03 | 2022-12-13 | Natera, Inc. | Methods for detection of donor-derived cell-free DNA |
| WO2020014586A1 (en) * | 2018-07-12 | 2020-01-16 | Board Of Regents, The University Of Texas System | Molecular neighborhood detection by oligonucleotides |
| WO2020046833A1 (en) * | 2018-08-28 | 2020-03-05 | Cellular Research, Inc. | Sample multiplexing using carbohydrate-binding and membrane-permeable reagents |
| JP2022502029A (ja) * | 2018-09-24 | 2022-01-11 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | バーコード化ペプチド−mhc複合体およびその使用 |
| US11639517B2 (en) | 2018-10-01 | 2023-05-02 | Becton, Dickinson And Company | Determining 5′ transcript sequences |
| US11932849B2 (en) | 2018-11-08 | 2024-03-19 | Becton, Dickinson And Company | Whole transcriptome analysis of single cells using random priming |
| EP3894552A1 (en) | 2018-12-13 | 2021-10-20 | Becton, Dickinson and Company | Selective extension in single cell whole transcriptome analysis |
| UY38538A (es) * | 2019-01-07 | 2020-06-30 | Pivot Bio Inc | Ensayos de colonización de plantas con códigos de barras microbianos naturales |
| EP3914728B1 (en) | 2019-01-23 | 2023-04-05 | Becton, Dickinson and Company | Oligonucleotides associated with antibodies |
| SG11202111242PA (en) | 2019-03-11 | 2021-11-29 | 10X Genomics Inc | Systems and methods for processing optically tagged beads |
| US11965208B2 (en) | 2019-04-19 | 2024-04-23 | Becton, Dickinson And Company | Methods of associating phenotypical data and single cell sequencing data |
| US20200385791A1 (en) * | 2019-06-07 | 2020-12-10 | Bio-Rad Laboratories, Inc. | Multiple Beads Per Droplet Resolution |
| US11939622B2 (en) | 2019-07-22 | 2024-03-26 | Becton, Dickinson And Company | Single cell chromatin immunoprecipitation sequencing assay |
| CN114729350A (zh) | 2019-11-08 | 2022-07-08 | 贝克顿迪金森公司 | 使用随机引发获得用于免疫组库测序的全长v(d)j信息 |
| WO2021128036A1 (zh) * | 2019-12-25 | 2021-07-01 | 苏州绘真生物科技有限公司 | 用于构建人单细胞tcr测序文库的试剂盒及其应用 |
| CA3167722A1 (en) * | 2020-01-13 | 2021-07-22 | Fluent Biosciences Inc. | Reverse transcription during template emulsification |
| WO2021146207A1 (en) | 2020-01-13 | 2021-07-22 | Becton, Dickinson And Company | Methods and compositions for quantitation of proteins and rna |
| EP4106769A4 (en) * | 2020-02-17 | 2024-03-27 | Universal Sequencing Tech Corporation | METHOD FOR BARCODING NUCLEIC ACIDS FOR DETECTION AND SEQUENCING |
| WO2021231779A1 (en) | 2020-05-14 | 2021-11-18 | Becton, Dickinson And Company | Primers for immune repertoire profiling |
| WO2021241721A1 (ja) | 2020-05-29 | 2021-12-02 | 国立研究開発法人理化学研究所 | 細胞集団の処理方法および細胞集団に含まれる遺伝子の分析方法 |
| US11932901B2 (en) | 2020-07-13 | 2024-03-19 | Becton, Dickinson And Company | Target enrichment using nucleic acid probes for scRNAseq |
| CN116635533A (zh) | 2020-11-20 | 2023-08-22 | 贝克顿迪金森公司 | 高表达的蛋白和低表达的蛋白的谱分析 |
| WO2023048300A1 (ja) * | 2021-09-27 | 2023-03-30 | 国立大学法人東京大学 | 細胞標識分子及び細胞の分析方法 |
| GB202211182D0 (en) * | 2022-08-01 | 2022-09-14 | Univ Oxford Innovation Ltd | Bead-hashing |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015103339A1 (en) | 2013-12-30 | 2015-07-09 | Atreca, Inc. | Analysis of nucleic acids associated with single cells using nucleic acid barcodes |
| WO2016138490A1 (en) | 2015-02-27 | 2016-09-01 | Fluidigm Corporation | Single-cell nucleic acids for high-throughput studies |
Family Cites Families (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5643722A (en) | 1994-05-11 | 1997-07-01 | Trustees Of Boston University | Methods for the detection and isolation of proteins |
| US5962271A (en) | 1996-01-03 | 1999-10-05 | Cloutech Laboratories, Inc. | Methods and compositions for generating full-length cDNA having arbitrary nucleotide sequence at the 3'-end |
| WO2002068104A1 (en) | 2001-02-23 | 2002-09-06 | Japan Science And Technology Corporation | Process for producing emulsion and microcapsules and apparatus therefor |
| US20030175749A1 (en) | 2001-12-08 | 2003-09-18 | Jong-Yoon Chun | Annealing control primer and its uses |
| EP1757357B1 (en) | 2004-03-23 | 2013-04-24 | Japan Science and Technology Agency | Method and device for producing micro-droplets |
| EP1924704B1 (en) * | 2005-08-02 | 2011-05-25 | Rubicon Genomics, Inc. | Compositions and methods for processing and amplification of dna, including using multiple enzymes in a single reaction |
| ES2559313T3 (es) * | 2007-06-19 | 2016-02-11 | Stratos Genomics Inc. | Secuenciación de ácidos nucleicos de alto rendimiento por expansión |
| JP5455243B2 (ja) | 2008-06-18 | 2014-03-26 | 独立行政法人理化学研究所 | 未知の配列を含む増幅した二本鎖核酸の混合物を製造する方法 |
| US20120010091A1 (en) | 2009-03-30 | 2012-01-12 | Illumina, Inc. | Gene expression analysis in single cells |
| AU2010232439C1 (en) * | 2009-04-02 | 2017-07-13 | Fluidigm Corporation | Multi-primer amplification method for barcoding of target nucleic acids |
| CN101864477A (zh) * | 2009-04-15 | 2010-10-20 | 上海聚类生物科技有限公司 | 一种利用高通量测序单通道复用技术进行microRNA表达谱测定的方法 |
| CN102933721B (zh) | 2010-06-09 | 2015-12-02 | 凯津公司 | 用于高通量筛选的组合序列条形码 |
| CA2814049C (en) * | 2010-10-08 | 2021-07-13 | President And Fellows Of Harvard College | High-throughput single cell barcoding |
| EP2652155B1 (en) | 2010-12-16 | 2016-11-16 | Gigagen, Inc. | Methods for massively parallel analysis of nucleic acids in single cells |
| SI2702146T1 (sl) | 2011-04-28 | 2019-06-28 | The Board Of Trustees Of The Leland Stanford Junior University | Identifikacija polinukleotidov, povezanih z vzorcem |
| WO2012162267A2 (en) * | 2011-05-20 | 2012-11-29 | Fluidigm Corporation | Nucleic acid encoding reactions |
| CN104080462B (zh) * | 2011-12-16 | 2019-08-09 | 塔尔盖特基因生物技术有限公司 | 用于修饰预定的靶核酸序列的组合物和方法 |
| SG11201404332RA (en) * | 2012-02-01 | 2014-08-28 | Synthetic Genomics Inc | Materials and methods for the synthesis of error-minimized nucleic acid molecules |
| AU2013246050B2 (en) * | 2012-04-13 | 2017-03-16 | Adaptive Biotechnologies Corp. | Detection and quantitation of sample contamination in immune repertoire analysis |
| JP2015523087A (ja) * | 2012-07-24 | 2015-08-13 | シーケンタ インコーポレイテッド | 配列タグを用いる単一細胞分析 |
| US20150376609A1 (en) * | 2014-06-26 | 2015-12-31 | 10X Genomics, Inc. | Methods of Analyzing Nucleic Acids from Individual Cells or Cell Populations |
| JP6338221B2 (ja) | 2012-10-24 | 2018-06-06 | タカラ バイオ ユーエスエー, インコーポレイテッド | 核酸生成物を生成するための、テンプレートスイッチに基づく方法 |
| CA2889862C (en) * | 2012-11-05 | 2021-02-16 | Rubicon Genomics, Inc. | Barcoding nucleic acids |
| JP6431895B2 (ja) * | 2013-03-15 | 2018-12-05 | アダプティブ バイオテクノロジーズ コーポレイション | 複合遺伝子セットにおいてユニークにタグ付けされた再構成された適応免疫受容体遺伝子 |
| GB2525568B (en) * | 2013-03-15 | 2020-10-14 | Abvitro Llc | Single cell barcoding for antibody discovery |
| WO2014201273A1 (en) * | 2013-06-12 | 2014-12-18 | The Broad Institute, Inc. | High-throughput rna-seq |
| KR102436171B1 (ko) | 2013-06-27 | 2022-08-24 | 10엑스 제노믹스, 인크. | 샘플 처리를 위한 조성물 및 방법 |
| US9708657B2 (en) * | 2013-07-01 | 2017-07-18 | Adaptive Biotechnologies Corp. | Method for generating clonotype profiles using sequence tags |
| CA2921603C (en) | 2013-08-23 | 2019-11-05 | Ludwig Institute For Cancer Research Ltd | Methods and compositions for cdna synthesis and single-cell transcriptome profiling using template switching reaction |
| SG10201806890VA (en) * | 2013-08-28 | 2018-09-27 | Cellular Res Inc | Massively parallel single cell analysis |
| EP3760733A1 (en) | 2013-10-17 | 2021-01-06 | Takara Bio USA, Inc. | Methods for adding adapters to nucleic acids and compositions for practicing the same |
| US9719136B2 (en) | 2013-12-17 | 2017-08-01 | Takara Bio Usa, Inc. | Methods for adding adapters to nucleic acids and compositions for practicing the same |
| CN107075543B (zh) * | 2014-04-21 | 2021-11-16 | 哈佛学院院长及董事 | 用于条形码化核酸的系统和方法 |
| AU2015261440A1 (en) | 2014-05-14 | 2017-01-05 | Barbara BURWINKEL | Synthesis of double-stranded nucleic acids |
| AU2015318011B2 (en) * | 2014-09-15 | 2020-07-23 | Abvitro Llc | High-throughput nucleotide library sequencing |
| EP3277843A2 (en) * | 2015-03-30 | 2018-02-07 | Cellular Research, Inc. | Methods and compositions for combinatorial barcoding |
| CN107580632B (zh) | 2015-04-23 | 2021-12-28 | 贝克顿迪金森公司 | 用于全转录组扩增的方法和组合物 |
-
2016
- 2016-11-04 KR KR1020187015881A patent/KR20180097536A/ko not_active Application Discontinuation
- 2016-11-04 WO PCT/US2016/060576 patent/WO2017079593A1/en active Application Filing
- 2016-11-04 SG SG11201803646YA patent/SG11201803646YA/en unknown
- 2016-11-04 JP JP2018543062A patent/JP7064439B2/ja active Active
- 2016-11-04 EP EP16801644.2A patent/EP3371309B1/en active Active
- 2016-11-04 CN CN201680077294.5A patent/CN108473984A/zh active Pending
- 2016-11-04 CA CA3004310A patent/CA3004310A1/en active Pending
- 2016-11-04 AU AU2016348439A patent/AU2016348439B2/en active Active
- 2016-11-04 US US15/772,723 patent/US11098304B2/en active Active
-
2021
- 2021-07-28 US US17/443,909 patent/US20210380974A1/en active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015103339A1 (en) | 2013-12-30 | 2015-07-09 | Atreca, Inc. | Analysis of nucleic acids associated with single cells using nucleic acid barcodes |
| WO2016138490A1 (en) | 2015-02-27 | 2016-09-01 | Fluidigm Corporation | Single-cell nucleic acids for high-throughput studies |
Also Published As
| Publication number | Publication date |
|---|---|
| US20210380974A1 (en) | 2021-12-09 |
| CA3004310A1 (en) | 2017-05-11 |
| CN108473984A (zh) | 2018-08-31 |
| JP2018538006A (ja) | 2018-12-27 |
| EP3371309A1 (en) | 2018-09-12 |
| KR20180097536A (ko) | 2018-08-31 |
| AU2016348439A1 (en) | 2018-05-10 |
| SG11201803646YA (en) | 2018-05-30 |
| EP3371309B1 (en) | 2023-07-05 |
| US11098304B2 (en) | 2021-08-24 |
| AU2016348439B2 (en) | 2023-03-09 |
| US20180320171A1 (en) | 2018-11-08 |
| WO2017079593A1 (en) | 2017-05-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7064439B2 (ja) | 単一細胞に関連する核酸の解析のための、核酸バーコードの組み合わせセット | |
| US20230087127A1 (en) | Methods and systems for processing polynucleotides | |
| US10584381B2 (en) | Methods and systems for processing polynucleotides | |
| US10752949B2 (en) | Methods and systems for processing polynucleotides | |
| US10457986B2 (en) | Methods and systems for processing polynucleotides | |
| US10273541B2 (en) | Methods and systems for processing polynucleotides | |
| WO2019032760A1 (en) | IMPROVED METHOD OF ANALYZING NUCLEIC ACID CONTENT FROM MULTIPLE BIOLOGICAL PARTICLES | |
| WO2018031631A1 (en) | Methods of de novo assembly of barcoded genomic dna fragments | |
| Ma et al. | Microfluidics for genome-wide studies involving next generation sequencing | |
| US20220325275A1 (en) | Methods of Barcoding Nucleic Acid for Detection and Sequencing | |
| US20150133310A1 (en) | Nucleic acid sequencing systems and methods | |
| WO2024033174A1 (en) | Barcoding of nucleic acids from single cells | |
| CN115175985A (zh) | 从未经处理的生物样本中提取单链dna和rna并测序的方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180523 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20191101 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20191101 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200923 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20201221 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20210120 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210318 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210729 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20211027 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220121 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20220228 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220330 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20220422 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7064439 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |