JP7019727B2 - インフルエンザの治療方法 - Google Patents
インフルエンザの治療方法 Download PDFInfo
- Publication number
- JP7019727B2 JP7019727B2 JP2019563650A JP2019563650A JP7019727B2 JP 7019727 B2 JP7019727 B2 JP 7019727B2 JP 2019563650 A JP2019563650 A JP 2019563650A JP 2019563650 A JP2019563650 A JP 2019563650A JP 7019727 B2 JP7019727 B2 JP 7019727B2
- Authority
- JP
- Japan
- Prior art keywords
- influenza
- virus
- influenza virus
- pharmaceutical composition
- pharmaceutically acceptable
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 241000712461 unidentified influenza virus Species 0.000 claims description 100
- 150000003839 salts Chemical class 0.000 claims description 60
- 230000009385 viral infection Effects 0.000 claims description 44
- 208000024891 symptom Diseases 0.000 claims description 35
- 239000003814 drug Substances 0.000 claims description 23
- 239000008194 pharmaceutical composition Substances 0.000 claims description 23
- 241000712431 Influenza A virus Species 0.000 claims description 20
- 230000010076 replication Effects 0.000 claims description 15
- VSZGPKBBMSAYNT-RRFJBIMHSA-N oseltamivir Chemical compound CCOC(=O)C1=C[C@@H](OC(CC)CC)[C@H](NC(C)=O)[C@@H](N)C1 VSZGPKBBMSAYNT-RRFJBIMHSA-N 0.000 claims description 13
- 229960003752 oseltamivir Drugs 0.000 claims description 13
- 238000011282 treatment Methods 0.000 claims description 13
- 241000713196 Influenza B virus Species 0.000 claims description 11
- 229940079593 drug Drugs 0.000 claims description 11
- 230000002829 reductive effect Effects 0.000 claims description 11
- 241000197306 H1N1 subtype Species 0.000 claims description 10
- 239000003443 antiviral agent Substances 0.000 claims description 10
- 230000002265 prevention Effects 0.000 claims description 10
- 241000252870 H3N2 subtype Species 0.000 claims description 8
- 241001473385 H5N1 subtype Species 0.000 claims description 7
- 238000004519 manufacturing process Methods 0.000 claims description 6
- 229960001084 peramivir Drugs 0.000 claims description 5
- XRQDFNLINLXZLB-CKIKVBCHSA-N peramivir Chemical compound CCC(CC)[C@H](NC(C)=O)[C@@H]1[C@H](O)[C@@H](C(O)=O)C[C@H]1NC(N)=N XRQDFNLINLXZLB-CKIKVBCHSA-N 0.000 claims description 5
- 229960001028 zanamivir Drugs 0.000 claims description 5
- ARAIBEBZBOPLMB-UFGQHTETSA-N zanamivir Chemical compound CC(=O)N[C@@H]1[C@@H](N=C(N)N)C=C(C(O)=O)O[C@H]1[C@H](O)[C@H](O)CO ARAIBEBZBOPLMB-UFGQHTETSA-N 0.000 claims description 5
- 241000713297 Influenza C virus Species 0.000 claims description 3
- 238000000034 method Methods 0.000 description 45
- 241000700605 Viruses Species 0.000 description 44
- 206010022000 influenza Diseases 0.000 description 44
- WVROWPPEIMRGAB-UHFFFAOYSA-N bit225 Chemical compound C1=NN(C)C=C1C1=CC=CC2=CC(C(=O)NC(N)=N)=CC=C12 WVROWPPEIMRGAB-UHFFFAOYSA-N 0.000 description 41
- 230000003612 virological effect Effects 0.000 description 27
- 210000004027 cell Anatomy 0.000 description 22
- 239000000203 mixture Substances 0.000 description 22
- 208000015181 infectious disease Diseases 0.000 description 19
- 229960003805 amantadine Drugs 0.000 description 18
- DKNWSYNQZKUICI-UHFFFAOYSA-N amantadine Chemical compound C1C(C2)CC3CC2CC1(N)C3 DKNWSYNQZKUICI-UHFFFAOYSA-N 0.000 description 18
- 230000029812 viral genome replication Effects 0.000 description 18
- 150000001875 compounds Chemical class 0.000 description 16
- -1 1-methyl-1H-pyrazol-4-yl Chemical group 0.000 description 14
- 201000010099 disease Diseases 0.000 description 14
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 14
- 208000037797 influenza A Diseases 0.000 description 14
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 12
- 230000000120 cytopathologic effect Effects 0.000 description 12
- 230000000694 effects Effects 0.000 description 12
- 230000000840 anti-viral effect Effects 0.000 description 11
- 239000000243 solution Substances 0.000 description 10
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 9
- RMHJJUOPOWPRBP-UHFFFAOYSA-N naphthalene-1-carboxamide Chemical compound C1=CC=C2C(C(=O)N)=CC=CC2=C1 RMHJJUOPOWPRBP-UHFFFAOYSA-N 0.000 description 9
- 238000002360 preparation method Methods 0.000 description 9
- 229940124597 therapeutic agent Drugs 0.000 description 9
- 108090000862 Ion Channels Proteins 0.000 description 8
- 102000004310 Ion Channels Human genes 0.000 description 8
- 238000003556 assay Methods 0.000 description 7
- 239000003795 chemical substances by application Substances 0.000 description 7
- 208000037798 influenza B Diseases 0.000 description 7
- 230000005764 inhibitory process Effects 0.000 description 7
- 238000012360 testing method Methods 0.000 description 7
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 6
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 6
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 238000011260 co-administration Methods 0.000 description 6
- 239000000463 material Substances 0.000 description 6
- 230000001225 therapeutic effect Effects 0.000 description 6
- 238000002560 therapeutic procedure Methods 0.000 description 6
- UBCHPRBFMUDMNC-UHFFFAOYSA-N 1-(1-adamantyl)ethanamine Chemical compound C1C(C2)CC3CC2CC1(C(N)C)C3 UBCHPRBFMUDMNC-UHFFFAOYSA-N 0.000 description 5
- 239000004480 active ingredient Substances 0.000 description 5
- 230000002401 inhibitory effect Effects 0.000 description 5
- 230000035772 mutation Effects 0.000 description 5
- 239000002245 particle Substances 0.000 description 5
- 229960000888 rimantadine Drugs 0.000 description 5
- 102200049623 rs6529 Human genes 0.000 description 5
- 239000002911 sialidase inhibitor Substances 0.000 description 5
- 239000002904 solvent Substances 0.000 description 5
- 208000035143 Bacterial infection Diseases 0.000 description 4
- 101710154606 Hemagglutinin Proteins 0.000 description 4
- 201000002481 Myositis Diseases 0.000 description 4
- 108010006232 Neuraminidase Proteins 0.000 description 4
- 102000005348 Neuraminidase Human genes 0.000 description 4
- 101710093908 Outer capsid protein VP4 Proteins 0.000 description 4
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 description 4
- 101710176177 Protein A56 Proteins 0.000 description 4
- 206010047700 Vomiting Diseases 0.000 description 4
- 208000006673 asthma Diseases 0.000 description 4
- 208000022362 bacterial infectious disease Diseases 0.000 description 4
- 239000002775 capsule Substances 0.000 description 4
- 229940042406 direct acting antivirals neuraminidase inhibitors Drugs 0.000 description 4
- 239000000185 hemagglutinin Substances 0.000 description 4
- 239000004615 ingredient Substances 0.000 description 4
- 239000002609 medium Substances 0.000 description 4
- 210000000056 organ Anatomy 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 239000003826 tablet Substances 0.000 description 4
- 210000001519 tissue Anatomy 0.000 description 4
- 229960005486 vaccine Drugs 0.000 description 4
- 230000008673 vomiting Effects 0.000 description 4
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- 206010028813 Nausea Diseases 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 239000013543 active substance Substances 0.000 description 3
- 230000000890 antigenic effect Effects 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 206010006451 bronchitis Diseases 0.000 description 3
- 230000001684 chronic effect Effects 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 238000010790 dilution Methods 0.000 description 3
- 239000012895 dilution Substances 0.000 description 3
- 239000002612 dispersion medium Substances 0.000 description 3
- 239000000796 flavoring agent Substances 0.000 description 3
- 235000013355 food flavoring agent Nutrition 0.000 description 3
- 229960003971 influenza vaccine Drugs 0.000 description 3
- 230000009545 invasion Effects 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 230000008693 nausea Effects 0.000 description 3
- PGSADBUBUOPOJS-UHFFFAOYSA-N neutral red Chemical compound Cl.C1=C(C)C(N)=CC2=NC3=CC(N(C)C)=CC=C3N=C21 PGSADBUBUOPOJS-UHFFFAOYSA-N 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 239000000049 pigment Substances 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 239000011541 reaction mixture Substances 0.000 description 3
- 238000003786 synthesis reaction Methods 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- NKDXJORRKXIXDN-UHFFFAOYSA-N 5-(1-methylpyrazol-4-yl)naphthalene-2-carboxylic acid Chemical compound C1=NN(C)C=C1C1=CC=CC2=CC(C(O)=O)=CC=C12 NKDXJORRKXIXDN-UHFFFAOYSA-N 0.000 description 2
- 241000167854 Bourreria succulenta Species 0.000 description 2
- 241000282465 Canis Species 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- 208000035473 Communicable disease Diseases 0.000 description 2
- 229920002261 Corn starch Polymers 0.000 description 2
- 206010011224 Cough Diseases 0.000 description 2
- 241000283086 Equidae Species 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 206010019233 Headaches Diseases 0.000 description 2
- 241000713772 Human immunodeficiency virus 1 Species 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- 208000000112 Myalgia Diseases 0.000 description 2
- 241000712464 Orthomyxoviridae Species 0.000 description 2
- 206010035664 Pneumonia Diseases 0.000 description 2
- 241000288906 Primates Species 0.000 description 2
- 206010037660 Pyrexia Diseases 0.000 description 2
- 206010039101 Rhinorrhoea Diseases 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- 210000001744 T-lymphocyte Anatomy 0.000 description 2
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 2
- 102000004142 Trypsin Human genes 0.000 description 2
- 108090000631 Trypsin Proteins 0.000 description 2
- 108010067390 Viral Proteins Proteins 0.000 description 2
- 208000036142 Viral infection Diseases 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 230000000844 anti-bacterial effect Effects 0.000 description 2
- 229940121375 antifungal agent Drugs 0.000 description 2
- 239000003429 antifungal agent Substances 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 235000019693 cherries Nutrition 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 239000008120 corn starch Substances 0.000 description 2
- 229940099112 cornstarch Drugs 0.000 description 2
- 239000012228 culture supernatant Substances 0.000 description 2
- 231100000517 death Toxicity 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 206010014599 encephalitis Diseases 0.000 description 2
- 230000005713 exacerbation Effects 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 206010016256 fatigue Diseases 0.000 description 2
- 235000003599 food sweetener Nutrition 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 231100000869 headache Toxicity 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 230000036039 immunity Effects 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 208000037799 influenza C Diseases 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 2
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- ZJAOAACCNHFJAH-UHFFFAOYSA-N phosphonoformic acid Chemical compound OC(=O)P(O)(O)=O ZJAOAACCNHFJAH-UHFFFAOYSA-N 0.000 description 2
- 239000006187 pill Substances 0.000 description 2
- 238000002962 plaque-reduction assay Methods 0.000 description 2
- 230000035755 proliferation Effects 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 230000000241 respiratory effect Effects 0.000 description 2
- 238000005204 segregation Methods 0.000 description 2
- 230000035945 sensitivity Effects 0.000 description 2
- 239000002356 single layer Substances 0.000 description 2
- 201000009890 sinusitis Diseases 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 239000003765 sweetening agent Substances 0.000 description 2
- 208000011580 syndromic disease Diseases 0.000 description 2
- 239000006188 syrup Substances 0.000 description 2
- 235000020357 syrup Nutrition 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- 239000012588 trypsin Substances 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- 230000017613 viral reproduction Effects 0.000 description 2
- BPBRVCJSVGJSDY-UHFFFAOYSA-N 5-(1-methylpyrazol-4-yl)naphthalene-2-carboxamide Chemical compound CN1C=C(C=N1)C2=CC=CC3=C2C=CC(=C3)C(=O)N BPBRVCJSVGJSDY-UHFFFAOYSA-N 0.000 description 1
- QPOQPJDDJJNVRY-UHFFFAOYSA-N 5-bromonaphthalene-2-carboxylic acid Chemical compound BrC1=CC=CC2=CC(C(=O)O)=CC=C21 QPOQPJDDJJNVRY-UHFFFAOYSA-N 0.000 description 1
- LHEJDBBHZGISGW-UHFFFAOYSA-N 5-fluoro-3-(3-oxo-1h-2-benzofuran-1-yl)-1h-pyrimidine-2,4-dione Chemical compound O=C1C(F)=CNC(=O)N1C1C2=CC=CC=C2C(=O)O1 LHEJDBBHZGISGW-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 208000006820 Arthralgia Diseases 0.000 description 1
- 206010003658 Atrial Fibrillation Diseases 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 206010006473 Bronchopulmonary aspergillosis Diseases 0.000 description 1
- 206010006784 Burning sensation Diseases 0.000 description 1
- 241000282832 Camelidae Species 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 108091006146 Channels Proteins 0.000 description 1
- 206010008479 Chest Pain Diseases 0.000 description 1
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 1
- 206010010071 Coma Diseases 0.000 description 1
- 206010010356 Congenital anomaly Diseases 0.000 description 1
- 241000938605 Crocodylia Species 0.000 description 1
- 235000019739 Dicalciumphosphate Nutrition 0.000 description 1
- BXZVVICBKDXVGW-NKWVEPMBSA-N Didanosine Chemical compound O1[C@H](CO)CC[C@@H]1N1C(NC=NC2=O)=C2N=C1 BXZVVICBKDXVGW-NKWVEPMBSA-N 0.000 description 1
- 206010059866 Drug resistance Diseases 0.000 description 1
- 241000283074 Equus asinus Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 208000001951 Fetal Death Diseases 0.000 description 1
- 206010055690 Foetal death Diseases 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 241000606768 Haemophilus influenzae Species 0.000 description 1
- 206010019280 Heart failures Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- XQFRJNBWHJMXHO-RRKCRQDMSA-N IDUR Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(I)=C1 XQFRJNBWHJMXHO-RRKCRQDMSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 208000032420 Latent Infection Diseases 0.000 description 1
- 240000007472 Leucaena leucocephala Species 0.000 description 1
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 1
- 101150046652 M2 gene Proteins 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 244000246386 Mentha pulegium Species 0.000 description 1
- 235000016257 Mentha pulegium Nutrition 0.000 description 1
- 235000004357 Mentha x piperita Nutrition 0.000 description 1
- 206010065838 Middle ear inflammation Diseases 0.000 description 1
- 208000034486 Multi-organ failure Diseases 0.000 description 1
- 208000010718 Multiple Organ Failure Diseases 0.000 description 1
- 102000007474 Multiprotein Complexes Human genes 0.000 description 1
- 108010085220 Multiprotein Complexes Proteins 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 241000238367 Mya arenaria Species 0.000 description 1
- 206010058735 Myoglobinaemia Diseases 0.000 description 1
- 206010028629 Myoglobinuria Diseases 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 229940123424 Neuraminidase inhibitor Drugs 0.000 description 1
- 206010067482 No adverse event Diseases 0.000 description 1
- 206010053159 Organ failure Diseases 0.000 description 1
- 206010068319 Oropharyngeal pain Diseases 0.000 description 1
- 208000005141 Otitis Diseases 0.000 description 1
- 206010033078 Otitis media Diseases 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 208000002193 Pain Diseases 0.000 description 1
- 241000282579 Pan Species 0.000 description 1
- 241000845082 Panama Species 0.000 description 1
- 208000037273 Pathologic Processes Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 201000007100 Pharyngitis Diseases 0.000 description 1
- 206010035734 Pneumonia staphylococcal Diseases 0.000 description 1
- 206010035737 Pneumonia viral Diseases 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 208000028017 Psychotic disease Diseases 0.000 description 1
- 208000004430 Pulmonary Aspergillosis Diseases 0.000 description 1
- 206010061926 Purulence Diseases 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 208000001647 Renal Insufficiency Diseases 0.000 description 1
- 208000036071 Rhinorrhea Diseases 0.000 description 1
- IWUCXVSUMQZMFG-AFCXAGJDSA-N Ribavirin Chemical compound N1=C(C(=O)N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 IWUCXVSUMQZMFG-AFCXAGJDSA-N 0.000 description 1
- 206010040047 Sepsis Diseases 0.000 description 1
- 206010040070 Septic Shock Diseases 0.000 description 1
- 229920001800 Shellac Polymers 0.000 description 1
- 101001039853 Sonchus yellow net virus Matrix protein Proteins 0.000 description 1
- 208000005392 Spasm Diseases 0.000 description 1
- 241000191967 Staphylococcus aureus Species 0.000 description 1
- XNKLLVCARDGLGL-JGVFFNPUSA-N Stavudine Chemical compound O=C1NC(=O)C(C)=CN1[C@H]1C=C[C@@H](CO)O1 XNKLLVCARDGLGL-JGVFFNPUSA-N 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 206010044248 Toxic shock syndrome Diseases 0.000 description 1
- 231100000650 Toxic shock syndrome Toxicity 0.000 description 1
- 206010044302 Tracheitis Diseases 0.000 description 1
- 206010044565 Tremor Diseases 0.000 description 1
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical class OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 1
- HDOVUKNUBWVHOX-QMMMGPOBSA-N Valacyclovir Chemical compound N1C(N)=NC(=O)C2=C1N(COCCOC(=O)[C@@H](N)C(C)C)C=N2 HDOVUKNUBWVHOX-QMMMGPOBSA-N 0.000 description 1
- OIRDTQYFTABQOQ-UHTZMRCNSA-N Vidarabine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@@H]1O OIRDTQYFTABQOQ-UHTZMRCNSA-N 0.000 description 1
- WREGKURFCTUGRC-POYBYMJQSA-N Zalcitabine Chemical compound O=C1N=C(N)C=CN1[C@@H]1O[C@H](CO)CC1 WREGKURFCTUGRC-POYBYMJQSA-N 0.000 description 1
- 150000001242 acetic acid derivatives Chemical class 0.000 description 1
- 229960004150 aciclovir Drugs 0.000 description 1
- MKUXAQIIEYXACX-UHFFFAOYSA-N aciclovir Chemical compound N1C(N)=NC(=O)C2=C1N(COCCO)C=N2 MKUXAQIIEYXACX-UHFFFAOYSA-N 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- ORILYTVJVMAKLC-UHFFFAOYSA-N adamantane Chemical class C1C(C2)CC3CC1CC2C3 ORILYTVJVMAKLC-UHFFFAOYSA-N 0.000 description 1
- 238000007605 air drying Methods 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 230000000202 analgesic effect Effects 0.000 description 1
- 230000000954 anitussive effect Effects 0.000 description 1
- 230000001754 anti-pyretic effect Effects 0.000 description 1
- 230000027645 antigenic variation Effects 0.000 description 1
- 239000002221 antipyretic Substances 0.000 description 1
- 229940124584 antitussives Drugs 0.000 description 1
- 229940121357 antivirals Drugs 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 230000036760 body temperature Effects 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 239000006189 buccal tablet Substances 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 210000000234 capsid Anatomy 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 239000013553 cell monolayer Substances 0.000 description 1
- 239000007958 cherry flavor Substances 0.000 description 1
- 150000001805 chlorine compounds Chemical class 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- 150000001860 citric acid derivatives Chemical class 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 239000013058 crude material Substances 0.000 description 1
- 239000012043 crude product Substances 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 238000011461 current therapy Methods 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 231100000263 cytotoxicity test Toxicity 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 239000003405 delayed action preparation Substances 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- NEFBYIFKOOEVPA-UHFFFAOYSA-K dicalcium phosphate Chemical compound [Ca+2].[Ca+2].[O-]P([O-])([O-])=O NEFBYIFKOOEVPA-UHFFFAOYSA-K 0.000 description 1
- 229940038472 dicalcium phosphate Drugs 0.000 description 1
- 229910000390 dicalcium phosphate Inorganic materials 0.000 description 1
- 229960002656 didanosine Drugs 0.000 description 1
- UGMCXQCYOVCMTB-UHFFFAOYSA-K dihydroxy(stearato)aluminium Chemical compound CCCCCCCCCCCCCCCCCC(=O)O[Al](O)O UGMCXQCYOVCMTB-UHFFFAOYSA-K 0.000 description 1
- PCHPORCSPXIHLZ-UHFFFAOYSA-N diphenhydramine hydrochloride Chemical compound [Cl-].C=1C=CC=CC=1C(OCC[NH+](C)C)C1=CC=CC=C1 PCHPORCSPXIHLZ-UHFFFAOYSA-N 0.000 description 1
- 208000037771 disease arising from reactivation of latent virus Diseases 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 208000017574 dry cough Diseases 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 241001493065 dsRNA viruses Species 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 208000019258 ear infection Diseases 0.000 description 1
- 201000002491 encephalomyelitis Diseases 0.000 description 1
- 210000001163 endosome Anatomy 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 208000016253 exhaustion Diseases 0.000 description 1
- 239000003172 expectorant agent Substances 0.000 description 1
- 230000003419 expectorant effect Effects 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 229960004396 famciclovir Drugs 0.000 description 1
- GGXKWVWZWMLJEH-UHFFFAOYSA-N famcyclovir Chemical compound N1=C(N)N=C2N(CCC(COC(=O)C)COC(C)=O)C=NC2=C1 GGXKWVWZWMLJEH-UHFFFAOYSA-N 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 231100000479 fetal death Toxicity 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 229960005102 foscarnet Drugs 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-L fumarate(2-) Chemical class [O-]C(=O)\C=C\C([O-])=O VZCYOOQTPOCHFL-OWOJBTEDSA-L 0.000 description 1
- 229960002963 ganciclovir Drugs 0.000 description 1
- IRSCQMHQWWYFCW-UHFFFAOYSA-N ganciclovir Chemical compound O=C1NC(N)=NC2=C1N=CN2COC(CO)CO IRSCQMHQWWYFCW-UHFFFAOYSA-N 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 230000007614 genetic variation Effects 0.000 description 1
- 230000035784 germination Effects 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 229960000789 guanidine hydrochloride Drugs 0.000 description 1
- PJJJBBJSCAKJQF-UHFFFAOYSA-N guanidinium chloride Chemical compound [Cl-].NC(N)=[NH2+] PJJJBBJSCAKJQF-UHFFFAOYSA-N 0.000 description 1
- 229940047650 haemophilus influenzae Drugs 0.000 description 1
- 238000003306 harvesting Methods 0.000 description 1
- 230000005802 health problem Effects 0.000 description 1
- 210000002216 heart Anatomy 0.000 description 1
- 208000019622 heart disease Diseases 0.000 description 1
- 208000021760 high fever Diseases 0.000 description 1
- 235000001050 hortel pimenta Nutrition 0.000 description 1
- 229960004716 idoxuridine Drugs 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 239000003701 inert diluent Substances 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 230000036512 infertility Effects 0.000 description 1
- 208000037801 influenza A (H1N1) Diseases 0.000 description 1
- 108700010900 influenza virus proteins Proteins 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 238000007917 intracranial administration Methods 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 201000006370 kidney failure Diseases 0.000 description 1
- 150000003893 lactate salts Chemical class 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 201000003453 lung abscess Diseases 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 206010025482 malaise Diseases 0.000 description 1
- 150000002688 maleic acid derivatives Chemical class 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 210000004379 membrane Anatomy 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 230000034217 membrane fusion Effects 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-M methanesulfonate group Chemical class CS(=O)(=O)[O-] AFVFQIVMOAPDHO-UHFFFAOYSA-M 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 239000012452 mother liquor Substances 0.000 description 1
- 230000000510 mucolytic effect Effects 0.000 description 1
- 208000029744 multiple organ dysfunction syndrome Diseases 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 208000013465 muscle pain Diseases 0.000 description 1
- 239000000133 nasal decongestant Substances 0.000 description 1
- 208000010753 nasal discharge Diseases 0.000 description 1
- 150000002823 nitrates Chemical class 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 239000007968 orange flavor Substances 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 239000012044 organic layer Substances 0.000 description 1
- 239000012074 organic phase Substances 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 208000035824 paresthesia Diseases 0.000 description 1
- 230000009054 pathological process Effects 0.000 description 1
- 230000000149 penetrating effect Effects 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 230000009984 peri-natal effect Effects 0.000 description 1
- 206010034674 peritonitis Diseases 0.000 description 1
- 239000008177 pharmaceutical agent Substances 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 150000002989 phenols Chemical class 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 239000000902 placebo Substances 0.000 description 1
- 229940068196 placebo Drugs 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 230000004481 post-translational protein modification Effects 0.000 description 1
- 229920001592 potato starch Polymers 0.000 description 1
- 229940116317 potato starch Drugs 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 1
- 208000005069 pulmonary fibrosis Diseases 0.000 description 1
- 230000010837 receptor-mediated endocytosis Effects 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 230000003362 replicative effect Effects 0.000 description 1
- 210000001533 respiratory mucosa Anatomy 0.000 description 1
- 210000002345 respiratory system Anatomy 0.000 description 1
- 206010039083 rhinitis Diseases 0.000 description 1
- 229960000329 ribavirin Drugs 0.000 description 1
- HZCAHMRRMINHDJ-DBRKOABJSA-N ribavirin Natural products O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1N=CN=C1 HZCAHMRRMINHDJ-DBRKOABJSA-N 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 229940081974 saccharin Drugs 0.000 description 1
- 235000019204 saccharin Nutrition 0.000 description 1
- 239000000901 saccharin and its Na,K and Ca salt Substances 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 230000001932 seasonal effect Effects 0.000 description 1
- 230000035807 sensation Effects 0.000 description 1
- 235000019615 sensations Nutrition 0.000 description 1
- 239000004208 shellac Substances 0.000 description 1
- ZLGIYFNHBLSMPS-ATJNOEHPSA-N shellac Chemical compound OCCCCCC(O)C(O)CCCCCCCC(O)=O.C1C23[C@H](C(O)=O)CCC2[C@](C)(CO)[C@@H]1C(C(O)=O)=C[C@@H]3O ZLGIYFNHBLSMPS-ATJNOEHPSA-N 0.000 description 1
- 229940113147 shellac Drugs 0.000 description 1
- 235000013874 shellac Nutrition 0.000 description 1
- 238000004904 shortening Methods 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 208000004048 staphylococcal pneumonia Diseases 0.000 description 1
- 229960001203 stavudine Drugs 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- 238000004347 surface barrier Methods 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 201000010740 swine influenza Diseases 0.000 description 1
- 150000003892 tartrate salts Chemical class 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 125000000341 threoninyl group Chemical group [H]OC([H])(C([H])([H])[H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 208000009174 transverse myelitis Diseases 0.000 description 1
- 229960003962 trifluridine Drugs 0.000 description 1
- VSQQQLOSPVPRAZ-RRKCRQDMSA-N trifluridine Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(C(F)(F)F)=C1 VSQQQLOSPVPRAZ-RRKCRQDMSA-N 0.000 description 1
- 238000002255 vaccination Methods 0.000 description 1
- 238000001291 vacuum drying Methods 0.000 description 1
- 229940093257 valacyclovir Drugs 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 229960003636 vidarabine Drugs 0.000 description 1
- 230000007501 viral attachment Effects 0.000 description 1
- 208000009421 viral pneumonia Diseases 0.000 description 1
- 230000006656 viral protein synthesis Effects 0.000 description 1
- 235000012431 wafers Nutrition 0.000 description 1
- 229960000523 zalcitabine Drugs 0.000 description 1
- 229960002555 zidovudine Drugs 0.000 description 1
- HBOMLICNUCNMMY-XLPZGREQSA-N zidovudine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](N=[N+]=[N-])C1 HBOMLICNUCNMMY-XLPZGREQSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/196—Carboxylic acids, e.g. valproic acid having an amino group the amino group being directly attached to a ring, e.g. anthranilic acid, mefenamic acid, diclofenac, chlorambucil
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/215—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/351—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom not condensed with another ring
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/415—1,2-Diazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7012—Compounds having a free or esterified carboxyl group attached, directly or through a carbon chain, to a carbon atom of the saccharide radical, e.g. glucuronic acid, neuraminic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/16—Antivirals for RNA viruses for influenza or rhinoviruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Virology (AREA)
- Molecular Biology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pulmonology (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Emergency Medicine (AREA)
- Physiology (AREA)
- Nutrition Science (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Description
●ノイラミニダーゼ阻害剤-オセルタミビル(oseltamivir)、ザナミビル(zanamivir)、及びペラミビル(peramivir)を含む。
●M2イオンチャネル阻害剤-アマンタジン(amantadine)及びリマンタジン(rimantadine)を含む。これらの薬物は、構造的に異なるM2チャネルのため、A型インフルエンザウイルスに対しては有効であるが、B型インフルエンザウイルスに対しては有効ではない。
以前は、N-カルバムイミドイル-5-(1-メチル-1H-ピラゾール-4-イル)-2-ナフトアミド(BIT225)は、A型インフルエンザのM2ビロポリンに対して限られた活性しか有しないことが示されており、インフルエンザを治療するのに適切であるとは考えられていなかった(Jalily et al., MolPharm, 2016. 90: 80-95)。しかし、本出願は、驚くべきことに、BIT225が、インフルエンザウイルスの複数の亜型及び株に対して活性を有することを示す。重要なことに、BIT225は、アマンタジン(amantadine)に耐性のある亜型及び株に対して活性を有することが見出されている。
本発明の説明及び特許請求の範囲において、以下の用語は、以下に記載される定義に従って使用されている。また、本明細書で使用される用語は、本発明の特定の実施形態を説明することのみを目的としており、限定することを意図するものではないことも理解されたい。他に定義されない限り、本明細書で使用される全ての技術用語及び科学用語は、本発明が関係する当業者によって一般に理解されるのと同じ意味を有する。
本明細書に詳述される特定の実施形態を参照して本発明を説明しているが、他の実施形態は同じ又は同様の結果を達成することができる。本発明のバリエーション及び変更は当業者には明らかであり、本発明は全てのそのような変更及び均等物に及ぶことが意図される。
250mLの丸底フラスコ中の5-ブロモ-2-ナフトエ酸(2.12g、8.44mmol)、1-メチル-4-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-1H-ピラゾール(1.84g、8.86mmol)、及びテトラキス(トリフェニルホスフィン)パラジウム(0)(502mg、0.435mmol)の混合物を、排気し、窒素でパージした(3回のサイクルにおいて)。アセトニトリル(40mL)及び2M炭酸ナトリウム水溶液(10mL)をシリンジにより混合物に添加し、混合物を還流下で窒素下で22時間加熱した。反応混合物を冷まし、その後、1M塩酸水溶液(30mL)を添加し、次いで、それを酢酸エチル(3×50mL)で抽出した。合わせた有機層を乾燥させ(MgSO4)、ろ過し、真空中で濃縮し、粗生成物(空気乾燥後2.98g)を得た。この粗材料を熱エタノール(150mL)に溶解し、熱いうちにろ過して、黄色不純物(120mg)を除去した。ろ液を真空中で濃縮し、残渣をジクロロメタン(30mL)から再結晶化し、5-(1-メチル-1H-ピラゾール-4-イル)-2-ナフトエ酸を白色固体(724mg、34%)として得た。2回目の収穫の5-(1-メチル-1H-ピラゾール-4-イル)-2-ナフトエ酸(527mg、25%)は、ジクロロメタン(20mL)からの再結晶化により濃縮母液から得られた。
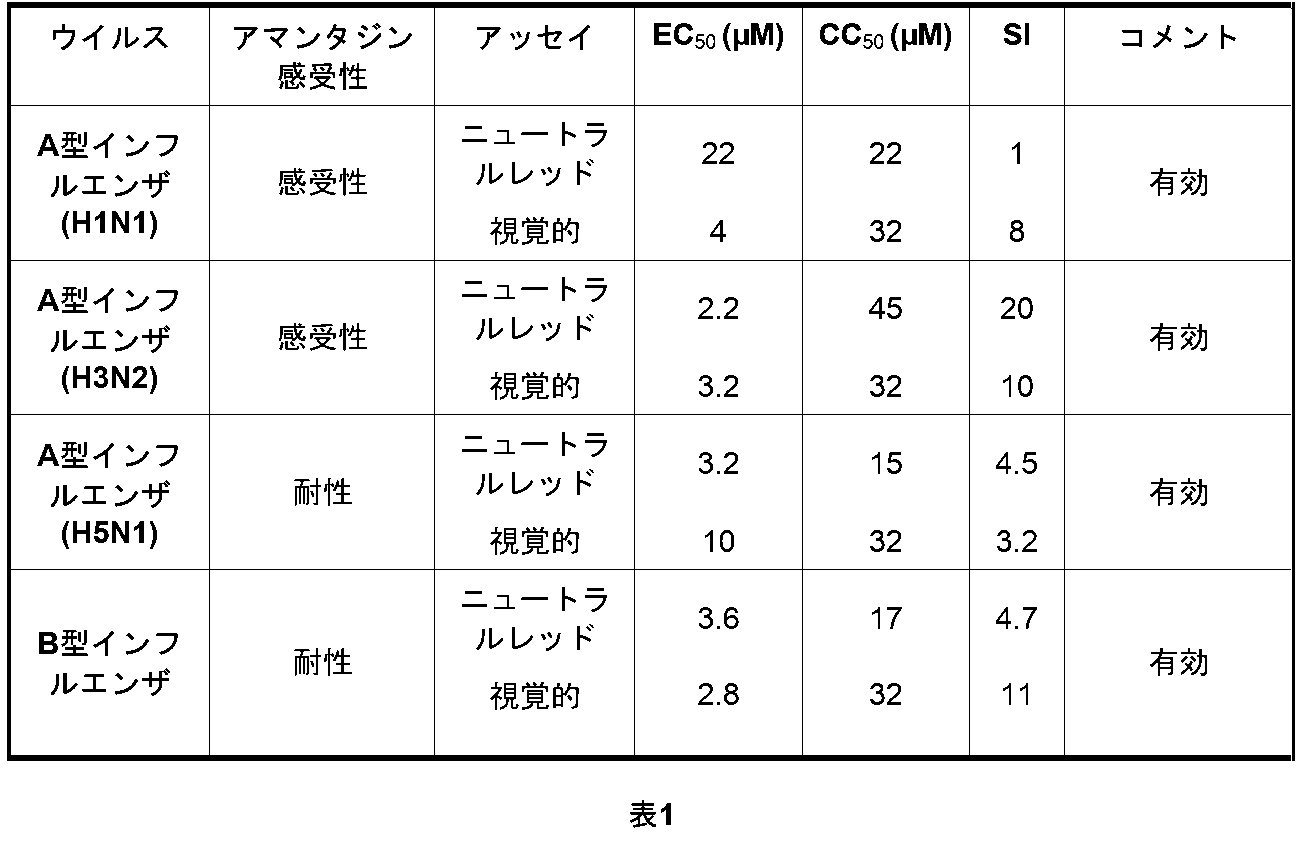
BIT225の活性は、次のウイルス株に対して測定した:
●A型インフルエンザ/ニューカレドニア(New Caledonia)/20/99(H1N1)。最新のワクチン(CDC)に使用される最近の臨床分離株;
●A型インフルエンザ/パナマ(Panama)/2007/99(H3N2)。最新のワクチン(CDC)に使用される最近の臨床分離株;
●B型インフルエンザ/香港(Hong Kong)/330/02。最新のワクチン(CDC)に使用される最近の臨床分離株;
●A型インフルエンザ/NWS/33(H1N1)。よく認識されている実験室株(KW. Cochran, Univ. Michigan)。
迅速スクリーニングアッセイ
標準的な細胞変性効果(CPE)アッセイは、適切な細胞の18時間単層(80~100%コンフルエント)を使用し、培地を除去し、各濃度の試験化合物又はプラセボを添加し、その後15分以内にウイルス又はウイルス希釈液を添加する。抗ウイルス試験及び細胞毒性試験の両方について、化合物の各濃度について2つのウェルを使用する。プレートを密封し、ほぼ最大のウイルスCPEを誘導するのに必要な標準時間インキュベートする。次いで、以下に説明する方法でプレートをニュートラルレッドで染色し、生細胞を示す取り込みの割合を405及び540nmの二重波長でマイクロプレートオートリーダーで読み取り、バックグラウンドを除去するために差を取る。おおよそのウイルス阻害濃度、50%エンドポイント(EC50)及び細胞阻害濃度、50%エンドポイント(CC50)を決定し、これらから一般的な選択性指数を計算する: SI=(CC50)/(EC50)。3以上のSIは、確認試験を誘発する。
このアッセイは、96ウェルの平底マイクロプレートで実行され、全ての新しい試験化合物の最初の抗ウイルス評価に使用される。このCPE阻害試験では、各試験化合物の4個のlog10希釈液(例えば、1000、100、10、1μg/mL)を、細胞単層を含有する3個のウェルに添加し、5分以内にウイルスを添加し、プレートを密封し、37℃でインキュベートする。CPEは、未処理の感染対照が3~4+のCPEを生じるとき(約72~120時間)に顕微鏡で読み取る。公知の陽性対照薬物を、各アッセイ実行で試験薬物と並行して評価する。最初のスクリーニング試験で有効であることが見出された化合物を使用したフォローアップ試験を、各化合物の8個の1/2log10希釈液を、1つの希釈液あたり細胞単層を含有する4個のウェルに使用することを除いて、同じ方法で実行する。
このアッセイは、最初の試験で観察されたCPE阻害を検証するために実行され、CPEが評価された後に同じ96ウェルマイクロプレートを利用する。ニュートラルレッドを培地に添加する; ウイルスによって損傷を受けていない細胞は、より大量の色素を取り込み、これをコンピュータ化されたマイクロプレートオートリーダーで読み取る。McManus(McManus, App Environ Microbiol, 1976. 31(1): 35-38)によって記載された方法を使用する。EC50を色素取り込みから決定する。
BIT225の抗A型インフルエンザウイルス活性を、メイディン・ダービー(Madin Darby)イヌ腎臓(MDCK)細胞におけるin vitro用量反応プラーク低減アッセイによって確認した。実験室株PR8をこれらの実験で使用し、アマンタジン(amantadine)耐性バリアントウイルスを、アラニンの代わりに30位の配列トレオニンをコードするようにM2遺伝子を変異させることによって作成した。[A30T]変異体ウイルスはPR8 4Cとして公知である。
それぞれA型インフルエンザM2又はHIV-1 Vpuのイオンチャネル配列を発現するキメラウイルスSHIV-1M2及びSHIV-1SCVpuのT細胞株(C8166)中での複製に対するBIT225の効果を調べるために、実験を行った。10μM BIT225で処理すると、ウイルスp27タンパク質によって測定される培養上清に放出されるウイルスが低減した(図2)。担体溶媒単独(DMSO)で処理した対照を比較のために示す。
(付記)
(付記1)
対象におけるインフルエンザウイルス感染の治療又は予防方法であって、対象に、有効量のN-カルバムイミドイル-5-(1-メチル-1H-ピラゾール-4-イル)-2-ナフトアミド又はその薬学的に許容される塩を投与するステップを含む、方法。
(付記2)
インフルエンザウイルスの複製が阻害される、付記1に記載の方法。
(付記3)
インフルエンザウイルス感染に関連する合併症又は症状の重症度、強度、又は期間が低減する、付記1又は付記2に記載の方法。
(付記4)
インフルエンザウイルスの力価が低減する、付記1~3のいずれか一つに記載の方法。
(付記5)
インフルエンザウイルスが、A型インフルエンザウイルス、B型インフルエンザウイルス、及びC型インフルエンザウイルスから選択される、付記1~4のいずれか一つに記載の方法。
(付記6)
インフルエンザウイルスが、A型インフルエンザウイルスである、付記1~5のいずれか一つに記載の方法。
(付記7)
A型インフルエンザウイルスが、H1N1、H1N2、H2N2、H3N2、H3N8、H5N1、H5N2、H5N3、H5N6、H5N8、H5N9、H7N1、H7N2、H7N3、H7N4、H7N7、H7N9、H9N2、及びH10N7亜型から選択される、付記6に記載の方法。
(付記8)
A型インフルエンザウイルスが、H1N1、H3N2及びH5N1亜型から選択される、付記6又は付記7に記載の方法。
(付記9)
インフルエンザウイルスが、B型インフルエンザウイルスである、付記1~5のいずれか一つに記載の方法。
(付記10)
N-カルバムイミドイル-5-(1-メチル-1H-ピラゾール-4-イル)-2-ナフトアミド又はその薬学的に許容される塩が、経口、経鼻、静脈内、腹腔内、吸入及び局所から選択される経路により投与される、付記1~9のいずれか一つに記載の方法。
(付記11)
N-カルバムイミドイル-5-(1-メチル-1H-ピラゾール-4-イル)-2-ナフトアミド又はその薬学的に許容される塩が、経口的に投与される、付記1~10のいずれか一つに記載の方法。
(付記12)
N-カルバムイミドイル-5-(1-メチル-1H-ピラゾール-4-イル)-2-ナフトアミド又はその薬学的に許容される塩が、約100mg~約600mgの投与量で投与される、付記1~11のいずれか一つに記載の方法。
(付記13)
N-カルバムイミドイル-5-(1-メチル-1H-ピラゾール-4-イル)-2-ナフトアミド又はその薬学的に許容される塩が、経口的に、1日1回、約100mg~約200mgの投与量で投与される、付記1~12のいずれか一つに記載の方法。
(付記14)
N-カルバムイミドイル-5-(1-メチル-1H-ピラゾール-4-イル)-2-ナフトアミド又はその薬学的に許容される塩が、経口的に、1日2回、約100mg~約200mgの投与量で投与される、付記1~12のいずれか一つに記載の方法。
(付記15)
N-カルバムイミドイル-5-(1-メチル-1H-ピラゾール-4-イル)-2-ナフトアミド又はその薬学的に許容される塩が、好ましくはザナミビル、オセルタミビル及びペラミビルから選択される、1つ以上の追加の抗ウイルス剤と組み合わせて投与される、付記1~14のいずれか一つに記載の方法。
(付記16)
インフルエンザウイルス感染の治療又は予防のための医薬の製造のための、N-カルバムイミドイル-5-(1-メチル-1H-ピラゾール-4-イル)-2-ナフトアミド又はその薬学的に許容される塩の使用。
(付記17)
インフルエンザウイルスの複製が阻害される、付記16に記載の使用。
(付記18)
インフルエンザウイルス感染に関連する合併症又は症状の重症度、強度、又は期間が低減する、付記16又は付記17に記載の使用。
(付記19)
インフルエンザウイルスの力価が低減する、付記16~18のいずれか一つに記載の使用。
Claims (20)
- 対象におけるインフルエンザウイルス感染の治療又は予防のための医薬組成物であって、有効量のN-カルバムイミドイル-5-(1-メチル-1H-ピラゾール-4-イル)-2-ナフトアミド又はその薬学的に許容される塩を含む、医薬組成物。
- インフルエンザウイルスの複製を阻害する、請求項1に記載の医薬組成物。
- インフルエンザウイルス感染に関連する合併症又は症状の重症度、強度、又は期間を低減させる、請求項1又は請求項2に記載の医薬組成物。
- インフルエンザウイルスの力価を低減する、請求項1~3のいずれか一項に記載の医薬組成物。
- インフルエンザウイルスが、A型インフルエンザウイルス、B型インフルエンザウイルス、及びC型インフルエンザウイルスから選択される、請求項1~4のいずれか一項に記載の医薬組成物。
- インフルエンザウイルスが、A型インフルエンザウイルスである、請求項1~5のいずれか一項に記載の医薬組成物。
- A型インフルエンザウイルスが、H1N1、H1N2、H2N2、H3N2、H3N8、H5N1、H5N2、H5N3、H5N6、H5N8、H5N9、H7N1、H7N2、H7N3、H7N4、H7N7、H7N9、H9N2、及びH10N7亜型から選択される、請求項6に記載の医薬組成物。
- A型インフルエンザウイルスが、H1N1、H3N2及びH5N1亜型から選択される、請求項6又は請求項7に記載の医薬組成物。
- インフルエンザウイルスが、B型インフルエンザウイルスである、請求項1~5のいずれか一項に記載の医薬組成物。
- N-カルバムイミドイル-5-(1-メチル-1H-ピラゾール-4-イル)-2-ナフトアミド又はその薬学的に許容される塩が、経口、経鼻、静脈内、腹腔内、吸入及び局所から選択される経路により投与される、請求項1~9のいずれか一項に記載の医薬組成物。
- N-カルバムイミドイル-5-(1-メチル-1H-ピラゾール-4-イル)-2-ナフトアミド又はその薬学的に許容される塩が、経口的に投与される、請求項1~10のいずれか一項に記載の医薬組成物。
- N-カルバムイミドイル-5-(1-メチル-1H-ピラゾール-4-イル)-2-ナフトアミド又はその薬学的に許容される塩が、約100mg~約600mgの投与量で投与される、請求項1~11のいずれか一項に記載の医薬組成物。
- N-カルバムイミドイル-5-(1-メチル-1H-ピラゾール-4-イル)-2-ナフトアミド又はその薬学的に許容される塩が、経口的に、1日1回、約100mg~約200mgの投与量で投与される、請求項1~12のいずれか一項に記載の医薬組成物。
- N-カルバムイミドイル-5-(1-メチル-1H-ピラゾール-4-イル)-2-ナフトアミド又はその薬学的に許容される塩が、経口的に、1日2回、約100mg~約200mgの投与量で投与される、請求項1~12のいずれか一項に記載の医薬組成物。
- N-カルバムイミドイル-5-(1-メチル-1H-ピラゾール-4-イル)-2-ナフトアミド又はその薬学的に許容される塩が、1つ以上の追加の抗ウイルス剤と組み合わせて投与される、請求項1~14のいずれか一項に記載の医薬組成物。
- 1つ以上の追加の抗ウイルス剤が、ザナミビル、オセルタミビル及びペラミビルから選択される、請求項15に記載の医薬組成物。
- インフルエンザウイルス感染の治療又は予防のための医薬の製造のための、N-カルバムイミドイル-5-(1-メチル-1H-ピラゾール-4-イル)-2-ナフトアミド又はその薬学的に許容される塩の使用。
- インフルエンザウイルスの複製が阻害される、請求項17に記載の使用。
- インフルエンザウイルス感染に関連する合併症又は症状の重症度、強度、又は期間が低減する、請求項17又は請求項18に記載の使用。
- インフルエンザウイルスの力価が低減する、請求項17~19のいずれか一項に記載の使用。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| AU2017900385A AU2017900385A0 (en) | 2017-02-08 | Methods of treating influenza | |
| AU2017900385 | 2017-02-08 | ||
| PCT/AU2018/050085 WO2018145148A1 (en) | 2017-02-08 | 2018-02-07 | Methods of treating influenza |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2020506243A JP2020506243A (ja) | 2020-02-27 |
| JP2020506243A5 JP2020506243A5 (ja) | 2021-03-11 |
| JP7019727B2 true JP7019727B2 (ja) | 2022-02-15 |
Family
ID=63106827
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019563650A Active JP7019727B2 (ja) | 2017-02-08 | 2018-02-07 | インフルエンザの治療方法 |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US10918623B2 (ja) |
| EP (1) | EP3579833B1 (ja) |
| JP (1) | JP7019727B2 (ja) |
| KR (1) | KR102607599B1 (ja) |
| CN (1) | CN110325187B (ja) |
| AU (1) | AU2018218179B2 (ja) |
| BR (1) | BR112019016316A2 (ja) |
| CA (1) | CA3052503A1 (ja) |
| ES (1) | ES2910136T3 (ja) |
| MX (1) | MX387115B (ja) |
| RU (1) | RU2769317C2 (ja) |
| SG (1) | SG11201907034PA (ja) |
| WO (1) | WO2018145148A1 (ja) |
Families Citing this family (30)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20120027752A1 (en) | 2010-07-22 | 2012-02-02 | Gilead Sciences, Inc. | Methods and compounds for treating paramyxoviridae virus infections |
| TWI767201B (zh) | 2014-10-29 | 2022-06-11 | 美商基利科學股份有限公司 | 絲狀病毒科病毒感染之治療 |
| HRP20220355T1 (hr) | 2015-09-16 | 2022-05-13 | Gilead Sciences, Inc. | Postupci za liječenje infekcija coronaviridae |
| TW201836615A (zh) | 2017-03-14 | 2018-10-16 | 美商基利科學股份有限公司 | 治療貓冠狀病毒感染之方法 |
| CA3059777C (en) | 2017-05-01 | 2023-02-21 | Gilead Sciences, Inc. | Crystalline forms of (s)-2-ethylbutyl 2-(((s)-(((2r,3s,4r,5r)-5-(4-aminopyrrolo[2,1-f] [1,2,4]triazin-7-yl)-5-cyano-3,4-dihydroxytetrahydrofuran-2-yl)methoxy)(phenoxy) phosphoryl)amino)propanoate |
| WO2019014247A1 (en) | 2017-07-11 | 2019-01-17 | Gilead Sciences, Inc. | COMPOSITIONS COMPRISING POLYMERASE RNA INHIBITOR AND CYCLODEXTRIN FOR THE TREATMENT OF VIRAL INFECTIONS |
| CN118766947A (zh) | 2020-01-27 | 2024-10-15 | 吉利德科学公司 | 用于治疗SARS CoV-2感染的方法 |
| TWI785528B (zh) | 2020-03-12 | 2022-12-01 | 美商基利科學股份有限公司 | 1’-氰基核苷之製備方法 |
| KR20220164784A (ko) | 2020-04-06 | 2022-12-13 | 길리애드 사이언시즈, 인코포레이티드 | 1'-시아노 치환된 카르바뉴클레오시드 유사체의 흡입 제형 |
| AU2021281351A1 (en) | 2020-05-29 | 2023-01-19 | Gilead Sciences, Inc. | Remdesivir treatment methods |
| PH12022553530A1 (en) | 2020-06-24 | 2024-06-24 | Gilead Sciences Inc | 1'-cyano nucleoside analogs and uses thereof |
| PL4200301T3 (pl) | 2020-08-24 | 2025-06-09 | Gilead Sciences, Inc. | Związki fosfolipidowe i ich zastosowania |
| ES2985995T3 (es) | 2020-08-27 | 2024-11-08 | Gilead Sciences Inc | Compuestos y métodos para el tratamiento de infecciones víricas |
| TWI811812B (zh) | 2020-10-16 | 2023-08-11 | 美商基利科學股份有限公司 | 磷脂化合物及其用途 |
| EP4346772A1 (en) | 2021-05-26 | 2024-04-10 | Gilead Sciences, Inc. | Phospholipid formulations of 1'-cyano substituted carba-nucleoside analogs |
| CA3228162A1 (en) | 2021-08-18 | 2023-02-23 | Gilead Sciences, Inc. | Phospholipid compounds and methods of making and using the same |
| EP4436576A4 (en) * | 2021-11-24 | 2025-09-17 | Biotron Ltd | METHODS FOR TREATING SARS-CoV-2 INFECTION |
| US20230295172A1 (en) | 2022-03-02 | 2023-09-21 | Gilead Sciences, Inc. | Compounds and methods for treatment of viral infections |
| CA3243944A1 (en) | 2022-03-02 | 2023-09-07 | Gilead Sciences, Inc. | COMPOUNDS AND METHODS OF TREATMENT FOR VIRAL INFECTIONS |
| CR20240365A (es) | 2022-03-03 | 2024-10-04 | Gilead Sciences Inc | Compuestos antivirales y métodos de elaboración y uso de los mismos |
| CR20240367A (es) | 2022-03-03 | 2024-09-30 | Gilead Sciences Inc | Compuestos antivirales y métodos de elaboración y uso de los mismos. |
| AU2023283718A1 (en) | 2022-06-06 | 2024-12-12 | Gilead Sciences, Inc. | Methods for treatment of viral infections including sars-cov-2 |
| EP4547334A1 (en) | 2022-06-29 | 2025-05-07 | Gilead Sciences, Inc. | Solid forms of a nucleoside analogue and uses thereof |
| EP4547665A1 (en) | 2022-06-30 | 2025-05-07 | Gilead Sciences, Inc. | Solid forms of a nucleoside analogue and uses thereof |
| EP4665737A1 (en) | 2023-02-16 | 2025-12-24 | Gilead Sciences, Inc. | Phospholipid compounds and methods of making and using the same |
| US20250084088A1 (en) | 2023-08-31 | 2025-03-13 | Gilead Sciences, Inc. | Antiviral compounds and methods of making and using the same |
| US20250090537A1 (en) | 2023-08-31 | 2025-03-20 | Gilead Sciences, Inc. | Antiviral compounds and methods of making and using the same |
| US20250099476A1 (en) | 2023-09-06 | 2025-03-27 | Gilead Sciences, Inc. | Solid forms of a nucleoside analogue and uses thereof |
| US20250109157A1 (en) | 2023-09-28 | 2025-04-03 | Gilead Sciences, Inc. | Compounds and methods for treatment of viral infections |
| US12357577B1 (en) | 2024-02-02 | 2025-07-15 | Gilead Sciences, Inc. | Pharmaceutical formulations and uses thereof |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008543886A (ja) | 2005-06-24 | 2008-12-04 | バイオトロン リミテッド | 抗ウイルス化合物および方法 |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101827589B (zh) * | 2007-08-03 | 2016-08-17 | 拜伊特朗有限公司 | 抗丙型肝炎病毒的组合物及方法 |
| KR101369584B1 (ko) * | 2011-04-19 | 2014-03-06 | 일양약품주식회사 | 페닐-이속사졸 유도체 및 그의 제조방법 |
| BR112017000285A2 (pt) * | 2014-07-07 | 2017-10-31 | Prophylaxis LLC | métodos de tratamento da profilaxia viral e kits de profilaxia de pré-exposição |
| CN110870864B (zh) * | 2018-08-29 | 2021-09-24 | 复旦大学 | 马来酸卡比沙明在制备抗流感病毒药物中的应用 |
-
2018
- 2018-02-07 EP EP18751710.7A patent/EP3579833B1/en active Active
- 2018-02-07 JP JP2019563650A patent/JP7019727B2/ja active Active
- 2018-02-07 BR BR112019016316-6A patent/BR112019016316A2/pt not_active Application Discontinuation
- 2018-02-07 SG SG11201907034PA patent/SG11201907034PA/en unknown
- 2018-02-07 KR KR1020197024919A patent/KR102607599B1/ko active Active
- 2018-02-07 WO PCT/AU2018/050085 patent/WO2018145148A1/en not_active Ceased
- 2018-02-07 MX MX2019009443A patent/MX387115B/es unknown
- 2018-02-07 RU RU2019126746A patent/RU2769317C2/ru active
- 2018-02-07 US US16/483,958 patent/US10918623B2/en active Active
- 2018-02-07 AU AU2018218179A patent/AU2018218179B2/en active Active
- 2018-02-07 CA CA3052503A patent/CA3052503A1/en active Pending
- 2018-02-07 ES ES18751710T patent/ES2910136T3/es active Active
- 2018-02-07 CN CN201880010492.9A patent/CN110325187B/zh active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008543886A (ja) | 2005-06-24 | 2008-12-04 | バイオトロン リミテッド | 抗ウイルス化合物および方法 |
Non-Patent Citations (4)
| Title |
|---|
| A. D. Balgi et al.,Inhibitors of the Influenza A Virus M2 Proton Channel Discovered Using a High-Throughput Yeast Growth Restoration Assay,PLOS One,2013年02月01日,8 (2),e55271 |
| J. L. Nieva et al.,Viroporins: structure and biological functions,Nature Reviews Microbiology,2012年08月,10,563-574 |
| J. Wilkinson et al.,A Phase 1b/2a study of the safety, pharmacokinetics and antiviral activity of BIT225 in patients with HIV-1 infection,J. of Antimicrobial Chemotherapy,2016年,71,731-738 |
| P. H. Jalily et al.,Mechanisms of Action of Novel Influenza A/M2 Viroporin Inhibitors Derived from Hexamethylene Amiloride,Molecular Pharmacology,2016年08月,90 (2),80-95 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2020506243A (ja) | 2020-02-27 |
| WO2018145148A1 (en) | 2018-08-16 |
| EP3579833B1 (en) | 2022-01-05 |
| NZ755900A (en) | 2025-03-28 |
| CA3052503A1 (en) | 2018-08-16 |
| KR20190112051A (ko) | 2019-10-02 |
| AU2018218179B2 (en) | 2023-05-04 |
| EP3579833A1 (en) | 2019-12-18 |
| US20200093796A1 (en) | 2020-03-26 |
| KR102607599B1 (ko) | 2023-11-28 |
| SG11201907034PA (en) | 2019-08-27 |
| CN110325187B (zh) | 2022-09-30 |
| AU2018218179A1 (en) | 2019-08-22 |
| US10918623B2 (en) | 2021-02-16 |
| MX2019009443A (es) | 2019-12-16 |
| ES2910136T3 (es) | 2022-05-11 |
| CN110325187A (zh) | 2019-10-11 |
| RU2769317C2 (ru) | 2022-03-30 |
| BR112019016316A2 (pt) | 2020-03-31 |
| RU2019126746A (ru) | 2021-03-09 |
| MX387115B (es) | 2025-03-19 |
| EP3579833A4 (en) | 2021-01-13 |
| RU2019126746A3 (ja) | 2021-05-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7019727B2 (ja) | インフルエンザの治療方法 | |
| WO2020241759A1 (ja) | インフルエンザウイルス感染症またはコロナウイルス感染症の予防および/または治療剤 | |
| US11433080B2 (en) | Antiviral treatment | |
| US10221152B2 (en) | Usage of mycophenolate mofetil or salt thereof in preparing drug for resisting against influenza virus | |
| CA2465062C (en) | Preventive and/or therapeutic agent for viral infection | |
| CN118574614A (zh) | 治疗sars-cov-2感染的方法 | |
| CN110870864A (zh) | 马来酸卡比沙明在制备抗流感病毒药物中的应用 | |
| HK40017310B (en) | Methods of treating influenza | |
| HK40017310A (en) | Methods of treating influenza | |
| CN114377009A (zh) | Sb216763在制备抗流感病毒药物中的应用 | |
| CN102526086A (zh) | 女贞苷的提取方法及其制备药物用途 | |
| WO2019089734A1 (en) | Methods and compositions for the treatment of influenza | |
| TWI530284B (zh) | 馬替麥考酚酯或其鹽類用於製備抗流感病毒之藥物的用途 | |
| US20230225988A1 (en) | Antiviral use of calixarenes | |
| CN115414370A (zh) | 牛磺胆酸钠在制备治疗或预防流感病毒感染的药物中的应用 | |
| HK40087524A (zh) | 氮卓斯汀用作抗病毒治疗 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210201 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20210201 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20211117 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20220104 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20220202 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7019727 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |