JP6325544B2 - 原核細胞のペリプラズムにおけるポリペプチドの産生のための方法 - Google Patents
原核細胞のペリプラズムにおけるポリペプチドの産生のための方法 Download PDFInfo
- Publication number
- JP6325544B2 JP6325544B2 JP2015531568A JP2015531568A JP6325544B2 JP 6325544 B2 JP6325544 B2 JP 6325544B2 JP 2015531568 A JP2015531568 A JP 2015531568A JP 2015531568 A JP2015531568 A JP 2015531568A JP 6325544 B2 JP6325544 B2 JP 6325544B2
- Authority
- JP
- Japan
- Prior art keywords
- tris
- polypeptide
- cells
- cell
- reported
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K1/00—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length
- C07K1/14—Extraction; Separation; Purification
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K1/00—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length
- C07K1/14—Extraction; Separation; Purification
- C07K1/145—Extraction; Separation; Purification by extraction or solubilisation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/195—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria
- C07K14/21—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria from Pseudomonadaceae (F)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P21/00—Preparation of peptides or proteins
- C12P21/02—Preparation of peptides or proteins having a known sequence of two or more amino acids, e.g. glutathione
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/52—Cytokines; Lymphokines; Interferons
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P21/00—Preparation of peptides or proteins
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- General Health & Medical Sciences (AREA)
- Zoology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Biophysics (AREA)
- Medicinal Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- Microbiology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biotechnology (AREA)
- Analytical Chemistry (AREA)
- Gastroenterology & Hepatology (AREA)
- Toxicology (AREA)
- Peptides Or Proteins (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Description
組換えにより産生されたポリペプチドは、適切なシグナル配列を有する場合、大腸菌(E.coli)細胞のペリプラズム空間中へ分泌され得る(Joly, J.C. and Laird, M.W., The Periplasm ed. Ehrmann, M., ASM Press, Washington D.C., (2007) 345-360(非特許文献1))。化学的酸化環境においては、ジスルフィド結合の形成、およびそれによるポリペプチドの機能的に正確なフォールディングが起きやすい。これらのポリペプチドをペリプラズム空間から選択的に単離することが、大腸菌由来の宿主細胞タンパク質(HCP)の混入を回避するために望ましい。それにより、ポリペプチドのその後の精製が容易になる。
[本発明1001]
(再懸濁した)原核細胞を、約10mM〜約95mMのTris-HClと約2mM〜約6mMのEDTAとを含む約7〜約10のpH値の溶液中で、約15分間〜約6時間、約25℃でインキュベーションする段階を含む、ポリペプチドを産生するための方法であって、該溶液がペプチドグリカン加水分解酵素および糖を実質的に含んでいない、方法。
[本発明1002]
pH値が約8であることを特徴とする、前記本発明のいずれかの方法。
[本発明1003]
インキュベーション時間が約30分間であることを特徴とする、前記本発明のいずれかの方法。
[本発明1004]
Tris-HClの濃度が約20mMであることを特徴とする、前記本発明のいずれかの方法。
[本発明1005]
原核細胞がグラム陰性細胞であることを特徴とする、前記本発明のいずれかの方法。
[本発明1006]
原核細胞が大腸菌(E.coli)細胞であることを特徴とする、前記本発明のいずれかの方法。
[本発明1007]
原核細胞からペリプラズムポリペプチドを単離するための、前記本発明のいずれかの方法の使用。
定義
「ペリプラズム空間」または「ペリプラズム」という用語は、2つの選択的透過性バリア、例えば生体膜によって境界をつけられた空間を意味する。1つの態様において、ペリプラズムは、グラム陰性細菌において内膜(すなわち細胞質膜)と外膜との間に位置する。
本明細書において報告される1つの局面は、原核細胞を、約10mM〜約95mMの緩衝剤と約0.5mM〜約9.5mMのキレート剤とを含む約7〜約10のpH値の溶液中で、約15分間〜約6時間インキュベーションする段階を含む、ポリペプチドを産生するための方法である。
‐収集した細胞を20mM Tris-HCl緩衝液(pH 8)中に再懸濁する
‐20mM Tris-HCl-4mM EDTA緩衝液(pH 8)の1:1比での添加
‐30分間、25℃での振盪を伴うインキュベーション
‐ペリプラズム空間のタンパク質を含有する上清からの細胞の分離
組換えにより産生されたタンパク質の量の測定
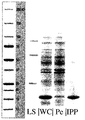
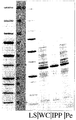
本実施例は、様々な方法を用いて大腸菌のペリプラズム空間から単離可能な、組換えにより産生された関心対象のタンパク質の量を測定するために行った。
いかなる前処置も無く細胞を崩壊させることにより得られた関心対象のタンパク質の100%に対応する、細胞全体の溶解物。
すべての方法を、3 OD値に対応する培養試料(3/OD = ml)中に含まれる細胞を採取して行った。細胞は、遠心分離により取得した。
細胞にPBS 150μlを添加し、その後SDS試料調製用緩衝液150μlを添加した。振盪しながら10分間95℃に加熱した後、5μlをSDSゲルにアプライした。
ペレットにした細胞を、EDTAを含むまたは含まない氷冷TRIS緩衝液150μlを用いて再懸濁した。
低分子量輸送タンパク質(α-シヌクレイン)の大規模生産
低分子量輸送タンパク質(α-シヌクレイン)をコードする核酸を含む大腸菌細胞を、10Lの発酵槽で培養した。培養の終わりに、578nmで測定した78のOD値を有する9.52Lを収集した。これは、細胞湿重量817gに対応する。
シュードモナス外毒素(Nlys-PE25-LR8M)の大規模生産
シュードモナス外毒素(Nlys-PE25-LR8M)をコードする核酸を含む大腸菌細胞を、実施例2に従って培養し、収集した。
Claims (5)
- 大腸菌(E.coli)細胞を、10mM〜95mMのTrisと2mM〜6mMのEDTAとを含む7〜10のpH値の溶液中で、15分間〜6時間、20℃〜33℃でインキュベーションする段階を含む、ポリペプチドを産生するための方法であって、該溶液がペプチドグリカン加水分解酵素および糖を実質的に含んでいない、方法。
- pH値が8であることを特徴とする、請求項1に記載の方法。
- インキュベーション時間が30分間であることを特徴とする、請求項1または2に記載の方法。
- Trisの濃度が20mMであることを特徴とする、請求項1〜3のいずれか一項に記載の方法。
- 大腸菌細胞からペリプラズムポリペプチドを単離するための、請求項1〜4のいずれか一項に記載の方法の使用。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP12184738.8 | 2012-09-17 | ||
| EP12184738 | 2012-09-17 | ||
| PCT/EP2013/068993 WO2014041116A1 (en) | 2012-09-17 | 2013-09-13 | Method for the production of polypeptides in the periplasm of prokaryotic cells |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2015528477A JP2015528477A (ja) | 2015-09-28 |
| JP6325544B2 true JP6325544B2 (ja) | 2018-05-16 |
Family
ID=47115284
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015531568A Expired - Fee Related JP6325544B2 (ja) | 2012-09-17 | 2013-09-13 | 原核細胞のペリプラズムにおけるポリペプチドの産生のための方法 |
Country Status (14)
| Country | Link |
|---|---|
| US (1) | US9926582B2 (ja) |
| EP (1) | EP2895497B1 (ja) |
| JP (1) | JP6325544B2 (ja) |
| KR (1) | KR20150056552A (ja) |
| CN (1) | CN104619716B (ja) |
| AU (1) | AU2013314264B2 (ja) |
| BR (1) | BR112015004415A2 (ja) |
| CA (1) | CA2880469A1 (ja) |
| IL (1) | IL237100A0 (ja) |
| MX (1) | MX2015003028A (ja) |
| RU (1) | RU2644652C2 (ja) |
| SG (1) | SG11201501191XA (ja) |
| WO (1) | WO2014041116A1 (ja) |
| ZA (1) | ZA201500792B (ja) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11667944B2 (en) * | 2017-09-05 | 2023-06-06 | Scarab Genomics, Llc | Methods and compositions for improved expression of recombinant proteins |
| WO2022191223A1 (ja) * | 2021-03-10 | 2022-09-15 | 株式会社カネカ | 原核生物細胞から標的タンパク質を抽出する方法 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH07184680A (ja) * | 1993-12-28 | 1995-07-25 | Mitsui Toatsu Chem Inc | ペリプラズムタンパク質の回収法 |
| JP4885359B2 (ja) | 1999-02-16 | 2012-02-29 | セネスコ,インコーポレイティド | 植物リパーゼをコードするdna、トランスジェニック植物及び植物の老化を制御する方法 |
| CN1137139C (zh) * | 2000-03-03 | 2004-02-04 | 上海复旦张江生物医药股份有限公司 | 重组淋巴毒素衍生物的生产工艺 |
| AU2002239576B2 (en) | 2000-12-14 | 2007-03-29 | Genentech, Inc. | Bacterial host strains |
| AU2003205623A1 (en) * | 2002-01-18 | 2003-07-30 | Cytos Biotechnology Ag | Prion protein carrier-conjugates |
| SI1656455T1 (sl) * | 2003-08-13 | 2012-12-31 | Sandoz Ag | Postopek za čiščenje rekombinantnih polipeptidov |
| GB201001791D0 (en) * | 2010-02-03 | 2010-03-24 | Ucb Pharma Sa | Process for obtaining antibodies |
| RU2488635C1 (ru) | 2012-03-22 | 2013-07-27 | Государственное бюджетное образовательное учреждение высшего профессионального образования Первый Московский государственный медицинский университет им. И.М. Сеченова Министерства здравоохранения и социального развития Российской Федерации (ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздравсоцразвития | Способ получения рекомбинантного антиангиогенного полипептида |
-
2013
- 2013-09-13 KR KR1020157006657A patent/KR20150056552A/ko not_active Withdrawn
- 2013-09-13 CN CN201380047706.7A patent/CN104619716B/zh active Active
- 2013-09-13 JP JP2015531568A patent/JP6325544B2/ja not_active Expired - Fee Related
- 2013-09-13 EP EP13763039.8A patent/EP2895497B1/en active Active
- 2013-09-13 SG SG11201501191XA patent/SG11201501191XA/en unknown
- 2013-09-13 RU RU2015114092A patent/RU2644652C2/ru not_active IP Right Cessation
- 2013-09-13 CA CA2880469A patent/CA2880469A1/en not_active Abandoned
- 2013-09-13 WO PCT/EP2013/068993 patent/WO2014041116A1/en not_active Ceased
- 2013-09-13 AU AU2013314264A patent/AU2013314264B2/en not_active Ceased
- 2013-09-13 BR BR112015004415A patent/BR112015004415A2/pt not_active IP Right Cessation
- 2013-09-13 MX MX2015003028A patent/MX2015003028A/es unknown
-
2015
- 2015-02-03 ZA ZA2015/00792A patent/ZA201500792B/en unknown
- 2015-02-05 IL IL237100A patent/IL237100A0/en unknown
- 2015-03-16 US US14/659,232 patent/US9926582B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| US9926582B2 (en) | 2018-03-27 |
| AU2013314264A1 (en) | 2015-02-19 |
| RU2015114092A (ru) | 2016-11-10 |
| BR112015004415A2 (pt) | 2017-07-04 |
| KR20150056552A (ko) | 2015-05-26 |
| IL237100A0 (en) | 2015-03-31 |
| CN104619716A (zh) | 2015-05-13 |
| WO2014041116A1 (en) | 2014-03-20 |
| HK1210193A1 (en) | 2016-04-15 |
| EP2895497B1 (en) | 2017-11-22 |
| AU2013314264B2 (en) | 2017-08-31 |
| CN104619716B (zh) | 2018-05-11 |
| JP2015528477A (ja) | 2015-09-28 |
| EP2895497A1 (en) | 2015-07-22 |
| SG11201501191XA (en) | 2015-04-29 |
| CA2880469A1 (en) | 2014-03-20 |
| RU2644652C2 (ru) | 2018-02-13 |
| MX2015003028A (es) | 2015-06-10 |
| US20150275260A1 (en) | 2015-10-01 |
| ZA201500792B (en) | 2016-01-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2834967T3 (es) | Purificación de proteínas | |
| JP6682734B2 (ja) | 生体試料を保存するための安定化剤 | |
| JP4011115B2 (ja) | 新規な融合蛋白回収および精製方法 | |
| CN107108692B (zh) | 蛋白质制造 | |
| US20120157659A1 (en) | Affinity peptides and method for purification of recombinant proteins | |
| JP5168604B2 (ja) | タンパク質のリフォールディング方法 | |
| JP6325544B2 (ja) | 原核細胞のペリプラズムにおけるポリペプチドの産生のための方法 | |
| US20150044718A1 (en) | On-column enzymatic cleavage | |
| KR102537099B1 (ko) | 단백질 제조 방법 | |
| JP3346563B2 (ja) | 組換え蛋白類を精製する改良方法および該方法で有用な化合物類 | |
| CN1181093C (zh) | 膜内在蛋白质的抽提 | |
| HK1210193B (en) | Method for the production of polypeptides in the periplasm of prokaryotic cells | |
| CN113896798B (zh) | 拉沙洛菌素和盐霉素单链抗体和双特异性单链抗体及其应用 | |
| CN103864916B (zh) | 人胸腺肽β4三倍体蛋白、编码基因及其分离纯化方法 | |
| Humbert | Cloning, expression, and purification of recombinant Neisseria gonorrhoeae proteins | |
| WO2023285762A1 (fr) | Méthode de purification de glycoprotéines | |
| TW201900257A (zh) | 使用親和力層析術純化抗體或其抗體片段的方法 | |
| JP6702984B2 (ja) | タンパク質の単離 | |
| WO2024064112A2 (en) | Affinity capturing and directly determining structures of proteins and other materials on superparamagnetic beads by cryo-electron microscopy single-particle analysis | |
| HK1240956B (zh) | 蛋白质制造 | |
| CN121358855A (zh) | 高表达和高活性的新型n-糖苷酶、其生产方法和应用 | |
| CN114184780A (zh) | 免疫磁珠净化-酶联免疫试验检测莱克多巴胺的方法及其单链抗体 | |
| HK1241388B (zh) | 蛋白质制造方法 | |
| JP2010116357A (ja) | 甘味誘導物質ミラクリンの精製方法 | |
| HK1240956A1 (en) | Protein manufacture |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20160912 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20170721 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170731 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20171027 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180118 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20180328 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20180412 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6325544 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |