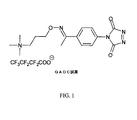
JP6324321B2 - 標識化学およびlc−msmsを使用するエストラジオールおよびフェノール性ohを有する分析物の分析 - Google Patents
標識化学およびlc−msmsを使用するエストラジオールおよびフェノール性ohを有する分析物の分析 Download PDFInfo
- Publication number
- JP6324321B2 JP6324321B2 JP2014552706A JP2014552706A JP6324321B2 JP 6324321 B2 JP6324321 B2 JP 6324321B2 JP 2014552706 A JP2014552706 A JP 2014552706A JP 2014552706 A JP2014552706 A JP 2014552706A JP 6324321 B2 JP6324321 B2 JP 6324321B2
- Authority
- JP
- Japan
- Prior art keywords
- phenolic
- analyte
- qaoc
- sample
- adduct
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 0 *N(*)C(N(*)*)=O Chemical compound *N(*)C(N(*)*)=O 0.000 description 13
- UZEKTDVGUQCDBI-UHFFFAOYSA-N CC(C)N=C(N)N Chemical compound CC(C)N=C(N)N UZEKTDVGUQCDBI-UHFFFAOYSA-N 0.000 description 1
- LOBSVGRXQAHJDT-UHFFFAOYSA-N CC(CN1CCOCC1)=O Chemical compound CC(CN1CCOCC1)=O LOBSVGRXQAHJDT-UHFFFAOYSA-N 0.000 description 1
- GNKZMNRKLCTJAY-UHFFFAOYSA-N CC(c1ccc(C)cc1)=O Chemical compound CC(c1ccc(C)cc1)=O GNKZMNRKLCTJAY-UHFFFAOYSA-N 0.000 description 1
- GDIRQJJOGLAOJK-UHFFFAOYSA-N CCCCNC(CN1CCN(C)CC1)=O Chemical compound CCCCNC(CN1CCN(C)CC1)=O GDIRQJJOGLAOJK-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/74—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving hormones or other non-cytokine intercellular protein regulatory factors such as growth factors, including receptors to hormones and growth factors
- G01N33/743—Steroid hormones
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/58—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2560/00—Chemical aspects of mass spectrometric analysis of biological material
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N30/00—Investigating or analysing materials by separation into components using adsorption, absorption or similar phenomena or using ion-exchange, e.g. chromatography or field flow fractionation
- G01N30/02—Column chromatography
- G01N30/62—Detectors specially adapted therefor
- G01N30/72—Mass spectrometers
- G01N30/7233—Mass spectrometers interfaced to liquid or supercritical fluid chromatograph
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T436/00—Chemistry: analytical and immunological testing
- Y10T436/18—Sulfur containing
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T436/00—Chemistry: analytical and immunological testing
- Y10T436/20—Oxygen containing
- Y10T436/200833—Carbonyl, ether, aldehyde or ketone containing
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T436/00—Chemistry: analytical and immunological testing
- Y10T436/20—Oxygen containing
- Y10T436/203332—Hydroxyl containing
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Chemical & Material Sciences (AREA)
- Biomedical Technology (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Microbiology (AREA)
- Analytical Chemistry (AREA)
- Biotechnology (AREA)
- Pathology (AREA)
- Food Science & Technology (AREA)
- Medicinal Chemistry (AREA)
- Physics & Mathematics (AREA)
- Cell Biology (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- General Physics & Mathematics (AREA)
- Endocrinology (AREA)
- Other Investigation Or Analysis Of Materials By Electrical Means (AREA)
- Investigating Or Analysing Biological Materials (AREA)
Description
本出願は、米国仮出願第61/588902号からの優先権の利益を主張し、それの全教示は、参照により本明細書で援用される。
本教示は、マススペクトロメトリー分野およびマススペクトロメトリーに有用なタグ付け試薬(tagging reagent)に関する。
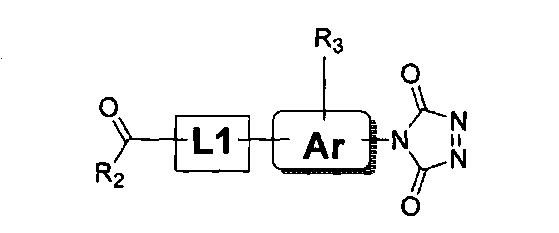
R2は、環式、分岐もしくは直鎖の、置換もしくは非置換C1〜C18アルキル、C1〜C18アルケン、もしくはC1〜C18アルキン、または置換もしくは非置換芳香族基であり、
R3は、存在しないか、または同じかもしくは異なっている1つもしくはそれよりも多くの置換基であり、この置換基は、環式、分岐もしくは直鎖C1〜C18アルキル、C1〜C18アルケン、もしくはC1〜C18アルキン;ハロゲン(例えば、Cl、Br、IもしくはF);−NO2;置換もしくは非置換芳香族(アリール)基;保護されているかもしくは保護されていないアミノ基、アシル基、カルボン酸基もしくはチオール基;−SO3H、−PO4 −、チオエーテル、エーテル、エポキシド、チオ−エポキシド、アジドもしくはアジリジンであり、
各R4は、独立して、H、または環式、分岐もしくは直鎖C1〜C18アルキル、C1〜C18アルケン、もしくはC1〜C18アルキンであり、
mは、1〜20の整数であり、
Xは、アニオンであり、
L1およびL2は、独立して、結合またはリンカーであり、
Arは、結合、アリール基、またはヘテロアリール基である。
本発明の実施形態において、例えば以下の項目が提供される。
(項目1)
試料のマススペクトロメトリー分析方法であって、
前記試料をQAOC試薬で処理し、その結果として、前記試料中の少なくとも1つのフェノール性OH分析物を標識することにより、フェノール性QAOC付加物を作り出すステップと、
前記フェノール性QAOC付加物を質量分析計を使用して分析するステップと
を含む、方法。
(項目2)
前記QAOC試薬が次式を有し、
式中、R 1 は、
であり、
R 2 は、環式、分岐もしくは直鎖の、置換もしくは非置換C 1 〜C 18 アルキル、C 1 〜C 18 アルケン、もしくはC 1 〜C 18 アルキン、または置換もしくは非置換芳香族基であり、
R 3 は、存在しないか、または同じかもしくは異なっている1つもしくはそれよりも多くの置換基であり、この置換基は、環式、分岐もしくは直鎖C 1 〜C 18 アルキル、C 1 〜C 18 アルケン、もしくはC 1 〜C 18 アルキン;ハロゲン;−NO 2 ;置換もしくは非置換芳香族基;保護されているかもしくは保護されていないアミノ基、アシル基、カルボン酸基もしくはチオール基;−SO 3 H、−PO 4 − 、チオエーテル、エーテル、エポキシド、チオ−エポキシド、アジドもしくはアジリジンであり、
各R 4 は、独立して、H、または環式、分岐もしくは直鎖C 1 〜C 18 アルキル、C 1 〜C 18 アルケン、もしくはC 1 〜C 18 アルキンであり、
mは、1〜20の整数であり、
Xは、アニオンであり、
L1およびL2は、独立して、結合またはリンカーであり、
Arは、結合、アリール基、またはヘテロアリール基である、
項目1に記載の方法。
(項目3)
R 2 が、メチルもしくはエチルであり、R 3 が存在せず、
かつ/またはL1およびL2が、独立して、結合、ペプチド、オリゴマー、PEGもしくはC 1 〜C 20 アルキレン鎖である、
項目2に記載の方法。
(項目4)
前記少なくとも1つのフェノール性OH分析物が、ステロイドであり、必要に応じて、
前記ステロイドが、エストリオール、16−エピエストリオール、17−エピエストリオールおよび16,17−エピエストリオール、エストロン(E1)、エストロンサルフェート(E1s)、17α−エストラジオール(E2a)、17β−エストラジオール(E2b)、エストラジオールサルフェート(E2s)、エキリン(EQ)、17α−ジヒドロエキリン(EQa)、17β−ジヒドロエキリン(EQb)、エキレニン(EN)、17α−ジヒドロエキレニン(ENa)、17β−ジヒドロエキレニン(ENb)、Δ8,9−デヒドロエストロン(dE1)、Δ8,9−デヒドロエストロンサルフェート(dE
1s)からなる群から選択されたエストロゲン化合物である、項目2に記載の方法。
(項目5)
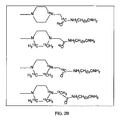
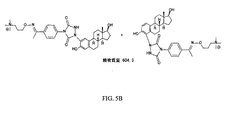
前記QAOC試薬が、構造
を有する化合物をアミノオキシタグと反応させることにより、構造
[式中、nは、1〜20の整数である]、
を有するタグ付きQAOC試薬を形成することによって作製される、項目2に記載の方法。
(項目6)
R 2 が、メチルもしくはエチルであり、R 3 が存在せず、R 4 がメチルであり、mが1〜5の整数であり、Xがペルフルオロカルボキシレートであり、かつ/またはL1が結合であり、Arがフェニル基であり、nが1〜8の整数である、項目5に記載の方法。
(項目7)
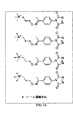
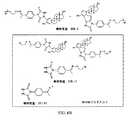
前記タグ付きQAOC試薬が、構造
を有する、項目5に記載の方法。
(項目8)
前記フェノール性QAOC付加物をアミノオキシタグと反応させることにより、下記の下位構造
を有するタグ付き付加物を形成するステップをさらに含む、項目2に記載の方法。
(項目9)
R 2 が、メチルまたはエチルであり、R 3 が存在せず、R 4 がメチルであり、nが2〜4の整数であり、Xがペルフルオロカルボキシレートである、項目8に記載の方法。
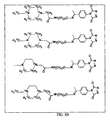
(項目10)
Xが、CF 3 COO−、CF 3 CF 2 COO−、CF 3 CF 2 CF 2 COO−、CF 3 SO 3 COO−、(C 6 H 5 ) 4 B−である、項目2または8に記載の方法。
(項目11)
前記タグ付き付加物が、下位構造
を有する、項目8に記載の方法。
(項目12)
前記試料が、生物学的試料であり、前記生物学的試料が、血液、血漿、血清、尿または唾液、脳脊髄液、組織、毛髪、体液から必要に応じて選択される、項目1に記載の方法。
(項目13)
前記少なくとも1つのフェノール性OH分析物が、ステロイドであり、前記方法が、
(a)公知の量の、1つまたはそれよりも多くのフェノール性OH分析物が枯渇した生物学的試料に、公知の量の1つまたはそれよりも多くのフェノール性OH内標準物質、および公知の増分濃度を有する1つまたはそれよりも多くのフェノール性OH分析物をスパイク添加することによって、一組の較正マトリックスを作り出すステップと、
(b)ステップ(a)から得られた前記試料をQAOC試薬で処理し、その結果、少なくとも1つのフェノール性OH分析物および対応する内標準物質を標識するステップと、
(c)ステップ(b)の前記較正マトリックスを、LC−MSMSを使用して分析するステップと、
(d)前記ステップ(c)の分析から得られたデータを使用して、較正曲線を作成するステップと、
(e)前記試料中の前記フェノール性OH分析物に、公知の量の1つまたはそれよりも多くのフェノール性OH内標準物質をスパイク添加するステップと、
(f)前記較正曲線を使用して、試料中のステロイドである前記少なくとも1つのフェノール性OH分析物の量を推定するステップと
をさらに含み、
必要に応じて、前記混合物を分析するステップが、マススペクトロメトリーを使用する前に前記標準付加物および前記フェノール性QAOC付加物を時間を隔てて溶出させることを含み、必要に応じて、前記方法が、試料調製を行って、前記較正マトリックス中の前記フェノール性OH分析物および前記1つまたはそれよりも多くのフェノール性OH内標準物質を濃縮または浄化するステップをさらに含む、項目1に記載の方法。
(項目14)
前記混合物を分析することが、三連四重極MSプラットフォームを使用して、前記フェノール性QAOC付加物の親娘イオン遷移モニタリング(PDITM)を行うことをさらに含む、項目13に記載の方法。
(項目15)
前記少なくとも1つのフェノール性OH分析物が、ステロイドであり、前記方法が、
(a)フェノール性OHを含む公知の濃度のステロイド分析物を含む内標準物質または外標準物質を提供するステップと、
(b)前記標準物質を前記QAOC試薬で処理することにより、標準付加物を形成するステップと、
(c)前記標準付加物をマススペクトロメトリーを使用して分析するステップと、
(d)前記試料中のステロイドである前記少なくとも1つのフェノール性OH分析物の量を推定するステップと
をさらに含み、
必要に応じて、前記フェノール性QAOC付加物を分析するステップおよび前記標準付加物を分析するステップが、三連四重極MSプラットフォームを使用して、前記フェノール性AOC付加物および前記標準付加物の親娘イオン遷移モニタリング(PDITM)を行うことを含む、項目1に記載の方法。
(項目16)
少なくとも2つのフェノール性OH分析物、および必要に応じて4つのフェノール性OH分析物が、同時に測定される、項目1に記載の方法。
(項目17)
前記フェノール性OH分析物を、前記QAOC試薬の1つまたはそれよりも多くの同位体変種と反応させることにより、少なくとも1つのフェノール性OH内標準物質を形成することのステップをさらに含む、項目1に記載の方法。
(項目18)
1つまたはそれよりも多くのビタミンD−QAOCおよびフェノール性QAOC付加物を、同時に定量することをさらに含む、項目1に記載の方法。
(項目19)
試料のマススペクトロメトリー分析で使用するためのキットであって、
1つのパッケージ内に、
QAOC試薬と、
フェノール性OHを含む公知の濃度のステロイド分析物を含む標準物質と
を含み、
必要に応じて、前記QAOC試薬は、アミノオキシマススペクトロメトリータグ付け剤を含む、
キット。
(項目20)
試料のマススペクトロメトリー分析で使用するためのキットであって、
1つのパッケージ内に、
カルボニル置換PTADベースの試薬と、
アミノオキシマススペクトロメトリータグ付け剤と、
フェノール性OHを含む公知の濃度のステロイド分析物を含む標準物質と
を含む、キット。
明確にするために、下記の論述によって、本出願人らの教示による実施形態の様々な態様を詳説するが、好都合または適切な場合には、いくつかの具体的な詳細を省いていることが、理解される。例えば、代替的な実施形態における同様または類似の特徴の論述は、ある程度省略され得る。周知の発想または概念についても、簡潔にするために詳細には論じていない場合がある。いくつかの実施形態は、実施ごとに具体的に説明された詳細のいくつかを必要としない場合があり、これらは、それらの実施形態を十分な理解を提供するためだけに本明細書に記載されることを、当業者は認識する。同様に、記載の実施形態には、本開示の範囲から逸脱することなく、一般的な共通の知識に従ってわずかな変更または変動を受け入れる余地のあることが明らかとなる。本出願人らの教示の態様は、下記の実施例および様々な実施形態の記載を考慮することにより、さらに理解され得るが、それらは、本出願人らの教示の範囲をいかなる方式であっても制限するものと解釈されるべきでない。
R2は、環式、分岐もしくは直鎖の、置換もしくは非置換C1〜C18アルキル、C1〜C18アルケン、もしくはC1〜C18アルキン、または置換もしくは非置換芳香族基であり、
R3は、存在しないか、または同じかもしくは異なっている1つもしくはそれよりも多くの置換基であり、この置換基は、環式、分岐もしくは直鎖C1〜C18アルキル、C1〜C18アルケン、もしくはC1〜C18アルキン;ハロゲン(例えば、Cl、Br、IもしくはF);−NO2;置換もしくは非置換芳香族(アリール)基;保護されているかもしくは保護されていないアミノ基、アシル基、カルボン酸基もしくはチオール基;−SO3H、−PO4 −、チオエーテル、エーテル、エポキシド、チオ−エポキシド、アジドもしくはアジリジンであり、
各R4は、独立して、H、または環式、分岐もしくは直鎖C1〜C18アルキル、C1〜C18アルケン、もしくはC1〜C18アルキンであり、
mは、1〜20の整数であり、
Xは、アニオンであり、
L1およびL2は、独立して、結合またはリンカーであり、
Arは、結合、アリール基、またはヘテロアリール基である。
式中、R1は、
R2は、環式、分岐もしくは直鎖の、置換もしくは非置換C1〜C18アルキル、C1〜C18アルケン、もしくはC1〜C18アルキン、または置換もしくは非置換芳香族基であり、
R3は、存在しないか、または同じかもしくは異なっている1つもしくはそれよりも多くの置換基であり、この置換基は、環式、分岐もしくは直鎖C1〜C18アルキル、C1〜C18アルケン、もしくはC1〜C18アルキン;ハロゲン(例えば、Cl、Br、IもしくはF);−NO2;置換もしくは非置換芳香族(アリール)基;保護されているかもしくは保護されていないアミノ基、アシル基、カルボン酸基もしくはチオール基;−SO3H、−PO4 −、チオエーテル、エーテル、エポキシド、チオ−エポキシド、アジドもしくはアジリジンであり、
各R4は、独立して、H、または環式、分岐もしくは直鎖C1〜C18アルキル、C1〜C18アルケン、もしくはC1〜C18アルキンであり、
mおよびnは、独立して、1〜20の整数であり、
Xは、アニオンであり、
L2は、結合またはリンカーであり、
Arは、存在しないか、アリール基、またはヘテロアリール基である。
R3は、存在しないか、または同じかもしくは異なっている1つもしくはそれよりも多くの置換基であり、この置換基は、環式、分岐もしくは直鎖C1〜C18アルキル、C1〜C18アルケン、もしくはC1〜C18アルキン;ハロゲン(例えば、Cl、Br、IもしくはF);−NO2;置換もしくは非置換芳香族(アリール)基;保護されているかもしくは保護されていないアミノ基、アシル基、カルボン酸基もしくはチオール基;−SO3H、−PO4 −、チオエーテル、エーテル、エポキシド、チオ−エポキシド、アジドもしくはアジリジンであり、
Arは、結合、アリール基、またはヘテロアリール基であり、
L1は、結合またはリンカーである。
mは、1〜20の整数であり、Xはアニオンである]。タグ付き付加物は、下記の下位構造を有する。
R3は、存在しないか、または同じかもしくは異なっている1つもしくはそれよりも多くの置換基であり、この置換基は、環式、分岐もしくは直鎖C1〜C18アルキル、C1〜C18アルケン、もしくはC1〜C18アルキン;ハロゲン(例えば、Cl、Br、IもしくはF);−NO2;置換もしくは非置換芳香族(アリール)基;保護されているかもしくは保護されていないアミノ基、アシル基、カルボン酸基もしくはチオール基;−SO3H、−PO4 −、チオエーテル、エーテル、エポキシド、チオ−エポキシド、アジドもしくはアジリジンであり、
L1は、結合またはリンカーであり、
Arは、結合、アリール基、またはヘテロアリール基である。
R1−(CH2)n−ONH2
であり、式中、R1は、第四級アミンもしくはホスフェート、または例えば下記の構造を有する置換基であり、
R1−(CH2)n−ONH2
であり、式中、R1は、限定されるものではないが、下記の5つの構造のうちの1つまたはそれよりも多くであってよく、
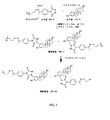
p−アセチル−4−フェニルウラゾール(2)の合成
p−アセチル−4−フェニルウラゾール第四級アミノオキシ付加臭化物(4)の合成
標識されたQAOC試薬(6)の合成
(実施例2)
試料の濃縮
(実施例3)
マススペクトロメトリー分析
(実施例4)
API−5500QTRPでのエストロゲンの分析
実施例5−3200QTRAPでのエストロゲンの分析
Claims (27)
- 試料のマススペクトロメトリー分析方法であって、
前記試料をQAOC試薬で処理し、その結果として、前記試料中の少なくとも1つのフェノール性OH分析物を標識することにより、フェノール性QAOC付加物を作り出すステップと、
前記フェノール性QAOC付加物を質量分析計を使用して分析するステップと
を含む、方法。 - 前記QAOC試薬が次式を有し、
式中、R1は、
であり、
R2は、環式、分岐もしくは直鎖の、置換もしくは非置換C1〜C18アルキル、C1〜C18アルケン、もしくはC1〜C18アルキン、または置換もしくは非置換芳香族基であり、
R3は、存在しないか、または同じかもしくは異なっている1つもしくはそれよりも多くの置換基であり、この置換基は、環式、分岐もしくは直鎖C1〜C18アルキル、C1〜C18アルケン、もしくはC1〜C18アルキン;ハロゲン;−NO2;置換もしくは非置換芳香族基;保護されているかもしくは保護されていないアミノ基、アシル基、カルボン酸基もしくはチオール基;−SO3H、−PO4 −、チオエーテル、エーテル、エポキシド、チオ−エポキシド、アジドもしくはアジリジンであり、
各R4は、独立して、H、または環式、分岐もしくは直鎖C1〜C18アルキル、C1〜C18アルケン、もしくはC1〜C18アルキンであり、
mは、1〜20の整数であり、
Xは、アニオンであり、
L1およびL2は、独立して、結合またはリンカーであり、
Arは、結合、アリール基、またはヘテロアリール基である、
請求項1に記載の方法。 - R2が、メチルもしくはエチルであり、R3が存在せず、
かつ/またはL1およびL2が、独立して、結合、ペプチド、オリゴマー、PEGもしくはC1〜C20アルキレン鎖である、
請求項2に記載の方法。 - 前記少なくとも1つのフェノール性OH分析物が、ステロイドである、請求項2に記載の方法。
- 前記ステロイドが、エストリオール、16−エピエストリオール、17−エピエストリオールおよび16,17−エピエストリオール、エストロン(E1)、エストロンサルフェート(E1s)、17α−エストラジオール(E2a)、17β−エストラジオール(E2b)、エストラジオールサルフェート(E2s)、エキリン(EQ)、17α−ジヒドロエキリン(EQa)、17β−ジヒドロエキリン(EQb)、エキレニン(EN)、17α−ジヒドロエキレニン(ENa)、17β−ジヒドロエキレニン(ENb)、Δ8,9−デヒドロエストロン(dE1)、Δ8,9−デヒドロエストロンサルフェート(dE1s)からなる群から選択されたエストロゲン化合物である、請求項4に記載の方法。
- R2が、メチルもしくはエチルであり、R3が存在せず、R4がメチルであり、mが1〜5の整数であり、Xがペルフルオロカルボキシレートであり、かつ/またはL1が結合であり、Arがフェニル基であり、nが1〜8の整数である、請求項6に記載の方法。
- R2が、メチルまたはエチルであり、R3が存在せず、R4がメチルであり、nが2〜4の整数であり、Xがペルフルオロカルボキシレートである、請求項9に記載の方法。
- Xが、CF3COO−、CF3CF2COO−、CF3CF2CF2COO−、CF3SO3COO−、(C6H5)4B−である、請求項2または9に記載の方法。
- 前記試料が、生物学的試料である、請求項1に記載の方法。
- 前記生物学的試料が、血液、血漿、血清、尿または唾液、脳脊髄液、組織、毛髪、体液から選択される、請求項13に記載の方法。
- 前記少なくとも1つのフェノール性OH分析物が、ステロイドであり、前記方法が、
(a)公知の量の、1つまたはそれよりも多くのフェノール性OH分析物が枯渇した生物学的試料に、公知の量の1つまたはそれよりも多くのフェノール性OH内標準物質、および公知の増分濃度を有する1つまたはそれよりも多くのフェノール性OH分析物をスパイク添加することによって、一組の較正マトリックスを作り出すステップと、
(b)ステップ(a)から得られた前記試料をQAOC試薬で処理し、その結果、少なくとも1つのフェノール性OH分析物および対応する内標準物質を標識するステップと、
(c)ステップ(b)の前記較正マトリックスを、LC−MSMSを使用して分析するステップと、
(d)前記ステップ(c)の分析から得られたデータを使用して、較正曲線を作成するステップと、
(e)前記試料中の前記フェノール性OH分析物に、公知の量の1つまたはそれよりも多くのフェノール性OH内標準物質をスパイク添加するステップと、
(f)前記較正曲線を使用して、試料中のステロイドである前記少なくとも1つのフェノール性OH分析物の量を推定するステップと
をさらに含む、請求項1に記載の方法。 - ステップ(c)が、マススペクトロメトリーを使用する前に前記標準付加物および前記フェノール性QAOC付加物を時間を隔てて溶出させることを含む、請求項15に記載の方法。
- 前記方法が、試料調製を行って、前記較正マトリックス中の前記フェノール性OH分析物および前記1つまたはそれよりも多くのフェノール性OH内標準物質を濃縮または浄化するステップをさらに含む、請求項15または16に記載の方法。
- ステップ(c)が、三連四重極MSプラットフォームを使用して、前記フェノール性QAOC付加物の親娘イオン遷移モニタリング(PDITM)を行うことをさらに含む、請求項15〜17のいずれか1項に記載の方法。
- 前記少なくとも1つのフェノール性OH分析物が、ステロイドであり、前記方法が、
(a)フェノール性OHを含む公知の濃度のステロイド分析物を含む内標準物質または外標準物質を提供するステップと、
(b)前記標準物質を前記QAOC試薬で処理することにより、標準付加物を形成するステップと、
(c)前記標準付加物をマススペクトロメトリーを使用して分析するステップと、
(d)前記試料中のステロイドである前記少なくとも1つのフェノール性OH分析物の量を推定するステップと
をさらに含む、請求項1に記載の方法。 - 前記フェノール性QAOC付加物を分析するステップおよび前記標準付加物を分析するステップが、三連四重極MSプラットフォームを使用して、前記フェノール性QAOC付加物および前記標準付加物の親娘イオン遷移モニタリング(PDITM)を行うことを含む、請求項19に記載の方法。
- 少なくとも2つのフェノール性OH分析物が、同時に測定される、請求項1に記載の方法。
- 少なくとも4つのフェノール性OH分析物が、同時に測定される、請求項21に記載の方法。
- 前記フェノール性OH分析物を、前記QAOC試薬の1つまたはそれよりも多くの同位体変種と反応させることにより、少なくとも1つのフェノール性OH内標準物質を形成することのステップをさらに含む、請求項1に記載の方法。
- 1つまたはそれよりも多くのビタミンD−QAOCおよびフェノール性QAOC付加物を、同時に定量することをさらに含む、請求項1に記載の方法。
- 試料のマススペクトロメトリー分析で使用するためのキットであって、
1つのパッケージ内に、
QAOC試薬と、
フェノール性OHを含む公知の濃度のステロイド分析物を含む標準物質と
を含む、
キット。 - 前記QAOC試薬が、アミノオキシマススペクトロメトリータグ付け剤を含む、請求項25に記載のキット。
- 試料のマススペクトロメトリー分析で使用するためのキットであって、
1つのパッケージ内に、
カルボニル置換PTADベースの試薬と、
アミノオキシマススペクトロメトリータグ付け剤と、
フェノール性OHを含む公知の濃度のステロイド分析物を含む標準物質と
を含む、キット。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261588902P | 2012-01-20 | 2012-01-20 | |
| US61/588,902 | 2012-01-20 | ||
| PCT/IB2013/000055 WO2013108113A1 (en) | 2012-01-20 | 2013-01-16 | Analysis of estradiol and analytes with phenolic oh using labeling chemistry and lc-msms workflow |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2015508504A JP2015508504A (ja) | 2015-03-19 |
| JP6324321B2 true JP6324321B2 (ja) | 2018-05-16 |
Family
ID=48798726
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014552706A Expired - Fee Related JP6324321B2 (ja) | 2012-01-20 | 2013-01-16 | 標識化学およびlc−msmsを使用するエストラジオールおよびフェノール性ohを有する分析物の分析 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US9874575B2 (ja) |
| EP (1) | EP2807482B1 (ja) |
| JP (1) | JP6324321B2 (ja) |
| CN (1) | CN104040332B (ja) |
| WO (1) | WO2013108113A1 (ja) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6012635B2 (ja) * | 2011-02-07 | 2016-10-25 | ラボラトリー コーポレイション オブ アメリカ ホールディングス | サンプル中のテストステロンの存在または量を決定するための方法およびシステム |
| US20140349885A1 (en) * | 2012-01-05 | 2014-11-27 | Dh Technologies Development Pte. Ltd. | Enhancement of sensitivity and specificity of ketosteroids and keto or aldehyde containing analytes |
| CN104569167A (zh) * | 2013-10-17 | 2015-04-29 | 苏州市产品质量监督检验所 | 一种联二脲的液相色谱串联质谱检测方法 |
| CN103728382B (zh) * | 2013-11-25 | 2016-04-13 | 华润紫竹药业有限公司 | 雌三醇的分析方法 |
| CN105842379A (zh) * | 2016-06-02 | 2016-08-10 | 云南省农业科学院质量标准与检测技术研究所 | 一种衍生化测定酚类雌激素的方法 |
| KR20190109448A (ko) * | 2017-01-31 | 2019-09-25 | 에프. 호프만-라 로슈 아게 | 질량 분광분석을 위한 시약 |
| JP7547314B2 (ja) * | 2018-07-24 | 2024-09-09 | エフ. ホフマン-ラ ロシュ アーゲー | 質量分析のための試薬 |
| KR20210035813A (ko) * | 2018-07-24 | 2021-04-01 | 에프. 호프만-라 로슈 아게 | 질량 분석법용 시약 |
| CN109959743A (zh) * | 2019-03-27 | 2019-07-02 | 上海市环境科学研究院 | 固相萃取前处理结合液质联用技术同时检测农业污水中7种结合态雌激素的方法 |
| CN115667220A (zh) * | 2020-05-20 | 2023-01-31 | 豪夫迈·罗氏有限公司 | 质谱用苄基吡啶鎓试剂 |
| EP4154010A1 (en) * | 2020-05-20 | 2023-03-29 | F. Hoffmann-La Roche AG | Reagent for mass spectrometry |
| CN112125827A (zh) * | 2020-09-30 | 2020-12-25 | 华中科技大学 | 一种用于含羰基甾体化合物衍生化试剂的合成方法 |
| CN112763590A (zh) * | 2020-12-14 | 2021-05-07 | 上海明捷医药科技有限公司 | Lc-ms衍生化法测定抗生素中的叠氮化钠 |
| CN112903855B (zh) * | 2021-01-22 | 2022-01-04 | 山东英盛生物技术有限公司 | 高效液相色谱-串联质谱法定量检测衍生后的维生素k1的方法 |
| CN114594176B (zh) * | 2022-01-19 | 2024-08-06 | 杭州盛弗泰新材料科技有限公司 | 一种检测氮丙啶类交联剂中残留原料的方法 |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4613299B2 (ja) | 2003-01-30 | 2011-01-12 | ディーエイチ テクノロジーズ デベロップメント プライベート リミテッド | 分析物分析に関する方法、混合物、キット、および組成物 |
| US8012693B2 (en) * | 2003-12-16 | 2011-09-06 | 3M Innovative Properties Company | Analysis of chemically crosslinked cellular samples |
| US20090215111A1 (en) * | 2005-06-07 | 2009-08-27 | Veenstra Timothy D | Analysis of steroid hormones in thin tissue sections |
| US7972868B2 (en) * | 2007-11-28 | 2011-07-05 | Quest Diagnostics Investments Incorporated | Methods for detecting dihydroxyvitamin D metabolites by mass spectrometry |
| US20110212534A1 (en) | 2008-08-11 | 2011-09-01 | Taylor Robert L | Methods for determining levels of 1,25 dihydroxy vitamin d2 and d3 |
| US20110003395A1 (en) | 2009-05-31 | 2011-01-06 | Dh Technologies Development Pte. Ltd. | Specific analysis of analytes using reagent compounds, labeling strategies, and mass spectrometry workflow |
| CN107607662B (zh) * | 2009-12-11 | 2020-05-08 | 奎斯特诊断投资公司 | 多重样品中的甾族化合物的质谱法 |
| EP2526428B1 (en) * | 2010-01-22 | 2016-03-30 | DH Technologies Development Pte. Ltd. | Mass tag reagents for simultaneous quantitation and identification of small molecules |
| US8617898B2 (en) * | 2010-01-25 | 2013-12-31 | Dh Technologies Development Pte. Ltd. | Quantitative analysis of vitamin D3, vitamin D2, and metabolites thereof |
-
2013
- 2013-01-16 JP JP2014552706A patent/JP6324321B2/ja not_active Expired - Fee Related
- 2013-01-16 US US14/367,230 patent/US9874575B2/en active Active
- 2013-01-16 WO PCT/IB2013/000055 patent/WO2013108113A1/en not_active Ceased
- 2013-01-16 CN CN201380005066.3A patent/CN104040332B/zh not_active Expired - Fee Related
- 2013-01-16 EP EP13738395.6A patent/EP2807482B1/en not_active Not-in-force
Also Published As
| Publication number | Publication date |
|---|---|
| EP2807482A1 (en) | 2014-12-03 |
| JP2015508504A (ja) | 2015-03-19 |
| US9874575B2 (en) | 2018-01-23 |
| EP2807482A4 (en) | 2015-06-10 |
| CN104040332A (zh) | 2014-09-10 |
| WO2013108113A1 (en) | 2013-07-25 |
| US20150051111A1 (en) | 2015-02-19 |
| CN104040332B (zh) | 2017-10-20 |
| EP2807482B1 (en) | 2018-03-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6324321B2 (ja) | 標識化学およびlc−msmsを使用するエストラジオールおよびフェノール性ohを有する分析物の分析 | |
| JP6585743B2 (ja) | 複合試料中のステロイド化合物の質量分析 | |
| CA3000272C (en) | Methods for detecting dihydroxyvitamin d metabolites by mass spectrometry | |
| JP2021532128A (ja) | 質量分析のための試薬 | |
| US20250244343A1 (en) | Mass spectrometry assay for estrogenic compounds | |
| CA2860418A1 (en) | Enhancement of sensitivity and specificity of ketosteroids and keto or aldehyde containing analytes | |
| JP7747664B2 (ja) | 質量分析のためのベンジルピリジニウム試薬 | |
| Fu et al. | Click chemoselective probe with a photoswitchable handle for highly sensitive determination of steroid hormones in food samples | |
| CN116710783A (zh) | 通过交叉喷雾esi质谱检测目标分析物 | |
| CN116323568A (zh) | 通过nanoESI质谱检测目标分析物 | |
| JP2023525915A (ja) | 質量分析のための試薬 | |
| CN115667223A (zh) | 质谱用咪唑鎓试剂 | |
| JPWO2007029668A1 (ja) | ソフトイオン化法のための誘導体化試薬 | |
| JP7799627B2 (ja) | 質量分析のための試薬 | |
| Armbruster | Isotope Tagging for High-Throughput Metabolomics | |
| Singh et al. | Analytical Chemistry Across Biomedical, Pharmaceutical, and Environmental | |
| EP4196794A1 (en) | Phenacylbromide-based mass tags for carboxyl and phenolic functional group containing analytes | |
| Houghton et al. | Current research into new analytical procedures |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20160114 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20161202 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170222 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170802 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20171031 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180117 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20180312 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20180410 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6324321 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |