JP5826766B2 - 試料採取デバイスインタフェース - Google Patents
試料採取デバイスインタフェース Download PDFInfo
- Publication number
- JP5826766B2 JP5826766B2 JP2012549079A JP2012549079A JP5826766B2 JP 5826766 B2 JP5826766 B2 JP 5826766B2 JP 2012549079 A JP2012549079 A JP 2012549079A JP 2012549079 A JP2012549079 A JP 2012549079A JP 5826766 B2 JP5826766 B2 JP 5826766B2
- Authority
- JP
- Japan
- Prior art keywords
- fluid
- skin
- subject
- interface
- vacuum
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- GDOPTJXRTPNYNR-UHFFFAOYSA-N CC1CCCC1 Chemical compound CC1CCCC1 GDOPTJXRTPNYNR-UHFFFAOYSA-N 0.000 description 1
- HEUSUILDTYLSGB-UHFFFAOYSA-N CCCC1NC1 Chemical compound CCCC1NC1 HEUSUILDTYLSGB-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/145—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue
- A61B5/14532—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue for measuring glucose, e.g. by tissue impedance measurement
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/15—Devices for taking samples of blood
- A61B5/150007—Details
- A61B5/150015—Source of blood
- A61B5/150022—Source of blood for capillary blood or interstitial fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/15—Devices for taking samples of blood
- A61B5/150007—Details
- A61B5/150053—Details for enhanced collection of blood or interstitial fluid at the sample site, e.g. by applying compression, heat, vibration, ultrasound, suction or vacuum to tissue; for reduction of pain or discomfort; Skin piercing elements, e.g. blades, needles, lancets or canulas, with adjustable piercing speed
- A61B5/150061—Means for enhancing collection
- A61B5/150099—Means for enhancing collection by negative pressure, other than vacuum extraction into a syringe by pulling on the piston rod or into pre-evacuated tubes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/15—Devices for taking samples of blood
- A61B5/150007—Details
- A61B5/150206—Construction or design features not otherwise provided for; manufacturing or production; packages; sterilisation of piercing element, piercing device or sampling device
- A61B5/150221—Valves
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/15—Devices for taking samples of blood
- A61B5/150007—Details
- A61B5/150206—Construction or design features not otherwise provided for; manufacturing or production; packages; sterilisation of piercing element, piercing device or sampling device
- A61B5/150229—Pumps for assisting the blood sampling
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/15—Devices for taking samples of blood
- A61B5/150007—Details
- A61B5/150206—Construction or design features not otherwise provided for; manufacturing or production; packages; sterilisation of piercing element, piercing device or sampling device
- A61B5/150236—Pistons, i.e. cylindrical bodies that sit inside the syringe barrel, typically with an air tight seal, and slide in the barrel to create a vacuum or to expel blood
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/15—Devices for taking samples of blood
- A61B5/150007—Details
- A61B5/150206—Construction or design features not otherwise provided for; manufacturing or production; packages; sterilisation of piercing element, piercing device or sampling device
- A61B5/150244—Rods for actuating or driving the piston, i.e. the cylindrical body that sits inside the syringe barrel, typically with an air tight seal, and slides in the barrel to create a vacuum or to expel blood
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/15—Devices for taking samples of blood
- A61B5/150007—Details
- A61B5/150206—Construction or design features not otherwise provided for; manufacturing or production; packages; sterilisation of piercing element, piercing device or sampling device
- A61B5/150274—Manufacture or production processes or steps for blood sampling devices
- A61B5/150297—Manufacture or production processes or steps for blood sampling devices for piercing devices, i.e. devices ready to be used for lancing or piercing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/15—Devices for taking samples of blood
- A61B5/150007—Details
- A61B5/150374—Details of piercing elements or protective means for preventing accidental injuries by such piercing elements
- A61B5/150381—Design of piercing elements
- A61B5/150389—Hollow piercing elements, e.g. canulas, needles, for piercing the skin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/15—Devices for taking samples of blood
- A61B5/150007—Details
- A61B5/150374—Details of piercing elements or protective means for preventing accidental injuries by such piercing elements
- A61B5/150381—Design of piercing elements
- A61B5/150412—Pointed piercing elements, e.g. needles, lancets for piercing the skin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/15—Devices for taking samples of blood
- A61B5/150007—Details
- A61B5/150374—Details of piercing elements or protective means for preventing accidental injuries by such piercing elements
- A61B5/150381—Design of piercing elements
- A61B5/150503—Single-ended needles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/15—Devices for taking samples of blood
- A61B5/150007—Details
- A61B5/150755—Blood sample preparation for further analysis, e.g. by separating blood components or by mixing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/15—Devices for taking samples of blood
- A61B5/150969—Low-profile devices which resemble patches or plasters, e.g. also allowing collection of blood samples for testing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/15—Devices for taking samples of blood
- A61B5/150977—Arrays of piercing elements for simultaneous piercing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/15—Devices for taking samples of blood
- A61B5/150977—Arrays of piercing elements for simultaneous piercing
- A61B5/150984—Microneedles or microblades
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/15—Devices for taking samples of blood
- A61B5/151—Devices specially adapted for taking samples of capillary blood, e.g. by lancets, needles or blades
- A61B5/15101—Details
- A61B5/15103—Piercing procedure
- A61B5/15105—Purely manual piercing, i.e. the user pierces the skin without the assistance of any driving means or driving devices
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/15—Devices for taking samples of blood
- A61B5/151—Devices specially adapted for taking samples of capillary blood, e.g. by lancets, needles or blades
- A61B5/15101—Details
- A61B5/15103—Piercing procedure
- A61B5/15107—Piercing being assisted by a triggering mechanism
- A61B5/15113—Manually triggered, i.e. the triggering requires a deliberate action by the user such as pressing a drive button
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/15—Devices for taking samples of blood
- A61B5/151—Devices specially adapted for taking samples of capillary blood, e.g. by lancets, needles or blades
- A61B5/15101—Details
- A61B5/15115—Driving means for propelling the piercing element to pierce the skin, e.g. comprising mechanisms based on shape memory alloys, magnetism, solenoids, piezoelectric effect, biased elements, resilient elements, vacuum or compressed fluids
- A61B5/15117—Driving means for propelling the piercing element to pierce the skin, e.g. comprising mechanisms based on shape memory alloys, magnetism, solenoids, piezoelectric effect, biased elements, resilient elements, vacuum or compressed fluids comprising biased elements, resilient elements or a spring, e.g. a helical spring, leaf spring, or elastic strap
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/15—Devices for taking samples of blood
- A61B5/151—Devices specially adapted for taking samples of capillary blood, e.g. by lancets, needles or blades
- A61B5/15101—Details
- A61B5/15115—Driving means for propelling the piercing element to pierce the skin, e.g. comprising mechanisms based on shape memory alloys, magnetism, solenoids, piezoelectric effect, biased elements, resilient elements, vacuum or compressed fluids
- A61B5/15125—Driving means for propelling the piercing element to pierce the skin, e.g. comprising mechanisms based on shape memory alloys, magnetism, solenoids, piezoelectric effect, biased elements, resilient elements, vacuum or compressed fluids comprising a vacuum or compressed fluids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/15—Devices for taking samples of blood
- A61B5/151—Devices specially adapted for taking samples of capillary blood, e.g. by lancets, needles or blades
- A61B5/15142—Devices intended for single use, i.e. disposable
- A61B5/15144—Devices intended for single use, i.e. disposable comprising driving means, e.g. a spring, for retracting the piercing unit into the housing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/15—Devices for taking samples of blood
- A61B5/151—Devices specially adapted for taking samples of capillary blood, e.g. by lancets, needles or blades
- A61B5/15186—Devices loaded with a single lancet, i.e. a single lancet with or without a casing is loaded into a reusable drive device and then discarded after use; drive devices reloadable for multiple use
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/15—Devices for taking samples of blood
- A61B5/157—Devices characterised by integrated means for measuring characteristics of blood
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/68—Arrangements of detecting, measuring or recording means, e.g. sensors, in relation to patient
- A61B5/6846—Arrangements of detecting, measuring or recording means, e.g. sensors, in relation to patient specially adapted to be brought in contact with an internal body part, i.e. invasive
- A61B5/6847—Arrangements of detecting, measuring or recording means, e.g. sensors, in relation to patient specially adapted to be brought in contact with an internal body part, i.e. invasive mounted on an invasive device
- A61B5/685—Microneedles
Description
本願は、2010年1月13日に出願された、Chickeringらによる、「Blood Sampling Device and Method」と題された米国仮特許出願第61/294,543号;2010年5月13日に出願された、Chickeringらによる、「Rapid Delivery and/or Withdrawal of Fluids」と題された米国仮特許出願第61/334,533号;2010年5月13日に出願された、Chickeringらによる、「Sampling Device Interfaces」と題された米国仮特許出願第61/334,529号;2010年6月23日に出願された、Chickeringらによる、「Sampling Devices and Methods Involving Relatively Little Pain」と題された米国仮特許出願第61/357,582号;2010年7月26日に出願された、Davisらによる、「Rapid Delivery and/or Withdrawal of Fluids」と題された米国仮特許出願第61/367,607号;および2010年8月13日に出願された、Chickeringらによる、「Clinical and/or Consumer Techniques and Devices」と題された米国仮特許出願第61/373,764号の利益を主張する。これらの出願は、本明細書中に参考として援用される。
本発明は、一般に、血液または間質液などの流体もしくは他の材料を対象に、たとえば皮膚および/または皮下に送達し、および/またはこれらの流体もしくは他の材料を対象から、たとえば皮膚および/または皮下から採取する(withdraw)ためのシステムおよび方法に関する。
本発明は、例えば以下の項目を提供する。
(項目1)
対象の皮膚からおよび/または皮下から物質を採取するためのデバイスであって、該デバイスは、
流体輸送器と、
該対象から採取された流体を受けるための貯蔵チャンバであって、該貯蔵チャンバは、該流体輸送器と流体的に連絡している、貯蔵チャンバと、
該デバイスを外部装置と係合するためのインタフェースであって、該インタフェースは、該流体貯蔵チャンバの中におよび/または該流体貯蔵チャンバから外に流体を輸送するための流体経路を画定する、インタフェースと
を備える、デバイス。
(項目2)
前記貯蔵チャンバは、負圧が前記対象の皮膚に加えられると、前記流体輸送器を介して該対象から採取された流体を該対象から受けることができる、項目1に記載のデバイス。
(項目3)
前記貯蔵チャンバは、血液が前記デバイスに採取される前において大気圧よりも低い内圧を有する、項目1または2のいずれか一項に記載のデバイス。
(項目4)
前記デバイスは、前記貯蔵チャンバから分離されている真空チャンバをさらに備え、該真空チャンバは、流体が該デバイスに採取される前において大気圧よりも低い内圧を有する、項目1から3のいずれか一項に記載のデバイス。
(項目5)
前記貯蔵チャンバは、前記真空チャンバから膜によって分離されている、項目4に記載のデバイス。
(項目6)
前記膜は、親水性である、項目5に記載のデバイス。
(項目7)
前記膜は、疎水性である、項目5に記載のデバイス。
(項目8)
前記インタフェースは、針を備える、項目1から7のいずれか一項に記載のデバイス。
(項目9)
前記針は、後退可能である、項目8に記載のデバイス。
(項目10)
前記外部装置は、前記針を受けるための隔壁を備える、項目8または9のいずれか一項に記載のデバイス。
(項目11)
前記インタフェースは、隔壁を備える、項目1から10のいずれか一項に記載のデバイス。
(項目12)
前記外部装置は、前記デバイスが該外部装置と係合されるときに前記隔壁に挿入されることができる針を備える、項目11に記載のデバイス。
(項目13)
前記インタフェースは、前記外部装置に取り付けられることができる、項目1から12のいずれか一項に記載のデバイス。
(項目14)
前記インタフェースは、第1の表面を有し、前記外部装置は、該第1の表面と相補的な第2の表面を有する、項目1から13のいずれか一項に記載のデバイス。
(項目15)
前記インタフェースは、1つ以上の要素を備え、該1つ以上の要素は、前記外部装置の1つ以上の要素と相補的であり、および係合可能である、項目1から14のいずれか一項に記載のデバイス。
(項目16)
前記外部装置は、外側に延在している1つ以上の部材を備え、前記インタフェースは、該1つ以上の部材を受けるための1つ以上の受け器を備える、項目1から15のいずれか一項に記載のデバイス。
(項目17)
前記外部装置は、前記デバイスが該外部装置と係合されているとき、該デバイスを取り囲む、項目1から16のいずれか一項に記載のデバイス。
(項目18)
前記外部装置は、クランプを備える、項目1から17のいずれか一項に記載のデバイス。
(項目19)
前記外部装置は、機械式クランプを備える、項目1から18のいずれか一項に記載のデバイス。
(項目20)
前記外部装置は、電磁式クランプを備える、項目1から19のいずれか一項に記載のデバイス。
(項目21)
前記インタフェースは、ルアーロックインタフェースを備える、項目1から20のいずれか一項に記載のデバイス。
(項目22)
前記インタフェースは、ルアースリップインタフェースを備える、項目1から21のいずれか一項に記載のデバイス。
(項目23)
前記インタフェースの少なくとも一部分は、前記外部装置にねじ込まれ、それによって前記デバイスを該外部装置と係合させる、項目1から22のいずれか一項に記載のデバイス。
(項目24)
前記インタフェースの少なくとも一部分は、前記外部装置に摩擦係合される、項目1から23のいずれか一項に記載のデバイス。
(項目25)
前記デバイスを前記外部装置と係合した後に、前記インタフェースは、前記貯蔵チャンバから該デバイスの外部に流体を輸送することができる、項目1から24のいずれか一項に記載のデバイス。
(項目26)
前記外部装置は、前記貯蔵チャンバから輸送された前記流体および/または該流体内に含有される種を決定することができる、項目25に記載のデバイス。
(項目27)
前記デバイスは、該デバイスから前記インタフェースを介して流体を排出するための流体排出機構を備える、項目1から26のいずれか一項に記載のデバイス。
(項目28)
前記流体排出機構は、ポンプを備える、項目27に記載のデバイス。
(項目29)
前記流体排出機構は、膨張可能な材料を備える、項目27または28のいずれか一項に記載のデバイス。
(項目30)
前記流体排出機構は、ピストンを備える、項目27から29のいずれか一項に記載のデバイス。
(項目31)
前記流体排出機構は、拡張可能なネジを備える、項目27から30のいずれか一項に記載のデバイス。
(項目32)
前記流体排出機構は、膨張可能な袋を備える、項目27から31のいずれか一項に記載のデバイス。
(項目33)
前記流体排出機構は、圧縮ガスを備える、項目27から32のいずれか一項に記載のデバイス。
(項目34)
前記流体排出機構は、真空を備える、項目27から33のいずれか一項に記載のデバイス。
(項目35)
前記流体輸送器は、1つ以上のマイクロニードルを備える、項目27から34のいずれか一項に記載のデバイス。
(項目36)
前記マイクロニードルのうちの少なくともいくつかは、中実である、項目35に記載のデバイス。
(項目37)
前記対象は、ヒトである、項目1から36のいずれか一項に記載のデバイス。
(項目38)
前記デバイスは、内蔵型である、項目1から37のいずれか一項に記載のデバイス。
(項目39)
前記貯蔵チャンバと前記インタフェースとを含有する前記デバイスの一部分は、該デバイスから取外し可能であり、および前記外部装置と係合可能である、項目1から38のいずれか一項に記載のデバイス。
(項目40)
前記外部装置は、分析デバイスの一部分である、項目1から39のいずれか一項に記載のデバイス。
(項目41)
前記分析デバイスは、自動化されている、項目40に記載のデバイス。
(項目42)
前記インタフェースは、前記デバイスから流体を除去するための除去機構をさらに備える、項目1から41のいずれか一項に記載のデバイス。
(項目43)
前記除去機構は、ピペットを備える、項目42に記載のデバイス。
(項目44)
前記除去機構は、真空を備える、項目42または43のいずれか一項に記載のデバイス。
(項目45)
対象の皮膚からおよび/または皮下から流体を採取するためのデバイスであって、該デバイスは、流体輸送器と、該対象から採取された流体を受けるための貯蔵チャンバとを備え、該貯蔵チャンバは、該流体輸送器と流体的に連絡している、デバイスと、
該デバイス内に含有される該流体および/または種を決定することができる外部装置と
を備え、
該デバイスの少なくとも一部分は、該外部装置と係合される、物品。
(項目46)
前記貯蔵チャンバは、負圧が前記対象の皮膚に加えられると、前記流体輸送器を介して該対象から採取された流体を受けることができる、項目45に記載の物品。
(項目47)
前記貯蔵チャンバは、流体が前記デバイスに採取される前において大気圧よりも低い内圧を有する、項目45または46のいずれか一項に記載の物品。
(項目48)
前記デバイスは、前記貯蔵チャンバから分離されている真空チャンバをさらに備え、該真空チャンバは、流体が該デバイスに採取される前において大気圧よりも低い内圧を有する、項目45から47のいずれか一項に記載の物品。
(項目49)
前記貯蔵チャンバは、前記真空チャンバから膜によって分離されている、項目48に記載の物品。
(項目50)
前記膜は、親水性である、項目49に記載の物品。
(項目51)
前記膜は、疎水性である、項目49に記載の物品。
(項目52)
前記デバイスの一部分および前記外部装置は、該デバイス上のインタフェースおよび該外部装置上の外部ホルダによって移動不能にされる、項目45から51のいずれか一項に記載の物品。
(項目53)
前記インタフェースは、針を備える、項目52に記載の物品。
(項目54)
前記針は、後退可能である、項目53に記載の物品。
(項目55)
前記外部装置は、前記針を受けるための隔壁を備える、項目52または53のいずれか一項に記載の物品。
(項目56)
前記インタフェースは、第1の表面を有し、前記外部装置は、該第1の表面と相補的な第2の表面を有する、項目52から55のいずれか一項に記載の物品。
(項目57)
前記インタフェースは、外側に延在している1つ以上の部材を備え、前記外部装置は、該1つ以上の部材を受けるための1つ以上の受け器を備える、項目52から56のいずれか一項に記載の物品。
(項目58)
前記外部装置は、外側に延在している1つ以上の部材を備え、前記インタフェースは、該1つ以上の部材を受けるための1つ以上の受け器を備える、項目52から57のいずれか一項に記載の物品。
(項目59)
前記外部装置は、前記デバイスが該外部装置の中に係合されているとき、該デバイスを取り囲む、項目52から58のいずれか一項に記載の物品。
(項目60)
前記外部装置は、クランプを備える、項目52から59のいずれか一項に記載の物品。
(項目61)
前記外部装置は、機械式クランプを備える、項目52から60のいずれか一項に記載の物品。
(項目62)
前記外部装置は、電磁式クランプを備える、項目52から61のいずれか一項に記載の物品。
(項目63)
前記インタフェースは、ルアーロックインタフェースを含む、項目52から62のいずれか一項に記載の物品。
(項目64)
前記インタフェースは、ルアースリップインタフェースを含む、項目52から63のいずれか一項に記載の物品。
(項目65)
前記インタフェースの少なくとも一部分は、前記外部装置にねじ込まれ、それによって前記デバイスを該外部装置上に係合する、項目52から64のいずれか一項に記載の物品。
(項目66)
前記インタフェースの少なくとも一部分は、前記外部装置上に摩擦係合される、項目52から65のいずれか一項に記載の物品。
(項目67)
前記デバイスを前記外部装置に係合した後に、前記インタフェースは、前記貯蔵チャンバから該デバイスから外部に流体を輸送することができる、項目52から66のいずれか一項に記載の物品。
(項目68)
前記インタフェースは、隔壁を備える、項目52から67のいずれか一項に記載の物品。
(項目69)
前記外部装置は、前記デバイスが該外部装置上に係合されるときに前記隔壁に挿入されることができる針を備える、項目68に記載の物品。
(項目70)
前記外部装置は、前記貯蔵チャンバから輸送された前記流体および/または該流体内に含有される種を決定することができる、項目52から69のいずれか一項に記載の物品。
(項目71)
前記デバイスは、該デバイスから前記外部装置まで流体を排出するための流体排出機構を備える、項目45から70のいずれか一項に記載の物品。
(項目72)
前記流体排出機構は、ポンプを備える、項目71に記載の物品。
(項目73)
前記流体排出機構は、膨張可能な材料を備える、項目71または72のいずれか一項に記載の物品。
(項目74)
前記流体排出機構は、ピストンを備える、項目71から73のいずれか一項に記載の物品。
(項目75)
前記流体排出機構は、拡張可能なネジを備える、項目71から74のいずれか一項に記載の物品。
(項目76)
前記流体排出機構は、膨張可能な袋を備える、項目71から75のいずれか一項に記載の物品。
(項目77)
前記流体排出機構は、圧縮ガスを備える、項目71から76のいずれか一項に記載の物品。
(項目78)
前記流体排出機構は、真空を備える、項目71から77のいずれか一項に記載の物品。
(項目79)
前記流体輸送器は、1つ以上のマイクロニードルを備える、項目71から78のいずれか一項に記載の物品。
(項目80)
前記マイクロニードルのうちの少なくともいくつかは、中実である、項目79に記載の物品。
(項目81)
前記外部装置は、前記デバイスから流体を除去するための除去機構をさらに備える、項目45から80のいずれか一項に記載の物品。
(項目82)
前記除去機構は、ピペットを備える、項目81に記載の物品。
(項目83)
前記除去機構は、真空を備える、項目81または82のいずれか一項に記載の物品。
(項目84)
前記流体は、血液を含む、項目45から83のいずれか一項に記載の物品。
(項目85)
対象の皮膚からおよび/または皮下から血液を採取するためのデバイスの少なくとも一部分を外部装置に係合することであって、該外部装置は、該デバイス内に含有される該血液および/または種を決定することができる、こと
を含み、
該デバイスは、流体輸送器と、該対象から採取された血液を受けるための貯蔵チャンバとを含み、該貯蔵チャンバは該流体輸送器と流体的に連絡している、方法。
(項目86)
対象の皮膚からおよび/または皮下から血液を採取するためのデバイスであって、該デバイスは、流体輸送器と、該対象から採取された流体を受けるための貯蔵チャンバとを備え、該貯蔵チャンバは、該流体輸送器と流体的に連絡している、デバイスと、
該デバイス内に含有される該血液および/または種を決定することができる外部装置と
を備え、
該デバイスの少なくとも一部分が、該外部装置と係合される、物品。
(項目87)
対象の皮膚からおよび/または皮下から流体を採取するためのデバイスの少なくとも一部分を外部装置に係合することであって、該外部装置は、該デバイス内に含有される該流体および/または種を決定することができる、こと
を含み、
該デバイスは、流体輸送器と、該対象から採取された流体を受けるための貯蔵チャンバとを備え、該貯蔵チャンバは、該流体輸送器と流体的に連絡している、方法。
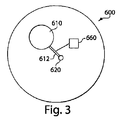
この実施例は、対象の皮膚にマイクロニードルアレイを挿入するためのデバイスを示す。図13Aは、流体輸送器(たとえば、マイクロニードルアレイ833)と、可逆的に変形可能な構造(たとえば、スナップドーム832)と、アクティベータ(たとえば、起動ボタン831)と、後退機構(たとえば、シリコンフォーム835)と、3M 1509テープまたは3M 1513テープなどの両面接着剤を使用して互いに接合された複数のポリカーボネート層から構築された構造構成要素とを含むデバイス800を示す。マイクロニードルアレイは、スナップドームの下側にある積層柱837に接合されることができる。構造構成要素838および柱837は、ポリカーボネートおよび3M 1509接着剤または3M 1513接着剤から形成される。アレイは、針の数(4〜28の針)、針の長さ(350〜1000マイクロメートル)、および/または配列(四角形、方形、および円形のアレイ)に幅があってよく、アレイの設置面積は直径で3mm未満であり、ここで「設置面積」とは、針が付着される基部の面積である。
この実施例は、真空を使用して血液を採取するためのデバイスを示す。このデバイスは図13Bに示されている。このデバイスは、3M 1509テープまたは3M 1513テープなどの両面接着剤を使用して互いに接合されたポリカーボネート層、ポリエチレンテレフタレートグリコール(PETG)層、およびシリコン層からなる真空チャンバを含む。このチャンバは、直径がほぼ2.7cm、高さが0.6cmであり、基部のカップ形の開口858は、直径が3から7mmまでの範囲である。この真空チャンバは、3M 1509またはKatecho 10Gヒドロゲルなどの接着剤857を使用して、マイクロニードル挿入部位を覆う対象の皮膚に付着されることができる。真空源(すなわち、真空ポンプ、シリンジ、真空リザーバなど)は、シリコン層852を通して挿入された皮下注射針859を使用してチャンバに接続されることができ、真空(すなわち、30〜70kPa)が、一定の期間(すなわち、10秒から10分まで)部位に適用されることができる。真空を適用することによって、血液が皮膚の穴から真空チャンバに流れる。
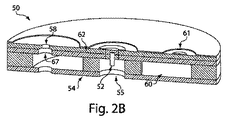
この実施例では、全体的に統合されたデバイスが、ヒト被験者からの流体の採取のために構成された。このデバイスの図が図13Cに示されている。この実施例では、統合されたデバイス800は、対象の皮膚に適用するための支持構造801を含む。この構造は、複数のポリエチレンテレフタレートグリコール(PETG)層から構成される。これらの層は、シート素材(sheet stock)の機械加工または射出成形によって、必要な幾何学的形状に形成されることができる。個々の層は、3M 1513テープなどの両面接着剤を使用して互いに接合されるが、超音波溶接またはレーザ溶接などの接着剤でない方法を使用して接合されることもできる。支持構造は、Katecho 10Gヒドロゲルなどの接着剤802を使用して対象の皮膚に付着される。
Claims (41)
- 対象の皮膚からおよび/または皮下から物質を採取するためのデバイスであって、該デバイスは、
1つ以上のマイクロニードルを備える流体輸送器と、
該流体輸送器と流体的に連絡している真空チャンバであって、該真空チャンバは、該デバイスが該対象の皮膚に適用される前において大気圧よりも低い内圧を有する、貯蔵チャンバと、
該デバイスを外部装置と係合するためのインタフェースであって、該インタフェースは、該デバイスの中におよび/または該デバイスから外に流体を輸送するための流体経路を画定する、インタフェースと
を備える、デバイス。 - 前記真空チャンバは、負圧が該真空チャンバを介して前記対象の皮膚に加えられると、前記流体輸送器を介して該対象から採取された流体を受けることができる、請求項1に記載のデバイス。
- 前記デバイスは、前記流体輸送器を介して前記対象から採取された流体を受けることができる貯蔵チャンバをさらに備え、該貯蔵チャンバは、前記真空チャンバから分離されている、請求項1から2のいずれか一項に記載のデバイス。
- 前記貯蔵チャンバは、前記真空チャンバから膜によって分離されている、請求項3に記載のデバイス。
- 前記膜は、親水性である、請求項4に記載のデバイス。
- 前記膜は、疎水性である、請求項4に記載のデバイス。
- 前記インタフェースは、針を備える、請求項1から6のいずれか一項に記載のデバイス。
- 前記針は、後退可能である、請求項7に記載のデバイス。
- 前記外部装置は、前記針を受けるための隔壁を備える、請求項7または8のいずれか一項に記載のデバイス。
- 前記インタフェースは、隔壁を備える、請求項1から9のいずれか一項に記載のデバイス。
- 前記外部装置は、前記デバイスが該外部装置と係合されるときに前記隔壁に挿入されることができる針を備える、請求項10に記載のデバイス。
- 前記インタフェースは、前記外部装置に取り付けられることができる、請求項1から11のいずれか一項に記載のデバイス。
- 前記インタフェースは、第1の表面を有し、前記外部装置は、該第1の表面と相補的な第2の表面を有する、請求項1から12のいずれか一項に記載のデバイス。
- 前記インタフェースは、1つ以上の要素を備え、該1つ以上の要素は、前記外部装置の1つ以上の要素と相補的であり、および係合可能である、請求項1から13のいずれか一項に記載のデバイス。
- 前記外部装置は、外側に延在している1つ以上の部材を備え、前記インタフェースは、該1つ以上の部材を受けるための1つ以上の受け器を備える、請求項1から14のいずれか一項に記載のデバイス。
- 前記インタフェースは、前記デバイスが前記外部装置と係合されているとき、該外部装置によって取り囲まれるように構成されている、請求項1から15のいずれか一項に記載のデバイス。
- 前記インタフェースは、クランプを備える外部装置と連携するように構成されている、請求項1から16のいずれか一項に記載のデバイス。
- 前記外部装置は、機械式クランプを備える、請求項1から17のいずれか一項に記載のデバイス。
- 前記外部装置は、電磁式クランプを備える、請求項1から18のいずれか一項に記載のデバイス。
- 前記インタフェースは、ルアーロックインタフェースを備える、請求項1から19のいずれか一項に記載のデバイス。
- 前記インタフェースは、ルアースリップインタフェースを備える、請求項1から20のいずれか一項に記載のデバイス。
- 前記インタフェースの少なくとも一部分は、前記外部装置にねじ込まれ、それによって前記デバイスを該外部装置と係合させるように構成されている、請求項1から21のいずれか一項に記載のデバイス。
- 前記インタフェースの少なくとも一部分は、前記外部装置に摩擦係合されるように構成されている、請求項1から22のいずれか一項に記載のデバイス。
- 前記デバイスを前記外部装置と係合した後に、前記インタフェースは、前記デバイスから該デバイスの外部に流体を輸送することができるように構成されている、請求項1から23のいずれか一項に記載のデバイス。
- 前記外部装置は、前記デバイスから輸送された前記流体および/または該流体内に含有される種を決定することができる、請求項24に記載のデバイス。
- 前記デバイスは、該デバイスから前記インタフェースを介して流体を排出するための流体排出機構を備える、請求項1から25のいずれか一項に記載のデバイス。
- 前記流体排出機構は、ポンプを備える、請求項26に記載のデバイス。
- 前記流体排出機構は、膨張可能な材料を備える、請求項26または27のいずれか一項に記載のデバイス。
- 前記流体排出機構は、ピストンを備える、請求項26から28のいずれか一項に記載のデバイス。
- 前記流体排出機構は、拡張可能なネジを備える、請求項26から29のいずれか一項に記載のデバイス。
- 前記流体排出機構は、膨張可能な袋を備える、請求項26から30のいずれか一項に記載のデバイス。
- 前記流体排出機構は、圧縮ガスを備える、請求項26から31のいずれか一項に記載のデバイス。
- 前記流体排出機構は、真空を備える、請求項26から32のいずれか一項に記載のデバイス。
- 前記マイクロニードルのうちの少なくともいくつかは、中実である、請求項26から33のいずれか一項に記載のデバイス。
- 前記対象は、ヒトである、請求項1から34のいずれか一項に記載のデバイス。
- 前記貯蔵チャンバと前記インタフェースとを含有する前記デバイスの一部分は、該デバイスから取外し可能であり、および前記外部装置と係合可能である、請求項1から35のいずれか一項に記載のデバイス。
- 前記外部装置は、分析デバイスの一部分である、請求項1から36のいずれか一項に記載のデバイス。
- 前記分析デバイスは、自動化されている、請求項37に記載のデバイス。
- 前記インタフェースは、前記デバイスから流体を除去するための除去機構をさらに備える、請求項1から38のいずれか一項に記載のデバイス。
- 前記除去機構は、ピペットを備える、請求項39に記載のデバイス。
- 前記除去機構は、真空を備える、請求項39または40のいずれか一項に記載のデバイス。
Applications Claiming Priority (13)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US29454310P | 2010-01-13 | 2010-01-13 | |
| US61/294,543 | 2010-01-13 | ||
| US33453310P | 2010-05-13 | 2010-05-13 | |
| US33452910P | 2010-05-13 | 2010-05-13 | |
| US61/334,533 | 2010-05-13 | ||
| US61/334,529 | 2010-05-13 | ||
| US35758210P | 2010-06-23 | 2010-06-23 | |
| US61/357,582 | 2010-06-23 | ||
| US36760710P | 2010-07-26 | 2010-07-26 | |
| US61/367,607 | 2010-07-26 | ||
| US37376410P | 2010-08-13 | 2010-08-13 | |
| US61/373,764 | 2010-08-13 | ||
| PCT/US2011/021131 WO2011088211A2 (en) | 2010-01-13 | 2011-01-13 | Sampling device interfaces |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015085864A Division JP6058063B2 (ja) | 2010-01-13 | 2015-04-20 | 試料採取デバイスインタフェース |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2013517061A JP2013517061A (ja) | 2013-05-16 |
| JP2013517061A5 JP2013517061A5 (ja) | 2014-02-13 |
| JP5826766B2 true JP5826766B2 (ja) | 2015-12-02 |
Family
ID=45755597
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012549079A Active JP5826766B2 (ja) | 2010-01-13 | 2011-01-13 | 試料採取デバイスインタフェース |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US20110172508A1 (ja) |
| EP (1) | EP2523603A2 (ja) |
| JP (1) | JP5826766B2 (ja) |
| CN (1) | CN102791197B (ja) |
| WO (1) | WO2011088211A2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11478175B1 (en) | 2021-10-20 | 2022-10-25 | Paulus Holdings Limited | Devices for collecting capillary blood and methods for same |
Families Citing this family (41)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9033898B2 (en) | 2010-06-23 | 2015-05-19 | Seventh Sense Biosystems, Inc. | Sampling devices and methods involving relatively little pain |
| US9295417B2 (en) | 2011-04-29 | 2016-03-29 | Seventh Sense Biosystems, Inc. | Systems and methods for collecting fluid from a subject |
| US20110105952A1 (en) * | 2009-10-30 | 2011-05-05 | Seventh Sense Biosystems, Inc. | Relatively small devices applied to the skin, modular systems, and methods of use thereof |
| EP2408372B1 (en) | 2009-03-02 | 2019-01-09 | Seventh Sense Biosystems, Inc. | Devices associated with blood sampling |
| WO2010101625A2 (en) * | 2009-03-02 | 2010-09-10 | Seventh Sense Biosystems, Inc. | Oxygen sensor |
| WO2012018486A2 (en) | 2010-07-26 | 2012-02-09 | Seventh Sense Biosystems, Inc. | Rapid delivery and/or receiving of fluids |
| US9041541B2 (en) | 2010-01-28 | 2015-05-26 | Seventh Sense Biosystems, Inc. | Monitoring or feedback systems and methods |
| US20120277629A1 (en) | 2011-04-29 | 2012-11-01 | Seventh Sense Biosystems, Inc. | Systems and methods for collection and/or manipulation of blood spots or other bodily fluids |
| US20120016308A1 (en) | 2010-07-16 | 2012-01-19 | Seventh Sense Biosystems, Inc. | Low-pressure packaging for fluid devices |
| US20120039809A1 (en) | 2010-08-13 | 2012-02-16 | Seventh Sense Biosystems, Inc. | Systems and techniques for monitoring subjects |
| WO2012064802A1 (en) | 2010-11-09 | 2012-05-18 | Seventh Sense Biosystems, Inc. | Systems and interfaces for blood sampling |
| ES2597081T3 (es) | 2011-04-29 | 2017-01-13 | Seventh Sense Biosystems, Inc. | Entrega y/o recepción de fluidos |
| US20130158468A1 (en) | 2011-12-19 | 2013-06-20 | Seventh Sense Biosystems, Inc. | Delivering and/or receiving material with respect to a subject surface |
| CA3026548C (en) * | 2013-04-15 | 2022-01-04 | Becton, Dickinson And Company | Medical device for collection of a biological sample |
| JP6339663B2 (ja) * | 2013-04-15 | 2018-06-06 | ベクトン・ディキンソン・アンド・カンパニーBecton, Dickinson And Company | 生体液採集装置、および、生体液採集検査システム |
| MX368793B (es) * | 2013-04-15 | 2019-10-16 | Becton Dickinson Co | Dispositivo de recogida de fluidos biologicos y sistema de separacion y analisis de fluidos biologicos. |
| WO2015009970A1 (en) | 2013-07-18 | 2015-01-22 | Erythron Llc | Spectroscopic measurements with parallel array detector |
| WO2015131151A2 (en) | 2014-02-28 | 2015-09-03 | Erythron, Llc | Method and apparatus for determining markers of health by analysis of blood |
| CN106153379A (zh) * | 2015-04-02 | 2016-11-23 | 赵正芳 | 一种颗粒状物料取样设备 |
| EP3282937A4 (en) | 2015-04-14 | 2018-11-21 | Nueon Inc. | Method and apparatus for determining markers of health by analysis of blood |
| ES2908909T3 (es) * | 2015-06-19 | 2022-05-04 | Becton Dickinson Co | Dispositivo de recogida de fluido biológico |
| US10371606B2 (en) | 2015-07-21 | 2019-08-06 | Theraos IP Company, LLC | Bodily fluid sample collection and transport |
| CN115161178A (zh) | 2015-09-09 | 2022-10-11 | 集联健康有限公司 | 用于样品收集、稳定化和保存的系统、方法和装置 |
| HUE064082T2 (hu) | 2016-01-19 | 2024-02-28 | Hoffmann La Roche | Érzékelõösszeállítás és eljárás legalább egy analit testfolyadékban való érzékelésére |
| WO2017165403A1 (en) | 2016-03-21 | 2017-09-28 | Nueon Inc. | Porous mesh spectrometry methods and apparatus |
| ES2947231T3 (es) * | 2016-06-22 | 2023-08-03 | Hoffmann La Roche | Dispositivo médico para insertar de forma transcutánea un elemento insertable en un tejido corporal |
| US10653349B2 (en) | 2016-10-18 | 2020-05-19 | International Business Machines Corporation | Diagnostic apparatus |
| AU2017347902B2 (en) * | 2016-10-31 | 2023-02-23 | Dexcom, Inc. | Transcutaneous analyte sensor systems and methods |
| WO2018085699A1 (en) | 2016-11-04 | 2018-05-11 | Nueon Inc. | Combination blood lancet and analyzer |
| CN106482306B (zh) * | 2016-12-13 | 2021-12-17 | 福建工程学院 | 一种照片档案出库控制系统及控制方法 |
| JP2018134392A (ja) | 2017-01-10 | 2018-08-30 | ドローブリッジ ヘルス,インコーポレイテッド | サンプル収集のためのデバイス、システム、及び方法 |
| WO2019155386A1 (en) * | 2018-02-06 | 2019-08-15 | NGageIT Digital Health, Inc. | Portable devices and methods for detecting, identifying and quantifying amounts of subcutaneously injected compounds |
| EP3962363A1 (en) | 2019-05-02 | 2022-03-09 | YourBio Health, Inc. | Devices and methods for receiving fluids |
| US11877847B2 (en) * | 2020-01-31 | 2024-01-23 | Taiwan Semiconductor Manufacturing Company, Ltd. | Biosensor apparatus |
| WO2021222805A1 (en) | 2020-05-01 | 2021-11-04 | Seventh Sense Biosystems, Inc. | Vacuum generation devices and methods |
| CN112790768B (zh) * | 2021-03-26 | 2022-02-22 | 德诺杰亿(北京)生物科技有限公司 | 一次性采血器 |
| US20220330860A1 (en) * | 2021-04-14 | 2022-10-20 | Neoenta LLC | Dermal patch system |
| US20220369957A1 (en) * | 2021-05-19 | 2022-11-24 | Satio, Inc. | Self-contained dermal patch for blood analysis |
| CN113210024B (zh) * | 2021-06-03 | 2022-04-08 | 北京中科生仪科技有限公司 | 基于pcr的连续进液装置 |
| US11964121B2 (en) | 2021-10-13 | 2024-04-23 | Satio, Inc. | Mono dose dermal patch for pharmaceutical delivery |
| US11877848B2 (en) | 2021-11-08 | 2024-01-23 | Satio, Inc. | Dermal patch for collecting a physiological sample |
Family Cites Families (106)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3711606A (en) * | 1970-09-02 | 1973-01-16 | Crown Zellerbach Corp | Enhancing tissue penetration of physiologically active steroidal agents with dmso |
| US3711602A (en) * | 1970-10-30 | 1973-01-16 | Crown Zellerbach Corp | Compositions for topical application for enhancing tissue penetration of physiologically active agents with dmso |
| US4253460A (en) * | 1979-07-27 | 1981-03-03 | E. R. Squibb & Sons, Inc. | Ostomy adhesive |
| US4437567A (en) * | 1982-01-27 | 1984-03-20 | The Kendall Company | Sterile package and method of making |
| US4627445A (en) * | 1985-04-08 | 1986-12-09 | Garid, Inc. | Glucose medical monitoring system |
| US5279294A (en) * | 1985-04-08 | 1994-01-18 | Cascade Medical, Inc. | Medical diagnostic system |
| US4908404A (en) * | 1988-08-22 | 1990-03-13 | Biopolymers, Inc. | Synthetic amino acid-and/or peptide-containing graft copolymers |
| US5858188A (en) * | 1990-02-28 | 1999-01-12 | Aclara Biosciences, Inc. | Acrylic microchannels and their use in electrophoretic applications |
| US6436078B1 (en) * | 1994-12-06 | 2002-08-20 | Pal Svedman | Transdermal perfusion of fluids |
| US5345070A (en) * | 1992-09-25 | 1994-09-06 | Cobe Laboratories, Inc. | Radio frequency tubing sealer |
| US5379895A (en) * | 1993-09-13 | 1995-01-10 | Minnesota Mining And Manufacturing Company | Package for surgical device |
| US5582184A (en) * | 1993-10-13 | 1996-12-10 | Integ Incorporated | Interstitial fluid collection and constituent measurement |
| US5885211A (en) * | 1993-11-15 | 1999-03-23 | Spectrix, Inc. | Microporation of human skin for monitoring the concentration of an analyte |
| US5636640A (en) * | 1995-02-06 | 1997-06-10 | Volunteers For Medical Engineering | Liquid sampling and test apparatus |
| US5879367A (en) * | 1995-09-08 | 1999-03-09 | Integ, Inc. | Enhanced interstitial fluid collection |
| AU7015096A (en) * | 1995-09-08 | 1997-04-09 | Integ, Inc. | Body fluid sampler |
| US5653739A (en) * | 1995-09-13 | 1997-08-05 | Empi, Inc. | Electronic pain feedback system and method |
| US20020068357A1 (en) * | 1995-09-28 | 2002-06-06 | Mathies Richard A. | Miniaturized integrated nucleic acid processing and analysis device and method |
| DE19540950A1 (de) | 1995-11-03 | 1997-05-07 | Bayer Ag | Unter Einsatz von Recycling-Polyolen hergestellte Polyurethan-Formkörper, ein Verfahren zu deren Herstellung sowie deren Verwendung |
| US6015392A (en) * | 1996-05-17 | 2000-01-18 | Mercury Diagnostics, Inc. | Apparatus for sampling body fluid |
| US5879311A (en) * | 1996-05-17 | 1999-03-09 | Mercury Diagnostics, Inc. | Body fluid sampling device and methods of use |
| US6340354B1 (en) * | 1996-05-17 | 2002-01-22 | Christopher L Rambin | Automated compulsory blood extraction system |
| US6230051B1 (en) * | 1996-06-18 | 2001-05-08 | Alza Corporation | Device for enhancing transdermal agent delivery or sampling |
| US6361944B1 (en) * | 1996-07-29 | 2002-03-26 | Nanosphere, Inc. | Nanoparticles having oligonucleotides attached thereto and uses therefor |
| US5714390A (en) * | 1996-10-15 | 1998-02-03 | Bio-Tech Imaging, Inc. | Cartridge test system for the collection and testing of blood in a single step |
| US6071251A (en) * | 1996-12-06 | 2000-06-06 | Abbott Laboratories | Method and apparatus for obtaining blood for diagnostic tests |
| US7590549B2 (en) * | 1996-12-23 | 2009-09-15 | Health Hero Network, Inc. | Network media access control system for encouraging patient compliance with a treatment plan |
| US6527716B1 (en) * | 1997-12-30 | 2003-03-04 | Altea Technologies, Inc. | Microporation of tissue for delivery of bioactive agents |
| AU8238998A (en) * | 1997-07-07 | 1999-02-08 | Loctite (R&D) Limited | A container for anaerobic products |
| US5876675A (en) * | 1997-08-05 | 1999-03-02 | Caliper Technologies Corp. | Microfluidic devices and systems |
| US20020013538A1 (en) * | 1997-09-30 | 2002-01-31 | David Teller | Method and apparatus for health signs monitoring |
| US5857973A (en) * | 1997-09-30 | 1999-01-12 | Siemens Medical Systems, Inc. | Fuzzy logic tissue flow determination system |
| US6706000B2 (en) * | 1997-11-21 | 2004-03-16 | Amira Medical | Methods and apparatus for expressing body fluid from an incision |
| CA2317777C (en) * | 1998-01-08 | 2005-05-03 | Sontra Medical, Inc. | Sonophoretic enhanced transdermal transport |
| US6059736A (en) * | 1998-02-24 | 2000-05-09 | Tapper; Robert | Sensor controlled analysis and therapeutic delivery system |
| US6192890B1 (en) * | 1998-03-31 | 2001-02-27 | David H Levy | Changeable tattoos |
| JP3382853B2 (ja) * | 1998-04-09 | 2003-03-04 | 松下電器産業株式会社 | 体液検査装置 |
| ATE245937T1 (de) * | 1998-05-13 | 2003-08-15 | Cygnus Therapeutic Systems | Überwachung physiologischer analyte |
| US6503231B1 (en) * | 1998-06-10 | 2003-01-07 | Georgia Tech Research Corporation | Microneedle device for transport of molecules across tissue |
| EP1109594B1 (en) * | 1998-08-31 | 2004-10-27 | Johnson & Johnson Consumer Companies, Inc. | Electrotransport device comprising blades |
| SE9900378D0 (sv) * | 1999-02-05 | 1999-02-05 | Forskarpatent I Syd Ab | Gels with shape memory |
| US6368563B1 (en) * | 1999-03-12 | 2002-04-09 | Integ, Inc. | Collection well for body fluid tester |
| WO2000062857A1 (en) * | 1999-04-16 | 2000-10-26 | Johnson & Johnson Consumer Companies, Inc. | Electrotransport delivery system comprising internal sensors |
| CA2376128C (en) * | 1999-06-04 | 2009-01-06 | Georgia Tech Research Corporation | Devices and methods for enhanced microneedle penetration of biological barriers |
| US7133717B2 (en) * | 1999-08-25 | 2006-11-07 | Johnson & Johnson Consumer Companies, Inc. | Tissue electroperforation for enhanced drug delivery and diagnostic sampling |
| JP2001249996A (ja) * | 1999-12-28 | 2001-09-14 | Sony Corp | ホームドクターシステム、血液収納用カプセルおよび注射装置 |
| US6706159B2 (en) * | 2000-03-02 | 2004-03-16 | Diabetes Diagnostics | Combined lancet and electrochemical analyte-testing apparatus |
| US6465002B1 (en) * | 2000-03-13 | 2002-10-15 | Brown University Research Foundation | Liquid crystalline polymers |
| US6506168B1 (en) * | 2000-05-26 | 2003-01-14 | Abbott Laboratories | Apparatus and method for obtaining blood for diagnostic tests |
| US6537243B1 (en) * | 2000-10-12 | 2003-03-25 | Abbott Laboratories | Device and method for obtaining interstitial fluid from a patient for diagnostic tests |
| US6685921B2 (en) * | 2000-10-25 | 2004-02-03 | The Procter & Gamble Company | Dental care compositions |
| US20050282774A1 (en) * | 2000-10-31 | 2005-12-22 | Eek Bjorn C | Method and pharmaceutical to treat spinal discs |
| US6890338B1 (en) * | 2001-02-27 | 2005-05-10 | Origin Medsystems, Inc. | Method and apparatus for performing anastomosis using ring having tines with weak sections |
| US6591124B2 (en) * | 2001-05-11 | 2003-07-08 | The Procter & Gamble Company | Portable interstitial fluid monitoring system |
| US6503209B2 (en) * | 2001-05-18 | 2003-01-07 | Said I. Hakky | Non-invasive focused energy blood withdrawal and analysis system |
| US6721586B2 (en) * | 2001-06-12 | 2004-04-13 | Lifescan, Inc. | Percutaneous biological fluid sampling and analyte measurement devices and methods |
| US7001344B2 (en) * | 2001-06-12 | 2006-02-21 | Pelikan Technologies, Inc. | Blood sampling device with diaphragm actuated lancet |
| US6501976B1 (en) * | 2001-06-12 | 2002-12-31 | Lifescan, Inc. | Percutaneous biological fluid sampling and analyte measurement devices and methods |
| WO2003026733A2 (en) * | 2001-09-28 | 2003-04-03 | Biovalve Technologies, Inc. | Microneedle with membrane |
| US6689100B2 (en) * | 2001-10-05 | 2004-02-10 | Becton, Dickinson And Company | Microdevice and method of delivering or withdrawing a substance through the skin of an animal |
| US7429258B2 (en) * | 2001-10-26 | 2008-09-30 | Massachusetts Institute Of Technology | Microneedle transport device |
| WO2003049610A1 (en) * | 2001-12-06 | 2003-06-19 | University Of Virginia Patent Foundation | An apparatus for fluid transport and related method thereof |
| AU2002357002A1 (en) * | 2001-12-17 | 2003-06-30 | Powderject Research Limited | Diagnostic sensing apparatus |
| US7004928B2 (en) * | 2002-02-08 | 2006-02-28 | Rosedale Medical, Inc. | Autonomous, ambulatory analyte monitor or drug delivery device |
| DE20213607U1 (de) * | 2002-02-21 | 2003-07-03 | Hartmann Paul Ag | Blutanalysegerät zur Bestimmung eines Analyten |
| US7115108B2 (en) * | 2002-04-02 | 2006-10-03 | Becton, Dickinson And Company | Method and device for intradermally delivering a substance |
| US20040058458A1 (en) * | 2002-04-18 | 2004-03-25 | The Regents Of The University Of Michigan | Modulated chemical sensors |
| US8372016B2 (en) * | 2002-04-19 | 2013-02-12 | Sanofi-Aventis Deutschland Gmbh | Method and apparatus for body fluid sampling and analyte sensing |
| US20040010207A1 (en) * | 2002-07-15 | 2004-01-15 | Flaherty J. Christopher | Self-contained, automatic transcutaneous physiologic sensing system |
| CA2497154C (en) * | 2002-08-29 | 2012-01-03 | Becton, Dickinson And Company | Substance delivery via a rotating microabrading surface |
| US20050070819A1 (en) * | 2003-03-31 | 2005-03-31 | Rosedale Medical, Inc. | Body fluid sampling constructions and techniques |
| US20050038669A1 (en) * | 2003-05-02 | 2005-02-17 | Orametrix, Inc. | Interactive unified workstation for benchmarking and care planning |
| US7393345B2 (en) * | 2003-07-18 | 2008-07-01 | Chang-Ming Yang | Sterilized safety syringe |
| WO2005017571A2 (en) * | 2003-07-31 | 2005-02-24 | Skymoon Research & Development | Optical in vivo analyte probe using embedded intradermal particles |
| US20050069925A1 (en) * | 2003-08-15 | 2005-03-31 | Russell Ford | Microprocessors, devices, and methods for use in monitoring of physiological analytes |
| US20050054907A1 (en) * | 2003-09-08 | 2005-03-10 | Joseph Page | Highly portable and wearable blood analyte measurement system |
| JP4682144B2 (ja) * | 2003-10-31 | 2011-05-11 | アルザ・コーポレーシヨン | 微小突起列のための自己−作動性アプリケーター |
| US20060036187A1 (en) * | 2004-06-30 | 2006-02-16 | Hester Vos | Devices, systems and methods for extracting bodily fluid and monitoring an analyte therein |
| US20060001551A1 (en) * | 2004-06-30 | 2006-01-05 | Ulrich Kraft | Analyte monitoring system with wireless alarm |
| KR20070043768A (ko) * | 2004-07-01 | 2007-04-25 | 비보메디칼 인코포레이티드 | 비-침습성 포도당 측정 |
| US20060030790A1 (en) * | 2004-08-06 | 2006-02-09 | Braig James R | Sample element with barrier material and vacuum |
| US20060058602A1 (en) * | 2004-08-17 | 2006-03-16 | Kwiatkowski Krzysztof C | Interstitial fluid analyzer |
| US7767017B2 (en) | 2004-11-10 | 2010-08-03 | The Regents Of The University Of Michigan | Multi-phasic nanoparticles |
| US20070054119A1 (en) * | 2005-03-04 | 2007-03-08 | Piotr Garstecki | Systems and methods of forming particles |
| US8206650B2 (en) * | 2005-04-12 | 2012-06-26 | Chromedx Inc. | Joint-diagnostic spectroscopic and biosensor meter |
| US20070031283A1 (en) * | 2005-06-23 | 2007-02-08 | Davis Charles Q | Assay cartridges and methods for point of care instruments |
| US20070004989A1 (en) * | 2005-06-29 | 2007-01-04 | Parvinder Dhillon | Device for transdermal sampling |
| US7609155B2 (en) * | 2005-08-25 | 2009-10-27 | Hinkamp Thomas J | System providing medical personnel with immediate critical data for emergency treatments |
| US20070066934A1 (en) * | 2005-09-19 | 2007-03-22 | Transport Pharmaceuticals, Inc. | Electrokinetic delivery system and methods therefor |
| RU2008116614A (ru) * | 2005-09-26 | 2009-11-10 | Конинклейке Филипс Электроникс Н.В. (Nl) | Отбор проб вещества и/или доставка вещества через кожу |
| US20080014627A1 (en) * | 2005-12-02 | 2008-01-17 | Cabochon Aesthetics, Inc. | Devices and methods for selectively lysing cells |
| ES2327963T3 (es) * | 2005-12-23 | 2009-11-05 | Unomedical A/S | Dispositivo de inyeccion. |
| WO2007149310A2 (en) | 2006-06-16 | 2007-12-27 | The Regents Of The University Of Michigan | Multiphasic biofunctional nano-components and methods for use thereof |
| US20080077430A1 (en) * | 2006-09-25 | 2008-03-27 | Singer Michael S | Systems and methods for improving medication adherence |
| JP4333724B2 (ja) * | 2006-10-05 | 2009-09-16 | セイコーエプソン株式会社 | 液滴吐出ヘッド、液滴吐出装置、液滴吐出ヘッドの製造方法及び液滴吐出装置の製造方法 |
| US8968272B2 (en) * | 2006-10-06 | 2015-03-03 | Lipocosm Llc | Closed system and method for atraumatic, low pressure, continuous harvesting, processing, and grafting of lipoaspirate |
| JP2008099992A (ja) * | 2006-10-20 | 2008-05-01 | Olympus Corp | 採血装置 |
| IL185737A0 (en) * | 2007-09-05 | 2008-01-06 | Sindolor Medical Ltd | A device and method for piercing a patient's skin with an injector whilst reducing pain caused by the piercing |
| WO2009105564A2 (en) * | 2008-02-19 | 2009-08-27 | Xvasive, Inc. | Acupuncture and acupressure therapies |
| EP2408372B1 (en) * | 2009-03-02 | 2019-01-09 | Seventh Sense Biosystems, Inc. | Devices associated with blood sampling |
| US9033898B2 (en) * | 2010-06-23 | 2015-05-19 | Seventh Sense Biosystems, Inc. | Sampling devices and methods involving relatively little pain |
| JP2012524065A (ja) * | 2009-04-17 | 2012-10-11 | ゼノポート,インコーポレーテッド | GABAB受容体リガンドとしてのγ−アミノ酪酸誘導体 |
| US20130018279A1 (en) * | 2009-09-01 | 2013-01-17 | Pathway Genomics | "blood sample collection apparatus and kits" |
| US20120016308A1 (en) * | 2010-07-16 | 2012-01-19 | Seventh Sense Biosystems, Inc. | Low-pressure packaging for fluid devices |
| EP2954916A3 (en) * | 2010-08-13 | 2016-04-20 | Seventh Sense Biosystems, Inc. | Clinical and/or consumer techniques and devices |
| US20120039809A1 (en) * | 2010-08-13 | 2012-02-16 | Seventh Sense Biosystems, Inc. | Systems and techniques for monitoring subjects |
-
2011
- 2011-01-13 JP JP2012549079A patent/JP5826766B2/ja active Active
- 2011-01-13 WO PCT/US2011/021131 patent/WO2011088211A2/en active Application Filing
- 2011-01-13 US US13/006,165 patent/US20110172508A1/en not_active Abandoned
- 2011-01-13 EP EP11700780A patent/EP2523603A2/en not_active Withdrawn
- 2011-01-13 CN CN201180013052.7A patent/CN102791197B/zh active Active
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11478175B1 (en) | 2021-10-20 | 2022-10-25 | Paulus Holdings Limited | Devices for collecting capillary blood and methods for same |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2011088211A3 (en) | 2011-12-01 |
| WO2011088211A2 (en) | 2011-07-21 |
| US20110172508A1 (en) | 2011-07-14 |
| CN102791197A (zh) | 2012-11-21 |
| JP2013517061A (ja) | 2013-05-16 |
| CN102791197B (zh) | 2016-03-23 |
| EP2523603A2 (en) | 2012-11-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5826766B2 (ja) | 試料採取デバイスインタフェース | |
| JP6058063B2 (ja) | 試料採取デバイスインタフェース | |
| JP5806236B2 (ja) | 流体の急速送達および/また採取 | |
| US20230309873A1 (en) | Systems and interfaces for blood sampling | |
| US20210369150A1 (en) | Relatively small devices applied to the skin, modular systems, and methods of use thereof | |
| US20220257158A1 (en) | Plasma or serum production and removal of fluids under reduced pressure | |
| US20210259599A1 (en) | Systems and methods for collecting fluid from a subject | |
| EP2493536B1 (en) | Relatively small devices applied to the skin, modular systems, and methods of use thereof | |
| US20120271125A1 (en) | Devices and methods for delivery and/or withdrawal of fluids and preservation of withdrawn fluids |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20131216 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20131216 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20141020 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20141022 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20150120 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20150309 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20150309 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20150309 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150420 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20150929 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20151014 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5826766 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| S533 | Written request for registration of change of name |
Free format text: JAPANESE INTERMEDIATE CODE: R313533 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |