JP5421908B2 - 短時間作用型フェニルアルキルアミンカルシウムチャネルブロッカーおよびその使用 - Google Patents
短時間作用型フェニルアルキルアミンカルシウムチャネルブロッカーおよびその使用 Download PDFInfo
- Publication number
- JP5421908B2 JP5421908B2 JP2010513245A JP2010513245A JP5421908B2 JP 5421908 B2 JP5421908 B2 JP 5421908B2 JP 2010513245 A JP2010513245 A JP 2010513245A JP 2010513245 A JP2010513245 A JP 2010513245A JP 5421908 B2 JP5421908 B2 JP 5421908B2
- Authority
- JP
- Japan
- Prior art keywords
- lower alkyl
- methyl
- ethyl
- dimethoxyphenyl
- benzoate
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/275—Nitriles; Isonitriles
- A61K31/277—Nitriles; Isonitriles having a ring, e.g. verapamil
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/215—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids
- A61K31/216—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acids having aromatic rings, e.g. benactizyne, clofibrate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/26—Cyanate or isocyanate esters; Thiocyanate or isothiocyanate esters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/275—Nitriles; Isonitriles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/06—Antiarrhythmics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C229/00—Compounds containing amino and carboxyl groups bound to the same carbon skeleton
- C07C229/02—Compounds containing amino and carboxyl groups bound to the same carbon skeleton having amino and carboxyl groups bound to acyclic carbon atoms of the same carbon skeleton
- C07C229/34—Compounds containing amino and carboxyl groups bound to the same carbon skeleton having amino and carboxyl groups bound to acyclic carbon atoms of the same carbon skeleton the carbon skeleton containing six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C229/00—Compounds containing amino and carboxyl groups bound to the same carbon skeleton
- C07C229/38—Compounds containing amino and carboxyl groups bound to the same carbon skeleton having amino groups bound to acyclic carbon atoms and carboxyl groups bound to carbon atoms of six-membered aromatic rings of the same carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C255/00—Carboxylic acid nitriles
- C07C255/01—Carboxylic acid nitriles having cyano groups bound to acyclic carbon atoms
- C07C255/32—Carboxylic acid nitriles having cyano groups bound to acyclic carbon atoms having cyano groups bound to acyclic carbon atoms of a carbon skeleton containing at least one six-membered aromatic ring
- C07C255/42—Carboxylic acid nitriles having cyano groups bound to acyclic carbon atoms having cyano groups bound to acyclic carbon atoms of a carbon skeleton containing at least one six-membered aromatic ring the carbon skeleton being further substituted by singly-bound nitrogen atoms, not being further bound to other hetero atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C255/00—Carboxylic acid nitriles
- C07C255/01—Carboxylic acid nitriles having cyano groups bound to acyclic carbon atoms
- C07C255/32—Carboxylic acid nitriles having cyano groups bound to acyclic carbon atoms having cyano groups bound to acyclic carbon atoms of a carbon skeleton containing at least one six-membered aromatic ring
- C07C255/42—Carboxylic acid nitriles having cyano groups bound to acyclic carbon atoms having cyano groups bound to acyclic carbon atoms of a carbon skeleton containing at least one six-membered aromatic ring the carbon skeleton being further substituted by singly-bound nitrogen atoms, not being further bound to other hetero atoms
- C07C255/43—Carboxylic acid nitriles having cyano groups bound to acyclic carbon atoms having cyano groups bound to acyclic carbon atoms of a carbon skeleton containing at least one six-membered aromatic ring the carbon skeleton being further substituted by singly-bound nitrogen atoms, not being further bound to other hetero atoms the carbon skeleton being further substituted by singly-bound oxygen atoms
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Emergency Medicine (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Urology & Nephrology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Neurology (AREA)
- Vascular Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Description
カルシウムチャネルブロッカー(CCB)は、例えば高血圧、狭心症、および心不整脈等の数種の心血管障害を含む種々の疾患のコントロールにおいて重要な治療的価値を有する化学的に多様な種類の化合物であり、細胞のカルシウムチャネルを調節することによって細胞内へのカルシウムの流入を抑制するか、または遅くさせる異種の薬剤群を含む。これらのチャネルを通してのカルシウムの流入によって電気機械的カップリングプロセスが開始し、最終的に筋肉の収縮に到る。心臓および血管の平滑筋細胞へのカルシウムの侵入を調節する能力は、それぞれ狭心症および高血圧の治療への強力な治療的アプローチである。同様に、心組織および伝達系へのカルシウムの流入を遮断することで、特定の型の不整脈を制御するための有用なアプローチが提供される。
血清エステラーゼは、膨大な数の構造的に多様な薬剤の加水分解による生体内変化において重要な役割を果たしている。これらの酵素は、エステル結合を有するほとんどの治療薬の薬物動態学的挙動の主たる決定因子である。血清エステラーゼは、有機リン酸エステルとの相互作用に基づいて3つの群、A-、B-、およびC-エステラーゼに分類される(De Vrieseら, Endocrinology (2004) 145, No. 11, 4997-5005)。アリールエステラーゼ/パラオキソナーゼを含むA-エステラーゼは、有機リン酸エステルを速やかに加水分解する。アセチルコリンエステラーゼ、ブチリルコリンエステラーゼ、および非特異的カルボキシルエステラーゼを含むB-エステラーゼは有機リン酸エステルによって阻害される。アセチルエステラーゼ等のC-エステラーゼは有機リン酸エステルと相互作用しない。
狭心症は、不均衡な酸素需給比率のために心臓の一領域への血中酸素供給が不十分となる症状である。狭心症は通常、感受性がある患者で激しい運動または情動的ストレスの後に起こるが、これは冠動脈の脈管構造が心臓への十分な酸素灌流を提供できないことによる。冠動脈の狭窄は、動脈硬化または血管の冠攣縮性(vasospastic)狭窄の結果として、潜在的な原因であることがしばしばである。狭心症の持続時間は通常15分未満であり、典型的にはニトログリセリンの舌下投与による治療で症状が軽減する。ニトログリセリンおよび他の硝酸エステルは、酸化窒素(NO)の放出を通じて血管拡張を誘導し、それによって血圧低下を引き起こす。
不整脈、あるいは異常な心拍リズムは、興奮および心臓への伝導が異常であることによって引き起こされる。不整脈の発生のメカニズムは、以下の3つのグループに分類される:(1) 興奮異常、(2) 興奮伝導異常、および(3) 興奮異常および興奮伝導異常の組み合わせ。
高血圧は、通常140 (心臓収縮時)/90 (心臓拡張時)を超える高い血圧として定義される。高血圧状態は、外科的処置の実施と関連して生じ得る。例えば、手術前、手術中、および手術後において、血圧調節は重要である。高血圧から生じる高血圧性クリーゼ(hypertensive crisis)は、更に2つのカテゴリー:切迫(urgent)および緊急(emergency)に分けられる。緊急性高血圧性クリーゼの症状はより重篤であり、脳腫脹、卒中、肺水腫、心臓発作または他の症状が含まれ得る。切迫および緊急の双方のカテゴリーにおいて、高血圧性クリーゼは深刻な血圧上昇を伴い、そして起こり得る合併症(すなわち卒中または臓器および組織への損傷)を防止するために速やかな処置を必要とする。
−a、b、c、d、e、f、およびgはそれぞれ独立して-CH2-、-O-、-S-、または単結合であり;
−R11、R12、R13、R14、R15、R16、R17、およびR20はそれぞれ独立してH、ハロゲン、置換されていても良い低級アルキル、置換されていても良い低級アルコキシアルキル、またはCO2R10であり;
−R10はそれぞれ独立してH、置換されていても良い低級アルキル、または置換されていても良い低級アルコキシアルキルであり;
−R18はH、CN、またはCO2R10であり;そして
−R19はCH3、H、またはハロゲンである]。
−R11、R12、R13、R14、R15、R16、R17、およびR20はそれぞれ独立して:H、低級アルキル、-CO2(低級アルキル)で置換された低級アルキル、-CO2(低級アルコキシアルキル)で置換された低級アルキル、フッ素もしくは塩素で置換された低級アルキル、低級アルコキシアルキル、−CO2(低級アルキル)で置換された低級アルコキシアルキル、-CO2(低級アルコキシアルキル)で置換された低級アルコキシアルキル、フッ素もしくは塩素で置換された低級アルコキシアルキル、またはCO2R10であり;そして
−R10はそれぞれ独立して低級アルキルまたは低級アルコキシアルキルである。
−a、b、c、d、e、f、およびgはそれぞれ独立して-CH2-、-O-、-S-、または単結合であり;
−R10はそれぞれ独立してH、置換されていても良い低級アルキル、または置換されていても良い低級アルコキシアルキルであり;
−R11、R12、R13、R14、R15、R16、R17、およびR20はそれぞれ独立してH、ハロゲン、置換されていても良い低級アルキル、置換されていても良い低級アルコキシアルキル、またはCO2R10であり;
−R18はH、CN、またはCO2R10であり;そして
−R19はCH3、H、またはハロゲンである]。
−R11、R12、R13、R14、R15、R16、R17、およびR20はそれぞれ独立して:H、低級アルキル、-CO2(低級アルキル)で置換された低級アルキル、-CO2(低級アルコキシアルキル)で置換された低級アルキル、フッ素もしくは塩素で置換された低級アルキル、低級アルコキシアルキル、-CO2(低級アルキル)で置換された低級アルコキシアルキル、-CO2(低級アルコキシアルキル)で置換された低級アルコキシアルキル、フッ素もしくは塩素で置換された低級アルコキシアルキル、またはCO2R10であり;そして
−R10はそれぞれ独立して低級アルキルまたは低級アルコキシアルキルである。
−a、b、c、d、e、f、およびgはそれぞれ独立して-CH2-、-O-、-S-、または単結合であり;
−R10はそれぞれ独立してH、置換されていても良い低級アルキル、または置換されていても良い低級アルコキシアルキルであり;
−R11、R12、R13、R14、R15、R16、R17、およびR20はそれぞれ独立してH、ハロゲン、置換されていても良い低級アルキル、置換されていても良い低級アルコキシアルキル、またはCO2R10であり;
−R18はH、CN、またはCO2R10であり;そして
−R19はCH3、H、またはハロゲンである]。
−R11、R12、R13、R14、R15、R16、R17、およびR20はそれぞれ独立して:H、低級アルキル、-CO2(低級アルキル)で置換された低級アルキル、-CO2(低級アルコキシアルキル)で置換された低級アルキル、フッ素もしくは塩素で置換された低級アルキル、低級アルコキシアルキル、-CO2(低級アルキル)で置換された低級アルコキシアルキル、-CO2(低級アルコキシアルキル)で置換された低級アルコキシアルキル、フッ素もしくは塩素で置換された低級アルコキシアルキル、またはCO2R10であり;そして
−R10はそれぞれ独立して低級アルキルまたは低級アルコキシアルキルである。
−a、b、c、d、e、f、およびgはそれぞれ独立して-CH2-、-O-、-S-、または単結合であり;
−R10はそれぞれ独立してH、置換されていても良い低級アルキル、または置換されていても良い低級アルコキシアルキルであり;
−R11、R12、R13、R14、R15、R16、R17、およびR20はそれぞれ独立してH、ハロゲン、置換されていても良い低級アルキル、置換されていても良い低級アルコキシアルキル、またはCO2R10であり;
−R18はH、CN、またはCO2R10であり;そして
−R19はCH3、H、またはハロゲンである]。
−R11、R12、R13、R14、R15、R16、R17、およびR20はそれぞれ独立して:H、低級アルキル、-CO2(低級アルキル)で置換された低級アルキル、-CO2(低級アルコキシアルキル)で置換された低級アルキル、フッ素もしくは塩素で置換された低級アルキル、低級アルコキシアルキル、-CO2(低級アルキル)で置換された低級アルコキシアルキル、-CO2(低級アルコキシアルキル)で置換された低級アルコキシアルキル、フッ素もしくは塩素で置換された低級アルコキシアルキル、またはCO2R10であり;そして
−R10はそれぞれ独立して低級アルキルまたは低級アルコキシアルキルである。
−a、b、c、d、e、f、およびgはそれぞれ独立して-CH2-、-O-、-S-、または単結合であり;
−R10はそれぞれ独立してH、置換されていても良い低級アルキル、または置換されていても良い低級アルコキシアルキルであり;
−R11、R12、R13、R14、R15、R16、R17、およびR20はそれぞれ独立してH、ハロゲン、置換されていても良い低級アルキル、置換されていても良い低級アルコキシアルキル、またはCO2R10であり;
−R18はH、CN、またはCO2R10であり;そして
−R19はCH3、H、またはハロゲンである]。
−R11、R12、R13、R14、R15、R16、R17、およびR20はそれぞれ独立して:H、低級アルキル、-CO2(低級アルキル)で置換された低級アルキル、-CO2(低級アルコキシアルキル)で置換された低級アルキル、フッ素もしくは塩素で置換された低級アルキル、低級アルコキシアルキル、-CO2(低級アルキル)で置換された低級アルコキシアルキル、-CO2(低級アルコキシアルキル)で置換された低級アルコキシアルキル、フッ素もしくは塩素で置換された低級アルコキシアルキル、またはCO2R10であり;そして
−R10はそれぞれ独立して低級アルキルまたは低級アルコキシアルキルである。
−虚血性心疾患;
−心不整脈;
−緊急治療室環境(emergency room setting)における高血圧性クリーゼ;
−手術前、手術中、または手術後の高血圧;
−再灌流後の非再灌流現象;および
−骨格筋血流低下と関連する疾患。
(a) 以下の構造を有する化合物、もしくは製薬上許容されるその付加塩、またはその任意のエナンチオマーもしくはジアステレオマーを含む医薬組成物:
−a、b、c、d、e、f、およびgはそれぞれ独立して-CH2-、-O-、-S-、または単結合であり;
−R10はそれぞれ独立してH、置換されていても良い低級アルキル、または置換されていても良い低級アルコキシアルキルであり;
−R11、R12、R13、R14、R15、R16、R17、およびR20はそれぞれ独立してH、ハロゲン、置換されていても良い低級アルキル、置換されていても良い低級アルコキシアルキル、またはCO2R10であり;
−R18はH、CN、またはCO2R10であり;そして
−R19はCH3、H、またはハロゲンである。]
(b) 以下よりなる群から選択される症状の治療のための(a)の医薬組成物を使用するための説明書:
−虚血性心疾患;
−心不整脈;
−緊急治療室環境における高血圧性クリーゼ;
−手術前、手術中、または手術後の高血圧;
−再灌流後の非再灌流現象;および
−骨格筋血流低下と関連する疾患。
−R11、R12、R13、R14、R15、R16、R17、およびR20はそれぞれ独立して:H、低級アルキル、-CO2(低級アルキル)で置換された低級アルキル、-CO2(低級アルコキシアルキル)で置換された低級アルキル、フッ素もしくは塩素で置換された低級アルキル、低級アルコキシアルキル、-CO2(低級アルキル)で置換された低級アルコキシアルキル、-CO2(低級アルコキシアルキル)で置換された低級アルコキシアルキル、フッ素もしくは塩素で置換された低級アルコキシアルキル、またはCO2R10であり;そして
−R10はそれぞれ独立して低級アルキルまたは低級アルコキシアルキルである。
−a、b、c、d、e、f、およびgはそれぞれ独立して-CH2-、-O-、-S-、または単結合であり;
−R11、R12、R13、R14、R15、R16、R17、およびR20はそれぞれ独立して:H、低級アルキル、-CO2(低級アルキル)で置換された低級アルキル、-CO2(低級アルコキシアルキル)で置換された低級アルキル、フッ素もしくは塩素で置換された低級アルキル、低級アルコキシアルキル、-CO2(低級アルキル)で置換された低級アルコキシアルキル、-CO2(低級アルコキシアルキル)で置換された低級アルコキシアルキル、フッ素もしくは塩素で置換された低級アルコキシアルキル、またはCO2R10であり;
−R10はそれぞれ独立して低級アルキルまたは低級アルコキシアルキルであり;
−R18はH、CN、またはCO2R10であり;そして
−R19はCH3またはHであり;
ここで、化合物はベラパミル、ガロパミル、エモパミル(emopamil)、メパミル(mepamil)、またはデバパミル(devapamil)ではない。
(a)R17は低級アルキルであり;
(b)R18はCNまたはCO2R10であり;
(c)-a-R11、-b-R12、または-c-R13の少なくとも1つは独立して
(i)-O-(低級アルキル);
(ii)-O-( -CO2(低級アルキル)で置換された低級アルキル);
(iii)-O-( -CO2(低級アルコキシアルキル)で置換された低級アルキル);
(iv)-O-(フッ素もしくは塩素で置換された低級アルキル);
(v)-O-(低級アルコキシアルキル);
(vi)-O-( -CO2(低級アルキル)で置換された低級アルコキシアルキル);
(vii)-O-( -CO2(低級アルコキシアルキル)で置換された低級アルコキシアルキル);
(viii)-O-(フッ素もしくは塩素で置換された低級アルキル);または
(ix)-(単結合)-CO2R10であり;そして
(d)-d-R14、-e-R15、-f-R16、または-g-R20の少なくとも1つは独立して
(i)-O-(低級アルキル);
(ii)-O-( -CO2(低級アルキル)で置換された低級アルキル);
(iii)-O-( -CO2(低級アルコキシアルキル)で置換された低級アルキル);
(iv)-O-(フッ素もしくは塩素で置換された低級アルキル);
(v)-O-(低級アルコキシアルキル);
(vi)-O-( -CO2(低級アルキル)で置換された低級アルコキシアルキル);
(vii)-O-( -CO2(低級アルコキシアルキル)で置換された低級アルコキシアルキル);
(viii)-O-(フッ素もしくは塩素で置換された低級アルキル);または
(ix)-(単結合)-CO2R10である。
本明細書において用いる用語「狭心症」は、虚血性心疾患のために感じる胸部の不快感をいう。狭心症は、その主たる根本的原因が動脈硬化である安定狭心症、その根本的原因が冠動脈の一過性の血管痙攣によるものである冠攣縮性狭心症(異型狭心症またはプリンツメタル狭心症とも呼ばれる)、または動脈硬化性プラークの破裂部位における血小板凝集によって引き起こされる不安定狭心症に分類することができる。
−a、b、c、d、e、f、およびgはそれぞれ独立して-CH2-、-O-、-S-、または単結合であり;
−R11、R12、R13、R14、R15、R16、R17、およびR20はそれぞれ独立して:H、低級アルキル、-CO2(低級アルキル)で置換された低級アルキル、-CO2(低級アルコキシアルキル)で置換された低級アルキル、フッ素もしくは塩素で置換された低級アルキル、低級アルコキシアルキル、-CO2(低級アルキル)で置換された低級アルコキシアルキル、-CO2(低級アルコキシアルキル)で置換された低級アルコキシアルキル、フッ素もしくは塩素で置換された低級アルコキシアルキル、またはCO2R10であり;
−R10はそれぞれ独立して低級アルキルまたは低級アルコキシアルキルであり;
−R18はH、CN、またはCO2R10であり;そして
−R19はCH3またはHである。
本発明において使用される化合物(例えば式Iを有する化合物)の望ましい投与経路としては、舌下、バッカル、経皮、鼻内、吸入、局所、および非経口(例えば静脈内)投与が挙げられる。化合物は望ましくは製薬上許容される担体と共に投与する。本明細書に記載した障害の治療のために製剤化される、本明細書に記載した化合物の医薬製剤もまた、本発明の一部である。
本発明に従って使用するための製薬上許容される局所製剤は、本発明の化合物(例えば式Iの化合物)を薬学的に使用することができる調製物に加工することを容易にする添加剤および助剤を含む1種以上の生理的に許容される担体を使用して、従来の方法で製剤化することができる。適切な製剤化は、選択された所望の製品に依存する。製剤の非限定的な例を以下に示す。
本発明における使用のための化合物(例えば式Iの化合物)は、製薬上許容される局所(例えば経皮)製剤で投与することができる。本発明の原理に従う局所的治療計画は、組成物を皮膚の投与部位に1日1〜数回直接適用することを含み得る。更に含まれるのは、薬用パッチの形態での送達方法である。
・試験マトリクスはプールされたヒト血漿である;
・試験する類似体の濃度は10μMである;
・二重に、混合液を37℃でインキュベートする;
・0、0.5、1、2および30分の時点で等量のアセトニトリルを添加し、インキュベーションを停止する;そして
・抽出したサンプルを、既に確立された一般的な方法を用いて(+)-または(-)-ESI LC/MSで分析する。
・データを時間ゼロのサンプルの%として表す。
本発明の化合物は、本明細書に記載したようにして調製することができる。特に、スキーム1に示す方法は、式Iの化合物の合成のために使用することができる。化合物は、一般構造Aのハロゲン置換化合物を、一般構造Bのアミンと共に加熱して調製することができる。反応は、反応物質を合わせてそのまま、または溶媒、例えばジクロロメタンもしくはテトラヒドロフランの存在下で加熱することによって実施することができる。ヨウ化ナトリウム等の触媒を添加しても、あるいは添加しなくても良い。
−a、b、c、d、e、f、およびgはそれぞれ独立して-CH2-、-O-、-S-、または単結合であり;
−R11、R12、R13、R14、R15、R16、R17、およびR20はそれぞれ独立して:H、低級アルキル, -CO2(低級アルキル)で置換された低級アルキル、-CO2(低級アルコキシアルキル)で置換された低級アルキル、フッ素もしくは塩素で置換された低級アルキル、低級アルコキシアルキル、-CO2(低級アルキル)で置換された低級アルコキシアルキル、-CO2(低級アルコキシアルキル)で置換された低級アルコキシアルキル、フッ素もしくは塩素で置換された低級アルコキシアルキル、またはCO2R10であり;
−R10はそれぞれ独立して低級アルキルまたは低級アルコキシアルキルであり;
−R18はH、CN、またはCO2R10であり;そして
−R19はCH3またはHである。
1a:ジメチル2-(3-ブロモプロピル)-2-(3,4-ジメトキシフェニル)マロネート;
1b:メチル5-ブロモ-2-シアノ-2-(3,4-ジメトキシフェニル)ペンタノエート;
1c:エチル5-ブロモ-2-シアノ-2-(3,4-ジメトキシフェニル)ペンタノエート;
1d:イソプロピル5-ブロモ-2-シアノ-2-(3,4-ジメトキシフェニル)ペンタノエート;
1e:メチル5-クロロ-2-(3,4-ジメトキシフェニル)-2-イソプロピルペンタノエート;
1f:5-ブロモ-2-(3,4-ジメトキシフェニル)-2-イソプロピルペンタンニトリル;
1g:1-エチル3-メチル2-(3-ブロモプロピル)-2-(3,4-ジメトキシフェニル)マロネート;
1h:ジエチル2-(3-ブロモプロピル)-2-(3,4-ジメトキシフェニル)マロネート;
1i:1-tert-ブチル3-メチル2-(3-ブロモプロピル)-2-(3,4-ジメトキシフェニル)マロネート;
1j:1-イソプロピル3-メチル2-(3-ブロモプロピル)-2-(3,4-ジメトキシフェニル)マロネート;
1k:メチル5-ブロモ-2-(3,4-ジメトキシフェニル)-2-メチルペンタノエート;
1l:エチル5-ブロモ-2-(3,4-ジメトキシフェニル)-2-メチルペンタノエート;
1m:メチル5-ブロモ-2-(3,4-ジメトキシフェニル)-2-エチルペンタノエート;
1n:メチル4-(6-ブロモ-3-シアノ-2-メチルヘキサン-3-イル)ベンゾエート;
1o:エチル5-ブロモ-2-(3,4-ジメトキシフェニル)-2-エチルペンタノエート;
1p:イソプロピル5-ブロモ-2-(3,4-ジメトキシフェニル)-2-メチルペンタノエート;
1q:メチル4-(5-ブロモ-2-シアノ-1-メトキシ-1-オキソペンタン-2-イル)ベンゾエート;
1r:メチル3-(6-ブロモ-3-シアノ-2-メチルヘキサン-3-イル)ベンゾエート;
1s:メチル3-(5-ブロモ-2-シアノ-1-メトキシ-1-オキソペンタン-2-イル)ベンゾエート;
1t:エチル4-(6-ブロモ-3-シアノ-2-メチルヘキサン-3-イル)ベンゾエート;および
1u:イソプロピル4-(6-ブロモ-3-シアノ-2-メチルヘキサン-3-イル)ベンゾエート。
2a:2-(3,4-ジメトキシフェニル)-N-メチルエタンアミン;
2b:メチル4-(2-(メチルアミノ)エチル)ベンゾエート;
2c:エチル4-(2-(メチルアミノ)エチル)ベンゾエート;
2d:メチル3-(2-(メチルアミノ)エチル)ベンゾエート;
2e:エチル3-(2-(メチルアミノ)エチル)ベンゾエート;
2f:イソプロピル3-(2-(メチルアミノ)エチル)ベンゾエート;
2g:プロピル3-(2-(メチルアミノ)エチル)ベンゾエート;
2h:メチル2-メトキシ-5-(2-(メチルアミノ)エチル)ベンゾエート;
2i:ジメチル5-(2-(メチルアミノ)エチル)イソフタレート;
2j:メチル2-(4-(2-(メチルアミノ)エチル)フェノキシ)アセテート;
2k:エチル2-(4-(2-(メチルアミノ)エチル)フェノキシ)アセテート;
2l:メチル2-(3-(2-(メチルアミノ)エチル)フェノキシ)アセテート;
2m:ブチル3-(2-(メチルアミノ)エチル)ベンゾエート;
2n:2-メトキシエチル3-(2-(メチルアミノ)エチル)ベンゾエート;および
2o:メチル2-(3-(2-(メチルアミノ)エチル)フェニル)アセテート;
3a:ジメチル2-(3-((3,4-ジメトキシフェネチル)(メチル)アミノ)プロピル)-2-(3,4-ジメトキシフェニル)マロネート;
3b:メチル5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-(3,4-ジメトキシフェニル)ペンタノエート;
3c:メチル2-シアノ-5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-(3,4-ジメトキシフェニル)ペンタノエート;
3d:エチル2-シアノ-5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-(3,4-ジメトキシフェニル)ペンタノエート;
3e:イソプロピル2-シアノ-5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-(3,4-ジメトキシフェニル)ペンタノエート;
3f:メチル5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-(3,4-ジメトキシフェニル)-2-イソプロピルペンタノエート;
3g:メチル4-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート;
3h:メチル4-(2-((4-(3,4-ジメトキシフェニル)-4-(メトキシカルボニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート;
3i:メチル4-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メトキシ-5-オキソペンチル)(メチル)アミノ)エチル)ベンゾエート;
3j:1-エチル3-メチル2-(3-((3,4-ジメトキシフェネチル)(メチル)アミノ)プロピル)-2-(3,4-ジメトキシフェニル)マロネート;
3k:ジエチル2-(3-((3,4-ジメトキシフェネチル)(メチル)アミノ)プロピル)-2-(3,4-ジメトキシフェニル)マロネート;
3l:1-tert-ブチル3-メチル 2-(3-((3,4-ジメトキシフェネチル)(メチル)アミノ)プロピル)-2-(3,4-ジメトキシフェニル)マロネート;
3m:1-イソプロピル3-メチル 2-(3-((3,4-ジメトキシフェネチル)(メチル)アミノ)プロピル)-2-(3,4-ジメトキシフェニル)マロネート;
3n:エチル4-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メトキシ-5-オキソペンチル)(メチル)アミノ)エチル)ベンゾエート;
3o:メチル3-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート;
3p:メチル4-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-エトキシ-5-オキソペンチル)(メチル)アミノ)エチル)ベンゾエート;
3q:エチル4-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-エトキシ-5-オキソペンチル)(メチル)アミノ)エチル)ベンゾエート;
3r:エチル4-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート;
3s:メチル5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-(3,4-ジメトキシフェニル)-2-メチルペンタノエート;
3t:メチル3-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メトキシ-5-オキソペンチル)(メチル)アミノ) エチル)ベンゾエート;
3u:メチル3-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-エトキシ-5-オキソペンチル)(メチル)アミノ) エチル)ベンゾエート;
3v:エチル5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-(3,4-ジメトキシフェニル)-2-メチルペンタノエート;
3w:エチル4-(2-((4-(3,4-ジメトキシフェニル)-4-(メトキシカルボニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート;
3x:メチル5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-(3,4-ジメトキシフェニル)-2-エチルペンタノエート;
3y:メチル4-(3-シアノ-6-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-メチルヘキサン-3-イル)ベンゾエート;
3z:エチル3-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート;
3aa:エチル5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-(3,4-ジメトキシフェニル)-2-エチルペンタノエート;
3ab:イソプロピル5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-(3,4-ジメトキシフェニル)-2-メチルペンタノエート;
3ac:メチル4-(2-シアノ-5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-1-メトキシ-1-オキソペンタン-2-イル)ベンゾエート;
3ad:メチル3-(3-シアノ-6-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-メチルヘキサン-3-イル)ベンゾエート;
3ae:イソプロピル3-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート;
3af:プロピル3-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート;
3ag:メチル5-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)-2-メトキシベンゾエート;
3ah:メチル3-(2-シアノ-5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-1-メトキシ-1-オキソペンタン-2-イル)ベンゾエート;
3ai:ジメチル5-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル) (メチル)アミノ)エチル)イソフタレート;
3aj:メチル3-(2-((4-(3,4-ジメトキシフェニル)-4-(メトキシカルボニル)-5-メチルヘキシル) (メチル)アミノ)エチル)ベンゾエート;
3ak:メチル2-(4-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル) アミノ)エチル)フェノキシ)アセテート;
3al:エチル2-(4-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル) アミノ)エチル)フェノキシ)アセテート;
3am:メチル3-(3-シアノ-6-((4-(メトキシカルボニル)フェネチル)(メチル)アミノ)-2-メチルヘキサン-3-イル)ベンゾエート;
3an:エチル4-(3-シアノ-6-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-メチルヘキサン-3-イル)ベンゾエート;
3ao:イソプロピル4-(3-シアノ-6-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-メチルヘキサン-3-イル)ベンゾエート;
3ap:メチル3-(2-((4-シアノ-4-(3-(メトキシカルボニル)フェニル)-5-メチルヘキシル) (メチル)アミノ)エチル)ベンゾエート;
3aq:メチル2-(3-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル) (メチル)アミノ)エチル)フェノキシ)アセテート;
3ar:ブチル3-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル) (メチル)アミノ)エチル)ベンゾエート;
3as:2-メトキシエチル 3-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル) (メチル)アミノ)エチル)ベンゾエート;
3at:メチル2-(3-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル) アミノ)エチル)フェニル)アセテート;および
3au:メチル2-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート。
実施例1 5-ブロモ-2-(3,4-ジメトキシフェニル)-2-イソプロピルペンタンニトリル (1f)
方法A 段階1:9.99g (56.4mmol)の(3,4-ジメトキシフェニル)アセトニトリルを141mLのテトラヒドロフラン (THF) に溶解した-30℃の溶液に、56.4mL(56.4mmol)のナトリウムビス(トリメチルシリル)アミド (NaHMDS、THF中1.0 M)をゆっくり添加した。混合液を-30℃で10分間攪拌し、10.6mL (113.0mmol) の2-ブロモプロパンを添加した。混合液を2時間(h)加熱還流し、次いで22℃で約16時間放置した。NH4Clの飽和水溶液を添加し、混合液を酢酸エチルで抽出した。有機相を塩水で洗浄し、乾燥し(Na2SO4)、濾過し、エバポレートした。残渣をシリカゲル上のフラッシュクロマトグラフィーにより、まずヘキサンで溶出し、次いで15% 酢酸エチル/ヘキサンまで次第に上昇させて精製し、油状の2-(3,4-ジメトキシフェニル)-3-メチルブタンニトリルを得た。
1a:ジメチル2-(3-ブロモプロピル)-2-(3,4-ジメトキシフェニル)マロネート;段階1で、(3,4-ジメトキシフェニル)-酢酸メチルエステルを(3,4-ジメトキシフェニル)アセトニトリルの代わりに使用し、炭酸ジメチルを2-ブロモプロパンの代わりに使用し、水素化ナトリウムをNaHMDSの代わりに使用した。段階2で、水素化ナトリウムをNaHMDSの代わりに使用した。
1b:メチル5-ブロモ-2-シアノ-2-(3,4-ジメトキシフェニル)ペンタノエート;段階1で、炭酸ジメチルを2-ブロモプロパンの代わりに使用し、水素化ナトリウムをNaHMDSの代わりに使用した。
1c:エチル5-ブロモ-2-シアノ-2-(3,4-ジメトキシフェニル)ペンタノエート;段階1で、炭酸ジエチルを2-ブロモプロパンの代わりに使用し、水素化ナトリウムをNaHMDSの代わりに使用した。
1d:イソプロピル5-ブロモ-2-シアノ-2-(3,4-ジメトキシフェニル)ペンタノエート;段階1で、イソプロピルクロロホルメートを2-ブロモプロパンの代わりに使用した。
1e:メチル5-クロロ-2-(3,4-ジメトキシフェニル)-2-イソプロピルペンタノエート;段階1で、(3,4-ジメトキシフェニル)-酢酸メチルエステルを(3,4-ジメトキシフェニル)アセトニトリルの代わりに使用し、2-ヨードプロパンを2-ブロモプロパンの代わりに使用し、KHMDSをNaHMDSの代わりに使用した。段階2で、1-ブロモ-3-クロロプロパンを1,3-ジブロモプロパンの代わりに使用した。
1g:1-エチル3-メチル2-(3-ブロモプロピル)-2-(3,4-ジメトキシフェニル)マロネート;段階1で、(3,4-ジメトキシフェニル)-酢酸メチルエステルを(3,4-ジメトキシフェニル)アセトニトリルの代わりに使用し、エチルクロロホルメートを2-ブロモプロパンの代わりに使用し、リチウムジイソプロピルアミド(LDA)をNaHMDSの代わりに使用した。段階2で、水素化ナトリウムをNaHMDSの代わりに使用した。
1h:ジエチル2-(3-ブロモプロピル)-2-(3,4-ジメトキシフェニル)マロネート;段階1で、(3,4-ジメトキシフェニル)-酢酸エチルエステルを(3,4-ジメトキシフェニル)アセトニトリルの代わりに使用し、エチルクロロホルメートを2-ブロモプロパンの代わりに使用し、リチウムジイソプロピルアミド(LDA)をNaHMDSの代わりに使用した。段階2で、水素化ナトリウムをNaHMDSの代わりに使用した。
1i:1-tert-ブチル3-メチル 2-(3-ブロモプロピル)-2-(3,4-ジメトキシフェニル)マロネート;段階1で、(3,4-ジメトキシフェニル)-酢酸メチルエステルを(3,4-ジメトキシフェニル)アセトニトリルの代わりに使用し、二炭酸ジ-tert-ブチルを2-ブロモプロパンの代わりに使用し、LDAをNaHMDSの代わりに使用した。段階2で、水素化ナトリウムをNaHMDSの代わりに使用した。
1j:1-イソプロピル3-メチル 2-(3-ブロモプロピル)-2-(3,4-ジメトキシフェニル)マロネート;段階1で、(3,4-ジメトキシフェニル)-酢酸メチルエステルを(3,4-ジメトキシフェニル)アセトニトリルの代わりに使用し、イソプロピルクロロホルメートを2-ブロモプロパンの代わりに使用し、LDAをNaHMDSの代わりに使用した。段階2で、水素化ナトリウムをNaHMDSの代わりに使用した。
1k:メチル5-ブロモ-2-(3,4-ジメトキシフェニル)-2-メチルペンタノエート;段階1で、(3,4-ジメトキシフェニル)-酢酸メチルエステルを(3,4-ジメトキシフェニル)アセトニトリルの代わりに使用し、硫酸ジメチルを2-ブロモプロパンの代わりに使用した。
1l:エチル5-ブロモ-2-(3,4-ジメトキシフェニル)-2-メチルペンタノエート;段階1で、(3,4-ジメトキシフェニル)-酢酸エチルエステルを(3,4-ジメトキシフェニル)アセトニトリルの代わりに使用し、硫酸ジメチルを2-ブロモプロパンの代わりに使用した。
1m:メチル5-ブロモ-2-(3,4-ジメトキシフェニル)-2-エチルペンタノエート;段階1で、(3,4-ジメトキシフェニル)-酢酸メチルエステルを(3,4-ジメトキシフェニル)アセトニトリルの代わりに使用し、硫酸ジエチルを2-ブロモプロパンの代わりに使用した。
1n:メチル4-(6-ブロモ-3-シアノ-2-メチルヘキサン-3-イル)ベンゾエート;段階1で、メチル4-(シアノメチル)ベンゾエートを(3,4-ジメトキシフェニル)アセトニトリルの代わりに使用した。段階2で、水素化ナトリウムをNaHMDSの代わりに使用した。
1o:エチル5-ブロモ-2-(3,4-ジメトキシフェニル)-2-エチルペンタノエート;段階1で、(3,4-ジメトキシフェニル)-酢酸エチルエステルを(3,4-ジメトキシフェニル)アセトニトリルの代わりに使用し、硫酸ジエチルを2-ブロモプロパンの代わりに使用した。
1p:イソプロピル5-ブロモ-2-(3,4-ジメトキシフェニル)-2-メチルペンタノエート;段階1で、(3,4-ジメトキシフェニル)-酢酸イソプロピルエステルを(3,4-ジメトキシフェニル)アセトニトリルの代わりに使用し、硫酸ジメチルを2-ブロモプロパンの代わりに使用した。
1q:メチル4-(5-ブロモ-2-シアノ-1-メトキシ-1-オキソペンタン-2-イル)ベンゾエート;段階1で、メチル4-(シアノメチル)ベンゾエートを(3,4-ジメトキシフェニル)アセトニトリルの代わりに使用し、炭酸ジメチルを2-ブロモプロパンの代わりに使用した。段階2で、水素化ナトリウムをNaHMDSの代わりに使用した。
1r:メチル3-(6-ブロモ-3-シアノ-2-メチルヘキサン-3-イル)ベンゾエート;段階1で、メチル3-(シアノメチル)ベンゾエートを(3,4-ジメトキシフェニル)アセトニトリルの代わりに使用し、水素化ナトリウムをNaHMDSの代わりに使用した。段階2で、水素化ナトリウムをNaHMDSの代わりに使用した。
1s:メチル3-(5-ブロモ-2-シアノ-1-メトキシ-1-オキソペンタン-2-イル)ベンゾエート;段階1で、メチル3-(シアノメチル)ベンゾエートを(3,4-ジメトキシフェニル)アセトニトリルの代わりに使用し、炭酸ジメチルを2-ブロモプロパンの代わりに使用した。
1t:エチル4-(6-ブロモ-3-シアノ-2-メチルヘキサン-3-イル)ベンゾエート;エチル4-(1-シアノ-2-メチルプロピル)ベンゾエートは、メチル4-(1-シアノ-2-メチルプロピル)ベンゾエート(実施例14で記載する変換における中間体として得られるもの)のNaOH加水分解、続いてエタノールおよび触媒のH2SO4中で加熱することによるエステル化によって得られた。次いでこのエチルエステルに方法A、段階2の手法を行った。
1u:イソプロピル 4-(6-ブロモ-3-シアノ-2-メチルヘキサン-3-イル)ベンゾエート;イソプロピル4-(1-シアノ-2-メチルプロピル)ベンゾエートは、メチル4-(1-シアノ-2-メチルプロピル)ベンゾエート(実施例14に記載する変換における中間体として得られるもの)のNaOH加水分解、続いて2-プロパノールおよび触媒のH2SO4中で加熱することによるエステル化によって得られた。次いでこのイソプロピルエステルに方法A、段階2の手法を行った。
実施例22 メチル 4-(2-(メチルアミノ)エチル)ベンゾエート(2b)
2.02g (10.0mmol)の4-(2-アミノエチル)安息香酸塩酸塩を25mLのメタノールに溶解した溶液に1.5mLのH2SO4を添加した。混合液を加熱還流すると、1時間後に均一な溶液となった。溶液を約16時間還流し、22℃に冷却し、エバポレーションによって約10mLに濃縮した。溶液を100mLの水で希釈し、1N NaOHで塩基性として、100mLのジクロロメタン(DCM)で抽出した。水相をDCMで逆抽出した(4 x 100mL)。抽出物を合わせて乾燥し(Na2SO4)、エバポレートして無色の油のメチル4-(2-アミノエチル)ベンゾエートを得た。この物質を次の変換に直接使用した。
2c:エチル4-(2-(メチルアミノ)エチル)ベンゾエート;2.72g (13.5 mmol)の4-(2-アミノエチル)安息香酸塩酸塩を67.5mLの1N NaOHおよび30mLのジオキサンに溶解した溶液に、3.24g (14.9 mmol) の二炭酸ジ-tert-ブチル (BOC2O) を10mLのジオキサンに溶解した22℃の溶液を添加した。溶液を2時間22℃で攪拌し、更に1.66g (7.61mmol) のBOC2O を添加した。更に30分間攪拌した後、反応液を250mLの氷水中に注ぎ入れ、混合液を1N HClでpH 約2に酸性化し、250mLの酢酸エチルで抽出し、乾燥し(Na2SO4)、エバポレートして白色固体を得た。この固体を50mLの酢酸エチルから再結晶させ、過剰のBOC2Oを除去して白色固体の4-(2-(tert-ブトキシカルボニルアミノ)エチル) 安息香酸を得た。
2d:メチル3-(2-(メチルアミノ)エチル)ベンゾエート;5.71g (24.9mmol) のメチル3-ブロモメチルベンゾエートを36mLのメタノールに溶解した溶液に、2.11g (32.4 mmol)のシアン化カリウムを添加した。混合液を約16時間還流し、22℃に冷却して濾過した。濾液をエバポレートし、残渣をシリカゲル上のフラッシュクロマトグラフィーにより、まずヘキサンで溶出し、次いで15%酢酸エチル/ヘキサンまで次第に上昇させて精製し、メチル3-(シアノメチル)ベンゾエートを得た。
2e:エチル3-(2-(メチルアミノ)エチル)ベンゾエート;1.90g (10.6mmol) のメチル3-(2-アミノエチル)ベンゾエートを106mLの1N NaOHおよび50mLのジオキサンに溶解した溶液に、3.47g (15.9mmol) のBOC2Oを10mLのジオキサンに溶解した22℃の溶液を添加した。溶液を2時間22℃で攪拌し、次いで1N HClの添加によってpH 2に酸性化した。水性/有機性混合液を、固体のNaClと共に攪拌することで飽和させ、次いでDCMで抽出した(5 x 100mL)。有機抽出物を合わせて乾燥し(Na2SO4)、エバポレートして泡状白色固体の3-(2-(tert-ブトキシカルボニルアミノ)エチル)安息香酸を得、これを精製することなく続けて使用した。
2f:イソプロピル3-(2-(メチルアミノ)エチル)ベンゾエート;3-(2-(tert-ブトキシカルボニルアミノ)エチル)安息香酸からイソプロピル3-(2-(tert-ブトキシカルボニルアミノ)エチル)ベンゾエートへの変換は、2-ヨードプロパンおよび炭酸カリウムを用い、実施例23に記載したものと類似の方法で達成した。
2g:プロピル3-(2-(メチルアミノ)エチル)ベンゾエート;0.580g (1.98 mmol) のメチル3-(2-(tert-ブトキシカルボニル(メチル)アミノ)エチル)ベンゾエートを5mLのジオキサンに溶解した溶液に、10mLの1N NaOHを添加した。混合液を22℃で2時間攪拌し、次いで1N HClでpH 約1に酸性化した。次いで混合液をDCMで抽出し(4 x 25 mL)、乾燥し(Na2SO4)、エバポレートして泡状白色固体の3-(2-(tert-ブトキシカルボニル(メチル)アミノ)エチル)安息香酸を得、これを精製することなく続けて使用した。
2h:メチル2-メトキシ-5-(2-(メチルアミノ)エチル)ベンゾエート;1.01g (6.09mmol) の5-ホルミル-2-ヒドロキシ安息香酸を25mLのアセトンに溶解した溶液に、4.25g (30.5 mmol) の炭酸カリウムおよび1.15mL (18.3mmol)のヨードメタンを添加した。混合液を約16時間加熱還流し、22℃に冷却し、濾過した。回収した固体をアセトンで洗浄した。濾液を合わせ、エバポレートし、残渣をシリカゲル上のフラッシュクロマトグラフィーにより、ヘキサンおよび酢酸エチルの混合液で溶出して精製し、灰色がかった白色固体のメチル5-ホルミル-2-メトキシベンゾエートを得た。
2i:ジメチル 5-(2-(メチルアミノ)エチル)イソフタレート;
3.15g (14.1mmol) のジメチル 5-(ヒドロキシメチル)イソフタレート(Dimick 等, J. Am. Chem. Soc. (1999) 121, No. 44, 10286-10296に記載のようにして調製)を60mLのDCMに溶解した溶液に、7.34g (84.4mmol)のMnO2を添加した。混合液を還流下で約16時間攪拌し、更に3.5gのMnO2を添加した。還流を更に6時間継続し、混合液を冷却し、セライトを通して濾過し、エバポレートして白色固体のジメチル 5-ホルミルイソフタレートを得、これを精製することなく続けて使用した。
2j:メチル2-(4-(2-(メチルアミノ)エチル)フェノキシ)アセテート;
方法D:1.00g (5.75 mmol) の4-(2-アミノエチル)フェノールを5mLのジオキサンに溶解した22℃の溶液に、2mLの1N NaOH、続いて2mLのジオキサンに溶解した1.88g (8.62 mmol) のBOC2Oを添加した。混合液を22℃で2時間攪拌し、次いで25mLの飽和NaHCO3を添加して中和し、pHを約7.5-8とした。水相を分離し、DCMで抽出した(3 x 50 mL)。有機相を合わせ、乾燥し(Na2SO4)、エバポレートした。残渣をシリカゲル上のフラッシュクロマトグラフィーにより、ヘキサンおよび酢酸エチルの混合液で溶出して精製し、無色の油のtert-ブチル4-ヒドロキシフェネチルカルバメートを得た。
方法E:1.11g (4.70 mmol) のtert-ブチル4-ヒドロキシフェネチルカルバメートを20mLのDMFに溶解した22℃の溶液に、1.3g (9.4mmol) の炭酸カリウムおよび0.700mL(5.87mmol)の臭化ベンジルを添加した。混合液を約16時間22℃で攪拌し、100mLの水で希釈し、酢酸エチルで抽出した (3 x 75 mL)。有機相を合わせ、100mLの1N HClで洗浄し、乾燥し(Na2SO4)、エバポレートした。残渣をシリカゲル上のフラッシュクロマトグラフィーにより、ヘキサンおよび酢酸エチルの混合液で溶出して精製し、油のtert-ブチル4-(ベンジルオキシ)フェネチルカルバメートを得、これはその後真空下で固形化した。
2k:エチル2-(4-(2-(メチルアミノ)エチル)フェノキシ)アセテート;tert-ブチル 4-ヒドロキシフェネチル(メチル)カルバメートから2kへの変換は、方法E(臭化ベンジルの代わりにエチル2-ブロモアセテートを、DMFの代わりにアセトンを使用)、続いて方法Bの段階2と類似の方法で達成した。
2l:メチル2-(3-(2-(メチルアミノ)エチル)フェノキシ)アセテート;2-(3-メトキシフェニル)エタンアミンからtert-ブチル3-メトキシフェネチル(メチル)カルバメートへの変換は、方法D、続いて方法Bの段階1と類似の方法で達成した。
2m:ブチル3-(2-(メチルアミノ)エチル)ベンゾエート;3-(2-(tert-ブトキシカルボニル(メチル)アミノ)エチル)安息香酸からブチル3-(2-(tert-ブトキシカルボニル(メチル)アミノ)エチル)ベンゾエートへの変換は、1-ヨードブタンおよび炭酸カリウムを用い、実施例23に記載したものと類似の方法で達成した。ブチル3-(2-(tert-ブトキシカルボニル(メチル)アミノ)エチル)ベンゾエートから2mへの変換は、方法Bの段階2に記載したものと類似の方法で達成した。
2n:2-メトキシエチル3-(2-(メチルアミノ)エチル)ベンゾエート;3-(2-(tert-ブトキシカルボニル(メチル)アミノ)エチル)安息香酸から2-メトキシエチル3-(2-(tert-ブトキシカルボニル(メチル)アミノ)エチル)ベンゾエートへの変換は、1-ブロモ-2-メトキシエタンおよび炭酸カリウムを用い、実施例23に記載したものと類似の方法で達成した。
2o:メチル2-(3-(2-(メチルアミノ)エチル)フェニル)アセテート
2-(3-ブロモフェニル)エタンアミンからtert-ブチル3-ブロモフェネチル(メチル)カルバメートへの変換は、方法C、続いて方法Bの段階1と類似の方法で達成した。
本発明において例示する式1の化合物の調製は、方法Fの一般的方法によって実施した。方法Fの条件は、以下の実施例に記載する化合物の合成に好適である。場合によって、反応はTHFの蒸発なしに行い、または代わりに他の好適な非反応性有機溶媒を使用した。場合によって、反応を促進するために2〜3個のヨウ化ナトリウムの結晶を添加し、またはDIEA等の塩基を添加した。これらの変更は一般的方法の結果を大きく変えるものではなかった。
エチル4-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート(3r)
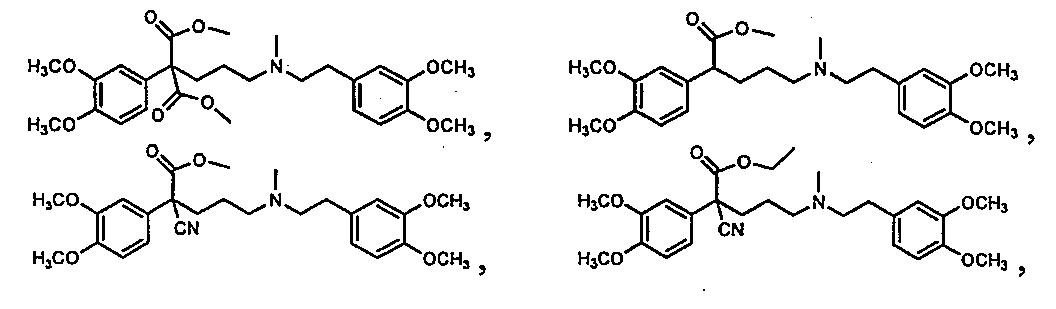
方法F:0.326g (0.961 mmol)の化合物1fを1mLのTHFに溶解した溶液、および0.292g (1.41mmol)の化合物2cを1mLのTHFに溶解した別の溶液を合わせた。得られた溶液を90℃の油浴中で加熱し、THFをゆっくりした窒素流下で蒸発させた。得られた混合液を85℃で18時間、窒素下で攪拌し、22℃に冷却して飽和NaHCO3および酢酸エチル間で分配した。有機相を乾燥し(Na2SO4)、エバポレートして、残渣をシリカゲル上のフラッシュクロマトグラフィーにより、まずDCMで溶出し、次いで2%メタノール/DCMまで次第に上昇させて精製し、化合物3rを無色の油として得た。MSの結果はM+H = 467。化合物3rのシュウ酸塩を酢酸エチルから再結晶させた。mp 111-112℃。
3a:ジメチル2-(3-((3,4-ジメトキシフェネチル)(メチル)アミノ)プロピル)-2-(3,4-ジメトキシフェニル)マロネート;1aを2aと反応させて3aを得た。MSの結果はM+H = 504。3aのシュウ酸塩を酢酸エチルから再結晶させた。mp 165-166℃。
3b:メチル5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-(3,4-ジメトキシフェニル)ペンタノエート;0.349g (0.694mmol)の3aを20mLのTHFに溶解した22℃の溶液に、0.281mL (6.94 mmol) のメタノール、続いて56mg (1.39 mmol) の NaH(鉱油中60%の分散液)を添加した。反応液を1時間還流し、22℃に冷却し、100mLのDCMで希釈した。混合液を50mLの飽和NaHCO3、50mLの水で洗浄し、乾燥し、エバポレートして油を得た。この油を、シリカゲル上のフラッシュクロマトグラフィーにより、まず2%メタノール/DCMで溶出し、次いで4%メタノール/DCMまで次第に上昇させて精製し、無色の油の3bを得た。MSの結果はM+H = 446。3rのシュウ酸塩を酢酸エチルから再結晶させた。mp 112-113.5℃。
3c:メチル2-シアノ-5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-(3,4-ジメトキシフェニル)ペンタノエート;1bを2aと反応させて3cを得た。MSの結果はM+H = 471。3cのシュウ酸塩を酢酸エチルから再結晶させた。mp 129-130℃。
3d:エチル2-シアノ-5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-(3,4-ジメトキシフェニル)ペンタノエート;1cを2aと反応させて3dを得た。MSの結果はM+H = 485。3dのシュウ酸塩を酢酸エチルから再結晶させた。mp 77-78℃。
3e:イソプロピル2-シアノ-5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-(3,4-ジメトキシフェニル)ペンタノエート;1dを2aと反応させて3eを得た。MSの結果はM+H = 499。3eのシュウ酸塩を酢酸エチルから再結晶させた。mp 66-67℃。
3f:メチル5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-(3,4-ジメトキシフェニル)-2-イソプロピルペンタノエート;1eを2aと反応させて3fを得た。MSの結果はM+H = 488。3fのシュウ酸塩を酢酸エチルから再結晶させた。mp 158-159℃。
3g:メチル4-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート;1fを2bと反応させて3gを得た。MSの結果はM+H = 453。3gのシュウ酸塩を酢酸エチルから再結晶させた。mp 130-131℃。
3h:メチル4-(2-((4-(3,4-ジメトキシフェニル)-4-(メトキシカルボニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート;1eを2bと反応させて3hを得た。MSの結果はM+H = 486。3hのシュウ酸塩を酢酸エチルから再結晶させた。mp 129-131℃。
3i:メチル4-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メトキシ-5-オキソペンチル)(メチル)アミノ)エチル)ベンゾエート;1bを2bと反応させて3iを得た。MSの結果はM+H = 469。3iのシュウ酸塩を酢酸エチルから再結晶させた。mp 80-83℃。
3j:1-エチル3-メチル2-(3-((3,4-ジメトキシフェネチル)(メチル)アミノ)プロピル)-2-(3,4-ジメトキシフェニル)マロネート;1gを2aと反応させて3jを得た。MSの結果はM+H = 518。3jのシュウ酸塩をイソプロパノール/エーテルから再結晶させた。mp 146-149℃。
3k:ジエチル2-(3-((3,4-ジメトキシフェネチル)(メチル)アミノ)プロピル)-2-(3,4-ジメトキシフェニル)マロネート;1hを2aと反応させて3kを得た。MSの結果はM+H = 532。3kのシュウ酸塩を酢酸エチル/エーテルから再結晶させた。mp 101-104℃。
3l:1-tert-ブチル3-メチル2-(3-((3,4-ジメトキシフェネチル)(メチル)アミノ)プロピル)-2-(3,4-ジメトキシフェニル)マロネート;化合物1iを2aと反応させて3lを得た。MSの結果はM+H = 546。化合物3lのシュウ酸塩を酢酸エチル/ヘキサンから再結晶させた。mp 161-163℃。
3m:1-イソプロピル3-メチル2-(3-((3,4-ジメトキシフェネチル)(メチル)アミノ)プロピル)-2-(3,4-ジメトキシフェニル)マロネート;1jを2aと反応させて3mを得た。MSの結果はM+H = 532。3mのシュウ酸塩をメタノール/エーテルから再結晶させた。mp 157-159℃。
3n:エチル4-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メトキシ-5-オキソペンチル)(メチル)アミノ)エチル)ベンゾエート;1bを2cと反応させて3nを得た。MSの結果はM+H = 483。3nのシュウ酸塩を酢酸エチルから再結晶させた。mp 88-89℃。
3o:メチル3-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート;1fを2dと反応させて3oを得た。MSの結果はM+H = 453。3oのシュウ酸塩を酢酸エチルから再結晶させた。mp 135-136℃。
3p:メチル4-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-エトキシ-5-オキソペンチル)(メチル)アミノ)エチル)ベンゾエート;1cを2bと反応させて3pを得た。MSの結果はM+H = 483。3pのシュウ酸塩を酢酸エチルから再結晶させた。mp 75-77℃。
3q:エチル4-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-エトキシ-5-オキソペンチル)(メチル)アミノ)エチル)ベンゾエート;1cを2cと反応させて3qを得た。MSの結果はM+H = 497。3qのシュウ酸塩を酢酸エチルから再結晶させた。mp 83-84℃。
3r:エチル4-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート;1fを2cと反応させて3rを得た。MSの結果はM+H = 467。3rのシュウ酸塩を酢酸エチルから再結晶させた。mp 111-112℃。
3s:メチル5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-(3,4-ジメトキシフェニル)-2-メチルペンタノエート;1kを2aと反応させて3sを得た。MSの結果はM+H = 460。3sのシュウ酸塩を酢酸エチルから再結晶させた。mp 88-89℃。
3t:メチル3-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メトキシ-5-オキソペンチル)(メチル)アミノ)エチル)ベンゾエート;1bを2dと反応させて3tを得た。MSの結果はM+H = 469。3tのシュウ酸塩を酢酸エチルから再結晶させた。mp 94-95℃。
3u:メチル3-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-エトキシ-5-オキソペンチル)(メチル)アミノ)エチル)ベンゾエート;1cを2dと反応させて3uを得た。MSの結果はM+H = 483。3uのシュウ酸塩を酢酸エチルから再結晶させた。mp 89-91℃。
3v:エチル5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-(3,4-ジメトキシフェニル)-2-メチルペンタノエート;化合物1lを2aと反応させて3vを得た。MSの結果はM+H = 474。3vのシュウ酸塩を酢酸エチルから再結晶させた。mp 118-121℃。
3w:エチル4-(2-((4-(3,4-ジメトキシフェニル)-4-(メトキシカルボニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート;1eを2cと反応させて3wを得た。MSの結果はM+H = 500。3wのシュウ酸塩を酢酸エチルから再結晶させた。mp 121-123℃。
3x:メチル5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-(3,4-ジメトキシフェニル)-2-エチルペンタノエート;1mを2aと反応させて3xを得た。MSの結果はM+H = 474。3xのシュウ酸塩をメタノール/酢酸エチルから再結晶させた。mp 148-150℃。
3y:メチル4-(3-シアノ-6-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-メチルヘキサン-3-イル)ベンゾエート;化合物1nを2aと反応させて3yを得た。MSの結果はM+H = 453。3yのシュウ酸塩をメタノール/エーテルから再結晶させた。mp 179-182℃。
3z:エチル3-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート;1fを2eと反応させて3zを得た。MSの結果はM+H = 467。3zのシュウ酸塩を酢酸エチルから再結晶させた。mp 128-129℃。
3aa:エチル5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-(3,4-ジメトキシフェニル)-2-エチルペンタノエート;1oを2aと反応させて3aaを得た。MSの結果はM+H = 488。3aaのシュウ酸塩をメタノール/酢酸エチルから再結晶させた。mp 122-124℃。
3ab:イソプロピル5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-(3,4-ジメトキシフェニル)-2-メチルペンタノエート;1pを2aと反応させて3abを得た。MSの結果はM+H = 488。3abのシュウ酸塩をメタノール/酢酸エチルから再結晶させた。mp 85-87℃。
3ac:メチル4-(2-シアノ-5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-1-メトキシ-1-オキソペンタン-2-イル)ベンゾエート;1qを2aと反応させて3acを得た。MSの結果はM+H = 469。3acのシュウ酸塩をメタノール/エーテルから再結晶させた。mp 133-136℃。
3ad:メチル3-(3-シアノ-6-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-メチルヘキサン-3-イル)ベンゾエート;1rを2aと反応させて3adを得た。MSの結果はM+H = 453。3adのシュウ酸塩をメタノール/エーテルから再結晶させた。mp 158-159℃。
3ae:イソプロピル3-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート;1fを2fと反応させて3aeを得た。MSの結果はM+H = 481。3aeのシュウ酸塩を酢酸エチルから再結晶させた。mp 130-132℃。
3af:プロピル3-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート;1fを2gと反応させて3afを得た。MSの結果はM+H = 481。3afのシュウ酸塩を酢酸エチルから再結晶させた。mp 110-114℃。
3ag:メチル5-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)-2-メトキシベンゾエート;1fを2hと反応させて3agを得た。MSの結果はM+H = 483。3agのシュウ酸塩を酢酸エチルから再結晶させた。mp 76-81℃。
3ah:メチル3-(2-シアノ-5-((3,4-ジメトキシフェネチル)(メチル)アミノ)-1-メトキシ-1-オキソペンタン-2-イル)ベンゾエート;1sを2aと反応させて3ahを得た。MSの結果はM+H = 469。3ahのシュウ酸塩をメタノール/エーテルから再結晶させた。mp 132-139℃。
3ai:ジメチル5-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)イソフタレート;1fを2iと反応させて3aiを得た。MSの結果はM+H = 511。3aiのシュウ酸塩をヘキサン/酢酸エチルから再結晶させた。mp 100-103℃。
3aj:メチル3-(2-((4-(3,4-ジメトキシフェニル)-4-(メトキシカルボニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート;1eを2dと反応させて3ajを得た。MSの結果はM+H = 486。3ajのシュウ酸塩を酢酸エチルから再結晶させた。mp 87-90℃。
3ak:メチル2-(4-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)フェノキシ)アセテート;1fを2jと反応させて3akを得た。MSの結果はM+H = 483。3akのシュウ酸塩を酢酸エチルから再結晶させた。
3al:エチル2-(4-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)フェノキシ)アセテート;1fを2kと反応させて3alを得た。MSの結果はM+H = 497。3alのシュウ酸塩を酢酸エチルから再結晶させた。
3am:メチル3-(3-シアノ-6-((4-(メトキシカルボニル)フェネチル)(メチル)アミノ)-2-メチルヘキサン-3-イル)ベンゾエート;1rを2bと反応させて3amを得た。MSの結果はM+H = 451。3amのシュウ酸塩をメタノール/エーテルから再結晶させた。mp 108-112℃。
3an:エチル4-(3-シアノ-6-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-メチルヘキサン-3-イル)ベンゾエート;1tを2aと反応させて3anを得た。MSの結果はM+H = 467。3anのシュウ酸塩をメタノール/エーテルから再結晶させた。mp 159-163℃。
3ao:イソプロピル4-(3-シアノ-6-((3,4-ジメトキシフェネチル)(メチル)アミノ)-2-メチルヘキサン-3-イル)ベンゾエート;1uを2aと反応させて3aoを得た。MSの結果はM+H = 481。3aoのシュウ酸塩をメタノール/エーテルから再結晶させた。mp 165-167℃。
3ap:メチル3-(2-((4-シアノ-4-(3-(メトキシカルボニル)フェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート;1rを2dと反応させて3apを得た。MSの結果はM+H = 451。3apのシュウ酸塩をメタノール/エーテルから再結晶させた。mp 129-136℃。
3aq:メチル2-(3-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)フェノキシ)アセテート;1fを2lと反応させて3aqを得た。MSの結果はM+H = 483。3aqのシュウ酸塩をメタノール/エーテルから再結晶させた。mp 96-100℃。
3ar:ブチル3-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート;1fを2mと反応させて3arを得た。MSの結果はM+H = 495。3arのシュウ酸塩をメタノール/エーテルから再結晶させた。mp 97-103℃。
3as:2-メトキシエチル3-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート;1fを2nと反応させて3asを得た。MSの結果はM+H = 497。3arのシュウ酸塩をメタノール/エーテルから再結晶させた。
3at:メチル2-(3-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)フェニル)アセテート;1fを2oと反応させて3atを得た。MSの結果はM+H = 467。3atのシュウ酸塩を酢酸エチルから再結晶させた。mp 77-82℃。
3au:メチル2-(2-((4-シアノ-4-(3,4-ジメトキシフェニル)-5-メチルヘキシル)(メチル)アミノ)エチル)ベンゾエート;1fをN-メチル-2-フェニルエタンアミンと反応させて2-(3,4-ジメトキシフェニル)-2-イソプロピル-5-(メチル(フェネチル)アミノ)ペンタンニトリルを得、これを更にLiang, C.D. 等, Tetrahedron Lett., (1986) 27, 1971-1974に報告された手法と類似の方法で反応させた。
カルシウムチャネル結合阻害定数 (Ki)を以下のようにして決定した。
本発明をその特定の実施形態と関連付けて記載したが、更なる改変が可能であり、本出願が、一般的に本発明の原理に従って本発明のいかなる変更、使用、または適応も包含することを意図するものであり、本明細書の開示からのこうした逸脱を含めることは本発明が関連する分野において公知または慣用の実務の範囲内のものであり、これを本明細書で示した必須の特徴に適用することができることは理解されるであろう。
Claims (7)
- 以下の式を有する化合物、もしくは製薬上許容されるその付加塩、またはその任意のエナンチオマーもしくはジアステレオマー
[式中、
−a、b、c、d、e、およびfは、それぞれ独立して、-O-または単結合であり、
−R11、R12、R13、R14、R15、およびR16 は、それぞれ独立して、H、低級アルキル、-CO2(低級アルキル)で置換された低級アルキル、またはCO2R10であり、
−R10はそれぞれ独立して低級アルキルまたは低級アルコキシアルキルであり、
−R 17 は低級アルキル、またはCO 2 R 10 であり、
−R18はCN、またはCO2R10であり、かつ
−R19はHであり、gは単結合であり、R 20 はHであり、
R 11 、R 12 、R 13 、R 14 、R 15 、R 16 、R 17 、およびR 18 の少なくとも1つが、CO 2 R 10 、または-CO 2 (低級アルキル)で置換された低級アルキルである]
を含有する医薬組成物。 - 以下のものである、請求項1記載の医薬組成物、
(a)R17が低級アルキルであり、
(b) -a-R11、-b-R12、または-c-R13の少なくとも1つが独立して、
(i) -O-(低級アルキル)、
(ii) -O-( -CO2(低級アルキル)で置換された低級アルキル)、
(iii) -O-( -CO2(低級アルコキシアルキル)で置換された低級アルキル)、
(iv) -O-(フッ素もしくは塩素で置換された低級アルキル)、
(v) -O-(低級アルコキシアルキル)、
(vi) -O-( -CO2(低級アルキル)で置換された低級アルコキシアルキル)、
(vii) -O-( -CO2(低級アルコキシアルキル)で置換された低級アルコキシアルキル)、
(viii) -O-(フッ素もしくは塩素で置換された低級アルキル)、または
(ix) -(単結合)-CO2R10であり、そして
(c) -d-R14、-e-R15、または-f-R16 の少なくとも1つが独立して、
(i) -O-(低級アルキル)、
(ii) -O-( -CO2(低級アルキル)で置換された低級アルキル)、
(iii) -O-( -CO2(低級アルコキシアルキル)で置換された低級アルキル)、
(iv) -O-(フッ素もしくは塩素で置換された低級アルキル)、
(v) -O-(低級アルコキシアルキル)、
(vi) -O-( -CO2(低級アルキル)で置換された低級アルコキシアルキル)、
(vii) -O-( -CO2(低級アルコキシアルキル)で置換された低級アルコキシアルキル)、
(viii) -O-(フッ素もしくは塩素で置換された低級アルキル)、または
(ix) -(単結合)-CO2R10である。 - 上記医薬組成物が以下よりなる群から選択される症状を治療するために製剤化されているものである、請求項1〜3のいずれか1項記載の医薬組成物、
虚血性心疾患、
心不整脈、
緊急治療室環境における高血圧性クリーゼ、
術前、術中または術後の高血圧、
再灌流後の非再灌流現象、および
骨格筋の血流低下に関連する疾患。 - 下記(a)および(b)、
(a) 請求項1〜3のいずれか1項記載の医薬組成物および
(b) 虚血性心疾患、
心不整脈、
緊急治療室環境における高血圧性クリーゼ、
術前、術中または術後の高血圧、
再灌流後の非再灌流現象、および
骨格筋の血流低下に関連する疾患、
からなる群より選択される疾患の治療のための前記(a)の医薬組成物の使用説明書
を含むキット。 - (a) 虚血性心疾患、好ましくは安定狭心症、不安定狭心症、または冠攣縮性狭心症、
(b) 心不整脈、好ましくは心房細動、心房粗動、発作性上室性頻拍(PSVT)、心房性、結節性もしくは心室性の期外脱分極、心房頻拍、心室頻拍、心室細動、またはトルサードドゥポワント、
(c) 緊急治療室環境における高血圧性クリーゼ、
(d) 術前、術中または術後の高血圧、
(e) 再灌流後の非再灌流現象、または
(f) 骨格筋の血流低下に関連する疾患、好ましくはレイノー現象または間欠性跛行、
の治療を必要とする患者の治療に使用するための請求項1〜3のいずれか1項記載の医薬組成物であって、前記患者に投与される、前記医薬組成物。 - 前記疾患が虚血性心疾患または心不整脈である場合は、舌下、バッカル、経皮、鼻内、もしくは吸入投与される、または
前記疾患が緊急治療室環境における高血圧性クリーゼである場合は、舌下、バッカル、鼻内、吸入、もしくは非経口投与される、好ましくは前記非経口投与は静脈内投与である、または
前記疾患が術前、術中もしくは術後の高血圧、または再灌流後の非再灌流現象である場合は、非経口投与、好ましくは静脈内投与される、または
前記疾患が骨格筋の血流低下に関連する疾患である場合は、舌下、バッカル、経皮、鼻内、吸入、もしくは局所投与される、請求項6記載の医薬組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US93644007P | 2007-06-20 | 2007-06-20 | |
| US60/936,440 | 2007-06-20 | ||
| PCT/US2008/007665 WO2008156820A1 (en) | 2007-06-20 | 2008-06-19 | Short acting phenylalkylamine calcium channel blockers and uses thereof |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010530429A JP2010530429A (ja) | 2010-09-09 |
| JP5421908B2 true JP5421908B2 (ja) | 2014-02-19 |
Family
ID=40156562
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010513245A Active JP5421908B2 (ja) | 2007-06-20 | 2008-06-19 | 短時間作用型フェニルアルキルアミンカルシウムチャネルブロッカーおよびその使用 |
Country Status (18)
| Country | Link |
|---|---|
| US (18) | US20100190852A1 (ja) |
| EP (1) | EP2170050B1 (ja) |
| JP (1) | JP5421908B2 (ja) |
| KR (1) | KR101541557B1 (ja) |
| CN (1) | CN101754678B (ja) |
| AU (1) | AU2008266798B2 (ja) |
| BR (1) | BRPI0812919B8 (ja) |
| CA (1) | CA2693627C (ja) |
| CY (1) | CY1115619T1 (ja) |
| DK (1) | DK2170050T3 (ja) |
| ES (1) | ES2498047T3 (ja) |
| HR (1) | HRP20140801T1 (ja) |
| MX (1) | MX347325B (ja) |
| NZ (1) | NZ582033A (ja) |
| PL (1) | PL2170050T3 (ja) |
| PT (1) | PT2170050E (ja) |
| SI (1) | SI2170050T1 (ja) |
| WO (1) | WO2008156820A1 (ja) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2008266798B2 (en) | 2007-06-20 | 2014-07-17 | Milestone Pharmaceuticals Inc. | Short acting phenylalkylamine calcium channel blockers and uses thereof |
| KR101052620B1 (ko) * | 2008-08-28 | 2011-07-29 | 한국과학기술연구원 | 신규 페닐아세테이트 유도체 또는 이의 약학적으로 허용가능한 염, 이의 제조방법 및 이를 유효성분으로 함유하는 t-형 칼슘 이온 채널의 활성에 의해 유발되는 질환의 예방 또는 치료용 조성물 |
| ES2543470T3 (es) * | 2009-09-30 | 2015-08-19 | Microdose Therapeutx, Inc. | Métodos y composiciones para el tratamiento del fenómeno de Raynaud |
| WO2015073919A1 (en) * | 2013-11-14 | 2015-05-21 | University Medical Pharmaceuticals Corporation | Microneedles for therapeutic agent delivery with improved mechanical properties |
| KR102653347B1 (ko) * | 2015-04-14 | 2024-04-02 | 마일스톤 파마슈티컬즈 인코포레이티드 | 단기 작용 페닐알킬아민 칼슘 채널 차단제의 고수용성 염 및 그 용도 |
| US12257224B2 (en) | 2021-07-15 | 2025-03-25 | Milestone Pharmaceuticals Inc. | Methods of administration for highly water-soluble salts of a short acting phenylalkylamine calcium channel blocker |
| WO2025215083A1 (en) | 2024-04-10 | 2025-10-16 | Dipharma Francis S.R.L. | Method for preparing a drug used for paroxysmal supraventricular tachycardia |
Family Cites Families (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE1154810B (de) * | 1961-04-01 | 1963-09-26 | Knoll Ag | Verfahren zur Herstellung basisch substituierter Phenylacetonitrile |
| US3957845A (en) * | 1962-04-27 | 1976-05-18 | Knoll A.G. Chemische Fabriken | Trifluoromethyl-substituted phenyl acetonitriles |
| DE1493904A1 (de) * | 1965-07-31 | 1969-06-19 | Knoll Ag | Verfahren zur Herstellung basisch substituierter Phenylacetonitrile |
| DE2059923C3 (de) * | 1970-12-05 | 1979-01-25 | Knoll Ag, 6700 Ludwigshafen | l-a-Isopropyl-o-[(N-methyl-N-homoveratryl)v-aminopropyl] -3,4-dimethoxyphenylacetonitril, Verfahren zu dessen Herstellung und dieses enthaltende Arzneimittel |
| JPS5118940B2 (ja) * | 1971-12-25 | 1976-06-14 | ||
| DE2631222C3 (de) * | 1976-07-12 | 1979-01-04 | Knoll Ag, 6700 Ludwigshafen | Verfahren zur Herstellung basisch substituierter Phenylacetonitrile |
| DE3144150A1 (de) * | 1981-04-10 | 1982-12-09 | Basf Ag, 6700 Ludwigshafen | (omega)-cyan-1,(omega)-diphenyl-azaalkan-derivate, ihre herstellung und diese enthaltende arzneimittel |
| DE3433383A1 (de) * | 1984-09-12 | 1986-03-20 | Boehringer Mannheim Gmbh, 6800 Mannheim | Neue phenyl-acetonitril-derivate |
| DE3603032A1 (de) * | 1986-01-31 | 1987-08-06 | Basf Ag | Basisch substituierte phenylacetonitrile, ihre herstellung und diese enthaltende arzneimittel |
| US4833162A (en) * | 1988-02-03 | 1989-05-23 | American Cyanamid Company | Substituted benzeneacetonitriles and their use as calcium channel blockers |
| US5162569A (en) * | 1989-12-21 | 1992-11-10 | G. D. Searle & Co. | Phenylacetonitrilealkylaminoalkyl-ortho-substituted aryl compounds as immunosuppressives |
| IE64870B1 (en) | 1989-12-21 | 1995-09-20 | Searle & Co | Methods of using 2-isopropyl-2-phenylaminovaleronitriles immunosuppressants and vasodilators |
| US5486539A (en) * | 1989-12-21 | 1996-01-23 | G. D. Searle & Co. | Method of using phenylacetonitrilealkylaminoalkyl-ortho-substituted aryl compounds as immunosuppressives |
| US5247119A (en) * | 1990-12-12 | 1993-09-21 | G. D. Searle & Co. | Phenylacetonitrilehydroxyalkylaminoalkyl-ortho-substituted aryl compounds as immunosuppressives |
| US6057344A (en) * | 1991-11-26 | 2000-05-02 | Sepracor, Inc. | Methods for treating hypertension, and angina using optically pure (-) amlodipine |
| US5451604A (en) * | 1993-07-26 | 1995-09-19 | G. D. Searle & Co. | Halogenated phenylacetonitrile alkylaminoalkylphenyl compounds as immunosuppressives |
| US5910601A (en) * | 1994-09-26 | 1999-06-08 | Darwin Discovery Limited | Chiral nitriles, their preparation and their use for the manufacture of verapamil and analogues |
| US5859279A (en) | 1996-09-10 | 1999-01-12 | Darwin Discovery Limited | Compound and process |
| US6750238B1 (en) | 2000-05-12 | 2004-06-15 | The University Of Toledo | Aralkyl ester soft drugs |
| US7511077B2 (en) * | 2005-02-09 | 2009-03-31 | Neuromed Pharmaceuticals Ltd. | Diamine calcium channel blockers |
| GB2435824A (en) | 2006-03-09 | 2007-09-12 | Esteve Labor Dr | Use of nitrile compounds in the treatment of food related and other disorders |
| AU2008266798B2 (en) | 2007-06-20 | 2014-07-17 | Milestone Pharmaceuticals Inc. | Short acting phenylalkylamine calcium channel blockers and uses thereof |
-
2008
- 2008-06-19 AU AU2008266798A patent/AU2008266798B2/en active Active
- 2008-06-19 MX MX2009014052A patent/MX347325B/es active IP Right Grant
- 2008-06-19 WO PCT/US2008/007665 patent/WO2008156820A1/en not_active Ceased
- 2008-06-19 JP JP2010513245A patent/JP5421908B2/ja active Active
- 2008-06-19 ES ES08768636.6T patent/ES2498047T3/es active Active
- 2008-06-19 HR HRP20140801AT patent/HRP20140801T1/hr unknown
- 2008-06-19 PT PT87686366T patent/PT2170050E/pt unknown
- 2008-06-19 SI SI200831291T patent/SI2170050T1/sl unknown
- 2008-06-19 EP EP08768636.6A patent/EP2170050B1/en active Active
- 2008-06-19 CA CA2693627A patent/CA2693627C/en active Active
- 2008-06-19 NZ NZ582033A patent/NZ582033A/en unknown
- 2008-06-19 CN CN200880020979.1A patent/CN101754678B/zh active Active
- 2008-06-19 DK DK08768636.6T patent/DK2170050T3/da active
- 2008-06-19 US US12/664,026 patent/US20100190852A1/en not_active Abandoned
- 2008-06-19 KR KR1020107000124A patent/KR101541557B1/ko active Active
- 2008-06-19 BR BRPI0812919A patent/BRPI0812919B8/pt active IP Right Grant
- 2008-06-19 PL PL08768636T patent/PL2170050T3/pl unknown
-
2014
- 2014-06-16 US US14/305,626 patent/US9227918B2/en active Active
- 2014-09-18 CY CY20141100766T patent/CY1115619T1/el unknown
-
2015
- 2015-11-23 US US14/949,107 patent/US9463179B2/en active Active
-
2016
- 2016-09-12 US US15/262,567 patent/US9737503B2/en active Active
-
2017
- 2017-07-18 US US15/653,246 patent/US10010522B2/en active Active
- 2017-07-18 US US15/653,367 patent/US10010523B2/en active Active
- 2017-07-20 US US15/655,564 patent/US10010524B2/en active Active
-
2018
- 2018-06-04 US US15/997,229 patent/US20180280339A1/en not_active Abandoned
-
2019
- 2019-01-14 US US16/246,980 patent/US20190142781A1/en not_active Abandoned
- 2019-08-29 US US16/555,766 patent/US20190380993A1/en not_active Abandoned
-
2020
- 2020-04-09 US US16/844,440 patent/US20200230097A1/en not_active Abandoned
- 2020-11-12 US US17/096,498 patent/US20210059972A1/en not_active Abandoned
-
2021
- 2021-06-22 US US17/354,288 patent/US20210315855A1/en not_active Abandoned
-
2022
- 2022-01-26 US US17/584,686 patent/US20220142963A1/en not_active Abandoned
-
2023
- 2023-04-24 US US18/138,341 patent/US20230255923A1/en not_active Abandoned
- 2023-12-08 US US18/533,381 patent/US20240115543A1/en not_active Abandoned
-
2024
- 2024-07-19 US US18/778,038 patent/US20240366552A1/en not_active Abandoned
-
2025
- 2025-02-28 US US19/066,738 patent/US20250195462A1/en not_active Abandoned
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20240366552A1 (en) | Short acting phenylalkylamine calcium channel blockers and uses thereof | |
| US8501727B2 (en) | Short acting benzothiazepine calcium channel blockers and uses thereof | |
| HK1140913B (en) | Short acting phenylalkylamine calcium channel blockers and uses thereof | |
| HK1086819B (en) | 2-(butyl-1-sulfonylamino)-n-[1(r)-(6-methoxy-pyridin-3-yl)-propyl]- benzamid, the use thereof in the form of drug an pharmaceutical preparations containing said compound | |
| HK1086819A1 (en) | 2-(butyl-1-sulfonylamino)-n-[1(r)-(6-methoxy-pyridin-3-yl)-propyl]- benzamid, the use thereof in the form of drug an pharmaceutical preparations containing said compound |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD01 | Notification of change of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7426 Effective date: 20100625 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20100625 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20110510 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130611 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130904 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130911 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20131011 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20131105 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20131122 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5421908 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |