JP5404636B2 - 新規のイヌインフルエンザウイルス及びこのワクチン - Google Patents
新規のイヌインフルエンザウイルス及びこのワクチン Download PDFInfo
- Publication number
- JP5404636B2 JP5404636B2 JP2010530910A JP2010530910A JP5404636B2 JP 5404636 B2 JP5404636 B2 JP 5404636B2 JP 2010530910 A JP2010530910 A JP 2010530910A JP 2010530910 A JP2010530910 A JP 2010530910A JP 5404636 B2 JP5404636 B2 JP 5404636B2
- Authority
- JP
- Japan
- Prior art keywords
- influenza virus
- seq
- canine
- amino acid
- represented
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 241000712461 unidentified influenza virus Species 0.000 title claims abstract description 102
- 241000282465 Canis Species 0.000 title claims abstract description 86
- 229960005486 vaccine Drugs 0.000 title claims abstract description 59
- 241000700605 Viruses Species 0.000 claims abstract description 57
- 239000000203 mixture Substances 0.000 claims abstract description 29
- 201000010099 disease Diseases 0.000 claims abstract description 13
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 13
- 238000000034 method Methods 0.000 claims abstract description 9
- 238000003149 assay kit Methods 0.000 claims abstract description 6
- 241000282472 Canis lupus familiaris Species 0.000 claims description 44
- 101710154606 Hemagglutinin Proteins 0.000 claims description 40
- 101710093908 Outer capsid protein VP4 Proteins 0.000 claims description 40
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 claims description 40
- 101710176177 Protein A56 Proteins 0.000 claims description 40
- 239000000185 hemagglutinin Substances 0.000 claims description 39
- 108010006232 Neuraminidase Proteins 0.000 claims description 34
- 108090000623 proteins and genes Proteins 0.000 claims description 28
- 102000005348 Neuraminidase Human genes 0.000 claims description 25
- 206010022000 influenza Diseases 0.000 claims description 16
- 239000002773 nucleotide Substances 0.000 claims description 16
- 125000003729 nucleotide group Chemical group 0.000 claims description 16
- 108010061100 Nucleoproteins Proteins 0.000 claims description 14
- 102000011931 Nucleoproteins Human genes 0.000 claims description 14
- 102000004190 Enzymes Human genes 0.000 claims description 12
- 108090000790 Enzymes Proteins 0.000 claims description 12
- 229940124873 Influenza virus vaccine Drugs 0.000 claims description 11
- 102000004169 proteins and genes Human genes 0.000 claims description 11
- 230000000890 antigenic effect Effects 0.000 claims description 9
- 101710085035 RNA-directed RNA polymerase catalytic subunit Proteins 0.000 claims description 7
- 239000004480 active ingredient Substances 0.000 claims description 5
- 125000000539 amino acid group Chemical group 0.000 claims description 5
- 239000012634 fragment Substances 0.000 claims description 5
- 239000003623 enhancer Substances 0.000 claims description 4
- 241000701157 Canine mastadenovirus A Species 0.000 claims description 3
- 108060003393 Granulin Proteins 0.000 claims description 3
- 229940024546 aluminum hydroxide gel Drugs 0.000 claims description 3
- SMYKVLBUSSNXMV-UHFFFAOYSA-K aluminum;trihydroxide;hydrate Chemical compound O.[OH-].[OH-].[OH-].[Al+3] SMYKVLBUSSNXMV-UHFFFAOYSA-K 0.000 claims description 3
- 230000001900 immune effect Effects 0.000 claims description 3
- 241000588779 Bordetella bronchiseptica Species 0.000 claims description 2
- 241000712083 Canine morbillivirus Species 0.000 claims description 2
- 241001353878 Canine parainfluenza virus Species 0.000 claims description 2
- 125000003275 alpha amino acid group Chemical group 0.000 claims 10
- 230000005847 immunogenicity Effects 0.000 claims 4
- 239000002671 adjuvant Substances 0.000 claims 1
- 230000009385 viral infection Effects 0.000 abstract description 8
- 150000001413 amino acids Chemical group 0.000 description 36
- 238000011081 inoculation Methods 0.000 description 25
- 239000000427 antigen Substances 0.000 description 12
- 102000036639 antigens Human genes 0.000 description 12
- 108091007433 antigens Proteins 0.000 description 12
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 10
- 241000287828 Gallus gallus Species 0.000 description 10
- 235000013330 chicken meat Nutrition 0.000 description 10
- 238000002474 experimental method Methods 0.000 description 10
- 229940024606 amino acid Drugs 0.000 description 9
- 235000001014 amino acid Nutrition 0.000 description 9
- 230000003612 virological effect Effects 0.000 description 9
- 241001465754 Metazoa Species 0.000 description 8
- 230000029142 excretion Effects 0.000 description 8
- 208000015181 infectious disease Diseases 0.000 description 8
- 235000018102 proteins Nutrition 0.000 description 8
- 208000024891 symptom Diseases 0.000 description 8
- -1 PA (Polymerase) Proteins 0.000 description 7
- 235000013601 eggs Nutrition 0.000 description 7
- 239000000126 substance Substances 0.000 description 7
- 101150039660 HA gene Proteins 0.000 description 6
- 241000282412 Homo Species 0.000 description 6
- 206010039101 Rhinorrhoea Diseases 0.000 description 6
- 230000036760 body temperature Effects 0.000 description 6
- 239000003814 drug Substances 0.000 description 6
- 230000000694 effects Effects 0.000 description 6
- 239000012530 fluid Substances 0.000 description 6
- 206010011224 Cough Diseases 0.000 description 5
- 241000283073 Equus caballus Species 0.000 description 5
- 101150080862 NA gene Proteins 0.000 description 5
- 208000036071 Rhinorrhea Diseases 0.000 description 5
- 229940088598 enzyme Drugs 0.000 description 5
- 230000002068 genetic effect Effects 0.000 description 5
- 230000036039 immunity Effects 0.000 description 5
- 238000004519 manufacturing process Methods 0.000 description 5
- 238000011160 research Methods 0.000 description 5
- 230000028327 secretion Effects 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- AZQWKYJCGOJGHM-UHFFFAOYSA-N 1,4-benzoquinone Chemical compound O=C1C=CC(=O)C=C1 AZQWKYJCGOJGHM-UHFFFAOYSA-N 0.000 description 4
- 238000002965 ELISA Methods 0.000 description 4
- 206010061218 Inflammation Diseases 0.000 description 4
- 208000002979 Influenza in Birds Diseases 0.000 description 4
- 241001500351 Influenzavirus A Species 0.000 description 4
- 206010037660 Pyrexia Diseases 0.000 description 4
- 238000003556 assay Methods 0.000 description 4
- 206010064097 avian influenza Diseases 0.000 description 4
- 210000004027 cell Anatomy 0.000 description 4
- 238000006243 chemical reaction Methods 0.000 description 4
- 230000004054 inflammatory process Effects 0.000 description 4
- 210000004072 lung Anatomy 0.000 description 4
- 210000003928 nasal cavity Anatomy 0.000 description 4
- 230000001717 pathogenic effect Effects 0.000 description 4
- 230000007918 pathogenicity Effects 0.000 description 4
- 230000000405 serological effect Effects 0.000 description 4
- 241000894007 species Species 0.000 description 4
- 229940124597 therapeutic agent Drugs 0.000 description 4
- 210000003437 trachea Anatomy 0.000 description 4
- 241000271566 Aves Species 0.000 description 3
- 208000035473 Communicable disease Diseases 0.000 description 3
- 241000283086 Equidae Species 0.000 description 3
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 3
- 241000282887 Suidae Species 0.000 description 3
- 206010006451 bronchitis Diseases 0.000 description 3
- 230000035931 haemagglutination Effects 0.000 description 3
- 229960000310 isoleucine Drugs 0.000 description 3
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 3
- 230000003902 lesion Effects 0.000 description 3
- 210000000214 mouth Anatomy 0.000 description 3
- 230000001338 necrotic effect Effects 0.000 description 3
- 238000003757 reverse transcription PCR Methods 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 241000272525 Anas platyrhynchos Species 0.000 description 2
- 241000272517 Anseriformes Species 0.000 description 2
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 2
- 206010006448 Bronchiolitis Diseases 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- 108010015776 Glucose oxidase Proteins 0.000 description 2
- 239000004366 Glucose oxidase Substances 0.000 description 2
- QIGBRXMKCJKVMJ-UHFFFAOYSA-N Hydroquinone Chemical compound OC1=CC=C(O)C=C1 QIGBRXMKCJKVMJ-UHFFFAOYSA-N 0.000 description 2
- 241000712431 Influenza A virus Species 0.000 description 2
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 2
- 108060001084 Luciferase Proteins 0.000 description 2
- 239000005089 Luciferase Substances 0.000 description 2
- 206010035664 Pneumonia Diseases 0.000 description 2
- 239000004698 Polyethylene Substances 0.000 description 2
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 2
- 239000004473 Threonine Substances 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 229960001230 asparagine Drugs 0.000 description 2
- 235000009582 asparagine Nutrition 0.000 description 2
- 210000003123 bronchiole Anatomy 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 230000009918 complex formation Effects 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- 239000012153 distilled water Substances 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 230000002550 fecal effect Effects 0.000 description 2
- 239000010419 fine particle Substances 0.000 description 2
- 229940116332 glucose oxidase Drugs 0.000 description 2
- 235000019420 glucose oxidase Nutrition 0.000 description 2
- 230000036737 immune function Effects 0.000 description 2
- 230000000951 immunodiffusion Effects 0.000 description 2
- 238000001114 immunoprecipitation Methods 0.000 description 2
- 230000002779 inactivation Effects 0.000 description 2
- 208000037797 influenza A Diseases 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 238000002372 labelling Methods 0.000 description 2
- 239000004816 latex Substances 0.000 description 2
- 229920000126 latex Polymers 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 230000002956 necrotizing effect Effects 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 244000052769 pathogen Species 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- 229920000573 polyethylene Polymers 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 210000005126 pseudostratified columnar epithelium Anatomy 0.000 description 2
- 238000003127 radioimmunoassay Methods 0.000 description 2
- 230000006798 recombination Effects 0.000 description 2
- 238000005215 recombination Methods 0.000 description 2
- 210000002345 respiratory system Anatomy 0.000 description 2
- 206010041232 sneezing Diseases 0.000 description 2
- 229940031626 subunit vaccine Drugs 0.000 description 2
- 229940126577 synthetic vaccine Drugs 0.000 description 2
- 230000009897 systematic effect Effects 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 230000014599 transmission of virus Effects 0.000 description 2
- 238000002255 vaccination Methods 0.000 description 2
- 229960004854 viral vaccine Drugs 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 229940005561 1,4-benzoquinone Drugs 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- 102000012440 Acetylcholinesterase Human genes 0.000 description 1
- 108010022752 Acetylcholinesterase Proteins 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- 206010001889 Alveolitis Diseases 0.000 description 1
- 102000004625 Aspartate Aminotransferases Human genes 0.000 description 1
- 108010003415 Aspartate Aminotransferases Proteins 0.000 description 1
- 208000003322 Coinfection Diseases 0.000 description 1
- 241000272201 Columbiformes Species 0.000 description 1
- 201000003883 Cystic fibrosis Diseases 0.000 description 1
- IGXWBGJHJZYPQS-SSDOTTSWSA-N D-Luciferin Chemical compound OC(=O)[C@H]1CSC(C=2SC3=CC=C(O)C=C3N=2)=N1 IGXWBGJHJZYPQS-SSDOTTSWSA-N 0.000 description 1
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 1
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 1
- CYCGRDQQIOGCKX-UHFFFAOYSA-N Dehydro-luciferin Natural products OC(=O)C1=CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 CYCGRDQQIOGCKX-UHFFFAOYSA-N 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- 108090000204 Dipeptidase 1 Proteins 0.000 description 1
- 241001635598 Enicostema Species 0.000 description 1
- 241001428841 Equine influenza virus H3N8 Species 0.000 description 1
- BJGNCJDXODQBOB-UHFFFAOYSA-N Fivefly Luciferin Natural products OC(=O)C1CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 BJGNCJDXODQBOB-UHFFFAOYSA-N 0.000 description 1
- 102000053187 Glucuronidase Human genes 0.000 description 1
- 108010060309 Glucuronidase Proteins 0.000 description 1
- 102000005548 Hexokinase Human genes 0.000 description 1
- 108700040460 Hexokinases Proteins 0.000 description 1
- DDWFXDSYGUXRAY-UHFFFAOYSA-N Luciferin Natural products CCc1c(C)c(CC2NC(=O)C(=C2C=C)C)[nH]c1Cc3[nH]c4C(=C5/NC(CC(=O)O)C(C)C5CC(=O)O)CC(=O)c4c3C DDWFXDSYGUXRAY-UHFFFAOYSA-N 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 206010054949 Metaplasia Diseases 0.000 description 1
- 206010027626 Milia Diseases 0.000 description 1
- 101150076514 NS gene Proteins 0.000 description 1
- 238000011887 Necropsy Methods 0.000 description 1
- 206010070831 Necrotising bronchiolitis Diseases 0.000 description 1
- 241000712464 Orthomyxoviridae Species 0.000 description 1
- 206010033078 Otitis media Diseases 0.000 description 1
- 102000003992 Peroxidases Human genes 0.000 description 1
- 241000286209 Phasianidae Species 0.000 description 1
- 108091000041 Phosphoenolpyruvate Carboxylase Proteins 0.000 description 1
- 102000001105 Phosphofructokinases Human genes 0.000 description 1
- 108010069341 Phosphofructokinases Proteins 0.000 description 1
- 108010053210 Phycocyanin Proteins 0.000 description 1
- 108010004729 Phycoerythrin Proteins 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- 206010057190 Respiratory tract infections Diseases 0.000 description 1
- 108010083644 Ribonucleases Proteins 0.000 description 1
- 102000006382 Ribonucleases Human genes 0.000 description 1
- KJTLSVCANCCWHF-UHFFFAOYSA-N Ruthenium Chemical compound [Ru] KJTLSVCANCCWHF-UHFFFAOYSA-N 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- 108010006785 Taq Polymerase Proteins 0.000 description 1
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 1
- 108010046334 Urease Proteins 0.000 description 1
- ATQVBSVAXDRWFW-HBMCJLEFSA-N [(1r)-2-(4-hydroxyphenyl)-1-[[(2s)-1-[[(2s)-3-methyl-2-(methylamino)butanoyl]amino]-1-oxo-3-phenylpropan-2-yl]amino]ethyl]phosphonic acid Chemical compound C([C@@H](C(=O)NC(=O)[C@H](C(C)C)NC)N[C@@H](CC=1C=CC(O)=CC=1)P(O)(O)=O)C1=CC=CC=C1 ATQVBSVAXDRWFW-HBMCJLEFSA-N 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 229940022698 acetylcholinesterase Drugs 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 238000007792 addition Methods 0.000 description 1
- 239000011543 agarose gel Substances 0.000 description 1
- 108010004469 allophycocyanin Proteins 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 1
- ILRRQNADMUWWFW-UHFFFAOYSA-K aluminium phosphate Chemical compound O1[Al]2OP1(=O)O2 ILRRQNADMUWWFW-UHFFFAOYSA-K 0.000 description 1
- 229940024545 aluminum hydroxide Drugs 0.000 description 1
- 238000003277 amino acid sequence analysis Methods 0.000 description 1
- 208000022531 anorexia Diseases 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 230000002238 attenuated effect Effects 0.000 description 1
- 229960001212 bacterial vaccine Drugs 0.000 description 1
- 102000005936 beta-Galactosidase Human genes 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- 102000006635 beta-lactamase Human genes 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 125000004057 biotinyl group Chemical class [H]N1C(=O)N([H])[C@]2([H])[C@@]([H])(SC([H])([H])[C@]12[H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C(*)=O 0.000 description 1
- 238000009395 breeding Methods 0.000 description 1
- 230000001488 breeding effect Effects 0.000 description 1
- 210000000621 bronchi Anatomy 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 229910001417 caesium ion Inorganic materials 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 208000037976 chronic inflammation Diseases 0.000 description 1
- 230000006020 chronic inflammation Effects 0.000 description 1
- 229940001442 combination vaccine Drugs 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 206010061428 decreased appetite Diseases 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- RAABOESOVLLHRU-UHFFFAOYSA-N diazene Chemical compound N=N RAABOESOVLLHRU-UHFFFAOYSA-N 0.000 description 1
- 229910000071 diazene Inorganic materials 0.000 description 1
- 238000003748 differential diagnosis Methods 0.000 description 1
- 208000017574 dry cough Diseases 0.000 description 1
- 210000001951 dura mater Anatomy 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 230000008029 eradication Effects 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- ZMMJGEGLRURXTF-UHFFFAOYSA-N ethidium bromide Chemical compound [Br-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CC)=C1C1=CC=CC=C1 ZMMJGEGLRURXTF-UHFFFAOYSA-N 0.000 description 1
- 229960005542 ethidium bromide Drugs 0.000 description 1
- 201000001155 extrinsic allergic alveolitis Diseases 0.000 description 1
- 210000003608 fece Anatomy 0.000 description 1
- KTWOOEGAPBSYNW-UHFFFAOYSA-N ferrocene Chemical compound [Fe+2].C=1C=C[CH-]C=1.C=1C=C[CH-]C=1 KTWOOEGAPBSYNW-UHFFFAOYSA-N 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- ZFKJVJIDPQDDFY-UHFFFAOYSA-N fluorescamine Chemical compound C12=CC=CC=C2C(=O)OC1(C1=O)OC=C1C1=CC=CC=C1 ZFKJVJIDPQDDFY-UHFFFAOYSA-N 0.000 description 1
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 1
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 238000000227 grinding Methods 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 108010029257 guanosine-diphosphatase Proteins 0.000 description 1
- 230000002008 hemorrhagic effect Effects 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 1
- 206010020718 hyperplasia Diseases 0.000 description 1
- 208000022098 hypersensitivity pneumonitis Diseases 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000003053 immunization Effects 0.000 description 1
- 238000002649 immunization Methods 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 238000012744 immunostaining Methods 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 229940031551 inactivated vaccine Drugs 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 229960003971 influenza vaccine Drugs 0.000 description 1
- 108700010900 influenza virus proteins Proteins 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 230000015788 innate immune response Effects 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 150000002540 isothiocyanates Chemical class 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 230000015689 metaplastic ossification Effects 0.000 description 1
- 239000011859 microparticle Substances 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 208000010753 nasal discharge Diseases 0.000 description 1
- 208000013435 necrotic lesion Diseases 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 229960005030 other vaccine in atc Drugs 0.000 description 1
- 239000000123 paper Substances 0.000 description 1
- 230000001314 paroxysmal effect Effects 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 108040007629 peroxidase activity proteins Proteins 0.000 description 1
- RXNXLAHQOVLMIE-UHFFFAOYSA-N phenyl 10-methylacridin-10-ium-9-carboxylate Chemical compound C12=CC=CC=C2[N+](C)=C2C=CC=CC2=C1C(=O)OC1=CC=CC=C1 RXNXLAHQOVLMIE-UHFFFAOYSA-N 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 229930029653 phosphoenolpyruvate Natural products 0.000 description 1
- DTBNBXWJWCWCIK-UHFFFAOYSA-N phosphoenolpyruvic acid Chemical compound OC(=O)C(=C)OP(O)(O)=O DTBNBXWJWCWCIK-UHFFFAOYSA-N 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 231100000614 poison Toxicity 0.000 description 1
- 230000007096 poisonous effect Effects 0.000 description 1
- 229920002239 polyacrylonitrile Polymers 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 229920001155 polypropylene Polymers 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- OTYBMLCTZGSZBG-UHFFFAOYSA-L potassium sulfate Chemical compound [K+].[K+].[O-]S([O-])(=O)=O OTYBMLCTZGSZBG-UHFFFAOYSA-L 0.000 description 1
- 229910052939 potassium sulfate Inorganic materials 0.000 description 1
- 239000001120 potassium sulphate Substances 0.000 description 1
- 235000011151 potassium sulphates Nutrition 0.000 description 1
- 244000144977 poultry Species 0.000 description 1
- 235000013594 poultry meat Nutrition 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 235000004252 protein component Nutrition 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 208000023504 respiratory system disease Diseases 0.000 description 1
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 1
- 229910052707 ruthenium Inorganic materials 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 201000009890 sinusitis Diseases 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 238000013190 sterility testing Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 108700026220 vif Genes Proteins 0.000 description 1
- 210000000605 viral structure Anatomy 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- BPICBUSOMSTKRF-UHFFFAOYSA-N xylazine Chemical compound CC1=CC=CC(C)=C1NC1=NCCCS1 BPICBUSOMSTKRF-UHFFFAOYSA-N 0.000 description 1
- 229960001600 xylazine Drugs 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
- A61K39/145—Orthomyxoviridae, e.g. influenza virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/12—Antidiarrhoeals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/16—Otologicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/16—Antivirals for RNA viruses for influenza or rhinoviruses
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/005—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from viruses
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/24—Hydrolases (3) acting on glycosyl compounds (3.2)
- C12N9/2402—Hydrolases (3) acting on glycosyl compounds (3.2) hydrolysing O- and S- glycosyl compounds (3.2.1)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y302/00—Hydrolases acting on glycosyl compounds, i.e. glycosylases (3.2)
- C12Y302/01—Glycosidases, i.e. enzymes hydrolysing O- and S-glycosyl compounds (3.2.1)
- C12Y302/01018—Exo-alpha-sialidase (3.2.1.18), i.e. trans-sialidase
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/525—Virus
- A61K2039/5252—Virus inactivated (killed)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/55—Medicinal preparations containing antigens or antibodies characterised by the host/recipient, e.g. newborn with maternal antibodies
- A61K2039/552—Veterinary vaccine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55505—Inorganic adjuvants
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/16011—Orthomyxoviridae
- C12N2760/16111—Influenzavirus A, i.e. influenza A virus
- C12N2760/16121—Viruses as such, e.g. new isolates, mutants or their genomic sequences
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/16011—Orthomyxoviridae
- C12N2760/16111—Influenzavirus A, i.e. influenza A virus
- C12N2760/16122—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/16011—Orthomyxoviridae
- C12N2760/16111—Influenzavirus A, i.e. influenza A virus
- C12N2760/16134—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Health & Medical Sciences (AREA)
- Wood Science & Technology (AREA)
- Medicinal Chemistry (AREA)
- Zoology (AREA)
- Virology (AREA)
- General Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- Biomedical Technology (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Biotechnology (AREA)
- Animal Behavior & Ethology (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Pulmonology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Epidemiology (AREA)
- Mycology (AREA)
- Biophysics (AREA)
- Gastroenterology & Hepatology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Description
イヌインフルエンザウイルスは新種ウイルスとして、現在、イヌにはワクチン又は自然免疫に成れない状態で、全ての種と年齢で感染性があるウイルスである。急性呼吸器疾患を引き起こすイヌインフルエンザウイルスはひどい咳、熱、鼻腔の分泌物等の臨床症状を有する。
このイヌインフルエンザウイルは、致死率が高い2次感染の可能性のため、ワクチンで予防することが重要だ。しかし、現在全世界的に、市販されているイヌインフルエンザウイルスワクチンはない状態である。
本発明の他の目的は、前記インフルエンザウイルスのタンパク質成分をコードするヌクレオチド配列を提供するためのものである。
本発明の更に他の目的は、前記新規ウイルスに対する免疫を形成させることができるワクチン組成物を提供するためのものである。
本発明の更に他の一つの目的は、 本発明のウイルス又はこの抗原決定基を含むH3N2血清型インフルエンザウイルスの検定キットを提供するためのものである。
本発明は、配列番号9のアミノ酸配列又はこれと95%以上の相同性を有するアミノ酸配列で表示される血球凝集素(HA)を含むH3N2血清型のインフルエンザウイルスに関する。
また、本発明のイヌインフルエンザウイルスの、全体ノイラミニダーぜ(NA)アミノ酸配列(図1)及び全体血球凝集素(HA)アミノ酸配列(図2)を分析した結果、本院発明で分離したイヌインフルエンザウイルスは既存に周知されたウマインフルエンザウイルスH3N8と比較した際、非常に特徴的にアミノ酸配列が変化されていることを確認することができる。特に、A/Canine/Korea/01/07(H3N2)、 A/Canine/Korea/02/07(H3N2)及びA/Canine/Korea/03/07(H3N2)のHAアミノ酸配列分析でアミノ酸配列番号27、127、142、176、188、209、212 及び252の位置で、各々N(Asparagine)、I (Isoleucine)、 T(Threonine)、T(Threonine)、N(Asparagine)、S(Serine)、I(Isoleucine)及び I(Isoleucine)の8個のアミノ酸が特徴的に変化されていることを確認することができた(図3)。配列番号9のアミノ酸配列と、少なくとも95%以上の相同性を有するアミノ酸配列は、配列番号9で表示されるアミノ酸配列中97、127、142、176、188、209、212及び252の位置に、少なくとも一つのアミノ酸配列と同一アミノ酸残基を含む。
以外に、本発明による新規のインフルエンザウイルスは、配列番号3の塩基配列で表示される非構造性タンパク質(NS)、配列番号4の塩基配列で表示されるマトリックスタンパク質(M)、配列番号5の塩基配列で表示される核タンパク質(NP)、配列番号6の塩基配列で表示される重合酵素タンパク質(PA)、配列番号7の塩基配列で表示される重合酵素タンパク質2(PB2)、及び配列番号8の塩基配列で表示される重合酵素タンパク質1(PB1)、及びこの結合物により選択されたタンパク質を追加で含むことができる。
前記A/Canine/Korea/01/07(H3N2)インフルエンザウイルスは、鳥インフルエンザウイルスと95.5乃至98.9%の相同性を有する。特に、HA(Hemagglutinin)及びNA(Neuraminidase)遺伝子は、韓国で分離されたハトインフルエンザウイルスであるA/Dove/Korea/S11/03(H3N2)と最も高い相同性を見せ、NS(nonstructural)遺伝子は、中国で分離されたニワトリインフルエンザウイルスであるA/Chicken/Nanchang/7-010/2000(H3N6)と最も高い相同性を見せる。PB1(Polymerase basic protein 1)、PB2、PA(Polymerase)、NP(nucleoprotein)及びM(matrix)遺伝子は、香港、日本及び中国で分離された鳥インフルエンザウイルスと高い相同性を見せた。A/Canine/Korea/01/07(H3N2)インフルエンザウイルスは、2007年9月19日付で、大韓民国大田市儒城区魚隠洞に位置する韓国生命工学研究院生物資源センターにKCTC11205BPで寄託された。
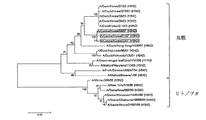
本発明によるイヌインフルエンザウイルスは韓国のイヌの鼻腔から分離したことで、これらウイルスは図4及び図5で図示した系統図と同じ系統発生学的関連性を有する。代表的に、図4 及び図5はA/Canine/Korea/01/07(H3N2) インフルエンザウイルスの系統発生学的関連性をHAと NAをを利用して分析したものである。 HAと NAの系統図によれば、本発明のインフルエンザウイルスは鳥インフルエンザウイルスと群落(cluster)を成し、HA及びNA遺伝子はウマとイヌから分離されたH3N8ウイルスとは異なる群落に属することと確認された。
もう一つの様態として、本発明は配列番号9のアミノ酸配列又はそれと95%以上の相同性を有するアミノ酸配列で表示される血球凝集素(HA)をコードするヌクレオチド に関することであり、好ましくは配列番号9の塩基配列を有するヌクレオチド である。
また、本発明は配列番号11のアミノ酸配列又はそれと95%以上の相同性を有するアミノ酸配列で表示されるノイラミニダーゼ(NA)をコードするヌクレオチド に関することであり、好ましくは配列番号10の塩基配列を有するヌクレオチド である。
好ましくは、本発明のワクチンの組成物はイヌインフルエンザウイルス又はこの抗原を有效成分として含む。より具体的に、前記イヌインフルエンザウイルスはA/Canine/Korea/01/07 (H3N2)、A/Canine/Korea/02/07 (H3N2)、A/Canine/Korea/03/07 (H3N2) 及びこの結合物で成る群から一種以上が選択させられる。
本発明にて用いられる前記抗原はウイルスの構成成分中で免疫機能を起せる抗原成分を指し、配列番号9のアミノ酸配列又はそれと90%以上、好ましくは95%以上の相同性を有するアミノ酸配列で表示される血球凝集素(HA)又はこれの断片を含むことができる。また、前記95%以上の相同性を有するアミノ酸配列は配列番号9で表示されるアミノ酸配列中97、127、142、176、188、209、212、及び252の位置のアミノ酸残基中の一つ以上が配列番号9の当該アミノ酸残基と同一血球凝集素(HA)又はこれの断片を含む。
本発明によるワクチンは弱毒化された生ワクチン又は死ワクチン、サブユニットワクチン(Subunit vaccine)合成ワクチン(Synthetic vaccine)又は遺伝工学ワクチン(Genetic vaccine)であるが、効果的な免疫反応を誘導する生ワクチンが好ましい。
用語「生ワクチン」というのは、生きているウイルス活性成分を含むワクチンを意味する。用語「弱毒化(attenuation)」というのは、生きている病原体の毒性を人工的に弱化したことであり、病原体の必需代謝に関与する遺伝子を変異させ体内で、疾病を起こせずに免疫体系だけを刺激し免疫性を誘導することを意味する。ウイルスの弱毒化は紫外線(UV)照射、薬品処理又は試験管内での高次連続継代培養により達成される。また、弱毒化は明確な遺伝の変化をさせることで、例えば毒性を提供すると周知られたウイルス配列の特定損失又はウイルスゲノム内へのヌクレオチドの挿入により達成される。
用語「サブユニットワクチン」はウイルスの構成成分中で免疫機能を起せる抗原成分だけを抽出し製造したワクチンで、ウイルス防御に必要な抗原部位だけに対して免疫形成を誘導し副作用を最小化できる。例えばイヌインフルエンザウイルスのHAタンパク質及び/又はNAタンパク質を抽出して用いられる。
用語「合成ワクチン」は、ウイルスの抗原又は抗原決定基だけを化学的に合成し、又は再組合DNA技術で生産したペプチドを含むワクチンで、例えば、イヌインフルエンザウイルスのHAタンパク質及び/又はNAタンパク質を合成して用いられる。
また、本発明のインフルエンザワクチンは、イヌに発生するインフルエンザ以外の疾病を予防するため作られる他のワクチンの製造に用いられる不活化された菌体又は抗原と混合し、インフルエンザを含む他の疾病を共に予防できる混合ワクチン又は複合ワクチンで用いられるのが好ましい。用語「混合ワクチン」というのは、相違するウイルスワクチンを共に用いられたワクチンを指し、用語「複合ワクチン」というのは、ウイルスワクチンと細菌ワクチンを共に用いられたワクチンを指す。本発明の具体的な実施例として、例えば、イヌパラインフルエンザウイルス(canine parainfluenza virus)、イヌジステンパーウイルス(canine distemper virus)、イヌアデノウイルス (canine adenovirus)、イヌボデテラブロンキセプテイカ菌(Bordetella bronchiseptica)と混合又は複合されてワクチンに用いられる。
前記(a)段階は、イヌインフルエンザウイルスを9乃至11日齢の孵化卵に注入し、孵化卵は30乃至40℃で24乃至72時間おき、ウイルスの増殖を誘導する。前記 (b) 段階では、通常の方法で漿尿膜腔液を抽出して、ここに最終濃度0.005乃至0.2(v/w)%でホルマリン、BEI又はBPLを加えて低温に放置しウイルスを不活化させる。前記 (c) 段階ではホルマリン、BEI又はBPLが処理された漿尿幕腔液を円心分離又は濾過を通じて不活化されたウイルスを抽出する。抽出されたウイルスは、水酸化アルミナゲルに吸着させる。前記ワクチン製造方法は、公知の方法を採択し、又は一部修正を経て容易に実施できる。
好ましくは、本発明のワクチン組成物はイヌインフルエンザウイルスを25 HAU(hemagglutination unit, 血球凝集段位)で含むが、これに限定されない。
ただ、ワクチンの血球凝集段位が25HAU未満の場合、イヌに効果的に抗体形成を誘導できないこともあり、25HAUを超過する場合、効率に比して非経済的である。
本発明のワクチン組成物は、A/Canine/Korea/01/07(H3N2)、A/Canine/Korea/02/07 (H3N2)、又はA/Canine/Korea/03/07 (H3N2)に感染されることができ、前記インフルエンザウイルスを他の個体に伝染させる全種類の家禽及び鳥類、例えば、イヌ、ブタ、ニワトリ、カモ、シチメンチョウ等及び人にでも用いることができる。
もう一つの様態として、本発明は、前記ワクチン組成物をインフルエンザウイルスの感染が疑われる個体に投与し、インフルエンザウイルスの感染疾患を予防又は治療する方法に関する。
本発明での用語「個体」というのは、インフルエンザウイルスにすでに感染されたり感染される可能性がある人間を含め、全ての動物を意味する。本発明の抽出物が含まれた組成物を個体に投与することにより、前記疾患を効果的に予防し、治療できる。例えば、本発明のワクチン組成物で多様なインフルエンザウイルスの亞形又は変異形のインフルエンザウイルスに感染された人間を治療できる。また、本発明のワクチン組成物で多様なインフルエンザウイルスの亞形又は変異形の鳥インフルエンザウイルスに感染された人間を治療できる。また、多様なインフルエンザウイルスの亞形また変異形の鳥インフルエンザウイルスに感染されたニワトリやブタを治療できる。本発明のワクチン組成物を既存のインフルエンザウイルス感染疾患治療剤と並行し投与できる。
本発明のワクチン組成物は薬剤学的に有効な量で投与する。用語「薬剤学的に有効な量」は医学的治療に適用できる合理的な効果/危険の比率で疾患を治療しに十分な量を意味し、有効用量の水準は個体の種類及び重症度、年齢、性別、感染されたウイルスの種類、薬物の活性、薬物に対する敏感度、投与時間、投与経路、排出比率、治療期間、共に用いられる薬物を含んだ要素及びその他の医学分野でよく周知された要素により決定される。本発明の組成物は個別治療剤に投与し、他の治療剤と併用して投与でき、従来の治療剤とは順次的又は同時に投与できる。そして、単一投与又は多重投与もできる。前記要素を全て考慮し、副作用なしに最小限の量で最大の効果を上げる量を投与することが重要であり、当業者により容易に決定される。
本発明のインフルエンザウイルス又はこの抗原決定基は、抗原/抗体複合体の反応を通じて感染の恐れがある又はすでに感染された細胞中のインフルエンザウイルスを除去するにのみならずインフルエンザウイルスを特異的に検出するためにも用いられる。
このような検定キットは本発明のインフルエンザウイルスのみならず、疫学的な分析に用いられる当分野で一般的に用いられる道具、試薬等が含まれる。このような道具/試薬としては適合な擔体、検出可能な信号を生成できる標識物質、溶解剤、洗浄剤、緩衝剤、安定化剤等を含むが、これに制限されない。標識物質が酵素の場合は、酵素活性を測定できる基質や反応停止剤を含める。適合擔体としては可溶性擔体ー例えば当分野で周知された生理学的に許容される緩衝液(一例としてPBS)、不溶性擔体ー例えばポリエスチレン、ポリエチレン、ポリプロピレン、ポリエステル、ポリアクリロニトリル、フッソ樹脂、cross-linked デキストラン(dextran)、多糖類(poly-saccharide)、ラテックスに金属を鍍金した磁性微粒子のような高分子、その他、紙、ガラス、金属、アガローズ(agarose)及びこれらの組合であるが、これらに限定されない。
抗原/抗体復合体の形成を定性又は定量的に測定できるようにするラベルには酵素、蛍光物、リガンド、発光物、微素粒子(microparticle)、レドックス分子及び放射線同位元素等があり、絶対にこれで制限されることはない。検出ラベルで利用の可能な酵素にはベータ−グルクロニダーゼ、ベータ−D-グルコシダーゼ,ベータ−D-ガラクトシダーゼ、ウレアーゼ、ペルオキシダーゼ、アルカリホスファターゼ、アセチルコリンエステラーゼ。グルコースオキシダーゼ、へキソキナーゼとGDPase、RNase、グルコースオキシダーゼとルシフェラーゼ、ホスホフルクトキナーゼ、ホスホエノールピルベートカルボキシラーゼ、アスパラテートアミノトランスフェラーゼ、ホスホエノールピルベートディカルボキシルラーゼ、β−ラクタマーゼ等があり、これで制限されない。蛍光物にはフルオレセイン、イソチオシアネート、ローダミン、フィコエリトリン、フィコシアニン、アロフィコシアニン(allophycocyanin)、オルソーフタルデヒド(ο-phthaldehyde)、フルオレスカミン等があり、これに制限されない。リガンドにはビオチン誘導体等があり、これに制限されない。発光物には アクリジニウムエステル(acridinium ester)、ルシフェリン、ルシフェラーゼ等があり、これに制限されない。微素粒子には金コロイド、着色されたラテックス等があり、これに制限されない。レドックス分子にはフェロセン、ルテニウム着化学物、ビオローゲン、キノン、Tiイオン、Csイオン、ディイミド(diimide)、1,4-ベンゾキノン、ヒドロキノン、 K4W(CN)、[Os(bpy)3]2+、3H、14C、32P、35S、36CI、51Cr、57Co、58Co、59Fe、90Y、125I、131I、186Re等があり、これで制限されない。
実施例1.検体の確保及ウイルスの分離
韓国の京畿都地方に位置する地元の動物病院で検体(鼻腔分泌物)の提供を受けた。臨床症状として一番目の場合、5歳のミニチュア・シュナウザーは3日間鼻水があり、2日間くしゃみをした後回復した。二番目の場合、3歳のコッカー・スパニエルは熱、咳、鼻水と食欲不尽の症状と共に死に至った。三番目の場合、ヨークシャ・テリア一匹と珍島犬2匹はひどい咳、熱と鼻水を伴いながら動物病院を訪問2日後の死に至った。
このイヌたちから採取された検体(鼻腔分泌物)を利用して11日齢の発育鶏卵に接種した結果、採取した尿膜腔液はニワトリの赤血球細胞を凝集させた。そして、分離されたウイルスを血清学的に同定した結果、H3N2ウイルスだと明らかになった。この分離されたウイルスをA/Canine/Korea/01/07、(H3N2)、A/Canine/Korea/02/07(H3N2)、及びA/Canine/Korea/03/07、(H3N2)と命名し、2007年9月19日付で大韓民国儒城区魚隠洞に位置する韓国生命工学研究院の生物資源センターに各々寄託番号KCTC11205BP、KCTC11206BP及びKCTC11207BPで寄託した。
実施例1で分離されたウイルスの遺伝的な特性を究明するため、ウイルスに対して各遺伝子を分析した。トリゾル (Trizol)LSを利用して尿膜腔液から抽出したインフルエンザウイルスRNAは無作為のヘキサマープライマー (hexamerprimer)でRT-PCRを実行した後、表1のプライマーを用いてPCRを遂行した。H3、N2、PB1、PB2、PA、NP、M及びNS遺伝子を検出するためプライマー配列は変形されたプライマー3プログラム(Whitehead Institude/MTCenter for Genome Research)を用いた。
PCR反応はcDNA(2μL)を反応混合物{2.5μL、10X Taq DNA重合酵素緩衝液、MgCl2、1.5mM、dNTPs(2.5mM/μL)2.0μL、各特定のプライマー(各10pmol)1μLTaq DNA重合酵素(Promega、USA)1μL}と混合して蒸留水を添加して全体の容積を25μLに作った。PCRは94℃で10分、94℃で30秒間32サイクル、55℃で30秒、72℃で30秒、72℃で10分間実行し、反応は4℃で止めた。PCR産物は臭化エチジウムを含有した1.5%のアガローズゲルを電気泳動して分析した。分離されたウイルス配列はバイオエディット (Bioedit)ソフトウェアを利用して分析し、編集した。
A/Canine/Korea/01/07の系通学的な分類は多重整列アルゴリズム(Clustal alignment algorithm)とMEGALIGNプログラム(DNASTAR、Madison、WI)を利用して確認した。その結果、HA及びNA遺伝子はウマとイヌから分離されたH3N8ウイルスとは相違な群落に属すると確認され、韓国で分離されたH3N2とは非常に近縁関係を見せた(図4及び図5)。
分離したイヌインフルエンザウイルスA/Canine/Korea/01/07(H3N2)の病原性の有無を確認するため、イヌに対して攻撃接種の実験を実施した。
10週齢のビーグル犬を接種群7匹、対照群3匹で分け、接種群7匹には1:64HA力価(106.9 EID50/0.1mL)を有する分離されたウイルス(2mL)を鼻腔と口腔に投与した。対照群3匹は無菌のPBS(phosphate buffer saline、2mL)を鼻腔と口腔に投与した 。投与後臨床症状を7日間観察し、ウイルスの排出は接種後10日間糞便と鼻腔の分泌物を通じてRT-PCRを実行して確認した。各々のグループの血清学的変化は再組合NP(Nucleoprotein)を抗原とする競争的原理を有するELISA(Animal Genetic Inc. Korea)及びHI実験を用いて確認した。HI実験はOIE推薦実験方法に従って実行した。また死後剖検のため、接種後3日、6日及び9日に接種グループで2匹ずつ、対照群で1匹ずつキシラジン(xylazine)1mLで安楽死させて病変を確認した。
また、血清学的検査を遂行した結果、接種前に全ての実験犬の血清学的実験は陰性で、対照群実験犬の血清は実験する間、陰性として残っていた。接種群では接種6日後、ELISA実験の結果、パーセント阻害率(Percent Inhibition)の価は他の対照群の実験犬より非常に高くて抗体が高く上昇したのを確認できた。面白いことに接種群の接種8日後、HI力価が1:80を見せた。
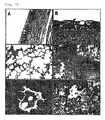
一方、組織病理学的病変は気管と肺に局限されていた。組織学的に上部呼吸器(気管、bronchi)と下部呼吸器(bronchioleとalveoli)でひどい壊死病変があった。たとえ、攻撃接種したイヌ全てに少しの病変程度に差はあったが、組織学的に細気管支炎及び気管支炎を見せる等しい様子を見せた(図7)。
結論を言えば分離されたウイルスは、イヌで体温上昇と肺に炎症を引き起こす病原性があることを確認することができる。また、6日間ウイルスが排出されるのも確認することができる。
分離したイヌインフルエンザウイルスA/Canine/Korea/01/07(H3N2)を種(seed)ウイルスとしてワクチンを製造した。10日齢の孵化卵の漿尿膜腔に種(seed)ウイルスを接種3日後、漿尿膜腔を採取してウイルスバルクにした。このウイルスバルクに0.2%ホルマリンを添加して室温で24時間不活化した。不活化の可否は不活化されたバルクを孵化卵に再接種してウイルスが生存しなかった際、不活化されたことに確認した。不活化が完了されたバルクは25HAU以上になるようにした。このバルク70%とアルミニウム水酸化物ゲル30%を10,000rpmで10分間混合した後無菌検査を実施し、異状なしを確認後、ワクチンとして利用した。
製造されたワクチンを0.5mLずつ10週齢のビーグル犬10匹の皮下に接種し、3週間後同一方法で追加接種した。追加接種の2週間後1:64HA力價 106.9 ID50/0.1mL)を有する、分離されたウイルスA/Canine/Korea/01/07(H3N2)を2mLずつ口腔と鼻腔に攻撃接種した。対照群は3匹を公示し、PBSを 接種した。実験の間、体温とウイルスの排出有無、臨床症状及び抗体の上昇有無を確認した。
その結果、接種群の場合体温変化が攻撃接種後まで正常的な体温が一定に維持され、ウイルスの排出もなく、臨床症状も確認されなかった。しかし、対照群の場合は攻撃接種後1週間、体温の上昇を確認でき(表3)、ウイルスの排出が3匹全てでPCRとして確認されたが、6日後には排出がなかった(表4)。そして、対照群は接種後、鼻水を流しながら乾性の咳又は湿性の咳きをする等の臨床症状を確認する事ができた。抗体価は接種群の場合、核タンパク質に対するELISA抗体及び血球凝集素に対するHI抗体は7日後から上昇し始め、実験の間続けた(表5)。しかし、対照群は攻撃接種7日後から核タンパク質及び血球凝集素に対するHI抗体が上昇され始まった。
従って、ワクチン接種群は攻撃接種に対して防御できることを確認できてワクチンとしての効果を証明できた。
本発明の好ましい実施態様は例示する目的で説明され、当業者達は添付した特許の請求範囲に記述された発明の範囲及び精神に外れず多様な変形、付加及び置換が可能である事を認識する。
KCTC11206BP
KCTC11207BP
Claims (20)
- 配列番号10のアミノ酸配列又はこれと98%以上の同一性を有するアミノ酸配列で表示され、同等な免疫原性を有する血球凝集素(HA)を含むH3N2血清型のイヌインフルエンザウイルスであって、配列番号10で表わされるアミノ酸配列中97、127、142、176、188、209、212及び252の位置のアミノ酸残基が保存されている、イヌインフルエンザウイルス。
- 配列番号12のアミノ酸配列又はこれと98%以上の同一性を有するアミノ酸配列で表示され、同等な免疫原性を有するノイラミニダーゼ(NA)を含む請求項1に記載のインフルエンザウイルス。
- 配列番号3の塩基配列で表示される非構造性タンパク質(NS)、配列番号4の塩基配列で表示されるマトリックスタンパク質(M)、配列番号5の塩基配列で表示される核タンパク質(NP)、配列番号6の 塩基配列で表示される重合酵素タンパク質(PA)、配列番号7の塩基配列で表示される重合酵素タンパク質2(PB2) 及び配列番号8の塩基配列で表示される重合酵素タンパク質1(PB1)を追加で含む請求項2に記載のインフルエンザウイルス。
- 受託番号KCTC11205BPの請求項1に記載のインフルエンザウイルス。
- 受託番号KCTC11206BPの請求項1に記載のインフルエンザウイルス。
- 受託番号KCTC11207BPの請求項1に記載のインフルエンザウイルス。
- 血球凝集素(HA)タンパク質が、配列番号9のヌクレオチド 配列又はこれと98%以上の同一性を有するヌクレオチド配列によりコードされる、請求項1に記載のH3N2血清型のインフルエンザウイルス。
- 配列番号9の塩基配列を有するヌクレオチド 。
- ノイラミニダーゼ(NA)タンパク質が、配列番号11のヌクレオチド配列又はこれと98%以上の同一性を有するヌクレオチド配列によりコードされる、請求項2に記載のH3N2血清型のインフルエンザウイルス。
- 配列番号11の塩基配列を有するヌクレオチド 。
- 請求項1〜6のいずれか一項に記載のウイルス又はその抗原決定基を有効成分として含むインフルエンザウイルスワクチン組成物。
- 前記ワクチンはイヌに適用される請求項11に記載のインフルエンザウイルスワクチン組成物。
- 免疫増強剤(adjuvant)として、アルミニウム水酸化物ゲル又はオイルを追加的に含む請求項11に記載のインフルエンザウイルスワクチン組成物。
- 前記ワクチンはイヌパラインフルエンザウイルス(canine parainfluenzavirus)、イヌジステンパーウイルス(canine distemper virus)、イヌアデノウイルス (canine adenovirus)、又はイヌボデテラブロンキセプテイカ菌(Bordetella bronchiseptica)と混合又は複合されたワクチンである請求項11に記載のインフルエンザウイルスワクチン組成物。
- 前記ワクチンはウイルスを弱毒化させて作る生のワクチンである請求項11に記載のインフルエンザウイルスワクチン組成物。
- 前記ワクチンはインフルエンザウイルスを25HAU以上含有した請求項11に記載のインフルエンザウイルスワクチン組成物。
- 前記抗原決定基は配列番号10のアミノ酸配列又はこれと98%以上の同一性を有するアミノ酸配列で表示され、同等な免疫原性を有する血球凝集素(HA)又は免疫活性を有する、これの断片で、このような抗原決定基が90%以上含有され、配列番号10で表わされるアミノ酸配列中97、127、142、176、188、209、212及び252の位置のアミノ酸残基が保存されている、請求項11に記載のインフルエンザウイルスワクチン組成物。
- 前記抗原決定基は配列番号12のアミノ酸配列又はこれと98%以上の同一性を有するアミノ酸配列で表示され、同等な免疫原性を有するノイラミ二ダーゼ(NA)又は免疫活性を有する、これの断片で、このような抗原決定基が90%以上含有された請求項11に記載のインフルエンザウイルスワクチン組成物。
- 請求項11に記載のインフルエンザウイルスワクチン組成物を個体(ヒトを除く)に投与してインフルエンザウイルス感染疾患を予防又は治療する方法。
- 請求項1〜6のいずれか一項に記載のウイルス又はその抗原決定基を包含するH3N2血清型インフルエンザウイルスの検定キット。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020070109535A KR100850545B1 (ko) | 2007-10-30 | 2007-10-30 | 신규한 개 인플루엔자 바이러스 및 이의 백신 |
| KR10-2007-0109535 | 2007-10-30 | ||
| PCT/KR2007/005789 WO2009057843A1 (en) | 2007-10-30 | 2007-11-16 | A novel canine influenza virus and vaccine therefore |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2011501950A JP2011501950A (ja) | 2011-01-20 |
| JP2011501950A5 JP2011501950A5 (ja) | 2013-06-20 |
| JP5404636B2 true JP5404636B2 (ja) | 2014-02-05 |
Family
ID=39881230
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010530910A Active JP5404636B2 (ja) | 2007-10-30 | 2007-11-16 | 新規のイヌインフルエンザウイルス及びこのワクチン |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US8246962B2 (ja) |
| EP (1) | EP2078083B1 (ja) |
| JP (1) | JP5404636B2 (ja) |
| KR (1) | KR100850545B1 (ja) |
| CN (1) | CN101605898B (ja) |
| AT (1) | ATE554789T1 (ja) |
| ES (1) | ES2383158T3 (ja) |
| WO (1) | WO2009057843A1 (ja) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101838708B (zh) * | 2010-03-30 | 2012-07-18 | 华南农业大学 | 一种检测犬流感的方法 |
| ES2842595T3 (es) | 2011-03-14 | 2021-07-14 | Boehringer Ingelheim Animal Health Usa Inc | Vacuna contra la rinitis equina |
| CN102220293B (zh) * | 2011-05-26 | 2012-12-19 | 中国农业科学院上海兽医研究所 | 犬流感重组病毒及其制备方法和应用 |
| KR101390554B1 (ko) | 2012-05-22 | 2014-05-21 | 충남대학교산학협력단 | 신규한 개 인플루엔자 바이러스(h3n2), 이를 포함하는 백신 조성물 및 h3n2 바이러스 검정 키트 |
| KR101484588B1 (ko) * | 2012-10-24 | 2015-01-20 | 대한민국 | 개 인플루엔자 vlp 백신의 제조방법 |
| CN103223162B (zh) * | 2013-04-03 | 2014-07-30 | 华南农业大学 | 一株h3n2犬流感病毒株cgd1的应用 |
| KR101511619B1 (ko) * | 2013-04-30 | 2015-04-13 | 한국생명공학연구원 | 개 인플루엔자 바이러스 h3n2의 ha1 단백질을 항원으로 포함하는 개 인플루엔자 바이러스 h3n2에 특이적인 혈청 진단용 키트 |
| KR101627623B1 (ko) | 2013-08-29 | 2016-06-08 | 한국생명공학연구원 | 이종 인플루엔자 바이러스에 대한 백신 조성물 |
| KR101768600B1 (ko) * | 2015-05-18 | 2017-08-17 | 한국생명공학연구원 | 범용성 개 인플루엔자 바이러스 백신 조성물 |
| KR20180021816A (ko) * | 2015-06-26 | 2018-03-05 | 메리얼 인코포레이티드 | 불활성화된 개 인플루엔자 백신 및 이의 제조 방법 및 용도 |
| WO2017031401A2 (en) * | 2015-08-20 | 2017-02-23 | University Of Rochester | Ns1 truncated virus for the development of canine influenza vaccines |
| AU2016308917A1 (en) | 2015-08-20 | 2018-03-15 | Cornell University | Live-attenuated vaccine having mutations in viral polymerase for the treatment and prevention of canine influenza virus |
| CN105463021A (zh) * | 2015-12-25 | 2016-04-06 | 华南农业大学 | 表达h3n2犬流感ha蛋白的重组犬腺病毒疫苗载体的构建方法 |
| CN106248937A (zh) * | 2016-09-09 | 2016-12-21 | 华中农业大学 | 一种检测犬副流感病毒抗体的间接elisa试剂盒 |
| AR114410A1 (es) | 2018-02-27 | 2020-09-02 | Univ Rochester | Vacuna multivalente contra influenza viva atenuada para prevenir y controlar el virus influenza equino (vie) en caballos |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU1308495A (en) * | 1994-01-11 | 1995-08-01 | Rijksuniversiteit Gent | Influenza vaccine |
| AT407958B (de) * | 1999-02-11 | 2001-07-25 | Immuno Ag | Inaktivierte influenza-virus-vakzine zur nasalen oder oralen applikation |
| JP4667507B2 (ja) * | 2005-10-07 | 2011-04-13 | ファイザー・プロダクツ・インク | イヌインフルエンザを治療するワクチンおよび方法 |
-
2007
- 2007-10-30 KR KR1020070109535A patent/KR100850545B1/ko active IP Right Grant
- 2007-11-16 US US12/375,924 patent/US8246962B2/en active Active
- 2007-11-16 ES ES07834095T patent/ES2383158T3/es active Active
- 2007-11-16 CN CN2007800299717A patent/CN101605898B/zh active Active
- 2007-11-16 AT AT07834095T patent/ATE554789T1/de active
- 2007-11-16 WO PCT/KR2007/005789 patent/WO2009057843A1/en active Application Filing
- 2007-11-16 JP JP2010530910A patent/JP5404636B2/ja active Active
- 2007-11-16 EP EP07834095A patent/EP2078083B1/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2011501950A (ja) | 2011-01-20 |
| KR100850545B1 (ko) | 2008-08-05 |
| EP2078083A4 (en) | 2009-10-28 |
| US8246962B2 (en) | 2012-08-21 |
| WO2009057843A1 (en) | 2009-05-07 |
| EP2078083B1 (en) | 2012-04-25 |
| ATE554789T1 (de) | 2012-05-15 |
| ES2383158T3 (es) | 2012-06-18 |
| CN101605898B (zh) | 2012-05-23 |
| EP2078083A1 (en) | 2009-07-15 |
| CN101605898A (zh) | 2009-12-16 |
| US20100285063A1 (en) | 2010-11-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5404636B2 (ja) | 新規のイヌインフルエンザウイルス及びこのワクチン | |
| US11160859B2 (en) | Materials and methods for respiratory disease control in canines | |
| JP6301855B2 (ja) | イヌにおける呼吸器疾患管理のための材料および方法 | |
| RU2711807C2 (ru) | Вирус гриппа, способный инфицировать собачьих, и его применение | |
| AU2018203186A1 (en) | Influenza viruses able to infect canids, uses thereof | |
| KR101390554B1 (ko) | 신규한 개 인플루엔자 바이러스(h3n2), 이를 포함하는 백신 조성물 및 h3n2 바이러스 검정 키트 | |
| KR101626798B1 (ko) | 신규한 h3n2 혈청형의 인플루엔자 바이러스 및 이를 포함하는 백신 조성물 | |
| KR101627623B1 (ko) | 이종 인플루엔자 바이러스에 대한 백신 조성물 | |
| KR20120135015A (ko) | 공기전파가 가능한 신규한 h9n2형 저병원성 조류인플루엔자 바이러스 균주 및 그로부터 유래된 백신 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20121113 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130131 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130207 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130312 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130319 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130412 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130419 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20130430 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130723 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130829 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20131001 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20131029 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5404636 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |