(発明の詳細な説明)
本発明は、CD40受容体を標的とし、ADCC調節し、CD40シグナル伝達、特に、CD40の、CD40リガンド(CD40L)との相互作用によって媒介されるCD40シグナル伝達経路を干渉するか、または両方である抗CD40治療薬を用いる治療から恩恵を受ける、癌または前癌状態を有する被験体を同定する方法を対象とする。一実施形態では、本方法は、CD40Lにより媒介されるCD40シグナル伝達と関連している3種のバイオマーカー、特に、細胞増殖または生存および細胞アポローシス経路のバイオマーカーならびにAKT、NF−κBおよびマイトジェン活性化プロテインキナーゼ(MAPK)シグナル伝達経路をはじめとする重要なCD40Lにより媒介されるCD40シグナル伝達経路のバイオマーカーの発現レベルに対する、CD40Lにより媒介されるCD40シグナル伝達をブロックまたは干渉するアンタゴニスト抗CD40治療薬の効果をモニターするためのex vivo予後アッセイの使用を含む。本明細書において後述されるように、CD40Lにより媒介されるCD40シグナル伝達をブロックまたは干渉するアンタゴニスト抗CD40治療薬の効果をモニターするために役立ち得るさらなるマーカーとして、CD40Lにより媒介されるCD40シグナル伝達を介してアップレギュレートされるサイトカインが挙げられる。細胞アポトーシス経路のバイオマーカーはまた、ADCCを調節する抗CD40治療薬、例えば、作用様式としてADCCを有する抗CD40抗体の効果をモニターするために役立ち得る。本明細書において「CD40アンタゴニスト」と呼ばれる、CD40シグナル伝達のアンタゴニストとして作用する治療薬は、CD40LのCD40受容体との結合によって、通常、誘発される1種以上のシグナル伝達合図を干渉し得る。本発明のex vivo予後アッセイを用いて、CD40アンタゴニストを用いた介入およびCD40を標的とし、ADCCを調節する治療薬から恩恵を受ける被験体と、これらの種類の治療薬を用いた介入が有益にならないものとを識別することができる。さらに、またはあるいは、候補被験体を、1種以上のCD40関連因子および/または1種以上の臨床的に有用な予後マーカーの有無、またはその上昇したか、減少したレベルについてスクリーニングして、CD40Lにより媒介されるCD40シグナル伝達および/またはADCCを調節する抗CD40治療薬を用いる治療介入から恩恵を受ける候補被験体の個体または下位個体群を規定できる。これらのスクリーニング方法において同定された被験体を、本明細書に記載されるex vivo予後アッセイを用いてさらにスクリーニングすることができる。本明細書に記載されるバイオマーカーおよびCD40関連因子はまた、CD40シグナル伝達および/またはADCCを調節する抗CD40治療薬を用いる治療の有効性のモニタリングにおいて、および個々の癌患者または癌患者の下位個体群における薬剤反応性の根拠の調査においても用途を見い出せる。
本明細書において「腫瘍」とは、悪性であろうと良性であろうと、すべての腫瘍性細胞成長および増殖ならびにすべての前癌状態および癌性細胞および組織を指す。本明細書において「腫瘍性」とは、悪性であろうと良性であろうと、異常な組織成長をもたらす任意の形の調節不全のまたは未制御の細胞成長を指す。したがって、「腫瘍性細胞」は、調節不全のまたは未制御の細胞成長を有する悪性および良性細胞を含む。
用語「癌」および「癌性」とは、通常、未制御の細胞成長を特徴とする、哺乳類における生理学的状態を指すか、説明する。癌の例としては、それだけには限らないが、リンパ腫および白血病および充実腫瘍が挙げられる。「B細胞関連癌」または「B細胞系統の癌」とは、調節不全のまたは未制御の細胞成長がB細胞と関連しているいずれの種類の癌も意味する。
癌との関連で「不応性」とは、特定の治療薬を用いる療法に対して耐性であるか、非反応性である特定の癌を意味する。癌は、特定の治療薬を用いる治療の開始から(すなわち、治療薬に対する最初の曝露に対して非反応性である)か、または、治療薬を用いる第1の治療期間の過程にかけてか、もしくは、治療薬を用いる次の治療期間の間のいずれかの、治療薬に対する耐性の発生の結果としてのいずれかで、特定の治療薬を用いる療法に対して不応性であり得る。
「CD40抗原」、「CD40細胞表面抗原」、「CD40受容体」または「CD40」は、腫瘍壊死因子(TNF)受容体ファミリーに属する膜貫通糖タンパク質を意味とする(例えば、米国特許第5,674,492号および同4,708,871号、Stamenkovic et al.(1989)EMBO 8:1403、Clark(1990)Tissue Antigens 36:33、Barclay et al(1997)The Leucocyte Antigen Facts Book(2d ed.; Academic Press、San Diego)参照のこと)。ヒトCD40遺伝子の選択的スプライスによる転写物変異体によってコードされるこの遺伝子の2種のアイソフォームが同定されている。第1のアイソフォーム(「長いアイソフォーム」または「アイソフォーム1」としても知られる)は、最初の19残基によって表されるシグナル配列を有する、277アミノ酸の前駆体ポリペプチド(配列番号11(GenBank受託番号X60592およびNM_001250参照のこと)によってコードされる配列番号12(GenBank受託番号CAA43045として最初に報告され、GenBank受託番号NP_001241でアイソフォームとして同定された))として発現される。第2のアイソフォーム(「短いアイソフォーム」または「アイソフォーム2」としても知られる)は、同様に、最初の19残基によって表されるシグナル配列を有する、203アミノ酸の前駆体ポリペプチド(配列番号9(GenBank受託番号NM_152854)によってコードされる配列番号10(GenBank受託番号NP_690593))として発現される。ヒトCD40のこれらの2種のアイソフォームの前駆体ポリペプチドは、共通のそれらの最初の165残基(すなわち、配列番号10および配列番号12の残基1〜165)を共有している。短いアイソフォーム(配列番号10で示される)の前駆体ポリペプチドは、コーディングセグメントを欠く転写物変異体(配列番号9)によってコードされ、翻訳フレームシフトをもたらし、得られるCD40アイソフォームは、短い、CD40の長いアイソフォームに含まれるもの(配列番号12の残基166〜277に示されるC末端)とは別個のC末端(配列番号10の残基166〜203)を含む。本発明の目的上、用語「CD40抗原」、「CD40細胞表面抗原」、「CD40受容体」または「CD40」は、CD40の短いアイソフォームおよび長いアイソフォームの両方を包含する。
本明細書において他で記載されるように、CD40抗原は、種々の細胞種の表面にディスプレイされる。「表面にディスプレイされた」および「表面に発現された」とは、CD40抗原のすべてまたは一部が細胞の外部に曝されることを意味する。ディスプレイされたまたは発現されたCD40抗原は完全にまたは部分的にグリコシル化されている場合がある。
「アゴニスト活性」は、物質がアゴニストとして機能することを意味する。アゴニストは、細胞上の受容体と結合し、受容体の天然リガンドによって開始されるものと同様または同一の反応または活性を開始する。CD40のアゴニストは、それだけには限らないが、以下の反応のいずれかまたはすべてを誘導する:B細胞増殖および分化、抗体産生、細胞内接着、B細胞記憶生成、アイソタイプスイッチ、MHCクラスIIおよびCD80/86の細胞表面発現のアップレギュレーションおよび炎症性サイトカイン、例えば、VEGF、IL−8、IL−12およびTNFの分泌。「アンタゴニスト活性」とは、物質がアンタゴニストとして機能することを意味する。CD40のアンタゴニストは、CD40受容体の、アゴニストリガンド、特に、CD40Lとの結合によって誘導される任意の反応の誘導を妨げるか、減少させる。アンタゴニストはアゴニスト結合に対する反応のいずれか1種以上の誘導を、5%、10%、15%、20%、25%、30%、35%、好ましくは、40%、45%、50%、55%、60%、より好ましくは、70%、80%、85%、最も好ましくは、90%、95%、99%または100%減少させることができる。CD40リガンド結合特異性および抗CD40治療薬、例えば、抗CD40抗体のアンタゴニスト活性を測定する方法は、当技術分野で公知であり、それだけには限らないが、標準競合結合アッセイ、B細胞による免疫グロブリン分泌をモニタリングするためのアッセイB細胞増殖アッセイ、バンチェロー(Banchereau)様B細胞増殖アッセイ、抗体産生についてのT細胞ヘルパーアッセイ、B細胞増殖アッセイの同時刺激およびB細胞活性化マーカーのアップレギュレーションのアッセイが挙げられる。例えば、参照により本明細書に組み込まれる、WO00/75348および米国特許第6,087,329号に開示されるようなアッセイを参照のこと。また、2003年11月4日、2003年11月26日および2004年4月27日に出願された「Antagonist Anti−CD40 Monoclonal Antibodies and Methods for Their Use」と題された仮出願および譲渡された米国特許出願第60/517,337号(それぞれ、代理人整理番号PP20107.001(035784/258442))、同60/525,579号(代理人整理番号PP20107.002(035784/271525))および同60/565,710号(代理人整理番号PP20107.003(035784/277214))および2004年11月4日に出願され、WO2005/044854として公開され、同様に「Antagonist Anti−CD40 Monoclonal Antibodies and Methods for Their Use」と題された国際特許出願PCT/US2004/037152(代理人整理番号PP20107.004(035784/282916))も参照のこと。これらの各々の内容は、参照によりその全文が本明細書に組み込まれる。
「顕著な」アゴニスト活性は、B細胞応答のアッセイにおいて測定される、中立物質または陰性対照によって誘導されるアゴニスト活性を少なくとも30%、35%、40%、45%、50%、60%、70%、75%、80%、85%、90%、95%または100%大きいアゴニスト活性を意味する。「顕著な」アゴニスト活性は、B細胞応答のアッセイにおいて測定される、中立物質または陰性対照によって誘導されるアゴニスト活性よりも少なくとも2倍大きいか、少なくとも3倍大きいアゴニスト活性であることが好ましい。したがって、例えば、注目するB細胞応答がB細胞増殖である場合には、「顕著な」アゴニスト活性は、中立物質または陰性対照によって誘導されるB細胞増殖のレベルよりも少なくとも2倍大きいか、少なくとも3倍大きいB細胞増殖のレベルの誘導である。一実施形態では、非特異的免疫グロブリン、例えば、CD40と結合しないIgG1は陰性対照として働く。「顕著なアゴニスト活性がない」物質は、中立物質または陰性対照によって誘導されるアゴニスト活性の最大約25%大きいアゴニスト活性を示し、B細胞応答のアッセイにおいて測定される、中立物質または陰性対照によって誘導されるアゴニスト活性よりも最大約20%大きい、15%大きい、10%大きい、5%大きい、1%大きい、0.5%大きいまたはさらに最大約0.1%大きいことが好ましい。
本発明のいくつかの実施形態では、抗CD40治療薬は、アンタゴニスト抗CD40抗体である。このような抗体は、ヒト細胞上のCD40抗原と結合している場合は、上記のように顕著なアゴニスト活性がない。本発明の一実施形態では、アンタゴニスト抗CD40抗体は、1つの細胞応答において顕著なアゴニスト活性がない。本発明のもう1つの実施形態では、アンタゴニスト抗CD40抗体は、2以上の細胞応答(例えば、増殖および分化、または増殖、分化およびB細胞の抗体産生)のアッセイにおいて顕著なアゴニスト活性がない。本発明のいくつかの実施形態では、本明細書において後述されるように、注目する抗CD40治療薬は、アンタゴニスト抗CD40抗体、例えば、完全ヒトモノクローナル抗体CHIR−12.12もしくはCHIR−5.9、またはその抗原結合性断片である。
任意の当技術分野で公知のアッセイを用いて、抗CD40治療薬が1以上のB細胞応答のアンタゴニストとして作用するかどうかを調べることができる。いくつかの実施形態では、治療薬は、B細胞増殖、B細胞分化、抗体産生、細胞内接着、B細胞記憶生成、アイソタイプスイッチ、MHCクラスIIおよびCD80/86の細胞表面発現のアップレギュレーションおよび炎症性サイトカイン、例えば、VEGF、IL−8、IL−12およびTNFの分泌からなる群から選択される少なくとも1種のB細胞応答のアンタゴニストとして作用する抗CD40抗体である。特に注目されるのは、ヒトB細胞の表面にあるヒトCD40抗原と結合している場合には、B細胞増殖に関して顕著なアゴニスト活性がないアンタゴニスト抗CD40抗体である。
このような一実施形態では、抗CD40抗体は、B細胞増殖アッセイ、例えば、本明細書において以下、実施例6に記載されるものにおいて測定されるB細胞増殖のアンタゴニストであり、アンタゴニスト抗CD40抗体は、中立物質または陰性対照によって誘導されるB細胞増殖よりも最大約25%高いレベルでB細胞増殖を刺激し、中立物質または陰性対照によって誘導されるB細胞増殖よりも20%大きい、15%大きい、10%大きい、5%大きい、1%大きい、0.5%大きいまたはさらに最大約0.1%大きいことが好ましい。
その他の実施形態では、抗CD40抗体は、B細胞増殖アッセイ、例えば、本明細書において以下、実施例6に記載されるものにおいて測定される、別の抗CD40抗体、例えば、S2C6抗CD40抗体によって誘導される、B細胞増殖のアンタゴニストであり、アンタゴニスト抗CD40抗体の存在下でその他の抗CD40抗体によって刺激されるB細胞増殖のレベルは、アンタゴニスト抗CD40抗体の不在下でその他の抗CD40抗体によって誘導されるB細胞増殖の最大約25%であり(すなわち、少なくとも75%阻害)、アンタゴニスト抗CD40抗体の不在下でその他の抗CD40抗体によって誘導されるB細胞増殖の最大約20%、15%、10%、5%、1%、0.5%、またはさらに最大約0.1%が好ましい。
さらにその他の実施形態では、抗CD40抗体は、本明細書において以下、実施例6において記載されるB細胞活性化アッセイにおいて測定される、細胞株EL4B5によって誘導されるB細胞増殖のアンタゴニストであり、アンタゴニスト抗CD40抗体の存在下でEL4B5細胞株によって刺激されるB細胞増殖のレベルは、アンタゴニスト抗CD40抗体の不在下でこの細胞株によって誘導されるB細胞増殖の最大約25%である(すなわち、少なくとも75%阻害)であり、アンタゴニスト抗CD40抗体の不在下でこの細胞株によって誘導されるB細胞増殖の最大約20%、15%、10%、5%、1%、0.5%、またはさらに約0.1%が好ましい。
さらにその他の実施形態では、抗CD40抗体は、本明細書において以下、実施例6に記載される、B細胞による抗体産生についてのヒトT細胞ヘルパーアッセイにおいて測定される、ヒトB細胞によるヒトT細胞誘導性抗体産生のアンタゴニストである。このように、アンタゴニスト抗CD40抗体の存在下、T細胞によって刺激されたB細胞によるIgG抗体産生、IgM抗体産生またはIgGおよびIgM両方の抗体産生のレベルが、アンタゴニスト抗CD40抗体の不在下でT細胞によって刺激されたB細胞によるそれぞれの抗体産生の最大約50%であり(すなわち、少なくとも75%阻害)、アンタゴニスト抗CD40抗体の不在下でT細胞によって刺激されたB細胞によるそれぞれの抗体産生の最大約25%、20%、15%、10%、5%、1%、0.5%またはさらに約0.1%が好ましい。
「CD40リガンド」とは、1種以上のCD40シグナル伝達経路と結合し、活性化できるいずれかのペプチド、ポリペプチドまたはタンパク質を意味する。したがって、「CD40リガンド」としては、それだけには限らないが、全長CD40リガンドタンパク質ならびにCD40発現細胞上のCD40シグナル伝達と結合し、刺激するという機能を実施するのに十分な活性を保持するその変異体および断片が挙げられる。天然CD40リガンド、例えば、ヒトCD40リガンド(CD40L;CD154としても知られる)の修飾としては、それだけには限らないが、置換、欠失、末端切断、伸長、融合タンパク質、断片、ペプチドミメティクスなどが挙げられる。本発明のいくつかの実施形態では、ex vivo予後アッセイは、生体サンプルのCD40発現腫瘍性細胞でのCD40シグナル伝達を刺激するための、可溶性CD40L、例えば、可溶性組換えヒトCD40L(Alexis Corporation、Bingham、Nottinghamshire、UK)の使用を含む。 「CD40Lにより媒介されるCD40シグナル伝達」とは、細胞表面受容体CD40の、CD40リガンドとの相互作用に起因するいずれかの生物活性を意味する。CD40シグナル伝達の例としては、CD40発現細胞増殖および生存ならびにCD40発現細胞内の1以上のCD40シグナル伝達経路の刺激をもたらすシグナルがある。CD40「シグナル伝達経路(signaling pathway)」または「シグナル変換経路(signal transdution pathway)」とは、CD40受容体の、CD40リガンド、例えば、CD40Lとの相互作用に起因し、シグナル経路によって伝達された場合に、シグナル伝達カスケード中の1種以上の下流分子の活性化をもたらすシグナルを生じる、少なくとも1種の生化学的反応または生化学的反応の一群を意味するものとする。シグナル伝達経路は、細胞表面CD40受容体から細胞の原形質膜を超えて、1種以上の一連のシグナル伝達分子を介して、細胞の細胞質を介して、時には、細胞の核へシグナルの伝達を導くいくつかのシグナル伝達分子を含む。本発明の特に注目されるものとして、CD40シグナル伝達経路、例えば、AKTの活性化および最終的にNF−κBシグナル伝達経路を介したNF−κBの活性化をもたらすAKTシグナル伝達経路、マイトジェン活性化プロテインキナーゼ(MAPK)シグナル伝達経路、例えば、それぞれ、ERKおよびp38の活性化をもたらす、MEK/ERKシグナル伝達経路およびMEK/p38シグナル伝達経路がある。これらのシグナル伝達経路の活性化およびブロッキングの間のバランスが、以下、本明細書に記載される細胞生存またはアポトーシスのいずれかに有利に働く。
本発明の方法は、ex vivo予後アッセイおよび、検出ステップにおいて、またはこれらのex vivo予後アッセイにおいて試験されている候補抗CD40治療薬として抗体を用いる予後アッセイを対象とする。以下の用語および定義はこのような抗体に当てはまる。
「抗体」および「免疫グロブリン」(Ig)は、同一の構造特徴を有する糖タンパク質である。これらの用語は同義的に用いられる。いくつかの例では、免疫グロブリンの抗原特異性が公知である場合がある。
用語「抗体」は広義で用いられ、完全に組み立てられた抗体、抗原と結合できる抗体断片(例えば、Fab、F(ab’)2、Fv、一本鎖抗体、ダイアボディ、抗体キメラ、ハイブリッド抗体、二重特異性抗体、ヒト化抗体など)および前記のものを含む組換えペプチドを意味する。
本明細書において、用語「モノクローナル抗体」および「mAb」とは、実質的に均質な抗体集団、すなわち、少量で存在し得る、天然に存在する可能性のある突然変異を除いて同一である集団を含む個別の抗体から得られた抗体を指す。
「天然抗体」および「天然免疫グロブリン」は、通常、2つの同一の軽(L)鎖と2つの同一の重(H)鎖からなる、約150,000ダルトンのヘテロ四量体糖タンパク質である。各軽鎖は、1つの共有ジスルフィド結合によって重鎖と結合しているが、ジスルフィド結合の数は、種々の免疫グロブリンアイソタイプの重鎖の間で異なる。各重鎖および軽鎖はまた、規則的な間隔の鎖内ジスルフィド架橋を有する。各重鎖は一方の末端に可変ドメイン(VH)、続いていくつかの定常ドメインを有する。各軽鎖は、一方の末端に可変ドメイン(VL)およびもう一方の末端に定常ドメインを有し、軽鎖の定常ドメインは、重鎖の第1の定常ドメインと並んでおり、軽鎖可変ドメインは、重鎖の可変ドメインと並んでいる。特定のアミノ酸残基が、軽鎖および重鎖可変ドメイン間の界面を形成すると考えられている。
用語「可変」とは、可変ドメインの特定の部分が、抗体間の配列において大きく異なるという事実を指す。可変領域は、抗原結合特異性を付与する。しかし、可変性は、抗体の可変ドメインにわたって均一に分配されているわけではない。軽鎖および重鎖可変ドメイン双方において、相補性決定領域(CDR)または超可変領域と呼ばれる3つのセグメントに集中している。可変ドメインのより高度に保存された部分は、フレームワーク(FR)領域にセルされている(celled)。天然重鎖および軽鎖の可変ドメインは各々、大部分がβプリーツシート配置を採る4つのFR領域を含み、3つのCDRによって連結され、これはループ連結を形成し、βプリーツシート構造の一部形成する場合もある。各鎖中のCDRは、FR領域によって近接近してまとまっており、他の鎖のCDRとともに、抗体の抗原結合部位の形成に寄与する(Kabat et al.(1991)NIH Publ No.91−3242、Vol.I、pages 647−669参照のこと)。定常ドメインは抗体を抗原と結合させることに直接関与していないが、種々のエフェクター機能、例えば、Fc受容体(FcR)結合、抗体依存性細胞毒性における抗体の参加、補体依存性細胞傷害性の阻害および肥満細胞脱顆粒を示す。
本明細書において、用語「超可変領域」とは、抗原結合に関与する抗体のアミノ酸残基を指す。超可変領域は、「相補性決定領域」または「CDR」に由来するアミノ酸残基(すなわち、軽鎖可変ドメイン中、残基24〜34(L1)、50〜56(L2)および89〜97(L3)ならびに重鎖可変ドメイン中、31〜35(H1)、50〜65(H2)および95〜102(H3)を含む:Kabat et al.(1991)Sequences of Proteins of Immunological Interest、5th Ed.Public Health Service、National Institute of Health、Bethesda、MD)ならびに/または「超可変ループ」由来の残基(すなわち、軽鎖可変ドメイン中、残基26〜32(Ll)、50〜52(L2)および91〜96(L3)ならびに重鎖可変ドメイン中、(Hl)、53〜55(H2)および96〜101(H3);Clothia and Lesk、(1987)J.Mol.Biol、196:901−917)を含む。「フレームワーク」または「FR」残基は、超可変領域残基以外の可変ドメイン残基であると、本明細書では考える。
「抗体断片」は、無傷の抗体、好ましくは、無傷の抗体の抗原結合領域または可変領域の一部を含む。抗体断片の例として、Fab、Fab、F(ab’)2およびFv断片、ダイアボディ、直鎖抗体(Zapata et al(1995)Protein Eng.10:1057−1062)、一本鎖抗体分子および抗体断片から形成される多重特異性抗体が挙げられる。抗体のパパイン消化により、「Fab」断片と呼ばれる、2つ同一の抗原結合性断片が生じ、各々、1つの抗原結合部位と残りの「Fc」断片とを含み、その名前は容易に結晶化するその能力を反映している。ペプシン処理によって、2つの抗原結合部位を有し、依然として抗原と架橋できるF(ab’)2断片が生じる。
「Fv」は、完全な抗原認識および結合部位を含む最小抗体断片である。この領域は、強固な非共有結合で結合している、1つの重鎖と1つの軽鎖可変ドメインからなる二量体からなる。この配置において、各可変ドメインの3つのCDRが相互作用してVH−VL二量体の表面に抗原結合部位を規定する。合わせて、6つのCDRが抗原結合特異性を抗体に付与する。しかし、単一の可変ドメイン(または抗原に特異的な3つのCDRのみしか含まないFvの半分)も、完全結合部位よりもより低い親和性でであるが、抗原を認識し、結合する能力を有する。
Fab断片はまた、軽鎖の定常ドメインと重鎖の第1の定常ドメイン(CH1)を含む。Fab断片は、重鎖CH1ドメインのカルボキシ末端に数個の残基、例えば、抗体ヒンジ領域由来の1個以上のシステインが加わっていることがFab’断片とは異なる。Fab’−SHは本明細書では、定常ドメインのシステイン残基が遊離チオール基を有しているFab’の意味である。Fab’断片はF(ab’)2断片の重鎖ジスルフィド架橋の還元によって生じる。抗体断片のその他の化学的カップリングも公知である。
脊椎動物種に由来する抗体(免疫グロブリンs)の「軽鎖」はいずれも、その定常ドメインのアミノ酸配列に基づいて、カッパ(κ)およびラムダ(λ)と呼ばれる2つの明確に異なる種類の一方に割り当てることができる。
その重鎖の定常ドメインのアミノ酸配列に応じて、免疫グロブリンを異なるクラスに割り当てることができる。ヒト免疫グロブリンの5つの主要なクラス:IgA、IgD、IgE、IgGおよびIgMがあり、これらのうちいくつかはさらにサブクラス(アイソタイプ)、例えば、IgG1、IgG2、IgG3、IgG4、IgA1およびIgA2に分けることができる。異なるクラスの免疫グロブリンに対応する重鎖定常ドメインは、それぞれ、α、δ、υ、γおよびμと呼ばれる。異なるクラスの免疫グロブリンのサブユニット構造および3次元配置は周知である。異なるアイソタイプは異なるエフェクター機能を有する。例えば、ヒトIgG1およびIgG3アイソタイプは、ADCC(抗体依存性細胞媒介性細胞傷害性)活性を有する。
本明細書において用いられる場合、語句「標識」は、抗体と直接的にまたは間接的に結合しており、「標識された」抗体を生じる検出可能な化合物または組成物を指す。標識は、それ自体検出可能である場合もあるし(例えば、放射性同位元素標識または蛍光標識)、または酵素標識の場合には、検出可能である基質化合物または組成物の化学変化を触媒する場合もある。
本明細書において「宿主細胞」とは、組換えベクターまたはその他のトランスファーポリヌクレオチドの受容者として使用できるか、使用されている単細胞実体としての微生物または真核細胞または培養細胞株を指し、トランスフェクトされた元の細胞の子孫を含む。単一細胞の子孫は、天然の、偶発的なまたは計画的な変異のために、形態においてまたはゲノムDNAもしくは全DAN相補体において、元の親と必ずしも完全に同一ではない場合があるということは理解される。
「ヒトエフェクター細胞」は、1種以上のFcRを発現し、エフェクター機能を発揮する白血球である。この細胞は少なくともFcγRIIIを発現し、抗原依存性細胞媒介性細胞傷害性(ADCC)エフェクター機能を実施することが好ましい。ADCCを媒介するヒト白血球の例として、末梢血単核細胞(PBMC)、ナチュラルキラー(NK)細胞、単球、マクロファージ、好酸球および好中球が挙げられ、PBMCおよびNK細胞が好ましい。ADCC活性を有する抗体は、通常、IgG1またはIgG3アイソタイプのものである。IgG1およびIgG3抗体を単離することに加えて、IgG1またはIgG3アイソタイプ定常領域に対して非ADCC抗体由来の可変領域または可変領域断片を設計することによって、このようなADCC媒介性抗体を作製できることは留意されたい。
用語「Fc受容体」またはFcR」は、抗体のFc領域と結合する受容体を説明するよう用いられる。好ましいFcRは天然配列ヒトFcRである。さらに、好ましいFcRはIgG抗体と結合するもの(γ受容体)であり、これとしてはFcγRI、FcγRIIおよびFcγRIIIサブクラスの受容体が挙げられ、これらの受容体の対立遺伝子変異体および選択的スプライスされた形も含む。FcγRII受容体は、FcγRIIA(「活性化受容体」)およびFcγRIIB(「阻害受容体」)を含み、これらは、主にその細胞質ドメインが異なる類似のアミノ酸配列を有する。活性化受容体FcγRIIAは、その細胞質ドメインに免疫受容体チロシンベースの活性化モチーフ(ITAM)を含む。阻害受容体FcγRIIBは、その細胞質ドメインに免疫受容体チロシンベースの阻害モチーフ(ITIM)を含む(Daeron(1997)Annu.Rev.Immunol.15:203−234参照のこと)。FcRは、Ravetch and Kinet(1991)Annu.Rev.Immunol.9:457−492; Capel et al.(1994)Immunomethods 4:25−34およびde Haas et al.(1995)J.Lab.Clin.Med.126:330−341に概説されている。今後同定されるものを含め、その他のFcRsは、本明細書において用語「FcR」に包含される。この用語はまた、新生児受容体、母のIgGの胎児への移行に関与しているFcRnを含む(Guyer et al.(1976)J.Immunol.117:587およびKim et al.(1994)J.Immunol.24:249)。
ヒト抗体を作製するには、いくつかの方法がある。例えば、分泌細胞をエプスタイン−バーウイルス(EBV)に感染させることによって不死化させることができる。しかし、EBV感染細胞はクローニングすることが困難であり、通常、比較的低い収率でしか免疫グロブリンを産生しない(James and Bell(1987)J.Immunol.Methods 100:5−40)。規定の組合せのトランスフォーミング遺伝子を導入することによって、将来、ヒトB細胞の不死化が達成できる可能性がある。このような可能性は、SV40ラージ腫瘍性タンパク質およびH−rasの発癌性対立遺伝子とともの、テロメラーゼ触媒サブユニットの発現が、正常ヒト上皮細胞および繊維芽細胞の腫瘍性変換をもたらしたということが最近実証されたことによって浮き上がっている(Hahn et al.(1999)Nature 400:464−468)。現在、免疫化すると、内因性免疫グロブリン産生がない状態でヒト抗体のレパートリーを産生できるトランスジェニック動物(例えば、マウス)を作製することが可能である(Little et al.(2000)Immunol.Today 21:364−370に概説される、Jakobovits et al.(1993)Nature 362:255−258; Lonberg and Huszar(1995)Int.Rev.Immunol.13:65−93; Fishwild et al.(1996)Nat.Biotechnol.14:845−851; Mendez et al.(1997)Nat.Genet.15:146−156; Green(1999)J.Immunol.Methods 231:11−23; Tomizuka et al.(2000)Proc.Natl.Acad.Sci USA 97:722−727)。例えば、キメラマウスおよび生殖細胞系列突然変異マウスにおける抗体重鎖結合領域(JH)遺伝子のホモ接合型欠失は、内因性抗体産生の完全阻害をもたらすということが記載されている(Jakobovits et al.(1993)Proc.Natl.Acad.Sci.USA 90:2551−2555)。このような生殖細胞系列突然変異マウスにおけるヒト生殖系列免疫グロブリン遺伝子アレイの移入は、抗原チャレンジの際にヒト抗体の産生をもたらす(Jakobovits et al.(1993)Nature 362:255−258)。Mendez et al.(1997)(Nature Genetics 15:146−156)は、抗原でチャレンジすると、高親和性完全ヒト抗体を生成するトランスジェニックマウスの系統を作製した。これは、メガ塩基対のヒト重鎖および軽鎖遺伝子座の、上記のような内因性JHセグメントに欠失のあるマウスへの生殖系列組込みによって達成された。これらのマウス(ゼノマウス(登録商標)IIテクノロジー(Abgenix; Fremont、California))は、約66のVH遺伝子、完全DHおよびJH領域、および3つの異なる定常領域を含む1,020kbのヒト重鎖遺伝子座を有し、また、32のVκ遺伝子、JκセグメントおよびCκ遺伝子を含む800kbのヒトκ遺伝子座を有する。これらのマウスにおいて産生される抗体は、ヒトにおいて見られるものと、遺伝子再構成、アセンブリーおよびレパートリーをはじめ、あらゆる点で酷似している。ヒト抗体は、マウス遺伝子座における遺伝子再構成を妨げる内因性セグメントの欠失のために内因性抗体を上回って優先的に発現される。このようなマウスは、特に注目される抗原を用いて免疫化できる。
このように免疫化された動物から得た血清を、初回抗原に対する抗体反応性についてスクリーニングできる。リンパ球をリンパ節または脾臓細胞から単離でき、CD138陰性およびCD19陽性細胞を選択することによってB細胞をさらに選択できる。一態様では、このようなB細胞培養物(BCC)を骨髄腫細胞と融合して、上記で詳述したハイブリドーマを作製することができる。
もう1つの態様では、このようなB細胞培養物を、初回抗原に対する反応性についてさらにスクリーニングできることが好ましい。このようなスクリーニングとして、標的/抗原タンパク質を用いる酵素結合免疫吸着測定法(ELISA)、注目する抗原と結合する既知抗体を用いる競合アッセイおよび標的抗原を発現する一過性にトランスフェクトされたCHOまたはその他の細胞とのin vitro結合が挙げられる。
本発明の予後アッセイに用いる、バイオマーカー、サイトカインマーカー、CD40関連因子および臨床的に有用な予後マーカー
いくつかの実施形態では、本発明の方法は、細胞生存、増殖、アポトーシスおよびCD40シグナル伝達経路のうち1種以上のバイオマーカーの発現レベルの変化をモニターするためのex vivo予後アッセイの使用を含む。ex vivo予後アッセイは単独で用いてもよく、またはその他の予後アッセイ、例えば、その他のCD40関連因子の発現に基づいて、および/または抗CD40治療薬によって用いられるものとは異なる作用様式を有する標準治療薬を用いる治療介入で不良予後を示すその他の臨床的に有用な予後マーカーの発現の有無または発現の増大もしくは低下に基づいて抗CD40治療薬を用いる治療に対して反応性である、癌または前癌状態を有する候補被験体を同定する予後アッセイと併用してもよい。「抗CD40治療薬を用いる治療に反応性」とは、候補被験体(すなわち、以下、本明細書に記載される癌または前癌状態を有する個体)が、抗CD40治療薬で治療された場合に、治療が求められる癌または前癌状態に対して正の治療反応を有することを意味する。
ex vivo予後アッセイにおいて使用するためのバイオマーカー
シグナル伝達経路は、シグナル伝達を促進するタンパク質ファミリー特徴とする。用語「ファミリー」とは、タンパク質および核酸分子に言及する場合は、共通構造ドメインまたはモチーフを有し、本明細書に定義される十分なアミノ酸またはヌクレオチド配列相同性を有する2種以上のタンパク質または核酸分子を意味するものとする。このようなファミリーメンバーは天然に存在するものである場合もあり、天然に存在しないものである場合もあり、同一または異なる種のいずれかに由来するものである場合もある。例えば、ファミリーは、ヒト起源の第1のタンパク質、ならびにヒト起源のその他の別個のタンパク質を含み得るか、あるいは、非ヒト起源の相同体を含み得る。ファミリーのメンバーはまた、共通の機能的特徴を有し得る。
セリン/トレオニンキナーゼのAKT(プロテインキナーゼBについてはPKBと呼ばれることもある)ファミリーは、細胞増殖、生存および代謝に一体的に関与している。PKBは最初、レトロウイルス癌遺伝子として同定された。現在、AKTファミリーの3種の変異体、480残基AKT−1、481残基AKT−2および479残基AKT−3が特性決定されている。悪性腫瘍におけるAkt遺伝子の役割は、いくつかの癌におけるAKTタンパク質の、その増幅および/または過剰発現によって示されている。例えば、Nicholson and Anderson(2002)Cell Signal 14:381−398; Sun et al.(2001)Cancer Res.61:5985−5991; Cheng et al.(1997)Oncogene 14:2793−2801; Ruggeri et al.(1998)Mol.Carcinog.21:81−86; Liu et al.(1998)Cancer Res.58:2973−2977; Lin et al.(2001)Langenbecks Arch Surg.386:293−301参照のこと。本発明の目的上、AKTファミリーのタンパク質のメンバーは、通常、AKTタンパク質と呼ばれるが、本発明の方法は、AKTの3種の形すべて、すなわち、AKT−1、AKT−2およびAKT−3ならびにその変異体に当てはまることは認識される。
AKTは、PH(プレクストリン相同性)ドメインを含む増殖因子調節性セリン/トレオニンキナーゼである。このPHドメインは、ホスファチジルイノシトール3−キナーゼ(PI3K)、ホスファチジルイノシトール−3,4−ビホスフェートおよびホスファチジルイノシトール−3,4,5−トリホスフェートの脂質生成物と相互作用し、これがAKTの細胞のサイトゾルからその原形質膜への輸送をもたらす。この輸送は、AKTを上流活性化キナーゼ、PDKl(ホスホイノシチド依存性キナーゼ1)に提示するために必要である。種々の生存および増殖因子、例えば、PDGF、EGF、インスリン、トロンビンおよびNGFが、AKTの輸送を活性化することがわかっている。AKT/PKBタンパク質の活性化された(すなわち、リン酸化された)形は、多数の基質、例えば、GSK−3(グリコーゲン合成酵素キナーゼ3)、eNOS(内皮一酸化窒素合成酵素)、FKHR1(フォークヘッド転写因子ファミリーメンバー1)、Bad(Bcl−2アポトーシス促進性ファミリーメンバー)およびp21 CIP(細胞周期進行の阻害剤)をリン酸化する。これらの作用は、さまざまな生物学的効果、例えば、アポトーシスの抑制、グルコース代謝の制御、細胞増殖、転写、翻訳、細胞遊走および血管新生をもたらし得る。AKTタンパク質は、細胞が癌性となった場合にはその活性化と関連する抗アポトーシス活性を有する。AKTのリン酸化は、細胞周期およびアポトーシスに関与する基質の核−細胞質局在を誘発すると考えられている。これは、結果的に悪性腫瘍になる事象、例えば、増殖シグナル自律性の獲得、アポトーシスシグナルに対する非感受性、無制限の複製、持続性の血管新生、組織浸潤および転移の宿主をもたらす。
活性化AKT(すなわち、p−AKT)は、下流エフェクター分子のリン酸化を含むいくつかの別個の経路によって細胞生存を促進する。第1に、p−AKTは、Bad/Bcl−xl複合体のBad成分をリン酸化することによってアポトーシスを阻害する。リン酸化されたBadは、14−3−3と結合し、Bad/Bcl−xl複合体の解離を引き起こし、それによってBcl−xlを遊離させ細胞生存を可能にする。第2に、Iカッパ−B(Iκ−B)ファミリーの阻害タンパク質との結合によって細胞質において不活性で保たれているNF−κBを、NF−κB誘導キナーゼ(NIK)との相互作用によって活性化できるか、またはAKTシグナル伝達経路によって活性化できる。このように、活性化AKT(すなわち、p−AKT)は、Iκ−Bキナーゼ多タンパク質複合体(IKK−α/β)の中間体リン酸化を介して、Iκ−Bファミリー(例えば、Iκ−Bα)のNF−κB阻害分子を活性化し、Iκ−Bの活性化は、その分解およびそれまでに結合していたNF−κBの放出をもたらし、これがこの転写因子の活性化をもたらす。次いで、NF−κBの活性型は核に移動し、数百の遺伝子の発現を調節してアポトーシスに対抗することができる。AKTが細胞生存を促進し、アポトーシスに対抗するもう1つの手段は、プロテアーゼカスパーゼ9またはフォークヘッド転写因子、例えば、FKHRL1をリン酸化することによってである。
いくつかの実施形態では、CD40Lにより媒介されるCD40シグナル伝達をブロックするか、干渉する抗CD40治療薬を用いる治療から恩恵を受ける、癌または前癌状態を有する被験体を同定するための本発明の方法は、AKTおよびNF−κBシグナル伝達経路を介してCD40シグナル伝達に対する抗CD40治療薬の効果をモニターするためのex vivo予後アッセイの使用を含む。このように、候補被験体から採取した試験生体サンプルを、注目する抗CD40治療薬と、本明細書において以下に記載されるCD40Lにより媒介されるCD40シグナル伝達の調節を可能にするのに十分な時間接触させ、次いで、そのサンプルを、リン酸化AKT(p−AKT)、リン酸化PI3K(p−PI3K)、リン酸化PDK1(p−PDK1)、リン酸化IKK−α/β(p−IKK−α/β)、リン酸化Iκ−B(p−Iκ−B、例えば、p−Iκ−Bα)および活性化NF−κBからなる群から選択される少なくとも1種のCD40シグナル伝達バイオマーカーの発現レベルの変化についてアッセイする。対照生体サンプルについて観察されたものと比較した、抗CD40治療薬ととものインキュベーションに応じた、CD40Lにより刺激されたCD40発現腫瘍性細胞を含む試験生体サンプル中のこれらのリン酸化バイオマーカーの発現レベルの低下の検出は、CD40Lにより媒介されるCD40シグナル伝達のダウンレギュレーションを示し、ひいては、その抗CD40治療薬を用いた正の治療転帰を示す。いくつかの実施形態では、AKTおよびNF−κBシグナル伝達経路によるCD40シグナル伝達の任意の所与のバイオマーカーの発現レベルが、対照生体サンプルにおいて検出されるものと比較して、少なくとも約5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%または100%低下する。
CD40/CD40L相互作用はまた、MEK/ERKシグナル伝達経路、MEK/p38シグナル伝達経路およびMEKK/JNKK/JNKシグナル伝達経路を含むMAPKシグナル伝達カスケードの活性化ももたらす。すべてのMAPK経路は、逐次リン酸化事象によって働き、転写因子をリン酸化し、遺伝子発現を調節する。それらはまた、細胞質標的をリン酸化し、細胞内事象を調節できる。これらのカスケードは、細胞増殖、分化、発達、細胞周期および発癌性シグナルの伝達の調節にかかわっている。本発明の方法にとって特に興味深いことは、MEK/ERKおよびMEK/p38シグナル伝達経路の活性化である。
MAPキナーゼ(細胞外シグナル調節プロテインキナーゼまたはERKとも呼ばれる)は、3キナーゼカスケード中の終末酵素であり、各酵素は、シークエンス中の次のメンバーをリン酸化することによって活性化する。各MAPKモジュールは、3種のプロテインキナーゼ:次いで、MAPK/ERK酵素を活性化する、MAPKキナーゼ(またはMEK)を活性化するMAPKキナーゼキナーゼ(またはMEKK)からなる。MEKKは、1種以上のMEK酵素を、触媒コア内のSerまたはThr残基(Ser−X−X−X−Ser/Thr)で二重リン酸化することによって活性化するセリン/トレオニン特異的プロテインキナーゼである。MEKは、MAPKのTXYコンセンサス配列内のThrおよびTyr双方をリン酸化することによってMAPKを活性化するセリン/トレオニン/チロシン特異的プロテインキナーゼである。この二重リン酸化が活性化には必要である。ERK1(p44)、ERK2(p42)、p38/HOGおよびJNK/SAPKは、平行経路中の関連しているが別個の末端MAPKを表す。
いくつかの実施形態では、抗CD40治療薬を用いる治療から恩恵を受ける、癌または前癌状態を有する被験体を同定するための本発明の方法は、MEK/ERKおよびMEK/p38経路を介してCD40シグナル伝達に対する抗CD40治療薬の効果をモニターするためのex vivo予後アッセイの使用を含む。このように、候補被験体から採取した試験生体サンプルを、注目する治療薬と、以下に記載されるCD40Lにより媒介されるCD40シグナル伝達の調節を可能にするのに十分な時間接触させ、次いで、そのサンプルを、リン酸化MEK(p−MEK)、例えば、p−MEK1、p−MEK2、p−MEK3およびp−MEK6、リン酸化ERK(p−ERK)、例えば、p−ERK1またはp−ERK2ならびにリン酸化p38(p−p38)からなる群から選択される少なくとも1種のCD40シグナル伝達バイオマーカーの発現レベルの変化についてアッセイする。対照生体サンプルについて観察されたものと比較した、抗CD40治療薬ととものインキュベーションに応じた、CD40Lにより刺激されたCD40発現腫瘍性細胞を含む生体サンプル中のこれらのリン酸化バイオマーカーの発現レベルの低下の検出は、CD40Lにより媒介されるCD40シグナル伝達のダウンレギュレーションを示し、ひいては、その抗CD40治療薬を用いた正の治療転帰を示す。いくつかの実施形態では、MEK/ERKおよびMEK/p38経路によるCD40シグナル伝達の任意の所与のバイオマーカーの発現レベルは、対照生体サンプルにおいて検出されるものと比較して、少なくとも約5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%または100%低下する。
CD40Lにより媒介されるCD40シグナル伝達をブロックするか、干渉する抗CD40治療薬を用いる治療に対する候補被験体の反応性はまた、CD40Lにより媒介されるCD40シグナル伝達の任意のサイトカインマーカーの発現レベルに対する治療薬のex vivo効果をモニターすることによって評価できる。in vivoでは、CD40の、その天然リガンドによる結合が、CD40発現細胞の種類に応じていくつかの炎症誘発性サイトカインのアップレギュレーションをもたらす。本明細書において後述されるように、正常B細胞のEx vivo CD40L刺激は、いくつかのサイトカイン、例えば、それだけには限らないが、血管内皮増殖因子(VEGF)、インターロイキン(IL)−6、IL−8、IL−10、腫瘍壊死因子−α(TNF−α)、単球化学誘引物質タンパク質−1(MCP−1)およびマクロファージ炎症性タンパク質−1β(MIP−1β)の産生のアップレギュレーションをもたらすが、腫瘍性B細胞、例えば、慢性リホシティック(lyphocytic)白血病細胞のex vivo CD40L刺激は、VEGF、IL−8、IL−10、顆粒球単球コロニー刺激因子(GM−CSF)、TNF−αおよびMCP−1の産生のアップレギュレーションをもたらす。
本発明のスクリーニング方法に従って、候補被験体から採取した試験生体サンプルを、注目する抗CD40治療薬と、本明細書において以下に記載されるCD40Lにより媒介されるCD40シグナル伝達の調節を可能にするのに十分な時間接触させ、次いで、そのサンプルを、VEGF、IL−6、IL−8、IL−10、GM−CSF、TNF−α、MCP−1およびMlP−1βからなる群から選択される少なくとも1種のサイトカインマーカーの発現レベルの変化についてアッセイする。本明細書において後述されるように、サイトカインの発現レベルは当技術分野で公知の任意の検出方法を用いて達成できる。対照生体サンプルについて観察されたものと比較した、抗CD40治療薬ととものインキュベーションに応じた、CD40Lにより刺激されたCD40発現腫瘍性細胞を含む試験生体サンプル中のこれらのサイトカインマーカーの発現レベルの低下の検出は、CD40Lにより媒介されるCD40シグナル伝達のダウンレギュレーションを示し、ひいては、その抗CD40治療薬を用いた正の治療転帰を示す。いくつかの実施形態では、任意の所与のサイトカインの発現レベルは、対照生体サンプルにおいて検出されるものと比較して、少なくとも約5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%または100%低下する。
AKT、NF−κBおよびMAPKシグナル伝達経路は、すべて細胞増殖および生存に関与している。免疫系では、アポトーシスは、T細胞レパートリーの選択、自己反応性TおよびBリンパ球の欠失、免疫応答の終結後の末梢エフェクターT細胞の除去、インムノロジカル(inmmunological)記憶の調節において、およびCTLおよびNK細胞による標的細胞の細胞傷害性において重要な役割を果たしている。B細胞系統の悪性腫瘍については、B細胞増殖とアポトーシス間のバランスの異常な調節が、腫瘍性B細胞の制御されない増殖をもたらす。腫瘍性B細胞に対してCD40生存シグナル伝達をブロックし、細胞アポトーシスプロセスを促進できるる治療薬は、B細胞系統の前癌状態および悪性腫瘍の治療において有益である。
したがって、抗CD40治療薬を用いる治療から恩恵を受ける、癌または前癌状態を有する被験体を同定するための本発明の方法は、腫瘍性細胞に対するCD40シグナル伝達をモニターすることに加え、1種以上のアポトーシスのバイオマーカー、特に、細胞アポトーシス促進性タンパク質、例えば、それだけには限らないが、切断されたカスパーゼタンパク質および切断されたポリADPリボースポリメラーゼ(PARP)の発現に対する抗CD40治療の効果をモニターするex vivo予後アッセイの使用を含む。アッセイできるさらなるアポトーシスのバイオマーカーとして、それだけには限らないが、細胞表面の原形質膜の変化、例えば、細胞表面ホスファチジルセリン(PS)の存在およびゲノムDNAの切断または断片化が挙げられる。PSは通常、もっぱら原形質膜の内側に局在するが、細胞膜が無傷のままであるアポトーシス細胞死の初期相の間に細胞の外表面に移動される。本明細書において後述されるように、細胞表面PSの存在およびゲノムDNA断片化は、例えば、それぞれ、アネキシンV染色およびTUNEL染色によって検出できる。対照生体サンプルについて観察されたものと比較した、抗CD40治療薬ととものインキュベーションに応じた、CD40Lにより刺激されたCD40発現腫瘍性細胞を含む試験生体サンプルにおけるこれらのアポトーシスのバイオマーカーのうち1種以上の発現レベルの増大の検出は、抗CD40治療薬を用いた正の治療転帰を示す。いくつかの実施形態では、任意の所与のアポトーシスのバイオマーカーの発現レベルは、対照生体サンプルにおいて検出されるものと比較して、少なくとも約5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、125%、150%、200%、250%、300%以上増大する。
あるいは、本発明の方法は、上記のex vivoアッセイと組合せて、細胞増殖および/または細胞生存のバイオマーカーである1種以上のタンパク質、例えば、それだけには限らないが、Bcl−2ファミリーのメンバーである抗アポトーシスタンパク質、IAPアポトーシス阻害剤タンパク質およびTNF受容体関連因子−1(TRAF−1)の発現に対する抗CD40治療薬の効果をモニターするex vivo予後アッセイの使用を含む。対照生体サンプルにおいて観察されたものと比較した、抗CD40治療薬ととものインキュベーションに応じた、CD40発現腫瘍性細胞を含む試験生体サンプル中のこれらの細胞増殖および/または細胞生存のバイオマーカーの発現レベルの低下の検出は、その抗CD40治療薬を用いた正の治療転帰を示す。いくつかの実施形態では、任意の所与の細胞増殖および/または細胞生存のバイオマーカーの発現レベルは、対照生体サンプルにおいて検出されるものと比較して、少なくとも約5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%または100%低下する。
カスパーゼファミリーのメンバーのタンパク質は、細胞アポトーシスの主要なエフェクターである。カスパーゼは、不活性のプロ型またはいわゆる「チモーゲン(zymogens)」として細胞内に存在するシステインプロテアーゼである。チモーゲンは、アポトーシスの死受容体により媒介される経路またはミトコンドリア経路のいずれかによるアポトーシスの誘導後に切断されて活性酵素を形成する。例えば、参照によりその全文が本明細書に組み込まれる、Gupta et al.(2003)Intl.J.Oncol.22:15−20参照のこと。アポトーシス経路に応じて、種々のカスパーゼがアポトーシスプロセスを開始し、カスパーゼ−8および−10は死受容体経路を開始し、カスパーゼ−9はミトコンドリア経路を開始する。活性イニシエーターカスパーゼは、次いで、エフェクターカスパーゼ、例えば、カスパーゼ−3、−6および−7を活性化(すなわち、切断)し、アポトーシスを誘導する。これらのエフェクターカスパーゼは、重要な細胞タンパク質を切断し、アポトーシスを受けている細胞において観察される典型的な形態変化を導く。
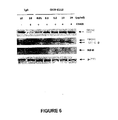
したがって、いくつかの実施形態では、抗CD40治療薬を用いる治療から恩恵をうける、癌または前癌状態を有する被験体を同定するための本発明の方法は、アポトーシスに関連する特異的細胞タンパク質のタンパク質分解をモニターするためのex vivo予後アッセイの使用を含む。例えば、ポリ(ADP−リボース)ポリメラーゼ(PARP−1)は、アポトーシスの間に特異的に切断される。PARP−1は、いくつかの核タンパク質へのポリ(ADP−リボース)鎖の付加を触媒するDNA結合タンパク質であり、DNA損傷修復において重要な役割を果たしていると考えられている。PARP−1は、細胞ストレス、例えば、熱ショック、電離放射線、発癌物質に対する曝露および化学療法薬での治療の際に迅速に活性化される(Scovassi and Poirier(1999)Mol.Cell Biochem.199:125−137; Wyllie(1997)Eur.J.Cell Biol.73:189−197)。アポトーシスの間に、活性化された(すなわち、切断された)カスパーゼ−3は、次いで、PARP−1を切断する。実際、89kDaおよび24kDaのタンパク質分解断片の分離が、アポトーシスの特徴として認められている(Scovassi and Poirier(1999)前掲; Wyllie et al.(1997)前掲。本明細書に記載されるex vivo予後アッセイは、CD40Lにより媒介されるCD40シグナル伝達を調節する、かつ/またはADCCを調節する抗CD40治療薬に応じた、候補被験体から採取した試験生体サンプルにおける、1種以上の切断されたカスパーゼタンパク質、例えば、切断されたカスパーゼ−3、切断されたカスパーゼ−7および切断されたカスパーゼ−9のレベル、ならびに、場合により、切断されたPARP−1、細胞表面PSおよび/またはゲノムDNA断片化のレベルの変化をモニターする。生体サンプル内のアポトーシスバイオマーカーのレベルの上昇は、本明細書において以下に記載されるものをはじめとする当業者に公知の任意の方法を用いて検出できる。
細胞生存および増殖のバイオマーカーとしては、それだけには限らないが、Bcl−2ファミリーのメンバーのタンパク質である抗アポトーシスタンパク質が挙げられる。Bcl−2ファミリーのタンパク質は、少なくとも16メンバーを含み、細胞アポトーシスの調節に関与している。いくつかのファミリーメンバー、例えば、Bcl−2、Bcl−xl、McI−1、Bcl−wおよびA1は抗アポトーシス性、ひいては、細胞生存のバイオマーカーであり、その他のもの(例えば、Bid、Bim、Bik、Bmf、Bad、Hrk、BNIP3、Bax、BakおよびBok)はアポトーシス促進性、ひいては、アポトーシス活性のバイオマーカーである。Bcl−2ファミリーメンバーは、多数の異なる機序、例えば、それによってシトクロムc(Cyt c)およびその他の膜間タンパク質が脱出し得るミトコンドリア外膜における孔形成によって、およびアポトーシス促進性および抗アポトーシス性ファミリーメンバー間のヘテロ二量化によって作用すると示唆されている。
CD40シグナル伝達およびアポトーシスの調節に対する抗CD40治療薬の効果は、本明細書に記載されるex vivo予後アッセイを用いて評価し、これらの細胞生存/アポトーシスのバイオマーカーのうち1種以上をモニターすることができる。特に注目される細胞生存のバイオマーカーとして、それだけには限らないが、抗アポトーシスタンパク質Bcl−xlおよびMcl−1が挙げられる。
ミトコンドリア膜タンパク質Bcl−2をコードするbcl−2遺伝子は、B細胞リンパ腫において最初に同定され(Tsujimoto et al.(1984)Science 226:1097)、これでは原因遺伝子病変は、bcl−2遺伝子を免疫グロブリンプロモーターの制御下に置く染色体転座(t(14:18))として特性決定されている。得られたBcl−2の過剰発現は、そうでなければB細胞ホメオスタシスを維持するアポトーシス細胞死の正常な経過を遅らせ、B細胞蓄積および濾胞性リンパ腫をもたらす(Adams and Cory、1998; Cory(1994)Philos.Trans.R.Soc.Lond.B.Biol.Sci.345:289)。この知見は、癌は無制限の細胞増殖に厳密に起因するわけではなく、不十分なアポトーシスによるターンオーバーによる場合もあることを示した。Bcl−2レベルは、濾胞性リンパ腫の他、広範なその他のヒト癌において上昇しており、このことは、この分子が、広範囲の癌性障害におけるアポトーシス閾値の上昇において役割を有している可能性があることを示す。Bcl−2は、ホモ二量体として存在する場合があり、またはbaxとヘテロ二量体を形成する場合がある。baxは、ホモ二量体として機能し、アポトーシスを誘導する。しかし、bax−Bcl−2複合体の形成はアポトーシスをブロックする。Bcl−2発現はまた、薬剤耐性の発生において役割を果たし得る。Bcl−2の発現は、p53によって負に調節される。Bcl−2の過剰発現は前腫瘍性病変には存在せず、このことは、Bcl−2の変化は腫瘍進行において比較的遅くに生じることを示唆する。
bcl−2遺伝子に対して相同性を有するいくつかの遺伝子、例えば、以下のものがその後特性決定された:GM−CSFまたはLPSに応じてマクロファージにおいて迅速に誘導される80アミノ酸のA1タンパク質をコードするal(Lin et al.(1993)J.Immunol.151:1979−1988);mcl−1、マクロファージ分化を起こす骨髄系細胞株における初期応答遺伝子(Kozopas et al.(1993)Proc.Natl.Acad.Sci.USA 90:3516−3520)およびbak、アポトーシスを増強し得るbcl−2相同体(Chittenden et al.(1995)Nature 374:733; Kiefer et al.(1995)Nature 374:736)。bcl−2遺伝子産物と相互作用し、かつ/またはそれと構造的に関連しているその他のタンパク質、例えば、Bcl−xlおよびBcl−xs(Boise et al.(1993)Cell 74:597)、Ced−9(Vaux et al.(1992)Science 258:1955)なども同定されている。
bcl−x遺伝子産物、Bcl−xはBcl−2タンパク質と密接に関連しており、同様に細胞をアポトーシスから保護する。ヒトBcl−xの選択的スプライシングの結果、少なくとも2種の別個のBcl−x mRNA種、Bcl−xlおよびBcl−xsが生じ得る。より大きなbcl−x mRNAの主要なタンパク質産物(233アミノ酸)、Bcl−xlは、増殖因子の除去の際に細胞死を阻害し(Boise et al.(1993)Cell 74:597−608)、そのトランスジェニック発現は胸腺細胞成熟を変更し、成熟胸腺細胞数の増大をもたらす(Chao et al.(1995)J.Exp.Med.182:821−828; Grillot et al.(1995)J.Exp.Med.182:1973−1983)。
骨髄系細胞白血病関連遺伝子mcl−1は、骨髄系細胞白血病における分化のプログラミングの際に初期に発現されるタンパク質、McI−1をコードする(例えば、米国特許出願公開第20020086321号参照のこと)。Mcl−1のカルボキシル部分は、Bcl−2と相同性を共有する。Mcl−1は、Bcl−2ファミリーのその他のメンバー同様、生存力から死または増殖から分化などの細胞運命における移行のプログラミングとの関連を特徴とする。報告によれば、mcl−1遺伝子の高発現は、非ホジキンスリンパ腫における予後不良と関連している(Kuramoto et al.(2002)Br.J.Haematol.116:158−161)。さらに、報告によれば、比較的高レベルのmcl−1遺伝子発現は、マントル細胞リンパ腫(MCL)における高悪性度形態、高増殖状態およびp53過剰発現と相関している(Khoury et al.(2003)J.Pathol.199:90−97)。
Bcl−2ファミリーのメンバーに加え、本発明の方法において使用するための細胞生存バイオマーカーとして、バキュロウイルスIAP遺伝子と関連しているアポトーシスの阻害剤の遺伝子ファミリーのメンバーが挙げられる(Bimbaum et al.(1994)J.Virol.68:2521−2528; Clem et al.(1994)Mol.Cell Biol.14:5212−5222; Duckett et al.(1996)EMBO J.(1996)15:2685−2694; Hay et al.(1995)Cell 83:1253−1262; Liston et al.(1996)Nature 379:349−353; Rothe et al.(1995)Cell 83:1243−1252; Roy et al.(1995)Cell 80:167−178)。少なくとも8種のヒトIAPが同定されている(Salvesen and Duckett(2002)Nat.Rev.MoI.Cell.Biol.3:401−410)。
IAPは、進化的に高度に保存されている。それらは1〜3個の約70アミノ酸のアミノ末端Cys/HisバキュロウイルスIAPリピート(BIR)に、またRINGフィンガーと呼ばれるカルボキシ末端亜鉛結合ドメインによって組織される類似の構造を共有している。IAPファミリータンパク質はアポトーシスおよび腫瘍形成の調節において重要な役割を有する可能性があると認識されている(Deveraux and Reed(1999)Genes Dev.13:239−252; Tamm et al.(2000)Clin.Cancer Res.6:1796−1803)。スルビビン、IAPファミリータンパク質の1種の発現は、いくつかのヒト癌において大幅に増大している(Hoffman et al.(2002)J.Biol.Chem.277:3247−3257)。また、c−IAP2は粘膜関連リンパ組織リンパ腫の原因遺伝子として、また、発癌および腫瘍進行において役割を有すると示唆されている(Dierlamm et al.(1999)Blood 93:3601−3609)。
IAPは、上流および末端カスパーゼを阻害することによって細胞死を抑制する(例えば、Thompson(1995)Science 267:1456参照のこと)。カスパーゼ−3および−7の活性な(すなわち、切断された)形は、XIAP、c−IAP1およびc−IAP2によって直接阻害され(例えば、Roy et al.(1997)、前掲参照のこと)、これはまた、プロカスパーゼ−3、−6および−7のタンパク質分解によるプロセシングも、プロカスパーゼ−9のシトクロムc誘導性活性化をブロックすることによって妨げ得る(Deveraux et al.(1998)EMBO J.17:2215−2223)。IAPファミリーのメンバーと関連しているアポトーシスの種々の阻害剤をコードする核酸の治療上および診断上の使用は特許文献に記載されている。例えば、国際特許出願WO97/06255、WO97/26331およびWO97/32601参照のこと。細胞生存のバイオマーカーとして使用できるIAPタンパク質の例として、それだけには限らないが、XIAP、cIAPl、cIAP2およびスルビビンが挙げられる。
XIAPは、カスパーゼの最も広く発現され、最も強力なカスパーゼの阻害剤である(例えば、Takahasi et al.(1998)J.Biol.Chem.273:7787; Reed(1994)J.Cell Biol.124:1参照のこと)。報告によれば、このIAPの発現は特定の癌および癌細胞株において高められている(Kornblau et al.(1999)Clin Cancer Res.5:1758; Kitada et al.(1998)Blood 91:3379; Tamm et al.(2000)Clin.Cancer Res.6:1796−1803)。XIAPのダウンレギュレーションは、化学耐性ヒト卵巣癌細胞においてアポトーシスを誘導することがわかっている(Altman et al.(1994)J.Natl.Cancer Inst.86:829)。
スルビビンは、単一のBIRと、RINGフィンガーの代わりに高度に帯電したカルボキシル末端コイルドコイル領域とを含有する約16.5kDaの細胞質タンパク質であり(例えば、米国特許出願公開20030100525参照のこと)、これは、B細胞前駆体に導入した場合に、増殖因子(IL−3)除去によって誘導されるアポトーシスを阻害する(Ambrosini et al.(1997)Nature Med.3:917−921)。スルビビンは、Bcl−2またはその他のIAPタンパク質とは異なり、成体組織では検出不可能であるが、肺、結腸、胸部、膵臓および前立腺の最もよく見られるヒト癌すべてにおいて、また、in vivoで高悪性度非ホジキンスリンパ腫の約50%において顕著に発現されるようになる。報告によれば、スルビビンは、野生型p53によって負に調節される。外因性スルビビンタンパク質の過剰発現は、細胞をp53誘導性アポトーシスから用量依存的に救出し、このことはスルビビンの喪失が少なくとも幾分か、p53依存性アポトーシス経路を媒介することを示唆する(Mirza et al.(2002)Oncogene 21 :2613−2622)。
本発明の方法において使用するためのもう1つの代表的な細胞生存のバイオマーカーとして、TRAF−1がある。TRAFファミリーメンバーはCD40の細胞質ドメインと結合し、B細胞生存、増殖、分化、アイソタイプスイッチ、胚中心の発達および体液性記憶応答を調節する複数のシグナル伝達経路の活性化を媒介する(例えば、Pullen et al.(1999)J.Biol.Chem.274:14246−14254参照のこと)。CD40受容体の活性化がTRAF−1遺伝子の転写をもたらし得るということが報告されている(Schwenzer et al.(1999)J.Biol.Chem.274(27):19368−19374)。CD40受容体活性化の結果としてのTRAF−1遺伝子発現の増大は、正常B細胞および慢性リンパ性白血病(CLL)細胞において差別的に調節され得る(Gricks et al.(2004)Blood 104(13):4002−4009)。したがって、TRAF−1遺伝子発現に対する効果は正常B細胞におけるCD40活性を示すものである場合も示すものでない場合もあるが、腫瘍性血液細胞におけるCD40受容体活性化に応じたTRAF−1遺伝子発現の変化は薬物有効性を予測するものであり得、これによってCD40Lにより媒介されるCD40シグナル伝達に対する抗CD40治療薬の効果および細胞生存/アポトーシスの調節を評価かつ/またはモニターするための適したバイオマーカーを提供する。TRAF−1発現の変化は、本明細書において後述されるように、ノーザンブロットまたは定量的RT−PCRなどの技術によってmRNAレベルで、または例えば、ウエスタンブロットによってタンパク質レベルでのいずれかで容易に検出できる。
前述の細胞生存のバイオマーカーは、これらのバイオマーカーのうち1種またはすべてを含む任意の組合せで、ならびに、その他の細胞増殖のバイオマーカーと組合せて、本明細書に記載されるex vivo予後アッセイにおいてモニターできる。したがって、一実施形態では、本明細書に記載されるex vivo予後アッセイはまた、候補被験体から得た試験生体サンプルにおいて細胞増殖バイオマーカーKi67の発現をモニターするために用いられる。
Ki67は、分裂細胞のG1、S、MおよびG2相にある細胞の核に存在するが、静止状態の細胞のG0相には存在しない細胞周期関連核タンパク質である(Gerdes et al.(1984)J.Immunol.133、1710−1715)。これらの理由のために、細胞増殖マーカーとして用いられる。また、侵襲性乳癌(Tan et al.(2005)Mod.Pathol.18:374−81)および肺腺癌(Haga et al.(2003)Ann.Thorac.Surg.75:1727−32)において予後良好および予後不良カテゴリーを階層化するために用いられてきた。Ki67の高発現はまた、卵巣癌における不良予後と関連している(Henriksen et al.(1994)Gynecol.Oncol.53:301−6; Henzen−Logmans et al.(1994)Int.J.Cancer 57:468−72; Wong and Tattersall(1989)Br.J.Obstet.Gynaecol.96:720−4)。さらに、Ki67タンパク質発現のアンチセンス抑制は細胞増殖を妨げることがわかっている(Schluter et al.(1993)J.Cell Biol.123:513−522)。
したがって、本発明のex vivo予後アッセイにおいてモニターされるバイオマーカーとしては、上記の細胞生存およびアポトーシスタンパク質および本明細書において先に記載されるCD40シグナル伝達経路に関与するタンパク質が挙げられる。モニタリングはタンパク質レベルであっても、核酸レベルであってもよい。したがって、バイオマーカーとしては、これらのタンパク質およびこれらのタンパク質をコードする遺伝子が挙げられる。検出がタンパク質レベルである場合には、バイオマーカータンパク質は、全長ポリペプチドまたはその任意の検出可能な断片を含み、これらのタンパク質配列の変異体を含み得る。同様に、検出がヌクレオチドレベルである場合には、バイオマーカー核酸としては、全長コード配列、全長コード配列の断片、これらの配列の変異体、例えば、天然に存在する変異体もしくはスプライス変異体またはこのような配列の相補体を含むDNAが挙げられる。バイオマーカー核酸としてまた、RNA、例えば、注目するバイオマーカータンパク質をコードする全長配列を含むmRNA、注目する全長RNA配列の断片またはこれらの配列の変異体が挙げられる。バイオマーカータンパク質およびバイオマーカー核酸はまた、これらの配列の変異体を含む。「断片」とは、ポリヌクレオチドの一部またはアミノ酸配列の一部、ひいては、それらによってコードされるタンパク質を意味する。バイオマーカーヌクレオチド配列の断片であるポリヌクレオチドは、通常、少なくとも10、15、20、50、75、100、150、200、250、300、350、400、450、500、550、600、650、700、800、900、1,000、1,100、1,200、1,300または1,400の隣接するヌクレオチドまたは、最大、本明細書に開示される全長バイオマーカーポリヌクレオチド中に存在するヌクレオチド数を含む。バイオマーカーポリヌクレオチの断片は、通常、少なくとも15、25、30、50、100、150、200または250の隣接するアミノ酸、または、最大、本発明の全長バイオマーカータンパク質中に存在する全アミノ酸数をコードする。「変異体」とは、実質的に類似の配列を意味するものとする。通常、本発明の個々のバイオマーカーの変異体は、そのバイオマーカーに対して少なくとも約40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%以上の配列同一性を有することが、当技術分野で公知の配列アラインメントプログラムによって調べられる。これらのマーカー各々のタンパク質および対応するコード配列は当技術分野で公知である。本明細書において以下、実施例5中表6参照のこと。
その他の予後アッセイにおいて使用するためのCD40関連因子および臨床的に有用な診断マーカー
本発明の方法に従って、1種以上のCD40関連因子の有無またはそのレベルの上昇もしくは低下を探す予後アッセイを用いて、抗CD40治療薬を用いる治療から恩恵をうける、癌または前癌状態を有する個体または患者の下位個体群も同定できる。これらのCD40関連因子に基づいて、抗CD40治療薬を用いる治療に反応性であると同定される被験体を、抗CD40治療薬を用いて治療できる。あるいは、例えば、癌または前癌状態が、CD40Lにより媒介されるCD40シグナル伝達をブロックするか、ADCC活性を調節するか、これらの作用様式の両方を有する抗CD40治療薬を用いる治療に対してより反応性であるかどうかを同定するための、本明細書に記載されるex vivo予後アッセイを用いて、抗CD40治療薬を用いる治療からの利益の可能性についてそれらをさらにスクリーニングできる。
注目するCD40関連因子としては、それだけには限らないが、細胞表面CD40抗原の発現レベル、細胞表面CD40Lの発現レベル、可溶性CD40(sCD40)の循環レベルおよび可溶性CD40L(sCD40L)の循環レベルが挙げられる。このように、候補被験体から採取した生体サンプルを、少なくとも1種のこれらのCD40関連因子の発現レベルについて分析する。これらのCD40関連因子の発現レベルを、CLLおよびB細胞系統のその他の癌の予後マーカーとして使用できる。それらは抗CD40治療薬に応答する、または応答しない被験体の診断薬として有用であり得る。
当技術分野で公知の任意の方法をこれらのマーカーの分析に使用できる。例えば、候補被験体から得られた血液サンプル中のssCD40またはsCD40Lの循環レベルを、例えば、ELISA、ラジオイムノアッセイ(RIA)、放射性免疫測定法、放射免疫分析(RIA)、電気化学発光(ECL)、ウエスタンブロット、多重化技術またはその他の同様の方法によって測定できる。CD40またはCD40Lの細胞表面発現は、例えば、フローサイトメトリー、免疫組織化学、ウエスタンブロット、免疫沈降、磁性ビーズ選択およびこれらの細胞表面マーカーのいずれかを発現する細胞の定量化によって測定できる。CD40およびCD40L RNA発現レベルは、RT−PCR、Qt−PCR、マイクロアレイ、ノーザンブロットまたはその他の同様の技術によって測定できる。CD40抗原、CD40Lおよび可溶性CD40Lの配列は、当技術分野で公知である。例えば、本明細書において、以下実施例5中表7参照のこと。いくつかの実施形態では、CD40を単離し、配列決定し、CD40発現腫瘍性細胞によって分泌されるsCD40と、これらの細胞の表面からタンパク質分解によって切断されたsCD40の間の差異を確認する。分泌されたsCD40および/またはタンパク質分解によって切断されたsCD40の発現レベルを、病状および/または注目する抗CD40治療薬を用いる治療に対する疾患の反応性と関連づけることができる。
本発明のその他の実施形態では、候補被験体を、当技術分野で公知の1種以上の臨床的に有用な予後マーカーについてスクリーニングすることによって、抗CD40治療薬を用いる治療から恩恵を受ける、癌または前癌状態を有する患者の下位個体群を同定する。任意の当業者に公知の臨床的に有用な予後マーカーを使用できる。いくつかの実施形態では、下位個体群は慢性リンパ性白血病(CLL)を有する患者を含み、特に注目される臨床的に有用な予後マーカーとして、それだけには限らないが、ZAP−70、CD38、β2ミクログロブリンおよび細胞遺伝学的マーカー、例えば、p53突然変異状態、ATM突然変異状態、染色体欠失、例えば、染色体17p欠失および染色体11q欠失が挙げられ、そのすべてがこの疾患の臨床的に有用な予後マーカーである。したがって、一実施形態では、候補被験体の下位個体群は、治療の最新治療法が治癒的ではないが、抗CD40治療薬を用いる治療が有益であるCLLを有する患者に相当する。
ZAP−70は、T細胞抗原受容体(TCR)のζサブユニットと結合しており、T細胞活性化および発達において極めて重要な役割を果たすチロシンキナーゼである(Chan et al.(1992)Cell 71:649−662)。ZAP−70はチロシンリン酸化を受け、TCR刺激後のシグナル伝達の媒介において必須である。チロシンキナーゼの過剰発現または構成的活性化がいくつかの悪性腫瘍、例えば、白血病および数種の充実腫瘍に関与していることが実証されている。例えば、ZAP−70RNA発現レベルの増大は、慢性リンパ性白血病(CLL)の予後マーカーである(Rosenwald et al.(2001)J.Exp.Med.194:1639−1647)。ZAP−70は、T細胞およびナチュラルキラー細胞において発現されるが、正常B細胞において発現されることは知られていない。しかし、ZAP−70は慢性リンパ性白血病/小リンパ球性リンパ腫(CLL/SLL)患者、より詳しくは、突然変異していないIg遺伝子を有するCLL/SLL患者において見られる、より侵攻性の臨床経過を有する傾向のある一部のCLL患者のB細胞では高レベルで発現される(Wiestner et al.(2003)Blood 101:4944−4951;米国特許出願公開第20030203416)。ZAP−70発現レベルとIg遺伝子突然変異状態の間の相関関係のために、ZAP−70を、重篤な疾患を有する可能性が高く(高ZAP−70、突然変異していないIg遺伝子)、従って積極的治療の候補である患者を同定するための予後指標として使用できる。
CD38はシグナル伝達分子ならびにサイクリックADPリボース(cADPR)の合成および分解を触媒する外酵素である。CD38発現は、骨髄前駆体B細胞において高レベルで存在し、休止正常B細胞ではダウンレギュレートされ、次いで、最終分化した形質細胞において再度発現される(Campana et al.(2000)Chem.Immunol.75:169−188)。CD38は、B−CLLにおける信頼できる予後指標であり、通常、CD38の発現はあまり良好でない転帰を示す(D’Arena et al.(2001)Leuk.Lymphoma 42:109; Del Poeta et al.(2001)Blood 98:2633; Durig et al.(2002)Leukemia 16:30; Ibrahim et al.(2001)Blood 98:181; Deaglio et al.(2003)Blood 102:2146−2155)。CD38発現が関連している好ましくない臨床的適応として、進行した段階の疾患、化学療法に対する反応性低下、初期治療が必要とされる前の短い時間および短い生存時間が挙げられる(Deaglio et al.(2003)Blood 102:2146−2155)。最初に、CD38発現とIgV遺伝子突然変異の間の強力な相関関係が観察され、突然変異していないV遺伝子を有する患者は、突然変異したV遺伝子を有するものよりも高いパーセンテージのCD38+B−CLL細胞を示す(Damle et al.(1999)Blood 94:1840−1847)。しかし、その後の研究により、CD38発現はIgV遺伝子の再配列と常に相関しているわけではないということが示された(Hamblin et al.(2002)Blood 99:1023; Thunberg et al.(2001)Blood 97:1892)。
p53は、腫瘍サプレッサーとして作用する核リンタンパク質である。野生型p53は、細胞増殖および分裂の調節に関与している。p53はDNAと結合し、細胞分裂刺激性タンパク質(cdk2)と相互作用するタンパク質(p21)の産生を刺激する。p21がcdk2と結合している場合には、細胞は細胞分裂の次の段階へ入ることからブロックされる。突然変異p53はDNAと効率的に結合できないために、p21が細胞分裂の停止シグナルとして作用するのを妨げ、その結果、制御されない細胞分裂および腫瘍形成がもたらされる。p53はまた、DNA損傷、細胞ストレスまたはいくつかの癌遺伝子の異常発現に応じてプログラム細胞死(アポトーシス)の誘導を調節する。いくつかの癌細胞株における野生型p53の発現は増殖抑制コントロールを回復させることがわかっている(Casey et al.(1991)Oncogene 6:1791−1797; Takahashi et al.(1992)Cancer Res.52:734−736)。p53の突然変異は、ほとんどの腫瘍の種類、例えば、結腸、胸部、肺、卵巣、膀胱および多数のその他の臓器の腫瘍において見られる。p53突然変異は、バーキットリンパ腫、L3型B細胞急性リンパ芽球性白血病、B細胞慢性リンパ性白血病と関連していることがわかっている(Gaidano et al.(1991)Proc.Natl.Acad.Sci.U.S.A.88:5413−5417)。p53異常性は、B細胞前リンパ球性白血病と関連していることもわかっている(Lens et al.(1997)Blood 89:2015−2023)。p53の遺伝子は、染色体17の短腕上、l7pl3.105−pl2に位置する。
β2ミクログロブリンは、クラスI主要組織適合抗原(MHC)のα鎖と非共有結合している細胞外タンパク質である。血清において検出可能であり、CLL(Keating et al.(1998)Blood 86:606a)およびホジキンスリンパ腫(Chronowski et al.(2002)Cancer 95:2534−2538)における有害な予後指標である。血清β2−ミクログロブリンレベルが腫瘍細胞負荷、予後および疾患活性と関連している、リンパ球増殖性疾患、例えば、白血病、リンパ腫および多発性骨髄腫のために臨床的に使用されている(Bataille et al.(1983)Br.J.Haematol 55:439−447; Aviles et al.(1992)Rev.Invest.Clin.44:215−220)。β2ミクログロブリンはまた、骨髄腫患者のステージングにおいても有用である(Pasqualetti et al.(1991)Eur.J.Cancer 27:1123−1126)。
細胞遺伝学的異常はまた、現在の癌療法に対する不良な反応を予測するためのマーカーとして使用できる。染色体異常が大部分のCLL患者に見られ、CLLの経過を予測するのに役立つ。例えば、17p欠失は侵攻性の疾患進行を示す。さらに、染色体17p欠失またはp53における突然変異、または両方を有するCLL患者は、化学療法薬およびリツキシマブに対して不良にしか反応しないことがわかっている。染色体17pでの対立遺伝子欠失もまた、結腸直腸癌における有用な予後マーカーであり得、これでは、17pが欠失している患者は結腸直腸癌における疾患の広がりやすさの増大と関連している(Khine et al.(1994)Cancer 73:28−35)。
染色体11(11q)の長腕の欠失は、種々の種類のリンパ球増殖性障害において最も頻繁に起こる構造的染色体異常の1種である。染色体11qが欠失しており、おそらくはATM突然変異を有するCLL患者は、この欠陥または17p欠失のいずれかを有さない患者と比較して生存率が低い。さらに、11q欠失は広範なリンパ節合併症を伴うことが多い(Dohner et al.(1997)Blood 89:2516−2522)。また、この欠失により、高用量療法および自己移植後に疾患持続の危険の高い患者が同定される。
毛細血管拡張性運動失調症突然変異(ATM)遺伝子は、細胞周期停止、アポトーシスおよびDNA二本鎖破損の修復と関与している腫瘍サプレッサー遺伝子である。染色体11上に見られる。ATM突然変異は、乳癌(Chenevix−Trench et al.(2002)J.Natl.Cancer Inst.94:205−215; Thorstenson et al.(2003)Cancer Res.63:3325−3333)および/または若年性乳癌(Izatt et al.(1999)Genes Chromosomes Cancer 26:286−294; Teraoka et al.(2001)Cancer 92:479−487)の家族歴を有する女性の間の乳癌の危険の増大と関連している。また、横紋筋肉腫も、ATM遺伝子突然変異/欠失と高頻度の関係がある(Zhang etal.(2003)Cancer Biol.Ther.1:87−91)。
患者において染色体異常を検出する方法は、当技術分野では周知である(例えば、Cuneo et al.(1999)Blood 93:1372−1380; Dohner et al.(1997)Blood 89:2516−2522参照のこと)。突然変異したタンパク質、例えば、ATMを測定する方法は、当技術分野で周知である(例えば、Butch et al.(2004)Clin.Chem.50:2302−2308参照のこと)。
したがって、既存の治療に対して反応の良くない癌患者の下位個体群を、現在用いられるアッセイ法、例えば、これらの臨床的に有用な予後マーカーのうち1種以上を用いる本明細書に開示される予後アッセイによって容易に同定できる。これらの臨床的に有用な予後マーカーに基づいて、これらの下位個体群の1つに入る被験体を同定すると、本明細書において上記で同定された1種以上のex vivo予後アッセイを用いて、この被験体をさらにスクリーニングし、この被験体の、CD40Lにより媒介されるCD40シグナル伝達および/またはADCC活性を調節する抗CD40治療薬での治療の利益を評価できる。
予後アッセイ
本発明のいくつかの実施形態では、CD40Lにより媒介されるCD40シグナル伝達を調節する、ADCCを調節する、または両方である抗CD40治療薬を用いる治療的有用性の可能性を、CD40発現細胞に対するCD40シグナル伝達の刺激によって媒介される、癌または前癌状態のための治療介入を必要とする候補被験体から採取される生体サンプルにおける細胞の増殖および生存、細胞アポトーシスおよびCD40シグナル伝達経路の1種以上の前記バイオマーカーの発現レベルの変化をモニターするex vivo予後アッセイを用いて評価する。「CD40発現細胞」とは、CD40抗原を発現する、正常細胞、前癌細胞および悪性細胞を意味する。いくつかの実施形態では、CD40発現細胞は悪性B細胞である、「悪性」B細胞は、任意の腫瘍性B細胞、例えば、それだけには限らないが、リンパ腫に由来するB細胞、例えば、低、中および高悪性度B細胞リンパ腫、免疫芽球性リンパ腫、非ホジキンスリンパ腫、ホジキン病、エプスタイン−バーウイルス(EBV)誘導性リンパ腫およびAIDS関連リンパ腫ならびにB細胞急性リンパ芽球性白血病、骨髄腫、慢性リンパ性白血病などを意味する。その他の実施形態では、CD40発現細胞は癌腫または肉腫細胞である。「CD40発現癌腫細胞」またはCD40発現肉腫細胞」とは、任意の、CD40細胞表面抗原を発現する、充実腫瘍の悪性(すなわち腫瘍性)または前癌性の癌腫または肉腫細胞を意味する。本発明の目的上、CD40抗原を発現する、癌細胞および前癌性細胞または前癌状態の細胞は、「CD40発現腫瘍性細胞」を指す。細胞におけるCD40発現を検出する方法は当技術分野では周知であり、それだけには限らないが、PCR技術、免疫組織化学、フローサイトメトリー、ウエスタンブロット、ELISAなどが挙げられる。ex vivoアッセイから、生体サンプル内の注目する1種以上のバイオマーカーの発現レベルにおいて好都合な変化が得られる場合には、抗CD40治療薬を用いる治療介入が正当化される。さらに、本明細書において論じられるバイオマーカー、サイトカインマーカーおよびCD40関連因子を用いて、本明細書において開示されるex vivo予後アッセイを用いてスクリーニングされている場合もされていない場合もある被験体における抗CD40治療薬の治療有効性をモニターし、ひいては、同じ抗CD40治療薬を用いるさらなる治療が正当化されるかどうか、または代替治療プロトコールが必要であるか、もしくは望ましいかどうかを調べることができる。抗CD40治療薬を用いる治療が正当化されると本発明の方法によって調べられる場合は、この治療薬を任意の適した投与経路によって投与できる。
CD40Lにより媒介されるCD40シグナル伝達を調節する、ADCCを調節する、または両方である抗CD40治療薬を用いる治療介入が考慮されている候補被験体は、CD40発現腫瘍性細胞でのCD40シグナル伝達によって媒介される、いずれかの癌または前癌状態に苦しんでいるか、それを発症する危険にあるか、または再発する危険にある可能性がある。このような癌および前癌状態の例として、それだけには限らないが、B細胞系統の癌、非B細胞血液悪性腫瘍、CD40発現腫瘍性細胞でのCD40シグナル伝達によって媒介されることがわかっている充実腫瘍のいずれかが挙げられる。
CD40発現腫瘍性細胞を含むB細胞系統の癌の例として、急性リンパ芽球性白血病(ALL)、慢性リンパ性白血病(CLL)、前リンパ球白血病(PLL)、ヘアリー細胞白血病、ホジキン病、多発性骨髄腫、ワルデンシュトレームマクログロブリン血症、重鎖疾患およびリンパ腫、例えば、それだけには限らないが、びまん性小リンパ球性リンパ腫、濾胞性、DLBCL、粘膜関連リンパ組織リンパ腫、単球様B細胞リンパ腫、脾臓リンパ腫、リンパ腫様肉芽腫症、血管内リンパ腫症、免疫芽球性リンパ腫、AIDS関連リンパ腫などがある。
したがって、本発明の方法は、異常な、制御できないB細胞増殖または蓄積と関連している非ホジキンスリンパ腫を有する被験体の同定および治療に用途が見出せる。本発明の目的上、このようなリンパ腫は、Working Formulation分類スキームに従って、低悪性度、中悪性度および高悪性度として分類されるB細胞リンパ腫を指す(「The Non−Hodgkin’s Lymphoma Pathologic Classification Project」 Cancer 49(1982):2112−2135参照のこと)。したがって、低悪性度B細胞リンパ腫は小リンパ性、濾胞性小開裂細胞および濾胞性小開裂混合型および大細胞型リンパ腫を含み、中悪性度リンパ腫は濾胞性大細胞、びまん性小開裂細胞、びまん性小細胞および大細胞混合型ならびにびまん性大細胞型リンパ腫を含み、高悪性度リンパ腫は大細胞型免疫芽球性、リンパ芽球性リンパ腫およびバーキット型および非バーキット型の小非切断細胞型リンパ腫を含む。
本発明の方法は、Revised European and American Lymphoma分類(REAL)システムに従って分類されるB細胞リンパ腫の同定および治療的処置において有用であるということは認識される。このようなB細胞リンパ腫としては、それだけには限らないが、前駆体B細胞新生物として分類されるリンパ腫、例えば、Bリンパ芽球性白血病/リンパ腫、末梢B細胞新生物、例えば、B細胞慢性リンパ性白血病/小リンパ球性リンパ腫、リンパ形質細胞性リンパ腫/免疫細胞腫、マントル細胞リンパ腫(MCL)、濾胞中心リンパ腫(濾胞性)(例えば、びまん性小細胞型、びまん性小細胞および大細胞混合型ならびにびまん性大細胞型リンパ腫)、辺縁帯B細胞リンパ腫(例えば、節外性、節性および脾性)、形質細胞腫/骨髄腫、サブタイプ縦隔原発のびまん性大細胞型B細胞リンパ腫(胸腺)、バーキットリンパ腫およびバーキット様高悪性度B細胞リンパ腫および分類できない低悪性度または高悪性度B細胞リンパ腫が挙げられる。
また、これらのアッセイを用いて、CD40Lにより媒介されるCD40シグナル伝達のモジュレーターを用いる治療から恩恵を受ける、MGUS(意味不明の単クローン性高ガンマグロブリン血症)として知られる前癌状態の被験体を同定できる。MGUSの患者の約25%が、最終的に、多発性骨髄腫(MM)または関連形質細胞障害を発生する(Kyle(1993)Mayo Clinic.Proc.68:26−36)。骨髄における悪性形質細胞の増殖、血清または尿モノクローナルタンパク質(Mタンパク質)の検出、貧血、高カルシウム血症、腎不全および溶解性骨病変は、MMの臨床症状であるが、MGUSは臨床的に、MMのその他の臨床特徴を伴わない血清または尿におけるMタンパク質の存在として認識される(例えば、Kyle and Lust(1989)Semin.Hematol.26:176−200; Greipp and Lust Stem Cells(1995)13:10−21参照のこと)。MGUS患者は無症候性であり、Mタンパク質の安定な測定値を有する(Kyle(1993)Mayo Clinic.Proc.68:26−36)。被験体においてMGUSが同定されると、適当な抗CD40治療薬、例えば、本明細書に開示されるアンタゴニスト抗CD40抗体を用いた維持療法によって、これらの被験体における多発性骨髄腫の発生をブロックできる。したがって、本明細書に開示されるex vivo予後アッセイを用いて、抗CD40治療薬を用いる治療から恩恵を受けるMGUSの被験体を同定できる。あるいはまたはさらに、本明細書において他の場所に記載されるように、本明細書に記載されるバイオマーカー、サイトカインマーカーおよびCD40関連因子を用いて、抗CD40治療薬を用いる治療の有効性をモニターできる。
特に、本発明の方法は、一次腫瘍治療性治療に対して不応性である(すなわち、耐性である、または耐性になった)B細胞リンパ腫、例えば、上記で列挙されるものの同定および治療にとって有用である。用語「腫瘍治療性」とは、癌の治療、例えば、化学療法、手術、放射線療法、単一抗癌抗体治療およびそれらの組合せを意味するものとする。ex vivo予後アッセイを用いて、CD40Lにより媒介されるCD40シグナル伝達を調節する、ADCCを調節する、または両方である、1種以上の抗CD40治療薬を用いた治療介入が望ましい患者の下位個体群を同定できる。
本発明の方法はまた、非B細胞関連血液悪性腫瘍の同定および治療にとって有用である。このような悪性腫瘍(malignances)としては、それだけには限らないが、急性白血病、骨髄芽球白血病、急性骨髄性白血病、前骨髄球白血病、骨髄単球性白血病、単球性白血病、赤白血病、顆粒球性白血病(慢性骨髄性白血病)、真性赤血球増加症などが挙げられる。
CD40発現腫瘍性細胞を含む充実腫瘍としては、それだけには限らないが、卵巣癌、肺癌(例えば、扁平上皮癌の非小細胞肺癌、腺癌および大細胞癌の種類および小細胞肺癌)、乳癌、結腸癌、腎臓癌(例えば、腎細胞癌をはじめとする)、膀胱癌、肝臓癌(例えば、肝細胞癌をはじめとする)、胃癌、子宮頸癌、前立腺癌、上咽頭癌、甲状腺癌(例えば、甲状腺乳頭癌)、皮膚癌、例えば、黒色腫ならびに例えば、骨肉腫およびユーイング肉腫をはじめとする肉腫が挙げられる。
用語「予後」は当技術分野では認識されており、治療介入に対する反応のあり得る経過および疾患または疾患進行あり得る経過についての、特に、疾患寛解、疾患再発、腫瘍再発、転移および死亡の可能性に関する予測を包含する。本発明のex vivo予後アッセイを用いて、CD40Lにより媒介されるCD40シグナル伝達を調節する、ADCCを調節する、または両方である、個々の抗CD40治療薬、または抗CD40治療薬の種類に対する候補被験体の反応を予測できる。「候補被験体の反応を予測すること」とは、問題の被験体が個々の抗CD40治療薬を用いて正のまたは負の転帰を経験する可能性の評価を意味する。本発明の目的上、本発明のex vivo予後アッセイに関連して「正の治療転帰を示す」とは、候補被験体が検討中の抗CD40治療薬を用いる治療に応じて有益な結果を経験し、したがって、抗CD40治療薬を用いる治療介入が正当化される可能性の増大を意味するものとする。対照的に、「負の治療転帰を示す」とは、患者が、検討中である抗CD40治療薬を用いる治療介入から恩恵を受けず、したがって、抗CD400治療薬を用いる治療介入が正当化されない可能性の増大を意味するものとする。
CD40Lにより媒介されるCD40シグナル伝達を調節する抗CD40治療薬を用いる治療介入を用いて達成できる有益な結果として、何らかの正の治療反応が挙げられる。癌治療に関連して「正の治療反応」とは、疾患における改善、抗CD40治療薬の抗腫瘍活性と関連した疾患の改善および/または注目する疾患に伴われる症状における改善を意味する。すなわち、抗増殖性効果、さらなる腫瘍の増殖の阻止、腫瘍の大きさの減少、癌細胞数の減少および/またはCD40発現細胞の刺激によって媒介される1以上の症状の減少を観察できる。したがって、例えば、正の治療反応とは、疾患における以下の改善のうち1以上を指す:(1)腫瘍の大きさの減少、(2)癌(すなわち、腫瘍性)細胞数の減少、(3)腫瘍性細胞死の増加、(4)腫瘍性細胞生存の阻害、(4)腫瘍増殖の阻害(すなわち、ある程度の減速、好ましくは停止)、(5)末梢臓器への癌細胞浸潤の阻害(すなわち、ある程度の減速、好ましくは停止)、(6)腫瘍転移の阻害(すなわち、ある程度の減速、好ましくは停止)、(7)さらなる腫瘍増殖の阻止、(8)患者生存率の増大および(9)癌と関連している1以上の症状のある程度の軽減。任意の所与の悪性腫瘍における正の治療反応は、その悪性腫瘍に特異的な標準化反応基準によって決定できる。
腫瘍反応は、磁気共鳴画像法(MRI)スキャン、X線画像、コンピュータ断層撮影(CT)スキャン、骨スキャン画像、内視鏡検査および骨髄穿刺(BMA)をはじめとする腫瘍生検サンプリングおよび循環中の腫瘍細胞の計数などのスクリーニング技術を用いて腫瘍形態(すなわち、全腫瘍量、腫瘍の大きさなど)の変化について評価できる。抗CD40治療薬を用いる治療を受けている被験体は、これらの正の治療反応に加え、疾患と関連している症状の改善について有益な効果を経験し得る。したがって、被験体は、B細胞腫瘍について、いわゆるB症状、すなわち、寝汗、発熱、体重減少および/またはじんま疹の減少を経験し得る。前癌状態については、抗CD40治療薬を用いる治療薬は、関連する悪性腫瘍状態の発生、例えば、意味不明の単クローン性高ガンマグロブリン血症(MGUS)を患っている患者における多発性骨髄腫の発生前の時間をブロックおよび/または延長できる。
いくつかの実施形態では、本発明の方法に使用するためのex vivo予後アッセイは、本明細書に記載される抗CD40治療薬を用いる治療介入のための予後を必要とする候補被験体から試験生体サンプルおよび対照生体サンプルを提供することと(試験および対照生体サンプルは、in vivoまたはex vivoのいずれかでCD40リガンドで刺激されているCD40発現腫瘍性細胞を含む)、試験生体サンプルを、有効量の注目する抗CD40治療薬と接触させることと、この試験生体サンプルにおいて、注目する抗CD40治療薬の作用様式に応じて、細胞アポトーシスのバイオマーカー、CD40Lにより媒介されるCD40シグナル伝達経路のバイオマーカーおよび細胞生存のバイオマーカーからなる群から選択される少なくとも1種のバイオマーカーのレベルを検出するステップと、試験生体サンプル中のバイオマーカー(類)のレベルを、抗CD40治療薬と接触していない対照生体サンプル中のバイオマーカー(類)のレベルと比較することとを含む。抗CD40治療薬は、CD40Lにより媒介されるCD40シグナル伝達をブロックもしくは干渉するか、またはこのシグナル伝達をブロックもしくは干渉し、またADCCを調節するアンタゴニストである場合、抗CD40治療薬を用いる治療に対して反応性である、癌または前癌状態を有する被験体同定するために、細胞の増殖および生存、アポトーシスおよびCD40Lにより媒介されるCD40シグナル伝達のこれらのバイオマーカーのいずれかまたはすべてについての本明細書に開示されるex vivo予後アッセイを用いて、治療薬の有益な効果の可能性を、単独で、またはCD40Lにより媒介されるCD40シグナル伝達によってアップレギュレートされるサイトカインマーカーのアッセイおよび/または本明細書に記載される1種以上のCD40関連因子のアッセイと組合せて評価できる。抗CD40治療薬がADCC活性の調節を介してその作用様式を有する場合、例えば、抗CD40抗体は、抗CD40治療薬を用いる治療に対して反応性である、癌または前癌状態を有する被験体を同定するために、1種以上のアポトーシスのマーカーについてのex vivo予後アッセイを用いて、治療薬の有益な効果の可能性を、単独で、または本明細書に記載される1種以上のCD40関連因子についてのアッセイと組合せて評価できる。
本発明のex vivo予後アッセイに従って、注目する抗CD40治療薬と接触させる試験生体サンプル中の1種以上のバイオマーカーおよび場合により1種以上のサイトカインマーカーの発現レベルを、対照生体サンプル中のバイオマーカー(類)および場合によりサイトカインマーカー(類)の発現レベルと比較する。「試験生体サンプル」とは、候補被験体から得られたCD40発現腫瘍性細胞を含む生体サンプルを意味し、これを候補被験体の治療のために検討中の抗CD40治療薬と接触させる。「対照生体サンプル」とは、同様に、ほぼ同じ数および同じ種類のCD40発現腫瘍性細胞を含み、同一時間枠において、試験生体サンプルを得るために用いたものと同等の方法で候補被験体から得られたという点で試験生体サンプルに同等である生体サンプルを意味し、これを、注目する抗CD40治療薬とは接触させないが、試験サンプルと同一実験条件に付す。試験生体サンプルおよび対照生体サンプルは、被験体から得られサブサンプルに分けられる単一の生体サンプルから提供されたものであってもよく、その一方が試験生体サンプルと呼ばれ、もう一方が対照生体サンプルと呼ばれる。あるいは、試験生体サンプルおよび対照生体サンプルは、2種以上の生体サンプルから提供されたものであってもよく、これはプールされ、次いで上記のサブサンプルに細分割される場合もあるし、または試験および対照生体サンプルに個別に相当する場合もある。
候補被験体から得られたCD40発現腫瘍性細胞は、生体サンプルの採取の先立ってin vivoでCD40Lによって構造的に刺激されている場合があるということは認識されるが、試験および対照生体サンプルのCD40発現腫瘍性細胞をex vivoで刺激し、その結果、CD40関連活性に対する抗CD40治療薬のアンタゴニスト効果、例えば、細胞増殖およびCD40シグナル伝達の刺激を効率的に評価できることが好ましい。
このように、CD40発現腫瘍性細胞の試験生体サンプルを、注目する抗CD40治療薬と接触させる前に、候補被験体から採取した任意の所与の生体サンプル内のCD40発現腫瘍性細胞を、例えば、CD40Lで刺激し、ex vivo予後アッセイに用いられる、試験および対照生体サンプルのCD40発現腫瘍性細胞でのCD40シグナル伝達を確実にアップレギュレーションさせることができる。CD40Lの供給源はいずれを使用してもよいが、例えば、それだけには限らないが、可溶性CD40Lが挙げられる。その他の適したCD40刺激分子としては、例えば、CD40の細胞外ドメインと特異的に結合するアゴニスト抗体が挙げられる。したがって、いくつかの実施形態では、適したCD40刺激分子として、それだけには限らないが、膜結合型CD40L(例えば、細胞の原形質膜と結合しているCD40L、例えば、CD40Lを発現するホルムアルデヒドで固定されたCHO細胞形質転換体またはリポソームまたはミセルなどの合成脂質ベースの基質に組み込まれたCD40L)、可溶性CD40L、アゴニスト抗CD40抗体、例えば、抗ヒトCD40抗体G28−5(Bristol−Myers Squibb、Seattle、Washington)およびそれらの混合物が挙げられる。1種以上のCD40シグナル伝達経路を刺激するために、採取した生体サンプルまたはそのサブサンプルの細胞と接触させる刺激分子の有効量は、用いるリガンドの種類(例えば、単量体または多量体、溶解度および透過性など)およびCD40発現腫瘍性細胞上のCD40受容体の存在量などの因子に応じて変わる。CD40シグナル伝達を刺激するために、約1.0nMと約1mMの間のCD40Lまたは可溶性CD40Lが用いられることが好ましい。
いくつかの実施形態では、接触ステップの前に、生体サンプルまたはそのサブサンプルを可溶性CD40LとともにCD40シグナル伝達を刺激するのに十分な時間インキュベートすることによって、生体サンプルまたはそのサブサンプル内のCD40発現腫瘍性細胞を可溶性組換えヒトCD40L(Alexis Corporation、Bingham、Nottinghamshire、UK)を用いて刺激する。いくつかの実施形態では、インキュベーション時間は約10分〜約4時間である。インキュベーション期間の間に存在する可溶性CD40Lの量は、滴定によって容易に求められる。このような一実施形態では、可溶性CD40Lの量は約1μg/mlである。試験生体サンプルを注目する抗CD40治療薬と接触させるために許容されるプロトコールはいずれも、本発明のex vivo予後アッセイに使用できる。考慮されるべき因子として、それだけには限らないが、試験生体サンプルを含む容器内の、接触させる予定の細胞数;試験生体サンプルと接触させる予定の抗CD40治療薬の濃度;抗CD40治療薬の、試験生体サンプル中の細胞とのインキュベーション時間;適用される場合には、試験生体サンプルと接触させる予定の刺激分子、例えば、CD40L、可溶性CD40Lまたはその刺激性断片もしくは変異体の濃度、ならびに、適用される場合には、刺激分子の、試験生体サンプル中の細胞とのインキュベーション時間が挙げられる。このような因子の決定は、当業者ならば、試験されている生体サンプルの種類、保持容器の大きさ、容器中の液体の容量および試験される抗CD40治療薬の化学組成(すなわち、大きさ、電荷など)などの変量に基づいて達成できる。
一実施形態では、適した数のCD40発現腫瘍性細胞を含む試験生体サンプルまたはそのサブサンプルを96ウェル組織培養ディッシュに加える。適した数の細胞とは、本明細書において他で記載される1種以上の検出方法用いて、CD40により媒介される活性(すなわち、細胞増殖および細胞生存、アポトーシスのレベル、CD40シグナル伝達経路)のうち1種以上の変化を検出するのを可能にするいくつかの細胞である。いくつかの実施形態では、適した数の細胞とは、96ウェル組織培養ディッシュのウェルあたり約1〜約1×106個細胞の間である。細胞を組織培養ディッシュに加えた後、細胞を約0〜約96時間の間プレインキュベートし、その後、細胞を抗CD40治療薬と接触させてもよい。いくつかの実施形態では、細胞を本明細書において先に記載されるCD40刺激分子とともにプレインキュベートする。
抗CD40治療薬の有効量を、試験生体サンプルの細胞に加え、注目するCD40により媒介される活性(すなわち、CD40と結合する物質のCD40Lにより媒介されるCD40シグナル伝達、ADCC活性、または両方)の調節を、本明細書において他で開示される1種以上の検出方法を用いて調節が検出可能であるように提供する。有効量は、当然ながら、試験されている抗CD40治療薬に応じて変わる。一般に、抗CD40治療薬の有効量は、96ウェルプレートのウェルあたり約1nM〜約10mMの間である。一実施形態では、抗CD40治療薬はアンタゴニスト抗CD40抗体、例えば、CHIR−12.12またはCHIR−5.9完全ヒトモノクローナル抗体またはその抗原結合性断片であり、有効量は約0.01μg/ml〜約30μg/ml、例えば、約0.01μg/ml、0.1μg/ml、0.5μg/ml、1μg/ml、5μg/ml、10μ/ml、20μg/mlおよび30μg/mlおよび約0.01μg/ml〜約30μg/mlの間のその他のこのような値である。試験生体サンプルまたはそのサブサンプル内の細胞を、抗CD40治療薬が細胞と相互作用し、1種以上の生体学的応答が生じるのを可能にするのに適した期間インキュベートすることができる。いくつかの実施形態では、抗CD40治療薬と試験生体サンプルまたはそのサブサンプルの細胞の間の好ましいインキュベーション時間は、約1分〜48時間の間である。その他の実施形態では、インキュベーション時間は、約20分、約30分、約1時間、約4時間、約12時間、約22時間または約24時間である。
試験および対照生体サンプルとして働く生体サンプル(類)は、CD40抗原を発現する腫瘍性細胞を含む細胞、組織また体液の任意の収集物から提供されるものであり得る。このような生体サンプルの例として、それだけには限らないが、血液、リンパ、生検、塗布標本などが挙げられる。生体サンプルは、当技術分野で許容される任意の手順を用いて、例えば、体液の針吸引、組織サンプルの採取(すなわち、生検、例えば、細針吸引生検、コア針生検または切除生検)などによって候補被験体から採取できる。生体サンプルをアッセイの前に保存しなくてはならない場合には、生体サンプルをガラススライドに移し、その後、アッセイすることができ、または後の調製のために凍結させてもよいし、または固定液中に直ちに入れてもよい。
先に記載したように、タンパク質またはヌクレオチドレベルでの注目するバイオマーカーの検出は、当業者に公知の任意の検出方法を用いて達成できる。「発現を検出する」または「のレベルを検出する」とは、生体サンプル中のバイオマーカータンパク質または遺伝子の量または存在を調べることを意味する。したがって、「発現を検出する」は、バイオマーカーが、発現されない、検出可能に発現されない、低レベルで発現される、正常レベルで発現されるまたは過剰発現されると調べられる場合を包含する。CD40Lにより媒介されるCD40シグナル伝達に対する抗CD40治療薬の効果を調べるために、CD40リガンドを用いて刺激されている(in vivoまたはex vivoのいずれかで)CD40発現腫瘍性細胞を含む試験生体サンプルを、抗CD40治療薬と、治療薬が細胞反応を引き起こすのを可能にするのに十分な時間接触させ、次いで、その試験生体サンプル中の1種以上の注目するバイオマーカーの発現レベルを、抗CD40治療薬と接触させていない対照生体サンプルにおける発現レベルと比較する。いくつかの実施形態では、腫瘍性細胞の対照生体サンプルを、CD40Lにより媒介されるCD40シグナル伝達を干渉しない中立物質または陰性対照と接触させる。例えば、一実施形態では、非特異的免疫グロブリン、例えば、CD40と結合しないIgG1が、陰性対照として役立つ。検出を経時的推移にわたって行い、経時的なバイオマーカーの変化のモニタリングを可能にすることができる。また、検出を種々の濃度の抗CD40治療薬に対する曝露を用いて行い、任意の所与の注目するバイオマーカーの「用量−反応」曲線を作製することもできる。
試験および対照生体サンプル内の、本発明のバイオマーカー、および場合によりサイトカインマーカーの発現を検出する方法は、これらのマーカーの量または存在を、核酸またはタンパク質レベルのいずれかで調べる任意の方法を含む。このような方法は当技術分野で周知であり、それだけには限らないが、ウエスタンブロット、ノーザンブロット、ELISA、免疫沈降、免疫蛍光、フローサイトメトリー、免疫組織化学、核酸ハイブリダイゼーション技術、核酸逆転写法および核酸増幅法が挙げられる。特定の実施形態では、バイオマーカーの発現を、例えば、特異的バイオマーカータンパク質に対する抗体を用いてタンパク質レベルで検出する。これらの抗体は、ウエスタンブロット、ELISA、多重化技術、免疫沈降または免疫組織化学技術など、種々の方法で使用できる。いくつかの実施形態では、サイトカインマーカーの検出は電気化学発光(ECL)によって達成される。バイオマーカーおよび場合によりサイトカインマーカーのためのこれらの検出方法のいずれも、臨床情報の評価、従来の予後の方法、その他のCD40関連因子の発現、特に、細胞表面CD40および/またはCD40Lの発現および可溶性CD40および/またはCD40Lの循環レベルならびに当技術分野で公知の臨床的に有用な予後マーカー、例えば、それだけには限らないが、CLL患者について本明細書において先に記載したもの(例えば、ZAP−70、CD38、β2ミクログロブリン、可溶性CD52および細胞遺伝学的マーカー、例えば、p53突然変異状態、ATM突然変異状態および染色体欠失、例えば、染色体17p欠失および染色体11q欠失の発現または存在と組合せることができる。このように、開示される方法は、癌または前癌状態が本明細書に開示される抗CD40治療薬を用いる治療介入から恩恵を受ける候補被験体のより正確な決定を可能にし得る。
したがって、いくつかの実施形態では、CD40発現腫瘍性細胞と関連している癌または前癌状態を有する候補被験体を、注目する抗CD40治療薬に対する反応性について、本明細書に記載されるex vivo予後アッセイを用いて試験し、1種以上のCD40により媒介される活性に対する治療薬の効果を評価する。ex vivo予後アッセイのさらなる改良が望ましい場合には、本明細書において上記で同定される1種以上のCD40関連因子、1種以上の臨床的に有用な予後マーカー、例えば、CLL患者について本明細書において上記で同定されるもの、または両方の発現レベルまたはその発現がないことについて候補被験体を調べることができる。このように、CD40発現腫瘍性細胞を含む生体サンプルを候補被験体から採取し、注目するCD40関連因子(類)および/または臨床的に有用な予後マーカー(類)の発現レベルまたはそれらの発現がないことについて評価することができる。本明細書において先に記載されるCD40発現腫瘍性細胞を含む生体サンプルはいずれも、これらの予後アッセイのために採取することができる。さらに、当業者に公知の任意の検出方法を用いて、本明細書において他で記載される注目するCD40関連因子(類)および/または臨床的に有用な予後マーカー(類)の発現レベルまたはそれらの発現がないことを検出できる。
抗CD40治療薬を用いる治療に反応性である、癌または前癌状態を有する被験体を同定するために、1種以上のCD40関連因子の発現レベルが評価される場合には、生体サンプルを被験体から採取し、そのサンプル中の発現のレベルを、対照または参照標準中のその因子(または複数の因子)の発現のレベルと比較する。細胞表面CD40および/または細胞表面CD40Lの発現レベルについては、本明細書において先に記載される、CD40発現および/またはCD40L発現腫瘍性細胞を含む任意の生体サンプルを使用できる。sCD40および/またはsCD40Lの循環レベルについては、血液サンプルまたは血漿もしくは血清などの血液成分を含むサンプルを、候補被験体から得ることができる。「対照」または「参照標準」とは、同一の生物学的供給源(すなわち、組織または体液)のものである標準を意味し、これにより癌または前癌状態を有する被験体が、疾患に罹患していない健常な被験体と区別される。当業者ならば、年齢、性別、人種などについて制御した、疾患を有していない健常な被験体および疾患を有している被験体においてこれらのCD40関連因子(すなわち、細胞表面CD40、細胞表面CD40L、sCD40、sCD40L)の発現レベルの測定値をとることと、発現レベルを比較して、健常な被験体において予測される発現の標準レベルを求めることとによって参照標準を提供できる。いくつかの実施形態では、癌または前癌状態を有する候補被験体における発現レベルは、参照標準における発現レベルよりも少なくとも20%、30%、40%、50%、60%、70%、80%、100%、150%、200%、250%、300%高い。抗CD40治療薬を用いる治療の適用性は、1種以上のこれらのCD40関連因子の発現レベルを検出することによって評価でき、参照標準と比較した生体サンプルにおける発現のレベルの増大は、CD40により媒介される活性、例えば、細胞生存および増殖ならびに/またはADCC活性に対する抗CD40治療薬のex vivo効果についてさらなるスクリーニングを行わなくとも、被験体が、注目する抗CD40治療薬を用いる治療に対して反応性である癌または前癌状態を有することを証明するのに十分であるということは認識される。
本発明はまた、本発明のex vivo予後アッセイを実施するためのキットを包含する。例えば、本キットは、生体サンプルにおいて本明細書に記載されるバイオマーカー、例えば、アポトーシス、細胞増殖または生存、またはCD40Lにより媒介されるCD40シグナル伝達経路のバイオマーカーを、タンパク質または核酸レベルのいずれかで検出できる標識化合物または物質と、サンプルの、注目する抗CD40治療薬ととものインキュベーション後にサンプル中のバイオマーカーの量を調べる手段(例えば、注目するバイオマーカーをコードするRNAと結合する抗体またはオリゴヌクレオチドプローブ)とを含む。キットは、注目する個々のバイオマーカー各々を検出できる個別に標識された化合物または物質と、サンプル中の各バイオマーカーの量を検出するための手段とを含むことによって注目する複数のバイオマーカーの検出を可能にするようパッケージングできる。
キットはまた、ex vivo予後アッセイから抗CD40治療薬を用いて正の治療転帰を示す結果が得られる場合に、被験体を治療するための説明書を含み得る。
本キットは、抗体ベースのキットについて、例えば、以下のものを含み得る:(1)注目するバイオマーカーと結合する第1の抗体(例えば、固相支持体と結合している)と、場合により(2)バイオマーカーまたは第1の抗体と結合し、検出可能な物質とコンジュゲートしている第2の異なる抗体。本キットは、オリゴヌクレオチドベースのキットについては、例えば、以下を含み得る:(1)バイオマーカーをコードする核酸配列とハイブリダイズするオリゴヌクレオチド、例えば、検出可能なように標識されたオリゴヌクレオチドまたは(2)注目するバイオマーカーをコードする核酸分子を増幅するのに有用な一対のプライマー。本キットはまた、例えば、緩衝剤、防腐剤またはタンパク質分解防止剤を含み得る。本キットはまた、検出可能な物質を検出するために必要な成分(例えば、酵素または基質)を含み得る。本キットはまた、アッセイされ、含まれる試験サンプルと比較され得る、対照サンプルまたは一連の対照を含み得る。キットの各成分は、通常、個別の容器内に入れられ、種々の容器のすべては、試験される被験体が、抗CD40治療薬を用いる治療のための候補であるかどうかを観察するための説明書とともに単一パッケージ内にある。
検出方法
候補被験体の生体サンプルにおいて、注目するバイオマーカー、サイトカインマーカーまたはCD40関連因子タンパク質(例えば、細胞生存または増殖のバイオマーカー、アポトーシスのバイオマーカー、CD40Lにより媒介されるCD40シグナル伝達経路のバイオマーカー、循環可溶性CD40もしくはCD40L、細胞表面CD40もしくはCD40Lまたは臨床的に有用な予後マーカー、例えば、CLL患者のZAP−70、CD38およびβ2ミクログロブリン)を特異的に同定し、定量する手段はいずれも考慮される。したがって、いくつかの実施形態では、バイオマーカータンパク質またはその生物学的に活性な変異体と特異的に相互作用できる結合タンパク質によって、生体サンプル中のその注目するバイオマーカータンパク質の発現レベルを検出する。標識抗体、その結合部分またはその他の結合パートナーを使用できることが好ましい。単語「標識」とは、本明細書において用いられる場合、「標識化された」抗体が生じるよう抗体と直接的または間接的にコンジュゲートされた、検出可能な化合物または組成物を指す。標識はそれ自身で検出可能(例えば、放射性同位元素標識または蛍光標識)である場合もあり、または酵素標識の場合には、検出可能である基質化合物または組成物の化学変換を触媒することができる。
バイオマーカータンパク質の検出のための抗体は、起源はモノクローナルであってもポリクローナルであってもよく、合成によってまたは組換えによって作製したものであってもよい。複合タンパク質の量、例えば、結合タンパク質、例えば、バイオマーカータンパク質と特異的に結合する抗体と結合しているバイオマーカータンパク質の量は、当業者に公知の標準タンパク質検出方法論を用いて求める。免疫学的アッセイ設計、理論およびプロトコールのについての詳細な総説は、当技術分野における多数の教本に見ることができる(例えば、Ausubel et al.、eds.(1995)Current Protocols in Molecular Biology)(Greene Publishing and Wiley−Interscience、NY)); Coligan et al.eds.(1994)Current Protocols in Immunology(John Wiley & Sons、Inc.New York、NY参照のこと)。
標識抗体を用いてタンパク質を検出するために種々のアッセイが利用可能である。一段階アッセイでは、検出しようとする注目する標的タンパク質を、存在する場合には、固定化し、標識抗体とともにインキュベートする。標識抗体は、固定化された標的タンパク質分子と結合する。結合していない分子を除去するために洗浄した後、サンプルを標識の存在についてアッセイする。標準形式では、サンプルあたり単一のタンパク質をアッセイする。より新しいマルチプレックス技術を用いれば、単一のサンプルにおいて各検出抗体に対して種々の標識を用いることによって複数のタンパク質をアッセイできる。
二段階アッセイでは、固定化された、注目する標的タンパク質分子を、標識化されていない抗体とともにインキュベートする。標的タンパク質−標識化されていない抗体複合体が存在すれば、次いで、これを標識化されていない抗体に特異的である二次標識抗体と結合させる。サンプルを洗浄し、標識の存在についてアッセイする。
抗体を標識するために用いるマーカーの選択は適応に応じて変わる。しかし、当業者ならば、マーカーの選択は容易に決定することができる。これらの標識抗体は、イムノアッセイにおいて、ならびに組織学的適用において使用し、注目する任意のバイオマーカーまたはタンパク質の存在を検出することができる。標識抗体はポリクローナルであってもよいし、モノクローナルであってもよい。さらに、注目するタンパク質の検出に用いる抗体は、本明細書において他で記載される、放射性原子、酵素、発色団部分もしくは蛍光部分または比色定量タグを用いて標識できる。タギング標識の選択はまた、望ましい検出限界に応じて変わる。酵素アッセイ(ELISA)は、通常、酵素タグがついた複合体の、酵素基質との相互作用によって形成された着色した生成物の検出を可能にする。検出可能な標識として役立ち得る放射性核種として、例えば、I−131、I−123、I−125、Y−90、Re−188、Re−186、At−211、Cu−67、Bi−212およびPd−109が挙げられる。検出可能な標識として役立ち得る酵素の例として、それだけには限らないが、西洋ワサビペルオキシダーゼ、アルカリ性ホスファターゼ、β−ガラクトシダーゼおよびグルコース−6−リン酸デヒドロゲナーゼが挙げられる。発色団部分としては、それだけには限らないが、フルオレセインおよびローダミンが挙げられる。抗体は、当技術分野で公知の方法によってこれらの標識とコンジュゲートさせることができる。例えば、酵素および発色団分子を、カップリング剤、例えば、ジアルデヒド、カルボジイミド、ジマレイミドなどによって抗体とコンジュゲートさせることができる。あるいは、コンジュゲーションはリガンド−受容体対によって起こる場合がある。適したリガンド−受容体対の例として、ビオチン−アビジンまたはビオチン−ストレプトアビジンおよび抗体−抗原がある。
いくつかの実施形態では、本発明は、血清および生物学的液体において、本明細書において上述される、注目する、1種以上のバイオマーカーまたはその他のタンパク質を検出するためのサンドイッチ技術の使用を考慮する。国際公開番号WO93/09437に記載されるように、このような技術は、注目するタンパク質と結合できる2種の抗体、例えば、その一方が溶液中で遊離しているが検出可能な化合物で標識されており、そのもう一方が固相支持体上に固定化されているものを用いる。二次抗体に使用できる化学標識の例として、それだけには限らないが、反応物質または酵素基質に対して曝露されると着色生成物または電気化学的に活性な生成物を生じる、放射性同位体、蛍光化合物および酵素またはその他の分子が挙げられる。注目する、バイオマーカーまたはその他のタンパク質を含有するサンプルをこの系に入れる場合、注目する、バイオマーカーまたはその他のタンパク質は固定化抗体および標識抗体の両方と結合する。この結果が、支持体の表面上の「サンドイッチ」免疫複合体である。複合タンパク質は、結合していないサンプル成分および過剰の標識抗体を洗浄除去することと、支持体表面上のタンパク質と複合体を形成している標識抗体の量を測定することとによって検出する。サンドイッチイムノアッセイは、良好な検出限界を有する標識が用いられれば、高度に特異的であり、極めて感度が高い。
生体サンプルは個別に、スクリーニングしてもよいし、あるいは、例えば、広く用いられ、容易に自動化できる、従来の96ウェルマイクロタイター形式を用いて、生体液の多数のサンプルを同時にスクリーニングしてもよい。また、96ウェルプレートを熱量測定によって分析するためのいくつかの市販の分光計(「プレートリーダー」)がある。さらに、生体サンプルは、当技術分野で公知の方法を用いて、1種のバイオマーカー、または複数のマーカー、例えば、バイオマーカーのパネルについてスクリーニングできる。
好ましい実施形態では、生体サンプル、例えば、体液のサンプル内の、注目する、1種以上のバイオマーカーまたはその他のタンパク質の発現を、ラジオイムノアッセイまたは酵素結合免疫測定法(ELISA)、競合結合酵素結合免疫測定法、ドットブロット(例えば、Promega Protocols and Applications Guide(2nd ed.; Promega Corporation(1991)参照のこと、ウエスタンブロット(例えば、Sambrook et al.(1989)Molecular Cloning, A Laboratory Manual、Vol.3、Chapter 18(Cold Spring Harbor Laboratory Press、Plainview、NY)、クロマトグラフィー、好ましくは、高速液体クロマトグラフィー(HPLC)または当技術分野で公知のその他のアッセイによって検出する。したがって、検出アッセイは、それだけには限らないが、免疫ブロット法、免疫拡散法、免疫電気泳動法または免疫沈降などのステップを含み得る。
任意の所与のタンパク質検出アッセイのために、CD40発現腫瘍性細胞を含む生体サンプルまたはそのサブサンプルを、結合パートナー、例えば、注目するバイオマーカーまたはその他のタンパク質についての、抗体または検出可能に標識された抗体と、抗体−抗原複合体の形成を可能にするのに十分な時間接触させ、次いで、抗体結合を、例えば、本明細書において上記で示される任意の手段によって検出する。本明細書に記載される、バイオマーカー、CD40関連因子および臨床的に有用な予後マーカーに対する抗体および検出可能に標識された抗体は、当技術分野では周知であり、市販されている。例えば、アポトーシス、細胞生存およびCD40シグナル伝達経路のバイオマーカーならびに臨床的に有用な予後マーカー、例えば、Cell Signaling Technology,Beverly,Massachusetts; DAKO,Copenhagen,Denmarkなどから入手可能なZAP−70およびp53参照のこと。あるいは、抗体またはこれらの抗体の検出可能に標識された抗体は、当技術分野で周知である、さらに、本明細書において以下に記載される抗体作製法を用いて作製できる。
カスパーゼのバイオマーカーのためのいくつかのアッセイキットは市販されている。例えば、Homogeneous Caspases Assay(Roche Applied Sciences、Indianapolis、Indiana)は、マイクロプレートにおけるカスパーゼ活性の定量的in vitro測定のための蛍光定量的分析である。このアッセイは、ハイスループットスクリーニングにとって、例えば、96ウェルプレートでの100試験、および384ウェルプレート(カタログ番号3005372)での400試験にとって特に有用である。このアッセイにより、生体サンプル、例えば、血清または血漿における、いくつかのカスパーゼ、例えば、カスパーゼ−2、カスパーゼ−3、カスパーゼ−7の検出が、より低い程度で、カスパーゼ−6、カスパーゼ−8、カスパーゼ−9およびカスパーゼ−10の検出が可能である。Cell Death Detection ELISAPLUSアッセイ(カタログ番号1774425; Roche Applied Sciences、Indianapolis、Indiana)は、DNAおよびヒストン、それぞれに対するマウスモノクローナル抗体を用いる、定量的サンドイッチ酵素イムノアッセイ原則に基づいている。このアッセイにより、アポトーシスによって死滅した細胞の細胞質に放出されたモノおよびオリゴヌクレオソームの特異的検出および定量化が可能である。種々のサンプル、例えば、細胞溶解物、血清、培養上清などに使用できる。
細胞表面PSは、任意の市販のアネキシンV染色試薬を用いて検出でき、これはPSに対するアネキシンVの高親和性に基づいている。例えば、Roche Applied Scienceから市販されているアネキシンV染色試薬参照のこと。FITCをアネキシンVにコンジュゲートすることによって、フローサイトメトリーによって単細胞ベースでアポトーシス細胞を同定および定量することが可能である。FITC−アネキシンV(緑色蛍光)および非生体染色色素ヨウ化プロピジウム(赤色蛍光)を用いて細胞を同時に染色することにより、無傷の細胞(FITC−PI−)、初期アポトーシスの細胞(FITC+PI−)および後期アポトーシスまたは壊死細胞(FITC+PI+)の識別を提供できる。
さらに、生体サンプル内でのアポトーシスの上昇は、アポトーシスの特徴であるDNA断片化を検出する核酸ベースの方法を用いて確認できる。アガロースゲルでの電気泳動を用いて分離すると、例えば、壊死またはその他の非特異的DNA分解において観察される核酸のスメアと対照的に、アポトーシスDNAは、まず特徴的な「ラダー」パターンを有する。DNA断片化を検出するための一般的な組織学的技術は、末端標識DNAを用いる。APOLERT DNA断片化キット(Clontech Laboratories,Inc.,Palo Alto,California)など、そのためのキットは市販されている。このアッセイは、ターミナルデオキシヌクレオチジルトランスフェラーゼ(Tdt)媒介性dUTPニック末端標識に基づいており、これではアポトーシスを起こしている細胞において、Tdtが、断片化されたDNAの遊離3’−ヒドロキシル末端でのフルオレセイン−dUTPの組み込みを触媒する。
当技術分野で公知の任意の方法を用いて、サイトカインマーカーの産生を検出できる。標準アッセイは、ELISA形式を含み、これではサンプルあたり1種のサイトカインを測定する。あるいは、より高感度の技術は、電気化学発光(ECL)である。一実施形態では、サイトカイン産生を、例えば、市販されている高性能サイトカイン分析用Meso Scale Discovery(登録商標)システム(Meso Scale Discovery、Gaithersburg、Maryland)などのマルチアレイシステムを用いてECLを用いてアッセイする。サンプル内の複数のサイトカイン(またはその他の分析物)の一度での測定を考慮するその他の形式としては、マルチプレックス技術が挙げられる。1種のこのような製品として、Luminex(登録商標)ビーズ技術(Luminex Corporation、Austin、Texas)があり、これでは、個々のバイオアッセイに特異的な試薬(サイトカインに対する抗体など)で被覆された、最大100色に色分けされたミクロスフェアを一緒に混合し、ラサル(lasar)技術を用いて分析できる。
候補被験体から得られた生体サンプル内の、本明細書に記載される、1種以上のバイオマーカー、サイトカイン、CD40関連因子および臨床的に有用な予後マーカーの存在はまた、核酸レベルで調べることができる。発現を評価するための核酸ベースの技術は当技術分野で周知であり、例えば、生体サンプルにおけるバイオマーカーmRNAのレベルを調べることが挙げられる。多数の発現検出法は、単離RNAを用いる。mRNAの単離に対して選択しない任意のRNA単離技術を、RNAの精製のために利用できる(例えば、Ausubel et al.ed.(1987−1999)Current Protocols in Molecular Biology(John Wiley & Sons、New York)参照のこと。さらに、当業者に周知の技術、例えば、米国特許第4,843,155号に開示される一段階RNA単離法などを用いて、多数の組織サンプルを容易に処理できる。
したがって、いくつかの実施形態では、注目するバイオマーカーまたはその他のタンパク質の検出は、核酸プローブを用いて核酸レベルでアッセイする。用語「核酸プローブ」とは、特に意図される標的核酸分子、例えば、ヌクレオチド転写物と選択的に結合できる任意の分子を指す。プローブは、当業者によって合成できるか、または適当な生物学的調製物に由来するものであり得る。プローブは例えば、放射性標識、蛍光標識、酵素、化学発光タグ、比色定量タグまたは上記論じられるか、当技術分野で公知のその他の標識もしくはタグで標識されるよう特別に設計できる。プローブとして利用できる分子の例として、それだけには限らないが、RNAおよびDNAが挙げられる。
例えば、単離mRNAはハイブリダイゼーションまたは増幅アッセイ、例えば、それだけには限らないが、サザンまたはノーザン分析、ポリメラーゼ連鎖反応分析およびプローブアレイにおいて使用できる。mRNAレベルを検出するための1つの方法は、単離mRNAを、検出される遺伝子によってコードされるmRNAとハイブリダイズできる核酸分子(プローブ)と接触させることを含む。核酸プローブは、例えば、全長cDNAまたはその一部、例えば、長さが少なくとも7、15、30、50、100、250または500ヌクレオチドであり、ストリンジェントな条件下で本明細書において上述されるバイオマーカー、CD40関連因子または臨床的に有用な予後マーカーをコードするmRNAまたはゲノムDNAと特異的にハイブリダイズするのに十分であるオリゴヌクレオチドであり得る。mRNAのプローブとのハイブリダイゼーションは、注目するバイオマーカーまたはその他の標的タンパク質が発現されていることを示す。
一実施形態では、mRNAを、固体表面上に固定化し、例えば、単離したmRNAをアガロースゲルに流すことおよびmRNAをゲルからニトロセルロースなどのメンブレンにトランスファーすることとによってプローブと接触させる。代替実施形態では、プローブ(類)を固体表面上に固定化し、例えば、遺伝子チップアレイにおいてmRNAをプローブ(類)と接触させる。当業者ならば、注目するバイオマーカーまたはその他のタンパク質をコードするmRNAのレベルの検出において使用するための既知mRNA検出法を容易に適合させることができる。
サンプル中の注目するmRNAのレベルを調べるための代替方法は、例えば、RT−PCR(例えば、米国特許第4,683,202参照のこと)、リガーゼ連鎖反応(Barany(1991)Proc.Natl.Acad.Sci.USA 88:189−193)、自律的配列複製(Guatelli et al.(1990)Proc.Natl.Acad.Sci.USA 87:1874−1878)、転写増幅システム(Kwoh et al.(1989)Proc.Natl.Acad.Sci.USA 86:1173−1177)、Q−βレプリカーゼ(Lizardi et al.(1988)Bio/Technology 6:1197)、ローリングサークル複製(米国特許第5,854,033)による核酸増幅法または任意のその他の核酸増幅法と、それに続く、当業者に周知の技術を用いる増幅さされた分子の検出を含む。これらの検出スキームは、核酸分子が極めて少数で存在する場合にはこのような分子の検出にとって特に有用である。本発明の特定の態様では、バイオマーカー発現またはCD40関連因子もしくはその他の臨床的に有用な予後マーカーの発現を定量的蛍光発生的RT−PCR(すなわち、TaqMan(登録商標)システム)によって評価する。
注目するRNAの発現レベルは、メンブレンブロット(ノーザン、ドットなどのハイブリダイゼーション分析に用いられるような)またはマイクロウェル、サンプルチューブ、ゲル、ビーズまたはファイバー(または結合している核酸を含む任意の固相支持体)を用いてモニターできる。参照により本明細書に組み込まれる、米国特許第5,770,722号、同5,874,219号、同5,744,305号、同5,677,195号および同5,445,934号参照のこと。発現の検出はまた、溶液において核酸プローブを用いることを含み得る。
本発明の一実施形態では、マイクロアレイを用いて1種以上のバイオマーカー、CD40関連因子および/または臨床的に有用な予後マーカーの発現を検出する。マイクロアレイは、種々の実験間の再現性のためにこの目的に特によく適している。DNAマイクロアレイは、多数の遺伝子の発現レベルを同時測定するための1つの方法を提供する。各アレイは、固相支持体と結合している捕捉プローブの再現可能なパターンからなる。標識RNAまたはDNAを、アレイ上の相補的プローブとハイブリダイズさせ、次いで、レーザースキャニングによって検出する。アレイ上の各プローブのハイブリダイゼーション強度を調べ、相対的遺伝子発現レベルを表す定量的値に変換する。参照により本明細書に組み込まれる、米国特許第6,040,138号、同5,800,992号および同6,020,135号、同6,033,860号および同6,344,316号参照のこと。高密度オリゴヌクレオチドアレイは、サンプル中の多数のRNAの遺伝子発現プロフィールを調べるために特に有用である。
機械的合成法を用いるこれらのアレイの合成のための技術は、例えば、参照によりその全文が本明細書に組み込まれる米国特許第5,384,261号に記載されている。平面アレイ表面が好ましいが、アレイは実質的に任意の形の表面、さらには多様な表面で作製されてもよい。アレイはビーズ、ゲル、高分子表面、ファイバー、例えば、光ファイバー、ガラスまたは任意のその他の適当な基板上のペプチドまたは核酸であり得る。各々、あらゆる目的のために参照によりその全文が本明細書に組み込まれる、米国特許第5,770,358号、同5,789,162号、同5,708,153号、同6,040,193号および同5,800,992号参照のこと。アレイは、診断または含まれる全装置のその他の操作を可能にするような方法でパッケージングされていもよい。例えば、参照により本明細書に組み込まれる米国特許第5,856,174号および同5,922,591号参照のこと。
一アプローチでは、サンプルから単離された全mRNAを、標識cRNAに変換し、次いで、オリゴヌクレオチドアレイとハイブリダイズさせる。各サンプルを別個のアレイとハイブリダイズさせる。相対転写物レベルは、アレイ上およびサンプル中に存在する適当な対照に対する参照によって算出できる。
抗CD40治療薬
本明細書に記載されるex vivo予後アッセイを用いて、注目する抗CD40治療薬を用いる治療から恩恵を受ける、CD40発現腫瘍性細胞と関連している癌または前癌状態を有する被験体を同定できる。特に注目されるものは、CD40Lにより媒介されるCD40シグナル伝達を調節する、かつ/またはADCCを調節する抗CD40治療薬である。このような抗CD40治療薬としては、それだけには限らないが、CD40、CD40Lアンタゴニスト、例えば、抗CD40L抗体、CD40と結合できるがCD40シグナル伝達を誘発しないCD40Lの突然変異型、可溶性CD40、CD40を含む融合タンパク質の可溶性型およびD40L−CD40相互作用を混乱させ、もしくは干渉する、かつ/またはCD40シグナル伝達を干渉する薬理作用のある物質、例えば、参照によりその全文が本明細書に組み込まれる米国特許出願公開第20040067982号に開示される、CD40:CD40L結合妨害化合物と結合すると、CD40Lにより媒介されるシグナル伝達をブロックまたは干渉する、かつ/またはADCC活性を調節するアンタゴニスト抗CD40抗体が挙げられる。特に注目されるものとして、CD40L媒介性CD40シグナル伝達をブロックするために役立つアンタゴニスト抗CD40治療薬、例えば、アンタゴニスト抗CD40抗体およびアンタゴニスト抗CD40L抗体またはその抗原結合性断片ならびにADCCを調節する抗CD40治療薬、例えば、抗CD40抗体およびその抗原結合性断片がある。
抗CD40抗体
CD40に対するモノクローナル抗体は当技術分野で公知である。例えば、すべて、参照により本明細書に組み込まれる、McMichael,ed.(1987; 1989)Leukocyte Typing III and IV(Oxford University Press、New York)中、B細胞抗原に対して設けられた項;米国特許第5,674,492号、同5,874,082号、同5,677,165号、同6,056,959号、WO00/63395、国際公開公報WO02/28905およびWO02/28904、Gordon et al.(1988)J.Immunol.140:1425、Valle et al.(1989)Eur.J.Immunol 19:1463、Clark et al.(1986)PNAS 83:4494、Paulie et al.(1989)J Immunol 142:590; Gordon et al.(1987)Eur.J.Immunol.17:1535、Jabara et al(1990)J.Exp.Med.172:1861、Zhang et al.(1991)J.Immunol.146:1836、Gascan et al.(1991)J.Immunol.147:8、Banchereau et al(1991)Clin.Immunol.Spectrum 3:8およびBanchereau et al.(1991)Science 251:70参照のこと。その他の抗CD40モノクローナル抗体としては、それだけには限らないが、ヒト化抗CD40抗体、例えば、マウス抗CD40抗体SGN−14(Francisco et al(2000)Cancer Res.60:3225−31)のヒト化型であるSGN−40(Tai et al.(2004)Cancer Res.64:2846−52、米国特許第6,838,261号)ならびに参照によりその全文が本明細書に組み込まれる、米国特許出願公開第2004/0120948号に開示されるアゴニストおよびアンタゴニスト抗体が挙げられる。
一実施形態では、ex vivo予後アッセイを用いてアンタゴニスト抗CD40抗体を用いる治療の適合性または有効性を調べる。本発明の方法に用いられるアンタゴニスト抗CD40抗体として、ヒト細胞の表面に発現されるヒトCD40抗原と特異的に結合できるモノクローナル抗体またはその抗原結合性断片が挙げられる。いくつかの実施形態では、本発明の方法において用いられるアンタゴニスト抗CD40抗体は、CD40細胞表面抗原に対して強力な単一部位結合親和性を示す。このようなモノクローナル抗体は、Biacore(商標)などの標準アッセイを用いて測定された、少なくとも10−5M、少なくとも3×10−5M、好ましくは、少なくとも10−6M〜10−7M、より好ましくは、少なくとも10−8M〜約10−12MというCD40の解離平衡定数(KD)を示す。Biacore分析は当技術分野で公知であり、詳細は「BIAapplications handbook」に提供されている。WO01/27160に記載された方法を用いて結合親和性を調節できる。
特に注目されるものとして、本明細書において上記で定義される、顕著なアゴニスト活性がないアンタゴニスト抗CD40抗体があるが、ヒト細胞上のCD40抗原と結合すると、特に、腫瘍性ヒトB細胞上のCD40抗原と結合すると、アンタゴニスト活性を示す。本発明の一実施形態では、アンタゴニスト抗CD40抗体は、1種のB細胞反応で顕著なアゴニスト活性がない。本発明のもう1つの実施形態では、アンタゴニスト抗CD40抗体は、2種以上のB細胞反応(例えば、増殖および分化または増殖、分化および抗体産生)のアッセイにおいて顕著なアゴニスト活性がない。適したモノクローナル抗CD40抗体は、ヒト定常領域を有し、それらはまたヒト化フレームワーク領域を全体的にまたは部分的に有することが好ましく、完全ヒト抗体またはその抗原結合性断片が最も好ましい。このようなモノクローナル抗体の例として、本明細書においてCHIR−5.9およびCHIR−12.12と呼ばれる抗体がある。
モノクローナル抗体CHIR−5.9およびCHIR−12.12は、本発明の方法に用いるアンタゴニスト抗CD40抗体に相当する。CHIR−5.9およびCHIR−12.12抗体は、ハイブリドーマ細胞株131.2F8.5.9(本明細書において細胞株5.9と呼ばれる)および153.8E2.D10.D6.12.12(本明細書において細胞株12.12と呼ばれる)から産生されるIgG1アイソタイプの完全ヒト抗CD40モノクローナル抗体である。これらの細胞株は、免疫化した、ヒトIgG1重鎖遺伝子座とヒトκ鎖遺伝子座とを含む異種型マウス(XenoMouse(登録商標)技術;Abgenix; Fremont,California)から得た脾細胞を用いて作成した。脾臓細胞をマウス骨髄腫SP2/0細胞(Sierra BioSource)と融合した。得られたハイブリドーマを数回サブクローニングし、安定なモノクローナル細胞株5.9および12.12を作製した。本発明のその他の抗体は、ヒト免疫グロブリン遺伝子座についてトランスジェニックであるマウスを用いて、または当技術分野で公知であり、かつ/または本明細書に記載されるその他の方法によって同様に調製できる。
CHIR−12.12抗体の可変領域のヌクレオチドおよびアミノ酸配列ならびにCHIR−5.9抗体の可変領域のアミノ酸配列は開示されている。より詳しくは、mAb CHIR−12.12の軽鎖および重鎖のリーダー、可変および定常領域のアミノ酸配列は、配列番号2(mAb CHIR−12.12の軽鎖の完全配列)、配列番号4(mAb CHIR−12.12の重鎖の完全配列)および配列番号5(配列番号4に示されるmAb CHIR−12.12の重鎖の変異体の完全配列;ここで変異体は配列番号4の153位のアラニン残基のセリン置換を含む)に示される。mAb CHIR−12.12の軽鎖および重鎖をコードするヌクレオチド配列は、配列番号1(mAb CHIR−12.12の軽鎖のコード配列)および配列番号3(mAb CHIR−12.12の重鎖のコード配列)に示されている。CHIR−5.9mAbの軽鎖および重鎖のリーダー、可変および定常領域のアミノ酸配列は、配列番号6(mAb CHIR−5.9の軽鎖の完全配列)、配列番号7(mAb CHIR−5.9の重鎖の完全配列)および配列番号8(配列番号7に示されるmAb CHIR−5.9の重鎖の変異体の完全配列、ここで、変異体は配列番号7の158位のアラニン残基のセリン置換を含む)に示されている。さらに、CHIR−5.9およびCHIR−12.12抗体を発現するハイブリドーマは、それぞれ、特許寄託番号PTA−5542およびPTA−5543でATCCに寄託されている。
本発明の方法において用いる抗CD40抗体は、アンタゴニスト活性に加え、腫瘍細胞に対して別の作用機序を有する場合がある。例えば、天然CHIR−5.9およびCHIR−12.12抗体はADCC活性を有する。あるいは、CHIR−5.9およびCHIR−12.12抗体の可変領域は、ADCC活性を有する別の抗体アイソタイプで発現され得る。本明細書において後述されるように、CHIR−5.9またはCHIR−12.12の天然型、組換え型または抗原結合性断片を、細胞毒素、治療薬または放射性金属イオンもしくは放射性同位元素とコンジュゲートすることも可能である。
CHIR−5.9およびCHIR−12.12モノクローナル抗体は、ELISA型アッセイにおいて可溶性CD40と結合し、CD40リガンドの、細胞表面CD40との結合を妨げ、予め結合しているCD40リガンドを置換することが、フローサイトメトリーによるアッセイによって調べられた。抗体CHIR−5.9およびCHIR−12.12は、CD40との結合について互いに競合するが、双方とも参照によりその全文が本明細書に組み込まれる、2000年10月2日に出願された「Human Anti−CD40 Antibodies」と題された米国仮出願番号第60/237,556号および2001年10月2日に出願された同様に「Human Anti−CD40 Antibodies」と題されたPCT国際出願PCT/US0l/30857(代理人整理番号PPl6092.003)に記載される15B8抗CD40モノクローナル抗体とは競合しない。正常ヒト被験体から得たB細胞の増殖に対する効果についてin vitroで試験すると、CHIR−5.9およびCHIR−12.12はアンタゴニスト抗CD40抗体として作用する。さらに、CHIR−5.9およびCHIR−12.12は正常被験体から得たヒトリンパ球の強力な増殖を誘導しない。これらの抗体は抗体依存性細胞媒介性細胞傷害性(ADCC)によってCD40発現標的細胞を死滅させることができる。ヒトCD40に対するCHIR−5.9の結合親和性は、1.2×10−8Mであり、CHIR−12.12の結合親和性は5×10−10Mであると、Biacore(商標)アッセイによって求められた。
上記のモノクローナル抗体CHIR−5.9およびCHIR−12.12に特徴的な結合を共有するその他のアンタゴニスト抗CD40抗体として、それだけには限らないが、以下が挙げられる:(1)それぞれ、特許寄託番号PTA−5542および特許寄託番号PTA−5543としてATCCに寄託された、131.2F8.5.9(本明細書では細胞株5.9と呼ばれる)および153.8E2.D10.D6.12.12(本明細書では細胞株12.12と呼ばれる)と呼ばれるハイブリドーマ細胞株によって産生されるモノクローナル抗体、(2)配列番号2に示される配列、配列番号4に示される配列、配列番号5に示される配列、配列番号2および配列番号4に示される両配列、配列番号2および配列番号5に示される両配列からなる群から選択されるアミノ酸配列を含むモノクローナル抗体、(3)配列番号6に示される配列、配列番号7に示される配列、配列番号8に示される配列、配列番号6および配列番号7に示される両配列ならびに配列番号6および配列番号8に示される両配列からなる群から選択されるアミノ酸配列を含むモノクローナル抗体、(4)配列番号1に示されるヌクレオチド配列、配列番号3に示されるヌクレオチド配列、配列番号1および配列番号3に示される両配列からなる群から選択されるヌクレオチド配列を含む核酸分子によってコードされるアミノ酸配列を有するモノクローナル抗体、(5)ハイブリドーマ細胞株5.9またはハイブリドーマ細胞株12.12によって産生されるモノクローナル抗体と結合できるエピトープと結合するモノクローナル抗体、(6)配列番号10または配列番号12に示されるアミノ酸配列の残基82〜87を含むエピトープと結合するモノクローナル抗体、(7)競合結合アッセイにおいてモノクローナル抗体CHIR−5.9またはCHIR−12.12と競合するモノクローナル抗体ならびに(8)ヒトCD40抗原と特異的に結合する能力を保持する、CHIR−12.12またはCHIR−5.9モノクローナル抗体または前記の項(1)〜(7)における前述のモノクローナル抗体の抗原結合性断片であるモノクローナル抗体。
当業者ならば、本明細書に記載される抗体およびこれらの抗体の抗原結合性断片は、当技術分野で周知であり、本明細書において以下に記載される方法を用いて組換えによって製造された抗体およびこれらの抗原結合性断片を含むことは認識しており、これとして、例えば、組換えによって製造されたモノクローナル抗体CHIR−5.9およびCHIR−12.12が挙げられる。
さらなるアンタゴニスト抗CD40抗体として、それぞれ、ATCC受託番号HB11339、HB12024およびHB11340を有するハイブリドーマから分泌される5D12、3A8および3C6と呼ばれるモノクローナル抗体が挙げられる。例えば、参照によりその全文が本明細書に組み込まれる米国特許第6,315,998号参照のこと。
その他のアンタゴニスト抗CD40抗体は当技術分野で公知である。例えば、参照によりその全文が本明細書に組み込まれる米国特許出願公開第20020142358号および同20030059427号において開示されるF4−465と呼ばれるハイブリドーマによって産生されるヒト抗CD40抗体参照のこと。F4−465は、HACマウス(Kuroiwa et al.(2000)Nature Biotech.10:1086(2000))から得、したがって、ヒトλ軽鎖を発現する。
アンタゴニスト抗CD40L抗体
CD40Lと結合し、それによって、CD40/CD40L相互作用またはCD40Lにより媒介されるCD40シグナル伝達を干渉する抗体は当技術分野で公知である。例として、それだけには限らないが、国際特許公報WO95/06666に開示されるものが挙げられ、その内容は参照によりその全文が本明細書にある。特別な例として、それだけには限らないが、American Type Culture Collection(ATCC)10801 University Blvd.、Manassas、Virgina 20110−2209に寄託され、それぞれ、ATCC受託番号HB11713およびHB11712を割り当てられた、89−76および24−31ハイブリドーマによってそれぞれ産生される89−76および24−31と呼ばれるアンタゴニスト抗CD40L抗体が挙げられる。
抗体の製造
本発明の方法に使用するための抗体、例えば、本明細書に開示されるアンタゴニスト抗CD40抗体および注目するバイオマーカーまたはその他の臨床的に有用な予後マーカーと特異的に結合する任意の抗体は、当業者に公知の任意の抗体製造法を用いて製造できる。したがって、ポリクローナル血清は、従来法によって調製できる。一般に、まず、注目する抗原、例えば、CD40抗原またはCD40L抗原を含む溶液を用いて適した動物、好ましくはマウス、ラット、ウサギまたはヤギを免疫化する。得られる血清の容積ならびに標識抗ウサギおよび抗ヤギ抗体が入手可能であることのために、ポリクローナル血清の調製にはウサギまたはヤギが好ましい。
ポリクローナル血清は、トランスジェニック動物、好ましくは、ヒト免疫グロブリン遺伝子座を有するマウスにおいて調製できる。好ましい実施形態では、注目するタンパク質、例えば、CD40またはCD40Lを発現するSf9細胞を免疫原として用いる。免疫化はまた、生理食塩水に、好ましくは、フロイントの完全アジュバントなどのアジュバントに抗原含有溶液を混合することまたは乳化することと、混合物またはエマルションを非経口的に(通常、皮下に、または筋肉内に)注射することとによって実施できる。50〜200μg/注射という用量は通常十分である。免疫化は、通常、好ましくはフロイントの不完全アジュバントを用いて、生理食塩水中のタンパク質の1回以上の注射によって2〜6週間後にブーストする。あるいは、当技術分野で公知の方法を用いてin vitro免疫化によって抗体を作製でき、これは、本発明の目的上、in vivo免疫化と同等と考えられる。ポリクローナル抗血清は、免疫化した動物からガラスまたはプラスチック容器中に放血させることと、25℃で1時間血液をインキュベートすること、続いて、4℃で2〜18時間インキュベートすることとによって得る。血清は遠心分離(例えば、1000×gで10分間)によって回収する。ウサギから放血あたり約20〜50mlを得ることができる。
Sf9(ヨトウガ)細胞の製造は、参照により本明細書に組み込まれる米国特許第6,004,552号に開示されている。手短には、CD40の場合には、ヒトCD40をコードする配列を、トランスファーベクターを用いてバキュロウイルス中に組換えた。このプラスミドを、Sf9細胞に野生型バキュロウイルスDNAと同時トランスフェクトした。組換えバキュロウイルス感染Sf9細胞を同定し、クローニングによって精製した。
抗体は本来モノクローナルであることが好ましい。「モノクローナル抗体」とは、実質的に均一な抗体の集団から得られた抗体、すなわち、集団を含む個々の抗体が、微量で存在し得る天然に存在する突然変異の可能性を除いて同一であることを意味する。この用語は、抗体の種または供給源に関して制限されない。この用語は全免疫グロブリンならびにFab、F(ab’)2、Fvおよび抗体の抗原結合機能を保持するその他のものなどの断片を包含する。モノクローナル抗体は高度に特異的であり、単一の抗原性部位、例えば、抗CD40抗体または抗CD40L抗体の場合には、それぞれ、CD40細胞表面抗原またはCD40L細胞表面抗原に対するものである。さらに、通常、種々の決定基(エピトープ)に対する種々の抗体を含む従来の(ポリクローナル)抗体調製物とは対照的に、各モノクローナル抗体は、抗原上の単一の決定基に対するものである。修飾語句「モノクローナル」は、実質的に均一な抗体集団から得られている抗体の特徴を示し、任意の特定の方法による抗体の製造を必要とすると解釈されるべきではない。例えば、本発明に従って使用されるモノクローナル抗体は、最初にKohler et al.(1975)Nature 256:495によって記載されたハイブリドーマ法によって作製されたものであってもよいし、組換えDNA法によって作製したものであってもよい(例えば、米国特許第4,816,567号参照のこと)。「モノクローナル抗体」はまた、例えば、Clackson et al.(1991)Nature 352:624−628; Marks et al.(1991)J.MoI Biol.222:581−597および米国特許第5,514,548号に記載される技術を用いてファージ抗体ライブラリーから単離できる。
「エピトープ」とは、それに対して抗体が作製され、それと抗体が結合する抗原性分子の一部を意味する。エピトープは、線形のアミノ酸残基(すなわち、エピトープ内の残基は線状様式に次々連続して配列している)、非線形のアミノ酸残基(本明細書において「非線形エピトープ」と呼ばれ、これらのエピトープは連続して配列していない)または線形および非線形アミノ酸残基双方を含み得る。
モノクローナル抗体は、Kohler et al.(1975)Nature 256:495−496の方法またはその改良版を用いて調製できる。通常、マウスを抗原を含有する溶液を用いて免疫化する。免疫化は、生理食塩水に、好ましくは、フロイントの完全アジュバントなどのアジュバントに抗原含有溶液を混合することまたは乳化することと、混合物またはエマルションを非経口的に注射することとによって実施できる。当技術分野で公知の任意の免疫化方法を用いて本発明のモノクローナル抗体を得ることができる。動物を免疫化した後、脾臓(および場合により、いくつかの大きなリンパ節)を採取し単細胞に解離する。細胞懸濁液を注目する抗原でコーティングしたプレートまたはウェルに適用することによって脾臓細胞をスクリーニングできる。抗原に特異的な膜結合型免疫グロブリンを発現するB細胞はプレートと結合し、リンスによって除去されない。次いで、得られたB細胞またはすべての解離された脾臓細胞を誘導し、骨髄腫細胞と融合させ、ハイブリドーマを形成し、選択培地で培養する。得られた細胞を段階希釈によってプレーティングし、注目する抗原と特異的に結合する(かつ、無関係の抗原と結合しない)抗体の産生についてアッセイする。次いで、選択されたモノクローナル抗体(mAb)を分泌するハイブリドーマをin vitro(例えば、組織培養ボトルまたは中空繊維反応器において)またはin vivo(マウスにおける腹水のような)のいずれかで培養する。
本発明の方法において使用するための抗体、例えば、アンタゴニスト抗CD40抗体またはアンタゴニスト抗CD40L抗体が組換えDNA法を用いて調製される場合は、モノクローナル抗体をコードするDNAは、従来の手順を用いて(例えば、マウス抗体の重鎖および軽鎖をコードする遺伝子と特異的に結合できるオリゴヌクレオチドプローブを用いることによって)容易に単離され、配列決定される。本明細書に記載されるハイブリドーマ細胞は、このようなDNAの好ましい供給源として役立つ。DNAは単離すると、発現ベクターに入れることができ、次いで、これを宿主細胞、例えば、大腸菌(E.coli)細胞、サルCOS細胞、チャイニーズハムスター卵巣(CHO)細胞または本来なら免疫グロブリンタンパク質を産生しない骨髄腫細胞にトランスフェクトし、組換え宿主細胞におけるモノクローナル抗体の合成を得ることができる。抗体をコードするDNAの、細菌における組換え発現に関する総説として、Skerra et al.(1993)Curr.Opinion in Immunol.5:256およびPhickthun(1992)Immunol.Revs.130:151が挙げられる。あるいは、抗体は、参照により本明細書に組み込まれる米国特許第5,545,403号、同5,545,405号および同5,998,144号に開示されるようにCHO細胞株などの細胞株において産生され得る。手短には、軽鎖および重鎖をそれぞれ発現できるベクターを用いて細胞株をトランスフェクトする。2種のタンパク質を別個のベクターにトランスフェクトすることによって、キメラ抗体を作製することができる。もう1つの利点は抗体の正しいグリコシル化である。
いくつかの実施形態では、アンタゴニスト抗CD40抗体、例えば、CHIR−12.12またはCHIR−5.9抗体またはその抗原結合性断片を、マーカーとしてグルタミン合成酵素を用いるGS遺伝子発現系(Lonza Biologies、Portsmouth、New Hampshire)を用いてCHO細胞において製造する。内容が参照により本明細書に全文で組み込まれる、米国特許第5,122,464号、同5,591,639号、同5,658,759号、同5,770,359号、同5,827,739号、同5,879,936号、同5,891,693号および同5,981,216号も参照のこと。
さらに、本発明の方法に用いるための抗体は、望ましい結合特性を有するキメラ抗体であり得る。したがって、例えば、本発明の方法に用いるためのキメラ抗CD40抗体は、本明細書に記載されるCHIR−5.9およびCHIR−12.12モノクローナル抗体の結合特性を有し得る。「キメラ」抗体とは、最も好ましくは、組換えデオキシリボ核酸技術を用いて誘導され、ヒト(例えば、免疫学的に「関連する」種、例えば、チンパンジー)および非ヒト成分の両方を含む抗体を意味する。したがって、キメラ抗体の定常領域は、天然ヒト抗体の定常領域と実質的に同一であることが最も好ましい。キメラ抗体の可変領域は非ヒト供給源から誘導され、注目する抗原、例えば、CD40またはCD40L抗原に対して所望の抗原特異性を有することが最も好ましい。非ヒト供給源は、ヒト抗原またはヒトCD40抗原を含む物質に対する抗体を作製するために使用できる任意の脊椎動物供給源であり得る。このような非ヒト供給源としては、それだけには限らないが、げっ歯類(例えば、ウサギ、ラット、マウスなど;例えば、参照により本明細書に組み込まれる米国特許第4,816,567号参照のこと)、および非ヒト霊長類(例えば、旧世界ザル、類人猿など;例えば、参照により本明細書に組み込まれる米国特許第5,750,105号および同5,756,096号参照のこと)が挙げられる。本明細書において、語句「免疫学的に活性」とは、例えば、キメラ抗CD40抗体またはキメラ抗CD40L抗体に関連して用いられる場合、それぞれ、ヒトCD40またはヒトCD40Lと結合するキメラ抗体を意味する。
「ヒト化」とは、非ヒト免疫グロブリン配列由来の最小配列を含む抗体の形を意味する。ヒト化抗体は、大部分はヒト免疫グロブリン(レシピエント抗体)であり、レシピエントの超可変領域(相補性決定領域またはCDRとしても知られる)由来の残基が、所望の特異性、親和性および能力を有するマウス、ラット、ウサギまたは非ヒト霊長類などの非ヒト種(ドナー抗体)の超可変領域由来の残基で置換されている。語句「相補性決定領域」とは、天然の免疫グロブリン結合部位の天然Fv領域の結合親和性および特異性を同時に規定するアミノ酸配列を指す。例えば、Chothia et al.(1987)J.Mol.Biol.196:901−917、Kabat et al.(1991)U.S.Dept.of Health and Human Services、NIH Publication No.91−3242)参照のこと。語句「定常領域」とは、エフェクター機能を付与する抗体分子の一部を指す。ヒト疾患の治療に用いるための非免疫原性抗体の製造に向けられたこれまでの研究では、マウス定常領域をヒト定常領域で置換した。主題ヒト化抗体の定常領域はヒト免疫グロブリンに由来するものであった。しかし、これらのヒト化抗体は、ヒトにおいて、不要な、危険になりかねない免疫応答を依然として惹起し、親和性の喪失があった。本発明の方法に用いるためのヒト化抗体、例えば、ヒト化抗CD40抗体は、注目する親抗体、例えば、本明細書に記載されるCHIR−5.9およびCHIR−12.12モノクローナル抗体によって示されるものと同様の結合特性を有する。
ヒト化は、原則的に、Winterおよび共同研究者(Jones et al.(1986)Nature 321:522−525、Riechmann et al.(1988)Nature 332:323−327、Verhoeyen et al.(1988)Science 239:1534−1536)の方法に従い、げっ歯類または突然変異げっ歯類CDRまたはCDR配列を、ヒト抗体の対応する配列と置換することによって実施できる。参照により本明細書に組み込まれる、米国特許第5,225,539号、同5,585,089号、同5,693,761号、同5,693,762号、同5,859,205号も参照のこと。いくつかの例では、ヒト免疫グロブリンの1以上の可変領域のフレームワーク領域内の残基を、対応する非ヒト残基によって置換する(例えば、米国特許第5,585,089号、同5,693,761号、同5,693,762号および同6,180,370号参照のこと)。さらに、ヒト化抗体は、レシピエント抗体にもドナー抗体にも見られない残基を含み得る。これらの改変は、抗体性能をさらに高めるために(例えば、所望の親和性を得るために)行う。通常、ヒト化抗体は、少なくとも1つの、通常、2つの可変ドメインの実質的にすてべを含み、これでは、超可変領域のすべてまたは実質的にすべてが非ヒト免疫グロブリンのものに相当し、フレームワーク領域のすべてまたは実質的にすべてはヒト免疫グロブリン配列のものである。ヒト化抗体は、通常、ヒト免疫グロブリンのものである免疫グロブリン定常領域(Fc)の少なくとも一部も場合により含む。さらなる詳細については、参照により本明細書に組み込まれる、Jones et al.(1986)Nature 331:522−525、Riechmann et al.(1988)Nature 332:323−329およびPresta(1992)Curr.Op.Struct.Biol.2:593−596を参照のこと。したがって、このような「ヒト化」抗体は、無傷のヒトよりもかなり少ない可変ドメインが、非ヒト種由来の対応する配列によって置換されている抗体を含み得る。実際には、ヒト化抗体は、通常、いくつかのCDR残基と、ことによるといくつかのフレームワーク残基が、げっ歯類抗体の類似の部位に由来する残基によって置換されているヒト抗体である。例えば、米国特許第5,225,539号、同5,585,089号、同5,693,761号、同5,693,762号、同5,859,205号参照のこと。所定の抗原に対する親和性が改良されたヒト化抗体およびヒト化抗体を製造するための技術が開示されている、米国特許第6,180,370および国際公開番号WO01/27160も参照のこと。
本発明はまた、不活化内因性免疫グロブリン(Ig)遺伝子座を特徴とする、非ヒト哺乳類宿主、より詳しくは、トランスジェニックマウスにおいて製造した異種抗体または改変抗体を用いて実施できる。このようなトランスジェニック動物では、宿主免疫グロブリンのライトサブユニットおよびヘビーサブユニットの発現のための適格な内因性遺伝子が非機能的にされており、類似のヒト免疫グロブリン遺伝子座で置換されている。これらのトランスジェニック動物は、ライトまたはヘビー宿主免疫グロブリンサブユニットの実質的に不在下で、ヒト抗体を産生する。例えば、参照により本明細書に組み込まれる米国特許第5,877,397号および同5,939,598号参照のこと。
いくつかの実施形態では、CD40に対する完全ヒト抗体を、例えば、トランスジェニックマウスを免疫化することによって得る。1種のこのようなマウスは、XenoMouse(登録商標)技術(Abgenix; Fremont、California)を用いて得られ、すべて参照により本明細書に組み込まれる、米国特許第6,075,181号、同6,091,001号および同6,114,598号に開示されている。本明細書に開示される抗体を製造するために、ヒトIgG1重鎖遺伝子座およびヒトκ軽鎖遺伝子座についてトランスジェニックなマウスを、ヒトCD40を発現するSf9細胞を用いて免疫化した。マウスはまた、その他のアイソタイプについてトランスジェニックであってもよい。本発明の方法において有用な完全ヒト抗CD40抗体は、本明細書において開示されるCHIR−5.9およびCHIR−12.12モノクローナル抗体によって示されるものと同様の結合特性を特徴とする。
注目する特定の抗体、例えば、抗CD40抗体または抗CD40L抗体の断片は、それらが全長抗体の所望の親和性を保持する限り、本発明の方法において使用するのに適している。したがって、例えば、抗CD40抗体の断片は、CD40B細胞表面抗原と結合する能力を保持する。このような断片は、対応する全長抗体と同様の特性を特徴とする。したがって、例えば、全長アンタゴニスト抗CD40抗体の断片は、ヒト細胞の表面に発現され、顕著なアゴニスト活性がないが、ヒトCD40発現細胞上のCD40抗原と結合するとアンタゴニスト活性を示すヒトCD40抗原と特異的に結合する。このような断片は、本明細書において「抗原結合性」断片と呼ばれる。
抗体の適した抗原結合性断片は、全長抗体の一部、通常、その抗原結合領域または可変領域を含む。
抗体断片の例として、それだけには限らないが、Fab、F(ab’)2およびFv断片および一本鎖抗体分子が挙げられる。「Fab」は、軽鎖と重鎖の一部とからなる免疫グロブリンの一価の抗原結合性断片を意味する。F(ab’)2は、両軽鎖および両重鎖の一部を含む免疫グロブリンの二価の抗原結合性断片を意味する。「一本鎖Fv」または「sFv」抗体断片とは、抗体のVHおよびVLドメインを含み、これらのドメインが単一のポリペプチド鎖中に存在する断片を意味する。例えば、参照により本明細書に組み込まれる、米国特許第4,946,778号、同5,260,203号、同5,455,030号および同5,856,456号参照のこと。通常、FvポリペプチドはVHおよびVLドメインの間にポリペプチドリンカーをさらに含み、これによりsFvが抗原結合のために望まれる構造を形成することが可能となる。sFvの総説については、Pluckthun(1994)in The Pharmacology of Monoclonal Antibodies、Vol.113、ed.Rosenburg and Moore(Springer−Verlag、New York)、pp.269−315参照のこと。本明細書に開示されるアンタゴニスト抗CD40抗体の抗原結合性断片は、本明細書において後述されるように、細胞毒素とコンジュゲートさせ、標的癌細胞の死滅を達成することができる。
抗体または抗体断片は、例えば、McCafferty et al.(1990)Nature 348:552−554(1990)および米国特許第5,514,548号に記載される技術を用いて作製された抗体ファージライブラリーから単離できる。Clackson et al.(1991)Nature 352:624−628およびMarks et al.(1991)J.Mol.Biol.222:581−597には、ファージライブラリーを用いるマウスおよびヒト抗体、それぞれの単離が記載されている。続報には、鎖シャッフリング(Marks et al.(1992)Bio/Technology 10:779−783)による高親和性(nMレンジ)ヒト抗体の製造ならびに極めて大きなファージライブラリーを構築するための戦略としてのコンビナトリアル感染およびin vivo組換えが記載されている(Waterhouse et al.(1993)Nucleic.Acids Res.21:2265−2266)。したがって、これらの技術は、モノクローナル抗体を単離するための従来のモノクローナル抗体ハイブリドーマ法の実行可能な代替案である。
抗体断片を製造するために種々の技術が開発されている。従来、これらの断片は無傷の抗体のタンパク質分解による消化を介して誘導した(例えば、Morimoto et al.(1992)Journal of Biochemical and Biophysical Methods 24:107−117(1992)およびBrennan et al.(1985)Science 229:81参照のこと)。しかし、現在、これらの断片は組換え宿主細胞によって直接産生され得る。例えば、抗体断片は、上記で論じられる抗体ファージライブラリーから単離できる。あるいは、Fab’−SH断片は、大腸菌から直接回収し、化学的に結合させてF(ab’)2断片を形成できる(Carter et al.(1992)Bio/Technology 10:163−167)。もう1つのアプローチによれば、F(ab’)2断片を、組換え宿主細胞培養物から直接単離できる。抗体断片を製造するためのその他の技術は、当業者には明らかである。
本発明の方法に用いるためのアンタゴニスト抗CD40抗体として、本明細書に開示されるCHIR−5.9およびCHIR−12.12モノクローナル抗体、ならびにこの抗体とは異なるがCDRを保持している抗体および1以上のアミノ酸付加、欠失または置換を含む抗体が挙げられ、これでは、アンタゴニスト活性はB細胞増殖および/または分化の阻害によって測定される。本発明はまた、脱免疫された(de−immunized)抗体、特に、脱免疫されたアンタゴニスト抗CD40抗体を包含し、これは、例えば、参照により本明細書に組み込まれる、国際公開公報WO98/52976およびWO0034317に記載されるように製造できる。このように、本発明のアンタゴニスト抗CD40抗体内の残基を、抗体を、ヒトCD40発現細胞に向けたそのアンタゴニスト活性を保持しながら、ヒトに対する免疫原性をなくさせるよう、または免疫原性が少なくなるよう改変するが、これでは、このような活性は本明細書において他で記載されるアッセイによって測定する。また、注目する抗体、例えば、アンタゴニスト抗CD40抗体またはアンタゴニスト抗CD40L抗体またはその断片を含む融合タンパク質も本発明の範囲内に含まれ、当技術分野で公知のように、この融合タンパク質は対応するポリヌクレオチドベクターから合成または発現させることができる。このような融合タンパク質は、本明細書において他で記載されるように、抗体のコンジュゲーションに関連して記載されている。
注目する結合特異性を有する任意の既知抗体は、例えば、参照により本明細書に組み込まれる、特許公報EP0983303A1、WO00/34317およびWO98/52976に記載される方法を用いて生じた配列変動を有し得る。例えば、CDR内の配列は抗体をMHCクラスIIと結合させ、不要なヘルパーT細胞応答を誘発できることがわかっている。保存的置換は抗体が結合活性を保持するが、不要なT細胞反応を誘発するその能力を失うのを可能にすることができる。任意のこのような保存的または非保存的置換は、当技術分野で認められた方法、例えば、本明細書において他で記載されるものを用いて行うことができ、得られた抗体もまた本発明の方法に使用できる。変異体抗体は、特定の活性、例えば、アンタゴニスト活性、親和性および特異性について本明細書に記載される方法を用いてごく普通に試験できる。
抗CD40治療薬がアンタゴニスト抗CD40抗体である場合には、上記の方法のいずれか、または本明細書に開示されない任意のその他の方法によって製造されたアンタゴニスト抗CD40抗体は、CHIR−12.12またはCHIR−5.9抗体と類似の方法で使用でき、これでは、以下の生物活性のうち少なくとも1つを有する:T細胞によって刺激された正常ヒト末梢B細胞による免疫グロブリン分泌の阻害、ジャーカットT細胞によって刺激された正常ヒト末梢B細胞の生存および/または増殖の阻害、CD40L発現細胞または可溶性CD40リガンド(sCD40L)によって刺激された正常ヒト末梢B細胞の生存および/または増殖の阻害、sCD40Lまたは固相CD40Lによって刺激された任意の細胞における「生存」抗アポトーシス性細胞内シグナルの阻害、sCD40Lまたは固相CD40Lとの連結の際の任意の細胞におけるCD40シグナル伝達の阻害および以下に記載されるようなヒト悪性B細胞の増殖の阻害。このような生物活性のアッセイは、本明細書に、および2003年11月4日、2003年11月26日および2004年4月27日に出願され、それぞれ、米国特許出願第60/517,337号(代理人整理番号PP20107.001(035784/258442))、同60/525,579号(代理人整理番号PP20107.002(035784/271525))および同60/565,710号(代理人整理番号PP20107.003(035784/277214))に割り当てられた「Antagonist Anti−CD40 Monoclonal Antibodies and Methods for Their Use」と題された仮出願および同様に「Antagonist Anti−CD40 Monoclonal Antibodies and Methods for Their Use」と題された、2004年11月4日に出願された国際特許出願PCT/US2004/037152(代理人整理番号PP20107.004(035784/282916))に記載されるように実施できる。なお、これらの各々の内容は参照によりその全文が本明細書に組み込まれる。参照により本明細書に組み込まれる、Schultze et al.(1998)Proc.Natl.Acad.Sci.USA 92:8200−8204、Denton et al.(1998)Pediatr.Transplant.2:6−15、Evans et al.(2000)J.Immunol.164:688−697、Noelle(1998)Agents Actions Suppl.49:17−22、Lederman et al.(1996)Curr.Opin.Hematol.3:77−86、Coligan et al.(1991)Current Protocols in Immunology 13:12、Kwekkeboom et al.(1993)Immunology 79:439−444および米国特許第5,674,492号および同5,847,082号に記載されるアッセイも参照のこと。
本明細書において同定される、CD40抗原エピトープに対して特異的であるアンタゴニスト抗CD40抗体を検出するための代表的なアッセイとして、「競合結合アッセイ」がある。競合結合アッセイは、未知のものが検出され、標識された既知リガンドの、その特異的抗体との結合を阻害するその能力によって定量化される血清学的アッセイである。これは、競合阻害アッセイとも呼ばれる。代表的な競合結合アッセイでは、標識CD40ポリペプチドを、例えば、本発明のモノクローナル抗体の1種以上のエピトープに対するモノクローナル抗体と組合せた、サンプル中の候補抗体によって沈降させる。注目するエピトープと特異的に反応する抗CD40抗体は、CD40タンパク質または注目するCD40タンパク質の特定のエピトープを含むタンパク質の断片に対して調製した一連の抗体をスクリーニングすることによって同定できる。例えば、ヒトCD40については、注目するエピトープとして、ヒトCD40の短いアイソフォーム(配列番号9に示される配列によってコードされる配列番号10に示される、GenBank受託番号NP_690593参照のこと、GenBank受託番号NM_152854も参照のこと)の、またはヒトCD40の長いアイソフォーム(配列番号11に示される配列によってコードされる配列番号12に示される、GeneBank受託番号CAA43045およびNP_001241参照のこと、GenBank受託番号X60592およびNM_001250も参照)の線形および/または非線形アミノ酸残基を含むエピトープが挙げられる。あるいは、これまでに同定された、適したアンタゴニスト抗CD40抗体を用いる競合結合アッセイを用いて、これまでに同定された抗体に匹敵するモノクローナル抗体を選択できる。
このようなイムノアッセイに用いられる抗体は標識されていても、標識されていなくてもよい。標識されていない抗体を凝集に使用でき、標識抗体は、さまざまな標識を用いるさまざまなアッセイにおいて使用できる。抗CD40抗体と注目するエピトープ間の抗体抗原複合体の形成の検出は、検出可能な物質を抗体に結合させることによって容易になり得る。適した検出手段は、放射性核種、酵素、コエンザイム、蛍光物質(fluorescers)、化学発光物質(chemiluminescers)、色原体、酵素基質または補助因子、酵素阻害剤、補欠分子族複合体、フリーラジカル、粒子、色素など標識の使用を含む。適した酵素の例として、西洋ワサビペルオキシダーゼ、アルカリホスファターゼ、β−ガラクトシダーゼまたはアセチルコリンエステラーゼが挙げられ、適した補欠分子族複合体の例として、ストレプトアビジン/ビオチンおよびアビジン/ビオチンが挙げられ、適した蛍光物質の例として、ウンベリフェロン、フルオレセイン、フルオレセインイソチオシアネート、ローダミン、ジクロロトリアジニルアミンフルオレセイン、ダンシルクロリドまたはフィコエリトリンが挙げられ、発光物質の例としてルミノールがあり、生物発光物質の例として、ルシフェラーゼ、ルシフェリンおよびエクオリンが挙げられ、適した放射性物質の例として、125I、131I、35Sまたは3Hが挙げられる。このような標識試薬は、種々の周知のアッセイ、例えば、ラジオイムノアッセイ、酵素イムノアッセイ、例えば、ELISA、蛍光イムノアッセイなどにおいて使用できる。例えば、米国特許第3,766,162号、同3,791,932号、同3,817,837号および同4,233,402号参照のこと。
これまでに記載された抗体はいずれも、例えば、アンタゴニスト抗CD40抗体またはその抗体断片は、本発明の方法において使用する前にコンジュゲートさせることができる。コンジュゲートしている抗体を製造する方法は当技術分野では公知である。したがって、抗体は、間接標識化または間接標識化アプローチを用いて標識できる。「間接標識化」または「間接標識化アプローチ」とは、キレート剤が抗体と共有結合していることおよび少なくとも1種の放射性核種がキレート剤に挿入されていることを意味する。例えば、参照により本明細書に組み込まれるSrivagtava and Mease(1991)Nucl Med.Bio.18:589−603に記載されるキレート化剤および放射性核種を参照のこと。適した標識としては、フルオロフォア、発色団、放射性原子(特に、32Pおよび125I)、電子密度試薬、酵素および特異的結合パートナーを有するリガンドが挙げられる。酵素は、通常、その活性によって検出される。例えば、西洋ワサビペルオキシダーゼは、通常、3,3’、5,5’テトラメチルベンジジン(TMB)を、分光光度計で定量可能な青色色素に変換する能力によって検出される。「特異的結合パートナー」とは、例えば、抗原およびそれに特異的なモノクローナル抗体の場合におけるように、リガンド分子と高い特異性で結合できるタンパク質を指す。その他の特異的結合パートナーとして、ビオチンおよびアビジンまたはストレプトアビジン、IgGおよびプロテインAおよび当技術分野で公知の多数の受容体−リガンド対が挙げられる。同一の標識がいくつかの異なる様式で働く場合があるので、上記の記載は種々の標識を別個のクラスに分類することを意味するものではないということは理解されなくてはならない。例えば、125Iは放射性標識として、または電子密度試薬として働き得る。HRPは酵素としてまたはmAbの抗原として役立ち得る。さらに、種々の標識を所望の効果のために組合せることができる。例えば、mAbおよびアビジンはまた、本発明の実施において標識を必要とし、したがって、mAbをビオチンで標識し、125Iで標識したアビジンを用いて、またはHRPで標識した抗ビオチンmAbを用いてその存在を検出する。その他の順列および可能性は、当業者には容易に明らかとなり、本発明の範囲内の同等物として考慮される。
あるいは、注目する抗体、例えば、抗CD40抗体を「直接標識化」または「直接標識化アプローチ」を用いて標識でき、ここで、放射性核種は共有結合によって(通常、アミノ酸残基を介して)抗体と直接結合されている。好ましい放射性核種はSrivagtava and Mease(1991)前掲において提供されている。関節標識アプローチは特に好ましい。例えば、リンカーが放射線標識を抗体と結合するために用いられている、国際公開公報WO00/52031およびWO00/52473、ならびに参照により本明細書に組み込まれる米国特許第6,015,542号に記載される、抗CD40分子の標識化された形も参照のこと。
抗体の変異体
本発明の方法は、当技術分野で公知の抗体の変異体を用いて実施できる。このような変異体は、親抗体の所望の結合特性を保持する。したがって、例えば、試験される抗CD40治療薬がアンタゴニスト抗CD40抗体である場合、変異体抗体は、親アンタゴニスト抗CD40抗体、例えば、CHIR−12.12またはCHIR−5.9抗体の結合特性を保持する。抗体変異体を作製する方法は、通常、当技術分野で入手可能である。以下の議論はアンタゴニスト抗CD40抗体の変異体を指すが、本方法は注目する任意の抗体、例えば、本明細書に開示されるバイオマーカーまたは臨床的に有用な予後マーカーと特異的に結合する抗体に一般に適用可能である。
例えば、本明細書に記載されるアンタゴニスト抗CD40抗体、例えば、CHIR−5.9またはCHIR−12.12モノクローナル抗体のアミノ酸配列変異体は、注目する抗体をコードするクローニングされたDNA配列における突然変異によって調製できる。突然変異誘発法およびヌクレオチド配列変更方法は、当技術分野で周知である。例えば、参照により本明細書に組み込まれる、Walker and Gaastra、eds.(1983)Techniques in Molecular Biology(MacMillan Publishing Company、New York); Kunkel(1985)Proc.Natl.Acad.Sci.USA 82:488−492; Kunkel et al.(1987)Methods Enzymol.154:367−382; Sambrook et al.(1989)Molecular Cloning:A Laboratory Manual(Cold Spring Harbor、New York); 米国特許第4,873,192号および本明細書に列挙される参照文献を参照のこと。注目するポリペプチドの生体活性に影響を及ぼさない適当なアミノ酸置換に関する指針は、参照により本明細書に組み込まれるDayhoff et al.(1978)in Atlas of Protein Sequence and Structure(Natl.Biomed.Res.Found., Washington、D.C.)のモデルに見ることができる。保存的置換、例えば、あるアミノ酸を類似の特性を有する別のものと交換することが好ましいものであり得る。保存的置換の例として、それだけには限らないが、Gly−Ala、Val−Ile−Leu、Asp−Glu、Lys−Arg、Asn−GlnおよびPhe−Trp−Tyrが挙げられる。
注目する抗体、例えば、注目するアンタゴニスト抗CD40抗体ポリペプチドの変異体の構築では、変異体が所望の活性、すなわち、同様の結合親和性を保持し続けるよう、アンタゴニスト抗CD40抗体の場合には、ヒト細胞の表面に発現されたヒトCD40抗原と特異的に結合でき、顕著なアゴニスト活性がないが、ヒトCD40発現細胞上のCD40抗原と結合している場合にはアンタゴニスト活性を示すよう改変を行う。変異体ポリペプチドをコードするDNA中になされる突然変異はいずれも、リーディングフレーム外に配列を置いてはならないことは明らかであり、二次mRNA構造を生じることができる相補領域が生じないことが好ましい。EP特許出願公開第75,444号参照のこと。
さらに、抗体、例えば、アンタゴニスト抗CD40抗体の定常領域を突然変異させて、いくつかの方法でエフェクター機能を変更することができる。例えば、Fc受容体との抗体結合を最適化するFc突然変異を開示する、米国特許第6,737,056B1号および米国特許出願公開第2004/0132101A1号参照のこと。
参照抗体、例えば、アンタゴニスト抗CD40抗体の変異体は、少なくとも70%または75%の配列同一性を有するアミノ酸配列を有することが好ましく、参照抗体、例えば、アンタゴニスト抗CD40抗体分子、例えば、本明細書に記載されるCHIR−5.9またはCHIR−12.12モノクローナル抗体のアミノ酸配列に対して、または参照抗体分子のより短い部分に対して、少なくとも80%または85%の配列同一性が好ましく、少なくとも90%、91%、92%、93%、94%または95%の配列同一性が最も好ましい。分子が少なくとも96%、97%、98%または99%の配列同一性を共有することがより好ましい。本発明の目的上、パーセント配列同一性は、ギャップオープンペナルティー12およびギャップ伸長ペナルティー2、BLOSUMマトリックス62でアフィンギャップ検索を用いるSmith−Waterman相同性検索アルゴリズムを用いて求められる。Smith−Waterman相同性検索アルゴリズムは、Smith and Waterman(1981)Adv.Appl.Math.2:482−489に教示されている。変異体は、例えば、参照抗体、例えば、アンタゴニスト抗CD40抗体と、わずか1〜15個のアミノ酸残基で、わずか1個〜10個のアミノ酸残基、例えば、6〜10個の、わずか5個の、わずか、4、3、2個または実に1個のアミノ酸残基で異なり得る。
2つのアミノ酸配列の最適アラインメントについては、変異体アミノ酸配列の連続するセグメントが、参照アミノ酸配列に対してさらなるアミノ酸残基またはアミノ酸残基の欠失を有し得る。参照アミノ酸配列との比較に用いられる連続するセグメントは、少なくとも20個の連続するアミノ酸残基を含み、30、40、50またはそれより多いアミノ酸残基であり得る。保存的残基置換またはギャップと関連している配列同一性の補正を行うことができる(Smith−Waterman相同性検索アルゴリズム参照のこと)。治療法
本明細書に記載されるex vivo予後アッセイはまた、CD40発現腫瘍性細胞に関連する癌または前癌状態に対する治療を必要としている被験体のための治療法において使用できる。したがって、いくつかの実施形態では、ex vivo予後アッセイを候補被験体で実施でき、アッセイの結果から抗CD40治療薬を用いる治療の好ましい反応が予測される場合には、その被験体を抗CD40治療薬で治療する。本明細書において先に記載したように、ex vivo予後アッセイから得られた情報は、抗CD40治療薬を用いる治療の利益に関する判定を下すために単独で用いることができる。あるいは、ex vivo予後アッセイは、本明細書において同定される1種以上のCD40関連因子の発現レベル、または発現の有無についてスクリーニングを行う予後アッセイ、特定の癌または前癌状態の1種以上の臨床的に有用な予後マーカーの発現レベル、または発現の有無、例えば、CLLの被験体に関して、臨床的に有用な予後マーカー、例えば、本明細書において上記で同定される、ZAP−70発現レベル、CD38発現レベル、β2ミクログロブリン発現レベル、p53突然変異状態、ATM突然変異状態、染色体17p欠失、および染色体11q欠失についてスクリーニングを行う予後アッセイ、またはその両方と組合せて使用できる。
このように、本発明のex vivo予後アッセイを単独で、または本明細書に記載される他の予後アッセイと組合せて用いて同定された被験体は、候補被験体において疾患の治療のために有益であると、スクリーニング過程において確認された、1種以上の治療上有効な用量の抗CD40治療薬を用いてさらに治療することができる。本明細書において「治療」とは、患者への抗CD40治療薬の適用または投与、あるいは患者が疾患、疾患の症状または疾患になりやすい素因を有する場合の、患者由来の摘出組織または細胞株への抗CD40治療薬の適用または投与であり、その目的は疾患、疾患の症状または疾患になりやすい素因を治療する、癒す、緩和する、軽減する、変化させる、救済する、改善する、好転させるまたは影響を及ぼすことであると定義される。「治療」はまた、患者への抗CD40治療薬を含む薬剤組成物の適用または投与、あるいは疾患、疾患の症状または疾患になりやすい素因を有する患者由来の摘出組織もしくは細胞株への抗CD40治療薬を含む薬剤組成物の適用もしくは投与も意味し、その目的は疾患、疾患の症状または疾患になりやすい素因を、治療する、癒す、緩和する、軽減する、変化させる、救済する、改善する、好転させるまたは影響を及ぼすことである。
「抗腫瘍活性」は、悪性のCD40発現細胞増殖または蓄積の速度の低減、ひいては、既存の腫瘍または治療中に生じる腫瘍の成長速度の低下および/あるいは既存の腫瘍性(腫瘍)細胞または新しく形成された腫瘍性細胞の破壊、ひいては、治療中の腫瘍の全体的な大きさの減少を意味する。本明細書に記載されるex vivo予後アッセイを用いて同定される少なくとも1種の抗CD40治療薬を用いる治療は、ヒトにおいてCD40発現細胞でのCD40シグナル伝達の刺激に関連する癌および前癌状態の治療に対して有益な生理反応を引き起こす。
「治療上有効な用量または量」あるいは「有効な量」とは、投与されるとCD40発現腫瘍性細胞を含む疾患の患者の治療に関して正の治療反応をもたらす抗CD40治療薬の量を意味する。本発明のいくつかの実施形態では、抗CD40治療薬は、アンタゴニスト抗CD40抗体、アンタゴニスト抗CD40L抗体またはその抗原結合性断片であり、抗CD40抗体、抗CD40L抗体またはその断片の治療上有効な用量は、約0.01mg/kg〜約40mg/kg、約0.01mg/kg〜約30mg/kg、約0.1mg/kg〜約30mg/kg、約1mg/kg〜約30mg/kg、約3mg/kg〜約30mg/kg、約3mg/kg〜約25mg/kg、約3mg/kg〜約20mg/kg、約5mg/kg〜約15mg/kg、または約7mg/kg〜約12mg/kgの範囲である。治療の方法は、抗CD40治療薬、例えば、アンタゴニスト抗CD40抗体、アンタゴニスト抗CD40L抗体またはその抗原結合性断片の治療上有効な用量の単回投与または治療上有効な用量の複数回投与を含み得ることは認識される。
いくつかの実施形態では、本発明のex vivo予後アッセイを用いて、特定の抗CD40治療薬を用いる治療に対する反応性または反応性の欠如の生理的根拠を確認することができる。したがって、被験体における癌または前癌状態が、病初では抗CD40治療薬を用いる治療に反応性であり、癌または前癌状態のCD40発現腫瘍性細胞がこの種の治療法に対し耐性を生じる場合、ex vivo予後アッセイを用いて、どのCD40L−CD40相互作用がこれらのCD40発現腫瘍性細胞の不応性の一因となっているのかを明確にすることができる。
CD40Lにより媒介されるCD40シグナル伝達のバイオマーカー、すなわち、アポトーシス、細胞の増殖および生存のバイオマーカー、CD40Lにより媒介されるCD40シグナル伝達のサイトカインマーカーならびに本明細書に記載されるCD40関連因子を、単独またはそのいずれかの組合せで使用し、抗CD40治療薬を用いる治療の有効性をモニターすることもできる。このように、抗CD40治療薬を用いる治療後に、先に抗CD40治療薬を用いる治療の適合性について上記の予後アッセイを用いてスクリーニングされている場合もそうでない場合もある、抗CD40治療薬を用いる治療を受けている被験体を、細胞アポトーシス、細胞増殖および生存および/または1種以上のCD40シグナル伝達経路のうち少なくとも1種のバイオマーカーの発現におけるin vivoの変化をモニターし、場合により、サイトカイン産生をモニターする(抗CD40治療薬の作用様式に応じて)。あるいは、またはさらに、抗CD40治療薬を用いる治療後に、腫瘍性細胞上の細胞表面CD40抗原、腫瘍性細胞上の細胞表面CD40L、CD40の循環レベル、およびCD40L循環レベルからなる群から選択される1種以上のCD40関連因子の発現レベルのin vivoの変化に関して被験体をモニターしてもよい。
このように、第1の生体サンプルは、注目する抗CD40治療薬を用いる治療の前に被験体から採取し、1種以上のこれらのバイオマーカーおよび/またはCD40関連因子の発現レベルについてアッセイし、分析される各因子の発現レベルのベースラインを得る。この第1の生体サンプルは「ベースライン生体サンプル」と呼ぶ。同一組織種または体液の1以上の次の生体サンプルを被験体から採取し、同一バイオマーカーおよび/またはCD40関連因子についてアッセイするが、次の生体サンプルは、注目する抗CD40治療薬の少なくとも1用量の投与後に採取する。モニタリングは、抗CD40治療薬が被験体に投与される任意の所与の治療プロトコールの有効性を確かめるために、単一時点で行ってもよいし、複数時点で行ってもよい。アッセイされているバイオマーカーに応じて、任意の2時点間のバイオマーカーレベルの低下または増大が、癌または前癌状態の治療における抗CD40治療薬の有効性を示す。モニタリングが、1種以上のCD40関連因子の発現レベルの低下を示す場合には、このような結果は癌または前癌状態の治療における抗CD40治療薬の有効性を示す。
したがって、いくつかの実施形態において、CD40Lにより媒介されるCD40シグナル伝達をブロックまたは干渉する抗CD40治療薬を用いる被験体の治療の有効性を、被験体由来のベースライン生体サンプルを得ることと、本明細書において上述される細胞の生存および/またはCD40Lにより媒介されるCD40シグナル伝達経路の1種以上のバイオマーカーの発現レベルを検出することと、被験体に、治療薬、例えば、CHIR−12.12もしくはCHIR−5.9などのアンタゴニスト抗CD40抗体またはその抗原結合性断片の少なくとも1用量を投与することと、例えば、約30分〜約24時間、例えば、約30分〜約12時間、約30分〜約6時間、約30分〜約4時間、および約1時間〜約4時間のうちに被験体から次の生体サンプルを採取することと、次の生体サンプルにおいて細胞生存および/またはCD40Lにより媒介されるCD40シグナル伝達経路のバイオマーカーの発現レベルを検出することとによってモニターし、ベースライン生体サンプル中の発現レベルと比較した、次の生体サンプルにおける発現レベルの低下が、抗CD40治療薬を用いる治療の有効性を示す。検出は、本明細書において他で開示される方法などの、当技術分野で公知の任意の方法を用いて達成できる。いくつかの実施形態では、発現レベルは、ベースライン生体サンプルにおいて検出されたものに対して、少なくとも約5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%または100%低下する。ベースラインからの少なくとも25%のパーセント変化(すなわち、ベースライン生体サンプルに対し少なくとも25%の低下)が、抗CD40治療薬の有効性を示し、中間の反応性は、少なくとも30%または少なくとも40%のパーセント変化により示される。ベースラインからのパーセント変化は少なくとも50%(すなわち、ベースライン生体サンプルに対し少なくとも50%の低下)またはそれより高いことが好ましい。
いくつかの実施形態では、CD40Lにより媒介されるCD40シグナル伝達をブロックまたは干渉する抗CD40治療薬を用いる被験体の治療の有効性を、被験体由来のベースライン生体サンプルを得ることと、本明細書において上述されるCD40Lにより媒介されるCD40シグナル伝達のサイトカインマーカーの発現レベルを検出することと、被験体に、治療薬、例えば、CHIR−12.12もしくはCHIR−5.9などのアンタゴニスト抗CD40抗体またはその抗原結合性断片を少なくとも1用量を投与することと、例えば、投薬後約24時間〜約3週間、例えば、約48時間、約72時間、約1週間または約2週間のうちに被験体から次の生体サンプルを採取することと、次の生体サンプル中の細胞の生存および/またはCD40Lにより媒介されるCD40シグナル伝達経路のバイオマーカーの発現レベルを検出することとよってモニターし、ベースライン生体サンプル中の発現レベルと比較した、次の生体サンプル中の発現レベルの低下が、抗CD40治療薬を用いる治療の有効性を示す。検出は、本明細書において他で開示される方法などの、当技術分野で公知の任意の方法を用いて達成できる。さらに、データを正規化するために、CD40Lにより媒介されるCD40シグナル伝達の影響を受けないサイトカイン(例えば、IL−IbおよびIL−12;本明細書にける、以下の実験の項を参照)を対照として使用できる。いくつかの実施形態では、発現レベルは、ベースライン生体サンプルで検出されたものに対して、少なくとも約5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、または100%低下する。ベースラインからの少なくとも20%(すなわち、ベースライン生体サンプルに対し少なくとも20%の低下)以上のパーセント変化が、抗CD40治療薬の有効性を示す。いくつかの実施形態では、血清または血清抽出物を含むベースライン生体サンプルを、サイトカインマーカーの次の分析のために凍結する。
他の実施形態では、CD40Lにより媒介されるCD40シグナル伝達をブロックもしくは干渉する、またはその作用様式としてADCCを有する抗CD40治療薬を用いる被験体の治療の有効性を、被験体由来のベースライン生体サンプルを得ることと、本明細書に上述されている1種以上のアポトーシスのバイオマーカーの発現レベルを検出することと、被験体に、治療薬、例えば、CHIR−12.12もしくはCHIR−5.9などのアンタゴニスト抗CD40抗体またはその抗原結合性断片の少なくとも1用量を投与することと、例えば、投薬後約8時間、12時間、24時間、36時間、48時間または72時間のうちに、および場合により投与後約1週間、約2週間または約3週間に再度、被験体から次の生体サンプルを採取することと、次の生体サンプル中の、アポトーシスのバイオマーカーの発現レベルを検出することとによってモニターし、ベースライン生体サンプル中の発現レベルと比較した次の生体サンプル中の発現レベルの増大が、抗CD40治療薬を用いる治療の有効性を示す。検出は、本明細書において他で開示される方法などの、当技術分野で公知の任意の方法を用いて達成できる。いくつかの実施形態では、発現レベルは、ベースライン生体サンプルで検出されたものに対して、少なくとも約5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、125%、150%、200%、250%、300%以上増大する。ベースラインからの少なくとも20%(すなわち、ベースライン生体サンプルに対し少なくとも20%の増大)以上のパーセント変化が、抗治療薬の有効性を示す。
さらに他の実施形態では、CD40Lにより媒介されるCD40シグナル伝達をブロックまたは干渉する、ADCCを調節する、またはその両方である抗CD40治療薬を用いる被験体の治療の有効性を、被験体由来のベースライン生体サンプルを得ることと、本明細書に上述されている1種以上のCD40関連因子(すなわち、腫瘍性細胞上の細胞表面CD40および/もしくはCD40L、ならびに/またはsCD40および/もしくはsCD40Lの循環レベル)の発現レベルを検出することと、被験体に、治療薬、例えば、CHIR−12.12もしくはCHIR−5.9などのアンタゴニスト抗CD40抗体またはその抗原結合性断片の少なくとも1用量を投与することと、例えば、約1日(すなわち24時間)、2日、3日、4日、または1週間のうちに被験体から次の生体サンプルを採取することと、CD40関連因子の発現レベルを検出することとによってモニターし、ベースライン生体サンプルの発現レベルと比較した、次の生体サンプルの発現レベルの低下が、抗CD40治療薬を用いる治療の有効性を示す。いくつかの実施形態では、発現レベルは、ベースライン生体サンプルで検出されたものに対して、少なくとも約5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、または100%低下する。
これらのアッセイのいずれか1つまたは組合せを実施し、癌または前癌状態の被験体の、注目する抗CD40治療薬を、その作用様式に応じて用いる治療の有効性をモニターできることは認識される。有効性が証明される場合は、例えば、毎日、隔日、週3回、週2回、週1回、隔週、月1回など、推奨される投与計画に従って、抗CD40治療薬の次の用量を投与できる。あるいは、注目するマーカー(すなわち、細胞の増殖および生存のバイオマーカー、CD40Lにより媒介されるCD40シグナル伝達経路のバイオマーカー、サイトカインマーカー、CD40関連因子ならびにそのいずれかの組合せのin vivo発現レベルを投薬頻度の指針とすることができ、また、投与されるべき治療上有効な用量に関する指標とすることもできる。このように、次の生体サンプルが、注目するそれぞれのマーカーの発現レベルの許容される低下または増大を引き続き示す場合は、それぞれのマーカーの発現レベルがベースライン生体サンプルで観察された発現レベルに近づくような時点まで、抗CD40治療薬を用いるさらなる投与を延長してもよい。一部のバイオマーカーは、治療薬の作用とは独立して変動する可能性があり、また半減期および滞留時間も異なるため、マーカー(すなわち、アポトーシス、細胞の生存、CD40シグナル伝達経路のバイオマーカー、サイトカインマーカーおよび/またはCD40関連因子)の発現レベルを投薬頻度の指針として用いる場合は、少なくとも2回の連続測定(例えば、24〜48時間以内に)を考慮することが好ましい。
これらのアッセイ結果が、1種以上の細胞の生存のバイオマーカー、1種以上のCD40シグナル伝達経路のバイオマーカーおよび/または1種以上のCD40関連因子の発現の低下、ならびに、1種以上の細胞アポトーシスのマーカーの発現の増大に関して、CD40Lにより媒介されるCD40シグナル伝達の望ましいダウンレギュレーションを引き続き示す場合は、抗CD40治療薬を用いるさらなる治療が正当化される。本明細書において上述したように、治療の有効性を経時的にモニターすることを考慮するために治療期間にわたってさまざまな時間間隔で生体サンプルを採取し、治療を継続すべきかやめるべきかを決定することができる。
以下の実施例は、例示の目的で示されるものであって、限定を注目するものではない。
実験
緒言
以下の実施例で使用されるアンタゴニスト抗CD40抗体は、CHIR−5.9およびCHlR−12.12である。CHIR−5.9およびCHIR−12.12抗CD40抗体は、ヒトIgG1重鎖遺伝子座およびヒトκ軽鎖遺伝子座を有しているトランスジェニックマウス(ゼノマウス(登録商標)技術(Abgenix; Fremont、California))を免疫化することにより作製されたヒトIgG1サブタイプ抗ヒトCD40モノクローナル抗体(mAbs)である。CD40細胞外ドメインを発現するSF9昆虫細胞を免疫原として使用した。
手短には、Boer et al.(1988) J.Immunol.Meth.113:143により先に記載されたように、免疫化したマウス由来の脾臓細胞を、SP2/0またはP3x63Ag8.653マウス骨髄腫細胞と10:1の割合で50%ポリエチレングリコールを用いて融合させた。ヒポキサンチン(0.1mM)、アミノプテリン(0.01mM)、チミジン(0.016mM)および0.5ng/mlのhIL−6(Genzyme、Cambridge、Massachusetts)を補給した完全IMDM培地中に融合細胞を再懸濁した。次いで、各ウェルに平均して1つの増殖ハイブリドーマが含まれるように、この融合細胞を96ウェル組織培養プレートのウェルに分配した。
10〜14日後、特異的抗体の生成についてハイブリドーマ集団の上清をスクリーニングした。ハイブリドーマクローンによる特異的抗体の生成のスクリーニングのために、各ウェルの上清をプールし、最初にELISAにより抗CD40活性特異性の検査を行った。次いで、陽性であったものを標準FACSアッセイを用いるEBVトランスフォームB細胞の蛍光細胞染色に使用した。陽性ハイブリドーマ細胞を、0.5ng/mlのhIL−6を含有するIMDM/FBSでの制限希釈により2回クローニングした。
合計で31のマウス脾臓をマウス骨髄腫SP2/0細胞と融合させ、ELISAにおいて組換えCD40を認識する895の抗体を作製した。Abgenix ゼノマウス(登録商標)技術(Abgenix; Fremont、California)を用いて作製されるハイブリドーマの、平均して約10%が、ヒトκ鎖の代わりにマウスλ軽鎖を含み得る。マウスλ軽鎖を含む抗体を選び出した。細胞表面CD40への結合も示す260の抗体サブセットをさらなる分析のために選択した。一連のサブクローニング手順の間に選択された安定なハイブリドーマを、結合および機能分析におけるさらなる特性決定のために使用した。選択方法のさらなる詳細に関しては、2003年11月4日、2003年11月26日、および2004年4月27日に出願され、それぞれ、米国特許出願第60/517,337号(代理人整理番号PP20107.001(035784/258442))、同60/525,579号(代理人整理番号PP20107.002(035784/271525))、および同60/565,710号(代理人整理番号PP20107.003(035784/277214))に割り当てられた、「Antagonist Anti−CD40 Monoclonal Antibodies and Methods for Their Use」と題された同時係属仮出願および同様に「Antagonist Anti−CD40 Monoclonal Antibodies and Methods for Their Use」と題された、2004年11月4日に出願され、WO2005/044854として公開された国際特許出願PCT/US2004/037152(代理人整理番号PP20107.004(035784/282916))を参照のこと。なお、それぞれの内容は、参照によりその全文が本明細書に組み込まれる。
7つの他のハイブリドーマ由来のクローンが、アンタゴニスト活性を有することが確認された。それらの相対的アンタゴニスト効果およびADCC活性に基づいて、2つのハイブリドーマクローンをさらなる評価のために選択した(以下の表1)。それらを131.2F8.5.9(5.9)および153.8E2.D10.D6.12.12(12.12)と名付けた。
マウスハイブリドーマ系統131.2F8.5.9(CMCC番号12047)およびハイブリドーマ系統153.8E2.D10.D6.12.12(CMCC番号12056)は、American Type Culture Collection(ATCC;10801 University Blvd.、Manassas、Virginia 20110−2209 (USA))に、それぞれ特許寄託番号PTA−5542およびPTA−5543で寄託されている。
候補抗体の可変領域をコードしているcDNAを、PCRにより増幅し、クローニングし、配列決定した。CHIR−12.12抗体の軽鎖および重鎖のアミノ酸配列は、配列番号2(mAb CHIR−12.12の軽鎖)および配列番号4(mAb CHIR−12.12の重鎖)に示されている。mAb CHIR−12.12の重鎖の変異体は配列番号5に示されており、これは配列番号4の153位でアラニン残基の代わりにセリン残基を有するという点で、配列番号4とは異なっている。CHIR−12.12抗体の軽鎖および重鎖をコードしているヌクレオチド配列は、配列番号1(mAb CHIR−12.12の軽鎖のコード配列)および配列番号3(mAb CHIR−12.12の重鎖のコード配列)に示されている。CHIR−5.9抗体の軽鎖および重鎖のアミノ酸配列は、配列番号6(mAb CHIR−5.9の軽鎖)および配列番号7(mAb CHIR−5.9の重鎖)に示されている。mAb CHIR−5.9の重鎖の変異体は配列番号8に示されており、配列番号7の158位でアラニン残基の代わりにセリン残基を有するという点で、配列番号7とは異なっている。
無関係のハイブリドーマ由来の抗体に関して予想されるように、相補性決定領域(CDR)のヌクレオチド配列はかなり変化に富んでいる。VHのCDR3領域の多様性は、抗体特異性を最も大きく左右すると考えられている。
FACS分析により示されるように、CHIR−5.9およびCHIR−12.12はヒトCD40と特異的に結合し、CD40−リガンド結合を阻止することができる。両mAbとも、細胞表面CD40と先に結合していたCD40−リガンドと競合して除去することができる。CHIR−5.9のヒトCD40に対する結合親和性は1.2×10−8Mであり、CHIR−12.12のヒトCD40に対する結合親和性は5×10−10Mである。CHIR−12.12およびCHIR−5.9モノクローナル抗体は強力なアンタゴニストであり、in vitroで正常B細胞のCD40リガンドにより媒介される増殖を阻害し、さらにin vitroでNHLおよびCLL患者由来の癌細胞のCD40リガンドにより媒介される増殖を阻害する。CHIR−12.12モノクローナル抗体は、正常ヒトBリンパ球において、CD40リガンド(CD40L)により媒介される生存およびシグナル伝達経路を直接阻害する。In vitroでは、両抗体とも、NHL患者由来の原発性癌細胞を、ADCCによって死滅させた。異種移殖ヒトリンパ腫モデルでは、用量依存性の抗腫瘍活性が見られた。これらの結果およびそれらを得るために用いたアッセイの、より詳細な説明に関しては、2003年11月4日、2003年11月26日、および2004年4月27日に出願され、それぞれ、米国特許出願第60/517,337号(代理人整理番号PP20107.001(035784/258442))、同60/525,579号(代理人整理番号PP20107.002(035784/271525))、および同60/565,710号(代理人整理番号PP20107.003(035784/277214))に割り当てられた、「Antagonist Anti−CD40 Monoclonal Antibodies and Methods for Their Use」と題された仮出願および同様に「Antagonist Anti−CD40 Monoclonal Antibodies and Methods for Their Use」と題された、2004年11月4日に出願された国際特許出願PCT/US2004/037152(代理人整理番号PP20107.004(035784/282916))を参照のこと。なお、それぞれの内容は、参照によりその全文が本明細書に組み込まれる。
実施例1:CHIR−12.12はヒトB−CLL細胞においてCD40Lにより媒介されるCD40の生存およびシグナル伝達経路をブロックする
以下に説明する研究は、CHIR−12.12もまた、B−CLLにおけるCD40リガンド(CD40L)により媒介される生存およびシグナル伝達経路を直接阻害することを実証する。CD40Lは、Bリンパ球を活性化し、様々な機能的反応、例えば、生存の増強ならびにNFkB、ERK/MAPK、およびPI3K/Aktシグナル伝達経路の活性化を誘発する。さらに、CD40L刺激は、PARPの切断の減少および抗アポトーシスタンパク質、Bcl−xl、XIAPおよびcIAPの誘導により示される生存シグナルをもたらす。これとは対照的に、CD40Lにより刺激されたB−CLLのCHIR−12.12での処理は、時間および用量依存的な切断されたカスパーゼ−3および切断されたPARPの誘導ならびにBcl−xl、XIAP、およびcIAPの減少を引き起こした。CD40Lの刺激なしに、CHIR−12.12単独ではアポトーシスを引き起こさなかった。本発明者らは、リガンドによるCD40活性化によって誘発されるシグナル伝達事象を検討した。CD40とCD40リガンドとの結合は、NFκB、ERK/MAPK、p38およびPI3K/Aktシグナル伝達経路など、複数のシグナル伝達経路の活性化をもたらした。CHIR−12.12処理は、CD40Lにより媒介される、IκBキナーゼ(IKK)αおよびβ(NFκB経路)、ERKならびにAktのリン酸化を阻害した。本発明者らは、PI3K(LY294002)およびMEK(PD98595)の薬理学的阻害剤を用いて、CLL細胞の生存が少なくともある程度はPI3K/Akt経路に依存していることを示した。CD40Lにより刺激されたCLL細胞のCHIR−12.12処理はまた、サイクリンD1も阻害した。これらの結果は、CHIR−12.12が、B−CLLにおいてCD40Lにより媒介される生存および複数のシグナル伝達経路、例えば、NFκB、ERKおよびPI3K/Aktをブロックしたことを実証する。
完全ヒトアンタゴニスト抗CD40モノクローナル抗体であるCHIR−12.12は、上述のようにゼノマウス(登録商標)マウス(Abgenix, Inc.)において作製した。B−CLL細胞を購入し(Cureline, Inc.; South San Francisco, CA)、CD40リガンドにより媒介される生存およびシグナル伝達経路に対する抗CD40抗体CHIR−12.12の効果を評価するためにin vitro実験を行った。これらの実験では、NFκB、ERK、およびAkt経路を検討した。
B−CLL細胞においてCHIR−12.12処理は、CD40リガンドにより媒介される生存を阻害する
これらの実験では、1μg/mlのsCD40L(Alexis Corporation, Bingham, Nottinghamshire, UK)を用いて、1.0×106個の患者から得たB−CLL細胞を刺激した。次いで、CHIR−12.12(10μg/ml)および対照IgGを加えた。CHIR−12.12処理後24時間に、細胞を回収した。アポトーシスのバイオマーカーである切断されたPARP、生存のバイオマーカーである、Bcl−x1、Bcl−2およびcIAP1を、これらのバイオマーカーに特異的な市販の抗体を用いるウエスタンブロット解析によって、細胞溶解物において検出した。
図1で示されるように、CHIR−12.12を用いる処理は、2人の患者(4番および21番)由来のB−CLL細胞サンプルにおいて切断されたPARPの誘導ならびにBcl−x1、XIAPおよびcIAP1の減少をもたらした。対照とCHIR−12.12処理細胞との間で、Bcl−2およびTRAILレベルの変化はなかった。
30番の患者から得たB−CLL細胞のウエスタンブロット解析を図2に示す。対照IgG処理群と比較して、CHIR−12.12処理は、切断されたPARPの発現を誘導し、XIAPおよびBcl−2発現を減少させた。
31番の患者から得たB−CLL細胞のウエスタンブロット解析を図3に示す。対照IgG処理群と比較して、CHIR−12.12処理は、切断されたPARPの発現を誘導し、サイクリンD1およびBcl−x1発現を減少させた。
CHIR−12.12処理は、B−CLLにおいてCD40リガンドにより媒介されるNFκB、ERK、PI3/Aktおよびp38MAPKシグナル伝達経路を阻害する
これらの実験では、1μg/mlのsCD40L(Alexis Corporation, Bingham, Nottinghamshire, UK)を用いて、1.0×106個の患者由来のB−CLL細胞を刺激した。次いで、CHIR−12.12(10μg/ml)および対照IgGを加えた。0分および20分に細胞を回収した。ウエスタンブロットにより、細胞溶解物において、リン酸化IKKα(Serl80)およびIKKβ(Ser181)(p−IKKα/β;NFκB経路)、リン酸化ERK(p−ERK)、リン酸化Akt(p−Akt)およびリン酸化p38MAPK(p−p38)を検出した。
図4に示されるように、sCD40Lは、対照IgG処理B−CLL細胞において20分以内にIKKα/β、ERK、およびAktのリン酸化を刺激し、また、CHIR−12.12処理B−CLL細胞では、IKKα/β、ERKおよびAktのリン酸化の有意な阻害があった。興味深いことに、これらのB−CLL患者サンプルでは、恒常的に活性化されたp38MAPKが存在し、CHIR−12.12はp38MAPKの活性化を有意には阻害しなかった。
B−CLL細胞におけるCD40リガンドにより媒介される生存に対するCHIR12.12の用量依存効果
これらの実験では、1μg/mlのsCD40L(Alexis Corp., Bingham, Nottinghamshire, UK)を用いて、1.0×106個の患者由来のB−CLL細胞を刺激した。次いで、CHIR−12.12(0、0.01、0.1、1.0、10、および20μg/ml)および対照IgGを加えた。22〜24時間に細胞を回収した。切断されたPARP、カスパーゼ−3およびBcl−x1に対する抗体を用い、細胞溶解物でウエスタンブロット解析を行った。同等のローディングおよびトランスファー効率を検出するために、β−アクチンに対する抗体を用いた。
図5および6で示されるように、sCD40Lにより刺激されたB−CLL細胞のCHIR−12.12での処理は、0.01μg/mlという低用量で用量依存的な、切断されたPARPおよびカスパーゼ−3の誘導ならびにBcl−x1の減少をもたらした。
B−CLL細胞では、アポトーシスに対するCHIR−12.12の効果は、CD40L刺激が無ければ現れない
この実験では、CD40Lで刺激していない、1.0×106個の患者由来のB−CLL細胞を、CHIR−12.12(10μg/ml)または対照IgGで処理した。1、4および24時間に細胞を回収した。切断されたPARP(アポトーシスタンパク質)およびXIAP(抗アポトーシスタンパク質)に対する抗体を用い、細胞溶解物でウエスタンブロット解析を行った。
図7に示された結果は、CD40リガンド刺激がB−CLL細胞の生存に必要であり、CHIR−12.12単独ではB−CLL細胞のさらなるアポトーシスを誘発しなかったことを示す。
CLL細胞の生存に必要なシグナル伝達経路
PI3K阻害剤(LY294002; Sigma, St.Louis, Missouri)およびMEK阻害剤(PD98595;Cell Signaling Technology, Beverly, MA)を用い、CLL細胞の生存に必要な経路を精査した。これらの実験では、1.0×106個の患者由来のB−CLL細胞を1%FBS含有培地中で4時間、血清飢餓培養した。次いで、血清飢餓細胞をLY294002(PI3K阻害剤、30μM)またはPD98595(MEK阻害剤、10μM)を用いて前処理した。次いで、CD40L刺激前および刺激後20分に細胞溶解物を回収した。p−IKKα/β、p−ERK、p−Aktに対する抗体を用いるウエスタンブロット解析を行い、総ERKおよびβ−アクチンに対する抗体を探索することにより同等のローディングを評価した。
図8に示されるように、予想通り、PD98595はCD40L処理により誘発されたERKの活性化を阻害し、LY294002はCD40L処理により誘発されたAktの活性化を阻害した。いずれの阻害剤によってもIKK/NFκBの活性化に変化は起こらなかった。
しかし、PI3阻害剤であるLY294002で処理されたB−CLL細胞のみが、切断されたPARPおよびカスパーゼ−3の誘導ならびに抗アポトーシスタンパク質であるBcl−x1の減少を示した(図9)。MEK阻害剤であるPD98595では、CD40Lにより媒介される生存に変化は無かった。このことは、B−CLL細胞の生存はPI3K/Aktシグナル伝達経路によって媒介されているという知見を支持する。
フローサイトメトリー分析を用いて、CHIR−12.12処理は、B−CLL患者の細胞においてCD40リガンドにより媒介される生存を阻害する
この実験では、1μg/mlのsCD40L(Alexis Corp., Bingham, Nottinghamshire, UK)を用いて、0.4×106個の患者由来のB−CLL細胞を刺激した。次いで、CHIR12.12(10μg/ml)または対照IgGを加えた。CHIR−12.12処理後24時間に細胞を回収した。固定および透過処理後に、切断されたPARPおよびTUNEL法のために細胞を染色した。
CHIR12.12を用いて処理された細胞のフローサイトメトリー分析が図10および11に示されている。アポトーシスを評価するために、切断されたPARPおよびTUNEL法を用いた。sCD40Lの不在下で、細胞を24時間培養した後、細胞はアポトーシスのサインを示し始め、切断されたPARPおよびTUNELに対する細胞の染色結果は陽性となった。sCD40Lの添加は、これら2つのマーカーに対して陽性に染色される細胞の割合の低下を引き起こした。CHIR−12.12をsCD40Lと共に加えた場合、切断されたPARPまたはTUNELについて陽性細胞の割合は、sCD40L刺激が無い場合にみられるレベルに戻った。このことは、sCD40Lにより誘導される生存が、CHIR−12.12の添加により阻害されることを示している。
B−CLL細胞における、CD40リガンドにより媒介されるシグナル伝達事象に対するCHIR−12.12処理の転写物レベルでの効果
B−CLL細胞においてCHIR−12.12がどのように転写調節を媒介するかを調べるために、CHIR−12.12を経時的に用いた。この実験では、IgG1(10μg/mL)またはCHIR−12.12(10μg/mL)およびsCD40Lを用いて、1.0×106個の患者由来のB−CLL細胞を同時に処理した。細胞ペレットを0時間(CD40Lなし)、1、4および24時間に回収し、最後に同時に溶解させた。RNeasyキットを用いてRNAを単離し、ABI RTキットを用いてcDNAを調製した。各セットのオリゴのTM値に基づき、2つの別々の反応において示された遺伝子を用いてツーステップRT−PCRを行った。
IgG1対照サンプルと比較した場合に、様々な遺伝子が特定の時点においてCHIR−12.12により媒介される転写の変化を示した(図12)。CD40、CD40L、VEGF、TRAF2およびTRAF3はすべてRNA発現の阻害を示し、TRAF6およびMcl−1はわずかなダウンレギュレーションを示した。IL−6は転写の変化を示さなかった。
B−CLL細胞において、CHIR−12.12処理はCD40リガンドにより媒介されるp38MAPKシグナル伝達を阻害する
CD40シグナル伝達におけるp38MAPK経路の役割を精査するために、p38MAPK阻害剤(SB203580)およびCHIR−12.12を、4時間および24時間の2つの異なる時点で使用した。4時間の実験では、1ウェルあたりおよそ0.8×106個のB−CLL細胞を1%FBS含有培地中で4時間、血清飢餓培養した。細胞は、SB203580(30および60μM)ならびにCHIR−12.12(10μg/mL)を用いて前処理した。CD40L刺激前および刺激20分後に細胞溶解物を回収した。示された特異的タンパク質に対する抗体を用いるウエスタンブロット解析を行い、総p38(t−p38)およびβ−アクチンに対する抗体を探索することにより同等のローディングを評価した。
24時間の実験では、1ウェルあたりおよそ0.8×106個のB−CLL細胞を、完全血清(10%FBS)含有培地中に24時間入れた。細胞は、SB203580(30および60μM)またはCHIR−12.12(10μg/mL)のいずれかを用いて同時に24時間、前処理し、CD40Lで刺激した。示された特異的タンパク質に対する抗体を用いるウエスタンブロット解析を行い、β−アクチンに対する抗体を探索することにより同等のローディングを評価した。
図13は、この患者ではp38は恒常的にリン酸化されていなかったことを示すが、しかしながら、恒常的活性は患者間で変化するものであった。CD40Lによるその活性化は、4時間では、SB203580阻害剤によってわずかに阻害され、CHIR−12.12により完全に阻害された。CD40Lによるホスホ−IKKα/β活性化もまた、CHIR12.12により阻害された。
図14で示されるように、切断されたPARPはSB203580およびCHIR.12.12両方により顕著に誘導され、それによって、CD40Lにより媒介される刺激を阻害したが、切断されたカスパーゼ−3はより少ない程度にしか誘導されなかった。Bcl−x1の発現もまた、特に60μMのSB203580の濃度および10μg/mlのCHIR−12.12でブロックされ、p38のリン酸化は、4時間の実験において見られたと同様に、ブロックされた。CD40の発現もまた、CHIR−12.12によって阻害された。
図15は、p38の基礎リン酸化状態が、試験されたCLL患者サンプルの間で異なることを示す。基礎p−p38活性の低い患者は、基礎発現が高い患者よりも、CD40L刺激によりリン酸化がより強く誘導される。CHIR−12.12は、その基礎レベルの高低にかかわらず基礎リン酸化にまでp−p38レベルを低下させた。
実施例2:抗CD40mAbCHIR−12.12の、抗体依存性細胞媒介性細胞傷害(ADCC)により多発性骨髄腫(MM)細胞株を溶解させる能力
ヒトMM細胞株、KMS−12−BM、IM−9およびARH−77を、R2培地(2%FBSを含むフェノールレッド不含RPMI)を用いて3回洗浄し、R10培地(10%FBSを含むフェノールレッド不含RPMI)に1×106個/mLの密度で再懸濁した。カルセインAM(終濃度5mM)を加えて5%CO2の加湿雰囲気中37℃で30分間インキュベートすることにより、細胞を標識した。精製ヒトNK細胞およびカルセイン標識された標的細胞を、R10培地に10対1の割合で混合し(200mL中5×104個のNK細胞および5×103個の標的細胞)、U底の96ウェルプレート(Packard’s Instrument, Meriden, CT)中に加えた。CHIR−12.12を所望の濃度に段階希釈し、NK/標的細胞混合物を含むウェル中に3連で加えた。細胞溶解を最大にするために1%NP−40を3つのウェルに加えた。5%CO2の加湿雰囲気中37℃で4時間、かく乱することなく細胞をインキュベートした。次いで、このプレートを300rpmでブレーキをかけずに5分間遠心分離した。上清100mLを新しい96ウェルプレートに移した。上清中に放出されたカルセインを、励起485nmにて、放出535nmにて、Tecan SpectraFluor Plus (Tecan U.S., Inc.,Research Triangle,NC)を用いて任意蛍光単位(AFU)で測定した。特異的な溶解のパーセントは以下のように計算した:100×(AFU試験−AFU自然放出)/(AFU最大放出−AFU自然放出)。
抗体濃度の対数に対して特異的溶解パーセントをプロットすることにより、各細胞株のED50を求めた(図16参照)。KMS−12−BM細胞に対するCHIR−12.12のED50は17.9mMであり、IM−9細胞に対するCHIR−12.12のED50は5.9pMであり、ARH−77細胞に対するCHIR−12.12のED50は23.9pMであった。
実施例3:多発性骨髄腫動物モデルにおけるCHIR−12.12の抗腫瘍活性
CHIR−12.12は、合計3用量について週1回腹膜内投与(i.p.)された場合、いくつかの腫瘍モデルにおいて多発性骨髄腫の腫瘍の成長を用量依存的に有意に阻害した。CHIR−12.12とボルテゾミブ(ベルケード(登録商標))を組合せた場合、観察された有効性は相加的なものであった。
IM−9多発性骨髄腫異種移殖モデル
SCIDマウスの皮下に、マウス一匹あたり50%MATRIGEL(登録商標)中、5×106個のIM−9腫瘍細胞(CD40およびCD20両方を発現するヒト多発性骨髄腫細胞株)を接種した。第1の研究では、腫瘍移植後5、12および18日に、腫瘍担持マウスに10mg/kgの対照IgG1、1mg/kgのCHIR−12.12抗CD40mAb、または10mg/kgのCHIR−12.12抗CD40mAbを腹膜内注射した。あるいは、腫瘍移植後5、8、12および15日に1mg/kgのボルテゾミブ投与を静脈内に行った。第2の研究では、腫瘍担持マウスに、1mg/kgの対照IgG1を腹膜内に、1mg/kgのCHIR−12.12抗CD40mAbを腹膜内に、または1mg/kgのボルテゾミブを静脈内に注射した。抗体の投与は腫瘍移植後8、14および21日に行ったのに対し、ボルテゾミブの投薬は腫瘍移植後8、11、14および18日に行った。あるいは、腫瘍担持マウスに、腫瘍移植後8、14および21日に1mg/kgのCHIR−12.12抗CD40mAbを腹膜内に、さらに腫瘍移植後8、11、14および18日に1mg/kgのボルテゾミブを静脈内注射した。データは、ログランク検定を用いて分析した。
1および10mg/kgのCHIR−12.12の投与は、腫瘍移植後15、18および21日において腫瘍の成長を阻害した(図17参照)。ボルテゾミブも、腫瘍移植後5、8、12および15日に1mg/kgを投与された場合に、腫瘍移植後15、18、および21日において腫瘍の成長を阻害した(図17参照)。第2の研究では、1mg/kgのボルテゾミブは統計学的に有意な成長阻害を示さなかった。CHIR−12.12(1mg/kg)を最大耐量のボルテゾミブと組合せて投与した場合、腫瘍容積の減少が13、16、20、23、および26日に観察された(図18参照)。
要約すると、抗CD40mAbの投与は、CHIR−12.12の週1回の1mg/kgおよび10mg/kgで、実験的多発性骨髄腫モデルにおいて腫瘍の成長を阻害した。腫瘍成長阻害としては境界線の活性を示した1mg/kgの週2回でのボルテゾミブの投与は、ひとつの実験では統計学的に有意であり(図17)、第2の研究では有意ではなかった(図18)。さらに、CHIR−12.12とボルテゾミブ治療の組合せることによって、腫瘍成長阻害が増強された。これらのデータは、抗CD40mAb CHIR−12.12は強力な抗腫瘍活性を有し、単独または他の化学療法薬との組合せのいずれかで多発性骨髄腫の治療にとって臨床的に有効である可能性があることを示唆する。
CHIR−12.12はIM−9異種移植片において増殖速度を低減し、細胞死を増加させる
CHIR−12.12を皮下IM−9異種移殖モデルにおいて試験した際に、CHIR−12.12単回投与後5日に組織学的検査を行った。CHIR−12.12治療はKi67+増殖細胞数を有意に減少させ、2種のアポトーシスマーカーである、切断されたカスパーゼ3および切断されたPARPのレベルを増加させたが、これはCHIR−12.12治療によりもたらされた細胞増殖阻害および細胞死の誘導を実証している。
CHIR−12.12は病期分類されていないまたは病期分類された同所性(静脈内投与)IM−9異種移殖モデルの生存を延長する
SCIDマウスの皮下に、マウス一匹あたり50%MATRIGEL(商標)中5×106個のIM−9腫瘍細胞(CD40およびCD20両方を発現するヒト多発性骨髄腫細胞株)を接種した。病期分類されていないモデルでは、腫瘍移植後1日から治療を開始した。腫瘍担持マウスに10mg/kgの対照IgG1または0.1mg/kg、1mg/kgもしくは10mg/kgの抗CD40mAb CHIR−12.12を週1回腹膜内注射した。あるいは、腫瘍担持マウスに0.5mg/kgまたは1mg/kgのボルテゾミブを週1回静脈内注射した。データは、ログランク検定を用いて分析した。
病期分類されていない条件の生存モデルでは、CHIR−12.12は腫瘍担持マウスの生存を延長した(図20)。病期分類されたモデルでは、腫瘍細胞移植後7日から治療を開始した。腫瘍担持マウスに1mg/kgの対照IgG1または0.1mg/kg、1mg/kg、または10mg/kgの抗CD40mAb CHIR−12.12を週1回腹膜内注射した。あるいは、腫瘍担持マウスに0.5mg/kgのボルテゾミブを静脈内注射した。データは、ログランク検定を用いて分析した。この病期分類された同所性モデルでも、CHIR−12.12は腫瘍担持マウスの生存を延長した(図21)。
CHIR−12.12はヒトKMS−12−BM皮下異種移殖モデルの成長を阻害する
メスのSCIDマウスを、腫瘍細胞移植の1日前に3Gyの照射で治療した。移植の日、細胞を50%matrigel中5×107個細胞/mlの濃度に調製した。細胞を、5×106細胞/100μl/マウスで右脇腹の皮下に移植した。腫瘍容積が100〜200mm3に達した時に、マウスを無作為化して10mg/kgのIgG1アイソタイプ対照抗体、1mg/kgまたは10mg/kgの抗CD40抗体CHIR−12.12または1mg/kgのボルテゾミブのいずれかで治療した。抗体は、週1回、4週間にわたって腹膜内投与した。ボルテゾミブは、週2回、2週間にわたって静脈内投与した。
原発腫瘍の成長は、細胞移植後42日においてCHIR−12.12投与により用量依存的に阻害された。KMS−12−BMの腫瘍容積は1mg/kgおよび10mg/kg群でそれぞれ32%(P>0.05,分散分析と、それに続くテューキー多重比較検定)および35%(P<0.05)減少していた。ボルテゾミブは1mg/kgの最大耐量で腫瘍容積の減少が22%(P>0.05)であり、阻害傾向のみを示した。
実施例4:CD40+細胞における、CD40リガンドにより誘導されるサイトカイン分泌の評価
CD40は、B細胞性悪性腫瘍において高度に発現される。リガンドによるCD40の刺激は、正常および悪性B細胞に対して生存および増殖シグナルをもたらす。アンタゴニスト抗CD40抗体CHIR−12.12は、ヒト末梢血リンパ球の増殖は誘導しないが、CD40Lにより誘導されるリンパ球の増殖を阻害する。CD40シグナル伝達はまた、細胞がさまざまなサイトカインを産生するように誘導する。本実施例では、CHIR−12.12の、正常B細胞および原発性患者CLL細胞によるサイトカイン産生調節能を調べた。
細胞(ウェルあたり1×105細胞)を、96ウェルプレート中でCD40Lの存在下または不在下で培養した(CD40をトランスフェクトした、ホルムアルデヒドで固定したCHO細胞、ウェルあたり2×105個細胞)。細胞をhuIgG1(対照)または10μg/mlのCHIR−12.12と共に37℃で24時間インキュベートし、上清を回収した。hIL−6、hIL−8、hIL−10、TNF−α、hGM−CSF、hIL−1b、hIL−12p70、MCP−1およびMIP−1βの産生を、Meso Scale Discovery(登録商標)マルチ−アレイシステム(Meso Scale Discovery,Gaithersburg,Maryland)により測定した。
CD40Lの不在下でCHIR−12.12のみと共に培養した細胞は、バックグラウンドレベルを超えるサイトカインをいずれも産生しなかったことは、CHIR−12.12がサイトカイン産生に対してアゴニスト活性を持っていないことを示唆している。その一方で、CD40Lは正常B細胞において、hIL−10、hTNF−α、hIL−8、hIL−6、MCP−1およびMIP−1βの産生を誘導した(n=3)(表2)。これらの培養物へのCHIR−12.12の添加は、すべてのサイトカインの産生を阻害した(表3参照)。
CLL患者の細胞を用いる予備実験では、CHIR−12.12はCD40Lにより誘導されるhIL−10、hGM−CSF、hTNF−α、hIL−8およびMCP−1(n=1)の産生を阻害した(表4対表5)。
同時に、これらのデータはCHIR−12.12がCD40リガンドにより媒介される生存、増殖、およびサイトカイン産生の強力なアンタゴニストであることを示す。
CD40の結合はまた、正常細胞(Melter et al.(2000) Blood 96(12):3801−3808)および腫瘍性細胞(Farahani et al (2005) Leukemia 19(4):524−530; Tai et al.(2005) Cancer Res.65(13):5898−5906)においてVEGFの発現も誘導し得る。VEGFは多発性骨髄腫の細胞では、細胞の成長および遊走を促進し(Podar et al.(2001) Blood 98(2):428−435)、CLL細胞では細胞生存を促進する(Farahani et al.(2005),前掲)ことがわかっている。そのようなものとして、VEGFレベルの変化は、CD40Lにより媒介されるCD40シグナル伝達の有用なサイトカインマーカーを提供し得る。VEGFは分泌タンパク質であるため、VEGFタンパク質発現の変化は、ウエスタンブロットまたはELISAなどの技術を用いて細胞培養上清において、または患者血液サンプルから得た血漿において容易に検出できる。あるいは、ノーザンブロットまたは定量的RT−PCRなど、いくつかの技術のいずれかを用いて、腫瘍細胞から得られたmRNAから検出することができる。
もうひとつの実験において、正常B細胞およびCLL患者から得られたCLL細胞における、CD40Lにより誘導されるVEGFの産生を、上述の方法に類似した方法で検討した。CHIR−12.12のこれらの細胞培養物への添加は、CD40Lにより誘導されるVEGFの産生を阻害することがわかった。
実施例5:バイオマーカーおよび予後指標
本発明の方法において使用されるex vivo予後アッセイおよびさらなる予後アッセイは、その成熟タンパク質配列およびヌクレオチド配列が当技術分野で公知の、バイオマーカーの発現レベルについて生体サンプルをスクリーニングすることを必要とする。例えば、以下の表3に示される情報を参照のこと。これらのバイオマーカーを検出するためのプローブは、タンパク質(例えば、抗体プローブ)または核酸レベル(例えば、PCRプローブ)のいずれであっても、この配列情報に基づいて設計することができ、また、そのプローブは本明細書で開示された配列の変異体を検出するように設計できることは認識される。
実施例6:抗CD40治療薬のアンタゴニスト活性についてのアッセイ
以下に示すアッセイは、抗CD40抗体のアンタゴニスト活性を評価するために使用できる。これらのアッセイのためのヒトB細胞は、基本的にDe Groot et al.(1990) Lymphokine Research (1990) 9:321に記載のとおり、例えば扁桃摘出術を受けている個人から採取した扁桃腺からの単離により得ることができる。手短には、手術用メスの刃を用いて組織を分散させ、食細胞およびNK細胞は5mMのL−ロイシンメチルエステルを用いた処理により枯渇させ、T細胞は、臭化2−アミノエチルイソチオウロニウムを用いて処理したヒツジ赤血球(SRBC)を用いる1サイクルのロゼット形成により除去する。得られたBリンパ球調製物の純度は、抗(CD20)mAb B1(Coulter Clone,Hialeah,FA)または抗(CD3)mAb OKT3(Ortho,Raritan,NJ)およびウサギ抗(マウスIg)のFITCコンジュゲートF(ab’)
2断片(Zymed,San Francisco,CA)を用いる間接免疫蛍光標識、およびFACS分析によりチェックすることができる。
B細胞増殖アッセイ
B細胞(ウェルあたり4×10
4個)を、平底96ウェルマイクロタイタープレートにおいて、10%ウシ胎児血清を補給した200μlのIMDM中で培養する。B細胞は、固定化抗(IgM)抗体(イムノビーズ;5μg/ml;BioRad,Richmond,California)を加えることにより刺激する。所望により、100U/mlの組換えIL−2を加える。微小培養の開始時に様々な濃度の試験モノクローナル抗体(mAb)を加え、3日目に、18時間のパルシング後の(
3H)−チミジンの取り込みを測定することにより増殖を評価する。
アンタゴニスト抗CD40抗体は、固定化抗IgM存在下または固定化抗IgMおよびIL−2存在下で、ヒトB細胞の増殖を有意に共刺激しない。
バンチェロー様B細胞の増殖アッセイ
Banchereau et al.(1991) Science (1991) 251:70により記載されたものに類似した培養系中で、抗CD40モノクローナル抗体がB細胞の増殖を刺激する能力を試験するために、ヒトFcγRIIのHR対立遺伝子型を発現するマウス3T6形質転換体細胞を使用する。B細胞(ウェルあたり2×104個)を、平底マイクロウェルにおいて、1×104個の形質転換体細胞(5000Radを照射)存在下、10%ウシ胎児血清および100U/mlの組換えIL−4を補給した200μlのIMDM中で培養する。B細胞を加える前に、3T6細胞を培養プラスチックへ少なくとも5時間付着させる。抗CD40mAbを、15ng/ml〜2000ng/mlの様々な濃度で加え、7日目に、[3H]チミジンと共に18時間パルシングしてチミジン取り込みを測定することによりB細胞の増殖を評価する。
アンタゴニスト抗CD40mAb、S2C6により刺激されたB細胞の増殖の阻害
アンタゴニスト抗CD40モノクローナル抗体(mAb)はまた、上記のB細胞増殖アッセイを用いて、S2C6(SGN−14としても知られ、正常B細胞増殖のCD40刺激のアゴニストとして報告されている;Francisco et al.(2000) Cancer Res.60:3225−3231)などの抗CD40抗体によるB細胞増殖の刺激を阻害する能力によっても特徴づけることができる。ヒト扁桃腺のB細胞(ウェルあたり4×104個)を、セファロースビーズと結合している抗IgM(5μg/ml)および抗CD40mAb S2C6(1.25μg/ml)の存在下、マイクロウェルにおいて200μlで培養する。3日後に、様々な濃度の、注目する抗CD40mAbを加え、[3H]−チミジンの取り込みを評価する。対照として、抗(グルコセレブロシダーゼ)mAb 8E4を同様の濃度で加えることができる。Barneveld et al.(1983) Eur.J.Biochem.134:585。アンタゴニスト抗CD40抗体は、抗IgM誘導ヒトB細胞増殖のmAb S2C6による共刺激を、例えば、少なくとも75%以上阻害できる(すなわち、アンタゴニスト抗CD40抗体存在下でS2C6により刺激された増殖は、アンタゴニスト抗CD40抗体の不在下で観察されたもののせいぜい25%である)。その一方で、β−グルコセレブロシダーゼに対する同じ量の非関連mAb 8E4では有意な阻害は見られないであろう。Barneveld et al.,前掲。このような結果は、抗CD40mAbはヒトB細胞の増殖のための刺激性のシグナルは伝えないが、しかし、逆に、別のmAbによるCD40誘発によってもたらされる刺激性シグナルを阻害できることを示す。
EL4B5細胞を用いるB細胞の活性化アッセイ
Zubler et al.(1985) J.Immunol.(1985) 134:3662は、EL4B5として知られているマウス胸腺腫EL−4細胞株の変異株サブクローンが、in vitroにおいてネズミおよびヒト起源両方のB細胞を免疫グロブリン分泌形質細胞へと増殖および分化するよう強力に刺激できることを観察した。この活性化は、抗原依存性であり、MHC制限されないことがわかった。ヒトB細胞の最適な刺激のためには、活性化されたヒトT細胞由来の上清の存在が必要であるが、B細胞の反応はまた、EL4B5細胞がホルボール−12−ミリスチン酸13−アセテート(PMA)またはIL−1でプレ活性化された場合にも起こった。Zubler et al.(1987) Immunological Reviews 99:281およびZhang et al.(1990) J.Immunol.144:2955。この培養系におけるB細胞の活性化は効率的である−制限希釈実験から、ヒトB細胞の大多数が抗体分泌細胞へと増殖および分化するように活性化され得ることがわかった。Wen et al.(1987) Eur.J.Immunol.17:887.
B細胞(ウェルあたり1000個)を、放射線を照射した(5000Rad)EL4B5細胞(ウェルあたり5×104個)と共に、平底マイクロタイタープレートにおいて、10%熱不活性化ウシ胎児血清、5ng/mlホルボール−12−ミリスチン酸13−アセテート(Sigma)および5%ヒトT細胞上清を補給した、200μlのIMDM中で培養する。培養開始時に様々な濃度のmAbを加え、6日目に[3H]−チミジンと共に18時間パルシングした後にチミジン取り込みを評価する。T細胞上清調製のためには、精製されたT細胞を106個/mlの密度で1μg/mlのPHAおよび10ng/mlのPMA存在下で36時間培養する。Wen et al.(1987) Eur.J.Immunol.(1987) 17:887。T細胞上清は、細胞の遠心分離によって得、−20℃で保存する。EL4B5−B細胞培養物中での、ヒトB細胞の増殖促進におけるT細胞上清の有効性を試験し、最も有効な上清を実験で使用するためにプールする。EL4B5誘発ヒトB細胞増殖に対する抗CD40抗体の効果を評価する場合、MOPC−141(IgG2b)などのモノクローナル抗体を対照として加えることができる。
アンタゴニスト抗CD40抗体は、EL4B5細胞株により刺激されたB細胞増殖を、例えば、少なくとも75%以上阻害することができる(すなわち、アンタゴニスト抗CD40抗体存在下でのEL4B5誘導B細胞増殖は、アンタゴニスト抗CD40抗体の不在下で観察されたものの25%にすぎない)。その一方で、MOPC−141などの対照抗体は、EL4B5誘導B細胞増殖に対して有意な効果を持たない。
B細胞による抗体産生に対するヒトT細胞のヘルパーアッセイ
アンタゴニスト抗CD40抗体は、B細胞による免疫グロブリン産生のアンタゴニストとして機能できる。抗CD40抗体は、この種のアンタゴニスト活性について、T細胞ヘルパーアッセイにおいて、活性化されたT細胞との接触に依存して刺激されたB細胞による免疫グロブリン産生を阻害する抗体の能力を評価することにより試験することができる。このように、96ウェル組織培養プレートを抗CD3mAb CLB−T3/3(CLB,Amsterdam,The Netherlands)の腹水の1:500希釈液で被覆する。示されるように、共刺激性mAbを加える:抗CD2mAb CLB−T11.1/1およびCLB−T11.2/1(CLB,Amsterdam,The Netherlands)、共に腹水1:1000および抗CD28mAb CLB−28/1(CLB,Amsterdam,The Netherlands)。続いて、扁桃のT細胞(3000Rad照射;ウェルあたり105個)、扁桃のB細胞(ウェルあたり104個)、およびrIL−2(20U/ml)を加える。各細胞培養物の最終容量は200μlとする。8日後、細胞を遠心して沈降させ、細胞を含まない上清を回収した。(希釈された)サンプル中のヒトIgMおよびIgGの濃度を、以下に記載されるようにELISAにより推定する。
一実施形態では、抗CD3 mAbおよびT細胞を共刺激するための別のmAb使用または不使用で被覆した96ウェルプレート中で、ヒト扁桃のB細胞(104個/ウェル)を、放射線照射し精製したT細胞(3000rad、105個/ウェル)と共に培養する。8日間の培養後、B細胞による免疫グロブリン産生測定のために上清を回収する。B細胞による免疫グロブリン産生は、以下に記載されるELISAアッセイにより評価する。注目する抗CD40抗体を、培養開始時から、様々な濃度で加える。対照として、mAb MOPC−141を加えることができる。
アンタゴニスト抗CD40抗体は、ヒトT細胞により刺激されたB細胞のIgGおよびIgM抗体産生を、少なくとも50%あるいはそれ以上阻害できる(すなわち、アンタゴニスト抗CD40抗体存在下でのT細胞により誘導されるB細胞の抗体産生は、アンタゴニスト抗CD40抗体不在下で観察されたものの50%にすぎない)。その一方で、MOPC−141などの対照抗体は、T細胞により誘導されるB細胞の抗体産生に対し、有意な効果を持たない。
免疫グロブリン定量のためのELISAアッセイ
ヒトIgMおよびIgGの濃度は、ELISAにより推定する。0.05M炭酸塩バッファー(pH=9.6)中、4μg/mlのマウス抗ヒトIgGmAb MH16−01(CLB,Amsterdam,The Netherlands)または1.2μg/mlのマウス抗ヒトIgM mAb4102(Tago,Burlingame,CA)を用いて、4℃で16時間インキュベートすることにより、96ウェルELISAプレートを被覆する。プレートを、PBS−0.05%Tween−20(PBS−Tween)を用いて3回洗浄し、BSAで1時間飽和させる。2回の洗浄後、試験サンプルの様々な希釈液とともにプレートを37℃で1時間インキュベートする。3回の洗浄後、1μg/mlのペルオキシダーゼ標識マウス抗ヒトIgG mAb MH16−01(CLB)またはマウス抗ヒトIgM mAb MH15−01(CLB)とともに37℃で1時間インキュベートすることにより、結合しているIgを検出する。プレートを4回洗浄し、基質としてO−フェニレンジアミンを加えることにより、結合しているペルオキシダーゼ活性を示す。各アッセイに対して標準曲線を作成するためにヒト標準血清(H00,CLB)を用いる。
実施例7:正常B細胞およびB慢性リンパ性白血病細胞における、CD40リガンドにより媒介されるCD40シグナル伝達に対するCHIR−12.12の効果の比較
CD40リガンド(CD40L)によるCD40の活性化は、正常Bリンパ球の生存、増殖および分化を調節できる。B細胞では、CD40の結合は、腫瘍壊死因子受容体関連因子(TRAF)との結合と、それに続く、細胞の増殖および生存に関与する多数の下流シグナル伝達経路の活性化を引き起こす。この経路の活性化は、ex vivoで示すことができ、培養正常B細胞へのCD40Lの添加はそれらの生存および増殖を促進する。CD40Lは、培養正常B細胞におけるその活性と同様に、患者サンプルから得られたB慢性リンパ性白血病(CLL)細胞の生存および増殖を促進し、この経路は薬理学的介入に反応する。
以下に記載する追加研究は、正常ヒトB細胞およびヒトB−CLL細胞において、CD40Lにより媒介されるCD40生存およびシグナル伝達経路に対するCHIR−12.12モノクローナル抗体の効果をさらに特徴決定するために行った。これらの研究では、上記に概説された所見が裏付けられた。したがって、CHIR−12.12処理は、CD40LのCD40との結合をブロックし、正常ヒトB細胞および原発性B−CLL細胞のCD40Lにより誘導される増殖/生存を阻害した。CD40Lにより媒介される生存は、アポトーシスマーカーであるcPARPレベルの減少および抗アポトーシスタンパク質Mcl−1およびBcl−x1の誘導に関連していた。さらに、CD40Lにより誘導される生存は、Akt、p38MAPK、ERK、ならびにIκBキナーゼ(IKK)αおよびβのリン酸化に関連していた。その一方で、CD40Lにより刺激された原発性B−CLL細胞のCHIR−12.12処理は、ex vivoでこれらの抗アポトーシスタンパク質の発現および下流のシグナル伝達タンパク質のリン酸化を阻害し、最終的にはB−CLL細胞のアポトーシスを引き起こした。本研究で分析されたCLLサンプルの大多数は、CD40L刺激および抗体阻害に対して反応性であるように見えた。不応性であった少数のCLLサンプルは、これらのサンプルにおけるその不応性の原因となる経路を同定するために調査中である。
正常ヒトB細胞においてCHIR−12.12処理はCD40リガンドにより媒介されるCD40生存およびシグナル伝達経路をブロックする
正常ヒトB細胞を、MACS B細胞単離キットII(Miltenyi Biotech INC,Auburn,CA)を用いて陰性選択により末梢血から精製し、10μg/mlのCHIR−12.12またはアイソタイプ対照hgG1の存在下で、2μg/mlの組換えヒト可溶性CD40L(rhsCD40L)添加あるいは非添加で24時間培養した。細胞を溶解し、全細胞溶解物を、ヒトcPARP、Mcl−1、Bcl−x1、p−Aktおよびp−p38MAPKに特異的な抗体を用いて、SDS−PAGEおよびウエスタンブロッティングにより分離した。すべてのメンブレンをストリップにし、必要に応じてβ−アクチンまたはAKTまたはp38MAPK総タンパク質のいずれかについて再び探索した。結果は図23に示されている。
正常B細胞のCD40L刺激は、アポトーシスマーカー(cPARP)のレベルを低下させ、抗アポトーシスマーカー(Mcl−1、Bcl−x1)の発現を増加させ、シグナル伝達マーカー(p−Akt、p−p38)のリン酸化を活性化した。CHIR−12.12処理は、正常B細胞に対するこれらのCD40Lにより媒介される効果をブロックし、これらの細胞のアポトーシスを引き起こした。
B−CLL細胞における、CD40リガンドにより媒介される生存およびシグナル伝達経路に対するCHIR−12.12による処理の効果
B−CLL細胞における、生存およびシグナル伝達経路に対するCHIR−12.12の効果をさらに評価するために、クエン酸ナトリウムを含むVacutainer(登録商標)CPT(商標)細胞調製試験管(BD Biosciences,San Jose,CA)を用いてCLL患者の末梢血からPBMCを単離し、CD5、CD19およびCD40(マウス抗ヒトCD5−PerCP Cy5.5(BD Biosciences,San Jose,CA)、マウス抗ヒトCD19−PE(Ancell,Bayport,MN)およびFITC−標識マウス抗ヒトCD40抗体(FITC−CHIR−12.12,Chiron Corporation,Emeryville,CA))について染色し、固定し、そしてフローサイトメトリーにより分析した。患者およびPBMC発現の特性は表8に要約されている。
B−CLL細胞において、CHIR−12.12処理はCD40リガンドにより媒介される生存経路をブロックする
PBMC(2連のウェルでの50,000個/ウェル)を、96ウェル組織培養プレート(Corning Costar,Corning,NY)において、RPMI+10%FCS中、pen/strep単独または2μg/mlのrhsCD40L+4μg/mlのCD40Lエンハンサー存在下、10μg/mlのCHIR−12.12または対照ヒトIgG1のいずれかと共に接種した。細胞のATPを測定し、相対発光量(RLU)として表すCellTiter−Glo(登録商標)発光細胞生存力キット(Promega,Madison,WI)を用いて、細胞の生存力を72時間後に測定した。ブロックパーセントは、以下のように計算した:
培養24時間後にフローサイトメトリーによるcPARP分析を行った。細胞をFACSLysisバッファー(BD Biosciences)を用いて処理し、凍結した。1%ホルムアルデヒド中で45分間固定した後、細胞を洗浄してPE−コンジュゲートマウス抗ヒトCD19と共に室温(RT)にて30分間インキュベートした。次いで、70%エタノールを用いて氷上で30分間、細胞を透過処理し、ウサギ抗ヒトcPARP抗体またはアイソタイプ対照ウサギIgGをPerCP−Cy5.5標識マウス抗ヒトCD5と共に用いて、室温にて30分間染色した。続いて、ヤギ抗ウサギIgG−AlexaFluor647と共に室温にて30分間インキュベーションし、1%ホルムアルデヒドで固定して、フローサイトメトリーにより分析した。ブロックパーセントは、以下のように計算した:
培養B−CLL細胞において、CD40Lを用いる刺激は、生存を促進し/アポトーシスを防ぐことができ、これらの効果はCHIR−12.12によりブロックされ得る(図24)。CellTiter−Gloアッセイでは7/7サンプル、cPARPフローサイトメトリーアッセイでは6/7サンプルにおいて、CD40LはB−CLL細胞の生存を促進し、いずれの場合にも、これらの効果はCHIR−12.12によりブロックされた(表9)。
抗アポトーシスタンパク質の発現に対するCHIR−12.12処理の効果
PBMC単離後、2×10
6個細胞/mlを、図24に示されているデータに関して上述されたように培養した。全細胞溶解物は、RIPA溶解バッファー(1×リン酸緩衝生理食塩水中、1%NonidetP−40、0.5%デオキシコール酸ナトリウム、0.1%ドデシル硫酸ナトリウム、pH7.2)中で調製した。サンプルあたり10〜20μgのタンパク質を、10%Tris−グリシンゲル上で分離し、ニトロセルロースメンブレンへトランスファーし、ヒトcPARP、Mcl−1、またはBcl−x1に特異的なmAbを用いてメンブレンを探索した。このメンブレンをストリップにし、β−アクチンに関して再び探索し、ECLを用いて発現させた。結果は図25に示されている。原発性B−CLL細胞において、CHIR−12.12処理は、CD40Lにより媒介されるcPARPレベルの低下およびCD40Lにより媒介されるMcl−1およびBcl−x1発現の増大をブロックした。
B−CLL細胞における、CD40リガンドにより媒介されるシグナル伝達経路に対するCHIR−12.12処理の効果
AKTおよびp38MAPKシグナル伝達経路におけるCD40リガンドにより媒介されるシグナル伝達に対するCHIR−12.12の効果を、B−CLL細胞について評価した。リン酸化されたAkt(p−Akt)を評価するために、PBMCを、図24に示されているデータに関して上述されたように培養した。p38MAPKを検出するために、前述の条件を用い、インキュベーションの最後20分にrhsCD40Lを加え、細胞を3時間培養した。図25に示されているデータに関して上述されたように、細胞を処理した。ヒトp−Aktおよびp−p38MAPKに特異的なモノクローナル抗体を用いて、得られたメンブレンを探索し、これをAKTおよびp38総タンパク質に関してそれぞれ再び探索した。結果は図26に示されている。一部のサンプルにおいては、CD40LはAKTのリン酸化を刺激するようには見えなかったものの、いくつかのサンプルではCD40LはAKT経路を活性化し、CHIR−12.12はこの効果をブロックした。未処理細胞におけるp38MAPKのリン酸化レベルは様々であったものの、rhsCD40Lを用いる処理はp38MAPKのリン酸化を促進し、CHIR−12.12はこの効果をブロックした。
IKKα/βおよびERK1/2に対する、rhsCD40LおよびCHIR−12.12の効果を評価するために、図26のp38の検出に関して上述されたようにPBMCを培養し、処理した。ヒトp−IKKα/βおよびp−ERKに特異的なモノクローナル抗体を用いて、得られたメンブレンを探索した。結果は図27に示されている。B−CLL細胞において、CHIR−12.12処理は、IKKα/βおよびERK1/2の、CD40Lにより誘導されるリン酸化を阻害した。
要約
正常Bリンパ球は、培養に置かれると、自発的アポトーシスを起こすが、これはCD40Lを培養物に加えることにより食い止めることができる。本明細書に記載されている研究では、正常Bリンパ球へのCD40Lの添加は、結果としてMcl−1およびBcl−x1などの生存タンパク質のアップレギュレーションを引き起こし、AKTおよびp38経路を活性化した。慢性リンパ性白血病患者サンプルから得られたB−CLL細胞は、記載されたアッセイにおいてCD40Lに対し同様の反応性を示した。さらに、CD40LはB−CLL細胞においてIKKαおよびβならびにERK1/2のリン酸化を刺激した。これらの経路はB細胞生存のために重要であることがわかっており、またB−CLL細胞のジスレギュレートされた(disregulated)生存の一因である可能性があるため、B−CLL細胞においてこれらの経路を評価した。CD40L刺激に対し反応性を有する正常B細胞およびB−CLL細胞サンプル双方において、記載されたそれぞれの効果は、アンタゴニスト抗CD40抗体、CHIR−12.12によりブロックすることができた。
前述の説明および関連する図面に示される教示の利益を有する、本明細書において示された、本発明の多くの改変および他の実施形態は、これらの発明が関わる技術分野の当業者ならば思いつくであろう。したがって、本発明は開示された特定の実施形態に制限されるべきではないこと、ならびに、改変および他の実施形態は添付の特許請求の範囲の範囲内に含まれるよう意図されることは理解されなくてはならない。本明細書において、具体的な用語が使用されているが、それらは一般的、説明的な意味のみで用いられており、制限のために用いられるものではない。
明細書中で言及されたすべての刊行物および特許出願は、本発明が関わる技術分野の当業者のレベルを示す。すべての刊行物および特許出願は、個々の刊行物または特許出願が各々、具体的にかつ個別に参照により本明細書に組み込まれると示されるかのように、参照により本明細書に組み込まれる。