RU2442606C2 - Применение анти-cd40-антител - Google Patents
Применение анти-cd40-антител Download PDFInfo
- Publication number
- RU2442606C2 RU2442606C2 RU2008121899/15A RU2008121899A RU2442606C2 RU 2442606 C2 RU2442606 C2 RU 2442606C2 RU 2008121899/15 A RU2008121899/15 A RU 2008121899/15A RU 2008121899 A RU2008121899 A RU 2008121899A RU 2442606 C2 RU2442606 C2 RU 2442606C2
- Authority
- RU
- Russia
- Prior art keywords
- antibody
- seq
- monoclonal antibody
- cells
- disease
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2878—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/04—Drugs for disorders of the muscular or neuromuscular system for myasthenia gravis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2887—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against CD20
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/732—Antibody-dependent cellular cytotoxicity [ADCC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/77—Internalization into the cell
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Immunology (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biophysics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Diabetes (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Physical Education & Sports Medicine (AREA)
- Rheumatology (AREA)
- Hematology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Ophthalmology & Optometry (AREA)
- Microbiology (AREA)
- Hospice & Palliative Care (AREA)
- Obesity (AREA)
- Transplantation (AREA)
- Endocrinology (AREA)
- Emergency Medicine (AREA)
- Psychiatry (AREA)
- Dermatology (AREA)
- Pain & Pain Management (AREA)
- Mycology (AREA)
Abstract
Группа изобретений относится к медицине, а именно к иммунологии, и может быть использована при лечении воспалительных или аутоиммунных заболеваний, ассоциированных с CD40-экспрессирующими клетками у пациента, гетерозиготного или гомозиготного в отношении FcγRIIIa-158F (генотип V/F или F/F). Лекарственные средства по изобретению включают варианты моноклонального антитела против CD40, которое связывается с эпитопом, способным связывать моноклональное антитело CHIR-12.12. Способы по изобретению включают идентификацию пациента-человека, страдающего воспалительным или аутоиммунным заболеванием, подлежащего лечению антителом против CD40 и не поддающегося лечению ритуксимабом, путем определения генотипа FcγRIIIa-158 (V/V, V/F или F/F) с использованием биологического образца, полученного у этого пациента-человека. Использование изобретений позволяет лечить воспалительные или аутоиммунные заболевания, не поддающиеся лечению ритуксимабом. 4 н. и 37 з.п. ф-лы, 1 табл., 14 ил.
Description
Настоящее изобретение относится к новым способам применения анти-CD40-антител, в частности к способам лечения воспалительных и аутоиммунных заболеваний, ассоциированных с CD40-экспрессирующими клетками.
Предшествующий уровень техники
Многие члены семейства лигандов, к которому принадлежит фактор некроза опухоли (TNF), и их соответствующие рецепторы регулируют рост нормальных клеток посредством индуцирования апоптоза либо способствуют увеличению продолжительности жизни клеток и усилению их пролиферации. То есть между апоптотическими сигналами и сигналами выживаемости и пролиферации клеток существует определенный баланс, благодаря которому поддерживается нормальный клеточный гомеостаз. В настоящее время было идентифицировано по меньшей мере 26 рецепторов для лигандов семейства TNF и 18 лигандов этого семейства. Биологически активные формы этих рецепторов и лигандов представляют собой тримерные белки, способные к самосборке. Были идентифицированы трансмембранные и растворимые формы этих рецепторов и лигандов. Внутриклеточные домены указанных рецепторов не имеют гомологичных последовательностей, но их внеклеточные домены содержат цистеин-богатые повторы, состоящие из 40 аминокислот. Их цитоплазматические концы передают сигналы посредством взаимодействия с двумя главными группами внутриклеточных белков: факторами, ассоциированными с рецепторами TNF (TRAF), и белками, содержащими домен “гибели” (DD). Взаимодействие между по меньшей мере шестью человеческими TRAF и TRAF-связывающими сайтами на цитоплазматическом хвосте некоторых из этих рецепторов приводит к инициации нескольких путей передачи сигнала, включая AKT (сериновой/треониновой киназы, называемой протеинкиназой В или РВК), нуклеарный фактор-kB (NF-kB) и активируемые митогеном протеинкиназы (MAPK). См., например, публикацию Younes and Kadin (2003) J. Clin. Oncol. 18:3526-3534.
Член CD40 семейства TNF-рецепторов представляет собой антиген клеточной поверхности, имеющий массу 50-55 кДа и присутствующий на поверхности нормальных и опухолевых человеческих В-клеток, дендритных клеток, моноцитов, макрофагов, CD8+-Т-клеток, эндотелиальных клеток, а также моноцитарных и эпителиальных клеток. Антиген CD40 также экспрессируется на активированных Т-клетках, активированных тромбоцитах, воспалительных клетках сосудистых гладких мышц, эозинофилах, синовиальных мембранах при ревматоидном артрите, фибробластах дермы и других нелимфоидных клетках. В зависимости от типа CD40-экспрессирующих клеток, слияние этих клеток может индуцировать межклеточную адгезию, дифференцировку, активацию и пролиферацию. Так, например, связывание CD40 с его когнатным лигандом, CD40L (также называемым CD154), стимулирует пролиферацию B-клеток и их дифференцировку в плазматические клетки, вырабатывание антител, переключение изотипов и продуцирование В-клеток памяти. В процессе дифференцировки В-клеток CD40 экспрессируется на пре-B-клетках, но после дифференцировки эти клетки превращаются в плазматические клетки.
Лиганд CD40 (CD40L), также известный как CD154, представляет собой трансмембранный белок размером 32-33 кДа, который также существует в двух менее крупных биологически активных растворимых формах, 18 кДа и 31 кДа, соответственно (Graf et al. (1995) Eur. J. Immunol. 25:1749-1754; Mazzei et al. (1995) J. Biol. Chem. 270:7025-7028; Pietravalle et al. (1996) J. Biol. Chem. 271:5965-5967). CD40L экспрессируется на активированных, но не на покоящихся CD4+-Т-хелперных клетках (Lane et al. (1992) Eur. J. Immunol. 22:2573-2578; Spriggs et al. (1992) J. Exp. Med. 176:1543-1550; и Roy et al. (1993) J. Immunol. 151 :1-14). CD40 и CD40L были клонированы и охарактеризованы (Stamenkovi et al. (1989) EMBO J. 8:1403-1410; Armitage et al. (1992) Nature 357:80-82; Lederman et al. (1992) J. Exp. Med. 175:1091-1101; и Hollenbaugh et al. (1992) EMBO J. 11:4313-4321). См. также патент США № 5945513, в котором описан человеческий CD40L. Клетки, трансфицированные геном CD40L и экспрессирующие белок CD40L на своей поверхности, могут инициировать пролиферацию В-клеток, а вместе с другими стимулирующими сигналами они могут индуцировать вырабатывание антител (Armitage et al. (1992) выше; и патент США № 5945513). Пациенты с аутоиммунным заболеванием имеют повышенные уровни растворимого CD40L (sCD40L) в сыворотке, тогда как у здоровых пациентов они не наблюдаются. У животных-грызунов, используемых в качестве моделей, сверхэкспрессия CD40L приводит к развитию аутоиммунного заболевания, аналогичного системной красной волчанке (Higuchi et al. (2002) J. Immunol. 168:9-12). В противоположность этому, отсутствие функционального CD40L на активированных T-клетках приводит к развитию X-связанного гипер-IgM-синдрома (Allen et al (1993) Science 259:990; и Korthauer et al. (1993) Nature 361: 539). Кроме того, блокирование взаимодействия CD40/CD40L может предотвращать отторжение трансплантата у приматов-моделей, не являющихся человеком. См., например, Wee et al. (1992) Transplantation 53:501-7.
Экспрессия CD40 на АПК играет важную ко-стимулирующую роль в активации этих клеток. Так, например, было показано, что моноклональные анти-CD40-антитела-агонисты (mAb) имитируют действие хелперных Т-клеток, направленное на активацию В-клеток. При презентации на адгезивных клетках, экспрессирующих FcγRII, эти антитела индуцируют пролиферацию В-клеток (Banchereau et al. (1989) Science 251:70). Кроме того, анти-CD40 mAb-агонисты могут имитировать действие хелперных Т-клеток, направленное на передачу сигнала секреции IgM, IgG и IgE в присутствии IL-4 (Gascan et al. (1991) J. Immunol. 147:8). Кроме того, анти-CD40 mAb-агонисты могут предотвращать запрограммированную гибель (апоптоз) В-клеток, выделенных из лимфоузлов.
Эти и другие наблюдения подтверждают существующую теорию, основанную на предположении, что взаимодействие CD40 с CD40L играет ведущую роль в регуляции гуморального и клеточно-опосредованного иммунного ответа. Последние исследования выявили, что взаимодействие CD40/CD40L играет гораздо более широкую роль в различных физиологических и патологических процессах.
Пути передачи CD40-сигнала зависят от координированной регуляции многих внутриклеточных факторов. Подобно другим членам семейства TNF-рецепторов, CD40 активируют TRAF, включая TRAF-2, -3, -5 и -6, которые стимулируют различные пути передачи сигналов после контактирования CD40 с CD40L (с мембраносвязанным CD40L или с растворимым CD40L), включая внеклеточную активируемую сигналом киназу (ERK), амино-концевую киназу c-jun (JNK), p38 MAPK и NF-kB (см., например, Younes and Carbone (1999) Int. J. Biol. Markers 14:135-143; van Kooten and Banchereau (2000) J. Leukoc. Biol. 67:2-17).
Было показано, что передача сигнала посредством CD40 приводит к предупреждению гибели клеток в результате апоптоза (Makus et al. (2002) J. Immunol. 14:973-982). Апоптотические сигналы необходимы для индуцирования запрограммированной гибели в координированных путях передачи сигнала. Сигналы гибели клеток могут включать природные факторы, присутствующие в клетках, такие как фактор разрушения эндоплазматического ретикулума, или внешние факторы, такие как рецептор, связывающийся с FasL или TNFα. Такой путь передачи сигнала является сложным и включает активацию каспаз, таких как каспаза-3 и каспаза-9, и поли-(ADP-рибозо)-полимераза (PARP). В процессе осуществления каскада реакций происходит ингибирование белков, передающих антиапоптотический сигнал, таких как mcl-1 и bcl-x, а также членов семейства белков IAP, таких как X-связанный ингибитор апоптоза (XIAP) (Budihardjo et al. (1999) Annu. Rev. Cell. Dev. Biol. 15:269-290). Так, например, в дендритных клетках CD40-опосредуемая передача сигнала может блокировать сигналы апоптоза, трансдуцированные FasL (Bjorck et al. (1997) Intl. Immunol. 9:365-372).
Таким образом, взаимодействие CD40 с CD40L и последующая активация передачи сигнала CD40 представляют собой стадии, необходимые для продуцирования нормальных иммунных ответов, однако нарушение регуляции CD40 может приводить к развитию заболевания. Было обнаружено, что путь передачи сигнала CD40 участвует в развитии аутоиммунного заболевания (Ichikawa et al. (2002) J. Immunol. 169:2781-2787 и Moore et al. (2002) J. Autoimmun. 19:139-145). Кроме того, взаимодействие CD40/CD40L играет важную роль в развитии воспалительных процессов. Так, например, CD40 и CD40L сверхэкспрессируются в организме человека и в экспериментальных участках, пораженных атеросклерозом. Стимуляция CD40 индуцирует экспрессию матрикс-разлагающих ферментов и экспрессию тканевого фактора в ассоциированных с атеромой клетках, таких как эндотелиальные клетки, клетки гладких мышц и макрофаги. Кроме того, стимуляция CD40 индуцирует продуцирование провоспалительных цитокинов, таких как IL-1, IL-6 и IL-8, и адгезивных молекул, таких как ICAM-1, E-селектин и VCAM. Ингибирование взаимодействия CD40/CD40L предупреждает атерогенез у животных-моделей. У моделей с трансплантатом блокирование взаимодействия CD40/CD40L предотвращает воспаление. Было обнаружено, что связывание CD40/CD40L вместе с действием амилоидного пептида-бета, вызывающим болезнь Альцгеймера, является синергическим и стимулирует активацию макрофагов, что приводит к нейротоксичности.
У пациентов с ревматоидным артритом (РА) в хондроцитах суставов наблюдается повышенный уровень экспрессии CD40, и, таким образом, передача CD40-сигнала, вероятно, играет определенную роль в продуцировании цитокинов и металлопротеиназ матрикса, которые оказывают разрушающее действие. См., Gotoh et al. (2004) J. Rheumatol. 31 :1506-1512. Кроме того, было показано, что амплификация синовиального воспалительного ответа происходит в результате активации MAPK и NF-kB посредством присоединения CD40 к синовиальным CD14+-клеткам у пациентов с РА (Harigai et al. (2004) Arthritis. Rheum. 50:2167-2177). В экспериментальной модели РА обработка анти-CD40L антителом предупреждает индуцирование этого заболевания, воспаление суставов и продуцирование антител против коллагена (Durie et al. (1993) Science 261:1328-1330). И, наконец, клинические испытания показали, что истощение CD20+-B-клеток у пациентов с РА путем введения им ритуксана® (обычно применяемого для лечения В-клеточной лимфомы) приводит к ослаблению симптомов заболевания (Shaw et al. (2003) Ann. Rheum. Dis. 62(Suppl. 2):ii55-ii59).
Было также показано, что блокирование взаимодействий CD40/CD40L во время презентации антигена Т-клеткам индуцирует Т-клеточную толерантность. Поэтому блокирование взаимодействия CD40/CD40L предупреждает начальную активацию Т-клеток, а также индуцирует длительную толерантность к повторному воздействию антигена.
Человеческие моноклональные анти-CD40-антитела и их различные применения описаны в совместных опубликованных патентных заявках, а именно WO 2005/044854, WO 2005/044304, WO 2005/044305, WO 2005/044306, WO 2005/044855, WO 2005/044307 и WO 2005/044294. В этих заявках, в частности, описано человеческое моноклональное антитело IgG1 против CD40, обозначаемое здесь CHIR-12.12, которое было получено путем иммунизации трансгенных мышей, несущих локус тяжелой цепи и легкой цепи каппа человеческого IgG1 (XenoMouse® technology; Abgenix, California).
Как показал FACS-анализ, CHIR-12.12 специфически связывается с человеческим CD40 и может предотвращать связывание CD40 с лигандом (CD40L). CHIR-12.12 может конкурировать за связывание с CD40L, предварительно связанным с CD40 на клеточной поверхности. Моноклональное антитело CHIR-12.12 представляет собой сильный антагонист и ингибирует in vitro CD40L-опосредуемую пролиферацию нормальных и злокачественных В-клеток. Моноклональное антитело CHIR-12.12 непосредственно снижает выживаемость клеток и ингибирует CD40L-опосредуемые пути передачи сигнала в нормальных человеческих B-лимфоцитах. In vitro антитело CHIR-12.12 уничтожает первичные раковые клетки у пациентов с НХЛ посредством ADCC. Дозозависимая противоопухолевая активность наблюдалась у модели с ксенотрансплантатом человеческой лимфомы. В настоящее время CHIR-12.12 проходит испытание фазы I на его применение для лечения злокачественных B-клеточных опухолей.
CD20 представляет собой антиген клеточной поверхности, экспрессируемый на ранней стадии дифференцировки В-клеток и остающийся на клеточной поверхности в процессе развития В-клеток. CD20 участвует в активации В-клеток, экспрессируется в опухолевых В-клетках на очень высоких уровнях и является известной клиницистам терапевтической мишенью (см. например, Hooijberg et al. (1995) Cancer Research 55: 2627). Антитела против CD20, такие как ритуксимаб (ритуксан®), были разрешены Управлением по контролю за качеством пищевых продуктов, медикаментов и косметических средств (США) к применению для лечения неходжкинской лимфомы (см., например, Boye et al. (2003) Ann. Oncol. 14:520). Было обнаружено, что ритуксан является эффективным средством для лечения низкозлокачественной, среднезлокачественной и высокозлокачественной неходжкинской лимфомы (НХЛ) (см., например, Maloney et al. (1994) Blood 84:2457-2466), McLaughlin et al. (1998) J Clin. Oncol. 16:2825-2833, Maloney et al. (1997) Blood 90:2188-2195, Hainsworth et al. (2000) Blood 95:3052-3056, Colombat et al. (2001) Blood 97:101-106, Coiffer et al. (1998) Blood 92:1927-1932), Foran et al (2000) J. Clin. Oncol. 18:3l7-324, Anderson et al. (1997) Biochem. Soc. Trans. 25:705-708, или Vose et al. (1999) Ann. Oncol. 10:58a). Ритуксан® также истощает популяцию нормальных В-клеток, которые могут играть определенную роль в развитии воспалительных и аутоиммунных заболеваний. В настоящее время ритуксан проходит клиническое испытание на его применение для лечения аутоиммунных заболеваний.
Хотя точный механизм действия ритуксана® неизвестен, однако имеются данные, указывающие на то, что действие ритуксана®, направленное на подавление лимфомы, частично обусловлено комплемент-опосредуемой цитотоксичностью (CMC), антитело-зависимой клеточно-опосредуемой цитотоксичностью (ADCC), ингибированием пролиферации клеток и, в конечном счете, прямым индуцированием апоптоза. Однако у некоторых пациентов может вырабатываться резистентность к лечению ритуксаном® (см. Witzig et al. (2002) J. Clin. Oncol. 20:3262, Grillo-Lopez et al. (1998) J. Clin. Oncol. 16:2825 или Jazirehi et al. (2003) Mol. Cancer Ther. 2:1183-1193). Так, например, у некоторых пациентов после лечения анти-CD20-антителом ингибируется экспрессия CD20 на злокачественных В-клетках (Davis et al. (1999) Clin. Cancer Res. 5:611). Кроме того, у 30-50% пациентов с низкозлокачественной НХЛ наблюдается клинический ответ на указанное моноклональное антитело (Hainsworth et al. (2000) Blood 95:3052-3056; Colombat et al. (2001) Blood 97:101-106). Было показано, что клиническая активность ритуксимаба в НХЛ коррелирует с FcγRIIIa-генотипом пациента. Пациенты со 158а.к.-полиморфизмом FcγRIIIa генотипа V/V или V/F являются более восприимчивыми к лечению ритуксимабом, чем пациенты с генотипом F/F (см., например, Cartron et al. (2002) Blood 99(3):754-758 или Dall'Ozzo et al. (2004) Cancer Res. 64:4664-4669). Пациенты, у которых развивается резистентность к такому моноклональному антителу или которые страдают воспалительным заболеванием или аутоиммунным заболеванием, резистентным к первоначальной терапии указанным антителом, нуждаются в альтернативных формах терапевтического лечения.
Кроме того, ритуксан® истощает нормальные В-клетки у пациента. Поэтому он может быть использован для лечения В-клеточнозависимого аутоиммунного и воспалительного заболеваний.
Таким образом, необходимость в разработке новых терапевтических средств и новых терапевтических стратегий лечения воспалительных и аутоиммунных заболеваний остается актуальной. В частности, необходимо разработать новые терапевтические стратегии лечения пациентов, не поддающихся лечению анти-CD20-антителами, такими как ритуксимаб (ритуксан®).
Краткое описание сущности изобретения
Настоящее изобретение относится к способу лечения человека, страдающего воспалительным заболеванием или аутоиммунным заболеванием, ассоциированным с CD40-экспрессирующими клетками, где указанный пациент является гетерозиготным или гомозиготным по FcγRIIIa-158F (генотип V/F или F/F). Указанные способы включают введение пациенту терапевтически или профилактически эффективного количества анти-CD40-антитела. Настоящее изобретение также относится к использованию терапевтически или профилактически эффективного количества анти-CD40-антитела в целях получения лекарственного средства для лечения воспалительного заболевания или аутоиммунного заболевания, ассоциированного с CD40-экспрессирующими клетками у пациента, который является гетерозиготным или гомозиготным по FcγRIIIa-158F (генотип V/F или F/F).
Настоящее изобретение также относится к способам ингибирования продукции антитела В-клетками у пациента, гетерозиготного или гомозиготного по FcγRIIIa-158F (генотип V/F или F/F), где указанный способ включает введение указанному пациенту эффективного количества анти-CD40-антитела. Настоящее изобретение также относится к использованию эффективного количества анти-CD40-антитела в целях получения лекарственного средства для ингибирования продукции антитела В-клетками у пациента, гетерозиготного или гомозиготного по FcγRIIIa-158F (V/F или F/F).
Настоящее изобретение также относится к способам и к наборам для идентификации пациента, страдающего воспалительным или аутоиммунным заболеванием, которое поддается лечению под действием анти-CD40-антитела, и которое не поддается лечению ритуксимабом (ритуксаном®). В некоторых вариантах изобретения указанный способ включает: a) идентификацию пациента, страдающего воспалительным или аутоиммунным заболеванием, которое ассоциируется с CD40-экспрессирующими клетками и которое не поддается лечению ритуксимабом (ритуксаном®); и b) определение FcγRIIIa-158-генотипа (V/V, V/F или F/F) у данного пациента; где указанное воспалительное или аутоиммунное заболевание поддается лечению под действием анти-CD40-антитела в том случае, если указанный пациент является гетерозиготным или гомозиготным по FcγRIIIa-158F (генотип V/F или F/F). Настоящее изобретение может также включать стадию введения пациенту, который был идентифицирован таким способом, терапевтически или профилактически эффективного количества анти-CD40-антитела. Настоящее изобретение также относится к наборам для идентификации пациента, страдающего воспалительным или аутоиммунным заболеванием, которое поддается лечению под действием анти-CD40-антитела, где указанные наборы включают реагенты для определения у пациента FcγRIIIa-158-генотипа.
Настоящее изобретение также относится к способам и к наборам для выбора терапии антителом, подходящей для лечения пациента, страдающего воспалительным заболеванием или аутоиммунным заболеванием, которое не поддается лечению ритуксимабом (ритуксаном®). В некоторых вариантах изобретения указанный способ включает: a) идентификацию пациента, страдающего воспалительным заболеванием или аутоиммунным заболеванием, которое ассоциируется с CD40-экспрессирующими клетками и которое не поддается лечению ритуксимабом (ритуксаном®); и b) определение FcγRIIIa-158-генотипа (V/V, V/F или F/F) у данного пациента; где для лечения указанного воспалительного заболевания или аутоиммунного заболевания анти-CD40-антитело выбирают в том случае, если указанный пациент является гетерозиготным или гомозиготным по FcγRIIIa-158F (генотип V/F или F/F). Настоящее изобретение может также включать стадию введения пациенту, который был идентифицирован таким способом, терапевтически или профилактически эффективного количества анти-CD40-антитела. Настоящее изобретение также относится к наборам для выбора терапии антителом, подходящей для лечения пациента, страдающего воспалительным или аутоиммунным заболеванием, ассоциированным с CD40-экспрессирующими клетками, где указанные наборы включают реагенты для определения FcγRIIIa-158-генотипа у данного пациента.
Настоящее изобретение также относится к способам лечения пациента, страдающего воспалительным или аутоиммунным заболеванием, ассоциированным с CD40-экспрессирующими клетками, где указанные способы включают введение пациенту медленно интернализующегося антитела. В одном из таких вариантов терапевтически или профилактически эффективное количество анти-CD40-антитела вводят пациенту так, чтобы указанное анти-CD40-антитело после его введения не обнаруживало значительной интернализации в CD40-экспрессирующие клетки. В другом таком варианте терапевтически или профилактически эффективное количество анти-CD40-антитела вводят пациенту так, чтобы указанное анти-CD40-антитело после его введения по существу равномерно распределялось по поверхности CD40-экспрессирующих клеток. В еще одном из таких вариантов анти-CD40-антитело вводят пациенту так, чтобы после его введения терапевтически или профилактически эффективное количество указанного анти-CD40-антитела присутствовало на поверхности CD40-экспрессирующих клеток данного пациента.
Анти-CD40-антитела, используемые в соответствии с настоящим изобретением, специфически связываются с антигеном CD40. В некоторых вариантах изобретения анти-CD40-антитела, используемые в способах согласно изобретению, а в частности моноклональные антитела, обладают высокой аффинностью связывания с человеческим FcγRIIIa-158V, высокой аффинностью связывания с человеческим FcγRIIIa-158F или высокой аффинностью связывания с человеческим FcγRIIIa-158V и FcγRIIIa-158F. В некоторых из этих вариантов анти-CD40-антитела могут связываться с любыми из двух аллотипов FcγRIIIa, отличающихся по аминокислоте 158 (V или F) и присутствующих на человеческих природных клетках-киллерах (NK), причем связывающие свойства указанных антител являются подходящими для индуцирования сильной антитело-зависимой клеточной цитотоксичности (ADCC). Подходящими анти-CD40-антителами являются, но не ограничиваются ими, анти-CD40-антитела, не обладающие значительной агонистической активностью, включая, например, анти-CD40-антитела, которые являются антагонистами передачи CD40-CD40L-сигнала на CD40-экспрессирующих клетках. В некоторых вариантах изобретения анти-CD40-антитело выбирают из группы, состоящей из: а) моноклонального антитела CHIR-12.12; b) моноклонального антитела, продуцируемого гибридомной клеточной линией 12.12; с) моноклонального антитела, содержащего аминокислотную последовательность, выбранную из группы, состоящей из последовательности, представленной в SEQ ID NO:2, последовательности, представленной в SEQ ID NO:4, последовательности, представленной в SEQ ID NO:5, обеих последовательностей, представленных в SEQ ID NO:2 и SEQ ID NO:4, и обеих последовательностей, представленных в SEQ ID NO:2 и SEQ ID NO:5; d) моноклонального антитела, имеющего аминокислотную последовательность, кодируемую молекулой нуклеиновой кислоты, имеющей нуклеотидную последовательность, выбранную из группы, состоящей из последовательности, представленной в SEQ ID NO:1, последовательности, представленной в SEQ ID NO:3 и обеих последовательностей, представленных в SEQ ID NO:1 и SEQ ID NO:3; е) моноклонального антитела, которое связывается с эпитопом, способным связываться с моноклональным антителом, продуцируемым гибридомной клеточной линией 12.12; f) моноклонального антитела, которое связывается с эпитопом, содержащим остатки 82-87 человеческой последовательности CD40, представленной в SEQ ID NO:7 или SEQ ID NO:9; g) моноклонального антитела, которое связывается с эпитопом, содержащим остатки 82-89 человеческой последовательности CD40, представленной в SEQ ID NO:7 или SEQ ID NO:9; h) моноклонального антитела, которое конкурирует с моноклональным антителом CHIR-12.12 в анализе на конкурентное связывание; i) моноклонального антитела по предшествующему пункту а) или моноклонального антитела по любому из предшествующих пунктов с)-h), где указанное антитело является рекомбинантно продуцируемым; и j) моноклонального антитела, которое представляет собой антигенсвязывающий фрагмент моноклонального антитела по любому из предшествующих пунктов а)-i), где указанный фрагмент сохраняет способность к специфическому связыванию с человеческим антигеном CD40.
Способы согласно изобретению могут быть применены для лечения воспалительных заболеваний или аутоиммунных заболеваний, ассоциированных с CD40-экспрессирующими клетками. Примерами таких заболеваний являются, но не ограничиваются ими, системная красная волчанка (СКВ), дискоидная волчанка, волчаночный нефрит, саркоидоз, воспалительный артрит, включая ювенильный артрит, ревматоидный артрит, псориазный артрит, синдром Рейтера, анкилозирующий спондилит и подагрический артрит; отторжение трансплантата органов или тканей, сверхострое, острое или хроническое отторжение трансплантата и/или реакция “трансплантат против хозяина”, рассеянный склероз, гипер-IgM-синдром, нодозный полиартериит, первичный билиарный цирроз, воспалительное заболевание кишечника, болезнь Крона, глютеновая болезнь (глютен-чувствительная энтеропатия), аутоиммунный гепатит, пернициозная анемия, аутоиммунная гемолитическая анемия, псориаз, склеродермия, тяжелая миастения, аутоиммунная тромбоцитопеническая пурпура, аутоиммунный тиреоидит, болезнь Грейвса, тиреоидит Хашимото, болезнь иммунных комплексов, иммунодисфункциональный синдром хронической усталости (CFIDS), полимиозит и дерматомиозит, криоглобулинемия, тромболиз, кардиомиопатия, вульгарная пузырчатка, интерстициальный фиброз легких, сахарный диабет типа I и типа II, гиперчувствительность замедленного типа 1, 2, 3 и 4, аллергия или аллергические расстройства, нежелательные/самопроизвольные иммунные ответы на терапевтические белки, астма, синдром Черга-Штраусса (аллергический гранулематоз), атопический дерматит, аллергический и раздражающий контактный дерматит, крапивница, IgE-опосредуемая аллергия, атеросклероз, васкулит, идиопатические воспалительные миопатии, гемолитическое заболевание, болезнь Альцгеймера и хроническая воспалительная демиелинизирующая полиневропатия, воспаление легких, включая, но не ограничиваясь им, отторжение легочного трансплантата, астму, саркоидоз, эмфизему, кистозный фиброз, идиопатический фиброз легких, хронический бронхит, аллергический ринит и аллергические заболевания легких, такие как пневмонит, ассоциированный с гиперчувствительностью, эозинофильная пневмония, облитерирующий бронхиолит, вызываемый трансплантацией костного мозга и/или легких или другими факторами; атеросклероз/флебосклероз, вызываемый трансплантацией; фиброз легких, индуцированный коллагеном, сосудистые и аутоиммунные заболевания, такие как ревматоидный артрит и системная красная волчанка, а также воспалительные заболевания или аутоиммунные заболевания, ассоциированные с CD20-экспрессирующими клетками. Способы согласно изобретению являются особенно предпочтительными для их применения в целях лечения воспалительных заболеваний и аутоиммунных заболеваний, ассоциированных с клетками, экспрессирующими CD40 и CD20. Таким образом, настоящее изобретение может быть использовано для лечения пациентов, страдающих воспалительным или аутоиммунным заболеванием, которое является невосприимчивым к лечению у пациентов, гомозиготных или гетерозиготных по FcγRIIIa-158F (генотип V/F или F/F), другими терапевтическими средствами, включая анти-CD20-антитела, или вообще не поддается лечению такими терапевтическими средствами.
Краткое описание графического материала
На фиг. 1А-1F представлены результаты анализа на антитело-зависимую клеточную цитотоксичность (ADCC) в шести клеточных линиях.
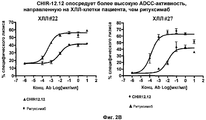
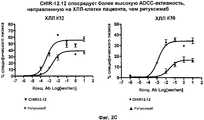
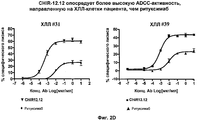
На фиг. 2A-2D представлены результаты анализа на антитело-зависимую клеточную цитотоксичность (ADCC) в клетках пациента с ХЛЛ (n = 8).
На фиг.3 систематизированы результаты анализа на ADCC в клетках пациента с ХЛЛ (n=9).
На фиг.4 представлены результаты анализа на ADCC в клетках пациента с ХЛЛ, проводимого с использованием эффекторных NK-клеток, взятых у двух различных доноров.
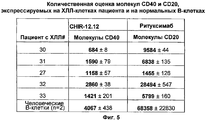
На фиг.5 представлены результаты количественной оценки экспрессии CD40 и CD20 на поверхности клеток пациента с ХЛЛ и на поверхности нормальных В-клеток.
На фиг.6 систематизированы результаты анализа на ADCC-активность для клеток, оцененных на уровень экспрессии CD40 и CD20 на поверхности указанных клеток.
На фиг.7 представлена гистограмма, иллюстрирующая уровни связанного антитела CHIR-12.12 на поверхности клеток клеточных линий Дауди и ARH77.
На фиг.8 представлены результаты исследований по интернализации антитела CHIR-12.12 и ритуксимаба в клетках пациента с ХЛЛ, полученные с помощью FACS-анализа.
На фиг.9 представлены результаты исследований по интернализации антитела CHIR-12.12 и ритуксимаба в нормальных В-клетках, полученные с помощью конфокальной микроскопии ФИТЦ-меченных антител.
На фиг.10 представлены результаты исследований по интернализации антитела CHIR-12.12 и ритуксимаба в клетках пациента с ХЛЛ, полученные с помощью конфокальной микроскопии Alexa488-меченных антител.
На фиг.11 систематизирована взаимосвязь между ADCC-активностью и интернализацией.
На фиг.12 представлена гистограмма, иллюстрирующая максимальный процент специфического лизиса клеток Дауди под действием антитела CHIR-12.12 или ритуксимаба, определяемого с использованием очищенных эффекторных NK-клеток, взятых у доноров с различными FcγRIIIa-генотипами.
На фиг.13 представлена гистограмма, иллюстрирующая ADCC-активность (ED50) антитела CHIR-12.12 или ритуксимаба по отношению к клеткам Дауди, определяемая с использованием очищенных эффекторных NK-клеток, взятых у доноров с различными FcγRIIIa-генотипами.
На фиг.14 систематизирована сравнительная ADCC-активность антитела CHIR-12.12 и ритуксимаба по отношению к клеткам пациента с ХЛЛ (n=9), определяемая с использованием человеческих NK-клеток, взятых у пациентов-доноров с различными генотипами.
Подробное описание изобретения
Авторами настоящего изобретения было неожиданно обнаружено, что анти-CD40-антитела, такие как CHIR-12.12, обладают способностью опосредовать сильную антитело-зависимую клеточную цитотоксичность (ADCC) по отношению к CD40-экспрессирующим клеткам-мишеням в условиях, при которых другие ADCC-опосредующие антитела являются менее эффективными или относительно неэффективными. По сравнению с другими антителами, такими как ритуксимаб (ритуксан®), анти-CD40-антитела, используемые в соответствии с настоящим изобретением, могут связываться с любыми из двух аллотипов FcγRIIIa, отличающихся по аминокислоте 158 (V или F) и находящихся на человеческих природных клетках-киллерах (NK), причем связывающие свойства этих антител являются достаточными для индуцирования сильной ADCC. Полученные результаты оказались неожиданными и явились большим шагом вперед в области разработки способов лечения воспалительных и аутоиммунных заболеваний путем проведения перекрестного обследования всех пациентов.
В соответствии с этим анти-CD40-антитела, такие как CHIR-12.12, могут быть использованы для лечения воспалительных заболеваний и аутоиммунных заболеваний, ассоциированных с CD40-экспрессирующими клетками, у пациентов, гетерозиготных или гомозиготных по FcγRIIIa-158F (генотип V/F или F/F), а также пациентов, гомозиготных по FcγRIIIa-158V (генотип V/V).
Настоящее изобретение также относится к способу лечения пациента, страдающего воспалительным или аутоиммунным заболеванием, ассоциированным с CD40-экспрессирующими клетками, где указанный пациент является гетерозиготным или гомозиготным по FcγRIIIa-158F (генотип V/F или F/F) и где указанный способ включает введение указанному пациенту терапевтически или профилактически эффективного количества анти-CD40-антитела. Настоящее изобретение также относится к применению терапевтически или профилактически эффективного количества анти-CD40-антитела в целях приготовления лекарственного средства для лечения воспалительного или аутоиммунного заболевания, ассоциированного с CD40-экспрессирующими клетками у пациента, гетерозиготного или гомозиготного по FcγRIIIa-158F (генотип V/F или F/F).
Как указывалось выше, было обнаружено, что клиническая активность ритуксимаба при лечении НХЛ коррелирует с FcγRIIIa-генотипом пациента. Пациенты с 158 а.к.-полиморфизмом FcγRIIIa F/F являются менее восприимчивыми к лечению ритуксимабом, чем V/V- или V/F-пациенты (см., например, Cartron et al. (2002) Blood 99(3):754-758 или Dall'Ozzo et al. (2004) Cancer Res. 64:4664-4669. Как указывалось выше, в настоящее время проводятся клинические испытания по применению ритуксана® для лечения аутоиммунных заболеваний. В соответствии с этим настоящее изобретение может быть использовано для лечения воспалительных заболеваний и аутоиммунных заболеваний, которые не являются восприимчивыми к лечению анти-CD20-антителом, таким как ритуксимаб (ритуксан®). Кроме того, может быть получено лекарственное средство, которое будет обладать сильным действием, направленным на уничтожение клеток-мишеней и которое необязательно использовать в виде конъюгата “антитело-токсин”, а поэтому такое средство будет более дешевым и будет продуцировать меньше побочных эффектов.
Анти-CD40-антитела, такие как CHIR-12.12, могут быть использованы в способах ингибирования продукции антител В-клетками у пациента, гетерозиготного или гомозиготного по FcγRIIIa-158F (генотип V/F или F/F), а также у пациентов, гомозиготных по FcγRIIIa-158V (генотип V/V).
Таким образом, настоящее изобретение относится к способу ингибирования продукции антитела В-клетками у пациента, гетерозиготного или гомозиготного по FcγRIIIa-158F (генотип V/F или F/F), где указанный способ включает введение указанному пациенту эффективного количества анти-CD40-антитела, такого как CHIR-12.12. Настоящее изобретение также относится к использованию эффективного количества анти-CD40-антитела в целях изготовления лекарственного средства для ингибирования продукции антитела В-клетками у пациента, гетерозиготного или гомозиготного по FcγRIIIa-158F (V/F или F/F).
Для специалистов в данной области явился неожиданным тот факт, что может быть осуществлено ингибирование продуцирования антитела В-клетками у пациента, гетерозиготного или гомозиготного по FcγRIIIa-158F (генотип V/F или F/F).
Настоящее изобретение относится к способу лечения, выбранному для отдельного индивидуума, исходя из его FcγRIIIa-158-генотипа, и включающему введение указанному пациенту ADCC-опосредующего анти-CD40-антитела.
Настоящее изобретение относится к способу идентификации пациента, страдающего воспалительным или аутоиммунным заболеванием, которое поддается лечению под действием анти-CD40-антитела и которое не поддается лечению ритуксимабом (ритуксаном®), где указанный способ включает:
а) идентификацию пациента, страдающего воспалительным заболеванием или аутоиммунным заболеванием, которое ассоциируется с CD40-экспрессирующими клетками и которое не поддается лечению ритуксимабом (ритуксаном®); и
b) определение указанного FcγRIIIa-158-генотипа у пациента (V/V, V/F или F/F),
где указанное воспалительное заболевание или аутоиммунное заболевание поддается лечению под действием анти-CD40-антитела в том случае, если указанный пациент является гетерозиготным или гомозиготным по FcγRIIIa-158F (генотип V/F или F/F). Настоящее изобретение может также включать стадию введения пациенту, идентифицированному с применением такого способа, терапевтически или профилактически эффективного количества анти-CD40-антитела.
Такой способ идентификации пациента, страдающего воспалительным заболеванием или аутоиммунным заболеванием, поддающимся лечению анти-CD40-антителом, может быть легко осуществлен специалистом в данной области с использованием подходящего диагностического набора. Такой набор должен включать реагенты, подходящие для установления у пациента FcγRIIIa-158-генотипа. Таким образом, настоящее изобретение также относится к набору для идентификации пациента, страдающего воспалительным или аутоиммунным заболеванием, поддающимся лечению анти-CD40-антителом, где указанный набор включает реагенты для определения FcγRIIIa-158-генотипа у данного пациента. Подходящие наборы более подробно описаны ниже.
Настоящее изобретение также относится к способу выбора курса лечения антителом для пациента, страдающего воспалительным или аутоиммунным заболеванием, которое не поддается лечению ритуксимабом (ритуксаном®), где указанный способ включает:
а) идентификацию пациента, страдающего воспалительным заболеванием или аутоиммунным заболеванием, которое ассоциируется с CD40-экспрессирующими клетками и которое не поддается лечению ритуксимабом (ритуксаном®); и
b) определение у пациента указанного FcγRIIIa-158-генотипа (V/V, V/F или F/F),
где для лечения указанного воспалительного заболевания или аутоиммунного заболевания анти-CD40-антитело выбирают в том случае, если указанный пациент является гетерозиготным или гомозиготным по FcγRIIIa-158F (генотип V/F или F/F). В частности, лечение анти-CD40-антителом может оказаться предпочтительнее, чем лечение ритуксимабом (ритуксаном®). Настоящее изобретение может также включать стадию введения пациенту, идентифицированному таким способом, терапевтически или профилактически эффективного количества анти-CD40-антитела.
Указанный способ выбора курса лечения антителом для данного пациента, страдающего воспалительным или аутоиммунным заболеванием, может быть легко осуществлен специалистом в данной области с использованием подходящего диагностического набора. Такой набор должен включать реагенты, подходящие для определения у пациента FcγRIIIa-158-генотипа. Таким образом, настоящее изобретение также относится к набору для выбора курса лечения антителом для пациента, страдающего воспалительным или аутоиммунным заболеванием, ассоциированным с CD40-экспрессирующими клетками, где указанный набор содержит реагенты для определения у пациента FcγRIIIa-158-генотипа.
Авторами настоящего изобретения было также неожиданно обнаружено, что анти-CD40-антитела, такие как CHIR-12.12, после их введения не обнаруживают какой-либо значительной интернализации CD40-экспрессирующими клетками. Вместо этого анти-CD40-антитела, такие как CHIR-12.12, по существу, однородно распределяются на поверхности CD40-экспрессирующих клеток в течение значительного периода времени после их введения. Однако такой эффект не наблюдается для других антител, а в частности анти-CD20-антител, таких как ритуксимаб (ритуксан®).
Длительность CD40-связывания на поверхности CD40-экспрессирующих клеток и однородное распределение анти-CD40-антитела на поверхности CD40-экспрессирующих клеток позволяет анти-CD40-антителам опосредовать сильную антитело-зависимую клеточную цитотоксичность (ADCC) по отношению к CD40-экспрессирующим клеткам-мишеням посредством связывания с FcR, таким как FcγRIIIa, на природных клетках-киллерах (NK).
Таким образом, настоящее изобретение относится к способу лечения пациента, страдающего воспалительным заболеванием или аутоиммунным заболеванием, ассоциированным с CD40-экспрессирующими клетками, где указанный способ включает введение указанному пациенту терапевтически или профилактически эффективного количества анти-CD40-антитела так, чтобы указанное анти-CD40-антитело после его введения не обнаруживало какой-либо значительной интернализации CD40-экспрессирующими клетками.
Настоящее изобретение также относится к способу лечения пациента, страдающего воспалительным заболеванием или аутоиммунным заболеванием, ассоциированным с CD40-экспрессирующими клетками, где указанный способ включает введение указанному пациенту терапевтически или профилактически эффективного количества анти-CD40-антитела так, чтобы указанное анти-CD40-антитело после его введения, по существу, сохраняло однородное распределение на поверхности CD40-экспрессирующих клеток.
Настоящее изобретение также относится к способу лечения пациента, страдающего воспалительным заболеванием или аутоиммунным заболеванием, ассоциированным с CD40-экспрессирующими клетками, где указанный способ включает введение указанному пациенту анти-CD40-антитела так, чтобы терапевтически или профилактически эффективное количество анти-CD40-антитела после его введения присутствовало на поверхности CD40-экспрессирующих клеток указанного пациента.
Эти аспекты настоящего изобретения также включают введение пациенту медленно интернализующегося антитела. Используемый авторами термин “медленно интернализующееся антитело” означает антитело, которое остается осажденным на поверхности клеток в течение значительного периода времени. Как известно специалистам, такое свойство антител резко отличается от свойств антител, которые считаются преимущественными для многих терапевтических схем лечения, и для эффективного применения которых фактически необходима интернализация комплекса “антитело-рецептор”. В этом контексте термин “значительный период времени”, по существу, означает период времени, превышающий 3 часа, предпочтительно 6 часов, более предпочтительно 12 часов, а еще более предпочтительно 24 часа, 36 часов, 48 часов, 72 часов, 96 часов, 120 часов, 144 часа, 168 часов или более.
При этом предпочтительно, чтобы по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или более антитела, первоначально осажденного на поверхности CD40-экспрессирующих клеток, оставалось на поверхности этих клеток в течение вышеуказанного значительного периода времени.
Интернализация антител может быть оценена с помощью различных анализов. Так, например, клеточные линии, такие как клеточная линия лимфомы Дауди или клеточная линия ARH77 ММ, могут быть использованы для оценки влияния связывания антитела-кандидата на интернализацию. Клетки инкубируют с человеческим IgG1 (контрольное антитело) или с антителом-кандидатом на льду (с 0,1% азидом натрия для блокирования интерализации) или при 37оС (без азида натрия) в течение определенного периода времени, например 3 часов. После промывки холодным окрашивающим буфером (например, PBS + l% BSA + 0,1% азида натрия), клетки окрашивают, например, козьим ФИТЦ-конъюгированным антителом против человеческого IgG в течение 30 минут на льду. Затем может быть оценена степень окрашивания, и в этом случае может быть вычислено геометрическое среднее интенсивности флуоресценции (MFI), например, с помощью устройства FACS Calibur. Специалистам известны и другие подходящие анализы (см., например, http://www.abgenix.com/documents/SBS2003%20poster.pdf).
В экспериментах, описанных в примерах 4 и 5, не наблюдалось какого-либо отличия в MFI для клеток, инкубированных с CH12.12 на льду в присутствии азида натрия или при 37оС в отсутствие азида натрия (см. фиг. 7-10). Эти данные показали, что CHl2.12 после связывания с CD40 не интернализуется и продолжает находиться на клеточной поверхности.
Краткий обзор стандартных методов и процедур, которые могут быть применены для осуществления настоящего изобретения, приводится ниже. Следует отметить, что настоящее изобретение не ограничивается описанными здесь конкретными методами, протоколами, клеточными линиями, векторами и реагентами. Следует также отметить, что используемая здесь терминология приводится лишь для описания конкретных вариантов изобретения и не рассматривается как ограничение объема настоящего изобретения. Объем настоящего изобретения ограничивается только прилагаемой формулой изобретения.
В настоящем описании используются стандартные аббревиатуры, обычно применяемые для обозначения нуклеотидов и аминокислот.
В настоящем изобретении, если это не оговорено особо, применяются стандартные методы молекулярной биологии, микробиологии, техники рекомбинантных ДНК и иммунологии, известные специалистам в данной области.
Такие методы подробно описаны в литературе. Примерами особенно подходящей справочной литературы являются следующие публикации: Sambrook et al. (1989) Molecular Cloning; A Laboratory Manual (2d ed.); D.N. Glover, ed. (1985) DNA Cloning, Volumes I and II; M.J. Gait, ed. (1984) Oligonucleotide Synthesis; B.D. Hames & S.J. Higgins, eds. (1984) Nucleic Acid Hybridization; B.D. Hames & S.J. Higgins, eds. (1984) Transcription and Translation; R.I. Freshney, ed. (1986) Animal Cell Culture; Immobilized Cells and Enzymes (IRL Press, 1986); B. Perbal (1984). А Practical Guide to Molecular Cloning; the Methods in Enzymology series (Academic Press, Inc.), especially volumes 154 & 155; J.H. Miller and M.P. Calos, eds. (1987) Gene Transfer Vectors for Mammalian Cells (Cold Spring Harbor Laboratory); Mayer and Walker, eds. (1987) Immunochemical Methods in Cell and Molecular Biology (Academic Press, London); Scopes (1987) Protein Purification: Principles and Practice (2d ed.; Springer Verlag, N.Y.); и D.M. Weir & C.C. Blackwell, eds. (1986) Handbook of Experimental Immunology, Volumes I-IV.
Способы согласно изобретению включают применение анти-CD40-антител для лечения воспалительных заболеваний и аутоиммунных заболеваний, ассоциированных с CD40-экспрессирующими клетками.
Термины “CD40", “антиген CD40" или “рецептор CD40" означают трансмембранный 50-55 кДа-гликопротеин семейства рецепторов фактора некроза опухоли (TNF) (см., например, патенты США №№ 5674492 и 4708871; Stamenkovic et al. (1989) EMBO 8:1403; Clark (1990) Tissue Antigens 36:33; Barclay et al. (1997) The Leucocyte Antigen Facts Book (2d ed.; Academic Press, San Diego)). Были идентифицированы две изоформы человеческого CD40, кодируемые альтернативно сплайсированными вариантами транскриптов этого гена. Первая изоформа (также известная как “длинная изоформа” или “изоформа 1”) экспрессируется в виде полипептида-предшественника, состоящего из 277 аминокислот (SEQ ID NO:9, впервые зарегистрированного в GenBank рег. № CAA43045 и идентифицированного как изоформа 1 в GenBank рег. № NP_001241) и кодируемого последовательностью SEQ ID NO:8 (см. GenBank рег. №№ X60592 и NM_001250), где указанная изоформа имеет сигнальную последовательность, представленную первыми 19 остатками. Вторая изоформа (также известная как “короткая изоформа” или “изоформа 2”) экспрессируется в виде полипептида-предшественника, состоящего из 203 аминокислот (SEQ ID NO:7; GenBank рег. № NP_690593) и кодируемого последовательностью SEQ ID NO:6 (GenBank рег. № NM_152854), где указанная изоформа также имеет сигнальную последовательность, представленную первыми 19 остатками. Полипептиды-предшественники этих двух изоформ человеческого CD40 имеют общие первые 165 остатков (то есть остатки 1-165 SEQ ID NO:7 и SEQ ID NO:9). Полипептид-предшественник короткой изоформы (представленный в SEQ ID NO:7) кодируется транскрипционным вариантом (SEQ ID NO:6), не содержащим кодирующего сегмента, что приводит к сдвигу рамки считывания, а поэтому эта изоформа CD40 содержит более короткие C-концы (остатки 166-203 SEQ ID NO:7), отличающиеся от концов, имеющихся в длинной изоформе CD40 (C-конец представлен остатками 166-277 SEQ ID NO:9). В соответствии с настоящим изобретением, термины “CD40", “антиген CD40", “антиген CD40 клеточной поверхности" или “рецептор CD40" охватывают как короткую, так и длинную изоформы CD40. Антиген CD40 может быть полностью или частично гликозилированным.
Как указывается в настоящей заявке, CD40 присутствует на поверхности нормальных и опухолевых человеческих В-клеток, дендритных клеток, моноцитов, макрофагов, CD8+-Т-клеток, эндотелиальных клеток, моноцитов и эпителиальных клеток, активированных Т-клеток, активированных тромбоцитов, воспалительных клеток сосудов гладких мышц, эозинофилов, синовиальных мембран при ревматоидном артрите, фибробластов дермы и других нелимфоидных клеток.
Используемый здесь термин “CD40-экспрессирующие клетки” означает любые нормальные или злокачественные клетки, экспрессирующие детектируемые уровни антигена CD40. CD40- экспрессирующими клетками, предпочтительно, являются клетки, экспрессирующие детектируемые уровни антигена CD40 клеточной поверхности. Методы детектирования экспрессии CD40 в клетках хорошо известны специалистам, и такими методами являются, но не ограничиваются ими, ПЦР-методы, иммуногистохимические анализы, проточная цитометрия, вестерн-блот-анализ, ELISA и т.п. Такие методы позволяют детектировать мРНК CD40, антиген CD40 и антиген CD40 клеточной поверхности. Детектирование экспрессии CD40 клеточной поверхности может быть осуществлено, как описано в примере 3 или другими подходящими методами.
Термин “лиганд CD40" или “CD40L" означает, главным образом, трансмембранный 32-33 кДа-белок, который также существует в двух менее биологически активных растворимых формах, 18 кДа и 31 кДа, соответственно (Graf et al. (1995) Eur. J. Immunol. 25:1749- 1754; Mazzei et al. (1995) J. Biol. Chem. 270:7025-7028; Pietravalle et al. (1996) J Biol. Chem. 271:5965-5967). Человеческий CD40L также известен как CD154 или gp39. Термин “лиганд CD40" или "CD40L" также означает любой другой пептид, полипептид или белок, который может связываться с одной или несколькими молекулами пути передачи CD40-сигнала и активировать такие молекулы. Таким образом, “лигандами CD40" являются, но не ограничиваются ими, полноразмерные белки-лиганды CD40 и их варианты и фрагменты, которые сохраняют активность, достаточную для осуществления функции связывания с молекулой, передающей сигнал CD40 в CD40-экспрессирующие клетки, и стимуляции такой молекулы. Модификациями нативного лиганда CD40, например человеческого CD40L, являются, но не ограничиваются ими, замены, делеции, усечения, удлинения, гибридные белки, фрагменты, пептидомиметики и т.п.
Термин “передача CD40-сигнала" означает любую биологическую активность, индуцируемую взаимодействием CD40 клеточной поверхности с лигандом CD40 или с другим агонистом, таким как антитело-агонист. Примерами CD40-сигналов являются сигналы, приводящие к пролиферации и выживанию CD40-экспрессирующих клеток и стимуляции одного или нескольких путей передачи CD40-сигнала в CD40-экспрессирующие клетки. Термин “путь передачи сигнала CD40” или “путь передачи сигнала” означает по меньшей мере одну биохимическую реакцию или группу биохимических реакций, которые происходят в результате взаимодействия рецептора CD40 с лигандом CD40, например CD40L, и вырабатывают сигнал, который при его передаче по пути прохождения каскада реакций активирует одну или несколько молекул в нижеследующих реакциях пути передачи сигнала. Пути передачи сигнала включают ряд молекул, которые передают сигнал от рецептора CD40 клеточной поверхности через плазматическую клеточную мембрану и через клеточную цитоплазму, а в некоторых случаях, в клеточное ядро посредством одной или нескольких серий молекул передачи сигнала. В соответствии с настоящим изобретением, особый интерес представляют пути передачи сигнала CD40, включая путь передачи сигнала AKT, который приводит к активации AKT и, в конечном счете, к активации NF-kB по пути передачи NF-kB-сигнала; пути передачи сигнала активированной митогеном протеин-киназы (MAPK), включая путь передачи MEK/ERK-сигнала и путь передачи MEK/p38-сигнала, приводящие к активации ERK и p38, соответственно.
Как указывалось выше, настоящее изобретение относится к способу лечения пациента, страдающего воспалительным или аутоиммунным заболеванием, ассоциированным с CD40-экспрессирующими клетками, где указанный пациент является гетерозиготным или гомозиготным по FcγRIIIa-158F (генотип V/F или F/F) и где указанный способ включает введение указанному пациенту терапевтически или профилактически эффективного количества анти-CD40-антитела.
Термин “человек, называемый здесь пациентом” относится к человеку, страдающему любым воспалительным или аутоиммунным заболеванием, ассоциированным с CD40-экспрессирующими клетками, или к человеку с риском развития или рецидива у него указанных заболеваний.
Термин “воспалительное заболевание или аутоиммунное заболевание, ассоциированное с CD40-экспрессирующими клетками” означает любое воспалительное заболевание или аутоиммунное заболевание, ассоциированное с CD40-экспрессирующими клетками. Воспалительным заболеванием или аутоиммунным заболеванием, ассоциированным с CD40-экспрессирующими клетками, может быть воспалительное заболевание или аутоиммунное заболевание, ассоциированное с нежелательным уровнем передачи CD40-сигнала CD40-экспрессирующим клеткам, либо такое воспалительное или аутоиммунное заболевание может лишь опосредованно ассоциироваться с CD40-экспрессирующими клетками. Термин “воспалительное заболевание или аутоиммунное заболевание, ассоциированное с нежелательным уровнем передачи CD40-сигнала“ означает воспалительное или аутоиммунное заболевание, развитие или прогрессирование которого ассоциируется с нежелательным уровнем передачи CD40-сигнала.
Термин “нежелательный уровень передачи CD40-сигнала” означает любой физиологически нежелательный уровень передачи CD40-сигнала, который может наблюдаться в CD40-экспрессирующих клетках пациента, страдающего воспалительным заболеванием или аутоиммунным заболеванием.
Воспалительные заболевания характеризуются воспалением и деструкцией ткани или их комбинациями. Термин “воспалительное заболевание” включает любой воспалительный иммуно-опосредованный процесс, при котором событие инициации или запуска иммунного ответа вызывается антигеном, не являющимся аутоантигеном, включая, например, аллоантигены, ксеноантигены, вирусные антигены, бактериальные антигены, неизвестные антигены или аллергены.
Используемый здесь термин “аутоиммунный ответ”, по существу, включает воспалительные иммуноопосредованные процессы, вызываемые “аутоантигенами”. При аутоиммунных заболеваниях аутоантиген(ы) запускает(ют) иммунные ответы у хозяина.
Настоящее изобретение может быть использовано для лечения воспаления, ассоциированного с отторжением тканевого трансплантата. Термины “отторжение трансплантата” или “отторжение органа или ткани” означают любой индуцируемый у хозяина иммунный ответ, направленный против данного трансплантата, включая, но не ограничиваясь ими, антигены HLA, антигены групп крови и т.п.
Настоящее изобретение может быть также использовано для предотвращения реакции “трансплантат против хозяина”, например, ассоциированной с трансплантацией костного мозга. При указанной реакции “трансплантат против хозяина” в костном мозге донора присутствуют лимфоциты и клетки, которые после созревания превращаются в лимфоциты. Лимфоциты донора распознают антигены реципиента как “не свои” и вырабатывают воспалительный иммунный ответ. Следовательно, используемые здесь термины “гомологичная болезнь” или реакция “трансплантат против хозяина” означают любой Т-клеточно-опосредуемый иммунный ответ, при котором лимфоциты донора реагируют с антигенами хозяина.
Воспалительными заболеваниями и аутоиммунными заболеваниями, которые могут быть подвергнуты лечению способами согласно изобретению, являются, но не ограничиваются ими, системная красная волчанка (СКВ), дискоидная волчанка, волчаночный нефрит, саркоидоз, воспалительный артрит, включая ювенильный артрит, ревматоидный артрит, псориазный артрит, синдром Рейтера, анкилозирующий спондилит и подагрический артрит; отторжение трансплантата органов или тканей, сверхострое, острое или хроническое отторжение трансплантата и/или реакция “трансплантат против хозяина”, рассеянный склероз, гипер-IgM-синдром, нодозный полиартериит, первичный билиарный цирроз, воспалительное заболевание кишечника, болезнь Крона, глютеновая болезнь (глютен-чувствительная энтеропатия), аутоиммунный гепатит, пернициозная анемия, аутоиммунная гемолитическая анемия, псориаз, склеродермия, тяжелая миастения, аутоиммунная тромбоцитопеническая пурпура, аутоиммунный тиреоидит, болезнь Грейвса, тиреоидит Хашимото, болезнь иммунных комплексов, иммунодисфункциональный синдром хронической усталости (CFIDS), полимиозит и дерматомиозит, криоглобулинемия, тромболиз, кардиомиопатия, вульгарная пузырчатка, интерстициальный фиброз легких, сахарный диабет типа I и типа II, гиперчувствительность замедленного типа 1, 2, 3 и 4, аллергия или аллергические расстройства, нежелательные/самопроизвольные иммунные ответы на терапевтические белки (см., например, заявку на патент США № 2002/0119151 и Koren, et al. (2002) Curr. Pharm. Biotechnol. 3:349-60), астма, синдром Черга-Штраусса (аллергический гранулематоз), атопический дерматит, аллергический и раздражающий контактный дерматит, крапивница, IgE-опосредуемая аллергия, атеросклероз, васкулит, идиопатические воспалительные миопатии, гемолитическое заболевание, болезнь Альцгеймера, хроническая воспалительная демиелинизирующая полиневропатия и т.п. Способы согласно изобретению могут быть также применены для лечения воспаления легких, включая, но не ограничиваясь ими, отторжение легочного трансплантата, астму, саркоидоз, эмфизему, кистозный фиброз, идиопатический фиброз легких, хронический бронхит, аллергический ринит и аллергические заболевания легких, такие как пневмонит, ассоциированный с гиперчувствительностью, эозинофильная пневмония, облитерирующий бронхиолит, вызываемый трансплантацией костного мозга и/или легких или другими факторами; атеросклероз/флебосклероз, ассоциированный с трансплантацией; а также фиброз легких, индуцированный коллагеном; сосудистые и аутоиммунные заболевания, такие как ревматоидный артрит и системная красная волчанка.
Указанными воспалительными заболеваниями или аутоиммунными заболеваниями могут быть воспалительные или аутоиммунные заболевания, ассоциированные с CD40-экспрессирующими клетками. Примерами антитело-зависимых аутоиммунных заболеваний являются ревматоидный артрит, псориаз, системная красная волчанка, болезнь Крона, тяжелая миастения, идиопатическая тромбоцитопеническая пурпура или синдром Шегрена.
Кроме того, истощение В-клеток и других CD40-несущих клеток должно ограничивать Т-клеточную активацию путем передачи сигнала посредством связывания с лигандом CD40. Следовательно, истощение В-клеток и других CD40-несущих клеток может быть использовано для лечения Т-клеточно-опосредуемых аутоиммунных и воспалительных заболеваний, таких как рассеянный склероз, отторжение трансплантата, реакция “трансплантат против хозяина”, болезнь Альцгеймера или диабет. Такое истощение также может быть использовано в случае трансплантации костного мозга.
Настоящее изобретение является особенно предпочтительным для лечения воспалительных и аутоиммунных заболеваний, ассоциированных с клетками, экспрессирующими CD40. Описанное здесь антитело CHIR-12.12 может быть использовано для лечения пациентов, страдающих воспалительным или аутоиммунным заболеванием, которое не поддается лечению другими терапевтическими средствами, включая анти-CD20-антитела, такие как ритуксан®, более подробно описанные ниже.
Используемый здесь термин “лечение" означает местное применение или введение анти-CD40-антитела индивидууму, или нанесение на выделенную ткань или клеточную линию индивидуума, либо введение в эту ткань или клеточную линию анти-CD40-антитела, где указанный индивидуум страдает аутоиммунным заболеванием и/или воспалительным заболеванием, имеет симптомы, ассоциированные с аутоиммунным заболеванием и/или воспалительным заболеванием, или имеет предрасположенность к развитию аутоиммунного и/или воспалительного заболевания, и где целью такого введения является лечение заболевания, снижение тяжести, облегчение или ослабление симптомов, подавление развития, модуляция, предотвращение, уменьшение интенсивности, улучшение динамики течения указанного аутоиммунного и/или воспалительного заболевания, либо подавление любых симптомов, ассоциированных с аутоиммунным и/или воспалительным заболеванием, либо устранение риска развития аутоиммунного и/или воспалительного заболевания у пациентов с предрасположенностью к данному заболеванию. Термин “лечение” также означает местное применение или введение фармацевтической композиции, содержащей анти-CD40-антитело, индивидууму, или нанесение на выделенную ткань или клеточную линию индивидуума, либо введение в эту ткань или клеточную линию фармацевтической композиции, содержащей анти-CD40-антитело, где указанный индивидуум страдает аутоиммунным заболеванием и/или воспалительным заболеванием, имеет симптомы, ассоциированные с аутоиммунным заболеванием или воспалительным заболеванием, и/или имеет предрасположенность к развитию аутоиммунного и/или воспалительного заболевания, где целью такого введения является лечение заболевания, снижение тяжести, облегчение или ослабление симптомов, подавление развития, модуляция, предотвращение, уменьшение интенсивности, улучшение динамики течения указанного аутоиммунного и/или воспалительного заболевания, или подавление любых симптомов, ассоциированных с аутоиммунным и/или воспалительным заболеванием, либо устранение риска развития аутоиммунного и/или воспалительного заболевания у пациентов с предрасположенностью к данному заболеванию.
Термин “противовоспалительная активность” означает снижение или предупреждение воспаления. Лечение анти-CD40-антителом, описанное в настоящей заявке, приводит к вырабатыванию физиологического ответа, эффективного для лечения аутоиммунного заболевания и/или воспалительного заболевания, где указанное заболевание ассоциируется с клетками, экспрессирующими антиген CD40. При этом следует отметить, что способы согласно изобретению могут быть применены для предотвращения фенотипических изменений в клетках, таких как пролиферация, активация и т.п.
В терапевтических способах согласно изобретению для стимуляции позитивного терапевтического ответа на воспалительное или аутоиммунное заболевание используется по меньшей мере одно анти-CD40-антитело, описанное в настоящей заявке.
Термин “позитивный терапевтический ответ”, относящийся к воспалительному заболеванию и/или аутоиммунному заболеванию, означает положительную динамику заболевания в сочетании с противовоспалительной активностью антитела и/или ослабление симптомов, ассоциированных с указанным заболеванием. То есть может наблюдаться антипролиферативный эффект, предотвращение последующей пролиферации CD40-экспрессирующих клеток и снижение воспалительного ответа, включая, но не ограничиваясь ими, снижение уровня секреции воспалительных цитокинов, адгезивных молекул, протеаз, иммуноглобулинов (в случаях, когда CD40-несущей клеткой является В-клетка), их комбинации и т.п., повышение уровня продуцирования противовоспалительных белков, снижение числа аутореактивных клеток, повышение иммунотолерантности, снижение выживаемости аутореактивных клеток и/или ослабление одного или нескольких симптомов, опосредуемых стимуляцией CD40-экспрессирующих клеток. Такие положительные терапевтические ответы не ограничиваются способом введения и могут включать введение донору, в донорную ткань (например, путем перфузии органа), хозяину или указанным объектам в любой их комбинации и т.п.
Клинический ответ может быть оценен с применением методов скрининга, таких как визуализирующее сканирование с помощью магнитного резонанса (MRI), рентгеновская визуализация, компьютерная томография (КТ), проточная цитометрия или клеточный сортинг с активацией флуоресценции (FACS), гистологический анализ, макропатологический анализ и химический анализ крови, включая, но не ограничиваясь ими, изменения, детектируемые с помощью ELISA, РИА, хроматографии и т.п. Помимо указанных позитивных терапевтических ответов, лечение индивидуума анти-CD40-антителом может давать благоприятный эффект, а именно способствовать ослаблению симптомов, ассоциированных с данным заболеванием.
Термин “терапевтически или профилактически эффективная доза” или “терапевтически или профилактически эффективное количество” означает количество анти-CD40-антитела, которое при его введении дает позитивный терапевтический ответ на лечение пациента, страдающего воспалительным заболеванием или аутоиммунным заболеванием, ассоциированным с CD40-экспрессирующими клетками. Подходящие дозы более подробно описаны ниже. Способ лечения может включать одно введение терапевтически эффективной дозы или многократные введения терапевтически эффективной дозы анти-CD40-антитела, более подробно описанные ниже.
Способы согласно изобретению могут быть особенно подходящими для лечения воспалительных заболеваний или аутоиммунных заболеваний, включая заболевания, перечисленные выше, которые не поддаются лечению одним или несколькими известными методами лечения воспалительных или аутоиммунных заболеваний. Такими методами лечения являются, но не ограничиваются ими, хирургия или хирургические операции (например, спленэктомия, лимфаденэктомия, тироидэктомия, плазмаферез, лейкаферез, трансплантация клеток, тканей или органов, операции на тонком кишечнике, перфузия органов и т.п.), лучевая терапия, стероидная и нестероидная терапия, гормональная терапия, терапия цитокинами, терапия с использованием дерматологических средств (например, средств местного действия, используемых для лечения кожных болезней, таких как аллергии, контактный дерматит и псориаз), терапия иммунодепрессантами и терапия другими противовоспалительными моноклональными антителами, и т.п., более подробно описанные ниже. Термин “не поддающийся лечению” относится к конкретному воспалительному заболеванию или аутоиммунному заболеванию, которое является резистентным или нечувствительным к конкретно применяемой терапии. Воспалительное заболевание или аутоиммунное заболевание может быть резистентным к конкретной терапии с самого начала применения этой конкретной терапии (то есть это заболевание может быть невосприимчивым к первоначальной терапии), либо такая резистентность может вырабатываться во время первого курса лечения или в его последующие периоды. Таким образом, настоящее изобретение может быть использовано для лечения пациента с воспалительным или аутоиммунным заболеванием, которое не поддается лечению либо является резистентным или невосприимчивым к ранее применяемой терапии.
Способы настоящего изобретения включают применение анти-CD40-антител. “Антитела" обычно представляют собой гетеротетрамерные гликопротеины размером примерно 150000 Да, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, а число дисульфидных связей в тяжелых цепях иммуноглобулинов различных изотипов варьируется. Каждая тяжелая и легкая цепь также имеют правильно расположенные внутрицепьевые дисульфидные мостики. Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH), за которым следует ряд константных доменов. Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на другом конце, причем константный домен легкой цепи находится непосредственно напротив константного домена тяжелой цепи, а вариабельный домен легкой цепи находится непосредственно напротив вариабельного домена тяжелой цепи. Очевидно, что конкретные аминокислотные остатки образуют границу между вариабельными доменами легкой и тяжелой цепей. Термин “вариабельный” означает, что некоторые части вариабельных доменов имеют последовательности, значительно отличающиеся у различных антител. Вариабельные области сообщают специфичность связывания с антигеном. Константные домены не принимают непосредственного участия в связывании антитела с антигеном, но обладают различными эффекторными функциями, такими как связывание с Fc-рецептором (FcR), участие антитела в вырабатывании антитело-зависимой клеточной токсичности, инициация комплемент-зависимой цитотоксичности и дегрануляция тучных клеток.
"Легкие цепи" антител (иммуноглобулинов) позвоночных любых видов могут быть отнесены к одному из двух абсолютно различных типов, называемых каппа (κ) и лямбда (λ), исходя из аминокислотных последовательностей их константных доменов.
Иммуноглобулины, в зависимости от аминокислотной последовательности константного домена “тяжелых цепей”, могут быть отнесены к различным классам. Существует пять основных классов человеческих иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, а некоторые из этих классов иммуноглобулинов могут быть дополнительно подразделены на подклассы (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, соответствующие иммуноглобулинам различных классов, называются альфа, дельта, эпсилон, гамма и мю, соответственно. Субъединичные структуры и трехмерные конфигурации иммуноглобулинов различных классов хорошо известны специалистам. Различные изотипы имеют различные эффекторные функции. Так, например, человеческие изотипы IgG1 и IgG3 обладают ADCC-активностью (антитело-зависимой клеточно-опосредуемой цитотоксичностью). Антитела IgG1, а в частности человеческие антитела IgG1, являются особенно подходящими для их применения в способах согласно изобретению.
“Человеческие эффекторные клетки" представляют собой лейкоциты, экспрессирующие один или несколько FcR и обладающие эффекторными функциями. Эти клетки предпочтительно экспрессируют по меньшей мере FcγRIII и осуществляют эффекторную функцию, заключающуюся в вырабатывании антитело-зависимой клеточно-опосредуемой цитотоксичности (ADCC). Примерами человеческих лейкоцитов, которые опосредуют ADCC, являются мононуклеарные клетки периферической крови (МКПК), природные клетки-киллеры (NK), моноциты, макрофаги, эозинофилы и нейтрофилы, при этом предпочтительными являются МКПК и NK. Антителами, обладающими ADCC-активностью, обычно являются антитела изотипа IgG1 и IgG3. Следует отметить, что помимо выделения антител IgG1 и IgG3, такие ADCC-опосредующие антитела могут быть получены путем встраивания вариабельной области, происходящей от антитела, не обладающего ADCC-активностью, или фрагмента вариабельной области в константную область антитела изотипа IgG1 или IgG3.
Термины “Fc-рецептор” или “FcR” используются для описания рецептора, который связывается с Fc-областью антитела. Предпочтительным FcR является человеческий FcR с нативной последовательностью. Кроме того, предпочтительным FcR является FcR, который связывается с антителом IgG (гамма-рецептор), и рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и альтернативно сплайсированные формы этих рецепторов. Рецепторами FcγRII являются FcγRIIA (“активирующий рецептор”) и FcγRIIB (“ингибирующий рецептор”), которые имеют аналогичные аминокислотные последовательности, отличающиеся, главным образом, своими цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит в своем цитоплазматическом домене тирозинсодержащий активирующий мотив иммунорецептора (ITAM). Ингибирующий рецептор FcγRIIB содержит в своем цитоплазматическом домене тирозинсодержащий ингибирующий мотив иммунорецептора (ITIM) (см. обзор М. Daeron, Annu. Rev. Immunol., 15:203-234 (1997)). FcR описаны у Ravetch and Kinet, Annu. Rev. Immunol. 9:457-92 (1991); Capel et al., Immunomethods, 4:25-34 (1994) и de Haas et al., (1995) J. Lab. Clin. Med., 126:330-341. Используемый здесь термин “FcR” также охватывает и другие FcR, включая FcR, которые будут идентифицированы в будущем. Этот термин также включает рецептор, имеющийся у новорожденных, FcRn, который является ответственным за передачу материнских IgG плоду (Guyer et al., (1976) J. Immunol., 117:587 и Kim et al., (1994) J. Immunol., 24:249 (1994)).
Термин “антитело” используется здесь в самом широком смысле и охватывает полноразмерные антитела, фрагменты антител, которые сохраняют способность специфически связываться с антигеном CD40 (например, Fab-, F(ab')2-, Fv-фрагменты и другие фрагменты, одноцепочечные антитела, диантитела, химерные антитела, гибридные антитела, биспецифические антитела, гуманизованные антитела и т.п.) и рекомбинантные пептиды, содержащие вышеуказанные фрагменты. Термин “антитело" охватывает как поликлональные антитела, так и моноклональные антитела.
Используемый здесь термин “анти-CD40-антитело" включает любое антитело, которое специфически распознает антиген CD40. В некоторых вариантах изобретения анти-CD40-антитела, используемые в способах согласно изобретению, а в частности моноклональные анти-CD40-антитела, обладают высокой аффинностью связывания с антигеном CD40 в одном сайте. Такие моноклональные антитела обладают аффинностью связывания с CD40 (KD), составляющей по меньшей мере 10-5 М, по меньшей мере 3×10-5 М, предпочтительно по меньшей мере 10-6 М или по меньшей мере 10-7 М, а более предпочтительно по меньшей мере 10-8 М или по меньшей мере 10-12 М, как было определено с помощью стандартного анализа, такого как BiacoreTM. Анализ Biacore известен специалистам и подробно описан в руководстве "BIAapplications handbook". Для модуляции аффинности связывания могут быть использованы методы, описанные в WO 01/27160.
Термины “специфически распознает” или “специфически связывается” означают, что анти-CD40-антитело не связывается с неродственными антигенами, такими как антиген CD20.
В некоторых вариантах анти-CD40-антитела, применяемые в способах согласно изобретению, а в частности моноклональные антитела, обладают высокой аффинностью связывания с человеческим FcγRIIIa-158V. Предпочтительно, анти-CD40-антитело, применяемое в способах согласно изобретению, связывается с человеческим FcγRIIIa-158V с аффинностью (KD), составляющей по меньшей мере примерно 0,5 мкМ, как было определено с помощью стандартного анализа, такого как BiacoreTM. Как описано в примере 6, антитело CHIR-12.12 связывается с человеческим FcγRIIIa-158V с аффинностью (KD), составляющей 492 нМ.
В некоторых вариантах анти-CD40-антитела, применяемые в способах согласно изобретению, а в частности моноклональные антитела, обладают высокой аффинностью связывания с человеческим FcγRIIIa-158F. Предпочтительно, анти-CD40-антитело, применяемое в способах согласно изобретению, связывается с человеческим FcγRIIIa-158F с аффинностью (KD), составляющей по меньшей мере примерно 12 мкМ, как было определено с помощью стандартного анализа, такого как BiacoreTM. Предпочтительно, анти-CD40-антитело, применяемое в способах согласно изобретению, связывается с человеческим FcγRIIIa-158F с аффинностью (KD), составляющей по меньшей мере примерно 10 мкМ, по меньшей мере примерно 8 мкМ, по меньшей мере примерно 6 мкМ, по меньшей мере примерно 5 мкМ, по меньшей мере примерно 4 мкМ или по меньшей мере примерно 3 мкМ. Как описано в примере 6, антитело CHIR-12.12 связывается с человеческим FcγRIIIa-158F с аффинностью (KD), составляющей 2,8 мкМ.
В некоторых вариантах анти-CD40-антитела, применяемые в способах согласно изобретению, а в частности моноклональные антитела, обладают высокой аффинностью связывания с человеческим FcγRIIIa-158V и FcγRIIIa-158F. Предпочтительно, анти-CD40-антитело, применяемое в способах согласно изобретению, связывается с человеческим FcγRIIIa-158V с аффинностью (KD), составляющей по меньшей мере примерно 0,5 мкМ, и с человеческим FcγRIIIa-158F с аффинностью (KD), составляющей по меньшей мере примерно 12 мкМ, как было определено с помощью стандартного анализа, такого как BiacoreTM.
Антитела, применяемые в способах согласно изобретению, могут быть продуцированы любым подходящим методом получения антител, известным специалистам.
Анти-CD40-антителом, применяемым в способах согласно изобретению, может быть поликлональное антитело. Таким образом, поликлональная сыворотка может быть получена стандартными методами. В общих чертах, раствор, содержащий представляющий интерес антиген (в данном случае антиген CD40), сначала используется для иммунизации подходящего животного, а предпочтительно мыши, крысы, кролика или козы. Для получения поликлональной сыворотки предпочтительными являются кролики или козы, что обусловлено объемом выделяемой сыворотки и доступностью меченых антикроличьих и антикозьих антител.
Сыворотка от иммунизованных животных может быть скринирована на реактивность антитела против исходного антигена. Лимфоциты могут быть выделены из лимфоузлов или клеток селезенки, из которых могут быть затем выбраны В-клетки путем отбора на CD138-негативные и CD19-позитивные клетки. В одном из аспектов изобретения такие В-клеточные культуры (BCC) могут быть слиты с миеломными клетками с получением гибридом, подробно описанных в настоящей заявке.
Поликлональная сыворотка может быть также получена от трансгенного животного, а предпочтительно мыши, несущей локус человеческого иммуноглобулина. В предпочтительном варианте изобретения клетки Sf9, экспрессирующие представляющий интерес белок (в данном случае антиген CD40), используются в качестве иммуногена. Иммунизация может быть также осуществлена путем смешивания или эмульгирования антигенсодержащего раствора в физиологическом растворе, предпочтительно в адъюванте, таком как полный адъювант Фрейнда, и парентерального введения (обычно подкожного или внутримышечного) указанной смеси или эмульсии. Обычно достаточной является доза 50-200 мкг/инъекцию. Иммунизацию обычно повторяют через 2-6 недель с введением одной или нескольких инъекций белка в физиологическом растворе, предпочтительно, с использованием неполного адъюванта Фрейнда. Альтернативно, могут быть получены антитела путем in vitro иммунизации с применением известных методов, которые с точки зрения настоящего изобретения рассматриваются как эквивалентные методы иммунизации in vivo. Поликлональную антисыворотку получают путем забора крови у иммунизованного животного в стеклянный или пластиковый контейнер и инкубирования крови при 25°С в течение одного часа с последующим инкубированием при 4°С в течение 2-18 часов. Сыворотку выделяют путем центрифугирования (например, 1000 g в течение 10 минут). От кроликов может быть получено примерно 20-50 мл крови.
Продуцирование клеток Sf9 (Spodoptera frugiperda) описано в патенте США № 6004552, который вводится в настоящее описание посредством ссылки. Вкратце, в случае CD40, рекомбинантные последовательности, кодирующие человеческий CD40, были получены в бакуловирусе с использованием трансфицирующих векторов. Плазмиды ко-трансфицировали ДНК бакуловируса дикого типа в клетках Sf9. Клетки Sf9, инфицированные рекомбинантным бакуловирусом, идентифицировали и клонально очищали.
Анти-CD40-антителом, применяемым в способах согласно изобретению, может быть моноклональное антитело. Используемый здесь термин “моноклональное антитело” (“mAb") означает антитело, полученное, в основном, из гомогенной популяции антител, то есть отдельные антитела, входящие в такую популяцию, являются идентичными, за исключением тех случаев, когда в этих антителах присутствуют возможные природные мутации в небольших количествах. Этот термин не ограничивается рассматриваемыми видами антител и конкретным способом их продуцирования.
В противоположность препаратам поликлональных антител, которые обычно включают различные антитела, направленные против различных антигенных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты (эпитопа) на антигене.
Термин “эпитоп” означает часть антигенной молекулы, против которой вырабатывается данное антитело и с которой оно связывается. Эпитопы могут содержать линейные аминокислотные остатки (то есть остатки в данном эпитопе расположены последовательно друг за другом в линейном порядке), нелинейные аминокислотные остатки (называемые здесь “нелинейными эпитопами”, то есть эти эпитопы расположены не в линейном порядке), или как линейные, так и нелинейные аминокислотные остатки. Моноклональное анти-CD40-антитело, подходящее для его применения в способах согласно изобретению, может обладать способностью к специфическому связыванию с эпитопом на человеческом антигене CD40, экспрессируемом на поверхности человеческих клеток, то есть с эпитопом, находящимся на поверхности клеток.
Моноклональные антитела, используемые в соответствии с настоящим изобретением, могут быть получены гибридомным методом, который был впервые описан Kohler et al. (1975) Nature 256:495, либо они могут быть получены методами рекомбинантных ДНК (см., например, патент США № 4816567). Моноклональные антитела могут быть также выделены из фаговых библиотек антител, полученных методами, описанными, например, в публикациях McCafferty et al. (1990) Nature 348:552-554 (1990) и в патенте США № 5514548. В публикации Clackson et al (1991) Nature 352:624-628 и Marks et al. (1991) J. Mol. Biol. 222:581-597 описано выделение мышиных и человеческих антител, соответственно, с использованием фаговых библиотек. В более поздних публикациях описано продуцирование высокоаффинных (в пределах нМ) человеческих антител путем перестановки цепей (Marks et al. (1992) Bio/Technology 10:779-783), а также путем комбинированного инфицирования и рекомбинации in vivo, применяемой в качестве стратегии для конструирования очень больших фаговых библиотек (Waterhouse et al. (1993) Nucleic. Acids Res. 21:2265-2266). Таким образом, эти методы являются приемлемой альтернативой традиционным гибридомным технологиям, применяемым для выделения моноклональных антител.
В традиционном методе Kohler et al. (1975) Nature 256:495-496, мышь обычно иммунизируют раствором, содержащим антиген. Иммунизация может быть осуществлена путем смешивания или эмульгирования антигенсодержащего раствора в физиологическом растворе, а предпочтительно в адъюванте, таком как полный адъювант Фрейнда, и парентерального введения такой смеси или эмульсии. Для получения моноклональных антител согласно изобретению может быть применен любой метод иммунизации, известный специалистам. После иммунизации животного селезенку (и, необязательно, несколько крупных лимфоузлов) удаляют и разделяют на отдельные клетки. Клетки селезенки могут быть скринированы путем нанесения клеточной суспензии на планшет или лунку, покрытые представляющим интерес антигеном. B-клетки, экспрессирующие мембраносвязанный иммуноглобулин, специфичный к данному антигену, связываются с планшетом и не удаляются путем промывки. Затем полученные В-клетки или все диссоциированные клетки селезенки подвергают слиянию с миеломными клетками с получением гибридом, которые культивируют в селективной среде. Полученные клетки высевают путем серийного разведения и анализируют на продуцирование антител, специфически связывающихся с представляющим интерес антигеном (и не связывающихся с неродственными антигенами). Затем отобранные гибридомы, секретирующие моноклональное антитело (mAb), культивируют либо in vitro (например, в колбах для культивирования тканей или в реакторах с системой полых волокон), либо in vivo (в асцитах у мышей).
В другом аспекте изобретения B-клеточные культуры, предпочтительно, могут быть дополнительно скринированы на реактивность с исходным антигеном. Такой скрининг включает твердофазный иммуноферментный анализ (ELISA), проводимый с использованием белка антигена-мишени; анализ на конкурентное связывание известных антител с представляющим интерес антигеном; и in vitro анализ на связывание с временно трансфицированными CHO или другими клетками, которые экспрессируют антиген-мишень.
Если анти-CD40-антитела, применяемые в способах согласно изобретению, получают методами рекомбинантных ДНК, где ДНК, кодирующая моноклональные антитела, может быть легко выделена и секвенирована стандартными методами (например, с использованием олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелые и легкие цепи мышиных антител). Описанные здесь гибридомные клетки служат предпочтительным источником такой ДНК. После выделения ДНК может быть помещена в экспрессионные векторы, которые затем переносят в клетки-хозяева, такие как E.coli, обезьяньи клетки COS, клетки яичника китайского хомячка (СНО) или миеломные клетки, которые, в иных случаях, не продуцируют белок иммуноглобулин, в результате чего в этих рекомбинантных клетках-хозяевах синтезируются моноклональные антитела. Обсуждение рекомбинантной экспрессии антитело-кодирующей ДНК в бактериях можно найти в статьях Skerra et al. (1993), Curr. Opinion in Immunol., 5:256-262 и Phickthun (1992), Immunol. Revs., 130:151. Альтернативно, антитело может быть продуцировано в клеточной линии, такой как клеточная линия CHO, как описано в патентах США №№ 5545403, 5545405 и 5998144, которые вводятся в настоящее описание посредством ссылки. Вкратце, клеточную линию трансфицируют векторами, способными экспрессировать легкую цепь и тяжелую цепь, соответственно. Химерные антитела могут быть продуцированы путем трансфекции двумя белками на отдельных векторах. Другим преимуществом является “правильное” гликозилирование антитела.
Используемый здесь термин “клетка-хозяин” означает микроорганизм или эукариотическую клетку или клеточную линию, культивированные в виде одноклеточного микроорганизма, который может быть или был использован в качестве реципиента для рекомбинантного вектора или других полинуклеотидов-переносчиков, а также включает потомство исходной клетки, которая была трансфицирована. Следует отметить, что потомство одной клетки необязательно должно быть полностью идентично родительской клетке по своей морфологии, геномной или полноразмерной ДНК, что может быть обусловлено природными, случайными или искусственными мутациями.
В некоторых вариантах изобретения анти-CD40-антитело, такое как CHIR-12.12, продуцируют в клетках CHO с использованием системы экспрессии гена GS (Lonza Biologies, Portsmouth, New Hampshire), которая использует глутамин-синтетазу в качестве маркера. См. также патенты США №№ 5122464; 5591639; 5658759; 5770359; 5827739; 5879936; 5891693 и 5981216, содержание которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Моноклональные антитела против CD40 известны специалистам. См., например, разделы, посвященные B-клеточному антигену, в публикации McMichael ed. (1987; 1989) Leukocyte Typing III and IV (Oxford University Press, New York); в патентах США №№ 5674492; 5874082; 5677165; 6056959; в WO 00/63395; в опубликованных международных заявках №№ WO 02/28905 и WO 02/28904; и в публикациях Gordon et al. (1988) J. Immunol. 140:1425; Valle et al. (1989) Eur. J. Immunol. 19:1463; Clark et al. (1986) PNAS 83:4494; Paulie et al. (1989) J. Immunol. 142:590; Gordon et al. (1987) Eur. J. Immunol. 17:1535; Jabara et al. (199O) J. Exp. Med. 172:1861; Zhang et al. (1991) J. Immunol. 146:1836; Gascan et al. (1991) J. Immunol. 147:8; Banchereau et al. (1991) Clin. Immunol. Spectrum 3:8; и Banchereau et al. (1991) Science 251:70; которые вводятся в настоящее описание посредством ссылки.
Как указывалось выше, используемый здесь термин “антитело" включает химерные антитела. Термин “химерные антитела” означает антитела, которые наиболее предпочтительно получают рекомбинантными методами с использованием дезоксирибонуклеиновых кислот и которые содержат как человеческие (включая антитела иммунологически “родственных” видов, например от шимпанзе), так и нечеловеческие компоненты. Так, например, наиболее предпочтительно, чтобы константная область химерного антитела была по существу идентична константной области природного человеческого антитела, а вариабельная область химерного антитела происходила от нечеловеческого источника и обладала нужной антигенной специфичностью к представляющему интерес антигену (CD40). Таким нечеловеческим источником может быть любое позвоночное, которое может быть использовано для вырабатывания антител против антигена CD40. Указанными нечеловеческими источниками являются, но не ограничиваются ими, грызуны (например, кролики, крысы, мыши и т.п., см., например, патент США № 4816567, который вводится в настоящее описание посредством ссылки) и приматы, не являющиеся человеком (например, мартышки, человекообразные обезьяны и т.п.; см., например, патенты США №№ 5750105 и 5756096, которые вводятся в настоящее описание посредством ссылки).
Как указывалось выше, используемый здесь термин “антитело" охватывает гуманизованные антитела. “Гуманизованные формы” антител содержат минимальную последовательность, происходящую от нечеловеческого иммуноглобулина. По большей части, гуманизованные антитела представляют собой человеческие иммуноглобулины (антитело реципиента), в которых остатки, происходящие от гипервариабельной области (также известной как комплементарность-определяющая область или CDR) данного антитела-реципиента, заменены остатками, происходящими от гипервариабельной области нечеловеческого антитела (донорного антитела), такого как мышиное антитело, крысиное антитело, кроличье антитело или антитело приматов, не являющихся человеком, где указанные антитела обладают нужной специфичностью, аффинностью и связывающей способностью. Термин “комплементарность-определяющая область” означает аминокислотные последовательности, которые, в целом, определяют аффинность и специфичность связывания природной Fv-области нативного сайта связывания иммуноглобулина. См., например, Chothia et al. (1987) J. Mol. Biol. 196:901-917; Kabat et al. (1991) U.S. Dept. of Health and Human Services, NIH Publication № 91-3242). Термин “константная область” означает часть молекулы антитела, которая сообщает эффекторные функции. В предыдущей работе, относящейся к продуцированию неиммуногенных антител, применяемых для лечения человеческого заболевания, мышиные константные области были заменены человеческими константными областями. Константные области рассматриваемых гуманизованных антител происходят от человеческих иммуноглобулинов. Однако эти гуманизованные антитела могут вырабатывать нежелательные и потенциально опасные иммунные ответы у человека и могут терять свою аффинность.
Гуманизация может быть осуществлена методом, описанным Winter и сотрудниками (Jones et al. (1986) Nature 321 :522-525; Riechmann et al. (1988) Nature 332:323-327; Verhoeyen et al. (1988) Science 239:1534-1536), путем замены последовательностей CDR грызунов или мутантных CDR грызунов соответствующими последовательностями человеческого антитела. См. также патенты США №№ 5225539; 5585089; 5693761; 5693762; 5859205, которые вводятся в настоящее описание посредством ссылки. В некоторых случаях остатки в каркасных областях одной или нескольких вариабельных областей человеческого иммуноглобулина заменяются соответствующими нечеловеческими остатками (см, например, патенты США №№ 5585089; 5693761; 5693762 и 6180370). Кроме того, гуманизованные антитела могут содержать остатки, не обнаруженные в антителе реципиента или в антителе донора. Такие модификации вводят для дополнительного уточнения свойств антител (например, для получения нужной аффинности). В общих чертах, гуманизованное антитело может содержать, по существу, все или по меньшей мере одно, а обычно два вариабельных домена, в которых все или по существу все гипервариабельные области соответствуют гипервариабельным областям нечеловеческого иммуноглобулина, а все или по существу все каркасные области представляют собой области последовательности человеческого иммуноглобулина. Такое гуманизованное антитело может также, но необязательно, содержать по меньшей мере часть константной области иммуноглобулина (Fc), обычно человеческого иммуноглобулина. Более подробное описание см. в публикациях Jones et al. (1986) Nature 331:522-525; Riechmann et al. (1988) Nature 332:323-329; и Presta (1992) Curr. Op. Struct. Biol. 2:593-596; которые вводятся в настоящее описание посредством ссылки. В соответствии с этим, такими “гуманизованными антителами” могут быть антитела, в которых последовательность, являющаяся по существу частью интактного человеческого вариабельного домена, была заменена соответствующей последовательностью, происходящей от нечеловеческих антител. Фактически, гуманизованные антитела обычно представляют собой человеческие антитела, в которых некоторые остатки CDR и, возможно, некоторые каркасные остатки заменены остатками, происходящими от аналогичных сайтов антител грызунов. См., например, патенты США №№ 5225539; 5585089; 5693761; 5693762; 5859205. См. также патент США № 6180370 и опубликованную международную заявку № WO 01/27160, где описаны гуманизованные антитела и способы продуцирования гуманизованных антител, обладающих повышенной аффинностью к уже определенному антигену.
Гуманизованные анти-CD40-антитела могут быть также получены с применением методов конструирования человеческих антител (Human EngineeringTM technology) (Xoma Ltd., Berkeley, California).
Гуманизованными моноклональными анти-CD40-антителами являются антитела, такие как антитело SGN-40 (Tai et al. (2004) Cancer Res. 64:2846-52; патент США № 6838261), которое представляет собой гуманизованную форму мышиного анти-CD40-антитела SGN-14 (Francisco et al. (2000) Cancer Res. 60:3225-31), и антитела, описанные в публикации заявки на патент США № 2004/0120948, которая во всей своей полноте вводится в настоящее описание посредством ссылки.
Настоящее изобретение может быть также осуществлено с использованием ксеногенных или модифицированных антител, продуцируемых у млекопитающего-хозяина, не являющегося человеком, а более конкретно у трансгенной мыши, и отличающихся инактивированным эндогенным локусом иммуноглобулина (Ig). У таких трансгенных животных компетентные эндогенные гены, экспрессирующие субъединицы легкой и тяжелой цепей человеческих иммуноглобулинов хозяина, делают нефункциональными и заменяют аналогичными локусами человеческого иммуноглобулина. У указанных трансгенных животных продуцируются человеческие антитела, в основном, в отсутствие субъединиц легкой или тяжелой цепи иммуноглобулина хозяина. См., например, патенты США №№ 5877397 и 5939598, которые вводятся в настоящее описание посредством ссылки.
Таким образом, в некоторых вариантах изобретения полностью человеческие антитела против CD40 получают, например, путем иммунизации трансгенных мышей. Одну из таких мышей получают с применением технологии XenoMouse® (Abgenix; Fremont, California), описанной в патентах США №№ 6075181, 6091001 и 6114598, которые вводятся в настоящее описание посредством ссылки. Так, например, для продуцирования антитела CHIR-12.12, мышей, трансгенных по локусу тяжелой цепи человеческого IgG1 и локусу человеческой легкой цепи каппа, иммунизуют клетками Sf9, экспрессирующими человеческий CD40. Эти мыши могут быть также трансгенными по другим изотипам. Полностью человеческие анти-CD40-антитела, применяемые в способах согласно изобретению, характеризуются связывающими свойствами, аналогичными свойствам, которые имеет моноклональное антитело CHIR-12.12.
Как указывалось выше, используемый здесь термин “антитело” также охватывает фрагменты антител, которые могут связываться с антигеном. “Фрагменты антител” содержат часть интактного антитела, а предпочтительно антигенсвязывающую или вариабельную область интактного антитела. Примерами фрагментов антител являются Fab-, Fab'-, F(ab')2- и Fv-фрагменты; диантитела; линейные антитела (Zapata et al. (1995) Protein Eng. 10:1057 1062); молекулы одноцепочечных антител; и мультиспецифические антитела, происходящие от фрагментов антител. В результате гидролиза антител папаином образуются два идентичных антигенсвязывающих фрагмента, называемых “Fab”-фрагментами, каждый из которых имеет один антигенсвязывающий сайт и один оставшийся “Fc”-фрагмент, название которого указывает на его способность легко кристаллизоваться. Обработка пепсином приводит к образованию F(ab')2-фрагмента, который имеет два антигенсвязывающих сайта и способен к перекрестному связыванию с антигеном.
“Fv” представляет собой минимальный фрагмент антитела, содержащий полноразмерный антигенраспознающий сайт и антигенсвязывающий сайт. Эта область состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи, жестко связанных друг с другом нековалентной связью. Указанная область имеет такую конфигурацию, при которой три CDR каждого вариабельного домена взаимодействуют друг с другом таким образом, что они образуют антигенсвязывающий сайт на поверхности димера VH-VL. Все шесть CDR сообщают антителу специфичность связывания с антигеном. Однако даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичные к антигену) обладает способностью распознавать антиген и связываться с ним, хотя и с меньшей аффинностью, чем весь сайт связывания.
Fab-фрагмент также содержит константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Fab-фрагменты отличаются от Fab'-фрагментов тем, что они имеют несколько дополнительных остатков у карбоксиконца СН1-домена тяжелой цепи, включая один или несколько цистеинов, происходящих от шарнирной области антитела. Используемое здесь обозначение Fab'-SH означает Fab'-фрагмент, в котором цистеиновый(е) остаток(ки) константных доменов имеет(ют) свободную тиоловую группу. Fab'-фрагменты продуцируются посредством восстановления дисульфидного мостика тяжелой цепи F(ab')2-фрагмента. Также известны и другие химические связи, соединяющие фрагменты антитела.
Фрагменты анти-CD40-антитела являются подходящими для их применения в способах согласно изобретению при условии, что они сохраняют нужную аффинность полноразмерного антитела. Так, например, фрагмент анти-CD40-антитела сохраняет способность связываться с антигеном CD40. Такие фрагменты отличаются тем, что их свойства аналогичны свойствам соответствующего полноразмерного антитела. Так, например, фрагмент полноразмерного анти-CD40-антитела-антагониста, предпочтительно, обладает способностью специфически связываться с человеческим антигеном CD40, экспрессируемым на поверхности человеческой клетки, и не обладает значительной агонистической активностью, но при этом он обладает антагонистической активностью при его связывании с антигеном CD40 на человеческой CD40-экспрессирующей клетке. Такие фрагменты называются здесь “антигенсвязывающими фрагментами”. Фрагменты анти-CD40-антитела, применяемые в способах согласно изобретению, также, предпочтительно, сохраняют способность связываться с соответствующим FcR или с соответствующими FcR. Так, например, фрагмент анти-CD40-антитела может сохранять способность связываться с FcγRIIIa. Так, например, фрагмент полноразмерного анти-CD40-антитела может обладать специфичностью связывания с антигеном CD40 клеточной поверхности, а также способностью связываться с FcγRIIIa на человеческих эффекторных клетках, таких как природные клетки-киллеры (NK). Такие фрагменты называются здесь “FcR-связывающими фрагментами". Указанные фрагменты обычно включают по меньшей мере часть константного домена тяжелой цепи.
Для продуцирования фрагментов антител были разработаны различные методы. Традиционно, эти фрагменты получают путем протеолитического расщепления интактных антител (см., например, Morimoto et al. (1992) Journal of Biochemical and Biophysical Methods 24:107-117 (1992) и Brennan et al. (1985) Science 229:81). Однако эти фрагменты могут продуцироваться непосредственно рекомбинантными клетками-хозяевами. Так, например, фрагменты антител могут быть выделены из фаговых библиотек антител, обсуждаемых выше. Альтернативно, Fab'-SH-фрагменты могут быть непосредственно выделены из E.coli и химически присоединены с образованием F(ab')2-фрагментов (Carter et al. (1992) Bio/Technology 10:163-167). В соответствии с другим подходом, F(ab')2-фрагменты могут быть непосредственно выделены из культур рекомбинантных клеток-хозяев. Специалистам известны и другие методы получения фрагментов антител.
Подходящие антигенсвязывающие фрагменты антитела содержат часть полноразмерного антитела, а обычно его антигенсвязывающую или вариабельную область. Примерами фрагментов антител являются, но не ограничиваются ими, Fab-, F(ab')2- и Fv-фрагменты, и одноцепочечные молекулы антител. “Fab" представляет собой одновалентный антигенсвязывающий фрагмент иммуноглобулина, состоящий из легкой цепи и части тяжелой цепи. F(ab')2-фрагмент представляет собой двухвалентный антигенсвязывающий фрагмент иммуноглобулина, содержащий обе легкие цепи и часть обеих тяжелых цепей. Термин “одноцепочечный Fv” или “sFv”-фрагменты антитела означает фрагменты, содержащие VH- и VL-домены антитела, где указанные домены присутствуют в одной полипептидной цепи. См., например, патенты США №№ 4946778, 5260203, 5455030 и 5856456, которые вводятся в настоящее описание посредством ссылки. Вообще говоря, полипептид Fv также содержит полипептидный линкер, расположенный между VH- и VL-доменами, что позволяет sFv-фрагменту образовывать нужную структуру для связывания с антигеном. Описание sFv можно найти в публикациях Pluckthun (1994) in The Pharmacology of Monoclonal Antibodies, Vol. 113, ed. Rosenburg and Moore (Springer-Verlag, New York), pp. 269-315. Антигенсвязывающие фрагменты описанных здесь анти-CD40-антител-антагонистов могут быть также конъюгированы с цитотоксином для осуществления цитолиза клеток-мишеней, как описано ниже.
В некоторых вариантах изобретения анти-CD40-антитело представляет собой анти-CD40-антитело-антагонист. Если такие антитела связываются с CD40, присутствующим на поверхности человеческих клеток, таких как человеческие В-клетки, то они не индуцируют значительной агонистической активности. В некоторых вариантах изобретения связывание антител с CD40, присутствующим на поверхности человеческих клеток, приводит к ингибированию пролиферации и дифференцировке таких человеческих клеток. Анти-CD40-антителами, подходящими для применения в способах согласно изобретению, являются антитела, которые могут обладать антагонистической активностью по отношению к нормальным и злокачественным человеческим клеткам, экспрессирующим на своей поверхности антиген CD40.
Термин “агонистическая активность" означает, что данное вещество действует как агонист. Агонист связывается с рецептором на клетке и инициирует реакцию или активность, которые аналогичны реакции или активности, инициируемой природным лигандом рецептора, или имеет такую же реакцию или активность. Агонист CD40 индуцирует любые или все нижеследующие ответы, такие как, но не ограничивающиеся ими, пролиферация и/или дифференцировка В-клеток; активация межклеточной адгезии посредством таких молекул, как ICAM-1, E-селектин, VCAM и т.п.; секреция провоспалительных цитокинов, таких как IL-1, IL-6, IL-8, IL-12, TNF и т.п.; передача сигнала посредством рецептора CD40 по таким путям, как TRAF (например, TRAF2 и/или TRAF3), киназа MAP, такая как NIK (NF-kB-индуцирующая киназа), киназы I-каппа B (IKK α/β), транскрипционный фактор NF-kB, Ras и путь MEK/ERK, путь PI3K/AKT, путь P38 MAPK и т.п.; передача антиапоптотического сигнала такими молекулами, как XIAP, mcl-1, bcl-x и т.п.; образование B- и/или T-клеток памяти; продуцирование антител В-клетками; переключение изотипа антител, вырабатываемых В-клетками; активация экспрессии МНС класса II и CD80/86 на клеточной поверхности и т.п.
Термин “значительная” агонистическая активность означает агонистическую активность, которая по меньшей мере на 30%, 35%, 40%, 45%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95% или 100% превышает агонистическую активность, индуцируемую нейтральным веществом или веществом, используемым в качестве негативного контроля, как было определено в анализе на В-клеточный ответ. Предпочтительной “значительной” агонистической активностью является агонистическая активность, которая по меньшей мере в 2 раза или по меньшей мере в 3 раза превышает агонистическую активность, индуцируемую нейтральным веществом или веществом, используемым в качестве негативного контроля, как было определено в анализе на В-клеточный ответ. Так, например, если представляющим интерес В-клеточным ответом является пролиферация В-клеток, то “значительная” агонистическая активность должна представлять собой индуцирование уровня пролиферации В-клеток, который по меньшей мере в 2 раза или по меньшей мере в 3 раза превышает уровень пролиферации В-клеток, индуцируемый нейтральным веществом или веществом, используемым в качестве негативного контроля. В одном из вариантов изобретения в качестве негативного контроля служит неспецифический иммуноглобулин, например IgG1, который не связывается с CD40. Вещество, “по существу не имеющее агонистической активности”, обладает агонистической активностью, которая не более чем примерно на 25%, а предпочтительно не более чем примерно на 20%, 15%, 10%, 5%, 1%, 0,5% или даже не более чем примерно на 0,1% превышает агонистическую активность, индуцируемую нейтральным веществом или веществом, используемым в качестве негативного контроля, как было определено с помощью анализа на В-клеточный ответ.
Термин “антагонистическая активность" означает вещество, действующее как антагонист. Антагонист CD40 предотвращает или снижает уровень индуцирования любых ответов, вызываемых связыванием рецептора CD40 с лигандом-агонистом, а в частности CD40L. Антагонист может снижать уровень индуцирования любого одного или нескольких ответов на связывание с агонистом на 5%, 10%, 15%, 20%, 25%, 30%, 35%, предпочтительно на 40%, 45%, 50%, 55%, 60%, более предпочтительно на 70%, 80%, 85%, а наиболее предпочтительно на 90%, 95%, 99% или 100%. Методы измерения специфичности связывания с лигандом CD40 и антагонистической активности терапевтического средства против CD40, например анти-CD40-антитела, известны специалистам, и такими методами являются, но не ограничиваются ими, стандартные анализы на конкурентное связывание, анализ-мониторинг на секрецию иммуноглобулина В-клетками, анализы на пролиферацию В-клеток, Баншеро-подобные анализы на пролиферацию; анализы на продуцирование антител хелперными Т-клетками, анализы на ко-стимуляцию пролиферации В-клеток и анализы на позитивную регуляцию маркеров активации В-клеток. Такие анализы описаны, например, в WO 00/75348 и в патенте США № 6087329, которые вводятся в настоящее описание посредством ссылки. См. также заявки WO 2005/044854, WO 2005/044304, WO 2005/044305, WO 2005/044306, WO 2005/044855, WO 2005/044307 и WO 2005/044294, содержание каждой из которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Антагонистическая активность/отсутствие агонистической активности могут быть оценены с помощью анализов, указывающих на то, что CHIR-12.12 не обладает агонистической активностью. Подходящие анализы описаны в патенте США № 5677165 (Chiron Corporation).
В одном из вариантов изобретения анти-CD40-антитело-антагонист не обладает значительной агонистической активностью в анализе на один клеточный ответ. В другом варианте изобретения анти-CD40-антитело-антагонист не обладает значительной агонистической активностью в анализах на более чем один клеточный ответ (например, пролиферацию и дифференцировку, или пролиферацию, дифференцировку и, для В-клеток, продуцирование антител).
Особый интерес представляют анти-CD40-антитела-антагонисты, не обладающие значительной агонистической активностью, определенной в настоящей заявке, но обладающие антагонистической активностью при их связывании с антигеном CD40 на человеческих В-клетках. В одном из вариантов изобретения анти-CD40-антитело-антагонист не обладает значительной агонистической активностью в анализе на один В-клеточный ответ. В другом варианте изобретения анти-CD40-антитело-антагонист не обладает значительной агонистической активностью в анализах на более чем один В-клеточный ответ (например, пролиферацию и дифференцировку, или пролиферацию, дифференцировку и продуцирование антител).
Для того чтобы определить, действует ли анти-CD40-антитело как антагонист одного или нескольких В-клеточных ответов, могут быть применены любые анализы, известные специалистам. В некоторых вариантах изобретения анти-CD40-антитело действует как антагонист по меньшей мере одного В-клеточного ответа, выбранного из группы, состоящей из пролиферации В-клеток, дифференцировки В-клеток, продуцирования антител, межклеточной адгезии, генерирования В-клеток памяти, переключения изотипа, активации экспрессии MHC класса II и CD80/86 на клеточной поверхности и секреции провоспалительных цитокинов, таких как IL-8, IL-12 и TNF. Особый интерес представляют анти-CD40-антитела-антагонисты, не обладающие значительной агонистической активностью в отношении пролиферации В-клеток, при связывании таких антител с человеческим антигеном CD40 на поверхности человеческих В-клеток.
В одном из таких вариантов анти-CD40-антителом является антагонист пролиферации В-клеток, индуцируемой растворимым CD40L или CD40L клеточной поверхности, как было определено в анализе на пролиферацию В-клеток. Подходящие анализы на пролиферацию В-клеток известны специалистам. Предпочтительно, анти-CD40-антитело-антагонист стимулирует пролиферацию В-клеток на уровне, не превышающем примерно 25%, а предпочтительно, не превышающем примерно 20%, 15%, 10%, 5%, 1%, 0,5% или даже примерно 0,1% по сравнению с уровнем пролиферации B-клеток, индуцируемой нейтральным веществом или веществом, используемым в качестве негативного контроля.
В других вариантах изобретения анти-CD40-антителом является антагонист пролиферации В-клеток, индуцируемой другим анти-CD40-антителом, например анти-CD40-антителом S2C6, как было определено в анализе на пролиферацию В-клеток, при этом уровень пролиферации В-клеток, стимулируемой этим другим анти-CD40-антителом в присутствии анти-CD40-антитела-антагониста, не превышает примерно 25% (то есть ингибирование составляет по меньшей мере 75%), по сравнению с пролиферацией B-клеток, индуцируемой другим анти-CD40-антителом в отсутствие анти-CD40-антитела-антагониста, а предпочтительно примерно 20%, 15%, 10%, 5%, 1%, 0,5% или даже примерно 0,1%.
В других вариантах изобретения анти-CD40-антитело представляет собой антагонист пролиферации В-клеток, индуцируемой клеточной линией EL4B5, как было определено в анализе на активацию В-клеток, при этом уровень пролиферации В-клеток, стимулируемой клеточной линией EL4B5 в присутствии анти-CD40-антитела-антагониста, не превышает примерно 25% (то есть ингибирование составляет по меньшей мере 75%), по сравнению с уровнем пролиферации B-клеток, индуцируемой этой клеточной линией в отсутствие анти-CD40-антитела-антагониста, а предпочтительно, примерно 20%, 15%, 10%, 5%, 1%, 0,5% или даже примерно 0,1%.
В других вариантах изобретения анти-CD40-антителом является антагонист продуцирования антитела человеческими В-клетками, индуцируемого человеческими Т-клетками, как было определено в анализе на продуцирование антитела В-клетками, индуцируемое человеческими хелперными Т-клетками. В этом анализе уровень продуцирования антитела IgG, антитела IgM или антител IgG и IgM В-клетками, стимулированного Т-клетками в присутствии анти-CD40-антитела-антагониста составляет не более чем примерно 50% от уровня продуцирования соответствующего антитела В-клетками, стимулированного Т-клетками в отсутствие анти-CD40-антитела-антагониста (то есть ингибирование составляет по меньшей мере 75%), предпочтительно не более чем примерно 25%, а предпочтительно примерно 20%, 15%, 10%, 5%, 1%, 0,5% или даже примерно 0,1%. Другими анти-CD40-антителами-антагонистами являются моноклональные антитела, обозначаемые 5D12, 3A8 и 3C6, которые секретируются гибридомой, депонированной в ATCC под рег. №№ HB 11339, HB 12024 и HB 11340, соответственно. См., например, патент США № 6315998, который во всей своей полноте вводится в настоящее описание посредством ссылки.
Анти-CD40-антитела-антагонисты известны специалистам. См., например, человеческое анти-CD40-антитело, продуцируемое гибридомой, обозначенной F4-465 и описанной в публикациях заявок на патент США №№ 20020142358 и 20030059427, которые во всей своей полноте вводятся в настоящее описание посредством ссылки. Гибридома F4-465 была получена от мышей HAC (Kuroiwa et al. (2000) Nature Biotech. 10:1086 (2000)), а поэтому она экспрессирует человеческую легкую цепь лямбда. См. также заявки WO 2005/044854, WO 2005/044304, WO 2005/044305, WO 2005/044306, WO 2005/044855, WO 2005/044307 и WO 2005/044294, содержание которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Помимо антагонистической активности, анти-CD40-антитело, применяемое в способах настоящего изобретения, будет предпочтительно обладать другим механизмом действия, направленным на клетки-мишени. Так, например, анти-CD40-антитело, предпочтительно, обладает ADCC-активностью. Альтернативно, вариабельные области анти-CD40-антитела могут экспрессироваться в антителе другого изотипа, обладающем ADCC-активностью. Может быть также осуществлено конъюгирование нативных форм, рекомбинантных форм или антигенсвязывающих фрагментов анти-CD40-антител с цитотоксином, с терапевтическим средством, или с ионом радиоактивного металла, или с радиоизотопом, как более подробно описано в настоящей заявке.
Как указывается в настоящей заявке, авторами настоящего изобретения было неожиданно обнаружено, что в отличие от других антител, анти-CD40-антитела, такие как CHIR-12.12, обладают способностью опосредовать сильную антителозависимую клеточную цитотоксичность (ADCC) по отношению к CD40-экспрессирующим клеткам-мишеням посредством связывания с любыми двумя аллотипами FcγRIIIa по аминокислоте 158 (V или F), находящимися на природных клетках-киллерах пациента (NK). В соответствии с этим анти-CD40-антитела, такие как CHIR-12.12, могут быть использованы для лечения воспалительных заболеваний и аутоиммунных заболеваний, ассоциированных с CD40-экспрессирующими клетками, не только у пациентов, гомозиготных по FcγRIIIa-158V (генотип V/V), но и у пациентов, гетерозиготных или гомозиготных по FcγRIIIa-158F (генотип V/F или F/F). Настоящее изобретение является особенно подходящим для лечения воспалительных заболеваний и аутоиммунных заболеваний, которые являются невосприимчивыми к лечению ритуксимабом (ритуксаном®), поскольку было обнаружено, что клиническая активность ритуксимаба при НХЛ коррелирует с FcγRIIIa-генотипом пациента.
Таким образом, особенно предпочтительными анти-CD40-антителами, применяемыми в способах согласно изобретению, являются антитела, которые помимо антагонистической активности обладают способностью опосредовать ADCC, направленную на CD40-экспрессирующие клетки, в присутствии человеческих эффекторных клеток, таких как природные клетки-киллеры (NK-клетки), экспрессирующие FcγRIIIa. Наиболее предпочтительными являются анти-CD40-антитела, обладающие способностью связываться с FcγRIIIa-158F и FcγRIIIa-158V с высокой аффинностью, как более подробно описано ниже.
Особенно предпочтительными анти-CD40-антителами являются антитела, описанные в заявках WO 2005/044854, WO 2005/044304, WO 2005/044305, WO 2005/044306, WO 2005/044855, WO 2005/044307 и WO 2005/044294, содержание которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Особый интерес с точки зрения настоящего изобретения представляют анти-CD40-антитела-антагонисты, которые обладают связывающими свойствами, аналогичными связывающим свойствам моноклонального антитела CHIR-12.12, описанного в заявках WO 2005/044854, WO 2005/044304, WO 2005/044305, WO 2005/044306, WO 2005/044855, WO 2005/044307 и WO 2005/044294. Такими антителами являются, но не ограничиваются ими,
a) моноклональное антитело CHIR-12.12;
b) моноклональное антитело, продуцируемое гибридомной клеточной линией 12.12;
c) моноклональное антитело, содержащее аминокислотную последовательность, выбранную из группы, состоящей из последовательности, представленной в SEQ ID NO:2, последовательности, представленной в SEQ ID NO:4, последовательности, представленной в SEQ ID NO:5, последовательностей, представленных в SEQ ID NO:2 и в SEQ ID NO:4, и последовательностей, представленных в SEQ ID NO:2 и SEQ ID NO:5;
d) моноклональное антитело, имеющее аминокислотную последовательность, кодируемую молекулой нуклеиновой кислоты, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из последовательности, представленной в SEQ ID NO:1, последовательности, представленной в SEQ ID NO:3, и последовательностей, представленных в SEQ ID NO:1 и SEQ ID NO:3;
e) моноклональное антитело, которое связывается с эпитопом, способным связываться с моноклональным антителом, продуцируемым гибридомной клеточной линией 12.12;
f) моноклональное антитело, которое связывается с эпитопом, содержащим остатки 82-87 последовательности человеческого CD40, представленной в SEQ ID NO:7 или SEQ ID NO:9;
g) моноклональное антитело, которое связывается с эпитопом, содержащим остатки 82-89 последовательности человеческого CD40, представленной в SEQ ID NO:7 или SEQ ID NO:9;
h) моноклональное антитело, которое конкурирует с моноклональным антителом CHIR-12.12 в анализе на конкурентное связывание;
i) моноклональное антитело по п. a) или моноклональное антитело по любому из пп. c)-h), где указанное антитело получено рекомбинантным путем; и
j) моноклональное антитело, которое представляет собой антигенсвязывающий фрагмент моноклонального антитела по любому из пп. a)-i), где указанный фрагмент сохраняет способность специфически связываться с указанным человеческим антигеном CD40.
Моноклональное антитело CHIR-12.12 является особенно предпочтительным для использования в способах согласно изобретению.
Моноклональное антитело CHIR-12.12 подробно описано в WO 2005/044854, WO 2005/044304, WO 2005/044305, WO 2005/044306, WO 2005/044855, WO 2005/044307 и WO 2005/044294. Антитело CHIR-12.12 представляет собой полностью человеческое моноклональное анти-CD40-антитело изотипа IgG1, продуцируемое гибридомной клеточной линией 153.8E2.D10.D6.12.12 (называемой клеточной линией 12.12). Эта клеточная линия была создана с использованием спленоцитов, полученных от иммунизованных ксенотипических мышей, содержащих локус тяжелой цепи и локус легкой цепи каппа человеческого IgG1 (технология XenoMouse®; Abgenix; Fremont, California). Клетки селезенки были слиты с клетками мышиной миеломы SP2/0 (Sierra BioSource). Полученные гибридомы несколько раз субклонировали и получали стабильную моноклональную клеточную линию 12.12. Другие антитела, подходящие для их использования в способах согласно изобретению, могут быть получены аналогичным образом с применением мышей, трансгенных по локусам человеческого иммуноглобулина, как описано в настоящей заявке.
Моноклональное антитело CHIR-12.12 связывается с растворимым CD40 в анализах типа ELISA, предотвращает связывание CD40-лиганда с CD40 клеточной поверхности и замещает предварительно связанный CD40-лиганд, как было определено в проточных цитометрических анализах. Антитела CHIR-5.9 и CHIR-12.12 конкурируют друг с другом за связывание с CD40, но не с антителом 15B8, то есть с моноклональным анти-CD40-антителом, описанным в предварительной заявке на патент США рег. № 60/237556, озаглавленной “Человеческие анти-CD40-антитела”, (“Human anti-CD40 antibodies") и поданной 2 октября 2000, и в международной заявке PCT № PCT/US01/30857, также озаглавленной “Человеческие анти-CD40-антитела”, (“Human anti-CD40 antibodies") и поданной 2 октября 2001 г. (документ патентного поверенного № PP16092.003), которая была опубликована как WO 2002/028904; обе указанные заявки во всей своей полноте вводятся в настоящее описание посредством ссылки. В in vitro-тесте, где было проанализировано влияние антитела CHIR-12.12 на пролиферацию В-клеток, взятых от здоровых людей, это антитело действовало как анти-CD40-антитело-антагонист. Кроме того, CHIR-12.12 не индуцировало значительную пролиферацию человеческих лимфоцитов у здоровых индивидуумов. Указанное антитело обладало способностью уничтожать CD40-экспрессирующие клетки-мишени благодаря антителозависимой клеточной цитотоксичности (ADCC). Аффинность связывания CHIR-12.12 с человеческим CD40 составляла 5×10-10 M, как было определено в анализе BiacoreTM.
Настоящее изобретение относится к нуклеотидным и аминокислотным последовательностям вариабельных областей антитела CHIR-12.12. Более конкретно, аминокислотные последовательности лидерной, вариабельной и константной областей легкой цепи и тяжелой цепи mAb CHIR-12.12 представлены в SEQ ID NO:2 (полноразмерная последовательность легкой цепи mAb CHIR-12.12), в SEQ ID NO:4 (полноразмерная последовательность тяжелой цепи mAb CHIR-12.12) и в SEQ ID NO:5 (полноразмерная последовательность варианта тяжелой цепи mAb CHIR-12.12, представленная в SEQ ID NO:4, где указанный вариант содержит замену аланинового остатка сериновым остатком в положении 153 SEQ ID NO:4). Нуклеотидная последовательность, кодирующая легкую цепь и тяжелую цепь mAb CHIR-12.12, представлена в SEQ ID NO:1 (кодирующая последовательность для легкой цепи mAb CHIR-12.12) и SEQ ID NO:3 (кодирующая последовательность для тяжелой цепи mAb CHIR-12.12). Гибридома, экспрессирующая CHIR-12.12, была депонирована в ATCC под номером патентного депозита PTA-5543.
Анти-CD40-антителами, используемыми в способах согласно изобретению, являются антитела, отличающиеся от моноклонального антитела CHIR-12.12, но сохраняющие CDR, и антитела с одной или несколькими аминокислотными инсерциями, делециями или заменами. Анти-CD40-антителами, используемыми в способах согласно изобретению, могут быть также антитела, лишенные иммуногенных свойств, а в частности неиммуногенные анти-CD40-антитела-антагонисты, которые могут быть продуцированы, как описано, например, в публикациях международных патентных заявок №№ WO 98/52976 и WO 0034317, которые вводятся в настоящее описание посредством ссылки. В этом способе остатки анти-CD40-антител-антагонистов согласно изобретению модифицируют так, чтобы эти антитела не обладали иммуногенными свойствами или обладали незначительными иммуногенными свойствами по отношению к человеку, но при этом сохраняли свою антагонистическую активность по отношению к человеческим CD40-экспрессирующим клеткам, где указанная активность была определена с помощью описанных здесь анализов. В объем настоящего изобретения также входят гибридные белки, содержащие представляющее интерес антитело, например анти-CD40-антитело-антагонист или анти-CD40L антитело-антагонист, или их фрагменты, где указанные гибридные белки могут быть синтезированы или экспрессированы из соответствующих полинуклеотидных векторов, известных специалистам. Такие гибридные белки описаны в литературе, посвященной конъюгированию рассматриваемых здесь антител.
Любое известное антитело, обладающее представляющей интерес специфичностью связывания, может иметь в своей последовательности модификации, внесенные методами, описанными, например, в публикациях патентных заявок №№ EP 0983303 A1, WO 00/34317 и WO 98/52976, которые вводятся в настоящее описание посредством ссылки. Так, например, было обнаружено, что последовательности в CDR могут индуцировать связывание антитела с MHC класса II и запускать нежелательный ответ с продуцированием хелперных Т-клеток. Консервативные замены позволяют антителу сохранять свою связывающую активность и при этом приводят к потере способности антитела запускать нежелательный Т-клеточный ответ. Любые такие консервативные или неконсервативные замены могут быть внесены хорошо известными методами, например, описанными в настоящей заявке, и полученные антитела могут быть также использованы в способах согласно изобретению. Варианты антител могут быть рутинно протестированы на конкретную активность, например на антагонистическую активность, аффинность и специфичность с применением описанных здесь способов.
Так, например, варианты аминокислотных последовательностей анти-CD40-антитела-антагониста, например моноклонального антитела CHIR-12.12, могут быть получены путем введения мутаций в клонированную последовательность ДНК, кодирующую представляющее интерес антитело. Методы мутагенеза и модификации нуклеотидных последовательностей хорошо известны специалистам. См., например, публикации Walker & Gaastra, eds. (1983) Techniques in Molecular Biology (MacMillan Publishing Company, New York); Kunkel (1985) Proc. Natl. Acad. Sci. USA 82:488-492; Kunkel et al. (1987) Methods Enzymol. 154:367-382; Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual (Cold Spring Harbor, New York); патент США № 4873192, а также цитируемые там работы, и все указанные материалы вводятся в настоящее описание посредством ссылки. Руководство по введению соответствующих аминокислотных замен, которые не оказывают влияния на биологическую активность представляющего интерес полипептида, можно найти в модели Dayhoff et al. (1978) в Атласе последовательностей и структур белков (Atlas of Protein Sequence and Structure) (Natl. Biomed. Res. Found., Washington, D.C.), который вводится в настоящее описание посредством ссылки. Могут оказаться предпочтительными консервативные замены, такие как замена одной аминокислоты другой аминокислотой, обладающей аналогичными свойствами. Примерами консервативных замен являются, но не ограничиваются ими, Gly⇔Ala, Val⇔Ile⇔Leu, Asp⇔Glu, Lys⇔Arg, Asn⇔Gln и Phe⇔Trp⇔Tyr.
При конструировании вариантов представляющего интерес антитела, например представляющего интерес полипептида анти-CD40-антитела-антагониста, вводят такие модификации, чтобы полученные варианты обладали нужной активностью, то есть аналогичной аффинностью связывания, а в случае анти-CD40-антител-антагонистов, способностью к специфическому связыванию с человеческим антигеном CD40, экспрессируемым на поверхности человеческих клеток, и что эти варианты не обладали значительной агонистической активностью, но при этом обладали антагонистической активностью при связывании с антигеном CD40 на человеческих CD40-экспрессирующих клетках. Очевидно, что никакие мутации, введенные в ДНК, кодирующую указанный вариант полипептида, не должны находиться в последовательности, присутствующей за пределами рамки считывания, а предпочтительно, не должны образовывать комплементарные области, которые могут продуцировать вторичную структуру мРНК. См. публикацию заявки на патент EP № 75444.
Кроме того, константная область антитела, например анти-CD40-антитела-антагониста, может быть мутирована различными способами в целях изменения его эффекторной функции. См., например, патент США № 6737056 B1 и публикацию заявки на патент США № 2004/0132101 A1, в которых описаны Fc-мутации, оптимизирующие связывание антитела с Fc-рецепторами.
При этом предпочтительно, чтобы варианты эталонного антитела, например, анти-CD40-антитела-антагониста, имели аминокислотные последовательности, которые были бы по меньшей мере на 70% или 75%, предпочтительно по меньшей мере на 80% или 85%, а более предпочтительно по меньшей мере на 90%, 91%, 92%, 93%, 94% или 95% идентичны аминокислотной последовательности эталонного антитела, например, молекулы анти-CD40-антитела-антагониста, например, описанного здесь моноклонального антитела CHIR-12.12, или более короткой части молекулы эталонного антитела. Более предпочтительно, чтобы такие молекулы имели по меньшей мере 96%, 97%, 98% или 99%-ную идентичность последовательностей. В соответствии с настоящим изобретением, процент идентичности последовательностей определяют с помощью алгоритма поиска гомологии Смита-Уотермана с введением “пробелов” и назначением штрафа на пробел-пропуск = 12 и штрафа на пробел-удлинение = 2, и с использованием матрицы BLOSUM 62. Алгоритм поиска гомологии Смита-Уотермана описан Смитом и Уотерманом (Smith & Waterman (1981) Adv. Appl. Math. 2:482-489). Данный вариант может, например, отличаться от эталонного антитела, например анти-CD40-антитела-антагониста, по меньшей мере на 1-15 аминокислотных остатков, по меньшей мере на 1-10 аминокислотных остатков, например на 6-10 аминокислотных остатков, по меньшей мере на 5, по меньшей мере на 4, 3, 2 или даже на 1 аминокислотный остаток.
Что касается оптимального выравнивания двух аминокислотных последовательностей, то непрерывный сегмент варианта аминокислотной последовательности может иметь дополнительные аминокислотные остатки, или делетированные аминокислотные остатки, по сравнению с аминокислотными остатками эталонной аминокислотной последовательности. Указанный непрерывный сегмент, используемый для сравнения с эталонной аминокислотной последовательностью, включает по меньшей мере 20 смежных аминокислотных остатков и может иметь 30, 40, 50 или более аминокислотных остатков. При этом могут быть внесены поправки на идентичность последовательностей, отличия которых обусловлены консервативными заменами аминокислотных остатков или введением “пробелов” (см. алгоритм поиска гомологии Смита-Уотермана).
Точная химическая структура полипептида, способного специфически связываться с CD40 и сохранять антагонистическую активность, в частности, при связывании с антигеном CD40 на клетках-мишенях, зависит от ряда факторов. Поскольку в данной молекуле присутствуют ионизуемые амино- и карбоксильные группы, то конкретный полипептид может быть получен в виде соли кислоты или основания или в нейтральной форме. Все указанные препараты, сохраняющие свою биологическую активность в подходящих условиях окружающей среды, входят в определение используемого здесь термина “анти-CD40-антитела-антагонисты”. Кроме того, первичная аминокислотная последовательность полипептида может быть увеличена путем дериватизации с использованием молекул сахара (гликозилирования), либо путем присоединения других дополнительных молекул, таких как липиды, фосфатные группы, ацетильные группы и т.п. Эти молекулы могут быть также увеличены путем конъюгирования с сахаридами. Некоторые способы такого увеличения могут быть осуществлены с использованием систем посттрансляционного процессинга хозяина-продуцента; при этом могут быть введены и другие модификации in vitro. В любом случае такие модификации входят в определение используемого здесь термина “анти-CD40-антитело”, при условии, что они не нарушают антагонистических свойств анти-CD40-антитела. При этом предполагается, что такие модификации могут количественно или качественно влиять на активность, то есть приводить к усилению или снижению активности данного полипептида в различных анализах. Кроме того, отдельные аминокислотные остатки в цепи могут быть модифицированы путем окисления, восстановления или другой дериватизации, и данный полипептид может быть расщеплен с получением фрагментов, сохраняющих его активность. Полипептидная последовательность с модификациями, которые не нарушают антагонистической активности, также подпадает под определение используемых здесь и представляющих интерес анти-CD40-антител.
Существуют подробные руководства, относящиеся к получению и применению полипептидных вариантов. При получении вариантов анти-CD40-антитела специалист в данной области может легко определить, какие модификации, введенные в нуклеотидную последовательность или в аминокислотную последовательность нативного белка, позволят получить вариант, который будет подходящим для его применения в качестве терапевтически активного компонента фармацевтической композиции, используемой в способах согласно изобретению.
Анти-CD40-антитело, используемое в способах согласно изобретению, предпочтительно обладает по меньшей мере одной из нижеследующих биологических активностей in vitro и/или in vivo, таких как ингибирование секреции иммуноглобулина нормальными человеческими периферическими В-клетками, стимулированными Т-клетками; снижение выживаемости и/или ингибирование пролиферации нормальных человеческих периферических В-клеток, стимулируемых CD40L-экспрессирующими клетками или растворимым лигандом CD40 (sCD40L); снижение выживаемости и/или ингибирование пролиферации нормальных человеческих периферических В-клеток, стимулируемых Т-клетками Jurkat; снижение “продолжительности” антиапоптотических внутриклеточных сигналов в любых клетках, стимулируемых sCD40L или CD40L на твердой фазе; и ингибирование передачи CD40-сигнала в любых клетках после лигирования с sCD40L или с CD40L на твердой фазе, делеции, анергии и/или индуцирования толерантности CD40-несущих клеток-мишеней или клеток, несущих когнатные лиганды, к CD40, включая, но не ограничиваясь ими, T-клетки и В-клетки, индуцирования размножения или активации регуляторных CD4+-CD25+-Т-клеток (см., например, “Donor alloantigen-specific tissue rejection via CD40-CD40L interference”, van Maurik et al. (2002) J. Immunol. 169:5401-5404), цитотоксичности, индуцируемой любыми механизмами (включая, но не ограничиваясь ими, антитело-зависимая клеточно-опосредуемая цитотоксичность (ADCC), комплемент-зависимая цитотоксичность (CDC), ингибирование пролиферации и/или апоптоз клеток-мишеней); модуляции секреции цитокинов клетками-мишенями и/или экспрессии молекулы клеточной поверхности и их комбинаций.
Анализы на указанные биологические активности могут быть осуществлены, как описано в настоящей заявке и в предварительных заявках, озаглавленных "Antagonist Анти-CD40 Monoclonal Antibodies and Methods for Their Use" и поданных 4 ноября 2003 г., 26 ноября 2003 г. и 27 апреля 2004 г., а также в переуступленных заявках на патент США №№ 60/517337 (документ патентного поверенного № PP20107.001 (035784/258442)), 60/525579 (документ патентного поверенного № PP20107.002 (035784/271525)) и 60/565710 (документ патентного поверенного № PP20107.003 (035784/277214)), соответственно; и в международной патентной заявке № PCT/US2004/037152 (документ патентного поверенного № PP20107.004 (035784/282916)), опубликованной под номером WO 2005/044854 и под названием “Antagonist Анти-CD40 Monoclonal Antibodies and Methods for Their Use" и поданной 4 ноября 2004 г., где содержание каждого из указанных документов во всей своей полноте вводится в настоящее описание посредством ссылки. См. также анализы, описанные в публикациях Schultze et al. (1998) Proc. Natl. Acad. Sci. USA 92:8200-8204; Denton et al. (1998) Pediatr. Transplant. 2:6-15; Evans et al. (2000) J. Immunol. 164:688-697; Noelle (1998) Agents Actions Suppl. 49:17-22; Lederman et al. (1996) Curr. Opin. Hematol. 3:77-86; Coligan et al. (1991) Current Protocols in Immunology 13:12; Kwekkeboom et al. (1993) Immunology 79:439-444; и в патентах США №№ 5674492 и 5847082, которые вводятся в настоящее описание посредством ссылки.
Репрезентативным анализом для детектирования анти-CD40-антител-антагонистов, специфичных к эпитопам антигена CD40, идентифицированным в настоящей заявке, является “анализ на конкурентное связывание”. Анализы на конкурентное связывание представляют собой серологические анализы, в которых детектируются неизвестные молекулы и количественно оценивается их способность ингибировать связывание меченого известного лиганда со специфичным к нему антителом. Такой анализ также называется анализом на конкурентное ингибирование. В репрезентативном анализе на конкурентное связывание меченый полипептид CD40 осаждают антителами-кандидатами в образце, например, в комбинации с моноклональными антителами против одного или нескольких эпитопов для моноклональных антител согласно изобретению. Анти-CD40-антитела, которые специфически реагируют с представляющим интерес эпитопом, могут быть идентифицированы путем скрининга на серию антител против белка CD40 или его фрагмента, содержащего конкретный эпитоп представляющего интерес белка CD40. Так, например, для человеческого CD40 представляющими интерес эпитопами являются эпитопы, содержащие линейные и/или нелинейные аминокислотные остатки короткой изоформы человеческого CD40 (см. GenBank рег. № NP_690593), представленной в последовательности SEQ ID NO:10, кодируемой последовательностью, представленной в SEQ ID NO:9; см. также GenBank рег. № NM_152854), или длинной изоформы человеческого CD40 (см. GenBank рег. №№ CAA43045 и NP_001241), представленной в последовательности SEQ ID NO:12, кодируемой последовательностью, представленной в SEQ ID NO:11; см. GenBank рег. №№ X60592 и NM_001250). Альтернативно, для отбора моноклональных антител, сравниваемых с уже идентифицированными антителами, могут быть проведены анализы на конкурентное связывание с использованием ранее идентифицированных подходящих анти-CD40-антител-антагонистов.
Антитела, используемые в таких иммуноанализах, могут быть мечеными или немечеными. Немеченые антитела могут быть применены в анализах на агглютинацию, а меченые антитела могут быть применены в анализах широкого ряда, проводимых с использованием меток широкого ряда. Детектирование образования комплекса “антитело-антиген” между анти-CD40-антителом и представляющим интерес эпитопом может быть облегчено путем присоединения детектируемого вещества к антителу. Подходящими средствами для детектирования являются метки, такие как радионуклиды, ферменты, коферменты, флуоресцентные вещества, хемилюминесцентные вещества, хромогены, субстраты ферментов или кофакторы, ингибиторы ферментов, комплексы, содержащие простетические группы, свободные радикалы, частицы, красители и т.п. Примерами подходящих ферментов являются пероксидаза хрена, щелочная фосфатаза, β-галактозидаза или ацетилхолинэстераза; примерами подходящих комплексов, содержащих простетические группы, являются стрептавидин/биотин и авидин/биотин; примерами подходящих флуоресцентных веществ являются умбеллиферон, флуоресцеин, изотиоцианат флуоресцеина, родамин, дихлортриазиниламинофлуоресцеин, данзилхлорид или фикоэритрин; примером люминесцентного вещества является люминол; примерами биолюминесцентных веществ являются люцифераза, люциферин и экворин, а примерами подходящих радиоактивных веществ являются 125I, 131I, 35S или 3Н. Такие меченые реагенты могут быть использованы в ряде хорошо известных анализов, таких как радиоиммуноанализы, иммуноферментные анализы, например ELISA, флуоресцентные иммуноанализы и т.п. См., например, патенты США №№ 3766162, 3791932, 3817837 и 4233402.
Может быть также сконструировано антитело, обладающее повышенной ADCC-активностью. В частности, карбокси-концевая половина домена CH2 играет важную роль в вырабатывании ADCC, опосредуемой рецептором FcRIII. Поскольку CH2 и шарнирная область играют важную роль в эффекторных функциях антитела, то могут быть получены серии мультидоменных антител, содержащих дополнительные области CH2 и/или шарнирные области, и такие антитела могут быть протестированы на любые изменения их эффекторной активности (см. Greenwood, J., Gorman, S. D., Routledge, E.G., Lloyd, I.S. & Waldmann, H., Ther. Immunol. 1994 Oct; 1(5):247-55). В альтернативном способе одновременно могут быть сконструированы дополнительные домены, например, путем получения димеров посредством введения цистеина в H-цепь химерного Ig (см. Shopes B. (1992) J. Immunol. 1992 1; 148(9): 2918-22). Кроме того, изменение ADCC-активности в сторону ее увеличения может быть достигнуто путем введения мутаций в Fc-область (см., например, US 6737056 B1), экспрессирующуюся в клетках клеточных линий, дефицитных по фукозилтрансферазе (см., например, US2003/0115614), или осуществления других изменений, например изменений характера гликозилирования антител (см., например, патент США 6602684).
Настоящее изобретение является особенно подходящим для лечения воспалительных заболеваний и аутоиммунных заболеваний, ассоциированных с CD20-экспрессирующими клетками, в частности, у пациентов, резистентных к ритуксану®, а более конкретно у пациентов, гетерозиготных или гомозиготных по FcγRIIIa-158F (генотип V/F или F/F).
Используемый здесь термин “анти-CD20-антитело" охватывает любые антитела, которые специфически распознают антиген CD20 клеточной поверхности, включая поликлональные антитела, моноклональные антитела, одноцепочечные антитела и их фрагменты, такие как Fab, F(ab')2, Fv и другие фрагменты, сохраняющие антигенсвязывающую функцию родительского анти-CD20-антитела. Что касается способов согласно изобретению, то особый интерес представляют анти-CD20-антитела или их антигенсвязывающие фрагменты, которые обладают связывающими свойствами, присущими моноклональному антителу IDEC-C2B8 (Biogen IDEC Inc., Cambridge, MA).
В некоторых вариантах изобретения анти-CD40-антитела, используемые в способах согласно изобретению, обладают более сильной терапевтической активностью, чем химерное моноклональное анти-CD20-антитело IDEC-C2B8, где терапевтическую активность оценивают с использованием эквивалентных количеств этих антител в соответствующей экспериментальной модели. Антитело IDEC-C2B8 (IDEC Pharmaceuticals Corp., San Diego, California; коммерчески доступное антитело под торговым знаком “Ритуксан®”, также называемое ритуксимабом) представляет собой химерное моноклональное анти-CD20-антитело, содержащее человеческий IgG1 и константные области цепи каппа вместе с мышиными вариабельными областями, выделенными из мышиного моноклонального анти-CD20-антитела, IDEC-2B8 (Reff et al. (1994) Blood 83:435-445). Ритуксимаб был разрешен для лечения рецидивирующей В-клеточной низкозлокачественной или фолликулярной неходжкинской лимфомы (НХЛ) и в настоящее время проходит клинические испытания на возможность его применения для лечения аутоиммунных заболеваний. Выявление антител с высокой терапевтической активностью по сравнению с ритуксимабом должно послужить крутым переломом в разработке способов лечения воспалительных заболеваний и аутоиммунных заболеваний.
Существуют подходящие модели, которые могут быть использованы для оценки активности антител при лечении системной красной волчанки (СКВ), рассеянного склероза, воспаления и атеросклероза, при трансплантации органов и при лечении болезни Альцгеймера, как описано ниже.
Так, например, для оценки эффективности антител при лечении системной красной волчанки (СКВ) у человека, мышам SCID трансплантируют мононуклеарные клетки периферической крови (МКПК), взятые у пациентов с СКВ. См., например, модель, описанную Duchosal et al. (1990) J. Exp. Med. 172:985-8. После переноса МКПК, взятых у пациентов с СКВ, мышам SCID необходимо определить, влияет ли такой перенос на Т-лимфоцитарный ответ на аутоантиген, на продуцирование аутоантител и на манифестации заболеваний, таких как гломерулонефрит.
Экспериментальный аутоиммунный энцефалит у игрунок (EAE) представляет собой модель человеческого рассеянного склероза. См., например, модель, описанную Raine et al. (1999) Ann. Neurol. 46:144-60 и Hart et al. (2004) Lancet Neurol. 3:588-97.
Антитела могут быть протестированы in vitro на их способность ингибировать CD40L-индуцированное продуцирование матрикс-разлагающих ферментов, экспрессию тканевого фактора, продуцирование провоспалительных цитокинов и активацию адгезивных молекул. В последующих исследованиях была протестирована способность этих антител к противовоспалительному действию in vivo на трансгенных мышах, экспрессирующих человеческие молекулы CD40 и/или CD20. См., например, модель, описанную Yasui (2002) Int. Immunol. 14:319-29.
Антитела могут быть протестированы на их способность предотвращать отторжение трансплантата у моделей-приматов, не являющихся человеком. Собакоподобных обезьян-реципиентов, которым был введен почечный аллотрансплантат, обрабатывали антителом в целях выявления его влияния на приживление трансплантата в присутствии или в отсутствие дополнительных иммунодепрессантов, таких как циклоспорин, FK506, рапамицин, кортикостероиды, CTLA4-Ig и антитело-стимулятор против B-лимфоцитов и т.п. См., например, модель, описанную Wee et al. (1992) Transplantation 53:501-7.
Что касается болезни Альцгеймера, то антитела могут быть сначала протестированы in vitro на их способность блокировать активацию микроглиальных клеток. Исследования на in vivo эффективность антител могут быть проведены на мышах с двумя трансгенами, у которых экспрессируются человеческие CD40 и/или CD20 и сверхпродуцируется бета-амилоидный пептид. См., например, модель, описанную Tan et al. (2002) Nat. Neurosci. 5:1288-93.
Термин “эквивалентное количество” анти-CD40-антитела согласно изобретению и ритуксана® означает такую же или меньшую миллиграммовую дозу, вводимую в расчете на массу тела. Так, например, если доза анти-CD40-антитела составляет 0,01 мг/кг массы тела мыши, используемой в этой модели, то доза ритуксана также составляет 0,01 мг/кг массы тела мыши. Аналогичным образом, если доза анти-CD40-антитела составляет 0,1; 1 или 10 мг/кг массы тела мыши, используемой в этой модели, то доза ритуксана также составляет 0,1; 1 или 10 мг/кг массы тела мыши, соответственно.
В целях определения концентрации антитела in vitro, необходимой для достижения максимального лизиса клеток-мишеней in vitro в присутствии NK-клеток, оценивают и другие отличительные параметры эффективности антител. Так, например, анти-CD40-антитела согласно изобретению обеспечивают максимальный лизис клеток Дауди при EC50, составляющей менее чем 1/2, предпочтительно 1/4, а наиболее предпочтительно 1/10 от концентрации ритуксана®. Такой тип измерений также описан в приведенных здесь примерах.
Анти-CD40-антителами, преимущества которых заключаются в их значительно более высокой эффективности по сравнению с эффективностью ритуксана в эквивалентных количествах, как показали вышеописанные анализы, могут быть:
a) моноклональное антитело CHIR-12.12;
b) моноклональное антитело, продуцируемое гибридомной клеточной линией 12.12;
c) моноклональное антитело, содержащее аминокислотную последовательность, выбранную из группы, состоящей из последовательности, представленной в SEQ ID NO:2, последовательности, представленной в SEQ ID NO:4, последовательности, представленной в SEQ ID NO:5, последовательностей, представленных в SEQ ID NO:2 и в SEQ ID NO:4, и последовательностей, представленных в SEQ ID NO:2 и SEQ ID NO:5;
d) моноклональное антитело, имеющее аминокислотную последовательность, кодируемую молекулой нуклеиновой кислоты, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из последовательности, представленной в SEQ ID NO:1, последовательности, представленной в SEQ ID NO:3, и последовательностей, представленных в SEQ ID NO:1 и SEQ ID NO:3;
e) моноклональное антитело, которое связывается с эпитопом, способным связываться с моноклональным антителом, продуцируемым гибридомной клеточной линией 12.12;
f) моноклональное антитело, которое связывается с эпитопом, содержащим остатки 82-87 последовательности человеческого CD40, представленной в SEQ ID NO:7 или SEQ ID NO:9;
g) моноклональное антитело, которое связывается с эпитопом, содержащим остатки 82-89 последовательности человеческого CD40, представленной в SEQ ID NO:7 или SEQ ID NO:9;
h) моноклональное антитело, которое конкурирует с моноклональным антителом CHIR-12.12 в анализе на конкурентное связывание;
i) моноклональное антитело по п. a) или моноклональное антитело по любому из пп. c)-h), где указанное антитело получено рекомбинантным путем; и
j) моноклональное антитело, которое представляет собой антигенсвязывающий фрагмент моноклонального антитела по любому из пп. a)-i), где указанный фрагмент сохраняет способность специфически связываться с указанным человеческим антигеном CD40.
Настоящее изобретение относится к способу идентификации пациента, страдающего воспалительным заболеванием или аутоиммунным заболеванием, поддающимся лечению анти-CD40-антителом, где указанный способ включает:
а) идентификацию пациента, страдающего воспалительным заболеванием или аутоиммунным заболеванием, которое ассоциируется с CD40-экспрессирующими клетками; и
b) определение FcγRIIIa-158-генотипа (V/V, V/F или F/F) у указанного пациента,
где указанное воспалительное заболевание или аутоиммунное заболевание поддается лечению под действием анти-CD40-антитела в том случае, если указанный пациент является гетерозиготным или гомозиготным по FcγRIIIa-158F (генотип V/F или F/F). Такое воспалительное или аутоиммунное заболевание может не поддаваться лечению ритуксимабом (ритуксаном®).
После идентификации пациента, страдающего воспалительным заболеванием или аутоиммунным заболеванием, поддающимся лечению анти-CD40-антителом, такой пациент может быть подвергнут лечению анти-CD40-антителом. Так, например, указанный способ может включать дополнительную стадию (с) введения пациенту, идентифицированному как гетерозиготный или гомозиготный по FcγRIIIa-158F (генотип V/F или F/F), терапевтически или профилактически эффективного количества анти-CD40-антитела.
Указанный способ идентификации пациента, страдающего воспалительным заболеванием или аутоиммунным заболеванием, поддающимся лечению анти-CD40-антителом, может быть легко осуществлен специалистом в данной области с использованием подходящего диагностического набора. Такой набор должен включать реагенты, подходящие для определения FcγRIIIa-158-генотипа у пациента. Таким образом, настоящее изобретение также относится к набору для идентификации пациента, страдающего воспалительным или аутоиммунным заболеванием, поддающимся лечению анти-CD40-антителом, где указанный набор включает реагенты для определения FcγRIIIa-158-генотипа у пациента. Подходящие наборы более подробно описаны ниже.
Настоящее изобретение также относится к способу выбора курса иммунотерапии для лечения пациента, страдающего воспалительным заболеванием или аутоиммунным заболеванием, где указанный способ включает:
а) идентификацию пациента, страдающего воспалительным заболеванием или аутоиммунным заболеванием, которое ассоциируется с CD40-экспрессирующими клетками; и
b) определения FcγRIIIa-158-генотипа (V/V, V/F или F/F) у указанного пациента,
где для лечения указанного воспалительного или аутоиммунного заболевания анти-CD40-антитело выбирают в том случае, если указанный пациент является гетерозиготным или гомозиготным по FcγRIIIa-158F (генотип V/F или F/F). Указанное воспалительное или аутоиммунное заболевание может не поддаваться лечению ритуксимабом (ритуксаном®).
После выбора курса лечения анти-CD40-антителом для пациента, страдающего воспалительным или аутоиммунным заболеванием, такой пациент может быть подвергнут лечению анти-CD40-антителом. Так, например, указанный способ может включать дополнительную стадию (с) введения пациенту, идентифицированному как гетерозиготный или гомозиготный по FcγRIIIa-158F (генотип V/F или F/F), терапевтически или профилактически эффективного количества анти-CD40-антитела.
Такой способ выбора курса иммунотерапии для данного пациента, страдающего воспалительным или аутоиммунным заболеванием, может быть легко осуществлен специалистом в данной области с использованием подходящего диагностического набора. Такой набор должен включать реагенты, подходящие для определения у пациента FcγRIIIa-158-генотипа. Таким образом, настоящее изобретение также относится к набору для выбора курса лечения антителом пациента, страдающего воспалительным заболеванием или аутоиммунным заболеванием, ассоциированным с CD40-экспрессирующими клетками, где указанный набор содержит реагенты для определения у пациента FcγRIIIa-158-генотипа.
Термин “поддается лечению под действием анти-CD40-антитела" относится к пациенту (то есть к индивидууму, страдающему воспалительным заболеванием или аутоиммунным заболеванием), у которого при его лечении анти-CD40-антителом вырабатывается “положительный терапевтический ответ” (как определено в настоящей заявке) по сравнению с терапевтическим ответом, наблюдаемым при лечении воспалительного или аутоиммунного заболевания каким-либо иным способом.
В настоящем изобретении рассматривается любой способ определения у пациента FcγRIIIa-158-генотипа с использованием биологического образца, полученного от данного пациента.
Так, например, настоящее изобретение относится к набору для определения у пациента FcγRIIIa-158-генотипа, где указанный набор включает микромассив, содержащий по меньшей мере один зонд, имеющий длину в 10 или более нуклеотидов, и включающий последовательность, подходящую для определения у пациента FcγRIIIa-158-генотипа. Меченая РНК или ДНК гибридизуется с комплементарными зондами на массиве, а затем такую гибридизацию детектируют путем лазерного сканирования. После этого определяют интенсивность гибридизации для каждого зонда на массиве и преобразуют в количественную величину, представляющую собой относительные уровни экспрессии гена. Выбор последовательностей и длины зондов может быть легко осуществлен специалистом в данной области. Нуклеотидная последовательность человеческого гена и мРНК, кодирующих F- и V-аллотипы FcγRIIIa-158, является известной. Так, например, специалист в данной области может выбрать зонд(ы), который(ые) в соответствующих экспериментальных условиях позволяет(ют) определять FcγRIIIa-158-генотип последовательностей-мишеней.
Способы синтеза этих массивов с применением методов механического синтеза описаны, например, в патенте США № 5384261, который во всей своей полноте вводится в настоящее описание посредством ссылки. Хотя предпочтительным является массив с плоской поверхностью, однако такой массив может быть получен на поверхности фактически любой формы или даже на множестве поверхностей. Такими массивами могут быть пептиды или нуклеиновые кислоты, нанесенные на сферы, гели, полимерные поверхности, волокна, такие как оптические волокна, стекло или любой другой подходящий субстрат, см. патенты США №№ 5770358, 5789162, 5708153, 6040193 и 5800992, каждый из которых во всей своей полноте вводится в настоящее описание посредством ссылки. Массивы могут быть упакованы так, чтобы можно было проводить диагностику или другие процедуры на одном универсальном устройстве. См., например, патенты США №№ 5856174 и 5922591, которые вводятся в настоящее описание посредством ссылки.
Таким образом, настоящее изобретение также относится к набору для определения FcγRIIIa-158-генотипа у пациента, включающему олигонуклеотиды, подходящие для их использования в качестве праймеров для катализируемой полимеразой амплификации области гена или мРНК, кодирующей аминокислоту 158 рецептора FcγRIIIa. Выбор последовательностей и длин праймеров может быть легко осуществлен специалистом в данной области. Нуклеотидная последовательность человеческого гена и мРНК, кодирующих F- и V-аллотипы FcγRIIIa-158, является известной. Так, например, специалист в данной области может выбрать праймеры, которые в соответствующих экспериментальных условиях позволяют амплифицировать область гена или мРНК, кодирующих аминокислоту 158 рецептора FcγRIIIa. Для определения FcγRIIIa-158-генотипа у пациента, амплифицированная последовательность может быть затем секвенирована известными методами.
Другим методом определения FcγRIIIa-158-генотипа у пациента является метод на основе нуклеиновых кислот, который позволяет детектировать фрагментацию ДНК, характерную для пациента с FcγRIIIa-158-генотипом. При разделении с помощью электрофореза на агарозном геле было обнаружено, что ДНК каждого FcγRIIIa-158-генотипа имеет характерную картину. Так, например, настоящее изобретение также относится к набору для определения у пациента FcγRIIIa-158-генотипа, где указанный набор включает один или несколько ферментов рестрикции, подходящих для определения FcγRIIIa-158-генотипа у пациента. Подходящие ферменты рестрикции известны специалистам (см., например, Koene et al., Blood, 1997, Vol. 90, No. 3, p. 1109-1114).
Наборы согласно изобретению могут также содержать инструкции по применению такого набора для определения FcγRIIIa-158-генотипа у пациента. Указанный набор может также содержать, например, забуферивающий агент, консервант или белок-стабилизирующий агент. Каждый компонент такого набора обычно находится в отдельном контейнере, а все отдельные различные контейнеры собраны в одну упаковку, в которую вложены инструкции по применению указанного набора для определения FcγRIIIa-158-генотипа у пациента.
Настоящее изобретение относится к применению анти-CD40-антител в целях приготовления лекарственного средства для лечения воспалительного заболевания или аутоиммунного заболевания, ассоциированного с CD40-экспрессирующими клетками, как описано в настоящей заявке.
Анти-CD40-антитела согласно изобретению вводят в концентрации, которая является терапевтически эффективной для предупреждения или лечения воспалительного или аутоиммунного заболевания, ассоциированного с CD40-экспрессирующими клетками. Для достижения этой цели антитела могут быть получены с использованием ряда подходящих носителей и/или наполнителей, известных специалистам. Анти-CD40-антитело может быть введено парентерально. Обычно антитела вводят путем инъекции, внутривенной или подкожной. Методы такого введения известны среднему специалисту в данной области.
Внутривенное введение осуществляют, предпочтительно, путем вливания в течение периода времени, примерно от получаса или 1 часа до 10 часов (менее чем в течение 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 часов). Последующее вливание может быть осуществлено в течение периода времени, составляющего примерно менее чем от 1 до 6 часов, включая период времени примерно от 1 до 4 часов, от 1 до 3 часов или от 1 до 2 часов или менее. Альтернативно, анти-CD40-антитело, такое как CHIR-12.12, может быть введено подкожно.
Фармацевтическую композицию согласно изобретению приготавливают так, чтобы она была совместима с нужным способом введения. Растворы или суспензии, подходящие для парентерального введения, могут включать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, физиологический раствор; антибактериальные средства, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатообразующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты; и агенты, придающие изотоничность, такие как хлорид натрия или декстроза. рН может быть скорректирован с использованием кислот или оснований, таких как соляная кислота или гидроксид натрия. Препарат для парентерального введения может быть заключен в ампулы, одноразовые шприцы или во флаконы для многократного введения доз, изготовленные из стекла или пластика.
Анти-CD40-антитела обычно приготавливают стандартным методом с использованием фармацевтически приемлемого буфера, например стерильного физиологического раствора, стерильной забуференной воды, их комбинаций и т.п. Методы получения парентерально вводимых средств описаны в руководстве Remington's Pharmaceutical Sciences (18th ed.; Mack Publishing Company, Eaton, Pennsylvania, 1990), которое вводится в настоящее описание посредством ссылки. См. также, например, заявку WO 98/56418, в которой описаны стабилизированные фармацевтические препараты антител, подходящие для их применения в способах согласно изобретению.
Количество по меньшей мере одного вводимого анти-CD40-антитела может быть легко определено средним специалистом в данной области без излишнего экспериментирования. Факторами, влияющими на выбор способа введения и соответствующего количества по меньшей мере одного анти-CD40-антитела, являются, но не ограничиваются ими, тяжесть заболевания, история болезни, возраст, рост, масса тела, состояние здоровья и общее физическое состояние индивидуума, подвергаемого лечению. Аналогичным образом, количество вводимого анти-CD40-антитела зависит от способа введения и от типа вводимой дозы противоопухолевого средства, то есть является ли эта доза разовой или многократной. Обычно чем больше масса индивидуума, подвергаемого терапии, тем предпочтительно выше должна быть доза анти-CD40-антитела.
Дозу анти-CD40-антитела вводят в количестве, составляющем примерно от 0,003 мг/кг до 50 мг/кг, примерно от 0,01 мг/кг до 40 мг/кг, примерно от 0,01 мг/кг до 30 мг/кг, примерно от 0,1 мг/кг до 30 мг/кг, примерно от 0,5 мг/кг до 30 мг/кг, примерно от 1 мг/кг до 30 мг/кг, примерно от 3 мг/кг до 30 мг/кг, примерно от 3 мг/кг до 25 мг/кг, примерно от 3 мг/кг до 20 мг/кг, примерно от 5 мг/кг до 15 мг/кг, или примерно от 7 мг/кг до 12 мг/кг.
Так, например, указанная доза может составлять 0,3 мг/кг, 0,5 мг/кг, 1 мг/кг, 1,5 мг/кг, 2 мг/кг, 2,5 мг/кг, 3 мг/кг, 5 мг/кг, 7 мг/кг, 10 мг/кг, 15 мг/кг, 20 мг/кг, 25 мг/кг, 30 мг/кг, 35 мг/кг, 40 мг/кг, 45 мг/кг или 50 мг/кг, либо любое другое количество, входящее в интервал, составляющий примерно от 0,3 мг/кг до 50 мг/кг.
Лечение индивидуума терапевтически эффективным количеством антитела может включать один курс лечения, либо, предпочтительно, несколько курсов лечения. Так, например, в другом варианте изобретения указанный способ включает введение многократных доз анти-CD40-антитела. Такой способ может включать введение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40 или более терапевтически эффективных доз фармацевтической композиции, содержащей анти-CD40-антитело. Частота и продолжительность введения многократных доз фармацевтических композиций, содержащих анти-CD40-антитело, могут быть легко определены специалистом в данной области без излишнего экспериментирования. На протяжении всего курса лечения может быть введена одна и та же терапевтически эффективная доза анти-CD40-антитела. Альтернативно, на протяжении всего курса лечения могут быть введены различные терапевтически эффективные дозы анти-CD40-антитела.
В предпочтительном примере индивидуум подвергается лечению анти-CD40-антителом в дозе, составляющей примерно от 0,1 до 20 мг/кг массы тела, один раз в неделю в течение примерно 1-10 недель, предпочтительно примерно 2-8 недель, более предпочтительно примерно 3-7 недель, а еще более предпочтительно примерно 4, 5 или 6 недель. Лечение может быть проведено два раза в год или ежегодно в целях предупреждения рецидивов или после их появления. Следует также отметить, что эффективная доза антитела, применяемого для лечения, может быть увеличена или снижена во время конкретного курса лечения. Доза может быть изменена и определена после проведения описанных здесь диагностических анализов.
Так, например, в одном из вариантов изобретения схема введения доз включает первоначальное введение терапевтически эффективной дозы по меньшей мере одного анти-CD40-антитела в дни 1, 8, 15 и 22 курса лечения. В другом варианте изобретения схема введения доз включает первоначальное введение терапевтически эффективной дозы по меньшей мере одного анти-CD40-антитела ежедневно или на 1, 3, 5 и 7 дни недели в течение всего курса лечения; первоначальное введение терапевтически эффективной дозы по меньшей мере одного анти-CD40-антитела на 1-й день и на 3-4 дни недели курса лечения, а предпочтительная схема введения доз включает первоначальное введение терапевтически эффективной дозы по меньшей мере одного анти-CD40-антитела на 1-й день недели курса лечения. Такой курс лечения может продолжаться 1 неделю, 2 недели, 3 недели, 1 месяц, 2 месяца, 3 месяца, 6 месяцев или год. Период лечения может продолжаться непрерывно или с перерывами в одну неделю, 2 недели, один месяц, 3 месяца, 6 месяцев или год.
В других вариантах изобретения первоначальная терапевтически эффективная доза анти-CD40-антитела, определенная в соответствии с настоящим изобретением, может составлять в пределах вышеуказанного более низкого интервала доз (то есть примерно от 0,003 мг/кг до 20 мг/кг) с последующим ее повышением до количеств, входящих в вышеуказанный более высокий интервал доз (то есть примерно от 20 мг/кг до 50 мг/кг).
В альтернативных вариантах изобретения первоначальная терапевтически эффективная доза анти-CD40-антитела, определенная в соответствии с настоящим изобретением, может составлять в пределах вышеуказанного более высокого интервала доз (то есть примерно от 20 мг/кг до 50 мг/кг) с последующим ее повышением до количеств, входящих в вышеуказанный более низкий интервал доз (то есть примерно от 0,003 мг/кг до 20 мг/кг). Таким образом, в некоторых вариантах изобретения терапию с применением анти-CD40-антитела можно начать с введения “ударной дозы” антитела индивидууму, нуждающемуся в таком лечении. Термин “ударная доза” означает первоначальную дозу анти-CD40-антитела, вводимого индивидууму, где указанную дозу антитела вводят в количестве, входящем в интервал более высоких доз (то есть примерно от 20 мг/кг до 50 мг/кг). “Ударная доза” может быть введена в виде разовой дозы, например, путем однократного вливания, где указанное антитело вводят внутривенно (i.v.), или многократных вливаний, где указанное антитело вводят i.v., при условии, что полную “ударную дозу” вводят в течение примерно 24 часов. После введения “ударной дозы” индивидууму вводят одну или несколько дополнительных терапевтически эффективных доз анти-CD40-антитела. Последующие терапевтически эффективные дозы могут быть введены, например, в соответствии со схемой введения доз каждую неделю, один раз в две недели, один раз в три недели, или один раз в четыре недели. В таких вариантах изобретения последующие терапевтически эффективные дозы обычно составляют в пределах более низкого интервала доз (то есть от 0,003 мг/кг и примерно до 20 мг/кг).
Альтернативно, в некоторых вариантах изобретения после введения “ударной дозы” индивидууму вводят последующие терапевтически эффективные дозы анти-CD40-антитела в соответствии со схемой “поддерживающей терапии”, где указанную терапевтически эффективную дозу антитела вводят один раз в месяц, один раз в 6 недель, один раз в два месяца, один раз в 10 недель, один раз в три месяца, один раз в 14 недель, один раз в четыре месяца, один раз в 18 недель, один раз в пять месяцев, один раз в 22 недели, один раз в шесть месяцев, один раз в 7 месяцев, один раз в 8 месяцев, один раз в 9 месяцев, один раз в 10 месяцев, один раз в 11 месяцев или один раз в 12 месяцев. В таких вариантах изобретения терапевтически эффективные дозы анти-CD40-антитела составляют в пределах более низкого интервала доз (то есть от 0,003 мг/кг и примерно до 20 мг/кг), особенно, если последующие дозы вводят более часто, например один раз в две недели или один раз в месяц, либо эти дозы составляют в пределах более высокого интервала доз (то есть примерно от 20 мг/кг до 50 мг/кг), особенно, если последующие дозы вводят менее часто, например, примерно от одного раза в месяц до одного раза в 12 месяцев.
Анти-CD40-антитела, присутствующие в фармацевтических композициях, описанных в настоящей заявке и используемых в способах настоящего изобретения, могут быть нативными или могут быть получены рекомбинантными методами, либо они могут происходить от любого источника, включая млекопитающих, например, таких как мышь, крыса, кролик, примат, свинья и человек. Такие полипептиды предпочтительно происходят от человека, а более предпочтительно они являются рекомбинантными человеческими белками, происходящими от гибридомных клеточных линий.
Фармацевтические композиции, используемые в способах согласно изобретению, могут содержать биологически активные варианты анти-CD40-антител-антагонистов согласно изобретению, описанных в настоящей заявке.
В способах согласно изобретению может быть использована любая фармацевтическая композиция, содержащая в качестве терапевтически активного компонента анти-CD40-антитело, обладающее описанными здесь связывающими свойствами. Таким образом, жидкие, лиофилизованные или осушенные распылением композиции, содержащие одно или несколько анти-CD40-антител, могут быть получены в виде водного или безводного раствора или суспензии для последующего введения индивидууму способами согласно изобретению. Каждая из этих композиций содержит по меньшей мере одно анти-CD40-антитело в качестве терапевтически или профилактически активного компонента. Термин “терапевтически или профилактически активный компонент” означает анти-CD40-антитело, специально введенное в данную композицию в целях вырабатывания нужного терапевтического или профилактического ответа для лечения, предупреждения или диагностики заболевания или состояния у индивидуума при введении указанному индивидууму данной фармацевтической композиции. Такие фармацевтические композиции, предпочтительно, содержат соответствующие стабилизаторы, наполнители, либо те и другие вещества, необходимые для минимизации нежелательных эффектов, ассоциированных с потерей стабильности белка и биологической активности в процессе получения и хранения таких композиций.
В фармацевтические композиции, содержащие анти-CD40-антитело согласно изобретению, могут быть добавлены и другие фармацевтические компоненты. Такими компонентами могут быть, но не ограничиваются ими, масла, полимеры, витамины, углеводы, аминокислоты, соли, буферы, альбумин, поверхностно-активные вещества или наполнители. Предпочтительными углеводами являются сахара или спирты ряда сахаров, такие как моно-, ди- или полисахариды, или водорастворимые глюканы. Сахаридами или глюканами могут быть фруктоза, глюкоза, манноза, сорбоза, ксилоза, мальтоза, сахароза, дестран, пуллулан, декстрин, α- и β-циклодекстрин, растворимый крахмал, гидроксиэтилированный крахмал и карбоксиметилцеллюлоза или их смеси. Термин “спирт ряда сахаров” означает С4-С8-углеводород, имеющий гидроксильную группу, и такими спиртами являются галактит, инозит, маннит, ксилит, сорбит, глицерин и арабит. Эти сахара или спирты ряда сахаров могут быть использованы отдельно или в комбинации друг с другом. Концентрация сахара или спирта ряда сахаров составляет 1,0-7% масс./об., а более предпочтительно 2,0-6,0% масс./об. Предпочтительными аминокислотами являются левовращающие (L) формы карнитина, аргинина и бетаина, однако могут быть также добавлены и другие аминокислоты. Предпочтительными полимерами являются поливинилпирролидон (ПВП), имеющий среднюю молекулярную массу 2000-3000, или полиэтиленгликоль (ПЭГ), имеющий среднюю молекулярную массу 3000-5000. В указанные композиции могут быть добавлены поверхностно-активные вещества, описанные в EP №№ 270799 и 268110.
Кроме того, антитела могут быть химически модифицированы, например, путем ковалентного связывания с полимером в целях увеличения их времени полужизни в кровотоке. Предпочтительные полимеры и методы их присоединения к пептидам описаны в патентах США №№ 4766106; 4179337; 4495285 и 4609546, которые во всей своей полноте вводятся в настоящее описание посредством ссылки. Предпочтительными полимерами являются полиоксиэтилированные полиолы и полиэтиленгликоль (ПЭГ). ПЭГ является растворимым в воде при комнатной температуре и имеет общую формулу: R(O-CH2-CH2)nO-R, где R может быть водородом или защитной группой, такой как алкильная или алканоильная группа. Предпочтительной защитной группой является группа, имеющая 1-8 атомов углерода, а более предпочтительно метил. Символ n означает положительное целое число, предпочтительно 1-1000, а более предпочтительно 2-500. ПЭГ имеет предпочтительную среднюю молекулярную массу 1000-40000, более предпочтительно 2000-20000, а наиболее предпочтительно 3000-12000. ПЭГ предпочтительно имеет по меньшей мере одну гидроксильную группу, а более предпочтительно концевую гидроксигруппу. Такой гидроксигруппой является гидроксигруппа, которую предпочтительно активируют так, чтобы она реагировала со свободной аминогруппой на ингибиторе. Однако следует отметить, что для ковалентного связывания ПЭГ с антителом согласно изобретению тип и количество таких реакционноспособных групп могут варьироваться.
В настоящем изобретении могут быть также использованы водорастворимые полиоксиэтилированные полиолы. Такими полиолами являются полиоксиэтилированный сорбит, полиоксиэтилированная глюкоза, полиоксиэтилированный глицерин (ПОГ) и т.п. При этом ПОГ является предпочтительным. Это обусловлено тем, что глицериновый остов полиоксиэтилированного глицерина является аналогичным природному остову, встречающемуся, например, в моно-, ди- и триглицеридах животных и человека. Поэтому такая разветвленная цепь необязательно должна распознаваться в организме как чужеродный агент. Предпочтительно, ПОГ имеет почти такую же молекулярную массу, как и ПЭГ. Структура ПОГ описана Knauf et al. (1988) J. Bio. Chem. 263:15064-15070, а обсуждение конъюгатов POG/IL-2 можно найти в патенте США № 4766106, и эти работы во всей своей полноте вводятся в настоящее описание посредством ссылки.
Другой системой доставки лекарственных средств, используемой в целях увеличения времени полужизни лекарственного средства в кровотоке, является липосома. Методы получения липосомных систем доставки обсуждаются в публикациях Gabizon et al. (1982) Cancer Research 42:4734; Cafiso (1981) Biochem Biophys. Acta 649:129; и Szoka (1980) Ann. Rev. Biophys. Eng. 9:467. Специалистам известны и другие системы доставки лекарственных средств, описанные, например, в публикациях Poznansky et al. (1980) Drug Delivery Systems (R.L. Juliano, ed., Oxford, N.Y.) pp. 253-315; Poznansky (1984) Pharm Revs 36:277.
Вспомогательные компоненты, включаемые в фармацевтическую композицию, должны сообщать стабильность анти-CD40-антителу. То есть анти-CD40-антитело должно сохранять свою физическую и/или химическую стабильность и обладать нужной биологической активностью, то есть одной или несколькими вышеописанными антагонистическими активностями, включая, но не ограничиваясь ими, ингибирование секреции иммуноглобулина нормальными человеческими периферическими В-клетками, стимулированной Т-клетками; снижение выживаемости и/или ингибирование пролиферации нормальных человеческих периферических В-клеток, стимулируемой Т-клетками Jurkat; снижение выживаемости и/или ингибирование пролиферации нормальных человеческих периферических В-клеток, стимулируемой CD40L-экспрессирующими клетками или растворимым лигандом CD40 (sCD40L); снижение “продолжительности” антиапоптотических внутриклеточных сигналов в любых клетках, стимулируемых sCD40L или CD40L на твердой фазе; ингибирование передачи CD40-сигнала в любых клетках после связывания с sCD40L или CD40L на твердой фазе; и ингибирование пролиферации человеческих злокачественных В-клеток, описанных в настоящей заявке.
Методы мониторинга стабильности белка хорошо известны специалистам, см., например, Jones (1993) Adv. Drug Delivery Rev. 10:29-90; Lee, ed. (1991) Peptide and Protein Drug Delivery (Marcel Dekker, Inc., New York, New York); а анализы на стабильность описаны ниже. Обычно стабильность белка определяют при выбранной температуре в течение определенного периода времени. В предпочтительных вариантах изобретения стабильная фармацевтическая композиция антитела обеспечивает стабильность анти-CD40-антитела при ее хранении при комнатной температуре (примерно 25°С) в течение по меньшей мере 1 месяца, по меньшей мере 3 месяцев или по меньшей мере 6 месяцев, и/или примерно при 2-8°С в течение по меньшей мере 6 месяцев, по меньшей мере 9 месяцев, по меньшей мере 12 месяцев, по меньшей мере 18 месяцев или по меньшей мере 24 месяцев.
Считается, что белок, такой как антитело, при его получении в виде фармацевтической композиции сохраняет свою физическую стабильность в течение определенного периода времени, если он не обнаруживает каких-либо визуальных признаков (то есть не изменяет свой цвет или не теряет прозрачности) или детектируемых признаков (обнаруживаемых, например, с помощью эксклюзионной хроматографии (SEC) или рассеяния УФ-излучения), таких как осаждение, агрегация и/или денатурация этого белка в фармацевтической композиции. Что касается химической стабильности, то считается, что белок, такой как антитело, при его получении в виде фармацевтической композиции сохраняет свою химическую стабильность в течение определенного периода времени, если измерения химической стабильности указывают на то, что данный белок (то есть антитело) сохраняет представляющую интерес биологическую активность в данной фармацевтической композиции. Методы мониторинга изменений химической стабильности хорошо известны специалистам, и такими методами являются, но не ограничиваются ими, методы детектирования химически модифицированных форм белка, образующихся в результате расщепления, с использованием, например, электрофореза в ДСН-ПААГ, SEC и/или десорбционной спектрометрии с ионизацией, индуцированной матричным лазером/времяпролетной масс-спектрометрии; и деградации, ассоциированной с изменением молекулярной массы (например, ассоциированной с дезамидированием), с использованием, например, ионообменной хроматографии. См., например, методы, описанные ниже.
Считается, что анти-CD40-антитело при его приготовлении в виде фармацевтической композиции сохраняет нужную биологическую активность в течение определенного периода времени в том случае, если нужная биологическая активность в данное время составляет примерно 30%, а предпочтительно, примерно 20% от желаемой биологической активности, наблюдаемой в процессе получения фармацевтической композиции, как было определено в подходящем анализе на нужную биологическую активность. Анализы для определения нужной биологической активности анти-CD40-антител могут быть проведены, как описано в примерах в данном описании. См. также анализы, описанные в публикациях Schultze et al. (1998) Proc. Natl. Acad. Sci. USA 92:8200-8204; Denton et al. (1998) Pediatr. Transplant. 2:6-15; Evans et al. (2000) J. Immunol. 164:688-697; Noelle (1998) Agents Actions Suppl. 49:17-22; Lederman et al. (1996) Curr. Opin. Hematol. 3:77-86; Coligan et al. (1991) Current Protocols in Immunology 13:12; Kwekkeboom et al. (1993) Immunology 79:439-444; и в патентах США №№ 5674492 и 5847082, которые вводятся в настоящее описание посредством ссылки.
В некоторых вариантах изобретения анти-CD40-антитело приготавливают в виде жидкой фармацевтической композиции. Анти-CD40-антитело может быть получено любым методом, известным специалистам, включая методы, описанные выше. В одном из вариантов изобретения анти-CD40-антитело рекомбинантно продуцируют в клеточной линии CHO.
Если перед получением препарата необходимо сохранение анти-CD40-антитела, то оно может быть заморожено, например, при ≤-20°С, а затем подвергнуто оттаиванию при комнатной температуре для последующей обработки. Жидкая фармацевтическая композиция содержит терапевтически эффективное количество анти-CD40-антитела. Количество антитела, присутствующего в такой композиции, зависит от способа введения и нужного объема доз.
Таким образом, жидкая фармацевтическая композиция содержит анти-CD40-антитело в концентрации примерно от 0,1 мг/мл до 50,0 мг/мл, примерно от 0,5 мг/мл до 40,0 мг/мл, примерно от 1,0 мг/мл до 30,0 мг/мл, примерно от 5,0 мг/мл до 25,0 мг/мл, примерно от 5,0 мг/мл до 20,0 мг/мл, или примерно от 15,0 мг/мл до 25,0 мг/мл. В некоторых вариантах изобретения жидкая фармацевтическая композиция содержит анти-CD40-антитело в концентрации примерно от 0,1 мг/мл до 5,0 мг/мл, примерно от 5,0 мг/мл до 10,0 мг/мл, примерно от 10,0 мг/мл до 15,0 мг/мл, примерно от 15,0 мг/мл до 20,0 мг/мл, примерно от 20,0 мг/мл до 25,0 мг/мл, примерно от 25,0 мг/мл до 30,0 мг/мл, примерно от 30,0 мг/мл до 35,0 мг/мл, примерно от 35,0 мг/мл до 40,0 мг/мл, примерно от 40,0 мг/мл до 45,0 мг/мл, или примерно от 45,0 мг/мл до 50,0 мг/мл. В других вариантах изобретения жидкая фармацевтическая композиция содержит анти-CD40-антитело в концентрации примерно 15,0 мг/мл, примерно 16,0 мг/мл, примерно 17,0 мг/мл, примерно 18,0 мг/мл, примерно 19,0 мг/мл, примерно 20,0 мг/мл, примерно 21,0 мг/мл, примерно 22,0 мг/мл, примерно 23,0 мг/мл, примерно 24,0 мг/мл или примерно 25,0 мг/мл. Жидкая фармацевтическая композиция содержит анти-CD40-антитело и буфер, который сохраняет pH указанной композиции в пределах примерно от pH 5,0 до pH 7,0, включая, примерно pH 5,0, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7,0 и другие величины в пределах примерно от pH 5,0 до pH 7,0. В некоторых вариантах изобретения буфер поддерживает pH данной композиции в пределах примерно от pH 5,0 до pH 6,5, примерно от pH 5,0 до pH 6,0, примерно от pH 5,0 до pH 5,5, примерно от pH 5,5 до 7,0, примерно от pH 5,5 до pH 6,5, или примерно от pH 5,5 до pH 6,0.
В данной композиции может быть использован любой подходящий буфер, который поддерживает pH жидкой композиции анти-CD40-антитела в пределах примерно от pH 5,0 до pH 7,0, при условии, что в этой фармацевтической композиции будет сохраняться физико-химическая стабильность и нужная биологическая активность антитела, как было описано выше. Подходящими буферами являются, но не ограничиваются ими, стандартные кислоты и их соли, в которых противоионами могут быть, например, натрий, калий, аммоний, кальций или магний. Примерами стандартных кислот и их солей, которые могут быть использованы для забуферивания жидкой фармацевтической композиции, являются, но не ограничиваются ими, янтарная кислота или сукцинат, лимонная кислота или цитрат, уксусная кислота или ацетат, винная кислота или тартрат, фосфорная кислота или фосфат, глюконовая кислота или глюконат, глутаминовая кислота или глутамат, аспарагиновая кислота или аспартат, малеиновая кислота или малеат, и яблочная кислота или малат. Концентрация буфера в данной композиции может составлять примерно от 1 мМ до 50 мМ, включая примерно 1 мМ, 2 мМ, 5 мМ, 8 мМ, 10 мМ, 15 мМ, 20 мМ, 25 мМ, 30 мМ, 35 мМ, 40 мМ, 45 мМ, 50 мМ или другие величины в пределах примерно от 1 мМ до 50 мМ. В некоторых вариантах изобретения концентрация буфера в данной композиции составляет примерно от 5 мМ до 15 мМ, включая примерно 5 мМ, 6 мМ, 7 мМ, 8 мМ, 9 мМ, 10 мМ, 11 мМ, 12 мМ, 13 мМ, 14 мМ, 15 мМ или другие величины в пределах примерно от 5 мМ до 15 мМ.
В некоторых вариантах изобретения жидкая фармацевтическая композиция включает терапевтически эффективное количество анти-CD40-антитела и сукцинатный буфер или цитратный буфер в концентрации, которая обеспечивает сохранение pH композиции в пределах примерно от pH 5,0 до pH 7,0, предпочтительно примерно от pH 5,0 до pH 6,5. Термин "сукцинатный буфер" или "цитратный буфер" означает буфер, содержащий соль янтарной кислоты или соль лимонной кислоты, соответственно. В предпочтительном варианте изобретения указанным противоионом сукцината или цитрата является катион натрия, а поэтому таким буфером является сукцинат натрия или цитрат натрия, соответственно. Однако считается, что эффективным может быть любой катион. Другими катионами сукцината или цитрата могут быть, но не ограничиваются ими, катионы калия, аммония, кальция и магния. Как указывалось выше, концентрация сукцинатного или цитратного буфера в данной композиции может составлять примерно от 1 мМ до 50 мМ, включая примерно 1 мМ, 2 мМ, 5 мМ, 8 мМ, 10 мМ, 15 мМ, 20 мМ, 25 мМ, 30 мМ, 35 мМ, 40 мМ, 45 мМ, 50 мМ или другие величины в пределах примерно от 1 мМ до 50 мМ. В некоторых вариантах изобретения концентрация буфера в данной композиции составляет примерно от от 5 мМ до 15 мМ, включая примерно 5 мМ, 6 мМ, 7 мМ, 8 мМ, 9 мМ, 10 мМ, 11 мМ, 12 мМ, 13 мМ, 14 мМ или примерно 15 мМ. В других вариантах изобретения жидкая фармацевтическая композиция содержит анти-CD40-антитело в концентрации примерно от 0,1 мг/мл до 50,0 мг/мл или примерно от 5,0 мг/мл до 25,0 мг/мл, и сукцинатный или цитратный буфер, например сукцинат натрия или цитрат натрия, в концентрации примерно от 1 мМ до 20 мМ, примерно от 5 мМ до 15 мМ, а предпочтительно примерно 10 мМ.
Если желательно, чтобы данная жидкая фармацевтическая композиция была почти изотоничной, то такая жидкая фармацевтическая композиция, содержащая анти-CD40-антитело и буфер, может также включать агент, придающий изотоничность, в количестве, достаточном для придания данной композиции свойств, близких к изотоничным. Термин “почти изотоничная” означает, что осмомолярность указанной водной композиции составляет примерно от 240 ммоль/кг до 360 ммоль/кг, предпочтительно примерно от 240 до 340 ммоль/кг, более предпочтительно примерно от 250 до 330 ммоль/кг, еще более предпочтительно примерно от 260 до 320 ммоль/кг, а наиболее предпочтительно примерно от 270 до 310 ммоль/кг. Методы определения изотоничности раствора известны специалистам в данной области. См., например, Setnikar et al. (1959) J. Am. Pharm. Assoc. 48:628.
Специалистам в данной области известны различные фармацевтически приемлемые растворенные вещества, которые могут придавать изотоничность фармацевтическим композициям. Агентом, придающим изотоничность, может быть любой реагент, способный корректировать осмотическое давление жидкой фармацевтической композиции согласно изобретению до величины, почти равной величине осмотического давления физиологической жидкости. При этом желательно использовать физиологически приемлемый агент, придающий изотоничность. Таким образом, жидкая фармацевтическая композиция, содержащая терапевтически эффективное количество анти-CD40-антитела и буфер, может также включать компоненты, которые могут быть использованы для придания изотоничности, например хлорид натрия; аминокислоты, такие как аланин, валин и глицин; сахара и спирты ряда сахаров (полиолы), включая, но не ограничиваясь ими, глюкозу, декстрозу, фруктозу, сахарозу, мальтозу, маннит, трегалозу, глицерин, сорбит и ксилит; уксусную кислоту, другие органические кислоты или их соли, и относительно небольшие количества цитратов или фосфатов. Среднему специалисту в данной области известны и другие агенты, которые могут быть использованы для придания жидкой композиции оптимальной изотоничности.
В некоторых предпочтительных вариантах изобретения жидкая фармацевтическая композиция, содержащая анти-CD40-антитело и буфер, также содержит хлорид натрия, используемый в качестве агента, придающего изотоничность. Концентрация хлорида натрия в данной композиции зависит от степени участия других компонентов в придании этой композиции тоничности. В некоторых вариантах изобретения концентрация хлорида натрия составляет примерно от 50 мМ до 300 мМ, примерно от 50 мМ до 250 мМ, примерно от 50 мМ до 200 мМ, примерно от 50 мМ до 175 мМ, примерно от 50 мМ до 150 мМ, примерно от 75 мМ до 175 мМ, примерно от 75 мМ до 150 мМ, примерно от 100 мМ до 175 мМ, примерно от 100 мМ до 200 мМ, примерно от 100 мМ до 150 мМ, примерно от 125 мМ до 175 мМ, примерно от 125 мМ до 150 мМ, примерно от 130 мМ до 170 мМ, примерно от 130 мМ до 160 мМ, примерно от 135 мМ до 155 мМ, примерно от 140 мМ до 155 мМ, или примерно от 145 мМ до 155 мМ. В одном из таких вариантов концентрация хлорида натрия составляет примерно 150 мМ. В других вариантах изобретения концентрация хлорида натрия составляет примерно 150 мМ, указанным буфером является сукцинатно-натриевый или цитратно-натриевый буфер, концентрация которого составляет примерно от 5 мМ до 15 мМ, жидкая фармацевтическая композиция содержит терапевтически эффективное количество анти-CD40-антитела, а рН данной композиции составляет примерно от 5,0 до 7,0, примерно от 5,0 до 6,0 или примерно от 5,5 до 6,5. В других вариантах изобретения жидкая фармацевтическая композиция содержит анти-CD40-антитело в концентрации примерно от 0,1 мг/мл до 50,0 мг/мл или примерно от 5,0 мг/мл до 25,0 мг/мл, хлорид натрия примерно при 150 мМ, а сукцинат натрия или цитрат натрия в концентрации примерно 10 мМ и при рН примерно 5,5.
Разложение белка, вызываемое замораживанием-оттаиванием или механическим сдвигом в процессе обработки жидких фармацевтических композиций согласно изобретению, может быть сведено до минимума путем введения в данную композицию поверхностно-активных веществ, уменьшающих степень поверхностного натяжения на границе раздела фаз “раствор-окружающая среда”. Так, например, в некоторых вариантах изобретения жидкая фармацевтическая композиция содержит терапевтически эффективное количество анти-CD40-антитела, буфер, а также поверхностно-активное вещество. В других вариантах изобретения жидкая фармацевтическая композиция содержит анти-CD40-антитело, буфер, агент, придающий изотоничность, а также поверхностно-активное вещество.
Обычно используемыми поверхностно-активными веществами являются неионогенные поверхностно-активные вещества, включая полиоксиэтилированные сложные эфиры сорбита, такие как полисорбат 80 (Твин 80) и полисорбат 20 (Твин 20); сложные эфиры полиоксипропилена-полиоксиэтилена, такие как плюроник F68 (Pluronic F68); полиоксиэтилированные спирты, такие как Brij 35; симетикон; полиэтиленгликоль, такой как ПЭГ400; лизофосфатидилхолин и полиоксиэтилен-п-т-октилфенол, такой как тритон Х-100. Классический метод стабилизации фармацевтических препаратов с использованием поверхностно-активных веществ или эмульгаторов описан, например, в публикации Levine et al. (1991) J. Parenteral Sci. Technol. 45(3):160-165, которая вводится в настоящее описание посредством ссылки. Предпочтительным поверхностно-активным веществом, используемым в настоящем изобретении, является полисорбат 80. Если в данный препарат вводят поверхностно-активное вещество, то обычно его добавляют в количестве, составляющем примерно от 0,001% до 1,0% (масс./об.), примерно от 0,001% до 0,5%, примерно от 0,001% до 0,4%, примерно от 0,001% до 0,3%, примерно от 0,001% до 0,2%, примерно от 0,005% до 0,5%, примерно от 0,005% до 0,2%, примерно от 0,01% до 0,5%, примерно от 0,01% до 0,2%, примерно от 0,03% до 0,5%, примерно от 0,03% до 0,3%, примерно от 0,05% до 0,5%, или примерно от 0,05% до 0,2%.
Так, например, в некоторых вариантах изобретения жидкая фармацевтическая композиция содержит терапевтически эффективное количество анти-CD40-антитела, указанным буфером является сукцинатно-натриевый или цитратно-натриевый буфер в концентрации примерно от 1 мМ до 50 мМ, примерно от 5 мМ до 25 мМ, или примерно от 5 мМ до 15 мМ; и указанная композиция имеет pH примерно от 5,0 до 7,0, примерно от 5,0 до 6,0 или примерно от 5,5 до 6,5, и дополнительно содержит поверхностно-активное вещество, например полисорбат 80, в количестве примерно от 0,001% до 1,0% или примерно от 0,001% до 0,5%. Такие композиции могут, но необязательно, содержать агент, придающий изотоничность, такой как хлорид натрия, в концентрации примерно от 50 мМ до 300 мМ, примерно от 50 мМ до 200 мМ или примерно от 50 мМ до 150 мМ. В других вариантах изобретения жидкая фармацевтическая композиция содержит анти-CD40-антитело в концентрации примерно от 0,1 мг/мл до 50,0 мг/мл или примерно от 5,0 мг/мл до 25,0 мг/мл, включая примерно 20,0 мг/мл; хлорид натрия в концентрации примерно от 50 мМ до 200 мМ, включая примерно 150 мМ; сукцинат натрия или цитрат натрия в концентрации примерно от 5 мМ до 20 мМ, включая примерно 10 мМ; хлорид натрия в концентрации примерно от 50 мМ до 200 мМ, включая примерно 150 мМ; и, необязательно, поверхностно-активное вещество, например полисорбат 80, в количестве примерно от 0,001% до 1,0%, включая примерно от 0,001% до 0,5%, где указанная жидкая фармацевтическая композиция имеет рН примерно от 5,0 до 7,0, примерно от 5,0 до 6,0, примерно от 5,0 до 5,5, примерно от 5,5 до 6,5 или примерно от 5,5 до 6,0.
Указанная жидкая фармацевтическая композиция, по существу, может не содержать консервантов и других носителей, наполнителей или стабилизаторов, упомянутых выше. Альтернативно, такая композиция может включать один или несколько консервантов, например антибактериальных средств, фармацевтически приемлемых носителей, наполнителей или стабилизаторов, упомянутых выше, при условии, что они не будут оказывать негативного влияния на физико-химическую стабильность анти-CD40-антитела. Примерами подходящих носителей, наполнителей и стабилизаторов являются, но не ограничиваются ими, дополнительные забуферивающие агенты, сорастворители, поверхностно-активные вещества, антиоксиданты, включая аскорбиновую кислоту и метионин, хелатообразующие агенты, такие как EDTA, металлокомплексы (например, комплексы Zn-белок) и биологически разлагаемые полимеры, такие как полиэфиры. Подробное обсуждение методов приготовления препаратов и выбора фармацевтически приемлемых носителей, стабилизаторов и изомолитов можно найти в руководстве Remington's Pharmaceutical Sciences (18th ed.; Mack Publishing Company, Eaton, Pennsylvania, 1990), которое вводится в настоящее описание посредством ссылки.
Используемый здесь термин "носители" включает фармацевтически приемлемые носители, наполнители или стабилизаторы, которые являются нетоксичными для клеток или млекопитающих при введении таких носителей в обычно используемых дозах и концентрациях. В большинстве случаев физиологически приемлемым носителем является водный рН-забуференный раствор. Примерами физиологически приемлемых носителей являются буферы, такие как фосфат, цитрат, сукцинат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту; низкомолекулярные (содержащие примерно менее 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как EDTA; спирты ряда сахаров, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионогенные поверхностно-активные вещества, такие как Твин, полиэтиленгликоль (ПЭГ) и плюроники.
Термин “введение в комбинации с одним или несколькими другими терапевтическими средствами” включает одновременное (конкурентное) и последовательное введение в любом порядке.
После приготовления жидкой фармацевтической композиции или другой фармацевтической композиции, описанных в настоящей заявке, они могут быть лиофилизованы для предотвращения их разложения. Методы лиофилизации жидких композиций известны среднему специалисту в данной области. Перед использованием композиция может быть разведена стерильным разбавителем (например, раствором Рингера, дистиллированной водой или стерильным физиологическим раствором), который может содержать дополнительные ингредиенты. После разведения указанную композицию предпочтительно вводят индивидуумам методами, известными специалистам в данной области.
В некоторых вариантах изобретения анти-CD40-антитела могут быть введены в комбинации по меньшей мере с одной другой известной терапией, применяемой для лечения воспалительных и/или аутоиммунных заболеваний. Такими способами лечения являются, но не ограничиваются ими, хирургия или хирургические операции (например, спленэктомия, лимфаденэктомия, тироидэктомия, плазмаферез, лейкаферез, трансплантация клеток, тканей или органов, операции на тонком кишечнике, перфузия органов и т.п.), лучевая терапия, стероидная и нестероидная терапия, гормональная терапия, терапия цитокинами, терапия дерматологическими средствами (например, средствами для местного применения, используемыми для лечения кожных болезней, таких как аллергии, контактный дерматит и псориаз), терапия иммунодепрессантами и другая терапия противовоспалительными моноклональными антителами и т.п. Если способы согласно изобретению включают комбинированные схемы лечения, то такие курсы терапии могут быть проведены одновременно, т.е., анти-CD40-антитело-антагонист или его антигенсвязывающий фрагмент вводят одновременно или в пределах одного и того же интервала времени с введением другого терапевтического средства (т.е. эти курсы терапии проводят одновременно, но при этом анти-CD40-антитело или его антигенсвязывающий фрагмент и другое терапевтическое средство вводят не в один и тот же момент времени с другой терапией). Альтернативно, анти-CD40-антитело-антагонист согласно изобретению или его антигенсвязывающий фрагмент могут быть введены до или после проведения другой терапии. Последующее введение других терапевтических средств может быть осуществлено независимо от того, наблюдалось ли у подвергаемого лечению индивидуума снижение вероятности ремиссии или рецидива в ответ на проведение первой терапии.
Таким образом, анти-CD40-антитела вводят в комбинации по меньшей мере с одной другой терапией, включая, но не ограничиваясь ими, хирургию, перфузию органов, лучевую терапию, стероидную терапию, нестероидную терапию, терапию антибиотиками, терапию противогрибковыми средствами, гормональную терапию, терапию цитокинами, терапию дерматологическими средствами (например, средствами для местного применения, используемыми для лечения кожных болезней, таких как аллергии, контактный дерматит и псориаз), терапию иммунодепрессантами, другую терапию противовоспалительными моноклональными антителами, их комбинации и т.п. Таким образом, если комбинированная терапия включает введение анти-CD40-антитела в комбинации с введением другого терапевтического средства, например стероидов, то способы согласно изобретению включают совместное введение этих средств в виде отдельных препаратов или одного фармацевтического препарата, и последующее их введение в любом порядке.
Примерами иммунодепрессантов, которые могут быть введены в комбинации с анти-CD40-антителами, являются но не ограничиваются ими, метотрексат, циклофосфамид, мизорибин, хлорамбуцил, циклоспорин, такой как, например, циклоспорин в виде аэрозоля (см., например, опубликованную заявку на патент США № US20020006901, которая во всей своей полноте вводятся в настоящее описание посредством ссылки), такролимус (FK506; ProGrafTM), микофенолят-мофетил и азатиоприн (6-меркаптопурин), сиролимус (рапамицин), дезоксиспергуалин, лефлуномид и его малононитриламидные аналоги, и иммуносупрессорные белки.
Примерами подходящих противовоспалительных средств, которые могут быть введены в комбинации с анти-CD40-антителами, являются, но не ограничиваются ими, кортикостероиды, такие как, например, клобетазол, галобетазол, гидрокортизон, триамцинолон, бетаметазон, флуоцинол, флуоцинонид, преднизон, преднизолон, метилпреднизолон; нестероидные противовоспалительные лекарственные средства (НСПВС), такие как, например, сульфасалазин, лекарственные препараты, содержащие мезаламин (известные как средства 5-ASA), целекоксиб, диклофенак, этодолак, фенопрофен, флурбипрофен, ибупрофен, кетопрофен, меклофамат, мелоксикам, набуметон, напроксен, оксапрозин, пироксикам, рофекоксиб, салицилаты, сулендак и толметин; Enbrel® (растворимый TNF-рецептор), противовоспалительные антитела, такие как адалимумаб (HUMIRA®, антагонист TNF-α) и инфликсимаб (Remicade®, антагонист TNF-α) и т.п.
Реакция отторжения трансплантата и реакция “трансплантат против хозяина” могут быть сверхострыми (гуморальными), острыми (T-клеточно-опосредуемыми) или хроническими (неизвестной этиологии) или могут иметь смешанный характер. Таким образом, в некоторых вариантах изобретения анти-CD40-антитела согласно изобретению используются для предупреждения и/или ослабления реакции отторжения трансплантата и/или симптомов, ассоциированных со сверхострой, острой и/или хронической реакцией отторжения трансплантата любых тканей, включая, но не ограничиваясь ими, ткани печени, почек, поджелудочной железы, клеток панкреатических островков, тонкого кишечника, легких, сердца, роговицы, кожи, кровеносных сосудов, костей, гетерологичного или аутологичного трансплантата костного мозга и т.п. Трансплантируемые ткани могут быть взяты от любого донора и трансплантированы любому реципиенту-хозяину, а поэтому процедура трансплантации может включать трансплантацию ткани животного человеку (например, ксенотрансплантаты), трансплантацию ткани, взятой у одного человека, другому человеку (например, аллотрансплантаты) и/или трансплантацию ткани, взятой из одной части организма человека, в другую его часть (например, аутотрансплантаты). Лечение антителами согласно изобретению может также минимизировать осложнения после трансплантации, такие как высокая температура, анорексия, гемодинамические нарушения, лейкопения, инфильтрация лейкоцитов в трансплантированных органах/тканях, а также развитие условно-патогенных инфекций.
В тех вариантах изобретения, в которых анти-CD40-антитела согласно изобретению используются для предотвращения отторжения трансплантата и для лечения ревматоидного артрита или рассеянного склероза, такие антитела могут быть использованы в комбинации с подходящими иммунодепрессантами, описанными в настоящей заявке.
Таким образом, настоящее изобретение относится к применению терапевтически или профилактически эффективного количества анти-CD40-антитела в целях приготовления лекарственного препарата для лечения воспалительного или аутоиммунного заболевания, ассоциированного с CD40-экспрессирующими клетками у пациента-человека, гетерозиготного или гомозиготного по FcγRIIIa-158F (генотип V/F или F/F), где указанный лекарственный препарат применяют в комбинации по меньшей мере с одной другой терапией.
Термин “комбинация” означает лекарственный препарат, содержащий анти-CD40-антитело, который вводят до, во время или после прохождения данным индивидуумом по меньшей мере одного курса другой терапии.
Настоящее изобретение также относится к применению анти-CD40-антитела в целях приготовления лекарственного препарата для лечения у человека воспалительного или аутоиммунного заболевания, ассоциированного с CD40-экспрессирующими клетками, где указанный пациент является гетерозиготным или гомозиготным по FcγRIIIa-158F (генотип V/F или F/F) и ранее проходил курс лечения с применением по меньшей мере одного другого терапевтического средства.
Термин “предварительная терапия” или “предварительное лечение” означает, что данный индивидуум был подвергнут терапии одного или нескольких видов (то есть прошел курс по меньшей мере одной другой терапии) до введения ему лекарственного средства, содержащего анти-CD40-антитело. Пациентами, прошедшими “предварительный курс лечения или терапии”, являются пациенты, которые проходили курс по меньшей мере одной другой терапии за 2 года, за 18 месяцев, за 1 год, за 6 месяцев, за 2 месяца, за 6 недель, за 1 месяц, за 4 недели, за 3 недели, за 2 недели, за 1 неделю, за 6 дней, за 5 дней, за 4 дня, за 3 дня, за 2 дня, или даже за 1 день до начала лечения лекарственным средством, содержащим анти-CD40-антитело. При этом необходимо, чтобы указанный индивидуум был восприимчив к указанном(ым) предварительному(ым) курсу(ам) терапии. Таким образом, индивидуум, подвергаемый лечению лекарственным средством, содержащим анти-CD40-антитело-антагонист, может быть восприимчивым либо не восприимчивым (то есть он может страдать заболеванием, резистентным к терапии) к ранее проводимому курсу лечения либо к одному или нескольким курсам предварительного лечения, где указанное предварительное лечение включает несколько различных видов терапии. Примерами других видов терапии, которым может быть подвергнут пациент до прохождения курса лечения лекарственным средством, содержащим анти-CD40-антитело, являются, но не ограничиваются ими, различные виды терапии, применяемые для лечения воспалительных или аутоиммунных заболеваний, описанных в настоящей заявке.
Термин “лечение”, используемый здесь в связи с применением лекарственного средства в описанных здесь курсах другой терапии одного или нескольких видов, означает местное применение или введение лекарственного препарата или другого терапевтического средства индивидууму, либо нанесение на выделенную ткань или клеточную линию индивидуума, либо введение в эту ткань или клеточную линию лекарственного препарата или другого терапевтического средства, где указанный индивидуум страдает аутоиммунным или воспалительным заболеванием, обнаруживает симптомы, ассоциированные с аутоиммунным или воспалительным заболеванием, или имеет предрасположенность к развитию аутоиммунного и/или воспалительного заболевания, и где целью такого введения является лечение заболевания, снижение тяжести, облегчение или ослабление симптомов, подавление развития, модуляция, предотвращение, уменьшение интенсивности, улучшение динамики течения указанного аутоиммунного и/или воспалительного заболевания, или подавление любых симптомов, ассоциированных с аутоиммунным и/или воспалительным заболеванием, либо устранение риска развития аутоиммунного и/или воспалительного заболевания у пациентов с предрасположенностью к данному заболеванию.
В некоторых вариантах изобретения комбинированная терапия позволяет достичь синергического терапевтического эффекта по сравнению с терапевтическим эффектом, достигаемым с применением лишь отдельно взятых терапевтических агентов. Термин “синергический эффект”, используемый для описания комбинированного эффекта двух или более активных агентов, означает эффект, который превышает сумму отдельных эффектов каждого активного агента. Таким образом, если комбинированный эффект двух или нескольких агентов приводит к “синергическому ингибированию” активности или процесса, то это означает, что уровень ингибирования данной активности или данного процесса превышает уровень ингибирования, равный сумме ингибирующих эффектов каждого соответствующего активного агента. Термин “синергический терапевтический эффект” означает терапевтический эффект, наблюдаемый при применении комбинации двух или нескольких видов терапии, где указанный терапевтический эффект (измеряемый по любому из ряда параметров) превышает сумму отдельных терапевтических эффектов, наблюдаемых при отдельном применении каждого из соответствующих видов терапии.
Различные аспекты и варианты настоящего изобретения более подробно описаны ниже лишь в качестве примеров. При этом следует отметить, что в эти аспекты и варианты могут быть внесены изменения, не выходящие за рамки объема настоящего изобретения.
Экспериментальная часть
Анти-CD40-антителом, используемым в нижеследующих примерах, является CHIR-12.12. Продуцирование, секвенирование и характеризация антитела CHIR-12.12 подробно описаны в опубликованных международных патентных заявках WO 2005/044854, WO 2005/044304, WO 2005/044305, WO 2005/044306, WO 2005/044855, WO 2005/044307 и WO 2005/044294. Гибридомная линия 153.8E2.D10.D6.12.12 (CMCC#12056), экспрессирующая антитело CHIR-12.12, была депонирована в Американской коллекции типовых культур [ATCC; 10801 University Blvd., Manassas, Virginia 20110-2209 (USA)] под номером патентного депозита PTA-5543.
В ряде нижеследующих примеров рассматривается связывание антитела CHIR-12.12 с раковыми клеточными линиями и раковыми клетками пациента. Однако все нижеследующие примеры относятся непосредственно к применению антитела CHIR-12.12 для лечения воспалительных заболеваний и/или аутоиммунных заболеваний, поскольку эти примеры иллюстрируют свойства анти-CD40-антитела, а именно CHIR-12.12, которое с равным успехом может быть применено для лечения воспалительных заболеваний и/или аутоиммунных заболеваний.
Пример 1: Анализ на ADCC в клеточных линиях
CHIR-12.12 и ритуксимаб сравнивали в отношении их ADCC-активности, направленной против различных злокачественных В-клеточных линий, экспрессирующих антигены CD40 и CD20, включая клеточные линии лимфомы (Daudi, Namalwa), клеточные линии множественной миеломы (ARH77, IM-9), В-клеточную линию ОЛЛ (CCRF-SB) и В-клеточную линию ХЛЛ (EHEB).
ADCC-эффективность и активность, измеряемые как максимальный процент лизиса и ED50, соответственно, сравнивали для антитела CHIR-12.12 и ритуксимаба. Результаты этих экспериментов представлены на фиг. 1A-1F. Для всех клеточных линий-мишеней антитело CHIR-12.12 представляло собой более сильный и эффективный медиатор ADCC, чем ритуксимаб. В шести протестированных клеточных линиях число молекул CD20 клеточной поверхности на клетку в 2,6-30,8 раз превышало число молекул CD40. Эти данные показали, что, несмотря на присутствие меньшего числа молекул CD40 по сравнению с молекулами CD20, злокачественные В-клеточные линии более эффективно подвергались лизису под действием антитела CHIR-12.12, чем под действием ритуксимаба.
Пример 2: Анализ на ADCC в клетках пациента с ХЛЛ
Было проведено сравнение относительной ADCC-активности CHIR-12.12 и ритуксимаба ex vivo, направленной на первичные ХЛЛ-клетки, взятые от 8 пациентов. У всех пациентов антитело CHIR-12.12 обнаруживало большую ADCC-активность, направленную на ХЛЛ-клетки, чем ритуксимаб (см. фиг. 2A-D и фиг.3). Результаты анализов систематизированы на фиг.3. Антитело CHIR-12.12 является более эффективным, чем ритуксимаб.
Экспериментальный анализ на антитело-зависимую клеточную цитотоксичность (ADCC)
Клетки-мишени: Клетки пациента с ХЛЛ: 5000/лунку. Эффекторные клетки: очищенные нормальные человеческие NK-клетки: 50000/лунку. Отношение E:T: 10. Концентрация Ab: 0,00001, 0,0001, 0,001, 0,01, 0,1, 1 и 10 мкг/мл. Время инкубирования: 4 часа. Культуральная среда: RPMI (без фенолового красного) + 10% FBS + 1% P/S. Устройство для культивирование клеток: 96-луночный круглодонный планшет. Экспериментальные данные: высвобождение кальцеина AM, измеряемое в произвольных единицах флуоресценции (AFU) при возбуждении на 485 нм и излучении на 535 нм. Вычисление: % специфического лизиса = 100 × (AFU тестируемого высвобождения - AFU спонтанного высвобождения 1)/(AFU максимального высвобождения 2 - AFU спонтанного высвобождения). Негативный контроль: кальцеин, высвобождаемый клетками-мишенями в отсутствие антитела или NK-клеток. Позитивный контроль: кальцеин, высвобождаемый клетками-мишенями после лизиса детергентом (1% NP40).
Результаты, проиллюстрированные на фиг. 2 и 3, показали, что антитело CHIR-12.12 опосредует более высокую ADCC-активность, направленную на ХЛЛ-клетки пациентов, чем ритуксимаб. Разность ADCC-активностей может зависеть от клеток-мишеней или от NK-клеток-доноров, но наблюдается во всех образцах, взятых у пациентов. При тестировании ХЛЛ-клеток, взятых от одного пациента, с использованием двух различных NK-клеток-доноров, было обнаружено, что антитело CHIR-12.12 опосредует более высокую ADCC-активность в случае обеих донорных NK-клеток, чем ритуксимаб, хотя величины разности ADCC-активностей не были идентичными (см. фиг.4). Механистической основой такого увеличения ADCC-активности могут служить относительные уровни экспрессии антигенов-мишеней (CD20 и CD40), степень интернализации антитела и аффинность антитела к рецептору FcγRIIIa на NK-клетках. Поэтому было проведено исследование влияния этих факторов на ADCC-активность CHIR-12.12 и ритуксимаба.
Пример 3: Количественная оценка молекул CD40 и CD20 клеточной поверхности
Плотность CD20 и CD40 на ХЛЛ-клетках (пример 3) и степень интернализации антител (пример 4) количественно оценивали с точки зрения их возможного влияния на вышеуказанное различие ADCC-активностей. Было обнаружено, что более высокая ADCC-активность и эффективность CHIR-12.12 не коррелирует с более высокой плотностью молекул CD40 клеточной поверхности, поскольку число молекул CD20 на клеточной поверхности в 1,3-14 раз превышало число молекул CD40 (см. фиг.5 и 6).
Методы
Клетки предварительно инкубировали с человеческим IgG1 при концентрации 1 мг/мл в окрашивающем буфере (PBS, содержащем 1% BSA, 0,1% азида Na) для блокирования неспецифических сайтов связывания. Клетки инкубировали в течение 30 минут при 4°С (на льду). Затем добавляли ФИТЦ-конъюгированный человеческий IgG1 контрольного изотипа, ФИТЦ-конъюгированное антитело CHIR-12.12 или ФИТЦ-конъюгированный ритуксимаб при 100, 10, 1, 0,1 мкг/мл, и клетки инкубировали в течение 30 минут при 4°С (на льду). Клетки промывали окрашивающим буфером (PBS + l% FBS + 0,1% азид натрия) и анализировали на приборе FACS Calibur.
Геометрическое среднее интенсивности флуоресценции измеряли с помощью FACS. Затем подсчитывали число молекул эквивалентного растворимого флуорохрома (MESF), исходя из стандартной кривой, построенной с использованием прокалиброванных ФИТЦ-конъюгированных сфер.
Пример 4: Антитело CHIR-12.12 не индуцирует интернализацию после связывания с CD40 на клеточных линиях
Для оценки влияния связывания антитела CHIR-12.12 на интерализацию использовали клеточную линию лимфомы Дауди и ARH77, клеточную линию ММ. Клетки инкубировали с человеческим IgG1 (контрольным антителом) или с антителом CHIR-12.12 при 1 мкг/мл на льду (в присутствии 0,1% азида натрия для блокирования интернализации) или при 37°С (без азида натрия) в течение 3 часов. После промывки холодным окрашивающим буфером (PBS + 1% BSA + 0,1% азида натрия) клетки окрашивали ФИТЦ-конъюгированным козьим антителом против человеческого IgG в течение 30 минут на льду. Геометрическое среднее интенсивности флуоресценции (MFI) измеряли с помощью FACS Calibur. Какого-либо отличия в величинах MFI для клеток, инкубированных с CHIR-12.12 на льду в присутствии азида натрия или при 37°С в отсутствие азида натрия, не наблюдалось (фиг.7). Эти данные показали, что антитело CHIR-12.12 после его связывания с CD40 не интернализуется в клетках и остается на клеточной поверхности.
Пример 5: Интернализация CHIR-12.12 и ритуксимаба после связывания с ХЛЛ-клетками пациента: FACS и конфокальная микроскопия
FACS-методика
Клетки инкубировали с huIgG1, CHIR-12.12 или ритуксимабом при 10 мкг/мл в течение 3 часов при 40°С (с 0,1% азида Na) или при 37°С (без азида Na). Клетки промывали окрашивающим буфером (PBS + 1% FBS + 0,1% азида Na), а затем добавляли ФИТЦ-конъюгированное козье антитело против человеческого IgG, после чего клетки инкубировали в течение 30 минут при 40°С и анализировали на устройстве FACS Calibur.
Методика с применением конфокальной микроскопии
Клетки инкубировали с Alexa 488 или с ФИТЦ-конъюгированным антителом CHIR-12.12, с ритуксимабом и IgG1 при 10 мкг/мл, в течение 3 часов при 40°С (с 0,1% азида Na) или при 37°С (без азида Na). Затем клетки промывали и фиксировали 2% формальдегидом в течение 5 минут при комнатной температуре. После этого клетки промывали и помещали на предметные стекла, покрытые поли-L-лизином, заливали в среду и герметично закрывали, а затем анализировали на конфокальном визуализирующем микроскопе.
Результаты
Результаты этих экспериментов проиллюстрированы на фиг.8 (FACS) и на фиг. 9 и 10 (конфокальная микроскопия). Результаты этих экспериментов систематизированы на фиг.11. Исследования по интернализации антител с использованием первичных ХЛЛ-клеток, проводимые с помощью проточной цитометрии и конфокальной микроскопии, показали, что антитело CHIR-12.12 после его связывания с CD40 при 37°С сохраняет однородное распределение на клеточной поверхности даже через 3 часа. В противоположность этому, ритуксимаб после его связывания при 37°С перераспределяется в области ореолов флуоресценции (кэпов) и интернализуется. Эти данные позволяют предположить, что сильная ADCC-активность антитела CHIR-12.12 может быть ассоциирована с его способностью равномерно распределяться на поверхности клеток-мишеней, что позволяет этому антителу оптимально взаимодействовать с эффекторными клетками. Полученные результаты дают основание предположить, что антитело CHIR-12.12 может эффективно опосредовать сильную ADCC-активность, направленную на ХЛЛ-клетки in vivo.
Пример 6: Анализ Biacore на связывание FcγRIIIa с ритуксаном® и CHIR-12.12
Аффинности связывания CHIR-12.12 и ритуксимаба с аллелями a.к.l58F и a.к.l58V-аллелями FcγRIIIa сравнивали с помощью стандартного анализа Biacore®. CHIR-12.12 связывается с a.к.l58F-аллелем с аффинностью, которая в 4,6 раз превышает аффинность связывания ритуксимаба (KD = 2,8 мкМ и 13 мкМ, соответственно). Результаты этих экспериментов систематизированы в следующей таблице:
| KD (нМ) | ||
| CHIR-12.12 | Ритуксимаб | |
| FcγRIIIa-158V | 492 | 466 |
| FcγRIIIa-158F | 2800 | 13000 |
Пример 7: Влияние FcγRIIIa-полиморфизма на ADCC в присутствии эффекторных NK-клеток
Антитело-зависимая клеточная цитотоксичность (ADCC) представляет собой основной механизм действия многих коммерчески доступных и исследуемых моноклональных антител. Считается, что ритуксимаб (ритуксан®), применяемый для лечения фолликулярной неходжкинской лимфомы (НХЛ) и обладающий активностью по отношению к другим В-клеточным злокачественным опухолям, имеет ADCC-активность, которая представляет собой один из главных механизмов его действия. При этом следует отметить, что клиническая активность ритуксимаба по отношению к НХЛ коррелирует с FcγRIIIa-генотипом. Пациенты со 158 a.к.-полиморфизмом FcγRIIIa V/V или V/F являются более восприимчивыми к ритуксимабу, чем пациенты с F/F (например, см. Cartron et al. (2002) Blood 99(3):754-758 или Dall'Ozzo et al. (2004) Cancer Res. 64:4664-4669).
В этих экспериментах очищенные эффекторные NK-клетки, взятые от различных доноров (людей) и экспрессирующие различные a.к.l58-полиморфизмы FcγRIIIa, оценивали с использованием человеческой клеточной линии лимфомы Дауди в качестве клеток-мишеней (см. фиг. 12 и 13). Как проиллюстрировано на этих фигурах, антитело CHIR-12.12 индуцирует сильную ADCC-активность, направленную на NK-клетки всех трех генотипов. ED50 антитела CHIR-12.12 в отношении лизиса клеточной линии Дауди составляет 4,2 и 0,4 пМ для генотипов F/F, V/F и V/V, соответственно (фиг.13). ED50 ритуксимаба в отношении лизиса клеточной линии Дауди составляет 53, 21 и 9 пМ для генотипов F/F, V/F и V/V, соответственно (фиг.13).
Очищенные эффекторные NK-клетки, взятые от различных доноров (людей) и экспрессирующие различные a.к.l58-полиморфизмы FcγRIIIa, также оценивали с использованием ХЛЛ-клеток пациента в качестве клеток-мишеней (см. фиг.14). Было обнаружено, что антитело CHIR-12.12 является более сильным медиатором ADCC-активности, направленной на все тестируемые ХЛЛ-клетки пациента, чем ритуксимаб (фиг.14). Эти данные позволяют предположить, что антитело CHIR-12.12 является более сильным медиатором ADCC, чем ритуксимаб, даже в присутствии NK-клеток с a.к.l58-V/F- или F/F-генотипом.
Полученные результаты были неожиданными, поскольку ранее предполагалось, что антитело CHIR-12.12 должно быть значительно менее активным в анализах на ADCC, проводимых с использованием NK-клеток со 158a.к.-полиморфизмом FcγRIIIa генотипа F/F или V/F, чем в анализах, проводимых с использованием клеток генотипа V/V. И снова было обнаружено, что клиническая активность ритуксимаба при НХЛ коррелирует с FcγRIIIa-генотипом. Пациенты со 158a.к.-полиморфизмом FcγRIIIa генотипа V/V или V/F являются более восприимчивыми к ритуксимабу, чем пациенты с генотипом F/F. Ритуксимаб также представляет собой моноклональное антитело IgG1, которое связывается с антигеном, экспрессируемым на поверхности В-клеток, а поэтому предполагается, что антитело CHIR-12.12 должно иметь аналогичную специфичность в отношении полиморфизма FcγRIIIa-158V. Вместо этого было обнаружено, что антитело CHIR-12.12 индуцирует сильную ADCC-активность в присутствии NK-клеток всех трех генотипов.
Исходя из описания настоящей заявки и прилагаемого графического материала специалистом в данной области, к которой относится настоящее изобретение, может быть внесено множество представляющих интерес модификаций и других вариантов, помимо вариантов, описанных в настоящей заявке. Поэтому следует отметить, что настоящее изобретение не ограничивается конкретно описанными здесь вариантами его осуществления, и такие модификации и другие варианты также входят в объем прилагаемой формулы изобретения. Хотя в настоящем изобретении используются конкретные термины, однако они имеют лишь общий и описательный смысл и не должны рассматриваться как ограничение изобретения.
Все цитируемые здесь публикации и патентные заявки во всей своей полноте вводятся в настоящее описание посредством ссылки так, как если бы каждая отдельная публикация или патентная заявка были конкретно и отдельно введены посредством ссылки.
Claims (41)
1. Лекарственное средство, содержащее анти-CD40-антитело для применения в лечении воспалительного заболевания или аутоиммунного заболевания, ассоциированных с экспрессирующими CD40 клетками, у пациента-человека гетерозиготного или гомозиготного по FcγRIIIa-158F (генотип V/F или F/F), где указанное антитело выбрано из группы, состоящей из:
a) моноклонального антитела, которое связывается с эпитопом, способным связывать моноклональное антитело CHIR-12.12, продуцируемое гибридомной клеточной линией, депонированной АТСС в виде патентного депозита № РТА-5543,
b) моноклонального антитела, которое связывается с эпитопом, содержащим остатки 82-87 последовательности CD40 человека, показанной в SEQ ID NO:7 или SEQ ID NO:9, и
c) моноклонального антитела, которое конкурирует с моноклональным антителом CHIR-12.12, продуцируемым гибридомной клеточной линией, депонированной АТСС в виде патентного депозита № РТА-5543, в анализе конкурентного связывания.
a) моноклонального антитела, которое связывается с эпитопом, способным связывать моноклональное антитело CHIR-12.12, продуцируемое гибридомной клеточной линией, депонированной АТСС в виде патентного депозита № РТА-5543,
b) моноклонального антитела, которое связывается с эпитопом, содержащим остатки 82-87 последовательности CD40 человека, показанной в SEQ ID NO:7 или SEQ ID NO:9, и
c) моноклонального антитела, которое конкурирует с моноклональным антителом CHIR-12.12, продуцируемым гибридомной клеточной линией, депонированной АТСС в виде патентного депозита № РТА-5543, в анализе конкурентного связывания.
2. Лекарственное средство по п.1, где указанное воспалительное заболевание или аутоиммунное заболевание выбрано из группы, состоящей из системной красной волчанки (СКВ), дискоидной волчанки, волчаночного нефрита, саркоидоза, воспалительного артрита, включая ювенильный артрит, ревматоидный артрит, псориатический артрит, синдром Рейтера, анкилозирующий спондилит и подагрический артрит; отторжения трансплантата органов или тканей, сверхострого, острого или хронического отторжения трансплантата и/или реакции "трансплантат против хозяина", рассеянного склероза, гипер-IgE-синдрома, нодозного полиартериита, первичного билиарного цирроза, воспалительного заболевания кишечника, болезни Крона, глютеновой болезни (глютен-чувствительной энтеропатии), аутоиммунного гепатита, пернициозной анемии, аутоиммунной гемолитической анемии, псориаза, склеродермии, тяжелой миастении, аутоиммунной тромбоцитопенической пурпуры, аутоиммунного тиреоидита, болезни Грейвса, тиреоидита Хашимото, болезни иммунных комплексов, иммунодисфункционального синдрома хронической усталости (CFIDS), полимиозита и дерматомиозита, криоглобулинемии, тромболиза, кардиомиопатии, вульгарной пузырчатки, интерстициального фиброза легких, сахарного диабета типа I и типа II, гиперчувствительности замедленного типа 1, 2, 3 и 4, аллергии или аллергических расстройств, нежелательных/непредусмотренных ответов на терапевтические белки, астмы, синдрома Черга-Штраусса (аллергического гранулематоза), атопического дерматита, аллергического и раздражающего контактного дерматита, крапивницы, IgE-опосредуемой аллергии, атеросклероза, васкулита, идиопатической воспалительной миопатии, гемолитического заболевания, болезни Альцгеймера и хронической воспалительной демиелинизирующей полиневропатии; воспаления легких, включая, но не ограничиваясь ими, отторжение легочного трансплантата, астму, саркоидоз, эмфизему, кистозный фиброз, идиопатический фиброз легких, хронический бронхит, аллергический ринит и аллергические заболевания легких, такие как пневмонит, ассоциированный с гиперчувствительностью, эозинофильная пневмония, облитерирующий бронхиолит, вызванный трансплантацией костного мозга и/или легких или другими факторами; атеросклероза/флебосклероза, вызванного трансплантацией; фиброза легких, индуцированного коллагеном; сосудистых и аутоиммунных заболеваний, таких как ревматоидный артрит и системная красная волчанка.
3. Лекарственное средство по п.1, где указанным воспалительным заболеванием или аутоиммунным заболеванием является воспалительное заболевание или аутоиммунное заболевание, ассоциированное с клетками, экспрессирующими как CD40, так и CD20.
4. Лекарственное средство по п.3, где указанным воспалительным заболеванием или аутоиммунным заболеванием является ревматоидный артрит, псориаз, системная красная волчанка, болезнь Крона, тяжелая миастения, идиопатическая тромбоцитопеническая пурпура или синдром Шегрена.
5. Лекарственное средство по п.3, где указанным воспалительным заболеванием или аутоиммунным заболеванием является рассеянный склероз, отторжение трансплантата, реакция "трансплантат против хозяина", болезнь Альцгеймера или диабет.
6. Лекарственное средство по п.1, где указанным антителом является моноклональное антитело CHIR-12.12, продуцируемое гибридомной клеточной линией, депонированной АТСС в виде патентного депозита № РТА-5543.
7. Лекарственное средство по п.1, где указанное антитело содержит: (i) остатки определяющей комплементарность области (CDR) SEQ ID NO:2 и (ii) остатки определяющей комплементарность области (CDR) SEQ ID NO:4.
8. Лекарственное средство по п.1, где указанным антителом является моноклональное антитело, содержащее аминокислотную последовательность, выбранную из группы, состоящей из: (i) SEQ ID NO:2, (ii) SEQ ID NO:4, (iii) SEQ ID NO:5, (iv) SEQ ID NO:2 и SEQ ID NO:4, и (v) SEQ ID NO:2 и SEQ ID NO:5.
9. Лекарственное средство по п.1, где указанное антитело выбрано из группы, состоящей из: (i) моноклонального антитела, содержащего последовательности вариабельной и константной области, показанные в SEQ ID NO:2, (ii) моноклонального антитела, содержащего последовательности вариабельной и константной области, показанные в SEQ ID NO:4, (iii) моноклонального антитела, содержащего последовательности вариабельной и константной области, показанные в SEQ ID NO: 5, (iv) моноклонального антитела, содержащего последовательности вариабельной и константной области, показанные в SEQ ID NO:2, и последовательности вариабельной и константной области, показанные в SEQ ID NO:4, (v) моноклонального антитела, содержащего последовательности вариабельной и константной области, показанные в SEQ ID NO:2, и последовательности вариабельной и константной области, показанные в SEQ ID NO:5.
10. Лекарственное средство по п.1, где указанным анти-СD40-антителом является человеческое моноклональное антитело.
11. Лекарственное средство по п.10, где указанное анти-СD40-антитело содержит константную область тяжелой цепи человеческого IgGl.
12. Лекарственное средство по п.11, где указанное человеческое IgGl содержит аминокислотную последовательность, приведенную в SEQ ID NO:4 или SEQ ID NO:5.
13. Лекарственное средство по любому из пп.1-12, где указанное антитело к CD40 связывается с CD40 человека с аффинностью (KD) от, по меньшей мере, приблизительно 10-6 М до, по меньшей мере, приблизительно 10-12 М.
14. Лекарственное средство по любому из пп.1-12, где указанное антитело к CD40 связывается с FcγRIIIa-158V человека с аффинностью(KD) по меньшей мере, приблизительно 0,5 мкМ и/или связывается с FcγRIIIa-158F человека с аффинностью (KD), по меньшей мере, приблизительно 12 мкМ.
15. Лекарственное средство по любому из пп.1-12, где указанным моноклональным антителом является антигенсвязывающий фрагмент моноклонального антитела, где указанный фрагмент сохраняет способность специфического связывания с указанным антигеном CD40 человека.
16. Лекарственное средство по п.15, где указанный антигенсвязывающий фрагмент выбран из группы, состоящей из Fab-фрагмента, F(ab')2-фрагмента, Fv-фрагмента и одноцепочечного Fv-фрагмента.
17. Лекарственное средство по любому из пп.1-12, где указанное моноклональное антитело продуцируется линией клеток СНО.
18. Лекарственное средство по любому из пп.1-12, где указанный пациент-человек не поддается терапии в отношении воспалительного или аутоиммунного заболевания.
19. Лекарственное средство по п.18, где указанный пациент-человек не поддается терапии моноклональным антителом к CD20.
20. Лекарственное средство по п.19, где указанным моноклональным антителом к CD20 является ритуксимаб (ритуксан).
21. Лекарственное средство по любому из пп.1-12, где указанное антитело к CD40 опосредует антителозависимую клеточную цитотоксичность (ADCC) экспрессирующих CD40 клеток экспрессирующими FcγRIIIa-158 природными киллерными (NK) клетками пациента-человека.
22. Лекарственное средство по любому из пп.1-12, где указанное антитело к CD40 является более сильным, чем ритуксимаб (ритуксан), в анализе антителозависимой клеточной цитотоксичности (ADCC), где этот анализ предусматривает инкубирование экспрессирующих CD40 клеток и экспрессирующих CD20 клеток с выделенными природными киллерными (NK) клетками человека в присутствии релевантного антитела.
23. Лекарственное средство по любому из пп.1-12, где указанное антитело к CD40 является более сильным, чем ритуксимаб (ритуксан), в модели системной красной волчанки (SLE), рассеянного склероза, воспаления и атеросклероза, трансплантации или болезни Альцгеймера.
24. Лекарственное средство, содержащее анти-CD40-антитело, для применения в ингибировании продукции антитела В-клетками у пациента-человека, гетерозиготного или гомозиготного в отношении FcγRIIIa-158F (генотип V/F или F/F), где указанный пациент страдает воспалительным заболеванием или аутоиммунным заболеванием, ассоциированными с экспрессирующими CD40 клетками, и где указанное антитело к CD40 выбрано из группы, состоящей из:
a) моноклонального антитела, которое связывается с эпитопом, способным связывать моноклональное антитело CHIR-12.12, продуцируемое гибридомной клеточной линией, депонированной АТСС в виде патентного депозита № РТА-5543,
b) моноклонального антитела, которое связывается с эпитопом, содержащим остатки 82-87 последовательности CD40 человека, показанной в SEQ ID NO:7 или SEQ ID NO:9, и
c) моноклонального антитела, которое конкурирует с моноклональным антителом CHIR-12.12, продуцируемым гибридомной клеточной линией, депонированной АТСС в виде патентного депозита № РТА-5543, в анализе конкурентного связывания.
a) моноклонального антитела, которое связывается с эпитопом, способным связывать моноклональное антитело CHIR-12.12, продуцируемое гибридомной клеточной линией, депонированной АТСС в виде патентного депозита № РТА-5543,
b) моноклонального антитела, которое связывается с эпитопом, содержащим остатки 82-87 последовательности CD40 человека, показанной в SEQ ID NO:7 или SEQ ID NO:9, и
c) моноклонального антитела, которое конкурирует с моноклональным антителом CHIR-12.12, продуцируемым гибридомной клеточной линией, депонированной АТСС в виде патентного депозита № РТА-5543, в анализе конкурентного связывания.
25. Лекарственное средство по п.24, где указанным антителом к CD40 является моноклональное антитело CHIR-12.12, продуцируемое гибридомной клеточной линией, депонированной АТСС в виде патентного депозита № РТА-5543.
26. Лекарственное средство по п.24, где указанное антитело содержит: (i) остатки определяющей комплементарность области (CDR) SEQ ID NO:2 или (ii) остатки определяющей комплементарность области (CDR) SEQ ID NO:4.
27. Лекарственное средство по п.24, где указанным антителом является моноклональное антитело, содержащее аминокислотную последовательность, выбранную из группы, состоящей из: (i) SEQ ID NO:2, (ii) SEQ ID NO:4, (iii) SEQ ID NO:5, (iv) SEQ ID NO:2 и SEQ ID NO:4, и (v) SEQ ID NO:2 и SEQ ID NO:5.
28. Лекарственное средство по п.24, где указанное антитело выбрано из группы, состоящей из: (i) моноклонального антитела, содержащего последовательности вариабельной и константной области, показанные в SEQ ID NO:2, (ii) моноклонального антитела, содержащего последовательности вариабельной и константной области, показанные в SEQ ID NO:4, (iii) моноклонального антитела, содержащего последовательности вариабельной и константной области, показанные в SEQ ID NO:5, (iv) моноклонального антитела, содержащего последовательности вариабельной и константной области, показанные в SEQ ID NO:2, и последовательности вариабельной и константной области, показанные в SEQ ID NO:4, (v) моноклонального антитела, содержащего последовательности вариабельной и константной области, показанные в SEQ ID NO:2, и последовательности вариабельной и константной области, показанные в SEQ ID NO:5.
29. Лекарственное средство по любому из пп.24-28, где указанное моноклональное антитело продуцируется в линии клеток СНО.
30. Способ идентификации пациента-человека, страдающего воспалительным заболеванием или аутоиммунным заболеванием, который поддается лечению антителом к CD40 и который не поддается лечению ритуксимабом (ритуксаном), включающий определение генотипа FcγRIIIa-158 (V/V, V/F или F/F) пациента-человека, имеющего воспалительное заболевание или аутоиммунное заболевание, которые ассоциированы с экспрессирующими CD40 клетками и который не поддается лечению ритуксимабом (ритуксаном), с использованием биологического образца, полученного у этого пациента-человека, где в том случае, если указанный пациент является гетерозиготным или гомозиготным по FcγRIIIa-158F (генотип V/F или F/F), указанный пациент идентифицируется как имеющий воспалительное заболевание или аутоиммунное заболевание, поддающийся лечению антителом к CD40 и не поддающийся лечению ритуксимабом (ритуксаном), и где указанное антитело к CD40 выбрано из группы, состоящей из:
a) моноклонального антитела, которое связывается с эпитопом, способным связывать моноклональное антитело CHIR-12.12, продуцируемое гибридомной клеточной линией, депонированной АТСС в виде патентного депозита № РТА-5543,
b) моноклонального антитела, которое связывается с эпитопом, содержащим остатки 82-87 последовательности CD40 человека, показанной в SEQ ID NO:7 или SEQ ID NO:9, и
c) моноклонального антитела, которое конкурирует с моноклональным антителом CHIR-12.12, продуцируемым гибридомной клеточной линией, депонированной АТСС в виде патентного депозита № РТА-5543, в анализе конкурентного связывания.
a) моноклонального антитела, которое связывается с эпитопом, способным связывать моноклональное антитело CHIR-12.12, продуцируемое гибридомной клеточной линией, депонированной АТСС в виде патентного депозита № РТА-5543,
b) моноклонального антитела, которое связывается с эпитопом, содержащим остатки 82-87 последовательности CD40 человека, показанной в SEQ ID NO:7 или SEQ ID NO:9, и
c) моноклонального антитела, которое конкурирует с моноклональным антителом CHIR-12.12, продуцируемым гибридомной клеточной линией, депонированной АТСС в виде патентного депозита № РТА-5543, в анализе конкурентного связывания.
31. Способ по п.30, где указанным антителом к CD40 является моноклональное антитело CHIR-12.12, продуцируемое гибридомной клеточной линией, депонированной АТСС в виде патентного депозита № РТА-5543.
32. Способ по п.30, где указанное антитело содержит: (i) остатки определяющей комплементарность области (CDR) SEQ ID NO:2 или (ii) остатки определяющей комплементарность области (CDR) SEQ ID NO:4.
33. Способ по п.30, где указанным антителом является моноклональное антитело, содержащее аминокислотную последовательность, выбранную из группы, состоящей из: (i) SEQ ID NO:2, (ii) SEQ ID NO:4, (iii) SEQ ID NO:5, (iv) SEQ ID NO:2 и SEQ ID NO:4, и (v) SEQ ID NO:2 и SEQ ID NO:5.
34. Способ по п.30, где указанное антитело выбрано из группы, состоящей из: (i) моноклонального антитела, содержащего последовательности вариабельной и константной области, показанные в SEQ ID NO:2, (ii) моноклонального антитела, содержащего последовательности вариабельной и константной области, показанные в SEQ ID NO:4, (iii) моноклонального антитела, содержащего последовательности вариабельной и константной области, показанные в SEQ ID NO:5, (iv) моноклонального антитела, содержащего последовательности вариабельной и константной области, показанные в SEQ ID NO:2, и последовательности вариабельной и константной области, показанные в SEQ ID NO:4, (v) моноклонального антитела, содержащего последовательности вариабельной и константной области, показанные в SEQ ID NO:2, и последовательности вариабельной и константной области, показанные в SEQ ID NO:5.
35. Способ по любому из пп.30-34, где указанное моноклональное антитело продуцируется в линии клеток СНО.
36. Способ выбора курса лечения антителом для пациента-человека, страдающего воспалительным заболеванием или аутоиммунным заболеванием, который не поддается лечению ритуксимабом (ритуксаном), включающий определение генотипа FcγRIIIa-158 (V/V, V/F или F/F) пациента-человека, имеющего воспалительное заболевание или аутоиммунное заболевание, которые ассоциированы с экспрессирующими CD40 клетками, и который не поддается лечению ритуксимабом (ритуксаном), с использованием биологического образца, полученного у этого пациента-человека, где анти-CD40-антитело выбирают для лечения указанного воспалительного заболевания или аутоиммунного заболевания в том случае, если указанный пациент является гетерозиготным или гомозиготным по FcγRIIIa-158F (генотип V/F или F/F), где указанное антитело выбрано из группы, состоящей из:
a) моноклонального антитела, которое связывается с эпитопом, способным связывать моноклональное антитело CHIR-12.12, продуцируемое гибридомной клеточной линией, депонированной АТСС в виде патентного депозита № РТА-5543,
b) моноклонального антитела, которое связывается с эпитопом, содержащим остатки 82-87 последовательности CD40 человека, показанной в SEQ ID NO:7 или SEQ ID NO:9, и
с) моноклонального антитела, которое конкурирует с моноклональным антителом CHIR-12.12, продуцируемым гибридомной клеточной линией, депонированной АТСС в виде патентного депозита № РТА-5543, в анализе конкурентного связывания.
a) моноклонального антитела, которое связывается с эпитопом, способным связывать моноклональное антитело CHIR-12.12, продуцируемое гибридомной клеточной линией, депонированной АТСС в виде патентного депозита № РТА-5543,
b) моноклонального антитела, которое связывается с эпитопом, содержащим остатки 82-87 последовательности CD40 человека, показанной в SEQ ID NO:7 или SEQ ID NO:9, и
с) моноклонального антитела, которое конкурирует с моноклональным антителом CHIR-12.12, продуцируемым гибридомной клеточной линией, депонированной АТСС в виде патентного депозита № РТА-5543, в анализе конкурентного связывания.
37. Способ по п.36, где указанным антителом к CD40 является моноклональное антитело CHIR-12.12, продуцируемое гибридомной клеточной линией, депонированной АТСС в виде патентного депозита № РТА-5543.
38. Способ по п.36, где указанное антитело содержит: (i) остатки определяющей комплементарность области (CDR) SEQ ID NO:2 или (ii) остатки определяющей комплементарность области (CDR) SEQ ID NO:4.
39. Способ по п.36, где указанным антителом является моноклональное антитело, содержащее аминокислотную последовательность, выбранную из группы, состоящей из: (i) SEQ ID NO:2, (ii) SEQ ID NO:4, (iii) SEQ ID NO:5, (iv) SEQ ID NO:2 и SEQ ID NO:4, и (v) SEQ ID NO:2 и SEQ ID NO:5.
40. Способ по п.36, где указанное антитело выбрано из группы, состоящей из: (i) моноклонального антитела, содержащего последовательности вариабельной и константной области, показанные в SEQ ID NO:2, (ii) моноклонального антитела, содержащего последовательности вариабельной и константной области, показанные в SEQ ID NO:4, (iii) моноклонального антитела, содержащего последовательности вариабельной и константной области, показанные в SEQ ID NO:5, (iv) моноклонального антитела, содержащего последовательности вариабельной и константной области, показанные в SEQ ID NO:2, и последовательности вариабельной и константной области, показанные в SEQ ID NO:4, (v) моноклонального антитела, содержащего последовательности вариабельной и константной области, показанные в SEQ ID NO:2, и последовательности вариабельной и константной области, показанные в SEQ ID NO:5.
41. Способ по любому из пп.36-40, где указанное моноклональное антитело продуцируется в линии клеток СНО.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US73258005P | 2005-11-01 | 2005-11-01 | |
| US60/732,580 | 2005-11-01 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2008121899A RU2008121899A (ru) | 2009-12-10 |
| RU2442606C2 true RU2442606C2 (ru) | 2012-02-20 |
Family
ID=38006484
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2008121899/15A RU2442606C2 (ru) | 2005-11-01 | 2006-11-01 | Применение анти-cd40-антител |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US20090202531A1 (ru) |
| EP (1) | EP1957538B1 (ru) |
| JP (1) | JP2009513712A (ru) |
| KR (1) | KR101395005B1 (ru) |
| CN (1) | CN101351478A (ru) |
| AU (1) | AU2006308860B2 (ru) |
| BR (1) | BRPI0618217A2 (ru) |
| CA (1) | CA2627891A1 (ru) |
| ES (1) | ES2428089T3 (ru) |
| HK (1) | HK1122579A1 (ru) |
| IL (1) | IL191117A (ru) |
| RU (1) | RU2442606C2 (ru) |
| WO (1) | WO2007053661A2 (ru) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2509573C2 (ru) * | 2010-07-27 | 2014-03-20 | Олег Ильич Эпштейн | Лекарственное средство для лечения рассеянного склероза и способ лечения рассеянного склероза |
Families Citing this family (38)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE10303974A1 (de) | 2003-01-31 | 2004-08-05 | Abbott Gmbh & Co. Kg | Amyloid-β(1-42)-Oligomere, Verfahren zu deren Herstellung und deren Verwendung |
| CA2628105A1 (en) | 2005-11-01 | 2007-05-10 | Novartis Ag | Uses of anti-cd40 antibodies |
| PL2289909T3 (pl) | 2005-11-30 | 2015-04-30 | Abbvie Inc | Sposób przeszukiwania, proces oczyszczania niedyfundujących oligomerów Abeta, selektywne przeciwciała przeciw niedyfundującym oligomerom Abeta i sposób wytwarzania tych przeciwciał |
| US8497072B2 (en) | 2005-11-30 | 2013-07-30 | Abbott Laboratories | Amyloid-beta globulomer antibodies |
| US8455626B2 (en) | 2006-11-30 | 2013-06-04 | Abbott Laboratories | Aβ conformer selective anti-aβ globulomer monoclonal antibodies |
| WO2008104386A2 (en) | 2007-02-27 | 2008-09-04 | Abbott Gmbh & Co. Kg | Method for the treatment of amyloidoses |
| EP2077281A1 (en) * | 2008-01-02 | 2009-07-08 | Bergen Teknologioverforing AS | Anti-CD20 antibodies or fragments thereof for the treatment of chronic fatigue syndrome |
| US20110275791A1 (en) | 2009-01-06 | 2011-11-10 | Ziad Mallat | A B Cell Depleting Agent for the Treatment of Atherosclerosis |
| US9752191B2 (en) | 2009-07-09 | 2017-09-05 | The Scripps Research Institute | Gene expression profiles associated with chronic allograft nephropathy |
| US8987419B2 (en) | 2010-04-15 | 2015-03-24 | AbbVie Deutschland GmbH & Co. KG | Amyloid-beta binding proteins |
| CA2808187A1 (en) | 2010-08-14 | 2012-02-23 | Abbvie Inc. | Amyloid-beta binding proteins |
| AR083847A1 (es) | 2010-11-15 | 2013-03-27 | Novartis Ag | Variantes de fc (fragmento constante) silenciosas de los anticuerpos anti-cd40 |
| WO2012075111A1 (en) | 2010-11-30 | 2012-06-07 | Novartis Ag | Uses of anti-cd40 antibodies in combination therapy for b cell-related cancers |
| DK2683406T3 (da) | 2011-03-11 | 2019-07-08 | Beth Israel Deaconess Medical Ct Inc | Anti-cd40-antistoffer og anvendelser deraf |
| AU2012249454B2 (en) | 2011-04-29 | 2016-03-24 | Apexigen, Inc. | Anti-CD40 antibodies and methods of use |
| ES2915263T3 (es) * | 2011-06-17 | 2022-06-21 | Roche Diagnostics Hematology Inc | Solución y procedimiento para el histoprocesamiento de muestras biológicas |
| US20140004131A1 (en) | 2012-05-04 | 2014-01-02 | Novartis Ag | Antibody formulation |
| EP2914627B1 (en) | 2012-10-30 | 2021-04-07 | Apexigen, Inc. | Anti-cd40 antibodies and methods of use |
| US10618963B2 (en) | 2014-03-12 | 2020-04-14 | Yeda Research And Development Co. Ltd | Reducing systemic regulatory T cell levels or activity for treatment of disease and injury of the CNS |
| US10519237B2 (en) | 2014-03-12 | 2019-12-31 | Yeda Research And Development Co. Ltd | Reducing systemic regulatory T cell levels or activity for treatment of disease and injury of the CNS |
| CN106687125B (zh) | 2014-03-12 | 2021-12-14 | 耶达研究与开发有限公司 | 降低系统性调节性t细胞水平或活性来治疗cns疾病和损伤 |
| CN108025068A (zh) * | 2014-03-12 | 2018-05-11 | 耶达研究与开发有限公司 | 降低系统性调节性t细胞水平或活性来治疗cns的疾病和损伤 |
| US11104951B2 (en) | 2014-05-22 | 2021-08-31 | The Scripps Research Institute | Molecular signatures for distinguishing liver transplant rejections or injuries |
| US10443100B2 (en) | 2014-05-22 | 2019-10-15 | The Scripps Research Institute | Gene expression profiles associated with sub-clinical kidney transplant rejection |
| CN107249318A (zh) | 2014-12-10 | 2017-10-13 | 明尼苏达大学董事会 | 用于治疗疾病的遗传修饰的细胞、组织和器官 |
| BR112017025693A2 (pt) | 2015-05-29 | 2018-08-14 | Abbvie Inc. | anticorpos anti-cd40 e seus usos |
| JP6976931B2 (ja) | 2015-09-04 | 2021-12-08 | プリマトープ・セラピューティクス・インコーポレイテッド | ヒト化抗cd40抗体及びその使用 |
| CN108368510B (zh) * | 2015-09-30 | 2023-09-01 | 詹森生物科技公司 | 特异性结合人cd40的激动性抗体和使用方法 |
| CN109475602B (zh) | 2016-06-20 | 2023-05-16 | 科马布有限公司 | 抗pd-l1和il-2细胞因子 |
| CN111344304B (zh) * | 2017-06-01 | 2023-09-01 | Pb免疫治疗公司 | 新型抗cd40抗体及其用途 |
| AU2019287765A1 (en) | 2018-06-15 | 2021-01-07 | Flagship Pioneering Innovations V, Inc. | Increasing immune activity through modulation of postcellular signaling factors |
| MA55805A (fr) | 2019-05-03 | 2022-03-09 | Flagship Pioneering Innovations V Inc | Métodes de modulation de l'activité immunitaire |
| WO2021127217A1 (en) | 2019-12-17 | 2021-06-24 | Flagship Pioneering Innovations V, Inc. | Combination anti-cancer therapies with inducers of iron-dependent cellular disassembly |
| US20230355804A1 (en) | 2020-06-29 | 2023-11-09 | Flagship Pioneering Innovations V, Inc. | Viruses engineered to promote thanotransmission and their use in treating cancer |
| AU2022246895A1 (en) | 2021-03-31 | 2023-10-19 | Flagship Pioneering Innovations V, Inc. | Thanotransmission polypeptides and their use in treating cancer |
| EP4363059A1 (en) | 2021-06-29 | 2024-05-08 | Flagship Pioneering Innovations V, Inc. | Immune cells engineered to promote thanotransmission and uses thereof |
| WO2024077191A1 (en) | 2022-10-05 | 2024-04-11 | Flagship Pioneering Innovations V, Inc. | Nucleic acid molecules encoding trif and additionalpolypeptides and their use in treating cancer |
| WO2024151687A1 (en) | 2023-01-09 | 2024-07-18 | Flagship Pioneering Innovations V, Inc. | Genetic switches and their use in treating cancer |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5874082A (en) * | 1992-07-09 | 1999-02-23 | Chiron Corporation | Humanized anti-CD40 monoclonal antibodies and fragments capable of blocking B cell proliferation |
| KR960704576A (ko) * | 1993-10-01 | 1996-10-09 | 크리스토퍼 엘. 와이트 | CD40에 대한 항체(Antibodies to CD40) |
| US6946129B1 (en) * | 1999-06-08 | 2005-09-20 | Seattle Genetics, Inc. | Recombinant anti-CD40 antibody and uses thereof |
| US7063845B2 (en) * | 2000-04-28 | 2006-06-20 | Gemini Science, Inc. | Human anti-CD40 antibodies |
| AU2002346999B2 (en) * | 2001-10-19 | 2007-11-08 | Centre Hospitalier Regional Et Universitaire De Tours | Methods and compositions to evaluate antibody treatment response |
| ZA200604419B (en) * | 2003-11-04 | 2008-06-25 | Novartis Vaccines & Diagnostic | Antagonist anti-CD40 monoclonal antibodies and methods for their use |
| ES2346978T3 (es) * | 2003-11-04 | 2010-10-22 | Novartis Vaccines And Diagnostics, Inc. | Uso de anticuerpos monoclonantes anti-cd40 antagonistas para el tratamiento del mieloma multiple. |
| SI1682177T1 (sl) * | 2003-11-04 | 2010-12-31 | Novartis Vaccines & Diagnostic | Uporaba antagonističnih anti-CD40 protiteles za zdravljenje kronične limfocitne levkemije |
| EP1844815B1 (en) * | 2003-11-04 | 2011-09-14 | Novartis Vaccines and Diagnostics, Inc. | Combination therapy comprising anti-CD20 and anti-CD40 antibodies for the treatment of B cell-related cancers |
| DE602004028643D1 (de) * | 2003-11-04 | 2010-09-23 | Novartis Vaccines & Diagnostic | Verfahren zur behandlung von soliden tumoren mit expression des cd40-zelloberflächen-antigens |
| US20070231813A1 (en) * | 2004-06-01 | 2007-10-04 | Centre Hospitalier Regional Et Universitaire De Tours | Fcgr3a Gebotype and Methods for Evaluating Treatment Response to Non-Depleting Antibodies |
| US20080057070A1 (en) * | 2004-11-04 | 2008-03-06 | Chiron Corporation | Antagonist Anti-Cd40 Monoclonal Antibodies and Methods for Their Use |
-
2006
- 2006-11-01 RU RU2008121899/15A patent/RU2442606C2/ru not_active IP Right Cessation
- 2006-11-01 AU AU2006308860A patent/AU2006308860B2/en not_active Ceased
- 2006-11-01 CA CA002627891A patent/CA2627891A1/en not_active Abandoned
- 2006-11-01 ES ES06836747T patent/ES2428089T3/es active Active
- 2006-11-01 CN CNA2006800501259A patent/CN101351478A/zh active Pending
- 2006-11-01 JP JP2008538984A patent/JP2009513712A/ja active Pending
- 2006-11-01 US US12/092,256 patent/US20090202531A1/en not_active Abandoned
- 2006-11-01 KR KR1020087012998A patent/KR101395005B1/ko not_active IP Right Cessation
- 2006-11-01 BR BRPI0618217-8A patent/BRPI0618217A2/pt not_active IP Right Cessation
- 2006-11-01 EP EP06836747.3A patent/EP1957538B1/en active Active
- 2006-11-01 WO PCT/US2006/042601 patent/WO2007053661A2/en active Application Filing
-
2008
- 2008-04-28 IL IL191117A patent/IL191117A/en not_active IP Right Cessation
-
2009
- 2009-01-21 HK HK09100670.8A patent/HK1122579A1/xx not_active IP Right Cessation
Non-Patent Citations (1)
| Title |
|---|
| SHAW Т. et al. В cell therapy for rheumatoid arthritis: the rituximab (anti-CD20) experience // Ann. Rheum. Dis. 2003; 62 (suppl II): ii55-ii59. LAW CL et al. Preclinical antilymphoma activity of a humanized anti-CD40 monoclonal antibody, SGN-40 // Cancer Res. 2005 Sep 15; 65(18):8331-8. он-лайн, [найдено в Интернет на (http://cancerres.aacrjournals.org/cgi/pmidlookup?view=long&pmid=16166310)]. * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2509573C2 (ru) * | 2010-07-27 | 2014-03-20 | Олег Ильич Эпштейн | Лекарственное средство для лечения рассеянного склероза и способ лечения рассеянного склероза |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2006308860A1 (en) | 2007-05-10 |
| BRPI0618217A2 (pt) | 2011-08-23 |
| WO2007053661A2 (en) | 2007-05-10 |
| JP2009513712A (ja) | 2009-04-02 |
| AU2006308860B2 (en) | 2012-01-12 |
| IL191117A (en) | 2013-05-30 |
| RU2008121899A (ru) | 2009-12-10 |
| EP1957538A2 (en) | 2008-08-20 |
| IL191117A0 (en) | 2008-12-29 |
| US20090202531A1 (en) | 2009-08-13 |
| HK1122579A1 (en) | 2009-05-22 |
| ES2428089T3 (es) | 2013-11-05 |
| KR101395005B1 (ko) | 2014-05-21 |
| WO2007053661A3 (en) | 2007-11-01 |
| CN101351478A (zh) | 2009-01-21 |
| KR20080100806A (ko) | 2008-11-19 |
| CA2627891A1 (en) | 2007-05-10 |
| EP1957538B1 (en) | 2013-05-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2442606C2 (ru) | Применение анти-cd40-антител | |
| RU2442605C2 (ru) | Применения антител против cd40 | |
| JP4746552B2 (ja) | 自己免疫疾患および炎症性疾患ならびに臓器移植拒絶の処置のためのアンタゴニスト抗cd40抗体の使用 | |
| JP5290152B2 (ja) | 拮抗剤抗cd40抗体薬学的組成物 | |
| JP5421590B2 (ja) | 自己免疫および/または炎症性成分を有する疾患の診断および治療のための方法 | |
| KR20100014588A (ko) | 길항제 ox40 항체 및 염증성 및 자가면역 질환의 치료에서의 이의 용도 | |
| AU2005323515A1 (en) | Antagonist anti-CD40 monoclonal antibodies and methods for their use | |
| MX2008005658A (en) | Uses of anti-cd40 antibodies |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20141102 |