JP5000483B2 - 医薬組成物 - Google Patents
医薬組成物 Download PDFInfo
- Publication number
- JP5000483B2 JP5000483B2 JP2007510045A JP2007510045A JP5000483B2 JP 5000483 B2 JP5000483 B2 JP 5000483B2 JP 2007510045 A JP2007510045 A JP 2007510045A JP 2007510045 A JP2007510045 A JP 2007510045A JP 5000483 B2 JP5000483 B2 JP 5000483B2
- Authority
- JP
- Japan
- Prior art keywords
- glycopyrrolate
- dry powder
- magnesium stearate
- powder
- powder formulation
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/141—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers
- A61K9/145—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers with organic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
- A61K9/0073—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy
- A61K9/0075—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy for inhalation via a dry powder inhaler [DPI], e.g. comprising micronized drug mixed with lactose carrier particles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical & Material Sciences (AREA)
- Epidemiology (AREA)
- Pulmonology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Otolaryngology (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Description
0.5kg/時で微粉化
注入(injection)圧力:10バール
微粉化圧力:7バール
Sympatec サイズ測定:d10 0.7μm、d50 1.8μm、d90 3.6μm
乾燥減量:0.7%
DVSは結晶性物質を示した。貯蔵時に、物質の柔らかい塊が原末(bulk powder)中に発見され、繰り返し(repeated)粒度測定により、2.6〜3.5μmの範囲のd50値が得られた。
0.5kg/時で微粉化
注入圧力:10バール
微粉化圧力:7バール
Sympatec サイズ測定:d10 1.0μm、d50 2.4μm、d90 4.8μm
乾燥減量:0.6%
水分活性:54%RH
DVSは、アモルファス物質が存在することを示した。貯蔵時に、物質の大きな硬い塊が発見され、繰り返し粒度測定により、36〜160μmの範囲のd50値が得られた。
0.4kg/時で微粉化
注入圧力:10バール
微粉化圧力:9.8バール
Sympatec サイズ測定:d10 0.8μm、d50 2.3μm、d90 4.8μm
乾燥減量:0.4%
DVSは、アモルファス物質が存在することを示した。貯蔵時に、物質の大きな硬い塊が原末中に発見され、繰り返し粒度測定により、51μmのd50値が得られた。
0.5kg/時で微粉化
注入圧力:10バール
微粉化圧力:9バール
Sympatec サイズ測定:d10 1.0μm、d50 2.4μm、d90 4.5μm
乾燥減量:0.5%
貯蔵時に、物質の柔らかい塊のみが原末中に発見された。
1)ステロイド薬、例えば、アルクロメタゾン(alcometasone)、ベクロメタゾン、ジプロピオン酸ベクロメタゾン、ベータメタゾン、ブデソニド、クロベタゾール、デフラザコート、ジフルコルトロン、デソキシメタゾン(desoxymethasone)、デキサメタゾン、フルドロコルチゾン、フルニソリド、フルオシノロン、フルオメトロン、プロピオン酸フルチカゾン、ヒドロコルチゾン、トリアムシノロン、デカン酸ナンドロロン、硫酸ネオマイシン、リメキソロン(rimexolone)、メチルプレドニゾロン、及びプレドニゾロンなど;
2)抗生物質及び抗菌剤、例えば、メトロニダゾール、スルファジアジン、トリクロサン、ネオマイシン、アモキシシリン、アンフォテリシン、クリンダマイシン、アクラルビシン、ダクチノマイシン、ナイスタチン、ムピロシン、及びクロルヘキシジンなど。
3)全身的活性薬(systemically active drug)、例えば、イソソルビドジニトレート、イソソルビドモノニトレート、アポモルヒネ、及びニコチンなど;
4)抗ヒスタミン剤、例えば、アゼラスチン、クロルフェニラミン、アステミゾール、セチリジン(cetirizine)、シンナリジン、デスロラタジン(desloratadine)、ロラタジン(loratadine)、ヒドロキシジン、ジフェンヒドラミン、フェキソフェナジン、ケトチフェン、プロメタジン、トリメプラジン、及びテルフェナジンなど;
5)抗炎症薬、例えば、ピロキシカム、ネドクロミル、ベンジダミン、ジクロフェナクナトリウム、ケトプロフェン、イブプロフェン、ヘパリノイド(heparinoid)、ネドクロミル、クロモグリケート(cromoglycate)、ファサファンジン(fasafungine)、及びヨードキサミド(iodoxamide)など;
6)抗コリン剤、例えば、アトロピン、ベンザトロピン(benzatropine)、ビペリデン、シクロペントレート、オキシブチニン、オルフェナドリン塩酸塩(orphenadine hydrochloride)、プロシクリジン、プロパンテリン、プロピベリン、チオトロピウム、トロピカミド、トロスピウム、臭化イプラトロピウム、及び臭化オキシトロピウムなど;
7)制吐剤、例えば、ベタヒスチン(bestahistine)、ドラセトロン、ナビロン、プロクロルペラジン、オンダンセトロン、トリフルオペラジン、トロピセトロン、ドムペリドン(domperidone)、ヒヨスチン、シンナリジン、メトクロプラミド、シクリジン、ジメンヒドリナート、及びプロメタジンなど;
8)ホルモン薬、例えば、プロチレリン、チロキシン、サルコトニン(salcotonin)、ソマトロピン、テトラコサクチド、バソプレシン又はデスモプレシンなど;
9)気管支拡張薬、例えば、サルブタモール、フェノテロール、ホルモテロール、及びサルメテロールなど;
10)交感神経様作用薬、例えば、アドレナリン、ノルアドレナリン、デキサンフェタミン(dexamfetamine)、ジピレフィン(dipirefin)、ドブタミン、ドペキサミン、フェニレフリン、イソプレナリン、ドーパミン、偽エフェドリン、トラマゾリン、及びキシロメタゾリンなど;
11)抗真菌薬、例えば、アンフォテリシン、カスポファンジン、クロトリマゾール、硝酸エコナゾール、フルコナゾール、ケトコナゾール、ナイスタチン、イトラコナゾール、テルビナフィン(terbinafine)、ボリコナゾール、及びミコナゾールなど;
12)局所麻酔薬、例えば、アメソカイン(amethocaine)、ブピバカイン、ヒドロコルチゾン、メチルプレドニゾロン、プリロカイン、プロキシメタカイン(proxymetacaine)、ロピバカイン、チロトリシン、ベンゾカイン、及びリグノカインなど;
13)アヘン剤(opiate)、好ましくは疼痛処理用のもの、例えば、ブプレノルフィン、デキストロモルアミド、ジアモルフィン(diamorphine)、リン酸コデイン、デキストロプロポキシフェン、ジヒドロコデイン、パパベレタム(papaveretum)、ホルコデイン(pholcodeine)、ロペラミド、フェンタニル、メタドン、モルヒネ、オキシコドン、フェナゾシン、ペチジン(pethidine)、及び制吐剤とこれらの組み合わせ物;
14)鎮痛薬及び片頭痛治療薬、例えば、クロニジン、コジン(codine)、コプロキサモール(coproxamol)、デキストロプロポキシペン(dextropropoxypene)、エルゴタミン、スマトリプタン、トラマドール、及び非ステロイド性抗炎症薬など;
15)麻酔作用薬(narcotic agonist)及び鎮静解毒剤(opiate antidote)、例えば、ナロキソン、及びペンタゾシンなど;
16)ホスホジエステラーゼ5型阻害薬、例えば、シルデナフィルなど;及び
17)前述のいずれかの医薬として許容可能な塩類。
(製剤A)
Pharmatose 150M(DMV)とともに、微粉化臭化グリコピロニウムを含む混合物をブレンドし、60μg用量を得る。
(製剤B)
Pharmatose 150M(DMV)とともに、微粉化臭化グリコピロニウムを含む混合物をブレンドし、120μg用量を得る。
(製剤C)
Pharmatose 150M(DMV)とともに、微粉化臭化グリコピロニウムを含む混合物をブレンドし、60μg用量を得る。
(製剤D)
Pharmatose 150M(DMV)とともに、微粉化臭化グリコピロニウムを含む混合物をブレンドし、120μg用量を得る。
(製剤E)
Pharmatose 150M(DMV)とともに、微粉化臭化グリコピロニウムを含む混合物をブレンドし、60μg用量を得る。
(製剤F)
Pharmatose 150M(DMV)とともに、微粉化臭化グリコピロニウムを含む混合物をブレンドし、120μg用量を得る。
(ステアリン酸マグネシウムを含めた480μgを対象とする製剤)
製剤1
この混合物には、90%のCapsulacラージキャリアラクトース、7.8%のSorbolac 400、0.25%のステアリン酸マグネシウム、及び1.92%の微粉化臭化グリコピロニウムを含めた。Sorbolac 400ラクトースを、Kenwood Mini Chopper高せん断ブレンダー内で、ステアリン酸マグネシウム及び微粉化臭化グリコピロニウムとともに5分間混合した。1分の間隔で、混合を最大限にするためにブレンダーの壁を下方へ掃いた(swept down)。
この混合物には、90%のPharmatose 325ラージキャリアラクトース、7.8%のSorbolac 400、0.25%のステアリン酸マグネシウム、及び1.92%の微粉化臭化グリコピロニウムを含めた。Sorbolac 400ラクトースを、Kenwood Mini Chopper高せん断ブレンダー内で、ステアリン酸マグネシウム及び微粉化臭化グリコピロニウムとともに5分間混合した。1分の間隔で、混合を最大限にするためにブレンダーの壁を下方へ掃いた。
これら繰り返し混合物には、90%のPharmatose 325ラージキャリアラクトース、7.8%のSorbolac 400、0.25%のステアリン酸マグネシウム、及び1.92%の微粉化臭化グリコピロニウムを含めた。Sorbolac 400ラクトースを、GrindoMix高せん断ブレンダー内で、ステアリン酸マグネシウム及びPharmatose 325ラージキャリアラクトースとともに2000rpmで1分間混合した。これを1時間放置し、粉末塊(powder mass)内の帯電(electrostatic charge)を減少させた。
これら繰り返し混合物には、90%のPharmatose 150ラージキャリアラクトース、7.8%のSorbolac 400、0.25%のステアリン酸マグネシウム、及び1.92%の微粉化臭化グリコピロニウムを含めた。Sorbolac 400ラクトースを、GrindoMix高せん断ブレンダー内で、ステアリン酸マグネシウム及びPharmatose 150ラージキャリアラクトースとともに2000rpmで1分間混合した。これを1時間放置し、粉末塊内の帯電を減少させた。
この混合物には、およそ90%のPharmatose 150ラージキャリアラクトース、7.9%のSorbolac 400、0.15%のステアリン酸マグネシウム、及び1.9%の微粉化臭化グリコピロニウムを含めた。Sorbolac 400ラクトースを、GrindoMix高せん断ブレンダー内で、ステアリン酸マグネシウム及びPharmatose 150ラージキャリアラクトースとともに2000rpmで1分間混合した。これを1時間放置し、粉末塊内の帯電を減少させた
製剤8
この混合物には、90.25%のPharmatose 325ラージキャリアラクトース、7.8%のSorbolac 400、及び1.92%の微粉化臭化グリコピロニウムを含めた。Sorbolac 400ラクトースを、GrindoMix高せん断ブレンダー内で、Pharmatose 325ラージキャリアラクトースとともに2000rpmで1分間混合した。これを1時間放置し、粉末塊内の帯電を減少させた。
この混合物には、90.25%のPharmatose 150ラージキャリアラクトース、7.8%のSorbolac 400、及び1.92%の微粉化臭化グリコピロニウムを含めた。Sorbolac 400ラクトースを、GrindoMix高せん断ブレンダー内で、Pharmatose 325ラージキャリアラクトースとともに2000rpmで1分間混合した。これを1時間放置し、粉末塊内の帯電を減少させた。
製造した全ての製剤を、十分な原末含量均一性について評価した。
・高せん断ブレンド;
・ステアリン酸マグネシウム含有量>0.05%、より好ましくは>0.1%であるが、CU又は毒性問題が生じるには不十分であることが好ましい(例えば、好ましくは<5%、より好ましくは<2%、より好ましくは<1%、及びより好ましくは<0.5%);及び
・微細ラクトース含有量が好ましくは>3%、より好ましくは>5%、より好ましくは>8%。
この研究に続いて、400μg、250μg、及び20μgのグリコピロレートを含む混合物を以下の方法を用いて製造した。
・ステアリン酸マグネシウムレベルを増加させること;
・湿気へ予め暴露することにより薬剤を調整(コンディショニング)すること;
・低湿気環境に予め暴露することにより賦形剤及び添加剤を調整(コンディショニング)すること;
・低湿気環境に予め暴露することによりカプセルを調整(コンディショニング)すること;
・低含水率(例えば、HPMC)カプセルを用いること;
・アルミニウムホイルオーバーラップを検討すること。
この新たな研究において、160μg、80μg、40μg、及び20μgのグリコピロレートを含む混合物を以下の方法を用いて製造する。この混合物には、およそ90%のPharmatose 150ラージキャリアラクトース、およそ9〜9.8%のSorbolac 400、0.15%のステアリン酸マグネシウム、及び微粉化臭化グリコピロニウムを含める。高せん断ミキサーで一度に粉末を混合する。これらの粉末を40%RHで予め調整する。
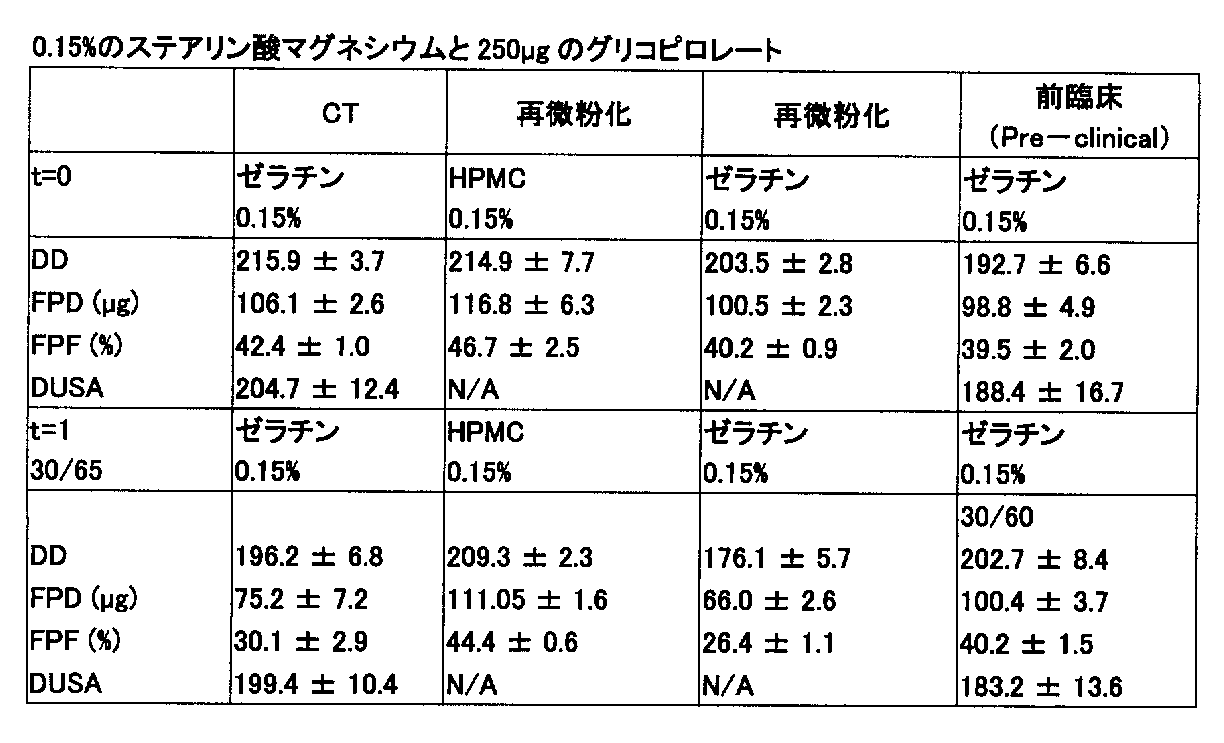
25mg中に250μg及び20μgのグリコピロレートを含む混合物を、実施例3に記載の方法を用いて製造した。粉末には、0.15%のステアリン酸マグネシウムを含めた。ついで、25mgの粉末をHPMCカプセル及びゼラチンカプセルに入れ、冷間成形のアルミニウムホイルパウチ(cold form aluminium foil pouch)でパッケージングした。ゼラチンカプセルを40%RHで予め調整しておいた。
別のデバイスとして、GyroHaler(簡単に上述したとおりのもの)と称されるプロトタイプシステムを用いた。このデバイスは、予め計量された(pre-metered)ホイルブリスター片内に粉末を含めることにより湿気から製剤を保護する。結果として、シールの完全性(integrity)が保たれている限り、湿気供給源のいずれも粉末に適用されることはない。
微粉化グリコピロレートへの調整効果を調査した。グリコピロレートの最初のバッチ「A」を、9.8バール、0.2kg/時の供給速度で微粉化した。ついで、この物質を、撹拌/回転させながら、又はさせずに、25℃/60%RHでトレイ上で調整(コンディショニング)した。これらの粉末のそれぞれを、Sympatecによりサイズ測定した。ついで、実施例4で概説した方法を用いて、0.15%のステアリン酸マグネシウムを含めた25mgの粉末中20μg用量として、粉末を製剤化し、ゼラチンカプセルに入れた。欧州薬局方第4版(2002)で定義される方法を用いて、Miat MonoHalerデバイスからマルチステージリキッドインピンジャーへとカプセルを発射することにより、微粒子割合を評価した。微粒子割合は、基準用量に関連して5μmより小さいものの質量割合として本明細書で定義した。
Malvern粒径データは、粒径が粉末供給速度に影響され得ることを示している。供給速度と得られた粒径との関係は、恐らく非線形である。従って、操作が最も高感度の条件にどれだけ近いかに応じて、効果が見られるか、又は見られないかもしれない。ここでは、効果が見られている。同様に、効果はミリング圧力で期待されるが、対照的にこのデータは、8〜10バールが上述の圧力感受性条件であるようであることを示しており、従って、一定の供給速度において、d50の変化がほとんど見られない。
(ステアリン酸マグネシウムとともにメカノフュージョンされた[mechanofused]グリコピロレート)
混合物1:微粉化グリコピロレートブロミド+5%のステアリン酸マグネシウム
相互作用力制御剤と薬剤とのメカノフュージョンを調べるためにさらなる研究を実施した。相互作用力制御剤としてステアリン酸マグネシウムを用いた。ホソカワAMS−MINIシステム(ホソカワミクロン株式会社)を用いて、95%の微粉化グリコピロレートブロミドと5%のステアリン酸マグネシウムとを、およそ4000rpmで60分間ブレンドすることにより、混合物を調製した。
198gのSorbolac 400(Meggle)ラクトースと2gのステアリン酸マグネシウムとを混合することによりバッチを調製した。Cyclomix(ホソカワミクロン株式会社、1mmのギャップ設定)を200rpmの速度で設定した。ラクトースの半分を添加し、それに続いて、ステアリン酸マグネシウム及び残りのラクトースを添加した。速度を徐々に増加し、2000rpmで10分間稼動させた。
199.76gのRespitose SV003(DMV)ラクトースと0.24gのステアリン酸マグネシウムを混合することによりバッチを調製した。Cyclomix(ホソカワミクロン株式会社、1mmのギャップ設定)を200rpmの速度で設定した。ラクトースの半分を添加し、それに続いて、ステアリン酸マグネシウム及び残りのラクトースを添加した。速度を徐々に増加し、2000rpmで10分間稼動させた。
上記の例は、表面の非結晶性物質の存在を減少させるために、どのようにして微粉化薬剤粒子を調整し得るかを例証している。調整は、グリコピロレートを、30〜100RH、好ましくは40〜95RH、45〜95RH、又は50〜90RHの湿度条件に暴露することを含む。グリコピロレート粉末は、好ましくは、この工程のためのトレイ上に置かれ、好ましくは、すべての粒子が均等に湿度雰囲気に暴露されることを確実にするために、粉末を撹拌又は回転させる。回転又は撹拌はまた、調整工程の間の粒子の凝集を回避又は減少させることにも役立つ。調整は、好ましくは、少なくとも約10分間、少なくとも約20分間、少なくとも約30分間、少なくとも約40分間、少なくとも約50分間、少なくとも約1時間、少なくとも約2、3、4、5、6、8、10、12、14、18、24、36、又は48時間にわたって実施される。
Claims (14)
- グリコピロレート及びステアリン酸マグネシウムを含む、吸入に適切な乾燥粉末製剤であって、グリコピロレートは、微粉化され、次いで、少なくとも48時間、5〜90℃の温度で30〜100% RHの湿度条件への暴露を含む調整工程にさらされる、乾燥粉末製剤。
- 調整工程が、50〜90% RHの湿度条件にグリコピロレートを暴露する工程を伴う、請求項1記載の乾燥粉末製剤。
- 調整工程が、10〜50℃の温度にグリコピロレートを暴露する工程を伴う、請求項1または2記載の乾燥粉末製剤。
- 製剤中のステアリン酸マグネシウム含有量が>0.05%で、かつ<5%である、請求項1乃至3のいずれか一項記載の乾燥粉末製剤。
- 10%未満の含水率を有する物質から製造されるパッケージング中で貯蔵される、請求項1乃至4のいずれか一項記載の乾燥粉末製剤。
- ヒドロキシプロピルメチルセルロースカプセル中で貯蔵される、請求項5記載の乾燥粉末製剤。
- ステアリン酸マグネシウムが、微粉化したグリコピロレートの表面を覆うように塗布されるか、または微粉化したグリコピロレートの表面に融合される、請求項1乃至6のいずれか一項記載の乾燥粉末製剤。
- ステアリン酸マグネシウムがグリコピロレートと共ミリングされる、請求項1乃至7のいずれか一項記載の乾燥粉末製剤。
- ステアリン酸マグネシウムがグリコピロレートとジェットミルされる、請求項8記載の乾燥粉末製剤。
- 調整工程を、微粉化したグリコピロレートへのステアリン酸マグネシウムの添加の後に行う、請求項7乃至9のいずれか一項記載の乾燥粉末製剤。
- 調整工程のために、微粉化したグリコピロレートが
a)トレイ上に配置され、場合により攪拌にさらされる、または
b)場合により流動化媒体の存在下で、流動床中に配置される、
請求項1乃至10のいずれか一項記載の乾燥粉末製剤。 - 外部供給源からの湿気の侵入を防ぐことができるパッケージング中で貯蔵される、請求項1乃至11のいずれか一項記載の乾燥粉末製剤。
- パッケージングそれ自体が、外部供給源からの湿気の侵入から保護される、請求項12記載の乾燥粉末製剤。
- 請求項1乃至13のいずれか一項記載の乾燥粉末製剤を含む、ドライパウダー吸入器デバイス。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB0409703.6 | 2004-04-30 | ||
| GBGB0409703.6A GB0409703D0 (en) | 2004-04-30 | 2004-04-30 | Pharmaceutical compositions |
| PCT/EP2005/051980 WO2005105043A2 (en) | 2004-04-30 | 2005-04-29 | Pharmaceutical compositions |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011244443A Division JP5124718B2 (ja) | 2004-04-30 | 2011-11-08 | 医薬組成物 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2007535522A JP2007535522A (ja) | 2007-12-06 |
| JP2007535522A5 JP2007535522A5 (ja) | 2010-03-18 |
| JP5000483B2 true JP5000483B2 (ja) | 2012-08-15 |
Family
ID=32408337
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007510045A Expired - Lifetime JP5000483B2 (ja) | 2004-04-30 | 2005-04-29 | 医薬組成物 |
| JP2011244443A Expired - Lifetime JP5124718B2 (ja) | 2004-04-30 | 2011-11-08 | 医薬組成物 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011244443A Expired - Lifetime JP5124718B2 (ja) | 2004-04-30 | 2011-11-08 | 医薬組成物 |
Country Status (26)
| Country | Link |
|---|---|
| US (1) | US20080063719A1 (ja) |
| EP (3) | EP1755555B1 (ja) |
| JP (2) | JP5000483B2 (ja) |
| KR (1) | KR101287919B1 (ja) |
| CN (3) | CN102008453A (ja) |
| AU (2) | AU2005237266B2 (ja) |
| BR (1) | BRPI0510500B8 (ja) |
| CA (1) | CA2563760C (ja) |
| CY (6) | CY1113069T1 (ja) |
| DK (2) | DK2422766T3 (ja) |
| ES (2) | ES2546982T3 (ja) |
| GB (1) | GB0409703D0 (ja) |
| HU (4) | HUE025463T2 (ja) |
| IL (2) | IL178651A (ja) |
| LT (1) | LTC2422766I2 (ja) |
| LU (2) | LU92176I2 (ja) |
| MX (2) | MXPA06012493A (ja) |
| NO (1) | NO20065502L (ja) |
| NZ (1) | NZ550479A (ja) |
| PL (2) | PL2422766T3 (ja) |
| PT (2) | PT1755555E (ja) |
| RU (1) | RU2396943C2 (ja) |
| SG (3) | SG186673A1 (ja) |
| SI (2) | SI2422766T1 (ja) |
| WO (1) | WO2005105043A2 (ja) |
| ZA (1) | ZA200609350B (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012031209A (ja) * | 2004-04-30 | 2012-02-16 | Vectura Group Plc | 医薬組成物 |
Families Citing this family (42)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB0425758D0 (en) * | 2004-11-23 | 2004-12-22 | Vectura Ltd | Preparation of pharmaceutical compositions |
| GB0525254D0 (en) * | 2005-12-12 | 2006-01-18 | Jagotec Ag | Powder compositions for inhalation |
| GB0613161D0 (en) | 2006-06-30 | 2006-08-09 | Novartis Ag | Organic Compounds |
| GB0622818D0 (en) * | 2006-11-15 | 2006-12-27 | Jagotec Ag | Improvements in or relating to organic compounds |
| ES2396471T3 (es) * | 2007-12-13 | 2013-02-21 | Novartis Ag | Procedimiento para reducir la tendencia de una sal de glicopirronio a agregarse durante el almacenamiento |
| EP2229148B1 (en) * | 2007-12-13 | 2014-03-05 | Novartis AG | Process for preparing a particulate and crystalline drug substance |
| AU2009241628A1 (en) * | 2008-02-26 | 2009-11-05 | Elevation Pharmaceuticals, Inc. | Method and system for the treatment of chronic obstructive pulmonary disease with nebulized anticholinergic administrations |
| US20100055045A1 (en) | 2008-02-26 | 2010-03-04 | William Gerhart | Method and system for the treatment of chronic obstructive pulmonary disease with nebulized anticholinergic administrations |
| EP4578502A3 (en) | 2009-02-26 | 2025-10-08 | Glaxo Group Limited | Pharmaceutical formulations comprising 4-{(1 r)-2-[(6-{2-[(2,6-dichlorobenzyl)oxy]ethoxy}hexyl)amino]-1-hydroxyethyl}-2-(hydroxymethyl)phenol |
| CA2759041A1 (en) * | 2009-04-24 | 2010-10-28 | Schering Corporation | Agglomerate formulations useful in dry powder inhalers |
| GB0921075D0 (en) | 2009-12-01 | 2010-01-13 | Glaxo Group Ltd | Novel combination of the therapeutic agents |
| GB0921481D0 (en) * | 2009-12-08 | 2010-01-20 | Vectura Ltd | Process and product |
| BR112012023407A2 (pt) * | 2010-03-31 | 2019-09-24 | Glenmark Pharmaceuticals Ltd | composição em pó farmacêutica para instalação, e, processo para a preparação da mesma. |
| MY162391A (en) * | 2010-04-01 | 2017-06-15 | Chiesi Farm Spa | Process for preparing carrier particles for dry powders for inhalation |
| DK2560611T3 (en) * | 2010-04-21 | 2018-02-26 | Chiesi Farm Spa | Process for providing particles with reduced electrostatic charges |
| ES2705494T3 (es) | 2010-08-31 | 2019-03-25 | Glaxosmithkline Ip Dev Ltd | Productos farmacológicos para la inhalación de polvo seco que presentan propiedades de control de la humedad y procedimientos de administración de los mismos |
| AU2011298315B2 (en) | 2010-08-31 | 2014-08-28 | Glaxo Group Limited | Dry powder inhalation drug products exhibiting moisture control properties and methods of administering the same |
| JO3510B1 (ar) * | 2011-03-04 | 2020-07-05 | Heptares Therapeutics Ltd | استخدام جلايكوبيرولات لعلاج عدم انتظام دقات القلب |
| US9763965B2 (en) | 2012-04-13 | 2017-09-19 | Glaxosmithkline Intellectual Property Development Limited | Aggregate particles |
| AU2013100007B4 (en) * | 2013-01-04 | 2013-05-23 | Novartis Ag | System for treating chronic obstructive pulmonary disease |
| US9006462B2 (en) | 2013-02-28 | 2015-04-14 | Dermira, Inc. | Glycopyrrolate salts |
| US8558008B2 (en) | 2013-02-28 | 2013-10-15 | Dermira, Inc. | Crystalline glycopyrrolate tosylate |
| ES2699257T3 (es) | 2013-02-28 | 2019-02-08 | Dermira Inc | Sales de glicopirrolato |
| CA2905542C (en) * | 2013-03-15 | 2022-05-03 | Pearl Therapeutics, Inc. | Methods and systems for conditioning of particulate crystalline materials |
| GB201305825D0 (en) | 2013-03-28 | 2013-05-15 | Vectura Ltd | New use |
| US9393202B2 (en) * | 2013-04-26 | 2016-07-19 | Chiesi Farmaceutici S.P.A | Particle size reduction of an antimuscarinic compound |
| GB201402556D0 (en) | 2014-02-13 | 2014-04-02 | Crystec Ltd | Improvements relating to inhalable particles |
| SI3191081T1 (sl) * | 2014-09-09 | 2020-07-31 | Vectura Limited | Formulacija, ki vsebuje glikopirolat, postopek in naprava |
| US9980904B2 (en) | 2014-10-16 | 2018-05-29 | Teva Branded Pharmaceutical Products R&D, Inc. | Dry powder formulation |
| US9925168B2 (en) | 2016-01-22 | 2018-03-27 | Chiesi Farmaceutici S.P.A. | Preparation of micronized particles of an antimuscarinic compound by hydrodynamic cavitation |
| MX385717B (es) | 2016-03-08 | 2025-03-18 | Mereo Biopharma 1 Ltd | Regimen de dosificacion para el tratamiento de exacerbaciones agudas de enfermedad pulmonar obstructiva cronica. |
| CA3016368A1 (en) | 2016-03-08 | 2017-09-14 | Mereo Biopharma 1 Limited | Dosage regimen for the treatment of acute exacerbations of inflammatory conditions |
| WO2018019803A1 (en) | 2016-07-29 | 2018-02-01 | Laboratorios Lesvi, S.L. | Particle size stabilization process |
| CN114712338A (zh) | 2016-09-19 | 2022-07-08 | 墨西哥氟石股份公司 | 药物组合物 |
| ES3009923T3 (en) | 2017-03-15 | 2025-03-31 | Vectura Ltd | Method and formulation |
| WO2019060604A1 (en) * | 2017-09-20 | 2019-03-28 | Teva Branded Pharmaceutical Products R&D, Inc. | INHALABLE MEDICINE |
| WO2019060595A1 (en) | 2017-09-20 | 2019-03-28 | Teva Branded Pharmaceutical Products R&D, Inc. | INHALABLE DRY POWDER MEDICINAL PRODUCT COMPRISING GLYCOPYRRONIUM |
| KR102760007B1 (ko) | 2017-12-11 | 2025-02-03 | 메레오 바이오파마 1 리미티드 | 만성 폐쇄성 폐 질환의 급성 악화의 예방 또는 감소에서의 3-[5-아미노-4-(3-시아노벤조일)-피라졸-1-일]-n-시클로프로필-4-메틸벤즈아미드의 용도 |
| HUE055425T2 (hu) | 2017-12-11 | 2021-11-29 | Mereo Biopharma 1 Ltd | 3-[5-amino-4-(3-cianobenzoil)-pirazol-1-il]-N-ciklopropil-4-metilbenzamid alkalmazása krónikus elzáródásos tüdõbetegség akut fokozódásának kezelésében |
| KR102696616B1 (ko) | 2018-12-21 | 2024-08-20 | 한미약품 주식회사 | 흡입 제형용 건조 분말 및 이의 제조방법 |
| WO2023117985A1 (en) | 2021-12-21 | 2023-06-29 | Chiesi Farmaceutici S.P.A. | Dry powder formulations filled in an inhaler with improved resistance to humidity |
| EP4452222A1 (en) | 2021-12-21 | 2024-10-30 | Chiesi Farmaceutici S.p.A. | Dry powder formulations filled in an inhaler with improved resistance to humidity |
Family Cites Families (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2956062A (en) * | 1959-02-26 | 1960-10-11 | Robins Co Inc A H | Esters of amino alcohols |
| US3709039A (en) * | 1970-08-31 | 1973-01-09 | Gen Time Corp | Comfort humidity indicator |
| SE9302777D0 (sv) * | 1993-08-27 | 1993-08-27 | Astra Ab | Process for conditioning substances |
| GB9501841D0 (en) | 1995-01-31 | 1995-03-22 | Co Ordinated Drug Dev | Improvements in and relating to carrier particles for use in dry powder inhalers |
| US5612053A (en) * | 1995-04-07 | 1997-03-18 | Edward Mendell Co., Inc. | Controlled release insufflation carrier for medicaments |
| GB9808470D0 (en) | 1998-04-22 | 1998-06-17 | Smithkline Beecham Plc | Novel process and apparatus |
| CN1150895C (zh) * | 1998-11-13 | 2004-05-26 | 杰格研究股份公司 | 用于吸入给药的干粉 |
| GB9826284D0 (en) * | 1998-12-01 | 1999-01-20 | Rhone Poulence Rorer Limited | Process |
| GB9826286D0 (en) | 1998-12-01 | 1999-01-20 | Rhone Poulence Rorer Limited | Process |
| GB0008660D0 (en) * | 2000-04-07 | 2000-05-31 | Arakis Ltd | The treatment of respiratory diseases |
| PE20011227A1 (es) | 2000-04-17 | 2002-01-07 | Chiesi Farma Spa | Formulaciones farmaceuticas para inhaladores de polvo seco en la forma de aglomerados duros |
| EP2266549B1 (en) | 2000-06-27 | 2019-08-07 | Vectura Limited | Method of making particles for use in a pharmaceutical composition |
| WO2002043702A2 (en) * | 2000-11-30 | 2002-06-06 | Vectura Limited | Pharmaceutical compositions for inhalation |
| EP2283817B1 (en) * | 2000-11-30 | 2016-05-18 | Vectura Limited | Method of making particles for use in a pharmaceutical composition |
| EP1372608B1 (de) * | 2001-03-30 | 2007-10-10 | Jagotec Ag | Medizinische aerosolformulierungen |
| KR20050003416A (ko) * | 2002-05-07 | 2005-01-10 | 넥타르 테라퓨틱스 | 건조분말 흡입기용 캡슐 및 이의 제조 및 사용 방법 |
| GB2405798A (en) * | 2003-09-15 | 2005-03-16 | Vectura Ltd | Dry powder inhaler with primary and secondary piercing elements and a medicament pack for use with an inhalation device. |
| GB0409703D0 (en) * | 2004-04-30 | 2004-06-02 | Vectura Ltd | Pharmaceutical compositions |
| WO2006100453A1 (en) * | 2005-03-24 | 2006-09-28 | Sosei R & D Ltd. | Glycopyrronium salts and their therapeutic use |
-
2004
- 2004-04-30 GB GBGB0409703.6A patent/GB0409703D0/en not_active Ceased
-
2005
- 2005-04-29 ES ES11190637.6T patent/ES2546982T3/es not_active Expired - Lifetime
- 2005-04-29 SG SG2012093886A patent/SG186673A1/en unknown
- 2005-04-29 JP JP2007510045A patent/JP5000483B2/ja not_active Expired - Lifetime
- 2005-04-29 RU RU2006142322/15A patent/RU2396943C2/ru active Protection Beyond IP Right Term
- 2005-04-29 HU HUE11190637A patent/HUE025463T2/en unknown
- 2005-04-29 US US11/587,725 patent/US20080063719A1/en not_active Abandoned
- 2005-04-29 DK DK11190637.6T patent/DK2422766T3/da active
- 2005-04-29 PL PL11190637T patent/PL2422766T3/pl unknown
- 2005-04-29 NZ NZ550479A patent/NZ550479A/en not_active IP Right Cessation
- 2005-04-29 CA CA2563760A patent/CA2563760C/en not_active Expired - Lifetime
- 2005-04-29 PL PL05738040T patent/PL1755555T3/pl unknown
- 2005-04-29 SG SG10201605001SA patent/SG10201605001SA/en unknown
- 2005-04-29 KR KR1020067024763A patent/KR101287919B1/ko not_active Expired - Lifetime
- 2005-04-29 PT PT05738040T patent/PT1755555E/pt unknown
- 2005-04-29 EP EP05738040A patent/EP1755555B1/en not_active Revoked
- 2005-04-29 BR BRPI0510500A patent/BRPI0510500B8/pt active IP Right Grant
- 2005-04-29 SG SG200903001-6A patent/SG152292A1/en unknown
- 2005-04-29 DK DK05738040.4T patent/DK1755555T3/da active
- 2005-04-29 MX MXPA06012493A patent/MXPA06012493A/es active IP Right Grant
- 2005-04-29 AU AU2005237266A patent/AU2005237266B2/en active Active
- 2005-04-29 CN CN2010105642463A patent/CN102008453A/zh active Pending
- 2005-04-29 SI SI200531999T patent/SI2422766T1/sl unknown
- 2005-04-29 ES ES05738040T patent/ES2388289T3/es not_active Expired - Lifetime
- 2005-04-29 EP EP11190638A patent/EP2422767A3/en not_active Withdrawn
- 2005-04-29 PT PT111906376T patent/PT2422766E/pt unknown
- 2005-04-29 EP EP11190637.6A patent/EP2422766B1/en not_active Revoked
- 2005-04-29 WO PCT/EP2005/051980 patent/WO2005105043A2/en not_active Ceased
- 2005-04-29 CN CN201710357916.6A patent/CN107252423A/zh active Pending
- 2005-04-29 SI SI200531570T patent/SI1755555T1/sl unknown
- 2005-04-29 CN CNA200580013592XA patent/CN1964700A/zh active Pending
-
2006
- 2006-10-16 IL IL178651A patent/IL178651A/en active IP Right Review Request
- 2006-10-27 MX MX2012008068A patent/MX341426B/es unknown
- 2006-11-10 ZA ZA2006/09350A patent/ZA200609350B/en unknown
- 2006-11-29 NO NO20065502A patent/NO20065502L/no not_active Application Discontinuation
-
2011
- 2011-02-09 AU AU2011200543A patent/AU2011200543B2/en not_active Expired
- 2011-11-08 JP JP2011244443A patent/JP5124718B2/ja not_active Expired - Lifetime
-
2012
- 2012-08-13 CY CY20121100722T patent/CY1113069T1/el unknown
- 2012-12-10 IL IL223545A patent/IL223545A/en active IP Right Grant
-
2013
- 2013-03-13 HU HUS1300006C patent/HUS1300006I1/hu unknown
- 2013-03-27 LU LU92176C patent/LU92176I2/fr unknown
- 2013-03-29 CY CY2013012C patent/CY2013012I1/el unknown
-
2014
- 2014-03-07 LU LU92392C patent/LU92392I2/xx unknown
- 2014-03-19 CY CY2014015C patent/CY2014015I1/el unknown
-
2015
- 2015-08-27 CY CY20151100754T patent/CY1116655T1/el unknown
- 2015-12-18 LT LTPA2015053C patent/LTC2422766I2/lt unknown
- 2015-12-21 HU HUS1500072C patent/HUS1500072I1/hu unknown
- 2015-12-21 HU HUS1500073C patent/HUS1500073I1/hu unknown
- 2015-12-23 CY CY2015059C patent/CY2015059I1/el unknown
- 2015-12-23 CY CY2015060C patent/CY2015060I1/el unknown
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012031209A (ja) * | 2004-04-30 | 2012-02-16 | Vectura Group Plc | 医薬組成物 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5000483B2 (ja) | 医薬組成物 | |
| AU2015314272B2 (en) | Formulation comprising glycopyrrolate, method and apparatus | |
| HK1095282B (en) | Methods for preparing dry powder compositions of glycopyrrolate | |
| HK1168273A (en) | Methods for preparing dry powder compositions of glycopyrrolate | |
| HK1167334B (en) | Dry powder compositions of glycopyrrolate and magnesium stearate | |
| HK40035236A (en) | Formulation comprising glycopyrrolate, method and apparatus | |
| AU2015331912A1 (en) | Inhalable formulation |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080325 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100127 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110510 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110602 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110609 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111108 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20111206 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20120220 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120305 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120306 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20120220 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20120417 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20120516 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 Ref document number: 5000483 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150525 Year of fee payment: 3 |
|
| R153 | Grant of patent term extension |
Free format text: JAPANESE INTERMEDIATE CODE: R153 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R153 | Grant of patent term extension |
Free format text: JAPANESE INTERMEDIATE CODE: R153 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |