JP4900536B2 - 特定の分散剤を含有する外水相を利用する二段階乳化法による単胞リポソームの製造方法、ならびに当該単胞リポソームの製造方法を用いる単胞リポソーム分散液またはその乾燥粉末の製造方法 - Google Patents
特定の分散剤を含有する外水相を利用する二段階乳化法による単胞リポソームの製造方法、ならびに当該単胞リポソームの製造方法を用いる単胞リポソーム分散液またはその乾燥粉末の製造方法 Download PDFInfo
- Publication number
- JP4900536B2 JP4900536B2 JP2011520844A JP2011520844A JP4900536B2 JP 4900536 B2 JP4900536 B2 JP 4900536B2 JP 2011520844 A JP2011520844 A JP 2011520844A JP 2011520844 A JP2011520844 A JP 2011520844A JP 4900536 B2 JP4900536 B2 JP 4900536B2
- Authority
- JP
- Japan
- Prior art keywords
- emulsification
- liposomes
- emulsion
- producing
- liposome
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/127—Synthetic bilayered vehicles, e.g. liposomes or liposomes with cholesterol as the only non-phosphatidyl surfactant
- A61K9/1277—Preparation processes; Proliposomes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/42—Proteins; Polypeptides; Degradation products thereof; Derivatives thereof, e.g. albumin, gelatin or zein
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K8/00—Cosmetics or similar toiletry preparations
- A61K8/02—Cosmetics or similar toiletry preparations characterised by special physical form
- A61K8/14—Liposomes; Vesicles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61Q—SPECIFIC USE OF COSMETICS OR SIMILAR TOILETRY PREPARATIONS
- A61Q19/00—Preparations for care of the skin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/28—Steroids, e.g. cholesterol, bile acids or glycyrrhetinic acid
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Inorganic Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Birds (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Organic Chemistry (AREA)
- Dispersion Chemistry (AREA)
- Dermatology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Virology (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Medicinal Preparation (AREA)
- Manufacturing Of Micro-Capsules (AREA)
- Cosmetics (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Emulsifying, Dispersing, Foam-Producing Or Wetting Agents (AREA)
- Colloid Chemistry (AREA)
- General Preparation And Processing Of Foods (AREA)
Description
・特定分散剤
本発明では、二次乳化工程において「特定分散剤」(自己による分子集合体を形成しない分散剤または自己による分子集合体を形成するがその体積平均粒径が10nm以下である分散剤)を含有する外水相を用いる。
一次乳化工程で用いる混合脂質成分(F1)は主としてリポソームの脂質二重膜の内膜を構成する。混合脂質成分(F2)は主として外膜を構成する。混合脂質成分(F1)および(F2)は、同一の組成であっても、異なる組成であってもよい。
水性溶媒(W1)および(W2)ならびに有機溶媒(O)は公知の一般的なものを用いることができる。一次乳化工程で用いられる水性溶媒(W1)および有機溶媒(O)は、それぞれW1/Oエマルションの水相および油相をなし、二次乳化工程で用いられる水性溶媒(W2)は、W1/O/W2エマルションの外水相をなす。水性溶媒としては、たとえば純水に必要に応じて水と混合する他の溶媒、浸透圧調整のための塩類・糖類、pH調整のための緩衝液などを配合したものが挙げられる。有機溶媒としては、たとえばヘキサン(n−ヘキサン)やクロロホルムなど、水性溶媒と混合しない化合物からなるものが挙げられるが、ヘキサンを主成分(50体積%以上)とする有機溶媒は、得られるナノサイズのW1/Oエマルションの単分散性が良好であるため好ましい。
本発明において、リポソームに内包させるべき物質(薬剤類と総称する)は特に限定されるものではなく、リポソームの用途に応じて医薬品、化粧品、食品などの分野で知られている各種の物質を用いることができる。
本発明の二段階乳化法によるリポソームの製造方法は、下記工程(1)〜(3)を有する。この製造方法は、特定分散剤を含有する外水相中でリポソームを形成するので、自ずとリポソームの分散液の製造方法となる。さらに、必要に応じて分離工程(4)および乾燥粉末化工程等のその他の工程(5)を適宜組み合わせることにより、リポソームの分散液またはその乾燥粉末の製造方法とすることができる。
一次乳化工程は、有機溶媒(O)、水性溶媒(W1)、および混合脂質成分(F1)を乳化してW1/Oエマルションを調製する工程である。
二次乳化工程は、上記工程(1)により得られたW1/Oエマルションを用いて、W1/O/W2エマルションを調製する工程である。
溶媒除去工程は、上記二次乳化工程(2)により得られたW1/O/W2エマルションに含まれる有機溶媒相(O)を除去し、リポソームの分散液を形成させる工程である。溶媒除去の方法としては、たとえばエバポレータで蒸発させる方法や液中乾燥法などが挙げられる。
分離工程は、特定分散剤とリポソームとを分離し、リポソーム分散液中から特定分散剤を除去するための工程である。たとえば、精密濾過膜(MF膜,孔径50nm〜10μm程度)または限外濾過膜(UF膜,孔径2〜200nm程度)の特定孔径のものを用いれば、リポソームと自己による分子集合体(たとえば体積平均粒径10nm以下)を形成した特定分散剤とを効率よく分離することができる。なお、製品の用途に鑑みて、特定分散剤とリポソームとを分離しなくとも問題がない場合には、この分離工程は設けなくともよい。分離工程を設けることで、内包薬剤等のリポソームからの漏えいをさらに抑制でき、長期的に安定したリポソームが形成できる。
必要に応じて行われるその他の工程としては、たとえば整粒工程や乾燥粉末化工程が挙げられる。
以下に述べる実施例および比較例におけるリポソームの体積平均粒径は、下記の方法に従って測定した。
(一次乳化工程によるW1/Oエマルションの製造)
ホスファチジルコリン含量が95%である卵黄レシチン「COATSOME NC-50」(日油株式会社)0.3g、コレステロール(Chol)0.152gおよびオレイン酸(OA)0.108gを含むヘキサン15mLを有機溶媒相(O)とし、カルセイン(0.4mM)を含むトリス−塩酸緩衝液(pH8、50mmol/L)5mLを内水相用の水分散相(W1)とした。50mLのビーカーにこれらの混合液を入れ、直径20mmのプローブをセットした超音波分散装置(UH−600S、株式会社エスエムテー)により、25℃にて15分間超音波を照射し(出力5.5)、乳化処理を行った。上記方法に従って測定したところ、この一次乳化工程で得られたW1/Oエマルションは体積平均粒径約220nmの単分散W/Oエマルションであることが確認された。
続いて、上記一次乳化工程により得られたW1/Oエマルションを分散相とし、実験用デッドエンド型マイクロチャネル乳化装置モジュールを使用して、マイクロチャネル乳化法によるW1/O/W2エマルションの製造を行った。
次に、上記W1/O/W2エマルションを蓋のない開放ガラス製容器に移し替え、室温下で約20時間、撹拌子により撹拌し、ヘキサンを揮発させた。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはカルセインが含まれていることが確認された。
実施例1において、二次乳化工程によるW1/O/W2エマルションの製造で、外水相の分散剤をアルカリ処理ゼラチンから「Tween 80」(東京化成工業株式会社,ポリオキシエチレンソルビタンモノオレアート,分子量1309.68)に変更し、その濃度を1%とすることを除いては、実施例1と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはカルセインが含まれていることが確認された。
実施例1において、二次乳化工程によるW1/O/W2エマルションの製造で、外水相の分散剤をアルカリ処理ゼラチンからアルブミン(キューピー株式会社,別名:乾燥脱糖卵白)に変更することを除いては、実施例1と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはカルセインが含まれていることが確認された。
実施例1において、二次乳化工程によるW1/O/W2エマルションの製造で、外水相の分散剤をアルカリ処理ゼラチンからカルボキシデキストランに変更することを除いては、実施例1と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはカルセインが含まれていることが確認された。
実施例1において、二次乳化工程によるW1/O/W2エマルションの製造で、外水相の分散剤をアルカリ処理ゼラチンから精製ゼラチン(株式会社ニッピ,ニッピ ハイグレードゼラチンタイプAP)に変更することを除いては、実施例1と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはカルセインが含まれていることが確認された。
実施例5において、二次乳化工程によるW1/O/W2エマルションの製造をマイクロチャネル乳化法からSPG膜を用いた膜乳化に変更した以外は、実施例5と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはカルセインが含まれていることが確認された。すなわち、一次乳化工程により得られたW1/Oエマルションを分散相とし、SPG膜乳化法によるW1/O/W2エマルションの製造を行った。SPG膜乳化装置(SPGテクノ社製、商品名「外圧式マイクロキット」)に直径10mm、長さ20mm、細孔径2.0μmの円筒形SPG膜を用い、装置出口側に外水相溶液(W2)である精製ゼラチン(株式会社ニッピ,ニッピ ハイグレードゼラチンタイプAP)を含むトリス−塩酸緩衝液(pH8、50mmol/L)を満たしておき、装置入口側から上記W1/Oエマルションを供給して、W1/O/W2エマルションを製造した。膜乳化に必要とした圧力は約25kPaであった。
実施例5において、二次乳化工程によるW1/O/W2エマルションの製造をマイクロチャネル乳化法から撹拌乳化法に変更した以外は、実施例5と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはカルセインが含まれていることが確認された。すなわち、撹拌乳化は、スターラーによりW2を強く撹拌しているところに、上記W1/Oエマルションを供給し、W1/O/W2エマルションを製造した。
実施例1において、二次乳化工程によるW1/O/W2エマルションの製造で、外水相の分散剤をアルカリ処理ゼラチンからコール酸ナトリウム(分子量430)に変更し、その濃度を0.1%とすることを除いては、実施例1と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはカルセインが含まれていることが確認された。
実施例6において、二次乳化工程によるW1/O/W2エマルションの製造で外水相の分散剤を精製ゼラチンからコール酸ナトリウム(分子量430)に変更し、その濃度を0.1%とすることを除いては、実施例6と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはカルセインが含まれていることが確認された。
実施例7において、二次乳化工程によるW1/O/W2エマルションの製造で外水相の分散剤を精製ゼラチンからコール酸ナトリウム(分子量430)に変更し、その濃度を0.1%とすることを除いては、実施例7と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはカルセインが含まれていることが確認された。
実施例1において、二次乳化工程によるW1/O/W2エマルションの製造で、外水相の分散剤をアルカリ処理ゼラチンからオクチルグルコシド(分子量292)に変更し、その濃度を1%とすることを除いては、実施例1と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはカルセインが含まれていることが確認された。
実施例6において、内包する薬剤をカルセインからシタラビンに変更した以外は、実施例6と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはシタラビンが含まれていることが確認された。
実施例7において、内包する薬剤をカルセインからシタラビンに変更した以外は、実施例6と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはシタラビンが含まれていることが確認された。
実施例1において、二次乳化工程によるW1/O/W2エマルションの製造で、外水相の分散剤をアルカリ処理ゼラチンから各々表1に記載の特定分散剤に変更することを除いては、実施例1と同様にして、実施例14〜23の製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはカルセインが含まれていることが確認された。
実施例23において、二次乳化工程によるW1/O/W2エマルションの製造をマイクロチャネル乳化法からSPG膜を用いた膜乳化に変更した以外は、実施例23と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはカルセインが含まれていることが確認された。
実施例23において、二次乳化工程によるW1/O/W2エマルションの製造をマイクロチャネル乳化法から撹拌乳化法に変更した以外は、実施例23と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはカルセインが含まれていることが確認された。
実施例1において、二次乳化工程によるW1/O/W2エマルションの製造で、外水相の分散剤をアルカリ処理ゼラチンから各々表1に記載の特定分散剤に変更することを除いては、実施例1と同様にして、実施例26〜30の製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはカルセインが含まれていることが確認された。
実施例30において、二次乳化工程によるW1/O/W2エマルションの製造をマイクロチャネル乳化法からSPG膜を用いた膜乳化に変更した以外は、実施例30と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはカルセインが含まれていることが確認された。
実施例2において、二次乳化工程によるW1/O/W2エマルションの製造をマイクロチャネル乳化法からSPG膜を用いた膜乳化に変更した以外は、実施例2と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはカルセインが含まれていることが確認された。
実施例32において、二次乳化工程によるW1/O/W2エマルションの製造で、外水相の分散剤をTween 80から各々表1に記載の特定分散剤に変更することを除いては、実施例1と同様にして、実施例33〜35の製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはカルセインが含まれていることが確認された。
実施例1において、内包する薬剤をカルセインからシタラビンに変更した以外は、実施例1と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはシタラビンが含まれていることが確認された。
実施例2において、内包する薬剤をカルセインからシタラビンに変更した以外は、実施例2と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはシタラビンが含まれていることが確認された。
実施例3において、内包する薬剤をカルセインからシタラビンに変更した以外は、実施例3と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはシタラビンが含まれていることが確認された。
実施例4において、内包する薬剤をカルセインからシタラビンに変更した以外は、実施例4と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはシタラビンが含まれていることが確認された。
実施例5において、内包する薬剤をカルセインからシタラビンに変更した以外は、実施例5と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはシタラビンが含まれていることが確認された。
(一次乳化工程によるW1/Oエマルションの製造)
ホスファチジルコリン含量が95%である卵黄レシチン「COATSOME NC-50」(日油株式会社)0.3g、コレステロール(Chol)0.152gおよびオレイン酸(OA)0.108gを含むヘキサン15mLを有機溶媒相(O)とし、カルセイン(0.4mM)を含むトリス−塩酸緩衝液(pH8、50mmol/L)5mLを内水相用の水分散相(W1)とした。50mLのビーカーにこれらの混合液を入れ、直径20mmのプローブをセットした超音波分散装置(UH−600S、株式会社エスエムテー)により、25℃にて15分間超音波を照射し(出力5.5)、乳化処理を行った。上記方法に従って測定したところ、この一次乳化工程で得られたW1/Oエマルションは体積平均粒径約220nmの単分散W/Oエマルションであることが確認された。
続いて、上記一次乳化工程により得られたW1/Oエマルションを分散相とし、実験用デッドエンド型マイクロチャネル乳化装置モジュールを使用して、マイクロチャネル乳化法によるW1/O/W2エマルションの製造を行った。
次に、上記W1/O/W2エマルションを蓋のない開放ガラス製容器に移し替え、室温下で約20時間静置し、ヘキサンを揮発させた。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはカルセインが含まれていることが確認された。
二次乳化工程によるW1/O/W2エマルションの製造において、外水相溶液(W2)である3%のカゼインナトリウムを含むトリス−塩酸緩衝液(pH8、50mmol/L)をトリス−塩酸緩衝液(pH8、50mmol/L)にすることを除いては、比較例1と同様にして、製造を実施した。しかし、W1/O/W2エマルションが一旦は形成するものの、すぐに合一してしまい、安定なW1/O/W2エマルションは得られなかった。そのため、次の工程に実験を進めることができなかった。
二次乳化工程によるW1/O/W2エマルションの製造において、外水相溶液(W2)である3%のカゼインナトリウムを含むトリス−塩酸緩衝液(pH8、50mmol/L)を3%ドデシルベンゼンスルホン酸ナトリウムを含むトリス−塩酸緩衝液(pH8、50mmol/L)にすることを除いては、比較例1と同様にして、製造を実施し、懸濁した液を得た。
比較例1において、二次乳化工程によるW1/O/W2エマルションの製造をマイクロチャネル乳化法からSPG膜を用いた膜乳化に変更した以外は、比較例1と同様にして、製造を実施した。微細リポソーム粒子の懸濁液が得られ、この粒子内にはカルセインが含まれていることが確認された。
比較例4において、内包する薬剤をカルセインからシタラビンに変更した以外は、比較例4と同様にして、製造を実施した。微細なリポソーム粒子の懸濁液が得られ、この粒子内にはシタラビンが含まれていることが確認された。
比較例1において、二次乳化工程によるW1/O/W2エマルションの製造をマイクロチャネル乳化法から撹拌乳化法に変更した以外は、比較例1と同様にして、製造を実施した。微細リポソーム粒子の懸濁液が得られ、この粒子内にはカルセインが含まれていることが確認された。
上記実施例1〜40、比較例1〜6について、リポソーム形成時、及び1ヶ月後の内包率を求め、1ヵ月後のリポソームの安定性を評価した。結果を表1に示す。
内包の低下率(%)=100−(1ヵ月後内包率/リポソーム形成時内包率)×100
◎:内包の低下率が0%以上5%未満
○:内包の低下率が5%以上15%未満
△:内包の低下率が15%以上35%未満
×:内包の低下率が35%以上100%以下
(リポソームの内包率(%))
上記実施例1〜40および比較例1〜6で得られたリポソームの形成時、及び1ヶ月後の内包率は、下記の方法に従って測定した。結果は表1に示した。
リポソーム粒子の懸濁液(3mL)全体の蛍光強度(Ftotal)を分光光度計(U−3310、日本分光株式会社)により測定した。次に0.01M,CoCl2トリス塩酸緩衝液30μLを加えて外水相に漏出した内包薬剤カルセインの蛍光をCo2+により消光することで、リポソーム内の蛍光強度(Fin)を測定した。さらに、カルセインを加えないでサンプルと同じ条件でリポソームを作製し、脂質自身が発する蛍光(Fl)を測定した。内包率は下記式より算出した;
内包率E(%) = (Fin−Fl)/(Ftotal−Fl)×100
(内包物がシタラビンの場合の内包率の測定方法)
リポソーム粒子の懸濁液を超遠心条件のもと超遠心装置を用い成分分離し、固形分(リポソーム)と上澄溶液とに含まれるシタラビンの量をそれぞれHPLC(カラム:VarianPolaris C18-A(3μm,2×40mm))で定量した。固形分(リポソーム)の定量値、すなわちリポソームに内包されているシタラビンの量と、上澄溶液の定量値、すなわちリポソームに内包されていないシタラビンの量との合計値で、前者のリポソームに内包されているシタラビンの量を除した値に100を乗じて、シタラビンの内包率(%)を算出した。
1ヵ月間、リポソーム粒子の懸濁液を恒温器中(20℃)にて、静置し保存した。
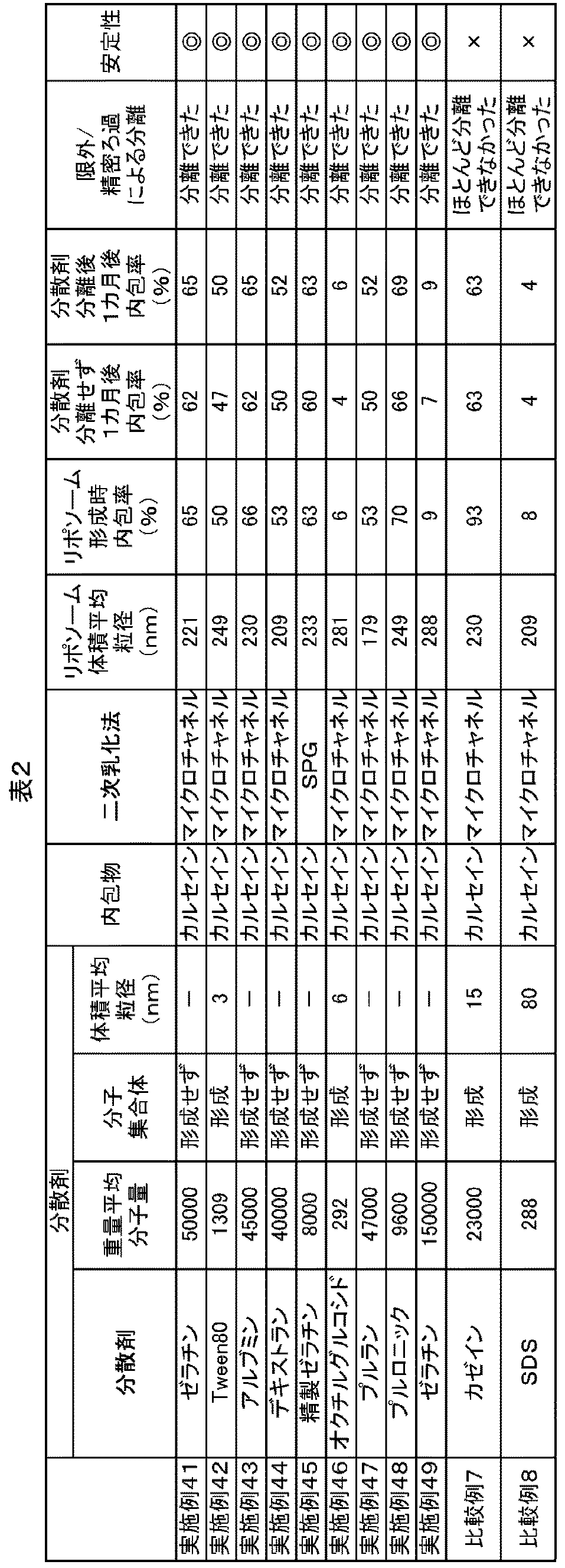
上記実施例1,2,3,4,6,11,19,23、及び30で製造したリポソーム粒子の懸濁液から、後述の精密/限外ろ過工程を行い、実施例41〜49のリポソーム懸濁液を製造した。
上記比較例1及び3で製造したリポソーム粒子の懸濁液から、後述の精密/限外ろ過工程を行い、比較例7及び8のリポソーム懸濁液を製造した。
精密/限外ろ過による分離は、加圧ろ過装置(デッドエンド型)に適宜設定した孔径のフィルターを装着し、リポソーム粒子の懸濁液を、トリス−塩酸緩衝液(pH=8、50mmol/L)で10倍に希釈した液を処理した。このろ液に含まれる分散剤の量を分析することで分離可能かを調べた。8割以上分離できたものを「分離できた」、1割以下しか分離できなかったものを「ほとんど分離できなかった」とした。また、その間のものはなかった。
上述したリポソームの安定性の評価と同様にして、実施例41〜49及び比較例7、8で得られたリポソームの安定性を評価した。結果は表2に示した。
Claims (10)
- 有機溶媒(O)、水性溶媒(W1)及びリポソーム脂質膜を構成する脂質成分を乳化してW1/Oエマルションを得る一次乳化工程と、前記一次乳化工程で得られた前記W1/Oエマルション及び外水相となる水性溶媒(W2)を用いて乳化することによりW1/O/W2エマルションを得る二次乳化工程と、前記二次乳化工程で得られた前記W1/O/W2エマルションより、前記W1/O/W2エマルションに含まれる有機溶媒相を除去する溶媒除去工程とを有する二段階乳化法による単胞リポソームの製造方法であって、前記二次乳化工程における前記外水相は、タンパク質、多糖類、イオン性界面活性剤または非イオン性界面活性剤の少なくとも1種から選ばれる、自己による分子集合体を形成しない分散剤または自己による分子集合体を形成するがその分子集合体の体積平均粒径が10nm以下である分散剤を含有することを特徴とする二段階乳化法による単胞リポソームの製造方法。
- 前記分散剤の重量平均分子量は1,000以上100,000以下であることを特徴とする請求項1に記載の二段階乳化法による単胞リポソームの製造方法。
- 前記分散剤は、ゼラチン、アルブミン、トリプシン、デキストラン、デンプン、グリコーゲン、アガロース、ペクチン、キトサン、カルボキシメチルセルロースナトリウム、キサンタンガム、ローカストビーンガム、グァーガム、マルトトリオース、アミロース、プルラン、ヘパリン、デキストリン、コール酸ナトリウム、デオキシコール酸ナトリウム、アルキルグリコシドまたはポリアルキレンオキサイド化合物の少なくとも1種を含有することを特徴とする請求項1または2に記載の二段階乳化法による単胞リポソームの製造方法。
- 前記単胞リポソームの体積平均粒径は50nm以上300nm以下であることを特徴とする請求項1〜3のいずれかに記載の二段階乳化法による単胞リポソームの製造方法。
- 前記二次乳化工程の乳化方法として撹拌乳化法を用いることを特徴とする請求項1〜4のいずれかに記載の二段階乳化法による単胞リポソームの製造方法。
- 前記二次乳化工程の乳化方法としてマイクロチャネル乳化法を用いることを特徴とする請求項1〜4のいずれかに記載の二段階乳化法による単胞リポソームの製造方法。
- 前記二次乳化工程の乳化方法としてSPG膜を用いた膜乳化を用いることを特徴とする請求項1〜4のいずれかに記載の二段階乳化法による単胞リポソームの製造方法。
- 前記単胞リポソームに内包されるべき物質として、医療用の薬剤を用いることを特徴とする請求項1〜7のいずれかに記載の二段階乳化法による単胞リポソームの製造方法。
- 請求項1〜8のいずれかに記載の二段階乳化法による単胞リポソームの製造方法を含むことを特徴とする単胞リポソーム分散液またはその乾燥粉末の製造方法。
- 前記二次乳化工程により得られた単胞リポソームと前記分散剤とを分離する分離工程をさらに有することを特徴とする請求項9に記載の単胞リポソーム分散液またはその乾燥粉末の製造方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2011520844A JP4900536B2 (ja) | 2009-07-02 | 2010-06-02 | 特定の分散剤を含有する外水相を利用する二段階乳化法による単胞リポソームの製造方法、ならびに当該単胞リポソームの製造方法を用いる単胞リポソーム分散液またはその乾燥粉末の製造方法 |
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2009157626 | 2009-07-02 | ||
| JP2009157626 | 2009-07-02 | ||
| PCT/JP2010/059371 WO2011001780A1 (ja) | 2009-07-02 | 2010-06-02 | 特定分散剤を含有する外水相を利用する二段階乳化法によるリポソームの製造方法、ならびに当該リポソームの製造方法を用いるリポソーム分散液またはその乾燥粉末の製造方法およびそれにより製造されるリポソーム分散液またはその乾燥粉末 |
| JP2011520844A JP4900536B2 (ja) | 2009-07-02 | 2010-06-02 | 特定の分散剤を含有する外水相を利用する二段階乳化法による単胞リポソームの製造方法、ならびに当該単胞リポソームの製造方法を用いる単胞リポソーム分散液またはその乾燥粉末の製造方法 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011204585A Division JP5754319B2 (ja) | 2009-07-02 | 2011-09-20 | 特定の分散剤を含有する外水相を利用する二段階乳化法によるリポソームの製造方法、ならびに当該リポソームの製造方法を用いるリポソーム分散液またはその乾燥粉末の製造方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP4900536B2 true JP4900536B2 (ja) | 2012-03-21 |
| JPWO2011001780A1 JPWO2011001780A1 (ja) | 2012-12-13 |
Family
ID=43410860
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011520844A Expired - Fee Related JP4900536B2 (ja) | 2009-07-02 | 2010-06-02 | 特定の分散剤を含有する外水相を利用する二段階乳化法による単胞リポソームの製造方法、ならびに当該単胞リポソームの製造方法を用いる単胞リポソーム分散液またはその乾燥粉末の製造方法 |
| JP2011204585A Expired - Fee Related JP5754319B2 (ja) | 2009-07-02 | 2011-09-20 | 特定の分散剤を含有する外水相を利用する二段階乳化法によるリポソームの製造方法、ならびに当該リポソームの製造方法を用いるリポソーム分散液またはその乾燥粉末の製造方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011204585A Expired - Fee Related JP5754319B2 (ja) | 2009-07-02 | 2011-09-20 | 特定の分散剤を含有する外水相を利用する二段階乳化法によるリポソームの製造方法、ならびに当該リポソームの製造方法を用いるリポソーム分散液またはその乾燥粉末の製造方法 |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US20120100207A1 (ja) |
| EP (1) | EP2450031B1 (ja) |
| JP (2) | JP4900536B2 (ja) |
| WO (1) | WO2011001780A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012055885A (ja) * | 2009-07-02 | 2012-03-22 | Konica Minolta Holdings Inc | 特定分散剤を含有する外水相を利用する二段階乳化法によるリポソームの製造方法、ならびに当該リポソームの製造方法を用いるリポソーム分散液またはその乾燥粉末の製造方法およびそれにより製造されるリポソーム分散液またはその乾燥粉末 |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2840339A1 (en) * | 2010-06-23 | 2011-12-29 | Brightside Innovations, Inc. | Lecithin carrier vesicles and methods of making the same |
| ES2646669T3 (es) | 2010-07-06 | 2017-12-14 | Glaxosmithkline Biologicals Sa | Procedimientos de aumento de una respuesta inmunitaria mediante el suministro de ARN |
| ES2586580T3 (es) | 2010-07-06 | 2016-10-17 | Glaxosmithkline Biologicals Sa | Inmunización de mamíferos grandes con dosis bajas de ARN |
| HRP20161352T1 (hr) | 2010-07-06 | 2016-12-02 | Glaxosmithkline Biologicals Sa | Čestice nalik na virione za unos samoreplicirajućih molekula rna |
| HUE026646T2 (en) | 2010-07-06 | 2016-07-28 | Glaxosmithkline Biologicals Sa | Preferred liposomes containing lipids of PKA value for delivery of RNA |
| DK4226941T3 (da) | 2010-08-31 | 2024-12-02 | Glaxosmithkline Biologicals Sa | Pegylerede liposomer til levering af immunogen-kodende rna |
| EP4043040B1 (en) * | 2010-08-31 | 2023-01-11 | GlaxoSmithKline Biologicals SA | Small liposomes for delivery of immunogen-encoding rna |
| KR102266691B1 (ko) | 2010-10-11 | 2021-06-23 | 노파르티스 아게 | 항원 전달 플랫폼 |
| JP6184945B2 (ja) | 2011-06-08 | 2017-08-23 | シャイアー ヒューマン ジェネティック セラピーズ インコーポレイテッド | mRNA送達のための脂質ナノ粒子組成物および方法 |
| US11896636B2 (en) | 2011-07-06 | 2024-02-13 | Glaxosmithkline Biologicals Sa | Immunogenic combination compositions and uses thereof |
| JP5834114B1 (ja) * | 2014-06-25 | 2015-12-16 | 日本食品化工株式会社 | 乳化剤および乳化食品 |
| JP6682180B2 (ja) * | 2014-11-05 | 2020-04-15 | キユーピー株式会社 | W/o/w型乳化調味料 |
| JP6682181B2 (ja) * | 2014-11-05 | 2020-04-15 | キユーピー株式会社 | W/o/w型乳化調味料 |
| AU2018341389A1 (en) * | 2017-09-26 | 2020-04-23 | Nanomi B.V. | Method for preparing micro-particles by double emulsion technique |
| WO2020198338A1 (en) * | 2019-03-25 | 2020-10-01 | Ohio State Innovation Foundation | Combination immunoregulation and uses thereof |
| JP7271374B2 (ja) * | 2019-09-10 | 2023-05-11 | 株式会社東芝 | 分析方法、分析基体、分析キット及び分析装置。 |
| CN111388423A (zh) * | 2020-03-23 | 2020-07-10 | 江苏永达药业有限公司 | 一种盐酸莫西沙星脂质体的制备方法 |
Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001181213A (ja) * | 1999-12-27 | 2001-07-03 | Kaiso Shigen Kenkyusho:Kk | 標的指向性を有するベシクル及びその調製法 |
| JP2001515853A (ja) * | 1997-09-08 | 2001-09-25 | スカイファーマ インコーポレーテッド | 多胞状リポソームへの薬剤封入量の調節 |
| JP2003001097A (ja) * | 2001-06-22 | 2003-01-07 | Techno Network Shikoku Co Ltd | ナノサイズ脂質ベシクルの製造方法 |
| JP2003286411A (ja) * | 2002-03-28 | 2003-10-10 | Dai Ichi Kogyo Seiyaku Co Ltd | W/o/w型多相エマルジョン |
| WO2005053643A1 (ja) * | 2003-12-01 | 2005-06-16 | Mitsubishi Pharma Corporation | リポソーム |
| JP2006272196A (ja) * | 2005-03-29 | 2006-10-12 | Toshiba Corp | 複合型微粒子の製造方法及び複合型微粒子の製造装置 |
| WO2008108324A1 (ja) * | 2007-03-02 | 2008-09-12 | University Of Tsukuba | ベシクルの製造方法、この製造方法によって得られるベシクル、ベシクルの製造に用いられる凍結粒子の製造方法 |
| WO2008140081A1 (ja) * | 2007-05-14 | 2008-11-20 | Konica Minolta Holdings, Inc. | リポソームおよびリポソームの製造方法 |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4938965A (en) * | 1987-07-22 | 1990-07-03 | Her Majesty The Queen In Right Of Canada, As Represented By The Minister Of National Defence Of Her Majesty's Canadian Government | Ocular delivery of prophylactic agents |
| US5853755A (en) * | 1993-07-28 | 1998-12-29 | Pharmaderm Laboratories Ltd. | Biphasic multilamellar lipid vesicles |
| ES2384094T3 (es) * | 1997-11-14 | 2012-06-29 | Pacira Pharmaceuticals, Inc. | Producción de liposomas multivesiculares |
| US20020114829A1 (en) * | 1998-12-18 | 2002-08-22 | Hayat Onyuksel | Materials and methods for making improved liposome compositions |
| JP2003514832A (ja) * | 1999-11-19 | 2003-04-22 | ザイコス インク. | 微粒子製造に関する連続フロー法 |
| GB0307428D0 (en) * | 2003-03-31 | 2003-05-07 | Medical Res Council | Compartmentalised combinatorial chemistry |
| CA2631875A1 (en) * | 2005-12-06 | 2007-10-04 | Rigel Pharmaceuticals, Inc. | Formulation of insoluble small molecule therapeutics in lipid-based carriers |
| WO2007127272A2 (en) * | 2006-04-24 | 2007-11-08 | The Cbr Institute For Biomedical Research | Method of producing immunoliposomes and compositions thereof |
| CA2705797A1 (en) * | 2007-11-14 | 2009-05-22 | The Regents Of The University Of California | Sterol-modified amphiphilic lipids |
| US9445975B2 (en) * | 2008-10-03 | 2016-09-20 | Access Business Group International, Llc | Composition and method for preparing stable unilamellar liposomal suspension |
| WO2010110118A1 (ja) * | 2009-03-23 | 2010-09-30 | コニカミノルタホールディングス株式会社 | リポソームの製造方法 |
| WO2011001780A1 (ja) * | 2009-07-02 | 2011-01-06 | コニカミノルタホールディングス株式会社 | 特定分散剤を含有する外水相を利用する二段階乳化法によるリポソームの製造方法、ならびに当該リポソームの製造方法を用いるリポソーム分散液またはその乾燥粉末の製造方法およびそれにより製造されるリポソーム分散液またはその乾燥粉末 |
-
2010
- 2010-06-02 WO PCT/JP2010/059371 patent/WO2011001780A1/ja not_active Ceased
- 2010-06-02 JP JP2011520844A patent/JP4900536B2/ja not_active Expired - Fee Related
- 2010-06-02 US US13/380,225 patent/US20120100207A1/en not_active Abandoned
- 2010-06-02 EP EP10793951.4A patent/EP2450031B1/en not_active Not-in-force
-
2011
- 2011-09-20 JP JP2011204585A patent/JP5754319B2/ja not_active Expired - Fee Related
Patent Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001515853A (ja) * | 1997-09-08 | 2001-09-25 | スカイファーマ インコーポレーテッド | 多胞状リポソームへの薬剤封入量の調節 |
| JP2001181213A (ja) * | 1999-12-27 | 2001-07-03 | Kaiso Shigen Kenkyusho:Kk | 標的指向性を有するベシクル及びその調製法 |
| JP2003001097A (ja) * | 2001-06-22 | 2003-01-07 | Techno Network Shikoku Co Ltd | ナノサイズ脂質ベシクルの製造方法 |
| JP2003286411A (ja) * | 2002-03-28 | 2003-10-10 | Dai Ichi Kogyo Seiyaku Co Ltd | W/o/w型多相エマルジョン |
| WO2005053643A1 (ja) * | 2003-12-01 | 2005-06-16 | Mitsubishi Pharma Corporation | リポソーム |
| JP2006272196A (ja) * | 2005-03-29 | 2006-10-12 | Toshiba Corp | 複合型微粒子の製造方法及び複合型微粒子の製造装置 |
| WO2008108324A1 (ja) * | 2007-03-02 | 2008-09-12 | University Of Tsukuba | ベシクルの製造方法、この製造方法によって得られるベシクル、ベシクルの製造に用いられる凍結粒子の製造方法 |
| WO2008140081A1 (ja) * | 2007-05-14 | 2008-11-20 | Konica Minolta Holdings, Inc. | リポソームおよびリポソームの製造方法 |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012055885A (ja) * | 2009-07-02 | 2012-03-22 | Konica Minolta Holdings Inc | 特定分散剤を含有する外水相を利用する二段階乳化法によるリポソームの製造方法、ならびに当該リポソームの製造方法を用いるリポソーム分散液またはその乾燥粉末の製造方法およびそれにより製造されるリポソーム分散液またはその乾燥粉末 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2450031A4 (en) | 2013-05-08 |
| US20120100207A1 (en) | 2012-04-26 |
| JP5754319B2 (ja) | 2015-07-29 |
| EP2450031A1 (en) | 2012-05-09 |
| WO2011001780A1 (ja) | 2011-01-06 |
| JPWO2011001780A1 (ja) | 2012-12-13 |
| JP2012055885A (ja) | 2012-03-22 |
| EP2450031B1 (en) | 2018-08-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4900536B2 (ja) | 特定の分散剤を含有する外水相を利用する二段階乳化法による単胞リポソームの製造方法、ならびに当該単胞リポソームの製造方法を用いる単胞リポソーム分散液またはその乾燥粉末の製造方法 | |
| JP5983608B2 (ja) | 溶解助剤を利用したリポソーム含有製剤およびその製造方法 | |
| Tsai et al. | Liposomal microencapsulation using the conventional methods and novel supercritical fluid processes | |
| JP5741442B2 (ja) | リポソームの製造方法 | |
| JP5831588B2 (ja) | リポソームの製造方法 | |
| JP2006508126A (ja) | 薬学的製剤のタンパク質安定化されたリポソーム製剤 | |
| JP5853453B2 (ja) | リポソームを製造する方法 | |
| JP5494054B2 (ja) | 二段階乳化によるリポソーム製造方法 | |
| Eskandari et al. | Physical and chemical properties of nano-liposome, application in nano medicine | |
| EP3235561B1 (en) | Liposome production method and liposome production device | |
| JP2011104572A (ja) | リポソームの製造方法およびフロー製造装置 | |
| JP5487666B2 (ja) | 内水相を固定化することを特徴とするリポソームの製造方法 | |
| WO2011062255A1 (ja) | 混合有機溶媒を油相として用いる二段階乳化によるリポソームの製造方法 | |
| JP5838970B2 (ja) | 水溶性脂質を内水相に添加する二段階乳化法による単胞リポソームの製造方法およびその製造方法により得られる単胞リポソーム | |
| JP2012102043A (ja) | 単胞リポソームの製造方法、単胞リポソームの分散液とその乾燥粉末及びそれらの製造方法 | |
| JP5649074B2 (ja) | ナノサイズの一次乳化物を利用する二段階乳化によるリポソーム製造方法 | |
| Gopi et al. | Liposomes for functional foods and nutraceuticals: from research to application | |
| Manna | SIGNIFICANCE OF VIROSOMES ON TARGETED DRUG DELIVERY | |
| JP5904555B2 (ja) | リポソームの製造方法 | |
| Aragão et al. | Liposomes: Methods and Protocols | |
| WO2019010521A1 (en) | THIN FILM VORTEX FLUID MANUFACTURING OF LIPOSOMES | |
| GR20180100082A (el) | Μεθοδος για την παραγωγη οχηματων μεταφορας λιπιδιων |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20111206 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20111219 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4900536 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150113 Year of fee payment: 3 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| S533 | Written request for registration of change of name |
Free format text: JAPANESE INTERMEDIATE CODE: R313533 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| LAPS | Cancellation because of no payment of annual fees |