JP4789618B2 - 新規転写因子、その製法および用途 - Google Patents
新規転写因子、その製法および用途 Download PDFInfo
- Publication number
- JP4789618B2 JP4789618B2 JP2005502807A JP2005502807A JP4789618B2 JP 4789618 B2 JP4789618 B2 JP 4789618B2 JP 2005502807 A JP2005502807 A JP 2005502807A JP 2005502807 A JP2005502807 A JP 2005502807A JP 4789618 B2 JP4789618 B2 JP 4789618B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- substituted
- carbon atoms
- unsubstituted
- pharmaceutically acceptable
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 238000004519 manufacturing process Methods 0.000 title description 8
- 102000040945 Transcription factor Human genes 0.000 title 1
- 108091023040 Transcription factor Proteins 0.000 title 1
- -1 imino compound Chemical class 0.000 claims abstract description 91
- 150000001875 compounds Chemical class 0.000 claims abstract description 86
- SETVRSKZJJWOPA-FLDGXQSCSA-N ascochlorin Chemical compound C[C@@H]1CCC(=O)[C@H](C)[C@@]1(C)\C=C\C(\C)=C\CC1=C(O)C(Cl)=C(C)C(C=O)=C1O SETVRSKZJJWOPA-FLDGXQSCSA-N 0.000 claims abstract description 59
- SHZXWVNJUPKTJN-UHFFFAOYSA-N Ascochlorin Natural products CC1CCC(=O)C(C)C1C=CC(C)=CCC1=C(O)C(Cl)=C(C)C(C=O)=C1O SHZXWVNJUPKTJN-UHFFFAOYSA-N 0.000 claims abstract description 46
- 208000037976 chronic inflammation Diseases 0.000 claims abstract description 7
- 230000006020 chronic inflammation Effects 0.000 claims abstract description 7
- 230000001225 therapeutic effect Effects 0.000 claims abstract description 4
- 125000004432 carbon atom Chemical group C* 0.000 claims description 88
- 125000000217 alkyl group Chemical group 0.000 claims description 58
- 150000003839 salts Chemical class 0.000 claims description 57
- 230000003287 optical effect Effects 0.000 claims description 53
- 239000003814 drug Substances 0.000 claims description 31
- 125000002252 acyl group Chemical group 0.000 claims description 30
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 28
- 229910052739 hydrogen Inorganic materials 0.000 claims description 24
- 239000001257 hydrogen Substances 0.000 claims description 24
- 125000003277 amino group Chemical group 0.000 claims description 22
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 21
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 21
- 125000003118 aryl group Chemical group 0.000 claims description 19
- 239000004480 active ingredient Substances 0.000 claims description 18
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 17
- 238000001308 synthesis method Methods 0.000 claims description 17
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 15
- 125000003342 alkenyl group Chemical group 0.000 claims description 15
- 125000000304 alkynyl group Chemical group 0.000 claims description 15
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 claims description 15
- 229940124597 therapeutic agent Drugs 0.000 claims description 13
- VGYPZLGWVQQOST-UHFFFAOYSA-N Ascofuranone Natural products OC=1C(Cl)=C(C)C(C=O)=C(O)C=1CC=C(C)CCC=C(C)C1CC(=O)C(C)(C)O1 VGYPZLGWVQQOST-UHFFFAOYSA-N 0.000 claims description 11
- 125000003172 aldehyde group Chemical group 0.000 claims description 11
- 150000001413 amino acids Chemical class 0.000 claims description 10
- VGYPZLGWVQQOST-JUERRSSISA-N ascofuranone Chemical compound OC=1C(Cl)=C(C)C(C=O)=C(O)C=1C\C=C(/C)CC\C=C(/C)[C@@H]1CC(=O)C(C)(C)O1 VGYPZLGWVQQOST-JUERRSSISA-N 0.000 claims description 10
- 210000004027 cell Anatomy 0.000 claims description 10
- 206010012601 diabetes mellitus Diseases 0.000 claims description 10
- 239000002207 metabolite Substances 0.000 claims description 10
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 9
- 206010020772 Hypertension Diseases 0.000 claims description 8
- 229910052799 carbon Inorganic materials 0.000 claims description 7
- 208000011580 syndromic disease Diseases 0.000 claims description 7
- 239000000654 additive Substances 0.000 claims description 6
- 230000001172 regenerating effect Effects 0.000 claims description 6
- 208000037803 restenosis Diseases 0.000 claims description 6
- 206010003210 Arteriosclerosis Diseases 0.000 claims description 5
- 206010028665 Myxoedema Diseases 0.000 claims description 5
- 208000011775 arteriosclerosis disease Diseases 0.000 claims description 5
- 208000003786 myxedema Diseases 0.000 claims description 5
- 125000004084 sesquiterpene group Chemical group 0.000 claims description 5
- 210000000130 stem cell Anatomy 0.000 claims description 5
- 241000233866 Fungi Species 0.000 claims description 4
- 150000001721 carbon Chemical class 0.000 claims description 4
- 239000003795 chemical substances by application Substances 0.000 claims description 4
- 239000003529 anticholesteremic agent Substances 0.000 claims description 3
- 229940127226 anticholesterol agent Drugs 0.000 claims description 3
- 239000003085 diluting agent Substances 0.000 claims description 3
- 239000003937 drug carrier Substances 0.000 claims description 3
- 230000003449 preventive effect Effects 0.000 claims description 3
- 230000000069 prophylactic effect Effects 0.000 claims description 3
- 230000000996 additive effect Effects 0.000 claims description 2
- 229940121363 anti-inflammatory agent Drugs 0.000 claims description 2
- 239000002260 anti-inflammatory agent Substances 0.000 claims description 2
- 230000000694 effects Effects 0.000 abstract description 13
- 201000010099 disease Diseases 0.000 abstract description 7
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 abstract description 7
- 102000003728 Peroxisome Proliferator-Activated Receptors Human genes 0.000 abstract description 4
- 108090000029 Peroxisome Proliferator-Activated Receptors Proteins 0.000 abstract description 4
- 239000003446 ligand Substances 0.000 abstract description 4
- 102000006255 nuclear receptors Human genes 0.000 abstract description 4
- 108020004017 nuclear receptors Proteins 0.000 abstract description 4
- 239000003054 catalyst Substances 0.000 abstract description 3
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 abstract description 3
- 206010028980 Neoplasm Diseases 0.000 abstract description 2
- 102100038637 Cytochrome P450 7A1 Human genes 0.000 abstract 1
- 101000957672 Homo sapiens Cytochrome P450 7A1 Proteins 0.000 abstract 1
- 102000016978 Orphan receptors Human genes 0.000 abstract 1
- 108070000031 Orphan receptors Proteins 0.000 abstract 1
- 102000007451 Steroid Receptors Human genes 0.000 abstract 1
- 108010085012 Steroid Receptors Proteins 0.000 abstract 1
- 230000003213 activating effect Effects 0.000 abstract 1
- 230000001737 promoting effect Effects 0.000 abstract 1
- 150000004492 retinoid derivatives Chemical class 0.000 abstract 1
- 230000035897 transcription Effects 0.000 abstract 1
- 238000013518 transcription Methods 0.000 abstract 1
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 48
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 48
- 150000002148 esters Chemical class 0.000 description 37
- 238000006243 chemical reaction Methods 0.000 description 30
- 239000002262 Schiff base Substances 0.000 description 27
- 150000004753 Schiff bases Chemical class 0.000 description 26
- GLOBOHBQKQLVIS-UHFFFAOYSA-N 2-(3-methylbut-2-enyl)phenol Chemical compound CC(C)=CCC1=CC=CC=C1O GLOBOHBQKQLVIS-UHFFFAOYSA-N 0.000 description 21
- 238000000034 method Methods 0.000 description 20
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 18
- 239000000843 powder Substances 0.000 description 17
- 239000000243 solution Substances 0.000 description 17
- 238000004809 thin layer chromatography Methods 0.000 description 15
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 14
- 230000015572 biosynthetic process Effects 0.000 description 13
- 239000002904 solvent Substances 0.000 description 13
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 13
- 150000001299 aldehydes Chemical class 0.000 description 12
- 125000003545 alkoxy group Chemical group 0.000 description 12
- 229940125782 compound 2 Drugs 0.000 description 12
- BEBCJVAWIBVWNZ-UHFFFAOYSA-N glycinamide Chemical compound NCC(N)=O BEBCJVAWIBVWNZ-UHFFFAOYSA-N 0.000 description 12
- 235000018102 proteins Nutrition 0.000 description 12
- 108090000623 proteins and genes Proteins 0.000 description 12
- 102000004169 proteins and genes Human genes 0.000 description 12
- 125000005196 alkyl carbonyloxy group Chemical group 0.000 description 11
- 230000002829 reductive effect Effects 0.000 description 11
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 10
- 239000004472 Lysine Substances 0.000 description 10
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 10
- 229940125904 compound 1 Drugs 0.000 description 10
- 229940079593 drug Drugs 0.000 description 10
- 239000000126 substance Substances 0.000 description 10
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 9
- 241000699670 Mus sp. Species 0.000 description 9
- 239000000203 mixture Substances 0.000 description 9
- 239000003242 anti bacterial agent Substances 0.000 description 8
- 229940088710 antibiotic agent Drugs 0.000 description 8
- 238000010898 silica gel chromatography Methods 0.000 description 8
- 238000003786 synthesis reaction Methods 0.000 description 8
- 241001465754 Metazoa Species 0.000 description 7
- 235000001014 amino acid Nutrition 0.000 description 7
- 229940024606 amino acid Drugs 0.000 description 7
- 230000008034 disappearance Effects 0.000 description 7
- 125000001424 substituent group Chemical group 0.000 description 7
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 7
- YRRAKQFQGINEPT-KPKJWKMQSA-N 2-[2-chloro-4-formyl-5-hydroxy-3-methyl-6-[(2e,4e)-3-methyl-5-[(1r,2r,6r)-1,2,6-trimethyl-3-oxocyclohexyl]penta-2,4-dienyl]phenoxy]acetic acid Chemical compound C[C@@H]1CCC(=O)[C@H](C)[C@@]1(C)\C=C\C(\C)=C\CC1=C(O)C(C=O)=C(C)C(Cl)=C1OCC(O)=O YRRAKQFQGINEPT-KPKJWKMQSA-N 0.000 description 6
- XUAAAHFMBMDZCQ-UMXIGZEWSA-N 5-chloro-2-hydroxy-4-methoxy-6-methyl-3-[(2e,4e)-3-methyl-5-[(1r,2r,6r)-1,2,6-trimethyl-3-oxocyclohexyl]penta-2,4-dienyl]benzaldehyde Chemical compound COC1=C(Cl)C(C)=C(C=O)C(O)=C1C\C=C(/C)\C=C\[C@]1(C)[C@@H](C)C(=O)CC[C@H]1C XUAAAHFMBMDZCQ-UMXIGZEWSA-N 0.000 description 6
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 6
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 6
- 238000010521 absorption reaction Methods 0.000 description 6
- 230000009471 action Effects 0.000 description 6
- 125000005843 halogen group Chemical group 0.000 description 6
- 125000001841 imino group Chemical group [H]N=* 0.000 description 6
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 6
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 6
- 239000000741 silica gel Substances 0.000 description 6
- 229910002027 silica gel Inorganic materials 0.000 description 6
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 5
- 238000005481 NMR spectroscopy Methods 0.000 description 5
- 241000700159 Rattus Species 0.000 description 5
- 210000004369 blood Anatomy 0.000 description 5
- 239000008280 blood Substances 0.000 description 5
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 5
- 210000000813 small intestine Anatomy 0.000 description 5
- 210000001519 tissue Anatomy 0.000 description 5
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 4
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 description 4
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 4
- 241000699666 Mus <mouse, genus> Species 0.000 description 4
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 4
- 241000283984 Rodentia Species 0.000 description 4
- 125000003668 acetyloxy group Chemical group [H]C([H])([H])C(=O)O[*] 0.000 description 4
- 239000002253 acid Substances 0.000 description 4
- RSDOASZYYCOXIB-UHFFFAOYSA-N beta-alaninamide Chemical compound NCCC(N)=O RSDOASZYYCOXIB-UHFFFAOYSA-N 0.000 description 4
- 125000006297 carbonyl amino group Chemical group [H]N([*:2])C([*:1])=O 0.000 description 4
- 239000007810 chemical reaction solvent Substances 0.000 description 4
- 238000000921 elemental analysis Methods 0.000 description 4
- 238000005755 formation reaction Methods 0.000 description 4
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 4
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 4
- 239000000546 pharmaceutical excipient Substances 0.000 description 4
- 230000002265 prevention Effects 0.000 description 4
- 230000008569 process Effects 0.000 description 4
- 210000002966 serum Anatomy 0.000 description 4
- 230000002194 synthesizing effect Effects 0.000 description 4
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 description 3
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 3
- OBSIQMZKFXFYLV-QMMMGPOBSA-N L-phenylalanine amide Chemical compound NC(=O)[C@@H](N)CC1=CC=CC=C1 OBSIQMZKFXFYLV-QMMMGPOBSA-N 0.000 description 3
- 102000007562 Serum Albumin Human genes 0.000 description 3
- 108010071390 Serum Albumin Proteins 0.000 description 3
- 229920002472 Starch Polymers 0.000 description 3
- 150000001241 acetals Chemical class 0.000 description 3
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 3
- 150000003862 amino acid derivatives Chemical class 0.000 description 3
- 239000002585 base Substances 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 235000008504 concentrate Nutrition 0.000 description 3
- 239000012141 concentrate Substances 0.000 description 3
- 239000002552 dosage form Substances 0.000 description 3
- 239000003112 inhibitor Substances 0.000 description 3
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 3
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 3
- 230000000813 microbial effect Effects 0.000 description 3
- 239000003960 organic solvent Substances 0.000 description 3
- 230000000144 pharmacologic effect Effects 0.000 description 3
- 239000006187 pill Substances 0.000 description 3
- 150000003141 primary amines Chemical class 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 239000002994 raw material Substances 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 239000008107 starch Substances 0.000 description 3
- 235000019698 starch Nutrition 0.000 description 3
- 238000003756 stirring Methods 0.000 description 3
- 231100000419 toxicity Toxicity 0.000 description 3
- 230000001988 toxicity Effects 0.000 description 3
- 210000002700 urine Anatomy 0.000 description 3
- ONBQEOIKXPHGMB-VBSBHUPXSA-N 1-[2-[(2s,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]oxy-4,6-dihydroxyphenyl]-3-(4-hydroxyphenyl)propan-1-one Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1OC1=CC(O)=CC(O)=C1C(=O)CCC1=CC=C(O)C=C1 ONBQEOIKXPHGMB-VBSBHUPXSA-N 0.000 description 2
- ZLAQYJKDQSZARB-FLDGXQSCSA-N 5-chloro-2,4-dihydroxy-6-methyl-3-[(2e,4e)-3-methyl-5-[(1s,2r,6r)-1,2,6-trimethyl-5-oxocyclohex-3-en-1-yl]penta-2,4-dienyl]benzaldehyde Chemical compound C[C@@H]1C=CC(=O)[C@H](C)[C@@]1(C)\C=C\C(\C)=C\CC1=C(O)C(Cl)=C(C)C(C=O)=C1O ZLAQYJKDQSZARB-FLDGXQSCSA-N 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 125000005915 C6-C14 aryl group Chemical group 0.000 description 2
- 0 CC(*)=CCc1c(*)c(Cl)c(C)c(C=*)c1* Chemical compound CC(*)=CCc1c(*)c(Cl)c(C)c(C=*)c1* 0.000 description 2
- ZLAQYJKDQSZARB-UHFFFAOYSA-N Cylindrochlorin Natural products CC1C=CC(=O)C(C)C1(C)C=CC(C)=CCC1=C(O)C(Cl)=C(C)C(C=O)=C1O ZLAQYJKDQSZARB-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- 229920000084 Gum arabic Polymers 0.000 description 2
- 208000035150 Hypercholesterolemia Diseases 0.000 description 2
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- 108020005497 Nuclear hormone receptor Proteins 0.000 description 2
- 102000015636 Oligopeptides Human genes 0.000 description 2
- 108010038807 Oligopeptides Proteins 0.000 description 2
- 102000035195 Peptidases Human genes 0.000 description 2
- 108091005804 Peptidases Proteins 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 102000034527 Retinoid X Receptors Human genes 0.000 description 2
- 108010038912 Retinoid X Receptors Proteins 0.000 description 2
- 241000978776 Senegalia senegal Species 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 2
- 238000000862 absorption spectrum Methods 0.000 description 2
- 235000010489 acacia gum Nutrition 0.000 description 2
- 239000000205 acacia gum Substances 0.000 description 2
- DHKHKXVYLBGOIT-UHFFFAOYSA-N acetaldehyde Diethyl Acetal Natural products CCOC(C)OCC DHKHKXVYLBGOIT-UHFFFAOYSA-N 0.000 description 2
- 235000011054 acetic acid Nutrition 0.000 description 2
- 125000003282 alkyl amino group Chemical group 0.000 description 2
- 230000036528 appetite Effects 0.000 description 2
- 235000019789 appetite Nutrition 0.000 description 2
- 150000003934 aromatic aldehydes Chemical group 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- UCMIRNVEIXFBKS-UHFFFAOYSA-N beta-alanine Chemical compound NCCC(O)=O UCMIRNVEIXFBKS-UHFFFAOYSA-N 0.000 description 2
- 244000309464 bull Species 0.000 description 2
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical class O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 2
- 201000011510 cancer Diseases 0.000 description 2
- 230000000711 cancerogenic effect Effects 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 235000014633 carbohydrates Nutrition 0.000 description 2
- 231100000315 carcinogenic Toxicity 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- 235000010980 cellulose Nutrition 0.000 description 2
- 239000012295 chemical reaction liquid Substances 0.000 description 2
- 229940126142 compound 16 Drugs 0.000 description 2
- 238000009833 condensation Methods 0.000 description 2
- 230000005494 condensation Effects 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- 238000004090 dissolution Methods 0.000 description 2
- 239000003651 drinking water Substances 0.000 description 2
- 235000020188 drinking water Nutrition 0.000 description 2
- 125000004494 ethyl ester group Chemical group 0.000 description 2
- 230000029142 excretion Effects 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 230000006126 farnesylation Effects 0.000 description 2
- 235000013305 food Nutrition 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- BTCSSZJGUNDROE-UHFFFAOYSA-N gamma-aminobutyric acid Chemical compound NCCCC(O)=O BTCSSZJGUNDROE-UHFFFAOYSA-N 0.000 description 2
- 210000001035 gastrointestinal tract Anatomy 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 150000002431 hydrogen Chemical class 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 235000019359 magnesium stearate Nutrition 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 230000007721 medicinal effect Effects 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- 125000001434 methanylylidene group Chemical group [H]C#[*] 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 125000000896 monocarboxylic acid group Chemical group 0.000 description 2
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 239000008188 pellet Substances 0.000 description 2
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 2
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 2
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 2
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 2
- 229910000027 potassium carbonate Inorganic materials 0.000 description 2
- 229940024999 proteolytic enzymes for treatment of wounds and ulcers Drugs 0.000 description 2
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 2
- 230000009257 reactivity Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- SMQUZDBALVYZAC-UHFFFAOYSA-N salicylaldehyde Chemical compound OC1=CC=CC=C1C=O SMQUZDBALVYZAC-UHFFFAOYSA-N 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 230000002459 sustained effect Effects 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 2
- OGNSCSPNOLGXSM-UHFFFAOYSA-N (+/-)-DABA Natural products NCCC(N)C(O)=O OGNSCSPNOLGXSM-UHFFFAOYSA-N 0.000 description 1
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 1
- JNYAEWCLZODPBN-JGWLITMVSA-N (2r,3r,4s)-2-[(1r)-1,2-dihydroxyethyl]oxolane-3,4-diol Chemical compound OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O JNYAEWCLZODPBN-JGWLITMVSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- MNCMBBIFTVWHIP-UHFFFAOYSA-N 1-anthracen-9-yl-2,2,2-trifluoroethanone Chemical group C1=CC=C2C(C(=O)C(F)(F)F)=C(C=CC=C3)C3=CC2=C1 MNCMBBIFTVWHIP-UHFFFAOYSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- 125000001637 1-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C(*)=C([H])C([H])=C([H])C2=C1[H] 0.000 description 1
- ZESRJSPZRDMNHY-YFWFAHHUSA-N 11-deoxycorticosterone Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 ZESRJSPZRDMNHY-YFWFAHHUSA-N 0.000 description 1
- 125000004974 2-butenyl group Chemical group C(C=CC)* 0.000 description 1
- 125000000069 2-butynyl group Chemical group [H]C([H])([H])C#CC([H])([H])* 0.000 description 1
- 125000006040 2-hexenyl group Chemical group 0.000 description 1
- 125000001622 2-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C(*)C([H])=C([H])C2=C1[H] 0.000 description 1
- 125000006024 2-pentenyl group Chemical group 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- 125000001494 2-propynyl group Chemical group [H]C#CC([H])([H])* 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- 125000004975 3-butenyl group Chemical group C(CC=C)* 0.000 description 1
- 125000000474 3-butynyl group Chemical group [H]C#CC([H])([H])C([H])([H])* 0.000 description 1
- 125000006041 3-hexenyl group Chemical group 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 102000014654 Aromatase Human genes 0.000 description 1
- 108010078554 Aromatase Proteins 0.000 description 1
- 229940122815 Aromatase inhibitor Drugs 0.000 description 1
- 206010003211 Arteriosclerosis coronary artery Diseases 0.000 description 1
- 241000708553 Ascochyta viciae Species 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- UTEKFENAKWJHHK-UHFFFAOYSA-N C(=CC=CC)C1(CC(=C(C=O)C(=C1Cl)C)O)O Chemical compound C(=CC=CC)C1(CC(=C(C=O)C(=C1Cl)C)O)O UTEKFENAKWJHHK-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 241000725101 Clea Species 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- XUIIKFGFIJCVMT-GFCCVEGCSA-N D-thyroxine Chemical compound IC1=CC(C[C@@H](N)C(O)=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-GFCCVEGCSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 102000015781 Dietary Proteins Human genes 0.000 description 1
- 108010010256 Dietary Proteins Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- 241000223218 Fusarium Species 0.000 description 1
- 241001149959 Fusarium sp. Species 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- LCWXJXMHJVIJFK-UHFFFAOYSA-N Hydroxylysine Natural products NCC(O)CC(N)CC(O)=O LCWXJXMHJVIJFK-UHFFFAOYSA-N 0.000 description 1
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 1
- 238000004566 IR spectroscopy Methods 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 206010022489 Insulin Resistance Diseases 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- WTDRDQBEARUVNC-LURJTMIESA-N L-DOPA Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-LURJTMIESA-N 0.000 description 1
- WTDRDQBEARUVNC-UHFFFAOYSA-N L-Dopa Natural products OC(=O)C(N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-UHFFFAOYSA-N 0.000 description 1
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- LEVWYRKDKASIDU-IMJSIDKUSA-N L-cystine Chemical compound [O-]C(=O)[C@@H]([NH3+])CSSC[C@H]([NH3+])C([O-])=O LEVWYRKDKASIDU-IMJSIDKUSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- FFFHZYDWPBMWHY-VKHMYHEASA-N L-homocysteine Chemical compound OC(=O)[C@@H](N)CCS FFFHZYDWPBMWHY-VKHMYHEASA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 108091005461 Nucleic proteins Proteins 0.000 description 1
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 1
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 1
- 229920002701 Polyoxyl 40 Stearate Polymers 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- 208000001647 Renal Insufficiency Diseases 0.000 description 1
- 208000034189 Sclerosis Diseases 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 241000223892 Tetrahymena Species 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- AUYYCJSJGJYCDS-LBPRGKRZSA-N Thyrolar Chemical compound IC1=CC(C[C@H](N)C(O)=O)=CC(I)=C1OC1=CC=C(O)C(I)=C1 AUYYCJSJGJYCDS-LBPRGKRZSA-N 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 1
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 238000002441 X-ray diffraction Methods 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 125000004442 acylamino group Chemical group 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 125000005907 alkyl ester group Chemical group 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 125000002078 anthracen-1-yl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C3C([*])=C([H])C([H])=C([H])C3=C([H])C2=C1[H] 0.000 description 1
- 125000000748 anthracen-2-yl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C3C([H])=C([*])C([H])=C([H])C3=C([H])C2=C1[H] 0.000 description 1
- 230000001093 anti-cancer Effects 0.000 description 1
- 230000003110 anti-inflammatory effect Effects 0.000 description 1
- 230000000840 anti-viral effect Effects 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 239000003886 aromatase inhibitor Substances 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- 125000003289 ascorbyl group Chemical group [H]O[C@@]([H])(C([H])([H])O*)[C@@]1([H])OC(=O)C(O*)=C1O* 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 239000000440 bentonite Substances 0.000 description 1
- 229910000278 bentonite Inorganic materials 0.000 description 1
- 235000012216 bentonite Nutrition 0.000 description 1
- SVPXDRXYRYOSEX-UHFFFAOYSA-N bentoquatam Chemical compound O.O=[Si]=O.O=[Al]O[Al]=O SVPXDRXYRYOSEX-UHFFFAOYSA-N 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 229940000635 beta-alanine Drugs 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 239000003613 bile acid Substances 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 208000026106 cerebrovascular disease Diseases 0.000 description 1
- 238000001311 chemical methods and process Methods 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- SURLGNKAQXKNSP-DBLYXWCISA-N chlorin Chemical compound C\1=C/2\N/C(=C\C3=N/C(=C\C=4NC(/C=C\5/C=CC/1=N/5)=CC=4)/C=C3)/CC\2 SURLGNKAQXKNSP-DBLYXWCISA-N 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 210000004351 coronary vessel Anatomy 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000002243 cyclohexanonyl group Chemical group *C1(*)C(=O)C(*)(*)C(*)(*)C(*)(*)C1(*)* 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 229960003067 cystine Drugs 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- ZESRJSPZRDMNHY-UHFFFAOYSA-N de-oxy corticosterone Natural products O=C1CCC2(C)C3CCC(C)(C(CC4)C(=O)CO)C4C3CCC2=C1 ZESRJSPZRDMNHY-UHFFFAOYSA-N 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- YSMODUONRAFBET-UHFFFAOYSA-N delta-DL-hydroxylysine Natural products NCC(O)CCC(N)C(O)=O YSMODUONRAFBET-UHFFFAOYSA-N 0.000 description 1
- 229940119740 deoxycorticosterone Drugs 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 235000021245 dietary protein Nutrition 0.000 description 1
- 125000001664 diethylamino group Chemical group [H]C([H])([H])C([H])([H])N(*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 230000000857 drug effect Effects 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 238000006911 enzymatic reaction Methods 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- YSMODUONRAFBET-UHNVWZDZSA-N erythro-5-hydroxy-L-lysine Chemical compound NC[C@H](O)CC[C@H](N)C(O)=O YSMODUONRAFBET-UHNVWZDZSA-N 0.000 description 1
- NTNZTEQNFHNYBC-UHFFFAOYSA-N ethyl 2-aminoacetate Chemical compound CCOC(=O)CN NTNZTEQNFHNYBC-UHFFFAOYSA-N 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 230000005713 exacerbation Effects 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 235000011087 fumaric acid Nutrition 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 229960003692 gamma aminobutyric acid Drugs 0.000 description 1
- 239000003349 gelling agent Substances 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 235000004554 glutamine Nutrition 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- QJHBJHUKURJDLG-UHFFFAOYSA-N hydroxy-L-lysine Natural products NCCCCC(NO)C(O)=O QJHBJHUKURJDLG-UHFFFAOYSA-N 0.000 description 1
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 1
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 1
- 238000007654 immersion Methods 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 210000001596 intra-abdominal fat Anatomy 0.000 description 1
- 125000002346 iodo group Chemical group I* 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- 235000014705 isoleucine Nutrition 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 201000006370 kidney failure Diseases 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 235000005772 leucine Nutrition 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 235000014666 liquid concentrate Nutrition 0.000 description 1
- 239000008297 liquid dosage form Substances 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 239000008176 lyophilized powder Substances 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- ZLNQQNXFFQJAID-UHFFFAOYSA-L magnesium carbonate Chemical compound [Mg+2].[O-]C([O-])=O ZLNQQNXFFQJAID-UHFFFAOYSA-L 0.000 description 1
- 239000001095 magnesium carbonate Substances 0.000 description 1
- 229910000021 magnesium carbonate Inorganic materials 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 125000005394 methallyl group Chemical group 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 150000004702 methyl esters Chemical class 0.000 description 1
- 230000011987 methylation Effects 0.000 description 1
- 238000007069 methylation reaction Methods 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 239000002395 mineralocorticoid Substances 0.000 description 1
- 125000002950 monocyclic group Chemical group 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 229960003104 ornithine Drugs 0.000 description 1
- AICOOMRHRUFYCM-ZRRPKQBOSA-N oxazine, 1 Chemical compound C([C@@H]1[C@H](C(C[C@]2(C)[C@@H]([C@H](C)N(C)C)[C@H](O)C[C@]21C)=O)CC1=CC2)C[C@H]1[C@@]1(C)[C@H]2N=C(C(C)C)OC1 AICOOMRHRUFYCM-ZRRPKQBOSA-N 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000002688 persistence Effects 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N phenol group Chemical group C1(=CC=CC=C1)O ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 229920005668 polycarbonate resin Polymers 0.000 description 1
- 239000004431 polycarbonate resin Substances 0.000 description 1
- 125000003367 polycyclic group Chemical group 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 229940099429 polyoxyl 40 stearate Drugs 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 238000009790 rate-determining step (RDS) Methods 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 229930002330 retinoic acid Natural products 0.000 description 1
- 102000003702 retinoic acid receptors Human genes 0.000 description 1
- 108090000064 retinoic acid receptors Proteins 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 238000005070 sampling Methods 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 230000002784 sclerotic effect Effects 0.000 description 1
- 235000004400 serine Nutrition 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 229940100515 sorbitan Drugs 0.000 description 1
- 235000000891 standard diet Nutrition 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 125000003107 substituted aryl group Chemical group 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 150000003505 terpenes Chemical group 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 229940126585 therapeutic drug Drugs 0.000 description 1
- 235000008521 threonine Nutrition 0.000 description 1
- 230000006016 thyroid dysfunction Effects 0.000 description 1
- 229940034208 thyroxine Drugs 0.000 description 1
- XUIIKFGFIJCVMT-UHFFFAOYSA-N thyroxine-binding globulin Natural products IC1=CC(CC([NH3+])C([O-])=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-UHFFFAOYSA-N 0.000 description 1
- 230000036962 time dependent Effects 0.000 description 1
- 125000003944 tolyl group Chemical group 0.000 description 1
- 238000006257 total synthesis reaction Methods 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 125000004951 trihalomethoxy group Chemical group 0.000 description 1
- 229940035722 triiodothyronine Drugs 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 230000002485 urinary effect Effects 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 235000014393 valine Nutrition 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 230000004584 weight gain Effects 0.000 description 1
- 235000019786 weight gain Nutrition 0.000 description 1
- 125000005023 xylyl group Chemical group 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/02—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings
- C07D307/26—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member
- C07D307/30—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D307/32—Oxygen atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/10—Antioedematous agents; Diuretics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C403/00—Derivatives of cyclohexane or of a cyclohexene or of cyclohexadiene, having a side-chain containing an acyclic unsaturated part of at least four carbon atoms, this part being directly attached to the cyclohexane or cyclohexene or cyclohexadiene rings, e.g. vitamin A, beta-carotene, beta-ionone
- C07C403/06—Derivatives of cyclohexane or of a cyclohexene or of cyclohexadiene, having a side-chain containing an acyclic unsaturated part of at least four carbon atoms, this part being directly attached to the cyclohexane or cyclohexene or cyclohexadiene rings, e.g. vitamin A, beta-carotene, beta-ionone having side-chains substituted by singly-bound oxygen atoms
- C07C403/10—Derivatives of cyclohexane or of a cyclohexene or of cyclohexadiene, having a side-chain containing an acyclic unsaturated part of at least four carbon atoms, this part being directly attached to the cyclohexane or cyclohexene or cyclohexadiene rings, e.g. vitamin A, beta-carotene, beta-ionone having side-chains substituted by singly-bound oxygen atoms by etherified hydroxy groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C403/00—Derivatives of cyclohexane or of a cyclohexene or of cyclohexadiene, having a side-chain containing an acyclic unsaturated part of at least four carbon atoms, this part being directly attached to the cyclohexane or cyclohexene or cyclohexadiene rings, e.g. vitamin A, beta-carotene, beta-ionone
- C07C403/06—Derivatives of cyclohexane or of a cyclohexene or of cyclohexadiene, having a side-chain containing an acyclic unsaturated part of at least four carbon atoms, this part being directly attached to the cyclohexane or cyclohexene or cyclohexadiene rings, e.g. vitamin A, beta-carotene, beta-ionone having side-chains substituted by singly-bound oxygen atoms
- C07C403/12—Derivatives of cyclohexane or of a cyclohexene or of cyclohexadiene, having a side-chain containing an acyclic unsaturated part of at least four carbon atoms, this part being directly attached to the cyclohexane or cyclohexene or cyclohexadiene rings, e.g. vitamin A, beta-carotene, beta-ionone having side-chains substituted by singly-bound oxygen atoms by esterified hydroxy groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C403/00—Derivatives of cyclohexane or of a cyclohexene or of cyclohexadiene, having a side-chain containing an acyclic unsaturated part of at least four carbon atoms, this part being directly attached to the cyclohexane or cyclohexene or cyclohexadiene rings, e.g. vitamin A, beta-carotene, beta-ionone
- C07C403/14—Derivatives of cyclohexane or of a cyclohexene or of cyclohexadiene, having a side-chain containing an acyclic unsaturated part of at least four carbon atoms, this part being directly attached to the cyclohexane or cyclohexene or cyclohexadiene rings, e.g. vitamin A, beta-carotene, beta-ionone having side-chains substituted by doubly-bound oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C403/00—Derivatives of cyclohexane or of a cyclohexene or of cyclohexadiene, having a side-chain containing an acyclic unsaturated part of at least four carbon atoms, this part being directly attached to the cyclohexane or cyclohexene or cyclohexadiene rings, e.g. vitamin A, beta-carotene, beta-ionone
- C07C403/18—Derivatives of cyclohexane or of a cyclohexene or of cyclohexadiene, having a side-chain containing an acyclic unsaturated part of at least four carbon atoms, this part being directly attached to the cyclohexane or cyclohexene or cyclohexadiene rings, e.g. vitamin A, beta-carotene, beta-ionone having side-chains substituted by nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/12—Systems containing only non-condensed rings with a six-membered ring
- C07C2601/14—The ring being saturated
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Vascular Medicine (AREA)
- Urology & Nephrology (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Emergency Medicine (AREA)
- Endocrinology (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Description
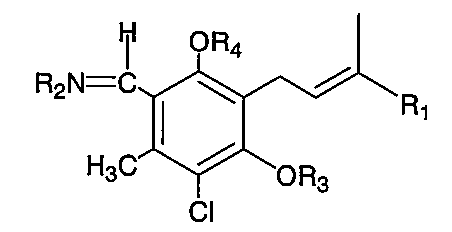
R1は、下記の2つの基、すなわち、
R3は、水素原子、置換若しくは非置換の炭素数1〜6のアルキル基、置換若しくは非置換の炭素数2〜6のアルケニル基、置換若しくは非置換の炭素数2〜6のアルキニル基、置換若しくは非置換の炭素数3〜8のシクロアルキル基、アシル基、アリール基、またはカルボキシル基を表し、
R4は、水素原子、置換若しくは非置換の炭素数1〜6のアルキル基、置換若しくは非置換の炭素数2〜6のアルケニル基、置換若しくは非置換の炭素数2〜6のアルキニル基、置換若しくは非置換の炭素数3〜8のシクロアルキル基、アシル基、アリール基、またはカルボキシル基を表す。)
で表される全置換芳香族アルデヒド化合物であり3位にセスキテルペン側鎖をもつ糸状菌の代謝産物またはその誘導体のアルデヒド基と下記式
R2NH2
(式中、R2は、−(CH2)n−CHR5R6(式中、R5は水素原子、アミノ基、1個または2個の炭素数1〜6のアルキル基により置換されたアミノ基、またはフェニルで置換された炭素数1〜6のアルキル基を表し、R6は、カルボキシル基、−CONH2、または−COOR7(式中、R7は、置換若しくは非置換の炭素数1〜6のアルキル基を表す)を表し、nは0または1〜6の整数を表す。)または任意のアミノ酸からNH2を除いた残基を表す。)
で表されるアミノ化合物のアミノ基とを反応させることにより生成する下記式
で表される新規イミノ化合物の合成法を提供する。
R1は、下記の2つの基、すなわち、
R2は、−(CH2)n−CHR5R6(式中、R5は水素原子、アミノ基、1個または2個の炭素数1〜6のアルキル基により置換されたアミノ基、またはフェニルで置換された炭素数1〜6のアルキル基を表し、R6は、カルボキシル基、−CONH2、または−COOR7(式中、R7は、置換若しくは非置換の炭素数1〜6のアルキル基を表す)を表し、nは0または1〜6の整数を表す。)または任意のアミノ酸からNH2を除いた残基を表し、
R3は、水素原子、置換若しくは非置換の炭素数1〜6のアルキル基、置換若しくは非置換の炭素数2〜6のアルケニル基、置換若しくは非置換の炭素数2〜6のアルキニル基、置換若しくは非置換の炭素数3〜8のシクロアルキル基、アシル基、アリール基、またはカルボキシル基を表し、
R4は、水素原子、置換若しくは非置換の炭素数1〜6のアルキル基、置換若しくは非置換の炭素数2〜6のアルケニル基、置換若しくは非置換の炭素数2〜6のアルキニル基、置換若しくは非置換の炭素数3〜8のシクロアルキル基、アシル基、アリール基、またはカルボキシル基を表す。)
で表される化合物またはその医薬上許容される塩若しくはエステルまたはそれらの光学異性体。
R1は、下記の2つの基、すなわち、
R2は、−(CH2)n−CHR5R6(式中、R5は水素原子、アミノ基、1個または2個の炭素数1〜6のアルキル基により置換されたアミノ基、またはフェニルで置換された炭素数1〜6のアルキル基を表し、R6は、カルボキシル基、−CONH2、または−COOR7(式中、R7は、置換若しくは非置換の炭素数1〜6のアルキル基を表す)を表し、nは0または1〜6の整数を表す。)または任意のアミノ酸からNH2を除いた残基を表し、
R3は、水素原子、置換若しくは非置換の炭素数1〜6のアルキル基、置換若しくは非置換の炭素数2〜6のアルケニル基、置換若しくは非置換の炭素数2〜6のアルキニル基、置換若しくは非置換の炭素数3〜8のシクロアルキル基、アシル基、アリール基、またはカルボキシル基を表し、
R4は、水素原子、置換若しくは非置換の炭素数1〜6のアルキル基、置換若しくは非置換の炭素数2〜6のアルケニル基、置換若しくは非置換の炭素数2〜6のアルキニル基、置換若しくは非置換の炭素数3〜8のシクロアルキル基、アシル基、アリール基、またはカルボキシル基を表す。)
で表される化合物またはその医薬上許容される塩若しくはエステルまたはそれらの光学異性体の1種若しくは2種以上、および医薬上許容される担体、希釈剤等の添加剤を含む医薬組成物。
R1は、下記の2つの基、すなわち、
R3は、水素原子、置換若しくは非置換の炭素数1〜6のアルキル基、置換若しくは非置換の炭素数2〜6のアルケニル基、置換若しくは非置換の炭素数2〜6のアルキニル基、置換若しくは非置換の炭素数3〜8のシクロアルキル基、アシル基、アリール基、またはカルボキシル基を表し、
R4は、水素原子、置換若しくは非置換の炭素数1〜6のアルキル基、置換若しくは非置換の炭素数2〜6のアルケニル基、置換若しくは非置換の炭素数2〜6のアルキニル基、置換若しくは非置換の炭素数3〜8のシクロアルキル基、アシル基、アリール基、またはカルボキシル基を表す。)
なお、ベンゼン環上の炭素原子の番号は、アルデヒド基と結合している炭素原子を1位とし、時計回りに2位、3位、・・・ 6位とする。
[反応式1]グリシンアミドとアスコクロリン誘導体との反応
1.原料のアスコクロリン類
アスコクリン誘導体の合成原料として、上に示したアスコクロリン(AC)、4−O−メチルアスコクロリン(MAC)、4−カルボキシメチルアスコクロリン(AS−6)およびアスコフラノン(AF)を使用した。
2.アセチルアスコクロリン類の合成
<合成>
アスコクロリン類(AC、MAC、AS−6、AF)を無水酢酸/ピリジンでアシル化後、酢酸エチル抽出、希塩酸と飽和重曹水洗浄、及び濃縮により、粗アセチルアスコクロリン類を得た。
上記アセチルアスコクロリン類のTLC(薄層クロマトグラフィー)、IR、NMRは後記の表にまとめて掲載した。
3.アセチルアスコクロリン類のシッフ塩基の合成
<合成>
原料のアスコクロリン類、またはアセチルアスコクロリン類と一級アミンを有するアミノ酸誘導体とを、トリエチルアミン、炭酸カリウム等の塩基の存在下または非存在下、メタノール、THF等の溶媒中で縮合した。
上記アセチルアスコクロリン類のTLC、IR、NMRは後記の表にまとめて掲載した。
4.アスコクロリン類のアセタールの合成
<合成>
2−O−アセチルアスコクロリン類とアルコールを、反応溶媒の存在下または非存在下、塩基触媒で縮合した。
各種アスコクロリン誘導体のRf値の確認、および純度確認のため、TLC分析を実施した。結果を以下に示す。
各種アスコクロリン誘導体の構造確認のため、IR測定を実施した。結果を以下に示す。
各種アスコクロリン誘導体の構造確認のため、IR測定を実施した。結果を以下に示す。
以下に、上記1〜4の製造および5〜7のデータに基づいて得られたアスコクロリン誘導体の構造式を示す。
実施例1:アスコクロリン誘導体を出発物質とするイミノ化合物の合成法
アスコクロリン及び誘導体(化合物−1&−2,アスコフラノン)と一級アミンを有するアミノ酸誘導体とを、トリエチルアミン、炭酸カリウム等の塩基の存在下または非存在下、メタノール、テトラハイドロフラン(THF)等の溶媒中で縮合した。
濃縮物をシリカゲルカラムクロマトにより精製し、イミノ化合物を単離した。
その他の留意事項は下記のとおりである。
(1)収率は、反応性により10%から定量的に至るまで大きく変動した。
(2)生成物は、いずれもアルデヒド基と反応して生成したイミノ化合物であった。
(3)4-位の水酸基が保護された化合物-1及び化合物-2は、反応性が良い。
(4)グリシンアミドは、すべてのアスコクロリン及び誘導体とイミノ化合物を形成した。
アスコクロリン(405 mg, 1mM)を10 mlのテトラハイドロフランに溶かし、液を室温で攪拌しながら5%のトリエチルアミンを含むメタノール5 mlにグリシンアミド(85 mg, 1.15 mM)を溶解した液を少しずつ加えた。加え終わったら室温で攪拌を続行し、反応の状況をシリカゲル薄層クロマトグラフィーによりモニターした。展開溶媒は、メタノール:クロロフォルム=5:95である。16時間後にアスコクロリンのスポットが消失し、黄色を呈するアスコクロリンとグリシンアミドとのシッフ塩基(Rf: 0.57)のスポットのみとなったので反応液を減圧濃縮して乾固した。乾固した黄色無定形の粉末を少量のメタノールに溶解し、シリカゲル・カラムクロマトグラフィー(溶媒:10%メタノール含有ジクロルメタン)によりシッフ塩基と不純物を分別した。黄色のシッフ塩基のみを含む溶出液を集め、減圧乾固して367 mgのアスコクロリンのアルデヒド基にグリシンアミドのアミノ基が反応して形成されたシッフ塩基を得た(収率80%)。
核磁気共鳴スペクトラム:アスコクロリンのアルデヒドプロトンの消失、アゾメチンプロトンの出現及びグリシンアミドのメチレン基に帰属するプロトンの出現で構造を確定した。これらの基に結合したプロトンのケミカルシフトは次のとおり。Ar-CH=N-; 8.63.-CH 2 CONH2; 4.38 (単位:ppm)、Ar-CH=N-のArはアルデヒドを除くアスコクロリン分子、-C=N-の-C=はグリシンアミドのアミノ基と結合したアスコクロリンのアルデヒド炭素を示す。
元素分析(C25H33O4N2Clとしての計算値):C 65.15、H 7.17, N 6.08, Cl 7.71
(実測値):C 65.08, H 7.20, N 6.05, Cl 7.82
実施例3
ジアセチルアスコクロリン(490 mg, 約1 mM)とβ-アラニンアミド(176 mg, 2 mM)を50 mlのテトラハイドロフランに溶解し、溶液を1時間煮沸環流した。1時間後にシリカゲル薄層クロマトグラフィー(展開溶媒:10%メタノール含有クロロフォルム)で調べると、アセチルアスコクロリンのスポットが消失し、黄色を呈するアセチルアスコクロリンとβアラニンアミドが結合したシッフ塩基のスポットのみになったので、反応液の温度を急速に室温まで下げ、生成物が乾固するまで減圧濃縮した。生成物は黄色無定形粉末である。この黄色粉末を少量のメタノールに溶かし、実施例1のようにシリカゲル・カラムクロマトグラフィーを行って、アセチルアスコクロリンのアルデヒド基がβアラニンアミドのアミノ基と結合したシッフ塩基507 mg(分子式C28H37O4N2Cl、分子量516.5)が黄色無定形粉末として得られた。収率:98%
赤外線吸収帯(cm-1):3425, 2972, 1776, 1674, 1628, 1423, 1371, 1200, 1095
核磁気共鳴スペクトラム:アスコクロリンのアルデヒドプロトンの消失、アゾメチンプロトンの出現及びグリシンアミドのメチレン基に帰属するプロトンの出現で構造を確定した。これらの基に結合したプロトンのケミカルシフトは次のとおり。Ar-CH=N-; 8.71.=N-CH 2 -CH 2 CONH2; 3.91、=N-CH2-CH 2 CONH2; 2.61、-O-COCH 3; 2.33 (単位:ppm)、Ar-CH=N-のArはアルデヒドを除くアスコクロリン分子、-C=N-の-C=はβ-アラニンアミドのアミノ基と結合したアスコクロリンのアルデヒド炭素を示す。
元素分析(C28H37O5N2Clとしての計算値):C 65.05、H 7.16, N 6.08, Cl 5.42
(実測値):C 64.98, H 7.22, N 6.05, Cl 5.72
4-O-メチルアスコクロリン(420 mg, 約1 mM)とL-フェニルアラニンアミド(200 mg, 1.22 mM)を20 mlのテトラハイドロフランに加温溶解し、溶解したのち30 mgのトリエチルアミンを加え、室温で攪拌して反応させた。反応の状況はメタノール:クロロフォルム混合液(1:9)を展開溶媒とするシリカゲル薄層クロマトグラフィーによりモニターした。16時間後に4-O-メチルアスコクロリンのスポットが消失し、黄色を呈するシッフ塩基(Rf: 0.36)のスポットのみとなったので反応液を減圧濃縮して乾固した。生成した黄色無定形の粉末を少量のメタノールに溶解し、シリカゲル・カラムクロマトグラフィー(溶媒:10%メタノール含有ジクロルメタン)によりシッフ塩基を精製した。黄色のシッフ塩基のみを含む溶出液を集め、減圧乾固して mgの4-O-メチルアスコクロリンのアルデヒド基にL-フェニルアラニンアミドのアミノ基が反応して形成されたシッフ塩基423 mgが得られた(収率75%)。
赤外線吸収帯(cm-1):3446, 2936, 1711, 1621, 1454, 1414, 1358, 1250, 1167, 1108, 1008, 970, 751, 698
核磁気共鳴スペクトラム:アスコクロリンのアルデヒドプロトンの消失、アゾメチンプロトンの出現及びフェニルアラニンアミドのメチン基及びフェニルアラニン芳香環に帰属するプロトンの出現で構造を確定した。これらの基に結合したプロトンのケミカルシフトは次のとおり。Ar-CH=N-; 8.63.PhH; 7.31, -CHCONH2; 4.10 (単位:ppm)、Ar-CH=N-のArはアルデヒドを除くアスコクロリン分子、-C=N-の-C=はグリシンアミドのアミノ基と結合したアスコクロリンのアルデヒド炭素を示す。
元素分析(C33H41O4N2Clとしての計算値):C 70.15、H 7.26, N 4.96, Cl 6.29
(実測値):C 70.28, H 7.19, N 5.05, Cl 6.33
4-O-カルボキシメチルアスコクロリン(463 mg, 約1 mM)とα-N-アセチル-L-リジン(300 mg, 約1.6 mM)を50 mlのメタノールに加温溶解し、さらに触媒として微粉末化した炭酸カリウム50 mgの存在下に室温で攪拌して反応させた。シリカゲル薄層クロマトグラフィーで反応状況をモニターしたところ、16時間後に原料である4-O-カルボキシメチルアスコクロリンのスポットが消失し、黄色を呈する反応生成物のスポットのみになった。直ちに反応液を減圧濃縮して溶媒を除去し、残留物を真空デシケーター中で乾固した。次ぎに生成した黄色無定形の粉末を少量のメタノールに溶解し、シリカゲル・カラムクロマトグラフィー(溶媒:20%メタノール含有ジクロルメタン)によりシッフ塩基を精製した。黄色のシッフ塩基のみを含む溶出液を集め減圧乾固し、4-O-カルボキシメチルアスコクロリンのアルデヒド基にα-N-アセチル-L-リジンの遊離アミノ基が反応して形成されたシッフ塩基278 mgが得られた(収率44%)。
核磁気共鳴スペクトラム:アスコクロリンのアルデヒドプロトンの消失、アゾメチンプロトンの出現及びα-N-アセチル-L-リジンのメチン、窒素に隣接するメチレン及びα-N-アセチル基のメチルに由来するプロトンの出現で構造を確定した。これらの基に結合したプロトンのケミカルシフトは次のとおり。Ar-CH=N-; 8.48.-CH(NHCOCH3)COOH; 4.30, =N-CH2-; 3.47, -NHCOCH3; 2.35 (単位:ppm)。
元素分析(C33H45O8N2Clとしての計算値):C 62.61、H 7.11, N 4.43, Cl 5.61
(実測値):C 62.88, H 7.14, N 4.37, Cl 5.80
1 gを約50 mlのアセトンに溶解した液を齧歯類動物の標準飼料(日本クレア(株)製、CE-2)1 kgに振りかけて充分混合した後、室内で風乾した。この飼料中における化合物-16の含量は約0.1%である。同様にして含量が0.05〜0.025%のペレット型固形飼料を調製し実験に使用した。対照飼料は同じ粉末飼料にアセトンを振りかけて成型ペレット化した。20頭の生後8週令雄性db/dbマウスをランダムに4群に分け、群ごとに採尿ケージに収容して、化合物-16含有ないし対照飼料を与え21日間飼育した。この間、飼料と飲料水は自由に摂取させ、表1に示す間隔で尿を採取し排泄された尿糖を酵素法で測定した。尿糖排泄量は1頭あたりの平均値で示した。
ICR系の5週令雄性マウス50頭を無作為に5群に分け、1群10頭のマウスをポリカーボネイト樹脂製のケージに5頭ずつ分散収容した。1群は対照群としてマウス用標準飼料粉末のみをあたえ、他の4群には4種類のアスコクロリン・カルボン酸誘導体の粉末を0.05%混合した上記飼料の粉末を1週間あたえた。実験期間中における各群の体重増加は、対照群と比べて有意差はなく、投薬による影響は認められなかった。1週間後に心臓から採血して血清総コレステロールを酵素法で測定した。
Claims (25)
- 下記式
R1は、下記の2つの基、すなわち、
R3は、水素原子、置換若しくは非置換の炭素数1〜6のアルキル基、置換若しくは非置換の炭素数2〜6のアルケニル基、置換若しくは非置換の炭素数2〜6のアルキニル基、置換若しくは非置換の炭素数3〜8のシクロアルキル基、アシル基、アリール基、またはカルボキシル基を表し、
R4は、水素原子、置換若しくは非置換の炭素数1〜6のアルキル基、置換若しくは非置換の炭素数2〜6のアルケニル基、置換若しくは非置換の炭素数2〜6のアルキニル基、置換若しくは非置換の炭素数3〜8のシクロアルキル基、アシル基、アリール基、またはカルボキシル基を表す。)
で表される全置換芳香族アルデヒド化合物であり3位にセスキテルペン側鎖をもつ糸状菌の代謝産物またはその誘導体のアルデヒド基と下記式
R2NH2
(式中、R2は、−(CH2)n−CHR5R6(式中、R5は水素原子、アミノ基、1個または2個の炭素数1〜6のアルキル基により置換されたアミノ基、またはフェニルで置換された炭素数1〜6のアルキル基を表し、R6は、カルボキシル基、−CONH2、または−COOR7(式中、R7は、置換若しくは非置換の炭素数1〜6のアルキル基を表す)を表し、nは0または1〜6の整数を表す。)または任意のアミノ酸からNH2を除いた残基を表す。)
で表されるアミノ化合物のアミノ基とを反応させることにより生成する下記式
で表される新規イミノ化合物の合成法。 - 全置換芳香族アルデヒド化合物が、その4位水酸基の水素をアルキル基で置換した誘導体である、請求項1記載の合成法。
- 全置換芳香族アルデヒド化合物が、その4位水酸基の水素をアシル基で置換した誘導体である、請求項1記載の合成法。
- 全置換芳香族アルデヒド化合物が、その2位水酸基の水素をアルキル基で置換した誘導体である、請求項1記載の合成法。
- 全置換芳香族アルデヒド化合物が、その2位並びに4位水酸基の双方の水素をアルキル基で置換した誘導体である、請求項1記載の合成法。
- 全置換芳香族アルデヒド化合物が、その2位水酸基の水素をアルキル基で置換し、4位水酸基の水素をアシル基で置換した誘導体である、請求項1記載の合成法。
- 全置換芳香族アルデヒド化合物が、その2位水酸基の水素をアシル基で置換し、4位水酸基の水素をアルキル基で置換した誘導体である、請求項1記載の合成法。
- 全置換芳香族アルデヒド化合物が、アスコクロリン、シリンドロクロリン、アスコフラノン、クロロネクチン、LLZ-1272-・、LLZ-1272-C・から選択される化合物である、請求項1〜請求項7のいずれか1項に記載の合成法。
- 下記式
R1は、下記の2つの基、すなわち、
R2は、−(CH2)n−CHR5R6(式中、R5は水素原子、アミノ基、1個または2個の炭素数1〜6のアルキル基により置換されたアミノ基、またはフェニルで置換された炭素数1〜6のアルキル基を表し、R6は、カルボキシル基、−CONH2、または−COOR7(式中、R7は、置換若しくは非置換の炭素数1〜6のアルキル基を表す)を表し、nは0または1〜6の整数を表す。)または任意のアミノ酸からNH2を除いた残基を表し、
R3は、水素原子、置換若しくは非置換の炭素数1〜6のアルキル基、置換若しくは非置換の炭素数2〜6のアルケニル基、置換若しくは非置換の炭素数2〜6のアルキニル基、置換若しくは非置換の炭素数3〜8のシクロアルキル基、アシル基、アリール基、またはカルボキシル基を表し、
R4は、水素原子、置換若しくは非置換の炭素数1〜6のアルキル基、置換若しくは非置換の炭素数2〜6のアルケニル基、置換若しくは非置換の炭素数2〜6のアルキニル基、置換若しくは非置換の炭素数3〜8のシクロアルキル基、アシル基、アリール基、またはカルボキシル基を表す。)
で表される化合物またはその医薬上許容される塩またはそれらの光学異性体。 - R4が置換若しくは非置換の炭素数1〜6のアルキル基である、請求項9記載の化合物またはその医薬上許容される塩またはそれらの光学異性体。
- R4がアシル基である、請求項9記載の化合物またはその医薬上許容される塩またはそれらの光学異性体。
- R3が置換若しくは非置換の炭素数1〜6のアルキル基である、請求項9記載の化合物またはその医薬上許容される塩またはそれらの光学異性体。
- R3およびR4が同一または異なった置換若しくは非置換の炭素数1〜6のアルキル基である、請求項9記載の化合物またはその医薬上許容される塩またはそれらの光学異性体。
- R3が置換若しくは非置換の炭素数1〜6のアルキル基、R4がアシル基である、請求項9記載の化合物またはその医薬上許容される塩またはそれらの光学異性体。
- R3がアシル基、R4が置換若しくは非置換の炭素数1〜6のアルキル基である、請求項9記載の化合物またはその医薬上許容される塩またはそれらの光学異性体。
- 下記式
R1は、下記の2つの基、すなわち、
R2は、−(CH2)n−CHR5R6(式中、R5は水素原子、アミノ基、1個または2個の炭素数1〜6のアルキル基により置換されたアミノ基、またはフェニルで置換された炭素数1〜6のアルキル基を表し、R6は、カルボキシル基、−CONH2、または−COOR7(式中、R7は、置換若しくは非置換の炭素数1〜6のアルキル基を表す)を表し、nは0または1〜6の整数を表す。)または任意のアミノ酸からNH2を除いた残基を表し、
R3は、水素原子、置換若しくは非置換の炭素数1〜6のアルキル基、置換若しくは非置換の炭素数2〜6のアルケニル基、置換若しくは非置換の炭素数2〜6のアルキニル基、置換若しくは非置換の炭素数3〜8のシクロアルキル基、アシル基、アリール基、またはカルボキシル基を表し、
R4は、水素原子、置換若しくは非置換の炭素数1〜6のアルキル基、置換若しくは非置換の炭素数2〜6のアルケニル基、置換若しくは非置換の炭素数2〜6のアルキニル基、置換若しくは非置換の炭素数3〜8のシクロアルキル基、アシル基、アリール基、またはカルボキシル基を表す。)
で表される化合物またはその医薬上許容される塩またはそれらの光学異性体の1種若しくは2種以上、および医薬上許容される担体、希釈剤等の添加剤を含む医薬組成物。 - 請求項9〜請求項15のいずれか1項に記載された化合物またはその医薬上許容される塩またはそれらの光学異性体の1種若しくは2種以上を有効成分とする糖尿病治療・予防薬。
- 請求項9〜請求項15のいずれか1項に記載された化合物またはその医薬上許容される塩またはそれらの光学異性体の1種若しくは2種以上を有効成分とする動脈硬化症治療薬。
- 請求項9〜請求項15のいずれか1項に記載された化合物またはその医薬上許容される塩またはそれらの光学異性体の1種若しくは2種以上を有効成分とする血清コレステロール低下剤。
- 請求項9〜請求項15のいずれか1項に記載された化合物またはその医薬上許容される塩またはそれらの光学異性体の1種若しくは2種以上を有効成分とする多重危険因子症候群の治療薬。
- 請求項9〜請求項15のいずれか1項に記載された化合物またはその医薬上許容される塩またはそれらの光学異性体の1種若しくは2種以上を有効成分とする高血圧症の治療薬。
- 請求項9〜請求項15のいずれか1項に記載された化合物またはその医薬上許容される塩またはそれらの光学異性体の1種若しくは2種以上を有効成分とする粘液水腫の治療薬。
- 請求項9〜請求項15のいずれか1項に記載された化合物またはその医薬上許容される塩またはそれらの光学異性体の1種若しくは2種以上を有効成分とする慢性炎症を治療する消炎剤。
- 請求項9〜請求項15のいずれか1項に記載された化合物またはその医薬上許容される塩またはそれらの光学異性体の1種若しくは2種以上を有効成分とするバルーンカテーテルあるいはステントにより拡張した動脈腔の再狭窄に対する予防・治療薬。
- 請求項9〜請求項15のいずれか1項に記載された化合物またはその医薬上許容される塩またはそれらの光学異性体の1種若しくは2種以上を有効成分とする、再生医療の実施に際し、レシピエントに移植する幹細胞から分化誘導した細胞ないし組織を生着させるための生着促進剤。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2005502807A JP4789618B2 (ja) | 2003-02-24 | 2004-02-24 | 新規転写因子、その製法および用途 |
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003092682 | 2003-02-24 | ||
| JP2003092682 | 2003-02-24 | ||
| PCT/JP2004/002110 WO2004074236A1 (ja) | 2003-02-24 | 2004-02-24 | 新規転写因子、その製法および用途 |
| JP2005502807A JP4789618B2 (ja) | 2003-02-24 | 2004-02-24 | 新規転写因子、その製法および用途 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPWO2004074236A1 JPWO2004074236A1 (ja) | 2006-06-01 |
| JP4789618B2 true JP4789618B2 (ja) | 2011-10-12 |
Family
ID=32905960
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2005502807A Expired - Fee Related JP4789618B2 (ja) | 2003-02-24 | 2004-02-24 | 新規転写因子、その製法および用途 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US7629471B2 (ja) |
| EP (1) | EP1616856B1 (ja) |
| JP (1) | JP4789618B2 (ja) |
| AT (1) | ATE513807T1 (ja) |
| CA (1) | CA2516698C (ja) |
| WO (1) | WO2004074236A1 (ja) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7432306B2 (en) | 2005-09-07 | 2008-10-07 | Nrl Pharma, Inc. | Method for preparing novel transcription factors and use |
| JP2009051731A (ja) * | 2005-11-25 | 2009-03-12 | Yokohama Tlo Co Ltd | 新規アスコクロリン誘導体化合物及びそれを含有する医薬組成物 |
| WO2013042782A1 (ja) * | 2011-09-22 | 2013-03-28 | 武田薬品工業株式会社 | 縮合複素環化合物 |
| CN108473408B (zh) | 2016-01-05 | 2021-08-17 | 星野达雄 | 壳二孢氯素衍生物及其作为ampk激活剂的用途 |
| EP3624849A4 (en) | 2017-05-18 | 2021-02-24 | Tatsuo Hoshino | COMBINATION THERAPY WITH ASCOCHLORINE DERIVATIVE |
| WO2018216821A1 (en) * | 2017-05-23 | 2018-11-29 | Nrl Pharma, Inc. | Use of ascochlorin derivative for combination therapy |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2000035867A1 (en) * | 1998-12-14 | 2000-06-22 | Nuclear Receptor Research Limited | Novel ligands of nuclear receptor |
| WO2000053563A1 (en) * | 1999-03-11 | 2000-09-14 | Nuclear Receptor Research Limited | Novel ligands of nuclear receptors ppar's |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0737402B2 (ja) * | 1987-06-09 | 1995-04-26 | 武田薬品工業株式会社 | フェノール誘導体、その製造法およびそれを含んでなる医薬組成物 |
| US6413507B1 (en) * | 1999-12-23 | 2002-07-02 | Shearwater Corporation | Hydrolytically degradable carbamate derivatives of poly (ethylene glycol) |
-
2004
- 2004-02-24 JP JP2005502807A patent/JP4789618B2/ja not_active Expired - Fee Related
- 2004-02-24 US US10/546,854 patent/US7629471B2/en not_active Expired - Fee Related
- 2004-02-24 WO PCT/JP2004/002110 patent/WO2004074236A1/ja not_active Ceased
- 2004-02-24 CA CA2516698A patent/CA2516698C/en not_active Expired - Fee Related
- 2004-02-24 AT AT04714032T patent/ATE513807T1/de not_active IP Right Cessation
- 2004-02-24 EP EP04714032A patent/EP1616856B1/en not_active Expired - Lifetime
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2000035867A1 (en) * | 1998-12-14 | 2000-06-22 | Nuclear Receptor Research Limited | Novel ligands of nuclear receptor |
| WO2000053563A1 (en) * | 1999-03-11 | 2000-09-14 | Nuclear Receptor Research Limited | Novel ligands of nuclear receptors ppar's |
Also Published As
| Publication number | Publication date |
|---|---|
| EP1616856A1 (en) | 2006-01-18 |
| EP1616856B1 (en) | 2011-06-22 |
| US7629471B2 (en) | 2009-12-08 |
| JPWO2004074236A1 (ja) | 2006-06-01 |
| CA2516698C (en) | 2012-01-31 |
| CA2516698A1 (en) | 2004-09-02 |
| ATE513807T1 (de) | 2011-07-15 |
| US20060247307A1 (en) | 2006-11-02 |
| EP1616856A4 (en) | 2007-03-28 |
| WO2004074236A1 (ja) | 2004-09-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP1176134A1 (en) | Ligands of nuclear receptors ppar's | |
| US11021454B2 (en) | Type of aryl benzofuran amidated derivative and medical use thereof | |
| JP2000501081A (ja) | アズレニルニトロンスピントラッピング剤、ならびにその製造方法および使用方法 | |
| JP6636133B2 (ja) | 心疾患の治療に対するcyp−エイコサノイドの代謝的にロバストな類縁体 | |
| CN102344481A (zh) | 3-o-咖啡酰齐墩果烷型五环三萜类酯衍生物、其制备方法及应用 | |
| JP4789618B2 (ja) | 新規転写因子、その製法および用途 | |
| CN111635315B (zh) | 一种解热镇痛药物及其制备方法和用途 | |
| CN111635309B (zh) | 一种新型解热镇痛药物及其制备方法和用途 | |
| JP2022511269A (ja) | シャペロン介在性オートファジー調節剤として有用な化合物 | |
| EP3922628B1 (fr) | Composés cytotoxiques inhibiteurs de la polymérisation de la tubuline | |
| CN110698445B (zh) | 一类3-胺烷基苯酞类化合物、其制备方法和用途 | |
| FR2597865A1 (fr) | Nouveaux derives d'un acide benzyl alkyl carboxylique substitue par un radical 4-pyridinyl aminocarbonyle, leur procede de preparation, les nouveaux intermediaires obtenus, leur application a titre de medicaments et les compositions pharmaceutiques les renfermant | |
| CH633541A5 (en) | Pharmacologically active substituted 1,2,4-triazines and medicaments containing these triazines | |
| KR101457637B1 (ko) | 디히드로피라졸카르보티오아미드 유도체 및 그 제법 및 그 유도체를 포함하는 항암제 조성물 | |
| JPH0778037B2 (ja) | カプサイシン誘導体又はその酸エステルを有効成分とする鎮痛剤、血管拡張剤 | |
| RU2732577C1 (ru) | Полиморф малеата ингибитора дипептидилпепдидазы iv(dppiv) и способ его получения | |
| US20240307427A1 (en) | Remdesivir cocrystal, compositions and methods thereof | |
| CN114099503B (zh) | 化合物作为cyp2e1抑制剂的应用 | |
| CN101906069A (zh) | (s)-2-取代-(3’-乙酰基-2’-吡啶酮-1’-基)乙酸及其制备方法和应用 | |
| JP2756941B2 (ja) | 2−クロロ−3−アリールアミノ−1,4−ナフトキノン誘導体の血小板凝集抑制剤としての用途 | |
| WO2024173233A2 (en) | Bromoquinone as a treatment for obesity and cancer | |
| CN118388421A (zh) | 一种姜黄素衍生物及制备方法、应用 | |
| CA2518328C (en) | Method for preparing transcription factors and use | |
| CN119529008A (zh) | 吉西他滨前药及其制备方法与应用 | |
| RU2183625C2 (ru) | Изоникотиноилгидразид цитраконовой кислоты, проявляющий гипогликемическую активность |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070216 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100608 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100809 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20100810 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20110620 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20110719 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140729 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |