JP4710009B2 - マダニのアスパラギン酸プロテアーゼ - Google Patents
マダニのアスパラギン酸プロテアーゼ Download PDFInfo
- Publication number
- JP4710009B2 JP4710009B2 JP2005154985A JP2005154985A JP4710009B2 JP 4710009 B2 JP4710009 B2 JP 4710009B2 JP 2005154985 A JP2005154985 A JP 2005154985A JP 2005154985 A JP2005154985 A JP 2005154985A JP 4710009 B2 JP4710009 B2 JP 4710009B2
- Authority
- JP
- Japan
- Prior art keywords
- polypeptide
- present
- aspartic protease
- amino acid
- acid sequence
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Landscapes
- Enzymes And Modification Thereof (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
Description
(1)配列番号2で表されるアミノ酸配列における23番〜391番のアミノ酸からなる配列からなるポリペプチド;
(2)配列番号2で表されるアミノ酸配列における23番〜391番のアミノ酸からなる配列を含み、しかも、アスパラギン酸プロテアーゼ活性を有するポリペプチド;
(3)配列番号2で表されるアミノ酸配列における23番〜391番のアミノ酸からなる配列、又は配列番号2で表されるアミノ酸配列において、1又は数個のアミノ酸が置換、欠失、及び/又は挿入されたアミノ酸配列を含み、しかも、アスパラギン酸プロテアーゼ活性を示すポリペプチド;又は
(4)配列番号2で表されるアミノ酸配列における23番〜391番のアミノ酸からなる配列、又は配列番号2で表されるアミノ酸配列との相同性が60%以上であるアミノ酸配列を含み、しかも、アスパラギン酸プロテアーゼ活性を有するポリペプチド
により解決することができる。
また、本発明は、前記ポリヌクレオチドを含むベクターに関する。
また、本発明は、前記ポリヌクレオチドを含む形質転換体に関する。
また、本発明は、前記形質転換体を培養する工程を含む、前記ポリペプチドを製造する方法に関する。
また、本発明は、前記ポリペプチド若しくはその断片、前記ポリヌクレオチド、又は前記ベクターと、薬剤学的又は獣医学的に許容することのできる担体又は希釈剤とを含む、医薬組成物に関する。
また、本発明は、前記ポリペプチド若しくはその断片、前記ポリヌクレオチド、又は前記ベクターを、マダニ駆除の必要な対象に、有効量で投与することを含む、マダニ駆除方法に関する。
また、本発明は、前記ポリペプチド若しくはその断片、前記ポリヌクレオチド、又は前記ベクターを、マダニ媒介性感染症の治療又は予防の必要な対象に、有効量で投与することを含む、マダニ媒介性感染症の治療又は予防方法に関する。
また、本発明は、前記ポリペプチドと試験物質とを接触させる工程、及び前記ポリペプチドのアスパラギン酸プロテアーゼ活性を分析する工程を含む、前記ポリペプチドのアスパラギン酸プロテアーゼ活性を修飾する物質のスクリーニング方法に関する。
また、本発明は、アスパラギン酸プロテアーゼ阻害剤、又は前記抗体若しくはその断片を有効成分として含む、マダニ駆除剤に関する。
本発明のポリペプチドには、
(1)配列番号2で表されるアミノ酸配列における23番〜391番のアミノ酸からなる配列からなるポリペプチド;
(2)配列番号2で表されるアミノ酸配列における23番〜391番のアミノ酸からなる配列を含み、しかも、アスパラギン酸プロテアーゼ活性を有するポリペプチド;
(3)配列番号2で表されるアミノ酸配列における23番〜391番のアミノ酸からなる配列、又は配列番号2で表されるアミノ酸配列において、1又は数個のアミノ酸が置換、欠失、及び/又は挿入されたアミノ酸配列を含み、しかも、アスパラギン酸プロテアーゼ活性を有するポリペプチド(以下、機能的等価改変体と称する);及び
(4)配列番号2で表されるアミノ酸配列における23番〜391番のアミノ酸からなる配列、又は配列番号2で表されるアミノ酸配列との相同性が60%以上であるアミノ酸配列を含み、しかも、アスパラギン酸プロテアーゼ活性を有するポリペプチド(以下、相同ポリペプチドと称する)
が含まれる。
本発明のポリヌクレオチドは、本発明のポリペプチドをコードするポリヌクレオチドである限り、特に限定されるものではなく、例えば、配列番号1で表される塩基配列における82番〜1188番の塩基からなる配列からなるポリヌクレオチド(シグナルペプチドを含まない成熟体ポリペプチドをコード)、又は配列番号1で表される塩基配列における16番〜1188番の塩基からなる配列からなるポリヌクレオチド(シグナルペプチドを含む前駆体ポリペプチドをコード)を挙げることができる。なお、本明細書における用語「ポリヌクレオチド」には、DNA及びRNAの両方が含まれる。
本発明のベクターは、本発明による前記ポリヌクレオチドを含む限り、特に限定されるものではなく、例えば、用いる宿主細胞に応じて適宜選択した公知の発現ベクターに、本発明による前記ポリヌクレオチドを挿入することにより得られるベクターを挙げることができる。
本発明の医薬(好ましくはマダニに対するワクチン)は、有効成分として、本発明のポリペプチド若しくはその断片、本発明のポリヌクレオチド、又は本発明のベクターを含む。すなわち、本発明においては、本発明のポリペプチド若しくはその断片、本発明のポリヌクレオチド、又は本発明のベクターを、それ単独で、又は好ましくは薬剤学的若しくは獣医学的に許容することのできる通常の担体又は希釈剤と共に、マダニ駆除の必要な動物、好ましくは哺乳動物(特には、ヒト)に経口的に又は非経口的に投与することができる。
本発明のポリペプチドに反応する抗体(例えば、ポリクローナル抗体又はモノクローナル抗体)は、各種動物に、本発明のポリペプチド、又はその断片を直接投与することで得ることができる。また、本発明のポリペプチドをコードするポリヌクレオチドを導入したプラスミドを用いて、DNAワクチン法(Raz, E. ら, Proc. Natl. Acad. Sci. USA, 91, 9519-9523, 1994; 又はDonnelly, J. J. ら, J. Infect. Dis., 173, 314-320, 1996)によっても得ることができる。
本発明のポリペプチドを用いると、試験物質が、本発明のポリペプチドのアスパラギン酸プロテアーゼ活性を修飾(例えば、抑制又は促進)するか否かをスクリーニングすることができる。本発明には、本発明のポリペプチドを含むスクリーニングキットが含まれる。
家兎を吸血4日目のフタトゲチマダニ(Haemaphysalis longicornis)の雌成ダニ200匹から唾液腺を、また別の雌成ダニ500匹からは中腸組織を、実体顕微鏡下で摘出した。これらから直ちに、アシッドグアニジニウム(Acid Guanidinium)−フェノール−クロロホルム法[Chomczynski et al., Anal Biochem 162: 156-159 (1987)](AGPC法)を用いて全RNAを調製し、これらのそれぞれ5μgを使用し、G−キャッピング法(G-Capping法)による完全長cDNA合成を行った。pGCAPベクター[Kato et al., DNA Res. 12: 53-62(2005)]に2本鎖cDNAがインサートされたプラスミドは、フェノール抽出後、エタノール沈殿により回収し、TE緩衝液に溶解した。得られたプラスミド溶液は、DH5αコンピテント細胞(Takara社)と混合し、エレクトロポレーション法により形質転換を行い、寒天培地に蒔いて培養した。
シグナルペプチド(配列番号2で表されるアミノ酸配列における1番〜22番のアミノ酸からなる配列)を含まない、フタトゲチマダニ・アスパラギン酸プロテアーゼ成熟体(配列番号2で表されるアミノ酸配列における23番〜391番のアミノ酸からなる配列)をコードする遺伝子断片をPCR法にて増幅した。PCR産物をフェノール/クロロホルム処理した後に、エタノール沈澱法にて回収し、蒸留水中に溶解した。得られたDNA液を制限酵素EcoRIで消化した後に、電気泳動にて分離し、DNA精製キット(Biotechnologies社)にて精製し、蒸留水中に回収した。一方、大腸菌発現用ベクターpGEX-4T3(Pharmacia Biotech社)を制限酵素EcoRIで消化した後に、アルカリホスファターゼにて脱リン酸化処理し、その後、PCR産物と同様な方法にて精製した。
実施例2で得られた組換えプラスミドにて、大腸菌DH5α株を形質転換させた後、37℃でアンピシリン含有LB培地で培養した。培養液のOD600nmが0.3〜0.5に達した時点で、イソプロピルチオガラクトシド(IPTG)を最終濃度が0.5mmol/Lになるように添加し、更に37℃で4時間培養を続けた。組換えタンパク質の発現は、10%ドデシル硫酸ナトリウム(SDS)−ポリアクリルアミドゲルで電気泳動[Laemmli et al., Nature, 227, 680-685(1970)]を実施した後、クーマシー染色で確認した(下記図1参照)。その結果、約65.3kDaの組換えタンパク質の発現が認められ、GSTリーダータンパク質(26kDa)とフタトゲチマダニ・アスパラギン酸プロテアーゼタンパク質(39.3kDa)の融合タンパク質であることが確認された。
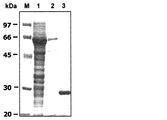
実施例3で述べた方法により、大腸菌で発現させた組換えフタトゲチマダニ(Hl)アスパラギン酸プロテアーゼ(AP)融合タンパク質(以下、組換えHlAP融合タンパク質と称する)を、市販のキット(Pharmacia Biotech社)に添付のプロトコールに従って精製した。精製前及び精製後の組換えHlAP融合タンパク質の電気泳動像を図1に示す。図1において、レーンMは、分子量マーカーの泳動結果であり、レーン1は、精製前の大腸菌ライセートの泳動結果であり、レーン2は、精製した組換えHlAP融合タンパク質の泳動結果であり、レーン3は、精製したGSTタンパク質の泳動結果である。
実施例4で得られた抗組換えHlAP融合タンパク質マウス血清を用い、イムノブロット法[Towbin et al., Proc Natl Acad Sci USA 76: 4350-4354 (1979)]にて天然型アスパラギン酸プロテアーゼタンパク質の同定を行なった。なお、試料として、未吸血又は一部吸血の成ダニライセートを使用した。結果を図2に示す。図2において、レーンMは、分子量マーカーの泳動結果であり、レーン1は、未吸血の成ダニライセートの泳動結果であり、レーン2は、一部吸血の成ダニライセートの泳動結果である。図2に示すように、成ダニライセートにおいて39.3kDaの特異的バンドが検出された。天然型アスパラギン酸プロテアーゼタンパク質の分子量が推定理論値(39.3kDa)と一致すると考えられた。
イムノブロット法を用いて、組換えHlAP融合タンパク質に対するウサギ免疫血清との反応性を検討した。結果を図3に示す。図3において、レーンMは、分子量マーカーの泳動結果であり、レーン1は、精製前の大腸菌ライセートの泳動結果であり、レーン2は、精製した組換えHlAP融合タンパク質の泳動結果であり、レーン3は、精製したGSTタンパク質の泳動結果である。その結果、組換えHlAP融合タンパク質は、ウサギで作製したダニ免疫血清と強く反応することが確認された。このことから、組換えHlAP融合タンパク質はダニワクチン候補分子の一つであることが示された。なお、免疫前のウサギ血清と組換えHlAP融合タンパク質との反応は認められなかった。
組換えHlAP融合タンパク質のプロテアーゼ活性を、市販のプロテアーゼ蛍光測定キット(SIGMA社)を用いて確認した。組換えHlAP融合タンパク質(5μg/μL)5μLと反応緩衝液10μLとを混合した後に、フルオレッセインイソチオシアネート(FITC)−カゼイン基質10μLを加え、37℃で所定時間(1〜8時間)反応させた。0.6mol/Lテトラクロロ酢酸液を加えて反応を中止した後に、8000xgで10分間遠心した。96穴のプレートに遠心後の上清2μLを取り、200μLの測定緩衝液を加えた後に、更に4℃で18〜24時間反応させた。その後、蛍光マイクロリーダ(Thermo Electron社)を用い、584nmの励起光と620nmの放射光にてプロテアーゼ活性を測定した。
主要内部器官における天然型アスパラギン酸プロテアーゼの発現分布について、常法に従って、RT−PCR法によりmRNA発現の分析を、ウェスタンブロッティングによりタンパク質発現の分析を、それぞれ実施した。RT−PCR法によるmRNA発現分析の結果を図5に、ウェスタンブロッティングによりタンパク質発現分析の結果を図6に示す。
実施例4で得られた組換えHlAP融合タンパク質を用いて、アスパラギン酸プロテアーゼのヘモグロビン(Hb)分解活性を検討した。250μg、500μg、又は1mgのヘモグロビン(シグマ)をpH3.5、pH4.0、pH4.5、又はpH5.0の0.1mol/L酢酸ナトリウム緩衝液に溶解後、これにそれぞれ組換えHlAP融合タンパク質1μgを加え、37℃で18時間反応させた後、この反応液を非還元下で15%SDS−ポリアクリルアミドゲル電気泳動(PAGE)し、クーマシー青で染色した。また、これと同様のヘモグロビン・組換えHlAP融合タンパク質の混合物に、アスパラギン酸プロテアーゼ阻害剤であるペプスタチン(シグマ)100μg、システインプロテアーゼ阻害剤であるロイペプチン(シグマ)100μg、又はシステインプロテアーゼ阻害剤であるE−64(シグマ)10μgを加え、37℃で18時間反応させた後の反応液についても、非還元下で15%SDS−PAGE後、クーマシー青で染色し、ヘモグロビン分解と阻害について確認を行った。
レーン 1 2 3 4 5 6
rHlAP + − + + + +
Hb − + + + + +
阻害剤 − − − P L E
本実施例では、dsRNA処理によりアスパラギン酸プロテアーゼ遺伝子の発現不活化を行い、その効果を検討した。dsRNAとしては、配列番号3で表される塩基配列(1216塩基)からなるRNAとその相補的塩基配列からなるRNAとからなるdsRNAを、リン酸緩衝化生理食塩水(PBS)に溶解して使用した。配列番号3で表される塩基配列における21番〜1196番の塩基からなる配列が、フタトゲチマダニ・アスパラギン酸プロテアーゼのコード領域(配列番号1で表される塩基配列における16番〜1191番の塩基からなる配列)に対応する。
Claims (7)
- (1)配列番号2で表されるアミノ酸配列における23番〜391番のアミノ酸からなる配列からなるポリペプチド;
(2)配列番号2で表されるアミノ酸配列における23番〜391番のアミノ酸からなる配列を含み、しかも、アスパラギン酸プロテアーゼ活性を有するポリペプチド;
(3)配列番号2で表されるアミノ酸配列における23番〜391番のアミノ酸からなる配列、又は配列番号2で表されるアミノ酸配列において、1又は数個のアミノ酸が置換、欠失、及び/又は挿入されたアミノ酸配列を含み、しかも、アスパラギン酸プロテアーゼ活性を示すポリペプチド;又は
(4)配列番号2で表されるアミノ酸配列における23番〜391番のアミノ酸からなる配列、又は配列番号2で表されるアミノ酸配列との同一性が90%以上であるアミノ酸配列を含み、しかも、アスパラギン酸プロテアーゼ活性を有するポリペプチド。 - 請求項1に記載のポリペプチドをコードするポリヌクレオチド。
- 請求項2に記載のポリヌクレオチドを含むベクター。
- 請求項2に記載のポリヌクレオチド、又は、請求項3に記載のベクターによって形質転換されている形質転換体。
- 請求項4に記載の形質転換体を培養する工程を含む、請求項1に記載のポリペプチドを製造する方法。
- 請求項1に記載のポリペプチドに対する抗体又はその抗原結合断片。
- 請求項1に記載のポリペプチドと試験物質とを接触させる工程、及び前記ポリペプチドのアスパラギン酸プロテアーゼ活性を分析する工程を含む、前記ポリペプチドのアスパラギン酸プロテアーゼ活性を修飾する物質のスクリーニング方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2005154985A JP4710009B2 (ja) | 2005-05-27 | 2005-05-27 | マダニのアスパラギン酸プロテアーゼ |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2005154985A JP4710009B2 (ja) | 2005-05-27 | 2005-05-27 | マダニのアスパラギン酸プロテアーゼ |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2006325497A JP2006325497A (ja) | 2006-12-07 |
| JP2006325497A5 JP2006325497A5 (ja) | 2008-05-01 |
| JP4710009B2 true JP4710009B2 (ja) | 2011-06-29 |
Family
ID=37547862
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2005154985A Active JP4710009B2 (ja) | 2005-05-27 | 2005-05-27 | マダニのアスパラギン酸プロテアーゼ |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4710009B2 (ja) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009508862A (ja) * | 2005-09-16 | 2009-03-05 | ユニバーシティ オブ コネチカット | 殺ダニ組成物およびその使用法 |
| CN108893458A (zh) * | 2018-07-19 | 2018-11-27 | 中国农业科学院饲料研究所 | 酸性蛋白酶Bs2688及其基因和应用 |
-
2005
- 2005-05-27 JP JP2005154985A patent/JP4710009B2/ja active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2006325497A (ja) | 2006-12-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8057801B2 (en) | Tick galectin | |
| JP5055522B2 (ja) | 多包条虫由来の新規蛋白質 | |
| JP4710009B2 (ja) | マダニのアスパラギン酸プロテアーゼ | |
| Yang et al. | Cloning and characterization of a new cysteine proteinase secreted by Paragonimus westermani adult worms | |
| Kwon et al. | Recombinant adenylate kinase 3 from liver fluke Clonorchis sinensis for histochemical analysis and serodiagnosis of clonorchiasis | |
| JP4452510B2 (ja) | ダニのキチナーゼ | |
| JP4710001B2 (ja) | マダニのロイシンアミノペプチダーゼ | |
| JP4783901B2 (ja) | マダニのシスタチン | |
| JP4752054B2 (ja) | バベシア・ギブソニ(Babesiagibsoni)の分泌抗原1タンパク質及びこのタンパク質をコードするDNA、並びにそれらの利用 | |
| JP3692396B2 (ja) | 豚回虫(Ascarissuum)感染幼虫の14kDa抗原、それをコードする核酸分子及びそれらの利用 | |
| JP5257886B2 (ja) | マダニのリジンケトグルタル酸レダクターゼ(lkr)とサッカロピンデヒドロゲナーゼ(sdh) | |
| US20050260219A1 (en) | Carboxypeptidases B from anopheles gambiae. compositions comprising them, vaccine applications and use as therapeutical targets | |
| US9139824B2 (en) | Sapolegina protein in for use as a medicament | |
| JP3613577B2 (ja) | 豚回虫(Ascarissuum)感染幼虫の16kDa抗原、それをコードする核酸分子及びそれらの利用 | |
| KR100986104B1 (ko) | 레플리킨 펩타이드 및 그의 이용 | |
| Botha | Two-Hybrid Analysis and Attempted Expression of Elongation Factor 1α from the Cattle Tick, Rhipicephalus Microplus | |
| KR20040027869A (ko) | 레플리킨 펩타이드 및 그의 이용 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080314 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080314 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20101207 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110201 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20110222 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4710009 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S533 | Written request for registration of change of name |
Free format text: JAPANESE INTERMEDIATE CODE: R313533 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |