JP4628625B2 - 蛍光エネルギー移動を含む標的核酸を検出するための増幅方法 - Google Patents
蛍光エネルギー移動を含む標的核酸を検出するための増幅方法 Download PDFInfo
- Publication number
- JP4628625B2 JP4628625B2 JP2001515326A JP2001515326A JP4628625B2 JP 4628625 B2 JP4628625 B2 JP 4628625B2 JP 2001515326 A JP2001515326 A JP 2001515326A JP 2001515326 A JP2001515326 A JP 2001515326A JP 4628625 B2 JP4628625 B2 JP 4628625B2
- Authority
- JP
- Japan
- Prior art keywords
- label
- probe
- sequence
- amplification
- acceptor
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 230000003321 amplification Effects 0.000 title claims abstract description 95
- 238000003199 nucleic acid amplification method Methods 0.000 title claims abstract description 95
- 238000000034 method Methods 0.000 title claims abstract description 63
- 150000007523 nucleic acids Chemical class 0.000 title claims abstract description 31
- 102000039446 nucleic acids Human genes 0.000 title claims abstract description 19
- 108020004707 nucleic acids Proteins 0.000 title claims abstract description 19
- 238000012546 transfer Methods 0.000 title description 4
- 239000000523 sample Substances 0.000 claims abstract description 164
- 238000006243 chemical reaction Methods 0.000 claims abstract description 65
- 125000003729 nucleotide group Chemical group 0.000 claims abstract description 41
- 239000002773 nucleotide Substances 0.000 claims abstract description 39
- 125000005647 linker group Chemical group 0.000 claims abstract description 38
- 239000000126 substance Substances 0.000 claims abstract description 20
- 238000012544 monitoring process Methods 0.000 claims abstract description 18
- 239000003153 chemical reaction reagent Substances 0.000 claims abstract description 15
- 230000000295 complement effect Effects 0.000 claims abstract description 15
- 108091028043 Nucleic acid sequence Proteins 0.000 claims abstract description 12
- 108020004414 DNA Proteins 0.000 claims description 26
- 238000003752 polymerase chain reaction Methods 0.000 claims description 24
- 238000009396 hybridization Methods 0.000 claims description 13
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical compound O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 claims description 10
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 claims description 7
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 claims description 7
- 230000008859 change Effects 0.000 claims description 6
- 239000000975 dye Substances 0.000 claims description 6
- 102000053602 DNA Human genes 0.000 claims description 5
- 229940035893 uracil Drugs 0.000 claims description 5
- 239000000155 melt Substances 0.000 claims description 4
- WCKQPPQRFNHPRJ-UHFFFAOYSA-N 4-[[4-(dimethylamino)phenyl]diazenyl]benzoic acid Chemical compound C1=CC(N(C)C)=CC=C1N=NC1=CC=C(C(O)=O)C=C1 WCKQPPQRFNHPRJ-UHFFFAOYSA-N 0.000 claims description 3
- 230000001687 destabilization Effects 0.000 claims description 3
- 102000054765 polymorphisms of proteins Human genes 0.000 claims description 3
- BDJDTKYGKHEMFF-UHFFFAOYSA-M QSY7 succinimidyl ester Chemical compound [Cl-].C=1C=C2C(C=3C(=CC=CC=3)S(=O)(=O)N3CCC(CC3)C(=O)ON3C(CCC3=O)=O)=C3C=C\C(=[N+](\C)C=4C=CC=CC=4)C=C3OC2=CC=1N(C)C1=CC=CC=C1 BDJDTKYGKHEMFF-UHFFFAOYSA-M 0.000 claims description 2
- CEQFOVLGLXCDCX-WUKNDPDISA-N methyl red Chemical compound C1=CC(N(C)C)=CC=C1\N=N\C1=CC=CC=C1C(O)=O CEQFOVLGLXCDCX-WUKNDPDISA-N 0.000 claims description 2
- 239000001022 rhodamine dye Substances 0.000 claims description 2
- 238000004020 luminiscence type Methods 0.000 claims 1
- 239000000370 acceptor Substances 0.000 description 39
- 239000000047 product Substances 0.000 description 33
- 108091033319 polynucleotide Proteins 0.000 description 25
- 239000002157 polynucleotide Substances 0.000 description 25
- 102000040430 polynucleotide Human genes 0.000 description 25
- 238000002866 fluorescence resonance energy transfer Methods 0.000 description 18
- 108091093088 Amplicon Proteins 0.000 description 16
- 238000002844 melting Methods 0.000 description 16
- 230000008018 melting Effects 0.000 description 16
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 11
- 238000004458 analytical method Methods 0.000 description 11
- 238000001514 detection method Methods 0.000 description 10
- 239000002585 base Substances 0.000 description 9
- 230000003993 interaction Effects 0.000 description 9
- 125000000524 functional group Chemical group 0.000 description 8
- 238000006460 hydrolysis reaction Methods 0.000 description 8
- 102000004190 Enzymes Human genes 0.000 description 7
- 108090000790 Enzymes Proteins 0.000 description 7
- 230000007062 hydrolysis Effects 0.000 description 7
- 238000002474 experimental method Methods 0.000 description 6
- 239000007850 fluorescent dye Substances 0.000 description 6
- 108091034117 Oligonucleotide Proteins 0.000 description 5
- 230000001419 dependent effect Effects 0.000 description 5
- 238000010586 diagram Methods 0.000 description 5
- 125000002485 formyl group Chemical class [H]C(*)=O 0.000 description 5
- 229910019142 PO4 Inorganic materials 0.000 description 4
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 4
- 239000011324 bead Substances 0.000 description 4
- 239000012071 phase Substances 0.000 description 4
- 239000010452 phosphate Substances 0.000 description 4
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 4
- 230000008569 process Effects 0.000 description 4
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- 238000000137 annealing Methods 0.000 description 3
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 3
- 238000011002 quantification Methods 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 238000001228 spectrum Methods 0.000 description 3
- 108091026890 Coding region Proteins 0.000 description 2
- 108700024394 Exon Proteins 0.000 description 2
- 108091092195 Intron Proteins 0.000 description 2
- 108020004711 Nucleic Acid Probes Proteins 0.000 description 2
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 2
- OIRDTQYFTABQOQ-KQYNXXCUSA-N adenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 description 2
- 125000000217 alkyl group Chemical group 0.000 description 2
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 2
- 125000004429 atom Chemical group 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 238000010367 cloning Methods 0.000 description 2
- 238000011109 contamination Methods 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 230000001186 cumulative effect Effects 0.000 description 2
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 2
- 230000007423 decrease Effects 0.000 description 2
- 230000027832 depurination Effects 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 230000007274 generation of a signal involved in cell-cell signaling Effects 0.000 description 2
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical compound O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 238000012966 insertion method Methods 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 238000011880 melting curve analysis Methods 0.000 description 2
- 239000002853 nucleic acid probe Substances 0.000 description 2
- 239000002777 nucleoside Substances 0.000 description 2
- 150000003833 nucleoside derivatives Chemical class 0.000 description 2
- 238000005457 optimization Methods 0.000 description 2
- 102000004169 proteins and genes Human genes 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 238000011895 specific detection Methods 0.000 description 2
- RWQNBRDOKXIBIV-UHFFFAOYSA-N thymine Chemical compound CC1=CNC(=O)NC1=O RWQNBRDOKXIBIV-UHFFFAOYSA-N 0.000 description 2
- -1 uracil-N-glycosylase Chemical class 0.000 description 2
- 239000002126 C01EB10 - Adenosine Substances 0.000 description 1
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 1
- 101150003085 Pdcl gene Proteins 0.000 description 1
- 108091093037 Peptide nucleic acid Proteins 0.000 description 1
- 239000002262 Schiff base Substances 0.000 description 1
- 150000004753 Schiff bases Chemical class 0.000 description 1
- 108010006785 Taq Polymerase Proteins 0.000 description 1
- 102000006943 Uracil-DNA Glycosidase Human genes 0.000 description 1
- 108010072685 Uracil-DNA Glycosidase Proteins 0.000 description 1
- CKUAXEQHGKSLHN-UHFFFAOYSA-N [C].[N] Chemical compound [C].[N] CKUAXEQHGKSLHN-UHFFFAOYSA-N 0.000 description 1
- HMDDXIMCDZRSNE-UHFFFAOYSA-N [C].[Si] Chemical compound [C].[Si] HMDDXIMCDZRSNE-UHFFFAOYSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 229960005305 adenosine Drugs 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 238000000246 agarose gel electrophoresis Methods 0.000 description 1
- 125000003158 alcohol group Chemical group 0.000 description 1
- 125000002723 alicyclic group Chemical group 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 125000005526 alkyl sulfate group Chemical group 0.000 description 1
- 230000029936 alkylation Effects 0.000 description 1
- 238000005804 alkylation reaction Methods 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 125000004103 aminoalkyl group Chemical group 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- CREMABGTGYGIQB-UHFFFAOYSA-N carbon carbon Chemical compound C.C CREMABGTGYGIQB-UHFFFAOYSA-N 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 108091036078 conserved sequence Proteins 0.000 description 1
- 230000001351 cycling effect Effects 0.000 description 1
- 229940104302 cytosine Drugs 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 230000001540 depurinating effect Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 238000002405 diagnostic procedure Methods 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 230000005518 electrochemistry Effects 0.000 description 1
- 125000004185 ester group Chemical group 0.000 description 1
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 238000013401 experimental design Methods 0.000 description 1
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 125000005842 heteroatom Chemical group 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- IIRDTKBZINWQAW-UHFFFAOYSA-N hexaethylene glycol Chemical compound OCCOCCOCCOCCOCCOCCO IIRDTKBZINWQAW-UHFFFAOYSA-N 0.000 description 1
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 238000009830 intercalation Methods 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 description 1
- 229910052753 mercury Inorganic materials 0.000 description 1
- CSJDCSCTVDEHRN-UHFFFAOYSA-N methane;molecular oxygen Chemical compound C.O=O CSJDCSCTVDEHRN-UHFFFAOYSA-N 0.000 description 1
- YQCIWBXEVYWRCW-UHFFFAOYSA-N methane;sulfane Chemical compound C.S YQCIWBXEVYWRCW-UHFFFAOYSA-N 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 239000003068 molecular probe Substances 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 150000008300 phosphoramidites Chemical class 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 238000003672 processing method Methods 0.000 description 1
- 238000004445 quantitative analysis Methods 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 238000012340 reverse transcriptase PCR Methods 0.000 description 1
- 125000000548 ribosyl group Chemical group C1([C@H](O)[C@H](O)[C@H](O1)CO)* 0.000 description 1
- 238000007086 side reaction Methods 0.000 description 1
- 238000010532 solid phase synthesis reaction Methods 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 108010068698 spleen exonuclease Proteins 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 238000005382 thermal cycling Methods 0.000 description 1
- 125000004149 thio group Chemical group *S* 0.000 description 1
- 125000004001 thioalkyl group Chemical group 0.000 description 1
- 229940113082 thymine Drugs 0.000 description 1
- 230000017105 transposition Effects 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6844—Nucleic acid amplification reactions
- C12Q1/6853—Nucleic acid amplification reactions using modified primers or templates
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6813—Hybridisation assays
- C12Q1/6816—Hybridisation assays characterised by the detection means
- C12Q1/6818—Hybridisation assays characterised by the detection means involving interaction of two or more labels, e.g. resonant energy transfer
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Wood Science & Technology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Zoology (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- General Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Molecular Biology (AREA)
- Analytical Chemistry (AREA)
- Biotechnology (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biophysics (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Investigating Or Analysing Materials By The Use Of Chemical Reactions (AREA)
- Eye Examination Apparatus (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Geophysics And Detection Of Objects (AREA)
Description
本発明は、試料中の標的ポリヌクレオチドを、例えば、増幅反応を、好ましくは定量的方法でモニターすることにより検出する方法、及びその方法に用いられるプローブ及びキットに関する。該方法は、多型性又は対立遺伝子変化のような配列の特徴の検出に適しているので、診断法に用いることができる。
既知の蛍光ポリメラーゼ連鎖反応(PCR)モニター法には、わずかな第二世代のPCR熱サイクル装置により使用し得る鎖特異的DNA挿入法と包括的DNA挿入法の双方が含まれている。
包括的蛍光PCR法は、二本鎖DNA化学種に結合した場合に蛍光が増加するDNA挿入色素を利用している。増幅中のDNAの容積濃度の上昇による蛍光増加は、反応の進行を測定するために、また、最初の標的分子コピー数を求めるために使用し得る。更に、温度変化が制御された蛍光をモニターすることにより、例えば、PCR熱サイクルの終わりにDNA融解曲線が作成され得る。
これらの包括的蛍光PCR法は、時間を遅延させずに核酸の容積濃度の上昇をモニターする方法である。単一の蛍光読取りは、反応毎に同じ点で読み取ることができる。終点融解曲線分析は、アンプリコンからの人為産物を判別するために、また、アンプリコンを判別するために使用し得る。産物のピークは、アガロースゲル電気泳動によって可視化し得る濃度で見ることができない。
【0002】
高分解能融解データを得るために、既存のハードウエアにより5分までかけて徐々に融解実験を行わなければならない。しかしながら、蛍光増幅を連続してモニターすることにより、融解とハイブリダイゼーションのヒステリシスの3D画像が作成され得る。この3D画像は、アンプリコン依存性であり、産物の判別に十分な情報を与えることができる。
一般的にDNA融解曲線分析は、PCR熱サイクルを最適化するのに強力な手段であることがわかった。アンプリコンの融解温度を求めることにより、後のPCRサイクルの変性温度をこの温度まで下げることが可能である。ゲノムDNAよりむしろ第一世代の反応産物からの増幅の最適化により、後のサイクルで生じる人為産物の生成が減少する。プライマーオリゴヌクレオチドとその補体の融解温度は、アニーリング温度を求めるために用いることができ、経験的最適化の要求が減少する。
しかしながら、包括的挿入法は、擬似鎖特異的にすぎないので、鎖特異的検出が必要とされる場合にはほとんど役に立たない。
【0003】
蛍光PCR鎖特異的方法は、更に、核酸反応成分を用いて増幅反応の進行をモニターする方法である。その方法は、検出の根拠として蛍光エネルギー移動(FET)を用いることができる。1種以上の核酸プローブを蛍光分子で標識し、その一方がエネルギー供与分子として、もう一方がエネルギー受容分子として作用し得る。これらは、それぞれリポーター分子及び消光分子としてしばしば知られている。供与分子は、通常は蛍光発光波長を示す光の特定の波長で励起する。受容分子は、この発光波長で励起し、様々な距離依存性エネルギー移動メカニズムによって供与分子の発光エネルギーを受容し得る。起こり得る蛍光エネルギー移動の個々の例は、蛍光共鳴エネルギー移動又は『FRET』である。一般に、受容分子は、密接に近接している(例えば、同じ分子、又は隣接分子)場合に供与分子の発光エネルギーを受容する。FET又はFRET検出の根拠は、供与体発光波長での変化をモニターすることである。受容体が蛍光分子である場合、受容体発光波長をモニターすることもできる。
2種類の一般に用いられるFETプローブ又はFRETプローブ、供与体を受容体から分けるために核酸プローブの加水分解を用いるプローブ、及び供与分子と受容分子の空間的関係を変えるためにハイブリダイゼーションを用いるプローブがある。
【0004】
加水分解プローブは、TaqMan(登録商標)プローブとして市販されている。これらは、供与分子と受容分子で標識されているDNAオリゴヌクレオチドからなっている。プローブは、PCR産物の1本の鎖の特定領域に結合するように設計されている。PCRプライマーとこの鎖をアニーリングした後、Taq酵素が5' →3' ポリメラーゼ活性によりDNAを伸長させる。Taq酵素は、5' →3' エキソヌクレアーゼ活性も示す。TaqMan(登録商標)プローブは、Taq伸長を開始するのを防止するためにリン酸化によって3' 端で保護される。TaqMan(登録商標)プローブが産物鎖に対してハイブリッド形成する場合には、伸長しているTaq分子もプローブを加水分解することができ、検出の根拠として供与体を受容体から遊離させる。この場合のシグナルは累積し、遊離供与分子と受容分子の濃度は増幅反応の各サイクルと共に増大する。
シグナル生成がプローブ加水分解反応の発生に左右されるという事実は、この方法に伴う時間の遅延があることを意味する。更に、プローブの存在がPCR法の順調な操作を中断することがある。
更に、加水分解が非特異的になることがあり、特に、例えば、50サイクルを超える多数の増幅が必要であることがわかった。その場合、プローブの非特異的加水分解によって、過度に高いシグナルが生じる。
【0005】
このことは、そのような手法がアイダホテクノロジー社(Idaho Technologies Inc.)のRapidCycler(登録商標)やLightCycler(登録商標)のような急速熱風サーマルサイクラーの開発とともに更に優れてきている急速PCR法と全く適合しないことを意味している。他の急速PCR装置は、例えば、同時係属英国特許出願第9625442.0号及び同第9716052.7号に記載されている。従来の熱サイクルを超える急速サイクルの長所は、別の方法で報告されている。そのような手法は、例えば、生物学的闘争の検出システムに特に有効であり、生命の喪失又は重大な損傷が避けられる場合には結果の速度が重要である。
更に、シグナル生成が、一般的には、アンプリコン又はプローブの融解温度よりむしろプローブの加水分解に左右されるので、加水分解プローブは融解のヒステリシスについての情報をほとんど与えない。
ハイブリダイゼーションプローブは、多くの外観で入手できる。分子ビーコンは、相補的5' 配列と3' 配列をもつオリゴヌクレオチドであり、その結果、ヘアピンループを形成する。末端蛍光標識は、ヘアピン構造が形成されるときにFRETが生じるように密接に近接している。分子ビーコンを相補的配列に対してハイブリッド形成した後、蛍光標識が分離されるので、FRETは起こらず、これにより検出の根拠が生じる。
【0006】
一対の標識オリゴヌクレオチドを用いることができる。これらは、FRETが起こり得るように供与分子と受容分子を共にもたらすPCR産物鎖により密接に近接してハイブリッド形成する。増強されたFRETが検出の根拠である。隣接の単一プローブを含む標識増幅プライマーを用いたこのタイプの変形も含まれている。
2つのプローブ、又は2つの標識分子を含んでいる分子ビーコン型のプローブの使用によって、プロセスに関係するコストがかかる。更に、この方法には、特に相互に密接に近接して結合するのに十分長い2つのプローブが既知であるようにかなり長い既知の配列の存在が必要である。これは、HIVウイルスのような有効なプローブを設計するために使用し得る生物体の保存配列の長さが相対的に短かくてもよい一部の診断用途においては問題となり得る。
更に、一対のプローブの使用は、複雑な実験設計を必要とする。例えば、プローブの融解物によって得られるシグナルは、双方のプローブの融解の関数である。小さな不適合の実験又はプローブの一方がスプライス領域を横切って結合することを必要とする実験(例えば、イントロンの両側の配列がプローブ部位として利用し得る試料においてDNAに比べてRNAを検出する)は、もう一方が最初に融解する場合には不正確な結果を生じることがある。
【0007】
同時係属国際特許出願第PCT/GB990504号には、試料中の標的配列の量を定量するように適合することができる具体的な核酸配列の存在を検出する分析が記載されている。この分析においては、少なくとも1つが蛍光で標識されている一組のヌクレオチドを用いて増幅反応が行われる。従って、増幅産物は、蛍光標識がその中に取込まれている。反応は、増幅産物に対してハイブリッド形成することができかつ前記蛍光標識ヌクレオチドから蛍光を吸収し得る又は蛍光エネルギーをそれに供与し得る反応性分子を含んでいるプローブの存在下に行われる。次に、プローブに対してハイブリッド形成しかつそれらの間でFET又はFRET相互作用を生じる反応の過程で変わる前記試料の蛍光を測定することにより、反応がモニターされ得る。
ここで、出願人は、前記分析の改良された方法を見出した。
本発明は、試料中の標的核酸配列の存在を検出する方法であって、少なくとも1つが第1標識で標識されている一組のヌクレオチド、及び一本鎖の形にあるときの前記標的核酸配列に対してハイブリッド形成することができかつ第2標識を有しているプローブに化学結合基によって5' 端で結合している増幅プライマーを含んでいる試薬を用いて前記試料を増幅反応に供し、標識した前記プローブが、増幅産物の相補的領域に対してハイブリッド形成することができるように前記標的配列と同様の配列を有し、該第1標識又は該第2標識の一方が蛍光エネルギーを該第1標識又は該第2標識のもう一方に供与し得る蛍光分子を含んでいる段階; 及び前記試料の蛍光をモニターする段階を含む、前記方法を提供する。
【0008】
本分析においては、第1段階で標的配列が一本鎖にされるので、試薬のプライマー領域がハイブリッド形成し得る。従って、これにより、標識ヌクレオチドを含みかつ産物の下流に相補的な5' 端の下流に標識したプローブ領域をもつ相補鎖を生成する鎖の伸長が開始し得る。
伸長相が完了するとすぐに、融解相中に産物がその鋳型鎖から分けられるので、一本鎖になる。この形で、標識したプローブ領域がねじれるとともに産物鎖の相補的領域に対してハイブリッド形成することができ、そのときに蛍光エネルギー(供与体)をもう一方の標識にFET又はFRETによって供与し得る標識がそのようにされるので、試料からの蛍光シグナルが変化する。このシグナルの変化は、増幅反応の過程をモニターするために反応全体でモニターし得る。
増幅の第2段階と後続段階においては、産物鎖は、それ自体伸長の鋳型鎖として作用することができる。しかしながら、化学結合が伸長反応を停止させた後、前記プローブに相補的な配列が生じる。従って、プローブ領域は一本鎖のままである。
必要な場合には、増幅反応中に標識したプローブ領域に結合しない対応する増幅プライマーが存在してもよい。このプライマーにより、用いられている検出装置の動的範囲へシグナルを仲介する働きをすることができる従来の非標識増幅産物の作製がもたらされる。複雑なプローブ/プライマー構造の存在によって悪影響を及ぼすことがある反応効率を改善することができる。
【0009】
供与標識(受容体)から蛍光を吸収し得る標識がこの機能を行う場合、供与体からの蛍光が減少する。この減少は、検出することができ、これにより、プローブ領域の結合が示される。
最も好ましくは、蛍光を吸収し得る標識(受容体)は、それ自体固有の波長で蛍光を放射する蛍光分子である。この場合、供与標識と異なる波長を有している受容分子からの蛍光の増加によって、プローブの結合が示される。
適切には、供与標識はヌクレオチドについて標識され、受容標識はプローブについて標識される。この場合、このように標識した増幅産物の存在は、プローブについて受容分子からの蛍光をモニターすることによって検出することができ、同じ産物鎖の下流領域に主として結合する。この場合、増幅産物からのシグナルは、蛍光標識のバックグラウンドシグナルからも非特異的増幅産物からも区別し得る。
シグナルが標識した増幅産物によってのみ生じるという事実は、多量のバックグラウンドDNAを含む反応混合物中の特定の標的配列を検出することによって系が非常に特異的であることを意味する。これは、非特異的増幅産物がプローブ領域に対してハイブリッド形成しないので、測定したシグナルに寄与しないためである。
【0010】
この種類の分析は、安価な試薬を用いて行うことができる。標識した単一プローブは、受容分子と供与分子双方を含むものより経済的である。
試薬の中の標識したプローブは、一本鎖であってもよく、上記の分子ビーコンの形を取るように5' 及び3' 相補的配列を含んでいてもよい。しかしながら、この場合、プローブには、プローブについての標識とアンプリコン鎖内の標識ヌクレオチド間の相互作用の結果として検出の根拠となるFET又はFRETシグナルが生じる1つの標識分子だけが必要である。
本明細書に用いられる『一組のヌクレオチド』という表現は、DNAやRNAや他の類縁体のような核酸を形成するのに十分なヌクレオチドのグループを意味する。従って、これらは、アデノシン、シトシン、グアニン及びチミン又はウラシル含有ヌクレオチドを含んでいる。これらの1つ以上は、蛍光で標識されている。標識ウラシルは、ベーリンガーマンハイム(Boehringer Mannhaeim)から入手できる。適切な蛍光標識としては、フルオレセインが含まれる。
標識したウラシルの使用は、その使用が反応容器内で行われる増幅反応から次の反応への汚染又は持ち越し汚染を防止する戦略に組入れることができる点で特に好ましいものである。ウラシル含有核酸を消化する酵素、例えば、ウラシル-N-グリコシラーゼは、プレサイクルインキュベーション段階に用いることができ、次の適用の熱サイクルが始まる前に残留アンプリコンを消化することを確実にする。
【0011】
増幅産物からのシグナルレベル、よってFET又はFRETシグナルを緩和するように適切には1を超えるヌクレオチド、おそらくすべてのヌクレオチドを標識する。
増幅は、適切には、ポリメラーゼ連鎖反応(PCR)、鎖置換分析(SDA)又はNASBAのような既知の増幅反応、好ましくはPCRを用いて行われる。
好ましくは、第1標識と第2標識双方(即ち、供与標識と受容標識の双方)の蛍光をモニターし、発光間の関係を計算する。
適切な受容標識は、蛍光色素、例えば、ローダミン色素又はCy5のような他の色素である。また、受容標識は、DABCYL又はメチルレッドのような『暗受容体』としてしばしば知られる非蛍光受容分子を含むことができる。これらは、慣用的方法でプローブに結合することができる。プローブに沿った受容標識の位置は重要ではないが、たいてい、プローブの末端領域に位置する。
FET、例えば、FRETが第1標識と第2標識間に生じるように、供与標識の蛍光放射は、受容標識より短い波長でなければならない。
従って、適切な組合わせを次の表に示す。
【0012】
* モレキュラープローブス(Molecular Probes)、英国から入手できる。
【0013】
好ましくは、供与体及び/又は受容体として用いられる分子は、尖った発光ピークを生じ、発光の波長には重なりがほとんど又は全くない。これらの状況下で、増幅産物によって生じるシグナルからの『鎖特異的ピーク』を分割することは必要なくてよい。鎖特異的シグナルのみの単純な測定(即ち、受容標識によって示される)は、標的反応によるFET又はFRETの程度に関する情報を与える。
しかしながら、供与標識と受容標識からの蛍光シグナルにスペクトルの重なりがある場合には、例えば、スペクトル間の関係を経験的に求めるとともにこの関係を用いて2つのシグナルからシグナルを規格化することにより結局は説明し得る。
標識プローブをプローブから分ける化学結合は、適切には、ヌクレオチド配列を結合し得るがDNAポリメラーゼによって認識されない分子である。この要求を満たす広範囲の化学リンカーが利用できる。
リンカーの形成に用いることができる化学のタイプと反応の例は、例えば、国際出願第95/08642号に記載されている。特に、化学リンカーは、2つのポリヌクレオチド配列(プライマーとプローブ)を共に結合する原子のグループを含んでいる。リンカーは、慣用的方法のいずれによってもそれぞれのポリヌクレオチドに結合し得る。
【0014】
一般的に言えば、リンカーは、第1官能基と第2官能基を有し、それによってそれぞれプローブ配列とプライマー配列に又は引き続きプローブ配列又はプライマー配列が生成される個々のヌクレオチドに結合し得る有機化学から誘導される。
リンカーの結合は、例えば、炭素-炭素単結合、炭素-炭素二重結合、炭素-炭素三重結合、炭素-窒素単結合、炭素-窒素二重結合、炭素-酸素単結合、炭素-イオウ単結合、炭素-ケイ素単結合、イオウ-窒素結合、イオウ-酸素結合、リン-酸素結合、又はリン-窒素結合により、リンカーを形成するのに用いられる有機化学と反応の種類に左右される。
適切な官能基としては、ヒドロキシル基、アミノ基、チオ基、アルキル硫酸基、ハロゲン基が含まれるがこれらに限定されない。
適切には、リンカーは段階で導入することができる。
例えば、第1官能基を有するが第2官能基(例えば、アルコール基、エステル基、チオアルキル基等)が遮断された有機化学を、プローブ配列か又はプライマー配列とその末端に結合するために反応させ得る。慣用的な方法を用いて遮断基を除去した後、化学リンカーを形成するために第2官能基をプローブ又はプライマーのもう一方と反応させることができる。
また、化学リンカーは、例えば、次の反応スキームを用いて2つの部分からその場で生成させることができる。
【0015】
【化1】
【0016】
(式中、P1及びP2はプライマーポリヌクレオチド配列とプローブポリヌクレオチド配列であり; Xはポリヌクレオチド配列の3' 端と反応させて-X' -部分をつくる官能基であり; Zはポリヌクレオチド配列の5' 端と反応させて-Z' -部分をつくる官能基であり; Y及びY' はポリヌクレオチドと反応せず相互に反応してY''基をつくる官能基であり; R1及びR2はリンカーの一部である。)
行われる反応の種類によっては、X'、Y" 又はX' は直接結合することができる。適切な基R1及び/又はR2の例としては、次のものが含まれる。
-NH-CH2-CH=CH-、SH-CH2-CH2-CH=CH-、-NH-CH2-CH2-O-CH2-CH=CH-、-(CH2)n-O-(式中、nは1〜20の整数である。)
リンカーをポリヌクレオチドの5' 又は3' 末端に結合する場合、便利な結合としては、リン酸結合、カルボキシ結合又はエーテル結合、特にリン酸結合が含まれる。適切なリン酸リンカーとしては、アミノアルキルホスホリル基、特にC1-12アルキル鎖、特にC6アルキル鎖を含むものが含まれる。これらのリンカーは、固相合成で合成オリゴヌクレオチドに容易に結合することができる。例えば、S. Agrawalら, Nucleic Acids Research, 1986, 14, 6227及び国際出願第88/02004号(アプライドバイオシステムズ)を参照されたい。
【0017】
リンカーをポリヌクレオチドベースに結合する他の一般法は、J. L. Ruth & D. E. Bergstrom, J. Org. Chem., 1978, 43, 2870; D. E. Bergstrom & M. K. Ogawa, J. Amer. Chem. Soc., 1978, 10, 8106; C. F. Bigge, P. Kalaritis, J. R. Deck & M. P. Mertes, J. Amer. Chem. Soc., 1980, 102, 2033に記載されている。好ましい方法は、欧州特許出願第063,879号に開示されているものである。該方法は、αビニル基を有するリンカー又はリンカー基と水銀化塩基とをK2PdCl4の存在下に反応させ、その水銀がHg+ としてリンカーと反応させる塩基の位置に結合している段階を含んでいる。
リンカーのサイズ又は含量は、プローブ領域と標的配列間でハイブリダイゼーションを可能にしつつ伸長に対する遮断として作用し得るのであればかなり変動させ得る。リンカーは、約2個の炭素から任意数の炭素まで、例えば、20原子まで有することができる。リンカーは、ヘテロ原子と不飽和を含むことができる。脂肪族基、脂環式基、芳香族基又は複素環基が化学リンカー内に有してもよい。便利には、-(CH2)n-を含んでいる。しかしながら、水溶解性の維持を援助する-O-、-CHOH-、-COO-、又は-CH2CH2-O-のような他の基を含んでもよい。
【0018】
リンカーのポリヌクレオチドの糖基への結合は、シッフ塩基によって予め選ばれた塩基の脱プリン又は脱ピリミジン後に1' アルデヒドに結合することができ、糖がリボースの場合には2' ヒドロキシに結合することができる。リン酸部分へのリンカーアームの結合は、例えば、米国特許第4,469,863号に記載されていようにリン酸基のアルキル化によることができる。
化学リンカーをポリヌクレオチドの塩基の基に結合するために、ポリヌクレオチドを生成する前に塩基に結合してもよいことは好ましいことである。これは、リンカーを塩基に結合するのに必要とされてもよい反応条件がポリヌクレオチド内で望ましくない副反応を引き起こしてしまうからである。更に、ポリヌクレオチドレベルでの結合が一様でない再生不可能な収量を与えることがある。ヌクレオチド又はヌクレオチドレベルでの結合は、修飾ヌクレオチド又はヌクレオチドを、まず精製し、次にポリヌクレオチドに組込ませる。組込みは、クローニング、例えば、M13ベクター中でのクローニングによるか又はポリヌクレオチドシンセサイザー装置における常法での合成によることができる。
【0019】
リンカーを糖の1' アルデヒドに結合する場合、ポリヌクレオチドプローブのポリヌクレオチド部分の形成後にリンカーを適切に結合する。これは、糖の結合には糖の1' 位に遊離アルデヒドを必要とするためである。遊離アルデヒドは、脱プリン又は脱ピリミジンによって生成される。塩基を含まずに糖とリン酸を含んでいる基は、ポリメラーゼ酵素の基質ではない。従って、まず、所望のポリヌクレオチド配列を選択的に脱プリン又は脱ピリミジンさせ、次に、リンカーを糖にアルデヒドによって結合させることにより、リンカーを結合させなければならない。リンカーをリボース糖の2' ヒドロキシ基に結合する場合、リンカーは、ヌクレオシド、ヌクレオチド又はポリヌクレオチドのレベルで結合し得る。
これは、リンカーで修飾したヌクレオチドがポリヌクレオチドシンセサイザー装置によってポリヌクレオチドに組込み得るからである。リンカーアームがリン酸基に結合する場合、リンカーアームは、好ましくは、ヌクレオシド又はヌクレオチドのレベルで結合するので、結合はリン酸基以外の位置ではない。リンカーをポリヌクレオチドの5' 又は3' 端に組込むために核酸シンセサイザーにおいてホスホルアミダイト技術を用いることができる。
【0020】
特に、リンカーは、エチレングリコール、例えば、Hexエチレングリコールの多重形を含んでいる。そのようなリンカーは、構造-(CHOH-CHOH)n-(nは1を超える整数、例えば、1〜10、適切には6である。)であってもよい。
リンカー基を含んでいるプローブは、オズウェル社(Oswell Ltd)、英国から入手し得る。
本発明の方法は、その適用に非常に反応しやすい。本方法は、後に詳述されるように、試料中の標的核酸配列に関して定量的データと定性的データ双方をつくるために使用し得る。特に、本発明は、定量的増幅を与えるだけでなく、更に又は代わりに、二重らせんの不安定化温度又は融点のような確認するデータを得るために使用し得る。
本発明の方法においては、標識プローブは、増幅プローブとともに欠くことのできないものであるので、増幅反応の過程全体に存在する。プロセスは、すべての試薬が最初に添加された単一容器内で増幅とモニターが行われ得るという点で、均質な方法で検出を行うことができる。後続の試薬添加段階は必要としない。固体支持体(これは後述されるように選択であるが)の存在下に本方法を行うことも求められていない。
【0021】
プローブが増幅反応全体に存在するので、蛍光シグナルによって増幅反応の進行をモニターすることができる。これにより、試料中に存在する標的配列の量を定量する手段を与えることができる。
増幅反応の各サイクル中、標的配列とプローブ領域を有するアンプリコン鎖によって受容体シグナルが生じる。その試料中のアンプリコンの量が増加するにつれて、受容体シグナルが増加する。サイクルについて増加率をプロットすることにより、増加の開始点を求めることができる。
標識プローブは、DNA又はRNAのような核酸分子を含むことができ、一本鎖の形にあるときの標的核酸配列に対してハイブリッド形成する。この場合、段階(b)は、標的核酸を一本鎖にする条件の使用を必要とする。また、プローブは、ぺプチド核酸又は二本鎖の形でも標的配列を結合する他の核酸類縁体のような分子を含むこともできる。
特に、用いられる増幅は、PCR又はLCRのような、試料中に存在する標的核酸配列のいずれもが一本鎖になる条件に試料を供する段階を必要とする。次に、プローブ領域は、適切なハイブリダイゼーション条件が起こるのであれば増幅反応の過程でそれを含むアンプリコン鎖の下流領域に対してハイブリッド形成することが可能である。
【0022】
好適実施態様においては、増幅反応の各サイクルでこれらの条件を満たすようにプローブを設計することができる。従って、増幅反応の各サイクル中の点で、プローブは標的配列に対してハイブリッド形成し、FET又はFRETの結果としてシグナルを生じる。増幅が進行するのにつれて、プローブ領域が下流配列から分離又は融解するので、受容標識によって生じるシグナルは、供与分子を含むか受容分子を含むかによって減少又は増加する。例えば、受容体である場合、増幅の各サイクルにおいて受容標識からの蛍光ピークが生じる。ピークの強さは、プローブを含むアンプリコン鎖が利用できることから増幅が進行するにつれて増加する。
各サイクルで試料からの受容標識の蛍光をモニターすることにより、増幅反応の進行がさまざまな方法でモニターし得る。例えば、融解ピークによって得られるデータは、例えば、その融解ピーク下の面積を計算することにより分析することができ、このデータはサイクル数に対してプロットされ得る。
蛍光は、既知の蛍光光度計を用いて適切にモニターされる。これらからのシグナルは、例えば、光電子倍増電圧の形で、データプロセッサボードに送られ、各試料管と関連があるスペクトルに変換される。多重管、例えば、96管を同時に評価し得る。データは、この方法で反応全体で頻繁な間隔で、例えば、10回おきに収集し得る。
【0023】
この方法で生じたスペクトルを、例えば、色素のような予め選ばれた蛍光部分の『一致』を用いて分割することができ、各シグナル部分(即ち、ヌクレオチド標識及び/又はプローブ標識)の代表的なピークを生じる。ピーク下の面積を求めて各シグナルに対する強度値を示すことができ、必要な場合には、相互に商として表すことができる。シグナル強度及び/又は比率の差によって、FET又はFRETの変化を反応によって又は温度のような異なる反応条件で記録することができる。微分ピーク下の面積の積分によって、FET又はFRET作用の強度値を計算することができる。
このデータによって、試料中に存在する標的核酸の量を定量する手段が示される。
プライマー/標識プローブ試薬は、溶液中に遊離していてもよく、固体支持体、例えば、産物を分離するのに有効な磁気ビーズのようなビーズの表面、又は表面プラスモン共鳴検出器の導波管のような検出装置の表面上に固定化されてもよい。その選択は、調べる具体的な分析の種類や用いられる具体的な検出手段に左右される。
プローブは、増幅反応に用いられるDNAポリメラーゼによって加水分解され、よって受容分子を遊離するように設計することができる。これにより、累積したシグナルが得られ、遊離プローブ標識量がシステム内に存在し、各サイクルとともに増加する。しかしながら、この分析において、シグナルがプローブの加水分解に左右されないこの方法においてはプローブが消費されることは必要でない。
【0024】
適切には、プローブは、標的配列から無傷で遊離され、適切なハイブリダイゼーション条件が増幅反応中に満たされる場合に再び結合し得るように設計される。これは、例えば、増幅反応の伸長相であってもよい。しかしながら、シグナルがプローブ加水分解に左右されないので、プローブは、増幅サイクル中の段階でハイブリッド形成するとともに標的配列から融解するように設計されてもよい。特に、プローブは、増幅反応による妨害ができるだけ少なくすることを確実にする反応の伸長温度より高い温度でハイブリッド形成するように設計される。
これにより、反応の各段階に有する増幅産物の量に直接関係する十分に可逆的なシグナルが得られる。更に、反応速度が非常に重要である場合、例えば、急速PCRにおいてには、検出されるアンプリコン鎖とともに欠くことのできないプローブがそれに対して急速にハイブリッド形成し得るので有利である。
この方法で作成されるデータは、様々な方法で説明し得る。その最も単純な形においては、増幅反応の過程で又は終わりに受容分子の蛍光の増加は、増幅反応が進行したので標的配列が実際に試料中に存在するという事実を示す、標的配列の存在量の増加を示している。しかしながら、上記のように、増幅反応全体にモニターすることにより定量が可能である。更に、後述されるように配列についての情報を得るために、終点測定としてか又は全体で確認データや特に融点分析を得ることが可能である。
【0025】
従って、本発明の好適実施態様は、核酸増幅を検出する方法であって、(a)核酸ポリメラーゼ、(b)少なくとも1つが第1標識で標識されている一組のヌクレオチド及び(c)一本鎖の形にあるときの標的配列に対してハイブリッド形成することができかつ第2標識を有しているプローブに化学結合基によって5' 端で結合している増幅プライマーを含んでいる試薬の存在下に標的ポリヌクレオチドについて核酸増幅を行い、標識した前記プローブが、増幅産物の相補的領域に対してハイブリッド形成することができるように前記標的配列と同様の配列を有し、該第1標識又は該第2標識の一方が、供与分子からの蛍光エネルギーを吸収しうる受容標識を含んでいる該第1標識又は該第2標識のもう一方に供与し得る供与標識を含み、前記プライマーが前記標的ポリヌクレオチドに対してハイブリッド形成し得る段階; 及び増幅反応中の蛍光の変化をモニターする段階を含む、前記方法を含んでいる。適切には、受容標識は、それ自体蛍光であり、固有の波長において蛍光エネルギーを放射する。
増幅は、適切には、当該技術において十分に理解されるようにDNA鎖内の標的ヌクレオチド配列のみが増幅されるように設計されている一対のプライマーを用いて行われる。核酸ポリメラーゼは、適切には、Taqポリメラーゼのような熱安定ポリメラーゼである。
【0026】
増幅反応を行うことができる適切な条件は、当該技術において周知である。最適条件は、それぞれの場合において可変であってもよく、必要とされる具体的なアンプリコン、用いられるプライマーの種類又は用いられる酵素に左右される。最適条件は、それぞれの場合において当業者が決定することができる。典型的な変性温度は95℃程度であり、典型的なアニーリング温度は55℃程度であり、伸長温度は72℃程度である。
本発明の具体的な実施態様においては、標識したプローブは、薬剤発見に用いることができるRNA転写物を定量するために、例えば、発現実験において用いることができる。特に、本実施態様は、真核生物体からの組織における発現実験に適している。真核細胞におけるタンパク質をコードしているDNAは、イントロン、DNA配列の非コード領域、及びタンパク質配列をコードしているエキソンを含んでいてもよい。非コードイントロン配列は、細胞の『スプライシング』プロセス中にDNA配列から誘導されるRNA配列から除去される。PCRプライマーは、通常は、コード領域に標的があり、逆転写酵素PCRが全核酸抽出物について用いられる場合、産物はDNA依存性増幅とRNA依存性増幅双方から得られる。従って、発現実験に用いられる場合、PCRのみがゲノムDNAと発現したRNAから得られる増幅を有する。
【0027】
コードエキソンの隣接末端領域についてイントロンを横切って結合するように設計されている標識したプローブは、イントロン領域のために相互作用が制限される。スプライスRNAはこれらの領域が除去されているので、コードエキソンの隣接末端領域は、連続配列をなし、プローブ領域の効率のよい結合を可能にする。
逆に、プローブ領域がイントロン領域を結合するように設計されている場合には、ゲノムDNAの増幅産物だけを検出することができる。そのようなプローブから生じるシグナルは、DNA濃度にのみ関係し、試料のRNA濃度に関係しない。
従って、実施態様においては、更に、プローブ領域は、RNAのスプライス領域か又はDNAのイントロンに特異的であるので、増幅RNA又は増幅DNAの一方のみが検出及び/又は定量される。
代わりに又は更に、本発明の方法は、配列の特徴を求めるハイブリダイゼーション分析に使用し得る。従って、態様においては、更に、本発明は、配列の特徴を決定する方法であって、(a)少なくとも一方が第1標識で標識されている一組のヌクレオチド、及び標的配列の領域と同様の配列を含みかつ第2標識を更に含んでいるプローブに化学結合によって5' 端で結合している増幅プライマーを含んでいる試薬を用いて前記配列を増幅し、前記第1標識又は前記第2標識の一方が供与標識であり、もう一方が受容標識であり、該供与標識が蛍光エネルギーを該受容標識に供与することができ、その結果、プローブ領域を組込んでいる増幅産物を形成する段階、(b)増幅産物を、該プローブ領域が該増幅産物の相補的領域に対してハイブリッド形成する条件に供する段階、及び(c)前記試料の蛍光をモニターするとともに、該試料に対する該プローブ領域のハイブリダイゼーション又は該プローブ領域と標的核酸配列間に形成された二重らせんの不安定化の結果として蛍光が変化する、前記配列に特有の具体的な反応条件を求める段階を含む、前記方法を提供する。
【0028】
適切な反応条件としては、温度、電気化学、又は具体的な酵素又は化学薬品の存在に対する応答が含まれる。蛍光の変化をこれらの特性が変化するにつれてモニターすることにより、配列の正確な種類に特有な情報を得ることができる。例えば、温度の場合には、プローブが加熱の結果として試料中の配列から分離する温度を求めることができる。このことは、遺伝子診断において多型性及び/又は対立遺伝子の変化を検出及び所望される場合には定量するのに非常に有効になり得る。『多型性』とは、配列に起こることができる、特に天然に起こることができる転移、トランスバージョン、挿入、逆位の欠失が含まれる。
融解のヒステリシスは、標的配列が唯一の塩基対によって変化する場合には異なる。従って、例えば、試料が単一の対立遺伝子変異体のみを有する場合、プローブ領域の融解温度は、他の対立遺伝子変異体のみを有する試料中に見出されるものと異なる特定値となる。両方の対立遺伝子変異体を有する試料は、対立遺伝子変異体のそれぞれに対応する2つの融点を示す。同様の考察が電気化学的性質について、又はある種の酵素又は化学薬品の存在に当てはまる。標識プローブは、電気化学ポテンシャルを加えることができる固体表面上に固定化することができる。下流の標的配列は、配列の正確な種類によって特定の電気化学値でプローブに結合し、プローブから反発もする。
【0029】
更に、プローブハイブリダイゼーションの速度論は、絶対項で標的配列濃度の定量を可能にする。試料からの蛍光の変化により、試料に対するプローブ領域のハイブリダイゼーション速度を計算することができる。ハイブリダイゼーション速度の増加は、試料中に有する標的配列の量に関係する。増幅反応が進行するにつれて標的配列の濃度が高くなるので、プローブ領域のハイブリダイゼーションは急速に起こる。従って、このパラメータは、定量化の根拠として用いることができる。このデータ処理方式は、シグナル強度に直接依存せずに情報を得る点で有効である。
本発明の態様は、更に、本発明の方法に用いられるキットを含んでいる。そのキットは、増幅プライマーの5' 端に結合した標識、特に受容標識を含む標的ヌクレオチド配列に特異的なプローブを有する。所望される場合には、プローブは、ビーズ、例えば、磁気ビーズのような支持体、又は消失性波形検出装置の導波管のような検出器に用いられる支持体上に固定化し得る。
【0030】
更に、キットは、1つ以上の標識ヌクレオチド、特に前記受容標識と適合する蛍光標識ヌクレオチドを含むことができる。キットの他の潜在的成分としては、DNAポリメラーゼのような増殖反応に用いられる試薬が含まれる。
非蛍光受容分子の使用は、同時係属国際特許出願第PCT/GB990504号に記載される分析に用いることができる。
従って、態様においては、本発明は、更に、試料中の標的核酸配列の存在を検出する方法であって、(a)少なくとも1つが第1標識で標識されている一組のヌクレオチドを用いて前記試料を増幅反応に供する段階、(b)増幅産物とプローブとを、第2標識分子を含んでいる該プローブが前記標的配列に対してハイブリッド形成する条件下で接触させ、前記第1標識又は前記第2標識の一方が蛍光分子であり、もう一方が蛍光エネルギーを受容し得る非蛍光分子である段階及び(c)前記試料の蛍光をモニターする段階を含んでいる、前記方法を提供する。
適切には、非蛍光レベルは、DABCYL、マルリック(メチル)レッド又はQSY-7ジアリールローダミン色素である。非蛍光標識は、好ましくは第2標識であり、プローブについて標識される。
【0031】
ここで、本発明を、添付の図面によって一例として特に記載する。
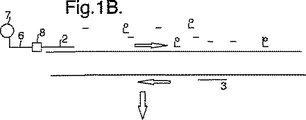
図1は、本発明の方法で行われる相互作用を示す概略図である。
図示した増幅反応においては、DNA分子(1)を一組の増幅プライマー(2)、(3)及び一部が蛍光標識(5)で標識している一組のヌクレオチド(4)と接触させることにより増幅用に調製する。プライマー(2)の一方を受容標識(7)を含むプローブ(6)に化学結合によって結合する。
DNA分子(1)を一本鎖にし(図1B)、そのときプライマー(2、3)は、周知である増幅反応において前進プライマーと逆プライマーとして結合する。
続いての増幅反応の過程で、アンプリコン産物(9)が作製される(図1C)。標識及び非標識双方のヌクレオチドが形成される産物に組込まれている。アンプリコン鎖のかなりの割合が標識プローブ領域(6、7)を含んでいる。
この産物を続いての増幅相で融解したときに、受容分子(7)を含むプローブ領域(6)はアンプリコン鎖内で標的配列を結合する。蛍光ヌクレオチドと受容分子(7)間のFRET相互作用によって、受容体に固有の波長でシグナルが生成する。
次に、受容分子(7)からのシグナルを、慣用の蛍光検出装置を用いてモニターし得る。
【図面の簡単な説明】
【図1A】 本発明の方法で行われる相互作用を示す概略図である。
【図1B】 本発明の方法で行われる相互作用を示す概略図である。
【図1C】 本発明の方法で行われる相互作用を示す概略図である。
【図1D】 本発明の方法で行われる相互作用を示す概略図である。
Claims (16)
- 試料中の標的核酸配列の存在を検出する方法であって、
少なくとも1つが第1標識で標識されている一組のヌクレオチド、及び一本鎖の形にあるときの前記標的核酸配列に対してハイブリッド形成することができかつ第2標識を有しているプローブに、DNAポリメラーゼにより認識されない化学結合基によって5' 端で結合している増幅プライマーを含んでいる試薬を用いて
前記試料を、前記標的核酸が増幅される増幅反応に供し、
標識した前記プローブが、増幅産物の相補的領域に対してハイブリッド形成することができ、蛍光エネルギーが該第1標識と該第2標識の間で移動することができるように前記標的配列と同様の配列を有し、
該第1標識又は該第2標識の一方が供与標識を含み、もう一方が受容標識を含み、
該供与標識が蛍光エネルギーを該受容標識に供与し得る蛍光分子を含んでいる段階; 及び
前記試料の蛍光をモニターする段階
を含む、前記方法。 - 前記第1標識が供与標識を含み、前記第2標識がその受容標識を含んでいる、請求項1記載の方法。
- 該受容標識が、固有の波長でエネルギーを放射する蛍光分子である、請求項1又は2記載の方法。
- 該受容標識がローダミン色素又はCy5のような他の色素である、請求項3記載の方法。
- 該受容標識がDABCYL、メチルレッド又はQSY-7ジアリールローダミン色素のような暗受容体である、請求項1又は2記載の方法。
- 標識した該ヌクレオチドが標識ウラシル含有ヌクレオチドである、請求項1〜5のいずれか1項に記載の方法。
- 該増幅反応に用いられるすべてのヌクレオチドが標識されている、請求項1〜6のいずれか1項に記載の方法。
- 該増幅反応がポリメラーゼ連鎖反応(PCR)を含んでいる、請求項1〜7のいずれか1項に記載の方法。
- 該受容分子が蛍光分子であり、該供与分子と該受容分子双方の蛍光をモニターし、発光間の関係を計算する、請求項1〜8のいずれか1項に記載の方法。
- 蛍光の変化を該増幅反応中に検出し、その結果が核酸増幅反応の生起を検出するために用いられる、請求項1記載の方法。
- 該試料からの蛍光シグナルを該増幅反応全体でモニターし、その結果が該試料中に存在する標的配列量を定量するために用いられる、請求項1〜10のいずれか1項に記載の方法。
- DNA鎖内の標的ヌクレオチド配列のみが増幅されるように設計されている一対のプライマーを用いて増幅が行われる、請求項11記載の方法。
- 該プローブがRNAのスプライス領域か又はDNAのイントロンに特異的であるので、増幅したRNA又は増幅したDNAの一方だけが検出及び/又は定量される、請求項1〜12のいずれか1項に記載の方法。
- 配列の特徴を決定する方法であって、
(a)少なくとも一方が第1標識で標識されている一組のヌクレオチド、及び標的配列の領域と同様の配列を含みかつ第2標識を更に含んでいるプローブに、DNAポリメラーゼにより認識されない化学結合基によって5' 端で結合している増幅プライマーを含んでいる試薬を用いて前記配列を増幅し、
前記第1標識又は前記第2標識の一方が供与標識であり、もう一方が受容標識であり、
該供与標識が蛍光エネルギーを該受容標識に供与することができ、その結果、プローブ領域に、DNAポリメラーゼにより認識されない化学結合基によって5' 端で結合している増幅産物を形成する段階、
(b)増幅産物を、該プローブ領域が該増幅産物の相補的領域に対して、蛍光エネルギーが該第1標識と該第2標識の間で移動することができるようにハイブリッド形成する条件に供する段階、及び
(c)前記試料の蛍光をモニターするとともに、該試料に対する該プローブ領域のハイブリダイゼーション又は該プローブ領域と標的核酸配列間に形成された二重らせんの不安定化の結果として蛍光が変化する、前記配列に特有の具体的な反応条件を求める段階
を含む、前記方法。 - 決定される特徴が多型性及び/又は対立遺伝子変化の存在である請求項14記載の方法であって、
請求項1記載の方法を用いて前記多型性又は変化を含むことが疑われる配列を増幅する段階、
生成した蛍光シグナルを用いて増幅産物内の相補的配列からプローブ領域が融解する温度を測定する段階、及び
これを多型性及び/又は対立遺伝子変化の存在に関係させる段階
を含む、前記方法。 - 標識を含むプローブであって、標的ヌクレオチド配列に特異的なプローブに、DNAポリメラーゼにより認識されない化学結合基によって5' 端で結合している増幅プライマーを含んでいる試薬; 及びヌクレオチド上の標識が該プローブ上の標識と相互作用し得る標識したヌクレオチドを含む、請求項1〜15のいずれか1項に記載の方法に用いられるキット。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB9918237.0 | 1999-08-04 | ||
| GBGB9918237.0A GB9918237D0 (en) | 1999-08-04 | 1999-08-04 | Detection system |
| PCT/GB2000/003016 WO2001011078A1 (en) | 1999-08-04 | 2000-08-03 | Amplification method for detection of target nucleic acids involving fluorescence energy transfer |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2003506068A JP2003506068A (ja) | 2003-02-18 |
| JP2003506068A5 JP2003506068A5 (ja) | 2007-09-27 |
| JP4628625B2 true JP4628625B2 (ja) | 2011-02-09 |
Family
ID=10858467
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2001515326A Expired - Fee Related JP4628625B2 (ja) | 1999-08-04 | 2000-08-03 | 蛍光エネルギー移動を含む標的核酸を検出するための増幅方法 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US7015018B1 (ja) |
| EP (1) | EP1198593B1 (ja) |
| JP (1) | JP4628625B2 (ja) |
| AT (1) | ATE287969T1 (ja) |
| AU (1) | AU774766B2 (ja) |
| CA (1) | CA2381037C (ja) |
| DE (1) | DE60017750T2 (ja) |
| ES (1) | ES2245315T3 (ja) |
| GB (1) | GB9918237D0 (ja) |
| WO (1) | WO2001011078A1 (ja) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1377683A4 (en) * | 2001-04-11 | 2004-09-08 | Us Gov Health & Human Serv | MODIFIED RANDOM SPRAYERS FOR PROBE MARKING |
| GB0112868D0 (en) * | 2001-05-25 | 2001-07-18 | Secr Defence | Detection system |
| EP1509624A2 (en) * | 2002-05-31 | 2005-03-02 | Secretary, Department Of Atomic Energy | Met/fret based method of target nucleic acid detection whereby the donor/acceptor moieties are on complementary strands |
| US8658366B2 (en) | 2008-09-18 | 2014-02-25 | Roche Molecular Systems, Inc. | Detection of target variants using a fluorescent label and a soluble quencher |
| WO2012102260A1 (ja) | 2011-01-26 | 2012-08-02 | オリンパス株式会社 | 核酸分子の多型識別方法 |
| CN103339256B (zh) | 2011-01-26 | 2016-03-16 | 奥林巴斯株式会社 | 鉴别核酸分子多态性的方法 |
| CN112266950A (zh) * | 2020-10-23 | 2021-01-26 | 深圳澳东检验检测科技有限公司 | 一种探针引物组合及其检测试剂盒 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE69207580T2 (de) * | 1992-03-23 | 1996-08-08 | Hoffmann La Roche | Verfahren zum DNS-Nachweis |
| US6117635A (en) * | 1996-07-16 | 2000-09-12 | Intergen Company | Nucleic acid amplification oligonucleotides with molecular energy transfer labels and methods based thereon |
| GB9725237D0 (en) * | 1997-11-29 | 1998-01-28 | Secr Defence | Amplification system |
| GB9803382D0 (en) * | 1998-02-19 | 1998-04-15 | Secr Defence | Detection system |
| GB9812768D0 (en) * | 1998-06-13 | 1998-08-12 | Zeneca Ltd | Methods |
| US6440675B1 (en) * | 1999-09-17 | 2002-08-27 | Whitehead Institute For Biomedical Research | Methods for selecting primers |
-
1999
- 1999-08-04 GB GBGB9918237.0A patent/GB9918237D0/en not_active Ceased
-
2000
- 2000-08-03 AU AU64558/00A patent/AU774766B2/en not_active Ceased
- 2000-08-03 US US10/048,752 patent/US7015018B1/en not_active Expired - Fee Related
- 2000-08-03 AT AT00951700T patent/ATE287969T1/de not_active IP Right Cessation
- 2000-08-03 EP EP00951700A patent/EP1198593B1/en not_active Expired - Lifetime
- 2000-08-03 ES ES00951700T patent/ES2245315T3/es not_active Expired - Lifetime
- 2000-08-03 CA CA2381037A patent/CA2381037C/en not_active Expired - Fee Related
- 2000-08-03 DE DE60017750T patent/DE60017750T2/de not_active Expired - Lifetime
- 2000-08-03 WO PCT/GB2000/003016 patent/WO2001011078A1/en active IP Right Grant
- 2000-08-03 JP JP2001515326A patent/JP4628625B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| ATE287969T1 (de) | 2005-02-15 |
| AU6455800A (en) | 2001-03-05 |
| ES2245315T3 (es) | 2006-01-01 |
| WO2001011078A8 (en) | 2001-06-14 |
| DE60017750D1 (de) | 2005-03-03 |
| CA2381037A1 (en) | 2001-02-15 |
| JP2003506068A (ja) | 2003-02-18 |
| EP1198593A1 (en) | 2002-04-24 |
| EP1198593B1 (en) | 2005-01-26 |
| US7015018B1 (en) | 2006-03-21 |
| GB9918237D0 (en) | 1999-10-06 |
| WO2001011078A1 (en) | 2001-02-15 |
| AU774766B2 (en) | 2004-07-08 |
| CA2381037C (en) | 2011-04-12 |
| DE60017750T2 (de) | 2005-12-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US6287781B1 (en) | Method for detection of target nucleic acids using PCR | |
| JP4457001B2 (ja) | ドナー/アクセプター部分が相補鎖上となる標的核酸検出のmet/fretに基づく方法 | |
| JP5685561B2 (ja) | 核酸の検出用物質及び検出方法 | |
| JP4540844B2 (ja) | 核酸の蛍光定量的検出システム | |
| EP2316975A1 (en) | Asynchronous primed PCR | |
| US20100227326A1 (en) | Detection System | |
| AU2002311414A1 (en) | Nucleic acid detection method | |
| JP2004532044A5 (ja) | ||
| JP4628625B2 (ja) | 蛍光エネルギー移動を含む標的核酸を検出するための増幅方法 | |
| US20050176014A1 (en) | Fluorescent hybridization probes with reduced background | |
| JP2003508064A (ja) | 核酸増幅時の外因性コントロール、内部コントロールのための方法 | |
| JP3647109B2 (ja) | Dna検出法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070803 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070803 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100513 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100813 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20101021 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20101110 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20131119 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |