JP4518754B2 - ヌクレオチド鎖修飾方法 - Google Patents
ヌクレオチド鎖修飾方法 Download PDFInfo
- Publication number
- JP4518754B2 JP4518754B2 JP2003186151A JP2003186151A JP4518754B2 JP 4518754 B2 JP4518754 B2 JP 4518754B2 JP 2003186151 A JP2003186151 A JP 2003186151A JP 2003186151 A JP2003186151 A JP 2003186151A JP 4518754 B2 JP4518754 B2 JP 4518754B2
- Authority
- JP
- Japan
- Prior art keywords
- nucleotide chain
- nucleotide
- modifying
- modified
- substance
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Landscapes
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Description
【発明の属する技術分野】
本発明は、ヌクレオチド鎖修飾方法に関するものであり、特にヌクレオチド鎖の3´末端を修飾物質で直接的に修飾して、ヌクレオチド鎖をラベル化、標識化、固定化する方法に関する。
【0002】
【従来の技術】
従来、遺伝子解析において、DNA、RNA、オリゴヌクレオチド、核酸等のヌクレオチド鎖をラベル化、標識化するための修飾物質として、放射性同位元素が採用されてきたが、半減期による取扱期間の制限、取扱場所の制限、被爆の問題、廃棄の問題等があるため、その利用は減少傾向にある。近年では、放射性同位元素に代替する修飾物質として、フルオレセイン等の蛍光物質あるいはビオチン等を用いて、ヌクレオチド鎖を修飾し、ラベル化、標識化する方法が汎用されるようになっている。ヌクレオチド鎖を修飾する方法は、5´末端修飾法、3´末端修飾法、内部修飾法の3つに大別できる。
【0003】
5´末端修飾法としては、5´末端のリン酸基を介してビオチンで修飾する方法が考案されており(例えば、非特許文献1参照)、さらに、ビオチンとアビジンとの高親和性を利用して、アルカリフォスファターゼ、西洋ワサビペルオキシダーゼ等の酵素で修飾することにより、これら酵素の化学発光を用いて遺伝子解析を高感度化する方法が報告されている(例えば、非特許文献2〜3参照)。ヌクレオチドの5´末端のリン酸基を介した修飾方法は、これら以外にも多数提案されている(例えば、特許文献1及び非特許文献4〜13参照)。
【0004】
しかし5´末端のリン酸基を介した修飾方法においては、ヌクレオチド鎖への修飾物質の修飾量は基本的に1つであり、その一方で高感度化を実現するために使用するアルカリフォスファターゼはヌクレオチドの5´末端のリン酸基を解離させるので、ヌクレオチド鎖の5´末端修飾とアルカリフォスファターゼ利用との組み合せは基本的に避ける必要がある。またアルカリフォスファターゼは、空気中に浮遊する細菌中にも存在するので、遺伝子解析中に夾雑した場合には、5´末端のリン酸基に結合した修飾物質が解離しやすい等、修飾状態に安定性を欠くのみならず、バックグランドノイズの要因になるという課題がある。
【0005】
ヌクレオチドの3´末端修飾法としては、予めラベル化、標識化処理を施したデオキシヌクレオチド三リン酸あるいはジデオキシヌクレオチド三リン酸を合成し(例えば、非特許文献14及び特許文献2参照)、このラベル化、標識化ヌクレオチドをターミナルデオキシヌクレオチジルトランスフェラーゼによりヌクレオチド鎖の3´側に付加させるテーリング法が開発されている(例えば、特許文献3及び非特許文献15〜18参照)。
【0006】
このような3´末端修飾法は、5´末端修飾法に比べて修飾物質の保持安定性が高く、汎用されているが、デオキシヌクレオチド三リン酸あるいはジデオキシヌクレオチド三リン酸のラベル化、標識化処理が煩雑であるため、任意のラベル化、標識化処理体は誰にでも容易に得られるものではなく、結果として修飾物質の種類が限定される。また、テーリング段階でヌクレオチド鎖の3´側に不要なヌクレオチド配列が付加するため、特にデオキシヌクレオチド三リン酸を利用した場合に反応条件によってヌクレオチドの付加数がランダムになるため(例えば、非特許文献19参照)、遺伝子解析の高感度化は実現できるものの、定量性に課題がある。また3´側に付加した不要な塩基配列は、遺伝子解析のハイブリダイゼーションの際にミスマッチの要因となる課題がある。
【0007】
他の3´末端修飾法として、化学合成ヌクレオチド鎖を作成する合成初期に、3´末端のヌクレオチドに直接的に、ラベル化、標識化のための修飾物質を結合させる方法もあり、ヌクレオチド鎖への修飾物質の高い保持安定性を実現している。しかし化学合成で得られるヌクレオチド鎖のヌクレオチド数は、合成副産物、収率等の合成能力の関係で100程度であり、ここで使用されている3´末端への直接的な修飾物質の結合方法を、生体抽出及びPCR等で増幅したヌクレオチド数100を超えるヌクレオチド鎖の3´末端修飾に適用することはできない。つまり、修飾されるヌクレオチド鎖の鎖長に制限がある、という課題がある。
【0008】
内部修飾法としては、ヌクレオチド鎖を複製させる反応の際に、ラベル化、標識化のための修飾物質で予め修飾処理を施したデオキシヌクレオチド三リン酸をヌクレオチド鎖内に取り込ませることで、ヌクレオチド鎖をラベル化、標識化するランダムプライマー法あるいはニックトランスレーション法が開発されている(例えば、特許文献4及び非特許文献20〜22参照)。
【0009】
これらの方法は、遺伝子増幅反応であるポリメラーゼ連鎖反応いわゆるPCR法(例えば、特許文献5〜8及び非特許文献23〜25参照)と組み合わせることで、ヌクレオチド鎖の増幅とラベル化、標識化とを同時に行なうことが可能であり(例えば、非特許文献26参照)、遺伝子解析の高感度化をもたらし、定量性も報告されており、遺伝子マイクロアレイに代表される遺伝子解析のハイスループット化を実現している(例えば、特許文献9及び非特許文献27〜29参照)。
【0010】
これらランダムプライマー法、ニックトランスレーション法及びPCR法においては、ヌクレオチドの取り込み効率、修飾ヌクレオチド合成等の点から、チミジン塩基に替えてウラシル塩基あるいは予め蛍光物質などでラベル化、標識化したウラシル塩基を取り込んだヌクレオチド鎖の形成が繁用されている。さらにウラシル塩基に代替する利点として、PCR法の際に、反応混液中に夾雑する外因性汚染由来のヌクレオチド鎖にウラシル塩基を取り込ませ、ウラシルDNAグリコシラーゼを作用させることで、汚染由来のヌクレオチド鎖の増幅を防止する方法もある(例えば、特許文献11〜13及び非特許文献31〜33参照)。
【0011】
しかしこれらの方法は、ヌクレオチド鎖内へのラベル化、標識化されたヌクレオチドの取り込み数が10〜2,30程度(例えば、非特許文献30参照)とランダムであり、完全な定量化には課題がある。また3´末端修飾法であるテーリング法と同様に、ヌクレオチド鎖内に取り込ませるためのデオキシヌクレオチド三リン酸のラベル化、標識化処理が煩雑であるため、任意のラベル化、標識化処理体は誰にでも容易に得られるものではなく、結果として修飾物質の種類が限定される。さらに、ヌクレオチド鎖内に修飾物質が取り込まれているため、遺伝子解析のハイブリダイゼーションの際に、つまりヌクレオチド鎖の二本鎖形成の際に、取り込まれた修飾物質による立体障害を回避できない課題がある。
【0012】
ヌクレオチド鎖の修飾は、ラベル化、標識化の他に、ヌクレオチド鎖を基板に固定化するために行なわれている。ヌクレオチド鎖の5´末端あるいは3´末端にアミノ基、アルデヒド基等の官能基を持たせる修飾処理を施し、ガラス、シリコンなどの基板の表面を、ヌクレオチド鎖の末端がアミノ基である時はアルデヒド基あるいはエポキシ基になるように、またヌクレオチド鎖の末端がアルデヒド基である時はアミノ基になるように、処理を施すことにより、ヌクレオチド鎖を基板に固定化するのである。このようにして配列の異なるヌクレオチド鎖を基板単位面積当たり多数固定化することにより、遺伝子解析マイクロアレイを実現している。
【0013】
基板に固定化したヌクレオチド鎖を安定に保持するためには、上述したようにヌクレオチド鎖の3´末端を修飾することにより、アミノ基あるいはアルデヒド基を持たせるのが望ましい。そしてそのために使用可能なヌクレオチド鎖は、化学合成したヌクレオチド鎖のみである。しかしこれも上述したように、化学合成可能なヌクレオチド鎖はヌクレオチド数100程度に制限されるものであり、そのため、固定化が不安定であっても、5´末端を修飾したヌクレオチド鎖を使用しているのが現状である。
【0014】
修飾処理を施さずにヌクレオチド鎖を基板へ固定化する方法もある。基板表面を正に帯電するよう表面処理し、ヌクレオチド鎖中の負に帯電しているリン酸基を静電結合させることでヌクレオチド鎖を固定化するか、あるいは基板表面を疎水性にし、ヌクレオチド鎖を吸着結合させている。この方法を利用してヌクレオチド鎖を固定化したマイクロアレイも実現されている。
【0015】
しかしこの固定化方法では、ヌクレオチド鎖長が長くなるにしたがってヌクレオチド鎖1分子の基板占有率が高くなるため、長鎖のヌクレオチド鎖ほど基板単位面積当たりの固定化量が少なくなる課題がある。そのため、基板単位面積当たりの固定化量を向上させるにはやはり、ヌクレオチド鎖の5´末端あるいは3´末端を、基板へ固定化するための修飾物質で修飾する方法をとることになる。
【0016】
上述したヌクレオチド鎖のラベル化、標識化、固定化の課題を解決するものとして、ヌクレオチド鎖の3´末端部を直接的に修飾物質で修飾する方法が提案されている(特許文献10参照)。この方法は、ヌクレオチド鎖の3´側に2つ以上のウラシル塩基を付加させ、付加したウラシルのグリコシド結合をウラシルDNAグリコシラーゼで分解して、3´末端にアルデヒド基を形成させ、このアルデヒド基とアミノ基を有する修飾物質とを共有結合させることにより、ヌクレオチド鎖の3´末端を修飾する。
【0017】
【特許文献1】
特許1706289号公報
【0018】
【特許文献2】
特開昭61−115094号公報
【0019】
【特許文献3】
特公平7−31194号公報
【0020】
【特許文献4】
特表2000−508709号公報
【0021】
【特許文献5】
特許1814713号公報
【0022】
【特許文献6】
特許2093730号公報
【0023】
【特許文献7】
特許2093731号公報
【0024】
【特許文献8】
特許2613877号公報
【0025】
【特許文献9】
特表平10−503841号公報
【0026】
【特許文献10】
特開2003−246794公報
【0027】
【特許文献11】
特許2103155号公報
【0028】
【特許文献12】
特表2000−502251号公報
【0029】
【特許文献13】
特開平11−113599号公報
【0030】
【非特許文献1】
チュ(Chu B.C.F)ら、「ヌクレイック・アシッズ・リサーチ(Nucleic Acids Res.)」、11巻、6513頁、1983年
【0031】
【非特許文献2】
ベック(Beck.S.)、「メソッズ・イン・エンザイモロジー(Methods Enzymol.)」、216巻、143頁、1992年
【0032】
【非特許文献3】
ブロンシュタイン(Bronstein.I.)ら、「メソッズ・イン・エンザイモロジー(Methods Enzymol.)」、217巻、398頁、1993年
【0033】
【非特許文献4】
アルブス(Alves.A.M.)ら、「テトラヘドロン・レターズ(Tetrahedron Lett.)」、30巻、3089頁、1989年
【0034】
【非特許文献5】
コクッザ(Cocuzza.A.J.)、「テトラヘドロン・レターズ(Tetrahedron Lett.)」、30巻、6287頁、1989年
【0035】
【非特許文献6】
タイセン(Theisen.P.)ら、「テトラヘドロン・レターズ(Tetrahedron Lett.)」、33巻、5033頁、1992年
【0036】
【非特許文献7】
ケンプ(Kempe.T.)ら、「ヌクレイック・アシッズ・リサーチ(Nucleic Acids Res.)」、13巻、45頁、1985年
【0037】
【非特許文献8】
スミス(Smith.L.M.)ら、「ヌクレイック・アシッズ・リサーチ(Nucleic Acids Res.)」、13巻、2399頁、1985年
【0038】
【非特許文献9】
アンソージュ(Ansorge.W.)ら、「ヌクレイック・アシッズ・リサーチ(Nucleic Acids Res.)」、15巻、4593頁、1987年
【0039】
【非特許文献10】
クック(Cook.A.F.)、「ヌクレイック・アシッズ・リサーチ(Nucleic Acids Res.)」、16巻、4077頁、1988年
【0040】
【非特許文献11】
ロジェ(Roget.A)ら、「ヌクレイック・アシッズ・リサーチ(Nucleic Acids Res.)」、17巻、1989年
【0041】
【非特許文献12】
ミシウラ(Misiura.K.)ら、「ヌクレイック・アシッズ・リサーチ(Nucleic Acids Res.)」、18巻、4345頁、1990年
【0042】
【非特許文献13】
ピールス(Pieles.U.)ら、「ヌクレイック・アシッズ・リサーチ(Nucleic Acids Res.)」、18巻、4355頁、1990年
【0043】
【非特許文献14】
ランガー(Langer.P.R.)ら、「プロシーディングス・オブ・ザ・ナショナル・アカデミー・オブ・サイエンスズ(Proc.Natl.Acad.Sci.)USA」、78巻、6633頁、1981年
【0044】
【非特許文献15】
ロイコウドリー(Roychoudhury.R.)ら、「ヌクレイック・アシッズ・リサーチ(Nucleic Acids Res.)」、3巻、101頁、1976年
【0045】
【非特許文献16】
ビンセント(Vincent.C.)ら、「ヌクレイック・アシッズ・リサーチ(Nucleic Acids Res.)」、10巻、6787頁、1982年
【0046】
【非特許文献17】
ヨウサフ(Yousaf.S.I.)ら、「ジーン(Gene)」、3巻、309頁、1984年
【0047】
【非特許文献18】
シュミッツ(Schmitz.G.G.)ら、「アナリティカル・バイオケミストリー(Anal.Biochem.)」、192巻、222頁、1991年
【0048】
【非特許文献19】
ジャクソン(Jackson.D.A.)ら、「プロシーディングス・オブ・ザ・ナショナル・アカデミー・オブ・サイエンスズ(Proc.Natl.Acad.Sci.)USA」、69巻、2905頁、1972年
【0049】
【非特許文献20】
ファインバーグ(Feinberg.A.P)ら、「アナリティカル・バイオケミストリー(Anal.Biochem.)」、132巻、6頁、1983年
【0050】
【非特許文献21】
ファインバーグ(Feinberg.A.P)ら、「アナリティカル・バイオケミストリー(Anal.Biochem.)」、137巻、266頁、1984年
【0051】
【非特許文献22】
リグビー(Rigby.P.W.J)ら、「ジャーナル・オブ・モレキュラー・バイオロジー(J.Mol.Biol.)、113巻、237頁、1977年
【0052】
【非特許文献23】
ミュリス(Mullis.K.B.)ら、「メソッズ・イン・エンザイモロジー(Methods Enzymol.)」、155巻、335頁、1987年
【0053】
【非特許文献24】
サイキ(Saiki.R.)、「サイエンス(Science)」、239巻、487頁、1988年
【0054】
【非特許文献25】
シーバート(Siebert.P.D.)ら、「ネイチャー(Nature)」、359巻、557頁、1991年
【0055】
【非特許文献26】
デイ(Day.P.J.R.)ら、「バイオケミカル・ジャーナル(Biochem.J.)、267巻、119頁、1990年
【0056】
【非特許文献27】
シェナ(Schena.M.)ら、「サイエンス(Science)」、270巻、467頁、1995年
【0057】
【非特許文献28】
シャロン(Schalon.D.)ら、「ゲノム・リサーチ(Genome Res.)」、6巻、639頁、1996年
【0058】
【非特許文献29】
核酸マイクロアレイ特集、「ネーチャージェネティックス(Nature Genet.)」、21巻 Supplement、1月、1999年
【0059】
【非特許文献30】
アマーシャム・バイオサイエンス(AmershamBiosciences)社ウェブサイト、[2003年4月14日検索]、インターネット<URL:http://www1.amershambiosciences.com/aptrix/upp01077.nsf/Content/microarrays_labelling%5Cmicroarrays_labelling_cyscribe_postlabelling?OpenDocument&hometitle=microarrays>
【0060】
【非特許文献31】
ロンゴ(Longo.M.C.)ら、「ジーン(Gene)」、93巻、125頁、1990年
【0061】
【非特許文献32】
ソーントン(Thornton.C.G.)ら、「バイオテクニクス(BioTechniques)」、13巻、180頁、1992年
【0062】
【非特許文献33】
ソベック(Sobek.H.)ら、「FEBSレターズ(FEBS Lett.)」、388巻、1頁、1996年
【0063】
【発明が解決しようとする課題】
上述したように、ヌクレオチド鎖の修飾方法には、5´末端修飾法、3´末端修飾法、及び内部修飾法の3種類があるが、それぞれに一長一短があるため、利用者は、利用目的に応じてそれぞれの方法を取捨選択しなければならないという負担がある。
【0064】
この問題を解決するものとして特許文献10記載の方法が提案されており、ヌクレオチド鎖の鎖長に関係なく、ヌクレオチド鎖の3´側を直接的に簡便に任意の修飾物質で修飾して、安定に保持可能な方法であるが、その一方で、付加したウラシルのグリコシド結合をウラシルDNAグリコシラーゼにより分解する原理から理解されるように、ヌクレオチド鎖中にウラシル塩基の配列が存在しない時しか実施できないという制約を有している。
【0065】
ところが、上述したように、ランダムプライマー法、ニックトランスレーション法及びPCR法においては、チミジン塩基に替えてウラシル塩基を取り込んだヌクレオチド鎖の形成が繁用されている。またPCR法の際に、汚染由来のヌクレオチド鎖の増幅を防止するために用いるウラシル塩基が、増幅を目的するヌクレオチド鎖にも取り込まれる。したがって、このようにウラシル塩基を取り込んだヌクレオチド鎖に対して特許文献10記載の方法を適用すると、3´側に付加したウラシルのみならずヌクレオチド鎖中のウラシルにもウラシルDNAグリコシラーゼが作用し、ヌクレオチド鎖自体が分解されてしまう。
【0066】
本発明は上記問題を解決するもので、ヌクレオチド鎖の塩基構成に関わらず、ヌクレオチド鎖の分解を伴うことなく、3´末端部に修飾物質を直接的に修飾できるヌクレオチド鎖修飾方法を提供することを目的とする。
【0067】
【課題を解決するための手段】
上記課題を解決するために本発明は、ヒポキサンチンを有したヌクレオチド配列が修飾対象のヌクレオチド鎖の3´側に形成され、前記ヒポキサンチンが前記修飾対象のヌクレオチド鎖に存在せず、前記ヒポキサンチンを有したヌクレオチドに3−メチルアデニンDNAグリコシラーゼを作用させることにより、前記修飾対象のヌクレオチド鎖の分解を回避し、配列情報を保持した状態で3´末端に修飾物質に対してアルデヒド基を形成し、前記修飾対象のヌクレオチド鎖の3´末端に直接に前記修飾物質を結合させるヌクレオチド鎖修飾方法を提供する。
【0068】
酵素基質となる特定の塩基を有したヌクレオチド配列が3´側に存在するヌクレオチド鎖を修飾対象とすることにより、前記ヌクレオチド配列部分のみを分解して、所望の修飾物質と反応して結合する官能基を形成するのである。このようにすることにより、ヌクレオチド鎖を修飾物質で直接に修飾することができ、簡便にラベル化、標識化可能となるとともに、ヌクレオチド鎖の固定化を目的とする場合には、修飾物質をリンカーとして安定、強固な固定を行なうことが可能となる。
【0069】
前記特定の塩基が前記修飾対象のヌクレオチド鎖に存在しないことが必要である。このことにより、分解酵素が作用しても主鎖部分が分解されるのを回避することができ、主鎖部分の配列情報が完全に保持された状態を維持可能となる。ヌクレオチド鎖の配列情報を定義するには、少なくとも10塩基前後のヌクレオチド配列を有することが望ましい。
【0070】
反応性を有する官能基として、アルデヒド基を形成することが必要である。
特定の塩基がヒポキサンチンであり、分解酵素が3−メチルアデニンDNAグリコシラーゼであることが必要である。特定の塩基および分解酵素は種々の組み合わせが可能であるが、たとえばウラシル塩基のヌクレオチド鎖への組み込みは、遺伝子解析の様々な手法の中で汎用されているため、これを特定の塩基として利用することは望ましくない。汎用頻度の低いヒポキサンチン塩基とその分解酵素である3−メチルアデニンDNAグリコシラーゼを利用することで、ヌクレオチド鎖の3´末端修飾を実施する際の利用者の利便性を大幅に向上することが可能となる。また、ヌクレオチド鎖の塩基の構成や鎖長に関わらず、ヌクレオチド鎖の3´末端側を直接的に簡便に、任意の修飾物質で、定量的、安定的に修飾することが可能となる。ヌクレオチド鎖内への不必要な塩基配列、修飾された塩基の取り込みを排除し、ヌクレオチド鎖の3´末端に限定して修飾物質で修飾できる方法である。
【0071】
特定の塩基を有したヌクレオチド配列は、テーリング法により付加することができる。酵素基質となる塩基を持ったヌクレオチドを意図的に付加させておく方法である。
【0072】
分解酵素を作用させるに先だって、特定の塩基と相補的な塩基配列を有するオリゴヌクレオチドを添加するのが好ましい。2本のヌクレオチドの塩基間に相補的結合を生じさせることにより、酵素の基質特異性を高めることができ、反応効率を向上させることが可能となる。
【0073】
修飾物質として、ヌクレオチド鎖をラベル化、標識化可能な物質を使用できる。これにより、修飾されたヌクレオチド鎖を、遺伝子解析における検出プローブあるいはターゲットとして使用可能である。
【0074】
また修飾物質として、遺伝子解析のための基板への結合能を有した物質を使用できる。これにより、修飾されたヌクレオチド鎖を、検出プローブあるいはターゲットとして、基板に安定に固定化することが可能となる。
【0075】
ヌクレオチド鎖の3´末端の官能基に反応する修飾物質として、アミノ基を有するものを好適に使用できる。
修飾物質として例えば、アミノ酸、オリゴペプチド、またはタンパク質を用いることができる。アミノ酸、オリゴペプチド、タンパク質は、アミノ基を有しているため、ヌクレオチド鎖の3´末端のアルデヒド基と融合させることが可能であり、これによりヌクレオチド鎖にアミノ酸、オリゴペプチド、タンパク質が有する機能を付加することができる。
【0076】
修飾物質として例えば、アミノアルカンチオールまたはアミノシランカップリング化合物を用いることができる。これら化合物は貴金属製、ガラス製あるいは樹脂製の基板に安定に結合可能である。
【0077】
【発明の実施の形態】
本発明の実施の形態を図面を参照しながら説明する。
(実施の形態1)
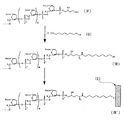
本発明の実施の形態1を図1に基づき説明する。図中、l、m及びnは、0または任意の自然数を表わし、Baseは、アデニン、グアニン、シトシン、チミン、ウラシル等の任意の塩基を示し、Hxはヒポキサンチン塩基を、Cytはシトシン塩基をそれぞれ示す。
【0078】
まず、任意の塩基配列を有するヌクレオチド鎖(I)と、2´−デオキシイノシン−5´−三リン酸(A)とに、ターミナルデオキシヌクレオチジルトランスフェラーゼを作用させることにより、ヌクレオチド鎖(I)の3´末端に、2´−デオキシイノシン−5´−三リン酸(A)由来のヒポキサンチン塩基配列が付加したヌクレオチド鎖(II)を得る。2´−デオキシイノシン−5´−三リン酸(A)は以下の構造を有する。
【0079】
【化1】
得られたヌクレオチド鎖(II)に、シトシン塩基を有した数十ヌクレオチド長のオリゴヌクレオチド鎖(B)をハイブリダイズさせることにより、ヌクレオチド鎖(III )を得る。
【0080】
この一部2本鎖となったヌクレオチド鎖(III )に3−メチルアデニンDNAグリコシラーゼII型を作用させ、アルカリ熱処理することにより、ヒポキサンチン塩基を有するヌクレオチドのグリコシド結合を切断し、残存するデオキシリボース−リン酸結合を切断して、3´末端にアルデヒド基を持ったヌクレオチド鎖(IV)を得る。
【0081】
このヌクレオチド鎖(IV)に、アミノ基を有する修飾物質(H2N−R(Rについては後述する))を反応させることにより、ヌクレオチド鎖(IV)と修飾物質とが脱水縮合したシッフ塩基、すなわち、3´末端が修飾物質で直接的に修飾されたヌクレオチド鎖(V)を得ることができる。
【0082】
なお、この実施の形態1では、ヒポキサンチン塩基を有するヌクレオチド(A)をテーリングさせ、3−メチルアデニンDNAグリコシラーゼII型を作用させる例を示したが、これに限らず、以下の表1に例示するDNAグリコシラーゼあるいはDNA修復酵素と各塩基を有するヌクレオチドのテーリングとを組み合せても、同様にしてヌクレオチド鎖の3´末端を修飾物質で直接的に修飾できる。
【0083】
【表1】
目的とするヌクレオチド鎖が化学合成可能な数十ヌクレオチド鎖長のものであれば、予め特定の塩基の配列を有するヌクレオチド鎖を合成しておくことで、第1段階の反応を省略することも可能である。
(実施の形態2)
本発明の実施の形態2を図2に基づいて説明する。図中、mは、0または任意の自然数を表わし、Baseは、アデニン、グアニン、シトシン、チミン、ウラシル等の任意の塩基を示す。
【0084】
上記実施の形態1と同様にして製造した、3´末端にアルデヒド基を持ったヌクレオチド鎖(IV)に対して、蛍光物質として知られるフルオレセインカダベリン(C)を反応させることにより、ヌクレオチド鎖の3´末端に直接的にフルオレセインカダベリンが結合した修飾ヌクレオチド鎖(VI)を得る。
【0085】
このようにしてフルオレセインで修飾することにより、ヌクレオチド鎖を蛍光ラベル化(標識化)することができ、このヌクレオチドをハイブリダイゼーションなどの遺伝子解析のためのプローブあるいはターゲットとして利用可能となる。
【0086】
フルオレセインのほかに、アミノ基を有するテキサスレッド、ローダミン、Cy3・Cy5に代表されるシアニン系化合物、ジゴギシゲニン、ビオチン等を用いて同様に、ラベル化、標識化することが可能である。
【0087】
アミノ酸、ペプチド、タンパク質も、ヌクレオチド鎖への修飾物質として使用可能である。アミノ酸の内、フェニルアラニン、トリプトファン、チロシンは、蛍光性を有するため、ヌクレオチド鎖のラベル化、標識化に使用できる。なおラベル化は、蛍光化合物、染料系化合物等による標識化を言う。蛍光性を有しないアミノ酸やペプチドも、側鎖にフルオレセイン等(以下、標識化合物と言う)を結合させることで、ラベル化、標識化に使用可能である。
【0088】
アミノ酸が連鎖したペプチドは、その数に応じた側鎖が存在するため、複数の標識化合物を結合させることが可能となる。例えば、リシンが3つ連鎖したトリリシンには側鎖にアミノ基が3つ存在するため、カルボキシル基、スクシンイミド基等を有する標識化合物を任意に合計3つ修飾することが可能となる。
【0089】
ペプチドに限らず、アミノ基を有するアルキル、アリル、シクロアルカン、芳香族、糖類等の炭化水素類を標識化合物で修飾したものを修飾物質として用いて、ヌクレオチド鎖を修飾することが可能であり、ラベル化、標識化を実現できる。
【0090】
タンパク質として例えば、アルカリフォスファターゼ、ペルオキシダーゼ、有色性、蛍光性を有するトランスフェリン、ヘモグロビン、緑色蛍光タンパク、青色蛍光タンパク、エクオリン等を使用すると、ヌクレオチド鎖のラベル化、標識化が可能となり、遺伝子解析、とりわけin situでのハイブリダイゼーションに有用である。
【0091】
その他、表面にアミノ基を形成させた金コロイド、銀コロイド等の貴金属コロイド、磁性微粒子、ポリスチレンビーズ等の高分子微粒子に代表される微粒子なども、ヌクレオチド鎖の修飾物質として使用可能である。
(実施の形態3)
本発明の実施の形態3を図3に基づいて説明する。図中、mは、0または任意の自然数を表わし、Baseは、アデニン、グアニン、シトシン、チミン、ウラシル等の任意の塩基を示す。
【0092】
上記実施の形態1で説明したのと同様にして製造した、3´末端にアルデヒド基を持ったヌクレオチド鎖(IV)に対して、アミノ基を有するチオール、ここでは8−アミノ−1−オクタンチオール(D)を反応させることにより、ヌクレオチド鎖の3´末端に直接的に8−アミノ−1−オクタンチオール残基が結合した修飾ヌクレオチド鎖(VII )を得る。
【0093】
この修飾ヌクレオチド鎖(VII )を貴金属の基板(E)に作用させることにより、チオール基と基板(E)との強固な共有結合を形成させて、ヌクレオチド鎖(VII ′)を基板(E)に固定化することができる。
【0094】
このようにすることにより、貴金属を基板として利用する電気化学的測定法、水晶発振子マイクロバランス法、表面プラズモン共鳴法等の測定法を、遺伝子解析に利用することが可能となる。
【0095】
なお、修飾物質たるアミノ基を有するチオールとして、8−アミノ−1−オクタンチオールを例示したが、ヌクレオチド鎖と結合するアミノ基と貴金属と結合するチオール基とが存在する化合物であれば、特に限定なく使用することができ、アミノ基・チオール基間の炭化水素残基は、直鎖状、分岐鎖状、シクロ環状、アリル鎖状、芳香環状等、種々の形態であってよく、その炭素数、アミノ基の位置等、変更可能である。
【0096】
貴金属製の基板も、水晶発振子マイクロバランス法、表面プラズモン共鳴法等では、金基板を汎用するが、これに限定されることなく使用することができ、金の他に、白金、銀、銅、パラジウム、インジウム、ニッケル、鉄、アルミニウム、及びそれらの合金等も基板として使用可能である。
【0097】
修飾物質として、アミノ基を有するシランカップリング化合物を使用してもよく、それにより、ガラス、シリコン、シリカ、アルミナ、マイカ、及びポリスチレン、ナイロン、エポキシ等の高分子樹脂等の基板にヌクレオチド鎖を固定化することが可能となり、従来からの様々な遺伝子解析手法にも適用可能となる。
【0098】
シランカップリング化合物は、アミノ基とアルコキシ基とを有する化合物であれば、アルカンチオールと同様に、構造等に特に制限なく使用可能である。使用可能なシランカップリング化合物はたとえば、ガンマ−アミノプロピルトリエトキシシラン、N−ベータ(アミノエチル)−ガンマ−アミノプロピルメチルジメトキシシラン、N−ベータ(アミノエチル)−ガンマ−アミノプロピルトリメトキシシラン、N−ベータ(アミノエチル)−ガンマ−アミノプロピルトリエトキシシラン、ガンマ−アミノプロピルトリメトキシシラン等である。
【0099】
なお、本来はアミノ基を有しない物質も、アミノ基を有する適当なスペーサーを介することで、ヌクレオチド鎖を修飾可能である。たとえばカルボキシル基を有する物質は、スペーサーとして、1,2−ジアミノエタン、1,6−ジアミノヘキサン等のジアミノ構造を有する物質を介在させることで、ヌクレオチド鎖を修飾可能となる。
【0100】
さらには、ヒドラジン基、アミノオキシル基、シアノ基を有する物質、あるいはグリニャール試薬の様にハロゲン化マグネシウムを有する物質も、修飾物質として使用可能である。
【0101】
【実施例】
以下、具体的な実施例を挙げて本発明をさらに詳細に説明する。
(実施例1)
修飾対象のヌクレオチド鎖として、ヌクレオチド数30の一本鎖化学合成ヌクレオチド鎖(Sigma−Genosys社に合成を委託)を用いた。このヌクレオチド鎖は、大腸菌の16Sリボゾームリボ核酸遺伝子の8〜37位をコードするもので、その塩基配列は5´末端よりagagtttgatcatggctcagattgaacgctである(配列番号1)。a、t、g、cはそれぞれデオキシヌクレオチド中の塩基、アデニン、チミン、グアニン、シトシンを示す。
【0102】
まず、ヌクレオチド鎖を5μMになるように、2単位(以下、uと略す)/μlのターミナルデオキシヌクレオチジルトランスフェラーゼ(Invitrogen社製)、10mM2´−デオキシイノシン−5´−三リン酸、2mM塩化コバルト、1mMジチオスレイトール、0.1Mカコジル酸カリウム(pH7.2)の反応液50μl中に混和し、37℃で4時間反応させて、ヌクレオチド鎖の3´側に、ヒポキサンチン塩基を有するヌクレオチド配列をテーリングさせた。
【0103】
このヌクレオチド鎖をエタノール沈殿により回収し、100μMのオリゴデオキシシトシン(ヌクレオチド数18、NewEnglandBioLabs社製)を添加して、ヌクレオチド鎖の3´側にテーリングしたヌクレオチド配列のヒポキサンチン塩基とアニーリングさせた。
【0104】
次にヌクレオチド鎖を、0.3u/μlの3−メチルアデニンDNAグリコシラーゼII型(Trevigen社製)、1mMエチレンジアミン四酢酸、1mMグリコールエーテルジアミン四酢酸、1mMジチオスレイトール、10mM2−[4−(2−ヒドロキシエチル)−1−ピペラジニル]エタンスルフォン酸−水酸化カリウム(pH7.4)の反応液に混和し、37℃で一昼夜反応させて、ヌクレオチド鎖の3´側にテーリングしたヌクレオチド配列のグリコシド結合を切断した。
【0105】
この反応液に0.1Mになるように水酸化ナトリウムを添加し、100℃で5分間加熱して、ヌクレオチド鎖の3´側に残存するリン酸を解離させ、3´末端にアルデヒド基を形成させた。
【0106】
このヌクレオチド鎖をエタノール沈殿により回収し、0.1M炭酸ナトリウム(pH9.5)条件下で5mMフルオレセインカダベリン(MolecularProbes社製)と混合し、反応液を50μlにして、室温で2時間反応させて、ヌクレオチド鎖の3´末端のアルデヒド基とフルオレセインカダベリンに存在するアミノ基との間でシッフ塩基を形成させた。その後に、1mg/mlになるよう水素化ホウ素ナトリウムを添加し、反応液を100μlとし、4℃で一昼夜反応させることにより、シッフ塩基を還元し、結合を安定化させた。
【0107】
この修飾プロセスを7モル尿素−ポリアクリルアミドゲル電気泳動(Molecular Cloning 第2版 11.23頁 1989年)により追跡した結果を図4に示す。なお、図中左側の数字と矢印は各塩基数を有するヌクレオチド鎖の泳動位置を示している。ヌクレオチド鎖の検出は、銀染色法(Electrophoresis 4巻 92頁 1983年)に従った。
【0108】
レーンA、B及びCはそれぞれ、分子量マーカー、オリゴデオキシシトシン、及び未処理のヌクレオチド鎖をそれぞれ示している。レーンDは、ヒポキサンチン塩基を有するヌクレオチド配列が3´側にテーリングしたヌクレオチド鎖を示し、ヌクレオチド数は100以上に増加している。レーンEは、オリゴデオキシシトシンがアニーリングしたヌクレオチド鎖を示す。レーンFは、3´末端にアルデヒド基が形成したヌクレオチド鎖を示し、ヌクレオチド数は30に減少している。レーンGは、3´末端がフルオレセインカダベリンで修飾され安定化されたヌクレオチド鎖を示す。
【0109】
レーンDにおいて、ヒポキサンチン塩基を有するヌクレオチドのテーリングが認められず、未反応のヌクレオチド鎖が若干残存しているのが認められるが、これは、テーリング反応時間の延長や、ターミナルデオキシヌクレオチジルトランスフェラーゼ添加量の増加等により、容易に解消可能である。
【0110】
なお、修飾対象のヌクレオチド鎖のアデニン塩基、グアニン塩基、シトシン塩基にもアミノ基が存在するため、ヌクレオチド鎖内部で反応が生じ、自己重合してしまう可能性もあるが、レーンFに示す通り、自己重合は生じなかった。しかし必要があれば、ヌクレオチド鎖の化学合成時に用いられるベンゾイル基、イソブチリル基等の適当な保護基で、ヌクレオチド鎖のアミノ基を保護することも可能である。
(実施例2)
実施例1で電気泳動させた各過程のヌクレオチド鎖を、Southernの方法(J.Mol.Biol.98巻、503頁、1975年)に従って、ナイロン膜(Schleicher&Schuell社製)に転写した。
【0111】
ナイロン膜上のヌクレオチド鎖に対して、西洋ワサビ由来のペルオキシダーゼで標識した抗フルオレセイン抗体(AmershamBiosciences社製)を滴下し、フルオレセインの有無を化学発光法(AmershamBiosciences社製、ECL Detection Reagents)によりフィルム(AmershamBiosciences社製、HyperfilmECL)を露光させて検出した。結果を図5に示す。なお、図中左側の数字と矢印は、図4と同様に各塩基数を有するヌクレオチド鎖の位置を示している。
【0112】
レーンAは分子量マーカーを示す。予めフルオレセインラベルした2´,3´―ジデオキシウリジン−5´−三リン酸(EnzoDiagnostics社製)をターミナルデオキシヌクレオチジルトランスフェラーゼでテーリング処理したものである。
【0113】
レーンB〜Fでは、発光の検出は認められず、ヌクレオチド鎖はフルオレセインで修飾されていないことがわかる。
レーンGにおいて、ヌクレオチド数30のヌクレオチド鎖の発光が検出されており、修飾ヌクレオチド鎖が実際にフルオレセインカバベリンで修飾されていたことがわかる。しかしヌクレオチド数18のオリゴデオキシシトシンもフルオレセインカバベリンで修飾されている。
【0114】
これは、テーリングしたヒポキサンチンのヌクレオチド鎖部分にオリゴデオキシシトシンがランダムにアニールするため、部分的に2本鎖が形成されず、3−メチルアデニンDNAグリコシラーゼII型が作用しない箇所が存在してしまうためである。
【0115】
それにより、わずかなヌクレオチド数のオリゴデオキシヒポキサンチンが生じ、その3´末端にアルデヒド基が形成され、そのアルデヒド基をフルオレセインカダベリンが修飾し、これらの反応中にオリゴデオキシヒポキサンチンとオリゴデオキシシトシンとが再アニールするためである。
【0116】
しかし、不要なオリゴデオキシシトシンは、ゲルクロマトグラフィー、イオン交換クロマトグラフィーさらにはポリスチレンビーズ等の微粒子に適当な方法で固定化したオリゴデオキシヒポキサンチン、オリゴデオキシグアニン、あるいはこれらを混合したオリゴヌクレオチドとアニールさせることで、容易に分離除去可能である。
【0117】
以上、実施例1及び実施例2に示した通り、本発明の方法によって、ヌクレオチド鎖の3´末端に直接的に修飾物質を修飾することが可能である。
上記各実施例に示したヌクレオチド鎖の構成・鎖長さ、修飾物質、反応条件、反応組成等は単なる例示であり、これらに限定されることなく任意に改変可能である。
【0118】
以上のように本発明によれば、ヒポキサンチンを有したヌクレオチド配列を修飾対象のヌクレオチド鎖の3´側に形成し、前記ヒポキサンチンが前記修飾対象のヌクレオチド鎖に存在せず、前記ヌクレオチド配列部分のみを分解する3−メチルアデニンDNAグリコシラーゼを作用させ、その後に修飾物質と反応させることにより、前記修飾対象のヌクレオチド鎖の分解を回避し、配列情報を保持した状態で3´末端を修飾物質で直接に修飾することができ、ヌクレオチド鎖を簡便にラベル化、標識化可能であるとともに、ヌクレオチド鎖の固定化を目的とする場合には、修飾物質をリンカーとして安定、強固な固定が可能である。
【0119】
特定の塩基として、修飾対象のヌクレオチド鎖に存在しない塩基、たとえば、本来は遺伝子として存在せず、PCR増幅の際等にもヌクレオチド鎖に取り込まれない塩基を選択することで、前記修飾対象のヌクレオチド鎖部分の分解を回避できる。よって、ヌクレオチド鎖の塩基構成や鎖長に関わらず、ヌクレオチド鎖の3´末端側を直接的に簡便に、任意の修飾物質で、定量的、安定的に修飾することができる。
【図面の簡単な説明】
【図1】本発明の実施の形態1におけるヌクレオチド鎖修飾方法の原理を示す反応模式図
【図2】本発明の実施の形態2におけるヌクレオチド鎖修飾方法の一部過程であって、形成されるアルデヒド誘導体をフルオレセインで修飾する過程を示す反応模式図
【図3】本発明の実施の形態3におけるヌクレオチド鎖修飾方法の一部過程であって、形成されるアルデヒド誘導体をアルカンチオールで修飾し、貴金属基板に固定化する過程を示す反応模式図
【図4】本発明の実施例1におけるヌクレオチド鎖修飾方法の各反応過程での反応状況を示すポリアクリルアミド電気泳動図
【図5】本発明の実施例2におけるヌクレオチド鎖修飾法による修飾を化学発光法により検出したフィルム露光図
Claims (8)
- ヒポキサンチンを有したヌクレオチド配列が修飾対象のヌクレオチド鎖の3´側に形成され、前記ヒポキサンチンが前記修飾対象のヌクレオチド鎖に存在せず、前記ヒポキサンチンを有したヌクレオチドに3−メチルアデニンDNAグリコシラーゼを作用させることにより、前記修飾対象のヌクレオチド鎖の分解を回避し、配列情報を保持した状態で3´末端に修飾物質に対してアルデヒド基を形成し、前記修飾対象のヌクレオチド鎖の3´末端に直接に前記修飾物質を結合させるヌクレオチド鎖修飾方法。
- ヒポキサンチンを有したヌクレオチド配列は、テーリング法により付加する請求項1記載の
ヌクレオチド鎖修飾方法。 - 3−メチルアデニンDNAグリコシラーゼを作用させるに先だって、ヒポキサンチンと相補的な塩基配列を有するオリゴヌクレオチドを添加する請求項1記載のヌクレオチド鎖修飾方法。
- 修飾物質が、ヌクレオチド鎖をラベル化、標識化する物質である請求項1記載のヌクレオチド鎖修飾方法。
- 修飾物質が、遺伝子解析のための基板への結合能を有した物質である請求項1記載のヌクレオチド鎖修飾方法。
- ヌクレオチド鎖の3´末端のアルデヒド基に反応する修飾物質がアミノ基を有する請求項1に記載のヌクレオチド鎖修飾方法。
- 修飾物質が、アミノ酸、オリゴペプチド、またはタンパク質である請求項6記載のヌクレオチド鎖修飾方法。
- 修飾物質が、アミノアルカンチオールまたはアミノシランカップリング化合物である請求項6記載のヌクレオチド鎖修飾方法。
Priority Applications (10)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003186151A JP4518754B2 (ja) | 2003-06-30 | 2003-06-30 | ヌクレオチド鎖修飾方法 |
| PCT/JP2004/009524 WO2005014808A1 (ja) | 2003-06-30 | 2004-06-29 | ヌクレオチド鎖修飾方法 |
| CNB200480011356XA CN100355886C (zh) | 2003-06-30 | 2004-06-29 | 核苷酸链修饰方法 |
| US10/554,495 US20070077629A1 (en) | 2003-06-30 | 2004-06-29 | Method for modifying nucleotide chain |
| DE602004019926T DE602004019926D1 (de) | 2003-06-30 | 2004-06-29 | Verfahren zur modifizierung einer nukleotidkette |
| AT04746993T ATE425250T1 (de) | 2003-06-30 | 2004-06-29 | Verfahren zur modifizierung einer nukleotidkette |
| KR1020057017735A KR100683025B1 (ko) | 2003-06-30 | 2004-06-29 | 뉴클레오티드쇄 수식방법 |
| CA2517167A CA2517167C (en) | 2003-06-30 | 2004-06-29 | Method for modifying nucleotide chain |
| EP04746993A EP1647592B1 (en) | 2003-06-30 | 2004-06-29 | Method of modifying nucleotide chain |
| US12/720,482 US20100291637A1 (en) | 2003-06-30 | 2010-03-09 | Method for modifying nucleotide chain |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003186151A JP4518754B2 (ja) | 2003-06-30 | 2003-06-30 | ヌクレオチド鎖修飾方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2005013173A JP2005013173A (ja) | 2005-01-20 |
| JP2005013173A5 JP2005013173A5 (ja) | 2006-04-27 |
| JP4518754B2 true JP4518754B2 (ja) | 2010-08-04 |
Family
ID=34185358
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003186151A Expired - Fee Related JP4518754B2 (ja) | 2003-06-30 | 2003-06-30 | ヌクレオチド鎖修飾方法 |
Country Status (2)
| Country | Link |
|---|---|
| JP (1) | JP4518754B2 (ja) |
| CN (1) | CN100355886C (ja) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007142202A1 (ja) * | 2006-06-06 | 2007-12-13 | Panasonic Corporation | ヌクレオチド鎖修飾方法 |
| KR101023164B1 (ko) * | 2007-06-19 | 2011-03-18 | (주)바이오니아 | 화학물질로 코팅된 금도금 스텐트, 올리고뉴클레오타이드를 바인딩시킨 금도금 스텐트 및 이들의제조방법 |
| CN103228785B (zh) * | 2010-11-24 | 2016-09-07 | 株式会社钟化 | 扩增核酸的检测方法和检测装置 |
| CN112920247B (zh) * | 2021-01-22 | 2022-12-27 | 南京大学 | 一种利用糖苷酶和氧胺化合物修饰dna的方法 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1999006055A1 (en) * | 1997-08-01 | 1999-02-11 | Supratek Pharma Inc. | Polynucleotide compositions |
| JP2000316587A (ja) * | 1999-03-05 | 2000-11-21 | Tosoh Corp | 核酸プローブ |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6150105A (en) * | 1998-08-20 | 2000-11-21 | Genetic Assays, Inc. | Methods of screening nucleic acids for nucleotide variations |
| GB9907245D0 (en) * | 1999-03-29 | 1999-05-26 | Goldsborough Andrew | Cleavage of nucleic acids from solid supports |
| US6893822B2 (en) * | 2001-07-19 | 2005-05-17 | Nanogen Recognomics Gmbh | Enzymatic modification of a nucleic acid-synthetic binding unit conjugate |
| EP1281757A1 (en) * | 2001-07-31 | 2003-02-05 | Direvo Biotech AG | Method for the production of nucleic acids consisting of stochastically combined parts of source nucleic acids |
-
2003
- 2003-06-30 JP JP2003186151A patent/JP4518754B2/ja not_active Expired - Fee Related
-
2004
- 2004-06-29 CN CNB200480011356XA patent/CN100355886C/zh not_active Expired - Fee Related
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1999006055A1 (en) * | 1997-08-01 | 1999-02-11 | Supratek Pharma Inc. | Polynucleotide compositions |
| JP2000316587A (ja) * | 1999-03-05 | 2000-11-21 | Tosoh Corp | 核酸プローブ |
Also Published As
| Publication number | Publication date |
|---|---|
| CN100355886C (zh) | 2007-12-19 |
| JP2005013173A (ja) | 2005-01-20 |
| CN1780909A (zh) | 2006-05-31 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP1877415B1 (en) | New labelling strategies for the sensitive detection of analytes | |
| JP4823310B2 (ja) | ヌクレオチド鎖修飾方法 | |
| WO2003078623A1 (fr) | Molecule fonctionnelle et son procede de production | |
| US20020142308A1 (en) | Methods and compositions for analyzing nucleotide sequence mismatches using RNase H | |
| JP4518754B2 (ja) | ヌクレオチド鎖修飾方法 | |
| US9005892B2 (en) | Labelling strategies for the sensitive detection of analytes | |
| JP4383265B2 (ja) | ヌクレオチド鎖修飾方法 | |
| JP2005512544A (ja) | 核酸の合成後ラベリングとその使用 | |
| KR100683025B1 (ko) | 뉴클레오티드쇄 수식방법 | |
| JP2010035451A (ja) | タグ配列、タグ配列固定化バイオチップおよびタグ配列を用いた選択結合性物質の検出方法 | |
| JP2003246794A (ja) | ヌクレオチド鎖修飾方法 | |
| US20100291637A1 (en) | Method for modifying nucleotide chain | |
| JP2006006179A5 (ja) | ||
| JP2004337022A (ja) | 機能性分子及びその製造方法 | |
| JP2006132980A (ja) | タンパク質の固定化方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060313 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060313 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20080430 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090609 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090807 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20090901 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20091130 |
|
| A911 | Transfer of reconsideration by examiner before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20091216 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20100420 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20100518 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130528 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130528 Year of fee payment: 3 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |