JP4463418B2 - T細胞共同刺激性ポリペプチド、モノクローナル抗体、ならびにその製法および使用 - Google Patents
T細胞共同刺激性ポリペプチド、モノクローナル抗体、ならびにその製法および使用 Download PDFInfo
- Publication number
- JP4463418B2 JP4463418B2 JP2000512857A JP2000512857A JP4463418B2 JP 4463418 B2 JP4463418 B2 JP 4463418B2 JP 2000512857 A JP2000512857 A JP 2000512857A JP 2000512857 A JP2000512857 A JP 2000512857A JP 4463418 B2 JP4463418 B2 JP 4463418B2
- Authority
- JP
- Japan
- Prior art keywords
- cells
- lymphocytes
- antibody
- molecule
- cell
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 210000001744 T-lymphocyte Anatomy 0.000 title claims description 104
- 108090000765 processed proteins & peptides Proteins 0.000 title claims description 42
- 229920001184 polypeptide Polymers 0.000 title claims description 36
- 102000004196 processed proteins & peptides Human genes 0.000 title claims description 36
- 230000000139 costimulatory effect Effects 0.000 title claims description 26
- 238000000034 method Methods 0.000 title description 16
- 210000003719 b-lymphocyte Anatomy 0.000 claims description 24
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 claims description 15
- 230000004071 biological effect Effects 0.000 claims description 11
- 230000004940 costimulation Effects 0.000 claims description 9
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 8
- 210000004443 dendritic cell Anatomy 0.000 claims description 6
- 230000000284 resting effect Effects 0.000 claims description 6
- 210000000822 natural killer cell Anatomy 0.000 claims description 4
- 238000012217 deletion Methods 0.000 claims description 3
- 230000037430 deletion Effects 0.000 claims description 3
- 210000003714 granulocyte Anatomy 0.000 claims description 3
- 239000000203 mixture Substances 0.000 claims description 3
- 210000001616 monocyte Anatomy 0.000 claims description 3
- 238000007792 addition Methods 0.000 claims description 2
- 125000003275 alpha amino acid group Chemical group 0.000 claims 3
- 101100005713 Homo sapiens CD4 gene Proteins 0.000 claims 1
- 238000006467 substitution reaction Methods 0.000 claims 1
- 210000004027 cell Anatomy 0.000 description 40
- 239000000427 antigen Substances 0.000 description 33
- 108091007433 antigens Proteins 0.000 description 33
- 102000036639 antigens Human genes 0.000 description 33
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 31
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 31
- 230000014509 gene expression Effects 0.000 description 31
- 238000000684 flow cytometry Methods 0.000 description 25
- 230000004913 activation Effects 0.000 description 19
- PHEDXBVPIONUQT-RGYGYFBISA-N phorbol 13-acetate 12-myristate Chemical compound C([C@]1(O)C(=O)C(C)=C[C@H]1[C@@]1(O)[C@H](C)[C@H]2OC(=O)CCCCCCCCCCCCC)C(CO)=C[C@H]1[C@H]1[C@]2(OC(C)=O)C1(C)C PHEDXBVPIONUQT-RGYGYFBISA-N 0.000 description 18
- 210000002741 palatine tonsil Anatomy 0.000 description 16
- 239000002299 complementary DNA Substances 0.000 description 15
- 239000012634 fragment Substances 0.000 description 15
- 150000001413 amino acids Chemical class 0.000 description 13
- 210000000987 immune system Anatomy 0.000 description 13
- 108090000623 proteins and genes Proteins 0.000 description 13
- 108091028043 Nucleic acid sequence Proteins 0.000 description 12
- 239000003814 drug Substances 0.000 description 12
- 230000006698 induction Effects 0.000 description 12
- PGHMRUGBZOYCAA-ADZNBVRBSA-N ionomycin Chemical compound O1[C@H](C[C@H](O)[C@H](C)[C@H](O)[C@H](C)/C=C/C[C@@H](C)C[C@@H](C)C(/O)=C/C(=O)[C@@H](C)C[C@@H](C)C[C@@H](CCC(O)=O)C)CC[C@@]1(C)[C@@H]1O[C@](C)([C@@H](C)O)CC1 PGHMRUGBZOYCAA-ADZNBVRBSA-N 0.000 description 12
- PGHMRUGBZOYCAA-UHFFFAOYSA-N ionomycin Natural products O1C(CC(O)C(C)C(O)C(C)C=CCC(C)CC(C)C(O)=CC(=O)C(C)CC(C)CC(CCC(O)=O)C)CCC1(C)C1OC(C)(C(C)O)CC1 PGHMRUGBZOYCAA-UHFFFAOYSA-N 0.000 description 12
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 11
- 230000006870 function Effects 0.000 description 11
- 235000018102 proteins Nutrition 0.000 description 11
- 102000004169 proteins and genes Human genes 0.000 description 11
- 108020003175 receptors Proteins 0.000 description 11
- 239000000126 substance Substances 0.000 description 11
- 108090000695 Cytokines Proteins 0.000 description 9
- 108010002350 Interleukin-2 Proteins 0.000 description 9
- 102000000588 Interleukin-2 Human genes 0.000 description 9
- 235000001014 amino acid Nutrition 0.000 description 9
- 201000010099 disease Diseases 0.000 description 8
- 102000004127 Cytokines Human genes 0.000 description 7
- 230000015572 biosynthetic process Effects 0.000 description 7
- 238000007799 mixed lymphocyte reaction assay Methods 0.000 description 7
- 230000028327 secretion Effects 0.000 description 7
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 6
- 230000000903 blocking effect Effects 0.000 description 6
- 238000001727 in vivo Methods 0.000 description 6
- 239000011159 matrix material Substances 0.000 description 6
- 210000005259 peripheral blood Anatomy 0.000 description 6
- 239000011886 peripheral blood Substances 0.000 description 6
- YBYRMVIVWMBXKQ-UHFFFAOYSA-N phenylmethanesulfonyl fluoride Chemical compound FS(=O)(=O)CC1=CC=CC=C1 YBYRMVIVWMBXKQ-UHFFFAOYSA-N 0.000 description 6
- 230000000638 stimulation Effects 0.000 description 6
- 108091034117 Oligonucleotide Proteins 0.000 description 5
- 108091008874 T cell receptors Proteins 0.000 description 5
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 5
- 239000000556 agonist Substances 0.000 description 5
- 239000005557 antagonist Substances 0.000 description 5
- 238000001514 detection method Methods 0.000 description 5
- 238000009396 hybridization Methods 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 230000003993 interaction Effects 0.000 description 5
- 239000003446 ligand Substances 0.000 description 5
- 238000010186 staining Methods 0.000 description 5
- 238000010561 standard procedure Methods 0.000 description 5
- 238000003786 synthesis reaction Methods 0.000 description 5
- 239000013598 vector Substances 0.000 description 5
- 108020004414 DNA Proteins 0.000 description 4
- 102100025137 Early activation antigen CD69 Human genes 0.000 description 4
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 4
- 101000934374 Homo sapiens Early activation antigen CD69 Proteins 0.000 description 4
- 108060003951 Immunoglobulin Proteins 0.000 description 4
- 102100035304 Lymphotactin Human genes 0.000 description 4
- 206010028980 Neoplasm Diseases 0.000 description 4
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 4
- 239000007983 Tris buffer Substances 0.000 description 4
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 201000011510 cancer Diseases 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 210000004408 hybridoma Anatomy 0.000 description 4
- 102000018358 immunoglobulin Human genes 0.000 description 4
- 150000007523 nucleic acids Chemical group 0.000 description 4
- 239000002773 nucleotide Substances 0.000 description 4
- 125000003729 nucleotide group Chemical group 0.000 description 4
- 230000002265 prevention Effects 0.000 description 4
- 230000035755 proliferation Effects 0.000 description 4
- 230000009467 reduction Effects 0.000 description 4
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 4
- 208000030507 AIDS Diseases 0.000 description 3
- 208000023275 Autoimmune disease Diseases 0.000 description 3
- 241000283707 Capra Species 0.000 description 3
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 3
- 238000002965 ELISA Methods 0.000 description 3
- 101000804764 Homo sapiens Lymphotactin Proteins 0.000 description 3
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 3
- 238000000636 Northern blotting Methods 0.000 description 3
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 3
- 230000006044 T cell activation Effects 0.000 description 3
- 230000000735 allogeneic effect Effects 0.000 description 3
- 208000006673 asthma Diseases 0.000 description 3
- 230000001684 chronic effect Effects 0.000 description 3
- 230000004186 co-expression Effects 0.000 description 3
- 238000007796 conventional method Methods 0.000 description 3
- 238000003745 diagnosis Methods 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 230000001744 histochemical effect Effects 0.000 description 3
- 230000007124 immune defense Effects 0.000 description 3
- 238000001114 immunoprecipitation Methods 0.000 description 3
- 208000015181 infectious disease Diseases 0.000 description 3
- 108020004999 messenger RNA Proteins 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 230000002093 peripheral effect Effects 0.000 description 3
- 238000012163 sequencing technique Methods 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 239000006228 supernatant Substances 0.000 description 3
- 238000013519 translation Methods 0.000 description 3
- 238000000539 two dimensional gel electrophoresis Methods 0.000 description 3
- 230000003827 upregulation Effects 0.000 description 3
- 230000003612 virological effect Effects 0.000 description 3
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- UMCMPZBLKLEWAF-BCTGSCMUSA-N 3-[(3-cholamidopropyl)dimethylammonio]propane-1-sulfonate Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(=O)NCCC[N+](C)(C)CCCS([O-])(=O)=O)C)[C@@]2(C)[C@@H](O)C1 UMCMPZBLKLEWAF-BCTGSCMUSA-N 0.000 description 2
- 206010003445 Ascites Diseases 0.000 description 2
- 102000008203 CTLA-4 Antigen Human genes 0.000 description 2
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 2
- 229940045513 CTLA4 antagonist Drugs 0.000 description 2
- 101000867232 Escherichia coli Heat-stable enterotoxin II Proteins 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 description 2
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 2
- 101000835093 Homo sapiens Transferrin receptor protein 1 Proteins 0.000 description 2
- 102100037850 Interferon gamma Human genes 0.000 description 2
- 108010074328 Interferon-gamma Proteins 0.000 description 2
- 102100026878 Interleukin-2 receptor subunit alpha Human genes 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- 241000699670 Mus sp. Species 0.000 description 2
- 239000000020 Nitrocellulose Substances 0.000 description 2
- 239000004677 Nylon Substances 0.000 description 2
- 108010047620 Phytohemagglutinins Proteins 0.000 description 2
- 206010035226 Plasma cell myeloma Diseases 0.000 description 2
- 229920002684 Sepharose Polymers 0.000 description 2
- 101100013500 Solanum lycopersicum 2A11 gene Proteins 0.000 description 2
- 230000006052 T cell proliferation Effects 0.000 description 2
- 102100026144 Transferrin receptor protein 1 Human genes 0.000 description 2
- 102000004142 Trypsin Human genes 0.000 description 2
- 108090000631 Trypsin Proteins 0.000 description 2
- 230000006907 apoptotic process Effects 0.000 description 2
- AIYUHDOJVYHVIT-UHFFFAOYSA-M caesium chloride Chemical compound [Cl-].[Cs+] AIYUHDOJVYHVIT-UHFFFAOYSA-M 0.000 description 2
- 239000013592 cell lysate Substances 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 238000010367 cloning Methods 0.000 description 2
- 231100000433 cytotoxic Toxicity 0.000 description 2
- 230000001472 cytotoxic effect Effects 0.000 description 2
- 238000009795 derivation Methods 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- 238000001962 electrophoresis Methods 0.000 description 2
- 231100000655 enterotoxin Toxicity 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 238000005194 fractionation Methods 0.000 description 2
- 230000003053 immunization Effects 0.000 description 2
- 229940072221 immunoglobulins Drugs 0.000 description 2
- 239000002555 ionophore Substances 0.000 description 2
- 230000000236 ionophoric effect Effects 0.000 description 2
- 230000004807 localization Effects 0.000 description 2
- 210000004698 lymphocyte Anatomy 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 201000000050 myeloid neoplasm Diseases 0.000 description 2
- 229920001220 nitrocellulos Polymers 0.000 description 2
- 229920001778 nylon Polymers 0.000 description 2
- 230000001885 phytohemagglutinin Effects 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 230000003248 secreting effect Effects 0.000 description 2
- 210000004989 spleen cell Anatomy 0.000 description 2
- 230000009261 transgenic effect Effects 0.000 description 2
- 238000002054 transplantation Methods 0.000 description 2
- 239000012588 trypsin Substances 0.000 description 2
- 238000001262 western blot Methods 0.000 description 2
- 108020004463 18S ribosomal RNA Proteins 0.000 description 1
- 108020005096 28S Ribosomal RNA Proteins 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- 206010002556 Ankylosing Spondylitis Diseases 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 101150100936 CD28 gene Proteins 0.000 description 1
- 108010029697 CD40 Ligand Proteins 0.000 description 1
- 102100032937 CD40 ligand Human genes 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 206010009900 Colitis ulcerative Diseases 0.000 description 1
- 206010019799 Hepatitis viral Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000995194 Homo sapiens Nebulette Proteins 0.000 description 1
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 description 1
- 241000725303 Human immunodeficiency virus Species 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical group SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- 241000699660 Mus musculus Species 0.000 description 1
- OKIZCWYLBDKLSU-UHFFFAOYSA-M N,N,N-Trimethylmethanaminium chloride Chemical compound [Cl-].C[N+](C)(C)C OKIZCWYLBDKLSU-UHFFFAOYSA-M 0.000 description 1
- 102100034431 Nebulette Human genes 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 208000037581 Persistent Infection Diseases 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- 241000276498 Pollachius virens Species 0.000 description 1
- 108010021757 Polynucleotide 5'-Hydroxyl-Kinase Proteins 0.000 description 1
- 102000008422 Polynucleotide 5'-hydroxyl-kinase Human genes 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 208000021386 Sjogren Syndrome Diseases 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- 230000020385 T cell costimulation Effects 0.000 description 1
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 description 1
- 108091036066 Three prime untranslated region Proteins 0.000 description 1
- 101710120037 Toxin CcdB Proteins 0.000 description 1
- 201000006704 Ulcerative Colitis Diseases 0.000 description 1
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 210000000612 antigen-presenting cell Anatomy 0.000 description 1
- 230000001640 apoptogenic effect Effects 0.000 description 1
- 230000003305 autocrine Effects 0.000 description 1
- 244000052616 bacterial pathogen Species 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 238000010804 cDNA synthesis Methods 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 210000003855 cell nucleus Anatomy 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 230000001659 chemokinetic effect Effects 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 230000000875 corresponding effect Effects 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- VHJLVAABSRFDPM-QWWZWVQMSA-N dithiothreitol Chemical compound SC[C@@H](O)[C@H](O)CS VHJLVAABSRFDPM-QWWZWVQMSA-N 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 238000010195 expression analysis Methods 0.000 description 1
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 1
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 1
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 210000004602 germ cell Anatomy 0.000 description 1
- 210000001280 germinal center Anatomy 0.000 description 1
- ZRALSGWEFCBTJO-UHFFFAOYSA-O guanidinium Chemical compound NC(N)=[NH2+] ZRALSGWEFCBTJO-UHFFFAOYSA-O 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 230000006801 homologous recombination Effects 0.000 description 1
- 238000002744 homologous recombination Methods 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 238000002649 immunization Methods 0.000 description 1
- 238000010166 immunofluorescence Methods 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 239000012133 immunoprecipitate Substances 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 230000004073 interleukin-2 production Effects 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- PGLTVOMIXTUURA-UHFFFAOYSA-N iodoacetamide Chemical compound NC(=O)CI PGLTVOMIXTUURA-UHFFFAOYSA-N 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 210000003563 lymphoid tissue Anatomy 0.000 description 1
- 108010019677 lymphotactin Proteins 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- JBPWDTQELHPIPV-UHFFFAOYSA-N n-(3,6-dihydro-2h-pyridin-1-yl)pyridine-4-carboxamide Chemical compound C=1C=NC=CC=1C(=O)NN1CCC=CC1 JBPWDTQELHPIPV-UHFFFAOYSA-N 0.000 description 1
- 230000006654 negative regulation of apoptotic process Effects 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 239000002831 pharmacologic agent Substances 0.000 description 1
- 239000002644 phorbol ester Substances 0.000 description 1
- 239000013600 plasmid vector Substances 0.000 description 1
- 229920001469 poly(aryloxy)thionylphosphazene Polymers 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- XJMOSONTPMZWPB-UHFFFAOYSA-M propidium iodide Chemical compound [I-].[I-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CCC[N+](C)(CC)CC)=C1C1=CC=CC=C1 XJMOSONTPMZWPB-UHFFFAOYSA-M 0.000 description 1
- 238000001742 protein purification Methods 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 238000003127 radioimmunoassay Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- 239000000523 sample Substances 0.000 description 1
- 239000012723 sample buffer Substances 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 210000005212 secondary lymphoid organ Anatomy 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 239000004332 silver Substances 0.000 description 1
- RWVGQQGBQSJDQV-UHFFFAOYSA-M sodium;3-[[4-[(e)-[4-(4-ethoxyanilino)phenyl]-[4-[ethyl-[(3-sulfonatophenyl)methyl]azaniumylidene]-2-methylcyclohexa-2,5-dien-1-ylidene]methyl]-n-ethyl-3-methylanilino]methyl]benzenesulfonate Chemical compound [Na+].C1=CC(OCC)=CC=C1NC1=CC=C(C(=C2C(=CC(C=C2)=[N+](CC)CC=2C=C(C=CC=2)S([O-])(=O)=O)C)C=2C(=CC(=CC=2)N(CC)CC=2C=C(C=CC=2)S([O-])(=O)=O)C)C=C1 RWVGQQGBQSJDQV-UHFFFAOYSA-M 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 229940104230 thymidine Drugs 0.000 description 1
- 238000011830 transgenic mouse model Methods 0.000 description 1
- 238000000108 ultra-filtration Methods 0.000 description 1
- 238000005199 ultracentrifugation Methods 0.000 description 1
- 201000001862 viral hepatitis Diseases 0.000 description 1
- 244000052613 viral pathogen Species 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70521—CD28, CD152
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- General Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Molecular Biology (AREA)
- Engineering & Computer Science (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Virology (AREA)
- Communicable Diseases (AREA)
- Gastroenterology & Hepatology (AREA)
- Zoology (AREA)
- Oncology (AREA)
- Toxicology (AREA)
- Pulmonology (AREA)
- Cell Biology (AREA)
- Transplantation (AREA)
- AIDS & HIV (AREA)
- Tropical Medicine & Parasitology (AREA)
- Peptides Or Proteins (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Description
本発明は、T細胞を共同刺激する生物学的活性を有するポリペプチド(8F4分子)に関する。本発明はさらに、8F4分子に対するモノクローナル抗体、およびそのモノクローナル抗体を産生するハイブリドーマ細胞に関する。加えて本発明は、医薬として、本発明のポリペプチド8F4の生物学的活性を阻害する物質、特にモノクローナル抗体、天然もしくは合成リガンド、アゴニストもしくはアンタゴニストの使用に関する。詳しくは、本発明は、免疫系が関与する疾患の予防または治療、特には自己免疫疾患の治療および臓器移植に伴う拒絶反応の予防を目的とするこれらの物質の使用に関する。本発明は加えて、特に免疫系が関与する疾患の予防または治療、特には癌、エイズ、喘息性疾患またはHCVもしくはHBV感染のような慢性的ウイルス病の治療を目的とした医薬としての8F4分子または8F4分子を含む細胞の使用に関する。さらに本発明は、免疫系が関与する疾患の診断のための、本発明のポリペプチドを特異的に認識する物質、特にモノクローナル抗体、天然もしくは合成リガンド、アゴニストもしくはアンタゴニストの使用に関する。詳しくは、本発明は、ELISA検出法、フローサイトメトリーもしくはウエスタンブロット、放射性免疫学的検出法、比濁分析法または組織化学的染色による診断に関する。
【0002】
Tリンパ球は、それらのT細胞受容体を介して「抗原提示細胞」、例えば樹状細胞、B細胞およびマクロファージによって提示されたそれらの抗原を認識する。しかしながら、T細胞受容体単独による抗原の認識は、Tリンパ球の適切な活性化には不十分である場合が多い。このためTリンパ球の表面の他の受容体によるさらなる同時的刺激(以下、「共同刺激」ともいう)が必要となる。これらの受容体分子の1つにいわゆるCD28受容体があり、これは共同刺激性分子B7によって刺激される。これらの「共同刺激性」分子、例えばCD28が有効であれば、T細胞受容体によって抗原が認識された後にT細胞の活性化は十分なレベルに達する。このように完全に活性化された後、T細胞はその表面でさらなる分子、例えばCD25、CD69、CD71を発現し、伝達物質として機能する例えばIL−2やIFN−γなど、多くのサイトカインを合成する。これらのさらなる表面分子とサイトカインの両者は、T細胞が免疫系の他の細胞と情報交換をするための働く。活性化されたT細胞はこのさらなる表面分子とサイトカインによって完全な抗原特異的免疫防御を指示する。細胞傷害性細胞(「キラー細胞」)の生成およびB細胞による抗原特異的抗体の生成は双方ともこのようにして制御される。細胞傷害性細胞ならびに特異的に形成される抗体は、体内に入るウイルスまたは細菌性の病原体を排除する。しかしながら、この免疫応答が及びすぎて免疫系が身体の自己細胞に対して向けられることもある。これにより「自己免疫疾患」、例えばとりわけリウマチ様関節炎、強直性脊椎炎、シェーグレン症候群、潰瘍性大腸炎が起こる。抗原により活性化されたT細胞と免疫系の他の細胞との共同の必須部位の1つとして、扁桃腺をはじめとする二次的なリンパ器官がある。そこでは樹状細胞によって提示された抗原によりTリンパ球が活性化され、かつ、Tリンパ球がB細胞と相互作用する。この相互作用を通じ、B細胞は分化段階がいくつか介在した後にIgMおよび遺伝子IgG型の抗原特異的抗体を分泌する。
【0003】
最もよく特徴づけられ、またこれまでに最も有効なものに属する共同刺激性分子はCD28表面分子(以下、CD28受容体またはCD28と呼ばれる)であり、これはT細胞の大フラクションで構成的に発現する。in vitroにおいてCD28により共同刺激すると、T細胞受容体により抗原が認識された後、サイトカイン、例えばIL−2およびIFN−γの分泌が極めて高くなり、T細胞と他の免疫細胞、例えばBリンパ球との相互作用に必要なCD25、CD69、CD71のような細胞表面分子の発現の顕著なアップレギュレーションが起こる;Chambers and Allison, Current Opinion in Immunology 9 (1997), 396, 404を参照。CD28受容体による共同刺激はまた、Tリンパ球の増殖を顕著に増加させることができる。さらに、CD28受容体による共同刺激はT細胞のB細胞を制御する機能を至適化して抗体の分泌を高める。
【0004】
CD28受容体の機能が無効になると、免疫防御の機能が劇的に低下する。このことは、相同組換えによりCD28遺伝子が破壊されたトランスジェニックマウス(いわゆる「CD28ノックアウト」)によって示されている。抗原特異的T細胞の活性化のこうした破壊により共同刺激が欠如することとなる。このことは次ぎに、T細胞機能の攪乱、すなわちT細胞増殖の低下、および種々のサイトカインの合成の劇的な低下をもたらす。共同刺激の欠如は結果として抗原特異的免疫防御の機能を低下させることとなる。このようにとりわけBリンパ球による抗原特異的IgG1およびIgG2抗体の形成は、CD28の欠如により正常レベルの10%まで低下する;Shahinian et al., Science 262 (1993), 609-612; Lucas et al., Journal of Immunology 154 (1995), 5757-5768を参照。また、in vitroでCD28による共同刺激によりエイズウイルスがTリンパ球に侵入するのを防ぐこともできる;Riley et al., Journal of Immunology 158 (1997), 5545-5553を参照。これに対応するin vivoにおける実験はまだ行われていない。CD28はin vivoにおいて重大な副作用をもたらし得る多数のサイトカイン遺伝子のスイッチを入れる。可溶性CTLA−4免疫グロブリン分子によるCD28受容体のブロックは、移植された腎臓の拒絶反応を防ぐためにサルのモデルで首尾良く使用されている。この場合、CTLA−4はCD40リガンド分子に対する抗体と組み合わせて使用されてきた;Kirk et al., Proc. Natl. Acad. Sci. USA 94 (1997) 8789-8794を参照。しかしながら、CD28はTリンパ球で構成的に発現するので、CD28受容体のブロックは総てのTリンパ球に影響を及ぼし、すでに活性化されたものには影響を及ぼさない。
【0005】
このように、活性化されたTリンパ球でしか発現しない共同刺激性表面分子が必要とされている。従って本発明は、Tリンパ球の中心機能に対して強い共同刺激作用を有する表面分子を活性化T細胞上に提供するという目的に基づいている。本発明のもう1つの目的は、例えば共同刺激性表面分子に対するモノクローナル抗体、その表面分子の天然もしくは合成リガンド、アゴニストもしくはアンタゴニストといった物質を提供することである。
【0006】
第1の具体例では、本発明は、T細胞の共同刺激の生物学的活性を有するポリペプチドであって、a)活性化されたCD4+およびCD8+Tリンパ球で生じるが、休止中の、もしくは活性化されたB細胞、顆粒球、単球、NK細胞(ナチュラルキラー細胞)または樹状細胞では生じないこと、およびb)二量体であり、非還元ドデシル硫酸ナトリウムポリアクリルアミドゲル電気泳動(SDS−PAGE)で測定した場合に約55〜60kDa(キロダルトン)の分子量を有し、その2つのポリペプチド鎖が還元SDS−PAGEで測定した場合に約27kDaおよび約29kDaの分子量を有することを特徴とするポリペプチドに関する。
【0007】
本発明のポリペプチド(以下、8F4分子または8F4とも呼ばれる)は、Tリンパ球、特にCD4+およびCD8+T細胞の双方が活性化された後にのみ発現される。非還元SDS−PAGEでは、8F4分子は約55〜60kDa(キロダルトン)の間の分子量を有する。この8F4分子は2つのペプチド鎖からなり、その2つのペプチド鎖は還元SDS−PAGEでは約27および29kDaの分子量を有する。8F4抗原は扁桃腺およびリンパ節のリンパ組織、特に胚細胞の中心部、抗体の生成時にTリンパ球とBリンパ球が相互作用する部位において活性化されたTリンパ球で組織学的に明らかに検出できる。ex vivoに単離された扁桃T細胞は約50〜80%が8F4抗原に関して陽性であり、活性化の進行の徴候を示す。8F4分子は休止中の、または活性化されたB細胞、顆粒球、単球、NK細胞および樹状細胞では検出されない。
【0008】
8F4分子の重要な生物学的活性は、Tリンパ球に対するその共同刺激活性でである。この共同刺激活性はLinsley ea al., Journal of Experimental Medicine 176 (1992), 1595-604の方法によって測定できる。8F4分子の共同刺激活性は、免疫系による抗原認識の中枢増強要素として同定されているCD28分子の共同刺激活性と類似している。しかしながら8F4分子は多くの点でCD28とは異なっている。例えば、T細胞の表面における8F4分子の発現には誘導を要するが、CD28は構成的に発現する。また機能において検出可能な明瞭な違いもあり、CD28による共同刺激は多くのリンパ球、とりわけインターロイキン−2(IL−2)の過剰発現をもたらす。8F4による共同刺激もまた、リンホカインの分泌を増強するが、IL−2の分泌は増強しない。このように8F4分子の共同刺激活性は、CD28分子の活性とは異なっている。8F4による共同刺激は総てのサイトカイン遺伝子のスイッチを入れることはなく、in vivoにおける8F4による共同刺激は、例えばCD28受容体を介する共同刺激と比較すると有利である。さらに、8F4分子の誘導、発現、発現部位および機能は、共同刺激活性を有する他の公知の分子のいずれとも異なっている。
【0009】
本発明の8F4分子は、Tリンパ球の中枢機能に強い共同刺激作用を有する、活性化されたT細胞上の新規な表面分子である。in vivoにおける発現は、とりわけウイルスおよび細菌に対する体液性および細胞性免疫防御の範囲で、T細胞と、B細胞または樹状細胞のような免疫系の他の細胞との共同作用における8F4分子の必須の関与を示している。
【0010】
発現の後、8F4分子はin vitroにおいてTリンパ球の種々の機能に強い共同刺激作用を有する:
1.Tリンパ球の増殖の顕著な増強
2.Tリンパ球によるある種のサイトカイン合成の顕著な増強
3.Tリンパ球上およびTリンパ球内での制御分子、例えば表面分子およびサイトカインの極めて高い発現
4.T細胞によって誘導されるB細胞による抗体形成(IgMおよびIgG)における顕著な向上。
【0011】
さらに本発明は、T細胞の共同刺激の生物学的活性を有し、かつ、図15(配列番号2)の199個のアミノ酸を含んでなる配列、またはその生物学的に有効な断片もしくは類似体と少なくとも40%の相同性を示すアミノ酸配列を有するポリペプチドを提供する。生物学的に有効な断片または類似体とは、T細胞リンパ球に対して同様に共同刺激作用を示すか、あるいは少なくともブロックの特徴の生物学的作用示す断片または類似体をいう。図15(配列番号2)の199個のアミノ酸を含んでなる配列と少なくとも60%の相同性を示すポリペプチド、またはその生物学的に有効な断片もしくは類似体が好ましい。特に好ましい具体例では、本発明のポリペプチドは、図15(配列番号2)の199個のアミノ酸を含んでなる配列と少なくとも80%の相同性を示すアミノ酸配列、またはその生物学的に有効な断片もしくは類似体を含んでなる。
【0012】
特に好ましいポリペプチドはT細胞を共同刺激する生物学的活性を有し、かつ図15に示されるアミノ酸配列(配列番号2)、またはその生物学的に有効な断片もしくは類似体を含んでなる。
【0013】
本発明には8F4分子の対立遺伝子変異体、断片および類似体が含まれる。これらの変異体には、天然に存在している対立遺伝子変異体、1以上のアミノ酸が異なるアミノ酸で置換された置換類似体、1以上のアミノ酸を欠失した欠失類似体および、1以上のアミノ酸が付加された付加類似体が含まれる。1以上のアミノ酸の欠失および付加はポリペプチドの内部領域か、またはアミノもしくはカルボキシル末端のいずれで行われてもよい。
【0014】
異種ポリペプチドと融合した本発明のポリペプチドも同様に包含される。
【0015】
もう1つの具体例では、本発明は、本発明のポリペプチドまたはその生物学的に有効な断片もしくは類似体をコードするDNA配列に関する。
【0016】
これらのDNA配列には、配列番号1で示される配列(図16)ならびに生物学的活性を有する対立遺伝子変異体、断片および類似体が含まれる。
【0017】
好ましいDNA配列は、T細胞を共同刺激する生物学的活性を有するポリペプチドをコードし、その配列は:
a)配列番号1で示されるDNA配列(図16)、およびその相補鎖
b)(a)の配列とハイブリダイズするDNA配列
c)遺伝子コードの縮重により(a)および(b)の配列とハイブリダイズするDNA配列
からなる群から選択される。前記のDNA配列はストリンジェントな条件下でともにハイブリダイズすることが好ましい。
【0018】
またこれらのDNA配列を含んでなるベクター、およびこれらのベクターで形質転換されるか、またはトランスフェクトされた宿主細胞も提供される。
【0019】
もう1つの具体例では、本発明は8F4分子に対するモノクロナール抗体に関する。本発明のモノクロナール抗体は、Milstein and Kohler, Nature 256 (1975), 495-497により記載されている常法で調製できる。本発明のモノクロナール抗体は特に、in vitroでホルボールミリステートアセテート(PMA)およびイオノマイシン(「2シグナル系」)で24時間活性化させたT細胞でマウスを免疫化することにより調製できる。免疫化したマウスの脾臓細胞を骨髄腫細胞と融合させる。8F4特異的モノクロナール抗体は休止中のものではなく、2つのシグナルで活性化されたTリンパ球を認識することにより同定される。さらに8F4特異的抗体は、常法で行われる検出法において1つのシグナル(PMAまたはイオノマイシンのいずれか)で刺激されたT細胞を染色しない。8F4特異的抗体は典型的な扁桃T細胞の染色パターンを示し、活性化されたTリンパ球の非還元SDS−PAGEでは約55〜60kDa、および還元SDS−PAGEで約27kDaおよび約29kDaの抗原を認識する。
【0020】
もう1つの具体例では、本発明は、本発明のモノクローナル抗体を産生するハイブリドーマ細胞に関する。
【0021】
もう1つの具体例では、本発明は、本発明のポリペプチド8F4の生物学的活性を阻害する物質の医薬としての使用に関する。本発明の8F4分子のモノクロナール抗体、天然または合成リガンド、アゴニストまたはアンタゴニストの使用が特に好ましい。これらの物質は免疫系が関与する疾患の予防または治療、特には自己免疫疾患の治療、または臓器移植における拒絶反応の予防を目的とした医薬として使用され得る。8F4抗原のその受容体との相互作用のブロックは予め活性化されたTリンパ球にのみ影響を及ぼすため、例えば臓器拒絶の予防に適している。本発明のもう1つの具体例は、本発明のポリペプチドの医薬としての使用に関する。本発明のポリペプチドは、特に免疫系が関与する疾患の予防または治療、特には癌、エイズ、喘息性疾患またはHCVもしくはHBV感染などの慢性ウイルス病の治療を目的として使用され得る。
【0022】
同様に本発明のポリペプチドは、これらの細胞が例えばそのポリペプチドを構成的に発現するように常法で細胞に導入することができる。例えばそのポリペプチドをコードする核酸配列、またはそのポリペプチド、例えばcDNAまたはゲノムDNA、プロモーター、エンハンサーおよび核酸配列の発現に必要な他のエレメントを含んでなるベクターを細胞に挿入することができる。図16で示された8F4 cDNA(2641個のヌクレオチド)(配列番号1)またはその断片もしくは誘導体を本発明のポリペプチドまたはその断片の発現に使用することが好ましい。
【0023】
本発明のポリペプチドはまた、例えばリポソームにより、後にその細胞表面にポリペプチドを形成する細胞へ導入することができる。これらの細胞は本発明に従い医薬として、特に多くの慢性感染症、例えばエイズ、喘息性疾患、または慢性ウイルス性肝炎(例えばHCV、HBV感染)の枠組み内にあるとき、ヒト免疫系の正確な調節を回復させるために、または例えば癌の治療のようなin viroまたはin vivoで免疫系を刺激するために使用できる。
【0024】
もう1つの具体例では、本発明のポリペプチドを特異的に認識する物質が、免疫系が関与する疾患を診断するために使用される。この物質には特に、モノクロナール抗体、天然または合成リガンド、アゴニストまたはアンタゴニストが包含される。例えばELISA検出法、フローサイトメトリー、ウエスタンブロット、放射性免疫検定法、比濁分析法または組織化学的染色が診断のために使用可能である。本発明のポリペプチドを認識する物質はまた核酸配列もまた含んでおり、それはハイブリダイゼーションおよび/または核酸(RNA,DNA)増幅(例えば、PCR)に使用することが好ましい。
【0025】
もう1つの具体例では、本発明は、本発明のポリペプチドのT細胞へのシグナル変換経路に正または負の影響を及ぼす(調節する)物質、およびこれらの物質の医薬としての使用に関する。
【0026】
もう1つの具体例では、本発明はT細胞表面の本発明のポリペプチドのアップレギュレーションを妨げる物質、およびその医薬としての使用に関する。
【0027】
もう1つの具体例では、本発明のポリペプチドまたはその断片はトランスジェニック動物により発現される。
【0028】
もう1つの具体例では、本発明は、本発明のポリペプチドをコードする遺伝子のスイッチが切られた(「ノックアウト」)トランスジェニック動物を包含する。
【0029】
以下、実施例により本発明を説明するが、それらに限定するものではない。
【0030】
実施例1:8F4抗体の作製
Balb/cマウスを、予めホルボールエステル、ホルボールミリステートアセテート(PMA)(Sigma,Deisenhofen)33ng/mlおよびCa2+イオノフォア、イオノマイシン(Sigma,Deisenhofen)20ng/mlで24時間活性化(いわゆる、「2−シグナル活性化」)させたヒトT細胞で免疫化した。3度追加抗原投与した後、マウスの脾臓細胞を骨髄腫P3X63Ag8.653(ATCC CRL−1580)と融合させ、標準法により抗体分泌ハイブリドーマを作製した;Peters and Baumgarten, Monoclonal Antibodies, Springer, Heidelberg, 1992を参照。得られた抗体をフローサイトメトリーにおいて休止中のT細胞に対して活性化されたものについてスクリーニングした。活性化(「2シグナル活性化」)されたT細胞および休止中のT細胞をハイブリドーマ上清とともにインキュベートし、次いで蛍光標識二次抗体で標識した;Shapiro, Practical Flow Cytometry, Wiley-Liss, New York, 1995を参照。T細胞表面において1つの薬剤単独によってではなく、優先的にPMAおよびCa2+イオノフォア、イオノマイシンによってのみ誘導された分子(2シグナル分子)を認識する抗体だけをさらなる精製により選択した。得られた抗体をフローサイトメトリーにおいてT細胞の活性化分子に対する既知の抗体(表1参照)との類似点または相違点について調べた。これについての基準は前記の「2シグナル依存性」のほか、刺激されたT細胞における誘導の速度論および様々な細胞系における発現であった。
【0031】
実施例2:8F4抗原の免疫沈降
活性化されたヒトT細胞由来の分子の表面を125Iで標準法によりヨウ素化し、抗体8F4で標準法により免疫沈降させた;Goding, Monoclonal Antibodies: Principle and Practice, Academic Press, London, 1996を参照。免疫沈降反応用の抗体をSchneider et al., Journal of Biological Chemistry 257 (1982), 10766-10769の方法によりprotein G(Pharmacia, Freiburgへ結合させた(8F4マトリックス)。このマトリックスをSchneider et al.により記載されるように洗浄した、前記参照。免疫沈降した8F4分子をSDS−PAGE(非還元および還元)により常法で分子量について解析した;Goding 、前記参照。
【0032】
実施例3:フローサイトメトリー
8F4を有するT細胞をフローサイトメトリーにおいて標準法により解析した;Shapiro, Practical Flow Cytometry, Wiley-Liss, New York, 1995を参照。
【0033】
具体例3.1:CD4+T細胞における8F4抗原誘導後のフローサイトメトリー。
末梢血由来のCD4+T細胞を様々な薬剤により常法で刺激し、8F4分子の発現をフローサイトメトリーにおいて常法で調べた。T細胞の活性化時間は種々の薬剤で24時間〜144時間の間とした。活性化モード:ホルボールミリステートアセテート(PMA;33ng/ml)、イオノマイシン(200ng/ml)、フィトヘマグルチニン(PHA 1.5mg/ml)、OKT3(CD3に対するモノクロナール抗体)、混合リンパ球反応(MLR,CD4+T細胞50,000とB細胞100,000間)、mAk9.3(CD28に対するモノクロナール抗体)、ブドウ球菌エンテロトキシンB(SEB,0.1ng/ml)。解析により、種々の刺激はT細胞の8F4分子の誘導に好適であるが、発現強度が異なっていることが示された。最も有効な刺激は、非常に有効な薬理学的薬剤であるPMAおよびイオノマイシンの他、例えばMLRの補助細胞または共同刺激性mAk9.3などの共同刺激状態を示すものである。
【0034】
具体例3.2:PMAおよびイオノマイシンでの活性化後のCD4+T細胞における8F4抗原誘導の速度論
末梢血由来のCD4+T細胞をPMA(33ng/ml)およびイオノマイシン(200ng/ml)により常法で刺激し、0,4,8,12,24および48時間後、8F4分子の発現をフローサイトメトリーにおいて常法で調べた。この分子は4時間後でのみ表面上で検出可能であり、比較的初期のクラスの活性化抗原に属する。48時間後の抗原でもさらに強い発現がある。
【0035】
具体例3.3:「混合リンパ球反応」において8F4の誘導に関与する分子を同定するためのフローサイトメトリー
末梢血由来のCD4+T細胞50,000を同種扁桃B細胞100,000と6日間同時培養し(37℃、5.2%CO2、96ウェル丸底プレートに10%FCSの入ったPRMI 200μl)、次いで8F4分子の発現をフローサイトメトリーで調べた。培養の開始時に種々の抗体(抗CD80、抗CD86、抗MHCII;総て10mg/ml)を培地に添加し、8F4誘導のこれら分子への依存性を試験した。8F4の発現はCD86/CD28の相互作用のブロックによってのみ阻害でき、CD80のブロックによっては阻害できない。この場合のブロック作用はMHCIIのブロックよりいっそう強いものである(正の調節)。
【0036】
具体例3.4:ヒト扁桃由来のTおよびB細胞の発現
種々の起源からの扁桃組織のTおよびB細胞を常法で精製し、8F4分子の発現をフローサイトメトリーにより調べた。B細胞ではシグナルが明らかに有意でなかったのに対し、扁桃T細胞の密度が約50〜80%の場合には8F4分子の発現がみられた。この場合、蛍光のレベルが異なり(それぞれ8F4が高いものと低いもの)、かつ種々の扁桃における発現が異なる2集団の同定が可能である。従って、例えばある扁桃は明らかに8F4の低い集団を示し、他の扁桃は明らかに8F4の高い集団を示す。
【0037】
具体例3.5:8F4分子の他の活性化マーカーとの同時発現
ヒト扁桃から精製したT細胞を、8F4分子の他の活性化マーカーとの同時発現について2色系フローサイトメトリーで解析した。扁桃において8F4はCD69と、ならびにCD45分子の変異体とともに同時発現する。この場合、8F4の高い細胞は明らかにCD45RO発現と相互関係があるが、一方8F4が陰性の細胞は表現型CD45RAを有する。CD45RAは主として、いわゆる「天然」T細胞により発現されるが、CD45ROはエフェクター細胞の機能に関与している。よって8F4+細胞は主として「成熟」T細胞である。CD45ROおよびCD45RAはCD45のイソ型である。
【0038】
実施例4:8F4陽性細胞の扁桃における局在性
扁桃組織の凍結切片をAPAAP手法(アルカリ性ホスファターゼ−抗アルカリ性ホスファターゼ)において標準法により8F4抗体で染色した。8F4+細胞は扁桃の胚中心で優先的に見られるが、扁桃のT細胞ゾーンの一部分でも見られた。
【0039】
実施例5:Tリンパ球の共同刺激
96ウェルプレートにヤギ抗マウスIg抗体(20μg/ml)を塗布し、洗浄して、抗CD3モノクロナール抗体OKT3(種々の希釈の腹水)および本発明の8F4抗体(2μg/ml)を添加した。OKMl抗体または2A11抗体(双方2μg/ml)をイソタイプの対照として用いた。
【0040】
具体例5.1:8F4により共同刺激された後のTリンパ球の活性化分子の発現の増強
末梢血由来の精製CD4+T細胞を種々の濃度のモノクロナール抗体OKT3、同時に8F4抗体または同じイソタイプの非特異的抗体により活性化した。比較として、既知の最も強い共同刺激性抗体の1つである抗CD28抗体−9.3により共同刺激を行った。CD3によっては最適に共同刺激されるものの、mAk8F4およびmAk9.3双方によってもなお共同刺激作用が認められる。最適下限のOKT3領域、すなわち共同刺激無しではT細胞の完全な活性化がなされ得ない領域では、両抗体は4〜100の因子によって他の活性化抗原の発現を高めることができ、抗CD28抗体の作用はOKT3の希釈度が非常に高いときでもなお認識できる。このことは極めて弱いOKT3による刺激では、8F4抗原はもはや細胞表面にもたらされず、そのためmAk 8F4のいずれかでは架橋できないということに帰すことができる。
【0041】
具体例5.2:8F4の共同刺激作用とCD28の共同刺激作用との比較
精製CD8+T細胞を最適下限濃度のモノクロナール抗体OKT3で51時間刺激した。使用した共同刺激物質は抗体8F4、抗体9.3(抗体CD28)およびイソタイプの対照(各2μg/ml)であった。刺激時間が完了した後、T細胞増殖速度を3H−チミジンの組み込みにより求めた。同時に行った培養では上清を除去し、サイトカイン ATAC/リンフォタクチンおよびIL−2の濃度を決定した。8F4およびCD28はIL−2合成に関して、互いに顕著に異なっている。CD28共同刺激により、先行技術にも記載されるように(Chambers and Allison, Current Opinion in Immunology 9 (1997), 396-404)IL−2の分泌が極めて多くなる。これに対し、8F4によるIL−2産生は検出限界以下である。しかしながら、増殖については2つの混合物で比較できる、よってT細胞の自己分泌増殖は8F4の共同刺激における他の因子に帰すべきであろう。この2つの抗体はリンフォカインATACの分泌に関する共同刺激作用においてほとんど全く差がない。
【0042】
実施例6:8F4により共同刺激されたT細胞との相互作用後にB細胞によって合成された免疫グロブリンの測定
96ウェルプレートをヤギ抗マウスIg抗体(20μg/ml)で被覆し、抗CD3モノクローナル抗体OKT3(1:500〜1:80,000腹水)および本発明の8F4抗体(2μg/ml)を入れた。OKM1抗体または2A11抗体をイソタイプ対照として使用した。ある実験では、比較のためにCD28特異的抗体(「9.3」)を用いて共同刺激を行った;Hara et al., Journal of Experimental Medicine 161 (1985), 1513-1524を参照。末梢血由来の50,000個の精製した(Magnetbeads, Dynal, Hamburg)CD4+T細胞(純度>95%)および25,000個の同種扁桃B細胞(ヒツジ赤血球とロゼットを形成するT細胞による負の選抜、純度96%)をこのように予め処理した培養プレートの各ウェルにピペットで入れ、8日間共存培養した。この後、上清を採取してIgMおよびIgG型の分泌免疫グロブリンの濃度を常法にてELISA法で分析した;Nishioka and Lipsky, Journal of Immunology 153 (1994), 1027-1036を参照。
【0043】
具体例6.1:T細胞の共同刺激後のB細胞によるIgMおよびIgG型の抗体合成の増強
末梢血由来の精製したCD4+T細胞を扁桃由来の同種B細胞とともに常法で8日間共存培養した。OKT3抗体によるT細胞の最適下限刺激では、8F4によるT細胞の共同刺激はIgMおよびIgG型免疫グロブリンの分泌を40だけ増強する。
【0044】
実施例7:8F4による共同刺激後の末梢T細胞の活性化誘導性アポトーシスの阻害
末梢T細胞(常法においてナイロンウール付着によって精製した)をPHA(1.5mg/ml)で20時間刺激し、IL−2とともに6日間培養した。次いで、細胞をmAK 8F4(2μg/ml)による共同刺激を伴い、または伴わずにOKT3で再刺激した。フローサイトメトリー(FACS)においてヨー化プロピジウムでDNAを染色することによってアポトーシスを測定した。T細胞受容体複合体を介した最適下限の刺激を伴う8F4による共同刺激は、アポトーシス細胞の割合を4だけ減少できる。
【0045】
実施例8:8F4タンパク質をコードするcDNAのクローニング
フローサイトメトリーにおいて蛍光色素を結合させた8F4抗体で染色することによって、8F4抗原を構成的に発現する細胞系統(MOLT−4V)を同定した(図11)。MOLT−4V系統はヒトT細胞系統MOLT−4の変異体である(American Type Culture Collection(ATCC) CRL−1582)。
【0046】
この細胞系統をモノクローナル抗体を用いる8F4抗原の予備精製に使用した。
細胞を回転培養瓶中で大量培養し(150l)、遠心分離により回収して溶解緩衝液(50mM トリス、pH8.0、150mM NaCl、1mM EDTA、1mM PMSF(Sigma、Deisenhofen)、1% NP−40(Boehringer, Mannheim))を用いて細胞性タンパク質を抽出した。細胞核および他の不溶性成分を超遠心分離によって除去した。このようにして得た細胞溶解物をセファロースCL4−B(Pharmacia, Freiburg)とともに2時間プレインキュベートしてセファロースに非特異的に結合するタンパク質を除去した。次いで前記実施例2に記載の8F4免疫親和性マトリックスとともにインキュベーションを行った(4℃で4時間)。マトリックスをカラムに詰め、次いで非特異的に結合しているタンパク質の完全な除去を行う条件(1.50mM トリス、pH8.0、300mM NaCl、1mM EDTA、1mM PMSF、0.5% NP−40;2.50mM トリス、pH8.0、150mM NaCl、1mM EDTA、1mM PMSF、0.5% NP−40、0.1% SDS;3.0.2M グリシン pH4.0、0.5% CHAPS(Merck, Darmstadt))下で数回洗浄した。0.2M グリシン、pH2.5、0.5% CHAPSを用いてマトリックスから8F4抗原を溶出させた。溶出液を限外濾過(Amicon Centricon 10, Millipore, Eschborn)によって濃縮した。
【0047】
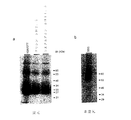
8F4分子のさらなる精製を実施するために、ニ次元ゲル電気泳動(非還元/還元)において分子のニ量体構造(図1を参照)を利用した。ほとんどのタンパク質は単量体として生じるので、それらがゲル電気泳動においては対角線上に移動するのに対し、8F4分子は第1の次元(非還元)では55〜60kDaに、また第2の次元(還元)では27および29kDaに移動する(図12)。
【0048】
予備分画のために、各場合において20×109細胞からの免疫沈降物を図12に関して前記に記載のように調製し、ニ次元ゲル電気泳動で分画し、ゲルをクマシーブルーG250(Biorad, Munich)で染色して図12において示された領域をゲルから個々に切り出した(それぞれ8F4−27kDaおよび8F4−29kDa)。
【0049】
ペプチドのマイクロシーケンシングのために、各場合においてゲル4片からのタンパク質をトリプシンで消化してゲルから溶出させた。トリプシンによって生じた断片をHPLCによって分画し、個々の画分をEdman分解(Groettrup, M. et al. (1996), Eur. J. Immunol., 26: 863-869に詳細に記載された方法)に付した。
【0050】
8F4−29kDaサンプルの配列決定により、既知のタンパク質の断片に加え、いずれのタンパク質データベースにおいてもヒトとの相関性が認められないペプチド配列XRLTDVTが示された。
【0051】
タンパク質配列のDNA配列への明確な逆翻訳は可能でない。従って前記のペプチド配列の、17個のヌクレオチドを含むオリゴヌクレオチドへの逆翻訳は結果として2048通りの組合せを生ずる。しかしながら、特殊な方法(Wozney, J.M. (1990), Methods Enzymol. 182; 738-751)により縮重オリゴヌクレオチドを用いてcDNAバンクをスクリーニングすることは可能である。見出したペプチド配列をもとにして、2つのオリゴヌクレオチド(オリゴ1(配列番号3);MGN CTS ACN GAY GTN AC、512通りの組合せ;オリゴ2(配列番号4):MGN YTD ACN GAY GTN AC、1024通りの組合せ)を合成した。
【0052】
スクリーニングのために、タンパク質精製のためにも用いたMOLT−4V細胞系統からcDNAバンクを構築した。:
グアニジニウム/CsCl法(Chirgwin, J.M. et al. (1979), Biochemistry 18: 5294-5299)によって完全RNAを単離し、オリゴ−dT−セルロースカラム(Gibco BRL, Eggenstein)でmRNAを濃縮した。オリゴ−dT−プライマーを用いる市販のcDNA合成系(Gibco BRL, Eggenstein)を用いて、製造業者の使用説明書に従って第1および第2cDNA鎖の合成を行った。cDNAをEcoRIアダプターを介してLambda ZAPIIベクター(Stratagene, Heidelberg)に連結した。
【0053】
cDNAバンクを標準法(Vogeli, G, and kaytes, P.S. (1987), Methods Enzymol., 152: 407-515)によって平板培養し、ニトロセルロースフィルター(Optitran BA-S 85, Schleicher&Schuell, Dassel)上にLambda DNAを固定した。
【0054】
前記のオリゴヌクレオチドをT4ポリヌクレオチドキナーゼ(NEBL、Schwalbach)およびγ−32P ATP(NEN Du Pont、Brussels)を用いて放射性標識した(Wallace, R.B. and Miyata, C.G. (1987), Methods Enzymol.,152: 432-442)。
【0055】
3Mのテトラメチル塩化アンモニウム(Roth、Karlsruhe)を含む縮重オリゴヌクレオチドに関して記載された緩衝液(Wozney, J.M. (1990), Methods Enzymol, 182: 738-751)中、48℃でフィルターのハイブリダイゼーションを行った。洗浄温度を50℃とし、前記参照文献に記載のようにフィルターを洗浄した。X線フィルム上でのこれらのフィルターの露光により、100,000個の平板培養ファージ当たり約50個の陽性クローンが現れた(図13)。
【0056】
ベクターの製造業者(Stratagene, Heidelberg)によって記載された方法を用いるin vivo切り出しによって、それらをプラスミドベクターに導入することにより6個のクローンをさらに同定し、T3およびT7プライマーを用いて部分的に配列決定した(BigDyeターミネーターサイクルシークエンシングキット、Applied Biosystems, Foster City, USA)。1つのクローンは、求めたペプチド配列を翻訳時に正確に提供する配列を含んでいた。このクローンをノーザンブロットのハイブリダイゼーション(図14)に用いた(Kroczek, R.A. (1993), J. Chromatogr., 618, 133-145)。フローサイトメトリーによるモノクローナル抗体に対する研究から知られていたように、mRNAの発現パターンは8F4分子の発現に厳密に対応した。見出されたクローンは求めるcDNAの3’末端のみしか含んでいなかったので、5’側に対する断片を用いて完全な8F4cDNAを単離した。数個のクローンを両鎖に関して配列決定した。
【0057】
8F4cDNA(2641個のヌクレオチド)は図16および配列番号1で記載されている配列中に示されており、また図15および配列番号2で記載されている配列中に示されている199個のアミノ酸(ヌクレオチド68〜664)を有するタンパク質をコードする。cDNAバンク由来の数個の独立したクローンの配列決定により、本明細書に示される配列からのいくらかのずれが示されたが、これらは総て3’非翻訳領域中にある:
位置909−910:欠失
位置1631:T→C
位置2074:G→T
位置2440:G→C
位置2633:選択可能なポリアデニル化部位。
【0058】
表1:表1は使用した抗体(クローン)、それらの起源の供給源(供給源)、それらの特定の抗原に対する特異性(特異性)、および要すればそれらの標識化(標識)をまとめたものである。
【表1】
実施例で使用した抗血清および二次試薬は以下から購入した:Jackson Immuno Research Lab., USAからのFITC結合ヤギ抗マウスIg;Jackson Immuno Research Lab., USAからのPE結合ストレプトアビジン;Sigma, Deisenhofenからのウサギ抗マウスIg画分。
【0059】
【配列表】
【表2】
【0060】
【表3】
【0061】
【表4】
【0062】
【表5】
【図面の簡単な説明】
【図1】 活性化されたヒトT細胞由来の8F4抗原の免疫沈降反応の結果を示す図である。(a)還元ドデシル硫酸ナトリウムポリアクリルアミドゲル電気泳動(SDS−PAGE;12%ポリアクリルアミドゲル(PAAゲル))、(b)非還元SDS−PAGE(10%PAAゲル)。8F4マトリックスから抗原を溶出させる条件を示す。「SDS」はドデシル硫酸ナトリウムを意味し;「DTT」はジチオトレイトールを意味し、「Mr」は分子量を意味し、「kDa」はキロダルトンを意味する。
【図2a】 CD4+T細胞のおける8F4抗原の誘導後のフローサイトメトリーの結果を示す図である。T細胞の活性化時間を括弧内に示す。「PMA」はホルボールミリステートアセテートを意味し;「PHA」はフィトヘマグルチニンを意味し;「OKT3」はCD3に対するモノクロナール抗体であり;「MLR」は混合リンパ球反応を意味し;「mAK9.3」はCD28に対するモノクロナール抗体であり;「SEB」はブドウ球菌エンテロトキシンBを意味する。
【図2b】 フローサイトメトリーにおいてPMAおよびイオノマイシンで活性化させた後のCD4+T細胞の8F4抗原誘導の速度論についての結果を示す図である。免疫蛍光(log)は細胞数に対してプロットされている。
【図3】 混合リンパ球反応における8F4の誘導に関与している分子の同定についてのフローサイトメトリーの結果を示す図である。「bio」はビオチン化された抗体を意味する。
【図4】 扁桃における8F4陽性細胞の局在性に関する組織化学的研究の結果を示す図である。
【図5】 フローサイトメトリーにおけるヒト扁桃由来TおよびB細胞の8F4の発現解析の結果を示している。「bioPE」はビオチン化された抗体およびストレプトアビジン−フィコエリトリン二次試薬を意味する。
【図6】 フローサイトメトリーにおける8F4分子の他の活性化マーカー(CD69,CD45)との同時発現を示す図である。
【図7】 8F4により共同刺激された後のTリンパ球の活性化分子の発現の高まりを図示している。白丸(○)は8F4抗体を示し;三角(▲)は同じイソタイプの非特異的抗体を示し;黒丸(●)抗CD28抗体9.3を示している。
【図8】 8F4の共同刺激作用とCD28の共同刺激作用との比較を図示している。「mAk」はモノクロナール抗体を意味し;「ATAC」は「活性化により誘導されたT細胞誘導および化学運動性関連」を意味し;「cpm」は毎分の放射性放出を意味する。
【図9】 T細胞の共同刺激後のB細胞によるIgMおよびIgG型の抗体の合成の増強を図示している。「ng」はナノグラムを意味し;「ml」はミリリットルを意味し;「mAk」はモノクロナール抗体を意味する。
【図10】 8F4による共同刺激後の周辺T細胞の活性化により誘導されるアポトーシスの阻害を図示している。
【図11】 MOLT−4V細胞系の8F4抗原の発現を示している。MOLT−4V細胞をフルオレセインで標識された8F4抗体(8F4−FITC)で染色し、フローサイトメトリーで調べた(白抜きのライン、イソタイプの対照(塗りつぶしたライン)との比較)。
【図12】 二次元ゲル電気泳動を図示している。300x106細胞からのMOLT−4V細胞溶解物を記載のように免疫沈降させた。溶出液を非還元SDS−PAGE(10%PAA)で分画し、60kDa付近の領域をゲルから切り取った。8F4分子のジスルフィド架橋を還元するために、ゲル片を5.3M尿素、0.5M Tris、pH8.0、1%SDS、1%β−メルカプトエタノール中50℃で1時間インキュベートし、分子中の遊離システイン残基を10mMヨードアセトアミド(Sigma,Deisenhofen)でアルカリ化した(37℃、30分)。ゲル片を1xSDS−PAGEサンプル緩衝液でさらに30分間平衡化し、12%PAA−SDSゲル上に(積層ゲル)のせた。電気泳動により分画した後、ゲルを銀染色した。8F4タンパク質の位置を表面のヨウ素処理により決定し(参照図1)、丸で印をつけた。(詳細に記載していない手順は総て標準法により行った、例えばWestermeier, R., Electrophoresis in Practice, VCH Verlagsgesellschaft, Weinheim, 1997を参照)。
【図13】 オリゴ1(配列番号3)とのハイブリダイゼーションを示す図である。ニトロセルロースフィルター上に固定化したラムダクローンを実施例で記載されるようにオリゴ1とハイブリダイズさせた。X線フィルムに対する露光を示している(詳細)。
【図14】 8F4 cDNAを用いたノーザンブロット解析を示す図である。ノーザンブロットと8F4 cDNAとのハイブリダイゼーションによりゲル中18S〜28SRNA間に移動するバンドが生ずる。図14は2シグナル依存性(前記参照)活性化抗原としての挙動:休止中のリンパ球(PBL)では発現せず、PMA+イオノマイシン活性化CD4+T細胞では強く発現され、かつPMAまたはイオノマイシン単独では明らかに発現が低下することを示している。図14は異なる刺激時間(ナイロンウールの付着により精製した、NTC)T細胞を(PMA+イオノマイシン)により刺激する)の後のmRNAの発現の強さを示している。このほか、最小限の発現しか示さないMOLT−4細胞系(ATCC CRL−1582)、離れて右側にクローニングに用いられ、かつ異なるシグナルを示すMOLT−4V。フローサイトメトリーによる解析では8F4発現が検出できない他の細胞系:CEM(ATCC CCL−119)、HUT−102(ATCC TIB−162)、HUT−78(ATCC TIB−161)、Jurkat(ATCC TIB−152)、DG75(Deutsche Sammlung von Mikrooganismen und Zellkulturen(DSMZ) ACC83)、Karpas 299(Fischer, P. et al., (1988), Blood, 72: 234-240)、DEL(Barbey, S. et al., (1990), Int. J. Cancer, 45: 546-553)由来のRNAも添加する。
【図15】 ポリペプチド8F4のアミノ酸配列(配列番号2)を示す図である。
【図16】 8F4 cDNA(配列番号1)を示す図である。
Claims (2)
- a)T細胞の共同刺激の生物学的活性を有し、
b)活性化されたヒトCD4+およびCD8+Tリンパ球で生じるが、休止中の、もしくは活性化されたB細胞、顆粒球、単球、NK細胞または樹状細胞では生じず、かつ
c)2つのポリペプチド鎖を有し、非還元SDSポリアクリルアミドゲル電気泳動で測定した場合に約55〜60kDaの分子量を有し、その分子の2つのポリペプチド鎖が還元SDSポリアクリルアミドゲル電気泳動で測定した場合に約27kDaおよび約29kDaの分子量を有する
共同刺激性分子を含んでなる、ヒトTリンパ球を共同刺激するための組成物。 - 共同刺激性分子が、配列番号2記載のアミノ酸配列、または1以上のアミノ酸の置換、欠失、または付加を有し、かつ、ヒトTリンパ球を共同刺激できる配列番号2記載のアミノ酸配列を含んでなる、請求項1に記載の組成物。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE19741929 | 1997-09-23 | ||
| DE19741929.1 | 1997-09-23 | ||
| DE19821060A DE19821060A1 (de) | 1997-09-23 | 1998-05-11 | Ko-stimulierendes Polypeptid von T-Zellen, monoklonale Antikörper sowie die Herstellung und deren Verwendung |
| DE19821060.4 | 1998-05-11 | ||
| PCT/DE1998/002896 WO1999015553A2 (de) | 1997-09-23 | 1998-09-23 | Ko-stimulierendes polypeptid von t-zellen, monoklonale antikörper sowie die herstellung und deren verwendung |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009211970A Division JP5021008B2 (ja) | 1997-09-23 | 2009-09-14 | T細胞共同刺激性ポリペプチド、モノクローナル抗体、ならびにその製法および使用 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2001517425A JP2001517425A (ja) | 2001-10-09 |
| JP2001517425A5 JP2001517425A5 (ja) | 2006-01-05 |
| JP4463418B2 true JP4463418B2 (ja) | 2010-05-19 |
Family
ID=26040229
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2000512857A Expired - Fee Related JP4463418B2 (ja) | 1997-09-23 | 1998-09-23 | T細胞共同刺激性ポリペプチド、モノクローナル抗体、ならびにその製法および使用 |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US7259247B1 (ja) |
| EP (1) | EP1017723B1 (ja) |
| JP (1) | JP4463418B2 (ja) |
| AU (1) | AU752433B2 (ja) |
| CA (1) | CA2305350C (ja) |
| DE (1) | DE59813875D1 (ja) |
| ES (1) | ES2279585T3 (ja) |
| WO (1) | WO1999015553A2 (ja) |
Families Citing this family (59)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7112655B1 (en) | 1997-02-27 | 2006-09-26 | Japan Tobacco, Inc. | JTT-1 protein and methods of inhibiting lymphocyte activation |
| JP3521382B2 (ja) | 1997-02-27 | 2004-04-19 | 日本たばこ産業株式会社 | 細胞間接着及びシグナル伝達を媒介する細胞表面分子 |
| WO1999015553A2 (de) | 1997-09-23 | 1999-04-01 | Bundesrepublik Deutschland Letztvertreten Durch Den Direktor Des Robert-Koch-Instituts | Ko-stimulierendes polypeptid von t-zellen, monoklonale antikörper sowie die herstellung und deren verwendung |
| DE19821060A1 (de) * | 1997-09-23 | 1999-04-15 | Bundesrepublik Deutschland Let | Ko-stimulierendes Polypeptid von T-Zellen, monoklonale Antikörper sowie die Herstellung und deren Verwendung |
| CA2346496A1 (en) * | 1998-10-07 | 2000-04-13 | Millennium Pharmaceuticals, Inc. | Novel th2-specific molecules and uses thereof |
| DK1149114T3 (da) * | 1999-02-03 | 2014-06-23 | Amgen Inc | Polypeptider, der er involveret ved et immunrespons |
| US7435796B1 (en) | 1999-02-03 | 2008-10-14 | Amgen Inc. | Antibodies which bind B7RP1 |
| US8624010B1 (en) | 1999-02-03 | 2014-01-07 | Steven K. Yoshinaga | Nucleic acids encoding B7RP1 |
| US7708993B2 (en) * | 1999-02-03 | 2010-05-04 | Amgen Inc. | Polypeptides involved in immune response |
| AU6458400A (en) * | 1999-08-11 | 2001-03-13 | Isis Innovation Limited | Nucleic acid, polypeptides, assays, therapeutic methods and means |
| JP4210454B2 (ja) | 2001-03-27 | 2009-01-21 | 日本たばこ産業株式会社 | 炎症性腸疾患治療剤 |
| JP3871503B2 (ja) * | 1999-08-30 | 2007-01-24 | 日本たばこ産業株式会社 | 免疫性疾患治療剤 |
| JP4737905B2 (ja) | 1999-09-21 | 2011-08-03 | ジェネティクス インスティテュート,エルエルシー | Gl50分子およびその使用 |
| EP1900816A3 (en) * | 1999-09-21 | 2008-03-26 | Genetics Institute, LLC | GL50 molecules and uses therefor |
| JP3597140B2 (ja) | 2000-05-18 | 2004-12-02 | 日本たばこ産業株式会社 | 副刺激伝達分子ailimに対するヒトモノクローナル抗体及びその医薬用途 |
| WO2002044364A2 (en) * | 2000-11-28 | 2002-06-06 | Amgen Inc. | Polypeptides involved in immune response |
| WO2002074803A2 (en) * | 2001-01-16 | 2002-09-26 | Bayer Aktiengesellschaft | Regulation of human icos v protein |
| JP4212278B2 (ja) | 2001-03-01 | 2009-01-21 | 日本たばこ産業株式会社 | 移植片拒絶反応抑制剤 |
| JP2008501638A (ja) | 2004-04-23 | 2008-01-24 | ドイツ連邦共和国 | ICOS陽性細胞のinvivo枯渇によるT細胞介在病態の治療方法 |
| US9244059B2 (en) | 2007-04-30 | 2016-01-26 | Immutep Parc Club Orsay | Cytotoxic anti-LAG-3 monoclonal antibody and its use in the treatment or prevention of organ transplant rejection and autoimmune disease |
| BR112013006718B1 (pt) | 2010-09-20 | 2021-12-07 | Tron - Translationale Onkologie An Der Universitätsmedizin Der Johannes Gutenberguniversität Mainz Gemeinnutzige Gmbh | Receptor de células t com especificidade para ny-eso-1, composição farmacêutica compreendendo o mesmo e uso do mesmo |
| AU2012233652B2 (en) * | 2011-03-31 | 2017-05-18 | Centre Leon Berard | Antibodies directed against ICOS and uses thereof |
| PH12022550138A1 (en) | 2013-03-13 | 2023-03-06 | Amgen Inc | Proteins specific for baff and b7rp1 and uses thereof |
| US9458246B2 (en) | 2013-03-13 | 2016-10-04 | Amgen Inc. | Proteins specific for BAFF and B7RP1 |
| MY210104A (en) | 2013-03-15 | 2025-08-27 | Glaxosmithkline Ip Dev Ltd | Anti-lag-3 binding proteins |
| GB201403775D0 (en) | 2014-03-04 | 2014-04-16 | Kymab Ltd | Antibodies, uses & methods |
| MA41414A (fr) | 2015-01-28 | 2017-12-05 | Centre Nat Rech Scient | Protéines de liaison agonistes d' icos |
| HUE049938T2 (hu) | 2015-03-23 | 2020-11-30 | Jounce Therapeutics Inc | Icos elleni antitestek |
| IL257798B2 (en) | 2015-09-02 | 2024-10-01 | Immutep Sas | Antibodies against LAG-3 |
| CA2998208A1 (en) | 2015-10-22 | 2017-04-27 | Jounce Therapeutics, Inc. | Gene signatures for determining icos expression |
| US9567399B1 (en) | 2016-06-20 | 2017-02-14 | Kymab Limited | Antibodies and immunocytokines |
| JP7461741B2 (ja) | 2016-06-20 | 2024-04-04 | カイマブ・リミテッド | 抗pd-l1およびil-2サイトカイン |
| WO2018029474A2 (en) | 2016-08-09 | 2018-02-15 | Kymab Limited | Anti-icos antibodies |
| JP7198752B2 (ja) | 2016-08-09 | 2023-01-04 | カイマブ・リミテッド | 抗icos抗体 |
| EP3534947A1 (en) | 2016-11-03 | 2019-09-11 | Kymab Limited | Antibodies, combinations comprising antibodies, biomarkers, uses & methods |
| TWI788340B (zh) | 2017-04-07 | 2023-01-01 | 美商必治妥美雅史谷比公司 | 抗icos促效劑抗體及其用途 |
| GB201709808D0 (en) | 2017-06-20 | 2017-08-02 | Kymab Ltd | Antibodies |
| US11629189B2 (en) | 2017-12-19 | 2023-04-18 | Kymab Limited | Bispecific antibody for ICOS and PD-L1 |
| GB201721338D0 (en) | 2017-12-19 | 2018-01-31 | Kymab Ltd | Anti-icos Antibodies |
| PE20210665A1 (es) | 2018-03-23 | 2021-03-31 | Bristol Myers Squibb Co | Anticuerpos contra mica y/o micb y sus usos |
| CN114174538A (zh) | 2019-05-30 | 2022-03-11 | 百时美施贵宝公司 | 适合于免疫肿瘤学疗法的多肿瘤基因特征 |
| KR20220016155A (ko) | 2019-05-30 | 2022-02-08 | 브리스톨-마이어스 스큅 컴퍼니 | 면역-종양학 (i-o) 요법에 적합한 대상체를 확인하는 방법 |
| EP3977132A1 (en) | 2019-05-30 | 2022-04-06 | Bristol-Myers Squibb Company | Cell localization signature and combination therapy |
| AR120309A1 (es) | 2019-10-28 | 2022-02-09 | Medimmune Ltd | Formulaciones de polvo seco de anticuerpos que se unen a la linfopoyetina del estroma tímico (tslp) y métodos de uso de las mismas |
| GB202007099D0 (en) | 2020-05-14 | 2020-07-01 | Kymab Ltd | Tumour biomarkers for immunotherapy |
| CA3190660A1 (en) | 2020-08-31 | 2022-03-03 | George C. Lee | Cell localization signature and immunotherapy |
| WO2022120179A1 (en) | 2020-12-03 | 2022-06-09 | Bristol-Myers Squibb Company | Multi-tumor gene signatures and uses thereof |
| CA3196999A1 (en) | 2020-12-28 | 2022-07-07 | Masano HUANG | Methods of treating tumors |
| SMT202500208T1 (it) | 2020-12-28 | 2025-07-22 | Bristol Myers Squibb Co | Composizioni anticorpali e metodi per il loro uso |
| EP4314068A1 (en) | 2021-04-02 | 2024-02-07 | The Regents Of The University Of California | Antibodies against cleaved cdcp1 and uses thereof |
| WO2022243378A1 (en) | 2021-05-18 | 2022-11-24 | Kymab Limited | Uses of anti-icos antibodies |
| GB202107994D0 (en) | 2021-06-04 | 2021-07-21 | Kymab Ltd | Treatment of cancer |
| KR20240159621A (ko) | 2022-03-18 | 2024-11-05 | 브리스톨-마이어스 스큅 컴퍼니 | 폴리펩티드를 단리하는 방법 |
| US20250340641A1 (en) | 2022-05-18 | 2025-11-06 | Kymab Limited | Uses of anti-icos antibodies |
| WO2023235847A1 (en) | 2022-06-02 | 2023-12-07 | Bristol-Myers Squibb Company | Antibody compositions and methods of use thereof |
| EP4583999A1 (en) | 2022-09-09 | 2025-07-16 | Bristol-Myers Squibb Company | Methods of separating chelator |
| WO2024196952A1 (en) | 2023-03-20 | 2024-09-26 | Bristol-Myers Squibb Company | Tumor subtype assessment for cancer therapy |
| WO2025038763A1 (en) | 2023-08-15 | 2025-02-20 | Bristol-Myers Squibb Company | Ceramic hydroxyapatite chromatography flow through method |
| US20250215087A1 (en) | 2023-12-29 | 2025-07-03 | Bristol-Myers Squibb Company | Combination therapy of kras inhibitor and treg depleting agent |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SE8801537D0 (sv) | 1988-04-26 | 1988-04-26 | Ellco Food Ab | Cellodlingsmedium samt forfarande for dess framstellning |
| KR900702370A (ko) | 1988-10-06 | 1990-12-06 | 제임스 디. 그랜트 | 가용성 t세포 표면분자를 사용하는 치료 및 진단방법 |
| JP3521382B2 (ja) * | 1997-02-27 | 2004-04-19 | 日本たばこ産業株式会社 | 細胞間接着及びシグナル伝達を媒介する細胞表面分子 |
| US7112655B1 (en) * | 1997-02-27 | 2006-09-26 | Japan Tobacco, Inc. | JTT-1 protein and methods of inhibiting lymphocyte activation |
| DE19821060A1 (de) * | 1997-09-23 | 1999-04-15 | Bundesrepublik Deutschland Let | Ko-stimulierendes Polypeptid von T-Zellen, monoklonale Antikörper sowie die Herstellung und deren Verwendung |
| WO1999015553A2 (de) | 1997-09-23 | 1999-04-01 | Bundesrepublik Deutschland Letztvertreten Durch Den Direktor Des Robert-Koch-Instituts | Ko-stimulierendes polypeptid von t-zellen, monoklonale antikörper sowie die herstellung und deren verwendung |
-
1998
- 1998-09-23 WO PCT/DE1998/002896 patent/WO1999015553A2/de not_active Ceased
- 1998-09-23 CA CA2305350A patent/CA2305350C/en not_active Expired - Lifetime
- 1998-09-23 US US09/509,283 patent/US7259247B1/en not_active Expired - Lifetime
- 1998-09-23 JP JP2000512857A patent/JP4463418B2/ja not_active Expired - Fee Related
- 1998-09-23 AU AU13320/99A patent/AU752433B2/en not_active Ceased
- 1998-09-23 ES ES98956800T patent/ES2279585T3/es not_active Expired - Lifetime
- 1998-09-23 EP EP98956800A patent/EP1017723B1/de not_active Expired - Lifetime
- 1998-09-23 DE DE59813875T patent/DE59813875D1/de not_active Expired - Lifetime
-
2007
- 2007-10-23 US US11/977,335 patent/US20080118513A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| CA2305350C (en) | 2015-04-07 |
| US7259247B1 (en) | 2007-08-21 |
| ES2279585T3 (es) | 2007-08-16 |
| AU752433B2 (en) | 2002-09-19 |
| EP1017723A2 (de) | 2000-07-12 |
| WO1999015553A3 (de) | 1999-05-20 |
| JP2001517425A (ja) | 2001-10-09 |
| EP1017723B1 (de) | 2007-01-10 |
| US20080118513A1 (en) | 2008-05-22 |
| AU1332099A (en) | 1999-04-12 |
| CA2305350A1 (en) | 1999-04-01 |
| DE59813875D1 (de) | 2007-02-22 |
| WO1999015553A2 (de) | 1999-04-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4463418B2 (ja) | T細胞共同刺激性ポリペプチド、モノクローナル抗体、ならびにその製法および使用 | |
| JP5021008B2 (ja) | T細胞共同刺激性ポリペプチド、モノクローナル抗体、ならびにその製法および使用 | |
| RU2203682C2 (ru) | Фармацевтическая композиция для лечения иммунных заболеваний | |
| US10035857B2 (en) | Regulatory T cell mediator proteins and uses thereof | |
| US6576754B2 (en) | CD100 antigen and uses therefor | |
| US20100015153A1 (en) | Novel Triggering Receptor Involved in Natural Cytotoxicity Mediated by Human Natural Killer Cells and Antibodies That Identify the Same | |
| JPH09500788A (ja) | B7−2:ctla4/cd28カウンターレセプター | |
| KR20030028466A (ko) | 새로운 수상 세포 상호자극 분자 | |
| EP1240326B1 (en) | Triggering receptor involved in natural cytotoxicity mediated by human natural killer cells and antibodies that identify this receptor | |
| US20230015969A1 (en) | Regulatory t cell mediator proteins and uses thereof | |
| AU4691796A (en) | Secreted human fas antigen | |
| WO1996020206A9 (en) | Secreted human fas antigen | |
| AU2002323894B2 (en) | Costimulating t-cell polypeptide, monoclonal antibodies, their preparation and use | |
| JP2007008958A (ja) | 哺乳動物細胞表面抗原をコードする精製された遺伝子;タンパク質および抗体 | |
| CA2288307C (en) | Novel triggering receptor involved in natural cytotoxicity mediated by human natural killer cells and antibodies that identify the same |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20050921 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050921 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080808 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20081024 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20081031 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20081208 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20081215 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090206 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090116 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090313 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090605 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090612 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090914 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20091211 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20091224 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20100122 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20100217 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130226 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130226 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140226 Year of fee payment: 4 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |