JP4366222B2 - リチウム二次電池用の電極材料、該電極材料を有する電極構造体、該電極構造体を有する二次電池 - Google Patents
リチウム二次電池用の電極材料、該電極材料を有する電極構造体、該電極構造体を有する二次電池 Download PDFInfo
- Publication number
- JP4366222B2 JP4366222B2 JP2004087996A JP2004087996A JP4366222B2 JP 4366222 B2 JP4366222 B2 JP 4366222B2 JP 2004087996 A JP2004087996 A JP 2004087996A JP 2004087996 A JP2004087996 A JP 2004087996A JP 4366222 B2 JP4366222 B2 JP 4366222B2
- Authority
- JP
- Japan
- Prior art keywords
- electrode
- secondary battery
- silicon
- lithium
- electrode material
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/10—Energy storage using batteries
Landscapes
- Silicon Compounds (AREA)
- Powder Metallurgy (AREA)
- Secondary Cells (AREA)
- Battery Electrode And Active Subsutance (AREA)
Description
(1) Sn+xLi→ LixSn E1(Li/Li+)
(2) Si+xLi→ LixSi E2(Li/Li+)
E1(Li/Li+)>E2(Li/Li+)
Lc:結晶子の大きさ
λ:X線ビームの波長
β:ピークの半価幅(ラジアン)
θ:回折線のブラッグ角
(A)シリコン、スズ或いはアルミニウム、亜鉛、インジウム、アンチモン、ビスマス、鉛、遷移金属などを混合溶融した上でアトマイズ処理により合金化する方法(ガスアトマイズ法、あるいは、水アトマイズ法など)、
(B)シリコン、スズ或いはアルミニウム、亜鉛、インジウム、アンチモン、ビスマス、鉛、遷移金属などを混合溶融して作製したシリコン合金のインゴッドを粉砕する方法、
(C)シリコン粉末、スズ或いはアルミニウム、亜鉛、インジウム、アンチモン、ビスマス、鉛の粉末、遷移金属粉末などを不活性ガス下で粉砕混合しながら合金化する方法(メカニカルアロイング法)、
(D)揮発性の塩化物(或いは他のハロゲン化物)や酸化物などを用いてプラズマ、電子ビーム、レーザー、あるいは誘導加熱により気相から生成する方法、などが挙げられる。
(1)負極301,403と、成形した正極303,406の間に、セパレータとしてのイオン伝導体302,407を挟んで、正極缶305または負極缶408に組み込む。
(2)電解液を注入した後、負極キャップ304または正極キャップ409とガスケット306,410を組み立てる。
(3)上記(2)を、かしめる。
まず、負極材料を調製する実施例について説明する。
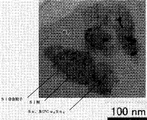
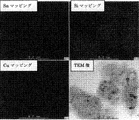
Si65重量%、Sn30重量%、Cu5重量%を溶融、混合して合金を作製し、水アトマイズ法にて平均粒径が10μmのSi−Sn−Cu合金粉末を調製した。次に、調製した合金粉末をビーズミル(つまり、粉砕メディアに比較的小径のビーズを用いたボールミル)にて粉砕し、Si−Sn−Cu合金の微粉末を得た。なお、この粉砕は、イソプロピルアルコール中でジルコニアビーズを用いて行った。
前記実施例1において、Si70重量%、Zn25重量%、Cu5重量%の組成の合金を窒素ガスによるガスアトマイズ法で調製した以外は、実施例1と同様の操作にて、Si−Zn−Cu合金微粉末の電極材料を得た。
前記実施例1において、Si50重量%、Sn40重量%、Co10重量%の組成の合金を水アトマイズ法で調製した以外は、実施例1と同様の操作にて、Si−Sn−Co合金微粉末の電極材料を得た。
前記実施例1において、Si85重量%、Sn10重量%、Ni5重量%の組成の合金を水アトマイズ法で調製した以外は、実施例1と同様の操作にて、Si−Sn−Ni合金微粉末の電極材料を得た。
実施例1において高エネルギー遊星ボールミル処理を行わなかった、Si−Sn−Cu合金微粉末の電極材料を得た。
実施例2において高エネルギー遊星ボールミル処理を行わなかった、Si−Zn−Cu合金微粉末の電極材料を得た。
実施例3において高エネルギー遊星ボールミル処理を行わなかった、Si−Sn−Co合金微粉末の電極材料を得た。
実施例4において高エネルギー遊星ボールミル処理を行わなかった、Si−Sn−Ni合金微粉末の電極材料を得た。
次に、厚み100μmのリチウム金属箔を銅箔に圧着することにより、リチウム電極を作製した。次に、エチレンカーボネートとジエチルカーボネートとを3:7の体積比で混合して得た有機溶媒にLiPF6の塩を1M(モル/リットル)溶解させて、電解液を調製した。
本実施例では、本発明の負極材料を用いて集電体の両面に電極層を設けた電極構造体を作製し、作製した電極構造体を負極として使用して、図5に示した断面構造の18650サイズ(直径18mmφ×高さ65mm)のリチウム二次電池を作製した。
実施例1〜4の電極材料を用いて以下の手順で負極403を作製した。
[1] クエン酸リチウムと硝酸コバルトを1:3のモル比で混合し、クエン酸を添加してイオン交換水に溶解した水溶液を、200℃空気気流中に噴霧して、微粉末のリチウム−コバルト酸化物の前駆体を調製した。
[2] 上記[1]で得られたリチウム−コバルト酸化物の前駆体を、更に、酸素気流中において850℃で熱処理した。
[3] 上記[2]において調製したリチウム−コバルト酸化物に、黒鉛粉3重量%とポリフッ化ビリニデン粉5重量%を混合した後、N−メチル−2−ピロリドンを添加してペーストを作製した。
[4] 上記[3]で得られたペーストを、厚み20ミクロンのアルミニウム箔の集電体404の両面に塗布乾燥した後、ロールプレス機で片側の正極活物質層の厚みを90ミクロンに調整した。さらに、アルミニウムのリードを超音波溶接機で接続し、150℃で減圧乾燥して正極406を作製した。
[1] 十分に水分を除去したエチレンカーボネートとジエチルカーボネートとを、体積比3:7で混合した溶媒を調製した。
[2] 上記[1]で得られた溶媒に、四フッ化ホウ酸リチウム塩(LiBF4)を1M(モル/リットル)溶解したものを電解液として用いた。
厚み25ミクロンのポリエチレンの微孔性フィルムをセパレータとして用いた。
組み立ては、露点−50℃以下の水分を管理した乾燥雰囲気下で全て行なった。
それぞれの電池について、充放電を行ない、放電容量を計測した。
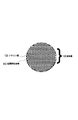
102 電極構造体
103 負極材料微粉末
104 導電補助材
105 結着剤
106 シリコン相
107 金属間化合物
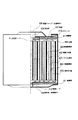
201、301、403 負極
203、303、406 正極
202、302、407 イオン伝導体
204 負極端子
205 正極端子
206 電槽(電池ハウジング)
304 負極キャップ
305 正極缶
306、410 ガスケット
401 負極集電体
402 負極材料層
404 正極集電体
405 正極材料層
408 負極缶(負極端子)
409 正極キャップ(正極端子)
411 絶縁板
412 負極リード
413 正極リード
414 安全弁
Claims (9)
- シリコンを主成分とする平均粒径が0.02μm〜5μm以下の合金の粒子からなるリチウム二次電池用の電極材料であって、
前記合金の結晶子サイズが2nm以上500nm以下であり、かつシリコン相中に少なくともスズを含む金属間化合物が分散していることを特徴とするリチウム二次電池用の電極材料。 - 前記スズを含む金属間化合物が、銅、ニッケル、コバルト、鉄、マンガン、バナジウム、モリブデン、ニオブ、タンタル、ジルコニア、イットリウム、ランタン、セレン、マグネシウムの少なくとも1種類以上の元素を有することを特徴とする請求項1記載のリチウム二次電池用の電極材料。
- 前記シリコンを主成分とする合金が、スズ、アルミニウム、亜鉛、インジウム、アンチモン、ビスマス、鉛から選ばれる少なくとも1種類以上の金属単体を有することを特徴とする請求項1又は2記載のリチウム二次電池用の電極材料。
- シリコンを主成分とする平均粒径が0.02μm〜5μm以下の合金の粒子からなるリチウム二次電池用の電極材料であって、
前記合金の結晶子サイズが2nm以上500nm以下であり、シリコン相中に、少なくともアルミニウム、亜鉛、インジウム、アンチモン、ビスマス、鉛のいずれかを含む1種類以上の金属間化合物が分散していることを特徴とするリチウム二次電池用の電極材料。 - 前記シリコンを主成分とする合金が、スズ、アルミニウム、亜鉛、インジウム、アンチモン、ビスマス、鉛から選ばれる少なくとも1種類以上の金属単体を有することを特徴とする請求項4記載のリチウム二次電池用の電極材料。
- 前記合金中のシリコンの含有量は50wt%以上90wt%以下である、ことを特徴とする請求項1乃至5の何れか1項に記載のリチウム二次電池用の電極材料。
- 請求項1乃至6のいずれか1項に記載の電極材料と、導電補助材、結着剤、集電体から構成されていることを特徴とする電極構造体。
- 前記導電補助材が炭素材料である、ことを特徴とする請求項7記載の電極構造体。
- 請求項7又は8記載の電極構造体を用いた負極、電解質及び正極を具備し、リチウムの酸化反応及びリチウムイオンの還元反応を利用した二次電池。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004087996A JP4366222B2 (ja) | 2003-03-26 | 2004-03-24 | リチウム二次電池用の電極材料、該電極材料を有する電極構造体、該電極構造体を有する二次電池 |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003086628 | 2003-03-26 | ||
| JP2004087996A JP4366222B2 (ja) | 2003-03-26 | 2004-03-24 | リチウム二次電池用の電極材料、該電極材料を有する電極構造体、該電極構造体を有する二次電池 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2004311428A JP2004311428A (ja) | 2004-11-04 |
| JP4366222B2 true JP4366222B2 (ja) | 2009-11-18 |
Family
ID=33478348
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004087996A Expired - Fee Related JP4366222B2 (ja) | 2003-03-26 | 2004-03-24 | リチウム二次電池用の電極材料、該電極材料を有する電極構造体、該電極構造体を有する二次電池 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4366222B2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9181674B2 (en) | 2011-06-27 | 2015-11-10 | Hubbell Incorporated | Seismic restraint helical pile systems and method and apparatus for forming same |
Families Citing this family (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5094013B2 (ja) * | 2004-12-10 | 2012-12-12 | キヤノン株式会社 | リチウム二次電池用の電極構造体及び該電極構造体を有する二次電池 |
| US7767349B2 (en) * | 2005-07-25 | 2010-08-03 | 3M Innovative Properties Company | Alloy compositions for lithium ion batteries |
| JP5398962B2 (ja) | 2006-06-30 | 2014-01-29 | 三洋電機株式会社 | リチウム二次電池及びその製造方法 |
| JP5157216B2 (ja) | 2007-03-29 | 2013-03-06 | Tdk株式会社 | 活物質の製造方法及び活物質 |
| JP5211526B2 (ja) | 2007-03-29 | 2013-06-12 | Tdk株式会社 | 全固体リチウムイオン二次電池及びその製造方法 |
| JP5152743B2 (ja) * | 2007-06-06 | 2013-02-27 | 本城金属株式会社 | リチウム二次電池用電極及びその製造方法 |
| JP5520538B2 (ja) * | 2009-08-03 | 2014-06-11 | 古河電気工業株式会社 | ナノサイズ粒子を含むリチウムイオン二次電池用負極材料、リチウムイオン二次電池用負極、リチウムイオン二次電池 |
| JP5139386B2 (ja) * | 2009-09-01 | 2013-02-06 | 有限会社 ナプラ | コンポジット構造を有するナノ球状粒子、粉末、及び、その製造方法 |
| JP5790282B2 (ja) * | 2010-09-30 | 2015-10-07 | 大同特殊鋼株式会社 | リチウム二次電池用負極活物質およびリチウム二次電池用負極 |
| JP5884573B2 (ja) * | 2011-09-30 | 2016-03-15 | 大同特殊鋼株式会社 | リチウムイオン電池用負極活物質及びこれを用いたリチウムイオン電池用負極 |
| JP5945903B2 (ja) * | 2011-12-16 | 2016-07-05 | 日産自動車株式会社 | 電気デバイス用負極活物質 |
| KR20180031067A (ko) | 2012-11-22 | 2018-03-27 | 닛산 지도우샤 가부시키가이샤 | 전기 디바이스용 부극, 및 이것을 사용한 전기 디바이스 |
| JP6139117B2 (ja) * | 2012-12-06 | 2017-05-31 | ユニチカ株式会社 | シリコン系粒子分散塗液およびその製造方法 |
| JP6329888B2 (ja) * | 2013-12-13 | 2018-05-23 | エルジー・ケム・リミテッド | 二次電池用負極材及びこれを用いた二次電池 |
| WO2015111187A1 (ja) | 2014-01-24 | 2015-07-30 | 日産自動車株式会社 | 電気デバイス |
| CN105934846B (zh) | 2014-01-24 | 2019-06-28 | 日产自动车株式会社 | 电器件 |
| US10516161B2 (en) | 2014-12-17 | 2019-12-24 | Nissan Motor Co., Ltd. | Negative electrode active material for electric device and electric device using the same |
| KR20180115809A (ko) * | 2014-12-17 | 2018-10-23 | 닛산 지도우샤 가부시키가이샤 | 전기 디바이스용 부극 활물질, 및 이것을 사용한 전기 디바이스 |
| KR101779602B1 (ko) * | 2016-01-12 | 2017-09-18 | 경희대학교 산학협력단 | 아연공기전지 음극용 합금 및 그 제조방법 |
| JP7010099B2 (ja) * | 2018-03-20 | 2022-01-26 | 株式会社Gsユアサ | 負極活物質、負極及び非水電解質蓄電素子 |
| JP2025154092A (ja) * | 2024-03-29 | 2025-10-10 | 三菱製鋼株式会社 | リチウムイオン二次電池用負極材及びリチウムイオン二次電池 |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3805053B2 (ja) * | 1997-02-10 | 2006-08-02 | 旭化成エレクトロニクス株式会社 | リチウム二次電池 |
| JP4635283B2 (ja) * | 1999-10-01 | 2011-02-23 | パナソニック株式会社 | 非水電解質二次電池 |
| JP2001118574A (ja) * | 1999-10-15 | 2001-04-27 | Sanyo Electric Co Ltd | リチウム二次電池 |
| JP3546798B2 (ja) * | 2000-03-09 | 2004-07-28 | 松下電器産業株式会社 | 非水電解質二次電池と該電池用合金およびその製造方法 |
| JP2001291514A (ja) * | 2000-04-06 | 2001-10-19 | Sumitomo Metal Ind Ltd | 非水電解質二次電池用負極材料とその製造方法 |
| JP4608743B2 (ja) * | 2000-07-19 | 2011-01-12 | パナソニック株式会社 | 非水電解質二次電池 |
| JP4464173B2 (ja) * | 2003-03-26 | 2010-05-19 | キヤノン株式会社 | リチウム二次電池用の電極材料、該電極材料を有する電極構造体、及び該電極構造体を有する二次電池 |
-
2004
- 2004-03-24 JP JP2004087996A patent/JP4366222B2/ja not_active Expired - Fee Related
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9181674B2 (en) | 2011-06-27 | 2015-11-10 | Hubbell Incorporated | Seismic restraint helical pile systems and method and apparatus for forming same |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2004311428A (ja) | 2004-11-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US7378041B2 (en) | Electrode material for lithium secondary battery, electrode structure comprising the electrode material and secondary battery comprising the electrode structure | |
| JP4164342B2 (ja) | リチウム二次電池用の電極材料、該電極材料を有する電極構造体、該電極構造体を有する二次電池、前記電極材料の製造方法、前記電極構造体の製造方法、及び前記二次電池の製造方法 | |
| JP4366222B2 (ja) | リチウム二次電池用の電極材料、該電極材料を有する電極構造体、該電極構造体を有する二次電池 | |
| JP4464173B2 (ja) | リチウム二次電池用の電極材料、該電極材料を有する電極構造体、及び該電極構造体を有する二次電池 | |
| JP5517637B2 (ja) | リチウム二次電池用の電極材料、該電極材料を有する電極構造体、及び該電極構造体を有する二次電池 | |
| JP3733292B2 (ja) | リチウム二次電池の負極用電極材、該電極材を用いた電極構造体、該電極構造体を用いたリチウム二次電池、及び該電極構造体及び該リチウム二次電池の製造方法 | |
| JP3620703B2 (ja) | 二次電池用負極電極材、電極構造体、二次電池、及びこれらの製造方法 | |
| JPWO2000017949A1 (ja) | リチウム二次電池の負極用電極材、該電極材を用いた電極構造体、該電極構造体を用いたリチウム二次電池、及び該電極構造体及び該リチウム二次電池の製造方法 | |
| JP2006216277A (ja) | リチウム二次電池用電極材料の製造方法、電極構造体および二次電池 | |
| JP2000100429A (ja) | 電極構造体及び二次電池 | |
| CA2610487C (en) | Electrode material for lithium secondary battery, electrode structure comprising the electrode material and secondary battery comprising the electrode structure |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070323 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20090804 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20090818 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20090824 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120828 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120828 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130828 Year of fee payment: 4 |
|
| LAPS | Cancellation because of no payment of annual fees |