JP4189043B2 - N−アシルピペラジン誘導体及び抗菌剤、抗潰瘍剤 - Google Patents
N−アシルピペラジン誘導体及び抗菌剤、抗潰瘍剤 Download PDFInfo
- Publication number
- JP4189043B2 JP4189043B2 JP08593797A JP8593797A JP4189043B2 JP 4189043 B2 JP4189043 B2 JP 4189043B2 JP 08593797 A JP08593797 A JP 08593797A JP 8593797 A JP8593797 A JP 8593797A JP 4189043 B2 JP4189043 B2 JP 4189043B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- salt
- compound
- formula
- reaction
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- JWJACYQOYXLDMG-YDZHTSKRSA-N CC(C)=CCC/C(/C)=C/COc(cc1)ccc1C(N1CCN(Cc2ccc3OCOc3c2)CC1)=O Chemical compound CC(C)=CCC/C(/C)=C/COc(cc1)ccc1C(N1CCN(Cc2ccc3OCOc3c2)CC1)=O JWJACYQOYXLDMG-YDZHTSKRSA-N 0.000 description 1
- XRMOAXDUGLIUQF-HHHXNRCGSA-N CC(C)Cc(cc([C@H](N(CC1)CCN1c1ncccc1)O)cc1)c1OCc(cc1)ccc1F Chemical compound CC(C)Cc(cc([C@H](N(CC1)CCN1c1ncccc1)O)cc1)c1OCc(cc1)ccc1F XRMOAXDUGLIUQF-HHHXNRCGSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/16—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms acylated on ring nitrogen atoms
- C07D295/18—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms acylated on ring nitrogen atoms by radicals derived from carboxylic acids, or sulfur or nitrogen analogues thereof
- C07D295/182—Radicals derived from carboxylic acids
- C07D295/192—Radicals derived from carboxylic acids from aromatic carboxylic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/78—Carbon atoms having three bonds to hetero atoms, with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D213/79—Acids; Esters
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/78—Carbon atoms having three bonds to hetero atoms, with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D213/79—Acids; Esters
- C07D213/80—Acids; Esters in position 3
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D317/00—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms
- C07D317/08—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms having the hetero atoms in positions 1 and 3
- C07D317/44—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms having the hetero atoms in positions 1 and 3 ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D317/46—Heterocyclic compounds containing five-membered rings having two oxygen atoms as the only ring hetero atoms having the hetero atoms in positions 1 and 3 ortho- or peri-condensed with carbocyclic rings or ring systems condensed with one six-membered ring
- C07D317/48—Methylenedioxybenzenes or hydrogenated methylenedioxybenzenes, unsubstituted on the hetero ring
- C07D317/62—Methylenedioxybenzenes or hydrogenated methylenedioxybenzenes, unsubstituted on the hetero ring with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to atoms of the carbocyclic ring
- C07D317/68—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen
Description
【産業上の利用分野】
本発明はN−アシルピペラジン誘導体、特にヘリコバクター・ピロリに対する抗菌作用ないし抗潰瘍作用を有するN−アシルピペラジン誘導体に関する。
【0002】
【従来の技術】
人間における潰瘍の発生原因としては各種の説が考えられている。特にストレス、及びリウマチ疾患などの治療のための非ステロイド性抗炎症剤の服用などが潰瘍の発生に密接に関連していることが解明されており、これらは胃や十二指腸への過剰な酸分泌を誘発することが大きな原因といわれている。このため、酸分泌を抑制することで、潰瘍の発生予防及び治療を行うことが重要である。
【0003】
一方、胃に常在する桿菌であるヘリコバクター・ピロリは、これが持つ強いウレアーゼ活性によりアンモニアを発生し、潰瘍を誘発するとともに、粘液や粘膜内にしつこく生存するために潰瘍再発の最大の要因と考えられるようになってきた。従って、この菌を殺菌することができれば、潰瘍の再発を防止できると考えられている。
【0004】
【発明が解決しようとする課題】
従来より各種潰瘍治療薬が開発されているが、ストレス性潰瘍の発生防止効果あるいはヘリコバクター・ピロリに対する抗菌作用を持つ薬剤は少ない。
本発明は前記従来技術の課題に鑑みなされたものであり、その目的は潰瘍の発生防止効果に優れたN−アシルピペラジン誘導体及びそれを主成分とするヘリコバクター・ピロリに対する抗菌剤、抗潰瘍剤を提供することにある。
【0005】
【課題を解決するための手段】
前記目的を達成するために本発明者らが鋭意検討を行った結果、特定のN−アシルピペラジン誘導体が、ヘリコバクター・ピロリに対する抗菌性ないし酸分泌抑制を主作用機序として各種潰瘍に有効であることを見いだし、本発明を完成するにいたった。
すなわち、本発明にかかるN−アシルピペラジン誘導体又はその塩は、下記一般式化5で示されることを特徴とする。
【0006】
【化5】
(上記化5中、R1は式:
【化5a】
(上記化1a中、pは1〜4の整数を意味する。)で示されるピリジルカルボニルオキシアルキル基、式:
【化5b】
(上記化1b中、Yはフェニル基又は3,4−メチレンジオキシフェニル基、qは1〜4の整数を意味する。)で示されるベンゾイルアミノアルキル基、ベンジル基又はピペロニル基、窒素原子上に置換基として炭素数1〜6のアルキル基を有していてもよいカルバモイル基、ピリジル基、又はジフェニルメチル基を意味する。
R2は炭素数1〜6のアルキル基又は炭素数1〜6のアルコキシ基を意味し、nは0〜2の整数を意味する。
R3は二重結合が1つ以上含まれる炭素数2〜20のアルケニル基又は芳香環上に置換基としてハロゲン原子を有していてもよいベンジル基を意味し、mは1〜3の整数を意味する。)
【0007】
また、本発明化合物において、R3が二重結合が1つ以上含まれる炭素数2〜20のアルケニル基であることが好適であり、さらには下記一般式化6で示される化合物であることが好適である。
【化6】
(化6中、Raはメチル基又はプレニル−CH2−基を意味し、R1は前記化5aで示されるピリジルカルボニルオキシアルキル基、前記化5bで示されるベンゾイルアミノアルキル基又はベンジル基又はピペロニル基を意味する。R2、m、及びnは前記化5と同じである。)
なお、前記化5においてR3が二重結合が1つ以上含まれる炭素数2〜20のアルケニル基である化合物において、nが1又は2であり、R2がイソブチル基又はメトキシ基であることが好適である。
【0008】
また、前記化5においてR3が二重結合が1つ以上含まれる炭素数2〜20のアルケニル基である化合物において、nが0であることが好適である。
また、本発明化合物において、R3が芳香環上に置換基としてハロゲン原子を有していてもよいベンジル基、R2が炭素数1〜6のアルキル基であり、且つn=m=1であることが好適であり、さらには下記一般式化7で示される化合物であることが好適である。
【化7】
(化7中、R1は窒素原子上に置換基として炭素数1〜6のアルキル基を有していてもよいカルバモイル基、ベンジル基又はピペロニル基、又はピリジル基、R2は炭素数1〜6のアルキル基、Rbはハロゲン原子を意味し、lは0又は1を意味する。)
【0009】
なお、前記化7においてlが1であり、Rbがフッ素原子で、且つパラ位に結合していることが好適である。
また、前記化5においてR3が芳香環上に置換基としてハロゲン原子を有していてもよいベンジル基、R2が炭素数1〜6のアルキル基であり、且つn=m=1である化合物において、R2がイソブチル基であることが好適である。
【0010】
また、本発明にかかるヘリコバクター・ピロリに対する抗菌剤は、前記N−アシルピペラジン誘導体ないしその薬理的に許容できる塩を有効成分とすることを特徴する。
また、本発明にかかる抗潰瘍剤は、前記N−アシルピペラジン誘導体ないしその薬理的に許容できる塩を有効成分とすることを特徴とする。
【0011】
【発明の実施の形態】
以下、本発明の実施の形態について説明する。
本発明化合物において、R1に見られる「ピリジルカルボニルオキシ低級アルキル基」は下記一般式化9に示される基を意味する。
【化9】
なお、上記化9中、pは1〜4の整数を意味するが、好ましくは2である。
【0012】
また、R1に見られる「ベンゾイルアミノ低級アルキル基」は下記一般式化10に示される基を意味する。
【化10】
なお、上記化10中、Yは置換若しくは無置換のフェニル基、qは1〜4の整数を意味するが、Yとして好ましくは3,4−メチレンジオキシフェニル基であり、qとして好ましくは2である。
【0013】
R1に見られるベンジル基としては、その芳香環上に置換基を有していてもよい。
このような置換基を有するベンジル基としては例えばピペロニル基が挙げられる。
R1に見られるカルバモイル基としては、その窒素原子上に置換基を有していてもよい。このような置換基としては低級アルキル基が挙げられる。なお、ここでいう低級アルキル基とは後述するR2における定義と同じであるが、好ましくは分岐低級アルキル基であり、特に好ましくはイソプロピル基である。
【0014】
R1に見られるピリジル基としては、無置換ピリジル基である。
本発明化合物において、R2に見られる低級アルキル基とは炭素数1〜6の直鎖もしくは分岐状のアルキル基で、たとえばメチル、エチル、n−プロピル、n−ブチル、イソプロピル、イソブチル、1−メチルプロピル、tert−ブチル、n−ペンチル、1−エチルプロピル、イソアミル、n−ヘキシルなどを挙げることができるが、好ましくは分岐低級アルキル基であり、特に好ましくはイソブチル基である。
【0015】
また、R2に見られる低級アルコキシ基とは、上記の低級アルキル基から誘導されるアルコキシ基を意味するが、好ましい例はメトキシ基である。
R3に見られるアルケニル基とは、二重結合が1つ以上含まれる炭素数2〜20の直鎖又は分岐状のアルケニル基を意味する。なお、二重結合の立体配置についてはシス(cis)、トランス(trans)の二種が存在するが、アルケニル基中のそれぞれの立体配置はこの何れであってもよい。このようなアルケニル基のうち、好ましくは分岐アルケニル基であり、特に好ましくはプレニル基、ゲラニル基、ネリル基、ファルネシル基であり、さらに好ましくはプレニル基、ゲラニル基である。
【0016】
また、R3に見られるベンジル基としては、その芳香環上に置換基を有していてもよい。このような置換基としては、好ましくはハロゲン原子であり、塩素、臭素、ヨウ素、フッ素が挙げられるが、最も好ましい例はフッ素である。また、該フッ素原子はパラ位に存在することが好適である。
以下に本発明化合物の製造方法の例を説明するが、これらに限定されるものではない。
【0017】
まず、前記化5で示される本発明化合物(I)のうち、R3がアルケニル基又はベンジル基である化合物(I− a )は、図1に示す反応式Aのようして合成することができる。
反応式Aにおいては、一般式(II)で表されるカルボン酸と一般式(III)で表される置換ピペラジンから、混合酸無水物法、酸塩化物法、DCC法あるいはアジド法などの公知のアミド結合形成反応を用いることにより、一般式(I− a )で表される本発明化合物であるN−アシルピペラジン誘導体が得られる。化合物(III)中におけるR1及び化合物(II)中におけるR2,m,nは上記化5の定義の通りであり、R3はアルケニル基又はベンジル基を意味する。
【0018】
混合酸無水物法の場合には、活性化剤としてたとえば、ジフェニルホスフィニッククロライド、エチルクロロホルメート、イソブチルクロロホルメート、ピバロイルクロライドなどを用いて、カルボン酸(II)をその対応する酸無水物へと変換した後、化合物(III)と反応させる。添加剤として例えば、有機塩基であるトリエチルアミン、ピリジン、N−メチルモルホリン等が用いられる。溶媒として例えば、ジクロロメタン、クロロホルム等のハロゲン化炭化水素、ベンゼン、トルエン、キシレン等の芳香族炭化水素、テトラヒドロフラン、ジオキサン等のエーテル類、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミドなどのアミド類などが用いられている。反応温度、反応時間は使用する原料化合物に応じて変化させればよいが、通常−15℃から溶媒の還流温度の範囲で行われる。
【0019】
酸塩化物法の場合には、活性化剤として例えば、五塩化リン、三塩化リン、塩化チオニル等を用いて、カルボン酸(II)をその対応する酸塩化物へと変換した後、化合物(III)と反応させる。添加剤として例えば、有機塩基であるトリエチルアミン、ピリジン、N−メチルモルホリン等が用いられる。溶媒として例えば、ジクロロメタン、クロロホルムなどのハロゲン化炭化水素、ベンゼン、トルエン、キシレンなどの芳香族炭化水素、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミドなどのアミド類などが用いられる。反応温度、反応時間は使用する原料化合物に応じて変化させればよいが通常、0℃から溶媒の還流温度の範囲で行われる。
【0020】
DCC法の場合には、縮合剤として例えば、N,N’−ジシクロヘキシルカルボジイミド(DCC)、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(EDCI)等が用いられる。溶媒として例えば、ジクロロメタン、クロロホルムなどのハロゲン化炭化水素、ベンゼン、トルエン、キシレンなどの芳香族炭化水素、テトラヒドロフラン、ジオキサンなどのエーテル類、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミドなどのアミド類などが用いられる。本反応は必要に応じて1−ヒドロキシベンゾトリアゾール(HOBt)やN−ヒドロキシスクシンイミド(HONSu)を添加して行ってもよい。反応温度、反応時間は使用する原料化合物に応じて変化させればよいが通常、0℃から溶媒の還流温度の範囲で行われる。
【0021】
アジド法の場合には、活性化剤として例えば、ジフェニルホスホリルアジドなどを用いてカルボン酸(II)をその対応するアジドへと変換した後、化合物(III)と反応させる。添加剤として例えば、有機塩基であるトリエチルアミン、ピリジン、N−メチルモルホリンなどが用いられる。溶媒として例えば、ジクロロメタン、クロロホルムなどのハロゲン化炭化水素、ベンゼン、トルエン、キシレンなどの芳香族炭化水素、テトラヒドロフラン、ジオキサンなどのエーテル類、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミドなどのアミド類などが用いられる。反応温度、反応時間は使用する原料化合物に応じて変化させればよいが通常、0℃から溶媒の還流温度の範囲で行われる。
【0022】
具体的には、例えば混合酸無水物法の活性化剤として、ジフェニルホスフィニッククロライド、ピバロイルクロライド等を用い、添加剤としてはトリエチルアミンを用いてクロロホルムまたはN,N−ジメチルホルムアミド等の溶媒中にて、−15℃から室温の範囲で反応を行うことにより目的を達する。
また、化5においてR3がアルケニル基又はベンジル基である化合物(I− a )は、図2に示す反応式Bのようにしても合成することができる。
【0023】
反応式Bの第一段階において、一般式(II)で表されるカルボン酸と、一般式(IV)で表される保護ピペラジンから、反応式Aにおいて記述した縮合方法を用いることにより、一般式(V)で表される化合物が得られる。化合物(II)中におけるR2、n、mは上記化5の定義の通りであり、R3はアルケニル基又はベンジル基を意味する。化合物(IV)中におけるR4はアミノ保護基を表し、以後の反応において問題が起きない限りベンジルオキシカルボニル基、第三ブチルオキシカルボニル基などのウレタン型保護基、ホルミル基やトシル基などのアシル型保護基、あるいはトリチル基などのアルキル型保護基を用いることができる。
【0024】
反応式Bの第二段階において、一般式(V)で表される化合物を脱保護反応に付すことにより、一般式(VI)で表される化合物が得られる。
本脱保護反応はアミノ保護基R4の種類により公知の各種の方法を用いることができる。例えばR4がホルミル基の場合、脱保護剤としてヒドラジン、塩酸、過酸化水素などが用いられる。具体的には例えば1Nから6Nの範囲の塩酸を用いてメタノール中にて、0℃から室温の範囲で反応を行うことにより目的を達する。
【0025】
反応式Bの第三段階において、一般式(VI)で表される化合物と一般式(VII)で表されるハロゲン化物とを塩基の存在下で反応させることにより、一般式(I-a)で表される本発明化合物であるN−アシルピペラジン誘導体が得られる。化合物(VII)中におけるXはハロゲン原子を表し、R1は上記化5の定義のとおりである。
なお、塩基として例えば、炭酸カリウム、水酸化カリウム、水酸化ナトリウム、水素化ナトリウムなどの無機塩基、トリエチルアミン、ピリジン等の有機塩基が用いられる。具体的には例えば塩基として炭酸カリウムを用い、アセトン、N,N−ジメチルホルムアミド、ジクロロメタン、ベンゼンなどの溶媒中にて、0℃から溶媒の還流温度の範囲で反応を行うことにより目的を達する。
【0026】
また、本発明化合物(I)において、R1がベンゾイルアミノ低級アルキル基である化合物、例えば一般式(I−b)で示される化合物は図3の反応式Cのようにして合成することができる。
反応式Cの第1段階において、上述の反応式Bの第1段階のようにして合成できる化合物(V’)を還元反応に付すことにより、アミン(XVIII)が得られる。なお、R4’はシアノアルキル基を表す。
【0027】
本反応のシアノ基の還元においては公知の方法が用いられ、例えばBirch還元法、金属水素錯化合物による還元法、ラネーニッケルを用いる方法などを使用することができる。Birch還元の場合は、触媒として主にナトリウムやリチウムなどを用い、液体アンモニアとメタノール、エタノールなどのアルコールとの混合溶媒中で反応を行うことができる。金属水素錯化合物を用いる場合は、試薬として水素化アルミニウムリチウムや水素化アルミニウム、水素化ホウ素ナトリウムなどが使用できる。溶媒としてはジエチルエーテル、テトラヒドロフラン、ジオキサンなどのエーテル類、メタノール、エタノール、ブタノールなどのアルコール類などが使用される。水素化ホウ素ナトリウムを用いる場合は触媒としてラネーニッケル、塩化アルミニウムや塩化コバルトなどを使用することができる。ラネーニッケルを用いる場合は、アンモニア飽和メタノールを溶媒として加圧下、水素添加を行なうことにより目的を達する。いずれの反応においても反応温度、反応時間は使用する原料化合物に応じて変化させれば良いが、通常0℃から溶媒の還流温度の範囲で行われる。
【0028】
具体的には、例えば水素化アルミニウムリチウムなどを氷冷下テトラヒドロフラン中に懸濁させ、そこへ化合物(V’)を滴下し、0℃から溶媒の還流温度の範囲で反応を行なう。次いで水、あるいは水酸化ナトリウム水溶液などで処理することにより目的を達する。
【0029】
反応式Cの第2段階において、化合物(XVII)とA−CO−Yとをアミド化させることにより本発明化合物(I−b)が得られる。なお、Yは前記化10の定義と同じであり、Aはヒドロキシ基、ハロゲン、または−OCOYを示す。本アミド化反応は、前記反応式Aにおける反応条件と同様にして行うことができる。
また、本発明化合物(I)において、R3がベンジル基である化合物、例えば前記化7で示される化合物は、図4に示す反応式Dのようにして合成することができる。
【0030】
反応式Dの第一段階において、一般式(VIII)で表されるカルボン酸と一般式(III)で表される置換ピペラジンから、反応式Aにおいて記述した縮合方法を用いることにより、一般式(IX)で表される化合物が得られる。化合物(III)中におけるR1、及び化合物(VIII)中におけるR2は上記化5の定義の通りである。又、化合物(VIII)中におけるR5はフェノール性水酸基の保護基を表し、以後の反応において問題を起こさない限りベンジル基、各種の置換ベンジル基、ベンジルオキシカルボニル基あるいは第三ブチルオキシカルボニル基等を用いることができる。
【0031】
反応式Dの第二段階において、一般式 (IX) で表される化合物を脱保護反応に付すことにより、R5が水素原子である化合物 (XIX) が得られる。
本脱保護反応は保護基R5の種類により公知の各種の方法が用いることができる。例えばR5がベンジル基の場合、還元的な除去又は酸処理による除去法が用いられる。具体的には、例えば接触還元条件下、触媒としてパラジウム−炭素を用い、エタノール等の溶媒中にて室温から溶媒の還流温度の範囲で反応を行なうことにより目的を達する。
【0032】
反応式Dの第三段階において、一般式 (XIX) で表される化合物と一般式 (X) で表される適当に置換されたベンジルハライドを塩基存在下で反応させることにより、R3がベンジル基である本発明化合物 (I-c)が得られる。化合物 (X) 中におけるRb、lは上記化7の定義のとおりであり、Xはハロゲン原子を表す。
本反応における塩基として例えば、炭酸カリウム、水酸化カリウム、水酸化ナトリウム、水素化ナトリウム等の無機塩基、トリエチルアミン、ピリジン等の有機塩基が用いられる。具体的には、例えば塩基として炭酸カリウムを用い、アセトン、N,N−ジメチルホルムアミド等の溶媒中にて、室温から溶媒の還流温度の範囲で反応を行なうことにより目的を達する。
【0033】
なお、この反応式Dと同様にすれば、本発明化合物(I)においてR3がベンジル基であって、n=m=1でない化合物も合成することが可能である。
【0034】
次に、各原料化合物の製造方法について説明する。
【0035】
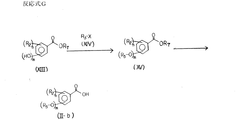
まず、反応式A及びBにおいて一般式 (II) で表される原料化合物は、商業上入手可能であるか、又は公知の合成方法を用いて製造することが可能である。例えば、原料化合物(II)においてR3がベンジル基で、n=m=1である化合物(II-a)は図5に示す反応式Fによって製造することができる。
【0036】
反応式Fの第一段階において、一般式 (XI) で表される化合物と一般式 (X)で表される適当に置換されたベンジルハライドを塩基存在下で反応させることにより、一般式 (XII)で表される化合物が得られる。化合物 (XI) 中におけるR2は上記化5の定義の通りであり、化合物 (X) 中におけるRb、lは上記化7の定義のとおりである。化合物 (X) 中におけるXはハロゲン原子を表す。また、化合物 (XI) 中におけるR6はカルボキシル保護基を表し、以後の反応において問題を起こさない限り、メチル基、エチル基、第三ブチル基等の低級アルキル基、フェナシル基あるいはトリクロロエチル基等を用いることができる。
【0037】
本反応における塩基として例えば、炭酸カリウム、水酸化カリウム、水酸化ナトリウム、水素化ナトリウム等の無機塩基、トリエチルアミン、ピリジン等の有機塩基が用いられる。具体的には、例えば塩基として炭酸カリウムを用い、アセトン、N,N−ジメチルホルムアミド等の溶媒中にて、室温から溶媒の還流温度の範囲で反応を行なうことにより目的を達する。
反応式Fの第二段階において、一般式 (XII) で表される化合物を脱保護反応に付すことにより、一般式 (II-a) で表されるカルボン酸が得られる。
【0038】
本脱保護反応は保護基R6の種類により公知の各種の方法が用いられる。例えばR6がメチル基、エチル基の場合には公知のエステル加水分解によって脱保護される。具体的には、例えば水酸化ナトリウム、水酸化カリウム等の無機塩基を用い、水、メタノール、エタノール等の溶媒中にて、室温から溶媒の還流温度の範囲で反応を行なうことにより目的を達する。
【0039】
また、前記反応式A及びBで用いる原料化合物(II)のうち、例えばR3がアルケニル基である化合物(II-b)は、例えば図6に示す反応式Gのようにして合成することができる。
反応式G中、化合物(XIII)においてR2、m、nは上記化5の定義のとおりであり、R7はカルボキシル保護基を表し、以後の反応において問題を起こさない限りメチル基、エチル基、第3ブチル基等の低級アルキル基、フェナシル基あるいはトリクロロエチル基等を用いることができる。化合物(XIV)におけるR3はアルケニル基、Xはハロゲン原子を表す。
【0040】
反応式Gにおいて、(XIV)で表されるアルケニルハライドを、塩基存在下で(XIII)で表される化合物と反応させ、ついで加水分解することによりカルボン酸(II-b)を合成することができる。
本反応の一段階めは塩基の存在下に行うことができ、ナトリウムアミド、トリエチルアミン、水素化ナトリウム、水酸化ナトリウム、炭酸カリウム、酸化バリウム、酸化銀などが用いられる。また、触媒量のヨウ化カリウムを加えることもできる。溶媒としては例えば、メタノール、エタノール、ブタノールなどのアルコール類、ベンゼン、トルエン、キシレン、ピリジンなどの芳香族化合物、ジエチルエーテル、テトラヒドロフラン、ジオキサンなどのエーテル類、ジメチルホルムアミド、ジメチルアセトアミドなどのアミド類、ジメチルスルホキシド、アセトンなどのケトン類などが使用される。反応温度、反応時間は使用する原料化合物に応じて変化させれば良いが、通常0℃から溶媒の還流温度の範囲で行われる。
【0041】
具体的には例えば化合物(XIII)をテトラヒドロフラン、N,N−ジメチルホルムアミド等に溶解し、塩基として水素化ナトリウム等を加えて撹拌した後、アルケニルハライドを加えて室温から溶媒の還流温度の範囲で反応を行なうことにより目的を達する。
【0042】
また、2段階めの反応では、エステル化合物(XV)を酸あるいは塩基の存在下で加水分解することにより、カルボン酸(II-b)を合成することができる。酸としては塩酸、硫酸、p-トルエンスルホン酸など、塩基としては水酸化ナトリウム、水酸化カリウム、カリウムt−ブトキシドなどが用いられる。溶媒としてはギ酸、酢酸などのカルボン酸類、メタノール、エタノールなどのアルコール類、水あるいはこれらの混合溶媒などが使用される。反応温度、反応時間は使用する原料化合物に応じて変化させれば良いが、通常0℃から溶媒の還流温度の範囲で行われる。
【0043】
具体的には、例えばエステル化合物(XV)をメタノール、エタノールなどのアルコール類に溶解し、水酸化ナトリウムあるいは水酸化カリウム水溶液を加え、室温から還流温度で反応を行うことにより目的を達する。
なお、反応式Gで用いた原料化合物(XIV)は図7に示す反応式Hのようにして合成することができる。
反応式H中、X及びR3は上記反応式Gにおける定義のとおりである。本反応において一般式(XVI)で表されるアルコールをハロゲン化することにより一般式(XIV)で表されるアルケニルハライドを得ることができる。
【0044】
本反応は水酸基のハロゲン化反応として一般的な方法を用いることができる。例えばハロゲン化の試薬として、塩酸や臭化水素酸などの強酸、三臭化リン、三塩化リン、五塩化リンなどのリン化合物、塩化チオニル、N-ハロゲノスクシンイミドとジメチルスルフィド、トリフェニルホスフィンとハロゲン化炭化水素、塩化メタンスルホニルとリチウムハライドなどを用いて実施することができる。溶媒としては、例えばジクロロメタン、クロロホルムなどのハロゲン化炭化水素、ベンゼン、トルエン、キシレン、ピリジンなどの芳香族類、ジエチルエーテル、テトラヒドロフラン、ジオキサンなどのエーテル類、N,N-ジメチルホルムアミド、N,N-ジメチルアセトアミドなどのアミド類が用いられる。反応温度、反応時間は使用する原料化合物に応じて変化させれば良いが、通常0℃から溶媒の還流温度の範囲で行われる。
【0045】
具体的には例えば塩化リチウムとトリエチルアミンの存在下でメタンスルホニルクロリド等を用い、アセトン等の溶媒中において0℃から室温の範囲で反応を行うことにより目的を達する。
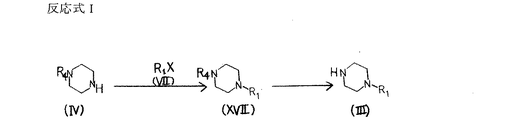
また、反応式AまたはDにおいて一般式 (III) で表される原料化合物は商業上入手可能であるか、または図8に示す反応式Iによって製造することができる。
【0046】
反応式Iの第一段階において、一般式 (IV) で表される保護ピペラジンと一般式 (VII) で表される適当なハライドを塩基存在下で反応させることにより、一般式 (XVII) で表される化合物が得られる。化合物 (IV) 中におけるR4はアミノ保護基を表し、以後の反応において問題が起きない限りベンジルオキシカルボニル基、第三ブチルオキシカルボニル基等のウレタン型保護基、ホルミル基やトシル基等のアシル型保護基、あるいはトリチル基等のアルキル型保護基を用いることができる。化合物 (VII) 中におけるXはハロゲン原子を表す。
【0047】
なお、塩基として例えば、炭酸カリウム、水酸化カリウム、水酸化ナトリウム、水素化ナトリウムなどの無機塩基、トリエチルアミン、ピリジン等の有機塩基が用いられる。具体的には例えば塩基として炭酸カリウムを用い、アセトン、N,N−ジメチルホルムアミド、ジクロロメタン、ベンゼンなどの溶媒中にて、0℃から溶媒の還流温度の範囲で反応を行うことにより目的を達する。
【0048】
反応式Iの第二段階において、一般式 (XVII) で表される化合物を脱保護反応に付すことにより、一般式 (III) で表される化合物が得られる。
本脱保護反応はアミノ保護基R4の種類により公知の各種の方法を用いることができる。例えばR4がホルミル基の場合、脱保護剤としてヒドラジン、塩酸、過酸化水素等が用いられる。具体的には、例えば1Nから6Nの範囲の塩酸を用いてメタノール中にて、0℃から室温の範囲で反応を行なうことにより目的を達する。
なお、上記の各反応式において用いられている原料化合物で、製造法を記述していない化合物、例えば(IV)、 (VII)、(VIII)、(X)等は商業上入手可能であるか、あるいは公知の方法を用い、容易に合成することができる。
【0049】
また、本発明化合物であるN−アシルピペラジン誘導体(I)の酸付加塩としては、例えば塩酸、臭化水素酸、硫酸、リン酸等の無機酸との塩、酢酸、プロピオン酸、クエン酸、乳酸、シュウ酸、マレイン酸、フマル酸、コハク酸、酒石酸、メタンスルホン酸等の有機酸との塩が挙げられる。これらの塩は通常の方法により容易に製造することができる。
【0050】
本発明にかかるN−アシルピペラジン誘導体は、強力な抗ストレス性潰瘍作用や優れた胃酸分泌抑制作用を有し、さらに潰瘍再発の原因とされるヘリコバクター・ピロリに対する抗菌作用を有し、しかも安全性が高い。このため、人または動物の消化性潰瘍の治療・予防剤として有用である。このように、胃酸分泌抑制作用及びヘリコバクター・ピロリに対する抗菌作用を共に有する化合物は従来殆ど認められておらず、本発明化合物が潰瘍の予防、治療のみならず、再発防止にも有効であることが示される。
【0051】
本発明化合物を消化性潰瘍の治療・予防剤として投与する場合、錠剤、散剤、顆粒剤、カプセル剤、シロップ剤などとして経口的に投与してもよいし、また坐剤、注射剤、外用剤、点滴剤として非経口的に投与してもよい。投与量は症状の程度、個人差、年齢、潰瘍の種類などにより下記範囲外の量を投与することもあり得るが、勿論それぞれの特定の場合における個々の状況に適合するように調節しなければならない。通常成人1日あたり約0.01〜200mg/kg、好ましくは0.05〜50mg/kg、さらに好ましくは0.1〜10mg/kgを1日1〜数回に分けて投与する。
【0052】
製剤化の際は、通常の製剤担体を用い、常法により製造するが、必要により薬理学的、製剤学的に許容しうる添加物を加えてもよい。
すなわち、経口用固形製剤を調製する場合には、主薬に賦形剤、さらに必要に応じて結合剤、崩壊剤、滑沢剤、着色剤、矯味矯臭剤等を加えた後、常法により錠剤、被服錠剤、顆粒剤、散剤、カプセル剤などとする。
【0053】
賦形剤としては、例えば乳糖、コーンスターチ、白糖、ブドウ糖、ソルビット、結晶セルロース、二酸化ケイ素等が、結合剤としては、例えばポリビニルアルコール、ポリビニルエーテル、エチルセルロース、メチルセルロース、アラビアゴム、トラガント、ゼラチン、シェラック、ヒドロキシプロピルセルロース、ヒドロキシプロピルスターチ、ポリビニルピロリドン等が、崩壊剤としては、例えば澱粉、寒天、ゼラチン末、結晶セルロース、炭酸カルシウム、炭酸水素ナトリウム、クエン酸カルシウム、デキストリン、ペクチン等が、滑沢剤としては、例えばステアリン酸マグネシウム、タルク、ポリエチレングリコール、シリカ、硬化植物油などが、着色剤としては医薬品に添加することが許されているものが、矯味矯臭剤としては、ココア末、ハッカ脳、芳香酸、ハッカ油、龍脳、桂皮末などが用いられる。これらの錠剤、顆粒剤には糖衣、ゼラチン衣、その他必要により適宜コーティングすることが可能である。
【0054】
注射剤を調製する場合には、必要により主薬にpH調整剤、緩衝剤、安定化剤、可溶化剤などを添加し、常法により皮下、筋肉内、静脈内用注射剤とする。
以下、具体例を挙げて本発明を詳細に説明するが、本発明はこれらに限定されるものではない。
まず、各実施例の抗潰瘍剤としての評価に用いた試験方法について説明する。
【0055】
WIS:水浸拘束ストレス潰瘍抑制試験
<意義>
ストレスによる潰瘍発生の抑制度を検証する。
<方法>
6〜7週齢Crj:SD系雄性ラットまたはSlc:SD系雄性ラットを一晩絶食し(摂水は自由)、一群あたり5〜8匹として0.3%カルボキシメチルセルロースナトリウムまたは0.05%Tween80水溶液に溶解または懸濁した被験薬物(100mg/10ml/kg)を経口投与した。なお、対象には基剤のみを投与した。10分後にラットをストレスケージに入れ、21℃の恒温水槽内に剣状突起まで浸した。水浸開始より7時間後にラットを水槽より引き上げ、直ちにエーテルまたは炭酸ガスで屠殺して胃を摘出した。5%中性ホルマリン緩衝液10mlを胃内に注入し、そのまま1%中性ホルマリン緩衝液中に30分以上浸して固定したのち、胃の大彎に沿って切開し腺胃部に発生している糜爛の長さを解剖顕微鏡下にで測定した。胃一つあたりの糜爛の長さの総和を潰瘍係数とした。
【0056】
<判定基準>
被験薬物100mg/kg投与時の効果を、潰瘍発生抑制率(%)として表した。
潰瘍発生抑制率(%)=(1-(被験薬物群の潰瘍係数/対象群の潰瘍係数))×100
【0057】
CAP:酸分泌抑制試験(in vitro)
<意義>
細胞レベルでの酸分泌抑制能を検討する。また作用機序の検討に用いることができる。
<方法>
まず遊離胃底腺膜標本を作製した。雄性日本白色種家兎(2.5−3Kg)をネンブタールTMで麻酔死させ、正中切開して直ちに胃を摘出し、幽門・噴門部を切除して大彎部に沿って切開して2枚に分けた。粘膜面に付着している胃内容物を氷冷PBS(−)で洗い流したのち、氷冷PBS(−)中で丁寧に洗い去った。胃壁を粘膜面を上にしてコルク板上に広げ、滅菌ガーゼで餌・粘液を完全に除去した。スパチラで粘膜を剥離し、氷冷PBS(−)に集めた。PBS(−)で2回洗浄後、はさみで2〜3mm3に細切した。さらに栄養液で2回洗浄した。栄養液の組成は、NaCl 132.4mM,KCl 5.4mM,Na2HPO4・12H2O 5mM,NaH2PO4・2H2O 1mM,MgSO4 1.2mM,CaCl2 1mM,HEPES 25mM,glucose 2mg/ml,BSA 1mg/mlである。コラゲナーゼ 1mg/mlを含む栄養液70mlに細切した粘膜片を分散させ、三角フラスコに入れて37℃で40−60分間スターラーで激しく撹拌した。この間、100%O2を栄養液表面に吹き付けておき、またpHを適 宜測定して、低下していたら直ちにアルカリでpH7.4に調整した。反応液に栄養液を加えて約200mlとし、メッシュでろ過して50mlの遠沈管に分注し、15分間静置して胃底腺を沈殿させた。上清をアスピレーターで除去・栄養液に分散・静置、を繰り返して胃底腺を3回洗浄した。この時、ピペッティングではなく、遠沈管2本に交互に繰り返し注ぎ入れるかたちで分散させた。顕微鏡下で細胞数をカウントし、1.6×106cells/mlに調整した。
【0058】
次に[14C]−アミノピリンの取り込み実験を行なつた。エッペンドルフチューブを秤量したのち、上述した栄養液に溶解したヒスタミン10μl(最終濃度10−5M)、DMSOに溶解した被験薬物10pl(最終濃度10−5M)、栄養液で希釈した[14C]−アミノピリン10μl(最終濃度0.05μCi/ml)を入れ、上で調製した遊離胃底腺分散液970μlを加え、37℃で40分間125回/分で振盪させた。30秒間遠心し、上清200μlをミニバイアルにとり、残りはアスピレーターで除去した。沈澱はチューブの蓋を開けた状態で80℃の乾燥機に一晩入れて完全に乾固させたのち、蓋を閉めて室温に戻して秤量した。次いで1N KOH 100μlを加え、蓋をして60℃で1−2時間処理して溶解し、ミニバイアルに移した。上清または沈澱の入ったミニバイアルにアトムライト TM 4mlを加え、液体シンチレーションカウンターで放射活性を測定した。なお、20mM NaSCNを加えて水素イオン濃度勾配をキャンセルさせたものを用いて沈澱の放射活性の補正を行なったのち、沈澱に特異的にトラップされたアミノピリンの集積率を算出した。なお、本実験はduplicateで実施した。
【0059】
ここで、原理について簡単に説明する。遊離胃底腺では酸は分泌小管から腺腔にかけての空間に蓄積する。アミノピリンは弱塩基(pKa=5.0)で中性溶液中では非イオン型で細胞膜を自由に通過し、酸性溶液中ではイオン化して電荷のため細胞膜を通過できなくなることから、遊離胃底腺の閉じられた酸性空間にアミノピリンが蓄積する性質を利用している。アミノピリンの集積率(R)は以下の式で算出される。
R=((補正した沈澱の放射活性)/(上清の放射活性))×(200/(沈澱のmg乾燥重量))
<判定基準>
最終濃度10-5Mにおける被験薬物の効果は、酸分泌抑制率(%)で表した。
酸分泌抑制率(%)=(1−(被験薬物のR/対照群のR))×100
【0060】
AHP:ヘリコバクター・ピロリに対する抗菌性試験
<意義>
潰瘍の発生及び再燃・再発に深く関与するといわれているヘリコバクター・ピロリ(微好気性のグラム陰性菌;以下、HP)に対する最小発育阻止濃度(MIC)を測定し、抗ヘリコバクター・ピロリ作用を有する化合物を見出す。
【0061】
<方法>
MICは寒天希釈法にて測定した。すなわち、Helicobacter pylori NCTC11637株の凍結菌株(−80℃)を市販の5%羊血液加トリブチケースソイ寒天培地で復元させ、さらに同培地で継代し、3日間前培養した。なお、培養条件は、37℃,5%O2・10%CO2・85%N2で行った。
【0062】
次に被験薬物の1000pg/ml溶液を25%以下のDMSO溶液にて調製し、これを減菌清製水で種々の濃度となるように希釈し、各濃度の溶液各々100μlを24ウエルプレートにとり、5%馬血液加ブルセラ寒天培地900μlを加えて混合し固化させ、MIC測定用培地を調製した。
前培養で生育したコロニーは適当量とり、Mueller Hinton Brothに、肉眼で濁りが確認できる程度まで懸濁し、約107cfu/mlの菌懸濁原液とした。この菌懸濁原液をMueller Hinton Brothで102希釈し、接種用菌液(105cfu/ml)とした。菌の接種は、接種用菌液10μl(約10 3 cfu)を分注器にてMIC測定用培地上に滴下して行った。菌を接種したMIC測定用培地は、前培養と同条件下で7日間培養し、培養終了後に菌の生育の無有を判定した。
【0063】
<判定基準>
HPのコロニーを認めないか、認めても数個(5個以内)の被験薬物の最小濃度をMIC値(μg/ml)として数値で表示した。
なお、MIC値が100μg/ml以上であったものについては、被験薬物濃度250mMの溶液で同様に調製したMIC測定用培地と、被験薬物を含有しない溶液で同様に調製したMIC測定用培地(コントロール)を用い、同様に菌を接種して、比較を行った。そして、コントロールのHPコロニー数に対する薬物含有培地のコロニー数が90%未満であった場合は+、90%以上であった場合は−で表示した。
【0064】
AT:単回投与毒性予備試験
<方法>
5週齢のSlc:ICR系雄性マウスを一群3〜5匹で用いた。試験当日朝9時より4〜5時間絶食(摂水は自由)し、0.5%カルボキシメチルセルロースナトリウム水溶液に溶解または懸濁した被験薬物2000mg/10ml/kgを経口投与した。なお、対照には基剤のみを投与した。投与後15分、30分、1時間、2時間、3時間の各時点で行動・症状観察を行い、一週間後まで毎日経過観察した。体重は、絶食前・絶食後毎日同じ時刻に測定した。死亡例については直ちに剖検し、臓器の肉眼的観察を行った。生存例についても、投与一週間後にエーテルまたは炭酸ガスで屠殺し、臓器の肉眼的観察を行った。
【0065】
<判定基準>
被験薬物2000mg/kg単回投与時の毒性を5段階に分類して表した。
5:死亡率0%、行動・臓器とも全く毒性を認めない。
4:死亡率0%、臓器には毒性を認めないが、行動ないし体重増加に若干の毒性を認める。
3:死亡例がある(全例死亡ではない)が臓器には毒性を認めない。
2:死亡例の有無に関わらず、臓器に毒性を認める。
1:全例死亡
【0066】
MTT:細胞障害・保護作用試験
<意義>
細胞レベルでの毒性がないことを確認する。細胞レベルでの毒性があるものも、抗潰瘍剤としては不適当である。また、他の細胞レベルの試験における被験薬物の作用が毒性によるものではないことを確認することができる。
【0067】
<方法>
雄性日本白色種家兎(2.5〜3kg)をネンブタールTMで麻酔死させ、直ちに胃を摘出した。胃大彎を切開して胃内容物を除去し、粘膜表面をHBSS(Hanks’balanced salt solution)で洗浄したのち、氷冷したHBSS中で実験室へ運搬した。幽門前庭部を取り除き、胃体部粘膜をスパチラではがし、BME(BasalMedium Eagle)中で2〜3mm3に細切した後、ディスパーゼ280U/ml及びコラゲナーゼ30〜50U/ml(メディウム:BME60ml)にて37℃で15分間120〜130回/分振盪した。なお、コラゲナーゼ濃度はロットが変わるごとに、細胞の状態を見て適宜変更した。1mMEDTA含有EBSS(Earle’s BalancedSalt Solution)で2回洗浄した後、1mMEDTA含有MEM(Minimum Essential Medium)で5分間37℃で振盪した。次に、前述と同濃度のディスパーゼ・コラゲナーゼで15分振盪させて上清を除去し、さらに50〜60分間、37℃・120〜130回/分振盪した。その後、HBSSで2回洗浄した後、2%Ultrocer GTMを含むHam F12にて1×106Cells/mlとし、96穴プレートに200μlづつ分注した。37℃・5%CO2・95%airで3日間インキュベートしてコンフルエントに達した状態で、MTTアッセイに用いた。
【0068】
被験薬物は10-2MとなるようにDMSOに溶解し、最終濃度10-4Mとなるように2%Ultrocer GTM含有HBSSで希釈した。8well/群とし、メディウム100μlと交換後直ちにMTT試薬10μlを加えた。37℃・5%CO2・95%airで4時間インキュベート後、遠心して上清を捨て、100%エタノール100μlを加えてMTTホルマザンを溶解し、マイクロプレートリーダーで吸光度(OD570−630)を測定した。これは生細胞のミトコンドリアのみによってMTTがMTTホルマザンに変化し、色が変わる現象を利用した方法である。
【0069】
<判定基準>
最終濃度10-4Mにおける被験薬物の細胞障害作用または細胞保護作用を細胞障害率(%)として表した。
細胞障害率(%)=(1-(被験薬物群の吸光度/対照群の吸光度))×100
従って、数字が小さい方が好ましい。
【0070】
以上の効果試験及び安全性試験に基づき、本発明の実施例にかかる化合物の抗潰瘍作用、HPに対する抗菌作用及び安全性を調べた。
化合物群1
本化合物群1のN−アシルピペラジン誘導体は前記化5においてR3がアルケニル基の化合物である。本化合物群1のN−アシルピペラジン誘導体として、下記の実施例化合物を試験した。
【0071】
[実施例1]
【化11】
[実施例2]
【化12】
[実施例3]
【化13】
[実施例4]
【化14】
[実施例5]
【化15】
[実施例6]
【化16】
[実施例7]
【化17】
【0072】
【表1】
【0073】
上記表1より明らかなように、本化合物群1の化合物は優れた抗潰瘍作用、酸分泌抑制作用を有しており、ヘリコバクター・ピコリに対する高い抗菌性も併有している。また、安全性も高いことが理解される。
【0074】
化合物群2
本化合物群2にかかるN−アシルピペラジン誘導体は、前記化5において、R3がベンジル基、R2が低級アルキル基であり、且つn=m=1である化合物である。本化合物群2のN−アシルピペラジン誘導体として、下記の実施例化合物を試験した。
【0075】
[実施例8]
【化18】
[実施例9]
【化19】
[実施例10]
【化20】
【0076】
【表2】
【0077】
上記表2より明らかなように、R3にベンジル基をもち、隣接位にアルキル基をもつ本化合物群2のN−アシルピペラジン誘導体において、高い抗潰瘍作用、酸分泌抑制作用及びヘリコバクター・ピロリに対する高い抗菌性を有し、また、非常に安全性が高いことが理解される。
【0082】
【実施例】
以下に本発明化合物の実施例の製造方法を示す。
実施例1
1-(4-ゲラニルオキシ)ベンゾイル-4-[2-(ピペロニロイルアミノ)エチル]ピペラジンの合成
実施例8と同様にして、4-ゲラニルオキシ安息香酸 5.49gと、シアノメチルピペラジン2.75gとの縮合反応に付することにより、7.19gのアミド体を得た。このアミド体2.29gをメタノールに溶解し、氷冷下塩化コバルト2.86g、及び水素化ホウ素ナトリウム2.27gを加えて20分室温で撹拌した。反応液を濃縮し、得られた残渣をクロロホルムに溶解し、濾過した。濃縮によりアミン体1.12gを得た。
【0083】
アミン体1.12gを塩化メチレンに溶解し、トリエチルアミン0.45gを加えて氷冷した。ピペロニロイルクロライド0.41gを加えて0℃で3時間撹拌した。炭酸水素ナトリウム溶液、食塩水で順次洗浄し、無水硫酸ナトリウムで乾燥した。濾過濃縮後、残渣をシリカゲルクロマトグラフィー(クロロホルム:メタノール=50:1)で精製して、淡黄色オイル状の標題化合物0.27g(23%)を得た。
【0084】
1H-NMR (CDCl3)δ: 7.37(2H, d, J=8.8Hz), 7.31-7.24(2H, m), 6.91(2H, d, J=8.8Hz), 6.84(1H, d, J=8.8Hz), 6.57(1H, s), 6.03(2H, s), 5.48(1H, t, J=6.4Hz), 5.09(1H, t, J=6.8Hz), 4.56(2H, d, J=6.4Hz), 3.80-3.50(4H, bs), 3.53(2H, q, J=5.4Hz), 2.62(2H, t, J=5.9Hz), 2.17-2.03(4H, m), 1.74(3H, s), 1.68(3H, s), 1.61(3H,s).
【0085】
実施例2
1-(4-ゲラニルオキシ-3-イソブチル)ベンゾイル-4-[2-(ピペロニロイルアミノ)エチル]ピペラジンの合成
実施例8と同様にして、4-ゲラニルオキシ-3-イソブチル安息香酸 1.51gをN-ヒドロキシエチルピペラジン0.65gとの縮合反応に付することにより、1.95g(94%)のアミド体を得た。このアミド体1.95gとピペロニロイルクロライド0.93gとを反応させることにより、淡黄色オイル状の標題化合物1.92g(68%)を得た。
【0086】
1H-NMR (CDCl3)δ: 7.63(1H, d, J=8.3Hz), 7.45(1H, s), 7.25(1H, d, J=8.3Hz), 7.15(1H, s), 6.84(1H, d, J=8.8Hz), 6.82(1H, d, J=8.3Hz), 6.04(1H, s), 5.45(1H, t, J=6.8Hz), 5.10(1H, t, J=6.4Hz), 4.55(2H, d, J=5.8Hz), 4.42(2H, t, J=5.8Hz), 3.82-3.40(4H, bs), 2.79(2H, t, J=5.8Hz), 2.58(4H, s), 2.49(2H, d, J=6.8Hz), 2.18-2.04(4H, m), 1.91(1H, n, J=6.4), 1.72(3H, s), 1.68(3H,s), 1.61(3H, s), 0.88(6H, d, J=6.4Hz).
【0087】
実施例3
1−(4−ゲラニルオキシ)ベンゾイル−4−(2−イソニコチノイルオキシエチル)ピペラジンの合成
実施例8と同様にして4−ゲラニルオキシ安息香酸8.23gをN−ヒドロキシエチルピペラジン3.91gとの縮合反応に付すことによりアミド体11.6gを得た。このアミド体1.93gを、イソニコチノイルクロライド0.89gと反応させることにより、標題化合物1.13g(46%)を得た。
【0088】
m.p. 52.5-55.0℃
1H-NMR (CDCl3)δ: 8.79(2H, d, J=5.8Hz), 7.84(2H, d, J=5.4Hz), 7.36(2H, d, J=8.8Hz), 6.91(2H, d, J=8.8Hz), 5.47(1H, t, J=6.8Hz), 5.09(1H, t, J=6.8Hz), 4.56(2H, d, J=6.4Hz), 4.50(2H, t, J=5.4Hz), 3.85-3.40(4H, bs), 2.81(2H, t, J=5.4) 2,58(4H, s), 2.19-2.06(4H, m), 1.74(3H, s), 1.68(3H, s), 1.61(3H, s).
【0089】
実施例4
1-(4-ゲラニルオキシ)ベンゾイル-4-ピペロニルピペラジンの合成
実施例8と同様にして、4-ゲラニルオキシ安息香酸 1.10gをN-ピペロニルピペラジン0.97gとの縮合反応に付することにより、標題化合物1.85g(96%)を得た。
【0090】
実施例5
1-ベンジル-4-(3,5-ジメトキシ-4-ゲラニルオキシ)ベンゾイルピペラジンの合成
実施例8と同様にして、3,5-ジメトキシ-4-ゲラニルオキシ安息香酸をN-ベンジルピペラジンとの縮合反応に付することにより、標題化合物を得た。
【0091】
実施例6
1-ベンジル-4-(3,4,5-トリプレニルオキシ)ベンゾイルピペラジンの合成
実施例8と同様にして、3,4,5-トリプレニルオキシ安息香酸1.12gをN-ベンジルピペラジン0.57gとの縮合反応に付することにより、標題化合物1.14g(72%)を得た。
1H-NMR (CDCl3)δ: 7.27-7.32(2H, s), 6.60(2H,s), 5.52-5.60(1H, m), 5.44-5.52(2H, m), 4.54(4H, d, J=6.3Hz), 4.50(2H, d, J=6.3Hz), 3.50-3.77(4H, m), 3.53(2H, s), 2.41-2.55(4H, m), 1.71- 1.76(18H, m).
【0092】
実施例7
1-ベンジル-4-(3,4-ジメトキシ-5-ゲラニルオキシ)ベンゾイルピペラジンの合成
実施例8と同様にして、3,4-ジメトキシ-5-ゲラニルオキシ安息香酸1.00gをN-ベンジルピペラジン0.56gとの縮合反応に付することにより、標題化合物1.29g(87%)を得た。
1H-NMR (CDCl3)δ: 7.26-7.32(5H, m), 6.62(2H,s), 5.45-5.53(1H, m), 5.04-5.12(1H, m), 4.58(2H, d, J=6.4Hz), 3.85(6H, s), 3.45-3.90(4H, m), 3.54(2H ,s), 2.35-2.59(4H, m), 2.05-2.10(4H, m), 1.72(3H, s), 1.67(3H, s), 1.60(3H, s).
【0093】
実施例8
1-[4-(4-フルオロベンジルオキシ)-3-イソブチル]ベンゾイル-4-(N-イソプロピルカルバモイル)ピペラジンの合成
[4-(4-フルオロベンジルオキシ)-3-イソブチル]安息香酸 1.51gをクロロホルム 25ml、トリエチルアミン1.39mlに溶解し、氷冷下ジフェニルホスフィニッククロライド0.96mlを加えた。40分間撹拌後、1-イソプロピルカルバモイルピペラジン0.89gを加え、1.5時間室温にて撹拌した。反応液を1N-水酸化ナトリウム水溶液、食塩水で順次洗浄し、無水硫酸ナトリウムで乾燥した。濾過後、濾液を減圧濃縮し、残渣を再結晶(n-ヘキサン−酢酸エチル混液)することにより、標題化合物の白色結晶1.66g(73%)を得た。
【0094】
mp 166.8-167.9 ℃
1H-NMR (CDCl3)δ: 7.39(2H, dd, J=8.8, 5.4Hz), 7.28-7.22(1H, m), 7.18(1H,s), 7.09(1H, t, J=8.8Hz), 6.89(1H, d, J=8.3Hz), 5.06(2H, s), 4.23(1H, d, J=7.3Hz), 3.98(1H, d, J=6.8Hz), 3.75-3.50(4H, bs), 3.39(4H, t, J=5.4Hz), 2.53(2H, d, J=7.3Hz), 2.02-1.85(1H, m), 1.17(6H, d, J=6.8Hz), 0.89(6H, d, J=6.4Hz).
【0095】
実施例9
1-(4-ベンジルオキシ-3-イソブチル)ベンゾイル-4-ベンジルピペラジンの合成実施例8と同様にして、4-ベンジルオキシ-3-イソブチル安息香酸をN-ベンジルピペラジンとの縮合反応に付することにより、標題化合物を得た。
【0096】
実施例10
1-[4-(4-フルオロベンジルオキシ)-3-イソブチル]ベンゾイル-4-(2-ピリジル)ピペラジンの合成
実施例8と同様にして、4-(4-フルオロベンジルオキシ)-3-イソブチル安息香酸をN-(2-ピリジル)ピペラジンとの縮合反応に付することにより、標題化合物を得た。
【0100】
【発明の効果】
以上説明したように本発明にかかるN−アシルピペラジン誘導体は、優れた抗潰瘍効果及びヘリコバクター・ピロリに対する抗菌作用と、高い安全性を有する。
【図面の簡単な説明】
【図1】 本発明にかかるN−アシルピペラジン誘導体の製造行程の一例を示す説明図である。
【図2】 本発明にかかるN−アシルピペラジン誘導体の製造行程の一例を示す説明図である。
【図3】 本発明にかかるN−アシルピペラジン誘導体の製造行程の一例を示す説明図である。
【図4】 本発明にかかるN−アシルピペラジン誘導体の製造行程の一例を示す説明図である。
【図5】 本発明にかかるN−アシルピペラジン誘導体の原料化合物の製造行程の一例を示す説明図である。
【図6】 本発明にかかるN−アシルピペラジン誘導体の原料化合物の製造行程の一例を示す説明図である。
【図7】 本発明にかかるN−アシルピペラジン誘導体の原料化合物の製造行程の一例を示す説明図である。
【図8】 本発明にかかるN−アシルピペラジン誘導体の原料化合物の製造行程の一例を示す説明図である。
Claims (11)
- 下記一般式化1で示されることを特徴とするN−アシルピペラジン誘導体又はその塩。
R2は炭素数1〜6のアルキル基又は炭素数1〜6のアルコキシ基を意味し、nは0〜2の整数を意味する。
R3は二重結合が1つ以上含まれる炭素数2〜20のアルケニル基又は芳香環上に置換基としてハロゲン原子を有していてもよいベンジル基を意味し、mは1〜3の整数を意味する。) - 請求項1記載の化合物において、R3が二重結合が1つ以上含まれる炭素数2〜20のアルケニル基であることを特徴とするN−アシルピペラジン誘導体又はその塩。
- 請求項2又は3記載の化合物において、nが1又は2であり、R2がイソブチル基又はメトキシ基であることを特徴とするN−アシルピペラジン誘導体又はその塩。
- 請求項2又は3記載の化合物において、nが0であることを特徴とするN−アシルピペラジン誘導体又はその塩。
- 請求項1記載の化合物において、R3が芳香環上に置換基としてハロゲン原子を有していてもよいベンジル基、R2が炭素数1〜6のアルキル基であり、且つn=m=1であることを特徴とするN−アシルピペラジン誘導体又はその塩。
- 請求項7記載の化合物において、lが1であり、Rbがフッ素原子で、且つパラ位に結合していることを特徴とするN−アシルピペラジン誘導体又はその塩。
- 請求項6〜8の何れかに記載の化合物において、R2がイソブチル基であることを特徴とするN−アシルピペラジン誘導体又はその塩。
- 請求項1〜9の何れかに記載のN−アシルピペラジン誘導体ないしその薬理的に許容できる塩を有効成分とするヘリコバクター・ピロリに対する抗菌剤。
- 請求項1〜9の何れかに記載のN−アシルピペラジン誘導体ないしその薬理的に許容できる塩を有効成分とする抗潰瘍剤。
Priority Applications (8)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP08593797A JP4189043B2 (ja) | 1996-09-30 | 1997-03-18 | N−アシルピペラジン誘導体及び抗菌剤、抗潰瘍剤 |
| US08/939,912 US5962456A (en) | 1996-09-30 | 1997-09-29 | N-acylpiperazine derivative, anti-ulcer drug, and antibacterial drug |
| CA002216763A CA2216763A1 (en) | 1996-09-30 | 1997-09-29 | N-acylpiperazine derivative, anti-ulcer drug, and antibacterial drug |
| KR1019970051173A KR19980025185A (ko) | 1996-09-30 | 1997-09-30 | N-아실피페라진 유도체 및 항균제, 항궤양제 |
| AU39322/97A AU717312B2 (en) | 1996-09-30 | 1997-09-30 | N-acylpiperazine derivative, anti-ulcer drug, and antibacterial drug |
| EP97307709A EP0832887B1 (en) | 1996-09-30 | 1997-09-30 | N-acylpiperazine derivative, anti-ulcer drug, and antibacterial drug |
| DE69706012T DE69706012T2 (de) | 1996-09-30 | 1997-09-30 | N-Acylpiperazinderivat, antibakterielle und gegen Geschwüre wirksame Medikamente |
| AT97307709T ATE203989T1 (de) | 1996-09-30 | 1997-09-30 | N-acylpiperazinderivat, antibakterielle und gegen geschwüre wirksame medikamente |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP8-278872 | 1996-09-30 | ||
| JP27887296 | 1996-09-30 | ||
| JP08593797A JP4189043B2 (ja) | 1996-09-30 | 1997-03-18 | N−アシルピペラジン誘導体及び抗菌剤、抗潰瘍剤 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPH10152487A JPH10152487A (ja) | 1998-06-09 |
| JP4189043B2 true JP4189043B2 (ja) | 2008-12-03 |
Family
ID=26426951
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP08593797A Expired - Lifetime JP4189043B2 (ja) | 1996-09-30 | 1997-03-18 | N−アシルピペラジン誘導体及び抗菌剤、抗潰瘍剤 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US5962456A (ja) |
| EP (1) | EP0832887B1 (ja) |
| JP (1) | JP4189043B2 (ja) |
| KR (1) | KR19980025185A (ja) |
| AT (1) | ATE203989T1 (ja) |
| AU (1) | AU717312B2 (ja) |
| CA (1) | CA2216763A1 (ja) |
| DE (1) | DE69706012T2 (ja) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE59814233D1 (de) * | 1997-08-27 | 2008-07-03 | Solvay Pharm Gmbh | Indolmethyl-N,N'-bisacylpiperazine als Neurokininrezeptorantagonisten |
| DE19824865A1 (de) * | 1997-08-27 | 1999-03-04 | Solvay Pharm Gmbh | Neue Harnstoffderivate |
| UA75425C2 (en) * | 2001-07-09 | 2006-04-17 | Piperazine oxime derivatives with antagonistic activity to nk-1 receptor, use thereof, a pharmaceutical composition based thereon, a method for producing and a method for producing intermediary compounds |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB964232A (en) * | 1962-04-16 | 1964-07-22 | Analyses Et De Rech S Biolog M | Substituted benzamides and pharmaceutical compositions containing them |
| US4208205A (en) * | 1977-10-03 | 1980-06-17 | E. I. Du Pont De Nemours And Company | Herbicidal benzamides |
| JPS6058954A (ja) * | 1983-09-13 | 1985-04-05 | Kureha Chem Ind Co Ltd | ジヒドロキシベンズアミド誘導体 |
| US5143910A (en) * | 1989-09-07 | 1992-09-01 | Shionogi & Co., Ltd. | Piperaziniocephalosporins |
| HUT60458A (en) * | 1991-02-01 | 1992-09-28 | Sandoz Ag | Process for producing benzyloxyphenyl derivatives and pharmaceutical compositions comprising same |
| FR2701259B1 (fr) * | 1993-02-08 | 1995-03-24 | Rhone Poulenc Agrochimie | Procédé pour la préparation de dérivés phénylbenzamides fongicides agricoles. |
| JP3081773B2 (ja) * | 1995-03-31 | 2000-08-28 | 株式会社資生堂 | N−アシルピペラジン誘導体及び抗菌剤、抗潰瘍剤 |
-
1997
- 1997-03-18 JP JP08593797A patent/JP4189043B2/ja not_active Expired - Lifetime
- 1997-09-29 CA CA002216763A patent/CA2216763A1/en not_active Abandoned
- 1997-09-29 US US08/939,912 patent/US5962456A/en not_active Expired - Lifetime
- 1997-09-30 EP EP97307709A patent/EP0832887B1/en not_active Expired - Lifetime
- 1997-09-30 DE DE69706012T patent/DE69706012T2/de not_active Expired - Lifetime
- 1997-09-30 KR KR1019970051173A patent/KR19980025185A/ko not_active Application Discontinuation
- 1997-09-30 AU AU39322/97A patent/AU717312B2/en not_active Ceased
- 1997-09-30 AT AT97307709T patent/ATE203989T1/de not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| EP0832887B1 (en) | 2001-08-08 |
| AU3932297A (en) | 1998-04-02 |
| US5962456A (en) | 1999-10-05 |
| JPH10152487A (ja) | 1998-06-09 |
| DE69706012D1 (de) | 2001-09-13 |
| ATE203989T1 (de) | 2001-08-15 |
| EP0832887A1 (en) | 1998-04-01 |
| CA2216763A1 (en) | 1998-03-30 |
| AU717312B2 (en) | 2000-03-23 |
| DE69706012T2 (de) | 2002-05-29 |
| KR19980025185A (ko) | 1998-07-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP3933244B2 (ja) | アルキレンジアミン誘導体及び抗潰瘍剤、抗菌剤 | |
| JP4113602B2 (ja) | ピロリジン誘導体及び抗潰瘍剤、抗菌剤 | |
| JP4090087B2 (ja) | ベンズアミド誘導体及び抗潰瘍剤、抗菌剤 | |
| JP4058129B2 (ja) | ピリジン誘導体及び抗潰瘍剤、抗菌剤 | |
| JP3081773B2 (ja) | N−アシルピペラジン誘導体及び抗菌剤、抗潰瘍剤 | |
| JP4189043B2 (ja) | N−アシルピペラジン誘導体及び抗菌剤、抗潰瘍剤 | |
| JP4150435B2 (ja) | アルキレンジアミン誘導体及び抗潰瘍剤、抗菌剤 | |
| JPH09510718A (ja) | 5ht1dアンタゴニストとしてのビフェニル誘導体 | |
| JPH08283220A (ja) | N−アリールアルキルフェニルアセトアミド化合物 | |
| JPS62212386A (ja) | 2−ピリジルメチルベンズイミダゾ−ル誘導体 | |
| JP2004217602A (ja) | 抗ヘリコバクター・ピロリ活性を有するアズレン誘導体及びその製造方法並びにそれを含有する薬剤 | |
| JPS6330462A (ja) | 新規グアニジノメチルベンツアミド誘導体およびそれを有効成分とする抗潰瘍剤 | |
| JP3215042B2 (ja) | チアジアゾールアミド誘導体及び抗潰瘍剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20040309 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20040309 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20071213 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080122 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080324 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20080826 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20080912 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110919 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110919 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120919 Year of fee payment: 4 |