JP4160263B2 - 尿サンプル中の所定のタンパク質の全含有量を測定する方法 - Google Patents
尿サンプル中の所定のタンパク質の全含有量を測定する方法 Download PDFInfo
- Publication number
- JP4160263B2 JP4160263B2 JP2000589950A JP2000589950A JP4160263B2 JP 4160263 B2 JP4160263 B2 JP 4160263B2 JP 2000589950 A JP2000589950 A JP 2000589950A JP 2000589950 A JP2000589950 A JP 2000589950A JP 4160263 B2 JP4160263 B2 JP 4160263B2
- Authority
- JP
- Japan
- Prior art keywords
- albumin
- quality
- disease
- urine
- protein
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 210000002700 urine Anatomy 0.000 title claims abstract description 74
- 102000004169 proteins and genes Human genes 0.000 title claims abstract description 70
- 108090000623 proteins and genes Proteins 0.000 title claims abstract description 70
- 238000000034 method Methods 0.000 title claims abstract description 56
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 abstract description 25
- 201000010099 disease Diseases 0.000 abstract description 24
- 230000001900 immune effect Effects 0.000 abstract 2
- 102000035118 modified proteins Human genes 0.000 abstract 1
- 108091005573 modified proteins Proteins 0.000 abstract 1
- 102000009027 Albumins Human genes 0.000 description 139
- 108010088751 Albumins Proteins 0.000 description 139
- 208000017169 kidney disease Diseases 0.000 description 52
- 238000003127 radioimmunoassay Methods 0.000 description 40
- 238000004128 high performance liquid chromatography Methods 0.000 description 39
- 206010012601 diabetes mellitus Diseases 0.000 description 27
- 210000003734 kidney Anatomy 0.000 description 16
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 15
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 12
- 210000003712 lysosome Anatomy 0.000 description 12
- 230000001868 lysosomic effect Effects 0.000 description 12
- 210000004027 cell Anatomy 0.000 description 11
- 230000008859 change Effects 0.000 description 11
- 238000001514 detection method Methods 0.000 description 11
- 230000029142 excretion Effects 0.000 description 11
- 230000002132 lysosomal effect Effects 0.000 description 11
- 230000014759 maintenance of location Effects 0.000 description 11
- 239000012634 fragment Substances 0.000 description 10
- 238000013467 fragmentation Methods 0.000 description 10
- 238000006062 fragmentation reaction Methods 0.000 description 10
- 208000007342 Diabetic Nephropathies Diseases 0.000 description 9
- 208000033679 diabetic kidney disease Diseases 0.000 description 9
- 239000002904 solvent Substances 0.000 description 9
- 238000001542 size-exclusion chromatography Methods 0.000 description 8
- 238000003556 assay Methods 0.000 description 7
- 150000001875 compounds Chemical class 0.000 description 7
- 238000003018 immunoassay Methods 0.000 description 7
- 238000000926 separation method Methods 0.000 description 7
- 208000022461 Glomerular disease Diseases 0.000 description 6
- 102000008100 Human Serum Albumin Human genes 0.000 description 6
- 108091006905 Human Serum Albumin Proteins 0.000 description 6
- 206010027525 Microalbuminuria Diseases 0.000 description 6
- 230000002209 hydrophobic effect Effects 0.000 description 6
- 201000004681 Psoriasis Diseases 0.000 description 5
- 230000005856 abnormality Effects 0.000 description 5
- 230000001154 acute effect Effects 0.000 description 5
- 238000004587 chromatography analysis Methods 0.000 description 5
- 229940079593 drug Drugs 0.000 description 5
- 239000003814 drug Substances 0.000 description 5
- 230000004064 dysfunction Effects 0.000 description 5
- 238000001962 electrophoresis Methods 0.000 description 5
- 231100000852 glomerular disease Toxicity 0.000 description 5
- 238000004191 hydrophobic interaction chromatography Methods 0.000 description 5
- 208000027866 inflammatory disease Diseases 0.000 description 5
- 230000004048 modification Effects 0.000 description 5
- 238000012986 modification Methods 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- 206010003210 Arteriosclerosis Diseases 0.000 description 4
- 201000001320 Atherosclerosis Diseases 0.000 description 4
- 208000024172 Cardiovascular disease Diseases 0.000 description 4
- 206010010356 Congenital anomaly Diseases 0.000 description 4
- 102000003886 Glycoproteins Human genes 0.000 description 4
- 108090000288 Glycoproteins Proteins 0.000 description 4
- 208000034578 Multiple myelomas Diseases 0.000 description 4
- 206010035226 Plasma cell myeloma Diseases 0.000 description 4
- 102000005686 Serum Globulins Human genes 0.000 description 4
- 108010045362 Serum Globulins Proteins 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 239000007857 degradation product Substances 0.000 description 4
- 208000014674 injury Diseases 0.000 description 4
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 4
- 229920002521 macromolecule Polymers 0.000 description 4
- 208000030761 polycystic kidney disease Diseases 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- 208000009304 Acute Kidney Injury Diseases 0.000 description 3
- 208000024985 Alport syndrome Diseases 0.000 description 3
- 208000002814 Autosomal Recessive Polycystic Kidney Diseases 0.000 description 3
- 208000017354 Autosomal recessive polycystic kidney disease Diseases 0.000 description 3
- 102000008186 Collagen Human genes 0.000 description 3
- 108010035532 Collagen Proteins 0.000 description 3
- 206010011732 Cyst Diseases 0.000 description 3
- 208000024720 Fabry Disease Diseases 0.000 description 3
- 208000010159 IgA glomerulonephritis Diseases 0.000 description 3
- 206010021263 IgA nephropathy Diseases 0.000 description 3
- 108060003951 Immunoglobulin Proteins 0.000 description 3
- 206010029164 Nephrotic syndrome Diseases 0.000 description 3
- 206010065427 Reflux nephropathy Diseases 0.000 description 3
- 208000033626 Renal failure acute Diseases 0.000 description 3
- 208000034189 Sclerosis Diseases 0.000 description 3
- 102100026383 Vasopressin-neurophysin 2-copeptin Human genes 0.000 description 3
- 201000011040 acute kidney failure Diseases 0.000 description 3
- 208000012998 acute renal failure Diseases 0.000 description 3
- 230000001580 bacterial effect Effects 0.000 description 3
- 230000015556 catabolic process Effects 0.000 description 3
- 229920001436 collagen Polymers 0.000 description 3
- 208000031513 cyst Diseases 0.000 description 3
- 238000006731 degradation reaction Methods 0.000 description 3
- 230000003111 delayed effect Effects 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 201000010064 diabetes insipidus Diseases 0.000 description 3
- 238000013399 early diagnosis Methods 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 230000002255 enzymatic effect Effects 0.000 description 3
- 230000006870 function Effects 0.000 description 3
- 238000005227 gel permeation chromatography Methods 0.000 description 3
- 208000003215 hereditary nephritis Diseases 0.000 description 3
- 102000018358 immunoglobulin Human genes 0.000 description 3
- 208000015446 immunoglobulin a vasculitis Diseases 0.000 description 3
- 229940072221 immunoglobulins Drugs 0.000 description 3
- 201000006334 interstitial nephritis Diseases 0.000 description 3
- 230000003902 lesion Effects 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 201000008383 nephritis Diseases 0.000 description 3
- 238000002331 protein detection Methods 0.000 description 3
- 201000001474 proteinuria Diseases 0.000 description 3
- 238000011084 recovery Methods 0.000 description 3
- 241000894007 species Species 0.000 description 3
- 230000003612 virological effect Effects 0.000 description 3
- 208000006542 von Hippel-Lindau disease Diseases 0.000 description 3
- LJRDOKAZOAKLDU-UDXJMMFXSA-N (2s,3s,4r,5r,6r)-5-amino-2-(aminomethyl)-6-[(2r,3s,4r,5s)-5-[(1r,2r,3s,5r,6s)-3,5-diamino-2-[(2s,3r,4r,5s,6r)-3-amino-4,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-6-hydroxycyclohexyl]oxy-4-hydroxy-2-(hydroxymethyl)oxolan-3-yl]oxyoxane-3,4-diol;sulfuric ac Chemical compound OS(O)(=O)=O.N[C@@H]1[C@@H](O)[C@H](O)[C@H](CN)O[C@@H]1O[C@H]1[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](N)C[C@@H](N)[C@@H]2O)O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)N)O[C@@H]1CO LJRDOKAZOAKLDU-UDXJMMFXSA-N 0.000 description 2
- 208000030507 AIDS Diseases 0.000 description 2
- 206010000599 Acromegaly Diseases 0.000 description 2
- 206010001580 Albuminuria Diseases 0.000 description 2
- 108010068307 Alpha-Globulins Proteins 0.000 description 2
- 102000002572 Alpha-Globulins Human genes 0.000 description 2
- 208000035143 Bacterial infection Diseases 0.000 description 2
- 208000025760 Benign familial haematuria Diseases 0.000 description 2
- 102000006734 Beta-Globulins Human genes 0.000 description 2
- 108010087504 Beta-Globulins Proteins 0.000 description 2
- 102000004506 Blood Proteins Human genes 0.000 description 2
- 108010017384 Blood Proteins Proteins 0.000 description 2
- 108010075016 Ceruloplasmin Proteins 0.000 description 2
- 102100023321 Ceruloplasmin Human genes 0.000 description 2
- 208000032170 Congenital Abnormalities Diseases 0.000 description 2
- 206010013654 Drug abuse Diseases 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- 208000005189 Embolism Diseases 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 206010016207 Familial Mediterranean fever Diseases 0.000 description 2
- 108010049003 Fibrinogen Proteins 0.000 description 2
- 102000008946 Fibrinogen Human genes 0.000 description 2
- 102000016359 Fibronectins Human genes 0.000 description 2
- 108010067306 Fibronectins Proteins 0.000 description 2
- 102000006395 Globulins Human genes 0.000 description 2
- 108010044091 Globulins Proteins 0.000 description 2
- 108010015776 Glucose oxidase Proteins 0.000 description 2
- 239000004366 Glucose oxidase Substances 0.000 description 2
- 108010051696 Growth Hormone Proteins 0.000 description 2
- 206010019280 Heart failures Diseases 0.000 description 2
- 208000032759 Hemolytic-Uremic Syndrome Diseases 0.000 description 2
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 2
- 206010020751 Hypersensitivity Diseases 0.000 description 2
- 206010020772 Hypertension Diseases 0.000 description 2
- 102000004877 Insulin Human genes 0.000 description 2
- 108090001061 Insulin Proteins 0.000 description 2
- 102000003855 L-lactate dehydrogenase Human genes 0.000 description 2
- 108700023483 L-lactate dehydrogenases Proteins 0.000 description 2
- 102000004895 Lipoproteins Human genes 0.000 description 2
- 108090001030 Lipoproteins Proteins 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- 206010060880 Monoclonal gammopathy Diseases 0.000 description 2
- 102000016943 Muramidase Human genes 0.000 description 2
- 108010014251 Muramidase Proteins 0.000 description 2
- 108010062374 Myoglobin Proteins 0.000 description 2
- 102100030856 Myoglobin Human genes 0.000 description 2
- 108010062010 N-Acetylmuramoyl-L-alanine Amidase Proteins 0.000 description 2
- 208000000175 Nail-Patella Syndrome Diseases 0.000 description 2
- 206010028851 Necrosis Diseases 0.000 description 2
- 206010028980 Neoplasm Diseases 0.000 description 2
- 108010061952 Orosomucoid Proteins 0.000 description 2
- 102000012404 Orosomucoid Human genes 0.000 description 2
- 206010033645 Pancreatitis Diseases 0.000 description 2
- 102000003982 Parathyroid hormone Human genes 0.000 description 2
- 108090000445 Parathyroid hormone Proteins 0.000 description 2
- 208000018262 Peripheral vascular disease Diseases 0.000 description 2
- 206010037596 Pyelonephritis Diseases 0.000 description 2
- 206010037660 Pyrexia Diseases 0.000 description 2
- 208000001647 Renal Insufficiency Diseases 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 102100038803 Somatotropin Human genes 0.000 description 2
- 201000009594 Systemic Scleroderma Diseases 0.000 description 2
- 208000004732 Systemic Vasculitis Diseases 0.000 description 2
- 206010042953 Systemic sclerosis Diseases 0.000 description 2
- 206010043561 Thrombocytopenic purpura Diseases 0.000 description 2
- 208000001435 Thromboembolism Diseases 0.000 description 2
- 206010052779 Transplant rejections Diseases 0.000 description 2
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical group [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 2
- 206010047115 Vasculitis Diseases 0.000 description 2
- 208000027418 Wounds and injury Diseases 0.000 description 2
- 230000003187 abdominal effect Effects 0.000 description 2
- 238000012084 abdominal surgery Methods 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 208000009956 adenocarcinoma Diseases 0.000 description 2
- 238000005377 adsorption chromatography Methods 0.000 description 2
- 238000001042 affinity chromatography Methods 0.000 description 2
- 230000007815 allergy Effects 0.000 description 2
- 150000001413 amino acids Chemical group 0.000 description 2
- 206010002022 amyloidosis Diseases 0.000 description 2
- 230000003444 anaesthetic effect Effects 0.000 description 2
- 230000001028 anti-proliverative effect Effects 0.000 description 2
- 239000002246 antineoplastic agent Substances 0.000 description 2
- 208000022362 bacterial infectious disease Diseases 0.000 description 2
- 210000002469 basement membrane Anatomy 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 210000000481 breast Anatomy 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 201000001981 dermatomyositis Diseases 0.000 description 2
- 238000009826 distribution Methods 0.000 description 2
- 239000012156 elution solvent Substances 0.000 description 2
- 208000030172 endocrine system disease Diseases 0.000 description 2
- 230000012202 endocytosis Effects 0.000 description 2
- 229940088598 enzyme Drugs 0.000 description 2
- 210000002919 epithelial cell Anatomy 0.000 description 2
- 229940012952 fibrinogen Drugs 0.000 description 2
- 201000005206 focal segmental glomerulosclerosis Diseases 0.000 description 2
- 108010074605 gamma-Globulins Proteins 0.000 description 2
- 238000001030 gas--liquid chromatography Methods 0.000 description 2
- 229940116332 glucose oxidase Drugs 0.000 description 2
- 235000019420 glucose oxidase Nutrition 0.000 description 2
- 239000000122 growth hormone Substances 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 230000000984 immunochemical effect Effects 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 229940125396 insulin Drugs 0.000 description 2
- 238000004255 ion exchange chromatography Methods 0.000 description 2
- 238000001155 isoelectric focusing Methods 0.000 description 2
- 201000006370 kidney failure Diseases 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 210000004072 lung Anatomy 0.000 description 2
- 230000000527 lymphocytic effect Effects 0.000 description 2
- 229960000274 lysozyme Drugs 0.000 description 2
- 239000004325 lysozyme Substances 0.000 description 2
- 235000010335 lysozyme Nutrition 0.000 description 2
- 201000006823 malignant adenoma Diseases 0.000 description 2
- 230000003211 malignant effect Effects 0.000 description 2
- 201000001441 melanoma Diseases 0.000 description 2
- 208000010125 myocardial infarction Diseases 0.000 description 2
- 230000017074 necrotic cell death Effects 0.000 description 2
- 230000002956 necrotizing effect Effects 0.000 description 2
- 208000001797 obstructive sleep apnea Diseases 0.000 description 2
- 238000004816 paper chromatography Methods 0.000 description 2
- 239000000199 parathyroid hormone Substances 0.000 description 2
- 229960001319 parathyroid hormone Drugs 0.000 description 2
- 238000004810 partition chromatography Methods 0.000 description 2
- 229960001639 penicillamine Drugs 0.000 description 2
- 208000005987 polymyositis Diseases 0.000 description 2
- 238000001556 precipitation Methods 0.000 description 2
- 230000002285 radioactive effect Effects 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 210000005084 renal tissue Anatomy 0.000 description 2
- 208000023504 respiratory system disease Diseases 0.000 description 2
- 206010039073 rheumatoid arthritis Diseases 0.000 description 2
- 208000007056 sickle cell anemia Diseases 0.000 description 2
- 208000017520 skin disease Diseases 0.000 description 2
- 150000003431 steroids Chemical class 0.000 description 2
- 239000004575 stone Substances 0.000 description 2
- 208000011117 substance-related disease Diseases 0.000 description 2
- 238000001356 surgical procedure Methods 0.000 description 2
- 201000000596 systemic lupus erythematosus Diseases 0.000 description 2
- 238000004809 thin layer chromatography Methods 0.000 description 2
- 239000012581 transferrin Substances 0.000 description 2
- 230000008733 trauma Effects 0.000 description 2
- 238000007631 vascular surgery Methods 0.000 description 2
- 238000009423 ventilation Methods 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 238000007693 zone electrophoresis Methods 0.000 description 2
- FPIPGXGPPPQFEQ-UHFFFAOYSA-N 13-cis retinol Natural products OCC=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-UHFFFAOYSA-N 0.000 description 1
- 239000005541 ACE inhibitor Substances 0.000 description 1
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 1
- 206010003445 Ascites Diseases 0.000 description 1
- 208000010061 Autosomal Dominant Polycystic Kidney Diseases 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 108010059378 Endopeptidases Proteins 0.000 description 1
- 102000005593 Endopeptidases Human genes 0.000 description 1
- 102000018389 Exopeptidases Human genes 0.000 description 1
- 108010091443 Exopeptidases Proteins 0.000 description 1
- 206010018364 Glomerulonephritis Diseases 0.000 description 1
- 206010018370 Glomerulonephritis membranoproliferative Diseases 0.000 description 1
- 206010018372 Glomerulonephritis membranous Diseases 0.000 description 1
- 208000000913 Kidney Calculi Diseases 0.000 description 1
- 206010023439 Kidney transplant rejection Diseases 0.000 description 1
- 208000004451 Membranoproliferative Glomerulonephritis Diseases 0.000 description 1
- 206010029148 Nephrolithiasis Diseases 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 241000473945 Theria <moth genus> Species 0.000 description 1
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 1
- FPIPGXGPPPQFEQ-BOOMUCAASA-N Vitamin A Natural products OC/C=C(/C)\C=C\C=C(\C)/C=C/C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-BOOMUCAASA-N 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- SHGAZHPCJJPHSC-YCNIQYBTSA-N all-trans-retinoic acid Chemical compound OC(=O)\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-YCNIQYBTSA-N 0.000 description 1
- FPIPGXGPPPQFEQ-OVSJKPMPSA-N all-trans-retinol Chemical compound OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-OVSJKPMPSA-N 0.000 description 1
- 150000004347 all-trans-retinol derivatives Chemical class 0.000 description 1
- 229940035676 analgesics Drugs 0.000 description 1
- 238000013103 analytical ultracentrifugation Methods 0.000 description 1
- 229940044094 angiotensin-converting-enzyme inhibitor Drugs 0.000 description 1
- 239000000730 antalgic agent Substances 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000001093 anti-cancer Effects 0.000 description 1
- 230000000118 anti-neoplastic effect Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 229940034982 antineoplastic agent Drugs 0.000 description 1
- 229940041181 antineoplastic drug Drugs 0.000 description 1
- 208000022185 autosomal dominant polycystic kidney disease Diseases 0.000 description 1
- 230000007698 birth defect Effects 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 230000033077 cellular process Effects 0.000 description 1
- -1 changes or is masked Proteins 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 239000013256 coordination polymer Substances 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 230000024924 glomerular filtration Effects 0.000 description 1
- 206010061989 glomerulosclerosis Diseases 0.000 description 1
- 230000036252 glycation Effects 0.000 description 1
- 229910001385 heavy metal Inorganic materials 0.000 description 1
- 229960003444 immunosuppressant agent Drugs 0.000 description 1
- 239000003018 immunosuppressive agent Substances 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 230000006525 intracellular process Effects 0.000 description 1
- 230000002427 irreversible effect Effects 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 230000003907 kidney function Effects 0.000 description 1
- 210000000244 kidney pelvis Anatomy 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 206010025482 malaise Diseases 0.000 description 1
- 230000007257 malfunction Effects 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 201000008350 membranous glomerulonephritis Diseases 0.000 description 1
- 231100000855 membranous nephropathy Toxicity 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 230000000877 morphologic effect Effects 0.000 description 1
- 239000002547 new drug Substances 0.000 description 1
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 239000005416 organic matter Substances 0.000 description 1
- 229960005489 paracetamol Drugs 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 201000008171 proliferative glomerulonephritis Diseases 0.000 description 1
- 230000009145 protein modification Effects 0.000 description 1
- 230000007420 reactivation Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 229930002330 retinoic acid Natural products 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 238000004513 sizing Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- WROMPOXWARCANT-UHFFFAOYSA-N tfa trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F.OC(=O)C(F)(F)F WROMPOXWARCANT-UHFFFAOYSA-N 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 229960001727 tretinoin Drugs 0.000 description 1
- 229910052722 tritium Inorganic materials 0.000 description 1
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 1
- 230000036325 urinary excretion Effects 0.000 description 1
- 235000019155 vitamin A Nutrition 0.000 description 1
- 239000011719 vitamin A Substances 0.000 description 1
- 229940045997 vitamin a Drugs 0.000 description 1
- 239000011800 void material Substances 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5091—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing the pathological state of an organism
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S436/00—Chemistry: analytical and immunological testing
- Y10S436/811—Test for named disease, body condition or organ function
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Veterinary Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Immunology (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biomedical Technology (AREA)
- Molecular Biology (AREA)
- Analytical Chemistry (AREA)
- Pathology (AREA)
- General Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Physics & Mathematics (AREA)
- Food Science & Technology (AREA)
- Microbiology (AREA)
- Cell Biology (AREA)
- Biotechnology (AREA)
- Diabetes (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Tropical Medicine & Parasitology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Physiology (AREA)
- Dermatology (AREA)
- Virology (AREA)
- Neurology (AREA)
- Emergency Medicine (AREA)
- Rheumatology (AREA)
Description
(発明の分野)
本発明は、生理学的サンプル中の所定のタンパク質の全含有量を測定する方法に関する。
【0002】
(発明の背景)
尿中に過剰のアルブミンの如きタンパク質が出現することは、腎臓病であることを示している。糖尿病性腎症はそのような疾病である。過剰のアルブミンが検出されるまでに、病気は、恐らくは、取り返しができず、処置の効果が殆どない段階に進行している。それ故、本発明の目的は、疾病を阻止するか或いは疾病の処置を早期に開始できるようにするように、そのような疾病をできるだけ早期に検出するための、現在知られている放射免疫測定法よりも感受性のある試験法を提供することにある。
【0003】
所定のタンパク尿、及び特にアルブミン尿(ミクロ−又はマクロ−)は、腎臓の疾病(腎糸体炎、バクテリア及びウイルス性腎糸体炎、IgA腎症、及びヘノッホ−シェーンライン紫斑病、膜性増殖性糸体腎炎、膜性腎臓病、ジェーグレン徴候群、糖尿病、ネフローゼ症候群(極少病変、巣状腎糸球体硬化症及び関連する機能不全)、急性腎不全、急性管状間質性腎炎、腎盂腎臓炎、GU路炎症性疾病、プレクランプシア(Pre-clampsia)、腎移植拒絶、乾癬、逆流性腎症、腎石症)、遺伝性腎臓病(髄質嚢胞、髄質スポンジ、多嚢胞腎臓病(オートゾーム優性多嚢胞腎臓病、オートゾーム劣性多嚢胞腎臓病、管状硬化症)、フォン・ヒッペル−リンドウ病、家族性薄糸球体基部膜病(familial thin-glomerular basement membrane disease) 、コラーゲンIII 腎糸球体病、フィブロネクチン腎糸球体病、アルポート症候群、ファブリー病、爪・膝蓋骨症候群、先天性泌尿器異常)、モノクロナール高ガンマグロブリン血症(多発性骨髄細胞腫、アミロイド症及び関連する機能異常)、熱病(家族性地中海熱、HIV感染エイズ)、炎症性疾病(全身的脈管炎(結節性多発性動脈炎、ウエゲナー多発性肉芽腫症、多発性動脈炎、壊死性及び半月状腎糸球体炎)、多発性筋炎、皮膚筋炎、膵臓炎、ロイマチス様関節炎、全身的紅斑性狼瘡、通風)、血液機能異常(鎌状赤血球病、血栓性血小板減少紫斑病、溶血尿毒症症候群、急性皮質(corticol)壊死、腎臓の血栓性栓塞)、外傷及び手術(広い範囲の損傷、火傷、腹部及び脈管の手術、麻酔薬の注入)、薬物(ペニシラミン、ステロイド類)及び薬物乱用、悪性の疾病(上皮細胞の(肺、乳房)、悪性腺腫(腎臓の)、黒色腫、リンパ性網内症、多発性骨髄細胞腫)、循環器の疾病(心筋梗塞、心不全、末梢血管病、高血圧、冠状心臓血管病、非アテローム硬化性心臓血管病、アテローム硬化性心臓血管病)、皮膚病(乾癬、全身的硬化症)、呼吸器の疾病(COPD、閉塞性睡眠無呼吸、高標高におけるヒポイア(hypoia))、及び内分泌の疾病(アクロメガリー、真性糖尿病、尿崩症)を含む疾病の製造元である。
【0004】
腎臓病は、バクテリア感染、アレルギー、先天性の欠陥、石、抗生物質、免疫抑制剤、抗ネオプラスチック、非ステロイド系抗炎症薬、鎮痛薬、重金属、腫瘍、化学物質に起因する。
【0005】
出願人は、アルブミンを含むタンパク質が、天然(native)タンパク質と腎臓通過の間に特定的に作られたフラグメントとの混合物として正常に排泄されることを発見した(Osicka,T.M.他(1996)「Nephrology」第2巻、第199〜212頁)。タンパク質は、管状細胞を含むポスト糸球体(基部膜)細胞によって、腎臓通過の間に厳しく劣化される。腎管状細胞のリソソームが、腎臓通過の間に排泄されるタンパク質の分解の原因となっている(図1参照)。分解生成物は管状内腔に排泄される。正常な個体では、尿内のアルブミンの殆どがフラグメント化される。
【0006】
リソソームの活性が、又はリソソームに対する基質を支配する細胞内プロセスが低下する場合は、高い分子量の、そして実質的には全長のアルブミンがより多く尿に現れる。これは腎臓組織における細胞プロセスが不均衡になっていることを反映している。
【0007】
今日まで、慣用のラジオイムノアッセイ(放射免疫測定法)が、サンプル中の所定のタンパク質の全て(全量)の検出に適当であると考えられていた。しかしながら、タンパク質の全内容は、慣用のラジオイムノアッセイ(RIA)を用いる公知の抗体によって確認可能なもの以上のものを含んでいる。現在利用できるラジオイムノアッセイは、アルブミンの如きタンパク質を検出するための抗体に依存している。抗体検出は、ナノグラムのレベルまで非常に正確である。しかしながら、抗体の特異性がタンパク質の検出に影響する。抗体は或るエピトープを検出する。もしもアルブミン上に所定のエピトープが存在しなかったり、変化したり又はマスクされたり、或いはアルブミンが他の方法で変質し、そのため抗体がアルブミンの検出に失敗するならば、慣用のラジオイムノアッセイは尿サンプルに存在するアルブミンの真の量についての正しい表示をしていないことになる。
【0008】
本発明の目的は、サンプル中の所定のタンパク質の全含有量を測定する方法にある。
【0009】
(発明の概要)
本発明は、腎臓病及び/又は疾病の腎臓合併症の初期の段階を診断する方法に関係するものである。
【0010】
特定の疾病に限定されるものではないけれども、本発明の方法によれば、診断される疾病には、腎症、尿崩症、I型糖尿病、II型糖尿病、腎臓の疾病(腎糸体炎、バクテリア及びウイルス性腎糸体炎、IgA腎症、及びヘノッホ−シェーンライン紫斑病、膜状増殖性糸体腎炎、膜性腎症、ジェーグレン徴候群、糖尿病、ネフローゼ症候群(極少病変、巣状腎糸球体硬化症及び関連する機能不全)、急性腎不全、急性管状間質性腎炎、腎盂腎臓炎、GU路炎症性疾病、プレクランプシア、腎移植拒絶、乾癬、逆流性腎症、腎石症)、遺伝性腎臓病(髄質嚢胞、髄質スポンジ、多嚢胞腎臓病(オートゾーム優性多嚢胞腎臓病、オートゾーム劣性多嚢胞腎臓病、管状硬化症)、フォン・ヒッペル−リンドウ病、家族性薄糸球体基部膜病、コラーゲンIII 腎糸球体病、フィブロネクチン腎糸球体病、アルポート症候群、ファブリー病、爪・膝蓋骨症候群、先天性泌尿器異常)、モノクロナール高ガンマグロブリン血症(多発性骨髄細胞腫、アミロイド症及び関連する機能異常)、熱病(家族性地中海熱、HIV感染エイズ)、炎症性疾病(全身的脈管炎(結節性多発性動脈炎、ウエゲナー多発性肉芽腫症、多発性動脈炎、壊死性及び半月状腎糸球体炎)、多発性筋炎、皮膚筋炎、膵臓炎、ロイマチス様関節炎、全身的紅斑性狼瘡、通風)、血液機能異常(鎌状赤血球病、血栓性血小板減少紫斑病、溶血尿毒症症候群、急性皮質壊死、腎臓の血栓性栓塞)、外傷及び手術(広い範囲の損傷、火傷、腹部及び脈管の手術、麻酔薬の注入)、薬物(ペニシラミン、ステロイド類)及び薬物乱用、悪性の疾病(上皮細胞の(肺、乳房)、悪性腺腫(腎臓の)、黒色腫、リンパ性網内症、多発性骨髄細胞腫)、循環器の疾病(心筋梗塞、心不全、末梢血管病、高血圧、冠状心臓血管病、非アテローム硬化性心臓血管病、アテローム硬化性心臓血管病)、皮膚病(乾癬、全身的硬化症)、呼吸器の疾病(COPD、閉塞性睡眠無呼吸、高標高におけるヒポイア)、及び内分泌の疾病(アクロメガリー、真性糖尿病、尿崩症)が含まれる。
【0011】
さらに、本方法は、如何なるタンパク質、好ましくは、アルブミン、グロブリン(α−グロブリン(α1−グロブリン、α2−グロブリン)、β−グロブリン、γ−グロブリン)、ユウグロブリン、プソイドグロブリンI及びII、フィブリノーゲン、α1酸性糖タンパク質(オロソムコイド)、α1糖タンパク質、α1リポプロテイン、セルロプラスミン、α219S糖タンパク質、β1トランスフェリン、β1リポタンパク質、免疫グロブリンA、E、GおよびM、ホースラディッシュ・ペルオキシダーゼ、ラクテート・デヒドロゲナーゼ、グルコース・オキシダーゼ、ミオグロビン、リゾチーム、タンパク質ホルモン、成長ホルモン、インスリン、又は上皮小体ホルモンを用いても行うことができる。
【0012】
本方法は、クロマトグラフィー、電気泳動又は沈殿法のような方法を用いる非抗体的手段を用いて行うことができ、そしてそれらはさらに、分配クロマトグラフィー、吸着クロマトグラフィー、濾紙クロマトグラフィー、薄層クロマトグラフィー、気−液クロマトグラフィー、ゲルクロマトグラフィー、イオン交換クロマトグラフィー、親和クロマトグラフィー、又は疎水性相互反応クロマトグラフィー(hydrophobic interaction chromatography)、移動界面電気泳動、ゾーン電気泳動、又は等電集束法の如き方法を含む。
【0013】
特に、本発明の方法は、高圧液体クロマトグラフィー(HPLC)装置における疎水性相互反応クロマトグラフィーを用いることに関する。
【0014】
本発明は、腎臓病及び/又は疾病の腎臓合併症の初期の段階を診断するための抗体検出法に関係する。抗体検出法は、尿において慣用の手段によっては正常に同定することができない、損なわれていない/変質したタンパク質(intact/modified protein)をアッセイすることによって実施される。損なわれていない/変質したタンパク質は、病人の、又は病気にかかり易い人の尿サンプル中に、天然タンパク質が検知される前に存在している。それ故、尿サンプル中に損なわれていない/変質したタンパク質が検出されることは、被験者が他の点で正常に見えても、被験者が病気になったか又は病気にかかり易いかのいずれかの初期の段階にあることを示している。このアッセイ法は、タンパク質の変質した又は未変質の形態の両者に対して特異的な抗体によって、損なわれていない/変質したタンパク質を検出することを含んでいる。抗体は変質したタンパク質に対して特異的であるのが好ましい。抗体は、酵素性、放射性、蛍光性又は化学発光性の標識に添着させることができ、そして検出手段は、ラジオイムノアッセイ、免疫性ラジオメトリックアッセイ、蛍光イムノアッセイ、酵素結合イムノアッセイ、又はプロテインAイムノアッセイよりなる。
【0015】
上記の方法において、変質したタンパク質が尿中に存在し、時間の経過により量が増加し、そして慣用のラジオイムノアッセイが変質したタンパク質を検知しないときに、疾病が初期の段階であると診断される。
【0016】
【0017】
【0018】
【0019】
本発明の目的は、サンプルにおける所定のタンパク質の全含有量を測定することにあり、
(a)サンプル中のタンパク質の全部を分離し、
(b)所定のタンパク質の変質した又は未変質の形態を検出し、そして
(c)所定のタンパク質の変質した又は未変質の形態を統合して、サンプル中の所定のタンパク質の全含有量を測定する。
サンプルは尿の如き生理学的サンプルであるのが好ましい。
【0020】
本発明の目的は、本発明の次の記載、添付の参照図面及び添付の請求の範囲からより一層十分に理解されるであろう。
【0021】
(発明の詳細な説明)
本出願人は、アルブミンおよび免疫グロブリンの如き大部分の血漿タンパク質を含むタンパク質が腎臓によって濾過される場合、物質が排泄される前にそれらは腎臓の細胞によって引き続いて分解されることを発見した。濾過されたタンパク質は、管状細胞によって引き取られるようである。管状細胞は腎臓フィルターを越えて横たわり、そして最初の濾液と直接接触する。タンパク質が管状細胞によって内部に取り込まれると、それらはリソソームに向けられ、そこで種々のサイズのフラグメントに部分的に分解され、そして次いで細胞の外側に噴き戻される。これらの噴き戻されたフラグメントは、特定の型のタンパク質のどれかから生じた少なくとも60の異なるフラグメントであり、次いで尿中に排泄される。
【0022】
出願人は、腎臓病においては、蛋白質のフラグメント化が阻止されることを発見した。このことは、濾過された実質的に全長のタンパク質が腎臓病に罹患した人では排泄されることを意味する。排泄されたタンパク質の、このフラグメント化からフラグメント化阻止への転移は、新しい薬剤および診断アッセイの発展のための出発点となる。例えば、糖尿病における腎合併症の発症が起こる最初の変化は、排泄されたアルブミンのフラグメント化プロフィールにおける変化に関連する。これは、糖尿病性腎症の進行と同義である外見上明らかなミクロアルブミン尿症に導く。これは、糖尿病において管状細胞のリソソーム活性が抑制されることによるらしい。したがって、薬剤は腎合併症が起こる糖尿病においてリソソーム活性に向けられるように処方することができる。また、薬剤はリソソーム活性が影響する他の腎臓病に、またはリソソーム活性が非腎臓組織において消える状態にある腎合併症のない糖尿病に有用である。その様な薬剤には、抗癌薬の如き抗増殖性剤が含まれる。
【0023】
出願人は、所定のタンパク質の変質した形態を検出するための独特なアッセイであって、そしてそれは、所定のタンパク質の未変質の形態がラジオイムノアッセイの如き慣用のアッセイを用いて検知される前に、或る被験者の尿において検出されることを発見した。
【0024】
(定義)
「フラグメント化タンパク質又はフラグメントアルブミン」は、腎臓通過の間に生じる化学的、酵素的又は物理的分解の後のポスト糸球体分解生成物を含む。これらの成分は、小さくなったサイズをもつか、及び/又は疎水性に変化する。
【0025】
ここで用いる「損なわれていないアルブミン、変質したアルブミン、又はアルブミンの変質した形態」は、天然アルブミンと同様なサイズ及び構造的特徴をもつ化合物であって、アミノ酸連鎖が天然アルブミンと実質的に同一であるものを意味する。濾過された損なわれていない蛋白質が好ましい。それは高圧液体クロマトグラフィー(HPLC)において天然アルブミンと同じ位置又はその近くで溶離される(図5参照)。しかしながら、その構造は、小さな酵素が介在した変質又はその塩基構造の付加のいずれかによって生化学的に変質しているか、及び/又は慣用的に用いる抗アルブミン抗体による検知から逃れるような3次元構造の変化によって物理的に変質している。生化学的変質は、エンド又はエキソ−ペプチターゼの如き酵素によってなされてもよい。アルブミンの3次元構造は、幾つかの方法で変えることができる。リガンドがアルブミンに結合するか、又はこれらのどのような組合わせでもよい。本発明の方法によって検出される変質したアルブミンは、入手可能な抗体を使用する現在の、及び慣用のラジオイムノアッセイによっては検出できない。
【0026】
慣用の抗アルブミン抗体は、免疫化学品の供給者から購入することができる。例えば、モノクロナール抗体カタログ番号A6684(クローンno.HSA−11)、及びA2672(クローンno.HSA−9)、並びに液体血清、凍結乾燥分別品、液体IgG留分、及び腹水流体の形態のモノクロナール抗体は、カタログ「1994 Sigma-Biochemicals Organic Compounds for Research and Diagnostic Reagents」の第1151〜1152頁における免疫化学品に見付けられるように、シグマ、セントルイス、MOから得ることができる。
【0027】
ここで用いる損なわれていない/変質したアルブミンには、実質的に全長(full-length)アルブミン、フラグメント化された、化学的に変質した、又は物理的に変質したアルブミンが含まれる。ここで用いる損なわれていない/変質したアルブミンは、全長アルブミンよりも、以下の、同等の又は以上の分子量をもつアルブミンを示し、そしてクロマトグラフィー、好ましくはHPLC、最も好ましくは疎水HPLCの如き、分離媒体における天然アルブミンの位置又はその近くで溶離されることを意味する。ここで用いるフラグメント化されたアルブミンは、慣用の抗アルブミン抗体によって検出されないアルブミンのフラグメントに関するものを意味し、その存在により、腎臓病及び/又は疾病の腎臓合併症の初期の段階で診断することが検知される。損なわれていない/変質したアルブミンの存在の検出により、腎臓病になりやすいことが示される。
【0028】
ここで用いる「損なわれていないタンパク質、変質したタンパク質又はタンパク質の変質した形態」は、慣用のラジオイムノアッセイによって検出できない実質的に全長のタンパク質の形態のものを含む。限定されるものではないが、蛋白質には、アルブミン、グロブリン(α−グロブリン(α1−グロブリン、α2−グロブリン)、β−グロブリン、γ−グロブリン)、ユウグロブリン、プソイドグロブリンI及びII、フィブリノーゲン、α1酸性糖タンパク質(オロソムコイド)、α1糖タンパク質、α1リポタンパク質、セルロプラスミン、α219S 糖タンパク質、β1トランスフェリン、β1リポプロテイン、免疫グロブリンA、E、GおよびM、成長ホルモン、インスリン、上皮小体ホルモンを含む蛋白質ホルモン類、及びホースラディッシュ・ペルオキシダーゼ、ラクテート・デヒドロゲナーゼ、グルコース・オキシダーゼ、ミオグロビン、リゾチームを含む他の蛋白質が含まれる。
【0029】
ここで用いる「腎臓病」は、腎臓の如何なる機能不全をも含む。腎臓病は、尿中に損なわれていない又は変質したアルブミンが存在することによって確認される。好ましくは、腎臓病の早期の診断は、尿中の変質したタンパク質の存在、又は時間の経過で尿中の変質したタンパク質の増加を検出することによって行われる。
【0030】
ここで用いる「低リソソーム活性」は、正常な個体におけるリソソーム活性の正常なレベルに対して、及び/又はリソソームにタンパク質を渡すリソソーム機構に対して比較される。その活性は、リソソームに関してタンパク質をフラグメントにするには不十分であって、そのため損なわれていないタンパク質が正常な低いレベルよりも多量に排泄される。
【0031】
ここで用いる「リソソーム活性化化合物」は、リソソームの再活性化に有益な化合物をいう。この化合物は、リソソームに直接又は間接的に作用して、リソソームの機能を活性化する。これらの化合物には、限定されるものではないが、抗癌化合物、抗増殖化合物、パラセタモール、ビタミンA(レチン酸)又はレチノールの誘導体が含まれる。
【0032】
「マクロアルブミン尿」は、個体が、慣用のラジオイムノアッセイ(RIA)によって測定されたものとして、尿にアルブミン200μg/minよりも多く排泄する状態である。
【0033】
「ミクロアルブミン尿」は、個体が、慣用のラジオイムノアッセイ(RIA)によって測定されたものとして、尿にアルブミンを少なくとも20μg/min排泄する状態である。RIAは、15.6ng/mlまで測定し、6μg/minより低いクリアランスをもつ正常な被験者の尿中のアルブミンを測定することが可能である。しかしながら、アルブミン排泄が20μg/minを超える場合、腎臓病の処置は限定され、そしてこの時点から完全な回復は困難になる。
【0034】
ここで用いる「ミクロアルブミン尿性」は、慣用のラジオイムノアッセイ(RIA)によって測定されたものとして、少なくとも20μg/minの排泄割合で、アルブミンが尿に排泄される時の状態である。
【0035】
ここで用いる「天然」及び「未変質」は、有機物、好ましくは人間に自然に見出されるタンパク質を記載するために用いられ、腎糸球体の濾過工程によって変質しなかったものである。
【0036】
ここで用いる「正常な個体」は、尿中に発見される損なわれていないアルブミンが病気のインディケイターとなる病気をもたない個体である。好ましくは、病気は腎臓病である。
【0037】
「リソソーム活性の正常レベル」は、正常な個体の病気にかかっていない腎臓に見出だされるリソソーム活性のレベルである。
【0038】
ここで用いる「ノルモアルブミン尿性」は、アルブミンが尿に排泄され、そしてRIAによって検出できないか又は20μg/min(RIAで測定されるものとして)より少なく排泄される状態を意味する。
【0039】
ここで用いる「病気になる傾向」は、変質したアルブミンの如き変質したタンパク質の存在及び排泄速度の測定によって判断されるものとして、個体に結果として病気があることを意味する。
【0040】
ここで用いる「タンパク尿」は、尿にタンパク質が、通常、アルブミンの形態で存在するものであり、そのタンパク質は、水溶性であり、熱によって凝固する。これに関して「特定のタンパク尿」は、尿に所定のタンパク質が存在することをいう。
【0041】
ここで用いる「ラジオイムノアッセイ」は、放射性的に標識化された所定の抗体又は抗原を用いて物質を検出及び測定する方法である。
【0042】
ここで用いる「リソソームの再活性化」は、リソソーム活性が活性化して、タンパク質、特にアルブミンの分解がリソソームの不活性状態に比較して増加することを含む。
【0043】
ここで用いる「回復」は、回復された要素がその前の機能と比較して改善された機能を持つように、完全に又は部分的に回復することを意味する。
【0044】
ここで用いる「全タンパク質」は、天然の、未変質の、変質した又は尿に排泄されたフラグメント化された形態で存在する所定の濾過されたタンパク質をいう。これは慣用のラジオイムノアッセイ又はタンパク質の検出に現在使用されている慣用の方法によっては検出されないタンパク質を含んでいる。
【0045】
本発明によれば、限定されるものではないが、処置される疾病には、腎臓病(腎糸体炎、バクテリア及びウイルス性腎糸体炎、IgA腎症、及びヘノッホ−シェーンライン紫斑病、膜性増殖性腎糸体炎、膜性腎臓病、ジェーグレン徴候群、糖尿病、ネフローゼ症候群(極少病変、巣状腎糸球体硬化症及び関連する機能不全)、急性腎不全、急性管状間質性腎炎、腎盂腎臓炎、GU路炎症性疾病、プレクランプシア(Pre-clampsia)、腎移植拒絶、乾癬、逆流性腎症、腎石症)、遺伝性腎臓病(髄質嚢胞、髄質スポンジ、多嚢胞腎臓病(オートゾーム優性多嚢胞腎臓病、オートゾーム劣性多嚢胞腎臓病、管状硬化症)、フォン・ヒッペル−リンドウ病、家族性薄糸球体基部膜病(familial thin-glomerular basement membrane disease) 、コラーゲンIII 腎糸球体病、フィブロネクチン腎糸球体病、アルポート症候群、ファブリー病、ネール−パテラ症候群、先天性泌尿器異常)が含まれる。
【0046】
本発明の一態様において、腎臓病及び/又は疾病の腎臓合併症になる傾向又は早期の診断を決定する方法を提供する。この方法は、尿サンプル中のアルブミン含有量の変化を測定することを含む。疾病は腎臓病に限定される必要はないけれども、腎臓病であってもよい。
【0047】
本発明の方法において、尿で検出されるタンパク質の例として、ここではアルブミンのみが用いられている。患者におけるアルブミンが慣用のRIAによって分析された場合には、ノルモアルブミン尿症患者又は正常な個体は、若年者で3〜10μg/minの範囲、そして老年者ではそれ以上のアルブミンを尿に有する。しかしながら、ノルモアルブミン尿症患者はまた、もしもHPLCによって測定されるならば、尿中にアルブミンの複数のレベルを示す。出願人は、これらのレベルは、5μg/minのオーダーにあることを見出した。腎臓病の進行に伴い、損なわれていない/変質したアルブミンのレベルは、RIAにより測定されるものとして20〜200μg/minのオーダーのマクロアルブミン尿のレベルまで増加するであろう。これはHPLC、又は変質したアルブミンを含む全アルブミンを測定する方法によって測定された場合、非常に高くなるであろう。損なわれていない/変質したアルブミンをモニターすることによって、腎臓病の初期の徴候が検出される。しかしながら、これらのレベルは、現在商業的に利用されている抗体を用いるラジオイムノアッセイの如き、現在利用可能な方法では、恐らく、抗体が或るエピトープを検出するために、検出することができない。もしもアルブミンが上記したどれかの方法で変質しているならば、エピトープはそれによって破壊されて、変質したアルブミンを検知不可能にする。
【0048】
糖尿病性腎症をもつことが疑われる患者は、RIA法の如き、現在利用されている方法によってアルブミンを検出する場合には、10年ないし15年後まで腎臓悪化の徴候を示さないであろう。個体がミクロアルブミン尿の状態に入った場合に、少なくとも20μg/minの尿排泄速度がRIAによって検出される。また、変質したアルブミンの排泄を観察することによって、腎臓における変化及び腎臓病の発症可能性が検出される。
【0049】
ノルモアルブミン尿の被験者、又はノルモアルブミン尿性糖尿病患者は、RIAによる測定として、20μg/minよりも低い低アルブミン排泄速度を何年も持ち続ける。尿中のアルブミンの存在は、腎臓の機能が害されている兆候である。このレベルが変化し始めるや否や、処置を開始することができる。
【0050】
正常の個体においては、少量のアルブミンが尿中で検出可能である。全濾過アルブミンは、尿中にフラグメント化したアルブミンとして主に現れる。いくつかのアルブミンは、ノルモアルブミン尿の個体において検出される。しかしながら、ノルモアルブミン尿の個体において、尿におけるアルブミンの排泄速度は、5μg/min程度に低い。このレベルは一般にRIAによって検出可能である。
【0051】
本発明の変質したタンパク質は、特に限定されるものではないが、クロマトグラフィー、電気泳動、沈殿法、又はそれらの組合わせを含む当業界で公知の種々の方法によって検出することができる。それらは、Karger BL、 Hancock WS(eds.), High Resolution Separation and Analysis of biological Macromolecules. Part A Fundamentals in Methods in Enzymology, Vol.270, 1996 (Academic Press, San Diego, California, USA) ; Karger BL, Hancock WS(eds.), High Resolution Separation and Analysis of biological Macromolecules. Part B Applications in Methods in Enzymology, Vol.271, 1996 (Academic Press, San Diego, California, USA) ;又はHarding SE, Rowe, AJ, Horton JC(eds.) Analytical Ultracentrifugation in Biochemistry and Polymer Science. 1992, Royal Soc. Chemistry, Cambridge, UK に記載され、これらの文献はそっくり そのまま参照によりここに組み入れる。
【0052】
電気泳動法には、限定されるものではないが、移動界面電気泳動法、ゾーン電気泳動法、及び等電集束法が含まれる。
【0053】
クロマトグラフ法には、分配クロマトグラフィー、吸着クロマトグラフィー、濾紙クロマトグラフィー、薄層クロマトグラフィー、気−液クロマトグラフィー、ゲルクロマトグラフィー、イオン交換クロマトグラフィー、親和クロマトグラフィー、及び疎水性相互反応クロマトグラフィーが含まれる。好ましくは、これはサイジングゲルクロマトグラフィー及び疎水性相互反応クロマトグラフィーである。さらに好ましくは、HPLCカラムを用いる疎水性相互反応クロマトグラフィーである。
【0054】
出願人は、糖尿病の中で、ノルモアルブミン尿性糖尿病患者が慣用のRIAによって分析した時に、殆ど検出できないレベルのアルブミンをもつことを見出した。彼等は、正常であるように見える。しかしながら、尿をHPLCによって試験した場合、変質したアルブミンのレベルは、正常の個体で見られるよりも遥かに大きい。このアルブミンの差異は、損なわれていない又は変質した形態にある全てのアルブミン(全アルブミン)を十分に検出するためには、慣用のRIAは無力であるということに帰する。したがって、HPLCは、フラグメント化プロフィールを作るのに好適である。HPLC上のフラグメント化プロフィールは、損なわれていない又は変質した形態にあるアルブミンの多数の種類を表す一連のピークによって特徴付けられる。
【0055】
好ましい態様において、被験者について腎臓病になる傾向又は早期の診断を決定する方法は、被験者がミクロアルブミン尿症になる前になされる。
【0056】
本発明のHPLC法によるサンプル中のアルブミン含有量の測定は、慣用のRIAによる測定とは異なる結果をもたらす。HPLC技術では、低いレベルのアルブミンが正常の個体において観察される。変質したアルブミンのレベルが検出され始め、そしてそのレベルが上昇し、そしてミクロアルブミン尿症に進行した時、患者は腎臓病になる傾向をもつと決定することができる。
【0057】
正常な個体においては、HPLCが作るフラグメント化プロフィールは、全長天然アルブミンが溶離する領域にはピークが存在しないことによって特徴付けられる。その代り、多数のフラグメント化されたアルブミンが検出できる。純粋なタンパク質生成物(未変質の)は、本質的に単一のピークを作る。例えば、疎水性HPLCを用いて、アルブミンが39〜44分間の範囲で溶離することが観察された(図5)。したがって、正常な個体は、腎臓病がないか又は腎臓病になる傾向がないことを示す明確なフラグメント化プロフィールを作る。しかしながら、腎臓病の進行に従って、最初に変質したアルブミン量の増加、次いでその後に天然の形態が検出される。フラグメント化プロフィールは変化し始め、そして全長アルブミンの領域においてより多くの生成物が、追加のピークとして、又は尿中のより多くの損なわれない/変質したアルブミンを表す拡大されたピークとして現れる。
【0058】
尿サンプルのフラグメント化プロフィールが作られるHPLCにおいて、変質したアルブミンは、天然アルブミンが溶離する領域に現れ、しかし変質したアルブミンの多数の形態の存在を示す多数のピークとして現れる。
【0059】
さらに好ましい実施態様において、腎臓病になる傾向は、少なくとも1種の変質したアルブミンの存在を測定又は同定することによって評価される。これは、HPLCプロフィール上の特定のピークの存在によって測定又は同定され、好ましくは、ピークは天然アルブミンの溶離位置に相当する位置の範囲内にある。
【0060】
変質したアルブミン又は未変質アルブミンを検出するためのHPLCカラムは、Zorbax300SB−CB(4.6mm×150mm)の如き疎水性カラムであってもよい。50μlのサンプルループを用いることができる。アルブミン及びその分解生成物の検出においてHPLCに好適な溶離溶剤には、アセトニトリル溶剤の如き標準溶離溶剤が含まれる。好ましくは、水/1%トリフルオロ酢酸(TFA)の緩衝液、続いて60%アセトニトリル/0.09%TFAの緩衝液を用いることができる。0ないし100%の勾配の60%アセトニトリル/0.09%TFAが好ましいことが分かった。
【0061】
疎水性カラム用の好適なHPLC条件は次の通りである。
溶剤A H2O、 1%トリフルオロ酢酸
溶剤B 60%アセトニトリル、0.09%TFA
溶剤A2 99.96>00.00:49.58min
圧力 9.014Mパスカル(〜1100psi)
溶剤B2 0.04>100.0:49.58min
圧力 7.154Mパスカル
HPLCにおいて用いられる波長は約214nmである。
【0062】
変質したアルブミンは、39〜44分の間で溶離する(図5参照)。アルブミンフラグメントは、非常に早く、主に20分より以下で溶離する。
【0063】
腎臓病になる傾向を決定する方法は、如何なる個体にも適用可能である。腎臓病は、バクテリア感染、アレルギー、先天性の欠陥、石、腫瘍、化学物質又は糖尿病を含む多数の要因によって引き起こされる。好ましくは、本方法は、腎臓病に進行するかも知れない糖尿病患者について腎臓病になる傾向を確定するために適用できる。個体はノルモアルブミン尿性糖尿病であるのが好ましい。しかしながら、正常な個体について、尿中の損なわれていない又は変質したアルブミンのレベルが増加するのを測定することによって、病気になる傾向をモニターすることができる。
【0064】
本発明の方法は、上記した非抗体分離法を用いて実施することができる。しかしながら、変質したタンパク質に対して特異的な抗体もまた変質したタンパク質の存在を検出するために用いることができる。
【0065】
変質したタンパク質に対する抗体は、次の方法によって得ることができる。実施例によりアルブミンに関する処理のみを特に記載するが、尿中の他の如何なるタンパク質に対する抗体製造にも容易に適用することができる。この方法は、例えば腎臓合併症に進行するであろう糖尿病患者を同定するために、どの変質したアルブミン分子が最も感受性あるマーカーであるかを追求する。
【0066】
変質したアルブミンは、例えば予備的HPLCにより、変質したアルブミン分子の定量的分離を行うことによって特徴付けられる。変質したタンパク質は、グリケーションの如き、リガンドの結合について分析される。続いて、個々の変質したタンパク質のアミノ酸連鎖が、好ましくは、例えば、Karger BL, Hancock WS(eds.), High Resolution Separation and Analysis of biological Macromolecules. Part A Fundamentals in Methods in Enzymology. Vol.270, 1996 (Academic Press, San Diego, California, USA) ;又は Karger BL, Hancock WS(eds.), High Resolution Separation and Analysis of biological Macromolecules. Part B Applications in Methods in Enzymology, Vol.271, 1996 (Academic Press, San Diego, California, USA) に記載された方法を用いる質量分析法によって測定され、そしてこれらの文献は、そっくりそのまま参照によりここに組み入れる。好ましい実施態様において、約3ないし4の変質したアルブミンスピーシズがある。
【0067】
変質したアルブミンに対する抗体を発生させる方法は、糖尿病患者、例えば、腎臓合併症に進行する患者を予言する変質したアルブミンのための診断的イムノアッセイの発展を追求する。これを遂行するために、HPLCによって十分な量の変質したアルブミンが用意される。抗体は、良好な力価を発生させるために、変質したアルブミンを兎等の動物に連続的に注入することによって作られ、そして抗体は、例えば、Goding JW, Monoclonal Antibodies: Principles and Practice. Production and Application of Monoclonal Antibodies in Cell Biology, Biochemistry and Immunology, 2nd Edition 1986, Academic Press, London, UK ;又はJohnstone A, Thorpe R, Immunochemistry in Practice, 3rd edition 1996, Blackwell Science Ltd., Oxford, UK に記載の方法を用いる慣用の技術によって単離される。これらの文献はそっくりそのまま参照によりここに組み入れる。得られた抗体は、ポリクロナール抗体またはモノクロナール抗体である。
【0068】
好ましくは、変質したアルブミンの少なくとも1つのスピーシズが単離され、そして腎臓病になる傾向を決定するのに用いるために同定される。単離されたスピーシズは、イムノアッセイに用いるための抗体を発生させるために用いられる。抗体には、酵素性、放射性、蛍光性または化学的発光性ラベルが付けられる。限定されるものではないが、検出方法には、ラジオイムノアッセイ、免疫性ラジオメトリックアッセイ、蛍光イムノアッセイ、酵素結合イムノアッセイ、又はプロテインAイムノアッセイが含まれる。アッセイは、例えば、Goding JW, Monoclonal Antibodies: Principles and Practice. Production and Application of Monoclonal Antibodies in Cell Biology, Biochemistry and Immunology, 2nd Edition 1986, Academic Press, London, UK ;Johnstone A, Thorpe R, Immunochemistry in Practice, 3rd edition 1996, Blackwell Science Ltd., Oxford, UK ;またはPrice CP, Newman DJ(eds.) Principles and Practice of Immunoassay, 2nd Edition, 1997 Stockton Press, New York, NY, USA に記載された方法によって行われる。これらの文献はそっくりそのまま参照によりここに組み入れる。
【0069】
【0070】
【0071】
【0072】
【0073】
【0074】
【0075】
【0076】
【0077】
【0078】
【0079】
【0080】
【0081】
【0082】
【0083】
本発明の他の態様において、被験者における腎臓病を阻止する方法を提供し、その方法は、
(a)尿サンプルの全アルブミン含有量を測定し、
(b)慣用のRIA法によって検出できないように変質した、尿中の損なわれていないアルブミンの量の変化を測定し、ここでその変化は腎臓病になる傾向を示すものであり、そして
変化が測定された時に腎臓病の動物を処置することよりなる。
【0084】
次の例は、本発明の説明のために示したものであり、そして限定するためのものではない。
【0085】
例1:人漿液アルブミン(HSA)のサイズ・イクスクルージョン・クロマトグラフィー(Size Exclusion Chromatography)
【0086】
尿中のアルブミンの分配を分析するための尿を提供するために、正常で健康なボランティアを採用した。
【0087】
3H[HSA]を健康なボランティアに注射し、そして尿及び血漿を集め、G −100カラムを用いるサイズ・イクスクルージョン・クロマトグラフィーによって分析した。カラムは、4℃において20ml/hrでPBS(pH=7.4)を用いて溶離した。カラムのボイド容積(V0)は青色デキストランT2000で測定し、全容積をトリチウム原子含有水で測定した。
【0088】
トリチウム放射能は、1mlの水性サンプルで、3mlのシンチラントを用いて測定し、そしてWallac1410液体シンチレーション計数管(Wallac Turku, Finland)上で計測した。
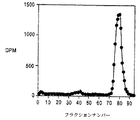
図2は、尿及び血漿中のアルブミンの分配を説明する。
【0089】
例2:正常で健康なボランティア及び糖尿病患者のアルブミン排泄
【0090】
例1において用いられた3H[HSA]を正常で健康なボランティア及び糖尿病患者に注射した。尿のサンプルを集め、そして3H[HSA]が例1におけるように測定した。
【0091】
正常で健康なボランティア(図3)は、例1において行ったようなサイズ・イクスクルージョン・クロマトグラフィー上にアルブミンのフラグメントが排泄されたことを示している。
【0092】
糖尿病患者(図4)は、サイズ・イクスクルージョン・クロマトグラフィー上に実質的に全長の及びフラグメント化されたアルブミンが存在していることを示している。しかしながら、これらの方法で検出可能なアルブミンの排泄速度は、5μg/min(対照)及び1457μg/min(糖尿病)であった。
【0093】
例3:HPLC上の全アルブミン及び損なわれていない/変質したアルブミンの測定
【0094】
正常で健康なボランティア、ノルモアルブミン尿性糖尿病患者及びマクロアルブミン尿症患者から、尿サンプルを集めた。尿は、50ml尿標本容器に中ほどまで集められた。尿はさらに使用するまで凍結させた。HPLC分析に先立って、尿は5000gで遠心処理した。
【0095】
サンプルを、疎水性カラム:Zorbax300SB−CB(4.6mm×150mm)を用いてHPLC上で分析した。50μlのサンプルループが使用された。
【0096】
サンプルは、次の条件を用いてカラムから溶離した。
溶剤A H2O、 1%トリフルオロ酢酸
溶剤B 60%アセトニトリル、0.09%TFA
溶剤A2 99.96>00.00:49.58min
圧力 9.014Mパスカル(〜1100psi)
溶剤B2 0.04>100.0:49.58min
圧力 7.154Mパスカル
214nmの波長を用いた。
【0097】
(結果)
図5は、アルブミン単独のHPLCプロフィールを示す。ほぼ39〜44分の保持時間において溶離した本質的に単一のピークが得られた。
【0098】
図6は、血漿のHPLCプロフィールを示すものであって、およそ39〜44分の保持時間における明確なアルブミンピーク並びに他の血漿タンパク質に相当するピークを示している。
【0099】
図7は、尿サンプルにアルブミンのピークを示さない正常で健康なボランティアのHPLCプロフィールを示す。この個体は、尿に排泄されたアルブミンを恐らく活性リソソームを経由して分解する。フラグメント化された実質の生成物は、幾つかのスピーシズ、特に約14.5分より以下の保持時間におけるスピーシズが目立つことを示していることが明らかである。
【0100】
ノルモアルブミン尿性糖尿病患者の尿(RIAにより測定されたものとして、アルブミン排泄速度8.07μg/min)を分析したとき(図8)、少量の変質したアルブミンがおよそ39〜44分の保持時間において溶離することが明らかである。慣用の試験では、尿サンプルに<6mg/lのアルブミンの存在を示すが、本発明の方法では、尿サンプルの真のアルブミン含有量が26.7mg/lであることを示した。この個体に対しては疾病の治療を開始すべきである。アルブミン副生物又はフラグメント化したアルブミンは、正常で健康なボランティアにおけるように存在していた。
【0101】
ノルモアルブミン尿性糖尿病患者の他の尿サンプル(アルブミン排泄速度17.04μg/min)を分析した(図9)。RIA試験ではこの患者についてアルブミンが尿に排泄されたことを示す。しかしながら、HPLC上に(図9)およそ39〜44分の保持時間においてアルブミンまたは変質したアルブミンのピークが明白である。慣用の試験では尿サンプルに<6mg/lのアルブミンの存在を示すが、本発明の方法では、尿サンプルの真のアルブミン含有量が81.3mg/lであることを示した。この個体に対しては疾病の治療を開始すべきである。このピークは、多数のピーク外観を示し始める。損なわれていないアルブミンに相当する小さいピークは、変質したアルブミンが39〜44分のピークとして現れたことを示している。アルブミンのピークを持たない正常で健康なボランティアのプロフィールと比較して、このアルブミンのピークの存在は、損なわれていない/変質したアルブミン量の検出可能なレベルに変化があることを示している。これは腎臓病になる傾向を合図している。
【0102】
ノルモアルブミン尿性糖尿病患者からの他の尿サンプル(アルブミン排泄速度4.37μg/min)を分析した。そしてHPLCプロフィールを図10に示す。また、変質したアルブミンが、およそ39〜44分の保持時間に多数のピークを示すものとして検出された。この患者はRIAにより再び正常アルブミンとして登録された。慣用の試験では、尿サンプルに<6mg/lのアルブミンの存在を示すが、本発明の方法では、尿サンプルの真のアルブミン含有量が491mg/lであることを示した。この個体に対しては疾病の治療を開始すべきである。変質したアルブミンのアセスメントがこれらの変化を同定するために必要であることが明らかである。この患者は腎臓病になる傾向を持つと決定されるであろう。腎臓病が進行するに従って、変質したアルブミンピークは増え続けるであろう。
【0103】
このことは、マクロアルブミン尿患者の尿サンプルを分析した図11に示されている。およそ39〜44分の保持時間に多数のピークを示す非常に重要なアルブミンピークがあることが明白であった。この患者のアルブミン含有量は1796mg/lであった。この個体の処置は進行中である。
【0104】
本発明方法を利用すると、図12〜図14に経時の調査によって示しているように、腎臓病になる傾向が早期に検知できるようになる。図12〜図14は、糖尿病のACEインヒビター処置が、変質したアルブミンの検出法が用いられるべきであるよりも後に開始された状態を示している。本発明による方法を用いた変質したタンパク質の検出は、慣用のRIAを用いるよりも腎臓病の発症を予言するためのより有効な方法である。
ここで引用された文献の全ては、その全体が参照される。
【0105】
最後に、種々の他の改変及び/または変更が、ここに示された本発明の精神を逸脱することなくなされることが理解されるべきである。
【図面の簡単な説明】
【図1】 図1は、濾過された損なわれていないタンパク質が管状細胞中を進行すること及びアルブミンが分解して排泄アルブミンフラグメントを生じることを示す。
【図2】 図2a及び2bは、正常で健康なボランティアからサイズ・イクスクルージョン・クロマトグラフィーによって集められた(a)尿及び(b)血漿における(3H)HSAの代表的なプロフィールを示す。尿は殆どフラグメント化されたアルブミンを含んでいる。そして血漿は、殆ど損なわれていないアルブミンを含んでいる。
【図3】 図3は、フラグメント化されたアルブミンピークを示すが、サイズ・イクスクルージョン・クロマトグラフィーからの損なわれていないアルブミンのピークのない正常で健康なボランティアからの尿を示す。
【図4】 図4は、サイズ・イクスクルージョン・クロマトグラフィーからの損なわれていない及びフラグメント化されたアルブミンのピークの両者を示す糖尿病患者からの尿を示す。
【図5】 図5は、アルブミン単独のHPLCプロフィールを示す。
【図6】 図6は、アルブミンピークを示す正常で健康なボランティアからの血漿のHPLCプロフィールを示す。
【図7】 図7は、アルブミンのフラグメント化された生成物を含むが、損なわれていないアルブミンのピークがない正常で健康なボランティアからの尿のHPLCプロフィールを示す。
【図8】 図8は、アルブミン分解生成物、及びおよそ39〜44分の保持時間において変質したアルブミンの小さなピークを示しているノルモ(正常)アルブミン尿性糖尿病患者からの尿サンプルのHPLCプロフィールを示す。
【図9】 図9は、腎不全の徴候を示し、およそ39〜44分の保持時間において特徴的スパイク状のアルブミンピークの存在を示しているノルモアルブミン尿性糖尿病患者からの尿サンプルのHPLCプロフィールを示す。
【図10】 図10は、腎不全の徴候を示し、およそ39〜44分の保持時間において特徴的スパイク状の変質したアルブミンのピークの存在を示しているノルモアルブミン尿性糖尿病患者のHPLCプロフィールを示す。
【図11】 図11は、高いレベルのノーマルアルブミン、及びおよそ39〜44分の保持時間において特徴的スパイク状の外観を示しているマクロアルブミン尿性糖尿病患者のHPLCを示す。
【図12】 図12は、糖尿病性腎症の発症の前に変質したタンパク質が検出された患者の経時の調査を示し、糖尿病性腎症になりやすいことを示し、そして慣用のRIA法に依存することにより処置が遅延することを示している。
【図13】 図13は、糖尿病性腎症の発症の前に変質したタンパク質が検出された患者の経時の調査を示し、糖尿病性腎症になりやすいことを示し、そして慣用のRIA法に依存することにより処置が遅延することを示している。
【図14】 図14は、糖尿病性腎症の発症の前に変質したタンパク質が検出された患者の経時の調査を示し、糖尿病性腎症になりやすいことを示し、そして慣用のRIA法に依存することにより処置が遅延することを示している。
Claims (1)
- (a)尿サンプル中のタンパク質の全部を分離し、
(b)所定のタンパク質の未変質の形態及び所定のタンパク質の未変質の形態に対して特異的な抗体によって検出できない、実質的に全長のタンパク質の形態である、所定のタンパク質の変質した形態を検出し、そして
(c)前記変質した形態及び未変質の形態を統合して、尿サンプル中の変質した及び未変質の所定のタンパク質の全含有量を測定する
ことよりなる尿サンプル中の変質した及び未変質の所定のタンパク質の全含有量を測定する方法。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| AUPP7843A AUPP784398A0 (en) | 1998-12-21 | 1998-12-21 | Kidney disease detection and treatment |
| US09/415,217 US6447989B1 (en) | 1998-12-21 | 1999-10-12 | Kidney disease detection and treatment |
| US09/415,217 | 1999-10-12 | ||
| US7843 | 1999-10-12 | ||
| PCT/IB1999/002029 WO2000037944A1 (en) | 1998-12-21 | 1999-12-20 | Kidney disease detection and treatment |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2005270160A Division JP4388515B2 (ja) | 1998-12-21 | 2005-09-16 | 腎臓病の検出方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2002533680A JP2002533680A (ja) | 2002-10-08 |
| JP2002533680A5 JP2002533680A5 (ja) | 2005-09-22 |
| JP4160263B2 true JP4160263B2 (ja) | 2008-10-01 |
Family
ID=25645955
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2000589950A Expired - Fee Related JP4160263B2 (ja) | 1998-12-21 | 1999-12-20 | 尿サンプル中の所定のタンパク質の全含有量を測定する方法 |
| JP2005270160A Expired - Fee Related JP4388515B2 (ja) | 1998-12-21 | 2005-09-16 | 腎臓病の検出方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2005270160A Expired - Fee Related JP4388515B2 (ja) | 1998-12-21 | 2005-09-16 | 腎臓病の検出方法 |
Country Status (13)
| Country | Link |
|---|---|
| US (3) | US6589748B2 (ja) |
| EP (1) | EP1141728B1 (ja) |
| JP (2) | JP4160263B2 (ja) |
| CN (1) | CN1331801A (ja) |
| AT (1) | ATE376187T1 (ja) |
| AU (1) | AU1674400A (ja) |
| BR (1) | BR9916407A (ja) |
| CA (1) | CA2356174A1 (ja) |
| DE (1) | DE69937368T2 (ja) |
| DK (1) | DK1141728T3 (ja) |
| IL (1) | IL143892A0 (ja) |
| MX (1) | MXPA01006404A (ja) |
| WO (1) | WO2000037944A1 (ja) |
Families Citing this family (77)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1331801A (zh) | 1998-12-21 | 2002-01-16 | 莫纳什大学 | 肾病检测及治疗 |
| AUPP784398A0 (en) | 1998-12-21 | 1999-01-21 | Monash University | Kidney disease detection and treatment |
| US7250294B2 (en) * | 2000-05-17 | 2007-07-31 | Geron Corporation | Screening small molecule drugs using neural cells differentiated from human embryonic stem cells |
| JP2004537036A (ja) * | 2001-03-28 | 2004-12-09 | ヘスカ コーポレイション | 動物において早期腎疾患を検出する方法 |
| US20030003588A1 (en) * | 2001-06-28 | 2003-01-02 | Comper Wayne D. | Method for kidney disease detection by protein profiling |
| JP2006518251A (ja) * | 2003-02-13 | 2006-08-10 | ベクトン・ディキンソン・アンド・カンパニー | 血液採取の際に成分を除去するための装置並びにその使用法 |
| US7482128B2 (en) | 2003-03-27 | 2009-01-27 | Heska Corporation | Anti-feline albumin antibodies |
| US7318925B2 (en) * | 2003-08-08 | 2008-01-15 | Amgen Fremont, Inc. | Methods of use for antibodies against parathyroid hormone |
| US20050112123A1 (en) * | 2003-10-06 | 2005-05-26 | Vaughan Michael R. | Methods of treating proteinuria |
| US20060286602A1 (en) * | 2004-05-10 | 2006-12-21 | Harald Mischak | Method and markers for the diagnosis of renal diseases |
| US20090176864A1 (en) * | 2004-11-24 | 2009-07-09 | Hill's Pet Nutrition, Inc. | Methods For Improving Hepatic and Immune Function In An Animal |
| CN101107012A (zh) * | 2004-11-24 | 2008-01-16 | 希尔氏宠物营养品公司 | 改进动物异生素物质肝清除率的方法 |
| US8647660B2 (en) | 2004-12-29 | 2014-02-11 | Hill's Pet Nutrition, Inc. | Combination of limited nutrients and enhanced dietary antioxidants to impart improved kidney health |
| US8252742B2 (en) | 2004-12-30 | 2012-08-28 | Hill's Pet Nutrition, Inc. | Methods for enhancing the quality of life of a senior animal |
| WO2006074089A2 (en) * | 2004-12-30 | 2006-07-13 | Hill's Pet Nutrition, Inc. | Methods for enhancing the quality of life of a senior animal |
| US20060205818A1 (en) * | 2005-03-08 | 2006-09-14 | Burzynski Stanislaw R | Method for the treatment of von Hippel-Lindau (VHL) disease with phenylacetyl-derivatives |
| US9272033B2 (en) * | 2005-04-19 | 2016-03-01 | Hill's Pet Nutrition, Inc. | Methods and compositions for the prevention and treatment of kidney disease |
| JP2008539274A (ja) * | 2005-04-29 | 2008-11-13 | ヒルズ・ペット・ニュートリシャン・インコーポレーテッド | ネコの寿命を延長する方法 |
| BRPI0610060A2 (pt) * | 2005-05-20 | 2010-05-25 | Hills Pet Nutrition Inc | método para promover a saúde ou bem estar em um animal adulto, método para regular a ingestão de rações por um animal adulto, kit, meios para comunicar informação sobre ou instruções para promover a saúde ou bem estar em um animal adulto, método para aumentar a retenção de nitrogênio por um animal adulto, processo para fabricar uma ração, produto, e, ração |
| RU2412608C2 (ru) * | 2005-06-29 | 2011-02-27 | Хилл`С Пет Ньютришн, Инк. | Кормовая композиция для профилактики заболевания почек, способ ее получения, способ профилактики заболевания почек, набор |
| US8492432B2 (en) * | 2005-08-17 | 2013-07-23 | Hill's Pet Nutrition, Inc. | Methods for the treatment of kidney disease |
| EP2118666B1 (de) * | 2007-03-07 | 2011-08-03 | Mosaiques Diagnostics And Therapeutics AG | Verfahren zur normierung der konzentration von analyten in einer urinprobe |
| EP1972940A1 (de) * | 2007-03-14 | 2008-09-24 | mosaiques diagnostics and therapeutics AG | Verfahren und Marker zur Diagnose von Nierenerkrankungen |
| US9000134B2 (en) * | 2007-05-11 | 2015-04-07 | Wallace B. Haigh | Reagent and kit for early diagnosis of kidney disease |
| WO2009047280A2 (de) * | 2007-10-09 | 2009-04-16 | Mosaiques Diagnostics And Therapeutics Ag | Polypeptidmarker zur diagnose von prostatakrebs |
| EP2051078A1 (de) * | 2007-10-19 | 2009-04-22 | mosaiques diagnostics and therapeutics AG | Verfahren und Marker zur Diagnose von Diabetes Mellitus |
| WO2009115570A2 (de) * | 2008-03-19 | 2009-09-24 | Mosaiques Diagnostics And Therapeutics Ag | Verfahren und marker zur diagnose von tubulären nierenschäden und -erkrankungen |
| DK2313778T3 (en) | 2008-07-18 | 2015-04-27 | Boston Medical Ct Corp | Diagnostics for membranous nephropathy |
| KR20110073471A (ko) * | 2008-08-28 | 2011-06-29 | 아스튜트 메디컬 인코포레이티드 | 신손상 및 신부전의 진단 및 예후를 위한 방법 및 조성물 |
| EP2324354B1 (en) * | 2008-08-29 | 2014-07-16 | Astute Medical, Inc. | Methods for prognosis of acute renal failure |
| WO2010031822A1 (de) * | 2008-09-17 | 2010-03-25 | Mosaiques Diagnostics And Therapeutics Ag | Nierenzellkarzinom |
| EP3246707B1 (en) | 2008-10-21 | 2020-09-30 | Astute Medical, Inc. | Methods and compositions for diagnosis and prognosis of renal injury and renal failure |
| EP2347260A4 (en) * | 2008-10-21 | 2012-09-26 | Astute Medical Inc | METHODS AND COMPOSITIONS FOR THE DIAGNOSIS AND PROGNOSIS OF RENAL INJURY AND RENAL FAILURE |
| CN104330574B (zh) | 2008-11-10 | 2017-04-12 | 阿斯图特医药公司 | 用于诊断和预后肾损伤和肾衰竭的方法和组合物 |
| NZ592552A (en) * | 2008-11-22 | 2013-12-20 | Astute Medical Inc | Methods and compositions for diagnosis and prognosis of renal injury and renal failure |
| WO2010064239A1 (en) | 2008-12-04 | 2010-06-10 | Technion Research And Development Foundation Ltd. | Apparatus and methods for diagnosing renal disorders |
| WO2010085878A1 (en) * | 2009-01-28 | 2010-08-05 | Industrial Technology Research Institute | Biomarkers associated with nephropathy |
| US9229010B2 (en) | 2009-02-06 | 2016-01-05 | Astute Medical, Inc. | Methods and compositions for diagnosis and prognosis of renal injury and renal failure |
| WO2011017654A1 (en) * | 2009-08-07 | 2011-02-10 | Astute Medical, Inc. | Methods and compositions for diagnosis and prognosis of renal injury and renal failure |
| CN104483488A (zh) * | 2009-08-28 | 2015-04-01 | 阿斯图特医药公司 | 肾损伤和肾衰竭的诊断及预后的方法及组合物 |
| JP2013510322A (ja) | 2009-11-07 | 2013-03-21 | アスチュート メディカル,インコーポレイテッド | 腎損傷および腎不全の診断および予後診断のための方法ならびに組成物 |
| EP3153863B1 (en) * | 2009-11-07 | 2020-04-01 | Astute Medical, Inc. | Methods and uses for evaluation of acute renal failure/acute renal injury |
| CN102725636B (zh) * | 2009-12-20 | 2015-04-01 | 阿斯图特医药公司 | 用于肾损伤和肾衰竭的诊断及预后的方法和组合物 |
| BR112012019542A2 (pt) | 2010-02-05 | 2018-03-27 | Astute Medical Inc | "método para avaliar o estado renal em um indivíduo, medição de um ou mais biomarcadores, e, kit" |
| EA201290711A1 (ru) | 2010-02-26 | 2013-10-30 | Астьют Медикал, Инк. | Способы и композиции для диагностики и прогнозирования повреждений почек и почечной недостаточности |
| WO2011119920A2 (en) | 2010-03-25 | 2011-09-29 | Oregon Health & Science University | Cmv glycoproteins and recombinant vectors |
| NZ703055A (en) | 2010-06-23 | 2016-07-29 | Astute Medical Inc | Methods and compositions for diagnosis and prognosis of renal injury and renal failure |
| NZ605698A (en) | 2010-06-23 | 2015-03-27 | Astute Medical Inc | Methods and compositions for diagnosis and prognosis of renal injury and renal failure |
| US8930222B2 (en) * | 2010-08-05 | 2015-01-06 | Abbott Laboratories | Method and system for managing patient healthcare |
| DE102010038014B4 (de) * | 2010-10-06 | 2021-10-07 | Numares Ag | Verwendung spezifischer Substanzen als Marker zur Bestimmung des Risikos einer Nierenabstoßung |
| KR101215759B1 (ko) | 2010-11-01 | 2012-12-26 | 서울대학교산학협력단 | 오로소뮤코이드를 포함하는 조성물의 용도 |
| DK2691530T3 (en) | 2011-06-10 | 2018-05-22 | Univ Oregon Health & Science | CMV GLYCOPROTEIN AND RECOMBINANT VECTORS |
| CN102854325B (zh) * | 2011-07-01 | 2015-01-07 | 复旦大学 | 胰岛素与血清蛋白可逆性结合的亲和力指标测定方法及应用 |
| AU2012216792A1 (en) | 2011-09-12 | 2013-03-28 | International Aids Vaccine Initiative | Immunoselection of recombinant vesicular stomatitis virus expressing HIV-1 proteins by broadly neutralizing antibodies |
| US9402894B2 (en) | 2011-10-27 | 2016-08-02 | International Aids Vaccine Initiative | Viral particles derived from an enveloped virus |
| WO2013067420A1 (en) * | 2011-11-03 | 2013-05-10 | Tumlin James A | Acth for treatment of kidney disease |
| EP2788759B1 (en) | 2011-12-08 | 2019-02-20 | Astute Medical, Inc. | Methods and uses for diagnosis of renal injury and renal failure |
| US9689826B2 (en) | 2012-03-11 | 2017-06-27 | Technion Research And Development Foundation Ltd. | Detection of chronic kidney disease and disease progression |
| ES2631608T3 (es) | 2012-06-27 | 2017-09-01 | International Aids Vaccine Initiative | Variante de la glicoproteína Env del VIH-1 |
| ES2681955T3 (es) | 2013-01-17 | 2018-09-17 | Astute Medical, Inc. | Métodos y composiciones para el diagnóstico y pronóstico de lesión renal e insuficiencia renal |
| JP2016188761A (ja) * | 2013-08-23 | 2016-11-04 | 国立研究開発法人国立国際医療研究センター | 糖尿病腎症の発症または発症リスクの検出方法及びキット |
| EP2848937A1 (en) | 2013-09-05 | 2015-03-18 | International Aids Vaccine Initiative | Methods of identifying novel HIV-1 immunogens |
| CN104007258B (zh) * | 2013-09-30 | 2016-07-06 | 中国医学科学院基础医学研究所 | 局灶性节段性肾小球硬化的蛋白标志物 |
| EP2873423B1 (en) | 2013-10-07 | 2017-05-31 | International Aids Vaccine Initiative | Soluble hiv-1 envelope glycoprotein trimers |
| US10300108B2 (en) | 2013-12-03 | 2019-05-28 | Astute Medical, Inc. | Methods and compositions for diagnosis and prognosis of renal injury and renal failure |
| CN104849466A (zh) * | 2014-02-14 | 2015-08-19 | 张曼 | 尿液玻璃体结合蛋白在2型糖尿病合并早期肾损伤诊治中的应用 |
| US20170205427A1 (en) * | 2014-07-23 | 2017-07-20 | University Of British Columbia | Biomarkers for anderson-fabry disease |
| EP3069730A3 (en) | 2015-03-20 | 2017-03-15 | International Aids Vaccine Initiative | Soluble hiv-1 envelope glycoprotein trimers |
| EP3072901A1 (en) | 2015-03-23 | 2016-09-28 | International Aids Vaccine Initiative | Soluble hiv-1 envelope glycoprotein trimers |
| EP3281011B1 (en) | 2015-04-09 | 2024-06-05 | Astute Medical, Inc. | Methods and compositions for diagnosis and prognosis of renal injury and renal failure |
| US11243217B2 (en) | 2016-06-06 | 2022-02-08 | Astute Medical, Inc. | Management of acute kidney injury using insulin-like growth factor-binding protein 7 and tissue inhibitor of metalloproteinase 2 |
| CN117577321A (zh) | 2017-08-08 | 2024-02-20 | 费森尤斯医疗保健控股公司 | 用于治疗和评估慢性肾脏疾病的进程的系统和方法 |
| CN107561175A (zh) * | 2017-08-10 | 2018-01-09 | 武汉大学 | 一种肾小球硬化大鼠模型的评价方法 |
| RU2697722C1 (ru) * | 2018-12-06 | 2019-08-19 | Ирина Сергеевна Шатохина | Способ диагностики активности воспалительного процесса при латентном течении хронического пиелонефрита |
| CN110632229A (zh) * | 2019-09-24 | 2019-12-31 | 华兰生物工程重庆有限公司 | 高效液相色谱仪检测静注人免疫球蛋白(pH4)蛋白质含量的方法 |
| CN111714517A (zh) * | 2020-04-14 | 2020-09-29 | 南开大学 | 一种溶酶体作为制备药物领域的应用 |
| RU2768464C1 (ru) * | 2021-04-27 | 2022-03-24 | Федеральное государственное бюджетное образовательное учреждение высшего образования "Рязанский государственный медицинский университет имени академика И.П. Павлова" Министерства здравоохранения Российской Федерации | Способ диагностики мембранозной нефропатии как одной из форм хронического гломерулонефрита |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4994165A (en) * | 1989-02-16 | 1991-02-19 | Cornell Research Foundation, Inc. | Liquid junction coupling for capillary zone electrophoresis/ion spray spectrometry |
| DK0514928T3 (da) * | 1991-05-24 | 1997-10-20 | Wakamoto Pharma Co Ltd | Fremgangsmåde til diagnosticering af nyresygdomme ved påvisning af albuminfragmenter |
| JPH0682446A (ja) * | 1992-08-31 | 1994-03-22 | Wakamoto Pharmaceut Co Ltd | 腎疾患の診断法 |
| DE4336498A1 (de) * | 1993-10-26 | 1995-04-27 | Bender & Co Gmbh | Verfahren zur Diagnose von Nieren- und Gefäßerkrankungen |
| US5534431A (en) | 1994-02-28 | 1996-07-09 | The Board Of Regents Of The University Of Nebraska | Hybridomas and monoclonal antibodies specific for unique determinants of nephropathy-related immunoglobulin G and complexes thereof |
| US5908925A (en) | 1996-06-27 | 1999-06-01 | Exocell, Inc. | Genetically engineered immunoglobulins with specificity for glycated albumin |
| US5800998A (en) * | 1996-11-12 | 1998-09-01 | Millennium Pharmaceuticals, Inc. | Assays for diagnosing type II diabetes in a subject |
| CN1331801A (zh) | 1998-12-21 | 2002-01-16 | 莫纳什大学 | 肾病检测及治疗 |
-
1999
- 1999-12-20 CN CN99814862A patent/CN1331801A/zh active Pending
- 1999-12-20 CA CA002356174A patent/CA2356174A1/en not_active Abandoned
- 1999-12-20 BR BR9916407-8A patent/BR9916407A/pt not_active Application Discontinuation
- 1999-12-20 WO PCT/IB1999/002029 patent/WO2000037944A1/en active IP Right Grant
- 1999-12-20 DK DK99959616T patent/DK1141728T3/da active
- 1999-12-20 AU AU16744/00A patent/AU1674400A/en not_active Abandoned
- 1999-12-20 IL IL14389299A patent/IL143892A0/xx unknown
- 1999-12-20 EP EP99959616A patent/EP1141728B1/en not_active Expired - Lifetime
- 1999-12-20 MX MXPA01006404A patent/MXPA01006404A/es not_active IP Right Cessation
- 1999-12-20 JP JP2000589950A patent/JP4160263B2/ja not_active Expired - Fee Related
- 1999-12-20 AT AT99959616T patent/ATE376187T1/de not_active IP Right Cessation
- 1999-12-20 DE DE69937368T patent/DE69937368T2/de not_active Expired - Lifetime
-
2001
- 2001-06-28 US US09/892,797 patent/US6589748B2/en not_active Expired - Fee Related
- 2001-06-28 US US09/893,346 patent/US20020012906A1/en not_active Abandoned
-
2003
- 2003-11-26 US US10/721,351 patent/US20040106155A1/en not_active Abandoned
-
2005
- 2005-09-16 JP JP2005270160A patent/JP4388515B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| AU1674400A (en) | 2000-07-12 |
| JP4388515B2 (ja) | 2009-12-24 |
| DE69937368D1 (de) | 2007-11-29 |
| EP1141728A1 (en) | 2001-10-10 |
| CA2356174A1 (en) | 2000-06-29 |
| US20020022236A1 (en) | 2002-02-21 |
| US20020012906A1 (en) | 2002-01-31 |
| JP2006038877A (ja) | 2006-02-09 |
| JP2002533680A (ja) | 2002-10-08 |
| EP1141728A4 (en) | 2005-01-12 |
| US6589748B2 (en) | 2003-07-08 |
| WO2000037944A1 (en) | 2000-06-29 |
| BR9916407A (pt) | 2001-09-25 |
| DE69937368T2 (de) | 2008-07-17 |
| DK1141728T3 (da) | 2008-02-04 |
| CN1331801A (zh) | 2002-01-16 |
| MXPA01006404A (es) | 2003-06-06 |
| US20040106155A1 (en) | 2004-06-03 |
| ATE376187T1 (de) | 2007-11-15 |
| IL143892A0 (en) | 2002-04-21 |
| EP1141728B1 (en) | 2007-10-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4160263B2 (ja) | 尿サンプル中の所定のタンパク質の全含有量を測定する方法 | |
| US6447989B1 (en) | Kidney disease detection and treatment | |
| JP2004530904A (ja) | 蛋白質プロフィール化による腎臓病の検知方法 | |
| Niemelä et al. | Markers of fibrogenesis and basement membrane formation in alcoholic liver disease: Relation to severity, presence of hepatitis, and alcohol intake | |
| Guéchot et al. | Relationship between procollagen III aminoterminal propeptide and hyaluronan serum levels and histological fibrosis in primary biliary cirrhosis and chronic viral hepatitis C | |
| EP0559795B1 (en) | Methods for the diagnosis of chronic lower back and cervical pain | |
| Lee et al. | Antineutrophil antibodies in familial inflammatory bowel disease | |
| US20110143456A1 (en) | Method for the early detection of renal injury | |
| US9365888B2 (en) | Assessing the risk of a major adverse cardiac event in patients with chest pain | |
| US20050191664A1 (en) | Method for kidney disease detection | |
| JPH0580053A (ja) | ヒト子宮体癌細胞の免疫化学的検出方法 | |
| US4654313A (en) | Methods for the determination of brain antigens | |
| JP3998245B2 (ja) | 酸化アポリポタンパク質ai及びそれを含有する酸化リポタンパク質の測定法及びキット | |
| JP3499875B2 (ja) | 解離性大動脈瘤を検出するための抗体試薬及びその用途 | |
| GB2173306A (en) | The determination of albumin and a carrier and fixation technique usable therein | |
| Torffvit et al. | A new enzyme-linked immunosorbent assay for urine and serum concentrations of the carboxyterminal domain (NCI) of collagen IV. Application in type I (insulin-dependent) diabetes | |
| WONG, WILLIAM LS CHEW, TAR-CHOON AW | Serum lipoprotein (a) profiles in a Singaporean population | |
| EP0692715A1 (en) | Method of assaying for fructose-1,6-biphosphatase and diagnostic test therefrom | |
| WO2021216585A1 (en) | Methods for prediction, detection and monitoring of substance use disorders and/or an infection | |
| ZA200309593B (en) | Method for kidney disease detection by protein profiling. | |
| JPH06317588A (ja) | 腎疾患の検査方法,検査試薬およびキット | |
| JPH07128333A (ja) | コレステリルエステル転送蛋白の免疫測定法 | |
| Dawnay et al. | The Measurement of Kidney-Derived Immunologically Reactive Material in Urine and Plasma for Studying Renal Integrity |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20040120 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20040120 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20040909 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20040921 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20041217 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20041227 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20050531 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20050916 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20051130 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20051228 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20080118 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20080118 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080523 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20080717 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110725 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120725 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120725 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130725 Year of fee payment: 5 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |