JP4156038B2 - ニガウリの経口活性画分、その活性ペプチドおよび糖尿病治療におけるその使用 - Google Patents
ニガウリの経口活性画分、その活性ペプチドおよび糖尿病治療におけるその使用 Download PDFInfo
- Publication number
- JP4156038B2 JP4156038B2 JP54197198A JP54197198A JP4156038B2 JP 4156038 B2 JP4156038 B2 JP 4156038B2 JP 54197198 A JP54197198 A JP 54197198A JP 54197198 A JP54197198 A JP 54197198A JP 4156038 B2 JP4156038 B2 JP 4156038B2
- Authority
- JP
- Japan
- Prior art keywords
- peptide
- seq
- sequence
- substitution
- diabetes
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 108090000765 processed proteins & peptides Proteins 0.000 title claims abstract description 53
- 206010012601 diabetes mellitus Diseases 0.000 title abstract description 35
- 235000009811 Momordica charantia Nutrition 0.000 title description 13
- 235000008322 Trichosanthes cucumerina Nutrition 0.000 title description 10
- 244000078912 Trichosanthes cucumerina Species 0.000 title 1
- 230000002218 hypoglycaemic effect Effects 0.000 claims abstract description 23
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 17
- 102000004196 processed proteins & peptides Human genes 0.000 claims abstract description 13
- 230000003345 hyperglycaemic effect Effects 0.000 claims abstract description 9
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 claims description 34
- 239000008103 glucose Substances 0.000 claims description 34
- 210000004369 blood Anatomy 0.000 claims description 26
- 239000008280 blood Substances 0.000 claims description 26
- 150000001413 amino acids Chemical group 0.000 claims description 21
- 229940024606 amino acid Drugs 0.000 claims description 17
- 235000001014 amino acid Nutrition 0.000 claims description 16
- 238000006467 substitution reaction Methods 0.000 claims description 12
- 201000010099 disease Diseases 0.000 claims description 11
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 7
- 239000008194 pharmaceutical composition Substances 0.000 claims description 7
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 claims description 6
- 239000003814 drug Substances 0.000 claims description 6
- 208000001072 type 2 diabetes mellitus Diseases 0.000 claims description 6
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 claims description 5
- 238000012217 deletion Methods 0.000 claims description 5
- 230000037430 deletion Effects 0.000 claims description 5
- 239000004471 Glycine Substances 0.000 claims description 3
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 claims description 3
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 claims description 3
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 claims description 3
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 claims description 3
- 235000004279 alanine Nutrition 0.000 claims description 3
- 239000004474 valine Substances 0.000 claims description 3
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 claims description 2
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 claims description 2
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 claims description 2
- 125000001165 hydrophobic group Chemical group 0.000 claims description 2
- 229960000310 isoleucine Drugs 0.000 claims description 2
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 claims description 2
- 238000004519 manufacturing process Methods 0.000 claims description 2
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 claims description 2
- 125000003295 alanine group Chemical group N[C@@H](C)C(=O)* 0.000 claims 2
- 125000003630 glycyl group Chemical group [H]N([H])C([H])([H])C(*)=O 0.000 claims 2
- 125000000741 isoleucyl group Chemical group [H]N([H])C(C(C([H])([H])[H])C([H])([H])C([H])([H])[H])C(=O)O* 0.000 claims 1
- 125000001909 leucine group Chemical group [H]N(*)C(C(*)=O)C([H])([H])C(C([H])([H])[H])C([H])([H])[H] 0.000 claims 1
- 125000002987 valine group Chemical group [H]N([H])C([H])(C(*)=O)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 claims 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 abstract description 14
- 238000000034 method Methods 0.000 abstract description 13
- 238000002360 preparation method Methods 0.000 abstract description 8
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 abstract description 7
- 239000013543 active substance Substances 0.000 abstract description 5
- 239000000284 extract Substances 0.000 abstract description 5
- 241000797947 Paria Species 0.000 abstract 1
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 52
- 229940125396 insulin Drugs 0.000 description 28
- 241000700159 Rattus Species 0.000 description 26
- 102000004877 Insulin Human genes 0.000 description 24
- 108090001061 Insulin Proteins 0.000 description 24
- 244000302512 Momordica charantia Species 0.000 description 14
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 13
- 230000000694 effects Effects 0.000 description 13
- 239000002953 phosphate buffered saline Substances 0.000 description 13
- 102000015636 Oligopeptides Human genes 0.000 description 9
- 108010038807 Oligopeptides Proteins 0.000 description 9
- 201000001421 hyperglycemia Diseases 0.000 description 9
- 241000124008 Mammalia Species 0.000 description 7
- 230000037396 body weight Effects 0.000 description 7
- 239000003981 vehicle Substances 0.000 description 7
- 238000004458 analytical method Methods 0.000 description 6
- 230000007246 mechanism Effects 0.000 description 6
- 210000002966 serum Anatomy 0.000 description 6
- 210000001519 tissue Anatomy 0.000 description 6
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 5
- 239000000287 crude extract Substances 0.000 description 5
- 238000010586 diagram Methods 0.000 description 5
- 235000013399 edible fruits Nutrition 0.000 description 5
- 238000000746 purification Methods 0.000 description 5
- 241001131796 Botaurus stellaris Species 0.000 description 4
- 241000196324 Embryophyta Species 0.000 description 4
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 4
- 241000282412 Homo Species 0.000 description 4
- ZSJLQEPLLKMAKR-UHFFFAOYSA-N Streptozotocin Natural products O=NN(C)C(=O)NC1C(O)OC(CO)C(O)C1O ZSJLQEPLLKMAKR-UHFFFAOYSA-N 0.000 description 4
- 150000001875 compounds Chemical class 0.000 description 4
- 239000002552 dosage form Substances 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 238000002474 experimental method Methods 0.000 description 4
- 238000001914 filtration Methods 0.000 description 4
- 238000004128 high performance liquid chromatography Methods 0.000 description 4
- 238000001990 intravenous administration Methods 0.000 description 4
- 239000012528 membrane Substances 0.000 description 4
- 230000002265 prevention Effects 0.000 description 4
- 102000004169 proteins and genes Human genes 0.000 description 4
- 108090000623 proteins and genes Proteins 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 4
- 229960001052 streptozocin Drugs 0.000 description 4
- 230000009885 systemic effect Effects 0.000 description 4
- AXAVXPMQTGXXJZ-UHFFFAOYSA-N 2-aminoacetic acid;2-amino-2-(hydroxymethyl)propane-1,3-diol Chemical compound NCC(O)=O.OCC(N)(CO)CO AXAVXPMQTGXXJZ-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 241000699670 Mus sp. Species 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- 239000002775 capsule Substances 0.000 description 3
- 230000007423 decrease Effects 0.000 description 3
- 230000007812 deficiency Effects 0.000 description 3
- 108020001507 fusion proteins Proteins 0.000 description 3
- 102000037865 fusion proteins Human genes 0.000 description 3
- 239000011544 gradient gel Substances 0.000 description 3
- 210000004731 jugular vein Anatomy 0.000 description 3
- 239000000203 mixture Substances 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 3
- -1 polyethyleneoxy group Polymers 0.000 description 3
- 229920001184 polypeptide Polymers 0.000 description 3
- 235000018102 proteins Nutrition 0.000 description 3
- 238000004007 reversed phase HPLC Methods 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- WRMNZCZEMHIOCP-UHFFFAOYSA-N 2-phenylethanol Chemical compound OCCC1=CC=CC=C1 WRMNZCZEMHIOCP-UHFFFAOYSA-N 0.000 description 2
- 208000002109 Argyria Diseases 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 238000011537 Coomassie blue staining Methods 0.000 description 2
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- 238000005481 NMR spectroscopy Methods 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 125000000539 amino acid group Chemical group 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 210000001715 carotid artery Anatomy 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- 239000000356 contaminant Substances 0.000 description 2
- 239000000599 controlled substance Substances 0.000 description 2
- 239000008367 deionised water Substances 0.000 description 2
- 229910021641 deionized water Inorganic materials 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- 238000012377 drug delivery Methods 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 230000010030 glucose lowering effect Effects 0.000 description 2
- 239000013542 high molecular weight contaminant Substances 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 230000003914 insulin secretion Effects 0.000 description 2
- 230000002608 insulinlike Effects 0.000 description 2
- 238000010253 intravenous injection Methods 0.000 description 2
- 238000002955 isolation Methods 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 210000004185 liver Anatomy 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 238000007410 oral glucose tolerance test Methods 0.000 description 2
- 210000000496 pancreas Anatomy 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 230000000069 prophylactic effect Effects 0.000 description 2
- 238000003127 radioimmunoassay Methods 0.000 description 2
- 108020003175 receptors Proteins 0.000 description 2
- 102000005962 receptors Human genes 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L sodium carbonate Substances [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 1
- AENZGWONVTXLRC-UHFFFAOYSA-N 2-(2,5-dioxopyrrol-1-yl)benzoic acid Chemical compound OC(=O)C1=CC=CC=C1N1C(=O)C=CC1=O AENZGWONVTXLRC-UHFFFAOYSA-N 0.000 description 1
- 108010066676 Abrin Proteins 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 201000004569 Blindness Diseases 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 208000017667 Chronic Disease Diseases 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- 102000016607 Diphtheria Toxin Human genes 0.000 description 1
- 108010053187 Diphtheria Toxin Proteins 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 229920002527 Glycogen Polymers 0.000 description 1
- 101000976075 Homo sapiens Insulin Proteins 0.000 description 1
- 208000013016 Hypoglycemia Diseases 0.000 description 1
- 102000003746 Insulin Receptor Human genes 0.000 description 1
- 108010001127 Insulin Receptor Proteins 0.000 description 1
- 206010022489 Insulin Resistance Diseases 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 108010058846 Ovalbumin Proteins 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 108010039491 Ricin Proteins 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 150000001242 acetic acid derivatives Chemical class 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 238000002266 amputation Methods 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000006286 aqueous extract Substances 0.000 description 1
- 239000012223 aqueous fraction Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 229940072107 ascorbate Drugs 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 230000004531 blood pressure lowering effect Effects 0.000 description 1
- 229910021538 borax Inorganic materials 0.000 description 1
- 150000001642 boronic acid derivatives Chemical class 0.000 description 1
- 238000007707 calorimetry Methods 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 150000007942 carboxylates Chemical class 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- 150000001860 citric acid derivatives Chemical class 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 238000013267 controlled drug release Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 239000003431 cross linking reagent Substances 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000018044 dehydration Effects 0.000 description 1
- 238000006297 dehydration reaction Methods 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 230000005684 electric field Effects 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 230000006126 farnesylation Effects 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 230000006377 glucose transport Effects 0.000 description 1
- 230000004190 glucose uptake Effects 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 229940096919 glycogen Drugs 0.000 description 1
- 208000019622 heart disease Diseases 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 229920001600 hydrophobic polymer Polymers 0.000 description 1
- 230000002163 immunogen Effects 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- PBGKTOXHQIOBKM-FHFVDXKLSA-N insulin (human) Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@H]1CSSC[C@H]2C(=O)N[C@H](C(=O)N[C@@H](CO)C(=O)N[C@H](C(=O)N[C@H](C(N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=3C=CC(O)=CC=3)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=3C=CC(O)=CC=3)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=3C=CC(O)=CC=3)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=3NC=NC=3)NC(=O)[C@H](CO)NC(=O)CNC1=O)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)NCC(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(O)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O)=O)CSSC[C@@H](C(N2)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](NC(=O)CN)[C@@H](C)CC)[C@@H](C)CC)[C@@H](C)O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CC=1C=CC=CC=1)C(C)C)C1=CN=CN1 PBGKTOXHQIOBKM-FHFVDXKLSA-N 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 108010045069 keyhole-limpet hemocyanin Proteins 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 208000017169 kidney disease Diseases 0.000 description 1
- 125000005647 linker group Chemical group 0.000 description 1
- 125000003473 lipid group Chemical group 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000007791 liquid phase Substances 0.000 description 1
- 239000008176 lyophilized powder Substances 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 208000030159 metabolic disease Diseases 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 239000002547 new drug Substances 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- 239000003538 oral antidiabetic agent Substances 0.000 description 1
- 229940127209 oral hypoglycaemic agent Drugs 0.000 description 1
- 229940092253 ovalbumin Drugs 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 239000013618 particulate matter Substances 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- VUXSPDNLYQTOSY-UHFFFAOYSA-N phenylmercuric borate Chemical compound OB(O)O[Hg]C1=CC=CC=C1 VUXSPDNLYQTOSY-UHFFFAOYSA-N 0.000 description 1
- 229960000247 phenylmercuric borate Drugs 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 230000013823 prenylation Effects 0.000 description 1
- MVCPDOUDYOUTKS-UHFFFAOYSA-N propanedithioic acid Chemical compound CCC(S)=S MVCPDOUDYOUTKS-UHFFFAOYSA-N 0.000 description 1
- AQHHHDLHHXJYJD-UHFFFAOYSA-N propranolol Chemical compound C1=CC=C2C(OCC(O)CNC(C)C)=CC=CC2=C1 AQHHHDLHHXJYJD-UHFFFAOYSA-N 0.000 description 1
- 230000006337 proteolytic cleavage Effects 0.000 description 1
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 1
- 238000003751 purification from natural source Methods 0.000 description 1
- FFISLTWEISOMFC-UHFFFAOYSA-N pyridin-2-yl propanedithioate Chemical compound CCC(=S)SC1=CC=CC=N1 FFISLTWEISOMFC-UHFFFAOYSA-N 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 238000002271 resection Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 210000002027 skeletal muscle Anatomy 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- WXMKPNITSTVMEF-UHFFFAOYSA-M sodium benzoate Chemical compound [Na+].[O-]C(=O)C1=CC=CC=C1 WXMKPNITSTVMEF-UHFFFAOYSA-M 0.000 description 1
- 235000010234 sodium benzoate Nutrition 0.000 description 1
- 239000004299 sodium benzoate Substances 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229940001607 sodium bisulfite Drugs 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 235000017550 sodium carbonate Nutrition 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 235000011083 sodium citrates Nutrition 0.000 description 1
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 235000011008 sodium phosphates Nutrition 0.000 description 1
- 235000010339 sodium tetraborate Nutrition 0.000 description 1
- AKHNMLFCWUSKQB-UHFFFAOYSA-L sodium thiosulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=S AKHNMLFCWUSKQB-UHFFFAOYSA-L 0.000 description 1
- 229940001474 sodium thiosulfate Drugs 0.000 description 1
- 235000019345 sodium thiosulphate Nutrition 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 239000008227 sterile water for injection Substances 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 150000003890 succinate salts Chemical class 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 229940126585 therapeutic drug Drugs 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- NBOMNTLFRHMDEZ-UHFFFAOYSA-N thiosalicylic acid Chemical compound OC(=O)C1=CC=CC=C1S NBOMNTLFRHMDEZ-UHFFFAOYSA-N 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 108700012359 toxins Proteins 0.000 description 1
- BSVBQGMMJUBVOD-UHFFFAOYSA-N trisodium borate Chemical compound [Na+].[Na+].[Na+].[O-]B([O-])[O-] BSVBQGMMJUBVOD-UHFFFAOYSA-N 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 230000003827 upregulation Effects 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 210000003462 vein Anatomy 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K36/00—Medicinal preparations of undetermined constitution containing material from algae, lichens, fungi or plants, or derivatives thereof, e.g. traditional herbal medicines
- A61K36/18—Magnoliophyta (angiosperms)
- A61K36/185—Magnoliopsida (dicotyledons)
- A61K36/42—Cucurbitaceae (Cucumber family)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/01—Hydrolysed proteins; Derivatives thereof
- A61K38/011—Hydrolysed proteins; Derivatives thereof from plants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
Landscapes
- Health & Medical Sciences (AREA)
- Natural Medicines & Medicinal Plants (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Epidemiology (AREA)
- Botany (AREA)
- Diabetes (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Medical Informatics (AREA)
- Biotechnology (AREA)
- Alternative & Traditional Medicine (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Hematology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Obesity (AREA)
- Endocrinology (AREA)
- Emergency Medicine (AREA)
- Gastroenterology & Hepatology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Plant Substances (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Description
技術分野
本発明の分野は糖尿病である。
発明の背景
インシュリン非依存性糖尿病(NIDDMまたはII型)は米国における第4位の主要な死因であり、全世界人口の5から7%を襲っており、西欧諸国において罹患率が増加している。糖尿病においては、身体は充分なインシュリンを作らないか、または作られるインシュリンが効果的でなく、血糖値の上昇を生じさせ、高血糖症として技術的に知られている状態を引き起こす。糖尿病はどの年代の人をも冒し得るが、糖尿病の大多数は45才以上である。この病気は家族に伝わる傾向があり、糖尿病になる危険因子は肥満個体で増加する。
糖尿病は治癒しない慢性病であり他のいくつかの疾患とリンクしている。糖尿病は25〜74歳の人々の失明の主要な原因である。糖尿病の全ての人の10%が腎疾患を起こす。糖尿病は非外傷性下肢切断の最も頻度の高い原因である。糖尿病の人については脚切除の危険性は30倍高い。糖尿病の人は2から4倍心臓疾患を起こし易く、5倍発作(stroke)を起こしやすい。
糖尿病の原因は未だ謎であるが、遺伝および環境の両方が重要な役割を果たすようである。糖尿病には2つの型がある:インシュリン依存性(I型)およびインシュリン非依存性(II型)。I型糖尿病は子供および青少年にしばしば起こる自己免疫疾患である。I型糖尿病の発症に関与する自己抗原は未だ知られておらず、患者はその生命を維持するために毎日インシュリンi.v.を受けなければならない。
II型糖尿病は身体が充分な量のインシュリンを作れない、または身体が実際に作るインシュリンを適切に利用できないことから起こる代謝異常であって、糖尿病の最も一般的な形態であると考えられる。インシュリン分泌およびインシュリン抵抗性が主要な欠陥であると考えられているが、関係する正確な遺伝的要因はまだ未知である。通常、糖尿病の患者は以下の1以上の欠陥を有している。それらは以下のものである:膵臓によるインシュリン生産低下;肝臓によるグルコースの分泌過多;骨格筋によるグルコース取込障害;グルコース輸送欠損(Glut-1、Glut-4);インシュリンレセプターの感受性低下;および、炭水化物の代謝分解における欠損。
現行の治療はインシュリンi.v.以外に4種の経口血糖降下剤を使用する。それらは以下に要約される:
上の表から明らかなように、糖尿病の治療に利用できる現行の薬剤のそれぞれはある種の不利益を有している。従って、糖尿病の治療における使用のための新規な薬剤の同定と開発に継続した関心がもたれている。
ニガウリ(M.charantia)はその果実が野菜として使用される熱帯植物である。いくつかのグループがニガウリの血糖降下作用について、哺乳動物モデル(Shibibら、Biochem. J., 292, 267-270(1993);Aliら、Planta Med. 59, 408-412(1993);Akhtarら、Planta Med. 42, 205-212(1981))およびヒト(Leatherdaleら、Br. Med. J. 282, 1823-1824(1981);Aslamら、Lancet, I. 607(1979))に関して報告している。しかしながら、血糖降下成分および作用機序は未知である。
ニガウリから得られた、インシュリン様活性を有する11kDalペプチドの単離が以下に報告されている:Khannaら、”Hypoglycemic Activity of Polypeptide-p from a Plant Source”第20回アメリカ薬理学会年会、Purdue大学、West Lafayette, 1979年7月29日〜8月3日;Baldwaら、Upsala J. Med. Sci.(1977)82:39-41および米国特許第3,945,988号。これらすべの報告の中で、インシュリン様ポリペプチドは非経口的に投与、すなわちi.v.または皮下投与されている。
最近の報告ではニガウリのアルコール粗抽出物が一部は肝臓におけるグリコーゲン合成の刺激により血漿グルコース濃度を低下させることが示されており、これがインシュリン分泌薬剤として作用することはありそうもない(Sarkarら、Pharmacol. Res., 33, 1-4(1996))。
発明の要約
ニガウリの水可溶性画分(MC6)及びその調製方法及び高血糖症の治療における使用が提供される。MC6は、分子量が10kDal未満であるSDS-PAGE電気泳動による単一バンドとして移動すること、サイズが組換えインシュリンより小さいこと、3種のペプチドを含むこと、及び高分子量タンパク質混入物を含まないことを特徴とする。また、低血糖活性を示しかつ種々の高血糖症を治療するために経口投与されるMC6の個々のペプチド成分、標識したMC6.1、及び長さがMC6.1より短いMC6.1のペプチド誘導体、MC6.2及びMC6.3が提供される。
【図面の簡単な説明】
図1Aは、ニガウリの種々の水可溶性画分のSDS-20%-PAGEによるゲル電気泳動の結果を示す図である。図1Bは、精製したMC6標品を示す図である。図1Cは、MC6のHPLCの結果を示す図である。
図2Aは、SDラットにおける経時血漿グルコースレベルに対するニガウリの未精製水性抽出液及び対照の作用を示すグラフ図である。図2Bは、SDラットにおける経時血中グルコースレベルに対する経口投与したMC6の作用を示すグラフ図である。
図3A及び図3Bは、SZC誘導糖尿病に罹っているラットにおける血中グルコースレベルに対するMC6の作用を示すグラフ図である。
図4は、MC6を経口投与すると血清インシュリンレベルが上昇しないことを示すグラフ図である。
図5は、MC6の経口投与が血中グルコースレベルを低下させるのにr-インシュリンを静注投与するのと同様の効果があることを示すグラフ図である。
図6(a)及び図6(b)は、各々クーマシーブルー染色と銀染色を用いた4〜20%トリスグリシン勾配ゲルにおけるMC6.1のSDS-PAGE分析の結果を示す図である。
図7は、C18 RP-HPLCを用いたMC6.1の精製から得られた結果を示すグラフ図である。
図8a及びbは、MC6.1の等電点分析の結果を示す図である。
図9は、MC6.1のNMR分析の結果を示す図である。
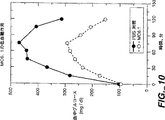
図10は、血中グルコースレベルに対するMC6.1の作用を示すグラフ図である。
図11は、正常ラットにおける経口グルコース負荷試験でのMC6.1、MC6.2及びMC6.3の低血糖活性を示すグラフ図である。
図12は、糖尿病ラットにおけるMC6.2のグルコース低下能を示すグラフ図である。
図13は、非肥満糖尿病マウスにおけるMC6.2の低血糖効果を示すグラフ図である。
具体的な実施態様の説明
MC6と称するニガウリの水可溶性画分、MC6.1と称するその活性ペプチド成分、およびそのペプチド誘導体MC6.2およびMC6.3、その調製方法、および高血糖疾患の治療におけるそれらの使用が提供される。MC6はSDS-PAGE上で10kDalの分子量を有する単一のバンドとして一緒に移動し、組換えインシュリンよりも小さいサイズを有する3種のペプチドを含むことを特徴とする。MC6およびMC6.1は血糖降下作用を示し、経口的に活性である。本発明のさらなる説明において、MC6およびMC6.1の特徴が更に詳細に説明され、それと共にそれらの調製方法の説明および高血糖疾患の治療におけるそれらの使用、特に糖尿病にかかった人の治療における使用の説明がなされるであろう。
誘導体MC6.2およびMC6.3は、それぞれ18−a.a.ペプチドMC6.1の11-a.a.および7−a.a.ペプチド誘導体である。
本発明を更に説明する前に、本発明は以下に記載される具体的な実施態様に限定されるものではないことを理解しておけなければならない。なぜなら、具体的な実施態様のバリエーションを行うことができ、それはなお添付の請求の範囲の範囲内にあるからである。また使用される用語は具体的な実施態様を説明する目的のものであって、限定を意図したものではないことは言うまでもない。そうではなく、本発明の範囲は添付の請求の範囲によって確定されるである。
本明細書および添付の請求の範囲において使用される場合、単数形は特に文脈がそうでないことを明確に意味しない限り、複数の参照を含むものである。特に明確にしない限り、ここで用いる全ての技術用語および科学用語は本発明が属する分野の通常の知識を有するが通常理解するのと同じ意味である。
本発明のMC6は植物種M.charantia(ニガウリ)の水可溶性画分または抽出物である。MC6は葉、茎、根、果実、種子その他を含み、植物体全体を含む、ニガウリの1以上の組織または構成部分に由来しても良いが、MC6は通常ニガウリの果実、好ましくは種子と分離した未熟なニガウリ果実に由来する。
MC6はSDS-20%PAGE上で単一バンドとして移動し、SDS-20%PAGEの際に電場の強さが100Vのときその単一バンドの分子量が10kDalより小さいことを特徴とする。MC6は組換えインシュリンよりも小さなサイズを有しており、従って、約6kDalよりも小さい。MC6は、C8またはC18カラムの逆相条件で高性能液体クロマトグラフィー(HPLC)によって、3つのピークとして溶出されることによって更に特徴づけられる。これらの条件下では、第1のピークは11.33分に溶出され、第2のピークは25.35分で溶出され、第3のピークは34.67分で溶出される。
本発明のMC6は高分子量夾雑物、例えば、タンパク質を含まない調製物である。ここで、本出願では高分子量夾雑物とは約50kDalを越える分子量を有する分子を意味するために使用される。通常、MC6は10kDalを越える分子量を有するいかなる夾雑物も含まない。
MC6は哺乳動物において血糖降下作用を示す。血糖降下作用とはMC6を哺乳動物に投与すると、哺乳動物の血中グルコース濃度が低下し、血中グルコース濃度の低下量はその哺乳動物に投与されたMC6の量に比例する。MC6は経口投与されても静脈内投与されても血糖降下作用を示し、従って、経口的に活性、または経口的に生物有効的(bioavailable)であり、そのことは哺乳動物の消化管内を通過することによって不活性化されないことを意味する。
MC6はその供給源のニガウリ組織からMC6を分離するために提供されるどのような都合のよい手段を用いて調製されてもよい。ニガウリ組織からMC6を得るための一つの方法は、例えばリン酸緩衝生理食塩水(PBS)、水その他のような溶媒存在下で組織を細断することによって組織の粗懸濁液をまず作ることである。ここで細断はブレンダーまたは他の細断手段によって行ってよい。次に、得られた懸濁物の粒子状の物質は分離され、液体相から捨てさられる。このステップは遠心、通常約10,000から16,000rpmの速度の遠心、続いて、その上清を濾過することによっておこなってよい。この濾過は0.5から0.1μの範囲、通常は約0.45から0.22μの孔サイズを有するフィルターを通して行われ、この濾過は真空下で行われてよい。得られた濾液は次に順次30kDalおよび10kDalカットオフメンブレンに通され(そのようなメンブレンはこの技術で知られており、アミコンM.W.カットオフフィルターその他に代表される)、MC6を含む初期ニガウリ組織の水可溶性画分が得られる。得られた水可溶性画分はそのまま使用されてもよく、また、続く使用のために更に処理されてもよい。更なる処理は脱水処理、例えば、凍結乾燥その他を含むことがある。得られた水可溶性画分は、安息香酸ナトリウムその他のような保存剤の存在下で1から5℃、通常2から4℃にて液体形態で保存することもできる。
MC6.1はSDS-PAGE解析(4-20%トリス−グリシン勾配ゲル)において単一のバンドとして泳動されるMC6の特定のペプチド成分であり、SDS-PAGEによる測定では2.5kDよりも小さな分子量を有する。MC6.1は8.2の等電点を有する。MC6.1は18アミノ酸残基長であり、MC6.1のアミノ酸配列は以下の通りである:
MC6.1は哺乳動物において血糖降下作用を示す。本発明のMC6.1はその天然の環境、例えばMC6における環境から分離された、単離形態または純粋な形態その他の形態のMC6.1である。
また、血圧降下作用を示すMC6.1のペプチドアナログおよび疑似物(mimetics)も提供される。MC6.1アナログおよび疑似物は活性モチーフ配列として少なくとも8アミノ酸、通常少なくとも約12アミノ酸、より普通には少なくとも約18アミノ酸、かつ約40アミノ酸よりも少ない、通常は30よりも少ないアミノ酸を含むであろう。以下の配列を有する、MC6.1の11-a.a.誘導体、MC6.2はその具体的なペプチドである:
および、以下の配列を有する7-a.a.誘導体:
主題の配列中で約3つまでの置換または欠失を作成してもよく、その改変は約活性モチーフ中のアミノ酸数の約20%(数%)を越えず、通常約10%(数%)を越えないことが理解されるであろう。この技術で知られているように、、大きな疎水性グループ:イソロイシン、ロイシン、バリンおよびフェニルアラニン;セリンとスレオニン;グリシンとアラニン;アスパラギンとグルタミン;アスパラギン酸とグルタミン酸;またはリジン、アルギニンおよびヒスチジン内の置換を含む保存的置換が好ましい。
天然の供給源からの精製に加えて、MC6.1および、MC6.2およびMC6.3のような、そのペプチドアナログおよび疑似物は合成(例えばMechman Model 990ペプチド合成機または他の商業的合成機を使用)のような従来技術によって調製してもよい。ペプチドは組換え法(Sambrookら、Molecular Cloning:A Laboratory Manual, CSHL Press, Cold Spring Harbor, NY, 1989参照)によって直接に作製してもよく融合タンパク質、例えばアフィニティー試薬による精製を可能とする特異的結合対の一つとの融合タンパク質として作製し、続いてタンパク質分解性切断、通常望みのペプチドを生じるように操作した部位での切断によって作製してよい(例えば、Driscollら、(1993)、J.Mol. Bio. 232:342-350)。
オリゴペプチド(すなわち、MC6.1、MC6.1アナログ、MC6.1疑似物)は安定性を増強する、特定のレセプターに結合させる、部位指向的作用を与える、精製の容易化、物理的特性(例えば、溶解性、電荷等)を改変する、コンフォメーションを安定化させる等のために都合のよいリンキング部位、例えば、システインまたはリジンを生じるように伸長されることもある。オリゴヌクレオチドは融合タンパクとして非野生型側方領域に結合されること、リンキング基またはシステイン残基(ジスルフィド)またはペプチド結合を介して共有結合的に結合されてよい。このオリゴペプチドはマレインイミド安息香酸(maleimidobenzoic acid)、メチルジチオ酢酸、メルカプト安息香酸、S-ピリジルジチオプロピオン酸、等のような種々の二官能性試薬を介して結合してもよい。オリゴペプチドはアミノ酸鎖のN−またはC−末端の単一アミノ酸に結合してもよく、内部に結合しても良い。例えば、この主題のペプチドに対する抗体産生を容易にするためキーホールリンペットヘモシアニン、オボアルブミン等のような免疫原性ペプチドに主題のペプチドが共有結合的に結合してもよい。
あるいは、主題のポリペプチドは他のペプチドまたはタンパク質と共に発現され、内部あるいはN−またはC−末端において鎖の一部となっても良い。種々の発現後修飾が行われてもよい。例えば、適切なコード配列を使用することにより、ファルネシル化(farnesylation)またはプレニル化(prenylation)を与えることがあり、それにより主題のペプチドは一端で脂質群に結合しリポソームのような脂質膜に挿入され得るであろう。
主題のオリゴペプチドはPEG化(PEGylate)されてもよく、ボリエチレンオキシ基は血流中で増強された寿命を与える。主題のオリゴペプチドは補体結合を増強するためIgGアイソタイプのFcのような他のタンパク質と結合させ、またはリシン、アブリン、ジフテリア毒素その他のような毒素、特にA鎖と結合させてもよい。このオリゴペプチドは部位指向性作用のために抗体に結合させてもよい。結合技術に関しては、例えば、米国特許第3,817,837号;3,853,914号;3,850,752号;3,905,654号;4,156,081号;4,069,105号;および4,043,989号を参照せよ。これらは本明細書に含まれるものとする。
主題の発明のMC6、MC6.1、MC6.2およびMC6.3(およびそのアナログおよび疑似物)は上昇した血中グルコース濃度の存在を特徴とする疾病、例えば、I型およびII型糖尿病を含む糖尿病のような血糖上昇異常、および肥満、多コレステロール腎関連疾患その他のような高血糖に関連する他の疾患の治療に用途が見出せる。「治療」とはMC6、MC6.1、MC6.2およびMC6.3(およびそのアナログおよび疑似物)が高血糖疾患に苦しむ宿主の血中グルコース濃度を少なくとも低下させるために投与されることを意味する。MC6および主題のオリゴペプチドによる高血糖疾患の治療において、MC6またはオリゴペプチドは宿主の血中グルコース濃度を許容できる範囲まで低下させるに充分な量で宿主に投与される。ここで、許容できる範囲とは宿主にとって正常な平均血中グルコース濃度の±10%、通常±8%、より普通には±5%を意味する。
主題の発明により、種々の宿主がその血中グルコース濃度を下げるために治療されることがあり、そのような宿主は哺乳動物、および家畜、有用または希少動物、イヌやネコのようなペットおよびヒトを含む。
特に関心があるのは、I型およびII型の両方を含む糖尿病のようなヒトの高血糖疾患の治療法であり、そこではMC6、MC6.1、MC6.2、MC6.3およびそのアナログおよび疑似物が高血糖疾患に苦しむヒトに血中グルコース濃度を少なくとも低下させるために投与される。ここで、血中グルコース濃度はほぼヒトの正常な血中グルコース濃度範囲にまで低下される。活性薬剤は上述したようなどのような都合のよい技術を用いてヒトに投与してもよいが、特に関心があるのは活性薬剤の経口投与である。
画分MC6またはMC6.1、6.2および/または6.3ペプチドによる治療のため、活性化合物は高血糖疾患に苦しむ宿主に、どのような都合のよい投与技術を用いて投与してもよく、そのような技術には、静脈投与、皮内投与、筋肉内投与、皮下投与、経口投与その他が含まれ、経口経路投与が特に注目される。宿主にデリバリーされる用量は投与経路に必然的に依存するが、一般には約50〜500mg/70kgヒト体重、通常は約100〜200mg/70kgヒト体重であろう。MC6によるヒトの高血糖疾患の治療において、ヒトに投与すべき活性画分または化合物の用量は一般には約50〜500、通常約100〜200mg/70kgヒト体重の範囲であろう。
主題の発明の活性画分あるいは化合物の使用において、それらは生理学的に許容されるビヒクルと一緒にされて医薬組成物を生成することがある。医薬組成物を生み出すために活性画分または化合物が一緒にされる生理学的に許容されるビヒクルの性質は、必然的にその医薬組成物が投与されようとしている方法に依存する。ビヒクルの例としては、水、例えば注射用滅菌水、生理食塩水その他が含まれる。特に関心があるのは、経口投与に使用するために適した、生理学的に許容できるビヒクルである。そのようなビヒクルはこの技術で知られており、水、例えば脱イオン水;生理食塩水、例えばリン酸緩衝生理食塩水、錠剤またはカプセル形態の凍結乾燥粉末(このような形態には種々の充填剤、バインダーその他を含むことがある)、その他が含まれる。この医薬組成物中の活性成分の量はその医薬組成物が投与される方法の観点から選ばれ、当業者によって経験的に決定されるであろう。
治療のため、MC6.2および/またはMC6.3、およびそのアナログまたは疑似物が経口的、局所的または非経口的、例えば特定部位への注射、例えば、皮下的に、腹腔内、脈管内、鼻内、経皮的その他で投与されてよい。経口投与のための剤形には、MC6と共に使用するのに適した、上に掲げたものが含まれる。注射用の剤形は水、生理食塩水、PBS、水性エタノール、水性エチレングリコール、その他のような、生理学的に許容できるメディウムを含むであろう。使用され得る水可溶性保存剤には、亜硫酸水素ナトリウム、チオ硫酸ナトリウム、アスコルビン酸塩、塩化ベンザルコニウム、クロロブタノール、チメロサール、ホウ酸フェニル水銀、パラオキシ安息香酸エステル類(parabens)、ベンジルアルコールおよびフェニルエタノールが含まれる。これらの薬剤は個々に約0.001から約5質量%、好ましくは約0.01から約2%で存在してよい。使用され得る適切な水可溶性緩衝剤は、リン酸ナトリウム、クエン酸ナトリウム、ホウ酸ナトリウム、酢酸ナトリウム、炭酸水素ナトリウムおよび炭酸ナトリウムのような、アルカリまたはアルカリ土類カルボン酸塩、リン酸塩、炭酸水素塩、クエン酸塩、ホウ酸塩、酢酸塩、コハク酸塩その他である。カルボキシメチルセルロースのような添加剤が約0.01から約5質量%の量で担体として使用されてよい。剤形はその製剤の目的、レセプター活性を調節するために使用される特定のモード、意図する治療その他に依存して変動するであろう。この剤形には、貼付剤、カプセル、リポソーム、遅延性コーティング、丸剤が含まれ、あるいは連続投与のためポンプ内に製剤化されることもある。具体的な用量は既知の方法に従って経験的に決定することができる。例えば、Harriosn’s Priciples of Internal Medicine,第11版、Braunwaldら編集、McGraw Hill Book. Co., New York, 1987を参照せよ。
一般には、活性画分またはペプチド、そのアナログおよび疑似物の治療上効果的な用量は約0.005-10mg/kg宿主重量、より通常は約0.01-1mg/kg宿主重量の範囲であろう。そのような用量は所望の血糖降下作用を達成するのに充分であろう。投与は毎日のように頻繁でもよく;通常は1日に1〜数回を越えることなく、毎週のごとく時たまに投与され、投与される薬剤の濃度に依存する。投与されるオリゴペプチドの量は一般にそのペプチドの半減期に依存して調整されるであろう。ペプチドが増強された半減期を有しているか、または、例えばペプチドを長期間にわたって維持するマトリックス(例えばコラーゲンマトリックス)中に導入された徐放性組成物含有粒子のようなデポ製剤(depot)として供給されている場合、本質的に連続的速度で長期間にわたってペプチドを連続的に注入するポンプの使用、その他の場合は、範囲内の低い部分の用量が使用されてよい。CRC Critical Reviews in Therapeutic Drug Carrier Systems,第1巻、CRC Press、Boca Raton, FL, 1987,pp39-90のHeller, Biodegradabel Plymers in Controlled Drug Deliveryには、制御薬剤デリバリーのためのカプセル形成が記載されており、Di Colo(1992)Biomaterials 13:850-856には疎水性ポリマーからの制御薬剤放出が記載されている。
以下の実施例は説明のために提示されるものであり、限定のためではない。
実施例1
A. ニガウリ(Momordica Charantia)抽出液の活性成分の単離と精製
新鮮で未熟な果実モモルディカ・チャランチアを洗い、ふき取り、種子を取り除いた。果肉をリン酸塩緩衝食塩水(PBS)か又は脱イオン水中でブレンドした。懸濁液を12,000×gで遠心分離し、減圧下滅菌フィルター(ワットマンから入手):0.22でろ過した。透明な上澄みをアミコンろ過から得られた30kD、10kD及び3kDカットオフメンブレンに順次通過させた。0.45μ(第1工程)、0.22μ(第2工程)及び10kD(第3工程)区分の画分をSDS-20%ポリアクリルアミドゲルで分析し、結果を図1Aに示す。第3工程の精製画分は、サイズがヒトインシュリンより小さい単一バンドを示した。ゲル分析から、精製した画分が種々の高分子量タンパク質バンドを含まないことは明らかである。MC6とラベルした10K区分の画分のグラム量での数個のバッチを図1Bに示したように精製した。得られた精製画分を凍結乾燥して結合していない水のないMC6を得た。
100〜500mgの凍結乾燥MC6を高性能液体クロマトグラフィー(HPLC)(C8又はC18カラムを用いてTFA/アセトニトリル直線勾配を用いた逆相HPLC(分析用))にかけ、結果を図1Cに示す。HPLC分析から、3本の主要ピークが各々リテンション時間17.35分、25.35分及び34.67分において示され、MC6が3種のペプチドを含むことが証明された。
B. MC6の低血糖活性
精製した画分の低血糖作用を出発粗抽出標品と比較した。SDラット(平均200gチャールズリバー、マサチューセッツ州から入手)を3時間絶食し、基礎血漿グルコースレベルを測定するために尾静脈から血液アリコートを採取した。5mlの粗抽出標品又はPBS(上記パートAで調製した)中1mlの精製画分MC6(500:g)を各ラットに経口投与した。対照ラットには同量のPBSを投与した。サリトール(静注)(0.08μg/ml/kg、プロパノロール(1.7μg/分/kg))を用いてラットを麻酔した。各ラットの頚静脈にカニューレを挿入し、グルコースを5mM KClと140mM NaClの溶液として3時間注入した(18mg/分/kg体重)。30、60、90、150及び180分に頚動脈から採血した。血漿グルコースレベルをKadishら,Clin. Chem.(1968)14:116に記載された確定熱量測定法によって定量した。
結果を図2Aに示す。結果から、粗抽出液を投与したラットは全ての時点で血中グルコースレベルが著しく低下し、その作用は60分でかなり大きい(相対差がほぼ100%)ことが証明される。同時に、図2Bに示されるように、経口投与したPBS中MC6(500:g)の1mlの精製した水性画分は粗抽出液と同様の作用があり、MC6の単離したポリペプチドプールが粗抽出液中の有効主成分であること意味する。
C. 予防及び治療機序に対するMC6の作用
動物モデルにおいて糖尿病の予防機序と治療機序双方での精製画分の効力を示すために次の実験セットを行った。雄SDラット(各200〜225g)においてストレプトゾトシン(40mg/kg体重)(シグマChem.、ミズーリ州から入手)を用いて糖尿病を誘導した。予防モデルにおいては、ラットに毎日の有効な0日に1ml(500:g)の精製画分MC6を投与した。治療モデルにおいては、ラットに病気に罹患した5日目に1mlの精製画分MC6(500:g)を経口投与した。血清グルコースレベルを15日間毎日モニターした。図3A及び図3Bに示されるように、精製した画分MC6は、予防機序及び治療機序双方に非常に効果的である(p<0.001、10日目)。
ストレプトゾトシン誘導糖尿病の予防機序におけるMC6の作用は、I型自己免疫糖尿病を治療するのにMC6を用いるという適合性を強く支持するものである。
D. 血清インシュリンレベルに対するMC6の作用
低血糖作用中の全身系インシュリンの調節におけるMC6の役割を調べるためにパートCに記載された実験とは異なる日に動物の血清インシュリンレベルを測定した。血清インシュリンレベルの定量的測定をHales & Randle, Biochem. J.(1963)88:137に記載されるラジオイムノアッセイ(LINKOアッセイ)で行った。図4から、本画分の経口投与が血清インシュリンレベルを高めることに対して効果がなかったことがわかり、本画分の作用が膵臓によるインシュリン分泌によって仲介されないことを意味する。図4においては、ストレプトゾトシンを用いて糖尿病を誘導した。未処理グループにはPBSのみ投与し、SZCグループには40mg/kg SZCを投与し、予防グループには1日目からMC6を経口投与し、治療グループには5日目からMC6を投与した。標準RIAによりインシュリンを測定した。データは、3回の測定の平均を示した。
E. MC6の経口投与はインシュリンの全身系注射と同様に有効である
次の実験においては、SDラットにおいて経口投与した精製画分MC6(500:g)をインシュリン(150mU)の静注と比較した。ラットを4つのグループに分け、3時間絶食した。グループ1にはPBSのみ投与し、グループ2にはグルコース注入の60分前にMC6を経口投与し、グループ3にはグルコースを頚静脈に注入した60分後に150mU r-インシュリン(ノボ・ノルディスクのHumalin-R▲R▼)を投与し、グループ4にはグルコースを頚静脈に注入した60分後に1mlのPBS中500:gのMC6を投与した(静注)。全ての場合において、グルコース注入は18mg/分/kgであった。間隔をおいた時間に頚動脈から血液試料を採取し、定量的血漿グルコースレベルを熱量測定法で測定した。
結果を図5に示す。結果から、MC6の経口投与が120分間でr-インシュリンの静注に匹敵することがわかる。更に、本画分とr-インシュリンの全身系注射は同じ低血糖プロファイルを示した。これらの結果から、精製画分は経口及び全身系に有効であることが証明される。
F. MC6.1の特徴付け
分割したバンドを目に見えるようにするためにクーマシーブルー染色か又は銀染色を用いて4〜20%のトリスグリシン勾配ゲルによるSDS-PAGE分析でMC6.1の特性解析をした。
G. MC6.1の更なる精製
MC6.1を更に精製し、C-18 RP HPLC(勾配0.1%TFA緩衝液A;0.1%TFA中60%AcN)により分析した。結果を図7に示す。
H. MC6.1の等電点
MC6.1の等電点を分析し、8.2であることがわかった。結果を図8a及び図8bに示す。
I. MC6.1のNMR分析
MC6.1でプロトンNMR分析を行い、結果を図9に示す。
J. MC6.1の低血糖活性
MC6.1の低血糖活性を上記実施例Bと同様の方法で分析した。体重が平均220gのSD雄ラットを用いた。ラットに50μgのMC6.1を500μlとして投与した。対照ラットにPBSを投与した。結果を図10に示す。結果から、MC6.1が経口投与後に低血糖活性を示すことが証明される。
実施例2
図11は、正常ラットにおける経口グルコース負荷試験におけるMC6.1及びその誘導体、MC6.2及びMC6.3の低血糖活性を示すグラフである。3種のペプチドは全て、本実験において賦形剤処理ラットに比べて血中グルコースを低下するのに有効であった。
MC6.2(11アミノ酸ペプチド)のグルコース低下活性を糖尿病ラットにおいて更に評価した。ストレプトゾトシンを40mg/kg体重の用量で平均200gのSDラットに注射した。図12に示されるように、糖尿病ラット(血中グルコース平均330mg/dl)をMC6.2で100〜g/ラット(0.5mg/kg体重)の用量で経口治療すると対照グループに比べて顕著に血中グルコースレベルが低下した。
非肥満糖尿病(NOD)マウスの治療機序においてMC6.2(11-アミノ酸ペプチド)の低血糖作用を評価した。図13に示されるように、NODマウスに毎日MC6.2を経口投与すると賦形剤処理ラットに比べて血中グルコースレベルに対する作用が顕著である。
これらの結果から、MC6.1のN末端7〜11アミノ酸残基はヒト糖尿病の治療の治療法の開発に有効である血中グルコースレベルを低下させるのに重要であることが証明される。
上記の結果及び考察から、ニガウリの新規な抽出液及び個々のペプチド物質が高血糖症、特に糖尿病の治療に有効であることを示すことは明らかである。本発明の活性剤は、体内で生じたインシュリン量のアップレギュレーションを引き起こさないので、血中グルコースレベルを調節する別の有効なメカニズムを与える。更に、MC6及びペプチドMC6.1、MC6.2とMC6.3は経口的に活性であるので、侵襲的で便利でない投与手段によって導入されなければならない糖尿病治療において用いられてきた従来のインシュリン製剤より著しく有利である。
本明細書に引用した文献及び特許出願の記載は全て、各々の文献又は特許出願が明確にかつ別個に含まれることを意味するかのように本願明細書に含まれるものとする。文献の引用は、出願日以前に発表されたものであり、本発明が先行発明に基づいてその文献に先行する権利を与えないことを認めるものとして解釈すべきではない。
理解を明らかにするために本発明を具体的な説明及び実施例によって詳述してきたが、後記の請求の範囲の真意又は範囲から逸脱することなくある種の変更や修正が行なわれることは本発明の教示から当業者に容易に明らかである。
配列表
(2)配列番号1の情報
(i)配列の特徴
(A)配列の長さ:18アミノ酸
(B)配列の型:アミノ酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(xi)配列:配列番号1
(2)配列番号2の情報
(i)配列の特徴
(A)配列の長さ:11アミノ酸
(B)配列の型:アミノ酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(xi)配列:配列番号2
(2)配列番号3の情報
(i)配列の特徴
(A)配列の長さ:7アミノ酸
(B)配列の型:アミノ酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(xi)配列:配列番号3
Claims (13)
- 配列番号1,2および3からなる群より選ばれる配列からなる血糖降下作用性ペプチド。
- 請求項1〜4のいずれか1項記載のペプチドの少なくとも一つを効果的な量で生理学的に許容できるビヒクル中に含む医薬組成物。
- 経口投与または静脈内投与可能である、請求項5記載の医薬組成物。
- 配列番号1の配列からなるペプチド、配列番号2の配列からなるペプチド、配列番号3の配列からなるペプチド、配列番号1の配列からなるペプチドのアナログおよび擬似物、および、配列番号2の配列からなるペプチドのアナログおよび擬似物からなる群より選ばれるペプチドの少なくとも1つの、対象の血糖値を低下させる医薬の製造のための使用であって、前記アナログまたは擬似物が配列番号1または2のいずれかにおける3つまでの置換または欠失からなる変種配列からなり、前記置換または欠失がアミノ酸数の20%未満であり、前記置換が以下からなる群より選ばれ、:
大きな疎水性グループ:イソロイシン、ロイシン、バリンおよびフェニルアラニン間の置換、および
グリシンとアラニン間の置換、
かつ、前記欠失が、アラニン、グリシンおよびバリンからなる群より選ばれる、前記使用。 - 置換または欠失がアミノ酸数の10%未満である、請求項7記載の使用。
- 少なくとも一つのペプチドが、配列番号1の少なくとも1つのバリン残基のロイシン残基、イソロイシン残基またはフェニルアラニン残基による置換からなる変種配列からなるアナログまたは擬似物である、請求項7または8記載の使用。
- 少なくとも一つのペプチドが、配列番号1または2の少なくとも1つのグリシン残基のアラニン残基による置換またはアラニン残基のグリシン残基による置換からなる変種配列からなるアナログまたは擬似物である、請求項7または8記載の使用。
- 少なくとも1つのペプチドの配列が配列番号1、配列番号2、配列番号3からなる群より選ばれる、請求項7記載の使用。
- 対象が高血糖疾患に係っている、請求項7〜11のいずれか1項記載の使用。
- 高血糖疾患がI型およびII型糖尿病である、請求項12記載の使用。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US83103997A | 1997-04-01 | 1997-04-01 | |
| US08/831,039 | 1997-04-01 | ||
| US85085597A | 1997-05-02 | 1997-05-02 | |
| US08/850,855 | 1997-05-02 | ||
| PCT/US1998/006450 WO1998043484A1 (en) | 1997-04-01 | 1998-04-01 | Orally active fraction of momordica charantia, active peptides thereof, and their use in the treatment of diabetes |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2002516608A JP2002516608A (ja) | 2002-06-04 |
| JP2002516608A5 JP2002516608A5 (ja) | 2005-11-24 |
| JP4156038B2 true JP4156038B2 (ja) | 2008-09-24 |
Family
ID=27125412
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP54197198A Expired - Fee Related JP4156038B2 (ja) | 1997-04-01 | 1998-04-01 | ニガウリの経口活性画分、その活性ペプチドおよび糖尿病治療におけるその使用 |
Country Status (11)
| Country | Link |
|---|---|
| US (3) | US6127338A (ja) |
| EP (1) | EP1005274B1 (ja) |
| JP (1) | JP4156038B2 (ja) |
| KR (1) | KR100509438B1 (ja) |
| CN (1) | CN1255044A (ja) |
| AT (1) | ATE403672T1 (ja) |
| AU (1) | AU749792B2 (ja) |
| CA (1) | CA2285452A1 (ja) |
| DE (1) | DE69839842D1 (ja) |
| ES (1) | ES2310006T3 (ja) |
| WO (1) | WO1998043484A1 (ja) |
Families Citing this family (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN100413884C (zh) * | 1999-04-13 | 2008-08-27 | 普什帕康纳 | 从苦瓜中提取降血糖多肽的方法及其产物和用途 |
| WO2005063156A1 (en) * | 2003-12-22 | 2005-07-14 | Shear/Kershman Laboratories, Inc. | Oral peptide delivery system with improved bioavailability |
| EP1563842A1 (en) * | 2004-02-03 | 2005-08-17 | Novartis AG | Simarouba amara and/or Momordica charantia extracts for the treatment of coccidiosis in poultry |
| US20070269898A1 (en) * | 2004-09-15 | 2007-11-22 | Yokohama City University | Amino Acid Sequences Essential to Neuron Specific Gene Expression |
| US8669348B2 (en) * | 2007-03-30 | 2014-03-11 | Aparna Dixit | Anti diabetic protein |
| US20100081860A1 (en) * | 2008-04-24 | 2010-04-01 | Searete Llc, A Limited Liability Corporation Of The State Of Delaware | Computational System and Method for Memory Modification |
| TWI342781B (en) * | 2008-12-01 | 2011-06-01 | Univ China Medical | Blood sugar-modulating polypeptides |
| CN101691394B (zh) * | 2009-09-17 | 2012-05-09 | 中国药科大学 | 微波促进固相合成苦瓜mc-jj6多肽类似物及其应用 |
| WO2011032360A1 (zh) * | 2009-09-17 | 2011-03-24 | 中国药科大学 | 苦瓜mc-jj2多肽及其应用与微波促进固相合成方法 |
| WO2011032359A1 (zh) * | 2009-09-17 | 2011-03-24 | 中国药科大学 | 苦瓜mc-jj6多肽及其应用与微波促进固相合成方法 |
| CN101824076A (zh) * | 2010-05-20 | 2010-09-08 | 中国药科大学 | 微波促进固相合成苦瓜mc-jj0105多肽类似物及其应用 |
| CN101824075A (zh) * | 2010-05-20 | 2010-09-08 | 中国药科大学 | 微波促进固相合成苦瓜mc-jj0101多肽类似物及其应用 |
| CN101824074A (zh) * | 2010-05-20 | 2010-09-08 | 中国药科大学 | 微波促进固相合成苦瓜mc-jj0107多肽类似物及其应用 |
| CN101838309A (zh) * | 2010-05-20 | 2010-09-22 | 中国药科大学 | 微波促进固相合成苦瓜mc-jj0102多肽类似物及其应用 |
| CN101824073A (zh) * | 2010-05-20 | 2010-09-08 | 中国药科大学 | 微波促进固相合成苦瓜mc-jj0103多肽类似物及其应用 |
| CN101830969A (zh) * | 2010-05-20 | 2010-09-15 | 中国药科大学 | 微波促进固相合成苦瓜降血糖mc-jj0104多肽类似物及其应用 |
| CN101942010A (zh) * | 2010-05-20 | 2011-01-12 | 中国药科大学 | 微波促进固相合成苦瓜mc-jj0106多肽类似物及其应用 |
| CN101985644B (zh) * | 2010-10-25 | 2013-06-12 | 邹远东 | 一种苦瓜多肽及其制备方法与应用 |
| EP2667884B1 (en) | 2011-01-28 | 2017-01-04 | Piramal Enterprises Limited | Process for preparation of an extract of momordica charantia |
| TWI588153B (zh) | 2012-05-18 | 2017-06-21 | 中國醫藥大學 | 多胜肽、編碼該多胜肽之核酸分子、以及該多胜肽之應用 |
| CN104650198B (zh) * | 2015-02-09 | 2018-05-08 | 武汉华康臣生物科技有限公司 | 三叉黑顶藻中分离的能治疗糖尿病的活性肽及其用途 |
| CN106729606A (zh) * | 2017-01-03 | 2017-05-31 | 河北省农林科学院经济作物研究所 | 苦瓜降糖提取物复合剂及其制备方法 |
| CN107412720A (zh) * | 2017-09-15 | 2017-12-01 | 李玉保 | 一种治疗糖尿病的苦瓜多肽复方植物药及其制备方法 |
| CN107412721B (zh) * | 2017-09-15 | 2020-11-24 | 李玉保 | 一种降血糖苦瓜多肽复方胶囊及其制备方法 |
| CN108707181B (zh) * | 2018-06-14 | 2021-03-12 | 苏秀兰 | 一种抑制肿瘤细胞增殖的苦瓜多肽及其制备方法和应用 |
| CN112675292B (zh) * | 2021-01-11 | 2021-11-02 | 中食安泓(广东)健康产业有限公司 | 含有益生菌的制剂在治疗疾病中的应用 |
| CN117700489B (zh) * | 2023-12-19 | 2024-08-20 | 深圳泰华赛尔生物科技有限公司 | 脂肪干细胞在治疗糖尿病的药物中的应用 |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NL154598B (nl) * | 1970-11-10 | 1977-09-15 | Organon Nv | Werkwijze voor het aantonen en bepalen van laagmoleculire verbindingen en van eiwitten die deze verbindingen specifiek kunnen binden, alsmede testverpakking. |
| US3853914A (en) * | 1971-01-11 | 1974-12-10 | Syva Co | Ligand determination of spin labeled compounds by receptor displacement |
| US3817837A (en) * | 1971-05-14 | 1974-06-18 | Syva Corp | Enzyme amplification assay |
| US3905654A (en) * | 1973-11-14 | 1975-09-16 | Kelsey Hayes Co | Skid control system for dual brake |
| US3945988A (en) * | 1974-07-16 | 1976-03-23 | Pushpa Khann | Process for isolation of insulin from plant source |
| US4043989A (en) * | 1975-09-11 | 1977-08-23 | Syva Company | Oxazepam derivatives for immunoassay reagents |
| US4069105A (en) * | 1977-03-03 | 1978-01-17 | Syva Company | Lidocaine antigens and antibodies |
| US4156081A (en) * | 1977-04-15 | 1979-05-22 | Syva Company | Theophylline antigens and antibodies |
| JPS57106626A (en) * | 1980-12-22 | 1982-07-02 | Teijin Ltd | Cytotoxic protein complex and its preparation |
| US4985248A (en) * | 1987-06-18 | 1991-01-15 | Yaguang Liu | Pharmaceutical composition containing a safe extracts of fruits and vegetables for the treating and preventing of diabetes |
| US5086043A (en) * | 1987-06-18 | 1992-02-04 | Yaguang Liu | Production of Saponins of Lichi |
| US5098710A (en) * | 1987-06-18 | 1992-03-24 | Yaguang Liu | Production of kuguasu |
| JP4233604B2 (ja) * | 1991-12-03 | 2009-03-04 | プロセリックス メディスンズ ディベロップメント リミテッド | プリオンタンパク質のフラグメント |
| US5750361A (en) * | 1995-11-02 | 1998-05-12 | The Regents Of The University Of California | Formation and use of prion protein (PRP) complexes |
-
1998
- 1998-04-01 AT AT98914405T patent/ATE403672T1/de not_active IP Right Cessation
- 1998-04-01 CA CA002285452A patent/CA2285452A1/en not_active Abandoned
- 1998-04-01 ES ES98914405T patent/ES2310006T3/es not_active Expired - Lifetime
- 1998-04-01 CN CN98805001A patent/CN1255044A/zh active Pending
- 1998-04-01 KR KR10-1999-7008994A patent/KR100509438B1/ko not_active IP Right Cessation
- 1998-04-01 DE DE69839842T patent/DE69839842D1/de not_active Expired - Fee Related
- 1998-04-01 AU AU68765/98A patent/AU749792B2/en not_active Ceased
- 1998-04-01 US US09/053,617 patent/US6127338A/en not_active Expired - Fee Related
- 1998-04-01 JP JP54197198A patent/JP4156038B2/ja not_active Expired - Fee Related
- 1998-04-01 EP EP98914405A patent/EP1005274B1/en not_active Expired - Lifetime
- 1998-04-01 WO PCT/US1998/006450 patent/WO1998043484A1/en active IP Right Grant
-
2000
- 2000-07-31 US US09/628,588 patent/US6391854B1/en not_active Expired - Fee Related
-
2002
- 2002-03-21 US US10/101,952 patent/US6852695B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| EP1005274A4 (en) | 2004-09-08 |
| ATE403672T1 (de) | 2008-08-15 |
| DE69839842D1 (de) | 2008-09-18 |
| US6391854B1 (en) | 2002-05-21 |
| US6852695B2 (en) | 2005-02-08 |
| US6127338A (en) | 2000-10-03 |
| CA2285452A1 (en) | 1998-10-08 |
| AU749792B2 (en) | 2002-07-04 |
| ES2310006T3 (es) | 2008-12-16 |
| AU6876598A (en) | 1998-10-22 |
| EP1005274A1 (en) | 2000-06-07 |
| JP2002516608A (ja) | 2002-06-04 |
| US20020193310A1 (en) | 2002-12-19 |
| KR20010005917A (ko) | 2001-01-15 |
| KR100509438B1 (ko) | 2005-08-23 |
| CN1255044A (zh) | 2000-05-31 |
| EP1005274B1 (en) | 2008-08-06 |
| WO1998043484A1 (en) | 1998-10-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4156038B2 (ja) | ニガウリの経口活性画分、その活性ペプチドおよび糖尿病治療におけるその使用 | |
| KR102255479B1 (ko) | 인슐린 저항성에 대한 개선된 펩티드 제약 | |
| US7423014B2 (en) | Insulin conjugates for treating diabetes mellitus | |
| CN114901682B (zh) | 胰岛素衍生物 | |
| ZA200406332B (en) | ACC inhibitors. | |
| AU2002244020A1 (en) | Methods of treating diabetes mellitus | |
| TW201607553A (zh) | 包含長效胰島素類似物接合物及長效促胰島素肽接合物之治療糖尿病組成物 | |
| MX2010013454A (es) | Co-agonistas de receptor de glucagon/glp-1. | |
| AU741901B2 (en) | Insulin C-peptides | |
| WO2007133778A2 (en) | Methods to restore glycemic control | |
| EP1711532A2 (en) | Combined use of a glp-1 agonist and gastrin compounds | |
| CA2224859A1 (en) | Ligand inhibitors of insulin-like growth factor binding proteins and methods of use therefor | |
| JP2023539476A (ja) | アネキシンa1のn末端ペプチド製剤及び方法 | |
| AU2024203093A1 (en) | Polypeptide compounds and use thereof in the prevention or treatment of diabetes or diagnostic compounds | |
| AU2022245736A1 (en) | Gip and glp-1 dual receptor agonist, pharmaceutical composition, and use | |
| KR20170069997A (ko) | 미리스토일화된 렙틴-관련된 펩티드 및 이들의 용도 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20050401 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050401 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20070717 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20071017 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20071126 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20071114 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080212 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080512 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20080701 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20080709 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110718 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |