JP4125481B2 - レーザー捕捉顕微解剖用の消耗品 - Google Patents
レーザー捕捉顕微解剖用の消耗品 Download PDFInfo
- Publication number
- JP4125481B2 JP4125481B2 JP2000514115A JP2000514115A JP4125481B2 JP 4125481 B2 JP4125481 B2 JP 4125481B2 JP 2000514115 A JP2000514115 A JP 2000514115A JP 2000514115 A JP2000514115 A JP 2000514115A JP 4125481 B2 JP4125481 B2 JP 4125481B2
- Authority
- JP
- Japan
- Prior art keywords
- laser capture
- capture microdissection
- film
- laser
- transfer film
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 238000000370 laser capture micro-dissection Methods 0.000 title claims abstract description 160
- 238000012546 transfer Methods 0.000 claims abstract description 69
- 239000000758 substrate Substances 0.000 claims abstract description 24
- 239000000463 material Substances 0.000 claims description 24
- NJPPVKZQTLUDBO-UHFFFAOYSA-N novaluron Chemical compound C1=C(Cl)C(OC(F)(F)C(OC(F)(F)F)F)=CC=C1NC(=O)NC(=O)C1=C(F)C=CC=C1F NJPPVKZQTLUDBO-UHFFFAOYSA-N 0.000 claims description 7
- 239000006260 foam Substances 0.000 claims description 6
- 238000001531 micro-dissection Methods 0.000 claims description 4
- 239000011358 absorbing material Substances 0.000 claims 1
- 238000002224 dissection Methods 0.000 claims 1
- 238000000034 method Methods 0.000 abstract description 44
- 238000006243 chemical reaction Methods 0.000 abstract description 9
- 238000011109 contamination Methods 0.000 abstract description 7
- 210000001519 tissue Anatomy 0.000 description 52
- 239000000523 sample Substances 0.000 description 50
- 210000004027 cell Anatomy 0.000 description 33
- 239000005038 ethylene vinyl acetate Substances 0.000 description 20
- 238000004458 analytical method Methods 0.000 description 19
- 239000003795 chemical substances by application Substances 0.000 description 18
- 239000011521 glass Substances 0.000 description 18
- 238000004519 manufacturing process Methods 0.000 description 17
- DQXBYHZEEUGOBF-UHFFFAOYSA-N but-3-enoic acid;ethene Chemical compound C=C.OC(=O)CC=C DQXBYHZEEUGOBF-UHFFFAOYSA-N 0.000 description 16
- 239000000975 dye Substances 0.000 description 16
- 229920001200 poly(ethylene-vinyl acetate) Polymers 0.000 description 16
- 229920003023 plastic Polymers 0.000 description 12
- 239000004033 plastic Substances 0.000 description 11
- 230000008901 benefit Effects 0.000 description 10
- 239000000853 adhesive Substances 0.000 description 6
- 230000001070 adhesive effect Effects 0.000 description 6
- 239000003153 chemical reaction reagent Substances 0.000 description 6
- 201000010099 disease Diseases 0.000 description 6
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 6
- 238000010304 firing Methods 0.000 description 6
- 229920000642 polymer Polymers 0.000 description 6
- 206010028980 Neoplasm Diseases 0.000 description 5
- 238000010521 absorption reaction Methods 0.000 description 5
- 238000001574 biopsy Methods 0.000 description 5
- 238000005266 casting Methods 0.000 description 5
- 238000005516 engineering process Methods 0.000 description 5
- 229920001296 polysiloxane Polymers 0.000 description 5
- -1 polytetrafluoroethylene Polymers 0.000 description 5
- 229920001169 thermoplastic Polymers 0.000 description 5
- 239000004416 thermosoftening plastic Substances 0.000 description 5
- 230000002745 absorbent Effects 0.000 description 4
- 239000002250 absorbent Substances 0.000 description 4
- 201000011510 cancer Diseases 0.000 description 4
- 239000000969 carrier Substances 0.000 description 4
- 239000011248 coating agent Substances 0.000 description 4
- 238000000576 coating method Methods 0.000 description 4
- 238000003384 imaging method Methods 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- 230000033001 locomotion Effects 0.000 description 4
- 238000012986 modification Methods 0.000 description 4
- 230000004048 modification Effects 0.000 description 4
- 239000004926 polymethyl methacrylate Substances 0.000 description 4
- 230000008569 process Effects 0.000 description 4
- 125000006850 spacer group Chemical group 0.000 description 4
- 239000004094 surface-active agent Substances 0.000 description 4
- 239000004743 Polypropylene Substances 0.000 description 3
- 230000014509 gene expression Effects 0.000 description 3
- 229910052751 metal Inorganic materials 0.000 description 3
- 239000002184 metal Substances 0.000 description 3
- 229920001155 polypropylene Polymers 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 238000007789 sealing Methods 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- 208000035473 Communicable disease Diseases 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 229920000219 Ethylene vinyl alcohol Polymers 0.000 description 2
- 108091005804 Peptidases Proteins 0.000 description 2
- 229920005372 Plexiglas® Polymers 0.000 description 2
- 238000007792 addition Methods 0.000 description 2
- 238000003486 chemical etching Methods 0.000 description 2
- 229910003460 diamond Inorganic materials 0.000 description 2
- 239000010432 diamond Substances 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 239000004715 ethylene vinyl alcohol Substances 0.000 description 2
- 229920006225 ethylene-methyl acrylate Polymers 0.000 description 2
- 239000005043 ethylene-methyl acrylate Substances 0.000 description 2
- 239000012467 final product Substances 0.000 description 2
- 238000005187 foaming Methods 0.000 description 2
- 239000005337 ground glass Substances 0.000 description 2
- 230000001678 irradiating effect Effects 0.000 description 2
- 238000004020 luminiscence type Methods 0.000 description 2
- 239000000155 melt Substances 0.000 description 2
- 210000003205 muscle Anatomy 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 238000004806 packaging method and process Methods 0.000 description 2
- 239000012071 phase Substances 0.000 description 2
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 2
- 239000004417 polycarbonate Substances 0.000 description 2
- 229920000515 polycarbonate Polymers 0.000 description 2
- 229920001343 polytetrafluoroethylene Polymers 0.000 description 2
- 239000004810 polytetrafluoroethylene Substances 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 230000008707 rearrangement Effects 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- RWMKKWXZFRMVPB-UHFFFAOYSA-N silicon(4+) Chemical compound [Si+4] RWMKKWXZFRMVPB-UHFFFAOYSA-N 0.000 description 2
- 238000012876 topography Methods 0.000 description 2
- NKJOXAZJBOMXID-UHFFFAOYSA-N 1,1'-Oxybisoctane Chemical compound CCCCCCCCOCCCCCCCC NKJOXAZJBOMXID-UHFFFAOYSA-N 0.000 description 1
- KEQXNNJHMWSZHK-UHFFFAOYSA-L 1,3,2,4$l^{2}-dioxathiaplumbetane 2,2-dioxide Chemical group [Pb+2].[O-]S([O-])(=O)=O KEQXNNJHMWSZHK-UHFFFAOYSA-L 0.000 description 1
- 229910000980 Aluminium gallium arsenide Inorganic materials 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 239000004134 Dicalcium diphosphate Substances 0.000 description 1
- 229920003345 Elvax® Polymers 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 238000012408 PCR amplification Methods 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- 229910000831 Steel Inorganic materials 0.000 description 1
- 239000004809 Teflon Substances 0.000 description 1
- 229920006362 Teflon® Polymers 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- KYDACBKVLZCERN-UHFFFAOYSA-N ac1mpb82 Chemical compound [V+2]=O.[N-]1C(N=C2C3=CC4=CC=C(C=C4C=C3C(N=C3C4=CC5=CC=C(C=C5C=C4C(=N4)[N-]3)C(C)(C)C)=N2)C(C)(C)C)=C(C=C2C(C=CC(=C2)C(C)(C)C)=C2)C2=C1N=C1C2=CC3=CC(C(C)(C)C)=CC=C3C=C2C4=N1 KYDACBKVLZCERN-UHFFFAOYSA-N 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 210000003484 anatomy Anatomy 0.000 description 1
- 230000003466 anti-cipated effect Effects 0.000 description 1
- 230000000712 assembly Effects 0.000 description 1
- 238000000429 assembly Methods 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 201000005389 breast carcinoma in situ Diseases 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 210000003855 cell nucleus Anatomy 0.000 description 1
- 239000000919 ceramic Substances 0.000 description 1
- 210000000038 chest Anatomy 0.000 description 1
- 230000003749 cleanliness Effects 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 238000000151 deposition Methods 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 238000007598 dipping method Methods 0.000 description 1
- 238000004980 dosimetry Methods 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 208000015355 drug-resistant tuberculosis Diseases 0.000 description 1
- 229920006332 epoxy adhesive Polymers 0.000 description 1
- BFMKFCLXZSUVPI-UHFFFAOYSA-N ethyl but-3-enoate Chemical compound CCOC(=O)CC=C BFMKFCLXZSUVPI-UHFFFAOYSA-N 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 239000005338 frosted glass Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- RZXDTJIXPSCHCI-UHFFFAOYSA-N hexa-1,5-diene-2,5-diol Chemical compound OC(=C)CCC(O)=C RZXDTJIXPSCHCI-UHFFFAOYSA-N 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 238000005286 illumination Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 238000007689 inspection Methods 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 230000031700 light absorption Effects 0.000 description 1
- 239000007791 liquid phase Substances 0.000 description 1
- 210000005004 lymphoid follicle Anatomy 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 239000007769 metal material Substances 0.000 description 1
- 238000000386 microscopy Methods 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 201000009671 multidrug-resistant tuberculosis Diseases 0.000 description 1
- LKKPNUDVOYAOBB-UHFFFAOYSA-N naphthalocyanine Chemical compound N1C(N=C2C3=CC4=CC=CC=C4C=C3C(N=C3C4=CC5=CC=CC=C5C=C4C(=N4)N3)=N2)=C(C=C2C(C=CC=C2)=C2)C2=C1N=C1C2=CC3=CC=CC=C3C=C2C4=N1 LKKPNUDVOYAOBB-UHFFFAOYSA-N 0.000 description 1
- 230000009826 neoplastic cell growth Effects 0.000 description 1
- 230000009871 nonspecific binding Effects 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 239000011236 particulate material Substances 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 239000004814 polyurethane Substances 0.000 description 1
- 239000011118 polyvinyl acetate Substances 0.000 description 1
- 229920002689 polyvinyl acetate Polymers 0.000 description 1
- 238000012805 post-processing Methods 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 238000004080 punching Methods 0.000 description 1
- 238000000275 quality assurance Methods 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000003362 replicative effect Effects 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 239000002210 silicon-based material Substances 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 238000004528 spin coating Methods 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 238000005507 spraying Methods 0.000 description 1
- 239000010959 steel Substances 0.000 description 1
- 210000004895 subcellular structure Anatomy 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- BFKJFAAPBSQJPD-UHFFFAOYSA-N tetrafluoroethene Chemical compound FC(F)=C(F)F BFKJFAAPBSQJPD-UHFFFAOYSA-N 0.000 description 1
- 239000012815 thermoplastic material Substances 0.000 description 1
- 230000008719 thickening Effects 0.000 description 1
- DQQMDUNOVOLBEK-UHFFFAOYSA-L tin(iv) 2,3-naphthalocyanine dichloride Chemical compound N1=C(C2=CC3=CC=CC=C3C=C2C2=NC=3C4=CC5=CC=CC=C5C=C4C(=N4)N=3)N2[Sn](Cl)(Cl)N2C4=C(C=C3C(C=CC=C3)=C3)C3=C2N=C2C3=CC4=CC=CC=C4C=C3C1=N2 DQQMDUNOVOLBEK-UHFFFAOYSA-L 0.000 description 1
- 230000005944 tissue migration Effects 0.000 description 1
- 229920006352 transparent thermoplastic Polymers 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 238000012800 visualization Methods 0.000 description 1
- 238000003466 welding Methods 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N1/00—Sampling; Preparing specimens for investigation
- G01N1/28—Preparing specimens for investigation including physical details of (bio-)chemical methods covered elsewhere, e.g. G01N33/50, C12Q
- G01N1/2813—Producing thin layers of samples on a substrate, e.g. smearing, spinning-on
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N1/00—Sampling; Preparing specimens for investigation
- G01N1/02—Devices for withdrawing samples
- G01N2001/028—Sampling from a surface, swabbing, vaporising
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N1/00—Sampling; Preparing specimens for investigation
- G01N1/28—Preparing specimens for investigation including physical details of (bio-)chemical methods covered elsewhere, e.g. G01N33/50, C12Q
- G01N1/2813—Producing thin layers of samples on a substrate, e.g. smearing, spinning-on
- G01N2001/2833—Collecting samples on a sticky, tacky, adhesive surface
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N1/00—Sampling; Preparing specimens for investigation
- G01N1/28—Preparing specimens for investigation including physical details of (bio-)chemical methods covered elsewhere, e.g. G01N33/50, C12Q
- G01N1/2813—Producing thin layers of samples on a substrate, e.g. smearing, spinning-on
- G01N2001/2833—Collecting samples on a sticky, tacky, adhesive surface
- G01N2001/284—Collecting samples on a sticky, tacky, adhesive surface using local activation of adhesive, i.e. Laser Capture Microdissection
Landscapes
- Physics & Mathematics (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- General Physics & Mathematics (AREA)
- Immunology (AREA)
- Pathology (AREA)
- Sampling And Sample Adjustment (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Microscoopes, Condenser (AREA)
- Glass Compositions (AREA)
- Lasers (AREA)
- Gyroscopes (AREA)
- Piezo-Electric Or Mechanical Vibrators, Or Delay Or Filter Circuits (AREA)
- Laser Beam Processing (AREA)
Description
(発明の背景)
本発明は一般に、レーザー捕捉顕微解剖(LCM)の分野に関する。特に本発明は、分析容器の内部部品の少なくとも一部に取り付けたLCMフィルムを含むLCM試料を取得する装置に関する。さらに、本発明の好ましい実施は、ミクロ遠心管キャップの底で高温真空焼成される、実質的に平面のエチレンビニルアセテート(EVA)ポリマーLCMフィルムに関する。本発明はそれゆえ、平面キャップと称することができる型のLCM試料取得装置に関する。
【0002】
(関連技術の説明)
ガンのような疾病を、長い間、組織バイオプシーを検査して正常でない細胞を同定することによって同定してきた。周囲の組織から目的とする細胞を抽出する満足すべき方法が従来技術にないことが問題であった。現在、研究者は目的の細胞を手動で抽出しようとするか、又は細胞を手動装置で機械的に分離するか若しくは細胞を分離し培養する複雑な方法によって目的とする細胞を顕微解剖しなければならない。多くの研究者はいずれのやり方も単調で時間を浪費し、非効率であると考えている。
ほんの数秒で組織から小さな一群の細胞を抽出できる新規な技術が開発された。この技術はレーザー捕捉顕微解剖(LCM)と言われる。レーザー捕捉顕微解剖は一段階の技術で、低エネルギーレーザーの標準的な研究室用顕微鏡と、例えば食品の包装に使用するプラスチックシールのような、透明なエチレンビニルアセテートポリマーの熱可塑性フィルムを統合したものである。
【0003】
レーザー捕捉顕微解剖では、操作者は標準的な組織病理学のガラススライド上に乗せた組織バイオプシー切片を顕微鏡を通して観察するが、その切片は典型的には数群の異なる型の細胞を含んでいる。熱可塑性フィルムを組織バイオプシー切片の上にそれと接して置く。組織切片中の一群の目的細胞を同定する場合は、操作者はそれを顕微鏡視野の標的領域の中央に置き、次いでレーザーからのパルスを発生するが、そのレーザーは例えば二酸化炭素レーザーであり、約50ミリワット(mW)の強度と約50から500ミリセコンド(mS)の間のパルス持続時間を有している。レーザーパルスは、それがフィルムを通過する際にそれを局所的に加熱し、それに接着性を賦与する。次いで細胞は、プラスチックテープの局所的に接着性となった領域に直接接着し、テープの上に細胞がただちに抽出され、いつでも分析が可能となる。レーザービームの直径が小さいので、極めて小さい細胞群を組織切片から顕微解剖することができる。
【0004】
これらの目的とする細胞だけを組織資料から直接取り出すことによって、科学者は目的とする細胞の遺伝子及び酵素活性を他の研究手段を使用してただちに分析することができる。DNA及びRNAのポリメラーゼ連鎖反応増幅のような手順、及び組織試料からの酵素の回収が示されてきた。レーザー捕捉顕微解剖で抽出した腫瘍細胞からのDNA又はRNAの増幅能力には制限がないことが報告されている。
レーザー捕捉顕微解剖では試験したすべての組織で細胞の抽出に成功した。これらには腎糸球体、インサイチュー乳ガン、胸部の異型管肥厚、前立腺上皮間新形成(prostatic interepithielial neoplasia)及びリンパ小節(lymphoid follicle)が含まれる。レーザー捕捉顕微解剖が提供する細胞への直接アクセスは、早期かつより正確な疾病の検出に対する基盤形成に役立ち、ガン及び他の疾病の分子レベルにおける理解が革命的になろう。この技術の他の適切な役割は、医学研究での新たな課題である、種々の細胞型における遺伝子発現のパターンを記録することである。例えば、国立ガン研究所ガンゲノム解剖計画(the National Cancer Institute's Cancer Genome Anatomy Project、CGAP)は、正常細胞、前ガン細胞及び悪性細胞の遺伝子発現のパターンを明らかにしようとしている。CGAPのような計画では、レーザー捕捉顕微解剖が組織試料から純粋な細胞試料を得るのに役立つ手段である。
【0005】
LCM技術は最近の刊行物である、Laser Capture Microdissection, Science, Vol.274, No.5289, Issue 8, pp998-1001, 1996年発行、に総説が記載されており、そのすべての内容を本明細書に参考として取り込む。LCM技術の目的は、典型的な組織病理学のバイオプシースライド上に含まれる不均一な集合から選択したヒトの細胞を取得する簡単な方法を提供することである。
典型的な組織バイオプシー試料は5−10μm(5−10ミクロン)の組織切片から成っており、これを組織学の分野で周知の技術を使用してガラスの顕微鏡のスライド上に乗せる。この組織切片は研究している体器官の断面である。組織は種々の異なる型の細胞から成る。組織学者はさらなる分析のために、組織のごく小部分を除去しようとすることが多い。
LCMでは、組織試料の一番上に置く熱可塑性の移動フィルムを使用する。このフィルムは有機染料を含んで製造され、この染料を、通常のAlGaAsレーザーダイオードの放射領域と重複するスペクトルの赤外に近い領域を選択的に吸収するように選択する。収束したレーザービームをフィルムに当てると、当たった領域がレーザーで加熱されて溶融し、ビームを当てた領域の組織に接着する。次いでフィルムが組織から引き上げられ、組織のうちの選択した部分がフィルムと共に除去される。
【0006】
熱可塑性の移動フィルム、例えば100μm(100ミクロン)の厚さのエチルビニルアセテート(EVA)フィルムは、Electroseal Corporation of Pompton Lakes, New Jersey(E540型)から入手可能であり、LCM用に使用される。約90℃という低い溶融温度のフィルムを選択する。
LCM技術で使用する熱可塑性のEVAフィルムは染料、例えば赤外ナフタロシアニン染料でドーピングされてきており、この染料はAldrich Chemical Company (染料番号43296−2又は39317−7)から入手可能である。これらの染料は800nm領域に強い吸収を有し、波長領域がフィルムを選択的に溶融するのに使用するレーザーエミッターと重複する。この染料を溶融したバルクプラスチックと高温で混合する。染色したプラスチックを次いで標準的なフィルム形成技術を使用してフィルムに形成する。プラスチック中の染料の濃度は約0.001Mである。
LCMを適用する場合に使用するフィルムはこの操作については満足すべきものであることが分かっているが、いくつかの欠点がある。染料を含浸させたフィルムの光吸収は厚さの関数である。フィルムのこの性質は、他の理由からフィルムの厚さを選択しようとする場合に対立することがある。
フィルムの吸収特性を変更するのに使用する有機染料が、有害な光化学作用を生じる場合がある。この結果LCM試料が汚染される可能性がある。さらに、現在使用されている有機染料は同時に使用するレーザー光の波長に対して感受性であり、従ってフィルムは使用するレーザーに適合しなければならない。
【0007】
(発明の概要)
本発明の目的はレーザー捕捉顕微解剖技術の速度を改良することである。本発明の他の目的はレーザー捕捉顕微解剖技術の精度を改良することである。本発明の他の目的はレーザー捕捉顕微解剖技術の再現性を改良することである。さらに本発明の他の目的はレーザー捕捉顕微解剖技術に含まれる汚染の量を減らすことである。それゆえ、LCMフィルムを分析容器の内部に組み込むLCM消耗品に対する特別な要望がある。平面キャップは実質的に平面のエチレンビニルアセテート(EVA)ポリマーLCMフィルムを含み、このフィルムがミクロ遠心管キャップの底で高温真空焼成される。レーザー捕捉顕微解剖キャップを焼成されたものとして組み込まれて(すなわち後焼成処理をせずにパッケージされて)、レーザー捕捉顕微解剖の移動フィルムを保護しかつ汚染を最小化することができる。キャップ及びそれを組み込んだ構成により、迅速かつ容易な利用という付加的な利点が提供される。従って、速度、精度及び汚染への抵抗という要件を同時に満足することが可能となり、このことは、先行技術においては相互に対立しかつ同時には満たすことができなかった。
【0008】
本発明の最初の観点は、以下を含むレーザー捕捉顕微解剖組立体を含む:実質的に平面の上面を有する平板;及び該実質的に平面である平板の上面と結合した少なくとも一のレーザー捕捉顕微解剖キャップ、ここで該少なくとも一のレーザー捕捉顕微解剖キャップは基盤表面を有する移動フィルム担体を含む;及び該移動フィルム担体の該基盤表面に結合した実質的に平面のレーザー捕捉顕微解剖の移動フィルム。本発明の第二の観点は、以下を含むレーザー捕捉顕微解剖装置を含む:基盤表面を有する移動フィルム担体;及び該移動フィルムの該基盤表面に結合したレーザー捕捉顕微解剖の移動フィルム、ここで該レーザー捕捉顕微解剖の移動フィルムは少なくとも一の一体として形成した構造部材を含んでおり、この構造部材が突出し該レーザー捕捉顕微解剖の移動フィルムと試料の間に制御可能な間隙を提供している。本発明の第三の観点は、以下を含む生物学的反応管の一体化部分を含む:基盤表面を有する移動フィルム担体;及び該移動フィルム担体の該基盤表面に結合したレーザー捕捉顕微解剖の移動フィルム。本発明の第四の観点は、以下を含むレーザー捕捉顕微解剖組立体を含む:上面を有する平板;及び該平板の上部表面に結合した少なくとも一のレーザー捕捉顕微解剖のキャップ、ここで該少なくとも一のレーザー捕捉顕微解剖のキャップのそれぞれは基盤表面を有する移動フィルム担体を含む;及び該移動フィルム担体の該基盤表面に結合したレーザー捕捉顕微解剖の移動フィルム。
【0009】
本発明の第五の観点は、以下の工程を含むレーザー捕捉顕微解剖組立体の製造方法を含む:実質的に平面の上部表面を有する平板を提供する工程;少なくとも一のレーザー捕捉顕微解剖キャップを提供する工程、ここで該少なくとも一のレーザー捕捉顕微解剖キャップは基盤表面を有する移動フィルム担体を含む;該移動フィルム担体の該基盤表面に隣接しているレーザー捕捉顕微解剖の移動フィルムを提供する工程;及び該少なくとも一のレーザー捕捉顕微解剖キャップと該平板を高温真空焼成して、該レーザー捕捉顕微解剖の移動フィルムを実質的に平面化する工程。本発明の第六の観点は、以下の工程を含むレーザー捕捉顕微解剖の消耗品を製造する方法を含む:基盤表面を有する移動フィルム担体を提供する工程;及び該基盤表面上にレーザー捕捉顕微解剖の移動フィルムを形成する工程、この形成において該レーザー捕捉顕微解剖の移動フィルムを高温真空焼成することを含む。本発明の第七の観点は、以下の工程を含む生物学的反応管の一体化部分の製造方法を含む:基盤表面を有する移動フィルム担体を提供する工程;及び該基盤表面上にレーザー捕捉顕微解剖の移動フィルムを形成する工程。本発明の第八の観点は、以下の工程を含む、レーザー捕捉顕微解剖組立体を製造する方法を含む:上部表面を有する平板を提供する工程;少なくとも一のレーザー捕捉顕微解剖キャップを提供する工程、ここで該少なくとも一のレーザー捕捉顕微解剖キャップは基盤表面を有する移動フィルム担体を含む;該少なくとも一のレーザー捕捉顕微解剖キャップに対して、該移動フィルム担体の該基盤表面に結合したレーザー捕捉顕微解剖の移動フィルムを提供する工程;該少なくとも一のレーザー捕捉顕微解剖キャップを該平板と接して置く工程;及び該少なくとも一のレーザー捕捉顕微解剖キャップと該平板の両者を高温真空焼成して、該レーザー捕捉顕微解剖組立体を製造する工程。
【0010】
本発明の第九の観点は、以下の工程を含む、顕微鏡で試料を映像化する方法を含む:顕微鏡を用意する工程;該顕微鏡で規定される光線路の範囲内であって試料から数ミリメートルの範囲内に散乱媒体を置く工程;及び該顕微鏡で該散乱媒体を通して該試料を映像化する工程。本発明の第十の観点は、以下を含む顕微鏡を含む:該顕微鏡で規定される光線路の範囲内であって試料から数ミリメートルの範囲内に置かれた散乱媒体。
本発明のこれらの観点及び他の観点は、以下の説明及び添付の図を組み合わせて考慮すると、よりよくわかり理解されるであろう。しかしながら、以下の説明は本発明の好ましい態様を示し、その多くの特定の細部を示すものであるが、これらは説明のためにあるものであって制限するものではないことを理解すべきである。本発明の精神から離れずにその範囲内で多くの変化や変更を行うことができ、本発明はこのようなすべての変更を含む。
【0011】
(好ましい態様の記載)
本発明並びにその種々の特徴及び利点の詳細を、添付図面に示されている限定しない態様に言及しつつより完全に説明し、以下の記載で詳細に説明する。本発明の詳細にわたって不必要にわかりにくくするのを避けるために、周知の構成及び処理技術の説明は省く。
米国特許出願 60/037,864号、1997年2月7日出願(事件番号ARCT−002)、米国特許出願 08/797,026号、1997年2月7日出願、米国特許出願 08/800,882号、1997年2月14日出願、米国特許出願 60/060,731号、1997年10月1日出願、及び米国特許出願 60/060,732号、1997年10月1日出願の全内容を参考として本出願にそれらが完全に記載されているように本明細書に明確に取り込む。
図1A−1Cにおいて、平板100が記載されている。平板100を金属、ガラス、セラミック又は以下に記載する後処理工程に適するあらゆる材料から製造することができる。好ましい態様において、平板100はガラスの顕微鏡スライドである。平板100の上面101が平面であることが重要である。記載した態様では何もない顕微鏡スライドを示しているが、平板は被覆することができ、そうしない場合は最初の処理工程で表面を処理する。
【0012】
図2A−2Cにおいて、平板100は剥離剤210を有するものとして記載されている。剥離剤210を上面101に適用する。図2A−2Bにおいて、上面101は剥離剤210によって隠されているが、図2Cの界面として明らかに可視性である。
剥離剤は適切な非接着性材料であればいずれでもよく、例えばシリコーン又はTEFLON(すなわちポリテトラフルオロエチレン)である。有利には、剥離被覆は界面活性剤であることができ、それは接触することとなる液体の接触角を大きくする。最初に上面101によって提供された平面性を剥離剤210が維持し広げることが重要である。好ましい態様において、剥離剤210は界面活性剤、例えばRAIN−Xを含むシリコーンを含むことができる。
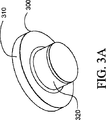
図3A−3Dにおいて、試料担体300が記載されている。試料担体300は上の部分310及び下の部分320を有している。上の部分310は上面315と外部外辺部317及び肩319を含む。下の部分320はフレア322、内辺外辺部324、テーパー326及び基盤表面328を含む。
試料担体300は透明な光学特性の重合性キャップであることができる。例えば、キャップはポリカーボネート、又は他の適切な光学的に透明なプラスチックから製造することができる。しかしながら、キャップが製造されるポリマーの吸収特性が、レーザーエネルギーの捕捉フィルムへの適切な伝達に適合していれば、キャップは光学的に透明である必要はない。
【0013】
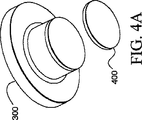
図4A−4Dにおいて、レーザー捕捉顕微解剖(LCM)の移動フィルム400が、試料担体300に適用されて示されている。LCM移動フィルム400が、明確さのために異なる縮尺で示されていることを理解すべきである。独立のエチレンビニルアセテートシートから円形断面をパンチングすることによって、レーザー捕捉顕微解剖の移動フィルム400を円形キャップの底に適用することができる。他の方法として、LCMの移動フィルム400をキャップの底に成形することができる。例えばスピンコーティング、浸漬、又は噴霧のような方法を使用して、LCMの移動フィルム400をキャップの上に堆積することができる。いずれの場合でも、消耗品の製造は滅菌環境下で行うべきである。
LCM移動フィルム400は薄いことが有利である。例えば、50μm(ミクロン)の厚さのフィルムは100μm(ミクロン)の厚さのフィルムより好ましい。しかしながら、約500、400、300、200、50μm(ミクロン)又はそれより薄い厚さで有利に製造することができる。
【0014】
図5A−5Cにおいて、複数の試料担体300とそれに対応するLCM移動フィルム400を共に組み合わせたものが、平板100の上面に被覆した剥離剤210の方向に降下するように記載されている。LCM移動フィルム400はエチレンビニルアセテート(EVA)の重合性材料であることができる。図5CではLCM移動フィルム400と剥離剤210との間がほとんど密接していることとの対比により、図5Aが時間的に早期の組み立て工程を記載していることが分かる。
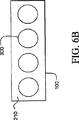
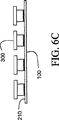
図6A−6Cでは、真空高温焼成の処理工程中にある、平板100に4個の試料担体300を乗せたものが記載されている。真空高温焼成処理によりEVAは軟化し、溶融しかつ流動することによって、剥離剤210によって与えられた実質的に平面の表面に一致する。このようにして、平板100が有している平面性がLCM移動フィルム400に移動する。これは捕捉した空気も排除する。
フィルムの高温真空焼成は穏やかな真空で行うことができる。好ましい態様では、高温注型成形は1.3hPa(1トール)、95℃、約1時間で起こる。
【0015】
他の態様では、キャップを剥離剤被覆した平板の上面に置く前にLCMフィルムをキャップの基部に取り付ける代わりに、LCMフィルムを剥離剤の上にフィルム層として被覆することができる。次いで試料担体をLCMフィルムの上面に置くことができる。このような組合せで一又は複数を組み立てたものを次いで高温真空溶融注型して、試料担体と剥離剤の間の界面に位置している少なくともLCMフィルムの部分を平面化する。このようにして、試料担体が平板から除去され、試料担体の底表面に相当する平面化したLCMフィルムの部分が、除去されるキャップと共に組立体から離脱する。除去されるキャップの底に隣接していないLCMフィルムのこれらの部分は平板上に残る。好ましい態様では、試料担体を平板から引き離す場合、二つの主要な構成体を線状に分離する前及び/又は間に試料担体にひねりの動きを与えて、LCMフィルム内及びLCMフィルムと剥離層の間の両者に剪断力を及ぼす。
剥離被覆はシリコーンであることができる。これとは別に剥離被覆はポリテトラフルオロエチレンであることができる。
本明細書を通じて、記述的な語句である“移動フィルム担体”を“試料担体”という語句に置き換えることができる。一般に、移動フィルム担体は移動フィルムを担持する。移動フィルムに移動される試料の部分だけが担体に担持される。
【0016】
エチレンビニルアセテートを入手可能な材料の中から次の基準に基づいて選択することができる。エチレンビニルアセテートは高いメルトインデックスを有しなければならない。高いメルトインデックスは、低い粘性及び低い分子量で示される。エチレンビニルアセテート、又はLCM移動フィルムに使用される他の材料は、適度な粘着性を有することが重要である。それゆえ、移動フィルムはいくらか接着性であるが接触するすべてのものに結合することはない。キャップを透明なプレキシグラス(すなわち、ポリメチルメタクリレート)から製造することができる。キャップに真空高温注型を適切に行う前に、ガラススライドを界面活性剤で処理することにより、試料材料の取得にキャップが必要となる直前に、完成したキャップをガラススライドから取り出すことができる。
好ましい態様において、キャップの大きさを標準的なミクロ遠心管に合わせる。LCM移動フィルムをキャップに、接着剤を使用し、又はプラスチックを溶着させることにより、又は他の機械的な手段によりフィルムを適切に保持して取り付けることができる。
キャップの側壁はネガティブドラフトを有することができる。ネガティブドラフトを加工してキャップが製造される装置にすることができる。
分析用の組織をキャップの底に捕捉した後、キャップを蛋白質分解酵素(すなわちプロテアーゼ、例えばトリプシン)を含むミクロ遠心管の上に置き、この管を反転させる。次いで組織が溶解し、DNAが遊離して溶液中に流出する。次いで溶液を管の外に吸い出してPCR混合物に移す。
【0017】
理論に縛られなければ、レーザーエネルギーを照射された場合、EVAフィルムは上及び下の両方に発泡すると考えられる。概算すると、レーザーのLCMチャージを受けた場合、EVAフィルムは下方及び上方に約12−15%発泡すると考えられる。上方への発泡はプラスチックキャップで制限される。
LCM移動フィルムの厚さは20%、好ましくは5%以内に保持されるべきである。底はLCM移動フィルムの照射された表面であり、捕捉表面と言うこともできる。LCM移動フィルムの平面性は約5μm(ミクロン)、好ましくは約1μm(ミクロン)以内に保持すべきである。フィルムの平面性は、λ/2で増加するフリンジ数(number of fringes)に基づいてただちに特徴づけられる。LCM移動フィルムの平面性は、540nmのλによって与えられるフリンジ当たり1/4μm(ミクロン)にほぼ等しい二つの波の間に保持されるべきである。
エチレンビニルアセテート中の染料はレーザーエネルギーを吸収する。エチレンビニルアセテートは液相に変換し、目的の細胞構造に浸入し、次いで固まる。
組立体を製造するのに使用する特定の製造方法は廉価で再現性がなければならない。本発明の製造をすべての被覆及び焼成方法を使用することによって簡便に実施することができる。方法は汚染物のない環境で行われることが好ましい。製造操作に関して、自動化方法を使用することがさらに有利である。
しかしながら、製造方法が記載した組立体を提供する限り、組立体を製造するのに使用する特定の製造方法は、本発明にとって必須ではない。本発明を行い又は使用する者は通常、装置及びエネルギーの要件、最終製品の期待する適用要件、及び全体的な製造工程に対する要望に基づいて製造工程を選択するであろう。
【0018】
キャップに使用する特定の材料は生物学的及び化学的に不活性であるべきである。本発明のキャップはEVAより高い融点を有するすべての材料で有利に製造することができる。安価な材料が好ましい。製造の操作に関して、射出成形又は加工が可能で透明な熱可塑性材料を使用することがさらに有利である。例えば、キャップはポリメチルメタクリレートを含むことができる。重合性材料を適切に選択すると、キャップは固体である。キャップの中心軸を通るスルーホールは必要がない。
しかしながら、材料が記載した機能を提供する限り、キャップ用に選択した特定の材料は本発明にとって必須ではない。本発明を行い又は使用する者は通常、コスト及び入手可能性、最終製品の期待する適用要件、及び全体的な製造工程に対する要望に基づいて市場で入手可能な最良の材料を選択するであろう。
LCM移動フィルムはいかなる適切なプラスチックであってよい。例えば、LCM移動フィルムは一又は複数のEVA;ポリウレタン(PU);ポリビニルアセテート;エチレン−メチルアアクリレート(EMAC);ポリカーボネート(PC);エチレン−ビニルアルコールポリマー(EVOH);ポリプロピレン(PP);及び発泡性又は汎用ののポリスチレン(PS)を含むことができる。ELVAX410、200及び205は、DuPontから市場で入手可能なEVAの適切な樹脂であり、この操作上の変数はビニル基の量である。
【0019】
LCM移動フィルムは吸収性物質を含むことができる。吸収性物質は吸収性染料を含むことができる。この染料は広域吸収性染料又は周波数特異的吸収性染料であることができる。例えば、吸収性染料は一又は複数のスズ(IV)2,3−ナフタロシアニンジクロリド;シリコン(IV)2,3−ナフタロシアニンジヒドロキシド;シリコン(IV)2,3−ナフタロシアニンジオクチルオキシド;及びバナジル2,11,20,29−テトラ−tert−ブチル−2,3−ナフタロシアニンを含むことができる。吸収性物質は多数のフレリン(Fullerine すなわちバッキーボール(Bucky Ball)例えばC60)も含むことができる。
LCM移動フィルムは散乱媒体をも含むことができる。LCM移動フィルムは試料の極めて近くに存在するので、散乱物質が影を減少させ、これによって映像化の工程が改良される。散乱媒体は拡散材料を含むことができる。例えば、LCM移動フィルムを小さな粒子材料に負荷させることができ、これが照明光を散乱させて影を最小化し、かつLCM線に悪影響を与えずに映像化を改良する。他の方法として、移動フィルムは同様の作用をする二色性のゼラチン(DCG)を含むことができる。DCGは照射されて発色して移動フィルムの中で特定の散乱特性の形成剤として提供することができる。
非接触性LCM移動フィルム及び/又は担体を組み立てるための方法は多数存在する。非接触性LCMを使用することの目的は、組織のLCMフィルムへの非特異的な結合に伴う問題点を排除する方法を提供することである。より詳細には、試料スライドが緩く付着した細胞の部分を有していると、LCMフィルムへの非特異的な付着に起因して、試料のこれらの部分が誤ってスライドから持ち上げられる。すなわち、これらの部分が、レーザーで照射されていないのにフィルムに結合することとなる。これらの部分を試薬管に移すと、これらが試薬で消化されて試料中の汚染物として現れることになる。緩く結合した組織の部分をフィルムと接触させないことが重要である。
【0020】
非特異的に移動する可能性のある組織の部分にフィルムが接触するのを防ぐ一つの方法は、組織試料からフィルムを数マイクロメートル(ミクロン)離す(距離をおく)ことである。レーザーを照射する部分では、フィルムはその厚さの約10%(典型的な50から100μm(ミクロン)に基づき約5から10μm(ミクロン))発泡し、組織と接触し、これにより、照射した領域への移動が許されることになる。この領域の外では、フィルムと組織の間に空間があるため、フィルムと組織は接触することがない。しかしながら、レーザー照射による発泡後にはフィルムは組織と接触する必要があるので、フィルムを組織からあまり遠くに(数マイクロメートルより遠くに)配置すべきではない。
数マイクロメートル(ミクロン)“離れている”非接触性のLCM移動フィルムを製造する技術の一つは、数マイクロメートル(ミクロン)高い一連の台座を創製することであり、それにより基礎となるキャップに対して一連の離れたものを提供することができる。これらの台座を、移動フィルムの角に収束したレーザー光を照射することによって創製することができる。レーザー光により、通常は平面であるフィルムが、収束した領域においてこの領域が盛り上がって歪められる。移動フィルム担体の縁に位置する点を有する正三角形の頂点にこれらの台座を置くことにより、良好な三点取付を提供できる。これらの台座の高さは、収束したレーザー光の出力とパルス長を変化することによって調整できる。直径はレーザー光の直径を変化することによって調整できる。照射レベルは組織移動に使用されるレベルと同様であり、約10−90ミリセコンド当たり10−90mWである。(台座を創製する場合に、フィルムがガラススライドと接触しているときにフィルムを照射することが有用である。)試薬バイアルを、台座に接触する内部縁を有するように構成することができ、台座を試薬からシールし、これにより台座の上に存在する可能性のある組織が試料を汚染するのを防ぐ。
【0021】
図7A−7Bにおいて、LCMフィルム700に部材710を付けることができる。部材710は盛り上がった部分720(台座)及び突き出した部材730(すなわち縁)を含むことができる。部材710をLCMフィルム700中で成形(例えば複製)することができ、そうでなければ形成(例えばレーザーにより)することができる。このような部材がLCMフィルム700のトポグラフィーを規定する作業表面となる。
部材710の目的は、極微小のレーザースポットの大きさのものを除き、LCMを使用する組織試料から単一細胞を選択する付加的な方法を提供することである。LCM移動フィルム中に作られる部材710は、所望の細胞とほぼ同じ大きさであることができる。部材710はフィルム表面から数マイクロメートル(ミクロン)広がることができる。
フィルム700自体は、キャップの周囲を通る突き出し部材730によって約5から約10μm(ミクロン)の距離で、細胞から離しておくことができる。フィルムの平面を安定化するために、突き出し部材はフィルムの外辺部の少なくとも三点に沿って伸びる必要があるが、連続する縁である必要はないことが理解されよう。
【0022】
部材710は金型に対してLCMフィルム700を高温注型成形することによって製造することができ、この金型はその表面にレーザーで加工した部材の形に対応する形を有している。約5から約20μm(ミクロン)の直径に収束したQスイッチレーザーを使用して研磨した金属表面又はガラス表面から、この金型を製造することができる。部材710は、ダイヤモンド針で微小加工した金型表面に対してフィルムを成形することによっても製造することができる。トポグラフィーを金型からフィルムへ複製によって移動する。
所望の細胞740を得るための隆起(盛り上がった部分720)は、直径がほぼ5〜20μm(ミクロン)のLCMフィルムの小さな盛り上がった部分を含むことができる。レーザー光が750がこの部分を加熱すると、盛り上がった部分720が組織にまず接触するが、周囲の隣接するフィルム領域が組織と接触しないようにレーザーの出力を調整することができる。従って、レーザー光の位置、大きさ及びモードによって行われた空間的な区分に加えて、盛り上がった部分720が空間的な区分を行う。部材710の利点は、大きなレーザー光を使用することができ、また、研究者又は研究所の技術者が単一細胞の離昇(lift-off)を従来どおり行えることである。フィルムの盛り上がった部分(盛り上がった部分720)を周囲の平面フィルム部分より高い温度まで加熱する。突き出した部材730(すなわち縁)は加熱しない。このことにより、この部材のこの領域の細胞が排他的に捕捉される可能性が増加することにもなる。もちろん、盛り上がった部分720が突き出した部材730より突き出さないことが有利である。
【0023】
図8において、複数の台座800をLCMフィルム810に成形して複数の単一細胞の離昇領域とすることができる。LCMフィルム810は再度縁820を含むことができる。複数の細胞を次いで単一の遠心管で分析することができる。
試料から離れてフィルムを保持する構造部材(すなわちスペーサー)を高温真空焼成して移動フィルムとすることができる。この方法によると、この構造部材の鋳型(negative)を平板中で形成できる。次いで、この構造部材を加熱してこの部材の鋳型によって規定されたくぼみに流し込み、フィルム中に構造部材を複製する(現物(positive)として)。他の方法として、構造部材をレーザーを使用し、又は微細加工装置で、移動フィルム中に形成することができる。
構造部材、又はスペーサーをレーザー捕捉顕微解剖の移動フィルム中に一体形成することができる。構造部材は移動フィルムと試料の間を分離する。この分離によりフィルムは試料から離れて保持され、これにより非接触のレーザー捕捉顕微解剖が可能となる。
移動フィルムを屈折率が合った透明な液体又は接着剤で基盤表面に結合することができる。他の方法として、試料担体と移動フィルムの両者を原材料から同時にパンチングして移動フィルムを基盤表面に結合することができる。フィルムを担体と両面テープで結合することも可能である。
【0024】
レーザー捕捉顕微解剖の移動フィルムは実質的に平面化した低地部分を含む。レーザー捕捉顕微解剖の取得領域を規定するように突き出している構造部材をこの低地部分とすることが可能である。ほとんどのフィルムを試料から離して保持する構造部材を低地領域とすることも可能である。フィルムの平板を支持するために、少なくとも三つの支持部材を有することが好ましい。これらの支持部材が移動フィルムの外辺部のほとんど又は全部を通っている場合、これらを縁と称することができる。
移動フィルムを通る線量測定が一定であるためには、組織と接触するものはすべて組織から等距離であることが必要である。このようにして、組織と移動フィルムの間の公知の距離を確立することができる。多くの場合、このような公知の距離は、移動フィルム表面の実質的な部分を越えて固定されている。しかしながら、知るべき距離は十分であり、固定する必要はない。組織の移動を行うためのレーザー出力を調整する目的から距離を知る必要がある。
移動フィルムに電磁エネルギーを照射すると、フィルムは基盤表面に対して発泡して(上下の両方向)組織と接触し、これにより自体を試料中に注入する。移動フィルムと試料の上部表面との間に空間がある場合は、(非接触レーザー捕捉顕微解剖)注入相の開始時にフィルムが試料の上部表面と接触する前に、発泡フィルムがその空間突き出す。
【0025】
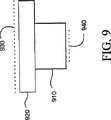
図9において、LCM装置用の散乱発光体の構造が示されている。散乱発光体の構造の目的は、隠されている内部の細胞構造から生じる陰を防止する発光も発生するLCM顕微鏡により適する発光体を提供することである。
レーザー捕捉顕微解剖装置は上部部分910及び底の部分920を含む。上部部分910は散乱媒体930が結合することができる上部表面を含む。底の部分920は散乱媒体940を結合することができる基盤表面を含む。散乱媒体930及び940の一方又は両方を使用することができる。散乱媒体を移動フィルム担体及び/又はLCM移動フィルムに取り込むことができる。
標準の逆相顕微鏡用光源を使用し、散乱媒体(例えば紙片)を組織の近くにおいて光を散乱させると、結果として試料の発光が劇的に改善され、可視化が良好となる。この型の散乱媒体により試料の屈折率を合わせる必要がなくなる。このような散乱媒体により、普通の発光技術では通常隠されている細胞の核及び他の細胞下の構造を可視化することが可能になる。
【0026】
散乱媒体は拡散材料であることができる。散乱媒体として使用するのが適切な拡散材料は乳白ガラスであり、これは非常に濃厚、微小な拡散剤で、Edmund Scientific からPart No. P43,717として入手可能である。標準のレーザープリンター/写真複写機用紙を散乱媒体としても使用することができる。他の型の透明な散乱媒体、例えば曇りガラス、レンズ紙(lenticular sheet)、体積拡散剤、及び/又は表面拡散剤を使用することができる。いずれの場合でも、散乱媒体は激しく発光を散乱する材料であるべきである。典型的なすりガラスの単一シートは一般に不適切であり、3又は4枚のすりガラスのシートを重ねて一組の多重層に組み合わせて発光を十分に拡散させる必要がある。
散乱媒体を移動フィルム担体及び/又はLCM移動フィルムに直接又は間接に結合することができる。他の方法として、移動フィルム担体及び/又はLCM移動フィルムの表面又は内部で散乱媒体を形成することができる。散乱媒体をLCM線及び/又は発光光線を形成するように製造することができる。有効であるためには散乱媒体は試料から数ミリメートルの範囲内にあることが必要である。数ミリメートルは、1センチメートルより少なく、好ましくは5ミリメートルより少ないことを意味している。
【0027】
図10において、レーザー捕捉顕微解剖装置1000が示されている。装置1000は上部部分1010及び底の部分1020を含む。底の部分1020はネガティブドラフト1030を含む。ネガティブドラフト1030は好ましくは約5°である。底の部分1020は面取り部1040も含む。面取り部1040は好ましくは約20°である。底の部分1020はガードル1050も含む。分析管の内部と線接触するガードル1050の幅は好ましくは約0.254mm(0.01インチ)である。ネガティブドラフトを有するキャップを、プラスチック射出成形ダイから離して製造することができる。他の方法として、ネガティブドラフトキャップを、コンピュータで数値制御する切断装置で内挿して製造することができる。
【0028】
図11A−11Dにおいて、内部に筋を付けた分析管1110及び移動フィルム1130を有するキャップ1120を含むレーザー捕捉顕微解剖(LCM)の生物学的反応管1100が示されている。移動フィルム1130はEVAを含むことができ、離れた縁1150を有することができる。離れた縁1150は10〜20μm(ミクロン)の筋であることができ、移動フィルム1130の中央に非接触領域を提供する。キャップ1120は生物学的反応管1100の一体化した部分である。分析管1110は内部の筋1140を含んで形成される。内部の筋は分析管1110の開口部に向かって傾斜しており、これによって離れた縁がなくてもキャップ1120で緊密に密閉することができる。ある態様において内部の筋1140を離れた縁1150と組み合わせる目的は、組織試料の上に移動フィルムを置く非接触的な方法を容易に行うための部材を有するLCM分析管及びフィルム担体を提供することである。LCM非接触方法により、照射を受けて接着性となる領域外の組織部分が移動される可能性が低くなる。しかしながら、離れた縁1150が後で反応と接触すると、この利点は失われる。この内部の密閉部材を有する分析管1110により、移動フィルム1130が離れた縁1150と共に組織と接触するが分析管1110中で反応液とは接触しないようになる。
【0029】
生物学的反応管1110はキャップ1120(蓋)を含み、これは分析管1110に取り外し可能なように結合している。移動フィルム1130を透明なプラスチックキャップ1120に取り付ける。移動フィルム1130を高温注型成形で製造することができ、これはキャップ1120の中心領域より10μm(ミクロン)厚い離れた縁を含んでいる。離れた縁1150を環状の縁と称することができる。移動フィルム1130は収束したレーザー光の領域で発泡して10μm(ミクロン)のギャップを架橋することが可能となり、これによって組織と接触させ、組織の部分をフィルムに移動させる。この離れた縁1150を離れた領域と称することができ、移動フィルム1130の中央領域を組織の上で上昇させ、またLCMレーザーが移動フィルム1130を活性化するまで、この中央領域で移動フィルム1130が組織と接触するのを妨げて、スペーサーとして作用する。本ステップ(スペーサー)の部材と逆の像を含む加熱平板上に移動フィルム1130を押圧して移動フィルム1130中に、この離れた領域の部材を成形することができる。この方法で部材を複製する。このような金型は研磨した金属板と標準的な化学的エッチング技術を用いて構成することができる。ガラス又はシリコン物質と化学的エッチング技術を用いても製造できる。他の方法では、ダイヤモンド旋盤を用いて、この部材を適切な金属物質(例えば銅、アルミニウム、鋼等)上に加工することができる。
【0030】
分析管1110の液体試薬を密閉するキャップ1120を不活性プラスチック、例えばポリプロピレン又はポリエチレンから製造することができる。分析管1110は内部の筋1140(ステップ)を有しており、これはキャップ1120の環状の縁と組み合わせてそれをカバーするように設計されており、この点で緊密な封止を提供する。この密閉により分析管1110中の液体がキャップの縁の底面と接触することが防げる。この設計により非特異的な組織の移動が除去されるのは、離れた縁1150が組織(レーザーで照射した所望の移動領域を除く)と接触するキャップ1120の唯一の部分であり、分析管1110中の消化試薬がこの領域(離れた縁1150)と接触することはないからである。分析管中の内部の筋1140部材にわずかな角度を付けて移動フィルム1130に部分的に切り込むように設計することが可能であり、これによって真空フランジ密閉技術と同様に非常に緊密な封止が可能となる。わずかな隆起又は圧入をキャップ1120の筒の中、又は分析管1110の上部部分に成形することができ、これによって下降方向の力を提供してキャップ1120と分析管1110の間にポジティブシール(positive seal)が可能となる。
【0031】
(実施例)
本発明の特定の態様をさらに以下の制限するものではない実施例によって示すが、これは種々の重要な意義を有する特徴をいくらか詳細に示すのに役立つであろう。実施例は、本発明を実施するやり方を理解するのを容易にし、さらに当業者が本発明を実施するのを容易にすることのみを意図している。従って、実施例を、本発明の範囲を制限するものとして解釈すべきでない。
本発明の典型的な態様において、ガラスの顕微鏡スライドをまず洗浄する。次いで、ガラスの顕微鏡スライドを、市場から入手可能なシリコーン剥離剤の薄層でスプレー被覆するが、本実施例では剥離剤は界面活性剤を含むシリコーンであり、これはただちに市場から入手可能である(すなわち、RAINEX)。一方、ミクロ遠心管キャップの形での試料担体の供給はプレキシグラスGから成形されたものである。次いで、エチレンビニルアセテート(EVA)のシートからパンチングしたLCMフィルムの円筒状チップを、任意にエポキシ接着剤でキャップの底の表面に付着させる。次いで、得られたキャップの半組立体を、剥離剤で被覆したガラスの半組立体の表面に置き、高温真空焼成する。高温真空焼成を、約1.3hPa(1トール)より下の圧力下に95℃の温度で約1時間行う。この操作が移動フィルムを平面化する。次いで焼成した組立体を室温まで放冷する。得られた組立体は、各キャップと下にある平板との間に位置する平凹くぼみを含むことができる。この方法により、キャップの底の外辺部だけがガラス平板と接触する。このことから二つの大きな利点が生じる。第一に、LCMフィルムの作業表面は真空中でガラススライドから離れて間隔があいており、表面の損傷及び汚染がないままに残る。第二に、ガラススライドから各キャップを除去するのが容易になるが、これは、キャップの底のごくわずかな表面部分のみがガラススライドに被覆した剥離剤層に付着しているという事実による。それゆえ、キャップをスライドから除去するのに必要な力は、キャップの全底面が剥離層に接触している場合に比べてより少ない。
【0032】
キャップの製造と組み込みを同一のガラススライド上で行うことにより、再現性と清浄性が改良される一方処理及び包装の工程数が減少することが理解できる。
完成した消耗品を滅菌することができる(例えばβ線又はγ線照射で)。最後に、完成した消耗品の厳格な品質保証検査を行うべきである。
キャップを使用するまでスライドに残しておくことに多くの利点がある。これらの利点には、光学的に平らな表面を保護することが含まれる。例えば、キャップをスライドに残しておくことにより、移動フィルムのヒドロキシル汚染が減少する。これらの利点は表面に沈着するものからの粒状物を阻止することも含む。
【0033】
(本発明の実際の適用)
技術的な価値を有する本発明の実際の適用は、疾病の異なる段階における、健康及び疾病組織の両者の遺伝子発現パターンの大きなデータベースを収集することである。このデータベースはガン及び感染性疾患の病因をより完全に理解するために使用される。本発明により科学者は、遺伝子パターンを特定し、この情報を疾病の有効な診断に取り入れることができる。本発明により、医師は現実の患者の組織試料を異なる疾病の段階における患者からの確認済みのデータと比較することができ、これによって医師はより効果的な段階の治療を行い、不要な手順を廃し、患者の苦痛を軽減することができる。本発明の使用が見込まれる他の研究分野は、医薬の発見、発生生物学、法医学、植物学、及び薬剤耐性結核症のような感染性疾患の研究である。本発明の使用は事実上無数にあり、そのすべてをここで詳細に述べる必要はない。
【0034】
(本発明の利点)
本発明の態様を示すレーザー捕捉顕微解剖は費用の点で有効であり少なくとも以下の理由で利点がある。本発明は現在行われている方法をよりよい技術で代替するものであり、これによってより正確かつ再現性のある結果が得られる。本発明を使用して低コストの射出成形したポリマーの使い捨て製品を提供することが可能であり、この製品はレーザー捕捉顕微解剖のフィルムを、分析容器、例えばミクロ遠心管の内表面に組み込んでいる。
本明細書で記載した本発明の開示したすべての態様は、過度の実験をしなくても実現しかつ実施することができる。本発明者らが考えた本発明を実施するための最良の形をが先に記載しているが、本発明の実施はこれに制限されない。本発明の特徴の種々の付加、変形及び再構成を、根底にある発明概念の精神及び範囲から逸脱することなく、行うことができる。すなわち、本明細書で特定して記載したものとは別のやり方で本発明が実施できることを、当業者は理解するであろう。
【0035】
例えば、個々の構成物を開示した形に形成する必要はなく、また開示した構成に組み立てる必要はなく、事実上いかなる形で提供しても、また事実上いかなる構成に組み立ててもよい。さらに、個々の構成物を開示した材料から製造する必要はなく、事実上いかなる適切な材料から製造してもよい。さらに、本明細書に開示したキャップ及びキャップ組立体は物理的に分離したモジュールとして記載されているが、キャップとキャップ組立体が結合している他の装置にそれらが組み込まれてもよいことは明白である。さらに、すべての開示した素子及びそれぞれの開示した態様の部材は、開示した素子及びすべての他の開示した態様の部材と組み合わせても、又はそれらで置き換えてもよいが、ただし、それらの素子及び部材が相互に排他的である場合は除く。
添付のクレームはすべてのこのような付加、変形及び再構成を含むことを意図している。クレーム中に“手段”(means)という用語が使用されて限定が明白である場合を除き、手段−プラス−機能(means-plus-function)限定を含むものとしてクレームを解釈すべきではない。本発明の好適な態様は添付のサブクレームと区別される。
【図面の簡単な説明】
本発明を構成する利点及び特徴並びに本発明が提供するモデルシステムの構成及び操作の明確な概念が、本明細書に付属しかつ本明細書の一部である図面で示されている典型的な、それゆえ制限するものではない態様に言及することによってただちに明白になるが、本明細書において、参照番号は(番号が二度以上現れる場合には)同一の素子を意味する。従って、請求項は最も広く解釈されるべきであり、このことは明細書及び図面と矛盾しない。図面に示された特徴は同一の縮尺である必要がないことに留意すべきである。
【図1】 図1A−1Cは、レーザー捕捉顕微解剖(LCM)の試料平板の三つの外観を示しており、本発明の態様を表わしている。
【図2】 図2A−2Cは、図1A−1Cで示された試料平板に剥離剤を被覆した後の平板の三つの外観を示しており、本発明の態様を表している。
【図3】 図3A−3Dは、試料担体の四つの外観を示しており、本発明の態様を表している。
【図4】 図4A−4Dは、図3A−3Dで示された資料担体にLCMフィルムを加えた後の試料担体の四つの外観を示しており、本発明を表している。
【図5】 図5A−5Cは、図4A−4Dに示された四つの試料担体及び図2A−2Cに示された一つの平板を含む組立体の三つの外観を示しており、本発明の態様を表している。
【図6】 図6A−6Cは、真空高温注型成形した後の完成した組立体の三つの外観を示し、本発明の態様を表している。
【図7】 図7A−7Bは、成形した部材を有するレーザー捕捉顕微解剖フィルムの二つの経時的な外観を示し、本発明の態様を表す。
【図8】 図8は、成形した部材を有するレーザー捕捉顕微解剖フィルムの底の外観を示し、本発明の態様を表す。
【図9】 図9は、レーザー捕捉顕微解剖装置の側面を示し、本発明の態様を表す。
【図10】 図10は、ネガティブドラフト(negative draft)を有するミクロ遠心管キャップの側面を示し、本発明の態様を表す。
【図11】 図11A−11Dは、生物学的反応管のいくつかの外観を示し、本発明の態様を表している。
Claims (14)
- 以下を含むレーザー捕捉顕微解剖装置:
基盤表面を有する移動用フィルム担体;及び
該移動用フィルム担体の該基盤表面に結合したレーザー捕捉顕微解剖の移動用フィルムであって、該レーザー捕捉顕微解剖の移動用フィルムが、該レーザー捕捉顕微解剖の移動用フィルムと試料の間に空間を提供するように、少なくとも一の一体的に形成した突き出し部材を含む。 - レーザー捕捉顕微解剖の移動用フィルムが、十分な電磁エネルギーの照射を受けて発泡しかつ基盤表面から離れて突出する材料を形成する、請求項1のレーザー捕捉顕微解剖装置。
- レーザー捕捉顕微解剖の試料から1センチメールより少ない範囲内に位置する、または試料に接触する散乱媒体を含む、請求項1のレーザー捕捉顕微解剖装置。
- レーザー捕捉顕微解剖の移動用フィルムが光エネルギ吸収性物質を含む、請求項1のレーザー捕捉顕微解剖装置。
- レーザー捕捉顕微解剖の移動用フィルムが基盤表面上で高温真空焼成されることにより、実質的に平坦なフィルム面を形成する、請求項1のレーザー捕捉顕微解剖装置。
- 移動用フィルム担体が、移動用フィルム担体の表面で規定される遠位直径が移動用フィルム担体の内部外辺部で規定される近位直径より大きいネガティブドラフトを含む、請求項1のレーザー捕捉顕微解剖装置。
- 移動用フィルム担体がネガティブドラフトの下端に連続しているガードルを含む、請求項6のレーザー捕捉顕微解剖装置。
- 移動用フィルム担体が基盤表面の上端に連続している面取り部を含む、請求項6のレーザー捕捉顕微解剖装置。
- レーザー捕捉顕微解剖の移動用フィルムが500μm(ミクロン)より小さい厚さを有する、請求項1のレーザー捕捉顕微解剖装置。
- レーザー捕捉顕微解剖の移動用フィルムが所与の厚みの20%以内に保持される厚さを有する、請求項1のレーザー捕捉顕微解剖装置。
- レーザー捕捉顕微解剖の移動用フィルムが、基盤表面に対面し、捕捉表面が5μm(ミクロン)以内に保持される平面性を有する捕捉表面を有する、請求項1のレーザー捕捉顕微解剖装置。
- レーザー捕捉顕微解剖の移動用フィルムが少なくとも一の台座を更に含み、この台座が突き出してレーザー捕捉顕微解剖取得領域を規定している、請求項1のレーザー捕捉顕微解剖装置。
- 一体的に形成された突き出し部材は、レーザー捕捉顕微解剖の移動用フィルムの外辺部の少なくとも三点に沿って通っている、請求項1のレーザー捕捉顕微解剖装置。
- 請求項1のレーザー捕捉顕微解剖装置を含むミクロ遠心管キャップ。
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US6073297P | 1997-10-01 | 1997-10-01 | |
| US60/060,732 | 1997-10-01 | ||
| US08/984,983 US5985085A (en) | 1997-10-01 | 1997-12-04 | Method of manufacturing consumable for laser capture microdissection |
| US08/984,983 | 1997-12-04 | ||
| US08/984,979 US7075640B2 (en) | 1997-10-01 | 1997-12-04 | Consumable for laser capture microdissection |
| US08/984,979 | 1997-12-04 | ||
| PCT/US1998/020340 WO1999017094A2 (en) | 1997-10-01 | 1998-09-30 | Consumable for laser capture microdissection |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008039148A Division JP4423482B2 (ja) | 1997-10-01 | 2008-02-20 | レーザー捕捉顕微解剖用の消耗品 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2001518615A JP2001518615A (ja) | 2001-10-16 |
| JP2001518615A5 JP2001518615A5 (ja) | 2008-04-10 |
| JP4125481B2 true JP4125481B2 (ja) | 2008-07-30 |
Family
ID=27369893
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2000514115A Expired - Fee Related JP4125481B2 (ja) | 1997-10-01 | 1998-09-30 | レーザー捕捉顕微解剖用の消耗品 |
| JP2008039148A Expired - Lifetime JP4423482B2 (ja) | 1997-10-01 | 2008-02-20 | レーザー捕捉顕微解剖用の消耗品 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008039148A Expired - Lifetime JP4423482B2 (ja) | 1997-10-01 | 2008-02-20 | レーザー捕捉顕微解剖用の消耗品 |
Country Status (8)
| Country | Link |
|---|---|
| EP (3) | EP1260807B1 (ja) |
| JP (2) | JP4125481B2 (ja) |
| AT (2) | ATE500496T1 (ja) |
| AU (1) | AU9671898A (ja) |
| CA (1) | CA2306030C (ja) |
| DE (2) | DE69842157D1 (ja) |
| HK (1) | HK1029623A1 (ja) |
| WO (1) | WO1999017094A2 (ja) |
Families Citing this family (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6743601B1 (en) | 1998-12-10 | 2004-06-01 | The United States Of America As Represented By The Department Of Health And Human Services | Non-contact laser capture microdissection |
| DE69941724D1 (de) * | 1998-12-10 | 2010-01-07 | Us Gov Health & Human Serv | Laseranheftungs-mikrodissektion mit zwei laserpulsen zum ausdehnen und zurückziehen einer schicht |
| AU4708600A (en) * | 1999-05-10 | 2000-11-21 | Government Of The United States Of America, As Represented By The Secretary Of The Department Of Health And Human Services, The | Surface coatings for hot-melt adhesive films |
| WO2001061311A1 (en) | 2000-02-16 | 2001-08-23 | Arcturus Engineering, Inc. | Transfer film for laser microcapture |
| DE10018251C2 (de) | 2000-04-13 | 2003-08-14 | Leica Microsystems | Laserschneid-Vorrichtung mit Mikroskop |
| US7776273B2 (en) | 2000-04-26 | 2010-08-17 | Life Technologies Corporation | Laser capture microdissection (LCM) extraction device and device carrier, and method for post-LCM fluid processing |
| US6699721B1 (en) | 2000-05-09 | 2004-03-02 | The United States Of America As Represented By The Department Of Health And Human Services | Surface coatings for hot-melt adhesive film |
| JP3773831B2 (ja) * | 2000-10-31 | 2006-05-10 | 富士写真フイルム株式会社 | 生体試料の切断方法およびそれに用いる装置 |
| DE10058316A1 (de) * | 2000-11-24 | 2002-06-13 | P A L M Gmbh | Aufnahmeelement zum Aufnehmen eines mit einem Mikroskop zu betrachtenden Objekts, insbesondere eines biologischen Objekts |
| US7749388B2 (en) | 2001-06-15 | 2010-07-06 | Life Technologies Corporation | Low volume filtration column devices and methods of filtering therewith |
| US7229595B2 (en) | 2001-06-15 | 2007-06-12 | Molecular Devices Corporation | Filtration column devices and methods of filtering therewith |
| US7556733B2 (en) | 2001-06-15 | 2009-07-07 | Mds Analytical Technologies (Us) Inc. | Low volume filtration column devices and methods of filtering therewith |
| WO2005001138A2 (en) * | 2003-06-18 | 2005-01-06 | Arcturus Bioscience, Inc. | Breast cancer survival and recurrence |
| US8012693B2 (en) | 2003-12-16 | 2011-09-06 | 3M Innovative Properties Company | Analysis of chemically crosslinked cellular samples |
| DE202010017281U1 (de) | 2010-04-15 | 2011-06-22 | Mmi Ag | Probengefäßträger für die Ablage von Einzelzellen unter einem Mikroskop |
| DE102011076238A1 (de) | 2011-05-20 | 2012-11-22 | Siemens Ag | Anordnung und Verfahren zur optischen Analyse und spezifischen Isolierung von biologischen Proben |
| JP6530314B2 (ja) * | 2012-10-03 | 2019-06-12 | コーニンクレッカ フィリップス エヌ ヴェKoninklijke Philips N.V. | 組み合わされた試料検査 |
| US11085039B2 (en) | 2016-12-12 | 2021-08-10 | xCella Biosciences, Inc. | Methods and systems for screening using microcapillary arrays |
| CA3046827A1 (en) | 2016-12-12 | 2018-06-21 | xCella Biosciences, Inc. | Methods and systems for screening using microcapillary arrays |
| WO2018125832A1 (en) | 2016-12-30 | 2018-07-05 | xCella Biosciences, Inc. | Multi-stage sample recovery system |
| JP7309140B1 (ja) * | 2022-04-07 | 2023-07-18 | 学校法人昭和大学 | 顕微鏡標本作製用平板及び顕微鏡標本の作製方法 |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2801568A (en) * | 1954-11-15 | 1957-08-06 | Evelyn S Dakin | Microscope slide |
| CH566015A5 (en) * | 1973-04-12 | 1975-08-29 | Ciba Geigy Ag | Producing relief contrast in microscope image of phase object - including suppression of disturbing interference and refraction |
| US5170285A (en) * | 1988-11-09 | 1992-12-08 | Senko Medical Instruments Mfg. Co., Ltd. | Semitransparent slide and filter combination for a microscope |
| US5037613A (en) * | 1989-03-16 | 1991-08-06 | Eastman Kodak Company | Incubator |
| JP2906069B2 (ja) * | 1989-12-20 | 1999-06-14 | 泉工医科工業株式会社 | シール片およびスライド |
| US5843657A (en) * | 1994-03-01 | 1998-12-01 | The United States Of America As Represented By The Department Of Health And Human Services | Isolation of cellular material under microscopic visualization |
| US5734498A (en) * | 1994-05-09 | 1998-03-31 | The Regents Of The University Of California | Illuminator elements for conventional light microscopes |
| US6469779B2 (en) * | 1997-02-07 | 2002-10-22 | Arcturus Engineering, Inc. | Laser capture microdissection method and apparatus |
| US5859699A (en) * | 1997-02-07 | 1999-01-12 | Arcturus Engineering, Inc. | Laser capture microdissection analysis vessel |
-
1998
- 1998-09-30 DE DE69842157T patent/DE69842157D1/de not_active Expired - Lifetime
- 1998-09-30 WO PCT/US1998/020340 patent/WO1999017094A2/en active IP Right Grant
- 1998-09-30 EP EP02015774.9A patent/EP1260807B1/en not_active Expired - Lifetime
- 1998-09-30 EP EP98950746A patent/EP1021700B1/en not_active Expired - Lifetime
- 1998-09-30 AT AT02027060T patent/ATE500496T1/de not_active IP Right Cessation
- 1998-09-30 JP JP2000514115A patent/JP4125481B2/ja not_active Expired - Fee Related
- 1998-09-30 AU AU96718/98A patent/AU9671898A/en not_active Abandoned
- 1998-09-30 AT AT98950746T patent/ATE259057T1/de not_active IP Right Cessation
- 1998-09-30 EP EP02027060A patent/EP1304556B1/en not_active Expired - Lifetime
- 1998-09-30 DE DE69821508T patent/DE69821508T2/de not_active Expired - Lifetime
- 1998-09-30 CA CA002306030A patent/CA2306030C/en not_active Expired - Fee Related
-
2001
- 2001-01-13 HK HK01100380A patent/HK1029623A1/xx unknown
-
2008
- 2008-02-20 JP JP2008039148A patent/JP4423482B2/ja not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| JP4423482B2 (ja) | 2010-03-03 |
| EP1304556A2 (en) | 2003-04-23 |
| DE69821508D1 (de) | 2004-03-11 |
| EP1260807B1 (en) | 2016-03-30 |
| EP1304556B1 (en) | 2011-03-02 |
| JP2001518615A (ja) | 2001-10-16 |
| CA2306030A1 (en) | 1999-04-08 |
| DE69821508T2 (de) | 2004-12-16 |
| EP1304556A3 (en) | 2003-06-04 |
| AU9671898A (en) | 1999-04-23 |
| CA2306030C (en) | 2003-11-25 |
| ATE500496T1 (de) | 2011-03-15 |
| EP1021700B1 (en) | 2004-02-04 |
| JP2008157967A (ja) | 2008-07-10 |
| EP1260807A1 (en) | 2002-11-27 |
| EP1021700A2 (en) | 2000-07-26 |
| WO1999017094A3 (en) | 1999-07-22 |
| ATE259057T1 (de) | 2004-02-15 |
| HK1029623A1 (en) | 2001-04-06 |
| DE69842157D1 (de) | 2011-04-14 |
| WO1999017094A2 (en) | 1999-04-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4423482B2 (ja) | レーザー捕捉顕微解剖用の消耗品 | |
| US5985085A (en) | Method of manufacturing consumable for laser capture microdissection | |
| US7221447B2 (en) | Consumable for laser capture microdissection | |
| EP0974044B1 (en) | Laser capture microdissection analysis vessel | |
| JP3786711B2 (ja) | レーザー捕捉顕微解剖法と装置 | |
| US5817032A (en) | Means and method for harvesting and handling tissue samples for biopsy analysis | |
| AU716979B2 (en) | Isolation of cellular material under microscopic visualization | |
| JP4070247B2 (ja) | レーザ捕獲顕微解剖のための凸形状接着性フィルムシステム | |
| US9103757B2 (en) | Laser capture microdissection (LCM) extraction device and device carrier, and method for post-LCM fluid processing | |
| WO1998035215A9 (en) | Laser capture microdissection analysis vessel | |
| EP1558912A2 (en) | Methods and apparatus for interactive micromanipulation of biological materials | |
| CZ331298A3 (cs) | Zařízení pro optickou analýzu vzorků | |
| EP1672349A2 (en) | Laser capture microdissection (lcm) extraction device and device carrier and method for post-lcm fluid processing |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050930 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20070820 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20071120 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20071128 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20080220 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20080414 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20080508 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110516 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110516 Year of fee payment: 3 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| S533 | Written request for registration of change of name |
Free format text: JAPANESE INTERMEDIATE CODE: R313533 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110516 Year of fee payment: 3 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120516 Year of fee payment: 4 |
|
| LAPS | Cancellation because of no payment of annual fees |