JP2019505565A - 新規の抗血管新生融合ポリペプチド - Google Patents
新規の抗血管新生融合ポリペプチド Download PDFInfo
- Publication number
- JP2019505565A JP2019505565A JP2018546726A JP2018546726A JP2019505565A JP 2019505565 A JP2019505565 A JP 2019505565A JP 2018546726 A JP2018546726 A JP 2018546726A JP 2018546726 A JP2018546726 A JP 2018546726A JP 2019505565 A JP2019505565 A JP 2019505565A
- Authority
- JP
- Japan
- Prior art keywords
- seq
- fusion polypeptide
- ang
- amino acid
- mutein
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 108090000765 processed proteins & peptides Proteins 0.000 title claims abstract description 365
- 102000004196 processed proteins & peptides Human genes 0.000 title claims abstract description 347
- 229920001184 polypeptide Polymers 0.000 title claims abstract description 341
- 230000004927 fusion Effects 0.000 title claims abstract description 285
- 230000001772 anti-angiogenic effect Effects 0.000 title description 4
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 claims abstract description 109
- 125000003275 alpha amino acid group Chemical group 0.000 claims abstract description 95
- 102000019298 Lipocalin Human genes 0.000 claims abstract description 84
- 108050006654 Lipocalin Proteins 0.000 claims abstract description 84
- 238000000034 method Methods 0.000 claims abstract description 40
- 102000013382 Gelatinases Human genes 0.000 claims abstract description 6
- 108010026132 Gelatinases Proteins 0.000 claims abstract description 6
- 210000000440 neutrophil Anatomy 0.000 claims abstract description 6
- 102000009524 Vascular Endothelial Growth Factor A Human genes 0.000 claims abstract 10
- 230000027455 binding Effects 0.000 claims description 111
- 150000001413 amino acids Chemical class 0.000 claims description 61
- 238000006467 substitution reaction Methods 0.000 claims description 55
- 239000012634 fragment Substances 0.000 claims description 45
- 108060003951 Immunoglobulin Proteins 0.000 claims description 32
- 102000018358 immunoglobulin Human genes 0.000 claims description 32
- 125000000539 amino acid group Chemical group 0.000 claims description 28
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 20
- 108010047041 Complementarity Determining Regions Proteins 0.000 claims description 17
- 239000000427 antigen Substances 0.000 claims description 17
- 108091007433 antigens Proteins 0.000 claims description 17
- 102000036639 antigens Human genes 0.000 claims description 17
- 229960000397 bevacizumab Drugs 0.000 claims description 3
- 150000007523 nucleic acids Chemical class 0.000 abstract description 41
- 108020004707 nucleic acids Proteins 0.000 abstract description 37
- 102000039446 nucleic acids Human genes 0.000 abstract description 37
- 230000033115 angiogenesis Effects 0.000 abstract description 28
- 239000000203 mixture Substances 0.000 abstract description 24
- 239000003795 chemical substances by application Substances 0.000 abstract description 16
- 230000001225 therapeutic effect Effects 0.000 abstract description 10
- 230000003042 antagnostic effect Effects 0.000 abstract 1
- 102100039037 Vascular endothelial growth factor A Human genes 0.000 description 99
- 235000001014 amino acid Nutrition 0.000 description 73
- 210000004027 cell Anatomy 0.000 description 67
- 108090000623 proteins and genes Proteins 0.000 description 58
- 229940024606 amino acid Drugs 0.000 description 55
- 235000018102 proteins Nutrition 0.000 description 49
- 102000004169 proteins and genes Human genes 0.000 description 49
- 206010028980 Neoplasm Diseases 0.000 description 40
- 101001023833 Homo sapiens Neutrophil gelatinase-associated lipocalin Proteins 0.000 description 39
- 102000047202 human LCN2 Human genes 0.000 description 39
- 201000011510 cancer Diseases 0.000 description 31
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 29
- 239000004037 angiogenesis inhibitor Substances 0.000 description 25
- 238000012360 testing method Methods 0.000 description 24
- 108010088751 Albumins Proteins 0.000 description 20
- 102000009027 Albumins Human genes 0.000 description 20
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 20
- 201000010099 disease Diseases 0.000 description 20
- 239000002953 phosphate buffered saline Substances 0.000 description 20
- 101100481408 Danio rerio tie2 gene Proteins 0.000 description 19
- 101100481410 Mus musculus Tek gene Proteins 0.000 description 19
- 239000002773 nucleotide Substances 0.000 description 19
- 125000003729 nucleotide group Chemical group 0.000 description 19
- 238000012286 ELISA Assay Methods 0.000 description 18
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 18
- 238000002965 ELISA Methods 0.000 description 17
- 230000014509 gene expression Effects 0.000 description 17
- 239000003446 ligand Substances 0.000 description 17
- 239000005557 antagonist Substances 0.000 description 16
- 230000000875 corresponding effect Effects 0.000 description 16
- 230000035772 mutation Effects 0.000 description 16
- 210000002966 serum Anatomy 0.000 description 16
- 238000012217 deletion Methods 0.000 description 15
- 230000037430 deletion Effects 0.000 description 15
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 14
- 238000002703 mutagenesis Methods 0.000 description 14
- 231100000350 mutagenesis Toxicity 0.000 description 14
- 238000005406 washing Methods 0.000 description 14
- 108020004414 DNA Proteins 0.000 description 13
- CKLJMWTZIZZHCS-REOHCLBHSA-N aspartic acid group Chemical group N[C@@H](CC(=O)O)C(=O)O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 13
- 150000001875 compounds Chemical class 0.000 description 13
- 241000283973 Oryctolagus cuniculus Species 0.000 description 11
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 11
- 235000018417 cysteine Nutrition 0.000 description 11
- 238000011534 incubation Methods 0.000 description 11
- 238000003780 insertion Methods 0.000 description 11
- 230000037431 insertion Effects 0.000 description 11
- 229920001223 polyethylene glycol Polymers 0.000 description 11
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 10
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 10
- 238000002474 experimental method Methods 0.000 description 10
- 108020001507 fusion proteins Proteins 0.000 description 10
- 102000037865 fusion proteins Human genes 0.000 description 10
- 230000001105 regulatory effect Effects 0.000 description 10
- 102000014914 Carrier Proteins Human genes 0.000 description 9
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 9
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 9
- 239000002202 Polyethylene glycol Substances 0.000 description 9
- 108091008324 binding proteins Proteins 0.000 description 9
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 8
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 8
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 8
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 8
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 8
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 8
- 230000015572 biosynthetic process Effects 0.000 description 8
- 210000004204 blood vessel Anatomy 0.000 description 8
- 230000002860 competitive effect Effects 0.000 description 8
- 208000035475 disorder Diseases 0.000 description 8
- 230000000694 effects Effects 0.000 description 8
- 238000000338 in vitro Methods 0.000 description 8
- 238000001727 in vivo Methods 0.000 description 8
- 210000005073 lymphatic endothelial cell Anatomy 0.000 description 8
- 230000004048 modification Effects 0.000 description 8
- 238000012986 modification Methods 0.000 description 8
- 239000013641 positive control Substances 0.000 description 8
- 230000035755 proliferation Effects 0.000 description 8
- 239000000126 substance Substances 0.000 description 8
- 102000004190 Enzymes Human genes 0.000 description 7
- 108090000790 Enzymes Proteins 0.000 description 7
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 7
- 229920001612 Hydroxyethyl starch Polymers 0.000 description 7
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 7
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 7
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 7
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 7
- 239000004472 Lysine Substances 0.000 description 7
- 201000004681 Psoriasis Diseases 0.000 description 7
- 206010064930 age-related macular degeneration Diseases 0.000 description 7
- 229960002685 biotin Drugs 0.000 description 7
- 235000020958 biotin Nutrition 0.000 description 7
- 239000011616 biotin Substances 0.000 description 7
- 230000021615 conjugation Effects 0.000 description 7
- 210000002889 endothelial cell Anatomy 0.000 description 7
- 229940088598 enzyme Drugs 0.000 description 7
- 229940050526 hydroxyethylstarch Drugs 0.000 description 7
- 239000003112 inhibitor Substances 0.000 description 7
- 208000002780 macular degeneration Diseases 0.000 description 7
- 239000008194 pharmaceutical composition Substances 0.000 description 7
- 230000002792 vascular Effects 0.000 description 7
- 239000013598 vector Substances 0.000 description 7
- 102000004127 Cytokines Human genes 0.000 description 6
- 108090000695 Cytokines Proteins 0.000 description 6
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 6
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 6
- 102000004338 Transferrin Human genes 0.000 description 6
- 108090000901 Transferrin Proteins 0.000 description 6
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 6
- 108010073923 Vascular Endothelial Growth Factor C Proteins 0.000 description 6
- 102100038232 Vascular endothelial growth factor C Human genes 0.000 description 6
- 206010003246 arthritis Diseases 0.000 description 6
- 230000001580 bacterial effect Effects 0.000 description 6
- 230000004071 biological effect Effects 0.000 description 6
- 238000006243 chemical reaction Methods 0.000 description 6
- 230000012010 growth Effects 0.000 description 6
- 229930182817 methionine Natural products 0.000 description 6
- 239000013642 negative control Substances 0.000 description 6
- 229920001515 polyalkylene glycol Polymers 0.000 description 6
- 102000005962 receptors Human genes 0.000 description 6
- 108020003175 receptors Proteins 0.000 description 6
- 241000894007 species Species 0.000 description 6
- 239000012581 transferrin Substances 0.000 description 6
- 239000004475 Arginine Substances 0.000 description 5
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 5
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 5
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 5
- 102000013463 Immunoglobulin Light Chains Human genes 0.000 description 5
- 108010065825 Immunoglobulin Light Chains Proteins 0.000 description 5
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 5
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 5
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 5
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 5
- 208000017442 Retinal disease Diseases 0.000 description 5
- 206010038923 Retinopathy Diseases 0.000 description 5
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 5
- 239000004473 Threonine Substances 0.000 description 5
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 5
- 235000004279 alanine Nutrition 0.000 description 5
- 230000004075 alteration Effects 0.000 description 5
- 238000004458 analytical method Methods 0.000 description 5
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 5
- 235000009582 asparagine Nutrition 0.000 description 5
- 229960001230 asparagine Drugs 0.000 description 5
- 235000003704 aspartic acid Nutrition 0.000 description 5
- 238000003556 assay Methods 0.000 description 5
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 5
- 239000005018 casein Substances 0.000 description 5
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 description 5
- 235000021240 caseins Nutrition 0.000 description 5
- 238000001516 cell proliferation assay Methods 0.000 description 5
- 230000008859 change Effects 0.000 description 5
- 235000013922 glutamic acid Nutrition 0.000 description 5
- 239000004220 glutamic acid Substances 0.000 description 5
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 5
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 5
- 229960000310 isoleucine Drugs 0.000 description 5
- 238000004519 manufacturing process Methods 0.000 description 5
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 5
- 230000002829 reductive effect Effects 0.000 description 5
- 230000009870 specific binding Effects 0.000 description 5
- 238000010561 standard procedure Methods 0.000 description 5
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 5
- 238000003786 synthesis reaction Methods 0.000 description 5
- 238000013519 translation Methods 0.000 description 5
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 5
- 239000004474 valine Substances 0.000 description 5
- 108010009906 Angiopoietins Proteins 0.000 description 4
- 102000009840 Angiopoietins Human genes 0.000 description 4
- 102000001301 EGF receptor Human genes 0.000 description 4
- 108060006698 EGF receptor Proteins 0.000 description 4
- 241000588724 Escherichia coli Species 0.000 description 4
- 101000924533 Homo sapiens Angiopoietin-2 Proteins 0.000 description 4
- 206010021143 Hypoxia Diseases 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 4
- 108091028043 Nucleic acid sequence Proteins 0.000 description 4
- 230000000903 blocking effect Effects 0.000 description 4
- 210000004369 blood Anatomy 0.000 description 4
- 239000008280 blood Substances 0.000 description 4
- 238000001514 detection method Methods 0.000 description 4
- 239000003814 drug Substances 0.000 description 4
- 238000005516 engineering process Methods 0.000 description 4
- 208000027866 inflammatory disease Diseases 0.000 description 4
- 230000001590 oxidative effect Effects 0.000 description 4
- 238000001542 size-exclusion chromatography Methods 0.000 description 4
- 239000000758 substrate Substances 0.000 description 4
- 238000002560 therapeutic procedure Methods 0.000 description 4
- 210000001519 tissue Anatomy 0.000 description 4
- 238000011282 treatment Methods 0.000 description 4
- 230000004614 tumor growth Effects 0.000 description 4
- 238000001262 western blot Methods 0.000 description 4
- 102100034594 Angiopoietin-1 Human genes 0.000 description 3
- 102100034608 Angiopoietin-2 Human genes 0.000 description 3
- 201000001320 Atherosclerosis Diseases 0.000 description 3
- 241000894006 Bacteria Species 0.000 description 3
- 241000283690 Bos taurus Species 0.000 description 3
- 241000282693 Cercopithecidae Species 0.000 description 3
- 108091026890 Coding region Proteins 0.000 description 3
- 108020004705 Codon Proteins 0.000 description 3
- 102100033553 Delta-like protein 4 Human genes 0.000 description 3
- 239000004471 Glycine Substances 0.000 description 3
- 101000872077 Homo sapiens Delta-like protein 4 Proteins 0.000 description 3
- 101000808011 Homo sapiens Vascular endothelial growth factor A Proteins 0.000 description 3
- 108091006905 Human Serum Albumin Proteins 0.000 description 3
- 102000008100 Human Serum Albumin Human genes 0.000 description 3
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 description 3
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 description 3
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 3
- 101150055061 LCN2 gene Proteins 0.000 description 3
- 206010027476 Metastases Diseases 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 206010029113 Neovascularisation Diseases 0.000 description 3
- 102100035194 Placenta growth factor Human genes 0.000 description 3
- 229920001213 Polysorbate 20 Polymers 0.000 description 3
- 108010073919 Vascular Endothelial Growth Factor D Proteins 0.000 description 3
- 102100038234 Vascular endothelial growth factor D Human genes 0.000 description 3
- 239000002870 angiogenesis inducing agent Substances 0.000 description 3
- 238000013459 approach Methods 0.000 description 3
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 3
- 230000008827 biological function Effects 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 230000004663 cell proliferation Effects 0.000 description 3
- 238000010367 cloning Methods 0.000 description 3
- 238000004590 computer program Methods 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- 238000013461 design Methods 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- 238000010353 genetic engineering Methods 0.000 description 3
- 102000058223 human VEGFA Human genes 0.000 description 3
- 230000007954 hypoxia Effects 0.000 description 3
- 239000004615 ingredient Substances 0.000 description 3
- 230000002401 inhibitory effect Effects 0.000 description 3
- 239000008011 inorganic excipient Substances 0.000 description 3
- 229910052751 metal Inorganic materials 0.000 description 3
- 239000002184 metal Substances 0.000 description 3
- 230000003287 optical effect Effects 0.000 description 3
- 239000008012 organic excipient Substances 0.000 description 3
- 229910052760 oxygen Inorganic materials 0.000 description 3
- 239000001301 oxygen Substances 0.000 description 3
- 230000007170 pathology Effects 0.000 description 3
- 230000037361 pathway Effects 0.000 description 3
- 230000026731 phosphorylation Effects 0.000 description 3
- 238000006366 phosphorylation reaction Methods 0.000 description 3
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 3
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 230000002265 prevention Effects 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 206010039073 rheumatoid arthritis Diseases 0.000 description 3
- 239000000523 sample Substances 0.000 description 3
- 208000011581 secondary neoplasm Diseases 0.000 description 3
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 3
- 230000004083 survival effect Effects 0.000 description 3
- 230000008685 targeting Effects 0.000 description 3
- 239000003053 toxin Substances 0.000 description 3
- 231100000765 toxin Toxicity 0.000 description 3
- 108700012359 toxins Proteins 0.000 description 3
- 238000013518 transcription Methods 0.000 description 3
- 230000035897 transcription Effects 0.000 description 3
- 208000019553 vascular disease Diseases 0.000 description 3
- 230000000007 visual effect Effects 0.000 description 3
- 210000004127 vitreous body Anatomy 0.000 description 3
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- GOJUJUVQIVIZAV-UHFFFAOYSA-N 2-amino-4,6-dichloropyrimidine-5-carbaldehyde Chemical group NC1=NC(Cl)=C(C=O)C(Cl)=N1 GOJUJUVQIVIZAV-UHFFFAOYSA-N 0.000 description 2
- 108010011170 Ala-Trp-Arg-His-Pro-Gln-Phe-Gly-Gly Proteins 0.000 description 2
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 2
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 2
- 108010049777 Ankyrins Proteins 0.000 description 2
- 102000008102 Ankyrins Human genes 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- 125000001433 C-terminal amino-acid group Chemical group 0.000 description 2
- 102000053642 Catalytic RNA Human genes 0.000 description 2
- 108090000994 Catalytic RNA Proteins 0.000 description 2
- 108091035707 Consensus sequence Proteins 0.000 description 2
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 2
- 102000012545 EGF-like domains Human genes 0.000 description 2
- 108050002150 EGF-like domains Proteins 0.000 description 2
- 102000006402 Endocrine-Gland-Derived Vascular Endothelial Growth Factor Human genes 0.000 description 2
- 108010044063 Endocrine-Gland-Derived Vascular Endothelial Growth Factor Proteins 0.000 description 2
- 101150009958 FLT4 gene Proteins 0.000 description 2
- 102100037362 Fibronectin Human genes 0.000 description 2
- 108010067306 Fibronectins Proteins 0.000 description 2
- 108010070675 Glutathione transferase Proteins 0.000 description 2
- 102000005720 Glutathione transferase Human genes 0.000 description 2
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 2
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 2
- 241000238631 Hexapoda Species 0.000 description 2
- 101000924552 Homo sapiens Angiopoietin-1 Proteins 0.000 description 2
- 101001001487 Homo sapiens Phosphatidylinositol-glycan biosynthesis class F protein Proteins 0.000 description 2
- 101000595923 Homo sapiens Placenta growth factor Proteins 0.000 description 2
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 2
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 2
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 2
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 2
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 2
- 125000000510 L-tryptophano group Chemical group [H]C1=C([H])C([H])=C2N([H])C([H])=C(C([H])([H])[C@@]([H])(C(O[H])=O)N([H])[*])C2=C1[H] 0.000 description 2
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 2
- 206010025323 Lymphomas Diseases 0.000 description 2
- 102000029749 Microtubule Human genes 0.000 description 2
- 108091022875 Microtubule Proteins 0.000 description 2
- 125000001429 N-terminal alpha-amino-acid group Chemical group 0.000 description 2
- 208000022873 Ocular disease Diseases 0.000 description 2
- 208000034038 Pathologic Neovascularization Diseases 0.000 description 2
- 241001494479 Pecora Species 0.000 description 2
- 102100040681 Platelet-derived growth factor C Human genes 0.000 description 2
- 108010076504 Protein Sorting Signals Proteins 0.000 description 2
- 108020004459 Small interfering RNA Proteins 0.000 description 2
- 229920002472 Starch Polymers 0.000 description 2
- 208000005718 Stomach Neoplasms Diseases 0.000 description 2
- 102000012753 TIE-2 Receptor Human genes 0.000 description 2
- 108010090091 TIE-2 Receptor Proteins 0.000 description 2
- 102100028644 Tenascin-R Human genes 0.000 description 2
- 208000002495 Uterine Neoplasms Diseases 0.000 description 2
- 108010073925 Vascular Endothelial Growth Factor B Proteins 0.000 description 2
- 102000016663 Vascular Endothelial Growth Factor Receptor-3 Human genes 0.000 description 2
- 102100038217 Vascular endothelial growth factor B Human genes 0.000 description 2
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 238000007792 addition Methods 0.000 description 2
- 230000006229 amino acid addition Effects 0.000 description 2
- 230000000692 anti-sense effect Effects 0.000 description 2
- -1 antisense molecule Proteins 0.000 description 2
- 238000002820 assay format Methods 0.000 description 2
- 238000002869 basic local alignment search tool Methods 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 239000012472 biological sample Substances 0.000 description 2
- 238000006664 bond formation reaction Methods 0.000 description 2
- 210000004899 c-terminal region Anatomy 0.000 description 2
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 239000013599 cloning vector Substances 0.000 description 2
- 230000001447 compensatory effect Effects 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- 210000000172 cytosol Anatomy 0.000 description 2
- 230000003111 delayed effect Effects 0.000 description 2
- 239000000539 dimer Substances 0.000 description 2
- 238000010494 dissociation reaction Methods 0.000 description 2
- 230000005593 dissociations Effects 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 210000003527 eukaryotic cell Anatomy 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 206010017758 gastric cancer Diseases 0.000 description 2
- 210000004602 germ cell Anatomy 0.000 description 2
- 125000003630 glycyl group Chemical group [H]N([H])C([H])([H])C(*)=O 0.000 description 2
- 239000005090 green fluorescent protein Substances 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- 208000014829 head and neck neoplasm Diseases 0.000 description 2
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 2
- 229940072221 immunoglobulins Drugs 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 229920000831 ionic polymer Polymers 0.000 description 2
- 238000000111 isothermal titration calorimetry Methods 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 210000004072 lung Anatomy 0.000 description 2
- 201000005202 lung cancer Diseases 0.000 description 2
- 208000020816 lung neoplasm Diseases 0.000 description 2
- 210000004962 mammalian cell Anatomy 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 230000009401 metastasis Effects 0.000 description 2
- 210000004688 microtubule Anatomy 0.000 description 2
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 description 2
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 2
- 108010017992 platelet-derived growth factor C Proteins 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 108020001580 protein domains Proteins 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 230000002285 radioactive effect Effects 0.000 description 2
- 238000002708 random mutagenesis Methods 0.000 description 2
- 108091008146 restriction endonucleases Proteins 0.000 description 2
- 230000000717 retained effect Effects 0.000 description 2
- 108091092562 ribozyme Proteins 0.000 description 2
- 238000003118 sandwich ELISA Methods 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 238000002864 sequence alignment Methods 0.000 description 2
- 230000019491 signal transduction Effects 0.000 description 2
- 230000011664 signaling Effects 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- 239000007790 solid phase Substances 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 230000006641 stabilisation Effects 0.000 description 2
- 238000011105 stabilization Methods 0.000 description 2
- 239000008107 starch Substances 0.000 description 2
- 235000019698 starch Nutrition 0.000 description 2
- 201000011549 stomach cancer Diseases 0.000 description 2
- 201000000596 systemic lupus erythematosus Diseases 0.000 description 2
- 108010020387 tenascin R Proteins 0.000 description 2
- 150000003573 thiols Chemical group 0.000 description 2
- 238000004448 titration Methods 0.000 description 2
- 230000005030 transcription termination Effects 0.000 description 2
- 210000004881 tumor cell Anatomy 0.000 description 2
- 206010046766 uterine cancer Diseases 0.000 description 2
- 229910052720 vanadium Inorganic materials 0.000 description 2
- 108010047303 von Willebrand Factor Proteins 0.000 description 2
- 102100036537 von Willebrand factor Human genes 0.000 description 2
- 229960001134 von willebrand factor Drugs 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 108091005957 yellow fluorescent proteins Proteins 0.000 description 2
- UKAUYVFTDYCKQA-UHFFFAOYSA-N -2-Amino-4-hydroxybutanoic acid Natural products OC(=O)C(N)CCO UKAUYVFTDYCKQA-UHFFFAOYSA-N 0.000 description 1
- FVFVNNKYKYZTJU-UHFFFAOYSA-N 6-chloro-1,3,5-triazine-2,4-diamine Chemical group NC1=NC(N)=NC(Cl)=N1 FVFVNNKYKYZTJU-UHFFFAOYSA-N 0.000 description 1
- 108010048154 Angiopoietin-1 Proteins 0.000 description 1
- 102100033402 Angiopoietin-4 Human genes 0.000 description 1
- 108091023037 Aptamer Proteins 0.000 description 1
- 206010003210 Arteriosclerosis Diseases 0.000 description 1
- 206010003571 Astrocytoma Diseases 0.000 description 1
- 244000063299 Bacillus subtilis Species 0.000 description 1
- 235000014469 Bacillus subtilis Nutrition 0.000 description 1
- 208000023328 Basedow disease Diseases 0.000 description 1
- 102100026189 Beta-galactosidase Human genes 0.000 description 1
- 206010005003 Bladder cancer Diseases 0.000 description 1
- 206010005949 Bone cancer Diseases 0.000 description 1
- 208000018084 Bone neoplasm Diseases 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- 108090000342 C-Type Lectins Proteins 0.000 description 1
- 102000003930 C-Type Lectins Human genes 0.000 description 1
- 239000002126 C01EB10 - Adenosine Substances 0.000 description 1
- 108050009459 C2 domains Proteins 0.000 description 1
- 102000002110 C2 domains Human genes 0.000 description 1
- 102000008203 CTLA-4 Antigen Human genes 0.000 description 1
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 1
- 229940045513 CTLA4 antagonist Drugs 0.000 description 1
- 241000282836 Camelus dromedarius Species 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 241000700199 Cavia porcellus Species 0.000 description 1
- 102000000844 Cell Surface Receptors Human genes 0.000 description 1
- 108010001857 Cell Surface Receptors Proteins 0.000 description 1
- 238000003734 CellTiter-Glo Luminescent Cell Viability Assay Methods 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 1
- 208000003322 Coinfection Diseases 0.000 description 1
- 206010009900 Colitis ulcerative Diseases 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 208000011231 Crohn disease Diseases 0.000 description 1
- 235000004035 Cryptotaenia japonica Nutrition 0.000 description 1
- 102000053602 DNA Human genes 0.000 description 1
- 206010012689 Diabetic retinopathy Diseases 0.000 description 1
- SHIBSTMRCDJXLN-UHFFFAOYSA-N Digoxigenin Natural products C1CC(C2C(C3(C)CCC(O)CC3CC2)CC2O)(O)C2(C)C1C1=CC(=O)OC1 SHIBSTMRCDJXLN-UHFFFAOYSA-N 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 229940122558 EGFR antagonist Drugs 0.000 description 1
- 208000001976 Endocrine Gland Neoplasms Diseases 0.000 description 1
- 206010014733 Endometrial cancer Diseases 0.000 description 1
- 206010014759 Endometrial neoplasm Diseases 0.000 description 1
- 201000009273 Endometriosis Diseases 0.000 description 1
- 108010041308 Endothelial Growth Factors Proteins 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 1
- 208000006168 Ewing Sarcoma Diseases 0.000 description 1
- 108700024394 Exon Proteins 0.000 description 1
- 201000001342 Fallopian tube cancer Diseases 0.000 description 1
- 208000013452 Fallopian tube neoplasm Diseases 0.000 description 1
- 108010087819 Fc receptors Proteins 0.000 description 1
- 102000009109 Fc receptors Human genes 0.000 description 1
- 108010008177 Fd immunoglobulins Proteins 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 102000002090 Fibronectin type III Human genes 0.000 description 1
- 108050009401 Fibronectin type III Proteins 0.000 description 1
- 241000192125 Firmicutes Species 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- 208000007465 Giant cell arteritis Diseases 0.000 description 1
- 208000032612 Glial tumor Diseases 0.000 description 1
- 201000010915 Glioblastoma multiforme Diseases 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 208000015023 Graves' disease Diseases 0.000 description 1
- HVLSXIKZNLPZJJ-TXZCQADKSA-N HA peptide Chemical compound C([C@@H](C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](C)C(O)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](N)CC=1C=CC(O)=CC=1)C1=CC=C(O)C=C1 HVLSXIKZNLPZJJ-TXZCQADKSA-N 0.000 description 1
- 208000030836 Hashimoto thyroiditis Diseases 0.000 description 1
- 102000013271 Hemopexin Human genes 0.000 description 1
- 108010026027 Hemopexin Proteins 0.000 description 1
- 208000032843 Hemorrhage Diseases 0.000 description 1
- 208000017604 Hodgkin disease Diseases 0.000 description 1
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 1
- 241001272567 Hominoidea Species 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101001046870 Homo sapiens Hypoxia-inducible factor 1-alpha Proteins 0.000 description 1
- 101001076408 Homo sapiens Interleukin-6 Proteins 0.000 description 1
- 101000766306 Homo sapiens Serotransferrin Proteins 0.000 description 1
- 102000003839 Human Proteins Human genes 0.000 description 1
- 108090000144 Human Proteins Proteins 0.000 description 1
- PMMYEEVYMWASQN-DMTCNVIQSA-N Hydroxyproline Chemical compound O[C@H]1CN[C@H](C(O)=O)C1 PMMYEEVYMWASQN-DMTCNVIQSA-N 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 206010021245 Idiopathic thrombocytopenic purpura Diseases 0.000 description 1
- 102000016844 Immunoglobulin-like domains Human genes 0.000 description 1
- 108050006430 Immunoglobulin-like domains Proteins 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 108091029795 Intergenic region Proteins 0.000 description 1
- 108010002352 Interleukin-1 Proteins 0.000 description 1
- 102000000589 Interleukin-1 Human genes 0.000 description 1
- 108090000177 Interleukin-11 Proteins 0.000 description 1
- 102000003815 Interleukin-11 Human genes 0.000 description 1
- 108010065805 Interleukin-12 Proteins 0.000 description 1
- 108090000176 Interleukin-13 Proteins 0.000 description 1
- 108050003558 Interleukin-17 Proteins 0.000 description 1
- 102000013691 Interleukin-17 Human genes 0.000 description 1
- 108090000171 Interleukin-18 Proteins 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 102000000588 Interleukin-2 Human genes 0.000 description 1
- 108010002386 Interleukin-3 Proteins 0.000 description 1
- 102000000646 Interleukin-3 Human genes 0.000 description 1
- 108090000978 Interleukin-4 Proteins 0.000 description 1
- 108010002616 Interleukin-5 Proteins 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 102000004889 Interleukin-6 Human genes 0.000 description 1
- 108090001007 Interleukin-8 Proteins 0.000 description 1
- 108010002335 Interleukin-9 Proteins 0.000 description 1
- 206010061252 Intraocular melanoma Diseases 0.000 description 1
- 108091092195 Intron Proteins 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- 241000235058 Komagataella pastoris Species 0.000 description 1
- SNDPXSYFESPGGJ-BYPYZUCNSA-N L-2-aminopentanoic acid Chemical group CCC[C@H](N)C(O)=O SNDPXSYFESPGGJ-BYPYZUCNSA-N 0.000 description 1
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- 125000000998 L-alanino group Chemical group [H]N([*])[C@](C([H])([H])[H])([H])C(=O)O[H] 0.000 description 1
- RHGKLRLOHDJJDR-BYPYZUCNSA-N L-citrulline Chemical compound NC(=O)NCCC[C@H]([NH3+])C([O-])=O RHGKLRLOHDJJDR-BYPYZUCNSA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- UKAUYVFTDYCKQA-VKHMYHEASA-N L-homoserine Chemical compound OC(=O)[C@@H](N)CCO UKAUYVFTDYCKQA-VKHMYHEASA-N 0.000 description 1
- SNDPXSYFESPGGJ-UHFFFAOYSA-N L-norVal-OH Chemical group CCCC(N)C(O)=O SNDPXSYFESPGGJ-UHFFFAOYSA-N 0.000 description 1
- LRQKBLKVPFOOQJ-YFKPBYRVSA-N L-norleucine Chemical compound CCCC[C@H]([NH3+])C([O-])=O LRQKBLKVPFOOQJ-YFKPBYRVSA-N 0.000 description 1
- 108010001831 LDL receptors Proteins 0.000 description 1
- 102000007547 Laminin Human genes 0.000 description 1
- 108010085895 Laminin Proteins 0.000 description 1
- 108091026898 Leader sequence (mRNA) Proteins 0.000 description 1
- 108010006444 Leucine-Rich Repeat Proteins Proteins 0.000 description 1
- 108050001157 Link domains Proteins 0.000 description 1
- 102000010954 Link domains Human genes 0.000 description 1
- 102100024640 Low-density lipoprotein receptor Human genes 0.000 description 1
- 208000005777 Lupus Nephritis Diseases 0.000 description 1
- 208000028018 Lymphocytic leukaemia Diseases 0.000 description 1
- YEIYAQQKADPIBJ-GARJFASQSA-N Lys-Asp-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC(=O)O)NC(=O)[C@H](CCCCN)N)C(=O)O YEIYAQQKADPIBJ-GARJFASQSA-N 0.000 description 1
- 241000282567 Macaca fascicularis Species 0.000 description 1
- 208000032271 Malignant tumor of penis Diseases 0.000 description 1
- 208000000172 Medulloblastoma Diseases 0.000 description 1
- 206010027406 Mesothelioma Diseases 0.000 description 1
- 206010027458 Metastases to lung Diseases 0.000 description 1
- 108700011259 MicroRNAs Proteins 0.000 description 1
- 108090000143 Mouse Proteins Proteins 0.000 description 1
- 101100434911 Mus musculus Angpt1 gene Proteins 0.000 description 1
- 108091007491 NSP3 Papain-like protease domains Proteins 0.000 description 1
- RHGKLRLOHDJJDR-UHFFFAOYSA-N Ndelta-carbamoyl-DL-ornithine Natural products OC(=O)C(N)CCCNC(N)=O RHGKLRLOHDJJDR-UHFFFAOYSA-N 0.000 description 1
- 108091005461 Nucleic proteins Proteins 0.000 description 1
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 1
- 108700020796 Oncogene Proteins 0.000 description 1
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 1
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 101150062285 PGF gene Proteins 0.000 description 1
- 235000021314 Palmitic acid Nutrition 0.000 description 1
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 1
- 208000000821 Parathyroid Neoplasms Diseases 0.000 description 1
- 208000037273 Pathologic Processes Diseases 0.000 description 1
- 206010061336 Pelvic neoplasm Diseases 0.000 description 1
- 208000002471 Penile Neoplasms Diseases 0.000 description 1
- 206010034299 Penile cancer Diseases 0.000 description 1
- 208000007913 Pituitary Neoplasms Diseases 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 102000004079 Prolyl Hydroxylases Human genes 0.000 description 1
- 108010043005 Prolyl Hydroxylases Proteins 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 1
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 1
- 108090000244 Rat Proteins Proteins 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 101000930457 Rattus norvegicus Albumin Proteins 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 208000015634 Rectal Neoplasms Diseases 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- 208000006265 Renal cell carcinoma Diseases 0.000 description 1
- 206010038934 Retinopathy proliferative Diseases 0.000 description 1
- 208000025747 Rheumatic disease Diseases 0.000 description 1
- 108050003452 SH2 domains Proteins 0.000 description 1
- 102000014400 SH2 domains Human genes 0.000 description 1
- 108050008861 SH3 domains Proteins 0.000 description 1
- 102000000395 SH3 domains Human genes 0.000 description 1
- 108050008568 SRCR domains Proteins 0.000 description 1
- 102000000185 SRCR domains Human genes 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 1
- 206010039491 Sarcoma Diseases 0.000 description 1
- 206010040047 Sepsis Diseases 0.000 description 1
- 229940122055 Serine protease inhibitor Drugs 0.000 description 1
- 101710102218 Serine protease inhibitor Proteins 0.000 description 1
- 208000000453 Skin Neoplasms Diseases 0.000 description 1
- 208000021712 Soft tissue sarcoma Diseases 0.000 description 1
- 102000000890 Somatomedin B domains Human genes 0.000 description 1
- 108050007913 Somatomedin B domains Proteins 0.000 description 1
- 101000677856 Stenotrophomonas maltophilia (strain K279a) Actin-binding protein Smlt3054 Proteins 0.000 description 1
- 108700011201 Streptococcus IgG Fc-binding Proteins 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 102000019197 Superoxide Dismutase Human genes 0.000 description 1
- 108010012715 Superoxide dismutase Proteins 0.000 description 1
- 102100024554 Tetranectin Human genes 0.000 description 1
- 208000031981 Thrombocytopenic Idiopathic Purpura Diseases 0.000 description 1
- 102000002938 Thrombospondin Human genes 0.000 description 1
- 108060008245 Thrombospondin Proteins 0.000 description 1
- 102000009843 Thyroglobulin Human genes 0.000 description 1
- 108010034949 Thyroglobulin Proteins 0.000 description 1
- 208000024770 Thyroid neoplasm Diseases 0.000 description 1
- 101710120037 Toxin CcdB Proteins 0.000 description 1
- 102000007641 Trefoil Factors Human genes 0.000 description 1
- 235000015724 Trifolium pratense Nutrition 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- 229940122618 Trypsin inhibitor Drugs 0.000 description 1
- 101710162629 Trypsin inhibitor Proteins 0.000 description 1
- 108090000848 Ubiquitin Proteins 0.000 description 1
- 102000044159 Ubiquitin Human genes 0.000 description 1
- 201000006704 Ulcerative Colitis Diseases 0.000 description 1
- 208000023915 Ureteral Neoplasms Diseases 0.000 description 1
- 206010046392 Ureteric cancer Diseases 0.000 description 1
- 206010046431 Urethral cancer Diseases 0.000 description 1
- 206010046458 Urethral neoplasms Diseases 0.000 description 1
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 201000005969 Uveal melanoma Diseases 0.000 description 1
- 101150117115 V gene Proteins 0.000 description 1
- 108091008605 VEGF receptors Proteins 0.000 description 1
- 108010053099 Vascular Endothelial Growth Factor Receptor-2 Proteins 0.000 description 1
- 102000009484 Vascular Endothelial Growth Factor Receptors Human genes 0.000 description 1
- 208000032594 Vascular Remodeling Diseases 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 206010047741 Vulval cancer Diseases 0.000 description 1
- 208000004354 Vulvar Neoplasms Diseases 0.000 description 1
- 101710185494 Zinc finger protein Proteins 0.000 description 1
- 102100023597 Zinc finger protein 816 Human genes 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 206010069351 acute lung injury Diseases 0.000 description 1
- 229960005305 adenosine Drugs 0.000 description 1
- 230000001464 adherent effect Effects 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 201000005188 adrenal gland cancer Diseases 0.000 description 1
- 208000024447 adrenal gland neoplasm Diseases 0.000 description 1
- 238000003314 affinity selection Methods 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- 229940035676 analgesics Drugs 0.000 description 1
- 108010069801 angiopoietin 4 Proteins 0.000 description 1
- 239000000730 antalgic agent Substances 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000002001 anti-metastasis Effects 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 229940121357 antivirals Drugs 0.000 description 1
- 125000000637 arginyl group Chemical group N[C@@H](CCCNC(N)=N)C(=O)* 0.000 description 1
- 208000011775 arteriosclerosis disease Diseases 0.000 description 1
- 210000004507 artificial chromosome Anatomy 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-M asparaginate Chemical class [O-]C(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-M 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- 201000003710 autoimmune thrombocytopenic purpura Diseases 0.000 description 1
- 229940120638 avastin Drugs 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- 201000009036 biliary tract cancer Diseases 0.000 description 1
- 208000020790 biliary tract neoplasm Diseases 0.000 description 1
- 238000004166 bioassay Methods 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 229960000074 biopharmaceutical Drugs 0.000 description 1
- 208000034158 bleeding Diseases 0.000 description 1
- 230000000740 bleeding effect Effects 0.000 description 1
- 238000007469 bone scintigraphy Methods 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- 210000000133 brain stem Anatomy 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000021164 cell adhesion Effects 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 230000003306 cell dissemination Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 201000007455 central nervous system cancer Diseases 0.000 description 1
- 208000025997 central nervous system neoplasm Diseases 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 238000007385 chemical modification Methods 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 210000000038 chest Anatomy 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 208000023819 chronic asthma Diseases 0.000 description 1
- 208000037976 chronic inflammation Diseases 0.000 description 1
- 208000037893 chronic inflammatory disorder Diseases 0.000 description 1
- 235000013477 citrulline Nutrition 0.000 description 1
- 229960002173 citrulline Drugs 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 230000009918 complex formation Effects 0.000 description 1
- 238000002591 computed tomography Methods 0.000 description 1
- 230000001268 conjugating effect Effects 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000011254 conventional chemotherapy Methods 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 229960001334 corticosteroids Drugs 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 208000030381 cutaneous melanoma Diseases 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 108700041286 delta Proteins 0.000 description 1
- 230000000368 destabilizing effect Effects 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- QONQRTHLHBTMGP-UHFFFAOYSA-N digitoxigenin Natural products CC12CCC(C3(CCC(O)CC3CC3)C)C3C11OC1CC2C1=CC(=O)OC1 QONQRTHLHBTMGP-UHFFFAOYSA-N 0.000 description 1
- SHIBSTMRCDJXLN-KCZCNTNESA-N digoxigenin Chemical compound C1([C@@H]2[C@@]3([C@@](CC2)(O)[C@H]2[C@@H]([C@@]4(C)CC[C@H](O)C[C@H]4CC2)C[C@H]3O)C)=CC(=O)OC1 SHIBSTMRCDJXLN-KCZCNTNESA-N 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 208000037765 diseases and disorders Diseases 0.000 description 1
- 125000002228 disulfide group Chemical group 0.000 description 1
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 210000005069 ears Anatomy 0.000 description 1
- 230000002526 effect on cardiovascular system Effects 0.000 description 1
- 230000002900 effect on cell Effects 0.000 description 1
- 230000000431 effect on proliferation Effects 0.000 description 1
- 210000002472 endoplasmic reticulum Anatomy 0.000 description 1
- 230000003511 endothelial effect Effects 0.000 description 1
- 210000003989 endothelium vascular Anatomy 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 229950001752 enoticumab Drugs 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 238000006911 enzymatic reaction Methods 0.000 description 1
- 201000004101 esophageal cancer Diseases 0.000 description 1
- 239000013604 expression vector Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 239000012894 fetal calf serum Substances 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 208000005017 glioblastoma Diseases 0.000 description 1
- 125000000291 glutamic acid group Chemical group N[C@@H](CCC(O)=O)C(=O)* 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- 210000003128 head Anatomy 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 201000002222 hemangioblastoma Diseases 0.000 description 1
- 201000011066 hemangioma Diseases 0.000 description 1
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 102000047825 human ANGPT2 Human genes 0.000 description 1
- 229940116886 human interleukin-6 Drugs 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 229960002591 hydroxyproline Drugs 0.000 description 1
- 230000001146 hypoxic effect Effects 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 210000003000 inclusion body Anatomy 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 229940079322 interferon Drugs 0.000 description 1
- 208000028867 ischemia Diseases 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 238000004246 ligand exchange chromatography Methods 0.000 description 1
- 238000012417 linear regression Methods 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- 229940076783 lucentis Drugs 0.000 description 1
- 210000002751 lymph Anatomy 0.000 description 1
- 230000001926 lymphatic effect Effects 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 208000003747 lymphoid leukemia Diseases 0.000 description 1
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 238000002595 magnetic resonance imaging Methods 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 208000029559 malignant endocrine neoplasm Diseases 0.000 description 1
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 1
- 208000026037 malignant tumor of neck Diseases 0.000 description 1
- 208000026045 malignant tumor of parathyroid gland Diseases 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 206010027191 meningioma Diseases 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 230000001394 metastastic effect Effects 0.000 description 1
- 206010061289 metastatic neoplasm Diseases 0.000 description 1
- 210000002500 microbody Anatomy 0.000 description 1
- 238000000386 microscopy Methods 0.000 description 1
- 210000004925 microvascular endothelial cell Anatomy 0.000 description 1
- 230000000394 mitotic effect Effects 0.000 description 1
- 238000001823 molecular biology technique Methods 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 238000000302 molecular modelling Methods 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 1
- 210000004897 n-terminal region Anatomy 0.000 description 1
- 230000001613 neoplastic effect Effects 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 230000003472 neutralizing effect Effects 0.000 description 1
- 238000010606 normalization Methods 0.000 description 1
- 201000002575 ocular melanoma Diseases 0.000 description 1
- 238000006384 oligomerization reaction Methods 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 229960003104 ornithine Drugs 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 201000002528 pancreatic cancer Diseases 0.000 description 1
- 208000008443 pancreatic carcinoma Diseases 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000009054 pathological process Effects 0.000 description 1
- 230000003239 periodontal effect Effects 0.000 description 1
- 210000001322 periplasm Anatomy 0.000 description 1
- 230000002688 persistence Effects 0.000 description 1
- 210000001539 phagocyte Anatomy 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 238000002732 pharmacokinetic assay Methods 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 229920001281 polyalkylene Polymers 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 108010094020 polyglycine Proteins 0.000 description 1
- 229920000232 polyglycine polymer Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 230000029279 positive regulation of transcription, DNA-dependent Effects 0.000 description 1
- 238000011533 pre-incubation Methods 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 230000001023 pro-angiogenic effect Effects 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 230000013777 protein digestion Effects 0.000 description 1
- 229940124272 protein stabilizer Drugs 0.000 description 1
- XNSAINXGIQZQOO-SRVKXCTJSA-N protirelin Chemical compound NC(=O)[C@@H]1CCCN1C(=O)[C@@H](NC(=O)[C@H]1NC(=O)CC1)CC1=CN=CN1 XNSAINXGIQZQOO-SRVKXCTJSA-N 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 239000012857 radioactive material Substances 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 229960003876 ranibizumab Drugs 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 206010038038 rectal cancer Diseases 0.000 description 1
- 201000001275 rectum cancer Diseases 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 230000006884 regulation of angiogenesis Effects 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 230000002207 retinal effect Effects 0.000 description 1
- 230000000552 rheumatic effect Effects 0.000 description 1
- 210000000582 semen Anatomy 0.000 description 1
- 239000003001 serine protease inhibitor Substances 0.000 description 1
- 238000009097 single-agent therapy Methods 0.000 description 1
- 201000000849 skin cancer Diseases 0.000 description 1
- 201000003708 skin melanoma Diseases 0.000 description 1
- 201000002314 small intestine cancer Diseases 0.000 description 1
- 239000006104 solid solution Substances 0.000 description 1
- 208000037959 spinal tumor Diseases 0.000 description 1
- 206010041823 squamous cell carcinoma Diseases 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000009469 supplementation Effects 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 206010043207 temporal arteritis Diseases 0.000 description 1
- 229950001790 tendamistat Drugs 0.000 description 1
- 108010037401 tendamistate Proteins 0.000 description 1
- 108010013645 tetranectin Proteins 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 229960002175 thyroglobulin Drugs 0.000 description 1
- 201000002510 thyroid cancer Diseases 0.000 description 1
- FGMPLJWBKKVCDB-UHFFFAOYSA-N trans-L-hydroxy-proline Natural products ON1CCCC1C(O)=O FGMPLJWBKKVCDB-UHFFFAOYSA-N 0.000 description 1
- 230000005026 transcription initiation Effects 0.000 description 1
- 230000002103 transcriptional effect Effects 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000001131 transforming effect Effects 0.000 description 1
- 230000008733 trauma Effects 0.000 description 1
- 238000011277 treatment modality Methods 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- 239000002753 trypsin inhibitor Substances 0.000 description 1
- 230000005747 tumor angiogenesis Effects 0.000 description 1
- 239000000439 tumor marker Substances 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 201000005112 urinary bladder cancer Diseases 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 210000004291 uterus Anatomy 0.000 description 1
- 206010046885 vaginal cancer Diseases 0.000 description 1
- 208000013139 vaginal neoplasm Diseases 0.000 description 1
- 201000005102 vulva cancer Diseases 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/22—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against growth factors ; against growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/475—Growth factors; Growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/475—Growth factors; Growth regulators
- C07K14/515—Angiogenesic factors; Angiogenin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2318/00—Antibody mimetics or scaffolds
- C07K2318/20—Antigen-binding scaffold molecules wherein the scaffold is not an immunoglobulin variable region or antibody mimetics
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Gastroenterology & Hepatology (AREA)
- Toxicology (AREA)
- Zoology (AREA)
- Immunology (AREA)
- Vascular Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Epidemiology (AREA)
Abstract
Description
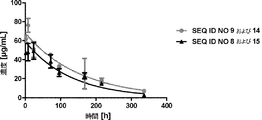
血管新生、すなわち既存の血管からの新しい血管の形成は、多くの生理学的プロセスおよび病理学的プロセスに不可欠である。通常は、血管新生は血管新生促進因子および抗血管新生因子によってしっかりと調節されているが、癌、眼の新血管新生疾患、関節炎、および乾癬などの疾患の場合には、このプロセスはおかしくなり得る。Folkman, J., Nat. Med., 1:27-31 (1995)(非特許文献1)。無秩序な血管新生または望まれない血管新生に関連していることが公知であるいくつかの疾患がある。このような疾患には、眼の新血管新生、例えば網膜症(糖尿病性網膜症を含む)、加齢黄斑変性症、乾癬、血管芽細胞腫、血管腫、動脈硬化症、炎症性疾患、例えば、リウマチ様もしくはリウマチ性の炎症性疾患、特に関節炎(関節リウマチを含む)、または他の慢性炎症性障害、例えば慢性喘息、動脈アテローム性硬化または移植後アテローム性動脈硬化症、子宮内膜症、ならびに新生物疾患、例えば、いわゆる固形腫瘍および液状(もしくは造血器)腫瘍(例えば、白血病およびリンパ腫)が含まれるが、それらに限定されるわけではない。望まれない血管新生に関連している他の疾患は、当業者には明らかであると考えられる。
下記のリストは、本明細書の全体を通して使用される用語、語句、および略語を定義するものである。本明細書において列挙され定義される用語はすべて、あらゆる文法的語形を包含することを意図する。
いくつかの態様において、本開示の融合ポリペプチドは、少なくとも2つのサブユニットを任意の順序で含む:VEGF-Aに特異的な完全長免疫グロブリンまたはその抗原結合ドメインを含む第1のサブユニット、およびAng-2に特異的なリポカリンムテインを含む第2のサブユニット。これらのサブユニットは、共有結合、例えばペプチド結合によって連結され得る。
いくつかの態様において、融合ポリペプチドに関して、第1のサブユニットは、VEGF-Aに特異的な完全長免疫グロブリンまたはその抗原結合ドメインを含む。免疫グロブリンは、例えば、IgG1、IgG2、IgG3、またはIgG4であってよく、優先的にはIgG1である。別の態様において、免疫グロブリンは、VEGF-Aに対するモノクローナル抗体である。このような免疫グロブリンのいくつかの例示的な例には、例えば、ベバシズマブ(商品名アバスチン)およびラニビズマブ(商品名ルセンティス)が含まれる。
本明細書において使用される場合、「リポカリン」は、複数の(好ましくは4つの)ループによって2つ1組で片端が連結されている複数の(好ましくは8本の)β鎖を含み、それによって結合ポケットを画定している円柱状βプリーツシート超二次構造領域を有する、重量約18〜20kDAの単量体タンパク質と定義される。その他の点では強固なリポカリン骨格におけるループのこの多様性こそが、サイズ、形状、および化学的特徴が異なる標的を収容する能力をそれぞれ有するリポカリンファミリーメンバー間の、種々の異なる結合様式をもたらしている(例えば、Flower, D.R. (1996)、前記; Flower, D.R. et al. (2000)、前記、またはSkerra, A. (2000) Biochim. Biophys. Acta 1482, 337-350に総説がある)。実際、リポカリンファミリーのタンパク質は、幅広いリガンドに結合するように自然に進化しており、それらは、全体的配列保存は異常に低レベルである(多くの場合、20%未満の配列同一性を有する)が、高度に保存された全体的フォールディングパターンは保持している。様々なリポカリンにおける位置間の対応は、当業者に周知である。例えば米国特許第7,250,297号を参照されたい。
1つの局面において、本開示は、Ang-2結合ヒトリポカリン2(ヒトLcn2またはhNGAL)ムテインを含む融合ポリペプチドを提供する。
。いくつかの態様において、本開示の融合ポリペプチドに含まれるhNGALムテインは、成熟hNGALのこれらの配列位置に、2個またはそれ以上、例えば、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、もしくはさらにそれ以上、またはすべての変異アミノ酸残基を含む。
。アミノ酸置換のこれらのセットのそれぞれは、Gln28→HisおよびCys87→Serの置換を、更に含んでいてもよい。
本開示の融合ポリペプチドとの関連で本明細書において使用される場合、Ang-2に結合するムテインに関して、「に特異的な」という用語は、そのムテインがAng-2を標的とするか、Ang-2に結合するか、またはAng-2と反応することを含む。したがって、標的とすること、結合すること、または反応することは、ムテインがAng-2に特異的に結合することを含む。この文脈において「特異的に」という用語は、ムテインが本明細書において説明するようにAng-2と係合するが、別の標的とは本質的に反応しないことを意味する。ムテインが本明細書において上記に定義したように標的に特異的に結合するかまたは反応するかどうかは、特に、本開示の融合ポリペプチドに含まれるhNGALムテインとAng-2の反応を該ムテインと別の標的の反応と比較することによって、容易に試験することができる。「特異的結合」はまた、例えば、ウェスタンブロット、ELISA試験、RIA試験、ECL試験、IRMA試験、FACS、IHC、およびペプチドスキャンに基づいて判定することもできる。
。他の置換もまた許容され、経験に基づいて、または他の公知の保存的置換もしくは非保存的置換を踏まえて、決定することができる。さらなる方針として、以下の8個のグループはそれぞれ、互いにとっての保存的置換を定めるように典型的に選ぶことができるアミノ酸を含む:
a. アラニン(Ala)、グリシン(Gly);
b. アスパラギン酸(Asp)、グルタミン酸(Glu);
c. アスパラギン(Asn)、グルタミン(Gln);
d. アルギニン(Arg)、リジン(Lys);
e. イソロイシン(Ile)、ロイシン(Leu)、メチオニン(Met)、バリン(Val);
f. フェニルアラニン(Phe)、チロシン(Tyr)、トリプトファン(Trp);
g. セリン(Ser)、トレオニン(Thr);および
h. システイン(Cys)、メチオニン(Met)。
である。
血管新生には、正常内皮細胞の表面の受容体に血管内皮増殖因子(VEGF)のようなシグナル伝達分子が結合することが必要である。VEGFおよび他の内皮増殖因子が内皮細胞上のそれらの受容体に結合すると、新しい血管の成長および存続を促進する、これらの細胞内のシグナルが働き出す(initiated)。有効な抗血管新生治療様式の開発への1つのアプローチは、血管新生に関与している様々な標的、好ましくは、十分に離れたシグナル伝達経路に影響を与える標的に作用する作用物質を組み合わせることであった。
項目1。 第1のサブユニットおよび第2のサブユニットを含む融合ポリペプチドであって、第1のサブユニットが、VEGF-Aに特異的な免疫グロブリンまたはその抗原結合ドメインから構成されており、第2のサブユニットが、Ang-2に特異的なヒト好中球ゼラチナーゼ関連リポカリン(hNGAL)ムテインから構成されている、融合ポリペプチド。
項目2。 約1nMまたはそれ未満のEC50値でVEGF-Aに結合することができる、項目1記載の融合ポリペプチド。
項目3。 実施例2に本質的に説明されるELISAアッセイ法において測定される場合、約1nMまたはそれ未満のEC50値でVEGF-Aに結合することができる、項目1記載の融合ポリペプチド。
項目4。 約200pMまたはそれ未満のEC50値でVEGF-Aに結合することができる、項目1記載の融合ポリペプチド。
項目5。 実施例2に本質的に説明されるELISAアッセイ法において測定される場合、約200pMまたはそれ未満のEC50値でVEGF-Aに結合することができる、項目1記載の融合ポリペプチド。
項目6。 約1nMまたはそれ未満のEC50値でAng-2に結合することができる、項目1記載の融合ポリペプチド。
項目7。 実施例3に本質的に説明されるELISAアッセイ法において測定される場合、約1nMまたはそれ未満のEC50値でAng-2に結合することができる、項目1記載の融合ポリペプチド。
項目8。 約250pMまたはそれ未満のEC50値でAng-2に結合することができる、項目1記載の融合ポリペプチド。
項目9。 実施例3に本質的に説明されるELISAアッセイ法において測定される場合、約250pMまたはそれ未満のEC50値でAng-2に結合することができる、項目1記載の融合ポリペプチド。
項目10。 VEGF-AおよびAng-2に同時に結合することができ、
VEGF-Aに結合するサブユニットが、約1nMまたはそれ未満のEC50値でその標的に結合できる、項目1記載の融合ポリペプチド。
項目11。 VEGF-AおよびAng-2に同時に結合することができ、
VEGF-Aに結合するサブユニットが、実施例4に本質的に説明されるELISAアッセイ法において測定される場合、約1nMまたはそれ未満のEC50値でその標的に結合できる、項目1記載の融合ポリペプチド。
項目12。 VEGF-AおよびAng-2に同時に結合することができ、
VEGF-Aに結合するサブユニットが、約500pMまたはそれ未満のEC50値でその標的に結合できる、項目1記載の融合ポリペプチド。
項目13。 VEGF-AおよびAng-2に同時に結合することができ、
VEGF-Aに結合するサブユニットが、実施例4に本質的に説明されるELISAアッセイ法において測定される場合、約500pMまたはそれ未満のEC50値でその標的に結合できる、項目1記載の融合ポリペプチド。
項目14。 VEGF-AおよびAng-2に同時に結合することができ、
Ang-2に結合するサブユニットが、約1.5nMまたはそれ未満のEC50値でその標的に結合できる、項目1記載の融合ポリペプチド。
項目15。 VEGF-AおよびAng-2に同時に結合することができ、
Ang-2に結合するサブユニットが、実施例4に本質的に説明されるELISAアッセイ法において測定される場合、約1.5nMまたはそれ未満のEC50値でその標的に結合できる、項目1記載の融合ポリペプチド。
項目16。 VEGF-AおよびAng-2に同時に結合することができ、
Ang-2に結合するサブユニットが、約600pMまたはそれ未満のEC50値でその標的に結合できる、項目1記載の融合ポリペプチド。
項目17。 VEGF-AおよびAng-2に同時に結合することができ、Ang-2に結合するサブユニットが、実施例4に本質的に説明されるELISAアッセイ法において測定される場合、約600pMまたはそれ未満のEC50値でその標的に結合できる、項目1記載の融合ポリペプチド。
項目18。 約1nMまたはそれ未満のEC50値で、ヒトTie-2へのヒトAng-2の結合を妨害する能力を有する、項目1記載の融合ポリペプチド。
項目19。 実施例5に本質的に説明される競合細胞ECL様式において、約1nMまたはそれ未満のEC50値で、ヒトTie-2へのヒトAng-2の結合を妨害する能力を有する、項目1記載の融合ポリペプチド。
項目20。 VEGF-Aの生物学的機能のうちの少なくとも1つを低減させるか、または妨害する能力を有する、項目1記載の融合ポリペプチド。
項目21。 実施例6に本質的に説明される機能的な細胞に基づく増殖アッセイ法において測定されるようなVEGF-Aの生物学的機能のうちの少なくとも1つ、特にVEGF-A依存性の細胞増殖を低減させるか、または妨害する能力を有する、項目1記載の融合ポリペプチド。
項目22。 ウサギにおける半減期が約3〜5日である、項目1記載の融合ポリペプチド。
項目23。 実施例7に本質的に説明される薬物動態アッセイ法において測定されるように、ウサギにおける半減期が約3〜5日である、項目1記載の融合ポリペプチド。
項目24。 ヒト対象における半減期が約3〜5日である、項目1記載の融合ポリペプチド。
項目25。 ムテインが、成熟hNGALの直鎖ポリペプチド配列(SEQ ID NO: 1)の位置28、36、40、41、49、52、65、68、70、72〜74、77、79、81、87、96、100、103、106、116、125、126、127、129、132、および134に対応する位置に、1つまたは複数の変異アミノ酸残基を含む、前記項目のいずれか一項記載の融合ポリペプチド。
項目26。 ムテインが、成熟hNGALの直鎖ポリペプチド配列の位置36、40、41、49、52、68、70、72〜73、77、79、81、96、100、103、106、125、127、132、および134に、1つまたは複数の変異アミノ酸残基を含む、前記項目のいずれか一項記載の融合ポリペプチド。
項目27。 成熟hNGALの直鎖ポリペプチド配列と比較して、ムテインが、以下のアミノ酸置換のセットの1つを含む、前記項目のいずれか一項記載の融合ポリペプチド:
項目28。 成熟hNGALの直鎖ポリペプチド配列と比較して、ムテインが、以下の変異アミノ酸置換のセットの1つを含む、前記項目のいずれか一項記載の融合ポリペプチド:Gln28→His;Asn65→Asp;Lys74→Glu;Cys87→Ser;Asn116→Asp;Val126→Met、およびAsn129→Asp。
項目29。 ムテインが、成熟hNGALの直鎖ポリペプチド配列(SEQ ID NO: 1)の配列位置28、36、40、41、49、52、65、68、70、72〜74、77、79、81、87、96、100、103、106、116、125、126、127、129、132、および134に、少なくとも1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、または21個の変異アミノ酸残基を含む、前記項目のいずれか一項記載の融合ポリペプチド。
項目30。 成熟hNGALの直鎖ポリペプチド配列と比較して、ムテインが、以下のアミノ酸置換のセットの1つを含み:
その際、アミノ酸置換の各セットが、置換Gln28→HisおよびCys87→Serを任意でさらに含む、前記項目のいずれか一項記載の融合ポリペプチド。
項目31。 第2のサブユニットが、SEQ ID NO: 2および3からなる群より選択されるアミノ酸配列を有するムテインおよびその機能的断片または変種を含む、前記項目のいずれか一項記載の融合ポリペプチド。
項目32。 ムテインのアミノ酸配列が、SEQ ID NO: 2および3からなる群より選択されるアミノ酸配列に対して少なくとも85%、少なくとも90%、少なくとも95%、少なくとも97%、または少なくとも98%の配列同一性を有する、前記項目のいずれか一項記載の融合ポリペプチド。
項目33。 1つまたは複数のサブユニットが、有機分子、酵素標識、放射性標識、着色標識、蛍光標識、発色標識、発光標識、ハプテン、ジゴキシゲニン、ビオチン、細胞分裂阻害剤、毒素、金属複合体、金属、およびコロイド金からなる群より選択される化合物にコンジュゲートされている1つまたは複数の要素を有する、前記項目のいずれか一項記載の融合ポリペプチド。
項目34。 第2のサブユニットが、ヒトAng-2およびマウスAng-2の両方と交差反応性であるムテインを含む、項目33記載の融合ポリペプチド。
項目35。 第2のサブユニットが、約5nMまたはそれ未満のEC50値によって示される親和性でマウスAng-2に結合することができるムテインを含む、項目34記載の融合ポリペプチド。
項目36。 第2のサブユニットが、標準ELISAアッセイ法において測定された場合に、約5nMまたはそれ未満のEC50値によって示される親和性でマウスAng-2に結合することができるムテインを含む、項目34記載の融合ポリペプチド。
項目37。 第2のサブユニットに由来するムテインが、ポリペプチドの血清半減期を延長する化合物にコンジュゲートされていてよい、前記項目のいずれか一項記載の融合ポリペプチド。
項目38。 血清半減期を延長する化合物が、ポリアルキレングリコール分子、ヒドロエチルデンプン、免疫グロブリンのFc部分、免疫グロブリンのCH3ドメイン、免疫グロブリンのCH4ドメイン、アルブミン結合ペプチド、およびアルブミン結合タンパク質からなる群より選択される、項目37記載の融合ポリペプチド。
項目39。 ポリアルキレングリコールが、ポリエチレン(PEG)またはその活性化された誘導体である、項目38記載の融合ポリペプチド。
項目40。 第1のサブユニットおよび第2のサブユニットが、ペプチド結合によって連結されている、前記項目のいずれか一項記載の融合ポリペプチド。
項目41。 第1のサブユニットおよび第2のサブユニットが、第2のサブユニットのリポカリンムテインのN末端と第1のサブユニットの免疫グロブリンの重鎖定常領域(CH)のC末端との間のペプチド結合によって連結されている、前記項目のいずれか一項記載の融合ポリペプチド。
項目42。 第1のサブユニットが、第2のサブユニットのリポカリンムテインのN末端と第1のサブユニットの免疫グロブリンの軽鎖定常領域(CL)のC末端との間のペプチド結合によって第2のサブユニットに連結されている、前記項目のいずれか一項記載の融合ポリペプチド。
項目43。 第1のサブユニットが、第2のサブユニットのリポカリンムテインのC末端と第1のサブユニットの免疫グロブリンの軽鎖定常領域(CH)のN末端との間のペプチド結合によって第2のサブユニットに連結されている、前記項目のいずれか一項記載の融合ポリペプチド。
項目44。 第1のサブユニットが、第2のサブユニットのリポカリンムテインのC末端と第1のサブユニットの免疫グロブリンの軽鎖定常領域(CL)のN末端との間のペプチド結合によって第2のサブユニットに連結されている、前記項目のいずれか一項記載の融合ポリペプチド。
項目45。 ペプチド結合が(G4S)3ペプチドリンカーによって提供される、前記項目のいずれか一項記載の融合ポリペプチド。
項目46。 ペプチド結合が、少なくとも4つのグリシン残基および少なくとも1つのセリン残基を含む、前記項目のいずれか一項記載の融合ポリペプチド。
項目47。 ペプチド結合が、少なくとも1つの(G4S)単位を含む、前記項目のいずれか一項記載の融合ポリペプチド。
項目48。 (G4S)単位がn回(n=1〜10)繰り返されていてよい、項目48記載の融合ポリペプチド。
項目49。 免疫グロブリンがモノクローナル抗体である、前記項目のいずれか一項記載の融合ポリペプチド。
項目50。 モノクローナル抗体が、SEQ ID NO: 8の重鎖に含まれる重鎖相補性決定領域(CDR)およびSEQ ID NO: 9の軽鎖に含まれる軽鎖CDRを有する、項目51記載の融合ポリペプチド。
項目51。 モノクローナル抗体が、SEQ ID NO: 8によって定められる重鎖およびSEQ ID NO: 9によって定められる軽鎖を有する、前記項目のいずれか一項記載の融合ポリペプチド。
項目52。 モノクローナル抗体がIgG1骨格を有する、前記項目のいずれか一項記載の融合ポリペプチド。
項目53。 モノクローナル抗体がベバシズマブである、前記項目のいずれか一項記載の融合ポリペプチド。
項目54。 SEQ ID NO: 9および10に示されるアミノ酸、またはSEQ ID NO: 8および11に示されるアミノ酸、またはSEQ ID NO: 9および12に示されるアミノ酸、またはSEQ ID NO: 8および13に示されるアミノ酸、またはSEQ ID NO: 9および14に示されるアミノ酸、またはSEQ ID NO: 8および15に示されるアミノ酸、またはSEQ ID NO: 9および16に示されるアミノ酸、またはSEQ ID NO: 8および17に示されるアミノ酸を含む、前記項目のいずれか一項記載の融合ポリペプチド。
項目55。 項目1〜54のいずれか一項記載のポリペプチドをコードするヌクレオチド配列を含む核酸分子。
項目56。 核酸分子の発現を可能にする調節配列と機能的に連結されている、項目55記載の核酸分子。
項目57。 ベクターまたはファージミドベクター中に含まれている、項目55または56記載の核酸分子。
項目58。 項目56または57記載の核酸分子を含む宿主細胞。
項目59。 ムテインをコードしている核酸配列を発現させる段階を含む、前記項目のいずれか一項記載の融合ポリペプチドを作製する方法。
項目60。 融合ポリペプチドが、細菌宿主生物または真核宿主生物において産生され、かつこの宿主生物またはその培養物から単離される、項目59記載の方法。
項目61。 項目1〜54のいずれか一項記載の融合ポリペプチドを含む薬学的組成物。
項目62。 無秩序な血管新生に関連している疾患または障害の治療、予防、および/または改善に適した薬学的組成物を製造するための、項目1〜54のいずれか一項記載の融合ポリペプチドの使用。
項目63。 対象中のAng-2およびVEGF-Aに同時に結合するための、項目1〜54のいずれか一項記載の融合ポリペプチドの使用。
項目64。 対象中のAng-2およびVEGF-Aに同時に結合するための、項目1〜54のいずれか一項記載の融合ポリペプチドまたはこのような融合ポリペプチドを含む組成物の使用。
項目65。 対象における血管新生を阻害するための、項目1〜54のいずれか一項記載の融合ポリペプチドまたはこのような融合ポリペプチドを含む組成物の使用。
項目66。 「滲出」型の加齢黄斑変性症(ARMD)に罹患している患者を治療するための、項目1〜54のいずれか一項記載のポリペプチドまたはこのような融合ポリペプチドを含む組成物の使用。
項目67。 診断目的で血管新生因子を検出する際の、項目1〜54のいずれか一項記載のポリペプチドまたはこのような融合ポリペプチドを含む組成物の使用。
項目69。 項目1〜54のいずれか一項記載の融合ポリペプチドまたはこのような融合ポリペプチドを含む組成物を対象に投与する段階を含む、対象中のAng-2およびVEGF-Aに同時に結合する方法。
項目70。 有効量の、項目1〜54のいずれか一項記載の融合ポリペプチドまたはこのような融合ポリペプチドを含む組成物を対象に投与する段階を含む、対象における血管新生を阻害するか、または低減させる方法。
項目71。 有効量の、項目1〜54のいずれか一項記載の融合ポリペプチドまたはこのような融合ポリペプチドを含む組成物を対象に投与する段階を含む、対象における無秩序な血管新生に関連している疾患または障害を治療、予防、または改善する方法。
項目72。 疾患または障害が、腫瘍増殖、眼障害、血管疾患、炎症性疾患または感染症、癌、眼の新血管新生疾患、関節炎、および乾癬からなる群より選択される、項目71記載の方法または項目62記載の使用。
項目73。 項目1〜54のいずれか一項記載の融合ポリペプチドまたはこのような融合ポリペプチドを含む組成物を含む、診断用または分析用のキット。
実施例1:融合ポリペプチドの発現および解析
VEGF-AおよびAng-2と同時に結合するように、本発明者らは、SEQ ID NO: 8および9によって提供される重鎖および軽鎖を有する抗体とSEQ ID NO: 2またはSEQ ID NO: 3のリポカリンムテインのうちの1つを、明確な構造を持たない(G4S)3リンカー(SEQ ID NO: 19)を介して互いに融合させて、いくつかの代表的な抗体-リポカリンムテイン融合ポリペプチドを作製した。設計された様々な形態を図1に示している。このような融合ポリペプチド(SEQ ID NO: 9および10、SEQ ID NO: 8および11、SEQ ID NO: 9および14、SEQ ID NO: 8および15)は、抗体の2つのC末端のいずれか1つへの、SEQ ID NO: 2またはSEQ ID NO: 3のリポカリンムテインのうちの1つの融合によって、作製した。
本発明者らは、ELISAアッセイ法を用いて、組換えVEGF-Aに対する融合ポリペプチドの親和性を測定した。標的をPBSに溶解し(5μg/mL)、4℃で一晩、マイクロタイタープレートにコーティングした。各インキュベーション段階の後に、0.05%(v/v)Tween20を添加したPBS(PBS-T)80μLでプレートを5回洗浄した。これらのプレートを室温で1時間、PBS中2%BSA(w/v)でブロックし、続いて洗浄した。様々な濃度のベンチマーク二重特異性抗体(SEQ ID NO: 20、21、22、および23)ならびに陽性対照抗体 (SEQ ID NO: 8および9)または融合ポリペプチド(SEQ ID NO: 9および10、SEQ ID NO: 8および11、SEQ ID NO: 9および14、SEQ ID NO: 8および15)をウェルに添加し、室温で1時間インキュベーションし、次に洗浄段階を行った。試験中に結合された作用物質を、PBS-T中の1:5000希釈された抗ヒトIgG Fc-HRP(109-035-098番、Jackson Laboratory)と共にインキュベーションした後に検出した。さらなる洗浄段階の後、蛍光原性HRP基質(QuantaBlu, Thermo)を各ウェルに添加し、蛍光マイクロプレートリーダーを用いて蛍光強度を検出した。
本発明者らは、ELISAアッセイ法を用いて、組換えヒトAng-2(Creative BioMart)に対する融合ポリペプチドおよびSEQ ID NO: 2またはSEQ ID NO: 3の陽性対照リポカリンムテインの親和性を測定した。標的をPBSに溶解し(5μg/mL)、4℃で一晩、マイクロタイタープレートにコーティングした。各インキュベーション段階の後に、80μLのPBS-Tでプレートを5回洗浄した。これらのプレートを室温で1時間、PBS中2%BSA(w/v)でブロックし、続いて洗浄した。様々な濃度の単量体型のAng-2特異的リポカリンムテイン(SEQ ID NO: 2もしくはSEQ ID NO: 3)または融合ポリペプチド(SEQ ID NO: 9および10、SEQ ID NO: 8および11、SEQ ID NO: 9および14、SEQ ID NO: 8および15)またはベンチマーク二重特異性対照(SEQ ID NO: 20、21、22、および23)をウェルに添加し、室温で1時間インキュベーションし、次に洗浄段階を行った。試験中に結合された作用物質を、PBS-T中の1:1000希釈された、HRPにコンジュゲートされた抗リポカリン抗体、またはPBS-T中の1:5000希釈された抗ヒトIgG Fc-HRP(109-035-098番、Jackson Laboratory)と共に室温で1時間インキュベーションした後に検出した。さらなる洗浄段階の後、蛍光原性HRP基質(QuantaBlu, Thermo)を各ウェルに添加し、蛍光マイクロプレートリーダーを用いて蛍光強度を検出した。
VEGF-AおよびAng-2への融合ポリペプチドの同時結合を実証するために、二重結合ELISA様式を使用した。PBS中組換えVEGF-A(R&D Systems)(5μg/mL)を、4℃で一晩、マイクロタイタープレートにコーティングした。各インキュベーション段階の後に、Biotek ELx405 select CW洗浄機を用いて、0.05%(v/v)Tween20を添加したPBS(PBS-T)80μLでプレートを5回洗浄した。これらのプレートを室温で1時間、PBS中2%BSA(w/v)でブロックし、続いて再び洗浄した。様々な濃度の融合ポリペプチドをウェルに添加し、室温で1時間インキュベーションし、次に洗浄段階を行った。続いて、ビオチン標識ヒトAng-2を、PBS-T中1μg/mLの一定濃度で1時間、添加した。洗浄後、エクストラアビジン-HRP(Sigma-Adrich、PBS-T中1:5000)をウェルに1時間添加した。さらなる洗浄段階の後、蛍光原性HRP基質(QuantaBlu, Thermo)を各ウェルに添加し、蛍光マイクロプレートリーダーを用いて蛍光強度を検出した。
融合ポリペプチドがヒトAng-2に競合的様式で結合するかどうかを、競合細胞電気化学発光(ECL)アッセイ様式を用いて、hTie-2過剰発現HEK細胞において試験した(図5)。この実験において、一定濃度のヒトAng-2を、様々な濃度の融合ポリペプチド(SEQ ID NO: 9および10、SEQ ID NO: 8および11、SEQ ID NO: 9および14、SEQ ID NO: 8および15)、陽性対照リポカリンムテイン(SEQ ID NO: 2またはSEQ ID NO: 3)、ベンチマーク抗体(SEQ ID NO: 6および7)、ならびに陰性対照(SEQ ID NO: 1およびhIgG1)と共に1時間インキュベーションした。溶液中でのこのプレインキュベーションの後、一定量の結合部分/Ang-2混合物を、hTie-2過剰発現HEK細胞でコーティングしたMSDプレートに移して、hTie-2に結合するのを妨害されなかったhAng-2の濃度をそれぞれ測定した。
融合ポリペプチド(SEQ ID NO: 9および10、SEQ ID NO: 8および11、SEQ ID NO: 9および14、SEQ ID NO: 8および15)、陽性対照リポカリンムテイン(SEQ ID NO: 2またはSEQ ID NO: 3)、ベンチマーク抗体(SEQ ID NO: 6および7;SEQ ID NO: 8および9)、ならびに陰性対照(SEQ ID NO: 1およびhIgG1)がVEGF-Aの生物活性を無効にする能力を、リンパ微小管内皮細胞(LEC)を使用する短期増殖バイオアッセイ法を適用することによって評価した。LEC増殖は、hVEGF-AまたはhAng-2いずれかの効力を消す効果を有する作用物質によって、阻害することができる。このアッセイ法にhAng-2は直接的に添加されないものの、内因性hAng-2がLEC細胞によって放出される。
融合ポリペプチドのインビボ評価では、ウサギ(HY79b;有色)に試験物質を硝子体内注射し、続いて、336時間の期間に渡って、血液、硝子体液、および網膜組織を試料採取した。手短に言えば、ウサギ(処置1つにつきn=16)の片方の眼(右)に100ugの融合ポリペプチド(SEQ ID NO: 9および14、SEQ ID NO: 8および15)を注射し、他方の眼(左)を対照として使用した(すなわち、未処置)。眼の検査を定期的に実施して、ウサギの耳の全般的健康を評価した。
Claims (20)
- 第1のサブユニットおよび第2のサブユニットを含む融合ポリペプチドであって、該第1のサブユニットが、VEGF-Aに特異的な免疫グロブリンまたはその抗原結合ドメインから構成されており、該第2のサブユニットが、Ang-2に特異的なヒト好中球ゼラチナーゼ関連リポカリン(hNGAL)ムテインから構成されている、融合ポリペプチド。
- 約1nMまたはそれ未満のEC50値でVEGF-Aに結合することができる、請求項1記載の融合ポリペプチド。
- 約200pMまたはそれ未満のEC50値でVEGF-Aに結合することができる、請求項1記載の融合ポリペプチド。
- 約1nMまたはそれ未満のEC50値でAng-2に結合することができる、請求項1記載の融合ポリペプチド。
- 約250pMまたはそれ未満のEC50値でAng-2に結合することができる、請求項1記載の融合ポリペプチド。
- VEGF-AおよびAng-2に同時に結合することができ、
VEGF-Aに結合するサブユニットが、約1nMまたはそれ未満のEC50値でその標的に結合できる、請求項1記載の融合ポリペプチド。 - VEGF-AおよびAng-2に同時に結合することができ、
VEGF-Aに結合するサブユニットが、約500pMまたはそれ未満のEC50値でその標的に結合できる、請求項1記載の融合ポリペプチド。 - VEGF-AおよびAng-2に同時に結合することができ、
Ang-2に結合するサブユニットが、約1.5nMまたはそれ未満のEC50値でその標的に結合できる、請求項1記載の融合ポリペプチド。 - ムテインが、成熟hNGALの直鎖ポリペプチド配列(SEQ ID NO: 1)の位置28、36、40、41、49、52、65、68、70、72〜74、77、79、81、87、96、100、103、106、116、125、126、127、129、132、および134に対応する位置に、1つまたは複数の変異アミノ酸残基を含む、前記請求項のいずれか一項記載の融合ポリペプチド。
- ムテインが、成熟hNGALの直鎖ポリペプチド配列の位置36、40、41、49、52、68、70、72〜73、77、79、81、96、100、103、106、125、127、132、および134に、1つまたは複数の変異アミノ酸残基を含む、前記請求項のいずれか一項記載の融合ポリペプチド。
- 成熟hNGALの直鎖ポリペプチド配列と比較して、ムテインが、以下の変異アミノ酸置換のセットの1つを含む、前記請求項のいずれか一項記載の融合ポリペプチド:
Gln28→His;Asn65→Asp;Lys74→Glu;Cys87→Ser;Asn116→Asp;Val126→Met、およびAsn129→Asp。 - ムテインが、成熟hNGALの直鎖ポリペプチド配列(SEQ ID NO: 1)の配列位置28、36、40、41、49、52、65、68、70、72〜74、77、79、81、87、96、100、103、106、116、125、126、127、129、132、および134に、少なくとも1個、2個、3個、4個、5個、6個、7個、8個、9個、10個、11個、12個、13個、14個、15個、16個、17個、18個、19個、20個、または21個の変異アミノ酸残基を含む、前記請求項のいずれか一項記載の融合ポリペプチド。
- 第2のサブユニットが、SEQ ID NO: 2および3からなる群より選択されるアミノ酸配列を有するムテインおよびその機能的断片または変種を含む、前記請求項のいずれか一項記載の融合ポリペプチド。
- ムテインのアミノ酸配列が、SEQ ID NO: 2および3からなる群より選択されるアミノ酸配列に対して少なくとも85%、少なくとも90%、少なくとも95%、少なくとも97%、または少なくとも98%の配列同一性を有する、前記請求項のいずれか一項記載の融合ポリペプチド。
- 免疫グロブリンがモノクローナル抗体である、前記請求項のいずれか一項記載の融合ポリペプチド。
- モノクローナル抗体が、SEQ ID NO: 8の重鎖に含まれる重鎖相補性決定領域(CDR)およびSEQ ID NO: 9の軽鎖に含まれる軽鎖CDRを有する、請求項17記載の融合ポリペプチド。
- モノクローナル抗体がベバシズマブである、請求項17記載の融合ポリペプチド。
- SEQ ID NO: 9および10のアミノ酸、またはSEQ ID NO: 8および11のアミノ酸、またはSEQ ID NO: 9および12のアミノ酸、またはSEQ ID NO: 8および13のアミノ酸、またはSEQ ID NO: 9および14のアミノ酸、またはSEQ ID NO: 8および15のアミノ酸、またはSEQ ID NO: 9および16のアミノ酸、またはSEQ ID NO: 8および17のアミノ酸を含む、前記請求項のいずれか一項記載の融合ポリペプチド。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP15197019 | 2015-11-30 | ||
| EP15197019.1 | 2015-11-30 | ||
| PCT/AU2016/051168 WO2017091850A1 (en) | 2015-11-30 | 2016-11-30 | Novel anti-angiogenic fusion polypeptides |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2019505565A true JP2019505565A (ja) | 2019-02-28 |
| JP2019505565A5 JP2019505565A5 (ja) | 2020-01-16 |
Family
ID=54754521
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018546726A Pending JP2019505565A (ja) | 2015-11-30 | 2016-11-30 | 新規の抗血管新生融合ポリペプチド |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US10703810B2 (ja) |
| EP (1) | EP3383921A4 (ja) |
| JP (1) | JP2019505565A (ja) |
| KR (1) | KR20180083943A (ja) |
| CN (1) | CN108699162A (ja) |
| AU (1) | AU2016363668A1 (ja) |
| BR (1) | BR112018010887A2 (ja) |
| CA (1) | CA3004918A1 (ja) |
| EA (1) | EA035586B1 (ja) |
| MX (1) | MX2018006559A (ja) |
| SG (2) | SG10201911499TA (ja) |
| WO (1) | WO2017091850A1 (ja) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3094650A2 (en) * | 2014-01-13 | 2016-11-23 | Pieris Pharmaceuticals GmbH | Multi-specific polypeptide useful for localized tumor immunomodulation |
| US9840553B2 (en) | 2014-06-28 | 2017-12-12 | Kodiak Sciences Inc. | Dual PDGF/VEGF antagonists |
| WO2017117464A1 (en) | 2015-12-30 | 2017-07-06 | Kodiak Sciences Inc. | Antibodies and conjugates thereof |
| EP3758737A4 (en) | 2018-03-02 | 2022-10-12 | Kodiak Sciences Inc. | IL-6 ANTIBODIES AND FUSION CONSTRUCTS AND CONJUGATES THEREOF |
| CN109829882B (zh) * | 2018-12-18 | 2020-10-27 | 广州比格威医疗科技有限公司 | 一种糖尿病视网膜病变分期预测方法 |
| EP4041312A4 (en) | 2019-10-10 | 2023-12-20 | Kodiak Sciences Inc. | METHOD FOR TREATING AN EYE DISORDER |
| CN117083305A (zh) * | 2021-03-25 | 2023-11-17 | 南京金斯瑞生物科技有限公司 | 抗体融合蛋白及其用途 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010040508A1 (en) * | 2008-10-08 | 2010-04-15 | F. Hoffmann-La Roche Ag | Bispecific anti-vegf/anti-ang-2 antibodies |
| WO2011117329A1 (en) * | 2010-03-26 | 2011-09-29 | F. Hoffmann-La Roche Ag | Bispecific, bivalent anti-vegf/anti-ang-2 antibodies |
| WO2015177175A2 (en) * | 2014-05-22 | 2015-11-26 | Pieris Ag | Novel specific-binding polypeptides and uses thereof |
Family Cites Families (43)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2032831T5 (es) | 1986-08-19 | 2001-02-16 | Genentech Inc | Dispositivo y dispersion para suministro intrapulmonar de factores de crecimiento polipeptidos y citoquinas. |
| JPH01215289A (ja) | 1988-02-22 | 1989-08-29 | Toa Nenryo Kogyo Kk | 遺伝子組換えによる正常ヒト血清アルブミンaの製造方法 |
| FR2649991B2 (fr) | 1988-08-05 | 1994-03-04 | Rhone Poulenc Sante | Utilisation de derives stables du plasmide pkd1 pour l'expression et la secretion de proteines heterologues dans les levures du genre kluyveromyces |
| US5728553A (en) | 1992-09-23 | 1998-03-17 | Delta Biotechnology Limited | High purity albumin and method of producing |
| ES2245780T3 (es) | 1994-05-18 | 2006-01-16 | Nektar Therapeutics | Metodos y composiciones para la formulacion de interferones como un polvo seco. |
| DE4417598A1 (de) | 1994-05-19 | 1995-12-14 | Max Planck Gesellschaft | Verwendung des Tetracyclinpromotors zur stringent regulierten Produktion von rekombinanten Proteinen in prokaryontischen Zellen |
| WO1996023879A1 (en) | 1995-01-30 | 1996-08-08 | Terrapin Technologies, Inc. | Glubodies - multiplicities of proteins capable of binding a variety of small molecules |
| US5908621A (en) | 1995-11-02 | 1999-06-01 | Schering Corporation | Polyethylene glycol modified interferon therapy |
| US6620413B1 (en) | 1995-12-27 | 2003-09-16 | Genentech, Inc. | OB protein-polymer chimeras |
| DE19641876B4 (de) | 1996-10-10 | 2011-09-29 | Iba Gmbh | Streptavidinmuteine |
| WO1998016873A1 (fr) | 1996-10-14 | 1998-04-23 | Firm Forsat Ltd. | Procede de preparation de dispersions a base de composants chromogenes |
| DE19742706B4 (de) | 1997-09-26 | 2013-07-25 | Pieris Proteolab Ag | Lipocalinmuteine |
| GB9722131D0 (en) | 1997-10-20 | 1997-12-17 | Medical Res Council | Method |
| CA2233725A1 (en) | 1998-03-31 | 1999-09-30 | Hemosol Inc. | Hemoglobin-hydroxyethyl starch complexes |
| RS50144B (sr) | 1998-06-08 | 2009-03-25 | F. Hoffmann-La Roche Ag., | Primena peg-inf-alfa 2a i ribavirina za proizvodnju leka za lečenje hroničnog hepatitisa c |
| US6403564B1 (en) | 1998-10-16 | 2002-06-11 | Schering Corporation | Ribavirin-interferon alfa combination therapy for eradicating detectable HCV-RNA in patients having chronic hepatitis C infection |
| DE19926068C1 (de) | 1999-06-08 | 2001-01-11 | Arne Skerra | Muteine des Bilin-Bindungsproteins |
| US7211395B2 (en) | 2001-03-09 | 2007-05-01 | Dyax Corp. | Serum albumin binding moieties |
| CA2464690A1 (en) | 2001-09-27 | 2003-04-10 | Pieris Proteolab Ag | Muteins of apolipoprotein d |
| WO2003029462A1 (en) | 2001-09-27 | 2003-04-10 | Pieris Proteolab Ag | Muteins of human neutrophil gelatinase-associated lipocalin and related proteins |
| US7691970B2 (en) | 2003-08-25 | 2010-04-06 | Pieris Ag | Muteins of a bilin-binding protein with affinity for a given target |
| WO2005019255A1 (en) | 2003-08-25 | 2005-03-03 | Pieris Proteolab Ag | Muteins of tear lipocalin |
| JP2007284351A (ja) | 2004-07-27 | 2007-11-01 | Osaka Bioscience Institute | アミロイド蛋白質の凝集を抑制する物質とその作用 |
| EP1814988A2 (en) | 2004-11-26 | 2007-08-08 | Pieris AG | Compound with affinity for the cytotoxic t lymphocyte-associated antigen (ctla-4) |
| WO2006078717A2 (en) * | 2005-01-19 | 2006-07-27 | Beth Israel Deaconess Medical Center | Lipocalin 2 for the treatment, prevention, and management of cancer metastasis, angiogenesis, and fibrosis |
| CA2622441A1 (en) | 2005-09-27 | 2007-04-05 | Amunix, Inc. | Proteinaceous pharmaceuticals and uses thereof |
| JP2011501673A (ja) | 2007-10-19 | 2011-01-13 | アボット・ラボラトリーズ | グリコシル化された哺乳動物ngal及びその使用 |
| WO2009142460A2 (en) * | 2008-05-23 | 2009-11-26 | Samsung Electronics Co., Ltd. | Antibody-peptide fused synergibody |
| WO2009156456A1 (en) | 2008-06-24 | 2009-12-30 | Technische Universität München | Muteins of hngal and related proteins with affinity for a given target |
| US8133979B2 (en) | 2008-12-16 | 2012-03-13 | Hoffmann-La Roche Inc. | Antibodies against human angiopoietin 2 |
| CN102448984A (zh) * | 2009-03-27 | 2012-05-09 | 酶遗传学股份有限公司 | 使用包含抗体-受体组合的多特异性结合蛋白的组合物和方法 |
| WO2011069992A2 (en) | 2009-12-07 | 2011-06-16 | Pieris Ag | Muteins of human lipocalin 2 (lcn2, hngal) with affinity for a given target |
| AU2011290751B2 (en) | 2010-08-16 | 2015-08-13 | Pieris Ag | Binding proteins for Hepcidin |
| WO2012065978A1 (en) | 2010-11-15 | 2012-05-24 | Pieris Ag | Muteins of human lipocalin 2 with affinity for glypican-3 (gpc3) |
| PL3495387T3 (pl) * | 2012-07-13 | 2022-01-10 | Roche Glycart Ag | Dwuswoiste przeciwciała anty-VEGF/anty-ANG-2 i ich zastosowanie w leczeniu chorób naczyniowych oka |
| WO2014076321A1 (en) | 2012-11-19 | 2014-05-22 | Pieris Ag | Novel specific-binding polypeptides and uses thereof |
| KR102282134B1 (ko) * | 2013-04-29 | 2021-07-27 | 에프. 호프만-라 로슈 아게 | 인간 fcrn-결합 변형된 항체 및 사용 방법 |
| EP3094650A2 (en) * | 2014-01-13 | 2016-11-23 | Pieris Pharmaceuticals GmbH | Multi-specific polypeptide useful for localized tumor immunomodulation |
| JP6839087B2 (ja) | 2015-01-28 | 2021-03-03 | ピエリス ファーマシューティカルズ ゲーエムベーハー | 血管新生に特異的な新規のタンパク質 |
| AR103477A1 (es) * | 2015-01-28 | 2017-05-10 | Lilly Co Eli | Compuestos de vegfa / ang2 |
| CN107660211A (zh) | 2015-02-18 | 2018-02-02 | 赛诺菲 | 新的对绿脓菌荧光素和绿脓菌螯铁蛋白特异性的蛋白质 |
| SG11201708339QA (en) | 2015-05-04 | 2017-11-29 | Pieris Pharmaceuticals Gmbh | Proteins specific for cd137 |
| CA2982034A1 (en) | 2015-05-18 | 2016-11-24 | Pieris Pharmaceuticals Gmbh | Muteins of human lipocalin 2 with affinity for glypican-3 (gpc3) |
-
2016
- 2016-11-30 EP EP16869402.4A patent/EP3383921A4/en not_active Withdrawn
- 2016-11-30 CA CA3004918A patent/CA3004918A1/en not_active Abandoned
- 2016-11-30 EA EA201891141A patent/EA035586B1/ru not_active IP Right Cessation
- 2016-11-30 SG SG10201911499TA patent/SG10201911499TA/en unknown
- 2016-11-30 US US15/777,340 patent/US10703810B2/en not_active Expired - Fee Related
- 2016-11-30 JP JP2018546726A patent/JP2019505565A/ja active Pending
- 2016-11-30 AU AU2016363668A patent/AU2016363668A1/en not_active Abandoned
- 2016-11-30 KR KR1020187018593A patent/KR20180083943A/ko unknown
- 2016-11-30 WO PCT/AU2016/051168 patent/WO2017091850A1/en active Application Filing
- 2016-11-30 SG SG11201803732PA patent/SG11201803732PA/en unknown
- 2016-11-30 CN CN201680080597.2A patent/CN108699162A/zh active Pending
- 2016-11-30 BR BR112018010887A patent/BR112018010887A2/pt not_active Application Discontinuation
- 2016-11-30 MX MX2018006559A patent/MX2018006559A/es unknown
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010040508A1 (en) * | 2008-10-08 | 2010-04-15 | F. Hoffmann-La Roche Ag | Bispecific anti-vegf/anti-ang-2 antibodies |
| WO2011117329A1 (en) * | 2010-03-26 | 2011-09-29 | F. Hoffmann-La Roche Ag | Bispecific, bivalent anti-vegf/anti-ang-2 antibodies |
| WO2015177175A2 (en) * | 2014-05-22 | 2015-11-26 | Pieris Ag | Novel specific-binding polypeptides and uses thereof |
Non-Patent Citations (1)
| Title |
|---|
| BESSHO, H., ET AL.: ""Effect of Ang-2-VEGF-A bispecific antibody in renal cell carcinoma."", CANCER INVESTIGATION, vol. 33, no. 8, JPN6020050083, 2015, pages 378 - 386, ISSN: 0004602501 * |
Also Published As
| Publication number | Publication date |
|---|---|
| SG10201911499TA (en) | 2020-01-30 |
| US20180334499A1 (en) | 2018-11-22 |
| EA201891141A1 (ru) | 2018-10-31 |
| WO2017091850A1 (en) | 2017-06-08 |
| US10703810B2 (en) | 2020-07-07 |
| AU2016363668A1 (en) | 2018-05-24 |
| MX2018006559A (es) | 2019-06-12 |
| BR112018010887A2 (pt) | 2018-11-21 |
| CA3004918A1 (en) | 2017-06-08 |
| KR20180083943A (ko) | 2018-07-23 |
| SG11201803732PA (en) | 2018-06-28 |
| CN108699162A (zh) | 2018-10-23 |
| EA035586B1 (ru) | 2020-07-10 |
| EP3383921A1 (en) | 2018-10-10 |
| EP3383921A4 (en) | 2019-04-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6839087B2 (ja) | 血管新生に特異的な新規のタンパク質 | |
| JP7084965B2 (ja) | 特異的結合ポリペプチドおよびその使用 | |
| JP2019505565A (ja) | 新規の抗血管新生融合ポリペプチド | |
| RU2625011C2 (ru) | Белки, связывающиеся с гепсидином | |
| US11034737B2 (en) | Proteins specific for calcitonin gene-related peptide | |
| JP2018513384A (ja) | Ror1−ror2結合のモジュレーター | |
| JP2021533203A (ja) | Cd137とpd−l1に特異的な新規融合タンパク質 | |
| JP2022523524A (ja) | Cd137およびgpc3に特異的な新規融合タンパク質 | |
| US9062109B2 (en) | Anti-ephrin-B2 antibody and compositions comprising it |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180613 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20191129 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20191129 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20210105 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210106 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210119 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20210929 |