JP2014511365A - 心臓障害の処置に関連する静脈刺激を調節するための(s)−エスモロールの使用 - Google Patents
心臓障害の処置に関連する静脈刺激を調節するための(s)−エスモロールの使用 Download PDFInfo
- Publication number
- JP2014511365A JP2014511365A JP2013551325A JP2013551325A JP2014511365A JP 2014511365 A JP2014511365 A JP 2014511365A JP 2013551325 A JP2013551325 A JP 2013551325A JP 2013551325 A JP2013551325 A JP 2013551325A JP 2014511365 A JP2014511365 A JP 2014511365A
- Authority
- JP
- Japan
- Prior art keywords
- subject
- propoxy
- isopropylamino
- phenylpropionate
- hydroxy
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 238000011282 treatment Methods 0.000 title claims abstract description 23
- 208000019622 heart disease Diseases 0.000 title claims abstract description 13
- 208000020446 Cardiac disease Diseases 0.000 title claims abstract description 11
- 230000000638 stimulation Effects 0.000 title claims description 68
- AQNDDEOPVVGCPG-AWEZNQCLSA-N (S)-esmolol Chemical compound COC(=O)CCC1=CC=C(OC[C@@H](O)CNC(C)C)C=C1 AQNDDEOPVVGCPG-AWEZNQCLSA-N 0.000 title 1
- 125000002572 propoxy group Chemical group [*]OC([H])([H])C(C([H])([H])[H])([H])[H] 0.000 claims abstract description 116
- 150000003839 salts Chemical class 0.000 claims abstract description 111
- DYUMLJSJISTVPV-UHFFFAOYSA-N phenyl propanoate Chemical compound CCC(=O)OC1=CC=CC=C1 DYUMLJSJISTVPV-UHFFFAOYSA-N 0.000 claims abstract description 96
- 238000000034 method Methods 0.000 claims abstract description 74
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 69
- 239000000203 mixture Substances 0.000 claims description 202
- 239000003814 drug Substances 0.000 claims description 54
- 238000002347 injection Methods 0.000 claims description 47
- 239000007924 injection Substances 0.000 claims description 47
- 208000001871 Tachycardia Diseases 0.000 claims description 41
- 230000006794 tachycardia Effects 0.000 claims description 33
- 210000003462 vein Anatomy 0.000 claims description 29
- 229940079593 drug Drugs 0.000 claims description 24
- GXLJZLBKWSJXFP-UHFFFAOYSA-N phenyl propanoate;hydrochloride Chemical compound Cl.CCC(=O)OC1=CC=CC=C1 GXLJZLBKWSJXFP-UHFFFAOYSA-N 0.000 claims description 21
- 206010020772 Hypertension Diseases 0.000 claims description 20
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 19
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 claims description 18
- 238000001990 intravenous administration Methods 0.000 claims description 15
- 208000003734 Supraventricular Tachycardia Diseases 0.000 claims description 11
- 206010047249 Venous thrombosis Diseases 0.000 claims description 11
- 201000000596 systemic lupus erythematosus Diseases 0.000 claims description 11
- 206010012601 diabetes mellitus Diseases 0.000 claims description 10
- 239000012530 fluid Substances 0.000 claims description 10
- 230000004968 inflammatory condition Effects 0.000 claims description 10
- 239000003795 chemical substances by application Substances 0.000 claims description 9
- 230000003204 osmotic effect Effects 0.000 claims description 9
- 206010007559 Cardiac failure congestive Diseases 0.000 claims description 8
- 206010019280 Heart failures Diseases 0.000 claims description 8
- 235000005911 diet Nutrition 0.000 claims description 8
- 230000037213 diet Effects 0.000 claims description 8
- 230000002980 postoperative effect Effects 0.000 claims description 8
- 206010049447 Tachyarrhythmia Diseases 0.000 claims description 6
- 239000006172 buffering agent Substances 0.000 claims description 5
- 230000004936 stimulating effect Effects 0.000 claims description 5
- 230000000622 irritating effect Effects 0.000 claims description 3
- 238000004519 manufacturing process Methods 0.000 claims 4
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 abstract description 12
- 229960003745 esmolol Drugs 0.000 description 87
- AQNDDEOPVVGCPG-UHFFFAOYSA-N esmolol Chemical compound COC(=O)CCC1=CC=C(OCC(O)CNC(C)C)C=C1 AQNDDEOPVVGCPG-UHFFFAOYSA-N 0.000 description 74
- 229960001015 esmolol hydrochloride Drugs 0.000 description 42
- VZTMYLWJKCAXMZ-UHFFFAOYSA-N 2-[(2-chloroquinazolin-4-yl)amino]ethanol Chemical compound C1=CC=C2C(NCCO)=NC(Cl)=NC2=C1 VZTMYLWJKCAXMZ-UHFFFAOYSA-N 0.000 description 35
- 238000012360 testing method Methods 0.000 description 30
- 241000283973 Oryctolagus cuniculus Species 0.000 description 25
- 230000001225 therapeutic effect Effects 0.000 description 21
- 238000009472 formulation Methods 0.000 description 20
- 238000001802 infusion Methods 0.000 description 20
- 230000000694 effects Effects 0.000 description 18
- 230000007794 irritation Effects 0.000 description 16
- 240000007711 Peperomia pellucida Species 0.000 description 14
- 208000007536 Thrombosis Diseases 0.000 description 14
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 13
- 241001465754 Metazoa Species 0.000 description 12
- 206010030113 Oedema Diseases 0.000 description 11
- 230000008901 benefit Effects 0.000 description 11
- 230000000740 bleeding effect Effects 0.000 description 11
- 206010061218 Inflammation Diseases 0.000 description 10
- 239000002876 beta blocker Substances 0.000 description 10
- 230000004054 inflammatory process Effects 0.000 description 10
- 229940097320 beta blocking agent Drugs 0.000 description 9
- 210000003038 endothelium Anatomy 0.000 description 8
- 239000011780 sodium chloride Substances 0.000 description 8
- 210000001519 tissue Anatomy 0.000 description 8
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 7
- 238000012423 maintenance Methods 0.000 description 7
- 230000001954 sterilising effect Effects 0.000 description 7
- 238000004659 sterilization and disinfection Methods 0.000 description 7
- 206010062886 Procedural hypertension Diseases 0.000 description 6
- 239000000243 solution Substances 0.000 description 6
- 230000003511 endothelial effect Effects 0.000 description 5
- 229920000642 polymer Polymers 0.000 description 5
- 230000004044 response Effects 0.000 description 5
- 230000002861 ventricular Effects 0.000 description 5
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 4
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 4
- 239000008121 dextrose Substances 0.000 description 4
- 239000012895 dilution Substances 0.000 description 4
- 238000010790 dilution Methods 0.000 description 4
- 230000002757 inflammatory effect Effects 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 230000000877 morphologic effect Effects 0.000 description 4
- 230000000284 resting effect Effects 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- ITPDYQOUSLNIHG-UHFFFAOYSA-N Amiodarone hydrochloride Chemical compound [Cl-].CCCCC=1OC2=CC=CC=C2C=1C(=O)C1=CC(I)=C(OCC[NH+](CC)CC)C(I)=C1 ITPDYQOUSLNIHG-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 229960000583 acetic acid Drugs 0.000 description 3
- 229960005260 amiodarone Drugs 0.000 description 3
- 239000003242 anti bacterial agent Substances 0.000 description 3
- 229940088710 antibiotic agent Drugs 0.000 description 3
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 3
- 230000017531 blood circulation Effects 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- RMRJXGBAOAMLHD-IHFGGWKQSA-N buprenorphine Chemical compound C([C@]12[C@H]3OC=4C(O)=CC=C(C2=4)C[C@@H]2[C@]11CC[C@]3([C@H](C1)[C@](C)(O)C(C)(C)C)OC)CN2CC1CC1 RMRJXGBAOAMLHD-IHFGGWKQSA-N 0.000 description 3
- 229960001736 buprenorphine Drugs 0.000 description 3
- 230000000747 cardiac effect Effects 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- 238000004296 chiral HPLC Methods 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000011109 contamination Methods 0.000 description 3
- 239000002552 dosage form Substances 0.000 description 3
- 238000001631 haemodialysis Methods 0.000 description 3
- 230000000322 hemodialysis Effects 0.000 description 3
- 230000036732 histological change Effects 0.000 description 3
- 208000017169 kidney disease Diseases 0.000 description 3
- 230000000813 microbial effect Effects 0.000 description 3
- 239000000825 pharmaceutical preparation Substances 0.000 description 3
- 239000004800 polyvinyl chloride Substances 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 230000002792 vascular Effects 0.000 description 3
- -1 12.5 μg / kg / min Chemical compound 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 2
- 206010013654 Drug abuse Diseases 0.000 description 2
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- MWUXSHHQAYIFBG-UHFFFAOYSA-N Nitric oxide Chemical compound O=[N] MWUXSHHQAYIFBG-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 2
- LCTONWCANYUPML-UHFFFAOYSA-N Pyruvic acid Chemical compound CC(=O)C(O)=O LCTONWCANYUPML-UHFFFAOYSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 208000027418 Wounds and injury Diseases 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 230000001154 acute effect Effects 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 230000000721 bacterilogical effect Effects 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 230000036772 blood pressure Effects 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 239000000356 contaminant Substances 0.000 description 2
- 239000006184 cosolvent Substances 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 238000009826 distribution Methods 0.000 description 2
- 229940126534 drug product Drugs 0.000 description 2
- 210000005069 ears Anatomy 0.000 description 2
- 210000003743 erythrocyte Anatomy 0.000 description 2
- 239000000835 fiber Substances 0.000 description 2
- 238000011049 filling Methods 0.000 description 2
- 235000013305 food Nutrition 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 208000014674 injury Diseases 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 210000000265 leukocyte Anatomy 0.000 description 2
- 244000005700 microbiome Species 0.000 description 2
- 238000000386 microscopy Methods 0.000 description 2
- 230000007935 neutral effect Effects 0.000 description 2
- 238000011587 new zealand white rabbit Methods 0.000 description 2
- 238000004806 packaging method and process Methods 0.000 description 2
- 239000012188 paraffin wax Substances 0.000 description 2
- 230000003108 parasitologic effect Effects 0.000 description 2
- 238000007911 parenteral administration Methods 0.000 description 2
- 244000052769 pathogen Species 0.000 description 2
- 229920000915 polyvinyl chloride Polymers 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- AQHHHDLHHXJYJD-UHFFFAOYSA-N propranolol Chemical compound C1=CC=C2C(OCC(O)CNC(C)C)=CC=CC2=C1 AQHHHDLHHXJYJD-UHFFFAOYSA-N 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 230000000405 serological effect Effects 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 208000011117 substance-related disease Diseases 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 238000011179 visual inspection Methods 0.000 description 2
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- WBYWAXJHAXSJNI-VOTSOKGWSA-M .beta-Phenylacrylic acid Natural products [O-]C(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-M 0.000 description 1
- SGTNSNPWRIOYBX-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-{[2-(3,4-dimethoxyphenyl)ethyl](methyl)amino}-2-(propan-2-yl)pentanenitrile Chemical compound C1=C(OC)C(OC)=CC=C1CCN(C)CCCC(C#N)(C(C)C)C1=CC=C(OC)C(OC)=C1 SGTNSNPWRIOYBX-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- CYDQOEWLBCCFJZ-UHFFFAOYSA-N 4-(4-fluorophenyl)oxane-4-carboxylic acid Chemical compound C=1C=C(F)C=CC=1C1(C(=O)O)CCOCC1 CYDQOEWLBCCFJZ-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 238000012371 Aseptic Filling Methods 0.000 description 1
- 206010003658 Atrial Fibrillation Diseases 0.000 description 1
- 206010003662 Atrial flutter Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-N Butyric acid Natural products CCCC(O)=O FERIUCNNQQJTOY-UHFFFAOYSA-N 0.000 description 1
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 1
- WBYWAXJHAXSJNI-SREVYHEPSA-N Cinnamic acid Chemical compound OC(=O)\C=C/C1=CC=CC=C1 WBYWAXJHAXSJNI-SREVYHEPSA-N 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- RGHNJXZEOKUKBD-SQOUGZDYSA-M D-gluconate Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O RGHNJXZEOKUKBD-SQOUGZDYSA-M 0.000 description 1
- LTMHDMANZUZIPE-AMTYYWEZSA-N Digoxin Natural products O([C@H]1[C@H](C)O[C@H](O[C@@H]2C[C@@H]3[C@@](C)([C@@H]4[C@H]([C@]5(O)[C@](C)([C@H](O)C4)[C@H](C4=CC(=O)OC4)CC5)CC3)CC2)C[C@@H]1O)[C@H]1O[C@H](C)[C@@H](O[C@H]2O[C@@H](C)[C@H](O)[C@@H](O)C2)[C@@H](O)C1 LTMHDMANZUZIPE-AMTYYWEZSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 208000000816 Intravenous Substance Abuse Diseases 0.000 description 1
- PWKSKIMOESPYIA-BYPYZUCNSA-N L-N-acetyl-Cysteine Chemical compound CC(=O)N[C@@H](CS)C(O)=O PWKSKIMOESPYIA-BYPYZUCNSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 238000011887 Necropsy Methods 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 229940022663 acetate Drugs 0.000 description 1
- 229960004308 acetylcysteine Drugs 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000009798 acute exacerbation Effects 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 239000003708 ampul Substances 0.000 description 1
- 230000000202 analgesic effect Effects 0.000 description 1
- 238000000540 analysis of variance Methods 0.000 description 1
- 239000003416 antiarrhythmic agent Substances 0.000 description 1
- 238000012865 aseptic processing Methods 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 229940050390 benzoate Drugs 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 239000001110 calcium chloride Substances 0.000 description 1
- 229910001628 calcium chloride Inorganic materials 0.000 description 1
- 235000011148 calcium chloride Nutrition 0.000 description 1
- BPKIGYQJPYCAOW-FFJTTWKXSA-I calcium;potassium;disodium;(2s)-2-hydroxypropanoate;dichloride;dihydroxide;hydrate Chemical compound O.[OH-].[OH-].[Na+].[Na+].[Cl-].[Cl-].[K+].[Ca+2].C[C@H](O)C([O-])=O BPKIGYQJPYCAOW-FFJTTWKXSA-I 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 238000012754 cardiac puncture Methods 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 208000037976 chronic inflammation Diseases 0.000 description 1
- 230000006020 chronic inflammation Effects 0.000 description 1
- 235000013985 cinnamic acid Nutrition 0.000 description 1
- 229930016911 cinnamic acid Natural products 0.000 description 1
- 229940001468 citrate Drugs 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000035487 diastolic blood pressure Effects 0.000 description 1
- LTMHDMANZUZIPE-PUGKRICDSA-N digoxin Chemical compound C1[C@H](O)[C@H](O)[C@@H](C)O[C@H]1O[C@@H]1[C@@H](C)O[C@@H](O[C@@H]2[C@H](O[C@@H](O[C@@H]3C[C@@H]4[C@]([C@@H]5[C@H]([C@]6(CC[C@@H]([C@@]6(C)[C@H](O)C5)C=5COC(=O)C=5)O)CC4)(C)CC3)C[C@@H]2O)C)C[C@@H]1O LTMHDMANZUZIPE-PUGKRICDSA-N 0.000 description 1
- 229960005156 digoxin Drugs 0.000 description 1
- LTMHDMANZUZIPE-UHFFFAOYSA-N digoxine Natural products C1C(O)C(O)C(C)OC1OC1C(C)OC(OC2C(OC(OC3CC4C(C5C(C6(CCC(C6(C)C(O)C5)C=5COC(=O)C=5)O)CC4)(C)CC3)CC2O)C)CC1O LTMHDMANZUZIPE-UHFFFAOYSA-N 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 125000004185 ester group Chemical group 0.000 description 1
- 150000002148 esters Chemical group 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 235000011087 fumaric acid Nutrition 0.000 description 1
- 239000012362 glacial acetic acid Substances 0.000 description 1
- 229940050410 gluconate Drugs 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- 229940049906 glutamate Drugs 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 210000002837 heart atrium Anatomy 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 238000012735 histological processing Methods 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- 230000001631 hypertensive effect Effects 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 229940001447 lactate Drugs 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- RUZLIIJDZBWWSA-INIZCTEOSA-N methyl 2-[[(1s)-1-(7-methyl-2-morpholin-4-yl-4-oxopyrido[1,2-a]pyrimidin-9-yl)ethyl]amino]benzoate Chemical group COC(=O)C1=CC=CC=C1N[C@@H](C)C1=CC(C)=CN2C(=O)C=C(N3CCOCC3)N=C12 RUZLIIJDZBWWSA-INIZCTEOSA-N 0.000 description 1
- WBYWAXJHAXSJNI-UHFFFAOYSA-N methyl p-hydroxycinnamate Natural products OC(=O)C=CC1=CC=CC=C1 WBYWAXJHAXSJNI-UHFFFAOYSA-N 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 208000010125 myocardial infarction Diseases 0.000 description 1
- SYSQUGFVNFXIIT-UHFFFAOYSA-N n-[4-(1,3-benzoxazol-2-yl)phenyl]-4-nitrobenzenesulfonamide Chemical class C1=CC([N+](=O)[O-])=CC=C1S(=O)(=O)NC1=CC=C(C=2OC3=CC=CC=C3N=2)C=C1 SYSQUGFVNFXIIT-UHFFFAOYSA-N 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 229960001412 pentobarbital Drugs 0.000 description 1
- WEXRUCMBJFQVBZ-UHFFFAOYSA-N pentobarbital Chemical compound CCCC(C)C1(CC)C(=O)NC(=O)NC1=O WEXRUCMBJFQVBZ-UHFFFAOYSA-N 0.000 description 1
- 229940127557 pharmaceutical product Drugs 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 229940071643 prefilled syringe Drugs 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 229960003712 propranolol Drugs 0.000 description 1
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Natural products CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 1
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 229940107700 pyruvic acid Drugs 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 238000011555 rabbit model Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 238000009517 secondary packaging Methods 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 239000003421 short acting drug Substances 0.000 description 1
- 235000021309 simple sugar Nutrition 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 239000001540 sodium lactate Substances 0.000 description 1
- 235000011088 sodium lactate Nutrition 0.000 description 1
- 229940005581 sodium lactate Drugs 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 230000035488 systolic blood pressure Effects 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 238000007492 two-way ANOVA Methods 0.000 description 1
- 229960001722 verapamil Drugs 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
- 230000029663 wound healing Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/215—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids
- A61K31/235—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids having an aromatic ring attached to a carboxyl group
- A61K31/24—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids having an aromatic ring attached to a carboxyl group having an amino or nitro group
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/06—Antiarrhythmics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
Landscapes
- Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Emergency Medicine (AREA)
- Epidemiology (AREA)
- Hospice & Palliative Care (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicinal Preparation (AREA)
Abstract
(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートを約75mMと約150mMの間の濃度で含む薬学的組成物であって、該フェニルプロピオナートのR−異性体または薬学的に許容し得るその塩を実質的に含んでいない該薬学的組成物が提供される。心臓障害を処置する方法も提供され、この方法には、該処置を必要とする被験体へ(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリドを含む治療有効量の薬学的組成物を投与するステップが含まれる。
Description
(関連出願の引用)
2011年1月27日に出願された米国仮特許出願第61/436,995号の米国特許法第119条(e)項の下での利益がここで主張される。米国仮特許出願第61/436,995号の開示は全て本明細書中に参考として援用される。
2011年1月27日に出願された米国仮特許出願第61/436,995号の米国特許法第119条(e)項の下での利益がここで主張される。米国仮特許出願第61/436,995号の開示は全て本明細書中に参考として援用される。
(発明の分野)
本発明は、エスモロールのS−異性体を含む治療有効量の薬学的組成物を投与することを含む、静脈刺激を最小化しながら心臓の状態を処置するための組成物および方法に関する。
本発明は、エスモロールのS−異性体を含む治療有効量の薬学的組成物を投与することを含む、静脈刺激を最小化しながら心臓の状態を処置するための組成物および方法に関する。
(背景)
エスモロールヒドロクロリド(メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリド)は、S−異性体およびR−異性体の50:50のラセミ混合物である。エスモロールヒドロクロリドは、頻拍および高血圧のような心臓障害の処置のために使用される急速作用発現型(fast−onset)β遮断薬である。現在入手可能なたいていのβ遮断薬は作用開始時間が比較的長い。しかしながら、救命救急診療設定において、例えば心筋梗塞の間または直後の心臓発症(cardiac crisis)の間に、心拍数を迅速に減少させおよび/または律動性を改良することが望ましいことが多い。従来のβ遮断薬は、このような処置のために採用することはできるが、その比較的長い作用開始時間は、例えば、患者が臨床症状の急性増悪にある場合、臨床医が迅速に効果的に用量を設定するのを妨げる可能性がある。エスモロールヒドロクロリドは、心臓発症を経験中の患者を処置する場合に特に有用である。その比較的短い作用開始時間のため、フィードバックは即時であり、したがって、投薬は患者の応答に従って迅速に調整することができる。
エスモロールヒドロクロリド(メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリド)は、S−異性体およびR−異性体の50:50のラセミ混合物である。エスモロールヒドロクロリドは、頻拍および高血圧のような心臓障害の処置のために使用される急速作用発現型(fast−onset)β遮断薬である。現在入手可能なたいていのβ遮断薬は作用開始時間が比較的長い。しかしながら、救命救急診療設定において、例えば心筋梗塞の間または直後の心臓発症(cardiac crisis)の間に、心拍数を迅速に減少させおよび/または律動性を改良することが望ましいことが多い。従来のβ遮断薬は、このような処置のために採用することはできるが、その比較的長い作用開始時間は、例えば、患者が臨床症状の急性増悪にある場合、臨床医が迅速に効果的に用量を設定するのを妨げる可能性がある。エスモロールヒドロクロリドは、心臓発症を経験中の患者を処置する場合に特に有用である。その比較的短い作用開始時間のため、フィードバックは即時であり、したがって、投薬は患者の応答に従って迅速に調整することができる。
エスモロールヒドロクロリドは、迅速に加水分解することのできるエステル官能基を含有しているという点で、従来のβ遮断化合物とは異なる。エスモロールヒドロクロリドは、該エステル基の存在により、インビボでの持続時間は短く、周術期の状況、術後状況、または短時間作用薬を用いた心室拍動数(ventricular rate)の短時間での制御が望ましい他の緊急状況において、上室頻拍症(すなわち、心房細動または心房粗動)を有する患者における心室拍動数の迅速な制御が必要とされる。エスモロールヒドロクロリドは、術中および術後の頻拍および/または高血圧にも必要とされる。エスモロールヒドロクロリドは典型的には、注入によって投与される。かなりの数の患者は、注入部位で静脈刺激を経験している。Esmolol Hydrochloride Injection Ready−to−use 10mL Vialsの添付文書(Baxter Healthcare Corporation)を参照されたい。患者において観察される静脈刺激の発生率および量は、エスモロールヒドロクロリドの投与用量の濃度とともに増加する(同上)。それゆえ、所望のより高い注入濃度は、有意な静脈刺激が発生し得るという懸念から、ストレス下にある患者の心拍数を低下させるよう使用することができないことが多い。結果として、エスモロールヒドロクロリド投与で有効となるには、別途より高い注入濃度のものが投与された場合にかかることになるよりも長くかかることが多い。
上記の点において、エスモロールヒドロクロリド投与において有意な頻度で発生する苦痛な静脈刺激を最小化しながら、エスモロールヒドロクロリドの効果的なβ遮断効果を保有することは有利であろう。
本開示は、エスモロールヒドロクロリドのラセミ混合物の投与としばしば関連する静脈刺激を最小化するために、エスモロールのS−異性体もしくは薬学的に許容し得るその塩を含む薬学的組成物を投与することによって、心臓の状態(例えば、頻拍および高血圧)を処置するための、および/または心拍数を制御するための方法および組成物を提供する。
一態様において、本発明は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含む薬学的組成物を提供し、この中で、該(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩は、約60mMと約150mMの間の濃度で存在し、かつこの中で、該薬学的組成物は、(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を実質的に含んでいない。
関連する態様において、本発明は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩、浸透圧調整剤、および緩衝剤を含む水性の薬学的組成物を提供し、この中で、該(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩は、約60mMと約150mMの間の濃度で存在し、かつこの中で、該薬学的組成物は、(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を実質的に含んでいない。
なおも別の関連する態様において、本発明は、心臓障害を処置することを必要とする被験体へ、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含む治療有効量の薬学的組成物を投与するステップを含む、心臓障害を処置する方法を提供し、この中で、該(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩は、約60mMと約150mMの間の濃度で存在し、かつこの中で、該薬学的組成物は、(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を実質的に含んでいない。
別の態様において、本発明は、心拍数を制御する必要のある被験体へ、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含む治療有効量の薬学的組成物を投与するステップを含む、心拍数を制御する方法を提供し、この中で、該(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩は、約60mMと約150mMの間の濃度で存在し、かつこの中で、該薬学的組成物は、(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を実質的に含んでいない。
本発明の他の特長および利点は、以下の詳細な記載および特許請求の範囲から明らかとなる。
(詳細な説明)
本開示は、エスモロールのラセミ混合物の投与としばしば関連する静脈刺激を最小化するために、エスモロールのS−異性体を含む組成物を使用して、高血圧(例えば、術中および術後高血圧)および頻拍(例えば、上室頻拍症、術中および術後頻拍)を含む心臓の状態を処置するための方法および組成物を提供する。本開示は、エスモロールのラセミ混合物の投与と時には関連する静脈刺激を最小化するために、エスモロールのS−異性体を含む組成物を使用して心拍数を制御するための方法および組成物も提供する。本発明者らは、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含む組成物を約60mMと約150mMの間の濃度で投与する場合、およびより好ましくはエスモロールのS−異性体を含む組成物を約75mMと約150mMの間の濃度で投与する場合、有意に小さな静脈刺激が観察されるという予期せぬかつ驚くべき発見をした。驚くべきことに、エスモロールのS−異性体を含む開示された組成物を投与すると、該ラセミ混合物の等しい濃度と比較して、有意に小さな静脈刺激が観察され、静脈刺激低減の作用は、エスモロールのS−異性体が等しい治療効果をもたらす濃度(equitherapeutic concentration)を該ラセミ混合物の対応する濃度と比較すると特に顕著である。その上、本発明者らは、投薬された量(すなわち注入速度)が一定に保持されたという事実にもかかわらず、静脈刺激の低減が、本明細書で示されるように(薬物)濃度依存性であることを発見した。
本開示は、エスモロールのラセミ混合物の投与としばしば関連する静脈刺激を最小化するために、エスモロールのS−異性体を含む組成物を使用して、高血圧(例えば、術中および術後高血圧)および頻拍(例えば、上室頻拍症、術中および術後頻拍)を含む心臓の状態を処置するための方法および組成物を提供する。本開示は、エスモロールのラセミ混合物の投与と時には関連する静脈刺激を最小化するために、エスモロールのS−異性体を含む組成物を使用して心拍数を制御するための方法および組成物も提供する。本発明者らは、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含む組成物を約60mMと約150mMの間の濃度で投与する場合、およびより好ましくはエスモロールのS−異性体を含む組成物を約75mMと約150mMの間の濃度で投与する場合、有意に小さな静脈刺激が観察されるという予期せぬかつ驚くべき発見をした。驚くべきことに、エスモロールのS−異性体を含む開示された組成物を投与すると、該ラセミ混合物の等しい濃度と比較して、有意に小さな静脈刺激が観察され、静脈刺激低減の作用は、エスモロールのS−異性体が等しい治療効果をもたらす濃度(equitherapeutic concentration)を該ラセミ混合物の対応する濃度と比較すると特に顕著である。その上、本発明者らは、投薬された量(すなわち注入速度)が一定に保持されたという事実にもかかわらず、静脈刺激の低減が、本明細書で示されるように(薬物)濃度依存性であることを発見した。
上記で説明したように、エスモロールは、その迅速な作用開始のため、開業医によってしばしば使用されており、患者の体重および応答を基にした用量設定を一般に必要とする。糖尿病患者、肥満患者、および流体制限患者については特に、希釈することなくまたは最小の体積希釈で投与することのできる比較的濃縮されたエスモロール組成物を投与することが非常に望ましいであろう。本発明は、このような組成物および該組成物を投与するための方法を提供する。例えば、流体制限患者、例えば、うっ血性心不全または、体積注入に対して感受性のある他の状態のために流体制限下にある患者は、開示された方法および組成物から利益を得ることができる。なぜなら、より高い治療濃度の開示されたS−エスモロール含有組成物を投与することができ、それによりこのような患者に対する体積効果を最小化することができるからである。このようなより高い薬物濃度は、上記ラセミ混合物を含む組成物と典型的に関連する静脈刺激が、S−エスモロールを含む開示された組成物を投与する場合に小さくなるので、投与することができる。その上、エスモロールのS−異性体を含む組成物は、(上記で説明したとおり、)より高い薬物濃度のものを投与することができるので、エスモロールのラセミ混合物を含む組成物よりも有意に少ない塩を含有することができ、したがって、(等張性であるように)溶液の浸透圧に塩が寄与する必要性は低く、それにより該処置と関連する毎日の塩(すなわち塩化ナトリウム)摂取量を最少化し、このことは、塩分制限食の患者(例えば、うっ血性心不全および/または高血圧に罹患している患者)に特に有益であることができる。同様に、エスモロールのS−異性体を含む組成物は、(上記で説明したとおり、)より高い薬物濃度のものを投与することができるので、エスモロールのラセミ混合物を含む組成物よりも有意に少量のデキストロースを含有することができ、したがって、等張性であるように溶液の浸透圧にデキストロースが寄与する必要性は低く、それにより該処置と関連する単純糖(simple sugar)摂取量を最少化し、このことは、糖尿病患者に特に有益であることができる。
一態様において、本発明は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナート(S−エスモロール)または薬学的に許容し得るその塩を含む薬学的組成物を提供し、この中で、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリドは、約60mMと約150mMの間の濃度で存在し、かつこの中で、該薬学的組成物は、(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリドまたは薬学的に許容し得るその塩を実質的に含んでいない。
関連する態様において、本発明は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナート(S−エスモロール)または薬学的に許容し得るその塩、浸透圧調整剤、および緩衝剤を含む水性の薬学的組成物を提供し、この中で、該(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩は、約60mMと約150mMの間の濃度で存在し、かつこの中で該薬学的組成物は、(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を実質的に含んでいない。
さらに別の関連する態様において、本発明は、心臓障害を処置する必要のある被験体へ、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナート(S−エスモロール)または薬学的に許容し得るその塩を含む治療有効量の薬学的組成物を投与するステップを含む、心臓障害を処置する方法を提供し、この中で、該(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩は、約60mMと約150mMの間の濃度で存在し、かつこの中で該薬学的組成物は、(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を実質的に含んでいない。本態様による種々の実施形態において、該薬学的組成物は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を約75mMと約150mMの間の、約75mMと約135mMの間の、約90mMと約150mMの間の、約90mMと約135mMの間の、約105mMと約150mMの間の、および/または約105mMと約135mMの間の濃度で含む。本態様のすべての実施形態において、該薬学的組成物は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリドを約20mg/mLと約50mg/mLの間の、約25mg/mLと約50mg/mLの間の、約25mg/mLと約45mg/mLの間の、約30mg/mLと約50mg/mLの間の、約30mg/mLと約45mg/mLの間の、約35mg/mLおよび/または約約45mg/mLの間の濃度で含むことができる。
別の関連する態様において、本発明は、心拍数を制御する必要のある被験体へ、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含む治療有効量の薬学的組成物を投与するステップを含む、心拍数を制御する方法を提供し、この中で、該(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩は、約60mMと約150mMの間の濃度で存在し、かつこの中で、該薬学的組成物は、(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を実質的に含んでいない。
さらに別の関連する態様において、本発明は、心臓障害を処置する必要のある被験体において、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナート(S−エスモロール)または薬学的に許容し得るその塩を含む治療有効量の薬学的組成物を投与するステップを含む、心臓障害を処置する方法を提供し、この中で、該(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩は、約3mMと約300mMの間の濃度で存在し、かつこの中で、該薬学的組成物は、(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を実質的に含んでいない。本発明の本態様に従って処置される患者は、β遮断の必要がありかつ例えば、該患者はすでに、静脈刺激性のある薬物(例えば、アミオダロン、静脈内抗生物質、血液透析中の腎臓病患者)を摂取しており、該患者は、全身性エリテマトーデスもしくは静脈血栓症のような静脈刺激を引き起こす炎症状態に罹患しており、高齢であり、糖尿病患者であり、肥満であり、および/または薬物乱用者であるので、静脈刺激に対して感受性がある。本方法によると、該(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナート(S−エスモロール)または薬学的に許容し得るその塩は、約3mMと約300mMの間の、約15mMと約300mMの間の、約30mMと約300mMの間の、約45mMと約300mMの間の、約60mMと約300mMの間の、約75mMと約300mMの間の、約90mMと約300mMの間の、約105mMと約300mMの間の、約120mMと約300mMの間の、約135mMと約300mMの間の、約150mMと約300mMの間の、約165mMと約300mMの間の、約180mMと約300mMの間の、約195mMと約300mMの間の、約210mMと約300mMの間の、および/または約225mMと約300mMの間の濃度で存在する。上記の方法に関する開示されたすべての実施形態において、該薬学的組成物は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリド(S−エスモロールヒドロクロリド)を約1mg/mLと約100mg/mLの間の、約5mg/mLと約100mg/mLの間の、約10mg/mLと約100mg/mLの間の、約15mg/mLと約100mg/mLの間の、約20mg/mLと約100mg/mLの間の、約25mg/mLと約100mg/mLの間の、約30mg/mLと約100mg/mLの間の、約35mg/mLと約100mg/mLの間の、約40mg/mLと約100mg/mLの間の、約45mg/mLと約100mg/mLの間の、約50mg/mLと約100mg/mLの間の、約55mg/mLと約100mg/mLの間の、約60mg/mLと約100mg/mLの間の、約65mg/mLと約100mg/mLの間の、約70mg/mLと約100mg/mLの間の、および/または約75mg/mLと約100mg/mLの間の濃度で含むことができる。
さらに追加的な関連する態様において、本発明は、心拍数を制御する必要のある被験体へ(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナート(S−エスモロール)または薬学的に許容し得るその塩を含む治療有効量の薬学的組成物を投与するステップを含む、心拍数を制御する方法を提供し、この中で、該(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩は、約3mMと約300mMの間の濃度で存在し、かつこの中で該薬学的組成物は、(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を実質的に含んでいない。本発明の本態様に従って処置される患者は、β遮断の必要がありかつ例えば、該患者はすでに、静脈刺激性のある薬物(例えば、アミオダロン、静脈内抗生物質、血液透析中の腎臓病患者)を摂取しており、該患者は、全身性エリテマトーデスもしくは静脈血栓症のような静脈刺激を引き起こす炎症状態に罹患しており、高齢であり、糖尿病患者であり、肥満であり、および/または薬物乱用者であるので、静脈刺激に対して感受性がある。本方法によると、該(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナート(S−エスモロール)または薬学的に許容し得るその塩は、約3mMと約300mMの間の、約15mMと約300mMの間の、約30mMと約300mMの間の、約45mMと約300mMの間の、約60mMと約300mMの間の、約75mMと約300mMの間の、約90mMと約300mMの間の、約105mMと約300mMの間の、約120mMと約300mMの間の、約135mMと約300mMの間の、約150mMと約300mMの間の、約165mMと約300mMの間の、約180mMと約300mMの間の、約195mMと約300mMの間の、約210mMと約300mMの間の、および/または約225mMと約300mMの間の濃度で存在する。上記の方法に関する開示されたすべての実施形態において、該薬学的組成物は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリド(S−エスモロールヒドロクロリド)を約1mg/mLと約100mg/mLの間の、約5mg/mLと約100mg/mLの間の、約10mg/mLと約100mg/mLの間の、約15mg/mLと約100mg/mLの間の、約20mg/mLと約100mg/mLの間の、約25mg/mLと約100mg/mLの間の、約30mg/mLと約100mg/mLの間の、約35mg/mLと約100mg/mLの間の、約40mg/mLと約100mg/mLの間の、約45mg/mLと約100mg/mLの間の、約50mg/mLと約100mg/mLの間の、約55mg/mLと約100mg/mLの間の、約60mg/mLと約100mg/mLの間の、約65mg/mLと約100mg/mLの間の、約70mg/mLと約100mg/mLの間の、および/または約75mg/mLと約100mg/mLの間の濃度で含むことができる。
本発明の方法によって処置することのできる心臓の状態および/または障害には、エスモロールを用いた処置から利益を得ることが公知の任意の心臓の状態が含まれる。このような心臓の状態には、上室頻拍症、術中頻拍、および術後頻拍を含む頻拍、ならびに術中高血圧および術後高血圧を含む高血圧が含まれるが、これらに限定されない。その上、本発明の方法は、臨床的に望ましい場合、被験体が上記の心臓の状態のうちの1つを有していようとなかろうと、患者の心拍数を制御するのにも使用することができる。
本明細書で使用する場合、用語「(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含む薬学的組成物」および「エスモロールのS−異性体を含む組成物」は、(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を実質的に含んでいない薬学的組成物を指す。用語「(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートを実質的に含んでいない」は、組成物中のメチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩の総量を基にした10重量%未満の、5重量%未満の、3重量%未満の、2重量%未満の、1重量%未満の、および/または0.5重量%未満の(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含有する該組成物を指す。好ましくは、「(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートを実質的に含んでいない」は、組成物中のメチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩の総量を基にした5重量%以下の、例えば、3重量%未満、2重量%未満、1重量%未満、および/または0.5重量%未満の(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含有する該組成物を指す。総エスモロール含有量は、標準的なHPLCカラムまたは当該技術分野で公知の類似の分析方法を使用して決定することができる。所与の組成物におけるエスモロールのS−異性体およびエスモロールのR−異性体の個々の相対含有量は、キラルHPLC法または当該技術分野で公知の類似の分析方法を使用して決定することができる。例えば、Tangら、J. Biochem. Biophys. Methods,59:159‐166(2004)を参照されたい。
一態様において、「治療有効量」は、頻拍および/または高血圧を制御するのに十分な(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含む薬学的組成物の量を指す。したがって、頻拍を制御するのに十分な量には、頻拍および/または高血圧を軽減および/または改善するのに十分な量を含むが、これに限定されない。
別の態様において、「治療有効量」は、心拍数を制御するのに十分な(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含む薬学的組成物の量を指す。したがって、心拍数を制御するのに十分な量には、心拍数の増加を制御および/または低下させるのに十分な量を含むが、これに限定されない。
用語「薬学的に許容し得る塩」は、上記エスモロールの生物学的効能および特性を保有しかつ生物学的にも他の点でも望ましくないものではない塩を指す。このような塩は、塩酸、臭化水素酸、硫酸、硝酸、リン酸などのような無機酸、好ましくは塩酸、ならびに酢酸、プロピオン酸、グリコール酸、ピルビン酸、シュウ酸(oxylic acid)、マレイン酸、マロン酸、コハク酸、フマル酸、酒石酸、クエン酸、安息香酸、ケイ皮酸、マンデル酸、メタンスルホン酸、エタンスルホン酸、p−トルエンスルホン酸、サリチル酸、N−アセチルシステインなどのような有機酸を使用して形成することができる。開示されたすべての実施形態において、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートの薬学的に許容し得る塩は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリドであることができる。
本明細書において使用する場合、用語「それを必要とする(すなわち、頻拍および/または高血圧の処置を必要とする)被験体」は、頻拍および/または高血圧を制御するためのβ遮断薬の投与から利益を受けることになる個体として定義される。特に、該用語は、頻拍および/または高血圧を制御するためのβ遮断薬の投与から利益を受けることになる個体であって、等しい濃度の上記ラセミ混合物の投与(およびエスモロールのS−異性体が等しい治療効果をもたらす濃度に対応する濃度の該ラセミ混合物を投与する場合、なおさらである)に関係する静脈刺激の発達に対して感受性のある個体を指す。
別の態様において、用語「それを必要とする被験体」(すなわち、心拍数の制御を必要とする)は、心拍数の増加を制御するためのβ遮断薬の投与から利益を受けることになる個体として定義される。特に、該用語は、心拍数の増加を制御するためのβ遮断薬の投与から利益を受けることになる個体であって、上記ラセミ混合物を含む等しい濃度の薬学的組成物の投与(およびエスモロールのS−異性体が等しい治療効果をもたらす濃度に対応する濃度の該ラセミ混合物が投与される場合、なおさらである)に関係する静脈刺激の発達に対して感受性のある個体を指す。
本明細書で使用する場合、用語「頻拍」は、異常に速い心拍、典型的には15歳以上のヒトで安静時に1分間あたり100拍超の心拍数を指す。「上室頻拍症」は、心房において生じるこのような異常に速い心拍を指す。
本明細書で使用する場合、用語「高血圧」は、異常に高い血圧を指す。当業者によって認められるように、「高血圧性」として特徴づけられる血圧は、個体に応じて異なり得る。しかしながら、高血圧は一般的に、収縮期血圧140mmHg超および/または拡張期血圧90mmHg超として定義される。
本明細書で使用する場合、用語「心拍数の増加」は、個体の正常安静時脈拍(pulse)より多くの1分間あたり20超の拍動、より典型的には、個体の正常安静時脈拍より多くの1分間あたり25超の拍動、および/または個体の正常安静時脈拍より多くの1分間あたり30超の拍動である心拍数を指す。このような心拍数の増加は、本明細書において定義されるような頻拍ではない可能性があるが、頻拍は、心拍数の増加に関する上記の定義によっても包含される。
本願の薬学的組成物は一般的に、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を約60mMと約150mMの間の、およびより好ましくは約75mMと約150mMの間の濃度で含む。種々の実施形態において、該薬学的組成物は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を、約75mMと約135mMの間の、約90mMと約150mMの間の、約90mMと約135mMの間の、約105mMと約150mMの間の、および/または約105mMと約135mMの間の濃度で含む。本願の組成物のすべての実施形態において、該薬学的組成物は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリドを、約20mg/mLと約50mg/mLの間の、約25mg/mLと約50mg/mLの間の、約25mg/mLと約45mg/mLの間の、約30mg/mLと約50mg/mLの間の、約30mg/mLと約45mg/mLの間の、および/または約35mg/mLと約45mg/mLの間の濃度で含むことができる。関連する実施形態において、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含む薬学的組成物は、プロピレングリコールおよびエタノールを実質的に含まないことも可能である。
β遮断薬は典型的には、RSラセミ混合物として製造および市販されているが、S−異性体は、β遮断活性すべてを担う。MehvarおよびBrocks,J.Pharm.Pharmaceut.Sci.,4(2):185−200(2001)を参照されたい。上記と一致して、国際特許公開第WO88/01614号は、エスモロールのS−異性体が等量のラセミ混合物よりもβアドレナリン作動性遮断薬の約2倍強力であることを開示している。したがって、本明細書で使用する場合、用語「等しい治療効果をもたらす濃度」は、メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩の所与の濃度のラセミ混合物と同じ、β遮断の治療上の有益性を提供する(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩の濃度を指す。一般に、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩が等しい治療効果をもたらす濃度は、メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩のラセミ混合物の濃度の半分である。言い換えれば、エスモロールのラセミ混合物を含む組成物中の薬物の量が50mg/mLであれば、エスモロールのS−異性体が等しい治療効果をもたらす濃度は25mg/mLである。
本発明の薬学的組成物は、患者への非経口投与に適切である。非経口投与に適切な経路には、皮下、皮内、筋肉内、関節内、および髄腔内(intrathecal)が挙げられる。例えば、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含む薬学的組成物は、ボーラス投与、静脈内注入、またはボーラス投与/静脈内注入の併用の形態で投与してもよい。本発明のすぐに使える(ready−to−use)製剤は好ましくは、静脈内注入によって投与される。
(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含む薬学的組成物は、注入に適切な滅菌済みのすぐに使える製剤の形態をとる。すぐに使えるという体裁は、濃縮した少容量の非経口製剤を注入前に注入希釈物へ希釈する不便さを回避し、ならびに、取扱中に微生物汚染の危険性および任意の潜在的な誤計算もしくは誤希釈の危険性を排除する。本明細書で使用する場合、「すぐに使える」製剤または組成物は、患者への投与の前に希釈を必要としない(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含む組成物として定義される。同様に、「非経口注入に適切な」とは、pHおよび容量オスモル濃度(osmolarity)が注入による患者への投与に適した生理学的レベルまたはほぼ生理学的レベルに調整された製剤または組成物を指す。このような製剤は、プロピレングリコールおよびエタノールが本質的に含まないことも可能である。
頻拍を処置する場合、エスモロールのS−異性体または薬学的に許容し得るその塩を含む組成物の投与される用量は典型的には、心室拍動数を指標として使用して用量設定される。一般的には、エスモロールヒドロクロリドのS−異性体の投与される用量は、12.5μg/kg/分と1000μg/kg/分の間、12.5μg/kg/分と500μg/kg/分の間、12.5μg/kg/分と400μg/kg/分の間、12.5μg/kg/分と300μg/kg/分の間、12.5μg/kg/分と200μg/kg/分の間、および/または12.5μg/kg/分と100μg/kg/分の間である。例えば、上室頻拍症を処置するための代表的な投与プロトコールには、心室拍動数の応答性に関する指標を得るために、1分間にわたって注入された250μgのS−異性体エスモロールヒドロクロリド/体重kg(μg/kg)の初期負荷用量に続いて、4分間にわたるエスモロールヒドロクロリドのS−異性体25μg/kg/分の維持注入を含んでもよい。例えば、12.5μg/kg/分のようなエスモロールヒドロクロリドのS−異性体のより低い初期維持用量、または例えば、37.5μg/kg/分、50μg/kg/分、62.5μg/kg/分、75μg/kg/分、87.5μg/kg/分、もしくはさらには100μg/kg/分のようなエスモロールヒドロクロリドのS−異性体のより高い初期維持用量を使用してもよい。本発明に従ったエスモロールのS−異性体を含む組成物のための用量計算において、投与されるエスモロールは100%のS−異性体を含むことが想定される。一部の場合、初期維持注入の4分間の後、所望の心室応答が達成されたかどうかに応じて、1分間にわたって注入されるエスモロールヒドロクロリドのS−異性体250μg/kgの負荷用量が反復された後、追加的な維持注入がさらに4分間、25μg/kg/分で続行してもよいかまたは50μg/kg/分まで段階的に増加してもよい。適当な治療効果がこの時点で観察されない場合、エスモロールヒドロクロリドのS−異性体250μg/kgの第三の負荷用量を1分間にわたって反復してもよく、それに続いて、エスモロールヒドロクロリドのS−異性体の追加的な維持注入が4分間、元の25μg/kg/分で続行してもよく、または50μg/kg/分もしくは75μg/kg/分のいずれかまで増加してもよい。維持注入は次に、所望の治療効果を達成するために、最長48時間、最大100μg/kg/分で続行してもよい。上室頻拍症患者における心拍数の適切な制御および安定した臨床状態を達成した後に、プロプラノロール、ジゴキシン、またはベラパミルのような代替的な抗不整脈薬への移行を完成してもよい。エスモロールのS−異性体を含む薬学的組成物の負荷用量は、300μg/kg/分以上、350μg/kg/分以上、400μg/kg/分、上、450μg/kg/分以上、500μg/kg/分以上、550μg/kg/分以上、600μg/kg/分以上、650μg/kg/分以上、700μg/kg/分以上、750μg/kg/分以上、800μg/kg/分以上、850μg/kg/分以上、900μg/kg/分以上、950μg/kg/分以上、および/または1000μg/kg/分以上であることができる。塩酸塩以外のS−エスモロールの薬学的に許容し得る塩を投与する場合、上記の範囲に対するモル当量を投与することができる。
即時応答/制御が臨床状況、例えば、急性の術中頻拍および/または急性の術中高血圧を処置するときに望ましい場合、エスモロールヒドロクロリドのS−異性体、ほぼ500μg/kgのボーラス用量を30秒間かけて投与した後、必要であれば、エスモロールヒドロクロリドのS−異性体75μg/kg/分を注入する。注入速度は、必要に応じて、所望の心拍数および/または血圧に到達するよう維持(または達成)するために、エスモロールヒドロクロリドのS−異性体を最大150μg/kg/分に調整することができる。さらに、塩酸塩以外のS−エスモロールの薬学的に許容し得る塩を投与する場合、上記の範囲に対するモル当量を投与することができる。
その一方で、徐々の応答/制御が許容され得る場合、例えば、術後頻拍および/または術後高血圧を処置する場合、上室頻拍症を処置するための代表的な投与プロトコールを使用してもよい。加えて、上室頻拍症を処置するための代表的な投与プロトコールは、心拍数が増加した(すなわち、上記で説明したとおり、患者の正常安静時脈拍と比べて増加した)患者の心拍数をうまく制御するために、臨床医によっても使用されてもよい。
本発明の処置方法が人間医学および獣医学の分野において有用であることは認められる。したがって、処置されるべき被験体または個体は、動物、例えば、哺乳類、好ましくはヒトであってもよい。
本発明による(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含む薬学的組成物を包装するのに適切な容器には、バイアル、注射器、バッグ、ボトル、およびアンプルの体裁を含むがこれらに限定されない当該技術分野で公知の数多くの密封容器が挙げられる。容器は、ガラスからまたはポリマー材料から作製してもよい。すぐに使える製剤は典型的には、バイアル、注射器、バッグ、およびボトル中に包装されるが、濃縮された製剤は典型的にはアンプル中に包装される。
本発明による薬学的組成物は、小容量非経口(SVP)剤形および大容量非経口(LVP)剤形へと調製することができる。剤形は、任意の適切な容器に包装することができる。適切な容器としては、例えば、1mLから500mLまでに及ぶ大きさのガラスバイアル、ポリマーバイアル、アンプル、注射器、およびバッグが挙げられる。SVPのすぐに使える溶液は典型的には、1〜100mLの体裁でアンプルおよびバイアルへと充填される。加えて、注射器は、SVPのための容器として使用することができ、該注射器は、「あらかじめ充填した注射器」として販売されている。LVPの体裁は、バックまたはボトルの中に含有することができる。すぐに使えるLVPのための好ましい体裁は、ポリマーバッグである。
ポリマーバッグのようなポリマー容器は、好ましくは可撓性であり、かつポリ塩化ビニル(PVC)を含有することができるかまたはPVCを含まないことも可能である。好ましい容器は、米国特許第5,849,843号および第5,998,019号に開示されているもののように、PVCを含んでいない。ポリマー容器はさらに、保管中の水分の損失を防止するために、および製剤の安定性をさらに確実にするために、二次包装システムとしての吸湿防止材を提供することができる。好ましい吸湿防止材は、アルミニウム外装である。
上記薬学的組成物のpHは、上記(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩の安定性に影響し得る。該pHは、3.5と6.5の間、好ましくは4.5と5.5の間、より好ましくは約5.0であるべきである。該pHは、当該技術分野で公知のように、例えば水酸化ナトリウムまたは塩酸の添加によって調整することができる。
特に有益な製剤は、60〜150mM、およびより好ましくは75〜150mMの(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含有する(例えば、20〜50mg/mLおよびより好ましくは25〜50mg/mLのS−異性体のエスモロールヒドロクロリド)。60〜150mMおよびより好ましくは75〜150mMの(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含有する製剤は、等しい濃度の上記ラセミ混合物と比べ有意に少ない静脈刺激を引き起こすことがすでに示されている。
適切な緩衝剤は、当該技術分野で公知であり、典型的には、0.01〜2Mに及ぶ濃度で本発明による薬学的組成物中に存在する。すぐに使える製剤は典型的には、0.01〜0.5Mの、例えば0.02〜0.1Mの緩衝剤濃度を有する。濃縮した製剤は典型的には、0.5〜2Mの緩衝剤濃度を有する。例示的な緩衝剤としては、酢酸塩、グルタミン酸塩、クエン酸塩、酒石酸塩、安息香酸塩、乳酸塩、グルコン酸塩、リン酸塩、およびグリシンが挙げられるが、これらに限定されない。好ましい緩衝剤は、酢酸ナトリウムおよび氷酢酸の組み合わせを含む。
本発明の薬学的組成物は典型的には、水性である。このような水性の薬学的組成物はさらに、エスモロールのS−異性体または薬学的に許容し得るその塩の可溶化を助けるための医薬として許容し得る共溶媒を含んでもよい。あるいは、本発明の薬学的組成物は、1以上の医薬として許容し得る溶媒を含む溶媒ベースのものであってもよい。医薬として許容し得る溶媒(および共溶媒)の例としては、エタノール、イソプロパノール、酢酸エチル、酢酸、およびエタノールアミンが挙げられるが、これらに限定されない。
適切な浸透圧調整剤は、当該技術分野で公知であり、かつ典型的には、1〜500mg/mLに及ぶ量で本発明による薬学的組成物中に存在する。例示的な浸透圧調整剤としては、塩化ナトリウム、デキストロース、重炭酸ナトリウム、塩化カルシウム、塩化カリウム、乳酸ナトリウム、リンゲル溶液、および乳酸化リンゲル溶液が挙げられるが、これらに限定されない。好ましい浸透圧調整剤には、塩化ナトリウムおよび/またはデキストロースが挙げられる。すべての実施形態において、開示された製剤は、1〜100mg/mL浸透圧調整剤、例えば、3〜60mg/mL塩化ナトリウムまたは3〜10mg/mL塩化ナトリウムを含有し得る。
本発明の薬学的組成物を容器中に充填するための手順、およびそれらのその後の処理(processing)は、当該技術分野で公知である。これらの手順は、医療のために必要とされることが多い滅菌医薬生成物を生成するために、従来から使用されている。このような処理技術は好ましくは、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含む薬学的組成物中に存在するかもしれない任意の微生物を、該薬学的組成物の調製および/または包装後に破壊または除去するための滅菌プロセスを使用する。例えば、終末滅菌は該薬学的組成物を含有する最終の密封包装内で生存している微生物をすべて破壊するために使用することができる。オートクレーブは共通して、該最終包装中の薬物生成物の終末熱滅菌を達成するために使用される。
最終生成物の終末滅菌を達成するための医薬産業における典型的なオートクレーブ周期は、121℃、15分間である。本発明のエスモロールヒドロクロリド組成物は、115℃から130℃までに及ぶ温度で、5から40分間に及ぶ期間、該(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩の実質的な分解を引き起こすことなくオートクレーブすることができる。オートクレーブ処理は好ましくは、119℃から122℃の温度範囲で、10〜36分間に及ぶ期間実施される。
あるいは、本発明による滅菌の薬学的組成物は、無菌処理技術を使用して調製してもよい。無菌充填は通常、熱滅菌に耐えられない薬物生成物を調製するために使用されるが、該生成物の中で、該成分のすべてが無菌である。滅菌状態は、滅菌材料および制御された作業環境を使用することによって維持される。すべての容器および装置は、好ましくは充填前の熱滅菌によって滅菌される。該容器(例えば、バイアル、アンプル、バッグ、ボトル、または注射器)は次に、無菌条件下で充填される。
開示された方法において、本発明の組成物を使用して処置される患者は、β遮断の必要があり、かつ、エスモロールのラセミ混合物を含む組成物を受容した後に、静脈刺激に対して感受性があり得または静脈刺激の病歴を有する。その一方で、患者は単純に、頻拍および/または高血圧に関する該患者の症状を消散させるために、比較的高い治療濃度を必要とするので、静脈刺激に対して感受性があり得る。加えて、患者はすでに、静脈刺激性のある薬物(例えば、アミオダロン、静脈内抗生物質、血液透析中の腎臓病患者)を摂取しており、該患者は、全身性エリテマトーデスもしくは静脈血栓症のような静脈刺激を引き起こす炎症状態に罹患しており、高齢であり、糖尿病患者であり、肥満であり、および/または薬物乱用者であるので、静脈刺激に対して感受性があり得る。
例えば、処置されるべき患者は、β遮断の必要があり得、かつ全身性エリテマトーデスもしくは静脈血栓症のような炎症状態に罹患している可能性がある。全身性エリテマトーデスにおいて、免疫応答は、静脈刺激を引き起こすことのできる、静脈の慢性炎症を引き起こすことができる。静脈血栓症において、血流を遮断しかつ静脈刺激を引き起こすことのできるクロットが形成し得る。したがって、一部の実施形態において、本発明の方法により処置されるべき患者は、β遮断の必要がありかつ全身性エリテマトーデスもしくは静脈血栓症のような炎症状態に罹患している。
加えて、高齢の患者は、静脈刺激に対して感受性があることが公知である。したがって、種々の実施形態においては、処置の必要のある患者は、β遮断の必要がありかつ65歳以上である。
その上、糖尿病患者は、創傷治癒(would healing)能力に欠陥をすでに発生させており、したがって静脈刺激性の傷害はより深刻である。結果として、糖尿病患者は、静脈刺激に対する感受性を示す。したがって、一部の実施形態において、本発明の方法により処置されるべき患者はβ遮断の必要がありかつ糖尿病患者である。
加えて、肥満の個体は、比較的大きな炎症性サイトカインプロファイルのため、炎症性傷害に対してより感受性があることが公知である。したがって、一部の実施形態において、本発明の方法により処置されるべき患者は、β遮断の必要がありかつ肥満である。
その上、静脈内薬物乱用者は、静脈の慢性穿刺により実質的に損傷した静脈を有することが多い。結果的に、静脈内薬物乱用は、静脈刺激に対する感受性を引き起こすことができる。したがって、一部の実施形態において、本発明の方法により処置されるべき患者は、β遮断の必要がありかつ静脈内薬物乱用者である。
患者はまた単純に、頻拍および/または高血圧の症状を消散させるために、比較的高い治療濃度を必要とするので、静脈刺激に対して感受性があり得る。例えば、流体制限患者、例えば、うっ血性心不全または体積注入に対して感受性のある他の状態のため流体制限下にある、β遮断の必要のある患者は、開示された方法および組成物から利益を得ることができる。なぜなら、より高い治療濃度の開示されたS−エスモロール含有組成物を投与し、それによりエスモロールのラセミ混合物の投与と関連することが多い静脈刺激を同時に最小化しながら、このような患者に対する体積効果を最小化することができるからである。
加えて、重度の頻拍性不整脈を経験している患者は、より迅速な様式で頻拍性不整脈を制御下に導くために、高濃度のエスモロールのようなβ遮断薬の迅速な用量設定の必要があり、それゆえ、かなりの静脈刺激に対して感受性がある可能性がある。したがって、一部の実施形態において、本発明の方法により処置されるべき患者は、重度の頻拍性不整脈を制御するために高濃度のS−エスモロールの迅速な用量設定を必要とする。
さらに、β遮断の必要のある塩分制限食中の患者は、本開示された方法および組成物から利益を得ることができる。なぜなら、エスモロールのS−異性体を含む本開示された組成物は、静脈刺激を最小化しながらより高い薬物濃度を投与することが可能であるという点で、エスモロールのラセミ混合物を含む組成物よりも有意に少量の塩分を含有することができるからである。したがって、一部の実施形態において、本発明の方法により処置されるべき患者は、β遮断の必要がありかつ塩分制限食中にある。
以下の実施例は、説明のために提供されており、いずれの方法においても本発明の範囲を制限するためではない。
表1は、以下の研究において利用されるエスモロール組成物の特性を列挙する。「バッチ数」とは、エスモロールヒドロクロリドの意図した濃度を指す。「実際のエスモロール濃度」とは、下記に示されるように、製剤を調製したときに(「動物試験前」)または動物試験の後(「動物試験後」)に非キラルHPLC法によって決定されるような特定の各製剤中のエスモロールヒドロクロリドの実際の濃度を指す。キラルHPLC法を使用して、該組成物中のS−異性体とR−異性体の比を決定した。動物試験前に決定された実際のエスモロール濃度は、動物への投与量(animal dosing)を決定するために使用された。動物試験前の値と動物試験後の値の間の濃度の小さな変動は、該組成物の安定性を示す。重量オスモル濃度(osmolality)およびpHを動物試験後に決定した。
(実施例1)
ウサギ耳静脈刺激試験を使用して、(i)メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリドのラセミ混合物(表1の「ラセミ化合物」)を含む組成物、および(ii)(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリドを実質的に含んでいない(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリド(表1における「S−異性体」)を含む組成物がヒト患者における静脈刺激を引き起こすための相対的な潜在能力を評価した。静脈刺激研究における使用のための受容性に関する確立された知識を基に、ウサギを試験システムとして選択した。HessovおよびBojen−Moller、Europ J Intens Care Med,2:97−101(1976);Hessovら、Intens Care Med,5:79−81(1979);Johnsonら、J Oral Maxil Surg,47:819−822(1989);Hooverら、Fundam Appl Toxicol,14:589−597(1990)。ウサギモデルはヒトよりも感度が高い可能性があるが、それにもかかわらず、ヒトにおけるかなりの静脈刺激を引き起こしそうな治療濃度を示すために適切である。
ウサギ耳静脈刺激試験を使用して、(i)メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリドのラセミ混合物(表1の「ラセミ化合物」)を含む組成物、および(ii)(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリドを実質的に含んでいない(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリド(表1における「S−異性体」)を含む組成物がヒト患者における静脈刺激を引き起こすための相対的な潜在能力を評価した。静脈刺激研究における使用のための受容性に関する確立された知識を基に、ウサギを試験システムとして選択した。HessovおよびBojen−Moller、Europ J Intens Care Med,2:97−101(1976);Hessovら、Intens Care Med,5:79−81(1979);Johnsonら、J Oral Maxil Surg,47:819−822(1989);Hooverら、Fundam Appl Toxicol,14:589−597(1990)。ウサギモデルはヒトよりも感度が高い可能性があるが、それにもかかわらず、ヒトにおけるかなりの静脈刺激を引き起こしそうな治療濃度を示すために適切である。
体重の範囲が2〜3kgの96羽の雌ニュージーランド白色家兎を試験した。ウサギの齢を試験のときに記録した。該ウサギは、血清学、細菌学、および寄生虫学の試験によって決定されるように、特定の病原体は報告によると含んでいなかった。ウサギは、投薬中を除き、水を自由に、かつCertified Hi−Fiber Rabbit LabDiet(登録商標)(#5325)を毎日1回摂取した。微生物および化学物質の混入について、水を定期的に分析し、餌にも水にも、本研究を妨げることになるいかなる公知の混入物も同定されなかった。
静脈内の投与経路は、臨床状況における意図した投与経路であるので、静脈内の投与経路を選択した。
投薬の前に、両耳の耳辺縁静脈の周りの毛を刈込んだ。各耳の辺縁静脈に24ゲージの血管内カテーテルを使用してアクセスした。カテーテルを、組成物が血流の方向に投与されるよう配置した。メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリドのラセミ混合物または(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリドを含む組成物の算出した体積を左耳に、対照組成物(食塩水)を右耳に、300μg/kg/分の速度に対応する体積を送達するようプログラムされたポンプによって投与した。剖検のときにたやすく得られる位置のために、すべての動物における注入部位を消えないインクまたは等価物で標識した。消えないインクは、必要に応じて再塗付した。
ウサギを4個体からなる群へと分けた。第1〜12群の各動物は、個々の製剤の刺激能力(irritation potential)を比較するために、表2に示すように、5mg/mL(すなわち、15mM)、10mg/mL(すなわち、30mM)、20mg/mL(すなわち60mM)、25mg/mL(すなわち、75mM)、35mg/mL(すなわち、105mM)、もしくは50mg/mL(すなわち、150mM)のエスモールヒドロクロリドのラセミ混合物(RS)、またはエスモロールヒドロクロリドのS−異性体(S)を含む組成物のいずれかの耳辺縁静脈への注入を受けた。各ウサギの耳を表3に呈示する肉眼による検査所見による分類により、投薬のおよそ2〜4時間後、24時間後、および72時間後に等級分けした。
組織試料を処置のおよそ24時間後または72時間後に回収し、10%中性緩衝化ホルマリン中で固定し、切り取り、処理し、パラフィン包埋し、薄片作製した。ヘマトキシリン−エオシン染色したスライドを調製し、光学顕微鏡によって調査した。
各組織試料(注射部位)由来の3枚の薄片を評価した。5つの形態学的特徴、すなわち内皮の損失、血栓症、血管周囲の炎症、血管周囲の浮腫、および血管周囲の出血を評価した。内皮の損失は、内皮を有さない静脈の相対的な周囲面積(circumference)の概算値を基に等級分けした。血栓症は、血栓の相対的な大きさおよび血管の管腔閉塞の程度を基に等級分けした。血管周囲の炎症および血管周囲の出血はそれぞれ、白血球および赤血球の数および分布を基に等級分けした。これらの特徴を等級分けするための基準を表4に詳述する。
血管周囲の浮腫を、変化の相対的な重症度を基に主観的に等級分けした:等級1=最小、等級2=軽度、等級3=中程度、等級4=顕著。
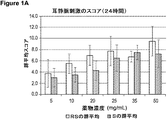
注入部位の組織病理学的観察を行い、注入24時間後(図1a)および注入72時間後(図1b)にスコア化した。図1は、耳への刺激の合計の集成値を示す。このスコアは、内皮の損失のスコア(図2)、血栓症スコア(図3)、炎症スコア(図4)、出血スコア(図5)、および浮腫スコア(図6)から構成される。
SAS(登録商標)手順MIXEDを使用して、二元配置分散分析(ANOVA)を各時点で実施した。従属変数は各々、内皮の損失スコア、血栓症スコア、炎症スコア、出血スコア、浮腫スコア、及びこれらの全体のスコア(合計)についての耳静脈刺激スコアの各々であった。表5は、示される試験組成物濃度についての静脈刺激試験集成値を比較する統計的有意性を要約する。
注入24時間後、20mg/mL(60mM)以上の濃度でラセミ混合物R,S−エスモロールヒドロクロリドを含む組成物を受けたウサギは、10mg/mL(30mM)以下の濃度のR,S−エスモロールヒドロクロリドを受けているウサギよりも有意に高い刺激スコアを有した。注入24時間後、R−異性体を実質的に含んでいない25mg/mL(75mM)以上の濃度のエスモロールヒドロクロリドのS−異性体を含む組成物を受けているウサギは、20mg/mL(60mM)以下の濃度のS−エスモロールヒドロクロリドを受けているウサギよりも有意に高い刺激スコアを有した。ラセミ混合物およびS−異性体組成物についての刺激スコアは、20mg/mL(60mM)のエスモロールヒドロクロリド濃度で異なり始めたが、20mg/mL(60mM)以上の濃度では、この早期の時点で刺激の増大を有意に引き起こさなかった。
注入72時間後、25mg/mL(75mM)以上の濃度でラセミ混合物R,S−エスモロールヒドロクロリドを含む組成物を受けているウサギは、20mg/mL(60mM)以下の濃度のR,S−エスモロールヒドロクロリドを受けているウサギよりも有意に高い刺激スコアを有した。注入72時間後、R−異性体を実質的に含んでいない50mg/mL(150mM)の濃度でエスモロールヒドロクロリドのS−異性体を含む組成物を受けているウサギは、35mg/mL(105mM)以下のS−エスモロールヒドロクロリドを受けているウサギよりも有意に高い刺激スコアを有した。刺激スコアは、25mg/mL(75mM)のエスモロールヒドロクロリド濃度で異なり始めた。エスモロールヒドロクロリドのラセミ混合物は、25mg/mL(60mM)以上のすべての濃度で有意により大きな刺激(p=0.002)を引き起こした。
S−異性体は、上記ラセミ混合物中に存在する治療的潜在能力を実質的にすべて有しているので、S−異性体の量の半分は、所与の量のエスモロールのラセミ混合物に対して等しい治療効果をもたらす(equitherapeutic)と考えられた。それゆえ、50mg/mL(150mM)のR,S−エスモロールヒドロクロリドのラセミ混合物を含む組成物が投与される場合、直接比較のために投与されるエスモロールヒドロクロリドのS−異性体が等しい治療効果をもたらす濃度は25mg/mL(75mM)であった。注入24時間後の等しい治療効果をもたらす濃度(例えば、50mg/mL(150mM)のラセミ混合物対25mg/mL(75mM)のエスモロールのS−異性体)を比較すると、試験したすべての濃度におけるエスモロールのラセミ混合物を含む組成物について、刺激スコアは有意により高かった(p<0.0001)。
注入72時間後の等しい治療効果をもたらす濃度(例えば、50mg/mL(150mM)のラセミ混合物を含む組成物対25mg/mL(75mM)のエスモロールのS−異性体を含む組成物)を比較すると、刺激の集成値は、試験したすべての濃度でエスモロールのラセミ混合物を含む組成物について有意により高かった(p<0.0001)(図1b)。同様に、注入72時間後の等しい治療効果をもたらす濃度を比較すると、エスモロールヒドロクロリドのラセミ混合物を含む組成物は、ウサギ耳静脈刺激試験のうちの副次成分ごとに、エスモロールヒドロクロリドのS−異性体を含む組成物よりも有意に高いスコアを生じた。内皮の損失について、p値は0.034であり(図2b)、血栓症について、p値は0.019であり(図3b)、炎症について、p値は0.0001未満であり(図4b)、出血について、p値は0.001であり(図5b)、浮腫について、p値は0.0001未満であった(図6b)。
表6は、試験組成物の示される濃度についての静脈刺激の個々の成分についての試験スコアを比較する統計的有意性を要約する。
総合すると、これらのデータは、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を25mg/mL(75mM)と50mg/mL(150mM)の間の量で含む組成物を、等しい濃度のそのラセミ混合物と比較して投与すると、有意に低い静脈刺激が観察されること、および等しい治療効果をもたらす濃度のエスモロールのS−異性体を含む組成物を対応する濃度のラセミ混合物と比較すると、静脈刺激低減の作用が特に顕著であることという本発明者らの予期せぬかつ驚くべき発見を示す。これらのデータはさらに、R−異性体がラセミ製剤の刺激への潜在能力に寄与していることを示唆する。
(実施例2)
実施例1に記載した研究を拡張して、(i)メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリドのラセミ混合物(表1の「ラセミ化合物」)を含む組成物、および(ii)(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリドを実質的に含んでいない88mg/mLまたは133mg/mLの(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリド(表1の「S−異性体」)を含む組成物が、ヒト患者における静脈刺激を引き起こす相対的な潜在能力を評価した。
実施例1に記載した研究を拡張して、(i)メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリドのラセミ混合物(表1の「ラセミ化合物」)を含む組成物、および(ii)(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリドを実質的に含んでいない88mg/mLまたは133mg/mLの(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリド(表1の「S−異性体」)を含む組成物が、ヒト患者における静脈刺激を引き起こす相対的な潜在能力を評価した。
体重範囲が2〜3kgの15週齢の16羽の雌ニュージーランド白色家兎を試験した。該ウサギは、血清学、細菌学、および寄生虫学の試験によって決定されるように、特定の病原体は報告によると含んでいなかった。到着の際、動物を7日間隔離した。臨床的な疾病の徴候を示さないウサギのみを本研究において使用した。動物を耳タグによって識別し、ステンレス鋼ケージの中で個々に飼育した。ウサギは、投薬中を除き、水を自由に、かつCertified Hi−Fiber Rabbit LabDiet(登録商標)(#5325)を毎日1回摂取した。ウサギは、Timothy Hay CubesまたはNutra Blocks(Bio−Serv)を1週間に1〜2回提供された。微生物および化学物質の混入について、水を定期的に分析し、餌にも水にも、本研究を妨げることになるいかなる公知の混入物も同定されなかった。
88mg/mLおよび133mg/mLのS−異性体エスモロール濃度を本研究において評価し、該濃度は実施例1において試験した最高濃度よりも1.8倍および2.7倍高い濃度を表す。実施例1にあるように、300μg/kg/分の投薬速度を4時間使用した。本研究のパラメータを表2の第13群および第14群に示す。
投薬の前に、両耳の耳辺縁静脈の周りの毛を刈込んだ。各耳の辺縁静脈に24ゲージの血管内カテーテルを使用してアクセスした。カテーテルを、物品が血流の方向に投与されるよう配置した。試験物品の算出された体積を左耳に、対照物品を右耳に、300μg/kg/分の速度に対応する体積を送達するようプログラムされたポンプによって投与した。注入部位の位置を消えないインクで注射時に標識した。
投薬の1時間±10分前に、ウサギに0.03mg/kgのブプレノルフィン(鎮痛薬)を皮下的に投与した。追加的なブプレノルフィン用量をおよそ8〜12時間の間隔で最長24時間の観察時点まで投与した。24時間の時点で、注射部位を評価して全体の刺激を決定した。等級4の肉眼検査での刺激をある群において1個体以上で観察した場合、72時間の観察時点まで8〜12時間の間隔でブプレノルフィン投与を続行した。
各ウサギの耳を表3に呈示される肉眼による検査所見による分類により、適宜投薬のおよそ2〜4時間後、24時間後、および72時間後に等級分けした。
終了および組織回収の当日、ウサギを1:2の酸素:一酸化窒素における最大5%ノイソフルランで麻酔した後、心穿刺によって投与したペントバルビタールナトリウム含有溶液で安楽死させた。耳辺縁静脈および周辺組織(耳の長軸に平行なおよそ1.5cm×耳の長軸に垂直な1cm)の全厚切片を各ウサギの処置した耳および対照の耳の両方から切り出した。該切片をカテーテル尖端に対して近位で始まって切り出し、この切片を、さらなる組織学処理にこの組織を適合させるためにカテーテル尖端に対して最も近い側に刻み目で標識した。すべての切片を10%中性緩衝化ホルマリン中で保存した。固定した試料を切り取り、処理し、パラフィン包埋し、薄片作製した。ヘマトキシリン−エオシン染色したスライドを調製し、光学顕微鏡によって調査した。
各組織試料(注射部位)由来の3枚の薄片を評価した。5つの形態学的特徴、すなわち内皮の損失、血栓症、血管周囲の炎症、血管周囲の浮腫、および血管周囲の出血を評価した。内皮の損失は、内皮を有さない静脈の相対的な周囲面積の概算値を基に等級分けした。血栓症は、血栓の相対的な大きさおよび血管の管腔閉塞の程度を基に等級分けした。血管周囲の炎症および血管周囲の出血はそれぞれ、白血球および赤血球の数および分布を基に等級分けした。これらの特徴を等級分けするための基準を表4に詳述する。
血管周囲の浮腫を、変化の相対的な重症度を基に主観的に等級分けした:等級1=最小、等級2=軽度、等級3=中程度、等級4=顕著。
最も重度の変化を有する各組織試料(注射部位)の組織学的切片は、該試料におけるその形態学的特徴についての等級を決定した。各注射部位について、全体的なスコアはすべての観察について観察等級を加算することによって導出した。正の観察を有さない形態学的特徴を等級=0に割り当て、全体的なスコアを算出した。刺激の程度を顕微鏡検査による所見とともに肉眼による検査所見を基に決定した。各試験物品群についての所見を、対応する対照と比較した。
個々の肉眼検査での観察を表7に要約する。試験物品についてのスコアは、食塩水対照と比較してより高かった。本結果の要約を表8に示す。88mg/mLおよび133mg/mLのS−異性体エスモロール製剤は、中程度の刺激および中程度から重度の刺激を処置の24〜72時間後にそれぞれ呈した。組織の腫脹は、S−異性体エスモロールで処置したすべての注射部位に存在した。
エスモロールのS−異性体の両濃度についての全体的な平均スコアは、食塩水対照標本と比較して24時間および72時間での両評価においてより高かった。全体的な平均スコアは、両製剤濃度で同様であり、起こり得る最大刺激スコアである16に到達した。72時間での標本についてのスコアは、24時間での標本についてのスコアと類似していた。
88mg/mL濃度についての24時間での評価で、組織学的変化は、中程度(等級3)の内皮の損失、軽度〜中程度(等級2〜3)の血栓症および血管周囲の出血、ならびに顕著な(等級4)血管周囲の浮腫を、最小(等級1)の血管周囲の炎症とともに含んでいた。133mg/mL濃度で、すべての標本において、血栓症は中程度(等級3)であり、かつ血管周囲の炎症は軽症(等級2)であり、別途、133mg/mLでの組織学的変化の重症度は、88mg/mL濃度での重症度と類似していた。
72時間での評価で、88mg/mLおよび133mg/mL濃度での組織学的変化の重症度は類似しており、軽度〜中程度(等級2〜3)の内皮の損失、血栓症、ならびに血管周囲の出血および炎症、ならびに中程度から顕著な(等級3〜4)血管周囲の浮腫を含んでいた。
本研究の条件下で、エスモロールのS−異性体の88mg/mLまたは133mg/mLの製剤を与えられたウサギ由来の標本についての血管刺激の組織学的スコアは、両方の濃度ならびに24時間および72時間の両方の評価で類似していた。刺激の平均スコア130〜14.8は、起こり得る最大刺激スコアである16に到達した。総合すると、これらのデータは、静脈刺激をあまり引き起こさない(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含む方法および組成物についての上限が約50mg/mL(150mMに相当)であることを示す。
Claims (92)
- (S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含む薬学的組成物であって、この中で、該(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩は約60mMと約150mMの間の濃度で存在し、かつこの中で該薬学的組成物は、(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を実質的に含んでいない、薬学的組成物。
- (S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩、浸透圧調整剤、および緩衝剤を含む水性の薬学的組成物であって、この中で、該(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩は、約60mMと約150mMの間の濃度で存在し、かつこの中で、該薬学的組成物は、(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を実質的に含んでいない、水性の薬学的組成物。
- 前記水性の薬学的組成物は、プロピレングリコールおよびエタノールを実質的に含んでいない、前記請求項のいずれかに記載の水性の薬学的組成物。
- 前記組成物はすぐに使える、前記請求項のいずれかに記載の組成物。
- 前記組成物は無菌である、前記請求項のいずれかに記載の組成物。
- 前記組成物は、非経口注入に適切である、前記請求項のいずれかに記載の組成物。
- 前記組成物は、約4.5〜約5.5のpHを有する、前記請求項のいずれかに記載の組成物。
- 前記組成物は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリドを約20mg/mLと約50mg/mLの間の、または約25mg/mLと約50mg/mLの間の濃度で含む、前記請求項のいずれかに記載の組成物。
- 前記組成物は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を約75mMと約150mMの間の濃度で含む、請求項1〜7のいずれか一項に記載の組成物。
- 前記薬学的組成物は、該組成物中にメチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩の総量を基に、10重量%未満、5重量%未満、3重量%未満、2重量%未満、1重量%未満、および/または0.5重量%未満の(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含有する、前記請求項のいずれかに記載の組成物。
- 心臓障害を処置する必要のある被験体へ、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含む治療有効量の薬学的組成物を投与するステップを含む、心臓障害を処置する方法であって、この中で、該(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩は、約60mMと約150mMの間の濃度で存在し、かつこの中で、該薬学的組成物は、(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を実質的に含んでいない、方法。
- 前記組成物は、プロピレングリコールおよびエタノールを実質的に含んでいない、請求項11に記載の方法。
- 前記心臓の状態は、頻拍および高血圧からなる群から選択される、請求項11または12に記載の方法。
- 前記頻拍は、上室頻拍症、術中頻拍、および術後頻拍からなる群から選択される、請求項13に記載の方法。
- 前記被験体は、重度の頻拍性不整脈の迅速な制御を必要とする、請求項11〜14のいずれか一項に記載の方法。
- 前記被験体は塩分制限食中にある、請求項11〜15のいずれか一項に記載の方法。
- 前記被験体は流体制限中にある、請求項11〜16のいずれか一項に記載の方法。
- 前記被験体は、うっ血性心不全に罹患している、請求項11〜17のいずれか一項に記載の方法。
- 前記被験体は、静脈刺激に対して感受性がある、請求項11〜18のいずれか一項に記載の方法。
- 前記被験体は、静脈刺激性である薬物を併せて摂取している、請求項11〜19のいずれか一項に記載の方法。
- 前記被験体は、全身性エリテマトーデスおよび静脈血栓症から選択される炎症状態に罹患している、請求項11〜20のいずれか一項に記載の方法。
- 前記被験体は65歳以上である、請求項11〜21のいずれか一項に記載の方法。
- 前記被験体は糖尿病患者である、請求項11〜22のいずれか一項に記載の方法。
- 前記被験体は肥満である、請求項11〜23のいずれか一項に記載の方法。
- 前記被験体は静脈内薬物乱用者である、請求項11〜24のいずれかに記載の方法。
- 前記組成物は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリドを約20mg/mLと約50mg/mLの間の、または約25mg/mLと約50mg/mLの間の濃度で含む、請求項11〜25のいずれか一項に記載の方法。
- 前記組成物は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を約75mMと約150mMの間の濃度で含む、請求項11〜25のいずれか一項に記載の方法。
- 前記薬学的組成物は、該組成物中のメチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩の総量を基に、10重量%未満、5重量%未満、3重量%未満、2重量%未満、1重量%未満、および/または0.5重量%未満の(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含有する、請求項11〜27のいずれか一項に記載の方法。
- 心臓障害を処置する目的での使用のための請求項1〜10のいずれか一項に記載の組成物。
- 頻拍および/または高血圧を処置する目的での使用のための請求項29に記載の組成物。
- 上室頻拍症、術中頻拍、および術後頻拍から選択される頻拍を処置する目的での使用のための請求項30に記載の組成物。
- 重度の頻拍性不整脈の迅速な制御を必要とする被験体を処置するための請求項29〜31のいずれか一項に記載の組成物。
- 塩分制限食中の被験体を処置するための請求項29〜32のいずれか一項に記載の組成物。
- 流体制限されている被験体を処置するための請求項29〜33のいずれか一項に記載の組成物。
- うっ血性心不全に罹患している被験体を処置するための請求項29〜34のいずれか一項に記載の組成物。
- 静脈刺激に対して感受性がある被験体を処置するための請求項29〜35のいずれか一項に記載の組成物。
- 静脈刺激性である薬物を併せて摂取している被験体を処置するための請求項29〜36のいずれか一項に記載の組成物。
- 全身性エリテマトーデスおよび静脈血栓症から選択される炎症状態に罹患している被験体を処置するための請求項29〜37のいずれか一項に記載の組成物。
- 65歳以上の被験体を処置するための請求項29〜38のいずれか一項に記載の組成物。
- 糖尿病の被験体を処置するための請求項29〜39のいずれか一項に記載の組成物。
- 肥満の被験体を処置するための請求項29〜40のいずれか一項に記載の組成物。
- 静脈内薬物乱用者である被験体を処置するための請求項29〜41のいずれかに記載の組成物。
- 心臓障害を処置する薬剤の製造における(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩の使用であって、この中で、該薬剤は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を約60mMと約150mMの間の濃度で含み、かつ(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を実質的に含んでいない、使用。
- プロピレングリコールおよびエタノールを実質的に含んでいない薬剤の製造における、請求項43に記載の使用。
- 前記薬剤は、頻拍および/または高血圧を処置するためのものである、請求項43または44に記載の使用。
- 前記薬剤は、上室頻拍症、術中頻拍、および術後頻拍から選択される頻拍を処置するためのものである、請求項45に記載の使用。
- 前記薬剤は、重度の頻拍性不整脈の迅速な制御を必要とする被験体を処置するためのものである、請求項45〜46のいずれか一項に記載の使用。
- 前記薬剤は、塩分制限食中の被験体を処置するためのものである、請求項45〜47のいずれか一項に記載の使用。
- 前記薬剤は、流体制限されている被験体を処置するためのものである、請求項45〜48のいずれか一項に記載の使用。
- 前記薬剤は、うっ血性心不全に罹患している被験体を処置するためのものである、請求項45〜49のいずれか一項に記載の使用。
- 前記薬剤は、静脈刺激に対して感受性がある被験体を処置するためのものである、請求項45〜50のいずれか一項に記載の使用。
- 前記薬剤は、静脈刺激性である薬物との併用投与のためのものである、請求項45〜51のいずれか一項に記載の使用。
- 前記薬剤は、全身性エリテマトーデスおよび静脈血栓症から選択される炎症状態に罹患している被験体の処置のためのものである、請求項45〜52のいずれか一項に記載の使用。
- 前記薬剤は、65歳以上の被験体を処置するためのものである、請求項45〜53のいずれか一項に記載の使用。
- 前記薬剤は、糖尿病の被験体を処置するためのものである、請求項45〜54のいずれか一項に記載の使用。
- 前記薬剤は、肥満の被験体の処置のためのものである、請求項45〜55のいずれか一項に記載の使用。
- 前記薬剤は、静脈内薬物乱用者である被験体の処置のためのものである、請求項45〜56のいずれか一項に記載の使用。
- 前記薬剤は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリドを約20mg/mLと約50mg/mLの間の、または約25mg/mLと約50mg/mLの間の濃度で含む、請求項45〜57のいずれか一項に記載の使用。
- 前記組成物は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を約75mMと約150mMの間の濃度で含む、請求項45〜57のいずれか一項に記載の使用。
- 前記薬学的組成物は、該組成物中のメチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩の総量を基に、10重量%未満、5重量%未満、3重量%未満、2重量%未満、1重量%未満、および/または0.5重量%未満の(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含有する、請求項45〜59のいずれか一項に記載の使用。
- 心拍数を制御する必要のある被験体へ、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含む治療有効量の薬学的組成物を投与するステップを含む、心拍数を制御する方法であって、この中で、該(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩は、約60mMと約150mMの間の濃度で存在し、かつこの中で、該薬学的組成物は、(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を実質的に含んでいない、方法。
- 前記組成物は、プロピレングリコールおよびエタノールを実質的に含んでいない、請求項61に記載の方法。
- 前記被験体は、重度の頻拍性不整脈の迅速な制御を必要とする、請求項61または62に記載の方法。
- 前記被験体は塩分制限食中にある、請求項61〜63のいずれか一項に記載の方法。
- 前記被験体は流体制限されている、請求項61〜64のいずれか一項に記載の方法。
- 前記被験体は、うっ血性心不全に罹患している、請求項61〜65のいずれか一項に記載の方法。
- 前記被験体は、静脈刺激に対して感受性がある、請求項61〜66のいずれか一項に記載の方法。
- 前記被験体は、静脈刺激性である薬物を併せて摂取している、請求項61〜67のいずれか一項に記載の方法。
- 前記被験体は、全身性エリテマトーデスおよび静脈血栓症から選択される炎症状態に罹患している、請求項61〜68のいずれか一項に記載の方法。
- 前記被験体は65歳以上である、請求項61〜69のいずれか一項に記載の方法。
- 前記被験体は糖尿病患者である、請求項61〜70のいずれか一項に記載の方法。
- 前記被験体は肥満である、請求項61〜71のいずれか一項に記載の方法。
- 前記被験体は、静脈内薬物乱用者である、請求項61〜72のいずれか一項に記載の方法。
- 前記組成物は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリドを約20mg/mLと約50mg/mLの間の、または約25mg/mLと約50mg/mLの間の濃度で含む、請求項61〜73のいずれか一項に記載の方法。
- 前記組成物は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を約75mMと約150mMの間の濃度で含む、請求項61〜73のいずれか一項に記載の方法。
- 前記薬学的組成物は、該組成物中のメチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩の総量を基に、10重量%未満、5重量%未満、3重量%未満、2重量%未満、1重量%未満、および/または0.5重量%未満の(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含有する、請求項61〜75のいずれか一項に記載の方法。
- 被験体における心拍数を制御するための薬剤の製造における(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩の使用であって、この中で、該薬剤は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を約60mMと約150mMの間の濃度で含み、かつ(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を実質的に含んでいない、使用。
- プロピレングリコールおよびエタノールを実質的に含んでいない薬剤の製造における請求項77に記載の使用。
- 前記薬剤は、重度の頻拍性不整脈の迅速な制御を必要とする被験体を処置するためのものである、請求項77または78に記載の使用。
- 前記薬剤は、塩分制限食中にある被験体を処置するためのものである、請求項77〜79のいずれか一項に記載の使用。
- 前記薬剤は、流体制限されている被験体を処置するためのものである、請求項77〜80のいずれか一項に記載の使用。
- 前記薬剤は、うっ血性心不全に罹患している被験体を処置するためのものである、請求項77〜81のいずれか一項に記載の使用。
- 前記薬剤は、静脈刺激に対して感受性がある被験体を処置するためのものである、請求項77〜82のいずれか一項に記載の使用。
- 前記薬剤は、静脈刺激性である薬物との併用投与のためのものである、請求項77〜83のいずれか一項に記載の使用。
- 前記薬剤は、全身性エリテマトーデスおよび静脈血栓症から選択される炎症状態に罹患している被験体の処置のためのものである、請求項77〜84のいずれか一項に記載の使用。
- 前記薬剤は、65歳以上の被験体を処置するためのものである、請求項77〜85のいずれか一項に記載の使用。
- 前記薬剤は、糖尿病の被験体を処置するためのものである、請求項77〜86のいずれか一項に記載の使用。
- 前記薬剤は、肥満の被験体の処置のためのものである、請求項77〜87のいずれか一項に記載の使用。
- 前記薬剤は、静脈内薬物乱用者である被験体の処置のためのものである、請求項77〜88のいずれか一項に記載の使用。
- 前記薬剤は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートヒドロクロリドを約20mg/mLと約50mg/mLの間の、または約25mg/mLと約50mg/mLの間の濃度で含む、請求項77〜89のいずれか一項に記載の使用。
- 前記組成物は、(S)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を、約75mMと約150mMの間の濃度で含む、請求項77〜89のいずれか一項に記載の使用。
- 前記薬学的組成物は、該組成物中のメチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩の総量を基に、10重量%未満、5重量%未満、3重量%未満、2重量%未満、1重量%未満、および/または0.5重量%未満の(R)−メチル−3−[4−(2−ヒドロキシ−3−イソプロピルアミノ)プロポキシ]フェニルプロピオナートまたは薬学的に許容し得るその塩を含有する、請求項77〜91のいずれか一項に記載の使用。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161436995P | 2011-01-27 | 2011-01-27 | |
| US61/436,995 | 2011-01-27 | ||
| PCT/US2012/022679 WO2012103305A1 (en) | 2011-01-27 | 2012-01-26 | Use of (s) - esmolol for controlling venous irritation associated with the treatment of a cardiac disorder |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2014511365A true JP2014511365A (ja) | 2014-05-15 |
| JP2014511365A5 JP2014511365A5 (ja) | 2015-03-19 |
Family
ID=45567140
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013551325A Withdrawn JP2014511365A (ja) | 2011-01-27 | 2012-01-26 | 心臓障害の処置に関連する静脈刺激を調節するための(s)−エスモロールの使用 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US8829047B2 (ja) |
| EP (1) | EP2667866B1 (ja) |
| JP (1) | JP2014511365A (ja) |
| KR (1) | KR20140019334A (ja) |
| CN (1) | CN103347513A (ja) |
| AU (1) | AU2012211309B2 (ja) |
| BR (1) | BR112013018598A2 (ja) |
| CA (1) | CA2825716A1 (ja) |
| MX (1) | MX2013008715A (ja) |
| WO (1) | WO2012103305A1 (ja) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20140034729A (ko) * | 2011-01-27 | 2014-03-20 | 백스터 인터내셔널 인코포레이티드 | 저혈압을 최소화 및/또는 제어하면서 심계항진을 치료 및/또는 심박동수를제어하는 방법 |
| US10813630B2 (en) | 2011-08-09 | 2020-10-27 | Corquest Medical, Inc. | Closure system for atrial wall |
| US10307167B2 (en) | 2012-12-14 | 2019-06-04 | Corquest Medical, Inc. | Assembly and method for left atrial appendage occlusion |
| US10314594B2 (en) | 2012-12-14 | 2019-06-11 | Corquest Medical, Inc. | Assembly and method for left atrial appendage occlusion |
| US20140142689A1 (en) | 2012-11-21 | 2014-05-22 | Didier De Canniere | Device and method of treating heart valve malfunction |
| US9566443B2 (en) | 2013-11-26 | 2017-02-14 | Corquest Medical, Inc. | System for treating heart valve malfunction including mitral regurgitation |
| US10842626B2 (en) | 2014-12-09 | 2020-11-24 | Didier De Canniere | Intracardiac device to correct mitral regurgitation |
| WO2023170680A1 (en) | 2022-03-08 | 2023-09-14 | Equashield Medical Ltd | Fluid transfer station in a robotic pharmaceutical preparation system |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1985004580A1 (en) | 1984-04-09 | 1985-10-24 | American Hospital Supply Corporation | Pharmaceutical composition and method for treatment or prophylaxis of cardiac disorders |
| EP0248879A4 (en) | 1985-12-04 | 1990-02-26 | Du Pont | PRODUCTION OF ARYLOXYPROPANOLAMINES AND ARYLÄTHANOLAMINES. |
| JP2521317B2 (ja) | 1986-09-02 | 1996-08-07 | ザ・デュポン・メルク・ファーマシュウティカル・カンパニー | dl―メチル3―[4―(2―ヒドロキシ―3―イソプロピルアミノ)プロポキシ]フエニルプロピオネ―ト[(dl―エスモロ―ル)]の分割 |
| US4857552A (en) | 1988-06-08 | 1989-08-15 | E. I. Du Pont De Nemours And Co. | Stable pharmaceutical composition |
| US5998019A (en) | 1993-11-16 | 1999-12-07 | Baxter International Inc. | Multi-layered polymer structure for medical products |
| US5849843A (en) | 1993-11-16 | 1998-12-15 | Baxter International Inc. | Polymeric compositions for medical packaging and devices |
| US5977409A (en) * | 1997-04-15 | 1999-11-02 | University Of Toledo | Method of using α-substituted benzylamine chiral auxiliary synthetic reagents |
| TWI277414B (en) * | 2001-01-12 | 2007-04-01 | Baxter Int | Esmolol formulation |
| US6310094B1 (en) * | 2001-01-12 | 2001-10-30 | Baxter International Inc. | Ready-to-use esmolol solution |
| US20060286037A1 (en) | 2003-08-08 | 2006-12-21 | Ono Pharmaceutical Co., Ltd. | Heart-slowing drug containing short-acting ß blocker as the active ingredient |
| US20080293814A1 (en) | 2007-05-22 | 2008-11-27 | Deepak Tiwari | Concentrate esmolol |
| CN101323580A (zh) | 2008-07-25 | 2008-12-17 | 河北科技大学 | 手性芳氧丙醇胺类化合物及其盐的合成方法 |
| CN101881755B (zh) | 2009-05-04 | 2013-05-29 | 南京海辰药业有限公司 | 通过高效液相色谱法检测盐酸艾司洛尔光学异构体的方法 |
| CN101891636A (zh) | 2009-05-21 | 2010-11-24 | 南京海辰药业有限公司 | 制备盐酸艾司洛尔光学异构体的新方法 |
| CN102106846A (zh) | 2009-12-23 | 2011-06-29 | 南京海辰药业有限公司 | 左旋盐酸艾司洛尔药物组合物及其制备方法 |
| KR20140034729A (ko) | 2011-01-27 | 2014-03-20 | 백스터 인터내셔널 인코포레이티드 | 저혈압을 최소화 및/또는 제어하면서 심계항진을 치료 및/또는 심박동수를제어하는 방법 |
-
2012
- 2012-01-26 US US13/358,949 patent/US8829047B2/en active Active
- 2012-01-26 AU AU2012211309A patent/AU2012211309B2/en not_active Ceased
- 2012-01-26 WO PCT/US2012/022679 patent/WO2012103305A1/en active Application Filing
- 2012-01-26 KR KR1020137022490A patent/KR20140019334A/ko not_active Application Discontinuation
- 2012-01-26 MX MX2013008715A patent/MX2013008715A/es active IP Right Grant
- 2012-01-26 BR BR112013018598A patent/BR112013018598A2/pt not_active IP Right Cessation
- 2012-01-26 JP JP2013551325A patent/JP2014511365A/ja not_active Withdrawn
- 2012-01-26 CN CN2012800067439A patent/CN103347513A/zh active Pending
- 2012-01-26 CA CA2825716A patent/CA2825716A1/en not_active Abandoned
- 2012-01-26 EP EP20120702940 patent/EP2667866B1/en not_active Not-in-force
Also Published As
| Publication number | Publication date |
|---|---|
| MX2013008715A (es) | 2013-08-29 |
| CA2825716A1 (en) | 2012-08-02 |
| BR112013018598A2 (pt) | 2016-10-18 |
| EP2667866B1 (en) | 2015-05-20 |
| US8829047B2 (en) | 2014-09-09 |
| KR20140019334A (ko) | 2014-02-14 |
| CN103347513A (zh) | 2013-10-09 |
| US20120277309A1 (en) | 2012-11-01 |
| AU2012211309A1 (en) | 2013-05-02 |
| WO2012103305A1 (en) | 2012-08-02 |
| EP2667866A1 (en) | 2013-12-04 |
| AU2012211309B2 (en) | 2014-10-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2014511365A (ja) | 心臓障害の処置に関連する静脈刺激を調節するための(s)−エスモロールの使用 | |
| JP6282699B2 (ja) | 安定で保存剤非含有の散瞳および抗炎症注射用液剤 | |
| US10561607B2 (en) | Pharmaceutical compositions comprising gels and methods for fabricating thereof | |
| TW202140062A (zh) | Glp-1組成物及其用途 | |
| US8741953B2 (en) | Topical formulation for diabetic foot ulcers | |
| US20200155450A1 (en) | Pharmaceutical compositions comprising gels and methods for fabricating thereof | |
| WO2022193975A1 (zh) | 供注射用罗哌卡因长效溶液制剂及其制备方法 | |
| US9084763B2 (en) | Methods for treating tachycardia and/or controlling heart rate while minimizing and/or controlling hypotension | |
| US20240058320A1 (en) | Mydriatic compositions and methods for fabricating thereof | |
| WO2022046976A1 (en) | An epinephrine injection formulation with very low epinephrine concentration and low impurities during its shelf-life | |
| Bafna et al. | Comparison of intrathecal buprenorphine versus clonidine as an adjuvant to 0.5% hyperbaric bupivacaine in lower abdominal surgeries | |
| TWI819756B (zh) | 包含塞納布啡的藥物組合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150126 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20150126 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20151116 |