JP2014504857A - ロックドヌクレオチドを含むmicroRNA阻害剤 - Google Patents
ロックドヌクレオチドを含むmicroRNA阻害剤 Download PDFInfo
- Publication number
- JP2014504857A JP2014504857A JP2013544772A JP2013544772A JP2014504857A JP 2014504857 A JP2014504857 A JP 2014504857A JP 2013544772 A JP2013544772 A JP 2013544772A JP 2013544772 A JP2013544772 A JP 2013544772A JP 2014504857 A JP2014504857 A JP 2014504857A
- Authority
- JP
- Japan
- Prior art keywords
- mir
- oligonucleotide
- nucleotides
- locked
- antimir
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/7105—Natural ribonucleic acids, i.e. containing only riboses attached to adenine, guanine, cytosine or uracil and having 3'-5' phosphodiester links
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/11—Antisense
- C12N2310/113—Antisense targeting other non-coding nucleic acids, e.g. antagomirs
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/31—Chemical structure of the backbone
- C12N2310/315—Phosphorothioates
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/32—Chemical structure of the sugar
- C12N2310/323—Chemical structure of the sugar modified ring structure
- C12N2310/3231—Chemical structure of the sugar modified ring structure having an additional ring, e.g. LNA, ENA
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/34—Spatial arrangement of the modifications
- C12N2310/346—Spatial arrangement of the modifications having a combination of backbone and sugar modifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2525/00—Reactions involving modified oligonucleotides, nucleic acids, or nucleotides
- C12Q2525/10—Modifications characterised by
- C12Q2525/204—Modifications characterised by specific length of the oligonucleotides
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/178—Oligonucleotides characterized by their use miRNA, siRNA or ncRNA
Abstract
【課題】本発明は、miR−208a、miR−208b、および/またはmiR−499を含むmiR−208ファミリーのmiRNAの発現(たとえば存在量)を阻害可能な化学修飾オリゴヌクレオチドを提供する。
【解決手段】本発明は、いくつかの実施形態において、miR−208a、miR−208b、およびmiR−499のそれぞれの発現または存在量を特異的に阻害可能なオリゴヌクレオチドを提供する。本発明は、本オリゴヌクレオチドを含む医薬組成物、およびmiR−208ファミリーのmiRNAに関連するまたはそれが関与する病状または障害、たとえば、心臓血管病状を有する患者を治療する方法をさらに提供する。種々の実施形態において、本オリゴヌクレオチドは、効力、送達効率、標的特異性、毒性、および/または安定性の1つ以上の利点を提供する。
【選択図】なし
【解決手段】本発明は、いくつかの実施形態において、miR−208a、miR−208b、およびmiR−499のそれぞれの発現または存在量を特異的に阻害可能なオリゴヌクレオチドを提供する。本発明は、本オリゴヌクレオチドを含む医薬組成物、およびmiR−208ファミリーのmiRNAに関連するまたはそれが関与する病状または障害、たとえば、心臓血管病状を有する患者を治療する方法をさらに提供する。種々の実施形態において、本オリゴヌクレオチドは、効力、送達効率、標的特異性、毒性、および/または安定性の1つ以上の利点を提供する。
【選択図】なし
Description
関連発明の相互参照
本出願は、2010年12月15日に出願された米国仮出願第61/423,456号および2011年6月9日に出願された米国仮出願第61/495,224号(それぞれその全体を参照により本明細書に援用する)の優先権および利益を主張する。
本出願は、2010年12月15日に出願された米国仮出願第61/423,456号および2011年6月9日に出願された米国仮出願第61/495,224号(それぞれその全体を参照により本明細書に援用する)の優先権および利益を主張する。
発明の分野
本発明は、microRNA(miRNAまたはmiR)阻害剤の化学モチーフ、特に、患者に投与したときに効力(potency)、送達効率、標的特異性、安定性、および/または毒性における利点を有する化学修飾されたmiRNAアンチセンスオリゴヌクレオチドに関する。
本発明は、microRNA(miRNAまたはmiR)阻害剤の化学モチーフ、特に、患者に投与したときに効力(potency)、送達効率、標的特異性、安定性、および/または毒性における利点を有する化学修飾されたmiRNAアンチセンスオリゴヌクレオチドに関する。
背景
microRNA(miR)は、心臓機能の制御および維持を含む多くの生物学的プロセスに関与している(Eva Van Rooij and Eric Olson, MicroRNAs: Powerful new regulators of heart disease and proactive therapeutic targets, J. Clin. Invest. 117(9):2369-2376 (2007)、Chien KR, Molecular Medicine: MicroRNAs and the tell-tale heart. Nature 447, 389-390 (2007)を参照)。したがって、miRは、約18〜約25ヌクレオチドの長さの小さな、タンパク質をコードしない(non-protein coding)RNAであり、配列が完全に相補的である場合には分解を促進することにより、または配列がミスマッチを含む場合には翻訳を阻害することにより、標的mRNAのリプレッサーとして働く。その機序は、RNA誘導サイレンシング複合体(RISC)中への成熟miRNA鎖の導入(incorporation)を含み、ここで、塩基対の相補性によって標的RNAと会合する。
microRNA(miR)は、心臓機能の制御および維持を含む多くの生物学的プロセスに関与している(Eva Van Rooij and Eric Olson, MicroRNAs: Powerful new regulators of heart disease and proactive therapeutic targets, J. Clin. Invest. 117(9):2369-2376 (2007)、Chien KR, Molecular Medicine: MicroRNAs and the tell-tale heart. Nature 447, 389-390 (2007)を参照)。したがって、miRは、約18〜約25ヌクレオチドの長さの小さな、タンパク質をコードしない(non-protein coding)RNAであり、配列が完全に相補的である場合には分解を促進することにより、または配列がミスマッチを含む場合には翻訳を阻害することにより、標的mRNAのリプレッサーとして働く。その機序は、RNA誘導サイレンシング複合体(RISC)中への成熟miRNA鎖の導入(incorporation)を含み、ここで、塩基対の相補性によって標的RNAと会合する。
miRNA機能は、アンチセンスポリヌクレオチドまたはmiRNA機能を模倣するポリヌクレオチド(「miRNAミメティック(mimetic)」)によって治療的に標的とされ得る。しかしながら、オリゴヌクレオチド系作用剤によるmiRNAの治療的標的化は、RNA結合親和性および特異性、細胞内取込みの効率、ならびにヌクレアーゼ耐性を含むいくつかの難題を呈する。たとえば、ポリヌクレオチドを無傷の細胞に導入したとき、ヌクレアーゼによる攻撃および分解を受けて、活性が失われる。その分解を2’置換等によって回避しようとしてポリヌクレオチド類似体が調製されているが(B. Sproat et al., Nucleic Acids Research 17 (1989), 3373-3386)、この修飾は、意図する生物学的作用に関するポリヌクレオチドの効力に影響を与えることが多い。そのような効力低下は、いずれの場合も、修飾ポリヌクレオチドが標的RNAと安定な二本鎖を形成できないことおよび/または細胞機構との相互作用が失われることに起因し得る。他の修飾は、RNA結合親和性を向上させる可能性を有するロックド核酸の使用を含む。Veedu RN and Wengel J, Locked nucleic acid as a novel class of therapeutic agent. RNA Biology 6:3, 321-323 (2009)。
miRNA阻害剤のオリゴヌクレオチドの化学様式(chemistry patterns)または化学モチーフは、阻害剤の送達、安定性、効力、特異性、および/または毒性プロフィールを改善する可能性を有しており、そうしたことが、治療場面においてmiRNA機能を効果的に標的とするのに必要とされている
発明の概要
本発明は、miR−208a、miR−208b、および/またはmiR−499を含むmiR−208ファミリーのmiRNAの発現(たとえば存在量)を阻害可能な化学修飾オリゴヌクレオチドを提供する。本発明は、本オリゴヌクレオチドを含む医薬組成物、およびmiR−208ファミリーのmiRNAに関連するまたはそれが関与する病状または障害を有する患者を治療する方法をさらに提供する。そのような病状は、種々の心臓血管病状を含む。種々の実施形態において、本オリゴヌクレオチドは、効力、送達効率、標的特異性、毒性、および/または安定性の1つ以上の利点を提供する。
本発明は、miR−208a、miR−208b、および/またはmiR−499を含むmiR−208ファミリーのmiRNAの発現(たとえば存在量)を阻害可能な化学修飾オリゴヌクレオチドを提供する。本発明は、本オリゴヌクレオチドを含む医薬組成物、およびmiR−208ファミリーのmiRNAに関連するまたはそれが関与する病状または障害を有する患者を治療する方法をさらに提供する。そのような病状は、種々の心臓血管病状を含む。種々の実施形態において、本オリゴヌクレオチドは、効力、送達効率、標的特異性、毒性、および/または安定性の1つ以上の利点を提供する。
一態様において、本発明は、miR−208ファミリーのmiRNAの発現または存在量を低減可能な化学修飾オリゴヌクレオチドを提供する。本オリゴヌクレオチドの活性または効力は、in vitroおよび/またはin vivoで決定してもよい。たとえば、本オリゴヌクレオチドは、有意に約50nM以下、または他の実施形態において、40nM以下、20nM以下、もしくは10nM以下の濃度で、miR−208ファミリーのmiRNAの活性(デュアル(dual)ルシフェラーゼアッセイにおいて決定される)を阻害することができる(たとえば、約50%阻害)。代わりに、またはさらに、本オリゴヌクレオチドの活性は、本明細書に記載されるように、好適なマウスモデルもしくはラットモデルまたは非ヒト霊長動物モデルで決定することができ、miR−208ファミリーのmiRNAの阻害(たとえば、少なくとも50%)は、50mg/kg以下、たとえば、25mg/kg以下、10mg/kg以下、または5mg/kg以下の用量で観測される。これらの実施形態において、本オリゴヌクレオチドは、皮下または静脈内に投与することができ(本明細書に記載のとおり)、水性調製物(たとえば、生理食塩水)中に製剤化することができる。
本オリゴヌクレオチドのヌクレオチド配列は、ヒトmiR−208aまたはmiR−208b(あるいはpre−またはpri−miRNA)のヌクレオチド配列に実質的に相補的であり、ロックド(locked)ヌクレオチドと非ロックド(non-locked)ヌクレオチドとの混合物を含む。たとえば、本オリゴヌクレオチドは、少なくとも3、少なくとも5、または少なくとも7つのロックドヌクレオチドと、少なくとも1つの非ロックドヌクレオチドとを含んでいてもよい。一般的には、本オリゴヌクレオチドの長さならびにロックドヌクレオチドの数および位置は、本明細書に記載されるように、本オリゴヌクレオチドが、in vitroルシフェラーゼアッセイにおいて、約50nM以下のオリゴヌクレオチド濃度で、または、好適なラットモデルもしくはマウスモデルまたは非ヒト霊長動物モデルにおいて50mg/kg以下の用量で、miR−208a、miR−208b、および/またはmiR−499の活性を低減するようなものである。代表的な実施形態において、ロックドヌクレオチドは、2’−4’メチレン架橋を有する。
本オリゴヌクレオチドは、全長または短縮(truncated)されたmiR−208a、miR−208b、またはmiR−499アンチセンス配列を含んでもよく、これらから本質的になってもよく、またはこれらからなってもよい。これらの実施形態において、本オリゴヌクレオチドは、約6〜22ヌクレオチド長であり、または約10〜18ヌクレオチド長であり、または約11〜約16ヌクレオチド長である。いくつかの実施形態において、本オリゴヌクレオチドは、約14、15、16、または17ヌクレオチド長である。本オリゴヌクレオチドは、5’−TGCTCGTCTTA−3’(配列番号1)のヌクレオチド配列を含んでいてもよく、または5’−TGTTCGTCTTA−3’(配列番号2)のヌクレオチド配列を含んでいてもよい。特定の実施形態において、本オリゴヌクレオチドは、ヌクレオチド配列5’−CTTTTTGCTCGTCTTA−3’(配列番号3)または5’−CCTTTTGTTCGTCTTA−3’(配列番号4)を含む、これらから本質的になる、またはこれらからなる。
本オリゴヌクレオチドは、少なくとも約3、少なくとも約5、もしくは少なくとも約7つのロックドヌクレオチド、または少なくとも9つのロックドヌクレオチドを含んでいてもよいが、種々の実施形態において、完全にはロックドヌクレオチドで構成されない。一般的には、ロックドヌクレオチドの数および位置は、本オリゴヌクレオチドが、miR−208a、miR−208b、および/またはmiR−499の活性を高い効力で低減または阻害するようなものである。特定の実施形態において、本オリゴヌクレオチドは、4超、3超、または2超の隣接する非ロックドヌクレオチドを有する一続きのヌクレオチドを含んでいない。代表的な実施形態において、本オリゴヌクレオチドは、正確に9つのロックドヌクレオチドおよび7つの非ロックドヌクレオチドを有する。たとえば、ロックドヌクレオチドの様式は、少なくとも位置1、6、10、13、および15がロックドヌクレオチドであるようなものであってもよい。特定の実施形態において、少なくとも位置1、5、10、および16は、ロックドヌクレオチドである。特定の実施形態において、位置1、5、6、8、10、11、13、15、および16は、ロックドヌクレオチドであり、残りの位置は、非ロックドヌクレオチドである。他の実施形態において、位置1、3、4、5、6、8、10、13、15、および16は、ロックドヌクレオチドであり、残りの位置は、非ロックドヌクレオチドである。さらに他の実施形態様において、位置1、4、5、7、9、10、12、14、および16は、ロックドヌクレオチドであり、残りの位置は、非ロックドヌクレオチドである。ロックドヌクレオチドのこれらの様式は、特定の実施形態において、本明細書に記載の配列番号3もしくは配列番号4またはそれらの変異体のヌクレオチド配列を用いて、利用してもよい。阻害剤が配列番号3または配列番号4のヌクレオチド配列からなるまたはこれらから本質的になる場合、本オリゴヌクレオチドは、すべてロックドヌクレオチドを含んでいてもよい。
非ロックドヌクレオチドでは、ヌクレオチドは、2’ヒドロキシルに対して2’修飾を含んでいてもよい。いくつかの実施形態において、2’修飾は、O−アルキル(置換されていてもよい)、ハロ、およびデオキシ(H)から独立して選択してもよい。
本オリゴヌクレオチドはまた、1つまたは複数のホスホロチオエートリンケージを含んでいてもよい。たとえば、本オリゴヌクレオチドは、完全にホスホロチオエートリンケージ(fully phosphorothioate-linked)であってもよく、または約半分もしくは3/4がホスホロチオエート(phosphorotioate)リンケージを含んでいてもよい。
例示的なオリゴヌクレオチド阻害剤を表1に示す。
他の態様において、本発明は、細胞内送達のための種々の高分子集合体、ミセル、またはリポソーム組成物中へのオリゴヌクレオチドの導入を含んでいてもよい、本発明のオリゴヌクレオチドを含む医薬組成物および製剤を提供する。特定の実施形態において、本オリゴヌクレオチドは、従来の静脈内、皮下、または筋内投与のために製剤化される。そのような製剤は、従来の水性製剤、たとえば、生理食塩水中の製剤であってもよい。特定の実施形態において、本組成物は、皮内、皮下、筋内、腹腔内、もしくは静脈内注入、または標的組織(たとえば心臓組織)中への直接注入に好適であり、あるいはそのために製剤化される。
さらに他の態様において、本発明は、たとえば、哺乳動物患者の病状の進行を治療、寛解、または予防するために、in vitroまたはex vivoのいずれかで哺乳動物細胞にオリゴヌクレオチドおよび医薬組成物を送達する方法を提供する。本方法は、本オリゴヌクレオチドまたはそれを含む組成物を哺乳動物患者または標的細胞集団に投与することを含んでいてもよい。患者は、miR−208ファミリー発現に関連する、それにより介される、またはそれから生じる症状を有していてもよい。そのような病状は、たとえば、心臓肥大、心筋梗塞、心不全(たとえば鬱血性心不全)、血管傷害、再狭窄症、または病的心臓線維症(pathologic cardiac fibrosis)を含む。したがって、本発明は、そのような病状を治療するための、およびそのような治療のための医薬を調製するための、本発明の修飾オリゴヌクレオチドおよび組成物の使用を提供する。
本発明の他の態様および実施形態は、以下の本発明の詳細な説明から明らかになるであろう。
発明の詳細な説明
本発明は、miR−208a、miR−208b、および/またはmiR−499を含むmiR−208ファミリーのmiRNAの発現(たとえば存在量)を阻害可能な化学修飾オリゴヌクレオチドを提供する。本発明は、いくつかの実施形態において、miR−208a、miR−208b、およびmiR−499のそれぞれの発現または存在量を特異的に阻害可能なオリゴヌクレオチドを提供する。本発明は、本オリゴヌクレオチドを含む医薬組成物、およびmiR−208ファミリーのmiRNAに関連するまたはそれが関与する病状または障害、たとえば、種々の心臓血管病状を有する患者を治療する方法をさらに提供する。種々の実施形態において、本オリゴヌクレオチドは、効力、送達効率、標的特異性、毒性、および/または安定性の1つ以上の利点を提供する。
本発明は、miR−208a、miR−208b、および/またはmiR−499を含むmiR−208ファミリーのmiRNAの発現(たとえば存在量)を阻害可能な化学修飾オリゴヌクレオチドを提供する。本発明は、いくつかの実施形態において、miR−208a、miR−208b、およびmiR−499のそれぞれの発現または存在量を特異的に阻害可能なオリゴヌクレオチドを提供する。本発明は、本オリゴヌクレオチドを含む医薬組成物、およびmiR−208ファミリーのmiRNAに関連するまたはそれが関与する病状または障害、たとえば、種々の心臓血管病状を有する患者を治療する方法をさらに提供する。種々の実施形態において、本オリゴヌクレオチドは、効力、送達効率、標的特異性、毒性、および/または安定性の1つ以上の利点を提供する。
化学修飾miR−208aアンチセンスオリゴヌクレオチド
一態様において、本発明は、miR−208ファミリーのmiRNAの発現または存在量を低減可能なオリゴヌクレオチドを提供する。本オリゴヌクレオチドの活性は、in vitroおよび/またはin vivoで決定することができる。たとえば、miR−208a、miR−208b、またはmiR−499の活性の阻害をin vitroで決定する場合、活性は、本明細書に記載のデュアルルシフェラーゼアッセイを用いて決定することができる。本オリゴヌクレオチドは、約50nM以下、または他の実施形態において40nM以下、20nM以下、もしくは10nM以下の濃度で、デュアルルシフェラーゼ活性で決定したとき、そのような活性を有意に阻害する。たとえば、本オリゴヌクレオチドは、デュアルルシフェラーゼアッセイにおいて決定したとき、miR−208a、miR−208b、および/またはmiR−499の活性の阻害に対して、約50nM以下、40nM以下、30nM以下、または20nM以下のIC50を有し得る。
一態様において、本発明は、miR−208ファミリーのmiRNAの発現または存在量を低減可能なオリゴヌクレオチドを提供する。本オリゴヌクレオチドの活性は、in vitroおよび/またはin vivoで決定することができる。たとえば、miR−208a、miR−208b、またはmiR−499の活性の阻害をin vitroで決定する場合、活性は、本明細書に記載のデュアルルシフェラーゼアッセイを用いて決定することができる。本オリゴヌクレオチドは、約50nM以下、または他の実施形態において40nM以下、20nM以下、もしくは10nM以下の濃度で、デュアルルシフェラーゼ活性で決定したとき、そのような活性を有意に阻害する。たとえば、本オリゴヌクレオチドは、デュアルルシフェラーゼアッセイにおいて決定したとき、miR−208a、miR−208b、および/またはmiR−499の活性の阻害に対して、約50nM以下、40nM以下、30nM以下、または20nM以下のIC50を有し得る。
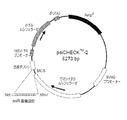
デュアルルシフェラーゼアッセイは、市販品として入手可能な製品PsiCHECKTM(Promega)により例示されるように、検出可能なタンパク質(たとえば、ウミシイタケルシフェラーゼ)の遺伝子の3’UTRにmiR認識部位を配置することを含む。構築物は、阻害活性をシグナル変化により決定できるように、標的miRNAと共に共発現される。検出可能なタンパク質(たとえば、ホタルルシフェラーゼ)をコードする第2の遺伝子を同一プラスミドに組み込んで、シグナル比をantimiR活性の指標として決定することができる。
代わりに、またはさらに、本オリゴヌクレオチドの活性は、本明細書に記載されるように、好適なマウスモデルまたはラットモデルで決定することができ、miR−208ファミリーのmiRNAの阻害(たとえば、少なくとも50%)は、50mg/kg以下、たとえば、25mg/kg以下、10mg/kg以下、または5mg/kg以下のオリゴヌクレオチド用量で観測される。いくつかの実施形態において、本オリゴヌクレオチドの活性は、国際公開第2008/016924号(その記載を参照により本明細書に援用する)に記載の動物モデルで決定される。たとえば、本オリゴヌクレオチドは、50mg/kg以下または25mg/kg以下、たとえば、10mg/kg以下または5mg/kg以下の用量で、少なくとも50%の標的miRNA阻害または標的脱抑制を呈することができる。そのような実施形態において、本オリゴヌクレオチドは、マウスに静脈内または皮下投与することができ、本オリゴヌクレオチドは、生理食塩水中に製剤化することができる。
これらのまたは他の実施形態において、本発明のオリゴヌクレオチドは、投与後、安定であり、投与の少なくとも3週間後、少なくとも4週間後、少なくとも5週間後、または少なくとも6週間後、循環血および/または標的器官で検出可能である。したがって、本発明のオリゴヌクレオチドは、より低頻度の投与、より低い用量、および/または治療効果のより長い持続期間を提供する可能性を有する。
本オリゴヌクレオチドのヌクレオチド配列は、ヒトmiR−208aおよび/またはmiR−208bのヌクレオチド配列に実質的に相補的であり、ロックドヌクレオチドと非ロックドヌクレオチドとの混合物を含む。たとえば、本オリゴヌクレオチドは、少なくとも5または少なくとも7または少なくとも9つのロックドヌクレオチドと、少なくとも1つの非ロックドヌクレオチドとを含んでいてもよい。一般的には、本オリゴヌクレオチドの長さならびにロックドヌクレオチドの数および位置は、それぞれ記載されるように、本オリゴヌクレオチドが、in vitroルシフェラーゼアッセイにおいて、約50nM以下のオリゴヌクレオチド濃度で、または、好適なマウスモデルもしくはラットモデルにおいて約50mg/kg以下もしくは約25mg/kg以下の用量で、miR−208a、miR−208b、および/またはmiR−499の活性を低減するようなものである。実質的に相補的なオリゴヌクレオチドは、miR−208aまたはmiR−208bの標的配列に対して1〜4つのミスマッチ(たとえば、1または2つのミスマッチ)を有していてもよい。
miR−208aは、その構造およびプロセシング、ならびにそれにより(いくつかある病状の中で特に)心臓肥大、心不全、または心筋梗塞を治療する可能性を含めて、国際公開第2008/016924号に記載されており、その全体を参照により本明細書に援用する。本発明による阻害miRNAの設計に使用可能なヒトmiR−208aのpre−miRNA配列は、以下のとおりである(下線付き配列は成熟型である)。
miR−208bおよびmiR−499の構造およびプロセシングはまた、国際公開第2009/018492号にも記載されており、参照により本明細書に援用する。成熟miR−208bは、ヌクレオチド配列5’−AUAAGACGAACAAAAGGUUUGU−3’(配列番号6)を有し、成熟miR−499は、ヌクレオチド配列5’−UUAAGACUUGCAGUGAUGUUU−3’(配列番号7)を有する。これらの配列は、本発明による相補的阻害剤を設計するために使用してもよい。
本オリゴヌクレオチドは、1つまたは複数のロックド核酸(LNA)残基または「ロックドヌクレオチド」を含む。LNAは、たとえば、米国特許第6,268,490号、米国特許第6,316,198号、米国特許第6,403,566号、米国特許第6,770,748号、米国特許第6,998,484号、米国特許第6,670,461号、および米国特許第7,034,133号に記載されており、そのすべてをその全体を参照により本明細書に援用する。LNAは、「ロックされた(locked)」コンフォメーションおよび/または二環式構造をもたらすリボース糖部分の2’および4’炭素間の追加の架橋を含む、修飾されたヌクレオチドまたはリボヌクレオチドである。一実施形態において、本オリゴヌクレオチドは、以下の構造Aにより示される構造を有する1つまたは複数のLNAを含む。代わりに、またはさらに、本オリゴヌクレオチドは、以下の構造Bにより示される構造を有する1つまたは複数のLNAを含んでいてもよい。代わりに、またはさらに、本オリゴヌクレオチドは、以下の構造Cにより示される構造を有する1つまたは複数のLNAを含む。
本発明のオリゴヌクレオチドに導入できる他の好適なロックドヌクレオチドは、米国特許第6,403,566号および米国特許第6,833,361号に記載されるものが含まれ、これらの両方をその全体を参照により本明細書に援用する。
代表的な実施形態において、ロックドヌクレオチドは、たとえば、構造Aに示されるように、2’−4’メチレン架橋を有する。
本オリゴヌクレオチドは、全長または短縮されたmiR−208aまたはmiR−208bアンチセンス配列を含んでもよく、これらから本質的になってもよく、またはこれらからなってもよい。本明細書で用いられる場合、miRNA配列に関して「全長」という用語は、成熟miRNAアンチセンス対応物の長さを意味する。したがって、本明細書に記載の阻害剤は、短縮されたまたは全長のアンチセンス成熟miRNA配列であってもよく、または他のポリヌクレオチド配列と組み合わせてこれらの配列を含んでいてもよい。特定の実施形態において、本明細書に記載の化学修飾モチーフでは、全長アンチセンスmiRNA(成熟)配列が不要になる。これらの実施形態において、本オリゴヌクレオチドは、8〜20ヌクレオチド長であり、または10〜18のヌクレオチド長であり、または11〜16ヌクレオチド長である。いくつかの実施形態の本オリゴヌクレオチドは、約12、約13、約14、約15、約16、約17、または約18ヌクレオチド長である。短縮されたオリゴヌクレオチドは、5’−UAAGACGAGCAAAAAG−3’(配列番号8)内のmiR−208a配列またはUAAGACGAACAAAAAG−3’(配列番号9)内のmiR−208b配列をアンチセンス阻害による標的とする配列を有していてもよい。
本オリゴヌクレオチドは、一般的には、成熟miR−208a、成熟miR−208b、および/または成熟miR−499を標的とするように設計されたヌクレオチド配列を有する。本オリゴヌクレオチドは、これらのもしくは他の実施形態において、または代替的に、pre−またはpri−miRNA形を標的としてもよい。特定の実施形態において、本オリゴヌクレオチドは、完全に相補的な(成熟)miR−208配列に対して、1〜5つ(たとえば、1、2、3、または4つ)のミスマッチを含む配列を有するように設計してもよい。
特定の実施形態において、本オリゴヌクレオチドは、miR−208aまたはmiR−208bのヌクレオチド配列に完全に相補的なヌクレオチド配列を含む。たとえば、本オリゴヌクレオチドは、5’−TGCTCGTCTTA−3’(配列番号1)のヌクレオチド配列を含んでいてもよく、または5’−TGTTCGTCTTA−3’(配列番号2)のヌクレオチド配列を含んでいてもよい。特定の実施形態において、本オリゴヌクレオチドは、ヌクレオチド配列5’−CTTTTTGCTCGTCTTA−3’(配列番号3)または’5−CCTTTTGTTCGTCTTA(配列番号4)を含み、これらから本質的になり、またはこれらからなる。これとの関連では、「〜から本質的になる」は、追加のヌクレオチドが、デュアルルシフェラーゼアッセイまたはマウスモデルにおいて標的miRNA活性の本オリゴヌクレオチドによる阻害に実質的に影響しない限り(20%以下のIC50の増加により定義される)、5’および3’末端の一方または両方にヌクレオチド(たとえば、1または2つ)の任意選択の付加を含む。
本オリゴヌクレオチドは、一般的には、少なくとも3、少なくとも5、少なくとも7、または少なくとも9つのロックドヌクレオチドを含むが、種々の実施形態において、完全にはロックドヌクレオチドで構成されない。一般的には、ロックドヌクレオチドの数および位置は、本オリゴヌクレオチドが、記載のとおりin vitroまたはin vivoで決定したとき、miR−208a、miR−208b、および/またはmiR−499の活性を低減するようなものである。特定の実施形態において、本オリゴヌクレオチドは、4超または3超の隣接する非ロックドヌクレオチドを有する一続きのヌクレオチドを含んでいない。特定の実施形態において、本オリゴヌクレオチドは、2超の隣接する非ロックドヌクレオチドを有する一続きのヌクレオチドを含んでいない。たとえば、本オリゴヌクレオチドは、隣接する非ロックドヌクレオチドの丁度1つの出現を有していてもよい。これらのまたは他の実施形態において、miR−208a、miR−208b、および/またはmiR−499のシード領域に相補的な領域は、少なくとも3または少なくとも4つのロックドヌクレオチドを含む。これらの実施形態は、たとえば、配列番号3または配列番号4のヌクレオチド配列を利用してもよい。
したがって、種々の実施形態において、本オリゴヌクレオチドは、少なくとも9つのロックドヌクレオチドまたは少なくとも11のロックドヌクレオチドを含む。本オリゴヌクレオチドは、少なくとも3または少なくとも5つの非ロックドヌクレオチドを含んでいてもよい。たとえば、本オリゴヌクレオチドは、9つのロックドヌクレオチドおよび7つの非ロックドヌクレオチドを含んでいてもよく、または11のロックドヌクレオチドおよび5つの非ロックドヌクレオチドを含んでいてもよい。
ロックドヌクレオチドの様式は、少なくとも位置1、6、10、13、および15がロックドヌクレオチドであるようなものであってもよい。特定の実施形態において、位置1、5、6、8、10、11、13、15、および16は、ロックドヌクレオチドであり、残りの位置は、非ロックドヌクレオチドである。他の実施形態において、位置1、3、4、5、6、8、10、13、15、および16は、ロックドヌクレオチドであり、残りの位置は、非ロックドヌクレオチドである。いくつかの実施形態において、位置1、4、5、7、9、10、12、14、および16は、ロックドヌクレオチドであり、残りの位置は、非ロックドヌクレオチドである。代表的な実施形態において、そのような様式は、配列番号3または配列番号4の配列を有するオリゴヌクレオチドと併用される。
非ロックドヌクレオチドでは、ヌクレオチドは、2’ヒドロキシルに対して2’修飾を含んでいてもよい。たとえば、2’修飾は2’デオキシであってもよい。アンチセンスオリゴヌクレオチド中への2’修飾ヌクレオチドの導入は、ヌクレアーゼに対する本オリゴヌクレオチドの耐性およびそれが相補的RNAを伴うときの熱安定性の両方を増大させることができる。2’位の種々の修飾は、RNA標的との分子相互作用または細胞機構を損なうことなく、増大されたヌクレアーゼ感受性を提供するものから独立して選択することができる。そのような修飾は、in vitroまたはin vivoでの増加した効力に基づいて選択することができる。miRNA阻害に関する増大された効力(たとえば、IC50)を決定する例示的な方法は、デュアルルシフェラーゼアッセイおよびin vivo miRNA発現または標的脱抑制を含めて、本明細書に記載されている。
いくつかの実施形態において、2’修飾は、O−アルキル(置換されていてもよい)、ハロ、デオキシ(H)から独立して選択されてもよい。非ロックドヌクレオチドの実質的にすべてのまたはすべてのヌクレオチド2’位は、特定の実施形態において、たとえば、O−アルキル(たとえばO−メチル)、ハロ(たとえばフルオロ)、デオキシ(H)、およびアミノから独立して選択されるように、修飾してもよい。たとえば、2’修飾は、それぞれ、O−メチルおよびフルオロから独立して選択してもよい。代表的な実施形態において、プリンヌクレオチドは、それぞれ、2’OMeを有し、ピリミジンヌクレオチドは、それぞれ、2’−Fを有する。特定の実施形態において、1〜約5つの2’位または約1〜約3つの2’位は、非修飾のまま残存する(たとえば、2’−ヒドロキシとして)。
本発明による2’修飾はまた、小さい炭化水素置換基も含む。炭化水素置換基は、アルキル、アルケニル、アルキニル、およびアルコキシアルキルを含み、アルキル(アルコキシのアルキル部分を含む)、アルケニル、およびアルキニルは、置換であっても非置換であってもよい。アルキル、アルケニル、およびアルキニルは、C1〜C10アルキル、アルケニル、またはアルキニル、たとえば、C1、C2、またはC3であってもよい。炭化水素置換基は、N、O、および/またはSから独立して選択され得る1または2または3つの非炭素原子を含んでいてもよい。2’修飾は、O−アルキル、O−アルケニル、およびO−アルキニルとして、アルキル、アルケニル、およびアルキニルをさらに含んでいてもよい。
本発明による例示的な2’修飾には、2’−O−アルキル(C1〜3アルキル、たとえば、2’OMeもしくは2’OEt)、2’−O−メトキシエチル(2’−O−MOE)、2’−O−アミノプロピル(2’−O−AP)、2’−O−ジメチルアミノエチル(2’−O−DMAOE)、2’−O−ジメチルアミノプロピル(2’−O−DMAP)、2’−O−ジメチルアミノエチルオキシエチル(2’−O−DMAEOE)、または2’−O−N−メチルアセトアミド(2’−O−NMA)が含まれる。
特定の実施形態において、本オリゴヌクレオチドは、少なくとも1つの2’ハロ修飾(たとえば、2’ヒドロキシルの代わりに)、たとえば、2’−フルオロ、2’−クロロ、2’−ブロモ、および2’−ヨードを含む。いくつかの実施形態において、2’ハロ修飾はフルオロである。本オリゴヌクレオチドは、1〜約5つの2’ハロ修飾(たとえばフルオロ)、または1〜約3つの2’ハロ修飾(たとえばフルオロ)を含んでいてもよい。いくつかの実施形態において、本オリゴヌクレオチドは、非ロックド位にすべて2’−フルオロヌクレオチドを含み、またはすべての非ロックドピリミジンヌクレオチド上に2’−フルオロを含む。特定の実施形態において、2’−フルオロ基は、独立して、ジ−、トリ−、または非メチル型である。
本オリゴヌクレオチドは、1つまたは複数の2’−デオキシ修飾(たとえば、2’ヒドロキシルに対してH)を有していてもよく、いくつかの実施形態において、非ロックド位に2〜約10の2’−デオキシ修飾を含んでいてもよく、またはすべての非ロックド位に2’デオキシを含んでいてもよい。
代表的な実施形態において、本オリゴヌクレオチドは、非ロックド位に2’OMeとして修飾2’位を含む。あるいは、非ロックドプリンヌクレオチドは、2’OMeとして2’位で修飾され、非ロックドピリミジンヌクレオチドは、2’−フルオロとして2’位で修飾される。
特定の実施形態において、本オリゴヌクレオチドは、少なくとも1つの末端修飾または「キャップ」をさらに含む。キャップは、5’および/または3’キャップ構造であってもよい。「キャップ」または「末端キャップ」という用語は、オリゴヌクレオチドのいずれかの末端における化学修飾(末端リボヌクレオチドに関して)が含まれ、5’末端の最後の2つのヌクレオチドおよび3’末端の最後の2つのヌクレオチドの間の結合における修飾が含まれる。本明細書に記載のキャップ構造は、RNA標的または細胞機構との分子相互作用を弱めることなく、エキソヌクレアーゼに対するオリゴヌクレオチドの抵抗性を増加することができる。そのような修飾は、in vitroまたはin vivoでの増加した効力に基づいて選択することができる。キャップは、5’末端(5’キャップ)または3’末端(3’キャップ)に存在してもよいし、あるいは両端に存在してもよい。特定の実施形態において、5’および/または3’キャップは、ホスホロチオエートモノホスフェート、脱塩基(abasic)残基(部分)、ホスホロチオエートリンケージ、4’−チオヌクレオチド、炭素環式ヌクレオチド、ホスホロジチオエートリンケージ、逆方向(inverted)ヌクレオチドまたは逆方向脱塩基部分(2’−3’または3’−3’)、ホスホロジチオエートモノホスフェート、およびメチルホスホネート部分から独立して選択される。ホスホロチオエートまたはホスホロジチオエートリンケージは、キャップ構造の一部である場合、5’末端の2つの末端ヌクレオチドおよび3’末端の2つの末端ヌクレオチドの間に通常位置する。
特定の実施形態において、本オリゴヌクレオチドは、少なくとも1つの末端ホスホロチオエートモノホスフェートを有する。ホスホロチオエートモノホスフェートは、エキソヌクレアーゼの作用を阻害することにより、より高い効力を支援することができる。ホスホロチオエートモノホスフェートは、オリゴヌクレオチドの5’および/または3’末端にあってもよい。ホスホロチオエートモノホスフェートは、以下の構造によって定義され、ここで、Bは塩基であり、Rは上記の2’修飾である。
キャップ構造がロックドヌクレオチドの化学物質を支援できる場合、キャップ構造は、本明細書に記載のロックドヌクレオチドに導入してもよい。
ホスホロチオエートリンケージは、いくつかの実施形態において、たとえば(キャップ構造の一部などとして)5’および3’末端の最後の2つのヌクレオチド間に存在してもよいし、あるいはホスホジエステルリンケージで代替されてもよい。これらの実施形態または他の実施形態において、本ポリヌクレオチドは、5’および3’末端のいずれかまたは両端で少なくとも1つの末端脱塩基残基を含むことができる。脱塩基部分は、アデノシン、グアニン、シトシン、ウラシル、またはチミンなどの一般的に認知されるプリンまたはピリミジンヌクレオチド塩基を含まない。したがって、そのような脱塩基部分は、ヌクレオチド塩基を欠くか、または他の非ヌクレオチド塩基化学基を1’位に有する。たとえば、脱塩基ヌクレオチドは、逆脱塩基ヌクレオチドであってもよく、たとえば逆脱塩基ホスホロアミダイトが(3’アミダイトの代わりに)5’アミダイトを介して結合し、5’−5’リン酸結合となる。ポリヌクレオチドの5’および3’末端の逆脱塩基ヌクレオシドの構造を以下に示す。
本オリゴヌクレオチドは、1つまたは複数のホスホロチオエートリンケージを含んでいてもよい。ホスホロチオエートリンケージは、ヌクレアーゼ切断に対するポリヌクレオチドの耐性をより高めるために使用されている。たとえば、本ポリヌクレオチドは、部分的にホスホロチオエートリンケージしてもよく、たとえば、ホスホロチオエートリンケージは、ホスホジエステル(phophodiester)リンケージで代替されてもよい。しかしながら、特定の実施形態において、本ポリヌクレオチドは、完全にホスホロチオエートリンケージされる。他の実施形態において、本オリゴヌクレオチドは、1〜5つまたは1〜3つのホスフェートリンケージを有する。
いくつかの実施形態において、本ヌクレオチドは、国際出願PCT/US11/59588号(ヘテロ環式置換基を有するそこに開示されたすべての例示的なピリミジンカルボキサミド修飾に関するものを含めて、参照により本明細書に援用する)に記載されるように1つまたは複数のカルボキサミド修飾塩基を有する。
代表的な実施形態において、本オリゴヌクレオチドは、以下の表1に列記された化合物構造を有する。
特定の実施形態において、本オリゴヌクレオチドは、10101、10673、10674、10677、10679、10683、10707、もしくは10680、または表1に記載の他のオリゴヌクレオチドである。
固相合成によるオリゴヌクレオチドの合成は、修飾ポリヌクレオチドを含めて、周知であり、New Chemical Methods for Synthesizing Polynucleotides. Caruthers MH, Beaucage SL, Efcavitch JW, Fisher EF, Matteucci MD, Stabinsky Y. Nucleic Acids Symp. Ser. 1980;(7):215-23に概説されている。
組成物、製剤、および送達
本オリゴヌクレオチドは、種々の高分子集合体または組成物内に導入してもよい。そのような送達のための複合体には、患者への送達のために製剤化される種々のリポソーム、ナノ粒子、およびミセルが含まれてもよい。複合体は、細胞膜浸透を開始するために1つまたは複数の融合性または親油性分子を含んでいてもよい。そのような分子は、たとえば、米国特許第7,404,969号および米国特許第7,202,227号に記載され、これらはその全体を参照により本明細書に援用する。あるいは、本オリゴヌクレオチド(oligonucelotide)は、国際公開第2010/129672号(参照により本明細書に援用する)に記載されるように、細胞内送達を支援するためにペンダント親油性基をさらに含んでいてもよい。
本オリゴヌクレオチドは、種々の高分子集合体または組成物内に導入してもよい。そのような送達のための複合体には、患者への送達のために製剤化される種々のリポソーム、ナノ粒子、およびミセルが含まれてもよい。複合体は、細胞膜浸透を開始するために1つまたは複数の融合性または親油性分子を含んでいてもよい。そのような分子は、たとえば、米国特許第7,404,969号および米国特許第7,202,227号に記載され、これらはその全体を参照により本明細書に援用する。あるいは、本オリゴヌクレオチド(oligonucelotide)は、国際公開第2010/129672号(参照により本明細書に援用する)に記載されるように、細胞内送達を支援するためにペンダント親油性基をさらに含んでいてもよい。
本組成物または製剤では、本明細書に記載の少なくとも1つを含む複数の治療用オリゴヌクレオチドを利用してもよい。たとえば、本組成物または製剤では、本明細書に記載の少なくとも2、3、4、または5つのmiRNA阻害剤を利用してもよい。
本発明のオリゴヌクレオチドは、種々の医薬組成物として製剤化することができる。医薬組成物は、意図する用途に適切な形態で調製されるであろう。一般に、これは、発熱原およびヒトまたは動物に有害となり得る他の不純物を本質的に含まない組成物を調製することを包含する。例示的な送達/製剤系は、コロイド分散系、高分子複合体、ナノカプセル、マイクロスフェア、ビーズ、脂質ベース系、たとえば、水中油型エマルジョン、ミセル、混合ミセル、およびリポソームを含む。本発明に係る核酸を心筋組織および骨格筋組織に送達するのに好適な市販の脂肪エマルジョンとしては、Intralipid(登録商標)、Liposyn(登録商標)、Liposyn(登録商標)II、Liposyn(登録商標)III、Nutrilipid、および他の類似の脂質エマルジョンが含まれる。in vivoの送達媒体として使用するのに好ましいコロイド系は、リポソーム(すなわち人工膜小胞)である。そのような系の調製および使用は、当業界で周知である。例示的な製剤もまた、米国特許第5,981,505号、米国特許第6,217,900号、米国特許第6,383,512号、米国特許第5,783,565号、米国特許第7,202,227号、米国特許第6,379,965号、米国特許第6,127,170号、米国特許第5,837,533号、米国特許第6,747,014号、および国際公開第03/093449号に開示されており、これらはその全体を参照により本明細書に援用する。
いくつかの実施形態において、本オリゴヌクレオチドは、従来の皮下または静脈内投与のために、たとえば、無菌水および正常生理食塩水を含む適切な水性希釈剤を用いて製剤化することにより、製剤化される。
本医薬組成物および製剤では、送達運搬体を安定にし、標的細胞による取込みを可能とするための適切な塩および緩衝剤を利用してもよい。本発明の水性組成物は、薬学的に許容可能な担体または水性媒体に溶解または分散された、阻害剤オリゴヌクレオチド(たとえばリポソームまたは他の複合体)を含む送達運搬体を有効量含む。「薬学的に許容可能な」または「薬理学的に許容可能な」という表現は、動物またはヒトに投与したときに、有害反応、アレルギー性反応、または他の不利な反応を引き起こさない分子体および組成物を意味する。本明細書で用いられる場合、「製薬上許容される担体」には、医薬、たとえばヒトへの投与に好適な医薬の製剤化での使用が許容される1つまたは複数の溶媒、緩衝剤、溶液剤、分散媒、コーティング剤、抗細菌剤および抗菌類剤、等張化剤および吸収遅延剤などが含まれる。医薬活性物質用のそのような媒体および作用剤の使用は、当業界で周知である。補充活性成分もまた、組成物に導入することができる。
本発明の医薬組成物の投与または送達は、その経路によって標的組織が利用可能である限り、任意の経路とすることができる。たとえば、投与は、皮内、皮下、筋内、腹腔内、もしくは静脈内注入であってもよいし、または標的組織(たとえば心臓組織)への直接注入によるものであってもよい。本明細書に開示されるオリゴヌクレオチドの安定性および/または効力は、皮下、皮内、および筋内を含めて、便利な投与経路を可能にする。miRNA阻害剤を含む医薬組成物はまた、カテーテルシステムまたは心臓に治療剤を送達するために冠循環を分離するシステムにより投与することもできる。心臓および冠血管系に治療剤を送達するための種々のカテーテルシステムは、当業界で公知である。本発明で使用するのに好適なカテーテルに基づく送達法または冠脈分離法のいくつかの例(これらに限定されるものではない)は、米国特許第6,416,510号、米国特許第6,716,196号、米国特許第6,953,466号、国際公開第2005/082440号、国際公開第2006/089340号、米国特許出願公開第2007/0203445号、米国特許出願公開第2006/0148742号および米国特許出願公開第2007/0060907号に開示されており、これらはすべてその全体を参照によりに本明細書に援用する。
本組成物または製剤はまた、非経口投与してもよいし、または腹腔内投与してもよい。例示のため、遊離塩基または薬理学的に許容可能な塩としてのコンジュゲートの溶液は、ヒドロキシプロピルセルロースなどの界面活性剤と好適に混合される水中で調製することができる。グリセロール、液体ポリエチレングリコール、およびそれらの混合物、ならびに油に導入して、ディスパージョン剤を調製することもできる。通常の貯蔵条件下および使用条件下では、こうした調製物は、微生物の増殖を防止するために一般的には保存剤を含有する。
注入またはカテーテル送達に使用するのに好適な医薬製剤としては、たとえば、無菌の注入用の溶液または分散液を即時調製するための無菌の水性の溶液剤またはディスパージョン剤および無菌の粉末剤が含まれる。一般的には、これらの製剤は、無菌であり、容易な注入が行える程度に流動性である。製剤は、製造条件下および貯蔵条件下で安定でなければならず、かつ細菌や菌類などの微生物の汚染作用を受けないように貯蔵されなければならない。適切な溶媒または分散媒体は、たとえば、水、エタノール、ポリオール(たとえば、グリセロール、プロピレングリコール、および液体ポリエチレングリコールなど)、それらの好適な混合物、ならびに植物油を含有することができる。適正な流動性は、たとえば、レシチンなどのようなコーティング剤を用いることにより、ディスパージョン剤の場合には所要の粒子サイズを維持することにより、および界面活性剤を用いることにより、維持することができる。微生物の活動の防止は、種々の抗細菌剤および抗菌類剤、たとえば、パラベン、クロロブタノール、フェノール、ソルビン酸、チメロサールなどにより行うことが可能である。多くの場合、等張化剤、たとえば、糖または塩化ナトリウムを組み込むことが好ましいであろう。吸収を遅らせる作用剤、たとえば、アルミニウムモノステアレートおよびゼラチンを組成物で使用することにより、注入用組成物を長期間にわたり吸収させるようにすることが可能である。
滅菌注射用溶液剤は、適切な量のコンジュゲートを、必要に応じて任意の他の成分(たとえば、以上に列記したもの)と共に、溶媒中に導入することにより、調製することができる。一般的には、ディスパージョン剤は、基剤としての分散媒と所望の他の成分(たとえば、以上に列挙したもの)とを含有する滅菌媒体中に種々の無菌の活性成分を導入することにより調製される。滅菌注射用溶液を調製するための滅菌粉末剤の場合、好ましい調製方法は、活性成分と任意の追加の所望の成分とよりなる粉末を事前に滅菌濾過されたその溶液から生成する真空乾燥技術および凍結乾燥技術を含む。
製剤化後、溶液剤は、好ましくは、投与処方に適合し得る形でかつ治療上有効な量で投与される。製剤は、注入用溶液剤、薬剤放出カプセル剤などのようなさまざまな剤形で容易に投与することができる。たとえば水溶液の状態で非経口投与に供する場合、一般的には、溶液を適切に緩衝化し、かつたとえば十分な生理食塩水またはグルコースを用いて最初に液体希釈液を等張化する。そのような水性溶液は、たとえば、静脈内、筋肉内、皮下、および腹腔内への投与に使用することができる。好ましくは、当業者に公知のように、特に本開示に照らして、無菌の水性媒体が利用される。例として、1回の投与量を1mlの等張NaCl溶液中に溶解させて、1000mlの皮下注入液に添加するかまたは提案された注入部位に注入することが可能である(たとえば、”Remington’s Pharmaceutical Sciences” 15th Edition, pages 1035-1038 and 1570-1580を参照されたい)。治療される対象の病状に依存して投与量のいくらかの変更を生じることは避けられないであろう。いずれにせよ、投与の責任者が個々の対象に対して適切な用量を決定するであろう。さらに、ヒトに投与する場合、調製物は、食品医薬品局(FDA)生物製剤部(Office of Biologics)基準に規定された、無菌性、発熱原性、ならびに一般的安全性および純度の基準を満たさなければならない。
治療方法
本発明は、オリゴヌクレオチドを哺乳動物細胞に送達する方法(たとえば、本明細書に記載の組成物または製剤の一部として)、および哺乳動物患者の病状の進行を治療、寛解、または予防する方法を提供する。本オリゴヌクレオチドまたは医薬組成物はin vitroまたはin vivoで標的細胞(たとえば、哺乳動物細胞)に接触させることができる。細胞は、心臓細胞であり得る。
本発明は、オリゴヌクレオチドを哺乳動物細胞に送達する方法(たとえば、本明細書に記載の組成物または製剤の一部として)、および哺乳動物患者の病状の進行を治療、寛解、または予防する方法を提供する。本オリゴヌクレオチドまたは医薬組成物はin vitroまたはin vivoで標的細胞(たとえば、哺乳動物細胞)に接触させることができる。細胞は、心臓細胞であり得る。
本方法は、一般的には、本オリゴヌクレオチドまたはそれを含む組成物を哺乳動物患者または標的細胞集団に投与することを含む。本オリゴヌクレオチドは、すでに記載したように、miRNA阻害剤である(たとえば、miR−208ファミリーのmiRNAの発現または活性を阻害するように設計されたヌクレオチド配列を有する)。したがって、患者は、miR−208ファミリー発現に関連する、それにより介される、またはそれから生じる症状を有していてもよい。そのような病状は、たとえば、心臓肥大、心筋梗塞、心不全(たとえば鬱血性心不全)、血管傷害、再狭窄症、または病的心臓線維症を含む。したがって、本発明は、そのような病状を治療するための、およびそのような治療のための医薬を調製するための、本発明の修飾オリゴヌクレオチドおよび組成物の使用を提供する。
特定の実施形態において、患者(たとえば、ヒト患者)は、たとえば、長期持続性コントロール不良高血圧、非根治弁膜疾患、慢性アンギナ、亜急性心筋梗塞、鬱血性心不全、心疾患先天的素因、および病的肥大を含む1つまたは複数のリスク因子を有する。代わりに、またはさらに、患者は、たとえば心臓肥大の遺伝的素因を有すると診断されていてもよいし、またはたとえば心臓肥大の家族歴を有していてもよい。
この態様において、本発明は、心不全または心臓肥大の患者における、運動耐容能の向上、入院期間の短縮、生活の質の向上、罹患率の低減、および/または死亡率の低減を提供し得る。
特定の実施形態において、miR−208a、miR−208b、および/またはmiR−499の活性は、心臓組織でまたは患者血清で決定したとき、低減または阻害される。
種々の実施形態において、本医薬組成物は、心臓組織中への非経口投与によりまたは直接注入により、投与される。非経口投与は、静脈内、皮下、または筋内であり得る。いくつかの実施形態において、本組成物は、経口投与、経皮投与、持続放出投与、制御放出投与、遅延放出投与、坐剤投与、カテーテル投与、または舌下投与により投与される。特定の実施形態において、本オリゴヌクレオチドは、25mg/kg以下の用量、10mg/kg以下の用量、または5mg/kg以下の用量で投与される。これらの実施形態において、本オリゴヌクレオチドまたは組成物は、筋内もしくは皮下注入によりまたは静脈内に投与することができる。
いくつかの実施形態において、本方法は、治療後のmiRNA阻害剤を捕捉または除去する(clearing)ことをさらに含む。たとえば、阻害剤の機能を減衰または停止するために、阻害剤に相補的なヌクレオチド配列を有するオリゴヌクレオチドを治療後に投与してもよい。
実施例
実施例1:miRNA208ファミリーを標的とするmiRNA阻害剤のin vitro活性
miRNA208ファミリー(miR208a、miR−208b、およびmiR−499)を標的として一群のmiRNA阻害剤(一本鎖オリゴヌクレオチド)を合成した。配列および修飾の様式を表1に示す。塩基コードの説明を表2に提供する。一群は、11ヌクレオチド〜16ヌクレオチドの範囲内の複数の長さの逆相補阻害剤を含む。本オリゴヌクレオチド中のLNA修飾の数さらにはLNA修飾の位置を変化させた。
実施例1:miRNA208ファミリーを標的とするmiRNA阻害剤のin vitro活性
miRNA208ファミリー(miR208a、miR−208b、およびmiR−499)を標的として一群のmiRNA阻害剤(一本鎖オリゴヌクレオチド)を合成した。配列および修飾の様式を表1に示す。塩基コードの説明を表2に提供する。一群は、11ヌクレオチド〜16ヌクレオチドの範囲内の複数の長さの逆相補阻害剤を含む。本オリゴヌクレオチド中のLNA修飾の数さらにはLNA修飾の位置を変化させた。
最初に、デュアルルシフェラーゼアッセイ読取りを利用して少数の一群をHeLa細胞で試験した。アッセイでは、psiCHECTM−2構築物(Promega)を使用した(図1)。HeLa細胞は、miR−208ファミリーを発現しないので、プラスミドと共に対応するミミックも共トランスフェクトした。
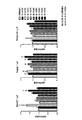
結果から、LNA様式は、miR−208ファミリーのmiRNAの阻害剤としてin vitroで本質的に異なる活性を有することが示される。いくつかのとくに強力な設計物を図2に示す。たとえば、M−10673は、M−10101と同数のLNA修飾(16のうち9)を有するにもかかわらず、1nMでmiR−208aのより大きい阻害を示した。これらの結果を考慮して、すべて9つのLNA修飾(残りはDNAヌクレオシドである)を有する16ヌクレオチド長の他の限られた一群の阻害剤を合成し試験した。図3〜5は、miR−208a、miR−208b、およびmiR−499(それぞれ)に対するデュアルルシフェラーゼレポートでのこれらの阻害剤の結果を示している。M−10673は、miR−208aだけでなく、miR−208bおよびmiR−499に対しても阻害を示した。16mer阻害剤中にはmiR−208aとmiR−208bとの間に2つのミスマッチが存在する。
次いで、より完全な一群の阻害剤設計物を構築した。これらの分子の構造を表1に示す。
実施例2:miRNA208ファミリーを標的とするmiRNA阻害剤のin vivo活性
miR−208ファミリーを標的とする3つの阻害剤を合成し、miR−208aおよびmiR−208bのレベルに及ぼす影響に関して正常マウスで試験した。低圧尾静脈注入を介して2.5、10、および25mg/kgをマウス(n=4)に投与し、4日間後、qPCRによりmiRNAレベルに関して心臓組織を分析した。結果(図6)は、in vitroデュアルルシフェラーゼの結果とよく相関した。これらの結果から、治療効果を得るのに用量を少なくとも1/10倍に低減可能であることが示唆される(25mpkから2.5mpkへ)。
miR−208ファミリーを標的とする3つの阻害剤を合成し、miR−208aおよびmiR−208bのレベルに及ぼす影響に関して正常マウスで試験した。低圧尾静脈注入を介して2.5、10、および25mg/kgをマウス(n=4)に投与し、4日間後、qPCRによりmiRNAレベルに関して心臓組織を分析した。結果(図6)は、in vitroデュアルルシフェラーゼの結果とよく相関した。これらの結果から、治療効果を得るのに用量を少なくとも1/10倍に低減可能であることが示唆される(25mpkから2.5mpkへ)。
以上の初期の実験から、miR−208ファミリーのmiRNAに対する効力を増強する特有のLNA含有修飾モチーフ(LNAの数および位置を含む)が存在することが実証される。
以下でさらに説明するダール食塩感受性ラットモデルで、M−10101およびM−10673を試験した。図7および8は、M−10101で最良の生存率および体重制御を示している。
実施例3:miR−208の治療的阻害は心不全時に心臓機能および生存率を改善する
これまで、心臓特異的miR−208aの遺伝子欠失は、ストレスに応答して病的心臓リモデリングおよびMyh7のアップレギュレーションを予防すると報告された。この実施例は、アンチセンスオリゴヌクレオチド(表1のM−10101)の全身送達が心臓でmiR−208aの強力かつ持続的なサイレンシングを誘導することを示している。ダール高血圧ラットにおける高血圧症起因性心不全時の抗miR−208aの皮下送達によるmiR−208aの治療上の阻害は、病的ミオシンスイッチングおよび心臓リモデリングを用量依存的に予防すると同時に、心臓機能、全身の健康状態、および生存率を改善する。転写プロフィーリングは、antimiR−208aが心臓遺伝子発現に顕著な影響を引き起こすことを示し、一方、血漿分析は、antimiR−208a治療によるmiRNAの循環レベルの有意な変化を示す。これらの試験から、心臓miRNAを変調するオリゴヌクレオチドベースの治療の可能性が示され、心疾患時の心臓機能およびリモデリングの操作のための強力な治療標的としてmiR−208が確証される。
これまで、心臓特異的miR−208aの遺伝子欠失は、ストレスに応答して病的心臓リモデリングおよびMyh7のアップレギュレーションを予防すると報告された。この実施例は、アンチセンスオリゴヌクレオチド(表1のM−10101)の全身送達が心臓でmiR−208aの強力かつ持続的なサイレンシングを誘導することを示している。ダール高血圧ラットにおける高血圧症起因性心不全時の抗miR−208aの皮下送達によるmiR−208aの治療上の阻害は、病的ミオシンスイッチングおよび心臓リモデリングを用量依存的に予防すると同時に、心臓機能、全身の健康状態、および生存率を改善する。転写プロフィーリングは、antimiR−208aが心臓遺伝子発現に顕著な影響を引き起こすことを示し、一方、血漿分析は、antimiR−208a治療によるmiRNAの循環レベルの有意な変化を示す。これらの試験から、心臓miRNAを変調するオリゴヌクレオチドベースの治療の可能性が示され、心疾患時の心臓機能およびリモデリングの操作のための強力な治療標的としてmiR−208が確証される。
心臓への慢性および急性のストレスは、心筋細胞肥大、線維症、心力不全、筋細胞変性、およびアポトーシスを伴う病的リモデリング応答をもたらし、その結果、心不全および突然死になることが多い(1)。古典的な薬理学的治療戦略により心不全患者でリモデリングを低減して生存率を延長することが可能であるが、この治療は、最終的には、疾患の進行の予防に有効でない。病的肥大および心不全の顕著な特徴は、心房性ナトリウム利尿因子(ANF)、B型ナトリウム利尿ペプチド(BNP)、および収縮タンパク質の胎児性アイソフォーム、たとえば、骨格αアクチンおよびMyh7(βミオシン重鎖、β−MHC)をコード化するものを含む一群の胎児性心臓遺伝子の再活性化である(2)。Myh6(α−MHC)のダウンレギュレーションおよびMyh7のアップレギュレーションは、種に関係なく心臓傷害に対する通常の応答である(3〜5)。Myh6とMyh7との比の比較的わずかな増加は、ヒトおよび齧歯動物において、心臓の収縮力および性能に有益な効果を有することが示されている(6〜8)。これらのプロセスを治療的に操作する可能な方法の探索で、心臓リモデリングおよびミオシンスイッチングを制御する機序を理解することに多くの関心が払われてきた。
これまでに、心疾患のヒトモデルおよびマウスモデルで、病的心肥大、心不全、および心筋梗塞に関連するmicroRNA(miRNA)のシグネチャー発現様式が同定された(9〜10)。マウスでの機能獲得および機能喪失の試験では、筋細胞の成長、収縮性、エネルギー代謝、線維症、および血管新生の制御を含めて、心臓生物学の多くの側面でこれらのmiRNAの重要かつ予想外な機能が明らかにされてきた(11で再検討される)。特に興味深いのは、Myh6遺伝子のイントロン内にコードされるmiRNAのmiR−208であり、これは、心臓ストレス応答を制御する(12〜13)。マウスにおいてmiR−208の遺伝子欠失があると、いくつかの形の心臓ストレスに応答して、ベースライン時に明白な表現型を誘導できないが、miR−208ヌルマウスは、実質上、心筋細胞肥大や線維症を示さず、Myh7発現をアップレギュレートすることができなかった(12)。
成人心臓では、miR−208は、Myh7の発現だけでなく、近縁のミオシンアイソフォームMyh7bの発現にも、不可欠である(14)。注目すべき点として、これらの遺伝子は両方とも、遅筋型ミオシンをコードし、イントロンmiRNA(それぞれmiR−208bおよびmiR−499)を含む(15〜16)。miR−208(本発明者らはmiR−208aとして参照する)、miR−208b、およびmiR−499は、ミオシン遺伝子から生じる関連miRNAであるので、本発明者らは、まとめてmyomiRとして参照する(17)。マウスでの機能獲得および機能喪失の実験に通して、本発明者らは、miR−208aの遺伝子欠失が、成人心臓内のMyh7b/miR−499発現を用量依存的に低減することを示した(18)。miR−499突然変異型動物は、ストレスに応答してMyh7発現や心臓リモデリングに影響を示さず、miR−499の再導入は、miR−208a突然変異型マウスで観測される心臓への影響を除去するので(18)、本発明者らは、miR−208aおよびmiR−499の組み合わせた低減が、miR−208a突然変異型動物で観測される心臓保護作用に関与すると結論付ける。
心臓の機能および機能不全に対するmiRNAの重要性から、心疾患の場合にmiRNAの生物学を治療的に活用する可能性が示唆される。一本鎖RNAオリゴヌクレオチドは、相補的塩基対を介してin vivoでmiRNAを不活性化するのに有効であり、病的miRNAを不活性化するのに潜在的に有効な手段になることが示されている(19〜23)。ここで、本発明者らは、miR−208aに対する非接合ロックド核酸(LNA)修飾アンチセンスオリゴヌクレオチドの全身送達が、心臓でのmiR−208aの特異的、強力、かつ持続的なサイレンシングを誘導するのに十分であることを示す。さらに、antimiR−208aは、ストレス起因性リモデリング、機能悪化、および心臓ミオシンスイッチングを用量依存的に予防すると同時に、心不全のラットモデル(ダール食塩感受性ラット)で全般的健康状態および生存率を改善する。遺伝子発現解析から、以上に規定された標的遺伝子の変化を含めて、antimiR−208a治療に応答して特定の遺伝子発現変化が示された。興味深いことに、高血圧ラットにおけるantimiR−208aのこれらの生理学的作用は、循環miRNAの血漿中レベルの有意な変化に反映されている。全体として、これら試験から、心疾患の場合のantimiRの全身送達の効力が示唆され、心不全時の重要な治療標的としてmiR−208が確証される。
in vivoでのmiR−208aのantimiR媒介サイレンシング
in vivoで心筋細胞におけるmiR−208a阻害の治療可能性を調べるために、本発明者らは、miR−208aに対する非接合LNA含有antimiR(antimiR−208a(表2のM−10101))を設計した。antimiR−208aは、成熟miR−208aの5’領域の塩基2〜17を標的とし、ホスホロチオエートリンケージにより結合されたLNAおよびDNAの組合せを含む。0.1〜33mg/kgの範囲内の用量でマウスにantimiR−208aを静脈内(i.v.)送達した1週間後のリアルタイムPCRおよびノーザンブロット分析は、miR−208aの用量応答性サイレンシングを示したが、類似の化学物質のミスマッチantimiRの注入は、miR−208aの阻害を示さなかった(図12)。特に、本発明者らは、16merのLNA antimiRの存在下でmiR−208のアップシフトを観測したが、これは、miR−208aとLNA antimiRとの間の安定なヘテロ二本鎖の形成を反映する。他の2つのmyomiRのmiR−208bおよびmiR−499のリアルタイム分析は、1回注入の7日後、阻害を示さず、本発明者らは、Myh7の変化をなんら観測しなかった(データは示されていない)。
in vivoで心筋細胞におけるmiR−208a阻害の治療可能性を調べるために、本発明者らは、miR−208aに対する非接合LNA含有antimiR(antimiR−208a(表2のM−10101))を設計した。antimiR−208aは、成熟miR−208aの5’領域の塩基2〜17を標的とし、ホスホロチオエートリンケージにより結合されたLNAおよびDNAの組合せを含む。0.1〜33mg/kgの範囲内の用量でマウスにantimiR−208aを静脈内(i.v.)送達した1週間後のリアルタイムPCRおよびノーザンブロット分析は、miR−208aの用量応答性サイレンシングを示したが、類似の化学物質のミスマッチantimiRの注入は、miR−208aの阻害を示さなかった(図12)。特に、本発明者らは、16merのLNA antimiRの存在下でmiR−208のアップシフトを観測したが、これは、miR−208aとLNA antimiRとの間の安定なヘテロ二本鎖の形成を反映する。他の2つのmyomiRのmiR−208bおよびmiR−499のリアルタイム分析は、1回注入の7日後、阻害を示さず、本発明者らは、Myh7の変化をなんら観測しなかった(データは示されていない)。
さらなる投与経路を介してantimiR−208aを送達する可能性を調べるために、本発明者らは、25mg/kgのantimiR−208aをマウスにi.v.、腹腔内(i.p.)、または皮下(s.c.)注入し、1、4、7、および14日目にmiR−208a阻害を測定した。3つの投与経路はすべて、異なる送達方法間で血漿、心臓、肝臓、および腎臓でのantimiR−208a検出の有意差を生じることなく(図示せず)、miR−208aのロバストな阻害を示した(図13)。
長期間のmiR−208a阻害はin vivoでMyh7制御をもたらす
miR−208aノックアウトマウスで見られたように、antimiR−208aの単回投与は、7日後、Myh7に対する効果を確立できなかったので、本発明者らは、antimiR−208a投与後の効率的Myh7制御に必要とされる用量および時間の決定に着手した。33mg/kgのantimiR−208aの3回連続投与は、少なくとも6週間にわたりmiR−208aをロバストに阻害した(図14)。miR−208により制御されることがわかっているmiR−499は(18)、antimiR−208a投与1〜6週間後、miR−499の35%低減から75%低減へ、発現の時間依存性低減を示した(図14A)。さらに、Myh7 mRNA発現は、antimiR−208a治療4週間後から始まって有意に低減されたことから、miR−208aおよびmiR−499のレベルの特異的閾値がMyh7発現に必要であることが示唆され(図14B)、これは、Myh7タンパク質の低減と併行的に起こった(図14C)。antimiR−208aに応答するMyh7 mRNAの初期スパイクは、増大されたMyh7タンパク質に翻訳されない。
miR−208aノックアウトマウスで見られたように、antimiR−208aの単回投与は、7日後、Myh7に対する効果を確立できなかったので、本発明者らは、antimiR−208a投与後の効率的Myh7制御に必要とされる用量および時間の決定に着手した。33mg/kgのantimiR−208aの3回連続投与は、少なくとも6週間にわたりmiR−208aをロバストに阻害した(図14)。miR−208により制御されることがわかっているmiR−499は(18)、antimiR−208a投与1〜6週間後、miR−499の35%低減から75%低減へ、発現の時間依存性低減を示した(図14A)。さらに、Myh7 mRNA発現は、antimiR−208a治療4週間後から始まって有意に低減されたことから、miR−208aおよびmiR−499のレベルの特異的閾値がMyh7発現に必要であることが示唆され(図14B)、これは、Myh7タンパク質の低減と併行的に起こった(図14C)。antimiR−208aに応答するMyh7 mRNAの初期スパイクは、増大されたMyh7タンパク質に翻訳されない。
Myh7発現に及ぼす影響がmiR−208aおよびmiR−499の両方の低減に基づくかを確認するために、本発明者らは、antimiR−208aおよびantimiR−499のカクテルをそれぞれ33mg/kgで連続3日間にわたりマウスに注入した。antimiR−208a/−499による治療は、6週間にわたりmiR−208aおよびmiR−499のロバストな阻害を引き起こし、Myh7のmRNAおよびタンパク質のかなり急速な制御を示し、治療2週間後まで発現が低減された(図14A〜C)。心臓、肝臓、腎臓、および血漿でのantimiR−208aを定量化するサンドイッチハイブリダイゼーションアッセイを用いたantimiR分布データから、33mg/kgまたは3×33mg/kgのantimiR−208aのいずれかを投与した6週間後、かなりの量のantimiR−208aが依然として検出可能であることが示された(図15)。
miR−208の治療的サイレンシングは、心臓リモデリングを低減すると同時に、心不全時の心臓機能および生存率を改善する
これまでのデータから、miR−208aの遺伝子欠失が心臓保護効果をもたらすことが示されたので、本発明者らは、miR−208a阻害の治療的妥当性の試験をめざした。この目的のために、本発明者らは、8週齢から始めて、低食塩(LS)食(0.25%NaCl)または高食塩(HS)食(8.0%NaCl)が給餌されたダール食塩感受性ラットを使用した。1週間のHSの後、生理食塩水、25mg/kgのantimiR−208a、または25mg/kgのスクランブルコントロールオリゴを2週間ごとにラットに皮下投与した。3〜4週間のHS食の後、生理食塩水およびコントロールの治療動物は、不動および不快感および死の目視可能な徴候を示し、一方、antimiR−208aの皮下送達は、これらの症状を有意に緩和していることが可能であった(図16)。健康の指標として、本発明者らは、試験期間中、体重をモニターした。生理食塩水またはコントロールオリゴのいずれかが注入されたHS食のダールラットは、LS食コントロールと比較して、体重増加の有意な低減を呈した。しかしながら、HS/antimiR−208a治療ラットは、同程度の体重増加を示した(図16B)。antimiR−208a治療動物が8%HS食のより少ない摂取により体重を維持していた可能性を除外するために、食物摂取をモニターしたが、すべてのHS摂食群間で同程度の摂取を示した(図示せず)。
これまでのデータから、miR−208aの遺伝子欠失が心臓保護効果をもたらすことが示されたので、本発明者らは、miR−208a阻害の治療的妥当性の試験をめざした。この目的のために、本発明者らは、8週齢から始めて、低食塩(LS)食(0.25%NaCl)または高食塩(HS)食(8.0%NaCl)が給餌されたダール食塩感受性ラットを使用した。1週間のHSの後、生理食塩水、25mg/kgのantimiR−208a、または25mg/kgのスクランブルコントロールオリゴを2週間ごとにラットに皮下投与した。3〜4週間のHS食の後、生理食塩水およびコントロールの治療動物は、不動および不快感および死の目視可能な徴候を示し、一方、antimiR−208aの皮下送達は、これらの症状を有意に緩和していることが可能であった(図16)。健康の指標として、本発明者らは、試験期間中、体重をモニターした。生理食塩水またはコントロールオリゴのいずれかが注入されたHS食のダールラットは、LS食コントロールと比較して、体重増加の有意な低減を呈した。しかしながら、HS/antimiR−208a治療ラットは、同程度の体重増加を示した(図16B)。antimiR−208a治療動物が8%HS食のより少ない摂取により体重を維持していた可能性を除外するために、食物摂取をモニターしたが、すべてのHS摂食群間で同程度の摂取を示した(図示せず)。
antimiR−208aに応答して観測される保護作用についてさらなる知見を得るために、9週間の4.0%NaCl食を用いて、後続試験を行い、その間、ラットは、生理食塩水、5もしくは25mg/kgのantimiR−208a、または25mg/kgのantimiRコントロールのいずれかを2週間ごとに摂取した。体重分析から、HS食のダールラットは、LS食コントロールと比較して、体重増加の有意な低減を呈し、一方、HS/antimiR−208a治療ラットは、体重増加の増大を維持することが示唆された(図17A)。antimiR−208a治療ダールラットの心エコー検査を用いた機能評価から、拡張機能の測定で有意な用量依存性改良が示された。antimiR−208a治療ラットは、HS食8週間後、HS/生理食塩水コントロールと比較して、等容弛綬時間(IVRT)の有意な減少を呈し、さらにはHS/生理食塩水コントロールと比較して、僧帽弁早期対能動期充満速度比(mitral valve early to active filling velocity ratio)(MV E/A)の標準化を呈した(図17B)。心筋細胞サイズの定量化から、antimiR−208aによる治療後、心筋細胞肥大の有意な減少が示された(図18A、B)。加えて、antimiR−208a治療は、ピクロシリウスレッド染色の定量化により評価したとき、HS食により誘導された細動脈周囲線維症を低減した(図18A、B)。
miR−208a阻害は心不全時のミオシンスイッチを逆にする
分子変化および細胞変化を伴うantimiR−208a治療後に観測される生理学的変化を比較するために、本発明者らは、HS治療後、myomiR発現を調べた。antimiR−208aは、最終注入2週間後に左室および右室の両方でmiR−208aの用量依存性阻害を引き起こしたが、コントロールオリゴは、生理食塩水と比較して差を示さなかった(図19A、左のパネル)。miR−499はまた、miR−208aの持続的阻害後に発現の用量依存性低減を示した(図19A、中間のパネル)。miR−208bは、HS/生理食塩水およびHS/コントロール治療動物の両方で誘導されたが、antimiR−208a治療は、miR−208bレベルの用量依存性低減をもたらした(図19A、右のパネル)。ノーザンブロット分析から、miR−499およびmiR−208bのこの制御が確認された(図19B)。
分子変化および細胞変化を伴うantimiR−208a治療後に観測される生理学的変化を比較するために、本発明者らは、HS治療後、myomiR発現を調べた。antimiR−208aは、最終注入2週間後に左室および右室の両方でmiR−208aの用量依存性阻害を引き起こしたが、コントロールオリゴは、生理食塩水と比較して差を示さなかった(図19A、左のパネル)。miR−499はまた、miR−208aの持続的阻害後に発現の用量依存性低減を示した(図19A、中間のパネル)。miR−208bは、HS/生理食塩水およびHS/コントロール治療動物の両方で誘導されたが、antimiR−208a治療は、miR−208bレベルの用量依存性低減をもたらした(図19A、右のパネル)。ノーザンブロット分析から、miR−499およびmiR−208bのこの制御が確認された(図19B)。
宿主遺伝子の制御を評価するために、本発明者らは、Myh6、Myh7、およびMyh7bのmRNAレベルを調べた。Myh7は、HS/生理食塩水群およびHS/コントロール群の両方でHSに応答して有意に増大された。この増大は、antimiR−208aに応答して用量依存的に減弱された。加えて、antimiR−208a治療は、HS/生理食塩水群およびHS/コントロール群の両方で観測されたMyh6 mRNAの発現の減少を標準化した(図20A)。Myh7bの発現は、miR−499レベルを反映し、antimiR−208a治療による用量依存性低減を呈する。さらに、Myh7の用量依存性制御は、ウェスタンブロット(図20B)により確認された。
antimiR−208aは、心臓コンダクタンスまたは毒性徴候の変化を誘導しない
miR−208aの遺伝子欠失は、生存能に影響を及ぼしたり、全形態的心臓欠陥を引き起こしたりすることはなく、既報では、miR−208aは、適正な心臓電気生理学に必要とされると言及された。本発明者らは、miR−208ノックアウト動物でなんら明白な異常を観測しなかったが、antimiR−208a治療が、心臓コンダクタンス効果をもたらすか確証するためには、本発明者らは、野生型マウスおよび疾患ラットの両方でECGを測定した。antimiR−208a治療の後、両方の種が、長期間にわたりに適正な心臓電気生理を示した(図示せず)。
miR−208aの遺伝子欠失は、生存能に影響を及ぼしたり、全形態的心臓欠陥を引き起こしたりすることはなく、既報では、miR−208aは、適正な心臓電気生理学に必要とされると言及された。本発明者らは、miR−208ノックアウト動物でなんら明白な異常を観測しなかったが、antimiR−208a治療が、心臓コンダクタンス効果をもたらすか確証するためには、本発明者らは、野生型マウスおよび疾患ラットの両方でECGを測定した。antimiR−208a治療の後、両方の種が、長期間にわたりに適正な心臓電気生理を示した(図示せず)。
投与経路に関係なく、すべてのマウスおよびラットは、antimiR−208aまたはコントロールオリゴに良好に耐えて、試験全体を通じて、活性レベルおよびグルーミングにより決定したとき、正常挙動を呈した。生理食塩水と比較して、antimiR−208aまたはコントロールオリゴは、投与6週間後まで、心臓、腎臓、肝臓、肺、または脾臓を含めて、体重またはさらなる組織重量中のベースライン変化を誘導しなかった(図示せず)。antimiR−208a治療もコントロールオリゴ治療も、ラットにおいてアラニンアミノトランスフェラーゼ(ALT)およびアスパラギン酸アミノトランスフェラーゼ(AST)肝酵素の血清中レベルを変化させなかったことから(図示せず)、本オリゴヌクレオチドがなんら明白な肝臓毒性を誘導しないことが示唆される。
antimiR−208aは特定の遺伝子発現変化を誘導する
遺伝子発現変化に及ぼすmiR−208a阻害の影響を確認するために、本発明者らは、生理食塩水、antimiR−208a、またはコントロールオリゴのいずれかが注入されたHS食のダールラットでマイクロアレイ分析を行った。コントロールオリゴ治療動物と比較して、antimiR−208a治療動物は、131の遺伝子の有意な変化を示した。15の遺伝子だけ(67%の偽陽性発見率)は、生理食塩水およびコントロールオリゴが注入された動物間で有意差があったことから、本オリゴヌクレオチド化学物質自体による遺伝子発現に及ぼす影響の欠如が示唆される。ヒートマップで視覚的に実証されるように、コントロールオリゴおよびantimiR−208aで治療された心臓間で有意に変化した131の遺伝子の発現の階層的クラスタリングは、antimiR−208a治療後にアップレギュレートおよびダウンレギュレートされた遺伝子のロバストなクラスタリングを示し、コントロールオリゴ治療後に遺伝子発現応答が存在しないことが確証された(図示せず)。遺伝子アレイ分析から、コントロールオリゴと比較して、antimiR−208aに応答してMyh7およびMyh7bの有意なダウンレギュレーションが確認され(それぞれ、−1.31、p=0.005、および−2.38、p=0.037 )、一方、これまでに特性解析された標的Thrap1は増大された(1.56およびp=0.49)。アレイ上で検出された13518の遺伝子のうち、289の遺伝子は、miR−208標的であると生物情報学的に予測された。これらの予測された標的のうち、28の遺伝子は、マイクロアレイにより、antimiR−208治療で発現増大を示し、そのいくつかは、リアルタイムPCRにより確認された(図示せず)。8週間にわたり生理食塩水、antimiR−208a、またはコントロールオリゴで治療されたダール高血圧ラットの心臓サンプルで遺伝子発現解析を行ったので、本発明者らは、遺伝子発現変化の残りが、miR−208a阻害の直接的遺伝子制御効果の二次的なものであろうと推測する。
遺伝子発現変化に及ぼすmiR−208a阻害の影響を確認するために、本発明者らは、生理食塩水、antimiR−208a、またはコントロールオリゴのいずれかが注入されたHS食のダールラットでマイクロアレイ分析を行った。コントロールオリゴ治療動物と比較して、antimiR−208a治療動物は、131の遺伝子の有意な変化を示した。15の遺伝子だけ(67%の偽陽性発見率)は、生理食塩水およびコントロールオリゴが注入された動物間で有意差があったことから、本オリゴヌクレオチド化学物質自体による遺伝子発現に及ぼす影響の欠如が示唆される。ヒートマップで視覚的に実証されるように、コントロールオリゴおよびantimiR−208aで治療された心臓間で有意に変化した131の遺伝子の発現の階層的クラスタリングは、antimiR−208a治療後にアップレギュレートおよびダウンレギュレートされた遺伝子のロバストなクラスタリングを示し、コントロールオリゴ治療後に遺伝子発現応答が存在しないことが確証された(図示せず)。遺伝子アレイ分析から、コントロールオリゴと比較して、antimiR−208aに応答してMyh7およびMyh7bの有意なダウンレギュレーションが確認され(それぞれ、−1.31、p=0.005、および−2.38、p=0.037 )、一方、これまでに特性解析された標的Thrap1は増大された(1.56およびp=0.49)。アレイ上で検出された13518の遺伝子のうち、289の遺伝子は、miR−208標的であると生物情報学的に予測された。これらの予測された標的のうち、28の遺伝子は、マイクロアレイにより、antimiR−208治療で発現増大を示し、そのいくつかは、リアルタイムPCRにより確認された(図示せず)。8週間にわたり生理食塩水、antimiR−208a、またはコントロールオリゴで治療されたダール高血圧ラットの心臓サンプルで遺伝子発現解析を行ったので、本発明者らは、遺伝子発現変化の残りが、miR−208a阻害の直接的遺伝子制御効果の二次的なものであろうと推測する。
ラットゲノムに対するantimiR配列のBLAST解析から、antimiR−208aの配列は、4つのコード配列に近い相同性(少なくとも14塩基の相補性)を示すことが示されたが、これらの遺伝子はいずれも、マイクロアレイ分析により決定したとき、制御されなかった。全体として、これらの分析から、LNA修飾オリゴは、化学物質クラスにより誘導される遺伝子発現変化を伴うことなく、miR−208aをきわめて特異的に標的とすることが示唆される。
miR−499は、antimiR−208aの有効性に関する血漿中バイオマーカーである
種々の疾患状況時の血漿中miRNAの検出は、診断の大きな将来性を示している。antimiR−208aの有効性と相関する特異的miRNAが存在することを確認するために、本発明者らは、HS治療時、一群の筋肉関連miRNAを調べた。miR−1および−133などの試験されたいくつかの筋肉特異的miRNAは、試験群間で有意差を示さなかった(図示せず)。注目すべき点として、miR−499は、高食塩下で血漿中検出の中程度の増加を示すにすぎなかったが、antimiR−208a治療動物で有意に低減されたことから、miR−499は、antimiR−208aの有効性の血漿ベースのマーカーとして作用可能であることが示唆される。加えて、これまでに血漿中レベルがヒト心不全に相関付けられたmiR−423−5pは(24)、antimiR−208aで治療された動物において低減されることが判明した。
種々の疾患状況時の血漿中miRNAの検出は、診断の大きな将来性を示している。antimiR−208aの有効性と相関する特異的miRNAが存在することを確認するために、本発明者らは、HS治療時、一群の筋肉関連miRNAを調べた。miR−1および−133などの試験されたいくつかの筋肉特異的miRNAは、試験群間で有意差を示さなかった(図示せず)。注目すべき点として、miR−499は、高食塩下で血漿中検出の中程度の増加を示すにすぎなかったが、antimiR−208a治療動物で有意に低減されたことから、miR−499は、antimiR−208aの有効性の血漿ベースのマーカーとして作用可能であることが示唆される。加えて、これまでに血漿中レベルがヒト心不全に相関付けられたmiR−423−5pは(24)、antimiR−208aで治療された動物において低減されることが判明した。
考察
本明細書に提示されたデータから、miR−208の治療的阻害は、心臓リモデリングの大幅な低減をもたらすことが示唆され、これは、心疾患時の生存率および心臓機能の有意な改善と一致する。
本明細書に提示されたデータから、miR−208の治療的阻害は、心臓リモデリングの大幅な低減をもたらすことが示唆され、これは、心疾患時の生存率および心臓機能の有意な改善と一致する。
アンチセンスオリゴヌクレオチドは、in vivoでmiRNAを効果的にサイレンシングするために使用することができる(19〜23)。これらのantimiRは、in vivo安定性、目標のmiRNAに対する特異性および高い結合親和性を確保するために化学修飾である。LNAは、オリゴヌクレオチドとの熱力学的に強い二本鎖形成を引き起こすと同時に、相補的RNAまたはDNAオリゴヌクレオチドに対する特異性を向上させる核酸修飾である(19〜20)。高い結合親和性の結果として、LNA修飾antimiRの生物学的活性は、より短いオリゴヌクレオチド(8〜16塩基)を用いて到達される(25)。近年、齧歯動物および非ヒト霊長動物で治療的適用可能性が報告され、非接合LNAantimiRの全身送達は、肝臓発現miR−122を強力にアンタゴナイズし、慢性感染チンパンジー(23)においてC型肝炎ウィルス起因性肝臓病変の改善をもたらした。
本試験の主要な知見は、LNA修飾オリゴヌクレオチドの全身送達が、心臓でmiR−208の強力かつ持続的なサイレンシングを誘導するのに有効であることである。antimiR−208aの全身送達後の持続的なmiR−208a阻害および近縁miR−208bに及ぼす影響の不在から、in vivo安定性および特異性が示唆される。持続的なmiR−208aサイレンシングおよび経時的な下流のMyh7制御に基づいて、antimiR−208aは、心臓細胞に蓄積して、Myh6転写により産生されるmiR−208aの新たに形成されたすべてのコピーをサイレンシングできる可能性があると思われる。この効果は、心筋細胞の代謝回転の全般的欠如によりさらに裏付けられ、antimiRにより標的とされた細胞の一部での低減による希釈を予防する。
直接標的に及ぼすmiRNAの遺伝子制御の影響は、かなり即時的であるが、miR−208a阻害は、Myh7bおよびMyh7発現に及ぼす影響を確認するまでに、数週間を必要とする。本発明者らの仮説によれば、下流の生物学的作用の遅延は、多くの直接的および間接的な標的遺伝子の発現の変化が必要であることに起因し、その変化を誘導するために効果の組合せが必要とされる。miR−122阻害に応答して同等の現象が観測された。これは、血漿中コレステロールの低下を誘導するが、antimiR治療の数週間後に初めて起こり、一方、遺伝子発現変化は、即時的である(19〜20)。それにもかかわらず、Myh7bおよびMyh7発現に及ぼす影響は、miR−208遺伝子欠失で観測される影響を表現型模写することから(12)、miR−208aが効果的にサイレンシングされることが示唆される。
ダール高血圧ラットにおけるantimiR−208aの治療効果は、皮下送達がin vivoでantimiRを心臓に効果的に送達するのに十分であり、かつmiR−208a阻害が心疾患時の心臓リモデリング、機能悪化、および致死率を予防するという強力な証拠を提供する。これら効果がmiR−208a阻害に基づいて心筋細胞に及ぼす効果のみから生じるのか、または現在知られていないmiR−208a阻害に応答する心外性効果が存在するのかは、依然として不明のままであるが、用量応答性およびコントロール化学物質で治療された動物での効果の不在から、観測された効果が、miR−208aレベルの低下に基づくものであることが強く示唆される。進行中の実験から、この治療効果が、心不全の複数のモデルで確証可能であるか、ならびにmiR−208aおよびmiR−499に対する併行的なantimiRの組合せ投与が、観測された効果をより迅速に解明するかが示唆されるであろう。初期の齧歯動物データは、非常に希望のもてるものと思われ、有害な副作用は、antimiR治療で観測されなかったが、種々の状況でそのような作用剤の長期安全性を調べるために、広範な分析が必要とされるであろう。
近年、miRNAは、ヒトおよび動物の血清および血漿で検出され、心疾患を含めて種々の疾患の診断バイオマーカーとしてmiRNAを用いる可能性が開かれている(24,26〜28)。血漿中miRNA分析から、いくつかの他のmiRNA変化に加えて、antimiR−208a治療は、血清中miR−499の検出低減をもたらし、それと併行して、antimiR−208a治療に応答してMyh7b/miR−499の心臓発現の低減が起こることが示される。心臓中および血漿中のmiR−499レベルとantimiR−208aの有効性との間の相関を仮定すれば、これらのデータから、血漿中miR−499レベルは、患者に移行したとき、心臓へのantimiR−208aの効果的な送達のバイオマーカーとして作用され得る。
ミオシンおよび後続のmyomiRの発現は、種間で有意に異なる。より小さい齧歯動物の心臓では、Myh6/miR−208aが主なミオシン/myomiRアイソフォームであるが、より大きい哺乳動物は、より多くのMyh7/miR208bを発現する(17)。miR−208aおよび208bはオーバーラップシード配列を有するが、それらは、それらの3’領域の3つの塩基が異なる。より大きい種で同等の治療効果を確証するためにmiR−208a、miR−208b、または両方のmiR−208アイソフォームの阻害が必要とされるかを確証するために、より大きい哺乳動物での後続の薬動学的試験および有効性試験が必要とされるであろう。加えて、miR−208阻害の治療的使用は、おそらく、心不全患者において現行の標準のケアとの組合せ治療になるであろうから、これらの現行の治療と組み合わせたとき、antimiR−208aが、これらの薬剤の有益な効果を高めるか評価することが重要であろう。
まとめると、この試験から、LNAベースのantimiRの皮下送達は、心臓を効果的に標的とすることができ、心疾患時の標的としてmiR−208をさらに確証することが実証される。
方法
動物処置。すべての動物プロトコルは、Institutional Animal Care and Use Committee of miRagen Therapeutics, Inc.により承認された。
動物処置。すべての動物プロトコルは、Institutional Animal Care and Use Committee of miRagen Therapeutics, Inc.により承認された。
動物およびLNA修飾antimiRの送達。LNA−antimiRオリゴヌクレオチドは、成熟miR−208a配列の5’領域に完全に相補的な非接合および完全にホスホロチオレート化されたオリゴヌクレオチドとしてmiRagen Therapeutics, Inc.で合成した。LNAコントロールオリゴヌクレオチドは、C.エレガンス(C. elegans)特異的miRNAに対する配列からなるものであった。別段の指定がないかぎり、オリゴヌクレオチド化学物質のin vivo送達は、成体雄C56B16マウスまたは成体雄ダール食塩感受性ラット(Harlan, Indianapolis)のいずれかに、尾静脈を介して低圧静脈内(i.v.)注入により達成した。すべての化学物質を同等の最終体積の生理食塩水に溶解させて注入し、その後、化学物質の明確な副作用に関して動物を調べた。指定の時点で組織サンプルを採取し、分子的または組織学的検査に供した。8週齢でダールラットを0.25NaClで維持し、または4%もしくは8%NaCl食で配置した(Harlan, Indianapolis)。
定量的リアルタイムPCR分析。in vivoリアルタイムPCR分析のために、Trizol(Invitrogen)を用いて心臓組織からRNAを取り出し、その後、各組織サンプルからの2μgのRNAを用いて、製造業者の仕様(Invitrogen)に従ってSuper Script II逆転写酵素によりcDNAを産生した。miR−208のレベルを検出するために、10〜100ngの全RNAを用いて、製造業者の推奨基準に従ってTaqman microRNAアッセイ(Applied Biosystems, ABI)によりRT−PCRを行った。ABIから購入したTaqmanプローブを用いて定量的リアルタイムPCRにより遺伝子の一部の発現を分析した。
ノーザンブロット分析。Trizol試薬(Gibco/BRL)を用いて心臓組織サンプルから全RNAを単離した。上述のように、microRNAを検出するノーザンブロットを行った。U6プローブは、ローディングコントロールとして機能した(IDT)。心筋細胞または心臓組織からの10μgの全RNAを20%アクリルアミド変性ゲル上に充填し、電気泳動によりZeta-probe GTゲノムブロット膜(Bio-Rad)に移した。転写後、ブロットを架橋して、80℃で1時間焼成した。miRNA検出感度を最大化するために、Starfire Oligos Kit(IDT, Coralville, IA)およびα-32P dATP(AmershamまたはPerkin Elmer)を用いて、オリゴヌクレオチドプローブを標識した。Rapid-hyb緩衝液(Amersham)中39℃でプローブを膜に一晩ハイブリダイズさせ、その後、0.1%SDSを含む0.5×SSCを用いて39℃で10分間2回洗浄した。ブロットを露出させて、PhosphorImager分析(GE HealthCare Life Sciences)により定量化し、U6プローブをローディングコントロールとして機能させた(ABI)。phosphorimagerおよびImageQuant(Bio-Rad)を用いて、放射性シグナルの強度により発現の変化倍率を定量化した。
ウェスタンブロット分析。ウェスタンブロット分析のために、記載のように、ミオシンを心臓細胞または組織から取り出した(29)。4〜15%グラジエントゲル上に0.1μgのタンパク質溶解物を充填することによりMHCアイソフォームを検出し、SDS PAGEにより分離し、Myh7にきわめて特異的なマウスモノクローナル抗ミオシン(遅筋型、骨格M8421)(Sigma, MO)を用いてウェスタンブロッティングを行った。
生体内分布アッセイ。血漿および組織のサンプル中のantimiR−208aの定量化のために、サンドイッチハイブリダイゼーションアッセイを使用した。2’OmeおよびLNA修飾ヌクレオチドを用いて、ハイブリダイゼーションアッセイ用プローブを合成した。それらは、bTEG−mU;lA;mA;lG;mA;lC;mG(捕獲プローブ)およびmA;lG;mC;lA;mA;lA;mA;lA;mG−6FAM(検出プローブ)である。抗蛍光-POD Fabフラグメント(Roche)、およびTMBペルオキシダーゼ基質(KPL)を用いて、検出を達成した。4パラメーター(4−PL)の非線形ロジスティック回帰分析を用いて、標準曲線を作成した。アッセイの動作濃度範囲は、2〜536ng/mlであった。6.0の速度設定でMP FastPre-24を用いて、3M GITC緩衝液(3Mグアニジンイソチオシアネート、0.5M NaCl、0.1M Tris pH7.5、10mM EDTA)中で2×30秒間ホモジナイズすることにより、100mg/mlで組織サンプルを調製した。試験のために血漿サンプルおよび組織ホモジネートを1M GITC緩衝液(1Mグアニジンイソチオシアネート、0.5M NaCl、0.1M Tris pH7.5、10mM EDTA)中に最小で50倍希釈した。
心エコー検査。30MHzトランスデューサーを有するVisual Sonic Ultrasoundシステムを用いて鎮静ラット(2〜2.5%イソフルラン)で二次元経胸壁心エコー検査により心臓機能を評価した。心臓を乳頭筋レベルで傍胸骨短軸図で画像化し、Mモード測定値を記録し、心拍数、壁厚さ、ならびに拡張末期および収縮末期の寸法を決定する。内径短縮率(拡張末期寸法−拡張末期寸法に標準化された収縮末期寸法として定義される)を心収縮機能の指標として使用した。心尖部四室像から経僧帽弁フロードップラーを用いて、E/A比、等容弛綬時間、およびE波速度の減速時間を測定することにより、拡張機能を評価した。
表面ECG測定。200mL/分 O2中2%イソフルランを用いてマウスを麻酔し、ノーズコーンを介して500mL/分吸気中2%イソフルランを用いてラットを麻酔した。Homeothermic Warming System(Kent Scientific)またはヒートランプおよび加温プラットフォーム(Visual Sonics)を介してマウスおよびラットの体温を37〜38℃に維持した。皮下針電極およびIworxデータ取得システムを用いて1kHzでサンプリングして、第II誘導心電図を10分間記録した。Labscribeソフトウェア(Iworx)を用いて、2、4、6、8、および10分後にトレースを解析し、正常洞調律に関して検査し、コンピューター化技術を用いて、各時点で約40鼓動を解析し、信号間隔(HR、PR、QRS、QT、およびQTc)を定量化した。
組織診断。組織診断に使用する組織をクレブス・ヘンゼライト溶液中でインキュベートし、4%パラホルムアルデヒド中で固定し、切片にし、標準的技術(30)によりヘマトキシリン+エオシン(H&E)染色およびピクロシリウスレッド染色のために処理し、またはin situハイブリダイゼーションのために処理した。動物1匹あたり約100個の心筋細胞の断面画像をH&E染色切片から取り込んだ。Image-Pro Plusソフトウェアを用いて心筋細胞断面積を測定し、各動物に対して平均値を決定した。各動物のピクロシリウスレッド染色切片から、心外膜領域、心筋中層領域、および心内膜領域の血管周囲線維症画像を取得した。Image-Pro plusソフトウェアを用いて血管周囲線維症を含む全血管壁領域を決定した。全血管壁領域から管腔領域を差し引いた。色領域分割により血管周囲線維症を決定し、全血管壁基準の%として報告した。
遺伝子発現解析。サービスプロバイダー(Expression Analysis, Durham, NC)により、Illumina RatRef-12 BeadChipアレイを用いて、マイクロアレイプロフィーリングを行った。上述のように、全RNAを心臓組織から単離した。PADE(Permutation Analysis of Differential Expression)を用いて、サービスプロバイダーにより、差次的遺伝子発現の分析を行った。遺伝子プローブが12アレイすべてで検出p値<0.05を有していない場合、その遺伝子を後続の分析から削除したことに留意されたい。差次的発現グラフは、サービスプロバイダーにより提供された。Cluster 3.0を用いて遺伝子クラスタリングを行い、ヒートマップ画像をJava(登録商標) TreeViewで作成した。www.pantherdb.orgに見られるオンラインのツールを用いて、遺伝子オントロジー解析を行った。targetscan.org(TargetScan)、pictar.mdc-berlin.de(Pictar)、およびmicroma.org(miRanda)を用いて、ラット中の予測miR−208遺伝子標的を見いだした。miRandaにより予測されたすべての遺伝子標的のうち、<−0.1のmirsvrスコアを有するものを解析に組み入れた。miR−208標的を同定するために、差次的発現のために≦0.05のp値カットオフを使用した。
血漿からの定量的リアルタイムPCR分析。製造業者のプロトコルにより、Trizol LS Reagent(Invitrogen)を用いて、血漿サンプルからのRNAを単離した。RNA単離前、250pmolの2つの異なる合成C.エレガンス(C. elegans)miRNA配列を添加して、標的miRNAの標準化内部コントロールとして機能させた。使用したC.エレガンス(C. elegans)配列は、cel−miR−2(UAUCACAGCCAGCUUUGAUGUGC(配列番号92))およびcel−lin−4(UCCCUGAGACCUCAAGUGUGA(配列番号93))(Dharmacon)であった。上述のように、初期血漿体積に等しい最終体積で最終RNAペレットを再懸濁させ、5μlを後続のRT−PCR反応に使用した。
統計解析。一元配置ANOVAおよびニューマン・クールズ多重比較事後検定を用いて有意性を決定した。P<0.05は、統計的に有意とみなした。
実施例4:非ヒト霊長動物における阻害剤投与
antimir10101および10707を25mg/kgの用量で伏在静脈によりアフリカミドリザル(約3kg)に3回投与した。4週間後に組織を採取し、阻害剤に関してアッセイした。結果を図22に示す。右のパネルは、薬剤血漿クリアランスを示している。左のパネルは、組織中および血漿中の分布を示している(暗色棒、M−10101、明色棒、M−10707)。
antimir10101および10707を25mg/kgの用量で伏在静脈によりアフリカミドリザル(約3kg)に3回投与した。4週間後に組織を採取し、阻害剤に関してアッセイした。結果を図22に示す。右のパネルは、薬剤血漿クリアランスを示している。左のパネルは、組織中および血漿中の分布を示している(暗色棒、M−10101、明色棒、M−10707)。
図23は、miRNA標的阻害を示している。左のパネルは、左室でのmiR−208a発現の変化を示している(左から右へ:未治療、M−10101、10707、10591)。右のパネルは、左室でのmiR−208bの変化を示している(左から右へ:未治療、M−10101、M−10707、M−10591)。M−10101とM−10707との差はわずか2ヌクレオチドにすぎないが、antimiRは、それらの標的miR(それぞれmiR−208aおよびmiR−208b)に特異的である。
図24は、治療後のMir−499レベルを示している。レベルは、左室(LV)、右室(RV)、および中隔に対して示されている。棒は、左から右へ、未治療、M−10101、M−10707、およびM−10591である。
実施例5:antimiR−208a治療の分子的分析
7つのantimiR−208a化学物質。ここで選択されたものは、in vivoで有効性を示したものであり、それぞれ、9つのLNAおよび7つのDNAヌクレオチドを有する。化合物を25mg/kg s.c.でマウスに投与し、4日目に摘出した。miRおよび標的の発現を測定した。化合物は、M−10101、M−10680、M−10681、M−10682、M−10683、M−10673、およびM−11184であった(表1参照)。
7つのantimiR−208a化学物質。ここで選択されたものは、in vivoで有効性を示したものであり、それぞれ、9つのLNAおよび7つのDNAヌクレオチドを有する。化合物を25mg/kg s.c.でマウスに投与し、4日目に摘出した。miRおよび標的の発現を測定した。化合物は、M−10101、M−10680、M−10681、M−10682、M−10683、M−10673、およびM−11184であった(表1参照)。
肝臓および腎臓の毒性マーカーは、生理食塩水から有意な増大を示さなかった(データは示されていない)。
化合物は、さまざまなレベルの標的脱抑制を示す。M−10101およびM−10683は、特に有効であった。図25は、miR−208aおよびDynlt1の発現を示している。図26は、Dynlt1、Vcpip、およびTmbim6の発現を示している。図27は、Thrap1およびsp3の発現を示している。図28は、Purb、Gata4、およびSox6の発現を示している。
図29に示されるように、antimir−208a治療は、無ストレス齧歯動物(SDラット)において血漿中miR−19bレベルを増大させる。
ダール食塩感受性ラットモデルを用いて示されるように、標的脱抑制度は、ストレス度に依存する。図30は、4%食塩および6%食塩でのDynlt1発現の結果を示している。Dynlt1は、6%でよりロバストな脱抑制を示す。図31は、標的Vcpip1の結果を示している。図32は、標的Tmbim6の結果を示している。
図33〜39は、心臓の異なる領域でのmiR阻害度を示しており、より多くのストレスを受けた領域がより大きい影響を示すことを示している。図33は、miR−208a、miR−208b、およびmiR−499の阻害を示している。図34は、ミオシンマーカーの脱抑制を示している。図35は、特定の心臓ストレスマーカーの発現度を示している。図36は、Dynlt1、Vcpip、Tmbim6、およびCbxlの脱抑制を示している。図37は、Thrap1、Sox6、sp3、およびpur−betaの発現を示している。図38に示されるように、閉塞(infarted)領域は、Dynlt1の最大の脱抑制を示した。図39は、M−10101による心臓の異なる領域での標的の脱抑制を示している。
Claims (47)
- ヒトmiR−208aまたはヒトmiR−208bのヌクレオチド配列に実質的に相補的であるヌクレオチド配列を含み、かつロックドヌクレオチドと非ロックドヌクレオチドとの混合物を有する、オリゴヌクレオチドであって、
前記オリゴヌクレオチドの長さならびにロックドヌクレオチドの数および位置は、前記オリゴヌクレオチドが、in vitroルシフェラーゼアッセイにおいて約50nM以下のオリゴヌクレオチド濃度で、または、マウスモデルにおいて25mg/kg以下の用量で、miR−208a、miR−208b、および/またはmiR−499の活性を低減するようなものである、オリゴヌクレオチド。 - 少なくとも7つのヌクレオチドがロックドヌクレオチドであり、かつ少なくとも1つのヌクレオチドが非ロックドヌクレオチドである、請求項1に記載のオリゴヌクレオチド。
- 前記オリゴヌクレオチドが約8〜約18ヌクレオチド長である、請求項1に記載のオリゴヌクレオチド。
- 前記オリゴヌクレオチドが約16ヌクレオチド長である、請求項3に記載のオリゴヌクレオチド。
- 前記ヌクレオチド配列がmiR−208aまたはmiR−208bのヌクレオチド配列に完全に相補的である、請求項1に記載のオリゴヌクレオチド。
- 配列番号1または配列番号2のヌクレオチド配列を含む、請求項5に記載のオリゴヌクレオチド。
- 配列番号3または配列番号4のヌクレオチド配列を有する、請求項5に記載のオリゴヌクレオチド。
- 前記オリゴヌクレオチドが、3超の隣接する非ロックドヌクレオチドを有する一続きのヌクレオチドを含んでいない、請求項1〜7のいずれか1項に記載のオリゴヌクレオチド。
- 前記オリゴヌクレオチドが、2超の隣接する非ロックドヌクレオチドを有する一続きのヌクレオチドを含んでいない、請求項8に記載のオリゴヌクレオチド。
- 前記オリゴヌクレオチドが、隣接する非ロックドヌクレオチドの1つの出現を有する、請求項8または9に記載のオリゴヌクレオチド。
- 前記miR−208aまたは前記miR−208bのシード領域に相補的な領域が、少なくとも4つのロックドヌクレオチドを含む、請求項1〜10のいずれか1項に記載のオリゴヌクレオチド。
- 少なくとも9つのロックドヌクレオチドを含む、請求項7に記載のオリゴヌクレオチド。
- 少なくとも11のロックドヌクレオチドを含む、請求項12に記載のオリゴヌクレオチド。
- 少なくとも3つの非ロックドヌクレオチドを含む、請求項7に記載のオリゴヌクレオチド。
- 9つのロックドヌクレオチドと7つの非ロックドヌクレオチドとを含む、請求項14に記載のオリゴヌクレオチド。
- 11のロックドヌクレオチドと5つの非ロックドヌクレオチドとを含む、請求項14に記載のオリゴヌクレオチド。
- 少なくとも位置1、6、10、13、および15がロックドヌクレオチドである、請求項7に記載のオリゴヌクレオチド。
- 位置1、5、6、8、10、11、13、15、および16がロックドヌクレオチドであり、かつ残りの位置が非ロックドヌクレオチドである、請求項7に記載のオリゴヌクレオチド。
- 位置1、3、4、5、6、8、10、13、15、および16がロックドヌクレオチドであり、かつ残りの位置が非ロックドヌクレオチドである、請求項7に記載のオリゴヌクレオチド。
- 位置1、4、5、7、9、10、12、14、および16がロックドヌクレオチドであり、かつ残りの位置が非ロックドヌクレオチドである、請求項7に記載のオリゴヌクレオチド。
- ロックド配置でないヌクレオチドが2’デオキシである、請求項1〜20のいずれか1項に記載のオリゴヌクレオチド。
- 少なくとも1つの非ロックドヌクレオチドが2’O−アルキルまたは2’ハロである、請求項1〜20のいずれか1項に記載のオリゴヌクレオチド。
- 前記ロックドヌクレオチドが2’−4’メチレン架橋を有する、請求項1〜22のいずれか1項に記載のオリゴヌクレオチド。
- 5’および/または3’キャップ構造を有する、請求項1〜23のいずれか1項に記載のオリゴヌクレオチド。
- 1つまたは複数のホスホロチオエートリンケージを含む、請求項1〜24のいずれか1項に記載のオリゴヌクレオチド。
- 前記オリゴヌクレオチドが、完全に、ホスホロチオエートリンケージされる、請求項25に記載のオリゴヌクレオチド。
- 1〜3つのホスフェートリンケージを有する、請求項25に記載のオリゴヌクレオチド。
- 化合物10101、10673、10674、10677、10679、10683、10707、または10680の構造を有する、請求項7に記載のオリゴヌクレオチド。
- ペンダント親油性基をさらに含む、請求項1〜28のいずれか1項に記載のオリゴヌクレオチド。
- 有効量の、請求項1〜29のいずれか1項に記載のオリゴヌクレオチドまたはその薬学的に許容可能な塩と、薬学的に許容可能な担体または希釈剤と、を含む医薬組成物。
- 前記薬学的に許容可能な担体が、コロイド分散系、高分子複合体、ナノカプセル、マイクロスフェア、ビーズ、水中油型エマルジョン、ミセル、混合ミセル、またはリポソームを含む、請求項30に記載の医薬組成物。
- 前記薬学的に許容可能な担体または希釈剤が、生理食塩水から本質的になる、請求項30に記載の医薬組成物。
- 細胞を、請求項1〜29のいずれか1項に記載のオリゴヌクレオチドもしくは請求項30〜32のいずれか1項に記載の組成物に接触させることを含む、細胞においてmiR−208aおよび/またはmiR−208bの活性を低減または阻害する方法。
- 前記細胞においてmiR−499の活性も低減または阻害される、請求項33に記載の方法。
- 前記細胞が哺乳動物細胞である、請求項33または34に記載の方法。
- 前記細胞が心臓細胞である、請求項35に記載の方法。
- 前記細胞がin vivoまたはex vivoにある、請求項33に記載の方法。
- 請求項30または32に記載の医薬組成物を対象に投与することを含む、miR−208a、miR−208(b)、および/またはmiR−499に関連するかまたはそれにより介される対象の病状を予防または治療する方法。
- 前記病状が心臓病状である、請求項38に記載の方法。
- 前記心臓病状が、病的心肥大、心筋梗塞、または心不全である、請求項38に記載の方法。
- 前記医薬組成物が、非経口投与によりまたは心臓組織中への直接注入により投与される、請求項38〜40のいずれか1項に記載の方法。
- 前記非経口投与が、静脈内、皮下、腹腔内、または筋内である、請求項41に記載の方法。
- 前記組成物が、経口投与、経皮投与、持続放出投与、制御放出投与、遅延放出投与、坐剤投与、カテーテル投与、または舌下投与により投与される、請求項38〜42のいずれか1項に記載の方法。
- 前記対象がヒトである、請求項38〜43のいずれか1項に記載の方法。
- 前記オリゴヌクレオチドが10mg/kg以下の用量で送達される、請求項38〜44のいずれか1項に記載の方法。
- 前記オリゴヌクレオチドが生理食塩水中に製剤化されて皮下投与される、請求項45に記載の方法。
- 前記オリゴヌクレオチドが、M−10101、M−10673、M−10674、M−10677、M−10679、M−10683、M−10707、およびM−10680で表される化合物から選択される、請求項46に記載の方法。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US42345610P | 2010-12-15 | 2010-12-15 | |
| US61/423,456 | 2010-12-15 | ||
| US201161495224P | 2011-06-09 | 2011-06-09 | |
| US61/495,224 | 2011-06-09 | ||
| PCT/US2011/065121 WO2012083005A2 (en) | 2010-12-15 | 2011-12-15 | Microrna inhibitors comprising locked nucleotides |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2014504857A true JP2014504857A (ja) | 2014-02-27 |
| JP2014504857A5 JP2014504857A5 (ja) | 2015-01-29 |
Family
ID=45771875
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013544772A Pending JP2014504857A (ja) | 2010-12-15 | 2011-12-15 | ロックドヌクレオチドを含むmicroRNA阻害剤 |
Country Status (14)
| Country | Link |
|---|---|
| US (2) | US8642751B2 (ja) |
| EP (1) | EP2652151A2 (ja) |
| JP (1) | JP2014504857A (ja) |
| KR (1) | KR20140004646A (ja) |
| CN (1) | CN103380215A (ja) |
| AR (1) | AR084319A1 (ja) |
| AU (1) | AU2011343720A1 (ja) |
| BR (1) | BR112013012319A2 (ja) |
| CA (1) | CA2817371A1 (ja) |
| EA (1) | EA201370139A1 (ja) |
| MX (1) | MX2013005875A (ja) |
| SG (1) | SG190355A1 (ja) |
| WO (1) | WO2012083005A2 (ja) |
| ZA (1) | ZA201303422B (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015521626A (ja) * | 2012-06-21 | 2015-07-30 | ミラゲン セラピューティクス, インコーポレイテッド | ロックド核酸モチーフを含むオリゴヌクレオチドベースの阻害剤 |
| JP2017528441A (ja) * | 2014-08-04 | 2017-09-28 | ミラゲン セラピューティクス, インコーポレイテッド | Myh7bの阻害剤およびその使用 |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5995855B2 (ja) | 2010-11-05 | 2016-09-21 | ミラゲン セラピューティクス,インコーポレイテッド | 塩基修飾オリゴヌクレオチド |
| AU2011343720A1 (en) * | 2010-12-15 | 2013-04-11 | Miragen Therapeutics | MicroRNA inhibitors comprising locked nucleotides |
| EP2763703B1 (en) | 2011-10-06 | 2018-02-14 | Miragen Therapeutics, Inc. | Control of whole body energy homeostasis by microrna regulation |
| CN105189751B (zh) | 2013-03-15 | 2019-04-23 | 米拉根医疗股份有限公司 | 桥接双环核苷 |
| CA2902623A1 (en) * | 2013-03-15 | 2014-09-25 | MiRagen Therapeutics, Inc. | Locked nucleic acid inhibitor of mir-145 and uses thereof |
| AU2016209386A1 (en) | 2015-01-20 | 2017-08-03 | MiRagen Therapeutics, Inc. | miR-92 inhibitors and uses thereof |
| CA2997786A1 (en) * | 2015-09-22 | 2017-03-30 | MiRagen Therapeutics, Inc. | Mir-19 modulators and uses thereof |
| EP3181698A1 (en) | 2015-12-16 | 2017-06-21 | European Molecular Biology Laboratory (EMBL) | Microrna mir-142 as stem cell marker |
| US20190127736A1 (en) * | 2016-04-29 | 2019-05-02 | Aptamir Therapeutics, Inc. | Inhibition of mir-22 mirna by apt-110 |
| EP3481404A4 (en) * | 2016-07-07 | 2020-03-25 | Miragen Therapeutics, Inc. | METHOD FOR TREATING CUTANEOUS T CELL LYMPHOMA (CTCL) WITH MIR-155 INHIBITORS |
| AU2017368050A1 (en) | 2016-11-29 | 2019-06-20 | Puretech Lyt, Inc. | Exosomes for delivery of therapeutic agents |
| CN108220423A (zh) * | 2018-01-16 | 2018-06-29 | 新开源跃博(武汉)医疗科技有限公司 | 基于血浆miRNA的急性心梗快速诊断试剂及其在诊断试剂盒、评估方法中的应用 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2194129A2 (en) * | 2006-04-03 | 2010-06-09 | Santaris Pharma A/S | Pharmaceutical composition comprising anti-miRNA antisense oligonucleotides |
| WO2010091204A1 (en) * | 2009-02-04 | 2010-08-12 | Board Of Regents, The University Of Texas System | Dual targeting of mir-208 and mir-499 in the treatment of cardiac disorders |
Family Cites Families (96)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US627170A (en) | 1899-06-20 | Tripod | ||
| US1159588A (en) | 1913-08-19 | 1915-11-09 | Jeddie Jubert | Fruit-picker. |
| US5981505A (en) | 1993-01-26 | 1999-11-09 | The Trustees Of The University Of Pennsylvania | Compositions and methods for delivery of genetic material |
| AU7404994A (en) | 1993-07-30 | 1995-02-28 | Regents Of The University Of California, The | Endocardial infusion catheter |
| US5837533A (en) | 1994-09-28 | 1998-11-17 | American Home Products Corporation | Complexes comprising a nucleic acid bound to a cationic polyamine having an endosome disruption agent |
| US5840710A (en) | 1994-12-09 | 1998-11-24 | Genzyme Corporation | Cationic amphiphiles containing ester or ether-linked lipophilic groups for intracellular delivery of therapeutic molecules |
| JP3756313B2 (ja) | 1997-03-07 | 2006-03-15 | 武 今西 | 新規ビシクロヌクレオシド及びオリゴヌクレオチド類縁体 |
| US6770748B2 (en) | 1997-03-07 | 2004-08-03 | Takeshi Imanishi | Bicyclonucleoside and oligonucleotide analogue |
| US6416510B1 (en) | 1997-03-13 | 2002-07-09 | Biocardia, Inc. | Drug delivery catheters that attach to tissue and methods for their use |
| US6217900B1 (en) | 1997-04-30 | 2001-04-17 | American Home Products Corporation | Vesicular complexes and methods of making and using the same |
| WO1999001579A1 (en) | 1997-07-01 | 1999-01-14 | Isis Pharmaceuticals, Inc. | Compositions and methods for the delivery of oligonucleotides via the alimentary canal |
| US6794499B2 (en) | 1997-09-12 | 2004-09-21 | Exiqon A/S | Oligonucleotide analogues |
| US6749617B1 (en) | 1997-11-04 | 2004-06-15 | Scimed Life Systems, Inc. | Catheter and implants for the delivery of therapeutic agents to tissues |
| NZ507913A (en) | 1998-05-26 | 2003-02-28 | Icn Pharmaceuticals | Novel nucleosides having bicyclic sugar moiety |
| US6833361B2 (en) | 1998-05-26 | 2004-12-21 | Ribapharm, Inc. | Nucleosides having bicyclic sugar moiety |
| ATE501269T1 (de) | 1999-03-18 | 2011-03-15 | Exiqon As | Detektion von genmutationen mittels lna primer |
| WO2002028875A2 (en) | 2000-10-04 | 2002-04-11 | Cureon A/S | Improved synthesis of purine locked nucleic acid analogues |
| WO2003029459A2 (en) | 2001-09-28 | 2003-04-10 | MAX-PLANCK-Gesellschaft zur Förderung der Wissenschaften e.V. | Micro-rna molecules |
| AU2003266014B2 (en) | 2002-05-06 | 2009-05-14 | Alnylam Pharmaceuticals, Inc. | Methods for delivery of nucleic acids |
| US20080214437A1 (en) | 2002-09-06 | 2008-09-04 | Mohapatra Shyam S | Methods and compositions for reducing activity of the atrial natriuretic peptide receptor and for treatment of diseases |
| DK2752488T3 (da) | 2002-11-18 | 2020-04-20 | Roche Innovation Ct Copenhagen As | Antisense-design |
| CA2533701A1 (en) | 2003-07-31 | 2005-02-17 | Isis Pharmaceuticals, Inc. | Oligomeric compounds and compositions for use in modulation of small non-coding rnas |
| WO2005017145A1 (ja) | 2003-08-13 | 2005-02-24 | Japan Biological Informatics Consortium | 機能性rnaが制御する被制御遺伝子の同定・予測方法及びその利用方法 |
| US20050256072A1 (en) | 2004-02-09 | 2005-11-17 | University Of Massachusetts | Dual functional oligonucleotides for use in repressing mutant gene expression |
| WO2005078139A2 (en) | 2004-02-09 | 2005-08-25 | Thomas Jefferson University | DIAGNOSIS AND TREATMENT OF CANCERS WITH MicroRNA LOCATED IN OR NEAR CANCER-ASSOCIATED CHROMOSOMAL FEATURES |
| US7772389B2 (en) | 2004-02-13 | 2010-08-10 | Rockefeller University | Anti-microRNA oligonucleotide molecules |
| US20070203445A1 (en) | 2004-02-26 | 2007-08-30 | V-Kardia Pty Ltd | Isolating cardiac circulation |
| US7722596B2 (en) | 2004-02-26 | 2010-05-25 | Osprey Medical, Inc. | Regional cardiac tissue treatment |
| EP1735037B1 (en) | 2004-02-26 | 2015-05-20 | Osprey Medical Inc. | Isolating cardiac circulation |
| EP2471922A1 (en) | 2004-05-28 | 2012-07-04 | Asuragen, Inc. | Methods and compositions involving microRNA |
| EP2322616A1 (en) | 2004-11-12 | 2011-05-18 | Asuragen, Inc. | Methods and compositions involving miRNA and miRNA inhibitor molecules |
| WO2006063356A1 (en) | 2004-12-10 | 2006-06-15 | Isis Phamaceuticals, Inc. | Regulation of epigenetic control of gene expression |
| US20060185027A1 (en) | 2004-12-23 | 2006-08-17 | David Bartel | Systems and methods for identifying miRNA targets and for altering miRNA and target expression |
| US20070099196A1 (en) | 2004-12-29 | 2007-05-03 | Sakari Kauppinen | Novel oligonucleotide compositions and probe sequences useful for detection and analysis of micrornas and their target mRNAs |
| US8071306B2 (en) | 2005-01-25 | 2011-12-06 | Merck Sharp & Dohme Corp. | Methods for quantitating small RNA molecules |
| US7404969B2 (en) | 2005-02-14 | 2008-07-29 | Sirna Therapeutics, Inc. | Lipid nanoparticle based compositions and methods for the delivery of biologically active molecules |
| WO2006089340A2 (en) | 2005-02-23 | 2006-08-31 | V-Kardia Pty Ltd | Polynucleotide delivery to cardiac tissue |
| WO2006111512A1 (en) | 2005-04-19 | 2006-10-26 | Basf Plant Science Gmbh | Improved methods controlling gene expression |
| CA2609142C (en) | 2005-05-27 | 2016-02-09 | Fondazione Centro San Raffaele Del Monte Tabor | Therapeutic gene vectors comprising mirna target sequences |
| NZ569738A (en) | 2005-12-12 | 2012-03-30 | Univ North Carolina | MicroRNAs (miRNA) that regulate muscle cell proliferation and differentiation |
| US8129515B2 (en) | 2006-01-27 | 2012-03-06 | Isis Pharmaceuticals, Inc. | Oligomeric compounds and compositions for the use in modulation of microRNAs |
| PL2056882T3 (pl) * | 2006-08-01 | 2013-03-29 | Univ Texas | Identyfikacja mikro-RNA, który aktywuje ekspresję łańcucha ciężkiego beta-miozyny |
| WO2008042231A2 (en) | 2006-09-29 | 2008-04-10 | Children's Medical Center Corporation | Compositions and methods for evaluating and treating heart failure |
| WO2008043521A2 (de) | 2006-10-09 | 2008-04-17 | Julius-Maximilians-Universität Würzburg | Microrna (mirna) zur diagnose und therapie von herzerkrankungen |
| WO2008147430A2 (en) | 2006-10-11 | 2008-12-04 | Nucleonics, Inc. | Microrna-formatted multitarget interfering rna vector constructs and methods of using the same |
| JP2010509923A (ja) | 2006-11-23 | 2010-04-02 | ミルクス セラピューティクス アンパーツゼルスカブ | 標的rnaの活性を変化させるためのオリゴヌクレオチド |
| WO2008076324A2 (en) | 2006-12-14 | 2008-06-26 | Novartis Ag | Compositions and methods to treat muscular & cardiovascular disorders |
| EP3536788A1 (en) | 2006-12-21 | 2019-09-11 | QIAGEN GmbH | Microrna target site blocking oligos and uses thereof |
| WO2008074328A2 (en) | 2006-12-21 | 2008-06-26 | Exiqon A/S | Microrna target site blocking oligos and uses thereof |
| DK2149605T3 (da) | 2007-03-22 | 2013-09-30 | Santaris Pharma As | Korte RNA antagonist forbindelser til modulering af det ønskede mRNA |
| WO2008131191A2 (en) * | 2007-04-20 | 2008-10-30 | Amgen Inc. | Nucleic acids hybridizable to micro rna and precursors thereof |
| CA2687336C (en) | 2007-05-23 | 2014-12-23 | Dharmacon, Inc. | Micro-rna scaffolds and non-naturally occurring micro-rnas |
| MX2010001216A (es) | 2007-07-31 | 2010-04-30 | Univ Texas | Microarn que controla la expresion de miosina y la identidad de miofibras. |
| WO2009026576A1 (en) | 2007-08-23 | 2009-02-26 | Keren Pharmaceuticals | Targeting rna with external guide sequences |
| EP2190992B1 (en) | 2007-09-14 | 2013-04-03 | The Ohio State University Research Foundation | Mirna expression in human peripheral blood microvesicles and uses thereof |
| AU2008306327B2 (en) | 2007-10-04 | 2014-05-15 | Roche Innovation Center Copenhagen A/S | Micromirs |
| WO2009058818A2 (en) | 2007-10-29 | 2009-05-07 | The Board Of Regents Of The University Of Texas System | Compositions comprising a micro-rna and methods of their use in regulating cardiac remodeling |
| CN101424640B (zh) | 2007-11-02 | 2012-07-25 | 江苏命码生物科技有限公司 | 血清中微小核糖核酸的检测方法和用于检测的试剂盒、生物芯片及其制作和应用方法 |
| MX2010005166A (es) | 2007-11-09 | 2010-10-07 | Univ Texas | Micro arn de la familia mir-15 que modulan la sobrevivencia de cardiomiocitos y reparacion cardiaca. |
| EP2225002A4 (en) | 2007-12-31 | 2011-06-22 | Nanocor Therapeutics Inc | RNA INTERFERENCE FOR THE TREATMENT OF CARDIAC SUFFICIENCIES |
| EP2096171A1 (en) * | 2008-02-27 | 2009-09-02 | Julius-Maximilians-Universität Würzburg | MicroRNA (miRNA) and down-stream targets for diagnostic and therapeutic purposes |
| WO2009114681A2 (en) | 2008-03-13 | 2009-09-17 | Dharmacon, Inc. | Identification of mirna profiles that are diagnostic of hypertrophic cardiomyopathy |
| US20090326049A1 (en) | 2008-04-04 | 2009-12-31 | Alexander Aristarkhov | Blocking oligos for inhibition of microrna and sirna activity and uses thereof |
| WO2009149182A1 (en) | 2008-06-04 | 2009-12-10 | The Board Of Regents Of The University Of Texas System | Modulation of gene expression through endogenous small rna targeting of gene promoters |
| US20110152352A1 (en) | 2008-06-10 | 2011-06-23 | Tufts University | Smad proteins control drosha-mediated mirna maturation |
| CN101386848A (zh) * | 2008-08-12 | 2009-03-18 | 南京大学 | 细胞微粒子所载微小核糖核酸及其制备研究方法和应用 |
| US8691971B2 (en) | 2008-09-23 | 2014-04-08 | Scott G. Petersen | Self delivering bio-labile phosphate protected pro-oligos for oligonucleotide based therapeutics and mediating RNA interference |
| EP2447274B1 (en) | 2008-10-24 | 2017-10-04 | Ionis Pharmaceuticals, Inc. | Oligomeric compounds and methods |
| US20100249214A1 (en) | 2009-02-11 | 2010-09-30 | Dicerna Pharmaceuticals | Multiplex dicer substrate rna interference molecules having joining sequences |
| JP5883381B2 (ja) | 2009-05-05 | 2016-03-15 | ミラゲン セラピューティクス,インコーポレイテッド | 親油性ポリヌクレオチド接合体 |
| CA2765129A1 (en) * | 2009-06-08 | 2010-12-16 | Miragen Therapeutics | Chemical modification motifs for mirna inhibitors and mimetics |
| CN102573856B (zh) | 2009-09-10 | 2016-10-26 | 弗莱明·韦林 | 用于制备微小rna 的方法及其治疗性应用 |
| WO2011048125A1 (en) | 2009-10-20 | 2011-04-28 | Santaris Pharma A/S | Oral delivery of therapeutically effective lna oligonucleotides |
| US8592151B2 (en) | 2009-11-17 | 2013-11-26 | Musc Foundation For Research Development | Assessing left ventricular remodeling via temporal detection and measurement of microRNA in body fluids |
| US20130109738A1 (en) | 2010-02-24 | 2013-05-02 | The Board Of Trustees Of The Leland Stanford Junior University | Control of Cardiac Growth, Differentiation and Hypertrophy |
| EP2550360B1 (en) | 2010-03-24 | 2017-08-30 | Mirrx Therapeutics A/s | Bivalent antisense oligonucleotides |
| EP2559442B1 (en) | 2010-04-13 | 2017-12-06 | Jiangsu Mingma Biotech Co., Ltd | Method for regulating microrna content in organisms and uses thereof |
| US9611511B2 (en) | 2010-04-20 | 2017-04-04 | Comprehensive Biomarker Center Gmbh | Complex miRNA sets as novel biomarkers for an acute coronary syndrome |
| WO2011139911A2 (en) | 2010-04-29 | 2011-11-10 | Isis Pharmaceuticals, Inc. | Lipid formulated single stranded rna |
| WO2011154553A2 (en) | 2010-06-11 | 2011-12-15 | Cellartis Ab | Novel micrornas for the detection and isolaton of human embryonic stem cell-derived cardiac cell types |
| ITMI20101089A1 (it) | 2010-06-16 | 2011-12-17 | Istituto Naz Di Genetica Molecolare Ingm | Profili di espressione di micro-rna nel sangue periferico per il monitoraggio del sistema immunitario |
| CA2804791C (en) | 2010-07-08 | 2019-07-30 | Duke University | Direct reprogramming of cells to cardiac myocyte fate |
| WO2012018866A2 (en) | 2010-08-03 | 2012-02-09 | University Of South Alabama | Methods and compositions for the diagnosis and treatment of breast cancer |
| AU2011288262A1 (en) | 2010-08-13 | 2013-04-04 | The University Court Of The University Of Glasgow | Therapeutic uses of microvesicles and related microRNAs |
| KR20130137160A (ko) | 2010-08-24 | 2013-12-16 | 머크 샤프 앤드 돔 코포레이션 | 내부의 비-핵산 스페이서를 함유하는 단일-가닥 RNAi 작용제 |
| AU2011343720A1 (en) * | 2010-12-15 | 2013-04-11 | Miragen Therapeutics | MicroRNA inhibitors comprising locked nucleotides |
| WO2012149646A1 (en) | 2011-05-05 | 2012-11-08 | Sunnybrook Research Institute | Mirna inhibitors and their uses |
| EP2763703B1 (en) | 2011-10-06 | 2018-02-14 | Miragen Therapeutics, Inc. | Control of whole body energy homeostasis by microrna regulation |
| GB201117482D0 (en) | 2011-10-11 | 2011-11-23 | Univ Dundee | Targetiing of miRNA precursors |
| EP2584040A1 (en) | 2011-10-17 | 2013-04-24 | Pharmahungary 2000 Kft. | Compounds for treatment of ischemic injury |
| KR102011048B1 (ko) | 2011-10-18 | 2019-08-14 | 다이서나 파마수이티컬, 인크. | 아민 양이온성 지질 및 그것의 용도 |
| DK2790736T3 (en) | 2011-12-12 | 2018-05-07 | Oncoimmunin Inc | In vivo delivery of oligonucleotides |
| EP2604690A1 (en) | 2011-12-15 | 2013-06-19 | Oncostamen S.r.l. | MicroRNAs and uses thereof |
| US20140356459A1 (en) | 2011-12-15 | 2014-12-04 | Oncostamen S.R.L. | Micrornas and uses thereof |
| FR2984358A1 (fr) | 2011-12-16 | 2013-06-21 | Genethon | Methodes pour le diagnostic de dystrophies musculaires |
| CA2876180C (en) * | 2012-06-21 | 2019-11-19 | MiRagen Therapeutics, Inc. | Oligonucleotide-based inhibitors comprising locked nucleic acid motif |
-
2011
- 2011-12-15 AU AU2011343720A patent/AU2011343720A1/en not_active Abandoned
- 2011-12-15 SG SG2013039003A patent/SG190355A1/en unknown
- 2011-12-15 MX MX2013005875A patent/MX2013005875A/es not_active Application Discontinuation
- 2011-12-15 AR ARP110104716A patent/AR084319A1/es unknown
- 2011-12-15 KR KR1020137015018A patent/KR20140004646A/ko not_active Application Discontinuation
- 2011-12-15 CN CN2011800674456A patent/CN103380215A/zh active Pending
- 2011-12-15 BR BR112013012319A patent/BR112013012319A2/pt not_active IP Right Cessation
- 2011-12-15 JP JP2013544772A patent/JP2014504857A/ja active Pending
- 2011-12-15 US US13/327,507 patent/US8642751B2/en not_active Expired - Fee Related
- 2011-12-15 WO PCT/US2011/065121 patent/WO2012083005A2/en active Application Filing
- 2011-12-15 EA EA201370139A patent/EA201370139A1/ru unknown
- 2011-12-15 CA CA2817371A patent/CA2817371A1/en not_active Abandoned
- 2011-12-15 EP EP11820901.4A patent/EP2652151A2/en not_active Withdrawn
-
2013
- 2013-05-10 ZA ZA2013/03422A patent/ZA201303422B/en unknown
- 2013-12-16 US US14/107,784 patent/US20140187603A1/en not_active Abandoned
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2194129A2 (en) * | 2006-04-03 | 2010-06-09 | Santaris Pharma A/S | Pharmaceutical composition comprising anti-miRNA antisense oligonucleotides |
| WO2010091204A1 (en) * | 2009-02-04 | 2010-08-12 | Board Of Regents, The University Of Texas System | Dual targeting of mir-208 and mir-499 in the treatment of cardiac disorders |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015521626A (ja) * | 2012-06-21 | 2015-07-30 | ミラゲン セラピューティクス, インコーポレイテッド | ロックド核酸モチーフを含むオリゴヌクレオチドベースの阻害剤 |
| US9803202B2 (en) | 2012-06-21 | 2017-10-31 | MiRagen Therapeutics, Inc. | Oligonucleotide-based inhibitors comprising locked nucleic acid motif |
| US10337005B2 (en) | 2012-06-21 | 2019-07-02 | MiRagen Therapeutics, Inc. | Oligonucleotide-based inhibitors comprising locked nucleic acid motif |
| JP2017528441A (ja) * | 2014-08-04 | 2017-09-28 | ミラゲン セラピューティクス, インコーポレイテッド | Myh7bの阻害剤およびその使用 |
Also Published As
| Publication number | Publication date |
|---|---|
| EA201370139A1 (ru) | 2013-10-30 |
| KR20140004646A (ko) | 2014-01-13 |
| CA2817371A1 (en) | 2012-06-21 |
| ZA201303422B (en) | 2014-07-30 |
| SG190355A1 (en) | 2013-07-31 |
| EP2652151A2 (en) | 2013-10-23 |
| US20120184596A1 (en) | 2012-07-19 |
| CN103380215A (zh) | 2013-10-30 |
| BR112013012319A2 (pt) | 2019-09-24 |
| US8642751B2 (en) | 2014-02-04 |
| AR084319A1 (es) | 2013-05-08 |
| WO2012083005A2 (en) | 2012-06-21 |
| MX2013005875A (es) | 2014-04-30 |
| WO2012083005A3 (en) | 2012-08-16 |
| US20140187603A1 (en) | 2014-07-03 |
| AU2011343720A1 (en) | 2013-04-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8642751B2 (en) | MicroRNA inhibitors comprising locked nucleotides | |
| JP6208228B2 (ja) | ロックド核酸モチーフを含むオリゴヌクレオチドベースの阻害剤 | |
| US8871731B2 (en) | Micro-RNA for the regulation of cardiac apoptosis and contractile function | |
| US9163235B2 (en) | Inhibitors of the miR-15 family of micro-RNAs | |
| US8629119B2 (en) | Dual targeting of MIR-208 and MIR-499 in the treatment of cardiac disorders | |
| US10280422B2 (en) | MiR-92 inhibitors and uses thereof | |
| WO2010120969A1 (en) | Targeting of the mir-30 family and let-7 family as a treatment for heart disease | |
| WO2017053622A1 (en) | MiR-19 MODULATORS AND USES THEREOF | |
| WO2010129950A1 (en) | Micro-rna that regulates cardiac remodeling | |
| EP4269586A1 (en) | Targeting micro rna for treatment of heart failure with preserved ejection fraction (hfpef) |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20141203 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20141203 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20151125 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20160614 |