発明の詳細な説明
本明細書で言及する全ての特許および非特許文献は、その内容全体を参照によって本明細書に援用する。
本開示では、いくつかの用語および略語が使用される。標準三文字コードまたは一文字コードを使用して、アミノ酸に言及する。以下の定義が提供される。
「読み取り枠」は、「ORF」と略記される。
「ポリメラーゼ連鎖反応」は、「PCR」と略記される。
「American Type Culture Collection」は、「ATCC」と略記される。
「多価不飽和脂肪酸」は、「PUFA」と略記される。
「トリアシルグリセロール」は、「TAG」と略記される。
「総脂肪酸」は、「TFA」と略記される。
「脂肪酸メチルエステル」は、「FAME」と略記される。
「乾燥細胞重量」は、「DCW」と略記される。
配列番号7に記載のアミノ酸配列を有するモチーフ(すなわちHis−Pro−Gly−Gly)は、「HPGG」と略記される。
配列番号8に記載のアミノ酸配列を有するモチーフ(すなわちHis−Asp−Ala−Ser−His)は、「HDASH」と略記される。
本明細書の用法では、「発明」または「本発明」という用語は、特許請求の範囲および明細書に記載される、本発明の全ての態様および実施形態を指すことが意図され、いかなる特定の実施形態または態様にも限定されないものと解釈される。
「脂肪酸」という用語は、約C12〜C22の様々な鎖長の長鎖脂肪酸(アルカン酸)を指すが、鎖長のより長い酸およびより短い酸の双方も知られている。優勢な鎖長は、C16〜C22の間である。脂肪酸の構造は「X:Y」の簡易表記体系によって表され、式中、Xは特定の脂肪酸中の炭素[「C」]原子の総数であり、Yは二重結合数である。「飽和脂肪酸」対「不飽和脂肪酸」、「一不飽和脂肪酸」対「多価不飽和脂肪酸」[「PUFA」]、および「ω6脂肪酸」[「ω−6」または「n−6」]対「ω3脂肪酸」[「ω−3」]または[「n−3」]の間の区別の追加的詳細は、参照によって本明細書に援用する米国特許第7,238,482号明細書中に提供される。
本明細書でPUFAを記述するのに使用される命名法を下の表2に示す。「略記法」と題された欄ではω−基準系を使用して、炭素数、二重結合数、そしてこの目的で1番目であるω炭素から数えたω炭素に最も近い二重結合の位置を示す。表の残りは、ω−3およびω−6脂肪酸とそれらの前駆体の一般名、明細書全体を通じて使用される略称、および各化合物の化学名を要約する。
表2に列挙するω−3/ω−6 PUFAは、本明細書に記載される方法を使用して微生物および植物宿主の油画分中に蓄積する可能性が最も高いが、この一覧は限定的または完全なものとみなすべきではない。
「油」という用語は25℃で液体の脂質物質を指し;油は疎水性であるが、有機溶媒に可溶性である。油性生物では、油が総脂質の大部分を構成する。「油」は主にトリアシルグリセロールからなるが、その他の中性脂質、リン脂質、および遊離脂肪酸もまた含有してよい。油中の脂肪酸組成と総脂質の脂肪酸組成は、一般に類似しており;したがって総脂質中のPUFA濃度の増大または減少は、油中のPUFA濃度の増大または減少に対応し、逆もまた然りである。
「中性脂肪」とは、脂肪体の細胞中に貯蔵脂肪として一般に見られる脂質を指し、細胞のpHでは脂質は荷電基を有さないため、このように称される。一般にそれらは完全に非極性で、水に対する親和性がない。中性脂質とは、一般に脂肪酸によるグリセロールのモノ−、ジ−、および/またはトリエステルを指し、それぞれモノアシルグリセロール、ジアシルグリセロールまたはトリアシルグリセロールとも称され、または集合的にアシルグリセロールと称される。アシルグリセロールから遊離脂肪酸を放出する為には、加水分解反応が起きなくてはならない。
「トリアシルグリセロール」[「TAG」]という用語は、グリセロール分子にエステル化された3つの脂肪酸アシル残基から構成される中性脂質を指す。TAGは、長鎖PUFAおよび飽和脂肪酸、ならびに鎖長のより短い飽和および不飽和脂肪酸を含有し得る。
「総脂肪酸」[「TFA」]という用語は、本明細書では、例えば生物由来資源または油であってもよい特定サンプル中で、(当該技術分野で知られているような)塩基エステル交換法によって脂肪酸メチルエステル[「FAME」]に誘導体化し得る、細胞性脂肪酸の総和を指す。したがって総脂肪酸は、中性脂質画分(ジアシルグリセロール、モノアシルグリセロール、およびTAGをはじめとする)からの脂肪酸、および極性脂質画分(ホスファチジルコリンおよびホスファチジルエタノールアミン画分をはじめとする)からの脂肪酸を含むが、遊離脂肪酸は含まない。
細胞の「総脂質含量」という用語は、乾燥細胞重量[「DCW」]の%としてのTFA測定値であるが、総脂質含量は、DCWの%としてのFAME測定値[「FAME%DCW」]として近似し得る。したがって総脂質含量[「TFA%DCW」]は、例えば100ミリグラムのDCWあたりの総脂肪酸のミリグラムと同等である。
総脂質中の脂肪酸濃度は、本明細書では、例えば100ミリグラムのTFAあたりの特定の脂肪酸のミリグラムのように、TFAの重量%[「%TFA」]として表される。本開示中では、特に断りのない限り、総脂質に対する特定脂肪酸のパーセントへの言及は、%TFAとしての脂肪酸濃度に等しい(例えば総脂質の%EPAは、EPA%TFAに等しい)。
「脂質プロフィール」および「脂質組成」という用語は同義であり、総脂質中または油中などの特定の脂質画分に含有される個々の脂肪酸の量を指し、この量はTFAの重量%として表される。混合物中に存在する個々の脂肪酸の総和は、100になるべきである。
「PUFA生合成経路」という用語は、オレイン酸をLA、EDA、GLA、DGLA、ARA、DTA、およびDPAn−6などのω−6脂肪酸に、およびALA、STA、ETrA、ETA、EPA、DPA、およびDHAなどのω−3脂肪酸に変換する代謝過程を指す。この過程は、文献で十分に記載されている。例えば米国特許第7,932,077号明細書を参照されたい。簡単に述べるとこの過程は、小胞体膜内に存在する「PUFA生合成経路酵素」と称される一連の特有な延長酵素および不飽和化酵素による、炭素原子の付加を通じた炭素鎖の延長と、二重結合の付加を通じた分子の不飽和化とを伴う。より具体的には「PUFA生合成経路酵素」とは、PUFAの生合成と関連付けられている以下の酵素のいずれか(および前記酵素をコードする遺伝子)を指す。Δ4デサチュラーゼ、Δ5デサチュラーゼ、Δ6デサチュラーゼ、Δ12デサチュラーゼ、Δ15デサチュラーゼ、Δ17デサチュラーゼ、Δ9デサチュラーゼ、Δ8デサチュラーゼ、Δ9エロンガーゼ、C14/16エロンガーゼ、C16/18エロンガーゼ、C18/20エロンガーゼおよび/またはC20/22エロンガーゼ。
「デサチュラーゼ」という用語は、不飽和化させる、すなわち1つまたは複数の脂肪酸に二重結合を導入して、対象の脂肪酸または前駆体を生成し得るポリペプチドを指す。特定脂肪酸に言及するための明細書全体を通じたω−基準系の使用にもかかわらず、Δシステムを使用して、基質のカルボキシル末端から数えることで、デサチュラーゼ活性を示すことがより都合が良い。本明細書で特に興味深いのは、分子のカルボキシル末端から数えて5番目と6番目の炭素原子間で脂肪酸を不飽和化するΔ5デサチュラーゼであり、それは例えばDGLAからARAへおよび/またはETAからEPAへの変換を触媒し得る。その他の脂肪酸デサチュラーゼとしては、例えばΔ8デサチュラーゼ、Δ6デサチュラーゼ、Δ4デサチュラーゼ、Δ12デサチュラーゼ、Δ15デサチュラーゼ、Δ17デサチュラーゼ、およびΔ9デサチュラーゼが挙げられる。当該技術分野では、Δ15およびΔ17デサチュラーゼは時に、ω−6脂肪酸をそれらのω−3対応物に変換する(例えばそれぞれLAからALA、およびARAからEPAへの変換)それらの能力に基づいて、「ω−3デサチュラーゼ」、「w−3デサチュラーゼ」および/または「オメガ−3デサチュラーゼ」とも称される。適切な宿主を脂肪酸デサチュラーゼ遺伝子で形質転換して、宿主の脂肪酸プロフィールに対するその効果を判定することにより、特定の脂肪酸デサチュラーゼの特異性を経験的に判断することが望ましいかもしれない。
「EgD5」という用語は、本明細書で配列番号20によってコードされる、ミドリムシ(Euglena gracilis)からのΔ5デサチュラーゼ(配列番号21)を指す。同様に「EgD5S」という用語は、ヤロウィア・リポリティカ(Yarrowia lipolytica)中での発現のためにコドン最適化された、ミドリムシ(E.gracilis)に由来する合成Δ5デサチュラーゼを指す(すなわち配列番号22および23)。EgD5およびEgD5Sに関するさらなる詳細は、米国特許第7,678,560号明細書に記載される。「EgD5R」という用語(すなわち配列番号24および25)は変種野生型EgD5を指し、位置347のアミノ酸残基はアルギニンである。「EgD5R*」という用語(すなわち配列番号26および27)は修飾変種野生型EgD5Rを指し、4つの制限酵素部位が野生型コード領域から除去されている。EgD5RおよびEgD5R*のアミノ酸配列は、同一である。
「EaD5」という用語は、本明細書で配列番号28によってコードされる、ユーグレナ・アナベナ(Euglena Anabaena)から単離されたΔ5デサチュラーゼ酵素(配列番号29)を指す。同様に「EaD5S」という用語は、ヤロウィア・リポリティカ(Yarrowia lipolytica)中での発現のためにコドン最適化された、E.アナベナ(E.anabaena)に由来する合成Δ5デサチュラーゼを指す(すなわち配列番号30および31)。EgD5およびEgD5Sに関するさらなる詳細は、米国特許第7,943,365号明細書に記載される。
「保存ドメイン」または「モチーフ」という用語は、進化的に関連したタンパク質の整合配列に沿った特定位置で保存される、一連のアミノ酸を意味する。その他の位置のアミノ酸が相同タンパク質間で変化し得るのに対し、特定位置で高度に保存されたアミノ酸は、これらのアミノ酸が、タンパク質の構造、安定性、または活性にとって重要なこともあることを示唆する。それらはタンパク質相同体ファミリーの整合配列中のそれらの高度な保存によって同定されるので、それらは新しく判定された配列があるタンパク質が、以前同定されたタンパク質ファミリーに属するかどうかを判定する識別子または「シグネチャー」として使用し得る。動物、植物、および真菌のΔ5デサチュラーゼ酵素中に普遍的に見られるモチーフとしては、3つのヒスチジンボックス(すなわちH(X)3〜4H[配列番号1および2]、H(X)2〜3HH[配列番号3および4]およびH/Q(X)2〜3HH[配列番号5および6])、およびN−末端の融合チトクロームb5ドメイン内のヘム結合モチーフ(すなわちHis−Pro−Gly−GlyまたはHPGG[配列番号7])が挙げられる。追加的なモチーフ(すなわちHis−Asp−Ala−Ser−HisまたはHDASH[配列番号8])は、いくつかのΔ5デサチュラーゼ遺伝子中で保存されているように見える。
「変異Δ5デサチュラーゼ」および「二重変異体」という用語は、チトクロームb5ドメインのHPGGモチーフ(配列番号7)内の少なくとも1つの変異と、HDASHモチーフ(配列番号8)内の少なくとも1つの変異とを有して、前記変異が保存的または非保存的のいずれかのアミノ酸置換をもたらす、本明細書に記載されるΔ5デサチュラーゼを指す。変異はあらゆるアミノ酸置換を含んでもよいが、変異Δ5デサチュラーゼは、好ましくは、His−Xaa−Gly−Xaaまたは「HxGx」(配列番号34)(Xaaはあらゆるアミノ酸であり得る)の配列を有する変異HPGG(配列番号7)モチーフと、His−Xaa−Xaa−Xaa−Hisまたは「HxxxH」(配列番号1)の配列を有する変異HDASH(配列番号8)モチーフとを含んでなる。より好ましくは、変異Δ5デサチュラーゼは、HxGG(配列番号32)およびHPGx(配列番号33)からなる群から選択される変異HPGGモチーフと、HxASH(配列番号35)、HDxSH(配列番号36)、およびHDAxH(配列番号37)からなる群から選択される変異HDASHモチーフとを含んでなり、変異Δ5デサチュラーゼのΔ5デサチュラーゼ活性は、野生型Δ5デサチュラーゼのΔ5デサチュラーゼ活性と、少なくとも機能的にほぼ同等である。より望ましくは、変異HPGGモチーフは、配列番号9(HgGG)、配列番号10(HhGG)、配列番号11(HPGs)、配列番号12(HcGG)、配列番号13(HwGG)、および配列番号14(HaGG)からなる群から選択され、変異HDASHモチーフは、配列番号15(HDgSH)、配列番号16(HDsSH)、配列番号17(HDAaH)、配列番号18(HDAgH)、および配列番号19(HeASH)からなる群から選択される。
各「変異Δ5デサチュラーゼ」は、「対応する野生型Δ5デサチュラーゼ」を有する。具体的には、野生型がチトクロームb5ドメイン内のHPGGモチーフ(配列番号7)およびHDASHモチーフ(配列番号8)を含んでなるのに対し、変異体は(上述したように)これらの各モチーフ内の少なくとも1つの変異を含んでなることを除いては、変異Δ5デサチュラーゼおよび対応する野生型Δ5デサチュラーゼは、同一アミノ酸配列を共有する。
変異Δ5配列の酵素活性および特異的選択性が、対応する野生型Δ5デサチュラーゼと本質的に匹敵する場合、変異Δ5デサチュラーゼは、対応する野生型Δ5デサチュラーゼと「少なくとも機能的にほぼ同等」である。したがって各酵素の「変換効率」を比較した場合、機能的に同等の変異Δ5デサチュラーゼは、対応する野生型Δ5デサチュラーゼと比較してΔ5デサチュラーゼ活性が実質的に低下していない(すなわち変異Δ5デサチュラーゼは、野生型Δ5デサチュラーゼの少なくとも約50〜64%、より好ましくは少なくとも60〜74%、より好ましくは少なくとも約75〜85%、より好ましくは少なくとも約85〜95%、最も好ましくは少なくとも約95%の酵素活性を有する)。好ましい範囲は上述のようであるが、変換効率の有用な例としては、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%または99%などの50%〜100%のあらゆる整数百分率が挙げられる。2つのポリペプチドのΔ5デサチュラーゼ活性は、実質的に同一であってもよい。好ましくは、変異Δ5デサチュラーゼは、対応する野生型Δ5デサチュラーゼと比べて、増大した酵素活性と特異的選択性を有し、すなわち野生型Δ5デサチュラーゼの酵素活性の少なくとも約101%、102%、103%、104%または105%、より好ましくは少なくとも約106%、107%、108%、109%、110%、111%、112%、113%、114%または115%、最も好ましくは少なくとも約116%以上を有する。
「親ポリペプチド」または「親酵素」という用語は、本明細書で開示される変異ポリペプチドまたは酵素がそれに由来する、あらゆるポリペプチドを指す。本用語は、HPGG(配列番号7)およびHDASH(配列番号8)アミノ酸モチーフを有する、野性型、変種野性型、および修飾変種野性型ポリペプチド、ならびにそれらをベースとした合成およびコドン最適化ポリペプチドを網羅する。本用語はそれから様々な制限酵素部位が除去されている、前述のポリペプチドのバージョンをさらに網羅する。
変異Δ5デサチュラーゼは2つの異なる命名システムを使用して命名されるが、どちらも変異体中の変異HPGG(配列番号7)モチーフおよびHDASH(配列番号8)モチーフの特定配列を記述する。第1のシステムは1)野生型親酵素;2)ハイフン(−);3)変異HPGGモチーフ;4)アンダースコア(_);5)変異HDASHモチーフを特定する。変異アミノ酸残基は小文字で示される。したがって、例えばヤロウィア・リポリティカ(Yarrowia lipolytica)中における発現のためにコドン最適化された、ミドリムシ(Euglena gracilis)に由来する合成Δ5デサチュラーゼに由来する、HaGG(配列番号14)とHDgSH(配列番号15)モチーフを含んでなる変異Δ5デサチュラーゼ(すなわち「EgD5S」)は、「EgD5S−HPGs_HDgSH」と称される。代わりに、この同じ変異Δ5デサチュラーゼはまた、第2の命名システムを使用して「EgD5S−36s157g」と称されてもよい。より具体的には、EgD5SのHPGG(配列番号7)モチーフがアミノ酸残基33〜36の間に位置する一方で、EgD5SのHDASH(配列番号8)モチーフはアミノ酸残基155〜159の間に位置する。したがって「36s」はアミノ酸残基36が野生型からSerに変更されていることを示す一方で、「157g」は、アミノ酸残基157が野生型からGlyに変更されていることを示す。
「変換効率」および「%基質変換」と言う用語は、それによって特定の酵素(例えばデサチュラーゼ)が基質を生成物に変換し得る効率を指す。変換効率は、次式に従って判定される。([生成物]/[基質+生成物)*100。したがって「DGLAからARAへの変換効率」とは、それによって基質DGLAが生成物ARAに変換される変換効率を指す。
「エロンガーゼ」という用語は、脂肪酸炭素鎖を延長して、エロンガーゼが作用する脂肪酸基質よりも炭素2個分だけ長い酸を生成し得るポリペプチドを指す。この延長過程は、米国特許第7,659,120号明細書に記載されるように、脂肪酸シンターゼと共同して多段階機序で起きる。エロンガーゼ系によって触媒される反応の例は、GLAからDGLAへ、STAからETAへ、およびEPAからDPAへの変換である。
一般に、エロンガーゼの基質選択性はやや広範であるが、鎖長と、不飽和の程度およびタイプとの双方によって区別される。例えばC14/16エロンガーゼはC14基質(例えばミリスチン酸)を利用し、C16/18エロンガーゼはC16基質(例えばパルミチン酸)を利用しC18/20エロンガーゼはC18基質(例えばGLA、STA、LA、ALA)を利用し、C20/22エロンガーゼ[Δ5エロンガーゼとも称される]はC20基質(例えばARA、EPA)を利用する。本明細書の目的では、2つの異なるタイプのC18/20エロンガーゼを定義し得る。Δ6エロンガーゼは、それぞれGLAおよびSTAからDGLAおよびETAへの変換を触媒する一方、Δ9エロンガーゼは、それぞれLAおよびALAからEDAおよびETrAへの転換を触媒し得る。
いくつかのエロンガーゼは広範な特異性を有し、したがって単一酵素がいくつかのエロンガーゼ反応を触媒できてもよく、例えばそれによってC16/18エロンガーゼとC18/20エロンガーゼの双方として作用することに留意することが重要である。適切な宿主を脂肪酸エロンガーゼ遺伝子で形質転換して、宿主の脂肪酸プロフィールに対するその効果を判定することにより、脂肪酸エロンガーゼの特異性を経験的に判断することが望ましいかもしれない。
一般に「油性」という用語は、それらのエネルギー源を油の形態で貯蔵する傾向がある生物を指す(Weete,In:Fungal Lipid Biochemistry,2nd Ed.,Plenum,1980)。この過程において、油性微生物の細胞油含量は概してS字形曲線に従い、脂質濃度は対数後期または初期定常期にそれが最大に達するまで増大し、次に静止後期および死滅期において徐々に低下する(Yongmanitchai and Ward,Appl.Environ.Microbiol.,57:419−25(1991))。本出願の目的では、そして微生物に関して使用される場合、「油性」という用語は、それらのDCWの少なくとも約25%を油として蓄積し得る微生物を指す。
「油性酵母」という用語は、油を産生し得る、すなわち油がそれらのDCWの約25%を超えて蓄積し得る、酵母に分類される油性微生物を指す。油性酵母の例としては、ヤロウィア(Yarrowia)属、カンジダ(Candida)属、ロドトルラ(Rhodotorula)属、ロドスポリジウム(Rhodosporidium)属、クリプトコッカス(Cryptococcus)属、トリコスポロン(Trichosporon)属、およびリポマイセス(Lipomyces)属が挙げられるが、これに限定されるものではない。酵母がDCWの約25%を超えて油を蓄積する能力は、組換え遺伝子操作の試みを通じた、または生物の天然能力を通じたものであってもよい。
それから油が絞られる種子を生じる植物は、「油料種子」植物または作物と称され得る。油料種子植物の例としては、大豆、ヒマワリ種子、カノーラ、ナタネ、紅花、亜麻仁、芥子、落花生、綿実、トウゴマ種子、およびゴマが挙げられるが、これに限定されるものではない。
「保存的アミノ酸置換」という用語は、タンパク質の化学的または機能的性質を変化させることなく、特定のタンパク質中のアミノ酸残基を別のアミノ酸で置換することを指す。例えば特定の部位において、化学的に等価なアミノ酸の生成をもたらす(しかしコードされた折り畳みタンパク質の構造および機能特性に影響しない)遺伝子の変更が一般的であることは、当該技術分野で良く知られている。本明細書の目的で、「保存的アミノ酸置換」は、次の5群の1つの中における交換と定義される。
1.小型脂肪族非極性またはわずかに極性の残基:Ala[A]、Ser[S]、Thr[T](Pro[P]、Gly[G]);
2.負に帯電した極性残基およびそれらのアミド:Asp[D]、Asn[N]、Glu[E]、Gln[Q];
3.正に帯電した極性残基:His[H]、Arg[R]、Lys[K];
4.大型脂肪族非極性残基:Met[M]、Leu[L]、Ile[I]、Val[V](Cys[C])、および
5.大型芳香族残基:Phe[F]、Tyr[Y]、Trp[W]。
したがってわずかに疎水性のアミノ酸であるAlaは、別のより疎水性の低い残基(例えばGly)によって置換されてもよい。同様に1つの負に帯電した残基による別の残基(例えばAspによるGlu)の置換、または1つの正に帯電した残基による別の残基(例えばLysによるArg)の置換をもたらす変化は、機能的に同等の生成物を生じることが予期され得る。したがって保存的アミノ酸置換は、一般に、置換領域内のポリペプチド主鎖構造、標的部位の分子の電荷または疎水性、または大半の側鎖を保持する。さらに多くの場合、タンパク質分子のN末端とC末端部分の改変は、タンパク質活性を変更することが予期されない。
「非保存的アミノ酸置換」という用語は、タンパク質特性に最大変化を生じることが一般に予期されるアミノ酸置換を指す。したがって例えば非保存的アミノ酸置換は、次の1つである。1)親水性残基が疎水性残基を置換し、またはそれによって置換される(例えばSerまたはThrがLeu、Ile、Valを置換し、またはそれによって置換される)、2)CysまたはProがあらゆるその他の残基を置換し、またはそれによって置換される、3)電気陽性側鎖を有する残基が電気陰性残基を置換し、またはそれによって置換される(例えばLys、ArgまたはHisがAspまたはGluを置換し、またはそれによって置換される)、または4)かさ高い側鎖を有する残基が側鎖を有さないものを置換し、またはそれによって置換される(例えばPheがGlyを置換し、またはそれによって置換される)。時として5群中の2群間の非保存的アミノ酸置換は、コードされるタンパク質の活性に影響しない。
「ポリヌクレオチド」、「ポリヌクレオチド配列」、「核酸配列」、「核酸断片」、および「単離核酸断片」という用語は、本明細書において同義的に使用される。これらの用語は、ヌクレオチド配列などを包含する。ポリヌクレオチドは、合成、非天然または改変ヌクレオチド塩基を任意選択的に含有する、一本鎖または二本鎖のRNAまたはDNAのポリマーであってもよい。DNAポリマーの形態のポリヌクレオチドは、cDNA、ゲノムDNA、合成DNA、またはそれらの混合物の1つ以上のセグメントを含んでなってもよい。ヌクレオチド(通常それらの5’一リン酸の形態で見られる)は、次のような一文字名によって言及される。「A」はアデニル酸またはデオキシアデニル酸(それぞれRNAまたはDNA)、「C」はシチジル酸またはデオキシシチジル酸、「G」はグアニル酸またはデオキシグアニル酸、「U」はウリジル酸、「T」はデオキシチミジル酸、「R」はプリン(AまたはG)、「Y」はピリミジン(CまたはT)、「K」はGまたはT、「H」はAまたはCまたはT、「I」はイノシン、および「N」は任意のヌクレオチドである。
核酸断片の一本鎖形態が、適切な温度および溶液イオン強度条件下でその他の核酸断片とアニールし得れば、ポリヌクレオチドまたは核酸断片は、cDNA、ゲノムDNA、またはRNA分子などの別の核酸断片と「ハイブリダイズ可能」である。ハイブリダイゼーションおよび洗浄の条件は良く知られており、参照によって本明細書に援用するSambrook,J.,Fritsch,E.F.and Maniatis,T.,Molecular Cloning:A Laboratory Manual,2nd ed.,Cold Spring Harbor Laboratory:Cold Spring Harbor,NY(1989)(「Sambrook et al.」)の特に第11章および表11.1で例示される。温度およびイオン強度の条件は、ハイブリダイゼーションの「ストリンジェンシー」を決定する。ストリンジェンシー条件を調節して、(遠縁の生物からの相同的な配列などの)中程度に類似した断片から、(近縁関係にある生物からの機能酵素を複製する遺伝子などの)類似性の高い断片までをスクリーニングし得る。ハイブリダイゼーション後の洗浄が、ストリンジェンシー条件を決定する。好ましい条件の一組は、6×SSC、0.5%SDSで室温で15分間で開始して、次に2×SSC、0.5%SDSで45℃で30分間での反復、次に0.2×SSC、0.5%SDSで50℃で30分間を2回繰り返す、一連の洗浄を使用する。よりストリンジェントな条件の組はより高い温度を使用し、0.2×SSC、0.5%SDS中の最後の2回の30分間の洗浄温度を60℃に上げることを除いて、洗浄は上と同一である。別の好ましい高度にストリンジェントな条件の組は、0.1×SSC、0.1%SDS中65℃で2回の最終洗浄を使用する。追加的なストリンジェントな条件の組としては、例えば0.1×SSC、0.1%SDSで65℃、および2×SSC、0.1%SDSで洗浄後、0.1×SSC、0.1%SDSというハイブリダイゼーションが挙げられる。
ハイブリダイゼーションは、2つの核酸が相補的配列を含有することを要するが、ハイブリダイゼーションのストリンジェンシー次第で、塩基間のミスマッチが可能である。核酸をハイブリダイズするための適切なストリンジェンシーは、当該技術分野で周知の変数である、核酸の長さおよび相補性の程度に左右される。2つのヌクレオチド配列間の類似性または相同性の程度が大きいほど、これらの配列を有する核酸がハイブリダイズするためのTm値はより大きくなる。より高いTmに対応する核酸ハイブリダイゼーションの相対的安定性は、RNA:RNA、DNA:RNA、DNA:DNAの順で低下する。長さが100個を超えるヌクレオチドのハイブリッドについて、Tmを計算する方程式が誘導されている(前出のSambrook et al.,9.50−9.51参照)。より短い核酸、すなわちオリゴヌクレオチドのハイブリダイゼーションでは、ミスマッチの位置がより重要となり、オリゴヌクレオチドの長さがその特異性を決定する(前出のSambrook et al.,11.7−11.8参照)。一実施形態では、ハイブリダイズ可能な核酸の長さは、少なくとも約10個のヌクレオチドである。好ましくはハイブリダイズ可能な核酸の最小長さは、少なくとも約15個のヌクレオチド、より好ましくは少なくとも約20個のヌクレオチドであり、最も好ましくは長さは少なくとも約30個のヌクレオチドである。さらに当業者は、プローブ長などの要素次第で、必要に応じて温度および洗浄液塩濃度を調節してもよいことを認識する。
アミノ酸またはヌクレオチド配列の「かなりの部分」とは、当業者による配列の手動評価、またはBasic Local Alignment Search Tool[“BLAST”](Altschul,S.F.,et al.,J.Mol.Biol.,215:403−410(1993))などのアルゴリズムを使用したコンピュータ自動化配列比較および同定のいずれかによって、そのポリペプチドまたは遺伝子を推定的に同定するのに十分な、ポリペプチドのアミノ酸配列または遺伝子のヌクレオチド配列を含んでなる部分である。一般に、ポリペプチドまたは核酸配列が、既知のタンパク質または遺伝子と相同的であると推定的に同定するために、10個以上の隣接するアミノ酸または30個以上のヌクレオチドの配列が必要である。さらにヌクレオチド配列に関して、配列依存性の遺伝子同定法(例えばサザンハイブリダイゼーション)および単離法(例えば細菌コロニーまたはバクテリオファージプラークの原位置ハイブリダイゼーション)中で、20〜30個の隣接ヌクレオチドを含んでなる遺伝子特異的オリゴヌクレオチドプローブを使用してもよい。これに加えて、プライマーを含んでなる特定の核酸断片を得るために、12〜15個の塩基の短鎖オリゴヌクレオチドをPCRの増幅プライマーとして使用してもよい。したがってヌクレオチド配列の「かなりの部分」は、配列を構成する核酸断片を明確に同定および/または分離するのに十分な配列を含んでなる。本明細書の開示は、特定のデサチュラーゼタンパク質をコードする、完全長アミノ酸およびヌクレオチド配列を教示する。当業者は、本明細書で報告される配列の便益を有して、当業者に知られている目的のために、開示される配列の全てまたはかなりの部分を使用できる。したがって添付の配列一覧に報告される完全な配列、ならびに上で定義されるこれらの配列のかなりの部分は、本開示に包含される。
「相補的」という用語は、互いにハイブリダイズできるヌクレオチド塩基間の関係性を記述するために使用される。例えばDNAに関して、アデノシンはチミンに相補的であり、シトシンはグアニンに相補的である。したがって添付の配列一覧に報告される完全な配列に相補的な単離された核酸断片、ならびに実質的に同様の核酸配列は本開示に包含される。
「相同性」および「相同的」という用語は、同義的に使用される。それらは、類似しているが同一でない配列を有する、核酸断片またはポリペプチドを指す。これらの用語は、時に、最初の未修飾断片と比較して、得られた核酸断片の機能特性を実質的に変化させない、(例えば1つまたは複数のヌクレオチドの欠失または挿入を介した)核酸断片の修飾もまた指す。したがって当業者は、本発明が特定の例示的な配列以上のものを包含することを理解するであろう。
さらに当業者は、相同的な核酸配列が、例えば0.5×SSC、0.1%SDS、60℃の中程度にストリンジェントな条件下で、本明細書で例示される配列と、または本明細書で開示されるヌクレオチド配列と機能的に同等のそのあらゆる部分と、ハイブリダイズするそれらの能力によってもまた定義されることも認識する。ストリンジェンシー条件は、遠縁の生物からの相同的な配列などの中程度に類似した断片から、近縁関係にある生物からの機能酵素を複製する遺伝子などの類似性の高い断片までスクリーニングするために調節し得る。
「選択的にハイブリダイズする」という用語は、ストリンジェントなハイブリダイゼーション条件下における、核酸配列の特定の核酸標的配列へのハイブリダイゼーションを指し、それは非標的核酸配列へのハイブリダイゼーションよりも検出可能により高く(例えばバックグラウンドの少なくとも2倍)、非標的核酸は実質的に除外される。選択的にハイブリダイズする配列は、典型的に互いに少なくとも約80%の配列同一性、または90%の配列同一性、100%(すなわち完全に相補的)以下の配列同一性を有する。
核酸またはポリペプチド配列の文脈において「配列同一性」または「同一性」は、特定の比較ウィンドウ間で最大一致のために整列させると同じになる、2つの配列中の核酸塩基またはアミノ酸残基を指す。
「%同一性」および「%類似性」を判定する方法は、公的に入手可能なコンピュータプログラムで体系化されている。「%同一性」および「%類似性」は、1)Computational Molecular Biology(Lesk,A.M.,Ed.)Oxford University:NY(1988);2)Biocomputing:Informatics and Genome Projects(Smith,D.W.,Ed.)Academic:NY(1993);3)Computer Analysis of Sequence Data,Part I(Griffin,A.M.,and Griffin,H.G.,Eds.)Humania:NJ(1994);4)Sequence Analysis in Molecular Biology(von Heinje,G.,Ed.)Academic(1987);および5)Sequence Analysis Primer(Gribskov,M.and Devereux,J.,Eds.)Stockton:NY(1991)に記載されるものをはじめとするが、これに限定されるものではない公知の方法によって容易に計算され得る。
配列アラインメントおよび%同一性または類似性の計算は、LASERGENEバイオインフォマティクス演算スイートのMegAlign(商標)プログラム(DNASTAR Inc.,Madison,WI)をはじめとするが、これに限定されるものではない、相同的な配列を検出するようにデザインされた多様な比較法を使用して判定されてもよい。配列の多重アラインメントは、「アラインメントのClustal V法」および「アラインメントのClustal W法」をはじめとする、アルゴリズムのいくつかの変種を包含する「アラインメントのClustal法」を使用して実施される(Higgins and Sharp,CABIOS,5:151−153(1989);Higgins,D.G.et al.,Comput.Appl.Biosci.,8:189−191(1992)により記載され、MegAlign(商標)(バージョン8.0.2)プログラム(前出)にある)。いずれかのClustalプログラムを使用した配列のアラインメント後、プログラムの「配列距離」表を見ることで「%同一性」を得ることが可能である。
アラインメントのClustal V法を使用した多重アラインメントでは、デフォルト値は、GAP PENALTY=10、GAP LENGTH PENALTY=10に相当する。Clustal V法を使用したタンパク質配列のペアワイズ配列比較および%同一性計算のデフォルトパラメーターは、KTUPLE=1、GAP PENALTY=3、WINDOW=5、およびDIAGONALS SAVED=5である。核酸ではこれらのパラメーターは、KTUPLE=2、GAP PENALTY=5、WINDOW=4、およびDIAGONALS SAVED=4である。
アラインメントのClustal W法を使用した多重アラインメントのデフォルトパラメーターは、GAP PENALTY=10、GAP LENGTH PENALTY=0.2、Delay Divergent Seqs(%)=30、DNA Transition Weight=0.5、Protein Weight Matrix=Gonnet Series、DNA Weight Matrix=IUBに相当する。
「配列比較のBLASTN法」が、デフォルトパラメーターを使用してヌクレオチド配列を比較する、国立バイオテクノロジー情報センター(NCBI)が提供するアルゴリズムである一方、「BLASTPアラインメント法」は、デフォルトパラメーターを使用してタンパク質配列を比較する、NCBIによって提供されるアルゴリズムである。
その他の種から同一または同様の機能または活性を有するポリペプチドを同定する上で、多くのレベルの配列同一性が有用であることを当業者は良く理解している。適切な核酸断片、すなわち本明細書の開示に従った単離されたポリヌクレオチドが、本明細書で報告されるアミノ酸配列と少なくとも約70〜85%同一のポリペプチドをコードする一方、より好ましい核酸断片は少なくとも約85〜95%同一のアミノ酸配列をコードする。好ましい範囲は上述のようであるが、%同一性の有用な例としては、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%または99%などの50%〜100%のあらゆる整数百分率が挙げられる。またこの単離されたヌクレオチド断片のあらゆる全長または部分的補体も興味深い。
適切な核酸断片は上の相同性を有するだけでなく、典型的に少なくとも50個のアミノ酸、好ましくは少なくとも100個のアミノ酸、より好ましくは少なくとも150個のアミノ酸、なおもより好ましくは少なくとも200個のアミノ酸、最も好ましくは少なくとも250個のアミノ酸を有するポリペプチドをコードする。
「コドン縮重」とは、コードされるポリペプチドのアミノ酸配列に影響を及ぼさないヌクレオチド配列のバリエーションを可能にする遺伝子コードの性質を指す。したがって本明細書に記載されるのは、配列番号139、141、143、145、147、149、151、153、157、181、183、185、187、213、215、217、255、260、271、および276に記載の当該ポリペプチドをコードするアミノ酸配列の全部またはかなりの部分コードする、あらゆる核酸断片である。
当業者は、所定のアミノ酸を特定するヌクレオチドコドン使用における、特定の宿主細胞によって示される「コドンバイアス」について良く知っている。したがって宿主細胞中の改善された発現のために遺伝子を合成する場合、そのコドン使用頻度が、宿主細胞の好むコドン使用頻度に近くなるように遺伝子をデザインすることが望ましい。
「合成遺伝子」は、当業者に知られている手順を使用して、化学的に合成されたオリゴヌクレオチド構成単位から組み立て得る。これらのオリゴヌクレオチド構成単位はアニールされ、次にライゲートされて遺伝子セグメントを形成し、それは次に酵素的にアセンブリーされて遺伝子全体が構築される。したがって遺伝子は、宿主細胞のコドンバイアスを反映するヌクレオチド配列の最適化に基づいて、最適遺伝子発現のために調整し得る。当業者は、宿主によって好まれるにコドンに向けて、コドン使用頻度を偏らせた場合の成功裏の遺伝子発現の可能性を認識する。好ましいコドンの判定は、配列情報が利用できる宿主細胞に由来する遺伝子の調査に基づき得る。例えばヤロウィア・リポリティカ(Yarrowia lipolytica)のコドン使用頻度プロフィールは、米国特許第7,125,672号明細書に提供される。
「遺伝子」とは、特異的タンパク質を発現する核酸断片を指し、それはコード領域のみを指してもよく、またはコード領域の上流および/または下流の調節配列(例えばコード領域の転写開始部位である上流の5’非翻訳領域、3’非コード領域)を含んでもよい。「天然遺伝子」とは、それ自体の制御配列と共に天然に見られる遺伝子を指す。「キメラ遺伝子」とは、自然界では一緒に見られない調節およびコード配列を含んでなる、天然遺伝子でないあらゆる遺伝子を指す。したがって、キメラ遺伝子は、異なる起源に由来する調節配列およびコード配列、または同じ起源に由来するが、天然に見られるのとは異なる様式で配列された調節配列およびコード配列を含んでなってもよい。「内在性遺伝子」とは、生物のゲノム中のその自然な位置にある天然遺伝子を指す。「外来性」遺伝子とは、遺伝子移入によって宿主生物に導入された遺伝子を指す。外来性遺伝子は、非天然生物中に挿入された天然遺伝子、天然宿主内の新たな位置に導入された天然遺伝子、またはキメラ遺伝子を構成し得る。「導入遺伝子」は、形質転換手順によってゲノムに導入された遺伝子である。「コドン最適化遺伝子」は、宿主細胞の好むコドン使用頻度を模倣するように、そのコドン使用頻度がデザインされている遺伝子である。
「コード配列」とは、特定のアミノ酸配列をコードするDNA配列を指す。「調節配列」は、コード配列の転写開始部位上流に位置するヌクレオチド配列、5’非翻訳領域および3’非コード領域を指し、それらは関連するコード配列の転写、RNAプロセシングまたは安定性、または翻訳に影響を及ぼすこともある。調節配列としては、プロモーター、エンハンサー、サイレンサー、5’非翻訳リーダー配列、イントロン、ポリアデニル化認識配列、RNAプロセシング部位、作動体結合部位、およびステムループ構造が挙げられるが、これに限定されるものではない。
「プロモーター」という用語は、コード配列または機能性RNAの発現を制御できるDNA配列を指す。一般にプロモーター配列は、コード配列の5’上流に位置する。プロモーターはその全体が天然遺伝子に由来してもよく、または自然界に見られる異なるプロモーターに由来する異なる要素から構成されてもよく、または合成DNAセグメントを含んでなってさえよい。当業者は、異なる組織または細胞タイプにおいて、または異なる発達段階において、または異なる環境条件に答えて、異なるプロモーターが遺伝子の発現を指示してもよいことを理解する。細胞増殖および/または発達のほぼ全ての段階で遺伝子の発現を引き起こすプロモーターは、一般に「構成的プロモーター」と称される。ほとんどの場合、制御配列の正確な境界は(特にそれらの5’末端で)完全に定義されていないので、いくらかの変動があるDNA断片が、同一プロモーター活性を有してもよいことがさらに認識される。
「3’非コード配列」、「転写ターミネーター」、「ターミネーター」、および「終結配列」という用語は、コード配列下流に位置するDNA配列を指す。これは、ポリアデニル化認識配列と、mRNAプロセッシングまたは遺伝子発現に影響を及ぼすことができる調節シグナルをコードするその他の配列とを含む。ポリアデニル化シグナルは、通常、mRNA前駆体の3’末端へのポリアデニル酸トラクトの付加に影響を及ぼすことで特徴付けられる。3’領域は、関連するコード配列の転写、RNAプロセシングまたは安定性、または翻訳に影響し得る。
「RNA転写物」とは、RNAポリメラーゼが触媒する、DNA配列転写から得られる生成物を指す。RNA転写物がDNA配列の完璧な相補コピーである場合、それは一次転写産物と称される。RNA転写物は、それが一次転写産物の転写後プロセッシングに由来するRNA配列である場合に、成熟RNAと称される。「メッセンジャーRNA」または「mRNA」とは、イントロンがなく、細胞によってタンパク質に翻訳されるRNAを指す。「cDNA」とは、mRNAテンプレートに相補的であり、逆転写酵素を使用してそれから合成されるDNAを指す。cDNAは一本鎖であり得て、またはDNAポリメラーゼIのクレノウ(Klenow)断片を使用して、二本鎖形態に変換され得る。「センス」RNAとは、mRNAを含んで、細胞内または生体外でタンパク質に翻訳され得るRNA転写物を指す。「アンチセンスRNA」とは、標的一次転写産物またはmRNAの全部または一部に相補的で、標的遺伝子の発現をブロックするRNA転写物を指す(米国特許第5,107,065号明細書)。
「作動的に結合する」という用語は、一方の機能が他方の機能によって影響される、単一核酸断片上の核酸配列のつながりを指す。例えばプロモーターは、コード配列の発現に影響できる場合、そのコード配列と作動的に結合し、すなわちコード配列はプロモーターの転写調節下にある。コード配列は、センスまたはアンチセンス方向で制御配列に作動的に結合し得る。
「組み換え」という用語は、例えば化学合成による、または遺伝子操作技術を通じた核酸の単離セグメントの操作による、2つのさもなければ分離した配列セグメントの人為的組み合わせを指す。
「発現」という用語は、本明細書での用法では、センス(mRNA)またはアンチセンスRNAの転写および安定した蓄積を指す。発現はまた、mRNAの(前駆型または成熟型いずれかの)タンパク質への翻訳も含む。
「形質転換」とは、遺伝的に安定した遺伝形質をもたらす、宿主生物または宿主生物中への核酸分子の転移を指す。核酸分子は、例えば自律的に複製するプラスミドであってもよく、またはそれは宿主生物のゲノムに組み込まれてもよい。形質転換核酸断片を含有する宿主生物は、「組換え」、「リコンビナント」、「形質転換」または「形質転換体」生物と称される。
「プラスミド」および「ベクター」という用語は、細胞の中央代謝の一部ではない遺伝子を保有することが多く、通常は環状二本鎖DNA断片の形態である染色体外要素を指す。このような要素は、あらゆる起源に由来する、一本鎖または二本鎖のDNAまたはRNAの直線または環状であってもよい、自己複製配列、ゲノム組み込み配列、ファージまたはヌクレオチド配列を有してもよく、その中ではいくつかのヌクレオチド配列が結合しまたは組み換えされて、細胞に発現カセットを導入できるユニークな構造になる。
「発現カセット」という用語は、選択された遺伝子のコード配列と、選択された遺伝子産物の発現に必要である、コード配列に先行する(5’非コード配列)および後続の(3’非コード配列)制御配列とを含んでなる、DNA断片を指す。したがって発現カセットは、典型的に、1)プロモーター;2)コード配列(すなわちORF]);および3)真核生物中では通常、ポリアデニル化部位を含有するターミネーターから構成される。発現カセットは通常はベクター内に含めて、クローニングおよび形質転換を容易にする。各宿主に対する妥当な制御配列を使用しさえすれば、異なる発現カセットを細菌、酵母、植物、および哺乳類細胞をはじめとする異なる生物に形質転換できる。
「組換えコンストラクト」、「発現コンストラクト」、「キメラコンストラクト」、「コンストラクト」、および「組換えDNAコンストラクト」という用語は、本明細書において同義的に使用される。組換えコンストラクトは、例えば自然界では一緒に見られない調節およびコード配列などの核酸断片の人工的組み合わせを含んでなる。例えば組換えコンストラクトは、1つまたは複数の発現カセットを含んでなってもよい。別の実施例では、組換えDNAは、異なる起源に由来する調節配列およびコード配列、または同じ起源に由来するが、天然に見られるのとは異なる様式で配列された調節配列およびコード配列を含んでなってもよい。このようなコンストラクトは、単独で使用されてもよく、またはベクターと併せて使用されてもよい。ベクターが使用される場合、当業者に良く知られているように、ベクターの選択は、宿主細胞を形質転換するのに使用される方法に左右される。例えばプラスミドベクターを使用し得る。
当業者は、本明細書に記載される単離核酸断片のいずれかを含んでなる宿主細胞を成功裏に形質転換し、選択して増殖するために、ベクター上に存在しなくてはならない遺伝要素を十分承知している。当業者はまた、異なる独立した形質転換事象が、異なるレベルとパターンの発現をもたらすことを認識し(Jones et al.,EMBO J.,4:2411−2418(1985);De Almeida et al.,Mol.Gen.Genetics,218:78−86(1989))、したがって所望の発現レベルとパターンを呈する株または系統を得るために、複数事象をスクリーニングしなくてはならないこともまた認識する。このようなスクリーニングは特に、DNAのサザン分析、mRNA発現のノーザン分析、タンパク質発現のウエスタン分析、または表現型分析によって達成されてもよい。
「宿主細胞」および「宿主生物」という用語は、本明細書において同義的に使用され、外来性または異種遺伝子を受け入れることができ、これらの遺伝子を発現できる微生物または植物(すなわち油料種子植物)などのあらゆる生物を指す。「組換え宿主細胞」とは、組換え遺伝子操作されている宿主細胞を指す。
「配列分析ソフトウェア」という用語は、ヌクレオチドまたはアミノ酸配列の分析に有用なあらゆるコンピュータアルゴリズム、またはソフトウェアプログラムを指す。「配列分析ソフトウェア」は市販されることもあり、または独立して開発されることもある。典型的な配列分析ソフトウェアとしては、1)プログラムのGCGスイート(Wisconsin Package Version 9.0,Genetics Computer Group(GCG),Madison,WI);2)BLASTP,BLASTN,BLASTX(Altschul et al.,J.Mol.Biol.,215:403−410(1990));3)DNASTAR(DNASTAR,Inc.Madison,WI);4)Sequencher(Gene Codes Corporation,Ann Arbor,MI);および5)Smith−Watermanアルゴリズムを組み込んだFASTAプログラム(W.R.Pearson,Comput.Methods Genome Res.,[Proc.Int.Symp.](1994),Meeting Date 1992,111−20.Editor(s):Suhai,Sandor.Plenum:New York,NY)が挙げられるが、これに限定されるものではない。特に断りのない限り、本説明中で分析のために配列分析ソフトウェアが使用される場合はいつでも、分析結果は、言及されるプログラムの「デフォルト値」に基づく。本明細書での用法では「デフォルト値」とは、ソフトウェアを初期化した際に、初めからロードされる値またはパラメーターのあらゆる組を意味する。
本明細書で使用される標準組換えDNAおよび分子クローニング技術は、当該技術分野で周知であり、Sambrook,et al.;by Silhavy,T.J.,Bennan,M.L.and Enquist,L.W.,Experiments with Gene Fusions,Cold Spring Harbor Laboratory:Cold Spring Harbor,NY(1984)(以下「Silhavyu et al.」);およびAusubel,F.M.et al.,Current Protocols in Molecular Biology,published by Greene Publishing Assoc.and Wiley−Interscience,Hoboken,NJ(1987)(以下「Ausubel et al.」)によって、より詳しく記載される。
図1Aおよび図1Bは、組み合わさって、後述するようなω−3/ω−6脂肪酸生成の複数経路を記載する。全ての経路は、オレイン酸がΔ12デサチュラーによって、第1のω−6脂肪酸であるリノール酸[「LA」]に最初に変換されることを要する。次に「Δ9エロンガーゼ/Δ8デサチュラーゼ経路」および基質としてLAを使用して、長鎖ω−6脂肪酸が次のように形成される。1)LAがΔ9エロンガーゼによってエイコサジエン酸[「EDA」]に変換され;2)EDAがΔ8デサチュラーゼによってジホモ−γ−リノレン酸[「DGLA」]に変換され;3)DGLAがΔ5デサチュラーゼによってアラキドン酸[「ARA」]に変換され;4)ARAがC20/22エロンガーゼによってドコサテトラエン酸[「DTA」]に変換され;5)DTAがΔ4デサチュラーゼによってドコサペンタエン酸[「DPAn−6」]に変換される。
「Δ9エロンガーゼ/Δ8デサチュラーゼ経路」はまた、基質としてα−リノレン酸[「ALA」]を使用して、長鎖ω−3脂肪酸を次のように生成し得る。1)LAがΔ15デサチュラーゼによって第1のω−3脂肪酸ALAに変換され;2)ALAがΔ9エロンガーゼによってエイコサトリエン酸[「ETrA」]に変換され;3)ETrAがΔ8デサチュラーゼによってエイコサテトラエン酸[「ETA」]に変換され;4)ETAがΔ5デサチュラーゼによってエイコサペンタエン酸[「EPA」]に変換され;5)EPAがC20/22エロンガーゼによってドコサペンタエン酸[「DPA」]に変換され;6)DPAがΔ4デサチュラーゼによってドコサヘキサエン酸[「DHA」]に変換される。任意選択的に、ω−6脂肪酸がω−3脂肪酸に変換されてもよい。例えばETAおよびEPAはΔ17デサチュラーゼ活性によって、それぞれDGLAおよびARAから生成される。
ω−3/ω−6脂肪酸生合成の代わりの経路は、Δ6デサチュラーゼおよびC18/20エロンガーゼを利用し、すなわち「Δ6デサチュラーゼ/Δ6エロンガーゼ経路」である。より具体的には、Δ6デサチュラーゼによって、LAおよびALAがそれぞれGLAおよびステアリドン酸[「STA」]に変換されてもよく、次にC18/20エロンガー
ゼが、GLAをDGLAにおよび/またはSTAをETAに変換する。引き続いて上述のように、下流PUFAが形成される。
ω−3/ω−6脂肪酸を生成するために特定の宿主生物中に導入される必要がある特定の機能性は、宿主細胞(およびその天然PUFAプロフィールおよび/またはデサチュラーゼ/エロンガーゼプロフィール)、基質可用性、および所望の最終産物に左右されることが考察される。例えば実施形態によっては、Δ9エロンガーゼ/Δ8デサチュラーゼ経路の発現は、Δ6デサチュラーゼ/Δ6エロンガーゼ経路発現との対比で好ましいこともあるが、それは前者の経路を介したPUFA産生がGLAおよび/またはSTAを欠いているためである。
当業者は、ω−3/ω−6脂肪酸生合成で所望される酵素のそれぞれをコードする、様々な候補遺伝子を同定できる。有用なデサチュラーゼおよびエロンガーゼ配列は、あらゆる起源に由来してもよく、例えば天然原料から(細菌、藻類、真菌、植物、動物などから)単離され、半合成手段を介して生成され、または新規に合成されてもよい。宿主中に導入されるデサチュラーゼおよびエロンガーゼ遺伝子の特定の供給源は重大でないが、デサチュラーゼまたはエロンガーゼ活性を有する特異的ポリペプチド選択のための考察事項としては、以下が挙げられる。1)ポリペプチドの基質特異性;2)ポリペプチドまたはその構成要素が律速酵素であるかどうか;3)デサチュラーゼまたはエロンガーゼが、所望のPUFAの合成に必須であるかどうか;4)ポリペプチドに必要な補因子;および/または、5)ポリペプチドが、その生成後に(例えばキナーゼまたはプレニルトランスフェラーゼによって)修飾されたかどうか。発現されるポリペプチドは、好ましくは宿主細胞中のその所在位置の生化学的環境に適合するパラメーターを有する(追加的詳細については米国特許第7,238,482号明細書を参照されたい)。
各特定のデサチュラーゼおよび/またはエロンガーゼの変換効率を検討することは、有用であろう。より具体的には、各酵素が基質を生成物に変換する際に100%の効率で機能することは稀なので、宿主細胞中で生成する未精製油の最終脂質プロフィールは、典型的に所望のω−3/ω−6脂肪酸、ならびに様々な上流の中間PUFAからなる様々なPUFAの混合物である。したがって所望の脂肪酸生合成を最適化する場合、各酵素の変換効率もまた考慮すべき変数である。
上の考察のそれぞれを念頭に置いて、適切なデサチュラーゼおよびエロンガーゼ(例えばΔ6デサチュラーゼ、C18/20エロンガーゼ、Δ5デサチュラーゼ、Δ17デサチュラーゼ、Δ15デサチュラーゼ、Δ9デサチュラーゼ、Δ12デサチュラーゼ、C14/16エロンガーゼ、C16/18エロンガーゼ、Δ9エロンガーゼ、Δ8デサチュラーゼ、Δ4デサチュラーゼ、およびC20/22エロンガーゼ)活性を有する候補遺伝子が、公的に入手できる文献(例えばGenBank)、特許文献、およびPUFA生産能力を有する生物の実験解析に従って同定され得る。これらの遺伝子は、特定宿主生物に導入して、生物のPUFA合成を可能にしまたは高めるのに適する。
生物中で、(飽和および不飽和脂肪酸および短鎖および長鎖脂肪酸をはじめとする)脂肪酸が合成されると、それらはTAGに組み込まれてもよい。TAGは、脂肪酸の主要貯蔵単位である。
これまでに同定されたほとんどのΔ5デサチュラーゼ酵素は、DGLAをARAに変換する一次能力を有し、ETAをEPAに変換する二次活性がある。公の文献および特許文献の双方で、いくつかのΔ5デサチュラーゼが開示されている。デサチュラーゼ進化に基づくΔ5デサチュラーゼの一般的特徴は、P.Sperling et al.(Prostaglandins Leukot.Essent.Fatty Acids,68:73−95(2003)で詳述される。Δ6、Δ8、およびΔ4デサチュラーゼと並んで、Δ5デサチュラーゼは長鎖PUFA「フロントエンド」デサチュラーゼとして知られている(メチル依存性不飽和化とは対照的に、既存の二重結合と脂肪酸のアシル基のカルボキシル末端との間で不飽和化が起きる)。これらのデサチュラーゼは、3個のヒスチジンボックス[H(X)3−4H(配列番号1および2)、H(X)2−3HH(配列番号3および4)、およびH/Q(X)2−3HH(配列番号5および6)]によって特徴付けられ、電子供与体として機能するそれらのN末端に融合チトクロームb5ドメインを有することから、チトクロームb5融合スーパーファミリーのメンバーである。残るチトクロームb5ドメイン配列の多様性にもかかわらず、チトクロームb5ドメインは、保存ヘム結合モチーフ(すなわちHPGG配列[配列番号7])もまた含有する。酵素活性に対するHDASHモチーフの重要性は未だ解明されていないが、いくつかのΔ5デサチュラーゼ中で以前同定された追加的なモチーフもまた、ヒスチジンに富むようある(すなわちHDASH配列[配列番号8])。
いくつかの研究は、HPGG(配列番号7)モチーフが酵素活性に関係することを示唆している。Sayanova,O.et al.(Plant Physiol.,121:641(1999))は、部位特異的変異誘発を実施して、ルリヂサのΔ6デサチュラーゼ中でHPGGモチーフのHis残基をAla残基で置換した。変異酵素はアラビドプシス属(Arabidopsis)中で発現された;しかし酵素活性は測定できず、デサチュラーゼのチトクロームb5ドメイン中のHPGG(配列番号7)モチーフのHis残基が機能にとって重要であることが示唆された。同様の研究がラットΔ6デサチュラーゼ中で実施され、AlaによるHisの置換がHPGG(配列番号7)モチーフ内で操作された。この変異タンパク質もまた、活性を有さなかった(Guillou,H.,et al.,J.Lipid Res.,45:32−40(2004))。より最近では、Hongsthong,A.et al.(Appl.Microbiol.Biotechnol.,72:1192−1201(2006))が、スピルリナ属(Spirulina)のΔ6デサチュラーゼ中のHPGG(配列番号7)モチーフのHis残基のAla残基による置換を報告した。以前の報告同様、変異によって変異酵素は大腸菌(E.coli)中でGLAを生成できなくなり、チトクロームb5ドメインが活性のために重要であり、HPGG(配列番号7)モチーフ中のHis残基の変更は酵素活性低下をもたらすことが示唆された。Δ5デサチュラーゼ酵素は比較的一般的であり、特徴が良く分かっているが、PUFAを産生できる生産宿主細胞中において、高レベルで効率的に発現される酵素に対する必要性が残されている。
上述したように、Δ5デサチュラーゼはいくつかの保存された配列を含有する。しかしヘム結合モチーフ(すなわちHPGG[配列番号7])およびHDASHモチーフ(配列番号8)のみが、配列内変動を欠いている。これらのモチーフを本明細書の変異誘発の標的として選択した。酵素機能に対するHDASH(配列番号8)モチーフの重要性は不明確なままであるが、文献は、少なくともHPGG(配列番号7)モチーフ内のHis残基が機能にとって重要であることを提案する。その結果、残りの残基の置換を優先して、どちらのモチーフ内のHis残基の置換も回避された。
米国特許出願公開第2010−0075386−A1号明細書は、いくつかのΔ5デサチュラーゼのHPGG(配列番号7)モチーフ内のProおよび第2のGly残基における部位特異的変異誘発と、それに続く得られた変異ポリペプチドの発現、および野生型酵素と比較したそれらの活性測定を記載する。この出願は、HxGG(配列番号32)およびHPGx(配列番号33)をはじめとする、アミノ酸変異モチーフを含んでなる様々な変異Δ5デサチュラーゼの作成を開示し、変異Δ5デサチュラーゼのΔ5デサチュラーゼ活性は、対応する野生型Δ5デサチュラーゼのΔ5デサチュラーゼ活性と機能的に等しかった。
多数の部位特異的変異誘発プロトコルが存在する[例えばIshii,T.M.,et al.,Methods Enzymol.,293:53−71(1998);Ling M.M.and B.H.Robinson,Anal.Biochem.,254:157−178(1997);Braman J.(ed.)In Vitro Mutagenesis Protocols.2nd Ed.,Humania:Totowa,NJ(2002);Kunkel T.A.,et al.,Methods Enzymol.,154:367−382(1987);Sawano A.and Miyawaki,A.Nucleic Acids Res.,28:e78(2000)];しかしその容易な実行と高い効率に基づいて、QuikChange(登録商標)部位特異的変異誘発キット(Stratagene,La Jolla,CA)を選択して使用した。基本的手順は、対象の挿入断片がある超らせん二本鎖DNAベクター、および所望の変異を含有する2つの合成オリゴヌクレオチドプライマーを利用する。DNAポリメラーゼによって、ベクターの逆ストランドにそれぞれ相補的なオリゴヌクレオチドプライマーを温度サイクル中に延長させる。オリゴヌクレオチドプライマーの組み込みによって、スタッガードニックを含有する変異プラスミドが生じる。温度サイクルに続いて、親DNAテンプレートを消化して新たに合成された変異DNAを選択する手段として、(メチル化およびヘミメチル化DNAに特異的な)DpnIエンドヌクレアーゼで生成物を処理する。次に所望の変異を含有するニックのあるベクターDNAを大腸菌(Escherichia coli)宿主に形質転換して増殖させる。
上述の技術を使用して、いくつかのΔ5デサチュラーゼのHDASH(配列番号8)モチーフ内のAsp[D]、Ala[A]、およびSer[S]残基上で、部位特異的変異誘発を独立して実施し、得られた変異ポリペプチドの発現と、野生型酵素と比較したそれらの活性測定がそれに続いた。驚くことに、HxASH(配列番号35)、HDxSH(配列番号36)、およびHDAxH(配列番号37)をはじめとするアミノ酸変異モチーフを含んでなる、様々な変異Δ5デサチュラーゼが作り出され、変異Δ5デサチュラーゼΔの5デサチュラーゼ活性は、対応する野生型Δ5デサチュラーゼのΔ5デサチュラーゼ活性と機能的に同様であった。
例えばキメラFBAIN::EgD5R*::Pex20遺伝子(すなわちEgD5R*[配列番号27]、EgD5[配列番号21]と比べて、遺伝子内の4つの内部制限酵素部位を欠き、位置347にSerの代わりにArgを含んでなる)を含んでなるプラスミドコンストラクト内で、ミドリムシ(Euglena gracilis)に由来する修飾変種野生型Δ5デサチュラーゼに、HDASH(配列番号8)モチーフ内のAla残基の全ての可能なアミノ酸置換を部位特異的変異誘発によって導入した。変異した配列があるプラスミドを個々に大腸菌(E.coli)に形質転換して配列決定し、次に約18%のDGLAを産生するようにあらかじめ遺伝子操作された適切なヤロウィア・リポリティカ(Yarrowia lipolytica)株に形質転換した。これによりARA生成に基づく(すなわちGC分析による)、Δ5デサチュラーゼ活性のスクリーニングが可能になった。
野生型酵素と比較して実質的に低下したΔ5デサチュラーゼ活性を有する変異Δ5デサチュラーゼをもたらす、多数の変異が同定された。しかし驚くことに、予備スクリーニングは、HDASH(配列番号8)モチーフ内のAlaを置換できて、対応する野生型酵素(すなわちEgD5R*)のΔ5デサチュラーゼ活性との比較で、ほぼ同等のまたは増大したΔ5デサチュラーゼ活性を変異体中にもたらす、2つのアミノ酸残基を同定した。したがってこの予備実験は、EgD5R*のΔ5デサチュラーゼ活性に顕著に影響を及ぼすことなく、HDASH(配列番号8)モチーフ内のAla残基をGlyまたはSerによって置換し得ることを示唆した。
HDASH(配列番号8)モチーフのSer残基を変異させる部位特異的変異誘発反応において、EgD5R*をテンプレートとして使用して、同様の実験を実施した。変異酵素の分析は、野生型アミノ酸(すなわちSer)を置き換えて、同等のまたは改善されたΔ5デサチュラーゼ活性を有する変異EgD5R*酵素をもたらすのに、2つのアミノ酸残基(すなわちAlaまたはGly)で十分であると判定した。
EgD5R*のHDASH(配列番号8)モチーフ中のアミノ酸置換の予備分析が、上述したように完了すると、オリゴヌクレオチド媒介部位特異的変異誘発をさらに利用して、上述のΔ5デサチュラーゼのいくつかの変異HDASHモチーフと組み合わさった特異的点突然変異をHPGG(配列番号7)モチーフ内に作り出した。このようにして、それぞれプラスミドpDMW367M4−157g(配列番号129)、pDMW367M4−158a(配列番号130)、およびpDMW367M4−158g(配列番号131)内で、上述した3つの変異HDASHモチーフΔ5デサチュラーゼ(すなわちEgD5R*−157g[配列番号87]、EgD5R*−158a[配列番号127]、およびEgD5R*−158g[配列番号128])のそれぞれに、HPGG(配列番号7)モチーフ内の様々なアミノ酸置換を部位特異的変異誘発によって導入し、それによってHPGG(配列番号7)およびHDASH(配列番号8)モチーフのそれぞれに単一変異を有する、二重変異体を作り出した。大腸菌(E.coli)中で二重変異体を増幅してDNA配列決定によって確認し、次に適切なY.リポリティカ(Y.lipolytica)株に形質転換した。この場合もやはり、ARA生成に基づく(すなわちGC分析による)、Δ5デサチュラーゼ活性のスクリーニングを実施した。
全ての二重変異体は、非変異野生型EgD5R*酵素と比較して、いくらかの検出可能なレベルのΔ5デサチュラーゼ活性を有した。より具体的には、全ての7つの変異Δ5デサチュラーゼは、対応する野生型EgD5R*対照と比較して、少なくとも64%のDGLAからARAへの変換効率で機能した一方、3つは少なくとも83%の変換効率でDGLAをARAに変換できた(表3、後述)。スクリーニングは、HPGG(配列番号7)モチーフのProおよび第2のGlyと、HDASH(配列番号8)モチーフのAlaおよびSerとを同時に置換して、対応する野生型酵素(すなわちEgD5R*)中のΔ5デサチュラーゼ活性と比べて、ほぼ同等のΔ5デサチュラーゼ活性を有する二重変異体をもたらし得ることを確認した。したがってこの実験は、EgD5R*のΔ5デサチュラーゼ活性に顕著に影響を及ぼすことなく、1)a)HDASH[配列番号8]モチーフ内のAla残基のGlyによる置換、またはb)HDASH[配列番号8]モチーフ内のSer残基のAlaまたはGlyによる置換のいずれかの同時置換と共に、HPGG[配列番号7]モチーフ内のPro残基をGlyで置換し得て;2)HDASH[配列番号8]モチーフ内のSerのAlaまたはGlyのいずれかによる同時置換と共に、HPGG[配列番号7]モチーフ内のPro残基もまたHisで置換し得て;3)HDASH[配列番号8]モチーフ内のSerのAlaまたはGlyのいずれかによる同時置換と共に、HPGG[配列番号7]モチーフ内の第2のGly残基をSerで置換し得ることを示唆した。
EgD5R*(すなわちEgD5R*−34g158g;配列番号142)と比較して、最高変換効率を有すると同定された、二重変異EgD5R*Δ5デサチュラーゼをコードする遺伝子のN末端をヤロウィア・リポリティカ(Yarrowia lipolytica)中での発現のためにコドン最適化した(すなわちEgD5M;配列番号152)。次にΔ5デサチュラーゼ活性に対するR347S変異の効果を分析するために、位置347でSerをコードするようにEgD5Mを修飾した(すなわちEgD5M1;配列番号156)。EgD5M(すなわちpDMW367−5M;配列番号155)またはEgD5M1(すなわちpDMW367−5M1;配列番号159)のいずれかを含んでなるプラスミドを適切なY.リポリティカ(Y.lipolytica)株に別々に形質転換し、Δ5デサチュラーゼ活性および変換効率を測定して、野生型EgD5R*と比較した。
双方の二重変異Δ5デサチュラーゼ、すなわちEgD5MおよびEgD5M1は、野生型EgD5R*と比較して増大した活性を有した(表3、後述)。驚くことに、EgD5M1は、EgD5Mと比較して改善されたΔ5デサチュラーゼ活性を実証し、アミノ酸残基347のSerが酵素活性を改善したことが示唆された。
次に上述の技術を使用して、キメラFBAIN::EgD5S−36s::Pex20遺伝子を含んでなるプラスミドコンストラクト内で、部位特異的変異誘発によって、ヤロウィア・リポリティカ(Yarrowia lipolytica)中における発現のためにコドン最適化された、ミドリムシ(Euglena gracilis)に由来する、変異HPGs(配列番号11)モチーフを有する合成Δ5デサチュラーゼ(すなわちEgD5S−36s[配列番号160];米国特許出願公開第2010−0075386−A1号明細書)のHDASH(配列番号8)モチーフのAsp、Ala、またはSer残基に、単一アミノ酸置換を個々に導入した。Y.リポリティカ(Y.lipolytica)中での発現のためにコドン最適化されて、ユーグレナ・アナベナ(Euglena anabaena)に由来する、変異HaGG(配列番号14)モチーフ(すなわちEaD5S−35a[配列番号188];米国特許出願公開第2010−0075386−A1号明細書)を有する合成Δ5デサチュラーゼを使用して、プロトコルを繰り返した。二重変異があるプラスミドを大腸菌(E.coli)内で別々に増幅してDNA配列決定によって確認し、次にARA生成に基づいた(すなわちGC分析による)Δ5デサチュラーゼ活性スクリーニングのために、適切なY.リポリティカ(Y.lipolytica)株に形質転換した。HxGx(配列番号34)とHxxxH(配列番号1)モチーフを含んでなり、適切なΔ5デサチュラーゼ活性を有する、二重変異Δ5デサチュラーゼを各実験から得た(追加的な詳細については、後述する実施例、および表3を参照されたい)。
上の研究は、HPGG(配列番号7)およびHDASH(配列番号8)モチーフ内のどの特定の同時アミノ酸置換が、許容可能なΔ5デサチュラーゼ活性を有する変異ポリペプチドを生成するのに十分であるかに関する合意を示唆しない。しかし当該技術分野における以前の報告に反して、HDASH(配列番号8)モチーフのAsp、AlaまたはSer残基の置換と組み合わさった、HPGG(配列番号7)モチーフのProまたはGly残基のいずれかの置換が、その野生型親と比較して、機能的に同等のまたは改善されたΔ5デサチュラーゼ活性を有する酵素をもたらすこともあることを実証するデータは、驚くべきである。
したがって配列番号9(HgGG)、配列番号10(HhGG)、配列番号11(HPGs)、配列番号12(HcGG)、配列番号13(HwGG)、および配列番号14(HaGG))からなる群から選択される第1のアミノ酸モチーフと、配列番号15(HDgSH)、配列番号16(HDsSH)、配列番号17(HDAaH)、配列番号18(HDAgH)、および配列番号19(HeASH)からなる群から選択される第2のアミノ酸モチーフとを含んでなる、Δ5デサチュラーゼ活性を有するポリペプチドを提供することは、本発明の範囲内である。
より好ましくは、上述の変異Δ5デサチュラーゼ(すなわちHxGx[配列番号34]モチーフと変異HxxxH[配列番号1]モチーフを含んでなる)は、HPGG(配列番号7)とHDASH(配列番号8)アミノ酸モチーフの双方を有する、対応する野生型Δ5デサチュラーゼの少なくとも64%のΔ5デサチュラーゼ活性をさらに有する。
変異HPGGモチーフと変異HDASHモチーフを含んでなる変異Δ5デサチュラーゼポリペプチドは、配列番号21、配列番号25、および配列番号29からなる群から選択される配列を有するポリペプチドと比べて、BLASTPアラインメント法に基づいて、少なくとも90%の配列同一性、より好ましくは少なくとも95%の配列同一性を有してもよい。
いくつかの実施形態では、ポリペプチドは、配列番号139、配列番号141、配列番号143、配列番号145[EgD5R*−34h158a]、配列番号147[EgD5R*−34h158g]、配列番号149[EgD5R*−36s158a]、配列番号151[EgD5R*−36s158g]、配列番号153、配列番号157、配列番号181、配列番号183、配列番号185、配列番号187、配列番号213、配列番号215、配列番号217、配列番号255[EgD5R−34g158g]、配列番号260[EgD5R−34g158a]、配列番号271[EaD5−35g159g]、および配列番号276[EaD5−35g159a]からなる群から選択されるアミノ酸配列を有する。
当業者は、有用な変異Δ5デサチュラーゼが上述の変異に限定されるものではないことを理解するであろう。それよりむしろ結果は、チトクロームb5ドメイン内のHPGG(配列番号7)モチーフと、HDASHモチーフ(配列番号8)とを有するあらゆるΔ5野生型デサチュラーゼ酵素を使用して、同様の実験を実施して、それによって適切なΔ5デサチュラーゼ活性を有する変異Δ5デサチュラーゼを改変し得て、変異は、変異HxGG(配列番号32)またはHPGxモチーフ(配列番号33)および変異HxASH(配列番号35)、HDxSH(配列番号36)またはHDAxHモチーフ(配列番号37)をもたらすことを示唆する。適切なΔ5デサチュラーゼ活性を有する変異酵素は、ω−3/ω−6脂肪酸生成を増大させるのに有用たり得る。
例えば生体外変異誘発と選択または誤りがちなPCR(Leung et al.,Techniques,1:11−15(1989);Zhou et al.,Nucleic Acids Res.,19:6052−6052(1991);Spee et al.,Nucleic Acids Res.,21:777−778(1993);Melnikov et al.,Nucleic Acids Res.,27(4):1056−1062(February 15,1999))もまた、天然Δ5デサチュラーゼ遺伝子の変異を得る手段として採用でき、変異としては、欠失、挿入、および点変異、またはそれらの組み合わせが挙げられる。誤りがちなPCRの主な利点は、この方法によって導入される全ての変異が所望のデサチュラーゼ遺伝子内にあり、PCR条件を変更することであらゆる変更が容易に制御できることである。代案としては、Stratagene(La Jolla,CA)からの大腸菌(E.coli)XL1−Red株およびEpicurian coli XL1−Red mutator株などの市販材料を使用した生体内変異誘発を用いてもよい(Greener and Callahan,Strategies,7:32−34(1994))。この株は主要DNA修復経路の内3つ(mutS、mutD、およびmutT)が欠損しており、野生型より5000倍高い変異率がもたらされる。生体内変異誘発は(誤りがちなPCRと同様に)ライゲーション効率に依存しない;しかし変異はベクターのあらゆる領域で起きてもよく、変異率は一般にはるかにより低い。
改変または改善されたΔ5デサチュラーゼ活性がある変異Δ5デサチュラーゼを「遺伝子シャフリング」法(米国特許第5,605,793号明細書、米国特許第5,811,238号明細書、米国特許第5,830,721号明細書、米国特許第5,837,458号明細書)を使用して構築してもよいこともまた考察される。遺伝子シャフリング法は、その容易な実行、および高率な変異誘発のために特に魅力的である。遺伝子シャフリングのプロセスは、対象の遺伝子との類似性(または相違性)があるDNA領域の追加的集団存在下で、対象の遺伝子を制限酵素で切断して特定サイズ断片にすることを伴う。この断片のプールを変性させ、再アニールして変異遺伝子を作り出す。次に変異遺伝子は、活性変化についてスクリーニングされる。これらの方法のいずれかを使用して、置換モチーフHxGG(配列番号32)またはHPGx(配列番号33)、およびHxASH(配列番号35)、HDxSH(配列番号36)、またはHDAxH(配列番号37)を有するΔ5デサチュラーゼ変異酵素を作成してもよく、次に本明細書に記載される方法を使用して、適切な活性についてスクリーニングしてもよい。
適切なプロモーター制御下における、本明細書に記載される変異Δ5デサチュラーゼをコードするキメラ遺伝子(すなわち前記変異Δ5デサチュラーゼが、HPGGアミノ酸モチーフをコードする領域の少なくとも1つの変異と、HDASHアミノ酸モチーフをコードする領域の少なくとも1つの変異を含んでなり、前記変異Δ5デサチュラーゼが、好ましくは対応する野生型Δ5デサチュラーゼと比較して、少なくとも64%のΔ5デサチュラーゼ活性を有する)の導入は、形質転換宿主生物中において、それぞれARAおよび/またはEPAの生成をもたらすことが予測される。したがって本明細書で開示されるのは、基質が所望の脂肪酸生成物(すなわちそれぞれARAおよび/またはEPA)に変換されるように、脂肪酸基質(すなわちDGLAおよび/またはETA)を本明細書に記載される変異デサチュラーゼ(例えば配列番号139、141、143、145、147、149、151、153、157、181、183、185、187、213、215、217、255、260、271、および276のいずれか)に曝露するステップを含んでなる、PUFAを直接生成する方法である。
より具体的には、本明細書に記載されるのは、微生物宿主細胞(例えば細菌、酵母、藻類、ユーグレナ属、ストラメノパイル、卵菌綱および真菌)、または植物宿主細胞(例えば油料種子植物細胞)中でPUFAを生成する方法であり、微生物または植物宿主細胞は、
a)配列番号9(HgGG)、配列番号10(HhGG)、配列番号11(HPGs)、配列番号12(HcGG)、配列番号13(HwGG)、および配列番号14(HaGG)からなる群から選択される第1のアミノ酸モチーフと、配列番号15(HDgSH)、配列番号16(HDsSH)、配列番号17(HDAaH)、配列番号18(HDAgH)、および
b)配列番号19(HeASH)からなる群から選択される第2のアミノ酸モチーフとを含んでなる、Δ5デサチュラーゼ活性を有するポリペプチド;およびDGLAおよびETA
からなる群から選択される基質脂肪酸源を含んでなり;宿主細胞は、変異Δ5デサチュラーゼが発現されて、基質脂肪酸が生成物PUFAに変換されるような条件下で培養され、DGLAはARAに変換されおよび/またはETAはEPAに変換され;生成物PUFAは任意選択的に回収される。
代案としては、様々なω−6およびω−3PUFAの製造のために、本明細書に記載される、各変異Δ5デサチュラーゼ遺伝子とそれに対応する酵素生成物を間接的に使用し得る(図1;米国特許第7,238,482号明細書;米国特許第7,678,560号明細書;米国特許第7,695,950号明細書を参照されたい)。ω−3/ω−6 PUFAの間接的生成は、中間工程または経路中間体の手段を通じて、脂肪酸基質が所望の脂肪酸産物に間接的に変換されて起きる。したがってPUFA生合成経路の酵素(例えばΔ6デサチュラーゼ、C18/20エロンガーゼ、Δ17デサチュラーゼ、Δ8デサチュラーゼ、Δ15デサチュラーゼ、Δ9デサチュラーゼ、Δ12デサチュラーゼ、C14/16エロンガーゼ、C16/18エロンガーゼ、Δ9エロンガーゼ、Δ5デサチュラーゼ、Δ4デサチュラーゼ、C20/22エロンガーゼ)をコードする追加的な遺伝子と併せて、本明細書に記載される変異Δ5デサチュラーゼを発現させ、例えばARA、EPA、DTA、DPAn−6、DPAおよび/またはDHAなどの長鎖ω−3/ω−6脂肪酸のより高いレベルの生成をもたらしてもよいことが検討される。
好ましくは本明細書に記載されるΔ5デサチュラーゼは、少なくともΔ9エロンガーゼおよびΔ8デサチュラーゼと併せて発現される。Δ5デサチュラーゼはまた、少なくともΔ6デサチュラーゼおよびΔ6エロンガーゼと併せて発現させ得る。しかし特定の発現カセット内に含まれる特定の遺伝子は、宿主細胞(そしてそのPUFAプロフィールおよび/またはデサチュラーゼ/エロンガーゼプロフィール)、基質可用性、および所望の最終産物に左右される。
変異Δ5デサチュラーゼ(すなわち前記変異体が、配列番号9(HgGG)、配列番号10(HhGG)、配列番号11(HPGs)、配列番号12(HcGG)、配列番号13(HwGG)、および配列番号14(HaGG)からなる群から選択される第1のアミノ酸モチーフと、配列番号15(HDgSH)、配列番号16(HDsSH)、配列番号17(HDAaH)、配列番号18(HDAgH)、および配列番号19(HeASH)からなる群から選択される第2のアミノ酸モチーフとを含んでなる)をコードするORFを含んでなる組換えコンストラクトを作成して、適切な宿主細胞に導入する必要がある。
当業者は、以下を記載する、標準資料を承知している。1)DNA分子、プラスミドなどの巨大分子の構築、操作、および単離のための特定条件と手順;2)組換えDNA断片と組換え発現コンストラクトの作成;および3)クローンまた植物系統のスクリーニングおよび単離。Sambrook et al.;Silhavy et al.;Ausubel et al.;Maliga et al.,Methods in Plant Molecular Biology,Cold Spring Harbor:NY(1995);Birren et al.,Genome Analysis:Detecting Genes,Vol.1,Cold Spring Harbor:NY(1998);Birren et al.,Genome Analysis:Analyzing DNA,Vol.2,Cold Spring Harbor:NY(1998);Plant Molecular Biology:A Laboratory Manual,eds.Clark,Springer:NY(1997)を参照されたい。
一般にコンストラクトに含まれる配列の選択は、所望の発現産物、宿主細胞の性質、および形質転換細胞と非形質転換細胞とを分離する提案される手段に左右される。当業者は、キメラ遺伝子を含有する宿主細胞を成功裏に形質転換させ、選択し、増殖させるために、プラスミドベクター上に存在しなくてはならない遺伝的要素を承知している。しかし典型的に、ベクターまたはカセットは、妥当な遺伝子の転写と翻訳を誘導する配列、選択可能なマーカー、および自律複製または染色体の組み込みを可能にする配列を含有する。適切な発現カセットは、典型的に、プロモーター、選択された遺伝子のコード配列、およびターミネーターを含んでなる。双方の制御領域が、形質転換宿主細胞からの遺伝子に由来することが最も望ましい。
所望の微生物宿主細胞または植物細胞中において、当該Δ5デサチュラーゼORFの発現を駆動するのに有用なプロモーターについては、良く知られている。選択された宿主細胞中においてこれらの遺伝子の発現を誘導できる、実質的にあらゆるプロモーター(すなわち天然、合成、またはキメラ)が、適切である。宿主細胞中の発現は、誘導的または構成的様式で達成できる。誘導性発現が、対象の遺伝子と作動的に連結する調節可能なプロモーターの活性を誘導することで起きるのに対し、構成的発現は構成的プロモーターの使用によって起きる。
一例として、米国特許出願公開第2009−0093543−A1号明細書は、ヤロウィア・リポリティカ(Yarrowia lipolytica)で使用されるプロモーターを記載する。構成的または誘導性転写が所望されるのか、対象のORFの発現におけるプロモーターの効率、構築の容易さなどに応じて、いくつかのプロモーターのいずれか1つを使用し得る。
翻訳開始コドン「ATG」周囲のヌクレオチド配列は、酵母細胞中の発現に影響を及ぼすことが分かっている。所望のポリペプチドが酵母中で不十分に発現される場合、効率的な酵母翻訳開始配列を含めるように外来性遺伝子のコード領域を修飾して、最適な遺伝子発現を得ることができる。酵母中における発現では、これは非効率的に発現される遺伝子を部位特異的変異誘発することで、またはそれを内在性酵母プロモーター、好ましくは高度に発現されるプロモーターにインフレームで融合させることで、成し得る。代案としては、異種遺伝子の最適発現のために、宿主のコンセンサス翻訳開始配列をそれに含め得る。
ターミネーターは、それからプロモーターが得られる遺伝子の3’領域、または異なる遺伝子に由来し得る。多数のターミネーターが知られており、それらが由来したのと同じおよび異なる属および種のどちらで使用した場合も、多様な宿主中で満足に機能する。ターミネーターは、通常いかなる特性のためでもなく、便宜上選択される。ターミネーターはまた、好ましい宿主に天然の様々な遺伝子に由来してもよい。当業者は、入手できる情報を利用してターミネーターをデザインおよび合成し得るので、ターミネーターはまた合成もされ得る。ターミネーターは不要なこともあるが、高度に好ましい。
遺伝子をクローニングベクターに単に挿入することは、所望の速度、濃度、量などでのその発現を保証しない。高レベルの発現に対する必要性に応えて、転写、RNA安定性、翻訳、タンパク質安定性および位置、ならびに微生物宿主細胞または植物細胞からの分泌を制御する、特定の特性を調節することにより、多数の特殊発現ベクターが作り出されている。これらの特性としては、以下が挙げられる。関連する転写プロモーターおよびターミネーター配列の性質;クローン遺伝子コピー数(単一発現コンストラクト中で追加的コピーをクローンしてもよく、および/またはプラスミドコピー数を増大させることで、またはゲノム中へのクローン遺伝子の複数の組み込みにより、追加的コピーを宿主細胞中に導入してもよい);遺伝子がプラスミド上にあるか、または宿主細胞ゲノム中に組み込まれているかどうか;合成外来性タンパク質の最終的細胞内所在;宿主生物中のタンパク質の翻訳と正しい折りたたみの効率;宿主細胞中のクローン遺伝子のmRNAおよびタンパク質の固有の安定性;およびクローン遺伝子内のコドン使用頻度。これらのそれぞれを本明細書に記載される方法および宿主細胞中で使用して、変異Δ5デサチュラーゼの発現をさらに最適化してもよい。
プロモーター、変異Δ5デサチュラーゼORF、およびターミネーターを含んでなる、少なくとも1つのキメラ遺伝子を含んでなる、組み換えコンストラクトを作り出した後、それを宿主細胞中で自律複製できるプラスミドベクターに入れ、または宿主細胞のゲノムに直接組み込む。発現カセットの組み込みは、宿主ゲノム内で無作為に生じ得て、または宿主遺伝子座内で組換えを標的とするのに十分な、宿主ゲノムとの相同領域を含有するコンストラクトの使用を通じて、標的化し得る。コンストラクトが内在性遺伝子座を標的とする場合、全部または一部の転写および翻訳調節領域は、内在性遺伝子座によって提供され得る。
2つ以上の遺伝子が別個の自己複製ベクターから発現される場合、各ベクターが異なる選択手段を有することが望ましく、その他のコンストラクトとの相同性を欠いて、安定発現を維持し、コンストラクト間の要素の再集合を妨げるべきである。調節領域の賢明な選択、選択手段、および導入コンストラクトの増殖法は、導入遺伝子が所望の生成物の合成を提供するのに必要なレベルで発現されるように、実験的に判定し得る。
対象の遺伝子を含んでなるコンストラクトは、任意の標準技術によって微生物宿主細胞または植物宿主細胞に導入されてもよい。これらの技術としては、例えば酢酸リチウム形質転換(Methods in Enzymology,194:186−187(1991))などの形質転換、微粒子銃衝撃、電気穿孔、マイクロインジェクション、または対象の遺伝子を宿主細胞に導入するその他のあらゆる方法が挙げられる。
便宜上、例えば発現カセット中に、DNA配列を取り込むように、あらゆる方法によって操作されている宿主細胞を「形質転換された」または「形質転換体」または「組み換え」と本明細書で称する。形質転換宿主は、発現カセットがゲノムに組み込まれるのか、増幅されるのか、または複数のコピー数を有する染色体外要素上に存在するのかに応じて、発現コンストラクトの少なくとも1つのコピーを有し、2つ以上を有してもよい。形質転換された宿主細胞は、導入されたコンストラクト上に含有されるマーカーについて選択することで同定できる。代案としては、多くの形質転換技術は多くのDNA分子を宿主細胞中に導入するので、所望のコンストラクトと共に別個のマーカーコンストラクトを同時形質転換してもよい。
典型的に形質転換された宿主は、選択的培地上で成長するそれらの能力について選択され、選択培地には抗生物質が組み込まれていてもよく、または非形質転換宿主の成長に必要な栄養素または成長因子などの要素が欠如していてもよい。導入されたマーカー遺伝子は、形質転換された宿主中で発現すると抗生物質耐性を与え、または必須成長因子または酵素をコードしてもよく、それによって選択培地上での成長を可能にしてもよい。発現したマーカーを直接または間接に検出し得る場合にもまた、形質転換された宿主を選択し得る。追加的な選択技術は、米国特許第7,238,482号明細書、米国特許第7,259,255号明細書、および米国特許第7,932,077号明細書に記載される。
形質転換に続いて、当該変異Δ5デサチュラーゼに適する基質(および任意選択的に、宿主細胞内で同時発現されるその他PUFA酵素)は、宿主によって自然にまたは遺伝子導入によって産生されてもよく、またはそれらは外部から提供されてもよい。
細菌、酵母、藻類、ストラメノパイル、卵菌綱、ユーグレナ属、真菌および/または植物をはじめとする多様な真核生物生物が、それによって本明細書に記載される変異Δ5デサチュラーゼを含んでなる形質転換体をもたらす宿主として適切である。これは転写、翻訳、およびタンパク質生合成装置が高度に保存されていることから考察される。したがって適切な宿主としては、広い温度およびpH値範囲にわたり、単純または複合糖質、脂肪酸、有機酸、油、グリセロール、およびアルコール、および/または炭化水素をはじめとする多様な原材料上で成長するものが挙げられるが、これに限定されるものではない。
好ましい微生物宿主は、油性生物である。これらの油性生物は天然に油を合成および蓄積でき、全含油量は、乾燥細胞重量[「DCW」]の約25%を超え、より好ましくはDCWの約30%を超え、より好ましくはDCWの約40%を超え、より好ましくはDCWの約50%を超え、最も好ましくはDCWの約60%を超えて構成し得る。様々な細菌、藻類、ユーグレナ属、コケ、真菌、酵母、およびストラメノパイルが油性として自然に分類される。代案の実施態様では、例えばサッカロミセス・セレヴィシエ(Saccharomyces cerevisiae)のような酵母などの非油性生物を遺伝子改変して、油性にし得る(国際公開第2006/102342号パンフレットを参照されたい)。
より好ましい実施態様では、微生物宿主細胞は、DCWの少なくとも25%を油として産生できる油性酵母である。典型的に油性酵母として同定される属としては、ヤロウィア属(Yarrowia)、カンジダ属(Candida)、ロドトルラ属(Rhodotorula)、ロドスポリジウム属(Rhodosporidium)、クリプトコッカス属(Cryptococcus)、トリコスポロン属(Trichosporon)、およびリポマイセス属(Lipomyces)が挙げられるが、これに限定されるものではない。より具体的には、例示的な油合成酵母としては、ロドスポリジウム・トルロイデス(Rhodosporidium toruloides)、リポマイセス・スターケイ(Lipomyces starkeyii)、L.リポフェラス(L.lipoferus)、カンジダ・レブカウフィ(Candida revkaufi)、C.プリケリーマ(C.pulcherrima)、C.トロピカリス(C.tropicalis)、C.ユチリス(C.utilis)、トリコスポロン・プランズ(Trichosporon pullans)、T.クタネウム(T.cutaneum)、ロドトルラ・グルチヌス(Rhodotorula glutinus)、R.グラミニス(R.graminis)、およびヤロウィア・リポリティカ(Yarrowia lipolytica)が挙げられる。
最も好ましいのは、油性酵母ヤロウィア・リポリティカ(Yarrowia lipolytica)である。さらなる実施態様では、最も好ましいのはATCC#20362、ATCC#8862、ATCC#18944、ATCC#76982および/またはLGAMS(7)1と称されるY.リポリティカ(Y.lipolytica)株である(Papanikolaou S.,and Aggelis G.,Bioresour.Technol.,82(1):43−9(2002))。
油性酵母(たとえばヤロウィア・リポリティカ(Yarrowia lipolytica))の形質転換に応用できる特定の教示としては、米国特許第4,880,741号明細書および米国特許第5,071,764号明細書、およびChen,D.C.et al.(Appl.Microbiol.Biotechnol.,48(2):232−235(1997))が挙げられる。Y.リポリティカ(Y.lipolytica)中におけるARA、EPAおよびDHA生成の遺伝子操作に応用できる特定の教示は、それぞれ米国特許第7,588,931号明細書、米国特許出願公開第2009−0093543−A1号明細書、米国特許出願公開第2010−0317072−A1号明細書、および米国特許第7,550,286号明細書で提供される。
この酵母中における遺伝子の好ましい発現方法は、宿主ゲノムへの線状DNAの組み込みによる。遺伝子座Ura3、Leu2、Lys5、Aco2、Pox3、Lip1、Lip2、SCP2、Pex3、Pex16および/またはPex10などのゲノム内の複数位置への組み込みは、遺伝子の高レベルの発現が所望される場合に、特に有用であり得る(例えば米国特許出願公開第2009−0093543−A1号明細書、および米国特許出願公開第2010−0317072−A1号明細書を参照されたい)。
ヤロウィア・リポリティカ(Yarrowia lipolytica)で使用される好ましい選択方法は、カナマイシン、ハイグロマイシン、およびアミノグリコシドG418に対する耐性、ならびにウラシル、ロイシン、リジン、トリプトファンまたはヒスチジンが欠如している培地上で成長する能力である。5−フルオロオロト酸(5−フルオロウラシル−6−カルボン酸一水和物;「5−FOA」)もまた、酵母Ura−変異体の選択のために特に有用であることもあり(米国特許出願公開第2009−0093543−A1号明細書)、またはスルホニル尿素除草剤耐性をもたらす天然アセトヒドロキシ酸シンターゼ(またはアセト乳酸シンターゼ;E.C.4.1.3.18)(米国特許第7,932,077号明細書)を利用して、形質転換体を選択してもよい。部位特異的リコンビナーゼシステムの使用によって、複数逐次形質転換で使用するために好ましい選択マーカーのペアを「再利用する」ユニークな方法もまた、米国特許出願公開第2009−0093543−A1号明細書で教示される。
上に基づいて、本明細書で開示されるのは
(a)(i)少なくとも1つの制御配列と作動可能に結合して、変異Δ5デサチュラーゼポリペプチドをコードする、第1の組換えヌクレオチド分子;および
(ii)それぞれDGLAおよび/またはETAからなるデサチュラーゼ基質源
を含んでなる、油性酵母(例えばヤロウィア・リポリティカ(Yarrowia lipolytica))を提供するステップと;
(b)ステップ(a)の酵母を適切な発酵性炭素源の存在下で培養し、変異Δ5デサチュラーゼポリペプチドをコードする遺伝子が発現されて、それぞれDGLAがARAに変換されおよび/またはETAがEPAに変換されるステップと;
(c)任意選択的にステップ(b)のARAおよび/またはEPAをそれぞれ回収するステップを含んでなる、ARAまたはEPAのいずれかをそれぞれ生成する方法である。
基質供給が必要なこともある。好ましい実施形態では、変異Δ5デサチュラーゼポリペプチドは、配列番号139[EgD5R*−34g157g]、配列番号141[EgD5R*−34g158a]、配列番号143[EgD5R*−34g158g]、配列番号145[EgD5R*−34h158a]、配列番号147[EgD5R*−34h158g]、配列番号149[EgD5R*−36s158a]、配列番号151[EgD5R*−36s158g]、配列番号153[EgD5M、(コドン最適化EgD5R*−34g158g)]、配列番号157[EgD5M1、(コドン最適化EgD5R*−34g158g347s)]、配列番号181[EgD5S−36s156e]、配列番号183[EgD5S−36s157g]、配列番号185[EgD5S−36s158a]、配列番号187[EgD5S−36s158g]、配列番号213[EaD5S−35a158g]、配列番号215[EaD5S−35a158s]、配列番号217[EaD5S−35a159g]、配列番号255[EgD5R−34g158g]、配列番号260[EgD5R−34g158a]、配列番号271[EaD5−35g159g]、および配列番号276[EaD5−35g159a]からなる群から選択される。したがって例えば変異Δ5デサチュラーゼポリペプチドをコードする遺伝子のヌクレオチド配列は、例えば配列番号138、140、142、144、146、148、150、152、156、180、182、184、186、212、214、216、254、259、270、および275からなる群から選択されてもよい。
天然では油性酵母中で生成されるPUFAは、18:2脂肪酸(すなわちLA)、および一般的ではないが18:3脂肪酸(すなわちALA)に限定されるので、油性酵母を遺伝子改変し、本明細書に記載される変異Δ5デサチュラーゼに加えて長鎖PUFA生合成に必要な複数酵素を発現させて(それによって例えばDPAn−6、DPA、およびDHAを生成できるようにして)もよい。
具体的には、本明細書において油性酵母が検討され、前記酵母は、
a)少なくとも1つの制御配列と作動可能に結合して、変異Δ5デサチュラーゼポリペプチドをコードする、単離ポリヌクレオチドを含んでなる第1の組換えDNAコンストラクト;
b)少なくとも1つの制御配列と作動可能に結合して、Δ4デサチュラーゼ、Δ6デサチュラーゼ、Δ9デサチュラーゼ、Δ12デサチュラーゼ、Δ15デサチュラーゼ、Δ17デサチュラーゼ、Δ8デサチュラーゼ、Δ9エロンガーゼ、C14/16エロンガーゼ、C16/18エロンガーゼ、C18/20エロンガーゼ、およびC20/22エロンガーゼからなる群から選択されるポリペプチドをコードする、単離ポリヌクレオチドを含んでなる少なくとも1つの追加的な組換えDNAコンストラクトを含んでなる。
その他の適切な微生物宿主としては、油性細菌、藻類、ユーグレナ属、ストラメノパイル、卵菌綱、および真菌が挙げられる。この広範な微生物宿主グループ内で、特に興味深いのは、ω−3/ω−6脂肪酸を合成する微生物であり、またはこの目的で遺伝子改変し得るものである。したがって例えば誘導性プロモーターまたは調節プロモーター制御下における、本Δ5デサチュラーゼ遺伝子のいずれかによるモルティエラ・アルピナ(Mortierella alpina)(ARA生成のために商業的に使用される)の形質転換は、増大した量のARAを合成できる形質転換体生物を生じ得る。M.アルピナ(M.alpina)を形質転換する方法は、Mackenzie et al.(Appl.Environ.Microbiol.,66:4655(2000))によって記載される。同様に、ヤブレツボカビ目(Thraustochytriales)微生物(例えばスラウストキトリウム属(Thraustochytrium)、シゾキトリウム属(Schizochytrium)を形質転換させる方法が、米国特許第7,001,772号明細書で開示される。
本明細書に記載されるΔ5デサチュラーゼ遺伝子および遺伝子産物は、一般に「油料種子」植物と称される、異種油性植物内の細胞中で生成されてもよい。油料種子植物の例としては、大豆(GlycineおよびSoja種)、亜麻(Linum種)、ナタネ(Brassica種)、トウモロコシ、綿、紅花(Carthamus種)およびヒマワリ(Helianthus種)が挙げられるが、これに限定されるものではない。
一実施形態では、本発明は、植物中での発現に適する、少なくとも1つの調節配列と作動可能に結合して、本発明のΔ5デサチュラーゼポリヌクレオチドのいずれか1つを含んでなる、組換えコンストラクトに関する。
適切な時に所望の宿主組織中で所望の核酸断片を与える、翻訳可能なmRNAの発現によって、本発明を達成するのに十分な転写活性を有しさえすれば、Δ5デサチュラーゼコード配列の発現を駆動するように選択される植物プロモーターは、重要でない。異種または非異種(すなわち内在性)プロモーターのどちらでも使用して、本発明を実施し得る。例えば適切なプロモーターとしては、13−コングリシニンプロモーターのαプライムサブユニット、クニッツトリプシン阻害剤3プロモーター、アネキシンプロモーター(P34プロモーターとしても知られる;国際公開第2004/071178号パンフレット)、Glylプロモーター、13−コングリシニンプロモーターの13サブユニット、P34/Gly Bd m 30Kプロモーター、アルブミンプロモーター、LegAlプロモーター、およびLegA2プロモーターが挙げられるが、これに限定されるものではない。
次にプロモーターは、当業者に良く知られている従来の手段を使用して、センス方向で作動可能に結合される。
次に当業者に良く知られている方法(例えば形質移入、形質転換、および電気穿孔)によって、組換えコンストラクトを1つまたは複数の選択された植物細胞に導入してもよい。次に形質転換植物細胞を培養して、長鎖PUFA発現を可能にする適切な条件下で再生し、次にそれを任意選択的に回収して精製する。
植物細胞中における、少なくとも1つの所望の長鎖PUFAの一過性または安定発現のいずれかが、上述したように達成されてもよい。このようなPUFAはまた、形質転換植物から得られる種子、植物部位、または形質転換植物の種子から得られる油中で発現され得る。
植物部位としては、根、茎、芽、苗条、花粉、種子、腫瘍組織、および細胞および培養物の様々な形態(例えば単一細胞、プロトプラスト、胚、およびカルス組織)をはじめとするが、これに限定されるものではない、分化および未分化組織が挙げられる。植物組織は、植物中または植物器官、組織または細胞培養中にあってもよい。
「植物器官」という用語は、形態学的および機能的に異なった植物部位を構成する、植物組織または1群の組織を指す。
したがって本発明は、本発明の組換えコンストラクトで細胞を形質転換するステップと、組換えコンストラクトで形質転換された細胞を選択するステップを含んでなる、細胞を形質転換する方法にも関し、前記組換えコンストラクトは、Δ5デサチュラーゼ活性を有する変異ポリペプチドをコードするヌクレオチド配列を含んでなり、変異ポリペプチドのアミノ酸配列は、配列番号34[HxGx]に記載のアミノ酸モチーフおよび配列番号1[HxxxH]に記載のアミノ酸モチーフを含んでなり、配列番号34[HxGx]は配列番号7[HPGG]と同一でなく、配列番号1[HxxxH]は配列番号8[HDASH]と同一でない。
また関心が持たれるのは、本発明の変異Δ5デサチュラーゼポリヌクレオチドがある形質転換植物細胞を生成し、形質転換植物細胞から植物を再生する方法である。
双子葉植物を形質転換し(主にアグロバクテリウム・ツメフアシェンス(Agrobacterium tumefaciens)の使用によって)、遺伝子導入植物を得る方法は、特に綿(米国特許第5,004,863号明細書;米国特許第5,159,135号明細書);大豆(米国特許第5,569,834号明細書;米国特許第5,416,011号明細書);アブラナ属(Brassica)(米国特許第5,463,174号明細書);落花生(Cheng et al.,Plant Cell Rep.,15:653−657(1996);McKently et al.,Plant Cell Rep.,14:699−703(1995));パパイア(Ling,K.et al.,Bio/technology,9:752−758(1991));およびエンドウマメ(Grant et al.,Plant Cell Rep.,15:254−258(1995))で公表されている。その他の通常使用される植物形質転換方法のレビューについては、Newell,C.A.(Mol.Biotechnol.,16:53−65(2000))を参照されたい。これらの形質転換方法の1つは、アグロバクテリウム・リゾゲネス(Agrobacterium rhizogenes)を使用する(Tepfler,M.and Casse−Delbart,F.,Microbiol.Sci.,4:24−28(1987))。PEG融合(国際公開第92/17598号パンフレット)、電気穿孔(Chowrira,G.M.et al.,Mol.Biotechnol.,3:17−23(1995);Christou,P.et al.,Proc.Natl.Acad.Sci.Sci.USA,84:3962−3966(1987))、マイクロインジェクション、または粒子衝突(McCabe,D.E.et al.,Bio/Technology,6:923(1988);Christou et al.,PlantPhysiol.,87:671−674(1988))を使用した、DNAの直接送達を使用した大豆の形質転換が公表されている。
植物を植物組織から再生するための多様な方法がある。特定の再生方法は、出発植物組織および再生させる特定の植物種に依存する。単一植物プロトプラスト形質転換体からの、または様々な形質転換外植片からの植物の再生、発育、および栽培は、当該技術分野で周知である(Weissbach and Weissbach,In:Methods for Plant Molecular Biology,(Eds.),Academic:San Diego,CA(1988))。この再生および成長プロセスは、典型的に、形質転換細胞を選択するステップと、これらの個別の細胞を、胚発生から根付いた小植物段階に至る、通常の段階を通じて培養するステップを含む。遺伝子導入胚および種子は、同様に再生される。その後、得られた遺伝子導入された根付いた苗条は、土壌などの適切な植物増殖培地に植え付けられる。好ましくは、再生植物は自家受粉して、ホモ接合遺伝子導入植物を提供する。そうでなければ、再生植物から得られる花粉を作物学的に重要な系列の種子成長植物と交配させる。その反対に、これらの重要な系統の植物からの花粉を使用して、再生植物に受粉させる。所望のポリペプチドを含有する本発明の遺伝子導入植物が、当業者に良く知られている方法を使用して栽培される。
一実施形態では本発明は、
a)少なくとも1つの制御配列と作動可能に結合して、Δ5デサチュラーゼ活性を有する変異ポリペプチドをコードする、単離ポリヌクレオチドを含んでなる第1の組換えDNAコンストラクト;および
b)少なくとも1つの制御配列と作動可能に結合して、Δ4デサチュラーゼ、Δ5デサチュラーゼ、Δ6デサチュラーゼ、Δ9デサチュラーゼ、Δ12デサチュラーゼ、Δ15デサチュラーゼ、Δ17デサチュラーゼ、Δ9エロンガーゼ、C14/16エロンガーゼ、C16/18エロンガーゼ、C18/20エロンガーゼ、およびC20/22エロンガーゼからなる群から選択されるポリペプチドをコードする、単離ポリヌクレオチドを含んでなる少なくとも1つの追加的な組換えDNAコンストラクト
を含んでなる、油料種子植物に関する。
このような追加的なデサチュラーゼおよびエロンガーゼについては、特許および公開文献中の多数の参考文献で考察されている。(例えば米国特許第6,075,183号明細書、米国特許第5,968,809号明細書、米国特許第6,136,574号明細書、米国特許第5,972,664号明細書、米国特許第6,051,754号明細書、米国特許第6,410,288号明細書、米国特許第7,932,077、および国際公開第98/46763号パンフレット、国際公開第98/46764号パンフレット、国際公開第00/12720号パンフレット、国際公開第00/40705号パンフレット)。
使用されるカセットの組み合わせの選択は、形質転換させる油料種子植物細胞のPUFAプロファイルおよび/またはデサチュラーゼ/エロンガーゼプロファイルと、発現させる長鎖PUFAとにある程度左右される。
別の態様では、本発明は、
a)細胞を本発明の組換えコンストラクトで形質転換するステップと;
b)長鎖PUFAを産生する形質転換細胞を選択するステップと
を含んでなる、植物細胞中で長鎖PUFAを生成する方法に関する。
なおも別の態様では、本発明は、
(a)植物細胞を
i.少なくとも1つの制御配列と作動可能に結合して、Δ5デサチュラーゼ活性を有する変異ポリペプチドをコードする単離ポリヌクレオチドを含んでなる、第1の組換えDNAコンストラクト;および
ii.少なくとも1つの制御配列と作動可能に結合して、Δ4デサチュラーゼ、Δ5デサチュラーゼ、Δ6デサチュラーゼ、Δ9デサチュラーゼ、Δ12デサチュラーゼ、Δ15デサチュラーゼ、Δ17デサチュラーゼ、Δ9エロンガーゼ、C14/16エロンガーゼ、C16/18エロンガーゼ、C18/20エロンガーゼ、およびC20/22エロンガーゼからなる群から選択されるポリペプチドをコードする、単離ポリヌクレオチドを含んでなる、少なくとも1つの追加的な組換えDNAコンストラクト
で形質転換するステップと;
(b)植物をステップ(a)の形質転換細胞から再生するステップと;
(c)非形質転換植物から得られる種子中のレベルと比べて、PUFAレベルが変化している、ステップ(b)の植物から得られる種子を選択するステップと
を含んでなる、植物細胞中で少なくとも1つのPUFAを生成する方法に関する。
特に好ましい実施形態では、少なくとも1つの追加的な組換えDNAコンストラクトが、Δ9エロンガーゼ活性およびΔ8デサチュラーゼ活性を有するポリペプチドをコードする。
本明細書に記載される変異Δ5デサチュラーゼ発現のために選択される宿主に関わりなく、所望の発現レベルおよびパターンを示す株または植物系統を得るためには、複数形質転換体をスクリーニングしなくてはならない。例えばJuretzek et al.(Yeast,18:97ー113(2001))は、ヤロウィア・リポリティカ(Yarrowia lipolytica)中に組み込まれたDNA断片の安定性は、使用される個々の形質転換体、受容者株、および標的プラットフォームに左右されると述べた。このようなスクリーニングは、DNAブロットのサザン分析(Southern,J.Mol.Biol.,98:503(1975))、mRNA発現のノーザン分析(Kroczek,J.Chromatogr.Biomed.Appl.,618(1−2):133−145(1993))、タンパク質発現のウェスタンおよび/またはElisa分析、PUFA生成物の表現型分析またはGC分析によって達成されてもよい。
本変異Δ5デサチュラーゼの配列知識は、様々な宿主細胞中でω−3および/またはω−6脂肪酸生合成を操作する上で有用であろう。生化学的経路を操作する方法は当業者に良く知られており、油性酵母中、特にヤロウィア・リポリティカ(Yarrowia lipolytica)中で、そして油料種子植物中で、ω−3および/またはω−6脂肪酸生合成を最大化する多数の操作が可能であることが予測される。この操作は、PUFA生合成経路内の直接的代謝エンジニアリング、または炭素からPUFAへの生合成経路に寄与する経路の追加的操作を必要とするかもしれない。望ましい生化学的経路のアップレギュレート、および望ましくない生化学的経路のダウンレギュレートに有用な方法は、当業者に良く知られている。
例えばエネルギーまたは炭素についてω−3および/またはω−6脂肪酸生合成経路と競合する生化学的経路、または特定のPUFA最終産物の生成を妨げる天然PUFA生合成経路酵素を遺伝子破壊によって除去し、または例えばアンチセンスmRNAなどのその他の手段によってダウンレギュレートしてもよい。
ARA、EPAまたはDHAを増大させる手段としてのPUFA生合成経路内操作、およびその関連技術の詳細な考察は、それぞれ米国特許第7,588,931号明細書、米国特許第7,932,077号明細書、米国特許出願公開第2009−0993543−A1号明細書、および米国特許第7,550,286号明細書に提示され、TAG生合成経路およびTAG分解経路における望ましい操作(およびその関連技術)についても同様である。
上述の戦略のいずれか1つによって、脂肪酸生合成経路の発現を調節することが有用かもしれない。例えば本明細書で提供されるのは、ω−3および/またはω−6脂肪酸の生成のために、Δ9エロンガーゼ/Δ8デサチュラーゼ生合成経路およびΔ6デサチュラーゼ/Δ6エロンガーゼ生合成経路中の鍵酵素をコードする遺伝子を油性酵母または油料種子植物に導入する方法である。天然ではω−3および/またはω−6脂肪酸生合成経路を持たない油性酵母または油料種子中で本変異Δ5デサチュラーゼ遺伝子を発現させ、宿主生物の代謝エンジニアリングの様々な手段を使用して、これらの遺伝子の発現を連係させて、好ましいPUFA生成物の産生を最大化することが特に有用であろう。
形質転換された微生物宿主細胞をキメラ遺伝子の発現(例えばデサチュラーゼ、エロンガーゼ)を最適化する条件下で培養し、所望のPUFAの最大かつ最も経済的な収率を生じさせる。一般に最適化されてもよい培地条件としては、炭素源のタイプおよび量、窒素源のタイプおよび量、炭素対窒素比、異なる無機イオン量、酸素レベル、生育温度、pH、バイオマス生産相の長さ、油蓄積相の長さ、および細胞収穫時間および方法が挙げられる。油性酵母(例えばヤロウイア・リポリティカ(Yarrowia lipolytica))などの対象の微生物は、酵母抽出物−ペプトン−デキストロース液体培地[「YPD」]などの複合培地上で、または生育に必要な構成要素が欠如していることで所望の発現カセットの選択を強要する規定最少培地(例えば酵母菌窒素ベース(DIFCO Laboratories,Detroit,MI))上で一般に培養される。
本明細書に記載される方法および宿主細胞のための発酵培地は、米国特許第7,238,482号明細書および米国特許出願公開第2011−0059204−A1号明細書で開示されるような、適切な炭素源を含有しなくてはならない。本明細書の方法で利用される炭素源は多種多様な炭素含有源を包含してもよいことが考察されるが、好ましい炭素源は糖(例えばグルコース、転化糖、果糖、およびそれらの組み合わせ)、グリセロール、および/または脂肪酸である。
窒素は、無機(例えば(NH4)2SO4)または有機(例えば尿素またはグルタミン酸または「酵母抽出物」)原料から供給されてもよい。適切な炭素および窒素源に加えて、発酵培地はまた、油性宿主の成長と、PUFA産生に必須の酵素経路の促進とに適することが当業者に知られている、適切なミネラル、塩、補助因子、緩衝液、ビタミン、およびその他の構成要素を含有しなくてはならない。脂質およびPUFAの合成を促進する、Fe+2、Cu+2、Mn+2、Co+2、Zn+2、およびMg+2などのいくつかの金属イオンが、特に注目された(Nakahara,T.et al.,Ind.Appl.Single Cell Oils,D.J.Kyle and R.Colin,eds.pp61−97(1992))。
本明細書に記載される方法および宿主細胞に好ましい増殖培地は、酵母窒素原礎培地(DIFCO Laboratories,Detroit,MI)などの一般的な商業的に調製された培地である。その他の規定培地または合成増殖培地もまた使用してよく、形質転換宿主細胞の成長に適した培地は、微生物学または発酵化学当業者に知られている。発酵のための適切なpH範囲は典型的に約pH4.0〜pH8.0の間であり、初期成長条件範囲としてはpH5.5〜pH7.5が好ましい。発酵は好気性または嫌気性条件下で実行されてもよく、微好気条件が好ましい。
典型的に、代謝状態は、成長と脂肪合成/貯蔵の間で「平衡状態」でなくてはならないので、油性酵母細胞中の高レベルのPUFA蓄積は、二段階過程を必要とする。したがって最も好ましくは、油性酵母(例えばヤロウィア・リポリティカ(Yarrowia lipolytica))中でのPUFA生成のために、二段階発酵過程が必要である。このアプローチは米国特許第7,238,482号明細書に記載され、様々な適切な発酵過程デザイン(すなわちバッチ、流加、および連続)および成長中の配慮についても同様である。
PUFAは、宿主微生物中に、遊離脂肪酸として、またはアシルグリセロール、リン脂質、硫脂質または糖脂質などのエステル化形態で見られ、当該技術分野で周知の多様な手段を通じて、宿主細胞から抽出されてもよい。酵母脂質の抽出技術、品質分析、および許容基準に関する1つのレビューは、Z.Jacobs(Critical Reviews in Biotechnology,12(5/6):463−491(1992))である。A.Singh and O.Ward(Adv.Appl.Microbiol.,45:271−312(1997))による後処理過程の簡単なレビューもまた入手できる。
一般にPUFA精製のための手段としては、有機溶剤による抽出(例えば米国特許第6,797,303号明細書、および米国特許第5,648,564号明細書)、超音波処理、超臨界流体抽出(例えば二酸化炭素を使用する)、鹸化、および圧搾などの物理的手段、またはそれらの組み合わせが挙げられる。追加的な詳細については、米国特許第7,238,482号明細書を参照されたい。
ω−3および/またはω−6脂肪酸、特に例えばALA、GLA、ARA、EPA、DPA、およびDHAが組み込まれた多数の食品および飼料製品がある。長鎖PUFAを含んでなる微生物または植物バイオマス、PUFAを含んでなる部分的に精製されたバイオマス、PUFAおよび/または精製PUFAを含んでなる精製油は、食品および飼料製品中で機能して、現行の調合物に健康上の利点を与えることが考察される。より具体的にはω−3および/またはω−6脂肪酸を含有する油は、類似食品、肉製品、穀物製品、ベークド食品、スナック食品、および乳製品をはじめとするが、これに限定されるものではない、多様な食品および飼料製品中での使用に適する(例えば米国特許第7,588,931号明細書を参照されたい)。
本組成物を調合物中で使用して、医療栄養物、健康補助食品、乳児用調製粉乳、および医薬品をはじめとするメディカルフードに健康上の利点を与えてもよい。食品加工および食品調合の当業者は、一定量および組成の本油をどのように食品または飼料製品に添加してもよいかを理解するであろう。このような量は本明細書で「有効」量と称され、食品または飼料製品、栄養補給することが意図される食餌、またはメディカルフードまたは医療栄養物が矯正または治療することが意図される疾患によって決まる。
本組成物はまた、動物の健康を改善するために使用されてもよく;それらは動物の食料、飼料、および医薬品中で使用されてもよい。
本発明の具体化を例示するが、その可能なバリエーションの全てを完全に定義するものではない、以下の実施例において本発明についてさらに詳述する。
一般方法
実施例で使用される標準組換えDNAおよび分子クローニング技術は、当該技術分野で周知であり、1)Sambrook et al.;2)Silhavy et al.;および3)Ausubel et al.によって記載される。
微生物培養の維持および成長に適した材料と方法は、当該技術分野で周知である。以下の実施例で使用するのに適した技術は、Manual of Methods for General Bacteriology(Phillipp Gerhardt,R.G.E.Murray,Ralph N.Costilow,Eugene W.Nester,Willis A.Wood,Noel R.Krieg and G.Briggs Phillips,Eds),American Society for Microbiology:Washington,D.C.(1994));またはThomas D.Brock in Biotechnology:A Textbook of Industrial Microbiology,2nd ed.,Sinauer Associates:Sunderland,MA(1989)に記載される。微生物細胞の成長および維持のために使用される全ての試薬および材料は、特に断りのない限りAldrich Chemicals(Milwaukee,WI)、DIFCO Laboratories(Detroit,MI)、GIBCO/BRL(Gaithersburg,MD)、またはSigma Chemical Company(St.Louis,MO)から得られた。大腸菌(E.coli)株は、典型的に、ルリア・ベルターニ[「LB」]プレート上で、37℃で培養された。
一般的分子クローニングは、標準法(Sambrook et al.、前出)に従って実施された。DNA配列は、ダイターミネーター技術(米国特許第5,366,860号明細書;欧州特許第272,007号明細書)を使用し、ベクターおよび挿入特異的プライマーの組み合わせを使用して、ABI自動配列決定装置によって生成された。配列編集は、Sequencher(Gene Codes Corporation,Ann Arbor,MI)中で実施された。全ての配列は、両方向の少なくとも2回のカバレッジに相当する。遺伝子配列の比較は、DNASTARソフトウェア(DNASTAR Inc.,Madison,WI)を使用して達成された。
略語の意味は、次の通り。「sec」は秒を意味し、「min」は分を意味し、「h」または「hr」は時間を意味し、「d」は日を意味し、「μL」はマイクロリットルを意味し、「mL」はミリリットルを意味し、「L」はリットルを意味し、「μM」はマイクロモルを意味し、「mM」はミリモルを意味し、「M」はモルを意味し、「mmol」はミリモルを意味し、「μmole」マイクロモルを意味し、「g」はグラムを意味し、「μg」はマイクログラムを意味し、「ng」はナノグラムを意味し、「U」は単位を意味し、「bp」は塩基対を意味し、「kB」はキロベースを意味する。
発現カセット命名法:
発現カセットの構造は簡易表記体系「X::Y::Z」で表され、Xはプロモーター断片を記載し、Yは遺伝子断片を記載し、Zはターミネーター断片を記載し、それらは全て互いに作動的に連結する。
ヤロウィア・リポリティカ(Yarrowia lipolytica)の形質転換および培養:
ATCC登録番号#20362、#76982、および#90812のY.リポリティカ(Y.lipolytica)株は、American Type Culture Collection(Rockville,MD)から購入された。Y.リポリティカ(Y.lipolytica)株は、典型的に下に示すレシピに従った、いくつかの培地中で28〜30℃で培養した。寒天プレートは、標準手順に従って、各液体培地に20g/Lの寒天を添加して、必要に応じて調製した。
YPD寒天培地(1Lあたり):10gの酵母抽出物[Difco];20gのバクトペプトン[Difco];および20gのグルコース。
基礎最少培地(MM)(1Lあたり):20gのグルコース;アミノ酸を含まない1.7gの酵母窒素原礎培地;1.0gのプロリン;およびpH6.1(調節なし)。
最少培地+ロイシン(MM+ロイシンまたはMMLeu)(リットルあたり):上の通りにMM培地を作成して、0.1gのロイシンを添加する。
高グルコース培地(HGM)(リットルあたり):80のグルコース;2.58gのKH2PO4;および5.36gのK2HPO4;pH7.5(調節の必要なし)。
Y.リポリティカ(Y.lipolytica)の形質転換は、参照によって本明細書に援用する、米国特許出願公開第2009−0093543−A1号明細書に記載されるように実施した。
ヤロウィア・リポリティカ(Yarrowia lipolytica)の脂肪酸分析: 脂肪酸分析のためには、Bligh,E.G.& Dyer,W.J.(Can.J.Biochem.Physiol.,37:911−917(1959))に記載されるようにして、細胞を遠心分離によって収集し脂質を抽出した。ナトリウムメトキシドによる脂質抽出物のエステル交換によってFAMEを調製し(Roughan,G.and Nishida I.,Arch Biochem Biophys.,276(1):38−46(1990))、引き続いて30m×0.25mm(i.d.)HP−INNOWAX(Hewlett−Packard)カラムを装着した、Hewlett−Packard 6890 GCで分析した。オーブン温度は、170℃(25分間の保持時間)から、3.5℃/分で185℃にした。
直接塩基エステル交換のために、ヤロウィア(Yarrowia)培養物(3mL)を採取して蒸留水で1回洗浄し、Speed−Vac内において真空下で5〜10分間乾燥させた。サンプルにナトリウムメトキシド(1%;100μL)を添加して、次にサンプルをボルテックスして20分間振盪した。3滴の1M NaClおよび400μLのヘキサンを添加した後、サンプルをボルテックスして遠沈した。上層を除去し、上述のようにGCによって分析した。
代わりとして、発酵またはフラスコサンプルのいずれかからのブロスサンプルをルーチン分析するために、Lipid Analysis,William W.Christie,2003に記載される塩基触媒エステル交換法の変法を使用した。具体的には、ブロスサンプルを室温水中で迅速に解凍し、次に0.22μmのCorning(登録商標)Costar(登録商標)Spin−X(登録商標)遠心管フィルター(カタログ番号8161)と共に、風袋を測定した2mL微量遠心管内に量り入れた(0.1mg)。あらかじめ測定したDCWに応じて、サンプル(75〜800μl)を使用した。エッペンドルフ5430遠心分離機を使用して、サンプルを14,000rpmで5〜7分間、またはブロスを除去するのに必要な時間遠心分離した。フィルターを取り出して液体を排出し、約500μlの脱イオン水をフィルターに添加してサンプルを洗浄した。遠心分離して水を除去した後、フィルターを再度取り出して、液体を排出してフィルターを再度挿入した。遠心管を遠心分離機に今度は蓋を開けたまま、約3〜5分間再度挿入して乾燥させた。次にフィルターに遠心管の半ばまで切り込みを入れて、新鮮な2mL丸底エッペンドルフ管(カタログ番号2236335−2)に挿入した。切断されたフィルター容器の縁のみに接触し、サンプルまたはフィルター材料に接触しない適切な道具によって、フィルターを遠心管の底に押しつけた。既知量のトルエン中のC15:0 TAG(前出)、および500μlの新鮮に調整されたメタノール溶液中の1%ナトリウムメトキシドを添加した。サンプルペレットを適切な道具によってしっかりと砕き、遠心管を閉じて50℃ヒートブロックに30分間入れた(VWR カタログ番号12621−088)。次に遠心管を少なくとも5分間放冷した。次に400μlのヘキサンおよび500μlの1M NaCl水溶液を添加して、遠心管を2×6秒間ボルテックスして1分間遠心分離した。およそ150μlの上(有機)層をインサート付きGCバイアルに入れ、GCによって分析した。
ヤロウィア・リポリティカ(Yarrowia lipolytica)Y4036U株の構築
後述する実施例3〜5、7〜8、および10では、国際公開第2008/073367号パンフレットに記載されるY.リポリティカ(Y.lipolytica)Y4036U株(Leu−、Ura−)を宿主として使用した。
Y4036U株は、Y2224株(Ura3−、Ura3遺伝子の自律変異からのFOA耐性変異体)、Y4001株(Leu−表現型で17%EDAを産生する)、Y4001U1株(Leu−およびUra−)、およびY4036株(Leu−表現型で18%DGLAを産生する)の構築を介して、Y.リポリティカ(Y.lipolytica)ATCC#20362から誘導された。
野性型Y.リポリティカ(Y.lipolytica)ATCC#20362と比較したY4036U株の最終遺伝子型は、Ura3−、YAT1::ME3S::Pex16、EXP1::EgD9eS::Lip1、FBAINm::EgD9eS::Lip2、GPAT::EgD9e::Lip2、FBAINm::EgD8M::Pex20、EXP1::EgD8M::Pex16、GPD::FmD12::Pex20、YAT1::FmD12::OCTであった(FmD12はフザリウム・モニリフォルメ(Fusarium moniliforme)Δ12デサチュラーゼ遺伝子[米国特許第7,504,259号明細書]であり;ME3Sは、モルティエラ・アルピナ(Mortierella alpina)[米国特許第7,470,532号明細書]に由来するコドン最適化C16/18エロンガーゼ遺伝子であり;EgD9eは、ミドリムシ(Euglena gracilis)Δ9エロンガーゼ遺伝子[米国特許第7,645,604号明細書]であり;EgD9eSは、ミドリムシ(E.gracilis)[米国特許第7,645,604号明細書]に由来するコドン最適化Δ9エロンガーゼ遺伝子であり;EgD8Mは、ミドリムシ(E.gracilis)[米国特許第7,256,033号明細書]に由来する合成変異Δ8デサチュラーゼ遺伝子[米国特許第7,709,239号明細書]である。
実施例1
ミドリムシ(Euglena gracilis)Δ5デサチュラーゼ[「EgD5」]のための位相モデルの開発
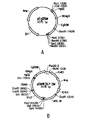
ミドリムシ(E.gracilis)からのΔ5デサチュラーゼ[「EgD5」;米国特許第7,678,560号明細書]内のHDASHモチーフの可能な重要性をより良く予測するために、下の論理および分析に基づいて位相モデル(図2)を開発した。
最初に、TMHMMプログラム(「Prediction of transmembrane helices in proteins」;TMHMM Server v.2.0,Center for Biological Sequence Analysis,BioCentrum−DTU,Technical University of Denmark,DK−2800 Lyngby,Denmark)を使用して、EgD5の膜貫通ドメインの分析を実施した。予測は、NおよびC末端の双方が膜の細胞質側に位置する、6つの膜貫通らせん(アミノ酸残基103〜125、130〜152、165〜187、234〜256、280〜302、および306〜328)を示唆した。
以下のEgD5の相同体を使用して、同様のTMHMM分析を実施した。GenBank受入番号AAT09160[ニッチア・クロステリウム(Nitzschia closterium)ミヌティシマ(minutissima)品種]、GenBank受入番号BAG71007[オブロンギキトリウム(Oblongichytrium)属SEK347種]、およびGenBank受入番号AAL92562[フェオダクチラム・トリコルナタム(Phaeodactylum tricornutum)]。各相同体毎に、4つの膜貫通部分が予測され、それはEgD5で予測された最初の2つおよび最後の2つの膜貫通ドメインに相当した。
膜結合脂肪酸デサチュラーゼは3つのヒスチジンに富む(Hisに富む)モチーフ、HX(3−4)H(配列番号1および2)、HX(2−3)HH(配列番号3および4)、および(H/Q)X(2−3)HH(配列番号5および6)を特徴とする、膜二鉄タンパク質のスーパーファミリーに属する。これらのHisに富む残基は、膜の細胞質面に位置することが予測されており、酵素活性に重要であることが示されている(Shanklin,J.et al.,Biochemistry,33:12787−12794(1994);Shanklin,J.,and Cahoon,E.B.,Annu.Rev.Plant Physiol.Plant Mol.Biol.,49:611−641(1998))。EgD5内では、最初のHisに富む領域(HDASH[配列番号8])が、アミノ酸残基165〜187に及ぶ第3の予測された膜貫通部分の前に位置する一方、第2のHisに富む領域(HIMRHH[配列番号4])はこの膜貫通部分の後ろに位置する。第3の膜貫通部分が実際に膜の内外にまたがれば、第2のHisに富む領域は細胞膜周辺腔内に位置し、したがってその鉄活性部位への関与を妨げる。その結果、第3の膜貫通部分(アミノ酸残基165〜187)または第4の膜貫通部分(アミノ酸残基234〜256)のどちらも、膜貫通でないというという仮説が立てられた。これは3つのΔ5デサチュラーゼ相同体(すなわちGenBank受入番号AAT09160、BAG71007、およびAAL92562)のTMHMM予測と一致した。
Δ5デサチュラーゼ基質(すなわちDGLA、ETA)は高度に疎水性であるので、恐らく脂質二重層内に分配されることが推測された。同様に、3つのHisに富むクラスターから組み立てられる活性部位は、恐らく膜表面にまたはその非常に近くに現れることが推測された。したがって、それぞれ残基165〜187および234〜256の間に発見され、TMHMMによって最初は膜を貫通すると予測された第3および第4の膜貫通部分は、そうではなく、膜表面近くに位置して、活性部位が確実に膜の近くに配置されるようにすることが予測された。アミノ酸残基103〜125、130〜152、280〜302、および306〜328の膜貫通領域は、TMHMMによる予測通りであった。
このようにして、EgD5について予測された最終トポロジーモデルを図2に示す。垂直の円柱が膜貫通ドメインを示す一方、水平の円柱は膜を貫通しないが、内膜表面近くに位置する2つの高度に疎水性の領域を示す。丸は、恐らくは活性部位に関与するHis残基に相当する。HPGG(配列番号7)モチーフおよびHDASH(配列番号8)モチーフの位置もまた同定された。最後に、「中」が細胞質空間に対応するのに対し、「外」は細胞膜周辺腔に相当する。
実施例2
デサチュラーゼ中の天然HDASH(配列番号8)モチーフ変動の測定
選択されたデサチュラーゼタンパク質配列を検査して、HDASH(配列番号8)モチーフ内に自然変動が起きたかどうかを判定した。具体的には、デサチュラーゼタンパク質としては、ミドリムシ(Euglena gracilis)Δ5デサチュラーゼ[「EgD5」;米国特許第7,678,560号明細書]と、モルティエラ・アルピナ(Mortierella alpina)Δ5デサチュラーゼ[「MaD5」;米国特許第5,972,664号明細書]と、その他の既知のΔ5デサチュラーゼに対するおよび/またはΔ5デサチュラーゼに密接に関係していることが知られているΔ6デサチュラーゼに対するBLASTヒットとが挙げられる。LASERGENEバイオインフォマティクス演算スイート(DNASTAR Inc.,Madison,WI)のMegAlign(商標)プログラムを使用して、選択された配列を配列比較し、HDASHモチーフ(またはその変種)を下の表4に要約する。
上の分析に基づいて、HDASH(配列番号8)モチーフのAsp[「D」]残基は恐らくGlu残基[「E」]によって置換され、Ala[「A」]残基は恐らくGly[「G」]、Ser[「S」]、Phe[「F」]、Tyr[「Y」]またはMet[「M」]残基によって置換され、および/またはHDASH(配列番号8)モチーフのSer[
「S」]残基は恐らくCys[「C」]、Asn[「N」]、Gly[「G」]、Ala[「A」]またはThr[T」]残基によって置換され得るようであった。
実施例3
野生型ミドリムシ(Euglena gracilis)Δ5デサチュラーゼ[「EgD5」]の配列
米国特許第7,678,560号明細書は、ミドリムシ(E.gracilis)からのΔ5デサチュラーゼ(すなわちEgD5、配列番号21)の単離およびクローニングを記載する。最近、クローンされたEgD5のより詳細な分析が、以前に認識されていなかった、EgD5Rと称されて本明細書で配列番号25として記載される、もう1つの変種「野生型」ミドリムシ(E.gracilis)Δ5デサチュラーゼ配列を同定した。米国特許第7,678,560号明細書に記載されるEgD5の位置347のSerアミノ酸残基の代わりに、EgD5R(配列番号25)は、位置347にArg残基を含んでなる。この矛盾は、PCRまたはcDNA作成手順の結果として生じるという仮説が立てられた。
具体的には、ミドリムシ(E.gracilis)の二本鎖cDNAをテンプレートとして5’−および3’−RACE技術を使用して、EgD5(配列番号20;米国特許第7,678,560号明細書の配列番号1に相当する)が得られた(米国特許第7,678,560号明細書の実施例4〜5)。次にミドリムシ(E.gracilis)cDNAをテンプレートとして使用して、ミドリムシ(E.gracilis)Δ5デサチュラーゼをコードするORFをPCRによって増幅し、精製して制限酵素消化して、次に適切なベクターに一方向性にライゲートしてpDMW367を得た(米国特許第7,678,560号明細書の実施例6)。pDMW367の配列は、米国特許第7,678,560号明細書で配列番号23として提供される(本明細書の配列番号38に相当する)。米国特許第7,678,560号明細書では、pDMW367はキメラFBAIN::EgD5::Pex20遺伝子を含んでなると報告されたが、このキメラ遺伝子内のΔ5デサチュラーゼ配列は、実際にはEgD5R(配列番号24)のヌクレオチド配列であることが今は理解されている。
EgD5(配列番号20)とEgD5R(配列番号24)(図3A、3B、3C、および3D)のアラインメントは、4つのヌクレオチドの相違を示し、配列番号20に関する変異は、G819A、T948C、C1041A、およびG1349Aである。G1349Aの変異は、pDMW367へのクローニングのためにEgD5を増幅するのに利用される、特定プライマー配列に起因する。EgD5(配列番号21)およびEgD5R(すなわち配列番号25)の翻訳産物のアラインメントは、単一アミノ酸の相違、すなわちS347Rの変異を明らかにする。
米国特許第7,678,560号明細書の実施例9はまた、ヤロウィア・リポリティカ(Yarrowia lipolytica)中での発現のためにコドン最適化された、EgD5に由来する、合成Δ5デサチュラーゼ(すなわちEgD5S;配列番号22および23)の作成を記載する。EgD5のコドン最適化は、1350bpのコード領域の内196bp(14.5%)の修飾、および全449コドンの内189コドン(42%)の最適化をもたらした。コドン最適化EgD5S遺伝子(すなわち配列番号23)によってコードされるタンパク質配列は、野生型タンパク質配列(すなわち配列番号21)と同一であり、347位置のアミノ酸はSerである。
実施例4
4つの制限エンドヌクレアーゼ部位が除去された野生型EgD5Rを含んでなるコンストラクトpDMW367−M4[「EgD5R*」]の作成
本実施例は、キメラFBAIN::EgD5R*::Pex20遺伝子を含んでなる、プラスミドpDMW367−M4の構築を記載する。EgD5R*(配列番号26)は、引き続くクローニング手順を容易にするために作成された野生型EgD5R(配列番号24)の修飾変種であり、修飾は、野生型EgD5Rコード領域からの4つの制限酵素部位(すなわちEcoRI、HindIII、BglII、およびNcoI)の除去をもたらした。EgD5R(配列番号25)およびEgD5R*(配列番号27)のアミノ酸配列は、同一であった。
具体的には、プラスミドpDMW367−M4(配列番号39;図4C)は、pDMW367(配列番号38、実施例3;図4A)に由来した。EgD5Rコード領域から、天然EcoRI HindIII、BglII、およびNcoI制限酵素部位を逐次除去して、pDMW367−M4を作成した。最初に、pDMW367(配列番号38)をテンプレートとして、2対のオリゴヌクレオチドをプライマーとして使用して、生体外変異誘発によってEcoRIおよびBglII部位を除去した。YL813(配列番号40)およびYL814(配列番号41)のプライマー対が、EcoI部位の変異を可能にした一方、YL815(配列番号42)およびYL816(配列番号43)のプライマー対は、BglII部位の変異を可能にした。これらの反応は、コンストラクトpDMW367−M2(図4B;配列番号44)を生成した。配列分析は、pDMW367−M2中の変種EgD5Rのアミノ酸配列が、pDMW367中のEgD5Rのアミノ酸配列と同一であることを確認した。
次に、pDMW367−M2をテンプレートとして、2対のオリゴヌクレオチドをプライマーとして使用して、生体外変異誘発によってHindIIIおよびNcoI部位を除去した。YL829(配列番号45)およびYL830(配列番号46)のプライマー対が、HindIII部位の変異を可能にした一方、YL831(配列番号47)およびYL832(配列番号48)のプライマー対は、NcoI部位の変異を可能にした。これは、pDMW367−M4の生成をもたらした。この場合もやはり、配列分析は、pDMW367−M4中の変種EgD5(すなわちEgD5R*)のアミノ酸配列が、pDMW367中のEgD5Rのアミノ酸配列と同一であることを確認した。
引き続く実施例では、野生型EgD5への言及は、特に断りのない限り、事実上、EgD5R(配列番号24および25)およびEgD5R*(配列番号26および27)への言及を含む。
実施例5
EgD5R*のΔ5デサチュラーゼ活性と同様のΔ5デサチュラーゼ活性をもたらすHDxSH(配列番号36)変異の同定
HDASH(配列番号8)モチーフは、EgD5R*(配列番号27)のアミノ酸残基155から159に広がる。pDMW367−M4(実施例4)をテンプレートとして、19対のオリゴヌクレオチド(配列番号49〜86;後述の表5)をプライマーとして使用して単一アミノ酸変異を実施し、部位特異的変異誘発(QuickChange Kit,Stratagene,CA)によって、EgD5R*のHDASH(配列番号8)モチーフのAla残基を個々に変異させ、それによって全ての可能なアミノ酸置換を作り出した(すなわちHDxSH[配列番号36]変異体)。各変異からのプラスミドを大腸菌(E.coli)XL2Blue細胞に形質転換した。19個の各形質転換から3個のコロニーを拾い、液体培地中において37℃で一晩、個別培養した。プラスミド(すなわち合計57個)をこれらの培養物から単離し、個々に配列決定して変異を確認した。
一般方法に記載されるように、野性型pDMW367−M4プラスミドおよび単離された変異プラスミドをY.リポリティカ(Y.lipolytica)Y4036U1株に個々に形質転換した。形質転換体をMMLeuプレート上で選択した。30℃で2日間の培養後、形質転換反応からの各3つの形質転換体を新しいMMLeuプレート上に画線塗抹し、30℃でさらに2日間培養した。次にコロニーを使用して、24ウェルQiagenブロック内の3mLのMMLeuに接種した。30℃の恒温器内でブロックを200rpmで振盪しながら、インキュベートした。培養物を2日間インキュベートした後、ブロックを遠心分離して上清を除去し、3mLのHGMを添加した。ブロックを30℃の恒温器内に戻し、さらに5日間200rpmで振盪した。細胞を遠心分離により収集して脂質を抽出し、エステル交換により脂肪酸メチルエステル[「FAME」]を調製して、引き続いてHewlett−Packard 6890 GCで分析した。
各変異体HDxSH(配列番号36)モチーフに起因する、Δ5デサチュラーゼ活性(3つの形質転換体の平均)を下の表5に要約する。EgD5R*変異体を含んでなる、変異pDMW367−M4コンストラクトを含んでなる、形質転換体は、EgD5R*内の位置157のAla残基で起きたアミノ酸置換に準じて命名される(すなわち形質転換体pDMW367M4−157cは、EgD5R*−157cと称される、位置157でAlaを置換するCysを有し、それによってHDcSH[配列番号277]モチーフをもたらす、変異Δ5デサチュラーゼを含んでなり;形質転換体pDMW367M4−157gは、EgD5R*−157gと称される、Alaを置換するGlyを有し、それによってHDgSH[配列番号15]モチーフをもたらす、変異Δ5デサチュラーゼを含んでなるなど)。変換効率(「平均変換効率」)は、次式に従って測定される:([生成物]/[基質+生成物])*100、式中、「生成物」は、即時生成物と、それに由来する経路中の全ての生成物とを含む。結果をプラスミドpDMW367−M4内の野生型EgD5R*(配列番号26)と比較し、GC分析は、形質転換体によって総脂質の10.8%のDGLAおよび3.6%のARAが生成されたと判定した(すなわち平均変換効率は24.8%であった)。
上に基づいて、HDASH(配列番号8)モチーフ内のAla残基は、EgD5R*のΔ5デサチュラーゼ活性に実質的に影響を及ぼすことなく、GlyまたはSerのいずれかで置換し得ることが明らかである。具体的には、pDMW367M4−157g形質転換体中のEgD5R*−157g(配列番号87)が、23.8%の変換効率でDGLAをARAに変換できたのに対し、pDMW367M4−157s形質転換体中のEgD5R*−157s(配列番号88)は、23.3%の変換効率でDGLAをARAに変換できた。
実施例6
EgD5R*のΔ5デサチュラーゼ活性と同様のΔ5デサチュラーゼ活性をもたらすHDAxH(配列番号37)変異の同定
pDMW367−M4(実施例4)をテンプレートとして、19対のオリゴヌクレオチド(配列番号89〜126;後述の表6)をプライマーとして使用して、単一アミノ酸変異を実施し、部位特異的変異誘発(QuickChange Kit,Stratagene,CA)によって、EgD5R*(配列番号27)のHDASH(配列番号8)モチーフのSer残基を個々に変異させ、それによって全ての可能なアミノ酸置換を作り出した(すなわちHDAxH[配列番号37]変異体)。実施例5に記載されるようにして、変異誘発に続いてプラスミドをY.リポリティカ(Y.lipolytica)Y4036U1に形質転換し、MMLeuおよびHGM中で形質転換体を選択して培養し、FAMEを調製してGCによって分析した。
各変異体HDASH(配列番号8)モチーフ内の各変異に起因する、Δ5デサチュラーゼ活性(3つの形質転換体の平均)を下の表6に要約する。EgD5R*変異体を含んでなる、変異pDMW367−M4コンストラクトを含んでなる、形質転換体は、EgD5R*内の位置158のSer残基で起きたアミノ酸置換に準じて命名される(すなわち形質転換体pDMW367M4−158aは、EgD5R*−158aと称される、位置158でSerを置換するAlaを有し、それによってHDAaH[配列番号17]モチーフをもたらす、変異Δ5デサチュラーゼを含んでなり;形質転換体pDMW367M4−158rは、EgD5R*−158rと称される、Serを置換するArgを有し、それによってHDArH[配列番号306]モチーフをもたらす、変異Δ5デサチュラーゼを含んでなるなど)。変換効率は、実施例5に記載される式に従って判定した。結果をプラスミドpDMW367−M4内の野生型EgD5R*(配列番号26)と比較し、GC分析は、形質転換体によって総脂質の11.3%のDGLAおよび3.4%のARAが生成されたと判定した(すなわち平均変換効率は23.3%であった)。
結果は、HDASH(配列番号8)モチーフ内のSer残基が、EgD5R*のΔ5デサチュラーゼ活性に実質的に影響を及ぼすことなく、AlaまたはGlyのいずれかで置換し得ることを実証した。具体的には、pDMW367M4−158a形質転換体中のEgD5R*−158a(配列番号127)が23.5%の変換効率でDGLAをARAに変換できたのに対し、pDMW367M4−158g形質転換体中のEgD5R*−158g(配列番号128)は、25.1%の変換効率でDGLAをARAに変換できた。
実施例7
EgD5R*のΔ5デサチュラーゼ活性と同様のΔ5デサチュラーゼ活性をもたらすHxGx(配列番号34)およびHDxxH(配列番号311)変異の同定
米国特許出願公開第2010−0075386−A1号明細書は、チトクロームb5様ドメインのHPGG(配列番号7)モチーフ内に少なくとも1つの変異を有する、変異Δ5デサチュラーゼを記載する(すなわちHxGx[配列番号34]変異)。HPGG(配列番号7)モチーフは、EgD5R(配列番号25)のアミノ酸残基33から36に広がる。
本実施例は、EgD5R*−157g(実施例5、配列番号87)、EgD5R*−158a(実施例6、配列番号127)、およびEgD5R*−158g(実施例6、配列番号128)のHPGG(配列番号7)モチーフ内に変異を導入して、HPGG(配列番号7)およびHDASH(配列番号8)ドメイン内の二重変異の効果を調べる。
pDMW367M4−157g(実施例5、配列番号129)、pDMW367M4−158a(実施例6、配列番号130)、およびpDMW367−158g(実施例6、配列番号131)をテンプレートとして、数対のオリゴヌクレオチド(配列番号132〜137;表7)をプライマーとして使用して、単一アミノ酸変異を実施し、部位特異的変異誘発(QuickChange Kit,Stratagene,CA)によって、変異Δ5デサチュラーゼ遺伝子のHPGG(配列番号7)モチーフのPro残基または第2のGly残基のいずれかを個々に変異させ、それによってHPGG(配列番号7)およびHDASH(配列番号8)モチーフ内に二重変異を作り出した。実施例5に記載されるようにして、変異誘発に続いてプラスミドをY.リポリティカ(Y.lipolytica)Y4036U1株に形質転換し、MMLeuおよびHGM中で形質転換体を選択して培養し、FAMEを調製してGCによって分析した。
HxGx(配列番号34)およびHDxxH(配列番号311)変異の双方がある、変異Δ5デサチュラーゼのΔ5デサチュラーゼ活性を下の表7に要約する。EgD5R*変異体を含んでなる、変異pDMW367M4コンストラクトを含んでなる、形質転換体は、EgD5R*のHDASH(配列番号8)モチーフ内のAla残基またはSer残基のアミノ酸置換と組み合わさった、EgD5R*のHPGG(配列番号7)モチーフ内のPro残基または第2のGly残基のアミノ酸置換に準じて命名される。すなわち、例えば形質転換体pDMW367−34g158gは、EgD5R*−34g158gと称される、位置34でProを置換するGlyを有し(それによってHgGG[配列番号9]モチーフをもたらし)、位置158でSerを置換するGlyを有する(それによってHDAgG[配列番号18]モチーフをもたらす)、変異Δ5デサチュラーゼを含んでなる。変換効率は、実施例5に記載される式に従って判定した。結果をプラスミドpDMW367−M4内の野生型EgD5R*と比較し、GC分析は、形質転換体によって総脂質の11.7%のDGLAおよび4.4%のARAが生成されたと判定した(すなわち平均変換効率は27.5%であった)。
結果はHPGG(配列番号7)モチーフおよびHDASH(配列番号8)モチーフがΔ5デサチュラーゼ酵素活性にとって重要ではあるが、野生型と比べて少なくとも64%の
Δ5デサチュラーゼ活性を保つ、HxGx(配列番号34)HDxxH(配列番号311)モチーフを有するデサチュラーゼが構築されてもよいことを実証した。具体的には、1)HDASH(配列番号8)モチーフ内のAla残基のGlyによる置換;または2)残基HDASH(配列番号8)モチーフ内のSerのAlaまたはGlyによる置換のいずれかの同時置換と共に、HPGG(配列番号7)モチーフ内のPro残基をGlyで置換し得る。HDASH[配列番号8]モチーフ内のSerのAlaまたはGlyのいずれかによる同時置換と共に、HPGG[配列番号7]モチーフ内のPro残基もまたHisで置換し得る。そしてHDASH[配列番号8]モチーフ内のSerのAlaまたはGlyのいずれかによる同時置換と共に、HPGG[配列番号7]モチーフ内の第2のGly残基をSerで置換し得る。
好ましい二重変異体は、EgD5R*−34g157g(配列番号139;pDMW367−34g157g形質転換体中において22.9%の変換効率でDGLAをARAに変換できる)、EgD5R*−34g158a(配列番号141;pDMW367−34g158a形質転換体中において24.3%の変換効率でDGLAをARAに変換できる)、およびEgD5R*−34g158g(配列番号143;pDMW367−34g158g形質転換体中において26.8%の変換効率でDGLAをARAに変換できる)であった。
実施例8
EgD5R*−34g158gに由来する、ヤロウィア・リポリティカ(Yarrowia lipolytica)中における発現のためのN末端コドン最適化変異Δ5デサチュラーゼ遺伝子(「EgD5M」)の合成
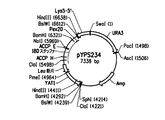
米国特許第7,125,672号明細書に記載されるのと同様の方法で、EgD5R*−34g158g(配列番号142、実施例7)の5’部分のコドン使用頻度をY.リポリティカ(Y.lipolytica)中での発現のために最適化した。具体的には、EgD5R*−34g158gの最初の204bpをコドン最適化して、「EgD5M」(配列番号152および153)と称されるコドン最適化Δ5デサチュラーゼ遺伝子の合成をもたらした。EgD5Mは、ヤロウィア属(Yarrowia)コドン使用頻度パターン(米国特許第7,125,672号明細書)、「ATG」翻訳開始コドン周囲の共通配列、およびRNA安定性の一般則(Guhaniyogi,G.and J.Brewer,Gene,265(1−2):11−23(2001))に従って、EgD5R*−34g158gのΔ5デサチュラーゼ遺伝子のコード配列に基づいてデザインされた。翻訳開始部位の修飾の他に、コード領域のN末端内の204bpの内52bpが修飾された(25.5%;図5)、およびデサチュラーゼタンパク質のN末端内の68個のアミノ酸の内45個のコドンが最適化された(66.2%)。NcoI部位およびNotI部位は、EgD5Mの翻訳開始コドン周囲および停止コドン後に、それぞれ組み込まれた。コドン最適化EgD5M遺伝子(すなわち配列番号153)によってコードされるタンパク質配列は、野生型EgD5R*−34g158gタンパク質配列(すなわち配列番号143)と同一である。デザインされたEgD5M遺伝子(配列番号152)は、GenScript Corporation(Piscataway,NJ)によって合成され、pUC57(GenBank受入番号Y14837)にクローンされて、pEgD5M(図6A;配列番号154)を生じた。
実施例9
EgD5Mを含んでなるコンストラクトpDMW367−5Mの作成
本実施例は、キメラFBAIN::EgD5M::Pex20遺伝子を含んでなる、プラスミドpDMW367−5Mの構築を記載する。pDMW367−M4(図4;配列番号39)のNcoI/NotIEgD5R*断片をpEgD5M(図6A;配列番号154)からのNcoI/NotIEgD5M断片で置換して、プラスミドpDMW367−5M(図6B;配列番号155)を構築した。このライゲーションの生成物はpDMW367−5Mであり、それは以下の構成要素を含有した。
実施例10
N末端コドン最適化変異Δ5デサチュラーゼ遺伝子の変種「EgD5M1」を含んでなるコンストラクトpDMW367−5M1の作成
本実施例は、キメラFBAIN::EgD5M1::Pex20遺伝子を含んでなる、プラスミドpDMW367−5M1の構築を記載する。EgD5M中の位置347のArgのためのCGAコドンが、EgD5M1中ではSerのためのAGCコドンをコードするように変化していることを除いて、EgD5M1(配列番号156)のヌクレオチド配列は、EgD5M(配列番号152)と同一である。この修飾は、Δ5デサチュラーゼ活性に対する、R347S変異(実施例3に記載される)の効果を分析するためにデザインされた。
デザインされたEgD5M1遺伝子(「EgD5R*−34g158g347S」とも称される;配列番号156)は、GenScript Corporation(Piscataway,NJ)によって合成され、pUC57(GenBank受入番号Y14837)にクローンされて、pEgD5M1(配列番号158)を生じた。
pDMW367−M4(図4;配列番号39)のNcoI/NotIEgD5R*断片をpEgD5M1(配列番号158)からのNcoI/NotIEgD5M1断片で置換して、プラスミドpDMW367−5M1(配列番号159)を構築した。このライゲーションの生成物は、キメラFBAIN::EgD5M1::Pex20遺伝子を含んでなるpDMW367−5M1であった。
実施例11
ヤロウィア・リポリティカ(Yarrowia lipolytica)Y4036U1株中のEgD5MおよびEgD5M1Δ5デサチュラーゼの機能分析
対照プラスミドpDMW367−M4(配列番号39;実施例4)およびプラスミドpDMW367−5M(配列番号155;実施例9)、およびpDMW367−5M1(配列番号159;実施例10)をY.リポリティカ(Y.lipolytica)Y4036U1株に、それぞれ別々に形質転換した。実施例5に記載されるようにして、形質転換体をMMLeuおよびHGM上で選択して培養し、FAMEを調製してGCによって分析した。
EgD5R*、EgD5M、およびEgD5M1のΔ5デサチュラーゼ活性(3つの形質転換体の平均)を下の表9に要約する。変換効率(「Conv.Effic.」)は、実施例5に記載される式に従って判定した。結果をプラスミドpDMW367−M4内の野生型EgD5R*(配列番号26)と比較し、GC分析は、形質転換体によって総脂質の10.8%のDGLAおよび3.6%のARAが生成されたと判定した(すなわち平均変換効率は24.8%であった)。
結果はEgD5M(配列番号153)およびEgD5M1(配列番号157)の双方が、野生型EgD5R*(配列番号27)よりも高いΔ5デサチュラーゼ活性を有したことを実証した。EgD5Mと比べて改善されたEgD5M1のΔ5デサチュラーゼ活性は、アミノ酸残基347がタンパク質のΔ5デサチュラーゼ活性に影響を及ぼし、Argとは対照的にSerが好ましいことを実証する。
実施例12
ヤロウィア・リポリティカ(Yarrowia lipolytica)中での発現のためにコドン最適化された、ミドリムシ(Euglena gracilis)に由来する、合成Δ5デサチュラーゼ遺伝子(「EgD5S」)中のHPGs(配列番号11)およびHxxxH(配列番号1)変異の同定
本実施例は、変異EgD5S−36s(または「EgD5S−HPGs」)遺伝子のHDASH(配列番号8)モチーフ内に変異を導入して、HPGG(配列番号7)およびHDASH(配列番号8)の保存ドメイン内の二重変異の効果を判定する。
EgD5S(配列番号22および23)は、Y.リポリティカ(Y.lipolytica)中での発現のためにコドン最適化された、EgD5(実施例3)に由来する、合成Δ5デサチュラーゼである(米国特許第7,678,560号明細書)。EgD5Sのアミノ酸配列はEgD5と同一であるが、ヌクレオチド配列が異なり;具体的には、翻訳開始部位の修飾に加えて、1350bpのコード領域の内196bp(14.5%)が修飾され、189コドン(42%)が最適化されていた。GC含有量は、野性型遺伝子(すなわちEgD5)内の55.5%から、合成遺伝子(すなわちEgD5S)内の54.4%に低下した。そしてNcoI部位およびNotI部位は、EgD5Sの翻訳開始コドン周囲および停止コドン後に、それぞれ組み込まれた。
米国特許出願公開第2010−0075386−A1号明細書の実施例1〜4は、チトクロームb5様ドメインのアミノ酸残基33〜36に広がる、EgD5SのHPGG(配列番号7)モチーフ内の第2のGly残基の修飾(すなわちHPGx[配列番号33]変異)を標的とする、部位特異的変異誘発反応のテンプレートとしてEgD5Sを使用した、変異EgD5S−36s(配列番号160)の同定を記載する。このようにして変異EgD5S−36sはHPGs(配列番号11)モチーフを含んでなり、その中でHPGG(配列番号7)モチーフの第2のGly残基は、EgD5S(配列番号23)をテンプレートとして使用してSerによって置換された。EgD5S−36sのΔ5デサチュラーゼ活性(米国特許出願公開第2010−0075386−A1号明細書)は、EgD5SのΔ5デサチュラーゼ活性の約106.9%であった。プラスミドpDMW369S(配列番号161)は変異EgD5S−36s遺伝子を含有し;ベクター構成要素は、EgD5M遺伝子の代わりに変異EgD5S−36s遺伝子があることを除いて)、pDME367−5M(本明細書の図6B)と同様である。
実施例7における二重EgD5R*変異体(すなわち変異HPGG[配列番号7]と変異HDASH[配列番号8]モチーフを同時に含んでなる)の成功裏の作成に基づいて、同様のHxxxH(配列番号1)変異をEgD5S−36sに導入した際に、耐容されることが予期された。具体的には、pDMW369S(キメラFBAIN::EgD5S−36S::Pex20遺伝子を含んでなる)をテンプレートとして、9対のオリゴヌクレオチド(配列番号162〜179;表10)をプライマーとして使用して、単一アミノ酸変異を実施し、部位特異的変異誘発(QuickChange Kit,Stratagene,CA)によって、EgD5S−36s(配列番号160)のHDASH(配列番号8)モチーフ内のAsp、AlaまたはSer残基のいずれかを個々に変異させ、それによって選択された9個のアミノ酸置換を作り出した。実施例5に記載されるようにして、変異誘発に続いてプラスミドをY.リポリティカ(Y.lipolytica)Y4036U1株に形質転換し、MMLeuおよびHGM中で形質転換体を選択して培養し、FAMEを調製してGCによって分析した。
HPGs(配列番号11)およびHxxxH(配列番号1)変異の双方がある、変異Δ5デサチュラーゼのΔ5デサチュラーゼ活性(3つの形質転換体の平均)を下の表10に要約する。EgD5S−36sの変異体を含んでなる、変異pDMW369Sコンストラクトを含んでなる、形質転換体は、HDASH(配列番号8)モチーフ内のAsp、AlaまたはSer残基で起きたアミノ酸置換に準じて命名される(すなわち形質転換体pDMW369S−156eは、EgD5S−36s156eと称される、位置156でAspを置換するGluを有し、それによってHeASH[配列番号19]モチーフをもたらす、変異Δ5デサチュラーゼを含んでなり;形質転換体pDMW369S−157gはEgD5S−36s157gと命名される変異Δ5デサチュラーゼを含んでなり、Alaを置換するGlyを有し、それによってHDgSH[配列番号15]モチーフをもたらすなど)。変換効率は、実施例5に記載される式に従って判定した。結果をプラスミドpDMW369S内のEgD5S−36s(配列番号160)と比較し、GC分析は、形質転換体によって総脂質の8.1%のDGLAおよび6.8%のARAが生成されたと判定した(すなわち平均変換効率は45.8%であった)。
結果は、変異HPGGモチーフ(すなわちHPGs[配列番号11])のみを有する変異EgD5S−36sと比べて、なおも妥当なΔ5デサチュラーゼ活性を保ちながら、コドン最適化EgD5SΔ5デサチュラーゼが、変異HPGG(配列番号7)および変異HDASH(配列番号8)モチーフの双方を含んでなるように、修飾され得ることを実証した。好ましい二重変異体は、EgD5S−36s156e(配列番号180および181;pDMW369S−156e形質転換体中において36.2%の変換効率でDGLAをARAに変換できる)、EgD5S−36s157g(配列番号182および183;pDMW369S−157g形質転換体中において36.6%の変換効率でDGLAをARAに変換できる)、EgD5S−36s158a(配列番号184および185;pDMW369S−158a形質転換体中において39.1%の変換効率でDGLAをARAに変換できる)、およびEgD5S−36s158g(配列番号186および187;pDMW369S−158g形質転換体中において34.3%の変換効率でDGLAをARAに変換できる)であった。
実施例13
ヤロウィア・リポリティカ(Yarrowia lipolytica)中での発現のためにコドン最適化された、ユーグレナ・アナベナ(Euglena anabaena)に由来する、合成Δ5デサチュラーゼ遺伝子(「EaD5S」)中のHaGG(配列番号14)およびHxxxH(配列番号1)変異の同定
本実施例は、変異EaD5S−35a(または「EaD5S−HaGG」)遺伝子のHDASH(配列番号8)モチーフ内に変異を導入して、HPGG(配列番号7)およびHDASH(配列番号8)の保存ドメイン内の二重変異の効果を判定する。
米国特許第7,943,365号明細書は、E.アナベナ(E.anabaena)からのΔ5デサチュラーゼ(すなわちEaD5、配列番号28)の単離およびクローニングを記載する。次にこの遺伝子は、Y.リポリティカ(Y.lipolytica)中での発現のためにコドン最適化され、合成Δ5デサチュラーゼEaD5S(配列番号30)がもたらされる。EaD5Sのアミノ酸配列はEaD5と同一であるが、ヌクレオチド配列が異なり;具体的には、翻訳開始部位の修飾に加えて、1362bpのコード領域の内183bp(13.4%)が修飾され、174コドン(38.3%)が最適化されていた。GC含有量は、野性型遺伝子(すなわちEaD5)内の57.6%から、合成遺伝子(すなわちEaD5S)内の54.6%に低下した。そしてNcoI部位およびNotI部位は、EaD5Sの翻訳開始コドン周囲および停止コドン後に、それぞれ組み込まれた。
米国特許出願公開第2010−0075386−A1号明細書の実施例6は、チトクロームb5様ドメインのアミノ酸残基34〜37に広がる、EaD5SのHPGG(配列番号7)モチーフのPro残基の修飾(すなわちHxGG[配列番号32]変異)を標的とする、部位特異的変異誘発反応のテンプレートとしてEaD5Sを使用した、変異EaD5S−35a(配列番号188)の同定を記載する。このようにして変異EaD5S−35a(配列番号188)はHaGG(配列番号14)モチーフを含んでなり、その中でHPGG(配列番号7)モチーフのPro残基は、EaD5S(配列番号31)をテンプレートとして使用してAlaで置換された。EaD5S−35aのΔ5デサチュラーゼ活性(米国特許出願公開第2010−0075386−A1号明細書)は、EgD5SのΔ5デサチュラーゼ活性の約99.2%であった。プラスミドpZuFmEaD5S−A(S)(配列番号189)は変異EaD5S−35a遺伝子を含有し;ベクター構成要素は、EgD5M遺伝子の代わりに変異EaD5S−35a遺伝子があることを除いて)、pDMW367−5M(本明細書の図6B)と同一である。
実施例7における二重EgD5R*変異体、および実施例12における二重EgD5S変異体(すなわちHPGG[配列番号7]と変異HDASH[配列番号8]モチーフを同時に含んでなる変異)の成功裏の作成に基づいて、同様のHxxxH(配列番号1)変異をEaD5S−35aに導入した際に、耐容されることが予期された。HDASH(配列番号8)モチーフは、EaD5S〜EaD5S−35aのアミノ酸残基156〜160に広がる。
pZuFmEaD5S−A(S)(キメラFBAIN::EaD5S−35a::Pex20遺伝子を含んでなる)をテンプレートとして、9対のオリゴヌクレオチド(配列番号190〜211;表11)をプライマーとして使用して単一アミノ酸変異を実施し、部位特異的変異誘発(QuickChange Kit,Stratagene,CA)によって、EaD5S−35a(配列番号188)のHDASH(配列番号8)モチーフ内のAsp、AlaまたはSerを個々に変異させ、それによって選択された9個のアミノ酸置換を作り出した。実施例5に記載されるようにして、変異誘発に続いてプラスミドをY.リポリティカ(Y.lipolytica)Y4036U1株に形質転換し、MMLeuおよびHGM中で形質転換体を選択して培養し、FAMEを調製してGCによって分析した。
HaGG(配列番号14)およびHxxxH(配列番号1)変異を含んでなる、変異Δ5デサチュラーゼのΔ5デサチュラーゼ活性(3つの形質転換体の平均)を下の表11に要約する。EaD5S−35aの変異体を含んでなる、変異pZuFmEaD5S−A(S)コンストラクトを含んでなる、形質転換体は、HDASH(配列番号8)モチーフ内のAsp、AlaまたはSer残基で起きたアミノ酸置換に準じて命名される。すなわち形質転換体pZuFmEaD5S−A(S)−157eは、EaD5S−35a157eと称される、位置157でAspを置換するGluを有し、それによってHeASH[配列番号19]モチーフをもたらす、変異Δ5デサチュラーゼを含んでなり;形質転換体pZuFmEaD5S−A(S)−158gは、EaD5S−35a158gと称される、Alaを置換するGlyを有し、それによってHDgSH[配列番号15]モチーフなどをもたらす、変異Δ5デサチュラーゼを含んでなる。変換効率は、実施例5に記載される式に従って判定した。結果をプラスミドpZuFmEaD5S−A(S)内のEaD5S−35a(配列番号188)と比較し、GC分析は、形質転換体によって総脂質の8.6%のDGLAおよび5.1%のARAが生成されたと判定した(すなわち平均変換効率は37.2%であった)。
結果は、変異HPGGモチーフ(すなわちHaGG[配列番号14])のみを有する変異EaD5S−35aと比べて、なおも妥当なΔ5デサチュラーゼ活性を保ちながら、コドン最適化EaD5SΔ5デサチュラーゼが、変異HPGG(配列番号7)および変異HDASH(配列番号8)モチーフの双方を含んでなるように、修飾され得ることを実証した。好ましい二重変異体は、EaD5S−35a158g(配列番号212および213;pZuFmEaD5S−A(S)−158g形質転換体中において28.4%の変換効率でDGLAをARAに変換できる)、EaD5S−35a158s(配列番号214および215;pZuFmEaD5S−A(S)−158s形質転換体中において27.4%の変換効率でDGLAをARAに変換できる)、およびEaD5S−35a159g(配列番号216および217;pZuFmEaD5S−A(S)−159g形質転換体中において26.5%の変換効率でDGLAをARAに変換できる)であった。
実施例14
総脂肪酸の約58.7%のEPAを産生するヤロウィア・リポリティカ(Yarrowia lipolytica)Z1978株の作成
本実施例は、Δ9エロンガーゼ/Δ8デサチュラーゼ経路の発現を介して、38.3%の総脂質含量[「TFA%DCW」]で、総脂肪酸に対して約58.7%のEPA[「EPA%TFA」]を産生できる、ヤロウィア・リポリティカ(Yarrowia lipolytica)ATCC#20362に由来する、Z1978株の構築を記載する。
ヤロウィア・リポリティカ(Yarrowia lipolytica)Y9502株の遺伝子型
Y9502株の作成は、米国特許出願公開第2010−0317072−A1号明細書に記載される。ヤロウィア・リポリティカ(Yarrowia lipolytica)ATCC#20362に由来するY9502株は、Δ9エロンガーゼ/Δ8デサチュラーゼ経路の発現を通じて、総脂質に対して約57.0%のEPAを産生できた(図7)。
野生型Y.リポリティカ(Y.lipolytica)ATCC#20362と比較したY9502株の最終遺伝子型は、次の通りであった。Ura+,Pex3−,unknown1−,unknown2−,unknown3−,unknown4−,unknown5−,unknown6−,unknown7−,unknown8−,unknown9−,unknown10−,YAT1::ME3S::Pex16,GPD::ME3S::Pex20,YAT1::ME3S::Lip1,FBAINm::EgD9eS::Lip2,EXP1::EgD9eS::Lip1,GPAT::EgD9e::Lip2,YAT1::EgD9eS::Lip2,FBAINm::EgD8M::Pex20,EXP1::EgD8M::Pex16,FBAIN::EgD8M::Lip1,GPD::EaD8S::Pex16(2copies),YAT1::E389D9eS/EgD8M::Lip1,YAT1::EgD9eS/EgD8M::Aco,FBAINm::EaD9eS/EaD8S::Lip2,GPD::FmD12::Pex20,YAT1::FmD12::Oct,EXP1::FmD12S::Aco,GPDIN::FmD12::Pex16,EXP1::EgD5M::Pex16,FBAIN::EgD5SM::Pex20,GPDIN::EgD5SM::Aco,GPM::EgD5SM::Oct,EXP1::EgD5SM::Lip1,YAT1::EaD5SM::Oct,FBAINm::PaD17::Aco,EXP1::PaD17::Pex16,YAT1::PaD17S::Lip1,YAT1::YlCPT1::Aco,YAT1::MCS::Lip1,FBA::MCS::Lip1,YAT1::MaLPAAT1S::Pex16.略称は、次のとおり:FmD12は、フザリウム・モニリフォルメ(Fusarium moniliforme)Δ12デサチュラーゼ遺伝子[米国特許第7,504,259号明細書]であり;FmD12Sは、F.モニリフォルメ(F.moniliforme)[米国特許第7,504,259号明細書]に由来するコドン最適化Δ12デサチュラーゼ遺伝子であり;ME3Sは、モルティエラ・アルピナ(Mortierella alpina)[米国特許第7,470,532号明細書]に由来するコドン最適化C16/18エロンガーゼ遺伝子であり;EgD9eは、ミドリムシ(Euglena gracilis)Δ9エロンガーゼ遺伝子[米国特許第7,645,604号明細書]であり;EgD9eSは、ミドリムシ(Euglena gracilis)[米国特許第7,645,604号明細書]に由来するコドン最適化Δ9エロンガーゼ遺伝子であり;EgD8Mは、ミドリムシ(E.gracilis)[米国特許第7,256,033号明細書]に由来するΔ8デサチュラーゼ遺伝子合成変異体[米国特許第7,709,239号明細書]であり;EaD8Sは、ユーグレナ・アナベナ(Euglena anabaena)[米国特許第7,790,156号明細書]に由来するコドン最適化Δ8デサチュラーゼ遺伝子であり;E389D9eS/EgD8Mは、ユートレプチエラ(Eutreptiella)属CCMP389種(米国特許第7,645,604号明細書)に由来するコドン最適化Δ9エロンガーゼ遺伝子(「E389D9eS」)と、Δ8デサチュラーゼ「EgD8M」(前出)[米国特許出願公開第2008−0254191−A1号明細書]とを連結させて作成されたDGLAシンターゼであり;EgD9eS/EgD8Mは、Δ9エロンガーゼ「EgD9eS」(前出)とΔ8デサチュラーゼ「EgD8M」(前出)[米国特許出願公開第2008−0254191−A1号明細書]とを連結させて作成されたDGLAシンターゼであり;EaD9eS/EgD8Mは、ユーグレナ・アナベナ(E.anabaena)[米国特許第7,794,701号明細書]に由来するコドン最適化Δ9エロンガーゼ遺伝子(「EaD9eS」)と、Δ8デサチュラーゼ「EgD8M」(前出)[米国特許出願公開第2008−0254191−A1号明細書]とを連結させて作成されたDGLAシンターゼであり;EgD5MおよびEgD5SMは、ミドリムシ(E.gracilis)[米国特許第7,678,560号明細書]に由来する、変異HPGs(配列番号11)モチーフ[米国特許出願公開第2010−0075386−A1号明細書]を含んでなる、合成変異Δ5デサチュラーゼ遺伝子であり;EaD5SMは、E.アナベナ(E.anabaena)[米国特許第7,943,365号明細書]に由来する、変異HaGG(配列番号14)モチーフ[米国特許出願公開第2010−0075386−A1号明細書]を含んでなる、合成変異Δ5デサチュラーゼ遺伝子であり;PaD17は、ピシウム・アファニデルマタム(Pythium aphanidermatum)Δ17デサチュラーゼ遺伝子[米国特許第7,556,949号明細書]であり;PaD17Sは、P.アファニデルマタム(P.aphanidermatum)[米国特許第7,556,949号明細書]に由来するコドン最適化Δ17デサチュラーゼ遺伝子であり;YlCPT1は、ヤロウィア・リポリティカ(Yarrowia lipolytica)ジアシルグリセロールコリンホスホトランスフェラーゼ遺伝子[米国特許第7,932,077号明細書]であり;MCSはリゾビウム・レグミノサーラム(Rhizobium leguminosarum)次亜種ビシアエ(viciae)3841[米国特許出願公開第2010−0159558−A1号明細書]に由来するコドン最適化マロニル−CoAシンセターゼ遺伝子であり、MaLPAAT1Sは、モルティエラ・アルピナ(Mortierella alpina)[米国特許第7,879,591号明細書]に由来する、コドン最適化リゾホスファチジン酸アシル基転移酵素遺伝子である。
Y9502株の総脂質含量および組成の詳述な分析のために、細胞を二段階で、合計7日間培養するフラスコアッセイを実施した。分析に基づいて、Y9502株は、3.8g/LのDCW、37.1TFA%DCW、21.3EPA%DCWを産生し、脂質プロフィールは次の通りであり、各脂肪酸濃度はTFAの重量%[「%TFA」]である。16:0(パルミチン酸)−2.5、16:1(パルミトレイン酸)−0.5、18:0(ステアリン酸)−2.9、18:1(オレイン酸)−5.0、18:2(LA)−12.7、ALA−0.9、EDA−3.5、DGLA−3.3、ARA−0.8、ETrA−0.7、ETA−2.4、EPA−57.0、その他ー7.5。
Y9502株からのヤロウィア・リポリティカ(Yarrowia lipolytica)Z1978株の作成
Y9502株からのZ1978株の開発は図7に示され、参照によって本明細書に援用する、米国仮特許出願第61/377248号明細書(代理人整理番号CL4783USPRV、2010年8月26日出願)に記載される。
具体的には、Y9502株中でUra3遺伝子を中断するために、SalI/PacI消化されたコンストラクトpZKUM(図8A;配列番号218;参照によって本明細書に援用する、米国特許出願公開第2009−0093543−A1号明細書の表15に記載される)を使用して、一般方法に従って、Ura3変異遺伝子をY9502株のUra3遺伝子に組み込んだ。合計27個の形質転換体(第1群から選択された8個の形質転換体、第2群から選択された8個の形質転換体、および第3群から選択された11個の形質転換体を含んでなる)を最少培地+5−フルオロオロト酸[「MM+5−FOA」]選択プレート上で培養して、30℃に2〜5日間保った。さらなる実験は、形質転換体の第3群のみが、真のUra−表現型を有すると判定した。
Ura−細胞をMM+5−FOAプレートから掻き取って、一般方法に従って脂肪酸分析を行った。このようにして、GC分析は、第3群のpZKUM−形質転換体#1、#3、#6、#7、#8、#10、および#11中に、それぞれTFAの28.5%、28.5%、27.4%、28.6%、29.2%、30.3%、および29.6%のEPAがあったことを示した。これらの7株をそれぞれ、Y9502U12株、Y9502U14株、Y9502U17株、Y9502U18株、Y9502U19株、Y9502U21株、およびY9502U22株と命名した(集合的にY9502U)。
コンストラクトpZKL3−9DP9N(図8B;配列番号219)が作成されて、1つのΔ9デサチュラーゼ遺伝子、1つのコリンリン酸シチジリルトランスフェラーゼ遺伝子、および1つのΔ9エロンガーゼ変異遺伝子をY9502U株のヤロウィア(Yarrowia)YALI0F32131p遺伝子座(GenBank受入番号XM_506121)に組み込んだ。pZKL3−9DP9Nプラスミドは、以下の構成要素を含有した。
一般方法に従って、pZKL3−9DP9NプラスミドをAscI/SphIで消化し、次にY9502U17株の形質転換のために使用した。形質転換体細胞をMMプレート上に播種して、30℃に3〜4日間保った。単一コロニーをMMプレート上に再度画線塗抹して、次に30℃の液体MMに接種し、250rpm/分で2日間振盪した。細胞を遠心分離によって収集してHGMに再懸濁し、次に250rpm/分で5日間振盪した。細胞に、前出の脂肪酸分析を行った。
GC分析は、pZKL3−9DP9NがあるY9502U17の選択された96株の大部分が、TFAの50〜56%のEPAを産生したことを示した。TFAの約59.0%、56.6%、58.9%、56.5%、および57.6%のEPAを産生した5株(すなわち、#31、#32、#35、#70、および#80)をそれぞれZ1977、Z1978、Z1979、Z1980、およびZ1981と命名した。
野生型ヤロウィア・リポリティカ(Yarrowia lipolytica)ATCC#20362と比較したこれらのpZKL3−9DP9N形質転換株の最終遺伝子型は、次の通りであった。Ura+,Pex3−,unknown1−,unknown2−,unknown3−,unknown4−,unknown5−,unknown6−,unknown7−,unknown8−,unknown9−,unknown10−,unknown11−,YAT1::ME3S::Pex16,GPD::ME3S::Pex20,YAT1::ME3S::Lip1,FBAINm::EgD9eS::Lip2,EXP1::EgD9eS::Lip1,GPAT::EgD9e::Lip2,YAT1::EgD9eS::Lip2,YAT::EgD9eS−L35G::Pex20,FBAINm::EgD8M::Pex20,EXP1::EgD8M::Pex16,FBAIN::EgD8M::Lip1,GPD::EaD8S::Pex16(2copies),YAT1::E389D9eS/EgD8M::Lip1,YAT1::EgD9eS/EgD8M::Aco,FBAINm::EaD9eS/EaD8S::Lip2,GPDIN::YlD9::Lip1,GPD::FmD12::Pex20,YAT1::FmD12::Oct,EXP1::FmD12S::Aco,GPDIN::FmD12::Pex16,EXP1::EgD5M::Pex16,FBAIN::EgD5SM::Pex20,GPDIN::EgD5SM::Aco,GPM::EgD5SM::Oct,EXP1::EgD5SM::Lip1,YAT1::EaD5SM::Oct,FBAINm::PaD17::Aco,EXP1::PaD17::Pex16,YAT1::PaD17S::Lip1,YAT1::YlCPT1::Aco,YAT1::MCS::Lip1,FBA::MCS::Lip1,YAT1::MaLPAAT1S::Pex16,EXP1::YlPCT::Pex16.
Z1977、Z1978、Z1979、Z1980、およびZ1981株中のYALI0F32131p遺伝子座(GenBank受入番号XM_50612)のノックアウトは、pZKL3−9DP9Nでの形質転換によって生じたEPA株のいずれでも確認されなかった。
Z1977、Z1978、Z1979、Z1980、およびZ1981株のYPDプレートからの細胞を培養し、総脂質含量と組成(前出)について分析した。下の表13は、Z1977、Z1978、Z1979、Z1980、およびZ1981株のフラスコアッセイで測定された、全DCW、tTFAs%DCW、TFAの重量%としての各脂肪酸濃度[「%TFA」]、およびEPA%DCWを要約する。脂肪酸は、16:0(パルミチン酸)、16:1(パルミトレイン酸)、18:0(ステアリン酸)、18:1(オレイン酸)、18:2(リノール酸)、ALA(α−リノレン酸)、EDA(エイコサジエン酸)、DGLA(ジホモ−γ−リノレン酸)、ARA(アラキドン酸)、ETrA(エイコサトリエン酸)、ETA(エイコサテトラエン酸)、EPA(エイコサペンタエン酸)、その他である。
米国仮特許出願第61/377248号明細書(代理人整理番号CL4783USPRV、2010年8月26日提出)の提出に引き続いて、Z1978株に部分的ゲノム配列決定を行った。この研究は、ヤロウィア属(Yarrowia)ゲノムに組み込まれる6つのΔ5デサチュラーゼ遺伝子でなく、遺伝子操作株は、実際には4つのみを有すると判定した。
より具体的には、下でさらに記述されるように、2つの別個のプラスミド断片(またはその部分)は、Z1978株中に検出されなかった。
(1)コンストラクトpZKL2−5mB89C(米国特許出願公開第2010−0317072−A1号明細書の配列番号131参照)は、1つのΔ5デサチュラーゼ遺伝子をY8069U株のLip2遺伝子座に組み込むことが意図された。しかしゲノムの配列決定は、pZKL2−5mB89C断片のLip2.3N末端部分、およびGPDIN::EgD5SM::Acoキメラ遺伝子を検出できなかった。DNA再配置は、Y8154株作成中に、GPDIN::EgD5SM::Acoカセットの喪失をもたらした可能性がある(図7)。
(2)コンストラクトpZKL1−2SR9G85(米国特許出願公開第2010−0317072−A1号明細書の配列番号132参照)は、1つのΔ5デサチュラーゼ遺伝子をY8154U1株のLip1遺伝子座に組み込むことが意図された。しかしゲノム配列決定またはPCR増幅のどちらも、Z1978株中のΔ5デサチュラーゼ遺伝子を検出できなかった。DNA再配置は、Y8269株作成中に、GPM::EgD5SM::Octカセットの喪失をもたらした可能性がある(図7)。
さらにコンストラクトpZSCP−Ma83(米国特許出願公開第2010−0317072−A1号明細書の中の配列番号133参照)、およびコンストラクトpZP2−85m98F(米国特許出願公開第2010−0317072−A1号明細書中の配列番号135参照)が、どちらもYALI0B21890g遺伝子座に組み込まれたと判定された。
野生型ヤロウィア・リポリティカ(Yarrowia lipolytica)ATCC#20362と比較したZ1978株の最終遺伝子型は、次の通りであった。Ura+,Pex3−,unknown1−,unknown2−,unknown3−,unknown4−,YALI0E12947g−,unknown6−,YALI0B21890g−,unknown8−,unknown10−,unknown11−,YAT1::ME3S::Pex16,GPD::ME3S::Pex20,YAT1::ME3S::Lip1,FBAINm::EgD9eS::Lip2,EXP1::EgD9eS::Lip1,GPAT::EgD9e::Lip2,YAT1::EgD9eS::Lip2,YAT1::EgD9eS−L35G::Pex20,FBAINm::EgD8M::Pex20,EXP1::EgD8M::Pex16,FBAIN::EgD8M::Lip1,GPD::EaD8S::Pex16(2copies),YAT1::E389D9eS/EgD8M::Lip1,YAT1::EgD9eS/EgD8M::Aco,FBAINm::EaD9eS/EaD8S::Lip2,GPDIN::YlD9::Lip1,GPD::FmD12::Pex20,YAT1::FmD12::Oct,EXP1::FmD12S::Aco,GPDIN::FmD12::Pex16,EXP1::EgD5M::Pex16,FBAIN::EgD5SM::Pex20,EXP1::EgD5SM::Lip1,YAT1::EaD5SM::Oct,FBAINm::PaD17::Aco,EXP1::PaD17::Pex16,YAT1::PaD17S::Lip1,YAT1::YlCPT1::Aco,YAT1::MCS::Lip1,FBA::MCS::Lip1,YAT1::MaLPAAT1S::Pex16,EXP1::YlPCT::Pex16.
実施例15
二重Δ5デサチュラーゼ変異体を含んでなりTFAの50%を上回るEPAを産生するヤロウィア・リポリティカ(Yarrowia lipolytica)株の作成
本実施例は、Δ9エロンガーゼ/Δ8デサチュラーゼ経路の発現を介して、DCWの35%を超えるTFAで、TFAの50%を超えるEPAを産生できる、ヤロウィア・リポリティカ(Yarrowia lipolytica)Z1978株(実施例14)に由来する一連の株の構築を記載する。EPA株は、HPGG(配列番号7)およびHDASH(配列番号8)モチーフの双方における二重変異を含んでなる、以下の変異Δ5デサチュラーゼを含んだ。EgD5S−36s157g(配列番号183;実施例12)およびEaD5S−35a158g(配列番号213;実施例13)、ならびにEgD5M(すなわちEgD5R*−34g158g;配列番号153;実施例9および11)またはEgD5M1(すなわちEgD5R*−34g158g347s;配列番号157;実施例10および11)のいずれか。
株は、図9に示されるように二段法で作成され、Z1978株の元のΔ5デサチュラーゼ遺伝子を最初に欠失させて、少なくとも約56%のETAを産生するが、もはやEPAを産生できない、Y0S9017(Ura−)株およびYOS9019(Ura−)株を得た。次にY0S9017(Ura−)株およびYOS9019(Ura−)株の染色体に、前出の二重変異Δ5デサチュラーゼを組み込み、それによって形質転換体株がEPAを産生する能力を復元した。
より具体的には、Z1978株中の4つのΔ5デサチュラーゼ遺伝子は、2つの異なるコンストラクトからの染色体に最初に組み込まれ;pZKSL−5S5A5(配列番号226;米国特許出願公開第2010−0317072−A1号明細書の図4Aおよび表6もまた参照されたい)が、キメラEXP1::EgD5M::Pex16、FBAIN::EgD5SM::Pex20およびYAT1::EaD5SM::OCT遺伝子を含んでなるのに対し、pZP2−85m98F(配列番号227;米国特許出願公開第2010−0317072−A1号明細書の図7Bおよび表13もまた参照されたい)は、キメラEXP1::EgD5SM::Lip1遺伝子を含んでなる。これらの4つのキメラ遺伝子を除去するために、3つの別個の相同的組換え事象が必要であった。
最初に、Z1978U株のゲノム中のキメラFBAIN::EgD5SM::Pex20遺伝子と、Leu遺伝子の大部分(すなわちpZKSL−5S5A5から)とが、相同的組換え(図10A)によって、プラスミドpYPS234(図10B;配列番号229)内の993bpのstuffer DNA断片(配列番号228)で置き換えられ、その中で993bpのstufferは、ヤロウィア(Yarrowia)カルニチン/アシルカルニチンキャリア遺伝子の5’および3’部分を含んでなった。より具体的には、pYSP234プラスミドは、以下の構成要素を含有した。
第1の乗換え事象がLys5−5’ DNA断片内で起きたのに対し、第2の乗換え事象はYAT1プロモーター領域内で起きた。この相同的組換えから、そのゲノム内に、Leu−、Ura−表現型と、3つのΔ5デサチュラーゼ遺伝子を有するYOS9001株が生じた。
次にYOS9001株のゲノム中のキメラEXP1::EgD5M::Pex16およびYAT1::EaD5SM::OCT遺伝子が、相同的組換え(図11A)によって、プラスミドpYPS233(図11B;配列番号231)内の1019bpのstuffer DNA断片(配列番号230)で置き換えられ、その中で1019bpのstufferは、ヤロウィア(Yarrowia)ALK2遺伝子の5’および3’部分を含んでなった。pYSP233プラスミドは、以下の構成要素を含有した。
第1の乗換え事象がLys5−3’ DNA断片内で起きたのに対し、第2の乗換え事象は3’ LeuまたはYAT1プロモーター領域内で起きた。この相同的組換えから、それぞれゲノム内にLeu−、Ura−表現型、および1つのΔ5デサチュラーゼ遺伝子を有する、YOS9006株およびYOS9009株(同一遺伝子型を有する2つの別個のコロニーに相当する)が生じた。
最後に、YOS9006株およびYOS9009株のゲノム中のキメラEXP1::EgD5SM::Lip1遺伝子を相同的組換え(図12A)によって、プラスミドpYSP241(図12B;配列番号232)内の機能性Leu2遺伝子で置き換えた。pYSP241プラスミドは、以下の構成要素を含有した。
第1の乗換え事象が染色体Bの位置2870148と2871250の間の領域で起きたのに対し、第2の乗換え事象はプラスミドpYSP241のEaD8S領域で起き、それによってYOS9017(Ura−)株およびYOS9019(Ura−)株が作り出された。この相同的組換えから、それぞれゲノム内にUra−表現型を有し、Δ5デサチュラーゼ遺伝子を有さない、YOS9017株およびYOS9019株(同一遺伝子型を有する2つの別個のコロニーに相当する)が生じた。
YOS9001(Leu−、Ura−)株、YOS9006(Leu−、Ura−)株、YOS9009(Leu−、Ura−)株、YOS9017(Ura−)株、YOS9019(Ura−)株、およびZ1978U(Ura−)対照株の脂肪酸組成と含油量を分析するために、実施例14の手順に従って、三連フラスコアッセイ(サンプル「A」、「B」、および「C」と同定された)を実施した。
表17は、TFAの重量%[「%TFA」]として、各脂肪酸濃度を要約する。脂肪酸は表13の通りであり、20:4(5,11,14,17)はジュニペロン酸を指す。各サンプル中の全脂肪酸の総計は、100になる。
表18は、全乾燥DCW、TFA%DCW、およびEPA%DCWを要約する。
フラスコ実験のデータは、YOS9001(Leu−、Ura−)株がゲノム内に3つのΔ5デサチュラーゼ遺伝子を含んでなり、約57EPA%TFAを産生した一方、YOS9006(Leu−、Ura−)株およびYOS9009(Leu−、Ura−)株は、それらのゲノム内に1つのΔ5デサチュラーゼ遺伝子のみを含んでなり、約52.0EPA%TFAを産生したことを実証した。対照的に、YOS9017(Ura−)株およびYOS9019(Ura−)株はEPAを全く産生できなかったが、約56%のETAを産生した。YOS9017(Ura−)株およびYOS9019(Ura−)株中のΔ5デサチュラーゼ活性の欠如は、上の全脂肪酸分析によって検証された;PCR分析もまた、Δ5デサチュラーゼをコードするあらゆるDNA配列の欠如を確認した。
コンストラクトpZR5AU−555(図13A;配列番号233)が作成されて、3つのキメラ変異Δ5デサチュラーゼ遺伝子(すなわちFBAIN::EgD5S−36s157g::Pex20[実施例12]、YAT1::EaD5S−35a158g::
Oct[実施例13]、およびEXP1::EgD5M(EgD5R*−34g158g)::Pex16[実施例9および11]をYOS9017株およびYOS9019株の染色体Cの1685392と1687267の間の領域に組み込んで、それによってEPAの生成を可能にした。
pZR5AU−555プラスミドは、以下の構成要素を含有した。
コンストラクトpZR5AU−555M(図13B;配列番号234)は、pZR5A
U−555のキメラEXP1::EgD5M(EgD5R*−34g158g)::Pex16遺伝子の代わりに、キメラEXP1::EgD5M1(EgD5R*−34g158g347s)::Pex16遺伝子[実施例10および11]が使用されたことを除いて、pZR5AU−555と同一である。
一般方法に従って、pZR5AU−555およびpZR5AU−555MプラスミドをAscIで別々に消化し、次にYOS9017株およびYOS9019株を個々に形質転換するために使用した。形質転換体細胞をMMプレート上に播種して、30℃に4〜5日間保った。単一コロニーをMMプレート上に再度画線塗抹して、引き続いて30℃の液体MMに接種し、250rpm/分で2日間振盪した。細胞を遠心分離によって収集してHGMに再懸濁し、次に250rpm/分で5日間振盪した。一般方法に従って、細胞に脂肪酸分析を行った。
YOS9017株中の96個のpZR5AU−555形質転換体のGC分析は、TFAの48%を超えるEPAを産生する20株(すなわち、#9、#17、#22、#27、#31、#32、#42、#44、#46、#52、#53、#63、#68、#72、#74、#75、#77、#79、#80、#84、および#89)を同定し;これらの株をそれぞれZ8001〜Z8020株と命名した。
YOS9017株中の82個のpZR5AU−555M形質転換体のGC分析は、TFAの48%を超えるEPAを産生する10株(すなわち、#1,#27,#29,#33,#39,#41,#44,#49,#69、および#82)を同定し;これらの株をそれぞれZ8021〜Z8030株と命名した。
YOS9019株中の84個のpZR5AU−555形質転換体のGC分析は、TFAの48%を超えるEPAを産生する12株(すなわち、#28、#31、#39、#41、#42、#45、#63、#71、#73、#75、#78、および#84)を同定し;これらの株をそれぞれZ8031〜Z8042株と命名した。
そしてYOS9019株中の76個のpZR5AU−555M形質転換体のGC分析は、TFAの48%を超えるEPAを産生する12株(すなわち、#2,#24,#28,#30,#38,#46,#50,#66,#67,#69,#72、および#73)を同定し;これらの株をそれぞれZ8043〜Z8054株と命名した。
これらの新しいEPA株の脂肪酸組成と含油量を分析するために、代表的な13株(すなわちZ8001、Z8005、Z8007、Z8011、Z8014、Z8018、Z8020、Z8022、Z8024、Z8026、Z8035、Z8048、およびZ8049)に複製フラスコアッセイを実施した。表20は、全DCW、TFA%DCW、TFAの重量%としての各脂肪酸濃度[「%TFA」]、およびEPA(%DCW)を要約する。脂肪酸は、表13および表17の通りである。
13株は全て、TFAの53%を超えるEPAを産生でき、TFAはDCWの37%を超えた。Z8024株およびZ8035株は、それぞれ58.5EPA%TFAおよび57.9EPA%TFAを産生し、TFAはそれぞれ40.8%DCWおよび37.8%DCWであった。
実施例16
植物発現ベクターにクローニングするための変種ミドリムシ(Euglena gracilis)Δ5デサチュラーゼ[「EgD5R」]中におけるHgGG(配列番号9)およびHDAxH(配列番号37)変異の作成
実施例7の表7は、HPGG(配列番号7)およびHDASH(配列番号8)モチーフの双方を変化させる変異を含んでなる、様々なEgD5R*変種からのΔ5デサチュラーゼ活性を要約する。表7では、修飾HgGG(配列番号9)およびHDAgH(配列番号18)モチーフ(EgD5R*−34g158g;配列番号143のような)または修飾HgGG(配列番号9)およびHDAaH(配列番号17)モチーフ(EgD5R*−34g158a;配列番号141のような)のいずれかを有するEgD5R*タンパク質は、(EgD5Rタンパク質と同一の)EgD5R*タンパク質活性の少なくとも88%を有する。
本実施例は、所望のヌクレオチド変化を含有するオリゴヌクレオチドによるPCRベースの変異誘発を使用して、既存の植物発現ベクター(後述、実施例18)中への容易なクローニングのためのNotI部位で挟まれるEgD5R(配列番号24)のDNA配列中へ、同様の変異を導入するのに使用される方法を記載する。より具体的には、2回のPCR増幅を通じて、Δ5デサチュラーゼ遺伝子中に二重変異体が導入され、各PCRは、製造業者のプロトコルに従って、Phusion(商標)High−FidelityDNAポリメラーゼ(カタログ番号F553S,Finnzymes Oy,Finland)を使用して実施された。生成物をアガロースゲル電気泳動によって分離し、特に断りのない限り、製造業者のプロトコルに従って、Zymoclean(商標)Gel DNA Recovery Kit(Zymo Research,Orange,CA)を使用して精製した。
HgGG(配列番号9)変異をNotI部位で挟まれるEgD5Rに導入する
HgGG(配列番号9)変異は、プラスミドpKR1032をDNAテンプレートとして使用して、2回のPCR増幅を通じて、EgD5R遺伝子(配列番号24)に導入された。プラスミドpKR1032は米国特許第7,678,560号明細書で以前記載されており、NotI部位で挟まれるEgD5R遺伝子(配列番号24)を含んでなる。EgD5R(配列番号24)の5’末端は、HgGG(配列番号9)変異をコードするDNA変化を導入するようにデザインされた、オリゴヌクレオチドプライマーEgD5−5(配列番号245)およびプライマーEgD5M1−3(配列番号246)によって、pKR1032から増幅された。EgD5R(配列番号24)の3’末端は、HgGG(配列番号9)変異をコードするDNA変化を導入するようにデザインされて、EgD5M1−3(配列番号246)と完璧に相補的なオリゴヌクレオチドプライマーEgD5M1−5(配列番号247)と、プライマーEgD5−3(配列番号248)とによって、同様にベクターpKR1032から増幅された。得られたDNA断片を分離し精製した。
次に2つの精製DNA断片を組み合わせて、オリゴヌクレオチドプライマーEgD5−5(配列番号245)およびEgD5−3(配列番号248)を用いた2回目のPCR中で、HgGG(配列番号9)変異をコードするDNA変化を有する完全長遺伝子を増幅した。得られたDNA断片を精製した。
HgGG(配列番号9)モチーフを含んでなる完全長Δ5デサチュラーゼDNA配列が配列番号249で示される一方、コードされたタンパク質は配列番号250で記載される。
NotI部位で挟まれるEgD5R中にHgGG(配列番号9)変異とHDAgH(配列番号18)変異を組み合わせる
HDAgH(配列番号18)変異は、上述の手順を使用して、HgGG(配列番号9)変異を含有する精製DNA断片をテンプレートとして使用して、2回の追加的なPCR増幅を通じて、配列番号250のΔ5デサチュラーゼをコードするDNA配列に導入された。具体的には配列番号249の5’末端が、HDAgH(配列番号18)変異をコードするDNA変化を導入するようにデザインされた、オリゴヌクレオチドプライマーEgD5−5(配列番号245)およびプライマーgD5M2−3(配列番号251)によって増幅され;配列番号249の3’末端は、HDAgH(配列番号18)変異をコードするDNA変化を導入するようにデザインされ、EgD5M2−3(配列番号251)と完璧に相補的なオリゴヌクレオチドプライマーEgD5M2−5(配列番号252)と、プライマーEgD5−3(配列番号248)とによって増幅された。得られたDNA断片を上述したように分離し精製した。
次に2つの精製DNA断片を組み合わせて、HgGG(配列番号9)およびHDAgH(配列番号18)変異をコードするDNA変化を有する完全長遺伝子をオリゴヌクレオチドプライマーEgD5−5(配列番号245)およびEgD5−3(配列番号248)を用いた2回目のPCR中で増幅した。製造業者のプロトコルに従って、Zero Blunt(登録商標)PCRクローニングキット(Invitrogen Corporation)を使用して、得られたPCR産物をpCR−Blunt’(登録商標)クローニングベクターにクローンし、pLF336(配列番号253)を生成した。
pLF336中にHgGG(配列番号9)モチーフおよびHDAgH(配列番号18)モチーフを含んでなる、得られたΔ5デサチュラーゼDNA配列が配列番号254で示される一方、コードされたタンパク質は配列番号255で記載される。
NotI部位で挟まれるEgD5R中にHgGG(配列番号9)変異とHDAaH(配列番号17)変異を組み合わせる
HDAaH(配列番号17)変異は、上述の手順を使用して、HgGG(配列番号9)変異を含有する精製DNA断片をテンプレートとして使用して、2回の追加的なPCR増幅を通じて、配列番号250のΔ5デサチュラーゼをコードするDNA配列に導入された。具体的には配列番号249の5’末端が、HDAaH(配列番号17)変異をコードするDNA変化を導入するようにデザインされた、オリゴヌクレオチドプライマーEgD5−5(配列番号245)およびプライマーEgD5M3−3(配列番号256)によって増幅され;配列番号249の3’末端は、HDAaH(配列番号17)変異をコードするDNA変化を導入するようにデザインされ、EgD5M3−3(配列番号256)と完璧に相補的なオリゴヌクレオチドプライマーEgD5M3−5(配列番号257)と、プライマーEgD5−3(配列番号248)とによって、同様に増幅された。得られたDNA断片を上述したように分離し精製した。
次に2つの精製DNA断片を組み合わせて、HgGG(配列番号9)およびHDAaH(配列番号17)変異をコードするDNA変化を有する完全長遺伝子をEgD5−5(配列番号245)およびEgD5−3(配列番号248)を用いた2回目のPCR中で増幅した。製造業者のプロトコルに従って、Zero Blunt(登録商標)PCRクローニングキット(Invitrogen Corporation)を使用して、得られたPCR産物をpCR−Blunt’(商標)クローニングベクターにクローンし、pLF337(配列番号258)を生成した。
pLF337中にHgGG(配列番号9)モチーフおよびHDAaH(配列番号17)モチーフを含んでなる、得られたΔ5デサチュラーゼDNA配列が配列番号259で示される一方、コードされたタンパク質は配列番号260で記載される。
実施例17
植物発現ベクターにクローニングするための変種ユーグレナ・アナベナ(Euglena
anabaena)Δ5デサチュラーゼ[「EaD5」]中におけるHgGG(配列番号9)およびHDAxH(配列番号37)変異の作成
本実施例は、実施例16に記載されるのと類似した様式でのPCR増幅による、EaD5(配列番号28)のDNA配列へのHgGG(配列番号9)変異と、HDAgH(SQEIDNO:18)またはHDAaH(配列番号17)変異のいずれかとの導入を記載する。得られた遺伝子は、一連の既存の植物発現ベクターへのクローニングを可能にする、NotI部位で挟まれた(実施例18、後述);具体的には、2回のPCR増幅を通じて、Δ5デサチュラーゼ遺伝子中に二重変異体が導入され、各PCRは、製造業者のプロトコルに従って、Phusion(商標)High−Fidelity DNAポリメラーゼ(カタログ番号F553S,Finnzymes Oy,Finland)を使用して実施された。生成物をアガロースゲル電気泳動によって分離し、特に断りのない限り、製造業者のプロトコルに従って、Zymoclean(商標)Gel DNA Recovery Kit(Zymo Research,Orange,CA)を使用して精製した。
HgGG(配列番号9)変異をNotI部位で挟まれるEaD5に導入する
HgGG(配列番号9)変異は、プラスミドpKR1136をDNAテンプレートとして使用して、2回のPCR増幅を通じて、EaD5遺伝子(配列番号28)に導入された。プラスミドpKR1136は、以前、米国特許出願公開第2008−0254191−A1号明細書記載されており、NotI部位で挟まれるEaD5遺伝子(配列番号28)を含んでなる。EaD5(配列番号28)の5’末端は、HgGG(配列番号9)変異をコードするDNA変化を導入するようにデザインされた、オリゴヌクレオチドプライマーEaD5−5(配列番号261)およびプライマーEaD5M1−3(配列番号262)によって、pKR1136から増幅された。EaD5(配列番号28)の3’末端は、HgGG(配列番号9)変異をコードするDNA変化を導入するようにデザインされて、EaD5M1−3(配列番号262)と完璧に相補的なオリゴヌクレオチドプライマーEaD5M1−5(配列番号263)と、EaD5−3(配列番号264)とによって、同様にベクターpKR1136から増幅された。得られたDNA断片を分離し精製した。
次に2つの精製DNA断片を組み合わせて、HgGG(配列番号9)変異をコードするDNA変化を有する完全長遺伝子をオリゴヌクレオチドプライマーEaD5−5(配列番号261)およびEaD5−3(配列番号264)を用いた2回目のPCR中で増幅した。得られたDNA断片を精製した。
HgGG(配列番号9)モチーフを含んでなる、得られたΔ5デサチュラーゼDNA配列が配列番号265で示される一方、コードされたタンパク質は配列番号266で記載される。
NotI部位で挟まれるEaD5中にHgGG(配列番号9)変異とHDAgH(配列番号18)変異を組み合わせる
HDAgH(配列番号18)変異は、上述の手順を使用して、HgGG(配列番号9)変異を含有する精製DNA断片をテンプレートとして使用して、2回の追加的なPCR増幅を通じて、配列番号265のΔ5デサチュラーゼをコードするDNA配列に導入された。配列番号265の5’末端は、HDAgH(配列番号18)変異をコードするDNA変化を導入するようにデザインされた、オリゴヌクレオチドプライマEaD5−5(配列番号261)およびプライマーEaD5M2−3(配列番号267)によって増幅され;配列番号265の3’末端は、HDAgH(配列番号18)変異をコードするDNA変化を導入するようにデザインされ、EaD5M2−3(配列番号267)と完璧に相補的なオリゴヌクレオチドプライマーEaD5M2−5(配列番号268)と、プライマーEaD5−3(配列番号264)とによって増幅された。得られたDNA断片を上述したように分離し精製した。
次に2つの精製DNA断片を組み合わせて、HgGG(配列番号9)およびHDAgH(配列番号18)変異をコードするDNA変化を有する完全長遺伝子をEaD5−5(配列番号261)およびEaD5−3(配列番号264)を用いた2回目のPCR中で増幅した。製造業者のプロトコルに従って、Zero Blunt(登録商標)PCRクローニングキット(Invitrogen Corporation)を使用して、得られたPCR産物をpCR−Blunt(登録商標)クローニングベクターにクローンし、pLF338(配列番号269)を生成した。
pLF338中にHgGG(配列番号9)モチーフおよびHDAgH(配列番号18)モチーフを含んでなる、得られたΔ5デサチュラーゼDNA配列が配列番号270で示される一方、コードされたタンパク質は配列番号271で記載される。
NotI部位で挟まれるEaD5中にHgGG(配列番号9)変異とHDAaH(配列番号17)変異を組み合わせる
HDAaH変異は、HgGG(配列番号9)変異を含有する精製DNA断片をテンプレートとして使用して、2回の追加的なPCR増幅を通じて、配列番号270のΔ5デサチュラーゼをコードするDNA配列に導入された。配列番号270の5’末端は、HDAaH(配列番号17)変異をコードするDNA変化を導入するようにデザインされた、オリゴヌクレオチドプライマEaD5−5(配列番号261)およびプライマーEaD5M3−3(配列番号272)によって増幅され;配列番号270の3’末端は、HDAaH(配列番号17)変異をコードするDNA変化を導入するようにデザインされ、EaD5M3−3(配列番号272)と完璧に相補的なオリゴヌクレオチドプライマーEaD5M3−5(配列番号273)と、プライマーEaD5−3(配列番号264)とによって、同様に増幅された。得られたDNA断片を上述したように分離し精製した。
次に2つの精製DNA断片を組み合わせて、HgGG(配列番号9)およびHDAaH(配列番号17)変異をコードするDNA変化を有する完全長遺伝子をEaD5−5(配列番号261)およびEaD5−3(配列番号264)を用いた2回目のPCR中で増幅した。製造業者のプロトコルに従って、Zero Blunt(登録商標)PCRクローニングキット(Invitrogen Corporation)を使用して、得られたPCR産物をpCR−Blunt(登録商標)クローニングベクターにクローンし、pLF339(配列番号274)を生成した。
pLF339中にHgGG(配列番号9)モチーフおよびHDAaH(配列番号17)モチーフを含んでなる、得られたΔ5デサチュラーゼDNA配列が配列番号275で示される一方、コードされたタンパク質は配列番号276で記載される。
実施例18
大豆中におけるΔ9エロンガーゼおよびΔ8デサチュラーゼによるEgD5RまたはEaD5二重Δ5デサチュラーゼ変異体の同時発現のための大豆発現ベクターの構築
本実施例は、大豆中の適切なΔ9エロンガーゼおよびΔ8デサチュラーゼによる、それぞれ実施例16および17に記載される、HgGG(配列番号9)およびHDAgH(配列番号18)モチーフ、またはHgGG(配列番号9)およびHDAaH(配列番号17)モチーフのいずれかを含んでなる、EgD5RまたはEaD5二重Δ5デサチュラーゼ変異体の同時発現のための大豆ベクターの構築を記載する。
pLF336およびpLF337(実施例16に記載される)からのEgD5R変異体、およびpLF338およびpLF339(実施例17に記載される)からのEaD5変異体は、NotIでの消化によってそれぞれのベクターから放出させ得る。これによってΔ5デサチュラーゼが、強力な種子特異的プロモーターの後で、いくつもの既存の大豆発現ベクターに容易にクローンできるようになる。
例えば変異Δ5デサチュラーゼのそれぞれを含んでなるNotI断片は、(その内容を参照によって本明細書に援用する)国際公開第2007/136877号パンフレットで以前記載されている、pKR974のNotI断片にクローンし得る。このようにして、強力な種子特異的発現のために、大豆グリシニン(Gy1)プロモーターの後で、変異Δ5デサチュラーゼを発現させ得る。
次にこれらのベクターをSbfIで消化して、変異Δ5デサチュラーゼを含有する断片をその内容を参照によって本明細書に援用する、国際公開第2008/137516号パンフレットで以前記載されている、pKR913のSbfI部位にクローンする。このようにして、強力な種子特異的プロモーターの後で、ミドリムシ(Euglena gracilis)Δ8デサチュラーゼ[「EgD8」]およびミドリムシ(E.gracilis)Δ9エロンガーゼ[「EgD9e」]と共に、変異Δ5デサチュラーゼを同時発現させ得る。
このようにして生成されたいずれかのベクターを精製し、ベクターまたはベクターのAscI断片のいずれかをアネキシンプロモーター制御下のサプロレグニア・ディクリナ(Saprolegnia diclina)Δ17デサチュラーゼ[「SdD17」]を含んでなり、植物中における選択のためのハイグロマイシン耐性遺伝子を有する、(国際公開第04/071467号パンフレットに記載される)pKR328などであるが、これに限定されるものではない、ω−3PUFAを増大させるようにデザインされたベクターと共に、国際公開第2008/137516号パンフレットに記載されるように大豆胚培養物に同時形質転換する。形質転換後、遺伝子導入大豆胚を選択し、成熟させて脂肪酸プロファイルを分析し、植物を再生させる。
このようにして、EPAおよび/またはARAなどの長鎖PUFAを含んでなる、変異Δ5デサチュラーゼを発現する胚または種子が得られる。
代案としては、EgD9およびEgD8遺伝子と共に変異Δ5デサチュラーゼを同時発現する、ベクターまたはそれらに由来する断片を米国特許第7,659,120号明細書に記載されるpKR325のような適切な選択可能なマーカーを含有するその他のベクターで、同時形質転換し得る。全く同じ様にして、胚を成熟させて分析し、植物を再生させ、得られた植物の種子中で、ARA増大とEPA低下などの代わりの脂肪酸プロファイルを達成し得る。
EgD9およびEgD8遺伝子と共に変異Δ5デサチュラーゼを発現するプラスミドもまた、米国特許出願公開第2008−0194685A1号明細書で以前記載されている、pKR1189またはpKR1249またはその他のコンストラクトなどであるが、これに限定されるものではない、遺伝子、またはDNA断片、または内在性大豆fad3遺伝子を発現停止するようにデザインされた人工マイクロRNAを含んでなるベクターで、同時形質転換し得る。このようにして、大豆種子中で、より高濃度のARAおよびより低濃度のEPAを達成し得る。
本明細書に記載される、遺伝子、プロモーター、ターミネーター、および遺伝子カセットに加えて、その他プロモーター/遺伝子/ターミネーターカセットの組み合わせが、本明細書に記載されるΔ5デサチュラーゼ変異体を発現させる方法などであるが、これに限定されるものではない方法と同様に、合成し得ることを当業者は理解し得る。同様に、本発明のΔ5デサチュラーゼとの同時発現のために、その他のPUFA遺伝子(表23に後述するものなど)を発現させることが望ましいことがある。
例えば国際公開第2004/071467号パンフレットおよび国際公開第2004/071178号パンフレットは、大豆中の胚特異的発現で使用するためのいくつかのプロモーターおよび転写ターミネーター配列の単離を記載する。さらに国際公開第2004/071467号パンフレット、国際公開第2005/047479号パンフレット、および国際公開第2006/012325号パンフレットは、個々のプロモーター、遺伝子、および転写ターミネーターを共にユニークな組み合わせに連結することによる、複数プロモーター/遺伝子/ターミネーターカセットの組み合わせの合成を記載する。一般に、(表21に列挙されるものなどであるが、これに限定されるものではない)適切なプロモーターと(表22に列挙されるものなどであるが、これに限定されるものではない)転写ターミネーターで挟まれるNotI部位を使用して、所望の遺伝子をクローンする。NotI部位は、遺伝子の5’および3’末端にNotI部位を導入するようにデザインされたオリゴヌクレオチドによるPCR増幅を使用して、表23に列挙されるものなどであるが、これに限定されるものではない対象の遺伝子に付加し得る。次に得られたPCR産物をNotIで消化して、適切なプロモーター/NotI/ターミネーターカセットにクローンする。
これに加えて、国際公開第2004/071467号パンフレット、国際公開第2005/047479号パンフレット、および国際公開第2006/012325号パンフレットは、所望の表現型の発現を得るために、適切な選択可能なマーカーカセットと共に、ユニークな組み合わせにさらに連結された個々の遺伝子カセットを記載する。これは主に異なる制限酵素部位を使用して実施されるが、当業者はいくつかの技術を利用して、所望のプロモーター/遺伝子/転写ターミネーターの組み合わせを達成し得ることを理解し得る。その際、胚特異的プロモーター/遺伝子/転写ターミネーターカセットのあらゆる組み合わせを達成し得る。当業者はまた、これらのカセットが、個々のDNA断片上にまたは複数断片上に位置し得て、複数DNA断片の同時形質転換の成果が、遺伝子の同時発現であることを理解し得る。
さらに米国特許出願公開第2008−0254191−A1号明細書は、Δ8デサチュラーゼと共に個々のΔ9エロンガーゼを同時発現する、いくつかのベクターの作成、ならびにマルチザイムを作り出すこれらの遺伝子の融合を記載する。本明細書に記載される変異Δ5デサチュラーゼのいずれでも、記載される発現ベクターへのクローニングによって、またはプラスミドまたは断片としての適切な発現ベクターの同時形質転換によって、米国特許出願公開第2008−0254191−A1号明細書に記載されるベクターと共に同時発現させて、ARA、EPA、DPA、およびDHAなどであるが、これに限定されるものではないPUFAを生成する大豆種子を達成し得る。