JP2009534032A - Δ17デサチュラーゼおよび多価不飽和脂肪酸の製造におけるそれらの使用 - Google Patents
Δ17デサチュラーゼおよび多価不飽和脂肪酸の製造におけるそれらの使用 Download PDFInfo
- Publication number
- JP2009534032A JP2009534032A JP2009506580A JP2009506580A JP2009534032A JP 2009534032 A JP2009534032 A JP 2009534032A JP 2009506580 A JP2009506580 A JP 2009506580A JP 2009506580 A JP2009506580 A JP 2009506580A JP 2009534032 A JP2009534032 A JP 2009534032A
- Authority
- JP
- Japan
- Prior art keywords
- desaturase
- seq
- polypeptide
- nucleic acid
- gene
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Ceased
Links
- 0 *[N+](CCC=C)[O-] Chemical compound *[N+](CCC=C)[O-] 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P7/00—Preparation of oxygen-containing organic compounds
- C12P7/64—Fats; Fatty oils; Ester-type waxes; Higher fatty acids, i.e. having at least seven carbon atoms in an unbroken chain bound to a carboxyl group; Oxidised oils or fats
- C12P7/6409—Fatty acids
- C12P7/6427—Polyunsaturated fatty acids [PUFA], i.e. having two or more double bonds in their backbone
- C12P7/6432—Eicosapentaenoic acids [EPA]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P7/00—Preparation of oxygen-containing organic compounds
- C12P7/64—Fats; Fatty oils; Ester-type waxes; Higher fatty acids, i.e. having at least seven carbon atoms in an unbroken chain bound to a carboxyl group; Oxidised oils or fats
- C12P7/6409—Fatty acids
- C12P7/6427—Polyunsaturated fatty acids [PUFA], i.e. having two or more double bonds in their backbone
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/82—Vectors or expression systems specially adapted for eukaryotic hosts for plant cells, e.g. plant artificial chromosomes (PACs)
- C12N15/8241—Phenotypically and genetically modified plants via recombinant DNA technology
- C12N15/8242—Phenotypically and genetically modified plants via recombinant DNA technology with non-agronomic quality (output) traits, e.g. for industrial processing; Value added, non-agronomic traits
- C12N15/8243—Phenotypically and genetically modified plants via recombinant DNA technology with non-agronomic quality (output) traits, e.g. for industrial processing; Value added, non-agronomic traits involving biosynthetic or metabolic pathways, i.e. metabolic engineering, e.g. nicotine, caffeine
- C12N15/8247—Phenotypically and genetically modified plants via recombinant DNA technology with non-agronomic quality (output) traits, e.g. for industrial processing; Value added, non-agronomic traits involving biosynthetic or metabolic pathways, i.e. metabolic engineering, e.g. nicotine, caffeine involving modified lipid metabolism, e.g. seed oil composition
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/0004—Oxidoreductases (1.)
- C12N9/0071—Oxidoreductases (1.) acting on paired donors with incorporation of molecular oxygen (1.14)
- C12N9/0083—Miscellaneous (1.14.99)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/0004—Oxidoreductases (1.)
- C12N9/0071—Oxidoreductases (1.) acting on paired donors with incorporation of molecular oxygen (1.14)
- C12N9/0083—Miscellaneous (1.14.99)
- C12N9/0087—Steroid 21-monooxygenase (1.14.99.10)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P7/00—Preparation of oxygen-containing organic compounds
- C12P7/64—Fats; Fatty oils; Ester-type waxes; Higher fatty acids, i.e. having at least seven carbon atoms in an unbroken chain bound to a carboxyl group; Oxidised oils or fats
- C12P7/6436—Fatty acid esters
- C12P7/6445—Glycerides
- C12P7/6472—Glycerides containing polyunsaturated fatty acid [PUFA] residues, i.e. having two or more double bonds in their backbone
Abstract
Description
本出願は、2006年4月20日に出願された米国仮特許出願第60/793575号明細書の優先権の利益を主張する。
a.)配列番号3および配列番号7よりなる群から選択される、Δ17デサチュラーゼをコードする単離されたヌクレオチド配列、または
b.)(a)に完全に相補的な単離されたヌクレオチド配列
よりなる群から選択される単離された核酸分子を提供する。
a)i)1)クラスタル(Clustal)法のアラインメントに基づいて、配列番号2で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも90.9%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子、
2)クラスタル(Clustal)法のアラインメントに基づいて、配列番号4で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも91.4%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子、および
3)クラスタル(Clustal)法のアラインメントに基づいて、配列番号6で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも89.5%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子
よりなる群から選択される、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子と、
ii)アラキドン酸源
とを含んでなる宿主細胞を提供するステップと、
b)Δ17デサチュラーゼポリペプチドをコードする核酸分子が発現されてアラキドン酸がエイコサペンタエン酸に転換される条件下で、ステップ(a)の宿主細胞を生育させるステップと、
c)場合によりステップ(b)のエイコサペンタエン酸を回収するステップと
を含んでなる、エイコサペンタエン酸を製造する方法を提供する。
a)i)1)クラスタル(Clustal)法のアラインメントに基づいて、配列番号2で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも90.9%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子、
2)クラスタル(Clustal)法のアラインメントに基づいて、配列番号4で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも91.4%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子、および
3)クラスタル(Clustal)法のアラインメントに基づいて、配列番号6で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも89.5%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子
よりなる群から選択される、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子と、
ii)ジホモ−γ−リノレン酸源
とを含んでなる宿主細胞を提供するステップと、
b)Δ17デサチュラーゼポリペプチドをコードする核酸分子が発現されてジホモ−γ−リノレン酸がエイコサテトラエン酸に変換される条件下で、ステップ(a)の宿主細胞を生育させるステップと、
c)場合によりステップ(b)のエイコサテトラエン酸を回収するステップと
を含んでなる、エイコサテトラエン酸を製造する方法を提供する。
a)i)1)クラスタル(Clustal)法のアラインメントに基づいて、配列番号2で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも90.9%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子、および
2)クラスタル(Clustal)法のアラインメントに基づいて、配列番号4で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも91.4%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子
よりなる群から選択される、二機能性Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子と、
ii)リノール酸源
とを含んでなる宿主細胞を提供するステップと、
b)二機能性Δ17デサチュラーゼポリペプチドをコードする核酸分子が発現されてリノール酸がα−リノレン酸に変換される条件下で、ステップ(a)の宿主細胞を生育させるステップと、
c)場合によりステップ(b)のα−リノレン酸を回収するステップと
を含んでなる、α−リノレン酸を製造する方法を提供する。
以下の生体物質が10801ユニバーシティ・ブールヴァード、マナッサス、VA20110−2209の米国微生物系統保存機関(ATCC)に寄託され、以下の命名、登録番号、および寄託日を有する。
次の配列は、37C.F.R.1.§821〜1.825(「ヌクレオチド配列および/またはアミノ酸配列開示を含む特許出願の要件−配列規則」)を満たし、世界知的所有権機関(WIPO)標準ST.25(1998年)、およびEPOおよびPCTの配列表要件(規則5.2および49.5(aの2)、および実施細則第208号および附属書C)に一致する。ヌクレオチドおよびアミノ酸配列データのために使用される記号および型式は、37C.F.R.§1.822で述べられる規則に従う。
本開示では、いくつかの用語および略語を使用する。以下の定義が提供される。
「読み取り枠」はORFと略記される。
「ポリメラーゼ連鎖反応」はPCRと略記される。
「米国微生物系統保存機関」はATCCと略記される。
「多価不飽和脂肪酸」はPUFAと略記される。
「トリアシルグリセロール」はTAGと略記される。
一般に、油性微生物中の脂質蓄積は、増殖培地中に存在する全体的な炭素対窒素比に応えて誘発される。油性微生物中に遊離パルミチン酸(16:0)の新規(de novo)合成をもたらすこのプロセスについては、国際公開第2004/101757号パンフレットで詳細に述べられる。パルミチン酸は、エロンガーゼおよびデサチュラーゼの作用を通じて形成される、より長鎖の飽和および不飽和脂肪酸誘導体の前駆物質である(図1)。
オレイン酸がω−3/ω−6脂肪酸に変換される代謝プロセスは、炭素原子付加を通じた炭素鎖の延長、および二重結合添加を通じた分子の不飽和化を伴う。これは、小胞体膜内に存在する一連の特別な不飽和化酵素および延長酵素を必要とする。しかし図1に示され下で述べられるように、特定ω−3/ω−6脂肪酸生成のための複数の代案の経路があることが多い。
フィトフトラ・ソジャ(Phytophthora sojae)およびP.ラモルム(ramorum)の双方から単離されて本願明細書で述べられる、本発明のΔ17デサチュラーゼの配列は、最初カリフォルニア州ウォールナットクリークの米国エネルギー省共同ゲノム研究所(U.S.Department of Energy’s Joint Genome Institute(JGI)(Walnut Creek,CA))によって報告された。しかし配列は知られていたが、Δ17デサチュラーゼとしてのそれらの機能は、本願明細書で研究成果が述べられる以前には解明されていなかったことに留意すべきである。出願人らが初めて、これらのポリペプチドの特異的Δ17デサチュラーゼ活性を認識した。
配列分析ソフトウェアを使用して、本デサチュラーゼ配列(すなわちPsD17、PrD17、PsD17S、PrD17S)またはその部分のいずれかを使用して、同一または別の細菌、藻類、真菌、卵菌綱または植物種中で、Δ17デサチュラーゼ相同体を検索してよい。一般には、このようなコンピューターソフトウェアは、様々な置換、欠失、およびその他の改変に相同性の程度を割り当てて同様の配列をマッチする。
ここで述べられるΔ17デサチュラーゼをコードするキメラ遺伝子(すなわちPsD17、PrD17、PsD17S、PrD17Sまたはその他の突然変異酵素、コドン最適化酵素またはその相同体)の導入は、適切なプロモーター制御下において、形質転換された宿主生物体中でそれぞれEPAの生成増大をもたらすことが期待される。したがって本発明は、基質が所望の脂肪酸生成物(すなわちEPA)に転換されるように、脂肪酸基質(すなわちARA)をここで述べられるデサチュラーゼ(例えばPsD17、PrD17、PsD17S、PrD17S)に曝すステップを含んでなる、PUFAの直接的生成方法を包含する。
a.)i.)クラスタル(Clustal)法のアラインメントに基づいて、配列番号2で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも90.9%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子、
ii.)クラスタル(Clustal)法のアラインメントに基づいて、配列番号4で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも91.4%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子、
iii.)クラスタル(Clustal)法のアラインメントに基づいて、配列番号6で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも89.5%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子
よりなる群から選択されるΔ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子、および
b)ARA源
を含んでなる宿主細胞(例えば油性酵母)中でEPAを製造する方法を提供することであり、
宿主細胞を、Δ17デサチュラーゼ遺伝子が発現してARAがEPAに変換されるような条件下で生育させ、EPAは場合により回収する。
a.)i.)クラスタル(Clustal)法のアラインメントに基づいて、配列番号2で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも90.9%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子、
ii.)クラスタル(Clustal)法のアラインメントに基づいて、配列番号4で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも91.4%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子、および
iii.)クラスタル(Clustal)法のアラインメントに基づいて、配列番号6で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも89.5%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子
よりなる群から選択される、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子と、
b.)ジホモ−γ−リノレン酸源
とを宿主細胞に提供するステップと、
c.)Δ17デサチュラーゼポリペプチドをコードする核酸分子が発現されてジホモ−γ−リノレン酸がエイコサテトラエン酸に変換される条件下で、ステップ(a)のヌクレオチド分子を含んでなる宿主細胞を生育させるステップと、
d.)場合によりステップ(c)のエイコサテトラエン酸を回収するステップと
を含んでなる、エイコサテトラエン酸を製造する方法を提供する。
a.)i.)クラスタル(Clustal)法のアラインメントに基づいて、配列番号2で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも90.9%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子、および
ii.)クラスタル(Clustal)法のアラインメントに基づいて、配列番号4で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも91.4%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子
よりなる群から選択される二機能性Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子と、
b)LA源
とを含んでなる宿主細胞(例えば油性酵母)中で、ALAを製造する方法を提供することであり、
宿主細胞を、二機能性Δ17デサチュラーゼ遺伝子が発現してLAがALAに変換されるような条件下で生育させ、ALAは場合により回収する。
本願明細書で述べられる本配列の遺伝子および遺伝子生成物は、異種の宿主細胞の細胞中で発現されてもよい。組み換え宿主中での発現は、様々なPUFA経路中間体を生成するために、または宿主を使用して従来可能でなかった新しい生成物を合成するのに宿主に既存のPUFA経路を調節するために有用かもしれない。
適切な宿主細胞中での発現に適したポリペプチドをコードするDNAがひとたび得られたら、それを宿主細胞中で自律複製できるプラスミドベクターに入れ、またはそれを宿主細胞のゲノムに直接組み込む。発現カセットの組み込みは、宿主ゲノム中で無作為に起きることができ、または宿主遺伝子座での遺伝子組み換えを標的とするのに十分な宿主ゲノムとの相同性領域を含有するコンストラクトの使用を通じて、標的を定めることができる。コンストラクトが内在性遺伝子座に標的を定めれば、全てまたはいくつかの転写および翻訳調節領域を内在性遺伝子座によって提供できる。
本Δ17デサチュラーゼの配列の知識は、様々な宿主細胞中でのω−3および/またはω−6脂肪酸生合成を操作するために有用であろう。これは直接にPUFA生合成経路内での代謝エンジニアリング、または炭素をPUFA生合成経路に与える経路の追加的操作を必要とするかもしれない。望ましい生化学的経路をアップレギュレートし、望ましくない生化学的経路をダウンレギュレートするのに有用な方法は、当業者にはよく知られている。例えばエネルギーまたは炭素についてω−3および/またはω−6脂肪酸生合成経路と競合する生化学的経路、または特定のPUFA最終産物の生成を妨げる天然PUFA生合成経路酵素を遺伝子中断によって排除し、またはその他の手段(例えばアンチセンスmRNA)によってダウンレギュレートしてもよい。
本遺伝子および核酸断片の発現のための宿主細胞としては、広範な温度およびpHで、単純または複合糖質、脂肪酸,有機酸、油、およびアルコール、および/または炭化水素をはじめとする多様な原材料上で生育する宿主が挙げられる。出願人らの譲受人のニーズに基づいて、本発明で述べられる遺伝子は、油性酵母菌(および特にヤロウィア・リポリティカ(Yarrowia lipolytica))中での発現のために単離された。しかし転写、翻訳、およびタンパク質生合成器官は高度に保存されているので、あらゆる細菌、酵母菌、藻類、卵菌類および/または糸状菌が、本核酸断片の発現のための適切な宿主になることが考察される。
形質転換された宿主細胞は、キメラデサチュラーゼ遺伝子の発現を最適化する条件下で生育させて、最大かつ最も経済的な所望のPUFA収率を生じさせる。一般に、最適化されてもよい培地条件としては、炭素源のタイプおよび量、窒素源のタイプおよび量、炭素−対−窒素比、異なる無機イオンの量、酸素レベル、生育温度、pH、バイオマス生成相の長さ、油蓄積相の長さ、および細胞収穫時間および方法が挙げられる。ヤロウィア・リポリティカ(Yarrowia lipolytica)は、一般に複合培地(例えば酵母菌抽出物−ペプトン−デキストロース液体培地(YPD))で、または生育に必要な構成要素が欠如することで所望の発現カセットの選択を強要する合成最少培地(例えばミシガン州デトロイトのディフコ・ラボラトリーズ(DIFCO Laboratories(Detroit,MI))からの酵母菌窒素ベース)上で生育させる。
実施例で使用する標準組み換えDNAおよび分子クローニング技術は、当該技術分野でよく知られており、1.)サムブルック(Sambrook),J.、フリッチュ(Fritsch),E.F.およびマニアティス(Maniatis),T.、「分子クローニング:実験室マニュアル(Molecular Cloning:A Laboratory Manual)」、コールド・スプリング・ハーバー・ラボラトリー(Cold Spring Harbor Laboratory):ニューヨーク州コールド・スプリング・ハーバー(Cold Spring Harbor,NY)(1989年)(マニアティス(Maniatis));2.)T.J.シルハビー(Silhavy)、M.L.ベンナン(Bennan)、およびL.W.エンクイスト(Enquist)、「遺伝子融合実験(Experiments with Gene Fusions)」、コールド・スプリング・ハーバー・ラボラトリー(Cold Spring Harbor Laboratory):ニューヨーク州コールド・スプリング・ハーバー(Cold Spring Harbor,NY)(1984年);および3.)オースベル(Ausubel),F.M.ら、「分子生物学現代プロトコル(Current Protocols in Molecular Biology)」、グリーン・パブリッシング・アソシエーツ・アンド・ウィリー−インターサイエンス(Greene Publishing Assoc.and Wiley−Interscience)による出版、ニュージャージー州ホーボーケン(Hoboken,NJ)(1987年)で述べられる。
ヤロウィア・リポリティカ(Yarrowia lipolytica)株ATCC登録番号#20362は、メリーランド州ロックビルの米国微生物系統保存機関から購入した。Y.リポリティカ(Y.lipolytica)株は、通常YPD寒天(1%酵母菌抽出物、2%バクトペプトン、2%グルコース、2%寒天)上で28℃で生育させた。
脂肪酸分析のために、ブライ(Bligh),E.G.およびダイヤー(Dyer),W.J.、Can.J.Biochem.Physiol.37:911〜917頁(1959年)で述べられるように、細胞を遠心分離して収集し、脂質を抽出した。ナトリウムメトキシドでの脂質抽出物のエステル交換反応によって、脂肪酸メチルエステルを調製し(ローガン(Roughan),G.およびニシダ(Nishida),I.、Arch Biochem Biophys.276(1):38〜46頁(1990年))、引き続きヒューレットパッカード(Hewlett−Packard)からの30m×0.25mm(内径)HP−INNOWAXカラムを装着したヒューレットパッカード(Hewlett−Packard)6890 GCで分析した。オーブン温度は3.5℃/分で、170℃(25分間保持)から185℃であった。
Δ17デサチュラーゼをコードするフィトフトラ・ソジャ(Phytophthora sojae)遺伝子の同定
カリフォルニア州ウォールナットクリークの米国エネルギー省共同ゲノム研究所(U.S.Department of Energy’s Joint Genome Institute(JGI)(Walnut Creek,CA))はフィトフトラ・ソジャ(Phytophthora sojae)ゲノム(推定ゲノムサイズ95Mbp)のバージョン1.0を作り出した。このゲノム配列は、全ゲノムショットガンストラテジーを使用して生成され、全部で19,276個の遺伝子モデルを含んでなる。
ヤロウィア・リポリティカ(Yarrowia lipolytica)のためにコドン最適化されたΔ17デサチュラーゼ遺伝子(「PsD17S」)の合成
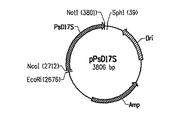
米国特許第7,125,672号明細書で述べられているのと類似の様式で、ヤロウィア・リポリティカ(Yarrowia lipolytica)中での発現のために、フィトフトラ・ソジャ(Phytophthora sojae)のΔ17デサチュラーゼ遺伝子のコドン使用頻度を最適化した。具体的には、ヤロウィア(Yarrowia)のコドン使用頻度パターン(国際公開第2004/101753号パンフレット)、「ATG」翻訳開始コドン周辺の共通配列、およびRNAの安定法則(グハニヨギ(Guhaniyogi),G.およびJ.ブルーアー(Brewer)、Gene 265(1〜2):11〜23頁(2001年))に従って、PsD17のコード配列(配列番号1および2)に基づいて、コドン最適化Δ17デサチュラーゼ遺伝子(「PsD17S」と称する、配列番号3および4)をデザインした。翻訳開始部位の修正に加えて、1092bpのコード領域の175bp(16,0%)を修正し、168個のコドン(46.2%)を最適化した。GC含量は、野性型遺伝子(すなわちPsD17)内の65.1%から、合成遺伝子(すなわちPsD17S)内の54.5%に低下した。NcoI部位およびNotI部位をPsD17S(配列番号3)の翻訳開始コドン周辺、および停止コドン後にそれぞれ組み込んだ。図2は、PsD17とPsD17Sのヌクレオチド配列の比較を示す。アミノ酸レベルでは、野性型PsD17と比較してPsD17Sは3番目および4番目のアミノ酸を欠いており、したがってPsD17Sの全長は361個のアミノ酸(配列番号4)であった。デザインされたPsD17S遺伝子はニュージャージー州ピスカタウェイのジェンスクリプト・コーポレーション(GenScript Corporation (Piscataway,NJ))によって合成され、pUC57(ジェンバンク登録番号Y14837)中にクローンされて、pPsD17S(配列番号10;図3A)を生じさせた。
コンストラクトpFmPsD17Sの発生
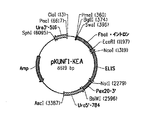
本実施例は、キメラのFBAINm::PsD17S::XPR遺伝子を含んでなるプラスミドpFmPsD17Sの構築について述べる。プラスミドpFmPsD17S(配列番号13;図3D)は、プラスミドpKUNF1−KEA、pDMW214、およびpPsD17Sからの断片を使用して、三元ライゲーションによって構築された。プラスミドpFmPsD17Sを利用して、下記の実施例5で述べるようにPsD17Sの機能性発現を試験した。
pKUNF1−KEA(配列番号11;図3B)は、キメラFBAINm::E1S::Pex20遺伝子を含んでなる。このキメラ遺伝子内の「FBAINm」プロモーターは(国際公開第05/049805号パンフレット;また図3Bで「Fba1+イントロン」としても同定されている)「FBAIN」プロモーター由来の合成プロモーターを指し、FBAINプロモーターは、発現に必要なfba1遺伝子によってコードされるフルクトース−ビスリン酸アルドラーゼ酵素(E.C.4.1.2.13)の「ATG」翻訳開始コドンの前の5’上流非翻訳領域と、fba1遺伝子のイントロンを有する5’コード領域の一部とを指す。FBAINmプロモーターはFBAINから改変され、FBAINmはFBAINプロモーターのATG翻訳開始コドンとイントロンの間に52bpの欠失があり(それによってN−末端の22個のアミノ酸のみを含む)、イントロン後の新しい翻訳コンセンサスモチーフを有する。さらにFBAINプロモーターは発現する遺伝子コード領域と縮合した際に、融合タンパク質を生じる一方、FBAINmプロモーターはこのような融合タンパク質を生じない。
pDMW214(配列番号12;図3C)は、大腸菌(E.coli)およびヤロウィア・リポリティカ(Yarrowia lipolytica)の双方の中で複製するシャトルプラスミドである。それは次の構成要素を含有した。
プラスミドpKUNF1−KEA(図3B;FBAINmプロモーターを含んでなる)のPmeI/NcoI断片、およびプラスミドpPsD17S(図3A;合成Δ17デサチュラーゼ遺伝子PsD17Sを含んでなる)のNcoI/NotI断片を一方向性に使用して、pDMW214(図3C)のPmeI/NotI断片を置き換えた。これはキメラFBAINm::PsD17S::XPR遺伝子を含んでなる、pFmPsD17S(配列番号13;図3D)の発生をもたらした。したがってpFmPsD17Sの構成要素は、下の表6で述べられるようであった。
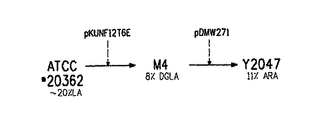
Δ6デサチュラーゼ/Δ6エロンガーゼ経路を通じて総脂質の約11%のARAを生成するヤロウィア・リポリティカ(Yarrowia lipolytica)Y2047株の発生
本実施例は、Δ6デサチュラーゼ/Δ6エロンガーゼ経路の発現を通じて総脂質に対して11%のARAを生成できる、ヤロウィア・リポリティカ(Yarrowia lipolytica)ATCC#20362由来のY2047株の構築について述べる(図4A)。Y2047は、ブダペスト条約の取り決めの元に寄託されており、ATCC番号PTA−7186を有する。さらにY2047の構築については、ここで参照によって援用する同時係属米国特許出願第11/265761号明細書で述べられている。
コンストラクトpKUNF12T6E(図4B;配列番号14)を発生させて4個のキメラ遺伝子(Δ12デサチュラーゼ、Δ6デサチュラーゼ、および2個のC18/20エロンガーゼを含んでなる)を野性型ヤロウィア(Yarrowia)ATCC#20362株のUra3遺伝子座に組み込み、それによってDGLAの生成を可能にした。pKU
NF12T6Eプラスミドは、以下の構成要素を含有した。
コンストラクトpDMW271(図4C;配列番号17)を発生させて、3個のΔ5キメラ遺伝をヤロウィア(Yarrowia)M4株のLeu2遺伝子に組み込んだ。表8で述べられるように、プラスミドpDMW271は以下の構成要素を含有した。
ヤロウィア・リポリティカ(Yarrowia lipolytica)Y2047株におけるコドン最適化Δ17デサチュラーゼ遺伝子(「PsD17S」)の発現
一般方法で述べられるように、プラスミドpFmPsD17S(図3D;実施例3)をヤロウィア・リポリティカ(Yarrowia lipolytica)Y2047株(実施例4)に形質転換した。形質転換細胞をMM選択培地プレート上に播種し、2〜3日間30℃に保った。MMプレート上に生育した8個の形質転換体を拾って、新鮮なMMプレート上に再度画線培養した。生育したらこれらの株を30℃の3mlの液体MM中に個別に接種して、250rpm/分で2日間振盪した。細胞を遠心分離によって収集し、脂質を抽出してエステル交換によって脂肪酸メチルエステルを調製し、引き続いてヒューレットパッカード(Hewlett−Packard)6890GCで分析した。
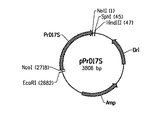
コンストラクトpZP3−P7Uの発生
本実施例は、ヤロウィア(Yarrowia)ゲノムのPox3遺伝子座(ジェンバンク登録番号XP_503244)に組み込むようにデザインされた、キメラのYAT::PsD17S::Lip1遺伝子を含んでなるプラスミドpZP3−P7Uの構築について述べる。下記の実施例8で述べられるように、プラスミドpZP3−P7Uを利用してPsD17Sの機能性発現を試験した。pZP3−P7Uの構成要素は、下の表9で述べられるようであった。
Δ9エロンガーゼ/Δ8デサチュラーゼ経路を通じて総脂質の約12%のARAを生成するためのヤロウィア・リポリティカ(Yarrowia lipolytica)Y4070株の発生
本実施例は、Δ9エロンガーゼ/Δ8デサチュラーゼ経路(図6A)の発現を通じて、総脂質に対して約12%のARAを生成できるヤロウィア・リポリティカ(Yarrowia lipolytica)ATCC#20362由来のY4070株の構築について述べる。Y4070株を利用して、下記の実施例8のPsD17Sおよび実施例12のPrD17Sの機能性発現を試験した。
Y2224株を次の様式で単離した。YPD寒天プレート(1%酵母抽出物、2%バクトペプトン、2%グルコース、2%寒天)からのヤロウィア・リポリティカ(Yarrowia lipolytica)ATCC#20362細胞を250mg/Lの5−FOA(ザイモ・リサーチ(Zymo Research))を含有するMMプレート(各75mg/Lのウラシルおよびウリジン、6.7g/L硫酸アンモニア添加YNB、アミノ酸無添加、および20g/Lグルコース)上に画線培養した。プレートを28℃でインキュベートし、得られたコロニーの内4つを200mg/mL 5−FOA含有MMプレート上、およびウラシルおよびウリジンを欠くMMプレート上に別々にパッチして、ウラシルUra3栄養要求性を確認した。
コンストラクトpZKLeuN−29E3(図6B)の組み込みを通じて、Y4001株を作り出した。4個のキメラ遺伝子(すなわちΔ12デサチュラーゼ、C16/18エロンガーゼ、および2個のΔ9エロンガーゼ)を含んでなるこのコンストラクトをY2224株のLeu2遺伝子座に組み込み、それによってEDAの生成を可能にした。
Y4001株において、プラスミドpY116中でのCreリコンビナーゼ酵素の一時的な発現を通じてY4001U株を作り出し(図6C)、Leu−およびUra−フェノタイプを生成した。コンストラクトpY116は次の構成要素を含有した。
コンストラクトpKO2UF8289(図7A;配列番号28)を発生させて、4個のキメラ遺伝子(1個のΔ12デサチュラーゼ、1個のΔ9エロンガーゼ、および2個の突然変異Δ8デサチュラーゼを含んでなる)をY4001U1株のΔ12遺伝子座に組み込み、それによってDGLAの生成を可能にした。コンストラクトpKO2UF8289は以下の構成要素を含有した。
コンストラクトpY116(図6C;配列番号27)を利用して、Y4036株中で一時的にCreリコンビナーゼ酵素を発現した。これはゲノムからLoxPに挟まれたUra3遺伝子を放出した。
コンストラクトpZKSL−555R(図7B;配列番号32)を発生させ、3個のΔ5デサチュラーゼ遺伝子をY4036U株のLys遺伝子座に組み込み、それによってARAの生成を可能にした。pZKSL−555Rプラスミドは次の構成要素を含有した。
ヤロウィア・リポリティカ(Yarrowia lipolytica)Y4070株におけるコドン最適化Δ17デサチュラーゼ遺伝子(「PsD17S」)の発現
一般方法に従ってプラスミドpZP3−P7U(図5;実施例6)をAscI/SphIで消化し、次にヤロウィア・リポリティカ(Yarrowia lipolytica)Y4070株を形質転換するのに使用した。形質転換に続いて細胞をMMプレート上に播種し、30℃に2〜3日間保った。MMプレート上で生育した12個の形質転換体を拾って新鮮なMMプレート上に再度画線培養した。生育したら、これらの株を30℃の3mL液体MMに個々に接種し、250rpm/分で2日間振盪した。遠心分離によって細胞を収集し、高グルコース培地に再懸濁して、次に30℃で5日間生育させて、250rpm/分で振盪した。遠心分離によって細胞を収集し、脂質を抽出してエステル交換により脂肪酸メチルエステルを調製して、引き続いてヒューレットパッカード(Hewlett−Packard)6890GCで分析した。
%のEPAが生成されたことを実証した。これらの12株中でPsD17SがARAをEPAに変換する変換効率は、平均率で約98%であった。変換効率は次の式に従って測定された。([生成物]/[基質+生成物])×100。式中、「生成物」には、直接生成物およびそれに由来する経路中の全生成物が含まれる。したがってこの実験データは、P.ソジャ(sojae)由来のコドン最適化Δ17デサチュラーゼ遺伝子(配列番号3)が、ARAをEPAに効率的に不飽和化したことを実証する。
Δ17デサチュラーゼをコードするフィトフトラ・ラモルム(Phytophthora ramorum)遺伝子の同定
カリフォルニア州ウォールナットクリークの米国エネルギー省共同ゲノム研究所(U.S.Department of Energy’s Joint Genome Institute(JGI)(Walnut Creek,CA))はフィトフトラ・ラモルム(Phytophthora ramorum)ゲノム(推定ゲノムサイズ65Mbp)のバージョン1.0を作り出した。このゲノム配列は、全ゲノムショットガンストラテジーを使用して生成され、全部で16,066個の遺伝子モデルを含んでなる。
ヤロウィア・リポリティカ(Yarrowia lipolytica)のためにコドン最適化されたΔ17デサチュラーゼ遺伝子(「PrD17S」)の合成
実施例2で述べられたのと類似の様式で、ヤロウィア・リポリティカ(Yarrowia lipolytica)中での発現のために、フィトフトラ・ラモルム(Phytophthora ramorum)のΔ17デサチュラーゼ遺伝子のコドン使用頻度を最適化した。具体的には、ヤロウィア(Yarrowia)のコドン使用頻度パターン(国際公開第2004/101753号パンフレット)、「ATG」翻訳開始コドン周辺の共通配列、およびRNAの安定法則(グハニヨギ(Guhaniyogi),G.およびJ.ブルーアー(Brewer)、Gene 265(1〜2):11〜23頁(2001年))に従って、PrD17のコード配列(配列番号5および6)に基づいて、コドン最適化Δ17デサチュラーゼ遺伝子(「PrD17S」と称する、配列番号7)をデザインした。翻訳開始部位の修正に加えて、1086bpのコード領域の168bp(15.5%)を修正し、160個のコドン(44.2%)を最適化した。GC含量は、野性型遺伝子(すなわちPrD17)内の64.4%から、合成遺伝子(すなわちPrD17S)内の54.5%に低下した。NcoI部位およびNotI部位をPrD17S(配列番号7)の翻訳開始コドン周辺、および停止コドン後にそれぞれ組み込んだ。図8は、PrD17およびPrD17Sのヌクレオチド配列の比較を示す。コドン最適化遺伝子内の改変は、いずれもタンパク質(配列番号6)をコードするアミノ酸配列を変化させなかった。デザインされたPrD17S遺伝子はニュージャージー州ピスカタウェイのジェンスクリプト・コーポレーション(GenScript Corporation(Piscataway,NJ))によって合成され、pUC57(ジェンバンク登録番号Y14837)中にクローンされて、pPrD17S(図9A;配列番号38)を生じた。
コンストラクトpZuFPrD17Sの発生
本実施例は、キメラのFBAIN::PrD17S::Pex20遺伝子を含んでなるプラスミドpZuFPrD17S(図9B)の構築について述べる。プラスミドpZuFPrD17Sを利用して、下記の実施例12で述べられるようにPrD17Sの機能性発現を試験した。
ヤロウィア・リポリティカ(Yarrowia lipolytica)Y4070株におけるコドン最適化Δ17デサチュラーゼ遺伝子PrD17Sの発現
一般方法で述べられるようにして、プラスミドpZuFPrD17S(図9B;実施例11)をヤロウィア・リポリティカ(Yarrowia lipolytica)Y4070株(実施例8)に形質転換した。形質転換細胞をMM選択培地プレート上に播種し、2〜3日間30℃に保った。MMプレート上に生育した10個の形質転換体を拾って、新鮮なMMプレート上に再度画線培養した。生育したらこれらの株を30℃の3mlの液体MM中に個別に接種して、250rpm/分で2日間振盪した。細胞を遠心分離によって収集し、高グルコース培地に再懸濁し、次に30℃で5日間生育させて250rpm/分で振盪した。遠心分離によって細胞を収集し、脂質を抽出してエステル交換により脂肪酸メチルエステルを調製して、引き続いてヒューレットパッカード(Hewlett−Packard)6890GCで分析した。
EPAが生成されたことを示した。これらの10株中でPrD17SがARAをEPAに変換する変換効率は、平均率で約49%であった。変換効率は実施例8で述べられるようにして測定された。したがってこの実験的データは、P.ラモルム(ramorum)由来のコドン最適化Δ17デサチュラーゼ遺伝子(配列番号5)が、ARAをEPAに効率的に不飽和化することを実証した。
Claims (17)
- a.)配列番号3および配列番号7よりなる群から選択されたΔ17デサチュラーゼ酵素をコードする単離されたヌクレオチド配列、または
b.)(a)に完全に相補的である単離されたヌクレオチド配列
よりなる群から選択される、単離された核酸分子。 - 配列番号4で記載されるΔ17デサチュラーゼ酵素をコードする単離された核酸分子。
- 少なくとも168個のコドンがヤロウィア中での発現のためにコドン最適化された、配列番号2で記載されるΔ17デサチュラーゼ酵素をコードする単離された核酸分子。
- 少なくとも160個のコドンがヤロウィア中での発現のためにコドン最適化された、配列番号6で記載されるΔ17デサチュラーゼ酵素をコードする単離された核酸分子。
- 適切な制御配列と作動的に結合する、請求項1に記載の単離された核酸分子を含むキメラ遺伝子。
- 請求項1に記載の単離された核酸分子を含む、形質転換されたヤロウィア種。
- ヤロウィア・リポリティカATCC#20362、ヤロウィア・リポリティカATCC#8862、ヤロウィア・リポリティカATCC#18944、ヤロウィア・リポリティカATCC#76982、およびヤロウィア・リポリティカ LGAMS(7)1よりなる群から選択される、請求項6に記載の形質転換されたヤロウィア種。
- a)i)1)クラスタルW法のアラインメントに基づいて、配列番号2で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも90.9%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子、
2)クラスタルW法のアラインメントに基づいて、配列番号4で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも91.4%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子、および
3)クラスタルW法のアラインメントに基づいて、配列番号6で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも89.5%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子
よりなる群から選択される、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子と、
ii)アラキドン酸源
とを含む宿主細胞を提供する工程と、
b)Δ17デサチュラーゼポリペプチドをコードする核酸分子が発現されてアラキドン酸がエイコサペンタエン酸に転換される条件下で、工程(a)の宿主細胞を生育させる工程と、
c)場合により工程(b)のエイコサペンタエン酸を回収する工程と
を含む、エイコサペンタエン酸を製造する方法。 - a)i)1)クラスタルW法のアラインメントに基づいて、配列番号2で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも90.9%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子、
2)クラスタルW法のアラインメントに基づいて、配列番号4で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも91.4%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子、および
3)クラスタルW法のアラインメントに基づいて、配列番号6で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも89.5%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子
よりなる群から選択される、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子と、
ii)ジホモ−γ−リノレン酸源
とを含む宿主細胞を提供する工程と、
b)Δ17デサチュラーゼポリペプチドをコードする核酸分子が発現されてジホモ−γ−リノレン酸がエイコサテトラエン酸に変換される条件下で、工程(a)の宿主細胞を生育させる工程と、
c)場合により工程(b)のエイコサテトラエン酸を回収する工程と
を含む、エイコサテトラエン酸を製造する方法。 - a)i)1)クラスタルW法のアラインメントに基づいて、配列番号2で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも90.9%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子、および
2)クラスタルW法のアラインメントに基づいて、配列番号4で記載されるアミノ酸配列を有するポリペプチドと比較すると少なくとも91.4%の同一性を有する、Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子
よりなる群から選択された、二機能性Δ17デサチュラーゼポリペプチドをコードする単離されたヌクレオチド分子と、
ii)リノール酸源
とを含む宿主細胞を提供する工程と、
b)二機能性Δ17デサチュラーゼポリペプチドをコードする核酸分子が発現されてリノール酸がα−リノレン酸に変換される条件下で、工程(a)の宿主細胞を生育させる工程と、
c)場合により工程(b)のα−リノレン酸を回収する工程と
を含む、α−リノレン酸を製造する方法。 - 単離された核酸分子が、配列番号2、4、および6よりなる群から選択されたアミノ酸配列を有するΔ17デサチュラーゼポリペプチドをコードする、請求項8または9に記載の方法。
- a.)単離された核酸分子が、配列番号3および配列番号7よりなる群から選択された核酸配列を有し、
b.)宿主細胞がヤロウィア・リポリティカである、
請求項8または9に記載の方法。 - 宿主細胞が、藻類、細菌、酵母、卵菌綱、および真菌よりなる群から選択される、請求項8または9に記載の方法。
- 宿主細胞が、スラウストキトリウム(Thraustochytrium)種、シゾキトリウム(Schizochytrium)種、およびモルティエラ(Mortierella)種よりなる群から選択された真菌である、請求項13に記載の方法。
- 酵母が油性酵母である、請求項13に記載の方法。
- 油性酵母が、ヤロウィア、カンジダ、ロドトルラ、ロドスポリジウム、クリプトコッカス、トリコスポロン、およびリポマイセスよりなる群から選択される、請求項15に記載の方法。
- ヤロウィアが、ヤロウィア・リポリティカATCC#20362、ヤロウィア・リポリティカATCC#8862、ヤロウィア・リポリティカATCC#18944、ヤロウィア・リポリティカATCC#76982、およびヤロウィア・リポリティカLGAMS(7)1よりなる群から選択される、請求項に16記載の方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US79357506P | 2006-04-20 | 2006-04-20 | |
| PCT/US2007/009572 WO2007123999A2 (en) | 2006-04-20 | 2007-04-19 | Δ17 desaturases and their use in making polyunsaturated fatty acids |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2009534032A true JP2009534032A (ja) | 2009-09-24 |
| JP2009534032A5 JP2009534032A5 (ja) | 2010-05-20 |
Family
ID=38625589
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009506580A Ceased JP2009534032A (ja) | 2006-04-20 | 2007-04-19 | Δ17デサチュラーゼおよび多価不飽和脂肪酸の製造におけるそれらの使用 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US7465793B2 (ja) |
| EP (1) | EP2010648B1 (ja) |
| JP (1) | JP2009534032A (ja) |
| CN (1) | CN101646766B (ja) |
| AT (1) | ATE542892T1 (ja) |
| AU (1) | AU2007240741B2 (ja) |
| DK (1) | DK2010648T3 (ja) |
| MX (1) | MX2008013306A (ja) |
| WO (1) | WO2007123999A2 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015029966A1 (ja) | 2013-08-27 | 2015-03-05 | 国立大学法人京都大学 | ω3不飽和脂肪酸酵素およびエイコサペンタエン酸の製造方法 |
| WO2016104607A1 (ja) * | 2014-12-25 | 2016-06-30 | 国立大学法人京都大学 | 新規ω3不飽和脂肪酸酵素およびエイコサペンタエン酸の製造方法 |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2500420B1 (en) * | 2006-08-24 | 2016-06-22 | BASF Plant Science GmbH | Pythium omega 3 desaturase with specificity to all omega 6 fatty acids longer than 18 carbon chains |
| AU2007314481B2 (en) * | 2006-10-30 | 2012-11-29 | E. I. Du Pont De Nemours And Company | Delta17 desaturase and its use in making polyunsaturated fatty acids |
| US7709239B2 (en) * | 2006-12-07 | 2010-05-04 | E.I. Du Pont De Nemours And Company | Mutant Δ8 desaturase genes engineered by targeted mutagenesis and their use in making polyunsaturated fatty acids |
| US8119860B2 (en) * | 2007-04-16 | 2012-02-21 | E. I. Du Pont De Nemours And Company | Delta-9 elongases and their use in making polyunsaturated fatty acids |
| EP2337791B1 (en) * | 2008-10-14 | 2013-07-24 | Monsanto Technology LLC | Utilization of fatty acid desaturases from hemiselmis spp |
| PL2376638T3 (pl) * | 2008-12-12 | 2014-01-31 | Basf Plant Science Gmbh | Desaturazy oraz sposób wytwarzania wielonienasyconych kwasów tłuszczowych w organizmach transgenicznych |
| KR20140008295A (ko) * | 2010-08-26 | 2014-01-21 | 이 아이 듀폰 디 네모아 앤드 캄파니 | 돌연변이 델타-9 연장효소 및 다중불포화 지방산의 제조에서의 그들의 용도 |
| CN105368851B (zh) * | 2015-12-09 | 2019-05-07 | 江南大学 | 一种来源于寄生疫霉的ω-3脱饱和酶、含所述脱饱和酶的载体、重组微生物及其应用 |
| US10533232B2 (en) * | 2015-12-09 | 2020-01-14 | Jiangnan University | Parasitic phytophthora-derived omega-3 fatty acid desaturase for synthesizing polyunsaturated fatty acids, carrier containing fatty acid desaturase, recombinant microorganisms, and application thereof |
| CN106916796B (zh) * | 2015-12-28 | 2021-06-29 | 丰益(上海)生物技术研发中心有限公司 | 裂殖壶菌delta-12脂肪酸脱饱和酶相关序列及其应用 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2005083093A2 (de) * | 2004-02-27 | 2005-09-09 | Basf Plant Science Gmbh | Verfahren zur herstellung mehrfach ungesättigter fettsäuren in transgenen pflanzen |
| WO2005083053A2 (de) * | 2004-02-27 | 2005-09-09 | Basf Plant Science Gmbh | Verfahren zur herstellung von ungesättigten omega-3-fettsäuren in transgenen organismen |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4683202A (en) | 1985-03-28 | 1987-07-28 | Cetus Corporation | Process for amplifying nucleic acid sequences |
| US7008664B1 (en) * | 1998-06-11 | 2006-03-07 | E. I. Du Pont De Nemours And Company | Method for improving the carcass quality of an animal |
| US6635451B2 (en) | 2001-01-25 | 2003-10-21 | Abbott Laboratories | Desaturase genes and uses thereof |
| US7125672B2 (en) | 2003-05-07 | 2006-10-24 | E. I. Du Pont De Nemours And Company | Codon-optimized genes for the production of polyunsaturated fatty acids in oleaginous yeasts |
| US7238482B2 (en) | 2003-05-07 | 2007-07-03 | E. I. Du Pont De Nemours And Company | Production of polyunsaturated fatty acids in oleaginous yeasts |
| EP1654344B1 (de) | 2003-08-01 | 2018-10-17 | BASF Plant Science GmbH | Verfahren zur herstellung mehrfach ungesättigter fettsäuren in transgenen |
| EP1685239B1 (en) | 2003-11-12 | 2014-05-21 | E.I. Du Pont De Nemours And Company | Delta-15 desaturases suitable for altering levels of polyunsaturated fatty acids in oilseed plants and oleaginous yeast |
| US7189559B2 (en) | 2004-11-04 | 2007-03-13 | E. I. Du Pont De Nemours And Company | Mortierella alpina lysophosphatidic acid acyltransferase homolog for alteration of polyunsaturated fatty acids and oil content in oleaginous organisms |
| US7192762B2 (en) | 2004-11-04 | 2007-03-20 | E. I. Du Pont De Nemours And Company | Mortierella alpina glycerol-3-phosphate o-acyltransferase for alteration of polyunsaturated fatty acids and oil content in oleaginous organisms |
| US7588931B2 (en) | 2004-11-04 | 2009-09-15 | E. I. Du Pont De Nemours And Company | High arachidonic acid producing strains of Yarrowia lipolytica |
| DE102005013779A1 (de) | 2005-03-22 | 2006-09-28 | Basf Plant Science Gmbh | Verfahren zur Herstellung von mehrfach ungesättigten C20- und C22-Fettsäuren mit mindestens vier Doppelbindungen in transgenen Pflanzen |
-
2007
- 2007-04-18 US US11/787,772 patent/US7465793B2/en not_active Expired - Fee Related
- 2007-04-19 MX MX2008013306A patent/MX2008013306A/es not_active Application Discontinuation
- 2007-04-19 JP JP2009506580A patent/JP2009534032A/ja not_active Ceased
- 2007-04-19 AT AT07775772T patent/ATE542892T1/de active
- 2007-04-19 WO PCT/US2007/009572 patent/WO2007123999A2/en active Application Filing
- 2007-04-19 AU AU2007240741A patent/AU2007240741B2/en not_active Ceased
- 2007-04-19 EP EP07775772A patent/EP2010648B1/en not_active Not-in-force
- 2007-04-19 CN CN2007800139991A patent/CN101646766B/zh not_active Expired - Fee Related
- 2007-04-19 DK DK07775772.2T patent/DK2010648T3/da active
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2005083093A2 (de) * | 2004-02-27 | 2005-09-09 | Basf Plant Science Gmbh | Verfahren zur herstellung mehrfach ungesättigter fettsäuren in transgenen pflanzen |
| WO2005083053A2 (de) * | 2004-02-27 | 2005-09-09 | Basf Plant Science Gmbh | Verfahren zur herstellung von ungesättigten omega-3-fettsäuren in transgenen organismen |
Non-Patent Citations (1)
| Title |
|---|
| JPN6012027998; Yeast Vol.18, 2001, p.97-113 * |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015029966A1 (ja) | 2013-08-27 | 2015-03-05 | 国立大学法人京都大学 | ω3不飽和脂肪酸酵素およびエイコサペンタエン酸の製造方法 |
| WO2016104607A1 (ja) * | 2014-12-25 | 2016-06-30 | 国立大学法人京都大学 | 新規ω3不飽和脂肪酸酵素およびエイコサペンタエン酸の製造方法 |
| JP6026709B1 (ja) * | 2014-12-25 | 2016-11-16 | 国立大学法人京都大学 | 新規ω3不飽和脂肪酸酵素およびエイコサペンタエン酸の製造方法 |
| US10538793B2 (en) | 2014-12-25 | 2020-01-21 | Kyoto University | ω3 fatty-acid desaturase and method for producing eicosapentaenoic acid |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2007123999A3 (en) | 2008-04-24 |
| US20070249026A1 (en) | 2007-10-25 |
| CN101646766B (zh) | 2013-03-27 |
| AU2007240741B2 (en) | 2013-01-31 |
| US7465793B2 (en) | 2008-12-16 |
| AU2007240741A1 (en) | 2007-11-01 |
| EP2010648B1 (en) | 2012-01-25 |
| WO2007123999A2 (en) | 2007-11-01 |
| CN101646766A (zh) | 2010-02-10 |
| DK2010648T3 (da) | 2012-05-21 |
| ATE542892T1 (de) | 2012-02-15 |
| EP2010648A2 (en) | 2009-01-07 |
| MX2008013306A (es) | 2008-10-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5193216B2 (ja) | Δ17デサチュラーゼおよび多価不飽和脂肪酸の製造におけるその使用 | |
| US7678560B2 (en) | Δ 5 desaturase and its use in making polyunsaturated fatty acids | |
| JP5769374B2 (ja) | 標的を定めた変異誘発によって改変された変異δ8デサチュラーゼ遺伝子及び多価不飽和脂肪酸の製造におけるそれらの使用 | |
| US8318463B2 (en) | Δ8 desaturases and their use in making polyunsaturated fatty acids | |
| JP5762291B2 (ja) | 変異δ5デサチュラーゼと、多価不飽和脂肪酸の製造におけるそれらの使用 | |
| JP5572620B2 (ja) | Δ4デサチュラーゼ、および多価不飽和脂肪酸の製造におけるその使用 | |
| US7695950B2 (en) | Δ5 desaturase and its use in making polyunsaturated fatty acids | |
| US7465793B2 (en) | Synthetic Δ17 desaturase derived from Phytophthora ramourum and its use in making polyunsaturated fatty acids | |
| US7923223B2 (en) | Δ-9 desaturase and its use in making polyunsaturated fatty acids |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100326 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20100326 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120605 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120903 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20121023 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130219 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20130226 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20130326 |
|
| A045 | Written measure of dismissal of application [lapsed due to lack of payment] |
Free format text: JAPANESE INTERMEDIATE CODE: A045 Effective date: 20130730 |