JP2012512145A - フリバンセリンの結晶性の塩形態 - Google Patents
フリバンセリンの結晶性の塩形態 Download PDFInfo
- Publication number
- JP2012512145A JP2012512145A JP2011540128A JP2011540128A JP2012512145A JP 2012512145 A JP2012512145 A JP 2012512145A JP 2011540128 A JP2011540128 A JP 2011540128A JP 2011540128 A JP2011540128 A JP 2011540128A JP 2012512145 A JP2012512145 A JP 2012512145A
- Authority
- JP
- Japan
- Prior art keywords
- crystalline
- benzimidazol
- dihydro
- trifluoro
- phenyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 150000003839 salts Chemical group 0.000 title claims abstract description 41
- PPRRDFIXUUSXRA-UHFFFAOYSA-N flibanserin Chemical compound FC(F)(F)C1=CC=CC(N2CCN(CCN3C(NC4=CC=CC=C43)=O)CC2)=C1 PPRRDFIXUUSXRA-UHFFFAOYSA-N 0.000 title claims abstract description 16
- 229960002053 flibanserin Drugs 0.000 title claims abstract description 15
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 14
- 239000003814 drug Substances 0.000 claims abstract description 9
- 238000000034 method Methods 0.000 claims abstract description 5
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 72
- 238000002844 melting Methods 0.000 claims description 61
- 230000008018 melting Effects 0.000 claims description 61
- 238000002076 thermal analysis method Methods 0.000 claims description 59
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 claims description 54
- 150000001875 compounds Chemical class 0.000 claims description 40
- 239000000843 powder Substances 0.000 claims description 33
- 208000008589 Obesity Diseases 0.000 claims description 24
- 235000020824 obesity Nutrition 0.000 claims description 24
- 208000002193 Pain Diseases 0.000 claims description 20
- 239000002253 acid Substances 0.000 claims description 20
- 125000004194 piperazin-1-yl group Chemical group [H]N1C([H])([H])C([H])([H])N(*)C([H])([H])C1([H])[H] 0.000 claims description 18
- 239000002904 solvent Substances 0.000 claims description 18
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 16
- 239000013078 crystal Substances 0.000 claims description 14
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 claims description 13
- 208000035475 disorder Diseases 0.000 claims description 11
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 claims description 10
- 238000002425 crystallisation Methods 0.000 claims description 9
- 230000008025 crystallization Effects 0.000 claims description 9
- 238000004519 manufacturing process Methods 0.000 claims description 9
- 208000006096 Attention Deficit Disorder with Hyperactivity Diseases 0.000 claims description 8
- 208000028017 Psychotic disease Diseases 0.000 claims description 8
- 239000012458 free base Substances 0.000 claims description 8
- 239000011541 reaction mixture Substances 0.000 claims description 8
- 208000036864 Attention deficit/hyperactivity disease Diseases 0.000 claims description 6
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 claims description 6
- AEMRFAOFKBGASW-UHFFFAOYSA-M Glycolate Chemical compound OCC([O-])=O AEMRFAOFKBGASW-UHFFFAOYSA-M 0.000 claims description 6
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 claims description 6
- 208000013738 Sleep Initiation and Maintenance disease Diseases 0.000 claims description 6
- 208000015802 attention deficit-hyperactivity disease Diseases 0.000 claims description 6
- MIOPJNTWMNEORI-UHFFFAOYSA-N camphorsulfonic acid Chemical compound C1CC2(CS(O)(=O)=O)C(=O)CC1C2(C)C MIOPJNTWMNEORI-UHFFFAOYSA-N 0.000 claims description 6
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 claims description 6
- 201000000980 schizophrenia Diseases 0.000 claims description 6
- 230000001568 sexual effect Effects 0.000 claims description 6
- 208000000103 Anorexia Nervosa Diseases 0.000 claims description 5
- OFOBLEOULBTSOW-UHFFFAOYSA-L Malonate Chemical compound [O-]C(=O)CC([O-])=O OFOBLEOULBTSOW-UHFFFAOYSA-L 0.000 claims description 5
- 206010046543 Urinary incontinence Diseases 0.000 claims description 5
- 201000010099 disease Diseases 0.000 claims description 5
- 238000010438 heat treatment Methods 0.000 claims description 5
- 238000002156 mixing Methods 0.000 claims description 5
- 208000008811 Agoraphobia Diseases 0.000 claims description 4
- 208000019901 Anxiety disease Diseases 0.000 claims description 4
- 208000008035 Back Pain Diseases 0.000 claims description 4
- 201000006474 Brain Ischemia Diseases 0.000 claims description 4
- 206010008120 Cerebral ischaemia Diseases 0.000 claims description 4
- 208000032131 Diabetic Neuropathies Diseases 0.000 claims description 4
- 206010021143 Hypoxia Diseases 0.000 claims description 4
- 208000021384 Obsessive-Compulsive disease Diseases 0.000 claims description 4
- 206010034912 Phobia Diseases 0.000 claims description 4
- 206010036376 Postherpetic Neuralgia Diseases 0.000 claims description 4
- 208000030047 Sexual desire disease Diseases 0.000 claims description 4
- 201000001880 Sexual dysfunction Diseases 0.000 claims description 4
- 206010041250 Social phobia Diseases 0.000 claims description 4
- 239000002585 base Substances 0.000 claims description 4
- 210000000988 bone and bone Anatomy 0.000 claims description 4
- 208000003295 carpal tunnel syndrome Diseases 0.000 claims description 4
- 206010008118 cerebral infarction Diseases 0.000 claims description 4
- 238000001816 cooling Methods 0.000 claims description 4
- 206010012601 diabetes mellitus Diseases 0.000 claims description 4
- 206010022437 insomnia Diseases 0.000 claims description 4
- 230000036651 mood Effects 0.000 claims description 4
- 208000004296 neuralgia Diseases 0.000 claims description 4
- 201000001119 neuropathy Diseases 0.000 claims description 4
- 230000007823 neuropathy Effects 0.000 claims description 4
- 208000019906 panic disease Diseases 0.000 claims description 4
- 208000033808 peripheral neuropathy Diseases 0.000 claims description 4
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 4
- 206010039073 rheumatoid arthritis Diseases 0.000 claims description 4
- 231100000872 sexual dysfunction Toxicity 0.000 claims description 4
- 201000001716 specific phobia Diseases 0.000 claims description 4
- 208000020431 spinal cord injury Diseases 0.000 claims description 4
- 239000000126 substance Substances 0.000 claims description 4
- KDYFGRWQOYBRFD-UHFFFAOYSA-N succinic acid Chemical compound OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 claims description 4
- 208000024891 symptom Diseases 0.000 claims description 4
- 208000011580 syndromic disease Diseases 0.000 claims description 4
- 206010044652 trigeminal neuralgia Diseases 0.000 claims description 4
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 claims description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 claims description 3
- 208000027534 Emotional disease Diseases 0.000 claims description 3
- FEWJPZIEWOKRBE-JCYAYHJZSA-L L-tartrate(2-) Chemical compound [O-]C(=O)[C@H](O)[C@@H](O)C([O-])=O FEWJPZIEWOKRBE-JCYAYHJZSA-L 0.000 claims description 3
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 claims description 3
- 206010028980 Neoplasm Diseases 0.000 claims description 3
- 229910019142 PO4 Inorganic materials 0.000 claims description 3
- 208000027030 Premenstrual dysphoric disease Diseases 0.000 claims description 3
- 208000027520 Somatoform disease Diseases 0.000 claims description 3
- 201000011510 cancer Diseases 0.000 claims description 3
- 230000002107 myocardial effect Effects 0.000 claims description 3
- PSZYNBSKGUBXEH-UHFFFAOYSA-M naphthalene-1-sulfonate Chemical compound C1=CC=C2C(S(=O)(=O)[O-])=CC=CC2=C1 PSZYNBSKGUBXEH-UHFFFAOYSA-M 0.000 claims description 3
- 201000008482 osteoarthritis Diseases 0.000 claims description 3
- 208000027753 pain disease Diseases 0.000 claims description 3
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 claims description 3
- 239000010452 phosphate Substances 0.000 claims description 3
- 230000002265 prevention Effects 0.000 claims description 3
- 206010048627 thoracic outlet syndrome Diseases 0.000 claims description 3
- 208000030507 AIDS Diseases 0.000 claims description 2
- 208000004611 Abdominal Obesity Diseases 0.000 claims description 2
- 208000024827 Alzheimer disease Diseases 0.000 claims description 2
- 206010002383 Angina Pectoris Diseases 0.000 claims description 2
- 206010002660 Anoxia Diseases 0.000 claims description 2
- 241000976983 Anoxia Species 0.000 claims description 2
- 208000006820 Arthralgia Diseases 0.000 claims description 2
- 208000020925 Bipolar disease Diseases 0.000 claims description 2
- 206010006002 Bone pain Diseases 0.000 claims description 2
- 206010048962 Brain oedema Diseases 0.000 claims description 2
- 206010007572 Cardiac hypertrophy Diseases 0.000 claims description 2
- 208000006029 Cardiomegaly Diseases 0.000 claims description 2
- 206010065941 Central obesity Diseases 0.000 claims description 2
- 206010064012 Central pain syndrome Diseases 0.000 claims description 2
- 206010008479 Chest Pain Diseases 0.000 claims description 2
- 206010068631 Childhood depression Diseases 0.000 claims description 2
- 208000000094 Chronic Pain Diseases 0.000 claims description 2
- 206010057254 Connective tissue inflammation Diseases 0.000 claims description 2
- 208000024254 Delusional disease Diseases 0.000 claims description 2
- 208000001640 Fibromyalgia Diseases 0.000 claims description 2
- 206010072132 Fracture pain Diseases 0.000 claims description 2
- 208000011688 Generalised anxiety disease Diseases 0.000 claims description 2
- 201000005569 Gout Diseases 0.000 claims description 2
- 206010019233 Headaches Diseases 0.000 claims description 2
- 208000010496 Heart Arrest Diseases 0.000 claims description 2
- 206010019280 Heart failures Diseases 0.000 claims description 2
- 208000016988 Hemorrhagic Stroke Diseases 0.000 claims description 2
- 208000023105 Huntington disease Diseases 0.000 claims description 2
- 206010020853 Hypertonic bladder Diseases 0.000 claims description 2
- 208000013016 Hypoglycemia Diseases 0.000 claims description 2
- 206010058359 Hypogonadism Diseases 0.000 claims description 2
- 208000001953 Hypotension Diseases 0.000 claims description 2
- 206010022773 Intracranial pressure increased Diseases 0.000 claims description 2
- 208000032382 Ischaemic stroke Diseases 0.000 claims description 2
- 206010024453 Ligament sprain Diseases 0.000 claims description 2
- 208000008930 Low Back Pain Diseases 0.000 claims description 2
- 206010027476 Metastases Diseases 0.000 claims description 2
- 208000019695 Migraine disease Diseases 0.000 claims description 2
- 208000003430 Mitral Valve Prolapse Diseases 0.000 claims description 2
- 208000000112 Myalgia Diseases 0.000 claims description 2
- 206010028923 Neonatal asphyxia Diseases 0.000 claims description 2
- 208000037212 Neonatal hypoxic and ischemic brain injury Diseases 0.000 claims description 2
- 208000027626 Neurocognitive disease Diseases 0.000 claims description 2
- 206010062501 Non-cardiac chest pain Diseases 0.000 claims description 2
- 206010030113 Oedema Diseases 0.000 claims description 2
- 208000001132 Osteoporosis Diseases 0.000 claims description 2
- 208000009722 Overactive Urinary Bladder Diseases 0.000 claims description 2
- 208000007683 Pediatric Obesity Diseases 0.000 claims description 2
- 208000000450 Pelvic Pain Diseases 0.000 claims description 2
- 208000004983 Phantom Limb Diseases 0.000 claims description 2
- 206010056238 Phantom pain Diseases 0.000 claims description 2
- 206010036618 Premenstrual syndrome Diseases 0.000 claims description 2
- 208000019568 Shared Paranoid disease Diseases 0.000 claims description 2
- 208000020307 Spinal disease Diseases 0.000 claims description 2
- 208000010040 Sprains and Strains Diseases 0.000 claims description 2
- 208000006011 Stroke Diseases 0.000 claims description 2
- 208000011963 Substance-induced psychotic disease Diseases 0.000 claims description 2
- 231100000393 Substance-induced psychotic disorder Toxicity 0.000 claims description 2
- 208000009205 Tinnitus Diseases 0.000 claims description 2
- 208000031674 Traumatic Acute Stress disease Diseases 0.000 claims description 2
- 208000030886 Traumatic Brain injury Diseases 0.000 claims description 2
- 208000000921 Urge Urinary Incontinence Diseases 0.000 claims description 2
- 208000026345 acute stress disease Diseases 0.000 claims description 2
- 229940035676 analgesics Drugs 0.000 claims description 2
- 150000001450 anions Chemical class 0.000 claims description 2
- 230000007953 anoxia Effects 0.000 claims description 2
- 239000000730 antalgic agent Substances 0.000 claims description 2
- 230000036506 anxiety Effects 0.000 claims description 2
- 230000015572 biosynthetic process Effects 0.000 claims description 2
- 208000006752 brain edema Diseases 0.000 claims description 2
- 230000000747 cardiac effect Effects 0.000 claims description 2
- 208000015114 central nervous system disease Diseases 0.000 claims description 2
- 230000002490 cerebral effect Effects 0.000 claims description 2
- 201000002342 diabetic polyneuropathy Diseases 0.000 claims description 2
- 235000005911 diet Nutrition 0.000 claims description 2
- 230000000378 dietary effect Effects 0.000 claims description 2
- 206010015037 epilepsy Diseases 0.000 claims description 2
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 claims description 2
- 208000029364 generalized anxiety disease Diseases 0.000 claims description 2
- 231100000869 headache Toxicity 0.000 claims description 2
- 208000018578 heart valve disease Diseases 0.000 claims description 2
- 208000013403 hyperactivity Diseases 0.000 claims description 2
- 230000002218 hypoglycaemic effect Effects 0.000 claims description 2
- 230000002267 hypothalamic effect Effects 0.000 claims description 2
- 230000007954 hypoxia Effects 0.000 claims description 2
- 208000014674 injury Diseases 0.000 claims description 2
- 208000020658 intracerebral hemorrhage Diseases 0.000 claims description 2
- 230000000302 ischemic effect Effects 0.000 claims description 2
- 208000024714 major depressive disease Diseases 0.000 claims description 2
- IWYDHOAUDWTVEP-UHFFFAOYSA-M mandelate Chemical compound [O-]C(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-M 0.000 claims description 2
- 230000009401 metastasis Effects 0.000 claims description 2
- 206010027599 migraine Diseases 0.000 claims description 2
- 208000010125 myocardial infarction Diseases 0.000 claims description 2
- 230000004770 neurodegeneration Effects 0.000 claims description 2
- 208000015122 neurodegenerative disease Diseases 0.000 claims description 2
- 208000021722 neuropathic pain Diseases 0.000 claims description 2
- 230000004112 neuroprotection Effects 0.000 claims description 2
- 208000020629 overactive bladder Diseases 0.000 claims description 2
- 208000002851 paranoid schizophrenia Diseases 0.000 claims description 2
- 208000033300 perinatal asphyxia Diseases 0.000 claims description 2
- 208000022821 personality disease Diseases 0.000 claims description 2
- 230000001817 pituitary effect Effects 0.000 claims description 2
- 208000028173 post-traumatic stress disease Diseases 0.000 claims description 2
- 230000002980 postoperative effect Effects 0.000 claims description 2
- 208000020016 psychiatric disease Diseases 0.000 claims description 2
- 230000000698 schizophrenic effect Effects 0.000 claims description 2
- 208000012672 seasonal affective disease Diseases 0.000 claims description 2
- 208000012201 sexual and gender identity disease Diseases 0.000 claims description 2
- 208000015891 sexual disease Diseases 0.000 claims description 2
- 208000019116 sleep disease Diseases 0.000 claims description 2
- 230000002966 stenotic effect Effects 0.000 claims description 2
- 239000001384 succinic acid Substances 0.000 claims description 2
- 238000011477 surgical intervention Methods 0.000 claims description 2
- 230000009885 systemic effect Effects 0.000 claims description 2
- 230000008719 thickening Effects 0.000 claims description 2
- 230000006016 thyroid dysfunction Effects 0.000 claims description 2
- 231100000886 tinnitus Toxicity 0.000 claims description 2
- 208000004371 toothache Diseases 0.000 claims description 2
- 230000008733 trauma Effects 0.000 claims description 2
- 206010046494 urge incontinence Diseases 0.000 claims description 2
- 230000001457 vasomotor Effects 0.000 claims description 2
- 208000006262 Psychological Sexual Dysfunctions Diseases 0.000 claims 3
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 claims 2
- 206010012239 Delusion Diseases 0.000 claims 1
- 206010028289 Muscle atrophy Diseases 0.000 claims 1
- 206010067171 Regurgitation Diseases 0.000 claims 1
- 208000029899 Sexual aversion disease Diseases 0.000 claims 1
- 206010066218 Stress Urinary Incontinence Diseases 0.000 claims 1
- 208000022531 anorexia Diseases 0.000 claims 1
- 230000006378 damage Effects 0.000 claims 1
- 206010061428 decreased appetite Diseases 0.000 claims 1
- 230000003247 decreasing effect Effects 0.000 claims 1
- 231100000868 delusion Toxicity 0.000 claims 1
- 230000004064 dysfunction Effects 0.000 claims 1
- 230000036543 hypotension Effects 0.000 claims 1
- 201000010901 lateral sclerosis Diseases 0.000 claims 1
- 206010027175 memory impairment Diseases 0.000 claims 1
- 230000005906 menstruation Effects 0.000 claims 1
- 208000005264 motor neuron disease Diseases 0.000 claims 1
- 230000020763 muscle atrophy Effects 0.000 claims 1
- 201000000585 muscular atrophy Diseases 0.000 claims 1
- 210000005036 nerve Anatomy 0.000 claims 1
- 238000002360 preparation method Methods 0.000 abstract description 3
- 238000010586 diagram Methods 0.000 description 47
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 41
- 238000000634 powder X-ray diffraction Methods 0.000 description 35
- 239000013543 active substance Substances 0.000 description 29
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 20
- 229920002261 Corn starch Polymers 0.000 description 12
- 239000008120 corn starch Substances 0.000 description 12
- 239000000203 mixture Substances 0.000 description 11
- 235000019359 magnesium stearate Nutrition 0.000 description 10
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 9
- 239000008101 lactose Substances 0.000 description 9
- RHQDFWAXVIIEBN-UHFFFAOYSA-N Trifluoroethanol Chemical compound OCC(F)(F)F RHQDFWAXVIIEBN-UHFFFAOYSA-N 0.000 description 7
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 7
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 7
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 7
- 239000012453 solvate Substances 0.000 description 7
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 6
- 150000004683 dihydrates Chemical group 0.000 description 6
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 5
- 238000004458 analytical method Methods 0.000 description 5
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- 239000002775 capsule Substances 0.000 description 4
- 239000008187 granular material Substances 0.000 description 4
- 150000004682 monohydrates Chemical group 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 239000000829 suppository Substances 0.000 description 4
- 239000000454 talc Substances 0.000 description 4
- 229910052623 talc Inorganic materials 0.000 description 4
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 229920002472 Starch Polymers 0.000 description 3
- 238000013480 data collection Methods 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 238000001914 filtration Methods 0.000 description 3
- 235000019698 starch Nutrition 0.000 description 3
- 239000008107 starch Substances 0.000 description 3
- 244000215068 Acacia senegal Species 0.000 description 2
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- 208000023890 Complex Regional Pain Syndromes Diseases 0.000 description 2
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 229920000084 Gum arabic Polymers 0.000 description 2
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 2
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 2
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 2
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 2
- 238000002441 X-ray diffraction Methods 0.000 description 2
- 239000000205 acacia gum Substances 0.000 description 2
- 235000010489 acacia gum Nutrition 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 239000003708 ampul Substances 0.000 description 2
- 239000001768 carboxy methyl cellulose Substances 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- JHIVVAPYMSGYDF-UHFFFAOYSA-N cyclohexanone Chemical compound O=C1CCCCC1 JHIVVAPYMSGYDF-UHFFFAOYSA-N 0.000 description 2
- 230000003111 delayed effect Effects 0.000 description 2
- 230000007613 environmental effect Effects 0.000 description 2
- 230000008020 evaporation Effects 0.000 description 2
- 238000001704 evaporation Methods 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- -1 fluoro-methyl-phenyl Chemical group 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 239000007903 gelatin capsule Substances 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- HJOVHMDZYOCNQW-UHFFFAOYSA-N isophorone Chemical compound CC1=CC(=O)CC(C)(C)C1 HJOVHMDZYOCNQW-UHFFFAOYSA-N 0.000 description 2
- 229940016286 microcrystalline cellulose Drugs 0.000 description 2
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 2
- 239000008108 microcrystalline cellulose Substances 0.000 description 2
- LQNUZADURLCDLV-UHFFFAOYSA-N nitrobenzene Chemical compound [O-][N+](=O)C1=CC=CC=C1 LQNUZADURLCDLV-UHFFFAOYSA-N 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 238000001179 sorption measurement Methods 0.000 description 2
- 239000007921 spray Substances 0.000 description 2
- 238000012916 structural analysis Methods 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 150000008163 sugars Chemical class 0.000 description 2
- 238000009492 tablet coating Methods 0.000 description 2
- 239000002700 tablet coating Substances 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical class CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- PTTPXKJBFFKCEK-UHFFFAOYSA-N 2-Methyl-4-heptanone Chemical compound CC(C)CC(=O)CC(C)C PTTPXKJBFFKCEK-UHFFFAOYSA-N 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-M 4-hydroxybenzoate Chemical compound OC1=CC=C(C([O-])=O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-M 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N 4-hydroxybenzoic acid Chemical class OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 206010001488 Aggression Diseases 0.000 description 1
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 1
- 101100335626 Caenorhabditis elegans fum-1 gene Proteins 0.000 description 1
- 101100067721 Caenorhabditis elegans gly-3 gene Proteins 0.000 description 1
- 101100505161 Caenorhabditis elegans mel-32 gene Proteins 0.000 description 1
- 101100401100 Caenorhabditis elegans mes-1 gene Proteins 0.000 description 1
- 101100347993 Caenorhabditis elegans nas-1 gene Proteins 0.000 description 1
- 101100083253 Caenorhabditis elegans pho-1 gene Proteins 0.000 description 1
- 206010058019 Cancer Pain Diseases 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 229920000623 Cellulose acetate phthalate Polymers 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 208000005171 Dysmenorrhea Diseases 0.000 description 1
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 1
- 101150031329 Ets1 gene Proteins 0.000 description 1
- 208000026139 Memory disease Diseases 0.000 description 1
- 208000019022 Mood disease Diseases 0.000 description 1
- 208000008238 Muscle Spasticity Diseases 0.000 description 1
- 208000029549 Muscle injury Diseases 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 206010037779 Radiculopathy Diseases 0.000 description 1
- 208000028810 Shared psychotic disease Diseases 0.000 description 1
- 229920001800 Shellac Polymers 0.000 description 1
- 206010043220 Temporomandibular joint syndrome Diseases 0.000 description 1
- 210000001015 abdomen Anatomy 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- 230000037007 arousal Effects 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 230000006399 behavior Effects 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical class [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- MYONAGGJKCJOBT-UHFFFAOYSA-N benzimidazol-2-one Chemical compound C1=CC=CC2=NC(=O)N=C21 MYONAGGJKCJOBT-UHFFFAOYSA-N 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 229940081734 cellulose acetate phthalate Drugs 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 101150091051 cit-1 gene Proteins 0.000 description 1
- 238000013329 compounding Methods 0.000 description 1
- 239000007859 condensation product Substances 0.000 description 1
- 229910052593 corundum Inorganic materials 0.000 description 1
- 239000010431 corundum Substances 0.000 description 1
- 229940109275 cyclamate Drugs 0.000 description 1
- HCAJEUSONLESMK-UHFFFAOYSA-N cyclohexylsulfamic acid Chemical compound OS(=O)(=O)NC1CCCCC1 HCAJEUSONLESMK-UHFFFAOYSA-N 0.000 description 1
- 230000003412 degenerative effect Effects 0.000 description 1
- 239000007857 degradation product Substances 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 239000002274 desiccant Substances 0.000 description 1
- 238000003795 desorption Methods 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 238000000113 differential scanning calorimetry Methods 0.000 description 1
- 229910001873 dinitrogen Inorganic materials 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-N ethanesulfonic acid Chemical class CCS(O)(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-N 0.000 description 1
- IDGUHHHQCWSQLU-UHFFFAOYSA-N ethanol;hydrate Chemical compound O.CCO IDGUHHHQCWSQLU-UHFFFAOYSA-N 0.000 description 1
- 210000003195 fascia Anatomy 0.000 description 1
- 239000003925 fat Substances 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 150000002191 fatty alcohols Chemical class 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 235000019264 food flavour enhancer Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 239000003365 glass fiber Substances 0.000 description 1
- 125000005456 glyceride group Chemical group 0.000 description 1
- 229960005150 glycerol Drugs 0.000 description 1
- 229940116364 hard fat Drugs 0.000 description 1
- 229910052738 indium Inorganic materials 0.000 description 1
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 description 1
- 239000003701 inert diluent Substances 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 208000012866 low blood pressure Diseases 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 208000013465 muscle pain Diseases 0.000 description 1
- YKYONYBAUNKHLG-UHFFFAOYSA-N n-Propyl acetate Natural products CCCOC(C)=O YKYONYBAUNKHLG-UHFFFAOYSA-N 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- LYGJENNIWJXYER-UHFFFAOYSA-N nitromethane Chemical compound C[N+]([O-])=O LYGJENNIWJXYER-UHFFFAOYSA-N 0.000 description 1
- 238000010606 normalization Methods 0.000 description 1
- 238000012856 packing Methods 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 239000003186 pharmaceutical solution Substances 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- DLRJIFUOBPOJNS-UHFFFAOYSA-N phenetole Chemical compound CCOC1=CC=CC=C1 DLRJIFUOBPOJNS-UHFFFAOYSA-N 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 239000004810 polytetrafluoroethylene Substances 0.000 description 1
- 229920001343 polytetrafluoroethylene Polymers 0.000 description 1
- 229920002689 polyvinyl acetate Polymers 0.000 description 1
- 239000011118 polyvinyl acetate Substances 0.000 description 1
- 230000002028 premature Effects 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- FVSKHRXBFJPNKK-UHFFFAOYSA-N propionitrile Chemical compound CCC#N FVSKHRXBFJPNKK-UHFFFAOYSA-N 0.000 description 1
- 229940090181 propyl acetate Drugs 0.000 description 1
- 239000002510 pyrogen Substances 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 229940081974 saccharin Drugs 0.000 description 1
- 235000019204 saccharin Nutrition 0.000 description 1
- 239000000901 saccharin and its Na,K and Ca salt Substances 0.000 description 1
- YGSDEFSMJLZEOE-UHFFFAOYSA-M salicylate Chemical compound OC1=CC=CC=C1C([O-])=O YGSDEFSMJLZEOE-UHFFFAOYSA-M 0.000 description 1
- 229960001860 salicylate Drugs 0.000 description 1
- 230000035946 sexual desire Effects 0.000 description 1
- 239000004208 shellac Substances 0.000 description 1
- 235000013874 shellac Nutrition 0.000 description 1
- 229940113147 shellac Drugs 0.000 description 1
- ZLGIYFNHBLSMPS-ATJNOEHPSA-N shellac Chemical compound OCCCCCC(O)C(O)CCCCCCCC(O)=O.C1C23[C@H](C(O)=O)CCC2[C@](C)(CO)[C@@H]1C(C(O)=O)=C[C@@H]3O ZLGIYFNHBLSMPS-ATJNOEHPSA-N 0.000 description 1
- AQRYNYUOKMNDDV-UHFFFAOYSA-M silver behenate Chemical compound [Ag+].CCCCCCCCCCCCCCCCCCCCCC([O-])=O AQRYNYUOKMNDDV-UHFFFAOYSA-M 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 208000018198 spasticity Diseases 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 238000001308 synthesis method Methods 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- 238000001757 thermogravimetry curve Methods 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 239000004408 titanium dioxide Substances 0.000 description 1
- 235000010215 titanium dioxide Nutrition 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 238000000870 ultraviolet spectroscopy Methods 0.000 description 1
- NQPDZGIKBAWPEJ-UHFFFAOYSA-N valeric acid Chemical compound CCCCC(O)=O NQPDZGIKBAWPEJ-UHFFFAOYSA-N 0.000 description 1
- MWOOGOJBHIARFG-UHFFFAOYSA-N vanillin Chemical compound COC1=CC(C=O)=CC=C1O MWOOGOJBHIARFG-UHFFFAOYSA-N 0.000 description 1
- FGQOOHJZONJGDT-UHFFFAOYSA-N vanillin Natural products COC1=CC(O)=CC(C=O)=C1 FGQOOHJZONJGDT-UHFFFAOYSA-N 0.000 description 1
- 235000012141 vanillin Nutrition 0.000 description 1
- 239000008215 water for injection Substances 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D235/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings
- C07D235/02—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings condensed with carbocyclic rings or ring systems
- C07D235/04—Benzimidazoles; Hydrogenated benzimidazoles
- C07D235/24—Benzimidazoles; Hydrogenated benzimidazoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached in position 2
- C07D235/26—Oxygen atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/496—Non-condensed piperazines containing further heterocyclic rings, e.g. rifampin, thiothixene or sparfloxacin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/10—Drugs for disorders of the urinary system of the bladder
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/02—Drugs for genital or sexual disorders; Contraceptives for disorders of the vagina
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/10—Drugs for genital or sexual disorders; Contraceptives for impotence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/12—Drugs for genital or sexual disorders; Contraceptives for climacteric disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/02—Muscle relaxants, e.g. for tetanus or cramps
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/06—Antimigraine agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/22—Anxiolytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/16—Otologicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/02—Non-specific cardiovascular stimulants, e.g. drugs for syncope, antihypotensives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C309/00—Sulfonic acids; Halides, esters, or anhydrides thereof
- C07C309/01—Sulfonic acids
- C07C309/02—Sulfonic acids having sulfo groups bound to acyclic carbon atoms
- C07C309/03—Sulfonic acids having sulfo groups bound to acyclic carbon atoms of an acyclic saturated carbon skeleton
- C07C309/04—Sulfonic acids having sulfo groups bound to acyclic carbon atoms of an acyclic saturated carbon skeleton containing only one sulfo group
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C309/00—Sulfonic acids; Halides, esters, or anhydrides thereof
- C07C309/01—Sulfonic acids
- C07C309/28—Sulfonic acids having sulfo groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton
- C07C309/29—Sulfonic acids having sulfo groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton of non-condensed six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C309/00—Sulfonic acids; Halides, esters, or anhydrides thereof
- C07C309/01—Sulfonic acids
- C07C309/28—Sulfonic acids having sulfo groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton
- C07C309/29—Sulfonic acids having sulfo groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton of non-condensed six-membered aromatic rings
- C07C309/30—Sulfonic acids having sulfo groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton of non-condensed six-membered aromatic rings of six-membered aromatic rings substituted by alkyl groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C55/00—Saturated compounds having more than one carboxyl group bound to acyclic carbon atoms
- C07C55/02—Dicarboxylic acids
- C07C55/06—Oxalic acid
- C07C55/07—Salts thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C55/00—Saturated compounds having more than one carboxyl group bound to acyclic carbon atoms
- C07C55/02—Dicarboxylic acids
- C07C55/08—Malonic acid
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D275/00—Heterocyclic compounds containing 1,2-thiazole or hydrogenated 1,2-thiazole rings
- C07D275/04—Heterocyclic compounds containing 1,2-thiazole or hydrogenated 1,2-thiazole rings condensed with carbocyclic rings or ring systems
- C07D275/06—Heterocyclic compounds containing 1,2-thiazole or hydrogenated 1,2-thiazole rings condensed with carbocyclic rings or ring systems with hetero atoms directly attached to the ring sulfur atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D279/00—Heterocyclic compounds containing six-membered rings having one nitrogen atom and one sulfur atom as the only ring hetero atoms
- C07D279/10—1,4-Thiazines; Hydrogenated 1,4-thiazines
- C07D279/14—1,4-Thiazines; Hydrogenated 1,4-thiazines condensed with carbocyclic rings or ring systems
- C07D279/18—[b, e]-condensed with two six-membered rings
- C07D279/22—[b, e]-condensed with two six-membered rings with carbon atoms directly attached to the ring nitrogen atom
- C07D279/24—[b, e]-condensed with two six-membered rings with carbon atoms directly attached to the ring nitrogen atom with hydrocarbon radicals, substituted by amino radicals, attached to the ring nitrogen atom
- C07D279/28—[b, e]-condensed with two six-membered rings with carbon atoms directly attached to the ring nitrogen atom with hydrocarbon radicals, substituted by amino radicals, attached to the ring nitrogen atom with other substituents attached to the ring system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/13—Crystalline forms, e.g. polymorphs
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Pain & Pain Management (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Diabetes (AREA)
- Endocrinology (AREA)
- Reproductive Health (AREA)
- Hematology (AREA)
- Psychiatry (AREA)
- Urology & Nephrology (AREA)
- Epidemiology (AREA)
- Obesity (AREA)
- Hospice & Palliative Care (AREA)
- Rheumatology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Gynecology & Obstetrics (AREA)
- Child & Adolescent Psychology (AREA)
- Anesthesiology (AREA)
- Psychology (AREA)
- Immunology (AREA)
- Vascular Medicine (AREA)
- Emergency Medicine (AREA)
Abstract
本発明は、薬学的に有用な特性を有するフリバンセリンの新規な結晶性の塩形態、それらの製造のための方法、それらを含む医薬製剤及び医薬としてのそれらの使用に関する。
Description
本発明は、フリバンセリン、1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンの結晶性の塩、それらを製造する方法、それらを含む医薬製剤及びそれらの医薬としての使用に関する。
背景技術
化合物1−[2−(4−(3−トリフルオロメチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンは、EP 0 526 434 B1から知られており、以下の式(I):
化合物1−[2−(4−(3−トリフルオロメチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンは、EP 0 526 434 B1から知られており、以下の式(I):
さらに、この化合物の遊離塩基は、その多形B形態ならびにその製造方法でEP 1 414 816 B1から知られている。
上記の特許文献はさらに、異なる疾患の処置、とりわけHSDD(性的欲求低下障害)の処置のための、この化合物の使用を開示している。
発明の要約
本発明の目的は、医薬の使用について有利な特性を有する、新規な形態のフリバンセリンを提供することである。
本発明の目的は、医薬の使用について有利な特性を有する、新規な形態のフリバンセリンを提供することである。
上述した、従来技術で開示されているフリバンセリンの薬理学的に有益な特性は、医薬組成物としての化合物の効果的な使用のための基本的な必要条件を構成する。しかしながら、医薬としての使用が許可されるためには、活性物質はまた、望ましい適応症に実際に効果的であることに限らず、さらなる要求を満足しなければならない。これらのパラメータは、活性物質の物理化学的性質に大きく関係する。
制限されることなく、これらのパラメータの例は、様々な環境条件下での出発物質の効果の安定性、医薬製剤を生産する間の安定性、及び薬物の最終組成物の安定性である。医薬組成物の製造のために用いられる薬学的な活性物質は、したがって、異なる環境条件下でさえ保障される卓越した安定性を有するべきである。例えば、活性物質それ自体に加えて分解産物を含む、医薬組成物を使用されることを防止することは完全に不可欠である。そのような場合、医薬製剤中に存在する活性物質の内容量は規定より低くなりうる。
水分の吸収は、水の取り込みにより引き起こされる質量の増加の結果として、薬学的な活性物質の内容量を減少させる。水分を吸収する傾向を有する医薬組成物は、例えば、適切な乾燥剤を加えるか、又は薬物を水分から保護される環境下で貯蔵することによって、貯蔵の間に水分から保護されなければならない。加えて、医薬の基質がいかなる方法でも水分から保護されていない環境に曝される場合、水分の取り込みは、製造の間に薬学的な活性物質の内容量を減少させうる。したがって好ましくは、薬学的な活性物質は、仮にあったとしても、吸湿性は僅かであるべきである。
製剤の選択又は製造方法の選択に依存する環境下での、特別な重要性となりうる他の基準は、活性物質の溶解性である。例えば医薬溶液を調製する場合(例えば、点滴液)、活性物質が、生理学的に許容される溶媒に十分に可溶性であるべきことは必須である。経口的に摂取される薬物にとって、活性物質が十分に可溶性であることもまた、非常に重要である。
本発明の課題は、高い薬理的な効力を特徴とするだけでなく、上記の物理化学的要求を可能な限り満足する、薬学的な活性物質を提供することである。
したがって、本発明の目的は、有利な物理化学的特性、特に改良された水への溶解性及び最小化された吸湿性を特徴とする、フリバンセリン、1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンの新規な結晶性の塩形態を提供することである。
本発明の他の態様は、1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンの新規な結晶性の塩形態を製造するための方法に関する。
本発明の他の態様は、1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンの新規な結晶性の塩形態を含む医薬組成物及びその医薬としての使用に関する。
発明の詳細な説明
第一の態様において、本発明は、化合物1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンの塩及び/又は結晶性形態及び/又は結晶性の塩形態に関し、以下:
I.DSCを用いた熱分析中に現れる、Tfus(開始)=215±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンクロリド(形態I)(=無水形態)。DSCダイアグラムは、さらに2つの弱い吸熱性の信号を、約122℃及び186℃に観察することができることを加えての特徴とする。この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=15.99±0.05Å、d=7.44±0.05Å、d=3.98±0.05Å及びd=3.44±0.05Åである;
第一の態様において、本発明は、化合物1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンの塩及び/又は結晶性形態及び/又は結晶性の塩形態に関し、以下:
I.DSCを用いた熱分析中に現れる、Tfus(開始)=215±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンクロリド(形態I)(=無水形態)。DSCダイアグラムは、さらに2つの弱い吸熱性の信号を、約122℃及び186℃に観察することができることを加えての特徴とする。この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=15.99±0.05Å、d=7.44±0.05Å、d=3.98±0.05Å及びd=3.44±0.05Åである;
II.DSCを用いた熱分析中に現れる、Tfus(開始)=217±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンクロリド(形態III)(=溶媒和物形態)。DSCダイアグラムは、さらに2つの弱い吸熱性の信号を、約56℃及び121℃に観察することができることを特徴とする。この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=16.43±0.05Å、d=5.08±0.05Å、d=4.35±0.05Å、d=3.47±0.05Å及びd=7.66±0.05Åである;
III.DSCを用いた熱分析中に現れる、Tfus(開始)=252±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンブロミド(形態I)(=溶媒和物形態)。DSCダイアグラムは、さらに2つの弱い吸熱性の信号を、約104℃及び222℃に観察することができることを加えての特徴とする。この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=3.48±0.05Å、d=3.33±0.05Å、d=4.28±0.05Å、d=3.43±0.05Å及びd=16.03±0.05Åである;
IV.DSCを用いた熱分析中に現れる、Tfus(開始)=252±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンブロミド(形態III)(=溶媒和物形態)。DSCダイアグラムは、さらに2つの弱い吸熱性の信号を、約89℃及び218℃に観察することができることを加えての特徴とする。この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=15.52±0.05Å、d=5.15±0.05Å、d=4.60±0.05Å、d=4.36±0.05Å及びd=3.94±0.05Åである;
V.DSCを用いた熱分析中に現れる、Tfus(開始)=144±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンエジシル酸塩(形態I)(=溶媒和物形態)。この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、14.34±0.05Å、d=3.95±0.05Å、d=4.64±0.05Å、d=3.75±0.05Å及びd=9.50±0.05Åである;
VI.DSCを用いた熱分析中に現れる、Tfus(開始)=238±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オントシル酸塩(形態I)(水和物形態)。この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=5.11±0.05Å、d=4.84±0.05Å、d=3.93±0.05Å及びd=3.48±0.05Åである;
VII.DSCを用いた熱分析中に現れる、Tfus(開始)=207±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンメシル酸塩(形態I)(=一水和物形態)。DSCダイアグラムは、さらに1つの弱い吸熱性の信号を、約60℃に観察することができることを加えての特徴とする。この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=15.25±0.05Å、d=4.18±0.05Å、d=3.47±0.05Å、d=4.95±0.05Å及びd=4.24±0.05Åである;室温における水への溶解性は、1.1mg/mlである。相対湿度10〜90%の範囲での水の取り込みで表される吸湿性は、3.4%である。
VIII.DSCを用いた熱分析中に現れる、Tfus(開始)=247±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンベシル酸塩(形態I)(=一水和物形態)。DSCダイアグラムは、さらに1つの弱い吸熱性の信号を、約111℃に観察することができることを加えての特徴とする。この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=3.99±0.05Å、d=4.69±0.05Å、d=4.85±0.05Å及びd=6.42±0.05Åである;室温における水への溶解性は、0.1mg/mlである。相対湿度10〜90%の範囲での水の取り込みで表される吸湿性は、0.15%である。
IX.DSCを用いた熱分析中に現れる、Tfus(開始)=209±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンシュウ酸塩(形態I)(=無水形態)。この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=7.09±0.05Å、d=6.01±0.05Å、d=4.92±0.05Å、d=4.24±0.05Å及びd=4.08±0.05Åである;室温における水への溶解性は、1.7mg/mlである。相対湿度10〜90%の範囲での水の取り込みで表される吸湿性は、0.7%である。
X.DSCを用いた熱分析中に現れる、Tfus(開始)=254±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンシュウ酸塩(形態V)(=二水和物形態)。DSCダイアグラムは、さらに2つの弱い吸熱性の信号を、約112℃及び198℃に観察することができることを加えての特徴とする。この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=7.09±0.05Å、d=5.67±0.05Å、d=5.04±0.05Å、d=4.87±0.05Å及びd=3.76±0.05Åである;
XI.DSCを用いた熱分析中に現れる、Tfus(開始)=90±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンサッカリン塩(形態I)(=1.5水和物形態)。この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=7.86±0.05Å、d=5.90±0.05Å、d=5.30±0.05Å、d=5.14±0.05Å及びd=4.62±0.05Åである;室温における水への溶解性は、0.3mg/mlである。相対湿度10〜90%の範囲での水の取り込みで表される吸湿性は、0.24%である。
XII.DSCを用いた熱分析中に現れる、Tfus(開始)=182±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンリン酸塩(形態I)(=半水和物形態);DSCダイアグラムは、さらに3つの弱い吸熱性の信号を、約81℃、141℃及び164℃に観察することができることを加えての特徴とする。この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=15.79±0.05Å、d=5.06±0.05Å、d=7.90±0.05Å及びd=3.75±0.05Åである;
XIII.DSCを用いた熱分析中に現れる、Tfus(開始)=98±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンマレイン酸塩(形態I)(=THF溶媒和物);DSCダイアグラムは、さらに弱い吸熱性の信号を、約78℃に観察することができることを加えての特徴とする。この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=9.58±0.05Å、d=7.71±0.05Å、d=6.13±0.05Å、d=5.93±0.05Å及びd=4.62±0.05Åである;
XIV.DSCを用いた熱分析中に現れる、Tfus(開始)=172±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンマレイン酸塩(形態III)(=無水形態);この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=6.07±0.05Å、d=5.16±0.05Å、d=4.52±0.05Å、d=4.10±0.05Å及びd=3.20±0.05Åである;
XV.DSCを用いた熱分析中に現れる、Tfus(開始)=207±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンエタンスルホン酸塩(形態I)(=一水和物形態);DSCダイアグラムは、さらに2つの弱い吸熱性の信号を、約105℃及び189℃に観察することができることを加えての特徴とする。この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=15.30±0.05Å、d=7.25±0.05Å、d=5.00±0.05Å、d=4.34±0.05Å及びd=4.23±0.05Åである;室温における水への溶解性は、1.3mg/mlである。相対湿度10〜90%の範囲での水の取り込みで表される吸湿性は、0.32%である。
XVI.DSCを用いた熱分析中に現れる、Tfus(開始)=217±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンカンファースルホン酸塩(形態I)(=無水形態):DSCダイアグラムは、さらに弱い吸熱性の信号を、約177℃に観察することができることを加えての特徴とする。この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=16.32±0.05Å、d=5.69±0.05Å、d=5.45±0.05Å、d=5.50±0.05Å及びd=3.62±0.05Åである;
XVII.DSCを用いた熱分析中に現れる、Tfus(開始)=103±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンマロン酸塩(形態I)(=二水和物形態);DSCダイアグラムは、さらに弱い吸熱性の信号を、約79℃に観察することができることを加えての特徴とする。この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=23.23±0.05Å、d=8.56±0.05Å、d=4.62±0.05Å、d=4.19±0.05Å及びd=3.72±0.05Åである;
XVIII.表2.9に記載されているデータを特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンマロン酸塩(形態II)(=溶媒和物形態);
XIX.表2.10に記載されているデータを特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンマロン酸塩(形態VI)(=二水和物形態);
XX.表2.11に記載されているデータを特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンサリチル酸塩(形態I)(=無水形態);
XXI.DSCを用いた熱分析中に現れる、Tfus(開始)=151±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンL−酒石酸塩(=二水和物形態);この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=5.46±0.05Å、d=4.94±0.05Å、d=4.30±0.05Å、d=4.08±0.05Å及びd=3.74±0.05Åである;
XXII.DSCを用いた熱分析中に現れる、Tfus(開始)=195±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オン半フマル酸塩(形態I)(=無水形態);この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=6.38±0.05Å、d=5.19±0.05Å、d=4.87±0.05Å、d=3.72±0.05Å及びd=3.45±0.05Åである;
XXIII.DSCを用いた熱分析中に現れる、Tfus(開始)=193±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンフマル酸塩(形態II)(=二水和物形態);DSCダイアグラムは、さらに弱い吸熱性の信号を、約157℃に観察することができることを加えての特徴とする。この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=5.42±0.05Å、d=4.73±0.05Å、d=4.25±0.05Å、d=4.06±0.05Å及びd=3.72±0.05Åである;
XXIV.DSCを用いた熱分析中に現れる、Tfus(開始)=139±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オングリコール酸塩(形態I)(=水和物形態);DSCダイアグラムは、さらに2つの弱い吸熱性の信号を、約30℃及び115℃に観察することができることを加えての特徴とする。この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=3.96±0.05Å、d=4.48±0.05Å、d=3.93±0.05Å、d=8.43±0.05Å及びd=3.74±0.05Åである;
XXV.DSCを用いた熱分析中に現れる、Tfus(開始)=176±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンクエン酸塩(形態I)(=溶媒和物形態);DSCダイアグラムは、さらに弱い吸熱性の信号を、約123℃に観察することができることを加えての特徴とする。この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=15.61±0.05Å、d=7.81±0.05Å、d=7.47±0.05Å、d=5.34±0.05Å及びd=4.87±0.05Åである;
XXVI.DSCを用いた熱分析中に現れる、Tfus(開始)=148±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンマンデル酸塩(形態I)(=無水形態);この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=4.87±0.05Å、d=4.66±0.05Å、d=4.10±0.05Å、d=3.88±0.05Å及びd=3.73±0.05Åである;
XXVII.DSCを用いた熱分析中に現れる、Tfus(開始)=176±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンL−リンゴ酸塩(形態I)(=一水和物形態);DSCダイアグラムは、さらに1つの弱い吸熱性の信号を、約106℃に観察することができることを加えての特徴とする。この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=7.82±0.05Å、d=6.10±0.05Å、d=5.22±0.05Å、d=4.95±0.05Å及びd=3.79±0.05Åである;
XXVIII.表2.18に記載されているデータを特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンコハク酸(形態I)(=二水和物形態):
XXIX.d=4.92±0.05Å、d=3.43±0.05Å、d=4.00±0.05Å及びd=3.96±0.05Åに現れる、粉末X線ディフラクトグラム中のピークを特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンナフタレンスルホン酸塩(形態I)(=半水和物形態);
XXX.DSCを用いた熱分析中に現れる、Tfus(開始)=241±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オントシル酸塩(形態II)(=無水形態);この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=4.94±0.05Å、d=4.57±0.05Å、d=4.32±0.05Å、d=3.53±0.05Å及びd=3.35±0.05Åである;室温における水への溶解性は、0.09mg/mlである。相対湿度10〜90%の範囲での水の取り込みで表される吸湿性は、0.25%である。
XXXI.DSCを用いた熱分析中に現れる、Tfus(開始)=202±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンフマル酸塩(形態III)(=無水形態);この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=5.33±0.05Å、d=5.21±0.05Å、d=4.53±0.05Å、d=4.12±0.05Å及びd=3.69±0.05Åである;室温における水への溶解性は、0.5mg/mlである。相対湿度10〜90%の範囲での水の取り込みで表される吸湿性は、0.28%である。
XXXII.DSCを用いた熱分析中に現れる、Tfus(開始)=231±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンカンファースルホン酸塩(形態II)(=無水形態);この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=5.47±0.05Å、d=5.44±0.05Å、d=4.76±0.05Å、d=4.46±0.05Å及びd=3.70±0.05Åである;室温における水への溶解性は、0.7mg/mlである。相対湿度10〜90%の範囲での水の取り込みで表される吸湿性は、0.13%である。
XXXIII.DSCを用いた熱分析中に現れる、Tfus(開始)=231±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オングリコール酸塩(形態II)(=水和物形態);この化合物の粉末X線ディフラクトグラムにおける特に特徴的なピークは、d=5.75±0.05Å、d=4.64±0.05Å、d=4.43±0.05Å、d=4.02±0.05Å及びd=3.97±0.05Åである;室温における水への溶解性は、0.5mg/mlである。相対湿度10〜90%の範囲での水の取り込みで表される吸湿性は、0.20%である。
他の実施態様において、本発明は、上記I)〜XXIX)下で規定されている、フリバンセリンの新規な結晶性の塩形態を調製する方法に関する。
本発明にしたがって、上記規定の化合物は、下記:
i)フリバンセリンの遊離塩基及び塩形成のためのアニオンを提供する酸を、適切な溶媒(好ましくはTFE/水(80:20))に溶解すること;
ii)フリバンセリンの遊離塩基を、酸に依存して1:1又は2:1より選択される、所定の塩基/酸モル比で、酸と混合すること;
iii)溶媒を除去すること(例えば、減圧下での蒸発);
iv)適切な結晶化溶媒を、工程iii)で得られた残留物へ加え、反応混合物をゆっくりと(例えば、加熱速度約5℃/分)約50℃まで加熱し;放置して、さらなる期間(例えば、約30分)静置すること;
v)反応混合物を、適切な結晶化温度(例えば、20℃又は3℃の間)へとゆっくりと冷却し(例えば、冷却速度約5℃/時)、放置して、十分な結晶が形成するまで静置すること;
vi)析出した結晶を単離することによって得ることができる。
i)フリバンセリンの遊離塩基及び塩形成のためのアニオンを提供する酸を、適切な溶媒(好ましくはTFE/水(80:20))に溶解すること;
ii)フリバンセリンの遊離塩基を、酸に依存して1:1又は2:1より選択される、所定の塩基/酸モル比で、酸と混合すること;
iii)溶媒を除去すること(例えば、減圧下での蒸発);
iv)適切な結晶化溶媒を、工程iii)で得られた残留物へ加え、反応混合物をゆっくりと(例えば、加熱速度約5℃/分)約50℃まで加熱し;放置して、さらなる期間(例えば、約30分)静置すること;
v)反応混合物を、適切な結晶化温度(例えば、20℃又は3℃の間)へとゆっくりと冷却し(例えば、冷却速度約5℃/時)、放置して、十分な結晶が形成するまで静置すること;
vi)析出した結晶を単離することによって得ることができる。
本発明にしたがう方法では、式(I)の化合物の遊離塩基は、TFE/水(80:20)のような適切な溶媒に溶解される。結晶化に用いられる酸は、TFE/水(80:20)のような適切な溶媒(酸に依存する)に同様に溶解される。式(I)の化合物の遊離塩基は次に、酸に依存して1:1又は2:1より選択される、所定の塩基/酸のモル比で、酸と混合される。次に溶媒を減圧下で蒸発させる。溶媒を蒸発させた後、適切な結晶化溶媒を反応混合物に加え、反応混合物をゆっくりと最大50℃まで加熱する(例えば、加熱速度約5℃/分)。非限定的に、結晶化のための適切な溶媒は、エタノール、テトラヒドロフラン、ジクロロメタン、n−メチルピロリドン、酢酸プロピル、メチルtert−ブチルエーテル、1,4−ジオキサン、1,2−ジメトキシエタン、水、2,2,2,−トリフルオロエタノール、クロロホルム、メタノール、ニトロベンゼン、ニトロメタン、シクロヘキサノン、プロピオニトリル、エチルフェニルエーテル、ジイソブチルケトン、イソホロン、水/エタノール(20/80)、水/n−メチルピロリドン(80/20)、水/2,2,2−トリフルオロエタノール(20/80)、水/アセトン(20/80)及び水/DMSO(80/20)である。50℃で30分間保った後、反応混合物を適切な結晶化温度、例えば20℃又は3℃の間までゆっくりと冷却する(例えば、冷却速度5℃/h)。反応混合物をこの温度で、十分な結晶が形成するまで保ち、次に例えば濾過により回収することができる。
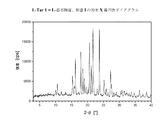
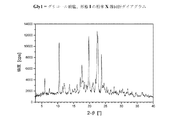
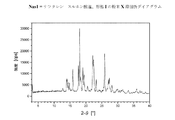
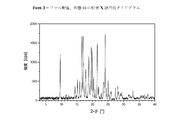
上記I)〜XXIX)下で規定されているフリバンセリンの塩形態は、粉末X線回折及び熱分析(DSC)によってより十分に特定される。得られたダイアグラムを、図1.1〜1.23に示す。表1.1〜1.23は、解析によって得られたデータを含む。表2.1〜2.18は、解析によって得られた単結晶のデータを含む。
本発明にしたがう結晶性の塩形態について記録される粉末X線反射及び強度の値(正規化)は、前記の表1.1〜1.23に示している。各々の結晶性の塩形態について、対応する表中の最高の値、つまり最高の相対強度を有する反射ピークの値(d[Å])は、結晶性の塩形態を特徴づける。値「2−θ[°]」は、回折角を度で示し、値「d[Å]間隔」は、格子面間の規定の距離をÅで示す。
本発明にしたがう結晶性の塩形態の、単結晶のデータ及び構造の精密化は、前記の表2.1〜2.18に示している。これらの表中で用いている略語は、以下の意味を有する:
Fw=式量;
T=データ収集の温度;
λ=X線源の波長;
Dm=密度の計算値;
θ範囲=データ収集のθ幅;
S=F2の適合度;
R[I>2σ(I)]=最終のR指数[I>2シグマ(I)]
Fw=式量;
T=データ収集の温度;
λ=X線源の波長;
Dm=密度の計算値;
θ範囲=データ収集のθ幅;
S=F2の適合度;
R[I>2σ(I)]=最終のR指数[I>2シグマ(I)]
本発明のさらなる目的は、以下の疾患の治療又は予防のための医薬の製造のための、上記の塩及び結晶性の塩形態の使用である。
上記本発明の塩及び結晶性の塩形態の適応症は、フリバンセリンについて公知の適応症全てを含むことができ、例えば、中枢神経系障害の患者の治療、特に情動障害(例えば、大うつ病性障害、小児うつ病、気分変調、季節性情動障害、気分変調性障害及び軽度うつ病性障害のようなうつ病;双極性障害)、不安症(広場恐怖症を伴うか又は伴わないパニック障害、パニック障害病歴を伴わない広場恐怖症、特定の恐怖症(単純恐怖)、社会恐怖症(社会不安障害)、強迫性障害(OCD)、心的外傷後ストレス障害、急性ストレス障害、全般性不安障害及び特定不能の不安障害を含む)、睡眠及び性的障害(例えば、性的欲求低下障害、月経前不快感、月経前症候群、月経前不快気分障害のような月経前障害;性嫌悪障害、性的興奮障害、オルガスム障害、性交疼痛症、膣痙、非性交時性的疼痛障害のような性的疼痛障害;全身状態が原因の性的機能異常及び物質誘発の性的機能異常)、精神病、統合失調症(解体型、緊張型、妄想型、鑑別不能型、残遺型の統合失調症、統合失調感情障害、統合失調症様障害、妄想性障害、短期精神病性障害、共有精神病性障害、全身状態が原因の精神病性障害、物質誘発の精神病性障害、及び特定不能の精神病性障害を含む)、人格障害、器質性精神障害、小児精神障害、攻撃性、加齢関連性記憶障害、神経防護のための、神経変性疾患ならびに様々な起源の脳虚血(例えば、てんかん、低血糖症、低酸素症、無酸素症、脳外傷、脳浮腫、筋萎縮性側索硬化症、ハンチントン病、アルツハイマー病、低血圧症、心筋梗塞、脳圧(頭蓋内圧上昇)、虚血性及び出血性脳卒中(脳卒中)、心停止中の全脳虚血、糖尿病性多発ニューロパシー、耳鳴、周産期仮死、心肥大(心筋肥厚)及び心不全(心筋衰弱);神経性食欲不振(無茶食い/排泄型の神経性食欲不振及び制限型の神経性食欲不振を含む)、注意欠陥多動性障害(ADHD)(混合優勢型ADHD、不注意優勢型ADHD及び多動・衝動性優勢型ADHDを含む)、肥満症(外因性肥満症、高インスリン性肥満症、過血漿性肥満症、下垂体性肥満症、減血漿性肥満症、甲状腺機能不全性肥満症、視床下部性肥満症、症候性肥満症、小児肥満症、上半身肥満症、食事性肥満症、性機能低下性肥満症及び中枢性肥満症を含む)、尿失禁(過活動膀胱症候群、緊急性、切迫性尿失禁、腹圧性尿失禁、混合型尿失禁を含む)、慢性疼痛(神経因性疼痛、糖尿病性神経障害、帯状疱疹後神経痛(PHN)、手根管症候群(CTS)、HIV神経障害、幻肢疼痛、複合性局所疼痛症候群(CPRS)、三叉神経痛(trigeminal neuralgia)/三叉神経痛(trigeminus neuralgia)/疼痛性チック(tic douloureux)、外科的介入(例えば、術後鎮痛薬)、糖尿病性脈管障害、膵島炎に関連する毛細血管抵抗又は糖尿病性症状、狭心症に関連する疼痛、月経に関連する疼痛、癌に関連する疼痛、歯痛、頭痛、片頭痛、三叉神経痛、顎関節症候群、筋膜疼痛筋肉損傷、線維筋痛症候群、骨及び関節の疼痛(変形性関節症)、リウマチ性関節炎、熱傷に関連する外傷に起因するリウマチ性関節炎及び浮腫、変形性関節症、骨粗鬆症、骨転移が原因の又は理由不明の捻挫又は骨折の疼痛、痛風、結合組織炎、筋膜疼痛、胸郭出口症候群、上背部疼痛又は下背部疼痛(ここで、背疼痛は組織的、局所的、又は原発性脊椎疾患(神経根障害)、骨盤疼痛、心臓性胸疼痛、非心臓性胸疼痛、脊髄損傷(SCI)関連疼痛、中枢性脳卒中後疼痛、癌の神経障害、AIDSの疼痛、鎌状赤血球の疼痛及び高齢者疼痛に起因する)、心臓弁膜症(狭窄性弁膜症、弁膜逆流、一つの弁の閉鎖、僧帽弁逸脱を含む)、不眠症(第一級及び第二級不眠症を含む)及び血管運動症状の治療及び/又は予防である。
好ましくは、塩及び結晶性の塩形態は、性的欲求の障害、より好ましくはHSDD(性的欲求低下障害)の処置に使用することができる。本発明はまた、上述した本発明の塩又は結晶性の塩形態を含む医薬組成物に関する。
上記本発明の塩及び結晶性の塩形態は、固体、液体又はスプレーの形態で従来の医薬製剤に組み込むことができる。組成物は、例えば、適切には、経口、直腸、非経口投与又は鼻孔吸入の形態で存在することができる:好ましい形態は、例えば、カプセル剤、錠剤、コーティング錠、アンプル剤、坐剤及び鼻孔スプレーを含む。
活性成分は、例えばタルク、アラビアゴム、ラクトース、ゼラチン、ステアリン酸マグネシウム、トウモロコシデンプン、水性又は非水性溶剤、ポリビニルピロリドン、脂肪酸の半合成グリセリド、塩化ベンザルコニウム、リン酸ナトリウム、EDTA、ポリソルベート80のような、医薬組成物中に従来的に用いられる賦形剤又は担体に組み込むことができる。組成物は、有利には用量単位で処方され、各々の用量単位は活性成分の単回用量を提供するのに適応される。1日につき適用できる量の範囲は、0.1〜400の間、好ましくは1.0〜300の間、より好ましくは2〜200mgの間である。各々の用量単位は、0.01mgから100mgまで、好ましくは0.1から50mgまで、好都合には含むことができる。
適切な錠剤は、例えば、活性物質を既知の賦形剤(例えば、炭酸カルシウム、リン酸カルシウムもしくは乳糖のような不活性希釈剤;トウモロコシデンプンもしくはアルギン酸のような崩壊剤;デンプンもしくはゼラチンのような結合剤;ステアリン酸マグネシウムもしくはタルクのような滑沢剤;及び/又はカルボキシメチルセルロース、酢酸フタル酸セルロース、もしくはポリ酢酸ビニルのような放出を遅延させる物質)と混合することにより得られる。錠剤はまた、複数の層を含んでいてもよい。
コーティング錠は、錠剤と同様に製造したコアを、通常錠剤コーティングに使用される物質、例えば、コリドン(collidone)又はシェラック、アラビアゴム、タルク、二酸化チタン又は糖類でコーティングすることにより、しかるべく調製することができる。遅延放出を達成するか、又は配合禁忌を妨げるために、コアはまた、数層からなっていてもよい。同様に、錠剤コーティングは、場合により錠剤用の上述の賦形剤を用いて、遅延放出を達成するために数層からなっていてもよい。
本発明の活性物質又はその組合せを含有するシロップ剤又はエリキシル剤は、更にサッカリン、サイクラマート、グリセロール又は糖類のような甘味料、及び香味増強剤、例えば、バニリン又はオレンジエキスのような香味料を含有してもよい。これらはまた、懸濁補助剤又はカルボキシメチルセルロースナトリウムのような増粘剤、例えば、脂肪アルコールとエチレンオキシドとの縮合生成物のような湿潤剤、又はp−ヒドロキシ安息香酸エステルのような保存料を含有してもよい。
注射用の液剤は、通常の方法、例えば、p−ヒドロキシ安息香酸エステルのような防腐剤、又はエチレンジアミン四酢酸のアルカリ金属塩のような安定化剤の添加を用いて調製され、注射バイアル又はアンプルに移す。
1種以上の活性物質又は活性物質の組合せを含有するカプセル剤は、例えば、活性物質を乳糖又はソルビトールのような不活性担体と混合して、これをゼラチンカプセルに詰めることにより調製できる。
適切な坐剤は、例えば、中性脂肪又はポリエチレングリコールもしくはその誘導体のような、この目的で提供される担体と混合することにより、製造することができる。
実施例
塩の特徴づけの解析的方法
採取した結晶は、粉末X線回折及び熱分析(DSC)によって特徴づけることができる。適切な単結晶が育つ場合、単結晶X線構造解析を実施することができる。以下の機器が、結晶性の塩形態を特徴づけることに用いられる。
塩の特徴づけの解析的方法
採取した結晶は、粉末X線回折及び熱分析(DSC)によって特徴づけることができる。適切な単結晶が育つ場合、単結晶X線構造解析を実施することができる。以下の機器が、結晶性の塩形態を特徴づけることに用いられる。
粉末X線回折(=XRPD)
XRPDパターンは、高処理能力XRPD装置を用いて得た。プレートを、Hi-Starエリア検出器を備えたBruker GADDS回折計に取り付けた。長い面間隔(d-spacings)にはベヘン酸銀を、短い面間隔にはコランダムを用いて、回折計を較正した。
XRPDパターンは、高処理能力XRPD装置を用いて得た。プレートを、Hi-Starエリア検出器を備えたBruker GADDS回折計に取り付けた。長い面間隔(d-spacings)にはベヘン酸銀を、短い面間隔にはコランダムを用いて、回折計を較正した。
データの収集は、1.5〜41.5°の間の2Θの領域での単色CuKα放射線を用いて室温でおこなった。各々のウェルの回折パターンを3〜4分間の露光により収集した。
単結晶X線構造解析
適切な単結晶を選択し、ガラスファイバーに接着し、X線回折ゴニオメーターに取り付けた。取り付けた結晶のX線回折データを、233Kの温度で、KappaCCDシステムと、FR590X線発生機(Bruker Nonius Delft, The Netherlands)により生成するMoKα線を用いて収集した。単位格子パラメータ及び結晶構造は、ソフトウェアパッケージmaXus(Mackay et al., 1997)を用いて決定し、精密化した。
適切な単結晶を選択し、ガラスファイバーに接着し、X線回折ゴニオメーターに取り付けた。取り付けた結晶のX線回折データを、233Kの温度で、KappaCCDシステムと、FR590X線発生機(Bruker Nonius Delft, The Netherlands)により生成するMoKα線を用いて収集した。単位格子パラメータ及び結晶構造は、ソフトウェアパッケージmaXus(Mackay et al., 1997)を用いて決定し、精密化した。
熱分析(DSC)
溶融特性は、DSC822e(Mettler-Toledo GmbH、Switzerland)で記録した示差走査熱量測定(=DSC)サーモグラムから得た。DSC822eは、小片のインジウム(Tfus=156.6℃、ΔHfus=28.45J/g)を用いて、温度及びエンタルピーについて較正した。サンプルを標準40μlアルミニウム皿中に密閉し、DSC中で加熱速度20℃/分にて25℃から300℃まで加熱した。測定中は、50ml/分の流量で乾燥窒素ガスを用いてDSC装置をパージした。用いた溶融温度は、DSCダイアグラム中、対応する融解ピークのTfus(開始)温度である。特定した融点の確度は約±5℃である。
溶融特性は、DSC822e(Mettler-Toledo GmbH、Switzerland)で記録した示差走査熱量測定(=DSC)サーモグラムから得た。DSC822eは、小片のインジウム(Tfus=156.6℃、ΔHfus=28.45J/g)を用いて、温度及びエンタルピーについて較正した。サンプルを標準40μlアルミニウム皿中に密閉し、DSC中で加熱速度20℃/分にて25℃から300℃まで加熱した。測定中は、50ml/分の流量で乾燥窒素ガスを用いてDSC装置をパージした。用いた溶融温度は、DSCダイアグラム中、対応する融解ピークのTfus(開始)温度である。特定した融点の確度は約±5℃である。
吸湿性
Hiden IsochemaからのIGAsorp水吸着モニターを室温での吸湿性挙動の解析に用いた。
湿度分析結果:10〜90%r.h.で10%ずつ、吸着ならびに脱着の分析結果を記録した。
計量した量(weight-in quantity):10〜20mg
Hiden IsochemaからのIGAsorp水吸着モニターを室温での吸湿性挙動の解析に用いた。
湿度分析結果:10〜90%r.h.で10%ずつ、吸着ならびに脱着の分析結果を記録した。
計量した量(weight-in quantity):10〜20mg
溶解性
異なる結晶性の塩形態の水への溶解性を、約5mgの化合物を5mlの水に室温で加えることで決定した。混合物を室温で2時間激しく振とうした。その後、不溶性固体を0.45μm PTFEフィルターを通した濾過により除去し、濾液中の溶解した化合物の量をUV−分光法により決定した。
異なる結晶性の塩形態の水への溶解性を、約5mgの化合物を5mlの水に室温で加えることで決定した。混合物を室温で2時間激しく振とうした。その後、不溶性固体を0.45μm PTFEフィルターを通した濾過により除去し、濾液中の溶解した化合物の量をUV−分光法により決定した。
塩形態の合成
方法は、96ウェルアッセイプレート中、並行して行われるように、以下の塩及び結晶性の塩形態の製造方法の実施例に例示した(各々のウェルの最大体積は約200μlである)。
方法は、96ウェルアッセイプレート中、並行して行われるように、以下の塩及び結晶性の塩形態の製造方法の実施例に例示した(各々のウェルの最大体積は約200μlである)。
約1gのフリバンセリンの遊離塩基を、10mlのTFE/水80:20に溶解した。塩の調製に用いられる酸を、フリバンセリンとそれぞれの酸のモル比が、表3下の「塩基/酸比」にて与えられた情報にしたがって定められるように、異なる溶媒に溶解した。フマル酸をTHF/水80:20に溶解し、水中のHCl及び用いた他の全ての酸をTFE/水80:20に溶解した。しかしながら、使用される酸を溶解することができる全ての溶媒が使用されうることを留意されたい。次に96ウェルプレートを、溶媒を蒸発させるために、室温で24時間、真空室(1kPa)中に置いた。その後、各々のウェルに、表3下の「結晶化溶媒」にて与えられた情報にしたがって、別の溶媒を加え、ウェルプレートを密閉し、加熱速度約5℃/分にて50℃まで加熱した。プレートを次に追加の30分間、50℃にて保持した。その後、プレートを冷却速度約5℃/時にて、表3下に「Tfinal[℃]」にて与えられる情報にしたがって、3又は20℃の最終温度まで冷却した。この温度で、プレートを24時間の保持時間保った。次にプレートを開き、固体を濾過により回収した。
表3に規定される全ての塩は、上記明細書にしたがって合成した。
表3に規定される全ての塩は、上記明細書にしたがって合成した。
製剤の実施例:
以下の実施例は、その範囲を制限することなく本発明を例示する:
以下の実施例は、その範囲を制限することなく本発明を例示する:
医薬製剤の実施例
A) 錠剤 1錠あたり
活性物質 100mg
乳糖 240mg
トウモロコシデンプン 340mg
ポリビニルピロリドン 45mg
ステアリン酸マグネシウム 15mg
740mg
A) 錠剤 1錠あたり
活性物質 100mg
乳糖 240mg
トウモロコシデンプン 340mg
ポリビニルピロリドン 45mg
ステアリン酸マグネシウム 15mg
740mg
微粉化した活性物質、乳糖及び少量のトウモロコシデンプンを一緒に混合する。この混合物を篩にかけ、次にポリビニルピロリドン水溶液で湿らせ、混練し、湿式造粒して乾燥する。この顆粒、残りのトウモロコシデンプン及びステアリン酸マグネシウムを篩にかけて、一緒に混合する。この混合物を圧縮することにより適切な形状と大きさの錠剤を作る。
B) 錠剤 1錠当たり
活性物質 80mg
トウモロコシデンプン 190mg
乳糖 55mg
微晶質セルロース 35mg
ポリビニルピロリドン 15mg
ナトリウム−カルボキシメチルデンプン 23mg
ステアリン酸マグネシウム 2mg
400mg
活性物質 80mg
トウモロコシデンプン 190mg
乳糖 55mg
微晶質セルロース 35mg
ポリビニルピロリドン 15mg
ナトリウム−カルボキシメチルデンプン 23mg
ステアリン酸マグネシウム 2mg
400mg
微粉化した活性物質、少量のトウモロコシデンプン、乳糖、微結晶性セルロース、及びポリビニルピロリドンを一緒に混合し、この混合物を篩にかけて、残りのトウモロコシデンプン及び水で処理することにより顆粒を形成し、これを乾燥して篩にかける。カルボキシメチルデンプンナトリウム及びステアリン酸マグネシウムを加えて混合し、そしてこの混合物を圧縮することにより適切な形状と大きさの錠剤を形成する。
C) コーティング錠 1コーティング錠当たり
活性物質 5mg
トウモロコシデンプン 41.5mg
乳糖 30mg
ポリビニルピロリドン 3mg
ステアリン酸マグネシウム 0.5mg
80mg
活性物質 5mg
トウモロコシデンプン 41.5mg
乳糖 30mg
ポリビニルピロリドン 3mg
ステアリン酸マグネシウム 0.5mg
80mg
活性物質、トウモロコシデンプン、乳糖、及びポリビニルピロリドンを充分に混合し、水で湿らせる。この湿った塊を、1mmメッシュサイズの篩から押出し、約45℃で乾燥させ、次にこの顆粒を同じ篩に通す。ステアリン酸マグネシウムをここに混合後、直径6mmの凸型の錠剤核を打錠機で圧縮する。こうして製造した錠剤核を、既知のやり方で、基本的に糖類及びタルクからなる被覆でコーティングする。完成したコーティング錠をロウで磨く。
D) カプセル剤 1カプセル剤当たり
活性物質 150mg
トウモロコシデンプン 268.5mg
ステアリン酸マグネシウム 1.5mg
420mg
活性物質 150mg
トウモロコシデンプン 268.5mg
ステアリン酸マグネシウム 1.5mg
420mg
活性物質及びトウモロコシデンプンを混合し、水で湿らせる。この湿った塊を篩にかけて乾燥させる。この乾燥顆粒を篩にかけ、ステアリン酸マグネシウムと混合する。工程の終了した混合物をサイズ1の硬ゼラチンカプセルに詰める。
E) アンプル溶液
活性物質 50mg
塩化ナトリウム 50mg
注射用水 5ml
活性物質 50mg
塩化ナトリウム 50mg
注射用水 5ml
活性物質を、それ自体のpHで、又は場合によりpH5.5〜6.5で水に溶解させ、塩化ナトリウムを加えて等張にする。得られた溶液を濾過して発熱性物質を除去し、濾液を無菌条件下でアンプルに移し、次にこれを滅菌して、溶融により密封する。
F) 坐剤
活性物質 50mg
脂質固体 1650mg
1700mg
活性物質 50mg
脂質固体 1650mg
1700mg
硬い脂肪を溶かす。40℃で、粉末にした活性物質を均一に分散する。それを38℃まで冷却し、わずかに冷却した坐薬型に注入する。
Claims (6)
- 以下:
I.DSCを用いた熱分析中に現れる、Tfus(開始)=215±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンクロリド;
II.DSCを用いた熱分析中に現れる、Tfus(開始)=217±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンクロリド;
III.DSCを用いた熱分析中に現れる、Tfus(開始)=252±5℃の融点、ならびにd=3.48±0.05Å、d=3.33±0.05Å、d=4.28±0.05Å、d=3.43±0.05Å及びd=16.03±0.05Åに現れる、粉末X線ディフラクトグラムのピークを特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンブロミド;
IV.DSCを用いた熱分析中に現れる、Tfus(開始)=252±5℃の融点、ならびにd=15.52±0.05Å、d=5.15±0.05Å、d=4.60±0.05Å、d=4.36±0.05Å及びd=3.94±0.05Åに現れる、粉末X線ディフラクトグラムのピークを特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンブロミド;
V.DSCを用いた熱分析中に現れる、Tfus(開始)=144±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンエジシル酸塩;
VI.DSCを用いた熱分析中に現れる、Tfus(開始)=238±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オントシル酸塩;
VII.DSCを用いた熱分析中に現れる、Tfus(開始)=207±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンメシル酸塩;
VIII.DSCを用いた熱分析中に現れる、Tfus(開始)=247±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンベシル酸塩;
IX.DSCを用いた熱分析中に現れる、Tfus(開始)=209±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンシュウ酸塩;
X.DSCを用いた熱分析中に現れる、Tfus(開始)=254±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンシュウ酸塩;
XI.DSCを用いた熱分析中に現れる、Tfus(開始)=90±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンサッカリン塩;
XII.DSCを用いた熱分析中に現れる、Tfus(開始)=182±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンリン酸塩;
XIII.DSCを用いた熱分析中に現れる、Tfus(開始)=98±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンマレイン酸塩;
XIV.DSCを用いた熱分析中に現れる、Tfus(開始)=172±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンマレイン酸塩;
XV.DSCを用いた熱分析中に現れる、Tfus(開始)=207±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンエタンスルホン酸塩;
XVI.DSCを用いた熱分析中に現れる、Tfus(開始)=217±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンカンファースルホン酸塩:
XVII.DSCを用いた熱分析中に現れる、Tfus(開始)=103±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンマロン酸塩;
XVIII.以下のデータ:
を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンマロン酸塩;
XIX.以下のデータ:
を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンマロン酸塩;
XX.以下のデータ:
を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンサリチル酸塩;
XXI.DSCを用いた熱分析中に現れる、Tfus(開始)=151±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンL−酒石酸塩;
XXII.DSCを用いた熱分析中に現れる、Tfus(開始)=195±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オン半フマル酸塩;
XXIII.DSCを用いた熱分析中に現れる、Tfus(開始)=193±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンフマル酸塩;
XXIV.DSCを用いた熱分析中に現れる、Tfus(開始)=139±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オングリコール酸塩(形態I)(=水和物の形態);
XXV.DSCを用いた熱分析中に現れる、Tfus(開始)=176±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンクエン酸塩;
XXVI.DSCを用いた熱分析中に現れる、Tfus(開始)=148±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンマンデル酸塩;
XXVII.DSCを用いた熱分析中に現れる、Tfus(開始)=176±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンL−リンゴ酸塩;
XXVIII.以下のデータ:
を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンコハク酸塩;
XXIX.d=4.92±0.05Å、d=3.43±0.05Å、d=4.00±0.05Å及びd=3.96±0.05Åに現れる、粉末X線ディフラクトグラム中のピークを特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンナフタレンスルホン酸塩;
XXX.DSCを用いた熱分析中に現れる、Tfus(開始)=241±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オントシル酸塩(形態II)(=無水形態);
XXXI.DSCを用いた熱分析中に現れる、Tfus(開始)=202±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンフマル酸塩(形態III)(=無水形態);
XXXII.DSCを用いた熱分析中に現れる、Tfus(開始)=231±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンカンファースルホン酸塩(形態II)(=無水形態);
XXXIII.DSCを用いた熱分析中に現れる、Tfus(開始)=231±5℃の融点を特徴とする、結晶性の1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オングリコール酸塩(形態II)(=水和物形態);
からなる群より選択される、化合物1−[2−(4−(3−トリフルオロ−メチル−フェニル)ピペラジン−1−イル)エチル]−2,3−ジヒドロ−1H−ベンゾイミダゾール−2−オンの塩。 - 医薬として用いるための、請求項1記載の結晶性の塩形態。
- 場合により1つ以上の薬学的に許容される賦形剤とともに、1つ以上の請求項1記載の結晶性の塩形態を含む、医薬組成物。
- 請求項1記載の結晶性の塩形態を調製するための方法であって、以下の工程:
i)フリバンセリンの遊離塩基及び塩形成のためのアニオンを提供する酸を、適切な溶媒に溶解する工程;
ii)フリバンセリンの遊離塩基を、酸に依存して1:1又は2:1より選択される、所定の塩基/酸モル比で、酸と混合する工程;
iii)溶媒を除去する工程;
iv)適切な結晶化溶媒を、工程iii)で得られた残留物へ加え、反応混合物をゆっくりと約50℃まで加熱し;放置して、さらなる期間静置する工程;
v)反応混合物を、適切な結晶化温度へとゆっくりと冷却し、放置して、十分な結晶が形成するまで静置する工程;
vi)析出した結晶を単離する工程を含む方法。 - 中枢神経系障害の治療、特に情動障害(例えば、大うつ病性障害、小児うつ病、気分変調、季節性情動障害、気分変調性障害及び軽度うつ病性障害のようなうつ病;双極性障害)、不安症(広場恐怖症を伴うか又は伴わないパニック障害、パニック障害病歴を伴わない広場恐怖症、特定の恐怖症(単純恐怖)、社会恐怖症(社会不安障害)、強迫性障害(OCD)、心的外傷後ストレス障害、急性ストレス障害、全般性不安障害及び特定不能の不安障害を含む)、睡眠及び性的障害(例えば、性的欲求低下障害、月経前不快感、月経前症候群、月経前不快気分障害のような月経前障害;性嫌悪障害、性的興奮障害、オルガスム障害、性交疼痛症、膣痙、非性交時性的疼痛障害のような性的疼痛障害;全身状態が原因の性的機能異常及び物質誘発の性的機能異常)、精神病、統合失調症(解体型、緊張型、妄想型、鑑別不能型、残遺型の統合失調症、統合失調感情障害、統合失調症様障害、妄想性障害、短期精神病性障害、共有精神病性障害、全身状態が原因の精神病性障害、物質誘発の精神病性障害、及び特定不能の精神病性障害を含む)、人格障害、器質性精神障害、小児精神障害、攻撃性、加齢関連性記憶障害、神経防護のための、神経変性疾患ならびに様々な起源の脳虚血(例えば、てんかん、低血糖症、低酸素症、無酸素症、脳外傷、脳浮腫、筋萎縮性側索硬化症、ハンチントン病、アルツハイマー病、低血圧症、心筋梗塞、脳圧(頭蓋内圧上昇)、虚血性及び出血性脳卒中(脳卒中)、心停止中の全脳虚血、糖尿病性多発ニューロパシー、耳鳴、周産期仮死、心肥大(心筋肥厚)及び心不全(心筋衰弱);神経性食欲不振(無茶食い/排泄型の神経性食欲不振及び制限型の神経性食欲不振を含む)、注意欠陥多動性障害(ADHD)(混合優勢型ADHD、不注意優勢型ADHD及び多動・衝動性優勢型ADHDを含む)、肥満症(外因性肥満症、高インスリン性肥満症、過血漿性肥満症、下垂体性肥満症、減血漿性肥満症、甲状腺機能不全性肥満症、視床下部性肥満症、症候性肥満症、小児肥満症、上半身肥満症、食事性肥満症、性機能低下性肥満症及び中枢性肥満症を含む)、尿失禁(過活動膀胱症候群、緊急性、切迫性尿失禁、腹圧性尿失禁、混合型尿失禁を含む)、慢性疼痛(神経因性疼痛、糖尿病性神経障害、帯状疱疹後神経痛(PHN)、手根管症候群(CTS)、HIV神経障害、幻肢疼痛、複合性局所疼痛症候群(CPRS)、三叉神経痛(trigeminal neuralgia)/三叉神経痛(trigeminus neuralgia)/疼痛性チック(tic douloureux)、外科的介入(例えば、術後鎮痛薬)、糖尿病性脈管障害、膵島炎に関連する毛細血管抵抗又は糖尿病性症状、狭心症に関連する疼痛、月経に関連する疼痛、癌に関連する疼痛、歯痛、頭痛、片頭痛、三叉神経痛、顎関節症候群、筋膜疼痛筋肉損傷、線維筋痛症候群、骨及び関節の疼痛(変形性関節症)、リウマチ性関節炎、熱傷に関連する外傷に起因するリウマチ性関節炎及び浮腫、変形性関節症、骨粗鬆症、骨転移が原因の又は理由不明の捻挫又は骨折の疼痛、痛風、結合組織炎、筋膜疼痛、胸郭出口症候群、上背部疼痛又は下背部疼痛(ここで、背疼痛は組織的、局所的、又は原発性脊椎疾患(神経根障害)、骨盤疼痛、心臓性胸疼痛、非心臓性胸疼痛、脊髄損傷(SCI)関連疼痛、中枢性脳卒中後疼痛、癌の神経障害、AIDSの疼痛、鎌状赤血球の疼痛及び高齢者疼痛に起因する)、心臓弁膜症(狭窄性弁膜症、弁膜逆流、一つの弁の閉鎖、僧帽弁逸脱を含む)、不眠症(第一級及び第二級不眠症を含む)及び血管運動症状の治療及び/又は予防のための医薬組成物を製造するための、請求項1記載の化合物の使用。
- 疾患が、性的欲求低下障害である、請求項6記載の使用。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP08171699.5 | 2008-12-15 | ||
| EP08171699 | 2008-12-15 | ||
| PCT/EP2009/067007 WO2010079045A2 (en) | 2008-12-15 | 2009-12-14 | New salts |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2012512145A true JP2012512145A (ja) | 2012-05-31 |
| JP2012512145A5 JP2012512145A5 (ja) | 2013-02-07 |
Family
ID=42115616
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011540128A Pending JP2012512145A (ja) | 2008-12-15 | 2009-12-14 | フリバンセリンの結晶性の塩形態 |
Country Status (5)
| Country | Link |
|---|---|
| US (2) | US20120322810A9 (ja) |
| EP (1) | EP2376457A2 (ja) |
| JP (1) | JP2012512145A (ja) |
| CA (1) | CA2686480A1 (ja) |
| WO (1) | WO2010079045A2 (ja) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| UA78974C2 (en) | 2001-10-20 | 2007-05-10 | Boehringer Ingelheim Pharma | Use of flibanserin for treating disorders of sexual desire |
| US10675280B2 (en) | 2001-10-20 | 2020-06-09 | Sprout Pharmaceuticals, Inc. | Treating sexual desire disorders with flibanserin |
| JP2009503020A (ja) | 2005-08-03 | 2009-01-29 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | 肥満症の治療におけるフリバンセリンの使用 |
| ATE524446T1 (de) * | 2006-12-20 | 2011-09-15 | Boehringer Ingelheim Int | Sulfatierte benzimidazolon-derivate mit gemischter serotonin-rezeptor-affinität |
| WO2017076356A1 (zh) * | 2015-11-05 | 2017-05-11 | 苏州晶云药物科技有限公司 | 氟班色林的新晶型及其制备方法 |
| US11492343B2 (en) | 2016-01-31 | 2022-11-08 | Xiaoming Meng | Polymorph of flibanserin and preparation method thereof and use of same |
| WO2017142002A1 (ja) * | 2016-02-17 | 2017-08-24 | 大正製薬株式会社 | C-4"位置換マクロライド化合物フリー体及び塩の結晶形並びにそれらの製造方法 |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH06509575A (ja) * | 1991-07-30 | 1994-10-27 | ベーリンガー インゲルハイム イタリア ソシエタ ペル アチオニ | 5−HT↓1↓a拮抗物質及び5−HT↓2 拮抗物質としてのベンゾイミダゾロン誘導体 |
| JP2004529175A (ja) * | 2001-05-11 | 2004-09-24 | カー. ベック ユルゲン | 2h−ベンズイミダゾール−2−オン、1,3−ジヒドロ−1−(2−{4−[3−(トリフルオロメチル)フェニル]−1−ピペラジニル}エチル)−及びその生理学的に許容される酸付加塩の新規使用 |
| JP2004537597A (ja) * | 2001-08-02 | 2004-12-16 | ビダケム ソシエタ ペル アチオニ | 安定多形体のフリバンセリン、その製造方法及び薬剤を製造するためのその使用 |
| WO2008006838A1 (en) * | 2006-07-14 | 2008-01-17 | Boehringer Ingelheim International Gmbh | Use of flibanserin for the treatment of sexual disorders in females |
| WO2008019996A2 (en) * | 2006-08-14 | 2008-02-21 | Boehringer Ingelheim International Gmbh | Formulations of flibanserin and method for manufacturing the same |
| WO2008116890A2 (en) * | 2007-03-28 | 2008-10-02 | Boehringer Ingelheim International Gmbh | Pharmaceutical compositions comprising flibanserin and a further agent in the treatment of sexual disorders |
Family Cites Families (44)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3362956A (en) | 1965-08-19 | 1968-01-09 | Sterling Drug Inc | 1-[(heterocyclyl)-lower-alkyl]-4-substituted-piperazines |
| IL57569A0 (en) | 1978-06-20 | 1979-10-31 | Synthelabo | Phenylpiperazine derivative,their preparation and pharmaceutical compositions containing them |
| DE3126703A1 (de) | 1981-07-07 | 1983-01-27 | Dr. Karl Thomae Gmbh, 7950 Biberach | Bromhexin-retardform und verfahren zu ihrer herstellung |
| JPS58134033A (ja) | 1982-02-02 | 1983-08-10 | Fujisawa Pharmaceut Co Ltd | 医薬組成物 |
| IE58370B1 (en) | 1985-04-10 | 1993-09-08 | Lundbeck & Co As H | Indole derivatives |
| HUT43600A (en) | 1985-06-22 | 1987-11-30 | Sandoz Ag | Process for production of new thiazole derivatives and medical compound containing those |
| US4954503A (en) | 1989-09-11 | 1990-09-04 | Hoechst-Roussel Pharmaceuticals, Inc. | 3-(1-substituted-4-piperazinyl)-1H-indazoles |
| HUT68769A (en) | 1991-05-07 | 1995-07-28 | Merck & Co Inc | FIBRINOGéN RECEPTOR ANTAGONIST COMPOUNDS AND PHARMACEUTICAL COMPOSITIONS COMPRISING THEM AS EFFECTIVE SUBSTANCE |
| US5407686A (en) | 1991-11-27 | 1995-04-18 | Sidmak Laboratories, Inc. | Sustained release composition for oral administration of active ingredient |
| DE4216364A1 (de) | 1991-12-14 | 1993-11-25 | Thomae Gmbh Dr K | Neue Pyridylderivate, diese Verbindungen enthaltende Arzneimittel und Verfahren zu ihrer Herstellung |
| EP0696919B1 (en) | 1993-04-05 | 2002-01-30 | Competitive Technologies, Inc. | Diagnosis and treatment of erectile dysfunction |
| US5883094A (en) | 1995-04-24 | 1999-03-16 | Pfizer Inc. | Benzimidazolone derivatives with central dopaminergic activity |
| ZA979937B (en) | 1996-11-06 | 1999-05-18 | Sharmatek Inc | Delayed delivery system for acid-sensitive drugs |
| AU742425B2 (en) | 1998-06-11 | 2002-01-03 | Merck & Co., Inc. | Spiropiperidine derivatives as melanocortin receptor agonists |
| CN1461216A (zh) | 1999-04-28 | 2003-12-10 | 呼吸器有限公司 | 用作治疗有关支气管收缩的机能障碍的药物的化合物 |
| US20030055070A1 (en) | 1999-07-01 | 2003-03-20 | Wilma Harrison | Phosphodiesterase type 5 (PDE5) inhibitors for the treatment of selective serotonin reuptake inhibitor (SSR) induced sexual dysfunction |
| IT1313625B1 (it) | 1999-09-22 | 2002-09-09 | Boehringer Ingelheim Italia | Derivati benzimidazolonici aventi affinita' mista per i recettori diserotonina e dopamina. |
| US6960597B2 (en) | 2000-06-30 | 2005-11-01 | Orth-Mcneil Pharmaceutical, Inc. | Aza-bridged-bicyclic amino acid derivatives as α4 integrin antagonists |
| US20020052370A1 (en) | 2000-07-06 | 2002-05-02 | Barber Christopher Gordon | Cyclopentyl-substituted glutaramide derivatives as inhibitors of neutral endopeptidase |
| US20040198706A1 (en) | 2003-03-11 | 2004-10-07 | Carrara Dario Norberto R. | Methods and formulations for transdermal or transmucosal application of active agents |
| GB0105893D0 (en) | 2001-03-09 | 2001-04-25 | Pfizer Ltd | Pharmaceutically active compounds |
| GB0106446D0 (en) | 2001-03-15 | 2001-05-02 | Vernalis Res Ltd | Chemical compounds |
| US6627646B2 (en) | 2001-07-17 | 2003-09-30 | Sepracor Inc. | Norastemizole polymorphs |
| US7183410B2 (en) | 2001-08-02 | 2007-02-27 | Bidachem S.P.A. | Stable polymorph of flibanserin |
| DE10138273A1 (de) | 2001-08-10 | 2003-02-27 | Boehringer Ingelheim Pharma | Arzneimittel mit neuroprotektiver Wirkung |
| HUP0202719A3 (en) | 2001-08-21 | 2006-01-30 | Pfizer Prod Inc | Pharmaceutical compositions for the treatment of female sexual dysfunctions |
| DE10149674A1 (de) | 2001-10-09 | 2003-04-24 | Apogepha Arzneimittel Gmbh | Orale Darreichungsformen für Propiverin oder seinen pharmazeutisch annehmbaren Salzen mit verlängerter Wirkstoffreisetzung |
| UA78974C2 (en) | 2001-10-20 | 2007-05-10 | Boehringer Ingelheim Pharma | Use of flibanserin for treating disorders of sexual desire |
| US20040048877A1 (en) | 2002-05-22 | 2004-03-11 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Pharmaceutical compositions containing flibanserin |
| CA2529857A1 (en) | 2002-07-30 | 2004-02-05 | Peter Migaly | Combination therapy for depression, prevention of suicide, and varous medical and psychiatric conditions |
| US20040147581A1 (en) | 2002-11-18 | 2004-07-29 | Pharmacia Corporation | Method of using a Cox-2 inhibitor and a 5-HT1A receptor modulator as a combination therapy |
| US20050037983A1 (en) | 2003-03-11 | 2005-02-17 | Timothy Dinan | Compositions and methods for the treatment of depression and other affective disorders |
| WO2005025562A1 (en) | 2003-09-11 | 2005-03-24 | Xenoport, Inc. | Treating and/or preventing urinary incontinence using prodrugs of gaba analogs |
| WO2005102342A1 (en) | 2004-04-22 | 2005-11-03 | Boehringer Ingelheim International Gmbh | New pharmaceutical compositions for the treatment of sexual disorders ii |
| US20060014757A1 (en) | 2004-07-14 | 2006-01-19 | Boehringer Ingelheim Pharmaceuticals | Method for the treatment of anorexia nervosa |
| EP1789048A1 (en) | 2004-09-03 | 2007-05-30 | Boehringer Ingelheim International GmbH | Method for the treatment of attention deficit hyperactivity disorder |
| JP2008540356A (ja) | 2005-05-06 | 2008-11-20 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | 薬物乱用の治療方法 |
| US20060258640A1 (en) | 2005-05-13 | 2006-11-16 | Boehringer Ingelheim International Gmbh | Use of Flibanserin in the treatment of chronic pain |
| EP2474308A1 (en) | 2005-06-27 | 2012-07-11 | Valeant International (Barbados) SRL | Pharmaceutical formulations containing bupropion hydrobromide |
| JP2009503020A (ja) | 2005-08-03 | 2009-01-29 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | 肥満症の治療におけるフリバンセリンの使用 |
| ES2336719T3 (es) | 2006-06-30 | 2010-04-15 | Boehringer Ingelheim International Gmbh | Flibanserina para el tratamiento de la incontinencia urinaria y las enfermedades relacionadas. |
| CL2007002214A1 (es) | 2006-08-14 | 2008-03-07 | Boehringer Ingelheim Int | Composicion farmaceutica en la forma de comprimido, donde al menos la longitud del comprimido en el estado anterior de la aplicacion es al menos 7/12 del diametro pilorico del paciente y despues de ingerirlo en estado alimentado, la longitud del comp |
| WO2008022932A2 (en) | 2006-08-25 | 2008-02-28 | Boehringer Ingelheim International Gmbh | Controlled release system and method for manufacturing the same |
| ATE524446T1 (de) | 2006-12-20 | 2011-09-15 | Boehringer Ingelheim Int | Sulfatierte benzimidazolon-derivate mit gemischter serotonin-rezeptor-affinität |
-
2009
- 2009-11-26 CA CA 2686480 patent/CA2686480A1/en not_active Abandoned
- 2009-12-14 JP JP2011540128A patent/JP2012512145A/ja active Pending
- 2009-12-14 EP EP09774901A patent/EP2376457A2/en not_active Withdrawn
- 2009-12-14 WO PCT/EP2009/067007 patent/WO2010079045A2/en active Application Filing
- 2009-12-14 US US13/131,926 patent/US20120322810A9/en not_active Abandoned
-
2014
- 2014-09-12 US US14/484,900 patent/US9546141B2/en not_active Expired - Fee Related
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH06509575A (ja) * | 1991-07-30 | 1994-10-27 | ベーリンガー インゲルハイム イタリア ソシエタ ペル アチオニ | 5−HT↓1↓a拮抗物質及び5−HT↓2 拮抗物質としてのベンゾイミダゾロン誘導体 |
| JP2004529175A (ja) * | 2001-05-11 | 2004-09-24 | カー. ベック ユルゲン | 2h−ベンズイミダゾール−2−オン、1,3−ジヒドロ−1−(2−{4−[3−(トリフルオロメチル)フェニル]−1−ピペラジニル}エチル)−及びその生理学的に許容される酸付加塩の新規使用 |
| JP2004537597A (ja) * | 2001-08-02 | 2004-12-16 | ビダケム ソシエタ ペル アチオニ | 安定多形体のフリバンセリン、その製造方法及び薬剤を製造するためのその使用 |
| WO2008006838A1 (en) * | 2006-07-14 | 2008-01-17 | Boehringer Ingelheim International Gmbh | Use of flibanserin for the treatment of sexual disorders in females |
| WO2008019996A2 (en) * | 2006-08-14 | 2008-02-21 | Boehringer Ingelheim International Gmbh | Formulations of flibanserin and method for manufacturing the same |
| WO2008116890A2 (en) * | 2007-03-28 | 2008-10-02 | Boehringer Ingelheim International Gmbh | Pharmaceutical compositions comprising flibanserin and a further agent in the treatment of sexual disorders |
Non-Patent Citations (1)
| Title |
|---|
| JPN7014000983; Drugs of the Future 23(1), 1998, pp.9-16 * |
Also Published As
| Publication number | Publication date |
|---|---|
| US20120122883A1 (en) | 2012-05-17 |
| WO2010079045A2 (en) | 2010-07-15 |
| US9546141B2 (en) | 2017-01-17 |
| WO2010079045A3 (en) | 2010-12-23 |
| CA2686480A1 (en) | 2010-06-15 |
| US20150126524A1 (en) | 2015-05-07 |
| US20120322810A9 (en) | 2012-12-20 |
| EP2376457A2 (en) | 2011-10-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5714824B2 (ja) | 1−4−(5−シアノインドール−3−イル)ブチル−4−(2−カルバモイルベンゾフラン−5−イル)ピペラジン塩酸塩の多形相 | |
| JP2020183408A (ja) | {[5−(3−クロロフェニル)−3−ヒドロキシピリジン−2−カルボニル]アミノ}酢酸の固体形態、組成物、及びその使用 | |
| US11028100B2 (en) | Polymorphs and solid forms of (s)-2-((2-((s)-4-(difluoromethyl)-2-oxooxazolidin-3-yl)-5,6-dihydrobenzo[f]imidazo[1,2-d][1,4]oxazepin-9-yl)amino)propanamide, and methods of production | |
| JP2008509953A (ja) | 4−[[(7r)−8−シクロペンチル−7−エチル−5,6,7,8−テトラヒドロ−5−メチル−4−6−オキソ−2−ピペリジニル]アミノ]−3−メトキシ−n−(1−メチル−4−ピペリジニル)ベンズアミドの水和物及び多形、その製造方法、並びにその薬物としての使用 | |
| JP6359971B2 (ja) | イバブラジン塩酸塩の形態iv | |
| US9546141B2 (en) | Salts | |
| JP7168447B2 (ja) | ビラスチンの結晶形態及びそれらの調製方法 | |
| BG64051B1 (bg) | Нова сол | |
| JP6827124B2 (ja) | (1r,3s)−3−(5−シアノ−4−フェニル−1,3−チアゾール−2−イルカルバモイル)シクロペンタンカルボン酸のアミン塩 | |
| TWI532734B (zh) | Crystallization of Alesartan Ester and its preparation method and pharmaceutical composition containing the same | |
| US9981912B2 (en) | Cocrystal of lorcaserin, preparation methods, pharmaceutical compositions and uses thereof | |
| JP6491653B2 (ja) | アルコール消費を低減するためまたは過剰のアルコール消費を防止するための薬剤としてのナルメフェン塩 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20121213 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20121213 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140401 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20140902 |